EP0073984A2 - Riech- und/oder Geschmackstoffkompositionen mit einem Gehalt an ungesättigten Säuren - Google Patents
Riech- und/oder Geschmackstoffkompositionen mit einem Gehalt an ungesättigten Säuren Download PDFInfo
- Publication number
- EP0073984A2 EP0073984A2 EP82107607A EP82107607A EP0073984A2 EP 0073984 A2 EP0073984 A2 EP 0073984A2 EP 82107607 A EP82107607 A EP 82107607A EP 82107607 A EP82107607 A EP 82107607A EP 0073984 A2 EP0073984 A2 EP 0073984A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- acid
- cis
- fragrance
- tobacco
- compositions
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11B—PRODUCING, e.g. BY PRESSING RAW MATERIALS OR BY EXTRACTION FROM WASTE MATERIALS, REFINING OR PRESERVING FATS, FATTY SUBSTANCES, e.g. LANOLIN, FATTY OILS OR WAXES; ESSENTIAL OILS; PERFUMES
- C11B9/00—Essential oils; Perfumes
- C11B9/0007—Aliphatic compounds
- C11B9/0015—Aliphatic compounds containing oxygen as the only heteroatom
- C11B9/0019—Aliphatic compounds containing oxygen as the only heteroatom carbocylic acids; Salts or esters thereof
-
- A—HUMAN NECESSITIES
- A24—TOBACCO; CIGARS; CIGARETTES; SIMULATED SMOKING DEVICES; SMOKERS' REQUISITES
- A24B—MANUFACTURE OR PREPARATION OF TOBACCO FOR SMOKING OR CHEWING; TOBACCO; SNUFF
- A24B15/00—Chemical features or treatment of tobacco; Tobacco substitutes, e.g. in liquid form
- A24B15/18—Treatment of tobacco products or tobacco substitutes
- A24B15/28—Treatment of tobacco products or tobacco substitutes by chemical substances
- A24B15/30—Treatment of tobacco products or tobacco substitutes by chemical substances by organic substances
-
- A—HUMAN NECESSITIES
- A24—TOBACCO; CIGARS; CIGARETTES; SIMULATED SMOKING DEVICES; SMOKERS' REQUISITES
- A24B—MANUFACTURE OR PREPARATION OF TOBACCO FOR SMOKING OR CHEWING; TOBACCO; SNUFF
- A24B15/00—Chemical features or treatment of tobacco; Tobacco substitutes, e.g. in liquid form
- A24B15/18—Treatment of tobacco products or tobacco substitutes
- A24B15/28—Treatment of tobacco products or tobacco substitutes by chemical substances
- A24B15/30—Treatment of tobacco products or tobacco substitutes by chemical substances by organic substances
- A24B15/32—Treatment of tobacco products or tobacco substitutes by chemical substances by organic substances by acyclic compounds
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11B—PRODUCING, e.g. BY PRESSING RAW MATERIALS OR BY EXTRACTION FROM WASTE MATERIALS, REFINING OR PRESERVING FATS, FATTY SUBSTANCES, e.g. LANOLIN, FATTY OILS OR WAXES; ESSENTIAL OILS; PERFUMES
- C11B9/00—Essential oils; Perfumes
- C11B9/0026—Essential oils; Perfumes compounds containing an alicyclic ring not condensed with another ring
- C11B9/0034—Essential oils; Perfumes compounds containing an alicyclic ring not condensed with another ring the ring containing six carbon atoms
Definitions
- the invention relates to fragrance and / or flavoring compositions which are characterized by a content of cis-3,7-dimethylocta-3,6-dienoic acid.
- the invention further relates to processes for improving the smell of fragrance compositions or the taste of flavoring compositions, which are characterized in that an amount of cis-3,7-dimethylocta-3,6-dienoic acid which is effective in terms of smell or taste is characterized used.
- the invention relates to the use of cis-3,7-dimethylocta-3,6-dienoic acid as a fragrance and / or flavoring.
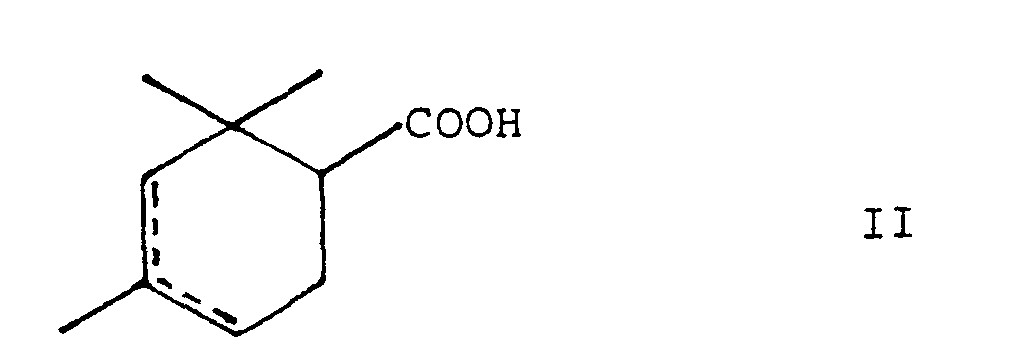
- I was very good with 2,2,4-trimethylcyclohex-3 (or 4) -enecarboxylic acid, ie the compound of the formula can be combined.
- the combination I + II shows surprising organoleptic properties.
- II supports the natural notes of Ir II in such compositions also rounds off, and Ir can support the resinous note of I.
- the compound of formula II is also known, see e.g. J. Org. Chem. 34 (1968) 2196-2203.
- the compound of the formula I, or the mixtures I + II, are particularly suitable for modifying known compositions owing to their natural odor notes.
- Remarkable is the way in which the compound I (or I + II) gives the olfactory notes of known compositions, e.g. oriental (i.e. heavier, sweeter) notes, amber, powdery notes, citrus notes rounded off in colognes and harmonized, even embossed. in perfume bases, e.g. in flowery, like rose bases the sought-after character of the heavy, sweet and somewhat fruity Bulgarian rose.
- Threshold value determinations have shown that I is almost 2 powers of ten more intense than I 'or I ". I is therefore a typical" impact chemical ".
- the compound of the formula I (or the mixture I + II) can be used within wide limits, which can range, for example, from 0.01 (detergents) -10% (alcoholic solutions) in compositions, without these values, however, being intended to represent limit values because the experienced Perfumers can achieve effects with even lower concentrations or can build up new complexes with even higher doses.
- the preferred concentrations are between 0.1 and 5%.
- the compositions produced with I can be used for all types of perfumed consumer goods (Eaux de Cologne, Eaux de Toilette, extras, lotions, creams, shampoos, soaps, ointments, powder, toothpastes, mouthwashes, deodorants, detergents, tobacco, etc.) .
- the compound I (or the mixture I + II) can accordingly be used in the production of compositions and - as the above composition shows - using a wide range of known fragrances or mixtures of fragrances.
- the above-mentioned known fragrances or mixtures of fragrances can be used in a manner known to the perfumer, such as from W.A. Poucher, Perfumes, Cosmetics, Soaps 2, 7th edition, Chapman and Hall, London 1974.
- the new compound of formula I or their mixtures with II are also excellently suitable for use in flavors, in particular in fruit flavors of all kinds, but in particular also for flavoring tobacco.
- the compounds I can be used, for example, to improve, enhance, increase or modify a wide variety of fruit flavors, e.g. Raspberry or apricot flavors can be used.
- Food yogurt, confectionery, etc.
- luxury foods tea, tobacco, etc.
- beverages lemonade, etc.
- a suitable dosage includes, for example, the range from 0.01 ppm to 100 ppm, preferably the range from 0.1 pp m - 2 0 ppm in the finished product, ie the flavored food, luxury food or drink.
- the dosage for example in the case of a top flavor, can range from 0.1 to 2 ppm in the end product.
- the compounds can be mixed in a conventional manner with the constituents used for flavoring compositions or added to such flavors.
- the aromas used according to the invention are understood to mean flavoring compositions which can be diluted in a manner known per se or distributed in edible materials. They contain, for example, about 0.1-10, in particular 0.5-3,% by weight. They can be converted into the usual forms of use, such as solutions, pastes or powders, using methods known per se.
- the products can be spray dried, vacuum dried or lyophilized.
- acid I (or the mixture of I + II) can serve in particular to improve the organoleptic properties of tobacco products.
- tobacco product is a common term in the industry, which not only includes tobacco itself, but also tobacco by-products, such as reconstituted and homogenized leaves and stems, tobacco surrogates (e.g. lettuce and cabbage leaves, etc.), materials used in the Tobacco processing are used, such as paper, filters etc. and flavor compositions used for tobacco products.
- tobacco product includes cigarette tobacco, cigar tobacco, chewing tobacco and pipe tobacco, etc.
- the differences between the treated and untreated tobacco are even more noticeable when smoking.
- the untreated cigarettes have an undesirable tartness when smoking, an effect that is reduced by the addition of I or I + II.
- the treated cigarettes give a smoother, lighter and more rounded taste when smoking, which is why they are clearly preferred to the untreated ones.
- the amount of acid I or the mixture of I + II which is expediently added can depend on various factors, including the desired effect, the type and amount of other additives used simultaneously and / or the personal preference of the aromatist. Even quantities of 0.01 ppm, based on the weight of the tobacco, have proven to be effective, but quantities of 10 ppm can still be used. However, amounts of 0.1 ppm to 2 ppm are preferably used;
- the compounds I and II can be added to the tobacco product (cigarette paper, etc.) by the methods known to the person skilled in the art, e.g. Atomize, immerse, coat, etc. can be added or mixed in.
- ratio of I: II this can vary within wide ranges.
- a suitable range is, for example, from 90: 1 to 1:90.
- the freshness effect of the base is significantly increased by adding 2 parts I.
- geranium acid does not fit into the base at all.
- the animal note becomes even more pronounced, which effect cannot be achieved with the same additions of geranic acid.
- the base note in the former case has the warmest, most voluminous and, in a typical way, the most animalistic effect on the smell strip.
- the composition on the freshly dipped scent strip is stronger and, above all, more balanced than when the same amount of geranic acid is added. This strength and harmony remain in the base note after 24.48 and 96 hours.
- a tobacco aroma (so-called top flavor towards apricot)
- composition A By adding I to composition A, the existing fruity note is significantly enhanced.
- a significantly more pronounced fruit note is noticeable, and the tobacco note is also significantly enhanced.
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Wood Science & Technology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Toxicology (AREA)
- General Chemical & Material Sciences (AREA)
- Fats And Perfumes (AREA)
- Cosmetics (AREA)
Abstract
Description
- Die Erfindung betrifft Riech- und/oder Geschmackstoffkompositionen, die durch einen Gehalt an cis-3,7-Dimethylocta-3,6-diensäure gekennzeichnet sind.
- Die Erfindung betrifft weiterhin Verfahren zur Ver - besserung des Geruchs von Riechstoffkompositionen bzw. des Geschmacks von Geschmackstoffkompositionen, die dadurch ge - kennzeichnet sind, dass man eine geruchlich bzw. geschmacklich wirksame Menge von cis-3,7-Dimethylocta-3,6-diensäure verwendet.
- Die Erfindung betrifft schliesslich die Verwendung von cis-3,7-Dimethylocta-3,6-diensäure als Riech- und/oder Geschmackstoff.
- cis-3,7-Dimethylocta-3,6-diensäure, die cis-Isogeraniumsäure der Formel
- Im Zuge der vorliegenden Untersuchungen wurde ferner gefunden, dass sich I sehr gut mit der 2,2,4-Trimethyl- cyclohex-3(bzw.4)-en-carbonsäure, also der Verbindung der Formel
- Die Geruchseigenschaften von II können wie folgt beschrieben werden:
- Sehr natürlich, Fondnoten von Weihrauch, Olibanum, Cistus, ambrig, nach Leder, Myrrhe, animalisch, Opoponax, antikes Holz.
- Die Verbindung der Formel II ist ebenfalls bekannt, siehe z.B. J. Org. Chem. 34 (1968)2196 - 2203.
- Obschon die einzelnen Isomeren von II leicht zugänglich sind, wird zweckmässigerweise das Isomerengemisch verwendet.
- Die Verbindung der Formel I, bzw. die Gemische I + II eignen sich aufgrund ihrer natürlichen Geruchsnoten insbesondere zur Modifizierung von bekannten Kompositionen.
- Die Säuren I und II verbinden sich mit zahlreichen bekannten Riechstoffingredienten natürlichen oder synthetischen Ursprungs, wobei die Palette der natürlichen Rohstoffe sowohl leicht- als auch mittel- und schwerflüchtige Komponenten, und diejenige der Synthetika Vertreter aus praktisch allen Stoffklassen umfassen kann, wie dies aus der folgenden Zusammenstellung ersichtlich ist:
- - Naturprodukte wie Basilikumöl, Baummoos absolue, Benzoebalsam, Bergamotteöl, Castoreum, Cedernholzöl, Cistusöle, Citronenöl, Corianderöl, Cypressenöl, Elemiöl, Fichtennadelöl, Galbanumöl, Grapefruitöl, Jasmin absolue, Lavendelöl, Mandarinöl , Mastix absolue, Moschusöle, Myrtenöl, Palmarosaöl, Patchouli- öl, Petitgrainöl Paraguay, Pfefferminzöle, Pfefferöl, Rosmarinöl, Sandelholzöl, Terpentinöle, Thymianöl, Vetiveröl, Wermutöl, Ylangöl, Zibetextrakte, etc.
- - Alkohole,wie Citronellol, Geraniol, Linalool, Nerol, Phenyläthylalkohol, Rhodinol, Sandalore (3-Methyl-5-(2,2,3-trimethylcyclopent-3-en-l-yl)pentan-2-ol), Sandela (3-Isocamphyl-(5)-cyclohexanol), Zimtalkohol, etc.
- - Aldehyde, wie Anisaldehyd, Benzaldehyd, Citral, Helional (a-Methyl-3,4-methylendioxy-hydrozimtaldehyd), Heliotropin, a-Hexylzimtaldehyd, Hydroxycitronellal, Laurinaldehyd, Lilial (p-tert-Butyl-a-methyl-hydrozimtaldehyd), Methylnonylacetaldehyd, Undecylenaldehyd, Vanillin, Zimtaldehyd, etc.
- - Ketone,wie Acetophenone (z.B. p-Methyl,p-Methoxy), Acetylcedren, Allyljonon, Irone,a-Jonon,ß-Jonon, Ketonmoschus, Methyljonone,etc.
- - Ester,wie Aethyl-acetoacetat, Allyl-phenoxyacetat, Anthranilsäureester, Benzylacetat, Cinnamylpropionat, Dimethylbenzylcarbinyl-butyrat, Fettsäureester, Linalylacetat, Metambrat (l-Acetoxy-l-methyl-2- sec.butyl-cyclohexan), Methyl-dihydrojasmonat, Salicylate, Styrallylacetat, Vetiverylacetat, etc.
- - Lactone, wie Aethylenbrassilat, Cumarin, y-Nonalacton, γ-Undecalacton, C14-Aldehyd (6-Undecalacton), etc.
- - Aether, wie Caryophyllenepoxyd, Cyclododecanoläther wie Madrox (1-Methyl-l-methoxy-cyclododecan), Epoxycedren, etc.
- - verschiedene, in der Parfümerie oft benützte Komponenten, wie Ambrettemoschus, Celestolid (4-Acetyl-6-tert.butyl-1,1-dimethylindan), Eugenol, Galaxolid (l,3,4,6,7,8-Hexahydro-4,6,6,7,8,8-hexamethyl-cyclo- penta-Y-2-benzopyran), Indol, Isobutylchinolin, p-Menthan-8-thiol-3-on, Methyleugenol, Musk 174 (12-Oxahexadecanolid), etc.
- Bemerkenswert ist die Art und Weise, wie die Verbindung I (bzw.I+II) die Geruchsnoten bekannter Kompositionen, z.B. orientalischer (d.h. schwerer, süsser) Noten, Ambra, pudriger Noten, Citrusnoten in Colognes abrundet und harmonisiert, ja sogar prägt.So unterstreicht sie z.B. in Parfümbasen, z.B. in blumigen, wie Rosen-basen den gesuchten Charakter der schweren, süssen und etwas fruchtig wirkenden bulgarischen Rose.
- Schwellenwertbestimmungen haben ergeben, dass I fast 2 Zehnerpotenzen intensiver ist als I' bzw. I". I ist deshalb ein typisches "impact chemical".
- In Fruchtbasen, z.B. des Typs Aprikose können I bzw.I+II mit Erfolg zum Erzielen eines kräftigeren und natürlich-fruchtigeren sowie abrundenden Effekts eingesetzt werden.
- Die Verbindung der Formel I (bzw. das Gemisch I+II) lassen sich in weiten Grenzen einsetzen, die beispielsweise von 0,01 (Detergentien)-10% (alkoholische Lösungen) in Kompositionen reichen können, ohne dass diese Werte jedoch Grenzwerte darstellen sollen, da der erfahrene Parfümeur auch mit noch geringeren Konzentrationen Effekte erzielen oder aber mit noch höheren Dosierungen neuartige Komplexe aufbauen kann. Die bevorzugten Konzentrationen bewegen sich zwischen O,1 und 5%. Die mit I hergestellten Kompositionen lassen sich für alle Arten von parfümierten Verbrauchsgütern einsetzen (Eaux de Cologne, Eaux de Toilette, Extraits, Lotionen, Cremes, Shampoos, Seifen, Salben, Puder, Zahnpasten, Mundwässer, Desodorantien, Detergentien, Tabak, etc.).
- Die Verbindung I (bzw. das Gemisch I + II)kann demgemäss bei der Herstellung von Kompositionen und - wie obige Zusammenstellung zeigt - unter Verwendung einer breiten Palette bekannter Riechstoffe bzw. Riechstoffgemische verwendet werden. Bei der Herstellung solcher Kompositionen können die oben angeführten bekannten Riechstoffe bzw. Riechstoffgemische nach (dem Parfümeur bekannter) Art und Weise verwendet werden, wie z.B. aus W.A. Poucher, Perfumes, Cosmetics, Soaps 2, 7. Auflage, Chapman und Hall, London 1974 hervorgehend.
- Die neue Verbindung der Formel I bzw. deren Gemische mit II sind ebenfalls vorzüglich geeignet zur Verwendung in Aromen, insbesondere in Fruchtaromen verschiedenster Art, insbesondere aber auch zur Aromatisierung von Tabak.
- Als Geschmackstoffe können die Verbindungen I beispielsweise zur Verbesserung, Verstärkung, Steigerung oder Modifizierung von Fruchtaromen verschiedenster Art, z.B. Himbeer- oder Aprikosenaromen verwendet werden. Als Anwendungsgebiet dieser Aromen kommen beispielsweise Nahrungsmittel(Joghurt, Süsswaren etc.), Genussmittel (Tee, Tabak etc.) und Getränke (Limonade etc.) in Frage.
- Die ausgeprägten geschmacklichen Qualitäten der Ver- bindung I(bzw. deren Gemische mit II)ermöglichen die Verwendung als Aromastoffe in geringen Konzentrationen. Eine geeignete Dosierung umfasst beispielsweise den Bereich von 0,01 ppm - 100 ppm, vorzugsweise den Bereich von 0,1 ppm - 20 ppm im Fertigprodukt, d.h. dem aromatisierten Nahrungsmittel, Genussmittel oder Getränk.
- Bei der Aromatisierung von beispielsweise Tabak kann die Dosierung, beispielsweise im Falle eines topflavour den Bereich von 0,1 bis 2 ppm im Endprodukt umfassen.
- Die Verbindungen können auf übliche Weise mit den für Geschmackstoffkompositionen verwendeten Bestandteilen vermischt bzw. solchen Aromen zugesetzt werden. Unter den erfindungsgemäss verwendeten Aromen werden Geschmackstoffkompositionen verstanden, die sich auf an sich bekannte Art verdünnen bzw. in essbaren Materialien verteilen lassen. Sie enthalten beispielsweise etwa 0,1 - 10, insbesondere 0,5 - 3 Gew.%. Die können nach an sich bekannten Methoden in die üblichen Gebrauchsformen, wie Lösungen, Pasten oder Pulver übergeführt werden. Die Produkte können sprühgetrocknet, vakuumgetrocknet oder lyophilisiert werden.
- Die bei der Herstellung solcher Aromen zweckmässigerweise verwendeten bekannten Aromastoffe sind entweder in der obigen Zusammenstellung enthalten oder können der einschlägigen Literatur entnommen werden, siehe z.B. J. Merory, Food Flavorings, Composition, Manufacture and Use, Second Edition, The Avi Pubishing Company, Inc., Westport, Conn. 1968, oder G. Fenaroli, Fenaroli's Handbook of Flavor Ingredients, Second Edition, Volume 2, CRC-Press, Inc. Cleveland, Ohio 1975.
- Für die Herstellung der üblichen Gebrauchsformen kommen beispielsweise folgende Trägermaterialien, Verdickungsmittel, Geschmackstoffverbesserer, Gewürze und Hilfsingredientien, etc. in Frage:
- Gummi arabicum, Tragant, Salze oder Brauereihefe, Alginate, Carrageen oder ähnliche Absorbentien; Indole, Maltol, Dienale, Gewürzoleoresine, Raucharomen; Gewürznelken, Diacetyl, Natriumcitrat; Monoatriumglutamat, Di- natriuminosin-5'-monophosphat (IMP), Dinatriumguanosin-5-phosphat (GMP); oder spezielle Aromastoffe, Wasser- Aethanol, Propylenglykol, Glycerin.
- Was den Tabak betrifft, so kann die Säure I(bzw. das Gemisch von I + II) insbesondere zur Verbesserung der organoleptischen Eigenschaften von Tabakerzeugnissen dienen.
- "Tabakerzeugnis" ist eine in der Branche übliche, allgemeine Bezeichnung, die aber nicht nur Tabak selbst umfasst, sondern auch Tabaknebenprodukte, wie rekonstituierte und homogenisierte Blätter und Stengel, Tabaksurrogate (z.B. Salat- und Kohlblätter , etc.), Materialien, die bei der Tabakverarbeitung gebraucht werden, wie Papier, Filter etc. und für Tabakerzeugnisse verwendete Geschmackskompositionen. Unter die Bezeichnung "Tabakerzeugnis" fallen Zigarettentabak, Zigarrentabak, Kautabak und Pfeifentabak, etc.
- Der Zusatz der Verbindung I bzw. des Gemisches von I + II zu einer Tabakmischung verbessert sowohl den Geruch des frischen Tabaks als auch den Geruch und den Geschmack des Tabaks beim Rauchen. Ein Vergleich von behandeltem mit unbehandeltem Tabak zeigt, dass der Geruch der Mischungen,die I enthalten, gegenüber dem unbehandelten verstärkt, abgerundeter und leichter ist.
- Die Unterschiede zwischen den behandelten und unbehandelten Tabaken werden noch auffälliger beim Rauchen. Die unbehandelten Zigaretten weisen beim Rauchen eine unerwünschte Herbheit auf, ein Effekt, der durch den Zusatz von I bzw. I + II verringert wird. Die behandelten Zigaretten ergeben beim Rauchen einen weicheren, leichteren und abgerundeteren Geschmack, weshalb sie den unbehandelten eindeutig vorgezogen werden.
- Die Menge der Säure I bzw. des Gemisches von I + II die zweckmässigerweise zugesetzt wird, kann von verschiedenen Faktoren, einschliesslich der gewünschten Wirkung,der Art und der Menge anderer, gleichzeitig verwendeter Zusätze und/oder der persönlichen Vorliebe des Aromatikers, abhängen. Schon Mengen von 0,01 ppm, bezogen auf das Gewicht des Tabaks, erweisen sich als wirksam, während aber auch Mengen von 10 ppm noch verwendbar sind. Bevorzugt werden jedoch Mengen von O,1 ppm bis 2 ppm eingesetzt;
- ' Die oben vorgeschlagenen Grenzen sollen selbstverständlich nur die bevorzugten Mengen andeuten; diese sind jedoch auch von der Geschicklichkeit des Aromatikers und der Wirkung, die er erzielen will, abhängig.
- Die Verbindungen I und II können dem Tabakprodukt (Zigarettenpapier, etc.) nach den dem Fachmann bekannten Methoden, z.B. Zerstäuben, Eintauchen, Ueberziehen, etc. zugesetzt oder beigemischt werden.
- Die folgenden Beispiele sollen als Veranschaulichung der bevorzugten Ausführungsformen der vorliegenden Erfindung und nicht als Einschränkung verstanden werden. Sie sollen also auch daraus ableitbare Variationen umfassen, die für den Fachmann naheliegend sind.
- Was das Verhältnis von I:II betrifft, so kann dies innerhalb weiter Bereiche variieren. Ein geeigneter Bereich ist beispielsweise der von 90:1 bis 1:90.
-
- Gibt man zu dieser blumigen Komposition 5 Teile I,so wirkt diese viel runder und wärmer. Die Lakton-Note (Jasminnote) wird sehr angenehm unterstrichen.
-
- Gibt man zu diesem Komplex 10 Teile I,so erkennt man im 24-Stunden Wert sofort, dass I sich sehr harmonisch einfügt und den etwas eckigen Eindruck der ursprünglichen Base verschwinden lässt. Frisch getaucht erscheint die Grapefruitnote nun unterstrichen. Andererseits würde dieselbe Menge Geraniumsäure eine in dieser Komposition unerwünschte Eau de Colognenote hervortreten lassen.
-
- Durch einen Zusatz von 2 Teilen I wird der Frischeeffekt der Base wesentlich erhöht. Im Gegensatz dazu passt sich Geraniumsäure überhaupt nicht in die Base ein.
-
- Durch einen Zusatz von 5-Teilen I wird im 48-Stunden Wert die weiche Jonon-Note der Base angenehm hervorgehoben. Andererseits hebt ein Zusatz von Geraniumsäure die zedrige Note zu stark hervor, die entstandene Base wirkt zu trocken.
-
- Gibt man zu dieser Chypre-Base 5 Teile einer 10%-igen Lösung von I, so wirkt die Base viel diffusiver, süsser .Im 24 Stunden-Wert (Fond) wird eine vorteilhafte Vetiver-Zitrusnote festgestellt. Andererseits bewirkt ein äquivalenter Zusatz von Geraniumsäure zur Komposition das Auftreten von unangenehmen staubigen, muffigen Noten.
-
- Gibt man zu dieser Gardenia-Base 3 Teile I, so wird die Base in sehr angenehmer Weise abgerundet; andererseits wird durch einen Zusatz von 3 Teilen Geraniumsäure die Base in negativer Weise beeinflusst: sie wirkt keineswegs abgerundet.
-
- Fügt man zu obiger Base 10 Teile cis-Isogeraniumsäure, so wird die animalische Note noch ausgeprägter, welcher Effekt mit gleichen Zusätzen an Geraniumsäure nicht erzielt werden kann.Die letztere Säure lässt die Base unausgewogen blumig erscheinen, wobei die Aldehydnote hervorsticht. Sowohl nach 24,48,72 und auch 96 Stunden wirkt die Fondnote im ersteren Fall am wärmsten, voluminösesten und auf typische Art animalischsten auf dem Riech-Streifen.
-
- Ein Zusatz von 10 Teilen cis-Isogeraniumsäure zu obiger Base verstärkt(im Gegensatz zu Geraniumsäure) den Citruscharakter enorm, wobei gleichzeitig die Holznote verstärkt wird. Sie führt diesen Citruscharakter harmonisch bis in den Fond, in welchem sich nach 24 Stunden eine feine,warme feuchtig-säuerliche Nuance manifestiert und auf dem Riech- streifen über 96 Stunden anhält. Geraniumsäurezusätze andererseits schaden bloss der Harmonie der Komposition.
-
- Ein Zusatz von 10 Teilen cis-Isogeraniumsäure zu obiger Base bewirkt eine deutlichere, kräftigere Holznote, die auf dem Riechstreifen auch nach 48,72 und96 Stunden wahrzunehmen ist. Geraniumsäure erzeugt diesen Effekt nicht.
-
- Fügt man zu obiger Base 10 Teile cis-Isogeraniumsäure, so wirkt die Komposition auf dem frisch getauchten Riech- streifen kräftiger und vor allem ausgewogener als bei Zusatz derselben Menge Geraniumsäure. Diese Kraft und Harmonie bleiben auch in der Fondnote nach 24,48 und 96 Stunden noch erhalten.
-
- Durch Zugabe von 10 g obigen Säuregemischs wird die Grundbase (holzig, waldig) charakteristisch in Ricntung Weihrauch (Olibanum, encens, frankincense)verändert, gewaltig verstärkt und überdies viel harziger. Die Komposition wirkt auch nach 72 Stunden im Fond noch viel kräftiger; der Weihrauchcharakter bleibt vollkommen erhalten.
-
- Durch den Zusatz von I zu der Komposition A wird die vorhandene fruchtige Note deutlich verstärkt. Beim Abrauchen des aromatisierten Tabaks ist eine wesentlich ausgeprägtere Fruchtnote feststellbar, daneben wird auch die Tabaknote deutlich verstärkt.
Claims (6)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH5823/81 | 1981-09-09 | ||
| CH582381 | 1981-09-09 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP0073984A2 true EP0073984A2 (de) | 1983-03-16 |
| EP0073984A3 EP0073984A3 (en) | 1985-01-09 |
| EP0073984B1 EP0073984B1 (de) | 1988-04-27 |
Family
ID=4299891
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP82107607A Expired EP0073984B1 (de) | 1981-09-09 | 1982-08-20 | Riech- und/oder Geschmackstoffkompositionen mit einem Gehalt an ungesättigten Säuren |
Country Status (4)
| Country | Link |
|---|---|
| US (2) | US4496476A (de) |
| EP (1) | EP0073984B1 (de) |
| JP (1) | JPS5857314A (de) |
| DE (1) | DE3278403D1 (de) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5024847A (en) * | 1989-09-18 | 1991-06-18 | Basf K&F Corporation | Sulfur containing acyclic terpenes |
| WO1994013766A3 (en) * | 1992-12-11 | 1996-02-01 | Quest Int | Dimethyl-cyclohexanecarboxylic acid esters in perfumery |
| WO2008119196A1 (en) * | 2007-03-30 | 2008-10-09 | Givaudan Sa | Off-note blocking sensory organic compounds |
| CN101652342A (zh) * | 2007-03-30 | 2010-02-17 | 吉万奥丹股份有限公司 | 遮蔽不适感感觉的有机化合物 |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4832059A (en) * | 1987-12-08 | 1989-05-23 | Lorillard, Inc. | Citrus-flavored tobacco articles |
| US6127450A (en) | 1998-06-09 | 2000-10-03 | Kerr Corporation | Dental restorative composite |
| ES2310562T3 (es) * | 2000-11-06 | 2009-01-16 | Japan Tobacco Inc. | Composicion desodorante contra el olor a tabaco, desodorante contra el olor a tabaco y paquete de tabaco y cigarrillos con olor a humo secundario reducido. |
| AU2002210998A1 (en) * | 2000-11-06 | 2002-05-15 | Japan Tobacco Inc. | Perfume compositions for deodorizing tobacco, tobacco deodorizing agents and cigarette and tobacco packages with little side smoke flow odor |
| CN106235396A (zh) * | 2016-08-17 | 2016-12-21 | 广西中烟工业有限责任公司 | 一种桃金娘提取物的制备方法及其在卷烟中的应用 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3553110A (en) * | 1967-02-02 | 1971-01-05 | Int Flavors & Fragrances Inc | Perfume compositions containing unconjugated octanitriles |
| NL7500220A (nl) * | 1975-01-08 | 1976-07-12 | Naarden International Nv | Vertakte carbonzuren. |
-
1982
- 1982-08-20 DE DE8282107607T patent/DE3278403D1/de not_active Expired
- 1982-08-20 EP EP82107607A patent/EP0073984B1/de not_active Expired
- 1982-08-23 US US06/410,296 patent/US4496476A/en not_active Expired - Fee Related
- 1982-09-08 JP JP57156494A patent/JPS5857314A/ja active Granted
-
1984
- 1984-06-20 US US06/622,435 patent/US4669490A/en not_active Expired - Fee Related
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5024847A (en) * | 1989-09-18 | 1991-06-18 | Basf K&F Corporation | Sulfur containing acyclic terpenes |
| WO1994013766A3 (en) * | 1992-12-11 | 1996-02-01 | Quest Int | Dimethyl-cyclohexanecarboxylic acid esters in perfumery |
| WO2008119196A1 (en) * | 2007-03-30 | 2008-10-09 | Givaudan Sa | Off-note blocking sensory organic compounds |
| CN101652342A (zh) * | 2007-03-30 | 2010-02-17 | 吉万奥丹股份有限公司 | 遮蔽不适感感觉的有机化合物 |
| US8409649B2 (en) | 2007-03-30 | 2013-04-02 | Givaudan S.A. | Off-note blocking sensory organic compounds |
| CN101652342B (zh) * | 2007-03-30 | 2014-01-29 | 奇华顿股份有限公司 | 遮蔽不适感感觉的有机化合物 |
| US9451784B2 (en) | 2007-03-30 | 2016-09-27 | Givaudan S.A. | Off-note blocking sensory organic compounds |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0073984B1 (de) | 1988-04-27 |
| JPH0221440B2 (de) | 1990-05-14 |
| US4669490A (en) | 1987-06-02 |
| DE3278403D1 (en) | 1988-06-01 |
| JPS5857314A (ja) | 1983-04-05 |
| US4496476A (en) | 1985-01-29 |
| EP0073984A3 (en) | 1985-01-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE2808710C3 (de) | 1- [3-(Methylthio)- butyryl] -2,6,6trimethylcyclohexen und das 13-Cyclohexadien-Analoge, Verfahren zu deren Herstellung und deren Verwendung | |
| SU988175A3 (ru) | Способ изменени , модифицировани и усилени аромата и /или вкуса пищевых продуктов | |
| DE2405568B2 (de) | Cycloaliphatische verbindungen und deren verwendung als riech- und geschmacksstoffe | |
| EP0073984B1 (de) | Riech- und/oder Geschmackstoffkompositionen mit einem Gehalt an ungesättigten Säuren | |
| DE2540624C3 (de) | Würz- und Aromastoff und Verfahren zu dessen Herstellung | |
| DE2611160A1 (de) | Stereoisomere 2-(2,2,6-trimethyl-1- cyclo-hexen-1-yl)aethen-1-ole, verfahren zu deren herstellung und ihre verwendung | |
| EP0164763B1 (de) | Neue substituierte Tetraline und Indane (I), Verwendung von (I) als Riech- und/oder Geschmackstoffe sowie Riech- und/oder Geschmackstoffkompositionen mit einem Gehalt an (I) | |
| DE2443191C3 (de) | Verwendung von Bicycle- [2,2,2] -oetanderivaten als Parfümierungs- und Aromatisierungsmittel | |
| DE2840823C2 (de) | Trans, trans- δ -Damascon, dessen Gemische mit mehr als 50% trans, trans- δ -Damascon und cis, trans- δ -Damascon sowie deren Verwendung als Würzstoffe | |
| EP0684299B1 (de) | Dihydrofarnesal | |
| DE2951508A1 (de) | Ungesaettigte alicyclische aether und ihre verwendung als parfuem- und aromabestandteile | |
| DE2065324C3 (de) | 2,6,6-Trimethyl-Miydroxy-lcrotonoyl-cyclohexen-Q), seine Verwendung als Riech- und Geschmacksstoff und Verfahren zu seiner Herstellung | |
| US3875307A (en) | Flavoring foodstuffs with a mixture containing 1,2 cyclohexanedione | |
| DE2433160A1 (de) | Geschmacks- und aromamaterialien und verfahren zu deren herstellung | |
| EP0021100A1 (de) | Als Einzelverbindungen (I) oder in Form von Gemischen mit (IV) vorliegende Cyclohexenderivate, Verfahren zur Herstellung von (I), Verwendung von (I) bzw. (I+IV) als Riech- und/oder Geschmackstoffe und Riech- und/oder Geschmackstoffkompositionen mit einem Gehalt an (I) bzw. (I+IV) | |
| DE2700688A1 (de) | Carbonylverbindungen, verfahren zu deren herstellung sowie deren verwendung als wuerzstoffe zur beeinflussung des aromas und geschmacks von lebensmitteln, tabak, getraenken und fuer parfuems und parfuemierte artikel | |
| EP0006616B1 (de) | Neues Tiglat, Verfahren zu dessen Herstellung, dessen Verwendung und dieses enthaltende Kompositionen | |
| DE2634077A1 (de) | Als riech- und geschmacksstoff verwendbares spiranderivat | |
| EP0773209B1 (de) | Ungesättigter Ester | |
| DE2610238A1 (de) | Verfahren zur herstellung von riech- und/oder geschmackstoffen | |
| DE2900395A1 (de) | Cyclohexandien-1-yl-1-butanon-derivate, verfahren zu deren herstellung und deren verwendung | |
| EP0195975A2 (de) | Bicyclisches Keton, Verfahren zu dessen Herstellung und Riech- und/oder Geschmackstoffkompositionen mit einem Gehalt an diesem bicyclischen Keton | |
| DE2166810B2 (de) | 5,7-dihydrothieno eckige klammer auf 3,4-b eckige klammer zu pyrazine, verfahren zu deren herstellung und ihre verwendung | |
| DE2028097C3 (de) | Verwendung von Alkoxyalkylpyrazinen zur Herstellung von Parfümzusammensetzungen | |
| DE2365750A1 (de) | Bicyclische verbindungen und ihre verwendung als riech- und/oder aromastoffe |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19820820 |
|
| AK | Designated contracting states |
Designated state(s): CH DE FR GB LI NL |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Designated state(s): CH DE FR GB LI NL |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): CH DE FR GB LI NL |
|
| REF | Corresponds to: |
Ref document number: 3278403 Country of ref document: DE Date of ref document: 19880601 |
|
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) | ||
| ET | Fr: translation filed | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 19920715 Year of fee payment: 11 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19920810 Year of fee payment: 11 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19920817 Year of fee payment: 11 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19920820 Year of fee payment: 11 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19920831 Year of fee payment: 11 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19930820 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Effective date: 19930831 Ref country code: CH Effective date: 19930831 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19940301 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee | ||
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 19930820 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Effective date: 19940429 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19940503 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |