-
Die
Erfindung betrifft ein Medikament zur Behandlung von Fehlregulationen
der Apoptose.
-
Mit
dem Begriff "Apoptose" wird der programmierte
Zelltod oder der zelluläre
Selbstmord bezeichnet.
-
Dieser
Tod entspricht einer Selbsteliminierung der Zellen nach einem bestimmten
Programm.
-
Sie
zeigt sich zunächst
durch Schwellungen auf der Ebene der Plasmamembran, Schwellungen,
die mit einer strukturellen Veränderung
der Membran einhergehen, und anschließend durch einen Volumenverlust der
Zelle, die sich zusammenzuziehen und zusammenzufallen scheint.
-
Der
Kern kondensiert und die DNA spaltet sich in kleine Stücke (Raff, "Nature", 356, 397, 1992;
Bortner et al. "Trends
in Cell. Biol" 5,
21, 1995).
-
In
vivo wird die apoptotische Zelle von den Makrophagen erkannt, die
diese phagozytieren und ohne Beteiligung irgendeines Entzündungsprozesses
vernichten.
-
Ebenfalls
in vivo wird die Apoptose von lebenden Organismen in hohem Maße zur Kontrolle
der Zellpopulationen benutzt, insbesondere der Lymphozyten nach
ihrer Aktivierung.
-
Überdies
spielt die Apoptose im Verlauf der Entwicklung der Organismen eine
wesentliche Rolle bei der Eliminierung von nicht erforderlichen
embryonalen Geweben (Eidechsenschwanz, Anlage der Geschlechtsorgane
des einen oder des anderen Geschlechts) und bei der Formung des
Organismus (Eliminierung der interdigitalen Schwimmhäute zwischen
den künftigen
Fingern und sonstigem).
-
Bestimmte
in lebenden Organismen vorhandene Verbindungen lösen spezifisch ein apoptotisches Phänomen aus.
So wird zum Beispiel bei Säugetieren
durch die Verbindung des Fas-Liganden mit dem Fas-Membranrezeptor,
auch bezeichnet als APO-1 oder CD95, spezifisch eine Apoptose induziert;
diese Apoptose wird vom lebenden Organismus zur Kontrolle der Lymphozytenpopulationen,
insbesondere der T-Lymphozytenpopulationen, benutzt.
-
Der
vorstehend genannte Rezeptor und Ligand stellen ein äußerst interessantes
physiologisches System dar, das an der spezifischen Eliminierung
von Zellen beteiligt ist, die im Organismus nicht mehr erwünscht sind.
-
Insbesondere
ist die Zelleliminierung im Verlauf der Reifung und der Aktivierung
der T-Lymphozyten zu nennen. Das Fas-System, das heißt Fas-Ligand/Fas-Rezeptor,
spielt bei der Homöostase
des Immunsystems eine wesentliche Rolle.
-
Der
Fas-Rezeptor ist ein Mitglied einer Familie von Proteinen, die an
der Oberfläche
der Zellen als Rezeptoren wirken und die auch TNF-Rezeptoren (Tumornekrosefaktor)
und NGF-Rezeptoren (Nervenwachstumsfaktor) umfassen.
-
Der
Fas-Rezeptor ist in zahlreichen Zellen exprimiert; in Höhe des Golgi-Apparates tritt er
gehäuft
auf.
-
Der
Mechanismus, mit dem das Fas-System den Zelltod auslöst, ist
nicht bekannt, er macht jedoch von der Aktivierung der Proteasen
Gebrauch, die auch unter der Bezeichnung ICE-like-Proteasen (Englisch für "interleukine-1 β-converting
enzyme") oder Caspasen
bekannt sind.
-
Es
kann festgehalten werden, dass der Fas-Ligand von den Zellen sekretiert
werden kann, um den eigenen Selbstmord zu induzieren; da sich dieser
Ligand aber auch an der Oberfläche
von Aktivierungszellen befindet, wird durch diese dadurch der Selbstmord
von Zielzellen durch einfachen Kontakt induziert. Nach der Aktivierung
des Fas-Rezeptors interagiert dieser mit zahlreichen intrazellulären Proteinen,
um das die Apoptose auslösende
Signal zu übertragen.
-
In
vitro existieren andere Mittel, um eine Apoptose zu induzieren,
zum Beispiel durch Inhibition der Aktivität bestimmter Kinasen, insbesondere
der Kinase C; in diesem Fall kann Staurosporin eingesetzt werden.
-
Dieses
Produkt ist zur Induzierung des Zelltods durch Apoptose sehr wirksam.
-
Im Übrigen ist
in dem Patent
EP 795 560 ein
Oligosaccharid-Keratansulfat als Wirkstoff beschrieben, der zur
Induzierung einer Apoptose geeignet ist.
-
Es
ist jedoch anzumerken, dass sich die Transduktion der durch das
Staurosporin induzierten Signale von der unterscheidet, bei der
der Fas-Rezeptor beteiligt ist.
-
Wenn
auch die Mittel zur Aktivierung der Apoptose unterschiedlich sind,
so ist die durch diese beiden Aktivierungsarten induzierte Exekution
des Todesprogramms jedoch gleich, die durch eine Aktivierung der Caspase-Kaskade
und einer Störung
der Mitochondrien gekennzeichnet ist, wodurch Verbindungen (zum
Beispiel Cytochrom c) freigesetzt werden, die die programmierte
Zerstörung
der Zelle fördern.
Dieses Phänomen ist
engergieabhängig,
erfordert jedoch nicht die Synthese neuer Proteine. In einer Zelle
steht tatsächlich
alles bereit, um die eigene Zerstörung zu gewährleisten.
-
In
vivo kommt der Regulation des apoptotischen Phänomens eine erhebliche Bedeutung
zu.
-
Mit
dessen Fehlregulation stehen nämlich
zahlreiche Erkrankungen in Zusammenhang.
-
Es
können
zum Beispiel zwei Fälle
von Fehlregulationen der Apoptose genannt werden, bei denen diese über das
Pas-System moduliert wird: Es handelt sich um Autoimmunkrankheiten,
bei denen die Apoptose fehlerhaft ist, und um die Zerstörung von
HIV-1 infizierten CD4+ T-Lymphozyten, in denen die Aktivität der Apoptose
zu hoch ist.
-
In
anderen Fällen,
wie den neuronalen Degenerationen, die zum Beispiel bei der multiplen
Sklerose auftreten, wird die Apoptose über noch nicht bekannte Wege
aktiviert.
-
Es
existieren weitere Erkrankungen, bei denen die Apoptose fehlerhaft
ist; diesbezüglich
kann die Akkumulation von Krebszellen genannt werden, deren Apoptose
vom Fas-System abzuhängen
scheint ("Green", Science, vol. 278,
1246, 1997).
-
In
Anbetracht der vorstehend getroffenen Feststellungen kam der Anmelderin
der Verdienst zu, herauszufinden, dass ab dem Augenblick, in dem
ein Medikament verfügbar
ist, das sich zur Modulierung der Fehlregulationen der Apoptose
sowohl hinsichtlich einer Aktivierung bei Erkrankungen, die Autoimmunkrankheiten
und Krebserkrankungen einschließen,
als auch hinsichtlich deren Inhibition bei Erkrankungen, die AIDS-Erkrankungen
einschließen,
eignet, eine Bekämpfung
dieser Erkrankungen möglich
wäre.
-
Und
es war ihr nicht weniger großer
Verdienst, herauszufinden, dass gewisse oligosaccharidsche und monosaccharidische
Substanzen, die gegebenenfalls auf wenigstens einigen ihrer Einheitsmotive
zumindest einen Substituenten der Klasse aufweisen, die die funktionellen
Gruppen Sulfat, Methyl und Acetyl umfasst, sich dazu eigneten, Fehlregulationen
der Apoptose zu modulieren.
-
Gegenstand
der Erfindung ist daher ein Medikament, dass dadurch gekennzeichnet
ist, dass es als Wirkstoff eine wirksame Menge von mindestens einer
oligosaccharidischen Substanz aufweist, die dazu geeignet ist, Fehlregulationen
der Apoptose zu modulieren, und gegebenenfalls auf wenigstens einigen
ihrer Einheitsmotive zumindest einen Substituenten der Klasse aufweist,
die die funktionellen Gruppen Sulfat, Methyl und Acetyl umfasst,
wobei die Substanz ausgewählt
ist aus der Klasse, umfassend
- – Oligosaccharide,
die auf enzymatischem oder chemischem Weg von Polymeren der Klasse
abgeleitet sind, die β-1-3-Glukane
umfasst, die gegebenenfalls β-1-6-Verzweigungen aufweisen,
- – Oligosaccharide,
die auf enzymatischem oder chemischen Weg von Carrageenanen, Agaren
und Porphyranen abgeleitet sind.
-
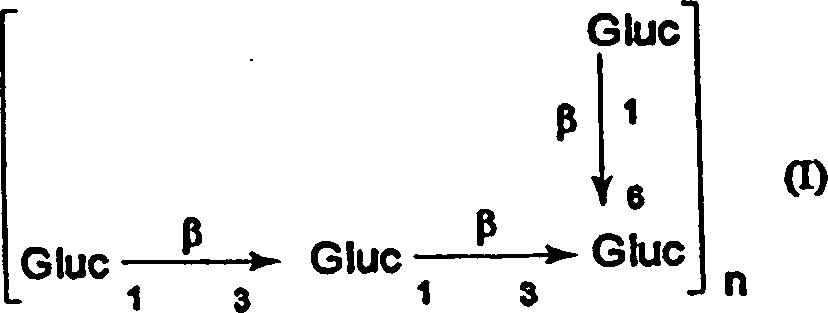
Gemäß einer
vorteilhaften Ausführungsform
weist das erfindungsgemäße Medikament
als Wirkstoff eine wirksame Menge von mindestens einem Oligosaccharid
auf, das dazu geeignet ist, Fehlregulationen der Apoptose zu modulieren,
und das der Formel
entspricht, in welcher n
eine ganze Zahl von 1 bis 50, vorzugsweise von 5 bis 10, darstellt,
und in welcher die Zahl der Verzweigungen von 0 bis 3 pro Wiederholungseinheit
variiert.
-
Gemäß einer
anderen vorteilhaften Ausführungsform
weist das erfindungsgemäße Medikament
als Wirkstoff eine wirksame Menge von mindestens einem sich wiederholenden
Disaccharid (Repetier – Disaccharid)
auf, das dazu geeigent ist, Fehlregulationen der Apoptose zu modulieren,
und das der Formel
entspricht, in welcher n
eine ganze Zahl von 1 bis 50 ist, vorzugsweise von 1 bis 20, wobei
mindestens einige der sich wiederholenden Disaccharide der Formel
(II) eine oder mehrere Sulfat-Gruppen aufweisen können.
-
Gemäß einer
anderen vorteilhaften Ausführungsform
weist das erfindungsgemäße Medikament
als Wirkstoff eine wirksame Menge des Produkts auf, das dazu geeignet
ist, die Apoptose wenigstens teilweise zu inhibieren, und das durch
Hydrolyse von Natrium-Jota-Carrageenat
erhalten wird, wobei dieses Produkt aus einem Gemisch aus Oligo-Jota-Carrageenanen, bezeichnet
als I9, gebildet wird, dessen Gesamtgehalt
an Monosacchariden (bestimmt nach Tillmans und Philippi) 62% beträgt und dessen
durch Polyacrylamid-Gelelektrophorese
nach Zablakis und Perez bestimmtes Größenverteilungsprofil lautet:
-
-
Die
vorstehend genannten Methoden sind beschrieben in "Botanica marina", 33, 273–276 (1990)
hinsichtlich Zablakis E. & Perez
J., und in "Biochem.
Z.", 215, 30–60 (1930)
hinsichtlich Tillmans J. & Philippi
K.
-
Zur
Herstellung des Produkts I9 kann, wie nachstehend
beschrieben, verfahren werden.
-
Das
Jota-Carrageenan wird in Gegenwart des teilweise gereinigten Jota-Carrageenase-Enzyms
bei einer Temperatur von 45–50°C inkubiert,
anschließend
werden die Hydrolyse-Produkte über
einer Membran von 10.000 Da ultrafiltriert. Man erhält somit
das Produkt I9.
-
Das
Jota-Carrageenan-Polymer wird insbesondere durch eine im Stamm Escherichia
coli überexprimierte,
rekombinante Jota-Carrageenase hydrolysiert.
-
Die
Herstellung des Enzyms erfolgt durch Auflösung des Bakterienüberstandes
(entspricht 1 Liter Kultur) in 50 ml Pufferlösung Tris 10 mM pH 7,5, 100
mM NaCl, 5 mM CaCl2, so dass man schließlich 500
U/ml erhält.
-
Praktisch
betrachtet, werden 100 g Jota-Carrageenan-Substrat in 20 l Wasser
aufgelöst,
das (bei 80°C)
heiß destilliert
wird, um eine Konzentration von 5 g/l zu erhalten, anschließend wird
der pH-Wert mit Ammoniumcarbonat auf 7,5 eingestellt.
-
Zur
Durchführung
der Hydrolyse wird das Enzym zu 50 U/g Polymer hinzugegeben. Die
kontinuierliche Ultrafiltration beginnt nach 30 Minuten; es handelt
sich um eine tangentiale Ultrafiltration.
-
Für diese
tangentiale Ultrafiltration kann ein Gerät der Marke Pellicon mit einer
Filterkassette von 10.000 Da 0,46 m2 PTGC
der Firma Millipore verwendet werden; dieses Gerät wird mit einem Eingangsdruck von
2 bar und einem Ausgangsdruck von 0,5 bar geregelt.
-
Der
Filtratablauf ist teilweise geschlossen, um die Filtrierdurchflussmenge
bei 1 Liter pro Stunde zu halten.
-
Die
Eigenschaften des Reaktionsraums sind so gewählt, dass eine Versorgung des
Enzyms mit Substrat bis zum Aufbrauch der 20-Liter-Lösung und
die Aufrechterhaltung eines festen Volumens von 2 Litern möglich ist.
-
Man
erhält
18 l eines Ultrafiltrats, das durch Rotationsverdampfung bis auf
1 Liter konzentriert wird; anschließend wird das Konzentrat gefriergetrocknet.
Die auf diese Weise gewonnene Trockensubstanz enthält das Produkt
I9.
-
Die
somit gewonnenen Oligo-Carrageenane der Fraktion I9 wurden
einer zusätzlichen
Fraktionierung durch Niederdruck-Chromatographie über einer
Biogel-P6-Säule
und anschließend über einer
Sephadex-G10-Säule
unterzogen.
-
Man
erhält
somit die weiter oben bestimmten Fraktionen.
-
Gemäß einer
anderen vorteilhaften Ausführungsform
weist das efindungsgemäße Medikament
als aktiven Wirkstoff eine wirksame Menge des Produkts auf, das
dazu geeignet ist, die Apoptose wenigstens teilweise zu inhibieren,
und das aus der Fraktion DP 7 des Produkts I9 gebildet
wird.
-
Gemäß einer
anderen vorteilhaften Ausführungsform
weist das erfindungsgemäße Medikament
als Wirkstoff eine wirksame Menge des Produkts auf, das dazu geeignet
ist, die Fehlregulationen der Apoptose zu aktivieren, und das durch
wässrig-saure
Extraktion aus einer als Laminaria digitata bezeichneten Braunalge gewonnen
wird, wobei dieses Produkt durch ein Gemisch aus Oligo-β-1-3-Glucanen,
bezeichnet als L11, gebildet wird und 1
bis 50, vorzugsweise 20 bis 30 Saccharid-Einheiten aufweist, wobei
das besagte Produkt das in 1 dargestellte
NMR-Spektrum zeigt.
-
Es
ist anzumerken, dass das Produkt L11 auch
durch wässrige
Extraktion allgemein aus Braunalgen gewonnen werden kann, von denen
Laminaria digitata ein Vertreter ist.
-
Die
Herstellung des Produkts L11 kann, wie nachstehend
beschrieben, erfolgen.
-
Zu
300 g frischen Algen vom Typ Laminaria digitata, die im August in
frischer oder trockener Form geerntet wurden, wird nach und nach
1 l 0,3%iger Schwefelsäure
zugegeben.
-
Der
Vorgang erfolgt im Wasserbad bei einer Temperatur von etwa 70°C für die Dauer
von 2 Stunden und 30 Minuten unter Rühren.
-
Dieser
Vorgang wird zweimal wiederholt.
-
Das
gewonnene Extrakt wird durch Filtration über einem Filter mit einer
Porosität
von 1,2 μm
geklärt.
-
Die
sich aus dieser Filtration ergebende Flüssigkeit wird einer tangentialen
Ultrafiltration über
einer Membran mit einer Porosität
von 50.000 Dalton unterzogen.
-
Die
Ultrafiltration wird bei einem gleich bleibenden Druck von 1 bar
durchgeführt.
-
Man
erhält
auf diese Weise ein Ultrafiltrat, dessen pH-Wert auf 5,5 gebracht
wird und das ein Volumen von etwa 0,8 Liter aufweist. Dieses Ultrafiltrat
wird einer Dialyse über
einer Membran aus Celluloseester mit einer Porosität von 500
Dalton unterzogen.
-
Man
erhält
ein Dialysat, das durch Verdampfung bei einer Temperatur von 80°C mit Hilfe
einer Vorrichtung vom Typ ROTOVAPOR auf ein Volumen von 100 ml konzentriert
und anschließend
gefriergetrocknet wird.
-
Man
erhält
7 g eines cremefarbenen Pulvers, das das Produkt L11 darstellt.
-
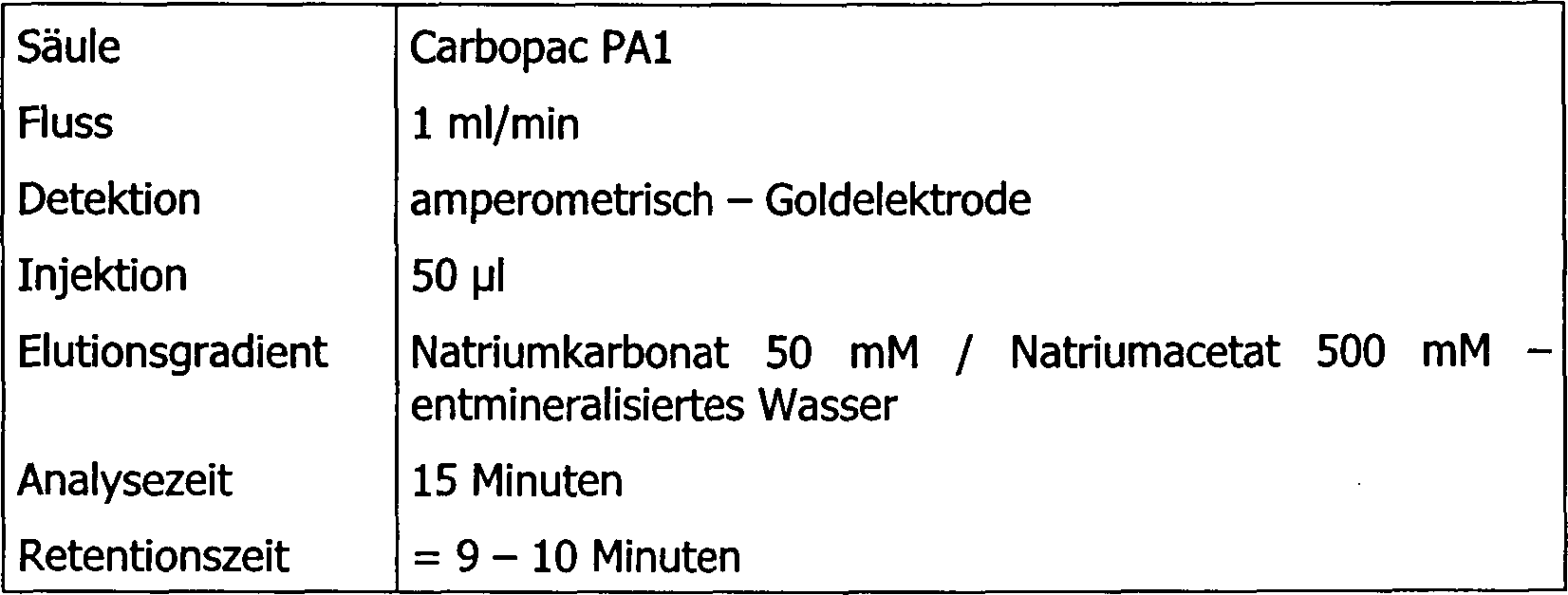
Eine
Analyse durch Ionenchromatographie in Verbindung mit Amperometrie,
unter Verwendung eines von der Firma DIONEX vertriebenen Ionenaustauscher-Harzes,
zeigt, dass die Oligo-β-1-3-Glukane,
aus denen dieses Pulver gebildet ist, tatsächlich 1 bis 50, vorzugsweise
20 bis 30 Saccharid-Einheiten haben.
-
Mit
den folgenden Chromatographie-Bedingungen (Verfahren bezeichnet
als HPLC, d. h. Hochdruck-Flüssigkeitschromatographie):
erhält man die
Kurve, die in
16 dargestellt ist und die das
Produkt L
11 kennzeichnet.
-
Die
Untersuchung des 13C NMR-Spektrums des Produkts
L11, das auf der Grundlage einer Lösung von 80
mg/ml in D2O ausgeführt wird und in 1 dargestellt
ist, zeigt ein Gerüst
des β-D-(1→3)-Glukans,
dessen Resonanzen der verschiedenen Kohlenstoffe im Vergleich zu
den Werten aus der Literatur [vgl. Williams et al., 1992 "Development of a
water-soluble, sulfated (1→3)-β-D-glucan
biological response modifier derived from Saccharomyces cerevisiae", Carbohydr. Res.
235: 247: 25] identifiziert werden konnten (diese sind nachstehend
in Tabelle I zusammengefasst).
-
-
Die
vorstehend bezeichneten erfindungsgemäßen Medikamente umfassen Adjuvantien
herkömmlicher
Formulierungen, die der für
diese gewählten
Verabreichungsart und Dosierung entsprechen.
-
Gegenstand
der Erfindung ist auch ein Verfahren zur Herstellung eines Medikaments
zur Behandlung von Fehlregulationen der Apoptose, das dadurch gekennzeichnet
ist, dass es in einer galenischen Zusammensetzung mindestens einen
der vorstehend identifizierten Wirkstoffe aufweisen muss.
-
Gemäß einer
vorteilhaften Ausführungsform
ist diese galenische Zusammensetzung für eine intravenöse Verabreichung
geeignet.
-
Die
Erfindung betrifft auch die Verwendung, zur Herstellung eines Medikaments
zur Behandlung von Fehlregulationen der Apoptose, von saccharidischen
Substanzen der Klasse, umfassend Oligosaccharide, die auf enzymatischem
oder chemischem Weg von Polymeren der Klasse abgeleitet sind, die β-1-3-Glukane
umfasst, die gegebenenfalls β-1-6-Verzweigungen aufweisen,
und Oligosaccharide, die auf enzymatischem oder chemischem Weg von
sulfatierten Galaktanen, insbesondere Carrageenanen, Agaren und
Porphyranen abgeleitet sind.
-
Insbesondere
betrifft sie die Verwendung von Oligosacchariden der Formel (I)
und denen der Formel (II) zur Herstellung eines Medikaments zur
Behandlung von Fehlregulationen der Apoptose.
-
Vor
allem aber auch betrifft sie die Verwendung der als I9 und
L11 bezeichneten Produkte und der Fraktionen
DP 2 und DP 7 des Produkts I9 zur Herstellung
von Medikamenten zur Behandlung von Fehlregulationen der Apoptose.
-
Die
Erfindung wird durch die nachstehende zusätzrliche Beschreibung und die
Beispiele verdeutlicht, die keineswegs einschränkend sind, sondern vorteilhaften
Ausführungsformen
entsprechen.
-
Bei
den nachstehend beschriebenen Versuchen wurde mit Zellkulturen gearbeitet,
in denen ein apoptotischer Prozess durch Einsatz des Fas-Systems
oder von Staurosporin ausgelöst
wurde; anschließend
wurden die Modulationswirkungen untersucht, die mit den Produkten
erzielt werden konnten, die den Wirkstoff der erfindungsgemäßen Medikamente
bilden.
-
Im
Rahmen dieser Versuche wurden zum einen die Wirkstoffmengen bestimmt,
die zur Erzielung der gewünschten
Wirkung bei der Modulation der Apoptose geeignet sind, und zum anderen
wurde der bzw. wurden die Zeitpunkte bestimmt, zu dem bzw. denen
die Verabreichung des Wirkstoffs oder des diesen enthaltenden Medikaments
zu erfolgen hat, um die gewünschte
Modulationswirkung zu erzielen.
-
BEISPIEL 1
-
Es
wurde eine Kultur von genetisch modifizierten murinen Fibroblasten
verwendet, um den Humanrezeptor Fas konstitutiv zu exprimieren;
der getestete Wirkstoff war das als I9 bezeichnete
Produkt.
-
Bei
einem vorangehenden Versuch zeigte sich, dass die murinen Fibroblasten
durch Apoptose zerstört werden,
wenn sie entweder mit dem Fas-Liganden oder einem agonistischen
Antikörper,
der den Fas-Rezeptor erkennt und nachstehend mit FasAb bezeichnet
ist, zusammengebracht werden.
-
Bei
einem anderen vorangehenden Versuch wurde festgestellt, dass das
Produkt I9 das Zellwachstum nicht beeinträchtigt,
dass es gegenüber
den murinen Fibroblasten in den verwendeten Konzentrationen nicht toxisch
ist, und dass es somit einem Zellkulturmedium problemlos hinzugegeben
werden kann.
-
Bei
dem für
die Kultur der murinen Fibroblasten verwendeten Kulturmedium handelt
es sich um das von der Firma Life Technologies unter dem Namen "Dulbecco's Modified Eagle
Medium" vertriebene
Medium; dieses Kulturmedium ist beschrieben in "Virology" 8, 396 (1959) von Dulbecco et al.
-
Diesem
Kulturmedium wurden 5 Vol.-% eines aus Kälberföten gewonnenen Serums hinzugegeben.
-
Dieses
Medium wurde anschließend
mit murinen Fibroblasten in Anwesenheit einer ausreichenden Menge
Antibiotika beimpft, um Kontaminationsmöglichkeiten auszuschließen; die
Konzentration der Fibroblasten im Kulturmedium lag bei 105 Zellen pro ml Kulturmedium.
-
Die
Kultur erfolgte im Inneren eines Brutschranks, in dem die Temperatur
bei 37°C
gehalten wurde, wobei die im Brutschrank herrschende Atmosphäre 5% CO2 enthielt.
-
Nach
einer Inkubation von 24 Stunden wurde dem Kulturmedium entweder
der Fas-Ligand oder der FasAb direkt hinzugegeben.
-
Die
zugegebene FasAb-Menge betrug 50 μg
pro ml Kulturmedium.
-
Unter
diesen Bedingungen werden etwa 70% der Zellen der Kultur nach einer
Inkubation von etwa 24 Stunden durch Apoptose zerstört.
-
Diese
Zerstörung
wird durch Färbung
der überlebenden
Zellen mit Kristallviolett sichtbar gemacht.
-
Anschließend wurde
eine gewisse Anzahl von en durchgeführt, die dazu bestimmt waren,
die Wirkung des Wirkstoffes aufzuzeigen.
-
Bei
diesen Versuchen wurde zum einen die Konzentration verändert, in
der der Wirkstoff dem Kulturmedium zugegeben wurde, und zum anderen
wurde der Zeitpunkt verändert,
in dem der Wirkstoff diesem Medium zugegeben wurde, um die optimalen
Konzentrationen des Wirkstoffs sowie den bzw. die günstigsten
Zeitpunkte der Zugabe des Wirkstoffs in Bezug auf die Hinzufügung von
FasAb zu ermitteln.
-
Die
Wirkstoffkonzentrationen variierten von 0,001 bis 2 mg pro ml.
-
Untersucht
wurde nacheinander die Wirkung, die erzielt wurde, wenn der Wirkstoff
zunächst
vor, dann gleichzeitig mit und schließlich nach dem FasAb zugegeben
wurde.
-
In
einem ersten Versuch wurde der Wirkstoff 24 Stunden vor dem FasAb
hinzugegeben.
-
Im
Rahmen dieses Versuchs wurde festgestellt, welche Wirkung erzielt
wurde, wenn nacheinander 0, dann 5, dann 10, dann 50, dann 100 und
schließlich
500 ng FasAb pro ml Kultur und in jedem Fall nacheinander Wirkstoffkonzentrationen
von 0,25, dann 0,5 und schließlich
1 mg pro ml Nährkultur
verwendet wurden, wobei selbstverständlich auch die Wirkung verzeichnet
wurde, die in Abwesenheit des Wirkstoffes, das heißt bei einer
Konzentration von 0%, erzielt wurde.
-
Nach
einer Inkubation von 24 Stunden wurde eine Überlebensanalyse durchgeführt.
-
Das
Ergebnis dieser Analyse ist in dem Histogramm in 2 dargestellt.
-
Auf
der Abszisse dieses Histogramms ist die in ng/ml ausgedrückte Konzentration
von FasAb im Kulturmedium und auf der Ordinate die in Prozent wiedergegebene Überlebensrate
aufgeführt.
-
Für jede FasAb-Konzentration
ist die Überlebensrate
für jede
der vier Wirkstoffkonzentrationen, also 0 mg/ml, 0,25 mg/ml, 0,5
mg/ml und 1 mg/ml, durch vier zur Ordinate parallele Rechtecke dargestellt,
wobei die Standardabweichung jedes Mal durch ein Segment über dem
jeweiligen Rechteck parallel zur Ordinate gekennzeichnet ist.
-
Das
0 mg/ml Wirkstoff entsprechende Rechteck ist jedes Mal ganz links,
rechts davon das 0,25 mg/ml Wirkstoff entsprechende, rechts von
dem vorangehenden das 0,5 mg/ml entsprechende und so weiter angeordnet.
-
Die
vier Rechtecke sind jedes Mal durch Kreuzschraffuren, Punktierungen
oder spezielle Schraffuren gekennzeichnet.
-
Die
Untersuchung der auf diese Weise in dem Histogramm in 2 zusammengefassten
Ergebnisse zeigt, dass in Abwesenheit des Wirkstoffs die Überlebensrate
mit Zunahme der FasAb-Konzentration abnimmt, und dass diese Überlebensrate
durch die Zugabe des Wirkstoffs deutlich verbessert wird.
-
In
einem zweiten Assay wurde dem Kulturmedium der FasAB und der Wirkstoff
gleichzeitig hinzugegeben.
-
Bei
diesem zweiten Assay wurde festgestellt, welche Wirkung erzielt
wurde, wenn nacheinander die gleichen FasAb- und Wirkstoffkonzentrationen
wie bei dem ersten Assay verwendet wurden.
-
Nach
einer Inkubation von 24 Stunden wurde eine Überlebensanalyse durchgeführt.
-
Die
erzielten Ergebnisse sind in dem Histogramm in 3 zusammengefasst,
das nach den gleichen Prinzipien wie den in 2 dargelegten
aufgebaut ist.
-
Die
Untersuchung dieser Ergebnisse zeigt, dass sich die Überlebensrate
analog zu der im ersten Assay festgestellten entwickelt.
-
In
einer dritten Assayreihe wurde der Wirkstoff nach FasAb zugegeben,
und zwar nacheinander
zunächst
1 Stunde nach FasAb,
dann 3 Stunden nach FasAb und
schließlich 6
Stunden nach FasAb,
wobei die FasAb-Konzentration stets von
0 bis 500 ng pro ml Kulturmedium variierte.
-
Bei
der Zugabe des Wirkstoffs 1 Stunde nach dem FasAb
- – sind in
dem Histogramm in 4 die Ergebnisse aufgeführt, die
für I9-Konzentrationen von 0 mg/ml, 0,005 mg/ml,
0,01 mg/ml und schließlich
0,05 mg/ml festgestellt wurden;
- – sind
in dem Histogramm in 5 die Ergebnisse aufgeführt, die
für I9-Konzentrationen von 0 mg/ml, 0,1 mg/ml,
0,25 mg/ml und schließlich
0,5 mg/ml festgestellt wurden; und
- – sind
in dem Histogramm in 6 die Ergebnisse aufgeführt, die
für I9-Konzentrationen von 0 mg/ml, 0,25 mg/ml,
0,5 mg/ml und schließlich
1 mg/ml festgestellt wurden.
-
Die
Histogramme der 4 bis 6 sind nach
den selben Prinzipien wie den in 2 dargelegten aufgebaut.
-
Im
Falle der Zugabe des Wirkstoffs 3 Stunden nach der Zugabe von FasAb
sind in dem Histogramm in 7 die Ergebnisse
aufgeführt,
die für
I9-Konzentrationen von 0 mg/ml, 0,25 mg/ml,
0,5 mg/ml und 1 mg/ml festgestellt wurden.
-
Im
Falle der Zugabe des Wirkstoffs 6 Stunden nach Zugabe des FasAb
sind in dem Histogramm in 8 die Ergebnisse
aufgeführt,
die für
I9-Konzentrationen von 0 mg/ml, 0,25 mg/ml,
0,5 mg/ml und 1 mg/ml festgestellt wurden.
-
Die
Histogramme der 7 und 8 sind nach
den selben Prinzipien wie den in 2 dargelegten aufgebaut.
-
Die
Untersuchung aller in den Histogrammen der 4 bis 8 aufgeführten Ergebnisse
zeigt, dass die Überlebensrate
stets zunimmt, wenn die Zugabe des Wirkstoffes nach der Zugabe von
FasAb erfolgt. Nimmt die Zeit, die zwischen den aufeinanderfolgenden
Zugaben von FasAb und des Wirkstoffs liegt, zu, dann nimmt diese
Wirkung jedoch eher immer ab. Sie reagiert im Übrigen auf die Wirkstoffkonzentration,
wenn diese unter 0,25 mg/ml liegt. Für Konzentrationen über 0,25
mg/ml sind keine merklichen Verbesserungen zu erzielen.
-
Bei
dem eben beschriebenen wird die Apoptose durch das FasAb-System
induziert.
-
Es
wurde ein weiteres Assay durchgeführt, indem die Apoptose durch
den Kinase-Inhibitor Staurosporin induziert wird.
-
Es
wird nochmals darauf hingewiesen, dass das Staurosporin bei Dosierungen
von 0,5 bis 5 μM
im Fall der meisten Zellen einen apoptotischen Tod induziert.
-
Bei
diesem Versuch erfolgte die Zugabe von Staurosporin und I9 gleichzeitig.
-
Es
wurden zwei I9-Dosierungen verwendet, nämlich 0,2
mg/ml und 0,5 mg/ml.
-
Das
Staurosporin wurde in einer Menge von 0,5 μM, dann von 1 μM und schließlich von
1,5 μM eingesetzt.
-
Die Überlebensrate
der behandelten Zellen wurde in jedem Fall nach einer Inkubation
von 18 Stunden ermittelt.
-
Die
erzielten Ergebnisse sind in dem in 9 dargestellten
Histogramm aufgeführt,
das die in % ausgedrückte Überlebensrate
in Abhängigkeit
von der Staurosporin-Konzentration
und für
die vorstehend genannten I9-Dosierungen
zeigt.
-
Ein
Kontroll-Versuch wurde für
eine Staurosporin-Konzentration von 0 μM durchgeführt.
-
Die
Untersuchung der in dem Histogramm aufgeführten Ergebnisse zeigt, dass
die durch das Staurosporin induzierte Apoptose durch den Einsatz
von I9 abgeschwächt wird.
-
Aus
den beiden beschriebenen Assays ergibt sich, dass durch das erfindungsgemäße Medikament eine
signifikante Abschwächung
der Apoptose erzielt werden kann, wenn diese durch verschiedene
Agenzien induziert wird.
-
BEISPIEL 2
-
Bei
diesem Beispiel handelte es sich bei der untersuchten Zellkultur
um eine Kultur aus immortalisierten Humanzellen, die aus T-Lymphozyten
(Typ Jurkat) gebildet sind.
-
Bei
dem verwendeten Kulturmedium handelt es sich um das von der Firma
Life Technologies unter dem Namen "RPMI 1640 Medium" verwendete Medium; dieses Kulturmedium
ist von Moore et al. in der Publikation "A. M. A." 199, 519 (1967) beschrieben.
-
Diesem
Kulturmedium werden 10 Vol.-% eines Kälberfötenserums und Antibiotika zum
Ausschluss möglicher
Kontaminationen hinzugegeben.
-
Dieses
Kulturmedium wird mit einer Menge von 106 T-Lymphozyten
pro ml Medium beimpft.
-
Die
Inkubationstemperatur beträgt
37°C und
die im Brutschrank herrschende Atmosphäre enthält 5% CO2.
-
Nach
einer Inkubation von 24 Stunden werden der FasAb und der Wirkstoff
gleichzeitig hinzugegeben.
-
Die
beigefügte
Menge von FasAb (hergestellt von der Firma Upstate Biotechnology
und von der Firma Euromedex unter der Katalognummer 05-201 vertrieben)
beträgt
50 ng pro ml Kulturmedium.
-
Der
Wirkstoff wird nacheinander durch das Produkt I9 und
das Produkt L11 gebildet.
-
Die
verwendeten Mengen betragen in jedem Fall 0,5 mg/ml.
-
Die Überlebensanalyse
wird 18 Stunden nach Beginn des Versuchs durchgeführt.
-
Diese Überlebensanalyse
besteht darin, ein Kulturvolumen mit 104 Zellen
ein Gerät
durchlaufen zu lassen, in der Art durchflusszytometrisch arbeitender
Geräte,
in diesem Fall ein Gerät,
das von der Firma Beckton Dickinson unter dem Namen "FAC Scan cytometer" vertrieben wird.
-
Dieses
Gerät verwendet
eine Sonde, mit der nachwiesen werden kann, ob sich an der Oberfläche der Zellen
Phosphatidylserin befindet; das Vorhandensein dieses Produktes zeigt,
dass die betreffenden Zellen apoptotisch sind.
-
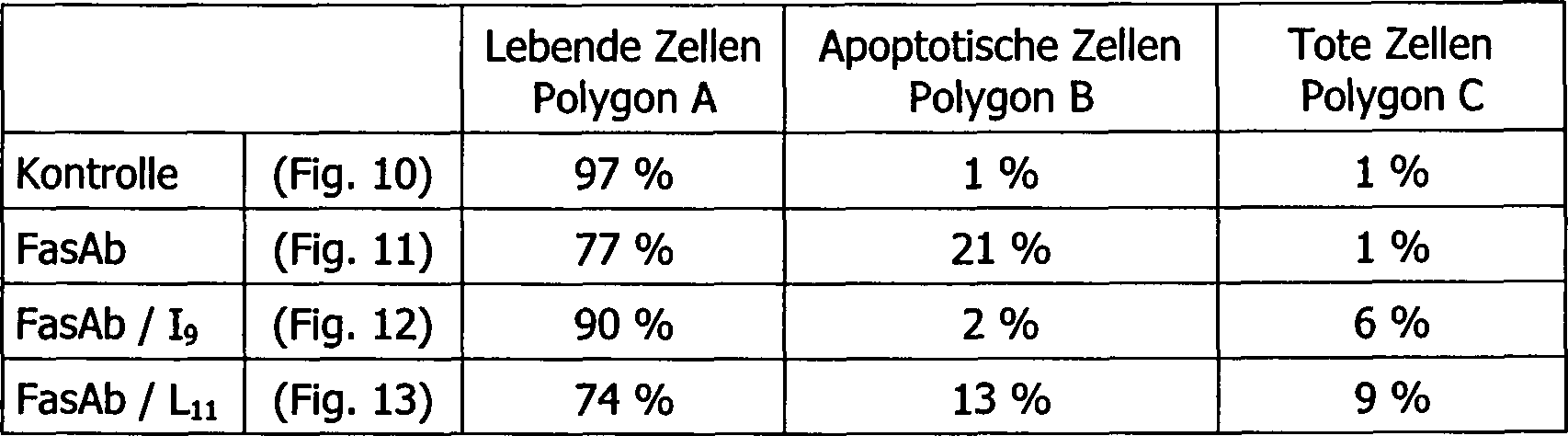
Die
Ergebnisse dieser Analyse sind in den 10 bis 13 aufgeführt, in
denen jeweils drei Polygone, A, B und C, dargestellt sind, deren
Konturen so definiert sind, dass sie für unterschiedliche Zellpopulationen
repräsentativ
sind. Polygon A umschließt
eine Gesamt- Einheit
aus lebenden Zellen, Polygon B eine Gesamtheit aus apoptotischen
Zellen und Polygon C eine Gesamtheit aus toten Zellen.
-
In
der nachfolgenden Tabelle II ist der Prozentsatz der lebenden Zellen,
der apoptotischen Zellen und der toten Zellen für jede der 10 bis 13 aufgeführt, die
nachstehend erläutert
werden.
-
-
10 zeigt
die Überlebensanalyse,
die an einer Probe eines Kulturmediums durchgeführt wurde, dem weder FasAb
noch ein Wirkstoff zugegeben wurde; es handelt sich hierbei um eine
Kontrolle. In diesem Fall ist zu erkennen, dass es im Wesentlichen
nur lebende Zellen gibt, die sich im Polygon A befinden (vgl. Zeile
1, Tabelle II).
-
11 zeigt
die Überlebensanalyse,
die an einer Probe eines Kulturmediums durchgeführt wurde, dem nur der FasAb
zugegeben wurde. In diesem Fall ist zu erkennen, dass das Polygon
B 21% apoptotische Zellen enthält
(vgl. Zeile 2, Tabelle II).
-
12 zeigt
eine Überlebensanalyse,
die an einer Probe eines Kulturmediums durchgeführt wurde, dem gleichzeitig
der FasAb und der Wirkstoff I9 (0,5 mg/ml)
zugegeben wurde. In diesem Fall ist zu erkennen, dass das Polygon
B praktisch keine apoptotischen Zellen (2%) enthält, während das Polygon A viele lebende Zellen
und das Polygon C eine gewisse Konzentration (6%) toter Zellen enthält (vgl.
Zeile 3, Tabelle II).
-
13 zeigt
eine Überlebensanalyse,
die an einer Probe eines Kulturmediums durchgeführt wurde, dem gleichzeitig
der FasAb und der Wirkstoff L11 (0,5 mg/ml)
zugegeben wurden. In diesem Fall ist zu erkennen, dass das Polygon
B eine große
Menge (13%) apoptotischer Zellen enthält und das Polygon C eine nicht unbedeutende
Menge (9%) toter Zellen (vgl. Zeile 4, Tabelle II).
-
Aus
den Schlüssen,
die bei eingehender Betrachtung der 10 bis 13 und
aus der Analyse des Prozentsatzes der in den einzelnen Polygonen
vorhandenen Zellen gezogen werden können, ergibt sich folglich,
dass der Wirkstoff I9 im Rahmen dieses s
die FasAb-Apoptose hemmt (die Zahl der apoptotischen Zellen sinkt
von 21% auf 2%). Allerdings ist eine leichte Zunahme der Anzahl
toter Zellen festzustellen (Zunahme von 1% auf 6%). Berücksichtigt
man die Anzahl lebender Zellen, ist ein Schutz in Höhe von 13%
festzustellen (Zunahme von 77% auf 90%).
-
Was
den Wirkstoff L11 anbelangt, so ist im Vergleich
zu der durch den FasAb alleine hervorgerufenen Wirkung eine Zunahme
der Anzahl toter Zellen (Zunahme von 1% auf 9%) zu beobachten. Durch
den Wirkstoff L11 wird demnach eine Zunahme
des Zelltods bewirkt, obgleich er auf die Anzahl lebender Zellen
keine große Auswirkung
hat.
-
Zur
Optimierung der Wirkung des L11 wurden die
nachfolgenden Assays durchgeführt.
-
Bei
Verwendung der gleichen Kultur wie vorstehend beschrieben, wurden
verabreicht:
- – in einem ersten Assay 50
ng/ml FasAb alleine (Herkunft: Euromedex, wie weiter oben bezeichnet),
- – in
einem Assay Versuch die gleiche Menge FasAb gleichzeitig mit 0,5
mg/ml des Produkts L11 und
- – in
einem dritten Assay 0,5 mg/ml des Produkts L11 und
anschließend,
24 Stunden später,
50 ng/ml des gleichen FasAb.
-
Im
Vergleich zu dem bei einer Kontrolle-Kultur ohne Zugabe von FasAb
und L11 festgestellten Ergebnis wurden nach
einer Inkubation von 18 Stunden die folgenden Ergebnisse erzielt,
wobei als herangezogene Größe die Anzahl
lebender Zellen diente:
- • bei Zugabe von FasAb alleine
nimmt die Anzahl lebender Zellen um 3,6% ab,
- • bei
gleichzeitiger Zugabe von FasAb und L11 nimmt
die Anzahl lebender Zellen um 6,4% ab, und
- • bei
der zeitversetzten Zugabe von FasAb und L11 nimmt
die Anzahl lebender Zellen um 13,7% ab.
-
Hieraus
folgt, dass L11 wesentlich wirksamer ist,
wenn es vor dem FasAb verabreicht wird.
-
Es
wird darauf hingewiesen, dass analoge Ergebnisse erzielt wurden,
wenn der vorstehend bezeichnete FasAb durch einen FasAb anderer
Herkunft ersetzt wurde, der von der Firma Alexis Corporation (San
Diego, USA) hergestellt und von der Firma Coger SA (Paris) vertrieben
wird.
-
Die
Untersuchung der Ergebnisse der vorstehend beschriebenen Assays
zeigt, dass die Apoptose durch ein Medikament auf der Grundlage
des Produkts L11 verstärkt werden kann; sein Einsatz
bei der Behandlung von Autoimmun- oder Krebserkrankungen kann daher
in Betracht gezogen werden.
-
Bei
weiteren Assays konnten die Wirkungen überprüft werden, die durch die Verabreichung
des Produkts I9 zum einen bei Lymphozytenkulturen,
bei denen eine Fas- Apoptose
geringer Intensität
induziert wurde, und zum anderen bei Lymphozytenkulturen, bei denen
eine Fas-Apoptose hoher Intensität
induziert wurde, hervorgerufen wurden.
-
Die
Fas-Apoptose geringer Intensität
kann durch Verwendung eines FasAb der Firma Euromedex induziert
werden; eine derartige Apoptose kann in der Größenordnung von 3 bis 10% liegen.
-
Die
Fas-Apoptose hoher Intensität
kann durch Verwendung eines FasAb der Firma Alexis Corporation induziert
werden; eine derartige Apoptose kann in der Größenordnung von 20 bis 50% liegen.
-
Die
unter Verwendung einer Dosis von 0,2 mg/ml des Produkts I9 durchgeführten Assays sind in 14 dargestellt,
die die festgestellten Wirkungen zeigt, das heißt entweder die Stimulation
oder die Inhibition der Apoptose (ausgedrückt in %) in Abhängigkeit
von der Intensität
(in %) der durch den FasAb alleine induzierten Apoptose (Konzentrationen
von 50 bis 200 ng/ml).
-
14 zeigt,
dass
- • im
Falle von Apoptosen mit einer geringen Intensität in der Größenordnung von 3 bis 10%, dargestellt
auf der Abszisse mit den Punkten a, b, e, d, e, f, g, h, i, die
Verabreichung von I9 im Vergleich zu der
durch den FasAb alleine induzierten Apoptose eine Verstärkung der
Apoptose um 20 bis 40% bewirkt, und
- • im
Falle von Apoptosen mit einer hohen Intensität in der Größenordnung von 20 bis 50%,
dargestellt auf der Abszisse mit den Punkten l, m, n, p, q, die
Verabreichung von I9 in der gleichen Menge
im Vergleich zu der durch den FasAb alleine induzierten Apoptose
eine Inhibition der Apoptose um 5 bis 20% bewirkt.
-
Da
es möglich
ist, bei einer gegebenen Person die induzierte Apoptose in Bezug
auf die Lymphozyten zu bestimmen, wird es somit möglich, diese
je nach festgestellter Intensität
der Apoptose hinsichtlich ihrer Verstärkung oder hinsichtlich ihrer
Inhibition zu modulieren, indem dieser Person ein Medikament auf
der Basis von I9 verabreicht wird.
-
Dieses
Medikament kann es somit ermöglichen,
die Apoptose hinsichtlich ihrer Verstärkung zu regulieren, wenn die
Person an einer Krankheit in der Art einer Krebs- oder Autoimmunerkrankung
leidet, die einer geringen Apoptose entspricht, oder aber die Apoptose
hinsichtlich ihrer Inhibition zu regulieren, wenn die Person an
einer Krankheit in der Art eines Immundefekts bzw. einer Immunschwäche leidet,
die einer starken Apoptose entspricht.
-
Da
dies so ist, wird darauf hingewiesen, dass es sich bei den T-Lymphozyten
vom Typ Jurkat, die in den Kulturen vorhanden waren, die bei den
vorstehend beschriebenen Versuchen verwendet wurden, um Zellen handelt,
deren Tumorsuppressor-Gen p53 oder Protein p53 (Bing An et al.,
1998, "Cell Death
and Differentiation" 5,
1062–1075)
mutiert und daher inaktiv ist.
-
Die
Wirkungen, die mit den erfindungsgemäß verwendeten Produkten, insbesondere
mit I9 und L11, festgestellt
wurden, sind somit wahrscheinlich p53-unabhängig; das heißt, die
Produkte I9 und L11 sind
imstande, die Stimulation oder die Inhibition der Apoptose allein
durch ihre Anwesenheit und unabhängig
von der Anwesenheit oder der Abwesenheit des aktiven p53-Gens zu
verstärken.
-
Bei
den meisten menschlichen Krebserkrankungen (vgl. Hollstein et al.,
1994, "Nucl. Acid
Res.", 22, 3551)
ist das Protein p53 jedoch mutiert, also inaktiv; hieraus folgt,
dass der Einsatz eines Medikaments auf der Grundlage eines der erfindungsgemäßen Produkte,
und insbesondere der Produkte I9 und L11, Funktionsstörungen des Proteins p53 zu
beheben und Erkrankungen in der Art von Krebs- und Autoimmunkrankheiten zu
behandeln erlaubt.
-
Die
Erfindung erlaubt es folglich, die besagten Erkrankungen auf eine
grundlegend andere Weise und wesentlich einfacher zu behandeln als
bei der Gentherapie, die insbesondere darauf beruht, ein normales p53-Gen
in das Genom der mutierten Zellen der erkrankten Person einzubringen.
-
Es
ist bekannt, dass die meisten Krebszellen ihre Empfindlichkeit gegenüber der
FasAb-Apoptose verloren haben und dass die meisten der gegenwärtig verwendeten
krebshemmenden Agenzien dadurch wirken, dass das p53-Gen aktiviert
wird, das seinerseits positiv auf das FasAb-System wirkt. Oder aber
diese Systeme funktionieren nicht mehr, wenn p53 mutiert ist (Müller et
al., 1998, J. Exp. Med. 188, 2033–2043).
-
Den
jüngsten
Beobachtungen zufolge ist das FasAb-System ausschlaggebend für die Zerstörung der Krebszellen,
entweder durch das Immunsystem oder durch die Wirkung krebshemmender
Arzneimittel. Hieraus folgt, dass dem Umstand, dass die erfindungsgemäß verwendeten
Produkte, insbesondere I9 und L11,
die Apoptose dieser Krebszellen unabhängig von p53 modulieren, eine
beträchtliche
Bedeutung zukommt und dadurch die Entwicklung einer neuen Generation
von insbesondere krebshemmenden Medikamenten in Betacht gezogen
werden kann.
-
BEISPIEL 3
-
Wie
vorstehend aufgezeigt, setzt sich das Produkt I9 aus
einem Gemisch aus Oligo-Jota-Carrageenanen zusammen.
-
Es
wurde die durch unterschiedliche Komponenten dieses Gemisches, insbesondere
der Fraktionen DP 2, DP 3, DP 4, DP 5 und DP 7, induzierte Wirkung
getestet.
-
Getestet
wurde auch das den Grundstoff des I9 bildende
Polymer, sowie das als KIK bezeichnete Produkt (Hexasaccharid vom
Typ Kappa-Jota-Kappa).
-
Bei
diesen Assays wurde wie in Beispiel 1 angegeben verfahren, indem
gleichzeitig zum einen 0,2 mg/ml von jeder der I9-Fraktionen
und zum anderen 100 ng/ml von FasAb der Firma Euromedex eingebracht wurden.
-
Nach
einer Inkubation von 24 Stunden wurden die nachstehend zusammengefassten
Feststellungen getroffen.
-
Die
Fraktionen DP 2, DP 3, DP 4 und DP 5 sind inaktiv und stimulieren
die Apoptose nicht, die durch eine geringe Dosis (100 ng/ml) FasAb
der Firma Euromedex induziert wird, die selbst nach einer Inkubation von
18 Stunden 6% des Zelltodes auslöst.
-
Eine
sehr starke stimulierende Wirkung wird dagegen bei der Fraktion
DP 7 (50%) und durch das Produkt I9 (70%)
erzielt, was zeigt, dass eine der aktiven Komponenten des I9-Gemisches durch die Fraktion DP 7 gebildet
sein kann; das Produkt KIK hat im Übrigen keinerlei Aktivität.
-
Es
wurde schließlich
auch festgestellt, dass das Polymer, das den Grundstoff für die Herstellung
des I9 vor Spaltung durch das Jotase-Enzym
bildet, seinerseits aktiv ist und eine Fas-Apoptose mit geringer
Intensität
stimuliert. Das Jotase-Enzym, das in einer Menge von 50 Einheiten
(50 U) verwendet wurde, hat hingegen keinerlei Aktivität, wenn
es mit den Zellen inkubiert wird.
-
Hieraus
ergibt sich, dass der Wirkstoff I9, der
keine inhärente
apoptotische Aktivität
hat, im Falle einer FasAb-Apoptose mit geringer Intensität eine sehr
hohe Stimulation induziert.
-
BEISPIEL 4
-
Es
wurde ein zusätzliches
Assay durchgeführt,
durch den die in 14 dargestellten Ergebnisse
bestätigt
werden.
-
Im
Fall der durch Fas induzierten apoptotischen Phänomene handelt es sich bei
der ersten Caspase der aktivierten Caspasen-Kasakde um die Caspase
8.
-
Nach
Lyse der Jurkat-Zellen, die mit oder ohne FasAb alleine und die
mit dem FasAb gleichzeitig mit I9 behandelt
wurden, wurde eine Messung der Aktivität dieser Caspase 8 vorgenommen,
die ein proteolytisches Enzym ist.
-
Hierzu
wurde gemessen
- • die Aktivität der Caspase
8 in einer ersten Fraktion einer Kultur von Jurkat-Zellen in Abwesenheit
des FasAb und des I9; der Prozentsatz der
lebenden Zellen in der Kultur liegt bei 93%;
- • die
Aktivität
der Caspase 8 in einer zweiten Fraktion der gleichen Kultur 18 Stunden
nach der Inkubation mit 500 ng/ml FasAb der Firma Euromedex (der,
wie vorstehend angegeben, eine schwache Apoptose in der Größenordnung
von 13% induziert); der Prozentsatz der lebenden Zellen in der Kultur
liegt bei 80%;
- • die
Aktivität
der Caspase 8 in einer dritten Fraktion der gleichen Kultur 18 Stunden
nach der Inkubation mit 500 ng/ml FasAb der Firma Euromedex und
0,2 mg/ml I9; der Prozentsatz der lebenden
Zellen in der Kultur liegt bei 50%;
- • die
Aktivität
der Caspase 8 in einer vierten Fraktion der gleichen Kultur 18 Stunden
nach der Inkubation mit 25 ng/ml FasAb der Firma Alexis (der, wie
vorstehend angegeben, eine starke Apoptose in der Größenordnung
von 40% induziert); der Prozentsatz der lebenden Zellen in der Kultur
liegt bei 53%;
- • die
Aktivität
der Caspase 8 in einer fünften
Fraktion der gleichen Kultur 18 Stunden nach der Inkubation mit
25 ng/ml FasAb der Firma Alexis und 0,2 mg/ml I9;
der Prozentsatz der lebenden Zellen in der Kultur liegt bei 59%.
-
Die
Messung der Caspase-Aktivität
erfolgte jedes Mal mit Hilfe des von der Firma Ozyme unter dem Markennamen "Apo Alert Flice Fluor" Nr. K2028-2 vertriebenen
Kits.
-
Die
Ergebnisse dieser Messungen sind in dem Histogramm in 15 zusammengefasst.
-
Die
Untersuchung dieses Histogramms zeigt, dass
- – die Caspase-8-Aktivität durch
den Euromedex-FasAb alleine schwach stimuliert wird (Faktor annähernd 1,37),
wobei die gleichzeitige Verabreichung von I9 eine
starke Stimulation bewirkt (Faktor annähernd 3,93);
- – die
Caspase-8-Aktivität
durch den Alexis-FasAb alleine stark stimuliert wird (Faktor annähernd 4,96),
wobei diese starke Stimulation verringert wird (Faktor annähernd 4,05),
wenn I9 gleichzeitig mit dem Alexis-FasAb
zugegeben wird.
-
Es
besteht folglich ein klarer Zusammenhang zwischen der Apoptose und
der Caspase-8-Aktivität.
-
Das
Produkt I9 stellt somit ein Produkt dar,
das die Aktivität
der Caspase 8 zu modulieren vermag.
-
Die
Tatsache, dass nachgewiesen wurde, dass dieses Enzym biochemisch
für die
durch Fas induzierte Apoptose äußerst wichtig
ist (Juo et al., Curr. Biol. 8, 1001–1008, 1998), erlaubt es, neue
Medikamente auf der Basis von Oligosacchariden in Betracht zu ziehen,
die es erlauben, auf Enzyme vom Typ Caspase abzuzielen.
-
Diese
Produkte stellen somit eine Alternative zu einer Therapie dar, die
auf Peptiden basiert, die Träger
der durch die Caspase 8 erkannten Sequenz sind ("Selbstmord-Substrate" der Caspase 8).