-
GEBIET DER ERFINDUNG
-
Die
vorliegende Erfindung betrifft ein Verfahren zur Herstellung von
meso-meso, β-β, β-β, dreifach
verknüpften
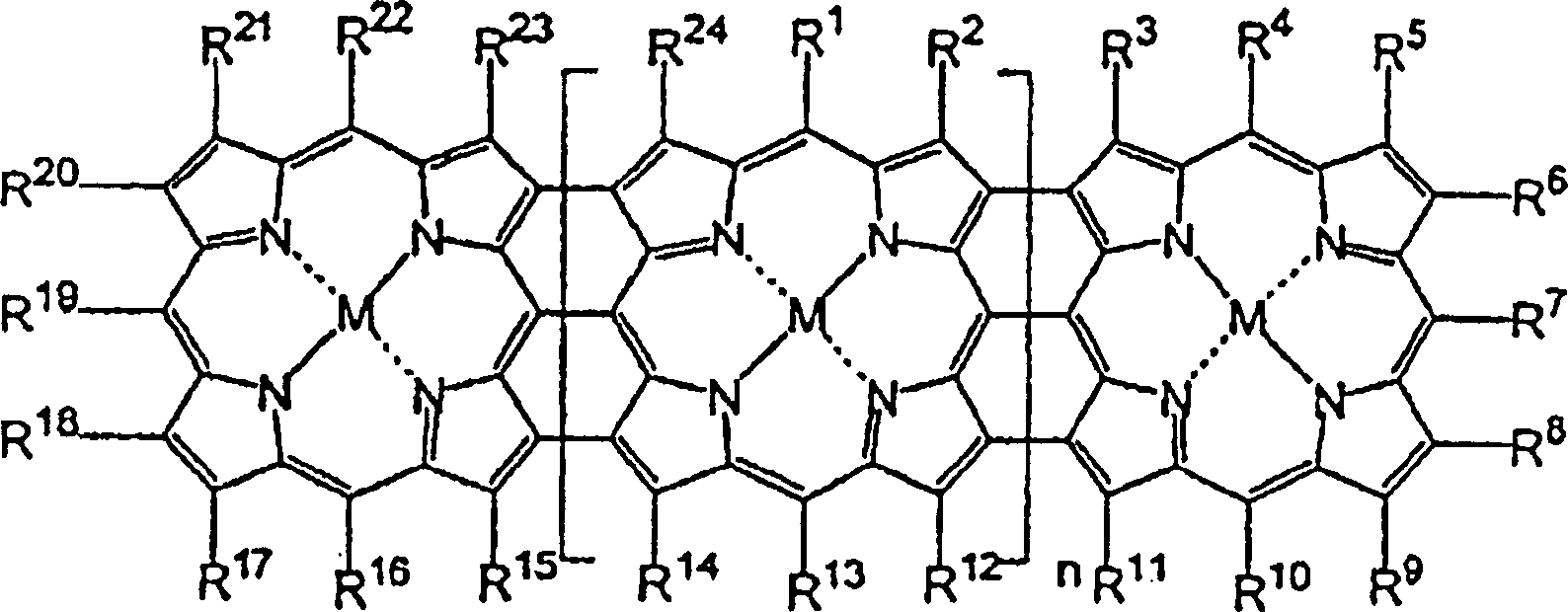
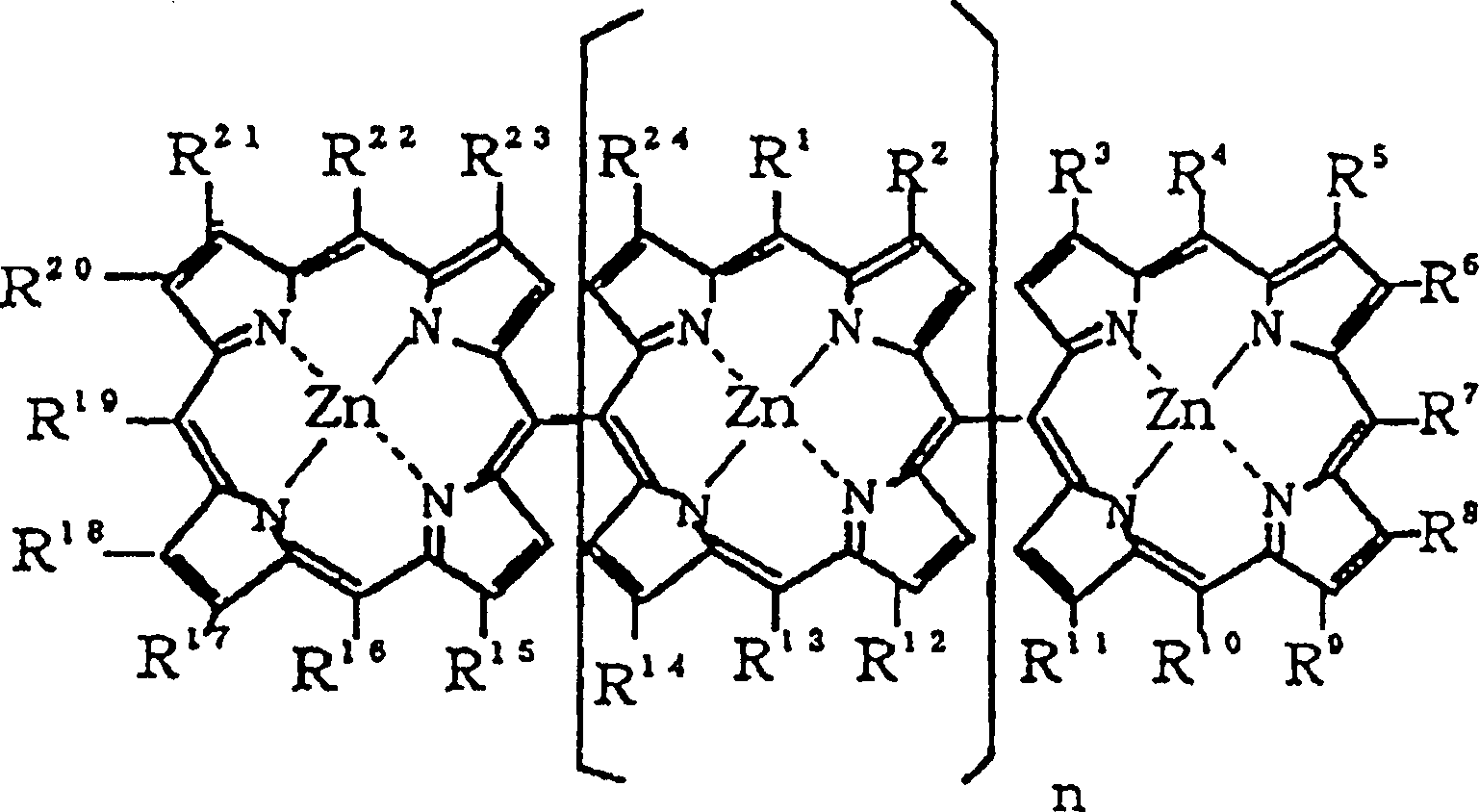
Porphyrinanordnungen, dargestellt durch die allgemeine Formel 1,
durch Oxidation der entsprechenden meso-meso verknüpften Zn(II)-Porphyrine, dargestellt
durch die allgemeine Formel 2, mit einer ausgewählten Kombination an Lewis-Säure und
Chinonoxidans, und ein Verfahren zur Herstellung von meso-meso, β-β, β-β, dreifach
verknüpften
Porphyrintetrameren (allgemeine Formel 1, n = 2) aus Zn(II)-Porphyrinmonomeren,
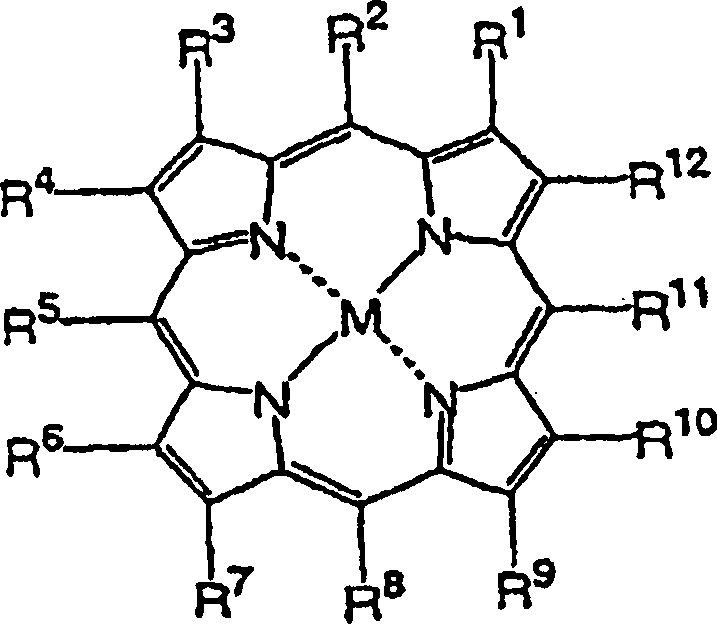
dargestellt durch die allgemeine Formel 3, wobei R1–R9 substituiert sind und speziell R2, R5 und R8 Arylgruppen sind, und R10,
R11 und R12 unsubstituiert
sind. Die meso-meso, β-β, β-β, dreifach
verknüpften Zn(II)-Porphyrinanordnungen
weisen eine bemerkenswerte Planarität und außergewöhnlich große elektronische Wechselwirkungen
auf, wie durch ihre Absorptionseigenschaften und elektronischen
Eigenschaften gezeigt.
-
HINTERGRUND DER ERFINDUNG
-
Porphyrine
zeigen starke Absorption im sichtbaren Bereich, starke Fluoreszenz
und Phosphoreszenz, und hohe elektrische Leitfähigkeit, da die HOMO-LUMO-Lücke relativ
klein ist. Weiterhin weisen Porphyrine den Vorteil auf, dass sie
nahezu alle Metallionen in ihren Hohlräumen als einen Liganden unterbringen,
und derartige Metallierungen und periphere Substitutionen ermöglichen
die Feineinstellung von optischen und elektrochemischen Eigenschaften,
wodurch somit eine Vielzahl von Verbindungen bereitgestellt wird,
die bei Verwendung in funktionellen Materialien und Vorrichtungen
die erforderlichen Eigenschaften erfüllen können. In der Natur sind Porphyrine
für verschiedene
wichtige Funktionen in biologischen Vorgängen verantwortlich, wie etwa
Oxidation-Reduktion-Reaktionen im Metabolismus, in der Photosynthese
und Atmung. Unter diesem Hintergrund wurden molekulare Systeme auf
Basis von Porphyrin, wie etwa zur Umwandlung von Energie funktionelle
Materialien und biomimetische Katalysatoren aktiv entwickelt. Vor
kurzem wurde multi-Porphyrinsystemen beträchtliche Aufmerksamkeit geschenkt,
unter einem Gesichtspunkt ihrer Anwendung als optoelektronische
Materialien. In dieser Hinsicht wurden Synthesen von langen, starren,
planaren Porphyrinpolymeren oder -oligomeren und somit die Erforschung
von extensiv π-konjugierten
elektronischen Systemen und von neuen Vorrichtungen auf Basis der
starken Absorption im sichtbaren Bereich, starken Fluoreszenz und
Phosphoreszenz, und der kleinen optischen HOMO-LUMO-Energielücke aktiv
versucht.
-
Von
diesen hat der Erfinder der vorliegenden Anmeldung die Synthese
von direkt meso-meso verknüpften
linearen Porphyrinpolymeren (bestehend aus 300–400 Porphyrin-Untereinheiten)
und von diskreten meso-meso verknüpften Porphyrinoligomeren bis
hin zu einem 128-mer veröffentlicht.
Zusätzlich
hat er die Möglichkeit
der Synthese von kondensierten Porphyrinoligomeren vorgeschlagen,
durch Verknüpfung
von zwei β-
und β-Positionen
direkt durch Oxidation von meso-meso
verknüpften
Porphyrinanordnungen. Darüber hinaus
offenbart Angew. Chemie, Int. Ed. 39(14), 2549–2551, die Transformation von
meso-meso verknüpften Diporphyrinen
zu dreifach verknüpften,
kondensierten Diporphyrinen.
-
Die
linearen meso-meso verknüpften
Porphyrinanordnungen wurden als eine viel versprechende Einheit
für die
Verwendung als optischer Draht und elektrischer molekularer Draht
angesehen, angesichts der stabähnlichen
Struktur, großen
elektronischen Wechselwirkungen zwischen den benachbarten Porphyrinen, welche
ausreichend sind um rasches nicht-kohärentes Anregungsenergietransferhopping
zu induzieren, und des Fehlens einer Energiesenke, welche die Energietransferkaskade
entlang der Anordnung blockiert. Diese Eigenschaften werden anscheinend
durch die direkte Verknüpfung
und die senkrechte Konformation der benachbarten Porphyrine induziert.
Die senkrechte Konformation führt
jedoch zu einer Zerstörung
von π-Konjugation,
und die elektrische Leitfähigkeit
der meso-meso verknüpften
Porphyrine ist daher nur mäßig. Wenn
die senkrechten meso-meso verknüpften
Porphyrinanordnungen in flache und coplanare Anordnungen überführt werden,
durch Verknüpfen
von zwei β-β, β-β Bindungen,
könnten
wir extensiv π-leitfähige Porphyrinanordnungen
erreichen, die als ein molekularer Draht in einem realistischen
molekularem Maßstab
sehr viel versprechend sein werden.
-
Der
Erfinder der vorliegenden Anmeldung schlug die linear kondensierten
Porphyrinanordnungen, welche meso-β und meso-β Doppelbindungen aufweisen,
als einen praktischeren Kandidaten für molekularen Draht vor. Derartige
Anordnungen sind jedoch unzureichend für praktische Anwendungen wie
optischen Draht und molekularen Draht, in Bezug auf elektronische
Wechselwirkung und Molekülgröße.
-
Daher
schlug der Erfinder der vorliegenden Anmeldung ein neues Verfahren
zur Herstellung von meso-meso, β-β, β-β, dreifach
direkt verknüpften
Porphyrinanordnungen vor, welche sich linear erstrecken, wobei ein
bandförmiges
Porphyrinband gebildet wird (Anmeldung
JP2000-110157 ;
JP-Offenlegungsschrift 2001-294591 ).
Dieses Syntheseprotokoll wurde jedoch nur zur Herstellung der Porphyrinbänder angewandt, bei
denen die Anzahl an Porphyrinen sehr begrenzt war, aufgrund von
gleichzeitigen peripheren β-Halogenierungen.
-
Der
Gegenstand der vorliegenden Erfindung ist es, extensiver π-konjugierte
Netzwerke auf Basis von Porphyrin zu erforschen, welche viel längere molekulare
Längen
und mehr Delokalisierung von Elektronen realisierten, und somit
konjugierte Porphyrinanordnungen bereitzustellen, die als optischer
Draht und elektrisch leitender Draht verwendet werden werden.
-
Für die Verwendung
als elektrischer Draht ist es wünschenswert,
die HOMO-LUMO-Lücke auf
so klein wie möglich
zu minimieren. Für
diesen Zweck sind extensiv konjugierte Porphyrinanordnungen, die
aus vielen Porphyrinen bestehen, erforderlich. Demgemäß ist der
zweite Gegenstand der vorliegenden Erfindung, ein effektives Verfahren
zur Synthese von konjugierten Porphyrinanordnungen mit einer sehr
kleinen HOMO-LUMO-Lücke
zu etablieren.
-
Im
Verlauf dieser Untersuchungen haben die Erfinder der vorliegenden
Anmeldung ein neues synthetisches Verfahren gefunden für die Umsetzung
von meso-meso verknüpften,
meso, meso'-Phenyl-substituierten – Zn(II)-Porphyrinoligomeren
zu meso-meso, β-β, β-β, dreifach
direkt verknüpften
Zn(II)-Porphyrinoligomeren mit Chinonoxidans in der Gegenwart einer
geeigneten Lewis-Säure
in unter Rückfluss
siedender Lösung von
Toluol oder Benzonitril.
-
OFFENBARUNG DER ERFINDUNG
-
Der
erste Aspekt der vorliegenden Erfindung sind meso-meso, β-β, β-β, dreifach
direkt verknüpfte,
so genannte kondensierte Porphyrinoligomere, dargestellt durch die
allgemeine Formel 1.
-
-
(Worin
R1–R24 jeweils unabhängig voneinander ausgewählt sind
aus der Gruppe, bestehend aus Wasserstoff, Halogen, Hydroxylgruppe,
Mercaptogruppe, Aminogruppe, Nitrogruppe, Cyanogruppe, Carboxylgruppe,
Sulfonsäuregruppe,
substituierter oder nicht substituierter Alkylgruppe, substituierter
oder nicht substituierter Arylgruppe, substituierter oder nicht
substituierter Alkoxygruppe, substituierter oder nicht substituierter
Aryloxygruppe, substituierter oder nicht substituierter Alkylthiogruppe,
substituierter oder nicht substituierter Arylthiogruppe, Alkylaminogruppe,
substituierter oder nicht substituierter Arylaminogruppe, substituierter
oder nicht substituierter Carboxylatgruppe, substituierter oder
nicht substituierter Carbonsäureaminogruppe,
substituierter oder nicht substituierter Sulfonatgruppe, substituierter
oder nicht substituierter Sulfonamidgruppe, substituierter oder
nicht substituierter Carbonylgruppe, substituierter oder nicht substituierter
Silylgruppe oder substituierter oder nicht substituierter Siloxygruppe,
n eine ganze Zahl von nicht kleiner als 2 ist, M gleich 2H ist, oder
ein Komplex, bei dem zwei Wasserstoffatome des Porphyrinrings durch
ein Metallatom ersetzt sind, ausgewählt aus der Gruppe von Metallatomen
A, wobei die Gruppe von Metallatomen A gleich Zn, Mg, Ca, Sr, Ba, Sc,
Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Ti, Zr,
Hf, V, Nb, Ta, Th, U, Cr, Mo, W, Mn, Tc, Re, Fe, Ru, Os, Co, Rh,
Ir, Ni, Pd, Pt, Cu, Ag, Au, Cd, Hg, Al, Ga, In, Tl, Si, Ge, Sn,
Pb, As, Sb und Bi ist.)
-
Die
vorliegende Erfindung ist wünschenswert
die vorstehend angegebenen kondensierten Porphyrinoligomere, wobei
in der vorstehend angegebenen allgemeinen Formel 1 R1,
R4, R10, R13, R16, R22 unabhängig voneinander
ausgewählt
sind aus Phenylgruppen mit Substituenten, welche unabhängig voneinander
ausgewählt
sind aus Alkylgruppen oder Alkoxygruppen mit 1 oder mehr Kohlenstoffatomen,
R7 und R19 unabhängig voneinander
jeweils ausgewählt
sind aus der Gruppe, bestehend aus Wasserstoff, Halogen, Hydroxylgruppe, Mercaptogruppe,
Aminogruppe, Nitrogruppe, Cyanogruppe, Carboxylgruppe, Sulfonsäuregruppe,
substituierter oder nicht substituierter Alkylgruppe, substituierter
oder nicht substituierter Arylgruppe, substituierter oder nicht
substituierter Alkoxygruppe, substituierter oder nicht substituierter
Aryloxygruppe, substituierter oder nicht substituierter Alkylthiogruppe,
substituierter oder nicht substituierter Arylthiogruppe, Alkylaminogruppe, substituierter
oder nicht substituierter Arylaminogruppe, substituierter oder nicht
substituierter Carboxylatgruppe, substituierter oder nicht substituierter
Carbonsäureaminogruppe,
substituierter oder nicht substituierter Sulfonatgruppe, substituierter
oder nicht substituierter Sulfonamidgruppe, substituierter oder
nicht substituierter Carbonylgruppe, substituierter oder nicht substituierter
Silylgruppe oder substituierter oder nicht substituierter Siloxygruppe.
-
Stärker wünschenswert
ist die vorliegende Erfindung die vorstehend angegebenen kondensierten
Porphyrinoligomere, wobei in der vorstehend angegebenen allgemeinen
Formel 1 R1, R4,
R10, R13, R16, R22 unabhängig voneinander
ausgewählt
sind aus der Gruppe, bestehend aus der 3,5-Ditertbutylphenylgruppe
und der 3,5-Dioctyloxyphenylgruppe.
-
Der
zweite Aspekt der vorliegenden Erfindung ist das Verfahren zur Synthese
der kondensierten Zn(II)-Porphyrinoligomere (n = 0, oder eine ganze
Zahl nicht kleiner als 1, und M ist gleich Zn in der vorstehend angegebenen
allgemeinen Formel 1), mit dem Merkmal, dass die benachbarten Porphyrinringe
meso-meso, β-β, β-β, dreifach
direkt verknüpft
sind, in einer linearen Weise, aus den meso-meso verknüpften Zn(II)-Porphyrinoligomeren,
dargestellt durch die allgemeine Formel 2, und der entsprechenden
kondensierten freie Base-Porphyrinoligomere (M = 2H), hergestellt
durch Entmetallisierung der vorstehenden kondensierten Zn(II)-Porphyrinoligomere,
oder der kondensierten M(+m)-Porphyrinoligomere durch Insertieren
eines anderen Metalls anstelle von Zn (wobei M ein Metall ist, ausgewählt aus
der vorstehend genannten Gruppe von Metallatomen außer Zn,
m eine mögliche
Ionenvalenzzahl jedes Metalls ist), dargestellt durch die allgemeine
Formel 1.
-
-
In
der allgemeinen Formel 2 sind R1–R24 gleich wie in der allgemeinen Formel 1,
n ist 0 oder eine ganze Zahl von nicht kleiner als 1. In diesem
synthetischen Verfahren wurde die Umsetzung von den meso-meso verknüpften Porphyrinoligomeren
zu den kondensierten Porphyrinoligomeren in Lösungsmittel mit Chinonoxidanzien
in der Gegenwart einer geeigneten Lewis-Säure, die ein Seltenerdion enthält, durchgeführt.
-
Wünschenswert
ist der zweite Aspekt der vorliegenden Erfindung das Verfahren zur
Synthese der kondensierten Zn(II)-Porphyrinoligomere, wobei R1, R4, R7,
R10, R13, R16, R19 und R22 der vorstehend angegebenen allgemeinen
Formel 1 eine Phenylgruppe sind oder eine substituierte Phenylgruppe
mit Substituenten, unabhängig
voneinander ausgewählt
aus einer Alkylgruppe oder Alkoxygruppe mit 1 oder mehr Kohlenstoffatomen, und
ist das Verfahren zur Synthese der kondensierten freie Base-Porphyrinoligomere,
worin M gleich 2H ist, durch Entmetallisieren der kondensierten
Zn(II)-Porphyrinoligomere, und der kondensierten M(+n)-Porphyrinoligomere,
durch Insertieren eines von Zn verschiedenen Metalls (wobei M ein
Metall aus der vorstehend angegebenen Gruppe von Metallatomen außer Zn ist,
n eine mögliche
Ionenvalenzzahl jedes Metalls ist). In diesem synthetischen Verfahren
wurde die Umsetzung von den meso-meso verknüpften Porphyrinoligomeren zu
den kondensierten Porphyrinoligomeren in Lösungsmittel mit Chinonoxidanzien
in der Gegenwart einer geeigneten Lewis-Säure, die ein Seltenerdion enthält, durchgeführt.
-
Der
dritte Aspekt der vorliegenden Erfindung ist das Verfahren zur Synthese
von meso-meso, β-β, β-β, dreifach
direkt verknüpften,
so genannten kondensierten Zn(II)-Porphyrindimeren, und ihren entsprechenden kondensierten
freie Base-Porphyrindimeren,
hergestellt durch Entmetallisieren des vorstehenden kondensierten
Zn(II)-Porphyrindimers, und der kondensierten M(+m)-Porphyrinverbindungen
(wobei M ein Metall ist, ausgewählt
aus der vorstehend angegebenen Gruppe von Metallatomen außer Zn,
m eine mögliche
Ionenvalenzzahl jedes Metalls ist), welche hergestellt werden durch
oxidative Dimerisierung eines Zn(II)-Porphyrinmonomers, dargestellt
durch die allgemeine Formel 3.
-
-
(Worin
M gleich Zn ist, R10–R12 Wasserstoff
sind, und R1–R9 unabhängig voneinander
jeweils ausgewählt
sind aus der Gruppe, bestehend aus Wasserstoff, Halogen, Hydroxylgruppe,
Mercaptogruppe, Aminogruppe, Nitrogruppe, Cyanogruppe, Carboxylgruppe,
Sulfonsäuregruppe,
substituierter oder nicht substituierter Alkylgruppe, substituierter
oder nicht substituierter Arylgruppe, substituierter oder nicht
substituierter Alkoxygruppe, substituierter oder nicht substituierter
Aryloxygruppe, substituierter oder nicht substituierter Alkylthiogruppe,
substituierter oder nicht substituierter Arylthiogruppe, Alkylaminogruppe,
substituierter oder nicht substituierter Arylaminogruppe, substituierter
oder nicht substituierter Carboxylatgruppe, substituierter oder nicht
substituierter Carbonsäureaminogruppe,
substituierter oder nicht substituierter Sulfonatgruppe, substituierter
oder nicht substituierter Sulfonamidgruppe, substituierter oder
nicht substituierter Carbonylgruppe, substituierter oder nicht substituierter
Silylgruppe oder substituierter oder nicht substituierter Siloxygruppe.)
Die oxidative Dimerisierungsreaktion wird in Lösungsmittel mit Chinonoxidanzien
in der Gegenwart einer geeigneten Lewis-Säure, die Seltenerdion enthält, durchgeführt.
-
Wünschenswert
ist der dritte Aspekt der vorliegenden Erfindung das Verfahren zur
Synthese der meso-meso, β-β, β-β, dreifach
direkt verknüpften,
so genannten kondensierten Zn(II)-Porphyrindimere, und der kondensierten
metallfreien Porphyrindimere, hergestellt durch Entmetallisieren
der vorstehenden Zn(II)-Porphyrindimere,
und der kondensierten M(+m)-Porphyrinverbindungen (wobei M ein Metall
ist, ausgewählt
aus der vorstehend angegebenen Gruppe von Metallatomen außer Zn,
m eine mögliche
Ionenvalenzzahl jedes Metalls ist), dargestellt durch die allgemeine
Formel 3, wobei R1, R3,
R4, R6, R7, R9, R12 Wasserstoff
sind, R2, R5 und
R8 der vorstehend angegebenen allgemeinen
Formel 3 eine Phenylgruppe mit Substituenten, unabhängig voneinander
ausgewählt
aus Alkylgruppen oder Alkoxygruppen mit 1 oder mehr Kohlenstoffatomen,
sind.
-
Stärker wünschenswert
ist der dritte Aspekt der vorliegenden Erfindung das Verfahren zur
Synthese der vorstehend angegebenen kondensierten Zn(II)-Porphyrindimere,
der vorstehend angegebenen kondensierten metallfreien Porphyrindimere,
hergestellt durch Entmetallisieren der vorstehenden Zn(II)-Porphyrindimere,
und der vorstehend angegebenen kondensierten M(+m)- Porphyrinverbindungen
(wobei M ein Metall ist, ausgewählt
aus der vorstehend angegebenen Gruppe von Metallatomen außer Zn,
m eine mögliche
Ionenvalenzzahl jedes Metalls ist), wobei die Phenylgruppe mit Substituenten,
die unabhängig
voneinander ausgewählt
sind aus Alkylgruppen oder Alkoxygruppen mit 1 oder mehr Kohlenstoffatomen,
die Phenylgruppe ist, deren 3-, 5-Positionen mit tert-Butylgruppen oder
Octyloxygruppen substituiert sind, und sogar noch wünschenswerter
ist der dritte Aspekt der vorliegenden Erfindung das Verfahren zur
Synthese der vorstehend angegebenen kondensierten metallfreien Porphyrindimere,
hergestellt durch Entmetallisieren der vorstehenden kondensierten
Zn(II)-Porphyrindimere,
und der entsprechenden kondensierten M(+m)-Porphyrinverbindungen (wobei M ein Metall
ist, ausgewählt
aus der vorstehend angegebenen Gruppe von Metallatomen außer Zn,
m eine mögliche
Ionenvalenzzahl jedes Metalls ist). Die oxidative Dimerisierungsreaktion
wird unter Rückflussbedingungen
in aromatischen Kohlenwasserstofflösungsmitteln in der Gegenwart
von Chinonoxidanzien, ausgewählt
aus Chinonen, und Lewis-Säuren,
die Seltenerdelement enthalten, durchgeführt.
-
KURZE BESCHREIBUNG DER FIGUREN
-
1 zeigt
die Absorptionsspektren der meso-meso, β-β, β-β, dreifach direkt verknüpften, so
genannten kondensierten Zn(II)-Porphyrinoligomere, welche die vorliegende
Erfindung ausmachen, bis zum 12-mer.
-
2 zeigt
die Infrarotabsorptionsspektren der meso-meso, β-β, β-β, dreifach direkt verknüpften, so genannten
kondensierten Zn(II)-Porphyrinoligomere, welche die vorliegende
Erfindung ausmachen, bis zum 12-mer.
-
ERKLÄRUNG DER INFRAROTSPEKTREN
-
Um
zu bestätigen,
dass die elektronischen Absorptionen der meso-meso, β-β, β-β, dreifach
direkt verknüpften,
so genannten kondensierten Zn(II)-Porphyrinoligomere in den Infrarotbereich
hinein reichen, wurden die Infrarotspektren (IR) dieser meso-meso, β-β, β-β, dreifach
direkt verknüpften,
so genannten kondensierten Zn(II)-Porphyrinoligomere in einem üblichen
KBr-Pressling gemessen. C-H Streckschwingung wird bei 2900 cm–1 beobachtet.
Die elektronische Absorptionsbande wird im Infrarotbereich im IR-Spektrum
des 2-mers (Dimers) beobachtet, aber die elektronische Absorptionsbande
im IR-Spektrum des 3-mers wird bei 5500–6500 cm–1 beobachtet,
und bei einer Erhöhung
der Anzahl der Porphyrine, 4-mer, 5-mer und 6-mer, reichen die elektronischen
Absorptionsbanden gut in diesen IR-Bereich hinein. Die elektronischen
Absorptionsbanden des 8-mers und 12-mers decken fast den gesamten
IR-Bereich vollständig
ab, so dass die C-H Streckschwingung beinahe nicht nachweisbar wird.
-
DIE BESTE AUSFÜHRUNGSFORM ZUR AUSFÜHRUNG DER
ERFINDUNG
-
Die
vorliegende Erfindung wird detaillierter beschrieben.
-
A.
Die bekannten meso-meso verknüpften
Zn(II)-Porphyrinoligomere, dargestellt durch die allgemeine Formel
2, werden als der Vorläufer
für die
Synthese der meso-meso, β-β, β-β, dreifach
direkt verknüpften,
so genannten kondensierten Zn(II)-Porphyrinoligomere verwendet. Des Weiteren
hatte der Erfinder der vorliegenden Anmeldung in Bezug auf die meso-meso
verknüpften
Porphyrinoligomere größer als
das 9-mer bereits vorgeschlagen (
japanische
Patentanmeldung 11-248756 ;
JP-Offenlegungsschrift
2001-72745 ), dass diese ebenfalls als das Ausgangsmaterial
für die
entsprechenden meso-meso, β-β, β-β, dreifach
direkt verknüpften, so
genannten kondensierten Zn(II)-Porphyrinoligomere der vorliegenden
Erfindung verwendet werden können.
Gemäß der Beschreibung
dieses Dokuments können
die entsprechenden Polymere der meso-meso verknüpften Porphyrine, Poly(porphynylen)e
mit einer Größe von mehr
als dem 200-mer auf einfache Weise hergestellt werden, und das Reaktionschromatogramm
der ähnlichen
Polymerisationsreaktion deutete auf die Bildung des 300-mers bis
400-mers und sogar noch höherer
Porphyrinanordnungen hin. Diese sehr großen meso-meso verknüpften Porphyrinanordnungen
werden ebenfalls als der Vorläufer
für die
Synthese der meso-meso, β-β, β-β, dreifach
direkt verknüpften,
so genannten kondensierten Zn(II)-Porphyrinoligomere verwendet.
-
Bei
der in dieser Erfindung beanspruchten Reaktion ergibt die Oxidation
der vorstehenden meso-meso verknüpften
Porphyrinoligomere mit Chinonoxidanzien in der Gegenwart einer Lewis-Säure, die
ein Seltenerdelement enthält,
die entsprechenden meso-meso, β-β, β-β, dreifach
direkt verknüpften,
so genannten kondensierten Zn(II)-Porphyrinoligomere, dargestellt
durch die allgemeine Formel 3.
-
B. Das Syntheseverfahren der Verbindungen
der vorliegenden Erfindung
-
1. Das Syntheseverfahren unter Verwendung
der meso-meso verknüpften
Porphyrinanordnungen, dargestellt durch die allgemeine Formel 2
-
Bei
der vorliegenden Reaktion der Erfindung werden zwischen den β-Positionen
benachbart zu der meso-meso Verknüpfung der benachbarten Porphyrinringe
Kohlenstoff-Kohlenstoff-Bindungen gebildet.
-
Bisher
hat der Erfinder der vorliegenden Erfindung herausgefunden, dass
5,15-Diarylmetalloporphyrine
und 5,10,15-Triarylmetalloporphyrine, die gewöhnlich keine sterisch überfüllten Peripherien
aufweisen, mittels elektrochemischer Oxidation effektiv zu Metalloporphyrindimeren
gekoppelt werden. Bei diesen Kopplungsreaktionen hängen die
Kopplungsregioselektivitäten
von dem zentralen Metall im Porphyrinkern ab. Beispielsweise werden
Zn(II)- und Mg(II)-Porphyrine gekoppelt, so dass meso-meso einfach
gebundene Diporphyrine gebildet werden, während Ni(II)-, Cu(II)- und
Pd(II)-Porphyrine gekoppelt werden, so dass meso-β einfach
gebundene Diporphyrine gebildet werden, welche weiter umgesetzt
werden können
zu meso-β doppelt verknüpften, so
genannten kondensierten coplanaren Diporphyrinen, mittels Oxidation
mit dem Aminiumkationradikal von Tris(para-bromphenyl)aminiumhexachloroantimonat
((p·BrC6H)3NSbCl6, BAHA).
-
Die
beobachteten unterschiedlichen Kopplungsregioselektivitäten, meso-meso-Bindung für Zn(II)-
und Mg(II)-Porphyrine und meso-β-Bindung
für Cu(II)-,
Ni(II)- und Pd(II)-Porphyrine, können
in Bezug auf die elektronische Struktur des zwischenzeitlich auftretenden
Kationradikals erklärt
werden. Bei den Mg(II)- und Zn(II)-Porphyrinen sollte das bei der
Oxidation um ein Elektron gebildete Kationradikal ein ungepaartes
Elektron am A2u HOMO Orbital aufweisen,
für das
an den meso-Positionen eine hohe Spindichte gefunden werden kann,
während
nur eine vernachlässigbare
Spindichte an den β-Positionen
gefunden werden kann.
-
Andererseits
sollten die bei der Oxidation um ein Elektron von 5,15-Diaryl Ni(II)-
und Cu(II)- und Pd(II)-Porphyrinen gebildeten Kationradikale ein
ungepaartes Elektron an den peripheren β-Positionen aufweisen, während nur
eine vernachlässigbare
Spindichte an den meso-Positionen gefunden werden kann.
-
Diese Überlegung
führt zu
der Schlussfolgerung, dass meso-meso verknüpfte Diporphyrine von Metalloporphyrinen
stammen, bei denen das A2u HOMO eine große Dichte
an der meso-Position aufweist, während
meso-β verknüpfte Diporphyrine
von Metalloporphyrinen gebildet werden, bei denen das A1u HOMO
Knotenflächen
an den meso-Positionen und eine große Dichte an der β-Position
aufweist. Trotz dieser Ergebnisse hat der Erfinder der vorliegenden
Anmeldung herausgefunden, dass Oxidation von meso-meso verknüpften Zn(II)-Porphyrinanordnungen
mit DDQ und Sc(OTf)3 zu der Bildung von
meso-meso, β-β, β-β, dreifach
direkt verknüpften
Porphyrinanordnungen in hoher Ausbeute führte.
-
2. Oxidationsverfahren zur
Bildung von β-β-Kohlenstoffbindungen
an zwei β-Positionen benachbart
zu der meso-meso Verknüpfung
-
Im
Verlauf dieser Studien zur Optimierung der oxidativen Transformierung
von meso-meso verknüpften
Porphyrinanordnungen zu den entsprechenden meso-meso, β-β, β-β, dreifach direkt verknüpften Porphyrinen
haben wir herausgefunden, dass die kombinierte Verwendung von Chinonoxidans
und einer Lewis-Säure,
die ein Seltenerdelement enthält,
beispielsweise Seltenerdtriflat (Seltenerdtrifluormethansulfonsäure), zu einer
verbesserten Kopplungsregioselektivität und einer erfolgreichen Kopplung
höherer
meso-meso verknüpfter
Porphyrine führt.
- 1) 2,3-Dichlor-5,6-dicyano-1,4-benzochinon
(DDQ), 1,4-Benzochinon und 2,3,5,6-Tetrafluor-1,4-benzochinon können als
ein wünschenswertes
Oxidationsmittel genannt werden.
- 2. Sc, Y, La und Eu können
als ein wünschenswertes
Seltenerdmetall genannt werden.
- 3. Aromatische Kohlenwasserstoffe wie etwa Toluol und Benzonitril
können
als ein wünschenswertes
Reaktionslösungsmittel
genannt werden.
- 4. Die Reaktion wird wünschenswert
unter Rückflussbedingungen
in dem vorstehend angegebenen wünschenswerten
Lösungsmittel
durchgeführt.
-
C. Verfahren zur Synthese von meso-meso, β-β, β-β, dreifach
direkt verknüpften,
Porphyrindimeren aus den vorstehend angegebenen 5,10,15-Triarylmetalloporphyrinen,
dargestellt durch die allgemeine Formel 3
-
- 1. Die grundlegenden Bedingungen, umfassend
Oxidans, Lewis-Säure,
Lösungsmittel
und Reaktionstemperatur, sind im Wesentlichen die gleichen wie diejenigen
von Abschnitt B.
- 2. Wünschenswert
werden annähernd
5 Äquivalentmengen
der Chinonoxidanzien sowie der Lewis-Säure pro zwei neu gebildeten β-β-Bindungen
verwendet.
-
BEISPIELE
-
Beispiel 1
-
In
einem 50 ml Kolben wurde meso-meso verknüpftes Zn(II)-Diporphyrin (18
mg, 8 μMol)
in Toluol (30 ml) aufgelöst.
2,3-Dichlor-5,6-dicyano-1,4-benzochinon (DDQ) (9 mg, 40 μMol) und
Scandiumtrifluormethansulfonat Sc(CF3SO3)3 (20 mg, 40 μMol) [oftmals
abgekürzt
als Sc(OTf)3] wurden zugegeben, und die
resultierende Lösung
wurde 1 h unter Rückfluss
sieden gelassen und wurde danach verdünnt durch Zugabe von Methanol
und Tetrahydrofuran (THF). Nachdem das Lösungsmittel mittels eines Rotationsverdampfers
entfernt worden war, wurde der Rückstand
in THF aufgelöst
und durch eine Aluminiumsäule
geführt.
Danach ergab Umkristallisation aus einem Gemisch von Benzol und
Acetonitril das meso-meso, β-β, β-β, dreifach direkt verknüpfte, so
genannte kondensierte Porphyrindimer (12,9 mg, Ausbeute 86%).
-
Diese
Reaktion wird durch Schema 1 gezeigt, worin Ar die 3,5-t-Butylphenylgruppe
ist.
Schema
(1)
- NMR: 1H NMR (CDCl3)
1,41 (s, 36H, t-Bu), 1,45 (s, 72H, t-Bu), 7,35 (s, 4H, Por-β), 7,59 (t,
J = 1,8 Hz, 2H, Ar-H), 7,61 (t, J = 1,8 Hz, 4H, Ar-H), 7,63 (d,
J = 1,8 Hz, 4H, Ar-H),
7,67 (d, J = 1,8 Hz, 8H, Ar-H), 7,70 (d, J = 4,9 Hz, 4H, Por-β), und 7,75
(d, J = 4,9 Hz, 4H, Por-β);
MALDI-TOF MS m/z = 1868, berechnet m/z für C124H138N8Zn2 ist
1867; UV/Vis (CHCl3): λmax =
419 (Soret), 582 (Soret), und 1068 nm.
-
Hier
ist anzumerken, dass die frühere
Herstellung des ähnlichen
kondensierten Porphyrindimers unter Verwendung von meso-meso verknüpftem Cu
II-Diporphyrin (Patentoffenlegungsschrift
2000-110157 ) bestenfalls
in einer Ausbeute von 82% erreicht wurde. In Tabelle 1 sind für die Reaktion
von Schema 1 die Ausbeuten des kondensierten Porphyrindimers und
die Rückgewinnung
des meso-meso verknüpften
Ausgangsdiporphyrins zusammengefasst, wobei verschiedene Chinonoxidanzien
und Seltenerdtriflate getestet wurden, mit veränderter Reaktionsdauer. Tabelle 1
| Nr. | Lösungsmittel | Dauer | Chinon | Aquivalentwert | Lewis-Säure | Aquivalentwert | Ausbeute
(%) |
| 2 | 1
rückgewonnen |
| 1 | Toluol | 0,5 | DDQ | 5 | Sc(OTf)3 | 5 | 86 | 0 |
| 2 | Toluol | 1 | DDQ | 2,2 | Sc(OTf)3 | 2,2 | 87 | 10 |
| 3 | Toluol | 12 | DDQ | 5 | Y(OTf)3 | 5 | 20 | 68 |
| 4 | Toluol | 24 | DDQ | 5 | La(OTf)3 | 5 | 16 | 80 |
| 5 | Toluol | 24 | DDQ | 5 | Eu(OTf)3 | 5 | 9 | 75 |
| 6 | Toluol | 36 | DDQ | 5 | Mg(OTf)3 | 5 | 0 | 74 |
| 7 | Toluol | 20 | p-Benzochinon | 5 | Sc(OTf)3 | 5 | 56 | 20 |
| 8 | Toluol | 20 | Fluoranil | 5 | Sc(OTf)3 | 5 | 67 | 27 |
| 9 | THF | 10 | DDQ | 5 | Sc(OTf)3 | 5 | 0 | 96 |
| 10 | Benzo-nitril | 0,5 | DDQ | 5 | Sc(OTf)3 | 5 | 35 | 0 |
| 11 | Toluol | 20 | DDQ | 5 | - | - | 0 | 80 |
| 12 | Toluol | 20 | - | - | Sc(OTf)3 | 5 | 0 | 96 |
-
Die
Ergebnisse von Tabelle 1 deuten darauf hin, dass das Reaktionslösungsmittel,
die Reaktionsdauer (Dauer unter Rückfluss), das Oxidationsmittel
(Konzentration) und die Seltenerd-Lewis-Säure (Konzentration) alle wichtige
Parameter für
die Synthese des meso-meso, β-β, β-β, dreifach
direkt verknüpften,
Porphyrindimers der vorliegenden Erfindung sind.
-
Weiterhin
legen die Ergebnisse von Tabelle 1 nahe, dass diese oxidative Ringschlussreaktion
auf monodisperse längere
meso-meso verknüpfte
Porphyrinoligomere, welche die end,end-Bisphenylsubstitutionen aufweisen,
angewandt werden kann, welche leicht aus den meso-meso verknüpften monodispersen
Porphyrinanordnungen hergestellt werden können, über die der Erfinder der vorliegenden
Anmeldung berichtet hat (
japanische
Patentanmeldung 11-248756 ;
JP-Offenlegungsschrift 2001-72745 ).
-
Beispiel 2
-
In
einem 50 ml Rundkolben wurde end,end-Diphenyl-substituiertes meso-meso
verknüpftes
Zn(II)-Hexaporphyrin (30 mg, 4,7 μMol)
in Toluol (50 ml) aufgelöst.
DDQ (27 mg, 119 μMol)
und Sc(OTf)3 (59 mg, 119 μMol) wurden
zugegeben, und das resultierende Gemisch wurde 2 h unter Rückfluss
sieden gelassen und wurde danach durch Zugabe von Methanol und THF
verdünnt.
Das Lösungsmittel
wurde mittels eines Rotationsverdampfers entfernt, und der Rückstand
wurde in THF aufgelöst
und durch eine Aluminiumsäule
geführt.
Danach ergab Umkristallisation aus einem Gemisch von Benzol und
Acetonitril die Zielverbindung meso-meso, β-β, β-β, dreifach direkt verknüpftes Porphyrinhexamer
(18,5 mg, Ausbeute 62%). UV/Vis (CHCl3): λmax =
448 (Soret), 876 (Soret), und 1892 nm.
-
Beispiel 3
-
Zu
einer Lösung
von 5,10,15-Tris(3,5-ditertbutylphenyl)-substituiertem Zn(II)-Porphyrin (30 mg,
32 μMol)
in Toluol (50 ml) wurden DDQ (36 mg, 160 μMol) und Sc(OTf)3 (79
mg, 160 μMol)
zugegeben. Die resultierende Lösung
wurde 5 h unter Rückfluss
sieden gelassen und wurde danach durch Zugabe von Methanol und THF
verdünnt.
Das Lösungsmittel
wurde mittels eines Rotationsverdampfers entfernt, und der Rückstand wurde
in THF aufgelöst
und durch eine Aluminiumsäule
geführt.
Danach ergab Umkristallisation aus einem Gemisch von Benzol und
Acetonitril die Zielverbindung meso-meso, β-β, β-β, dreifach direkt verknüpftes Porphyrindimer
(27 mg, Ausbeute 90%). UV/Vis (CHCl3): λmax =
448 (Soret), 876 (Soret), und 1892 nm.
-
Diese
oxidative Dimerisierungsreaktion wird durch Schema 2 gezeigt, worin
Ar jeweils die 3,5-t-Butylphenylgruppe ist.
-
-
In 1 sind
die Absorptionsspektren der in der vorliegenden Erfindung synthetisierten
meso-meso, β-β, β-β, dreifach
direkt verknüpften
Porphyrinoligomere (2-mer, 3-mer, 4-mer, 5-mer, 6-mer, 8-mer und 12-mer)
gezeigt, welche klar aufzeigen, dass die elektronische Absorption
dieser konjugierten Porphyrinanordnungen weit in den IR-Bereich
bei 2600–2700
cm–1 hinein
reichen.
-
Die
am weitesten nach rot verschobenen elektronischen Absorptionsbanden
von meso-meso, β-β, β-β, dreifach
direkt verknüpften
Zn(II)-Porphyrinoligomeren liegen bei 9400 cm–1 (2-mer),
7500 cm–1 (3-mer), 6600
cm–1 (4-mer),
6000 cm–1 (5-mer),
5400 cm–1 (6-mer),
4500 cm–1 (8-mer),
bzw. 3500 cm–1 (12-mer).
Die Oxidationspotentiale für
ein Elektron (gegen AgClO4/Ag) wurden ermittelt
mit 212 mV (2-mer), 14 mV (3-mer), –89 mV (4-mer), –147 mV
(5-mer), –180
mV (6-mer), –241
mV (8-mer), was eine progressive Abnahme bei zunehmender Anzahl
von Porphyrinen in den Anordnungen aufzeigt. Beide Ergebnisse zeigen
auf, dass die elektronischen Wechselwirkungen zwischen den Porphyrinen
in den kondensierten Porhyrinanordnungen bemerkenswert groß sind,
und mit zunehmender Anzahl an Porphyrinen sogar verstärkt sind.
Und somit kann vorhergesagt werden, dass dieser Effekt in höheren Porphyrinanordnungen
sehr viel mehr verstärkt
sein wird. Diese Eigenschaften hängen
auch von dem zentralen Metall im Porphyrinkern ab, und daher werden
die metallhaltigen kondensierten Porphyrinanordnungen mit einem
von Zn(II) verschiedenen Metall ebenfalls faszinierende Zielverbindungen
sein.
-
GEWERBLICHE ANWENDBARKEIT
-
Wie
vorstehend beschrieben, sind die meso-meso, β-β, β-β, dreifach direkt verknüpften Porphyrinanordnungen
sehr interessant als nicht-lineare optische Materialien, optische
limitierende Materialien und molekulare Module von elektronischen
molekularen Vorrichtungen, angesichts ihrer sehr niedrigen Einelektron-Oxidationspotentiale
sowie ihrer außerordentlich
stark nach rot verschobenen elektronischen Absorptionsbanden. Die
stark π-konjugierten
elektronischen Systeme dieser kondensierten Porphyrinanordnungen
sind ebenfalls interessant, unter einem Gesichtspunkt ihrer Anwendung
auf ferromagnetische Materialien.