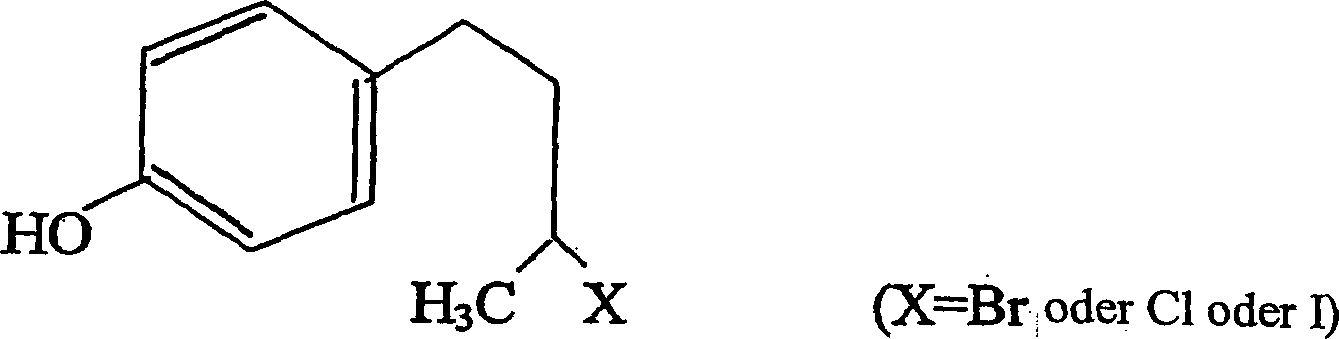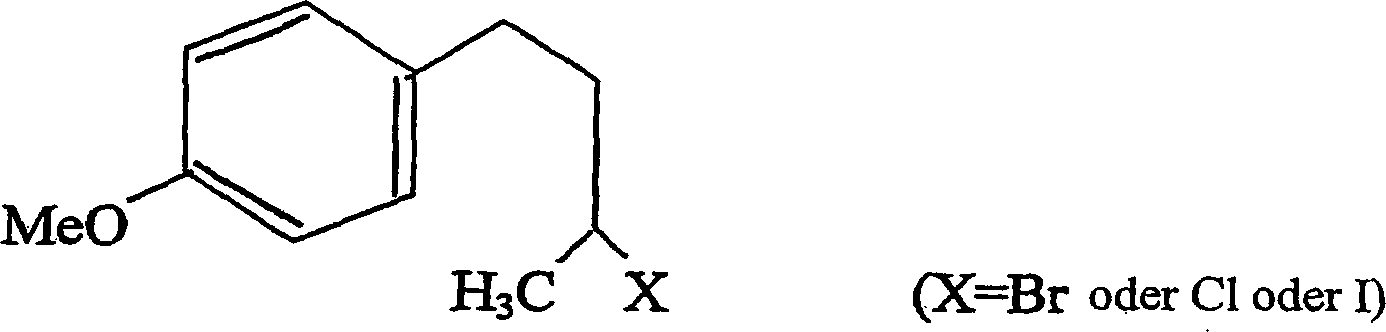DE60008697T2 - Verfahren zur Herstellung von 4-(P-methoxyphenyl)-2-amino-butane und Insektizide - Google Patents
Verfahren zur Herstellung von 4-(P-methoxyphenyl)-2-amino-butane und Insektizide Download PDFInfo
- Publication number
- DE60008697T2 DE60008697T2 DE2000608697 DE60008697T DE60008697T2 DE 60008697 T2 DE60008697 T2 DE 60008697T2 DE 2000608697 DE2000608697 DE 2000608697 DE 60008697 T DE60008697 T DE 60008697T DE 60008697 T2 DE60008697 T2 DE 60008697T2
- Authority
- DE
- Germany
- Prior art keywords
- formula
- compound
- azide
- methoxyphenyl
- hydroxyphenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000000034 method Methods 0.000 title claims description 21
- 238000002360 preparation method Methods 0.000 title description 9
- 239000002917 insecticide Substances 0.000 title description 7
- GPKUICFDWYEPTK-UHFFFAOYSA-N methoxycyclohexatriene Chemical group COC1=CC=C=C[CH]1 GPKUICFDWYEPTK-UHFFFAOYSA-N 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims description 51
- JMHAKVPFYWWNOW-UHFFFAOYSA-N 4-(4-methoxyphenyl)butan-2-amine Chemical compound COC1=CC=C(CCC(C)N)C=C1 JMHAKVPFYWWNOW-UHFFFAOYSA-N 0.000 claims description 14
- 241001330449 Taxus wallichiana Species 0.000 claims description 13
- SFUCGABQOMYVJW-UHFFFAOYSA-N 4-(4-Hydroxyphenyl)-2-butanol Chemical compound CC(O)CCC1=CC=C(O)C=C1 SFUCGABQOMYVJW-UHFFFAOYSA-N 0.000 claims description 11
- 150000001540 azides Chemical class 0.000 claims description 11
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 10
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 9
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 claims description 8
- HHKZYKLUBDPLEC-UHFFFAOYSA-N 1-(3-azidobutyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCC(C)N=[N+]=[N-])C=C1 HHKZYKLUBDPLEC-UHFFFAOYSA-N 0.000 claims description 7
- 238000006243 chemical reaction Methods 0.000 claims description 7
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 6
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 6
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 claims description 6
- 239000003054 catalyst Substances 0.000 claims description 6
- -1 phenol compound Chemical class 0.000 claims description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 5
- 239000002253 acid Substances 0.000 claims description 4
- 229910052794 bromium Inorganic materials 0.000 claims description 4
- 239000000460 chlorine Chemical group 0.000 claims description 4
- 229910052801 chlorine Inorganic materials 0.000 claims description 4
- 235000019441 ethanol Nutrition 0.000 claims description 4
- 229910052500 inorganic mineral Inorganic materials 0.000 claims description 4
- 229910052740 iodine Chemical group 0.000 claims description 4
- 239000012022 methylating agents Substances 0.000 claims description 4
- 239000011707 mineral Substances 0.000 claims description 4
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 claims description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 claims description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical group [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 3
- 150000005303 alkyl halide derivatives Chemical class 0.000 claims description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 3
- 125000001246 bromo group Chemical group Br* 0.000 claims description 3
- 239000001273 butane Substances 0.000 claims description 3
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 claims description 3
- 239000011630 iodine Chemical group 0.000 claims description 3
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 claims description 3
- 229910052763 palladium Inorganic materials 0.000 claims description 3
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 claims description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 claims description 2
- 238000009903 catalytic hydrogenation reaction Methods 0.000 claims description 2
- MUMZUERVLWJKNR-UHFFFAOYSA-N oxoplatinum Chemical compound [Pt]=O MUMZUERVLWJKNR-UHFFFAOYSA-N 0.000 claims description 2
- 229910003446 platinum oxide Inorganic materials 0.000 claims description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 claims 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 claims 1
- 241000238631 Hexapoda Species 0.000 description 15
- 239000005878 Azadirachtin Substances 0.000 description 12
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 12
- VEHPJKVTJQSSKL-UHFFFAOYSA-N azadirachtin Natural products O1C2(C)C(C3(C=COC3O3)O)CC3C21C1(C)C(O)C(OCC2(OC(C)=O)C(CC3OC(=O)C(C)=CC)OC(C)=O)C2C32COC(C(=O)OC)(O)C12 VEHPJKVTJQSSKL-UHFFFAOYSA-N 0.000 description 12
- FTNJWQUOZFUQQJ-IRYYUVNJSA-N azadirachtin A Natural products C([C@@H]([C@]1(C=CO[C@H]1O1)O)[C@]2(C)O3)[C@H]1[C@]23[C@]1(C)[C@H](O)[C@H](OC[C@@]2([C@@H](C[C@@H]3OC(=O)C(\C)=C/C)OC(C)=O)C(=O)OC)[C@@H]2[C@]32CO[C@@](C(=O)OC)(O)[C@@H]12 FTNJWQUOZFUQQJ-IRYYUVNJSA-N 0.000 description 12
- FTNJWQUOZFUQQJ-NDAWSKJSSA-N azadirachtin A Chemical compound C([C@@H]([C@]1(C=CO[C@H]1O1)O)[C@]2(C)O3)[C@H]1[C@]23[C@]1(C)[C@H](O)[C@H](OC[C@@]2([C@@H](C[C@@H]3OC(=O)C(\C)=C\C)OC(C)=O)C(=O)OC)[C@@H]2[C@]32CO[C@@](C(=O)OC)(O)[C@@H]12 FTNJWQUOZFUQQJ-NDAWSKJSSA-N 0.000 description 12
- 239000005893 Diflubenzuron Substances 0.000 description 11
- QQQYTWIFVNKMRW-UHFFFAOYSA-N diflubenzuron Chemical compound FC1=CC=CC(F)=C1C(=O)NC(=O)NC1=CC=C(Cl)C=C1 QQQYTWIFVNKMRW-UHFFFAOYSA-N 0.000 description 11
- 229940019503 diflubenzuron Drugs 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 10
- 239000000203 mixture Substances 0.000 description 7
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- YWLXLRUDGLRYDR-ZHPRIASZSA-N 5beta,20-epoxy-1,7beta,10beta,13alpha-tetrahydroxy-9-oxotax-11-ene-2alpha,4alpha-diyl 4-acetate 2-benzoate Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](O)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 YWLXLRUDGLRYDR-ZHPRIASZSA-N 0.000 description 4
- 241000626743 Spilarctia obliqua Species 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 230000009036 growth inhibition Effects 0.000 description 4
- 239000012044 organic layer Substances 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- 241001295925 Gegenes Species 0.000 description 3
- 229930012538 Paclitaxel Natural products 0.000 description 3
- 241000607479 Yersinia pestis Species 0.000 description 3
- 235000013305 food Nutrition 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 229960001592 paclitaxel Drugs 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 3
- 241000238876 Acari Species 0.000 description 2
- 235000010773 Cajanus indicus Nutrition 0.000 description 2
- 244000105627 Cajanus indicus Species 0.000 description 2
- 235000021508 Coleus Nutrition 0.000 description 2
- 244000061182 Coleus blumei Species 0.000 description 2
- 235000006679 Mentha X verticillata Nutrition 0.000 description 2
- 235000002899 Mentha suaveolens Nutrition 0.000 description 2
- 235000001636 Mentha x rotundifolia Nutrition 0.000 description 2
- 241001116500 Taxus Species 0.000 description 2
- 235000010716 Vigna mungo Nutrition 0.000 description 2
- 244000042295 Vigna mungo Species 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 239000003966 growth inhibitor Substances 0.000 description 2
- KDCIHNCMPUBDKT-UHFFFAOYSA-N hexane;propan-2-one Chemical compound CC(C)=O.CCCCCC KDCIHNCMPUBDKT-UHFFFAOYSA-N 0.000 description 2
- 238000005984 hydrogenation reaction Methods 0.000 description 2
- 230000000749 insecticidal effect Effects 0.000 description 2
- 238000001819 mass spectrum Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000003032 phytopathogenic effect Effects 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 230000003595 spectral effect Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- SEDZOYHHAIAQIW-UHFFFAOYSA-N trimethylsilyl azide Chemical compound C[Si](C)(C)N=[N+]=[N-] SEDZOYHHAIAQIW-UHFFFAOYSA-N 0.000 description 2
- JTRBKFKHLFWXOZ-UHFFFAOYSA-N 1-(3-bromobutyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCC(C)Br)C=C1 JTRBKFKHLFWXOZ-UHFFFAOYSA-N 0.000 description 1
- LDRUDKCVPWWAGG-UHFFFAOYSA-N 1-(3-chlorobutyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCC(C)Cl)C=C1 LDRUDKCVPWWAGG-UHFFFAOYSA-N 0.000 description 1
- NDMLXYGWOVXSJC-UHFFFAOYSA-N 4-(3-bromobutyl)phenol Chemical compound CC(Br)CCC1=CC=C(O)C=C1 NDMLXYGWOVXSJC-UHFFFAOYSA-N 0.000 description 1
- AVBSPNSLIOYGIU-UHFFFAOYSA-N 4-(3-chlorobutyl)phenol Chemical compound CC(Cl)CCC1=CC=C(O)C=C1 AVBSPNSLIOYGIU-UHFFFAOYSA-N 0.000 description 1
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 1
- IVRMZWNICZWHMI-UHFFFAOYSA-N Azide Chemical compound [N-]=[N+]=[N-] IVRMZWNICZWHMI-UHFFFAOYSA-N 0.000 description 1
- 101100453960 Drosophila melanogaster klar gene Proteins 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 206010035148 Plague Diseases 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 241000202349 Taxus brevifolia Species 0.000 description 1
- 235000006085 Vigna mungo var mungo Nutrition 0.000 description 1
- 240000005616 Vigna mungo var. mungo Species 0.000 description 1
- 239000000642 acaricide Substances 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000003905 agrochemical Substances 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000001887 anti-feedant effect Effects 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- VEMKTZHHVJILDY-UXHICEINSA-N bioresmethrin Chemical compound CC1(C)[C@H](C=C(C)C)[C@H]1C(=O)OCC1=COC(CC=2C=CC=CC=2)=C1 VEMKTZHHVJILDY-UXHICEINSA-N 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000711 cancerogenic effect Effects 0.000 description 1
- 231100000315 carcinogenic Toxicity 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 230000010485 coping Effects 0.000 description 1
- 238000005238 degreasing Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000002024 ethyl acetate extract Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- XPBBUZJBQWWFFJ-UHFFFAOYSA-N fluorosilane Chemical compound [SiH3]F XPBBUZJBQWWFFJ-UHFFFAOYSA-N 0.000 description 1
- 238000003898 horticulture Methods 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 150000005217 methyl ethers Chemical class 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 230000020477 pH reduction Effects 0.000 description 1
- 238000009304 pastoral farming Methods 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- RGCLLPNLLBQHPF-HJWRWDBZSA-N phosphamidon Chemical compound CCN(CC)C(=O)C(\Cl)=C(/C)OP(=O)(OC)OC RGCLLPNLLBQHPF-HJWRWDBZSA-N 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- JYQUHIFYBATCCY-UHFFFAOYSA-N quinalphos Chemical compound C1=CC=CC2=NC(OP(=S)(OCC)OCC)=CN=C21 JYQUHIFYBATCCY-UHFFFAOYSA-N 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000002689 soil Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 210000002023 somite Anatomy 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N33/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic nitrogen compounds
- A01N33/02—Amines; Quaternary ammonium compounds
- A01N33/08—Amines; Quaternary ammonium compounds containing oxygen or sulfur
- A01N33/10—Amines; Quaternary ammonium compounds containing oxygen or sulfur having at least one oxygen or sulfur atom directly attached to an aromatic ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C217/00—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton
- C07C217/54—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C217/56—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains not further substituted by singly-bound oxygen atoms
- C07C217/62—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains not further substituted by singly-bound oxygen atoms linked by carbon chains having at least three carbon atoms between the amino groups and the six-membered aromatic ring or the condensed ring system containing that ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
- Gebiet
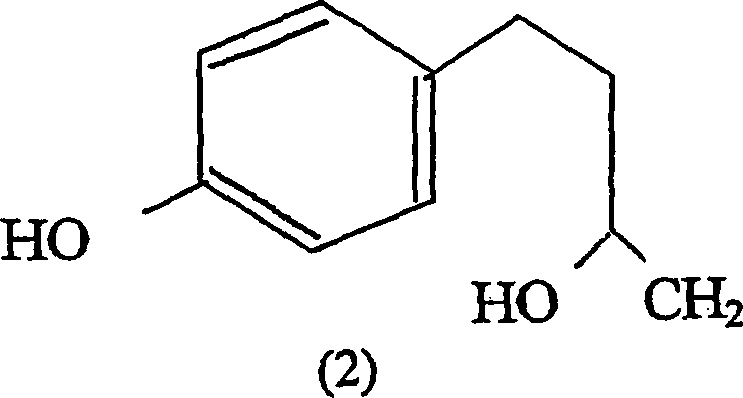
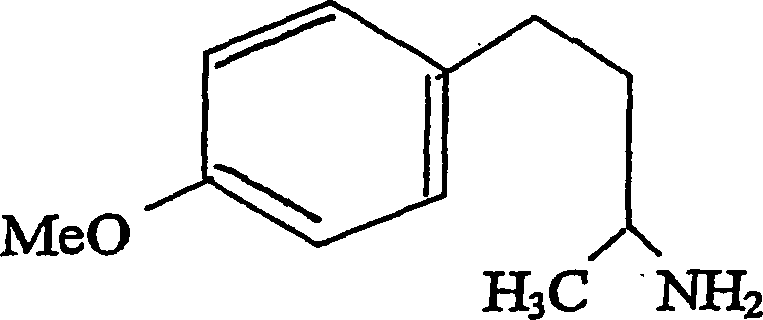
- Die Erfindung stellt ein Verfahren zur Herstellung des biologisch aktiven synthetischen Moleküls 4-(p-Methoxyphenyl)-2-aminobutan aus einer natürlich vorkommenden Verbindung 4-(p-Hydroxyphenyl)-butan-2-ol bereit. Das durch die Erfindung hergestellte Molekül ist ein farbloser kristalliner Feststoff, welcher durch die Molekularformel C11H17ON und die untenstehend gezeigte Strukturformel (1) dargestellt ist: C11H17ON = 4-(p-Methoxyphenyl)-2-aminobutan
- Die spektralen Charakteristika des Moleküls sind wie folgt: Das EI-Massenspektrum der Verbindung zeigte seinen Mt bei M/Z 179, wodurch seine Molekularformel als C11H17ON bestätigt wurde, und andere diagnostische Fragment-Peaks bei M/Z 162, 147, 121 und 91;1 IRυmax (KBr) 3360, 2940, 1610, 1515, 14501, 1030 und 850 cm–1.
- Das Produkt ist ein Molekül, das aus einem aus der Pflanze Taxus wallichiana isolierten, leicht erhältlichen Ausgangsmaterial 4-(p-Hydroxyphenyl)-butan-2-ol hergestellt wurde, welches durch die untenstehend gezeigte Formel (2) dargestellt ist.
- Hintergrund und Stand der Technik.
- Die Pflanze Taxus wallichiana, welche auch als Himalaja-Eibe bekannt ist, wird nunmehr als eine für die kommerzielle Nutzung am meisten benötigte Pflanze angesehen, da sie das Antikrebsmittel Taxol enthält. Taxol, ein hoch sauerstoffgesättigtes Diterpenoidmolekül und wirksames Antikrebsmittel, wurde zuerst aus der Stammrinde von Taxus brevifolia isoliert. Danach wurde es auch aus anderen Taxus-Pflanzen, einschließlich der Himalaja-Eibe Taxus wallichiana, isoliert.
- Die Anmelder arbeiteten an verschiedenen Teilen von Taxus wallichiana, welche in verschiedenen Gebieten Indiens gesammelt wurden, um Taxol, dessen wichtige Analoga und den Vorläufer 10-Deacetylbaccatin III (DAB) zu isolieren. Im Laufe der Untersuchung isolierten die Anmelder eine bedeutende Verbindung aus den Blättern von Taxus wallichiana, welche als 4-(p-Hydroxyphenyl)-butan-2-ol mit der Strukturformel (2) identifiziert wurde. Diese Verbindung kann in einer Ausbeute von 0,2% aus den Blättern von Taxus wallichiana erhalten werden. Demgemäß entwickelten die Anmelder eine einfache und kosteneffiziente Verarbeitungstechnologie zur Isolierung dieser Verbindung aus den Blättern von Taxus wallichiana. Das Verfahren zur Isolierung der Verbindung umfasst die Schritte des Entfettens luftgetrockneter pulverisierter Taxus-Blätter mit aliphatischen Kohlenwasserstofflösungsmitteln, des Extrahierens der entfetteten Blätter nacheinander mit chlorierten Lösungsmitteln und polaren Lösungsmitteln, des Konzentrierens der im chlorierten Lösungsmittel löslichen Fraktion zu einem Rest und des Behandelns des Rests mit einer wässrigen Alkalilösung sowie des Isolierens der Verbindung aus der Alkali-löslichen Fraktion durch Ansäuerung und Extraktion mit Ethylacetat, um die Verbindung mit der Strukturformel (2) zu erhalten.
- Die Verbindung (2) erwies sich in Bioassay-Studien zur Auswertung der wachstums- und fraßhemmenden Wirkung als nicht aktiv. Die Verbindung der Formel (2) wurde in hoher Ausbeute (0,2%) erhalten, ihre Umwandlung in andere strukturelle Analoga erfolgte durch eine Reihe von chemischen Reaktionen. Im Laufe dieser Untersuchung stellten die Anmelder aus der durch die Formel (2) dargestellten Verbindung das durch die Formel (1) dargestellte Molekül her. Die Verbindung mit der Strukturformel (1) zeigt eine beträchtliche Aktivität als Wachstums- und Fraßhemmer.
- Die Verbindung mit der Formel (1) wurde als Fraßabschrecker und Wachstumshemmer gegen Spilarctia Obliqua-Larven im 4. Stadium eingeschätzt. Dieses Insekt attackiert mehr als zwanzig zum Verkauf geeignete Feldfrüchte, einschließlich Urd, Mong, Arhar, Minze und Coleus etc.
- Die Verbindung mit der Formel (1) ist in der Natur ungefährlich und somit hinsichtlich ihrer Verwendung als Agrochemikalie ökologisch unbedenklich und umweltfreundlich.
- Ziele
- Das Ziel der Erfindung besteht in der Bereitstellung eines Verfahrens zur Herstellung einer durch die Strukturformel (1) dargestellten, biologisch aktiven Verbindung aus einem aus der Pflanze Taxus wallichiana isolierten, leicht erhältlichen Ausgangsmaterial, und zwar in höheren Ausbeuten.
- Detaillierte Beschreibung der Erfindung
- Demgemäß stellt die vorliegende Erfindung ein Verfahren zur Herstellung von 4-(p-Methoxyphenyl)-2-aminobutan, C11H17ON, bereit, welches durch die untenstehend gezeigte Strukturformel (1) dargestellt ist.
- Die Verbindung weist eine wachstums- und fraßhemmende Wirkung auf. Das Verfahren zur Isolierung der Verbindung umfasst die folgenden Schritte:
- a) das Isolieren eines durch die Strukturformel (2) dargestellten Phenolmoleküls aus den Blättern von Taxus wallichiana durch an sich bekannte Verfahren,
- b) 2- bis 10-stündiges Behandeln der Phenolverbindung aus Schritt (a) mit einer wässrigen Mineralsäure bei 25–100°C, um ein entsprechendes Alkylhalogenidderivat mit der Formel C10H13OX (3) zu erhalten,
- c) das Umwandeln des Alkylhalogenidderivats aus Schritt (b) in seinen Methylether durch Behandlung mit einem Methylierungsmittel, um einen entsprechenden Methylether mit der Formel C11H15OX (4) zu erhalten,
- d) das Umsetzen des so erhaltenen Methylethers aus Schritt (c) mit Azid, um ein Azidderivat mit der Formel C11H15ON3 (5) zu erhalten, und
- e) das Hydrieren der so gebildeten Azidverbindung durch katalytische Hydrierung in Gegenwart eines Katalysators in einem niederaliphatischen Alkohol, um eine
- Verbindung mit der Formel C11H17ON (1) zu erhalten, wobei X ausgewählt ist aus der Gruppe, bestehend aus Brom, Chlor und Iod.
- Die in Schritt (b) verwendete wässrige Mineralsäure kann ausgewählt sein aus der Gruppe, bestehend aus Chlorwasserstoffsäure, Bromwasserstoffsäure und Iodwasserstoffsäure. Das in Schritt (c) verwendete Methylierungsmittel kann ausgewählt sein aus Methyliodid oder Dimethylsulfat.
- Das in Schritt (d) verwendete Azid ist Natriumazid oder Trimethylsilylazid.
- Der beim Hydrierungsverfahren verwendete Katalysator ist ausgewählt aus Palladium-Aktivkohle und Platinoxid. Der niedere Alkohol, der als Medium zum Auflösen des Azidderivats im Hydrierungsverfahren verwendet wird, kann Methylalkohol, Ethylalkohol sein.
- Die vorliegende Erfindung stellt auch Zwischenverbindungen mit den Formeln 3 und 5 bereit, wobei X = Br, Cl oder I.
- Wie zuvor erwähnt, besitzt die Verbindung 4-(p-Methoxyphenyl)-2-aminobutan eine fraß- und wachstumshemmende Wirkung auf bestimmte Insekten, insbesondere die Larven von Spilarctia Obliqua.
- Folglich besitzt die Verbindung eine Verwendungsmöglichkeit als Insektizid und hätte umfassende Anwendungsmöglichkeiten in Insektizidzusammensetzungen. Ohne sich an irgendeine Theorie binden zu wollen, stellen die Anmelder fest, dass eine Insektizidzusammensetzung mit einer wirksamen Menge der Verbindung 4-(p-Methoxyphenyl)-2-aminobutan und einem Hilfsstoff in einer Menge, die zur Steigerung der Wirksamkeit der Zusammensetzung ausreicht, hergestellt werden kann. In der Praxis stellt sich heraus, dass die Verbindung 4-(p-Methoxyphenyl)-2-aminobutan an sich auch zur Insektenbekämpfung auf Feldern eingesetzt werden kann, obwohl empfohlen wird, die Verbindung vor der Verwendung mit Vermehrungshilfsstoffen, wie z.B. destilliertem Wasser, Aceton oder anderen derartigen Lösungsmitteln, zu vermischen. Die Insektizidzusammensetzungen können zur Schädlingsbekämpfung aufgesprüht oder in den Boden eingebracht werden. Weiters kann die Insektizidzusammensetzung wirksam zur Bekämpfung von Insekten/deren Larven, wie z.B. von Spilarctia Obliqua, eingesetzt werden. In der Praxis erweist sich die Verbindung als äußerst nützlich bei der Bekämpfung von phytopathogenen Insekten und Milben.
- Die Erfindung, ihre Ausführungsformen und Anwendungsmöglichkeiten sind im Detail in den untenstehend angeführten Beispielen beschrieben, welche zur Veranschaulichung der Erfindung vorgesehen sind und daher nicht als den Umfang dieser Erfindung einschränkend interpretiert werden sollten.
- Die Produkte der Reaktionen, wie in den nachstehenden Schritten beschrieben, sind hier dargestellt: Schritt 1 C10H13OX (4-(p-Hydroxyphenyl)-2-halogenbutan) (3) Schritt 2 C11H15OX (4-(p-Methoxyphenyl)-2-halogenbutan) (4) Schritt 3 C11H15ON3 = (4-(p-Methoxyphenyl)-2-azidobutan) (5) Schritt 4 C11H17ON = (4-(p-Methoxyphenyl)-2-aminobutan) (1)
- Beispiel 1
- Schritt 1 - Herstellung von 4-(p-Hydroxyphenyl)-2-brombutan (Formel 3) - (C10H13O Br)
- Eine Verbindung der Formel (2) (1 g) wurde in einen 50 ml-Erlenmeyerkolben gefüllt, und HBr (44%) (5 ml) wurde tropfenweise hinzugefügt, und die Reaktionsmischung wurde unter ständigem Rühren bei 80°C 6 Stunden lang refluxiert. Die Reaktionsmischung wurde mit Wasser im Überschuss verdünnt und mit Ethylacetat (25 ml × 3) extrahiert. Das Ethylacetat wurde über wasserfreiem Natriumsulfat getrocknet und konzentriert. Der in der obenstehenden Weise erhaltene ölige Rückstand wurde einer Säulenchromatographie auf Kieselgel unterzogen, um eine reine Verbindung mit der Formel (3) zu erhalten (1 g).
- Schritt 2 - Herstellung von 4-(p-Methoxvnhenyl)-2-brombutan
- Die Verbindung mit der Formel (3) (1 g) wurde in Aceton (10 ml) aufgelöst, und wasserfreies Kaliumcarbonat (10 g) und Dimethylsulfat (3 ml) wurden hinzugefügt, und es wurde unter Rühren 4 Stunden lang refluxiert. Wasser wurde in den Reaktionskolben hinzugefügt und 3 Stunden lang gerührt. Danach wurde mit Wasser-CHCl3 (25 ml × 3) extrahiert und mit Wasser (25 ml × 2) gewaschen. Die organische Schicht wurde über wasserfreiem Natriumsulfat getrocknet und unter Vakuum konzentriert, um ein öliges Material (4) zu erhalten (1,0 g).
- Schritt 3 - Herstellung von 4-(p-Methoxphenyl)-2-azidobutan (C11H15ON3)
- Eine Verbindung mit der Formel (4) (1,0 g) wurde in DMF (10 ml) aufgelöst und mit Natriumazid (2 g) behandelt und bei 20–80°C 6 Stunden lang gerührt. Die Reaktionsmischung wurde in Wasser gegossen und mit Benzol (50 ml × 3) extrahiert; die organische Schicht wurde mit Wasser (25 ml × 2) gewaschen, über Natriumsulfat getrocknet und konzentriert, um Azid (5) zu ergeben (800 mg).
- Schritt 4 - Herstellung von 4-(p-Methoxyphenyl)-2-aminobutan (C11H17ON) mit Formel (1)
- Das Azid (5) (300 mg) wurde in Methanol (20 ml) aufgelöst, und Palladium-Aktivkohle (30 mg) wurde hinzugefügt, und es wurde unter Wasserstoff 6 Stunden lang bei 55 Psi gerührt; dann wurde der Katalysator abfiltriert und das Filtrat konzentriert, um einen Rest zu ergeben, der in Form von Nadeln aus einer Aceton-Hexan-Mischung auskristallisierte, um eine Verbindung mit der Formel (1) zu ergeben (208 mg).
- Beispiel 2
- Schritt 1 - Herstellung von 4-(p-Hydroxyphenyl)-2-chlorbutan (C10H13OCl)
- Eine Verbindung mit der Formel (2) (1 g) wurde in einen 50 ml-Erlenmeyerkolben gefüllt, und HCl, 37%, 5 ml, wurde tropfenweise hinzugefügt, und die Reaktionsmischung wurde unter ständigem Rühren bei 80°C 6 Stunden lang refluxiert. Die Reaktionsmischung wurde mit Wasser im Überschuss verdünnt und mit Ethylacetat (25 ml × 3) extrahiert. Der Ethylacetat-Extrakt wurde über wasserfreiem Natriumsulfat getrocknet und konzentriert. Der so erhaltene ölige Rückstand wurde einer Flash-Chromatographie auf Fluorosil unterzogen, um eine reine Verbindung mit der Formel (3) zu ergeben (1 g).
- Schritt 2 - Herstellung von 4-(p-Methoxyphenyl)-2-chlorbutan (C11H15OCl) dargestellt durch Formel (4)
- Die Verbindung (3) (1 g) wurde in Aceton (10 ml) aufgelöst, und wasserfreies Kaliumcarbonat (10 g) und Methyliodid (3 ml) wurden hinzugefügt, und es wurde unter Rühren 4 Stunden lang refluxiert, Wasser wurde in den Reaktionskolben hinzugefügt und 3 Stunden lang gerührt. Danach wurde mit Wasser-CHCl3 (25 ml × 3) extrahiert und mit Wasser (25 ml × 2) gewaschen. Die organische Schicht wurde über wasserfreiem Natriumsulfat getrocknet und unter Vakuum konzentriert, um ein öliges Material mit der Formel (4) zu erhalten (1 g).
- Schritt 3 - Herstellung von 4-(p-Methoxyphenyl)-2-azidobutan (C11H15ON3) dargestellt durch Formel (5)
- Verbindung (4) (1,0 g) wurde in DMF (10 ml) aufgelöst und mit Trimethylsilylazid (2 g) behandelt und bei 20–80°C 6 Stunden lang gerührt. Die Reaktionsmischung wurde in Wasser gegossen und mit Benzol (50 ml × 3) extrahiert; die organische Schicht wurde mit Wasser (25 ml × 2) gewaschen, über wasserfreiem Natriumsulfat getrocknet und konzentriert, um 800 mg Azid der Formel (5) zu ergeben.
- Schritt 4 - Herstellung von 4-(p-Methoxyphenyl)-2-aminobutan (C11H17ON) mit Formel (1)
- Das Azid (5) (300 mg) wurde in Ethanol (20 ml) aufgelöst, und PtO2 (10 mg) wurde hinzugefügt, und es wurde unter Wasserstoff 6 Stunden lang bei 55 Psi gerührt; dann wurde der Katalysator abfiltriert und das Filtrat konzentriert, um einen Rest zu ergeben, der in Form von Nadeln aus einer Aceton-Hexan-Mischung auskristallisierte, um 208 mg der Verbindung der Formel (1) zu ergeben.
- Die spektralen Charakteristika des Moleküls sind wie folgt:
Das EI-Massenspektrum der Verbindung zeigte seinen M+ bei M/Z 179, wodurch seine Molekularformel als C11H17ON bestätigt wurde, und andere diagnostische Fragment-Peaks bei M/Z 162, 147, 121 und 91; IR⇆max (KBr) 3360, 2940, 1610, 1515, 14501, 1030 und 850 cm–1. - Das Molekül wurde aus einem aus der Pflanze Taxus wallichiana isolierten, leicht erhältlichen Ausgangsmaterial 4-(p-Hydroxyphenyl)-butan-2-ol mit der Formel (2) hergestellt.
- Bewertung des hergestellten Moleküls hinsichtlich seiner fraßhemmenden Wirkung Die Verbindung mit der Formel (1) wurde als Fraßabschrecker und Wachstumshemmer gegen Spilarctia Obliqua-Larven (die haarige Bihar-Raupe) im 4. Stadium bewertet. Dieses Insekt attackiert mehr als zwanzig zum Verkauf geeignete Feldfrüchte wie z.B. Urd, Moong, Arhar, Minze und Coleus etc. Mehrere synthetische Insektizide, wie z.B. Chinalphos, Phosphamidon und synthetische Pyrethroide, werden zur Bewältigung dieser Insektenplage kommerziell verwendet. Das Insekt entwickelt jedoch eine Resistenz gegen einige dieser Insektizide. Daher wurde nun die Suche nach neuen, ökologisch unbedenklichen, umweltfreundlichen und nicht toxischen Chemikalien zur Bewältigung dieser Plage dringend notwendig.
- Mit einer Verbindung mit der Formel (1) wurden die Fraßabschreckung und die Wachstumshemmung von Insekten durch das Mischernährungsverfahren getestet. Bei diesem Verfahren wurde 4-(p-Methoxyphenyl)-2-aminobutan, die Verbindung mit der Formel (1), in Aceton aufgelöst, um verschiedene Konzentrationen im Bereich von 1000 bis 5000 ppm herzustellen. Die Testlösung wurde in die künstliche Nahrung des Insekts gemischt, so dass jedes Gramm Nahrung 60–300 μg der Verbindung (1) enthielt. Eine Larve im 4. Stadium (frisch gehäutet) hungerte vier Stunden lang, wurde gewogen und auf behandelte künstliche Nahrung losgelassen, und zwar in dreißig Wiederholungen. Bei der Kontrolle wurde nur das Lösungsmittel Aceton zugemischt, und Azadirachtin in einer Konzentration von 1000 ppm wurde als Standard für den Fütterungs-Bioassay herangezogen. Nach 24 Stunden wurde die Anzahl der produzierten Kotpellets gezählt, und die Daten wurden hinsichtlich der % Fraßabschreckung ausgewertet. Einige Versuche wurden für die nächsten 24 Stunden fortgesetzt, und die Gewichte der Larven wurden täglich ermittelt. Nach 3 Tagen wurde der Versuch abgebrochen, und die Gewichtszunahme oder der Gewichtsverlust wurde hinsichtlich der % Wachstumshemmung ausgewertet.
- Im Fall einer Wachstumshemmungsanalyse wurde als Standard Diflubenzuron in einer Menge von 5 ppm herangezogen. Die Testergebnisse einer Verbindung mit der Formel (1) sind hinsichtlich ihrer Fraßabschreckung und Wachstumshemmung in Tabelle 1 angegeben, und zwar im Vergleich zu den Standards Azadirachtin und Diflubenzuron.
- Wie aus Tabelle 1 ersichtlich, ist eine Verbindung mit der Formel (1) als fraßabschreckendes Mittel im Vergleich zu Azadirachtin weniger aktiv. Das neue Molekül (1) besitzt jedoch im Vergleich zu Azadirachtin mehrere andere Vorteile, welche Folgendes umfassen:
- (a) Eine Verbindung mit der Formel (1) ist in struktureller Hinsicht ein sehr kleines Molekül (Molekülmasse 179), und zwar im Vergleich zu Azadirachtin, das ein großes Molekül mit vielen Chiralitätszentren, Molekülmasse 720, darstellt; daher kann das Molekül (1) im Gegensatz zu Azadirachtin, dessen Synthese niemals kommerziell durchführbar wäre, leicht synthetisiert werden.
- (b) Im Gegensatz zu Azadirachtin, das lichtempfindlich ist, d.h. beim Ausgesetztsein an Sonnenlicht zerfällt, ist eine Verbindung mit der Formel (1) gegenüber Licht (sowohl UV- als auch Sonnenlicht) unempfindlich. Daher kann die Verbindung (1) unter Freilandbedingungen verwendet werden, ganz im Gegensatz zu Azadirachtin, das bis heute unter Freilandbedingungen nicht eingesetzt werden kann. Hinsichtlich der wachstumshemmenden Eigenschaften ist eine Verbindung mit der Formel (1) weniger aktiv als die Standardverbindung Diflubenzuron. Viele Insekten entwickeln jedoch eine Resistenz gegen diese bestimmte Verbindung, und daher sind zum Abtöten der Insekten höhere Dosierungen als die in Tabelle 1 erwähnten 5 ppm erforderlich. Letztendlich wird ihre Wirksamkeit enden. Daher ist eine Verbindung mit der Formel (1), die sich von Diflubenzuron strukturell unterscheidet, nützlich gegen Diflubenzuron-resistente Insekten. Diflubenzuron enthält auch Fluoratome in seinem Molekül und neigt daher dazu, bei mikrobieller Aktivierung krebserregend und umweltschädlich zu sein. Aufgrund ihrer im Vergleich zu Diflubenzuron anderen Struktur ist eine Verbindung mit der Formel (1) ökologisch ungefährlich und umweltfreundlich. Aus dem Vorangegangenen geht klar hervor, dass die durch das erfindungsgemäße Verfahren hergestellten Verbindungen äußerst stark bekämpfende Wirkungen gegen verschiedene Arten von phytopathogenen Insekten, Milben etc. aufweisen und somit als Wirkstoffe in Insektiziden, Mitiziden etc. für Landwirtschaft und Gartenbau nützlich sind.
- Vorteile
- 1. Die Chemikalien und Reagenzien, die zur Herstellung der aktiven Verbindung verwendet werden, sind nicht kostspielig, und somit ist das Verfahren kosteneffizient und in Hinblick auf eine kommerzielle Produktion realisierbar.
- 2. Alle Schritte des Verfahrens sind unkompliziert; es ist nicht notwendig, zur Herstellung der aktiven Verbindung extreme Reaktionsbedingungen aufrechtzuerhalten, und somit ist das Verfahren kommerziell realisierbar.
Claims (8)
- Verfahren zur Herstellung von 4-(p-Methoxyphenyl)-2-aminobutan, das durch die untenstehend gezeigte Strukturformel dargestellt ist: Formel 1 und die Formel C11H17ON aufweist, wobei das Verfahren die folgenden Schritte umfasst: (a) das Isolieren einer Phenolverbindung (4-p-Hydroxyphenyl)-butan-2-ol mit der Formel C10H14O2 (2) aus den Blättern von Taxus wallichiana durch an sich bekannte V erfahren, (b) 2 bis 10-stündiges Behandeln der Phenolverbindung aus Schritt (a) mit einer wässrigen Mineralsäure bei 25–100°C, um ein entsprechendes Alkylhalogenidderivat mit der Formel C10H13OX (3) zu erhalten, (c) das Umwandeln des Alkylhalogenidderivats aus Schritt (b) in seinen Methylether durch Behandlung mit einem Methylierungsmittel, um einen entsprechenden Methylether mit der Formel C11H15OX (4) zu erhalten, (d) das Umsetzen des so erhaltenen Methylethers aus Schritt (c) mit Azid, um ein Azidderivat mit der Formel C11Hi5ON3 (5) zu erhalten, und (e) das Hydrieren der so gebildeten Azidverbindung durch katalytische Hydrierung in Gegenwart eines Katalysators in einem niederaliphatischen Alkohol, um eine Verbindung mit der Formel C11H17ON (1) zu erhalten, wobei X ausgewählt ist aus der Gruppe, bestehend aus Brom, Chlor und Iod.
- Verfahren, wie in Anspruch 1 beansprucht, wobei die in Schritt (b) verwendete wässrige Mineralsäure ausgewählt ist aus Chlorwasserstoffsäure, Bromwasserstoffsäure und Iodwasserstoffsäure.
- Verfahren, wie in Anspruch 1 beansprucht; wobei das in Schritt (c) verwendete Methylierungsmittel ausgewählt ist aus Methyliodid und Dimethylsulfat.
- Verfahren, wie in Anspruch 1 beansprucht, wobei das in Schritt (d) verwendete Azid ausgewählt ist aus Natriumazid und Trimethylsilylazid.
- Verfahren, wie in Anspruch 1 beansprucht, wobei der in Schritt (e) verwendete Katalysator ausgewählt ist aus Palladium-Aktivkohle und Platinoxid.
- Verfahren, wie in Anspruch 1 beansprucht, wobei der verwendete niederaliphatische Alkohol ausgewählt ist aus Methylalkohol oder Ethylalkohol.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP20000890102 EP1138666B1 (de) | 2000-03-28 | 2000-03-28 | Verfahren zur Herstellung von 4-(P-methoxyphenyl)-2-amino-butane und Insektizide |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE60008697D1 DE60008697D1 (de) | 2004-04-08 |
| DE60008697T2 true DE60008697T2 (de) | 2005-02-10 |
Family
ID=8175921
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE2000608697 Expired - Lifetime DE60008697T2 (de) | 2000-03-28 | 2000-03-28 | Verfahren zur Herstellung von 4-(P-methoxyphenyl)-2-amino-butane und Insektizide |
Country Status (2)
| Country | Link |
|---|---|
| EP (1) | EP1138666B1 (de) |
| DE (1) | DE60008697T2 (de) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103347517B (zh) | 2010-08-11 | 2018-10-02 | 德雷克塞尔大学 | 治疗帕金森病中运动障碍的d3多巴胺受体激动剂 |
| ES2769780T3 (es) | 2013-10-28 | 2020-06-29 | Univ Drexel | Tratamientos novedosos para los trastornos de atención y cognitivos y para la demencia asociada a un trastorno neurodegenerativo |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1544872A (en) * | 1976-06-25 | 1979-04-25 | Sterling Drug Inc | 4-hydroxyphenylalkanolamine derivatives and preparation thereof |
| DE3915755A1 (de) * | 1989-05-13 | 1990-11-29 | Bayer Ag | Fungizide mittel sowie substituierte aminosaeureamid-derivate und deren herstellung |
| JP2818958B2 (ja) * | 1990-02-23 | 1998-10-30 | 塩野義製薬株式会社 | 4―(4―アルコキシフェニル)―2―ブチルアミン誘導体およびその製造法 |
| DE19924273A1 (de) * | 1998-07-18 | 2000-01-20 | Bayer Ag | Imidamid-Derivate |
-
2000
- 2000-03-28 DE DE2000608697 patent/DE60008697T2/de not_active Expired - Lifetime
- 2000-03-28 EP EP20000890102 patent/EP1138666B1/de not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| EP1138666B1 (de) | 2004-03-03 |
| DE60008697D1 (de) | 2004-04-08 |
| EP1138666A1 (de) | 2001-10-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE60314240T2 (de) | Herstellung von dihydronepetalacton durch hydrierung von nepetalacton | |
| CH634818A5 (de) | Verfahren zur herstellung von cyclopropanverbindungen und diese verbindungen enthaltende insektizide. | |
| DE2348930A1 (de) | Insektizide mittel | |
| DE2034128C2 (de) | Cyclopentenolonester, Cyclopentenone und die Verwendung der Cyclopentenolonester als Insektizide | |
| DE2159882C3 (de) | Verfahren zur Herstellung niederer Alkylester der cis-Chrysanthemum-monocarbonsäure | |
| DE1618925B1 (de) | Cyclopropancarbonsäure-xyclopentenolonester, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende insektizide Mittel | |
| DE69913735T2 (de) | Verfahren zu herstellung von 5-(alfa-hydroxyalkyl)benzo-[1,3]dioxolane | |
| DE60008697T2 (de) | Verfahren zur Herstellung von 4-(P-methoxyphenyl)-2-amino-butane und Insektizide | |
| DE1768975A1 (de) | Pesticide Verbindungen und Verfahren zu ihrer Herstellung | |
| DE2735361C2 (de) | 4-trans,7-cis,10-cis-Trideca-trienylacetat, Verfahren zu seiner Herstellung und Lockmittel für die Kartoffelmotte mit dieser Verbindung als Wirkstoff | |
| DE2517179A1 (de) | Verfahren zur kontrolle von parasitischen unkraeutern und unkrautvertilgungsmittel | |
| US6441205B1 (en) | Synthetic precursors to 4-(P-methoxyphenyl)-2-amino-butane | |
| US6252114B1 (en) | Process for preparing novel biologically active synthetic molecule 4-(p-methoxyphenyl)-2-amino-butane | |
| DE2322853C3 (de) | Substituierte Phenylderivate, Verfahren zu ihrer Herstellung und Mittel zur Bekämpfung von Schädlingen | |
| DE2544313A1 (de) | Substituierte crotonanilide, verfahren zu ihrer herstellung und diese verbindungen enthaltende herbicid-zubereitungen | |
| DE3045909A1 (de) | 2,3-dihydropyrane, verfahren zu ihrer herstellung und ihre verwendung zur bekaempfung von insekten | |
| DE4436619C2 (de) | Nematizide Mittel gegen Kiefernholz-Nematoden | |
| DE1618925C (de) | Cyclopropancarbonsäure-cyclopentenolonester, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende insektizide Mittel | |
| DE1936495C (de) | l,l-Bis-(p-äthoxyphenyl)-2nitroalkane, Verfahren zu deren Herstellung sowie diese Verbindungen enthaltende Insektizide | |
| DE60106983T2 (de) | Alkylxanthate und ihre anwendung als schädlingsbekämpfungsmittel | |
| DE2313505C3 (de) | 2,3-Dihydrobenzofuranderivate, Verfahren zu ihrer Herstellung und Schädlingsbekämpfungsmittel mit einem Gehalt dieser Verbindungen | |
| DE2129991C3 (de) | Verfahren zur Herstellung von 2-(4,5-Dihydro-5-propyl-2(3H)-furyliden) -1,3-cyclopentandion | |
| DE2439104C3 (de) | Cyclohexanderivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Herbizide | |
| DE1543804C (de) | Furylmethylalkohole und Verfahren zu ihrer Herstellung | |
| DE2015869C (de) | 5-Propargyl-2- oder -3-cyclopropancarbonsäuretheuylester und ihre Verwendung als Insektizide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |