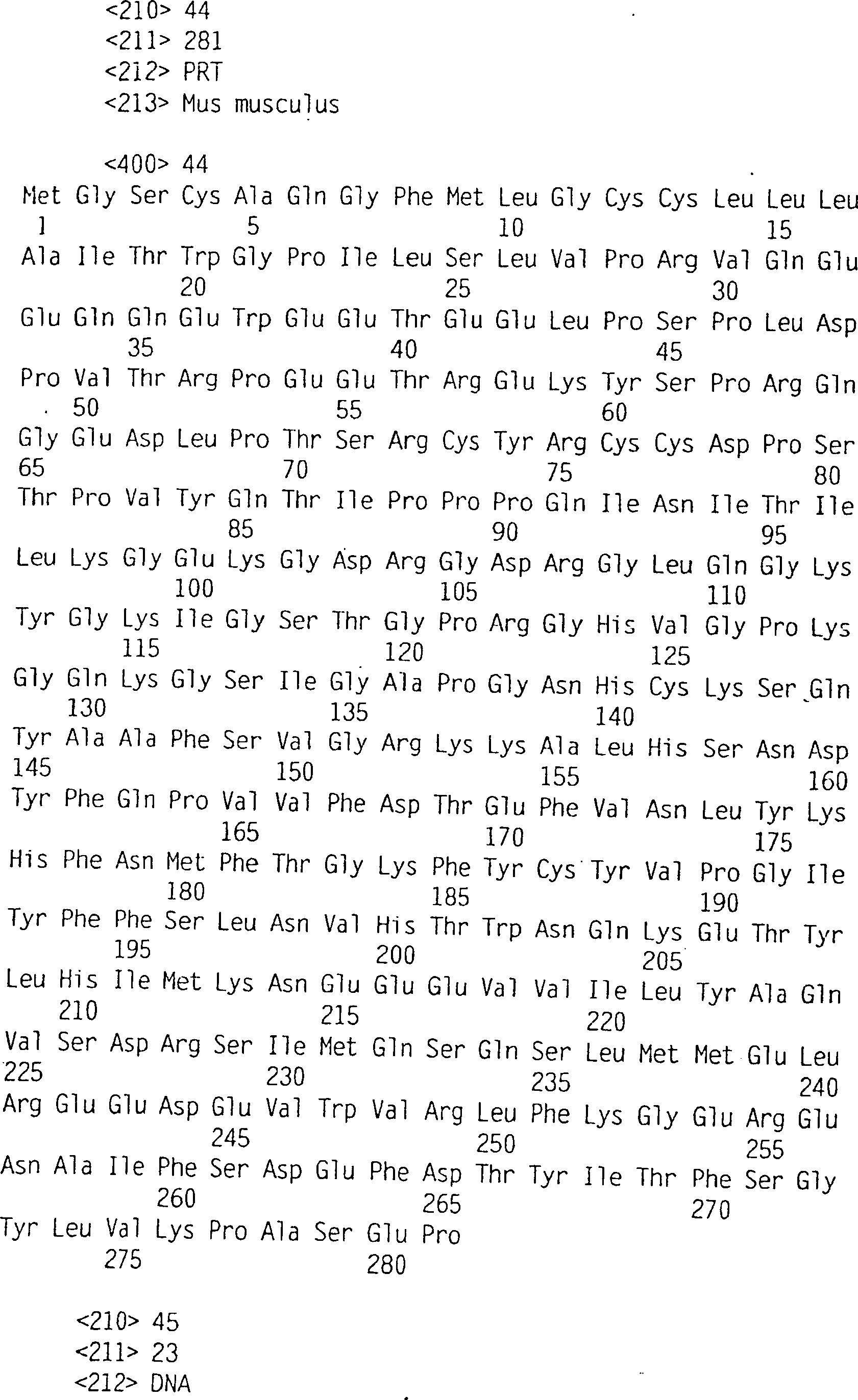-
HINTERGRUND
DER ERFINDUNG
-
Eine Verletzung der Blutgefäße setzt
eine Anzahl an Ereignissen in Bewegung, um den Schaden zu reparieren
und die Freisetzung von Blut aus dem Gefäß zu kontrollieren. Dieser
Vorgang ist bekannt als Hämostase.
Blutplättchen
spielen eine frühe
Rolle bei der Hämostase,
indem ein Blutgerinnsel oder ein Pfropfen gebildet wird, um die
Gefäßschädigung vorübergehend
zu reparieren. Blutplättchen
gehen normalerweise keine Wechselwirkung mit dem Endothelium ein,
das die Gefäßwände auskleidet,
aber Verletzung der Blutgefäße durch
Unfall oder während
chirurgischer Eingriffe kann die Endothelzellen stören. In
Abhängigkeit
von dem Ausmaß der
Verletzung werden unterschiedliche subendotheliale Elemente, wie
z. B. Kollagene, elastische Lamina oder glatte Muskelzellen mit
begleitenden fibrillären
Kollagenen dem fließenden
Blut ausgesetzt.
-
Wenn das Subendothelium nach einer
Gefäßverletzung
freigelegt wird, gehen Blutplättchen,
die sich in dem örtlichen
Blutfluss bewegen, Wechselwirkungen mit freigesetzter Subendotheliummatrix
ein, die Kollagen enthält,
und werden abgebremst. Die weitere Wechselwirkung zwischen Rezeptoren
auf der Oberfläche der
Blutplättchen
und der freigelegten Kollagenschicht führt zur Plättchenbindung und -aktivierung,
was zum Anhalten des lokalen Blutflusses führt. Die gebundenen Blutplättchen werden
aktiviert und bilden Aggregate mit Blutplättchen in dem vorbeifließenden Blutfluss
durch die Bildung von Fibrinogenbrücken zwischen den Plättchen (Moroi
und Jung, Frontiers in Bioscience 3: 719-28, 1998; Barnes et al., Atherosclerosis
XI, Jacotot et al., Hrsg., Elsevier Science, S. 299–306, 1998
und Barnes et al., Curr. Opin. Hematol. 5: 314–20, 1998)
-
Die hämostatische Antwort ist abgestuft
und abhängig
von dem Ausmaß der
Verletzung der Blutgefäße, der
spezifischen Blutgefäßbestandteile,
die freigelegt werden und den Blutflussbedingungen in dem verletzten
Gebiet (Rand et al., Thrombosis und Haemostasis 78: 445–50, 1997).
Durch Freilegen der Subendotheliummatrix (Typ VI-Kollagen und von-Willebrand-Faktor),
wie z. B. während
leichter Gefäßverletzung,
werden ein geringes Maß der
Haftung und Aggregation in Gebieten mit Bedingungen eines geringen Blutflusses gefördert. Verletzungen,
die in einem größerem Ausmaß der Gefäßverletzung
und dem Freisetzen zusätzlicher Gefäßbestandteile
resultieren, wie z. B. der inneren elastischen Lamina und elastinassoziierter
Mikrofibrillen, werden die Bildung von stärkeren Plättchenaggregaten stimulieren.
Starke Gefäßverletzung,
wodurch fibrilläre Kollagene
freigesetzt werden, ruft eine thrombotische Plättchenantwort hervor, die das
Opfer vor übermäßigem Blutverlust
bewahrt (Rand et al., ebenda).
-
Hämostaseinhibitoren
würden
nützlich
sein für
die Steigerung des Blutflusses nach Gefäßverletzung und, um Kollagenoberflächen zu
beruhigen.
-
Der Komplementfaktor C1q besteht
aus sechs Kopien dreier verwandter Polypeptide (A-, B- und C-Ketten),
wobei jedes Polypeptid ungefähr
225 Aminosäuren
lang ist, mit einer Kollagendomäne
in der Nähe des
Aminoterminus und einem carboxyterminalen globulären Bereich. Sechs Tripelhelixbereiche
werden durch die Kollagendomänen
der sechs A-, sechs B- und sechs C-Ketten gebildet, wodurch ein
Zentralbereich und sechs Stiele gebildet werden. Ein globulärer Kopfteil
wird gebildet durch das Verknüpfen
der globulären
carboxyterminalen Domäne
einer A-, einer B- und einer C-Kette. C1q ist deswegen aus sechs
globulären
Köpfen zusammengesetzt,
die über
sechs kollagenähnliche
Stiele mit einem zentralen fibrillären Bereich gekoppelt sind.
Sellar et al., Biochem. J. 274: 481–90, 1991. Auf diese Anordnung
wird oftmals Bezug genommen als Blumenstrauß. Acrp30 hat eine ähnliche
Bukettstruktur, die aus einem einzigen Polypeptidkettentyp gebildet wird.
-
Von C1q wurde herausgefunden, dass
es Abwehrmechanismen ebenso stimuliert, wie es die Bildung toxischer
Sauerstoffarten auslöst,
die eine Gewebeschädigung
bewirken können
(Tenner, Behring Inst. Mitt. 93: 241–53, 1993). C1q-Bindestellen
werden auf Blutplättchen
gefunden. Zusätzlich
spielen Komplement und C1q eine Rolle bei Entzündungen. Die Komplementaktivierung
wird durch das Binden von C1q an Immunoglobulinen in Gang gebracht.
-
Inhibitoren von C1q und des Komplementweges
würden
nützlich
sein bei antiinflammatorischen Anwendungen, der Inhibition der,
Komplementaktivierung und der thrombotischen Wirkung.
-
Die vorliegende Erfindung stellt
solche Polypeptide für
diese und andere Zwecke, die offensichtlich sein sollten für Fachleute,
aus den hierin offenbarten Lehren bereit.
-
In einem Aspekt der Erfindung wird
eine Verwendung eines komplementverwandten Proteins aus Adipozyten,
das die thrombogene und Komplementaktivität in dem Gefäßsystem reduziert,
zur Herstellung einer pharmazeutischen Zubereitung zur Förderung
des Blutstroms im Gefäßsystem
eines Säugers
bereitgestellt. In einem Ausführungsbeispiel
umfasst das komplementverwandte Protein aus Adipozyten ein Polypeptid,
das eine Sequenz von Aminosäureresten
umfasst, die wenigstens zu 75% identisch ist zu der Aminosäuresequenz der
Reste 26–281
von SEQ ID NO: 2, worin diese Sequenz umfasst: Gly-Xaa-Xaa- oder
Gly-Xaa-Pro-Repeats, die
eine Kollagendomäne
bilden, worin Xaa irgend eine Aminosäure ist, und einen carboxyterminalen
globulären
Anteil. In einem verwandten Ausführungsbeispiel
umfasst das Polypeptid eine Sequenz von Aminosäureresten, die zu wenigstens
90% identisch ist mit der Aminosäuresequenz
der Reste 22–281
von SEQ ID NO: 2. In einem anderen Ausführungsbeispiel umfasst das
Polypeptid eine Aminosäuresequenz,
die zu wenigstens 90% identisch ist mit der Aminosäuresequenz
der Reste 26–281
von SEQ ID NO: 2. In noch einem anderen Ausführungsbeispiel beruhen alle
Unterschiede zwischen diesem Polypeptid und SEQ ID NO: 2 auf konservativen
Aminosäuresubstitutionen.
In einem anderen Ausführungsbeispiel
besteht die Kollagendomäne
aus 13 Gly-Xaa-Xaa-Repeats und 1 Gly-Xaa-Pro-Repeat. In noch einem
anderen Ausführungsbeispiel
besteht die globuläre
Domäne
aus zehn β-Faltblättern. In
einem verwandten Ausführungsbeispiel
sind die β-Faltblätter verbunden
mit Aminosäureresten,
die den Resten 147–151,
170–172,
178–181,
191-203, 207–214, 219–225, 227–239, 244–250 und
269–274
der SEQ ID NO: 2 entsprechen. In noch einem anderen Ausführungsbeispiel umfasst
das Polypeptid die Reste 1–281
von SEQ ID NO: 2 oder Reste 1–281
von SEQ ID NO: 44.
-
Die Erfindung stellt auch das Polypeptid
bereit, das mit einem zweiten Polypeptid komplexiert ist, um ein
Oligomer zu bilden. In einem Ausführungsbeispiel sind die Polypeptide
komplexiert durch intermolekulare Disulfidbindungen. In einem anderen
Ausführungsbeispiel
ist das Oligomer ein Trimer. In noch einem anderen Ausführungsbeispiel
ist das Oligomer ein Hexamer. In noch einem anderen Ausführungsbeispiel
ist das Multimer ein 18mer.
-
In einem anderen Auführungsbeispiel
kann das Polypeptid verwendet werden, um die thrombogene und Komplementaktivität durch
Inhibition des Komplementweges und durch Inhibition kollagenvermittelter Plättchenhaftung,
-aktivierung oder -aggregation zu reduzieren. In einem anderen Ausführungsbeispiel
ist das Polypeptid vor, während
oder nach einer akuten Gefäßverletzung
in diesem Säuger
zu verabreichen. In noch einem anderen Ausführungsbeispiel beruht die Verletzung
auf einer Gefäßrekonstruktion.
In einem verwandten Ausführungsbeispiel
umfasst die Gefäßrekonstruktion
Angioplastik, Transplantation eines Koronararterien-Bypasses, Endarteriektomie,
mikrovaskuläre
Reparatur oder Anastomose eines Gefäßtransplantates. In einem anderen
verwandten Ausführungsbeispiel
beruht die Verletzung auf Trauma, Schlaganfall oder Aneurysma.
-
In einem anderen Aspekt der Erfindung
wird die Verwendung eines komplementverwandten Proteins aus Adipozyten,
wobei dieses Protein beschädigtes
Kollagengewebe inert macht für
Komplementaktivierung, thrombotische Aktivität oder Immunaktivierung, für die Herstellung
eines Medikamentes zur Beruhigung geschädigter Kollagengewebe in einem
Säuger
bereitgestellt.
-
In einem Ausführungsbeispiel beruhen die
geschädigten
Kollagengewebe auf Verletzung im Zusammenhang mit Ischämie und
Reperfusion. In einem anderen Ausführungsbeispiel umfasst die
Verletzung traumatische Verletzungsischämie, Intestinalstrangulation
oder Verletzung im Zusammenhang mit der Prä- und Postetablierung des Blutflusses.
In noch einem anderen Ausführungsbeispiel
wird das Polypeptid einem Menschen verabreicht, der an kardiopulmonaler
Bypassischämie
und Rezidiv (recesitation), Myokardinfarkt oder posttraumatischem
Vasospasmus leidet. In einem verwandten Ausführungsbeispiel umfasst der
posttraumatische Vasospasmus Schlaganfall, perkutane transluminale
Angioplastik, Endarteriektomie, Gefäßverletzung durch Unfall oder
chirurgisch induzierte Gefäßverletzung.
-
In noch einem anderen Aspekt stellt
die Erfindung die Verwendung eines komplementverwandten Proteins
aus Adipozyten für
die Herstellung eines Medikamentes zur Beruhigung der Oberfläche von
prothetischem Biomaterial zur Verwendung im Zusammenhang mit einem
Säuger
bereit, wobei dieses Protein die Oberfläche eines prothetischen Biomaterials
inert macht, für
Komplementaktivierung, thrombotische Aktivität oder Immunaktivierung.
-
In einem Ausführungsbeispiel ist die Oberfläche dieses
prothetischen Biomaterials mit Kollagen oder Kollagenfragmenten,
Gelatine, Fibrin oder Fibronektin überzogen.
-
In noch einem anderen Aspekt der
Erfindung wird die Verwendung eines komplementverwandten Proteins
aus Adipozyten, wobei dieses Protein das Fortschreiten der Wundheilung
verstärkt,
für die
Herstellung eines Medikamentes zur Vermittlung der Wundheilung in
einem Säuger
bereitgestellt.
-
KURZE BESCHREIBUNG
DER ZEICHNUNGEN
-
1 erläutert die
Anordnung mehrerer Sequenzen eines zsig37-Polypeptids der vorliegenden
Erfindung und von HUMUPST2_1 (Maeda et al., Biochem. Biophys. Res.
Comm. 221(2): 286–9,
1996); C1QA_HUMAN (Seilar et al., Biochem. J. 274: 481–90, 1991,
Reid, Biochem. J. 179: 367–71,
1979, und Reid et al., Biochem. J. 203: 559–69, 1982); HP25_TAMAS (Takamatsu
et al., Mol. Cell. Biol. 13: 1516–21, 1993 und Kondo & Kondo, J. Biol.
Chem. 267: 473–8,
1992); HP27_TAMAS (Takamatsu et al. und Kondo & Kondo oben zitiert); und CERL_RAT
(Wada & Ohtani,
Brain Res. Mol. Brain Res. 9: 71–7, 1991).
-
2 ist
eine Matrix, die die Aminosäureidentität im Vergleich
zu sechs Proteinen, die in der Anordnung der Sequenzen von 1 gezeigt sind, in Prozent
zeigt.
-
3a zeigt
die zsig37-FITC-Bindung an Typ VI-Kollagen.
-
3b zeigt
die Verdrängung
von unmarkiertem zsig37 mit FITC-markiertem zsig37, gebunden an Typ
VI-Kollagen.
-
4 zeigt
das Binden von Komplement-Clq-FITC an zsig37.
-
5 zeigt
die Hemmung der menschlichen Komplementaktivität durch zsig37.
-
6 zeigt
die Aggregation von Blutplättchen
durch Kollagen in Anwesenheit von zsig37 in Prozent.
-
7 zeigt
die Proliferation von SKS-Fibroblasten in Anwesenheit von zsig37.
-
DETAILLIERTE
BESCHREIBUNG DER ERFINDUNG
-
Bevor angefangen wird die Erfindung
im Detail zu beschreiben, kann es für deren Verständnis hilfreich sein,
die folgenden Begriffe zu definieren.
-
Der Begriff „Affinitätsmarkierung" wird hierin verwendet,
um einen Peptidabschnitt zu bezeichnen, der an ein Polypeptid angehängt werden
kann, um für
die Aufreinigung oder den Nachweis des Polypeptids zu sorgen, oder
um Stellen für
das Anheften des Peptids an ein Substrat bereitzustellen. Grundsätzlich kann
jedes Peptid oder Protein, für
das ein Antikörper
oder ein anders spezifisches Bindungsmittel erhältlich ist, als ein Affinitätsmarkierung
verwendet werden. Affinitätsmarkierungen
schließen
ein: Polyhistidinsystem, Protein A (Nilsson et al., EMBO J. 4: 1075,
1985; Nilsson et al., Methods Enzymol. 198: 3, 1991), Glutathion-S-Transferase
(Smith und Johnson, Gene 67: 31, 1988), Substanz P, F1agTM-Peptid (Hopp et al., Biotechnology 6: 1204–10, 1988;
erhältlich
von Eastman Kodak Co., New Haven, Connecticut, USA), Streptavidinbindungspeptid
oder ein anderes antigenes Epitop oder Bindungsdomäne. Siehe
allgemein Ford et al., Protein Expression and Purification 2: 95-107, 1991. DNS, die
Affinitätsanhänge kodieren,
sind erhältlich
von gewerblichen Lieferanten (z. B. Pharmacia Biotech, Piscataway,
New Jersey, USA).
-
Der Begriff „Komplemente eines Polynukleotidmoleküls" bezeichnet ein Polynukleotidmolekül mit einer
komplementären
Basensequenz und umgekehrten Orientierung im Vergleich zu einer
Bezugssequenz. Zum Beispiel ist die Sequenz 5' ATGCACGGG 3' komplementär zu 5' CCCGTGCAT 3'.
-
Der Begriff „degenerierte Nukleotidsequenz" bezeichnet eine
Sequenz an Nukleotiden, die eine oder mehrere degenerierte Codons
einschließt
(im Vergleich zu einem Bezugspolynukleotidmolekül, das ein Polypeptid kodiert).
Degenerierte Codons enthalten unterschiedliche Triplets an Nukleotiden,
aber kodieren denselben Aminosäurerest
(d. h. GAU- und GAC-Triplets kodieren jeweils Asp).
-
Der Begriff „isoliert", wenn er auf ein Polynukleotid angewendet
wird, gibt an, dass das Polynukleotid aus seiner natürlichen
genetischen Umgebung entfernt worden ist und folglich frei ist von
anderen äußeren oder
ungewollten kodierenden Sequenzen, und dass es in einer Form ist,
die geeignet ist zur Verwendung in genetisch modifizierten Proteinherstellungssystemen.
Solche isolierten Moleküle
sind folglich jene, die von ihrer natürlichen Umgebung getrennt werden
und schließen
cDNS und genomische Klone ein. Isolierte DNS-Moleküle der vorliegenden Erfindung
sind frei von anderen Genen, mit denen sie gewöhnlich verbunden sind, können aber
natürlich
vorkommende 5'-
und 3'-untranslatierte
Regionen, wie z. B. Promotoren und Terminatoren, einschließen. Die
Identifizierung verbundener Bereiche wird offensichtlich sein für Durchschnittsfachleute
(wie z. B. Dynan und Tijan, Nature 316: 774–78, 1985).
-
Ein „isoliertes" Polypeptid oder
Protein ist ein Polypeptid oder Protein, das in einem Zustand gefunden wird,
der von seiner natürlichen
Umgebung abweicht, wie z. B. entfernt von Blut und tierischem Gewebe.
In einer bevorzugten Form ist das isolierte Polypeptid im Wesentlichen
frei von anderen Polypeptiden, insbesondere von anderen Polypeptiden
tierischen Ursprungs. Es ist bevorzugt, die Polypeptide in einer
hochgereinigten Form bereitzustellen, d. h. zu mehr als 95% rein,
noch bevorzugter reiner als 99%. Wenn er in diesem Zusammenhang
verwendet wird, schließt
der Begriff „isoliert" die Anwesenheit desselben
Polypeptids in alternativen physikalischen Formen, wie z. B. als
Dimere oder alternativ glykosylierte oder derivatisierte Formen,
nicht aus.
-
Der Begriff „ortholog" bezeichnet ein Polypeptid oder Protein,
das aus einer Art gewonnen wird, die der funktionelle Gegenspieler
eines Polypeptids oder Proteins einer anderen Art ist. Sequenzunterschiede
unter Ortholgen sind das Ergebnis der Artenbildung.
-
Der Begriff „Polynukleotid" bezeichnet ein einzel-
oder doppelsträngiges
Polymer von Desoxyribonukleotid- oder Ribonukleotidbasen, die von
dem 5'- zu dem 3'-Ende gelesen werden.
Polynukleotide schließen RNS
und DNS ein und können
aus natürlichen
Quellen isoliert werden, in vitro synthetisiert werden oder aus einer
Kombination natürlicher
und synthetischer Moleküle
zubereitet werden. Die Größen von
Polynukleotiden werden in Basenpaare (abgekürzt „bp"), Nukleotide („nt") oder Kilobasen („kb") ausgedrückt. Wo es der Zusammenhang
erlaubt, können
die letzten beiden Begriffe Polynukleotide beschreiben, die einzelsträngig oder doppelsträngig sind.
Wenn der Begriff angewendet wird auf doppelsträngige Moleküle, wird er verwendet, um die
Gesamtlänge
zu bezeichnen und er wird als äquivalent
zu dem Begriff „Basenpaare" verstanden werden. Es
wird von Fachleuten bemerkt werden, dass die beiden Stränge eines
doppelsträngigen
Polynukleotids in der Länge
leicht voneinander abweichen können,
und dass deren Enden als ein Ergebnis enzymatischer Spaltung versetzt
sein können;
folglich mögen
nicht alle Nukleotide in einem doppelsträngigen Polynukleotidmolekül gepaart
sein. Solche ungepaarten Enden überschreiten
im Allgemeinen nicht 20 nt in der Länge.
-
Ein „Polypeptid" ist ein Polymer
von Aminosäureresten,
die durch Peptidbindungen verbunden sind, ob natürlich oder synthetisch hergestellt.
Auf Polypeptide mit weniger als ungefähr 10 Aminosäureresten
wird gewöhnlich
Bezug genommen als „Peptide".
-
„Sonden und/oder Primer", wie hierin verwendet,
können
RNS oder DNS sein. DNS kann sowohl cDNS als auch genomische DNS
sein. Polynukleotidsonden und primer sind einzel- oder doppelsträngige DNS oder
RNS und im Allgemeinen synthetische Oligonukleotide, aber sie können erzeugt
werden aus klonierter cDNS oder genomischen Sequenzen oder deren
Komplemente. Analytische Sonden werden im Allgemeinen wenigstens
20 Nukleotide lang sein, obwohl etwas kürzere Sonden (14–17 Nukleotide)
verwendet werden können.
PCR-Primer sind wenigstens 5 Nukleotide lang, vorzugsweise 15 oder
mehr nt, noch bevorzugter 20–30 nt.
Kurze Polynukleotide können
verwendet werden, wenn ein kleiner Bereich des Gens für die Analyse
zum. Ziel genommen wird. Für
die Grobanalyse von Genen kann eine Polynukleotidsonde ein gesamtes
Exon oder mehr umfassen. Sonden können markiert werden, um ein
detektierbares Signal bereitzustellen, z. B. mit einem Enzym, Biotin,
einem Radionuklid, Fluorophor, Chemilumineszenzerzeuger, mit paramagnetischen
Teilchen und Ähnlichen,
die im Handel erhältlich
sind von vielen Quellen, wie z. B. Molecular Probes, Inc., Eugene,
Oregon, USA, und Amersham Corp., Arlington Heights, Illinois, USA,
unter Verwendung von Techniken, die im Stand der Technik wohlbekannt
sind.
-
Molekulargewichte und Längen von
Polymeren, die durch unpräzise
analytische Verfahren (z. B. Gelelektrophorese) bestimmt sind, werden
verstanden werden als ungefähre
Werte. Wenn solch ein Wert ausgedrückt wird mit „ungefähr" X oder „annähernd" X, so wird verstanden
werden, dass der festgestellte Wert von X genau ±10% ist.
-
Die vorliegende Erfindung beruht
zum Teil auf der Entdeckung, dass ein neues komplementverwandtes
Adipozytenproteinhomolog die kollagenvermittelte Plättchenaktivierung
und den Komplementweg einschließlich
C1q inhibiert. Dieses Protein wurde als zsig37 bezeichnet und ist
vollständig
beschrieben in der allgemein angeführten, veröffentlichten PCT-Patentanmeldung
WO 99/04000.
-
Die zsig37-Nukleotidsequenz, (SEQ
ID NO: 1) kodiert ein Polypeptid (SEQ ID NO: 2) mit einer aminoterminalen
Signalsequenz, einem benachbarten N-terminalen Bereich der Nichthomologie,
einer gekürzten Kollagendomäne, bestehend
aus Gly-Xaa-Xaa- oder Gly-Xaa-Pro-Repeats und einem carboxyterminalen
globulären
Anteil. Die neue Polynukleotidsequenz enthält auch einen langen 3' -untranslatierten
Bereich. Die allgemeine, oben angeführte Polypeptidstruktur wird
geteilt von Acrp30 und HUMUPST2_1, mit der Ausnahme, dass die kollagenähnliche
Domäne
jedes dieser Proteine länger
ist als die von zsig37-Polypeptiden. Auch ist die HUMUPST2_1-DNS-Sequenz
charakterisiert durch einen langen 3'-untranslatierten Bereich. Weiterhin
teilen Acrp30 und alle in 1 angeordneten
Sequenzen, mit Ausnahme von CERL_RAT, einen konservierten Cysteinrest
an Position 187 des zsig37-Polypeptids, wie in 1 und SEQ ID NO: 2 zeigt. Auch schließen die zsig37-Polypeptide der vorliegenden
Erfindung eine mutmaßliche
N-gekoppelte Glykosylierungsstelle bei der Aminosäure 93 (Asn)
von SEQ ID NO: 2 ein.
-
Die Analyse der Gewebeverteilung
der mRNS, die zsig37 entspricht, zeigte, dass die Expression am höchsten war
in Herz und Plazenta, mit vergleichsweise weniger starken Signalen
in Niere, Eierstock, Nebenniere und Skelettmuskel, und mit geringeren
Signalen in einer weiten Reihe anderer Gewebe, die in dem Northern-Blot
vorhanden waren.
-
Eine homologe Beziehung mit dem komplementverwandten
Protein aus Adipozyten Acrp30 (SEQ ID NO: 3) und dem von Adipozyten
sezernierten Protein apM1 (HUMUPST2_1 in 1 und 2)
wurde für
zsig37 etabliert. Eine etwas weiter entfernte Homologie wurde auch
identifiziert für
den Komplementbestandteil C1 Q-A-Kette, zwei Faktoren, die im aktiven
Zustand Winterschlaf haltender Sibirischer Waldmurmeltiere (HP25 TAMAS
und HP27 TAMAS) beobachtet wurden, und in einem Rattenhirnprotein
(CERL_RAT), wie in den 1 und 2 gezeigt.
-
Die Nukleotidsequenz von zsig37 wird
beschrieben in SEQ ID NO: 1 und seine abgeleitete Aminosäuresequenz
ist beschrieben in SEQ ID NO: 2. Eine degenerierte Nukleotidsequenz,
die das Polypeptid von SEQ ID NO: 2 kodiert, ist in SEQ ID NO: 23
bereitgestellt. Wie oben allgemein beschrieben schließt das zsig37-Polypeptid
eine Signalsequenz, die sich von Aminosäure 1 (Met) zum Aminosäurerest
21 (Gly) erstreckt, ein. Eine alternative Signalsequenz erstreckt
sich von der Aminosäure
1 (Met) bis zur Aminosäure
25 (Ser). Das reife Polypeptid reicht demzufolge von der Aminosäure 22 (Leu)
oder 26 (Arg) bis zur Aminosäure
281 (Pro). In dem reifen Polypeptid wird ein N-terminaler Bereich
unbekannter Homologie gefunden, der sich zwischen den Aminosäureresten
22 (Leu) und 98 (Lys) erstreckt. Zusätzlich wird eine gekürzte Kollagendomäne zwischen
den Aminosäuren
99 (Gly) und 140 (Arg) gefunden. In der gekürzten Kollagendomäne werden
ein vollständiges Gly-Xaa-Pro-
und 13 unvollständige
Gly-Xaa-Xaa-Repeats beobachtet. Im Gegensatz dazu enthält Acrp30
22 vollständige
oder unvollständige
Repeats. Das zsig37-Polypeptid schließt auch eine carboxyterminale
globuläre
Domäne
ein, die sich von ungefähr
den Aminosäuren
141 (Cys) bis 281 (Pro) erstreckt. Zsig37-Polypeptid, HUMUPST2_1
und Acrp30 scheinen homolog innerhalb der Kollagendomäne zu sein
und in der globulären Domäne, aber
nicht in dem N-terminalen Anteil des reifen Polypeptids.
-
Von der globulären Clq-Domäne von Acrp30 wurde festgestellt,
dass sie eine 10 β-Stränge aufweisende "jelly-roll"-Topologie hat (Shapiro
und Scherer, Curr. Biol. 8: 335–8,
1998), die eine signifikante strukturelle Homologie zu der TNF-Familie
zeigt, und dass die zsig37-Sequenz, wie sie durch SEQ ID NO: 2 dargestellt ist,
alle 10 β-Stränge dieser
Struktur enthält.
(Aminosäurereste
147–151,
170–172,
178–181,
185–188, 191–203, 207–214, 219–225, 227–238, 244–250 und
269–274
von SEQ ID NO: 2). Diese Stränge
wurden bezeichnet als „A", „A'", „B", „B'", „C", „D", „E", „F", „G" und „H".
-
Zsig37 hat zwei Rezeptorbindungsschleifen
an den Aminosäureresten
152–180
und 213–226.
Die Aminosäurereste
191 (Gly), 193 (Tyr), 238 (Leu) und 272 (Gly) scheinen in der Superfamilie,
die CD40, TNFα, TNFβ, ACRP30
und zsig37 einschließt,
konserviert zu sein.
-
Ein anderer Aspekt der vorliegenden
Erfindung schließt
die Verwendung von zsig37-Polypeptidfragmenten
als Inhibitoren der Hämostase
und von Immunfunktionen ein. Bevorzugte Fragmente schließen die
kollagenähnliche
Domäne
von zsig37-Polypeptiden, die sich von der Aminosäure 99 (Gly) bis zur Aminosäure 140 (Arg)
der SEQ ID NO: 2 erstreckt, einen Teil des zsig37-Polypeptids, die
die kollagenähnliche
Domäne
enthält, oder
einen Teil der kollagenähnlichen
Domäne,
die fähig
ist zur Dimerisierung oder Oligomerisierung, ein. Andere bevorzugte
Fragmente schließen
die globuläre
Domäne
des zsig37-Polypeptids, die sich von der Aminosäure 140 (Arg) oder 141 (Cys)
bis zu 281 (Pro) von SEQ ID NO: 2 erstreckt, einen Teil des zsig37-Polypeptids, der
die der globulären
Domäne ähnliche
Domäne
oder einen aktiven Teil der zur globulären ähnlichen Domäne enthält, ein.
Ein anderes zsig37-Polypeptidfragment
der vorliegenden Erfindung schließt sowohl die kollagenähnliche
Domäne
als auch die globuläre
Domäne
ein, im Bereich vom Aminosäurerest
99 (Gly} bis 281 (Pro) von SEQ ID NO: 2. Diese Fragmente sind besonders
nützlich
bei der Hemmung der kollagenvermittelten Plättchenaktivierung und bei der
Hemmung von Komplement und C1q.
-
Die vorliegende Erfindung stellt
auch die Verwendung von zsig37-Fusionsproteinen bereit. Zum Beispiel
schließen
Fusionsproteine der vorliegenden Erfindung ein: (1) ein Polypeptid,
das ausgewählt
ist aus der Gruppe umfassend: (a) Polypeptidmoleküle, die
eine Sequenz der Aminosäurereste,
wie gezeigt in Sequenz ID NO: 2 vom Aminosäurerest 1 (Met), 22 (Leu) oder
26 (Arg) bis zum Aminosäurerest
281 (Pro) aufweisen; (b) Polypeptidmoleküle, die sich von der Aminosäure 99 (Gly)
bis zur Aminosäure
140 (Arg) der SEQ ID NO: 2 erstrecken, einen Teil des zsig37-Polypeptids,
das die kollagenähnliche
Domäne
oder einen Teil der kollagenähnlichen
Domäne
enthält,
der fähig
ist zur Dimerisierung oder Oligomerisierung; (c) Polypeptidmoleküle, die sich
von der Aminosäure
140 (Arg) oder 141 (Cys) bis 281 (Pro) von SEQ ID NO: 2 erstrecken,
einen Teil des zsig37-Polypeptids,
das die Domäne,
die der globulären
Domäne ähnlich ist,
oder einen aktiven Teil der zur globulären Domäne Ähnlichen enthält; oder
(d) Polypeptidmoleküle,
die sich von der Aminosäure
99 (Gly) bis zu 281 (Pro) erstrecken, einem Teil des zsig37-Polypeptids,
einschließlich
der kollagenähnlichen
Domäne
und der globulären
Domäne;
und (2) ein anderes Polypeptid. Das andere Polypeptid kann eine
alternative oder zusätzliche
globuläre Domäne, eine
alternative oder zusätzliche
kollagenähnliche
Domäne,
ein Signalpeptid zur Erleichterung der Sekretion des Fusionsproteins,
oder Ähnliches
sein.
-
In den Verfahren der Erfindung sind
auch zsig37-Agonisten und -Antagonisten nützlich. Verfahren zu Identifizierung
von Antagonisten sind im Stand der Technik bekannt. Zum Beispiel
können
Antagonisten des zsig37-Polypeptids identifiziert werden durch Bereitstellen
von Zellen, die reaktionsfähig
sind auf ein zsig37-Polypeptid, Kultivieren eines ersten Teils der
Zellen in Anwesenheit des zsig37-Polypeptids, Kultivieren eines
zweiten Teils der Zellen in Anwesenheit des zsig37-Polypeptids und
einer Testverbindung, und Nachweisen einer Abnahme der zellulären Antwort
auf den zweiten Teil der Zellen im Vergleich zum ersten Teil der
Zellen. Zusätzlich
zu jenen hierin offenbarten Nachweisen können Proben auf die Inhibition
der zsig37-Aktivität
in einer Reihe an Ansätzen,
die gestaltet sind, um die Rezeptorbindung oder die Stimulation/Inhibition
zsig37-abhängiger
zellulärer
Antworten zu messen, untersucht werden. Zum Beispiel können zsig37-reaktionsfähige Zelllinien
mit einem Reportergenkonstrukt transfiziert werden, das reaktionsfähig ist
für einen
zsig37-stimulierten Weg. Reportergenkonstrukte dieses Typs sind
im Stand der Technik bekannt und werden allgemein ein zsig37-Antwortelement
umfassen, das wirksam gekoppelt ist an ein Gen, das ein nachweisbares
Protein, wie zum Beispiel Luziferase, kodiert. DNS-Antwortelemente
können
einschließen
aber sind nicht beschränkt
auf zyklische AMP-Antwortelemente (CRE), Hormon-Antwortelemente
(HRE), Insulin-Antwortelemente
(IRE) (Nasrin et al., Proc. Natl. Acad. Sci. USA 87: 5273–7, 1990)
und Serum-Antwortelemente (SRE) (Shaw et al. Cell 56: 563–72, 1989).
Zyklische AMP-Antwortelemente
sind zusammenfassend berichtet in Roestler et al., J. Biol. Chem.
263 (19): 9063–6,
1988 und Habener, Molec. Endocrinol. 4 (8): 1087–94, 1990. Hormon-Antwortelemente sind
zusammenfassend berichtet in Beato, Cell 56: 335–44; 1989. Kandidatenverbindungen,
-lösungen,
-mischungen oder -extrake sind untersucht auf ihre Fähigkeit,
die Aktivität
von zsig37 auf Zielzellen zu inhibieren, wie nachgewiesen durch
eine Abnahme in der zsig37-Stimulation der Reportergenexpression. Nachweise
dieses Typs werden Verbindungen detektieren, die unmittelbar die
zsig37-Bindung an Zelloberflächenrezeptoren
hemmen, ebenso wie Verbindungen, die Vorgänge im zellulären Weg
im Anschluss an die Rezeptor-Ligand-Bindung hemmen. Als Alternative
können
Verbindungen oder andere Proben auf die unmittelbare Hemmung der
zsig37-Rezeptorbindung untersucht werden, unter Verwendung von zsig37,
das mit eine detektierbaren Markierung (z. B. 125I,
Biotin, Meerrettich-Peroxidase, FITC und Ähnliche) markiert ist. In Nachweisen
dieses Typs ist die Fähigkeit
einer Testprobe, die Bindung von markiertem zsig37 an den Rezeptor
zu inhibieren, kennzeichnend für
die inhibitorische Aktivität,
die bestätigt
werden kann durch Sekundärnachweise. Die
in den Bindungsassays verwendeten Rezeptoren können zelluläre Rezeptoren oder isolierte,
immobilisierte Rezeptoren sein.
-
Ebenso sind in den Verfahren der
Erfindung Antikörper
nützlich,
die spezifisch an zsig37-Polypeptidepitope, -peptide oder -polypeptide
binden. Verfahren zur Zubereitung polyklonaler und monoklonaler
Antikörper
sind im Stand der Technik wohlbekannt (siehe z. B. Sambrook et al.,
Molecular Cloning: A Laboratory Manual, 2. Auflage, Cold Spring
Harbor, New York, USA, 1989; und Hurrell, J. G. R., Hrsg., Monoclonal
Hybridoma Antibodies: Techniques and Applications, CRC Press, Inc.,
Boca Raton, Florida, USA, 1982).
-
Wie es für einen Durchschnittsfachmann
offensichtlich sind wird, können
polyklonale Antikörper
durch das Impfen einer Reihe warmblütiger Tiere, wie z. B. Pferde,
Kühe, Ziegen,
Schafe, Hunde, Hühner,
Kaninchen, Mäuse,
Hamster, Meerschweinchen und Ratten, ebenso wie transgener Tiere,
wie z. B. transgenen Schafen, Kühen,
Ziegen oder Schweinen, erzeugt werden. Antikörper können auch in Hefen und Pilzen
in modifizierten Formen exprimiert werden, ebenso wie in Säuger- und
Insektenezellen. Das zsig37-Polypeptid oder ein Fragment davon dient
als ein Antigen (Immunogen), um ein Tier zu impfen oder um eine
Immunantwort auszulösen.
Geeignete Antigene würden
das durch SEQ ID NO: 2, das durch die Aminosäurereste 22-281 der SEQ ID
NO: 2 und das durch die Aminosäurereste
26–281
der SEQ ID NO: 2 kodierte zsig37-Polypeptid einschließen, oder
ein zusammenhängendes
9–-281-Aminosäurerest-Fragment
davon. Die Immunogenität
eines zsig37-Polypeptids kann erhöht werden durch die Verwendung
eines Hilfsstoffes, wie z. B. Alaun (Aluminiumhydroxid) oder Freund's vollständiges oder
unvollständiges
Adjuvans. Polypeptide, die nützlich
sind für
die Immunisierung, schließen
auch Fusionspolypeptide, wie z. B. Fusionen von zsig37 oder einem
Teil davon, mit einem Immunglobulinpolypeptid oder mit einem Affinitätsmarkierung,
ein. Das Polypeptidimmunogen kann ein Molekül der vollen Länge oder
ein Teil davon sein. Falls der Polypeptidteil „Hapten-ähnlich" ist, kann solch ein Teil vorteilhafterweise
verbunden sein mit oder gekoppelt sein an einen makromolekularen
Träger
(wie z. B. Schlüssellochnapfschnecken-Hämozyanin
(KLH), Rinderserumalbumin (BSA) oder Tetanustoxoid) für die Immunisierung.
-
Wie hierin verwendet, schließt der Begriff „Antikörper" polyklonale Antikörper, affinitätsgereinigte
polyklonale Antikörper,
monoklonale Antikörper
und antigenbindende Fragmente, wie z. B. F(ab')2 und Fab-proteolytische
Fragmente, ein. Genetisch modifizierte intakte Antikörper oder
Fragmente, wie z. B. Chimärenantikörper, Fv-Fragmente,
Einzelkettenantikörper
und Ähnliche,
ebenso wie synthetische antigenbindende Peptide und Polypeptide
sind auch eingeschlossen. Nicht-menschliche Antikörper können menschlich
gemacht werden, indem nur nicht-menschliche CDRs auf menschliches
Gerüst
und konstante Bereiche übertragen
werden, oder indem die gesamten nicht-menschlichen variablen Domänen eingebaut
werden (wobei diese wahlweise mit einer menschenähnlichen Oberfläche „umhüllt" werden durch Ersetzen
ausgesetzter Reste, wodurch das Ergebnis ein „verkleideter" Antikörper ist).
In einigen Fällen
können
humanisierte Antikörper nicht-menschliche
Reste in den menschlichen Gerüstdomänen variabler
Bereiche beibehalten, um die richtigen Bindungseigenschaften zu
verstärken.
Durch humanisierte Antikörper
kann die biologische Halbwertszeit erhöht werden, und die Möglichkeit
ungünstiger
Immunreaktionen nach der Verabreichung an Menschen wird reduziert.
Alternative Techniken zur Herstellung oder Auswahl von hierin nützlichen
Antikörpern
schließen
das in vitro-Aussetzen von Lymphozyten an zsig37-Protein oder -Peptid
ein und die Auswahl eines Antikörpers,
der Bibliotheken in Phagen oder ähnlichen
Vektoren widerspiegelt (z. B. durch die Verwendung von immobilisiertem
oder markiertem zsig37-Protein oder -Peptid).
-
Antikörper sind als spezifisch bindend
definiert, falls: 1) sie einen Schwellenwert an Bindungsaktivität ausüben, und/oder
2) sie nicht signifikant mit verwandten Polypeptidmolekülen kreuzreagieren.
Erstens binden Antikörper
hierin spezifisch, falls sie an zsig37-Polypeptid, -Peptid oder -Epitop mit
einer Bindungsaffinität
(Ka) von 106 mol–1 oder
höher,
vorzugsweise 107 mol–1 oder
höher,
noch bevorzugter 108 mol–1 oder
höher und
am meisten bevorzugt 109 mol–1 oder
mehr binden. Die Bindungsaffinität
eines Antikörpers
kann leicht vom Durchschnittsfachmann bestimmt werden, z. B. durch
die Scatchard-Analyse (Scatchard, Ann. NY Acad. Sci. 51: 660–672, 1949).
-
Zweitens binden Antikörper spezifisch,
falls sie nicht mit verwandten Polypeptiden signifikant kreuzreagieren.
Antikörper
reagieren nicht signifikant kreuz mit verwandten Polypeptidmolekülen, z.
B. falls sie zsig37-Polypeptide detektieren, aber nicht bekannte
verwandte Polypeptide unter Verwendung einer Standard-Western-Blot-Analyse
(Ausubel et al., ebenda). Beispiele bekannter verwandter Polypeptide
schließen andere
Mitglieder einer Proteinfamilie ein, wie z. B. Acrp30 (SEQ ID NO:
3), die in der Anordnung von 1 gezeigten
Polypeptide und Ähnliche
ein. Sie können
auch einschließen,
falls dies gewünscht
ist, orthologe und mutierte menschliche zsig37-Polypeptide. Ferner
können
Antikörper „gescreent
werden gegen" bekannte
verwandte Polypeptide, um eine Population zu isolieren, die spezifisch
an die erfinderischen Polypeptide bindet. Zum Beispiel werden gegen
meschliche zsig37-Polypeptide erzeugte Antikörper an verwandte Polypeptide
adsorbiert, die an eine unlösliche
Matrix angeheftet sind; Antikörper,
die spezifisch sind für
menschliche zsig37-Polypeptide werden durch die Matrix unter geeigneten
Pufferbedingungen hindurchfließen.
Ein solches Screening ermöglicht
die Isolierung polyklonaler und monoklonaler Antikörper, die
nicht kreuzreaktiv für
eng verwandte Polypeptide sind (Antibodies: A Laboratory Manual,
Harlow und Lane (Hrsg.), Cold Spring Harbor Laboratory Press, 1988;
Current Protocols in Immunology, Cooligan, et al. (Hrsg.), National
Institutes of Health, John Wiley and Sons, Inc., 1995). Screening
und Isolierung spezifischer Antikörper sind im Stand der Technik wohlbekannt
(siehe Fundamental Immunology, Paul (Hrsg.), Raven Press, 1993;
Getzoff et al., Adv. in Immunol. 43: 1–98, 1988; Monoclonal Antibodies:
Principles and Practice, Goding, J. W. (Hrsg.), Academic Press Ltd.,
1996; Benjamin et al., Ann. Rev. Immunol. 2: 67–101, 1984). Typische Beispiele
solcher Nachweise schließen
ein: gleichzeitige Immunelektrophorese, Radioimmuntest, Radioimmunfällung, enzymgekoppelte Immunadsorptionsbestimmung
(ELISA), Dot-Blot- oder Western-Blot-Assay, Inhibitionsoder Verdrängungsnachweis
und Sandwichassay.
-
Die Wirkung von zsig37-Polypeptiden,
-Fragmenten, -Fusionen, -Agonisten oder – Antagonisten auf die Hämostase,
insbesondere auf die Plättchenanheftung
und -aktivierung, die zu Plättchenaggregation
führt, kann
bestimmt werden durch hierin bereitgestellte Verfahren und Nachweise
und durch jene im Stand der Technik bekannten. Kollagen ist ein
starker Induktor der Plättchenaggregation.
Dies birgt Risiken für
Patienten, die sich von Gefäßverletzungen
erholen. Inhibitoren der kollageninduzierten Plättchenaggregation würden für solche
Zwecke nützlich
sein. Von zsig37 wurde herausgefunden, dass es an Fibronektin und
Typ I-, II-, III-, V- und VI-Kollagene bindet. Insbesondere bindet
zsig37 an spezifische Domänen
auf Kollagen VI in einer konzentrationsabhängigen Weise. Von zsig37 wurde
auch herausgefunden, dass es die kollagenvermittelte Plättchenaktivierung
inhibiert. Die zsig37-induzierte
Inhibition war selektiv für
die Kollagenaktivierng, wobei zsig37 keine Wirkung auf Blutplättchen hatte,
die durch die bekannten Plättchenaktivatoren
ADP oder Thrombin aktiviert worden waren. Diese Ergebnisse sind
detaillierter unten im Abschnitt über die Beispiele beschrieben.
Es wird erwartet, dass zsig37-Polypeptide, -Fragmente, -Fusionen, – Agonisten
oder -Antagonisten zum Hemmen der Bindung von Blutplättchen an
kollagenüberzogene
Oberflächen
und für
die Reduktion der damit verbundenen kollageninduzierten Plättchenaggregtion
nützlich
sein werden.
-
C1q ist ein Bestandteil des Komplementweges
und es wurde festgestellt, dass es Abwehrmechanismen stimuliert,
ebenso wie es die Bildung von toxischen Sauerstoffarten, die eine
Gewebeschädigung
verursachen können,
auslöst
(Tenner, Behring Inst. Mitt. 91: 241–53, 1993). C1q-Bindungsstellen
werden auf Blutplättchen
gefunden. Von C1q, unabhängig
von einem Immunbindungspartner, wurde festgestellt, dass es die Plättchenaggregation
hemmt, aber nicht die Plättchenanheftung
oder -form ändert.
Der aminoterminale Bereich von C1q teilt eine Homologie mit Kollagen
(Peerschke und Ghebrehiwet, J. Immunol. 145: 2984–88, 1990).
Zsig37 bindet an Komplement C1q in einer konzentrationsabhängigen Weise.
Von zsig37 wurde festgestellt, dass es wirksam ist bei der Inhibition
des Komplementweges, einschließlich
C1q, sowohl mit sensibilisierten als auch mit unsensibilisierten
Schaf-Erythrozyten.
-
Die zsig37-Polypeptide, -Fragmente,
-Fusionsproteine, -Antikörper,
-Agonisten oder-Antagonisten
der vorliegenden Erfindung können
in Verfahren zur Förderung
des Blutflusses in dem Gefäßsystem
eines Säugers
verwendet werden, indem die Anzahl der Blutplättchen, die anhaften und aktiviert
werden und die Größe der Plättchenaggregate
reduziert werden. Solche Verfahren würden die Verabreichung einer
therapeutisch wirksamen Menge an zsig37-Polypeptiden, -Fragmenten,
-Fusionen, -Antikörpern,
-Agonisten oder -Antagonisten an einen Säuger, der Bedarf hat für eine solche
Behandlung, umfassen, wobei zsig37 die thrombogene und Komplementaktivität in dem
Gefäßsystem
des Säugers
reduziert. Wie oben beschrieben, hemmen zsig37-Polypeptide die kollagenvermittelte
Plättchenaktivierung
und inaktivieren Fibronektin und Typ I-, II-, III-, V- und VI-Kollagene
durch Bindung. Die zsig37-Verabreichung reduziert die thrombogene
Aktivität
an der Stelle der Gefäßverletzung
durch Reduktion der Arten der Plättchenanheftung,
-aktivierung und -aggregation. Zsig37 hemmt auch den Komplementweg
und C1q, wie unten beschrieben, wodurch folglich die Komplementaktivität in dem
Gefäßsystem
reduziert wird. Zsig37-Polypeptide, -Fragmente, – Fusionen, -Antikörper, -Agonisten,
oder -Antagonisten, die in solchen Verfahren verwendet werden, können dem
Säuger
vor, während oder
nach einer akuten Gefäßverletzung
verabreicht werden.
-
In einem bevorzugten Verfahren beruht
die Gefäßverletzung
auf der Gefäßrekonstruktion,
einschließlich
aber nicht beschränkt
auf, Angioplastik, Endarteriektomie, Koronararterien-Bypass-Transplantation,
mikrovaskulärer
Reparatur oder Anastomose eines Gefäßtransplantates. Auch sind
Gefäßverletzungen
bedacht, die auf Trauma, Schlaganfall oder Aneurysma beruhen. In
anderen bevorzugten Verfahren beruht die Gefäßverletzung auf Losreißen von
Plaques, Abbau des Gefäßsystems,
Komplikationen im Zusammenhang mit Diabetes und Atherosklerose.
Das Losreißen
von Plaques induziert in der Koronararterie einen Herzanfall und in
der Hirnarterie einen Schlaganfall. Die Verwendung von zsig37-Polypeptiden,
-Fragmenten, -Fusionsproteinen, -Antikörpern, -Agonisten oder – Antagonisten
in solchen Verfahren würde
auch nützlich
sein für
die Verbesserung von Gesamtsystemerkrankungen des Gefäßsystems,
die verbunden sind mit dem Immunsystem, wie beispielsweise disseminierte
intravaskuläre
Gerinnung (DIC) und SIDs. Zusätzlich
würde die
komplementinhibierende Aktivität
nützlich
sein für
die Behandlung von Nichtgefäßsystem-Immunerkrankungen
wie z. B. Arteriolosklerose.
-
Es wurde ein Zusammenhang gefunden
zwischen der Anwesenheit von C1q in örtlich begrenztem ischämischem
Myokard und der Anhäufung
von Leukozyten nach dem Koronarverschluss und der Reperfusion. Das
Freisetzen zellulärer
Bestandteile nach der Gewebeschädigung
löst die
Komplementaktivierung aus, was in toxischen Sauerstoffprodukten
resultiert, die die primäre
Ursache der Myokardschädigung
sein können (Rossen
et al., Circ. Res. 62: 572–84,
1998 und Tenner, ebenda). Es wurde herausgefunden, dass das Hemmen
des Komplementweges ischämisches
Myokard vor Reperfusionsverletzung schützt (Buerke et al., J. Pharm.
Exp. Therp. 286: 429–38,
1998). Die Komplementinhibition und C1q-Bindungsaktivität von zsig37-Polypeptiden
würden
nützlich
sein für
solche Zwecke.
-
Die Kollagen- und C1q-Bindungsfähigkeiten
von zsig37 würden
nützlich
sein, um beschädigte
Kollagengewebe zu beruhigen, wodurch die Plättchenanheftung, -aktivierung
oder -aggregation verhindert wird, und wodurch die Aktivierung von
Entzündungsvorgängen, die
zur Freisetzung von toxischen Sauerstoffprodukten führen, verhindert
wird. Indem das ausgesetzte Gewebe für solche Vorgänge, wie
Komplementaktivität, thrombotische
Aktivität
und Immunaktivierung, inert gemacht wird, würden zsig37-Polypeptide, -Fragmente, – Fusionen,
-Antikörper,
-Agonisten oder -Antagonisten nützlich
sein bei der Reduktion der schädlichen
Wirkungen von Ischämie
und Reperfusion. Insbesondere würden
solche Verletzungen einschließen
Trauma-Verletzungsischämie,
Intestinalstrangulation und Verletzung im Zusammenhang mit der Prä- und Postetablierung des
Blutflusses. Zsig37 würde
nützlich
sein bei der Behandlung von kardiopulmonaler Bypass-Ischämie und – Rezidiv,
Myokardinfarkt und posttraumatischem Vasospasmus, wie z. B. Schlaganfall
oder perkutaner transluminaler Angioplastik, ebenso wie durch Unfall
verursachtes oder chirurgisch induziertes Gefäßtrauma.
-
Zsig37-Polypeptide, -Fragmente, -Fusionen,
-Antikörper,
-Agonisten oder – Antagonisten
würden
auch nützlich
sein, um prothetische Biomaterialien und chirurgische Ausrüstung zu
beruhigen, um die Oberfläche der
Materialien inert für
die Komplementaktivierung, thrombotische Aktivität oder Immunaktivierung zu
machen. Solche Materialien schließen ein, aber sind nicht begrenzt
auf Kollagen oder mit Kollagenfragmenten überzogene Biomaterialien, mit
Gelatine überzogene
Biomaterialien, mit Fibrin überzogene
Biomaterialien, mit Fibronektin überzogene
Biomaterialien, mit Heparin überzogene
Biomaterialien, Kollagen und mit Gel überzogene Stents, Arterientransplantate,
synthetische Herzklappen, künstliche
Organe oder jede Prothesenanwendung, die dem Blut ausgesetzt ist,
die zsig37 zu mehr als 1 × 108 binden wird. Das Überziehen solcher Materialien
kann getan werden unter Verwendung von im Stand der Technik bekannten
Verfahren, siehe z. B. Rubens, US-Patent Nr. 5,272,074.
-
Komplement und C1q spielen eine Rolle
bei der Entzündung.
Die Komplementaktivierung wird durch das Binden von C1q an Immunglobuline
gestartet (Johnston, Pediatr. Infect. Dis. J. 12: 933–41, 1993;
Ward und Ghetie, Therap. Immunol. 2: 77–94, 1995). Inhibitoren von
C1q und Komplement würden
nützlich
sein als antiinflammatorische Mittel. Eine solche Anwendung kann
vorgenommen werden, um eine Infektion zu verhindern. Zusätzlich können solche
Inhibitoren einem Individuum verabreicht werden, das an einer Entzündung leidet,
die durch Komplementaktivierung und Binden von Immunkomplexen an
C1q vermittelt wurde. Zsig37-Polypeptide, -Fragmente, -Fusionsproteine,
-Antikörper,
-Agonisten oder -Antagonisten würden
bei Verfahren, die die Wundheilung vermitteln, nützlich sein, wodurch das Fortschreiten
der Wundheilung verstärkt
würde,
indem die beeinträchtigte
Wundheilung überwunden
würde.
Das Fortschreiten der Wundheilung würde einschließen, z.
B. solche Elemente, wie eine Reduktion der Entzündung, Verstärkung der
Fibroblasten, Zurückziehen
der Wunde und Reduktion der Infektion.
-
Die Fähigkeit von Tumorzellen, an
Kollagen zu binden, kann zu der Metastase von Tumoren beitragen. Inhibitoren
der Kollagenbindung sind auch nützlich,
um die adhäsiven
Wechselwirkungen und das metastatische Ausbreiten von Tumoren zu
vermitteln (Noeske-Jungbult
et al., US-Patent Nr. 5,723,312).
-
Von zsig37 wurde festgestellt, dass
es die Vasodilatation in durch Noradrenalin zusammengezogenen Aortenringen
induziert, unter Verwendung der Verfahren von Dainty et al., J.
Pharmacol. 100: 767, 1990 und Rhee et al., Neurotox. 16: 179, 1995,
wie es unten detaillierter beschrieben werden wird.
-
Plättchenanheftung, -aktivierung
und -aggregation kann abgeschätzt
werden unter Verwendung von hierin beschriebenen Verfahren oder
von im Stand der Technik bekannten Verfahren, wie z. B. dem Thrombozytenaggregationsansatz
(Chiang et al., Thrombosis Res. 37: 605–12, 1985) und Thrombozytenadhäsionsassays
(Peerschke und Ghebrehiwet, J. Immunol. 144: 221–25, 1990). Die Inhibition
von C1q und dem Komplementweg kann bestimmt werden unter Verwendung
von hierin offenbarten Verfahren oder von im Stand der Technik bekannten
Verfahren, wie z. B. beschrieben in Suba und Csako, J. Immunol.
117: 304–9,
1976. Nachweise für
die Plättchenanheftung
an Kollagen und die Inhibition der kollageninduzierten Plättchenaggregation können gemessen
werden unter Verwendung von Verfahren beschrieben in Keller et al.,
J. Biol. Chem. 268: 5450–6,
1993; Waxman und Connolly, J. Biol. Chem. 268: 5445–9, 1993;
Noeske-Jungblut et al., J. Biol. Chem. 269: 5050–3 oder 1994 Deckmyn et al.,
Blood 85: 712–9,
1995.
-
Zahlreiche in vitro- und in vivo-Modelle
sind erhältlich,
um die Wirkungen von zsig37-Polypeptiden, -Fragmenten, -Fusionen,
-Antikörpern,
-Agonisten oder -Antagonisten auf Ischämie und Reperfusionsverletzung
abzuschätzen.
Siehe z. B. Shandelya et al., Circulation 88: 2812–26, 1993;
Weisman et al., Science 249: 146–151, 1991; Buerke et al.,
Circulation 91: 393–402,
1995; Horstick et al., Circulation 95: 701–8, 1997 und Burke et al.,
J. Phar. Ex. Therp. 286: 429–38,
1998. Ein ex vivo-Hamsterthrombozytenaggregationsassay ist beschrieben
durch Deckmyn et al., ebenda. Blutungszeiten in Hamstern und Pavianen
können
gemessen werden nach der Injektion von zsig37-Polypeptiden unter
Verwendung des von Deckmyn et al., ebenda beschriebenen Modells.
Die Thrombusbildung in Antwort auf die Verabreichung von Proteinen
der vorliegenden Erfindung kann gemessen werden, unter Verwendung
des Hamsterfemoralvenen-Thrombosemodells, das bereitgestellt ist
durch Deckmyn et al., ebenda. Änderungen
in der Plättchenanheftung
unter Flussbedingungen nach der Verabreichung von zsig37, können gemessen
werden unter Verwendung der in Harsfalvi et al., Blood 85: 705–11, 1995
beschriebenen Verfahren.
-
Die Komplementinhibition und Wundheilung
durch zsig37-Polypeptide, -Fragmente, – Fusionsproteine, -Antikörper, -Agonisten
oder -Antagonisten kann allein oder in Kombination mit anderen bekannten
Inhibitoren der kollageninduzierten Plättchenaktivierung und -aggregation,
wie z. B. Palldipin, Moubatin oder Calin, nachgewiesen werden.
-
Zsig37-Polypeptide, -Fragmente, -Fusionsproteine,
-Antikörper,
-Agonisten oder – Antagonisten
können
beurteilt werden unter Verwendung von hierin oder von im Stand der
Technik bekannten Verfahren, wie z. B. dem Heilen von Hautschichten
in Schweinen (Lynch et al., Proc. Natl. Acad. Sci. USA 84: 7696–700, 1987) und
von Vollhautwunden in Mäusen
mit genetisch erzeugter Diabetes (Greenhalgh et al., Am. J. Pathol.
136: 1235–46,
1990), zum Beispiel. Die Polypeptide der vorliegenden Erfindung
können
allein oder in Kombination mit anderen bekannten Komplementinhibitoren,
wie oben beschrieben, untersucht werden.
-
Weiterhin können die zsig37-Polypeptide,
Fragmente, Fusionsagonisten, oder Antagonisten davon, therapeutisch
nützlich
sein für
antimikrobielle Anwendungen. Zum Beispiel spielt der Komplementbestandteil C1q
eine Rolle in der Wirtsverteidigung gegen infektiöse Mittel,
wie z. B. Bakterien und Viren. Von C1q ist bekannt, dass es zahlreiche
spezialisierte Funktionen ausübt.
Zum Beispiel löst
C1q die Komplementkaskade über
eine Wechselwirkung mit dem gebundenen Antikörper oder C-reaktiven Protein
(CRP) aus. Auch tritt C1q direkt in Wechselwirkung mit bestimmten
Bakterien, RNS-Viren, Mykoplasma, Harnsäurekristallen, dem Lipid-A-Bestandteil
bakteriellen Endotoxins und den Membranen gewisser intrazellulärer Organellen.
Von der C1q-Bindung an den C1q-Rezeptor wird angenommen, dass sie
die Phagozytose fördert.
C1q scheint auch den Antikörperbildungsaspekt
des Wirtsabwehrsystems zu steigern. Siehe z. B. Johnston, Pediatr.
Infect. Dis. J. 12 11: 933–41,
1993. Folglich können
lösliche
C1q-ähnliche
Moleküle
nützlich
sein als antimikrobielle Mittel, wodurch die Lyse oder Phagozytose
infektiöser
Mittel gefördert
wird.
-
Es wurde festgestellt, dass die positiv
geladenen, extrazellulären
Tripelhelix-Kollagendomänen von C1q
und Makrophagenfängerrezeptor
eine Rolle spielen in der Ligandbindung und es wurde gezeigt, dass
sie eine breite Bindungsspezifität
für Polyanione
haben (Acton et al., J. Biol. Chem. 268: 3530–37, 1993). Lysophospholipidwachstumsfaktor
(Lysophosphatidsäure,
LPA) und andere mitogenetische Anionen sind örtlich auf die Stelle geschädigter Gewebe
begrenzt und unterstützen
bei der Wundheilung. LPA übt
viele biologische Wirkungen aus, einschließlich der Aktivierung von Blutplättchen und
der Heraufregulierung des Matrixzusammenbaus. Es wird gedacht, dass
LPA mit anderen Blutgerinnungsfaktoren zusammenwirkt und die Wundheilung
vermittelt.
-
Von den Kollagendomänen von
Proteinen, wie z. B. C1q und Makrophagenfängerrezeptor, ist bekannt, dass
sie saure Phospholipide, wie z. B. LPA, binden. Ein 9mer-Bereich
der Kollagendomäne
von zsig37, die Aminosäurereste
127–135
von SEQ ID NO: 2, teilt eine Sequenzhomologie mit der Kollagendomäne, die
auf C1q und Makrophagenfängerrezeptor
gefunden wird. Die Wechselwirkung von zsig37-Polypeptiden, – Fragmenten,
-Fusionen, -Agonisten oder -Antagonisten mit mitogenischen Anionen,
wie z. B. LPA, kann bestimmt werden unter Verwendung von im Stand
der Technik bekannten Tests, siehe z. B. Acton et al., ebenda. Die Inhibition
entzündlicher
Prozesse durch Polypeptide und Antikörper der vorliegenden Erfindung
würden
auch nützlich
sein bei der Verhinderung von Infektion an der Wundstelle.
-
Für
die pharmazeutische Verwendung können
die Proteine der vorliegenden Erfindung mit pharmazeutisch annehmbaren
Trägern
für die
parenterale, orale, nasale, rektale, topische, transdermale Verabreichung
oder Ähnlichen,
gemäß den gängigen Verfahren
formuliert werden. Vorzugsweise wird die Verabreichung an oder in
der Nähe
der Stelle der Gefäßverletzung
getätigt.
Im Allgemeinen werden pharmazeutische Formulierungen ein zsig37-Protein
in Kombination mit einem pharmazeutisch annehmbaren Vehikel, wie
z. B. Kochsalzlösung,
gepufferter Salzlösung,
5% Dextrose in Wasser oder Ähnliches
einschließen.
Die Formulierungen können
weiterhin einen oder mehrere Trägerstoffe,
Konservierungsmittel, Lösungsvermittler,
Puffermittel, Albumin, um den Proteinverlust auf den Oberflächen von
Arzneimittelfläschchen
zu verhindern, etc. einschließen.
Verfahren der Formulierung sind im Stand der Technik wohlbekannt
und sind z. B. offenbart in Remington: The Science und Practice
of Pharmacy, Gennaro, Hrsg. Mack Publishing Co., Easton PA, 19.
Auflage, 1995. Therapeutische Dosen werden im Allgemeinen bestimmt
werden durch den Kliniker, gemäß angenommener
Standards, wobei die Art und Schwere des zu behandelnden Zustandes,
Patientenmerkmale, etc. mit einbezogen werden. Die Bestimmung der
Dosis liegt innerhalb des Maßes
des Durchschnittkönnens.
-
Wie hierin verwendet, ist eine „pharmazeutisch
wirksame Menge" eines
zsig37-Polypeptides,
-Fragmentes, -Fusionsproteins, -Agonisten oder -Antagonisten eine
Menge, die ausreichend ist, ein gewünschtes biologisches Ergebnis
zu erzielen. Das Ergebnis kann die Erleichterung der Anzeichen,
Symptome oder Ursachen einer Erkrankung sein, oder jede andere gewünschte Veränderung
eines biologischen Systems. Zum Beispiel kann eine wirksame Menge
eines zsig37-Polypeptids eine sein, die entweder eine subjektive
Erleichterung von Symptomen oder eine objektiv identifizierbare
Verbesserung, wie durch den Kliniker oder einen anderen qualifizierten
Beobachter festgestellt, bereitstellt. Solch eine wirksame Menge
eines zsig37-Polypeptids würde,
beispielsweise für
die Inhibition der kollagenaktivierten Plättchenaktivierung und des Komplementweges,
einschließlich
C1q, sorgen, wodurch der örtlich
begrenzte Blutfluss in dem Gefäßsystem
eines Patienten erhöht
wird/oder die Reduktion schädlicher
Wirkungen von Ischämie
und Reperfusion gesteigert wird. Wirksame Mengen der zsig37-Polypeptide
können
weit variieren, in Abhängigkeit
von der zu behandelnden Krankheit oder dem zu behandelnden Symptom.
Die Menge des zu verabreichenden Polypeptids und seine Konzentration
in den Formulierungen hängt
ab von dem gewählten
Vehikel, dem Applikationsweg, der Leistungsfähigkeit des bestimmten Polypeptids,
dem klinischen Zustand des Patienten, den Nebenwirkungen und der
Stabilität der
Verbindung in der Formulierung. Folglich wird der Kliniker die geeignete
Zubereitung anwenden, die die geeignete Konzentration in der Formulierung
enthält,
ebenso wie die Menge der verabreichten Formulierung, in Abhängigkeit
von der klinischen Erfahrung mit dem in Frage kommenden Patienten
oder mit ähnlichen
Patienten. Solche Mengen werden zum Teil abhängen von dem bestimmten zu
behandelnden Zustand, Alter, Gewicht und der allgemeinen Gesundheit
des Patienten und von anderen Faktoren, die offensichtlich sind
für Fachleute.
Typischerweise wird eine Dosis im Bereich von 0,01 bis 100 mg/kg
des Patienten sein. In Anwendungen wie z. B. Ballonkathetern wird
der typische Dosisbereich 0,05–5
mg/kg des Patienten sein. Dosen spezifischer Verbindungen können bestimmt
werden aus in vitrooder ex vivo-Untersuchungen, in Kombination mit Untersuchungen
an Versuchstieren. Konzentrationen von Verbindungen, die in vitro
oder ex vivo für
wirksam befunden wurden, stellen eine Orientierung für Tieruntcrsuchungen
bereit, wodürch
Dosen berechnet werden, um ähnliche
Konzentrationen an der Wirkungsstelle bereitzustellen.
-
Die Erfindung wird weiter erläutert durch
die folgenden, nicht begrenzenden Beispiele.
-
Beispiel 1
-
Ausdehnung der EST-Sequenz
-
Die neuen zsig37-Polypeptid-kodierenden
Polynukleotide der vorliegenden Erfindung wurden anfänglich identifiziert
durch Auswählen
eines ESTs aus einer EST-Datenbank, wodurch eine darauf basierende
Proteinsequenz vorhergesagt wurde, und durch Durchsuchen bekannter
Sequenzdatenbanken für
das sezernierte Protein, das zu dem basierend auf dem EST-vorhergesagten
Protein am homologsten ist. ESTs, die möglicherweise Proteine mit biologisch
interessanter Homologie zu bekannten sezernierten Proteinen kodieren, wurden
für weitere
Untersuchungen identifiziert. Eine einzelne EST-Sequenz wurde entdeckt
und es wurde von ihr vorhergesagt, dass sie homolog sei zu einem
adipozytenspezifischen Protein. Siehe z. B. Scherer et al., J. Biol.
Chem. 270 45: 26746–9,
1995. Um die entsprechene cDNS zu identifizieren wurde ein Klon
verwendet für
das Sequenzieren, von dem angenommen wurde, dass er wahrscheinlich
die gesamte kodierende Sequenz enthält. Unter Verwendung eines
Invitrogen S. N. A. P.TM-Mini-Prep-Kits
(Invitrogen, Corp., San Diego, Kalifornien, USA) wurde gemäß den Anleitungen
des Herstellers eine 5 ml-Übernachtkultur
in LB + 50 μg/ml
Ampizillin zubereitet. Die Matrize wurde sequenziert auf einem ABIPRISMTM Modell 377 DNS-Sequenziergerät (Perkin-Elmer
Cetus, Norwalk, Ct.) unter Verwendung des ABI PRISMTM Dye
Terminator Cycle Sequencing Ready Reaktion Kit (Perkin-Elmer Corp.),
gemäß den Anleitungen
des Herstellers. Die Oligonukleotide ZC695 (SEQ ID NO: 5) und ZC694
(SEQ ID NO: 6) der SP6- und T7-Promotoren auf dem Klon-enthaltenden
Vektor wurden als Sequenzierprimer verwendet. Die Oligonukleotide
ZC13210 (SEQ ID NO: 7), ZC13588 (SEQ ID NO: 8), ZC13532 (SEQ ID
NO: 9), ZC13641 (SEQ ID NO: 10), ZC13586 (SEQ ID NO: 11), ZC13651 (SEQ
ID NO: 12), ZC13622 (SEQ ID NO: 13), ZC13625 (SEQ ID NO: 14), ZC13650
(SEQ ID NO: 15), ZC13589 (SEQ ID NO: 16), ZC13624 (SEQ ID NO: 17),
ZC13531 (SEQ ID NO: 18), ZC13587 (SEQ ID NO: 19), und ZC13623 (SEQ
ID NO: 20) wurden verwendet, um die Sequenz des Klons zu vervollständigen.
Sequenzierreaktionen wurden in einem Hybaid OmniGene Temperature
Cycling-System (National Labnet Co., Woodbridge, NewYork, USA) durchgeführt. Die
SEQUENCHERTM 3.0 Sequenzanalysesoftware
(Gene Codes Corporation, Ann Arbor, Michigan, USA) wurde für die Datenanalyse
verwendet. Die resultierende 2769 bp lange Sequenz ist in SEQ ID
NO: 1 offenbart. Der Vergleich der ursprünglich abgeleiteten EST-Sequenz,
mit der in SEQ ID NO: 1 dargestellten Sequenz zeigt, dass eine Basenpaarmehrdeutigkeit
(ein unbekannter „N"-Rest) vorhanden war und keine Basenpaarinsertionen,
was in der Identifizierung von Leucin bei der Auflösung der
Mehrdeutigkeit resultierte und dass keine Leserasterverschiebungen
zwischen den abgeleiteten Aminosäuresequenzen vorhanden
waren.
-
Beispiel 2
-
Gewebeverteilung
-
Norhtern-Blots wurden durchgeführt unter
Verwendung von Human Multiple Tissue Blots von Clontech (Palo Alto,
Kalifornien, USA). Eine 30-Basenpaar-umfassende DNS-Sonde (ZC12447; SEQ
ID NO: 4) für
das 5'-Ende der
Nukelotidsequenz des in SEQ IDNO: 1 gezeigten reifen Proteins, wurde
radioaktiv mit 32P unter Verwendung von
T4-Polynukleotidkinase
und Vorwärts-Reaktionspuffer
(GIBCO BRL, Gaithersburg, Maryland, USA) gemäß den Anleitungen des Herstellers
markiert. Die Sonde wurde gereinigt unter Verwendung einer NUCTRAP
Drucksäule
(Stratagene Cloning Systems, La Jolla, Kalifornien, USA). EXPRESSHYB-
(Clontech, Palo Alto, Kalifornien, USA) Lösung wurde verwendet für die Prähybridisierung
und als eine Hybridisierungslösung
für die
Northern-Blots.
Die Hybridisierung fand über
Nacht bei 50°C
statt und die Blots wurden dann in 2X SSC und 0.1% SDS bei Raumtemperatur
gewaschen, gefolgt von einem Waschvorgang in 1X SSC und 0,1% SDS
bei 68°C
(ungefähr
5° weniger
als der Schmelzpunkt). Eine Transkriptgröße wurde bei ungefähr 2.8 kb
beobachtet. Die Signalintensität
war am höchsten
für Herz
und Plazenta, mit vergleichsweise weniger starken Signalen in Niere,
Eierstock, Nebenniere und Skelettmuskel, und mit geringen Signalen
in einer breiten Reihe von anderen, im Northern-Blot vorhandenen
Geweben.
-
Unter Verwendung eines Darmgewebe-Northern-Blots
wurde eine zusätzliche
Northern-Blot-Analyse durchgeführt.
Der Blot wurde zubereitet unter Verwendung von mRNS einer menschlichen
kolorektalen Adenokarzinom-Zelllinie SW480 (Clontech, Palo Alto,
Kalifornien, USA), menschlichen Dünndarmgewebes (Clontech), menschlichen
Magengewebes (Clontech), einer menschlichen glatten Darmmuskelzelllinie
(Hism; ATCC Nr. CRL–1692;
American Type Culture Collection, 12301 Parklawn Drive, Rockville,
Maryland, USA), einer normalen menschlichen Kolonzelllinie (FHC;
ATCC Nr. CRL–1831;
American Type Culture Collection) und einer menschlichen normalen
fetalen Dünndarmzelllinie
(FHs74 Int.; ATCC Nr. CCL241; American Type Culture Collection).
-
Aus Hism, FHC und FHs74 Int. wurde
Gesamt-RNS durch das Säure-Guanidium-Verfahren (Cheomczynski
et al., Anal. Biochem. 162: 156–9,
1987) isoliert. PolyA+-RNS wurde gesammelt,
indem Gesamt-RNS durch eine Säule,
die PolyA+-RNS zurückhält, eluiert
wurde (Aviv et al., Proc. Nat. Acad. Sci. 69: 1408–12, 1972).
Es wuden 2 μg
PolyA+-RNS von jeder Probe in einem 1,5% Agarosegel in 2,2 M Formaldehyd
und Phosphatpuffer abgetrennt. Die RNS wurde auf eine Nytran-Membran
(Schleicher und Schuell, Keene, New Hampshire, USA) in 20X SSC über Nacht übertragen.
Der Blot wurde in dem UV-Stratalinker
2400 (Stratagene, La Jolla, Kalifornien, USA) bei 0,12 Joule behandelt.
Der Blot wurde dann bei 80°C
für eine
Stunde gebacken.
-
Gesamtlängen-cDNS (gezeigt in SEQ ID
NO: 1) wurde durch PCR amplifiziert und mit 32P
dCTP radiomarkiert unter Verwendung eines Rediprime Pellet-Kits
(Amersham, Arlington Heights, Illinois, USA), gemäß den Anweisungen
des Herstellers. Der Blot wurde in EXPRESSHYB (Clontech) bei 56°C über Nacht
hybridisiert. Der Blot wurde bei Raumtemperatur in 2X SSC und 0,1%
SDS, dann in 2X SSC und 0,1% SDS bei 65°C und schließlich bei 65°C in 0,1X
SSC und 0,1% SDS gewaschen. Die Ergebnisse zeigten, dass zsig3 7
an alle Gewebe hybridisierte, mit Ausnahme der menschlichen glatten
Darmmuskelzelllinie HISM.
-
Beispiel 3
-
Chromosomale Markierung
des Zsig 37-Gens
-
Das zsig37-Gen wurde auf dem menschlichen
Chromosom 17, Region 17g25.2 durch PCR unter Verwendung der NIGMS
Mensch/Nager-Somazellhybrid-Kartiertafel Nr. 2 (National Institute
of General Medical Sciences, Coriell Institute of Medical Research)
kartiert. Die Tafel besteht aus DNS, die aus 24 Mensch/Nager-Körperzellhybriden,
von denen jedes ein spezifisches menschliches Chromosom und die
elterliche DNS behält,
isoliert wurde. Für
das Kartieren des zsig37-Gens wurden 20 μl-Reaktionen in einer 96-Well-Mikrotiterplatte
(Stratagene, La Jolla, Kalifornien, USA) angesetzt und in einem „RoboCycler
Gradient 96" Termocycler (Stratagene)
verwendet. Jede der 27 PCR-Reaktionen enthielt 2 μl 10X KlenTaq-PCR-Reaktionspuffer
(Clontech Laboratories, Inc., Palo Alto, Kalifornien, USA), 1,6 μl dNTP-Mischung
(2,5 mM von jedem, PERKIN-ELMER, Foster City, Kalifornien, USA),
lμl Sinn-Primer
(SEQ ID NO: 21), 1 μl
Gegensinn-Primer (SEQ ID NO: 22), 2 μl RediLoad (Research Genetics,
Inc.), 0,4 μl
50X Advantage K1enTaq-Polymerase-Mix
(Clontech Laboratories, Inc.), 25 ng DNS eines einzelnen Hybridklons
oder der Kontrolle und ddH2O für ein Gesamtvolumen von
20 μl. Die
Reaktionen wurden mit einer gleichen Menge Mineralöl überschichtet
und verschlossen. Die PCR-Cycler-Bedingungen waren wie folgt: ein
anfänglicher
Zyklus mit 5 Minuten Denaturierung bei 95°C, 35 Zyklen mit 1 Minute Denaturierung
bei 95°C,
1 Minute Annealing bei 60°C
und 1,5 Minuten Verlängerung
bei 72°C,
gefolgt von einer Endzyklus-Verlängerung
von 7 Minuten bei 72°C.
Die Reaktionen wurden durch Elektrophorese auf ein 3% NuSieve GTG-Agarosegel
(FMC Bioproducts, Rockland, Maine, USA) getrennt.
-
Beispiel 4
-
Schaffung eines Säugerexpressionsvektors
zsig37NEE/pZP9 und zsig37CEE/pZP9
-
Für
das zsig37-Polypeptid wurden zwei Expressionsvektoren zubereitet,
zSIG37NEE/pZP9 und zSIG37CEE/pZP9, worin die Konstrukte so angelegt
wurden, dass sie ein zsig37-Polypeptid mit einer C- oder N-terminalen
Glu-Glu-Markierung exprimieren.
-
Zsig37NEE/pZP9
-
Ein durch PCR erzeugtes 800 by zsig37-DNS-Fragment
wurde unter Verwendung von ZC15040 (SEQ ID NO: 24) und SC15033 (SEQ
ID NO: 25) als PCR-Primer und der in Beispiel 1 oben beschriebenen
Matrize geschaffen. Die PCR-Reaktion wurde bei 94°C für 3 Minuten
inkubiert und dann wurden 5 Zyklen laufen gelassen mit 94°C für 30 Sekunden,
30°C für 20 Sekunden
und 72°C
für 1 Minute,
gefolgt 25 Zyklen bei 94°C
für 30
Sekunden,64°C
für 20
Sekunden und 72°C
für 1 Minute.
Es folgte eine 5-minütige
Verlängerung
bei 72°C. Das
resultierende PCR-Produkt wurde dann auf einem 0,9%-TBE-Agarosegel
mit 1X TBE-Puffer laufen gelassen. Eine Bande der vorhergesagten
Größe wurde
ausgeschnitten und die DNS wurde von dem Gel aufgereinigt mit einem
Qiaex II®-Harz
(Qiagen) gemäß den Anweisungen
des Herstellers. Die DNS wurde mit den Restriktionsenzymen Bam HI
und Xba I verdaut, gefolgt von Extraktion und Fällung.
-
Das ausgeschnittene, restriktionsverdaute
zsig37-DNS-Fragment wurde in das Plasmid NEE/pZP9 subkloniert, das
mit den Restriktionsenzymen Bam HI und Xba I geschnitten worden
war. Der zsig37NEE/pZP9-Expressionsvektor baut das TPA-Leitpeptid
ein und hängt
eine Glu-Glu-Markierung (SEQ ID NO: 26) an den N-Terminus der das
zsig37-Polypeptid kodierenden Polynukleotidsequenz an. Das Plasmid NEE/pZP9
(hinterlegt bei der American Type Culture Collection, 12301 Parklawn
Drive, Rockville, Maryland, ATCC Nr. 98668) ist ein Säugerexpressionsvektor,
der eine Expressionskassette mit dem Maus-Metallothionein-l-Promoter, einem TPA-Leitpeptid,
gefolgt von der Sequenz, die die Glu-Glu-Markierung kodiert (SEQ
ID NO: 26), multiple Restriktionsstellen für das Einfügen kodierender Sequenzen und
eine Terminationssequenz des menschlichen Wachstumshormons enthält. Das
Plasmid enthält
auch einen E. coli-Replikationsstartpunkt, eine auswählbare Säuger-Markerexpressionseinheit
mit einem SV40-Promoter, -Enhancer und -Replikationsstartpunkt,
einem DHFR-Gen und der SV40-Terminationssequenz.
-
zsig376CEE/pZP9
-
Ein durch PCR erzeugtes, 866 by langes
zsig37-DNS-Fragment wurde in Übereinstimmung
mit dem oben ausgeführten
Vorgehen geschaffen unter Verwendung von ZC15721 (SEQ ID NO: 27)
und ZC15035 (SEQ ID NO: 28} als PCR-Primer. Das gereinigte PCR-Fragment
wurde mit den Restriktionsenzymen Eco RI und Bam HI verdaut, auf
Gel gereinigt unter Verwendung eines Qiaex II-Harzes, wie oben beschrieben.
-
Die ausgeschnittene und restriktionsverdaute
zsig37-DNS wurde in das Plasmid CEE/pZP9 subkloniert, das mit Eco
RI und Bam HI geschnitten worden war. Der zsig37CEE/pZP9-Expressionsvektor
verwendet das natürliche
zsig37-Signalpeptid, und das Glu-Glu-Epitop (SEQ ID NO:26) ist an
den C-Terminus als eine Aufreinigungshilfe angehängt. Das Plasmid CEE/pZP9 (hinterlegt
bei der American Type Culture Collection, 12301 Parklawn Drive,
Rockville, Maryland, USA, ATCC Nr. 98668) ist ein Säuger-Expressionsvektor,
der eine Expressionskassette mit dem Maus-Metallothionein-l-Promoter,
multiple Restriktionsstellen für
das Einfügen kodierender
Sequenzen, eine Sequenz, die die Glu-Glu-Markierung kodiert (SEQ
ID NO:26), ein Stop-Codon und eine menschliche Wachstumshormon-Terminationssequenz
enthält.
Das Plasmid hat auch einen E. coli-Replikationsstartpunkt, eine auswählbare Säuger-Markerexpressionseinheit
mit einem SV40-Promoter,
-Enhancer und -Replikationsstartpunkt, ein DHFR-Gen und die SV40-Terminationssequenz.
-
Für
die N- und C-markierten Konstrukte wurden ungefähr 30 ng der restriktionsverdauten
Inserts und 50 ng der entsprechenden Vektoren bei Raumtemperatur
für 4 Stunden
ligiert. Ein Mikroliter jeder Ligationsreaktion wurde unabhängig in
DH10Bkompetente Zellen (GIBCO BRL, Gaithersburg, Maryland, USA)
elektroporiert, gemäß der Anweisung
des Herstellers, und auf LB-Platten, die 50 mg/ml Ampicillin enthielten,
ausplattiert und über
Nacht inkubiert.
-
Die Kolonien wurden durch PCR gescreent,
wie oben beschrieben. Für
die zsig37NEE/pZP9- und zsig37CEE/pZA9-Screens waren die Primer
ZC13006 (SEQ ID NO: 29) und ZC13007 (SEQ ID NO: 20). Die PCR-Reaktion
wurde bei 94°C
für 2,5
Stunden inkubiert und dann wurden 25 Zyklen mit 94°C für 10 Sekunden, 58°C für 20 Sekunden
und 72°C
für 1 Minute
laufen gelassen. Eine 5-minütige
Verlängerung
bei 72°C
folgte. Die Insert-Sequenz der positiven Klone, 1013 by für zsig37NEE
und ein 950 bp-Fragment für
zsig37CEE, wurden durch eine Sequenzanalyse überprüft. Eine Plasmidzubereitung
im großen
Maßstab
wurde unter Verwendung eines QIAGEN® Maxi-Prep-Kit
(Qiagen} gemäß den Anweisungen
des Herstellers durchgeführt.
-
Beispiel 5
-
Transfektion und Expression
der zsig37NEE- und -CEE-Polypeptide
-
BHK 570-Zellen (ATCC Nr. CRL–10314)
wurden in 10 cm Gewebekulturschalen ausplattiert und man ließ sie wachsen
bis zu ungefähr
50–70%
Konfluenz über
Nacht bei 37°C,
5% CO2, in DMEM/FBS-Medien (DMEM, GibcoBRL
High Glucose, (Gibco BRL, Gaithersburg, Maryland, USA), 5% fetales
Rinderserum (Hyclone, Logan, Utah, USA), 2 μM L-Glutamin (JRH Biosciences,
Lenexa, Kansas, USA), 1 μM
Natriumpyruvat (Gibco BRL)). Die Zellen wurden dann mit dem Plasmid
zsig37NEE/pZP9 (N-terminale Glu-Glu-Markierung) oder zsig37CEE/pZP9 (C-terminale
Glu-Glu-Markierung) transfiziert unter Verwendung von LipofectaminTM (Gibco BRL), in serumfreier (SF) Medienformulierung
(DMEM, Gibco/BRL High Glucose, (Gibco BRL, Gaithersburg, Maryland,
USA), 2 mM L-Glutamin,
2 mM Natriumpyruvat, 10 μg/ml
Transferrin, 5 μg/ml
Insulin, 10 μg/ml
Fetuin und 2 ng/ml Selen). Sechzehn Mikrogramm zsig37NEE/pZP9 und
16 μg zsig37CEE/pZP9
wurden gesondert in 15 ml-Röhrchen
auf ein Gesamtendvolumen von 640 μl
SF-Medium verdünnt.
In gesonderten Röhrchen
wurden 35 μl
LipofectaminTM (Gibco BRL) mit 605 μl SF-Medium vermischt. Die LipofectaminTM-Mischung wurde zu der DNS-Mischung hinzugefügt und man
ließ sie
ungefähr
30 Minuten bei Raumtemperatur inkubieren. Fünf Milliliter SF-Medium wurden
zu der DNS:LipofectaminTM-Mischung hinzugefügt. Die
Zellen wurden einmal mit 5 ml SF-Medium gespült, abgesaugt und die DNS:LipofectaminTM-Mischung
wurde hinzugefügt.
Die Zellen wurden bei 37°C
für 5 Stunden
inkubiert, dann wurden 6,4 ml von DMEM / 10% FBS, 1% PSN-Medium
zu der Platte hinzugefügt.
Die Platte wurde bei 37°C über Nacht
inkubiert und die DNS:LipofectaminTM-Mischung
wurde durch frisches FBS/DMEM-Medium am nächsten Tag ersetzt. Am Tage „ 2" nach der Transfektion
wurden die Zellen in dem Selektionsmedium (ESTEP #1 mit 1 μM MTX) aufgeteilt
in 150 mm Platten, in Verhältnissen
von 1 : 50, 1 : 100, 1 : 200. Am Tage „5" nach der Transfektion wurden die Platten
erneut mit frischem Selektionsmedium gefüttert.
-
Screenig-Kolonien
-
Ungefähr 10–12 Tage nach der Transfektion
wurde eine 150 mm Kulturschale Methotrexat-resistenter Kolonien
von jeder Transfektion ausgewählt,
das Medium wurde abgesaugt, die Platten wurden gewaschen mit 10
ml serumfreiem ESTEP-2-Medium (668,7 g/50 l DMEM (Gibco), 5,5 g/501
Brenztraubensäure,
Natriumsalz 96% (Mallinckrodt), 185,0 g/50 lNaHCO3 (Mallinkrodt),
5,0 mg/ml, 25 ml/50 l Insulin, 10,0 mg/ml und 25 ml/50 l Transferrin).
Das Waschmedium wurde abgesaugt und durch 5 ml serumfreies ESTEP
2 ersetzt. Ein steriles Teflongitter (Spectrum Medical Industries,
Los Angeles, Kalifornien, USA), vorimprägniert mit serumfreinem ESTEP
2, wurde dann über
den Zellen plaziert. Ein in serumfreiem ESTEP 2 vorimprägniertes,
steriles Nitrocellulose-Filter wurde dann über das Gitter gelegt. Orientierungsmarkierungen
auf der Nitrocellulose wurden auf die Kulturschalen übertragen.
Die Platten wurden dann für
5–6 Stunden
in einem 37°C,
5% CO2 Inkubationsgerät inkubiert. Nach der Inkubation
wurde das Filter entfernt und das Medium abgesaugt und durch DMEM/5%
FBS, 1X PSN (Gibco BRL)-Medium ersetzt. Das Filter wurde dann in
einen verschließbaren
Beutel, der 50 ml Puffer (25 mM Tris, 25 mM Glyzin, 5 mM β-Mercaptoethanol)
enthält,
gegeben und in einem 65°C Wasserbad
für 10
Minuten inkubiert. Die Filter wurden in 10% nicht fettem, trockenem
Milch/Western-A-Puffer (Western A: 5OmM Tris pH 7,4, 5mM EDTA, 0,05%
NP–40,
150mM NaCl und 0,25% Gelatine) für
15 Minuten bei Raumtemperatur auf einem rotierendem Schüttler geblockt.
Das Filter wurde dann mit einem Anti-Glu-Glu-Antikörper-HRP-Konjugat
inkubiert in einer 1 : 1000-Verdünnung
in 2,5% nicht fettem, trockenen Milch/Western-A-Puffer (Western
A: 50 mM Tris pH 7,4, 5 mM EDTA, 0,05% NP–40, 150 mM NaCl und 0,25% Gelatine) über Nacht
bei 4°C
auf einem rotierenden Schüttler.
Das Filter wurde dann dreimal bei Raumtemperatur in PBS plus 0,1%
Tween 20 gewaschen, 5–15
Minuten pro Waschgang. Das Filter wurde mit ECL-Reagens (Amersham
Corp., Arlington Heights, Illinois, USA) entwickelt, gemäß den Anweisungen
des Herstellers und einem Film (Hyperfilm ECL, Amersham) für ungefähr 5 Minuten
ausgesetzt.
-
Der Film wurde mit der die Kolonien
enthaltenden Platte ausgerichtet. Geeignete Kolonien wurden unter
Verwendung des Film als Führung
ausgewählt.
Sterile, 3 mm Koloniescheiben (PGC Scientific Corp., Frederick,
Maryland, USA) wurden in Trypsin eingeweicht und auf die Kolonien
gelegt. Zwölf
Kolonien für
jedes Konstrukt wurden in 200 μl
Selektionsmedium in einer 96 Well-Platte übertragen. Eine Reihe an sieben
Zweifach-Verdünnungen
wurden für
jede Kolonie durchgeführt.
Man ließ die
Zellen für
eine Woche bei 37°C
wachsen, nach der Zeit wurden die Vertiefungen, die die geringste
Zellverdünnung
erhalten hatten, die nun in der optimalen Dichte vorlagen, ausgewählt, trypsiniert
und auf eine 12 Well-Platte, die Selektionsmedium enthält, übertragen.
Die 150 mm Kulturschale wurde auch trypsiniert und die verbleibenden
Zellen wurden vereinigt und der Western-Analyse und der Mycoplasma-Untersuchung
unterzogen. Der Pool wurde für
die Lagerung eingefroren.
-
Die Klone wurden direkt von der 12
Well-Platte auf zwei T-75-Flaschen erweitert. Eine Flasche wurde beibehalten,
um das Zellwachstum fortzusetzen, die zweite Flasche wurde in serumfreiem
ESTEP 2 wachsen gelassen, die für
Western-Blot-Analyse geerntet wurde. Klone von jedem der Expressionskonstrukte
basierend auf der Western-Blot-Analyse, wurden ausgewählt, vereinigt
und für
die Kultur im großen
Maßstab überführt.
-
Beispiel 7
-
Säuger-Expression von zsig37CEE
im großen
Maßstab
-
Eine T-162-Flasche, die konfluente,
zsig37CEE-exprimierende Zellen enthält und eine, die zsig37NEE,
gewonnen von dem oben beschriebenen Expressionsvorgang, enthält, wurden
jeweils auf vier T-162-Flaschen erweitert. Eine der vier resultierenden
Flaschen wurde verwendet, um vier Kryobehälter einzufrieren, und die
anderen drei Flaschen wurden verwendet, um eine Nunc-Zellfabrik
zu erzeugen.
-
Die Zellen der drei T-162-Flaschen
von zsig37CEE und zsig37NEE wurden verwendet, um unabhängig zwei
Nunc-Zellfabriken (10 Schichten, im Handel erhältlich von VWR) auszusäen. Kurz,
die Zellen der oben beschriebenen T-162-Flaschen wurden unter Verwendung
von Trypsin abgelöst,
vereinigt und zu 1,5 Litern ESTEPI-Medium (668,7 g/50 l DMEM (Gibco),
5,5 g/50 l Brenztraubensäure,
Natriumsalz 96% (Mallinckrodt), 185,0 g/50 l NaHCO3 (Mallinkrodt),
5,0 mg/ml und 25 ml/50 l Insulin (JRH Biosciences), 10,0 mg/ml und
25 ml 50 l Transferrin (JRH Biosciences), 2,5 l/50 lfetales Rinderserum
(charakterisiert) (Hyclone), 1 μM
MTX, mit einem pH, der auf 7,05 +/- 0,05 angepasst war), vorgewärmt auf
37°C, hinzugefügt. Das
Medium, das die Zellen enthielt, wurde dann in die Nunc-Zellfabriken über einen
Trichter eingefüllt.
Die Zellfabriken wurden in ein 37°C
/ 5,0% CO2-Inkubationsgerät gestellt.
-
Bei einer Konfluenz von 80–100 % wurde
ein Sicht-Kontaminationstest (Farbänderung von Phenolrot) mit
den Inhalten der Nunc-Zellfabriken durchgeführt. Da keine Kontamination
beobachtet wurde, wurde der Überstand
der konfluenten Fabriken in einen kleinen Erntebehälter gefüllt, eine
Probe entnommen und verworfen. Die anhaftenden Zellen wurden dann
einmal mit 400 ml PBS gewaschen. Um die Zellen von den Fabriken abzulösen, wurden
100 ml Trypsin zu jeder hinzugefügt
und entfernt, und die Zellen wurden dann für 5–10 Minuten in dem Rest-Trypsin
inkubiert. Die Zellen wurden nach zwei 200 ml-Waschvorgängen mit
ESTEPI-Medium gesammelt. Zu jedem der zehn ESTEPI-Medium enthaltenden
Flaschen (1,5 Liter jeweils, bei 37°C) wurden 40 ml der gesammelten
Zellen hinzugefügt.
Eine 1,5-Liter-Flasche wurde dann verwendet, um eine Nunc-Fabrik
zu beüllen.
Jede Zellfabrik wurde in ein 37°C/5,0%
CO2-Inkubationsgerät gestellt.
-
Bei einer Konfluenz von 80–90% wurde
ein Sicht-Kontaminationstest (Farbänderung von Phenolrot) an den
Nunc-Zellfabriken durchgeführt.
Da keine Kontamination beobachtet wurde, wurde der Überstand
der konfluenten Fabriken in einen kleinen Erntebehälter gefüllt, eine
Probe entnommen und verworfen. Die Zellen wurden dann einmal mit
400 ml PBS gewaschen. 1,5 Liter ESTEP2-Medium (668,7 g/50 l DMEM
(Gibco), 5,5 g/50 l Brenztraubensäure, Natriumsalz 96% (Mallinkrodt),
185,0 g/50 l NaHCO3 (Mallinkrodt), 5,0 mg/ml,
25 ml/50 l Insulin, 10,0 mg/ml und 25 ml/50 l Transferrin) wurden
zu jeder Nunc-Zellfabrik
hinzugefügt.
Die Zellfabriken wurden bei 37°C/5,0%
CO2 inkubiert.
-
Nach ungefähr 48 Stunden wurde ein Sicht-Kontaminationstest
(Farbänderung
von Phenolrot) an den Nunc-Zellfabriken durchgeführt. Der Überstand jeder Fabrik wurde
in kleine Erntebehälter
eingefüllt.
Frisches serumfreies Medium (1,5 Liter) wurde in jede Nunc-Zellfabrik gefüllt und
die Fabriken wurden bei 37°C/5,0% CO2 inkubiert. Ein Milliliter der Ernte des Überstandes
für jedes
Konstrukt wurde auf einen Mikroskop-Objektträger übertragen und der mikroskopischen
Analyse auf Kontamination unterzogen. Die Inhalte der kleinen Erntebehälter für jedes
Konstrukt wurden vereinigt und sofort gefiltert. Eine zweite Ernte
wurde dann nach 48 Stunden durchgeführt, im Wesentlichen wie oben
beschrieben, und die Zellfabriken wurden anschließend verworfen.
Ein aseptisch zusammengebauter Filterkolonnenapparat wurde für die aseptische
Filtration des geernteten Überstandes
verwendet (konditioniertes Medium). Der Zusammenbau war wie folgt:
Die Verrohrung wurde mit einem Draht an ein Opti-Cap-Filter (Millipore
Corp., Bedford, Massachusetts, USA) und ein Gelman-Supercap-50-Filter
(Gelman Sciences, Ann Arbor, Michigan, USA) gebunden. Das Supercap-50-Filter
wurde auch an einen sterilen, bedeckten Behälter, der in einem Abzug aufgestellt
war, befestigt; die Rohrleitung, die sich stromaufwärts des
Millipore Opti-Cap-Filters befand, wurde in eine Rollkolbenpumpe
eingeführt;
und das freie Ende der Verrohrung wurde in dem großen Erntebehälter angeordnet.
Die Rollkolbenpumpe wurde zwischen 200 und 300 rpm laufen gelassen,
bis das gesamte konditionierte Medium durch das 0,22 μm Endfilter in
einen sterilen Sammelbehälter
hindurchgeführt
worden war. Das Filtrat wurde in eine, in einem 4°C kalten Raum
hängende
Reinigung gegeben. Das Medium wurde 10X konzentriert mit einem Millipore-Konzentrationsgerät mit einem
Rückhaltevermögen von
5 kDA (Millipore Corp., Bedford, Massachusetts, USA) konzentriert,
gemäß der Anweisung
des Herstellers und der Western-Blot-Analyse unter Verwendung eines
Anti-FLAG-Markierungsantikörpers (Kodak)
unterzogen.
-
Zsig37CEE:
| 5 T-162
Flaschen = | 0,12
mg/l, 38 kDa; |
| 1 Fabrik,
FBS = | 0,12
mg/l, 38 kDa; |
| 10
Fabriken, FBS = | 0,12
mg/l, 38 kDa; |
| 10
Fabriken (#1), SF = | 1,2
mg/l, 38 kDa; und |
| 10
Fabriken (#2), SF = | 3,56
mg/l, 38 kDa |
-
Zsig37NEE:
| 5 T-162
Flaschen= | 0,137
mg/l, 35 kDa; |
| 1 Fabrik,
FBS = | 0,137
mg/l, 35 kDa; |
| 10
Fabriken, FBS = | 0,137
mg/l, 35 kDa; |
| 10
Fabriken (#1), SF = | 0,137
mg/l, 35 kDa; und |
| 10
Fabriken (#2), SF = | 4,11
mg/l, 35 kDa |
-
Beispiel 7
-
Aufreinigung von zsig37
NEE und zsig37 CEE
-
Falls nicht andersweitig festgestellt,
wurden alle Arbeiten bei 4°C
durchgeführt.
Das folgende Vorgehen wurde verwendet für die Aufreinigung von zsig37,
das N-terminale oder C-terminale Glu-Glu (EE)-Markierungen enthält. Ein
Gesamtvolumen von 25 Litern konditioniertes Medium von Babyhamster-Nieren
(BHK)-Zellen wurde nacheinander steril filtriert durch ein 4 inch,
0,2 mM Millipore (Bedford, Massachusetts, USA)-OptiCap-Kapselfilter und
ein 0,2 mM Gelman (Ann Arbor, Michigan, USA)-Supercap-50-Filter.
Das Material wurde dann auf ungefähr 1,3 Liter konzentriert unter
Verwendung eines Millipore ProFlux-A30 Tangentialfluss-Konzentrationsgerätes, ausgestattet
mit einer Amicon (Bedford, Massachusetts, USA) -S10Y3-Membran mit
einem Rückhaltevermögen von
3000 kDa. Das konzentrierte Material wurde wiederum steril filtriert
mit dem Gelman-Filter, wie oben beschrieben. Eine Mischung von Protease-Inhibitoren
wurde zu dem konzentrierten, konditionierten Medium hinzugefügt zu einer
Endkonzentration von 2,5 mM Ethylendiamintetraessigsäure (EDTA, Sigma
Chemical Co. St. Louis, Missouri, USA), 0,001 mM Leupeptin, (Boehringer-Mannheim,
Indianapolis, Indiana, USA) 0,001 mM Pepstatin (Boehringer-Mannhein)
und 0,4 mM Pefabloc (Boehringer-Mannheim). Eine 25,0 ml Probe einer
Anti-EE-Sepharose, zubereitet wie oben beschrieben, wurde zu der
Probe hinzugefügt
für die
Batch-Adsorption und die Mischung wurde sanft auf einem Wheaton
(Millville, New Jersey, USA)-Rollkulturgerät für 18,0 h bei 4°C bewegt.
-
Die Mischung wurde dann in eine 5,0 × 20,0 cm
Econo-Säule
(Bio-Rad, Laboratories, Hercules, Kalifornien, USA) gefüllt und
das Gel wurde mit 30 Säulenvolumen
Phosphatgepufferter Salzlösung
(PBS) gewaschen. Die nicht zurückgehaltene
Durchflussfraktion wurde verworfen. Wenn die Extinktion des Hindurchgeflossenen
bei 280 nm erst einmal geringer war als 0,05, wurde der Durchfluss
der Säule
auf Null reduziert und das Anti-EE-Sepharosegel wurde chargenweise mit
2,0 Säulenvolumen
PBS, das 0,4 mg/ml von EE-Peptid (AnaSpec, San Jose, Kalifornien,
USA) enthält,
gewaschen. Das verwendete Peptid hat die Sequenz Glu-Tyr-Met-Pro-Val-Asp,
SEQ ID NO: 31). Nach 1,0 h bei 4°C
wurde der Fluss wieder aufgenommen und das eluierte Protein wurde
gesammelt. Auf diese Fraktion wurde Bezug genommen als die Peptidelution.
Das Anti-EE-Sepharosegel wurde dann mit 2,0 Säulenvolumen 0,1 M Glycin, pH
2,5 gewaschen, und die Glycin-Waschflüssigkeit wurde getrennt gesammelt.
Der pH der Glycin-eluierten Fraktion wurde auf 7,0 durch die Zugabe
eines kleinen Volumens 10X PBS angepasst und bei 4°C für die zukünftige Analyse,
falls notwendig, gelagert.
-
Die Peptidelution wurde auf 5,0 ml
aufkonzentriert, unter Verwendung eines Membrankonzentrationsapparates
mit einem Molekulargewicht-Rückhaltevermögen von
15000 (Millipore, Bedford, Massachusetts, USA), gemäß den Anweisungen
des Herstellers. Die konzentrierte Peptidelution wurde von freiem
Peptid durch Chromatographie auf einer 1,5 × 50 cm Sephadex G-50 (Pharmacia,
Piscataway, New York)-Säule, equilibriert
in PBS, bei einer Flussrate von 1,0 ml/min unter Verwendung einer
BioCad Sprint HPLC (PerSeptive Biosystems, Framingham, Massachusetts,
USA) getrennt. Es wurden 2-ml-Fraktionen gesammelt und die Extinktion
bei 280 nm wurde aufgenommen. Der erste Peak an Material, der bei
280 nm absorbiert und in der Nähe
des Leervolumens der Säule
eluiert, wurde gesammelt. Diese Fraktion war reines zsig37 NEE oder zsig37
CEE. Das reine Material wurde aufkonzentriert, wie oben beschrieben,
analysiert durch SDS-PAGE und Western-Blotting mit Anti-EE-Antikörper, und
Proben wurden genommen für
die Aminosäure- Analyse und N-terminales
Sequenzieren. Der Rest der Probe wurde in Aliquote aufgeteilt, und
bei –80°C gemäß unseren Standardverfahren
gelagert.
-
Elektrophorese von zsig37 NEE auf
SDS-PAGE-Gelen in Abwesenheit von Reduktionsmitteln, zeigte eine
Coomassie Blau-gefärbte
Hauptbande mit einem anscheinenden Molekulargewicht von 39000 und
zahlreiche Nebenbestandteile mit Molekulargewichten zwischen 60000
und 116000. Alle Banden zeigten eine Kreuz-Reaktivität mit Anti-EE-Antikörpern auf
Western-Blots. In Anwesenheit von einer Reduktionsmittel war die
einzige wahrgenommene Bande ein 39000 kDa-Protein und seine Coomassie
Blau-Färbungsintensität war erhöht. Diese
Bande zeigte auch Kreuz-Reaktivität mit dem Anti-EE-Antikörper in
Western-Blots.
-
Für
zsig37 CEE zeigte die Elektrophorese auf SDS-PAGE-Gelen in Abwesenheit
von Reduktionsmitteln eine Coomassie Blau-gefärbte Hauptbande mit einem anscheinenden
Molekulargewicht von 39000 und zahlreiche Nebenbestandteile mit
Molekulargewichten zwischen 60000 und 116000. Auf Western-Blots
zeigten nur die Banden mit anscheinenden Molekulargewichten von
150000, 116000 und 60000 eine Kreuz-Reaktivität mit dem Anti-EE-Antikörper. In
Anwesenheit von Reduktionsmitteln wurde nur die Coomassie Blaugefärbte Bande
bei 39000 kDa wahrgenommen und dieses Material zeigte eine Kreuz-Reaktivität mit dem
Anti-EE-Antikörper
in Western-Blots. Unter diesen Bedingungen wurde eine kleine Menge
an Kreuz-reaktiven Material auch bei 150000 kDa gesehen.
-
Zubereitung
von Anti-EE-Sepharose
-
Ein 100 ml Grundvolumen von Protein
G-Sepharose (Pharmacia, Piscataway, New Jersey, USA) wurde dreimal
mit 100 ml PBS, das 0,02% Natriumazid enthielt, gewaschen, unter
Verwendung einer 500 ml Nalgene 0,45 Mikron-Filtereinheit. Das Gel
wurde mit 6,0 Volumen 200 mM Triethanolamin, pH 8,2 (TEA, Sigma, St.
Louis, Missouri, USA) gewaschen. Und ein gleiches Volumen einer
EE-Antikörper-Lösung, die
900 mg Antikörper
enthielt, wurde hinzugefügt.
Nach einer Inkubation über
Nacht bei 4°C
wurde ungebundener Antikörper
entfernt durch Waschen des Harzes mit 5 Volumen 200 mM TEA, wie
oben beschrieben. Das Harz wurde in 2 Volumen TEA resuspendiert,
in einen geeigneten Behälter überführt und
Dimethylpimilimidat-2HCl (Pierce, Rockford, Illinois, USA), gelöst in TEA,
wurde bis zu einer Endkonzentration von 36 mg/ml Gel hinzugefügt. Das
Gel wurde bei Raumtemperatur für
45 Minuten geschüttelt
und die Flüssigkeit
wurde entfernt unter Verwendung der Filtereinheit, wie oben beschrieben.
Nicht-spezifische Stellen auf dem Gel wurden dann durch Inkubieren
für 10
Minuten bei Raumtemperatur mit 5 Volumen 20 mM Ethanolamin in 200
mM TEA geblockt. Das Gel wurde mit Volumen PBS, die 0,02% Natiumazid
enthielt, gewaschen und in dieser Lösung bei 4°C gelagert.
-
Beispiel 8
-
Adhäsions- und Proliferationsassays
-
Die Fähigkeit von zsig37, Adhäsion und
Ausbreiten von TF-1-Zellen zu stimulieren, wurde wie folgt untersucht.
Eine Reihe an Verdünnungen
wurde zubereitet aus C-terminalem Glu-Glu-markiertem zsig37, von
10 bis 0,0625 μg/ml,
in entweder PBS oder ELISA-Überzugspuffer
(0,1 M NaCO3) und jede wurde in eine 96 Well-Platte
(Costar, Pleasanton, Kalifornien, USA) in einer Konzentration von
100 μl/Well
gegeben. Die Platten wurden bei 37°C, 5% CO2 für 2 Stunden
inkubiert. Die Platten wurden dann 3× gewaschen mit RPMI/10% FBS (RPMI
1640, 2 mM L-Glutamin, 110 μg/ml
Natriumpyruvat, PSN und 10% hitzeinaktiviertes fetales Rinderserum)
und es wurde ihnen ermöglicht,
für 15
Minuten zu blocken.
-
TF-1-Zellen (abgeleitet von akut
myeloischen Leukämiezellen)
wurden in RPMI/10% FBS resuspendiert und in einer Konzentration
von 10000 Zellen/Well in die zsig37CEEüberzogenen 96 Well-Platten
in einem Endvolumen von 120 μl/Well
ausplattiert. Die Platte wurde bei 37°C unter 5% CO2 für 2 Stunden
inkubiert. Die Platten wurden dann 3X mit PBS gewaschen und 200 μl/Well Wachstumsmedium
(RPMI/10% FBS, 5 ng/ml GM-CSF) wurden hinzugefügt. Die Zellen wurden mikroskopisch
untersucht vor und nach dem Waschvorgang.
-
Eine Farbstoffeinbauuntersuchung
wurde auch verwendet, um quantitativ die Anzahl anhaftender Zellen
zu messen, basierend auf einer colorimetrischen Änderung und einem Anstieg im
Fluoreszenzsignal. Alamar BlueTM (AccuMed,
Chicago, Illinois, USA) wurde zu den 96 Well-Platten hinzugefügt und die
Zellen wurden bei 37°C
unter 5% CO2 über Nacht inkubiert. Die Platten
wurden dann abgesucht unter Verwendung eines Fluorometers mit einer
Exzitationswellenlänge
von 544 nm und einer Emissionswellenlänge von 590 nm. Es gab mehr
anhaftende Zellen auf den zsig37CEE-PBS-überzogenen Platten als auf
den zsig37CEE-0,1
M NaCO3-überzogenen
Platten. Zugabe von löslichem
zsig37 hemmte die Adhäsion
von Zellen an das gebundene zsig37 nicht.
-
Eine zweite Untersuchung wurde gemacht
unter Verwendung von TF-1, DA-1 (einer IL-3-abhängigen Zelllinie, erhalten
aus dem Lymphknoten einer Maus mit einem B-Zelllymphom durch Auswuchs in IL-3-Medium
(bereitgestellt von Dr. Kenneth Kaushansky, University of Washington,
Seattle, Washington, USA)), pre-B (p53-/-Mausknochenmarkzellen,
IL-7-abhängig,
B220+, Thy 1 niedrig, Sca-1+), und A7BaF-3-Zeltlinien, wie oben
beschrieben, in einer Konzentration von 5000 Zellen/Well. BHK-Zellen
wurden auch ausplattiert in einer Konzentration von 500 Zellen/Well.
Zsig37 erhöhte
das Wachstum von A7-BaF-3-Zellen und hemmte leicht das Wachstum
von DA-1-Zellen.
-
Beispiel 9
-
Maus-Ortholog-Sequenz
-
Die neuen, menschlichen, zsig37-Polypeptid
kodierenden Polynukleotide der vorliegenden Erfindung wurden verwendet,
um eine Maus-EST-Datenbank nach homologen Maus-Sequenzen abzusuchen.
Eine einzelne EST-Sequenz wurde entdeckt und vorhergesagt für die menschliche
zsig37-Sequenz. Um die entsprechende cDNS zu identifizieren, wurde
ein Klon, von dem angenommen wurde, dass er wahrscheinlich die gesamte
kodierende Sequenz enthält,
für das
Sequenzieren verwendet. Unter Verwendung eines Invitrogen S. N.
A. P.TM-Miniprep-Kits (Invitrogen Corp.),
wurde gemäß den Anweisungen
des Herstellers eine 5 ml über-Nacht-Kultur
in LB + 50 μg/ml
Ampicillin zubereitet. Die Matrize wurde sequenziert auf einem ABIPRISMTM Modell 377 DNS-Sequenziergerät (Perkin-Elmer
Cetus, Norwalk, Connecticut, USA) unter Verwendung des ABIPRISMTM Big Dye Terminator Cycle Sequencing Ready
Reaction Kit (Perkin-Elmer Corp.), gemäß den Anweisungen des Herstellers.
Die Oligonukleotide ZC694 (SEQ ID NO: 6), ZC6768 (SEQ ID NO: 32), ZC18297
(SEQ ID NO: 33), ZC18298 (SEQ ID NO: 34), ZC18402 (SEQ ID NO: 35),
ZC18403 (SEQ ID NO: 36), ZC18456 (SEQ ID NO: 37), ZC18457 (SEQ ID
NO: 38), ZC 18560 (SEQ ID NO: 39), ZC 18561 (SEQ ID NO: 40), ZC
18687 (SEQ ID NO: 41) und ZC18688 (SEQ ID NO: 42), wurden verwendet,
um die Sequenz des Klons zu vervollständigen. Sequenzierreaktionen
wurden durchgeführt
in einem Hybaid OmniGene Temperature Cycling-System (National Labnet
Co., Woodbridge, New York, USA). SEQENCHERTM 3.1
Sequenzanalysesoftware (Gene Codes Corporation, Ann Arbor, Michigan,
USA) wurde verwendet für
die Datenanalyse. Die resultierende 2559 bp-Sequenz ist in SEQ ID
NO: 43 offenbart und die abgeleitete Aminosäuresequenz in SEQ ID NO: 44.
Die vergleichende Anordnung mit der menschlichen zsig37-Nukleotidsequenz
(SEQ ID NO: 1) zeigte eine 77%ige Identität auf der Nukleotidebene. Die
mutmaßliche
Aminosäuresequenz
(SEQ ID NO: 44) hatte eine 77%ige Identität mit der menschlichen Polypeptidsequenz
(SEQ ID NO: 2).
-
Beispiel 10
-
Zellbasierte Untersuchungen
-
Zsig37-Polypeptide wurden in einem
in vitro-Hochdurchsatzansatz untersucht, um Substanzen zu identifizieren,
die selektiv zelluläre
Antworten in unsterblich gemachten Osteoblasten-Zelllinien aktivieren.
Eine reife Osteoblasten-Zelllinie, abgeleitet von p53-/(defizienten)
Mäusen,
CCC4, die mit einem Plasmid transfiziert wurde, das ein induzierbares
Serum-Antwort-Element (SRE) enthielt, das die Expression von Luziferase lenkt,
wurde in der Untersuchung verwendet. Diese Zellen exprimieren auch
endogene PTH-, PDGF- und bFGF-Rezeptoren. Die Stimulation des SRE
und folglich die Expression von Luziferase in den CCC4-Zellen zeigt an,
dass die chemische Einheit wahrscheinlich Mitogenesis in Osteoblasten
stimuliert.
-
CCC4-Linien wurden trypsiniert und
auf 5 × 104 Zellen/ml in Plattiermedium (alpha-MEM, 1% hitzeinaktiviertes
fetales Rinderserum, 1 mM Na-Pyruvat und 2 mM L-Glutamat) angepasst
und (200 μl/Wett)
in Dynatech Microlite undurchsichtigen, weißen Mikrotiterplatten (Dynatech,
Chantilly, Virginia, USA) ausplattiert und über Nacht bei 37°C unter 5%
CO2 inkubiert. Das Wachstumsmedium wurde
dann abgesaugt und durch 50 μl/Welt
Assaymedium (F-12 HAM, 0,5% Rinderserumalbumin, 20 mM HEPES, 1 mM
Na-Pyruvat und 2 mM L-Glutamat) ersetzt. Reihenverdünnungen
von zsig37 wurden in Assay-Medium angesetzt (0,29–1000 ng/ml Assay-Konzentration)
und zu den Vertiefungen hinzugefügt.
Zsig37-Proben wurden dreifach untersucht. Serum (Negativ)- und bFGF
(Positiv)-Kontrollen wurden auch verwendet. Endkonzentration von
bFGF war 3 ng/ml. Die Kontrollen wurden 4-fach untersucht. Die Platten wurden
für 4 Stunden
bei 37°C
unter 5% CO2 inkubiert. Das Assay-Medium
wurde dann abgesaugt und die Platten wurden einmal mit PBS gespült. Zu jeder Vertiefung
wurden dann 25 μl
Lyse-Puffer (Luciferase Assay Reagent, E1501, Promega Corp., Madison,
Wisconsin, USA) hinzugefügt.
Die Platten wurden inkubiert für
15 Minuten bei Raumtemperatur. Es wurden 50 Mikroliter/Welt Luziferase-Substrat
(Luciferase-Assay Reagent, E1501, Promega Corp.) hinzugefügt und die
Luziferaseaktivität
wurde detektiert unter Verwendung eines Labsystems LUMINOSKAN® mit
einer Geschwindigkeit von 2 Sekunden/Well; gefolgt von einer Verzögerung von
1 Sekunde. Die durchschnittlichen basalen (nicht induzierten) Signale
wurden von allen Ablesungen abgezogen, die in Tabelle 5 als ein
Prozentsatz der durch 3 ng/ml bFGF maximal erzeugten Induktion ausgedrückt sind.
-
Zsig37 stimuliert die Expression
von Luziferase in diesem Ansatz, wodurch angezeigt wird, das die
Osteoblasten stimulieren. Zsig37 stimuliert in einer Konzentration
von 1000 ng/ml maximal zu 73 bis 75%.
-
Ein mimetischer Wachstumsfaktor-Gegenansatz
wurde durchgeführt,
um festzustellen, ob zsig37 als ein Wachstumsfaktor-Mimetikum wirkt,
insbesondere für
die Tyrosinkinaserezeptorliganden PDGF, bFGF und EGF (Insulin-R
negativ). Eine klonale Zelllinie, abgeleitet aus Swiss 3T3-Mäusen, Swiss
3T3, die mit einem Plasmid transfiziert ist, das ein induzierbares
Serum-Antwort-Element (SRE) enthält,
das die Expression von Luziferase lenkt, wurde in dem Ansatz verwendet.
Diese Zellen exprimieren auch endogene PMA-, EGF- und bFGF-Rezeptoren.
Die Stimulation des SRE und folglich die Expression von Luziferase
in den Swiss 3T3-Zellen zeigt an, dass die chemische Einheit wahrscheinlich
die PDGF-, bFGF- und EGF-Wachstumsfaktor nachahmt.
-
Swiss 3T3-Zellen wurden trypsiniert
und auf eine Konzentration von 5 ×104 Zellen/ml
in Ausplattiermedium angepasst, ausplattiert und inkubiert, wie
oben beschrieben. Das Wachstumsmedium wurde dann abgesaugt und durch
Assaymedium (F-12 HAM, 0,5 Rinderserumalbumin, 20 mM HEPES) in einer
Konzentration von 50 μl/Well
ersetzt. Reihenverdünnungen
von zsig37 wurden in Assaymedium durchgeführt (0,29–1000 ng/ml Assayendkonzentration)
und zu den Vertiefungen hinzugefügt.
Zsig37-Proben wurden 3-fach untersucht. Eine Serum (Negativ)- und
bFGF (Positiv)-Kontrolle, um die Zellproliferation zu fördern, wurden
auch verwendet. Die Endkonzentration von bFGF war 3 ng/ml. Kontrollen
wurden 4-fach untersucht. Die Platten wurden für 5 Stunden bei 37°C unter 5%
CO2 inkubiert. Das Assaymedium wurde dann
abgesaugt und die Platten wurden einmal mit PBS gespült. Zu jeder
Vertiefung wurden dann 25 μl
Lysepuffer (Luciferase Assay Reagent, E1501, Promega Corp., Madison,
Wisconsin, USA) hinzugefügt.
Die Platten wurden für
15 Minuten bei Raumtemperatur inkubiert. Vierzig Mikroliter/Welt
Luziferasesubstrat (Luciferase Assay Reagent, E1501, Promega Corp.)
wurden hinzugefügt
und die Luziferaseaktivität
wurde detektiert unter Verwendung des Labsystems LUMINOSKAN© mit
einer Geschwindigkeit 2 Sekunden/Well; gefolgt von einer Verzögerung von
1 Sekunde. Die durchschnittlichen basalen (nicht induzierten) Signale
wurden von allen Ablesungen abgezogen, die als ein Prozentsatz der
durch 3 ng/ml bFGF maximal erzeugten Induktion ausgedrückt sind.
Eine 5-stündige
Behandlung dieser Zelllinie mit bFGF, DDGF, EGF oder PMA führt zu einer
25–50-fachen
Induktion der SRE-Luziferase-Expression.
-
Zsig37 scheint nicht die Expression
von Luziferase in dieser Untersuchung zu stimulieren. Zsig37 stimuliert
in einer Konzentration von 1000 ng/ml maximal zu 0,2 bis 0,1%.
-
Beispiel 10
-
In vivo-Applikation von
zsig37 im Wege der adenoviralen Zufuhr
-
Vierundzwanzig männliche und vierundzwanzig
weibliche C57B16/J-Mäuse,
ungefähr
12 Wochen alt (Jackson Labs, Bar Harbor, Maine, USA) wurden gewogen,
die Körpertemperatur
wurde gemessen und die Futteraufnahme wurde täglich für vier Tage vor der Injektion
(Tage –4
bis –1) überwacht.
Am Tage 0 wurden die Mäuse
in drei Gruppen aufgeteilt und erhielten 0,1 ml Virus (AdV-leer
1,8 × 1011
Viruspartikel/0,1 ml oder AdVzsig37-CEE 5 × 1011 Viruspartikel/0,1 ml)
durch intravenöse
Schwanzveneninjektion, oder gar keine Injektion. Die Injektion sollte
in der Infektion der Leber des Wirtes resultieren und die Expression
des viral zugeführten
Gens sollte innerhalb von 24 Stunden beginnen und für 1 bis
4 Wochen andauern. Drei Mausgruppen wurden untersucht. Gruppe 1,
unbehandelt, n = 8, jeweils männlich
und weiblich. Gruppe 2, AdV-leer (leeres Virus), n = 8, jeweils
männlich
und weiblich. Gruppe 3, AdV-zsig37CEE, n = 8, jeweils männlich und
weiblich.
-
Die Körpertemperaturen, Gewichte
und das Gewicht des aufgenommenen Futters der Tiere wurden während der
3-wöchigen
Studie überwacht.
Es wurde kein Unterschied zwischen den Gruppen festgestellt.
-
Am Tag 21 wurden die weiblichen Mäuse der
Euthanasie unterzogen und durch zervikale Dislokation geschlachtet,
und am Tag 22 wurden dies die männlichen.
Die Tiere wurden ausgeblutet und Gewebe geerntet für die Nekropsie.
-
Zum Zeitpunkt der Schlachtung wurde
der Serumchemie-Standardplan durchgeführt. Leber-, Nieren- und Stoffwechselparameter
lagen alle innerhalb von normalen Bereichen. Es gab jedoch einen
Unterschied zwischen der zsig37-behandelten Gruppe und der mit leeren
Viren behandelten Gruppe. Die zsig37-Tiere hatten einen höheren lipämischen
Durchschnittsindex als die leeren Viruskontrollen. Der Unterschied
war nicht signifikant, es wurde jedoch eine weitere Untersuchung
angeordnet. Der Gesamtgehalt an freien Fettsäuren wurde in dem verbleibenden
Serum jedes Tieres untersucht. Ein statistisch signifikanter Unterschied
in den Serumspiegeln freier Fettsäuren wurde zwischen männlichen
Mäusen
(p = 0,0379), die das leere Virus erhielten, und jenen, die zsig37-kodierende
Viren enthielten, gesehen; die zsig37-Mäuse
hatten höhere
Spiegel. Ein Unterschied, obwohl nicht statistisch signifikant,
wurde auch in weiblichen Mäusen
(p = 0,3357) gesehen. Leber, Milz, Niere, Thymus, Herz und Gehim
wurden nach der Entnahme gewogen. Kein Unterschied wurde gefunden
zwischen den Behandlungsgruppen. Die histopathologische Analyse
dieser Gewebe und des Knochenmarks offenbarte keine Unterschiede
zwischen den Behandlungsgruppen.
-
Um die obigen Ergebnisse zu bestätigen, wurde
eine zweite Prüfung
durchgeführt,
wie oben mit den folgenden Abwandlungen. Drei Gruppen, a) unbehandelt
und gefastet, b) AdVleer und gefastet, c) AdV-zsig37-CEE und gefastet,
enthaltend 20 C57B16/J-Mäuse,
jeweils 10 männliche
und weibliche, wurden untersucht. Man ließ die Mäuse über Nacht fasten und 100 μl Serum wurden
gesammelt, um einen Grundwert für
die folgenden Parameter zu etablieren: Nüchternglucose, TP, alkalische
Phosphatase, Cholesterin, Triglyceride, freie Fettsäuren und
Insulin. Dreimal die Woche wurden Körpergewichte festgestellt.
Am Tag 0 wurden den Mäusen
in die laterale Schwanzvene 0,1 ml der geeigneten Viruslösung injiziert.
Am Tag 17 wurde Blut gesammelt nach einem Fasten über Nacht.
Nach 3 Wochen wurden die Mäuse
geschlachtet und das gesamte Blut wurde gesammelt. Ein Teil des
Bluts wurde mit EDTA vermischt, um CBCs anzuschauen und der Rest wird
erneut untersucht und überprüft werden,
wie oben beschrieben. Die Organe wurden gesammelt und der Rumpf
für die
Histopathologie aufbewahrt.
-
Beispiel 11
-
Vasodilatation von Aortenringen
-
Die Wirkung von zsig37 auf die Vasodilatation
von Aortenringen wurde gemessen, gemäß dem Vorgehen von (Dainty
et al., J. Pharmacol. 100: 767, 1990 und Rhee et al., Neurotox.
16: 179, 1995). Kurz, 4 mm lange Aortenringe wurden von 4 Monate
alten Sprague Dawley-Ratten genommen und in modifizierte Krebs-Lösung (118,5
mM NaCl, 4,6 mM KCl, 1,2 mM MgSO4·7H2O, 1,2 mM KH2PO4, 2,5 mM CaCl2·2H2O, 24,8 mM NaHCo3 und
10 mM Glucose) gegeben. Die Ringe wurden dann an isometrische Kraftwandler
(Radnoti Inc., Monrovia, Kalifornien, USA) angehängt und die Daten wurden mit
einer Ponemah Physiologieplattform (Gould Instrument Systems, Inc.,
Valley View, Ohio, USA) aufgenommen und in eine oxygenierte (95%
O2, 5% CO2), modifizierte
10 ml Gewebebad-Krebs-Lösung gegeben.
Die Gewebe wurden angepasst auf ein Gramm Ruhespannung und es wurde
ihnen ermöglicht,
sich für
eine Stunde vor der Untersuchung zu stabilisieren. Die Ringe wurden
untersucht durch 5 μl
Zugaben von 1 × 10–7 M
Noradrenalin (Sigma Co., St. Louis, Missouri, USA) zu einer Endkonzentration
von ungefähr
1 × 10–9 M,
und von Carbachol, einem muskarinischen Acetylcholinagonisten (Sigma
Co.) in einer Endkonzentration von 2 × 10–7 M,
um die Unversehrtheit der Ringe zu untersuchen. Nach jeder Untersuchung
wurden die Ringe dreimal mit frischem Puffer gewaschen, 5 Minuten zwischen
den Waschgängen,
und es wurde ihnen ermöglicht,
für eine
Stunde zu ruhen. Um die Vasodilatation zu untersuchen, wurden die
Ringe auf zwei Gramm kontrahiert, und es wurde ihnen ermöglicht,
sich für
15 Minuten zu stabilisieren. Zsig37 wurde dann zu 1, 2 oder 3 der
4 Bäder
hinzugefügt,
ohne zu spülen,
und die Spannung auf die Ringe wurde aufgenommen und mit den Kontrollringen
verglichen. Die Ringe wurden dann im Hinblick auf die Kontraktion
mit Noradrenalin untersucht, wie oben beschrieben. Die Ringe wurden
in Konzentrationen von 323, 162 und 81 ng/ml zsig37 untersucht,
aber eine Dosisantwort konnte nicht festgestellt werden. Um die
statistische Signifikanz der Daten zu beurteilen, wurde ein Zufallstest
durchgeführt,
mit all den zsig37-und Kontroll-Ringen unter Verwendung von Dilatation
als eine Bestimmungsgröße. Zehn
der zwölf
mit zsig37 untersuchten Ringe vasodialatierten, ebenso wie zwei
der sieben Kontrollen. Der P-Wert ist 0,045 im Fisher's Exakt-Test. Es
wurde geschlossen, dass zsig37 Vasodilatation in Noradrenalin-kontrahierten
Aortenringen induziert.
-
Beispiel 12
-
Binden von zsig37 an Matrixproteine
-
Ein ELISA (Enzyme-gekoppelte Immunadsorptionsbestimmung)
wurde verwendet, um das Binden von zsig37 an zahlreiche Matrixproteine
und Komplement C1q zu messen. Die verwendeten Matrixproteine waren
Rinderkollagen Typ I (Becton Dickinson, Lincoln Park, New Jersey,
USA), Laminin, Vitronektin, Fibronektin, menschliches Kollagen Typen
II, III, IV, V, VI (Chemicon International, Temecula, Kalifornien,
USA). BSA V (Sigma Co.) wurde verwendet als eine Negativkontrolle.
Die Proteine wurden erst unmittelbar vor der Verwendung in 2 × PBS (Phosphat-gepufferte
Salzlösung,
Sigma Co.) auf 100 μg/ml
verdünnt
und angepasst auf einen pH von 7,2 mit 0,1 N NaOH. Jede Proteinprobe
wurde 4-fach in
einer 96 Well-Platte ausplattiert (100 μl/Well). Der Platte wurde ermöglicht, über Nacht
zu trocknen in einem Laminarströmungsabzug,
und sie wurde dreimal mit 400 μl
5 mg/ml BSA in 1 × PBS
gewaschen und trocken geblottet. Zsig37 wurde FITC-markiert, gemäß der Anweisung
des Herstellers (Pierce, Rockford, Illinois, USA). Zu jeder Vertiefung
wurden 100 μl
1,8 μg/ml
zsig37-FITC in 5% BSA, PBS hinzugefügt. Die Platten wurden für 1,5 Stunden
bei Raumtemperatur inkubiert, dann dreimal mit 5% BSA, PBS gewaschen.
Zu jeder Vertiefung wurden dann 100 μl 1 : 400 Maus-Anti-FITCBiotin
(Sigma Co.) hinzugefügt.
Die Platte wurde für
1,5 Stunden bei Raumtemperatur inkubiert und dreimal mit 5% BSA,
PBS gewaschen. Die Platte wurde dann mit 100 μl 1 : 1000 Streptavidin/HRP
(Amersham, Piscataway, New Jersey, USA) für 1 Stunde inkubiert und dreimal
mit 5% BSA, PBS gewaschen. Die Platte wurde dann entwickelt unter
Verwendung von Supersignal® Ultra (Pierce, Rockford,
Illinois, USA) gemäß der Anleitung
des Herstellers. Nach dem Reagierenlassen für 1 Minute wurde die überschüssige Flüssigkeit
von der Platte durch Umdrehen der Platte entfernt und die Platte
wurde trocken geklopft. Die Platte wurde einem Röntgenstrahlfilm (Kodak, Rochester,
New York) ausgesetzt.
-
Die Ergebnisse dieser Prüfung zeigten
an, dass nur Fibronektin und die Kollagene I, II, III, V und VI signifikant
an zsig37-FITC binden. Ein solches Binden wurde nicht beobachtet
mit Laminin, Vitronektin, Kollagen IV oder der BSA-Kontrolle.
-
Beispiel 13
-
Spezifität der Zsig37-Bindung
an Kollagen-Typ VI
-
Die ELISA-Bestimmung für die Bindung,
wie beschrieben im Beispiel 12 wurde modifiziert, um das Binden
quantitativ abzuschätzen.
Zsig37-FITC, in einem Konzentrationsbereich von 0,41 μg/ml, wurde
an 10 μg Kollagen
Typ VI (Chemicon International), wie oben beschrieben, gebunden.
Die Lumineszenz des Supersignal -Reagens wurde auf einem Wallac
1420 Plattenlesegerät
(Wallac, Gaithersburg, Maryland, USA) gelesen und die Intensität wurde
verwendet als ein quantitatives Maß der zsig37-FITC-Bindung an
die ELISA-Platte.
-
Das Binden von zsig37 an Kollagen-Typ
VI passt zu einer typischen hyperbolischen Bindungskurve (3a). Das gebundene zsig37-FITC,
ausplattiert in einer Konzentration von 0,4 μg/ml, kann von dem Kollagen
verdrängt
werden durch die Zugabe von unmarkiertem Zsig37 in einem Konzentrationsbereich
von 0,8 bis 8 μg/ml
(3b). Diese Daten würden anzeigen,
dass das Binden spezifisch ist für
Domänen
auf Kollagen Typ VI und dass es konzentrationsabhängig ist.
-
Beispiel 14
-
Zsig37-Bindung an Komplement
C1q
-
Von Zsig37-FITC in einer Konzentration
von 0,2 μg/ml,
wurde gezeigt, dass es an Komplement C1q (Sigma Co.) in einer Konzentration
von 0,1 bis 10 μg/ml,
durch das im Beispiel 13 oben beschriebene Verfahren, bindet (4). Die Menge der Bindung
ist konzentrationsabhängig
und sättigbar.
-
Beispiel 15
-
Komplementinhibition durch
Zsig37
-
Komplementbestimmungen wurden durchgeführt in 96
Well-Platten mit rundem Boden. Gelatine-Veronal-Puffer, enthaltend
Magnesium und Calcium (141 mM NaCl, 1,8 mM Natriumbarbitol, 3,1
mM Barbitursäure,
0,1% Rindergelatine, 0,5 mM MgCl2 und 0,15
mM CaCl2), wurde verwendet für alle Serum-und
Inhibitorverdünnungen,
ebenso wie für
Erythrozytensuspensionen. Fünfzig
Mikroliter standardisierten menschlichen Komplementserums (Sigma
Co.), verdünnt
in einem Verhältnis
von 1/37,5 (für
eine Endverdünnung
von 1/150) wurde zu jeder Vertiefung hinzugefügt. Der Inhibitor wurde 3-fach
hinzugefügt,
50 μl/Well.
Serum und Inhibitor wurden für
30 Minuten bei Raumtemperatur inkubiert. Der Nachweis wurde gestartet
durch die Zugabe von 100 μl 2 × 108/ml unsensibilisierte Schaf-Erythrozyten (Colorado
Serum Co., Denver, Colorado, USA), sensibilisierte Schaf-Erythrozyten, sensibilisiert
unter Verwendung des Protokolls des Herstellers von Hämolysin
(BioWhittaker Inc., Walkersville, Maryland, USA), und Kaninchen-Erythrozyten,
die 16 mM EGTA und 4 mM Mg++ enthielten.
Eine Reihenverdünnung
menschlichen Serums in Verhältnissen
von 1/50 bis 1/400 wurde auch als eine Aktivitätskontrolle ausplattiert. Erythrozyten,
lysiert mit destilliertem Wasser und verdünnt auf 100, 75, 50, 25 und
12,5 Prozent Lyse, wurden verwendet, um die prozentuale Komplementlyse
zu quantifizieren. Die Platte wurde verschlossen und bei 37°C für 1 Stunde
inkubiert, wobei alle 15 Minuten gemischt wurde. Die Reaktion wurde
gestoppt durch die Zugabe von 220 mM EDTA, 20 μl/Well, und die Platten wurden
zentrifugiert bei 1500 × G
für 10
Minuten. Einhundert Mikroliter Überstand
wurden von jeder Vertiefung entfernt und in eine 96 Well-Platte
mit flachem Boden für
die Analyse überführt. Die
Platte wurde ausgelesen bei 415 nm und die prozentuale Lyse wurde
berechnet.
-
Zsig37 war wirksam beim Hemmen des
klassischen Weges, sowohl mit sensibilisierten als auch mit unsensibilisierten
Schaf-Erythrozyten (5).
Es gab keine offensichtliche Hemmung des untersuchten alternativen
Weges mit Kaninchen-Erythrozyten und EGTA. Der Mechanismus der Inhibition
ist unbestimmt, aber da C1q zsig37 bindet, ist C1q das wahrscheinlichste
Ziel.
-
Beispiel 16
-
Inhibition der Plättchenkollagenaktivierung
durch zsig37
-
Blut wurde von gesunden Freiwilligen
in Röhrchen,
die Natriumcitrat enthielten, entnommen, aufbewahrt bei Raumtemperatur
und innerhalb von vier Stunden nach der Entnahme verwendet. Gesamtblut
wurde analysiert auf die Plättchenaktivierung
unter Verwendung eines Chrono-Log 560A Whole Blood Lumi-Aggregometer
(Chrono-Log Corp., Haverton, PA), gemäß den Anweisungen des Herstellers.
Für jeden
Testpunkt wurden 500 μl
Blut zu einem Reagenzglas, das einen Rührstab und 500 μl isotonische
Salzlösung,
die zsig37 in Konzentrationen von 0 bis 20 μg/ml enthielt, hinzugefügt. Die
Mischung wurde für
vier Minuten inkubiert, gefolgt von der Plättchenaktivierung, gestartet
durch die Zugabe von 5 μl
1 mg/ml vernetztem Kollagen (Chrono-Log Corp.) zu der Blut/zsig37-Mischung.
Inhibition der Aktivierung durch ADP (Endkonzentration 10 μM) und Thrombin
(Endkonzentration 1 U/ml) wurde auf einem ähnlichen Wege untersucht.
-
Die Inhibition der kollagenvermittelten
Plättchenaktivierung
durch zsig37 zeigt eine dosisabhängige Beziehung
im Bereich zwischen 5 und 20 μg/ml
(6a). Die Inhibition ist selektiv
für die
Kollagenaktivierung und hat keine Wirkung auf die durch ADP oder
Thrombin stimulierte Aktivierung (6b).
Die Kollagenaktivierung wurde nicht gehemmt durch ein anderes zu
dem Komplement C1q verwandten Protein, zsig39 (ebenfalls anhängige US-Patentanmeldung
09/140,804).
-
Beispiel 17
-
Stimulation des SKS-Fibroblastenwachstums
durch Zsig37
-
Menschliches Fibronektin (25 μg/ml, GIBCO
BRL, Gaithersburg, Maryland, USA) wurde in 96 Well-Platten (Costar,
Pleasanton, Kalifornien, USA) in einer Konzentration von 100 μl/Well ausplattiert,
und trocknen gelassen in einem Laminarströmungsabzug über Nacht. Menschliche SKS-Fibroblasten
in DMEM (Gibco), enthaltend 10% fetales Rinderserum – niedrig
Endotoxin (Hyclone, Logan, Utah, USA), wurden in einer Konzentration
von 5000 Zellen/Well in den Fibronektin-überzogenen Platten ausplattiert
und bei 37°C,
5% CO2 für
2 bis 3 Tage inkubiert. Die Zahl der Zellen pro Platte wurde angepasst,
um Nicht-Konfluenz zu erreichen. Die Zellen wurden dann zweimal
gewaschen mit serumfreiem DMEM hi Glucose (Gibco) und Serum-ausgehungert
durch Wachsen in serumfreiem DMEM hi Glucose für 24 Stunden. Zsig37 wurde
dreifach zu den Vertiefungen hinzugefügt, in Konzentrationen von
312,2 ng/ml bis 10000 ng/ml in 100 μl DMEM. Die Zellen wurden dann
für 48
Stunden bei 37°C,
5% CO2 inkubiert. Die Zell-Proliferation
wurde untersucht durch Hinzufügen
von 15 μl
MTT-Farbstofflösung
(CellTiter96TM-Kit, Promega) zu jeder Vertiefung.
Die Platte wurde 4 Stunden bei 37°C,
5% CO2 inkubiert und die Reaktion wurde
gestoppt mit Solubilisierungs/Stop-Lösung (CellTiter96TM-Kit,
Promega), gemäß den Anweisungen
des Herstellers. Die Platte wurde für 1 Stunde inkubiert, um Formazan-Kristalle
löslich
zu machen, und die Extinktion wurde gemessen bei 570 nm mit einem
Bezug bei 650 nm unter Verwendung eines ELISA-Plattenlesegerätes.
-
Die Ergebnisse (7) zeigen einen dosisabhängigen Anstieg
in der SKS-Fibroblastenanzahl über den
Bereich der untersuchten zsig37-Konzentrationen. Diese Konzentrationen
lagen innerhalb des Bereiches der Werte, die für die mitogenischen Wirkungen
der Fibrinogen b-Kette (Gray, et al., Am J. Respir. Cell Mol. Biol.
12, 684, 1995 und Gray, et al., J. Biol. Chem. 270, 26602, 1995)
und für
die Fibroblast-Zelladhäsion
an ausplattiertem C1q (Bordin, und Ghebrehiwet, J. Immun. 145: 2520, 1990) beobachtet worden
waren, von denen von beiden angenommen wird, dass sie mit Calreticulin
der Zelloberfläche
in Wechselwirkung treten.
-
Beispiel 18
-
Zsig37-Anti-Sera-Produktion
-
Polyklonales Kaninchen-Antiserum
wurde zubereitet durch Immunisieren zweier weiblicher New Zealand
White-Kaninchen mit zsig37-CEE, aufgereinigt aus BHK-Zellen. Das
Protein wurde an das Trägerprotein Schlüssellochnapfschnecken-Hämozyanin
(KLH) mit Glutaraldehyd konjugiert. Den Kaninchen wurde jeweils eine
anfängliche
intraperitoneale (ip) Injektion von 200 μg Peptid in vollständigem Freund's Adjuvans gegeben, gefolgt
von ip Booster-Injektionen von 100 μg Peptid in unvollständigem Freund's Adjuvans alle drei
Wochen. Sieben bis zehn Tage nach der Applikation der zweiten Booster-Injektion
wurde Blut von den Tieren abgenommen und das Serum wurde gesammelt.
Die Tiere wurden dann alle drei Wochen geboostert und Blut abgenommen.
-
Beispiel 19
-
Nachweis von der Proteinbindung
von FITC-markiertem Zsig37 in Geweben
-
Die Proteinbindung von FITC-markiertem
zsig37 in Geweben wurde wie folgt nachgewiesen: In Paraffin eingebettete
und geschnittene menschliche Gewebe oder Mausembryonen auf Objektträgern wurden
erhalten entweder von Handelsquellen (d. h. DAKO Corporation, Carpinteria,
Kalifornien, USA; BioGenex, San Ramon, Kalifornien, USA; Novagen,
Madison, Wisconsin, USA; und Biomeda, Foster City, Kalifornien,
USA) oder vom Hause. Die menschlichen Gewebeschnitte schlossen ein:
Nebenniere, Gehirn, Herz, Dünndarm, Dickdarm,
Niere, Leber, Lunge, Eierstock, Pankreas, Prostata, Milz, Magen,
Hoden, Schilddrüse
und Uterus. Die Mausembryoschnitte waren von dem 16-Tage-Stadium.
-
Die Gewebeschnitte wurden entwachst
unter Verwendung der Standardbedingungen von 3 × 5 Minuten in Xylen, 4 Minuten
in 100% Ethanol (EtOH), 3 Minuten in 100% ETOH und 2 Minuten in
95% EtOH. Die Gewebeschnitte wurden dann einem 20-minütigem Antigenwiedergewinnungsverfahren
bei 94°C
gemäß den Anweisungen
des Herstellers (DAKO Corporation) unterzogen, gefolgt von einer
20-minütigen
0,01% Pepsin/0,2 N HCl-Verdauung.
Die Gewebeschnitte wurden zweimal in dH2O
und 1-mal in PBS/005% Tween 20 (Sigma, St. Louis, Missouri, USA)-Puffer
gespült
und dann für
45 Minuten mit 1 × PBS
/ 5% BSA/5% nicht fetter, trockener Milch (Carnation, Los Angeles,
Kalifornien, USA) geblockt. Auf dieses folgte ein Avidin/Biotin-Block-Schritt,
durchgeführt
gemäß den Anweisungen
des Herstellers (Vector Laboratories, Inc., Burlingame, Kalifornien,
USA). Die Gewebeschnitte wurden dreimal in 1 × PBS/0,05% Tween 20-Puffer
gewaschen und dann mit der geeigneten Konzentration an FITC-markiertem
Zsig37-Protein in PBS/5% BSA für
45–60
Minuten inkubiert. Nach dreimaligem Waschen der Gewebeschnitte in
1 × PBS
/ 0,05 % Tween 20, wurden sie mit einer 1 : 400-Verdünnung eines
Anti-FITC (mo) MAb-Biotin-Konjugates
(Sigma) für
30–60
Minuten inkubiert, dreimal in PBS/0,05% Tween 20 gewaschen, und
dann für
30–60
Minuten mit einer 1 : 500-Verdünnung von
Streptavidin-FITC (NEN Life Science Products, Boston, Massachusetts,
USA) inkubiert, gefolgt von zwei Waschvorgängen in 1 × PBS/0,05% Tween 20-Puffer
und einem Waschvorgang in 1 × PBS ohne
Tween 20. Die Gewebeschnitte wurden dann eingerahmt mit Antiverblassungs-Medium,
enthaltend 0,5 μg/ml
Propidiumiodid als Kontrastfarbe.
-
Signifikantes Binden wurde an Gefäßwänden und
feinen, faserigen, bindegewebsartigen Geweben, wie z. B. kollagenartiger
Matrix, in der Mehrheit der untersuchten menschlichen Gewebe- und
Embryonenschnitte beobachtet.
-
Beispiel 20
-
Zsig37 in dem Kaninchen-Karotis-Verletzungsmodell
-
Zsig37 wurde angewandt in einem modifizierten
Kaninchen-Karotis-Verletzungsmodell
(Folts et al., Circulation 79: 116–24, 1989 und Golino et al.,
Thrombosis und Haemostasis 67: 302–5, 1992), um das Ausmaß des Schutzes,
der angeboten wird, beim Verhindern des Gefäßverschlusses nach einer Quetschverletzung,
zu bestimmen.
-
Vierunddreißig männliche, weiße New Zealand
White-Kaninchen, ungefähr
3–6 Monate
alt (R&R Rabbitry,
Stanwood, Washington, USA) befanden sich in zwei Gruppen. Fünfzehn Kaninchen
erhielten Dosen von zsig37 im Bereich von 2–13,5 μg/kg und 19 Kontroll-Kaninchen
wurden mit PBS oder mit äquivalenten
Mengen an PBS oder zsig39, einem anderen komplementverwandten Protein
aus Adipozyten (WO99/10492), injiziert. Die Kaninchen wurden mit
Ketamin (50 mg/kg, IM) anästhesiert
und in einer Halothan-Inhalationsanästhesie für die Dauer
der Untersuchung gehalten. Das Haar wurde von den Ohren und vom
Hals abgeschert und ein Gefäßkatheter
wurde in der Ohrrandvene für
IV-Unterstützung platziert.
Ein Mittellinieneinschnitt wurde im Hals gemacht und die Karotis
wurde zugänglich
gemacht. Ungefähr
5 cm der gemeinsamen Karotis, benachbart zu der Innen/Außen-Abzweigung,
wurde freigelegt mit Hilfe von stumpfer Ablösung von dem umgebenden Gewebe
und jegliche sichtbaren Seitenverzweigungen wurden kauterisiert.
Eine Durchfluss-Sonde (Transonic Systems, Inc., Ithaca, New York,
USA) wurde distal zu der voraussichtlichen Verletzungsstelle angeordnet
und ein Basislinien-Blutfluss wurde etabliert. Ein 2,5 bis 3,0 cm-Abschnitt
des Gefäßes wurde
dann isoliert von dem Blutkreislauf unter Verwendung von atraumatischen
Gefäßklemmen.
Nach dem Entfernen des Blutes aus dem Gefäßsegment wurden 0,4 ml zsig37
in 0,9% Natiumchlorid oder 0,04 ml 0,9% Natriumchlorid als eine
Kontrolle in den leeren Gefäßabschnitt,
unter Verwendung einer 30 G-Nadel injiziert. Das Gefäß wurde
ungestört belassen
für eine
5-minütige
Behandlung vor der Verletzung. Eine 1,0 cm-Quetschverletzung wurde
dann dem Zentrum des Gefäßabschnittes
zugefügt
unter Verwendung einer geschützen
Arterienklemme und für
10 Minuten ungestört
belassen. Die Gefäßklemmen
wurden dann entfernt und der Blutfluss wurde wiederhergestellt. Der
Blutfluss wurde fortwährend
für 60
Minuten überwacht,
wonach die Kaninchen der Euthanasie unterzogen wurden und das Gefäß ausgeschnitten
wurde für
die histologische Analyse.
-
Es wurde keine Dosisabhängigkeit
bei diesen Konzentrationen gesehen. Eine Metaanalyse aller zsig37-Dosen
resultierte in einem signifikanten Anstieg in der offenen Zeit,
im Vergleich zu Kontrollen in einem ungepaarten t-Test (P = 0,019).
-
Die prozentuale mittlere Offenzeit
für die
kombinierten Gruppen der negativen Kontrolltiere, wie abgeleitet
von den Blutfluss-Aufzeichnungen, war 13,5% mit einer Standardabweichung
von ±1,7%.
Die prozentuale mittlere offene Zeit für die kombinierten zsig37-behandelten
Gruppen an Tieren, wie abgeleitet von den Blutfluss-Aufzeichnungen,
war 37,2% mit einer Standardabweichung von ±10,3%.
-
In einer zweiten Experimentenserie
wurde Fluorescein-markiertes zsig37 in dem Modell der verletzten Karotis
verwendet. Männliche
New Zealand White-Kaninchen wurden anästhesiert, wie oben. Über einen
Einschnitt im Hals wurde die Karotis freigelegt und ungefähr 5 cm
des Gefäßes wurden
von dem umgebenden Bindegewebe isoliert. Blut wurde aus dem isolierten
Segment abgezogen und atraumatische Gefäßklemmen wurden angelegt. Ungefähr 0,05
ml Fluorescein-markiertes zsig37 (Konzentration 100 μg/ml) wurden
in das isolierte Segment injiziert, um das Gefäß vollständig zu füllen, unter Verwendung einer
30 G-Nadel. Nach
einer Aussetzungsdauer von 5 Minuten wurde das Gefäß verletzt
und das Aussetzen dauerte für
weitere 110 Minuten an, ehe die Klammern entfernt wurden und der
Blutfluss wiederhergestellt wurde. Die Tiere wurden, wie oben beschrieben,
der Euthanasie unterzogen nach 1, 10 und 60 Minuten nach dem Wiederherstellen
des Blutflusses und die Gefäße wurden
gesammelt und in Formalin fixiert für die histologische Beurteilung.
-
Markiertes zsig37 band bevorzugt
an Rezeptoren in der Mitte der verletzten Gefäße. Markiertes zsig37 band
nicht an Bereiche des Gefäßes, die
nicht verletzt waren. Die Blutflusszeit vor dem Sammeln des Gefäßes scheint
nicht die Menge an zsig37 zu beeinflussen, die an das Gewebe gebunden
bleibt, d. h. es gab keinen Unterschied in der Menge des markierten
zsig37, gebunden an die Gewebe in der ersten Minute, im Vergleich zu
dem Sammelzeitpunkt nach 60 Minuten. Dies kann anzeigen, dass zsig37
fest an die verletzten Gefäße bindet
und nicht durch den wiederhergestellten Blutfluss abgewaschen wird.
-
Die Wirkung von zsig37 auf Blutströmungsdynamiken
nach der Gefäßverletzung
in einem Kaninchen-Darmbeinarterien-Quetschverletzungs/Stenose-Modell
wurde auch bewertet. Junge, erwachsene, männliche New Zealand White-Kaninchen
wurden anästhesiert,
wie oben beschrieben. Über
einen Abdominal-Einschnitt wurde die Aorta-Darmbein-Abzweigung freigelegt
und jedes Darmbein wurde von umgebenden Geweben befreit und die
Hauptzweige wurden abgebunden. Jedes Darmbein wurde mit einer Ultraschall-Fluss-Sonde
versehen, um den Blutfluss durch das Gefäß zu überwachen. Basierend auf Blutflussdaten wurde
ein Darmbein ausgewählt,
um für
die Verletzung verwendet zu werden, und das andere wurde katheterisiert
zur Zufuhr der Testprobe. Kaninchen wurden in Dosisgruppen von 6
Tieren/Gruppe aufgeteilt. Die zsig37-enthaltenden Testprobendosen,
stiegen in halblogarithmischen Zuwächsen von 3–1000 μg/kg über die ausgewählte Infusionsdauer
an. Die Testprobeninfusion wurde gestartet, gefolgt von der Schaffung
einer kritischen Stenose, die den Blutfluss durch das Gefäß um ungefähr 50% reduzierte.
Nach Schaffung der Stenose und einer Zeitspanne der Blutflussstabilisierung
wurde das Gefäß verletzt
durch Quetschen des Gefäßes zwischen
den Klauen eines glatten Nadelhalters. Die Infusion wurde nach der
Verletzung fortgesetzt für
eine festgesetzte Zeitdauer, 10–20
Minuten. Der Blutfluss durch das verletzte Gefäß wurde überwacht für 60 Minuten nach der Verletzung.
Die Tiere wurden der Euthanasie unterzogen, nach Abschluß der Studiendauer.
Der untere Abschnitt der Abdominalaorta und jedes Darmbein wurde
gesammelt und in Formalin fixiert für die histologische Beurteilung.
-
Blutflussparameter, bestimmt aus
den Flussaufzeichnungen, schlossen den mittleren Fluss nach der Stenose,
den mittleren Fluss nach der Verletzung und die Zeit, in der das
Gefäß offen
war, ein. Diese Daten legen nahe, dass eine Tendenz für zsig37
vorhanden ist, die gesteigerte Öffnungszeit
zu fördern,
mit einer erhöhten
Dosis bis zu 300 μg/kg über eine
60-minütige Zeitdauer.
-
Beispiel 21
-
Relaxation Serotonin-induzierter
Kontraktionen des Ratten-Aortenrings
-
Männliche
Sprague-Dawley-Ratten, ungefähr
3 Monate alt, wurden leicht mit CO2 anästhesiert
und dann enthauptet. Die Brustaorta wurde dann schnell entfernt
und in einen modifizierten Krebs-Henseleit-Puffer (NaCl, 118,2 mM;
KCl, 4,6 mM; CaCl2, 2,5 mM; MgSO4, 1,2 mM; NaHCO3,
24,8 mM; KH2PO4,
1,2 mM und Glucose, 10,0 mM) gegeben. Von jeder Ratte wurden vier
2–3 mm
lange Aortenringabschnitte geschnitten, nachdem das rauhe Ende der
Aorta verworfen worden war. In einigen Experimenten wurde das Endothelium
freigelegt, vor dem Schneiden der Ringabschnitte, indem das Lumen
der Aorta entlang einer 21 Gauge-Nadel gerieben wurde. Freilegen
des Endotheliums wurde durch Zugabe des Acetylcholinanalogs, Carbachol,
verwirklicht, vor der Bestimmung der konzentrationsabhängigen zsig27-Antworten.
In Abwesenheit des Endotheliums vasorelaxiert Carbachol verengte
Gefäßringabschnitte
nicht.
-
Die Ringe wurden fixiert und mit
Kraft-Verdrängungsumwandlern
in oxygenierten (95% O2, 5% CO2) ummantelten
Glasorganbädern,
gehalten bei 30°C
in modifiziertem Krebs-Henseleit-Puffer,
pH 7,4 verbunden. Die Ruhespannung wurde auf 1 gm gesetzt und kontinuierlich
erneut angepasst auf 1 gm über
eine 1-ständige Inkubationsdauer.
Frischer, oxygenierter modifizierter Krebs-Henseleit-Puffer wurde
hinzugefügt
zu den Bädern,
alle 15 Minuten während
der Ruhe-Inkubationsdauer. Nach dem Ende der 1-ständigen Inkubation
wurden die Ringabschnitte durch die Zugabe von 10 μM Serotonin
kontrahiert. Nachdem die maximale Kontraktion erreicht worden war,
wurden ungefähr
15–20
Minuten nach der Zugabe des Serotonins, kumulative Konzentrations-Antwort-Kurven
für zsig37
erstellt. Zsig37 wurde zu 5 ml Bädern
in Volumen von 5 bis 150 μl
hinzugefügt,
für Endkonzentrationen
im Bereich von 1 ng/ml bis zu 40 μg/ml.
Die Lebensfähigkeit
der Ringabschnitte wurde überprüft am Ende
der Konzentrationsantwort durch die Zugabe von Forskolin (2,5 μM oder 25 μM) oder Nitroglycerin
(22 μM).
-
Die Zugabe von zsig37 induzierte
eine konzentrationsabhängige
Vasorelaxation Serotonin-kontrahierter Ratten-Aortenabschnitte mit
und ohne intaktes Endothelium. Relaxation in Antwort auf zsig37
wurde zuerst beobachtet bei Konzentrationen über 100 ng/ml. Relaxation wurde
beobachtet ungefähr
30–60
Sekunden nach den Zugaben jeder zsig37-Konzentration zu dem Bad
und die Relaxationsantworten erreichten ein Plateau innerhalb von
3–5 Minuten
nach der Zugabe von zsig37. Die Eigenart der Relaxationsantwort
auf zsig37 zeigt an, dass die Vasorelaxation ein Rezeptor-Zweiter-Bote-vermitteltes
Ereignis ist. Zusätzlich
zeigt die Fähigkeit von
zsig37, Endothelium-entblöste
Aortenabschnitte zu vasorelaxieren, dass zsig37 direkt auf die glatten
Muskelzellen wirkt, um die vasorelaxierende Antwort auszulösen.
-
Beispiel 22
-
Identifizierung der Zellen,
die den zsig37-Rezeptor exprimieren unter Verwenden von in situ-Hybridisierung
-
Spezifische menschliche Gewebe wurden
isoliert und für
die zsig37-Expression durch in situ-Hybridisierung gescreent. Die
verschiedenen zubereiteten, geschnittenen und der in situ-Hybridisierung
ausgesetzten menschlichen Gewebe schlossen Aorta, Herz, Lymphknoten,
Plazenta, Prostata, Speicheldrüse,
Haut und Hoden ein. Die Gewebe wurden in 10% gepuffertem Formalin
(Surgipath, Richmond, Illinois, USA) fixiert und in Paraplast X-tra
(Oxford Scientific, St. Louis, Missouri, USA) eingebettet und in
5 μm mit
einem Reichart-Jung 2050–Mikrotom
(Leica Instruments GmbH, Nussloch, Deutschland) geschnitten. Die
Gewebe wurden auf 4–8 Mikron
geschnitten. Die Gewebe wurden zubereitet unter Verwendung eines
Standardprotokolls („Development
of nono-isotopic in situ Hybridization", Laboratory of Experimental Pathology,
National Institute of Environmental Health Sciences, Research Park
Triangle, North Carolina, USA). Kurz, von den Gewebeschnitten wurde
Paraffin entfernt mit HistoClear (National Diagnostics, Atlanta,
Georgia, USA) und dann mit Ethanol entwässert. Als nächstes wurden
die Schnitte jeweils verdaut mit Proteinase K (50 μg/ml) (Boehringer
Mannheim, Indinanapolis, Indiana, USA) bei 37°C für 2 bis 20 Minuten. Auf diesen
Schritt folgte die Acetylierung und Rehydrierung der Gewebe.
-
Drei durch PCR hergestellte in situ-Sonden
wurden für
die menschliche zsig37-Sequenz
entworfen. Zwei Sätze
an Oligonukleotidprimern wurden entwickelt, um Sonden herzustellen
für getrennte
Bereiche der zsig37-cDNS: (1) die Oligonukleotide ZC23,689 (SEQ
ID NO: 45) und ZC23,694 (SEQ ID NO: 46) wurden verwendet, um eine
414 bp-Sonde für
zsig37 zu erzeugen; (2) ZC23,703 (SEQ ID NO: 47) und ZC23,697 (SEQ ID
NO: 48) wurden verwendet, um eine 896 bp-Sonde für zsig37 zu erzeugen; (3) ZC24,441
(SEQ ID NO: 49) und ZC24,442 (SEQ ID NO: 50) wurden verwendet, um
eine 290 bp-Sonde für
zsig37 zu erzeugen. Die Gegensinn-Oligos jedes Satzes enthielten
auch die Arbeitssequenz für
den RNS-Polymerasepromoter von T7, um die leichte Transkription
der Gegensinn-RNS-Sonden
dieser Produkte zu ermöglichen.
Die PCR-Produkte wurden gereinigt durch Qiagen-Drehsäulen (Qiagen, Inc., Chatsworth,
Kalifornien, USA) gefolgt von Phenol/Chloroform-Extraktion und Ethanolfällung. Die
Sonden wurden anschließend
mit Digoxigenin (Boehringer) oder Biotin (Boehringer) markiert,
unter Verwendung eines in vitro- Transkriptionssystems
(Promega Corp., Madison, Wisconsin, USA), gemäß den Anweisungen des Herstellers.
-
In situ-Hybridisierung wurde durchgeführt mit
einer Digoxigenin- oder Biotinmarkierten zsig37-Sonde, wie oben
beschrieben. Die Sonde wurde zu den Objektträgern hinzugefügt in einer
Konzentration von 1 bis 5 pmol/ml für 12–16 Stunden bei 50–60°C. Die Objektträger wurden
anschließend
gewaschen in 2 × SSC
und 0,1 × SSC
bei 50–55°C. Die Objektträger wurden
anschließend
gewaschen in 2 × SSC
und 0,1 × SSC
bei 50–55°C. Die Signale
wurden amplifiziert unter Verwendung der Tyramid-Signal-Amplifikation
(TSA in situ-indirekter Kit, NEN, Boston, Massachusetts, USA) und
sichtbar gemacht mit einem Vektor Red-Substratkit (Vector Laboratories,
Burlingame, Kalifornien, USA), gemäß den Anweisungen der Hersteller.
Die Objektträger
wurden dann gegengefärbt
mit Hematoxylin (Vector Laboratories).
-
Positive Signale wurden in der menschlichen
Aorta, Herz, Prostata, Speicheldrüsen und Hoden gesehen. Die
positiv gefärbten
Zellen schienen Endothelzellen von Gefäßen mit kleinem Durchmesser
in der Adventitia, die die Aorta umgibt, mesotheliale Zellen, die über dem
Epikard liegen, Azinuszellen der Speicheldrüse und verstreute mononukleäre Zellen,
Trophoblasten der Plazenta, epitheliale Zellen der Prostata und Schichtepithel
der Samenkanälchen
der Hoden zu sein.
-
Beispiel 23
-
SEC-MALLS-Analyse von
Zsig37
-
Zsig37 enthält eine N-terminale kollagenähnliche
Domäne,
ebenso wie einen Cterminalen globulären Bereich, der Homologie
zu der Tumornekrosefaktor-Familie hat, und ähnlich anderen solchen Proteinen
wird von zsig37 erwartet, dass es Multimere bildet. Aufgereinigtes
zsig37, analysiert unter Verwendung eines ESI-Ionenfallen-Massenspektrometers
(Finnigan Matt, San Jose, Kalifornien, USA), zeigte die Anwesenheit von
Spezies an, die sich Trimeren und 9meren annähern, was im Vergleich zu anderen
homologen Proteinen ein unerwartetes Ergebnis war. Das Peptidkartieren
von zsig37 unter Verwendung von LC-MS/MS auf einem ESI-Ionenfallen-Massenspektrometer
(Finnigan Matt) offenbarte, dass zahlreiche Cystein-Reste modifiziert waren
mit einer S-Cysteinylgruppe. Es kann sein, dass die Modifikation
von Schlüssel-Cysteinresten
in dem zsig37-Protein während
der Fermentation mit freiem Cystein im Medium die richtige Oligomerverknüpfung dieses
Moleküls
verhindert.
-
Um mehr zu verstehen, wurde ein Vergleich
von reduziertem und nicht-reduziertem zsig37 gemacht, unter Verwendung
einer Biosep S-300 Größenausschlusssäule mit
einem Durchfluss von 1,0 ml/Minute (7,8 × 3000 mm; Phenomenex, Torrance,
Kalifornien, USA) auf einem HP 1050 HPLC-Gerät (Hewlett Packard, Heidelberg,
Deutschland). Das HP 1050 war an Lichtstreu- und Brechnungsindexdektoren,
miniDAWN und Optilab DSP (Waytt Technology, Santa Barbara, Kalifornien,
USA), für
on-line SEC-MALLS angeschlossen.
-
Ein Milligramm rekombinantes zsig37
(1,0 mg/ml) wurde zu TCEP in einem Verhältnis von 10 : 1 mol/mol TCEP
zu zsig37 hinzugefügt
und bei Raumtemperatur für
70 Minuten gehalten. Sechzig Mikroliter des reduzierten zsig37 wurden
für die
SEC-MALLS-Analyse
injiziert und der Rest reduziertes zsig37 wurde in 0,5–3,0 ml
Slide-A-Lyzer-Kassetten,
10K MWCO (Pierce, Rockford, Illinois, USA) unter Rühren gegen
PBS, pH 7,4 dialysiert mit drei Pufferänderungen wie folgt: 1 Liter
PBS bei Raumtemperatur für
4 Stunden, 1 Liter PBS bei 4°C über Nacht
und 1 Liter PBS bei Raumtemperatur für 4 Stunden.
-
Nach der Dialyse wurde der Oxidation
ermöglicht
fortzuschreiten bei 4°C.
Die Oxidation wurde überwacht
durch SEC-MALLS-Analyse von Aliquoten, die an drei Zeitpunkten,
T = 0 Stunden, T = 24 Stunden und T = 96 Stunden genommen worden
waren. Molekulargewichtswerte wurden bestimmt unter Verwendung des LS-RI
Zwei-Detektor-Verfahrens.
-
Analyse des reduzierten, dialysierten
rekombinaten zsig37 scheint anfänglich
die Bildung von Hexameren und 18meren, wie nachgewiesen durch SEC-MALLS,
anzuzeigen, was stärker
in Übereinstimmung
ist mit den in Homologen beobachteten Oligomerzuständen. Diese
Formen waren auch wirksam in in vitro-Untersuchungen.
-
Beispiel 24
-
Zsig37-Bindung an Monozyten
-
CD 14-positive Monozyten wurden aus
einem gefrorenen peripheren Blut-Aphareseprodukt
isoliert unter Verwendung eines positiven Selektionsverfahrens mit
Miltenyi-Perlen (Miltenyi Biotec, Auburn, Kalifornien, USA). Gereinigte
Zellen waren zu mehr als 80% CD14-positiv im Wege der FACS-Färbung. Die
Zellen wurden resuspendiert auf 1 × 106 Zellen/ml
in RPMI + 10% fetales Rinderserum (FBS) und in 100 mm Gewebekulturschalen
ausplattiert, 5 ml/Platte. Rekombinantes menschliches γ-Interferon
wurde hinzugefügt
in einer Konzentration von 100 ng/ml und die Zellen wurden inkubiert
bei 5% CO2, 37°C für 48 Stunden.
-
Die Zellen wurden von den Platten
entfernt durch nichtenzymatische Verfahren, unter Verwendung von sowohl
EDTA als auch Abschaben, konzentriert durch Zentrifugation, resuspendiert
in FACS-Färbepuffer
und in Aliquote aufgeteilt zu 500000 Zellen/Röhrchen für das Färben. Nicht-aktivierte Zellen
wurden gewonnen durch Durchführen
einer anderen CD 14-Selektion mit demselben Aphereseprodukt nach
48 Stunden in γ-Interferon.
Die Zellen wurden inkubiert in variierenden Konzentrationen von
biotinylierten zsig37, gefolgt von Strepavidin PE. Jegliches Blocken
mit „kaltem" zsig37 wurde durchgeführt auf
Eis für
30 Minuten. Ungebundenes Protein wurde entfernt durch einmaliges
Waschen in FACS-Puffer. Die Bindung wurde quantifiziert unter Verwendung
eines FACS-Caliburinstrumentes (Becton Dickinson, Lincoln Park,
New Jersey, USA) und als ein Signal über einem sekundären Antikörper als
einziger Kontrolle ausgedrückt.
Monozytenaktivierung wurde durch einen Anstieg um ungefähr 1 log
in ICAM-1-Expression in γ-Interferon-behandelten
Zellen nachgewiesen.
-
Zsig37-Bindung wurde detektiert,
sowohl in aktivierten als auch in nicht aktivierten Monozyten mit
einem Anstieg in der zsig37-Bindung, die in γ-Interferon-behandelten Zellen
beobachtet wurde. Eine Bindung wurde nachgewiesen knapp bis zu 1,5 μg/ml, der
niedrigsten untersuchten Konzentration. In einer Konzentration von
15 μg/ml,
war das Binden ungefähr
4-fach erhöht
in aktivierten Zellen. Eine leichte Reduktion (ungefähr 10%)
in der Bindung wurde in aktivierten Zellen nur gesehen, wenn diese
mit einem 70-fachen Überschuss an „kaltem" zsig37 vorbehandelt
worden waren. Die Anstiege der zsig37-Bindung in aktivierten Monozyten
legt die Heraufregulierung des Bindens von zsig37 an Monozyten-Proteine/Rezeptoren
durch entzündliche
Cytokine nahe. Dies könnte
möglicherweise
in der zsig37-Verwicklung in der Monozytenphagozytose, dem Abtöten von
Mikrobien und zellulärer
Zytotoxizität
resultieren. Nach 2 Tagen in Kultur waren Makrophagen in der Kultur vorhanden
und zsig37 kann vorzugsweise an diese Unterklasse von Zellen binden.
Es sind keine guten Makrophagen-Marker erhältlich, um festzustellen, ob
dies geschieht. Zsig37 band auch an eine Maus-Monozyten/Makrophagen-Linie,
RAW 264.7 (ATCC Nr. CRL-2278), was eine Makrophagen-Spezifität anzeigt.
-
Von dem vorangegangenen wird geschätzt werden,
dass obwohl spezifische Ausführungsbeispiele der
Erfindung hierin beschrieben worden waren, für Zwecke der Erläuterung
zahlreiche Modifikationen können gemacht
werden, ohne von dem Schutzumfang der Erfindung abzuweichen. Demgemäß wird die
Erfindung nicht beschränkt
mit der Ausnahme als durch die anhängenden Ansprüche.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-