-
QUERVERWEISE
AUF VERWANDTE ANMELDUNGEN
-
Diese Anmeldung beansprucht die Prioritäten der
folgenden vorläufigen
US-Anmeldungen: Nr. 60/344,117, eingereicht am 28. Dezember 2001,
Nr. 60/344,118, eingereicht am 28. Dezember 2001, Nr. 60/348,142,
eingereicht am 11. Januar 2002, Nr. 60/348,183, eingereicht am 11.
Januar 2002, Nr. 60/360,721, eingereicht am 1. März 2002 und Nr. 60/368,735,
eingereicht am 29. März
2002.
-
GEBIET DER ERFINDUNG
-
Die vorliegende Erfindung betrifft
die Festkörperchemie
der antibiotischen Pseudomoninsäure
A. Insbesondere betrifft die vorliegende Erfindung kristalline und
amorphe Formen von Mupirocin-Calcium.
-
HINTERGRUND
DER ERFINDUNG
-
Pseudomoninsäure A ist ein Antibiotikum,
das eine wachstumshemmende Wirkung hauptsächlich gegen Gram-positive
Bakterien (z.B. Staphylococcus aureus, Streptococcus pyogenes, Streptococcus
pneumoniae, Klebsiella pneumoniae) und einige Gram-negative Bakterien
(z.B. Haemophilus influenzae, Neisseria gonorrhoeae) [A. Ward, D.M.
Campoli-Richards, Drugs 32, 425-444
(1986)] hat, und seine minimale hemmende Konzentration liegt im
Bereich von 0,02 bis 0,5 mg/dm3. Pseudomoninsäure A beeinflußt durch
Hemmung des Enzyms Isoleucin-tRNA-Synthase die Peptidsynthese von
Bakterien [J. Hughes und G. Mellows, Biochem. J. 191, 209-219 (1980)].
Ein vorteilhaftes Merkmal dieses Antibiotikums ist, daß es sowohl
für den
Menschen als auch für
Tiere eine sehr geringe Toxizität
aufweist und in dem Ames-Test negativ ist. Pseudomoninsäure A wird derzeit
in der Therapie des Menschen in verschiedenen Formulierungen für die Behandlung
von Hautinfektionen (z.B. Impetigo, Pyoderma), Infektionen der Nase
und des äußeren Ohrs,
Akne, Verbrennungen, Ekzemen, Psoriasis, im Falle von Geschwürbildung
für die
Behandlung von sekundären
Infektionen und für
die Vorbeugung gegen Krankenhausinfektionen eingesetzt.
-
Die chemische Struktur von Pseudomoninsäure A ist
9-{4-[5S-(2S,3S-Epoxy-5S-hydroxy-4S-methylhexyl)-3R,4R-dihydroxytetrahydropyran-2S-yl]-3-methylbut-2(E)-enoyloxy}-nonansäure [E.B.
Chain und G. Mellows. J.C.S. Chem. Comm. 847-848 (1974); R.G. Alexander,
J.P. Clayton, K. Luk, N.H. Rogers, T.J. King, J.C.S. Perkin I. 561-565
(1978)], wie durch die folgende Formel (I) gezeigt:
-
-
Es ist bekannt, daß Pseudomonas
fluorescens in der Lage ist, Pseudomoninsäure A zu produzieren. Gemäß dem britischen
Patent Nr. 1 395 907 ist der Pseudomonas fluorescens-Stamm NCIB10586
in der Lage, Biosynthese des Pseudomoninsäurekomplexes, der aus Pseudomoninsäure A besteht,
und dessen Isomeren, bestehend aus einer Doppelbindung in der cis-Position
zwischen den Kohlenstoffatomen C2 und C3, und Pseudomoninsäure B zu betreiben. Das Verhältnis der
Bestandteile beträgt
4,5:4,5:1. Jedoch gemäß der japanischen
Patentanmeldung Nr. 52-70083 ist der Pseudomonas fluorescens-Stamm
Y-11633 zur Biosynthese des Pseudomoninsäurekomplexes, bestehend aus
Pseudomoninsäure
A, Pseudomoninsäure
B und weiteren zwei Bestandteilen mit' unbekannten Strukturen in dem Verhältnis von
9:0,5:0,5 in der Lage.
-
Mupirocin-Calcium ist ein von Pseudomoninsäure abgeleitetes
Antibiotikum und wird derzeit in den Vereinigten Staaten als Bactroban® vermarktet.
Bactroban® wird
für die
Behandlung von sekundär,
infizierten traumatischen Hautläsionen,
verursacht durch Stämme
von Staphylococcus aureus und Streptococcus pyogenes, empfohlen.
Bactroban® wird
als eine topische Creme oder eine nasale Salbe vertrieben und besitzt
eine Calciumsalzstärke
von 2% Basenäquivalent.
Gemäß dem Hersteller
von Bactroban® könnte Mupirocin-Calcium
oral mit 500 mg und intravenös
mit 250 mg ohne irgendwelche größere Nebenwirkungen
verabreicht werden.
-
Mupirocin-Calcium ist insbesondere
wirksam gegen Gram-positive Bakterien, aber es kann auch gegen Gram-negative
Bakterien eingesetzt werden. Es hemmt bakterielle Proteinsynthese
durch irreversible Bindung an bakterielle Isoleucyl-Transfer-RNA-Synthetase.
-
Das Calciumsalz von Pseudomoninsäure ("Mupirocin-Calcium") wurde in verschiedenen
Patenten offenbart. Die UK-Patente mit den Nummern 1 577 545 und
1 577 730, welche hierin durch Bezugnahme aufgenommen sind, offenbaren
die Verwendung von Mupirocin-Calcium bei der Behandlung von Erkrankungen.
Das Patent '545
ist auf die Behandlung und Prävention
von Schweinedysenterie mit dem Calciumsalz von Mupirocin gerichtet.
Das Patent '730
ist auf die Verwendung des Calciumsalzes von Mupirocin zur Behandlung
von respiratorischen, Geschlechts- und mykoplasmainduzierten Erkrankungen
in nicht-menschlichen Säugern
gerichtet. Die Offenbarung konzentriert sich eher auf die Wirksamkeit
von Mupirocin als ein Arzneimittel als auf dessen Herstellung.
-
Das US-Patent Nr. 4,879,287 ist auf
eine pharmazeutische Zusammensetzung von Mupirocin-Calcium für topische
Verabreichung gerichtet, welche hydratisiertes kristallines Calciumsalz
und ein Corticosteroid enthält.
Das Patent '287
offenbart verschiedene Formulierungen für kristallines Mupirocin-Calcium
und ist hierin durch Bezugnahme aufgenommen.
-
Die US-Patente mit den Nummern 5,596,672,
5,436,266, 5,191,093 und 4,916,155 (Baker et al.), alle in der gleichen
Familie, offenbaren ein kristallines Calciumsalz von Mupirocin und
beanspruchen dessen Zusammensetzung, Herstellungsverfahren und Verabreichung.
Alle diese Patente sind hierin durch Bezugnahme aufgenommen. Das
Patent '672 ist
auf ein Verfahren zur Behandlung von bakteriellen Infektionen mit
kristallinem Mupirocin-Calcium oder einem Hydrat davon gerichtet.
Das Patent '266
ist auf ein Hydrat von kristallinem Mupirocin-Calcium gerichtet.
Das Patent '155
ist auf wasserfreies kristallines Mupirocin-Calcium gerichtet. Das Patent '093 ist auf ein Verfahren
zur Herstellung von kristallinem Mupirocin-Calcium oder einem Hydrat
davon durch "Umsetzen
von Pseudomonationen mit Calciumionen in Lösung in einem wäßrigen Lösungsmittel,
Gewinnen eines kristallinen Calciumpseudomonathydrats aus der Lösung und
danach optional Entfernen von Kristallwasser" gerichtet.
-
Die Patente von Baker et al. offenbaren
die Herstellung einer amorphen Form von Mupirocin-Calcium durch Kristallisation
aus einer wäßrigen Lösung, bestehend
aus 50% Methanol, gefolgt von Triturierung mit trockenem Ether.
Amorphes Mupirocin-Calcium, das in den Patenten erhalten wird, zeigt
einen relativ niedrigen Schmelzpunkt von 70 bis 76°C, eine relativ
niedrige Gehaltsbestimmung von 89,9% (ausgedrückt als ein Prozentsatz von
reiner freier Pseudomoninsäure)
und schnelle Qualitätsminderung
bei hohen Temperaturen (Diagramm in den Spalten 8 und 9 von '093 und verwandte
Patente). Die Patente von Baker et al. offenbaren, daß "man von der einfach
isolierbaren amorphen Form von dessen Salz herausgefunden hat, daß sie ein
schwer wasserlösliches
Material mit einem niedrigen Schmelzpunkt und schlechter thermischer
Stabilität
ist" (Spalte 1,
Zeilen 31-33).
-
Das US-Patent Nr. 4,639,534, welches
hierin durch Bezugnahme aufgenommen ist, offenbart die Verwendung
eines Lithiumsalzes als ein Zwischenprodukt bei der Isolierung von
Pseudomoninsäure
aus einem Medium. Das Patent '534
extrahiert das Medium, um Mupirocin-Lithium zu erhalten, und hydrolysiert
das Salz, um Pseudomoninsäure
zu erhalten.
-
Es besteht auf dem Gebiet ein Bedarf
nach reineren und stabileren Formen von amorphem Mupirocin-Calcium,
Mupirocin-Calcium-Hydrat und Mupirocin-Calcium-Dihydrat.
-
ZUSAMMENFASSUNG
DER ERFINDUNG
-
Gemäß einem Aspekt liefert die
vorliegende Erfindung kristallines Mupirocin-Calcium-Hydrat oder
Anhydrat davon, hergestellt mit den Stufen, in denen man eine Lösung von
Pseudomoninsäure
in einem in Wasser unmischbaren Lösungsmittel herstellt, die
Lösung
mit einer Lösung
oder einer Suspension eines organischen Calcium-C2-C12-Carboxylats in einem wäßrigen Lösungsmittel unter Bildung einer
wäßrigen und
einer nicht-wäßrigen Phase
vereinigt, wobei Mupirocin-Calcium-Dihydrat aus der wäßrigen Phase
präzipitiert,
das Präzipitat
abtrennt und optional das Dihydrat in das Anhydrat umwandelt. Vorzugsweise
ist die wäßrige Suspension
oder Lösung
von einem Co-Solvent freies Wasser oder ein Gemisch aus Wasser und
einem C1-C4-Alkohol.
Bevorzugte organische Carboxylate sind Acetat, Propanoat und Hexanoat,
wobei alkylsubstituierte Hexanoate, wie 2-Ethylhexanoat, besonders bevorzugt sind.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung kristallines Mupirocin-Calcium-Hydrat oder Anhydrat
davon, hergestellt mit den Stufen, in denen man Pseudomoninsäure und
ein organisches Calcium-C2-C12-Carboxylat
einem wäßrigen Lösungsmittel
unter Ausbildung einer Lösung
hinzufügt,
wobei sich eine organische C2-C12-Carbonsäure ausbildet,
die Carbonsäure
entfernt, Mupirocin-Calcium-Dihydrat als ein Präzipitat von dem wäßrigen Lösungsmittel
abtrennt und optional das Dihydrat in das Anhydrat umwandelt. Vorzugsweise
ist das Lösungsmittel
ein Gemisch aus Wasser und einem C1-C4-Alkohol, dessen Wassergehalt vor der Kristallisationsstufe
erhöht
wird. Vorzugsweise wird die Carbonsäure durch Extraktion entfernt.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung kristallines Mupirocin-Calcium-Dihydrat oder Anhydrat
davon, hergestellt mit den Stufen, in denen man Pseudomoninsäure und
Calciumoxid zu von einem Co-Solvent freiem Wasser unter Ausbildung
einer Lösung
hinzufügt,
wobei Mupirocin-Calcium-Dihydrat aus der Lösung präzipitiert, das Mupirocin-Calcium-Dihydrat
abtrennt und optional das Dihydrat in das Anhydrat umwandelt.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung amorphes Mupirocin-Calcium, hergestellt
mit den Stufen, in denen man Pseudomoninsäure, eine Base und eine Quelle
für Calciumionen
zu einem C1-C4-Alkohol
unter Ausbildung einer Lösung
hinzufügt
und den Alkohol entfernt. Vorzugsweise ist der Alkohol im wesentlichen
wasserfrei, besonders bevorzugt hat er einen Wassergehalt von weniger
als etwa 1 % (Vol./Vol.) und ist aus der Gruppe ausgewählt, die
aus Methanol und Ethanol besteht. Vorzugsweise wird der Alkohol
durch Verdampfen entfernt.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung amorphes Mupirocin-Calcium, hergestellt
mit den Stufen, in denen man Pseudomoninsäure, eine Base und eine Quelle
für Calciumionen
zu einem C1-C4-Alkohol
unter Ausbildung einer Lösung
hinzufügt,
die Lösung
mit einem Anti-Solvent vereinigt, um amorphes Mupirocin-Calcium
zu präzipitieren,
und das Präzipitat
abtrennt. Vorzugsweise hat der Alkohol einen Wassergehalt von weniger
als etwa 1 % (Vol/Vol.) und ist Ethanol oder Methanol. Das Anti-Solvent
ist vorzugsweise ein Ester und ein Ether, wie Methyl-tbutylether,
Düsopropylether
und i-Butylacetat. Vorzugsweise wird die Lösung zu dem Anti-Solvent hinzugefügt.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung amorphes Mupirocin-Calcium, hergestellt
mit den Stufen, in denen man Pseudomoninsäure, eine Base und eine Quelle
für Calciumionen
zu einem Lösungsmittel,
ausgewählt
aus der Gruppe, bestehend aus Wasser, einem C1-C4-Alkohol und Gemischen davon, unter Ausbildung
einer Lösung
hinzufügt
und die Lösung
lyophilisiert. Vorzugsweise ist der Alkohol Methanol.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung kristallines Mupirocin-Calcium-Dihydrat oder Anhydrat
davon, hergestellt mit den Stufen, in denen man Pseudomoninsäure in einem
mit Wasser nicht mischbaren Lösungsmittel
unter Ausbildung einer Lösung
löst, die
Lösung
mit einer Lösung
oder Suspension einer Base und einer Quelle für Calciumionen in einem wäßrigen Lösungsmittel
unter Ausbildung einer wäßrigen und
einer nicht-wäßrigen Phase
vereinigt, wobei Mupirocin-Calcium-Dihydrat aus der wäßrigen Phase
präzipitiert,
das Dihydrat abtrennt und optional das Dihydrat in das Anhydrat
umwandelt. Vorzugsweise ist das mit Wasser nicht mischbare Lösungsmittel
aus der Gruppe ausgewählt,
die aus Estern und Ketonen besteht, wie Isobutylacetat und Isobutylmethylketon.
-
Gemäß einem weiteren Gesichtspunkt
liefert die vorliegende Erfindung amorphes Mupirocin-Calcium, hergestellt
mit den Stufen, in denen man Pseudomonationen und Calciumionen in
Lösung
in einem C1-C4-Alkohol
umsetzt und den Alkohol verdampft.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung amorphes Mupirocin-Calcium, hergestellt
mit den Stufen, in denen man Pseudomonationen und Calciumionen in
Lösung
in einem C1-C4-Alkohol umsetzt,
die Lösung
zu einem Ester oder einem Ether als ein Anti-Solvent hinzufügt, um amorphes
Mupirocin-Calcium zu präzipitieren,
und das Präzipitat
abtrennt.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung amorphes Mupirocin-Calcium, hergestellt
mit den Stufen, in denen man Pseudomonationen und Calciumionen in
Lösung
in Wasser oder einem Gemisch von Wasser und einem C1-C4-Alkohol umsetzt und die Lösung lyophilisiert.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung kristallines Mupirocin-Calcium-Dihydrat oder Anhydrat
davon, hergestellt mit den Stufen, in denen man Pseudomoninsäure und
ein organisches Calcium-C2-C8-Carboxylat
bereitstellt, saure Protonen der Pseudomoninsäure gegen die Calciumionen
des organischen C2-C8-Carboxylats
austauscht, das Mupirocin-Calcium-Dihydrat gewinnt und optional
das Dihydrat in das Anhydrat umwandelt.
-
Das Verfahren zur Herstellung von
amorphem und Dihydrat-Mupirocin-Calcium kann kombiniert werden,
indem man zuerst die amorphe Form herstellt und dann das Dihydrat
aus der amorphen Form erhält.
Das Dihydrat kann optional desolvatisiert werden, wenn es erwünscht ist,
um die Anhydratform zu erhalten.
-
Die vorliegende Erfindung liefert
pharmazeutische Zusammensetzungen von amorphem Mupirocin-Calcium, die zur
Verhinderung oder Behandlung von Infektionen geeignet sind.
-
KURZE BESCHREIBUNG
DER FIGUREN
-
1 ist
ein Pulverröntgenbeugungsmuster
("PXRD") des Produkts aus
Beispiel 6.
-
2 ist
ein PXRD-Muster des Produkts aus Beispiel 9.
-
3 ist
ein PXRD-Muster des Produkts aus Beispiel 10.
-
4 ist
ein PXRD-Muster des Produkts aus Beispiel 15.
-
5 ist
ein PXRD-Muster des Produkts aus Beispiel 16.
-
6 ist
ein PXRD-Muster von amorphem Mupirocin-Calcium.
-
7 ist
ein dynamische Differenzkalorimetrie- ("DSC"-)
Thermogramm von amorphem Mupirocin-Calcium.
-
8 ist
ein Fourier-Transformations-Infrarot- (FTIR-) Spektrum von amorphem
Mupirocin-Calcium.
-
9 sind
die Daten der thermischen Stabilität von amorphem Mupirocin-Calcium,
hergestellt nach dem Verfahren des Standes der Technik.
-
10 sind
die Daten der thermischen Stabilität von amorphem Mupirocin-Calcium,
hergestellt nach dem Verfahren des Standes der Technik.
-
11 ist
eine Erläuterung
der verschiedenen Verunreinigungen von Mupirocin und wie diese in
der vorliegenden Erfindung und im Europäischen Arzneibuch ("EP") bezeichnet werden.
-
AUSFÜHRLICHE
BESCHREIBUNG DER ERFINDUNG
-
Der Begriff "Pseudomonat" bezeichnet das Ion, welches man durch
Entfernen eines Wasserstoffs aus der Carbonsäuregruppe von Pseudomoninsäure erhält. Pseudomonat-Calcium
ist ein Synonym für
Mupirocin-Calcium.
-
Wie er hierin verwendet wird, bezeichnet
der Begriff "Co-Solvent" ein zweites Lösungsmittel,
das in Kombination mit einem ersten Lösungsmittel in solchen Mengen
verwendet wird, daß gewünschte Löslichkeitseigenschaften
geliefert werden. Verunreinigungen und Spuren eines Lösungsmittels
sind keine Co-Solvenzien. Jedoch kann von Co-Solvent freies Wasser
geringe Mengen an anderen Lösungsmitteln
enthalten.
-
Wie er hierin verwendet wird, bezieht
sich der Begriff "Gehaltsbestimmung" auf eine Bestimmung
von Reinheit/Vorhandensein einer Menge einer Substanz, wie es von
der Pharmacopeia Europea ("EP") beschrieben wird.
Pharmacopeia Europea, 4. Aufl., S. 1602-1604, Europarat, Straßburg, 2001.
Die Gehaltsbestimmung wird mit Hochdruckflüssigchromatographie ("HPLC") durchgeführt. Baker
et al. drücken
ihre Gehaltsbestimmung in Bezug auf Pseudomoninsäure aus. Die Gehaltsbestimmung
der vorliegenden Erfindung wird anders ausgedrückt, wie es von Tabelle 1 erläutert wird.
-
Tabelle
1 – Konvertierung
des bei Baker et al. offenbarten Tests
-
In Verbindung mit wasserfreiem Mupirocin-Calcium
kann die Gehaltsbestimmung der vorliegenden Erfindung in die Gehaltsbestimmung
konvertiert werden, wie es bei Baker et al. ausgedrückt ist,
indem man mit einem Faktor von 0,9637 multipliziert. Dieser Gehaltsbestimmung
von 89,9% von Baker et al. entspricht einer Gehaltsbestimmung von
93,29%, wenn man nach dem Verfahren der vorliegenden Erfindung berechnet.
-
In Verbindung mit Mupirocin-Calcium-Dihydrat
entspricht die Gehaltsbestimmung von 92,1% von Baker et al. einer
Gehaltsbestimmung von 98,88%, wenn sie nach der vorliegenden Erfindung
ausgedrückt
wird.
-
Wie er hierin verwendet wird, bezeichnet
der Begriff "Gesamtverunreinigung" die Summe aller
Flächen unter
den Peaks von Verunreinigungen, wie es in dem Europäischen Arzneibuch
beschrieben ist. Sie wird durch ein weiteres HPLC-Verfahren bestimmt
und unterscheidet sich von der Gehaltsbestimmung.
-
Die folgende Hypothese erklärt weiter
das Verhältnis
zwischen der Gehaltsbestimmung und den Verunreinigungen. Man nimmt
z.B. an, daß man
einen aktiven pharmazeutischen Bestandteil mit 99% chemischer Reinheit
(+1 % Verunreinigung) erhält.
Nach abschließendem
Trocknen wird ein Wassergehalt von 3% (KF) gemessen. Eine Gehaltsbestimmungsanalyse
sollte 96% liefern. Dies ist " Gehaltsbestimmung
als solche". Dann
berechnet man mit dem Wasser darin, um die Gehaltsbestimmung zur
Trockene (oder einfach „Gehaltsbestimmung") zu erhalten, was
99% liefern sollte.
-
Die vorliegende Erfindung liefert
eine hochgradig gereinigte amorphe Form von Mupirocin-Calcium. Der
amorphe Charakter und die Reinheit des Materials, das wir hergestellt
haben, wird durch ein Pulverröntgenbeugungsmuster
bestätigt,
das wir von einer Probe davon erhalten haben und welches als 6 wiedergegeben ist. Das
Muster ist ohne intensive konzentrierte Reflexionen.
-
Amorphes Mupirocin-Calcium nach der
vorliegenden Erfindung wird auch durch ein DSC-Thermogramm, wie es in 7 dargestellt ist, gekennzeichnet. Das
DSC-Thermogramm zeigt keine erkennbaren Endothermen oder Exothermen.
Das FTIR-Spektrum (8)
zeigt die gleichen Peaks wie solche von amorphem Mupirocin-Calcium
im Stand der Technik.
-
Die vorliegende Erfindung liefert
amorphes Mupirocin-Calcium mit einem Schmelzpunkt von etwa 76°C bis etwa
89°C, vorzugsweise
von etwa 85°C
bis etwa 89°C.
Der hohe Schmelzpunkt von amorphem Mupirocin-Calcium bestätigt die
hohe Reinheit des Produkts.
-
Die vorliegende Erfindung liefert
amorphes Mupirocin-Calcium mit hoher thermischer Stabilität. Thermische
Stabilität
ist als die Fähigkeit
definiert, chemischem Abbau während
einer Lagerung, insbesondere in Anbetracht der Bedingungen während der
Lagerung, zu widerstehen. Die höhere
Reinheit und die höheren Schmelzpunkte
von amorphem Mupirocin-Calcium machen es weniger empfänglich für chemischen
Abbau während
der Lagerung.
-
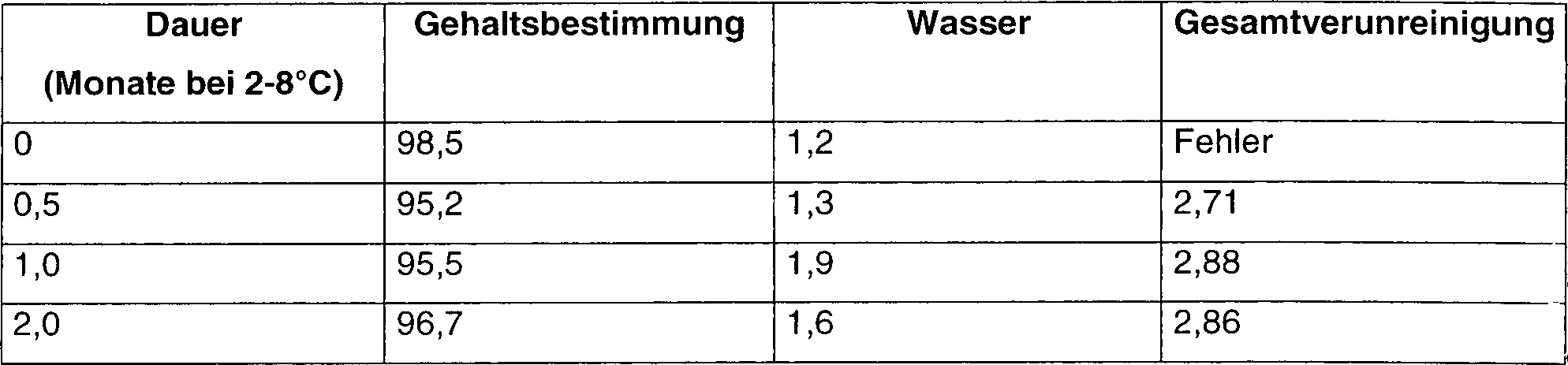
Wie es in Tabelle 2 gezeigt ist,
besitzt das amorphe Mupirocin-Calcium nach zwei Monaten der Lagerung
bei etwa 25°C
und bei etwa 2–8°C einer Gehaltsbestimmung
von etwa 96%, bestimmt nach dem Verfahren der vorliegenden Erfindung.
Zusätzlich
ist der Gehalt an Gesamtverunreinigung in etwa unverändert bei etwa
3% nach zwei Monaten.
-
Tabelle
2a – Thermische
Stabilität
eines 1 kg Ansatzes von amorphem Mupirocin-Calcium, hergestellt
nach dem Verfahren von Beispiel 17
-
Tabelle
2b – Thermische
Stabilität
eines 1 kg Ansatzes von amorphem Mupirocin-Calcium, hergestellt
nach dem Verfahren von Beispiel 17
-
Tabelle
2c – Thermische
Stabilität
eines 187,2 g Ansatzes von amorphem Mupirocin-Calcium, hergestellt
nach dem Verfahren von Beispiel 17
-
Tabelle
2d – Thermische
Stabilität
eines 187,2 g Ansatzes von amorphem Mupirocin-Calcium, hergestellt
nach dem Verfahren von Beispiel 7
-
Die thermische Stabilität von amorphem
Mupirocin-Calcium, hergestellt nach dem Verfahren von Baker et al.,
zeigt eine schnellere Qualitätsminderung.
Die 9 und 10 zeigen, daß die Gesamtmenge
an Verunreinigungen von amorphem Mupirocin-Calcium mehr als etwa
3,5% (nicht nach der Gehaltsbestimmung) nach zwei Monaten der Lagerung
bei dem Verfahren von Baker et al. beträgt, wogegen amorphes Mupirocin-Calcium
nach der vorliegenden Erfindung, eine Gesamtmenge an Verunreinigung
von weniger als etwa 3,5% (nicht nach der Gehaltsbestimmung) und
vorzugsweise weniger als etwa 3,3% nach wenigstens zwei Monaten
der Lagerung bei 25°C
aufweist. Das amorphe Mupirocin-Calcium der vorliegenden Erfindung
ist besonders stabil in Bezug auf eine Verunreinigung mit der Bezeichnung
MUP II (bezeichnet als Verunreinigung E in dem Europäischen Arzneibuch
(EP)), wobei eine Lagerung bei 25°C
und relativer Feuchte (RH) von 60% für wenigstens zwei Monate zu
einer Menge der Verunreinigung von NMT von etwa 1 %, vorzugsweise
weniger als etwa 0,8% führt,
wogegen amorphes Mupirocin-Calcium, hergestellt nach dem Stand der
Technik, eine Menge von mehr als 1 % nach Lagerung für einen
Monat erreicht.
-
Wie es in 11 erläutert ist, entsprechen die
Verunreinigungen der vorliegenden Erfindung dem EP folgendermaßen: IMP
A von EP ist B der vorliegenden Erfindung; B von EP ist C; C von
EP ist D; D von EP ist I (Eins); E von EP ist II (Zwei); und F von
EP ist E der vorliegenden Erfindung.
-
Die vorliegende Erfindung liefert
amorphes Mupirocin-Calcium, hergestellt mit den Stufen, in denen man
Pseudomoninsäure,
eine Base und eine Quelle für
Calciumionen zu einem C1-C4-Alkohol
unter Ausbildung einer Lösung
hinzufügt
und den Alkohol entfernt. Zur Herstellung der Lösung wird Pseudomoninsäure in einem
C1-C4-Alkohol gelöst, wobei
Methanol und Ethanol bevorzugt sind. Vorzugsweise wird der Alkohol
im wesentlichen wasserfrei eingesetzt. Die verwendeten Alkohole
enthalten vorzugsweise weniger als etwa 2% Wasser, besonders bevorzugt
weniger als etwa 1% Wasser (Vol./Vol.).
-
Nach dem Herstellen einer Lösung von
Pseudomoninsäure
in dem Alkohol wird eine Base zu der Lösung hinzugefügt, was
zu Pseudomonationen führt.
Basen, wie Natrium- oder Kaliumhydroxid können zum Neutralisieren der
Säure verwendet
werden. Da Neutralisierung einer Säure mit einer Base auf dem
Gebiet gut bekannt ist, wird dem Fachmann auf dem Gebiet klar sein,
daß andere
Alternativen verwendet werden können.
-
Die Menge und Konzentration der verwendeten
Base müssen
nicht genau sein. Es ist die Menge, welche ausreichend ist, um einen
wesentlichen Teil der Pseudomoninsäure zu neutralisieren. Dem
Fachmann auf dem Gebiet ist klar, daß verschiedene Mengen an verwendeter
Base in einem Routineverfahren bestimmt werden können, und Variationen in der
Menge der verwendeten Base verändern
die Ergebnisse nicht.
-
Um amorphes Mupirocin-Calcium zu
erhalten, wird eine Quelle für
Calciumionen zu dem Lösungsmittel
hinzugefügt.
Die vorliegende Erfindung erfordert nur die Hinzufügung von
Calciumionen, und es ist nicht so relevant, mit welchem Ion das
Calcium komplexiert werden kann, solange das andere Ion das Ergebnis
nicht stört.
In einer Ausführungsform
verwendet die vorliegende Erfindung ein Calciumsalz eines Halogens,
wie Calciumchlorid. Die Base und die Quelle für Calciumionen kann eine einzige
chemische Spezies sein, z.B. Calciumoxid, oder zwei verschiedene
chemische Spezies. Der Begriff "eine
Base und eine Quelle für
Calciumionen" umfaßt die Verwendung
einer einzigen chemischen Spezies.
-
Nach der Zugabe aller notwendigen
Bestandteile kann die Lösung
gerührt
werden. Die Lösung
kann von etwa 30 Minuten bis etwa 2 Stunden gerührt werden. Rühren beeinflußt häufig die
Qualität
und Quantität der
Kristalle, was dem Fachmann auf dem Gebiet klar ist.
-
Abhängig von der Base und den Calciumionen,
die verwendet werden, kann eine Trennungsstufe verwendet werden,
um Verunreinigungen zu entfernen, wie z.B. Salze, die infolge des
Vorhandenseins überschüssiger Ionen
in der Lösung
gebildet wird. In einer Ausführungsform
werden Kaliumhydroxid und Calciumchlorid als eine Base und eine
Quelle für
Calciumionen verwendet. Nach Hinzufügung von Kaliumhydroxid und Calciumchlorid
bilden die nicht benötigten
Kalium- und Chloridionen ein Salz, das abgetrennt werden kann. Vorzugsweise
wird ein Filter dazu verwendet, um das gebildete Kaliumchlorid abzutrennen.
-
Das Lösungsmittel wird dann von der
Lösung
entfernt. Besonders bevorzugt wird das Lösungsmittel durch Verdampfen
entfernt. Es können
verschiedene auf dem Gebiet gut bekannte Techniken zum Entfernen des
Lösungsmittels
verwendet werden. Zum Beispiel kann das Lösungsmittel unter Umgebungs-
oder vermindertem Druck verdampft werden, abhängig von der Flüchtigkeit
des Lösungsmittels.
In einer weiteren Ausführungsform
kann die Lösung
erhitzt werden, um die Verdampfung zu beschleunigen. Bei hochflüchtigen
Lösungsmitteln,
wie Methanol, kann die zusätzliche
Stufe des Erhitzens nicht notwendig sein. Das Lösungsmittel kann auch mit einem
Rotationsverdampfer bei Umgebungs- oder vermindertem Druck verdampft
werden.
-
Nach Entfernen des Lösungsmittels
kann der Rückstand
optional getrocknet werden, um die Menge an restlichem Lösungsmittel
zu reduzieren. Trocknen kann nach Verfahren, die auf dem Gebiet
gut bekannt sind, durchgeführt
werden. Der Rückstand
kann bei Umgebungs- oder vermindertem Druck getrocknet werden. Er
kann optional erhitzt werden, um den Trocknungsprozeß zu beschleunigen,
obwohl er nicht über
den Schmelzpunkt des amorphen Mupirocin-Calcium hinaus erhitzt werden
sollte. Vorzugsweise wird das Produkt auf etwa 30°C bis etwa
50°C, besonders
bevorzugt auf nicht mehr als etwa 45°C erhitzt. Es kann ein auf dem Gebiet
bekannter Vakuumofen verwendet werden.
-
In einer weiteren Ausführungsform
wird amorphes Mupirocin-Calcium nach einem Verfahren hergestellt
mit den Stufen, in denen man Pseudomoninsäure, eine Base und eine Quelle
für Calciumionen
zu einem C1-C4-Alkohol
unter Ausbildung einer Lösung
hinzufügt,
ein Anti-Solvent mit der Lösung
vereinigt, um amorphes Mupirocin-Calcium zu präzipitieren, und das Präzipitat
abtrennt. Wie er hierin verwendet wird, hat der Begriff "Anti-Solvent" seine übliche Bedeutung
auf dem Gebiet und bezeichnet eine Flüssigkeit, die zu einem Lösungsmittel
hinzugefügt
wird, um die Löslichkeit
einer Verbindung, wie eines Salzes, in dem Lösungsmittel zu verringern,
was zu einer Präzipitation
des Salzes führt.
Mupirocin-Calcium besitzt niedrige Löslichkeit hinsichtlich des
Anti-Solvents, was bewirkt, daß das
Salz präzipitiert.
Die Lösung
kann hergestellt werden, indem man methanolische Lösungen von
Pseudomoninsäure,
einer Base, wie Kaliumhydroxid, und einer Quelle für Calciumionen,
wie Calciumchlorid, vereinigt. Die resultierende Lösung kann
dann filtriert werden, um Verunreinigungen zu entfernen, wie es
oben beschrieben ist. Bevorzugte Lösungsmittel sind C1-C4-Alkohole,
insbesondere Methanol. Die verwendeten Alkohole haben vorzugsweise
einen Wassergehalt von weniger als etwa 2%, besonders bevorzugt
von weniger als etwa 1 %.
-
Das Anti-Solvent wird dann vorzugsweise
durch Hinzufügen
der Lösung
zu dem Anti-Solvent mit der Lösung
vereinigt. Das Anti-Solvent ist vorzugsweise ein Ether, wobei jedes
Radikal des Ethers aus einer C1-C4-Gruppe ausgewählt ist. Beispiele für solche
Ether sind Düsopropylether
oder Methyl-tbutylether. In einer weiteren Ausführungsform ist das Anti-Solvent
ein Ester, vorzugsweise ein C3-C8-Ester,
wie i-Butylacetat.
-
Das Anti-Solvent wird vorzugsweise
heftig gerührt
bei einer Temperatur von etwa –20°C bis etwa +25°C, vorzugsweise
von etwa –15°C bis etwa
0°C. Vorzugsweise
wird die Lösung
langsam zu dem Anti-Solvent hinzugefügt, z.B. tropfenweise. Der
Begriff Vereinigen umfaßt
solch eine tropfenweise Zugabe. Das resultierende Gemisch kann für etwa 4
bis 24 Stunden gerührt
werden. Es bildet sich ein Präzipitat,
das durch auf dem Gebiet gut bekannte Techniken abgetrennt werden
kann. Das Präzipitat
kann in einem Wirbelschichttrockner oder in einem Vakuumofen bei
einer Temperatur von etwa 35°C
getrocknet werden. Dem Fachmann auf dem Gebiet wird klar sein, daß auch andere
Temperaturen und Bedingungen zum Trocknen des Präzipitats verwendet werden können.
-
In einer alternativen Ausführungsform
wird amorphes Mupirocin-Calcium nach einem Verfahren hergestellt
mit den Stufen, in denen man Pseudomoninsäure, eine Base und eine Quelle
für Calciumionen
zu einem Lösungsmittel,
ausgewählt
aus der Gruppe, bestehend aus Wasser, einem C1-C4-Alkohol und Gemischen davon, unter Ausbildung
einer Lösung
hinzufügt,
und die Lösung
lyophilisiert. Die amorphe Form wird aus der Lösung lyophilisiert oder gefriergetrocknet,
wobei jede Kristallisations- oder Isolierungsstufe, wie vollständige Lösungsmittelenfternung
oder Hinzufügung
eines Anti-Solvent, übersprungen
werden.
-
Zur Lyophilisierung wird bei einer
Ausführungsform
das Lösungsmittel
zu wenigstens etwa 50% wäßrig verwendet.
Das wäßrige Lösungsmittel
ist vorzugsweise Wasser oder ein Gemisch aus Wasser und einem C1-C4-Alkohol. Eine
exakte Menge fürjeden
Bestandteil des Gemisches ist in der vorliegenden Erfindung nicht erforderlich.
Vielmehr sollte das Gemisch genug Wasser aufweisen, daß es von
seiner Beschaffenheit her wäßrig ist.
In einer Ausführungsform
beträgt
das Verhältnis
des Wasser/Lösungsmittel-Gemisches
etwa 1:1 bis 1:2 (Vol./Vol.). In einer weiteren Ausführungsform
beträgt
es etwa 3:1 bis 4:1 Wasser/Lösungsmittel.
Höhere Verhältnisse
von Wasser zu Lösungsmittel
sind im allgemeinen bevorzugt. Der Alkohol ist vorzugsweise ein C1-C4-Alkohol und besonders
bevorzugt Methanol. Theoretisch kann amorphes Mupirocin-Calcium
nur aus Alkohol lyophilisiert werden, aber dieses Verfahren wird
aufgrund von dessen Gesundheitsrisiken vermieden.
-
Die Lösung kann so modifiziert werden,
daß man
eine Lösung
mit Wasser als Lösungsmittel,
welches frei von einem Co-Solvent ist, erhält. Diese Modifikation umfaßt das Entfernen
von Lösungsmitteln,
die nicht Wasser sind, vorzugsweise durch Verdampfen. Organische
Lösungsmittel,
wie Alkohole, insbesondere Methanol, besitzen häufig eine viel höhere Flüchtigkeit
als Wasser. Diese höhere
Flüchtigkeit
macht es möglich,
das organische Lösungsmittel
unter entweder Umgebungs- oder vermindertem Druck zu verdampfen.
Vorzugsweise ist der Druck vermindert.
-
Die Lösung kann optional erhitzt
werden, um den Prozeß zu
beschleunigen, obwohl dies unnötig
ist, wenn man hochflüchtige
Lösungsmittel,
wie Methanol, verwendet. Die Temperatur sollte nicht über den Schmelzpunkt
des amorphen Mupirocin-Calcium hinaus erhöht werden oder irgendwelche
chemischen Reaktionen einleiten.
-
Um den Alkohol im wesentlichen zu
verdampfen, geht bei dem Verfahren wahrscheinlich auch etwas Wasser
verloren. Obwohl Wasser eine niedrigere Flüchtigkeit besitzt, verdampft
es trotzdem mit einer ausreichenden Rate, die einen Verlust von
Wasser bewirkt. Das verlorene Wasser kann ersetzt werden, und optional kann
zusätzliches
Wasser vor dem Gefriertrocknen der Lösung hinzugefügt werden,
um das optimale Volumen für
eine Lyophilisierung zu erhalten.
-
Die Lösung wird nach auf dem Gebiet
gut bekannten Verfahren lyophilisiert. Lyophilisierung ist ein Stabilisierungsverfahren,
bei dem eine Substanz zuerst gefroren und dann die Menge des Lösungsmittels
(im allgemeinen Wasser) zuerst durch Sublimation (was man als den
primären
Trocknungsprozeß bezeichnet)
und dann Desorption (bekannt als der sekundäre Trocknungsprozeß) auf Werte,
die keine chemischen Reaktionen mehr unterstützen, vermindert wird.
-
Dem Fachmann auf dem Gebiet ist klar,
daß viele
Faktoren die Effizienz von Lyophilisierung beeinflussen und die
erhaltene Probe durch Veränderung
dieser Faktoren modifiziert werden kann. Diese Faktoren umfassen
folgende: Oberfläche
der Probe, eutektische Temperatur, Vakuum, Kondensatortemperatur,
Dicke der Probe, Konzentration des gelösten Stoffes und Gerätefaktoren.
-
Eine amorphe Form, die nach dem oben
genannten Verfahren hergestellt wurde, wie durch Lösungsmittelentfernung,
Lyophilisierung oder unter Verwendung von Anti-Solvent, kann dazu
verwendet werden, Mupirocin-Calcium-Dihydrat zu erhalten. Da die
amorphe Form bereits ein Calciumsalz ist, sind eine Neutralisationsstufe
und die Zugabe einer Calciumquelle nicht notwendig. Das Verfahren
kann einfach in einer Stufe durchgeführt werden, indem man die amorphe
Form unter Ausbildung einer wäßrigen Lösung löst und das
Dihydrat aus der wäßrigen Lösung kristallisiert.
Zum Beispiel kann amorphes Mupirocin-Calcium, welches nach dem oben
genannten Verfahren hergestellt wurde, in einem Ethanol/Wasser-Gemisch
gelöst
werden, gefolgt von Entfernen des Ethanols und Kristallisation aus
Wasser zur Gewinnung des Dihydrats.
-
Spezieller kann amorphes Mupirocin-Calcium
zur Herstellung einer Lösung
in Wasser gelöst
werden. Die Temperatur kann auf etwa 5°C vermindert werden, um die
Kristallisation zu beschleunigen. Nach etwa fünf Tagen werden die Kristalle
abgetrennt. Das Dihydrat kann nach auf dem Gebiet gut bekannten
Techniken, wie Filtration, abgetrennt werden. Nach der Abtrennung
kann das Dihydrat mit Wasser gewaschen werden. Vorzugsweise wird
das Dihydrat anschließend
getrocknet. Zum Trocknen kann eine Temperatur von etwa 25°C bis etwa
50°C für einen
ausreichenden Zeitraum angewendet werden.
-
In einer weiteren Ausführungsform
zur Herstellung des Dihydrats aus der amorphen Form wird amorphes
Mupirocin-Calcium in einem mit Wasser mischbaren Lösungsmittel
gelöst.
Vorzugsweise wird ein C1-C4-Alkohol,
wie Methanol und Ethanol, verwendet. Nach der Herstellung einer
Lösung
in einem niedrigeren Alkohol wird die Lösung vorzugsweise mit Wasser
verdünnt.
Der Wassergehalt kann durch Entfernen des Co-Solvents, wie z.B.
durch Verdampfen, erhöht
werden. Vorzugsweise wird das Dihydrat durch Kristallisieren aus
einer Lösung,
die von einem Co-Solvent freies Wasser enthält, gewonnen.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung Mupirocin-Calcium-Dihydrat, hergestellt
mit den Stufen, in denen man Pseudomoninsäure und Calciumoxid zu von
einem Co-Solvent
freiem Wasser unter Ausbildung einer Lösung hinzufügt, wobei Mupirocin-Calcium-Dihydrat
aus der Lösung
präzipitiert, das
Mupirocin-Calcium-Dihydrat abtrennt und optional das Dihydrat in
das Anhydrat umwandelt. Pseudomoninsäure kann in Wasser suspendiert
werden. Calciumoxid kann dann zu der Suspension hinzugefügt werden, gefolgt
von Rühren
und Filtration. Eine Stufe der Entfernung von Co-Solvent ist nicht
notwendig, weil ein Co-Solvent nicht verwendet wird. Das Gemisch
kann auf etwa 5°C
gekühlt
und kristallisieren gelassen werden. Die Kristalle können durch
auf dem Gebiet gut bekannte Techniken abgetrennt werden. Zum Trocknen
der Kristalle kann ein Umluftofen bei Raumtemperatur verwendet werden.
-
Gemäß einem weiteren Aspekt liefert
die vorliegende Erfindung kristallines Mupirocin-Calcium-Dihydrat oder Anhydrat
davon, hergestellt mit den Stufen, in denen man eine Lösung von
Pseudomoninsäure
in einem mit Wasser nicht mischbaren Lösungsmittel herstellt, die
Lösung
mit einer Lösung
oder Suspension eines organischen Calcium-C2-C12-Carboxylats in einem wäßrigen Lösungsmittel unter Ausbildung
einer wäßrigen und
einer nicht-wäßrigen Phase
vereinigt, wobei Mupirocin-Calcium-Dihydrat aus der wäßrigen Phase präzipitiert,
das Präzipitat
abtrennt und optional das Dihydrat in das Anhydrat umwandelt.
-
Pseudomoninsäure wird zuerst in einem Lösungsmittel
gelöst,
das mit Wasser nicht mischbar ist. Ein mit Wasser nicht mischbares
Lösungsmittel
bezeichnet ein Lösungsmittel,
das ein Zweiphasensystem ausbilden kann, wenn es mit einem wäßrigen Lösungsmittel
vereinigt wird. Dem Fachmann auf dem Gebiet ist klar, daß es viele
solcher Lösungsmittel
gibt und daß das
bevorzugte Lösungsmittel
in Abhängigkeit
von dem Wassergehalt des wäßrigen Lösungsmittels
variieren kann. Bevorzugte mit Wasser nicht mischbare Lösungsmittel sind
solche, in denen Pseudomoninsäure
unter Ausbildung einer Lösung
gelöst
werden kann. Vorzugsweise wird Pseudomoninsäure in einem Keton (vorzugsweise
C3-C8), wie t-Butylmethylketon,
einem Ether (vorzugsweise mit Wasser nicht mischbaren Ethern, bei
denen jedes Radikal C1-C4 ist),
wie Methyl-t-butylether, oder einem Ester (vorzugsweise mit Wasser
nicht mischbaren C3-C8-Estern),
wie Ethylacetat, gelöst.
Das Lösungsmittel
kann erhitzt werden, um die Pseudomoninsäure vollständig zu lösen. Vorzugsweise wird das
Lösungsmittel
auf etwa 40°C
bis etwa 50°C
erhitzt.
-
Nach dem Lösen wird eine wäßrige Suspension
oder Lösung,
die das Calciumsalz von einer organischen Carbonsäure enthält, d.h.
Calciumcarboxylat, mit der Lösung
vereinigt. Das Verfahren führt
zu einem Austausch des sauren Protons von Pseudomoninsäure gegen
das Calciumion des Calciumcarboxylats. In einer Ausführungsform
ist das Lösungsmittel
der wäßrigen Suspension
oder Lösung
von einem Co-Solvent freies Wasser.
-
Der Begriff "organische Carbonsäure" ist auf dem Gebiet gut bekannt, und
der Begriff Carboxylat bezeichnet deren geladenes Ion, bei dem das
saure Proton entfernt wurde. Fettsäuren sind Beispiele für organische
Carbonsäuren.
Die verwendeten organischen Carbonsäuren sind verzweigte oder geradkettige C2-C12-Carbonsäuren, wobei
Essig-, Propion- und Hexansäuren
bevorzugt sind und Hexansäure
besonders bevorzugt ist. Vorzugsweise ist die Carbonsäure eine
alkylierte Hexansäure,
wie 2-Ethylhexansäure.
-
Die vorliegende Erfindung umfaßt Ausführungsformen,
bei denen eine Calciumquelle und ein organisches Carboxylat getrennt
hinzugefügt
werden oder wenn die Ionen des organischen Calciumcarboxylats entweder
teilweise oder vollständig
voneinander vor der Herstellung des endgültigen Reaktionsgemisches dissoziiert
wurden. Der Begriff Calciumcarboxylat umfaßt diese Ausführungsform.
-
Nach dem Vereinigen der zwei Flüssigkeiten
wird ein Zweiphasensystem erzeugt. Vorzugsweise wird das Zweiphasensystem
für wenige
Stunden bis zu etwa einem halben Tag gerührt, gefolgt von einer Trennung der
zwei Phasen. Die nicht-wäßrige Phase
kann entfernt werden. Die wäßrige Phase,
welche Mupirocin-Calcium enthält,
kann mit zusätzlichen
mit Wasser nicht mischbaren Lösungsmitteln
extrahiert werden, um jeden Überschuß an organischer
Carbonsäure
zu entfernen. Mupirocin-Calcium-Dihydrat wird dann aus der wäßrigen Phase
kristallisiert. Die wäßrige Phase
kann für
eine optimale Kristallisation vor der Kristallisation mit Wasser
verdünnt
werden. Die resultierende wäßrige Schicht
kann auf etwa 5°C
gekühlt
werden, um die Kristallisation zu beschleunigen. Nach der Kristallisation
kann das Dihydrat durch auf dem Gebiet gut bekannte Techniken, wie
Filtration, abgetrennt werden. Nach der Filtration kann das Dihydrat
optional gewaschen werden. Das Dihydrat kann optional unter vermindertem
Druck bei leicht erhöhten
Temperaturen von etwa 35°C
getrocknet werden, um restliche Lösungsmittel zu entfernen.
-
In einer weiteren Ausführungsform
liefert die vorliegende Erfindung kristallines Mupirocin-Calcium-Dihydrat oder Anhydrat
davon, hergestellt mit den Stufen, in denen man Pseudomoninsäure und
ein organisches Calcium-C2-C12-Carboxylat
zu einem wäßrigen Lösungsmittel
unter Ausbildung einer Lösung
hinzufügt,
wobei sich eine organische C2-C12-Carbonsäure bildet,
die Carbonsäure
entfernt, Mupirocin-Calcium-Dihydrat als ein Präzipitat von dem Lösungsmittel
abtrennt und optional das Dihydrat in das Anhydrat umwandelt.
-
In einer Ausführungsform wird Pseudomoninsäure mit
einem wäßrigen Lösungsmittel,
wie einem Methanol/Wasser-Gemisch, gelöst und mit einer weiteren wäßrigen Lösung, die
das Calciumcarboxylat enthält, vereinigt.
Besonders bevorzugt ist das Carboxylat Calcium-2-ethylhexanoat. Andere Co-Solvenzien,
wie Methanol, können
vorzugsweise durch Verdampfen entfernt werden, um eine Lösung zu
erhalten, die Wasser als ein Lösungsmittel
aufweisen, welches frei von einem Co-Solvent ist. Besonders bevorzugt
verbleibt nur eine Spur von anderen Lösungsmitteln.
-
Nach dem Kontakt bildet sich 2-Ethylhexansäure. Ein
mit Wasser nicht mischbares Lösungsmittel,
wie ein Ester (Ethylacetat), Ether oder Keton kann zum Extrahieren
der Säure
verwendet werden, wobei man ein Zweiphasensystem erhält. Die
wäßrige Phase
wird abgetrennt, vorzugsweise durch Verdampfen konzentriert und
kristallisieren gelassen. Nach einem oder zwei Tagen der Kristallisation
bei etwa Raumtemperatur werden die Kristalle vorzugsweise durch
Filtration abgetrennt. Nach dem Abtrennen können die Kristalle optional
mit Wasser gewaschen werden. Die Kristalle werden vorzugsweise bei
einer Temperatur von etwa 25°C
bis etwa 50°C,
vorzugsweise nicht mehr als 45°C
getrocknet.
-
In einer weiteren Ausführungsform
des Zweiphasensystems liefert die vorliegende Erfindung kristallines
Mupirocin-Calcium-Hydrat oder Anhydrat davon, hergestellt mit den
Stufen, in denen man Pseudomoninsäure in einem mit Wasser nicht
mischbaren Lösungsmittel
unter Ausbildung einer Lösung
löst, die
Lösung
mit einer Lösung
oder Suspension einer Base und einer Quelle für Calciumionen in einem wäßrigen Lösungsmittel unter
Ausbildung einer wäßrigen und
einer nichtwäßrigen Phase
vereinigt, wobei das Dihydrat aus der wäßrigen Phase präzipitiert,
das Dihydrat abtrennt und optional das Dihydrat in das Anhydrat
umwandelt. Geeignete mit Wasser nicht mischbare Lösungsmittel
sind solche, wie sie oben beschrieben sind. Vorzugsweise ist das Lösungsmittel
der wäßrigen Lösung ein
von einem Co-Solvent freies Wasser, zu welchem eine Base und eine Quelle
für Calciumionen,
wie Calciumoxid, hinzugefügt
wurde. Nach dem Mischen bildet sich ein Zweiphasensystem aus. Die
wäßrige Schicht
wird abgetrennt. Mupirocin-Calcium-Dihydrat kann dann aus der wäßrigen Schicht
kristallisiert werden, wie es oben beschrieben ist, z.B. durch Kühlen auf
etwa 5°C
und Kristallisierenlassen.
-
Gemäß einem weiteren Aspekt stellt
die vorliegende Erfindung ein durch Desolvatisieren des Dihydrats
erhältliches
kristallines, wasserfreies Mupirocin-Calcium ("Anhydratform") bereit. Der Begriff "Dihydrat" bezeichnet ein Solvat
von Wasser, bei welchem zwei Wassermoleküle ("Kristallwasser") ein Teil der Kristallstruktur in der
festen Phase sind. Baker et al. offenbaren, daß das Dihydrat bei einer Temperatur
von etwa 70°C desolvatisiert
werden kann. Oder das Dihydrat kann in der Gegenwart eines Trocknungsmittels,
wie Phosphorpentoxid, in einem Temperaturbereich von etwa 18°C bis 80°C für einen
Tag getrocknet werden. Dem Fachmann auf dem Gebiet wird klar sein,
daß auch
andere Bedingungen und Techniken, die auf dem Gebiet bekannt sind,
zum Desolvatisieren des Dihydrats verwendet werden können.
-
Das Verfahren zur Herstellung der
erfindungsgemäßen Produkte
kann auch auf andere Weise beschrieben werden, wie durch Umsetzung
von Pseudomonationen mit Calciumionen in Lösung und anschließendes Lyophilisieren,
Entfernen des Lösungsmittels
oder Verwenden eines Anti-Solvents zum Erhalt der amorphen Form.
-
Die offenbarten PXRD-Daten (1–5)
bestätigen
weiter das Ergebnis der Verfahren. Die PXRD-Daten zeigen ein Muster
für das
Mupirocin-Calcium-Dihydrat.
-
Die folgende Tabelle, Tabelle 3,
erläutert
die Reinheitsdaten für
die Proben aus den Beispielen. Die Reinheitsdaten in der Tabelle
sind Flächenprozentsätze und
nicht Gehaltsbestimmung.
-
Tabelle
3 – Reinheit
von Mupirocin-Calcium-Dihydrat
-
Viele Verfahren zur Herstellung der
erfindungsgemäßen Produkte
umfassen die Kristallisation aus einem bestimmten Lösungsmittel.
Dem Fachmann auf dem Gebiet wird klar sein, daß die Bedingungen in Bezug auf
die Kristallisation modifiziert werden können, ohne die Form des erhaltenen
Polymorphs zu beeinflussen. Wenn man einen gelösten Stoff in einem Lösungsmittel unter
Ausbildung einer Lösung
mischt, kann z.B. ein Erwärmen
des Gemisches notwendig sein, um das Ausgangsmaterial vollständig zu
lösen.
Wenn Erwärmen das
Gemisch nicht klärt,
kann das Gemisch verdünnt
oder filtriert werden. Zum Filtrieren kann das heiße Gemisch
durch Papier, Glasfaser oder ein anderes Membranmaterial oder ein
klärendes
Mittel, wie Kieselgur, hindurchgeleitet werden. Abhängig von
der verwendeten Ausrüstung
und der Konzentration und der Temperatur der Lösung kann es notwendig sein,
die Filtrationsvorrichtung vorzuwärmen, um eine frühzeitige
Kristallisation zu verhindern.
-
Die Bedingungen können auch verändert werden,
um eine Präzipitation
einzuleiten oder zu beschleunigen. Ein bevorzugter Weg zur Einleitung
von Kristallisation besteht darin, die Löslichkeit des Lösungsmittels zu
vermindern. Die Löslichkeit
des Lösungsmittels
kann z.B. durch Kühlen
des Lösungsmittels
vermindert werden.
-
Eine weitere Art und Weise, Kristallisation
zu beschleunigen, besteht darin, mit einem Kristall des Produkts
anzuimpfen oder die innere Oberfläche des Kristallisationsgefäßes mit
einem Glasstab zu kratzen. In anderen Fällen kann Kristallisation spontan
ohne jede Einleitung stattfinden. Die vorliegende Erfindung deckt
beide Ausführungsformen
ab, bei denen Kristallisation induziert/beschleunigt wird oder spontan
stattfindet. Eine getrennte Kristallisationsstufe wird nicht vorgetragen,
um zu betonen, daß Kristallisation
spontan stattfinden kann, aber eine solche Betonung soll nicht den
Umfang der vorliegenden Erfindung gegenüber demjenigen verändern, der
eine Kristallisationsstufe vorschlägt. Dem Fachmann auf dem Gebiet
wird klar sein, daß die
für die
Kristallisation in der vorliegenden Erfindung angegebenen Bedingungen
der Erläuterung
dienen und daß deren
Modifikation nicht notwendigerweise das Ergebnis verändert.
-
Pharmazeutische Zusammensetzungen,
die hochgradig gereinigtes, amorphes Calcium-Mupirocin enthalten
-
Gemäß der vorliegenden Erfindung
wird hochreines Calcium-Mupirocin, einschließlich der amorphen Form, nach
den hierin offenbarten neuen Verfahren hergestellt. Sie können als
pharmazeutische Zusammensetzungen hergestellt werden, die für die Behandlung
von Infektionen, insbesondere sekundär infizierten traumatischen
Hautläsionen,
besonders geeignet sind. Solche Zusammensetzungen umfassen Calcium-Mupirocin,
wie die amorphe Form, mit pharmazeutisch verträglichen Trägern und/oder Arzneistoffträgern, die
dem Fachmann auf dem Gebiet bekannt sind.
-
Zum Beispiel können diese Zusammensetzungen
als Medikamente hergestellt werden, die oral, parenteral, rektal,
transdermal, bukkal oder nasal zu verabreichen sind. Geeignete Formen
für eine
orale Verabreichung umfassen Tabletten, gepreßte oder beschichtete Pillen,
Dragees, Sachets, harte oder Gelatinekapseln, Sublingualtabletten,
Sirupe und Suspensionen. Geeignete Formen zur parenteralen Verabreichung
umfassen eine wäßrige oder
wasserfreie Lösung
oder Emulsion, während
für eine
rektale Verabreichung geeignete Formen für die Verabreichung Suppositorien
mit hydrophilem oder hydrophobem Vehikel umfassen. Für eine topische
Verabreichung stellt die Erfindung geeignete transdermale Verabreichungssysteme
bereit, die auf dem Gebiet bekannt sind, oder Formulierungen, die
für eine
topische Anwendung im wesentlichen lokal verbleiben, und für eine nasale
Verabreichung werden geeigneten Aerosolauslieferungssysteme bereitgestellt, die
auf dem Gebiet bekannt sind.
-
Die topischen Zusammensetzungen der
vorliegenden Erfindung können
hergestellt werden, wie es durch den Stand der Technik gelehrt wird.
Das US-Patent Nr. 4,879,287 wird hierin hinsichtlich der Zusammensetzung
einer topischen Creme aufgenommen. Die Zusammensetzung umfaßt vorzugsweise
weniger als 50% aktiven Bestandteil, besonders bevorzugt weniger
als 10% und ganz besonders bevorzugt etwa 2%. Die Zusammensetzung
kann mit einem Corticosteroidanteil von weniger als etwa 5%, vorzugsweise
weniger als etwa 2% verabreicht werden. Das US-Patent Nr. 4,879,287
kann für
eine vollständige
Beschreibung der Anforderungen an eine topische Creme zu Rate gezogen
werden. Bactroban° kann
ebenfalls als eine Anleitung verwendet werden.
-
Pharmazeutische Zusammensetzungen
der vorliegenden Erfindung enthalten hochgradig gereinigtes Calcium-Mupirocin,
einschließlich
der amorphen Form, optional im Gemisch mit anderen Formen von Mupirocin.
Zusätzlich
zu dem/den aktiven Bestandteil/en können die pharmazeutischen Zusammensetzungen
der vorliegenden Erfindung einen oder mehrere Arzneistoffträger enthalten.
Arzneistoffträger
werden der Zusammensetzung für
vielfältige
Zwecke hinzugefügt.
-
Verdünnungsmittel erhöhen die
Masse einer festen pharmazeutischen Zusammensetzung und können eine
pharmazeutische Dosierungsform, welche die Zusammensetzung enthält, für den Patienten
und den Pflegenden einfacher zu handhaben machen. Verdünnungsmittel
für feste
Zusammensetzungen umfassen z.B. mikrokristalline Zellulose (z.B.
Avicel®),
mikrofeine Zellulose, Lactose, Stärke, vorgelatinierte Stärke, Calciumcarbonat,
Calciumsulfat, Zucker, Dextrate, Dextrin, Dextrose, zweibasisches
Calciumphosphat-dihydrat, dreibasisches Calciumphosphat, Kaolin,
Magnesiumcarbonat, Magnesiumoxid, Maltodextrin, Mannitol, Polymethacrylate
(z.B. Eudragit®),
Kaliumchlorid, pulverförmige
Zellulose, Natriumchlorid, Sorbitol und Talkum.
-
Feste pharmazeutische Zusammensetzungen,
die zu einer Dosierungsform, wie einer Tablette, kompaktiert werden,
können
Arzneistoffträger
umfassen, deren Funktionen umfassen, daß sie helfen, den aktiven Bestandteil
und andere Arzneistoffträger
nach der Kompression zusammenzubinden. Bindemittel für feste pharmazeutische
Zusammensetzungen umfassen Akazie, Alginsäure, Carbomer (z.B. Carbopol),
Carboxymethylzellulose-natrium, Dextrin, Ethylzellulose, Gelatine,
Guargummi, hydriertes Gemüseöl, Hydroxyethylzellulose,
Hydroxypropylzellulose (z.B. Klucel®),
Hydroxypropylmethylzellulose (z.B. Methocel®),
flüssige
Glucose, Magnesium-Aluminium- Silicat,
Maltodextrin, Methylzellulose, Polymethacrylate, Povidon (z.B. Kollidon®,
Plasdone®),
vorgelatinierte Stärke,
Natriumalginat und Stärke.
-
Die Lösungsrate einer kompaktierten
festen pharmazeutischen Zusammensetzung im Magen eines Patienten
kann durch die Hinzufügung
eines Auflösungsmittels
zu der Zusammensetzung erhöht
werden. Auflösungsmittel
umfassen Alginsäure,
Carboxymethylzellulose-calcium, Carboxymethylzellulose-natrium (z.B. Ac-Di-Sol®,
Primellose®),
kolloidales Siliciumdioxid, Croscarmellose-natrium, Crospovidon
(z.B. Kollidon®,
Polyplasdone®),
Guargummi, Magnesium-Aluminium-Silicat,
Methylzellulose, mikrokristalline Zellulose, Polacrilin-Kalium,
gepulverte Zellulose, vorgelatinierte Stärke, Natriumalginat, Natrium-Stärke-Glycolat
(z.B. Explotab®)
und Stärke.
-
Gleitmittel können hinzugefügt werden,
um die Fließfähigkeit
von nicht-kompaktierter fester Zusammensetzung und die Genauigkeit
der Dosierung zu verbessern. Arzneistoffträger, die als Gleitmittel wirken, umfassen
kolloidales Siliciumdioxid, Magnesiumtrisilicat, gepulverte Zellulose,
Stärke,
Talkum und dreibasisches Calciumphosphat.
-
Wenn eine Dosierungsform, wie eine
Tablette, durch Kompaktierung einer gepulverten Zusammensetzung
hergestellt wird, wird die Zusammensetzung einem Druck von einem
Preßwerkzeug
und einer Form ausgesetzt. Einige Arzneistoffträger und aktive Bestandteile
neigen dazu, an den Oberflächen
des Preßwerkzeugs und
der Form zu haften, was dazu führen
kann, daß das
Produkt Löcher
und andere Oberflächenunregelmäßigkeiten
aufweist. Ein Schmierstoff kann zu der Zusammensetzung hinzugefügt werden,
um ein Anhaften zu vermindern und die Freigabe des Produkts aus
der Form zu erleichtern. Schmiermittel umfassen Magnesiumstearat,
Calciumstearat, Glycerylmonostearat, Glycerylpalmitostearat, hydriertes
Rizinusöl,
hydriertes Gemüseöl, Mineralöl, Polyethylenglycol,
Natriumbenzoat, Natriumlaurylsulfat, Natriumstearylfumarat, Stearinsäure, Talkum
und Zinkstearat.
-
Geschmacksstoffe und Geschmacksverstärker machen
die Dosierungsform für
den Patienten schmackhafter. Übliche
Geschmacksstoffe und Geschmacksverstärker für pharmazeutische Produkte,
die in die Zusammensetzung der vorliegenden Erfindung aufgenommen
werden können,
umfassen Maltol, Vanillin, Ethylvanillin, Menthol, Zitronensäure, Fumarsäure, Ethylmaltol
und Weinsäure.
-
Feste und flüssige Zusammensetzungen können auch
unter Verwendung jedes pharmazeutisch verträglichen Farbstoffs gefärbt werden,
um ihr Erscheinungsbild zu verbessern und/oder die Identifikation
des Produkts und der Dosiseinheitmenge zu erleichtern.
-
In flüssigen pharmazeutischen Zusammensetzungen
der vorliegenden Erfindung werden das amorphe Calcium-Mupirocin
und alle anderen festen Arzneistoffträger in einem flüssigen Träger, wie Wasser,
Gemüseöl, Alkohol,
Polyethylenglycol, Propylenglycol oder Glycerin, gelöst oder
suspendiert.
-
Flüssige pharmazeutische Zusammensetzungen
können
Emulgiermittel enthalten, um einen aktiven Bestandteil oder einen
anderen Arzneistoffträger,
der in dem flüssigen
Träger
nicht löslich
ist, gleichmäßig in der
Zusammensetzung zu dispergieren. Emulgiermittel, die in flüssigen Zusammensetzungen
der vorliegenden Erfindung geeignet sind, umfassen z.B. Gelatine,
Eigelb, Kasein, Cholesterol, Akazie, Tragantgummi, Knorpeltang,
Pektin, Methylzellulose, Carbomer, Ketostearylalkohol und Cetylalkohol.
-
Flüssige pharmazeutische Zusammensetzungen
der vorliegenden Erfindung können
auch ein die Viskosität
erhöhendes
Mittel zur Verbesserung des Mundgefühls des Produkts und/oder zur
Beschichtung der Innenwand des Gastrointestinaltraktes enthalten.
Solche Mittel umfassen Akazie, Alginsäurebentonit, Carbomer, Carboxymethylzellulose-calcium
oder -natrium, Ketostearylalkohol, Methylzellulose, Ethylzellulose,
Gelatine, Guargummi, Hydroxyethylzellulose, Hydroxypropylzellulose,
Hydroxypropylmethylzellulose, Maltodextrin, Polyvinylalkohol, Povidin.
Propylencarbonat, Propylenglycolalginat, Natriumalginat, Natriumstärkeglycolat,
Stärketragantgummi
und Xanthangummi.
-
Süßungsmittel,
wie Sorbitol, Saccharin, Natriumsaccharin, Sucrose, Aspartam, Fructose,
Mannitol und Inverszucker, können
zur Verbesserung des Geschmacks hinzugefügt werden.
-
Konservierungsmittel und Chelierungsmittel,
wie Alkohol, Natriumbenzoat, butyliertes Hydroxytoluol, butyliertes
Hydroxyanisol und Ethylendiamintetraessigsäure, können in Mengen, die für eine Nahrungsaufnahme
sicher sind, zur Verbesserung der Lagerungsstabilität hinzugefügt werden.
-
Eine flüssige Zusammensetzung gemäß der vorliegenden
Erfindung kann auch einen Puffer enthalten, wie Gluconsäure, Milchsäure, Zitronensäure oder
Essigsäure,
Natriumgluconat, Natriumlactat, Natriumcitrat oder Natriumacetat.
-
Die Auswahl von Arzneimittelträgern und
die zu verwendenden Mengen können
von dem Formulierungsexperten auf der Grundlage von Erfahrung und
Berücksichtigung
von Standardverfahren und Referenzarbeiten auf dem Gebiet einfach
bestimmt werden.
-
Die festen Zusammensetzungen der
vorliegenden Erfindung umfassen Pulver, Granulate, Aggregate und
kompaktierte Zusammensetzungen. Die Dosierungen umfassen Dosierungen,
die für
orale, bukkale, rektale, parenterale (einschließlich subkutane, intramuskuläre und intravenöse), Inhalations-
und ophthalmische Verabreichung geeignet sind. Die Dosierungen können auf herkömmliche
Weise in Einheitsdosisformen dargestellt und nach einer der auf
dem pharmazeutischen Gebiet gut bekannten Methoden hergestellt werden.
-
Dosierungsformen umfassen feste Dosierungsformen,
wie Tabletten, Pulver, Kapseln, Suppositorien, Sachets, Pastillen
und Pillen, sowie flüssige
Sirupe, Suspensionen und Elixiere.
-
Eine Dosierungsform der vorliegenden
Erfindung ist eine Kapsel, welche die Zusammensetzung enthält, vorzugsweise
eine pulverförmige
oder granulierte Feststoffzusammensetzung der Erfindung, in entweder einer
harten oder einer weichen Hülle.
Die Hülle
kann aus Gelatine hergestellt und optional einen Weichmacher, wie
Glycerin und Sorbitol, und ein Trübungsmittel und einen Farbstoff
enthalten.
-
Der aktive Bestandteil und die Arzneimittelträger können in
Zusammensetzungen und Dosierungsformen nach auf dem Gebiet bekannten
Verfahren formuliert werden.
-
Eine Zusammensetzung für die Tablettenherstellung
oder Kapselbefüllung
kann durch Naßgranulierung
hergestellt werden. Bei der Naßgranulierung
werden einige oder alle der aktiven Bestandteile und der Arzneistoffträger in Pulverform
verschnitten und dann in der Gegenwart einer Flüssigkeit, typischerweise Wasser, welche
bewirkt, daß die
Pulver zu Granulat verklumpen, weiter gemischt. Das Granulat wird
gesiebt und/oder gemahlen, getrocknet und dann gesiebt und/oder
auf die gewünschte
Teilchengröße gemahlen.
Das Granulat kann dann tablettiert werden, oder es können vor
der Tablettierung andere Arzneistoffträger, wie ein Gleitmittel oder
ein Schmiermittel, hinzugefügt
werden.
-
Eine Tablettierungszusammensetzung
kann in herkömmlicher
Weise durch Trockenmischen hergestellt werden. Zum Beispiel kann
die gemischte Zusammensetzung der aktiven Bestandteile und Arzneimittelträger zu einem
Rohling oder einem Bogen kompaktiert und dann zu kompaktierten Körnern zerbrochen
werden. Die kompaktierten Körner
können
anschließend
zu Tabletten komprimiert werden.
-
Als eine Alternative zur Trockengranulierung
kann eine vermischte Zusammensetzung direkt zu einer kompaktierten
Dosierungsform unter Anwendung direkter Kompressionstechniken komprimiert
werden. Direkte Kompression erzeugt eine gleichmäßigere Tablette ohne Körner. Arzneistoffträger, die
für eine
Tablettierung unter direkter Pressung besonders gut geeignet sind,
umfassen mikrokristalline Zellulose, sprühgetrocknete Lactose, Dicalciumphosphatdihydrat
und kolloidale Kieselsäure.
Die richtige Verwendung dieser und anderer Arzneistoftträger bei
der Tablettierung unter direktem Pressen ist denjenigen auf dem
Gebiet mit Erfahrung und Kenntnissen, insbesondere bezüglich Formulierungsanforderungen
an die Tablettierung unter direktem Pressen, bekannt.
-
Eine Kapselfüllung der vorliegenden Erfindung
kann jedes der vorgenannten Gemische und Granulate enthalten, die
unter Bezugnahme auf Tablettierung beschrieben wurden, nur daß sie nicht
einer abschließenden
Tablettierungsstufe unterzogen werden.
-
Eine einzelne orale Dosis von 500
mg Basenäquivalent
wurde gut vertragen, und der Fachmann auf dem Gebiet kann entsprechend
Kapseln, Tabletten und Pillen und andere Einheitsdosierungsformen
entwerfen.
-
Charakterisierungsdaten wurden auf
die folgende Art und Weise erhalten:
-
Thermische Stabilität
-
Als das Verpackungssystem wurde eine
Glasampulle in einer Aluminiumlaminattasche mit Silicagel verwendet.
-
Die relative Feuchte betrug exakt
60%.
-
Wassergehalt
-
Der Wassergehalt wurde nach der Karl-Fischer-Methode
gemessen.
-
Pulverröntgenbeugung
-
- Instrument: Scintag X'TRA-030
Röntgendiffraktometer
- Software: DMSNT
- Die Strahlungsquelle war Kupfer (FK61-1000).
- Röntgengenerator
Modell-20X2988, betrieben bei 45 kV und 40 mA.
- Detektor: Festkörper
- Daten wurden mit einer Abtastrate von 3,00 Grad/Min. in einem
Bereich von 4-40 Grad erhalten, Schrittweite 0,050°, Cnt-Zeit
1 Sekunde.
-
DSC
-
- Mettler TA 3000, DSC 20
- Heizintervall: 25-250°C
- Heizrate: 5°C/min
- Atmosphäre:
Stickstoff, 40 ml/min
- Probenhalter: Al-Tiegel mit Löchern
-
TG
-
- Mettler TA 3000, TG 50
- Heizintervall: 25-250°C
- Heizrate: 5°C/min
- Atmosphäre:
Stickstoff, 40 ml/min
- Probenhalter: Keramik 150 ml
-
IR
-
Perkin Elmer FTIR SPECTRUM 1000 Spektren
wurden im KBr-Preßling
im Bereich von 4000-400 cm–1 gemessen.
-
Bestimmung von
Verunreinigungen von Mupirocin-Calcium
-
Hochdruckflüssigchromatographie (HPLC)
wurde an einem Zorbax® C-8 (5 μm; 250×4,6 mm),
Umkehrphasensäule
mit Ammoniumacetatpufferlösung
in Wasser:Tetrahydrofuran-Gemisch als Elutionsmittel, durchgeführt. Detektiert
durch UV-Spektroskopie bei λ=240
nm.
-
Bestimmung von
Verunreinigungen von Pseudomoninsäure
-
Hochdruckflüssigchromatographie (HPLC)
wurde an einem Hypersil Shandan BDS® C-18
(3 μm; 100×4,6 mm),
Umkehrphasensäule
mit Natriumdihydrogenphosphatpufferlösung in Wasser:Acetonitril-Gemisch
als Gradientenelutionsmittel, durchgeführt. Detektiert durch UV-Spektroskopie bei λ=229 nm.
-
Die Gehaltsbestimmung verwendete
auch die gleichen HPLC-Instrumente.
-
BEISPIELE
-
Beispiel 1
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Amorphes Mupirocin-Calcium (2,50
g, 2,40 mmol) wurde in Wasser (10 ml) gelöst und unter Erhalt einer klaren
Lösung
gerührt.
Die Mupirocin-Calcium-Lösung
wurde für
60 h bei 5°C
kristallisieren gelassen. Das kristalline Produkt wurde filtriert
und mit Wasser (5 ml) gewaschen. Das kristalline Produkt wurde bei
45°C für 6 h getrocknet.
-
Beispiel 2
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Amorphes Mupirocin-Calcium (5,00
g, 4,80 mmol) wurde in Methanol (15 ml) gelöst und unter Erhalt einer klaren
Lösung
gerührt.
Wasser (10 ml) wurde zu der Lösung
hinzugefügt.
Methanol aus der Lösung
wurde unter vermindertem Druck bis zu einem Endvolumen von 7 ml
verdampft. Die Mupirocin-Calcium-Lösung wurde für 60 h bei
5°C kristallisieren
gelassen. Das kristalline Produkt wurde filtriert und mit Wasser
(5 ml) gewaschen. Das Produkt wurde bei 30°C für 12 h getrocknet.
-
Beispiel 3
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure (2,50 g, 10 mmol) wurde
in einem Gemisch aus Methanol und Wasser (30 ml und 30 ml) gelöst. Calcium-2-ethyl-hexanoat
(0,92 g, 5,00 mmol) wurde in einem Gemisch aus Methanol und Wasser
(60 ml und 30 ml) gelöst.
Die Calcium-2-ethyl-hexanoat-Lösung
wurde zu der Pseudomoninsäurelösung hinzugefügt und für 1 h gerührt. Der
Methanol wurde aus der Lösung
bei vermindertem Druck unter Erhalt eines Endvolumens von 60 ml
verdampft. Die 2-Ethyl-hexansäure
wurde mit Ethylacetat (2×40
ml) extrahiert, und die wäßrige Schicht
wurde aus der Lösung
unter vermindertem Druck unter Erhalt eines Endvolumens von 50 ml
verdampft. Die Mupirocin-Calcium-Lösung wurde
für 60
h bei Raumtemperatur kristallisieren gelassen. Das kristalline Produkt
wurde filtriert und mit Wasser (10 cm3)
gewaschen. Das Produkt wurde bei 40°C für 8 h getrocknet.
-
Beispiel 4
-
Herstellung von amorphem
Mupirocin-Calcium
-
Pseudomoninsäure (4000 g, 8 mol) wurde in
Ethanol (10 l) gelöst.
Ethanolische Lösung
von Kaliumhydroxid (448,88 g, 8 mol Kaliumhydroxid und 2,6:1 Ethanol)
und ethanolische Lösung
von Calciumchlorid (443,96 g, 5,0 mmol Calciumchlorid und 2,6:1
Ethanol) wurden zu dem Gemisch hinzugefügt. Das Gemisch wurde für 90 min
gerührt
und dann zur Entfernung von Kaliumchlorid filtriert. Dann wurde
3:1 Ethanol zu der Lösung
hinzugefügt
und der Ethanol bei vermindertem Druck unter Erhalt eines Endvolumens
von 10:1 (Lösung
A) verdampft. Ethanol wurde aus 1400 ml Lösung A unter Rotationsverdampfung
bei vermindertem Druck unter Erhalt eines festen weißen Schaums
verdampft. Das Produkt wurde für
12 h bei 45°C
unter Vakuum getrocknet.
-
Beispiel 5
-
Herstellung
von Mupirocin-Calcium-Dihydrat
-
Wasser (20 ml) wurde zu einem ethanolischen
Konzentrat von Mupirocin-Calcium (50,84 g, ca. 37 m/m%), das allgemein
nach der gleichen Technik wie das frühere Beispiel hergestellt worden
war, hinzugefügt. Der
Ethanol aus der Lösung
wurde unter vermindertem Druck unter Erhalt eines Endvolumens von
20 ml verdampft. Die Mupirocin-Calcium-Lösung wurde für 24 h bei
5°C kristallisieren
gelassen. Das kristalline Produkt wurde filtriert und mit Wasser
(15 ml) gewaschen. Das Produkt wurde bei 30°C für 12 h getrocknet.
-
Das Wasser aus dem Filtrat wurde
unter vermindertem Druck unter Erhalt eines Endvolumens von 5 ml
verdampft. Die Mupirocin-Calcium-Lösung wurde für 24 h bei
5°C kristallisieren
gelassen. Das kristalline Produkt wurde filtriert und mit Wasser
(2×15
ml) gewaschen. Das Produkt wurde bei 30°C für 12 h getrocknet.
-
Beispiel 6
-
Herstellung von Mupirocin-Calcium-Dihydrats
-
Pseudomoninsäure (10 g) wurde in Wasser
(26 ml) suspendiert. Calciumoxid (0,58 g) wurde zu der Suspension
hinzugefügt.
Das Gemisch wurde für
1 h gerührt
und filtriert. Das Gemisch wurde auf 5°C gekühlt. Nach Stehenlassen für 15 h wurde
das kristalline Produkt filtriert und mit gekühltem Wasser (10 ml) gewaschen und
in einem Umluftofen bei Raumtemperatur getrocknet. Mupirocin-Calcium-Dihydrat
(9,4 g, 87%) wurde erhalten.
-
PXRD-Bestätigungsdaten sind angefügt (1).
-
Beispiel 7
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Amorphes Mupirocin-Calcium (14 g)
wurde in Wasser (35 ml) gelöst
und für
1 h gerührt.
Das Gemisch wurde auf 5°C
gekühlt
und für
15 h bei dieser Temperatur gehalten. Dann wurde das Gemisch bei
5°C für 3 h gerührt. Das
kristalline Produkt wurde filtriert und in einem Umluftofen bei
Raumtemperatur getrocknet. Mupirocin-Calcium-Dihydrat (12,5 g, 83%)
wurde erhalten.
-
Beispiel 8
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Amorphes Mupirocin-Calcium (20,00
g, 19,20 mmol) wurde unter Rühren
in Wasser (20 ml) gegeben. Die Aufschlämmung wurde für 0,5 h
gerührt
und dann auf 5°C
gekühlt.
Die Mupirocin-Calcium-Lösung wurde für 16 h kristallisieren
gelassen. Die Kristallaufschlämmung
wurde mit 15 ml Wasser verdünnt,
und die Kristalle wurden filtriert und mit Wasser (5 ml) gewaschen.
Das Produkt (17,1 g) wurde bei 35°C
für 12
h getrocknet.
-
Beispiel 9
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure (10 g) wurde in Isobutylmethylketon
(120 ml) gelöst.
Calciumoxid (0,57 g) wurde in Wasser (68 ml) suspendiert und zu
der Lösung
von Pseudomoninsäure
hinzugefügt.
Das Gemisch wurde für
1 h gerührt,
und die Phasen wurden getrennt. Das Volumen der wäßrigen Phase
wurde auf 40 ml durch Vakuumdestillation reduziert. Das Gemisch
wurde auf 5°C
gekühlt,
und nach Stehenlassen für
15 h wurde das kristalline Produkt filtriert und mit gekühltem Wasser
(10 ml) gewaschen. Das Produkt wurde dann in einem Umluftofen bei
Raumtemperatur getrocknet. Mupirocin-Calcium-Dihydrat (3,7 g, 35%)
wurde erhalten.
-
PXRD-Bestätigungsdaten sind angefügt (2).
-
Beispiel 10
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure (10,00 g, 20 mmol) wurde
in 100 ml Ethylacetat bei 40°C
gelöst.
Calcium-2-ethyl-hexanoat
(3,32 g, 10 mmol) wurde in 25 ml Wasser suspendiert. Die Lösung von
Pseudomoninsäure
wurde zu der Calcium-2-ethyl-hexanoat-Suspension hinzugefügt, und
das resultierende Zweiphasensystem wurde für 14 h gerührt. Die zwei Phasen wurden
dann getrennt, und jegliche Spuren von Ethylacetat wurden aus der
wäßrigen Phase
verdampft. Die wäßrige Mupirocin-Calcium-Suspension
wurde im Kühlschrank
auf 5°C
gekühlt
und präzipitiert.
Das feste Mupirocin-Calcium-Dihydrat wurde anschließend filtriert,
mit 10 ml Wasser gewaschen und unter Vakuum bei 35°C für 14 h getrocknet.
Die Masse des Produkts betrug 7,82 g.
-
PXRD-Bestätigungsdaten sind angefügt (3).
-
Beispiel 11
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure (10,00 g, 20 mmol) wurde
in Methyl-tert-butylether (150 ml) bei 45°C gelöst. Calcium-2-ethyl-hexanoat
(3,32 g, 10 mmol) wurde in Wasser (30 ml) suspendiert. Die Lösung von
Pseudomoninsäure
wurde zu der Calcium-2-ethyl-hexanoat-Suspension hinzugefügt, und
das resultierende Zweiphasensystem wurde für 14 h gerührt. Die zwei Phasen wurden
dann getrennt, und Wasser (20 ml) und Methyl-tert-butylether (50
ml) wurden zu der wäßrigen Phase
hinzugefügt
und für
10 min gerührt.
Die resultierenden zwei Phasen wurden getrennt, und jegliche Spuren
von Methyl-tert-butylether wurden aus der wäßrigen Phase verdampft. Die
wäßrige Mupirocin-Calcium-Suspension wurde
in einem Kühlschrank
bei 5°C
gekühlt.
Das feste Mupirocin-Calcium-Dihydrat wurde filtriert, mit 20 ml
Wasser gewaschen und unter Vakuum bei 35°C für 5 h getrocknet. Die Masse
des Produkts betrug 5,88 g.
-
Beispiel 12
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure (10,00 g, 20 mmol) wurde
in Methyl-tert-butylether (180 ml) bei 40°C gelöst. Calcium-2-ethyl-hexanoat
(3,32 g, 10 mmol) wurde in Wasser (50 ml) suspendiert. (Es ist möglich, eine
Lösung zu
erhalten, indem man eine größere Menge
an Wasser oder ein Alkohol/Wasser-Gemisch verwendet.) Die Lösung von
Pseudomoninsäure
wurde zu der Calcium-2-ethyl-hexanoat-Suspension hinzugefügt, und das Zweiphasensystem
wurde für
24 h gerührt.
Die zwei Phasen wurden getrennt, 50 ml Methyl-tert-butylether wurden
zu der wäßrigen Phase
hinzugefügt
und für
10 min gerührt.
Die zwei resultierenden Phasen wurden getrennt, und der Methyl-tert-butylether
wurde aus der wäßrigen Phase
verdampft. Die wäßrige Mupirocin-Calcium-Suspension
wurde im Kühlschrank
bei 5°C
gekühlt.
Das feste Mupirocin-Calcium-Dihydrat wurde filtriert, mit Wasser
(20 ml) gewaschen und unter Vakuum bei 35°C für 14 h getrocknet. Die Masse
des Produkts betrug 8,65 g. Gehaltsbestimmung: 95,68%; Wasser: 3,48%.
-
Beispiel 13
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure (10,00 g, 20 mmol) wurde
in Isobutylmethylketon (100 ml) bei 40°C gelöst. Calcium-2-ethyl-hexanoat
(3,32 g, 10 mmol) wurde in Wasser (50 ml) suspendiert. (Es ist möglich, eine
Lösung
zu erhalten, indem man eine größere Menge
an Wasser oder ein Alkohol/Wasser-Gemisch verwendet.) Die Lösung von
Pseudomoninsäure
wurde zu der Calcium-2-ethyl-hexanoat-Suspension hinzugefügt, und das Zweiphasensystem
wurde für
24 h gerührt.
Die zwei Phasen wurden dann getrennt, Isobutylmethylketon (25 ml) wurde
zu der wäßrigen Phase
hinzugefügt
und für
10 min gerührt.
Die zwei resultierenden Phasen wurden getrennt, und jegliche Spuren
von Isobutylmethylketon wurden aus der wäßrigen Phase verdampft. Die
wäßrige Mupirocin-Calcium- Suspension wurde
in einem Kühlschrank
bei 5°C
gekühlt.
Das feste Mupirocin-Calcium-Dihydrat wurde filtriert, mit Wasser
(20 ml) gewaschen und unter Vakuum bei 35°C für 14 h getrocknet. Die Masse des
Produkts betrug 7,95 g. Gehaltsbestimmung: 97,72%; Wasser: 3,45%.
-
Beispiel 14
-
Herstellung von Mupirocin-Calcium-Dihydrats
-
Pseudomoninsäure (10,00 g, 20 mmol) wurde
in einem Gemisch aus Methanol (30 ml) und Wasser (15 ml) gelöst. Calcium-2-ethyl-hexanoat
(3,32 g, 10,00 mmol) wurde in einem Gemisch aus Methanol (60 ml) und
Wasser (30 ml) gelöst.
Die Calcium-2-ethyl-hexanoat-Lösung
wurde zu der Pseudomoninsäurelösung hinzugefügt und für 1 h gerührt. Der
Methanol wurde aus der Lösung
bei vermindertem Druck unter Erhalt eines Endvolumens von 45 ml
verdampft. Wasser (15 ml) wurde zu der Lösung hinzugefügt. Die
2-Ethyl-hexansäure wurde
mit Ethylacetat (3×20
ml) extrahiert, und die wäßrige Schicht
wurde aus der Lösung
unter vermindertem Druck unter Erhalt eines Endvolumens von 60 ml
verdampft. Die Mupirocin-Calcium-Lösung wurde für 36 h bei 5°C Temperatur
kristallisieren gelassen. Das kristalline Produkt wurde filtriert
und mit Wasser (10 ml) gewaschen. Das Produkt (3,6 g) wurde bei
35°C für 8 h getrocknet.
-
Gehaltsbestimmung: 96,9%
-
Wasser: 3,0%.
-
(Diese Gehaltsbestimmung ist anders
ausgedrückt
als solche für
die amorphe Form. In diesem Zusammenhang sollte Tabelle 1 konsultiert
werden.)
-
Beispiel 15
-
Herstellung von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure (50,00 g, 0,10 mol) wurde
in Methanol (150 ml) gelöst.
Calcium-2-ethylhexanoat (15,92 g, 48,00 mmol) wurde in einem Gemisch
aus Methanol/Wasser (250 ml und 125 ml) suspendiert. Die Pseudomoninsäurelösung wurde
zu der Calcium-2-ethyl-hexanoat-Lösung hinzugefügt und für 1 h gerührt. Der
Methanol wurde aus der Lösung
bei vermindertem Druck unter Erhalt eines Endvolumens von 125 ml
verdampft. Die 2-Ethyl-hexansäure
wurde mit Ethylacetat (4×50
ml) extrahiert, und die wäßrige Schicht
wurde aus der Lösung
bei vermindertem Druck unter Erhalt eines Endvolumens von 125 ml
verdampft. Die Mupirocin-Calcium-Lösung wurde für 48 h bei
5°C Temperatur
kristallisieren gelassen. Das kristalline Produkt wurde filtriert und
mit Wasser (10 ml) gewaschen. Das Produkt (18,4 g) wurde bei 35°C für 8 h getrocknet.
-
PXRD-Bestätigungsdaten sind angefügt (4).
-
Beispiel 16
-
Herstellung
von Mupirocin-Calcium-Dihydrat
-
Pseudomoninsäure wurde in Isobutylacetat
(130 ml) gelöst.
Calciumoxid (29 g) wurde in Wasser (32 ml) suspendiert und zu der
Lösung
von Pseudomoninsäure
hinzugefügt.
Das Gemisch wurde für
2 h gerührt, und
die Phasen wurden getrennt. Das Volumen der wäßrigen Phase wurde durch Vakuumdestillation
auf 15 ml reduziert. Das Gemisch wurde auf 5°C gekühlt. Nach Rühren für 2 h wurde das kristalline
Produkt filtriert und mit gekühltem
Wasser (5 ml) gewaschen. Das Produkt wurde in einem Umluftofen bei
Raumtemperatur getrocknet. Mupirocin-Calcium-Dihydrat (3,3 g, 62%)
wurde erhalten.
-
Beispiel 17
-
Herstellung von amorphem
Mupirocin-Calcium
-
Pseudomoninsäure (5,00 g, 10 mmol) wurde
in Methanol (5,5 ml) gelöst,
und methanolische Lösung von
Kaliumhydroxid (0,56 g, 10 mmol Kaliumhydroxid und 4 ml Methanol)
und methanolische Lösung
von Calciumchlorid (0,56 g, 5,0 mmol Calciumchlorid und 5 ml Methanol)
wurden zu dem Gemisch hinzugefügt.
Das Gemisch wurde für
1 h gerührt.
Die Lösung
wurde dann filtriert, um Kaliumchlorid (0,60 g) zu entfernen. Der Methanol
wurde dann bei vermindertem Druck unter Erhalt eines festen, weißen Schaums
verdampft. Das Produkt wurde für
12 h bei 45°C
unter Vakuum unter Erhalt von 4,85 g Endprodukt getrocknet. Gehaltsbestimmung:
95,9%; Wasser: 2,23% [Gesamtverunreinigung: 3,19%, höchste Verunreinigung:
1,23% – anderes
Verfahren als die Gehaltsbestimmung], Schmelzpunkt: 85-89°C.
-
Beispiel 18
-
Herstellung von amorphem
Mupirocin-Calcium
-
Pseudomoninsäure (5,00 g, 10 mmol) wurde
in Ethanol (20 ml) gelöst
und ethanolische Lösung
von Kaliumhydroxid (0,56 g, 10 mmol Kaliumhydroxid und 10 ml Ethanol)
und ethanolische Lösung
von Calciumchlorid (0,56 g, 5,0 mmol Calciumchlorid und 10 ml Ethanol)
wurden zu dem Gemisch hinzugefügt.
Das Gemisch wurde für
1 h gerührt,
und die Lösung
wurde filtriert, um Kaliumchlorid (0,51 g) zu entfernen. Der Ethanol wurde
anschließend
unter vermindertem Druck unter Erhalt eines festen, weißen Schaums
verdampft. Das Produkt wurde für
12 h bei 45°C
unter Vakuum getrocknet. Das Produkt hatte eine Masse von 4,38 g.
Gehaltsbestimmung: 99,1%; Wasser: 2,36% [Gesamtverunreinigung: 2,44%,
höchste
Verunreinigung: 1,10% – anderes
Verfahren als die Gehaltsbestimmung].
-
Beispiel 19
-
Herstellung von amorphem
Mupirocin-Calcium
-
Pseudomoninsäure (4000 g, 8 mol) wurde in
Ethanol (10 1) gelöst
und ethanolische Lösung
von Kaliumhydroxid (448,88 g, 8 mol Kaliumhydroxid und 2,6:1 Ethanol)
und ethanolische Lösung
von Calciumchlorid (443,96 g, 5,0 mmol Calciumchlorid und 2,6:1
Ethanol) wurden zu dem Gemisch hinzugefügt. Das Gemisch wurde für 90 Minuten
gerührt,
und die Lösung
wurde filtriert, um Kaliumchlorid zu entfernen. Ethanol wurde zu der
Lösung
in einem Verhältnis
von 1:3 hinzugefügt,
und der Ethanol wurde unter vermindertem Druck unter Erhalt eines
Endvolumens von 10:1 (Lösung
A) verdampft.
-
Ethanol wurde aus Lösung A (350
ml) mit Rotationsverdampfung unter vermindertem Druck unter Erhalt
eines festen, weißen
Schaums verdampft. Das Produkt wurde für 12 h bei 45°C unter Vakuum
unter Erhalt eines Endprodukts mit einer Masse von 110,02 g getrocknet.
-
Gehaltsbestimmung: 98,2%; Wasser:
0,36%, Schmelzpunkt: 84-86°C.
-
Ethanol wurde aus 1400 ml Lösung A mit
Rotationsverdampfung unter vermindertem Druck unter Erhalt eines
festen, weißen
Schaums verdampft. Das Produkt wurde für 12 h bei 45°C unter Vakuum
unter Erhalt einer Masse von 513,18 g getrocknet.
-
Gehaltsbestimmung: 96,8% [Gesamtverunreinigung:
3,66%, höchste
Verunreinigung: 1,29% – anderes
Verfahren als die Gehaltsbestimmung], Schmelzpunkt: 85-86°C.
-
Beispiel 20
-
Herstellung von amorphem
Mupirocin-Calcium
-
Pseudomoninsäure (220 g) wurde in Methanol
(210 ml), der bei 25-27°C
gehalten wurde, gelöst.
Getrennt davon wurde Kaliumhydroxid (27,9 g) in Methanol (154 ml)
gelöst.
Ebenfalls getrennt wurde Calciumchlorid (24,39 g) in Methanol (133
ml) gelöst.
Die Kaliumhydroxidlösung
wurde zu der Pseudomoninsäurelösung hinzugefügt, bis
ein pH-Wert von 9,4-9,5 erreicht wurde (es wurden 147 ml Kaliumhydroxidlösung hinzugefügt). Die
Calciumchloridlösung
wurde dann zu der Mupirocin-Kalium-Lösung hinzugefügt, bis
ein pH-Wert von 7,6-7,7 erreicht wurde (es wurden 128 ml Calciumchloridlösung hinzugefügt). Die
Lösung
wurde bei 24-25°C
für 1 h
gerührt.
Kaliumchlorid wurde filtriert, und die Lösung wurde als Lösung B markiert.
Lösung
B (25 ml) wurde zu Düsopropylether
(250 ml) bei –7°C unter Rühren hinzugefügt. Festes
amorphes Mupirocin-Calcium präzipitierte
aus der Lösung
und wurde bei –7°C für 3 h gerührt. Das
feste Produkt wurde filtriert und mit kaltem Düsopropylether (10 ml) gewaschen.
Das Produkt wurde in einem Wirbelschichttrockner für 6 h bei
35°C und
anschließend
in einem Vakuumofen für
12 h bei 35°C
getrocknet.
-
Beispiel 21
-
Herstellung
von amorphem Mupirocin-Calcium durch Lyophilisierunq
-
Pseudomoninsäure (10,01 g, 20 mmol) wurde
in einem Gemisch aus Methanol/Wasser (50 ml und 36 ml) gelöst. Calciumoxid
(0,78 g, 14 mmol) wurde portionsweise zu dem Gemisch hinzugefügt und für 1 h gerührt. Die
Lösung
wurde filtriert, und der Methanol wurde aus dem Filtrat unter vermindertem
Druck unter Erhalt eines Endvolumens von 30 ml verdampft. Wasser
(20 ml) wurde zu der Lösung
hinzugefügt.
Anschließend wurde
die Lösung
gefriergetrocknet unter Erhalt von 9,11 g Produkt.
-
Gehaltsbestimmung: 100%; Wasser:
1,59%, Schmelzpunkt: 84-86°C
[Gesamtverunreinigung: 2,64%, höchste
Verunreinigung: 1,35% – anderes
Verfahren als die Gehaltsbestimmung], Schmelzpunkt: 84-86°C.
-
Indem die Erfindung so unter Bezugnahme
auf bestimmte bevorzugte Ausführungsformen
beschrieben und anhand von Beispielen erläutert wurde, erkennen Fachleute
auf dem Gebiet Modifikationen an der Erfindung als beschrieben und
erläutert,
die von dem Gedanken und dem Umfang der Erfindung, wie sie in der Beschreibung
offenbart ist, nicht abweichen. Die Beispiele sind dazu angegeben,
das Verständnis
der Erfindung zu unterstützen,
aber sie sind nicht dazu beabsichtigt und sollten auch nicht so
verstanden werden, daß sie
auf irgendeine Weise ihren Umfang beschränken. Die Beispiele enthalten
keine ausführlichen
Beschreibungen herkömmlicher
Verfahren. Solche Verfahren sind den Fachleuten auf dem Gebiet gut
bekannt und in vielen Veröffentlichungen
beschrieben. Ausführliche
Beschreibungen herkömmlicher
Verfahren, die sich mit Festkörperchemie
befassen, werden in Polymorphism in Pharmaceutical Solids, Drugs
and the Pharmaceutical Sciences, Band 95, diskutiert. Alle Literaturstellen,
die hierin erwähnt
sind, sind in ihrer Gesamtheit aufgenommen.