-
Hintergrund der Erfindung
-
1. Gebiet der Erfindung
-
Die vorliegende Erfindung betrifft ein Verfahren zur Abtrennung eines polycyclischen Diols durch Destillation aus einer Mischung, die das polycyclische Diol und mindestens eine Aldehyd-Verbindung als Verunreinigung enthält.
-
2. Beschreibung des Stands der Technik
-
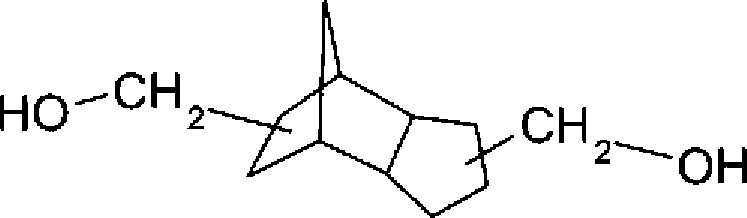
Kommerziell erhältliche polycyclische Diole, beispielsweise Tricyclo[5.2.1.0
2,6]decan-dimethanol (TCDDM), dargestellt durch die folgende Formel:
enthält üblicherweise Aldehyd-Zwischenprodukte wie
und
als Verunreinigungen in einem Anteil von 3875 bis 8000 ppm ausgedrückt als Carbonyl in den Aldehyd-Verunreinigungen. Zur Reinigung von TCDDM bis auf einen Aldehyd-Verunreinigungsgehalt entsprechend 2500 ppm Carbonyl oder weniger wird üblicherweise eine Methode verwendet, bei der TCDDM in einem organischen Lösungsmittel wie Alkohol gelöst, in Gegenwart eines Katalysators katalytisch hydriert und dann destilliert wird. Diese Methode erfordert jedoch einen zusätzlichen Schritt der katalytischen Hydrierung, erfordert die Verwendung und Rückgewinnung des organischen Lösungsmittels und führt mit großer Wahrscheinlichkeit zur Bildung anderer Verunreinigungen und ist daher wirtschaftlich unvorteilhaft.
-
Wie oben beschrieben, enthalten kommerziell erhältliche polycyclische Diole Aldehyd-Verbindungen (Vorläufer oder Zwischenprodukte der polycyclischen Diole) als Verunreinigungen. Da die Siedepunkte dieser Aldehyd-Verbindungen nahe bei denen der polycyclischen Diole liegen, können die Aldehyd-Verbindungen durch übliche Destillationsmethoden nicht effektiv aus den polycyclischen Diolen entfernt werden. Zusätzlich verursachen die verbleibenden Aldehyd-Verbindungen Verfärbung oder Vergilbung während einer Ester-Austausch-Polymerisation unter Verwendung der polycyclischen Diole als Monomer-Komponente, da die Aldehyd-Verbindungen hochreaktiv sind.
-
Die
JP-A-59-157038 beschreibt ein Verfahren zur Destillation von polycyclischen Diolen unter Zugabe von Polyethylenglykol und Polypropylenglykol und deren intermolekularem Kondensationsprodukt.
-
In der
DE 195 06 280 A1 wird die Reinigung von C3 bis C10 Alkoholen in Gegenwart von Alkalihydroxid bei Umgebungsdruck oder 100 mbar beschrieben.
-
Die
US 2,889,375 beschreibt ein Verfahren zur Behandlung spezieller Alkohole, die durch Hydroformulierung eines Olefins mit 4 bis 20 Kohlenstoffatomen und anschließender Hydrierung hergestellt werden.
-
Zusammenfassung der Erfindung
-
Als Ergebnis einer umfangreichen Untersuchung im Hinblick auf die Entwicklung einer Methode zur Reinigung des polycyclischen Diols durch Destillation haben die Erfinder gefunden, daß die Aldehydverbindungs-Verunreinigungen durch Destillation des polycyclischen Diols in Gegenwart von 200 bis 5000 ppm einer Alkalimetall-Verbindung und/oder einer Erdalkalimetall-Verbindung effizient entfernt werden können. Die vorliegende Erfindung wurde auf der Basis dieses Befunds erzielt.
-
Daher stellt die vorliegende Erfindung ein Verfahren zur Reinigung eines polycyclischen Diols, das ausgewählt wird aus der aus Tricyclodecandimethanol, Bicycloheptandimethanol, Decalindimethanol, Pentacyclopentadecandimethanol und Norbornendimethanol bestehenden Gruppe, bereit, welches Destillieren eines Gemisches des polycyclischen Diols und mindestens einer Aldehyd-Verbindung als Verunreinigung in Gegenwart einer Alkalimetall-Verbindung und/oder einer Erdalkalimetall-Verbindung in einem Anteil von 200 bis 5000 ppm bezogen auf das polycyclische Diol umfasst, wodurch die Aldehyd-Verbindung aus dem polycyclischen Diol entfernt wird,
wobei die Destillation bei 180 bis 230°C unter reduziertem Druck von 13,33 bis 1.999,84 Pa (0,1 bis 15 mmHg) durchgeführt wird, und
die Alkalimetall-Verbindung ausgewählt wird aus der Gruppe bestehend aus Natriumhydroxid, Kaliumhydroxid, Cäsiumhydroxid, Lithiumhydroxid, Natriumhydrogencarbonat, Natriumcarbonat, Kaliumcarbonat, Cäsiumcarbonat, Lithiumcarbonat, Natriumacetat, Kaliumacetat, Cäsiumacetat, Lithiumacetat, Natriumstearat, Kaliumstearat, Cäsiumstearat, Lithiumstearat, Natriumborhydrid, Natriumphenylborat, Natriumbenzoat, Kaliumbenzoat, Cäsiumbenzoat, Lithiumbenzoat, Dinatriumhydrogenphosphat, Dikaliumhydrogenphosphat, Dilithiumhydrogenphosphat, Dinatriumphenylphosphat, Dinatriumsalz von Bisphenol A, Dikaliumsalz von Bisphenol A, Dicäsiumsalz von Bisphenol A, Dilithiumsalz von Bisphenol A, Natriumphenolat, Kaliumphenolat, Cäsiumphenolat und Lithiumphenolat, und
die Erdalkalimetall-Verbindung ausgewählt wird aus der Gruppe bestehend aus Magnesiumhydroxid, Calciumhydroxid, Strontiumhydroxid, Bariumhydroxid, Magnesiumhydrogencarbonat, Calciumhydrogencarbonat, Strontiumhydrogencarbonat, Bariumhydrogencarbonat, Magnesiumacetat,Calciumacetat, Strontiumacetat, Bariumacetat, Magnesiumstearat, Calciumstearat, Calciumbenzoat und Magnesiumphenylphosphat.
-
Detaillierte Beschreibung der Erfindung
-
Die erfindungsgemäße Destillation des polycyclischen Diols, das ausgewählt wird aus der aus Tricyclodecandimethanol,Bicycloheptandimethanol,Decalindimethanol, Pentacyclopentadecandimethanol und Norbornendimethanol bestehenden Gruppe, wird im Folgenden in größerem Detail beschrieben.
-
Die Reinigungsmethode der vorliegenden Erfindung ist charakterisiert durch Destillieren eines rohen polycyclischen Diols, enthaltend mindestens eine Aldehyd-Verbindung als Verunreinigungen, in Gegenwart von 200 bis 5000 ppm einer Alkalimetall-Verbindung und/oder einer Erdalkalimetall-Verbindung, wodurch die Aldehydverbindungs-Verunreinigungen effizient aus dem polycyclischen Diol entfernt werden.
-
Das in dieser Erfindung in Bezug genommene polycyclische Diol ist Tricyclodecandimethanol, Bicycloheptandimethanol, Decalindimethanol, Pentacyclopentadecandimethanol, Norbornendimethanol, und insbesondere 3,8-Bis(hydroxymethyl)-tricyclo[5.2.1.02,6]decan und 4,9-Bis(hydroxymethyl)-tricyclo[5.2.1.02,6]decan.
-
Die erfindungsgemäß verwendbare Alkalimetall-Verbindung wird ausgewählt aus der Gruppe, bestehend aus Natriumhydroxid, Kaliumhydroxid, Cäsiumhydroxid, Lithiumhydroxid, Natriumhydrogencarbonat, Natriumcarbonat, Kaliumcarbonat, Cäsiumcarbonat, Lithiumcarbonat, Natriumacetat, Kaliumacetat, Cäsiumacetat, Lithiumacetat, Natriumstearat, Kaliumstearat, Cäsiumstearat, Lithiumstearat, Natriumborhydrid, Natriumphenylborat, Natriumbenzoat, Kaliumbenzoat, Cäsiumbenzoat, Lithiumbenzoat, Dinatriumhydrogenphosphat, Dikaliumhydrogenphosphat, Dilithiumhydrogenphosphat, Dinatriumphenylphosphat, Dinatriumsalz von Bisphenol A, Dikaliumsalz von Bisphenol A, Dicäsiumsalz von Bisphenol A, Dilithiumsalz von Bisphenol A, Natriumphenolat, Kaliumphenolat, Cäsiumphenolat und Lithiumphenolat. Besonders bevorzugt ist Kaliumhydroxid.
-
Die erfindungsgemäß verwendbare Erdalkalimetall-Verbindung wird ausgewählt aus der Gruppe, bestehend aus Magnesiumhydroxid, Calciumhydroxid, Strontiumhydroxid, Bariumhydroxid, Magnesiumhydrogencarbonat, Calciumhydrogencarbonat, Strontiumhydrogencarbonat, Bariumhydrogencarbonat, Magnesiumacetat, Calciumacetat, Strontiumacetat, Bariumacetat, Magnesiumstearat, Calciumstearat, Calciumbenzoat und Magnesiumphenylphosphat.
-
Diese Alkalimetall-Verbindung und/oder Erdalkalimetall-Verbindung kann allein oder in Kombination von zwei oder mehr in Form eines Feststoffs oder einer Lösung in Wasser oder einem niedrigen Alkohol wie Methanol und Ethanol oder einem Gemisch davon verwendet werden. Die Konzentration der Lösung ist nicht speziell beschränkt. Die verwendete Menge der Alkalimetall-Verbindung und/oder der Erdalkalimetall-Verbindung ist 200 bis 5000 ppm, bevorzugt 500 bis 2000 ppm insgesamt bezogen auf das polycyclische Diol.
-
Die Destillation der Aldehyd-Verunreinigungen enthaltenden polycyclischen Diole wird wie unten beschrieben durchgeführt, obwohl sie nicht strikt darauf beschränkt ist.
-
Eine feste Alkalimetall-Verbindung und/oder Erdalkalimetall-Verbindung oder eine wäßrige oder alkoholische Lösung davon mit einer Konzentration von 1 bis 30 Gew.-% wird im polycyclischen Diol in einem Anteil von 200 bis 5000 ppm bezogen auf das polycyclische Diol gelöst. Die resultierende Lösung wird bei 180 bis 230°C unter einem reduzierten Druck von 13,33 bis 1.999,84 Pa (0,1 bis 15 mmHg) destilliert. Es ist bevorzugt, das Anfangsdestillat (etwa 5 bis 20% der gesamten destillierten Lösung) zu verwerfen und das nachfolgende Hauptdestillat (etwa 80 bis 95% der gesamten destillierten Lösung) als gereinigtes polycyclisches Diol zu isolieren. Die Aldehyd-Konzentration im nach der erfindungsgemäßen Methode gereinigten polycyclischen Diol ist geringer als die Nachweisgrenze, d. h. 25 ppm als Carbonylgruppe.
-
Das so erhaltene gereinigte polycyclische Diol wird bevorzugt als Diol-Komponente zur Herstellung verschiedener Polymere, insbesondere von Polycarbonaten, mit weniger Vergilbung verwendet.
-
Die vorliegende Erfindung wird in größerem Detail unter Bezug auf das folgende Beispiel erläutert, welches nicht so aufgefaßt werden soll, daß es den Umfang der vorliegenden Erfindung beschränkt.
-
Aldehydgehalt
-
Der Gehalt an Aldehyd-Verunreinigungen (Carbonylgehalt) im polycyclischen Diol wurde bestimmt durch Absorptionsspektrophotometrie eines Hydrazons, das durch Reaktion von 2,4-Dinitrophenylhydrazin und dem Carbonyl der Aldehyd-Verunreinigungen entsprechend dem folgenden Reaktionsschema erhalten wurde.
-
1. Herstellung von Reagentien
-
Carbonyl-freies Methanol (MeOH)
-
In 500 ml garantiertes Methanol wurden etwa 5 g 2,4-Dinitrophenylhydrazin und einige Tropfen konzentrierte Salzsäure gegeben. Nach Kochen der Methanolmischung während 2 Stunden wurde das Methanol einer fraktionierten Destillation unterzogen. Die isolierte Fraktion wurde dicht verschlossen und im Kühlschrank gelagert.
-
2,4-Dinitrophenylhydrazin (DNP)
-
2,4-Dinitrophenylhydrazin wurde zweimal durch Umkristallisation aus dem Carbonyl-freien Methanol gereinigt. Die erhaltenen Kristalle wurden im Vakuum getrocknet und im Kühlschrank gelagert, während sie gegen das Licht durch Aluminiumfolie abgeschirmt wurden.
-
Gesättigte DNP Lösung
-
In 100 ml-Erlenmeyer-Kolben mit Schliffstopfen wurden 0,165 g DNP und 50 ml MeOH gegeben. Der Inhalt wurde auf einem Wasserbad während 30 Minuten unter Rühren auf 50°C erhitzt, während mindestens einer Stunde zum Abkühlen bei Raumtemperatur stehengelassen und durch ein 5A-Filterpapier filtriert. Die Lösung wurde unmittelbar vor ihrer Verwendung hergestellt und durch Aluminiumfolie gegen Licht geschützt.
-
10 Gew.-%ige KOH-Lösung
-
In eine Polymerflasche gegebenes KOH wurde mit deionisiertem Wasser verdünnt.
-
2. Absorptions-Spektrophotometrie
-
Nach exakter Einwaage einer Probe TCDDM (40 bis 42 mg) in ein Schraubreagenzglas wurde 1 ml carbonylfreies Methanol (MeOH) zugegeben. Nach vollständigem Lösen wurden weiter 1 ml gesättigte DNP-Lösung und zwei Tropfen Salzsäure dazugegeben, und das Reagenzglas wurde während 10 Sekunden geschüttelt.
-
Nach dichtem Verschließen wurde das Reagenzglas in einem Trockner während 5 Minuten auf 100°C erhitzt, während 10 Sekunden geschüttelt und dann während 30 Minuten stehengelassen. Nach Abkühlen auf Raumtemperatur wurden 5 ml MeOH in das Reagenzglas gegeben, welches weiter während 10 Sekunden geschüttelt wurde.
-
Dann wurden 4 ml 10 Gew.-%ige KOH-Lösung in das Reagenzglas gegeben, welches während 60 Sekunden geschüttelt wurde, wodurch eine Probelösung für die Absorptions-Spektrophotometrie hergestellt wurde. Eine Lösung für die Blindprobe wurde auf dieselbe Weise hergestellt, wobei TCDDM weggelassen wurde.
-
Nach Stehenlassen jeder Probe während 1 bis 1,5 Stunden zur Stabilisierung der Farbentwicklung wurde die Absorption jeder Probelösung im Bereich von 400 bis 650 nm gemessen.
-
Die Meßergebnisse wurde durch eine Eichkurve kalibriert, die unter Verwendung von Benzaldehyd erhalten wurde, wodurch der Gehalt an Aldehyd-Verunreinigungen (Carbonylgehalt) in der Probe TCDDM berechnet wurde.
-
Beispiel 1 (TCDDM-A)
-
TCDDM (Tricyclo[5.2.1.02,6]decandimethanol) mit einem Carbonylgehalt von 3875 bis 8000 ppm (erhältlich von Hoechst Celanese Co., Ltd.) wurde verwendet. Ein Gemisch von 328,8 g TCDDM und 0,7 g 20%iger Kaliumhydroxidlösung in Methanol wurde bei 190°C unter einem reduzierten Druck von 42,66 Pa (0,32 mmHg) destilliert. Die Destillations-Temperatur war 151°C. Das Anfangsdestillat, 90,0 g (28,0%) wurde verworfen, und 193,0 g (58,6%) des nachfolgenden Destillats wurde als Hauptfraktion gesammelt. Der Rückstand im Kolben war 28,1 g (8,5%). Der Carbonylgehalt des destillierten TCDDM (TCDDM-A) war niedriger als die Nachweisgrenze (25 ppm).
-
Vergleichsbeispiel 1 (TCDDM-B)
-
TCDDM wurde auf dieselbe Weise wie in Beispiel 1 destilliert mit der Ausnahme, daß die Zugabe von Kaliumhydroxid weggelassen wurde. Der Carbonylgehalt des destillierten TCDDM (TCDDM-B) war 6982 ppm.
-
Referenzbeispiel 1
-
In einen 300 ml Vierhalskolben mit Rührvorrichtung und Destillationsvorrichtung wurden 26,8 g (0,10 Mol) Bisphenol Z (BPZ), 22,8 g (0,10 Mol) TCDDM-A, 43,3 g (0,202 Mol) Diphenylcarbonat und 6,0 × 10–7 Mol Natriumhydrogencarbonat gegeben. Der Inhalt wurde unter Stickstoffatmosphäre auf 180°C erhitzt und während 30 Minuten gerührt. Dann wurde der Druck auf 19.998,36 Pa (150 mmHg) reduziert, während die Temperatur mit einer Temperatur-Erhöhungsgeschwindigkeit von 60°C/Stunde auf 200°C erhöht wurde, wodurch der Verlauf der Esteraustauschreaktion ermöglicht wurde. Die Temperatur wurde weiter auf 240°C erhöht, während Phenol abdestilliert wurde. Nach Halten der Temperatur bei 240°C während 10 Minuten wurde der Druck während 1 Stunde auf 133,32 Pa (1 mmHg) oder niedriger reduziert. Die Reaktion wurde insgesamt während 6 Stunden unter Rühren durchgeführt, und dann wurde der Druck durch Einleiten von Stickstoff in den Reaktor auf Normaldruck zurückgeführt, wodurch Polycarbonat erhalten wurde. Die Eigenschaften des Polycarbonats sind in Tabelle 1 gezeigt.
-
Referenzbeispiel 2
-
Dasselbe Verfahren wie in Referenzbeispiel 1 wurde wiederholt mit der Ausnahme, daß 34,2 g (0,15 Mol) BPA (Bisphenol A) und 11,4 g (0,05 Mol) TCDDM-A verwendet wurden, wobei ein BPA-TCDDM-Copolycarbonat erhalten wurde. Die Eigenschaften des Polycarbonats sind in Tabelle 1 gezeigt.
-
Referenzbeispiel 3
-
Dasselbe Verfahren wie in Referenzbeispiel 1 wurde wiederholt mit der Ausnahme, daß 13,7g (0,06 Mol) zu BPA und 31,9 g (0,14 Mol) TCDDM-A verwendet wurden, wobei ein BPA-TCDDM-Copolycarbonat erhalten wurde. Die Eigenschaften des Polycarbonats sind in Tabelle 1 gezeigt.
-
Referenzbeispiel 4
-
Dasselbe Verfahren wie in Referenzbeispiel 1 wurde wiederholt mit der Ausnahme, daß 11,4 g (0,05 Mol) BPA, 13,4 g (0,05 Mol) BPZ und 22,8 g (0,10 Mol) TCDDM-A verwendet wurden, wobei ein BPA-BPZ-TCDDM-Copolycarbonat erhalten wurde. Die Eigenschaften des Polycarbonats sind in Tabelle 1 gezeigt.
-
Referenzbeispiel 5
-
Dasselbe Verfahren wie in Referenzbeispiel 1 wurde wiederholt mit der Ausnahme, daß 11,4 g (0,05 Mol) BPA, 13,4 g (0,05 Mol) BPZ und 22,8 g (0,10 Mol) TCDDM-B verwendet wurden, wobei ein BPA-BPZ-TCDDM-Copolycarbonat erhalten wurde. Die Eigenschaften des Polycarbonats sind in Tabelle 1 gezeigt.
-
Die Eigenschaften in Tabelle 1 wurden mit den folgenden Methoden bestimmt.
-
(1) Gewichtsmittleres Molekulargewicht (Mw)
-
Gemessen unter Verwendung eines Gelpermeationschromatographie-Systems (Shodex GPC-System 11), wobei mit Styrolstandard kalibriert wurde. Chloroform wurde als Entwicklungslösungsmittel verwendet.
-
(2) Glasübergangs-Temperatur (Tg)
-
Gemessen unter Verwendung eines Differential-Scanning-Kalorimeters.
-
(3) Brechungsindex
-
Gemessen nach JIS K 7105 unter Verwendung eines Abbe-Refraktometers.
-
(4) Abbe-Zahl
-
Berechnet aus den durch das Abbe-Refraktometer gemessenen Brechungsindizes.
-
(5) Kugelfall-Schlagfestigkeit
-
Eine Stahlkugel wurde auf eine Probe mit 50 mm Durchmesser und 3,0 mm Dicke von 7 cm oberhalb der Probe fallengelassen. Die Schlagfestigkeit wurde ausgedrückt durch das Gewicht der Stahlkugel, wenn die Probe brach.
-
(6) YI-Wert (Vergilbung)
-
Gemessen durch ein Differential-Kolorimeter (TC-1800 MKZ, erhältlich von Tokyo Denshoku Kogyo Co., Ltd.) mit einer Scheibe von 40 mm Durchmesser und 3,0 mm Dicke, hergestellt durch Preßformen des Harzes. Tabelle 1
| | Referenzbeispiele |
| | 1 | 2 | 3 | 4 | 5 |
| Mw | 55000 | 47000 | 58000 | 57100 | 51000 |
| Tg (°C) | 108 | 125 | 95 | 125 | 124 |
| Brechungsindex | 1,558 | 1,568 | 1,546 | 1,560 | 1,572 |
| Abbe-Zahl | 39 | 33 | 43 | 39 | 38 |
| Kugelfall-Schlagfestigkeit (g) | 500 < | 500 < | 250 | 500 < | 500 < |
| YI-Wert | 2,0 | 1,9 | 2,2 | 1,7 | 5,2 |
-
Wie oben beschrieben werden durch die erfindungsgemäße Destillationsmethode die Aldehyd-Verbindungen, die die Verfärbung oder Vergilbung während der Ester-Austausch-Polymerisation verursachen, effizient aus den polycyclischen Diolen entfernt.