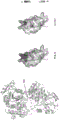CN109715796B - 类胡萝卜素的制造方法 - Google Patents
类胡萝卜素的制造方法 Download PDFInfo
- Publication number
- CN109715796B CN109715796B CN201780020844.4A CN201780020844A CN109715796B CN 109715796 B CN109715796 B CN 109715796B CN 201780020844 A CN201780020844 A CN 201780020844A CN 109715796 B CN109715796 B CN 109715796B
- Authority
- CN
- China
- Prior art keywords
- ala
- leu
- gly
- amino acid
- val
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 235000021466 carotenoid Nutrition 0.000 title claims abstract description 151
- 150000001747 carotenoids Chemical class 0.000 title claims abstract description 150
- 238000000034 method Methods 0.000 title claims description 69
- 230000008569 process Effects 0.000 title claims description 11
- 241000894006 Bacteria Species 0.000 claims abstract description 118
- 125000000539 amino acid group Chemical group 0.000 claims abstract description 115
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 115
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 80
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 44
- 235000011180 diphosphates Nutrition 0.000 claims abstract description 34
- 102000003960 Ligases Human genes 0.000 claims abstract description 20
- 108090000364 Ligases Proteins 0.000 claims abstract description 20
- 108010060155 deoxyxylulose-5-phosphate synthase Proteins 0.000 claims abstract description 17
- 241001057811 Paracoccus <mealybug> Species 0.000 claims description 71
- JEBFVOLFMLUKLF-IFPLVEIFSA-N Astaxanthin Natural products CC(=C/C=C/C(=C/C=C/C1=C(C)C(=O)C(O)CC1(C)C)/C)C=CC=C(/C)C=CC=C(/C)C=CC2=C(C)C(=O)C(O)CC2(C)C JEBFVOLFMLUKLF-IFPLVEIFSA-N 0.000 claims description 47
- 235000013793 astaxanthin Nutrition 0.000 claims description 47
- 239000001168 astaxanthin Substances 0.000 claims description 47
- MQZIGYBFDRPAKN-ZWAPEEGVSA-N astaxanthin Chemical compound C([C@H](O)C(=O)C=1C)C(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)C(=O)[C@@H](O)CC1(C)C MQZIGYBFDRPAKN-ZWAPEEGVSA-N 0.000 claims description 47
- 229940022405 astaxanthin Drugs 0.000 claims description 47
- 235000018102 proteins Nutrition 0.000 claims description 40
- 238000004519 manufacturing process Methods 0.000 claims description 29
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 10
- 238000012258 culturing Methods 0.000 claims description 10
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 claims 2
- 108090000790 Enzymes Proteins 0.000 description 207
- 102000004190 Enzymes Human genes 0.000 description 206
- 229940088598 enzyme Drugs 0.000 description 206
- 230000035772 mutation Effects 0.000 description 105
- NUHSROFQTUXZQQ-UHFFFAOYSA-N isopentenyl diphosphate Chemical compound CC(=C)CCO[P@](O)(=O)OP(O)(O)=O NUHSROFQTUXZQQ-UHFFFAOYSA-N 0.000 description 69
- 230000000694 effects Effects 0.000 description 63
- 239000011678 thiamine pyrophosphate Substances 0.000 description 57
- 229960002363 thiamine pyrophosphate Drugs 0.000 description 47
- 235000008170 thiamine pyrophosphate Nutrition 0.000 description 47
- YXVCLPJQTZXJLH-UHFFFAOYSA-N thiamine(1+) diphosphate chloride Chemical compound [Cl-].CC1=C(CCOP(O)(=O)OP(O)(O)=O)SC=[N+]1CC1=CN=C(C)N=C1N YXVCLPJQTZXJLH-UHFFFAOYSA-N 0.000 description 47
- VWFJDQUYCIWHTN-YFVJMOTDSA-N 2-trans,6-trans-farnesyl diphosphate Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CO[P@](O)(=O)OP(O)(O)=O VWFJDQUYCIWHTN-YFVJMOTDSA-N 0.000 description 44
- VWFJDQUYCIWHTN-UHFFFAOYSA-N Farnesyl pyrophosphate Natural products CC(C)=CCCC(C)=CCCC(C)=CCOP(O)(=O)OP(O)(O)=O VWFJDQUYCIWHTN-UHFFFAOYSA-N 0.000 description 44
- 239000000758 substrate Substances 0.000 description 43
- 241000282326 Felis catus Species 0.000 description 38
- 239000002609 medium Substances 0.000 description 36
- 108020004414 DNA Proteins 0.000 description 34
- 229940048084 pyrophosphate Drugs 0.000 description 31
- 238000003786 synthesis reaction Methods 0.000 description 30
- 230000015572 biosynthetic process Effects 0.000 description 29
- 239000011777 magnesium Substances 0.000 description 28
- 238000010586 diagram Methods 0.000 description 24
- 238000011282 treatment Methods 0.000 description 23
- 210000004027 cell Anatomy 0.000 description 22
- 108010047495 alanylglycine Proteins 0.000 description 20
- 229920001195 polyisoprene Polymers 0.000 description 20
- 238000004458 analytical method Methods 0.000 description 19
- 230000037361 pathway Effects 0.000 description 19
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 18
- XPPKVPWEQAFLFU-UHFFFAOYSA-N diphosphoric acid Chemical compound OP(O)(=O)OP(O)(O)=O XPPKVPWEQAFLFU-UHFFFAOYSA-N 0.000 description 18
- 230000003993 interaction Effects 0.000 description 18
- 235000001014 amino acid Nutrition 0.000 description 16
- 229940024606 amino acid Drugs 0.000 description 15
- 230000008859 change Effects 0.000 description 15
- 239000005515 coenzyme Substances 0.000 description 15
- 239000002773 nucleotide Substances 0.000 description 15
- 125000003729 nucleotide group Chemical group 0.000 description 15
- 239000013598 vector Substances 0.000 description 15
- 150000001413 amino acids Chemical class 0.000 description 14
- 239000002518 antifoaming agent Substances 0.000 description 14
- 239000000543 intermediate Substances 0.000 description 14
- JKQXZKUSFCKOGQ-JLGXGRJMSA-N (3R,3'R)-beta,beta-carotene-3,3'-diol Chemical compound C([C@H](O)CC=1C)C(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)C[C@@H](O)CC1(C)C JKQXZKUSFCKOGQ-JLGXGRJMSA-N 0.000 description 13
- JKQXZKUSFCKOGQ-LQFQNGICSA-N Z-zeaxanthin Natural products C([C@H](O)CC=1C)C(C)(C)C=1C=CC(C)=CC=CC(C)=CC=CC=C(C)C=CC=C(C)C=CC1=C(C)C[C@@H](O)CC1(C)C JKQXZKUSFCKOGQ-LQFQNGICSA-N 0.000 description 13
- QOPRSMDTRDMBNK-RNUUUQFGSA-N Zeaxanthin Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCC(O)C1(C)C)C=CC=C(/C)C=CC2=C(C)CC(O)CC2(C)C QOPRSMDTRDMBNK-RNUUUQFGSA-N 0.000 description 13
- JKQXZKUSFCKOGQ-LOFNIBRQSA-N all-trans-Zeaxanthin Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2=C(C)CC(O)CC2(C)C JKQXZKUSFCKOGQ-LOFNIBRQSA-N 0.000 description 13
- 239000001257 hydrogen Substances 0.000 description 13
- 229910052739 hydrogen Inorganic materials 0.000 description 13
- KBPHJBAIARWVSC-XQIHNALSSA-N trans-lutein Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2C(=CC(O)CC2(C)C)C KBPHJBAIARWVSC-XQIHNALSSA-N 0.000 description 13
- 235000010930 zeaxanthin Nutrition 0.000 description 13
- 239000001775 zeaxanthin Substances 0.000 description 13
- 229940043269 zeaxanthin Drugs 0.000 description 13
- 241000588724 Escherichia coli Species 0.000 description 12
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 12
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 12
- 108010047857 aspartylglycine Proteins 0.000 description 12
- 108010057821 leucylproline Proteins 0.000 description 12
- OWEFQTXQEHYDEJ-UHFFFAOYSA-N 2,3-dihydroxypropanal diphosphono hydrogen phosphate Chemical compound OCC(O)C=O.OP(O)(=O)OP(O)(=O)OP(O)(O)=O OWEFQTXQEHYDEJ-UHFFFAOYSA-N 0.000 description 11
- 241000131407 Brevundimonas Species 0.000 description 11
- 244000068697 Vitis rotundifolia Species 0.000 description 11
- 235000006359 Vitis rotundifolia var rotundifolia Nutrition 0.000 description 11
- 229910052757 nitrogen Inorganic materials 0.000 description 11
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 11
- FDSDTBUPSURDBL-LOFNIBRQSA-N canthaxanthin Chemical compound CC=1C(=O)CCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)C(=O)CCC1(C)C FDSDTBUPSURDBL-LOFNIBRQSA-N 0.000 description 10
- 229910052799 carbon Inorganic materials 0.000 description 10
- 108010017455 decaprenyl pyrophosphate synthetase Proteins 0.000 description 10
- -1 etc. Substances 0.000 description 10
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 9
- LCTONWCANYUPML-UHFFFAOYSA-M Pyruvate Chemical compound CC(=O)C([O-])=O LCTONWCANYUPML-UHFFFAOYSA-M 0.000 description 9
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 9
- 239000002585 base Substances 0.000 description 9
- 230000002255 enzymatic effect Effects 0.000 description 9
- 229940076788 pyruvate Drugs 0.000 description 9
- 238000012216 screening Methods 0.000 description 9
- 241000192091 Deinococcus radiodurans Species 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- JDBQSGMJBMPNFT-AVGNSLFASA-N Leu-Pro-Val Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O JDBQSGMJBMPNFT-AVGNSLFASA-N 0.000 description 8
- YBAFDPFAUTYYRW-UHFFFAOYSA-N N-L-alpha-glutamyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CCC(O)=O YBAFDPFAUTYYRW-UHFFFAOYSA-N 0.000 description 8
- FRPVPGRXUKFEQE-YDHLFZDLSA-N Phe-Asp-Val Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O FRPVPGRXUKFEQE-YDHLFZDLSA-N 0.000 description 8
- 241000191023 Rhodobacter capsulatus Species 0.000 description 8
- CFSSLXZJEMERJY-NRPADANISA-N Val-Gln-Ala Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O CFSSLXZJEMERJY-NRPADANISA-N 0.000 description 8
- 108010087924 alanylproline Proteins 0.000 description 8
- 239000003674 animal food additive Substances 0.000 description 8
- 108010068380 arginylarginine Proteins 0.000 description 8
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 8
- 108010015792 glycyllysine Proteins 0.000 description 8
- 108010077515 glycylproline Proteins 0.000 description 8
- 230000002209 hydrophobic effect Effects 0.000 description 8
- 230000005764 inhibitory process Effects 0.000 description 8
- 108010051673 leucyl-glycyl-phenylalanine Proteins 0.000 description 8
- 108010056582 methionylglutamic acid Proteins 0.000 description 8
- 238000002741 site-directed mutagenesis Methods 0.000 description 8
- 238000006467 substitution reaction Methods 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 7
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 7
- 239000013078 crystal Substances 0.000 description 7
- 238000000605 extraction Methods 0.000 description 7
- 238000000855 fermentation Methods 0.000 description 7
- 230000004151 fermentation Effects 0.000 description 7
- 244000005700 microbiome Species 0.000 description 7
- 239000002994 raw material Substances 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 108020004465 16S ribosomal RNA Proteins 0.000 description 6
- QXNWZXMBUKUYMD-ITUXNECMSA-N 4-keto-beta-carotene Chemical compound CC=1C(=O)CCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C QXNWZXMBUKUYMD-ITUXNECMSA-N 0.000 description 6
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- OOUTWVMJGMVRQF-DOYZGLONSA-N Phoenicoxanthin Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)C(=O)C(O)CC1(C)C)C=CC=C(/C)C=CC2=C(C)C(=O)CCC2(C)C OOUTWVMJGMVRQF-DOYZGLONSA-N 0.000 description 6
- 102000014701 Transketolase Human genes 0.000 description 6
- 108010043652 Transketolase Proteins 0.000 description 6
- 238000006555 catalytic reaction Methods 0.000 description 6
- 238000010276 construction Methods 0.000 description 6
- 230000003247 decreasing effect Effects 0.000 description 6
- 235000013373 food additive Nutrition 0.000 description 6
- 239000002778 food additive Substances 0.000 description 6
- 239000001963 growth medium Substances 0.000 description 6
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 6
- LJXQPZWIHJMPQQ-UHFFFAOYSA-N pyrimidin-2-amine Chemical group NC1=NC=CC=N1 LJXQPZWIHJMPQQ-UHFFFAOYSA-N 0.000 description 6
- 229940107700 pyruvic acid Drugs 0.000 description 6
- 230000009897 systematic effect Effects 0.000 description 6
- DMASLKHVQRHNES-UPOGUZCLSA-N (3R)-beta,beta-caroten-3-ol Chemical compound C([C@H](O)CC=1C)C(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C DMASLKHVQRHNES-UPOGUZCLSA-N 0.000 description 5
- AJPADPZSRRUGHI-RFZPGFLSSA-N 1-deoxy-D-xylulose 5-phosphate Chemical compound CC(=O)[C@@H](O)[C@H](O)COP(O)(O)=O AJPADPZSRRUGHI-RFZPGFLSSA-N 0.000 description 5
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Natural products NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 5
- NBZANZVJRKXVBH-ITUXNECMSA-N all-trans-alpha-cryptoxanthin Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2C(=CCCC2(C)C)C NBZANZVJRKXVBH-ITUXNECMSA-N 0.000 description 5
- 125000004429 atom Chemical group 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 239000011774 beta-cryptoxanthin Substances 0.000 description 5
- 235000002360 beta-cryptoxanthin Nutrition 0.000 description 5
- DMASLKHVQRHNES-ITUXNECMSA-N beta-cryptoxanthin Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2=C(C)CCCC2(C)C DMASLKHVQRHNES-ITUXNECMSA-N 0.000 description 5
- 235000012682 canthaxanthin Nutrition 0.000 description 5
- 239000001659 canthaxanthin Substances 0.000 description 5
- 229940008033 canthaxanthin Drugs 0.000 description 5
- 238000005421 electrostatic potential Methods 0.000 description 5
- 238000011331 genomic analysis Methods 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- 229910052760 oxygen Inorganic materials 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- 150000003505 terpenes Chemical class 0.000 description 5
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 4
- BRPMXFSTKXXNHF-IUCAKERBSA-N (2s)-1-[2-[[(2s)-pyrrolidine-2-carbonyl]amino]acetyl]pyrrolidine-2-carboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1C(=O)CNC(=O)[C@H]1NCCC1 BRPMXFSTKXXNHF-IUCAKERBSA-N 0.000 description 4
- WDVIDPRACNGFPP-QWRGUYRKSA-N (2s)-2-[[(2s)-6-amino-2-[[2-[(2-aminoacetyl)amino]acetyl]amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoic acid Chemical compound NCC(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O WDVIDPRACNGFPP-QWRGUYRKSA-N 0.000 description 4
- SCPRYBYMKVYVND-UHFFFAOYSA-N 2-[[2-[[1-(2-amino-4-methylpentanoyl)pyrrolidine-2-carbonyl]amino]-4-methylpentanoyl]amino]-4-methylpentanoic acid Chemical compound CC(C)CC(N)C(=O)N1CCCC1C(=O)NC(CC(C)C)C(=O)NC(CC(C)C)C(O)=O SCPRYBYMKVYVND-UHFFFAOYSA-N 0.000 description 4
- HHGYNJRJIINWAK-FXQIFTODSA-N Ala-Ala-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N HHGYNJRJIINWAK-FXQIFTODSA-N 0.000 description 4
- WQVFQXXBNHHPLX-ZKWXMUAHSA-N Ala-Ala-His Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](Cc1cnc[nH]1)C(O)=O WQVFQXXBNHHPLX-ZKWXMUAHSA-N 0.000 description 4
- JBVSSSZFNTXJDX-YTLHQDLWSA-N Ala-Ala-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](C)N JBVSSSZFNTXJDX-YTLHQDLWSA-N 0.000 description 4
- SVBXIUDNTRTKHE-CIUDSAMLSA-N Ala-Arg-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O SVBXIUDNTRTKHE-CIUDSAMLSA-N 0.000 description 4
- YAXNATKKPOWVCP-ZLUOBGJFSA-N Ala-Asn-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(O)=O YAXNATKKPOWVCP-ZLUOBGJFSA-N 0.000 description 4
- NXSFUECZFORGOG-CIUDSAMLSA-N Ala-Asn-Leu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O NXSFUECZFORGOG-CIUDSAMLSA-N 0.000 description 4
- KIUYPHAMDKDICO-WHFBIAKZSA-N Ala-Asp-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O KIUYPHAMDKDICO-WHFBIAKZSA-N 0.000 description 4
- LSLIRHLIUDVNBN-CIUDSAMLSA-N Ala-Asp-Lys Chemical compound C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN LSLIRHLIUDVNBN-CIUDSAMLSA-N 0.000 description 4
- LGFCAXJBAZESCF-ACZMJKKPSA-N Ala-Gln-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O LGFCAXJBAZESCF-ACZMJKKPSA-N 0.000 description 4
- CXQODNIBUNQWAS-CIUDSAMLSA-N Ala-Gln-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N CXQODNIBUNQWAS-CIUDSAMLSA-N 0.000 description 4
- FUSPCLTUKXQREV-ACZMJKKPSA-N Ala-Glu-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O FUSPCLTUKXQREV-ACZMJKKPSA-N 0.000 description 4
- WKOBSJOZRJJVRZ-FXQIFTODSA-N Ala-Glu-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O WKOBSJOZRJJVRZ-FXQIFTODSA-N 0.000 description 4
- PAIHPOGPJVUFJY-WDSKDSINSA-N Ala-Glu-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O PAIHPOGPJVUFJY-WDSKDSINSA-N 0.000 description 4
- UHMQKOBNPRAZGB-CIUDSAMLSA-N Ala-Glu-Met Chemical compound C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCSC)C(=O)O)N UHMQKOBNPRAZGB-CIUDSAMLSA-N 0.000 description 4
- PUBLUECXJRHTBK-ACZMJKKPSA-N Ala-Glu-Ser Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O PUBLUECXJRHTBK-ACZMJKKPSA-N 0.000 description 4
- XYTNPQNAZREREP-XQXXSGGOSA-N Ala-Glu-Thr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XYTNPQNAZREREP-XQXXSGGOSA-N 0.000 description 4
- BTBUEVAGZCKULD-XPUUQOCRSA-N Ala-Gly-His Chemical compound C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC1=CN=CN1 BTBUEVAGZCKULD-XPUUQOCRSA-N 0.000 description 4
- QHASENCZLDHBGX-ONGXEEELSA-N Ala-Gly-Phe Chemical compound C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 QHASENCZLDHBGX-ONGXEEELSA-N 0.000 description 4
- PNALXAODQKTNLV-JBDRJPRFSA-N Ala-Ile-Ala Chemical compound C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O PNALXAODQKTNLV-JBDRJPRFSA-N 0.000 description 4
- TZDNWXDLYFIFPT-BJDJZHNGSA-N Ala-Ile-Leu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(O)=O TZDNWXDLYFIFPT-BJDJZHNGSA-N 0.000 description 4
- QQACQIHVWCVBBR-GVARAGBVSA-N Ala-Ile-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O QQACQIHVWCVBBR-GVARAGBVSA-N 0.000 description 4
- MNZHHDPWDWQJCQ-YUMQZZPRSA-N Ala-Leu-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O MNZHHDPWDWQJCQ-YUMQZZPRSA-N 0.000 description 4
- DPNZTBKGAUAZQU-DLOVCJGASA-N Ala-Leu-His Chemical compound C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N DPNZTBKGAUAZQU-DLOVCJGASA-N 0.000 description 4
- MEFILNJXAVSUTO-JXUBOQSCSA-N Ala-Leu-Thr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MEFILNJXAVSUTO-JXUBOQSCSA-N 0.000 description 4
- PMQXMXAASGFUDX-SRVKXCTJSA-N Ala-Lys-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](C)N)CCCCN PMQXMXAASGFUDX-SRVKXCTJSA-N 0.000 description 4
- DEWWPUNXRNGMQN-LPEHRKFASA-N Ala-Met-Pro Chemical compound C[C@@H](C(=O)N[C@@H](CCSC)C(=O)N1CCC[C@@H]1C(=O)O)N DEWWPUNXRNGMQN-LPEHRKFASA-N 0.000 description 4
- ZBLQIYPCUWZSRZ-QEJZJMRPSA-N Ala-Phe-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](C)N)CC1=CC=CC=C1 ZBLQIYPCUWZSRZ-QEJZJMRPSA-N 0.000 description 4
- LSMDIAAALJJLRO-XQXXSGGOSA-N Ala-Thr-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(O)=O LSMDIAAALJJLRO-XQXXSGGOSA-N 0.000 description 4
- VHAQSYHSDKERBS-XPUUQOCRSA-N Ala-Val-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)NCC(O)=O VHAQSYHSDKERBS-XPUUQOCRSA-N 0.000 description 4
- DHONNEYAZPNGSG-UBHSHLNASA-N Ala-Val-Phe Chemical compound C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 DHONNEYAZPNGSG-UBHSHLNASA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- SGYSTDWPNPKJPP-GUBZILKMSA-N Arg-Ala-Arg Chemical compound NC(=N)NCCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O SGYSTDWPNPKJPP-GUBZILKMSA-N 0.000 description 4
- KJGNDQCYBNBXDA-GUBZILKMSA-N Arg-Arg-Cys Chemical compound C(C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CS)C(=O)O)N)CN=C(N)N KJGNDQCYBNBXDA-GUBZILKMSA-N 0.000 description 4
- XVLLUZMFSAYKJV-GUBZILKMSA-N Arg-Asp-Arg Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O XVLLUZMFSAYKJV-GUBZILKMSA-N 0.000 description 4
- QAODJPUKWNNNRP-DCAQKATOSA-N Arg-Glu-Arg Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O QAODJPUKWNNNRP-DCAQKATOSA-N 0.000 description 4
- HQIZDMIGUJOSNI-IUCAKERBSA-N Arg-Gly-Arg Chemical compound N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(O)=O HQIZDMIGUJOSNI-IUCAKERBSA-N 0.000 description 4
- YNSGXDWWPCGGQS-YUMQZZPRSA-N Arg-Gly-Gln Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(O)=O YNSGXDWWPCGGQS-YUMQZZPRSA-N 0.000 description 4
- PHHRSPBBQUFULD-UWVGGRQHSA-N Arg-Gly-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CCCN=C(N)N)N PHHRSPBBQUFULD-UWVGGRQHSA-N 0.000 description 4
- SLNCSSWAIDUUGF-LSJOCFKGSA-N Arg-His-Ala Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](C)C(O)=O SLNCSSWAIDUUGF-LSJOCFKGSA-N 0.000 description 4
- COXMUHNBYCVVRG-DCAQKATOSA-N Arg-Leu-Ser Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O COXMUHNBYCVVRG-DCAQKATOSA-N 0.000 description 4
- VVJTWSRNMJNDPN-IUCAKERBSA-N Arg-Met-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)NCC(O)=O VVJTWSRNMJNDPN-IUCAKERBSA-N 0.000 description 4
- JBIRFLWXWDSDTR-CYDGBPFRSA-N Arg-Met-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCCN=C(N)N)N JBIRFLWXWDSDTR-CYDGBPFRSA-N 0.000 description 4
- INXWADWANGLMPJ-JYJNAYRXSA-N Arg-Phe-Arg Chemical compound NC(=N)NCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)CC1=CC=CC=C1 INXWADWANGLMPJ-JYJNAYRXSA-N 0.000 description 4
- LXMKTIZAGIBQRX-HRCADAONSA-N Arg-Phe-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=CC=C2)NC(=O)[C@H](CCCN=C(N)N)N)C(=O)O LXMKTIZAGIBQRX-HRCADAONSA-N 0.000 description 4
- FVBZXNSRIDVYJS-AVGNSLFASA-N Arg-Pro-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CCCN=C(N)N FVBZXNSRIDVYJS-AVGNSLFASA-N 0.000 description 4
- WCZXPVPHUMYLMS-VEVYYDQMSA-N Arg-Thr-Asp Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O WCZXPVPHUMYLMS-VEVYYDQMSA-N 0.000 description 4
- YNSUUAOAFCVINY-OSUNSFLBSA-N Arg-Thr-Ile Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O YNSUUAOAFCVINY-OSUNSFLBSA-N 0.000 description 4
- XRNXPIGJPQHCPC-RCWTZXSCSA-N Arg-Thr-Val Chemical compound CC(C)[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)O)C(O)=O XRNXPIGJPQHCPC-RCWTZXSCSA-N 0.000 description 4
- XYOVHPDDWCEUDY-CIUDSAMLSA-N Asn-Ala-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O XYOVHPDDWCEUDY-CIUDSAMLSA-N 0.000 description 4
- ZZXMOQIUIJJOKZ-ZLUOBGJFSA-N Asn-Asn-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CC(N)=O ZZXMOQIUIJJOKZ-ZLUOBGJFSA-N 0.000 description 4
- ASCGFDYEKSRNPL-CIUDSAMLSA-N Asn-Glu-Met Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCSC)C(O)=O ASCGFDYEKSRNPL-CIUDSAMLSA-N 0.000 description 4
- GLWFAWNYGWBMOC-SRVKXCTJSA-N Asn-Leu-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O GLWFAWNYGWBMOC-SRVKXCTJSA-N 0.000 description 4
- XEDQMTWEYFBOIK-ACZMJKKPSA-N Asp-Ala-Glu Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O XEDQMTWEYFBOIK-ACZMJKKPSA-N 0.000 description 4
- OERMIMJQPQUIPK-FXQIFTODSA-N Asp-Arg-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O OERMIMJQPQUIPK-FXQIFTODSA-N 0.000 description 4
- JGDBHIVECJGXJA-FXQIFTODSA-N Asp-Asp-Arg Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O JGDBHIVECJGXJA-FXQIFTODSA-N 0.000 description 4
- FRSGNOZCTWDVFZ-ACZMJKKPSA-N Asp-Asp-Gln Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O FRSGNOZCTWDVFZ-ACZMJKKPSA-N 0.000 description 4
- PXLNPFOJZQMXAT-BYULHYEWSA-N Asp-Asp-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC(O)=O PXLNPFOJZQMXAT-BYULHYEWSA-N 0.000 description 4
- DGKCOYGQLNWNCJ-ACZMJKKPSA-N Asp-Glu-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O DGKCOYGQLNWNCJ-ACZMJKKPSA-N 0.000 description 4
- DTNUIAJCPRMNBT-WHFBIAKZSA-N Asp-Gly-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](C)C(O)=O DTNUIAJCPRMNBT-WHFBIAKZSA-N 0.000 description 4
- SVABRQFIHCSNCI-FOHZUACHSA-N Asp-Gly-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O SVABRQFIHCSNCI-FOHZUACHSA-N 0.000 description 4
- UJGRZQYSNYTCAX-SRVKXCTJSA-N Asp-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(O)=O UJGRZQYSNYTCAX-SRVKXCTJSA-N 0.000 description 4
- LBOVBQONZJRWPV-YUMQZZPRSA-N Asp-Lys-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(O)=O LBOVBQONZJRWPV-YUMQZZPRSA-N 0.000 description 4
- GKWFMNNNYZHJHV-SRVKXCTJSA-N Asp-Lys-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC(O)=O GKWFMNNNYZHJHV-SRVKXCTJSA-N 0.000 description 4
- HICVMZCGVFKTPM-BQBZGAKWSA-N Asp-Pro-Gly Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O HICVMZCGVFKTPM-BQBZGAKWSA-N 0.000 description 4
- KGHLGJAXYSVNJP-WHFBIAKZSA-N Asp-Ser-Gly Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O KGHLGJAXYSVNJP-WHFBIAKZSA-N 0.000 description 4
- XWKBWZXGNXTDKY-ZKWXMUAHSA-N Asp-Val-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CC(O)=O XWKBWZXGNXTDKY-ZKWXMUAHSA-N 0.000 description 4
- CLEFUAZULXANBU-MELADBBJSA-N Cys-Tyr-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=C(C=C2)O)NC(=O)[C@H](CS)N)C(=O)O CLEFUAZULXANBU-MELADBBJSA-N 0.000 description 4
- 101710101190 Decaprenyl diphosphate synthase Proteins 0.000 description 4
- 241000190844 Erythrobacter Species 0.000 description 4
- 102100035111 Farnesyl pyrophosphate synthase Human genes 0.000 description 4
- HHWQMFIGMMOVFK-WDSKDSINSA-N Gln-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H](N)CCC(N)=O HHWQMFIGMMOVFK-WDSKDSINSA-N 0.000 description 4
- YNNXQZDEOCYJJL-CIUDSAMLSA-N Gln-Arg-Asp Chemical compound C(C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)CN=C(N)N YNNXQZDEOCYJJL-CIUDSAMLSA-N 0.000 description 4
- QYTKAVBFRUGYAU-ACZMJKKPSA-N Gln-Asp-Asn Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O QYTKAVBFRUGYAU-ACZMJKKPSA-N 0.000 description 4
- PNENQZWRFMUZOM-DCAQKATOSA-N Gln-Glu-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O PNENQZWRFMUZOM-DCAQKATOSA-N 0.000 description 4
- KQOPMGBHNQBCEL-HVTMNAMFSA-N Gln-His-Ile Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O KQOPMGBHNQBCEL-HVTMNAMFSA-N 0.000 description 4
- LPIKVBWNNVFHCQ-GUBZILKMSA-N Gln-Ser-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O LPIKVBWNNVFHCQ-GUBZILKMSA-N 0.000 description 4
- UTKUTMJSWKKHEM-WDSKDSINSA-N Glu-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H](N)CCC(O)=O UTKUTMJSWKKHEM-WDSKDSINSA-N 0.000 description 4
- ITYRYNUZHPNCIK-GUBZILKMSA-N Glu-Ala-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O ITYRYNUZHPNCIK-GUBZILKMSA-N 0.000 description 4
- NCWOMXABNYEPLY-NRPADANISA-N Glu-Ala-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O NCWOMXABNYEPLY-NRPADANISA-N 0.000 description 4
- AVZHGSCDKIQZPQ-CIUDSAMLSA-N Glu-Arg-Ala Chemical compound C[C@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](N)CCC(O)=O)C(O)=O AVZHGSCDKIQZPQ-CIUDSAMLSA-N 0.000 description 4
- HJIFPJUEOGZWRI-GUBZILKMSA-N Glu-Asp-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)O)N HJIFPJUEOGZWRI-GUBZILKMSA-N 0.000 description 4
- PVBBEKPHARMPHX-DCAQKATOSA-N Glu-Gln-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCC(O)=O PVBBEKPHARMPHX-DCAQKATOSA-N 0.000 description 4
- SJPMNHCEWPTRBR-BQBZGAKWSA-N Glu-Glu-Gly Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O SJPMNHCEWPTRBR-BQBZGAKWSA-N 0.000 description 4
- MUSGDMDGNGXULI-DCAQKATOSA-N Glu-Glu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O MUSGDMDGNGXULI-DCAQKATOSA-N 0.000 description 4
- HPJLZFTUUJKWAJ-JHEQGTHGSA-N Glu-Gly-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O HPJLZFTUUJKWAJ-JHEQGTHGSA-N 0.000 description 4
- VXQOONWNIWFOCS-HGNGGELXSA-N Glu-His-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CCC(=O)O)N VXQOONWNIWFOCS-HGNGGELXSA-N 0.000 description 4
- VSRCAOIHMGCIJK-SRVKXCTJSA-N Glu-Leu-Arg Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O VSRCAOIHMGCIJK-SRVKXCTJSA-N 0.000 description 4
- HQTDNEZTGZUWSY-XVKPBYJWSA-N Glu-Val-Gly Chemical compound CC(C)[C@H](NC(=O)[C@@H](N)CCC(O)=O)C(=O)NCC(O)=O HQTDNEZTGZUWSY-XVKPBYJWSA-N 0.000 description 4
- PHONXOACARQMPM-BQBZGAKWSA-N Gly-Ala-Met Chemical compound [H]NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCSC)C(O)=O PHONXOACARQMPM-BQBZGAKWSA-N 0.000 description 4
- MZZSCEANQDPJER-ONGXEEELSA-N Gly-Ala-Phe Chemical compound NCC(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 MZZSCEANQDPJER-ONGXEEELSA-N 0.000 description 4
- QXPRJQPCFXMCIY-NKWVEPMBSA-N Gly-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)CN QXPRJQPCFXMCIY-NKWVEPMBSA-N 0.000 description 4
- JRDYDYXZKFNNRQ-XPUUQOCRSA-N Gly-Ala-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)CN JRDYDYXZKFNNRQ-XPUUQOCRSA-N 0.000 description 4
- KKBWDNZXYLGJEY-UHFFFAOYSA-N Gly-Arg-Pro Natural products NCC(=O)NC(CCNC(=N)N)C(=O)N1CCCC1C(=O)O KKBWDNZXYLGJEY-UHFFFAOYSA-N 0.000 description 4
- KQDMENMTYNBWMR-WHFBIAKZSA-N Gly-Asp-Ala Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(O)=O KQDMENMTYNBWMR-WHFBIAKZSA-N 0.000 description 4
- FUTAPPOITCCWTH-WHFBIAKZSA-N Gly-Asp-Asp Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O FUTAPPOITCCWTH-WHFBIAKZSA-N 0.000 description 4
- FZQLXNIMCPJVJE-YUMQZZPRSA-N Gly-Asp-Leu Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O FZQLXNIMCPJVJE-YUMQZZPRSA-N 0.000 description 4
- JMQFHZWESBGPFC-WDSKDSINSA-N Gly-Gln-Asp Chemical compound NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O JMQFHZWESBGPFC-WDSKDSINSA-N 0.000 description 4
- JSNNHGHYGYMVCK-XVKPBYJWSA-N Gly-Glu-Val Chemical compound [H]NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O JSNNHGHYGYMVCK-XVKPBYJWSA-N 0.000 description 4
- XPJBQTCXPJNIFE-ZETCQYMHSA-N Gly-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)CN XPJBQTCXPJNIFE-ZETCQYMHSA-N 0.000 description 4
- FQKKPCWTZZEDIC-XPUUQOCRSA-N Gly-His-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)CN)CC1=CN=CN1 FQKKPCWTZZEDIC-XPUUQOCRSA-N 0.000 description 4
- ORXZVPZCPMKHNR-IUCAKERBSA-N Gly-His-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CNC=N1 ORXZVPZCPMKHNR-IUCAKERBSA-N 0.000 description 4
- CCBIBMKQNXHNIN-ZETCQYMHSA-N Gly-Leu-Gly Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O CCBIBMKQNXHNIN-ZETCQYMHSA-N 0.000 description 4
- MIIVFRCYJABHTQ-ONGXEEELSA-N Gly-Leu-Val Chemical compound [H]NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O MIIVFRCYJABHTQ-ONGXEEELSA-N 0.000 description 4
- CLNSYANKYVMZNM-UWVGGRQHSA-N Gly-Lys-Arg Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)N[C@H](C(O)=O)CCCN=C(N)N CLNSYANKYVMZNM-UWVGGRQHSA-N 0.000 description 4
- PDUHNKAFQXQNLH-ZETCQYMHSA-N Gly-Lys-Gly Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)NCC(O)=O PDUHNKAFQXQNLH-ZETCQYMHSA-N 0.000 description 4
- DBJYVKDPGIFXFO-BQBZGAKWSA-N Gly-Met-Ala Chemical compound [H]NCC(=O)N[C@@H](CCSC)C(=O)N[C@@H](C)C(O)=O DBJYVKDPGIFXFO-BQBZGAKWSA-N 0.000 description 4
- YHYDTTUSJXGTQK-UWVGGRQHSA-N Gly-Met-Leu Chemical compound CSCC[C@H](NC(=O)CN)C(=O)N[C@@H](CC(C)C)C(O)=O YHYDTTUSJXGTQK-UWVGGRQHSA-N 0.000 description 4
- ZWRDOVYMQAAISL-UWVGGRQHSA-N Gly-Met-Lys Chemical compound CSCC[C@H](NC(=O)CN)C(=O)N[C@H](C(O)=O)CCCCN ZWRDOVYMQAAISL-UWVGGRQHSA-N 0.000 description 4
- GGAPHLIUUTVYMX-QWRGUYRKSA-N Gly-Phe-Ser Chemical compound OC[C@@H](C([O-])=O)NC(=O)[C@@H](NC(=O)C[NH3+])CC1=CC=CC=C1 GGAPHLIUUTVYMX-QWRGUYRKSA-N 0.000 description 4
- IXHQLZIWBCQBLQ-STQMWFEESA-N Gly-Pro-Phe Chemical compound NCC(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 IXHQLZIWBCQBLQ-STQMWFEESA-N 0.000 description 4
- GLACUWHUYFBSPJ-FJXKBIBVSA-N Gly-Pro-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)CN GLACUWHUYFBSPJ-FJXKBIBVSA-N 0.000 description 4
- SYOJVRNQCXYEOV-XVKPBYJWSA-N Gly-Val-Glu Chemical compound [H]NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O SYOJVRNQCXYEOV-XVKPBYJWSA-N 0.000 description 4
- WCNXUTNLSRWWQN-DCAQKATOSA-N His-Asp-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CC1=CN=CN1)N WCNXUTNLSRWWQN-DCAQKATOSA-N 0.000 description 4
- VYUXYMRNGALHEA-DLOVCJGASA-N His-Leu-Ala Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O VYUXYMRNGALHEA-DLOVCJGASA-N 0.000 description 4
- YAALVYQFVJNXIV-KKUMJFAQSA-N His-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC1=CN=CN1 YAALVYQFVJNXIV-KKUMJFAQSA-N 0.000 description 4
- LDFWDDVELNOGII-MXAVVETBSA-N His-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC1=CN=CN1)N LDFWDDVELNOGII-MXAVVETBSA-N 0.000 description 4
- KFQDSSNYWKZFOO-LSJOCFKGSA-N His-Val-Ala Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O KFQDSSNYWKZFOO-LSJOCFKGSA-N 0.000 description 4
- JRHFQUPIZOYKQP-KBIXCLLPSA-N Ile-Ala-Glu Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O JRHFQUPIZOYKQP-KBIXCLLPSA-N 0.000 description 4
- RWIKBYVJQAJYDP-BJDJZHNGSA-N Ile-Ala-Lys Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCCN RWIKBYVJQAJYDP-BJDJZHNGSA-N 0.000 description 4
- SACHLUOUHCVIKI-GMOBBJLQSA-N Ile-Arg-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N SACHLUOUHCVIKI-GMOBBJLQSA-N 0.000 description 4
- QTUSJASXLGLJSR-OSUNSFLBSA-N Ile-Arg-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N QTUSJASXLGLJSR-OSUNSFLBSA-N 0.000 description 4
- WZDCVAWMBUNDDY-KBIXCLLPSA-N Ile-Glu-Ala Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](C)C(=O)O)N WZDCVAWMBUNDDY-KBIXCLLPSA-N 0.000 description 4
- APDIECQNNDGFPD-PYJNHQTQSA-N Ile-His-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](C(C)C)C(=O)O)N APDIECQNNDGFPD-PYJNHQTQSA-N 0.000 description 4
- FZWVCYCYWCLQDH-NHCYSSNCSA-N Ile-Leu-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)O)N FZWVCYCYWCLQDH-NHCYSSNCSA-N 0.000 description 4
- UIEZQYNXCYHMQS-BJDJZHNGSA-N Ile-Lys-Ala Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)O)N UIEZQYNXCYHMQS-BJDJZHNGSA-N 0.000 description 4
- YKZAMJXNJUWFIK-JBDRJPRFSA-N Ile-Ser-Ala Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)O)N YKZAMJXNJUWFIK-JBDRJPRFSA-N 0.000 description 4
- YBKKLDBBPFIXBQ-MBLNEYKQSA-N Ile-Thr-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)O)N YBKKLDBBPFIXBQ-MBLNEYKQSA-N 0.000 description 4
- HJDZMPFEXINXLO-QPHKQPEJSA-N Ile-Thr-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)O)N HJDZMPFEXINXLO-QPHKQPEJSA-N 0.000 description 4
- HZVRQFKRALAMQS-SLBDDTMCSA-N Ile-Trp-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)N[C@@H](CC(=O)O)C(=O)O)N HZVRQFKRALAMQS-SLBDDTMCSA-N 0.000 description 4
- BCISUQVFDGYZBO-QSFUFRPTSA-N Ile-Val-Asp Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC(O)=O BCISUQVFDGYZBO-QSFUFRPTSA-N 0.000 description 4
- JCGMFFQQHJQASB-PYJNHQTQSA-N Ile-Val-His Chemical compound N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)O JCGMFFQQHJQASB-PYJNHQTQSA-N 0.000 description 4
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical compound CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 4
- IBMVEYRWAWIOTN-UHFFFAOYSA-N L-Leucyl-L-Arginyl-L-Proline Natural products CC(C)CC(N)C(=O)NC(CCCN=C(N)N)C(=O)N1CCCC1C(O)=O IBMVEYRWAWIOTN-UHFFFAOYSA-N 0.000 description 4
- SENJXOPIZNYLHU-UHFFFAOYSA-N L-leucyl-L-arginine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CCCN=C(N)N SENJXOPIZNYLHU-UHFFFAOYSA-N 0.000 description 4
- LJHGALIOHLRRQN-DCAQKATOSA-N Leu-Ala-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N LJHGALIOHLRRQN-DCAQKATOSA-N 0.000 description 4
- IBMVEYRWAWIOTN-RWMBFGLXSA-N Leu-Arg-Pro Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1CCC[C@@H]1C(O)=O IBMVEYRWAWIOTN-RWMBFGLXSA-N 0.000 description 4
- STAVRDQLZOTNKJ-RHYQMDGZSA-N Leu-Arg-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(O)=O STAVRDQLZOTNKJ-RHYQMDGZSA-N 0.000 description 4
- WUFYAPWIHCUMLL-CIUDSAMLSA-N Leu-Asn-Ala Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(O)=O WUFYAPWIHCUMLL-CIUDSAMLSA-N 0.000 description 4
- VCSBGUACOYUIGD-CIUDSAMLSA-N Leu-Asn-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O VCSBGUACOYUIGD-CIUDSAMLSA-N 0.000 description 4
- YKNBJXOJTURHCU-DCAQKATOSA-N Leu-Asp-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YKNBJXOJTURHCU-DCAQKATOSA-N 0.000 description 4
- VPKIQULSKFVCSM-SRVKXCTJSA-N Leu-Gln-Arg Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O VPKIQULSKFVCSM-SRVKXCTJSA-N 0.000 description 4
- ZTLGVASZOIKNIX-DCAQKATOSA-N Leu-Gln-Glu Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N ZTLGVASZOIKNIX-DCAQKATOSA-N 0.000 description 4
- LOLUPZNNADDTAA-AVGNSLFASA-N Leu-Gln-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O LOLUPZNNADDTAA-AVGNSLFASA-N 0.000 description 4
- HPBCTWSUJOGJSH-MNXVOIDGSA-N Leu-Glu-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HPBCTWSUJOGJSH-MNXVOIDGSA-N 0.000 description 4
- OXRLYTYUXAQTHP-YUMQZZPRSA-N Leu-Gly-Ala Chemical compound [H]N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](C)C(O)=O OXRLYTYUXAQTHP-YUMQZZPRSA-N 0.000 description 4
- VWHGTYCRDRBSFI-ZETCQYMHSA-N Leu-Gly-Gly Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)NCC(O)=O VWHGTYCRDRBSFI-ZETCQYMHSA-N 0.000 description 4
- CCQLQKZTXZBXTN-NHCYSSNCSA-N Leu-Gly-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(O)=O CCQLQKZTXZBXTN-NHCYSSNCSA-N 0.000 description 4
- UCDHVOALNXENLC-KBPBESRZSA-N Leu-Gly-Tyr Chemical compound CC(C)C[C@H]([NH3+])C(=O)NCC(=O)N[C@H](C([O-])=O)CC1=CC=C(O)C=C1 UCDHVOALNXENLC-KBPBESRZSA-N 0.000 description 4
- KOSWSHVQIVTVQF-ZPFDUUQYSA-N Leu-Ile-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(O)=O KOSWSHVQIVTVQF-ZPFDUUQYSA-N 0.000 description 4
- KYIIALJHAOIAHF-KKUMJFAQSA-N Leu-Leu-His Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 KYIIALJHAOIAHF-KKUMJFAQSA-N 0.000 description 4
- XVZCXCTYGHPNEM-UHFFFAOYSA-N Leu-Leu-Pro Natural products CC(C)CC(N)C(=O)NC(CC(C)C)C(=O)N1CCCC1C(O)=O XVZCXCTYGHPNEM-UHFFFAOYSA-N 0.000 description 4
- ZGUMORRUBUCXEH-AVGNSLFASA-N Leu-Lys-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZGUMORRUBUCXEH-AVGNSLFASA-N 0.000 description 4
- ZAVCJRJOQKIOJW-KKUMJFAQSA-N Leu-Phe-Asp Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CC(O)=O)C(O)=O)CC1=CC=CC=C1 ZAVCJRJOQKIOJW-KKUMJFAQSA-N 0.000 description 4
- PTRKPHUGYULXPU-KKUMJFAQSA-N Leu-Phe-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(O)=O PTRKPHUGYULXPU-KKUMJFAQSA-N 0.000 description 4
- FYPWFNKQVVEELI-ULQDDVLXSA-N Leu-Phe-Val Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CC1=CC=CC=C1 FYPWFNKQVVEELI-ULQDDVLXSA-N 0.000 description 4
- XOWMDXHFSBCAKQ-SRVKXCTJSA-N Leu-Ser-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC(C)C XOWMDXHFSBCAKQ-SRVKXCTJSA-N 0.000 description 4
- SVBJIZVVYJYGLA-DCAQKATOSA-N Leu-Ser-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O SVBJIZVVYJYGLA-DCAQKATOSA-N 0.000 description 4
- VDIARPPNADFEAV-WEDXCCLWSA-N Leu-Thr-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O VDIARPPNADFEAV-WEDXCCLWSA-N 0.000 description 4
- AIQWYVFNBNNOLU-RHYQMDGZSA-N Leu-Thr-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O AIQWYVFNBNNOLU-RHYQMDGZSA-N 0.000 description 4
- UPYKUZBSLRQECL-UKMVMLAPSA-N Lycopene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1C(=C)CCCC1(C)C)C=CC=C(/C)C=CC2C(=C)CCCC2(C)C UPYKUZBSLRQECL-UKMVMLAPSA-N 0.000 description 4
- JEVVKJMRZMXFBT-XWDZUXABSA-N Lycophyll Natural products OC/C(=C/CC/C(=C\C=C\C(=C/C=C/C(=C\C=C\C=C(/C=C/C=C(\C=C\C=C(/CC/C=C(/CO)\C)\C)/C)\C)/C)\C)/C)/C JEVVKJMRZMXFBT-XWDZUXABSA-N 0.000 description 4
- WSXTWLJHTLRFLW-SRVKXCTJSA-N Lys-Ala-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(O)=O WSXTWLJHTLRFLW-SRVKXCTJSA-N 0.000 description 4
- LZWNAOIMTLNMDW-NHCYSSNCSA-N Lys-Asn-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCCCN)N LZWNAOIMTLNMDW-NHCYSSNCSA-N 0.000 description 4
- NKKFVJRLCCUJNA-QWRGUYRKSA-N Lys-Gly-Lys Chemical compound NCCCC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCCCN NKKFVJRLCCUJNA-QWRGUYRKSA-N 0.000 description 4
- HAUUXTXKJNVIFY-ONGXEEELSA-N Lys-Gly-Val Chemical compound [H]N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O HAUUXTXKJNVIFY-ONGXEEELSA-N 0.000 description 4
- OIQSIMFSVLLWBX-VOAKCMCISA-N Lys-Leu-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OIQSIMFSVLLWBX-VOAKCMCISA-N 0.000 description 4
- WXHHTBVYQOSYSL-FXQIFTODSA-N Met-Ala-Ser Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O WXHHTBVYQOSYSL-FXQIFTODSA-N 0.000 description 4
- BMHIFARYXOJDLD-WPRPVWTQSA-N Met-Gly-Val Chemical compound [H]N[C@@H](CCSC)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O BMHIFARYXOJDLD-WPRPVWTQSA-N 0.000 description 4
- XDGFFEZAZHRZFR-RHYQMDGZSA-N Met-Leu-Thr Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XDGFFEZAZHRZFR-RHYQMDGZSA-N 0.000 description 4
- BQHLZUMZOXUWNU-DCAQKATOSA-N Met-Pro-Glu Chemical compound CSCC[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(=O)O)C(=O)O)N BQHLZUMZOXUWNU-DCAQKATOSA-N 0.000 description 4
- CIDICGYKRUTYLE-FXQIFTODSA-N Met-Ser-Ala Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O CIDICGYKRUTYLE-FXQIFTODSA-N 0.000 description 4
- KYXDADPHSNFWQX-VEVYYDQMSA-N Met-Thr-Asp Chemical compound CSCC[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC(O)=O KYXDADPHSNFWQX-VEVYYDQMSA-N 0.000 description 4
- ZBLSZPYQQRIHQU-RCWTZXSCSA-N Met-Thr-Val Chemical compound CSCC[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O ZBLSZPYQQRIHQU-RCWTZXSCSA-N 0.000 description 4
- OOLVTRHJJBCJKB-IHRRRGAJSA-N Met-Tyr-Asp Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC(=O)O)C(=O)O)N OOLVTRHJJBCJKB-IHRRRGAJSA-N 0.000 description 4
- FSTWDRPCQQUJIT-NHCYSSNCSA-N Met-Val-Glu Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](CCSC)N FSTWDRPCQQUJIT-NHCYSSNCSA-N 0.000 description 4
- WYBVBIHNJWOLCJ-UHFFFAOYSA-N N-L-arginyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CCCN=C(N)N WYBVBIHNJWOLCJ-UHFFFAOYSA-N 0.000 description 4
- XZFYRXDAULDNFX-UHFFFAOYSA-N N-L-cysteinyl-L-phenylalanine Natural products SCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XZFYRXDAULDNFX-UHFFFAOYSA-N 0.000 description 4
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 4
- 108010079364 N-glycylalanine Proteins 0.000 description 4
- VZUNGTLZRAYYDE-UHFFFAOYSA-N N-methyl-N'-nitro-N-nitrosoguanidine Chemical compound O=NN(C)C(=N)N[N+]([O-])=O VZUNGTLZRAYYDE-UHFFFAOYSA-N 0.000 description 4
- BQVUABVGYYSDCJ-UHFFFAOYSA-N Nalpha-L-Leucyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)CC(C)C)C(O)=O)=CNC2=C1 BQVUABVGYYSDCJ-UHFFFAOYSA-N 0.000 description 4
- AJOKKVTWEMXZHC-DRZSPHRISA-N Phe-Ala-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=CC=C1 AJOKKVTWEMXZHC-DRZSPHRISA-N 0.000 description 4
- JNRFYJZCMHHGMH-UBHSHLNASA-N Phe-Ala-Met Chemical compound CSCC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=CC=C1 JNRFYJZCMHHGMH-UBHSHLNASA-N 0.000 description 4
- SEPNOAFMZLLCEW-UBHSHLNASA-N Phe-Ala-Val Chemical compound N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)O SEPNOAFMZLLCEW-UBHSHLNASA-N 0.000 description 4
- GNUCSNWOCQFMMC-UFYCRDLUSA-N Phe-Arg-Phe Chemical compound C([C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 GNUCSNWOCQFMMC-UFYCRDLUSA-N 0.000 description 4
- KAGCQPSEVAETCA-JYJNAYRXSA-N Phe-Gln-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC1=CC=CC=C1)N KAGCQPSEVAETCA-JYJNAYRXSA-N 0.000 description 4
- BIYWZVCPZIFGPY-QWRGUYRKSA-N Phe-Gly-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)NCC(=O)N[C@@H](CO)C(O)=O BIYWZVCPZIFGPY-QWRGUYRKSA-N 0.000 description 4
- HTXVATDVCRFORF-MGHWNKPDSA-N Phe-Ile-His Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CC2=CC=CC=C2)N HTXVATDVCRFORF-MGHWNKPDSA-N 0.000 description 4
- LKRUQZQZMXMKEQ-SFJXLCSZSA-N Phe-Trp-Thr Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H]([C@@H](C)O)C(O)=O LKRUQZQZMXMKEQ-SFJXLCSZSA-N 0.000 description 4
- BNBBNGZZKQUWCD-IUCAKERBSA-N Pro-Arg-Gly Chemical compound NC(N)=NCCC[C@@H](C(=O)NCC(O)=O)NC(=O)[C@@H]1CCCN1 BNBBNGZZKQUWCD-IUCAKERBSA-N 0.000 description 4
- GRIRJQGZZJVANI-CYDGBPFRSA-N Pro-Arg-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H]1CCCN1 GRIRJQGZZJVANI-CYDGBPFRSA-N 0.000 description 4
- UTAUEDINXUMHLG-FXQIFTODSA-N Pro-Asp-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@@H]1CCCN1 UTAUEDINXUMHLG-FXQIFTODSA-N 0.000 description 4
- VPEVBAUSTBWQHN-NHCYSSNCSA-N Pro-Glu-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O VPEVBAUSTBWQHN-NHCYSSNCSA-N 0.000 description 4
- UUHXBJHVTVGSKM-BQBZGAKWSA-N Pro-Gly-Asn Chemical compound [H]N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O UUHXBJHVTVGSKM-BQBZGAKWSA-N 0.000 description 4
- XQSREVQDGCPFRJ-STQMWFEESA-N Pro-Gly-Phe Chemical compound [H]N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O XQSREVQDGCPFRJ-STQMWFEESA-N 0.000 description 4
- IBGCFJDLCYTKPW-NAKRPEOUSA-N Pro-Ile-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]1CCCN1 IBGCFJDLCYTKPW-NAKRPEOUSA-N 0.000 description 4
- NTXFLJULRHQMDC-GUBZILKMSA-N Pro-Met-Asp Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@@H]1CCCN1 NTXFLJULRHQMDC-GUBZILKMSA-N 0.000 description 4
- AJBQTGZIZQXBLT-STQMWFEESA-N Pro-Phe-Gly Chemical compound C([C@@H](C(=O)NCC(=O)O)NC(=O)[C@H]1NCCC1)C1=CC=CC=C1 AJBQTGZIZQXBLT-STQMWFEESA-N 0.000 description 4
- XYAFCOJKICBRDU-JYJNAYRXSA-N Pro-Phe-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C(C)C)C(O)=O XYAFCOJKICBRDU-JYJNAYRXSA-N 0.000 description 4
- KBUAPZAZPWNYSW-SRVKXCTJSA-N Pro-Pro-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 KBUAPZAZPWNYSW-SRVKXCTJSA-N 0.000 description 4
- KIDXAAQVMNLJFQ-KZVJFYERSA-N Pro-Thr-Ala Chemical compound C[C@@H](O)[C@H](NC(=O)[C@@H]1CCCN1)C(=O)N[C@@H](C)C(O)=O KIDXAAQVMNLJFQ-KZVJFYERSA-N 0.000 description 4
- CWZUFLWPEFHWEI-IHRRRGAJSA-N Pro-Tyr-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O CWZUFLWPEFHWEI-IHRRRGAJSA-N 0.000 description 4
- OOZJHTXCLJUODH-QXEWZRGKSA-N Pro-Val-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]1CCCN1 OOZJHTXCLJUODH-QXEWZRGKSA-N 0.000 description 4
- KHRLUIPIMIQFGT-AVGNSLFASA-N Pro-Val-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O KHRLUIPIMIQFGT-AVGNSLFASA-N 0.000 description 4
- JPIDMRXXNMIVKY-VZFHVOOUSA-N Ser-Ala-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O JPIDMRXXNMIVKY-VZFHVOOUSA-N 0.000 description 4
- XVAUJOAYHWWNQF-ZLUOBGJFSA-N Ser-Asn-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(O)=O XVAUJOAYHWWNQF-ZLUOBGJFSA-N 0.000 description 4
- UQFYNFTYDHUIMI-WHFBIAKZSA-N Ser-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CO UQFYNFTYDHUIMI-WHFBIAKZSA-N 0.000 description 4
- SFTZTYBXIXLRGQ-JBDRJPRFSA-N Ser-Ile-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O SFTZTYBXIXLRGQ-JBDRJPRFSA-N 0.000 description 4
- UIPXCLNLUUAMJU-JBDRJPRFSA-N Ser-Ile-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O UIPXCLNLUUAMJU-JBDRJPRFSA-N 0.000 description 4
- FZEUTKVQGMVGHW-AVGNSLFASA-N Ser-Phe-Gln Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O FZEUTKVQGMVGHW-AVGNSLFASA-N 0.000 description 4
- VFWQQZMRKFOGLE-ZLUOBGJFSA-N Ser-Ser-Cys Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N)O VFWQQZMRKFOGLE-ZLUOBGJFSA-N 0.000 description 4
- PYTKULIABVRXSC-BWBBJGPYSA-N Ser-Ser-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PYTKULIABVRXSC-BWBBJGPYSA-N 0.000 description 4
- DYEGLQRVMBWQLD-IXOXFDKPSA-N Ser-Thr-Phe Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CO)N)O DYEGLQRVMBWQLD-IXOXFDKPSA-N 0.000 description 4
- PLQWGQUNUPMNOD-KKUMJFAQSA-N Ser-Tyr-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(O)=O PLQWGQUNUPMNOD-KKUMJFAQSA-N 0.000 description 4
- OQSQCUWQOIHECT-YJRXYDGGSA-N Ser-Tyr-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OQSQCUWQOIHECT-YJRXYDGGSA-N 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- IGROJMCBGRFRGI-YTLHQDLWSA-N Thr-Ala-Ala Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(O)=O IGROJMCBGRFRGI-YTLHQDLWSA-N 0.000 description 4
- STGXWWBXWXZOER-MBLNEYKQSA-N Thr-Ala-His Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 STGXWWBXWXZOER-MBLNEYKQSA-N 0.000 description 4
- ZUXQFMVPAYGPFJ-JXUBOQSCSA-N Thr-Ala-Lys Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCCN ZUXQFMVPAYGPFJ-JXUBOQSCSA-N 0.000 description 4
- CAJFZCICSVBOJK-SHGPDSBTSA-N Thr-Ala-Thr Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O CAJFZCICSVBOJK-SHGPDSBTSA-N 0.000 description 4
- VFEHSAJCWWHDBH-RHYQMDGZSA-N Thr-Arg-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(O)=O VFEHSAJCWWHDBH-RHYQMDGZSA-N 0.000 description 4
- XPNSAQMEAVSQRD-FBCQKBJTSA-N Thr-Gly-Gly Chemical compound C[C@@H](O)[C@H](N)C(=O)NCC(=O)NCC(O)=O XPNSAQMEAVSQRD-FBCQKBJTSA-N 0.000 description 4
- URPSJRMWHQTARR-MBLNEYKQSA-N Thr-Ile-Gly Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(O)=O URPSJRMWHQTARR-MBLNEYKQSA-N 0.000 description 4
- PRNGXSILMXSWQQ-OEAJRASXSA-N Thr-Leu-Phe Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O PRNGXSILMXSWQQ-OEAJRASXSA-N 0.000 description 4
- TZJSEJOXAIWOST-RHYQMDGZSA-N Thr-Lys-Arg Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(O)=O)CCCN=C(N)N TZJSEJOXAIWOST-RHYQMDGZSA-N 0.000 description 4
- MUAFDCVOHYAFNG-RCWTZXSCSA-N Thr-Pro-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(O)=O MUAFDCVOHYAFNG-RCWTZXSCSA-N 0.000 description 4
- VTMGKRABARCZAX-OSUNSFLBSA-N Thr-Pro-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)[C@@H](C)O VTMGKRABARCZAX-OSUNSFLBSA-N 0.000 description 4
- KPMIQCXJDVKWKO-IFFSRLJSSA-N Thr-Val-Glu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O KPMIQCXJDVKWKO-IFFSRLJSSA-N 0.000 description 4
- QEJHHFFFCUDPDV-WDSOQIARSA-N Trp-His-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CC2=CNC3=CC=CC=C32)N QEJHHFFFCUDPDV-WDSOQIARSA-N 0.000 description 4
- DLZKEQQWXODGGZ-KWQFWETISA-N Tyr-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 DLZKEQQWXODGGZ-KWQFWETISA-N 0.000 description 4
- OOEUVMFKKZYSRX-LEWSCRJBSA-N Tyr-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CC=C(C=C2)O)N OOEUVMFKKZYSRX-LEWSCRJBSA-N 0.000 description 4
- IXTQGBGHWQEEDE-AVGNSLFASA-N Tyr-Asp-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 IXTQGBGHWQEEDE-AVGNSLFASA-N 0.000 description 4
- MNMYOSZWCKYEDI-JRQIVUDYSA-N Tyr-Asp-Thr Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MNMYOSZWCKYEDI-JRQIVUDYSA-N 0.000 description 4
- HIINQLBHPIQYHN-JTQLQIEISA-N Tyr-Gly-Gly Chemical compound OC(=O)CNC(=O)CNC(=O)[C@@H](N)CC1=CC=C(O)C=C1 HIINQLBHPIQYHN-JTQLQIEISA-N 0.000 description 4
- GGXUDPQWAWRINY-XEGUGMAKSA-N Tyr-Ile-Gly Chemical compound OC(=O)CNC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 GGXUDPQWAWRINY-XEGUGMAKSA-N 0.000 description 4
- RUCNAYOMFXRIKJ-DCAQKATOSA-N Val-Ala-Lys Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCCN RUCNAYOMFXRIKJ-DCAQKATOSA-N 0.000 description 4
- PAPWZOJOLKZEFR-AVGNSLFASA-N Val-Arg-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCCCN)C(=O)O)N PAPWZOJOLKZEFR-AVGNSLFASA-N 0.000 description 4
- OUUBKKIJQIAPRI-LAEOZQHASA-N Val-Gln-Asn Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O OUUBKKIJQIAPRI-LAEOZQHASA-N 0.000 description 4
- GMOLURHJBLOBFW-ONGXEEELSA-N Val-Gly-His Chemical compound CC(C)[C@@H](C(=O)NCC(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N GMOLURHJBLOBFW-ONGXEEELSA-N 0.000 description 4
- CPGJELLYDQEDRK-NAKRPEOUSA-N Val-Ile-Ala Chemical compound CC[C@H](C)[C@H](NC(=O)[C@@H](N)C(C)C)C(=O)N[C@@H](C)C(O)=O CPGJELLYDQEDRK-NAKRPEOUSA-N 0.000 description 4
- UKEVLVBHRKWECS-LSJOCFKGSA-N Val-Ile-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](C(C)C)N UKEVLVBHRKWECS-LSJOCFKGSA-N 0.000 description 4
- ZHQWPWQNVRCXAX-XQQFMLRXSA-N Val-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](C(C)C)N ZHQWPWQNVRCXAX-XQQFMLRXSA-N 0.000 description 4
- WMRWZYSRQUORHJ-YDHLFZDLSA-N Val-Phe-Asp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(=O)O)C(=O)O)N WMRWZYSRQUORHJ-YDHLFZDLSA-N 0.000 description 4
- VHIZXDZMTDVFGX-DCAQKATOSA-N Val-Ser-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](C(C)C)N VHIZXDZMTDVFGX-DCAQKATOSA-N 0.000 description 4
- NZYNRRGJJVSSTJ-GUBZILKMSA-N Val-Ser-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O NZYNRRGJJVSSTJ-GUBZILKMSA-N 0.000 description 4
- CEKSLIVSNNGOKH-KZVJFYERSA-N Val-Thr-Ala Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C)C(=O)O)NC(=O)[C@H](C(C)C)N)O CEKSLIVSNNGOKH-KZVJFYERSA-N 0.000 description 4
- GVNLOVJNNDZUHS-RHYQMDGZSA-N Val-Thr-Lys Chemical compound [H]N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(O)=O GVNLOVJNNDZUHS-RHYQMDGZSA-N 0.000 description 4
- NLNCNKIVJPEFBC-DLOVCJGASA-N Val-Val-Glu Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCC(O)=O NLNCNKIVJPEFBC-DLOVCJGASA-N 0.000 description 4
- 241000209149 Zea Species 0.000 description 4
- 108010076324 alanyl-glycyl-glycine Proteins 0.000 description 4
- 108010044940 alanylglutamine Proteins 0.000 description 4
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 description 4
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 4
- 108010001271 arginyl-glutamyl-arginine Proteins 0.000 description 4
- 235000003704 aspartic acid Nutrition 0.000 description 4
- 108010040443 aspartyl-aspartic acid Proteins 0.000 description 4
- 108010093581 aspartyl-proline Proteins 0.000 description 4
- 108010068265 aspartyltyrosine Proteins 0.000 description 4
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 4
- 235000013734 beta-carotene Nutrition 0.000 description 4
- 239000011648 beta-carotene Substances 0.000 description 4
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 description 4
- 229960002747 betacarotene Drugs 0.000 description 4
- 238000004364 calculation method Methods 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 230000000295 complement effect Effects 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 230000001687 destabilization Effects 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 101150056470 dxs gene Proteins 0.000 description 4
- 238000006911 enzymatic reaction Methods 0.000 description 4
- 239000000284 extract Substances 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 108010008237 glutamyl-valyl-glycine Proteins 0.000 description 4
- 108010079547 glutamylmethionine Proteins 0.000 description 4
- 108010075431 glycyl-alanyl-phenylalanine Proteins 0.000 description 4
- 108010027668 glycyl-alanyl-valine Proteins 0.000 description 4
- 108010072405 glycyl-aspartyl-glycine Proteins 0.000 description 4
- XKUKSGPZAADMRA-UHFFFAOYSA-N glycyl-glycyl-glycine Natural products NCC(=O)NCC(=O)NCC(O)=O XKUKSGPZAADMRA-UHFFFAOYSA-N 0.000 description 4
- 108010026364 glycyl-glycyl-leucine Proteins 0.000 description 4
- 108010028188 glycyl-histidyl-serine Proteins 0.000 description 4
- 108010077435 glycyl-phenylalanyl-glycine Proteins 0.000 description 4
- 108010020688 glycylhistidine Proteins 0.000 description 4
- 108010050848 glycylleucine Proteins 0.000 description 4
- 108010040030 histidinoalanine Proteins 0.000 description 4
- 108010044311 leucyl-glycyl-glycine Proteins 0.000 description 4
- 108010034529 leucyl-lysine Proteins 0.000 description 4
- 108010030617 leucyl-phenylalanyl-valine Proteins 0.000 description 4
- 108010000761 leucylarginine Proteins 0.000 description 4
- 108010091871 leucylmethionine Proteins 0.000 description 4
- 108010012058 leucyltyrosine Proteins 0.000 description 4
- 235000012661 lycopene Nutrition 0.000 description 4
- 239000001751 lycopene Substances 0.000 description 4
- 229960004999 lycopene Drugs 0.000 description 4
- OAIJSZIZWZSQBC-GYZMGTAESA-N lycopene Chemical compound CC(C)=CCC\C(C)=C\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C=C(/C)CCC=C(C)C OAIJSZIZWZSQBC-GYZMGTAESA-N 0.000 description 4
- 108010064235 lysylglycine Proteins 0.000 description 4
- 108010054155 lysyllysine Proteins 0.000 description 4
- 108010017391 lysylvaline Proteins 0.000 description 4
- 108010016686 methionyl-alanyl-serine Proteins 0.000 description 4
- 108010022588 methionyl-lysyl-proline Proteins 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 238000010369 molecular cloning Methods 0.000 description 4
- 108010072637 phenylalanyl-arginyl-phenylalanine Proteins 0.000 description 4
- 108010089198 phenylalanyl-prolyl-arginine Proteins 0.000 description 4
- 108010012581 phenylalanylglutamate Proteins 0.000 description 4
- 238000004321 preservation Methods 0.000 description 4
- 108010048818 seryl-histidine Proteins 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 230000001954 sterilising effect Effects 0.000 description 4
- 238000000547 structure data Methods 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 235000007586 terpenes Nutrition 0.000 description 4
- 108010061238 threonyl-glycine Proteins 0.000 description 4
- ZCIHMQAPACOQHT-ZGMPDRQDSA-N trans-isorenieratene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/c1c(C)ccc(C)c1C)C=CC=C(/C)C=Cc2c(C)ccc(C)c2C ZCIHMQAPACOQHT-ZGMPDRQDSA-N 0.000 description 4
- 108010017949 tyrosyl-glycyl-glycine Proteins 0.000 description 4
- 108010020532 tyrosyl-proline Proteins 0.000 description 4
- 229940088594 vitamin Drugs 0.000 description 4
- 229930003231 vitamin Natural products 0.000 description 4
- 235000013343 vitamin Nutrition 0.000 description 4
- 239000011782 vitamin Substances 0.000 description 4
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 description 4
- IGUZJYCAXLYZEE-RFZPGFLSSA-N 1-deoxy-D-xylulose Chemical compound CC(=O)[C@@H](O)[C@H](O)CO IGUZJYCAXLYZEE-RFZPGFLSSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- OINNEUNVOZHBOX-QIRCYJPOSA-K 2-trans,6-trans,10-trans-geranylgeranyl diphosphate(3-) Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CC\C(C)=C\COP([O-])(=O)OP([O-])([O-])=O OINNEUNVOZHBOX-QIRCYJPOSA-K 0.000 description 3
- DFNMSBYEEKBETA-JZLJSYQFSA-N 3-Hydroxyechinenone Chemical compound C([C@H](O)C(=O)C=1C)C(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C DFNMSBYEEKBETA-JZLJSYQFSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- YECXHLPYMXGEBI-DOYZGLONSA-N Adonixanthin Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)C(=O)C(O)CC1(C)C)C=CC=C(/C)C=CC2=C(C)CC(O)CC2(C)C YECXHLPYMXGEBI-DOYZGLONSA-N 0.000 description 3
- NGHMDNPXVRFFGS-IUYQGCFVSA-N D-erythrose 4-phosphate Chemical compound O=C[C@H](O)[C@H](O)COP(O)(O)=O NGHMDNPXVRFFGS-IUYQGCFVSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 241000223218 Fusarium Species 0.000 description 3
- OINNEUNVOZHBOX-XBQSVVNOSA-N Geranylgeranyl diphosphate Natural products [P@](=O)(OP(=O)(O)O)(OC/C=C(\CC/C=C(\CC/C=C(\CC/C=C(\C)/C)/C)/C)/C)O OINNEUNVOZHBOX-XBQSVVNOSA-N 0.000 description 3
- 108010026318 Geranyltranstransferase Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 241000611236 Paracoccus marcusii Species 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- JZRWCGZRTZMZEH-UHFFFAOYSA-N Thiamine Natural products CC1=C(CCO)SC=[N+]1CC1=CN=C(C)N=C1N JZRWCGZRTZMZEH-UHFFFAOYSA-N 0.000 description 3
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 3
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- YECXHLPYMXGEBI-ZNQVSPAOSA-N adonixanthin Chemical compound C([C@H](O)C(=O)C=1C)C(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)C[C@@H](O)CC1(C)C YECXHLPYMXGEBI-ZNQVSPAOSA-N 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 235000005822 corn Nutrition 0.000 description 3
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 3
- 235000006932 echinenone Nutrition 0.000 description 3
- YXPMCBGFLULSGQ-YHEDCBSUSA-N echinenone Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCC(=O)C1(C)C)C=CC=C(/C)C=CC2=C(C)CCCC2(C)C YXPMCBGFLULSGQ-YHEDCBSUSA-N 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 229910017053 inorganic salt Inorganic materials 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 3
- 235000019796 monopotassium phosphate Nutrition 0.000 description 3
- 229930003658 monoterpene Natural products 0.000 description 3
- 150000002773 monoterpene derivatives Chemical class 0.000 description 3
- 235000002577 monoterpenes Nutrition 0.000 description 3
- 229930014626 natural product Natural products 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 3
- 239000000049 pigment Substances 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 238000001556 precipitation Methods 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- DFNMSBYEEKBETA-FXGCUYOLSA-N rac-3-Hydroxyechinenon Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)C(=O)C(O)CC1(C)C)C=CC=C(/C)C=CC2=C(C)CCCC2(C)C DFNMSBYEEKBETA-FXGCUYOLSA-N 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 238000004659 sterilization and disinfection Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 125000002769 thiazolinyl group Chemical group 0.000 description 3
- 239000004474 valine Substances 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 2
- AJBZENLMTKDAEK-UHFFFAOYSA-N 3a,5a,5b,8,8,11a-hexamethyl-1-prop-1-en-2-yl-1,2,3,4,5,6,7,7a,9,10,11,11b,12,13,13a,13b-hexadecahydrocyclopenta[a]chrysene-4,9-diol Chemical compound CC12CCC(O)C(C)(C)C1CCC(C1(C)CC3O)(C)C2CCC1C1C3(C)CCC1C(=C)C AJBZENLMTKDAEK-UHFFFAOYSA-N 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical group C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 2
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 2
- 241000251468 Actinopterygii Species 0.000 description 2
- 241001135756 Alphaproteobacteria Species 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 241000972773 Aulopiformes Species 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 235000003880 Calendula Nutrition 0.000 description 2
- 240000001432 Calendula officinalis Species 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- ACTIUHUUMQJHFO-UHFFFAOYSA-N Coenzym Q10 Natural products COC1=C(OC)C(=O)C(CC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UHFFFAOYSA-N 0.000 description 2
- MNQZXJOMYWMBOU-VKHMYHEASA-N D-glyceraldehyde Chemical compound OC[C@@H](O)C=O MNQZXJOMYWMBOU-VKHMYHEASA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- PLUBXMRUUVWRLT-UHFFFAOYSA-N Ethyl methanesulfonate Chemical compound CCOS(C)(=O)=O PLUBXMRUUVWRLT-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 229930191978 Gibberellin Natural products 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- AMQJEAYHLZJPGS-UHFFFAOYSA-N N-Pentanol Chemical compound CCCCCO AMQJEAYHLZJPGS-UHFFFAOYSA-N 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- 101710082824 Octaprenyl diphosphate synthase Proteins 0.000 description 2
- 241001282110 Pagrus major Species 0.000 description 2
- 241000192142 Proteobacteria Species 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 240000006365 Vitis vinifera Species 0.000 description 2
- 235000014787 Vitis vinifera Nutrition 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 239000003513 alkali Substances 0.000 description 2
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 2
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 2
- 235000011130 ammonium sulphate Nutrition 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 229960002685 biotin Drugs 0.000 description 2
- 239000011616 biotin Substances 0.000 description 2
- 235000020958 biotin Nutrition 0.000 description 2
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 2
- 239000004327 boric acid Substances 0.000 description 2
- LLSDKQJKOVVTOJ-UHFFFAOYSA-L calcium chloride dihydrate Chemical compound O.O.[Cl-].[Cl-].[Ca+2] LLSDKQJKOVVTOJ-UHFFFAOYSA-L 0.000 description 2
- 159000000007 calcium salts Chemical class 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 150000001844 chromium Chemical class 0.000 description 2
- 235000017471 coenzyme Q10 Nutrition 0.000 description 2
- ACTIUHUUMQJHFO-UPTCCGCDSA-N coenzyme Q10 Chemical compound COC1=C(OC)C(=O)C(C\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UPTCCGCDSA-N 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 238000006482 condensation reaction Methods 0.000 description 2
- 150000001879 copper Chemical class 0.000 description 2
- 238000012136 culture method Methods 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- RMRCNWBMXRMIRW-BYFNXCQMSA-M cyanocobalamin Chemical compound N#C[Co+]N([C@]1([H])[C@H](CC(N)=O)[C@]\2(CCC(=O)NC[C@H](C)OP(O)(=O)OC3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)C)C/2=C(C)\C([C@H](C/2(C)C)CCC(N)=O)=N\C\2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O RMRCNWBMXRMIRW-BYFNXCQMSA-M 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 101150081397 dps gene Proteins 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 235000019688 fish Nutrition 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 239000003448 gibberellin Substances 0.000 description 2
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 239000000710 homodimer Substances 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 150000002505 iron Chemical class 0.000 description 2
- RUTXIHLAWFEWGM-UHFFFAOYSA-H iron(3+) sulfate Chemical compound [Fe+3].[Fe+3].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O RUTXIHLAWFEWGM-UHFFFAOYSA-H 0.000 description 2
- 229910000360 iron(III) sulfate Inorganic materials 0.000 description 2
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 159000000003 magnesium salts Chemical class 0.000 description 2
- 150000002696 manganese Chemical class 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 238000005374 membrane filtration Methods 0.000 description 2
- 150000002751 molybdenum Chemical class 0.000 description 2
- 239000003471 mutagenic agent Substances 0.000 description 2
- 231100000707 mutagenic chemical Toxicity 0.000 description 2
- 150000002815 nickel Chemical class 0.000 description 2
- 125000001477 organic nitrogen group Chemical group 0.000 description 2
- 239000003002 pH adjusting agent Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- LXNHXLLTXMVWPM-UHFFFAOYSA-N pyridoxine Chemical compound CC1=NC=C(CO)C(CO)=C1O LXNHXLLTXMVWPM-UHFFFAOYSA-N 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 229940005657 pyrophosphoric acid Drugs 0.000 description 2
- 238000010223 real-time analysis Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 235000019515 salmon Nutrition 0.000 description 2
- 238000011218 seed culture Methods 0.000 description 2
- 150000003342 selenium Chemical class 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- 239000011721 thiamine Substances 0.000 description 2
- 235000019157 thiamine Nutrition 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 150000003657 tungsten Chemical class 0.000 description 2
- 150000003751 zinc Chemical class 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- 101710165761 (2E,6E)-farnesyl diphosphate synthase Proteins 0.000 description 1
- FSCYHDCTHRVSKN-DJNGBRKISA-N (2Z,6Z,10Z,14Z,18Z,22Z,26Z,30Z,34E)-decaprenyl diphosphate Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C/CC\C(C)=C/CC\C(C)=C/CC\C(C)=C/CC\C(C)=C/CC\C(C)=C/CC\C(C)=C/CC\C(C)=C/COP(O)(=O)OP(O)(O)=O FSCYHDCTHRVSKN-DJNGBRKISA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- PAWQVTBBRAZDMG-UHFFFAOYSA-N 2-(3-bromo-2-fluorophenyl)acetic acid Chemical compound OC(=O)CC1=CC=CC(Br)=C1F PAWQVTBBRAZDMG-UHFFFAOYSA-N 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- WFCGYZPOBJZGDF-UHFFFAOYSA-N 2-methylbuta-1,3-diene;phosphono dihydrogen phosphate Chemical compound CC(=C)C=C.OP(O)(=O)OP(O)(O)=O WFCGYZPOBJZGDF-UHFFFAOYSA-N 0.000 description 1
- PMYDPQQPEAYXKD-UHFFFAOYSA-N 3-hydroxy-n-naphthalen-2-ylnaphthalene-2-carboxamide Chemical compound C1=CC=CC2=CC(NC(=O)C3=CC4=CC=CC=C4C=C3O)=CC=C21 PMYDPQQPEAYXKD-UHFFFAOYSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 239000004254 Ammonium phosphate Substances 0.000 description 1
- 241000380131 Ammophila arenaria Species 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 241000131418 Brevundimonas vesicularis Species 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- GHOKWGTUZJEAQD-UHFFFAOYSA-N Chick antidermatitis factor Natural products OCC(C)(C)C(O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-UHFFFAOYSA-N 0.000 description 1
- 241000195628 Chlorophyta Species 0.000 description 1
- 229910021555 Chromium Chloride Inorganic materials 0.000 description 1
- 241000238424 Crustacea Species 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 241000238557 Decapoda Species 0.000 description 1
- 108010006731 Dimethylallyltranstransferase Proteins 0.000 description 1
- 102000005454 Dimethylallyltranstransferase Human genes 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- 241000239366 Euphausiacea Species 0.000 description 1
- 101710156207 Farnesyl diphosphate synthase Proteins 0.000 description 1
- 101710125754 Farnesyl pyrophosphate synthase Proteins 0.000 description 1
- 101710089428 Farnesyl pyrophosphate synthase erg20 Proteins 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 241000193385 Geobacillus stearothermophilus Species 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 241000168517 Haematococcus lacustris Species 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 238000012218 Kunkel's method Methods 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 108010021466 Mutant Proteins Proteins 0.000 description 1
- 102000008300 Mutant Proteins Human genes 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 241000919410 Paracoccus carotinifaciens Species 0.000 description 1
- 241000589597 Paracoccus denitrificans Species 0.000 description 1
- 241001459979 Paracoccus sp. PC1 Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 241000081271 Phaffia rhodozyma Species 0.000 description 1
- OOUTWVMJGMVRQF-NWYYEFBESA-N Phoenicoxanthin Chemical compound C([C@H](O)C(=O)C=1C)C(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)C(=O)CCC1(C)C OOUTWVMJGMVRQF-NWYYEFBESA-N 0.000 description 1
- 102000006335 Phosphate-Binding Proteins Human genes 0.000 description 1
- 108010058514 Phosphate-Binding Proteins Proteins 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 1
- 101710150389 Probable farnesyl diphosphate synthase Proteins 0.000 description 1
- 235000019774 Rice Bran oil Nutrition 0.000 description 1
- 241000277331 Salmonidae Species 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 235000019764 Soybean Meal Nutrition 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- AJPADPZSRRUGHI-MGVUJODPSA-N [(2R,3S)-5-deuterio-2,3-dihydroxy-4-oxopentyl] dihydrogen phosphate Chemical compound [2H]CC(=O)[C@@H](O)[C@H](O)COP(O)(O)=O AJPADPZSRRUGHI-MGVUJODPSA-N 0.000 description 1
- YPXGTKHZRCDZTL-KSFOROOFSA-N [(2r,3s)-2,3,4-trihydroxypentyl] dihydrogen phosphate Chemical compound CC(O)[C@H](O)[C@H](O)COP(O)(O)=O YPXGTKHZRCDZTL-KSFOROOFSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960004050 aminobenzoic acid Drugs 0.000 description 1
- 150000005005 aminopyrimidines Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 229910000148 ammonium phosphate Inorganic materials 0.000 description 1
- 235000019289 ammonium phosphates Nutrition 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000000721 bacterilogical effect Effects 0.000 description 1
- LFYJSSARVMHQJB-QIXNEVBVSA-N bakuchiol Chemical compound CC(C)=CCC[C@@](C)(C=C)\C=C\C1=CC=C(O)C=C1 LFYJSSARVMHQJB-QIXNEVBVSA-N 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 238000010170 biological method Methods 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 229940043430 calcium compound Drugs 0.000 description 1
- 150000001674 calcium compounds Chemical class 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 125000001895 carotenoid group Chemical group 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- QSWDMMVNRMROPK-UHFFFAOYSA-K chromium(3+) trichloride Chemical compound [Cl-].[Cl-].[Cl-].[Cr+3] QSWDMMVNRMROPK-UHFFFAOYSA-K 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 229910000365 copper sulfate Inorganic materials 0.000 description 1
- ARUVKPQLZAKDPS-UHFFFAOYSA-L copper(II) sulfate Chemical compound [Cu+2].[O-][S+2]([O-])([O-])[O-] ARUVKPQLZAKDPS-UHFFFAOYSA-L 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 229960002104 cyanocobalamin Drugs 0.000 description 1
- 235000000639 cyanocobalamin Nutrition 0.000 description 1
- 239000011666 cyanocobalamin Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 238000010908 decantation Methods 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000000368 destabilizing effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- MNNHAPBLZZVQHP-UHFFFAOYSA-N diammonium hydrogen phosphate Chemical compound [NH4+].[NH4+].OP([O-])([O-])=O MNNHAPBLZZVQHP-UHFFFAOYSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000002050 diffraction method Methods 0.000 description 1
- ZJIPHXXDPROMEF-UHFFFAOYSA-N dihydroxyphosphanyl dihydrogen phosphite Chemical compound OP(O)OP(O)O ZJIPHXXDPROMEF-UHFFFAOYSA-N 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 235000013345 egg yolk Nutrition 0.000 description 1
- 210000002969 egg yolk Anatomy 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 238000005187 foaming Methods 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- IXORZMNAPKEEDV-UHFFFAOYSA-N gibberellic acid GA3 Natural products OC(=O)C1C2(C3)CC(=C)C3(O)CCC2C2(C=CC3O)C1C3(C)C(=O)O2 IXORZMNAPKEEDV-UHFFFAOYSA-N 0.000 description 1
- IXORZMNAPKEEDV-OBDJNFEBSA-N gibberellin A3 Chemical class C([C@@]1(O)C(=C)C[C@@]2(C1)[C@H]1C(O)=O)C[C@H]2[C@]2(C=C[C@@H]3O)[C@H]1[C@]3(C)C(=O)O2 IXORZMNAPKEEDV-OBDJNFEBSA-N 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- 235000002532 grape seed extract Nutrition 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 235000013402 health food Nutrition 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- 238000009830 intercalation Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- FBAFATDZDUQKNH-UHFFFAOYSA-M iron chloride Chemical compound [Cl-].[Fe] FBAFATDZDUQKNH-UHFFFAOYSA-M 0.000 description 1
- 159000000014 iron salts Chemical class 0.000 description 1
- 229910000358 iron sulfate Inorganic materials 0.000 description 1
- BAUYGSIQEAFULO-UHFFFAOYSA-L iron(2+) sulfate (anhydrous) Chemical compound [Fe+2].[O-]S([O-])(=O)=O BAUYGSIQEAFULO-UHFFFAOYSA-L 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000000944 linseed oil Substances 0.000 description 1
- 235000021388 linseed oil Nutrition 0.000 description 1
- 230000002366 lipolytic effect Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 229910001425 magnesium ion Inorganic materials 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229940099596 manganese sulfate Drugs 0.000 description 1
- 239000011702 manganese sulphate Substances 0.000 description 1
- 235000007079 manganese sulphate Nutrition 0.000 description 1
- SQQMAOCOWKFBNP-UHFFFAOYSA-L manganese(II) sulfate Chemical compound [Mn+2].[O-]S([O-])(=O)=O SQQMAOCOWKFBNP-UHFFFAOYSA-L 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000009629 microbiological culture Methods 0.000 description 1
- 229940057059 monascus purpureus Drugs 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 230000003505 mutagenic effect Effects 0.000 description 1
- LGQLOGILCSXPEA-UHFFFAOYSA-L nickel sulfate Chemical compound [Ni+2].[O-]S([O-])(=O)=O LGQLOGILCSXPEA-UHFFFAOYSA-L 0.000 description 1
- 229910000363 nickel(II) sulfate Inorganic materials 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 235000014593 oils and fats Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229940055726 pantothenic acid Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 238000000053 physical method Methods 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 239000004323 potassium nitrate Substances 0.000 description 1
- 235000010333 potassium nitrate Nutrition 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- CBIDRCWHNCKSTO-UHFFFAOYSA-N prenyl diphosphate Chemical compound CC(C)=CCO[P@](O)(=O)OP(O)(O)=O CBIDRCWHNCKSTO-UHFFFAOYSA-N 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 238000010298 pulverizing process Methods 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 235000008160 pyridoxine Nutrition 0.000 description 1
- 239000011677 pyridoxine Substances 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 239000008165 rice bran oil Substances 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000011684 sodium molybdate Substances 0.000 description 1
- 235000015393 sodium molybdate Nutrition 0.000 description 1
- TVXXNOYZHKPKGW-UHFFFAOYSA-N sodium molybdate (anhydrous) Chemical compound [Na+].[Na+].[O-][Mo]([O-])(=O)=O TVXXNOYZHKPKGW-UHFFFAOYSA-N 0.000 description 1
- 239000011655 sodium selenate Substances 0.000 description 1
- 235000018716 sodium selenate Nutrition 0.000 description 1
- 229960001881 sodium selenate Drugs 0.000 description 1
- XMVONEAAOPAGAO-UHFFFAOYSA-N sodium tungstate Chemical compound [Na+].[Na+].[O-][W]([O-])(=O)=O XMVONEAAOPAGAO-UHFFFAOYSA-N 0.000 description 1
- 239000004455 soybean meal Substances 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 238000009210 therapy by ultrasound Methods 0.000 description 1
- 229960003495 thiamine Drugs 0.000 description 1
- KYMBYSLLVAOCFI-UHFFFAOYSA-N thiamine Chemical compound CC1=C(CCO)SCN1CC1=CN=C(C)N=C1N KYMBYSLLVAOCFI-UHFFFAOYSA-N 0.000 description 1
- AYEKOFBPNLCAJY-UHFFFAOYSA-O thiamine pyrophosphate Chemical compound CC1=C(CCOP(O)(=O)OP(O)(O)=O)SC=[N+]1CC1=CN=C(C)N=C1N AYEKOFBPNLCAJY-UHFFFAOYSA-O 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- 229940048102 triphosphoric acid Drugs 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 238000009423 ventilation Methods 0.000 description 1
- 229940011671 vitamin b6 Drugs 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
- NWONKYPBYAMBJT-UHFFFAOYSA-L zinc sulfate Chemical compound [Zn+2].[O-]S([O-])(=O)=O NWONKYPBYAMBJT-UHFFFAOYSA-L 0.000 description 1
- 229910000368 zinc sulfate Inorganic materials 0.000 description 1
- 229960001763 zinc sulfate Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P23/00—Preparation of compounds containing a cyclohexene ring having an unsaturated side chain containing at least ten carbon atoms bound by conjugated double bonds, e.g. carotenes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/20—Bacteria; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/74—Vectors or expression systems specially adapted for prokaryotic hosts other than E. coli, e.g. Lactobacillus, Micromonospora
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1022—Transferases (2.) transferring aldehyde or ketonic groups (2.2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1085—Transferases (2.) transferring alkyl or aryl groups other than methyl groups (2.5)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y205/00—Transferases transferring alkyl or aryl groups, other than methyl groups (2.5)
- C12Y205/01—Transferases transferring alkyl or aryl groups, other than methyl groups (2.5) transferring alkyl or aryl groups, other than methyl groups (2.5.1)
- C12Y205/01086—Trans,polycis-decaprenyl diphosphate synthase (2.5.1.86)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y202/00—Transferases transferring aldehyde or ketonic groups (2.2)
- C12Y202/01—Transketolases and transaldolases (2.2.1)
- C12Y202/01007—1-Deoxy-D-xylulose-5-phosphate synthase (2.2.1.7)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y205/00—Transferases transferring alkyl or aryl groups, other than methyl groups (2.5)
- C12Y205/01—Transferases transferring alkyl or aryl groups, other than methyl groups (2.5) transferring alkyl or aryl groups, other than methyl groups (2.5.1)
- C12Y205/01091—All-trans-decaprenyl-diphosphate synthase (2.5.1.91)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Enzymes And Modification Thereof (AREA)
- Fodder In General (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
本发明提供一种突变型产类胡萝卜素细菌,其包含以下(a)~(c)中任一种基因。(a)编码包含突变型氨基酸序列的蛋白质的基因,所述突变型氨基酸序列是产类胡萝卜素细菌的1‑脱氧‑D‑木酮糖‑5‑磷酸合成酶的氨基酸序列中至少第225位氨基酸残基被其它氨基酸残基取代而成的。(b)编码包含突变型氨基酸序列的蛋白质的基因,所述突变型氨基酸序列是产类胡萝卜素细菌的十聚异戊二烯焦磷酸合成酶的氨基酸序列中至少第305位氨基酸残基被其它氨基酸残基取代而成的。(c)所述(a)及(b)两者的基因。
Description
技术领域
本发明涉及使用了产类胡萝卜素细菌的突变株制造类胡萝卜素方法。
背景技术
类胡萝卜素是作为饲料添加物、食品添加物、医药品等使用的有用的天然色素。类胡萝卜素包括虾青素、角黄素、玉米黄质、β-隐黄素、番茄红素、β-胡萝卜素、金盏花红素、金盏花黄质、海胆酮、Asteroidenone及3-羟基海胆酮等。其中,虾青素作为养殖鱼中的鲑鱼、鳟鱼、真鲷等的体色改良剂、作为家禽类的蛋黄颜色改良剂等饲料添加物是有用的。另外,天然的虾青素作为安全的食品添加物、健康食品材料在工业上的价值很高。金盏花黄质及金盏花红素与虾青素同样地期待具有作为饲料添加物、食品添加物、医药品等的用途。
另外,β-胡萝卜素作为饲料添加物、食品添加物、医药品等使用,角黄素作为饲料添加物、食品添加物、化妆品等使用,玉米黄质作为食品添加物、饲料添加物等使用。此外,番茄红素、海胆酮、β-隐黄素、3-羟基海胆酮、Asteroidenone等也期待作为饲料添加物、食品材料等使用。作为这些类胡萝卜素的制造方法,已知有化学合成法、从天然物提取的方法、基于微生物培养的生产方法等。
作为虾青素的化学合成法,已知基于β-胡萝卜素转化的方法(Pure Appl.Chem.,57,741,1985(非专利文献1))及由C15盐合成的方法(Helv.Chim.Acta,64,2436,1981(非专利文献2))。作为从天然物提取的方法,由于虾青素存在于鲑鱼、真鲷等鱼类及虾、蟹、磷虾等甲壳类中,因此可以从它们中提取收集。
作为利用微生物生产类胡萝卜素的方法,已报道了利用绿藻类Haematococcuspluvialis的培养法(日本特开2007-97584号公报(专利文献1))、利用红酵母Phaffiarhodozyma的发酵法(日本特开平11-69969号公报(专利文献2))、利用属于副球菌属的细菌(以下,也称为“副球菌属细菌”)的发酵法、利用属于短波单胞菌属的细菌的发酵法(日本特开2006-340676号公报(专利文献3))、利用属于赤杆菌属的细菌的发酵法(日本特开2008-259449号公报(专利文献4))。作为生产类胡萝卜素的副球菌属细菌的例子,可以举出E-396株及A-581-1株(日本特开平7-79796号公报(专利文献5)及International Journal ofSystematic Bacteriology(1999),49,277-282(非专利文献3))。作为其它类胡萝卜素生产性的属于副球菌属的细菌,可以列举:Paracoccus marcusii(马氏副球菌)MH1株(日本特表2001-512030号公报(专利文献6))、Paracoccus haeundaensis(海云台副球菌)BC74171株(International Journal of Systematic and Evolutionary Microbiology(2004),54,1699-1702(非专利文献4))、副球菌属细菌N-81106株(日本特开2007-244205号公报(专利文献7))、Paracoccus zeaxanthinifaciens(产玉米黄素副球菌)(International Journalof Systematic and Evolutionary Microbiology(2003),53,231-238(非专利文献5))及Paracoccus sp.PC-1株(WO 2005/118812号小册子(专利文献8))等。
然而,上述的类胡萝卜素的制造方法中存在若干待解决课题。例如,用化学合成法制造的类胡萝卜素即使安全也会给消费者留下不好的印象。与化学合成法相比,从天然物提取出的类胡萝卜素的制造成本非常高。在利用微生物进行的制造中,利用绿藻类、酵母的培养进行的生产的生产率低,而且这些微生物具有牢固的细胞壁,难以从培养物中提取类胡萝卜素。
另一方面,利用属于副球菌属的细菌进行类胡萝卜素的制造具有该菌体的增殖速度快、类胡萝卜素的生产率高、易于从培养物中提取类胡萝卜素等优点,已经报道了若干培养方法及制造方法。
例如,日本特开2007-143492号公报(专利文献9)公开了在培养中添加铁盐的方法,WO2010/044469号小册子(专利文献10)公开了在培养基中添加氨基酸的方法,日本特开2011-188795号公报(专利文献11)公开了在培养基中添加生物素的方法,另外,日本特开2012-139164号公报(专利文献12)公开了在培养基中添加3.6mM以上的钙化合物的方法。
但是,在产生类胡萝卜素的细菌中,哪个基因有助于提高生产效率的详细情况仍不明确。
现有技术文献
专利文献
专利文献1:日本特开2007-97584号公报
专利文献2:日本特开平11-69969号公报
专利文献3:日本特开2006-340676号公报
专利文献4:日本特开2008-259449号公报
专利文献5:日本特开平7-79796号公报
专利文献6:日本特表2001-512030号公报
专利文献7:日本特开2007-244205号公报
专利文献8:WO2005/118812号小册子
专利文献9:日本特开2007-143492号公报
专利文献10:WO2010/044469号小册子
专利文献11:日本特开2011-188795号公报
专利文献12:日本特开2012-139164号公报
非专利文献
非专利文献1:Pure Appl.Chem.,57,741,1985
非专利文献2:Helv.Chim.Acta,64,2436,1981
非专利文献3:International Journal of Systematic Bacteriology(1999),49,277-282
非专利文献4:International Journal of Systematic and EvolutionaryMicrobiology(2004),54,1699-1702
非专利文献5:International Journal of Systematic and EvolutionaryMicrobiology(2003),53,231-238
发明内容
发明要解决的课题
本发明的目的在于提供一种突变型产类胡萝卜素细菌、以及使用了该细菌制造类胡萝卜素的方法。
本发明人等为了解决上述课题而进行了深入研究,结果成功地从进行了突变处理的细菌中获得了高效生产虾青素的细菌,从而完成了本发明。
解决课题的方法
(1)一种突变型产类胡萝卜素细菌,其包含以下(a)~(c)中任一种基因:
(a)编码包含突变型氨基酸序列的蛋白质的基因,该突变型氨基酸序列是产类胡萝卜素细菌的1-脱氧-D-木酮糖-5-磷酸合成酶的氨基酸序列中至少第225位的氨基酸残基被其它氨基酸残基取代而成的;
(b)编码包含突变型氨基酸序列的蛋白质的基因,该突变型氨基酸序列是产类胡萝卜素细菌的十聚异戊二烯焦磷酸合成酶的氨基酸序列中至少第305位氨基酸残基被其它氨基酸残基取代而成的;
(c)所述(a)及(b)两者的基因。
(2)根据(1)所述的细菌,其中,1-脱氧-D-木酮糖-5-磷酸合成酶的氨基酸序列为序列号2所示的序列。
(3)根据(1)或(2)所述的细菌,其中,第225位氨基酸残基由甘氨酸被取代为天冬氨酸。
(4)根据(1)~(3)中任一项所述的细菌,其中,十聚异戊二烯焦磷酸合成酶的氨基酸序列为序列号4所示的序列。
(5)根据(1)~(4)中任一项所述的细菌,其中,第305位氨基酸残基由丙氨酸被取代为缬氨酸。
(6)根据(1)~(5)中任一项所述的细菌,其与不具有编码包含突变型氨基酸序列的蛋白质的基因的产类胡萝卜素细菌的类胡萝卜素产生能力相比,获得了更高的产生能力。
(7)根据(6)所述的细菌,其与不具有编码包含突变型氨基酸序列的蛋白质的基因的产类胡萝卜素细菌的类胡萝卜素产生量相比,获得了至少5倍以上的量的产生能力。
(8)根据(1)~(7)中任一项所述的细菌,其中,产类胡萝卜素细菌属于副球菌属。
(9)根据(8)所述的细菌,其中,属于副球菌属的细菌为E-396株。
(10)根据(1)~(9)中任一项所述的细菌,其中,类胡萝卜素为虾青素。
(11)一种类胡萝卜素的制造方法,该方法包括:培养(1)~(10)中任一项所述的细菌,从得到的培养物采集类胡萝卜素。
(12)根据(11)所述的方法,其中,与不具有编码包含突变型氨基酸序列的蛋白质的基因的产类胡萝卜素细菌的类胡萝卜素产生量相比,该方法的类胡萝卜素的产生量至少为5倍以上的产生量。
(13)根据(11)或(12)所述的方法,其中,类胡萝卜素为虾青素。
(14)一种产类胡萝卜素细菌的筛选方法,该方法包括:对产类胡萝卜素细菌进行突变处理,从进行了突变处理的细菌中选择具有以下(a)~(c)中任一种特征的细菌:
(a)1-脱氧-D-木酮糖-5-磷酸合成酶的活性较突变处理前的细菌的活性增加;
(b)十聚异戊二烯焦磷酸合成酶的活性较突变处理前的细菌的活性降低;
(c)上述(a)及(b)两者。
(15)一种类胡萝卜素的制造方法,该方法包括:对根据(14)所述的方法选择的细菌进行培养,从得到的培养物采集类胡萝卜素。
(16)一种基因,其编码包含突变型氨基酸序列的蛋白质,该突变型氨基酸序列是1-脱氧-D-木酮糖-5-磷酸合成酶的氨基酸序列中至少第225位氨基酸残基被其它氨基酸残基取代而成的。
(17)一种基因,其包含以下(a)或(b)的DNA:
(a)包含序列号5所示的碱基序列的DNA;
(b)在严格条件下,与包含和上述(a)的DNA互补的碱基序列的DNA进行杂交、且编码具有1-脱氧-D-木酮糖-5-磷酸合成酶活性的蛋白质的DNA。
(18)一种基因,其编码包含突变型氨基酸序列的蛋白质,该突变型氨基酸序列是十聚异戊二烯焦磷酸合成酶的氨基酸序列中至少第305位氨基酸残基被其它氨基酸残基取代而成的。
(19)一种基因,其包含以下(a)或(b)的DNA:
(a)包含序列号7所示的碱基序列的DNA;
(b)在严格条件下,与包含和上述(a)的DNA互补的碱基序列的DNA进行杂交、且编码降低了十聚异戊二烯焦磷酸合成酶活性的蛋白质的DNA。
(20)一种重组载体,其包含以下(a)~(c)中的任一种基因:
(a)(16)或(17)所述的基因,
(b)(18)或(19)所述的基因,
(c)所述(a)及(b)的基因。
(21)一种转化体,其含有(20)所述的重组载体。
(22)一种类胡萝卜素的制造方法,该方法包括:培养(21)所述的转化体,从得到的培养物采集类胡萝卜素。
发明的效果
根据本发明,可以提供类胡萝卜素的高产细菌。通过使用本发明的细菌,可以高效地制造类胡萝卜素。
附图说明
图1是示出E-396株及ASB-57株的总类胡萝卜素及虾青素的比生产率的图。
图2是示出酶A的模板结构的图。
图3A是示出酶A与模板结构(201X)的比对(alignment)的图。用绿色表示推测的活性部位。用蓝色条表示无序(disordered)区域。
图3B是示出酶A与模板结构(201X)的比对(alignment)的图。用绿色表示推测的活性部位。用蓝色条表示无序区域。
图4是示出模板结构、酶A与辅酶TPP复合体的模型结构的图。来自于模板D.Radiodurans(耐放射异常球菌)的1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)与TPP复合体的结构(2O1X)(左)构建而成的酶A的模型结构(右)。形成同源二聚体,各亚基的TPP与Mg结合。以Space-filling方式表示TPP及Mg。
图5是示出酶A与TPP中间体和底物的复合体的模型结构的图。示出了在辅酶TPP上加成丙酮酸而成的羟乙基-TPP中间体和三磷酸甘油醛(GAP)与构建成的酶A结合而得到的复合体。
图6是示出酶A与辅酶TPP的相互作用的图。
图7是示出通过酶A推测与TPP相互作用的氨基酸残基的图。以Sticks方式表示与TPP相互作用的残基。
图8是示出推测酶A与羟乙基-TPP中间体的羟乙基相互作用的氨基酸残基的图。用Sticks方式表示推测与羟乙基相互作用的残基。
图9是示出推测酶A与三磷酸甘油醛(GAP)相互作用的氨基酸残基的图。
图10是示出酶A与底物丙酮酸的相互作用的图。
图11是示出酶A与底物三磷酸甘油醛的相互作用的图。
图12是示出酶A与其它种DXS的比对的图。EnzymeA:酶A,DXS_ECOLI:DXS(E.coli),DXS_VITVI:DXS(Vitis vinifera),DXS_DEIRA:(Deinococcus radiodurans,耐放射异常球菌)。用蓝色条表示模板结构(DXS_DEIRA)的无序区域。用绿色框表示活性部位,用▲表示DXS_ECOLI及DXS_VITVI中观察到活性提高的突变。
图13是示出酶A的无序区域的位置的图。无序区域(蓝色的虚线)的N末端侧的环(loop)的Asn180、Met182与Mg结合,Ile184与TPP结合。
图14是示出酶A的无序区域的模型结构的图。酶A中的无序区域(淡蓝色)的模型结构(左)和无序区域的模型结构的静电势图(右)。
图15是示出虾青素合成路径中推测的酶A突变体的效果的图。
图16是示出酶C的模板结构的图。示出了来自于Rhodobacter capsulatus(荚膜红细菌)的十聚异戊二烯焦磷酸合成酶(PDB ID:3MZV)。
图17是示出酶C与模板结构(3MZV)的比对的图。用绿色表示推测的活性部位。
图18是示出模板结构、以及酶C与IPP及FPP的复合体的模型结构的图。来自于模板R.Capsulatus(荚膜红细菌)的十聚异戊二烯焦磷酸合成酶(3MZV)(左)和构建的酶C的模型结构(右)。用Space-filling的方式表示FPP及IPP。
图19是示出模板结构、以及酶C与IPP及FPP的复合体的模型结构的图。FPP与IPP以头尾相接(head-to-tail)的朝向结合,缩合反应在IPP的异戊烯基与FPP的磷酸基之间(左图、箭头)进行。对于长链异戊二烯二磷酸合成酶而言,反应生成物进一步与IPP结合,向底物结合部位的内部(右图、箭头)延伸。
图20是示出模板结构与酶C的模型结构的比较的图。来自于模板R.Capsulatus的十聚异戊二烯焦磷酸合成酶(左)和酶C(右)的底物复合体模型。用绿色表示一致的氨基酸残基的结构。底物结合区域和其附近的结构全部一致。
图21是示出酶C与十聚异戊二烯焦磷酸合成酶(产玉米黄素副球菌,Paracoccuszeaxanthinifaciens)的比对的图。
图22是示出酶C与FPP及IPP的复合体模型的图。带状图表示(左)和表面形状(右)。以A链(浅红色)、B链(浅蓝色)表示。用Space-filling方式表示FPP和IPP。
图23是示出推测在酶C中与FPP(上)、IPP(中)、Mg(下)相互作用的氨基酸残基的图。
图24是示出酶A与底物FPP及IPP的相互作用的图。
图25是示出酶A与Mg的相互作用的图。
图26是示出酶C的野生型和突变体A305V的立体结构模型的图。用Space-filling方式表示Ala305(绿色)及Val305(品红色)。
图27是示出野生型的Ala305(左)和突变体的Val305(右)的附近结构的图。Ala305与附近的氨基酸残基相接。通过突变为Val305,产生与附近的结构的空间位阻。用绿色表示Ala305,用品红色表示Val305。
图28是示出野生型(蓝色)与突变体A305V(红色)的分子内能的比较的图。
图29是示出野生型与突变体A305V的结构比较的图。通过A305V的突变,Ala305(绿色)和Val305(品红色)的附近的氨基酸残基的结构发生变化(左)。该结构变化对于邻接的α螺旋也造成影响(右)。
图30是示出酶C中的A305V的影响的图。
图31是示出酶C中的A305V的影响的图。
图32是示出酶C中的A305V的影响的图。
图33是示出虾青素合成路径中推测的酶C突变体的效果的图。
具体实施方式
以下,对本发明进行详细说明。
1.概要
本发明涉及高产类胡萝卜素的细菌,其是包含以下(a)及(b)中任一种基因或这两种基因的细菌。
(a)编码包含突变型氨基酸序列的蛋白质的基因,所述突变型氨基酸序列是产类胡萝卜素细菌的1-脱氧-D-木酮糖-5-磷酸合成酶的氨基酸序列中至少第225位氨基酸残基被其它氨基酸残基取代而成的。
(b)编码包含突变型氨基酸序列的蛋白质的基因,所述突变型氨基酸序列是产类胡萝卜素细菌的十聚异戊二烯焦磷酸合成酶的氨基酸序列中至少第305位氨基酸残基被其它氨基酸残基取代而成的。
为了开发类胡萝卜素的生产能力高的细菌,本发明人对E-396株及其突变处理后的株的类胡萝卜素产生能力进行了研究,并且对这些株中编码与类胡萝卜素合成路径相关的酶的基因的突变进行了分析。
其结果,获得了比作为亲株使用的E-396株具有更高的类胡萝卜素产生能力的株(称为“ASB-57株”)。进行了ASB-57株的基因组分析,结果确认了1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)的氨基酸序列、以及十聚异戊二烯焦磷酸合成酶(DPS)的氨基酸序列中发生了突变。因此,通过氨基酸立体结构分析进行预测功能分析,可以认为,至少DXS的第225位氨基酸残基和/或DPS的第305位氨基酸残基中发生突变有助于类胡萝卜素的高产。
本发明是基于上述见解而完成的。
2.突变型产类胡萝卜素细菌
本发明的产类胡萝卜素细菌是能够以高效率产生类胡萝卜素的细菌,其是对亲株进行突变处理、以DXS的第225位氨基酸残基和/或DPS的第305位氨基酸残基发生了突变作为指标而得到的突变型细菌。在本说明书中,将本发明的产类胡萝卜素细菌称为“突变型产类胡萝卜素细菌”。
(1)亲株
在本发明中,作为用于得到突变型产类胡萝卜素细菌的亲株而使用的细菌,只要是产生类胡萝卜素的细菌即可,没有任何限定,可以列举例如:属于副球菌属(Paracoccus属)、短波单胞菌属(Brevundimonas属)、赤杆菌属(Erythrobacter属)的细菌。
作为本发明中使用的细菌,只要是产生类胡萝卜素的细菌即可,没有任何限定,可以列举例如:属于副球菌属(Paracoccus属)、短波单胞菌属(Brevundimonas属)、赤杆菌属(Erythrobacter属)的细菌。
优选使用属于副球菌属的细菌、属于短波单胞菌属的细菌或属于赤杆菌属的细菌,更优选使用属于副球菌属的细菌。副球菌属、赤杆菌属及短波单胞菌属均分类于变形菌门(Proteobacteria门)、α变形菌纲(Alpha Proteobacteria纲),在细菌分类学上具有共通性,因此,在本发明中,可以使用属于这些属的细菌。
在属于副球菌属的细菌中,优选使用Paracoccus carotinifaciens(产类胡萝卜素副球菌)、Paracoccus marcusii(马氏副球菌)、Paracoccus haeundaensis(海云台副球菌)及Paracoccus zeaxanthinifaciens(产玉米黄素副球菌),特别优选使用Paracoccuscarotinifaciens。作为属于副球菌属的细菌的具体菌株的例子,可以列举:Paracoccuscarotinifaciens E-396株(FERM BP-4283)及副球菌属细菌A-581-1株(FERM BP-4671),本发明也可优选使用它们的突变株。
作为属于赤杆菌属的产类胡萝卜素细菌,可以列举例如:Erythrobacter JPCC M种(日本特开2008-259452)、Erythrobacter JPCC O种(日本特开2008-259449)等。
作为属于短波单胞菌属的产类胡萝卜素细菌,可以列举例如:BrevundimonasSD212株(日本特开2009-27995)、Brevundimonas FERM P-20515,20516株(日本特开2006-340676)、Brevundimonas vesicularis(泡囊短波单胞菌属)(Gene,Vol.379,p.101-108,1Sep 2006)等。
另外,作为产类胡萝卜素细菌,优选使用与16S核糖体RNA对应的DNA的碱基序列与序列号9中记载的E-396株的碱基序列具有高同源性的细菌。这里所谓的碱基序列的同源性优选为95%以上,更优选为96%以上,进一步优选为97%以上,特别优选为98%以上,最优选为99%以上。
与16S核糖体RNA对应的DNA的碱基序列是指将16S核糖体RNA的碱基序列中的U(尿嘧啶)取代为T(胸腺嘧啶)的而得到的碱基序列。
基于该16S核糖体RNA的碱基序列的同源性的微生物分类法近年成为主流。以往的微生物分类法基于以往的运动性、营养缺陷性、糖的同化性等菌学性质,因此,在发生了由自然突变所引起的性状变化等的情况下,有时会将微生物错误分类。与此相对,由于16S核糖体RNA的碱基序列在遗传上是非常稳定的,因此,与以往的分类法相比,基于其同源性的分类法的分类可靠度显著提高。
Paracoccus carotinifaciens(产类胡萝卜素副球菌)E-396株的16S核糖体RNA的碱基序列与其它的产类胡萝卜素细菌Paracoccus marcusii(马氏副球菌)DSM 11574株、副球菌属细菌N-81106株、Paracoccus haeundaensis(海云台副球菌)BC 74171株、副球菌属细菌A-581-1株、Paracoccus zeaxanthinifaciens(产玉米黄素副球菌)ATCC 21588株及Paracoccus sp.PC-1株的16S核糖体RNA的碱基序列的同源性分别为99.7%、99.7%、99.6%、99.4%、95.7%及95.4%,可知它们是分类学上极其接近的菌株。因此,可以认为这些菌株作为产生类胡萝卜素的细菌而形成了一个组。因此,这些菌株可以优选用于本发明,能够高效地产生类胡萝卜素。
在本发明中,可以使用改善了类胡萝卜素生产率的公知的突变株。作为该公知突变株的例子,可以列举:虾青素生产能力高的菌株(日本特开2001-95500)、选择性大量产生角黄素的菌株(日本特开2003-304875)、选择性大量产生玉米黄质和β-隐黄素的菌株(日本特开2005-87097)、选择性产生番茄红素的菌株(日本特开2005-87100)。
作为在本发明中用作亲株的产类胡萝卜素细菌的例子而举出的E-396株在IPOD,NITE-国家高级工业科学技术学院,国际专利生物保藏中心(独立行政法人製品評価技術基盤機構(NITE)特許生物寄託センター(NITE-IPOD))进行了以下所述的国际保藏。
国际保藏单位:IPOD,NITE-国家高级工业科学技术学院,国际专利生物保藏中心(独立行政法人製品評価技術基盤機構(NITE)特許生物寄託センター)
292-0818
千叶县木更津市上总镰足2-5-8(千葉県木更津市かずさ鎌足2-5-8)
显示标识:E-396
保藏编号:FERM BP-4283
原保藏日:平成5年(1993年)4月27日
另外,作为在本发明中用作亲株的产类胡萝卜素细菌的另一例子而举出的A-581-1株在上述保藏单位进行了以下所述的国际保藏。
显示标识:A-581-1
保藏编号:FERM BP-4671
原保藏日:平成6年(1994年)5月20日
(2)突变处理及筛选
本发明的突变型产类胡萝卜素细菌可以对上述亲株实施突变处理,以DXS的第225位氨基酸残基和/或DPS的第305位氨基酸残基产生突变作为指标而得到。
进行突变处理的方法只要是可诱发突变的方法即可,没有特别限定。例如,可以采用利用N-甲基-N’-硝基-N-亚硝基胍(NTG)及甲磺酸乙酯(EMS)等突变剂的化学方法、紫外线照射及X射线照射等物理方法、基于基因重组及转座子等的生物学方法等。突变处理的细菌没有特别限定,优选为产类胡萝卜素细菌。
另外,在本发明中,为了制备具有上述突变的蛋白质,可以在编码该蛋白质的基因(DNA)中导入点突变。作为该突变导入方法,可以使用利用了Kunkel法、Gapped duplex法等部位特异性诱变法的突变导入用试剂盒、例如QuikChangeTM Site-Directed MutagenesisKit(Stratagene公司制造)、GeneTailorTM Site-Directed Mutagenesis System(Invitrogen公司制造)、TaKaRa Site-Directed Mutagenesis System(Mutan-K、Mutan-Super Express Km等:Takara Bio公司制造)等。另外,可以使用“Molecular Cloning,ALaboratory Manual(4th edition)”(Cold Spring Harbor Laboratory Press(2012))等中记载的部位特异性诱变法等方法。
突变株的筛选方法没有特别限定,可以使用公知的基因组分析工具PacBio RS II(Pacific Biosciences公司制造)、MiSeq(Illumina公司制造)等进行基因分析,确认与DXS的第225位氨基酸残基和/或DPS的第305位氨基酸残基对应的碱基序列有无突变。
另外,与上述基因组分析同时进行,例如,除了根据琼脂培养基上的菌落的色调来选择目标突变株的方法以外,还可以用试管、烧瓶、发酵槽等培养突变株,并通过利用吸光度、高效液相色谱、薄层色谱等的类胡萝卜素色素分析,以类胡萝卜素的生产量作为指标来进行选择。
突变及筛选的工序可以为1次,另外,例如也可以如下所述将突变及筛选工序重复2次以上:通过突变处理和筛选得到突变株,然后进一步通过对其进行突变处理和筛选来获得改善了生产率的突变株。
这样筛选出的突变型产类胡萝卜素细菌具有编码如下氨基酸序列的基因,所述氨基酸序列是DXS的第225位氨基酸残基突变为其它氨基酸、和/或DPS的第305位氨基酸残基突变为其它氨基酸残基而成的。
DXS的第225位氨基酸残基向其它氨基酸的突变有助于DXS的酶活性升高。由此,促进从丙酮酸向1-脱氧-D-木酮糖-5-磷酸的合成,进而提高作为虾青素合成的底物的异戊烯焦磷酸(IPP)的生产。
DPS的第305位氨基酸残基向其它氨基酸残基的突变有助于降低DPS的酶活性。该突变抑制从法尼基焦磷酸(FPP)向十聚异戊二烯焦磷酸(DPP)的合成。由于从FPP向DPP的合成中使用IPP,因此可以通过上述突变减少DPP合成中使用的IPP的量,该IPP可用作上述虾青素合成的底物。
这里,在本发明中,只要是具有编码这些包含具有DXS活性的下述氨基酸序列的蛋白质、和/或包含降低(抑制)了DPS活性的下述氨基酸序列的蛋白质的基因即可,在该DXS和/或DPS的氨基酸序列的其它区域的氨基酸序列中,可以在1个以上的氨基酸残基中发生取代、缺失或添加等突变,所述氨基酸序列是DXS的第225位氨基酸残基突变成其它氨基酸、和/或DPS的第305位氨基酸残基突变成其它氨基酸残基而成的氨基酸序列。
因此,本申请发明的突变型产类胡萝卜素细菌可以含有以下(a)的基因、以下(b)的基因、或者以下(a)及(b)的基因两者。
(a)编码包含突变型氨基酸序列的蛋白质的基因,所述突变型氨基酸序列是产类胡萝卜素细菌的DXS的氨基酸序列中至少第225位氨基酸残基被其它氨基酸残基取代而成的
作为上述突变型DXS基因,可以举出例如以下的基因。
(i)编码包含突变型氨基酸序列且具有DXS活性的蛋白质的基因,所述突变型氨基酸序列是DXS的氨基酸序列(例如序列号2)中第225位氨基酸残基被其它氨基酸残基取代而成的
作为这样的突变型氨基酸序列,可以举出序列号6所示的序列,作为上述基因,可以举出序列号5所示的基因。在本发明中,优选为序列号2所示的氨基酸序列中第225位氨基酸残基的甘氨酸被天冬氨酸取代而成的氨基酸序列。
(ii)编码包含突变型氨基酸序列且具有DXS活性的蛋白质的基因,所述突变型氨基酸序列是DXS的氨基酸序列(例如序列号2)中第225位氨基酸残基被其它氨基酸残基取代、且除该第225位氨基酸残基以外的1个或多个(例如1~数个)氨基酸残基发生了缺失、取代或添加而成的
(iii)包含含有序列号5所示的碱基序列的DNA的基因
(iv)包含下述DNA的基因,所述DNA在严格条件下和包含与含有序列号5所示的碱基序列的DNA互补的碱基序列的DNA进行杂交、且编码具有DXS活性的蛋白质
上述序列号5所示的碱基序列编码包含以下氨基酸序列的蛋白质,所述氨基酸序列是在产类胡萝卜素细菌的编码DXS的氨基酸序列的DNA(序列号1)中第225位氨基酸残基被其它氨基酸残基取代而成的。
(b)编码包含突变型氨基酸序列的蛋白质的基因,所述突变型氨基酸序列是产类胡萝卜素细菌的DPS的氨基酸序列中至少第305位氨基酸残基被其它氨基酸残基取代而成的
作为这样的基因,可以举出例如以下的基因。
(i)编码包含突变型氨基酸序列且降低了DPS活性的蛋白质的基因,所述突变型氨基酸序列是DPS的氨基酸序列(例如序列号4)中第305位氨基酸残基被其它氨基酸残基取代而成的
作为这样的突变型氨基酸序列,可以举出序列号8所示的序列,作为上述基因,可以举出序列号7所示的基因。在本发明中,优选为序列号4所示的氨基酸序列中第305位氨基酸残基的丙氨酸被缬氨酸取代而成的氨基酸序列。
(ii)编码包含突变型氨基酸序列且降低了DPS活性的蛋白质,所述突变型氨基酸序列是DPS的氨基酸序列(例如序列号4)中第305位氨基酸残基被其它氨基酸残基取代、且除该第305位氨基酸残基以外的1个或多个(例如1~数个)氨基酸残基发生了缺失、取代或添加而成的
(iii)包含含有序列号7所示的碱基序列的DNA的基因
(iv)包含下述DNA的基因,所述DNA在严格条件下和包含与含有序列号7所示的碱基序列的DNA互补的碱基序列的DNA进行杂交、且编码降低了DPS活性的蛋白质
上述序列号7所示的碱基序列编码包含以下氨基酸序列的蛋白质,所述氨基酸序列是在产类胡萝卜素细菌的编码DPS的氨基酸序列的DNA(序列号3)中第305位氨基酸残基被其它氨基酸残基取代而成的。
这里,杂交可以按照公知的方法(例如,Sambrook J.et al.,Molecular Cloning,A Laboratory Manual(4th edition)(Cold Spring Harbor Laboratory Press(2012))来进行。高严格条件是指形成所谓的特异性杂种(hybrid)而不形成非特异性杂种的条件,例如,钠浓度为10mM~300mM、优选为20mM~100mM、温度为25℃~70℃、优选为42℃~55℃的条件。
作为这样的突变型产类胡萝卜素细菌,可以列举例如:ASB-57株、ASK-8株、ASH-66株等。
ASB-57株具有编码包含如下氨基酸序列的蛋白质的基因,所述氨基酸序列是DXS的第225位氨基酸残基的甘氨酸突变为天冬氨酸、且DPS的第305位氨基酸残基的丙氨酸突变为缬氨酸而成的。将ASB-57株中DXS的氨基酸序列及基因的碱基序列分别示于序列号6、5。另外,将ASB-57株中DPS的氨基酸序列及基因的碱基序列分别示于序列号8、7。
(4)基因重组体的制备
在本发明中,通过将编码上述突变型DXS的基因、和/或编码上述突变型DPS的基因导入宿主进行转化,可以得到基因重组型的突变型产类胡萝卜素细菌。
将突变型DXS基因和/或突变型DPS基因导入载体而得到的重组载体、以及将该重组载体导入宿主而得到的转化体可以采用任意的公知方法,例如可以按照Sambrook J.etal.,Molecular Cloning,A Laboratory Manual(4th edition)(Cold Spring HarborLaboratory Press(2012)来进行。
在基因工程合成上述DXS基因及DPS基因时,首先设计并合成编码该酶的DNA。DNA的设计及合成例如可以以包含全长基因的载体等作为模板,使用设计为能够合成希望的DNA区域的引物,通过PCR法来进行。然后,通过将上述DNA连结于适当的载体,得到蛋白质表达用重组载体,通过将该重组载体导入宿主中使得能够表达目标基因,从而得到转化体(Sambrook J.et al.,Molecular Cloning,A Laboratory Manual(4th edition)(ColdSpring Harbor Laboratory Press(2012))。
载体中可以使用能够在宿主微生物中自主增殖的噬菌体或质粒。另外,也可以使用动物病毒、昆虫病毒载体。重组载体的制备可以用适当的限制酶切断经过纯化的DNA,插入适当载体DNA的限制酶部位等,并连接于载体。作为转化中使用的宿主,只要能够表达目标基因即可,没有特别限定。例如,可以列举:细菌(枯草菌、副球菌属细菌等)、酵母、动物细胞(COS细胞、CHO细胞等)、植物细胞、昆虫细胞或昆虫。向宿主导入重组载体的方法是公知的。
另外,向基因导入突变的方法与上述相同。
(3)类胡萝卜素的生产
在本发明中,可以通过用给定的培养基培养上述产类胡萝卜素细菌或转化体来稳定地生产高浓度的类胡萝卜素。
产生的类胡萝卜素没有特别限定,例如为虾青素、角黄素、玉米黄质、β-隐黄素、番茄红素、β-胡萝卜素、金盏花红素、金盏花黄质、海胆酮、Asteroidenone或3-羟基海胆酮,优选为虾青素、角黄素、玉米黄质或β-隐黄素,更优选为虾青素或玉米黄质。通过本发明制造的类胡萝卜素可以是一种,也可以是多种组合。
以下,对培养本发明的突变型产类胡萝卜素细菌或转化体的方法进行说明。
对于本发明的培养所用的类胡萝卜素生产用培养基而言,只要是产类胡萝卜素细菌或转化体生长、生产类胡萝卜素的成分即可,可以添加任意成分。含有这样的添加物的培养基可以是任意培养基,可优选使用含有碳源、氮源、无机盐类及根据需要添加的维生素类等的培养基。
作为碳源,可以列举例如:葡萄糖、蔗糖、乳糖、果糖、海藻糖、甘露糖、甘露醇及麦芽糖等糖类、乙酸、富马酸、柠檬酸、丙酸、苹果酸、丙二酸及丙酮酸等有机酸、乙醇、丙醇、丁醇、戊醇、己醇、异丁醇及甘油等醇类、大豆油、米糠油、橄榄油、玉米油、芝麻油及亚麻籽油等油脂类等,其中,优选使用葡萄糖或蔗糖。在这些碳源中,可以使用1种或2种以上。培养前的培养基(初始培养基)中添加的量根据碳源种类而不同,可以适当调整,通常为每1L培养基1~100g,优选为2~50g。另外,也优选碳源不仅添加于初始培养基,也在培养过程中逐步或连续地追加供给。
作为氮源,可以使用作为无机盐的硝酸铵、硫酸铵、氯化铵、磷酸铵等铵盐类、硝酸钾等硝酸盐类、氨及尿素等中的1种或2种以上。添加量根据氮源的种类而不同,可以适当调整,通常相对于培养基1L为0.1g~20g,优选为0.2~10g。
另外,作为有机氮源,例如可以使用玉米浆(包含过滤处理物)、Pharmamedia、大豆粕、大豆粉、花生饼粉、大豆蛋白胨、酒糟、干燥酵母、酵母提取物、酪蛋氨基酸、谷氨酸、天冬氨酸等中的1种或2种以上。添加浓度根据氮源的种类而不同,可以适当调整,通常为0~80g/L,优选为1~30g/L。
无机氮源及有机氮源通常添加于初始培养基,也优选逐步或连续地进行追加供给。
作为无机盐类,例如可以使用磷酸二氢钾、磷酸氢二钾、磷酸氢二钠等磷酸盐类、硫酸镁、氯化镁等镁盐类、硫酸铁、氯化铁等铁盐类、氯化钙、碳酸钙等钙盐类、碳酸钠、氯化钠等钠盐类、硫酸锰等锰盐类、硫酸铜等铜盐类、硫酸锌等锌盐类、钼酸钠等钼盐类、硫酸镍等镍盐类、硒酸钠等硒盐类、钨酸钠等钨盐类、氯化铝等铝盐类、氯化铬等铬盐类、硼酸及碘化钾等中的1种或2种以上。添加量根据无机盐的种类而不同,可以适当调整,通常相对于培养基1L为0.0001~15g。对于磷酸盐类、镁盐类、钙盐类、钠盐类及铁盐类而言,优选为0.02~15g/L,在加入锰盐类、铜盐类、锌盐类、钼盐类、镍盐类、硒盐类、钨盐类、铝盐类、铬盐类、硼酸、碘化钾等的情况下,0.1~15mg/L为优选的浓度。无机盐类通常添加于初始培养基,也可以逐步或连续地进行追加供给。
作为维生素类,例如可以使用氰基钴胺、核黄素、泛酸、吡哆醇、硫胺素、抗坏血酸、叶酸、烟酸、对氨基苯甲酸、生物素、肌醇、胆碱等。添加比例根据维生素类的种类而不同,可以适当调整,通常相对于培养基1L为0.001~1000mg,优选为0.01~100mg。维生素类通常添加于初始培养基,也可以逐步或连续地进行追加供给。
在本发明中,为了抑制培养液起泡,优选使用消泡剂。对于消泡剂的种类而言,只要具有抑制泡的产生或消除产生的泡的作用、且对产生细菌的抑制作用小即可,可以是任意消泡剂。可以示例出例如:醇类消泡剂、聚醚类消泡剂、酯类消泡剂、脂肪酸类消泡剂、有机硅类消泡剂、磺酸类消泡剂等。添加量根据消泡剂的种类而不同,可以适当调整,通常相对于培养基1L为0.01g~10g。
消泡剂通常添加于灭菌前的初始培养基。另外,也可以在培养过程中连续或间歇地追加添加。作为在培养过程中添加消泡剂的方法,可以示例出:用传感器探测泡而自动添加的方法、利用程序计时器每隔一定时间进行添加的方法、与进料用碳源、氮源或pH调整剂等混合添加以使其与生长速度联动的方法等。添加于初始培养基的消泡剂与培养过程中添加于培养液的消泡剂可以是相同种类,也可以根据作用使用不同种类。
在本发明中,培养基的初期pH调整为2~12,优选调整为6~9,更优选调整为6.5~8.0。在培养中也优选保持上述范围的pH。作为pH调整剂,可以示例出氢氧化钠水溶液、氢氧化钾水溶液、碳酸钠水溶液、氨水、氨气、硫酸水溶液或它们的混合物。
在本发明中,培养基在进行了灭菌处理后用于细菌的培养。本领域技术人员可以适当进行灭菌处理。例如,可以用高压灭菌器对适当容器中的培养基进行加热灭菌。或者利用灭菌过滤器进行过滤灭菌。
本发明的突变型产类胡萝卜素细菌或转化体被接种至如上所述制备的培养基并在给定的条件下培养。接种可以通过以下方式进行:通过使用了试管、烧瓶或发酵槽等的种子培养使菌株适当增殖,将得到的培养液加入类胡萝卜素生产用培养基。种子培养所用的培养基只要是产类胡萝卜素细菌可良好增殖的培养基即可,没有特别限定。
培养可以在适当的培养容器中进行。培养容器可根据培养容量而适当选择,可以列举例如:试管、烧瓶、发酵槽等。
培养温度为15~40℃,优选为20~35℃,更优选为25℃~32℃,通常为1~18天,优选为2~12天,更优选为3~8天,在好氧条件下进行培养。作为好氧条件,可以举出例如振荡培养或通气搅拌培养等,优选将溶解氧浓度控制为一定的范围。溶解氧浓度的控制例如可以通过改变搅拌转速、通气量、内压等来进行。溶解氧浓度优选控制为0.3~10ppm,更优选控制为0.5~7ppm,进一步优选控制为1~5ppm。
对本发明的突变型产类胡萝卜素细菌或转化体进行了培养后的产类胡萝卜素细菌的菌体数或转化体数可以通过OD来测定。另外,培养产类胡萝卜素细菌或转化体而得到的培养物中的类胡萝卜素、或从培养物中采集的类胡萝卜素的定量可以通过高效液相色谱来进行。在如上所述培养产类胡萝卜素细菌或转化体后,可以从得到的培养物中采集类胡萝卜素。
培养物可以列举例如:培养液、培养上清、菌体浓缩液、湿菌体、干燥菌体、菌体溶解物等。培养上清可以通过对培养液进行离心处理或过滤处理,从培养液中除去菌体来制备。菌体浓缩液可以通过对培养液进行离心分离或膜过滤浓缩而得到。湿菌体可以通过对培养液进行离心或过滤而得到。干燥菌体可以通过用通常的干燥方法将湿菌体或菌体浓缩液干燥而得到。这样得到的含有类胡萝卜素的干燥菌体可以直接用作饲料添加物。
发酵培养时的产量至少为150mg/L,例如含有150mg/L、400mg/L、2000mg/L、4000mg/L的类胡萝卜素。根据使用的菌体,培养液中含有的类胡萝卜素的量发生波动,例如含有400mg/L~4000mg/L的类胡萝卜素,进一步优选含有500mg/L~3500mg/L的类胡萝卜素。
与不具有编码包含DXS和/或DPS的突变型氨基酸序列的蛋白质的基因的产类胡萝卜素细菌的类胡萝卜素生产量相比,本发明的细菌至少具有5倍的量的生产能力,优选具有10倍以上的量的生产能力。
在本发明中,从上述培养物中采集类胡萝卜素的方法没有特别限定,可以是能够稳定且高效地回收类胡萝卜素的任意方法。对于本领域技术人员,这些方法可以从公知的提取、纯化技术中适当选择进行。另外,在本发明中,也可以使用上述培养物作为含有类胡萝卜素的组合物。
在进行提取之前,可以对培养物进行以下的1种或2种以上的处理:使用了碱试剂、表面活性剂等的化学处理,使用了溶菌酶、脂肪分解酶及蛋白水解酶等的生化学处理,或者超声波或粉碎等物理处理。
例如,在从培养物中提取类胡萝卜素的情况下,提取及清洗所用的溶剂没有特别限定,可以列举:甲醇、乙醇、异丙醇等低级醇类、丙酮、四氢呋喃、甲乙酮、甲基异丁基酮、二氯甲烷、氯仿、二甲基甲酰胺、二甲基亚砜等。
在想要尽量防止提取操作中类胡萝卜素的氧化的情况下,可以在氮气等非活性气体氛围中进行处理。另外,也可以在提取溶剂中加入医药品、食品所用的抗氧化剂。或者可以将这些处理进行组合。另外,为了尽量防止光导致的类胡萝卜素的分解,可以在不照射光的条件下进行。
可以将这样得到的提取物直接作为类胡萝卜素使用,也可以进一步纯化后使用。
将残存在提取操作后的提取物中的细菌等分离的方法没有特别限定,可以使用膜过滤、离心分离、倾析等。
作为从提取液中得到类胡萝卜素沉淀物的方法,通常可以列举加热和/或减压浓缩、结晶析出。此外,也可以通过低温下的类胡萝卜素色素的析出、利用酸/碱试剂、各种盐类进行的析出而不使类胡萝卜素色素浓缩地进行分离。在工业上使用的情况下,优选结晶析出。
为了清洗,可以根据需要使用少量的低级醇类等溶剂将得到的类胡萝卜素沉淀物悬浮搅拌。清洗的方法没有特别限定,例如可以举出在悬浮搅拌后进行滤取的方法或使液体从沉淀物的上方通过的方法等作为实用的优选方法。
如上所述得到的培养物、提取物或纯化物可以作为类胡萝卜素而分别单独使用,也可以将它们以任意比例混合使用。
2.与虾青素合成路径相关的酶的立体结构分析
为了表明上述DXS的第225位氨基酸残基、以及DPS的第305位氨基酸残基的突变对类胡萝卜素合成起到重要作用,可以对这些酶的立体结构进行分析。
在本发明中,对于虾青素合成路径上的2种酶(称为酶A、酶C)鉴定了点突变。由于虾青素产生的增加被认为是由于这些酶发生的突变,因此对于鉴定了突变的2种酶构建立体结构模型,推测由突变带来的氨基酸取代的影响。
酶A推测为1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)。经过鉴定的氨基酸的突变G225D在位于活性部位附近的无序(disordered)区域。根据立体结构模型可以推测,酶A的突变G225D在酶A中引起与已知提高DXS活性的已知无序区域突变相同的结构变化,可以预测提高了突变G225D酶的酶活性。考虑到DXS受到IPP的反馈抑制的控制,对于突变G225D酶而言,反馈抑制失效,提示IPP的产生量增加。可以认为,由于酶A的突变G225D,作为虾青素原料的IPP的供给量增加,这是虾青素产生量增加的因素。
酶C推测为十聚异戊二烯焦磷酸合成酶。根据立体结构模型可以推测,经过鉴定的突变A305V会引起与附近的氨基酸残基的空间位阻,使酶C的立体结构不稳定。作为酶C的底物且是十聚异戊二烯焦磷酸的原料的FPP和IPP也是虾青素合成的原料。这表明,由于不稳定化,酶C的活性降低,从而使由酶C消耗的FPP和IPP的量减少。可以认为,其结果是可以用于虾青素合成的FPP、IPP的量增加,虾青素的产生量增加。
如上所述,作为本次鉴定的突变对虾青素合成路径带来的效果,可以推测有以下2项:酶A的活性提高带来的IPP产生量的增加、以及酶C的活性降低带来的IPP对虾青素合成路径的供给量的增加。可以认为,这些效果是虾青素产生量增加的重要原因。
实施例
以下,通过实施例对本发明更具体地进行说明。但是本发明的范围并不受这些实施例的限定。
[实施例1]
(1)副球菌属细菌的突变处理及基因组分析
突变处理方法
对亲株(E-396株)使用UV、NTG(亚硝基胍)等作为突变原,使用各种选择压力实施了数次筛选。筛选以虾青素的产量作为指标进行。
基因组分析法
使用PacBio RS II(Pacific Biosciences公司制造)、MiSeq(Illumina公司)的测序仪读取基因组序列,然后使用SMART Cell 8Pac V3(Pacific Biosciences公司制造)、MiSeq Control Software(MCS)v2.4.1.3、Real Time Analysis(RTA)v1.18.54,bcl2fastqv 1.8.4(Illumina公司)等分析软件进行了基因组分析。
基因组分析结果(突变部位的鉴定)
突变部位的鉴定通过以下方式进行:在被认为具有这些基因组分析结果的突变点的蛋白质的区域的氨基酸序列与Kyoto Encyclopedia of Genes and Genomes(KEGG)中收录的酶基因氨基酸序列之间同源性高的序列中,选出包含于副球菌属的序列,进而,根据这些信息进行酶的立体结构分析,找出序列一致的模板,由此确定了具有突变部位的蛋白质的氨基酸序列的最终的酶名称。
(2)虾青素的产量
(i)培养条件
试管冲程(stroke)–330rpm、28℃、pH7.2、培养基量8ml/根
培养时间–72小时。
培养基–
将以下组成的培养基8ml加入内径18mm的带有棉塞的试管中,在121℃下进行15分钟高压灭菌,制备了种子用试管培养基。种子用试管培养基的原料使用了已确认菌体充分生长的批次。
蔗糖 30g/L
玉米浆 30g/L
磷酸二氢钾 1.5g/L
磷酸氢二钠12水合物 3.8g/L
氯化钙2水合物 5.0g/L
硫酸镁7水合物 0.7g/L
硫酸铁7水合物 1.0g/L
pH7.2
接着,准备了5份将以下组成的培养基7.2ml加入内径18mm的带有棉塞的试管中的生产用试管培养基。生产用试管培养基的原料使用了已确认菌体生长不充分的批次。
葡萄糖 30g/L
玉米浆过滤处理物 30g/L
硫酸铵 1.5g/L
磷酸二氢钾 1.5g/L
磷酸氢二钠12水合物 3.8g/L
氯化钙2水合物 5.0g/L
硫酸镁7水合物 0.7g/L
硫酸铁7水合物 1.0g/L
有机硅类消泡剂 0.2g/L
(ii)结果
将各株的比生产率示于图1。
根据本实施例,得到了与E-396株相比具有10倍以上的类胡萝卜素产生能力的ASB-57株。
[实施例2]
与虾青素合成路径相关的酶的立体结构分析
1.立体结构数据及方法
通过同源建模(homology modeling)构建了酶A、酶C的立体结构模型。建模中使用了软件Swiss-Pdb viewer及SWISS-MODEL[1,2]。用Swiss-Pdb viewer制作了突变体模型。氨基酸残基的取代使用了mutate命令,分子内能的计算使用了compute energy命令,而且能量最小化计算使用了energy minimization命令。使用软件Waals(Altif Labs.Inc.)进行了与底物等的复合体模型的制作、底物附近残基的检测、原子间距离的测定、立体结构的显示。通过MarvinSketch(ChemAxon Ltd.)制作了低分子化合物的立体结构模型。
模板结构的立体结构的坐标数据从蛋白质立体结构数据库Protein Data Base(PDB)(http://www.rcsb.org/pdb/)获得。模板结构使用了PDB收录的数据中分别与酶A、酶C的氨基酸一致度最高的结构。将作为同源建模的模板而使用的立体结构数据示于表1。
表1同源建模中使用的立体结构数据
2.酶A的立体结构模型的构建和突变体的分析
酶A是在生物合成作为虾青素合成的原料的异戊二烯焦磷酸(IPP)的异戊间二烯化合物生物合成路径之一的脱氧木酮糖路径中,从丙酮酸和D-三磷酸甘油醛合成1-脱氧-D-木酮糖-5-磷酸的1-脱氧-D-木酮糖-5-磷酸合成酶:1-deoxy-D-xylurose-5-phosphatesynthase(DXS)。
根据构建的酶A的立体结构模型可知,通过基因组分析进行了鉴定的突变G225D位于已多次报告的产生突变时DXS酶活性提高的例子的活性部位附近的无序区域。通过突变体模型的分析结果可以推测,酶A的突变G225D引起与提高DXS活性的已知突变相同的结构变化,可以预测突变G225D酶也与已知突变同样地提高了DXS的酶活性。可以认为,通过DXS的活性提高,随着作为虾青素原料的IPP的供给量增加,虾青素的产生量增加。
2.1.1-脱氧-D-木酮糖-5-磷酸合成酶的酶反应
酶A、1-脱氧-D-木酮糖-5-磷酸合成酶:1-deoxy-D-xylurose-5-phosphatesynthase(DXS)在镁离子(Mg)存在下由丙酮酸和D-三磷酸甘油醛合成1-脱氧-D-木酮糖-5-磷酸。在催化反应中,需要焦磷酸硫胺素(Thiamine pyrophosphate,TPP)作为辅酶,首先,辅酶TPP与底物丙酮酸加成,生成羟乙基-TPP中间体。通过该中间体与三磷酸甘油醛反应,生成1-脱氧-D-木酮糖-5-磷酸。以下示出了酶A的酶反应。
[化学式1]
2.2.酶A的立体结构模型的构建
(1)通过同源建模进行酶A的立体结构模型的构建
通过同源建模,基于利用X射线晶体结构分析确定了与辅酶TPP的复合体的立体结构的来自于耐放射异常球菌(Deinococcus radiodurans,D.radiodurans)的1-deoxy-D-xylurose-5-phosphate synthase(DXS、模板)的立体结构(PDB ID:2O1X)[3](图2),构建了酶A的立体结构模型。
同源建模基于酶A与模板结构的立体结构比对来进行(图3A、3B)。
酶A与来自于D.radiodurans的DXS的氨基酸一致度为44.1%。在模板的DXS的立体结构中,氨基酸号199~242残基的区域(44残基)为无序(disordered),无法通过X射线晶体结构分析确定原子的位置。因此,构建了除去与酶A的无序区域相当的196~238残基(43残基)以外的氨基酸残基号7~630残基的立体结构模型。接着,通过将酶A的立体结构模型与模板结构叠合,嵌入TPP及Mg,制作了酶A与TPP的复合体模型。图4示出了构建成模板结构的模型结构。
酶A与模板结构同样地形成了同源二聚体,在各亚基具有TPP结合部位及底物结合部位。酶A的单体由结构域I(1~319残基)、结构域II(320~495残基)、结构域III(496~629残基)这3个结构域构成。
(2)酶A的底物复合体模型的制作
为了推测与酶A的底物的结合相关的氨基酸残基,构建了底物与酶A结合而成的复合体模型。在模板结构2O1X中,由于无法确定底物丙酮酸及三磷酸甘油醛的坐标,因此,首先,为了检测丙酮酸结合部位,基于来自于类似的酿酒酵母(Saccharomyces cerevisiae,S.cerevisiae)的转酮醇酶(Transketolase,TK)与羟乙基-TPP中间体结合而成的立体结构(PDB ID:1GPU)[6],与丙酮酸加成于辅酶TPP而成的羟乙基-TPP中间体的复合体模型叠合,从而嵌入羟乙基-TPP中间体,制作了复合体模型。同样地,基于来自于S.cerevisiae的TK与赤藓糖-4-磷酸的立体结构(PDB ID:1NGS)[7],嵌入赤藓糖-4-磷酸,进而根据赤藓糖-4-磷酸制作三磷酸甘油醛模型,由此制作了酶A与三磷酸甘油醛的复合体模型。
图5示出了酶A与底物复合体的模型结构。
2.3.酶A的活性部位的推测
为了推定结合辅酶及底物的氨基酸残基,在酶A与辅酶的复合体模型中,对TPP中间体、GAP及Mg的相互作用进行了研究。
(1)辅酶TPP的结合部位
在酶A与TPP的复合体模型中,与模板结构同样,TPP位于结构域I与结构域II之间,TPP的嘧啶环与结构域II结合,磷酸基与结构域I结合。
TPP由氨基嘧啶环、噻唑啉环、焦磷酸构成(图6)。氨基嘧啶环以恰好容纳于酶A的结合口袋内部的方式结合。Phe396和Ile369的侧链以从两侧夹持氨基嘧啶环的方式通过疏水性相互作用结合。可以推测特别是Phe396的侧链的环状苯基与氨基嘧啶环为π堆积带来的强结合。Gly120的主链的氧和Glu371的侧链的氧与氨基嘧啶环的1位的氮原子形成氢键。已知TPP的嘧啶环的1位的氮原子与Glu残基的氢键对于通过TPP进行的催化反应是重要的,通过使用TPP作为辅酶的酶保存下来。可以推测,Arg399的侧链不仅通过疏水键,而且通过与附近的氨基酸残基Glu371、Ser122的侧链的氢键形成了结合口袋。作为与噻唑啉环的相互作用,观察到了与Ile184、Ile369的疏水键。作为与焦磷酸的相互作用,可以推测在Gly152的主链、Lys285的侧链及His79的侧链之间有氢键。
辅酶TPP的结合需要Mg。Mg配位于TPP的2个磷酸基之间,可以推测Asp151和Asn180的侧链及Met182的主链与Mg结合。对于DXS,已知,作为TPP结合模体,保留了GDGX25-30N的序列[3]。酶A中包含推测出Mg结合的Asp151和Asn180的氨基酸序列Gly150-Asp151-Gly152-Asn180的序列与该模体一致。
如上所述,可以推测,TPP的氨基嘧啶环和噻唑啉环的碳与酶A的疏水性残基Ile184、Ile369、Phe396、Arg399之间存在疏水性相互作用。另外可以推测,氨基嘧啶环的2个氮原子与Gly120、Glu371形成氢键。在与焦磷酸之间,除了与His79、Gly152、Lys285的氢键以外,还推测有通过Asp151、Asn180、Met182的Mg形成的氢键。图7示出了推测的与TPP结合相关的氨基酸残基。
(2)与丙酮酸的相互作用
作为底物的丙酮酸与TPP反应生成羟乙基-TPP中间体。根据酶A和羟乙基-TPP中间体的复合体模型可以推测,作为与来自于丙酮酸的羟乙基的相互作用,有与Val77的疏水性相互作用及与His432的氢键。可以认为这些氨基酸残基与丙酮酸的结合相关。图8示出了推测与羟乙基相互作用的氨基酸残基。
(3)与三磷酸甘油醛的相互作用
作为与底物三磷酸甘油醛(GAP)相互作用的氨基酸残基,可以推测有与His48、Tyr393、Arg421、Asp428、Arg479的氢键(图9)。
His48和Asp428与GAP的醛基形成氢键。可以推测Tyr393、Arg421、Arg479与GAP的磷酸基形成氢键。
以上,将推测的活性部位示于表2~4。
[表2]
表2.推测与酶A中检测出的羟乙基-TPP中间体相互作用的氨基酸残基
[表3]
表3.推测与酶A中检测出的三磷酸甘油醛相互作用的氨基酸残基
[表4]
表4.酶A中推测的结合部位的氨基酸残基
另外,将酶A与辅酶TPP的结合方式、酶A与丙酮酸的结合方式、酶A与三磷酸甘油醛的结合方式的图分别示于图6、10、11。
由于酶A保持了结合在来自于模板的D.radiodurans的DXS中得到了明确的辅酶TPP、底物丙酮酸及GAP的活性部位,因此推测具有DXS的酶活性。已知,这些氨基酸残基不仅在来自于D.radiodurans的DXS中,在大肠杆菌等的DXS、来自于S.cerevisiae的TK中的保守性也高[3]。
已知在大肠杆菌DXS中,将相当于酶A的Glu370、Arg399、Arg479的氨基酸残基取代为Ala时会失活[3]。另外,文献[8]中记载了在使相当于大肠杆菌DXS的酶A的His48、Glu371、Asp428的氨基酸残基突变的实验中,所有的酶基本上均失活。可以推测,在酶A中,这些氨基酸残基对于DXS的活性是重要的。
2.4.酶A的突变G225D带来的影响
酶A的突变G225D存在于无法确定立体结构的无序区域(196~238残基)。为了推测该突变对酶A的立体结构造成影响,调查了以往的见解、立体结构上的无序区域的位置与活性部位的关联。
(1)关于已知的无序区域中的突变
目前,对于麝香葡萄和大肠杆菌的DXS,报告了无序区域中发生的突变,各2个部位、总计4种均使酶活性增加。
对于来自于麝香葡萄(Vitis vinifera)的DXS而言,报告了K284N的突变带来了与野生型相比Vmax及Kcat/Km增加约2倍的活性、且因过量表达而大幅增加单萜烯的产生量[9]。
另外,已知麝香葡萄中K284N和R306C的突变与大肠杆菌中K213N和K234C的突变有关的发明(日本特表2014-500710、US20130276166)。该发明涉及通过提高DXS的活性来增加萜烯的产生量的方法,因此4例均分别通过一个残基的突变增加萜烯的产生量。
图12示出了增加了酶A、大肠杆菌和麝香葡萄的DXS中的酶活性的突变的位置。
麝香葡萄的K284N和R306C、大肠杆菌的K213N和K234C均存在于无序区域(蓝色)。酶A的突变G225D也与它们一样,存在于无序区域。根据氨基酸序列比对,DXS的活性部位(绿色)是保守的,可以推测酶A也具有与这些DXS相同的反应方式。需要说明的是,无序区域的N末端侧(品红色)存在活性部位。
如上所述,DXS的无序区域中存在多个提高DXS的酶活性的突变,可以推测对本区域导入突变会对DXS的活性造成某种影响。
(2)酶A的突变G225D(无序区域)在立体结构中的位置
图13中用蓝色的虚线示出了酶A中存在突变G225D的无序区域(196~238残基)位置。
本区域位于DXS的活性所必需的辅酶TPP的结合部位附近。本区域的N末端侧的环(品红色)中存在作为活性部位的Asn180、Met182及Ile184。Asn180的侧链和Met182的主链与Mg结合。Ile184的侧链与TPP疏水键合。可以认为,为了使DXS的活性所必需的TPP与Mg结合,该环采取适当的结构是重要的。文献[9]中进行了如下考察:虽然生理作用不明,但本区域存在于活性部位附近,本区域内的突变可能合理地影响酶的活性。如图12、13所示,本区域在氨基酸序列上、立体结构上均存在于TPP结合部位附近,因此可以认为,本区域中的突变对这些活性部位造成影响是十分可能发生的。
(3)酶A的无序区域的模型及突变G225D酶的制备
接着,为了研究酶A的突变G225D对无序区域的立体结构造成的影响,对于酶A的196~238残基(43残基)的无序区域制作了模型结构。关于麝香葡萄的突变K284N,在报告的文献[9]中,对于麝香葡萄DXS的无序区域制作模型,观察到了突变引起的静电势变化。为了参考,对酶A进行了同样的分析。通过同源建模,以与酶A的无序区域同源性高的氨基酸序列的片段结构为基础制作了立体结构模型。作为模板结构,使用了PDB收录的立体结构中具有最高氨基酸一致度(34%)的1AL7片段。可以推测无序区域采取了摇摆的结构,作为本区域容易形成的折叠可以当作参考。将制作的模型示于图14(左)。
另外,通过将突变部位的Gly225取代为Asp,制作了突变G225D酶的立体结构模型。Gly225位于表面,通过对Asp的取代,Asp的侧链露出表面。对制作的立体结构模型的表面形状描绘静电势,将结果示于图14(右)。蓝色表示positive(正电荷)区域,红色表示negative(负电荷)区域。
可以确认,在野生型中存在强正电荷的区域,但在突变G225D酶中正电荷变弱,负电荷增强。在野生型中,带有正电荷的Arg227、Arg228、Lys230、K234侧链聚集,形成了强正电荷的区域。可以认为这是由于,通过将该区域中存在的不带电荷的Gly225取代为带有负电荷的Asp,Asp225附近的正电荷减弱。该结果与文献[9]中示出的麝香葡萄的突变K284N的静电势变化、即与无序区域的表面从正电荷至负电荷的静电势变化显示出相同的倾向。可以预测,酶A的G225D引起的无序区域的结构变化对包含TPP结合部位的活性部位造成与麝香葡萄的突变相同的影响,提示由于该影响,酶A的突变体G225D也与麝香葡萄的突变体K284N同样地增加了酶活性。
2.5.虾青素合成路径中酶A的突变G225D的影响
如上所述,确认了酶A的突变G225D发生在酶A的无序区域,本区域存在于活性所必需的TPP结合部位附近。另外,本区域中目前已发现了多个提高DXS的酶活性的突变,可以预测,G225D的突变与提高DXS的活性的已知突变发生同样的结构变化。
根据利用立体结构模型确认的无序区域的位置,认为至少如文献所述,通过无序区域的突变对TPP结合区域带来某种影响,从而提高了酶活性。在麝香葡萄的例子中,通过体外的酶学实验表明突变体的Kcat/Km为野生型的约2倍,可以预测无序区域中的突变带来了更适于TPP结合的结构变化。
为了使细胞内各种单萜烯大幅增加,需要增加作为单萜烯原料的异戊烯焦磷酸(IPP)。已经报告了DXS受到脱氧木酮糖路径的产物IPP的反馈抑制,IPP与TPP竞争抑制[10]。另外已知,IPP的量为一定量以上时,对脱氧木酮糖路径的最初的酶DXS造成抑制,进行控制以使IPP不超过该量。
通过该反馈抑制,供给的IPP的量由DXS控制为一定量,因此,在仅增加了DXS的酶活性Kcat/Km时,IPP的供给量没有增加,也无法大幅增加萜烯。在已知的例子中,通过无序区域的突变增加了萜烯的合成量,可以预测通过该突变增加了IPP的供给量,即,提示了DXS的通过IPP进行的反馈抑制失效了。
已知,在体外,IPP和TPP竞争与DXS结合,抑制DXS[10]。通过无序区域中的突变,在TPP结合区域发生结构变化,不仅形成适于TPP结合的结构,还对IPP的结合带来影响,由此提示通过IPP进行的反馈抑制可能失效。
酶A的突变G225D也一样,可以推测,通过在TPP结合区域带来结构变化使通过IPP进行的反馈抑制失效,从而增加了IPP的产生量。可以认为,其结果是通过增加作为虾青素合成原料的IPP的供给量,增加了虾青素的合成量(图15)。
3.酶C的立体结构模型的构建和突变体的分析
根据氨基酸序列的同源性及立体结构比较分析,酶C是聚异戊二烯焦磷酸合成酶的一种,是由法尼基焦磷酸(FPP)和7个异戊烯焦磷酸(IPP)合成十聚异戊二烯焦磷酸的十聚异戊二烯焦磷酸合成酶:Decaprenyl diphosphate synthase。
根据构建的酶C的立体结构模型,通过基因组分析鉴定的突变A305V引起因与附近的氨基酸残基的原子的碰撞而导致的空间位阻,可以推测酶C的立体结构变得不稳定。通过因立体结构的不稳定化而使酶C的活性降低,被酶C消耗的FPP和IPP的量减少。可以认为,其结果是,能够用于虾青素合成的FPP、IPP的量增加,因此虾青素的产生量增加。
3.1.十聚异戊二烯焦磷酸合成酶的酶反应
十聚异戊二烯焦磷酸合成酶具有使FPP与IPP缩合的活性,是反复进行与IPP的缩合、由FPP和7个IPP合成十聚异戊二烯焦磷酸(DPP)的酶。将十聚异戊二烯焦磷酸合成酶的酶反应示于以下。
[化学式2]
3.2.酶C的立体结构模型的构建
(1)通过同源建模进行酶C的立体结构模型的构建
为了研究酶C的活性部位及突变造成的影响,使用PDB的立体结构中氨基酸一致度最高(氨基酸一致度为76.2%)、且通过X射线晶体结构分析确定了立体结构的来自于荚膜红细菌(Rhodobacter capsulatus,R.capsulatus)十聚异戊二烯焦磷酸合成酶的立体结构(PDB ID:3MZV)作为模板结构,通过同源建模构建了立体结构模型(图16)[4]。
基于酶C与模板结构的立体结构比对进行了同源建模(图17)。
(2)酶C的底物复合体模型的制作
由于模板结构3MZV没有结合底物,因此使用来自于Escherichia coli的octaprenyl pyrophosphate synthase(八聚异戊二烯焦磷酸合成酶)(PDB ID:3WJN,3WJO)的立体结构数据[11],将3WJN与酶C的立体结构模型叠合,将底物FPP嵌入酶C的立体结构模型,由此制作了酶C与FPP的复合体模型。接着,同样地叠合3WJO,嵌入IPP,制作了酶C与FPP、IPP复合体模型。
图18示出了构建为模板结构的模型结构。酶C形成了与模板结构相同的同源二聚体。
3.3.关于酶C
(1)基于立体结构的比较
酶C十聚异戊二烯焦磷酸合成酶属于聚异戊二烯焦磷酸合成酶家族(PfamPF00348Polyprenyl synthetase)。图19中示出了酶C结合底物的形态。
聚异戊二烯焦磷酸合成酶以头尾相接(head-to-tail)(这里,按照文献[4],将磷酸基侧称为头(head),将异戊二烯基侧称为尾(tail))的朝向从FPP起缩合IPP,合成各种聚异戊二烯焦磷酸。十聚异戊二烯焦磷酸合成酶通过持续进行FPP与IPPG的缩合反应,使异戊二烯向底物结合部位的内部(图19右侧用箭头示出)延伸,合成C50的十聚异戊二烯焦磷酸。
酶C与来自于模板R.Capsulatus(荚膜红细菌)的十聚异戊二烯焦磷酸合成酶的氨基酸一致度高达76.3%,活性部位也保留下来(图17)。立体结构的Cα叠合的RMSD为2个酶非常类似,如果通过颜色区分表示氨基酸残基的一致性,则氨基酸残基的种类不同的区域限于分子表面,活性部位、结合底物的区域全部由一致的氨基酸残基构成(图20)。
(2)基于氨基酸序列的比较
接着,对于酶C的氨基酸序列进行了与来自于Paracoccus(副球菌属)的十聚异戊二烯焦磷酸合成酶的比较。作为来自于Paracoccus的十聚异戊二烯焦磷酸合成酶,UniProt(http://www.uniprot.org)中收录了来自于Paracoccus zeaxanthinifaciens(产玉米黄素副球菌)(Q8L1I6)和Paracoccus denitrificans(脱氮副球菌)(A1B3M9)的氨基酸序列作为已经明确的氨基酸序列。将它们与酶C的氨基酸序列进行比较,结果是氨基酸一致度为75.1%(类似度89.2%),显示出高同源性(表5)。
根据氨基酸序列也可以推测酶C为十聚异戊二烯焦磷酸合成酶。图21中示出了比对。
表5.酶C与十聚异戊二烯焦磷酸合成酶的氨基酸序列的比较
3.4.酶C的活性部位的推测
在酶C与底物的复合体模型中,推测了底物FPP结合部位和IPP结合部位、催化所必需的Mg结合部位。根据这些结果推测的活性部位和其它聚异戊二烯焦磷酸合成酶的活性中心、底物结合部位的保守性高,可以推测酶C具有与聚异戊二烯焦磷酸合成酶相同的反应方式。
将酶C与底物的复合体模型示于图22。
可以推测酶C与模板结构十聚异戊二烯焦磷酸合成酶同样地形成同源二聚体。图22中示出了A链(浅红色)的与FPP和IPP的结合部位。FPP与A链的隧道状区域结合,FPP和IPP以FPP的磷酸基朝向IPP的异戊烯基的头尾相接(head-to-tail)的形式结合。在Mg存在下,在FPP的磷酸基与IPP的异戊烯基之间发生催化反应。
为了推测酶C的活性部位,在酶C与底物复合体模型中,检测出存在于FPP、IPP附近的氨基酸残基,推测了底物与氨基酸残基的相互作用。对于FPP,可以推测在磷酸基与Arg102、Lys179、Lys244之间具有氢键,在聚异戊二烯基与Ala88、Thr89、His92、Phe125之间具有疏水性相互作用(图23上)。
对于IPP,可以推测在磷酸基与Lys54、Arg57、His86、Arg103之间具有氢键,在异戊烯基与Phe216之间具有疏水性相互作用(图23中央)。
本催化反应中需要Mg。作为Mg结合部位,在已知的聚异戊二烯焦磷酸合成酶中已知2个部位的DDXXD模体[11]。在模板结构中,Mg的坐标没有确定,但在酶C中,相当于DDXXD模体的Asp93、Asp94、Asp97及Asp220、Asp221、Asp224与已知的Mg结合部位同样地存在于磷酸基附近,可以推测这些氨基酸残基与Mg结合(图23下)。
以上,将推测的活性部位示于附带资料的表6~8。另外,将关于酶C与FPP及IPP的结合方式、以及酶C与Mg的结合方式的图分别示于图24、25。
[表6]
表6.推测与酶C中检测出的FPP及IPP相互作用的氨基酸残基
[表7]
表7.推测与酶C中检测出的Mg相互作用的氨基酸残基
[表8]
表8.酶C中推测的活性部位的氨基酸残基
推测进行结合的各氨基酸残基与作为模板结构的来自于R.capsulatus(荚膜红细菌)的十聚异戊二烯焦磷酸合成酶是一致的(图17)。另外,酶C的FPP结合部位、IPP结合部位、Mg结合部位保持了用于制作底物复合体模型的来自于E.coli的八聚异戊二烯焦磷酸合成酶的结合部位,因此可以认为,酶C具有与八聚异戊二烯焦磷酸合成酶相同的反应方式。
特别是可以认为,与FPP的磷酸基结合的Arg102、Lys179、Lys244、以及与Mg结合的Asp93、Asp94、Asp97、Asp220、Asp221、Asp224是与转移磷酸基的催化活性直接相关的重要残基。在制作大鼠、酵母的FPP合成酶的突变体进行的实验中报告了:作为酶C的磷酸结合部位的Arg102、Arg103、及作为Mg结合部位的Asp94、Asp97、Asp220、Asp221、Asp224、以及相当的氨基酸残基对于酶活性很重要;在聚异戊二烯焦磷酸合成酶之间这些氨基酸残基高度保守[14,15]。
另外,在FPP合成酶中,通过制备相当于酶C的Phe216、Gln217的氨基酸残基的突变体,明确了Phe和Gln的侧链对于底物结合是很重要的[16]。在酶C的复合体模型中,Phe216、Gln217位于活性部位的区域,可以预测对于活性很重要。
3.5.酶C的突变A305V带来的影响
为了推测酶C中经过鉴定的从Ala305至Val的突变对于立体结构造成的影响,制作了酶C的突变A305V酶的立体结构模型。
(1)A305V单残基取代的突变模型的制备
为了观察从Ala至Val的取代造成的影响,首先,将其它氨基酸残基的立体结构固定(假设rigid body),制作将Ala305单残基取代为Val而成的模型,与野生型进行比较。
图26中示出了野生型和突变A305V酶的立体结构模型。野生型的Ala305存在于α螺旋(粉红色),侧链与邻接的α螺旋(品红色)的氨基酸残基通过疏水性相互作用堆叠在一起。
图27中示出了与Ala305邻接的氨基酸残基的结构。
作为Ala305的侧链的甲基的碳原子与附近的氨基酸残基、Tyr208、Ala211、His301、Ala302相接,碳的原子间距离均低于通过从Ala305至Val的取代,侧链的甲基增加为2个。在将Ala305取代为Val而成的立体结构模型中,Val的侧链的甲基的碳与Tyr208及Ala211的碳的原子间距离为
碳之间的非共价键的接触距离的极限下限值为由于Val305中测定的碳的原子间距离低于该值,因此可以认为,这些碳原子发生碰撞,产生与附近的氨基酸残基的空间位阻。在Spece-filling方式的显示中可以确认,原子间的距离比范德华半径短,原子之间发生了碰撞。根据以上可以预测,A305V的突变通过原子碰撞而引起酶C的空间位阻,导致立体结构的不稳定。
(2)A305V突变引起的分子内能的变化
为了对A305V引起的结构不稳定进行评价,根据原子间的键的长度、键角、扭曲、键能等的总计,以千焦/mol(KJ/mol)单位计算出酶C的野生型和突变体A305V的分子内能。
其结果是,相对于野生型的-17,912(KJ/mol),突变A305V酶为-16,295(KJ/mol),突变A305V的分子内能增加了9.02%,确认了结构不稳定化。该分子内能的增加特别可以在Tyr208、Ala211、Val305的各氨基酸残基得到确认,可以认为这些氨基酸残基发生了碰撞是分子内能增加的原因。图28中示出了酶C的野生型与突变体A305V的分子内能的比较。
(3)突变A305V引起的结构变化
接着,对于突变体模型进行能量最小化计算,对于能否通过变动附近的氨基酸残基的立体结构来避免A305V导致的碰撞进行了研究。其结果是,为了避免Val305的侧链碰撞而允许侧链,必须变动存在Val305的α螺旋和邻接的α螺旋的氨基酸残基的立体结构。即,该结构变化不仅涉及侧链,还涉及主链,可以预想,在突变A305V酶中,无法形成α螺旋间原本的堆叠,2根螺旋附近的结构变得不稳定。另外,与突变A305V邻接的α螺旋中存在与作为底物的IPP、Mg结合的活性部位(Phe216、Gln217、Asp220)。可以认为,由于作为活性部位基础的α螺旋主链结构的结构变化,活性部位的氨基酸残基无法取得原本的位置,其结果是对底物结合、活性本身造成影响(图29右)。
图29示出了野生型和能量最小化计算后的突变体A305V的Ala305与Val305附近的结构,图30、31、32示出了突变体A305V的结构变化。
(4)结构不稳定化导致的酶C活性降低
如上所述,根据A305V的立体结构模型可以推测发生了与附近的氨基酸残基的空间位阻、分子内能的增加、以及邻接的2根α螺旋的结构变化,提示了A305V的突变使酶C的立体结构变得不稳定。关于点突变引起的立体结构不稳定,在遗传病等中有大量报告。可以考虑有例如,具有引起不稳定化的突变的蛋白质无法在溶剂中保持原本的立体结构而在比通常短的时间内失活,或者在细胞内原本无法堆叠的突变体蛋白质被细胞自身的功能所排除。因此可以推测,原本不具有活性、且为不稳定结构的突变A305V酶具有在细菌内被排除的可能性,结果是细菌内的酶C的活性降低。
3.6.虾青素合成路径中的酶C的突变A305V的效果
十聚异戊二烯焦磷酸合成酶是辅酶C10(CoQ10)合成路径的酶之一。此次已经明确,确认了与酶C具有高同源性的来自于Paracoccus zeaxanthinifaciens或Paracoccusdenitrificans的十聚异戊二烯焦磷酸合成酶是产生CoQ10的必要的酶[日本特开2005-211020、日本特表2006-517794]。作为十聚异戊二烯焦磷酸合成酶的底物的FPP和IPP,也是虾青素合成路径的香叶基香叶基焦磷酸(Geranyl-geranyl pyrophosphate;GGPP)合成酶的CrtE的底物。因此可以认为,在通常的Paracoccus的细胞内,十聚异戊二烯焦磷酸合成酶和CrtE竞争使用作为底物的FPP和IPP。
可以推测,酶C中经过鉴定的突变A305V通过使分子的立体结构变得不稳定而使酶C的活性降低。可以认为,在酶C的活性降低时,使用的底物FPP及IPP的量也减少,其结果是虾青素合成路径中能够使用的FPP、IPP的量增加。
CrtE从1分子FPP和1分子IPP合成1分子GGPP。另一方面,在酶C合成1分子十聚异戊二烯焦磷酸中,需要1分子FPP和7分子IPP。以IPP计,酶C在1个反应中消耗CrtE的7倍的IPP。因此可以认为,酶C的活性降低对于增加向虾青素合成路径供给的IPP是极其有效的。
可以推测,其结果是虾青素的合成量显著增加(图33)。
参考文献
1.SWISS-MODEL:modelling protein tertiary and quaternary structureusing evolutionary information.Biasini M,Bienert S,Waterhouse A,Arnold K,Studer G,Schmidt T,Kiefer F,Cassarino TG,Bertoni M,Bordoli L,SchwedeT.Nucleic Acids Res.2014;42:W252-8.
2.Automated comparative protein structure modeling with SWISS-MODELand Swiss-PdbViewer:A historical perspective.Guex,N.,Peitsch,M.C.,Schwede,T.Electrophoresis,(2009).30(S1),S162-S173.
3.Crystal structure of 1-deoxy-D-xylulose 5-phosphate synthase,acrucial enzyme for isoprenoids biosynthesis.Xiang S,Usunow G,Lange G,Busch M,Tong L.J Biol Chem.2007 26;282(4):2676-82.
4.Prediction of function for the polyprenyl transferase subgroup inthe isoprenoid synthase superfamily.Wallrapp FH,Pan JJ,Ramamoorthy G,Almonacid DE,Hillerich BS,Seidel R,Patskovsky Y,Babbitt PC,Almo SC,JacobsonMP,Poulter CD.Proc Natl Acad Sci U S A.2013 26;110(13):E1196-202.
14;107(50):21337-42.
6.Snapshot of a key intermediate in enzymatic thiamin catalysis:crystal structure of the alpha-carbanion of(alpha,beta-dihydroxyethyl)-thiamin diphosphate in the active site of transketolase from Saccharomycescerevisiae.Fiedler E,Thorell S,Sandalova T,Golbik R,S,Schneider G.ProcNatl Acad Sci U S A.2002 22;99(2):591-5.
7.Examination of substrate binding in thiamin diphosphate-dependenttransketolase by protein crystallography and site-directedmutagenesis.Nilsson U1,Meshalkina L,Lindqvist Y,Schneider G.J Biol Chem.199717;272(3):1864-9.
8.Catalytically Important Residues in E.coli 1-Deoxy-D-Xylulose5-Phosphate Synthase.Jordi Querol-Audí,Albert Boronat,Josep J.Centelles,Santiago Imperial Journal of Biosciences and Medicines,2014,2,30-35
9.Functional effect of grapevine 1-deoxy-D-xylulose 5-phosphatesynthase substitution K284N on Muscat flavour formation.Battilana J1,Emanuelli F,Gambino G,Gribaudo I,Gasperi F,Boss PK,Grando MS.J Exp Bot.2011;62(15):5497-508.
10.Feedback Inhibition of Deoxy-D-xylulose-5-phosphate SynthaseRegulates the Methylerythritol 4-Phosphate Pathway.Banerjee A1,Wu Y,BanerjeeR,Li Y,Yan H,Sharkey TD.J Biol Chem.2013 7;288(23):16926-36.
11.Crystal structures of ligand-bound octaprenyl pyrophosphatesynthase from Escherichia coli reveal the catalytic and chain-lengthdetermining mechanisms.Han X,Chen CC,Kuo CJ,Huang CH,Zheng Y,Ko TP,Zhu Z,FengX,Wang K,Oldfield E,Wang AH,Liang PH,Guo RT,Ma Y.Proteins.2015;83(1):37-45.
14.Effect of site-directed mutagenesis of conserved aspartate andarginine residues upon farnesyl diphosphate synthase activity.Joly A,EdwardsPA.J Biol Chem.1993 25;268(36):26983-9.
15.Yeast farnesyl-diphosphate synthase:site-directed mutagenesis ofresidues in highly conserved prenyltransferase domains I and II.Song L1,Poulter CD.Proc Natl Acad Sci U S A.1994 12;91(8):3044-8.
16.Significance of Phe-220 and Gln-221 in the catalytic mechanism offarnesyl diphosphate synthase of Bacillus stearothermophilus.Koyama T1,TajimaM,Nishino T,Ogura K.Biochem Biophys Res Commun.1995 7;212(2):681-6.
序列表
<110> JXTG能源株式会社(JXTG Nippon Oil & Energy Corporation)
<120> 类胡萝卜素的制造方法
<130> G1152WO
<150> JP2016-71303
<151> 2016-03-31
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 1926
<212> DNA
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<220>
<221> CDS
<222> (1)..(1923)
<400> 1
atg acc gat cga ccc aag acg ccg att ctg gac cgc gtt agc ctg ccg 48
Met Thr Asp Arg Pro Lys Thr Pro Ile Leu Asp Arg Val Ser Leu Pro
1 5 10 15
tcg gat ctg aag acc ctg acc gac gcg caa ctg cgc cag ctt gcc gac 96
Ser Asp Leu Lys Thr Leu Thr Asp Ala Gln Leu Arg Gln Leu Ala Asp
20 25 30
gag ttg cgg gcc gag acc atc agc gcc gtc agc gtg acc ggc ggc cat 144
Glu Leu Arg Ala Glu Thr Ile Ser Ala Val Ser Val Thr Gly Gly His
35 40 45
ctg ggc gcg ggc ctg ggc gtg gtc gag ctg acc gta gcc ctg cat gcg 192
Leu Gly Ala Gly Leu Gly Val Val Glu Leu Thr Val Ala Leu His Ala
50 55 60
gtc ttc gac acg ccg cgc gac aag ctg atc tgg gac gtg ggg cac cag 240
Val Phe Asp Thr Pro Arg Asp Lys Leu Ile Trp Asp Val Gly His Gln
65 70 75 80
tgc tat ccg cac aag atc ctg acc ggg cgg cgc gat cgc atc cgc acg 288
Cys Tyr Pro His Lys Ile Leu Thr Gly Arg Arg Asp Arg Ile Arg Thr
85 90 95
ctg cgc atg ggc ggg ggc ctt gcg ggg ttc acc aag cgc gcg gaa agc 336
Leu Arg Met Gly Gly Gly Leu Ala Gly Phe Thr Lys Arg Ala Glu Ser
100 105 110
ccc tat gac ccg ttc ggg gcg ggg cat tcg tcg acc tcg atc agc gcg 384
Pro Tyr Asp Pro Phe Gly Ala Gly His Ser Ser Thr Ser Ile Ser Ala
115 120 125
gcc ctg ggt ttc gcg atg gcg cgg gaa ctg ggc ggc gac ccg ggc gat 432
Ala Leu Gly Phe Ala Met Ala Arg Glu Leu Gly Gly Asp Pro Gly Asp
130 135 140
gcg atc gcg gtc atc ggc gac ggc gcc atg agc gcc ggc atg gct tat 480
Ala Ile Ala Val Ile Gly Asp Gly Ala Met Ser Ala Gly Met Ala Tyr
145 150 155 160
gaa gcg ctg aac aat gcg ggc cat gag ggc aag cgc ctg ttc gtg gtc 528
Glu Ala Leu Asn Asn Ala Gly His Glu Gly Lys Arg Leu Phe Val Val
165 170 175
ctg aat gac aac gag atg tcc att gcg ccc ccg gtc ggc gcc atg tcc 576
Leu Asn Asp Asn Glu Met Ser Ile Ala Pro Pro Val Gly Ala Met Ser
180 185 190
tcc tat ctg acg cgc ctt tat gca ggc ggg ccg ttc cag gag ctg aag 624
Ser Tyr Leu Thr Arg Leu Tyr Ala Gly Gly Pro Phe Gln Glu Leu Lys
195 200 205
gcg gtg gcc aag ggc gcc gtt ggc atg ctg ccg gac gcc ctg cag gag 672
Ala Val Ala Lys Gly Ala Val Gly Met Leu Pro Asp Ala Leu Gln Glu
210 215 220
ggc gcg cgc cgc gcc aag gag atg ctg aag ggc atg gcc gtg ggc ggc 720
Gly Ala Arg Arg Ala Lys Glu Met Leu Lys Gly Met Ala Val Gly Gly
225 230 235 240
acc ctg ttc gag gag ctg ggc ttt tcc tat atc ggg ccg gtc gac ggt 768
Thr Leu Phe Glu Glu Leu Gly Phe Ser Tyr Ile Gly Pro Val Asp Gly
245 250 255
cac gac atg gaa cag ctg ctg ccc ctg ctg cgc acc gtg cgg gcg cgg 816
His Asp Met Glu Gln Leu Leu Pro Leu Leu Arg Thr Val Arg Ala Arg
260 265 270
gcc gac ggt ccg gtc ctg atc cac gtc gtg acc aag aag ggc aag ggt 864
Ala Asp Gly Pro Val Leu Ile His Val Val Thr Lys Lys Gly Lys Gly
275 280 285
tat gcc ccg gcc gag gcg gcc gcg gac aag ggc cat gcc acc gcc aag 912
Tyr Ala Pro Ala Glu Ala Ala Ala Asp Lys Gly His Ala Thr Ala Lys
290 295 300
ttc gac gtg atc acc ggc gtg cag gcc aag gcg aaa tcg aac gcg ccc 960
Phe Asp Val Ile Thr Gly Val Gln Ala Lys Ala Lys Ser Asn Ala Pro
305 310 315 320
agc tat acc gcc gtc ttc gcg cag gcg ctg atc gat cag gcg ggg cgt 1008
Ser Tyr Thr Ala Val Phe Ala Gln Ala Leu Ile Asp Gln Ala Gly Arg
325 330 335
gac gac cgc atc ctg ggg gtg acc gcc gcg atg ccg gac ggg acc ggc 1056
Asp Asp Arg Ile Leu Gly Val Thr Ala Ala Met Pro Asp Gly Thr Gly
340 345 350
ctc aag cag ttc gcg cag cgc ttt ccg cgc cgc tgc ttc gac gtg ggc 1104
Leu Lys Gln Phe Ala Gln Arg Phe Pro Arg Arg Cys Phe Asp Val Gly
355 360 365
att gcc gaa cag cat gcc gtg acc ttt gcc gcc ggt ctg gcc gcg gga 1152
Ile Ala Glu Gln His Ala Val Thr Phe Ala Ala Gly Leu Ala Ala Gly
370 375 380
ggc atg aag cct ttc gtc gcg atc tat tcg acc ttt ctg cag cgc ggc 1200
Gly Met Lys Pro Phe Val Ala Ile Tyr Ser Thr Phe Leu Gln Arg Gly
385 390 395 400
tat gac cag atc gtg cat gac gtc gcg gtc cag aac ctg ccc gtc cgg 1248
Tyr Asp Gln Ile Val His Asp Val Ala Val Gln Asn Leu Pro Val Arg
405 410 415
ttc gcc gtc gac cgt gcc ggg ctg gtg ggc cag gac ggt ccg acc cat 1296
Phe Ala Val Asp Arg Ala Gly Leu Val Gly Gln Asp Gly Pro Thr His
420 425 430
tcc ggc gcc tat gac acc gcc ttc ctg gcc aat ctg ccc ggg ttt gtc 1344
Ser Gly Ala Tyr Asp Thr Ala Phe Leu Ala Asn Leu Pro Gly Phe Val
435 440 445
gtc atg gcc gcc gcg gac gag gcc gaa ctg gcc cac atg gtc gcc acg 1392
Val Met Ala Ala Ala Asp Glu Ala Glu Leu Ala His Met Val Ala Thr
450 455 460
gcc gcc gca cat gac agc ggc ccc atc gcc ttc cgc ttt ccg cgc gga 1440
Ala Ala Ala His Asp Ser Gly Pro Ile Ala Phe Arg Phe Pro Arg Gly
465 470 475 480
gag ggc acc ggg gtc gag atg ccc gag cgc ggg cag gtc ctg ccc atc 1488
Glu Gly Thr Gly Val Glu Met Pro Glu Arg Gly Gln Val Leu Pro Ile
485 490 495
ggc aag ggc cgc atg atc gcg gag ggc aag ggc gtc gcc atc ctg tcc 1536
Gly Lys Gly Arg Met Ile Ala Glu Gly Lys Gly Val Ala Ile Leu Ser
500 505 510
ttc ggc acg cgc ctg tcc gag gtg atg acc gcg cgc gag gcg ctg atg 1584
Phe Gly Thr Arg Leu Ser Glu Val Met Thr Ala Arg Glu Ala Leu Met
515 520 525
gcg cgg ggc atc acg ccc acg gtc gcc gac gcg cgc ttt gcc aag ccg 1632
Ala Arg Gly Ile Thr Pro Thr Val Ala Asp Ala Arg Phe Ala Lys Pro
530 535 540
ctg gat cgt gac ctg atc ctg gca ctg gcc cgc gat cac gag gcg ctg 1680
Leu Asp Arg Asp Leu Ile Leu Ala Leu Ala Arg Asp His Glu Ala Leu
545 550 555 560
atc acc atc gag gag ggc gcc gtg ggc ggt ttc ggc agc cat gtc gcc 1728
Ile Thr Ile Glu Glu Gly Ala Val Gly Gly Phe Gly Ser His Val Ala
565 570 575
cat ctg ctg gcc gag gag ggc gcc ttc gac aag ggg ctg cgc ttc cgg 1776
His Leu Leu Ala Glu Glu Gly Ala Phe Asp Lys Gly Leu Arg Phe Arg
580 585 590
tcg atg gtc ctg ccg gat gcg ttc gtc gac cac gac gcg ccg cgg gcg 1824
Ser Met Val Leu Pro Asp Ala Phe Val Asp His Asp Ala Pro Arg Ala
595 600 605
atg tat gac agc agc tgc ctg aac gcc cag cat atc gag gac aag gtc 1872
Met Tyr Asp Ser Ser Cys Leu Asn Ala Gln His Ile Glu Asp Lys Val
610 615 620
ctc tcc gtg atg ggc gtc cag tcg ctc gcg gcg cgg cgc acc gac cgc 1920
Leu Ser Val Met Gly Val Gln Ser Leu Ala Ala Arg Arg Thr Asp Arg
625 630 635 640
gcc tga 1926
Ala
<210> 2
<211> 641
<212> PRT
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<400> 2
Met Thr Asp Arg Pro Lys Thr Pro Ile Leu Asp Arg Val Ser Leu Pro
1 5 10 15
Ser Asp Leu Lys Thr Leu Thr Asp Ala Gln Leu Arg Gln Leu Ala Asp
20 25 30
Glu Leu Arg Ala Glu Thr Ile Ser Ala Val Ser Val Thr Gly Gly His
35 40 45
Leu Gly Ala Gly Leu Gly Val Val Glu Leu Thr Val Ala Leu His Ala
50 55 60
Val Phe Asp Thr Pro Arg Asp Lys Leu Ile Trp Asp Val Gly His Gln
65 70 75 80
Cys Tyr Pro His Lys Ile Leu Thr Gly Arg Arg Asp Arg Ile Arg Thr
85 90 95
Leu Arg Met Gly Gly Gly Leu Ala Gly Phe Thr Lys Arg Ala Glu Ser
100 105 110
Pro Tyr Asp Pro Phe Gly Ala Gly His Ser Ser Thr Ser Ile Ser Ala
115 120 125
Ala Leu Gly Phe Ala Met Ala Arg Glu Leu Gly Gly Asp Pro Gly Asp
130 135 140
Ala Ile Ala Val Ile Gly Asp Gly Ala Met Ser Ala Gly Met Ala Tyr
145 150 155 160
Glu Ala Leu Asn Asn Ala Gly His Glu Gly Lys Arg Leu Phe Val Val
165 170 175
Leu Asn Asp Asn Glu Met Ser Ile Ala Pro Pro Val Gly Ala Met Ser
180 185 190
Ser Tyr Leu Thr Arg Leu Tyr Ala Gly Gly Pro Phe Gln Glu Leu Lys
195 200 205
Ala Val Ala Lys Gly Ala Val Gly Met Leu Pro Asp Ala Leu Gln Glu
210 215 220
Gly Ala Arg Arg Ala Lys Glu Met Leu Lys Gly Met Ala Val Gly Gly
225 230 235 240
Thr Leu Phe Glu Glu Leu Gly Phe Ser Tyr Ile Gly Pro Val Asp Gly
245 250 255
His Asp Met Glu Gln Leu Leu Pro Leu Leu Arg Thr Val Arg Ala Arg
260 265 270
Ala Asp Gly Pro Val Leu Ile His Val Val Thr Lys Lys Gly Lys Gly
275 280 285
Tyr Ala Pro Ala Glu Ala Ala Ala Asp Lys Gly His Ala Thr Ala Lys
290 295 300
Phe Asp Val Ile Thr Gly Val Gln Ala Lys Ala Lys Ser Asn Ala Pro
305 310 315 320
Ser Tyr Thr Ala Val Phe Ala Gln Ala Leu Ile Asp Gln Ala Gly Arg
325 330 335
Asp Asp Arg Ile Leu Gly Val Thr Ala Ala Met Pro Asp Gly Thr Gly
340 345 350
Leu Lys Gln Phe Ala Gln Arg Phe Pro Arg Arg Cys Phe Asp Val Gly
355 360 365
Ile Ala Glu Gln His Ala Val Thr Phe Ala Ala Gly Leu Ala Ala Gly
370 375 380
Gly Met Lys Pro Phe Val Ala Ile Tyr Ser Thr Phe Leu Gln Arg Gly
385 390 395 400
Tyr Asp Gln Ile Val His Asp Val Ala Val Gln Asn Leu Pro Val Arg
405 410 415
Phe Ala Val Asp Arg Ala Gly Leu Val Gly Gln Asp Gly Pro Thr His
420 425 430
Ser Gly Ala Tyr Asp Thr Ala Phe Leu Ala Asn Leu Pro Gly Phe Val
435 440 445
Val Met Ala Ala Ala Asp Glu Ala Glu Leu Ala His Met Val Ala Thr
450 455 460
Ala Ala Ala His Asp Ser Gly Pro Ile Ala Phe Arg Phe Pro Arg Gly
465 470 475 480
Glu Gly Thr Gly Val Glu Met Pro Glu Arg Gly Gln Val Leu Pro Ile
485 490 495
Gly Lys Gly Arg Met Ile Ala Glu Gly Lys Gly Val Ala Ile Leu Ser
500 505 510
Phe Gly Thr Arg Leu Ser Glu Val Met Thr Ala Arg Glu Ala Leu Met
515 520 525
Ala Arg Gly Ile Thr Pro Thr Val Ala Asp Ala Arg Phe Ala Lys Pro
530 535 540
Leu Asp Arg Asp Leu Ile Leu Ala Leu Ala Arg Asp His Glu Ala Leu
545 550 555 560
Ile Thr Ile Glu Glu Gly Ala Val Gly Gly Phe Gly Ser His Val Ala
565 570 575
His Leu Leu Ala Glu Glu Gly Ala Phe Asp Lys Gly Leu Arg Phe Arg
580 585 590
Ser Met Val Leu Pro Asp Ala Phe Val Asp His Asp Ala Pro Arg Ala
595 600 605
Met Tyr Asp Ser Ser Cys Leu Asn Ala Gln His Ile Glu Asp Lys Val
610 615 620
Leu Ser Val Met Gly Val Gln Ser Leu Ala Ala Arg Arg Thr Asp Arg
625 630 635 640
Ala
<210> 3
<211> 1002
<212> DNA
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<220>
<221> CDS
<222> (1)..(999)
<400> 3
atg act gtg cag gac aac gtc cgc aaa ccg atg gat cgg ctg agc gag 48
Met Thr Val Gln Asp Asn Val Arg Lys Pro Met Asp Arg Leu Ser Glu
1 5 10 15
gcc ctg acc gcc gag atg gag gcg gtc aac gcg ctg atc cgc gac cgc 96
Ala Leu Thr Ala Glu Met Glu Ala Val Asn Ala Leu Ile Arg Asp Arg
20 25 30
atg gcc agc cgc cat gcc ccc cgc atc ccc gag gtg acg gcg cat ctg 144
Met Ala Ser Arg His Ala Pro Arg Ile Pro Glu Val Thr Ala His Leu
35 40 45
atc gag gcc ggc ggc aag cgc ctg cgc ccg atg ctg acg ctg gcc gcg 192
Ile Glu Ala Gly Gly Lys Arg Leu Arg Pro Met Leu Thr Leu Ala Ala
50 55 60
gcc aag ctg ctg ggc tat ccc ggc ccg tgg cat gtc cac ctg gcc gcc 240
Ala Lys Leu Leu Gly Tyr Pro Gly Pro Trp His Val His Leu Ala Ala
65 70 75 80
acg gtc gaa ttc atc cat acc gcc acg ctg ctg cat gac gac gtg gtc 288
Thr Val Glu Phe Ile His Thr Ala Thr Leu Leu His Asp Asp Val Val
85 90 95
gac gaa agc gcg cag cgg cgc ggg cgc ccg acg gcg aac ctg ctg tgg 336
Asp Glu Ser Ala Gln Arg Arg Gly Arg Pro Thr Ala Asn Leu Leu Trp
100 105 110
gac aac aag tcc agc gtg ctg gtc gga gat tac ctg ttc gcg cgc agc 384
Asp Asn Lys Ser Ser Val Leu Val Gly Asp Tyr Leu Phe Ala Arg Ser
115 120 125
ttt cag ctg atg gtc gaa ccc ggc aac ctg cga acg ctg gag atc ctg 432
Phe Gln Leu Met Val Glu Pro Gly Asn Leu Arg Thr Leu Glu Ile Leu
130 135 140
gcc aat gcc agc gcc acc atc gcc gag ggc gag gtg ctg cag ctg acc 480
Ala Asn Ala Ser Ala Thr Ile Ala Glu Gly Glu Val Leu Gln Leu Thr
145 150 155 160
gcg gcg cag gac ctg gcg acc gac gaa tcc gtc tat ctg cag gtg gtg 528
Ala Ala Gln Asp Leu Ala Thr Asp Glu Ser Val Tyr Leu Gln Val Val
165 170 175
cgc ggc aag acg gcg gcg ctg ttt tcc gcc gcg acc gag gtg ggc ggc 576
Arg Gly Lys Thr Ala Ala Leu Phe Ser Ala Ala Thr Glu Val Gly Gly
180 185 190
gtc atc gcc ggt gcg ccc gac gat cag gtg cag gcg ctg ttc gat tac 624
Val Ile Ala Gly Ala Pro Asp Asp Gln Val Gln Ala Leu Phe Asp Tyr
195 200 205
ggc gac gcc ctg ggc atc agc ttc cag att gtc gac gac ctg ctg gat 672
Gly Asp Ala Leu Gly Ile Ser Phe Gln Ile Val Asp Asp Leu Leu Asp
210 215 220
tac ggc ggc gcg acc gag acg atc ggc aag aac gtg ggc gac gat ttc 720
Tyr Gly Gly Ala Thr Glu Thr Ile Gly Lys Asn Val Gly Asp Asp Phe
225 230 235 240
cgc gaa cgc aag ctg acc ctg ccg gtc atc aag gcc atc gcc aag gcc 768
Arg Glu Arg Lys Leu Thr Leu Pro Val Ile Lys Ala Ile Ala Lys Ala
245 250 255
gac gcc gag gaa cgc gcc ttc tgg acc cgc acc atc gag gcg ggc gac 816
Asp Ala Glu Glu Arg Ala Phe Trp Thr Arg Thr Ile Glu Ala Gly Asp
260 265 270
cag cgc gac ggc gac ctg gag cac gcg ctg tcg ctg ctg gcc cgt cac 864
Gln Arg Asp Gly Asp Leu Glu His Ala Leu Ser Leu Leu Ala Arg His
275 280 285
ggt gcg atg gag gcc gcg cgc gcc gat gcg ctg gcc cat gcc gca cgg 912
Gly Ala Met Glu Ala Ala Arg Ala Asp Ala Leu Ala His Ala Ala Arg
290 295 300
gcc cgc gcg gcg ctg cag gtg ctg ccc gcg cat ccg att cgc gac atg 960
Ala Arg Ala Ala Leu Gln Val Leu Pro Ala His Pro Ile Arg Asp Met
305 310 315 320
ctg gcc gac ctc gcg gat ttc gtc gtc agc cgc gtg gcc tga 1002
Leu Ala Asp Leu Ala Asp Phe Val Val Ser Arg Val Ala
325 330
<210> 4
<211> 333
<212> PRT
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<400> 4
Met Thr Val Gln Asp Asn Val Arg Lys Pro Met Asp Arg Leu Ser Glu
1 5 10 15
Ala Leu Thr Ala Glu Met Glu Ala Val Asn Ala Leu Ile Arg Asp Arg
20 25 30
Met Ala Ser Arg His Ala Pro Arg Ile Pro Glu Val Thr Ala His Leu
35 40 45
Ile Glu Ala Gly Gly Lys Arg Leu Arg Pro Met Leu Thr Leu Ala Ala
50 55 60
Ala Lys Leu Leu Gly Tyr Pro Gly Pro Trp His Val His Leu Ala Ala
65 70 75 80
Thr Val Glu Phe Ile His Thr Ala Thr Leu Leu His Asp Asp Val Val
85 90 95
Asp Glu Ser Ala Gln Arg Arg Gly Arg Pro Thr Ala Asn Leu Leu Trp
100 105 110
Asp Asn Lys Ser Ser Val Leu Val Gly Asp Tyr Leu Phe Ala Arg Ser
115 120 125
Phe Gln Leu Met Val Glu Pro Gly Asn Leu Arg Thr Leu Glu Ile Leu
130 135 140
Ala Asn Ala Ser Ala Thr Ile Ala Glu Gly Glu Val Leu Gln Leu Thr
145 150 155 160
Ala Ala Gln Asp Leu Ala Thr Asp Glu Ser Val Tyr Leu Gln Val Val
165 170 175
Arg Gly Lys Thr Ala Ala Leu Phe Ser Ala Ala Thr Glu Val Gly Gly
180 185 190
Val Ile Ala Gly Ala Pro Asp Asp Gln Val Gln Ala Leu Phe Asp Tyr
195 200 205
Gly Asp Ala Leu Gly Ile Ser Phe Gln Ile Val Asp Asp Leu Leu Asp
210 215 220
Tyr Gly Gly Ala Thr Glu Thr Ile Gly Lys Asn Val Gly Asp Asp Phe
225 230 235 240
Arg Glu Arg Lys Leu Thr Leu Pro Val Ile Lys Ala Ile Ala Lys Ala
245 250 255
Asp Ala Glu Glu Arg Ala Phe Trp Thr Arg Thr Ile Glu Ala Gly Asp
260 265 270
Gln Arg Asp Gly Asp Leu Glu His Ala Leu Ser Leu Leu Ala Arg His
275 280 285
Gly Ala Met Glu Ala Ala Arg Ala Asp Ala Leu Ala His Ala Ala Arg
290 295 300
Ala Arg Ala Ala Leu Gln Val Leu Pro Ala His Pro Ile Arg Asp Met
305 310 315 320
Leu Ala Asp Leu Ala Asp Phe Val Val Ser Arg Val Ala
325 330
<210> 5
<211> 1926
<212> DNA
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<220>
<221> CDS
<222> (1)..(1923)
<400> 5
atg acc gat cga ccc aag acg ccg att ctg gac cgc gtt agc ctg ccg 48
Met Thr Asp Arg Pro Lys Thr Pro Ile Leu Asp Arg Val Ser Leu Pro
1 5 10 15
tcg gat ctg aag acc ctg acc gac gcg caa ctg cgc cag ctt gcc gac 96
Ser Asp Leu Lys Thr Leu Thr Asp Ala Gln Leu Arg Gln Leu Ala Asp
20 25 30
gag ttg cgg gcc gag acc atc agc gcc gtc agc gtg acc ggc ggc cat 144
Glu Leu Arg Ala Glu Thr Ile Ser Ala Val Ser Val Thr Gly Gly His
35 40 45
ctg ggc gcg ggc ctg ggc gtg gtc gag ctg acc gta gcc ctg cat gcg 192
Leu Gly Ala Gly Leu Gly Val Val Glu Leu Thr Val Ala Leu His Ala
50 55 60
gtc ttc gac acg ccg cgc gac aag ctg atc tgg gac gtg ggg cac cag 240
Val Phe Asp Thr Pro Arg Asp Lys Leu Ile Trp Asp Val Gly His Gln
65 70 75 80
tgc tat ccg cac aag atc ctg acc ggg cgg cgc gat cgc atc cgc acg 288
Cys Tyr Pro His Lys Ile Leu Thr Gly Arg Arg Asp Arg Ile Arg Thr
85 90 95
ctg cgc atg ggc ggg ggc ctt gcg ggg ttc acc aag cgc gcg gaa agc 336
Leu Arg Met Gly Gly Gly Leu Ala Gly Phe Thr Lys Arg Ala Glu Ser
100 105 110
ccc tat gac ccg ttc ggg gcg ggg cat tcg tcg acc tcg atc agc gcg 384
Pro Tyr Asp Pro Phe Gly Ala Gly His Ser Ser Thr Ser Ile Ser Ala
115 120 125
gcc ctg ggt ttc gcg atg gcg cgg gaa ctg ggc ggc gac ccg ggc gat 432
Ala Leu Gly Phe Ala Met Ala Arg Glu Leu Gly Gly Asp Pro Gly Asp
130 135 140
gcg atc gcg gtc atc ggc gac ggc gcc atg agc gcc ggc atg gct tat 480
Ala Ile Ala Val Ile Gly Asp Gly Ala Met Ser Ala Gly Met Ala Tyr
145 150 155 160
gaa gcg ctg aac aat gcg ggc cat gag ggc aag cgc ctg ttc gtg gtc 528
Glu Ala Leu Asn Asn Ala Gly His Glu Gly Lys Arg Leu Phe Val Val
165 170 175
ctg aat gac aac gag atg tcc att gcg ccc ccg gtc ggc gcc atg tcc 576
Leu Asn Asp Asn Glu Met Ser Ile Ala Pro Pro Val Gly Ala Met Ser
180 185 190
tcc tat ctg acg cgc ctt tat gca ggc ggg ccg ttc cag gag ctg aag 624
Ser Tyr Leu Thr Arg Leu Tyr Ala Gly Gly Pro Phe Gln Glu Leu Lys
195 200 205
gcg gtg gcc aag ggc gcc gtt ggc atg ctg ccg gac gcc ctg cag gag 672
Ala Val Ala Lys Gly Ala Val Gly Met Leu Pro Asp Ala Leu Gln Glu
210 215 220
gac gcg cgc cgc gcc aag gag atg ctg aag ggc atg gcc gtg ggc ggc 720
Asp Ala Arg Arg Ala Lys Glu Met Leu Lys Gly Met Ala Val Gly Gly
225 230 235 240
acc ctg ttc gag gag ctg ggc ttt tcc tat atc ggg ccg gtc gac ggt 768
Thr Leu Phe Glu Glu Leu Gly Phe Ser Tyr Ile Gly Pro Val Asp Gly
245 250 255
cac gac atg gaa cag ctg ctg ccc ctg ctg cgc acc gtg cgg gcg cgg 816
His Asp Met Glu Gln Leu Leu Pro Leu Leu Arg Thr Val Arg Ala Arg
260 265 270
gcc gac ggt ccg gtc ctg atc cac gtc gtg acc aag aag ggc aag ggt 864
Ala Asp Gly Pro Val Leu Ile His Val Val Thr Lys Lys Gly Lys Gly
275 280 285
tat gcc ccg gcc gag gcg gcc gcg gac aag ggc cat gcc acc gcc aag 912
Tyr Ala Pro Ala Glu Ala Ala Ala Asp Lys Gly His Ala Thr Ala Lys
290 295 300
ttc gac gtg atc acc ggc gtg cag gcc aag gcg aaa tcg aac gcg ccc 960
Phe Asp Val Ile Thr Gly Val Gln Ala Lys Ala Lys Ser Asn Ala Pro
305 310 315 320
agc tat acc gcc gtc ttc gcg cag gcg ctg atc gat cag gcg ggg cgt 1008
Ser Tyr Thr Ala Val Phe Ala Gln Ala Leu Ile Asp Gln Ala Gly Arg
325 330 335
gac gac cgc atc ctg ggg gtg acc gcc gcg atg ccg gac ggg acc ggc 1056
Asp Asp Arg Ile Leu Gly Val Thr Ala Ala Met Pro Asp Gly Thr Gly
340 345 350
ctc aag cag ttc gcg cag cgc ttt ccg cgc cgc tgc ttc gac gtg ggc 1104
Leu Lys Gln Phe Ala Gln Arg Phe Pro Arg Arg Cys Phe Asp Val Gly
355 360 365
att gcc gaa cag cat gcc gtg acc ttt gcc gcc ggt ctg gcc gcg gga 1152
Ile Ala Glu Gln His Ala Val Thr Phe Ala Ala Gly Leu Ala Ala Gly
370 375 380
ggc atg aag cct ttc gtc gcg atc tat tcg acc ttt ctg cag cgc ggc 1200
Gly Met Lys Pro Phe Val Ala Ile Tyr Ser Thr Phe Leu Gln Arg Gly
385 390 395 400
tat gac cag atc gtg cat gac gtc gcg gtc cag aac ctg ccc gtc cgg 1248
Tyr Asp Gln Ile Val His Asp Val Ala Val Gln Asn Leu Pro Val Arg
405 410 415
ttc gcc gtc gac cgt gcc ggg ctg gtg ggc cag gac ggt ccg acc cat 1296
Phe Ala Val Asp Arg Ala Gly Leu Val Gly Gln Asp Gly Pro Thr His
420 425 430
tcc ggc gcc tat gac acc gcc ttc ctg gcc aat ctg ccc ggg ttt gtc 1344
Ser Gly Ala Tyr Asp Thr Ala Phe Leu Ala Asn Leu Pro Gly Phe Val
435 440 445
gtc atg gcc gcc gcg gac gag gcc gaa ctg gcc cac atg gtc gcc acg 1392
Val Met Ala Ala Ala Asp Glu Ala Glu Leu Ala His Met Val Ala Thr
450 455 460
gcc gcc gca cat gac agc ggc ccc atc gcc ttc cgc ttt ccg cgc gga 1440
Ala Ala Ala His Asp Ser Gly Pro Ile Ala Phe Arg Phe Pro Arg Gly
465 470 475 480
gag ggc acc ggg gtc gag atg ccc gag cgc ggg cag gtc ctg ccc atc 1488
Glu Gly Thr Gly Val Glu Met Pro Glu Arg Gly Gln Val Leu Pro Ile
485 490 495
ggc aag ggc cgc atg atc gcg gag ggc aag ggc gtc gcc atc ctg tcc 1536
Gly Lys Gly Arg Met Ile Ala Glu Gly Lys Gly Val Ala Ile Leu Ser
500 505 510
ttc ggc acg cgc ctg tcc gag gtg atg acc gcg cgc gag gcg ctg atg 1584
Phe Gly Thr Arg Leu Ser Glu Val Met Thr Ala Arg Glu Ala Leu Met
515 520 525
gcg cgg ggc atc acg ccc acg gtc gcc gac gcg cgc ttt gcc aag ccg 1632
Ala Arg Gly Ile Thr Pro Thr Val Ala Asp Ala Arg Phe Ala Lys Pro
530 535 540
ctg gat cgt gac ctg atc ctg gca ctg gcc cgc gat cac gag gcg ctg 1680
Leu Asp Arg Asp Leu Ile Leu Ala Leu Ala Arg Asp His Glu Ala Leu
545 550 555 560
atc acc atc gag gag ggc gcc gtg ggc ggt ttc ggc agc cat gtc gcc 1728
Ile Thr Ile Glu Glu Gly Ala Val Gly Gly Phe Gly Ser His Val Ala
565 570 575
cat ctg ctg gcc gag gag ggc gcc ttc gac aag ggg ctg cgc ttc cgg 1776
His Leu Leu Ala Glu Glu Gly Ala Phe Asp Lys Gly Leu Arg Phe Arg
580 585 590
tcg atg gtc ctg ccg gat gcg ttc gtc gac cac gac gcg ccg cgg gcg 1824
Ser Met Val Leu Pro Asp Ala Phe Val Asp His Asp Ala Pro Arg Ala
595 600 605
atg tat gac agc agc tgc ctg aac gcc cag cat atc gag gac aag gtc 1872
Met Tyr Asp Ser Ser Cys Leu Asn Ala Gln His Ile Glu Asp Lys Val
610 615 620
ctc tcc gtg atg ggc gtc cag tcg ctc gcg gcg cgg cgc acc gac cgc 1920
Leu Ser Val Met Gly Val Gln Ser Leu Ala Ala Arg Arg Thr Asp Arg
625 630 635 640
gcc tga 1926
Ala
<210> 6
<211> 641
<212> PRT
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<400> 6
Met Thr Asp Arg Pro Lys Thr Pro Ile Leu Asp Arg Val Ser Leu Pro
1 5 10 15
Ser Asp Leu Lys Thr Leu Thr Asp Ala Gln Leu Arg Gln Leu Ala Asp
20 25 30
Glu Leu Arg Ala Glu Thr Ile Ser Ala Val Ser Val Thr Gly Gly His
35 40 45
Leu Gly Ala Gly Leu Gly Val Val Glu Leu Thr Val Ala Leu His Ala
50 55 60
Val Phe Asp Thr Pro Arg Asp Lys Leu Ile Trp Asp Val Gly His Gln
65 70 75 80
Cys Tyr Pro His Lys Ile Leu Thr Gly Arg Arg Asp Arg Ile Arg Thr
85 90 95
Leu Arg Met Gly Gly Gly Leu Ala Gly Phe Thr Lys Arg Ala Glu Ser
100 105 110
Pro Tyr Asp Pro Phe Gly Ala Gly His Ser Ser Thr Ser Ile Ser Ala
115 120 125
Ala Leu Gly Phe Ala Met Ala Arg Glu Leu Gly Gly Asp Pro Gly Asp
130 135 140
Ala Ile Ala Val Ile Gly Asp Gly Ala Met Ser Ala Gly Met Ala Tyr
145 150 155 160
Glu Ala Leu Asn Asn Ala Gly His Glu Gly Lys Arg Leu Phe Val Val
165 170 175
Leu Asn Asp Asn Glu Met Ser Ile Ala Pro Pro Val Gly Ala Met Ser
180 185 190
Ser Tyr Leu Thr Arg Leu Tyr Ala Gly Gly Pro Phe Gln Glu Leu Lys
195 200 205
Ala Val Ala Lys Gly Ala Val Gly Met Leu Pro Asp Ala Leu Gln Glu
210 215 220
Asp Ala Arg Arg Ala Lys Glu Met Leu Lys Gly Met Ala Val Gly Gly
225 230 235 240
Thr Leu Phe Glu Glu Leu Gly Phe Ser Tyr Ile Gly Pro Val Asp Gly
245 250 255
His Asp Met Glu Gln Leu Leu Pro Leu Leu Arg Thr Val Arg Ala Arg
260 265 270
Ala Asp Gly Pro Val Leu Ile His Val Val Thr Lys Lys Gly Lys Gly
275 280 285
Tyr Ala Pro Ala Glu Ala Ala Ala Asp Lys Gly His Ala Thr Ala Lys
290 295 300
Phe Asp Val Ile Thr Gly Val Gln Ala Lys Ala Lys Ser Asn Ala Pro
305 310 315 320
Ser Tyr Thr Ala Val Phe Ala Gln Ala Leu Ile Asp Gln Ala Gly Arg
325 330 335
Asp Asp Arg Ile Leu Gly Val Thr Ala Ala Met Pro Asp Gly Thr Gly
340 345 350
Leu Lys Gln Phe Ala Gln Arg Phe Pro Arg Arg Cys Phe Asp Val Gly
355 360 365
Ile Ala Glu Gln His Ala Val Thr Phe Ala Ala Gly Leu Ala Ala Gly
370 375 380
Gly Met Lys Pro Phe Val Ala Ile Tyr Ser Thr Phe Leu Gln Arg Gly
385 390 395 400
Tyr Asp Gln Ile Val His Asp Val Ala Val Gln Asn Leu Pro Val Arg
405 410 415
Phe Ala Val Asp Arg Ala Gly Leu Val Gly Gln Asp Gly Pro Thr His
420 425 430
Ser Gly Ala Tyr Asp Thr Ala Phe Leu Ala Asn Leu Pro Gly Phe Val
435 440 445
Val Met Ala Ala Ala Asp Glu Ala Glu Leu Ala His Met Val Ala Thr
450 455 460
Ala Ala Ala His Asp Ser Gly Pro Ile Ala Phe Arg Phe Pro Arg Gly
465 470 475 480
Glu Gly Thr Gly Val Glu Met Pro Glu Arg Gly Gln Val Leu Pro Ile
485 490 495
Gly Lys Gly Arg Met Ile Ala Glu Gly Lys Gly Val Ala Ile Leu Ser
500 505 510
Phe Gly Thr Arg Leu Ser Glu Val Met Thr Ala Arg Glu Ala Leu Met
515 520 525
Ala Arg Gly Ile Thr Pro Thr Val Ala Asp Ala Arg Phe Ala Lys Pro
530 535 540
Leu Asp Arg Asp Leu Ile Leu Ala Leu Ala Arg Asp His Glu Ala Leu
545 550 555 560
Ile Thr Ile Glu Glu Gly Ala Val Gly Gly Phe Gly Ser His Val Ala
565 570 575
His Leu Leu Ala Glu Glu Gly Ala Phe Asp Lys Gly Leu Arg Phe Arg
580 585 590
Ser Met Val Leu Pro Asp Ala Phe Val Asp His Asp Ala Pro Arg Ala
595 600 605
Met Tyr Asp Ser Ser Cys Leu Asn Ala Gln His Ile Glu Asp Lys Val
610 615 620
Leu Ser Val Met Gly Val Gln Ser Leu Ala Ala Arg Arg Thr Asp Arg
625 630 635 640
Ala
<210> 7
<211> 1002
<212> DNA
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<220>
<221> CDS
<222> (1)..(999)
<400> 7
atg act gtg cag gac aac gtc cgc aaa ccg atg gat cgg ctg agc gag 48
Met Thr Val Gln Asp Asn Val Arg Lys Pro Met Asp Arg Leu Ser Glu
1 5 10 15
gcc ctg acc gcc gag atg gag gcg gtc aac gcg ctg atc cgc gac cgc 96
Ala Leu Thr Ala Glu Met Glu Ala Val Asn Ala Leu Ile Arg Asp Arg
20 25 30
atg gcc agc cgc cat gcc ccc cgc atc ccc gag gtg acg gcg cat ctg 144
Met Ala Ser Arg His Ala Pro Arg Ile Pro Glu Val Thr Ala His Leu
35 40 45
atc gag gcc ggc ggc aag cgc ctg cgc ccg atg ctg acg ctg gcc gcg 192
Ile Glu Ala Gly Gly Lys Arg Leu Arg Pro Met Leu Thr Leu Ala Ala
50 55 60
gcc aag ctg ctg ggc tat ccc ggc ccg tgg cat gtc cac ctg gcc gcc 240
Ala Lys Leu Leu Gly Tyr Pro Gly Pro Trp His Val His Leu Ala Ala
65 70 75 80
acg gtc gaa ttc atc cat acc gcc acg ctg ctg cat gac gac gtg gtc 288
Thr Val Glu Phe Ile His Thr Ala Thr Leu Leu His Asp Asp Val Val
85 90 95
gac gaa agc gcg cag cgg cgc ggg cgc ccg acg gcg aac ctg ctg tgg 336
Asp Glu Ser Ala Gln Arg Arg Gly Arg Pro Thr Ala Asn Leu Leu Trp
100 105 110
gac aac aag tcc agc gtg ctg gtc gga gat tac ctg ttc gcg cgc agc 384
Asp Asn Lys Ser Ser Val Leu Val Gly Asp Tyr Leu Phe Ala Arg Ser
115 120 125
ttt cag ctg atg gtc gaa ccc ggc aac ctg cga acg ctg gag atc ctg 432
Phe Gln Leu Met Val Glu Pro Gly Asn Leu Arg Thr Leu Glu Ile Leu
130 135 140
gcc aat gcc agc gcc acc atc gcc gag ggc gag gtg ctg cag ctg acc 480
Ala Asn Ala Ser Ala Thr Ile Ala Glu Gly Glu Val Leu Gln Leu Thr
145 150 155 160
gcg gcg cag gac ctg gcg acc gac gaa tcc gtc tat ctg cag gtg gtg 528
Ala Ala Gln Asp Leu Ala Thr Asp Glu Ser Val Tyr Leu Gln Val Val
165 170 175
cgc ggc aag acg gcg gcg ctg ttt tcc gcc gcg acc gag gtg ggc ggc 576
Arg Gly Lys Thr Ala Ala Leu Phe Ser Ala Ala Thr Glu Val Gly Gly
180 185 190
gtc atc gcc ggt gcg ccc gac gat cag gtg cag gcg ctg ttc gat tac 624
Val Ile Ala Gly Ala Pro Asp Asp Gln Val Gln Ala Leu Phe Asp Tyr
195 200 205
ggc gac gcc ctg ggc atc agc ttc cag att gtc gac gac ctg ctg gat 672
Gly Asp Ala Leu Gly Ile Ser Phe Gln Ile Val Asp Asp Leu Leu Asp
210 215 220
tac ggc ggc gcg acc gag acg atc ggc aag aac gtg ggc gac gat ttc 720
Tyr Gly Gly Ala Thr Glu Thr Ile Gly Lys Asn Val Gly Asp Asp Phe
225 230 235 240
cgc gaa cgc aag ctg acc ctg ccg gtc atc aag gcc atc gcc aag gcc 768
Arg Glu Arg Lys Leu Thr Leu Pro Val Ile Lys Ala Ile Ala Lys Ala
245 250 255
gac gcc gag gaa cgc gcc ttc tgg acc cgc acc atc gag gcg ggc gac 816
Asp Ala Glu Glu Arg Ala Phe Trp Thr Arg Thr Ile Glu Ala Gly Asp
260 265 270
cag cgc gac ggc gac ctg gag cac gcg ctg tcg ctg ctg gcc cgt cac 864
Gln Arg Asp Gly Asp Leu Glu His Ala Leu Ser Leu Leu Ala Arg His
275 280 285
ggt gcg atg gag gcc gcg cgc gcc gat gcg ctg gcc cat gcc gca cgg 912
Gly Ala Met Glu Ala Ala Arg Ala Asp Ala Leu Ala His Ala Ala Arg
290 295 300
gtc cgc gcg gcg ctg cag gtg ctg ccc gcg cat ccg att cgc gac atg 960
Val Arg Ala Ala Leu Gln Val Leu Pro Ala His Pro Ile Arg Asp Met
305 310 315 320
ctg gcc gac ctc gcg gat ttc gtc gtc agc cgc gtg gcc tga 1002
Leu Ala Asp Leu Ala Asp Phe Val Val Ser Arg Val Ala
325 330
<210> 8
<211> 333
<212> PRT
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<400> 8
Met Thr Val Gln Asp Asn Val Arg Lys Pro Met Asp Arg Leu Ser Glu
1 5 10 15
Ala Leu Thr Ala Glu Met Glu Ala Val Asn Ala Leu Ile Arg Asp Arg
20 25 30
Met Ala Ser Arg His Ala Pro Arg Ile Pro Glu Val Thr Ala His Leu
35 40 45
Ile Glu Ala Gly Gly Lys Arg Leu Arg Pro Met Leu Thr Leu Ala Ala
50 55 60
Ala Lys Leu Leu Gly Tyr Pro Gly Pro Trp His Val His Leu Ala Ala
65 70 75 80
Thr Val Glu Phe Ile His Thr Ala Thr Leu Leu His Asp Asp Val Val
85 90 95
Asp Glu Ser Ala Gln Arg Arg Gly Arg Pro Thr Ala Asn Leu Leu Trp
100 105 110
Asp Asn Lys Ser Ser Val Leu Val Gly Asp Tyr Leu Phe Ala Arg Ser
115 120 125
Phe Gln Leu Met Val Glu Pro Gly Asn Leu Arg Thr Leu Glu Ile Leu
130 135 140
Ala Asn Ala Ser Ala Thr Ile Ala Glu Gly Glu Val Leu Gln Leu Thr
145 150 155 160
Ala Ala Gln Asp Leu Ala Thr Asp Glu Ser Val Tyr Leu Gln Val Val
165 170 175
Arg Gly Lys Thr Ala Ala Leu Phe Ser Ala Ala Thr Glu Val Gly Gly
180 185 190
Val Ile Ala Gly Ala Pro Asp Asp Gln Val Gln Ala Leu Phe Asp Tyr
195 200 205
Gly Asp Ala Leu Gly Ile Ser Phe Gln Ile Val Asp Asp Leu Leu Asp
210 215 220
Tyr Gly Gly Ala Thr Glu Thr Ile Gly Lys Asn Val Gly Asp Asp Phe
225 230 235 240
Arg Glu Arg Lys Leu Thr Leu Pro Val Ile Lys Ala Ile Ala Lys Ala
245 250 255
Asp Ala Glu Glu Arg Ala Phe Trp Thr Arg Thr Ile Glu Ala Gly Asp
260 265 270
Gln Arg Asp Gly Asp Leu Glu His Ala Leu Ser Leu Leu Ala Arg His
275 280 285
Gly Ala Met Glu Ala Ala Arg Ala Asp Ala Leu Ala His Ala Ala Arg
290 295 300
Val Arg Ala Ala Leu Gln Val Leu Pro Ala His Pro Ile Arg Asp Met
305 310 315 320
Leu Ala Asp Leu Ala Asp Phe Val Val Ser Arg Val Ala
325 330
<210> 9
<211> 1452
<212> DNA
<213> Paracoccus carotinifaciens(产类胡萝卜素副球菌)
<220>
<221> misc_feature
<222> (1350)..(1350)
<223> n为a、c、g或t
<400> 9
agtttgatcc tggctcagaa cgaacgctgg cggcaggctt aacacatgca agtcgagcga 60
gaccttcggg tctagcggcg gacgggtgag taacgcgtgg gaacgtgccc ttctctacgg 120
aatagccccg ggaaactggg agtaataccg tatacgccct ttgggggaaa gatttatcgg 180
agaaggatcg gcccgcgttg gattaggtag ttggtggggt aatggcccac caagccgacg 240
atccatagct ggtttgagag gatgatcagc cacactggga ctgagacacg gcccagactc 300
ctacgggagg cagcagtggg gaatcttaga caatgggggc aaccctgatc tagccatgcc 360
gcgtgagtga tgaaggcctt agggttgtaa agctctttca gctgggaaga taatgacggt 420
accagcagaa gaagccccgg ctaactccgt gccagcagcc gcggtaatac ggagggggct 480
agcgttgttc ggaattactg ggcgtaaagc gcacgtaggc ggactggaaa gtcagaggtg 540
aaatcccagg gctcaacctt ggaactgcct ttgaaactat cagtctggag ttcgagagag 600
gtgagtggaa ttccgagtgt agaggtgaaa ttcgtagata ttcggaggaa caccagtggc 660
gaaggcggct cactggctcg atactgacgc tgaggtgcga aagcgtgggg agcaaacagg 720
attagatacc ctggtagtcc acgccgtaaa cgatgaatgc cagacgtcgg caagcatgct 780
tgtcggtgtc acacctaacg gattaagcat tccgcctggg gagtacggtc gcaagattaa 840
aactcaaagg aattgacggg ggcccgcaca agcggtggag catgtggttt aattcgaagc 900
aacgcgcaga accttaccaa cccttgacat ggcaggaccg ctggagagat tcagctttct 960
cgtaagagac ctgcacacag gtgctgcatg gctgtcgtca gctcgtgtcg tgagatgttc 1020
ggttaagtcc ggcaacgagc gcaacccacg tccctagttg ccagcaattc agttgggaac 1080
tctatggaaa ctgccgatga taagtcggag gaaggtgtgg atgacgtcaa gtcctcatgg 1140
gccttacggg ttgggctaca cacgtgctac aatggtggtg acagtgggtt aatccccaaa 1200
agccatctca gttcggattg tcctctgcaa ctcgagggca tgaagttgga atcgctagta 1260
atcgcggaac agcatgccgc ggtgaatacg ttcccgggcc ttgtacacac cgcccgtcac 1320
accatgggag ttggttctac ccgacgacgn tgcgctaacc ttcggggggc aggcggccac 1380
ggtaggatca gcgactgggg tgaagtcgta acaaggtagc cgtaggggaa cctgcggctg 1440
gatcacctcc tt 1452
Claims (12)
1.一种突变型产类胡萝卜素细菌,其包含以下(a)~(c)中任一种基因:
(a)编码由突变型氨基酸序列构成的蛋白质的基因,所述突变型氨基酸序列是属于副球菌属的产类胡萝卜素细菌的1-脱氧-D-木酮糖-5-磷酸合成酶的序列号2所示的氨基酸序列中第225位氨基酸残基被天冬氨酸残基取代而成的;
(b)编码由突变型氨基酸序列构成的蛋白质的基因,所述突变型氨基酸序列是属于副球菌属的产类胡萝卜素细菌的十聚异戊二烯焦磷酸合成酶的序列号4所示的氨基酸序列中第305位氨基酸残基被缬氨酸残基取代而成的;
(c)所述(a)及(b)两者的基因。
2.根据权利要求1所述的细菌,其与不具有编码由突变型氨基酸序列构成的蛋白质的基因的产类胡萝卜素细菌的类胡萝卜素产生能力相比,获得了更高的产生能力。
3.根据权利要求2所述的细菌,其与不具有编码由突变型氨基酸序列构成的蛋白质的基因的产类胡萝卜素细菌的类胡萝卜素产生量相比,获得了至少5倍以上的量的产生能力。
4.根据权利要求1~3中任一项所述的细菌,其中,属于副球菌属的细菌为以保藏编号FERM BP-4283保藏的E-396株。
5.根据权利要求1所述的细菌,其中,类胡萝卜素为虾青素。
6.一种类胡萝卜素的制造方法,该方法包括:培养权利要求1~5中任一项所述的细菌,从得到的培养物采集类胡萝卜素。
7.根据权利要求6所述的方法,其中,与不具有编码由突变型氨基酸序列构成的蛋白质的基因的产类胡萝卜素细菌的类胡萝卜素产生量相比,该方法的类胡萝卜素的产生量至少为5倍以上的产生量。
8.根据权利要求6或7所述的方法,其中,类胡萝卜素为虾青素。
9.一种基因,其编码由突变型氨基酸序列构成的蛋白质,所述突变型氨基酸序列是来自属于副球菌属的产类胡萝卜素细菌的1-脱氧-D-木酮糖-5-磷酸合成酶的序列号2所示的氨基酸序列中第225位氨基酸残基被天冬氨酸残基取代而成的。
10.一种基因,其为由序列号5所示的碱基序列构成的DNA。
11.一种基因,其编码由突变型氨基酸序列构成的蛋白质,所述突变型氨基酸序列是来自属于副球菌属的产类胡萝卜素细菌的十聚异戊二烯焦磷酸合成酶的序列号4所示的氨基酸序列中第305位氨基酸残基被缬氨酸残基取代而成的。
12.一种基因,其为由序列号7所示的碱基序列构成的DNA。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016071303A JP6357186B2 (ja) | 2016-03-31 | 2016-03-31 | カロテノイドの製造方法 |
| JP2016-071303 | 2016-03-31 | ||
| PCT/JP2017/014162 WO2017171098A1 (ja) | 2016-03-31 | 2017-03-29 | カロテノイドの製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN109715796A CN109715796A (zh) | 2019-05-03 |
| CN109715796B true CN109715796B (zh) | 2021-04-09 |
Family
ID=59965870
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780020844.4A Active CN109715796B (zh) | 2016-03-31 | 2017-03-29 | 类胡萝卜素的制造方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US11268121B2 (zh) |
| EP (1) | EP3441464A4 (zh) |
| JP (1) | JP6357186B2 (zh) |
| KR (1) | KR102316650B1 (zh) |
| CN (1) | CN109715796B (zh) |
| AU (1) | AU2017245123B2 (zh) |
| CA (1) | CA3018942A1 (zh) |
| TW (1) | TW201738372A (zh) |
| WO (1) | WO2017171098A1 (zh) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6357186B2 (ja) * | 2016-03-31 | 2018-07-11 | Jxtgエネルギー株式会社 | カロテノイドの製造方法 |
| US20210346315A1 (en) * | 2018-09-20 | 2021-11-11 | Eneos Corporation | Composition for inhibition or treatment of brain tumors or symptoms attributable thereto |
| KR102323664B1 (ko) * | 2019-04-25 | 2021-11-08 | 부경대학교 산학협력단 | 파라코커스 속 균주를 이용한 사료첨가제 |
| CN110438033B (zh) * | 2019-07-02 | 2021-04-27 | 浙江工业大学 | 一种油脂降解菌、应用及油脂降解方法 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004056974A2 (en) * | 2002-12-19 | 2004-07-08 | E.I. Du Pont De Nemours And Company | Mutations affecting carotenoid production |
| WO2004056975A2 (en) * | 2002-12-19 | 2004-07-08 | E.I. Du Pont De Nemours And Company | Increasing carotenoid production in bacteria via chromosomal integration |
| CN1630718A (zh) * | 2001-06-06 | 2005-06-22 | Dsmip资产公司 | 改进的类异戊二烯生产 |
| WO2007050769A2 (en) * | 2005-10-27 | 2007-05-03 | Massachusetts Institute Of Technology | Gene targets for enhanced carotenoid production |
| CN101044243A (zh) * | 2004-08-19 | 2007-09-26 | 帝斯曼知识产权资产管理有限公司 | 类异戊二烯的生产方法 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK199887D0 (da) | 1987-04-15 | 1987-04-15 | Danisco Bioteknologi As | Gaerstamme |
| US5607839A (en) | 1993-07-22 | 1997-03-04 | Nippon Oil Company, Ltd. | Bacteria belonging to new genus process for production of carotenoids using same |
| JP3242531B2 (ja) | 1993-07-22 | 2001-12-25 | 日石三菱株式会社 | カロチノイド色素の製造方法 |
| US5935808A (en) | 1997-07-29 | 1999-08-10 | Yissum Research And Development Company Of The Hebrew University Of Jerusalem | Carotenoid-producing bacterial species and process for production of carotenoids using same |
| WO2005118812A1 (ja) | 2004-06-04 | 2005-12-15 | Marine Biotechnology Institute Co., Ltd. | カロテノイドケトラーゼ及びカロテノイドヒドロキシラーゼ遺伝子を利用したアスタキサンチンまたはその代謝物の製造法 |
| US20060219629A1 (en) | 2005-03-31 | 2006-10-05 | Andrew Noestheden | Oil and water separator |
| JP2006340676A (ja) | 2005-06-10 | 2006-12-21 | Asahi Kasei Corp | アスタキサンチンの製造方法 |
| US20070054351A1 (en) | 2005-09-06 | 2007-03-08 | Yamaha Hatsudoki Kabushiki Kaisha | Green algae having a high astaxanthin content and method for producing the same |
| JP2007097584A (ja) | 2005-09-06 | 2007-04-19 | Yamaha Motor Co Ltd | アスタキサンチン含有量の高い緑藻およびその製造方法 |
| JP2007143492A (ja) | 2005-11-29 | 2007-06-14 | Tosoh Corp | カロテノイド類の生産方法 |
| JP2007244205A (ja) | 2006-03-13 | 2007-09-27 | Tosoh Corp | カロテノイド類の製造方法 |
| US7422873B2 (en) | 2006-03-31 | 2008-09-09 | E.I. Du Pont De Nemours And Company | Mutant carotenoid ketolase |
| JP5066385B2 (ja) | 2007-04-12 | 2012-11-07 | 電源開発株式会社 | アスタキサンチン産生細菌、細菌培養物およびアスタキサンチンの製造方法 |
| KR20090062566A (ko) * | 2007-12-13 | 2009-06-17 | 한국원자력연구원 | 카로티노이드를 고농도로 생산하는 미생물 및 이를 이용한카로티노이드 생산 방법 |
| KR100936216B1 (ko) | 2008-01-03 | 2010-01-11 | 한국과학기술원 | 코엔자임 q10 생성능을 가지는 재조합 미생물 및 이를이용한 코엔자임 q10의 제조방법 |
| NZ592213A (en) | 2008-10-17 | 2012-10-26 | Jx Nippon Oil & Energy Corp | Carotenoid fermentation method using bacterium strain E-396 (FERM BP-4283) or A-581-1 (FERM BP-4671) |
| JP5762691B2 (ja) * | 2010-03-15 | 2015-08-12 | Jx日鉱日石エネルギー株式会社 | 発酵によるアスタキサンチン製造方法 |
| EP2444415A1 (en) | 2010-10-20 | 2012-04-25 | Genoplante-Valor | 1-Deoxy-D-xylulose 5-phosphate synthase alleles responsible for enhanced terpene biosynthesis |
| JP2012139164A (ja) | 2010-12-28 | 2012-07-26 | Tosoh Corp | 微生物を用いたカロテノイドの製造法 |
| WO2014081963A2 (en) * | 2012-11-21 | 2014-05-30 | Nair, Ramesh | Engineering plants to produce farnesene and other terpenoids |
| CA2950992A1 (en) | 2014-06-13 | 2015-12-17 | Deinove | Method of producing terpenes or terpenoids |
| JP6357186B2 (ja) * | 2016-03-31 | 2018-07-11 | Jxtgエネルギー株式会社 | カロテノイドの製造方法 |
-
2016
- 2016-03-31 JP JP2016071303A patent/JP6357186B2/ja active Active
-
2017
- 2017-03-29 CA CA3018942A patent/CA3018942A1/en active Pending
- 2017-03-29 WO PCT/JP2017/014162 patent/WO2017171098A1/ja active Application Filing
- 2017-03-29 CN CN201780020844.4A patent/CN109715796B/zh active Active
- 2017-03-29 KR KR1020187026936A patent/KR102316650B1/ko active IP Right Grant
- 2017-03-29 EP EP17775629.3A patent/EP3441464A4/en active Pending
- 2017-03-29 TW TW106110500A patent/TW201738372A/zh unknown
- 2017-03-29 AU AU2017245123A patent/AU2017245123B2/en active Active
- 2017-03-29 US US16/088,058 patent/US11268121B2/en active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1630718A (zh) * | 2001-06-06 | 2005-06-22 | Dsmip资产公司 | 改进的类异戊二烯生产 |
| WO2004056974A2 (en) * | 2002-12-19 | 2004-07-08 | E.I. Du Pont De Nemours And Company | Mutations affecting carotenoid production |
| WO2004056975A2 (en) * | 2002-12-19 | 2004-07-08 | E.I. Du Pont De Nemours And Company | Increasing carotenoid production in bacteria via chromosomal integration |
| CN101044243A (zh) * | 2004-08-19 | 2007-09-26 | 帝斯曼知识产权资产管理有限公司 | 类异戊二烯的生产方法 |
| WO2007050769A2 (en) * | 2005-10-27 | 2007-05-03 | Massachusetts Institute Of Technology | Gene targets for enhanced carotenoid production |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2017176099A (ja) | 2017-10-05 |
| AU2017245123B2 (en) | 2023-05-25 |
| CA3018942A1 (en) | 2017-10-05 |
| AU2017245123A1 (en) | 2018-10-11 |
| EP3441464A1 (en) | 2019-02-13 |
| US11268121B2 (en) | 2022-03-08 |
| TW201738372A (zh) | 2017-11-01 |
| CN109715796A (zh) | 2019-05-03 |
| KR102316650B1 (ko) | 2021-10-22 |
| US20200299747A1 (en) | 2020-09-24 |
| EP3441464A4 (en) | 2020-01-08 |
| JP6357186B2 (ja) | 2018-07-11 |
| WO2017171098A1 (ja) | 2017-10-05 |
| KR20180131543A (ko) | 2018-12-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10240215B2 (en) | Method for producing astaxanthin by fermentation | |
| CN109715796B (zh) | 类胡萝卜素的制造方法 | |
| CN108431205A (zh) | 牛磺酸在微生物中的异源表达 | |
| AU2011235718B2 (en) | Method of manufacturing zeaxanthin by fermentation | |
| JP6810096B2 (ja) | カロテノイドの製造方法 | |
| WO2007066454A1 (ja) | 新規微生物およびそれを用いたカロテノイド類の製造方法 | |
| CN115176024A (zh) | 红发夫酵母的虾青素高产菌株 | |
| KR100832584B1 (ko) | 라이코펜의 생합성에 관여하는 유전자, 그 유전자를포함하는 재조합 벡터, 및 그 재조합 벡터로 형질전환된미생물 | |
| CA3010090C (en) | Method for producing fermented carotenoid by paracoccus spp. cultured in cobalt-containing medium | |
| Henke et al. | C50 carotenoids: occurrence, biosynthesis, glycosylation, and metabolic engineering for their overproduction | |
| WO2022220014A1 (ja) | カロテノイドを生産する微生物 | |
| Henke et al. | OCCURRENCE, BIOSYNTHESIS, GLYCOSYLATION, AND | |
| JP2007181451A (ja) | 新規微生物およびそれを用いたカロテノイド類の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant | ||
| CP01 | Change in the name or title of a patent holder | ||
| CP01 | Change in the name or title of a patent holder |
Address after: Tokyo, Japan Patentee after: Yinnengshi Co.,Ltd. Address before: Tokyo, Japan Patentee before: JXTG Energy Corp. |