CN105579464B - 能够再活化p53突变体的肽 - Google Patents
能够再活化p53突变体的肽 Download PDFInfo
- Publication number
- CN105579464B CN105579464B CN201480053550.8A CN201480053550A CN105579464B CN 105579464 B CN105579464 B CN 105579464B CN 201480053550 A CN201480053550 A CN 201480053550A CN 105579464 B CN105579464 B CN 105579464B
- Authority
- CN
- China
- Prior art keywords
- peptide
- protein
- mutant
- cells
- peptides
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/10—Peptides having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4746—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used p53
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Zoology (AREA)
- Toxicology (AREA)
- Reproductive Health (AREA)
- Endocrinology (AREA)
- Pulmonology (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicinal Preparation (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
本发明提供可以有效地且特异性地再活化p53突变体的肽,以及允许以精确、节约成本和时间的方式鉴定、选择和分离此类肽的方法。具体而言,提供可以为突变体p53蛋白恢复天然野生型p53折叠并因此恢复肿瘤抑制物活性的突变体p53再活化肽。此类肽可用于治疗其中p53突变的各种病况和疾病。
Description
发明领域
本发明涉及能够再活化突变体p53蛋白的肽及其在治疗中的用途。
发明背景
癌症是发达国家中的主要死亡原因,且随着人口的平均年龄继续上升,诊断病例数和经济意义也上升。癌症不是单一疾病,而是特征在于异常细胞的失控生长和扩散的一组超过200种疾病。癌症是高度异质性疾病,甚至在具有相同类型和等级的癌症的患者间具有肿瘤细胞表面标记的表达和分布的主要分子差异。此外,随着癌症进展,细胞突变倾向于积聚,进一步增加肿瘤异质性。大多数肿瘤细胞表现出基因组不稳定性,具有癌基因的增加表达和肿瘤抑制基因的失活。
p53基因被认为是最重要的肿瘤抑制基因,其充当针对癌症发展的主要屏障。p53蛋白响应于各种类型的细胞应激,且触发细胞周期停滞、细胞凋亡或衰老(Levine, J.A.,p53, the cellular gatekeeper for growth and division. Cell, 1997. 88: p. 323-331)。这通过携带p53 DNA结合基序的特异性目标基因的转录反式活化来实现。得到广泛赞同的是,p53途径在几乎所有人癌症中受损。p53的突变被视为恶性转化过程中的关键步骤,且超过50%的癌症病例在它们的p53基因中携带突变。这些突变中的大多数是靶向p53的DNA-结合核心结构域(DBD)的错义点突变,从而取消p53与其目标位点的特异性DNA结合。这些突变阻止p53依赖性转录,且因此阻止p53介导的肿瘤抑制。不同类型的人肿瘤中的p53突变的异常高频率使得p53在参与肿瘤发育的基因间是独特的,使得突变的p53(Mut-p53)成新型癌症治疗的有吸引力的目标。
结构研究已经揭示,p53的DBD中的肿瘤来源的错义突变产生共同效果:在生理温度的DBD折叠的不稳定(Joerger, A.C., M.D. Allen,和A.R. Fersht, Crystal structure of a superstable mutant of human p53 core domain. Insights into the mechanism of rescuing oncogenic mutations. J Biol Chem, 2004. 279(2): p.1291-6)。该不稳定可以是可逆的,因为一些突变体可以恢复至野生型构象且在降低的温度结合DNA。因此,p53的大多数突变使p53蛋白折叠不稳定,在生理温度引起部分变性。
突变体p53蛋白在肿瘤细胞中以高水平积聚,主要由于它们无法上调p53的自身破坏者Mdm2的表达。此外,许多p53活化应激信号(如缺氧、基因组不稳定和癌基因表达)在癌细胞中得到组成型诱导。因此,预期Mut-p53的再活化发挥主要的抗肿瘤作用。此外,已经在小鼠模型中显示,p53功能的恢复在正常组织中被良好耐受,且不产生任何可见的毒性作用(Ventura, A., 等人, Restoration of p53 function leads to tumour regression invivo. Nature, 2007. 445(7128): p. 661-5)。
p53已经进化为动态的,且构象不稳定。根据应激类型和细胞环境,p53蛋白的刚性结构的缺乏可以导致展现不同活性的许多p53构象体。在简化模型中,p53可以假定为野生型、活性构象或突变体、错误折叠的无活性构象。p53的两种构象状态可以通过两种特异性单克隆抗体PAb240和PAb1620进行区分(Wang, P.L., F. Sait,和G. Winter, The 'wild type' conformation of p53: epitope mapping using hybrid proteins. Oncogene,2001. 20(18): p. 2318-24)。PAb240结合至p53的DBD中的残基212-217。该区域是野生型(WT)构象的抗体(Ab)不可接近的。然而,在变性或突变体p53中,其得到暴露(Vojtesek,B., 等人, Conformational changes in p53 analyzed using new antibodies to the core DNA binding domain of the protein. Oncogene, 1995. 10(2): p. 389-93)。PAb1620识别DBD中的构象、非线性表位,所述表位由p53的两个不同的区域构成,且包括残基R156、L206、R209和N210(Cook, A.和J. Milner, Evidence for allosteric variants of wild-type p53, a tumor suppressor protein. Br J Cancer, 1990. 61(4): p.548-52)。在野生型构象中,蛋白以彼此紧密接近地容纳环的方式折叠(Ravera, M.W., 等人, Identification of an allosteric binding site on the transcription factor p53 using a phage-displayed peptide library. Oncogene, 1998. 16(15): p. 1993-9),形成被PAb1620识别的完整表位。当p53蛋白被错误折叠(作为突变、温度、变性等的结果)时,这两个环移得更远,所述表位被破坏,因此突变体构象是PAb1620阴性的。已经显示,p53是构象柔性的蛋白。然而,此类突变体的折叠的缺陷是不可逆的:一些p53突变体维持残余DNA-结合能力,未能在37℃结合DNA的突变体可以在亚生理温度(32℃或25℃)结合,且在26℃从p53-应答启动子活化转录。此外,分离的DBD的突变蛋白R245S、R282W、V143A和其它显示在20℃具有残留(30-60%)DNA结合活性。
结构研究显示,错误折叠的程度在突变体间不同;然而,没有确定的替代折叠,而有部分变性。这表明,逆转p53突变对折叠的效果的“小分子”方法可适用于宽范围的突变体形式。来自结构研究的另一个重要预测是,根据质量作用定律,预期结合至该蛋白的正确折叠部分的配体将平衡朝向天然折叠移动。
p53最初被鉴定为与SV40大T抗原(LT)相互作用的细胞蛋白。LT和p53之间的界面面积大:总共23个LT残基和19个p53残基被埋在该界面中或被发现直接参与这两种分子之间的相互作用。p53/DNA相互作用残基与p53/LT相邻且重叠。LT与这些p53残基的结合可以有效屏蔽p53的整个DNA结合表面,包括癌症中三种最常见突变的p53残基:R273、R248和G245. 这抑制p53依赖性启动子的反式活化。由于p53/LT界面涉及几个不同的p53区域和环,所以p53蛋白必须正确折叠以对齐正确位置和取向的氨基酸以形成LT的结合环境。因此,p53与LT的结合可以充当p53构象状态的标记
p53构象领域中尝试了一些校正方法。Friedler和同事提供了构象稳定肽的原理论证(Friedler, A., 等人, A peptide that binds and stabilizes p53 core domain: chaperone strategy for rescue of oncogenic mutants. Proc. Natl. Acad. Sci.USA, 2002. 99(2): p. 937-42)。基于p53 DBD和ASPP之间的复合物的晶体结构设计九残基肽CDB3(Samuels-Lev, Y., 等人, ASPP proteins specifically stimulate the apoptotic function of p53. Mol. Cell, 2001. 8(4): p. 781-94)。该肽显示结Mut-p53且充当分子伴侣,朝向野生型构象移动平衡,如与PAb1620的增加反应性所示。然而,CDB3的生物效果(Issaeva, N., 等人, Rescue of mutants of the tumor suppressor p53 in cancer cells by a designed peptide. Proc. Natl. Acad. Sci. USA, 2003.100(23): p. 13303-7)仅仅是部分的,因为Mut-p53/CDB3复合物的构象处于野生型和突变体之间的中间状态。
已经使用基于蛋白或基于细胞的测定法鉴定靶向Mut-p53的小分子化合物(Peng,Y., 等人, Rescue of mutant p53 transcription function by ellipticine.Oncogene, 2003. 22(29): p. 4478-87)。通过筛选保护分离的p53 DBD免于热变性的分子鉴定CP-31398,如通过蛋白加热后PAb1620反应性的维持所评价(Foster, B.A., 等人,Pharmacological rescue of mutant p53 conformation and function. Science,1999. 286(5449): p. 2507-10)。CP-31398的作用机制仍不清楚。NMR研究未能检测到CP-31398与p53 DBD的任何结合(Rippin, T.M., 等人, Characterization of the p53- rescue drug CP-31398 in vitro and in living cells. Oncogene, 2002. 21(14): p.2119-29)。CP-31398以p53依赖和非依赖的方式影响基因表达且诱导细胞死亡。因此,看来CP-3138具有p53以外的其他细胞目标,这可以是其细胞毒性的原因。
通过使用基于细胞的筛选测定法发现在活癌细胞中解救p53功能的两种其他小分子PRIMA-1和MIRA-1。PRIMA-1和MIRA-1具有类似的活性概况(Bykov, V.J., 等人,Reactivation of mutant p53 and induction of apoptosis in human tumor cells by maleimide analogs. J Biol Chem, 2005. 280(34): p. 30384-91),但结构上无关。迄今为止,还没有证实与Mut-p53的直接结合。看来该机制可能涉及JNK通路。
在抗癌药物发现和设计的领域中,可以采用两种不同且有时互补的策略。在CDB3的情况下已经使用采用生物、数学或计算工具来设计分子用于特定目的的合理设计。然而,由于不同的蛋白及其环境之间的相互作用是复杂的,这是极端困难的,且经常得到具有适度生物影响的分子。第二种策略是分子文库的高通量筛选,以分离具有最佳性状的化合物。此类筛选可以采用化学小分子文库或肽文库。迄今可得的大多数药物是小分子,因为它们能够穿过细胞膜。化学文库通常由104-105种不同化合物组成;筛选此文库需要单个分子的功能评价,使其对于小型实验室是不切实际的,因为它要求机器人和/或人力的大量投资。肽展示文库大得多。肽的选择基于肽(且因此噬菌体)与固定化目标的结合,洗脱和扩增,然后通过测序鉴定。
在噬菌体展示程序中,呈递肽的噬菌体的富集通过对固定化目标的噬菌体文库的亲和力选择来实现。在该“淘选”方法中,捕获结合噬菌体,而洗掉不结合的噬菌体。在下一步骤中,洗脱结合的噬菌体且通过大肠杆菌细胞的再感染来扩增。扩增的噬菌体群体可以进而进行下一轮淘选。从噬菌体展示文库的选择是选择性富集和扩增的循环过程。几轮选择之后,以允许分离单个噬菌体克隆的方式稀释噬菌体。然后挑取单个克隆,在大肠杆菌中培养,提取噬菌体DNA,然后送去测序。新近开发的下一代测序技术大大增加噬菌体展示的有效性,允许分析整个选择的肽所有组成成分(repertoire),其中进行较少选择轮。
噬菌体展示相比于其他筛选方法提供几个重要的优点;噬菌体展示的主要优点是可以代表的序列的多样性,能够发现具有非常高亲和力和生物效果的分子。一旦发现共有肽序列,就可以将其通过定向进化技术或合理设计进一步改进。
尽管如此,本领域中仍然存在对于可以有效和特异性再活化p53突变体蛋白的药剂的未满足的需求。此类特异性和有效的药剂可以进一步用作用于具体而言通过恢复突变体p53蛋白的天然折叠和活性而治疗其中p53突变的各种病况的有效方式。
发明概述
本发明提供高度有效的肽和修饰的肽试剂,其可以理想地通过改变突变体p53蛋白构象和/或活性以类似于野生型、功能性p53蛋白的构象和/或活性而有效再活化p53构象突变体。因此,本发明提供肽和它们在治疗突变体p53相关病况(其中本仍构象缺陷的p53蛋白的活化可有益)的用途。
本发明基于高度有效的肽和基于肽的试剂的令人惊讶的鉴定,所述肽和基于肽的试剂可以有效地再活化p53构象突变体,比鉴定用于该用途的先前已知的肽更有效。因此,在一个方面,本发明提供由SEQ ID NO:321-286中任一个记载的氨基酸序列组成的重组或合成肽。
在另一个方面,本发明进一步提供包含SEQ ID NO:321-286中任一个记载的氨基酸序列的重组或合成肽,其中所述肽至少部分再活化突变体p53蛋白。
在又另一个方面,本发明进一步提供包含SEQ ID NO:314、268、282、340、376、298、377、378、253、20、379、302、275、380、273、381、280或382中任一个记载的氨基酸序列的共有基序的重组或合成肽,其中所述肽至少部分再活化突变体p53蛋白。
在某些实施方案中,所述肽由SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQ ID NO:307中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽由SEQ ID NO:321-302中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽由SEQ ID NO:321-312中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽由SEQ ID NO:321-316中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述肽包含SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQ ID NO:307中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽包含SEQ ID NO:321-302中任一个记载的氨基酸序列。在某些实施方案中,上述肽包含SEQ ID NO:321-312中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽包含SEQ ID NO:321-316中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述肽缀合至至少一种脂肪酸部分。在某些实施方案中,所述脂肪酸选自肉豆蔻酸、月桂酸、棕榈酸和硬脂酸。各可能性代表本发明的单独实施方案。在某些实施方案中,所述脂肪酸是肉豆蔻酰基脂肪酸。
在某些实施方案中,所述肽至少部分将所述突变体p53蛋白的构象改变为野生型(WT) p53蛋白的构象。
在某些实施方案中,所述肽至少部分改变所述突变体p53蛋白的构象,使得针对野生型p53蛋白的单克隆抗体识别所述突变体p53蛋白。在某些实施方案中,所述单克隆抗体是Ab1620。
在某些实施方案中,所述肽至少部分将所述突变体p53蛋白的活性恢复至野生型p53蛋白的活性。
在某些实施方案中,所述活性是降低表达所述突变体p53蛋白的细胞的活力。在某些实施方案中,所述活性是促进表达所述突变体p53蛋白的细胞的细胞凋亡。在某些实施方案中,所述活性是活化表达所述突变体p53蛋白的细胞的促细胞凋亡基因。在某些实施方案中,所述促细胞凋亡基因选自CD95、Bax、DR4、DR5、PUMA、NOXA、Bid、53AIP1和PERP。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述活性是结合至表达所述突变体p53蛋白的细胞中的p53共有DNA结合元件。在某些实施方案中,所述共有DNA结合元件包含SEQ ID NO:339中记载的氨基酸序列。
在某些实施方案中,所述结合导致内源p53目标基因的至少部分活化。在某些实施方案中,所述内源目标基因选自p21、MDM2和PUMA。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述突变体p53蛋白具有与野生型p53蛋白不同的构象。在某些实施方案中,所述突变体p53蛋白与野生型p53蛋白相比至少部分无活性。
在某些实施方案中,所述突变体p53蛋白不被针对野生型p53蛋白的单克隆抗体识别。在某些实施方案中,所述突变体p53蛋白,在与所述肽结合后,被针对野生型p53蛋白的单克隆抗体识别。在某些实施方案中,所述单克隆抗体是Ab1620。
在某些实施方案中,所述突变体p53蛋白包含选自以下的突变:R175H、V143A、R249S、R273H、R280K、P309S、P151S、P151H、C176S、C176F、H179L、Q192R、R213Q、Y220C、Y220D、R245S、R282W、D281G、S241F、C242R、R248Q、R248W、D281G、R273C和V274F。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述肽包含SEQ ID NO:314中记载的共有基序。在某些实施方案中,所述肽包含SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQID NO:307中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽由SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQID NO:307中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽包含SEQ ID NO:268、282、340、376、298、377、378、253、20、379、302、275、380、273、381、280或382中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽包含SEQ ID NO:379、302、275、380、273、381、280或382中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽包含SEQ ID NO:302、275、380、273、381、280或382中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。
在另一个方面,本发明进一步提供能够表达上述肽的表达载体。
在又另一个方面,本发明进一步提供包含上述肽的药物组合物。
在又另一个方面,本发明进一步提供包含上述表达载体的药物组合物。
在一个方面,上述药物组合物用于治疗与突变体p53蛋白相关的疾病、病症或病况。
在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述癌症选自乳腺癌、结肠癌和肺癌。各可能性代表本发明的单独实施方案。
在一些实施方案中,所述癌症的细胞表达突变体p53蛋白。
在另一个方面,本发明进一步提供治疗与突变体p53蛋白相关的疾病、病症或病况的方法,其包括将治疗有效量的上述药物组合物施用于有需要的主体,从而治疗所述疾病、病症或病况的步骤。
在又另一个方面,本发明进一步提供包含上述药物组合物的药剂盒。
在一个方面,上述药剂盒用于治疗与突变体p53蛋白相关的疾病、病症或病况。
本发明的其他目标、特征和优点从以下描述和附图将变得显而易见。
附图简述
图1A是筛选方法中的步骤的框图,所述筛选方法提供以非直接方式通过其对目标分子的构象或结构的影响选择结合伴侣(诸如肽)。
图1B是鉴定、筛选和选择突变体p53再活化肽的方法的示意图。该方法包括以渐增严格性交替各种选择策略以通过利用噬菌体展示法筛选和鉴定突变体p53再活化肽。策略A(左):根据构象选择:选择由噬菌体表达和呈递且可以结合突变体p53蛋白(例如,R175HMut-p53)的肽。Mut-p53蛋白结合至固定至基板的特异性p53抗体(例如,PAb1620),从而能够选择结合的噬菌体。策略B(右):根据功能选择:选择由噬菌体表达和呈递且可以再活化Mut-p53(例如,R175H Mut-p53)的肽,由此通过Mut-p53蛋白结合其DNA共有结合元件的能力测定活化。DNA结合元件(例如,WT p53-RE)固定至基板。Mut-p53无法结合WT p53-RE,除非其被与其结合的再活化肽至少部分再活化。该方法可以进一步包括对鉴定的肽测序(例如,深度测序)以测定它们的序列,和任选鉴定再活化肽的共有序列。
图2是免疫沉淀(IP)实验的蛋白印迹分析的象形图,其中与抗体(PAb1620或PAb240)或蛋白(ASPP2或Bcl2)共价交联的琼脂糖珠与野生型 p53蛋白、突变体p53 R175H蛋白或突变体p53 V143A(各自由用表达各自蛋白的杆状病毒转染的sf9细胞产生)在4℃孵育3小时。将所得免疫沉淀物以及上清液(sup)进行使用缀合至辣根过氧化物酶(HRP)的抗p53 (αp53)抗体的western印迹实验,以测定各样品中的p53蛋白水平。
图3是IP实验的western印迹分析的象形图,其中与PAb1620或PAb240抗体共价交联的珠粒与野生型 p53或突变体p53 R175H用各种溶液(A-I和IP缓冲液)在4℃孵育3小时。将所得免疫沉淀物以及上清液(sup)进行使用缀合至HRP的抗p53 (αp53)抗体的western印迹实验,以测定各样品中的p53蛋白水平。溶液A – 50mM Tris;溶液B – Tris, 150 mMNaCl;溶液C – Tris, NaCl, 0.5% Triton;溶液D – Tris, 0.5% Glycine;溶液E – 40mMNa4O7P2;溶液F – 400mM盐酸胍;溶液G – 800mM盐酸胍;溶液H – 1M尿素;溶液I – 3M尿素;IP – IP缓冲液。
图4是用作p53蛋白的结合元件的寡核苷酸的序列。该寡核苷酸(SEQ ID NO:61)包含5'生物素标记,随后HindIII识别位点(加下划线),随后EcoRI识别位点(加下划线),随后p53共有结合元件(加下划线,p53结合位点由两个半位点构成,各半位点结合p53的二聚体(dimmer)且与该位点一起形成DNA和p53四聚体的复合物),随后两个拷贝的p21启动子的p53识别元件(加下划线)。对于结合实验,该寡核苷酸与互补寡核苷酸退火以形成双链(ds)寡核苷酸。
图5是IP实验的western印迹分析的象形图,其中在通过用全长Mut-p53 R175H(175)或重组Mut-p53 R249S (249 DBD)的噬菌体展示选择获得的噬菌体存在的情况下,用通过噬菌体合并物与PAb1620珠粒的孵育进行的先前预清除步骤,使与PAb1620抗体共价交联的珠粒与纯化的突变体p53 R175H孵育。非选择的噬菌体(NS)用作对照。在4℃进行孵育3小时。通过使用针对p53 (αp53)的抗体的western印迹分析来分析免疫沉淀物中结合的p53。非选择的噬菌体(NS)用作对照。"In"代表直接上样于凝胶上的IP输入材料的10%。用PAb-421的免疫沉淀用作阳性对照且用作免疫沉淀的p53的标准品,因为该抗体结合C-末端的p53表位,无论p53蛋白构象。
图6是IP实验的western印迹分析的象形图,其中结合至用生物素标记的p53-RE-DNA或对照-RE-DNA寡核苷酸的链霉亲和素包被的珠粒与纯化的WT-p53-DBD或突变体p53-R249S-DBD在通过用Mut-p53 R175H (175)、克隆27 (从175选择分离的单一克隆, SEQ IDNO:328)、合并物#69和#94的噬菌体展示选择获得的噬菌体存在的情况下孵育,在交替选择轮用WT和Mut-p53 R175H使用SV-40大T抗原(T-ag)和PAb1620的组合进行选择。非选择的噬菌体(NS)用作对照。在4℃进行孵育3小时。通过使用针对p53(αp53)的抗体的western印迹分析显现结合的p53。
图7是如本文所述鉴定的几个共有肽基序的示意图。
图8A和8B是柱状图,其表明在稳定过表达Mut-p53 (R175H p53)的H1299细胞中测定测试肽对Mut-p53的构象变化的影响的代表性ELISA实验,如通过免疫测定法测定。为了测量所述肽对Mut-p53的构象影响,用PAb240、PAb1620或pAb421(作为阳性对照和总p53蛋白的标准品,因为所使用的抗体识别野生型和突变体构象两者)包被微滴定板,孵育过夜,洗涤,封闭,且添加细胞提取物(有或没有肽),持续额外2小时。除去提取物之后,将板洗涤且与αp53-HRP缀合的Ab孵育用于检测p53水平。进行TMB (HRP的底物)测定,且在450nm测定光密度。WT p53充当与PAb1620的反应性的阳性对照,且Mut-p53充当阴性对照。结果呈现为PAb1620或PAb240样品和对照pAb241样品之间的吸光度的比率。MCF7和H1299-Mut-p53(ts) A135V (TS)细胞用作WT p53构象的阳性对照(1620/240比率等于或超过5:1)。
图9是柱状图,其表明在稳定过表达Mut-p53 (R175H p53)的H1299细胞中测定测试肽对Mut-p53的DNA结合活性的影响的代表性ELISA实验。根据制造商的说明使用商业p53/DNA结合试剂盒(R&D)。简言之,96孔板用抗p53抗体包被过夜。在测试肽的存在或不存在(NT)的情况下,含有p53的细胞提取物与用生物素标记的含有p53共有结合位点的寡核苷酸反应。预期野生型p53结合该DNA结合位点以及包被板的测试孔的抗体。洗掉过量p53和寡核苷酸,且链霉亲和素-HRP用于定量孔中的寡核苷酸的量,其与p53结合的DNA成正比。进行TMB测定以测定HRP水平(450nm)。结果呈现为各测试样品的相对吸光度(在450nm)(Y-轴)。MCF7和H1299-Mut-p53 (ts) A135V细胞充当WT p53的阳性对照。
图10是柱状图,其描绘测试肽与重组WT p53和Mut-p53的结合的代表性ELISA实验。根据制造商的说明使用商业肽-蛋白结合试剂盒(TAKARA)。简言之,96孔板用肽包被2小时。将可溶性肽添加至相应孔中以充当证实肽与p53 (+ comp)的结合的特异性的竞争对照。将p53-RE DNA寡核苷酸添加至其他孔(+ DNA)中以检查其是否影响肽与p53的结合。除去重组蛋白之后,将板洗涤且与αp53-HRP缀合的Ab孵育用于定量p53。最后,进行TMB (HRP的底物)测定,且在450nm测定光密度。结果呈现为各测试样品的在450nm的相对吸光度(Y-轴)。以下αp53单克隆抗体充当内部对照:PAb1801;PAb1620和PAb240。
图11是柱状图,其表明活细胞中Mut-p53与代表性p53目标基因的启动子的结合。将内源表达突变体p53R249S的BT-549乳腺癌细胞用3种pCAPs(250、308和325)的混合物处理5小时。用对照肽(惰性肽)的混合物处理的细胞充当阴性对照。将细胞用1%甲醛固定,收获且通过超声处理剪切DNA。使用多克隆抗p53抗体(H47)免疫沉淀与p53交联的DNA。纯化DNA且通过qPCR定量与PUMA、p21、CD95和MDM2基因启动子的p53应答元件的结合。将结果针对代表总DNA水平的输入样品均一化。作为阴性对照,用无抗体的珠粒(珠粒)免疫沉淀提取物。不含任何p53结合元件的基因组位点充当阴性对照(黑色)。
图12是柱状图,其说明如各种测试的样品中测量的相对荧光素酶活性(cLuc/gLuc)。使用表达WT p53、R175H p53、R249S p53的质粒或作为对照的空载体、连同TK-RGC-luc(其中荧光素酶表达在多个p53-应答元件的串联阵列的控制下)进行H1299 p53-/-细胞的瞬时转染。转染之后24小时,细胞用测试肽处理。转染之后24小时,取培养基的样品用于生物发光测量。
图13A和13B是柱状图,其说明各种测试肽对表达Mut-p53的细胞的活力的影响,如通过结晶紫测定法所测定。表达内源WT p53的WI-38成纤维细胞用表达小鼠Noxa shRNA(WI38-m-Noxa-i)(作为非特异性对照)或R175H p53突变体(用于突变体p53的稳定过表达)(WI38-175)的逆转录病毒感染。将所述细胞(WI38-m-Noxa-i或WI38-175)以3000个细胞/孔接种于96孔板中。将测试肽添加至细胞。不同浓度的依托泊苷(细胞毒性药物,4'-去甲基-表鬼臼毒素9-[4,6-O-(R)-亚乙基-β-D-吡喃葡萄糖苷],4'-(磷酸二氢盐)被用作细胞死亡的阳性对照且作为标准参考曲线以评价测试肽的作用。处理之后48小时,用PBS洗涤细胞以排除死细胞和碎片,且仍然附着至板的细胞用结晶紫染色30分钟。除去结晶紫,且用PBS洗涤细胞4次以除去残余结晶紫。然后,将染色的细胞溶解于10%乙酸中,且取板用于在595nm的光密度测量(对于结晶紫最佳)。图13A和13B的柱状图显示在595nm的光密度读数,其反映针对未处理(NT)样品均一化的处理之后的板中的细胞数。
图14是柱状图,其说明通过如通过qRT-PCR测定测量p53目标基因的反式活化的测试肽对Mut-p53的活化的影响。H1299细胞是p53无效的,且广泛用于p53研究。使用用Mut-p53 (ts) A135V稳定转染的H1299细胞。将细胞铺板于12孔皿中,将所示肽以5ug/ml的浓度直接添加至培养基,然后将细胞移至32℃或返至37℃。18小时之后收获细胞,随后提取RNA,cDNA合成和实时PCR分析。检查3种代表性p53目标基因(p21、PUMA和Mdm2)的表达水平。图14中显示的柱状图说明测试的基因在各种样品中的转录相对于它们在未处理细胞中的转录水平的相对倍数诱导。
图15A和15B是柱状图,其说明各种所示肽对表达不同的Mut-p53同种型的乳腺癌细胞的活力的影响,如通过结晶紫测定法所测定。图15A:表达在DBD的位置280具有突变的Mut-p53的MDA-MB-231细胞。图15B:表达在DBD内的位置175具有突变的Mut-p53的SKBR3细胞。图15A和15B中的柱状图显示各测试肽在595nm的光密度读数,其反映针对未处理(NT)样品均一化的处理之后的板中的细胞数。
图16是柱状图,其说明通过如通过qRT-PCR测定测量p53目标基因的反式活化的所示肽对Mut-p53的活化的影响。使用针对p53表达敲低的SKBR3 ShCon细胞和SKBR3 Shp53细胞。将细胞铺板于12孔皿中,且将所示肽以5ug/ml的浓度直接添加至培养基。18小时后收获细胞,随后进行qRT-PCR分析。评估p21、PUMA和Mdm2的表达水平。图16说明测试的基因在各种样品中的转录相对于它们在未处理细胞中的转录水平的相对倍数诱导。平行测量GAPDHmRNA作为对照。
图17A、17B、17C和17D说明在表达在DBD内的位置241突变的Mut-p53的ES2卵巢癌细胞上进行的代表性实验。本质上,将细胞铺板于6cm皿中,且在所示时间点将所示肽以12ug/ml的浓度直接添加至培养基。收获细胞,且使用膜联蛋白-V染色试剂盒(Roche, REF11 988 549 001)进行细胞凋亡测定(图17A和17B)。根据制造商的说明,用检测细胞凋亡细胞的抗膜联蛋白FITC缀合的抗体和染色死细胞的PI(碘化丙啶)两者染色未固定的细胞。然后通过流式细胞术分析染色的细胞。对各样品计数总共10,000个细胞且根据染色强度分为四个亚群;PI和膜联蛋白(-PI,-膜联蛋白)均阴性的细胞被称为活的;PI阴性且膜联蛋白阳性(-PI,+膜联蛋白)的细胞正在经过细胞凋亡的早期阶段;PI和膜联蛋白阳性的细胞(+PI,+膜联蛋白)是经历过细胞凋亡过程的死细胞;且PI阳性和膜联蛋白阴性(+PI,-膜联蛋白)的细胞被假定为通过非细胞凋亡过程诸如坏死而死亡的死细胞。
图18A、18B和18C说明所示肽在小鼠异种移植模型中的体内效果。将表达内源突变体p53且稳定表达荧光素酶的MDA-MB-231细胞注入CD1裸/裸小鼠的左髋部。当肿瘤达到可见尺寸时,用IVIS200系统测量生物发光(指示癌细胞的数目)。然后通过肿瘤内注射(每周三次)用在体外不显示表型的3种对照肽的混合物(pCAP 76、77和12; 2mg各肽)处理小鼠。开始处理之后35天,结束实验。图18A显示对数刻度图,其表明作为开始处理(肽注射)之后的时间的函数的各肿瘤中的荧光素酶读数。图18B显示在处理开始时小鼠(7-10)的实时成像图像。图18C显示当结束实验时在35天的处理小鼠(7-9)的实时成像图像。由于肿瘤尺寸大,小鼠10在28天之后必须处死。
图19A、19B和19C说明所示肽在小鼠异种移植模型中的体内效果。将表达内源突变体p53且稳定表达荧光素酶的MDA-MB-231细胞注入CD1裸/裸小鼠的左髋部。当肿瘤达到可见尺寸时,用IVIS200系统测量生物发光(指示癌细胞的数目)。然后通过肿瘤内注射(每周三次)用表现出突变体p53-再活化能力的3种测试肽的混合物(pCAP 159、155和174;2mg各肽)处理小鼠。开始处理之后35天,结束实验。图19A显示对数刻度图,其表明作为开始处理(肽注射)之后的时间的函数的各肿瘤中的荧光素酶读数。图19B显示在处理开始时小鼠1-6的实时成像图像。图19C显示当结束实验时在35天的处理小鼠1-6的实时成像图像。所述肿瘤中的两个(小鼠1和小鼠4)显示对处理的部分响应,如35天之后荧光素酶信号分别减少50%和65%所测量。小鼠2和5显示完全响应,甚至处理21天之后达到低至或接近于IVIS系统的背景阈值检测水平(5x106个光子)的生物发光读数。35天之后停止处理后,小鼠号2和5仍然活着,且再监测21天;视觉上或通过实时成像都没有检测到肿瘤的再现。
图20A、20B、20C和20D说明所示肽在小鼠异种移植模型中的体内效果。将表达内源突变体p53且稳定表达荧光素酶的MDA-MB-231细胞注入CD1裸/裸小鼠的左髋部。当肿瘤达到可见尺寸时,用IVIS200系统测量生物发光(指示癌细胞的数目)。然后通过肿瘤内注射(每周三次)用在体外不显示表型的3种对照肽的混合物(pCAP 76、77和12; 2ug各肽)或表现出突变体p53-再活化能力的3种测试肽的混合物(pCAP 159、155和174; 2ug各肽)处理小鼠。图20A和20B显示对数刻度图,其表明作为开始处理(肽注射)之前(直到第18天)和之后的时间的函数的各肿瘤中的平均荧光素酶读数。图20C和20D显示在治疗开始时(第18天,左)和进入处理12天(第30天,右)的小鼠的实时成像图像。40%的小鼠显示完全响应,达到低至或接近于IVIS系统的背景阈值检测水平(5x106个光子)的生物发光读数。
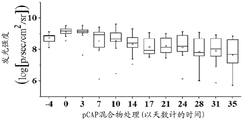
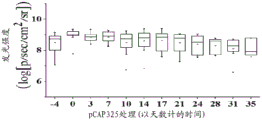
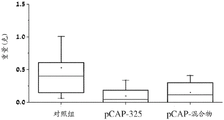
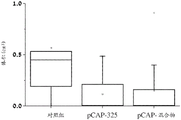
图21A、21B、21C、21D和21E说明所示肽在小鼠异种移植模型中的体内效果。将表达内源突变体p53且稳定表达荧光素酶的SW-480结肠癌细胞注入CD1裸/裸小鼠的左髋部。当肿瘤达到可见尺寸时,用IVIS200系统测量生物发光(指示癌细胞的数目)。然后通过肿瘤内注射(每周三次)用在体外不显示表型的3种对照肽的混合物(pCAP 76、77和12; 2ug各肽)或表现出突变体p53-再活化能力的3种测试肽的混合物(pCAP 250、308和325; 2ug各肽)处理小鼠。图21A、21B和21C显示对数刻度图,其表明作为开始处理(肽注射)之前(直到第0天)和之后的时间的函数的各肿瘤中的平均荧光素酶读数。图21D和21E分别显示肿瘤体积和肿瘤重量的盒形图。如21D和21E中所见,与从用对照肽处理的小鼠提取的肿瘤相比,从用肽混合物或PCAP-325单一肽处理的小鼠提取的肿瘤的尺寸和重量显著更小(p-值< 0.05)。
发明详述
本发明提供高度有效的肽和修饰的肽试剂,其可以理想地通过改变突变体p53蛋白构象和/或活性以类似于野生型、功能性p53蛋白的构象和/或活性而有效再活化p53构象突变体。因此,本发明提供肽和它们在治疗突变体p53相关病况(其中本仍构象缺陷的p53蛋白的活化可有益)的用途。
本发明基于高度有效的肽和基于肽的试剂的令人惊讶的鉴定,所述肽和基于肽的试剂可以有效地再活化p53构象突变体,比鉴定用于该用途的先前已知的肽更有效。
本发明提供能够至少部分提高突变体p53蛋白的抗癌和/或促细胞凋亡作用的试剂,及其在治疗由构象-异常的p53蛋白引起或与其相关的任何疾病或病况中的用途。不束缚于任何机制或理论,据推测,突变体p53蛋白在结合至本发明提供的试剂后的构象变化使它们更接近于野生型p53蛋白的三维构象,且因此为突变体p53蛋白恢复野生型p53蛋白的至少部分功能。
更具体地,在一个方面,本发明提供由SEQ ID NO:321-286中任一个记载的氨基酸序列组成的重组或合成肽。
在另一个方面,本发明进一步提供包含SEQ ID NO:321-286中任一个记载的氨基酸序列的重组或合成肽,其中所述肽至少部分再活化突变体p53蛋白。
在又另一个方面,本发明进一步提供包含SEQ ID NO:314、268、282、340、376、298、377、378、253、20、379、302、275、380、273、381、280或382中任一个记载的氨基酸序列的共有基序的重组或合成肽,其中所述肽至少部分再活化突变体p53蛋白。
在某些实施方案中,所述肽由SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQ ID NO:307中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽由SEQ ID NO:321-302中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽由SEQ ID NO:321-312中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽由SEQ ID NO:321-316中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述肽包含SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQ ID NO:307中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽包含SEQ ID NO:321-302中任一个记载的氨基酸序列。在某些实施方案中,上述肽包含SEQ ID NO:321-312中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,上述肽包含SEQ ID NO:321-316中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述肽缀合至至少一种脂肪酸部分。在某些实施方案中,所述脂肪酸选自肉豆蔻酸、月桂酸、棕榈酸和硬脂酸。各可能性代表本发明的单独实施方案。在某些实施方案中,所述脂肪酸是肉豆蔻酰基脂肪酸。
在某些实施方案中,所述肽至少部分将所述突变体p53蛋白的构象改变为野生型(WT) p53蛋白的构象。
本领域中已知仅特异性识别野生型p53蛋白的抗体。此类抗体在确定特定p53蛋白(野生型或突变体)是否保持野生型、功能性p53蛋白的构象中是高度有用的。因此,在某些实施方案中,所述肽至少部分改变所述突变体p53蛋白的构象,使得排他地针对野生型p53蛋白或针对保持野生型p53蛋白构象的p53蛋白的单克隆抗体识别所述突变体p53蛋白。在某些实施方案中,所述单克隆抗体是Ab1620。
应当理解,由于p53从两个等位基因表达,细胞内p53的总含量可以是野生型(wt/wt)、野生型和突变体p53的混合物(wt/mut)或仅突变体p53(当两个等位基因都突变(mut/mut),或一个等位基因缺失(mut/-)时)。在癌症中,情况经常是wt/mut、mut/mut或mut/-。由于p53充当四聚体,突变体p53蛋白可以废除癌症细胞中可存在的野生型p53蛋白的活性。因此,本发明提供的肽特别可用于治疗其中增加野生型p53蛋白的水平不卓有成效的癌症。
在某些实施方案中,所述肽至少部分将所述突变体p53蛋白的活性恢复至野生型p53蛋白的至少一种活性。
在某些实施方案中,所述活性是降低表达所述突变体p53蛋白的细胞的活力。在某些实施方案中,所述活性是促进表达所述突变体p53蛋白的细胞的细胞凋亡。在某些实施方案中,所述活性是活化表达所述突变体p53蛋白的细胞的促细胞凋亡基因。在某些实施方案中,所述促细胞凋亡基因选自CD95、Bax、DR4、DR5、PUMA、NOXA、Bid、53AIP1和PERP。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述活性是结合至表达所述突变体p53蛋白的细胞中的p53共有DNA结合元件。在某些实施方案中,所述共有DNA结合元件包含SEQ ID NO:339中记载的氨基酸序列或由其组成。
在某些实施方案中,所述结合导致内源p53目标基因的至少部分活化。在某些实施方案中,所述内源目标基因选自p21、MDM2和PUMA。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述突变体p53蛋白具有与野生型p53蛋白不同的构象。在某些实施方案中,所述突变体p53蛋白与野生型p53蛋白相比至少部分无活性。
在某些实施方案中,所述突变体p53蛋白不被针对野生型p53蛋白的单克隆抗体识别。在某些实施方案中,所述突变体p53蛋白,在与所述肽结合后,被针对野生型p53蛋白的单克隆抗体识别。在某些实施方案中,所述单克隆抗体是Ab1620。
在某些实施方案中,所述突变体p53蛋白包含选自以下的突变:R175H、V143A、R249S、R273H、R280K、P309S、P151S、P151H、C176S、C176F、H179L、Q192R、R213Q、Y220C、Y220D、R245S、R282W、D281G、S241F、C242R、R248Q、R248W、D281G、R273C和V274F。各可能性代表本发明的单独实施方案。
在某些实施方案中,所述肽包含SEQ ID NO:314中记载的共有基序。在某些实施方案中,所述肽包含SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQID NO:307中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽由SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQID NO:307中任一个记载的氨基酸序列组成。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽包含SEQ ID NO:268、282、340、376、298、377、378、253、20、379、302、275、380、273、381、280或382中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽包含SEQ ID NO:379、302、275、380、273、381、280或382中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。在某些实施方案中,所述肽包含SEQ ID NO:302、275、380、273、381、280或382中任一个记载的氨基酸序列。各可能性代表本发明的单独实施方案。
在另一个方面,本发明进一步提供能够表达上述肽的表达载体。
在另一个方面,本发明进一步提供包含上述肽的药物组合物。
在又另一个方面,本发明进一步提供包含上述表达载体的药物组合物。
在一个方面,上述药物组合物用于治疗与突变体p53蛋白相关的疾病、病症或病况。
在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述癌症选自乳腺癌、结肠癌和肺癌。各可能性代表本发明的单独实施方案。在一些实施方案中,所述癌症细胞表达突变体p53蛋白。
在另一个方面,本发明进一步提供治疗与突变体p53蛋白相关的疾病、病症或病况的方法,其包括将治疗有效量的上述药物组合物施用于有需要的主体,从而治疗所述疾病、病症或病况的步骤。
在又另一个方面,本发明进一步提供包含上述药物组合物的药剂盒。
在一个方面,上述药剂盒用于治疗与突变体p53蛋白相关的疾病、病症或病况。
定义
为了便于理解本发明,下面定义许多术语和短语。应当理解,这些术语和短语用于描述而非限制的目的,使得本说明书的术语或短语应当由技术人员鉴于本文呈现的教导和指导组合本领域普通技术人员的知识进行解释。
如本文所使用的术语“重组或合成肽”是指通过本领域已知的标准生物技术方法诸如在细菌中表达或固相肽合成(SPPS)产生的肽。
如本文可互换使用的术语“能够至少部分再活化突变体p53蛋白”或“至少部分再活化突变体p53蛋白”是指这样的肽,其中该肽与突变体p53蛋白结合后,该突变体p53蛋白获得或增加类似于野生型p53蛋白的相应活性的活性。
如本文所使用的术语“共有基序”是指在本发明提供的多于一种肽中发现的至少三个氨基酸的氨基酸序列。
如本文所使用的术语“脂肪酸部分”是指脂肪酸表现出类似于相应的完整脂肪酸来源分子的化学和药理学特征的特定集合的部分。该术语进一步是指包含脂肪酸(羧酸)的酰基组分的任何分子种类和/或分子片段。
根据本发明的渗透性增强部分优选经由直接键或经由接头共价连接至肽序列,以形成肽缀合物。渗透性增强部分可以直接或通过间隔基连接至所述肽部分的任何位置,优选连接至所述肽的氨基末端。根据某些实施方案,所述渗透性增强部分是脂肪酸。
本领域已知主动或被动促进或增强化合物进入细胞的渗透性的任何部分可以用于与根据本发明的肽核心结合。非限制性实例包括:疏水部分诸如脂肪酸、类固醇和大体积芳族或脂族化合物;可以具有细胞-膜受体或载体的部分,诸如类固醇,维生素和糖类,天然和非天然氨基酸和转运肽。根据一些实施方案,所述疏水部分是脂质部分或氨基酸部分。
如本文所使用的术语“渗透性”是指试剂或物质渗透、弥散或扩散通过屏障、膜或皮肤层的能力。“细胞渗透性”或“细胞渗透”部分是指本领域已知能够促进或增强分子渗透通过膜的任何分子。非限制性实例包括:疏水部分诸如脂质、脂肪酸、类固醇和大体积芳族或脂族化合物;可以具有细胞-膜受体或载体的部分,诸如类固醇,维生素和糖类,天然和非天然氨基酸,转运肽,纳米颗粒和脂质体。
根据本发明的疏水部分可以优选包含脂质部分或氨基酸部分。根据一个特定实施方案,所述疏水部分选自:磷脂类、类固醇类、鞘氨醇、神经酰胺类、辛基-甘氨酸、2-环己基丙氨酸、苯甲酰基苯丙氨酸(benzolylphenylalanine)、丙酰基(propionoyl)(C3);丁酰基(C4);戊酰基(C5);己酰基(C6);庚酰基(C7);辛酰基(C8);壬酰基(C9);癸酰基(C10);十一碳酰基(C11);月桂酰基(C12);十三碳酰基(C13);肉豆蔻酰基(C14);十五碳酰基(C15);棕榈酰基(C16);phtanoyl ((CH3)4);十七碳酰基(C17);硬脂酰基(C18);十九碳酰基(C19);花生酰基(arachidoyl)(C20);二十一碳酰基(heniecosanoyl)(C21);山萮酰基(C22);二十三碳酰基(trucisanoyl)(C23);和二十四碳酰基(lignoceroyl)(C24);其中所述疏水部分以酰胺键、巯基、胺、醇、酚基或碳-碳键连接至所述嵌合多肽。
可以根据本发明使用的脂质部分的其他实例:Lipofectamine、Transfectace、Transfectam、Cytofectin(细胞转染剂)、DMRIE、DLRIE、GAP-DLRIE、DOTAP、DOPE、DMEAP、DODMP、DOPC、DDAB、DOSPA、EDLPC、EDMPC、DPH、TMADPH、CTAB、赖氨酰-PE、DC-Cho、-丙氨酰胆固醇;DCGS、DPPES、DCPE、DMAP、DMPE、DOGS、DOHME、DPEPC、Pluronic、Tween、BRIJ、缩醛磷脂(plasmalogen)、磷脂酰乙醇胺,磷脂酰胆碱、甘油-3-乙基磷脂酰胆碱、二甲基铵丙烷、三甲基铵丙烷、二乙基铵丙烷、三乙基铵丙烷、二甲基双十八烷基溴化铵、鞘脂,鞘磷脂、溶血脂(lysolipid)、糖脂、硫苷脂(sulfatide)、鞘糖脂、胆固醇,胆固醇酯,胆固醇盐,油、N-琥珀酰基二油酰基磷脂酰乙醇胺、1,2-二油酰基-sn-甘油、1,3-二棕榈酰基-2-琥珀酰基甘油、1,2-二棕榈酰基-sn-3-琥珀酰基甘油、1-十六烷基-2-棕榈酰基甘油基磷脂酰乙醇胺、棕榈酰基高半胱氨酸、N,N'-双 (十二烷基(dodecy)氨基羰基亚甲基)-N,N'-双((-N,N,N-三甲基铵乙基-氨基羰基亚甲基)乙二胺四碘化物;N,N"-双(十六烷基氨基羰基亚甲基)-N,N',N"-三((-N,N,N-三甲基铵-乙基氨基羰基亚甲基二亚乙基三胺六碘化物;N,N'-双(十二烷基氨基羰基亚甲基)-N,N"-双((-N,N,N-三甲基铵乙基氨基羰基亚甲基)亚环己基-1,4-二胺四碘化物;1,7,7-四-((-N,N,N,N-四甲基铵乙基氨基-羰基亚甲基)-3- 十六烷基氨基羰基-亚甲基-1,3,7-三氮杂庚烷七碘化物;N,N,N',N'-四((-N,N,N-三甲基铵-乙基氨基羰基亚甲基)-N'- (1,2-二油酰基甘油基-3-磷酰乙醇氨基羰基亚甲基)二亚乙基三胺四碘化物;二油酰基磷脂酰乙醇胺、脂肪酸、溶血脂(lysolipid)、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、磷脂酰肌醇、鞘脂、糖脂(glycolipid)、糖脂(glucolipid)、硫苷脂、鞘糖脂、磷脂酸、棕榈酸,硬脂酸,花生四烯酸,油酸、携带聚合物的脂质、携带磺化糖的脂质、胆固醇,生育酚半琥珀酸酯、具有醚连接的脂肪酸的脂质、具有酯连接的脂肪酸的脂质、聚合脂质,磷酸二乙酰酯、硬脂胺,心磷脂、具有长6-8个碳的脂肪酸的磷脂、具有不对称酰基链的磷脂、6-(5-胆甾烯(cholesten)-3b-基氧基)-1-硫代-b-D-吡喃半乳糖苷、二半乳糖基二甘油酯、6-(5-胆甾烯-3b-基氧基)己基-6-氨基-6-脱氧基-1-硫代-b-D-吡喃半乳糖苷、6-(5-胆甾烯-3b-基氧基)己基-6-氨基-6-脱氧基l-1-硫代-a-D-吡喃甘露糖苷、12-(((7'-二乙基氨基-香豆素-3-基)羰基)甲基氨基)-十八烷酸;N-[12-(((7'-二乙基氨基香豆素-3-基)羰基)甲基-氨基) 十八碳酰基]-2-氨基棕榈酸;胆甾醇基)4'-三甲基-铵)丁酸盐;N-琥珀酰基二油酰基-磷脂酰乙醇胺;1,2-二油酰基-sn-甘油;1,2-二棕榈酰基-sn-3-琥珀酰基-甘油;1,3-二棕榈酰基-2-琥珀酰基甘油、1-十六烷基-2-棕榈酰基甘油基-磷酰乙醇胺和棕榈酰基高半胱氨酸。
如本文所使用的术语“表达突变体p53蛋白的细胞”是指从至少一种等位基因表达突变体p53蛋白的细胞。在某些实施方案中,术语“表达突变体p53蛋白的细胞”与“癌细胞”可互换。
术语“促细胞凋亡基因”是指直接(诸如某些胱天蛋白酶)或间接(例如,作为信号转导级联的部分)参与细胞凋亡的一种基因或多种基因。
如本文所使用的术语“药物组合物”是指包含至少一种药物活性成分的任何组合物。
如本文所使用的术语“与突变体p53蛋白相关的”是指由突变体p53蛋白引起或与细胞或器官中存在突变体p53蛋白相关的任何疾病、病症或病况。
应当理解,由于p53从两个等位基因表达,细胞内p53的总含量可以是野生型(wt/wt)、野生型和突变体p53的混合物(wt/mut)或仅突变体p53(当两个等位基因都突变(mut/mut),或一个等位基因缺失(mut/-)时)。在癌症中,情况经常是wt/mut、mut/mut或mut/-。由于p53充当四聚体,突变体p53蛋白可以废除癌症细胞中的确存在的野生型p53蛋白的活性。因此,本发明提供的肽特别可用于治疗其中增加野生型p53蛋白的水平不卓有成效的癌症。
如本文所使用的术语“治疗有效量”是指含有根据本发明的肽的组合物的量,其足以降低、减少和/或抑制个体中的疾病、病症或病况。
如本文所使用,术语p53涉及可以具有野生型p53的构象、突变体p53的构象或野生型和突变体p53之间的中间构象的p53蛋白。
如本文所使用,术语“野生型p53”、“wt p53”和“WT p53”可以互换使用,且涉及具有野生型p53蛋白的构象、因此具有野生型p53蛋白的活性的野生型p53蛋白。在一些实施方案中,野生型p53可以通过特异性单克隆抗体进行鉴定。
如本文所使用,术语“突变体p53”、“Mut-p53”、“突变的p53”和“p53突变体”可以互换使用,并且涉及不能在目标细胞中有效地发挥功能的突变的p53蛋白。在一些实施方案中,Mut-p53不能结合其目标位点。在一些实施方案中,Mut-p53在DNA结合结构域(DBD)区域突变。在一些实施方案中,Mut-p53以无活性构象错误折叠。在一些示例性实施方案中,Mut-p53是温度敏感(ts)突变体p53 R249S (R249S p53)、热点全长突变体p53 Mut-p53 R175H(R175H p53)或任何其他Mut-p53蛋白。在一些实施方案中,Mut-p53通过能够识别p53的错误折叠构象(由p53的突变引起)的特异性单克隆抗体进行鉴定。在一些实施方案中,Mut-p53通过特异性单克隆抗体进行鉴定。
如本文所使用的短语“肽再活化突变体p53蛋白”是指这样的肽,在其与突变体p53蛋白相互作用后,所述突变体p53蛋白增加其活性中的至少一种,其中所述活性是野生型p53蛋白的活性。例如,在其与本发明提供的肽相互作用后,突变体p53蛋白可以与野生型p53蛋白在类似情况下进行的方式类似的方式直接或间接增加癌细胞中的促细胞凋亡蛋白(诸如胱天蛋白酶)的表达。
如本文所提及,术语“再活化肽”、“Mut-p53再活化肽”可以互换使用,并且涉及能够为Mut-p53至少部分恢复活性的肽试剂。在一些实施方案中,再活化剂可以通过影响Mut-p53的构象再活化Mut-p53,以假定更加类似于或等同于天然野生型p53的构象。在一些实施方案中,所述再活化剂可以再活化Mut-p53以恢复Mut-p53与目标DNA中的WT p53结合位点的结合。在一些实施方案中,所述再活化剂可以恢复Mut-p53的生物化学特性。在一些实施方案中,所述再活化剂可以诱导Mut-p53蛋白以表现出癌细胞的p53-选择性抑制。在一些实施方案中,所述再活化剂可以再活化Mut-p53以具有类似于或等同于WT p53蛋白的结构特性、生物化学特性、生理特性和/或功能特性。在一些实施方案中,所述再活化剂是肽。在一些实施方案中,所述再活化剂是具有长3-25个氨基酸的肽。在一些实施方案中,所述再活化剂是具有长5-20个氨基酸的肽。在一些实施方案中,所述再活化剂是具有长6-15个氨基酸的肽。在一些实施方案中,所述再活化剂是具有长7或12个氨基酸的肽。
关于蛋白的术语“构象”涉及空间中蛋白的结构排列(折叠)。
术语“深度测序”和“下一代测序”可以互换使用,并且涉及能够快速平行测序多个核酸序列的增强测序方法。
“噬菌体展示”方法包括筛选各自表达和呈递特定外源分子诸如肽的噬菌体的文库。通过对固定化目标的噬菌体文库的亲和力选择来实现表达和呈递特定肽的噬菌体的富集。在该“淘选”过程中,捕获结合的噬菌体(即,表达和呈递可以结合固定化目标的肽的噬菌体),而洗掉未结合噬菌体(即,不表达和呈递可以结合固定化目标的肽的噬菌体)。该方法中的下一步骤可以包括洗脱结合的噬菌体和通过用鉴定的噬菌体再感染大肠杆菌细胞而扩增所述噬菌体。在一些实施方案中,噬菌体文库可以是原始文库,或可商购噬菌体展示文库。
术语“多肽”和“肽”在本文中可互换使用来指氨基酸残基的聚合物。该术语适用于其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物。
术语“核酸”、“多核苷酸”、“寡核苷酸”或“寡核苷酸(oligo)”涉及由DNA(脱氧核糖核酸)核苷酸、RNA(核糖核酸)核苷酸或两种类型的组合构成的单链或双链聚合物,并且可以包括天然核苷酸、化学修饰的核苷酸和合成的核苷酸。
“氨基酸”涉及20种天然存在的氨基酸中的任一种、已被化学修饰的氨基酸(参见下文)或合成的氨基酸。
“保守取代”是指一类中的氨基酸被同类中的氨基酸取代,其中类型通过共同的物理-化学氨基酸侧链特性和自然界中发现的同源蛋白中的高取代频率(如例如通过标准Dayhoff频率交换矩阵或BLOSUM矩阵来确定)来定义。氨基酸侧链的六个一般类型已经进行分类,且包括:I类(Cys);II类(Ser、Thr、Pro、Ala、Gly);III类(Asn、Asp、Gin、Glu);IV类(His、Arg、Lys);V类(He、Leu、Val、Met);和VI类(Phe、Tyr、Trp)。例如,Asp取代另一III类残基诸如Asn、Gin或Glu是保守取代。
“非保守取代”是指一类中的氨基酸被来自另一类的氨基酸取代;例如,Ala(II类残基)被III类残基(诸如Asp、Asn、Glu或Gin)取代。
“化学修饰的”是指通过天然过程或通过本领域众所周知的化学修饰技术修饰的氨基酸。在许多已知的修饰中,典型、但不唯一的实例包括:乙酰化、酰化、酰胺化、ADP-核糖基化、糖基化、葡糖氨基葡聚糖化(glycosaminoglycanation)、GPI锚形成、脂质或脂质衍生物的共价附接、甲基化、肉豆蔻酰化(myristlyation)、聚乙二醇化、异戊二烯化、磷酸化、泛素化或任何类似过程。
如本文所提及,术语“治疗疾病”或“治疗病况”涉及施用包括至少一种药剂的组合物,其在主体中有效改善与疾病相关的症状、减轻严重性或治愈疾病、或防止疾病发生。施用可以包括任何施用途径。在一些实施方案中,所述疾病是由细胞、组织、器官、身体等中存在突变的p53引起或与之相关的疾病。在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述癌症选自乳腺癌、结肠癌和肺癌。各可能性代表本发明的单独实施方案。在一些实施方案中,主体是哺乳动物,诸如人。在一些实施方案中,主体是哺乳动物。在一些实施方案中,主体是非哺乳动物。
如本文所使用,术语“表达”,是指在目标细胞中产生期望的最终产物分子。最终产物分子可以包括例如RNA分子;肽或蛋白;等;或其组合。
如本文所使用的术语“构建体”是指可以是一种或多种核酸序列的人工组装或分离的核酸分子,其中所述核酸序列可以包含编码序列(即,编码最终产物的序列)、调控序列、非编码序列或其任何组合。术语构建体涵盖,例如,载体,但不应该被看作是限于此。
“表达载体”是指具有在外来细胞中并入和表达异源核酸片段(诸如,例如,DNA)的能力的载体。换言之,表达载体包含能够被转录的核酸序列/片段(诸如DNA、mRNA、tRNA、rRNA)。许多原核和真核表达载体是已知和/或商业可得的。合适的表达载体的选择在本领域技术人员的知识之内。
如本文所使用的术语“上游”和“下游”是指核苷酸序列(诸如,例如,DNA序列或RNA序列)中的相对位置。如众所周知,核苷酸序列具有对于核苷酸骨架的糖(脱氧核糖或核糖)环上的碳所谓的5'末端和3'末端。因此,相对于核苷酸序列上的位置,术语下游涉及朝向序列的3'末端的区域。术语上游涉及朝向链的5'末端的区域。
如本文所使用,术语“引入”、“转染(transfection)”或“转染(transfecting)”和“感染(infection)”或“感染(infecting)”可以互换使用,并且是指将分子,诸如,例如,核酸、多核苷酸分子、载体等转移至目标细胞中,并且更具体地转移至目标细胞的膜-封闭空间的内部。分子可以通过本领域技术人员已知的任何方式“引入”目标细胞,所述方式例如如教导于Sambrook等人. Molecular Cloning: A Laboratory Manual, Cold SpringHarbor Laboratory Press, New York (2001),其内容通过引用并入本文。将分子“引入”细胞的方式包括,例如,但不限于:热休克、磷酸钙转染、PEI转染、电穿孔、脂转染、转染剂、病毒介导的转移等或其组合。可以在任何来源的任何类型的细胞上进行细胞的转染。
如本文所提及,术语“外源基因”涉及从外部引入细胞的基因(或其任何部分)。在一些实施方案中,以多核苷酸的形式(例如,DNA、RNA等)插入外源基因。在一些实施方案中,外源基因能够在细胞中表达。在一些实施方案中,外源基因在细胞内过表达。
如本文所使用,涉及本文记载的数值的术语“约”应理解为规定值+/- 10%。
在一些实施方案中,所述再活化肽可以再活化Mut-p53以具有类似于或等同于WTp53蛋白的结构特性、生物化学特性、生理特性和/或功能特性。
根据一些实施方案,提供Mut-p53再活化肽,其中所述肽为约3-25个氨基酸的长度。在一些实施方案中,所述Mut-p53再活化肽为约4-15个氨基酸的长度。在一些实施方案中,所述Mut-p53再活化肽为约7-12个氨基酸的长度。在一些实施方案中,所述Mut-p53再活化肽为7个氨基酸的长度。在一些实施方案中,所述Mut-p53再活化肽为12个氨基酸的长度。各可能性代表本发明的单独实施方案。
在一些实施方案中,提供具有如本文下面表6、7或8中的肽序列中任一个表示的氨基酸序列的Mut-p53再活化肽。
根据一些实施方案,Mut-p53再活化肽可以影响Mut-p53,使得其可以反式活化在其启动子中具有WT p53结合元件的报告基因(诸如荧光素酶)。在一些实施方案中,所述报告基因的反式活化可以在体外(例如,在试管或孔中)或在具有报告基因构建体的细胞中在体内进行。
根据一些实施方案,Mut-p53再活化肽可以结合至突变的p53的DNA结合结构域(DBD)。在一些实施方案中,所述突变的p53在其DNA结合结构域(DBD)中具有突变。
在一些实施方案中,癌症是肾上腺皮质癌、肛门癌、膀胱癌、脑肿瘤、脑干神经胶质瘤、脑肿瘤、小脑星形细胞瘤、脑星形细胞瘤、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层、松果体瘤、下丘脑神经胶质瘤、乳腺癌、类癌瘤、癌、子宫颈癌、结肠癌、子宫内膜癌、食道癌、肝外胆管癌、肿瘤的尤因家族(ewings family)(pnet)、颅外生殖细胞肿瘤、眼癌、眼内黑色素瘤、胆囊癌、胃癌、生殖细胞瘤、性腺外癌、妊娠滋养细胞肿瘤、头颈部癌、下咽癌、胰岛细胞癌、喉癌、白血病、急性淋巴细胞白血病、口腔癌、肝癌、肺癌、小细胞淋巴瘤、AIDS相关淋巴瘤、中枢神经系统(主要)、淋巴瘤、皮肤T细胞淋巴瘤、霍奇金氏病、非霍奇金氏病、恶性间皮瘤、黑色素瘤、梅克尔细胞癌、转移性鳞状细胞癌、多发性骨髓瘤、浆细胞瘤、蕈样肉芽肿、骨髓增生异常综合征、骨髓增生性病症、鼻咽癌、神经母细胞瘤、口咽癌、骨肉瘤、卵巢上皮癌、卵巢生殖细胞肿瘤、卵巢低恶性潜能肿瘤、胰腺癌、外分泌、胰腺癌、胰岛细胞癌、副鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、嗜铬细胞瘤癌、垂体癌、浆细胞肿瘤、前列腺癌、横纹肌肉瘤、直肠癌、肾细胞癌、唾液腺癌、塞扎里综合征、皮肤癌、皮肤T细胞淋巴瘤、皮肤癌、卡波济氏肉瘤、皮肤癌、黑色素瘤、小肠癌、软组织肉瘤、软组织肉瘤、睾丸癌、胸腺瘤、恶性甲状腺癌、尿道癌、子宫癌、肉瘤、儿童期的不寻常癌、阴道癌、外阴癌或维尔姆斯氏瘤。
在一些实施方案中,癌症是非实体瘤诸如血液癌症。在另一个实施方案中,非实体瘤或血液癌症是白血病或淋巴瘤。在另一个实施方案中,非实体瘤或血液癌症是急性淋巴细胞白血病(ALL)。在另一个实施方案中,非实体瘤或血液癌症是急性骨髓性白血病(AML)。在另一个实施方案中,非实体瘤或血液癌症是慢性淋巴细胞白血病(CLL)。在另一个实施方案中,非实体瘤或血液癌症是小淋巴细胞淋巴瘤(SLL)。在另一个实施方案中,非实体瘤或血液癌症是慢性骨髓性白血病(CML)。在另一个实施方案中,非实体瘤或血液癌症是急性单核细胞白血病(AMOL)。在另一个实施方案中,非实体瘤或血液癌症是霍奇金氏淋巴瘤(四种亚型中任一种)。在另一个实施方案中,非实体瘤或血液癌症是非霍奇金氏淋巴瘤(亚型中任一种)。在另一个实施方案中,非实体瘤或血液癌症是骨髓性白血病。
对于本发明的方法中的使用,可以常规方式使用一种或多种药学上可接受的载体、稳定剂或赋形剂(媒介物)配制所述再活化肽以形成药物组合物,如本领域中已知,特别是关于蛋白活性剂。载体在与组合物的其他成分相容且对其受体无害的意义上是“可接受的”。合适的载体通常包括生理盐水或乙醇多元醇诸如甘油或丙二醇。
所述再活化肽可以配制为中性或盐形式。药学上可接受的盐包括酸加成盐(与游离氨基形成),其是与无机酸诸如盐酸或磷酸或有机酸诸如乙酸、草酸、酒石酸和马来酸形成的。与游离羧基形成的盐也可以衍生自无机碱诸如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁和有机碱诸如异丙胺、三甲胺、2-乙基氨基乙醇、组氨酸和普鲁卡因。
该组合物可以合适地配制用于静脉内、肌内、皮下或腹膜内施用,且方便地包含所述再活化肽的无菌水溶液,其优选与受体的血液等渗。此类制剂通常通过以下制备:将固体活性成分溶解于含有生理上相容的物质诸如氯化钠、甘氨酸等且具有与生理条件相容的缓冲pH的水中以产生水溶液,且使得所述溶液无菌。这些可以制备于单位剂量或多剂量容器(例如,密封的安瓿或小瓶)中。
该组合物可以并入稳定剂,诸如例如聚乙二醇、蛋白、糖类(例如海藻糖)、氨基酸、无机酸及其混合物。稳定剂在水溶液中以适当的浓度和pH使用。将该水溶液的pH调整为5.0-9.0的范围内,优选6-8的范围内。在配制再活化肽中,可以使用抗吸附剂。其他合适的赋形剂可以通常包括抗氧化剂诸如抗坏血酸。
该组合物可以配制为控释制剂,其可以通过使用聚合物来复合或吸附蛋白来实现。用于控释制剂的适当聚合物包括例如聚酯、聚氨基酸、聚乙烯、吡咯烷酮、乙烯醋酸乙烯酯和甲基纤维素。用于控释的另一种可能方法是将再活化肽并入聚合物材料诸如聚酯、聚氨基酸、水凝胶、聚(乳酸)或乙烯醋酸乙烯酯共聚物的颗粒。或者,代替将这些试剂并入聚合颗粒,可能将这些材料分别陷入例如通过凝聚技术或通过界面聚合制备的微胶囊、例如羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊中,或胶体药物递送系统、例如脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊中或大乳剂(macroemulsions)中。
在一些实施方案中,本发明的再活化肽可以配制于经口或口腔组合物中,并且在一些实施方案中,包含液体溶液、乳液、悬浮液等。在一些实施方案中,适合用于制备此类组合物的药学上可接受的载体是本领域中众所周知的。在一些实施方案中,液体口服组合物包含约0.001%至约0.9%的再活化肽,或在另一个实施方案中,约0.01%至约10%的再活化肽。
在一些实施方案中,用于本发明的方法中使用的组合物包含溶液或乳液,其在一些实施方案中是包含安全和有效量的再活化肽和任选其他化合物的水溶液或乳液,其意欲用于局部鼻内施用。
在一些实施方案中,本发明的可注射溶液配制于水溶液中。在一个实施方案中,本发明的可注射溶液配制于生理上相容的缓冲液诸如Hank氏溶液、林格氏溶液或生理盐缓冲液中。在一些实施方案中,对于经粘膜施用,制剂中使用适于待渗透的屏障的渗透剂。此类渗透剂是本领域中通常已知的。
在一个实施方案中,本文所述的制备物配制用于肠胃外施用,例如通过快速浓注或连续输注。在一些实施方案中,用于注射的制剂与任选添加的防腐剂以单位剂量形式呈现,例如于安瓿中或多剂量容器中。在一些实施方案中,组合物是油性或水性媒介物中的悬浮液、溶液或乳液,且含有配制剂诸如悬浮剂、稳定剂和/或分散剂。
本发明的再活化肽可以通过任何合适的施用途径进行施用,所述施用途径选自口腔、局部、经皮或肠胃外施用。根据一些实施方案,所述施用途径是经由选自真皮、阴道、直肠、吸入、鼻内、经眼、经耳和经颊的局部应用。根据一些实施方案,所述施用途径是经由肠胃外注射。在各个实施方案中,施用步骤通过选自以下的肠胃外途径实施:静脉内、肌内、皮下、皮内、腹膜内、动脉内、脑内、脑室内、骨内和鞘内。例如,所述再活化肽可以全身施用,例如,通过肠胃外途径,诸如,腹膜内(i.p.)、静脉内(i.v.)、皮下或肌内途径。本发明的再活化肽和/或任何任选的额外药剂可以全身施用,例如,通过鼻内施用。本发明的再活化肽和/或任何任选的额外药剂可以全身施用,例如,通过口服施用,通过使用能够为蛋白提供口服生物利用度的特定组合物或制剂。本发明的再活化肽和/或任何任选的额外药剂可以局部施用。
所述再活化肽可以在约0.1至约20 mg/kg主体体重、通常约0.5至约10 mg/kg且经常约1至约5 mg/kg的范围内施用。在一些情况下,经治疗期间施用大负荷剂量、随后定期(例如,每周)维持剂量可以是有利的。所述再活化肽还可以通过缓释递送系统、泵和用于连续输注的其他已知递送系统进行递送。可以基于其药代动力学改变给药方案以提供特定再活化肽的期望循环水平。因此,计算剂量,使得维持治疗剂的期望循环水平。
通常,通过再活化肽的活性和主体的状况以及待治疗的主体的体重或表面积确定有效剂量。还通过伴随在具体主体中施用再活化肽的任何不良副作用的存在、性质和程度来确定剂量大小和施用方案。
在一些实施方案中,提供用于治疗或预防p53相关病况的药剂盒。在一些实施方案中,所述药剂盒包含在合适的缓冲液中包含Mut-p53再活化肽的容器(例如小瓶)和用于施用所述再活化肽的使用说明。
呈现以下实施方案以更完全地说明本发明的某些实施方案。然而,它们绝不应解释为限制本发明的宽范围。本领域技术人员可以容易地设计本文公开的原理的许多变化和修改,而不脱离本发明的范围。
实施例
材料和方法
从sf9细胞纯化重组全长(FL)蛋白:突变体p53 R249S、突变体p53 R175H和野生型p53:
使对数相的2x107个sf9细胞在九个含有25 ml的培养基的175 cm2烧瓶中生长,且在27℃孵育过夜。将含有重组p53的杆状病毒添加至各烧瓶中,且孵育72小时。将细胞从烧瓶刮下,且在4℃(3200g持续5分钟)离心,除去培养基且将细胞沉淀物用冰冷的等渗缓冲液(10mM Na2HPO4,pH 7.2,130 mM NaCl,1 mM DTPA-二亚乙基三氨五乙酸)洗涤两次。为了裂解细胞,将细胞通过轻轻倒转再悬浮于50ml含有0.2% Triton X-100的缓冲液A (20 mMTris-HCl, pH 8.0, 12%蔗糖, 2 mM EGTA, 2 mM PMSF, 5 mM DTT)。将核以5600G离心8分钟,且除去上清液。通过添加20 ml含有0.5M NaCl的缓冲液B (20 mM Tris-HCl, pH 8.0,12%蔗糖, 2 mM EGTA, 2 mM PMSF, 10 mM DTT + 蛋白酶抑制剂)裂解核,剧烈涡旋且在冰上孵育20分钟。将核裂解物转移至超速离心管,且在4℃以100,000g离心60分钟。除去上清液且用缓冲液B稀释至最终浓度0.04 M的NaCl,然后在4℃以20,000g离心5分钟。将核裂解物上样至5ml Hitrap Q FF (快速流) (Amersham Pharmacia)离子交换柱上,用50 ml缓冲液A预洗涤。然后,用含有较高盐浓度的缓冲液洗涤柱以洗脱蛋白。例如,在突变体p53R249S的情况下,以~150 mM NaCl从离子交换柱洗脱蛋白。通过凝胶过滤层析法使用制备型Superdex 75柱(Amersham Pharmacia Biotech)进一步纯化蛋白,用20 mM柠檬酸钠pH6.1, 150 mM NaCl, 10 μM ZnCl2和10 mM DTT预平衡。将含有纯化蛋白的级分合并在一起,且浓缩至6–7 mg/ml,等分且储存在-80℃。关于突变体p53的存在在点印迹上分析各纯化步骤之后获得的级分,且随后在SDS-PAGE上用考马斯蓝染色来检查级分的纯度。
夹心ELISA
使用3种不同的抗体(每孔中1种类型的抗体(Ab))包被96孔板:PAb421识别p53的构象且结合至C末端表位;PAb240识别p53的突变体构象,结合至核心结构域内的表位(氨基酸212-217)(Stephen, C.W.和D.P. Lane, Mutant conformation of p53. Precise epitope mapping using a filamentous phage epitope library. J. Mol. Biol.,1992. 225(3): p. 577-83),当部分变性蛋白时(例如,当DBD被突变时),所述表位可接近于Ab;和PAb1620,其识别p53的野生型构象,结合至当折叠呈野生型构象时形成的核心结构域内的表位(aa 156,206-210)(Wang, P.L., F. Sait,和G. Winter, The 'wild type' conformation of p53: epitope mapping using hybrid proteins. Oncogene, 2001.20(18): p. 2318-24)。
各孔在室温(RT)与100µl Ab (5µg/ml)孵育过夜(ON)。弃去液体,且各孔用磷酸盐缓冲盐水(PBS)洗涤3次,每次洗涤200µl。接下来,在各孔中以200µl稀释于PBS中的5%牛血清白蛋白(BSA)的封闭在室温(RT)进行1.5小时。弃去封闭缓冲液,随后如上所述在PBS中洗涤3次。将突变体和野生型p53蛋白的样品(100µl, 10µg/ml)连同对照肽pCAP-710(LPNPPER, SEQ ID NO:340)和pCAP-1220 (FRSFAIPLVVPF, SEQ ID NO:368) (5µg/ml,Sigma Aldrich)或连同测试肽1-153 (5µg/ml)一起孵育1.5小时,然后添加至各孔。将样品转动,并且在室温孵育1小时。如上所述使用三磷酸缓冲盐水(TPBS)洗涤4次之后,弃去样品。接下来,将辣根过氧化物酶(HRP)缀合的链霉亲和素p53抗体(10μg/ml HAF1355 (R&D))添加至各孔,且在室温孵育1小时。将板在TPBS中洗涤3次之后,添加TMB底物溶液(每孔50µl, Thermo, (目录号ES001-1L-K))且在37℃孵育20分钟。用2M硫酸(50μl)终止反应。用分光光度计测量450 nm的吸光度。通过将各样品的吸光度除以Ab 421样品的吸光度来测定蛋白浓度。
DNA结合测定
对于这些实验,根据制造商指南使用市售的"R&D"的p53/DNA结合试剂盒(Cat-DYC1355-5 Lot-1273366FA)。简言之,96孔板用抗p53抗体包被过夜。在测试肽的存在或不存在(NT)的情况下,含有p53的细胞提取物与用生物素标记的含有p53共有结合位点的寡核苷酸(在试剂盒中提供)反应。预期野生型p53结合该DNA结合位点以及包被板的测试孔的抗体。洗掉过量p53和寡核苷酸,且链霉亲和素-HRP用于定量孔中的寡核苷酸的量,其与p53结合的DNA成正比。进行TMB测定以测定HRP (ES001-1L-K)水平(450nm)。
结晶紫测定
将细胞以2500-4000个细胞/孔在96孔板中在0.1 ml中培养,且在37℃孵育过夜以粘附至板。将不同肽的系列稀释液(0.5 µg/ml)加入0.1ml等分试样,且将板在37℃孵育额外48小时。
然后移除培养基,且通过用结晶紫(0.5%)/甲醇/水(1:4, v/v)(各孔50µl)染色细胞10分钟、然后用PBS洗涤3次而测定细胞裂解。其后,将10%乙酸(50µl)添加至各孔且摇动10分钟。然后,在595 nm进行自动板阅读。
免疫荧光
将细胞在盖玻片上孵育过夜,然后用肽使用X-fect转染处理。恢复2小时之后,将细胞在室温用4%多聚甲醛固定30分钟,随后洗涤3次(PBS)。将样品在室温用0.1% Triton(1%BSA/PBS)透化10分钟,随后封闭(用0.5%BSA/PBS洗涤3次),每次洗涤5分钟。然后细胞用1:500稀释的小鼠抗p53 (DO-1)抗体探测1.5小时,随后封闭(用0.5%BSA/PBS洗涤3次),每次洗涤5分钟。然后细胞用1:600稀释的山羊抗小鼠Cy3和1:1000稀释的DAPI探测45分钟。样品用Elvanol封固。
荧光素酶测定
荧光素酶构建体的构建
具有序列的寡核苷酸(RGC-W)和具有序列的寡核苷酸突变体RGC寡核苷酸(RGC-M)两者都衍生自Kern等人(Kern, S.E., 等人,Identification of p53 as a sequence-specific DNA-binding protein. Science,1991. 252(5013): p. 1708-11),且充当用于野生型p53的共有结合位点。
将这些基序克隆至pCLuc Mini-TK 2载体(NEB, 目录号N0324S)中的KPN和Eco53IK位点中。荧光素酶构建体用于评价测试细胞中的p53的转录活化。
ChIP分析
简言之,克隆在室温用甲醛(1%最终浓度)交联10分钟。甲醛用2.5M甘氨酸(最终浓度0.25M)中和5分钟。细胞相继用1ml冰冷的PBS、缓冲液I (0.25% Triton X-100, 10mMEDTA, 0.5mM EGTA, 10mM HEPES, pH 6.5)和缓冲液II (200 mM NaCl, 1 mM EDTA, 0.5mM EGTA, 10 mM HEPES, pH 6.5)洗涤,且通过刮擦收获。然后将细胞重悬浮于0.3ml裂解缓冲液(1% SDS, 10mM EDTA, 50mM Tris-HCl, pH 8.1, 1X蛋白酶抑制剂混合物(RocheMolecular Biochemicals, Indianapolis, IN),且以最大设置(Biorupter, Diagenode,NY)超声处理10次(20秒“开”,随后40秒“关”) 随后在冰上离心10分钟以产生200-500bp片段。收集上清液且在ChIP稀释缓冲液(1% Triton X-100, 2 mM EDTA, 150 mM NaCl, 20mM Tris-HCl, pH 8.1)中稀释10次,随后用40 μl预封闭的蛋白A-琼脂糖(Santa CruzBiotech)与2μg剪切的鲑鱼精DNA和免疫前血清进行免疫清除(1μg兔血清与10μl 100mg/mLBSA在4℃持续2小时。保留样品用于制备输入样品。
在4℃用获得的特异性抗体进行免疫沉淀过夜。免疫沉淀之后,添加40 μl蛋白A-琼脂糖(用鲑鱼精DNA预封闭),且进一步再孵育1小时。将沉淀物在TSE I (0.1% SDS, 1%Triton X-100, 2 mM EDTA, 20 mM Tris-HCl, pH 8.1, 150 mM NaCl)、TSE II (0.1%SDS, 1% Triton X-100, 2 mM EDTA, 20 mM Tris-HCl, pH 8.1, 500 mM NaCl)和缓冲液III (0.25 M LiCl, 1% NP-40, 1%脱氧胆酸盐, 1 mM EDTA, 10 mM Tris-HCl, pH 8.1)中相继洗涤10分钟。沉淀物然后用TE缓冲液洗涤三次,且用1% SDS, 0.1 M NaHCO3提取两次。合并洗脱物,且在65℃加热最少6小时至过夜以反转甲醛交联。DNA片段用QIAquick离心试剂盒(Qiagen, CA)纯化。使用仅作为非特异性对照的珠粒一式三份进行免疫沉淀反应。通过定量实时PCR评价来自克隆的ChIP产物中的活跃和抑制的组蛋白标记的定量分析。为了均一化免疫沉淀(IP)的效率,使用针对抑蛋白启动子区域和5’区域(其对应于抑制的染色质区域)的特异性引物进行染色质IP的均一化。
细胞培养和荧光素酶报告测定
将H1299 p53-无效细胞培养过夜,然后根据制造商的方案使用MaxFect转染剂(Mediatech)用荧光素酶构建体转染。转染前,将细胞培养基交换为OPTI-MEM。
转染之后24小时,细胞用不同的肽处理。再24小时之后,将生长培养基收集至96黑色板:40µl用于Cluc测定,且20µl用于Gluc测定。使用Turner BioSystems Modulus微孔板进行测定。通过Cluc/gluc/NT(未处理的细胞)计算值。
RT-PCR
根据制造商的方案在细胞沉淀上使用Macherey-Nagel NucleoSpin RNA II试剂盒获得RNA。使用Bio-RT 2000 (Bio-Lab)和随机六聚体引物反转录0.4-1 µg的等分试样。使用PerfeCTa SYBR Green FastMix ROX (Quanta)在ABI 7300仪器(AppliedBiosystems)上进行定量实时聚合酶链式反应(QRT-PCR)。所用RT-PCR引物呈现于表1中(引物序列以5’至3’呈现)。
噬菌体展示文库
所用噬菌体展示文库是由New England Biolabs (NEB)生成的商售的噬菌体文库。一个文库是线性七肽(PhD-7)的,另一个文库是线性十二肽(PhD-12)的(目录号:PhD-7,E8100S; PhD-12, E8110S)。两个文库中的随机肽序列都表达在较小外壳蛋白pIII的N末端处,导致5个拷贝的展示肽/每病毒粒子的价(valency)。所有文库在展示肽和PIII之间具有短接头序列。
深度测序
测序前,用侧接插入文库的引物正向-和反向-进行PCR反应,将各引物的前8个碱基随机化且作为所有四种碱基的混合物引入。引入前面碱基的随机化,因为Solexa测序设备持续前几个循环不能测序重复序列。PCR反应产生所需量5μg和包括侧接引物的长度(约120 bp)的DNA和克隆的肽文库用于Solexa深度测序。
实施例1:实验条件的校准
选择p53蛋白源
当选择蛋白源用于噬菌体展示选择,考虑几个因素;推荐使用纯化的蛋白,因为噬菌体克隆与不同的蛋白在溶液中的相互作用可以引起非特异性的假阳性肽。从SF9细胞纯化的人全长p53蛋白(参见上文)用于以下实验中(登记号CG3336)。因此,使用由杆状病毒(如上详述)感染的SF9昆虫细胞系中的p53的表达系统。在该系统中表达的p53的一个主要优点是,它已经含有翻译后修饰。
杆状病毒表达的野生型p53和Mut-p53蛋白的构象
通过使用表达野生型p53、热点全长突变体p53(R175H)或温度敏感(ts)的突变体p53(V143A)的Sf9细胞的核提取物裂解物进行用杆状病毒(Baculo)-p53的初始实验。用携带三种表达载体中的任一种的病毒感染SF9细胞。感染之后48小时,收获细胞,提取核,且使提取物在4℃进行使用以下的免疫沉淀3小时:PAb1620、PAb240、ASPP2 (也称为(P53-BP2))和/或Bcl2。通过使用αp53-HRP Ab (目录号HAF1355 (R&D))的western印迹检测免疫沉淀的p53。该IP-Western实验的结果显示于图2。如可见,温度敏感(ts)-突变体p53 V143A (4℃)和野生型p53两者都很好结合至PAb1620抗体,但不结合至PAb240。另一方面,突变体p53R175H表现出对PAb240比对PAb1620更强的结合。这表明杆状病毒表达的突变体p53 R175H假定具有在突变体和野生型p53之间的中间的构象。Bcl2不表现出与p53形式中的任一种的结合,而ASPP2 (P53-BP2)以近似相同的亲和力结合至p53的所有形式。因此,得出结论,ASPP2和Bcl2不能被用作这些实验条件下的p53构象的标记。
溶液条件的校准
为了降低突变体p53 R175H与PAb1620的相对高的残余结合且增强野生型p53与该抗体的结合,进行测定条件的微调。结果显示于图3,其显示从用相应的杆状病毒(如上所述)感染的Sf9细胞的核提取的纯化的突变体p53(R175H)和野生型p53的印迹。将纯化的p53溶解于指定的缓冲液(A-Tris-50 mM; B-Tris , NaCl 150 mM; C-Tris , NaCl ,Triton0.5%; D-Tris, Glicyn 0.5 %; E-Na4O7P2 40-mM; F-GndCl 400mM; G-GndCl 800mM; H-尿素1M; I-尿素3M; IP-IP缓冲液)中,然后在4℃用PAb1620和PAb240免疫沉淀3小时,且进行使用αp53-HRP-Ab的western印迹。如可见,溶液(A)只含有50 mM Tris。在该溶液中,突变体p53 R175H与PAb1620的结合与结合至PAb240的该结合相比仅为约5%。150 mM NaCl(B)、150 mM NaCl + 0.5% Triton (C)或0.5 %甘氨酸(D)的添加增强了突变体R175H与PAb1620的结合。3M尿素(I)降低了p53突变体R175H与PAb1620的结合,可能是通过引起蛋白的变性。较低浓度的尿素1M (H)增加突变体p53 R175H (R175H p53)与PAb1620的结合。40mM Na4O7P2 (E)使R175H p53与PAb1620的结合降低至最低水平。最后,在IP缓冲液中,R175H p53维持PAb1620阴性;然而,在该缓冲液中,野生型p53显示强PAb 240结合和与PAb1620的降低结合,表明IP缓冲液引起野生型形式的轻微错误折叠。因此,仅含有Tris缓冲液用于进一步实验。
实施例2:初步筛选噬菌体抗体文库和选择Mut-p53再活化肽
最初进行使用R175H p53蛋白、单phd-12噬菌体文库(NEB,目录号E8110S)的噬菌体展示筛选和用PAb1620抗体选择。200ng R175H p53与1011个噬菌体反应1小时以允许噬菌体的展示肽与Mut-p53 (R175H)的结合。接下来,添加与PAb1620交联的珠粒持续额外1小时以免疫沉淀整个复合物。将该淘洗程序重复三轮,每轮之后通过减少孵育的Mut-p53的量而增加选择的严格性:第一轮200ng,第二轮100ng和第三轮50ng。使用纯化的野生型p53 DBD以2μg/ml的浓度洗脱噬菌体(将p53 DBD(残基94-293)亚克隆至pET-27b (Novagen)中)。将质粒转化至大肠杆菌BL21 (DE3)菌株中。遵循针对小鼠p53 DBD描述的程序进行蛋白产生(Suad, O., 等人, Structural basis of restoring sequence-specific DNA binding and transactivation to mutant p53 by suppressor mutations. J Mol. Biol.,2009. 385(1): p. 249-65)。每轮选择之后,进行洗脱的噬菌体的滴定,以得到选择的噬菌体的数目的估计(表2)。通过感染大肠杆菌扩增洗脱的噬菌体,以得到约1013个噬菌体用于下一轮中选择。从第二轮的淘选,仅用PAb1620进行对照淘选实验(不与Mut-p53孵育);该滴度指示淘选的特异性。
如表2中所见,在第一选择轮中获得100个感染性噬菌体颗粒/μl,且在选择轮之间获得典型富集值,导致在前两轮中的更高富集,然后在第三轮和第四轮淘选中达到平台。然而,在特异性选择淘选反应以及非特异性PAb1620对照淘选反应两者中洗脱的噬菌体的数目是类似的。此富集表明噬菌体可以直接结合至PAb1620,且不通过与p53 R175H目标的相互作用。
为了降低背景(非特异性结合),引入额外的预清除步骤和增加预清除时间;然而,背景结合的比例仍高。因此,实施噬菌体展示过程中的交替选择步骤,以便减少背景结合。为此目的,进行各选择轮的不同的选择策略,同时试图尽可能降低实验系统中的常见非特异性要素(且因此减少与那些非特异性要素的结合)。
因为假定p53的构象变化的先决条件是肽与p53的结合,在PAb1620选择之间引入针对野生型p53结合的额外选择步骤。据推测,由于PAb1620不会存在于第二淘选轮,所以排除噬菌体与它直接结合。此外,由于任何功能肽的先决条件是结合至p53,所以预期肽与野生型形式的优先结合稳定该构象。第一和第三轮淘选类似于先前实验。然而,在第二选择轮中,进行针对野生型-p53(His标签的)的噬菌体结合的选择,且使用镍珠(其结合至His标签)免疫沉淀p53蛋白/噬菌体复合物。各选择轮之后评估洗脱的噬菌体的滴度。如表3中所示,当第二轮与第一轮比较时,在噬菌体的洗脱中实现了10倍富集。尽管这通过噬菌体展示标准可被认为有点低,但这种相对低的富集的原因可能是在各轮淘选中使用不同的选择策略,增加特异性,但另一方面降低选择的噬菌体的总产率。与先前的10倍相比,从第二轮选择轮至第三选择轮的富集是100倍的量级,表明噬菌体富集的显著增加。这种显著增加是由于重复的PAb1620选择。重要地,第三轮之后噬菌体的数目是105的量级,而对于对照PAb1620,数目是4x103。因此,非特异性对照(即,背景)仅构成总选择噬菌体的约5%。
实施例3:用于筛选和鉴定Mut-p53再活化肽的方法。
为了筛选、鉴定和分离特异性p53再活化肽,设计和进行使用不同和互补的选择策略的组合的方法。
在本实施例中,组合三种选择策略。第一选择策略依赖于与PAb1620的反应性,如上所述。第二选择策略基于野生型p53与其共有DNA序列基序(p53响应元件(p53-RE))的结合。已经广泛证明了p53与其共有DNA的体外结合[Joerger, A.C., M.D. Allen,和A.R.Fersht, Crystal structure of a superstable mutant of human p53 core domain. Insights into the mechanism of rescuing oncogenic mutations. J Biol Chem,2004. 279(2): p. 1291-6)。因此,设计两种互补寡核苷酸以产生dsDNA(退火之后)。这些寡核苷酸含有两个串联拷贝的p53-RE共有序列:一种共有序列是推导自结合实验的完美共有结合位点),另一序列是衍生自p21基因启动子的p53 DNA结合位点),其位于第一共有序列的下游(图4)。此外,进一步引入两个限制性酶位点(HindIII)和EcoRI),其能够实现选择之后的更特异性洗脱步骤。一条寡核苷酸链也用生物素标记,以允许免疫沉淀与链霉亲和素包被的珠粒的DNA/p53/噬菌体复合物。图4显示p53-RE寡核苷酸及其序列元件的示意序列。上链寡核苷酸的序列是:
生物素-5’-
在使用DNA结合策略进行的选择程序中(如下详述),0.5-3 pmol生物素-p53-RE寡核苷酸与200ng纯化的野生型p53反应1小时以允许结合。然后引入来自PhD-7或PhD-12噬菌体文库的1010个噬菌体,持续额外一小时。接下来,添加链霉亲和素包被的琼脂糖珠粒,持续30分钟。然后进行5-12个洗涤步骤,随后通过添加限制性酶或过量的非生物素化的DNA而进行洗脱,持续30分钟。这些预防措施将减少噬菌体与DNA、生物素和链霉亲和素的结合的选择。
第三选择策略基于SV40大T (LT)抗原。p53和SV40 LT之间的结合被认为是非常强的。因此,p53必须被正确折叠以形成与SV40 LT的结合表位平台。为此目的,Sf9细胞被编码SV40 LT的杆状病毒感染。裂解细胞,且使用交联至PAb 419(对于SV40 LT特异性的抗体,(Abcam-ab1684))的蛋白-A珠粒分离SV40 LT。将珠粒洗涤数次,然后用于噬菌体展示选择。用于SV40 LT结合的淘选程序类似于基于构象的策略,除了不是使用PAb1620珠粒,而是使用PAb 419-SV40 LT珠粒用于选择。
在交替轮中所有三种选择策略的组合得到最佳结果,因为每轮逐渐增加携带所需特异性肽的噬菌体的百分比,同时降低非特异性背景。鉴定和选择的方法的示意性说明示出图1A和1B中。
用PhD-7和PhD-12噬菌体肽文库进行噬菌体展示筛选。在每步使用不同的固定化平台(PAb1620、p53-RE DNA或SV40 LT)进行交替轮的噬菌体选择。表4显示用于产生富集的噬菌体文库的不同的选择途径,并且指定每轮选择之后的滴度值。通过使用这种选择平台的不同组合(例如PAb1620、随后p53共有DNA、再随后PAb1620,或者SV40 LT、随后PAb1620、随后SV40 LT)以及2种不同的噬菌体文库,获得一组亚文库,然后可以将其在测序之后进行比较。3轮选择之后,获得超过60个含有高比例的Mut-p53-再活化噬菌体的不同的合并物(亚文库)(表4)。
实施例5:选择的噬菌体合并物诱导Mut-p53与PAb1620的结合
为了确定如上进行的噬菌体展示选择方法是否可以富集再活化Mut-p53的噬菌体,测试3轮选择之后获得的噬菌体合并物诱导全长R175H Mut-p53 (BD Pharmingen,Cat. No. 556439)或重组R249S p53 DBD (249 DBD)蛋白与PAb1620的结合的能力。为了减少表现出与PAb1620的直接结合的污染噬菌体的不期望的效果,包括预清除步骤,由此在添加至测试反应之前,将噬菌体合并物首先仅与PAb1620孵育。在通过用Mut-p53 R175H(175)或Mut-p53 R249S (249)的噬菌体展示选择获得的噬菌体存在的情况下,没有或有通过噬菌体合并物与PAb1620珠粒的孵育进行的先前预清除步骤的情况下,使共价交联至PAb1620的珠粒与纯化的突变体p53 R175H孵育。非选择的噬菌体(ns)用作对照。在4℃进行孵育3小时。通过使用针对p53的抗体的western印迹分析显现结合的p53。如图5中呈现的结果可见,与无噬菌体或非选择的输入噬菌体(ns)相比,一些选择的噬菌体合并物确实诱导Mut-p53与PAb1620的结合。
实施例6:选择的噬菌体合并物诱导Mut-p53与p53共有DNA的结合
为了进一步测试选择的噬菌体合并物是否可以促进Mut-p53与p53共有DNA结合元件的结合,通过使这些寡核苷酸与链霉生物素包被的珠粒反应而固定化生物素标记的对应于p53响应元件共有序列(p53-RE)的寡核苷酸生物素 或对于p53结合至关重要的关键残基突变的对照寡核苷酸(Con-RE 生物素- 。p53-RE或Con-RE珠粒与野生型p53 DBD或突变体249 DBD,连同选择3轮选择之后获得的噬菌体合并物一起孵育。结合至用生物素标记的p53-RE-DNA或Con-RE-DNA寡核苷酸的链霉亲和素包被的珠粒与纯化的野生型p53-DBD或突变体p53 R249S-DBD在通过用Mut-p53 R175H (175)、克隆27(LPNPPER, SEQ ID NO:328) (从R175H选择分离的单一克隆)、合并物#69和#94的噬菌体展示选择获得的噬菌体存在的情况下孵育,在交替选择轮用WT和Mut-p53 R175H使用T-AG和PAb1620的组合进行选择。非选择的噬菌体(NS)用作对照。在4℃进行孵育3小时。通过western印迹分析显现结合的p53。如图6中呈现的结果可见,如预期,野生型p53 DBD与p53-RE比与Con-RE更好结合。249DBD不结合至p53-RE,这与其已知的序列特异性DNA结合能力的丧失一致。重要地,选择的噬菌体合并物能够诱导Mut-p53与p53-RE的结合,表明它们的确能够再活化并恢复Mut-p53丧失的功能。
实施例7:选择的噬菌体合并物的深度测序
进行下一代测序,其大大增加噬菌体展示的有效性,允许提取和分析整个选择的肽所有组成成分,具有较少选择循环。使用选择轮和功能活性之间增加富集的标准选择八种噬菌体合并物用于深度测序。测序前,用侧接插入文库的引物:正向-和反向-进行PCR反应,将各引物的前8个碱基随机化且作为所有四种碱基的混合物引入。引入前面碱基的随机化以改进测序效率和精确度。PCR反应产生所需量5μg和包括侧接引物的长度(约120 bp)的DNA和克隆的肽文库用于Solexa深度测序。
深度测序产生3600万个读数的数据库。95%的序列含有当提取文库时PCR中使用的引物序列。接下来,进行数据的初步生物信息学分析。该分析包括除去不含原始引物的序列,除去不在正确阅读框架中的序列,根据插入物长度将数据库隔离成原始12氨基酸和7氨基酸文库,和最终对独特序列计数,和根据数据库中的出现次数对它们分选。发现,大多数序列在数据库中仅出现一次或两次,推测对应于背景噬菌体。12个读数被定义为截止值,低于该截止值,序列的富集被认为是不显著的。数据库中的DNA序列然后被翻译成氨基酸序列。
作为内部质量对照,在从相反方向测序且因此在它们的5'处含有不同引物的两条链之间比较序列及其作为来自总文库中的百分比的丰度。该比较显示,序列及其丰度在两条链之间相似,表明获得的序列数据库是有效的。
表5显示从5'链的深度测序数据库获得的肽序列的列表。过滤无关序列之后,该数据库总共含有107个序列。然后进行截止计数和翻译。列(#读数)显示所述序列在所述数据库中重复的次数,因此对应于特定序列的富集。由于对DNA序列进行生物信息学分析,且几种不同的DNA序列可以因为遗传密码简并性而编码个别肽,所以存在相当几个在表中出现多于一次的肽。如果不同的DNA序列编码特定肽,则它意味着它是在不同的噬菌体克隆内独立选择的。
或者,编码相同肽的许多DNA序列可以是测序错误的结果:然而,在这种情况下,可预期,此类错误的结果将是在随机碱基,因此没有在大量读数中富集。因此,排除在#重复计数中在30个读数以下的DNA序列。列(#重复)显示编码相同肽序列的DNA序列的数目,因此是选择的特异性和强度的进一步指标。
如表5中所见,所述序列可以被隔离成它们的两个来源文库。肽序列描述于中间列中,且根据对应于各文库中的富集的读数的数目将序列以降序排序。发现12aa文库以单一序列-为主,其占序列总数的几乎20%。7aa文库更多样化,且含有更多的序列,但具有较低的富集值。
表5呈现深度测序数据库的分析 - 序列被隔离成两个来源文库,肽序列描述于中间列中,且根据对应于各文库中的富集的读数的数目将序列以降序排序。列(#重复)显示编码相同肽序列的DNA序列的数目。
实施例8:深度测序数据库的生物信息学基序分析
接下来,进行更全面的生物信息学分析以鉴定共有基序。此类继续可以几种方式进行阐明。首先,在12aa和7aa文库中鉴定的肽序列之间的比较。共有基序在两个文库中的出现将支持此类基序的强度,因为它在两个完全独立的实验中被清楚地选择。其次,某些氨基酸的特定位置的丰度及其与基序的相同位置中的其他氨基酸的相似性可以充当此氨基酸在该特定位置的重要性的指标。第三,基序的位置可对其功能是关键重要的:短基序可以沿着较长的肽序列偏移,在其他氨基酸序列中具有变异性,且距肽的游离N-末端的距离可以告知对其活性的重要性。开发算法以检查肽长度的正在生长窗口中的氨基酸序列,如下:
1. 对各肽评分,将翻译为相同肽的不同核苷酸序列的数目与各此种类型的核苷酸序列的出现率整合;
2. 聚簇不同肽,将不同肽之间的序列相似性评分;且
3. 鉴定相关肽序列的组,且从其提取共有序列。
候选肽是具有最高出现率≥0.2%的那些:40个来自7aa文库,且32个来自12aa文库。这些可以通过它们的Blastp相似性和短氨基酸(aa基序)的出现率聚簇成40个组。大多数组包括单一肽,但9个组包括2-13个肽,且这些组中的6个包括7aa和12aa肽两者。
将该组转化成块多重比对,其中%出现率为序列权重。该块用于查询7aa和12aa肽聚簇的序列文件,且将最佳结果以相同的方式再次转化成块。在一些块中,但不是所有中,来自两个文库的结果彼此类似。
深度测序输出(即,与常规测序的数百个序列相比,生成数百万个肽序列数据的数据库)能够实现共有基序的更详细和全面得多的分析。总体而言,鉴定显著富集序列的约130个基序;大多数这些肽基序由几个DNA序列代表,且7aa和12aa文库两者之间共享这些基序中的16个。图7显示几个此类基序。一些基序由组合重叠序列而导致,因此比原始肽文库更长。
实施例9:肽的合成
从如上所述鉴定的获得的肽基序的列表,通过PEPTIDE 2.0利用96孔形式以粗纯度化学合成128种肽。这种半高通量合成实现了各肽的相对低成本。下表6列出合成的肽。该列表还包括衍生自从文献已知与p53相互作用的蛋白的一些肽。该列表还包括以两个版本(没有和有多精氨酸C-末端添加)合成的10种肽。该多-Arg添加据报道使肽穿过细胞膜。这允许评估多Arg C-末端添加实现肽递送至细胞中的能力以及它是否在体内干扰这些特定肽的活性。多Arg可以包括0-10个Arg残基,且被指定为R0-10。
化学合成的肽和选自噬菌体展示文库的肽之间的差异可以存在。具体而言,选择的肽在噬菌体的背景下作为与pIII噬菌体外壳蛋白的融合蛋白呈递。因此,这种向合成肽的转变不是不重要的,并且已知在一些情况下,已知当呈递于噬菌体上时显示有活性的肽当作为游离肽合成相同序列时丧失其活性。
实施例10:前导测试肽的功能筛选
使用几种替代和互补方法来针对对Mut-p53的构象和功能影响筛选前导肽候选。由于没有关于各测试肽渗透穿过细胞膜的信息是已知的,所以首先进行基于体外的测定用于评估:ELISA用于评价p53构象和p53的序列特异性DNA结合。随后,通过活力测定、对荧光素酶报告基因的p53转录活性和体内p53目标基因的检查在活细胞中检查肽的活性。这些测定(所有都以96孔形式进行)的组合允许鉴定和验证肽对不同的p53活性的影响和他们对Mut-p53赋予此能力的能力。
针对对p53构象的影响筛选肽
第一筛选策略基于ELISA。一种版本的夹心ELISA用于检查前导测试肽对p53构象的影响。为了测量肽对Mut-p53的构象影响,用PAb240、PAb1620或pAb421(作为阳性对照)包被微滴定板,然后检查p53与这些抗体的反应性。WT p53充当与PAb1620的反应性的阳性对照,且Mut-p53充当阴性对照。为了检查测试肽的效果,将其添加至含有Mut-p53的溶液中,且测试与任一Ab的反应性的变化。如果添加肽之后观察到Mut-p53针对PAb1620的增加反应性和与PAb240的降低反应性,则其表明测试肽具有再活化的Mut-p53的野生型构象。进行使用不同细胞提取物的几个ELISA实验。结果呈现于图8中,其显示在稳定过表达Mut-p53(R175H p53)的H1299细胞的提取物上进行的代表性实验。将提取物以750 ng/µl浓度制备于在生理pH和盐浓度且补充用于封闭的3%BSA的标准免疫沉淀缓冲液中,然后与50ng/ml浓度的不同的肽反应2小时。将板用各种抗体(Abs)包被过夜,洗涤,封闭,且添加细胞提取物(有或没有肽),持续额外2小时。除去提取物之后,将板洗涤且与αp53-HRP缀合的Ab孵育用于检测p53水平。最后,进行TMB (HRP的底物)测定,且在450nm测定光密度(如上所述)。MCF7和H1299-Mut-p53 (ts) A135V(Zhang, W., 等人, A temperature-sensitive mutant of human p53. Embo J, 1994. 13(11): p. 2535-44)细胞用作用于野生型 p53构象的阳性对照(1620/240比率等于或超过5:1)。H1299-R175H p53提取物,同时表现出更多突变体p53构象,仍维持与PAb1620或PAb240的PAb1620 (1620/240比率为1:2)相比PAb421的反应性。然而,当讨论分析的结果时,构象变化的程度是指最佳捕获的PAb1620/PAb240计算比率。为了检查这是否是与抗体的背景结合或实际的野生型折叠构象,通过加热提取物持续不同的时间长度、监测其与PAb1620和PAb240的反应性而诱导渐增水平的变性。如图8A和8B中所见,增加的热处理诱导与PAb240的反应性的增加和与PAb1620的反应性的减少,表明这些提取物中的R175H p53在这些实验条件下部分维持野生型构象。值得注意的是,在与一些测试肽孵育之后,检测R175H Mut-p53针对PAb1620的增加反应性和针对PAb240的降低反应性。例如,用肽24、36、47、60、68就是这种情况(表6),表明这些肽引发突变体p53蛋白的构象变化。
针对对Mut-p53与p53-RE DNA结合的影响筛选肽。
为了测量测试肽对Mut-p53的DNA结合的影响,商业ELISA试剂盒(R&D SystemsDYC1355-5, Lot-1273366FA)用作定量p53活化的高通量测定法。该试剂盒使用96孔板形式。根据制造商的说明使用该试剂盒。各孔用抗p53抗体包被过夜。含有p53的细胞提取物与生物素标记的含有p53共有结合位点的寡核苷酸(包括于试剂盒中)反应。预期野生型p53结合该寡核苷酸以及包被各孔的抗体。在洗涤缓冲液(0.05% Tween 20/PBS, pH 7.2 - 7.4;R&D Systems, 目录号WA126)中洗掉过量p53和寡核苷酸。然后,添加链霉亲和素-HRP (R&DSystems, Part 890803, 试剂盒中提供)持续15-45分钟以定量孔中寡核苷酸的量,其与p53结合的DNA成正比。如果将肽添加至Mut-p53蛋白提取物与背景相比增加ELISA读数,则该肽被认为在功能上有效且可以被选择用于进一步分析。图9显示代表性实验:与构象ELISA类似,在测试肽存在或不存在(NT)的情况下,将细胞提取物与生物素-p53-RE一起孵育。至于构象筛选,MCF7和H1299-Mut-p53 (ts) A135V细胞充当野生型p53的阳性对照。将提取液添加至用αp53-Ab包被的各孔,且几个洗涤步骤之后,添加链霉亲和素-HRP,持续1小时,然后将板再次洗涤,且进行TMB(HRP的底物)测定。如图9中可见,H1299-R175H p53提取物表现出与p53-RE寡核苷酸的一些背景结合,其进一步被未标记的竞争寡核苷酸降低。阳性对照显示与背景相比高3-4倍的信号。几种肽看起来升高了H1299-R175H p53提取物与p53-RE DNA的结合,例如:68、75、83、93、97。
肽与野生型p53和突变体p53的结合。
为了测量肽与Mut-p53和WT p53的结合,来自“TAKARA”的商业ELISA试剂盒(MK100Lot AK401)用作定量不同肽与蛋白或抗体的结合的高通量测定法。根据制造商的说明使用该试剂盒。通过进行将肽的C-末端附接至板的化学反应而用肽铺板各孔。
将重组WT p53或Mut-p53 R175H以10ng/ml的浓度溶解于PBS和封闭缓冲液中,然后添加至肽包被的板,持续2小时。将可溶性肽添加至相应孔中以充当指示肽与p53 (+comp)的结合的特异性的竞争对照,且将p53-RE DNA寡核苷酸添加至其他孔(+ DNA)中以检查其是否影响肽与p53的结合。除去重组蛋白之后,将板洗涤且与αp53-HRP缀合的Ab孵育以定量p53水平。最后,进行TMB (HRP的底物)测定,且在450nm测定光密度。图10显示用相应的肽和抗体进行的代表性实验。如所见,将各孔与αp53单克隆抗体附接以充当测定的内部对照;PAb1801如预期结合两种p53形式;PAb1620对于野生型 p53是特异性的且PAb240与突变体形式更具反应性。(封闭的)孔没有用肽包被且pep76是对照肽序列。如可见,与突变体p53相比,图中显示的大多数肽以更高的亲和力与重组野生型p53结合。
在活细胞中pCAP对Mut-p53与其应答元件的结合的影响。
接下来,检查p53是否也结合至其目标基因的染色质。使用染色质免疫沉淀(ChIP)测定法,检查pCAPs是否可以恢复Mut-p53 DNA与p53应答元件(p53-RE)的结合能力。将内源表达突变体p53R249S的乳腺癌BT-549用3种pCAPs(250、308和325)的混合物处理5小时。用对照肽的混合物处理的细胞充当阴性对照。然后固定细胞且通过超声处理剪切DNA。使用多克隆抗p53抗体免疫沉淀与p53交联的DNA。纯化DNA,然后在qPCR反应中使用不同的引物定量不同的p53目标基因的p53应答元件。将结果针对总DNA输入均一化。作为阴性对照,用无抗体的珠粒(珠粒)免疫沉淀提取物。如图11中所见,染色质与对照珠粒的结合在输入DNA的.005%的基础水平。pCAP混合物没有增加p53与非特异性基因组DNA控制序列的结合,但与对照肽相比,pCAPs使p53与PUMA、p21和CD95基因中的应答元件的结合分别增加2.34、9.78和4.54倍。
针对对p53转录活性的影响筛选肽
在体内进行用于鉴定再活化肽的额外筛选策略,并且基于报告基因测定。其通过定量置于含有17重复的p53共有结合位点(RGC)的启动子的控制下的报告基因的活性而测量p53转录活性。对活细胞进行荧光素酶测定,因此,提供关于在完整细胞的背景下测试肽对Mut-p53功能的影响的指标。使用在分泌的荧光素酶报告分子上游克隆的基于RGC的启动子(TK-RGC-luc)(New England Biolabs (目录号N0324S)),因为其不需要裂解细胞,且允许使用96孔形式。
图12显示进行以评价肽恢复对突变体p53的转录活性的能力的代表性荧光素酶测定实验。对于体内基于荧光素酶的筛选,使用H1299细胞。使用表达WT p53、R175H p53、R249S p53的载体或作为对照的空载体进行这些p53-/-细胞的瞬时转染(Suad, O., 等人,Structural basis of restoring sequence-specific DNA binding and transactivation to mutant p53 by suppressor mutations. J. Mol. Biol., 2009.385(1): p. 249-65)。细胞还用TK-RGC-luc (目录号NEB, N0324S)共转染。转染之后24小时,细胞用测试肽处理。转染之后24小时,取培养基的样品用于生物发光测量。如图12中可见,在未处理的样品中,与单独的TK-RGC-luc相比,野生型p53(阳性对照)的转染使从TK-RGC-luc的转录诱导20-30倍。当检查肽处理的样品时,可见所述肽对野生型p53活性没有显著影响;这是令人鼓舞的结果,因为预期肽大大增加野生型p53活性对正常细胞具有毒性作用。两种测试肽(即pCAP-68和pCAP-75)在R175H p53和R249S p53存在的情况下诱导从TK-RGC-luc的转录。
针对对表达突变体p53的细胞的活力的影响筛选肽
再活化肽酶活性的一个重要指标是它们在体内对表达Mut-p53的癌细胞的作用。具体而言,期望可以特异性引起癌细胞的Mut-p53依赖性死亡而对正常细胞的毒性作用最小的再活化肽。基于结晶紫的活力测定法用于测定各种测试肽对Mut-p53-依赖性死亡的作用,其中结晶紫用于染色粘附至板的细胞,因此,染料的量与细胞数成正比。结晶紫测定法直接、快速、可靠、便宜,且不需要样品的复杂制备。
将细胞以校准密度铺板于96孔板中,所述校准密度使它们生长48小时而不达到汇合。6小时之后添加肽。不同浓度的依托泊苷(细胞毒性药物)被用作细胞死亡的阳性对照且作为标准参考曲线以评估测试肽的作用。处理之后48小时,用PBS洗涤细胞以排除死细胞和碎片,且仍然附着至板的细胞用结晶紫染色30分钟。除去结晶紫,且用PBS洗涤细胞4次以消除结晶紫的剩余物。然后,将染色的细胞溶解于10%乙酸中,且取板用于在595nm的光密度测量(对于结晶紫特异性)。
图13A和13B说明对128种合成的肽进行的筛选的代表性实验。在该实验中,使用WI-38成纤维细胞。这些细胞表达内源野生型p53,且进一步感染表达小鼠Noxa shRNA(作为非特异性对照)或R175H p53突变体(用于突变体p53的稳定过表达)的病毒。这两个亚系(mNoxa或R175H p53)均以3000个细胞/孔接种且如上所述处理。光密度读数(595nm)反映处理之后的板中的细胞数,将其针对被认为是100%活的未处理样品进行均一化。如所见,尽管WI-38细胞对于杀灭相对耐受,但渐增浓度的依托泊苷充当细胞死亡和生长停滞的良好阳性对照,其中最高浓度在48小时之后使细胞数减少50%。
测试肽中的几种确实引起细胞数的显著减少;该减少是突变体p53依赖的,因为与mNoxa-i对照细胞相比,其在表达R175H p53的细胞中突出得多。这些肽包括,例如,pCAP-36、pCAP-46、pCAP-47、pCAP-60、pCAP-97。另一方面,发现一些肽对两种细胞亚系均具有毒性作用;一个实例是pCAP-68。在几种不同的表达Mut-p53的人癌细胞系上进行类似测定,对于不同肽的结果总结于表7中。
实施例11:前导肽与已知的p53结合蛋白的序列的同源性
在进行通过噬菌体展示预测的肽基序的功能筛选之后,鉴定了20种肽,其在各种测定法和细胞系中对突变体p53发挥功能作用。接下来,检查这些肽与一般人蛋白的序列和与具体已知与p53相互作用的蛋白的相似性,因为和与p53相互作用的蛋白的高相似性可以充当特定基序的生物学意义的指标,且可以提供在人工体外条件下选择的肽的确可以与p53相互作用的假设的验证。此外,蛋白结构和周围序列可能有助于设计均基于选择和合理设计的改进的肽。为了发现肽序列和已知的人蛋白之间的相似性,使用BLAST(基本局部比对搜索工具)算法。引入肽基序作为针对含有人蛋白序列的序列数据库的查询序列。BLAST发现类似于查询中的子序列的数据库中的子序列。BLAST的主要思想是,经常存在统计学显著比对中含有的高得分区段对(HSP)。BLAST使用近似于Smith-Waterman算法的启发式方法搜索查询序列和数据库中的序列之间的高得分序列比对。基于肽基序和已知的人蛋白之间的相似性和这些蛋白的结构数据,根据3维晶体学数据设计新的肽序列的列表(显示于下表8中),其中类似于肽基序的氨基酸酸侧接衍生自蛋白序列的其他氨基酸,所述蛋白序列或侧接所述基序或来自与同源基序物理接近的结构元件。
鉴定与选择的肽基序具有不同程度的相似性的超过70种不同的蛋白。这些蛋白中的许多先前已经显示与p53物理相互作用,而其他据报道参与p53的上游或下游的p53信号传导途径。发现几个基序与已知的p53相互作用蛋白具有非常高度的同源性;例如与RAD9A具有100%同源性(具有10-8的p-值),其已知与p53相互作用且活化p53;和与GAS2蛋白序列具有90%同源性,其中这些基序被两个氨基酸分开(类似于肽基序的氨基酸以粗体字母突出)。
采用几种替代和互补方法来针对对Mut-p53的构象和功能影响筛选前导肽候选。对于肽增加透过细胞膜,各肽含有3-6个精氨酸残基作为其序列的部分或添加于其N-末端或C-末端。40种肽也缀合至肉豆蔻酰脂肪酸(myr)用于与细胞膜的增强融合,这将可能导致更好地递送至细胞中。首先进行基于体外的测定用于评估,诸如ELISA用于评价p53构象和p53的序列特异性DNA结合。随后,通过活力测定、对萤光素酶报道基因的p53转录活性和体内p53目标基因的检查在活细胞中检查肽的活性。这些测定(所有都以96孔形式进行)的组合允许鉴定和验证肽对不同的p53活性的影响和他们对Mut-p53蛋白赋予此能力的能力。从表8可见,发现12种肽具有高于30的总活性得分;所有这12种肽被显示在各种不同的测定法(包括p53构象和序列特异性的DNA结合、表达Mut-p53的细胞的活力的降低和p53目标基因的活化)中是有效的。这些前导肽中的一些(其具有衍生自噬菌体展示的核心基序与添加的已知蛋白的序列(pCAPs 201-326))显示与衍生自单独噬菌体展示的肽(pCAPs 1-180)相比显著增加的效果,而其他则与pCAPs 1-180相当。
在仔细检查已经在测定的组合中显示最显著作用的肽序列之后,发现前导肽可以根据它们的共有基序分成几个主要的组。所述共有基序由假设形成p53突变体的序列或构象结合位点的至少3个连续的氨基酸组成。发现这些共有基序是HSTPHP、FPGHTIH、IRGRIIR、LPNPPER、SFILFIR、HANLHHT、YPTQGHL、WNHHHSTPHP、TLYLPHWHRH、YRRLLIGMMW、IRILMFLIGCG、SFILFIRRGRLG、LRCLLLLIGRVG、SWQALALYAAGW、IRILMFLIGCGR、glrgrriflifs、HSSHHHPVHSWN、LRCLLLLIGRVGRKKRRQ (分别为SEQ ID NO:314、268、282、340、376、298、377、378、253、20、379、302、275、380、273、381、280和382)。
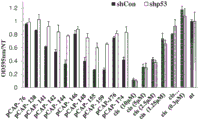
测试肽对p53目标基因的作用
野生型p53蛋白主要作为转录因子发挥作用。通过不同形式的应激活化后,其被积累,结合至其在许多目标基因中的应答元件且反式活化其转录。作为这些目标基因的产物的蛋白执行其功能;p21的反式活化,例如,导致生长停滞,而PUMA的反式活化将导致细胞凋亡。因此,p53功能活化的最重要指标之一是其不同的目标基因的诱导。因此体内测试各种测试肽对p53目标基因的作用。
用于体内功能筛选,使用几个实验系统。一个系统基于H1299细胞,这是p53无效的,且广泛用于p53研究。使用用Mut-p53 (ts) A135V稳定转染的H1299细胞。p53的这种形式是温度敏感的突变体,其在37℃具有突变体构象且在32℃具有野生型构象。图14显示代表性实验。本质上,将细胞铺板于12孔皿中,将所示肽以5ug/ml的浓度直接添加至培养基,然后将细胞移至32℃或返至37℃。
18小时之后收获细胞,随后提取RNA,cDNA合成和实时PCR分析。检查3种代表性p53目标基因的表达水平;p21、PUMA和Mdm2。基因在37℃在H1299-ts中的表达被认为是背景水平,且将所有结果针对其且还针对GAPDH持家基因进行归一化。基因在32℃在H1299-ts中的表达代表野生型p53构象,且因此充当阳性对照。如可见,温度转变至32℃大大增加所有3种目标基因的表达。
如图14中所见,阴性对照肽pCAP-76没有引起p53目标的诱导。几种测试肽的确引起p21、PUMA和Mdm2的表达的显著增加。对于pCAP-130、pCAP-135、pCAP-142、pCAP-144和pCAP-148就是如此。这些肽使目标基因的转录诱导2-4倍,相比之下,阳性对照、真实的野生型p53为9-11倍。用肽处理诱导所有三种基因、但对这些基因在对照H1299 (p53-/-)细胞中的表达没有影响的事实暗示这种诱导是p53依赖性的。
由于肽的递送是它们作为治疗剂的用途的主要障碍,采用克服该障碍的不同的方法。首先,基于测试的前导序列,阐明且合成短肽序列基序(最多6个氨基酸),因为这些小肽可以通过扩散穿过细胞膜。第二种方法是合成具有聚精氨酸C-末端尾部的测试肽以促进其基于内吞作用的机制的主动摄取。
将聚精氨酸尾部添加至肽大大增加具有高含量的疏水性氨基酸的肽的溶解度。在一些情况下,它也显著增加肽在体外和体内的活性;PCAP-25例如以10mg/ml的浓度不溶于DMSO中,并且当针对构象变化或活力测试时没有显示对p53活性的影响。而具有相同氨基酸序列且添加9R尾部的PCAP-68引起Mut-p53构象朝向PAb1620的显著移动,以及大量细胞死亡。前导肽进一步进行以Mut-p53特异性的方式对细胞活力的影响的严格检查。
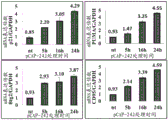
进行使用内源表达不同的突变体p53同种型的不同癌细胞的实验。图15A和15B说明在表达在DNA结合结构域(DBD)内的分别位置280或175具有突变的Mut-p53的MDA-MB-231(图15A)和SKBR3(图15B)乳腺癌细胞上进行的两个代表性实验。为了检查肽对Mut-p53的特异性,所用对照是具有Mut-p53的敲低(shp53)的此类细胞。如图15A和15B中所见,许多测试肽显示细胞活力以Mut-p53特异性的方式降低,具有相对于未处理的表达Mut-p53的细胞代表的100%活力的30%-80%的明显读数。一些肽通常显示一定程度的对细胞活力的毒性作用,如shp53细胞中所见。例如,pCAP-155在两个shp53感染的细胞亚系中表现出活力的30%至40%降低。此外,还看到,一些肽在特定细胞类型中显示细胞数的特异性降低,相比之下,在其他中活性最小。pCAP-146例如引起MDA-MB-231 shCon细胞的显著降低,但对SKBR3shCon细胞几乎没有任何特异性效果。
在表达内源R175H p53的SKBR3细胞中针对其对p53目标基因表达的影响进一步测试测试肽。结果显示于图16,其显示在针对p53表达敲低的SKBR3 ShCon细胞和SKBR3 Shp53细胞上进行的代表性实验的柱状图。本质上,将这些细胞铺板于12孔皿中;将所示肽以5ug/ml的浓度直接添加至培养基。18小时后收获细胞,随后进行qRT-PCR分析。评估p21、PUMA和Mdm2的表达水平。那些基因在未处理细胞中的表达被认为是背景,且所有结果都针对其以及GAPDH进行均一化。如所见,前导肽中的一些表现出p53目标基因的显著反式活化。该效果通过Mut-p53介导,因为它在SKBR3 shp53细胞中没有观察到。pCAP-155、pCAP-144和pCAP-148显示在最高反式活化水平之中。
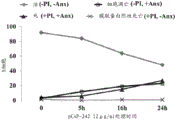
测试肽对细胞凋亡的作用和与p53目标基因的活化的关联
图17A和17B说明在表达在DBD内的位置241具有突变的Mut-p53的ES2卵巢癌细胞(图17A-D)上进行的代表性实验。简言之,将细胞铺板于6cm皿中,且在所示时间点将所示肽以12ug/ml的浓度直接添加至培养基。收获细胞,且取60%的细胞用于膜联蛋白-PI细胞凋亡测定且取40%用于提取RNA、cDNA合成和实时PCR分析。使用膜联蛋白-V染色试剂盒(Roche, REF 11 988 549 001)测定细胞凋亡。根据制造商的说明,用检测细胞凋亡细胞的抗膜联蛋白FITC缀合的抗体和染色化合物可透过的死细胞的PI(碘化丙啶)两者染色未固定的细胞。然后通过流式细胞术分析染色的细胞。对各样品计数总共10,000个细胞且根据染色强度分为四个亚群;PI和膜联蛋白均阴性(-PI,-膜联蛋白)的细胞被称为活的;PI阴性且膜联蛋白阳性(-PI,+膜联蛋白)的细胞正在经过细胞凋亡的早期阶段;PI和膜联蛋白阳性的细胞(+PI,+膜联蛋白)是经历过细胞凋亡过程的死细胞;且PI阳性和膜联蛋白阴性(+PI,-膜联蛋白)的细胞被假定为通过非细胞凋亡死亡诸如坏死而死亡的死细胞。如图17A、17B中所见,未处理的细胞(时间0h)大多(94%)是PI和膜联蛋白两者阴性的,意味着该细胞是活的且很好。用pCAP 242和250处理引起细胞凋亡细胞、随后细胞死亡的快速增加,且处理5小时之后,12%的细胞是膜联蛋白阳性的,且约7%是死的。用PCAP 250处理16和24小时之后,细胞凋亡群体增加至约27%,且死细胞在16小时时积累至29%,且24小时之后积累至36%。该趋势对于PCAP 242也是如此,尽管其影响被衰减且更慢。肽对细胞活力的影响伴随p53目标基因的显著反式活化,如图17C和17D中所见,其显示4种代表性目标的表达。如所见,在肽处理后,所有基因都被活化,且分别用pCAP 250和pCAP 242处理后,p21和PUMAmRNA表达随时间增加直至10倍和6 倍。与未处理的细胞相比,CD95和Btg-2表达升高直至6倍。
实施例12:Mut-p53再活化肽的体内(临床前)测试
在两种类型的模型中进行体内(临床前)实验:裸小鼠和Mut-p53“敲入”小鼠中的人异种移植模型。在各模型中,测定测试肽的瘤内注射对肿瘤生长和动物存活的影响。
在异种移植临床前模型中,用荧光素酶表达载体转染肿瘤细胞,允许通过实时成像监测肿瘤。
在Mut-p53“敲入”小鼠模型中,使用肺特定条件性Mut-p53敲入小鼠(Kim, C.F.,等人, Mouse models of human non-small-cell lung cancer: raising the bar. ColdSpring Harb. Symp. Quant. Biol., 2005. 70: p. 241-50。Olive, K.P., 等人,Mutant p53 gain of function in two mouse models of Li-Fraumeni syndrome.Cell, 2004. 119(6): p. 847-60)。该模型提供在K-ras中具有突变且组合三个p53等位基因(R273H、R175H或p53无效等位基因)之一的化合物条件性基因敲入小鼠。用AdenoCre感染诱导条件性基因的重组,并且显示早在肿瘤起始之后6周产生K-ras诱导的肺腺癌。该模型密切概括晚期人肺腺癌的几个方面,并且其允许在生理水平以正确的空间和时间概况从内源p53启动子表达两种不同的突变体(175和273)。该模型允许表明测试的再活化肽在体内关于几个关键点的特征;对正常小鼠组织或未感染小鼠的安全性可忽略的影响;处理小鼠与对照相比在肿瘤尺寸和数目方面的效力-降低;和表达Mut-p53的小鼠与p53敲除小鼠相比对肿瘤减小的特异性。此外,用阳性对照肽进行剂量递增实验,以评估最小活性浓度和最大耐受剂量。
异种移植模型中的临床前试验
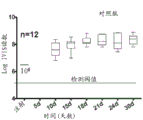
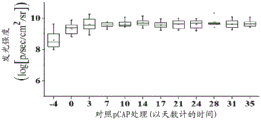
用荧光素酶表达载体和用于p53敲低的shp53或作为非特异性对照的小鼠NOXAshRNA (shmNOXA)感染内源表达p53 R280K的MDA-MB-231细胞。MDA-MB-231细胞是高度致瘤的,形成侵袭性、快速生长的肿瘤,以及在人中是转移性的。总共注射10只小鼠。各小鼠在右侧皮下注射2*106个表达shp53的MDA-MB-231细胞,且在左侧皮下注射2*106个表达shmNOXA的MDA-MB-231细胞。允许肿瘤生长14天以达到可见尺寸。使用IVIS200系统通过实时成像监测生长。在该系统中,荧光素酶生物发光与癌细胞数成正比。结果呈现于图18A至18C和图19A至19C中。注射细胞后14天,将4只小鼠(小鼠7-10)分配至对照组(图18A至18C),且将6只小鼠(小鼠1-6)分配至处理组(图19A至19C)。对照处理由在体外对p53没有显示效果(表型)的3种对照肽(pCAP 76、77和12)的混合物构成。用显示对p53的最佳体外表型效果的3种肽(pCAP 174、155和159)的混合物注射处理组。
在“逆反式(retro-inverso)”策略中,具有与类似的序列,其中添加精氨酸残基,所述肽由D-氨基酸构成,且以与相比相反的顺序()合成(小写字母代表D-氨基酸)。以40μl体积/肿瘤和混合物中各肽50μg/ml的浓度将肽直接注射入肿瘤(肿瘤内注射),每周三次。因此,每次将总共6μg对照肽或处理肽的混合物施用于各小鼠。从肽处理的开始监测小鼠,持续总共5周。每7天测量生物发光。如图18A中所示,当用对照肽混合物处理时,表达内源Mut-p53的shmNOXA肿瘤随着实验的时间进程显示荧光素酶强度的6-15倍(对数刻度)增加。由于肿瘤达到限制大尺寸,小鼠10在处理28天之后必须处死。图19A显示用3种Mut-p53活化肽的混合物平行处理的小鼠的分析。如图19A中所见,无一肿瘤经实验的35天期间显示癌细胞数目的显著增加。所述肿瘤中的两个(小鼠-1和小鼠-4)显示对处理的部分响应,如生物发光分别降低50%至65%所显见。小鼠编号2和5显示完全响应,其中荧光素酶读数甚至在处理21天之后低至或接近于IVIS系统的背景阈值检测水平(5*106个光子)。35天之后停止肽的施用,且小鼠编号2和5没有任何进一步处理且再监测21天。通过视觉或通过实时成像在那些小鼠中没有检测到肿瘤再现。
临床前试验#2
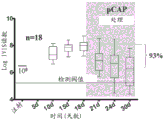
用荧光素酶表达载体感染内源表达p53 R280K的MDA-MB-231细胞,15只小鼠用1x106个MDA-MB-231-luc细胞皮下注射于两个髋部上。允许肿瘤生长10天以达到可见尺寸,且从该时间点起,通过实时成像监测肿瘤生长。结果呈现于图20A至20C中。注射细胞后18天,将6只小鼠分配至对照组,且将9只小鼠分配至处理组。如前所述,对照处理涉及3种对照肽(pCAP 76、77和12)的混合物。用3种肽(pCAP 174、155和159)的混合物注射处理组小鼠。以40μl体积/肿瘤和混合物中各肽50μg/ml的浓度将肽直接注射入肿瘤(肿瘤内注射),每周三次。如图20中所示,对照和处理组在处理之前均显示类似的行为;荧光素酶强度的约2-3倍(对数刻度)增加(第10-18天)。图20A显示用3种对照肽的混合物平行处理的小鼠的分析:如所见,对照处理对肿瘤生长仅具有非常轻微的影响,当与处理前期间相比时,降低生长速率。然而,如图20B中所见,用三种p53再活化pCAP的混合物处理引起MDA-MB-231肿瘤的发光的显著下降。单次注射pCAP混合物之后,平均发光降低70%,且18个肿瘤中的7个显示实时成像读数接近于背景检测阈的总消退(数据未显示)。如图20B中所示,开始处理(4次注射)之后12天,平均肿瘤发光减少93%,且18个肿瘤中的11个显示完全响应。18个肿瘤中仅一个显示无响应或一周响应。该肿瘤在开始处理之前相对大,因此,可能pCAP剂量不足以引起显著响应。
临床前试验#3 - SW-480结肠癌细胞
在MDA-MB-231实验中观察高度显著的结果之后,额外研究旨在延伸观察且检查来自具有不同的p53点突变的不同来源的细胞。SW-480结肠癌细胞系具有两个内源p53突变:R273H和P309S。SW-480细胞用荧光素酶报告基因稳定感染,且将106个细胞皮下注射至裸小鼠中。实验含有15只小鼠,其在实验过程中被随机分为3组:用3种先前证明无效的pCAP的混合物处理的对照组,用3种有效的pCAP(250、308、325)的混合物处理的组,和最后用单一肽pCAP-325处理的组。SW-480实验的持续时间是从细胞植入的点起42天。时间线相对于处理的第一天,其被标记为第0天。图21显示如通过IVIS中的实时成像测量的所有三组中随时间的肿瘤生长。如所见,随着时间推移,对照肿瘤显示肿瘤大小的2.75倍的平均增加(如从发光强度平均值从第0天的9.24至第35天的9.68的对数变化所推断,呈现于图21A中)。混合物处理组中的肿瘤显示等同于96.7%肿瘤尺寸减小的减小(如从发光强度平均值从第0天的9.13至第35天的7.65的对数变化所推断,呈现于图21B中)。类似地,pCAP 325组中的肿瘤显示等同于95.6%肿瘤尺寸减小的0.043的平均倍数变化(如从发光强度平均值从第0天的8.97至第35天的7.61的对数变化所推断,呈现于图21C中)。
临床前实验的概述
迄今已经进行了4次临床前实验,其使用以荧光素酶表达载体转染的表达Mut-p53的细胞的移植瘤模型,允许通过实时成像监测肿瘤。用MDA-MB-231三阴性乳腺癌细胞(p53R280K)进行两个实验,一个实验使用SW-480结肠癌癌细胞(p53 R273H),且另一个实验中使用SKBR3乳腺癌细胞(p53 R175H)。在各实验中,皮下注射来自相应细胞系的细胞,且允许形成通过眼睛和通过实时成像(通常2-3周)可见的良好建立的肿瘤。然后施用处理方案,其由每三天瘤内注射有效的前导肽或对照肽(没有显示体外活性)组成,持续直至42天的期间。
在进行的所有临床前实验中,用前导肽处理的小鼠显示所有其肿瘤参数的非常显著降低(百分比在不同的实验间变化);平均发光信号(如通过IVIS测量的81%-99%)、肿瘤重量和体积(肿瘤提取后测量的72%-93%)。另一方面,用对照肽处理的小鼠的肿瘤继续上涨,尽管与处理之前的生长速率相比速率降低。几乎所有用前导肽处理的肿瘤都对处理响应,且处理的肿瘤中的35%-70%显示完全响应,其中肿瘤消退至低于阈值检测水平。显示完全响应的小鼠中的六只在完成实验(未处理)之后持续两个月仍然活着,且没有检测到肿瘤的复发。
肽的毒性的体内测试
总共,6小鼠用于测试肽混合物的毒性:各肽浓度两只小鼠。在本实验中使用的肽混合物与上述肽混合物相同(图19A至19C)(pCAP 174、155和159)。用以100ug/ml的浓度制备的肽混合物腹膜内注射小鼠,每周三次,持续三周。用类似于临床前测试中小鼠接受的总量的40μl的体积注射两只小鼠。用120μl注射两只小鼠,且用400μl注射剩余两只小鼠。考虑到小鼠的平均体重是20g,这些量分别代表0.6、1.8和6 mg/Kg的浓度。注射之后每天检查小鼠。在任何小鼠中都没有检测到可见的变化。此外,处死小鼠之后,针对坏死或炎症的体征,检查临床前实验中使用的小鼠的肿瘤周围的组织(图18A至18C和图19A至19C)。然而,肿瘤周围的组织在所有情况下都看起来正常,表明用pCAP肽处理的无主要毒性作用。
表10概述本发明中测试的肽的活性。
前述具体实施方案的描述将如此完全地揭示了本发明的总体性质,其他人可以,通过应用现有知识,在无需过度实验且不脱离总体概念的情况下,容易地修改和/或针对各种应用调整此类具体实施方案,并且因此,此类调整和修改应该并且意欲涵盖于公开的实施方案的等同方案的含义和范围内。应该理解的是,本文使用的措辞或术语是为了描述的目的,而不是限制性的。用于实施各种公开的功能的装置、材料和步骤在不脱离本发明的情况下可以采取多种替代形式。
Claims (33)
1.重组或合成肽,其由SEQ ID NO:321、SEQ ID NO:314、SEQ ID NO:313、SEQ ID NO:310或SEQ ID NO:307中记载的氨基酸序列组成,
其中所述肽至少部分再活化突变体p53蛋白。
2.权利要求1的肽,其缀合至至少一个细胞渗透部分。
3.权利要求2的肽,其中所述细胞渗透部分是脂肪酸部分。
4.权利要求3的肽,其中所述脂肪酸选自肉豆蔻酸、月桂酸、棕榈酸和硬脂酸。
5.权利要求4的肽,其中所述脂肪酸是肉豆蔻酰基脂肪酸。
6.权利要求2的肽,其中所述细胞渗透部分是氨基酸部分。
7.权利要求6的肽,其中所述氨基酸部分是聚精氨酸部分。
8.权利要求1的肽,其中所述肽至少部分将所述突变体p53蛋白的构象改变为野生型(WT) p53蛋白的构象。
9.权利要求1的肽,其中所述肽至少部分改变所述突变体p53蛋白的构象,使得针对野生型p53蛋白的单克隆抗体识别所述突变体p53蛋白。
10.权利要求1的肽,其中所述突变体p53蛋白不被针对野生型p53蛋白的单克隆抗体识别。
11.权利要求10的肽,其中所述突变体p53蛋白,在结合至所述肽后,被针对野生型p53蛋白的单克隆抗体识别。
12.权利要求1的肽,其中所述肽至少部分将所述突变体p53蛋白的活性恢复至野生型p53蛋白的活性。
13.权利要求12的肽,其中所述活性是降低表达所述突变体p53蛋白的细胞的活力。
14.权利要求12的肽,其中所述活性是促进表达所述突变体p53蛋白的细胞的细胞凋亡。
15.权利要求12的肽,其中所述活性是结合至表达所述突变体p53蛋白的细胞中的p53共有DNA结合元件。
16.权利要求15的肽,其中所述共有DNA结合元件由SEQ ID NO:339中记载的氨基酸序列组成。
17.权利要求15的肽,其中所述结合导致内源p53目标基因的至少部分活化。
18.权利要求17的肽,其中所述内源目标基因选自p21、MDM2和PUMA。
19.权利要求1的肽,其中所述突变体p53蛋白具有与野生型p53蛋白不同的构象。
20.权利要求1的肽,其中所述突变体p53蛋白与野生型p53蛋白相比至少部分无活性。
21.权利要求1的肽,其中所述突变体p53蛋白包含选自以下的突变:R175H、V143A、R249S、R273H、R280K、P309S、P151S、P151H、C176S、C176F、H179L、Q192R、R213Q、Y220C、Y220D、R245S、R282W、D281G、S241F、C242R、R248Q、R248W、D281G、R273C和V274F。
22.权利要求21的肽,其中所述突变体p53蛋白包含选自以下的突变:R175H、V143A、R249S、R273H、R280K和P309S。
23.表达载体,其能够表达权利要求1至22中任一项的肽。
24.药物组合物,其包含权利要求1至22中任一项的肽。
25.药物组合物,其包含权利要求23的表达载体。
26.权利要求24或25的药物组合物,其用于治疗癌症。
27.权利要求26的药物组合物,其中所述癌症选自乳腺癌、结肠癌和肺癌。
28.权利要求26的药物组合物,其中所述癌症的细胞表达所述突变体p53蛋白。
29.药剂盒,其包含权利要求24或25的药物组合物。
30.权利要求29的药剂盒,其用于治疗与突变体p53蛋白相关的疾病、病症或病况。
31.重组或合成肽,其由SEQ ID NO:321中记载的氨基酸序列组成。
32.重组或合成肽,其由SEQ ID NO:314中记载的氨基酸序列组成。
33.权利要求1-22和31-32中任一项的肽,其用于治疗癌症。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361862977P | 2013-08-07 | 2013-08-07 | |
| US61/862977 | 2013-08-07 | ||
| PCT/IB2014/063777 WO2015019318A1 (en) | 2013-08-07 | 2014-08-07 | Peptides capable of reactivating p53 mutants |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN105579464A CN105579464A (zh) | 2016-05-11 |
| CN105579464B true CN105579464B (zh) | 2021-01-26 |
Family
ID=52460737
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201480053550.8A Active CN105579464B (zh) | 2013-08-07 | 2014-08-07 | 能够再活化p53突变体的肽 |
Country Status (13)
| Country | Link |
|---|---|
| US (4) | US9856289B2 (zh) |
| EP (1) | EP3030571B1 (zh) |
| JP (2) | JP6554099B2 (zh) |
| CN (1) | CN105579464B (zh) |
| AU (2) | AU2016200713B2 (zh) |
| BR (1) | BR112016002721A2 (zh) |
| CA (1) | CA2920147C (zh) |
| ES (1) | ES2795982T3 (zh) |
| HK (1) | HK1219742A1 (zh) |
| HU (1) | HUE049292T2 (zh) |
| IL (2) | IL243944B (zh) |
| RU (2) | RU2693487C2 (zh) |
| WO (1) | WO2015019318A1 (zh) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2920147C (en) | 2013-08-07 | 2022-09-20 | Yeda Research And Development Co. Ltd. | Peptides capable of reactivating p53 mutants |
| CN105112377B (zh) * | 2015-09-25 | 2018-10-30 | 福州迈新生物技术开发有限公司 | 一株分泌抗p53单克隆抗体的杂交瘤细胞株及其应用 |
| US20220251159A1 (en) * | 2016-02-04 | 2022-08-11 | Yeda Research And Development Co., Ltd | Peptides and use of same in the treatment of diseases, disroders or conditions associated with a mutant p53 |
| JP7072508B2 (ja) * | 2016-02-04 | 2022-05-20 | イェダ リサーチ アンド ディベロップメント カンパニー リミテッド | 変異型p53と関連している疾患、障害または病状の処置におけるペプチドおよびその使用 |
| CR20200170A (es) * | 2017-09-29 | 2020-11-23 | Us Health | Receptores de células t que reconocen p53 mutado |
| JOP20200134A1 (ar) | 2017-12-07 | 2022-10-30 | Reven Llc | تركيبات وطرق لمعالجة حالات أيضية |
| WO2019116376A1 (en) * | 2017-12-17 | 2019-06-20 | Yeda Research And Development Co. Ltd. | Cop9 signalosome (csn) complex modulators and uses thereof |
| WO2019134650A1 (en) * | 2018-01-02 | 2019-07-11 | Rui Jin Hospital, Shanghai Jiao Tong University School Of Medicine | Mp53 rescue compounds and methods of treating a p53 disorder |
| WO2019134070A1 (en) * | 2018-01-02 | 2019-07-11 | Rui Jin Hospital, Shanghai Jiao Tong University School Of Medicine | Panda as novel therapeutic |
| TW202112358A (zh) * | 2019-06-12 | 2021-04-01 | 美商里文Ip控股有限責任公司 | 用於改善癌症病患之成效的方法及組成物 |
| JP7402026B2 (ja) | 2019-11-27 | 2023-12-20 | 株式会社小松製作所 | 作業機械の制御システム、作業機械、作業機械の制御方法 |
| WO2021186431A1 (en) | 2020-03-16 | 2021-09-23 | Yeda Research And Development Co. Ltd. | Peptide analogs and use of same in treating diseases, disorders or conditions associated with a mutant p53 protein |
| CN111574591B (zh) * | 2020-04-29 | 2021-09-21 | 西安交通大学医学院第一附属医院 | 一种多肽及其合成方法 |
| CN113750246B (zh) * | 2020-06-04 | 2023-12-05 | 华南理工大学 | ZIF-8纳米材料在降解广谱突变p53蛋白中的应用 |
| CN111686127B (zh) * | 2020-06-04 | 2022-02-15 | 华南理工大学 | 锌铁纳米材料在降解突变p53蛋白中的应用 |
| WO2021262483A1 (en) * | 2020-06-24 | 2021-12-30 | Pmv Pharmaceuticals, Inc. | METHODS AND COMPOUNDS FOR RESTORING MUTANT p53 FUNCTION |
| CN112921032A (zh) * | 2020-12-29 | 2021-06-08 | 苏州中科先进技术研究院有限公司 | 一种引物对、探针、试剂盒及其使用方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1996025434A1 (en) * | 1995-02-16 | 1996-08-22 | The Wistar Institute | PEPTIDES AND PEPTIDOMIMETICS WITH STRUCTURAL SIMILARITY TO HUMAN p53 THAT ACTIVATE p53 FUNCTION |
| EP0989136A1 (en) * | 1997-05-15 | 2000-03-29 | Kyowa Hakko Kogyo Co., Ltd. | Peptides having cyclic structures and exerting p53 protein activty-restoring effect on p53 protein mutants |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5294605A (en) | 1990-07-19 | 1994-03-15 | The Scripps Research Institute | Amphiphilic peptide compositions and analogues thereof |
| US5614393A (en) * | 1991-10-10 | 1997-03-25 | Rhone-Poulenc Agrochimie | Production of γ-linolenic acid by a Δ6-desaturase |
| US5969120A (en) * | 1993-09-03 | 1999-10-19 | Research Development Foundation | Mutants of the RB and P53 genes |
| US6184205B1 (en) | 1994-07-22 | 2001-02-06 | University Of North Carolina At Chapel Hill | GRB2 SH3 binding peptides and methods of isolating and using same |
| US5877282A (en) | 1996-09-20 | 1999-03-02 | Bristol-Myers Squibb Company | Peptide inhibitors of nuclear protein translocation having nuclear localization sequences and methods of use thereof |
| US20030224379A1 (en) * | 2000-01-21 | 2003-12-04 | Tang Y. Tom | Novel nucleic acids and polypeptides |
| PT1377314E (pt) | 2001-01-26 | 2012-01-02 | Inhibitex Inc | Anticorpos monoclonais para a proteína clfa e método de utilização no tratamento ou prevenção de infecções |
| WO2002068601A2 (en) * | 2001-02-28 | 2002-09-06 | Skubitz Keith M | Small peptides capable of modulating the function of cd66 (ceacam) family members |
| ATE495251T1 (de) * | 2002-01-23 | 2011-01-15 | Mohammed Raafat El-Gewely | Molekulare bibliotheken |
| US7361747B2 (en) * | 2003-05-22 | 2008-04-22 | The University Of Hong Kong | Isolation and characterization of the precursor virus of human SARS virus: SARS-associated corona virus-like virus |
| KR101364374B1 (ko) * | 2005-03-14 | 2014-02-17 | 더 보드 오브 리전츠 오브 더 유니버시티 오브 텍사스 시스템 | 생활성 fus1 펩티드 및 나노입자-폴리펩티드 복합체 |
| US8877201B2 (en) * | 2007-10-25 | 2014-11-04 | Wake Forest University Health Sciences | Bordetella outer-membrane protein antigens and methods of making and using the same |
| EP2268658B1 (en) * | 2008-03-13 | 2015-12-09 | Universita'Degli Studi di Trieste | Peptides and aptamers thereof as specific modulators of mutant p53 function |
| US8287845B2 (en) * | 2008-12-18 | 2012-10-16 | E I Du Pont De Nemours And Company | Hair-binding peptides |
| WO2013036208A1 (en) * | 2011-09-09 | 2013-03-14 | Agency For Science, Technology And Research | P53 activating peptides |
| EP2771349B1 (en) * | 2011-09-16 | 2020-02-26 | Iogenetics, LLC. | Bioinformatic processes for determination of peptide binding |
| EP2895499B1 (en) * | 2012-09-13 | 2019-04-10 | Université de Genève | Cell penetrating peptides |
| CA2920147C (en) | 2013-08-07 | 2022-09-20 | Yeda Research And Development Co. Ltd. | Peptides capable of reactivating p53 mutants |
| JP7072508B2 (ja) | 2016-02-04 | 2022-05-20 | イェダ リサーチ アンド ディベロップメント カンパニー リミテッド | 変異型p53と関連している疾患、障害または病状の処置におけるペプチドおよびその使用 |
-
2014
- 2014-08-07 CA CA2920147A patent/CA2920147C/en active Active
- 2014-08-07 RU RU2016106583A patent/RU2693487C2/ru active
- 2014-08-07 RU RU2019119609A patent/RU2721423C2/ru active
- 2014-08-07 BR BR112016002721-3A patent/BR112016002721A2/pt not_active Application Discontinuation
- 2014-08-07 WO PCT/IB2014/063777 patent/WO2015019318A1/en active Application Filing
- 2014-08-07 CN CN201480053550.8A patent/CN105579464B/zh active Active
- 2014-08-07 ES ES14834903T patent/ES2795982T3/es active Active
- 2014-08-07 EP EP14834903.8A patent/EP3030571B1/en active Active
- 2014-08-07 HU HUE14834903A patent/HUE049292T2/hu unknown
- 2014-08-07 JP JP2016532782A patent/JP6554099B2/ja active Active
-
2016
- 2016-02-04 AU AU2016200713A patent/AU2016200713B2/en active Active
- 2016-02-04 US US15/015,208 patent/US9856289B2/en active Active
- 2016-02-04 IL IL243944A patent/IL243944B/en active IP Right Grant
- 2016-07-04 HK HK16107750.7A patent/HK1219742A1/zh unknown
-
2017
- 2017-04-28 AU AU2017202806A patent/AU2017202806B2/en not_active Ceased
- 2017-10-29 US US15/796,811 patent/US10336789B2/en active Active
-
2019
- 2019-06-25 US US16/451,081 patent/US10550152B2/en active Active
- 2019-07-04 JP JP2019125644A patent/JP2019214573A/ja active Pending
- 2019-07-30 IL IL268355A patent/IL268355A/en unknown
- 2019-12-05 US US16/704,010 patent/US11028127B2/en active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1996025434A1 (en) * | 1995-02-16 | 1996-08-22 | The Wistar Institute | PEPTIDES AND PEPTIDOMIMETICS WITH STRUCTURAL SIMILARITY TO HUMAN p53 THAT ACTIVATE p53 FUNCTION |
| EP0989136A1 (en) * | 1997-05-15 | 2000-03-29 | Kyowa Hakko Kogyo Co., Ltd. | Peptides having cyclic structures and exerting p53 protein activty-restoring effect on p53 protein mutants |
Non-Patent Citations (1)
| Title |
|---|
| Small peptides activate the latent sequencespecific DNA binding function of p53;Ted R. Hupp et al.,;《Cell》;19951020;第83卷;237-245 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN105579464B (zh) | 能够再活化p53突变体的肽 | |
| JP7011467B2 (ja) | ミスフォールドタンパク質の分解のための組成物及び方法 | |
| US9410943B2 (en) | Methods, compositions and screens for therapeutics for the treatment of synovial sarcoma | |
| JP2022112518A (ja) | 変異型p53と関連している疾患、障害または病状の処置におけるペプチドおよびその使用 | |
| WO2016130966A1 (en) | Compositions and methods for regulating blood pressure | |
| JP2023512562A (ja) | 人工シナプス | |
| US8414887B2 (en) | Methods for suppressing Toll-like Receptor 4 (TLR4) function using TLR14 antagonists | |
| US9683025B2 (en) | Methods and compositions for treating cancer and inflammatory diseases | |
| KR20080034995A (ko) | 혈관 투과성을 저해하는 방법 및 조성물 | |
| US20130345115A1 (en) | Nuclear penetrating h4 tail peptides for the treatment of diseases mediated by impaired or loss of p53 function | |
| US10233222B2 (en) | Methods, compositions, diagnostics and assays for the treatment of Alzheimer's disease | |
| CA2919855A1 (en) | Peptides capable of reactivating p53 mutants | |
| JP2021534826A (ja) | がんの処置のためのペプチド治療薬およびその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |