CN103833714A - 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 - Google Patents
木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 Download PDFInfo
- Publication number
- CN103833714A CN103833714A CN201410059639.7A CN201410059639A CN103833714A CN 103833714 A CN103833714 A CN 103833714A CN 201410059639 A CN201410059639 A CN 201410059639A CN 103833714 A CN103833714 A CN 103833714A
- Authority
- CN
- China
- Prior art keywords
- luteolin
- galuteolin
- hesperitin
- hesperidin
- demethylation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
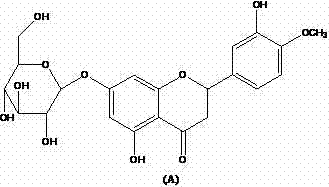
- MWDZOUNAPSSOEL-UHFFFAOYSA-N kaempferol Natural products OC1=C(C(=O)c2cc(O)cc(O)c2O1)c3ccc(O)cc3 MWDZOUNAPSSOEL-UHFFFAOYSA-N 0.000 title claims abstract description 68
- IQPNAANSBPBGFQ-UHFFFAOYSA-N luteolin Chemical compound C=1C(O)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(O)C(O)=C1 IQPNAANSBPBGFQ-UHFFFAOYSA-N 0.000 title claims abstract description 68
- LRDGATPGVJTWLJ-UHFFFAOYSA-N luteolin Natural products OC1=CC(O)=CC(C=2OC3=CC(O)=CC(O)=C3C(=O)C=2)=C1 LRDGATPGVJTWLJ-UHFFFAOYSA-N 0.000 title claims abstract description 68
- 235000009498 luteolin Nutrition 0.000 title claims abstract description 68
- PEFNSGRTCBGNAN-QNDFHXLGSA-N luteolin 7-O-beta-D-glucoside Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=C2C(=O)C=C(C=3C=C(O)C(O)=CC=3)OC2=C1 PEFNSGRTCBGNAN-QNDFHXLGSA-N 0.000 title claims abstract description 51
- KBGKQZVCLWKUDQ-UHFFFAOYSA-N luteolin-glucoside Natural products OC1C(O)C(O)C(CO)OC1OC1=CC(O)=CC2=C1C(=O)C=C(C=1C=C(O)C(O)=CC=1)O2 KBGKQZVCLWKUDQ-UHFFFAOYSA-N 0.000 title claims abstract description 49
- MGYBYJXAXUBTQF-TWJLCPPASA-N Luteolin rutinoside Chemical compound OC1[C@@H](O)[C@@H](O)C(C)O[C@H]1OCC1[C@@H](O)[C@H](O)C(O)[C@H](OC=2C=C3C(C(C=C(O3)C=3C=C(O)C(O)=CC=3)=O)=C(O)C=2)O1 MGYBYJXAXUBTQF-TWJLCPPASA-N 0.000 title claims abstract description 22
- 238000001308 synthesis method Methods 0.000 title abstract 7
- VUYDGVRIQRPHFX-UHFFFAOYSA-N hesperidin Natural products COc1cc(ccc1O)C2CC(=O)c3c(O)cc(OC4OC(COC5OC(O)C(O)C(O)C5O)C(O)C(O)C4O)cc3O2 VUYDGVRIQRPHFX-UHFFFAOYSA-N 0.000 claims abstract description 69
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims abstract description 63
- 239000001100 (2S)-5,7-dihydroxy-2-(3-hydroxy-4-methoxyphenyl)chroman-4-one Substances 0.000 claims abstract description 61
- QUQPHWDTPGMPEX-QJBIFVCTSA-N hesperidin Chemical compound C1=C(O)C(OC)=CC=C1[C@H]1OC2=CC(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@@H](CO[C@H]4[C@@H]([C@H](O)[C@@H](O)[C@H](C)O4)O)O3)O)=CC(O)=C2C(=O)C1 QUQPHWDTPGMPEX-QJBIFVCTSA-N 0.000 claims abstract description 55
- QUQPHWDTPGMPEX-UHFFFAOYSA-N Hesperidine Natural products C1=C(O)C(OC)=CC=C1C1OC2=CC(OC3C(C(O)C(O)C(COC4C(C(O)C(O)C(C)O4)O)O3)O)=CC(O)=C2C(=O)C1 QUQPHWDTPGMPEX-UHFFFAOYSA-N 0.000 claims abstract description 54
- QUQPHWDTPGMPEX-UTWYECKDSA-N aurantiamarin Natural products COc1ccc(cc1O)[C@H]1CC(=O)c2c(O)cc(O[C@@H]3O[C@H](CO[C@@H]4O[C@@H](C)[C@H](O)[C@@H](O)[C@H]4O)[C@@H](O)[C@H](O)[C@H]3O)cc2O1 QUQPHWDTPGMPEX-UTWYECKDSA-N 0.000 claims abstract description 54
- APSNPMVGBGZYAJ-GLOOOPAXSA-N clematine Natural products COc1cc(ccc1O)[C@@H]2CC(=O)c3c(O)cc(O[C@@H]4O[C@H](CO[C@H]5O[C@@H](C)[C@H](O)[C@@H](O)[C@H]5O)[C@@H](O)[C@H](O)[C@H]4O)cc3O2 APSNPMVGBGZYAJ-GLOOOPAXSA-N 0.000 claims abstract description 54
- 229940025878 hesperidin Drugs 0.000 claims abstract description 54
- ARGKVCXINMKCAZ-UHFFFAOYSA-N neohesperidine Natural products C1=C(O)C(OC)=CC=C1C1OC2=CC(OC3C(C(O)C(O)C(CO)O3)OC3C(C(O)C(O)C(C)O3)O)=CC(O)=C2C(=O)C1 ARGKVCXINMKCAZ-UHFFFAOYSA-N 0.000 claims abstract description 54
- 238000010520 demethylation reaction Methods 0.000 claims abstract description 52
- 230000017858 demethylation Effects 0.000 claims abstract description 50
- 238000006356 dehydrogenation reaction Methods 0.000 claims abstract description 43
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims abstract description 40
- AIONOLUJZLIMTK-AWEZNQCLSA-N hesperetin Chemical compound C1=C(O)C(OC)=CC=C1[C@H]1OC2=CC(O)=CC(O)=C2C(=O)C1 AIONOLUJZLIMTK-AWEZNQCLSA-N 0.000 claims abstract description 31
- 229960001587 hesperetin Drugs 0.000 claims abstract description 31
- -1 hesperetin glucoside Chemical class 0.000 claims abstract description 31
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims abstract description 20
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 60
- 238000004821 distillation Methods 0.000 claims description 33
- WKUHPOMCLBLCOV-UHFFFAOYSA-N Diosmetin-7-O-alpha-D-glucopyranosid Natural products C1=C(O)C(OC)=CC=C1C(OC1=C2)=CC(=O)C1=C(O)C=C2OC1C(O)C(O)C(O)C(CO)O1 WKUHPOMCLBLCOV-UHFFFAOYSA-N 0.000 claims description 28
- 239000000047 product Substances 0.000 claims description 28
- 238000000034 method Methods 0.000 claims description 27
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 claims description 24
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 claims description 24
- 239000011630 iodine Substances 0.000 claims description 24
- 229910052740 iodine Inorganic materials 0.000 claims description 24
- 239000007788 liquid Substances 0.000 claims description 24
- 150000003222 pyridines Chemical class 0.000 claims description 22
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 18
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 claims description 16
- MGYBYJXAXUBTQF-FSFUDZCRSA-N luteolin 7-O-rutinoside Natural products C[C@@H]1O[C@H](OC[C@H]2O[C@@H](Oc3cc(O)c4C(=O)C=C(Oc4c3)c5ccc(O)c(O)c5)[C@H](O)[C@@H](O)[C@@H]2O)[C@@H](O)[C@H](O)[C@H]1O MGYBYJXAXUBTQF-FSFUDZCRSA-N 0.000 claims description 16
- GZSOSUNBTXMUFQ-YFAPSIMESA-N diosmin Chemical compound C1=C(O)C(OC)=CC=C1C(OC1=C2)=CC(=O)C1=C(O)C=C2O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@H]2[C@@H]([C@H](O)[C@@H](O)[C@H](C)O2)O)O1 GZSOSUNBTXMUFQ-YFAPSIMESA-N 0.000 claims description 15
- 238000004128 high performance liquid chromatography Methods 0.000 claims description 15
- GZSOSUNBTXMUFQ-NJGQXECBSA-N 5,7,3'-Trihydroxy-4'-methoxyflavone 7-O-rutinoside Natural products O(C[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@H](Oc2cc(O)c3C(=O)C=C(c4cc(O)c(OC)cc4)Oc3c2)O1)[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@H](C)O1 GZSOSUNBTXMUFQ-NJGQXECBSA-N 0.000 claims description 14
- SHPPXMGVUDNKLV-UHFFFAOYSA-N Veronicastroside Natural products OC1C(O)C(O)C(C)OC1OC1C(O)C(O)C(CO)OC1OC1=CC(O)=C2C(=O)C=C(C=3C=C(O)C(O)=CC=3)OC2=C1 SHPPXMGVUDNKLV-UHFFFAOYSA-N 0.000 claims description 14
- 229960004352 diosmin Drugs 0.000 claims description 14
- IGBKNLGEMMEWKD-UHFFFAOYSA-N diosmin Natural products COc1ccc(cc1)C2=C(O)C(=O)c3c(O)cc(OC4OC(COC5OC(C)C(O)C(O)C5O)C(O)C(O)C4O)cc3O2 IGBKNLGEMMEWKD-UHFFFAOYSA-N 0.000 claims description 14
- MGYBYJXAXUBTQF-UHFFFAOYSA-N scolymoside Natural products OC1C(O)C(O)C(C)OC1OCC1C(O)C(O)C(O)C(OC=2C=C3C(C(C=C(O3)C=3C=C(O)C(O)=CC=3)=O)=C(O)C=2)O1 MGYBYJXAXUBTQF-UHFFFAOYSA-N 0.000 claims description 13
- 229910000147 aluminium phosphate Inorganic materials 0.000 claims description 12
- 239000002253 acid Substances 0.000 claims description 11
- 238000010438 heat treatment Methods 0.000 claims description 11
- 230000007062 hydrolysis Effects 0.000 claims description 10
- 238000006460 hydrolysis reaction Methods 0.000 claims description 10
- 239000000203 mixture Substances 0.000 claims description 10
- FKNQCJSGGFJEIZ-UHFFFAOYSA-N 4-methylpyridine Chemical compound CC1=CC=NC=C1 FKNQCJSGGFJEIZ-UHFFFAOYSA-N 0.000 claims description 8
- 238000009835 boiling Methods 0.000 claims description 8
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 claims description 6
- ITQTTZVARXURQS-UHFFFAOYSA-N 3-methylpyridine Chemical compound CC1=CC=CN=C1 ITQTTZVARXURQS-UHFFFAOYSA-N 0.000 claims description 6
- WKUHPOMCLBLCOV-MIUGBVLSSA-N Diosmetin 7-O-beta-D-glucopyranoside Chemical compound C1=C(O)C(OC)=CC=C1C(OC1=C2)=CC(=O)C1=C(O)C=C2O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 WKUHPOMCLBLCOV-MIUGBVLSSA-N 0.000 claims description 6
- 229910052782 aluminium Inorganic materials 0.000 claims description 6
- 230000000977 initiatory effect Effects 0.000 claims description 6
- 238000011835 investigation Methods 0.000 claims description 6
- MGYBYJXAXUBTQF-FOBVWLSUSA-N 2-(3,4-dihydroxyphenyl)-5-hydroxy-7-[(2s,3r,4s,5s,6r)-3,4,5-trihydroxy-6-[[(2r,3r,4r,5r,6s)-3,4,5-trihydroxy-6-methyloxan-2-yl]oxymethyl]oxan-2-yl]oxychromen-4-one Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@H](OC=2C=C3C(C(C=C(O3)C=3C=C(O)C(O)=CC=3)=O)=C(O)C=2)O1 MGYBYJXAXUBTQF-FOBVWLSUSA-N 0.000 claims description 5
- 238000010828 elution Methods 0.000 claims description 5
- IVTMALDHFAHOGL-UHFFFAOYSA-N eriodictyol 7-O-rutinoside Natural products OC1C(O)C(O)C(C)OC1OCC1C(O)C(O)C(O)C(OC=2C=C3C(C(C(O)=C(O3)C=3C=C(O)C(O)=CC=3)=O)=C(O)C=2)O1 IVTMALDHFAHOGL-UHFFFAOYSA-N 0.000 claims description 5
- BWZVCCNYKMEVEX-UHFFFAOYSA-N 2,4,6-Trimethylpyridine Chemical compound CC1=CC(C)=NC(C)=C1 BWZVCCNYKMEVEX-UHFFFAOYSA-N 0.000 claims description 4
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 claims description 4
- HWWYDZCSSYKIAD-UHFFFAOYSA-N 3,5-dimethylpyridine Chemical compound CC1=CN=CC(C)=C1 HWWYDZCSSYKIAD-UHFFFAOYSA-N 0.000 claims description 4
- 239000003463 adsorbent Substances 0.000 claims description 4
- 238000001556 precipitation Methods 0.000 claims description 4
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 claims description 4
- 239000011347 resin Substances 0.000 claims description 4
- 229920005989 resin Polymers 0.000 claims description 4
- 238000010898 silica gel chromatography Methods 0.000 claims description 4
- 238000010521 absorption reaction Methods 0.000 claims description 3
- 238000005903 acid hydrolysis reaction Methods 0.000 claims description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims description 3
- 239000006227 byproduct Substances 0.000 claims description 3
- MVTFTBIUYLXNKP-UHFFFAOYSA-N scolimoside Natural products COc1cc(O)c2C(=O)C=C(Oc2c1)c3ccc(OC4OC(COC5OC(C)C(O)C(O)C5O)C(O)C(O)C4O)c(O)c3 MVTFTBIUYLXNKP-UHFFFAOYSA-N 0.000 claims description 3
- XWKFPIODWVPXLX-UHFFFAOYSA-N 2-methyl-5-methylpyridine Natural products CC1=CC=C(C)N=C1 XWKFPIODWVPXLX-UHFFFAOYSA-N 0.000 claims description 2
- WKGHUAZJNBXABN-UHFFFAOYSA-N 3-bromo-2-chloro-6-methyl-5-nitropyridine Chemical compound CC1=NC(Cl)=C(Br)C=C1[N+]([O-])=O WKGHUAZJNBXABN-UHFFFAOYSA-N 0.000 claims description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 claims description 2
- CECABOMBVQNBEC-UHFFFAOYSA-K aluminium iodide Chemical compound I[Al](I)I CECABOMBVQNBEC-UHFFFAOYSA-K 0.000 claims description 2
- JPUHCPXFQIXLMW-UHFFFAOYSA-N aluminium triethoxide Chemical compound CCO[Al](OCC)OCC JPUHCPXFQIXLMW-UHFFFAOYSA-N 0.000 claims description 2
- 238000013375 chromatographic separation Methods 0.000 claims description 2
- ADSYMQORONDIDD-ZJHVPRRPSA-N hesperetin 7-O-beta-D-glucoside Chemical compound C1=C(O)C(OC)=CC=C1[C@H]1OC2=CC(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O3)O)=CC(O)=C2C(=O)C1 ADSYMQORONDIDD-ZJHVPRRPSA-N 0.000 claims description 2
- 239000012535 impurity Substances 0.000 claims description 2
- 239000000178 monomer Substances 0.000 claims description 2
- 239000000376 reactant Substances 0.000 claims description 2
- 238000006243 chemical reaction Methods 0.000 abstract description 26
- 229930182478 glucoside Natural products 0.000 abstract description 15
- 239000003814 drug Substances 0.000 abstract description 13
- 150000008131 glucosides Chemical class 0.000 abstract description 10
- QAGGICSUEVNSGH-UHFFFAOYSA-N Diosmetin Natural products C1=C(O)C(OC)=CC=C1C1=CC(=O)C2=CC=C(O)C=C2O1 QAGGICSUEVNSGH-UHFFFAOYSA-N 0.000 abstract description 9
- MBNGWHIJMBWFHU-UHFFFAOYSA-N diosmetin Chemical compound C1=C(O)C(OC)=CC=C1C1=CC(=O)C2=C(O)C=C(O)C=C2O1 MBNGWHIJMBWFHU-UHFFFAOYSA-N 0.000 abstract description 9
- 235000015428 diosmetin Nutrition 0.000 abstract description 9
- 229960001876 diosmetin Drugs 0.000 abstract description 9
- 239000003153 chemical reaction reagent Substances 0.000 abstract description 6
- 238000004519 manufacturing process Methods 0.000 abstract description 6
- 230000008901 benefit Effects 0.000 abstract description 3
- 229940079593 drug Drugs 0.000 abstract description 2
- AIONOLUJZLIMTK-UHFFFAOYSA-N hesperetin Natural products C1=C(O)C(OC)=CC=C1C1OC2=CC(O)=CC(O)=C2C(=O)C1 AIONOLUJZLIMTK-UHFFFAOYSA-N 0.000 abstract 4
- 235000010209 hesperetin Nutrition 0.000 abstract 4
- FTODBIPDTXRIGS-UHFFFAOYSA-N homoeriodictyol Natural products C1=C(O)C(OC)=CC(C2OC3=CC(O)=CC(O)=C3C(=O)C2)=C1 FTODBIPDTXRIGS-UHFFFAOYSA-N 0.000 abstract 4
- VSFKAJPKOFGJTH-MTDSMIIYSA-N Diosmetin glucoside Chemical compound COC1=CC=C(C=2OC3=CC(O)=CC(O)=C3C(=O)C=2)C=C1O[C@@H]1OC(CO)[C@@H](O)C(O)C1O VSFKAJPKOFGJTH-MTDSMIIYSA-N 0.000 abstract 1
- 238000010668 complexation reaction Methods 0.000 abstract 1
- 239000012530 fluid Substances 0.000 abstract 1
- 230000003301 hydrolyzing effect Effects 0.000 abstract 1
- 238000009776 industrial production Methods 0.000 abstract 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 abstract 1
- 238000003756 stirring Methods 0.000 description 24
- 244000167230 Lonicera japonica Species 0.000 description 16
- 235000017617 Lonicera japonica Nutrition 0.000 description 16
- 239000007787 solid Substances 0.000 description 12
- 229930182470 glycoside Natural products 0.000 description 10
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 9
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 9
- 230000000694 effects Effects 0.000 description 8
- 235000013824 polyphenols Nutrition 0.000 description 8
- 241000100289 Lonicera confusa Species 0.000 description 7
- 238000011084 recovery Methods 0.000 description 7
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- 230000000536 complexating effect Effects 0.000 description 6
- 229930003944 flavone Natural products 0.000 description 6
- 150000002213 flavones Chemical class 0.000 description 6
- 235000011949 flavones Nutrition 0.000 description 6
- 239000012456 homogeneous solution Substances 0.000 description 6
- 238000009413 insulation Methods 0.000 description 6
- 150000001298 alcohols Chemical class 0.000 description 5
- 230000003078 antioxidant effect Effects 0.000 description 5
- 238000001816 cooling Methods 0.000 description 5
- 230000001335 demethylating effect Effects 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 229930003935 flavonoid Natural products 0.000 description 5
- 235000017173 flavonoids Nutrition 0.000 description 5
- 150000002338 glycosides Chemical class 0.000 description 5
- 150000003254 radicals Chemical class 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 0 C*1C=C=C*C1 Chemical compound C*1C=C=C*C1 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- 235000001368 chlorogenic acid Nutrition 0.000 description 4
- 235000020971 citrus fruits Nutrition 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 239000001301 oxygen Substances 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- CWVRJTMFETXNAD-FWCWNIRPSA-N 3-O-Caffeoylquinic acid Natural products O[C@H]1[C@@H](O)C[C@@](O)(C(O)=O)C[C@H]1OC(=O)\C=C\C1=CC=C(O)C(O)=C1 CWVRJTMFETXNAD-FWCWNIRPSA-N 0.000 description 3
- IVCZEZUJCMWBBR-UHFFFAOYSA-N 7-O-beta-D-glucopyranosyl-7,3',4'-trihydroxyflavone Natural products OC1C(O)C(O)C(CO)OC1OC1=CC=C2C(=O)C=C(C=3C=C(O)C(O)=CC=3)OC2=C1 IVCZEZUJCMWBBR-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- PZIRUHCJZBGLDY-UHFFFAOYSA-N Caffeoylquinic acid Natural products CC(CCC(=O)C(C)C1C(=O)CC2C3CC(O)C4CC(O)CCC4(C)C3CCC12C)C(=O)O PZIRUHCJZBGLDY-UHFFFAOYSA-N 0.000 description 3
- 241000207199 Citrus Species 0.000 description 3
- 241001570521 Lonicera periclymenum Species 0.000 description 3
- MZSGWZGPESCJAN-MOBFUUNNSA-N Melitric acid A Natural products O([C@@H](C(=O)O)Cc1cc(O)c(O)cc1)C(=O)/C=C/c1cc(O)c(O/C(/C(=O)O)=C/c2cc(O)c(O)cc2)cc1 MZSGWZGPESCJAN-MOBFUUNNSA-N 0.000 description 3
- CWVRJTMFETXNAD-KLZCAUPSSA-N Neochlorogenin-saeure Natural products O[C@H]1C[C@@](O)(C[C@@H](OC(=O)C=Cc2ccc(O)c(O)c2)[C@@H]1O)C(=O)O CWVRJTMFETXNAD-KLZCAUPSSA-N 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 230000000844 anti-bacterial effect Effects 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- 235000006708 antioxidants Nutrition 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- CWVRJTMFETXNAD-JUHZACGLSA-N chlorogenic acid Chemical compound O[C@@H]1[C@H](O)C[C@@](O)(C(O)=O)C[C@H]1OC(=O)\C=C\C1=CC=C(O)C(O)=C1 CWVRJTMFETXNAD-JUHZACGLSA-N 0.000 description 3
- 229940074393 chlorogenic acid Drugs 0.000 description 3
- FFQSDFBBSXGVKF-KHSQJDLVSA-N chlorogenic acid Natural products O[C@@H]1C[C@](O)(C[C@@H](CC(=O)C=Cc2ccc(O)c(O)c2)[C@@H]1O)C(=O)O FFQSDFBBSXGVKF-KHSQJDLVSA-N 0.000 description 3
- BMRSEYFENKXDIS-KLZCAUPSSA-N cis-3-O-p-coumaroylquinic acid Natural products O[C@H]1C[C@@](O)(C[C@@H](OC(=O)C=Cc2ccc(O)cc2)[C@@H]1O)C(=O)O BMRSEYFENKXDIS-KLZCAUPSSA-N 0.000 description 3
- 230000007547 defect Effects 0.000 description 3
- TUJPOVKMHCLXEL-UHFFFAOYSA-N eriodictyol Natural products C1C(=O)C2=CC(O)=CC(O)=C2OC1C1=CC=C(O)C(O)=C1 TUJPOVKMHCLXEL-UHFFFAOYSA-N 0.000 description 3
- 235000011797 eriodictyol Nutrition 0.000 description 3
- SBHXYTNGIZCORC-UHFFFAOYSA-N eriodyctiol Natural products O1C2=CC(O)=CC(O)=C2C(=O)CC1C1=CC=C(O)C(O)=C1 SBHXYTNGIZCORC-UHFFFAOYSA-N 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- QZOVLVSTWSTHQN-UHFFFAOYSA-N luteolin 7-O-glucoside Natural products OCC1OC(Oc2cc(O)c3C(=O)C=C(C(=O)c3c2)c4ccc(O)c(O)c4)C(O)C(O)C1O QZOVLVSTWSTHQN-UHFFFAOYSA-N 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- SWWQQSDRUYSMAR-UHFFFAOYSA-N 1-[(4-hydroxyphenyl)methyl]-1,2,3,4-tetrahydroisoquinoline-6,7-diol;hydrochloride Chemical group Cl.C1=CC(O)=CC=C1CC1C2=CC(O)=C(O)C=C2CCN1 SWWQQSDRUYSMAR-UHFFFAOYSA-N 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- 238000005160 1H NMR spectroscopy Methods 0.000 description 2
- XKZQKPRCPNGNFR-UHFFFAOYSA-N 2-(3-hydroxyphenyl)phenol Chemical group OC1=CC=CC(C=2C(=CC=CC=2)O)=C1 XKZQKPRCPNGNFR-UHFFFAOYSA-N 0.000 description 2
- 239000001606 7-[(2S,3R,4S,5S,6R)-4,5-dihydroxy-6-(hydroxymethyl)-3-[(2S,3R,4R,5R,6S)-3,4,5-trihydroxy-6-methyloxan-2-yl]oxyoxan-2-yl]oxy-5-hydroxy-2-(4-hydroxyphenyl)chroman-4-one Substances 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- JMGZEFIQIZZSBH-UHFFFAOYSA-N Bioquercetin Natural products CC1OC(OCC(O)C2OC(OC3=C(Oc4cc(O)cc(O)c4C3=O)c5ccc(O)c(O)c5)C(O)C2O)C(O)C(O)C1O JMGZEFIQIZZSBH-UHFFFAOYSA-N 0.000 description 2
- 101100505076 Caenorhabditis elegans gly-2 gene Proteins 0.000 description 2
- 101100067721 Caenorhabditis elegans gly-3 gene Proteins 0.000 description 2
- 101100228196 Caenorhabditis elegans gly-4 gene Proteins 0.000 description 2
- 101100228200 Caenorhabditis elegans gly-5 gene Proteins 0.000 description 2
- 101100228206 Caenorhabditis elegans gly-6 gene Proteins 0.000 description 2
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- 235000007516 Chrysanthemum Nutrition 0.000 description 2
- 244000189548 Chrysanthemum x morifolium Species 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- IPQKDIRUZHOIOM-UHFFFAOYSA-N Oroxin A Natural products OC1C(O)C(O)C(CO)OC1OC(C(=C1O)O)=CC2=C1C(=O)C=C(C=1C=CC=CC=1)O2 IPQKDIRUZHOIOM-UHFFFAOYSA-N 0.000 description 2
- RXUWDKBZZLIASQ-UHFFFAOYSA-N Puerarin Natural products OCC1OC(Oc2c(O)cc(O)c3C(=O)C(=COc23)c4ccc(O)cc4)C(O)C(O)C1O RXUWDKBZZLIASQ-UHFFFAOYSA-N 0.000 description 2
- 102000019197 Superoxide Dismutase Human genes 0.000 description 2
- 108010012715 Superoxide dismutase Proteins 0.000 description 2
- MNZMECMQTYGSOI-UHFFFAOYSA-N acetic acid;hydron;bromide Chemical compound Br.CC(O)=O MNZMECMQTYGSOI-UHFFFAOYSA-N 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- RPMNUQRUHXIGHK-PYXJVEIZSA-N apigenin 7-O-neohesperidoside Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=C2C(=O)C=C(C=3C=CC(O)=CC=3)OC2=C1 RPMNUQRUHXIGHK-PYXJVEIZSA-N 0.000 description 2
- IKIIZLYTISPENI-ZFORQUDYSA-N baicalin Chemical compound O1[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1OC(C(=C1O)O)=CC2=C1C(=O)C=C(C=1C=CC=CC=1)O2 IKIIZLYTISPENI-ZFORQUDYSA-N 0.000 description 2
- 229960003321 baicalin Drugs 0.000 description 2
- AQHDANHUMGXSJZ-UHFFFAOYSA-N baicalin Natural products OC1C(O)C(C(O)CO)OC1OC(C(=C1O)O)=CC2=C1C(=O)C=C(C=1C=CC=CC=1)O2 AQHDANHUMGXSJZ-UHFFFAOYSA-N 0.000 description 2
- 235000013361 beverage Nutrition 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000003912 environmental pollution Methods 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- SBHXYTNGIZCORC-ZDUSSCGKSA-N eriodictyol Chemical compound C1([C@@H]2CC(=O)C3=C(O)C=C(C=C3O2)O)=CC=C(O)C(O)=C1 SBHXYTNGIZCORC-ZDUSSCGKSA-N 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- DFPMSGMNTNDNHN-ZPHOTFPESA-N naringin Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@H]1[C@H](OC=2C=C3O[C@@H](CC(=O)C3=C(O)C=2)C=2C=CC(O)=CC=2)O[C@H](CO)[C@@H](O)[C@@H]1O DFPMSGMNTNDNHN-ZPHOTFPESA-N 0.000 description 2
- 229930019673 naringin Natural products 0.000 description 2
- 229940052490 naringin Drugs 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 238000002531 positive electrospray ionisation time-of-flight mass spectrometry Methods 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- HKEAFJYKMMKDOR-VPRICQMDSA-N puerarin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1C1=C(O)C=CC(C2=O)=C1OC=C2C1=CC=C(O)C=C1 HKEAFJYKMMKDOR-VPRICQMDSA-N 0.000 description 2
- FDRQPMVGJOQVTL-UHFFFAOYSA-N quercetin rutinoside Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC=2C(C3=C(O)C=C(O)C=C3OC=2C=2C=C(O)C(O)=CC=2)=O)O1 FDRQPMVGJOQVTL-UHFFFAOYSA-N 0.000 description 2
- IKGXIBQEEMLURG-BKUODXTLSA-N rutin Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@@H]1OC[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](OC=2C(C3=C(O)C=C(O)C=C3OC=2C=2C=C(O)C(O)=CC=2)=O)O1 IKGXIBQEEMLURG-BKUODXTLSA-N 0.000 description 2
- 235000005493 rutin Nutrition 0.000 description 2
- ALABRVAAKCSLSC-UHFFFAOYSA-N rutin Natural products CC1OC(OCC2OC(O)C(O)C(O)C2O)C(O)C(O)C1OC3=C(Oc4cc(O)cc(O)c4C3=O)c5ccc(O)c(O)c5 ALABRVAAKCSLSC-UHFFFAOYSA-N 0.000 description 2
- 229960004555 rutoside Drugs 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 229940032362 superoxide dismutase Drugs 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- CSRZQMIRAZTJOY-UHFFFAOYSA-N trimethylsilyl iodide Chemical compound C[Si](C)(C)I CSRZQMIRAZTJOY-UHFFFAOYSA-N 0.000 description 2
- IBGBGRVKPALMCQ-UHFFFAOYSA-N 3,4-dihydroxybenzaldehyde Chemical compound OC1=CC=C(C=O)C=C1O IBGBGRVKPALMCQ-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 235000017166 Bambusa arundinacea Nutrition 0.000 description 1
- 235000017491 Bambusa tulda Nutrition 0.000 description 1
- 101100223920 Caenorhabditis elegans rha-1 gene Proteins 0.000 description 1
- 101100194642 Caenorhabditis elegans rha-2 gene Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102000016938 Catalase Human genes 0.000 description 1
- 108010053835 Catalase Proteins 0.000 description 1
- 241000675108 Citrus tangerina Species 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 1
- 241000790917 Dioxys <bee> Species 0.000 description 1
- OMQADRGFMLGFJF-MNPJBKLOSA-N Eriodictioside Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@H](OC=2C=C3O[C@@H](CC(=O)C3=C(O)C=2)C=2C=C(O)C(O)=CC=2)O1 OMQADRGFMLGFJF-MNPJBKLOSA-N 0.000 description 1
- 241000628997 Flos Species 0.000 description 1
- 229940123457 Free radical scavenger Drugs 0.000 description 1
- 102000006587 Glutathione peroxidase Human genes 0.000 description 1
- 108700016172 Glutathione peroxidases Proteins 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 244000082204 Phyllostachys viridis Species 0.000 description 1
- 235000015334 Phyllostachys viridis Nutrition 0.000 description 1
- 244000046146 Pueraria lobata Species 0.000 description 1
- 235000010575 Pueraria lobata Nutrition 0.000 description 1
- 241001093501 Rutaceae Species 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 241001300193 Speranskia Species 0.000 description 1
- 241000983344 Trachelospermum jasminoides Species 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 229960000583 acetic acid Drugs 0.000 description 1
- 230000000274 adsorptive effect Effects 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 239000004411 aluminium Substances 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000002225 anti-radical effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000009360 aquaculture Methods 0.000 description 1
- 244000144974 aquaculture Species 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 239000011425 bamboo Substances 0.000 description 1
- 235000013405 beer Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 208000015606 cardiovascular system disease Diseases 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 238000002451 electron ionisation mass spectrometry Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 150000002215 flavonoids Chemical class 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000007760 free radical scavenging Effects 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 125000003147 glycosyl group Chemical group 0.000 description 1
- 244000005709 gut microbiome Species 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- SHPPXMGVUDNKLV-KMFFXDMSSA-N luteolin 7-O-neohesperidoside Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=C2C(=O)C=C(C=3C=C(O)C(O)=CC=3)OC2=C1 SHPPXMGVUDNKLV-KMFFXDMSSA-N 0.000 description 1
- SHPPXMGVUDNKLV-YFPBDGJVSA-N luteolin 7-O-neohesperidoside Natural products C[C@@H]1O[C@H](O[C@@H]2[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]2Oc3cc(O)c4C(=O)C=C(Oc4c3)c5ccc(O)c(O)c5)[C@@H](O)[C@H](O)[C@H]1O SHPPXMGVUDNKLV-YFPBDGJVSA-N 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 231100000957 no side effect Toxicity 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 235000020737 peppermint extract Nutrition 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 229960001866 silicon dioxide Drugs 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- DKVBOUDTNWVDEP-NJCHZNEYSA-N teicoplanin aglycone Chemical compound N([C@H](C(N[C@@H](C1=CC(O)=CC(O)=C1C=1C(O)=CC=C2C=1)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)OC=1C=C3C=C(C=1O)OC1=CC=C(C=C1Cl)C[C@H](C(=O)N1)NC([C@H](N)C=4C=C(O5)C(O)=CC=4)=O)C(=O)[C@@H]2NC(=O)[C@@H]3NC(=O)[C@@H]1C1=CC5=CC(O)=C1 DKVBOUDTNWVDEP-NJCHZNEYSA-N 0.000 description 1
- 238000007039 two-step reaction Methods 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 230000036642 wellbeing Effects 0.000 description 1
- 239000009792 yinqiao Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/04—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring
- C07D311/22—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4
- C07D311/26—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4 with aromatic rings attached in position 2 or 3
- C07D311/28—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4 with aromatic rings attached in position 2 or 3 with aromatic rings attached in position 2 only
- C07D311/30—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4 with aromatic rings attached in position 2 or 3 with aromatic rings attached in position 2 only not hydrogenated in the hetero ring, e.g. flavones
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/04—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring
- C07D311/22—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4
- C07D311/26—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4 with aromatic rings attached in position 2 or 3
- C07D311/28—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4 with aromatic rings attached in position 2 or 3 with aromatic rings attached in position 2 only
- C07D311/32—2,3-Dihydro derivatives, e.g. flavanones
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H17/00—Compounds containing heterocyclic radicals directly attached to hetero atoms of saccharide radicals
- C07H17/04—Heterocyclic radicals containing only oxygen as ring hetero atoms
- C07H17/06—Benzopyran radicals
- C07H17/065—Benzo[b]pyrans
- C07H17/07—Benzo[b]pyran-4-ones
Abstract
Description
Claims (8)
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201410059639.7A CN103833714B (zh) | 2014-02-23 | 2014-02-23 | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 |
| PCT/CN2015/073238 WO2015124113A1 (zh) | 2014-02-23 | 2015-02-21 | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201410059639.7A CN103833714B (zh) | 2014-02-23 | 2014-02-23 | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN103833714A true CN103833714A (zh) | 2014-06-04 |
| CN103833714B CN103833714B (zh) | 2016-07-13 |
Family
ID=50797653
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201410059639.7A Expired - Fee Related CN103833714B (zh) | 2014-02-23 | 2014-02-23 | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 |
Country Status (2)
| Country | Link |
|---|---|
| CN (1) | CN103833714B (zh) |
| WO (1) | WO2015124113A1 (zh) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104327136A (zh) * | 2014-11-19 | 2015-02-04 | 陕西嘉禾植物化工有限责任公司 | 一种圣草次甙的制备方法 |
| WO2015124113A1 (zh) * | 2014-02-23 | 2015-08-27 | 闻永举 | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 |
| CN106278825A (zh) * | 2016-08-12 | 2017-01-04 | 荆楚理工学院 | 一种邻羟基苯基烷基醚的醚键断裂方法 |
| CN112851616A (zh) * | 2021-01-25 | 2021-05-28 | 三原润禾生物科技有限公司 | 一种圣草酚的半合成方法 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117330677B (zh) * | 2023-11-24 | 2024-02-23 | 成都凡微析医药科技有限公司 | 一种用于柑橘黄酮片生物等效性研究的香叶木素和橙皮素定量检测的方法 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1544427A (zh) * | 2003-11-20 | 2004-11-10 | 黑龙江大学 | 木犀草素的半合成方法 |
| US20040266699A1 (en) * | 2001-10-04 | 2004-12-30 | Amalia Porta | Flavonoid compounds capable of modifying the dynamic and/or physical state of biological membranes and to stimulate the endogenous synthesis of stress proteins in eukaryotic cells, relative synthesis and their use |
| CN1666987A (zh) * | 2004-03-11 | 2005-09-14 | 南京莱尔生物化工有限公司 | 木犀草素的合成方法 |
| CN103145668A (zh) * | 2013-01-07 | 2013-06-12 | 李玉山 | 一种橙皮苷制备木犀草素的新技术 |
| CN103145670A (zh) * | 2013-01-21 | 2013-06-12 | 李玉山 | 一种半合成制备木犀草素的新工艺 |
| WO2013111148A1 (en) * | 2011-12-13 | 2013-08-01 | Laurus Labs Private Limited | Process for preparation of luteolin |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103833714B (zh) * | 2014-02-23 | 2016-07-13 | 闻永举 | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 |
-
2014
- 2014-02-23 CN CN201410059639.7A patent/CN103833714B/zh not_active Expired - Fee Related
-
2015
- 2015-02-21 WO PCT/CN2015/073238 patent/WO2015124113A1/zh active Application Filing
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040266699A1 (en) * | 2001-10-04 | 2004-12-30 | Amalia Porta | Flavonoid compounds capable of modifying the dynamic and/or physical state of biological membranes and to stimulate the endogenous synthesis of stress proteins in eukaryotic cells, relative synthesis and their use |
| CN1544427A (zh) * | 2003-11-20 | 2004-11-10 | 黑龙江大学 | 木犀草素的半合成方法 |
| CN1666987A (zh) * | 2004-03-11 | 2005-09-14 | 南京莱尔生物化工有限公司 | 木犀草素的合成方法 |
| WO2013111148A1 (en) * | 2011-12-13 | 2013-08-01 | Laurus Labs Private Limited | Process for preparation of luteolin |
| CN103145668A (zh) * | 2013-01-07 | 2013-06-12 | 李玉山 | 一种橙皮苷制备木犀草素的新技术 |
| CN103145670A (zh) * | 2013-01-21 | 2013-06-12 | 李玉山 | 一种半合成制备木犀草素的新工艺 |
Non-Patent Citations (6)
| Title |
|---|
| 刘克建 等: "木犀草素合成研究进展", 《广州化工》 * |
| 单杨 等: "橙皮苷半合成5种生物活性黄酮类化合物", 《有机化学》 * |
| 孙志忠 等: "木犀草素的半合成", 《中国现代应用药学杂志》 * |
| 李玉山 等: "地奥司明的合成工艺", 《实验室研究与探索》 * |
| 李玉山: "橙皮苷研究新进展", 《科技导报》 * |
| 邢有权 等: "木犀草素及其葡萄糖昔的半合成", 《中国医药工业杂志》 * |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015124113A1 (zh) * | 2014-02-23 | 2015-08-27 | 闻永举 | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 |
| CN104327136A (zh) * | 2014-11-19 | 2015-02-04 | 陕西嘉禾植物化工有限责任公司 | 一种圣草次甙的制备方法 |
| CN106278825A (zh) * | 2016-08-12 | 2017-01-04 | 荆楚理工学院 | 一种邻羟基苯基烷基醚的醚键断裂方法 |
| CN106278825B (zh) * | 2016-08-12 | 2019-01-11 | 荆楚理工学院 | 一种邻羟基苯基烷基醚的醚键断裂方法 |
| CN112851616A (zh) * | 2021-01-25 | 2021-05-28 | 三原润禾生物科技有限公司 | 一种圣草酚的半合成方法 |
| CN112851616B (zh) * | 2021-01-25 | 2023-09-26 | 三原润禾生物科技有限公司 | 一种圣草酚的半合成方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN103833714B (zh) | 2016-07-13 |
| WO2015124113A1 (zh) | 2015-08-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103833714B (zh) | 木犀草素、木犀草苷、木犀草素芸香糖苷半合成的方法 | |
| CN105461772A (zh) | 一种曲氟尿苷中间体及曲氟尿苷的制备方法 | |
| CN109180627B (zh) | 一种香叶木素的半合成方法 | |
| JP2019509332A (ja) | バイカリンマグネシウム化合物、その製造方法及び使用 | |
| CN102617673B (zh) | 一种从胡柚白皮层分离纯化柚皮苷和新橙皮苷的方法 | |
| CN104045669B (zh) | 一种适合工业化生产的化学合成红景天苷的分离方法 | |
| CN104151373A (zh) | 一种木脂素苷类化合物及其制备方法 | |
| CN105037483A (zh) | 一种细梗香草皂苷a的制备方法及其用途 | |
| CN102002031A (zh) | 芒果苷元的全化学合成方法 | |
| CN102875511A (zh) | 一种从槐角中综合提取染料木素和山奈酚的方法 | |
| CN103275043A (zh) | 2-芳基苯并呋喃及其衍生物的合成方法 | |
| CN103819520A (zh) | 黄酮芸香糖苷或新橙皮糖苷选择水解鼠李糖制单糖苷方法 | |
| CN102302685A (zh) | 一种淡竹叶提取物及其制备方法和用途 | |
| CN105440092A (zh) | 一种油茶粕中黄酮苷的快速制备方法 | |
| CN103145670A (zh) | 一种半合成制备木犀草素的新工艺 | |
| CN1289609C (zh) | 一种番茄红素结晶及其浓缩物的制备方法 | |
| CN104311616A (zh) | 一种从秦皮中提取高纯度秦皮甲素和秦皮苷的方法 | |
| CN101817827A (zh) | 一种从芝麻中制备芝麻素的方法 | |
| CN103113437A (zh) | 曲克芦丁的制备方法 | |
| CN100572373C (zh) | 一种制备黄芩素的方法 | |
| CN101967505A (zh) | 一种二氢槲皮素的制备方法 | |
| CN108929220A (zh) | 一种没食子酸的制备方法 | |
| CN105732547B (zh) | 一种脱水穿心莲内酯二酸半酯的制备方法 | |
| CN115286606A (zh) | 一种天麻黄酮类化合物及其制备方法和应用 | |
| CN105177090B (zh) | 一种酶法制备穿心莲内酯糖苷衍生物的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| TR01 | Transfer of patent right |
Effective date of registration: 20181221 Address after: 233010 Yuhui Space Pioneer Building 309, 1750 Shengli West Road, Yuhui District, Bengbu City, Anhui Province Patentee after: Anhui Xuan Rui patent assessment technology Co., Ltd. Address before: 336000 576 Xuefu Road, Yuanzhou District, Yichun, Jiangxi. Patentee before: Wen Yongju |
|
| TR01 | Transfer of patent right | ||
| TR01 | Transfer of patent right | ||
| TR01 | Transfer of patent right |
Effective date of registration: 20190510 Address after: 537100 the Guangxi Zhuang Autonomous Region Guigang City, Hong Kong North District Guigang Avenue, Fuji New Town 4, third floor. Patentee after: Guigang thick Shun Information Technology Co., Ltd. Address before: 233010 Yuhui Space Pioneer Building 309, 1750 Shengli West Road, Yuhui District, Bengbu City, Anhui Province Patentee before: Anhui Xuan Rui patent assessment technology Co., Ltd. |
|
| TR01 | Transfer of patent right | ||
| TR01 | Transfer of patent right |
Effective date of registration: 20190703 Address after: 064300 Chestnut Trade Center, Baibaodian, Qianxi County, Tangshan City, Hebei Province Patentee after: Qianxi Chestnut Industry Research Development Center Address before: 537100 the Guangxi Zhuang Autonomous Region Guigang City, Hong Kong North District Guigang Avenue, Fuji New Town 4, third floor. Patentee before: Guigang thick Shun Information Technology Co., Ltd. |
|
| CF01 | Termination of patent right due to non-payment of annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20160713 Termination date: 20210223 |