CN100439513C - 含有非再生酶-辅酶复合体的方法和试剂体系 - Google Patents
含有非再生酶-辅酶复合体的方法和试剂体系 Download PDFInfo
- Publication number
- CN100439513C CN100439513C CNB038110679A CN03811067A CN100439513C CN 100439513 C CN100439513 C CN 100439513C CN B038110679 A CNB038110679 A CN B038110679A CN 03811067 A CN03811067 A CN 03811067A CN 100439513 C CN100439513 C CN 100439513C
- Authority
- CN
- China
- Prior art keywords
- coenzyme
- enzyme
- analyte
- reagent
- complex
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000005515 coenzyme Substances 0.000 title claims abstract description 61
- 239000003153 chemical reaction reagent Substances 0.000 title claims abstract description 42
- 238000000034 method Methods 0.000 title claims abstract description 36
- 230000001172 regenerating effect Effects 0.000 title claims description 6
- 239000012491 analyte Substances 0.000 claims abstract description 35
- 238000001514 detection method Methods 0.000 claims abstract description 34
- 238000006911 enzymatic reaction Methods 0.000 claims abstract description 7
- 239000011159 matrix material Substances 0.000 claims description 19
- 108090000790 Enzymes Proteins 0.000 claims description 17
- 102000004190 Enzymes Human genes 0.000 claims description 17
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 15
- 239000008103 glucose Substances 0.000 claims description 15
- 238000006243 chemical reaction Methods 0.000 claims description 14
- 239000000463 material Substances 0.000 claims description 13
- 238000012360 testing method Methods 0.000 claims description 13
- 101710088194 Dehydrogenase Proteins 0.000 claims description 12
- 230000003287 optical effect Effects 0.000 claims description 8
- -1 Hexose phosphate Chemical class 0.000 claims description 5
- 229910019142 PO4 Inorganic materials 0.000 claims description 5
- 210000004369 blood Anatomy 0.000 claims description 5
- 239000008280 blood Substances 0.000 claims description 5
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 claims description 5
- 239000010452 phosphate Substances 0.000 claims description 5
- 239000000376 reactant Substances 0.000 claims description 5
- XJLXINKUBYWONI-DQQFMEOOSA-N [[(2r,3r,4r,5r)-5-(6-aminopurin-9-yl)-3-hydroxy-4-phosphonooxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [(2s,3r,4s,5s)-5-(3-carbamoylpyridin-1-ium-1-yl)-3,4-dihydroxyoxolan-2-yl]methyl phosphate Chemical compound NC(=O)C1=CC=C[N+]([C@@H]2[C@H]([C@@H](O)[C@H](COP([O-])(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](OP(O)(O)=O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 XJLXINKUBYWONI-DQQFMEOOSA-N 0.000 claims description 4
- 238000010521 absorption reaction Methods 0.000 claims description 4
- 238000004458 analytical method Methods 0.000 claims description 4
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 claims description 3
- ACTIUHUUMQJHFO-UHFFFAOYSA-N Coenzym Q10 Natural products COC1=C(OC)C(=O)C(CC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UHFFFAOYSA-N 0.000 claims description 3
- 150000001413 amino acids Chemical class 0.000 claims description 3
- 210000001124 body fluid Anatomy 0.000 claims description 3
- 239000010839 body fluid Substances 0.000 claims description 3
- 235000017471 coenzyme Q10 Nutrition 0.000 claims description 3
- ACTIUHUUMQJHFO-UPTCCGCDSA-N coenzyme Q10 Chemical compound COC1=C(OC)C(=O)C(C\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UPTCCGCDSA-N 0.000 claims description 3
- BOPGDPNILDQYTO-NNYOXOHSSA-N nicotinamide-adenine dinucleotide Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 BOPGDPNILDQYTO-NNYOXOHSSA-N 0.000 claims description 3
- NPCOQXAVBJJZBQ-UHFFFAOYSA-N reduced coenzyme Q9 Natural products COC1=C(O)C(C)=C(CC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)C)C(O)=C1OC NPCOQXAVBJJZBQ-UHFFFAOYSA-N 0.000 claims description 3
- 210000002966 serum Anatomy 0.000 claims description 3
- 229940035936 ubiquinone Drugs 0.000 claims description 3
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 claims description 2
- KKAJSJJFBSOMGS-UHFFFAOYSA-N 3,6-diamino-10-methylacridinium chloride Chemical group [Cl-].C1=C(N)C=C2[N+](C)=C(C=C(N)C=C3)C3=CC2=C1 KKAJSJJFBSOMGS-UHFFFAOYSA-N 0.000 claims description 2
- 102000007698 Alcohol dehydrogenase Human genes 0.000 claims description 2
- 108010021809 Alcohol dehydrogenase Proteins 0.000 claims description 2
- YPZRHBJKEMOYQH-UYBVJOGSSA-N FADH2 Chemical compound C1=NC2=C(N)N=CN=C2N1[C@@H]([C@H](O)[C@@H]1O)O[C@@H]1COP(O)(=O)OP(O)(=O)OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C(NC(=O)NC2=O)=C2NC2=C1C=C(C)C(C)=C2 YPZRHBJKEMOYQH-UYBVJOGSSA-N 0.000 claims description 2
- YTNIXZGTHTVJBW-SCRDCRAPSA-N FMNH2 Chemical compound OP(=O)(O)OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2NC2=C1NC(=O)NC2=O YTNIXZGTHTVJBW-SCRDCRAPSA-N 0.000 claims description 2
- 101000892220 Geobacillus thermodenitrificans (strain NG80-2) Long-chain-alcohol dehydrogenase 1 Proteins 0.000 claims description 2
- 108030000198 L-amino-acid dehydrogenases Proteins 0.000 claims description 2
- 102000013460 Malate Dehydrogenase Human genes 0.000 claims description 2
- 108010026217 Malate Dehydrogenase Proteins 0.000 claims description 2
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 claims description 2
- FVTCRASFADXXNN-SCRDCRAPSA-N flavin mononucleotide Chemical compound OP(=O)(O)OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O FVTCRASFADXXNN-SCRDCRAPSA-N 0.000 claims description 2
- 239000001630 malic acid Substances 0.000 claims description 2
- 235000011090 malic acid Nutrition 0.000 claims description 2
- 229960002715 nicotine Drugs 0.000 claims description 2
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 claims description 2
- 150000004059 quinone derivatives Chemical class 0.000 claims description 2
- 230000035484 reaction time Effects 0.000 claims 1
- 102000014914 Carrier Proteins Human genes 0.000 abstract 1
- 108091008324 binding proteins Proteins 0.000 abstract 1
- 229940088598 enzyme Drugs 0.000 description 15
- 239000010410 layer Substances 0.000 description 13
- 238000006116 polymerization reaction Methods 0.000 description 10
- 239000007788 liquid Substances 0.000 description 9
- 239000000203 mixture Substances 0.000 description 6
- 239000000178 monomer Substances 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- 239000006096 absorbing agent Substances 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 3
- 239000002985 plastic film Substances 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 238000006479 redox reaction Methods 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 230000008929 regeneration Effects 0.000 description 3
- 238000011069 regeneration method Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- MAGFQRLKWCCTQJ-UHFFFAOYSA-N 4-ethenylbenzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=C(C=C)C=C1 MAGFQRLKWCCTQJ-UHFFFAOYSA-N 0.000 description 2
- 108010015776 Glucose oxidase Proteins 0.000 description 2
- 239000004366 Glucose oxidase Substances 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 238000006555 catalytic reaction Methods 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 238000002983 circular dichroism Methods 0.000 description 2
- 238000003851 corona treatment Methods 0.000 description 2
- 125000004386 diacrylate group Chemical group 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 238000012921 fluorescence analysis Methods 0.000 description 2
- 229940116332 glucose oxidase Drugs 0.000 description 2
- 235000019420 glucose oxidase Nutrition 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 230000001678 irradiating effect Effects 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 239000002594 sorbent Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- OTKCEEWUXHVZQI-UHFFFAOYSA-N 1,2-diphenylethanone Chemical compound C=1C=CC=CC=1C(=O)CC1=CC=CC=C1 OTKCEEWUXHVZQI-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- KWOLFJPFCHCOCG-UHFFFAOYSA-N Acetophenone Natural products CC(=O)C1=CC=CC=C1 KWOLFJPFCHCOCG-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 241001539917 Actina Species 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 101710157860 Oxydoreductase Proteins 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 238000007605 air drying Methods 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000001045 blue dye Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000005518 electrochemistry Effects 0.000 description 1
- 235000019441 ethanol Nutrition 0.000 description 1
- SQHOAFZGYFNDQX-UHFFFAOYSA-N ethyl-[7-(ethylamino)-2,8-dimethylphenothiazin-3-ylidene]azanium;chloride Chemical compound [Cl-].S1C2=CC(=[NH+]CC)C(C)=CC2=NC2=C1C=C(NCC)C(C)=C2 SQHOAFZGYFNDQX-UHFFFAOYSA-N 0.000 description 1
- 238000007421 fluorometric assay Methods 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000003760 hair shine Effects 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- VLCAYQIMSMPEBW-UHFFFAOYSA-N methyl 3-hydroxy-2-methylidenebutanoate Chemical compound COC(=O)C(=C)C(C)O VLCAYQIMSMPEBW-UHFFFAOYSA-N 0.000 description 1
- ZIUHHBKFKCYYJD-UHFFFAOYSA-N n,n'-methylenebisacrylamide Chemical compound C=CC(=O)NCNC(=O)C=C ZIUHHBKFKCYYJD-UHFFFAOYSA-N 0.000 description 1
- KVACMWXLNJTUIA-UHFFFAOYSA-N n-[1,2-dihydroxy-1-(prop-2-enoylamino)ethyl]prop-2-enamide Chemical compound C=CC(=O)NC(O)(CO)NC(=O)C=C KVACMWXLNJTUIA-UHFFFAOYSA-N 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000013047 polymeric layer Substances 0.000 description 1
- 239000004540 pour-on Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 150000003287 riboflavins Chemical class 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000002351 wastewater Substances 0.000 description 1
- 239000001043 yellow dye Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/26—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving oxidoreductase
- C12Q1/32—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving oxidoreductase involving dehydrogenase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/001—Enzyme electrodes
- C12Q1/002—Electrode membranes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/26—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving oxidoreductase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54353—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals with ligand attached to the carrier via a chemical coupling agent
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
- G01N33/54373—Apparatus specially adapted for solid-phase testing involving physiochemical end-point determination, e.g. wave-guides, FETS, gratings
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/582—Recycling of unreacted starting or intermediate materials
Abstract
本发明涉及一种通过酶促反应方法检测样品中分析物的方法和试剂体系,包括用酶-辅酶复合体作为化学计量反应配偶体来检测存在于样品中的分析物。
Description
本发明涉及一种通过酶促反应检测样品中分析物的方法和试剂体系,包括酶-辅酶复合体作为非再生、特别是化学计量量的反应物检测存在于样品中的分析物的用途。
已知通过酶促方法检测分析物,如血中的葡萄糖。这需要待分析的分析物与合适的催化量的酶和辅酶接触。辅酶在还原作用或氧化作用中所产生的氧化还原当量传递给介质,在随后的步骤中利用电化学或光度学方法检测介质。有一个校准提供了检测值和待测分析物浓度之间的直接关系。
Sierra等(Anal.Chem.69(1997),1471-1476)描述了一种基于葡萄糖氧化酶内在荧光特性的血葡萄糖检测方法。在该方法中,使用了催化量的酶和它的辅酶FAD,氧化还原当量被传递给介质氧。
Narayanswamy等(Aanlytical letters21(7)(1988),1165-1175)描述了一种用于葡萄糖检测的葡萄糖脱氢酶和NAD荧光测定方法。在此情况下所使用的酶是催化,即非化学计量的量。用荧光测定方法检测溶液中游离的NADH。
在现有技术检测体系中,需要电化学活性物质(介质)来检测待测的分析物,这是非直接的,即需要通过一系列的化学反应。在此情况下,通常需要对所用物质的浓度作出复杂的调整以尽量提高反应速度。而且,在危险是较长的贮藏阶段,所需的电化学活性物质是不稳定的。
而且,相对于酶-辅酶体系,通常不得不使用过量的介质。辅酶具有高的反应活性,因此介质的分解即使是很小的量,如小于1%或暴露于外部物质,如物质从包装材料向外的挥发,也会导致酶活性的急剧下降。这在分析物检测中会导致错误信号的产生。而且还有一个缺点是,分析物的检测时间通常至少要几秒,对于葡萄糖例如需要大于4秒,并且所需的样品量是大量的,如大于0.5μl。
本发明的目的是至少在一定程度上避免上述现有技术中的缺点。特别是提供一种非敏感和快速的用于分析物酶促检测的方法,使得即使不存在介质或/和指示剂的情况下仍然能够获得可靠的测定结果。
本发明的目的是通过使用酶-辅酶复合体作为化学计量量的反应物,而不是象通常那样作为催化剂来实现的。分析物的检测仅需需要唯一的反应步骤,因此非常快速。在此不再需要介质和指示剂以及复杂的反应混合物,因此也不再具有低稳定性和对干扰的高度敏感性。
因此,本发明的一个方面是提供了一种通过酶促反应检测样品中分析物的方法,包含以下步骤;(a)使样品与包含酶-辅酶复合体的检测试剂接触,其中不发生辅酶的再生,和(b)通过酶-辅酶复合体的变化检测分析物的反应。
本发明的另一方面是提供一种用于检测样品中分析物的试剂体系,包含:(a)包含酶-辅酶复合体的检测试剂,其中不发生辅酶的再生,和(b)容纳检测试剂的载体。
本发明使分析物在非常短的时间内,优选≤5秒,特别优选≤1秒,最优选≤0.1秒,进行简单的定性或定量检测成为可能。反应是在检测过程中不发生辅酶再生的条件下进行的。此外,分子酶-辅酶复合体可仅和一分子的分析物反应。因此,有利的是,反应应当在不存在介质或其它能够导致辅酶再生的物质的条件下进行。
根据所描述的试验设计,检测试剂包含足够量的用于定性或/和定量检测分析物的酶-辅酶复合体。尤其是对于分析物的定量检测,所使用的酶-辅酶复合体的量应当使酶-辅酶复合体的反应分子数目与存在于样品中的分析物的浓度相关联。特别优选所使用的酶-辅酶复合体的量相对于样品中分析物应当是至少化学计量的量,优选相对于分析物是过量的化学计量的量。在这里,“至少化学计量的量”意味着相对于酶-辅酶复合体分子的数目,需要对样品大小作出调整,使得根据预期的样品中分析物的浓度,与分析物反应的酶-辅酶复合体的分子数目与存在于样品中的分析物浓度相关联。“化学计量的量”优选使得指酶-辅酶复合体的分子数目与研究样品中预期的分析物分子最大数目相一致。
本方法和检测体系可以使用最少量的样品,例如,≤1μl的样品量,特别是≤0.1μl的样品量。任选地样品可以在与检测试剂接触前进行稀释。
本发明的方法和检测体系适合检测任何分析物,例如体液参数,体液如血、血清、血浆或尿,也可以是废水或食品。该方法可以在湿态条件下进行如在试管中,或者在干态下有合适反应物载体的条件下进行。
被检测的分析物可以是任何能够与酶-辅酶复合体进行反应,特别是氧化还原反应的生物或化学物质,例如,葡萄糖、乳酸、苹果酸、甘油、醇、胆固醇、甘油三脂,抗坏血酸、半胱氨酸、谷胱甘肽、肽等。
酶促反应优选是氧化还原反应,其中酶-辅酶复合体中的辅酶被还原或氧化。在这类反应中,优选使用的酶是氧化还原酶。特别优选使用的酶是脱氢酶,例如选自葡萄糖脱氢酶(E.C.1.1.1.47)、乳酸脱氢酶(E.C.1.1.127,1.1.1.28)、苹果酸脱氢酶(E.C.1.1.1.37)、甘油脱氢酶(E.C.1.1.1.6)、醇脱氢酶(E.C.1.1.1.1)或氨基酸脱氢酶,如L-氨基酸脱氢酶(E.C.1.4.1.5)。其它适合的酶是氧化酶,例如,葡萄糖氧化酶(E.C.1.1.3.4)或胆固醇氧化酶(E.C.1.1.3.6)。
用于本发明目的的辅酶优选是有机分子,其与酶共价或非共价连接,并且通过分析物的转化而发生变化,如被氧化或被还原。优选的辅酶例子有黄素、烟碱和苯醌衍生物,如核黄素衍生物,如FAD、FADH2、FMN、FMNH2等,烟碱核苷酸衍生物,如NAD+、NADH/H+、NADP+、NADPH/H+等,或泛醌,如辅酶Q、PQQ等。
辅酶通过与分析物反应而发生的变化,原则上可以通过任何方法得到检测。原则上可以使用现有技术中已知的所有检测酶促反应的方法。然而,优选使用光学方法来检测辅酶的变化。光学检测方法包括如测定吸收、荧光、圆二色性(CD)、旋光色散(ORD)、折射测定法等。特别优选通过测定荧光来检测辅酶的变化。荧光测定是高度灵敏的并且即使在微型化体系下分析物的浓度很低仍然能够检测。
本发明的方法和检测体系可以包含液体检测,在此情况下试剂是以例如溶液或悬浮在水或非水液体中、或以粉末或冻干粉的形式存在。但是本发明的方法和检测体系优选包含干态检测,在此情况下试剂被放置到载体上。载体包括例如含有吸附剂或/和可膨胀材料的、可以被待检测样品液体湿润的检测条。
在一个特别优选实施方式中,所使用的检测试剂是凝胶基质,其中嵌入酶-辅酶复合体。优选凝胶基质层厚≤50μm,特别≤5μm,并且被放置到载体上,载体例如至少在一定程度上是光学透明的。凝胶基质可以是含有一种或多种可溶性聚合物的基质,同已知的干态检测体系相同(如AccuChek Active),并且可被刀割下并干燥制备。基质优选基于有可光聚合结构特性的物质,如丙烯酸单体如丙烯酰胺或/和丙烯酸酯、如聚乙二醇二丙烯酸酯、或乙烯芳香族单体如4-乙烯苯磺酸、或其组合的聚合物。该类型凝胶基质可以通过如下方式制备,将含有酶、可光聚合特性单体和任选的辅酶的试剂、光引发剂或/和不反应成分的液体涂覆到至少部分透明的载体如塑料片上,并且例如用UV光从背面照射,使得一种单体或多种单体在载体上发生聚合并达到预定的层厚。层厚可以通过在试剂中加入吸附剂或/和通过调节照射的时间和强度来控制。可以在聚合后去掉过量的液体试剂,并再利用(参看例如图2)。
另一方面,凝胶基质还可以通过通常的涂覆步骤来制备,其中将液体试剂涂覆到载体上,使用合适的方法如使用刮刀使之达到所需要的厚度,然后使之完全聚合。
通过聚合或嵌入包含到基质后,酶处于被保护的微环境中。如果聚合物的凝胶基质是充分交联的,则酶分子处于不可移动状态。然而,低分子量物质或葡萄糖或其它分析物或其辅酶则可以在聚合物网状结构中自由扩散。
酶既可以通过聚合作用与其辅酶共同包含于基质中,也可以在聚合作用后将基质与辅酶溶液接触,使得形成合适的酶-辅酶复合体。凝胶基质中酶的浓度优选足够与待测分析物进行化学计量反应,并且能够进行被反应改变了的辅酶的直接检测。反应仅由唯一的催化反应组成,如氧化还原反应,其可以在毫秒或微秒的时间间隔内完成。被反应改变了的辅酶通过结合到酶的活性中心而得到最适的保护,使其免受干扰影响,并且任选地还可以将其嵌入凝胶基质中。
以下通过附图和实施例详细描述本发明。
附图
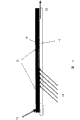
图1表示本发明检测体系第一种实施方式。试剂层(2),如含有酶-辅酶复合体的凝胶基质,涂布到透明的载体(1)上。酶-辅酶复合体是以一种在分析物检测期间使辅酶不能发生再生的形式存在。样品(3)如血,加到试剂层上。包含在样品(3)中的分析物和包含在试剂层(2)中的酶-辅酶复合体之间发生酶促反应通过光学方法进行检测。从光源(4)发出的光,如激光或LED,从后面(穿透载体)射到试剂层(2)。通过检测器(5)检测从样品反射回来的吸收光或荧光。任选地,特别是对于荧光检测,在检测器的前面放上光学过滤元件(6),目的是防止激发荧光的泄漏。
图2表示本发明检测体系的制备。将液体试剂(12)如第一个位置(13)涂到光透明的载体(11)上,如塑料片。从光源(14)发出的光从后面透过载体(11)照射到位于第二位置的液体试剂(12)。同时,沿着(15)所示的箭头方向移动载体。从而在载体(11)上直接形成聚合了的试剂层(16)。在聚合层(16)上有过量的液体试剂。聚合了的反应物层(16)的厚度可以通过调节试剂的组成、光束的强度和照射时间和通过载体(11)的性质来进行控制。
图3表示从后面的荧光传感器的实施方式。聚合了的试剂层,例如通过图2所示的连续步骤制备而成,它可以被切下,利用已知技术放置到载体(21)。将样品放置到向上的一面,从光源射出的激发光(23)如UV从下面射入。分析物与试剂层(22)的酶-辅酶复合体反应产生荧光(24)如蓝光,并用检测器对其进行检测。
将多种试剂(相同或不同)放置到载体上也是可以的。图4显示了其中一个圆盘形式的实施方式。多个试剂点(32)排列在光透明的载体(31)上。
图5A和5B显示了在CCD摄像机下本发明检测体系的荧光(葡萄糖脱氢酶和NAD+)与葡萄糖浓度增加的关系。
实施例
实施例1:在试管中葡萄糖脱氢酶(GlucDH)/NAD+体系下葡萄糖化学计量量的检测
100mg/ml GlucDH溶解于pH7的缓冲溶液并与适量的NAD+混合。随着葡萄糖量的增加,将会在紫外灯(激发波长为366nm)下观察到荧光强度的增加(图5A和5B)。
没有葡萄糖的酶体系的溶液不发出荧光,并且只有葡萄糖和NAD+的溶液也不发出荧光。
实施例2:在聚合物薄膜上在GlucDH/NAD+体系下进行的葡萄糖检测
在塑料试管中混合如下物质的悬浮液
配方1
| 物质 | 量(g) | 重量(%) |
| 丙烯酰胺 | 2.5 | 22.02 |
| 亚甲基双丙烯酰胺 | 0.7 | 6.17 |
| 2,2-二甲氧基-2苯基苯乙酮 | 0.05 | 0.44 |
| 甘油 | 5 | 44.05 |
| 甲基丙烯酸羟乙酯 | 1.4 | 12.33 |
| 甲基丙烯酸甲酯 | 0.4 | 3.52 |
| Crodasinic O溶液,pH8,0.3g/1000ml | 1 | 8.81 |
| N,N’-(1,2-二羟亚乙基)双丙烯酰胺 | 0.3 | 2.64 |
| 总量 | 11.35 | 100 |
0.5ml的悬浮液与0.5ml的GlucDH(100mg/ml)溶液混合,混合物在超声水浴锅中均化去掉气泡。
澄清的溶液倒入电晕处理的聚碳酸酯片上,其厚度125mm,并用常用的照射装置(Isel UV照射仪2)照射20分钟。塑料片短暂地用水冲洗并随后在空气中干燥。
制得的层的厚度<2μm。制备新鲜的葡萄糖/NAD+溶液(GKL-3溶液,300mg/dl的葡萄糖,1ml/6.4mg的NAD+)并倒到薄膜上。在紫外灯下立即可看到强烈的荧光。
实施例3:加紫外吸收剂对层厚的影响
制备更能证明试验结果的包含蓝色染料(最大吸收波长≈650nm)的聚合物层(配方2)。在进一步的试验中,在最初的配方中掺入了黄色染料作为UV吸收剂(配方3)。
配方2
| 物质 | 量 | 重量(%) |
| 丙烯酰胺 | 37.5g(0.53mol) | 25.78 |
| 聚乙二醇二丙烯酸酯,Mw≈575g/mol | 52.5g(约0.96mol) | 36.10 |
| Crodasinic O(0.3g/l l)溶液 | 50g | 34.38 |
| 4-乙烯基苯磺酸 | 5g | 3.44 |
| 2,2-二甲氧基-2-苯基苯乙酮光引发剂 | 350mg | 0.24 |
| 新亚甲蓝N | 100mg | 0.06 |
| 总量 | 145.45g | 100 |
搅拌混合物,并经过超声浴处理均化,用吸管分布到140μm的Pokalon片上(电晕处理,步骤4)并用紫外照射仪(Actina U4,W.Lemmen GmbH)照射1分钟。
用螺旋测定仪(Mikrometerschraube)测量制得的层的厚度,结果为2405μm。
配方3
| 物质 | 量 | 重量(%) |
| 配方2 | 1ml | 约99.99 |
| 黄色媒染剂7(No.686)(紫外吸收剂) | 0.0001g | 0.001 |
| 总量 | 约1.0001g | 100 |
将混合物如上所述分布到薄片上并随后聚合。用螺旋测定仪测量制得的层的厚度,结果为79.3μm。
试验结果表明是可以影响层的厚度的。其它条件相同的条件下,没有紫外吸收剂的情况下层厚240.5μm;在有紫外吸收剂(黄色媒染剂7)的情况下层厚仅为79.3μm。
Claims (23)
1.通过酶促反应检测样品中分析物的方法,包含如下步骤:(a)在不发生辅酶再生的条件下,使样品与包含酶-辅酶复合体的检测试剂接触,其中酶是脱氢酶,和(b)通过酶-辅酶复合体的变化检测分析物的反应。
2.根据权利要求1所述的方法,其特征在于所述脱氢酶选自葡萄糖脱氢酶(E.C.1.1.1.47)、乳酸脱氢酶(E.C.1.1.1.27,1.1.1.28)、苹果酸脱氢酶(E.C.1.1.1.37)、甘油脱氢酶(E.C.1.1.1.6)、醇脱氢酶(E.C.1.1.1.1)或氨基酸脱氢酶。
3.根据权利要求1所述的方法,其特征在于所使用的辅酶选自黄素、烟碱和苯醌衍生物。
4.根据权利要求3所述的方法,其特征在于辅酶选自FAD、FADH2、FMN、FMNH2、辅酶Q、PQQ、NAD+、NADH/H+、NADP+和NADPH/H+。
5.根据权利要求1-4中任一项所述的方法,其特征在于通过光学方法检测辅酶的变化。
6.根据权利要求5所述的方法,其特征在于通过测定吸收、荧光、CD、ORD或折射来检测辅酶的变化。
7.根据权利要求6所述的方法,其特征在于通过测定荧光来检测辅酶的变化。
8.根据权利要求1-4中任一项所述的方法,其特征在于使用其中具有嵌入的酶-辅酶复合体的凝胶基质作为检测试剂。
9.根据权利要求8所述的方法,其特征在于凝胶基质的层厚≤50μm。
10.根据权利要求9所述的方法,其特征在于凝胶基质的层厚≤5μm。
11.根据权利要求8所述的方法,其特征在于使用以可光聚合物质为基础的凝胶基质。
12.根据权利要求1-4中任一项所述的方法,其特征在于检测体液中的分析物。
13.根据权利要求12所述的方法,其特征在于进行血中葡萄糖的检测。
14.根据权利要求1-4中任一项所述的方法,其特征在于分析物的反应时间≤5秒。
15.根据权利要求1-4中任一项所述的方法,其特征在于反应是在不存在可与辅酶发生反应的介质的情况下进行的。
16.根据权利要求1-4中任一项所述的方法,其特征在于相对于分析物,使用的酶-辅酶复合体作为化学计量量的反应物。
17.根据权利要求2所述的方法,其特征在于所述氨基酸脱氢酶为L-氨基酸脱氢酶(E.C.1.4.1.5)。
18.一种用于检测样品中分析物的试剂体系,包含:(a)包含以不发生辅酶再生的形式存在的酶-辅酶复合体的检测试剂,其中使用的酶是脱氢酶,和(b)容纳检测试剂的载体。
19.根据权利要求18所述的试剂体系,其特征在于酶-辅酶复合体嵌入凝胶基质中。
20.根据权利要求18或19所述的试剂体系,其特征在于载体至少部分地是光学透明的。
21.根据权利要求18或19所述的试剂体系,其特征在于载体包含平的结构。
22.根据权利要求18或19所述的试剂体系,其特征在于载体包含多个不同的检测试剂。
23.根据权利要求18-22任一项所述的试剂体系在权利要求1-17任一项所述的方法中的应用。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE2002121845 DE10221845A1 (de) | 2002-05-16 | 2002-05-16 | Verfahren und Reagenzsystem mit nicht-regenerierbarem Enzym-Coenzym-Komplex |
| DE2002121840 DE10221840A1 (de) | 2002-05-16 | 2002-05-16 | Verfahren zur Herstellung von Polymerschichten |
| DE2002121846 DE10221846A1 (de) | 2002-05-16 | 2002-05-16 | Verfahren und Reagenzsystem mit inaktiviertem Enzym |
| DE10221840.4 | 2002-05-16 | ||
| DE10221846.3 | 2002-05-16 | ||
| DE10221845.5 | 2002-05-16 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1653190A CN1653190A (zh) | 2005-08-10 |
| CN100439513C true CN100439513C (zh) | 2008-12-03 |
Family
ID=29553736
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN038110814A Expired - Fee Related CN1653189B (zh) | 2002-05-16 | 2003-05-16 | 制备聚合物涂层的方法 |
| CNB038110679A Expired - Fee Related CN100439513C (zh) | 2002-05-16 | 2003-05-16 | 含有非再生酶-辅酶复合体的方法和试剂体系 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN038110814A Expired - Fee Related CN1653189B (zh) | 2002-05-16 | 2003-05-16 | 制备聚合物涂层的方法 |
Country Status (15)
| Country | Link |
|---|---|
| US (3) | US8846132B2 (zh) |
| EP (3) | EP1504116A1 (zh) |
| JP (4) | JP2005532796A (zh) |
| KR (2) | KR101164048B1 (zh) |
| CN (2) | CN1653189B (zh) |
| AT (1) | ATE345396T1 (zh) |
| AU (3) | AU2003240666B2 (zh) |
| BR (2) | BR0311175A (zh) |
| CA (2) | CA2493918C (zh) |
| DE (1) | DE50305687D1 (zh) |
| DK (1) | DK1504113T3 (zh) |
| ES (1) | ES2275095T3 (zh) |
| HK (2) | HK1081599A1 (zh) |
| MX (2) | MXPA04011103A (zh) |
| WO (3) | WO2003097863A1 (zh) |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005532796A (ja) * | 2002-05-16 | 2005-11-04 | エフ ホフマン−ラ ロッシュ アクチェン ゲゼルシャフト | 再生不能の酵素−補酵素複合体を有する方法および試薬システム |
| DE10325699B3 (de) * | 2003-06-06 | 2005-02-10 | Roche Diagnostics Gmbh | System zur Analyse einer zu untersuchenden Probe und Verwendung eines solchen Systems |
| DE102004007983A1 (de) * | 2004-02-18 | 2005-09-08 | Roche Diagnostics Gmbh | Testelement mit Einschicht-Reaktionsfilm |
| DE102004051830B4 (de) * | 2004-10-25 | 2007-12-13 | Roche Diagnostics Gmbh | Multifunktionales Referenzsystem bei Analytbestimmungen durch Fluoreszenz |
| US20060281187A1 (en) | 2005-06-13 | 2006-12-14 | Rosedale Medical, Inc. | Analyte detection devices and methods with hematocrit/volume correction and feedback control |
| DE102005035461A1 (de) | 2005-07-28 | 2007-02-15 | Roche Diagnostics Gmbh | Stabile NAD/NADH-Derivate |
| JP5147702B2 (ja) | 2005-09-30 | 2013-02-20 | インテュイティ メディカル インコーポレイテッド | 完全に統合された、ウエアラブル又はハンドヘルドモニタ |
| CA2564666A1 (en) * | 2005-10-25 | 2007-04-25 | F. Hoffmann-La Roche Ag | Fluorescence spectroscopy in absorbing media |
| GB0526051D0 (en) | 2005-12-21 | 2006-02-01 | Oxford Biosensors Ltd | Cholesterol sensor |
| EP1830177A1 (de) | 2006-03-02 | 2007-09-05 | F. Hoffman-la Roche AG | Integriertes Testelement |
| US20100056740A1 (en) * | 2006-06-14 | 2010-03-04 | Brigham Young University | Adsorption-resistant acrylic copolymer for fluidic devices |
| EP2022859A1 (de) * | 2007-08-01 | 2009-02-11 | Roche Diagnostics GmbH | Verfahren und Vorrichtung zur Bestimmung der Konzentration eines Analyten mittels Fluoreszenzmessung |
| EP2093284A1 (de) | 2008-02-19 | 2009-08-26 | F.Hoffmann-La Roche Ag | Stabilisierung von Dehydrogenasen mit stabilen Coenzymen |
| US9833183B2 (en) | 2008-05-30 | 2017-12-05 | Intuity Medical, Inc. | Body fluid sampling device—sampling site interface |
| JP5642066B2 (ja) | 2008-06-06 | 2014-12-17 | インテュイティ メディカル インコーポレイテッド | 体液の試料内に含まれている検体の存在または濃度を決定する検定を行う方法および装置 |
| CA2730544C (en) | 2008-07-11 | 2017-08-29 | Universal Biosensors Pty Ltd | Enhanced immunoassay sensor |
| EP2398909B1 (de) | 2009-02-19 | 2015-07-22 | F. Hoffmann-La Roche AG | Schnelle reaktionskinetik von enzymen mit niedriger aktivität in trockenen chemieschichten |
| WO2010094427A2 (de) | 2009-02-19 | 2010-08-26 | Roche Diagnostics Gmbh | Platzsparende magazinierung analytischer hilfsmittel |
| EP2226008A1 (de) | 2009-02-19 | 2010-09-08 | Roche Diagnostics GmbH | Verfahren zur Herstellung eines analytischen Magazins |
| EP2226007A1 (de) | 2009-02-19 | 2010-09-08 | Roche Diagnostics GmbH | Testelementmagazin mit abgedeckten Testfeldern |
| EP2292751A1 (de) | 2009-08-20 | 2011-03-09 | Roche Diagnostics GmbH | Stabilisierung von Enzymen mit stabilen Coenzymen |
| EP2506768B1 (en) | 2009-11-30 | 2016-07-06 | Intuity Medical, Inc. | Calibration material delivery devices and methods |
| EP2362207A1 (de) * | 2010-01-28 | 2011-08-31 | F. Hoffmann-La Roche AG | Messsystem und Messverfahren insbesondere zur Blutzuckerbestimmung |
| US9752990B2 (en) | 2013-09-30 | 2017-09-05 | Honeywell International Inc. | Low-powered system for driving a fuel control mechanism |
| EP2696764B1 (de) | 2011-04-12 | 2015-10-14 | Roche Diagnostics GmbH | Analytisches hilfsmittel |
| WO2013020103A1 (en) | 2011-08-03 | 2013-02-07 | Intuity Medical, Inc. | Devices and methods for body fluid sampling and analysis |
| EP2620507A1 (en) | 2012-01-25 | 2013-07-31 | Roche Diagnostics GmbH | Method for the evaluation of the quality of a test element |
| WO2013156526A1 (de) | 2012-04-19 | 2013-10-24 | F. Hoffmann-La Roche Ag | Verfahren und vorrichtung zur bestimmung einer analytkonzentration in blut |
| DE102013104906B4 (de) * | 2013-05-13 | 2015-06-25 | Brandenburgische Technische Universität Cottbus-Senftenberg | Wasserfreie Immobilisierung von Enzymen |
| EP3004372A1 (en) | 2013-06-04 | 2016-04-13 | Roche Diagnostics GmbH | Novel compounds useful for fret and methods related thereto |
| SG11201700876RA (en) * | 2014-08-05 | 2017-03-30 | Becton Dickinson Co | Methods and compositions for analyzing glucose-6-phosphate dehydrogenase activity in blood samples |
| KR102273051B1 (ko) | 2014-10-21 | 2021-07-06 | 삼성디스플레이 주식회사 | 정공 수송용 재료 및 이를 이용한 유기 발광 소자 |
| EP3339431A1 (en) | 2016-12-22 | 2018-06-27 | Roche Diabetes Care GmbH | Glucose dehydrogenase variants with improved properties |
| WO2020064723A1 (de) * | 2018-09-24 | 2020-04-02 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | MAßGESCHNEIDERTE SCHICHTEN AUS CELLULOSE-DISPERSIONEN ZUM NACHWEIS VON ANALYTEN |
| US11579093B2 (en) | 2020-04-22 | 2023-02-14 | SciLogica Corp. | Optical component |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4118880A1 (de) * | 1991-06-08 | 1992-12-17 | Fraunhofer Ges Forschung | Verfahren und vorrichtung zur selektiven bestimmung der konzentration von geloesten substanzen in enzymatischen reaktionen |
| US5447847A (en) * | 1993-09-02 | 1995-09-05 | Nissui Pharmaceutical Co., Ltd. | Quantitative determination of pyruvic acid and quantitative analysis for component of living body making use of such determination |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BE638336A (zh) * | 1964-12-21 | 1964-02-03 | ||
| CS164231B2 (zh) * | 1972-09-28 | 1975-11-07 | ||
| DE2924249C2 (de) * | 1978-06-22 | 1989-04-27 | Miles, Inc., Elkhart, Ind., Us | Spezifische bindungs-untersuchungsmethode zur bestimmung eines liganden in einem fluessigen medium und reagentien zur durchfuehrung dieser methode |
| US4238565A (en) | 1978-06-22 | 1980-12-09 | Miles Laboratories, Inc. | Specific binding assay with a prosthetic group as a label component |
| AT367796B (de) * | 1979-10-29 | 1982-07-26 | List Hans | Verfahren zur bestimmung einer stoffkonzentration in einer loesung |
| US4451568A (en) * | 1981-07-13 | 1984-05-29 | Battelle Memorial Institute | Composition for binding bioactive substances |
| DE3332144A1 (de) * | 1982-09-06 | 1984-03-08 | Konishiroku Photo Industry Co., Ltd., Tokyo | Analytisches element |
| DE3477849D1 (en) * | 1983-12-06 | 1989-05-24 | Ici Plc | Dry film resists |
| US4820399A (en) * | 1984-08-31 | 1989-04-11 | Shimadzu Corporation | Enzyme electrodes |
| GB8608435D0 (en) * | 1986-04-07 | 1986-05-14 | Cranfield Inst Of Tech | Specific binding assays |
| JPH0710896B2 (ja) | 1987-04-30 | 1995-02-08 | 第一工業製薬株式会社 | 高分子量カチオン性アクリル系重合体の製造方法 |
| GB8718430D0 (en) * | 1987-08-04 | 1987-09-09 | Ici Plc | Sensor |
| AU602277B2 (en) * | 1988-02-10 | 1990-10-04 | Miles Inc. | Self-indicating and improved resolution analyses employing stoichiometric chemical substraction |
| US5340722A (en) * | 1988-08-24 | 1994-08-23 | Avl Medical Instruments Ag | Method for the determination of the concentration of an enzyme substrate and a sensor for carrying out the method |
| US5296305A (en) * | 1990-05-11 | 1994-03-22 | Esslior International (Compagnie Generale D'optique) | Method of fabricating a lens made of transparent polymer with modulated refracting index |
| GB9022304D0 (en) * | 1990-10-15 | 1990-11-28 | Ares Serono Res & Dev Ltd | Assay technique |
| JP2977265B2 (ja) * | 1990-11-19 | 1999-11-15 | 旭化成工業株式会社 | 感光性エラストマー構成体 |
| JPH06506019A (ja) * | 1991-12-18 | 1994-07-07 | シメッド ライフ システムズ インコーポレイテッド | 潤滑性ポリマーネットワーク |
| DE59307720D1 (de) * | 1992-03-23 | 1998-01-08 | Siemens Ag | Biosensor |
| JPH07115997A (ja) | 1993-08-31 | 1995-05-09 | Iatron Lab Inc | Gpt測定用試薬 |
| JPH07115998A (ja) | 1993-08-31 | 1995-05-09 | Iatron Lab Inc | Got測定用試薬 |
| GB9404805D0 (en) * | 1994-03-11 | 1994-04-27 | Minnesota Mining & Mfg | Novel developing agents for (photo)thermographic systems |
| JP2986712B2 (ja) * | 1995-05-01 | 1999-12-06 | キヤノン株式会社 | 化学センサ、それを用いた塩化物イオン濃度の測定装置及び測定方法 |
| US5691205A (en) * | 1994-06-23 | 1997-11-25 | Canon Kabushiki Kaisha | Fluorometric analysis of chloride ion and chemical sensor therefor |
| DE4424179C2 (de) * | 1994-07-08 | 1998-09-10 | Biotechnolog Forschung Gmbh | UV-polymerisierbare Enzympaste zur Herstellung von Dickschicht-Biosensoren und damit hergestellte Dickschicht-Biosensoren |
| JPH09248200A (ja) | 1996-03-13 | 1997-09-22 | Nissho Corp | グルコース測定用試薬 |
| US5863650A (en) * | 1997-05-05 | 1999-01-26 | Bioengineered Materials, Inc. | Interfacial coatings |
| JP2000035413A (ja) | 1998-07-16 | 2000-02-02 | Sapporo Imuno Diagnostic Laboratory:Kk | 脱水素酵素と補酵素を用いたバイオセンサ |
| AT409307B (de) | 1999-01-12 | 2002-07-25 | Hoffmann La Roche | Optisch-chemischer sensor |
| JP3869601B2 (ja) | 1999-11-26 | 2007-01-17 | 株式会社トクヤマ | ホモシステインの測定方法 |
| US6635412B2 (en) * | 2000-07-11 | 2003-10-21 | Martin A. Afromowitz | Method for fabricating 3-D structures with smoothly-varying topographic features in photo-sensitized epoxy resists |
| WO2002052045A1 (en) | 2000-12-26 | 2002-07-04 | Aviva Biosciences | Active and biocompatible platforms prepared by polymerization of surface coating films |
| US20030087178A1 (en) * | 2001-04-20 | 2003-05-08 | Adrian Lungu | Photopolymerizable element for use as a flexographic printing plate and a process for preparing the plate from the element |
| JP2005532796A (ja) * | 2002-05-16 | 2005-11-04 | エフ ホフマン−ラ ロッシュ アクチェン ゲゼルシャフト | 再生不能の酵素−補酵素複合体を有する方法および試薬システム |
| US7553615B2 (en) * | 2005-07-28 | 2009-06-30 | Roche Diagnostics Operations, Inc. | Compounds, methods, complexes, apparatuses and uses relating to stabile forms of NAD/NADH |
| EP1964927A1 (de) * | 2007-02-27 | 2008-09-03 | F. Hoffmann-La Roche AG | Chinone als Mediatoren für photometrische Teste |
| US20080219811A1 (en) * | 2007-03-05 | 2008-09-11 | Van Der Meulen Peter | Semiconductor manufacturing process modules |
| EP2022859A1 (de) * | 2007-08-01 | 2009-02-11 | Roche Diagnostics GmbH | Verfahren und Vorrichtung zur Bestimmung der Konzentration eines Analyten mittels Fluoreszenzmessung |
-
2003
- 2003-05-16 JP JP2004506519A patent/JP2005532796A/ja active Pending
- 2003-05-16 CA CA2493918A patent/CA2493918C/en not_active Expired - Fee Related
- 2003-05-16 MX MXPA04011103A patent/MXPA04011103A/es active IP Right Grant
- 2003-05-16 US US10/514,758 patent/US8846132B2/en active Active
- 2003-05-16 AU AU2003240666A patent/AU2003240666B2/en not_active Ceased
- 2003-05-16 KR KR1020047018213A patent/KR101164048B1/ko not_active IP Right Cessation
- 2003-05-16 AU AU2003240260A patent/AU2003240260B2/en not_active Ceased
- 2003-05-16 US US10/514,451 patent/US7341830B2/en not_active Expired - Fee Related
- 2003-05-16 MX MXPA04011220A patent/MXPA04011220A/es active IP Right Grant
- 2003-05-16 WO PCT/EP2003/005177 patent/WO2003097863A1/de active Application Filing
- 2003-05-16 WO PCT/EP2003/005179 patent/WO2003097859A2/de active IP Right Grant
- 2003-05-16 CN CN038110814A patent/CN1653189B/zh not_active Expired - Fee Related
- 2003-05-16 BR BR0311175-0A patent/BR0311175A/pt not_active IP Right Cessation
- 2003-05-16 DK DK03730061T patent/DK1504113T3/da active
- 2003-05-16 AT AT03730061T patent/ATE345396T1/de active
- 2003-05-16 CN CNB038110679A patent/CN100439513C/zh not_active Expired - Fee Related
- 2003-05-16 ES ES03730061T patent/ES2275095T3/es not_active Expired - Lifetime
- 2003-05-16 JP JP2004506518A patent/JP4656938B2/ja not_active Expired - Fee Related
- 2003-05-16 EP EP03752757A patent/EP1504116A1/de not_active Withdrawn
- 2003-05-16 BR BRPI0309947-4B1A patent/BR0309947B1/pt not_active IP Right Cessation
- 2003-05-16 CA CA2486950A patent/CA2486950C/en not_active Expired - Fee Related
- 2003-05-16 DE DE50305687T patent/DE50305687D1/de not_active Expired - Lifetime
- 2003-05-16 JP JP2004506514A patent/JP5118288B2/ja not_active Expired - Fee Related
- 2003-05-16 EP EP03732396A patent/EP1504115A1/de not_active Withdrawn
- 2003-05-16 AU AU2003232790A patent/AU2003232790A1/en not_active Abandoned
- 2003-05-16 KR KR1020047018212A patent/KR101002194B1/ko not_active IP Right Cessation
- 2003-05-16 WO PCT/EP2003/005178 patent/WO2003097864A1/de active Application Filing
- 2003-05-16 EP EP03730061A patent/EP1504113B1/de not_active Expired - Lifetime
-
2006
- 2006-02-07 HK HK06101610.2A patent/HK1081599A1/xx not_active IP Right Cessation
- 2006-02-08 HK HK06101676.3A patent/HK1081600A1/xx not_active IP Right Cessation
-
2008
- 2008-01-10 US US12/008,283 patent/US7951581B2/en not_active Expired - Fee Related
-
2009
- 2009-08-19 JP JP2009190529A patent/JP2009275233A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4118880A1 (de) * | 1991-06-08 | 1992-12-17 | Fraunhofer Ges Forschung | Verfahren und vorrichtung zur selektiven bestimmung der konzentration von geloesten substanzen in enzymatischen reaktionen |
| US5447847A (en) * | 1993-09-02 | 1995-09-05 | Nissui Pharmaceutical Co., Ltd. | Quantitative determination of pyruvic acid and quantitative analysis for component of living body making use of such determination |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN100439513C (zh) | 含有非再生酶-辅酶复合体的方法和试剂体系 | |
| Lad et al. | Electrochemical creatinine biosensors | |
| Kuswandi et al. | Optical fibre biosensors based on immobilised enzymes | |
| US20060121547A1 (en) | Diffusion layer for an enzyme-based sensor application | |
| JP2005528896A5 (zh) | ||
| US20030164024A1 (en) | Biosensor and method for production thereof | |
| JP2015535077A (ja) | デバイスおよびアミノアシドパシーの検出のためにデバイスを用いる方法 | |
| JPH01280242A (ja) | 酸素濃度測定装置及び酸素濃度測定法 | |
| Ngo | Bioanalytical applications of immobilized enzymes | |
| JPH10206417A (ja) | 血液化学分析材料及び血液化学分析方法 | |
| Gautier et al. | Cofactor-containing bioluminescent fibre-optic sensor: new developments with poly (vinyl alcohol) matrices | |
| JPH10206419A (ja) | 血液化学分析材料 | |
| JPH11290096A (ja) | リン酸イオン濃度の定量方法 | |
| Wangsa | Chemical sensors: Accuracy of sodium glass electrodes and the development of NADH-based fiber optic biosensors | |
| Kharat et al. | Development of an optical urea biosensor using polypyrrole-polyvinyl sulphonate film | |
| Huang et al. | Preparation and properties of new complex sensing film for fiber optic glucose sensor | |
| Chan | Development of luminescence-based oxygen and pH optodes for toxicity and process monitoring | |
| Zhang | Development and Characterization of Fiber Optic Biosensors Utilizing Enzyme Amplification and Plant Tissue Materials | |
| JPH10206418A (ja) | 血液化学分析材料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1081600 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1081600 Country of ref document: HK |
|
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20081203 Termination date: 20140516 |