WO2016186177A1 - Wt1抗原ペプチドおよび免疫調節剤の併用 - Google Patents
Wt1抗原ペプチドおよび免疫調節剤の併用 Download PDFInfo
- Publication number
- WO2016186177A1 WO2016186177A1 PCT/JP2016/064923 JP2016064923W WO2016186177A1 WO 2016186177 A1 WO2016186177 A1 WO 2016186177A1 JP 2016064923 W JP2016064923 W JP 2016064923W WO 2016186177 A1 WO2016186177 A1 WO 2016186177A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- peptide
- seq
- cancer
- antibody
- pharmaceutical composition
- Prior art date
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 402
- 108091007433 antigens Proteins 0.000 title claims abstract description 205
- 102000036639 antigens Human genes 0.000 title claims abstract description 205
- 239000000427 antigen Substances 0.000 title claims abstract description 201
- 239000002955 immunomodulating agent Substances 0.000 title claims abstract description 79
- 229940121354 immunomodulator Drugs 0.000 title claims abstract description 76
- 230000002584 immunomodulator Effects 0.000 title claims abstract description 70
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 93
- 150000003839 salts Chemical class 0.000 claims abstract description 84
- 201000011510 cancer Diseases 0.000 claims abstract description 61
- 102000040856 WT1 Human genes 0.000 claims abstract description 23
- 108700020467 WT1 Proteins 0.000 claims abstract description 23
- 101150084041 WT1 gene Proteins 0.000 claims abstract description 20
- 239000008194 pharmaceutical composition Substances 0.000 claims description 128
- 239000003112 inhibitor Substances 0.000 claims description 104
- 239000000556 agonist Substances 0.000 claims description 67
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 claims description 66
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 claims description 66
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 claims description 66
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 claims description 66
- 239000003814 drug Substances 0.000 claims description 61
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 58
- 229940079593 drug Drugs 0.000 claims description 50
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 43
- 102100040678 Programmed cell death protein 1 Human genes 0.000 claims description 43
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 42
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 claims description 42
- 210000004027 cell Anatomy 0.000 claims description 41
- 239000003795 chemical substances by application Substances 0.000 claims description 41
- 229910052799 carbon Inorganic materials 0.000 claims description 40
- 150000001413 amino acids Chemical class 0.000 claims description 39
- 101800000324 Immunoglobulin A1 protease translocator Proteins 0.000 claims description 37
- 230000000139 costimulatory effect Effects 0.000 claims description 33
- 150000001875 compounds Chemical class 0.000 claims description 22
- 108090000623 proteins and genes Proteins 0.000 claims description 18
- 230000001939 inductive effect Effects 0.000 claims description 17
- 210000002443 helper t lymphocyte Anatomy 0.000 claims description 16
- 102000004169 proteins and genes Human genes 0.000 claims description 14
- 150000003384 small molecules Chemical class 0.000 claims description 14
- 229940045513 CTLA4 antagonist Drugs 0.000 claims description 12
- 229940123384 Toll-like receptor (TLR) agonist Drugs 0.000 claims description 12
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 11
- 108010081208 RMFPNAPYL Proteins 0.000 claims description 11
- 239000007787 solid Substances 0.000 claims description 10
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 claims description 9
- 102000015735 Beta-catenin Human genes 0.000 claims description 8
- 108060000903 Beta-catenin Proteins 0.000 claims description 8
- 108010021064 CTLA-4 Antigen Proteins 0.000 claims description 8
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 claims description 8
- 239000012190 activator Substances 0.000 claims description 8
- 239000003937 drug carrier Substances 0.000 claims description 8
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 claims description 7
- 102100024263 CD160 antigen Human genes 0.000 claims description 7
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 claims description 7
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 claims description 7
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 claims description 7
- 101000761938 Homo sapiens CD160 antigen Proteins 0.000 claims description 7
- 101000586618 Homo sapiens Poliovirus receptor Proteins 0.000 claims description 7
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 claims description 7
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 claims description 7
- 102000017578 LAG3 Human genes 0.000 claims description 7
- 101150030213 Lag3 gene Proteins 0.000 claims description 7
- 102100029740 Poliovirus receptor Human genes 0.000 claims description 7
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 claims description 7
- 102000002689 Toll-like receptor Human genes 0.000 claims description 7
- 108020000411 Toll-like receptor Proteins 0.000 claims description 7
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims description 7
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims description 7
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 claims description 7
- 229940022399 cancer vaccine Drugs 0.000 claims description 7
- 238000009566 cancer vaccine Methods 0.000 claims description 7
- 201000001441 melanoma Diseases 0.000 claims description 7
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 claims description 7
- 229940044655 toll-like receptor 9 agonist Drugs 0.000 claims description 7
- 101150013553 CD40 gene Proteins 0.000 claims description 6
- 201000009030 Carcinoma Diseases 0.000 claims description 6
- 101000831496 Homo sapiens Toll-like receptor 3 Proteins 0.000 claims description 6
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 claims description 6
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 6
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 6
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 claims description 6
- 229940124613 TLR 7/8 agonist Drugs 0.000 claims description 6
- 102100024324 Toll-like receptor 3 Human genes 0.000 claims description 6
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 claims description 6
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 claims description 6
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 claims description 6
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 6
- 210000003169 central nervous system Anatomy 0.000 claims description 6
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 claims description 6
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 claims description 6
- 208000032839 leukemia Diseases 0.000 claims description 6
- FBFJOZZTIXSPPR-UHFFFAOYSA-N 1-(4-aminobutyl)-2-(ethoxymethyl)imidazo[4,5-c]quinolin-4-amine Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CCCCN)C3=C(N)N=C21 FBFJOZZTIXSPPR-UHFFFAOYSA-N 0.000 claims description 5
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 claims description 5
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 claims description 5
- 102100040061 Indoleamine 2,3-dioxygenase 1 Human genes 0.000 claims description 5
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 claims description 5
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 claims description 5
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 claims description 5
- 108010017324 STAT3 Transcription Factor Proteins 0.000 claims description 5
- 206010039491 Sarcoma Diseases 0.000 claims description 5
- 102100024040 Signal transducer and activator of transcription 3 Human genes 0.000 claims description 5
- 229940111134 coxibs Drugs 0.000 claims description 5
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 claims description 5
- 206010041823 squamous cell carcinoma Diseases 0.000 claims description 5
- 102100027140 Butyrophilin subfamily 1 member A1 Human genes 0.000 claims description 4
- 102100027156 Butyrophilin subfamily 2 member A2 Human genes 0.000 claims description 4
- 102100027155 Butyrophilin subfamily 3 member A2 Human genes 0.000 claims description 4
- 102100025429 Butyrophilin-like protein 2 Human genes 0.000 claims description 4
- 102100038078 CD276 antigen Human genes 0.000 claims description 4
- 101710185679 CD276 antigen Proteins 0.000 claims description 4
- 102100031351 Galectin-9 Human genes 0.000 claims description 4
- 101100229077 Gallus gallus GAL9 gene Proteins 0.000 claims description 4
- 101000984929 Homo sapiens Butyrophilin subfamily 1 member A1 Proteins 0.000 claims description 4
- 101000984925 Homo sapiens Butyrophilin subfamily 2 member A2 Proteins 0.000 claims description 4
- 101000984917 Homo sapiens Butyrophilin subfamily 3 member A2 Proteins 0.000 claims description 4
- 101000934738 Homo sapiens Butyrophilin-like protein 2 Proteins 0.000 claims description 4
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 4
- 108010043610 KIR Receptors Proteins 0.000 claims description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 4
- 206010038389 Renal cancer Diseases 0.000 claims description 4
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 4
- 229940124614 TLR 8 agonist Drugs 0.000 claims description 4
- 108010079206 V-Set Domain-Containing T-Cell Activation Inhibitor 1 Proteins 0.000 claims description 4
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 claims description 4
- 229950009791 durvalumab Drugs 0.000 claims description 4
- 201000010982 kidney cancer Diseases 0.000 claims description 4
- 201000005202 lung cancer Diseases 0.000 claims description 4
- 208000020816 lung neoplasm Diseases 0.000 claims description 4
- 102000039446 nucleic acids Human genes 0.000 claims description 4
- 108020004707 nucleic acids Proteins 0.000 claims description 4
- 150000007523 nucleic acids Chemical class 0.000 claims description 4
- 206010000830 Acute leukaemia Diseases 0.000 claims description 3
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 3
- 206010061424 Anal cancer Diseases 0.000 claims description 3
- 208000007860 Anus Neoplasms Diseases 0.000 claims description 3
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 3
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 3
- 206010005003 Bladder cancer Diseases 0.000 claims description 3
- 206010005949 Bone cancer Diseases 0.000 claims description 3
- 208000018084 Bone neoplasm Diseases 0.000 claims description 3
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 3
- 206010006143 Brain stem glioma Diseases 0.000 claims description 3
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 208000026310 Breast neoplasm Diseases 0.000 claims description 3
- 102100027207 CD27 antigen Human genes 0.000 claims description 3
- 108010029697 CD40 Ligand Proteins 0.000 claims description 3
- 102100032937 CD40 ligand Human genes 0.000 claims description 3
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 3
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims description 3
- 206010009944 Colon cancer Diseases 0.000 claims description 3
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 claims description 3
- 206010014759 Endometrial neoplasm Diseases 0.000 claims description 3
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 3
- 201000010915 Glioblastoma multiforme Diseases 0.000 claims description 3
- 208000017604 Hodgkin disease Diseases 0.000 claims description 3
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 3
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 3
- 101001019455 Homo sapiens ICOS ligand Proteins 0.000 claims description 3
- 101000763579 Homo sapiens Toll-like receptor 1 Proteins 0.000 claims description 3
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 claims description 3
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 claims description 3
- 101000669460 Homo sapiens Toll-like receptor 5 Proteins 0.000 claims description 3
- 101000669406 Homo sapiens Toll-like receptor 6 Proteins 0.000 claims description 3
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 claims description 3
- 101000638251 Homo sapiens Tumor necrosis factor ligand superfamily member 9 Proteins 0.000 claims description 3
- 102100034980 ICOS ligand Human genes 0.000 claims description 3
- 206010052178 Lymphocytic lymphoma Diseases 0.000 claims description 3
- 206010025323 Lymphomas Diseases 0.000 claims description 3
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 claims description 3
- 101710150918 Macrophage colony-stimulating factor 1 receptor Proteins 0.000 claims description 3
- 208000032271 Malignant tumor of penis Diseases 0.000 claims description 3
- 208000034578 Multiple myelomas Diseases 0.000 claims description 3
- 101100481579 Mus musculus Tlr11 gene Proteins 0.000 claims description 3
- 101100481580 Mus musculus Tlr12 gene Proteins 0.000 claims description 3
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 3
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 3
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 3
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 claims description 3
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 3
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 3
- 206010033128 Ovarian cancer Diseases 0.000 claims description 3
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 208000000821 Parathyroid Neoplasms Diseases 0.000 claims description 3
- 208000002471 Penile Neoplasms Diseases 0.000 claims description 3
- 206010034299 Penile cancer Diseases 0.000 claims description 3
- 208000007913 Pituitary Neoplasms Diseases 0.000 claims description 3
- 201000005746 Pituitary adenoma Diseases 0.000 claims description 3
- 206010061538 Pituitary tumour benign Diseases 0.000 claims description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 3
- 206010060862 Prostate cancer Diseases 0.000 claims description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 3
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 3
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 3
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 3
- 208000021712 Soft tissue sarcoma Diseases 0.000 claims description 3
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 3
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 3
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 3
- 208000024313 Testicular Neoplasms Diseases 0.000 claims description 3
- 206010057644 Testis cancer Diseases 0.000 claims description 3
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 3
- 102100027010 Toll-like receptor 1 Human genes 0.000 claims description 3
- 102100024333 Toll-like receptor 2 Human genes 0.000 claims description 3
- 102100039360 Toll-like receptor 4 Human genes 0.000 claims description 3
- 102100039357 Toll-like receptor 5 Human genes 0.000 claims description 3
- 102100039387 Toll-like receptor 6 Human genes 0.000 claims description 3
- 102100039390 Toll-like receptor 7 Human genes 0.000 claims description 3
- 102100032101 Tumor necrosis factor ligand superfamily member 9 Human genes 0.000 claims description 3
- 208000023915 Ureteral Neoplasms Diseases 0.000 claims description 3
- 206010046392 Ureteric cancer Diseases 0.000 claims description 3
- 206010046431 Urethral cancer Diseases 0.000 claims description 3
- 206010046458 Urethral neoplasms Diseases 0.000 claims description 3
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 3
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 3
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 3
- 201000003761 Vaginal carcinoma Diseases 0.000 claims description 3
- 201000005188 adrenal gland cancer Diseases 0.000 claims description 3
- 208000024447 adrenal gland neoplasm Diseases 0.000 claims description 3
- 201000011165 anus cancer Diseases 0.000 claims description 3
- 239000010425 asbestos Substances 0.000 claims description 3
- 201000010881 cervical cancer Diseases 0.000 claims description 3
- 208000019065 cervical carcinoma Diseases 0.000 claims description 3
- 230000001684 chronic effect Effects 0.000 claims description 3
- 208000024207 chronic leukemia Diseases 0.000 claims description 3
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 claims description 3
- 208000029742 colonic neoplasm Diseases 0.000 claims description 3
- 201000003914 endometrial carcinoma Diseases 0.000 claims description 3
- 201000004101 esophageal cancer Diseases 0.000 claims description 3
- 206010017758 gastric cancer Diseases 0.000 claims description 3
- 201000003115 germ cell cancer Diseases 0.000 claims description 3
- 208000005017 glioblastoma Diseases 0.000 claims description 3
- 201000010536 head and neck cancer Diseases 0.000 claims description 3
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 3
- 201000007270 liver cancer Diseases 0.000 claims description 3
- 208000014018 liver neoplasm Diseases 0.000 claims description 3
- 208000029559 malignant endocrine neoplasm Diseases 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 claims description 3
- 229940124303 multikinase inhibitor Drugs 0.000 claims description 3
- DAZSWUUAFHBCGE-KRWDZBQOSA-N n-[(2s)-3-methyl-1-oxo-1-pyrrolidin-1-ylbutan-2-yl]-3-phenylpropanamide Chemical compound N([C@@H](C(C)C)C(=O)N1CCCC1)C(=O)CCC1=CC=CC=C1 DAZSWUUAFHBCGE-KRWDZBQOSA-N 0.000 claims description 3
- 229960003301 nivolumab Drugs 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- 229960002621 pembrolizumab Drugs 0.000 claims description 3
- 208000021310 pituitary gland adenoma Diseases 0.000 claims description 3
- 208000016800 primary central nervous system lymphoma Diseases 0.000 claims description 3
- 206010038038 rectal cancer Diseases 0.000 claims description 3
- 201000001275 rectum cancer Diseases 0.000 claims description 3
- 229910052895 riebeckite Inorganic materials 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 201000002314 small intestine cancer Diseases 0.000 claims description 3
- 208000037959 spinal tumor Diseases 0.000 claims description 3
- 201000011549 stomach cancer Diseases 0.000 claims description 3
- 201000003120 testicular cancer Diseases 0.000 claims description 3
- 201000002510 thyroid cancer Diseases 0.000 claims description 3
- 230000005747 tumor angiogenesis Effects 0.000 claims description 3
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 3
- 206010046766 uterine cancer Diseases 0.000 claims description 3
- 201000004916 vulva carcinoma Diseases 0.000 claims description 3
- 208000013013 vulvar carcinoma Diseases 0.000 claims description 3
- 206010014733 Endometrial cancer Diseases 0.000 claims description 2
- 230000001154 acute effect Effects 0.000 claims description 2
- 210000002751 lymph Anatomy 0.000 claims description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 128
- 102100037850 Interferon gamma Human genes 0.000 description 127
- 238000004519 manufacturing process Methods 0.000 description 126
- -1 Cit Chemical compound 0.000 description 105
- 210000001744 T-lymphocyte Anatomy 0.000 description 94
- 238000011282 treatment Methods 0.000 description 87
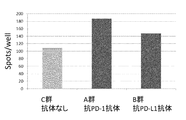
- 238000002965 ELISA Methods 0.000 description 64
- 210000004881 tumor cell Anatomy 0.000 description 63
- 241000699670 Mus sp. Species 0.000 description 62
- 229960005486 vaccine Drugs 0.000 description 48
- 238000000034 method Methods 0.000 description 46
- 229940024606 amino acid Drugs 0.000 description 45
- 235000001014 amino acid Nutrition 0.000 description 43
- 238000002360 preparation method Methods 0.000 description 35
- 241000699666 Mus <mouse, genus> Species 0.000 description 34
- 238000003501 co-culture Methods 0.000 description 29
- 239000000203 mixture Substances 0.000 description 28
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 26
- 239000002904 solvent Substances 0.000 description 23
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 22
- 102000004196 processed proteins & peptides Human genes 0.000 description 22
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 21
- 239000002671 adjuvant Substances 0.000 description 20
- 125000000539 amino acid group Chemical group 0.000 description 20
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 19
- 238000009472 formulation Methods 0.000 description 19
- 239000000243 solution Substances 0.000 description 18
- 210000004989 spleen cell Anatomy 0.000 description 18
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 16
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 15
- 239000013543 active substance Substances 0.000 description 15
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 15
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 15
- 239000003755 preservative agent Substances 0.000 description 15
- 238000010186 staining Methods 0.000 description 15
- 239000002585 base Substances 0.000 description 14
- 230000010261 cell growth Effects 0.000 description 14
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 14
- 238000010647 peptide synthesis reaction Methods 0.000 description 14
- 239000003102 growth factor Substances 0.000 description 13
- 235000018102 proteins Nutrition 0.000 description 13
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 12
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 12
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 239000002253 acid Substances 0.000 description 12
- 238000001514 detection method Methods 0.000 description 12
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 12
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 11
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 11
- 229930195725 Mannitol Natural products 0.000 description 11
- 101800005149 Peptide B Proteins 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 11
- 239000003963 antioxidant agent Substances 0.000 description 11
- 235000006708 antioxidants Nutrition 0.000 description 11
- 230000000694 effects Effects 0.000 description 11
- 239000004220 glutamic acid Substances 0.000 description 11
- 235000013922 glutamic acid Nutrition 0.000 description 11
- 239000000594 mannitol Substances 0.000 description 11
- 235000010355 mannitol Nutrition 0.000 description 11
- 210000000952 spleen Anatomy 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 10
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 10
- 108091054438 MHC class II family Proteins 0.000 description 10
- 210000000612 antigen-presenting cell Anatomy 0.000 description 10
- 239000007924 injection Substances 0.000 description 10
- 238000002347 injection Methods 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 9
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
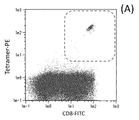
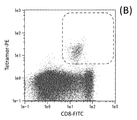
- 210000001239 CD8-positive, alpha-beta cytotoxic T lymphocyte Anatomy 0.000 description 9
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 9
- 102100028972 HLA class I histocompatibility antigen, A alpha chain Human genes 0.000 description 9
- 108010075704 HLA-A Antigens Proteins 0.000 description 9
- 108091054437 MHC class I family Proteins 0.000 description 9
- 239000002202 Polyethylene glycol Substances 0.000 description 9
- 229920002472 Starch Polymers 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 239000000543 intermediate Substances 0.000 description 9
- 229920001223 polyethylene glycol Polymers 0.000 description 9
- 239000003381 stabilizer Substances 0.000 description 9
- 235000019698 starch Nutrition 0.000 description 9
- 239000008107 starch Substances 0.000 description 9
- 125000003396 thiol group Chemical group [H]S* 0.000 description 9
- 239000003970 toll like receptor agonist Substances 0.000 description 9
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 8
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- 108090000394 Erythropoietin Proteins 0.000 description 8
- 102000003951 Erythropoietin Human genes 0.000 description 8
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 8
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 8
- 108010050904 Interferons Proteins 0.000 description 8
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 8
- 229910019142 PO4 Inorganic materials 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 8
- 235000003704 aspartic acid Nutrition 0.000 description 8
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 8
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 8
- 229940105423 erythropoietin Drugs 0.000 description 8
- 239000000796 flavoring agent Substances 0.000 description 8
- 235000013355 food flavoring agent Nutrition 0.000 description 8
- 239000008103 glucose Substances 0.000 description 8
- 229940090044 injection Drugs 0.000 description 8
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 8
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 8
- 235000021317 phosphate Nutrition 0.000 description 8
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 8
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 8
- 230000002335 preservative effect Effects 0.000 description 8
- 230000002265 prevention Effects 0.000 description 8
- 125000006239 protecting group Chemical group 0.000 description 8
- 210000004988 splenocyte Anatomy 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 8
- 239000004475 Arginine Substances 0.000 description 7
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 7
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 7
- 108010010803 Gelatin Proteins 0.000 description 7
- 102000037982 Immune checkpoint proteins Human genes 0.000 description 7
- 108091008036 Immune checkpoint proteins Proteins 0.000 description 7
- 102000014150 Interferons Human genes 0.000 description 7
- 102000043129 MHC class I family Human genes 0.000 description 7
- 102000043131 MHC class II family Human genes 0.000 description 7
- 241000124008 Mammalia Species 0.000 description 7
- 239000002246 antineoplastic agent Substances 0.000 description 7
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 7
- 230000008859 change Effects 0.000 description 7
- 239000003086 colorant Substances 0.000 description 7
- 239000000839 emulsion Substances 0.000 description 7
- 239000008273 gelatin Substances 0.000 description 7
- 229920000159 gelatin Polymers 0.000 description 7
- 235000019322 gelatine Nutrition 0.000 description 7
- 235000011852 gelatine desserts Nutrition 0.000 description 7
- 229940126546 immune checkpoint molecule Drugs 0.000 description 7
- 229940079322 interferon Drugs 0.000 description 7
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 7
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 7
- 239000010452 phosphate Substances 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 6
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 6
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 6
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 102000009465 Growth Factor Receptors Human genes 0.000 description 6
- 108010009202 Growth Factor Receptors Proteins 0.000 description 6
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 6
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 6
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 6
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 6
- 229930012538 Paclitaxel Natural products 0.000 description 6
- 239000004698 Polyethylene Substances 0.000 description 6
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 6
- 230000002378 acidificating effect Effects 0.000 description 6
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 6
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 6
- 230000003078 antioxidant effect Effects 0.000 description 6
- 239000001768 carboxy methyl cellulose Substances 0.000 description 6
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 6
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 6
- 239000011248 coating agent Substances 0.000 description 6
- 235000014113 dietary fatty acids Nutrition 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 229930195729 fatty acid Natural products 0.000 description 6
- 239000000194 fatty acid Substances 0.000 description 6
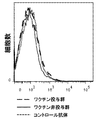
- 238000000684 flow cytometry Methods 0.000 description 6
- 230000006698 induction Effects 0.000 description 6
- 239000008101 lactose Substances 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 238000012986 modification Methods 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- 235000019198 oils Nutrition 0.000 description 6
- 229960001592 paclitaxel Drugs 0.000 description 6
- 238000007911 parenteral administration Methods 0.000 description 6
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 6
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 6
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 239000007921 spray Substances 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- WTKQMHWYSBWUBE-UHFFFAOYSA-N (3-nitropyridin-2-yl) thiohypochlorite Chemical group [O-][N+](=O)C1=CC=CN=C1SCl WTKQMHWYSBWUBE-UHFFFAOYSA-N 0.000 description 5
- 102000004127 Cytokines Human genes 0.000 description 5
- 108090000695 Cytokines Proteins 0.000 description 5
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 5
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 5
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 5
- 101000621309 Homo sapiens Wilms tumor protein Proteins 0.000 description 5
- 102000014429 Insulin-like growth factor Human genes 0.000 description 5
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 5
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 5
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 5
- 108010025020 Nerve Growth Factor Proteins 0.000 description 5
- 102000015336 Nerve Growth Factor Human genes 0.000 description 5
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 150000001298 alcohols Chemical class 0.000 description 5
- 125000003277 amino group Chemical group 0.000 description 5
- 239000011230 binding agent Substances 0.000 description 5
- 235000015165 citric acid Nutrition 0.000 description 5
- 238000007796 conventional method Methods 0.000 description 5
- 235000003599 food sweetener Nutrition 0.000 description 5
- 102000046004 human WT1 Human genes 0.000 description 5
- 229930195733 hydrocarbon Natural products 0.000 description 5
- 150000002430 hydrocarbons Chemical class 0.000 description 5
- 229940043355 kinase inhibitor Drugs 0.000 description 5
- 239000000314 lubricant Substances 0.000 description 5
- 230000008018 melting Effects 0.000 description 5
- 238000002844 melting Methods 0.000 description 5
- 229940053128 nerve growth factor Drugs 0.000 description 5
- 230000003287 optical effect Effects 0.000 description 5
- 238000007254 oxidation reaction Methods 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 5
- 230000000638 stimulation Effects 0.000 description 5
- 239000000375 suspending agent Substances 0.000 description 5
- 239000003765 sweetening agent Substances 0.000 description 5
- 239000011975 tartaric acid Substances 0.000 description 5
- 235000002906 tartaric acid Nutrition 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 4
- 108020004414 DNA Proteins 0.000 description 4
- 208000010201 Exanthema Diseases 0.000 description 4
- 239000004471 Glycine Substances 0.000 description 4
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 4
- 108010013476 HLA-A24 Antigen Proteins 0.000 description 4
- 102100021866 Hepatocyte growth factor Human genes 0.000 description 4
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 4
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 4
- 108010002350 Interleukin-2 Proteins 0.000 description 4
- 102000000588 Interleukin-2 Human genes 0.000 description 4
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 4
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 4
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 229920002125 Sokalan® Polymers 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 230000000340 anti-metabolite Effects 0.000 description 4
- 229940100197 antimetabolite Drugs 0.000 description 4
- 239000002256 antimetabolite Substances 0.000 description 4
- 239000006172 buffering agent Substances 0.000 description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 229940127089 cytotoxic agent Drugs 0.000 description 4
- 210000004443 dendritic cell Anatomy 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- IJKVHSBPTUYDLN-UHFFFAOYSA-N dihydroxy(oxo)silane Chemical compound O[Si](O)=O IJKVHSBPTUYDLN-UHFFFAOYSA-N 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 239000003995 emulsifying agent Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 4
- 201000005884 exanthem Diseases 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 235000001727 glucose Nutrition 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 4
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 4
- 230000001506 immunosuppresive effect Effects 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 239000004310 lactic acid Substances 0.000 description 4
- 235000014655 lactic acid Nutrition 0.000 description 4
- GZQKNULLWNGMCW-PWQABINMSA-N lipid A (E. coli) Chemical compound O1[C@H](CO)[C@@H](OP(O)(O)=O)[C@H](OC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCCCC)[C@@H](NC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCC)[C@@H]1OC[C@@H]1[C@@H](O)[C@H](OC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](NC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](OP(O)(O)=O)O1 GZQKNULLWNGMCW-PWQABINMSA-N 0.000 description 4
- 210000004698 lymphocyte Anatomy 0.000 description 4
- 229940124302 mTOR inhibitor Drugs 0.000 description 4
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 4
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 125000006178 methyl benzyl group Chemical group 0.000 description 4
- 239000008108 microcrystalline cellulose Substances 0.000 description 4
- 229940016286 microcrystalline cellulose Drugs 0.000 description 4
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 4
- 108010091748 peptide A Proteins 0.000 description 4
- 229910052697 platinum Inorganic materials 0.000 description 4
- 206010037844 rash Diseases 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 210000003491 skin Anatomy 0.000 description 4
- 239000011734 sodium Substances 0.000 description 4
- 229940083542 sodium Drugs 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 125000000101 thioether group Chemical group 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- 239000002525 vasculotropin inhibitor Substances 0.000 description 4
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 3
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 3
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 3
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 3
- SRQYLNYQAPCPIR-UHFFFAOYSA-N 4-[4-(5,5-dimethyl-4H-thiazol-2-yl)-1-piperazinyl]-6-propylthieno[2,3-d]pyrimidine Chemical compound N1=CN=C2SC(CCC)=CC2=C1N(CC1)CCN1C1=NCC(C)(C)S1 SRQYLNYQAPCPIR-UHFFFAOYSA-N 0.000 description 3
- UCINOBZMLCREGM-RNNUGBGQSA-N 4-n-[(1r,2s)-2-phenylcyclopropyl]cyclohexane-1,4-diamine;dihydrochloride Chemical compound Cl.Cl.C1CC(N)CCC1N[C@H]1[C@H](C=2C=CC=CC=2)C1 UCINOBZMLCREGM-RNNUGBGQSA-N 0.000 description 3
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 3
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 3
- BUROJSBIWGDYCN-GAUTUEMISA-N AP 23573 Chemical compound C1C[C@@H](OP(C)(C)=O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 BUROJSBIWGDYCN-GAUTUEMISA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 description 3
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- 239000004215 Carbon black (E152) Substances 0.000 description 3
- 235000005979 Citrus limon Nutrition 0.000 description 3
- 244000131522 Citrus pyriformis Species 0.000 description 3
- 229920002785 Croscarmellose sodium Polymers 0.000 description 3
- 108010092160 Dactinomycin Proteins 0.000 description 3
- 241000196324 Embryophyta Species 0.000 description 3
- 239000004386 Erythritol Substances 0.000 description 3
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 description 3
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 3
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 3
- 235000016623 Fragaria vesca Nutrition 0.000 description 3
- 235000011363 Fragaria x ananassa Nutrition 0.000 description 3
- 229930091371 Fructose Natural products 0.000 description 3
- 239000005715 Fructose Substances 0.000 description 3
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 3
- 102000025850 HLA-A2 Antigen Human genes 0.000 description 3
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 3
- 108010058597 HLA-DR Antigens Proteins 0.000 description 3
- 102000006354 HLA-DR Antigens Human genes 0.000 description 3
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 description 3
- 102000003964 Histone deacetylase Human genes 0.000 description 3
- 108090000353 Histone deacetylase Proteins 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 3
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 3
- 108010065805 Interleukin-12 Proteins 0.000 description 3
- 102000013462 Interleukin-12 Human genes 0.000 description 3
- 102100033627 Killer cell immunoglobulin-like receptor 3DL1 Human genes 0.000 description 3
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 3
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 3
- 235000006679 Mentha X verticillata Nutrition 0.000 description 3
- 235000002899 Mentha suaveolens Nutrition 0.000 description 3
- 235000001636 Mentha x rotundifolia Nutrition 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- 241000699660 Mus musculus Species 0.000 description 3
- 108010057466 NF-kappa B Proteins 0.000 description 3
- 102000003945 NF-kappa B Human genes 0.000 description 3
- 229910002651 NO3 Inorganic materials 0.000 description 3
- 102000007339 Nerve Growth Factor Receptors Human genes 0.000 description 3
- 108010032605 Nerve Growth Factor Receptors Proteins 0.000 description 3
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 3
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 3
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical class C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- 235000021355 Stearic acid Nutrition 0.000 description 3
- 230000006044 T cell activation Effects 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical class CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 244000290333 Vanilla fragrans Species 0.000 description 3
- 235000009499 Vanilla fragrans Nutrition 0.000 description 3
- 235000012036 Vanilla tahitensis Nutrition 0.000 description 3
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 3
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 3
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 3
- KLGQSVMIPOVQAX-UHFFFAOYSA-N XAV939 Chemical compound N=1C=2CCSCC=2C(O)=NC=1C1=CC=C(C(F)(F)F)C=C1 KLGQSVMIPOVQAX-UHFFFAOYSA-N 0.000 description 3
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 3
- 229940124532 absorption promoter Drugs 0.000 description 3
- 235000011054 acetic acid Nutrition 0.000 description 3
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 3
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 239000000853 adhesive Substances 0.000 description 3
- 230000001070 adhesive effect Effects 0.000 description 3
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 3
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 3
- QWCKQJZIFLGMSD-UHFFFAOYSA-N alpha-aminobutyric acid Chemical compound CCC(N)C(O)=O QWCKQJZIFLGMSD-UHFFFAOYSA-N 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 150000003863 ammonium salts Chemical class 0.000 description 3
- 239000004037 angiogenesis inhibitor Substances 0.000 description 3
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 3
- 239000003817 anthracycline antibiotic agent Substances 0.000 description 3
- 229940077388 benzenesulfonate Drugs 0.000 description 3
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 3
- 230000005540 biological transmission Effects 0.000 description 3
- 229940077737 brain-derived neurotrophic factor Drugs 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 3
- 159000000007 calcium salts Chemical class 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 3
- 239000008119 colloidal silica Substances 0.000 description 3
- 230000002301 combined effect Effects 0.000 description 3
- 239000006071 cream Substances 0.000 description 3
- 229960001681 croscarmellose sodium Drugs 0.000 description 3
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 3
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 3
- 229960000640 dactinomycin Drugs 0.000 description 3
- 229950006418 dactolisib Drugs 0.000 description 3
- JOGKUKXHTYWRGZ-UHFFFAOYSA-N dactolisib Chemical compound O=C1N(C)C2=CN=C3C=CC(C=4C=C5C=CC=CC5=NC=4)=CC3=C2N1C1=CC=C(C(C)(C)C#N)C=C1 JOGKUKXHTYWRGZ-UHFFFAOYSA-N 0.000 description 3
- 229960000975 daunorubicin Drugs 0.000 description 3
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 3
- MIOUTPXNKVBIFR-UHFFFAOYSA-J dicalcium 2-hydroxyacetate Chemical compound C(CO)(=O)[O-].[Ca+2].[Ca+2].C(CO)(=O)[O-].C(CO)(=O)[O-].C(CO)(=O)[O-] MIOUTPXNKVBIFR-UHFFFAOYSA-J 0.000 description 3
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical class CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 229960004679 doxorubicin Drugs 0.000 description 3
- INVTYAOGFAGBOE-UHFFFAOYSA-N entinostat Chemical compound NC1=CC=CC=C1NC(=O)C(C=C1)=CC=C1CNC(=O)OCC1=CC=CN=C1 INVTYAOGFAGBOE-UHFFFAOYSA-N 0.000 description 3
- 229940116977 epidermal growth factor Drugs 0.000 description 3
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 description 3
- 229940009714 erythritol Drugs 0.000 description 3
- 235000019414 erythritol Nutrition 0.000 description 3
- VFRSADQPWYCXDG-LEUCUCNGSA-N ethyl (2s,5s)-5-methylpyrrolidine-2-carboxylate;2,2,2-trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.CCOC(=O)[C@@H]1CC[C@H](C)N1 VFRSADQPWYCXDG-LEUCUCNGSA-N 0.000 description 3
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 3
- 229960005420 etoposide Drugs 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 229940126864 fibroblast growth factor Drugs 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 3
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 3
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 3
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 3
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 3
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 239000012442 inert solvent Substances 0.000 description 3
- 229960005386 ipilimumab Drugs 0.000 description 3
- 239000007951 isotonicity adjuster Substances 0.000 description 3
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 159000000003 magnesium salts Chemical class 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 229960004961 mechlorethamine Drugs 0.000 description 3
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 3
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000013546 non-drug therapy Methods 0.000 description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 3
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 3
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 3
- 230000001590 oxidative effect Effects 0.000 description 3
- 230000036961 partial effect Effects 0.000 description 3
- 239000006187 pill Substances 0.000 description 3
- 229920002451 polyvinyl alcohol Polymers 0.000 description 3
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 235000013772 propylene glycol Nutrition 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 238000001959 radiotherapy Methods 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- 229950010550 resiquimod Drugs 0.000 description 3
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 3
- 229960001302 ridaforolimus Drugs 0.000 description 3
- 229960003452 romidepsin Drugs 0.000 description 3
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 3
- OHRURASPPZQGQM-UHFFFAOYSA-N romidepsin Natural products O1C(=O)C(C(C)C)NC(=O)C(=CC)NC(=O)C2CSSCCC=CC1CC(=O)NC(C(C)C)C(=O)N2 OHRURASPPZQGQM-UHFFFAOYSA-N 0.000 description 3
- 108010091666 romidepsin Proteins 0.000 description 3
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 3
- 235000011121 sodium hydroxide Nutrition 0.000 description 3
- 239000001488 sodium phosphate Substances 0.000 description 3
- 159000000000 sodium salts Chemical class 0.000 description 3
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N squalane Chemical compound CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 3
- 239000008117 stearic acid Substances 0.000 description 3
- 150000005846 sugar alcohols Chemical class 0.000 description 3
- 125000002653 sulfanylmethyl group Chemical group [H]SC([H])([H])[*] 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 229940095064 tartrate Drugs 0.000 description 3
- 229960001278 teniposide Drugs 0.000 description 3
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 3
- 229960003433 thalidomide Drugs 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- UJLAWZDWDVHWOW-YPMHNXCESA-N tofacitinib Chemical compound C[C@@H]1CCN(C(=O)CC#N)C[C@@H]1N(C)C1=NC=NC2=C1C=CN2 UJLAWZDWDVHWOW-YPMHNXCESA-N 0.000 description 3
- JOXIMZWYDAKGHI-UHFFFAOYSA-M toluene-4-sulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-M 0.000 description 3
- 229960000303 topotecan Drugs 0.000 description 3
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 3
- 238000011830 transgenic mouse model Methods 0.000 description 3
- GSEJCLTVZPLZKY-UHFFFAOYSA-O triethanolammonium Chemical class OCC[NH+](CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-O 0.000 description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 3
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- 239000000811 xylitol Substances 0.000 description 3
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 3
- 235000010447 xylitol Nutrition 0.000 description 3
- 229960002675 xylitol Drugs 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 description 2
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- NQDROBVIYYEMDQ-WFYKWJGLSA-N (e)-3-(3,4-dimethoxyphenyl)-1-[1-[(e)-3-(3,4-dimethoxyphenyl)prop-2-enoyl]cyclohexyl]prop-2-en-1-one Chemical compound C1=C(OC)C(OC)=CC=C1\C=C\C(=O)C1(C(=O)\C=C\C=2C=C(OC)C(OC)=CC=2)CCCCC1 NQDROBVIYYEMDQ-WFYKWJGLSA-N 0.000 description 2
- VFUAJMPDXIRPKO-LQELWAHVSA-N (e)-3-(6-bromopyridin-2-yl)-2-cyano-n-[(1s)-1-phenylethyl]prop-2-enamide Chemical compound N([C@@H](C)C=1C=CC=CC=1)C(=O)C(\C#N)=C\C1=CC=CC(Br)=N1 VFUAJMPDXIRPKO-LQELWAHVSA-N 0.000 description 2
- FKSFKBQGSFSOSM-QFIPXVFZSA-N 1-[(2S)-butan-2-yl]-N-[(4,6-dimethyl-2-oxo-1H-pyridin-3-yl)methyl]-3-methyl-6-[6-(1-piperazinyl)-3-pyridinyl]-4-indolecarboxamide Chemical compound C1=C2N([C@@H](C)CC)C=C(C)C2=C(C(=O)NCC=2C(NC(C)=CC=2C)=O)C=C1C(C=N1)=CC=C1N1CCNCC1 FKSFKBQGSFSOSM-QFIPXVFZSA-N 0.000 description 2
- DWZAEMINVBZMHQ-UHFFFAOYSA-N 1-[4-[4-(dimethylamino)piperidine-1-carbonyl]phenyl]-3-[4-(4,6-dimorpholin-4-yl-1,3,5-triazin-2-yl)phenyl]urea Chemical compound C1CC(N(C)C)CCN1C(=O)C(C=C1)=CC=C1NC(=O)NC1=CC=C(C=2N=C(N=C(N=2)N2CCOCC2)N2CCOCC2)C=C1 DWZAEMINVBZMHQ-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- RGHYDLZMTYDBDT-UHFFFAOYSA-N 2-amino-8-ethyl-4-methyl-6-(1H-pyrazol-5-yl)-7-pyrido[2,3-d]pyrimidinone Chemical compound O=C1N(CC)C2=NC(N)=NC(C)=C2C=C1C=1C=CNN=1 RGHYDLZMTYDBDT-UHFFFAOYSA-N 0.000 description 2
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 2
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 2
- IBAKVEUZKHOWNG-UHFFFAOYSA-N 4-n-[2-(4-phenoxyphenyl)ethyl]quinazoline-4,6-diamine Chemical compound C12=CC(N)=CC=C2N=CN=C1NCCC(C=C1)=CC=C1OC1=CC=CC=C1 IBAKVEUZKHOWNG-UHFFFAOYSA-N 0.000 description 2
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 2
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 2
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 2
- KVLFRAWTRWDEDF-IRXDYDNUSA-N AZD-8055 Chemical compound C1=C(CO)C(OC)=CC=C1C1=CC=C(C(=NC(=N2)N3[C@H](COCC3)C)N3[C@H](COCC3)C)C2=N1 KVLFRAWTRWDEDF-IRXDYDNUSA-N 0.000 description 2
- 102100023635 Alpha-fetoprotein Human genes 0.000 description 2
- 102000009840 Angiopoietins Human genes 0.000 description 2
- 108010009906 Angiopoietins Proteins 0.000 description 2
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 2
- YUXMAKUNSXIEKN-BTJKTKAUSA-N BGT226 Chemical compound OC(=O)\C=C/C(O)=O.C1=NC(OC)=CC=C1C1=CC=C(N=CC2=C3N(C=4C=C(C(N5CCNCC5)=CC=4)C(F)(F)F)C(=O)N2C)C3=C1 YUXMAKUNSXIEKN-BTJKTKAUSA-N 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 description 2
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 229940046168 CpG oligodeoxynucleotide Drugs 0.000 description 2
- QRMPRVXWPCLVNI-YYFQZIEXSA-N Curcumol Chemical compound C1C(=C)[C@@H]2CC[C@H](C)[C@@]22C[C@@H](C(C)C)[C@]1(O)O2 QRMPRVXWPCLVNI-YYFQZIEXSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 239000012625 DNA intercalator Substances 0.000 description 2
- 229920001353 Dextrin Polymers 0.000 description 2
- 239000004375 Dextrin Substances 0.000 description 2
- 102400001047 Endostatin Human genes 0.000 description 2
- 108010079505 Endostatins Proteins 0.000 description 2
- 102400001368 Epidermal growth factor Human genes 0.000 description 2
- 101800003838 Epidermal growth factor Proteins 0.000 description 2
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 2
- 108010074604 Epoetin Alfa Proteins 0.000 description 2
- 239000001856 Ethyl cellulose Substances 0.000 description 2
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 2
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 2
- 244000307700 Fragaria vesca Species 0.000 description 2
- 229920002907 Guar gum Polymers 0.000 description 2
- 102100028976 HLA class I histocompatibility antigen, B alpha chain Human genes 0.000 description 2
- 102100028971 HLA class I histocompatibility antigen, C alpha chain Human genes 0.000 description 2
- 108010058607 HLA-B Antigens Proteins 0.000 description 2
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 2
- 102100022623 Hepatocyte growth factor receptor Human genes 0.000 description 2
- 108010027412 Histocompatibility Antigens Class II Proteins 0.000 description 2
- 102000011787 Histone Methyltransferases Human genes 0.000 description 2
- 108010036115 Histone Methyltransferases Proteins 0.000 description 2
- 102000003893 Histone acetyltransferases Human genes 0.000 description 2
- 108090000246 Histone acetyltransferases Proteins 0.000 description 2
- 108010033040 Histones Proteins 0.000 description 2
- 101000986084 Homo sapiens HLA class I histocompatibility antigen, C alpha chain Proteins 0.000 description 2
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- 108010047761 Interferon-alpha Proteins 0.000 description 2
- 102000006992 Interferon-alpha Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- 108010002616 Interleukin-5 Proteins 0.000 description 2
- 102000000743 Interleukin-5 Human genes 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 108010002586 Interleukin-7 Proteins 0.000 description 2
- 102100021592 Interleukin-7 Human genes 0.000 description 2
- 229940122245 Janus kinase inhibitor Drugs 0.000 description 2
- RFSMUFRPPYDYRD-CALCHBBNSA-N Ku-0063794 Chemical compound C1=C(CO)C(OC)=CC=C1C1=CC=C(C(=NC(=N2)N3C[C@@H](C)O[C@@H](C)C3)N3CCOCC3)C2=N1 RFSMUFRPPYDYRD-CALCHBBNSA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 2
- 239000004166 Lanolin Substances 0.000 description 2
- 108010000817 Leuprolide Proteins 0.000 description 2
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 2
- 229940126560 MAPK inhibitor Drugs 0.000 description 2
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 2
- 102000009571 Macrophage Inflammatory Proteins Human genes 0.000 description 2
- 108010009474 Macrophage Inflammatory Proteins Proteins 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- 229940119544 Menin-MLL inhibitor Drugs 0.000 description 2
- 229940079131 Methylase inhibitor Drugs 0.000 description 2
- 102000016397 Methyltransferase Human genes 0.000 description 2
- 108060004795 Methyltransferase Proteins 0.000 description 2
- 102000014962 Monocyte Chemoattractant Proteins Human genes 0.000 description 2
- 108010064136 Monocyte Chemoattractant Proteins Proteins 0.000 description 2
- FBKMWOJEPMPVTQ-UHFFFAOYSA-N N'-(3-bromo-4-fluorophenyl)-N-hydroxy-4-[2-(sulfamoylamino)ethylamino]-1,2,5-oxadiazole-3-carboximidamide Chemical compound NS(=O)(=O)NCCNC1=NON=C1C(=NO)NC1=CC=C(F)C(Br)=C1 FBKMWOJEPMPVTQ-UHFFFAOYSA-N 0.000 description 2
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 2
- HRNLUBSXIHFDHP-UHFFFAOYSA-N N-(2-aminophenyl)-4-[[[4-(3-pyridinyl)-2-pyrimidinyl]amino]methyl]benzamide Chemical compound NC1=CC=CC=C1NC(=O)C(C=C1)=CC=C1CNC1=NC=CC(C=2C=NC=CC=2)=N1 HRNLUBSXIHFDHP-UHFFFAOYSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 102400000058 Neuregulin-1 Human genes 0.000 description 2
- 108090000556 Neuregulin-1 Proteins 0.000 description 2
- 239000005642 Oleic acid Substances 0.000 description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 2
- 235000021314 Palmitic acid Nutrition 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 108010072866 Prostate-Specific Antigen Proteins 0.000 description 2
- 102100038358 Prostate-specific antigen Human genes 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 229940079156 Proteasome inhibitor Drugs 0.000 description 2
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 2
- VYGQUTWHTHXGQB-FFHKNEKCSA-N Retinol Palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C VYGQUTWHTHXGQB-FFHKNEKCSA-N 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- 101000935814 Salmonella typhimurium (strain LT2 / SGSC1412 / ATCC 700720) Periplasmic beta-glucosidase Proteins 0.000 description 2
- OCOKWVBYZHBHLU-UHFFFAOYSA-N Sobuzoxane Chemical compound C1C(=O)N(COC(=O)OCC(C)C)C(=O)CN1CCN1CC(=O)N(COC(=O)OCC(C)C)C(=O)C1 OCOKWVBYZHBHLU-UHFFFAOYSA-N 0.000 description 2
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 229940123155 T cell inhibitor Drugs 0.000 description 2
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 2
- 108060008245 Thrombospondin Proteins 0.000 description 2
- 102000002938 Thrombospondin Human genes 0.000 description 2
- 239000004012 Tofacitinib Substances 0.000 description 2
- 108010009583 Transforming Growth Factors Proteins 0.000 description 2
- 102000009618 Transforming Growth Factors Human genes 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 239000003655 absorption accelerator Substances 0.000 description 2
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 2
- 229960004176 aclarubicin Drugs 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 239000001361 adipic acid Substances 0.000 description 2
- 235000011037 adipic acid Nutrition 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 239000005456 alcohol based solvent Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940037003 alum Drugs 0.000 description 2
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- WMGSQTMJHBYJMQ-UHFFFAOYSA-N aluminum;magnesium;silicate Chemical compound [Mg+2].[Al+3].[O-][Si]([O-])([O-])[O-] WMGSQTMJHBYJMQ-UHFFFAOYSA-N 0.000 description 2
- KUFRQPKVAWMTJO-LMZWQJSESA-N alvespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCCN(C)C)C(=O)C=C1C2=O KUFRQPKVAWMTJO-LMZWQJSESA-N 0.000 description 2
- 239000003098 androgen Substances 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 239000003080 antimitotic agent Substances 0.000 description 2
- 239000000010 aprotic solvent Substances 0.000 description 2
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 229960003094 belinostat Drugs 0.000 description 2
- NCNRHFGMJRPRSK-MDZDMXLPSA-N belinostat Chemical compound ONC(=O)\C=C\C1=CC=CC(S(=O)(=O)NC=2C=CC=CC=2)=C1 NCNRHFGMJRPRSK-MDZDMXLPSA-N 0.000 description 2
- 229960000686 benzalkonium chloride Drugs 0.000 description 2
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 2
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 2
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 2
- 229960001467 bortezomib Drugs 0.000 description 2
- 238000002619 cancer immunotherapy Methods 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 229940105329 carboxymethylcellulose Drugs 0.000 description 2
- 238000002659 cell therapy Methods 0.000 description 2
- 230000007969 cellular immunity Effects 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229960000541 cetyl alcohol Drugs 0.000 description 2
- DREIJXJRTLTGJC-ZLBJMMTISA-N chembl3137308 Chemical compound C([C@H]1C[C@@](O)(C2)C3)C2C[C@H]3[C@H]1NC1=C2C=CNC2=NC=C1C(=O)N DREIJXJRTLTGJC-ZLBJMMTISA-N 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 229960001380 cimetidine Drugs 0.000 description 2
- CCGSUNCLSOWKJO-UHFFFAOYSA-N cimetidine Chemical compound N#CNC(=N/C)\NCCSCC1=NC=N[C]1C CCGSUNCLSOWKJO-UHFFFAOYSA-N 0.000 description 2
- KMPWYEUPVWOPIM-KODHJQJWSA-N cinchonidine Chemical compound C1=CC=C2C([C@H]([C@H]3[N@]4CC[C@H]([C@H](C4)C=C)C3)O)=CC=NC2=C1 KMPWYEUPVWOPIM-KODHJQJWSA-N 0.000 description 2
- KMPWYEUPVWOPIM-UHFFFAOYSA-N cinchonidine Natural products C1=CC=C2C(C(C3N4CCC(C(C4)C=C)C3)O)=CC=NC2=C1 KMPWYEUPVWOPIM-UHFFFAOYSA-N 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 229960003603 decitabine Drugs 0.000 description 2
- 230000017858 demethylation Effects 0.000 description 2
- 238000010520 demethylation reaction Methods 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 235000019425 dextrin Nutrition 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 150000002019 disulfides Chemical class 0.000 description 2
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 230000001804 emulsifying effect Effects 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 229960001904 epirubicin Drugs 0.000 description 2
- 239000003797 essential amino acid Substances 0.000 description 2
- 235000020776 essential amino acid Nutrition 0.000 description 2
- 239000003759 ester based solvent Substances 0.000 description 2
- 239000000262 estrogen Substances 0.000 description 2
- 229940011871 estrogen Drugs 0.000 description 2
- 239000004210 ether based solvent Substances 0.000 description 2
- 235000019325 ethyl cellulose Nutrition 0.000 description 2
- 229920001249 ethyl cellulose Polymers 0.000 description 2
- 229960000255 exemestane Drugs 0.000 description 2
- 229940125829 fibroblast growth factor receptor inhibitor Drugs 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 235000008191 folinic acid Nutrition 0.000 description 2
- 239000011672 folinic acid Substances 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 229960002737 fructose Drugs 0.000 description 2
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 229960001031 glucose Drugs 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 239000000665 guar gum Substances 0.000 description 2
- 235000010417 guar gum Nutrition 0.000 description 2
- 229960002154 guar gum Drugs 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- 230000006197 histone deacetylation Effects 0.000 description 2
- 238000001794 hormone therapy Methods 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 229960000908 idarubicin Drugs 0.000 description 2
- 229960002751 imiquimod Drugs 0.000 description 2
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000002998 immunogenetic effect Effects 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000007913 intrathecal administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 229960004768 irinotecan Drugs 0.000 description 2
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 2
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 2
- 235000019388 lanolin Nutrition 0.000 description 2
- 229940039717 lanolin Drugs 0.000 description 2
- 229960004942 lenalidomide Drugs 0.000 description 2
- 229960001691 leucovorin Drugs 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 2
- 229960004338 leuprorelin Drugs 0.000 description 2
- 229960001614 levamisole Drugs 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000000865 liniment Substances 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 229940057995 liquid paraffin Drugs 0.000 description 2
- 229960001855 mannitol Drugs 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 208000037819 metastatic cancer Diseases 0.000 description 2
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 235000006109 methionine Nutrition 0.000 description 2
- 190000032366 miboplatin Chemical compound 0.000 description 2
- 229950002777 miboplatin Drugs 0.000 description 2
- 239000000693 micelle Substances 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 239000012046 mixed solvent Substances 0.000 description 2
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 2
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 2
- RIJLVEAXPNLDTC-UHFFFAOYSA-N n-[5-[4-[(1,1-dioxo-1,4-thiazinan-4-yl)methyl]phenyl]-[1,2,4]triazolo[1,5-a]pyridin-2-yl]cyclopropanecarboxamide Chemical compound C1CC1C(=O)NC(=NN12)N=C1C=CC=C2C(C=C1)=CC=C1CN1CCS(=O)(=O)CC1 RIJLVEAXPNLDTC-UHFFFAOYSA-N 0.000 description 2
- JOWXJLIFIIOYMS-UHFFFAOYSA-N n-hydroxy-2-[[2-(6-methoxypyridin-3-yl)-4-morpholin-4-ylthieno[3,2-d]pyrimidin-6-yl]methyl-methylamino]pyrimidine-5-carboxamide Chemical compound C1=NC(OC)=CC=C1C1=NC(N2CCOCC2)=C(SC(CN(C)C=2N=CC(=CN=2)C(=O)NO)=C2)C2=N1 JOWXJLIFIIOYMS-UHFFFAOYSA-N 0.000 description 2
- 239000006199 nebulizer Substances 0.000 description 2
- 229950007221 nedaplatin Drugs 0.000 description 2
- 201000008026 nephroblastoma Diseases 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- CGBJSGAELGCMKE-UHFFFAOYSA-N omipalisib Chemical compound COC1=NC=C(C=2C=C3C(C=4C=NN=CC=4)=CC=NC3=CC=2)C=C1NS(=O)(=O)C1=CC=C(F)C=C1F CGBJSGAELGCMKE-UHFFFAOYSA-N 0.000 description 2
- AHLPHDHHMVZTML-BYPYZUCNSA-N ornithyl group Chemical group N[C@@H](CCCN)C(=O)O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 2
- 229960001756 oxaliplatin Drugs 0.000 description 2
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 239000003002 pH adjusting agent Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 229960003330 pentetic acid Drugs 0.000 description 2
- 235000019271 petrolatum Nutrition 0.000 description 2
- 238000011170 pharmaceutical development Methods 0.000 description 2
- 235000011007 phosphoric acid Nutrition 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 102000054765 polymorphisms of proteins Human genes 0.000 description 2
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 108010001062 polysaccharide-K Proteins 0.000 description 2
- 229940068968 polysorbate 80 Drugs 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 229940068984 polyvinyl alcohol Drugs 0.000 description 2
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 2
- 229960000688 pomalidomide Drugs 0.000 description 2
- UVSMNLNDYGZFPF-UHFFFAOYSA-N pomalidomide Chemical compound O=C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O UVSMNLNDYGZFPF-UHFFFAOYSA-N 0.000 description 2
- MREOOEFUTWFQOC-UHFFFAOYSA-M potassium;5-chloro-4-hydroxy-1h-pyridin-2-one;4,6-dioxo-1h-1,3,5-triazine-2-carboxylate;5-fluoro-1-(oxolan-2-yl)pyrimidine-2,4-dione Chemical compound [K+].OC1=CC(=O)NC=C1Cl.[O-]C(=O)C1=NC(=O)NC(=O)N1.O=C1NC(=O)C(F)=CN1C1OCCC1 MREOOEFUTWFQOC-UHFFFAOYSA-M 0.000 description 2
- 230000001376 precipitating effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 239000003207 proteasome inhibitor Substances 0.000 description 2
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 description 2
- 229960000620 ranitidine Drugs 0.000 description 2
- VMXUWOKSQNHOCA-LCYFTJDESA-N ranitidine Chemical compound [O-][N+](=O)/C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 VMXUWOKSQNHOCA-LCYFTJDESA-N 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 108091006082 receptor inhibitors Proteins 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- HFNKQEVNSGCOJV-OAHLLOKOSA-N ruxolitinib Chemical compound C1([C@@H](CC#N)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CCCC1 HFNKQEVNSGCOJV-OAHLLOKOSA-N 0.000 description 2
- 229960005399 satraplatin Drugs 0.000 description 2
- 190014017285 satraplatin Chemical compound 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- 229950010372 sobuzoxane Drugs 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 2
- 235000011083 sodium citrates Nutrition 0.000 description 2
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- QMGVPVSNSZLJIA-FVWCLLPLSA-N strychnine Chemical compound O([C@H]1CC(N([C@H]2[C@H]1[C@H]1C3)C=4C5=CC=CC=4)=O)CC=C1CN1[C@@H]3[C@]25CC1 QMGVPVSNSZLJIA-FVWCLLPLSA-N 0.000 description 2
- 239000006190 sub-lingual tablet Substances 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- SUVMJBTUFCVSAD-UHFFFAOYSA-N sulforaphane Chemical compound CS(=O)CCCCN=C=S SUVMJBTUFCVSAD-UHFFFAOYSA-N 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000008961 swelling Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 239000002562 thickening agent Substances 0.000 description 2
- 229960003087 tioguanine Drugs 0.000 description 2
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 229960001350 tofacitinib Drugs 0.000 description 2
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 2
- MFAQYJIYDMLAIM-UHFFFAOYSA-N torkinib Chemical compound C12=C(N)N=CN=C2N(C(C)C)N=C1C1=CC2=CC(O)=CC=C2N1 MFAQYJIYDMLAIM-UHFFFAOYSA-N 0.000 description 2
- XETCRXVKJHBPMK-MJSODCSWSA-N trehalose 6,6'-dimycolate Chemical compound C([C@@H]1[C@H]([C@H](O)[C@@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](COC(=O)C(CCCCCCCCCCC3C(C3)CCCCCCCCCCCCCCCCCC)C(O)CCCCCCCCCCCCCCCCCCCCCCCCC)O2)O)O1)O)OC(=O)C(C(O)CCCCCCCCCCCCCCCCCCCCCCCCC)CCCCCCCCCCC1CC1CCCCCCCCCCCCCCCCCC XETCRXVKJHBPMK-MJSODCSWSA-N 0.000 description 2
- 190014017283 triplatin tetranitrate Chemical compound 0.000 description 2
- 229950002860 triplatin tetranitrate Drugs 0.000 description 2
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 2
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 229940046728 tumor necrosis factor alpha inhibitor Drugs 0.000 description 2
- 239000002451 tumor necrosis factor inhibitor Substances 0.000 description 2
- 229960001055 uracil mustard Drugs 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 2
- 229960004355 vindesine Drugs 0.000 description 2
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- 229920001285 xanthan gum Polymers 0.000 description 2
- 239000000230 xanthan gum Substances 0.000 description 2
- 235000010493 xanthan gum Nutrition 0.000 description 2
- 229940082509 xanthan gum Drugs 0.000 description 2
- CGTADGCBEXYWNE-GTTQIJKGSA-N zotarolimus Chemical compound N1([C@H]2CC[C@@H](C[C@@H](C)[C@H]3OC(=O)[C@@H]4CCCCN4C(=O)C(=O)[C@@]4(O)[C@H](C)CC[C@H](O4)C[C@@H](\C(C)=C\C=C\C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C3)OC)C[C@H]2OC)C=NN=N1 CGTADGCBEXYWNE-GTTQIJKGSA-N 0.000 description 2
- UNSKMHKAFPRFTI-FDKLLANESA-N (1s,2r,5r)-5-(4-aminoimidazo[4,5-c]pyridin-1-yl)-3-(hydroxymethyl)cyclopent-3-ene-1,2-diol;hydrochloride Chemical compound Cl.C1=NC=2C(N)=NC=CC=2N1[C@@H]1C=C(CO)[C@@H](O)[C@H]1O UNSKMHKAFPRFTI-FDKLLANESA-N 0.000 description 1
- XUJHKPSBHDQIOD-UHFFFAOYSA-N (2-bromo-7,7-dimethyl-3-oxo-4-bicyclo[2.2.1]heptanyl)methanesulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)C(Br)C1C2(C)C XUJHKPSBHDQIOD-UHFFFAOYSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- LXFOLMYKSYSZQS-XKHGBIBOSA-N (2R,3R,4S,5R)-2-(6-aminopurin-9-yl)-5-[[[3-[2-(6-tert-butyl-1H-benzimidazol-2-yl)ethyl]cyclobutyl]-propan-2-ylamino]methyl]oxolane-3,4-diol Chemical compound CC(C)(C)C1=CC=C2NC(CCC3CC(C3)N(C[C@@H]3[C@H]([C@@H](O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)C(C)C)=NC2=C1 LXFOLMYKSYSZQS-XKHGBIBOSA-N 0.000 description 1
- XMAYWYJOQHXEEK-OZXSUGGESA-N (2R,4S)-ketoconazole Chemical compound C1CN(C(=O)C)CCN1C(C=C1)=CC=C1OC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 XMAYWYJOQHXEEK-OZXSUGGESA-N 0.000 description 1
- HPTXLHAHLXOAKV-INIZCTEOSA-N (2S)-2-(1,3-dioxo-2-isoindolyl)-3-(1H-indol-3-yl)propanoic acid Chemical compound O=C1C2=CC=CC=C2C(=O)N1[C@H](C(=O)O)CC1=CNC2=CC=CC=C12 HPTXLHAHLXOAKV-INIZCTEOSA-N 0.000 description 1
- DMWMUMWKGKGSNW-OPMCLZTFSA-N (2S)-6-amino-2-[[(2S)-2-[[(2S)-6-amino-2-[[(2S)-2-[[(2S)-2-[[(2S,3S)-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-4-amino-2-[[(2S)-4-amino-2-[[2-[[(2R)-2-amino-3-[(2R)-2,3-di(hexadecanoyloxy)propyl]sulfanylpropanoyl]amino]acetyl]amino]-4-oxobutanoyl]amino]-4-oxobutanoyl]amino]-3-carboxypropanoyl]amino]-4-carboxybutanoyl]amino]-3-hydroxypropanoyl]amino]-4-oxobutanoyl]amino]-3-methylpentanoyl]amino]-3-hydroxypropanoyl]amino]-3-phenylpropanoyl]amino]hexanoyl]amino]-4-carboxybutanoyl]amino]hexanoic acid Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](CSC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(O)=O)OC(=O)CCCCCCCCCCCCCCC DMWMUMWKGKGSNW-OPMCLZTFSA-N 0.000 description 1
- ZADWXFSZEAPBJS-SNVBAGLBSA-N (2r)-2-amino-3-(1-methylindol-3-yl)propanoic acid Chemical compound C1=CC=C2N(C)C=C(C[C@@H](N)C(O)=O)C2=C1 ZADWXFSZEAPBJS-SNVBAGLBSA-N 0.000 description 1
- WDQLRUYAYXDIFW-RWKIJVEZSA-N (2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-4-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxymethyl]oxan-2-yl]oxy-6-(hydroxymethyl)oxane-2,3,5-triol Chemical compound O[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)O1 WDQLRUYAYXDIFW-RWKIJVEZSA-N 0.000 description 1
- DSEKYWAQQVUQTP-XEWMWGOFSA-N (2r,4r,4as,6as,6as,6br,8ar,12ar,14as,14bs)-2-hydroxy-4,4a,6a,6b,8a,11,11,14a-octamethyl-2,4,5,6,6a,7,8,9,10,12,12a,13,14,14b-tetradecahydro-1h-picen-3-one Chemical compound C([C@H]1[C@]2(C)CC[C@@]34C)C(C)(C)CC[C@]1(C)CC[C@]2(C)[C@H]4CC[C@@]1(C)[C@H]3C[C@@H](O)C(=O)[C@@H]1C DSEKYWAQQVUQTP-XEWMWGOFSA-N 0.000 description 1
- YMYLGVIBUGDMLT-QMMMGPOBSA-N (2s)-2-(phenylmethoxyamino)propanoic acid Chemical compound OC(=O)[C@H](C)NOCC1=CC=CC=C1 YMYLGVIBUGDMLT-QMMMGPOBSA-N 0.000 description 1
- ZVEMACCDKBQNGX-KALODSIISA-N (2s)-2-amino-5-(diaminomethylideneamino)pentanoic acid;butanoic acid Chemical compound CCCC(O)=O.CCCC(O)=O.CCCC(O)=O.CCCC(O)=O.OC(=O)[C@@H](N)CCCN=C(N)N.OC(=O)[C@@H](N)CCCN=C(N)N.OC(=O)[C@@H](N)CCCN=C(N)N ZVEMACCDKBQNGX-KALODSIISA-N 0.000 description 1
- NAALWFYYHHJEFQ-ZASNTINBSA-N (2s,5r,6r)-6-[[(2r)-2-[[6-[4-[bis(2-hydroxyethyl)sulfamoyl]phenyl]-2-oxo-1h-pyridine-3-carbonyl]amino]-2-(4-hydroxyphenyl)acetyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid Chemical compound N([C@@H](C(=O)N[C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C=1C=CC(O)=CC=1)C(=O)C(C(N1)=O)=CC=C1C1=CC=C(S(=O)(=O)N(CCO)CCO)C=C1 NAALWFYYHHJEFQ-ZASNTINBSA-N 0.000 description 1
- CVCLJVVBHYOXDC-IAZSKANUSA-N (2z)-2-[(5z)-5-[(3,5-dimethyl-1h-pyrrol-2-yl)methylidene]-4-methoxypyrrol-2-ylidene]indole Chemical compound COC1=C\C(=C/2N=C3C=CC=CC3=C\2)N\C1=C/C=1NC(C)=CC=1C CVCLJVVBHYOXDC-IAZSKANUSA-N 0.000 description 1
- ASWBNKHCZGQVJV-UHFFFAOYSA-N (3-hexadecanoyloxy-2-hydroxypropyl) 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(O)COP([O-])(=O)OCC[N+](C)(C)C ASWBNKHCZGQVJV-UHFFFAOYSA-N 0.000 description 1
- LZGGUFLRKIMBDQ-BJMVGYQFSA-N (3e)-3-(1,3-benzodioxol-5-ylmethylidene)-2-oxopyrrolidine-1-carbaldehyde Chemical compound O=C1N(C=O)CC\C1=C/C1=CC=C(OCO2)C2=C1 LZGGUFLRKIMBDQ-BJMVGYQFSA-N 0.000 description 1
- PWZQFTQMMAIRRM-JFMUQQRKSA-N (3e,5e)-3,5-bis[(4-fluorophenyl)methylidene]-1-[(1-hydroxy-2,2,5,5-tetramethylpyrrol-3-yl)methyl]piperidin-4-one Chemical compound CC1(C)N(O)C(C)(C)C=C1CN(C\C(=C/C=1C=CC(F)=CC=1)C\1=O)CC/1=C\C1=CC=C(F)C=C1 PWZQFTQMMAIRRM-JFMUQQRKSA-N 0.000 description 1
- FELGMEQIXOGIFQ-CYBMUJFWSA-N (3r)-9-methyl-3-[(2-methylimidazol-1-yl)methyl]-2,3-dihydro-1h-carbazol-4-one Chemical compound CC1=NC=CN1C[C@@H]1C(=O)C(C=2C(=CC=CC=2)N2C)=C2CC1 FELGMEQIXOGIFQ-CYBMUJFWSA-N 0.000 description 1
- DIWRORZWFLOCLC-HNNXBMFYSA-N (3s)-7-chloro-5-(2-chlorophenyl)-3-hydroxy-1,3-dihydro-1,4-benzodiazepin-2-one Chemical compound N([C@H](C(NC1=CC=C(Cl)C=C11)=O)O)=C1C1=CC=CC=C1Cl DIWRORZWFLOCLC-HNNXBMFYSA-N 0.000 description 1
- ZAWXOCUFQSQDJS-VIFPVBQESA-N (3s)-8-hydroxy-3-methyl-3,4-dihydro-2h-benzo[a]anthracene-1,7,12-trione Chemical compound O=C1C2=C(O)C=CC=C2C(=O)C2=C1C=CC1=C2C(=O)C[C@@H](C)C1 ZAWXOCUFQSQDJS-VIFPVBQESA-N 0.000 description 1
- ONKCBKDTKZIWHZ-MRWFHJSOSA-N (4r)-4-[[(2r)-6-amino-2-[[(2r)-2-[[4-(aminocarbamothioylamino)benzoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]hexanoyl]amino]-5-[[(2r)-1-amino-6-[bis[2-[[4-[2-(1h-imidazol-5-yl)ethylamino]-4-oxobutanoyl]amino]acetyl]amino]-1-oxohexan-2-yl]amino]-5-oxope Chemical compound C([C@H](C(=O)N[C@H](CCCCN)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CCCCN(C(=O)CNC(=O)CCC(=O)NCCC=1NC=NC=1)C(=O)CNC(=O)CCC(=O)NCCC=1NC=NC=1)C(N)=O)NC(=O)C=1C=CC(NC(=S)NN)=CC=1)C1=CC=C(O)C=C1 ONKCBKDTKZIWHZ-MRWFHJSOSA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- FQVLRGLGWNWPSS-BXBUPLCLSA-N (4r,7s,10s,13s,16r)-16-acetamido-13-(1h-imidazol-5-ylmethyl)-10-methyl-6,9,12,15-tetraoxo-7-propan-2-yl-1,2-dithia-5,8,11,14-tetrazacycloheptadecane-4-carboxamide Chemical compound N1C(=O)[C@@H](NC(C)=O)CSSC[C@@H](C(N)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@@H]1CC1=CN=CN1 FQVLRGLGWNWPSS-BXBUPLCLSA-N 0.000 description 1
- QDITZBLZQQZVEE-YBEGLDIGSA-N (5z)-5-[(4-pyridin-4-ylquinolin-6-yl)methylidene]-1,3-thiazolidine-2,4-dione Chemical compound S1C(=O)NC(=O)\C1=C\C1=CC=C(N=CC=C2C=3C=CN=CC=3)C2=C1 QDITZBLZQQZVEE-YBEGLDIGSA-N 0.000 description 1
- WTSKMKRYHATLLL-UHFFFAOYSA-N (6-benzoyloxy-3-cyanopyridin-2-yl) 3-[3-(ethoxymethyl)-5-fluoro-2,6-dioxopyrimidine-1-carbonyl]benzoate Chemical compound O=C1N(COCC)C=C(F)C(=O)N1C(=O)C1=CC=CC(C(=O)OC=2C(=CC=C(OC(=O)C=3C=CC=CC=3)N=2)C#N)=C1 WTSKMKRYHATLLL-UHFFFAOYSA-N 0.000 description 1
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 1
- HQWTUOLCGKIECB-XZWHSSHBSA-N (6S,9aS)-6-[(4-hydroxyphenyl)methyl]-8-(1-naphthalenylmethyl)-4,7-dioxo-N-(phenylmethyl)-3,6,9,9a-tetrahydro-2H-pyrazino[1,2-a]pyrimidine-1-carboxamide Chemical compound C1=CC(O)=CC=C1C[C@H]1C(=O)N(CC=2C3=CC=CC=C3C=CC=2)C[C@H]2N1C(=O)CCN2C(=O)NCC1=CC=CC=C1 HQWTUOLCGKIECB-XZWHSSHBSA-N 0.000 description 1
- WSMQUUGTQYPVPD-OAHLLOKOSA-N (7r)-2-amino-7-[4-fluoro-2-(6-methoxypyridin-2-yl)phenyl]-4-methyl-7,8-dihydro-6h-pyrido[4,3-d]pyrimidin-5-one Chemical compound COC1=CC=CC(C=2C(=CC=C(F)C=2)[C@@H]2NC(=O)C3=C(C)N=C(N)N=C3C2)=N1 WSMQUUGTQYPVPD-OAHLLOKOSA-N 0.000 description 1
- MWWSFMDVAYGXBV-MYPASOLCSA-N (7r,9s)-7-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical compound Cl.O([C@@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-MYPASOLCSA-N 0.000 description 1
- MWWSFMDVAYGXBV-FGBSZODSSA-N (7s,9s)-7-[(2r,4s,5r,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydron;chloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-FGBSZODSSA-N 0.000 description 1
- ZPHYPKKFSHAVOE-YZIXBPQXSA-N (7s,9s)-7-[(2r,4s,5s,6s)-4-amino-6-methyl-5-[(2r)-oxan-2-yl]oxyoxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical compound Cl.O([C@H]1[C@@H](N)C[C@@H](O[C@H]1C)O[C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@@H]1CCCCO1 ZPHYPKKFSHAVOE-YZIXBPQXSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- WSWCOQWTEOXDQX-MQQKCMAXSA-M (E,E)-sorbate Chemical compound C\C=C\C=C\C([O-])=O WSWCOQWTEOXDQX-MQQKCMAXSA-M 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- LAMIXXKAWNLXOC-INIZCTEOSA-N (S)-HDAC-42 Chemical compound O=C([C@@H](C(C)C)C=1C=CC=CC=1)NC1=CC=C(C(=O)NO)C=C1 LAMIXXKAWNLXOC-INIZCTEOSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- PRXXYMVLYKJITB-IZZDOVSWSA-N (e)-n-(2-aminophenyl)-3-[1-[4-(1-methylpyrazol-4-yl)phenyl]sulfonylpyrrol-3-yl]prop-2-enamide Chemical compound C1=NN(C)C=C1C1=CC=C(S(=O)(=O)N2C=C(\C=C\C(=O)NC=3C(=CC=CC=3)N)C=C2)C=C1 PRXXYMVLYKJITB-IZZDOVSWSA-N 0.000 description 1
- BWDQBBCUWLSASG-MDZDMXLPSA-N (e)-n-hydroxy-3-[4-[[2-hydroxyethyl-[2-(1h-indol-3-yl)ethyl]amino]methyl]phenyl]prop-2-enamide Chemical compound C=1NC2=CC=CC=C2C=1CCN(CCO)CC1=CC=C(\C=C\C(=O)NO)C=C1 BWDQBBCUWLSASG-MDZDMXLPSA-N 0.000 description 1
- 229940058015 1,3-butylene glycol Drugs 0.000 description 1
- LHGUZCKPFXXVPV-UHFFFAOYSA-N 1-[1-(1-ethylsulfonyl-4-piperidinyl)ethyl]-N-[(4-methoxy-6-methyl-2-oxo-1H-pyridin-3-yl)methyl]-2-methyl-3-indolecarboxamide Chemical compound C1CN(S(=O)(=O)CC)CCC1C(C)N1C2=CC=CC=C2C(C(=O)NCC=2C(NC(C)=CC=2OC)=O)=C1C LHGUZCKPFXXVPV-UHFFFAOYSA-N 0.000 description 1
- KHWCPNJRJCNVRI-UHFFFAOYSA-N 1-[1-(2-methylsulfonylphenyl)-7-propoxyindolizin-3-yl]ethanone Chemical compound C=12C=C(OCCC)C=CN2C(C(C)=O)=CC=1C1=CC=CC=C1S(C)(=O)=O KHWCPNJRJCNVRI-UHFFFAOYSA-N 0.000 description 1
- QLHHRYZMBGPBJG-UHFFFAOYSA-N 1-[4-[1-(1,4-dioxaspiro[4.5]decan-8-yl)-4-(8-oxa-3-azabicyclo[3.2.1]octan-3-yl)-6-pyrazolo[3,4-d]pyrimidinyl]phenyl]-3-methylurea Chemical compound C1=CC(NC(=O)NC)=CC=C1C1=NC(N2CC3CCC(O3)C2)=C(C=NN2C3CCC4(CC3)OCCO4)C2=N1 QLHHRYZMBGPBJG-UHFFFAOYSA-N 0.000 description 1
- FHJATBIERQTCTN-UHFFFAOYSA-N 1-[4-amino-2-(ethylaminomethyl)imidazo[4,5-c]quinolin-1-yl]-2-methylpropan-2-ol Chemical compound C1=CC=CC2=C(N(C(CNCC)=N3)CC(C)(C)O)C3=C(N)N=C21 FHJATBIERQTCTN-UHFFFAOYSA-N 0.000 description 1
- LNMRSSIMGCDUTP-UHFFFAOYSA-N 1-[5-tert-butyl-2-(4-methylphenyl)pyrazol-3-yl]-3-[[5-fluoro-2-[1-(2-hydroxyethyl)indazol-5-yl]oxyphenyl]methyl]urea Chemical compound C1=CC(C)=CC=C1N1C(NC(=O)NCC=2C(=CC=C(F)C=2)OC=2C=C3C=NN(CCO)C3=CC=2)=CC(C(C)(C)C)=N1 LNMRSSIMGCDUTP-UHFFFAOYSA-N 0.000 description 1
- UEUPDYPUTTUXLJ-UHFFFAOYSA-N 1-[[4-(1,4,8,11-tetrazacyclotetradec-1-ylmethyl)phenyl]methyl]-1,4,8,11-tetrazacyclotetradecane;octahydrochloride Chemical compound Cl.Cl.Cl.Cl.Cl.Cl.Cl.Cl.C=1C=C(CN2CCNCCCNCCNCCC2)C=CC=1CN1CCCNCCNCCCNCC1 UEUPDYPUTTUXLJ-UHFFFAOYSA-N 0.000 description 1
- RGJOJUGRHPQXGF-INIZCTEOSA-N 1-ethyl-3-[4-[4-[(3s)-3-methylmorpholin-4-yl]-7-(oxetan-3-yl)-6,8-dihydro-5h-pyrido[3,4-d]pyrimidin-2-yl]phenyl]urea Chemical compound C1=CC(NC(=O)NCC)=CC=C1C(N=C1N2[C@H](COCC2)C)=NC2=C1CCN(C1COC1)C2 RGJOJUGRHPQXGF-INIZCTEOSA-N 0.000 description 1
- DMIDPTCQPIJYFE-UHFFFAOYSA-N 1-isoquinolin-6-yl-3-(2-oxo-2-pyrrolidin-1-ylethyl)urea Chemical compound C=1C=C2C=NC=CC2=CC=1NC(=O)NCC(=O)N1CCCC1 DMIDPTCQPIJYFE-UHFFFAOYSA-N 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- RQEUFEKYXDPUSK-UHFFFAOYSA-N 1-phenylethylamine Chemical compound CC(N)C1=CC=CC=C1 RQEUFEKYXDPUSK-UHFFFAOYSA-N 0.000 description 1
- GCKMFJBGXUYNAG-UHFFFAOYSA-N 17alpha-methyltestosterone Natural products C1CC2=CC(=O)CCC2(C)C2C1C1CCC(C)(O)C1(C)CC2 GCKMFJBGXUYNAG-UHFFFAOYSA-N 0.000 description 1
- IAJBQAYHSQIQRE-UHFFFAOYSA-N 2,4,5-trimethoxybenzaldehyde Chemical compound COC1=CC(OC)=C(C=O)C=C1OC IAJBQAYHSQIQRE-UHFFFAOYSA-N 0.000 description 1
- ZAVJTSLIGAGALR-UHFFFAOYSA-N 2-(2,2,2-trifluoroacetyl)cyclooctan-1-one Chemical compound FC(F)(F)C(=O)C1CCCCCCC1=O ZAVJTSLIGAGALR-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- MENNDDDTIIZDDN-UHFFFAOYSA-N 2-(4,6-dimethylpyrimidin-2-yl)sulfanyl-n-[5-(naphthalen-1-ylmethyl)-1,3-thiazol-2-yl]acetamide Chemical compound CC1=CC(C)=NC(SCC(=O)NC=2SC(CC=3C4=CC=CC=C4C=CC=3)=CN=2)=N1 MENNDDDTIIZDDN-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- WBHQYBZRTAEHRR-UHFFFAOYSA-N 2-[2-(4-heptylphenyl)ethyl]-6-hydroxybenzoic acid Chemical compound C1=CC(CCCCCCC)=CC=C1CCC1=CC=CC(O)=C1C(O)=O WBHQYBZRTAEHRR-UHFFFAOYSA-N 0.000 description 1
- VFUXSYAXEKYYMB-UHFFFAOYSA-N 2-[2-ethyl-3,5-dihydroxy-6-[3-methoxy-4-(2-morpholin-4-ylethoxy)benzoyl]phenyl]-n,n-bis(2-methoxyethyl)acetamide Chemical compound CCC1=C(O)C=C(O)C(C(=O)C=2C=C(OC)C(OCCN3CCOCC3)=CC=2)=C1CC(=O)N(CCOC)CCOC VFUXSYAXEKYYMB-UHFFFAOYSA-N 0.000 description 1
- RNUXIZKXJOGYQP-UHFFFAOYSA-N 2-[3-[[4-(4-methoxyphenyl)-5-pyridin-4-yl-1,2,4-triazol-3-yl]sulfanyl]propyl]benzo[de]isoquinoline-1,3-dione Chemical compound C1=CC(OC)=CC=C1N1C(C=2C=CN=CC=2)=NN=C1SCCCN(C1=O)C(=O)C2=C3C1=CC=CC3=CC=C2 RNUXIZKXJOGYQP-UHFFFAOYSA-N 0.000 description 1
- KHZOJCQBHJUJFY-UHFFFAOYSA-N 2-[4-(2-methylpyridin-4-yl)phenyl]-n-(4-pyridin-3-ylphenyl)acetamide Chemical compound C1=NC(C)=CC(C=2C=CC(CC(=O)NC=3C=CC(=CC=3)C=3C=NC=CC=3)=CC=2)=C1 KHZOJCQBHJUJFY-UHFFFAOYSA-N 0.000 description 1
- BOIPLTNGIAPDBY-UHFFFAOYSA-N 2-[6-(4-chlorophenoxy)hexyl]-1-cyano-3-pyridin-4-ylguanidine Chemical compound C1=CC(Cl)=CC=C1OCCCCCCN=C(NC#N)NC1=CC=NC=C1 BOIPLTNGIAPDBY-UHFFFAOYSA-N 0.000 description 1
- LHGWWAFKVCIILM-AMZGXZFVSA-N 2-[[(2r)-butan-2-yl]amino]-4-n-[(1s,5r)-8-[5-(cyclopropanecarbonyl)pyridin-2-yl]-8-azabicyclo[3.2.1]octan-3-yl]-5-methylbenzene-1,4-dicarboxamide Chemical compound C1=C(C(N)=O)C(N[C@H](C)CC)=CC(C(=O)NC2C[C@H]3CC[C@H](N3C=3N=CC(=CC=3)C(=O)C3CC3)C2)=C1C LHGWWAFKVCIILM-AMZGXZFVSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- XPRDUGXOWVXZLL-UHFFFAOYSA-N 2-[[2-fluoro-4-(3-methoxyphenyl)phenyl]carbamoyl]cyclopentene-1-carboxylic acid Chemical compound COC1=CC=CC(C=2C=C(F)C(NC(=O)C=3CCCC=3C(O)=O)=CC=2)=C1 XPRDUGXOWVXZLL-UHFFFAOYSA-N 0.000 description 1
- QCXJFISCRQIYID-IAEPZHFASA-N 2-amino-1-n-[(3s,6s,7r,10s,16s)-3-[(2s)-butan-2-yl]-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-10-propan-2-yl-8-oxa-1,4,11,14-tetrazabicyclo[14.3.0]nonadecan-6-yl]-4,6-dimethyl-3-oxo-9-n-[(3s,6s,7r,10s,16s)-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-3,10-di(propa Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N=C2C(C(=O)N[C@@H]3C(=O)N[C@H](C(N4CCC[C@H]4C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]3C)=O)[C@@H](C)CC)=C(N)C(=O)C(C)=C2O2)C2=C(C)C=C1 QCXJFISCRQIYID-IAEPZHFASA-N 0.000 description 1
- WJUNQSYQHHIVFX-UHFFFAOYSA-N 2-amino-4-[2,4-dichloro-5-(2-pyrrolidin-1-ylethoxy)phenyl]-n-ethylthieno[2,3-d]pyrimidine-6-carboxamide Chemical compound N1=C(N)N=C2SC(C(=O)NCC)=CC2=C1C(C(=CC=1Cl)Cl)=CC=1OCCN1CCCC1 WJUNQSYQHHIVFX-UHFFFAOYSA-N 0.000 description 1
- VDCRFBBZFHHYGT-IOSLPCCCSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-enyl-3h-purine-6,8-dione Chemical compound O=C1N(CC=C)C=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VDCRFBBZFHHYGT-IOSLPCCCSA-N 0.000 description 1
- QSPOQCXMGPDIHI-UHFFFAOYSA-N 2-amino-n,n-dipropyl-8-[4-(pyrrolidine-1-carbonyl)phenyl]-3h-1-benzazepine-4-carboxamide Chemical compound C1=C2N=C(N)CC(C(=O)N(CCC)CCC)=CC2=CC=C1C(C=C1)=CC=C1C(=O)N1CCCC1 QSPOQCXMGPDIHI-UHFFFAOYSA-N 0.000 description 1
- UCGWYCMPZXDHNR-UHFFFAOYSA-N 2-benzamido-1-(3-phenylpropyl)-5-benzimidazolecarboxylic acid methyl ester Chemical compound C=1C=CC=CC=1C(=O)NC1=NC2=CC(C(=O)OC)=CC=C2N1CCCC1=CC=CC=C1 UCGWYCMPZXDHNR-UHFFFAOYSA-N 0.000 description 1
- SPCKHVPPRJWQRZ-UHFFFAOYSA-N 2-benzhydryloxy-n,n-dimethylethanamine;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 SPCKHVPPRJWQRZ-UHFFFAOYSA-N 0.000 description 1
- CBIAKDAYHRWZCU-UHFFFAOYSA-N 2-bromo-4-[(6,7-dimethoxyquinazolin-4-yl)amino]phenol Chemical compound C=12C=C(OC)C(OC)=CC2=NC=NC=1NC1=CC=C(O)C(Br)=C1 CBIAKDAYHRWZCU-UHFFFAOYSA-N 0.000 description 1
- XULHFMYCBKQGEE-UHFFFAOYSA-N 2-hexyl-1-Decanol Chemical compound CCCCCCCCC(CO)CCCCCC XULHFMYCBKQGEE-UHFFFAOYSA-N 0.000 description 1
- CQOQDQWUFQDJMK-SSTWWWIQSA-N 2-methoxy-17beta-estradiol Chemical compound C([C@@H]12)C[C@]3(C)[C@@H](O)CC[C@H]3[C@@H]1CCC1=C2C=C(OC)C(O)=C1 CQOQDQWUFQDJMK-SSTWWWIQSA-N 0.000 description 1
- DPLMXAYKJZOTKO-UHFFFAOYSA-N 2-methyl-2-[4-(2-oxo-9-quinolin-3-yl-4h-[1,3]oxazino[5,4-c]quinolin-1-yl)phenyl]propanenitrile Chemical compound C1=CC(C(C)(C#N)C)=CC=C1N1C2=C3C=C(C=4C=C5C=CC=CC5=NC=4)C=CC3=NC=C2COC1=O DPLMXAYKJZOTKO-UHFFFAOYSA-N 0.000 description 1
- AQYNZOSCOWGGTP-UHFFFAOYSA-N 2-pyridin-2-ylsulfanylpyridine Chemical group C=1C=CC=NC=1SC1=CC=CC=N1 AQYNZOSCOWGGTP-UHFFFAOYSA-N 0.000 description 1
- AXRCEOKUDYDWLF-UHFFFAOYSA-N 3-(1-methyl-3-indolyl)-4-[1-[1-(2-pyridinylmethyl)-4-piperidinyl]-3-indolyl]pyrrole-2,5-dione Chemical compound C12=CC=CC=C2N(C)C=C1C(C(NC1=O)=O)=C1C(C1=CC=CC=C11)=CN1C(CC1)CCN1CC1=CC=CC=N1 AXRCEOKUDYDWLF-UHFFFAOYSA-N 0.000 description 1
- MAUCONCHVWBMHK-UHFFFAOYSA-N 3-[(dimethylamino)methyl]-N-[2-[4-[(hydroxyamino)-oxomethyl]phenoxy]ethyl]-2-benzofurancarboxamide Chemical compound O1C2=CC=CC=C2C(CN(C)C)=C1C(=O)NCCOC1=CC=C(C(=O)NO)C=C1 MAUCONCHVWBMHK-UHFFFAOYSA-N 0.000 description 1
- JUSFANSTBFGBAF-IRXDYDNUSA-N 3-[2,4-bis[(3s)-3-methylmorpholin-4-yl]pyrido[2,3-d]pyrimidin-7-yl]-n-methylbenzamide Chemical compound CNC(=O)C1=CC=CC(C=2N=C3N=C(N=C(C3=CC=2)N2[C@H](COCC2)C)N2[C@H](COCC2)C)=C1 JUSFANSTBFGBAF-IRXDYDNUSA-N 0.000 description 1
- DSOJSZXQRJGBCW-CABCVRRESA-N 3-[4-[(1r,2s)-2-aminocyclopropyl]phenyl]phenol Chemical compound N[C@H]1C[C@@H]1C1=CC=C(C=2C=C(O)C=CC=2)C=C1 DSOJSZXQRJGBCW-CABCVRRESA-N 0.000 description 1
- AVZCPICCWKMZDT-UHFFFAOYSA-N 3-[[2-(2-pyridinyl)-6-(1,2,4,5-tetrahydro-3-benzazepin-3-yl)-4-pyrimidinyl]amino]propanoic acid Chemical compound N=1C(NCCC(=O)O)=CC(N2CCC3=CC=CC=C3CC2)=NC=1C1=CC=CC=N1 AVZCPICCWKMZDT-UHFFFAOYSA-N 0.000 description 1
- WUIABRMSWOKTOF-OYALTWQYSA-N 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS([O-])(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-N 0.000 description 1
- NJTUORMLOPXPBY-UHFFFAOYSA-N 3-[benzyl(propan-2-yl)amino]-1-naphthalen-2-ylpropan-1-one;hydron;chloride Chemical compound Cl.C=1C=C2C=CC=CC2=CC=1C(=O)CCN(C(C)C)CC1=CC=CC=C1 NJTUORMLOPXPBY-UHFFFAOYSA-N 0.000 description 1
- JHSXDAWGLCZYSM-UHFFFAOYSA-N 4-(4-chloro-2-methylphenoxy)-N-hydroxybutanamide Chemical compound CC1=CC(Cl)=CC=C1OCCCC(=O)NO JHSXDAWGLCZYSM-UHFFFAOYSA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- IYULGYKOHUAYCG-UHFFFAOYSA-N 4-(cyclopropylamino)-2-[4-(4-ethylsulfonylpiperazin-1-yl)anilino]pyrimidine-5-carboxamide;hydrochloride Chemical compound Cl.C1CN(S(=O)(=O)CC)CCN1C(C=C1)=CC=C1NC1=NC=C(C(N)=O)C(NC2CC2)=N1 IYULGYKOHUAYCG-UHFFFAOYSA-N 0.000 description 1
- SUVMJBTUFCVSAD-JTQLQIEISA-N 4-Methylsulfinylbutyl isothiocyanate Natural products C[S@](=O)CCCCN=C=S SUVMJBTUFCVSAD-JTQLQIEISA-N 0.000 description 1
- XXJWYDDUDKYVKI-UHFFFAOYSA-N 4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-6-methoxy-7-[3-(1-pyrrolidinyl)propoxy]quinazoline Chemical compound COC1=CC2=C(OC=3C(=C4C=C(C)NC4=CC=3)F)N=CN=C2C=C1OCCCN1CCCC1 XXJWYDDUDKYVKI-UHFFFAOYSA-N 0.000 description 1
- XAEJIFARBQJLML-UHFFFAOYSA-N 4-[2-(2-cyclopentylidenehydrazinyl)-1,3-thiazol-4-yl]benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1=CSC(NN=C2CCCC2)=N1 XAEJIFARBQJLML-UHFFFAOYSA-N 0.000 description 1
- DPDZHVCKYBCJHW-UHFFFAOYSA-N 4-[4-(2,3-dihydro-1,4-benzodioxin-6-yl)-5-(2-pyridinyl)-1H-imidazol-2-yl]benzamide Chemical compound C1=CC(C(=O)N)=CC=C1C1=NC(C=2C=C3OCCOC3=CC=2)=C(C=2N=CC=CC=2)N1 DPDZHVCKYBCJHW-UHFFFAOYSA-N 0.000 description 1
- ZHSKUOZOLHMKEA-UHFFFAOYSA-N 4-[5-[bis(2-chloroethyl)amino]-1-methylbenzimidazol-2-yl]butanoic acid;hydron;chloride Chemical compound Cl.ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 ZHSKUOZOLHMKEA-UHFFFAOYSA-N 0.000 description 1
- FPEIJQLXFHKLJV-UHFFFAOYSA-N 4-[6-(1h-indol-5-yl)-1-[1-(pyridin-3-ylmethyl)piperidin-4-yl]pyrazolo[3,4-d]pyrimidin-4-yl]morpholine Chemical compound C=1C=CN=CC=1CN(CC1)CCC1N(C1=NC(=N2)C=3C=C4C=CNC4=CC=3)N=CC1=C2N1CCOCC1 FPEIJQLXFHKLJV-UHFFFAOYSA-N 0.000 description 1
- IMXHGCRIEAKIBU-UHFFFAOYSA-N 4-[6-[4-(methoxycarbonylamino)phenyl]-4-(4-morpholinyl)-1-pyrazolo[3,4-d]pyrimidinyl]-1-piperidinecarboxylic acid methyl ester Chemical compound C1=CC(NC(=O)OC)=CC=C1C1=NC(N2CCOCC2)=C(C=NN2C3CCN(CC3)C(=O)OC)C2=N1 IMXHGCRIEAKIBU-UHFFFAOYSA-N 0.000 description 1
- ZXGGCBQORXDVTE-UMCMBGNQSA-N 4-[[(2R,3S,4R,5R)-5-[6-amino-8-[(3,4-dichlorophenyl)methylamino]-9-purinyl]-3,4-dihydroxy-2-oxolanyl]methoxymethyl]benzonitrile Chemical compound C([C@H]1O[C@H]([C@@H]([C@@H]1O)O)N1C=2N=CN=C(C=2N=C1NCC=1C=C(Cl)C(Cl)=CC=1)N)OCC1=CC=C(C#N)C=C1 ZXGGCBQORXDVTE-UMCMBGNQSA-N 0.000 description 1
- JZWXMCPARMXZQV-UHFFFAOYSA-N 4-[[butyl(phenylcarbamoyl)amino]methyl]-n-hydroxybenzamide Chemical compound C=1C=CC=CC=1NC(=O)N(CCCC)CC1=CC=C(C(=O)NO)C=C1 JZWXMCPARMXZQV-UHFFFAOYSA-N 0.000 description 1
- VIGHQZSTZWNWFA-UHFFFAOYSA-N 4-{[4-amino-6-(5-chloro-1h,3h-benzo[de]isochromen-6-yl)-1,3,5-triazin-2-yl]sulfanyl}butanamide Chemical compound NC(=O)CCCSC1=NC(N)=NC(C=2C=3C=CC=C4COCC(C=34)=CC=2Cl)=N1 VIGHQZSTZWNWFA-UHFFFAOYSA-N 0.000 description 1
- TXUWMXQFNYDOEZ-UHFFFAOYSA-N 5-(1H-indol-3-ylmethyl)-3-methyl-2-sulfanylidene-4-imidazolidinone Chemical compound O=C1N(C)C(=S)NC1CC1=CNC2=CC=CC=C12 TXUWMXQFNYDOEZ-UHFFFAOYSA-N 0.000 description 1
- GYLDXIAOMVERTK-UHFFFAOYSA-N 5-(4-amino-1-propan-2-yl-3-pyrazolo[3,4-d]pyrimidinyl)-1,3-benzoxazol-2-amine Chemical compound C12=C(N)N=CN=C2N(C(C)C)N=C1C1=CC=C(OC(N)=N2)C2=C1 GYLDXIAOMVERTK-UHFFFAOYSA-N 0.000 description 1
- HUNAOTXNHVALTN-UHFFFAOYSA-N 5-(5-chloro-2,4-dihydroxyphenyl)-N-ethyl-4-(4-methoxyphenyl)pyrazole-3-carboxamide Chemical compound CCNC(=O)C1=NNC(C=2C(=CC(O)=C(Cl)C=2)O)=C1C1=CC=C(OC)C=C1 HUNAOTXNHVALTN-UHFFFAOYSA-N 0.000 description 1
- JXPCDMPJCKNLBY-UHFFFAOYSA-N 5-(5-chloro-2,4-dihydroxyphenyl)-n-ethyl-4-(4-methoxyphenyl)isoxazole-3-carboxamide Chemical compound CCNC(=O)C1=NOC(C=2C(=CC(O)=C(Cl)C=2)O)=C1C1=CC=C(OC)C=C1 JXPCDMPJCKNLBY-UHFFFAOYSA-N 0.000 description 1
- JEGHXKRHKHPBJD-UHFFFAOYSA-N 5-(7-methylsulfonyl-2-morpholin-4-yl-5,6-dihydropyrrolo[2,3-d]pyrimidin-4-yl)pyrimidin-2-amine Chemical compound CS(=O)(=O)N1CCC2=C1N=C(N1CCOCC1)N=C2C1=CN=C(N)N=C1 JEGHXKRHKHPBJD-UHFFFAOYSA-N 0.000 description 1
- JJMDCOVWQOJGCB-UHFFFAOYSA-N 5-aminopentanoic acid Chemical compound [NH3+]CCCCC([O-])=O JJMDCOVWQOJGCB-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- PDOQBOJDRPLBQU-QMMMGPOBSA-N 5-chloro-2-n-[(1s)-1-(5-fluoropyrimidin-2-yl)ethyl]-4-n-(5-methyl-1h-pyrazol-3-yl)pyrimidine-2,4-diamine Chemical compound N([C@@H](C)C=1N=CC(F)=CN=1)C(N=1)=NC=C(Cl)C=1NC=1C=C(C)NN=1 PDOQBOJDRPLBQU-QMMMGPOBSA-N 0.000 description 1
- YHHFKWKMXWRVTJ-XLNRJJMWSA-N 5-chloro-n-[(z)-[phenyl(pyridin-2-yl)methylidene]amino]pyridin-2-amine Chemical compound N1=CC(Cl)=CC=C1N\N=C(C=1N=CC=CC=1)\C1=CC=CC=C1 YHHFKWKMXWRVTJ-XLNRJJMWSA-N 0.000 description 1
- ROUFCTKIILEETD-UHFFFAOYSA-N 5-nitro-2-[(5-nitropyridin-2-yl)disulfanyl]pyridine Chemical compound N1=CC([N+](=O)[O-])=CC=C1SSC1=CC=C([N+]([O-])=O)C=N1 ROUFCTKIILEETD-UHFFFAOYSA-N 0.000 description 1
- MMRCWWRFYLZGAE-ZBZRSYSASA-N 533u947v6q Chemical compound O([C@]12[C@H](OC(C)=O)[C@]3(CC)C=CCN4CC[C@@]5([C@H]34)[C@H]1N(C)C1=C5C=C(C(=C1)OC)[C@]1(C(=O)OC)C3=C(C4=CC=CC=C4N3)CCN3C[C@H](C1)C[C@@](C3)(O)CC)C(=O)N(CCCl)C2=O MMRCWWRFYLZGAE-ZBZRSYSASA-N 0.000 description 1
- OSXFATOLZGZLSK-UHFFFAOYSA-N 6,7-dimethoxy-2-(4-methyl-1,4-diazepan-1-yl)-N-[1-(phenylmethyl)-4-piperidinyl]-4-quinazolinamine Chemical compound C=12C=C(OC)C(OC)=CC2=NC(N2CCN(C)CCC2)=NC=1NC(CC1)CCN1CC1=CC=CC=C1 OSXFATOLZGZLSK-UHFFFAOYSA-N 0.000 description 1
- WEXCGGWTIDNVNT-UHFFFAOYSA-N 6,7-dimethoxy-2-pyrrolidin-1-yl-n-(5-pyrrolidin-1-ylpentyl)quinazolin-4-amine Chemical compound C=12C=C(OC)C(OC)=CC2=NC(N2CCCC2)=NC=1NCCCCCN1CCCC1 WEXCGGWTIDNVNT-UHFFFAOYSA-N 0.000 description 1
- JTDYUFSDZATMKU-UHFFFAOYSA-N 6-(1,3-dioxo-2-benzo[de]isoquinolinyl)-N-hydroxyhexanamide Chemical compound C1=CC(C(N(CCCCCC(=O)NO)C2=O)=O)=C3C2=CC=CC3=C1 JTDYUFSDZATMKU-UHFFFAOYSA-N 0.000 description 1
- PFHDWRIVDDIFRP-UHFFFAOYSA-N 6-cyano-n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-1-pentan-3-ylindole-4-carboxamide Chemical compound C1=C(C#N)C=C2N(C(CC)CC)C=CC2=C1C(=O)NCC1=C(C)C=C(C)NC1=O PFHDWRIVDDIFRP-UHFFFAOYSA-N 0.000 description 1
- KAEVHZSIYLATMK-UHFFFAOYSA-N 6-n-[bis(aziridin-1-yl)phosphoryl]-2-n,2-n,7-trimethylpurine-2,6-diamine Chemical compound C=12N(C)C=NC2=NC(N(C)C)=NC=1NP(=O)(N1CC1)N1CC1 KAEVHZSIYLATMK-UHFFFAOYSA-N 0.000 description 1
- NKGPJODWTZCHGF-KQYNXXCUSA-N 6-thioinosinic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(S)=C2N=C1 NKGPJODWTZCHGF-KQYNXXCUSA-N 0.000 description 1
- PLIVFNIUGLLCEK-UHFFFAOYSA-N 7-[4-(3-ethynylanilino)-7-methoxyquinazolin-6-yl]oxy-n-hydroxyheptanamide Chemical compound C=12C=C(OCCCCCCC(=O)NO)C(OC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 PLIVFNIUGLLCEK-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- FSXIBBYWVGWQJL-UHFFFAOYSA-N 8-[[4-(cyclopropanecarbonyl)piperazin-1-yl]methyl]-1,3-dimethyl-7-(3-methylbutyl)purine-2,6-dione Chemical compound CC(C)CCN1C(CN2CCN(CC2)C(=O)C2CC2)=NC2=C1C(=O)N(C)C(=O)N2C FSXIBBYWVGWQJL-UHFFFAOYSA-N 0.000 description 1
- JCKGSPAAPQRPBW-OAQYLSRUSA-N 8-fluoro-n-[(2r)-1-oxo-1-pyrrolidin-1-yl-3-[3-(trifluoromethyl)phenyl]propan-2-yl]-1,2,3,4-tetrahydroisoquinoline-6-sulfonamide Chemical compound C([C@@H](NS(=O)(=O)C=1C=C(C=2CNCCC=2C=1)F)C(=O)N1CCCC1)C1=CC=CC(C(F)(F)F)=C1 JCKGSPAAPQRPBW-OAQYLSRUSA-N 0.000 description 1
- JGRPKOGHYBAVMW-UHFFFAOYSA-N 8-hydroxy-5-quinolinecarboxylic acid Chemical compound C1=CC=C2C(C(=O)O)=CC=C(O)C2=N1 JGRPKOGHYBAVMW-UHFFFAOYSA-N 0.000 description 1
- NKGPJODWTZCHGF-UHFFFAOYSA-N 9-[3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound OC1C(O)C(CO)OC1N1C(NC=NC2=S)=C2N=C1 NKGPJODWTZCHGF-UHFFFAOYSA-N 0.000 description 1
- 229940125668 ADH-1 Drugs 0.000 description 1
- OONFNUWBHFSNBT-HXUWFJFHSA-N AEE788 Chemical compound C1CN(CC)CCN1CC1=CC=C(C=2NC3=NC=NC(N[C@H](C)C=4C=CC=CC=4)=C3C=2)C=C1 OONFNUWBHFSNBT-HXUWFJFHSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 229920002126 Acrylic acid copolymer Polymers 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- ATXHVCQZZJYMCF-XUDSTZEESA-N Allylestrenol Chemical compound C1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)CC=C)[C@@H]4[C@@H]3CCC2=C1 ATXHVCQZZJYMCF-XUDSTZEESA-N 0.000 description 1
- AFHJQYHRLPMKHU-XXWVOBANSA-N Aloin Natural products O=C1c2c(O)cc(CO)cc2[C@H]([C@H]2[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O2)c2c1c(O)ccc2 AFHJQYHRLPMKHU-XXWVOBANSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- FVVDKUPCWXUVNP-UHFFFAOYSA-M Aminosalicylate sodium anhydrous Chemical compound [Na+].NC1=CC=C(C([O-])=O)C(O)=C1 FVVDKUPCWXUVNP-UHFFFAOYSA-M 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 229940127512 Androgen Synthesis Inhibitors Drugs 0.000 description 1
- BOJKULTULYSRAS-OTESTREVSA-N Andrographolide Chemical compound C([C@H]1[C@]2(C)CC[C@@H](O)[C@]([C@H]2CCC1=C)(CO)C)\C=C1/[C@H](O)COC1=O BOJKULTULYSRAS-OTESTREVSA-N 0.000 description 1
- 229940123200 Angiopoietin inhibitor Drugs 0.000 description 1
- 102400000068 Angiostatin Human genes 0.000 description 1
- 108010079709 Angiostatins Proteins 0.000 description 1
- 102000004452 Arginase Human genes 0.000 description 1
- 108700024123 Arginases Proteins 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Natural products OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- QULDDKSCVCJTPV-UHFFFAOYSA-N BIIB021 Chemical compound COC1=C(C)C=NC(CN2C3=NC(N)=NC(Cl)=C3N=C2)=C1C QULDDKSCVCJTPV-UHFFFAOYSA-N 0.000 description 1
- 229940125565 BMS-986016 Drugs 0.000 description 1
- 108700020463 BRCA1 Proteins 0.000 description 1
- 102000036365 BRCA1 Human genes 0.000 description 1
- 101150072950 BRCA1 gene Proteins 0.000 description 1
- 102000052609 BRCA2 Human genes 0.000 description 1
- 108700020462 BRCA2 Proteins 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 101150008921 Brca2 gene Proteins 0.000 description 1
- 108010037003 Buserelin Proteins 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 1
- 239000005461 Canertinib Substances 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- AOCCBINRVIKJHY-UHFFFAOYSA-N Carmofur Chemical compound CCCCCCNC(=O)N1C=C(F)C(=O)NC1=O AOCCBINRVIKJHY-UHFFFAOYSA-N 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 1
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 1
- 241000283153 Cetacea Species 0.000 description 1
- 101710163595 Chaperone protein DnaK Proteins 0.000 description 1
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- QMBJSIBWORFWQT-DFXBJWIESA-N Chlormadinone acetate Chemical compound C1=C(Cl)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 QMBJSIBWORFWQT-DFXBJWIESA-N 0.000 description 1
- RURLVUZRUFHCJO-UHFFFAOYSA-N Chromomycin A3 Natural products COC(C1Cc2cc3cc(OC4CC(OC(=O)C)C(OC5CC(O)C(OC)C(C)O5)C(C)O4)c(C)c(O)c3c(O)c2C(=O)C1OC6CC(OC7CC(C)(O)C(OC(=O)C)C(C)O7)C(O)C(C)O6)C(=O)C(O)C(C)O RURLVUZRUFHCJO-UHFFFAOYSA-N 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 101000904177 Clupea pallasii Gonadoliberin-1 Proteins 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- GVKKJJOMQCNPGB-JTQLQIEISA-N Cryptotanshinone Chemical compound O=C1C(=O)C2=C3CCCC(C)(C)C3=CC=C2C2=C1[C@@H](C)CO2 GVKKJJOMQCNPGB-JTQLQIEISA-N 0.000 description 1
- GVKKJJOMQCNPGB-UHFFFAOYSA-N Cryptotanshinone Natural products O=C1C(=O)C2=C3CCCC(C)(C)C3=CC=C2C2=C1C(C)CO2 GVKKJJOMQCNPGB-UHFFFAOYSA-N 0.000 description 1
- QRMPRVXWPCLVNI-UHFFFAOYSA-N Curcumenol Natural products C1C(=C)C2CCC(C)C22CC(C(C)C)C1(O)O2 QRMPRVXWPCLVNI-UHFFFAOYSA-N 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- QWCKQJZIFLGMSD-GSVOUGTGSA-N D-alpha-aminobutyric acid Chemical group CC[C@@H](N)C(O)=O QWCKQJZIFLGMSD-GSVOUGTGSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 229960005500 DHA-paclitaxel Drugs 0.000 description 1
- 230000007067 DNA methylation Effects 0.000 description 1
- 229940126190 DNA methyltransferase inhibitor Drugs 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 102100029721 DnaJ homolog subfamily B member 1 Human genes 0.000 description 1
- MWWSFMDVAYGXBV-RUELKSSGSA-N Doxorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-RUELKSSGSA-N 0.000 description 1
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000001301 EGF receptor Human genes 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 108010041308 Endothelial Growth Factors Proteins 0.000 description 1
- SAMRUMKYXPVKPA-VFKOLLTISA-N Enocitabine Chemical compound O=C1N=C(NC(=O)CCCCCCCCCCCCCCCCCCCCC)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 SAMRUMKYXPVKPA-VFKOLLTISA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- OBMLHUPNRURLOK-XGRAFVIBSA-N Epitiostanol Chemical compound C1[C@@H]2S[C@@H]2C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 OBMLHUPNRURLOK-XGRAFVIBSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 108010075944 Erythropoietin Receptors Proteins 0.000 description 1
- 102100036509 Erythropoietin receptor Human genes 0.000 description 1
- 229940127462 Estrogen Synthesis Inhibitors Drugs 0.000 description 1
- 108010008165 Etanercept Proteins 0.000 description 1
- IMROMDMJAWUWLK-UHFFFAOYSA-N Ethenol Chemical compound OC=C IMROMDMJAWUWLK-UHFFFAOYSA-N 0.000 description 1
- BFPYWIDHMRZLRN-SLHNCBLASA-N Ethinyl estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 BFPYWIDHMRZLRN-SLHNCBLASA-N 0.000 description 1
- 239000001293 FEMA 3089 Substances 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100028412 Fibroblast growth factor 10 Human genes 0.000 description 1
- 108090001047 Fibroblast growth factor 10 Proteins 0.000 description 1
- 108010029961 Filgrastim Proteins 0.000 description 1
- 240000009088 Fragaria x ananassa Species 0.000 description 1
- ULNXAWLQFZMIHX-UHFFFAOYSA-N GSK343 Chemical compound C1=C(C)NC(=O)C(CNC(=O)C=2C=3C=NN(C=3C=C(C=2)C=2C=C(N=CC=2)N2CCN(C)CC2)C(C)C)=C1CCC ULNXAWLQFZMIHX-UHFFFAOYSA-N 0.000 description 1
- 229940032072 GVAX vaccine Drugs 0.000 description 1
- 101000796901 Gallus gallus Alcohol dehydrogenase 1 Proteins 0.000 description 1
- SQSZANZGUXWJEA-UHFFFAOYSA-N Gandotinib Chemical compound N1C(C)=CC(NC2=NN3C(CC=4C(=CC(Cl)=CC=4)F)=C(C)N=C3C(CN3CCOCC3)=C2)=N1 SQSZANZGUXWJEA-UHFFFAOYSA-N 0.000 description 1
- RVAQIUULWULRNW-UHFFFAOYSA-N Ganetespib Chemical compound C1=C(O)C(C(C)C)=CC(C=2N(C(O)=NN=2)C=2C=C3C=CN(C)C3=CC=2)=C1O RVAQIUULWULRNW-UHFFFAOYSA-N 0.000 description 1
- JRZJKWGQFNTSRN-UHFFFAOYSA-N Geldanamycin Natural products C1C(C)CC(OC)C(O)C(C)C=C(C)C(OC(N)=O)C(OC)CCC=C(C)C(=O)NC2=CC(=O)C(OC)=C1C2=O JRZJKWGQFNTSRN-UHFFFAOYSA-N 0.000 description 1
- BJJXHLWLUDYTGC-ANULTFPQSA-N Gestrinone Chemical compound C1CC(=O)C=C2CC[C@@H]([C@H]3[C@@](CC)([C@](CC3)(O)C#C)C=C3)C3=C21 BJJXHLWLUDYTGC-ANULTFPQSA-N 0.000 description 1
- DCXXMTOCNZCJGO-UHFFFAOYSA-N Glycerol trioctadecanoate Natural products CCCCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCCCC DCXXMTOCNZCJGO-UHFFFAOYSA-N 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-M Glycolate Chemical compound OCC([O-])=O AEMRFAOFKBGASW-UHFFFAOYSA-M 0.000 description 1
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 102100036242 HLA class II histocompatibility antigen, DQ alpha 2 chain Human genes 0.000 description 1
- 102100040485 HLA class II histocompatibility antigen, DRB1 beta chain Human genes 0.000 description 1
- 108010035452 HLA-A1 Antigen Proteins 0.000 description 1
- 108010087480 HLA-B40 Antigen Proteins 0.000 description 1
- 108010014597 HLA-B44 Antigen Proteins 0.000 description 1
- 108010091938 HLA-B7 Antigen Proteins 0.000 description 1
- 108010010378 HLA-DP Antigens Proteins 0.000 description 1
- 102000015789 HLA-DP Antigens Human genes 0.000 description 1
- 108010062347 HLA-DQ Antigens Proteins 0.000 description 1
- 108010039343 HLA-DRB1 Chains Proteins 0.000 description 1
- 108010042283 HSP40 Heat-Shock Proteins Proteins 0.000 description 1
- 108010027814 HSP72 Heat-Shock Proteins Proteins 0.000 description 1
- 101150051208 HSPH1 gene Proteins 0.000 description 1
- 101710178376 Heat shock 70 kDa protein Proteins 0.000 description 1
- 102100040352 Heat shock 70 kDa protein 1A Human genes 0.000 description 1
- 101710152018 Heat shock cognate 70 kDa protein Proteins 0.000 description 1
- 102100031624 Heat shock protein 105 kDa Human genes 0.000 description 1
- 101710113864 Heat shock protein 90 Proteins 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 description 1
- 108010074870 Histone Demethylases Proteins 0.000 description 1
- 102000008157 Histone Demethylases Human genes 0.000 description 1
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 1
- 101000986086 Homo sapiens HLA class I histocompatibility antigen, A alpha chain Proteins 0.000 description 1
- 101000930801 Homo sapiens HLA class II histocompatibility antigen, DQ alpha 2 chain Proteins 0.000 description 1
- 101000968028 Homo sapiens HLA class II histocompatibility antigen, DRB1 beta chain Proteins 0.000 description 1
- 101000972946 Homo sapiens Hepatocyte growth factor receptor Proteins 0.000 description 1
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 1
- 101001050886 Homo sapiens Lysine-specific histone demethylase 1A Proteins 0.000 description 1
- 101000578784 Homo sapiens Melanoma antigen recognized by T-cells 1 Proteins 0.000 description 1
- 101000835893 Homo sapiens Mothers against decapentaplegic homolog 4 Proteins 0.000 description 1
- 101000884270 Homo sapiens Natural killer cell receptor 2B4 Proteins 0.000 description 1
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 description 1
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 206010020843 Hyperthermia Diseases 0.000 description 1
- 108010023610 IL13-PE38 Proteins 0.000 description 1
- 229940127185 IL13-PE38QQR Drugs 0.000 description 1
- ZGSXEXBYLJIOGF-ALFLXDJESA-N IWR-1-endo Chemical compound C=1C=CC2=CC=CN=C2C=1NC(=O)C(C=C1)=CC=C1N1C(=O)[C@@H]2[C@H](C=C3)C[C@H]3[C@@H]2C1=O ZGSXEXBYLJIOGF-ALFLXDJESA-N 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- JJKOTMDDZAJTGQ-DQSJHHFOSA-N Idoxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN2CCCC2)=CC=1)/C1=CC=C(I)C=C1 JJKOTMDDZAJTGQ-DQSJHHFOSA-N 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 102000003814 Interleukin-10 Human genes 0.000 description 1
- 108090000174 Interleukin-10 Proteins 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 102000003816 Interleukin-13 Human genes 0.000 description 1
- 102000003812 Interleukin-15 Human genes 0.000 description 1
- 108090000172 Interleukin-15 Proteins 0.000 description 1
- 102000049772 Interleukin-16 Human genes 0.000 description 1
- 101800003050 Interleukin-16 Proteins 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 102000003810 Interleukin-18 Human genes 0.000 description 1
- 108090000171 Interleukin-18 Proteins 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 102000000646 Interleukin-3 Human genes 0.000 description 1
- 108090001007 Interleukin-8 Proteins 0.000 description 1
- 102000004890 Interleukin-8 Human genes 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- YMFNPBSZFWXMAD-UHFFFAOYSA-N JSH-23 Chemical compound NC1=CC(C)=CC=C1NCCCC1=CC=CC=C1 YMFNPBSZFWXMAD-UHFFFAOYSA-N 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 102100020880 Kit ligand Human genes 0.000 description 1
- 101710177504 Kit ligand Proteins 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical group NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical group OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical group OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- JZKXXXDKRQWDET-QMMMGPOBSA-N L-m-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC(O)=C1 JZKXXXDKRQWDET-QMMMGPOBSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002144 L01XE18 - Ruxolitinib Substances 0.000 description 1
- 239000002138 L01XE21 - Regorafenib Substances 0.000 description 1
- XXYGTCZJJLTAGH-UHFFFAOYSA-N LGK974 Chemical compound C1=NC(C)=CC(C=2C(=CC(CC(=O)NC=3N=CC(=CC=3)C=3N=CC=NC=3)=CN=2)C)=C1 XXYGTCZJJLTAGH-UHFFFAOYSA-N 0.000 description 1
- UIARLYUEJFELEN-LROUJFHJSA-N LSM-1231 Chemical compound C12=C3N4C5=CC=CC=C5C3=C3C(=O)NCC3=C2C2=CC=CC=C2N1[C@]1(C)[C@](CO)(O)C[C@H]4O1 UIARLYUEJFELEN-LROUJFHJSA-N 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 1
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 102100024985 Lysine-specific histone demethylase 1A Human genes 0.000 description 1
- QQDIFLSJMFDTCQ-UHFFFAOYSA-N MC1568 Chemical compound CN1C(C=CC(=O)NO)=CC=C1C=CC(=O)C1=CC=CC(F)=C1 QQDIFLSJMFDTCQ-UHFFFAOYSA-N 0.000 description 1
- SBDNJUWAMKYJOX-UHFFFAOYSA-N Meclofenamic Acid Chemical compound CC1=CC=C(Cl)C(NC=2C(=CC=CC=2)C(O)=O)=C1Cl SBDNJUWAMKYJOX-UHFFFAOYSA-N 0.000 description 1
- 102100028389 Melanoma antigen recognized by T-cells 1 Human genes 0.000 description 1
- 102000000440 Melanoma-associated antigen Human genes 0.000 description 1
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- GCKMFJBGXUYNAG-HLXURNFRSA-N Methyltestosterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)CC2 GCKMFJBGXUYNAG-HLXURNFRSA-N 0.000 description 1
- 102100025725 Mothers against decapentaplegic homolog 4 Human genes 0.000 description 1
- 101100103015 Mus musculus Wt1 gene Proteins 0.000 description 1
- 241000186359 Mycobacterium Species 0.000 description 1
- 235000021360 Myristic acid Nutrition 0.000 description 1
- TUNFSRHWOTWDNC-UHFFFAOYSA-N Myristic acid Natural products CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 description 1
- WRKPZSMRWPJJDH-UHFFFAOYSA-N N-(6-methyl-1,3-benzothiazol-2-yl)-2-[(4-oxo-3-phenyl-6,7-dihydrothieno[3,2-d]pyrimidin-2-yl)thio]acetamide Chemical compound S1C2=CC(C)=CC=C2N=C1NC(=O)CSC1=NC=2CCSC=2C(=O)N1C1=CC=CC=C1 WRKPZSMRWPJJDH-UHFFFAOYSA-N 0.000 description 1
- BHUZLJOUHMBZQY-YXQOSMAKSA-N N-[4-[(2R,4R,6S)-4-[[(4,5-diphenyl-2-oxazolyl)thio]methyl]-6-[4-(hydroxymethyl)phenyl]-1,3-dioxan-2-yl]phenyl]-N'-hydroxyoctanediamide Chemical compound C1=CC(CO)=CC=C1[C@H]1O[C@@H](C=2C=CC(NC(=O)CCCCCCC(=O)NO)=CC=2)O[C@@H](CSC=2OC(=C(N=2)C=2C=CC=CC=2)C=2C=CC=CC=2)C1 BHUZLJOUHMBZQY-YXQOSMAKSA-N 0.000 description 1
- HEKAIDKUDLCBRU-UHFFFAOYSA-N N-[4-[2-ethyl-4-(3-methylphenyl)-5-thiazolyl]-2-pyridinyl]benzamide Chemical compound S1C(CC)=NC(C=2C=C(C)C=CC=2)=C1C(C=1)=CC=NC=1NC(=O)C1=CC=CC=C1 HEKAIDKUDLCBRU-UHFFFAOYSA-N 0.000 description 1
- WWGBHDIHIVGYLZ-UHFFFAOYSA-N N-[4-[3-[[[7-(hydroxyamino)-7-oxoheptyl]amino]-oxomethyl]-5-isoxazolyl]phenyl]carbamic acid tert-butyl ester Chemical compound C1=CC(NC(=O)OC(C)(C)C)=CC=C1C1=CC(C(=O)NCCCCCCC(=O)NO)=NO1 WWGBHDIHIVGYLZ-UHFFFAOYSA-N 0.000 description 1
- QGZYDVAGYRLSKP-UHFFFAOYSA-N N-[7-(hydroxyamino)-7-oxoheptyl]-2-(N-phenylanilino)-5-pyrimidinecarboxamide Chemical compound N1=CC(C(=O)NCCCCCCC(=O)NO)=CN=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 QGZYDVAGYRLSKP-UHFFFAOYSA-N 0.000 description 1
- AJRGHIGYPXNABY-UHFFFAOYSA-N N-hydroxy-1-[(4-methoxyphenyl)methyl]-6-indolecarboxamide Chemical compound C1=CC(OC)=CC=C1CN1C2=CC(C(=O)NO)=CC=C2C=C1 AJRGHIGYPXNABY-UHFFFAOYSA-N 0.000 description 1
- PAWIYAYFNXQGAP-UHFFFAOYSA-N N-hydroxy-2-[4-[[(1-methyl-3-indolyl)methylamino]methyl]-1-piperidinyl]-5-pyrimidinecarboxamide Chemical compound C12=CC=CC=C2N(C)C=C1CNCC(CC1)CCN1C1=NC=C(C(=O)NO)C=N1 PAWIYAYFNXQGAP-UHFFFAOYSA-N 0.000 description 1
- JOOXLOJCABQBSG-UHFFFAOYSA-N N-tert-butyl-3-[[5-methyl-2-[4-[2-(1-pyrrolidinyl)ethoxy]anilino]-4-pyrimidinyl]amino]benzenesulfonamide Chemical compound N1=C(NC=2C=C(C=CC=2)S(=O)(=O)NC(C)(C)C)C(C)=CN=C1NC(C=C1)=CC=C1OCCN1CCCC1 JOOXLOJCABQBSG-UHFFFAOYSA-N 0.000 description 1
- 102100038082 Natural killer cell receptor 2B4 Human genes 0.000 description 1
- 241000772415 Neovison vison Species 0.000 description 1
- 102000007530 Neurofibromin 1 Human genes 0.000 description 1
- 108010085793 Neurofibromin 1 Proteins 0.000 description 1
- JZFPYUNJRRFVQU-UHFFFAOYSA-N Niflumic acid Chemical compound OC(=O)C1=CC=CN=C1NC1=CC=CC(C(F)(F)F)=C1 JZFPYUNJRRFVQU-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- QMGVPVSNSZLJIA-UHFFFAOYSA-N Nux Vomica Natural products C1C2C3C4N(C=5C6=CC=CC=5)C(=O)CC3OCC=C2CN2C1C46CC2 QMGVPVSNSZLJIA-UHFFFAOYSA-N 0.000 description 1
- YGACXVRLDHEXKY-WXRXAMBDSA-N O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 Chemical compound O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 YGACXVRLDHEXKY-WXRXAMBDSA-N 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 241000207836 Olea <angiosperm> Species 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 108091008606 PDGF receptors Proteins 0.000 description 1
- 102100035593 POU domain, class 2, transcription factor 1 Human genes 0.000 description 1
- 101710084414 POU domain, class 2, transcription factor 1 Proteins 0.000 description 1
- NVRXTLZYXZNATH-UHFFFAOYSA-N PP121 Chemical compound N1=C(C=2C=C3C=CNC3=NC=2)C=2C(N)=NC=NC=2N1C1CCCC1 NVRXTLZYXZNATH-UHFFFAOYSA-N 0.000 description 1
- 241001631646 Papillomaviridae Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- KMSKQZKKOZQFFG-HSUXVGOQSA-N Pirarubicin Chemical compound O([C@H]1[C@@H](N)C[C@@H](O[C@H]1C)O[C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1CCCCO1 KMSKQZKKOZQFFG-HSUXVGOQSA-N 0.000 description 1
- 108090000778 Platelet factor 4 Proteins 0.000 description 1
- 102000004211 Platelet factor 4 Human genes 0.000 description 1
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 108091036414 Polyinosinic:polycytidylic acid Proteins 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- WDVSHHCDHLJJJR-UHFFFAOYSA-N Proflavine Chemical compound C1=CC(N)=CC2=NC3=CC(N)=CC=C3C=C21 WDVSHHCDHLJJJR-UHFFFAOYSA-N 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 108010089836 Proto-Oncogene Proteins c-met Proteins 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- AHHFEZNOXOZZQA-ZEBDFXRSSA-N Ranimustine Chemical compound CO[C@H]1O[C@H](CNC(=O)N(CCCl)N=O)[C@@H](O)[C@H](O)[C@H]1O AHHFEZNOXOZZQA-ZEBDFXRSSA-N 0.000 description 1
- 229940123934 Reductase inhibitor Drugs 0.000 description 1
- 108010041388 Ribonucleotide Reductases Proteins 0.000 description 1
- 102000000505 Ribonucleotide Reductases Human genes 0.000 description 1
- QHKYPYXTTXKZST-UHFFFAOYSA-N SB-202190 Chemical compound C1=CC(O)=CC=C1C1=NC(C=2C=CC(F)=CC=2)=C(C=2C=CN=CC=2)N1 QHKYPYXTTXKZST-UHFFFAOYSA-N 0.000 description 1
- 101000832889 Scheffersomyces stipitis (strain ATCC 58785 / CBS 6054 / NBRC 10063 / NRRL Y-11545) Alcohol dehydrogenase 2 Proteins 0.000 description 1
- 229920002305 Schizophyllan Polymers 0.000 description 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- ABBQHOQBGMUPJH-UHFFFAOYSA-M Sodium salicylate Chemical compound [Na+].OC1=CC=CC=C1C([O-])=O ABBQHOQBGMUPJH-UHFFFAOYSA-M 0.000 description 1
- 108010017622 Somatomedin Receptors Proteins 0.000 description 1
- 102000004584 Somatomedin Receptors Human genes 0.000 description 1
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 1
- 101000693619 Starmerella bombicola Lactone esterase Proteins 0.000 description 1
- 241001279009 Strychnos toxifera Species 0.000 description 1
- 210000000662 T-lymphocyte subset Anatomy 0.000 description 1
- JVDOKQYTTYUYDV-UHFFFAOYSA-N TG101209 Chemical compound C1CN(C)CCN1C(C=C1)=CC=C1NC1=NC=C(C)C(NC=2C=C(C=CC=2)S(=O)(=O)NC(C)(C)C)=N1 JVDOKQYTTYUYDV-UHFFFAOYSA-N 0.000 description 1
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 1
- WFWLQNSHRPWKFK-UHFFFAOYSA-N Tegafur Chemical compound O=C1NC(=O)C(F)=CN1C1OCCC1 WFWLQNSHRPWKFK-UHFFFAOYSA-N 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 1
- 210000000447 Th1 cell Anatomy 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 102000036693 Thrombopoietin Human genes 0.000 description 1
- 108010041111 Thrombopoietin Proteins 0.000 description 1
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 1
- IWEQQRMGNVVKQW-OQKDUQJOSA-N Toremifene citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 IWEQQRMGNVVKQW-OQKDUQJOSA-N 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 1
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- DOOTYTYQINUNNV-UHFFFAOYSA-N Triethyl citrate Chemical compound CCOC(=O)CC(O)(C(=O)OCC)CC(=O)OCC DOOTYTYQINUNNV-UHFFFAOYSA-N 0.000 description 1
- UMILHIMHKXVDGH-UHFFFAOYSA-N Triethylene glycol diglycidyl ether Chemical compound C1OC1COCCOCCOCCOCC1CO1 UMILHIMHKXVDGH-UHFFFAOYSA-N 0.000 description 1
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 1
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- 108010072912 YM753 compound Proteins 0.000 description 1
- 101000998548 Yersinia ruckeri Alkaline proteinase inhibitor Proteins 0.000 description 1
- MUXFZBHBYYYLTH-UHFFFAOYSA-N Zaltoprofen Chemical compound O=C1CC2=CC(C(C(O)=O)C)=CC=C2SC2=CC=CC=C21 MUXFZBHBYYYLTH-UHFFFAOYSA-N 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- LNFBAYSBVQBKFR-UHFFFAOYSA-N [7-(6-aminopyridin-3-yl)-3,5-dihydro-2h-1,4-benzoxazepin-4-yl]-(3-fluoro-2-methyl-4-methylsulfonylphenyl)methanone Chemical compound CC1=C(F)C(S(C)(=O)=O)=CC=C1C(=O)N1CC2=CC(C=3C=NC(N)=CC=3)=CC=C2OCC1 LNFBAYSBVQBKFR-UHFFFAOYSA-N 0.000 description 1
- 229960003697 abatacept Drugs 0.000 description 1
- GZOSMCIZMLWJML-VJLLXTKPSA-N abiraterone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CC[C@H](O)CC3=CC2)C)CC[C@@]11C)C=C1C1=CC=CN=C1 GZOSMCIZMLWJML-VJLLXTKPSA-N 0.000 description 1
- 229960000853 abiraterone Drugs 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 229960002692 allylestrenol Drugs 0.000 description 1
- CPUHNROBVJNNPW-UHFFFAOYSA-N aloin A Natural products OC1C(O)C(O)C(CO)OC1OC1C2=CC(CO)=CC(O)=C2C(=O)C2=C(O)C=CC=C21 CPUHNROBVJNNPW-UHFFFAOYSA-N 0.000 description 1
- AFHJQYHRLPMKHU-WEZNYRQKSA-N aloin B Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1[C@H]1C2=CC(CO)=CC(O)=C2C(=O)C2=C(O)C=CC=C21 AFHJQYHRLPMKHU-WEZNYRQKSA-N 0.000 description 1
- 108010026331 alpha-Fetoproteins Proteins 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 229950007861 alvespimycin Drugs 0.000 description 1
- 229950010817 alvocidib Drugs 0.000 description 1
- BIIVYFLTOXDAOV-YVEFUNNKSA-N alvocidib Chemical compound O[C@@H]1CN(C)CC[C@@H]1C1=C(O)C=C(O)C2=C1OC(C=1C(=CC=CC=1)Cl)=CC2=O BIIVYFLTOXDAOV-YVEFUNNKSA-N 0.000 description 1
- 229950010949 ambamustine Drugs 0.000 description 1
- QDWKGEFGLQMDAM-ULJHMMPZSA-N amcasertib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(=CC=C3NC\2=O)C=2N=C(SC=2)C=2C=CC=CC=2)=C1C QDWKGEFGLQMDAM-ULJHMMPZSA-N 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 1
- 235000011114 ammonium hydroxide Nutrition 0.000 description 1
- 229960002550 amrubicin Drugs 0.000 description 1
- VJZITPJGSQKZMX-XDPRQOKASA-N amrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC=C4C(=O)C=3C(O)=C21)(N)C(=O)C)[C@H]1C[C@H](O)[C@H](O)CO1 VJZITPJGSQKZMX-XDPRQOKASA-N 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- KAOMOVYHGLSFHQ-UTOQUPLUSA-N anacardic acid Chemical compound CCC\C=C/C\C=C/CCCCCCCC1=CC=CC(O)=C1C(O)=O KAOMOVYHGLSFHQ-UTOQUPLUSA-N 0.000 description 1
- 235000014398 anacardic acid Nutrition 0.000 description 1
- ADFWQBGTDJIESE-UHFFFAOYSA-N anacardic acid 15:0 Natural products CCCCCCCCCCCCCCCC1=CC=CC(O)=C1C(O)=O ADFWQBGTDJIESE-UHFFFAOYSA-N 0.000 description 1
- KZOWNALBTMILAP-JBMRGDGGSA-N ancitabine hydrochloride Chemical compound Cl.N=C1C=CN2[C@@H]3O[C@H](CO)[C@@H](O)[C@@H]3OC2=N1 KZOWNALBTMILAP-JBMRGDGGSA-N 0.000 description 1
- ASLUCFFROXVMFL-UHFFFAOYSA-N andrographolide Natural products CC1(CO)C(O)CCC2(C)C(CC=C3/C(O)OCC3=O)C(=C)CCC12 ASLUCFFROXVMFL-UHFFFAOYSA-N 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 229940040526 anhydrous sodium acetate Drugs 0.000 description 1
- 239000010775 animal oil Substances 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- RGHILYZRVFRRNK-UHFFFAOYSA-N anthracene-1,2-dione Chemical compound C1=CC=C2C=C(C(C(=O)C=C3)=O)C3=CC2=C1 RGHILYZRVFRRNK-UHFFFAOYSA-N 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000003474 anti-emetic effect Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 229940124599 anti-inflammatory drug Drugs 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 230000002137 anti-vascular effect Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 229940125683 antiemetic agent Drugs 0.000 description 1
- 239000002111 antiemetic agent Substances 0.000 description 1
- 239000003972 antineoplastic antibiotic Substances 0.000 description 1
- 229960001372 aprepitant Drugs 0.000 description 1
- ATALOFNDEOCMKK-OITMNORJSA-N aprepitant Chemical compound O([C@@H]([C@@H]1C=2C=CC(F)=CC=2)O[C@H](C)C=2C=C(C=C(C=2)C(F)(F)F)C(F)(F)F)CCN1CC1=NNC(=O)N1 ATALOFNDEOCMKK-OITMNORJSA-N 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- DNAVOCNYHNNEQI-UHFFFAOYSA-N asaronaldehyde Natural products COC1=CC(OC)=C(C=CC=O)C=C1OC DNAVOCNYHNNEQI-UHFFFAOYSA-N 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 1
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 1
- 229960003852 atezolizumab Drugs 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 229960000383 azatadine Drugs 0.000 description 1
- SEBMTIQKRHYNIT-UHFFFAOYSA-N azatadine Chemical compound C1CN(C)CCC1=C1C2=NC=CC=C2CCC2=CC=CC=C21 SEBMTIQKRHYNIT-UHFFFAOYSA-N 0.000 description 1
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 229950001858 batimastat Drugs 0.000 description 1
- XFILPEOLDIKJHX-QYZOEREBSA-N batimastat Chemical compound C([C@@H](C(=O)NC)NC(=O)[C@H](CC(C)C)[C@H](CSC=1SC=CC=1)C(=O)NO)C1=CC=CC=C1 XFILPEOLDIKJHX-QYZOEREBSA-N 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- LNHWXBUNXOXMRL-VWLOTQADSA-N belotecan Chemical compound C1=CC=C2C(CCNC(C)C)=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 LNHWXBUNXOXMRL-VWLOTQADSA-N 0.000 description 1
- 229950011276 belotecan Drugs 0.000 description 1
- 229960002707 bendamustine Drugs 0.000 description 1
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- 229940000635 beta-alanine Drugs 0.000 description 1
- 150000001576 beta-amino acids Chemical group 0.000 description 1
- 229960002537 betamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-DVTGEIKXSA-N betamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-DVTGEIKXSA-N 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- 229960004395 bleomycin sulfate Drugs 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- HZFGMQJYAFHESD-UHFFFAOYSA-M bromfenac sodium Chemical compound [Na+].NC1=C(CC([O-])=O)C=CC=C1C(=O)C1=CC=C(Br)C=C1 HZFGMQJYAFHESD-UHFFFAOYSA-M 0.000 description 1
- 229960002716 bromfenac sodium Drugs 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- 229960002719 buserelin Drugs 0.000 description 1
- CUWODFFVMXJOKD-UVLQAERKSA-N buserelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](COC(C)(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 CUWODFFVMXJOKD-UVLQAERKSA-N 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 235000019437 butane-1,3-diol Nutrition 0.000 description 1
- 108700002839 cactinomycin Proteins 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- KVUAALJSMIVURS-QNTKWALQSA-L calcium;(2s)-2-[[4-[[(6s)-2-amino-5-formyl-4-oxo-1,6,7,8-tetrahydropteridin-6-yl]methylamino]benzoyl]amino]pentanedioate Chemical compound [Ca+2].C([C@@H]1N(C=O)C=2C(=O)N=C(NC=2NC1)N)NC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-QNTKWALQSA-L 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 229940127093 camptothecin Drugs 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 229950002826 canertinib Drugs 0.000 description 1
- OMZCMEYTWSXEPZ-UHFFFAOYSA-N canertinib Chemical compound C1=C(Cl)C(F)=CC=C1NC1=NC=NC2=CC(OCCCN3CCOCC3)=C(NC(=O)C=C)C=C12 OMZCMEYTWSXEPZ-UHFFFAOYSA-N 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 1
- 229960002438 carfilzomib Drugs 0.000 description 1
- 108010021331 carfilzomib Proteins 0.000 description 1
- 229960003261 carmofur Drugs 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 229960003184 carprofen Drugs 0.000 description 1
- IVUMCTKHWDRRMH-UHFFFAOYSA-N carprofen Chemical compound C1=CC(Cl)=C[C]2C3=CC=C(C(C(O)=O)C)C=C3N=C21 IVUMCTKHWDRRMH-UHFFFAOYSA-N 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 229960002412 cediranib Drugs 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 229940082500 cetostearyl alcohol Drugs 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- YLQODGGPIHWTHR-UHFFFAOYSA-N chembl2443044 Chemical compound C1CN(C)CCC1NC(=O)C1=NOC(C=2C(=CC(O)=CC=2O)OC=2C=CC(=CC=2)[N+]([O-])=O)=C1 YLQODGGPIHWTHR-UHFFFAOYSA-N 0.000 description 1
- NKUDGJUBIVEDTF-FYJGNVAPSA-N chembl3104250 Chemical compound C=1C(Cl)=CC=C(O)C=1C(/C)=N/NC(=O)C(C=1)=CC=CC=1S(=O)(=O)N1CCOCC1 NKUDGJUBIVEDTF-FYJGNVAPSA-N 0.000 description 1
- JROFGZPOBKIAEW-HAQNSBGRSA-N chembl3120215 Chemical compound N1C=2C(OC)=CC=CC=2C=C1C(=C1C(N)=NC=NN11)N=C1[C@H]1CC[C@H](C(O)=O)CC1 JROFGZPOBKIAEW-HAQNSBGRSA-N 0.000 description 1
- ZFVRYNYOPQZKDG-MQMHXKEQSA-N chembl560895 Chemical compound O=C1CC(C)(C)CC2=C1C(C(F)(F)F)=NN2C(C=1)=CC=C(C(N)=O)C=1N[C@H]1CC[C@H](O)CC1 ZFVRYNYOPQZKDG-MQMHXKEQSA-N 0.000 description 1
- SZMJVTADHFNAIS-BJMVGYQFSA-N chidamide Chemical compound NC1=CC(F)=CC=C1NC(=O)C(C=C1)=CC=C1CNC(=O)\C=C\C1=CC=CN=C1 SZMJVTADHFNAIS-BJMVGYQFSA-N 0.000 description 1
- 229950009221 chidamide Drugs 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 229960001616 chlormadinone acetate Drugs 0.000 description 1
- ZYVSOIYQKUDENJ-WKSBCEQHSA-N chromomycin A3 Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@@H]1OC(C)=O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@@H](O)[C@H](O[C@@H]3O[C@@H](C)[C@H](OC(C)=O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@@H]1C[C@@H](O)[C@@H](OC)[C@@H](C)O1 ZYVSOIYQKUDENJ-WKSBCEQHSA-N 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 229960000928 clofarabine Drugs 0.000 description 1
- WDDPHFBMKLOVOX-AYQXTPAHSA-N clofarabine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1F WDDPHFBMKLOVOX-AYQXTPAHSA-N 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 229940000425 combination drug Drugs 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 238000005138 cryopreservation Methods 0.000 description 1
- 238000000315 cryotherapy Methods 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 239000002875 cyclin dependent kinase inhibitor Substances 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- UWFYSQMTEOIJJG-FDTZYFLXSA-N cyproterone acetate Chemical compound C1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 UWFYSQMTEOIJJG-FDTZYFLXSA-N 0.000 description 1
- 229960000978 cyproterone acetate Drugs 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- POZRVZJJTULAOH-LHZXLZLDSA-N danazol Chemical compound C1[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=CC2=C1C=NO2 POZRVZJJTULAOH-LHZXLZLDSA-N 0.000 description 1
- 229960000766 danazol Drugs 0.000 description 1
- 229960003109 daunorubicin hydrochloride Drugs 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 229960001251 denosumab Drugs 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- LRCZQSDQZJBHAF-PUBGEWHCSA-N dha-paclitaxel Chemical compound N([C@H]([C@@H](OC(=O)CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CC)C(=O)O[C@@H]1C(=C2[C@@H](OC(C)=O)C(=O)[C@]3(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]3[C@H](OC(=O)C=3C=CC=CC=3)[C@](C2(C)C)(O)C1)OC(C)=O)C)C=1C=CC=CC=1)C(=O)C1=CC=CC=C1 LRCZQSDQZJBHAF-PUBGEWHCSA-N 0.000 description 1
- NIJJYAXOARWZEE-UHFFFAOYSA-N di-n-propyl-acetic acid Natural products CCCC(C(O)=O)CCC NIJJYAXOARWZEE-UHFFFAOYSA-N 0.000 description 1
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 1
- 229960001259 diclofenac Drugs 0.000 description 1
- FKGKZBBDJSKCIS-UHFFFAOYSA-N diethyl-[[6-[[4-(hydroxycarbamoyl)phenyl]carbamoyloxymethyl]naphthalen-2-yl]methyl]azanium;chloride;hydrate Chemical compound O.[Cl-].C1=CC2=CC(C[NH+](CC)CC)=CC=C2C=C1COC(=O)NC1=CC=C(C(=O)NO)C=C1 FKGKZBBDJSKCIS-UHFFFAOYSA-N 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- LVTYICIALWPMFW-UHFFFAOYSA-N diisopropanolamine Chemical compound CC(O)CNCC(C)O LVTYICIALWPMFW-UHFFFAOYSA-N 0.000 description 1
- 229940043276 diisopropanolamine Drugs 0.000 description 1
- 238000003113 dilution method Methods 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 239000004205 dimethyl polysiloxane Substances 0.000 description 1
- 235000013870 dimethyl polysiloxane Nutrition 0.000 description 1
- 229960000520 diphenhydramine Drugs 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- MOUNHKKCIGVIDI-UHFFFAOYSA-L disodium;4-hydroxy-7-[(5-hydroxy-7-sulfonatonaphthalen-2-yl)carbamoylamino]naphthalene-2-sulfonate Chemical compound [Na+].[Na+].OC1=CC(S([O-])(=O)=O)=CC2=CC(NC(=O)NC=3C=C4C=C(C=C(C4=CC=3)O)S([O-])(=O)=O)=CC=C21 MOUNHKKCIGVIDI-UHFFFAOYSA-L 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 1
- 239000003968 dna methyltransferase inhibitor Substances 0.000 description 1
- MVCOAUNKQVWQHZ-UHFFFAOYSA-N doramapimod Chemical compound C1=CC(C)=CC=C1N1C(NC(=O)NC=2C3=CC=CC=C3C(OCCN3CCOCC3)=CC=2)=CC(C(C)(C)C)=N1 MVCOAUNKQVWQHZ-UHFFFAOYSA-N 0.000 description 1
- 229960002918 doxorubicin hydrochloride Drugs 0.000 description 1
- 229950004203 droloxifene Drugs 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 229960002224 eculizumab Drugs 0.000 description 1
- BNFRJXLZYUTIII-UHFFFAOYSA-N efaproxiral Chemical compound CC1=CC(C)=CC(NC(=O)CC=2C=CC(OC(C)(C)C(O)=O)=CC=2)=C1 BNFRJXLZYUTIII-UHFFFAOYSA-N 0.000 description 1
- 229960000925 efaproxiral Drugs 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 229940056913 eftilagimod alfa Drugs 0.000 description 1
- 229940121647 egfr inhibitor Drugs 0.000 description 1
- 210000002969 egg yolk Anatomy 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 229950005450 emitefur Drugs 0.000 description 1
- 238000004945 emulsification Methods 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 229950011487 enocitabine Drugs 0.000 description 1
- JRURYQJSLYLRLN-BJMVGYQFSA-N entacapone Chemical compound CCN(CC)C(=O)C(\C#N)=C\C1=CC(O)=C(O)C([N+]([O-])=O)=C1 JRURYQJSLYLRLN-BJMVGYQFSA-N 0.000 description 1
- 229960003337 entacapone Drugs 0.000 description 1
- 229950005837 entinostat Drugs 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 1
- 229950002189 enzastaurin Drugs 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 230000001973 epigenetic effect Effects 0.000 description 1
- 229960003265 epirubicin hydrochloride Drugs 0.000 description 1
- 229950002973 epitiostanol Drugs 0.000 description 1
- 229960003388 epoetin alfa Drugs 0.000 description 1
- 229960003649 eribulin Drugs 0.000 description 1
- UFNVPOGXISZXJD-XJPMSQCNSA-N eribulin Chemical compound C([C@H]1CC[C@@H]2O[C@@H]3[C@H]4O[C@H]5C[C@](O[C@H]4[C@H]2O1)(O[C@@H]53)CC[C@@H]1O[C@H](C(C1)=C)CC1)C(=O)C[C@@H]2[C@@H](OC)[C@@H](C[C@H](O)CN)O[C@H]2C[C@@H]2C(=C)[C@H](C)C[C@H]1O2 UFNVPOGXISZXJD-XJPMSQCNSA-N 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- 229960000403 etanercept Drugs 0.000 description 1
- 229960002568 ethinylestradiol Drugs 0.000 description 1
- XPGDODOEEWLHOI-GSDHBNRESA-N ethyl (2s)-2-[[(2s)-2-[[(2s)-2-amino-3-(4-fluorophenyl)propanoyl]amino]-3-[3-[bis(2-chloroethyl)amino]phenyl]propanoyl]amino]-4-methylsulfanylbutanoate Chemical compound C([C@@H](C(=O)N[C@@H](CCSC)C(=O)OCC)NC(=O)[C@@H](N)CC=1C=CC(F)=CC=1)C1=CC=CC(N(CCCl)CCCl)=C1 XPGDODOEEWLHOI-GSDHBNRESA-N 0.000 description 1
- TYXWLTBYINKVNT-UHFFFAOYSA-N ethyl 3-[[2-pyridin-2-yl-6-(1,2,4,5-tetrahydro-3-benzazepin-3-yl)pyrimidin-4-yl]amino]propanoate;hydrochloride Chemical compound Cl.N=1C(NCCC(=O)OCC)=CC(N2CCC3=CC=CC=C3CC2)=NC=1C1=CC=CC=N1 TYXWLTBYINKVNT-UHFFFAOYSA-N 0.000 description 1
- JBTWLSYIZRCDFO-UHFFFAOYSA-N ethyl methyl carbonate Chemical compound CCOC(=O)OC JBTWLSYIZRCDFO-UHFFFAOYSA-N 0.000 description 1
- 229960005237 etoglucid Drugs 0.000 description 1
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 1
- 229960000752 etoposide phosphate Drugs 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 201000001343 fallopian tube carcinoma Diseases 0.000 description 1
- 229960001596 famotidine Drugs 0.000 description 1
- XUFQPHANEAPEMJ-UHFFFAOYSA-N famotidine Chemical compound NC(N)=NC1=NC(CSCCC(N)=NS(N)(=O)=O)=CS1 XUFQPHANEAPEMJ-UHFFFAOYSA-N 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 1
- 229960005304 fludarabine phosphate Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229940014144 folate Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 1
- 229960004783 fotemustine Drugs 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 229950004410 galocitabine Drugs 0.000 description 1
- 229920000370 gamma-poly(glutamate) polymer Polymers 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 229940124670 gardiquimod Drugs 0.000 description 1
- 229950008209 gedatolisib Drugs 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- QTQAWLPCGQOSGP-GBTDJJJQSA-N geldanamycin Chemical compound N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(OC)C(=O)C=C1C2=O QTQAWLPCGQOSGP-GBTDJJJQSA-N 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 229960004761 gestrinone Drugs 0.000 description 1
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 1
- 239000002474 gonadorelin antagonist Substances 0.000 description 1
- 229960003690 goserelin acetate Drugs 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 239000003481 heat shock protein 90 inhibitor Substances 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 229960000443 hydrochloric acid Drugs 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 229960002927 hydroxychloroquine sulfate Drugs 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 230000036031 hyperthermia Effects 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 229960001176 idarubicin hydrochloride Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000008076 immune mechanism Effects 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- DBIGHPPNXATHOF-UHFFFAOYSA-N improsulfan Chemical compound CS(=O)(=O)OCCCNCCCOS(C)(=O)=O DBIGHPPNXATHOF-UHFFFAOYSA-N 0.000 description 1
- 229950008097 improsulfan Drugs 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 229940117681 interleukin-12 Drugs 0.000 description 1
- 229940100994 interleukin-7 Drugs 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- AFHJQYHRLPMKHU-UHFFFAOYSA-N isobarbaloin Natural products OC1C(O)C(O)C(CO)OC1C1C2=CC(CO)=CC(O)=C2C(=O)C2=C(O)C=CC=C21 AFHJQYHRLPMKHU-UHFFFAOYSA-N 0.000 description 1
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 description 1
- 229960002014 ixabepilone Drugs 0.000 description 1
- FABUFPQFXZVHFB-CFWQTKTJSA-N ixabepilone Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@H](C)C(=O)C(C)(C)[C@H](O)CC(=O)N1)O)C)=C\C1=CSC(C)=N1 FABUFPQFXZVHFB-CFWQTKTJSA-N 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 229960004125 ketoconazole Drugs 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 1
- 229960000991 ketoprofen Drugs 0.000 description 1
- OZWKMVRBQXNZKK-UHFFFAOYSA-N ketorolac Chemical compound OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 OZWKMVRBQXNZKK-UHFFFAOYSA-N 0.000 description 1
- 229960004752 ketorolac Drugs 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- TYQCGQRIZGCHNB-JLAZNSOCSA-N l-ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(O)=C(O)C1=O TYQCGQRIZGCHNB-JLAZNSOCSA-N 0.000 description 1
- 229950005692 larotaxel Drugs 0.000 description 1
- SEFGUGYLLVNFIJ-QDRLFVHASA-N larotaxel dihydrate Chemical compound O.O.O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@@]23[C@H]1[C@@]1(CO[C@@H]1C[C@@H]2C3)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 SEFGUGYLLVNFIJ-QDRLFVHASA-N 0.000 description 1
- 238000000608 laser ablation Methods 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- 229950001845 lestaurtinib Drugs 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000021633 leukocyte mediated immunity Effects 0.000 description 1
- XZEUAXYWNKYKPL-WDYNHAJCSA-N levormeloxifene Chemical compound C1([C@H]2[C@@H](C3=CC=C(C=C3OC2(C)C)OC)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1 XZEUAXYWNKYKPL-WDYNHAJCSA-N 0.000 description 1
- 229950002728 levormeloxifene Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 229940040145 liniment Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- YAFQFNOUYXZVPZ-UHFFFAOYSA-N liproxstatin-1 Chemical compound ClC1=CC=CC(CNC=2C3(CCNCC3)NC3=CC=CC=C3N=2)=C1 YAFQFNOUYXZVPZ-UHFFFAOYSA-N 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- DHMTURDWPRKSOA-RUZDIDTESA-N lonafarnib Chemical compound C1CN(C(=O)N)CCC1CC(=O)N1CCC([C@@H]2C3=C(Br)C=C(Cl)C=C3CCC3=CC(Br)=CN=C32)CC1 DHMTURDWPRKSOA-RUZDIDTESA-N 0.000 description 1
- 229950001750 lonafarnib Drugs 0.000 description 1
- 229960004391 lorazepam Drugs 0.000 description 1
- OXROWJKCGCOJDO-JLHYYAGUSA-N lornoxicam Chemical compound O=C1C=2SC(Cl)=CC=2S(=O)(=O)N(C)\C1=C(\O)NC1=CC=CC=N1 OXROWJKCGCOJDO-JLHYYAGUSA-N 0.000 description 1
- 229960002202 lornoxicam Drugs 0.000 description 1
- 229950005634 loxoribine Drugs 0.000 description 1
- NDAZATDQFDPQBD-UHFFFAOYSA-N luminespib Chemical compound CCNC(=O)C1=NOC(C=2C(=CC(O)=C(C(C)C)C=2)O)=C1C(C=C1)=CC=C1CN1CCOCC1 NDAZATDQFDPQBD-UHFFFAOYSA-N 0.000 description 1
- KHPKQFYUPIUARC-UHFFFAOYSA-N lumiracoxib Chemical compound OC(=O)CC1=CC(C)=CC=C1NC1=C(F)C=CC=C1Cl KHPKQFYUPIUARC-UHFFFAOYSA-N 0.000 description 1
- 229960000994 lumiracoxib Drugs 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 108010051618 macrophage stimulatory lipopeptide 2 Proteins 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 229960000733 mannosulfan Drugs 0.000 description 1
- UUVIQYKKKBJYJT-ZYUZMQFOSA-N mannosulfan Chemical compound CS(=O)(=O)OC[C@@H](OS(C)(=O)=O)[C@@H](O)[C@H](O)[C@H](OS(C)(=O)=O)COS(C)(=O)=O UUVIQYKKKBJYJT-ZYUZMQFOSA-N 0.000 description 1
- 229950001869 mapatumumab Drugs 0.000 description 1
- 229950008959 marimastat Drugs 0.000 description 1
- OCSMOTCMPXTDND-OUAUKWLOSA-N marimastat Chemical compound CNC(=O)[C@H](C(C)(C)C)NC(=O)[C@H](CC(C)C)[C@H](O)C(=O)NO OCSMOTCMPXTDND-OUAUKWLOSA-N 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 229950008001 matuzumab Drugs 0.000 description 1
- 229960003803 meclofenamic acid Drugs 0.000 description 1
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- 229960003464 mefenamic acid Drugs 0.000 description 1
- HYYBABOKPJLUIN-UHFFFAOYSA-N mefenamic acid Chemical compound CC1=CC=CC(NC=2C(=CC=CC=2)C(O)=O)=C1C HYYBABOKPJLUIN-UHFFFAOYSA-N 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960000667 mepartricin Drugs 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 239000003475 metalloproteinase inhibitor Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 229940117841 methacrylic acid copolymer Drugs 0.000 description 1
- 229920003145 methacrylic acid copolymer Polymers 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- ALPPGSBMHVCELA-WHUUVLPESA-N methyl (19E,21E,23E,25E,27E,29E,31E)-33-[(2R,3S,4S,5S,6R)-4-amino-3,5-dihydroxy-6-methyloxan-2-yl]oxy-17-[7-(4-aminophenyl)-5-hydroxy-7-oxoheptan-2-yl]-1,3,5,7,9,13,37-heptahydroxy-18-methyl-11,15-dioxo-16,39-dioxabicyclo[33.3.1]nonatriaconta-19,21,23,25,27,29,31-heptaene-36-carboxylate methyl (19E,21E,23E,25E,27E,29E,31E)-33-[(2R,3S,4S,5S,6R)-4-amino-3,5-dihydroxy-6-methyloxan-2-yl]oxy-1,3,5,7,9,13,37-heptahydroxy-17-[5-hydroxy-7-[4-(methylamino)phenyl]-7-oxoheptan-2-yl]-18-methyl-11,15-dioxo-16,39-dioxabicyclo[33.3.1]nonatriaconta-19,21,23,25,27,29,31-heptaene-36-carboxylate Chemical compound CC1\C=C\C=C\C=C\C=C\C=C\C=C\C=C\C(O[C@H]2[C@H]([C@@H](N)[C@H](O)[C@@H](C)O2)O)CC(O2)C(C(=O)OC)C(O)CC2(O)CC(O)CC(O)CC(O)CC(O)CC(=O)CC(O)CC(=O)OC1C(C)CCC(O)CC(=O)C1=CC=C(N)C=C1.C1=CC(NC)=CC=C1C(=O)CC(O)CCC(C)C1C(C)/C=C/C=C/C=C/C=C/C=C/C=C/C=C/C(O[C@H]2[C@H]([C@@H](N)[C@H](O)[C@@H](C)O2)O)CC(O2)C(C(=O)OC)C(O)CC2(O)CC(O)CC(O)CC(O)CC(O)CC(=O)CC(O)CC(=O)O1 ALPPGSBMHVCELA-WHUUVLPESA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- VDOCQQKGPJENHJ-UHFFFAOYSA-N methyl n-[4-[4-morpholin-4-yl-1-[1-(pyridin-3-ylmethyl)piperidin-4-yl]pyrazolo[3,4-d]pyrimidin-6-yl]phenyl]carbamate Chemical compound C1=CC(NC(=O)OC)=CC=C1C1=NC(N2CCOCC2)=C(C=NN2C3CCN(CC=4C=NC=CC=4)CC3)C2=N1 VDOCQQKGPJENHJ-UHFFFAOYSA-N 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 229960001566 methyltestosterone Drugs 0.000 description 1
- 229950010895 midostaurin Drugs 0.000 description 1
- BMGQWWVMWDBQGC-IIFHNQTCSA-N midostaurin Chemical compound CN([C@H]1[C@H]([C@]2(C)O[C@@H](N3C4=CC=CC=C4C4=C5C(=O)NCC5=C5C6=CC=CC=C6N2C5=C43)C1)OC)C(=O)C1=CC=CC=C1 BMGQWWVMWDBQGC-IIFHNQTCSA-N 0.000 description 1
- 229960003248 mifepristone Drugs 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 229960003539 mitoguazone Drugs 0.000 description 1
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004169 mitoxantrone hydrochloride Drugs 0.000 description 1
- 229950008814 momelotinib Drugs 0.000 description 1
- ZVHNDZWQTBEVRY-UHFFFAOYSA-N momelotinib Chemical compound C1=CC(C(NCC#N)=O)=CC=C1C1=CC=NC(NC=2C=CC(=CC=2)N2CCOCC2)=N1 ZVHNDZWQTBEVRY-UHFFFAOYSA-N 0.000 description 1
- 150000002763 monocarboxylic acids Chemical class 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- HWPKGOGLCKPRLZ-UHFFFAOYSA-M monosodium citrate Chemical compound [Na+].OC(=O)CC(O)(C([O-])=O)CC(O)=O HWPKGOGLCKPRLZ-UHFFFAOYSA-M 0.000 description 1
- 239000002524 monosodium citrate Substances 0.000 description 1
- 235000018342 monosodium citrate Nutrition 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 229950003968 motesanib Drugs 0.000 description 1
- RAHBGWKEPAQNFF-UHFFFAOYSA-N motesanib Chemical compound C=1C=C2C(C)(C)CNC2=CC=1NC(=O)C1=CC=CN=C1NCC1=CC=NC=C1 RAHBGWKEPAQNFF-UHFFFAOYSA-N 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- QCIJLRJBZDBVDB-UHFFFAOYSA-N n-(1,3-dimethyl-2-oxo-6-pyrrolidin-1-ylbenzimidazol-5-yl)-2-methoxybenzamide Chemical compound COC1=CC=CC=C1C(=O)NC(C(=C1)N2CCCC2)=CC2=C1N(C)C(=O)N2C QCIJLRJBZDBVDB-UHFFFAOYSA-N 0.000 description 1
- QNZVBFMXWNWVKG-UHFFFAOYSA-N n-(6-benzoyl-1h-benzimidazol-2-yl)-2-(1-thieno[3,2-d]pyrimidin-4-ylpiperidin-4-yl)-1,3-thiazole-4-carboxamide Chemical compound C=1SC(C2CCN(CC2)C=2C=3SC=CC=3N=CN=2)=NC=1C(=O)NC(NC1=CC=2)=NC1=CC=2C(=O)C1=CC=CC=C1 QNZVBFMXWNWVKG-UHFFFAOYSA-N 0.000 description 1
- LXFKEVQQSKQXPR-UHFFFAOYSA-N n-(6-chloro-1,3-benzothiazol-2-yl)-3-(3,4-dimethoxyphenyl)propanamide Chemical compound C1=C(OC)C(OC)=CC=C1CCC(=O)NC1=NC2=CC=C(Cl)C=C2S1 LXFKEVQQSKQXPR-UHFFFAOYSA-N 0.000 description 1
- JXTPJDDICSTXJX-UHFFFAOYSA-N n-Triacontane Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCC JXTPJDDICSTXJX-UHFFFAOYSA-N 0.000 description 1
- ZKXZLIFRWWKZRY-KRWDZBQOSA-N n-[(2s)-3-(3,4-dihydro-1h-isoquinolin-2-yl)-2-hydroxypropyl]-6-(oxetan-3-ylamino)pyrimidine-4-carboxamide Chemical compound C([C@H](O)CN1CC2=CC=CC=C2CC1)NC(=O)C(N=CN=1)=CC=1NC1COC1 ZKXZLIFRWWKZRY-KRWDZBQOSA-N 0.000 description 1
- NSQSAUGJQHDYNO-UHFFFAOYSA-N n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-3-[ethyl(oxan-4-yl)amino]-2-methyl-5-[4-(morpholin-4-ylmethyl)phenyl]benzamide Chemical compound C=1C(C=2C=CC(CN3CCOCC3)=CC=2)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C(C)C=1N(CC)C1CCOCC1 NSQSAUGJQHDYNO-UHFFFAOYSA-N 0.000 description 1
- HRDQQHUKUIKFHT-UHFFFAOYSA-N n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-3-methyl-6-[6-(4-methylpiperazin-1-yl)pyridin-3-yl]-1-propan-2-ylindole-4-carboxamide Chemical compound C1=C2N(C(C)C)C=C(C)C2=C(C(=O)NCC=2C(NC(C)=CC=2C)=O)C=C1C(C=N1)=CC=C1N1CCN(C)CC1 HRDQQHUKUIKFHT-UHFFFAOYSA-N 0.000 description 1
- PFPSFENQCNMITC-MRXNPFEDSA-N n-[(4-methoxy-6-methyl-2-oxo-1h-pyridin-3-yl)methyl]-2-methyl-1-[(1r)-1-(oxan-4-yl)ethyl]indole-3-carboxamide Chemical compound C1=C(C)NC(=O)C(CNC(=O)C=2C3=CC=CC=C3N([C@H](C)C3CCOCC3)C=2C)=C1OC PFPSFENQCNMITC-MRXNPFEDSA-N 0.000 description 1
- NKFHKYQGZDAKMX-PPRKPIOESA-N n-[(e)-1-[(2s,4s)-4-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-2,5,12-trihydroxy-7-methoxy-6,11-dioxo-3,4-dihydro-1h-tetracen-2-yl]ethylideneamino]benzamide;hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 NKFHKYQGZDAKMX-PPRKPIOESA-N 0.000 description 1
- XFAXSWXKPQWHDW-UHFFFAOYSA-N n-[1-(cyclohexylmethyl)piperidin-4-yl]-6-methoxy-7-(3-piperidin-1-ylpropoxy)-2-(4-propan-2-yl-1,4-diazepan-1-yl)quinazolin-4-amine Chemical compound N1=C(N2CCN(CCC2)C(C)C)N=C2C=C(OCCCN3CCCCC3)C(OC)=CC2=C1NC(CC1)CCN1CC1CCCCC1 XFAXSWXKPQWHDW-UHFFFAOYSA-N 0.000 description 1
- TVYPSLDUBVTDIS-FUOMVGGVSA-N n-[1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-methyloxolan-2-yl]-5-fluoro-2-oxopyrimidin-4-yl]-3,4,5-trimethoxybenzamide Chemical compound COC1=C(OC)C(OC)=CC(C(=O)NC=2C(=CN(C(=O)N=2)[C@H]2[C@@H]([C@H](O)[C@@H](C)O2)O)F)=C1 TVYPSLDUBVTDIS-FUOMVGGVSA-N 0.000 description 1
- BLCLNMBMMGCOAS-UHFFFAOYSA-N n-[1-[[1-[[1-[[1-[[1-[[1-[[1-[2-[(carbamoylamino)carbamoyl]pyrrolidin-1-yl]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-[(2-methylpropan-2-yl)oxy]-1-oxopropan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amin Chemical compound C1CCC(C(=O)NNC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)C(COC(C)(C)C)NC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 BLCLNMBMMGCOAS-UHFFFAOYSA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- QSYLKMKIVWJAAK-UHFFFAOYSA-N n-[4-[(2-amino-6-methylpyrimidin-4-yl)amino]phenyl]-4-(quinolin-4-ylamino)benzamide Chemical compound NC1=NC(C)=CC(NC=2C=CC(NC(=O)C=3C=CC(NC=4C5=CC=CC=C5N=CC=4)=CC=3)=CC=2)=N1 QSYLKMKIVWJAAK-UHFFFAOYSA-N 0.000 description 1
- VRYZCEONIWEUAV-UHFFFAOYSA-N n-[6-(hydroxyamino)-6-oxohexoxy]-3,5-dimethylbenzamide Chemical compound CC1=CC(C)=CC(C(=O)NOCCCCCC(=O)NO)=C1 VRYZCEONIWEUAV-UHFFFAOYSA-N 0.000 description 1
- HORXBWNTEDOVKN-UHFFFAOYSA-N n-[[4-(4-phenyl-1,3-thiazol-2-yl)oxan-4-yl]methyl]-3-[5-(trifluoromethyl)-1,2,4-oxadiazol-3-yl]benzamide Chemical compound O1C(C(F)(F)F)=NC(C=2C=C(C=CC=2)C(=O)NCC2(CCOCC2)C=2SC=C(N=2)C=2C=CC=CC=2)=N1 HORXBWNTEDOVKN-UHFFFAOYSA-N 0.000 description 1
- KBVFRXIGQQRMEF-UHFFFAOYSA-N n-[[4-[(pyridin-2-ylamino)methyl]phenyl]methyl]pyridin-2-amine Chemical compound C=1C=C(CNC=2N=CC=CC=2)C=CC=1CNC1=CC=CC=N1 KBVFRXIGQQRMEF-UHFFFAOYSA-N 0.000 description 1
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 1
- LJTSJTWIMOGKRJ-UHFFFAOYSA-N n-hydroxy-4-[(2-methyl-3,4-dihydro-1h-pyrido[4,3-b]indol-5-yl)methyl]benzamide;hydrochloride Chemical compound Cl.C1N(C)CCC2=C1C1=CC=CC=C1N2CC1=CC=C(C(=O)NO)C=C1 LJTSJTWIMOGKRJ-UHFFFAOYSA-N 0.000 description 1
- RFAZNTABYJYOAR-UHFFFAOYSA-N n-hydroxy-4-[2-[n-(2-hydroxyethyl)anilino]-2-oxoethyl]benzamide Chemical compound C=1C=CC=CC=1N(CCO)C(=O)CC1=CC=C(C(=O)NO)C=C1 RFAZNTABYJYOAR-UHFFFAOYSA-N 0.000 description 1
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 description 1
- QRGHOAATPOLDPF-VQFNDLOPSA-N nanatinostat Chemical compound N1=CC(C(=O)NO)=CN=C1N1C[C@@H]([C@@H]2NCC=3N=C4C=CC(F)=CC4=CC=3)[C@@H]2C1 QRGHOAATPOLDPF-VQFNDLOPSA-N 0.000 description 1
- DPHUWDIXHNQOSY-UHFFFAOYSA-N napabucasin Chemical compound O=C1C2=CC=CC=C2C(=O)C2=C1OC(C(=O)C)=C2 DPHUWDIXHNQOSY-UHFFFAOYSA-N 0.000 description 1
- CDBRNDSHEYLDJV-FVGYRXGTSA-M naproxen sodium Chemical compound [Na+].C1=C([C@H](C)C([O-])=O)C=CC2=CC(OC)=CC=C21 CDBRNDSHEYLDJV-FVGYRXGTSA-M 0.000 description 1
- 229960003940 naproxen sodium Drugs 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 210000000581 natural killer T-cell Anatomy 0.000 description 1
- 229960000801 nelarabine Drugs 0.000 description 1
- IXOXBSCIXZEQEQ-UHTZMRCNSA-N nelarabine Chemical compound C1=NC=2C(OC)=NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O IXOXBSCIXZEQEQ-UHTZMRCNSA-N 0.000 description 1
- QEFAQIPZVLVERP-UHFFFAOYSA-N nepafenac Chemical compound NC(=O)CC1=CC=CC(C(=O)C=2C=CC=CC=2)=C1N QEFAQIPZVLVERP-UHFFFAOYSA-N 0.000 description 1
- 229960001002 nepafenac Drugs 0.000 description 1
- 229950008835 neratinib Drugs 0.000 description 1
- ZNHPZUKZSNBOSQ-BQYQJAHWSA-N neratinib Chemical compound C=12C=C(NC\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 ZNHPZUKZSNBOSQ-BQYQJAHWSA-N 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 229960001920 niclosamide Drugs 0.000 description 1
- RJMUSRYZPJIFPJ-UHFFFAOYSA-N niclosamide Chemical compound OC1=CC=C(Cl)C=C1C(=O)NC1=CC=C([N+]([O-])=O)C=C1Cl RJMUSRYZPJIFPJ-UHFFFAOYSA-N 0.000 description 1
- 229960000916 niflumic acid Drugs 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- 229960000965 nimesulide Drugs 0.000 description 1
- HYWYRSMBCFDLJT-UHFFFAOYSA-N nimesulide Chemical compound CS(=O)(=O)NC1=CC=C([N+]([O-])=O)C=C1OC1=CC=CC=C1 HYWYRSMBCFDLJT-UHFFFAOYSA-N 0.000 description 1
- 229950010203 nimotuzumab Drugs 0.000 description 1
- 229960001420 nimustine Drugs 0.000 description 1
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 229950006584 obatoclax Drugs 0.000 description 1
- 229950005751 ocrelizumab Drugs 0.000 description 1
- 229960002700 octreotide Drugs 0.000 description 1
- 229960002450 ofatumumab Drugs 0.000 description 1
- 229940060184 oil ingredients Drugs 0.000 description 1
- 239000003883 ointment base Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- IFRGXKKQHBVPCQ-UHFFFAOYSA-N onalespib Chemical compound C1=C(O)C(C(C)C)=CC(C(=O)N2CC3=CC(CN4CCN(C)CC4)=CC=C3C2)=C1O IFRGXKKQHBVPCQ-UHFFFAOYSA-N 0.000 description 1
- 229960005343 ondansetron Drugs 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- OFPXSFXSNFPTHF-UHFFFAOYSA-N oxaprozin Chemical compound O1C(CCC(=O)O)=NC(C=2C=CC=CC=2)=C1C1=CC=CC=C1 OFPXSFXSNFPTHF-UHFFFAOYSA-N 0.000 description 1
- 229960002739 oxaprozin Drugs 0.000 description 1
- FZHHRERIIVOATI-UHFFFAOYSA-N p7c3 Chemical compound C12=CC=C(Br)C=C2C2=CC(Br)=CC=C2N1CC(O)CNC1=CC=CC=C1 FZHHRERIIVOATI-UHFFFAOYSA-N 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 229940108949 paclitaxel injection Drugs 0.000 description 1
- FPOHNWQLNRZRFC-ZHACJKMWSA-N panobinostat Chemical compound CC=1NC2=CC=CC=C2C=1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FPOHNWQLNRZRFC-ZHACJKMWSA-N 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 229960002087 pertuzumab Drugs 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- SWUARLUWKZWEBQ-VQHVLOKHSA-N phenethyl caffeate Chemical compound C1=C(O)C(O)=CC=C1\C=C\C(=O)OCCC1=CC=CC=C1 SWUARLUWKZWEBQ-VQHVLOKHSA-N 0.000 description 1
- SWUARLUWKZWEBQ-UHFFFAOYSA-N phenylethyl ester of caffeic acid Natural products C1=C(O)C(O)=CC=C1C=CC(=O)OCCC1=CC=CC=C1 SWUARLUWKZWEBQ-UHFFFAOYSA-N 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 235000014786 phosphorus Nutrition 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229950010773 pidilizumab Drugs 0.000 description 1
- 229960001221 pirarubicin Drugs 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- YIQPUIGJQJDJOS-UHFFFAOYSA-N plerixafor Chemical compound C=1C=C(CN2CCNCCCNCCNCCC2)C=CC=1CN1CCCNCCNCCCNCC1 YIQPUIGJQJDJOS-UHFFFAOYSA-N 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000447 polyanionic polymer Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229940034049 polysaccharide-k Drugs 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 235000011118 potassium hydroxide Nutrition 0.000 description 1
- LWIHDJKSTIGBAC-UHFFFAOYSA-K potassium phosphate Substances [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 1
- JHDKZFFAIZKUCU-ZRDIBKRKSA-N pracinostat Chemical compound ONC(=O)/C=C/C1=CC=C2N(CCN(CC)CC)C(CCCC)=NC2=C1 JHDKZFFAIZKUCU-ZRDIBKRKSA-N 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 229960003253 procainamide hydrochloride Drugs 0.000 description 1
- ABTXGJFUQRCPNH-UHFFFAOYSA-N procainamide hydrochloride Chemical compound [H+].[Cl-].CCN(CC)CCNC(=O)C1=CC=C(N)C=C1 ABTXGJFUQRCPNH-UHFFFAOYSA-N 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- XYWJNTOURDMTPI-UHFFFAOYSA-N procodazole Chemical compound C1=CC=C2NC(CCC(=O)O)=NC2=C1 XYWJNTOURDMTPI-UHFFFAOYSA-N 0.000 description 1
- 229950000989 procodazole Drugs 0.000 description 1
- 229940029359 procrit Drugs 0.000 description 1
- 229960000286 proflavine Drugs 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 229940034080 provenge Drugs 0.000 description 1
- 229950007401 pumitepa Drugs 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 230000004144 purine metabolism Effects 0.000 description 1
- 230000004147 pyrimidine metabolism Effects 0.000 description 1
- 229960001404 quinidine Drugs 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- 229950010654 quisinostat Drugs 0.000 description 1
- 239000000941 radioactive substance Substances 0.000 description 1
- 108010077182 raf Kinases Proteins 0.000 description 1
- 102000009929 raf Kinases Human genes 0.000 description 1
- 229950010994 ralimetinib Drugs 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- 229960004432 raltitrexed Drugs 0.000 description 1
- 229960003876 ranibizumab Drugs 0.000 description 1
- 229960002185 ranimustine Drugs 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 229960004836 regorafenib Drugs 0.000 description 1
- ZOPOQLDXFHBOIH-UHFFFAOYSA-N regorafenib hydrate Chemical compound O.C1=NC(C(=O)NC)=CC(OC=2C=C(F)C(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 ZOPOQLDXFHBOIH-UHFFFAOYSA-N 0.000 description 1
- XDZAHHULFQIBFE-UHFFFAOYSA-N remetinostat Chemical compound COC(=O)C1=CC=C(OC(=O)CCCCCCC(=O)NO)C=C1 XDZAHHULFQIBFE-UHFFFAOYSA-N 0.000 description 1
- 208000015347 renal cell adenocarcinoma Diseases 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- FECGNJPYVFEKOD-VMPITWQZSA-N resminostat Chemical compound C1=CC(CN(C)C)=CC=C1S(=O)(=O)N1C=C(\C=C\C(=O)NO)C=C1 FECGNJPYVFEKOD-VMPITWQZSA-N 0.000 description 1
- 229950002821 resminostat Drugs 0.000 description 1
- 239000011769 retinyl palmitate Substances 0.000 description 1
- 235000019172 retinyl palmitate Nutrition 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- BUROJSBIWGDYCN-QHPXJTPRSA-N ridaforolimus Chemical compound C1C[C@@H](OP(C)(C)=O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)\C(C)=C\C=C\C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 BUROJSBIWGDYCN-QHPXJTPRSA-N 0.000 description 1
- 229960000371 rofecoxib Drugs 0.000 description 1
- RZJQGNCSTQAWON-UHFFFAOYSA-N rofecoxib Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C1=C(C=2C=CC=CC=2)C(=O)OC1 RZJQGNCSTQAWON-UHFFFAOYSA-N 0.000 description 1
- VHXNKPBCCMUMSW-FQEVSTJZSA-N rubitecan Chemical compound C1=CC([N+]([O-])=O)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VHXNKPBCCMUMSW-FQEVSTJZSA-N 0.000 description 1
- 229950009213 rubitecan Drugs 0.000 description 1
- 229960000215 ruxolitinib Drugs 0.000 description 1
- 108010038379 sargramostim Proteins 0.000 description 1
- 229960002530 sargramostim Drugs 0.000 description 1
- 229950000055 seliciclib Drugs 0.000 description 1
- BTIHMVBBUGXLCJ-OAHLLOKOSA-N seliciclib Chemical compound C=12N=CN(C(C)C)C2=NC(N[C@@H](CO)CC)=NC=1NCC1=CC=CC=C1 BTIHMVBBUGXLCJ-OAHLLOKOSA-N 0.000 description 1
- 229950010746 selumetinib Drugs 0.000 description 1
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 1
- 229950003647 semaxanib Drugs 0.000 description 1
- WUWDLXZGHZSWQZ-WQLSENKSSA-N semaxanib Chemical compound N1C(C)=CC(C)=C1\C=C/1C2=CC=CC=C2NC\1=O WUWDLXZGHZSWQZ-WQLSENKSSA-N 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 229920002545 silicone oil Polymers 0.000 description 1
- 239000000344 soap Substances 0.000 description 1
- HELHAJAZNSDZJO-OLXYHTOASA-L sodium L-tartrate Chemical compound [Na+].[Na+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O HELHAJAZNSDZJO-OLXYHTOASA-L 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 229960002668 sodium chloride Drugs 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- VPZRWNZGLKXFOE-UHFFFAOYSA-M sodium phenylbutyrate Chemical compound [Na+].[O-]C(=O)CCCC1=CC=CC=C1 VPZRWNZGLKXFOE-UHFFFAOYSA-M 0.000 description 1
- 229960002232 sodium phenylbutyrate Drugs 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- 229960004025 sodium salicylate Drugs 0.000 description 1
- 239000001433 sodium tartrate Substances 0.000 description 1
- 229960002167 sodium tartrate Drugs 0.000 description 1
- 235000011004 sodium tartrates Nutrition 0.000 description 1
- AEQFSUDEHCCHBT-UHFFFAOYSA-M sodium valproate Chemical compound [Na+].CCCC(C([O-])=O)CCC AEQFSUDEHCCHBT-UHFFFAOYSA-M 0.000 description 1
- 229940084026 sodium valproate Drugs 0.000 description 1
- XLHBNJPXFOZFNJ-BYKQGDNKSA-M sodium;[(2r,3s,5r)-5-(2-amino-6-oxo-3h-purin-9-yl)-3-hydroxyoxolan-2-yl]methyl [(2r,3s,5r)-5-(4-amino-2-oxo-1,3,5-triazin-1-yl)-2-(hydroxymethyl)oxolan-3-yl] phosphate Chemical compound [Na+].O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](OP([O-])(=O)OC[C@@H]2[C@H](C[C@@H](O2)N2C3=C(C(N=C(N)N3)=O)N=C2)O)C1 XLHBNJPXFOZFNJ-BYKQGDNKSA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 229940075554 sorbate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- XFLBOEMFLGLWFF-HDXRNPEWSA-N spiruchostatin Chemical compound C1SSCC\C=C\[C@H]2OC(=O)C[C@H](O)[C@@H](C(C)C)NC(=O)[C@@H]1NC(=O)[C@@H](C)NC(=O)C2 XFLBOEMFLGLWFF-HDXRNPEWSA-N 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 229940032094 squalane Drugs 0.000 description 1
- 229940031439 squalene Drugs 0.000 description 1
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 229940012831 stearyl alcohol Drugs 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960005453 strychnine Drugs 0.000 description 1
- 229960004306 sulfadiazine Drugs 0.000 description 1
- SEEPANYCNGTZFQ-UHFFFAOYSA-N sulfadiazine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)NC1=NC=CC=N1 SEEPANYCNGTZFQ-UHFFFAOYSA-N 0.000 description 1
- 229960005404 sulfamethoxazole Drugs 0.000 description 1
- 238000006277 sulfonation reaction Methods 0.000 description 1
- 229960005559 sulforaphane Drugs 0.000 description 1
- 235000015487 sulforaphane Nutrition 0.000 description 1
- JLKIGFTWXXRPMT-UHFFFAOYSA-N sulphamethoxazole Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1 JLKIGFTWXXRPMT-UHFFFAOYSA-N 0.000 description 1
- FIAFUQMPZJWCLV-UHFFFAOYSA-N suramin Chemical compound OS(=O)(=O)C1=CC(S(O)(=O)=O)=C2C(NC(=O)C3=CC=C(C(=C3)NC(=O)C=3C=C(NC(=O)NC=4C=C(C=CC=4)C(=O)NC=4C(=CC=C(C=4)C(=O)NC=4C5=C(C=C(C=C5C(=CC=4)S(O)(=O)=O)S(O)(=O)=O)S(O)(=O)=O)C)C=CC=3)C)=CC=C(S(O)(=O)=O)C2=C1 FIAFUQMPZJWCLV-UHFFFAOYSA-N 0.000 description 1
- 229960005314 suramin Drugs 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229940095374 tabloid Drugs 0.000 description 1
- VAZAPHZUAVEOMC-UHFFFAOYSA-N tacedinaline Chemical compound C1=CC(NC(=O)C)=CC=C1C(=O)NC1=CC=CC=C1N VAZAPHZUAVEOMC-UHFFFAOYSA-N 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 229960003454 tamoxifen citrate Drugs 0.000 description 1
- FQZYTYWMLGAPFJ-OQKDUQJOSA-N tamoxifen citrate Chemical compound [H+].[H+].[H+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 FQZYTYWMLGAPFJ-OQKDUQJOSA-N 0.000 description 1
- AYUNIORJHRXIBJ-TXHRRWQRSA-N tanespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCC=C)C(=O)C=C1C2=O AYUNIORJHRXIBJ-TXHRRWQRSA-N 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 150000004579 taxol derivatives Chemical class 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- OULAJFUGPPVRBK-UHFFFAOYSA-N tetratriacontyl alcohol Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCO OULAJFUGPPVRBK-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- PLHJCIYEEKOWNM-HHHXNRCGSA-N tipifarnib Chemical compound CN1C=NC=C1[C@](N)(C=1C=C2C(C=3C=C(Cl)C=CC=3)=CC(=O)N(C)C2=CC=1)C1=CC=C(Cl)C=C1 PLHJCIYEEKOWNM-HHHXNRCGSA-N 0.000 description 1
- 229950009158 tipifarnib Drugs 0.000 description 1
- 229960002905 tolfenamic acid Drugs 0.000 description 1
- YEZNLOUZAIOMLT-UHFFFAOYSA-N tolfenamic acid Chemical compound CC1=C(Cl)C=CC=C1NC1=CC=CC=C1C(O)=O YEZNLOUZAIOMLT-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 229960004167 toremifene citrate Drugs 0.000 description 1
- AKCRNFFTGXBONI-UHFFFAOYSA-N torin 1 Chemical compound C1CN(C(=O)CC)CCN1C1=CC=C(N2C(C=CC3=C2C2=CC(=CC=C2N=C3)C=2C=C3C=CC=CC3=NC=2)=O)C=C1C(F)(F)F AKCRNFFTGXBONI-UHFFFAOYSA-N 0.000 description 1
- GUXXEUUYCAYESJ-UHFFFAOYSA-N torin 2 Chemical compound C1=NC(N)=CC=C1C1=CC=C(N=CC2=C3N(C=4C=C(C=CC=4)C(F)(F)F)C(=O)C=C2)C3=C1 GUXXEUUYCAYESJ-UHFFFAOYSA-N 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 229950007217 tremelimumab Drugs 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- 229960005294 triamcinolone Drugs 0.000 description 1
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- RTKIYFITIVXBLE-QEQCGCAPSA-N trichostatin A Chemical compound ONC(=O)/C=C/C(/C)=C/[C@@H](C)C(=O)C1=CC=C(N(C)C)C=C1 RTKIYFITIVXBLE-QEQCGCAPSA-N 0.000 description 1
- 239000001069 triethyl citrate Substances 0.000 description 1
- VMYFZRTXGLUXMZ-UHFFFAOYSA-N triethyl citrate Natural products CCOC(=O)C(O)(C(=O)OCC)C(=O)OCC VMYFZRTXGLUXMZ-UHFFFAOYSA-N 0.000 description 1
- 235000013769 triethyl citrate Nutrition 0.000 description 1
- IEDVJHCEMCRBQM-UHFFFAOYSA-N trimethoprim Chemical compound COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 IEDVJHCEMCRBQM-UHFFFAOYSA-N 0.000 description 1
- 229960001082 trimethoprim Drugs 0.000 description 1
- 229910000406 trisodium phosphate Inorganic materials 0.000 description 1
- 235000019801 trisodium phosphate Nutrition 0.000 description 1
- 102000015534 trkB Receptor Human genes 0.000 description 1
- 108010064880 trkB Receptor Proteins 0.000 description 1
- 125000000430 tryptophan group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C2=C([H])C([H])=C([H])C([H])=C12 0.000 description 1
- GOVYBPLHWIEHEJ-UHFFFAOYSA-N tubastatin A Chemical compound C1N(C)CCC2=C1C1=CC=CC=C1N2CC1=CC=C(C(=O)NO)C=C1 GOVYBPLHWIEHEJ-UHFFFAOYSA-N 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 229950009811 ubenimex Drugs 0.000 description 1
- YYSFXUWWPNHNAZ-PKJQJFMNSA-N umirolimus Chemical compound C1[C@@H](OC)[C@H](OCCOCC)CC[C@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 YYSFXUWWPNHNAZ-PKJQJFMNSA-N 0.000 description 1
- AHXICHPPXIGCBN-GPWPDEGDSA-N uqc681jjiv Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](OC(C)=O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)OC)C(=O)C1=CC=CC=C1 AHXICHPPXIGCBN-GPWPDEGDSA-N 0.000 description 1
- 229960002004 valdecoxib Drugs 0.000 description 1
- LNPDTQAFDNKSHK-UHFFFAOYSA-N valdecoxib Chemical compound CC=1ON=C(C=2C=CC=CC=2)C=1C1=CC=C(S(N)(=O)=O)C=C1 LNPDTQAFDNKSHK-UHFFFAOYSA-N 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229950000578 vatalanib Drugs 0.000 description 1
- YCOYDOIWSSHVCK-UHFFFAOYSA-N vatalanib Chemical compound C1=CC(Cl)=CC=C1NC(C1=CC=CC=C11)=NN=C1CC1=CC=NC=C1 YCOYDOIWSSHVCK-UHFFFAOYSA-N 0.000 description 1
- 229960003862 vemurafenib Drugs 0.000 description 1
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 1
- 229950010644 vidofludimus Drugs 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 1
- 229960004982 vinblastine sulfate Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- AQTQHPDCURKLKT-JKDPCDLQSA-N vincristine sulfate Chemical compound OS(O)(=O)=O.C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 AQTQHPDCURKLKT-JKDPCDLQSA-N 0.000 description 1
- 229960002110 vincristine sulfate Drugs 0.000 description 1
- NMDYYWFGPIMTKO-HBVLKOHWSA-N vinflunine Chemical compound C([C@@](C1=C(C2=CC=CC=C2N1)C1)(C2=C(OC)C=C3N(C)[C@@H]4[C@@]5(C3=C2)CCN2CC=C[C@]([C@@H]52)([C@H]([C@]4(O)C(=O)OC)OC(C)=O)CC)C(=O)OC)[C@H]2C[C@@H](C(C)(F)F)CN1C2 NMDYYWFGPIMTKO-HBVLKOHWSA-N 0.000 description 1
- 229960000922 vinflunine Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 229950005839 vinzolidine Drugs 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 229960000237 vorinostat Drugs 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 239000003871 white petrolatum Substances 0.000 description 1
- 229950004227 zaltoprofen Drugs 0.000 description 1
- 229950009002 zanolimumab Drugs 0.000 description 1
- SUPVGFZUWFMATN-UHFFFAOYSA-N zelavespib Chemical compound N1=CN=C2N(CCCNC(C)C)C(SC=3C(=CC=4OCOC=4C=3)I)=NC2=C1N SUPVGFZUWFMATN-UHFFFAOYSA-N 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001152—Transcription factors, e.g. SOX or c-MYC
- A61K39/001153—Wilms tumor 1 [WT1]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/82—Translation products from oncogenes
Definitions
- the present invention relates to the combined use of a WT1 antigen peptide and an immunomodulator.
- CTLs cytotoxic T cells
- MHC Major Histocompatibility Complex
- MHC is called human leukocyte antigen (HLA) in humans, and HLA-A, B and Cw are known.
- a tumor antigen peptide is produced by synthesizing a protein that is highly expressed in a tumor, that is, a tumor antigen protein, in a cell and then degrading in a cell by a protease.
- the produced tumor antigen peptide binds to the MHC class I antigen in the endoplasmic reticulum to form a complex, and is carried to the cell surface to present the antigen.
- the tumor-reactive CTL recognizes this antigen-presented tumor antigen peptide (killer peptide) and exhibits an antitumor effect through cytotoxicity and production of lymphokines.
- WT1 is a gene identified as a responsible gene for Wilms tumor, which is renal cancer of children, and is a transcription factor having a zinc finger structure (see Non-Patent Document 1). Initially, the WT1 gene was considered to be a tumor suppressor gene, but subsequent studies have shown that it acts rather as an oncogene in hematopoietic tumors and solid tumors.
- WT1 is highly expressed in many malignant tumors (see Non-Patent Document 2).
- WT1 is considered to be a new cancer antigen protein in leukemia and solid cancer (see Non-Patent Document 3). Therefore, cancer vaccine therapy and dendritic cell therapy using WT1 protein or WT1 protein-derived peptide, TCR-like antibody that recognizes WT1 protein-derived peptide and HLA complex, or chimeric antigen receptor using TCR-like antibody ( CAR) gene-modified T cell therapy is under development.
- CAR TCR-like antibody
- WT1 protein for example, WT1 126-134 peptide, WT1 235-243 peptide, WT1 10-18 peptide, WT1 187-195 peptide, WT1 302-310 peptide, and the like WT1 37-45 peptide bound to MHC class I
- Patent Document 1 Patent Document 2
- Patent Documents 4 and 5 Non-Patent Documents 4 and 5
- helper T (Th1) cells may be mentioned as cells that play an important role in cancer immunotherapy.
- an antigen protein is degraded by intracellular lysosomes, and a part of a fragment peptide composed of amino acids of about 13 to 17 residues binds to an MHC class II molecule as an antigen peptide (helper peptide).
- Th1 cells in which a complex of an antigen peptide and an MHC class II molecule is presented on the TCR / CD3 complex and activated promotes the induction and activation of CTL.
- HLA-DR, DQ and DP are known as human MHC class II molecules, and a plurality of helper peptides derived from the WT1 protein have been identified so far (see Non-Patent Documents 6 and 7).
- Non-Patent Document 8 a drug that interacts with a molecule involved in the transmission of a co-stimulatory signal on an antigen-presenting cell and / or T cell in T cell activation by the antigen-presenting cell can transmit the co-stimulatory signal. It is known that it can be controlled (see Non-Patent Document 8).
- PD-1 is a receptor belonging to the CD28 family expressed on activated lymphocytes (T cells, B cells and NKT cells) and myeloid cells, and PD-1 ligand (PD ⁇ ) expressed on antigen-presenting cells.
- L1 and PD-L2 bind to each other and transmit an inhibitory signal to lymphocytes to negatively regulate lymphocyte activation.
- PD-L1 has been shown to be expressed in various tumor tissues in addition to antigen-presenting cells. That is, cancer uses PD-L1 to avoid attacks from CTL.
- Non-Patent Documents 9 and 10 antibodies that inhibit the function of immune checkpoint molecules have been developed (see Non-Patent Documents 9 and 10). These antibodies release CTL exhaustion.
- anti-PD-1 antibody and anti-PD-L1 antibody inhibit the binding between PD-1 and PD-L1, and restore the cytotoxic activity of CTL.
- clinical trials of anti-PD-1 antibody or anti-PD-L1 antibody have been conducted for patients such as non-small cell lung cancer and melanoma, and remarkable effects have been observed.
- patients such as non-small cell lung cancer and melanoma
- remarkable effects have been observed.
- only about 20 to 30% of patients show remarkable effects, and treatment with anti-PD-1 antibody or anti-PD-L1 antibody is sufficiently satisfied, such as suffering a strong immune-related adverse event.
- Treatment with anti-PD-1 antibody or anti-PD-L1 antibody is sufficiently satisfied, such as suffering a strong immune-related adverse event.
- the problem to be solved by the present invention is to provide a method and a medicament for treating or preventing cancer using a WT1 antigen peptide and an immunomodulator.
- Possible causes of inadequate effects of anti-PD-1 antibody and anti-PD-L1 antibody include a small amount of CTL in the tumor and dependence on a strong immunosuppressive mechanism other than PD-1 / PD-L1. .
- combined use with cancer vaccines and inhibitors of immune checkpoint molecules other than PD-1 and PD-L1 is expected.
- the present inventors examined the combined use of cancer vaccines that increase tumor-reactive CTLs in tumors and inhibitors of immune checkpoint molecules or other immunomodulators. As a result of intensive studies using mice, the present inventors have found that administration of a WT1 antigen peptide results in the expression of immune checkpoint molecules in CD8-positive T cells, particularly WT1-specific killer T cells and CD4-positive T cells.
- induced and WT1-specific killer T cells are stimulated to activate in response to immunomodulators such as immune checkpoint inhibitors. Furthermore, as a result of earnest research using human-derived peripheral blood mononuclear cells, the combined use of a WT1 antigen peptide and an immunomodulator results in efficient induction of WT1-specific killer T cells from naive T cells, And WT1-specific killer T cells induced by WT1 antigenic peptides were found to be activated in response to immunomodulators.
- the present invention relates to the following.
- Item 1 A pharmaceutical composition for treating or preventing cancer, comprising a WT1 antigen peptide or a pharmaceutically acceptable salt thereof in combination with an immunomodulator.
- Item 2. A pharmaceutical composition for treating or preventing cancer, comprising an immunomodulator, in combination with a WT1 antigen peptide or a pharmaceutically acceptable salt thereof.
- Item 3. A pharmaceutical composition for treating or preventing cancer, comprising an immunomodulator and a WT1 antigen peptide or a pharmaceutically acceptable salt thereof.
- Item 4. The pharmaceutical composition according to any one of Items 1 to 3, wherein the WT1 antigen peptide is a WT1 killer peptide.
- WT1 killer peptide or a pharmaceutically acceptable salt thereof RMFPNAPYL (SEQ ID NO: 2), CMTWNQMNL (SEQ ID NO: 3), CYTWNQMNL (SEQ ID NO: 4), ALLPAVPSL (SEQ ID NO: 5), SLGEQQYSV (SEQ ID NO: 6), RVPGVAPTL (SEQ ID NO: 7), VLDFAPPGA, (SEQ ID NO: 8), C-CMTWNQMNL (SEQ ID NO: 9) (wherein the bond between C and C represents a disulfide bond), C-CYTWNQMNL (SEQ ID NO: 10) (wherein the bond between C and C represents a disulfide bond)
- WT1 killer peptide or a pharmaceutically acceptable salt thereof RMFPNAPYL (SEQ ID NO: 2), CMTWNQMNL (SEQ ID NO: 3), CYTWNQMNL (SEQ ID NO: 4), ALLPAVPSL (SEQ ID NO: 5), C-CYTWNQMNL (SEQ ID NO: 10) and YMFPNAPYL (SEQ ID NO: 26)
- Item 6 A pharmaceutical composition according to Item 5, which is a compound represented by: or a pharmaceutically acceptable salt thereof.
- Item 7. Item 7.
- WT1 helper peptide or a pharmaceutically acceptable salt thereof Less than: KRYFKLSHHLQMHSRKH (SEQ ID NO: 11), SGQARMFPNAPNAPLPSCLES (SEQ ID NO: 12), RSDELVRHNHMHQRNMTKL (SEQ ID NO: 13), PGCNKRYFKLLSHLQMHSRHKTG (SEQ ID NO: 14), CNKRYFKLSHHLQMHSRK (SEQ ID NO: 15), CNKRYFKLLSHLQMHSRKH (SEQ ID NO: 16), CNKRYFKLLSHLQMHSRKHTG (SEQ ID NO: 17), WAPVLDFAPPGASAYGSL (SEQ ID NO: 18), CWAPVLDFAPPGASAYGSL (SEQ ID NO: 19), WAPVLDFAPPGASAYGSLC (SEQ ID NO: 20) and SGQAYMFPNAPYLPSCLES (SEQ ID NO: 37) A peptide consisting of any amino acid sequence selected
- Item 9 The pharmaceutical composition according to Item 7 or 8, which is a peptide comprising the amino acid sequence and having helper T cell-inducing activity; or a pharmaceutically acceptable salt thereof.
- Item 10. WT1 helper peptide or a pharmaceutically acceptable salt thereof, Less than: KRYFKLSHHLQMHSRKH (SEQ ID NO: 11), PGCNKRYFKLLSHLQMHSRHKTG (SEQ ID NO: 14), WAPVLDFAPPGASAYGSL (SEQ ID NO: 18) and SGQAYMFPNAPYLPSCLES (SEQ ID NO: 37)
- Item 10 The pharmaceutical composition according to Item 9, which is a peptide consisting of any amino acid sequence selected from: or a pharmaceutically acceptable salt thereof.
- the WT1 killer peptide or a pharmaceutically acceptable salt thereof is RMFPNAPYL (SEQ ID NO: 2) or a pharmaceutically acceptable salt thereof; Item 11.
- the WT1 killer peptide or a pharmaceutically acceptable salt thereof is RMFPNAPYL (SEQ ID NO: 2) or a pharmaceutically acceptable salt thereof; Item 11.
- the pharmaceutical composition according to Item 10 wherein the WT1 helper peptide or a pharmaceutically acceptable salt thereof is PGCNKRYFKLLSHLQMHSRHKTG (SEQ ID NO: 14) or a pharmaceutically acceptable salt thereof.
- the WT1 killer peptide or a pharmaceutically acceptable salt thereof is ALLPAVPSL (SEQ ID NO: 5) or a pharmaceutically acceptable salt thereof;
- the pharmaceutical composition according to Item 10, wherein the WT1 helper peptide or a pharmaceutically acceptable salt thereof is KRYFKLLSHLQMHSRKH (SEQ ID NO: 11) or a pharmaceutically acceptable salt thereof.
- Item 14 The pharmaceutical composition according to Item 10, wherein the WT1 helper peptide or a pharmaceutically acceptable salt thereof is KRYFKLLSHLQMHSRKH (SEQ ID NO: 11) or a pharmaceutically acceptable salt thereof.
- the WT1 killer peptide or a pharmaceutically acceptable salt thereof is YMFPNAPYL (SEQ ID NO: 26) or a pharmaceutically acceptable salt thereof; Item 11.
- the WT1 killer peptide or a pharmaceutically acceptable salt thereof has the formula (3): (In the formula, the bond between C and C represents a disulfide bond.) Or a pharmaceutically acceptable salt thereof, Item 11.
- the pharmaceutical composition according to Item 10 wherein the WT1 helper peptide or a pharmaceutically acceptable salt thereof is WAPVLDFAPPGASAYGSL (SEQ ID NO: 18) or a pharmaceutically acceptable salt thereof.
- Item 16. The pharmaceutical composition according to any one of Items 1 to 15, which is used as a cancer vaccine.
- An immunomodulator (1) immune checkpoint inhibitor, (2) a costimulatory molecule agonist, Item 17.
- Item 19 The pharmaceutical composition according to Item 17 or 18, wherein the immunomodulator is an immune checkpoint inhibitor. Item 20.
- Immune checkpoint inhibitors (1) CTLA-4, (2) PD-1, (3) LAG-3, (4) BTLA, (5) KIR, (6) TIM-3, (7) PD-L1, (8) PD-L2, (9) B7-H3, (10) B7-H4, (11) HVEM, (12) GAL9, (13) CD160, (14) VISTA, (15) BTNL2, (16) TIGIT, (17) PVR, (18) BTN1A1, (19) BTN2A2, (20) BTN3A2 and (21) CSF-1R Item 20.
- the immune checkpoint inhibitor is one or more against a molecule selected from the group consisting of CTLA-4, PD-1, LAG-3, TIM-3, BTLA, VISTA, HVEM, TIGIT, PVR, PD-L1 and CD160 Item 21.
- Item 22. The pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is an agent for CTLA-4.
- Item 22. The pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is a drug against LAG-3.
- the pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is a drug against TIM-3. Item 26. Item 22. The pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is a drug against BTLA. Item 27. Item 22. The pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is a drug against HVEM. Item 28. Item 22. The pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is a drug against TIGIT. Item 29. Item 22. The pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is a drug against PVR. Item 30. Item 22. The pharmaceutical composition according to Item 21, wherein the immune checkpoint inhibitor is a drug against CD160. Item 31. Item 22.
- Item 32. The pharmaceutical composition according to any one of Items 19 to 31, wherein the immune checkpoint inhibitor is an antibody.
- Item 34. The pharmaceutical composition according to Item 33, wherein the antibody to PD-1 is nivolumab or pembrolizumab.
- Item 34. Item 34.
- the pharmaceutical composition according to Item 33, wherein the antibody to PD-L1 is Durvalumab, Atezolizumab (MPDL3280A) or BMS-936559.
- Item 19 The pharmaceutical composition according to Item 17 or 18, wherein the immunomodulator is a costimulatory molecule agonist agent.
- Item 36 A costimulatory molecule agonist, (1) 4-1BB, (2) 4-1BB-L, (3) OX40, (4) OX40-L, (5) GITR, (6) CD28, (7) CD40, (8) CD40-L, (9) ICOS, (10) ICOS-L, (11) LIGHT, and (12) CD27 Item 36.
- the pharmaceutical composition according to Item 35 which is one or more drugs for a molecule selected from the group consisting of: Item 37. Item 37.
- the pharmaceutical composition according to Item 36, wherein the costimulatory molecule agonist agent is one or more agents for a molecule selected from the group consisting of 4-1BB, OX40, GITR, CD40, and ICOS.
- Item 38. The pharmaceutical composition according to Item 37, wherein the costimulatory molecule agonist agent is an agent for 4-1BB.
- Item 39. Item 38.
- the pharmaceutical composition according to Item 37, wherein the costimulatory molecule agonist is an agent for OX40.
- Item 38. The pharmaceutical composition according to Item 37, wherein the costimulatory molecule agonist agent is an agent for GITR.
- the pharmaceutical composition according to Item 37, wherein the costimulatory molecule agonist is an agent for CD40.
- Item 38. The pharmaceutical composition according to Item 37, wherein the costimulatory molecule agonist is an agent for ICOS.
- Item 43. The pharmaceutical composition according to any one of Items 35 to 42, wherein the costimulatory molecule agonist agent is an antibody.
- Item 44. Item 19. The pharmaceutical composition according to Item 17 or 18, wherein the immunomodulator is an immune activator.
- TLR Toll-like receptor
- TLR agonists (1) TLR1 / 2 agonist, (2) TLR2 agonist, (3) TLR3 agonist, (4) TLR4 agonist, (5) TLR5 agonist, (6) TLR6 / 2 agonist, (7) TLR7 agonist, (8) TLR7 / 8 agonist, (9) TLR7 / 9 agonist, (10) TLR8 agonist, Item 46.
- the pharmaceutical composition according to Item 45 which is one or more drugs selected from the group consisting of (11) a TLR9 agonist and (12) a TLR11 agonist.
- the pharmaceutical composition of claim 46, wherein the TLR agonist is one or more drugs selected from the group consisting of a TLR3 agonist, a TLR7 agonist, a TLR7 / 8 agonist, and a TLR9 agonist.
- Item 52. The pharmaceutical composition according to any one of Items 45 to 51, wherein the Toll-like receptor agonist is a nucleic acid.
- Item 53. The pharmaceutical composition according to Item 17 or 18, wherein the immunomodulator is a small molecule inhibitor.
- Item 54. Item 53.
- the small molecule inhibitor is one or more drugs selected from the group consisting of ⁇ -catenin inhibitors, IDO inhibitors, COX-2 inhibitors, CXCR4 inhibitors, STAT3 inhibitors and multikinase inhibitors.
- the pharmaceutical composition according to claim 54, wherein the small molecule inhibitor is a ⁇ -catenin inhibitor.
- Cancer is leukemia, myelodysplastic syndrome, multiple myeloma, malignant lymphoma, stomach cancer, colon cancer, lung cancer, breast cancer, germ cell cancer, liver cancer, skin cancer, bladder cancer, prostate cancer, uterine cancer, cervical cancer, ovary Cancer, brain tumor, bone cancer, pancreatic cancer, head and neck cancer, skin or intraorbital malignant melanoma, rectal cancer, anal cancer, testicular cancer, fallopian carcinoma, endometrial carcinoma, cervical carcinoma, vaginal carcinoma, vulva carcinoma , Hodgkin disease, non-Hodgkin lymphoma, esophageal cancer, small intestine cancer, endocrine cancer, thyroid cancer, parathyroid cancer, adrenal cancer, soft tissue sarcoma, urethral cancer, penile cancer, acute myeloid leukemia, chronic myelogenous leukemia, acute lymph Blastic leukemia, chronic or acute leukemia including chronic lymphocytic leukemia, childhood solid
- the pharmaceutical composition according to any one of Items 1 to 60 selected from the group consisting of renal cell carcinoma and asbestos-induced cancer.
- Item 62. Item 62.
- Item 63. Item 62.
- the pharmaceutical composition according to any one of Items 1, 2, and 4-61, wherein the WT1 antigen peptide is administered before administration of the immunomodulator.
- Item 67. The pharmaceutical composition according to any one of Items 1 to 66 for treating cancer.
- Item 67. Item 70.
- Item 68. 68. A method for treating or preventing cancer, comprising administering a WT1 antigen peptide defined in any one of Items 1 to 67 or a pharmaceutically acceptable salt thereof and an immunomodulator to a mammal.
- Item 70 The method according to Item 68, wherein the WT1 antigen peptide or a pharmaceutically acceptable salt thereof and the immunomodulator are administered simultaneously or separately.
- Item 70. 68. A kit for treating or preventing cancer, comprising the WT1 antigen peptide defined in any one of Items 1 to 67 or a pharmaceutically acceptable salt thereof and an immunomodulator.
- the invention also relates to: A method for treating or preventing cancer comprising administering a WT1 antigen peptide or a pharmaceutically acceptable salt thereof and an immunomodulator to a mammal; A WT1 antigen peptide or a pharmaceutically acceptable salt thereof for use in the treatment or prevention of cancer, in combination with an immunomodulator; An immunomodulator for use in the treatment or prevention of cancer, in combination with a WT1 antigen peptide or a pharmaceutically acceptable salt thereof; Use of a WT1 antigen peptide or a pharmaceutically acceptable salt thereof for the manufacture of a medicament for treating or preventing cancer, in combination with an immunomodulator; For the manufacture of a medicament for treating or preventing cancer, in combination with a WT1 antigen peptide or a pharmaceutically acceptable salt thereof, the use of an immunomodulator; and for the manufacture of a medicament for treating or preventing cancer , WT1 antigen peptide or a pharmaceutically acceptable salt thereof and an immunomodulator.
- the invention also relates to: A method for treating or preventing cancer comprising administering to a mammal a WT1 antigen peptide or a pharmaceutically acceptable salt thereof and an immune checkpoint inhibitor; A WT1 antigen peptide or a pharmaceutically acceptable salt thereof for use in the treatment or prevention of cancer, in combination with an immune checkpoint inhibitor; An immune checkpoint inhibitor for use in the treatment or prevention of cancer, in combination with a WT1 antigen peptide or a pharmaceutically acceptable salt thereof; Use of a WT1 antigen peptide or a pharmaceutically acceptable salt thereof for the manufacture of a medicament for treating or preventing cancer, in combination with an immune checkpoint inhibitor; Use of an immune checkpoint inhibitor for the manufacture of a medicament for treating or preventing cancer, in combination with a WT1 antigen peptide or a pharmaceutically acceptable salt thereof; and the manufacture of a medicament for treating or preventing cancer Use of a WT1 antigen peptide or a pharmaceutically acceptable salt thereof and an immune checkpoint inhibitor.
- a method, a pharmaceutical composition and a kit for treating or preventing cancer characterized by using a WT1 antigen peptide or a pharmaceutically acceptable salt thereof together with an immunomodulator.
- the present invention also provides a method, a pharmaceutical composition, and a kit for treating or preventing cancer, characterized by combining a WT1 antigen peptide or a pharmaceutically acceptable salt thereof and an immunomodulator. .
- the horizontal axis indicates the staining intensity of the anti-CD8 antibody
- the vertical axis indicates the staining intensity of the HLA tetramer
- the dots in the area surrounded by the dashed line in the square represent WT1 antigen peptide-specific CTL.
- the horizontal axis indicates the staining intensity of the anti-CD8 antibody
- the vertical axis indicates the staining intensity of the HLA tetramer
- the dots in the area surrounded by the dashed line in the square represent WT1 antigen peptide-specific CTL.
- the horizontal axis indicates the staining intensity of the anti-CD8 antibody
- the vertical axis indicates the staining intensity of the HLA tetramer
- the dots in the area surrounded by the dashed line in the square represent WT1 antigen peptide-specific CTL.
- the vertical axis represents the number of spots detected by IFN- ⁇ ELISPOT.
- the change in the expression of PD-1 in mouse splenocytes by vaccine administration is shown.
- the horizontal axis represents the staining intensity of PD-1 by flow cytometry analysis.
- the one-dot short chain line represents the CD8 positive tetramer positive fraction derived from the spleen of the vaccine-treated individual, the broken line represents the CD8 positive tetramer negative fraction derived from the spleen of the vaccine administered individual, and the solid line represents the CD8 positive tetramer negative fraction derived from the spleen of the non-vaccinated individual.
- the analysis results are shown.
- a dotted line shows the result using isotype control.
- Detection of PD-1 in CD4 positive T cells The change in the expression of PD-1 in mouse splenocytes by vaccine administration is shown.
- the horizontal axis represents the staining intensity of PD-1 by flow cytometry analysis.
- a broken line shows the analysis result about CD4 positive T cell derived from a vaccine administration individual spleen cell, and a continuous line shows the analysis result about CD4 positive T cell derived from a vaccine non-administration individual spleen cell.
- a dotted line shows the result using isotype control.
- Detection of PD-1 in CD4 / CD8 negative cells The change in the expression of PD-1 in mouse splenocytes by vaccine administration is shown.
- the horizontal axis represents the staining intensity of PD-1 by flow cytometry analysis.
- a broken line shows the analysis result about CD4 / CD8 negative cell derived from a vaccine administration individual spleen cell, and a continuous line shows the analysis result about CD4 / CD8 negative cell derived from a vaccine non-administration individual spleen cell.
- a dotted line shows the result using isotype control.
- the expression change of PD-L1 in mouse spleen cells by vaccine administration is shown.
- the horizontal axis represents the staining intensity of PD-L1 by flow cytometry analysis.
- the one-dot short chain line represents the CD8 positive tetramer positive fraction derived from the spleen of the vaccine-treated individual, the broken line represents the CD8 positive tetramer negative fraction derived from the spleen of the vaccine administered individual, and the solid line represents the CD8 positive tetramer negative fraction derived from the spleen of the non-vaccinated individual.
- the analysis results are shown.
- a dotted line shows the result using isotype control.
- Detection of PD-L1 in CD4 positive T cells The expression change of PD-L1 in mouse spleen cells by vaccine administration is shown.
- the horizontal axis represents the staining intensity of PD-L1 by flow cytometry analysis.
- a broken line shows the analysis result about CD4 positive T cell derived from a vaccine administration individual spleen cell, and a continuous line shows the analysis result about CD4 positive T cell derived from a vaccine non-administration individual spleen cell.
- a dotted line shows the result using isotype control.
- Detection of PD-L1 in the CD4 / CD8 negative cell fraction The expression change of PD-L1 in mouse spleen cells by vaccine administration is shown.
- the horizontal axis represents the staining intensity of PD-L1 by flow cytometry analysis.
- a broken line shows the analysis result about CD4 / CD8 negative cell derived from a vaccine administration individual spleen cell, and a continuous line shows the analysis result about CD4 / CD8 negative cell derived from a vaccine non-administration individual spleen cell.
- a dotted line shows the result using isotype control.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ by immune checkpoint inhibitor treatment (C).
- WT1 antigen peptide-specific T cells induced in vaccinated mice were treated with anti-BTLA antibody or isotype control antibody, and IFN- ⁇ producing ability was observed when co-cultured with WT1 killer peptide and LLC-HHD-WT1 tumor cells. The result measured by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-TIM-3 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in vaccinated mice are treated with anti-LAG-3 antibody or isotype control antibody and co-cultured with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-L1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ by immune checkpoint inhibitor treatment (G).
- WT1 antigen peptide-specific T cells induced in vaccinated mice were treated with anti-HVEM antibody or isotype control antibody, and IFN- ⁇ producing ability was observed when co-cultured with WT1 killer peptide and LLC-HHD-WT1 tumor cells. The result measured by ELISA is shown.
- IFN- ⁇ by immune checkpoint inhibitor treatment (H).
- WT1 antigen peptide-specific T cells induced in vaccinated mice were treated with anti-VISTA antibody or isotype control antibody, and IFN- ⁇ producing ability was observed when co-cultured with WT1 killer peptide and LLC-HHD-WT1 tumor cells. The result measured by ELISA is shown.
- IFN- ⁇ by immune checkpoint inhibitor treatment (I).
- WT1 antigen peptide-specific T cells induced in vaccinated mice were treated with anti-PVR antibody or isotype control antibody, and IFN- ⁇ producing ability was observed when co-cultured with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result measured by ELISA is shown.
- IFN- ⁇ by immune checkpoint inhibitor treatment A. The results of measuring IFN- ⁇ production ability by ELISA when WT1 antigen peptide-specific T cells induced in a vaccinated tumor-bearing mouse were treated with anti-PD-1 antibody or isotype control antibody and cultured are shown. Production of IFN- ⁇ by immune checkpoint inhibitor treatment (B). The results of measuring IFN- ⁇ production ability by ELISA when WT1 antigen peptide-specific T cells induced in a vaccinated tumor-bearing mouse were treated with anti-CTLA-4 antibody or isotype control antibody and cultured are shown. Production of IFN- ⁇ by immune checkpoint inhibitor treatment (C).
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-L1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-OX-40 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-L1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-OX-40 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-L1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-PD-L1 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- IFN- ⁇ production upon treatment of WT1 antigen peptide-specific T cells induced in vaccinated mice with anti-OX-40 antibody or isotype control antibody and co-culture with WT1 killer peptide and LLC-HHD-WT1 tumor cells The result of having measured ability by ELISA is shown.
- mice transplanted with EL4-A24 / Kb-WT1 tumor cells were administered vehicle (group a), anti-PD-1 antibody (group b), vaccine (group c), anti-PD-1 antibody and vaccine (group d)
- the mean tumor volume is shown.
- mice transplanted with EL4-A24 / Kb-WT1 tumor cells were administered vehicle (group a), anti-CTLA-4 antibody (group b), vaccine (group c), anti-CTLA-4 antibody and vaccine (group d)
- group a mice transplanted with EL4-A24 / Kb-WT1 tumor cells were administered vehicle (group a), anti-CTLA-4 antibody (group b), vaccine (group c), anti-CTLA-4 antibody and vaccine (group d)
- the mean tumor volume is shown.
- shaft shows the ratio of WT1 antigen peptide specific CTL contained in the spleen cell of the mouse
- shaft shows the ratio of WT1 antigen peptide specific CTL contained in the spleen cell of the mouse
- IFN- ⁇ production by treatment with anti-PD-1 antibody A. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in mice administered killer vaccine are treated with anti-PD-1 antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-B7-H4 antibody A. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in mice administered killer vaccine were treated with anti-B7-H4 antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-B7-H4 antibody B. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in cocktail vaccine-treated mice were treated with anti-B7-H4 antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-PD-L1 antibody A. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in mice administered killer vaccine were treated with anti-PD-L1 antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-PD-L1 antibody B. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in cocktail vaccine-treated mice were treated with anti-PD-L1 antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-4-1BB antibody A. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in mice administered killer vaccine were treated with anti-4-1BB antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-4-1BB antibody B. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in cocktail vaccine-treated mice were treated with anti-4-1BB antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-OX-40 antibody A. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in mice administered killer vaccine were treated with anti-OX-40 antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- IFN- ⁇ production by treatment with anti-OX-40 antibody B. IFN- ⁇ production when WT1 antigen peptide-specific T cells induced in cocktail vaccine-treated mice are treated with anti-OX-40 antibody and co-cultured with LLC-HHD-WT1 tumor cells in the presence of WT1 killer peptide The result of having measured ability by ELISA is shown.
- the present invention relates to the combined use of a WT1 antigen peptide and an immunomodulator.
- the “WT1 antigen peptide” has an amino acid sequence derived from WT1 protein, binds to MHC class I or MHC class II, and is presented on the cell surface as a complex, whereby killer T cells or It means a peptide that induces helper T cells.
- WT1 antigen peptide that binds to MHC class I and induces killer T cells is referred to as “WT1 killer peptide”
- WT1 helper peptide a peptide that binds to MHC class II and induces helper T cells
- WT1 helper peptide a peptide that binds to MHC class II and induces helper T cells.
- Examples of the WT1 protein include, but are not limited to, mouse or human WT1 protein, preferably human WT1 protein.
- the human WT1 protein has the amino acid sequence of SEQ ID NO: 1.
- the term “WT1 antigen peptide” encompasses pharmaceutically acceptable salts thereof.
- the WT1 antigen peptide may be a modified product obtained by modifying a part or all of amino acid residues in the amino acid sequence.
- a modified form can be modified by a known method.
- the modified product may be, for example, a product obtained by subjecting a functional group in the side chain of an amino acid residue constituting a peptide to esterification, alkylation, halogenation, phosphorylation, sulfonation, amidation or the like.
- Various substances can be bound to the N-terminus and / or C-terminus of the peptide. For example, amino acids, peptides, analogs thereof and the like may be bound.
- these substances When these substances are bound to the WT1 antigen peptide, these substances may be processed by, for example, an in vivo enzyme or a process such as intracellular processing to finally produce the WT1 antigen peptide.
- Good These substances may be those that adjust the solubility of the peptide, or those that improve the stability such as protease resistance, and for example, the peptide may be specifically applied to a predetermined tissue or organ. It may be delivered, or may have an effect of enhancing the efficiency of antigen-presenting cell uptake.
- These substances may also be those that increase the ability to induce CTL, for example, killer peptides or helper peptides other than the WT1 antigen peptide or pharmaceutically acceptable salts thereof.
- the WT1 antigen peptide may be one in which amino acid residues are bonded by bonds other than peptide bonds such as carbon-carbon bond, carbon-nitrogen bond, and carbon-sulfur bond. Furthermore, the WT1 antigen peptide may contain one or more D-form amino acids.
- amino acid residue means a part corresponding to one unit of amino acid constituting the peptide or protein on the peptide or protein molecule.
- amino acid residue includes a natural or non-natural ⁇ -amino acid residue, ⁇ -amino acid residue, ⁇ -amino acid residue or ⁇ -amino acid residue. Specific examples include natural ⁇ -amino acid residues, ornithine residues, homoserine residues, homocysteine residues, ⁇ -alanine, ⁇ -aminobutanoic acid or ⁇ -aminopentanoic acid.
- amino acid residue in the present invention is indicated by an abbreviation, it is described by the following abbreviation.
- Ala or A alanine residue Arg or R: Arginine residue Asn or N: Asparagine residue Asp or D: Aspartic acid residue Cys or C: Cysteine residue Gln or Q: Glutamine residue Glu or E: Glutamic acid residue Gly or G: Glycine residue His or H: histidine residue Ile or I: isoleucine residue Leu or L: Leucine residue Lys or K: Lysine residue Met or M: methionine residue Phe or F: phenylalanine residue Pro or P: proline residue Ser or S: Serine residue Thr or T: Threonine residue Trp or W: Tryptophan residue Tyr or Y: tyrosine residue Val or V: valine residue Abu: 2-aminobutyric acid residue (also called ⁇ -aminobutyric acid residue) Orn: Ornith
- the amino acid sequence of the “peptide” in the present invention is described according to a conventional method such that the amino acid residue of the N-terminal amino acid is located on the left side and the amino acid residue of the C-terminal amino acid is located on the right side.
- the amino group of the amino acid residue of the N-terminal amino acid is bonded to a hydrogen atom
- the carbonyl group of the amino acid residue of the C-terminal amino acid is bonded to a hydroxyl group.
- the divalent group of the peptide means a group bonded through the amino group of the amino acid residue of the N-terminal amino acid and the carbonyl group of the amino acid residue of the C-terminal amino acid.
- the amino group of the amino acid residue of the N-terminal amino acid is a hydrogen atom unless otherwise specified for the peptide corresponding to the partial structure.
- the carbonyl group of the amino acid residue of the C-terminal amino acid is bonded to the hydroxyl group.
- MHC is called human leukocyte antigen (HLA) in humans.
- HLA corresponding to MHC class I molecules is classified into subtypes such as HLA-A, B, Cw, F and G.
- MHC class I-restricted means a property of inducing killer cells by binding to MHC class I molecules.
- the “MHC class I restriction” preferably includes HLA-A restriction, HLA-B restriction, or HLA-Cw restriction.
- HLA-A polymorphism examples include 27 or more types such as HLA-A1, HLA-A2, and HLA-A24.
- HLA-B polymorphism examples include HLA-B7, HLA-B40, and HLA-B44.
- the HLA-Cw polymorphism includes 10 or more types such as HLA-Cw0301, HLA-Cw0401, and HLA-Cw0602. Among these polymorphisms, HLA-A2 and HLA-A24 are preferable.
- the WT1 antigen peptide is a WT1 killer peptide that binds to MHC class I and induces killer T cells (cytotoxic T cells (CTL)).
- the WT1 killer peptide induces WT1-specific killer T cells by being presented on the cell surface as a complex with MHC class I.
- the WT1 killer peptide is a partial peptide consisting of 7 to 30 amino acids that are contiguous in the amino acid sequence of the human WT1 protein set forth in SEQ ID NO: 1, or a variant thereof.
- WT1 antigen peptide the following amino acid sequence: RMFPNAPYL (SEQ ID NO: 2), CMTWNQMNL (SEQ ID NO: 3), CYTWNQMNL (SEQ ID NO: 4), ALLPAVPSL (SEQ ID NO: 5), SLGEQQYSV (SEQ ID NO: 6), RVPGVAPTL (SEQ ID NO: 7), VLDFAPPGA (SEQ ID NO: 8), C-CMTWNQMNL (SEQ ID NO: 9) (wherein the bond between C and C represents a disulfide bond), and C-CYTWNQMNL (SEQ ID NO: 10) (wherein the bond between C and C is Represents a disulfide bond.)
- a peptide consisting of any amino acid sequence selected from SEQ ID NOs: 2 to 10 and a modified amino acid containing an amino acid residue modification in any amino acid sequence selected from SEQ ID NOs: 2 to 10 Peptides having a sequence and having CTL-inducing activity can be mentioned. More preferred is a peptide consisting of any amino acid sequence selected from SEQ ID NOs: 2 to 10. Even more preferably, a peptide consisting of any amino acid sequence selected from SEQ ID NOs: 2 to 6, 8, and 10 can be mentioned.
- peptide containing an amino acid sequence means a peptide in which an additional amino acid is added to the N-terminal amino acid and / or C-terminal amino acid of the amino acid sequence as usual.
- a peptide including a modified amino acid sequence containing a modified amino acid residue in the amino acid sequence and having CTL-inducing activity is also referred to as “modified killer peptide”.
- the modified killer peptide comprises an amino acid sequence in which one to several, preferably one to three amino acids are deleted, substituted and / or added in the amino acid sequence, binds to MHC class I, Means peptide to be derived.
- Examples of the substitution position of the amino acid to be substituted include 1-position (N-terminal), 2-position, 3-position and 9-position in the case of a peptide consisting of 9-residue amino acids.
- the number of amino acids to be added (including insertion) is preferably 1 or 2, more preferably 1.
- a preferred addition position includes the C-terminus.
- the number of amino acids to be deleted is preferably 1.
- the added amino acid or the substituted amino acid may be an unnatural amino acid other than the 20 kinds of amino acids encoded by the gene.
- binding motif there is regularity (binding motif) of the amino acid sequence of a peptide that can bind to the HLA antigen for each polymorphism of the HLA subtype.
- a binding motif of HLA-A24 in a peptide consisting of 8 to 11 amino acids, the amino acid at position 2 is Tyr, Phe, Met or Trp, and the C-terminal amino acid is Phe, Leu, Ile, It is known to be Trp or Met (J. Immunol., 152, p3913, 1994; J. Immunol., 155, p4307, 1994; Immunogenetics, 41, p178, 1995).
- substitution at position 2 with Tyr, Phe, Met or Trp and / or position 9 with Phe, Leu, Ile, Trp or Met is possible.
- the substituted peptide is preferred as the modified killer peptide.
- the amino acid at the 2nd position is Leu or Met and the C-terminal amino acid is Val or Leu in a peptide consisting of 8 to 11 amino acids.
- modified killer peptides include the following peptides: Is a modified killer peptide of RMFPNAPYL (SEQ ID NO: 2), RYFPNAPYL (SEQ ID NO: 21) (see WO 03/106682), FFPNAPYL (SEQ ID NO: 22), RLFPNAPYL (SEQ ID NO: 23), RMMPNAPYL (SEQ ID NO: 24), RMFPNAPYV (SEQ ID NO: 25) and YMFPNAPYL (SEQ ID NO: 26) (see WO 2009/072610); CMTWNQMNL (SEQ ID NO: 3) is a modified killer peptide, CYTWNQMNL (SEQ ID NO: 4) (see WO02 / 79253), Xaa-Met-Thr-Trp-Asn-Gln-Met-Asn-Leu (SEQ ID NO: 27), (Xaa in this sequence represents Ser or Ala) and Xaa-Tyr-
- the WT1 killer peptide is Formula (1): (In the formula, the bond between C and C represents a disulfide bond.) A compound represented by Formula (2): (In the formula, the bond between C and C represents a disulfide bond.) Or a compound represented by formula (3): (In the formula, the bond between C and C represents a disulfide bond.) It is a compound represented by these.
- WT1 antigen peptides include, in addition to the peptides and compounds listed above, compounds described in International Publication No. 2014/157692.
- the WT1 antigen peptide is a WT1 helper peptide that binds to MHC class II and induces helper T cells (CD4-positive T cells).
- the WT1 helper peptide induces WT1-specific helper T cells by being presented on the cell surface as a complex with MHC class II.
- WT1-specific helper T cells produce various cytokines such as IL-2, IL-4, IL-5, IL-6, or interferon (IFN), and are a subset of B cells and other T cell subsets. Promotes proliferation, differentiation and maturation. Therefore, the WT1 helper peptide activates helper T cells, induces and maintains CTL differentiation, and activates effector cells such as macrophages, and thus can be used for efficient treatment or prevention of cancer.
- HLA corresponding to MHC class II molecules is classified into subtypes such as HLA-DR, DQ and DP.
- MHC class II restricted means the property of binding to MHC class II molecules to induce helper T cells.
- the “MHC class II restriction” preferably includes HLA-DR restriction, HLA-DQ restriction or HLA-DP restriction.
- the WT1 helper peptide is a partial peptide consisting of 7 to 30 residues, preferably 14 to 30 amino acids that are continuous in the amino acid sequence of the human WT1 protein set forth in SEQ ID NO: 1, or a variant thereof. is there.
- WT1 helper peptides include the following amino acid sequences: KRYFKLSHHLQMHSRKH (SEQ ID NO: 11), SGQARMFPNAPNAPLPSCLES (SEQ ID NO: 12), RSDELVRHNHMHQRNMTKL (SEQ ID NO: 13), PGCNKRYFKLLSHLQMHSRHKTG (SEQ ID NO: 14), CNKRYFKLSHHLQMHSRK (SEQ ID NO: 15), CNKRYFKLLSHLQMHSRKH (SEQ ID NO: 16), CNKRYFKLLSHLQMHSRKHTG (SEQ ID NO: 17), WAPVLDFAPPGASAYGSL (SEQ ID NO: 18), CWAPVLDFAPPGASAYGSL (SEQ ID NO: 19), WAPVLDFAPPGASAYGSLC (SEQ ID NO: 20), SGQARMFPNAPYLPSC (SEQ ID NO: 34), SGQAYMFPNAPYLPSC (SEQ ID NO: 35
- Peptides having a modified amino acid sequence containing a group modification and having a helper T cell inducing activity can be mentioned. More preferably, it is a peptide consisting of any amino acid sequence selected from SEQ ID NO: 11-20 and 34-40, and even more preferably, from any amino acid sequence selected from SEQ ID NO: 11-20 The peptide is mentioned.
- a peptide containing a modified amino acid sequence containing a modified amino acid residue in the amino acid sequence and having a helper T cell inducing activity is also referred to as a “modified helper peptide”.
- the modified helper peptide consists of an amino acid sequence in which one to several, preferably one to three amino acids are deleted, substituted and / or added in the amino acid sequence, and binds to MHC class II. It means a peptide that induces cells.
- the added amino acid or the substituted amino acid may be an unnatural amino acid other than the 20 kinds of amino acids encoded by the gene.
- modified helper peptides include the following peptides: SGQARMFPNAPYLPSCLES (SEQ ID NO: 36) is a modified helper peptide, SGQAYMFPNAPYLPSCLES (SEQ ID NO: 37) (see International Publication No. 2007/120673), SGQARMFPNAPNAPLPSC (SEQ ID NO: 34) and SGQAYMFPNAPYLPSC (SEQ ID NO: 35); and It is a modified helper peptide of PGCNKRYFKLSHLQMHSRKHTG (SEQ ID NO: 40).
- PGCNKRYFKLSHHLQMHSRK (SEQ ID NO: 38), PGCNKRYFKLSHHLQMHSRKH (SEQ ID NO: 39), KRYFKLSHHLQMHSRKH (SEQ ID NO: 11), CNKRYFKLSHHLQMHSRK (SEQ ID NO: 15), CNKRYFKLLSHLQMHSRKH (SEQ ID NO: 16) and CNKRYFKLLSHLQMHSRRKHTG (SEQ ID NO: 17).
- WT1 antigen peptide can be produced according to a method used in normal peptide synthesis. Production methods include literature (Peptide Synthesis, Interscience, New York, 1966; The Proteins, Vol 2, Academic Press Inc., New York, 1976; Peptide Synthesis, Maruzen Co., Ltd. ), 1975; peptide synthesis basics and experiments, Maruzen Co., Ltd., 1985; Pharmaceutical Development, Vol. 14, Peptide Synthesis, Hirokawa Shoten, 1991).
- a method of producing by a solid phase synthesizer using the Fmoc method or Boc method and a method of producing by sequentially condensing Boc-amino acid or Z-amino acid by a liquid phase synthesis method (Fmoc is 9-fluorene).
- Fmoc is 9-fluorene
- Nylmethoxycarbonyl group, Boc represents t-butoxycarbonyl group, and Z represents benzyloxycarbonyl group).
- protecting groups such as amino group, carboxy group, mercapto group, etc. are protected with appropriate protective groups using protection and deprotection techniques as necessary. can do. Suitable protecting groups, protecting methods, and deprotecting methods are described in detail in “ProtectiveProtectGroups In Organic Synthesis 2nd Edition (John Wiley & Sons, Inc .; 1990)".
- the protecting group for the mercapto group includes an acetamidomethyl group or a trityl group.
- the disulfide bond can be formed between two different peptides containing a cysteine residue or between a peptide containing a cysteine residue and a cysteine according to a method used in normal peptide chemistry. Can be formed. Disulfide bond formation methods are described in the literature (Peptide Synthesis, Interscience, New York, 1966; The Proteins, Vol 2, Academic Press Inc., New York, 1976; peptide synthesis, Maruzen (Inc.), 1975; Basics and experiments of peptide synthesis, Maruzen Co., Ltd., 1985; Pharmaceutical Development, Vol. 14, Peptide Synthesis, Hirokawa Shoten, 1991).
- disulfide when a peptide has one cysteine residue, disulfide is obtained by removing all protecting groups including a mercapto group protecting group on the cysteine side chain and then oxidizing in an inert solvent.
- a compound having a bond (disulfide compound) can be produced.
- it can manufacture by mixing two intermediates which have a mercapto group in a suitable solvent, and oxidizing.
- oxidation method a known method for forming a disulfide bond by ordinary peptide synthesis may be appropriately selected.
- iodine oxidation a method of subjecting to an air oxidation reaction under alkaline conditions, or a method of forming a disulfide bond by adding an oxidizing agent under alkaline or acidic conditions.
- the oxidizing agent include iodine, dimethyl sulfoxide (DMSO), potassium ferricyanide and the like.
- DMSO dimethyl sulfoxide
- the solvent water, acetic acid, methanol, chloroform, DMF or DMSO, or a mixture thereof can be used. Oxidation reactions often give a mixture of symmetrical, asymmetrical disulfide compounds.
- the target asymmetric disulfide compound can be obtained by purification by various chromatography or recrystallization.
- a selective disulfide bond can be formed by mixing an intermediate having an activated mercapto group and an intermediate having a mercapto group.
- the intermediate having an activated mercapto group include a mercapto group to which an Npys group (3-nitro-2-pyridinesulfenyl group) is bonded.
- a selective disulfide bond is formed by adding the other intermediate after activating the mercapto group in advance by mixing one intermediate with, for example, 2,2′-dithiobis (5-nitropyridine). (Tetrahedron Letters. Vol.37. No.9, pp.1347-1350).
- a dimer in which a disulfide bond is formed between the target cysteine residues can be obtained by combining the protecting groups of the cysteine side chains in a specific combination.
- Combinations of the protecting groups include MeBzl (methylbenzyl) group and Acm (acetamidomethyl) group, Trt (trityl) group and Acm group, Npys (3-nitro-2-pyridylthio) group and Acm group, S-Bu- and t (S-tert-butyl) group and Acm group.
- WT1 antigen peptide may be a killer peptide and a helper peptide, or two different killer peptides or helper peptides bound via a disulfide bond.
- Such a peptide can be synthesized by a method including the following steps (1) to (3).
- step (1) using Fmoc-C (Mmt) A-SBn and the first antigen peptide, the carbonyl group of the C-terminal amino acid of C (Mmt) A and the N-terminal amino group of the first antigen peptide are Synthesize the bound peptide.
- Fmoc represents a 9-fluorenylmethoxycarbonyl group.
- Mmt represents a monomethoxytrityl group.
- SBn represents a thiobenzyl group.
- the step (1) using the peptide obtained in the step (1) and the second antigen peptide in which one cysteine residue protected with an Npys group is bonded to the N-terminus, the step (1)
- the peptide obtained by combining the thioether group of the cysteine residue of the first antigen peptide and the thioether group of the cysteine residue bonded to the N-terminus of the second antigen peptide in the peptide obtained in (1) is synthesized.
- “Npys” represents a 3-nitro-2-pyridylthio group.
- step (3) using the peptide obtained in the step (2) and a third antigen peptide containing a cysteine residue protected with an SPy group, the peptide in the peptide obtained in the step (2) A peptide in which the thioether group of the cysteine residue bonded to the N-terminus of the second antigen peptide and the thioether group of the cysteine residue of the third antigen peptide are combined is synthesized.
- SPy represents a 2-pyridyl sulfide group.
- the obtained WT1 antigen peptide can be purified according to a method known to those skilled in the art or a method used in ordinary peptide chemistry. For example, it can be purified by various chromatography (for example, silica gel column chromatography, ion exchange column chromatography, gel filtration, or reverse phase chromatography) or recrystallization.
- chromatography for example, silica gel column chromatography, ion exchange column chromatography, gel filtration, or reverse phase chromatography
- the recrystallization solvent includes alcohol solvents such as methanol, ethanol or 2-propanol, ether solvents such as diethyl ether, ester solvents such as ethyl acetate, aromatic hydrocarbon solvents such as benzene or toluene, acetone A ketone solvent such as hexane, a hydrocarbon solvent such as hexane, an aprotic solvent such as dimethylformamide or acetonitrile, water, or a mixed solvent thereof can be used.
- alcohol solvents such as methanol, ethanol or 2-propanol
- ether solvents such as diethyl ether
- ester solvents such as ethyl acetate
- aromatic hydrocarbon solvents such as benzene or toluene
- acetone A ketone solvent such as hexane
- a hydrocarbon solvent such as hexane
- an aprotic solvent such as dimethylformamide or acetonitrile
- the WT1 antigen peptide When the WT1 antigen peptide has one or more asymmetric points, it can be produced by using a raw material (amino acid) having the asymmetric point according to a usual method. In order to increase the optical purity of the WT1 antigen peptide, optical resolution or the like may be performed at an appropriate stage of the production process.
- a WT1 antigen peptide or an intermediate thereof in an inert solvent for example, an alcohol solvent such as methanol, ethanol or 2-propanol, an ether solvent such as diethyl ether, an ester solvent such as ethyl acetate, Hydrocarbon solvents such as toluene, aprotic solvents such as acetonitrile, and mixed solvents thereof
- optically active acids for example, monocarboxylic acids such as mandelic acid, N-benzyloxyalanine, or lactic acid, tartaric acid, o-diisopropylidene tartaric acid or dicarboxylic acid such as malic acid, or sulfonic acid such as camphorsulfonic acid or bromocamphorsulfonic acid
- a diastereomeric method for example, an alcohol solvent such as methanol, ethanol or 2-propanol, an ether solvent such as diethyl ether, an ester solvent such as ethyl
- a salt is formed with an optically active amine (for example, an organic amine such as ⁇ -phenethylamine, quinine, quinidine, cinchonidine, cinchonine, strychnine).
- an optically active amine for example, an organic amine such as ⁇ -phenethylamine, quinine, quinidine, cinchonidine, cinchonine, strychnine.
- the optical division can also be performed.
- the temperature at which the salt is formed is selected from the range from room temperature to the boiling point of the solvent. In order to improve the optical purity, it is desirable to raise the temperature once to near the boiling point of the solvent. When the precipitated salt is collected by filtration, the yield can be improved by cooling as necessary.
- the amount of the optically active acid or amine used is in the range of about 0.5 to about 2.0 equivalents, preferably in the range of about 1 equivalent, relative to the substrate. Crystals in an inert solvent as necessary (for example, alcohol solvents such as methanol, ethanol, 2-propanol, ether solvents such as diethyl ether, ester solvents such as ethyl acetate, hydrocarbon solvents such as toluene, acetonitrile, etc. And a high-purity optically active salt can be obtained. Further, if necessary, the optically resolved salt can be treated with an acid or base by a conventional method to obtain a free form.
- “pharmaceutically acceptable salts” include acid addition salts and base addition salts.
- the acid addition salts include inorganic acid salts such as hydrochloride, hydrobromide, sulfate, hydroiodide, nitrate and phosphate, citrate, oxalate, acetate, formate , Propionate, benzoate, trifluoroacetate, maleate, tartrate, methanesulfonate, benzenesulfonate, paratoluenesulfonate, and other organic acid salts.
- inorganic acid salts such as hydrochloride, hydrobromide, sulfate, hydroiodide, nitrate and phosphate, citrate, oxalate, acetate, formate , Propionate, benzoate, trifluoroacetate, maleate, tartrate, methanesulfonate, benzenesulfonate, paratoluenesulfonate, and
- Inorganic base salts such as sodium salt, potassium salt, calcium salt, magnesium salt, ammonium salt, organic base salts such as triethylammonium salt, triethanolammonium salt, pyridinium salt, diisopropylammonium salt, and the like, and arginine, Examples thereof include amino acid salts such as basic or acidic amino acids such as aspartic acid and glutamic acid.
- RMFPNAPYL SEQ ID NO: 2
- CMTWNQMNL SEQ ID NO: 3
- CYTWNQMNL SEQ ID NO: 4
- ALLPAVPSL SEQ ID NO: 5
- SLGEQQYSV SEQ ID NO: 6
- RVPGVAPTL SEQ ID NO: 7
- VLDFAPPGA VLDFAPPGA
- C-CMTWNQMNL SEQ ID NO: 9
- the bond between C and C represents a disulfide bond
- C-CYTWNQMNL SEQ ID NO: 10
- the bond between C and C is A peptide comprising any amino acid sequence selected from: Any one of the amino acid sequences selected from SEQ ID NOs: 2 to 10, wherein one to several amino acids have a deleted, substituted, and / or added amino acid sequence and have a CTL-inducing activity; or Examples include acid addition salts and base addition salt
- the acid addition salts include inorganic acid salts such as hydrochloride, hydrobromide, sulfate, hydroiodide, nitrate and phosphate, citrate, oxalate, acetate, formate , Propionate, benzoate, trifluoroacetate, maleate, tartrate, methanesulfonate, benzenesulfonate, paratoluenesulfonate, and other organic acid salts.
- inorganic acid salts such as hydrochloride, hydrobromide, sulfate, hydroiodide, nitrate and phosphate, citrate, oxalate, acetate, formate , Propionate, benzoate, trifluoroacetate, maleate, tartrate, methanesulfonate, benzenesulfonate, paratoluenesulfonate, and other organic acid salts.
- Inorganic base salts such as sodium salt, potassium salt, calcium salt, magnesium salt, ammonium salt, organic base salts such as triethylammonium salt, triethanolammonium salt, pyridinium salt, diisopropylammonium salt, and the like, and arginine, Examples thereof include amino acid salts such as basic or acidic amino acids such as aspartic acid and glutamic acid.
- KRYFKLSHHLQMHSRKH SEQ ID NO: 11
- SGQARMFPNAPNAPLPSCLES SEQ ID NO: 12
- RSDELVRHNHMHQRNMTKL SEQ ID NO: 13
- PGCNKRYFKLLSHLQMHSRHKTG SEQ ID NO: 14
- CNKRYFKLSHHLQMHSRK SEQ ID NO: 15
- CNKRYFKLLSHLQMHSRKH SEQ ID NO: 16
- CNKRYFKLLSHLQMHSRKHTG SEQ ID NO: 17
- WAPVLDFAPPGASAYGSL SEQ ID NO: 18
- CWAPVLDFAPPGASAYGSL SEQ ID NO: 19
- WAPVLDFAPPGASAYGSLC SEQ ID NO: 20
- the acid addition salts include inorganic acid salts such as hydrochloride, hydrobromide, sulfate, hydroiodide, nitrate and phosphate, citrate, oxalate, acetate, formate , Propionate, benzoate, trifluoroacetate, maleate, tartrate, methanesulfonate, benzenesulfonate, paratoluenesulfonate, and other organic acid salts.
- inorganic acid salts such as hydrochloride, hydrobromide, sulfate, hydroiodide, nitrate and phosphate, citrate, oxalate, acetate, formate , Propionate, benzoate, trifluoroacetate, maleate, tartrate, methanesulfonate, benzenesulfonate, paratoluenesulfonate, and other organic acid salts.
- Inorganic base salts such as sodium salt, potassium salt, calcium salt, magnesium salt, ammonium salt, organic base salts such as triethylammonium salt, triethanolammonium salt, pyridinium salt, diisopropylammonium salt, and the like, and arginine, Examples thereof include amino acid salts such as basic or acidic amino acids such as aspartic acid and glutamic acid.
- Examples of pharmaceutically acceptable salts of the WT1 antigen peptide include, but are not limited to, RMFPNAPYL acetate, CMTWNQMNL acetate, CYTWNQMNL acetate, ALLPAVPSL Acetate, SLGEQQYSV acetate, RVPGVAPTL acetate, VLDFAPPGA acetate, C-CMTWNQMNL acetate, C-CYTWNQMNL acetate, KRYFKLSHHLQMHSRKH acetate, SGQARMFPNAPYLPSCLES acetate, RSDELVRHHNMHQRNMTKL acetate, PGCNKRYFKLLSHLQMHSRKHTG acetate, CNKRYFKLSHHLQMHSRK acetate, CNKRYFKLLSHLQMHSRKH acetate, CNKRYFKLLSHLQMHSRKHTG acetate, WAPVLDFAPPGASAYGSL acetate, CWAPVLDFAPPG
- the WT1 antigen peptide of the present invention or a solvate such as a pharmaceutically acceptable salt hydrate or ethanol solvate thereof is also included in the present invention.
- the present invention also includes all possible stereoisomers, such as all diastereomers, enantiomers, etc. of the WT1 antigen peptide, and crystal forms of all embodiments.
- the CTL-inducing activity of the WT1 antigen peptide can be measured by the HLA tetramer method (Int. J. Cancer: 100, 565-570 (2002)) or limiting dilution method (Nat. Med .: 4, 321-327 (1998)). This can be confirmed by measuring the number.
- HLA-A24-restricted CTL inducing activity use the HLA-A24 model mouse described in WO 02/47474 and Int. J. Cancer: 100, 565-570 (2002), etc. Can be examined.
- the helper T cell-inducing activity of the WT1 antigen peptide can be examined by a known method such as the method described in Cancer Immunol. Immunother. 51: 271 (2002).
- the term “immunomodulator” refers to a costimulatory signal by interacting with a molecule involved in transmission of a costimulatory signal on an antigen-presenting cell and / or T cell in T cell activation by the antigen-presenting cell. Anything that controls transmission and also controls the function of molecules involved in the establishment of immune tolerance (immunosuppression) directly or indirectly in the immune mechanism.
- An “immunomodulatory agent” can be, but is not limited to, an agent selected from antibodies, nucleic acids, proteins, peptides and small molecule compounds.
- the term “antibody” includes antibody fragments.
- antibody fragments include antibody heavy and light chain variable regions (VH and VL), F (ab ') 2, Fab', Fab, Fv, Fd, sdFv, scFV and the like.
- VH and VL antibody heavy and light chain variable regions
- F (ab ') 2 F (ab ') 2
- Fab' Fab
- Fv Fd
- sdFv scFV
- protein means any protein except antibodies.
- Immunomodulators include, for example, immune checkpoint inhibitors, costimulatory molecule agonist agents, immune activators, and small molecule inhibitors.
- Immune checkpoint inhibitor inhibits immunosuppressive action by cancer cells and antigen-presenting cells.
- Immune checkpoint inhibitors include, but are not limited to, drugs against molecules selected from the group consisting of: (1) CTLA-4 (ipilimumab, tremelimumab, etc.); (2) PD-1 (nivolumab, (3) LAG-3 (IMP-321, BMS-986016, etc.); (4) BTLA; (5) KIR (IPH2101) Pembrolizumab, AMP-224, AMP-514 (MEDIA0680), Pidilizumab (CT-011), etc.); (6) TIM-3; (7) PD-L1 (Durvalumab (MEDi 4736), MPDL3280A, BMS-936559, Averumab (MSB0010718C), etc.); (8) PD-L2; (9) B7-H3 (MGA) -271 etc.); (10) B7-H4; (1 (12) GAL9; (13) CD160; (1
- Costimulatory molecule agonist activates T cells by transmitting co-stimulatory molecules via T-cells and antigen-presenting cells via co-stimulatory molecules and attenuates the immunosuppressive effect of cancer cells and antigen-presenting cells
- Costimulatory molecule agonist agents include, but are not limited to, agents for molecules selected from the following groups: (1) 4-1BB (2) 4-1BB-L; (3) OX40 (4) OX40 (5) GITR; (6) CD28; (7) CD40; (8) CD40-L (9) ICOS; (10) ICOS-L; (11) LIGHT; and (12) CD27.
- Immune activators efficiently stimulate killer T cells in lymph nodes by directly or indirectly activating immune cells such as T cells and dendritic cells.
- Immune activators include, but are not limited to, Toll-like receptor (TLR) agonists, interferon gene stimulating factor (STING) agonists, cytokines, or drugs for heat shock protein (HSP).
- TLR Toll-like receptor
- STING interferon gene stimulating factor
- cytokines cytokines
- HSP heat shock protein
- the “Toll-like receptor (TLR) agonist” is not particularly limited.
- the “cytokine” is not particularly limited, but for example, IL-1 ⁇ , IL-1 ⁇ , IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL -9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, interferon (INF) - ⁇ , INF- ⁇ , Examples include INF- ⁇ , SCF, GM-CSF, G-CSF, M-CSF, erythropoietin, thrombopoietin, MIP (macrophage inflammatory protein) and MCP (monocyte chemoattractant protein).
- HSP Heat shock protein
- HSP90 inhibitors include, but are not limited to, Tanespimycin (17-AAG), Luminespib (AUY-922, NVP-AUY922), Alvespimycin (17-DMAG) hydrochloride, Ganetespib (STA-9090), BIIB021, Onalespib (AT13387), Geldanamycin, NVP-BEP800, SNX-2112 (PF-0428473), PF-4929113 (SNX-5422), KW-2478, XL888, VER155008, VER-50589, CH5138303, VER-49009 NMS-E973, PU-H71, HSP990 (NVP-HSP990), or KNK437.
- histone deacetylation inhibitor histone demethylation inhibitor, histone acetylase inhibitor, histone methylase inhibitor, DNA methyltransferase inhibition Agent, anthracycline antibiotic, platinum preparation, MAPK inhibitor, ⁇ -catenin inhibitor, STAT3 inhibitor, NF-kB inhibitor, JAK inhibitor, mTOR inhibitor, IDO inhibitor, COX-2 inhibitor CXCR4 inhibitor Agents, arginase inhibitors and the like.
- the “histone deacetylation inhibitor” is not particularly limited.
- vorinostat SAHA, MK0683
- entinostat MS-275
- panobinostat LH589
- TSA trichostatin A
- mosetinostat MCD0103
- BG45 BRD73955
- Berinostat PXD101
- Romidepsin FK228, Decipeptide
- 4SC-202 HPOB
- LMK-235 CAY10603
- Taskinimod TMP269
- Nexturastat A Rocilinostat (109Y-1256), RCP1296, R Scriptaid
- Tubastatin A Pracinostat (SB939)
- CUDC-101 M344, PCI 34051
- dasinostat LAQ824)
- tubastatin A hydrochloride abexinostat (PCI-24781)
- CUDC-907 AR-42
- sodium phenylbutyrate sodium phenylbutyrate
- the “histone demethylation inhibitor” is not particularly limited.
- GSK J4 HCl, OG-L002, JIB-04, IOX1, SP2509, ORY-1001 (RG-6016), GSK J1, ML324, GSK- LSD1, 2HCl and the like can be mentioned.
- the “histone acetylase inhibitor” is not particularly limited, and examples thereof include C646, MG149, Remodelin, and Anacardic Acid.
- the “histone methylase inhibitor” is not particularly limited, but for example, Pinometostat (EPZ5676), EPZ005678, GSK343, BIX01294, Tazemetostat (EPZ6438), 3-deazaneplanocin A (DZNeP) HCl, UNC1999C, MG-9, SG-102, Entacapone, EPZ015666, UNC0379, EI1, MI-2 (Menin-MLLMLInhibitor), MI-3 (Menin-MLL Inhibitor), PFI-2, GSK126, EPZ04777, BRD4770, GSK-2816126 and UNC0631.
- the “DNA methyltransferase inhibitor” is not particularly limited, and examples thereof include decitabine, azatidine, RG108, thioguanine, zebraline, SGI-110, CC-486, SGI-1027, romegatorib and procainamide hydrochloride. .
- anthracycline antibiotics inhibit DNA from being unwound by insertion between DNA strands.
- examples of the anthracycline antibiotics include, but are not limited to, doxorubicin, liposomal doxorubicin, daunorubicin, pirarubicin, epirubicin, idarubicin, aclarubicin, amrubicin, aloin or mitoxatron.
- platinum preparation is not particularly limited, and examples thereof include cisplatin, carboplatin, miboplatin, nedaplatin, satraplatin (JM-126), oxaliplatin (ELOXATIN), triplatin tetranitrate, and their DDS preparations.
- the “MAPK inhibitor” is not particularly limited, but for example, SB203580, dramapimod (BIRB796), SB202190 (FHPI), LY2228820, VX-702, SB239063, Pexmetinib (ARRY-614), PH-797804, VX-745 or And TAK-715.
- the “ ⁇ -catenin inhibitor” is not particularly limited.
- XAV-939, ICG-001, IWR-1-endo, Wnt-C59 (C59), LGK-974, KY02111, IWP-2, IWP- L6, WIKI4, FH535, etc. are mentioned.
- STAT3 inhibitor is not particularly limited.
- S3I-201 Static, niclosamide, nifloxazide, napabucasin (BBI-608), cryptotanshinone, HO-3867, WHI-P154, FLLL32, STA-21, Examples thereof include WP1066 and SH-4-54.
- NF-kB inhibitor is not particularly limited, and examples thereof include QNZ (EVP 4593), sodium 4-aminosalicylate, JSH-23, phenethyl caffeate, sodium salicylate, andrographolide or SC75741.
- Examples of the “JAK inhibitor” include, but are not limited to, for example, ruxolitinib (INCB018424), tofacitinib (CP-6690550) citrate, AZD1480, fedratinib (SAR302503, TG101348), AT9283, tyrophostin B42 (AG-490), thimerotinib (CYT387), Tofacitinib (CP-690550, Tasocitinib), WP1066, TG101209, Gandotinib (LY2784544), NVP-BSK8052HCl, Varisitinib (LY30009104, INCB02850, CEP-33715B, CEP-33715BH) , S-luxoritinib (INCB018424), ZM39923 HCl, de Runochinibu (VX-509), Cerdulatinib (PRT062070, PRT2070), Firugochinibu (GL
- the “mTOR inhibitor” is not particularly limited.
- sirolimus rapamycin
- deforolimus AP23573, MK-8669
- everolimus RAD-001
- temsirolimus CI-779, NSC683864
- zotarolimus ABT-578)
- biolimus A9 umilolimus
- AZD8055 KU-0063794
- Voxtalisib XL765, SAR245409
- Torkinib PP242
- the “IDO inhibitor” is not particularly limited, and examples thereof include NLG919, INCB024360 analog, indoximod (NLG-8189), and Epacadostat (INCB024360).
- COX2 inhibitor examples include, but are not limited to, valdecoxib, rofecoxib, carprofen, celecoxib, lumiracoxib, tolfenamic acid, nimesulide, niflumic acid, Asaraldehyde, lornoxicam, sodium meclofenamic acid, amphenac sodium hydrate, diclofenac Examples thereof include sodium, ketoprofen, ketorolac, naproxen sodium, indomethacin, ibuprofen, aspirin, mefenamic acid, bromfenac sodium, oxaprozin, zaltoprofen and nepafenac.
- CXCR4 inhibitor is not particularly limited, and examples thereof include WZ811, Plerixafor (AMD3100), Plerixafor 8HCl (AMD3100 8HCl), and the like.
- the WT1 antigen peptide of the present invention shows an excellent anticancer effect even when used in combination with an immunomodulator, but the effect is further enhanced by combining it with several drugs in combination (multi-drug combination). Or improve the patient's QOL.
- the WT1 antigen peptide of the present application includes “hormone therapy agent”, “immunotherapy agent”, “biological preparation”, “cell growth factor”, “cell growth factor inhibitor”, “cell growth factor receptor inhibitor”, It can be used in combination with one or more drugs selected from the group consisting of “radiotherapy agent”, “adjuvant” or “chemotherapeutic agent”.
- the WT1 antigen peptide of the present application can be used in combination with 1 to 5 drugs selected from the above group. More preferably, the WT1 antigen peptide of the present application can be used in combination with 1 to 3 drugs selected from the above group. Particularly preferably, the WT1 antigen peptide of the present application can be used in combination with one drug selected from the above group.
- a drug that can be used in combination with the WT1 antigen peptide and immunomodulator of the present application is abbreviated as a concomitant drug.
- the dose of the concomitant drug can be appropriately selected based on the clinically used dose.
- “Hormonal therapy agents” include corticosteroids (eg, steroidal anti-inflammatory drugs, estrogen preparations, progesterone preparations, androgen preparations, etc.), antiestrogens, estrogen regulators, estrogen synthesis inhibitors, antiandrogens, Examples include androgen regulators, androgen synthesis inhibitors, LH-RH agonist formulations, LH-RH antagonist formulations, aromatase inhibitors, steroid lactonase inhibitors, pill formulations, or agents that delay the metabolism of retinoids and retinoids.
- corticosteroids eg, steroidal anti-inflammatory drugs, estrogen preparations, progesterone preparations, androgen preparations, etc.
- antiestrogens eg., antiestrogens, estrogen regulators, estrogen synthesis inhibitors, antiandrogens
- Examples include androgen regulators, androgen synthesis inhibitors, LH-RH agonist formulations, LH-RH antagonist formulations, aromat
- hormoneal therapeutic agent examples include phosfestol, diethylstilbestrol, fluoxymesterol, chlorotrianicene, methyltestosterone, medroxyprogesterone acetate, megestrol acetate, chlormadinone acetate, cyproterone acetate, danazol, allyl Estrenol, gestrinone, mepartricin, raloxifene, oleroxifene, levormeloxifene, tamoxifen citrate, toremifene citrate, iodoxifene, pill formulation, mepithiostan, testrolactone, aminoglutethimide, goserelin acetate, buserelin, Leuprorelin, leuprolide, droloxifene, epithiostanol, ethynyl estradiol sulfonate, estramustine, fadrozole hydrochloride, Stro
- immunotherapy agent examples include picibanil, krestin, schizophyllan, lentinan, ubenimex, interferon (IL) - ⁇ , interferon (IL) - ⁇ , interferon (IL) - ⁇ , interleukin, macrophage colony stimulating factor, granule Sphere colony stimulating factor, erythropoietin, lymphotoxin, BCG vaccine, corynebacterium parbum, levamisole, polysaccharide K, procodazole, anti-CTLA4 antibody, anti-PD-1 antibody or TLR agonist (eg TLR7 agonist, TLR8 agonist) Medicine, TLR9 agonist) and the like.
- TLR agonist eg TLR7 agonist, TLR8 agonist
- the “biological product” is not particularly limited, and examples thereof include interleukin-2 (Aldesleukin), interferon- ⁇ , interferon- ⁇ , interferon- ⁇ , erythropoietin (EPO), granulocyte colony-stimulating factor (filtrate).
- interleukin-2 Aldesleukin
- interferon- ⁇ interferon- ⁇
- interferon- ⁇ interferon- ⁇
- EPO erythropoietin
- filtrate granulocyte colony-stimulating factor
- the cell growth factor in the “cell growth factor”, “cell growth factor inhibitor” and “cell growth factor receptor inhibitor” may be any substance that promotes cell growth, such as molecular weight. Is a peptide of 20,000 or less, and a factor that exerts an action at a low concentration by binding to a receptor.
- the “cell growth factor” is not particularly limited.
- epidermal growth factor EGF
- insulin-like growth factor IGF
- IGF insulin-like growth factor
- TGF Transforming Growth Factor
- TGF TGF-alpha, TGF-beta
- Nerve Growth Factor NGF
- BDNF Brain-derived Neurotrophic Factor
- VEGF Vascular Endothelial Growth Factor
- CSF Colony Stimulating Factor
- G-CSF Granulocyte-Colony Stimulating Factor
- G-CSF Granulocyte Macrophage Colony Stimulating factor
- GM-CSF Granulocyte Macrophage Colony Stimulating Factor
- platelet-derived growth factor PDGF
- EPO erythropoietin
- FGF Fibroblast Growth Factor
- the “cell growth factor inhibitor” is not particularly limited, but for example, epidermal growth factor inhibitor (EGF inhibitor), insulin-like growth factor inhibitor (IGF inhibitor), nerve growth factor inhibitor (NGF inhibitor) Brain-derived neurotrophic factor inhibitor (NGF inhibitor), vascular endothelial growth factor inhibitor (VEGF inhibitor), colony stimulating factor inhibitor (CSF inhibitor), platelet-derived growth factor inhibitor (PDGF inhibitor), Examples include erythropoietin inhibitor (EPO inhibitor), fibroblast growth factor inhibitor (FGF inhibitor), hepatocyte growth factor inhibitor (HGF inhibitor), heregulin inhibitor, or angiopoietin inhibitor.
- a cell growth factor inhibitor is synonymous with a growth factor inhibitor.
- the “cell growth factor receptor inhibitor” is not particularly limited, and for example, epidermal growth factor receptor inhibitor (EGFR inhibitor), insulin-like growth factor receptor inhibitor (IGFR inhibitor), nerve growth factor receptor Body inhibitor (NGFR inhibitor), brain-derived neurotrophic factor receptor inhibitor (NGFR inhibitor), vascular endothelial growth factor inhibitor (VEGF inhibitor), colony stimulating factor inhibitor (CSF inhibitor), platelet-derived Growth factor receptor inhibitor (PDGFR inhibitor), erythropoietin receptor inhibitor (EPOR inhibitor), fibroblast growth factor receptor inhibitor (FGFR inhibitor), hepatocyte growth factor receptor inhibitor (HGFR inhibitor) ), A heregulin receptor inhibitor, or an angiopoietin receptor inhibitor.
- the cell growth factor receptor inhibitor is synonymous with the growth factor receptor inhibitor.
- the “radiotherapy agent” is not particularly limited, and examples thereof include radioactive substances and radiosensitizers.
- Adjuvant is used to suppress side effects and vomiting caused by anticancer agents, and is not particularly limited.
- aprepitant ondansetron, lorazepam, dexamethasone, diphenhydramine, ranitidine, cimetidine, ranitidine, famotidine, cimetidine , Procrit, epoetin alfa, filgrastim, oprelbekin, leucovorin and granulocyte macrophage colony stimulating factor (GM-CSF).
- chemotherapeutic agent is not particularly limited, but for example, alkylating agents, platinum preparations, antimetabolites, topoisomerase inhibitors, DNA intercalators, antimitotic agents, anticancer antibiotics, plant-derived anticancer agents, Epigenetic drugs, immunomodulators, molecular targeted therapeutics, angiogenesis inhibitors and other chemotherapeutic agents are used. A typical example is described below.
- alkylating agent examples include, but are not limited to, nitrogen mustard, nitrogen mustard hydrochloride-N-oxide, chlorambucil, cyclophosphamide, ifosfamide, thiotepa, carbocon, improsulfan tosylate, busulfan, hydrochloric acid Nimustine, mitoblonitol, melphalan, dacarbazine, procarbazine, ranimustine, sodium estramstin phosphate, triethylenemelamine, carmustine, lomustine, streptozidine, piprobroman, etoglucid, altretamine, ambermuthine, dibrospium hydrochloride, fotemustine, predumustine , Uramustine, semustine, pumitepa, ribomustine, temozolomide, treosulphane, trophosfami , Dinostatin styramar, Adzeresin, Systemustin,
- platinum preparation is not particularly limited, and examples thereof include cisplatin, carboplatin, miboplatin, nedaplatin, satraplatin, oxaliplatin, triplatin tetranitrate, and their DDS preparations.
- the “antimetabolite” is not particularly limited, and examples thereof include a folate antimetabolite, a pyrimidine metabolism inhibitor, a purine metabolism inhibitor, a ribonucleotide reductase inhibitor, and a nucleotide analog.
- the “antimetabolite” is not particularly limited, but for example, mercaptopurine, 6-mercaptopurine riboside, thioinosine, methotrexate, pemetrexed, eocitabine, enocitabine, cytarabine, cytarabine okphosphatate, ancitabine hydrochloride, 5-FU drug (For example, fluorouracil, carzonal, bennan, luconal, lunabon, tegafur, tegafur uracil, tegafur gimeracil oteracil potassium (TS-1), UFT, doxyfluridine, carmofur, galocitabine, emitefur, capecitabine, etc.) , Leucoporin calcium, tabloid, butosine, folinate calcium, levofolinate calcium, cladribine, emiteful, fludara , Gemcitabine, hydroxycarpamide, pentostatin, pyritrexim, i
- topoisomerase inhibitor is not particularly limited, and for example, doxorubicin, daunorubicin, epirubicin, idarubicin, anthracenedione, mitoxantrone, mitomycin C, bleomycin, dactinomycin, pricatomycin, irinotecan, camptothecin, rubitecan, belotecan , Etoposide, teniposide, topotecan, amsacrine and their DDS preparations.
- the “DNA intercalator” is not particularly limited, and examples thereof include proflavine, doxorubicin (adriamycin), daunorubicin, dactinomycin, thalidomide, and their DDS preparations.
- the “anti-mitotic agent” is not particularly limited, but for example, paclitaxel, paclitaxel derivatives (eg, DHA paclitaxel, polyglutamate paclitaxel, nabupaclitaxel, paclitaxel micelle, 7 ⁇ -glucosyloxyacetyl paclitaxel, BMS-275183, etc.) , Docetaxel, vinol levin, vincristine, vinblastine, vindesine, vinzolidine, etoposide, teniposide, ixabepilone, larotaxel, oltaxel, tecetaxel, ispineci, colchicine, vinflunine and their DDS preparations.
- paclitaxel paclitaxel derivatives (eg, DHA paclitaxel, polyglutamate paclitaxel, nabupaclitaxel, paclitaxel micelle, 7 ⁇ -glucosyloxyacetyl paclitaxel
- anticancer antibiotic For example, actinomycin D, actinomycin C, mitomycin C, chromomycin A3, mitramycin A, bleomycin hydrochloride, bleomycin sulfate, pepromycin sulfate, daunorubicin hydrochloride, doxorubicin hydrochloride , Aclarubicin hydrochloride, pirarubicin hydrochloride, epirubicin hydrochloride, alumubicin hydrochloride, neocalcinostatin, dinostatin stimaramer, myramicin, sarcomomycin, carcinophylline, mitotane, zorubicin hydrochloride, mitoxantrone hydrochloride, idarubicin hydrochloride, liposomal doxo Virucine and their DDS formulations are exemplified.
- the “plant-derived anticancer agent” is not particularly limited.
- a DNA methylation inhibitor for example, a histone deacetylase (HDAC) inhibitor, a DNA methyltransferase (DNMT) inhibitor, a histone deacetylase activator , Histone demethylase inhibitors, methylated nucleotides, and the like.
- HDAC histone deacetylase
- DNMT DNA methyltransferase
- Histone demethylase inhibitors methylated nucleotides, and the like.
- the “epigenomic drug” is not particularly limited, and for example, vorinostat, belinostat, mosetinostat (MGCD0103), entinostat (SNDX-275), romidepsin, azacitidine, decitabine, GSK28779552 2Hl, SGC707, ORY-1001 (RG-6011) ), PFI-4, SirReal2, GSK2801, CPI-360, GSK503, AMI-1, CPI-169 and their DDS preparations.
- the “immunomodulator” is not particularly limited, and examples thereof include thalidomide, lenalidomide, pomalidomide, and their DDS preparations.
- the “molecular target therapeutic agent” may be a low molecular compound or an antibody.
- the “molecular target therapeutic agent” is not particularly limited, and examples thereof include a kinase inhibitor, a proteasome inhibitor, a monoclonal antibody, an mTOR inhibitor, a TNF inhibitor, and a T cell inhibitor.
- Kinase inhibitors are not particularly limited, but include, for example, tyrosine kinase inhibitors, serine / threonine kinase inhibitors, Raf kinase inhibitors, CDK (cyclin dependent kinase) inhibitors, and MEK (mitogen activation). Protein kinase) inhibitors and the like.
- the ⁇ kinase inhibitor '' is not particularly limited. Serichinibu, Arekuchinibu, RUXOLITINIB, tofacitinib Iburuchinibu, sorafenib, vemurafenib, Dabrafenib, Paruboshikuribu, Trametinib, REGORAFENIB, Sejibanibu, lestaurtinib, Bandechinibu, vatalanib, seliciclib, Chibanchinibu, canertinib, Perichinibu, Tesebachinibu, cediranib, motesanib, midostaurin, Forechinibu, Kabozanteinibu, Selumetinib, neratinib, boraseltib, Rakachinibu enzastaurin, Tandeyuchinibu, semaxanib, Alvocidib, ICR-62, AEE788, PD0325901,
- proteasome inhibitor is not particularly limited, and examples thereof include bortezomib, carfilzomib, and their DDS preparations.
- the “monoclonal antibody” is not particularly limited, and for example, anti-CD22 antibody, anti-CD20 antibody, anti-CD25 antibody, anti-CD30 antibody, anti-CD33 antibody, anti-CD5 antibody, anti-CD52 antibody, anti-epidermal growth factor receptor antibody ( EGFR antibody), anti-vascular endothelial growth factor antibody (VEGF antibody), anti-TNF- ⁇ antibody, anti-IL-1 receptor antibody, anti-IL-2 receptor antibody, anti-IL-5 receptor antibody, anti-IL-6 receptor antibody, Anti-HER2 antibody, anti-IgE antibody, anti-IgG antibody, anti-RS virus antibody, anti-CCR4 antibody, anti-CTLA-4 (cytotoxic T lymphocyte-associated antigen 4, CD152) antibody, anti-PD-1 antibody, anti-RANKL (receptor) activator of nuclear factor ⁇ B ligand) antibody, anti-c-Met An antibody, an anti-CXCR4 antibody, etc. are mentioned.
- the ⁇ monoclonal antibody '' is not particularly limited. , Ranibizumab, Sertolizumab, Ocrelizumab, Mogum Rizumab, Eculizumab, Pertuzumab, Alemtumab, MO Examples of DDS preparations It is done.
- mTOR inhibitor examples include, but are not limited to, for example, everolimus (RAD001), rapamycin (sirolimus), AZD8055, temsirolimus (CCI-779, NSC683864) KU-0063794, Voxtalisib (XL-765, SAR245409), MHY1485 (BEZ235), PI-103, Torkinib (PP242) Ridaforolimus (Deforolimus, MK-8669), INK-128 (MLN0128), Torin1, Omiparisi (GSK2126458, GSK458), OSI-027, PF-0469150, G -0980, RG7422), GSK1059615, Gedatric (PF-05212384, PKI-587) , WYE-132, PP121, WYE-354, AZD2014, Torin2, WYE-687, CH5132799, WAY-600, ETP-46464, GDC-
- TNF inhibitor is not particularly limited, and examples thereof include etanercept, lenalidomide (CC-5013), pomalidomide, thalidomide, necrostatin-1 or QNZ (EVP 4593).
- T cell inhibitor is not particularly limited, and examples thereof include abatacept.
- angiogenesis inhibitor examples include, but are not limited to, CM101, IFN- ⁇ , IL-12, platelet factor-4, suramin, cemaxanib, thrombospondin, VEGFR antagonist, angiogenesis-inhibiting steroid plus Heparin, cartilage-derived angiogenesis inhibitor, matrix metalloprotease inhibitor, batimastat, marimastat, angiostatin, endostatin, 2-methoxyestradiol, tecogalan, thrombospondin, ⁇ V ⁇ 3 inhibitor, linimide, ADH-1, E7820 And their DDS preparations.
- the “other chemotherapeutic agent” is not particularly limited, and examples thereof include fistenalide, sobuzoxane, obatoclax, efaproxiral, tipifarnib, and lonafarnib.
- the pharmaceutical composition of the present invention is not particularly limited other than the WT1 antigen peptide and / or immunomodulator as an active ingredient, and may contain, for example, a pharmaceutically acceptable carrier. Moreover, since the WT1 antigen peptide contained in the pharmaceutical composition of the present invention induces WT1-specific CTL and / or helper T cells, in order to enhance the induction efficiency, the pharmaceutical composition of the present invention is an appropriate adjuvant. Or may be administered with a suitable adjuvant.
- the “pharmaceutically acceptable carrier” of the present invention does not show toxicity to cells or mammals exposed to the carrier at the dose and concentration used.
- a pharmaceutically acceptable carrier is often an aqueous pH buffered solution.
- pharmaceutically acceptable carriers include: buffering agents (eg, phosphoric acid, citric acid, lactic acid, tartaric acid, trifluoroacetic acid and other organic acids); antioxidants (including ascorbic acid); low Molecular weight polypeptide (less than about 10 residues); protein (eg, serum albumin, gelatin or immunoglobulin); hydrophilic polymer (eg, polyvinylpyrrolidone); amino acid (eg, glycine, glutamine, asparagine, arginine, methionine or lysine); monosaccharide , Disaccharides and other carbohydrates (eg glucose, mannose or dextrin); chelating agents (eg EDTA); sugar alcohols (eg mannitol, trehalose or sorbitol):
- the pharmaceutically acceptable carrier of the present invention is, for example, a large slow-release protein, polypeptide, liposome, polysaccharide, polylactose, polyglycolic acid, polymerized amino acid, amino acid copolymer, and inactive virus particles. It can be a macromolecule that is metabolized.
- the WT1 antigen peptide can also be administered as a liposome preparation, a preparation having a particle diameter bound to beads having a diameter of several ⁇ m, a preparation having a lipid bound thereto, or the like.
- the pharmaceutical composition of the present invention contains an appropriate adjuvant or can be administered together with an adjuvant so that cellular immunity can be established efficiently.
- Adjuvants described in the literature (Clin. Microbiol. Rev., 7: 277-289, 1994) and the like can be applied, and specifically include bacterial cell-derived components, GM-CSF, interleukin- 2. Cytokines such as interleukin-7 or interleukin-12, plant-derived components, marine organism-derived components, mineral gels such as aluminum hydroxide, surfactants such as lysolecithin and pluronic polyols, polyanions, peptides, or oil emulsions A liquid (emulsion formulation) etc. can be mentioned.
- the cell-derived components include lipid A (lipid A), its derivative monophospholino lipid A (monophosphoryl lipid A), dead cells of bacteria (including Mycobacterium genus bacteria such as BCG bacteria), bacteria-derived Examples thereof include proteins, polynucleotides, Freund's Incomplete Adjuvant, Freund's Complete Adjuvant, cell wall skeletal components (for example, BCG-CWS and the like), trehalose dimycolate (TDM) and the like.
- lipid A lipid A
- monophospholino lipid A monophosphoryl lipid A
- dead cells of bacteria including Mycobacterium genus bacteria such as BCG bacteria
- bacteria-derived examples thereof include proteins, polynucleotides, Freund's Incomplete Adjuvant, Freund's Complete Adjuvant, cell wall skeletal components (for example, BCG-CWS and the like), trehalose dimycolate (TDM) and the like.
- Precipitating adjuvant represents an inorganic suspending agent to which a peptide is adsorbed.
- Specific examples of the precipitating adjuvant include sodium hydroxide, aluminum hydroxide (Alum), calcium phosphate, aluminum phosphate, alum, pepes, carboxyvinyl polymer, and the like.
- An oily adjuvant represents an oil emulsion in which an aqueous solution containing a peptide is wrapped with mineral oil to form micelles and emulsified.
- oil-based adjuvant examples include liquid paraffin, lanolin, Freund's adjuvant (Freund's complete adjuvant, Freund's incomplete adjuvant), montanide, W / O emulsion (see WO2006 / 078059) and the like, but are not limited thereto.
- the pharmaceutical composition of the present invention is not particularly limited, but sugar alcohols such as mannitol, trehalose, and lactose, or hydrochloric acid, sulfuric acid, nitric acid, acetic acid, citric acid, tartaric acid, lactic acid, maleic acid, phosphoric acid, sodium hydroxide, Potassium hydroxide, aqueous ammonia, sodium acetate hydrate, anhydrous sodium acetate, sodium citrate hydrate, sodium dihydrogen citrate, sodium tartrate, disodium phosphate, dipotassium phosphate, sodium dihydrogen phosphate, phosphorus PH regulators, diluents, buffers, suspending agents, wetting agents, solubilizers, dispersants, preservatives and / or commonly used in pharmaceutical formulations, selected from potassium dihydrogen acid and trisodium phosphate, etc. Coloring agents can also be included.
- sugar alcohols such as mannitol, trehalose, and lactose,
- the pharmaceutical composition of the present invention is used as a solid preparation for internal use for oral administration, a liquid for internal use, and an injection, external preparation, suppository, inhalant, nasal preparation, etc. for parenteral administration.
- solid preparation for internal use for oral administration include tablets, pills, capsules, powders, granules and the like.
- Capsules include hard capsules and soft capsules. Tablets include sublingual tablets, buccal adhesive tablets, buccal quick disintegrating tablets and the like.
- one or more active substances are left as they are, or excipients (lactose, mannitol, glucose, microcrystalline cellulose, starch, etc.), binders (hydroxypropylcellulose, polyvinylpyrrolidone, Mixed with magnesium metasilicate aluminate, etc., disintegrating agent (calcium cellulose glycolate, etc.), lubricant (magnesium stearate, etc.), stabilizer, solubilizing agent (glutamic acid, aspartic acid, etc.), etc. According to the formulation.
- excipients lactose, mannitol, glucose, microcrystalline cellulose, starch, etc.
- binders hydroxypropylcellulose, polyvinylpyrrolidone, Mixed with magnesium metasilicate aluminate, etc.
- disintegrating agent calcium cellulose glycolate, etc.
- lubricant magnesium stearate, etc.
- solubilizing agent glycolutamic acid, aspartic acid, etc.
- a coating agent sucrose, gelatin, hydroxypropylcellulose, hydroxypropylmethylcellulose phthalate, etc.
- capsules of absorbable substances such as gelatin.
- additives such as preservatives, antioxidants, colorants, sweeteners and the like that are commonly used can be added as necessary.
- Sublingual tablets are manufactured according to known methods. For example, one or more active substances, excipients (lactose, mannitol, glucose, microcrystalline cellulose, colloidal silica, starch, etc.), binders (hydroxypropylcellulose, polyvinylpyrrolidone, magnesium aluminate metasilicate, etc.), disintegration Agents (starch, L-hydroxypropylcellulose, carboxymethylcellulose, croscarmellose sodium, calcium calcium glycolate, etc.), lubricants (magnesium stearate, etc.), swelling agents (hydroxypropylcellulose, hydroxypropylmethylcellulose, carbopol, Carboxymethylcellulose, polyvinyl alcohol, xanthan gum, guar gum, etc.), swelling aids (glucose, fructose, mannitol, xylitol, erythritol) Maltose, trehalose, phosphate, citrate, silicate, glycine, glutamic acid,
- a coating agent sucrose, gelatin, hydroxypropylcellulose, hydroxypropylmethylcellulose phthalate, etc.
- additives such as preservatives, antioxidants, colorants, sweeteners and the like that are commonly used can be added as necessary.
- Oral adhesive tablets are produced according to known methods.
- one or more active substances excipients (lactose, mannitol, glucose, microcrystalline cellulose, colloidal silica, starch, etc.), binders (hydroxypropylcellulose, polyvinylpyrrolidone, magnesium aluminate metasilicate, etc.), disintegration Agents (starch, L-hydroxypropylcellulose, carboxymethylcellulose, croscarmellose sodium, calcium calcium glycolate, etc.), lubricants (magnesium stearate, etc.), adhesives (hydroxypropylcellulose, hydroxypropylmethylcellulose, carbopol, Carboxymethylcellulose, polyvinyl alcohol, xanthan gum, guar gum, etc.), adhesion aids (glucose, fructose, mannitol, xylitol, erythritol) Maltose, trehalose, phosphate, citrate, silicate, glycine, glutamic acid
- a coating agent sucrose, gelatin, hydroxypropylcellulose, hydroxypropylmethylcellulose phthalate, etc.
- additives such as preservatives, antioxidants, colorants, sweeteners and the like that are commonly used can be added as necessary.
- Oral quick disintegrating tablets are produced according to known methods.
- one or more active substances as they are, or a coating agent (ethylcellulose, hydroxypropylcellulose, hydroxypropylmethylcellulose, acrylic acid / methacrylic acid copolymer, etc.) suitable for raw powder or granulated raw powder, plasticizer (polyethylene)
- Active substances coated with glycol, triethyl citrate, etc. excipients (lactose, mannitol, glucose, microcrystalline cellulose, colloidal silica, starch, etc.), binders (hydroxypropylcellulose, polyvinylpyrrolidone, metasilicic acid) Magnesium aluminate, etc.), disintegrants (starch, L-hydroxypropylcellulose, carboxymethylcellulose, croscarmellose sodium, calcium calcium glycolate, etc.), lubricants (stearin Magnesium), dispersion aids (glucose, fructose, mannitol, xylit
- ком ⁇ онент is mixed and used in a conventional manner. If necessary, it may be coated with a coating agent (sucrose, gelatin, hydroxypropylcellulose, hydroxypropylmethylcellulose phthalate, etc.), or may be coated with two or more layers. Moreover, additives such as preservatives, antioxidants, colorants, sweeteners and the like that are commonly used can be added as necessary.
- a coating agent sucrose, gelatin, hydroxypropylcellulose, hydroxypropylmethylcellulose phthalate, etc.
- additives such as preservatives, antioxidants, colorants, sweeteners and the like that are commonly used can be added as necessary.
- Oral solutions for oral administration include pharmaceutically acceptable solutions, suspensions, emulsions, syrups, elixirs and the like.
- one or more active substances are dissolved, suspended or emulsified in a commonly used diluent (purified water, ethanol or a mixture thereof).
- this liquid agent may contain a wetting agent, a suspending agent, an emulsifier, a sweetening agent, a flavoring agent, a fragrance, a preservative, a buffering agent and the like.
- External dosage forms for parenteral administration include, for example, ointments, gels, creams, poultices, patches, liniments, sprays, inhalants, sprays, aerosols, eye drops, and Nasal drops and the like are included. These contain one or more active substances and are produced by known methods or commonly used formulations.
- the ointment is manufactured by a known or commonly used formulation. For example, it is prepared by grinding or melting one or more active substances in a base.
- the ointment base is selected from known or commonly used ones.
- higher fatty acids or higher fatty acid esters such as adipic acid, myristic acid, palmitic acid, stearic acid, oleic acid, adipic acid ester, myristic acid ester, palmitic acid ester, stearic acid ester, oleic acid ester, etc.
- waxes beeswax) , Whale wax, ceresin, etc.
- surfactants polyoxyethylene alkyl ether phosphates, etc.
- higher alcohols cetanol, stearyl alcohol, cetostearyl alcohol, etc.
- silicone oils dimethylpolysiloxane, etc.
- hydrocarbons Hydrophilic petrolatum, white petrolatum, purified lanolin, liquid paraffin, etc.
- Gel is manufactured by a known or commonly used formulation. For example, it is prepared by melting one or more active substances in a base.
- the gel base is selected from known or commonly used ones.
- lower alcohols ethanol, isopropyl alcohol, etc.
- gelling agents carboxymethyl cellulose, hydroxyethyl cellulose, hydroxypropyl cellulose, ethyl cellulose, etc.
- neutralizing agents triethanolamine, diisopropanolamine, etc.
- surfactants monostearin
- Acid polyethylene glycol, etc. gums, water, absorption promoters, anti-rash agents, or a mixture of two or more.
- a preservative, an antioxidant, a flavoring agent and the like may be included.
- Creams are manufactured by known or commonly used formulations. For example, it is prepared by melting or emulsifying one or more active substances in a base.
- the cream base is selected from known or commonly used ones. For example, higher fatty acid esters, lower alcohols, hydrocarbons, polyhydric alcohols (propylene glycol, 1,3-butylene glycol, etc.), higher alcohols (2-hexyldecanol, cetanol, etc.), emulsifiers (polyoxyethylene alkyl ethers, fatty acids) Esters etc.), water, absorption promoters, anti-rash agents, or a mixture of two or more of them may be used. Furthermore, a preservative, an antioxidant, a flavoring agent and the like may be included.
- the poultice is manufactured by a known or commonly used formulation. For example, it is produced by melting one or more active substances in a base material, and applying it as a kneaded product on a support.
- the poultice base is selected from known or commonly used ones. For example, thickeners (polyacrylic acid, polyvinylpyrrolidone, gum arabic, starch, gelatin, methylcellulose, etc.), wetting agents (urea, glycerin, propylene glycol, etc.), fillers (kaolin, zinc oxide, talc, calcium, magnesium, etc.) ), Water, a solubilizing agent, a tackifier, and a rash prevention agent, or a mixture of two or more thereof. Furthermore, a preservative, an antioxidant, a flavoring agent and the like may be included.
- the patch is manufactured by a known or commonly used formulation. For example, it is produced by melting one or more active substances in a base and spreading and coating them on a support.
- the base for patch is selected from known or commonly used ones. For example, those selected from a polymer base, fats and oils, higher fatty acids, tackifiers and anti-rash agents may be used alone or in admixture of two or more. Furthermore, a preservative, an antioxidant, a flavoring agent and the like may be included.
- the liniment is manufactured by a known or commonly used formulation.
- one or more active substances may be dissolved, suspended or used alone or in combination of two or more selected from water, alcohol (ethanol, polyethylene glycol, etc.), higher fatty acids, glycerin, soap, emulsifier, suspending agent, etc. Prepared by emulsification.
- a preservative, an antioxidant, a flavoring agent and the like may be included.
- Sprays, inhalants, and sprays include buffers that provide isotonicity with stabilizers such as sodium bisulfite in addition to commonly used diluents, such as sodium chloride, sodium citrate or citric acid.
- stabilizers such as sodium bisulfite
- diluents such as sodium chloride, sodium citrate or citric acid.
- An isotonic agent such as sodium bisulfite
- injections for parenteral administration are solutions, suspensions, emulsions and solid injections used by dissolving or suspending in a solvent at the time of use.
- An injection is used by dissolving, suspending or emulsifying one or more active substances in a solvent.
- the solvent for example, distilled water for injection, physiological saline, vegetable oil, propylene glycol, polyethylene glycol, alcohols such as ethanol, and combinations thereof are used.
- this injection may contain a stabilizer, a solubilizing agent (glutamic acid, aspartic acid, polysorbate 80 (registered trademark), etc.), a suspending agent, an emulsifier, a soothing agent, a buffering agent, a preservative, and the like.
- a sterile solid preparation for example, a lyophilized product, can be produced and used by dissolving it in sterilized or sterile distilled water for injection or other solvent before use.
- Inhalants for parenteral administration include aerosols, inhalable powders or inhalable solutions, which are used by dissolving or suspending them in water or other suitable media at the time of use. It may be. These inhalants are produced according to known methods. For example, in the case of inhalation solutions, preservatives (benzalkonium chloride, parabens, etc.), coloring agents, buffering agents (sodium phosphate, sodium acetate, etc.), isotonic agents (sodium chloride, concentrated glycerin, etc.) , And thickeners (such as cariboxyvinyl polymer) and absorption accelerators are appropriately selected as necessary.
- preservatives benzalkonium chloride, parabens, etc.
- coloring agents for example, in the case of inhalation solutions, preservatives (benzalkonium chloride, parabens, etc.), coloring agents, buffering agents (sodium phosphate, sodium acetate, etc.), isotonic agents (so
- lubricants stearic acid and its salts
- binders starch, dextrin, etc.
- excipients lactose, cellulose, etc.
- colorants e.g., kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, kaolin, etc., binders (starch, dextrin, etc.), excipients (lactose, cellulose, etc.), colorants, preservatives (benzalkonium chloride) , Parabens, etc.), absorption promoters and the like are appropriately selected as necessary.
- a nebulizer (atomizer, nebulizer) is usually used when administering a solution for inhalation, and an inhalation administration device for powder drug is usually used when administering a powder for inhalation.
- sprays may contain a buffer that provides isotonicity with a stabilizer such as sodium bisulfite, for example, an isotonic agent such as sodium chloride, sodium citrate or citric acid. You may contain.
- a stabilizer such as sodium bisulfite
- an isotonic agent such as sodium chloride, sodium citrate or citric acid. You may contain.
- the production method of the spray is described in detail in, for example, US Pat. No. 2,868,691 and US Pat. No. 3,095,355.
- compositions for parenteral administration include suppositories for rectal administration and pessaries for intravaginal administration, which contain one or more active substances and are prescribed by conventional methods.
- the pharmaceutical composition comprising a WT1 antigen peptide is one or more pharmaceutically acceptable selected from the group consisting of trehalose, mannitol, methionine, citric acid, lactic acid, tartaric acid, acetic acid, trifluoroacetic acid and a pH adjusting agent.
- Carrier one or more pharmaceutically acceptable selected from the group consisting of trehalose, mannitol, methionine, citric acid, lactic acid, tartaric acid, acetic acid, trifluoroacetic acid and a pH adjusting agent.
- the pharmaceutical composition comprising an immunomodulator is one or more selected from the group consisting of mannitol, sodium citrate hydrate, sodium chloride, diethylenetriaminepentaacetic acid, polysorbate 80 TM and a pH adjuster. Contains a pharmaceutically acceptable carrier.
- the administration method of the WT1 antigen peptide and the immunomodulator can be appropriately selected according to conditions such as the type of disease, the state of the subject, and the target site.
- Such administration methods include, for example, intravenous, intramuscular, intradermal, intraperitoneal, subcutaneous, or spinal administration, or other parenteral routes of administration, such as by injection or infusion.
- parenteral administration means a mode of administration by normal injection other than intestinal and topical administration, and is intravenous, intramuscular, intraarterial, intrathecal peritoneal, intracapsular, intraorbital, heart Includes, but is not limited to, intradermal, intraperitoneal, transtracheal, subcutaneous, epidermal, intraarticular, subcapsular, intrathecal, intraspinal, epidural and intrasternal injection and infusion.
- the WT1 antigen peptide may be administered by lymphocyte therapy or DC (dendritic cell) therapy.
- the immunomodulating agent can be administered by a transdermal administration route or a transmucosal administration route such as intranasal, intraoral, intravaginal, intrarectal or sublingual.
- the WT1 antigen peptide of the present invention can prevent or treat cancer more effectively when combined with non-drug therapy in addition to an immunomodulator.
- non-drug therapy include surgery, radiation therapy, gene therapy, hyperthermia, cryotherapy, laser ablation, etc., and two or more of these can be combined.
- the pharmaceutical composition of the present invention or the pharmaceutical composition of the present invention and a concomitant drug are used before or after non-pharmaceutical therapy such as surgery, or before or after treatment combining two or three non-drug therapies. By doing so, effects such as inhibition of resistance development, prolongation of disease-free (Disease-Free Survival), suppression of cancer metastasis or recurrence, and life extension can be obtained.
- the dose of the WT1 antigen peptide and the immunomodulator, the dosage form of the pharmaceutical composition, the number of administrations, and the like can be appropriately selected according to conditions such as the type of disease, the condition of the subject, and the target site.
- the dose per dose of the WT1 antigen peptide is usually 0.0001 mg to 1000 mg, preferably 0.001 mg to 1000 mg, more preferably 0.1 mg to 10 mg.
- the dose of the immunomodulator per kg body weight is usually 0.0001 mg to 1000 mg, preferably 0.001 mg to 1000 mg, more preferably 0.1 mg to 10 mg.
- an “effective amount” is an amount of a WT1 antigen peptide or immunomodulator that completely or partially inhibits the progression of cancer or at least partially alleviates one or more symptoms of cancer. Or a combination of two or more WT1 antigen peptides or immunomodulators.
- An effective amount can be a therapeutically or prophylactically effective amount. Effective amounts are determined by the patient's age and sex, the condition being treated, the severity of the condition, and the outcome sought. For a given patient, the effective amount can be determined by methods known to those skilled in the art.
- the present invention can be used for the treatment or prevention (including prevention of recurrence) of a cancer in which the WT1 gene is expressed or a cancer accompanied by an increase in the expression level of the WT1 gene. Therefore, as an example of cancer in the present invention, in one embodiment, hematological cancer such as leukemia, myelodysplastic syndrome, multiple myeloma or malignant lymphoma, or stomach cancer, colon cancer, lung cancer, breast cancer, germ cell cancer, liver cancer , Solid cancers such as skin cancer, bladder cancer, prostate cancer, uterine cancer, cervical cancer, ovarian cancer, glioblastoma multiforme, malignant melanoma, non-small cell lung cancer, renal cell cancer or brain tumor.
- hematological cancer such as leukemia, myelodysplastic syndrome, multiple myeloma or malignant lymphoma, or stomach cancer, colon cancer, lung cancer, breast cancer, germ cell cancer, liver cancer .
- Solid cancers such as skin cancer, bladder cancer
- the present invention is also expected to increase the T cell activation threshold and activate the tumor response in the host by using an immunomodulator together. Therefore, as examples of cancer in the present invention, as other embodiments, bone cancer, pancreatic cancer, head and neck cancer, malignant melanoma of the skin or orbit, rectal cancer, anal cancer, testicular cancer, carcinoma of the fallopian tube, endometrium Carcinoma, cervical carcinoma, vaginal carcinoma, vulvar carcinoma, Hodgkin disease, non-Hodgkin lymphoma, esophageal cancer, small intestine cancer, endocrine cancer, thyroid cancer, parathyroid cancer, adrenal cancer, soft tissue sarcoma, urethral cancer, penile cancer, Acute myeloid leukemia, chronic myelogenous leukemia, acute lymphoblastic leukemia, chronic or acute leukemia including chronic lymphocytic leukemia, childhood solid cancer, lymphocytic lymphoma, renal or ureteral cancer, renal pelvic carcinoma, central
- mammal includes human and non-human animals.
- Non-human animals include, but are not limited to, mammals such as non-human primates, sheep, dogs, cats, horses, cows.
- mammals particularly human patients in need of enhanced immune response, are preferred.
- the present invention is particularly suitable for the treatment of human patients with diseases that can be expected to be treated by promoting a T cell mediated immune response.
- the WT1 antigen peptide and the immunomodulator may be contained in separate preparations or in a single preparation. That is, the pharmaceutical composition of the present invention includes a pharmaceutical composition containing a WT1 antigen peptide used in combination with an immunomodulator, a pharmaceutical composition containing an immunomodulator used in combination with a WT1 antigen peptide, or a WT1 antigen peptide and an immunomodulator. And a pharmaceutical composition (that is, a combination drug).
- the pharmaceutical composition of the present invention can also be provided as a kit.
- the kit includes a pharmaceutical composition containing a WT1 antigen peptide and a pharmaceutical composition containing an immunomodulator.
- the pharmaceutical composition and kit of the present invention can be provided together with package inserts, packaging containers, instruction manuals, etc. describing the usage, dosage and the like in the combined use of the WT1 antigen peptide and an immunomodulator.
- the pharmaceutical compositions and kits of the present invention can be provided as cancer therapeutics.
- the WT1 antigen peptide and the immunomodulator may be administered simultaneously or separately. Further, the WT1 antigen peptide and the immunomodulator may be administered simultaneously or separately with a further concomitant drug.
- “administered simultaneously” means that they are administered on the same administration schedule, and the active ingredient may be contained in a single preparation or in another preparation. When an active ingredient is contained in another formulation, all the formulations may be administered once and each formulation may be administered sequentially.
- “Separate administration” means administration on different administration schedules, and after administration of one, the other is administered at a certain interval, either of which may be administered first, and the interval Is also optional. The frequency of administration of each active ingredient may be the same or different. For example, one may be administered once a day and the other may be administered twice or more a day.
- the compounding ratio can be appropriately selected depending on the administration subject, administration route, target disease, symptom, or a combination thereof.
- the administration subject is a human
- the immunomodulator or the concomitant drug can be used in an amount of 0.01 to 100 parts by weight with respect to 1 part by weight of the WT1 antigen peptide.
- the pharmaceutical composition of the present invention can be used in further combination with drugs such as antiemetics, sleep inducers, anticonvulsants, etc. for the purpose of suppressing side effects.
- drugs such as antiemetics, sleep inducers, anticonvulsants, etc. for the purpose of suppressing side effects.
- WT1 antigen peptide is a drug that increases tumor-reactive CTL in the tumor
- the combination of WT1 antigen peptide and immunomodulator can reduce the dose of immunomodulator, that is, reduce adverse events There is a possibility.
- the combined use of the WT1 antigen peptide and the immunomodulator may provide a patient with a therapeutic method that has both higher effects and higher safety.
- Example 1 Combined effect of immune checkpoint inhibitor on tumor antigen peptide-specific cytotoxic T cell induction from human peripheral blood mononuclear cells
- HLA-A * 02 01-positive adult peripheral blood mononuclear cells (PBMC) (CTL) were asleep, suspended in culture and 1.5 ⁇ in a U-bottom 96-well plate. The cells were seeded at 10 5 cells / well. Using a culture medium containing 5% human serum (Lonza) and 1% MEM non-essential amino acid solution (100 ⁇ ) (Life Technologies) in AIM V medium (Life Technologies) at 37 ° C., 5% CO The culture was performed under the conditions of 2 .
- PBMC peripheral blood mononuclear cells
- Mouse IgG1, ⁇ (BioLegend) was used as an isotype antibody of anti-human PD-1 antibody
- Mouse IgG2b, ⁇ (BioLegend) was used as an isotype antibody of anti-human PD-L1 antibody.
- anti-human PD-1 antibody, Mouse IgG2b, and ⁇ were added at 10 ⁇ g / mL, respectively.
- anti-human PD-L1 antibody and Mouse IgG1, ⁇ were added at 10 ⁇ g / mL, respectively.
- Mouse IgG1, ⁇ and Mouse IgG2b, ⁇ were added at 10 ⁇ g / mL, respectively.
- WT1 killer peptide (compound of formula (3)) and WT1 helper peptide (SEQ ID NO: 18) were added to the cultured cells at 20 ⁇ g / mL, respectively.
- human IL-2 (Yoshio Shionogi) was added to 50 U / mL. Five and nine days after the start of the culture, half of the culture solution was replaced with a culture solution containing 100 U / mL human IL-2.
- killer peptide A-specific CTL and killer peptide B-specific CTL were not detected in 24 samples.
- group A to which anti-human PD-1 antibody was added killer peptide B-specific CTL was detected in 1 of 24 samples (FIG. 1).
- group B to which anti-human PD-L1 antibody was added killer peptide A-specific CTL was detected in 1 sample (FIG. 2) and killer peptide B-specific CTL was detected in 2 samples (FIG. 3). The results are shown in Fig. 1-3.
- the anti-human PD-1 antibody and anti-human PD-1 antibody which are immune checkpoint inhibitors, can enhance the efficiency of inducing CTL in a PBMC in vitro WT1 antigen peptide-stimulated culture system. Indicated.
- Example 2 Effect of immune checkpoint inhibitor on immune response to peptide of WT1 antigen peptide-specific CTL
- HLA-A * 02 01-positive adult peripheral blood mononuclear cells (CTL) were asleep, suspended in culture medium, and seeded in U-bottom 96-well plates.
- CTL peripheral blood mononuclear cells
- 20 ⁇ g / mL WT1 was added to a culture medium containing 5% human serum (Lonza) in AIM V medium (Life Technologies) and 1% MEM non-essential amino acid solution (100 ⁇ ) (Life Technologies).
- the killer peptide B specific CTL was analyzed using Miltenyi Biotec).
- Cells in wells in which killer peptide B (SEQ ID NO: 8) -specific CTL was detected were mixed to obtain a WT1 antigen peptide-specific CTL cell line.
- the WT1 antigen peptide-specific CTL cell line was cryopreserved using a cell cryopreservation solution CELLBANKER (Nippon Zenyaku Kogyo).
- the cryopreserved WT1 antigen peptide-specific CTL cell line was put to sleep and cultured overnight in a culture solution supplemented with 100 U / mL human IL-2 (Yoshio Shionogi).
- the cells were collected, washed with the culture medium, and then added with anti-human PD-1 antibody (EH12.2H7) (Group A), and added with anti-human PD-L1 antibody (29E.243) (Group B) ), And a control group (group C) to which no anti-human PD-1 antibody and anti-human PD-L1 antibody were added, were cultured for 2 hours.
- anti-human PD-1 antibody and Mouse IgG2b, ⁇ were added at 10 ⁇ g / mL, respectively.
- anti-human PD-L1 antibody and Mouse IgG1, ⁇ were added at 10 ⁇ g / mL, respectively.
- mouse IgG1, ⁇ and Mouse IgG2b, ⁇ were added at 10 ⁇ g / mL, respectively.
- the same antibody as in Example 1 was used.
- the specific response of the cells to the peptide was measured using IFN- ⁇ ELISPOT Set (BD).
- Cells treated as described above were added to ELISPOT plates, and cultured for 18 hours, divided into groups to which killer peptide B (SEQ ID NO: 8) was added at 40 ⁇ g / mL and not. There were 2 samples in each group. Thereafter, the plate was processed according to the manufacturer's protocol, and spots were developed with ACE Substrate Set (BD). The number of spots was measured with an ELISPOT analyzer (C.T.L). For each of the A group, the B group, and the C group, the average value of the number of spots of the sample to which the peptide was not added was subtracted from the average value of the number of spots of the sample to which the peptide was added.
- killer peptide B SEQ ID NO: 8
- Example 3 Expression change of immune checkpoint molecule in mouse splenocytes administered cocktail cocktail of WT1 killer peptide and WT1 helper peptide HLA-A * 02 : 01 transgenic mice (C57BL / 6CrHLA-A2.1DR1) used in this study were A mouse that lacks mouse MHC and expresses a chimeric HLA of human MHC HLA-A02: 01 and mouse MHC H-2D b, and HLA-DRB1 * 01: 01 (Eur J Immunol .2004; 34: 3060-9).
- CTL By using this mouse, it is possible to induce CTL with a peptide capable of binding to human HLA-A * 02 : 01. It is also possible to induce helper T cells with a peptide capable of binding to human HLA-DRB1 * 01 : 01 and evaluate the CTL induction enhancing effect.
- a composition comprising a WT1 killer peptide (compound of formula (3)) and a WT1 helper peptide (SEQ ID NO: 18) was mixed with an equal amount of incomplete Freund's adjuvant Montanide (ISA51VG) to make an emulsion.
- the obtained cocktail vaccine (hereinafter referred to as vaccine) was administered twice into the ridge skin of HLA-A * 02 : 01 transgenic mice at weekly intervals (per mouse immunization). 1 mg WT1 killer peptide and 0.75 mg WT1 helper peptide).
- mice in the vaccine administration group and the non-administration group were euthanized with CO 2 gas, and then the spleen was removed and spleen cells were prepared.
- the splenocytes were treated with FITC-labeled anti-CD8 antibody (BD Pharmingen), PE-labeled anti-CD4 antibody (BD Pharmingen), HLA tetramer reagent for PE-labeled WT1 killer peptide (SEQ ID NO: 8), MBL, and APC.
- APC-labeled isotype control (BD Pharmingen, clone J43), APC-labeled isotype control (BD Pharmingen, Hamster IgG2, ⁇ ) antibody, APC-labeled anti-PD-L1 antibody (manufactured by BioLegends, clone 10F.9G2), and After staining with an APC-labeled isotype control (eBioscience, Rat IgG2b, ⁇ ) antibody, analysis was performed using a flow cytometer MACSQuant Analyzer (Miltenyi Biotec).
- the one-dot short chain line is a CD8 positive tetramer positive fraction derived from a spleen cell administered with a vaccine
- a broken line is a CD8 positive tetramer negative fraction derived from a spleen cell administered with a vaccine
- a solid line is derived from a spleen non-vaccinated individual
- the expression of PD-1 (FIG. 5) and PD-L1 (FIG. 8) in the CD8 positive tetramer negative fraction is shown.
- the dotted line indicates the staining result using the isotype control.
- the broken line indicates CD4 positive T cells (FIGS.
- CD4 negative CD8 negative cells derived from the spleen of the vaccine recipient, and the solid line indicates the spleen of the non-vaccinated individual.
- Expression of PD-1 (FIGS. 6 and 7) and PD-L1 (FIGS. 9 and 10) in CD4 positive T cells (FIGS. 6 and 9) derived from CD4 negative CD8 negative cells (FIGS. 7 and 10) Indicates.
- the dotted line indicates the staining result using the isotype control.
- high expression induction of PD-1 was observed in CD8 positive T cells, particularly CD8 positive WT1 tetramer positive T cells by vaccine administration (FIGS. 5-7).
- PD-L1 was expressed in all cells regardless of whether or not vaccine was administered, but CD4 positive T cells showed increased expression by vaccine administration (FIGS. 8-10). From these results, it was found that PD-1 or PD-L1 expression was induced in WT1-specific CD8-positive T cells or CD4-positive T cells by vaccine administration.
- Example 4 Action of immune checkpoint inhibitor on immune response of WT1 antigen peptide-specific T cells to tumor cells
- a composition containing a WT1 killer peptide and a WT1 helper peptide is mixed with an equal amount of montanide and emulsified. Thereafter, it was administered into the ridge skin of HLA-A * 02 : 01 transgenic mice (1 mg of WT1 killer peptide and 0.75 mg of WT1 helper peptide were administered per immunization of one mouse).
- the mice were euthanized with CO 2 gas, and then the spleen was removed, and a spleen cell suspension was prepared using Complete T-cell medeium (hereinafter CTM).
- CTM Complete T-cell medeium
- the WT1 killer peptide (SEQ ID NO: 2) was dissolved in DMSO to 40 mg / mL, and further diluted to 500 ⁇ g / mL with CTM. This peptide solution was added to a part of the prepared splenocytes, and left at 37 ° C., 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour. After washing excess peptide with CTM, peptide-pulsed splenocytes and non-peptide-pulsed splenocytes were mixed at a ratio of 1:10.
- an anti-PD-1 antibody Bio X cell, clone RMP1-14
- an isotype control antibody Bio X cell, Rat IgGa, ⁇
- the cultured spleen cells were washed with RPMI1640 medium containing 10% FBS to obtain responder cells.
- WT1 killer peptide SEQ ID NO: 2 was dissolved in DMSO to 40 mg / mL, and further diluted to 100 ⁇ g / mL in RPMI 1640 medium containing 10% FBS.
- the mouse lymphoma-derived cell line EL4 S3-Rob (Eur J Immunol. 1990; 20: 171-7) was replaced with the ⁇ 3 domain of the HHD (human HLA-A * 02 : 01 molecule) and the ⁇ 3 domain of the mouse MHC class I molecule H-2Db.
- a cell line stably expressing the substituted chimeric HLA molecule (J Exp Med. 1997; 185: 2043-51) (hereinafter EL4HHD) was suspended in the above-mentioned peptide-containing RPMI1640 medium or peptide-free RPMI1640 medium, It was left to stand at 37 ° C. and 5% CO 2 for 1 hour.
- Combination of an antibody against PD-1 or PD-L1 and a WT1 antigen peptide leads to efficient induction of WT1-specific T cells, and increased expression of immune checkpoint molecules in T cells induced by vaccine administration It was found that the activity of WT1 antigen peptide-specific T cells induced by the WT1 antigen peptide is increased by treatment with an antibody against PD-1 or PD-L1. From this, it is expected that the combination therapy of the WT1 antigen peptide and the immune checkpoint inhibitor synergistically improves the therapeutic effect of each single agent, and can contribute to the improvement of the therapeutic effect of cancer and the improvement of QOL.
- Example 5 Action of various concomitant agents on immune response to WT1 antigen peptide-specific T cells and tumor cells
- WT1 killer peptide compound of formula (3)
- WT1 helper peptide SEQ ID NO: 18
- the prepared WT1 killer peptide solution was added to a part of the splenocytes and allowed to stand at 37 ° C. and 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour. After washing excess peptide with CTM, peptide-pulsed splenocytes and non-peptide-pulsed cells were mixed at a ratio of 1:10, and seeded at a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well.
- an X-ray was obtained from a cell line obtained by stably expressing HHD and the WT1 killer peptide (SEQ ID NO: 2) in the mouse Lewis lung cancer-derived cell line LLC (hereinafter also referred to as LLC-HHD-WT1 tumor cell).
- LLC-HHD-WT1 tumor cell LLC-HHD-WT1 tumor cell.
- the LLC-HHD-WT1 tumor cells were seeded and mixed at 5 ⁇ 10 4 cells / well or 3.5 ⁇ 10 4 cells / well in a U-bottom 96-well plate seeded with splenocytes, and mixed with CTM (medium), Alternatively, an isotype control antibody, an immune checkpoint inhibitor, a costimulatory molecule agonist antibody, a TLR agonist, or a ⁇ -catenin inhibitor was added and cultured at 37 ° C. under 5% CO 2 for about 3 days.
- anti-PD-1 antibody BioLegend, clone 29F.1A12
- anti-TIM-3 antibody BioLegend, clone RMT3-23
- anti-CD160 antibody eBioscience, clone eBioCNX46-3
- Anti-LAG-3 antibody BioLegend, clone C9B7W
- anti-BTLA antibody BioLegend, clone 6A6
- anti-PD-L1 antibody eBiosciecne, clone MIH5
- anti-VISTA antibody BioLegend, clone MH5A
- anti-PVR antibody Hycult Biotech, clone 3F1
- Anti-4-1BB antibody (Bio X Cell, clone LOB12.3), anti-OX-40 antibody (Bio X Cell, clone OX-86), anti-GITR antibody (BioLegend, clone DTA) as costimulatory molecule agonist antibodies -1), anti-CD-40 antibody (BioLegend, clone 1C10) was used at a final concentration of 30 ⁇ g / mL.
- Rat IgG2a ⁇ (BD Pharmingen) as an isotype control antibody corresponding to anti-PD-1 antibody, anti-TIM-3 antibody, anti-CD160 antibody, and anti-CD-40 antibody, and anti-PD-L1 antibody and anti-PVR antibody
- Rat IgG2a (Bio X Cell) as an isotype control antibody
- Armenian Hamster IgG (eBioscience) as an antitype control antibody corresponding to anti-BTLA antibody, anti-HVEM antibody, and anti-VISTA antibody
- anti-LAG-3 antibody anti-4 Rat IgG1 ⁇ (eBiosciecne) was used as an isotype control antibody corresponding to the ⁇ 1BB antibody and anti-OX-40 antibody
- Rat IgG2b (Bio X Cell) was used as an isotype control antibody corresponding to the anti-GITR antibody.
- TLR3 agonist PolyI C HMW (GE Healthcare, final concentration 30 ⁇ g / mL) and PolyI: C LMW (GeneDesign, final concentration 30 ⁇ g / mL), TLR7 agonist Imiquimod (final concentration 10 ⁇ g) / ML), R848 as TLR7 / 8 agonist (final concentration 1 ⁇ mol / L), and CpG-ODN-D19 (final concentration 1 ⁇ mol / L) as TLR9 agonist, CpG-ODN-1826 (final concentration 1 ⁇ mol / L) ), And CpG-ODN-C583 (final concentration 1 ⁇ mol / L).
- XAV939 was used at a final concentration of 5 ⁇ mol / L.
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- Fig. 12-15 The results are shown in Fig. 12-15.
- the immune checkpoint inhibitor is added and cultured (FIGS. 12A to 12I) or when the costimulatory molecule agonist antibody is added and cultured (FIGS. 13A to 13D), the isotype control antibody for each is added and cultured. In comparison, high IFN- ⁇ production was observed. Also, when TLR agonists (FIGS. 14A to 14D) or ⁇ -catenin inhibitors (FIG. 15) were added and cultured, compared to the case where CTM medium was added and cultured, IFN- ⁇ production was higher. Accepted the amount.
- Example 6 Effects of various concomitant agents on the immune activity of WT1 antigen peptide-specific T cells derived from tumor-bearing organisms HLA-A2402 / Kb (human HLA-A * 24: 02 ⁇ 3 domain of mouse MHC class in mouse lymphoma cell line EL4 A cell line stably expressing a WT1 killer peptide (SEQ ID NO: 4) and an EL4-A24 / Kb-WT1 tumor cell (also described as EL4-A24 / Kb-WT1 tumor cells) ) was suspended in Hanks balanced salt solution and transplanted into the ventral skin of HLA-A * 24 : 02 transgenic mice (3 ⁇ 10 5 or 5 ⁇ 10 5 per mouse).
- a composition containing a WT1 killer peptide (compound of formula (3)) and a WT1 helper peptide (SEQ ID NO: 18) was mixed with an equal amount of montanide and emulsified.
- HLA-A * 24 : 02 transgenic mice were administered in two portions in the forelimb root bark and in the hindlimb root bark (1 mg of WT1 killer peptide and 0.75 mg per mouse dose) Of WT1 helper peptide).
- 15 days after tumor implantation the mice were euthanized with CO 2 gas, and then the spleen was removed and a spleen cell suspension was prepared using CTM.
- the spleen cells were seeded in a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well, and CTM, isotype control antibody, immune checkpoint inhibitor, or costimulatory molecule agonist antibody was added at 37 ° C. Cultured for about 3 days under 5% CO 2 .
- an immune checkpoint inhibitor anti-PD-1 antibody (BioLegend, clone 29F.1A12), anti-CTLA-4 antibody (BioLegend, clone UC10-4B9), anti-TIGIT antibody (Bio X Cell, clone 1G9) Used at a final concentration of 30 ⁇ g / mL.
- an anti-ICOS antibody (BioLegend, clone C398.4A) was used at a final concentration of 30 ⁇ g / mL.
- Rat IgG2a ⁇ (BD Pharmingen) as an isotype control antibody corresponding to anti-PD-1 antibody
- Armenian Hamster IgG eBioscience
- Mouse IgG1 (Bio X Cell) was used as a corresponding isotype control antibody.
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- Example 7 Effects of various concomitant agents on immune response to WT1 antigen peptide-specific T cells and tumor cells Montanide in an equal amount of a composition containing WT1 killer peptide (SEQ ID NO: 2) and WT1 helper peptide (SEQ ID NO: 11) And then emulsified and administered into the ridge skin of HLA-A * 02 : 01 transgenic mice (0.3 mg of WT1 killer peptide and 0.3 mg of WT1 helper peptide were administered to each mouse) ).
- the mice were euthanized with CO 2 gas, and then the spleen was removed and a spleen cell suspension was prepared using CTM.
- WT1 killer peptide (SEQ ID NO: 2) was dissolved in DMSO at 40 mg / mL.
- the prepared WT1 killer peptide solution was added to a part of the splenocytes and allowed to stand at 37 ° C. and 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour.
- peptide-pulsed splenocytes and non-peptide-pulsed cells were mixed at a ratio of 1:10, and seeded at a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well.
- LLC-HHD-WT1 tumor cells were irradiated with X-rays (50 Gy), cultured in the presence of mouse recombinant IFN- ⁇ at a final concentration of 100 ng / mL for about 2 days, and washed with CTM.
- This LLC-HHD-WT1 tumor cell is seeded and mixed in a U-bottom 96-well plate seeded with splenocytes at 3.5 ⁇ 10 4 cells / well, and mixed with CTM, isotype control antibody, or immune checkpoint inhibitor Alternatively, a costimulatory molecule agonist antibody was added and cultured at 37 ° C. under 5% CO 2 for about 3 days.
- anti-PD-1 antibody BioLegend, clone 29F.1A12
- anti-B7-H4 antibody BioLegend, clone HMH4-5G1
- anti-PD-L1 antibody eBiosciecne, clone MIH5
- costimulatory molecule agonist antibodies anti-4-1BB antibody (Bio X Cell, clone LOB12.3) and anti-OX-40 antibody (Bio X Cell, clone OX-86) were used at a final concentration of 30 ⁇ g / mL.
- Rat IgG2a ⁇ (BD Pharmingen) as an isotype control antibody corresponding to anti-PD-1 antibody
- Rat IgG2a Bio X Cell
- Rat IgG1 ⁇ eBiosciecne
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- FIGS. 18-19 The results are shown in FIGS. 18-19.
- the immune checkpoint inhibitor is added and cultured (FIGS. 18A-C), or when the costimulatory molecule agonist antibody is added and cultured (FIGS. 19A-B), the isotype control antibody for each is added and cultured. In comparison, high IFN- ⁇ production was observed. From these results, it was shown that the immune checkpoint inhibitor and the costimulatory molecule agonist enhance the reactivity of the WT1 antigen peptide-specific CTL to peptides and tumor cells.
- Example 8 Effects of various concomitant agents on immune response to WT1 antigen peptide-specific T cells and tumor cells Montanide in an equal amount of a composition containing WT1 killer peptide (SEQ ID NO: 2) and WT1 helper peptide (SEQ ID NO: 14) And then emulsified and administered into the ridge skin of HLA-A * 02 : 01 transgenic mice (0.3 mg of WT1 killer peptide and 0.3 mg of WT1 helper peptide were administered to each mouse) ).
- the mice were euthanized with CO 2 gas, and then the spleen was removed and a spleen cell suspension was prepared using CTM.
- WT1 killer peptide (SEQ ID NO: 2) was dissolved in DMSO at 40 mg / mL.
- the prepared WT1 killer peptide solution was added to a part of the splenocytes and allowed to stand at 37 ° C. and 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour.
- peptide-pulsed splenocytes and non-peptide-pulsed cells were mixed at a ratio of 1:10, and seeded at a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well.
- LLC-HHD-WT1 tumor cells were irradiated with X-rays (50 Gy), cultured in the presence of mouse recombinant IFN- ⁇ at a final concentration of 100 ng / mL for about 2 days, and washed with CTM.
- This LLC-HHD-WT1 tumor cell is seeded and mixed in a U-bottom 96-well plate seeded with splenocytes at 3.5 ⁇ 10 4 cells / well, and mixed with CTM, isotype control antibody, or immune checkpoint inhibitor Alternatively, a costimulatory molecule agonist antibody was added and cultured at 37 ° C. under 5% CO 2 for about 3 days.
- anti-PD-1 antibody BioLegend, clone 29F.1A12
- anti-B7-H4 antibody BioLegend, clone HMH4-5G1
- anti-PD-L1 antibody eBiosciecne, clone MIH5
- costimulatory molecule agonist antibodies anti-4-1BB antibody (Bio X Cell, clone LOB12.3) and anti-OX-40 antibody (Bio X Cell, clone OX-86) were used at a final concentration of 30 ⁇ g / mL.
- Rat IgG2a ⁇ (BD Pharmingen) as an isotype control antibody corresponding to anti-PD-1 antibody
- Rat IgG2a Bio X Cell
- Rat IgG1 ⁇ eBiosciecne
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- Fig. 20-21 The results are shown in Fig. 20-21.
- the immune checkpoint inhibitor is added and cultured (FIGS. 20A to 20C), or when the costimulatory molecule agonist antibody is added and cultured (FIGS. 21A and B), the isotype control antibody for each is added and cultured. In comparison, high IFN- ⁇ production was observed. From these results, it was shown that the immune checkpoint inhibitor and the costimulatory molecule agonist enhance the reactivity of the WT1 antigen peptide-specific CTL to peptides and tumor cells.
- Example 9 Effects of various concomitant agents on immune response to WT1 antigen peptide-specific T cells and tumor cells Montanide in an equal amount of a composition containing WT1 killer peptide (SEQ ID NO: 26) and WT1 helper peptide (SEQ ID NO: 37) And then emulsified and administered into the ridge skin of HLA-A * 02 : 01 transgenic mice (0.234 mg of WT1 killer peptide and 0.234 mg of WT1 helper peptide were administered to each mouse) ).
- the mice were euthanized with CO 2 gas, and then the spleen was removed and a spleen cell suspension was prepared using CTM.
- the WT1 killer peptide (SEQ ID NO: 26) was dissolved in DMSO at 40 mg / mL.
- the prepared WT1 killer peptide solution was added to a part of the splenocytes and allowed to stand at 37 ° C. and 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour.
- peptide-pulsed splenocytes and non-peptide-pulsed cells were mixed at a ratio of 1:10, and seeded at a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well.
- LLC-HHD-WT1 tumor cells were irradiated with X-rays (50 Gy), cultured in the presence of mouse recombinant IFN- ⁇ at a final concentration of 100 ng / mL for about 2 days, and washed with CTM.
- This LLC-HHD-WT1 tumor cell is seeded and mixed in a U-bottom 96-well plate seeded with splenocytes at 3.5 ⁇ 10 4 cells / well, and mixed with CTM, isotype control antibody, or immune checkpoint inhibitor was added and cultured at 37 ° C. under 5% CO 2 for about 3 days.
- anti-PD-1 antibody BioLegend, clone 29F.1A12
- anti-PD-L1 antibody eBiosciecne, clone MIH5
- Rat IgG2a ⁇ (BD Pharmingen) was used as an isotype control antibody corresponding to the anti-PD-1 antibody
- Rat IgG2a (Bio X Cell) was used as an isotype control antibody corresponding to the anti-PD-L1 antibody.
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- Example 10 Effects of various concomitant agents on immune response to WT1 antigen peptide-specific T cells and tumor cells Montanide in an equal amount of a composition containing WT1 killer peptide (SEQ ID NO: 5) and WT1 helper peptide (SEQ ID NO: 11) And then emulsified and administered into the ridge skin of HLA-A * 02 : 01 transgenic mice (0.3 mg of WT1 killer peptide and 0.3 mg of WT1 helper peptide were administered to each mouse) ).
- the mice were euthanized with CO 2 gas, and then the spleen was removed and a spleen cell suspension was prepared using CTM.
- WT1 killer peptide (SEQ ID NO: 5) was dissolved in DMSO at 40 mg / mL.
- the prepared WT1 killer peptide solution was added to a part of the splenocytes and allowed to stand at 37 ° C. and 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour.
- peptide-pulsed splenocytes and non-peptide-pulsed cells were mixed at a ratio of 1:10, and seeded at a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well.
- LLC-HHD-WT1 tumor cells were irradiated with X-rays (50 Gy), cultured in the presence of mouse recombinant IFN- ⁇ at a final concentration of 100 ng / mL for about 2 days, and washed with CTM.
- This LLC-HHD-WT1 tumor cell is seeded and mixed in a U-bottom 96-well plate seeded with splenocytes at 3.5 ⁇ 10 4 cells / well, and mixed with CTM, isotype control antibody, or immune checkpoint inhibitor Alternatively, a costimulatory molecule agonist antibody was added and cultured at 37 ° C. under 5% CO 2 for about 3 days.
- anti-PD-1 antibody BioLegend, clone 29F.1A12
- anti-B7-H4 antibody BioLegend, clone HMH4-5G1
- anti-PD-L1 antibody eBiosciecne, clone MIH5
- Anti-4-1BB antibody Bio X Cell, clone LOB12.3
- anti-OX-40 antibody Bio X Cell, clone OX-86
- anti-GITR antibody BioLegend, clone DTA
- Rat IgG2a ⁇ (BD Pharmingen) as an isotype control antibody corresponding to anti-PD-1 antibody
- Rat IgG2a Bio X Cell
- Rat IgG2a Bio X Cell
- Armenian Hamster IgG eBioscience
- Rat IgG1 ⁇ eBiosciecne
- Rat IgG2b Bio X Cell
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- FIGS. 23-24 The results are shown in FIGS. 23-24.
- the immune checkpoint inhibitor is added and cultured (FIGS. 23A to C), or when the costimulatory molecule agonist antibody is added and cultured (FIGS. 24A to C), the isotype control antibody for each is added and cultured. In comparison, high IFN- ⁇ production was observed. From these results, it was shown that the immune checkpoint inhibitor and the costimulatory molecule agonist enhance the reactivity of the WT1 antigen peptide-specific CTL to peptides and tumor cells.
- Example 11 Immune checkpoint inhibitor was used to enhance the effect this study vaccine for in vivo tumor growth inhibitory effect of HLA-A * 24:02 transgenic mice (C57BL / 6CrHLA-A24 / Kb ) is a human MHC HLA A mouse that expresses a chimeric HLA of A24: 02 and mouse MHC, H-2Kb (Int. J. Cancer 2002; 100: 565-570). By using this mouse, CTL can be induced with a peptide capable of binding to human HLA-A * 24:02.
- EL4-A24 / Kb-WT1 tumor cells were suspended in Hank's balanced salt solution and transplanted into the ventral skin of HLA-A * 24: 02 transgenic mice (3 ⁇ 10 5 per mouse) .
- a group (group d) to administer vaccine and anti-PD-1 antibody was established. Five mice were used for each group.
- mice in groups a and b were mixed with an equal amount of montanide and emulsified with a composition containing water for injection. Were administered in two locations (0.1 mL was administered per administration per mouse).
- the mice of group c and group d were mixed with a composition containing WT1 killer peptide (compound of formula (3)) and WT1 helper peptide (SEQ ID NO: 18) with an equal amount of montanide, and then emulsified.
- -A * 24 : 02 transgenic mice were administered in two parts in the forelimb and hindlimb roots (0.5 mg of WT1 killer peptide and 0.375 mg per dose per mouse) Of WT1 helper peptide).
- phosphate buffered saline was administered intraperitoneally to mice in group a (0.1 mL per dose per mouse). Administration).
- Anti-PD-1 antibody Bio X Cell, clone RMP1-14
- An isotype control antibody Bio X Cell, rat IgG2a
- Tumor diameter was measured 4 days, 7 days, 10 days, 11 days, 17 days, and 21 days after tumor transplantation, and the tumor volume and the percentage of tumor rejection individuals were calculated.
- Example 12 Vaccine enhancement effect against in vivo tumor growth suppression effect by immune checkpoint inhibitor
- EL4-A24 / Kb-WT1 tumor cells were suspended in Hank's balanced salt solution and transplanted into the ventral skin of HLA-A * 24: 02 transgenic mice (3 ⁇ 10 5 per mouse) .
- a group (group d) to administer vaccine and anti-CTLA-4 antibody was established. Six mice were used for each group.
- mice in groups a and b were mixed with an equal amount of montanide and emulsified with a composition containing water for injection. It was administered in two places in the hindlimb root bark (0.1 mL was administered per administration per mouse).
- the mice of group c and group d were mixed with a composition containing WT1 killer peptide (compound of formula (3)) and WT1 helper peptide (SEQ ID NO: 18) with an equal amount of montanide, and then emulsified.
- Example 13 Effect of various concomitant agents on WT1 antigen peptide-specific T cell peptide induced by cocktail vaccine and immunoreactivity to tumor cells Includes WT1 killer peptide (compound of formula (3)) and WT1 helper peptide (SEQ ID NO: 18)
- the composition was mixed with an equal amount of Montanide to make an emulsion and then administered into the ridge skin of HLA-A * 02 : 01 transgenic mice (0.5 mg of WT1 killer peptide and 0. 1 per mouse). 375 mg WT1 helper peptide administered).
- a composition containing a WT1 killer peptide (compound of formula (3)) was mixed with an equal amount of montanide to make an emulsion, and then administered into the ridge skin of HLA-A * 02 : 01 transgenic mice ( 0.5 mg of WT1 killer peptide was administered per mouse).
- the mice were euthanized with CO 2 gas, and then the spleen was removed and spleen cells were prepared using CTM.
- the spleen cells were stained with HLA tetramer reagent (MBL) against FITC-labeled anti-CD8 antibody (BD Pharmingen) and PE-labeled WT1 killer peptide (SEQ ID NO: 2), and killer peptide-specific using a flow cytometer. CTL analysis was performed.
- a WT1 killer peptide (SEQ ID NO: 2) solution was added to a part of the spleen cells, and left at 37 ° C., 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour.
- peptide-pulsed splenocytes and non-peptide-pulsed cells were mixed at a ratio of 1:10 and seeded in a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well at 37 ° C. Cultured for about 3 days under 5% CO 2 .
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- LLC-HHD-WT1 tumor cells were irradiated with X-rays (50 Gy), then cultured in the presence of mouse recombinant IFN- ⁇ at a final concentration of 100 ng / mL for about 2 days, and washed with CTM. .
- This LLC-HHD-WT1 tumor cell is seeded and mixed in a U-bottom 96-well plate seeded with splenocytes at 3.5 ⁇ 10 4 cells / well, and mixed with CTM, isotype control antibody, or immune checkpoint inhibitor Alternatively, a costimulatory molecule agonist antibody or ⁇ -catenin inhibitor was added and cultured at 37 ° C. under 5% CO 2 for about 3 days.
- anti-PD-1 antibody BioLegend, clone 29F.1A12
- anti-LAG-3 antibody BioLegend, clone C9B7W
- anti-BTLA antibody BioLegend, clone 6A6
- An antibody eBiosciecne, clone MIH5
- an anti-VISTA antibody BioLegend, clone MH5A
- Anti-4-1BB antibody (Bio X Cell, clone LOB12.3), anti-OX-40 antibody (Bio X Cell, clone OX-86), anti-GITR antibody (BioLegend, clone DTA) as costimulatory molecule agonist antibodies -1) was used at a final concentration of 30 ⁇ g / mL.
- Rat IgG2a ⁇ (BD Pharmingen) as an isotype control antibody corresponding to anti-PD-1 antibody
- Rat IgG2a Bio X Cell
- Rat IgG2a Bio X Cell
- Armenian Hamster IgG eBioscience
- Rat IgG1 ⁇ eBiosciecne
- Rat IgG2b Bio X Cell
- XAV939 was used as an isotype control antibody corresponding to the antibody.
- XAV939 was used as a final concentration of 5 ⁇ mol / L.
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- FIGS. 27-32 The results are shown in FIGS. 27-32.
- the spleen cells of a mouse administered with a vaccine containing WT1 killer peptide (compound of formula (3)) and WT1 helper peptide (SEQ ID NO: 18) (hereinafter referred to as cocktail vaccine a) 1.9 times WT1 killer peptide (SEQ ID NO: 2) specific compared to spleen cells of mice administered with a vaccine containing only the killer peptide (compound of formula (3)) (hereinafter referred to as killer vaccine a) CTL was included (FIG. 27).
- the spleen cells of the mice administered with cocktail vaccine a were compared with the spleen cells of the mice administered with killer vaccine a, compared with the WT1 killer peptide (SEQ ID NO: 2)
- the amount of IFN- ⁇ produced was 6.9 times when no addition was made, and 12 times when WT1 killer peptide (SEQ ID NO: 2) was added (FIG. 29). From these results, the CTL contained in the spleen cells of the mice administered with the killer vaccine a is strongly inhibited by tumor cells compared to the CTL contained in the spleen cells of the mice administered with the cocktail vaccine a. Indicated.
- Example 14 Action of Various Concomitant Agents on WT1 Antigen Peptide Specific T Cell Peptide Induced by Cocktail Vaccine and Immunoreactivity to Tumor Cells
- Composition Containing WT1 Killer Peptide (SEQ ID NO: 2) and WT1 Helper Peptide (SEQ ID NO: 11) was mixed with an equal amount of montanide to make an emulsion, and then administered into the ridge skin of HLA-A * 02 : 01 transgenic mice (0.3 mg of WT1 killer peptide and 0.3 mg of each mouse). Administration of WT1 helper peptide).
- a composition containing the WT1 killer peptide (SEQ ID NO: 2) was mixed with an equal amount of montanide to make an emulsion, and then administered into the ridge skin of the HLA-A * 02 : 01 transgenic mouse (mouse 1 Each animal received 0.3 mg of WT1 killer peptide).
- the mice were euthanized with CO 2 gas, and then the spleen was removed and spleen cells were prepared using CTM.
- the spleen cells were stained with HLA tetramer reagent (MBL) against FITC-labeled anti-CD8 antibody (BD Pharmingen) and PE-labeled WT1 killer peptide (SEQ ID NO: 2), and killer peptide-specific using a flow cytometer. CTL analysis was performed.
- a WT1 killer peptide (SEQ ID NO: 2) solution was added to a part of the spleen cells, and left at 37 ° C., 5% CO 2 at a final concentration of 100 ⁇ g / mL for about 1 hour.
- peptide-pulsed splenocytes and non-peptide-pulsed cells were mixed at a ratio of 1:10 and seeded in a U-bottom 96-well plate at 3.85 ⁇ 10 5 cells / well at 37 ° C. Cultured for about 3 days under 5% CO 2 .
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- LLC-HHD-WT1 tumor cells were irradiated with X-rays (50 Gy), then cultured in the presence of mouse recombinant IFN- ⁇ at a final concentration of 100 ng / mL for about 2 days, and washed with CTM. .
- This LLC-HHD-WT1 tumor cell was seeded and mixed at a U-bottom 96-well plate seeded with splenocytes at 3.5 ⁇ 10 4 cells / well and mixed with an isotype control antibody, immune checkpoint inhibitor, Stimulating molecule agonist antibody was added and cultured at 37 ° C. under 5% CO 2 for about 3 days.
- anti-PD-1 antibody BioLegend, clone 29F.1A12
- anti-B7-H4 antibody BioLegend, clone HMH4-5G1
- anti-PD-L1 antibody eBiosciecne, clone MIH5
- costimulatory molecule agonist antibodies anti-4-1BB antibody (Bio X Cell, clone LOB12.3) and anti-OX-40 antibody (Bio X Cell, clone OX-86) were used at a final concentration of 30 ⁇ g / mL.
- Rat IgG2a ⁇ (BD Pharmingen) as an isotype control antibody corresponding to anti-PD-1 antibody
- Rat IgG2a Bio X Cell
- Rat IgG1 ⁇ eBiosciecne
- the concentration of mouse IFN- ⁇ contained in the culture supernatant was measured with an ELISA kit (R & D Systems).
- FIGS. 33-39 The results are shown in FIGS. 33-39.
- the spleen cells of a mouse administered with a vaccine containing WT1 killer peptide (SEQ ID NO: 2) and WT1 helper peptide (SEQ ID NO: 11) are WT1 killer peptide.
- cocktail vaccine b WT1 killer peptide.
- the WT1 killer peptide (SEQ ID NO: 2) specific CTL is contained 1.3 times as much. (FIG. 33).
- mice administered with cocktail vaccine b by the combination agent were remarkably activated as in Example 7, but the spleen cells of the mice administered with killer vaccine b were hardly activated. From these results, in order to enhance the reactivity of the WT1 antigen peptide-specific CTL against the WT1 peptide and tumor cells by an immune checkpoint inhibitor and a costimulatory molecule agonist agent in the tumor, It became clear that it was important to include both killer peptides and helper peptides.
- the present invention can be used in the field of pharmaceuticals and the like, for example, in the development or manufacturing field of cancer therapeutics and preventives.
Abstract
Description
免疫調節剤と併用される、WT1抗原ペプチドまたはその薬学上許容される塩を含む、癌を治療または予防するための医薬組成物。
項2.
WT1抗原ペプチドまたはその薬学上許容される塩と併用される、免疫調節剤を含む、癌を治療または予防するための医薬組成物。
項3.
免疫調節剤とWT1抗原ペプチドまたはその薬学上許容される塩とを含む、癌を治療または予防するための医薬組成物。
項4.
WT1抗原ペプチドがWT1キラーペプチドである、項1~3のいずれかに記載の医薬組成物。
項5.
WT1キラーペプチドまたはその薬学上許容される塩が、
RMFPNAPYL (配列番号:2)、
CMTWNQMNL (配列番号:3)、
CYTWNQMNL (配列番号:4)、
ALLPAVPSL (配列番号:5)、
SLGEQQYSV (配列番号:6)、
RVPGVAPTL (配列番号:7)、
VLDFAPPGA、(配列番号:8)、
C-CMTWNQMNL (配列番号:9)(式中、CとCの間の結合はジスルフィド結合を表す。)、
C-CYTWNQMNL (配列番号:10)(式中、CとCの間の結合はジスルフィド結合を表す。)
RYFPNAPYL (配列番号:21)、および
YMFPNAPYL (配列番号:26)から選択されるいずれかのアミノ酸配列からなるペプチド;
前記配列番号2~10、21および26から選択されるいずれかのアミノ酸配列において、1個~数個のアミノ酸が、欠失、置換、および/または付加されたアミノ酸配列を含み且つCTL誘導活性を有するペプチド;もしくは
式(1):
で表される化合物、
式(2):
で表される化合物、および
式(3):
で表される化合物
からなる群から選択される化合物;またはその薬学上許容される塩である、項4に記載の医薬組成物。
項6.
WT1キラーペプチドまたはその薬学上許容される塩が、
RMFPNAPYL(配列番号:2)、
CMTWNQMNL (配列番号:3)、
CYTWNQMNL (配列番号:4)、
ALLPAVPSL (配列番号:5)、
C-CYTWNQMNL (配列番号:10)、および
YMFPNAPYL (配列番号:26)
から選択されるいずれかのアミノ酸配列からなるペプチド;もしくは
式(3):
で表される化合物;またはその薬学上許容される塩である、項5に記載の医薬組成物。
項7.
WT1ヘルパーペプチドまたはその薬学上許容される塩をさらに含む、項4~6のいずれかに記載の医薬組成物。
項8.
WT1ヘルパーペプチドまたはその薬学上許容される塩と併用される、項4~6のいずれかに記載の医薬組成物。
項9.
WT1ヘルパーペプチドまたはその薬学上許容される塩が、
以下:
KRYFKLSHLQMHSRKH (配列番号:11)、
SGQARMFPNAPYLPSCLES(配列番号:12)、
RSDELVRHHNMHQRNMTKL (配列番号:13)、
PGCNKRYFKLSHLQMHSRKHTG (配列番号:14)、
CNKRYFKLSHLQMHSRK (配列番号:15)、
CNKRYFKLSHLQMHSRKH (配列番号:16)、
CNKRYFKLSHLQMHSRKHTG (配列番号:17)、
WAPVLDFAPPGASAYGSL (配列番号:18)、
CWAPVLDFAPPGASAYGSL (配列番号:19)、
WAPVLDFAPPGASAYGSLC (配列番号:20)、および
SGQAYMFPNAPYLPSCLES (配列番号:37)
から選択されるいずれかのアミノ酸配列からなるペプチド;もしくは
前記配列番号11~20から選択されるいずれかのアミノ酸配列において、1個~数個のアミノ酸が、欠失、置換、および/または付加されたアミノ酸配列を含み且つヘルパーT細胞誘導活性を有するペプチド;またはその薬学上許容される塩である、項7または8に記載の医薬組成物。
項10.
WT1ヘルパーペプチドまたはその薬学上許容される塩が、
以下:
KRYFKLSHLQMHSRKH (配列番号:11)、
PGCNKRYFKLSHLQMHSRKHTG (配列番号:14)、
WAPVLDFAPPGASAYGSL (配列番号:18)、および
SGQAYMFPNAPYLPSCLES (配列番号:37)
から選択されるいずれかのアミノ酸配列からなるペプチドまたはその薬学上許容される塩である、項9に記載の医薬組成物。
項11.
WT1キラーペプチドまたはその薬学上許容される塩が、RMFPNAPYL(配列番号:2)またはその薬学上許容される塩であり、
WT1ヘルパーペプチドまたはその薬学上許容される塩が、KRYFKLSHLQMHSRKH(配列番号:11)またはその薬学上許容される塩である、項10に記載の医薬組成物。
項12.
WT1キラーペプチドまたはその薬学上許容される塩が、RMFPNAPYL(配列番号:2)またはその薬学上許容される塩であり、
WT1ヘルパーペプチドまたはその薬学上許容される塩が、PGCNKRYFKLSHLQMHSRKHTG(配列番号:14)またはその薬学上許容される塩である、項10に記載の医薬組成物。
項13.
WT1キラーペプチドまたはその薬学上許容される塩が、ALLPAVPSL(配列番号:5)またはその薬学上許容される塩であり、
WT1ヘルパーペプチドまたはその薬学上許容される塩が、KRYFKLSHLQMHSRKH(配列番号:11)またはその薬学上許容される塩である、項10に記載の医薬組成物。
項14.
WT1キラーペプチドまたはその薬学上許容される塩が、YMFPNAPYL(配列番号:26)またはその薬学上許容される塩であり、
WT1ヘルパーペプチドまたはその薬学上許容される塩が、SGQAYMFPNAPYLPSCLES(配列番号:37)またはその薬学上許容される塩である、項10に記載の医薬組成物。
項15.
WT1キラーペプチドまたはその薬学上許容される塩が、式(3):
で表される化合物またはその薬学上許容される塩であり、
WT1ヘルパーペプチドまたはその薬学上許容される塩が、WAPVLDFAPPGASAYGSL(配列番号:18)またはその薬学上許容される塩である、項10に記載の医薬組成物。
項16.
癌ワクチンとして使用される、項1~15のいずれかに記載の医薬組成物。
項17.
免疫調節剤が、
(1)免疫チェックポイント阻害剤、
(2)共刺激分子アゴニスト剤、
(3)免疫活性化剤、および
(4)低分子阻害剤
からなる群から選択される1以上の薬剤である、項1~16のいずれかに記載の医薬組成物。
項18.
免疫調節剤が抗体、核酸、タンパク質、ペプチドまたは低分子化合物である、項17に記載の医薬組成物。
項19.
免疫調節剤が、免疫チェックポイント阻害剤である、項17または18に記載の医薬組成物。
項20.
免疫チェックポイント阻害剤が、
(1)CTLA-4、
(2)PD-1、
(3)LAG-3、
(4)BTLA、
(5)KIR、
(6)TIM-3、
(7)PD-L1、
(8)PD-L2、
(9)B7-H3、
(10)B7-H4、
(11)HVEM、
(12)GAL9、
(13)CD160、
(14)VISTA、
(15)BTNL2、
(16)TIGIT、
(17)PVR、
(18)BTN1A1、
(19)BTN2A2、
(20)BTN3A2、および
(21)CSF-1R
からなる群から選択される分子に対する1以上の薬剤である、項19に記載の医薬組成物。
項21.
免疫チェックポイント阻害剤が、CTLA-4、PD-1、LAG-3、TIM-3、BTLA、VISTA、HVEM、TIGIT、PVR、PD-L1およびCD160からなる群から選択される分子に対する1以上の薬剤である、項20に記載の医薬組成物。
項22.
免疫チェックポイント阻害剤が、PD-1またはPD-L1に対する薬剤である、項21に記載の医薬組成物。
項23.
免疫チェックポイント阻害剤が、CTLA-4に対する薬剤である、項21に記載の医薬組成物。
項24.
免疫チェックポイント阻害剤が、LAG-3に対する薬剤である、項21に記載の医薬組成物。
項25.
免疫チェックポイント阻害剤が、TIM-3に対する薬剤である、項21に記載の医薬組成物。
項26.
免疫チェックポイント阻害剤が、BTLAに対する薬剤である、項21に記載の医薬組成物。
項27.
免疫チェックポイント阻害剤が、HVEMに対する薬剤である、項21に記載の医薬組成物。
項28.
免疫チェックポイント阻害剤が、TIGITに対する薬剤である、項21に記載の医薬組成物。
項29.
免疫チェックポイント阻害剤が、PVRに対する薬剤である、項21に記載の医薬組成物。
項30.
免疫チェックポイント阻害剤が、CD160に対する薬剤である、項21に記載の医薬組成物。
項31.
免疫チェックポイント阻害剤が、CSF-1Rに対する薬剤である、項21に記載の医薬組成物。
項32.
免疫チェックポイント阻害剤が、抗体である、項19~31のいずれかに記載の医薬組成物。
項33.
免疫チェックポイント阻害剤が、PD-1またはPD-L1に対する抗体である、項32に記載の医薬組成物。
項33.
PD-1に対する抗体が、ニボルマブまたはペンブロリズマブである、項33に記載の医薬組成物。
項34.
PD-L1に対する抗体が、Durvalumab、Atezolizumab(MPDL3280A)またはBMS-936559である、項33に記載の医薬組成物。
項35.
免疫調節剤が、共刺激分子アゴニスト剤である、項17または18に記載の医薬組成物。
項36.
共刺激分子アゴニスト剤が、
(1)4-1BB、
(2)4-1BB-L、
(3)OX40、
(4)OX40-L、
(5)GITR、
(6)CD28、
(7)CD40、
(8)CD40-L、
(9)ICOS、
(10)ICOS-L、
(11)LIGHT、および
(12)CD27
からなる群から選択される分子に対する1以上の薬剤である、項35に記載の医薬組成物。
項37.
共刺激分子アゴニスト剤が、4-1BB、OX40、GITR、CD40およびICOSからなる群から選択される分子に対する1以上の薬剤である、項36に記載の医薬組成物。
項38.
共刺激分子アゴニスト剤が、4-1BBに対する薬剤である、項37に記載の医薬組成物。
項39.
共刺激分子アゴニスト剤が、OX40に対する薬剤である、項37に記載の医薬組成物。
項40.
共刺激分子アゴニスト剤が、GITRに対する薬剤である、項37に記載の医薬組成物。
項41.
共刺激分子アゴニスト剤が、CD40に対する薬剤である、項37に記載の医薬組成物。
項42.
共刺激分子アゴニスト剤が、ICOSに対する薬剤である、項37に記載の医薬組成物。
項43.
共刺激分子アゴニスト剤が、抗体である、項35~42のいずれかに記載の医薬組成物。
項44.
免疫調節剤が、免疫活性化剤である、項17または18に記載の医薬組成物。
項45.
免疫活性化剤が、Toll様受容体(TLR)作動薬である、項44に記載の医薬組成物。
項46.
TLR作動薬が、
(1)TLR1/2作動薬、
(2)TLR2作動薬、
(3)TLR3作動薬、
(4)TLR4作動薬、
(5)TLR5作動薬、
(6)TLR6/2作動薬、
(7)TLR7作動薬、
(8)TLR7/8作動薬、
(9)TLR7/9作動薬、
(10)TLR8作動薬、
(11)TLR9作動薬、および
(12)TLR11作動薬
からなる群から選択される1以上の薬剤である、項45に記載の医薬組成物。
項47.
TLR作動薬が、TLR3作動薬、TLR7作動薬、TLR7/8作動薬、およびTLR9作動薬からなる群から選択される1以上の薬剤である、請求項46に記載の医薬組成物。
項48.
Toll様受容体作動薬が、TLR3作動薬である、項47に記載の医薬組成物。
項49.
Toll様受容体作動薬が、TLR7作動薬である、項47に記載の医薬組成物。
項50.
Toll様受容体作動薬が、TLR7/8作動薬である、項47に記載の医薬組成物。
項51.
Toll様受容体作動薬が、TLR9作動薬である、項47に記載の医薬組成物。
項52.
Toll様受容体作動薬が、核酸である、項45~51のいずれかに記載の医薬組成物。
項53.
免疫調節剤が、低分子阻害剤である、項17または18に記載の医薬組成物。
項54.
低分子阻害剤が、β―カテニン阻害剤、IDO阻害剤、COX-2阻害剤、CXCR4阻害剤、STAT3阻害剤およびマルチキナーゼ阻害剤からなる群から選択される1以上の薬剤である、項53に記載の医薬組成物。
項55.
低分子阻害剤が、β―カテニン阻害剤である、請求項54に記載の医薬組成物。
項56.
低分子阻害剤が、IDO阻害剤である、項54に記載の医薬組成物。
項57.
低分子阻害剤が、COX-2阻害剤である、項54に記載の医薬組成物。
項58.
低分子阻害剤が、CXCR4阻害剤である、項54に記載の医薬組成物。
項59.
低分子阻害剤が、STAT3阻害剤である、項54に記載の医薬組成物。
項60.
低分子阻害剤が、マルチキナーゼ阻害剤である、項54に記載の医薬組成物。
項61.
癌が、白血病、骨髄異形成症候群、多発性骨髄腫、悪性リンパ腫、胃癌、大腸癌、肺癌、乳癌、胚細胞癌、肝癌、皮膚癌、膀胱癌、前立腺癌、子宮癌、子宮頸癌、卵巣癌、脳腫瘍、骨癌、膵癌、頭頚部癌、皮膚または眼窩内悪性メラノーマ、直腸癌、肛門部癌、精巣癌、卵管のカルシノーマ、子宮内膜カルシノーマ、子宮頚部カルシノーマ、膣カルシノーマ、外陰部カルシノーマ、ホジキン病、非ホジキンリンパ腫、食道癌、小腸癌、内分泌系癌、甲状腺癌、副甲状腺癌、副腎癌、柔組織肉腫、尿道癌、陰茎癌、急性骨髄性白血病、慢性骨髄性白血病、急性リンパ芽球性白血病、慢性リンパ球性白血病を含む慢性または急性白血病、小児固形癌、リンパ球性リンパ腫、腎臓または尿管の癌、腎盂カルシノーマ、中枢神経系(CNS)腫瘍、原発性CNSリンパ腫、腫瘍新脈管形成、脊椎腫瘍、脳幹グリオーム、下垂体アデノーマ、カポシ肉腫、扁平上皮癌、扁平細胞癌、T細胞リンパ腫、多型性膠芽腫、悪性黒色腫、非小細胞肺がん、腎細胞癌およびアスベスト誘発癌からなる群から選択される、項1~60のいずれかに記載の医薬組成物。
項62.
WT1抗原ペプチドと免疫調節剤とが同時に投与される、項1~61のいずれかに記載の医薬組成物。
項63.
WT1抗原ペプチドと免疫調節剤とが別々に投与される、項1、2、および4~61のいずれかに記載の医薬組成物。
項64.
WT1抗原ペプチドが免疫調節剤の投与前に投与される、項1、2、および4~61のいずれかに記載の医薬組成物。
項65.
WT1抗原ペプチドが免疫調節剤の投与後に投与される、項1、2、および4~61のいずれかに記載の医薬組成物。
項66.
癌を治療するための、項1~66のいずれかに記載の医薬組成物。
項67.
薬学上許容される担体をさらに含む、項1~66のいずれかに記載の医薬組成物。
項68.
項1~67のいずれかに規定されるWT1抗原ペプチドまたはその薬学上許容される塩と免疫調節剤とを哺乳動物に投与することを含む、癌を治療または予防するための方法。
項69.
WT1抗原ペプチドまたはその薬学上許容される塩と免疫調節剤とを同時にまたは別々に投与する、項68に記載の方法。
項70.
項1~67のいずれかに規定されるWT1抗原ペプチドまたはその薬学上許容される塩と免疫調節剤とを含む、癌を治療または予防するためのキット。
WT1抗原ペプチドまたはその薬学上許容される塩と免疫調節剤とを哺乳動物に投与することを含む、癌を治療または予防するための方法;
免疫調節剤と併用される、癌の治療または予防における使用のための、WT1抗原ペプチドまたはその薬学上許容される塩;
WT1抗原ペプチドまたはその薬学上許容される塩と併用される、癌の治療または予防における使用のための、免疫調節剤;
免疫調節剤と併用される、癌を治療または予防するための医薬の製造のため、WT1抗原ペプチドまたはその薬学上許容される塩の使用;
WT1抗原ペプチドまたはその薬学上許容される塩と併用される、癌を治療または予防するための医薬の製造のため、免疫調節剤の使用;および
癌を治療または予防するための医薬の製造のため、WT1抗原ペプチドまたはその薬学上許容される塩および免疫調節剤の使用。
WT1抗原ペプチドまたはその薬学上許容される塩と免疫チェックポイント阻害剤とを哺乳動物に投与することを含む、癌を治療または予防するための方法;
免疫チェックポイント阻害剤と併用される、癌の治療または予防における使用のための、WT1抗原ペプチドまたはその薬学上許容される塩;
WT1抗原ペプチドまたはその薬学上許容される塩と併用される、癌の治療または予防における使用のための、免疫チェックポイント阻害剤;
免疫チェックポイント阻害剤と併用される、癌を治療または予防するための医薬の製造のため、WT1抗原ペプチドまたはその薬学上許容される塩の使用;
WT1抗原ペプチドまたはその薬学上許容される塩と併用される、癌を治療または予防するための医薬の製造のため、免疫チェックポイント阻害剤の使用;および
癌を治療または予防するための医薬の製造のため、WT1抗原ペプチドまたはその薬学上許容される塩および免疫チェックポイント阻害剤の使用。
AlaまたはA:アラニン残基
ArgまたはR:アルギニン残基
AsnまたはN:アスパラギン残基
AspまたはD:アスパラギン酸残基
CysまたはC:システイン残基
GlnまたはQ:グルタミン残基
GluまたはE:グルタミン酸残基
GlyまたはG:グリシン残基
HisまたはH:ヒスチジン残基
IleまたはI:イソロイシン残基
LeuまたはL:ロイシン残基
LysまたはK:リジン残基
MetまたはM:メチオニン残基
PheまたはF:フェニルアラニン残基
ProまたはP:プロリン残基
SerまたはS:セリン残基
ThrまたはT:スレオニン残基
TrpまたはW:トリプトファン残基
TyrまたはY:チロシン残基
ValまたはV:バリン残基
Abu:2-アミノ酪酸残基(α-アミノ酪酸残基とも言う)
Orn:オルニチン残基
Cit:シトルリン残基
RMFPNAPYL (配列番号:2)、
CMTWNQMNL (配列番号:3)、
CYTWNQMNL (配列番号:4)、
ALLPAVPSL (配列番号:5)、
SLGEQQYSV (配列番号:6)、
RVPGVAPTL (配列番号:7)、
VLDFAPPGA (配列番号:8)、
C-CMTWNQMNL (配列番号:9)(式中、CとCの間の結合はジスルフィド結合を表す。)、および
C-CYTWNQMNL (配列番号:10)(式中、CとCの間の結合はジスルフィド結合を表す。)
から選択されるいずれかのアミノ酸配列を含むペプチド、並びに配列番号:2~10から選択されるいずれかのアミノ酸配列中にアミノ酸残基の改変を含有する改変アミノ酸配列を含み且つCTL誘導活性を有するペプチドが挙げられる。好ましくは、配列番号:2~10から選択されるいずれかのアミノ酸配列からなるペプチド、および配列番号:2~10から選択されるいずれかのアミノ酸配列中にアミノ酸残基の改変を含有する改変アミノ酸配列からなり且つCTL誘導活性を有するペプチドが挙げられる。より好ましくは、配列番号:2~10から選択されるいずれかのアミノ酸配列からなるペプチドが挙げられる。さらにより好ましくは、配列番号:2~6、8および10から選択されるいずれかのアミノ酸配列からなるペプチドが挙げられる。
RMFPNAPYL (配列番号:2)の改変キラーペプチドである、
RYFPNAPYL (配列番号:21)(国際公開第03/106682号参照)、
FMFPNAPYL (配列番号:22)、
RLFPNAPYL (配列番号:23)、
RMMPNAPYL (配列番号:24)、
RMFPNAPYV (配列番号:25)および
YMFPNAPYL (配列番号:26)(国際公開第2009/072610号参照);
CMTWNQMNL (配列番号:3)の改変キラーペプチドである、
CYTWNQMNL (配列番号:4)(国際公開第02/79253号参照)、
Xaa-Met-Thr-Trp-Asn-Gln-Met-Asn-Leu (配列番号:27)、
(本配列中XaaはSerまたはAlaを表す)および
Xaa-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu (配列番号:28)
(本配列中XaaはSer、Ala、Abu、Arg、Lys、Orn、Cit、Leu、PheまたはAsnを表す)(国際公開2004/026897号参照);
ALLPAVPSL (配列番号:5)の改変キラーペプチドである、
AYLPAVPSL (配列番号:29)(国際公開第2003/106682号参照);
SLGEQQYSV (配列番号:6)の改変キラーペプチドである、
FLGEQQYSV (配列番号:30)、
SMGEQQYSV (配列番号:31)および
SLMEQQYSV (配列番号:32)(国際公開第2009/072610号参照);並びに
RVPGVAPTL (配列番号:7)の改変キラーペプチドである、
RYPGVAPTL (配列番号:33)(国際公開第2003/106682号参照)。
式(1):
で表される化合物、
式(2):
で表される化合物、または
式(3):
で表される化合物
である。
KRYFKLSHLQMHSRKH (配列番号:11)、
SGQARMFPNAPYLPSCLES(配列番号:12)、
RSDELVRHHNMHQRNMTKL (配列番号:13)、
PGCNKRYFKLSHLQMHSRKHTG (配列番号:14)、
CNKRYFKLSHLQMHSRK (配列番号:15)、
CNKRYFKLSHLQMHSRKH (配列番号:16)、
CNKRYFKLSHLQMHSRKHTG (配列番号:17)、
WAPVLDFAPPGASAYGSL (配列番号:18)、
CWAPVLDFAPPGASAYGSL (配列番号:19)、
WAPVLDFAPPGASAYGSLC (配列番号:20)、
SGQARMFPNAPYLPSC (配列番号:34)、
SGQAYMFPNAPYLPSC (配列番号:35)、
SGQARMFPNAPYLPSCLES (配列番号:36)、
SGQAYMFPNAPYLPSCLES (配列番号:37)、
PGCNKRYFKLSHLQMHSRK (配列番号:38)、
PGCNKRYFKLSHLQMHSRKH (配列番号:39)、PGCNKRYFKLSHLQMHSRKHTG (配列番号:40)、
QARMFPNAPYLPSCL (配列番号:44)、
LKGVAAGSSSSVKWT (配列番号:45)および
RYFKLSHLQMHSRKH (配列番号:46)
から選択されるいずれかのアミノ酸配列を含むペプチド、および配列番号:11~20、34~40および44~46から選択されるいずれかのアミノ酸配列中にアミノ酸残基の改変を含有する改変アミノ酸配列を含み且つヘルパーT細胞誘導活性を有するペプチド、が挙げられる。好ましくは、配列番号:11~20および34~40から選択されるいずれかのアミノ酸配列からなるペプチド、および配列番号:11~20および34~40から選択されるいずれかのアミノ酸配列中にアミノ酸残基の改変を含有する改変アミノ酸配列からなり且つヘルパーT細胞誘導活性を有するペプチドが挙げられる。より好ましくは、配列番号:11~20および34~40から選択されるいずれかのアミノ酸配列からなるペプチドであり、さらにより好ましくは、配列番号:11~20から選択されるいずれかのアミノ酸配列からなるペプチドが挙げられる。
SGQARMFPNAPYLPSCLES (配列番号:36)の改変ヘルパーペプチドである、
SGQAYMFPNAPYLPSCLES (配列番号:37)(国際公開第2007/120673号参照)、
SGQARMFPNAPYLPSC (配列番号:34)および
SGQAYMFPNAPYLPSC (配列番号:35);並びに
PGCNKRYFKLSHLQMHSRKHTG (配列番号:40)の改変ヘルパーペプチドである、
PGCNKRYFKLSHLQMHSRK (配列番号:38)、
PGCNKRYFKLSHLQMHSRKH (配列番号:39)、
KRYFKLSHLQMHSRKH (配列番号:11)、
CNKRYFKLSHLQMHSRK (配列番号:15)、
CNKRYFKLSHLQMHSRKH (配列番号:16)および
CNKRYFKLSHLQMHSRKHTG (配列番号:17)。
RMFPNAPYL (配列番号:2)、
CMTWNQMNL (配列番号:3)、
CYTWNQMNL (配列番号:4)、
ALLPAVPSL (配列番号:5)、
SLGEQQYSV (配列番号:6)、
RVPGVAPTL (配列番号:7)、
VLDFAPPGA、(配列番号:8)、
C-CMTWNQMNL (配列番号:9)(式中、CとCの間の結合はジスルフィド結合を表す。)、および
C-CYTWNQMNL (配列番号:10)(式中、CとCの間の結合はジスルフィド結合を表す。)から選択されるいずれかのアミノ酸配列からなるペプチド;
前記配列番号2~10から選択されるいずれかのアミノ酸配列において、1個~数個のアミノ酸が、欠失、置換、および/または付加されたアミノ酸配列を含み且つCTL誘導活性を有するペプチド;または
式(1)~(3)で表される化合物の、酸付加塩および塩基付加塩が挙げられる。例えば、酸付加塩としては、塩酸塩、臭化水素酸塩、硫酸塩、ヨウ化水素酸塩、硝酸塩、リン酸塩などの無機酸塩、クエン酸塩、シュウ酸塩、酢酸塩、ギ酸塩、プロピオン酸塩、安息香酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、パラトルエンスルホン酸塩などの有機酸塩が挙げられ、塩基付加塩としては、ナトリウム塩、カリウム塩、カルシウム塩、マグネシウム塩、アンモニウム塩などの無機塩基塩、トリエチルアンモニウム塩、トリエタノールアンモニウム塩、ピリジニウム塩、ジイソプロピルアンモニウム塩などの有機塩基塩などが挙げられ、さらにはアルギニン、アスパラギン酸、グルタミン酸などの塩基性あるいは酸性アミノ酸といったアミノ酸塩が挙げられる。
KRYFKLSHLQMHSRKH (配列番号:11)、
SGQARMFPNAPYLPSCLES(配列番号:12)、
RSDELVRHHNMHQRNMTKL (配列番号:13)、
PGCNKRYFKLSHLQMHSRKHTG (配列番号:14)、
CNKRYFKLSHLQMHSRK (配列番号:15)、
CNKRYFKLSHLQMHSRKH (配列番号:16)、
CNKRYFKLSHLQMHSRKHTG (配列番号:17)、
WAPVLDFAPPGASAYGSL (配列番号:18)、
CWAPVLDFAPPGASAYGSL (配列番号:19)および
WAPVLDFAPPGASAYGSLC (配列番号:20)
から選択されるいずれかのアミノ酸配列からなるペプチド;または
前記配列番号11~20から選択されるいずれかのアミノ酸配列において、1個~数個のアミノ酸が、欠失、置換、および/または付加されたアミノ酸配列を含み且つヘルパーT細胞誘導活性を有するペプチドの、酸付加塩および塩基付加塩が挙げられる。例えば、酸付加塩としては、塩酸塩、臭化水素酸塩、硫酸塩、ヨウ化水素酸塩、硝酸塩、リン酸塩などの無機酸塩、クエン酸塩、シュウ酸塩、酢酸塩、ギ酸塩、プロピオン酸塩、安息香酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、パラトルエンスルホン酸塩などの有機酸塩が挙げられ、塩基付加塩としては、ナトリウム塩、カリウム塩、カルシウム塩、マグネシウム塩、アンモニウム塩などの無機塩基塩、トリエチルアンモニウム塩、トリエタノールアンモニウム塩、ピリジニウム塩、ジイソプロピルアンモニウム塩などの有機塩基塩などが挙げられ、さらにはアルギニン、アスパラギン酸、グルタミン酸などの塩基性あるいは酸性アミノ酸といったアミノ酸塩が挙げられる。
RMFPNAPYL 酢酸塩、
CMTWNQMNL 酢酸塩、
CYTWNQMNL 酢酸塩、
ALLPAVPSL 酢酸塩、
SLGEQQYSV 酢酸塩、
RVPGVAPTL 酢酸塩、
VLDFAPPGA 酢酸塩、
C-CMTWNQMNL 酢酸塩、
C-CYTWNQMNL 酢酸塩、
SGQARMFPNAPYLPSCLES 酢酸塩、
RSDELVRHHNMHQRNMTKL 酢酸塩、
PGCNKRYFKLSHLQMHSRKHTG 酢酸塩、
CNKRYFKLSHLQMHSRK 酢酸塩、
CNKRYFKLSHLQMHSRKH 酢酸塩、
CNKRYFKLSHLQMHSRKHTG 酢酸塩、
WAPVLDFAPPGASAYGSL 酢酸塩、
CWAPVLDFAPPGASAYGSL 酢酸塩、
WAPVLDFAPPGASAYGSLC 酢酸塩、
RMFPNAPYL トリフルオロ酢酸塩、
CMTWNQMNL トリフルオロ酢酸塩、
CYTWNQMNL トリフルオロ酢酸塩、
ALLPAVPSL トリフルオロ酢酸塩、
SLGEQQYSV トリフルオロ酢酸塩、
RVPGVAPTL トリフルオロ酢酸塩、
VLDFAPPGA トリフルオロ酢酸塩、
C-CMTWNQMNL トリフルオロ酢酸塩、
C-CYTWNQMNL トリフルオロ酢酸塩、
SGQARMFPNAPYLPSCLES トリフルオロ酢酸塩、
RSDELVRHHNMHQRNMTKL トリフルオロ酢酸塩、
PGCNKRYFKLSHLQMHSRKHTG トリフルオロ酢酸塩、
CNKRYFKLSHLQMHSRK トリフルオロ酢酸塩、
CNKRYFKLSHLQMHSRKH トリフルオロ酢酸塩、
CNKRYFKLSHLQMHSRKHTG トリフルオロ酢酸塩、
WAPVLDFAPPGASAYGSL トリフルオロ酢酸塩、
CWAPVLDFAPPGASAYGSL トリフルオロ酢酸塩、および
WAPVLDFAPPGASAYGSLC トリフルオロ酢酸塩
が挙げられる。
ヒト末梢血単核球からの腫瘍抗原ペプチド特異的細胞傷害性T細胞誘導に対する免疫チェックポイント阻害剤の併用効果
WT1抗原ペプチド特異的CTLのペプチドに対する免疫応答性に対する免疫チェックポイント阻害剤の作用
WT1キラーペプチドおよびWT1ヘルパーペプチドのカクテルワクチンを投与したマウス脾細胞における免疫チェックポイント分子の発現変化
本試験に使用したHLA-A*02:01遺伝子導入マウス(C57BL/6CrHLA-A2.1DR1)は、マウスのMHCを欠損し、ヒトのMHCであるHLA-A02:01とマウスMHCであるH-2DbとのキメラHLAと、HLA-DRB1*01:01とを発現するマウスである(Eur J Immunol.2004;34:3060-9)。本マウスを用いることで、ヒトのHLA-A*02:01に結合し得るペプチドでCTLを誘導することが可能である。また、ヒトのHLA-DRB1*01:01に結合し得るペプチドでヘルパーT細胞を誘導し、CTL誘導増強効果を評価することも可能である。
WT1抗原ペプチド特異的T細胞の腫瘍細胞に対する免疫応答性における免疫チェックポイント阻害剤の作用
実施例3と同様にWT1キラーペプチドおよびWT1ヘルパーペプチドを含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹の1回の免疫につき、1mgのWT1キラーペプチドと0.75mgのWT1ヘルパーペプチドを投与)。最終投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、Complete T-cell medeium(以下CTM)を用いて脾細胞懸濁液を調製した。WT1キラーペプチド(配列番号:2)をDMSOで40mg/mLに溶解し、さらにCTMで500μg/mLに希釈した。調製した脾細胞の一部にこのペプチド溶液を添加し、最終濃度100μg/mLで約1時間、37℃、5% CO2下に静置した。CTMで余分なペプチドを洗浄後、ペプチドパルスした脾細胞と非ペプチドパルス脾細胞を1:10の割合で混合した。この脾細胞懸濁液に抗PD-1抗体(Bio X cell社製、クローンRMP1-14)、またはアイソタイプコントロール抗体(Bio X cell社製、Rat IgGa, κ)を10μg/mLで添加し、37℃、5% CO2下で5日間培養した。培養した脾細胞を10%FBS含有RPMI1640培地で洗浄し、Responder細胞とした。次に、WT1キラーペプチド(配列番号:2)をDMSOで40mg/mLに溶解し、さらに10%FBS含有RPMI1640培地で100μg/mLに希釈した。マウスリンパ腫由来細胞株EL4 S3- Rob(Eur J Immunol.1990;20:171-7)にHHD(ヒトHLA-A*02:01分子のα3ドメインをマウスMHCクラスI分子H-2Dbのα3ドメインと置換したキメラHLA分子)を安定発現させた細胞株(J Exp Med.1997;185:2043-51)(以下、EL4HHD)を上記のペプチド含有RPMI1640培地、またはペプチド非含有RPMI1640培地で懸濁し、約1時間、37℃、5% CO2下に静置した。10%FBS含有RPMI1640培地で余分なペプチドを洗浄し、Stimulator細胞とした。U底96穴プレートにStimulator細胞であるEL4HHDを1×105細胞/穴、Responder細胞である5日間培養した脾細胞を5×105細胞/穴で播種して混合し、37℃、5% CO2下で24時間培養した。この培養上清中に含まれるマウスIFN-γの濃度をELISAキット(R&D Systems)で測定した。
WT1抗原ペプチド特異的T細胞のペプチドおよび腫瘍細胞に対する免疫応答性における各種併用剤の作用
WT1キラーペプチド(式(3)の化合物)およびWT1ヘルパーペプチド(配列番号:18)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.5mgのWT1キラーペプチドと0.375mgのWT1ヘルパーペプチドを投与)。投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞懸濁液を調製した。WT1キラーペプチド(配列番号:2)をDMSOで40mg/mLに溶解した。脾細胞の一部に調製したWT1キラーペプチド溶液を添加し、最終濃度100μg/mLで約1時間、37℃、5%CO2下に静置した。CTMで余分なペプチドを洗浄後、ペプチドパルスした脾細胞と非ペプチドパルス細胞を1:10の割合で混合し、U底96穴プレートに3.85×105細胞/穴で播種した。腫瘍細胞として、マウスルイス肺がん由来細胞株LLCにHHDおよびWT1キラーペプチド(配列番号:2)を安定発現させた細胞株(本明細書中、LLC―HHD―WT1腫瘍細胞とも記載する)にX線(50Gy)照射した後に最終濃度100ng/mLのマウスリコンビナントIFN―γの存在下で約2日間培養し、CTMで洗浄した。このLLC-HHD-WT1腫瘍細胞を、脾細胞を播種したU底96穴プレートに5×104細胞/穴あるいは3.5×104細胞/穴で播種して混合し、CTM(培地)、あるいはアイソタイプコントロール抗体、あるいは免疫チェックポイント阻害剤、あるいは共刺激分子アゴニスト抗体、あるいはTLR作動薬、あるいはβ―カテニン阻害剤を添加して37℃、5%CO2下で約3日間培養した。免疫チェックポイント阻害剤としては抗PD-1抗体(BioLegend社、クローン29F.1A12)、抗TIM-3抗体(BioLegend社、クローンRMT3-23)、抗CD160抗体(eBioscience社、クローンeBioCNX46-3)、抗LAG-3抗体(BioLegend社、クローンC9B7W)、抗BTLA抗体(BioLegend社、クローン6A6)、抗PD-L1抗体(eBiosciecne社、クローンMIH5)、抗HVEM抗体(BioLegend社、クローンHMHV-1B18)、抗VISTA抗体(BioLegend社、クローンMH5A)、抗PVR抗体(Hycult Biotech社、クローン3F1)を最終濃度10μg/mLで用いた。共刺激分子アゴニスト抗体としては抗4-1BB抗体(Bio X Cell社、クローンLOB12.3)、抗OX-40抗体(Bio X Cell社、クローンOX-86)、抗GITR抗体(BioLegend社、クローンDTA-1)、抗CD-40抗体(BioLegend社、クローン1C10)を最終濃度30μg/mLで用いた。抗PD―1抗体、抗TIM-3抗体、抗CD160抗体、および抗CD-40抗体に対応するアイソタイプコントロール抗体としてRat IgG2aκ(BD Pharmingen社)を、抗PD-L1抗体および抗PVR抗体に対応するアイソタイプコントロール抗体としてRat IgG2a(Bio X Cell社)を、抗BTLA抗体、抗HVEM抗体、および抗VISTA抗体に対応するアイソタイプコントロール抗体としてArmenian Hamster IgG(eBioscience社)を、抗LAG-3抗体、抗4-1BB抗体および抗OX-40抗体に対応するアイソタイプコントロール抗体としてRat IgG1κ(eBiosciecne社)を、抗GITR抗体に対応するアイソタイプコントロール抗体としてRat IgG2b(Bio X Cell社)を用いた。TLR作動薬としてはTLR3作動薬であるPolyI:C HMW(GEヘルスケア、最終濃度30μg/mL)およびPolyI:C LMW(GeneDesign、最終濃度30μg/mL)、TLR7作動薬であるImiquimod(最終濃度10μg/mL)、TLR7/8作動薬であるR848(最終濃度1μmol/L)、およびTLR9作動薬であるCpG-ODN-D19(最終濃度1μmol/L)、CpG-ODN-1826(最終濃度1μmol/L)、およびCpG-ODN-C583(最終濃度1μmol/L)を用いた。β―カテニン阻害剤としてはXAV939を最終濃度5μmol/Lで用いた。この培養上清中に含まれるマウスIFN―γの濃度をELISAキット(R&D Systems)で測定した。
担がん生体由来のWT1抗原ペプチド特異的T細胞の免疫活性における各種併用剤の作用
マウスリンパ腫細胞株EL4にHLA-A2402/Kb(ヒトHLA-A*24:02分子のα3ドメインをマウスMHCクラスI分子H-2Kbのα3ドメインと置換したキメラHLA分子)およびWT1キラーペプチド(配列番号:4)を安定発現させた細胞株(本明細書中、EL4―A24/Kb―WT1腫瘍細胞とも記載する)をハンクス平衡塩溶液中に浮遊させ、HLA-A*24:02遺伝子導入マウスの腹側部皮内に移植した(マウス1匹につき、3×105個あるいは5×105個)。腫瘍細胞を移植した1日後および8日後に、WT1キラーペプチド(式(3)の化合物)およびWT1ヘルパーペプチド(配列番号:18)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*24:02遺伝子導入マウスの前肢付け根皮内および後肢付け根皮内に2か所に分けて投与した(マウス1匹に対する1回の投与につき、1mgのWT1キラーペプチドと0.75mgのWT1ヘルパーペプチドを投与)。腫瘍移植15日後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞懸濁液を調製した。この脾細胞をU底96穴プレートに3.85×105細胞/穴で播種し、CTM、あるいはアイソタイプコントロール抗体、あるいは免疫チェックポイント阻害剤、あるいは共刺激分子アゴニスト抗体を添加して37℃、5%CO2下で約3日間培養した。免疫チェックポイント阻害剤としては抗PD-1抗体(BioLegend社、クローン29F.1A12)、抗CTLA―4抗体(BioLegend社、クローンUC10-4B9)、抗TIGIT抗体(Bio X Cell社、クローン1G9)を最終濃度30μg/mLで用いた。共刺激分子アゴニスト抗体としては抗ICOS抗体(BioLegend社、クローンC398.4A)を最終濃度30μg/mLで用いた。抗PD―1抗体に対応するアイソタイプコントロール抗体としてRat IgG2aκ(BD Pharmingen社)を、抗CTLA-4抗体および抗ICOS抗体に対応するアイソタイプコントロール抗体としてArmenian Hamster IgG(eBioscience社)を、抗TIGIT抗体に対応するアイソタイプコントロール抗体としてMouse IgG1(Bio X Cell社)を用いた。この培養上清中に含まれるマウスIFN―γの濃度をELISAキット(R&D Systems)で測定した。
WT1抗原ペプチド特異的T細胞のペプチドおよび腫瘍細胞に対する免疫応答性における各種併用剤の作用
WT1キラーペプチド(配列番号:2)およびWT1ヘルパーペプチド(配列番号:11)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.3mgのWT1キラーペプチドと0.3mgのWT1ヘルパーペプチドを投与)。投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞懸濁液を調製した。WT1キラーペプチド(配列番号:2)をDMSOで40mg/mLに溶解した。脾細胞の一部に調製したWT1キラーペプチド溶液を添加し、最終濃度100μg/mLで約1時間、37℃、5%CO2下に静置した。CTMで余分なペプチドを洗浄後、ペプチドパルスした脾細胞と非ペプチドパルス細胞を1:10の割合で混合し、U底96穴プレートに3.85×105細胞/穴で播種した。腫瘍細胞として、LLC―HHD―WT1腫瘍細胞にX線(50Gy)照射した後に最終濃度100ng/mLのマウスリコンビナントIFN―γの存在下で約2日間培養し、CTMで洗浄した。このLLC-HHD-WT1腫瘍細胞を、脾細胞を播種したU底96穴プレートに3.5×104細胞/穴で播種して混合し、CTM、あるいはアイソタイプコントロール抗体、あるいは免疫チェックポイント阻害剤、あるいは共刺激分子アゴニスト抗体を添加して37℃、5%CO2下で約3日間培養した。免疫チェックポイント阻害剤としては抗PD-1抗体(BioLegend社、クローン29F.1A12)、抗B7-H4抗体(BioLegend社、クローンHMH4-5G1)、抗PD-L1抗体(eBiosciecne社、クローンMIH5)を最終濃度30μg/mLで用いた。共刺激分子アゴニスト抗体としては抗4-1BB抗体(Bio X Cell社、クローンLOB12.3)、抗OX-40抗体(Bio X Cell社、クローンOX-86)を最終濃度30μg/mLで用いた。抗PD―1抗体に対応するアイソタイプコントロール抗体としてRat IgG2aκ(BD Pharmingen社)を、抗PD-L1抗体に対応するアイソタイプコントロール抗体としてRat IgG2a(Bio X Cell社)を、抗B7-H4抗体に対応するアイソタイプコントロール抗体としてArmenian Hamster IgG(eBioscience社)を、抗4-1BB抗体および抗OX-40抗体に対応するアイソタイプコントロール抗体としてRat IgG1κ(eBiosciecne社)を用いた。この培養上清中に含まれるマウスIFN―γの濃度をELISAキット(R&D Systems)で測定した。
WT1抗原ペプチド特異的T細胞のペプチドおよび腫瘍細胞に対する免疫応答性における各種併用剤の作用
WT1キラーペプチド(配列番号:2)およびWT1ヘルパーペプチド(配列番号:14)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.3mgのWT1キラーペプチドと0.3mgのWT1ヘルパーペプチドを投与)。投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞懸濁液を調製した。WT1キラーペプチド(配列番号:2)をDMSOで40mg/mLに溶解した。脾細胞の一部に調製したWT1キラーペプチド溶液を添加し、最終濃度100μg/mLで約1時間、37℃、5%CO2下に静置した。CTMで余分なペプチドを洗浄後、ペプチドパルスした脾細胞と非ペプチドパルス細胞を1:10の割合で混合し、U底96穴プレートに3.85×105細胞/穴で播種した。腫瘍細胞として、LLC―HHD―WT1腫瘍細胞にX線(50Gy)照射した後に最終濃度100ng/mLのマウスリコンビナントIFN―γの存在下で約2日間培養し、CTMで洗浄した。このLLC-HHD-WT1腫瘍細胞を、脾細胞を播種したU底96穴プレートに3.5×104細胞/穴で播種して混合し、CTM、あるいはアイソタイプコントロール抗体、あるいは免疫チェックポイント阻害剤、あるいは共刺激分子アゴニスト抗体を添加して37℃、5%CO2下で約3日間培養した。免疫チェックポイント阻害剤としては抗PD-1抗体(BioLegend社、クローン29F.1A12)、抗B7-H4抗体(BioLegend社、クローンHMH4-5G1)、抗PD-L1抗体(eBiosciecne社、クローンMIH5)を最終濃度30μg/mLで用いた。共刺激分子アゴニスト抗体としては抗4-1BB抗体(Bio X Cell社、クローンLOB12.3)、抗OX-40抗体(Bio X Cell社、クローンOX-86)を最終濃度30μg/mLで用いた。抗PD-1抗体に対応するアイソタイプコントロール抗体としてRat IgG2aκ(BD Pharmingen社)を、抗PD-L1抗体に対応するアイソタイプコントロール抗体としてRat IgG2a(Bio X Cell社)を、抗B7-H4抗体に対応するアイソタイプコントロール抗体としてArmenian Hamster IgG(eBioscience社)を、抗4-1BB抗体および抗OX-40抗体に対応するアイソタイプコントロール抗体としてRat IgG1κ(eBiosciecne社)を用いた。この培養上清中に含まれるマウスIFN-γの濃度をELISAキット(R&D Systems)で測定した。
WT1抗原ペプチド特異的T細胞のペプチドおよび腫瘍細胞に対する免疫応答性における各種併用剤の作用
WT1キラーペプチド(配列番号:26)およびWT1ヘルパーペプチド(配列番号:37)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.234mgのWT1キラーペプチドと0.234mgのWT1ヘルパーペプチドを投与)。投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞懸濁液を調製した。WT1キラーペプチド(配列番号:26)をDMSOで40mg/mLに溶解した。脾細胞の一部に調製したWT1キラーペプチド溶液を添加し、最終濃度100μg/mLで約1時間、37℃、5%CO2下に静置した。CTMで余分なペプチドを洗浄後、ペプチドパルスした脾細胞と非ペプチドパルス細胞を1:10の割合で混合し、U底96穴プレートに3.85×105細胞/穴で播種した。腫瘍細胞として、LLC―HHD―WT1腫瘍細胞にX線(50Gy)照射した後に最終濃度100ng/mLのマウスリコンビナントIFN―γの存在下で約2日間培養し、CTMで洗浄した。このLLC-HHD-WT1腫瘍細胞を、脾細胞を播種したU底96穴プレートに3.5×104細胞/穴で播種して混合し、CTM、あるいはアイソタイプコントロール抗体、あるいは免疫チェックポイント阻害剤を添加して37℃、5%CO2下で約3日間培養した。免疫チェックポイント阻害剤としては抗PD-1抗体(BioLegend社、クローン29F.1A12)、抗PD-L1抗体(eBiosciecne社、クローンMIH5)を最終濃度30μg/mLで用いた。抗PD-1抗体に対応するアイソタイプコントロール抗体としてRat IgG2aκ(BD Pharmingen社)を、抗PD-L1抗体に対応するアイソタイプコントロール抗体としてRat IgG2a(Bio X Cell社)を用いた。この培養上清中に含まれるマウスIFN-γの濃度をELISAキット(R&D Systems)で測定した。
WT1抗原ペプチド特異的T細胞のペプチドおよび腫瘍細胞に対する免疫応答性における各種併用剤の作用
WT1キラーペプチド(配列番号:5)およびWT1ヘルパーペプチド(配列番号:11)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.3mgのWT1キラーペプチドと0.3mgのWT1ヘルパーペプチドを投与)。投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞懸濁液を調製した。WT1キラーペプチド(配列番号:5)をDMSOで40mg/mLに溶解した。脾細胞の一部に調製したWT1キラーペプチド溶液を添加し、最終濃度100μg/mLで約1時間、37℃、5%CO2下に静置した。CTMで余分なペプチドを洗浄後、ペプチドパルスした脾細胞と非ペプチドパルス細胞を1:10の割合で混合し、U底96穴プレートに3.85×105細胞/穴で播種した。腫瘍細胞として、LLC―HHD―WT1腫瘍細胞にX線(50Gy)照射した後に最終濃度100ng/mLのマウスリコンビナントIFN―γの存在下で約2日間培養し、CTMで洗浄した。このLLC-HHD-WT1腫瘍細胞を、脾細胞を播種したU底96穴プレートに3.5×104細胞/穴で播種して混合し、CTM、あるいはアイソタイプコントロール抗体、あるいは免疫チェックポイント阻害剤、あるいは共刺激分子アゴニスト抗体を添加して37℃、5%CO2下で約3日間培養した。免疫チェックポイント阻害剤としては抗PD-1抗体(BioLegend社、クローン29F.1A12)、抗B7-H4抗体(BioLegend社、クローンHMH4-5G1)、抗PD-L1抗体(eBiosciecne社、クローンMIH5)を最終濃度30μg/mLで用いた。共刺激分子アゴニスト抗体としては抗4-1BB抗体(Bio X Cell社、クローンLOB12.3)、抗OX-40抗体(Bio X Cell社、クローンOX-86)、抗GITR抗体(BioLegend社、クローンDTA-1)を最終濃度30μg/mLで用いた。抗PD―1抗体に対応するアイソタイプコントロール抗体としてRat IgG2aκ(BD Pharmingen社)を、抗PD-L1抗体に対応するアイソタイプコントロール抗体としてRat IgG2a(Bio X Cell社)を、抗B7-H4抗体に対応するアイソタイプコントロール抗体としてArmenian Hamster IgG(eBioscience社)を、抗4-1BB抗体および抗OX-40抗体に対応するアイソタイプコントロール抗体としてRat IgG1κ(eBiosciecne社)を、抗GITR抗体に対応するアイソタイプコントロール抗体としてRat IgG2b(Bio X Cell社)を用いた。この培養上清中に含まれるマウスIFN―γの濃度をELISAキット(R&D Systems)で測定した。
免疫チェックポイント阻害剤によるイン・ビボ腫瘍増殖抑制効果に対するワクチンの増強効果
本試験に使用したHLA-A*24:02遺伝子導入マウス(C57BL/6CrHLA-A24/Kb)は、ヒトのMHCであるHLA-A24:02とマウスMHCであるH-2KbとのキメラHLAを発現するマウスである(Int. J. Cancer 2002;100:565-570)。本マウスを用いることで、ヒトのHLA-A*24:02に結合し得るペプチドでCTLを誘導することが可能である。
免疫チェックポイント阻害剤によるイン・ビボ腫瘍増殖抑制効果に対するワクチンの増強効果
カクテルワクチンで誘導したWT1抗原ペプチド特異的T細胞のペプチドおよび腫瘍細胞に対する免疫応答性における各種併用剤の作用
WT1キラーペプチド(式(3)の化合物)およびWT1ヘルパーペプチド(配列番号:18)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.5mgのWT1キラーペプチドと0.375mgのWT1ヘルパーペプチドを投与)。あるいは、WT1キラーペプチド(式(3)の化合物)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.5mgのWT1キラーペプチドを投与)。投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞を調製した。この脾細胞をFITC標識抗CD8抗体(BD Pharmingen社)およびPE標識されたWT1キラーペプチド(配列番号:2)に対するHLAテトラマー試薬(MBL社)で染色し、フローサイトメーターを用いてキラーペプチド特異的CTLの解析を行った。
フローサイトメトリー解析の結果、WT1キラーペプチド(式(3)の化合物)およびWT1ヘルパーペプチド(配列番号:18)を含むワクチン(以下、カクテルワクチンaとする)を投与したマウスの脾細胞は、WT1キラーペプチド(式(3)の化合物)のみを含むワクチン(以下、キラーワクチンaとする)を投与したマウスの脾細胞と比べて、1.9倍のWT1キラーペプチド(配列番号:2)特異的CTLを含んでいた(図27)。これらの脾細胞をWT1キラーペプチド(配列番号:2)の添加下で培養したところ、カクテルワクチンaを投与したマウスの脾細胞は、キラーワクチンaを投与したマウスの脾細胞と比べて、2倍のIFN―γ産生量を示した(図28)。一方で、これらの脾細胞を腫瘍細胞と混合した上で、WT1キラーペプチド(配列番号:2)非添加下あるいは添加下で培養したところ、腫瘍細胞と混合しなかった場合(図28)と比較して脾細胞からのIFN-γ産生量は抑制されたが、カクテルワクチンaを投与したマウスの脾細胞は、キラーワクチンaを投与したマウスの脾細胞と比べて、WT1キラーペプチド(配列番号:2)非添加下では6.9倍、WT1キラーペプチド(配列番号:2)添加下では12倍のIFN―γ産生量を示した(図29)。これらの結果より、キラーワクチンaを投与したマウスの脾細胞中に含まれるCTLは、カクテルワクチンaを投与したマウスの脾細胞中に含まれるCTLと比べて、腫瘍細胞による抑制を強く受けることが示された。更には、腫瘍細胞の存在下でWT1キラーペプチドに加えて免疫チェックポイント阻害剤(図30)、共刺激分子アゴニスト抗体(図31)、あるいはβ―カテニン阻害剤(図32)を添加したところ、これらの併用剤によってカクテルワクチンaを投与したマウスの脾細胞は実施例5と同様に著しく活性化したが、キラーワクチンaを投与したマウスの脾細胞はほとんど活性化されなかった。これらの結果より、腫瘍中において、免疫チェックポイント阻害剤、共刺激分子アゴニスト剤、β―カテニン阻害剤によってWT1抗原ペプチド特異的CTLのWT1ペプチドおよび腫瘍細胞に対する反応性が増強されるためには、投与されるWT1ワクチンにキラーペプチドとヘルパーペプチドの双方が含まれていることが重要であることが明らかとなった。
カクテルワクチンで誘導したWT1抗原ペプチド特異的T細胞のペプチドおよび腫瘍細胞に対する免疫応答性における各種併用剤の作用
WT1キラーペプチド(配列番号:2)およびWT1ヘルパーペプチド(配列番号:11)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.3mgのWT1キラーペプチドと0.3mgのWT1ヘルパーペプチドを投与)。あるいは、WT1キラーペプチド(配列番号:2)を含む組成物を等量のモンタナイドと混合しエマルション化させたのち、HLA-A*02:01遺伝子導入マウスの尾根部皮内に投与した(マウス1匹につき、0.3mgのWT1キラーペプチドを投与)。投与の1週間後にマウスをCO2ガスにより安楽死させたのち脾臓を摘出し、CTMを用いて脾細胞を調製した。この脾細胞をFITC標識抗CD8抗体(BD Pharmingen社)およびPE標識されたWT1キラーペプチド(配列番号:2)に対するHLAテトラマー試薬(MBL社)で染色し、フローサイトメーターを用いてキラーペプチド特異的CTLの解析を行った。
フローサイトメトリー解析の結果、WT1キラーペプチド(配列番号:2)およびWT1ヘルパーペプチド(配列番号:11)を含むワクチン(以下、カクテルワクチンbとする)を投与したマウスの脾細胞は、WT1キラーペプチド(配列番号:2)のみを含むワクチン(以下、キラーワクチンbとする)を投与したマウスの脾細胞と比べて、1.3倍のWT1キラーペプチド(配列番号:2)特異的CTLを含んでいた(図33)。これらの脾細胞をWT1キラーペプチド(配列番号:2)の添加下で培養したところ、カクテルワクチンbを投与したマウスの脾細胞は、キラーワクチンbを投与したマウスの脾細胞と比べて、2.6倍のIFN―γ産生量を示した(図34A-B)。これらの脾細胞を腫瘍細胞の存在下でWT1キラーペプチドに加えて免疫チェックポイント阻害剤(図35-37)あるいは共刺激分子アゴニスト抗体(図38-39)を添加して培養したところ、これらの併用剤によってカクテルワクチンbを投与したマウスの脾細胞は実施例7と同様に著しく活性化したが、キラーワクチンbを投与したマウスの脾細胞はほとんど活性化されなかった。これらの結果より、腫瘍中において、免疫チェックポイント阻害剤、共刺激分子アゴニスト剤によってWT1抗原ペプチド特異的CTLのWT1ペプチドおよび腫瘍細胞に対する反応性が増強されるためには、投与されるWT1ワクチンにキラーペプチドとヘルパーペプチドの双方が含まれていることが重要であることが明らかとなった。
配列番号:3 ペプチド
配列番号:4 ペプチド
配列番号:5 ペプチド
配列番号:6 ペプチド
配列番号:7 ペプチド
配列番号:8 ペプチド
配列番号:9 ペプチド
配列番号:10 ペプチド
配列番号:11 ペプチド
配列番号:12 ペプチド
配列番号:13 ペプチド
配列番号:14 ペプチド
配列番号:15 ペプチド
配列番号:16 ペプチド
配列番号:17 ペプチド
配列番号:18 ペプチド
配列番号:19 ペプチド
配列番号:20 ペプチド
配列番号:21 ペプチド
配列番号:22 ペプチド
配列番号:23 ペプチド
配列番号:24 ペプチド
配列番号:25 ペプチド
配列番号:26 ペプチド
配列番号:27 ペプチド
配列番号:28 ペプチド
配列番号:29 ペプチド
配列番号:30 ペプチド
配列番号:31 ペプチド
配列番号:32 ペプチド
配列番号:33 ペプチド
配列番号:34 ペプチド
配列番号:35 ペプチド
配列番号:36 ペプチド
配列番号:37 ペプチド
配列番号:38 ペプチド
配列番号:39 ペプチド
配列番号:40 ペプチド
配列番号:41 式(1)の化合物
配列番号:42 式(2)の化合物
配列番号:43 式(3)の化合物
配列番号:44 ペプチド
配列番号:45 ペプチド
配列番号:46 ペプチド
Claims (37)
- 免疫調節剤と併用される、WT1抗原ペプチドまたはその薬学上許容される塩を含む、癌を治療または予防するための医薬組成物。
- WT1抗原ペプチドまたはその薬学上許容される塩と併用される、免疫調節剤を含む、癌を治療または予防するための医薬組成物。
- 免疫調節剤とWT1抗原ペプチドまたはその薬学上許容される塩とを含む、癌を治療または予防するための医薬組成物。
- WT1抗原ペプチドがWT1キラーペプチドである、請求項1~3のいずれかに記載の医薬組成物。
- WT1キラーペプチドまたはその薬学上許容される塩が、
RMFPNAPYL (配列番号:2)、
CMTWNQMNL (配列番号:3)、
CYTWNQMNL (配列番号:4)、
ALLPAVPSL (配列番号:5)、
SLGEQQYSV (配列番号:6)、
RVPGVAPTL (配列番号:7)、
VLDFAPPGA、(配列番号:8)、
C-CMTWNQMNL (配列番号:9)(式中、CとCの間の結合はジスルフィド結合を表す。)、
C-CYTWNQMNL (配列番号:10)(式中、CとCの間の結合はジスルフィド結合を表す。)
RYFPNAPYL (配列番号:21)、および
YMFPNAPYL (配列番号:26)から選択されるいずれかのアミノ酸配列からなるペプチド;
前記配列番号2~10、21および26から選択されるいずれかのアミノ酸配列において、1個~数個のアミノ酸が、欠失、置換、および/または付加されたアミノ酸配列を含み且つCTL誘導活性を有するペプチド;もしくは
式(1):
で表される化合物、
式(2):
で表される化合物、および
式(3):
で表される化合物
からなる群から選択される化合物;またはその薬学上許容される塩である、請求項4に記載の医薬組成物。 - WT1ヘルパーペプチドまたはその薬学上許容される塩をさらに含む、請求項4~6のいずれかに記載の医薬組成物。
- WT1ヘルパーペプチドまたはその薬学上許容される塩と併用される、請求項4~6のいずれかに記載の医薬組成物。
- WT1ヘルパーペプチドまたはその薬学上許容される塩が、
以下:
KRYFKLSHLQMHSRKH (配列番号:11)、
SGQARMFPNAPYLPSCLES(配列番号:12)、
RSDELVRHHNMHQRNMTKL (配列番号:13)、
PGCNKRYFKLSHLQMHSRKHTG (配列番号:14)、
CNKRYFKLSHLQMHSRK (配列番号:15)、
CNKRYFKLSHLQMHSRKH (配列番号:16)、
CNKRYFKLSHLQMHSRKHTG (配列番号:17)、
WAPVLDFAPPGASAYGSL (配列番号:18)、
CWAPVLDFAPPGASAYGSL (配列番号:19)、
WAPVLDFAPPGASAYGSLC (配列番号:20)、および
SGQAYMFPNAPYLPSCLES (配列番号:37)
から選択されるいずれかのアミノ酸配列からなるペプチド;もしくは
前記配列番号11~20から選択されるいずれかのアミノ酸配列において、1個~数個のアミノ酸が、欠失、置換、および/または付加されたアミノ酸配列を含み且つヘルパーT細胞誘導活性を有するペプチド;またはその薬学上許容される塩である、請求項7または8に記載の医薬組成物。 - 癌ワクチンとして使用される、請求項1~9のいずれかに記載の医薬組成物。
- 免疫調節剤が、
(1)免疫チェックポイント阻害剤、
(2)共刺激分子アゴニスト剤、
(3)免疫活性化剤、および
(4)低分子阻害剤
からなる群から選択される1以上の薬剤である、請求項1~10のいずれかに記載の医薬組成物。 - 免疫調節剤が、抗体、核酸、タンパク質、ペプチドまたは低分子化合物である、請求項11に記載の医薬組成物。
- 免疫調節剤が、免疫チェックポイント阻害剤である、請求項11または12に記載の医薬組成物。
- 免疫チェックポイント阻害剤が、
(1)CTLA-4、
(2)PD-1、
(3)LAG-3、
(4)BTLA、
(5)KIR、
(6)TIM-3、
(7)PD-L1、
(8)PD-L2、
(9)B7-H3、
(10)B7-H4、
(11)HVEM、
(12)GAL9、
(13)CD160、
(14)VISTA、
(15)BTNL2、
(16)TIGIT、
(17)PVR、
(18)BTN1A1、
(19)BTN2A2、
(20)BTN3A2、および
(21)CSF-1R
からなる群から選択される分子に対する1以上の薬剤である、請求項11~13のいずれかに記載の医薬組成物。 - 免疫チェックポイント阻害剤が、CTLA-4、PD-1、LAG-3、TIM-3、BTLA、VISTA、HVEM、TIGIT、PVR、PD-L1およびCD160からなる群から選択される分子に対する1以上の薬剤である、請求項14に記載の医薬組成物。
- 免疫チェックポイント阻害剤が、PD-1またはPD-L1に対する薬剤である、請求項15に記載の医薬組成物。
- 免疫チェックポイント阻害剤が、抗体である、請求項11~16のいずれかに記載の医薬組成物。
- 免疫チェックポイント阻害剤が、PD-1またはPD-L1に対する抗体である、請求項17のいずれかに記載の医薬組成物。
- PD-1に対する抗体が、ニボルマブまたはペンブロリズマブである、請求項18に記載の医薬組成物。
- PD-L1に対する抗体が、Durvalumab、MPDL3280AまたはBMS-936559である、請求項19に記載の医薬組成物。
- 免疫調節剤が、共刺激分子アゴニスト剤である、請求項11に記載の医薬組成物。
- 共刺激分子アゴニスト剤が、
(1)4-1BB、
(2)4-1BB-L、
(3)OX40、
(4)OX40-L、
(5)GITR、
(6)CD28、
(7)CD40、
(8)CD40-L、
(9)ICOS、
(10)ICOS-L、
(11)LIGHT、および
(12)CD27
からなる群から選択される分子に対する1以上の薬剤である、請求項21に記載の医薬組成物。 - 共刺激分子アゴニスト剤が、4-1BB、OX40、GITR、CD40およびICOSからなる群から選択される分子に対する1以上の薬剤である、請求項22に記載の医薬組成物。
- 免疫調節剤が、免疫活性化剤である、請求項11に記載の医薬組成物。
- 免疫活性化剤が、Toll様受容体(TLR)作動薬である、請求項24記載の医薬組成物。
- TLR作動薬が、
(1)TLR1/2作動薬、
(2)TLR2作動薬、
(3)TLR3作動薬、
(4)TLR4作動薬、
(5)TLR5作動薬、
(6)TLR6/2作動薬、
(7)TLR7作動薬、
(8)TLR7/8作動薬、
(9)TLR7/9作動薬、
(10)TLR8作動薬、
(11)TLR9作動薬、および
(12)TLR11作動薬
からなる群から選択される1以上の薬剤である、請求項25に記載の医薬組成物。 - TLR作動薬が、TLR3作動薬、TLR7作動薬、TLR7/8作動薬、およびTLR9作動薬からなる群から選択される1以上の薬剤である、請求項26に記載の医薬組成物。
- 免疫調節剤が、低分子阻害剤である、請求項11に記載の医薬組成物。
- 低分子阻害剤が、β―カテニン阻害剤、IDO阻害剤、COX-2阻害剤、CXCR4阻害剤、STAT3阻害剤およびマルチキナーゼ阻害剤からなる群から選択される薬剤である、請求項28に記載の医薬組成物。
- 低分子阻害剤が、β―カテニン阻害剤である、請求項29に記載の医薬組成物。
- 癌が、白血病、骨髄異形成症候群、多発性骨髄腫、悪性リンパ腫、胃癌、大腸癌、肺癌、乳癌、胚細胞癌、肝癌、皮膚癌、膀胱癌、前立腺癌、子宮癌、子宮頸癌、卵巣癌、脳腫瘍、骨癌、膵癌、頭頚部癌、皮膚または眼窩内悪性メラノーマ、直腸癌、肛門部癌、精巣癌、卵管のカルシノーマ、子宮内膜カルシノーマ、子宮頚部カルシノーマ、膣カルシノーマ、外陰部カルシノーマ、ホジキン病、非ホジキンリンパ腫、食道癌、小腸癌、内分泌系癌、甲状腺癌、副甲状腺癌、副腎癌、柔組織肉腫、尿道癌、陰茎癌、急性骨髄性白血病、慢性骨髄性白血病、急性リンパ芽球性白血病、慢性リンパ球性白血病を含む慢性または急性白血病、小児固形癌、リンパ球性リンパ腫、腎臓または尿管の癌、腎盂カルシノーマ、中枢神経系(CNS)腫瘍、原発性CNSリンパ腫、腫瘍新脈管形成、脊椎腫瘍、脳幹グリオーム、下垂体アデノーマ、カポシ肉腫、扁平上皮癌、扁平細胞癌、T細胞リンパ腫、多型性膠芽腫、悪性黒色腫、非小細胞肺がん、腎細胞癌およびアスベスト誘発癌からなる群から選択される、請求項1~30のいずれかに記載の医薬組成物。
- WT1抗原ペプチドと免疫調節剤とが同時に投与される、請求項1~31のいずれかに記載の医薬組成物。
- WT1抗原ペプチドと免疫調節剤とが別々に投与される、請求項1、2、および4~31のいずれかに記載の医薬組成物。
- WT1抗原ペプチドが免疫調節剤の投与前に投与される、請求項1、2、および4~31のいずれかに記載の医薬組成物。
- WT1抗原ペプチドが免疫調節剤の投与後に投与される、請求項1、2、および4~31のいずれかに記載の医薬組成物。
- 薬学上許容される担体をさらに含む、請求項1~35のいずれかに記載の医薬組成物。
- 請求項1~36のいずれかに規定されるWT1抗原ペプチドまたはその薬学上許容される塩と免疫調節剤とを含む、癌を治療または予防するためのキット。
Priority Applications (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CA2986367A CA2986367A1 (en) | 2015-05-20 | 2016-05-19 | Combination use of wt1 antigen peptide and immunomodulator |
| JP2017519401A JP6515182B2 (ja) | 2015-05-20 | 2016-05-19 | Wt1抗原ペプチドおよび免疫調節剤の併用 |
| EP16796570.6A EP3299028A4 (en) | 2015-05-20 | 2016-05-19 | COMBINATION OF ANTIGEN WT1 PEPTIDE AND IMMUNOMODULATOR |
| US15/575,162 US20180140691A1 (en) | 2015-05-20 | 2016-05-19 | Combination use of wt1 antigen peptide and immunomodulator |
| CN201680042322.XA CN107921106B (zh) | 2015-05-20 | 2016-05-19 | Wt1抗原肽和免疫调节剂的组合用途 |
| HK18107308.2A HK1250213A1 (zh) | 2015-05-20 | 2018-06-05 | Wt1抗原肽和免疫調節劑的組合 |
| HK18108240.1A HK1248546A1 (zh) | 2015-05-20 | 2018-06-27 | Wt1抗原肽和免疫調節劑的組合 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015-103145 | 2015-05-20 | ||
| JP2015103145 | 2015-05-20 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2016186177A1 true WO2016186177A1 (ja) | 2016-11-24 |
Family
ID=57320344
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2016/064923 WO2016186177A1 (ja) | 2015-05-20 | 2016-05-19 | Wt1抗原ペプチドおよび免疫調節剤の併用 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20180140691A1 (ja) |
| EP (1) | EP3299028A4 (ja) |
| JP (4) | JP6515182B2 (ja) |
| CN (1) | CN107921106B (ja) |
| CA (1) | CA2986367A1 (ja) |
| HK (2) | HK1250213A1 (ja) |
| WO (1) | WO2016186177A1 (ja) |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018101309A1 (ja) * | 2016-11-30 | 2018-06-07 | 大日本住友製薬株式会社 | Wt1ヘルパーペプチド及びこれと癌抗原ペプチドコンジュゲート体との組合せ |
| CN108431022A (zh) * | 2015-11-20 | 2018-08-21 | 纪念斯隆凯特林癌症中心 | 用于治疗癌症的方法和组合物 |
| WO2020067453A1 (ja) | 2018-09-28 | 2020-04-02 | 大日本住友製薬株式会社 | 注射用組成物 |
| JP2020515632A (ja) * | 2017-03-15 | 2020-05-28 | キャンサー リサーチ マレーシア | 免疫原性ペプチド組成物 |
| JP2020531854A (ja) * | 2017-08-28 | 2020-11-05 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 癌の治療および診断のためのtim−3アンタゴニスト |
| JP2021513992A (ja) * | 2018-02-19 | 2021-06-03 | コリア ユニバーシティ リサーチ アンド ビジネス ファウンデーションKorea University Research And Business Foundation | 熱ショックタンパク質のエピトープを含むワクチン及びこの用途 |
| WO2021117771A1 (ja) | 2019-12-10 | 2021-06-17 | 大日本住友製薬株式会社 | ペプチドエマルション製剤の調製方法 |
| JP2022031915A (ja) * | 2017-10-05 | 2022-02-22 | フルクラム セラピューティクス,インコーポレイテッド | Fshdの治療のためにdux4および下流遺伝子発現を低減するp38キナーゼ阻害剤 |
| EP3952908A4 (en) * | 2019-04-10 | 2023-01-11 | SLSG Limited LLC | MULTIVALENT THERAPEUTIC COMPOSITION AND METHODS OF USE FOR TREATING WT1 POSITIVE EXPRESSION CANCERS |
| US11759509B2 (en) | 2013-03-29 | 2023-09-19 | Sumitomo Pharma Co., Ltd. | WT1 antigen peptide conjugate vaccine |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11364304B2 (en) | 2016-08-25 | 2022-06-21 | Northwestern University | Crosslinked micellar spherical nucleic acids |
| US11696954B2 (en) | 2017-04-28 | 2023-07-11 | Exicure Operating Company | Synthesis of spherical nucleic acids using lipophilic moieties |
| AU2019352354A1 (en) * | 2018-10-05 | 2021-05-13 | International Institute Of Cancer Immunology, Inc. | Prophylactic or therapeutic drug for benign tumor |
| WO2021021924A1 (en) * | 2019-07-29 | 2021-02-04 | Huang Cai Gu | Formulation of antibody based drugs for treating lung cancer by inhalation |
| US20230255978A1 (en) * | 2020-05-12 | 2023-08-17 | Board Of Regents, The University Of Texas System | Methods for treating glioblastoma |
| CN111647066B (zh) * | 2020-07-01 | 2020-12-18 | 维肽瀛(上海)生物技术有限公司 | Wt1多肽肿瘤抑制剂 |
| KR20230163364A (ko) * | 2021-03-31 | 2023-11-30 | 셀레론 테라퓨틱스 리미티드 | 백신 보조제 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013531970A (ja) * | 2010-04-13 | 2013-08-15 | セルデックス・セラピューティクス・インコーポレイテッド | ヒトcd27に結合する抗体およびその使用 |
| JP2014027935A (ja) * | 2006-05-03 | 2014-02-13 | Regents Of The Univ Of Colorado A Body Corprate:The | Cd40アゴニスト抗体/i型インターフェロン相乗性アジュバントの結合体、それを含む複合体、および細胞性免疫を強化する治療としてのその使用 |
| WO2014134165A1 (en) * | 2013-02-26 | 2014-09-04 | Memorial Sloan-Kettering Cancer Center | Compositions and methods for immunotherapy |
| JP2014169282A (ja) * | 2013-02-05 | 2014-09-18 | Nitto Denko Corp | 粘膜投与用wt1ペプチド癌ワクチン組成物 |
| JP2014221795A (ja) * | 2006-10-20 | 2014-11-27 | ユニバーシティ・オブ・サザンプトン | Cd27アゴニストを単独でまたは他の免疫調節剤と併用して用いる、ヒト免疫療法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2511538C (en) * | 2002-12-30 | 2013-11-26 | 3M Innovative Properties Company | Immunostimulatory combinations |
| DE602004023476D1 (de) * | 2003-01-15 | 2009-11-19 | Chugai Pharmaceutical Co Ltd | Dimerisiertes peptid |
| CA2520172C (en) * | 2003-03-27 | 2012-10-02 | Lankenau Institute For Medical Research | Novel methods for the treatment of cancer with an indoleamine 2, 3-dioxygenase inhibitor |
| US20040197312A1 (en) * | 2003-04-02 | 2004-10-07 | Marina Moskalenko | Cytokine-expressing cellular vaccine combinations |
| AU2004255470B2 (en) * | 2003-07-10 | 2010-08-19 | Cytos Biotechnology Ag | Packaged virus-like particles |
| EP1670513B1 (en) * | 2003-10-06 | 2013-01-23 | Cedars-Sinai Medical Center | Cox-2 inhibitors and dendritic cells for use in the treatment of cancer. |
| MX2008013993A (es) * | 2006-05-03 | 2009-05-11 | Univ Colorado | Combinación adyuvante sinergistica de anticuerpo agonista de cd40/interferona tipo 1, conjugados que la contienen y uso de los mismos como un terapeutico para aumentar la inmunidad celular. |
| DK2370593T3 (en) * | 2008-11-28 | 2016-07-04 | Univ Emory | A method for determining the effect of PD-1 Antagonists |
| KR101208587B1 (ko) * | 2009-06-24 | 2012-12-06 | 여오영 | 하이드록시클로로퀸을 포함하는 항암 치료를 위한 국소 투여용 주사제 조성물 |
| CN103157108B (zh) * | 2011-12-13 | 2016-01-20 | 宁云山 | 免疫调节剂组合物及其药物组合物和应用 |
| CA2858876A1 (en) * | 2011-12-15 | 2013-06-20 | The University Of Chicago | Methods and compositions for cancer therapy using mutant light molecules with increased affinity to receptors |
| AR090263A1 (es) * | 2012-03-08 | 2014-10-29 | Hoffmann La Roche | Terapia combinada de anticuerpos contra el csf-1r humano y las utilizaciones de la misma |
| CN103830211A (zh) * | 2012-11-27 | 2014-06-04 | 上海曼克尔瑞生物医药技术有限公司 | 一种β-catenin蛋白抑制剂-姜黄素在肝癌治疗方面的应用 |
| CA2907782C (en) * | 2013-03-29 | 2021-01-05 | Sumitomo Dainippon Pharma Co., Ltd. | Wt1 antigen peptide conjugate vaccine |
| JP2016527303A (ja) * | 2013-08-05 | 2016-09-08 | ケンブリッジ エンタープライズ リミテッド | がん免疫療法におけるcxcr4シグナル伝達の阻害 |
-
2016
- 2016-05-19 WO PCT/JP2016/064923 patent/WO2016186177A1/ja active Application Filing
- 2016-05-19 JP JP2017519401A patent/JP6515182B2/ja active Active
- 2016-05-19 CN CN201680042322.XA patent/CN107921106B/zh active Active
- 2016-05-19 CA CA2986367A patent/CA2986367A1/en active Pending
- 2016-05-19 US US15/575,162 patent/US20180140691A1/en active Pending
- 2016-05-19 EP EP16796570.6A patent/EP3299028A4/en active Pending
-
2018
- 2018-06-05 HK HK18107308.2A patent/HK1250213A1/zh unknown
- 2018-06-27 HK HK18108240.1A patent/HK1248546A1/zh unknown
-
2019
- 2019-04-15 JP JP2019076826A patent/JP6713160B2/ja active Active
-
2020
- 2020-01-29 JP JP2020012396A patent/JP6956967B2/ja active Active
-
2021
- 2021-09-22 JP JP2021154508A patent/JP7253210B2/ja active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014027935A (ja) * | 2006-05-03 | 2014-02-13 | Regents Of The Univ Of Colorado A Body Corprate:The | Cd40アゴニスト抗体/i型インターフェロン相乗性アジュバントの結合体、それを含む複合体、および細胞性免疫を強化する治療としてのその使用 |
| JP2014221795A (ja) * | 2006-10-20 | 2014-11-27 | ユニバーシティ・オブ・サザンプトン | Cd27アゴニストを単独でまたは他の免疫調節剤と併用して用いる、ヒト免疫療法 |
| JP2013531970A (ja) * | 2010-04-13 | 2013-08-15 | セルデックス・セラピューティクス・インコーポレイテッド | ヒトcd27に結合する抗体およびその使用 |
| JP2014169282A (ja) * | 2013-02-05 | 2014-09-18 | Nitto Denko Corp | 粘膜投与用wt1ペプチド癌ワクチン組成物 |
| WO2014134165A1 (en) * | 2013-02-26 | 2014-09-04 | Memorial Sloan-Kettering Cancer Center | Compositions and methods for immunotherapy |
Non-Patent Citations (3)
| Title |
|---|
| FU, C. ET AL.: "beta-catenin-mediated inhibition of croos-priming: A new mechanism for tumors to evade immunosurveilance", ONCOIMMUNOLOGY, vol. 2, no. 12, 2013, pages e26920, XP055331155, ISSN: 2162-4011 * |
| RIETHER, C. ET AL.: "Blocking programmed cell death 1 in combination with adoptive cytotoxic T- cell transfer eradicates chronic myelogenous leukemia stem cells", LEUKEMIA, vol. 29, no. 8, February 2015 (2015-02-01), pages 1781 - 5, XP055331159, ISSN: 1476-5551 * |
| STATHER, D. ET AL.: "High PD-1 Levels at Baseline are Associated With Unfavourable Clinical Outocome in a Wilms Tumour Gene 1 (Wt1) Peptide Vaccination Setting in Leukaemia Patients", J IMMUNOTHER, vol. 34, no. 9, 2011, pages 704, XP009507550, ISSN: 1524-9557 * |
Cited By (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11759509B2 (en) | 2013-03-29 | 2023-09-19 | Sumitomo Pharma Co., Ltd. | WT1 antigen peptide conjugate vaccine |
| JP6991969B2 (ja) | 2015-11-20 | 2022-03-03 | メモリアル スローン ケタリング キャンサー センター | 癌を治療するための方法及び組成物 |
| CN108431022A (zh) * | 2015-11-20 | 2018-08-21 | 纪念斯隆凯特林癌症中心 | 用于治疗癌症的方法和组合物 |
| JP2018538265A (ja) * | 2015-11-20 | 2018-12-27 | メモリアル スローン ケタリング キャンサー センター | 癌を治療するための方法及び組成物 |
| CN108431022B (zh) * | 2015-11-20 | 2022-08-09 | 纪念斯隆凯特林癌症中心 | 用于治疗癌症的方法和组合物 |
| US11033613B2 (en) | 2015-11-20 | 2021-06-15 | Memorial Sloan Kettering Cancer Center | Methods and compositions for treating cancer |
| JPWO2018101309A1 (ja) * | 2016-11-30 | 2019-11-21 | 大日本住友製薬株式会社 | Wt1ヘルパーペプチド及びこれと癌抗原ペプチドコンジュゲート体との組合せ |
| JP7209963B2 (ja) | 2016-11-30 | 2023-01-23 | 住友ファーマ株式会社 | Wt1ヘルパーペプチド及びこれと癌抗原ペプチドコンジュゲート体との組合せ |
| WO2018101309A1 (ja) * | 2016-11-30 | 2018-06-07 | 大日本住友製薬株式会社 | Wt1ヘルパーペプチド及びこれと癌抗原ペプチドコンジュゲート体との組合せ |
| JP7103571B2 (ja) | 2017-03-15 | 2022-07-20 | キャンサー リサーチ マレーシア | 免疫原性ペプチド組成物 |
| JP2020515632A (ja) * | 2017-03-15 | 2020-05-28 | キャンサー リサーチ マレーシア | 免疫原性ペプチド組成物 |
| JP2020531854A (ja) * | 2017-08-28 | 2020-11-05 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 癌の治療および診断のためのtim−3アンタゴニスト |
| JP2022031915A (ja) * | 2017-10-05 | 2022-02-22 | フルクラム セラピューティクス,インコーポレイテッド | Fshdの治療のためにdux4および下流遺伝子発現を低減するp38キナーゼ阻害剤 |
| JP2021513992A (ja) * | 2018-02-19 | 2021-06-03 | コリア ユニバーシティ リサーチ アンド ビジネス ファウンデーションKorea University Research And Business Foundation | 熱ショックタンパク質のエピトープを含むワクチン及びこの用途 |
| JP7301391B2 (ja) | 2018-02-19 | 2023-07-03 | アストン エスシーアイ. インコーポレイテッド | 熱ショックタンパク質のエピトープを含むワクチン及びこの用途 |
| WO2020067453A1 (ja) | 2018-09-28 | 2020-04-02 | 大日本住友製薬株式会社 | 注射用組成物 |
| EP3952908A4 (en) * | 2019-04-10 | 2023-01-11 | SLSG Limited LLC | MULTIVALENT THERAPEUTIC COMPOSITION AND METHODS OF USE FOR TREATING WT1 POSITIVE EXPRESSION CANCERS |
| WO2021117771A1 (ja) | 2019-12-10 | 2021-06-17 | 大日本住友製薬株式会社 | ペプチドエマルション製剤の調製方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6515182B2 (ja) | 2019-05-15 |
| HK1248546A1 (zh) | 2018-10-19 |
| EP3299028A1 (en) | 2018-03-28 |
| US20180140691A1 (en) | 2018-05-24 |
| CA2986367A1 (en) | 2016-11-24 |
| CN107921106A (zh) | 2018-04-17 |
| JP2022000454A (ja) | 2022-01-04 |
| HK1250213A1 (zh) | 2018-12-07 |
| JP2019135251A (ja) | 2019-08-15 |
| JP6956967B2 (ja) | 2021-11-02 |
| JP7253210B2 (ja) | 2023-04-06 |
| EP3299028A4 (en) | 2019-02-27 |
| JP2020075934A (ja) | 2020-05-21 |
| JPWO2016186177A1 (ja) | 2018-04-12 |
| JP6713160B2 (ja) | 2020-06-24 |
| CN107921106B (zh) | 2023-09-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7253210B2 (ja) | Wt1抗原ペプチドおよび免疫調節剤の併用 | |
| WO2018181648A1 (ja) | Wt1癌抗原ペプチドおよびこれを含むペプチドコンジュゲート体 | |
| JP7209963B2 (ja) | Wt1ヘルパーペプチド及びこれと癌抗原ペプチドコンジュゲート体との組合せ | |
| JP2017171678A (ja) | 新規ctlエピトープ4連結ペプチド | |
| WO2019131722A1 (ja) | Wt1由来ペプチドのコンジュゲート体およびこれを含む組成物 | |
| JP6077641B2 (ja) | 新規ctlエピトープ5連結ペプチド | |
| JP7209986B2 (ja) | 癌を処置するための医薬組成物 | |
| JP7162675B2 (ja) | 注射用組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 16796570 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2017519401 Country of ref document: JP Kind code of ref document: A Ref document number: 2986367 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 15575162 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2016796570 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 201680042322.X Country of ref document: CN |