WO2014050340A1 - 吸収性物品 - Google Patents
吸収性物品 Download PDFInfo
- Publication number
- WO2014050340A1 WO2014050340A1 PCT/JP2013/071930 JP2013071930W WO2014050340A1 WO 2014050340 A1 WO2014050340 A1 WO 2014050340A1 JP 2013071930 W JP2013071930 W JP 2013071930W WO 2014050340 A1 WO2014050340 A1 WO 2014050340A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- heat
- layer
- acid
- blood
- chain hydrocarbon
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F13/51104—Topsheet, i.e. the permeable cover or layer facing the skin the top sheet having a three-dimensional cross-section, e.g. corrugations, embossments, recesses or projections
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F13/51113—Topsheet, i.e. the permeable cover or layer facing the skin comprising an additive, e.g. lotion or odour control
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/15577—Apparatus or processes for manufacturing
- A61F13/15707—Mechanical treatment, e.g. notching, twisting, compressing, shaping
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/45—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the shape
- A61F13/47—Sanitary towels, incontinence pads or napkins
- A61F13/475—Sanitary towels, incontinence pads or napkins characterised by edge leakage prevention means
- A61F13/4751—Sanitary towels, incontinence pads or napkins characterised by edge leakage prevention means the means preventing fluid flow in a transversal direction
- A61F13/4756—Sanitary towels, incontinence pads or napkins characterised by edge leakage prevention means the means preventing fluid flow in a transversal direction the means consisting of grooves, e.g. channels, depressions or embossments, resulting in a heterogeneous surface level
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F13/5116—Topsheet, i.e. the permeable cover or layer facing the skin being formed of multiple layers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F13/513—Topsheet, i.e. the permeable cover or layer facing the skin characterised by its function or properties, e.g. stretchability, breathability, rewet, visual effect; having areas of different permeability
- A61F13/51394—Topsheet, i.e. the permeable cover or layer facing the skin characterised by its function or properties, e.g. stretchability, breathability, rewet, visual effect; having areas of different permeability creating a visual effect, e.g. having a printed or coloured topsheet, printed or coloured sub-layer but being visible from the topsheet, other than embossing for purposes of bonding, wicking, acquisition, leakage-prevention
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/84—Accessories, not otherwise provided for, for absorbent pads
- A61F13/8405—Additives, e.g. for odour, disinfectant or pH control
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/20—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing organic materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/22—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing macromolecular materials
- A61L15/34—Oils, fats, waxes or natural resins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/50—Lubricants; Anti-adhesive agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/15203—Properties of the article, e.g. stiffness or absorbency
- A61F2013/15284—Properties of the article, e.g. stiffness or absorbency characterized by quantifiable properties
- A61F2013/15422—Density
- A61F2013/15439—Density with a density gradient in the vertical plane
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F2013/51002—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers with special fibres
- A61F2013/51014—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers with special fibres characterized by the connection between the fibres
- A61F2013/51016—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers with special fibres characterized by the connection between the fibres followed by a distension heat treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F2013/51059—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers being sprayed with chemicals
- A61F2013/51066—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers being sprayed with chemicals for rendering the surface hydrophilic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F2013/51059—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers being sprayed with chemicals
- A61F2013/51073—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers being sprayed with chemicals with lubricants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/84—Accessories, not otherwise provided for, for absorbent pads
- A61F13/8405—Additives, e.g. for odour, disinfectant or pH control
- A61F2013/8455—Additives, e.g. for odour, disinfectant or pH control being lubricants
Abstract
Description
そこで、本発明は、液体透過性層から吸収体への向上した経血移行性を有し、液体透過性層に残存する経血を低減させることができる吸収性物品を提供することを目的とする。
態様1に係る吸収性物品は、液体透過性層と、液体不透過性層と、前記液体透過性層及び前記液体不透過性層の間に設けられた吸収体とを備えた吸収性物品であって、前記液体透過性層は、肌当接面及び非肌当接面を有する第1層と、前記第1層の非肌当接面側に設けられた第2層とを有し、前記第2層は、熱収縮性繊維層が熱収縮した層であり、前記第1層は、接合部によって前記熱収縮性繊維層と部分的に接合された熱伸長性繊維層が、前記熱収縮性繊維層の熱収縮及び前記熱伸長性繊維層の熱伸長によって変形した層であり、前記肌当接面のうち少なくとも排泄口当接領域には、前記熱伸長性繊維層の変形によって生じた、肌当接面側に隆起する凸部が形成されており、前記排泄口当接領域のうち少なくとも前記凸部には、40℃における動粘度が0.01~80mm2/s、抱水率が0.01~4.0質量%、重量平均分子量が1,000未満である血液滑性付与剤が塗工されている、前記吸収性物品である。
(i)炭化水素、
(ii) (ii-1)炭化水素部分と、(ii-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)及びオキシ基(-O-)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、及び
(iii) (iii-1)炭化水素部分と、(iii-2)炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)及びオキシ基(-O-)から成る群から選択される、一又は複数の、同一又は異なる基と、(iii-3)炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)及びヒドロキシル基(-OH)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、
並びにそれらの任意の組み合わせから成る群から選択される(ここで、(ii)又は(iii)の化合物において、オキシ基が2つ以上挿入されている場合には、各オキシ基は隣接していない)。
(i’)炭化水素、
(ii’) (ii’-1)炭化水素部分と、(ii’-2)炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、及びエーテル結合(-O-)から成る群から選択される、一又は複数の、同一又は異なる結合とを有する化合物、及び
(iii’) (iii’-1)炭化水素部分と、(iii’-2)炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、及びエーテル結合(-O-)から成る群から選択される、一又は複数の、同一又は異なる結合と、(iii’-3)炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)及びヒドロキシル基(-OH)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、
並びにそれらの任意の組み合わせから成る群から選択される(ここで、(ii’)又は(iii’)の化合物において、2以上の同一又は異なる結合が挿入されている場合には、各結合は隣接していない)。
(A) (A1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル、
(B) (B1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル、
(C) (C1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸又はオキソ酸と、(C2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル、
(D)鎖状炭化水素部分と、鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、及びカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物、
(E)ポリオキシC3~C6アルキレングリコール、又はそのアルキルエステル若しくはアルキルエーテル、及び
(F)鎖状炭化水素、
並びにそれらの任意の組み合わせから成る群から選択される。
以下、生理用ナプキンを例とし、図面に基づいて、本発明の吸収性物品の実施形態を説明する。
(1)トップシートの測定すべき範囲を、鋭利な刃物、例えば、カッターの替え刃を用いて、できるだけその厚さを変化させないように切り出して、サンプルを得る。
(2)サンプルの面積:SA(m2)及び質量:SM0(g)を測定する。
(3)サンプルを、血液滑性付与剤を溶解させることができる溶媒、例えば、エタノール、アセトン等の中で、少なくとも3分間攪拌し、血液滑性付与剤を溶媒中に溶解させる。
(4)サンプルを、質量を測定したろ紙の上でろ過し、ろ紙上で、サンプルを溶媒で十分に洗浄する。ろ紙上のサンプルを、60℃のオーブン内で乾燥させる。
(5)ろ紙及びサンプルの質量を測定し、そこからろ紙の質量を減ずることにより、乾燥後のサンプルの質量:SM1(g)を算出する。
(6)血液滑性付与剤の坪量BBS(g/m2)を、次の式:
BBS(g/m2)=[SM0(g)-SM1(g)]/SA(m2)
により算出する。
なお、誤差を少なくするために、サンプルの総面積が100cm2を超えるように、複数の吸収性物品から複数のサンプルを採取し、複数回実験を繰り返し、それらの平均値を採用する。
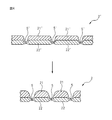
熱伸長性繊維は、加熱処理により実際の繊維長が伸長する繊維(例えば、樹脂の結晶状態が変化して実際の繊維長が伸長する繊維)であってもよいし、加熱処理により実際の繊維長は伸長しないが、見かけ上の繊維長が伸長する繊維(例えば、発現していたジクザク状、Ω状、スパイラル状等の捲縮が解除されて見かけ上の繊維長が伸長する捲縮繊維)であってもよい。
配向指数(%)=X/Y×100
[式中、Xは、熱伸長性複合繊維における樹脂の複屈折の値であり、Yは、樹脂の固有複屈折の値である。]
坪量の測定は、例えば、次の方法を使用することができる。
(1)測定すべき範囲にマークを付け、その面積:SAα(m2)を測定する。なお、誤差を少なくするために、サンプルの総面積が5cm2を超えるように、マーキングする。
(2)マーキングされた範囲を、鋭利な刃物、例えば、カッターの替え刃で切り出し、その総質量:TM(g)を測定する。
(3)測定すべき範囲の坪量BSα(g/m2)を、次の式:
BSα(g/m2)=TM(g)/SAα(m2)
により求める。
異なる5箇所(測定面φ44mm)を測定圧3g/cm2(定圧)で10秒間加圧した後、厚み計((株)大栄科学精器製作所,FS-60DS)を用いて測定する。
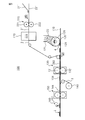
以下、生理用ナプキン1の製造方法を例として、本発明に係る吸収性物品の製造方法の一実施形態を説明する。
本実施形態に係る製造方法は、吸収体を形成する工程(工程1)と、吸収体にトップシートを積層する工程(工程2)と、バックシートを積層する工程(工程3)と、生理用ナプキンを切り出す工程(工程4)と、生理用ナプキンに血液滑性付与剤を塗工する工程(工程5)とを含み、図5に示す製造装置100が使用される。
搬送方向MDへ回転するサクションドラム120の周面には、吸収体材料122を詰める型として凹部124が周方向に所要のピッチで形成されている。サクションドラム120が回転して凹部124が材料供給部121へ進入すると、サクション部126が凹部124に作用し、材料供給部121から供給された吸収体材料122は凹部124に真空吸引される。材料供給部121は、サクションドラム120を覆うように形成されており、材料供給部121は、吸収体材料122を空気搬送により凹部124に対して供給し、凹部124には吸収体4が形成される。凹部124に形成された吸収体4は、搬送方向MDに向かって進むキャリアシート110上に転写される。
トップシート2が吸収体4に積層され、積層体262が形成される。
その後、積層体262には、必要に応じて圧搾溝が形成される。圧搾溝は、エンボス加工装置130により形成される。エンボス加工装置130は、凸部(不図示)が外周表面に設けられた上段ロール131と、外周の表面が平滑である下段ロール132とを有する。上段ロール131の凸部は、圧搾溝の形状、配置パターン等に対応するように形成されている。積層体262がエンボス加工装置130の上段ロール131と下段ロール132との間を通過すると、積層体262が厚さ方向に圧縮され、積層体262に圧搾溝が形成される。圧搾溝は、例えば、トップシート2のうち、排泄口当接領域20の周縁、排泄口当接領域20の周囲領域の周縁等に形成される。圧搾溝の形成により、トップシート2は吸収体4と一体化される。エンボス加工装置130による圧搾溝の形成工程は、必要がない場合には省略される。
バックシートロール140から供給されたバックシート3を、積層体134の下側(トップシートと反対側)の面に、接着剤層を介して積層し、生理用ナプキンの連続体144を形成する。なお、エンボス加工装置130による圧搾溝の形成工程が省略される場合、積層体134及び積層体262は同一である。
カッタ150を使用して生理用ナプキンの連続体144を切断し、生理用ナプキンを切り出す。
スプレー160を使用して生理用ナプキンのトップシート2に血液滑性付与剤161を塗工して、トップシート2の表面に血液滑性付与剤層を形成する。血液滑性付与剤層は、トップシート2の肌当接面のうち、少なくとも排泄口当接領域20に形成される。
血液滑性付与剤は、40℃における動粘度が約0.01~約80mm2/sであり、抱水率が約0.05~約4.0質量%であり、重量平均分子量が約1,000未満である。
(1)40℃の恒温室に、20mLの試験管、ゴム栓、測定すべき物質及び脱イオン水を一昼夜静置する。
(2)恒温室で、試験管に、測定すべき物質5.0gと、脱イオン水5.0gを投入する。
(3)恒温室で、試験管の口をゴム栓をし、試験管を1回転させ、5分間静置する。
(4)恒温室で、測定すべき物質の層(通常は、上層)3.0gを、直径90mmの、質量:W0(g)のガラス製シャーレに採取する。
(5)シャーレを、オーブン内で、105℃で3時間加熱し、水分を蒸発させ、シャーレごと、質量:W1(g)を測定する。
(6)抱水率を、以下の式に従って算出する。
抱水率(質量%)=100×[W0(g)-W1(g)]/3.0(g)
測定は3回実施し、平均値を採用する。
Mw=ΣNiMi 2/ΣNiMi
により求められるMwを意味する。
GPCの測定条件としては、例えば、以下が挙げられる。
機種:(株)日立ハイテクノロジーズ製 高速液体クロマトグラム Lachrom Elite
カラム:昭和電工(株)製 SHODEX KF-801、KF-803及びKF-804
溶離液:THF
流量 :1.0mL/分
打込み量:100μL
検出:RI(示差屈折計)
なお、本明細書の実施例に記載される重量平均分子量は、上記条件により測定したものである。
IOB(Inorganic Organic Balance)は、親水性及び親油性のバランスを示す指標であり、本明細書では、小田らによる次式:
IOB=無機性値/有機性値
により算出される値を意味する。
藤田氏による、主要な基の有機性値及び無機性値を、下記表1にまとめる。
(i)炭化水素、
(ii) (ii-1)炭化水素部分と、(ii-2)炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)及びオキシ基(-O-)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、及び
(iii) (iii-1)炭化水素部分と、(iii-2)炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)及びオキシ基(-O-)から成る群から選択される、一又は複数の、同一又は異なる基と、(iii-3)炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)及びヒドロキシル基(-OH)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、
並びにそれらの任意の組み合わせから成る群から選択される。
鎖状炭化水素には、直鎖状炭化水素及び分岐鎖状炭化水素が含まれる。
(i’)炭化水素、
(ii’) (ii’-1)炭化水素部分と、(ii’-2)炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、及びエーテル結合(-O-)から成る群から選択される、一又は複数の、同一又は異なる結合とを有する化合物、及び
(iii’) (iii’-1)炭化水素部分と、(iii’-2)炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、及びエーテル結合(-O-)から成る群から選択される、一又は複数の、同一又は異なる結合と、(iii’-3)炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)及びヒドロキシル基(-OH)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、
並びにそれらの任意の組み合わせから成る群から選択される。
(A) (A1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル、
(B) (B1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル、
(C) (C1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸又はオキソ酸と、(C2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル、
(D)鎖状炭化水素部分と、鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、及びカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物、
(E)ポリオキシC3~C6アルキレングリコール、又はそのアルキルエステル若しくはアルキルエーテル、及び
(F)鎖状炭化水素、
並びにそれらの任意の組み合わせから成る群から選択される。
以下、(A)~(F)に従う血液滑性付与剤について詳細に説明する。
(A)(A1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル(以下、「化合物(A)」と称する場合がある)は、上述の動粘度、抱水率及び重量平均分子量を有する限り、全てのヒドロキシル基がエステル化されていなくともよい。
化合物(A)としては、例えば、(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル、(a2)鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステル、及び(a3)鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステルが挙げられる。
鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステルとしては、例えば、次の式(1):
(式中、R1~R4は、それぞれ、鎖状炭化水素である)
また、ペンタエリトリトールと脂肪酸とのエステルとしては、抱水率の値を小さくする観点から、ジエステル、トリエステル又はテトラエステルであることが好ましく、トリエステル又はテトラエステルであることがより好ましく、そしてテトラエステルであることがさらに好ましい。
なお、IOBの計算に当たっては、二重結合、三重結合、iso分岐、及びtert分岐の影響は、考慮していない(以下、同様である)。
鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステルとしては、例えば、次の式(5):
のグリセリンと脂肪酸とのモノエステルが挙げられる。
グリセリンと脂肪酸とのトリエステルは、いわゆる、脂肪であり、人体を構成しうる成分であるため、安全性の観点から好ましい。
鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステルとしては、例えば、C2~C6の鎖状炭化水素ジオール、例えば、C2~C6のグリコール、例えば、エチレングリコール、プロピレングリコール、ブチレングリコール、ペンチレングリコール又はヘキシレングリコールと、脂肪酸とのモノエステル又はジエステルが挙げられる。
R8COOCkH2kOCOR9 (8)
(式中、kは、2~6の整数であり、そしてR8及びR9は、それぞれ、鎖状炭化水素である)
のC2~C6グリコールと脂肪酸とのジエステル、及び次の式(9):
R8COOCkH2kOH (9)
(式中、kは、2~6の整数であり、そしてR8は、鎖状炭化水素である)
のC2~C6グリコールと脂肪酸とのモノエステルが挙げられる。
さらに、C2~C6グリコールと脂肪酸とのエステルとしては、抱水率の値を小さくする観点から、ジエステルであることが好ましい。
C2~C6グリコールと脂肪酸とのエステルの市販品としては、例えば、コムポールBL、コムポールBS(以上、日油株式会社製)等が挙げられる。
(B) (B1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル(以下、「化合物(B)」と称する場合がある)は、上述の動粘度、抱水率及び重量平均分子量を有する限り、全てのヒドロキシル基がエーテル化されていなくともよい。
の、ペンタエリトリトールと脂肪族1価アルコールとのテトラエーテル、トリエーテル、ジエーテル及びモノエーテルが挙げられる。
の、グリセリンと脂肪族1価アルコールとのトリエーテル、ジエーテル及びモノエーテルが挙げられる。
R17OCnH2nOR18 (17)
(式中、nは、2~6の整数であり、そしてR17及びR18は、それぞれ、鎖状炭化水素である)
のC2~C6グリコールと脂肪族1価アルコールとのジエーテル、及び次の式(18):
R17OCnH2nOH (18)
(式中、nは、2~6の整数であり、そしてR17は、鎖状炭化水素である)
のC2~C6グリコールと脂肪族1価アルコールとのモノエーテルが挙げられる。
また、IOBを約0.00~約0.60とする観点から考察すると、式(18)に示されるエチレングリコール(n=2)と脂肪族1価アルコールとのモノエーテルでは、R17部分の炭素数が、約8以上であることが好ましい(炭素数が8の場合に、IOBが0.60となる)。
(C) (C1)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸又はオキソ酸と、(C2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル(以下、「化合物(C)」と称する場合がある)は、上述の動粘度、抱水率及び重量平均分子量を有する限り、全てのカルボキシル基がエステル化されていなくともよい。
(C2)鎖状炭化水素部分と、鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物としては、「化合物(B)」の項で列挙されるもの、例えば、脂肪族1価アルコールが挙げられる。
化合物(C)の例としては、アジピン酸ジオクチル、O-アセチルクエン酸トリブチル等が挙げられ、そして市販されている。
(D)鎖状炭化水素部分と、鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、及びカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物(以下、「化合物(D)」と称する場合がある)としては、(d1)脂肪族1価アルコールと脂肪族1価アルコールとのエーテル、(d2)ジアルキルケトン、(d3)脂肪酸と脂肪族1価アルコールとのエステル、及び(d4)ジアルキルカーボネートが挙げられる。
脂肪族1価アルコールと脂肪族1価アルコールとのエーテルとしては、次の式(19):
R19OR20 (19)
(式中、R19及びR20は、それぞれ、鎖状炭化水素である)
を有する化合物が挙げられる。
ジアルキルケトンとしては、次の式(20):
R21COR22 (20)
(式中、R21及びR22は、それぞれ、アルキル基である)
を有する化合物が挙げられる。
ジアルキルケトンは、市販されている他、公知の方法、例えば、第二級アルコールを、クロム酸等で酸化することにより得ることができる。
脂肪酸と脂肪族1価アルコールとのエステルとしては、例えば、次の式(21):
R23COOR24 (21)
(式中、R23及びR24は、それぞれ、鎖状炭化水素である)
を有する化合物が挙げられる。
ジアルキルカーボネートとしては、次の式(22):
R25OC(=O)OR26 (22)
(式中、R25及びR26は、それぞれ、アルキル基である)
を有する化合物が挙げられる。
ジアルキルカーボネートは、市販されている他、ホスゲンとアルコールとの反応、塩化ギ酸エステルとアルコール又はアルコラートとの反応、及び炭酸銀とヨウ化アルキルとの反応により合成することができる。
なお、(d2)ジアルキルケトンにおいて、炭素数の合計が約8の場合、例えば、5-ノナノンでは、融点は約-50℃であり、蒸気圧は20℃で約230Paである。
(E)ポリオキシC3~C6アルキレングリコール、又はそのアルキルエステル若しくはアルキルエーテル(以下、化合物(E)と称する場合がある)としては、(e1)ポリオキシC3~C6アルキレングリコール、(e2)ポリオキシC3~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル、(e3)ポリオキシC3~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテルが挙げられる。以下、説明する。
ポリオキシC3~C6アルキレングリコールは、i)オキシC3~C6アルキレン骨格、すなわち、オキシプロピレン骨格、オキシブチレン骨格、オキシペンチレン骨格、及びオキシヘキシレン骨格から成る群から選択されるいずれか1種の骨格を有し且つ両末端にヒドロキシ基を有するホモポリマー、ii)上記群から選択される2種以上の骨格を有し且つ両末端にヒドロキシ基を有するブロックコポリマー、又はiii)上記群から選択される2種以上の骨格を有し且つ両末端にヒドロキシ基を有するランダムコポリマーを意味する。
HO-(CmH2mO)n-H (23)
(式中、mは3~6の整数である)
により表わされる。
ポリオキシC3~C6アルキレングリコールと少なくとも1の脂肪酸とのエステルとしては、「(e1)ポリオキシC3~C6アルキレングリコール」の項で説明したポリオキシC3~C6アルキレングリコールのOH末端の一方又は両方が、脂肪酸によりエステル化されているもの、すなわち、モノエステル及びジエステルが挙げられる。
ポリオキシC3~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテルとしては、「(e1)ポリオキシC3~C6アルキレングリコール」の項で説明したポリオキシC3~C6アルキレングリコールのOH末端の一方又は両方が、脂肪族1価アルコールによりエーテル化されているもの、すなわち、モノエーテル及びジエーテルが挙げられる。
ポリオキシC3~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテルにおいて、エーテル化すべき脂肪族1価アルコールとしては、例えば、「化合物(B)」の項で列挙されている脂肪族1価アルコールが挙げられる。
鎖状炭化水素としては、例えば、(f1)鎖状アルカン、例えば、直鎖アルカン及び分岐鎖アルカンが挙げられる。直鎖アルカンは、融点が約45℃以下の場合には、炭素数が約22以下となり、そして蒸気圧が1気圧及び25℃で約0.01Pa以下である場合には、炭素数が約13以上となる。分岐鎖アルカンは、直鎖アルカンよりも、同一炭素数において融点が低い傾向がある。従って、分岐鎖アルカンは、融点が約45℃以下の場合でも、炭素数が22以上のものも含むことができる。
炭化水素の市販品としては、例えば、パールリーム6(日油株式会社)が挙げられる。
排泄口当接領域20のうち少なくとも凸部8には、血液滑性付与剤が単独で塗工されていてもよいし、血液滑性付与剤と、少なくとも1種の他の成分とを含有する血液滑性付与剤含有組成物が塗工されていてもよい。
血液滑性付与剤含有組成物は、上述の血液滑性付与剤と、少なくとも1種の他の成分とを含有する。他の成分としては、血液滑性付与剤の作用効果を阻害しないものであれば特に制限されず、当業界で吸収性物品、特にトップシートに慣用的に適用されるものを使用することができる。
なお、血液滑性付与剤含有組成物が固形物を含む場合には、動粘度及び抱水率の測定において、それらを濾過により取り除くことが好ましい。
以下に、本試験例で用いられた血液滑性付与剤を列挙する。
[(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル]
・ユニスター H-408BRS,日油株式会社製
テトラ2-エチルヘキサン酸ペンタエリトリトール,重量平均分子量:約640
・ユニスター H-2408BRS-22,日油株式会社製
テトラ2-エチルヘキサン酸ペンタエリトリトールと、ジ2-エチルヘキサン酸ネオペンチルグリコールとの混合物(58:42、重量比),重量平均分子量:約520
・Cetiol SB45DEO,コグニスジャパン株式会社製
脂肪酸が、オレイン酸又はステアリル酸である、グリセリンと脂肪酸とのトリエステル
・SOY42,日油株式会社製
C14の脂肪酸:C16の脂肪酸:C18の脂肪酸:C20の脂肪酸(飽和脂肪酸及び不飽和脂肪酸の両方を含む)がおおよそ0.2:11:88:0.8の質量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:880
C8の脂肪酸:C10の脂肪酸:C12の脂肪酸がおおよそ37:7:56の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約570
・トリCL油脂肪酸グリセリド,日油株式会社製
C8の脂肪酸:C12の脂肪酸がおおよそ44:56の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約570
C8の脂肪酸:C10の脂肪酸がおおよそ85:15の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約480
・パナセート800,日油株式会社製
脂肪酸が全てオクタン酸(C8)である、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約470
脂肪酸が全て2-エチルヘキサン酸(C8)である、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約470
・NA36,日油株式会社製
C16の脂肪酸:C18の脂肪酸:C20の脂肪酸(飽和脂肪酸及び不飽和脂肪酸の両方を含む)がおおよそ5:92:3の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約880
C8の脂肪酸:C10の脂肪酸:C12の脂肪酸:C14の脂肪酸:C16の脂肪酸(飽和脂肪酸及び不飽和脂肪酸の両方を含む)がおおよそ4:8:60:25:3の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:670
・カプリル酸ジグリセリド,日油株式会社製
脂肪酸がオクタン酸である、グリセリンと脂肪酸とのジエステル,重量平均分子量:340
・ユニスター H-208BRS,日油株式会社製
ジ2-エチルヘキサン酸ネオペンチルグリコール,重量平均分子量:約360
・コムポールBL,日油株式会社製
ブチレングリコールのドデカン酸(C12)モノエステル,重量平均分子量:約270
・コムポールBS,日油株式会社製
ブチレングリコールのオクタデカン酸(C18)モノエステル,重量平均分子量:約350
・O-アセチルクエン酸トリブチル,東京化成工業株式会社製
重量平均分子量:約400
・クエン酸トリブチル,東京化成工業株式会社製
重量平均分子量:約360
・アジピン酸ジオクチル,和光純薬工業製
重量平均分子量:約380
・エレクトールWE20,日油株式会社製
ドデカン酸(C12)と、ドデシルアルコール(C12)とのエステル,重量平均分子量:約360
・エレクトールWE40,日油株式会社製
テトラデカン酸(C14)と、ドデシルアルコール(C12)とのエステル,重量平均分子量:約390
・ユニオールPB500,日油株式会社製
ポリブチレングリコール,重量平均分子量:約500
・ユニオールPB700,日油株式会社製
ポリオキシブチレンポリオキシプロピレングリコール,重量平均分子量:約700
・パールリーム6,日油株式会社製
流動イソパラフィン、イソブテン及びn-ブテンを共重合し、次いで水素を付加することにより生成された分岐鎖炭化水素、重合度:約5~約10,重量平均分子量:約330
・NA50,日油株式会社製
NA36に水素を付加し、原料である不飽和脂肪酸に由来する二重結合の比率を下げたグリセリンと脂肪酸とのトリエステル,重量平均分子量:約880
・(カプリル酸/カプリン酸)モノグリセリド,日油株式会社製
オクタン酸(C8)及びデカン酸(C10)がおおよそ85:15の重量比で含まれている、グリセリンと脂肪酸とのモノエステル,重量平均分子量:約220
・Monomuls 90-L2ラウリン酸モノグリセリド,コグニスジャパン株式会社製
重量平均分子量:約230
・リンゴ酸ジイソステアリル
重量平均分子量:約640
・ユニオールPB1000R,日油株式会社製
ポリブチレングリコール,重量平均分子量:約1,000
・ユニオールD-250,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約250
ポリプロピレングリコール,重量平均分子量:約400
・ユニオールD-700,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約700
・ユニオールD-1000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約1,000
・ユニオールD-1200,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約1,160
ポリプロピレングリコール,重量平均分子量:約2,030
・ユニオールD-3000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約3,000
・ユニオールD-4000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約4,000
ポリエチレングリコール,重量平均分子量:約1,500~約1,600
・ウィルブライトcp9,日油株式会社製
ポリブチレングリコールの両末端のOH基が、ヘキサデカン酸(C16)によりエステル化された化合物,重量平均分子量:約1,150
・ユニルーブMS-70K,日油株式会社製
ポリプロピレングリコールのステアリルエーテル,約15の繰返し単位,重量平均分子量:約1,140
ポリオキシエチレンモノステアレート、約7の繰返し単位、重量平均分子量:約880
・ユニルーブ5TP-300KB
ペンタエリトリトール1モルに、エチレンオキシド5モルと、プロピレンオキシド65モルとを付加させることにより生成した、ポリオキシエチレンポリオキシプロピレンペンタエリスリトールエーテル,重量平均分子量:4,130
ポリオキシエチレンポリオキシプロピレンポリオキシブチレングリセリン,重量平均分子量:約960
・ユニオール TG-330,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約6の繰返し単位,重量平均分子量:約330
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約1,000
・ユニオール TG-3000,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約3,000
・ユニオール TG-4000,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約4,000
ポリプロピレングリコールのジグリセリルエーテル,約9の繰返し単位,重量平均分子量:約700
・ユニオックスHC60,日油株式会社製
ポリオキシエチレン硬化ヒマシ油,重量平均分子量:約3,570
・ワセリン,コグニスジャパン株式会社製
石油に由来する炭化水素、半固形
[大量の血液を吸収した際の経血の表面残存率A]
生理用ナプキンが一度に大量の血液を吸収した場合の吸収性を評価する実験を行った。
親水剤で処理されたエアスルー不織布(ポリエステル及びポリエチレンテレフタレートから成る複合繊維、坪量:35g/m2)から形成されたトップシートと、エアスルー不織布(ポリエステル及びポリエチレンテレフタレートから成る複合繊維、坪量:30g/m2)から形成されたセカンドシートと、パルプ(坪量:150~450g/m2、中央部ほど多い)、アクリル系高吸収ポリマー(坪量:15g/m2)及びコアラップとしてのティッシュを含む吸収体と、撥水剤処理されたサイドシートと、ポリエチレンフィルムから成るバックシートとを準備した。
次いで、バックシート、吸収体、セカンドシート、そして畝溝面を上にしてトップシートを順に重ね合わせることにより、生理用ナプキンNo.1-1を形成した。
また、血液滑性付与剤は、トップシートの肌当接面のほぼ全面に、そして畝部及び溝部の両方に塗工された。
トップシートの質量:W2(g)(試験前のトップシートの質量)を測定した後、吸収性物品の長手方向及び幅方向の中央部且つトップシートの上に、穴の開いたアクリル板(200mm×100mm,125g,中央に、40mm×10mmの穴が開いている)を置き、上記穴から、37±1℃のウマEDTA血(ウマの血液に、凝結防止のため、エチレンジアミン四酢酸(以下、「EDTA」と称する)が添加されたもの)4.0gを、ピペットを用いて滴下した。
表面残存率A(質量%)
=100×[W3(g)-W2(g)]/4.0(g)
○:タック性なし
△:若干のタック性有り
×:タック性有り
[少量の血液を吸収した際の経血の表面残存率B]
生理用ナプキンが少量の血液を吸収した場合の吸収性を評価する実験を行った。
親水剤で処理されたエアスルー不織布(ポリエステル及びポリエチレンテレフタレートから成る複合繊維、坪量:35g/m2)から形成されたトップシート(以下、「畝溝を有するトップシート」と称する場合がある)と、エアスルー不織布(ポリエステル及びポリエチレンテレフタレートから成る複合繊維、坪量:30g/m2)から形成されたセカンドシートと、パルプ(坪量:150~450g/m2、中央部ほど多い)、アクリル系高吸収ポリマー(坪量:15g/m2)及びコアラップとしてのティッシュを含む吸収体と、撥水剤処理されたサイドシートと、ポリエチレンフィルムから成るバックシートとを準備した。
次いで、バックシート、吸収体、セカンドシート、そして畝溝面を上にしてトップシートを順に重ね合わせることにより、生理用ナプキンNo.2-1(i)を形成した。
また、血液滑性付与剤は、トップシートの肌当接面のほぼ全面に、そして畝溝構造を有するトップシートでは、畝部及び溝部の両方に塗工された。
トップシートの質量:W4(g)(試験前のトップシートの質量)を測定した後、吸収性物品の長手方向及び幅方向の中央のトップシートの上に、37±1℃のウマEDTA血約0.25g(2滴)をピペットから滴下した。なお、畝溝を有するトップシートでは、畝部の頂部にウマEDTA血を滴下した。
表面残存率B(質量%)
=100×(W5(g)-W4(g))/W6(g)
なお、W6(g)は、滴下前後のピペットの質量から算出した、滴下されたウマEDTA血の質量である。
結果を、下記表3に示す。
[血液滑性付与剤を含む血液の粘性]
血液滑性付与剤を含む血液の粘性を、Rheometric Expansion System ARES(Rheometric Scientific,Inc)を用いて測定した。ウマ脱繊維血に、パナセート810sを2質量%添加し、軽く撹拌して試料を形成し、直径50mmのパラレルプレートに試料を載せ、ギャップを100μmとし、37±0.5℃で粘度を測定した。パラレルプレートゆえ、試料に均一なせん断速度はかかっていないが、機器に表示された平均せん断速度は、10s-1であった。
[血液滑性付与剤を含む血液の顕微鏡写真]
健常ボランティアの経血を、食品保護用ラップフィルム上に採取し、その一部に、10倍の質量のリン酸緩衝生理食塩水中に分散されたパナセート810sを、パナセート810sの濃度が1質量%となるように添加した。経血を、スライドグラスに適下し、カバーグラスをかけ、光学顕微鏡にて、赤血球の状態を観察した。血液滑性付与剤を含まない経血の顕微鏡写真を図7(a)に、そしてパナセート810sを含む経血の顕微鏡写真を図7(b)に示す。
[血液滑性付与剤を含む血液の表面張力]
血液滑性付与剤を含む血液の表面張力を、協和界面科学社製接触角計 Drop Master500を用い、ペンダントドロップ法にて測定した。表面張力は、ヒツジ脱繊維血に、所定の量の血液滑性付与剤を添加し、十分振とうした後に測定した。
測定は、機器が自動で行うが、表面張力γは、以下の式により求められる(図8を参照)。
g:重力定数
1/H:ds/deから求められる補正項
ρ:密度
de:最大直径
ds:滴下端よりdeだけ上がった位置での径
測定には、京都電子工業株式会社のDA-505を用いた。
結果を、下記表4に示す。
血液の表面張力を下げることにより、吸収した血液をトップシートの繊維間に保持せず、速やかに吸収体に移行させることができると考えられる。
(1)サンプルA1~C1,A2~C2の調製
3種類の市販の生理用ナプキンA~Cを準備した。
生理用ナプキンA(ユニ・チャーム社製「ソフィ肌おもい」)は、液体透過性層として、肌当接面に凹凸構造が形成されたトップシート(PET/HDPE芯鞘型複合繊維で構成されるエアスルー不織布,目付:35g/m2)と、トップシート及び吸収体の間に配置されたセカンドシート(PET/HDPE芯鞘型複合繊維で構成されるエアスルー不織布,目付:38g/m2)とを有する。トップシートの肌当接面に形成されている凹凸構造は、特開2008-2034号公報に記載の方法に従って形成された畝溝構造であり、畝部の厚みは約1.5mm、溝部の厚みが約0.4mm、畝溝構造のピッチ(畝部の幅+溝部の幅)は約4mm、溝部に形成された開孔部の開孔率は約15%であった。
[試験方法]
各サンプルの肌当接面上に、穴の開いたアクリル板(200mm×100mm,125g,中央に、40mm×10mmの穴が開いている)を置き、穴から、37±1℃のウマEDTA血(ウマの血液に、凝結防止のため、エチレンジアミン四酢酸(EDTA)が添加されたもの)3mLを、ピペットを用いて滴下(1回目)し、1分後、37±1℃のウマEDTA血3mLを、アクリル板の穴から、ピペットで再度滴下した(2回目)。滴下速度は90mL/分とした。
サンプルA1のリウェット量は0.05g、吸収体移行速度は8秒であり、サンプルA2のリウェット量は1.06g、吸収体移行速度は60秒以上であった。
(1)サンプルD1,D2の調製
非熱収縮性繊維層(坪量:15g/m2)及び熱収縮性繊維層(坪量:15g/m2)をそれぞれ上層及び下層に有する積層シートを調製した。非熱収縮性繊維層は、PET/PE芯鞘型複合繊維(3.3dtex×51mm,芯に酸化チタン4%含有)の含有量が100重量%であるウェブであり、熱収縮性繊維層(潜在捲縮性繊維層)は、coPP(PP共重合体)/PPサイド・バイ・サイド型複合繊維(2.2dtex×51mm)の含有量が20重量%、PET/PE芯鞘型複合繊維(2.2dtex×51mm,芯に酸化チタン4%含有)の含有量が80重量%であるウェブである。なお、いずれの繊維も界面活性剤で親水化処理されている。
[試験方法]
各サンプルの肌当接面上に、穴の開いたアクリル板(200mm×100mm,125g,中央に40mm×10mmの穴が開いている)を置き、穴から、37±1℃のウマEDTA血(ウマの血液に、凝結防止のため、エチレンジアミン四酢酸(EDTA)が添加されたもの)3mLを、ピペットを用いて滴下(1回目)し、1分後、37±1℃のウマEDTA血3mLを、アクリル板の穴から、ピペットで再度滴下した(2回目)。滴下速度は90mL/分とした。各滴下後、アクリル板の穴に滞留する馬血が無くなるまでの時間を測定し、これを浸透時間(秒)とするとともに、トップシートの表面及び内部から馬血が無くなるまでの時間(血液の赤さが見られなくなるまでの時間)を測定し、これを吸収体移行速度(ハケ速度)(秒)とした。
リウェット率(%)=100×(試験後のろ紙質量-当初のろ紙質量)/6
サンプルD1では、浸透速度(1回目)が2秒、浸透速度(2回目)が2.67秒、吸収体移行速度(1回目)が12.42秒、吸収体移行速度(2回目)が27.78秒、リウェット率が1.2%であった。
(1)サンプルE1,E2の調製
非熱収縮性繊維層(坪量:15g/m2)及び熱収縮性繊維層(坪量:15g/m2)をそれぞれ上層及び下層に有する積層シートを調製した。非熱収縮性繊維層は、PET/PE芯鞘型複合繊維(3.3dtex×51mm,芯に酸化チタン4%含有)の含有量が100重量%であるウェブであり、熱収縮性繊維層(潜在捲縮性繊維層)は、coPP(PP共重合体)/PPサイド・バイ・サイド型複合繊維(2.2dtex×51mm)の含有量が20重量%、PET/PE芯鞘型複合繊維(2.2dtex×44mm,芯に酸化チタン4%含有)の含有量が80重量%であるウェブである。なお、いずれの繊維も界面活性剤で親水化処理されている。
熱収縮性繊維層(潜在捲縮性繊維層)における質量混合比を、coPP(PP共重合体)/PPサイド・バイ・サイド型複合繊維:PET/PE芯鞘型複合繊維=5:5に変更した点を除き、サンプルE1,E2と同様にして、サンプルF1,F2を作製した。なお、熱処理前の坪量は17.5g/m2、熱処理後の坪量は165g/m2であった。
[試験方法]
各サンプルの肌当接面上に、穴の開いたアクリル板(200mm×100mm,125g,中央に40mm×10mmの穴が開いている)を置き、穴から、37±1℃のウマEDTA血(ウマの血液に、凝結防止のため、エチレンジアミン四酢酸(EDTA)が添加されたもの)3mLを、ピペットを用いて滴下(1回目)し、1分後、37±1℃のウマEDTA血3mLを、アクリル板の穴から、ピペットで再度滴下した(2回目)。滴下速度は90mL/分とした。2回目の血液の滴下後、1分間放置し、以下の式に従って、血液残存率を算出した。
血液残存率(%)=100×(試験後のサンプル質量-当初のサンプル質量)/6
血液残存率は、サンプルE1では17.3%、サンプルE2では26.6%、サンプルF1では10.2%、サンプルF2では17.8%であった。
(1)サンプルG1,G2の調製
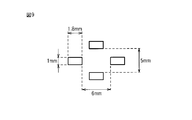
PET/PE芯鞘型複合繊維(3.3dtex×51mm,芯に酸化チタン4%含有)を使用して熱伸長性繊維層を形成した。熱伸長性繊維層は、坪量44g/m2,厚み1.6mmのウェブである。このウェブを、処理温度130℃、加圧時間1秒、圧力15kgf/mm2でエンボス加工した。この際、1辺が9mm、長い方の対角線が15mmの菱形状凸部が1mm間隔で配置されたエンボスパターンを使用した。なお、間隔1mmの部分によって幅1mmの凸部がウェブ表面に形成された。
PET/PE芯鞘型複合繊維(3.3dtex×51mm,芯に酸化チタン4%含有)を使用して非熱伸長性繊維層を形成した。熱伸長性繊維層は、坪量44g/m2,厚み1.2mmのウェブである。このウェブを使用して、サンプルG1,G2と同様にして、サンプルH1,H2を調製した。
試験例8と同様にして、浸透時間,吸収体移行時間(ハケ時間),リウェット率を測定した。
サンプルG1では、浸透速度(1回目)が2秒、浸透速度(2回目)が2.59秒、吸収体移行速度(1回目)が5.29秒、吸収体移行速度(2回目)が15.89秒、リウェット率が8.9%であった。
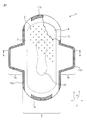
2 トップシート(液体透過性層)
3 バックシート(液体不透過性層)
4 吸収体
5 圧搾部(接合部)
8 凸部
9 凹部
Claims (11)
- 液体透過性層と、液体不透過性層と、前記液体透過性層及び前記液体不透過性層の間に設けられた吸収体とを備えた吸収性物品であって、
前記液体透過性層は、肌当接面及び非肌当接面を有する第1層と、前記第1層の非肌当接面側に設けられた第2層とを有し、
前記第2層は、熱収縮性繊維層が熱収縮した層であり、
前記第1層は、接合部によって前記熱収縮性繊維層と部分的に接合された熱伸長性繊維層が、前記熱収縮性繊維層の熱収縮及び前記熱伸長性繊維層の熱伸長によって変形した層であり、
前記肌当接面のうち少なくとも排泄口当接領域には、前記熱伸長性繊維層の変形によって生じた、肌当接面側に隆起する凸部が形成されており、
前記排泄口当接領域のうち少なくとも前記凸部には、40℃における動粘度が0.01~80mm2/s、抱水率が0.01~4.0質量%、重量平均分子量が1,000未満である血液滑性付与剤が塗工されている、前記吸収性物品。 - 前記第2層の密度が前記第1層の密度よりも大きい、請求項1に記載の吸収性物品。
- 前記第2層の密度が0.1g/cm3以下である、請求項2に記載の吸収性物品。
- 前記第1層の密度が0.05g/cm3以下である、請求項2又は3に記載の吸収性物品。
- 前記接合部が、前記熱伸長性繊維層及び前記熱収縮性繊維層を厚さ方向に一体化する圧搾部である、請求項1~4のいずれか1項に記載の吸収性物品。
- 前記血液滑性付与剤のIOBが、0.00~0.60のIOBである、請求項1~5のいずれか1項に記載の吸収性物品。
- 前記血液滑性付与剤が、次の(i)~(iii):
(i)炭化水素、
(ii) (ii-1)炭化水素部分と、(ii-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)及びオキシ基(-O-)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、及び
(iii) (iii-1)炭化水素部分と、(iii-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)及びオキシ基(-O-)から成る群から選択される、一又は複数の、同一又は異なる基と、(iii-3)前記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)及びヒドロキシル基(-OH)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、
並びにそれらの任意の組み合わせから成る群から選択され、
ここで、(ii)又は(iii)の化合物において、オキシ基が2つ以上挿入されている場合には、各オキシ基は隣接していない、
請求項1~6のいずれか1項に記載の吸収性物品。 - 前記血液滑性付与剤が、次の(i’)~(iii’):
(i’)炭化水素、
(ii’) (ii’-1)炭化水素部分と、(ii’-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、及びエーテル結合(-O-)から成る群から選択される、一又は複数の、同一又は異なる結合とを有する化合物、及び
(iii’) (iii’-1)炭化水素部分と、(iii’-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、及びエーテル結合(-O-)から成る群から選択される、一又は複数の、同一又は異なる結合と、(iii’-3)前記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)及びヒドロキシル基(-OH)から成る群から選択される、一又は複数の、同一又は異なる基とを有する化合物、
並びにそれらの任意の組み合わせから成る群から選択され、
ここで、(ii’)又は(iii’)の化合物において、2以上の同一又は異なる結合が挿入されている場合には、各結合は隣接していない、
請求項1~7のいずれか1項に記載の吸収性物品。 - 前記血液滑性付与剤が、次の(A)~(F):
(A) (A1)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル、
(B) (B1)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル、
(C) (C1)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸又はオキソ酸と、(C2)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル、
(D)鎖状炭化水素部分と、前記鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、及びカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物、
(E)ポリオキシC3~C6アルキレングリコール、又はそのアルキルエステル若しくはアルキルエーテル、及び
(F)鎖状炭化水素、
並びにそれらの任意の組み合わせから成る群から選択される、請求項1~8のいずれか1項に記載の吸収性物品。 - 前記血液滑性付与剤が、(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル、(a2)鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステル、(a3)鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステル、(b1)鎖状炭化水素テトラオールと少なくとも1の脂肪族1価アルコールとのエーテル、(b2)鎖状炭化水素トリオールと少なくとも1の脂肪族1価アルコールとのエーテル、(b3)鎖状炭化水素ジオールと少なくとも1の脂肪族1価アルコールとのエーテル、(c1)4個のカルボキシル基を有する鎖状炭化水素テトラカルボン酸、ヒドロキシ酸、アルコキシ酸又はオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、(c2)3個のカルボキシル基を有する鎖状炭化水素トリカルボン酸、ヒドロキシ酸、アルコキシ酸又はオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、(c3)2個のカルボキシル基を有する鎖状炭化水素ジカルボン酸、ヒドロキシ酸、アルコキシ酸又はオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、(d1)脂肪族1価アルコールと脂肪族1価アルコールとのエーテル、(d2)ジアルキルケトン、(d3)脂肪酸と脂肪族1価アルコールとのエステル、(d4)ジアルキルカーボネート、(e1)ポリオキシC3~C6アルキレングリコール、(e2)ポリオキシC3~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル、(e3)ポリオキシC3~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテル、及び(f1)鎖状アルカン、並びにそれらの任意の組み合わせから成る群から選択される、請求項1~9のいずれか1項に記載の吸収性物品。
- 前記血液滑性付与剤が、1気圧及び40℃において、0.00~0.01Paの蒸気圧を有する、請求項1~10のいずれか1項に記載の吸収性物品。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP13841496.6A EP2901983B1 (en) | 2012-09-28 | 2013-08-14 | Absorbent article |
| CN201380037659.8A CN104470481B (zh) | 2012-09-28 | 2013-08-14 | 吸收性物品 |
| US14/429,840 US9724249B2 (en) | 2012-09-28 | 2013-08-14 | Absorbent article |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012-218866 | 2012-09-28 | ||
| JP2012218866A JP6021566B2 (ja) | 2012-09-28 | 2012-09-28 | 吸収性物品 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2014050340A1 true WO2014050340A1 (ja) | 2014-04-03 |
Family
ID=50387752
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2013/071930 WO2014050340A1 (ja) | 2012-09-28 | 2013-08-14 | 吸収性物品 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US9724249B2 (ja) |
| EP (1) | EP2901983B1 (ja) |
| JP (1) | JP6021566B2 (ja) |
| CN (1) | CN104470481B (ja) |
| WO (1) | WO2014050340A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106031684A (zh) * | 2015-03-11 | 2016-10-19 | 金红叶纸业集团有限公司 | 一种薄型材料及吸收制品 |
| TWI763882B (zh) * | 2017-10-11 | 2022-05-11 | 日商優你 嬌美股份有限公司 | 吸收性物品的透液性薄片用不織布及不織布卷 |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6021565B2 (ja) * | 2012-09-28 | 2016-11-09 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP6062199B2 (ja) * | 2012-09-28 | 2017-01-18 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP5745487B2 (ja) * | 2012-09-28 | 2015-07-08 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP6355808B2 (ja) * | 2016-11-08 | 2018-07-11 | 花王株式会社 | 吸収性物品 |
| WO2018088164A1 (ja) * | 2016-11-08 | 2018-05-17 | 花王株式会社 | 吸収性物品 |
| JP2019080907A (ja) * | 2017-10-27 | 2019-05-30 | Jnc株式会社 | 吸収性物品 |
| JP7001444B2 (ja) * | 2017-11-29 | 2022-01-19 | 花王株式会社 | 吸収性物品 |
| CN108096625B (zh) * | 2017-12-14 | 2021-02-09 | 深圳市康乐美科技有限公司 | 抗菌保健护垫 |
| CN110055671A (zh) * | 2019-05-22 | 2019-07-26 | 青岛雪达集团有限公司 | 一种超柔蓬松保湿护肤针织织物及其织造方法 |
Citations (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02191720A (ja) | 1989-01-11 | 1990-07-27 | Daiwabo Co Ltd | 潜在捲縮性複合繊維及びその製造方法 |
| JPH09296325A (ja) | 1996-04-26 | 1997-11-18 | Toyobo Co Ltd | 複合繊維及びその製造法 |
| JP2003247155A (ja) | 2002-02-25 | 2003-09-05 | Kao Corp | 立体シート材料 |
| JP2004218183A (ja) | 2002-12-24 | 2004-08-05 | Kao Corp | 熱融着性複合繊維 |
| JP2005350836A (ja) | 2004-06-14 | 2005-12-22 | Kao Corp | 立体賦形不織布 |
| JP2007177340A (ja) | 2005-12-27 | 2007-07-12 | Kao Corp | 不織布の製造方法 |
| JP2007177335A (ja) | 2005-12-27 | 2007-07-12 | Kao Corp | 潜在捲縮性繊維 |
| JP2007204899A (ja) | 2006-02-06 | 2007-08-16 | Teijin Fibers Ltd | エアレイド不織布用熱接着性複合繊維およびその製造方法 |
| JP2007204901A (ja) | 2006-02-06 | 2007-08-16 | Teijin Fibers Ltd | 熱接着性複合繊維およびその製造方法 |
| JP2007204902A (ja) | 2006-02-06 | 2007-08-16 | Teijin Fibers Ltd | 熱接着性複合繊維およびその製造方法 |
| JP2007303035A (ja) | 2006-05-12 | 2007-11-22 | Teijin Fibers Ltd | 自己伸長性熱接着性複合繊維及びその製造方法 |
| JP2008002034A (ja) | 2006-06-23 | 2008-01-10 | Uni Charm Corp | 不織布、不織布製造方法及び不織布製造装置 |
| JP2008101285A (ja) | 2006-10-17 | 2008-05-01 | Kao Corp | 不織布の製造方法 |
| JP2010518918A (ja) | 2007-02-16 | 2010-06-03 | ザ プロクター アンド ギャンブル カンパニー | ポリプロピレングリコール材料を含むローションを備える吸収性物品 |
| JP2011510801A (ja) | 2008-02-15 | 2011-04-07 | ザ プロクター アンド ギャンブル カンパニー | ポリプロピレングリコール材料を含むローションを備える吸収性物品 |
| JP2011131044A (ja) * | 2009-11-24 | 2011-07-07 | Kao Corp | 吸収性物品 |
| JP2012005701A (ja) | 2010-06-25 | 2012-01-12 | Kao Corp | 吸収性物品の表面シート |
| JP2012055362A (ja) * | 2010-09-06 | 2012-03-22 | Kao Corp | 吸収性物品の表面シート |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2357516A1 (en) * | 2000-09-28 | 2002-03-28 | Uni-Charm Corporation | Absorbent article and barrier agent for absorbent article |
| CN100339520C (zh) | 2002-12-24 | 2007-09-26 | 花王株式会社 | 热熔融粘合性复合纤维 |
| US20100151054A1 (en) * | 2005-10-03 | 2010-06-17 | Taisho Pharmaceutical Co., Ltd. | Emulsion lotion |
| US20090243141A1 (en) | 2006-02-06 | 2009-10-01 | Hironori Goda | Manufacturing method of polyester fiber for airlaid nonwoven fabrics |
| US7674524B2 (en) | 2006-02-06 | 2010-03-09 | Teijin Fibers Limited | Thermoadhesive conjugate fiber and manufacturing method of the same |
| JP5717686B2 (ja) * | 2012-04-02 | 2015-05-13 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP6062199B2 (ja) * | 2012-09-28 | 2017-01-18 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP6112816B2 (ja) * | 2012-09-28 | 2017-04-12 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP6021565B2 (ja) * | 2012-09-28 | 2016-11-09 | ユニ・チャーム株式会社 | 吸収性物品 |
-
2012
- 2012-09-28 JP JP2012218866A patent/JP6021566B2/ja not_active Expired - Fee Related
-
2013
- 2013-08-14 WO PCT/JP2013/071930 patent/WO2014050340A1/ja active Application Filing
- 2013-08-14 CN CN201380037659.8A patent/CN104470481B/zh not_active Expired - Fee Related
- 2013-08-14 US US14/429,840 patent/US9724249B2/en not_active Expired - Fee Related
- 2013-08-14 EP EP13841496.6A patent/EP2901983B1/en not_active Not-in-force
Patent Citations (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02191720A (ja) | 1989-01-11 | 1990-07-27 | Daiwabo Co Ltd | 潜在捲縮性複合繊維及びその製造方法 |
| JPH09296325A (ja) | 1996-04-26 | 1997-11-18 | Toyobo Co Ltd | 複合繊維及びその製造法 |
| JP2003247155A (ja) | 2002-02-25 | 2003-09-05 | Kao Corp | 立体シート材料 |
| JP2004218183A (ja) | 2002-12-24 | 2004-08-05 | Kao Corp | 熱融着性複合繊維 |
| JP2005350836A (ja) | 2004-06-14 | 2005-12-22 | Kao Corp | 立体賦形不織布 |
| JP2007177340A (ja) | 2005-12-27 | 2007-07-12 | Kao Corp | 不織布の製造方法 |
| JP2007177335A (ja) | 2005-12-27 | 2007-07-12 | Kao Corp | 潜在捲縮性繊維 |
| JP2007204899A (ja) | 2006-02-06 | 2007-08-16 | Teijin Fibers Ltd | エアレイド不織布用熱接着性複合繊維およびその製造方法 |
| JP2007204901A (ja) | 2006-02-06 | 2007-08-16 | Teijin Fibers Ltd | 熱接着性複合繊維およびその製造方法 |
| JP2007204902A (ja) | 2006-02-06 | 2007-08-16 | Teijin Fibers Ltd | 熱接着性複合繊維およびその製造方法 |
| JP2007303035A (ja) | 2006-05-12 | 2007-11-22 | Teijin Fibers Ltd | 自己伸長性熱接着性複合繊維及びその製造方法 |
| JP2008002034A (ja) | 2006-06-23 | 2008-01-10 | Uni Charm Corp | 不織布、不織布製造方法及び不織布製造装置 |
| JP2008101285A (ja) | 2006-10-17 | 2008-05-01 | Kao Corp | 不織布の製造方法 |
| JP2010518918A (ja) | 2007-02-16 | 2010-06-03 | ザ プロクター アンド ギャンブル カンパニー | ポリプロピレングリコール材料を含むローションを備える吸収性物品 |
| JP2011510801A (ja) | 2008-02-15 | 2011-04-07 | ザ プロクター アンド ギャンブル カンパニー | ポリプロピレングリコール材料を含むローションを備える吸収性物品 |
| JP2011131044A (ja) * | 2009-11-24 | 2011-07-07 | Kao Corp | 吸収性物品 |
| JP2012005701A (ja) | 2010-06-25 | 2012-01-12 | Kao Corp | 吸収性物品の表面シート |
| JP2012055362A (ja) * | 2010-09-06 | 2012-03-22 | Kao Corp | 吸収性物品の表面シート |
Non-Patent Citations (3)
| Title |
|---|
| "Fiber structure formation in high-speed spinning of core-sheath composite fibers", JOURNAL OF THE SOCIETY OF FIBER SCIENCE AND TECHNOLOGY, JAPAN, vol. 51, no. 9, 1995, pages 408 |
| "Plastic materials in polymer processing", 10 February 1998, SIGMA PUBLISHING, article "Typical materials used in polymer processing" |
| FUJITA A.: "Organic compound predictions and organic paradigms", KAGAKU NO RYOIKI (JOURNAL OF JAPANESE CHEMISTRY, vol. 11, no. 10, 1957, pages 719 - 725 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106031684A (zh) * | 2015-03-11 | 2016-10-19 | 金红叶纸业集团有限公司 | 一种薄型材料及吸收制品 |
| TWI763882B (zh) * | 2017-10-11 | 2022-05-11 | 日商優你 嬌美股份有限公司 | 吸收性物品的透液性薄片用不織布及不織布卷 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6021566B2 (ja) | 2016-11-09 |
| US20150230998A1 (en) | 2015-08-20 |
| CN104470481B (zh) | 2016-03-16 |
| JP2014068943A (ja) | 2014-04-21 |
| EP2901983A4 (en) | 2016-04-06 |
| CN104470481A (zh) | 2015-03-25 |
| EP2901983A1 (en) | 2015-08-05 |
| EP2901983B1 (en) | 2018-04-25 |
| US9724249B2 (en) | 2017-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6062199B2 (ja) | 吸収性物品 | |
| JP6112816B2 (ja) | 吸収性物品 | |
| JP6021566B2 (ja) | 吸収性物品 | |
| JP6184721B2 (ja) | 吸収性物品 | |
| JP6004878B2 (ja) | 吸収性物品 | |
| JP6021565B2 (ja) | 吸収性物品 | |
| JP6195770B2 (ja) | 吸収性物品 | |
| JP6116177B2 (ja) | 吸収性物品 | |
| WO2014050767A1 (ja) | 吸収性物品 | |
| JP5745487B2 (ja) | 吸収性物品 | |
| WO2013154072A1 (ja) | 吸収性物品 | |
| JP6202967B2 (ja) | 吸収性物品 | |
| JP5988810B2 (ja) | 吸収性物品 | |
| JP6073101B2 (ja) | 吸収性物品 | |
| JP5988811B2 (ja) | 吸収性物品 | |
| JP5885633B2 (ja) | 吸収性物品 | |
| JP3211431U (ja) | 吸収性物品 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 201380037659.8 Country of ref document: CN |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 13841496 Country of ref document: EP Kind code of ref document: A1 |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2013841496 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 14429840 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: IDP00201502225 Country of ref document: ID |