WO2010050578A1 - カチオン性ナノゲルを用いる粘膜ワクチン - Google Patents
カチオン性ナノゲルを用いる粘膜ワクチン Download PDFInfo
- Publication number
- WO2010050578A1 WO2010050578A1 PCT/JP2009/068647 JP2009068647W WO2010050578A1 WO 2010050578 A1 WO2010050578 A1 WO 2010050578A1 JP 2009068647 W JP2009068647 W JP 2009068647W WO 2010050578 A1 WO2010050578 A1 WO 2010050578A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- vaccine
- antigen
- mucosal
- nanogel
- preparation according
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/08—Clostridium, e.g. Clostridium tetani
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/554—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound the modifying agent being a steroid plant sterol, glycyrrhetic acid, enoxolone or bile acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/61—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule the organic macromolecular compound being a polysaccharide or a derivative thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6903—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being semi-solid, e.g. an ointment, a gel, a hydrogel or a solidifying gel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5161—Polysaccharides, e.g. alginate, chitosan, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
- A61K2039/543—Mucosal route intranasal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55583—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6087—Polysaccharides; Lipopolysaccharides [LPS]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0043—Nose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/006—Oral mucosa, e.g. mucoadhesive forms, sublingual droplets; Buccal patches or films; Buccal sprays
Definitions
- the present invention relates to a mucosal vaccine comprising a complex of a vaccine antigen and a cationic nanogel administered by nasal administration or oral administration.
- the mucosal vaccine not based on injection is regarded as a safe and simple next-generation vaccine.
- Toxin-related proteins such as cholera toxin CT and detoxified cholera toxin mCT are known as mucosal adjuvants.
- mucosal adjuvants By adding these mucosal adjuvants to the mucosal vaccine, it is possible to induce not only systemic IgG antigen-specific to the nasal vaccine but also mucosal IgA.
- the above mucosal adjuvant has a risk of moving into the brain, and has a problem in safety to the living body.
- the present inventors have developed a nanogel composed of molecules such as cholesterol-bearing pulullan (CHP) in which hydrophobic cholesterol is added as a side chain to a hydrophilic polysaccharide as a DDS substrate (Patent Documents 1 to 6). And non-patent document 1). That is, CHP self-assembles in a water environment to form a colloid (nanogel) having a diameter of 20 to 30 nm, and various substances can be encapsulated therein.
- One of the excellent features of CHP is the “molecular chaperone effect”. This is because when protein-like molecules are encapsulated in the CHP nanogel and then released, refolding occurs during the release, acquiring a physiological three-dimensional structure and exhibiting normal activity. .
- the present invention is a mucosa for nasal or oral administration that can induce a vaccine antigen-specific immune response in a living body without adding a mucosal adjuvant such as a toxin-related protein (cholera toxin CT, detoxified cholera toxin mCT, etc.)
- a mucosal adjuvant such as a toxin-related protein (cholera toxin CT, detoxified cholera toxin mCT, etc.)
- the purpose is to provide a vaccine.
- the present inventors have previously developed a nanogel obtained by adding hydrophobic cholesterol as a side chain to a hydrophilic polysaccharide that can be used for delivery of a substance such as a physiologically active protein.
- nanogels with cationic functional groups such as amino groups are combined with vaccine antigens, which are viral and bacterial proteins, and administered via the nasal mucosa and intestinal mucosa, which is more effective than using liposomes.
- vaccine antigens which are viral and bacterial proteins
- the present invention has been found to cause systemic immune reaction and mucosal immune reaction and to help prevent or treat viral and bacterial infections.
- the present invention is as follows.
- a vaccine antigen and the nanogel comprising mixing a nanogel obtained by adding hydrophobic cholesterol as a side chain to a hydrophilic polysaccharide having a cationic functional group and a vaccine antigen at 4 to 37 ° C. for 2 to 48 hours.
- a method for producing a mucosal vaccine preparation comprising the complex of
- the mucosal vaccine prepared by combining the vaccine antigen of the present invention with a cationic nanogel effectively induces systemic and mucosal immune responses in animals by nasal or oral mucosal administration. Since the mucosal vaccine of the present invention uses a cationic nanogel, the vaccine antigen is efficiently delivered to the immune system, and the immune response is more effective than when non-cationic nanogels or cationic liposomes are used. To induce.
- the mucosal vaccine of the present invention can be effectively used for prevention or treatment of animal viruses and bacterial infections.
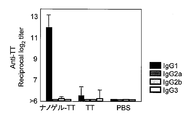
- IgG1, IgG2a, IgG2b, and IgG3 show the antibody titer of IgG1, IgG2a, IgG2b, and IgG3 with respect to TT in the serum of the mouse
- IgG1, IgG2a, IgG2b, and IgG3 are shown from the left, respectively.
- nanogel means a hydrophobic polymer gel nanoparticle having a structure in which hydrophobic cholesterol is added as a side chain to a hydrophilic polysaccharide.
- the nanogel to be used can be produced, for example, by the method described in International Publication No. WO00 / 12564 (high purity hydrophobic group-containing polysaccharide and production method thereof).
- a hydroxyl group-containing hydrocarbon or sterol having 12 to 50 carbon atoms is reacted with a diisocyanate compound represented by 0CN-R1 NCO (wherein R1 is a hydrocarbon group having 1 to 50 carbon atoms).
- R1 is a hydrocarbon group having 1 to 50 carbon atoms.
- an isocyanate group-containing hydrophobic compound obtained by reacting one molecule of a hydroxyl group-containing hydrocarbon or sterol having 12 to 50 carbon atoms is produced.
- the obtained isocyanate group-containing hydrophobic compound and polysaccharide are further reacted to produce a hydrophobic group-containing polysaccharide containing a hydrocarbon group having 12 to 50 carbon atoms or a steryl group as the hydrophobic group. .
- the resulting reaction product can be purified with a ketone solvent to produce a high purity hydrophobic group-containing polysaccharide.
- the polysaccharide include pullulan, amylopectin, amylose, dextran, hydroxyethyldextran, mannan, levan, inulin, chitin, chitosan, xyloglucan and water-soluble cellulose.
- nanogels examples include cholesterol-substituted pullulan (hereinafter referred to as CHP) and CHP derivatives.
- CHP has a structure in which 1 to 10, preferably 1 to several cholesterols are substituted per 100 monosaccharides in pullulan having a molecular weight of 30,000 to 200,000, for example, a molecular weight of 100,000.
- the properties of CHP can be changed by changing the amount of cholesterol substitution depending on the size of the protein and the degree of hydrophobicity.
- an alkyl group having 10 to 30 carbon atoms preferably about 12 to 20 carbon atoms may be introduced.
- the nanogel used in the present invention has a particle size of 10 to 40 nm, preferably 20 to 30 nm. Nanogels have already been widely marketed, and in the present invention, these commercially available products can be widely used.
- the mucosal vaccine uses a nanogel into which a functional group having a positive charge, such as an amino group, is introduced.
- the introduction rate of amino groups into the nanogel is 1-50, more preferably 5-30, per 100 glucose monosaccharides of CHP.
- a method for introducing an amino group into the nanogel a method using cholesterol pullulan (CHPNH 2 ) to which an amino group has been added is preferably mentioned as follows.
- the mucosal vaccine preparation of the present invention can efficiently induce systemic and mucosal immune responses specific to vaccine antigens to animals without adding other mucosal adjuvants.
- vaccine antigens used in the mucosal vaccine of the present invention include antigens of microorganisms such as bacteria, viruses, fungi, and protozoa that cause infectious diseases in animals.
- the antigen is an antigen that induces an animal to have a specific immune response to the antigen, and can be used as a vaccine, and is called a vaccine antigen.
- the antigens of microorganisms include influenza virus A, influenza virus B, hepatitis C virus, hepatitis A virus, hepatitis B virus, rotavirus, cytomegalovirus, RS virus, adenovirus, HIV , Varicella-zoster virus, herpes simplex virus type 1 and 2, ATL (adult T-cell leukemia) virus, coxsackie virus, enterovirus, idiopathic rash virus (HHV-6), measles virus, rubella virus, mumps virus , Poliovirus, Japanese encephalitis virus, rabies virus, hepatitis C virus, noo Oak virus, rabies virus, RS virus, cytomegalovirus, foot-and-mouth disease virus, infectious gastroenteritis virus, rubella virus, ATL virus, adenovirus ,echo Virus, herpes virus, smallpox virus, proboscis fever virus, yellow fever virus, West Nile virus, SARS (cor
- Viruses such as enterohaemorrhagic E. coli; pathogenic E. coli such as enterohemorrhagic E. coli; Staphylococcus such as Staphylococcus aureus; Streptococcus pneumoniae, Bordetella pertussis, Diphtheria, Tetanus, Haemophilus influenzae, Plague, Clostridium botulinum, Bacillus anthracis, Wild boar, Salmonella, VRE (Enterococcus), Mycobacterium tuberculosis, Shigella, Salmonella typhi, Paratyphi, Chlamydia , Amoeba dysentery, Legionella, Lyme disease Borrelia, Brucella disease (wavy fever) Q fever rickettsia, rickettsia, such chlamydia; pathogenic bacteria etc.
- enterohaemorrhagic E. coli pathogenic E. coli
- pathogenic E. coli such
- malaria pathogens insects, protozoa Cryptosporidium like can include a protein antigen of microorganisms such as fungi such as Cryptococcus Aspergillus.
- Proteins derived from pathogenic microorganisms include proteins or peptides that constitute pathogenic microorganisms (for example, surface proteins, capsid proteins, cilia proteins, etc.), proteins or peptides produced by pathogenic microorganisms (for example, toxins, enzymes, hormones) , Immunomodulators, receptors and their ligands), fragments or domains thereof, and the like.
- pathogenic microorganisms for example, surface proteins, capsid proteins, cilia proteins, etc.
- proteins or peptides produced by pathogenic microorganisms for example, toxins, enzymes, hormones
- Immunomodulators, receptors and their ligands fragments or domains thereof, and the like.
- what is necessary is just to use the protein antigen which can induce the antibody production which can carry out
- the protein antigen is not limited to one type, and the mucosal vaccine of the present invention may contain a plurality of vaccine antigens derived from the same or different microorganisms.
- a mucosal vaccine complexed with a cationic nanogel can be produced by using hemagglutinin (HA), neuraminidase (NA), etc., which are receptors, alone or in a mixture.
- Vaccine antigens can be obtained by processing from microorganisms or purification. It can also be chemically synthesized and can be obtained as a recombinant protein by genetic engineering techniques.
- the molecular weight of the vaccine antigen contained in the mucosal vaccine preparation of the present invention is not limited, but is, for example, about 500 to 1,000,000, preferably about 1,000 to 200,000.
- the complex of the vaccine antigen and the cationic nanogel can be prepared by allowing the cationic nanogel and the vaccine antigen to coexist and interact with each other and incorporating the vaccine antigen into the cationic nanogel. Making a composite is called composite.
- the mixing ratio of the vaccine antigen and the cationic nanogel can be appropriately determined according to the type of vaccine antigen and cationic nanogel used. For example, CHPNH 2 may be mixed with the vaccine antigen at a molar ratio of 1: 1 to 1: 100, preferably 1: 1 to 1:10.
- vaccine antigen and cationic nanogel are mixed in a buffer and mixed at 4 to 37 ° C. for 2 to 48 hours, preferably 20 to 30 hours. do it.
- the buffer used for forming the vaccine antigen-cationic nanogel complex can be appropriately prepared depending on the type of protein and nanogel. Examples of the buffer include Tris-HCl buffer (50 mM, pH 7.6).
- the prepared vaccine antigen-nanogel complex can be analyzed by a known method. For example, it can be analyzed by gel permeation chromatography (GPC), atomic force microscope (AFM), fluorescence microscope and confocal laser fluorescence microscope.
- the mucosal vaccine preparation of the present invention is administered via the mucosa.
- Administration via the mucosa is preferably via the nasal mucosa or the intestinal mucosa.
- it is administered nasally as a nasal vaccine formulation
- it is administered orally as an oral vaccine formulation.
- Nasal vaccine formulations induce an immune response intranasally by nasal administration. That is, it can induce an immune mechanism in the local mucosa of the respiratory tract (particularly the upper respiratory tract), which is the infection route of microorganisms that cause infections such as viruses.
- the nasal vaccine preparation may be administered to the nasal cavity by spraying, coating, dripping or the like.
- Oral vaccine formulations induce an immune response in the intestine by oral administration.
- the mucosal vaccine preparation stays in the administered mucosa, nasal cavity-related lymphoid tissue (NALT) and intestinal tract-related lymphoid tissue (GALT), and releases the vaccine antigen gradually.
- Both nasal vaccine preparations and oral vaccine preparations cause systemic immunity, producing virus-specific IgG in the body and mucosal immunity, producing IgA antibodies in the mucosa, systemic immunity mechanism, mucosal immunity mechanism Both mechanisms can protect against infection and treat infections.
- the mucosal vaccine preparation may contain known pharmaceutically acceptable stabilizers, preservatives, antioxidants and the like.
- stabilizer include gelatin, dextran, sorbitol and the like.
- preservatives include thimerosal and ⁇ -propiolactone.
- antioxidant include ⁇ -tocopherol.
- the administration target of the mucosal vaccine preparation of the present invention includes mammals such as humans, monkeys, mice, rats, rabbits, cats, cows, dogs, horses, goats, and birds such as chickens.
- the dose of the mucosal vaccine preparation can be appropriately determined depending on the type of immunogen, the age and weight of the administration target, etc., and includes a pharmaceutically effective amount of vaccine antigen.
- a pharmaceutically effective amount refers to the amount of antigen necessary to induce an immune response against the vaccine antigen.
- a single dose of vaccine antigen of several ⁇ g to several tens of mg may be administered once to several times a day, and may be administered several times at intervals of 1 to several weeks, for example, 1 to 5 times.
- Example 1 Production of Mucosal Vaccine Cationic nanogel (cationic CHP) used was one in which cholesterol was replaced with 1.4 and ethylenediamine was replaced with 18 per 100 monosaccharides (CHPNH 2 nanogel).
- CHP derivatives or cationic pullulan were dissolved in 1 mg / ml phosphate buffer solution (PBS). The CHPNH 2 nanogel was sonicated for 15 minutes and then passed through a filter (0.22 mm).
- Hc molecular weight 45000
- TT molecular weight 150000
- AIDS virus membrane antigen molecule gag p24, molecular weight 24000
- the complex of the obtained antigen and cationic nanogel was used as a cationic nanogel mucosal vaccine.
- the heavy chain C-terminal non-toxic region of the purified botulinum toxin was inserted into the GST fusion protein expression vector pGEX-6P3 (GE healthcare), transduced into Escherichia coli Rossetta2 (Novagen), and 0.1 mM IPTG was added. Expression was induced by addition.
- Hc cells suspended in PBS are sonicated, centrifuged, and the supernatant is anion exchange chromatography (DAEA ⁇ Sepharose; GE Healthcare), affinity chromatography (Glutathione Sepharose; GE healthcare), gel filtration chromatography. It was purified by subjecting it to a graphic (Sephacryl S-100; GE healthcare).
- Tetanus toxoid was obtained from the Osaka University Microbial Disease Research Group, and gag p24 was obtained from Yokota Yokota's Director, National Institute of Infectious Diseases, Immunity.
- Example 2 Nasal Immunization Cationic nanogel mucosal vaccine prepared in Example 1 or antigen alone was applied to 6-8 week old Balb / c mice (female) per Hc 10 ⁇ g (nanogel 88.9 ⁇ g), TT 30 ⁇ g ( The nasal immunization was performed by administering nanogel 80.0 ⁇ g) or gag p24 10 ⁇ g (nanogel 166.7 ⁇ g) into the nasal cavity once a week (3 times in total). The dose of antigen (fluid volume) was adjusted to 15 ⁇ l in all experimental groups, and 7.5 ⁇ l per nose was administered. At this time, PBS was administered as a control.
- Blood was collected before immunization and one week after each immunization, and systemic immune responses were evaluated by measuring IgG antibody titers against botulinum toxin, TT, or gag p24 in serum. Further, one week after the final immunization, the nasal cavity was washed with 200 ⁇ l of PBS, and the immune response in the mucosal system was evaluated by measuring the IgA antibody titer in the nasal cavity washing solution. The antibody titer was evaluated by ELISA.
- the antibody titers of IgG1, IgG2a, IgG2b, and IgG3 subclasses were measured, and the antibody production pattern at the subclass level was also evaluated, so that the immune balance of Th1 / Th2 after immunization was estimated. Furthermore, the number of antigen-specific IgA producing cells (plasma cells) in the nasal cavity tissue one week after the final immunization was evaluated by the ELISPOT method.
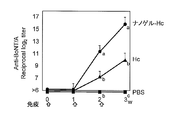
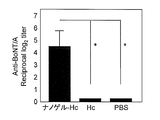
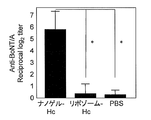
- FIG. 1 shows the total IgG antibody titer against botulinum toxin in serum.
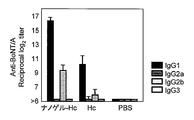
- FIG. 2 shows antibody titers of IgG1, IgG2a, IgG2b and Ig3 against botulinum toxin in serum collected after 3 immunizations.
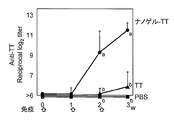
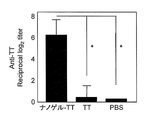
- FIG. 3 shows the total IgG antibody titer against TT in serum
- FIG. 4 shows the antibody titers of IgG1, IgG2a, IgG2b and Ig3 against TT in serum collected after 3 immunizations.
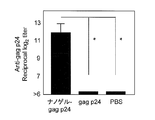
- FIG. 5 shows the gag p24-specific IgG antibody titer after the third immunization.
- FIG. 6 shows the IgA antibody titer against botulinum toxin in the nasal lavage fluid after the third immunization
- FIG. 7 shows the IgA antibody titer against TT in the nasal lavage fluid after the third immunization.
- the total IgG antibody titer against gag p24 was remarkably high. This causes a stronger systemic immune response when Hc, TT, or gag p24 is administered as a complex with a cationic nanogel compared to when Hc, TT, or gag p24 is administered alone. It shows that.
- most of the antigen-specific IgG was an IgG1 type subclass, and the IgG2a level was remarkably low. From the above results, it was speculated that Th2 type humoral immune response was effectively induced by nasal administration of vaccine antigen as a complex with cationic nanogel.
- IgA antibody titers were hardly observed when Hc or TT was administered alone, but botulinum toxin was observed when Hc or TT was administered as a complex with cationic nanogel.
- a high IgA antibody titer against TT was observed. This indicates that the mucosal immune reaction was induced in the nasal mucosa only when the mucosal vaccine of the present invention comprising a complex of an antigen and a cationic nanogel was administered nasally.
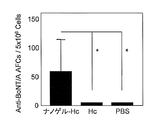
- FIG. 8 shows a comparison of the number of botulinum toxin antigen-specific IgA producing cells in the nasal mucosal tissue. As shown in FIG. 8, no IgA-producing cells were produced when administered with Hc alone, but IgA-producing cells were produced when a complex of Hc and cationic nanogel was administered.
- Example 3 Neutralizing effect after nasal immunization using nanogel mucosal vaccine Cationic nanogel vaccine using heavy chain C-terminal non-toxic region (Hc, molecular weight 45000) of botulinum toxin prepared in Example 1 as an antigen or Hc alone
- Hc heavy chain C-terminal non-toxic region
- mice were immunized intranasally in the same manner as in Example 2.
- PBS was administered as a negative control.
- 25,000 times (500 ng) botulinum toxin obtained by Prof. Toshiji Kosaki, graduate School of Life and Environmental Sciences, Osaka Prefecture University
- the intraperitoneal administration of the intraperitoneal dose was analyzed.
- botulinum progenitor toxin obtained from Wako Pure Chemical Industries
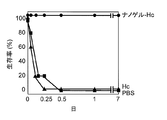
- FIG. 9 shows the survival rate of the mice over time after intraperitoneal administration of botulinum toxin. As shown in FIG. 9, all mice immunized with Hc alone died within one day, but all mice survived even one week after administration of Hc as a complex with cationic nanogel. This result indicates that powerful neutralization immunity in the systemic system can be induced by nasal administration of a complex of Hc and cationic nanogel.
- FIG. 10 shows the survival rate over time when botulinum progenitor toxin is administered intranasally. As shown in FIG. 10, all mice immunized with Hc alone died within one day, but all mice survived even one week after administration of Hc as a complex with cationic nanogel. This result shows that botulinum mucosal infection was effectively blocked by botulinum toxin-specific mucosal IgA induced by nasal administration of a complex of Hc and cationic nanogel.
- Example 4 Immunity-inducing effect of cationic nanogel vaccine compared with cationic liposome vaccine Cationic nanogel vaccine with heavy chain C-terminal non-toxic region (Hc, molecular weight 45000) of botulinum toxin prepared in Example 1 or the same
- Hc heavy chain C-terminal non-toxic region
- FIG. 11 shows the total IgG antibody titer against botulinum toxin after three immunizations.
- FIG. 12 shows the total IgA antibody titer against botulinum toxin after three immunizations.
- the total IgA antibody titer against botulinum toxin was significantly higher when Hc was administered as a complex with cationic nanogel than when Hc was administered as a complex with cationic liposomes.
- Example 5 Antigen retention effect of cation nanogel vaccine in nasal cavity tissue and presence / absence of transfer to cranial nervous system 111In (indium) using DTPA anhydride for heavy chain C-terminal non-toxic region (Hc, molecular weight 45000) of botulinum toxin was labeled by known methods. The labeling efficiency was 728.3233 ⁇ 115.3543 CPM / ng. Thereafter, labeled Hc was conjugated to the nanogel. The mouse was administered nasally with a nanogel mucosal vaccine combined with 1,000,000 CPM of labeled Hc or labeled Hc alone.
- Figure 13 shows the results of gamma ray measurements in the brain (A), olfactory bulb (B), nasal cavity tissue (C), nasal cavity related lymphoid tissue (NALT) (D), cervical lymph node (E) and spleen (F). Show.
- the nanogel mucosal vaccine was retained for a long time, particularly in the nasal cavity tissue (C), but the transition to the brain and olfactory bulb was not confirmed.
- This result shows that when the mucosal vaccine containing the cationic nanogel of the present invention is administered nasally, the antigen storage effect in the nasal cavity is higher than when the mucosal vaccine is administered alone. It can be applied as a safe and effective nasal administration agent that does not migrate to the central nervous system.
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Virology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Nanotechnology (AREA)
- Botany (AREA)
- Optics & Photonics (AREA)
- Inorganic Chemistry (AREA)
- AIDS & HIV (AREA)
- Molecular Biology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
Abstract
粘膜アジュバントを添加することなく、生体にワクチン抗原特異的な免疫応答を誘導し得る、経鼻又は経口投与用粘膜ワクチンの提供。 カチオン性の官能基を有する親水性の多糖に側鎖として疎水性のコレステロールを付加したナノゲルとワクチン抗原との複合体を含み、粘膜を介して投与される、微生物感染症の予防又は治療用粘膜ワクチン製剤。
Description
本発明は経鼻投与又は経口投与により投与されるワクチン抗原とカチオン性ナノゲルの複合体を含む粘膜ワクチンに関する。
注射によらない粘膜ワクチンは安全かつ簡便で次世代ワクチンと目されている。粘膜ワクチンを用いて効果的な抗原特異的免疫応答を誘導するには、粘膜ワクチンを粘膜アジュバントと同時に投与する必要があった。粘膜アジュバントとして、コレラ毒素CTや無毒化コレラ毒素mCT等の毒素関連タンパク質が知られている。粘膜ワクチンにこれらの粘膜アジュバントを加えることで経鼻ワクチンに抗原特異的な全身系IgGのみならず、粘膜IgAを誘導することができる。しかしながら、上記の粘膜アジュバントは脳内に移行するおそれがあり、生体への安全性に問題があった。
本発明者らは、DDSの基材として親水性の多糖に、側鎖として疎水性のコレステロールを付加した、cholesterol-bearing pulullan(CHP)などの分子からなるナノゲルを開発した(特許文献1から6及び非特許文献1を参照)。すなわち、CHPは水環境下で自己組織化し、直径20~30nmのコロイド(ナノゲル)となり、その内部に各種の物質を内包することが可能である。またCHPの持つ優れた特徴の一つとして、「分子シャペロン効果」が挙げられる。これはたんぱく質のような分子をCHPナノゲルの内部に内包したのち、放出させると、放出の際にリフォールディングが起こり、生理的な3次元構造を獲得し、正常な活性を発揮するというものである。
上記のナノゲルをワクチン製剤に利用することが報告されていたが(特許文献7を参照)、細胞障害性T細胞(CTL)の活性化により抗癌用、抗ウイルス用、自己免疫疾患用として用いられるものであり、必ずしも粘膜ワクチンとして効果を発揮するとは言えなかった。
また、糖脂質と燐脂質を含む脂質膜構造を有するリポソームを経口ワクチンのデリバリーに利用することが報告されていた(特許文献8を参照)。
国際公開第WO00/12564号パンフレット
特開2005-298644号公報
国際公開第WO2006/049032号パンフレット
特開2006-143808号公報
国際公開第WO2007/083643号パンフレット
特開2007-252304号公報
特許第4033497号公報
特開平5-339169号公報
長谷川他、細胞工学Vol.26、No.6、2007、p679-685
本発明は、毒素関連タンパク質(コレラ毒素CT、無毒化コレラ毒素mCT等)等の粘膜アジュバントを添加することなく、生体にワクチン抗原特異的な免疫応答を誘導し得る、経鼻又は経口投与用粘膜ワクチンの提供を目的とする。
本発明者らは、先に生理活性タンパク質等の物質のデリバリーに用い得る親水性の多糖に、側鎖として疎水性のコレステロールを付加したナノゲルを開発した。
本発明者等は、粘膜ワクチン製造へ前記ナノゲルを応用できないか鋭意検討を行った。その結果、アミノ基等のカチオン性官能基を付加したナノゲルをウイルスや細菌のタンパク質であるワクチン抗原と複合化し、鼻腔粘膜や腸管粘膜を介して投与することにより、リポソームを用いた場合よりも効果的に全身免疫反応及び粘膜免疫反応を引き起こし、ウイルスや細菌の感染症の予防又は治療に役立つことを見出し、本発明を完成させるに至った。
すなわち、本発明は以下のとおりである。
[1] カチオン性の官能基を有する親水性の多糖に側鎖として疎水性のコレステロールを付加したナノゲルとワクチン抗原との複合体を含み、粘膜を介して投与される、微生物感染症の予防又は治療用粘膜ワクチン製剤。
[2] カチオン性の官能基がアミノ基である、[1]の粘膜ワクチン製剤。
[3] ナノゲルがコレステロール置換プルランである、[1]又は[2]の粘膜ワクチン製剤。
[4] ワクチン抗原が微生物由来抗原である、[1]~[3]のいずれかの粘膜ワクチン製剤。
[5] 微生物がウイルス、細菌、原虫及び真菌からなる群から選択される、[4]の粘膜ワクチン製剤。
[6] ワクチン抗原がボツリヌス毒素の重鎖C末端無毒領域、破傷風トキソイド及びエイズウイルスの膜抗原分子gag p24からなる群から選択される、[5]の粘膜ワクチン製剤。
[7] ワクチン抗原とナノゲルが1:1~1:10のモル比で複合化される、[1]~[6]のいずれかの粘膜ワクチン製剤。
[8] 経鼻投与製剤である、[1]~[7]のいずれかの粘膜ワクチン製剤。
[9] 経口投与製剤である、[1]~[7]のいずれかの粘膜ワクチン製剤。
[10] カチオン性の官能基を有する親水性の多糖に側鎖として疎水性のコレステロールを付加したナノゲルとワクチン抗原を4~37℃で2~48時間混合することを含む、ワクチン抗原と前記ナノゲルの複合体を含む粘膜ワクチン製剤の製造方法。
[11] カチオン性の官能基がアミノ基である、[10]の粘膜ワクチン製剤の製造方法。
[12] ナノゲルがコレステロール置換プルランである、[10]又は[11]の粘膜ワクチン製剤の製造方法。
[13] ワクチン抗原が微生物由来抗原である、[10]~[12]のいずれかの粘膜ワクチン製剤の製造方法。
[14] 微生物がウイルス、細菌、原虫及び真菌からなる群から選択される、[13]の粘膜ワクチン製剤の製造方法。
本明細書は本願の優先権の基礎である日本国特許出願2008-281065号の明細書および/または図面に記載される内容を包含する。
本発明のワクチン抗原とカチオン性ナノゲルを複合化させて作製した粘膜ワクチンは、経鼻又は経口による粘膜投与により、動物に効果的に全身的及び粘膜免疫応答を引き起こす。本発明の粘膜ワクチンは、カチオン性のナノゲルを用いているがゆえに、ワクチン抗原を効率的に免疫系へデリバリーし、カチオン性でないナノゲルやカチオン性リポソームを用いた場合よりもより効果的な免疫応答を誘導する。本発明の粘膜ワクチンは、動物のウイルスや細菌感染症の予防又は治療に効果的に用いることができる。
以下、本発明を詳細に説明する。
本発明において「ナノゲル」とは親水性の多糖に、側鎖として疎水性のコレステロールを付加した構造を有する疎水化高分子ゲルナノ粒子をいう。用いるナノゲルは、例えば国際公開第WO00/12564号パンフレット(高純度疎水性基含有多糖類及びその製造方法)に記載の方法で製造することができる。
最初に、炭素数12~50の水酸基含有炭化水素又はステロールと、0CN-R1 NCO(式中、R1は炭素数1~50の炭化水素基である。)で表されるジイソシアナート化合物を反応させて、炭素数12~50の水酸基含有炭化水素又はステロールが1分子反応したイソシアナート基含有疎水性化合物を製造する。次いで、得られたイソシアナート基含有疎水性化合物と多糖類とをさらに反応させて、疎水性基として炭素数12~50の炭化水素基又はステリル基を含有する疎水性基含有多糖類を製造する。得られた反応生成物をケトン系溶媒で精製して高純度疎水性基含有多糖類の製造が可能である。多糖類としては、プルラン、アミロペクチン、アミロース、デキストラン、ヒドロキシエチルデキストラン、マンナン、レバン、イヌリン、キチン、キトサン、キシログルカン及び水溶性セルロース等が挙げられる。
本発明において好適に用い得るナノゲルとしてはコレステロール置換プルラン(以下、CHPと称する)及びCHP誘導体が例示される。CHPは、分子量3万から20万、例えば分子量100,000のプルランに100単糖あたりコレステロールが1~10個、好ましくは1~数個置換された構造を有する。CHPの性状は、タンパク質のサイズや疎水性の程度により、コレステロール置換量を変え変更可能である。CHPの疎水性をコントロールするためには、炭素数10~30、好ましくは炭素数12~20程度のアルキル基を導入してもよい。本発明で用いるナノゲルは、粒径10~40nm、好ましくは20~30nmである。ナノゲルは既に広く市販されており、本発明では、これら市販品を広く利用可能である。
本発明においては、粘膜ワクチンは、正電荷を有する官能基、例えばアミノ基を導入したナノゲルを用いる。ナノゲルへのアミノ基の導入率はCHPのグルコース100単糖あたり1~50、より好ましくは5~30である。ナノゲルへのアミノ基の導入方法としては、以下のように、アミノ基を付加したコレステロールプルラン(CHPNH2)を用いる手法が好適に挙げられる。
減圧乾燥したCHP 0.15 gをジメチルスルホキシドDMSO溶媒15mlに溶解し、これに1-1’カルボニルジイミダゾール75mgを窒素気流下に加え4時間室温で反応させる。その反応溶液にエチレンジアミン300mgをゆっくり添加し24時間攪拌する。この反応溶液を蒸留水により6日間透析する。これを凍結乾燥し、乳白色の固体を得る。エチレンジアミンの置換度は元素分析やH-NMRにより求められる。導入する置換基の数は適宜変えることができ、導入する置換基の数を変えることにより正電荷の大きさを制御し、ワクチン抗原-カチオン性ナノゲル複合体からのワクチン抗原のデリバリー効率を制御することが可能である。
本発明の粘膜ワクチン製剤は他の粘膜アジュバントを添加することなく、効率的に動物に対してワクチン抗原に特異的な全身的及び粘膜免疫応答を誘導し得る。
本発明の粘膜ワクチンに使用するワクチン抗原としては、動物に感染症を引き起こす細菌、ウイルス、真菌、原虫類等の微生物の抗原が挙げられる。該抗原は、動物にその抗原に対する特異的免疫反応を誘導する抗原であり、ワクチンとして用いることができ、ワクチン抗原と呼ぶ。
具体的には、微生物の抗原としては、インフルエンザウイルスA型、インフルエンザウイルスB型、C型肝炎ウイルス、A型肝炎ウイルス、B型肝炎ウイルス、ロタウイルス、サイトメガロウイルス、RSウイルス、アデノウイルス、HIV、水痘帯状疱疹ウイルス、単純ヘルペスウイルス1型・2型、ATL(成人型T細胞白血病)ウイルス、コクサッキーウイルス、エンテロウイルス、突発性発疹ウイルス(HHV-6)、麻疹ウイルス、風疹ウイルス、ムンプス(おたふくかぜ)ウイルス、ポリオウイルス、日本脳炎ウイルス、狂犬病ウイルス、C型肝炎ウイルス、ノーウオーク(ノロ)ウイルス、狂犬病ウイルス、RSウイルス、サイトメガロウイルス、口蹄疫ウイルス、伝染性胃腸炎ウイルス、風疹ウイルス、ATLウイルス、アデノウイルス、エコーウイルス、ヘルペスウイルス、天然痘ウイルス、テング熱ウイルス、黄熱ウイルス、西ナイルウイルス、SARS(コロナウイルス)、エボラ出血熱ウイルス(フィロウイルス)、マールブルグウイルス(フィロウイルス)、ラッサ熱ウイルス、ハンタウイルス、ニパウイルス等の病原性ウイルス等のウイルス類;腸管出血性大腸菌等の病原性大腸菌、黄色ブドウ球菌などのブドウ球菌、髄膜炎菌、緑膿菌、虫歯連鎖球菌、コレラ菌、チフス菌、クラミジア赤痢菌、肺炎球菌、百日咳菌、ジフテリア菌、破傷風菌、インフルエンザ菌、ペスト菌、ボツリヌス菌、炭ソ菌、野兎病菌、サルモネラ菌、VRE(腸球菌)、結核菌、赤痢菌、腸チフス菌、パラチフス菌、クラミジア菌、アメーバ赤痢、レジオネラ菌、ライム病ボレリア菌、ブルセラ病(波状熱)菌等の病原性細菌;Q熱リケッチャ、クラミジア等のリケッチャ;マラリア病原虫、クリプトスポリジウム等の原虫類;クリプトコッカス・アスペルギルス等の真菌等の微生物のタンパク質抗原を挙げることができる。病原性微生物に由来するタンパク質としては、病原性微生物を構成するタンパク質又はペプチド(例えば、表面タンパク質、カプシドタンパク質、繊毛タンパク質等)、病原性微生物が産生するタンパク質又はペプチド(例えば、毒素、酵素、ホルモン、免疫調節物質、受容体及びそのリガンド等)、それらの断片又はドメイン等が挙げられる。またタンパク質抗原は、コレラの微生物を攻撃中和し得る抗体産生を誘起し得るものを用いればよい。タンパク質抗原は1種類に限定されず、本発明の粘膜ワクチンは、複数の同種微生物又は異種微生物由来のワクチン抗原を含んでいてもよい。例えば、インフルエンザウイルスの場合に、受容体であるヘマグルチニン(HA)やノイラミニダーゼ(NA)等を単独又は混合物して、カチオン性ナノゲルと複合化した粘膜ワクチンを製造することができる。ワクチン抗原は、微生物からプロセッシングしたり、精製したりすることにより得ることができる。また、化学合成することもでき、遺伝子工学的手法によってリコンビナントタンパク質として得ることもできる。本発明の粘膜ワクチン製剤に含まれるワクチン抗原の分子量は、限定されないが、例えば、500~1,000,000、好ましくは1,000~200,000程度である。
ワクチン抗原と上記カチオン性ナノゲルとの複合体は、カチオン性ナノゲルとワクチン抗原を共存させ、相互作用させ、ワクチン抗原をカチオン性ナノゲル内に取り込むことにより作製することができる。複合体を作製することを複合化という。ワクチン抗原とカチオン性ナノゲルの混合比は、用いるワクチン抗原及びカチオン性ナノゲルの種類に応じて適宜決定することができる。例えば、ワクチン抗原に対しCHPNH2を1:1~1:100、好ましくは1:1~1:10のモル比で混合すればよい。
ワクチン抗原とカチオン性ナノゲルの複合体を形成するには、例えば、ワクチン抗原とカチオン性ナノゲルをバッファー中において混合し、4~37℃で2~48時間、好ましくは20~30時間静置により混合すればよい。ワクチン抗原-カチオン性ナノゲル複合体の形成に用いるバッファーは、タンパク質とナノゲルの種類により適宜調製することができ、バッファーとして例えばTris-HCl緩衝液(50mM、pH7.6)が挙げられる。調製したワクチン抗原-ナノゲル複合体は、公知の方法により解析することが可能である。例えば、ゲルろ過クロマトグラフィー(gel permeation chromatography、GPC)、原子間力顕微鏡(atomic force microscope、AFM)、蛍光顕微鏡及び共焦点レーザー蛍光顕微鏡により解析できる。
本発明の粘膜ワクチン製剤は、粘膜を介して投与する。粘膜を介しての投与は、好適には鼻腔粘膜又は腸管粘膜を介して行われる。前者の場合は、経鼻ワクチン製剤として経鼻投与され、後者の場合は経口ワクチン製剤として経口投与される。経鼻ワクチン製剤は経鼻投与によって鼻腔内で免疫応答を誘導する。すなわち、ウイルス等の感染症を引き起こす微生物の感染ルートである気道(特に上気道)の局所粘膜における免疫機構を誘導し得る。経鼻ワクチン製剤は噴霧、塗布、滴下等により鼻腔に投与すればよい。経口ワクチン製剤は経口投与によって腸管で免疫応答を誘導する。粘膜ワクチン製剤は投与した粘膜や鼻腔関連リンパ組織(NALT)や腸管関連リンパ組織(GALT)に留まり、ワクチン抗原を徐放する。経鼻ワクチン製剤も経口ワクチン製剤も全身免疫を引き起こし、生体内にウイルス等に特異的なIgGが産生されるとともに、粘膜免疫を引き起こし、粘膜においてIgA抗体が産生され、全身免疫機構、粘膜免疫機構の両方の機構で感染を防御し、感染症を治療し得る。
粘膜ワクチン製剤には、薬学的に許容できる公知の安定剤、防腐剤、酸化防止剤等を含ませても良い。安定剤としてはゼラチン、デキストラン、ソルビトール等が挙げられる。防腐剤としてはチメロサール、βプロピオラクトン等が挙げられる。酸化防止剤としてはαトコフェロール等が挙げられる。
本発明の粘膜ワクチン製剤の投与対象としては、ヒト、サル、マウス、ラット、ウサギ、ネコ、ウシ、イヌ、ウマ、ヤギ等の哺乳動物、及びニワトリ等の鳥類が挙げられる。
粘膜ワクチン製剤の投与量は、免疫原の種類、投与対象の年齢や体重等により適宜決定することができるが、薬学的に有効な量のワクチン抗原を含む。薬学的に有効な量とは、そのワクチン抗原に対する免疫反応を誘導するのに必要な抗原量をいう。例えば、1回のワクチン抗原投与量数μg~数十mgで1日1回~数回投与し、1~数週間間隔でトータル数回、例えば1~5回投与すればよい。
本発明を以下の実施例によって具体的に説明するが、本発明はこれらの実施例によって限定されるものではない。
実施例1 粘膜ワクチンの作製
カチオン性ナノゲル(カチオン性CHP)は100単糖あたりコレステロールが1.4及びエチレンジアミンが18置換されているものを使用した(CHPNH2ナノゲル)。CHP誘導体又はカチオン性プルランを1mg/mlのリン酸緩衝溶液(PBS)に溶かした。CHPNH2ナノゲルに15分間のソニケーションを行った後、フィルター(0.22 mm)に通した。
カチオン性ナノゲル(カチオン性CHP)は100単糖あたりコレステロールが1.4及びエチレンジアミンが18置換されているものを使用した(CHPNH2ナノゲル)。CHP誘導体又はカチオン性プルランを1mg/mlのリン酸緩衝溶液(PBS)に溶かした。CHPNH2ナノゲルに15分間のソニケーションを行った後、フィルター(0.22 mm)に通した。
大腸菌で発現させ、精製したボツリヌス毒素の重鎖C末端無毒領域(Hc、分子量45000)、破傷風トキソイド(TT、分子量150000)、又はエイズウイルス膜抗原分子(gag p24、分子量24000)を、等モル量の上記のようにして調製したカチオン性ナノゲルと混和し、45℃で5時間反応させることで複合化した。得られた抗原とカチオン性ナノゲルとの複合体をカチオン性ナノゲル粘膜ワクチンとして用いた。精製したボツリヌス毒素の重鎖C末端無毒領域は、GST融合タンパク発現ベクターであるpGEX-6P3(GE healthcare)内にその遺伝子を挿入し、大腸菌Rossetta2(Novagen)に形質導入後、0.1mMのIPTGを添加することで発現誘導させた。Hcは、PBSに懸濁させた菌体を超音波破砕後、遠心しその上清を陰イオン交換クロマトグラフィー(DAEA Sepharose; GE Healthcare)、アフィニティークロマトグラフィー(Glutathione Sepharose; GE healthcare)、ゲル濾過クロマトグラフィー(Sephacryl S-100; GE healthcare)に供することで精製した。HcのN末端に融合されたGSTは、アフィニティークロマトグラフィーを実施後、カラム内にPreScission Protease(GE herthcare)を添加することで切断除去した。また、破傷風トキソイドは(財)大阪大学微生物病研究会より、またgag p24は国立感染症研究所免疫部の横田恭子室長より入手した。
実施例2 経鼻免疫
実施例1で作製したカチオン性ナノゲル粘膜ワクチン又は抗原単独を、6~8週齢のBalb/cマウス(雌)に1匹あたりHc 10μg(ナノゲル88.9μg)、TT 30μg(ナノゲル80.0μg)、又はgag p24 10μg(ナノゲル 166.7μg)を、週1回(計3回)鼻腔内に投与することで、経鼻免疫を行った。投与抗原量(液量)はすべての実験区において15μlになるように調整し、片鼻当たり7.5μlを投与した。この際、コントロールとしてPBSを投与した。
実施例1で作製したカチオン性ナノゲル粘膜ワクチン又は抗原単独を、6~8週齢のBalb/cマウス(雌)に1匹あたりHc 10μg(ナノゲル88.9μg)、TT 30μg(ナノゲル80.0μg)、又はgag p24 10μg(ナノゲル 166.7μg)を、週1回(計3回)鼻腔内に投与することで、経鼻免疫を行った。投与抗原量(液量)はすべての実験区において15μlになるように調整し、片鼻当たり7.5μlを投与した。この際、コントロールとしてPBSを投与した。
免疫前及び各免疫1週間後に血液を採取し、血清中のボツリヌス毒素、TT、又はgag p24に対するIgG抗体価を測定することにより、全身系の免疫応答を評価した。また、最終免疫1週間後に200μlのPBSを用いて鼻腔を洗浄し、鼻腔洗浄液中のIgA抗体価を測定することにより粘膜系での免疫応答を評価した。抗体価の評価は、ELISA法で行った。血清中IgGに関しては、IgG1, IgG2a, IgG2b及びIgG3の各サブクラスの抗体価を測定し、サブクラスレベルでの抗体産生パターンも評価することで、免疫後のTh1/Th2の免疫バランスを推測した。さらに、最終免疫1週間後の鼻腔組織中の抗原特異的IgA産生細胞(形質細胞)数を、ELISPOT法で評価した。
血清中のボツリヌス毒素に対するトータルIgG抗体価を図1に示す。また、図2に3回免疫後に採取した血清中のボツリヌス毒素に対するIgG1、IgG2a、IgG2b及びIg3の抗体価を示す。さらに、図3に血清中のTTに対するトータルIgG抗体価を示し、図4に3回免疫後に採取した血清中のTTに対するIgG1、IgG2a、IgG2b及びIg3の抗体価を示す。図5に3回免疫後のgag p24特異的IgG抗体価を示す。
図6に3回免疫後の鼻腔洗浄液中のボツリヌス毒素に対するIgA抗体価を示し、図7に3回免疫後の鼻腔洗浄液中のTTに対するIgA抗体価を示す。
図1、3及び5に示すように、Hc、TT、又はgag p24をカチオン性ナノゲルとの複合体として投与した場合にHc、TT、又はgag p24を単独で投与した場合に比べボツリヌス毒素、TT、又はgag p24に対するトータルIgG抗体価が著しく高かった。このことは、Hc、TT、又はgag p24を単独で投与した場合と比較して、Hc、TT、又はgag p24をカチオン性ナノゲルとの複合体として投与した場合により強力な全身性免疫反応を引き起こすことを示す。また、図2及び図4に示すように、抗原特異的IgGの大半がIgG1タイプのサブクラスであり、IgG2aレベルは顕著に低かった。以上の結果から、ワクチン抗原をカチオン性ナノゲルとの複合体として経鼻投与することで、Th2型の液性免疫応答が効果的に誘導されていることが推測された。
図6及び図7に示すように、Hc又はTTを単独で投与した場合は、IgA抗体価は殆ど認められなかったが、Hc又はTTをカチオン性ナノゲルとの複合体として投与した場合にボツリヌス毒素又はTTに対する高いIgA抗体価が認められた。このことは、抗原とカチオン性ナノゲルの複合体からなる本発明の粘膜ワクチンを経鼻投与した場合のみに、鼻粘膜において、粘膜免疫反応を引き起こしたことを示す。
図8に鼻腔粘膜組織中のボツリヌス毒素抗原特異的IgA産生細胞の数の比較を示す。図8に示すように、Hc単独で投与した場合は、IgA産生細胞は全く産生されないが、Hcとカチオン性ナノゲルの複合体を投与した場合は、IgA産生細胞が産生された。
実施例3 ナノゲル粘膜ワクチンを用いた経鼻免疫後の中和効果
実施例1で作製したボツリヌス毒素の重鎖C末端無毒領域(Hc、分子量45000)を抗原とするカチオン性ナノゲルワクチン又はHc単独を実施例2と同様の方法でそれぞれマウス5匹に経鼻免疫した。陰性コントロールとしてPBSを投与した。3回の免疫後、腹腔投与致死量の25000倍(500ng)のボツリヌス毒素(大阪府立大学生命環境科学研究科獣医学専攻、小崎俊司教授により入手した)を腹腔内投与することで、その生存効果を解析した。また、鼻腔組織中に誘導されたHc特異的IgAの中和効果を解析する目的で、10μgのボツリヌスプロジェニター毒素(和光純薬より入手した)を経鼻投与し、その後の生存効果も解析した。
実施例1で作製したボツリヌス毒素の重鎖C末端無毒領域(Hc、分子量45000)を抗原とするカチオン性ナノゲルワクチン又はHc単独を実施例2と同様の方法でそれぞれマウス5匹に経鼻免疫した。陰性コントロールとしてPBSを投与した。3回の免疫後、腹腔投与致死量の25000倍(500ng)のボツリヌス毒素(大阪府立大学生命環境科学研究科獣医学専攻、小崎俊司教授により入手した)を腹腔内投与することで、その生存効果を解析した。また、鼻腔組織中に誘導されたHc特異的IgAの中和効果を解析する目的で、10μgのボツリヌスプロジェニター毒素(和光純薬より入手した)を経鼻投与し、その後の生存効果も解析した。
図9にボツリヌス毒素を腹腔内投与した後のマウスの経時的な生存率を示す。図9に示すように、Hc単独で免疫したマウスでは1日以内に全数が死亡したが、Hcをカチオン性ナノゲルとの複合体として投与したマウスでは、1週間後も全数が生存していた。この結果は、Hcとカチオン性ナノゲルとの複合体を経鼻投与することで、強力な全身系での中和免疫を誘導可能であることを示している。
図10にボツリヌスプロジェニター毒素を経鼻投与した場合の経時的な生存率を示す。図10に示すように、Hc単独で免疫したマウスでは1日以内に全数が死亡したが、Hcをカチオン性ナノゲルとの複合体として投与したマウスでは、1週間後も全数が生存していた。この結果は、Hcとカチオン性ナノゲルとの複合体を経鼻投与することで誘導されたボツリヌス毒素特異的粘膜IgAにより、ボツリヌス粘膜感染が効果的に阻止されたことを示している。
実施例4 カチオン性リポソームワクチンと比較したカチオン性ナノゲルワクチンの免疫誘導効果
実施例1で作製したボツリヌス毒素の重鎖C末端無毒領域(Hc、分子量45000)を抗原とするカチオン性ナノゲルワクチン又は、同一抗原を同量複合化させたカチオン性リポソーム(Pro-ject)を実施例2と同様の方法でそれぞれマウス5匹に経鼻免疫した。なお、Pro-jectはPIERCEより入手した。
実施例1で作製したボツリヌス毒素の重鎖C末端無毒領域(Hc、分子量45000)を抗原とするカチオン性ナノゲルワクチン又は、同一抗原を同量複合化させたカチオン性リポソーム(Pro-ject)を実施例2と同様の方法でそれぞれマウス5匹に経鼻免疫した。なお、Pro-jectはPIERCEより入手した。
図11に3回免疫後のボツリヌス毒素に対するトータルIgG抗体価を示す。
図11に示すように、Hcをカチオン性ナノゲルとの複合体として投与した場合に、Hcをカチオン性リポソームとの複合体で投与した場合に比べ、ボツリヌス毒素に対するトータルIgG抗体価が著しく高かった。
図12に3回免疫後のボツリヌス毒素に対するトータルIgA抗体価を示す。
図12に示すように、Hcをカチオン性ナノゲルとの複合体として投与した場合に、Hcをカチオン性リポソームとの複合体で投与した場合に比べ、ボツリヌス毒素に対するトータルIgA抗体価が著しく高かった。
実施例5 カチオン性ナノゲルワクチンの鼻腔組織内での抗原貯留効果と、脳神経系への移行の有無
ボツリヌス毒素の重鎖C末端無毒領域(Hc、分子量45000)にDTPA anhydrideを用いて111In(インジウム)を公知の方法で標識した。標識効率は、728.3233±115.3543 CPM/ngであった。その後、標識Hcをナノゲルに複合化させた。1,000,000 CPM量の標識Hcを複合化させたナノゲル粘膜ワクチン又は標識Hc単独をマウスに経鼻投与した。その後の体内動態(脳、嗅球、鼻腔、鼻腔関連リンパ組織(NALT)、頸部リンパ節及び脾臓)をガンマカウンターで追跡評価した。具体的には、経鼻投与の0.17、1、6、12、24及び48時間後に、マウスから脳、嗅球、鼻腔、鼻腔関連リンパ組織(NALT)、頸部リンパ節及び脾臓を採取し、試料重量を測定後、試料からのガンマ線をガンマカウンターで測定した。
ボツリヌス毒素の重鎖C末端無毒領域(Hc、分子量45000)にDTPA anhydrideを用いて111In(インジウム)を公知の方法で標識した。標識効率は、728.3233±115.3543 CPM/ngであった。その後、標識Hcをナノゲルに複合化させた。1,000,000 CPM量の標識Hcを複合化させたナノゲル粘膜ワクチン又は標識Hc単独をマウスに経鼻投与した。その後の体内動態(脳、嗅球、鼻腔、鼻腔関連リンパ組織(NALT)、頸部リンパ節及び脾臓)をガンマカウンターで追跡評価した。具体的には、経鼻投与の0.17、1、6、12、24及び48時間後に、マウスから脳、嗅球、鼻腔、鼻腔関連リンパ組織(NALT)、頸部リンパ節及び脾臓を採取し、試料重量を測定後、試料からのガンマ線をガンマカウンターで測定した。
図13に、脳(A)、嗅球(B)、鼻腔組織(C)、鼻腔関連リンパ組織(NALT)(D)、頸部リンパ節(E)及び脾臓(F)中のガンマ線測定の結果を示す。
図13に示すように、特に鼻腔組織(C)において、ナノゲル粘膜ワクチンが長時間貯留していたが、脳及び嗅球への移行は確認されなかった。この結果は、本発明のカチオン性ナノゲルを含む粘膜ワクチンを鼻腔投与した場合、粘膜ワクチン単体で投与した場合と比較して、鼻腔内における抗原貯留効果が高く、一方で、一部のアジュバントのような中枢神経系へ移行しない、安全かつ効果に優れた鼻腔投与用性剤として応用可能であることを示す。
本明細書で引用した全ての刊行物、特許および特許出願をそのまま参考として本明細書にとり入れるものとする。
Claims (14)
- カチオン性の官能基を有する親水性の多糖に側鎖として疎水性のコレステロールを付加したナノゲルとワクチン抗原との複合体を含み、粘膜を介して投与される、微生物感染症の予防又は治療用粘膜ワクチン製剤。
- カチオン性の官能基がアミノ基である、請求項1記載の粘膜ワクチン製剤。
- ナノゲルがコレステロール置換プルランである、請求項1又は2に記載の粘膜ワクチン製剤。
- ワクチン抗原が微生物由来抗原である、請求項1~3のいずれか1項に記載の粘膜ワクチン製剤。
- 微生物がウイルス、細菌、原虫及び真菌からなる群から選択される、請求項4記載の粘膜ワクチン製剤。
- ワクチン抗原がボツリヌス毒素の重鎖C末端無毒領域、破傷風トキソイド及びエイズウイルス膜抗原分子gag p24からなる群から選択される、請求項5記載の粘膜ワクチン製剤。
- ワクチン抗原とナノゲルが1:1~1:10のモル比で複合化される、請求項1~6のいずれか1項に記載の粘膜ワクチン製剤。
- 経鼻投与製剤である、請求項1~7のいずれか1項に記載の粘膜ワクチン製剤。
- 経口投与製剤である、請求項1~7のいずれか1項に記載の粘膜ワクチン製剤。
- カチオン性の官能基を有する親水性の多糖に側鎖として疎水性のコレステロールを付加したナノゲルとワクチン抗原を4~37℃で2~48時間混合することを含む、ワクチン抗原と前記ナノゲルの複合体を含む粘膜ワクチン製剤の製造方法。
- カチオン性の官能基がアミノ基である、請求項10記載の粘膜ワクチン製剤の製造方法。
- ナノゲルがコレステロール置換プルランである、請求項10又は11に記載の粘膜ワクチン製剤の製造方法。
- ワクチン抗原が微生物由来抗原である、請求項10~12のいずれか1項に記載の粘膜ワクチン製剤の製造方法。
- 微生物がウイルス、細菌、原虫及び真菌からなる群から選択される、請求項13記載の粘膜ワクチン製剤の製造方法。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/126,357 US20110206729A1 (en) | 2008-10-31 | 2009-10-30 | Mucosal vaccine using cationic nanogel |
| EP09823688.8A EP2345419B8 (en) | 2008-10-31 | 2009-10-30 | Mucosal vaccine using cationic nanogel |
| ES09823688.8T ES2624722T3 (es) | 2008-10-31 | 2009-10-30 | Vacuna mucosa que emplea nanogel catiónico |
| US14/478,127 US8961983B2 (en) | 2008-10-31 | 2014-09-05 | Mucosal vaccine using cationic nanogel |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008281065A JP5344558B2 (ja) | 2008-10-31 | 2008-10-31 | カチオン性ナノゲルを用いる粘膜ワクチン |
| JP2008-281065 | 2008-10-31 |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US13/126,357 A-371-Of-International US20110206729A1 (en) | 2008-10-31 | 2009-10-30 | Mucosal vaccine using cationic nanogel |
| US14/478,127 Division US8961983B2 (en) | 2008-10-31 | 2014-09-05 | Mucosal vaccine using cationic nanogel |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2010050578A1 true WO2010050578A1 (ja) | 2010-05-06 |
Family
ID=42128937
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2009/068647 WO2010050578A1 (ja) | 2008-10-31 | 2009-10-30 | カチオン性ナノゲルを用いる粘膜ワクチン |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US20110206729A1 (ja) |
| EP (1) | EP2345419B8 (ja) |
| JP (1) | JP5344558B2 (ja) |
| ES (1) | ES2624722T3 (ja) |
| WO (1) | WO2010050578A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013085021A1 (ja) * | 2011-12-09 | 2013-06-13 | 株式会社林原 | 抗体産生増強用の組成物 |
| WO2022210465A1 (ja) * | 2021-03-30 | 2022-10-06 | 国立大学法人東京大学 | ナノゲル被覆型ワクチン |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5532921B2 (ja) | 2007-05-14 | 2014-06-25 | コニカミノルタ株式会社 | リポソーム |
| JP5344558B2 (ja) | 2008-10-31 | 2013-11-20 | 国立大学法人 東京医科歯科大学 | カチオン性ナノゲルを用いる粘膜ワクチン |
| DK2490986T4 (da) * | 2009-10-21 | 2024-06-17 | Revance Therapeutics Inc | Fremgangsmåder og systemer til oprensning af ikke-kompleksbundet botulinum-neurotoksin |
| ES2556985T3 (es) | 2011-01-11 | 2016-01-21 | Capsugel Belgium Nv | Nuevas cápsulas duras que comprenden pululano |
| PL2750683T3 (pl) * | 2011-10-03 | 2018-10-31 | Mx Adjuvac Ab | Nanocząsteczki, sposób ich otrzymywania i ich zastosowanie jako nośnik dla związków amfipatycznych cząsteczek hydrofobowych w dziedzinach medycyny włączając leczenie raka i związki powiązane z żywnością |
| JP6310720B2 (ja) * | 2014-02-17 | 2018-04-11 | 知的財産戦略ネットワーク株式会社 | 肺炎球菌経鼻ワクチン |
| EP3153175B1 (en) * | 2014-06-04 | 2019-08-07 | Osaka University | Adjuvant for mucosal vaccine |
| WO2016081193A1 (en) * | 2014-11-18 | 2016-05-26 | Dow Global Technologies Llc | Delivering a drug to a mucosal surface |
| JP7246644B2 (ja) | 2016-12-03 | 2023-03-28 | ザ ユーエービー リサーチ ファウンデイション | 肺炎球菌表面プロテインaの選択されたアルファヘリカルドメインおよびプロリンリッチドメインを組み合わせた肺炎球菌ワクチン |
| CA3059527A1 (en) | 2017-04-14 | 2018-10-18 | Capsugel Belgium Nv | Pullulan capsules |
| BR112019021396A2 (pt) | 2017-04-14 | 2020-04-28 | Capsugel Belgium Nv | processo para fabricação de pululano |
| CN107583059B (zh) * | 2017-10-31 | 2021-03-30 | 宁夏医科大学 | 一种可包载量子点的阳离子脂质体流感疫苗及其制备方法 |
| JP2020019754A (ja) * | 2018-08-03 | 2020-02-06 | 国立研究開発法人農業・食品産業技術総合研究機構 | ウシ乳房炎に対する粘膜ワクチン組成物 |
| AU2019313996A1 (en) | 2018-08-03 | 2021-03-11 | Hanavax Inc. | Intranasal vaccine that induces cellular immunity |
Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0433497B2 (ja) | 1987-04-28 | 1992-06-03 | Nittetsu Mining Co Ltd | |
| JPH05339169A (ja) | 1992-03-03 | 1993-12-21 | Dai Ichi Seiyaku Co Ltd | 経口ワクチン |
| WO1998009650A1 (fr) * | 1996-09-06 | 1998-03-12 | Mitsubishi Chemical Corporation | Preparations vaccinales |
| WO2000012564A1 (fr) | 1998-08-31 | 2000-03-09 | Nof Corporation | Polysaccharide a haut degre de purete contenant des groupes hydrophobes et procede de production de ce polysaccharide |
| JP2005298644A (ja) | 2004-04-09 | 2005-10-27 | Kazunari Akiyoshi | ナノゲル工学によるハイブリッドゲルの調製とバイオマテリアル応用 |
| WO2006049032A1 (ja) | 2004-11-01 | 2006-05-11 | Tokyo Medical And Dental University | ナノゲル-アパタイト複合体の調製 |
| JP2006143808A (ja) | 2004-11-17 | 2006-06-08 | Tokyo Medical & Dental Univ | 量子ドット(Qdot)−ナノゲル複合体の調製 |
| WO2007083643A1 (ja) | 2006-01-18 | 2007-07-26 | National University Corporation Tokyo Medical And Dental University | 骨形成促進物質とナノゲルを含有する骨形成用生体材料 |
| JP2007252304A (ja) | 2006-03-24 | 2007-10-04 | Tokyo Medical & Dental Univ | ナノゲルを用いたタンパク質の細胞内導入法 |
| JP2008231343A (ja) * | 2007-03-23 | 2008-10-02 | Kumamoto Univ | ワクチン剤 |
| JP2008281065A (ja) | 2007-05-09 | 2008-11-20 | Nsk Ltd | 玉軸受 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5866135A (en) * | 1994-04-21 | 1999-02-02 | North American Vaccine, Inc. | Group A streptococcal polysaccharide immunogenic compositions and methods |
| US6967088B1 (en) * | 1995-03-16 | 2005-11-22 | Allergan, Inc. | Soluble recombinant botulinum toxin proteins |
| GB0717864D0 (en) * | 2007-09-13 | 2007-10-24 | Peptcell Ltd | Peptide sequences and compositions |
| JP5344558B2 (ja) | 2008-10-31 | 2013-11-20 | 国立大学法人 東京医科歯科大学 | カチオン性ナノゲルを用いる粘膜ワクチン |
-
2008
- 2008-10-31 JP JP2008281065A patent/JP5344558B2/ja active Active
-
2009
- 2009-10-30 US US13/126,357 patent/US20110206729A1/en not_active Abandoned
- 2009-10-30 ES ES09823688.8T patent/ES2624722T3/es active Active
- 2009-10-30 EP EP09823688.8A patent/EP2345419B8/en active Active
- 2009-10-30 WO PCT/JP2009/068647 patent/WO2010050578A1/ja active Application Filing
-
2014
- 2014-09-05 US US14/478,127 patent/US8961983B2/en active Active
Patent Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0433497B2 (ja) | 1987-04-28 | 1992-06-03 | Nittetsu Mining Co Ltd | |
| JPH05339169A (ja) | 1992-03-03 | 1993-12-21 | Dai Ichi Seiyaku Co Ltd | 経口ワクチン |
| WO1998009650A1 (fr) * | 1996-09-06 | 1998-03-12 | Mitsubishi Chemical Corporation | Preparations vaccinales |
| WO2000012564A1 (fr) | 1998-08-31 | 2000-03-09 | Nof Corporation | Polysaccharide a haut degre de purete contenant des groupes hydrophobes et procede de production de ce polysaccharide |
| JP2005298644A (ja) | 2004-04-09 | 2005-10-27 | Kazunari Akiyoshi | ナノゲル工学によるハイブリッドゲルの調製とバイオマテリアル応用 |
| WO2006049032A1 (ja) | 2004-11-01 | 2006-05-11 | Tokyo Medical And Dental University | ナノゲル-アパタイト複合体の調製 |
| JP2006143808A (ja) | 2004-11-17 | 2006-06-08 | Tokyo Medical & Dental Univ | 量子ドット(Qdot)−ナノゲル複合体の調製 |
| WO2007083643A1 (ja) | 2006-01-18 | 2007-07-26 | National University Corporation Tokyo Medical And Dental University | 骨形成促進物質とナノゲルを含有する骨形成用生体材料 |
| JP2007252304A (ja) | 2006-03-24 | 2007-10-04 | Tokyo Medical & Dental Univ | ナノゲルを用いたタンパク質の細胞内導入法 |
| JP2008231343A (ja) * | 2007-03-23 | 2008-10-02 | Kumamoto Univ | ワクチン剤 |
| JP2008281065A (ja) | 2007-05-09 | 2008-11-20 | Nsk Ltd | 玉軸受 |
Non-Patent Citations (3)
| Title |
|---|
| HASEGAWA ET AL., SAIBOU KOUGAKU, vol. 26, no. 6, 2007, pages 679 - 685 |
| See also references of EP2345419A4 |
| SHUNJI KOZAKI: "Division of Veterinary Science, School of Life and Environmental Sciences", OSAKA PREFECTURE UNIVERSITY |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013085021A1 (ja) * | 2011-12-09 | 2013-06-13 | 株式会社林原 | 抗体産生増強用の組成物 |
| WO2022210465A1 (ja) * | 2021-03-30 | 2022-10-06 | 国立大学法人東京大学 | ナノゲル被覆型ワクチン |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2624722T3 (es) | 2017-07-17 |
| US20140370056A1 (en) | 2014-12-18 |
| US20110206729A1 (en) | 2011-08-25 |
| EP2345419A1 (en) | 2011-07-20 |
| EP2345419B8 (en) | 2017-04-26 |
| EP2345419A4 (en) | 2013-07-10 |
| JP5344558B2 (ja) | 2013-11-20 |
| US8961983B2 (en) | 2015-02-24 |
| JP2010105968A (ja) | 2010-05-13 |
| EP2345419B1 (en) | 2017-02-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5344558B2 (ja) | カチオン性ナノゲルを用いる粘膜ワクチン | |
| JP6407208B2 (ja) | 合成ナノキャリア混合ワクチン | |
| Dmour et al. | Recent advances on chitosan as an adjuvant for vaccine delivery | |
| Krishnan et al. | Bacterial membrane vesicles for vaccine applications | |
| US20200215179A1 (en) | Nanoparticle-based compositions | |
| WO2005014038A1 (ja) | 粘膜免疫誘導アジュバントを含む新規ワクチン | |
| KR20180043352A (ko) | 다가 vlp 접합체 | |
| US9540420B2 (en) | Mucosal vaccines | |
| ES2374648T3 (es) | Composiciones de vacunas liposómicas que comprenden un antígeno polisacárido y un adyuvante proteico. | |
| WO2013085021A1 (ja) | 抗体産生増強用の組成物 | |
| WO2020067302A1 (ja) | 粘膜アジュバント | |
| Rosales-Mendoza et al. | Silica-based mucosal nanovaccines | |
| Ohta | Cholesteryl pullulan nanoparticles-encapsulated TNF-α: an effective mucosal vaccine adjuvant against influenza | |
| EP4316511A1 (en) | Nanogel-coated vaccine | |
| Yılmaz Çolak | Bacterial Membrane Vesicles as a Novel Vaccine Platform against SARS-CoV-2 | |
| Rodrigues et al. | Liposome-based dry powder vaccine immunization targeting the lungs induces broad protection against pneumococcus | |
| Nayerhoda | Development of Liposomal Encapsulation of Polysaccharides (Leps) Vaccine Design and Protection in Aged Hosts against Streptococcus pneumoniae Infections | |
| WO2020257315A1 (en) | Multiple antigen protein displayed adjuvant systems | |
| BRPI0700860B1 (pt) | Forma farmacêutica na forma de uma microesfera de pss recoberta com dodab e biomolécula com carga oposta à camada de dodab, composição farmacêutica, medicamento, e uso da forma farmacêutica |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 09823688 Country of ref document: EP Kind code of ref document: A1 |
|
| DPE1 | Request for preliminary examination filed after expiration of 19th month from priority date (pct application filed from 20040101) | ||
| WWE | Wipo information: entry into national phase |
Ref document number: 13126357 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| REEP | Request for entry into the european phase |
Ref document number: 2009823688 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2009823688 Country of ref document: EP |