RU2599717C2 - Сокристаллические формы трамадола и nsaid - Google Patents
Сокристаллические формы трамадола и nsaid Download PDFInfo
- Publication number
- RU2599717C2 RU2599717C2 RU2011119608/04A RU2011119608A RU2599717C2 RU 2599717 C2 RU2599717 C2 RU 2599717C2 RU 2011119608/04 A RU2011119608/04 A RU 2011119608/04A RU 2011119608 A RU2011119608 A RU 2011119608A RU 2599717 C2 RU2599717 C2 RU 2599717C2
- Authority
- RU
- Russia
- Prior art keywords
- tramadol
- crystalline form
- naproxen
- pain
- free base
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C217/00—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton
- C07C217/54—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C217/74—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with rings other than six-membered aromatic rings being part of the carbon skeleton
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/63—Compounds containing para-N-benzenesulfonyl-N-groups, e.g. sulfanilamide, p-nitrobenzenesulfonyl hydrazide
- A61K31/635—Compounds containing para-N-benzenesulfonyl-N-groups, e.g. sulfanilamide, p-nitrobenzenesulfonyl hydrazide having a heterocyclic ring, e.g. sulfadiazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/58—Unsaturated compounds containing ether groups, groups, groups, or groups
- C07C59/64—Unsaturated compounds containing ether groups, groups, groups, or groups containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2602/00—Systems containing two condensed rings
- C07C2602/02—Systems containing two condensed rings the rings having only two atoms in common
- C07C2602/04—One of the condensed rings being a six-membered aromatic ring
- C07C2602/10—One of the condensed rings being a six-membered aromatic ring the other ring being six-membered, e.g. tetraline
Abstract
Изобретение относится к новой сокристаллической форме трамадола в виде свободного основания и напроксена, или сокристаллической форму сольвата метанола, содержащего трамадол и напроксен, в которых молекулярное соотношение трамадола к напроксену составляет 1:2. Сокристаллическая форма может быть использована для лечения боли, предпочтительно острой боли, хронической боли, невропатической боли, тяжелой-умеренной боли, гипералгезии, аллодинии или раковой боли, в том числе диабетической невропатии или диабетической периферической невропатии и остеоартрита, фибромиалгии; ревматоидного артрита, анкилозирующего спондилита, плечелопаточного периартрита или ишиалгии. Сокристаллическая форма преимущественно содержит энантиомерные формы напроксена и трамадола, в частности (S)-напроксен или (R)-напроксен и (-)-трамадол или (+)-трамадол. Предлагаемые сокристаллические формы охарактеризованы данными порошковой дифракции рентгеновских лучей, а также показателями моноклинной элементарной ячейки и показателями эндометрического острого пика, соответствующего точке плавления, которая имеет начало при 82°С-84°С. Изобретение также относится к способу получения сокристаллической формы и фармацевтической композиции на ее основе. 4 н. и 8 з.п. ф-лы, 11 ил., 5 табл., 4 пр.
Description
Данное изобретение относится к сокристаллическим формам трамадола и NSAID (нестероидных противовоспалительных лекарственных средств), способам их получения и их применениям в качестве лекарственных средств или в фармацевтических готовых формах, более конкретно для лечения боли.
Боль является комплексной реакцией, которая была функционально классифицирована на сенсорные, моторные и аффективные компоненты. Сенсорный аспект включает в себя информацию о местоположении и интенсивности раздражителя, тогда как можно считать, что адаптивным компонентом является активация модуляции эндогенной боли и моторное планирование в отношении реакций избегания. Аффективный компонент, по-видимому, включает в себя оценивание неприятности боли и действия раздражителя, а также негативных эмоций, запускаемых памятью и контекстом этого болезненного раздражителя.
В общем, состояния боли могут быть подразделены на хронические и острые. Хроническая боль включает в себя невропатическую боль и хроническую воспалительную боль, например, артрит, или боль неизвестного происхождения, такую как фибромиалгия. Острая боль обычно сопровождает повреждение не-невральной ткани, например, повреждение ткани в результате хирургической операции или воспаления, или мигрень.
Известно, что многие лекарственные средства являются применимыми для лечения боли. Производные морфина показаны для лечения умеренной-острой боли у человека. Аналгезирующее действие получают через их действие на морфиновые рецепторы, предпочтительно µ-рецепторы. Среди этих производных морфина могут быть упомянуты морфин, кодеин, петидин, декстропропоксифенметадон, ленефопан и другие.
Одним из морфиновых производных, которое показало очень хорошие результаты при пероральном введении и которое широко распространено на рынке, является Трамадол, также доступный в качестве физиологически приемлемой соли, в частности, в виде хлоргидрата. Трамадол, химическим названием которого является 2-(диметиламинометил)-1-(3-метоксифенил)циклогексанол, имеет следующую формулу:
Эта структура имеет два различных хиральных центра и, следовательно, может существовать в виде различных диастереоизомеров, среди которых трамадол является цис-диастереоизомером: (1R, 2R) или (1S, 2S), оба из которых известны также как (+)-трамадол и (-)-трамадол и оба из которых вносят вклад различными способами в его активность.
Из существующего уровня техники можно предположить, что это соединение не является ни полностью опиоид-подобным, ни не подобным опиоидам. Некоторые исследования показали, что трамадол является агонистом опиоидов, тогда как клинический опыт указывает на то, что он лишен многих из типичных побочных действий агониста опиоидов, например, угнетения дыхания, запора или толерантности.
Вследствие их недостатков, опиоиды могут не всегда назначаться повторно или в более высоких дозах в качестве анальгетиков для лечения боли. Побочные действия опиоидов известны в данной области, в том числе, например, J. Jaffe in "Goodman and Gilman's, The Pharmacological Basis of Therapeutics", 8th edition; Gilman et al.; Pergamon Press, New York, 1990, Chapter 22, pages 522-573.
Таким образом, было предложено объединять опиоиды с другими лекарственными средствами, которые не являются опиоидными анальгетическими агентами, для уменьшения количества опиодов, необходимых для получения эквивалентной степени аналгезии. Сообщалось, что среди этих комбинаций особый интерес представляет ассоциация трамадола с нестероидными противовоспалительными лекарственными средствами (NSAID) (EP-0 546 676).
Таким образом, целью данного изобретения было обеспечение нового способа улучшения свойств трамадола, в частности, в отношении лечения боли, обеспечением новых применимых в качестве лекарственных средств форм трамадола.
Особенно желательные улучшения/преимущества этой новой применимой в качестве лекарственного средства формы могли бы включать в себя:
• улучшение физико-химических свойств для облегчения приготовления, технологии приготовления лекарственного средства, изготовления или улучшения абсорбции и/или биодоступности;
следовательно,
• придание большей активности в сравнении трамадолом в виде основания или гидрохлоридной солью; или
• обеспечение формы трамадола с дополнительным активным агентом, имеющим собственное полезное фармакологическое действие, позволяющее таким образом получать высокоэффективное отношение доза/масса конечного активного вещества лекарственного средства или даже
• позволяющее применение более низкой терапевтической дозы либо трамадола, либо дополнительного активного агента, NSAID, или обоих;
• достижение синергического действия посредством объединения трамадола и дополнительного активного агента, NSAID, в одной и той же применимой в качестве лекарственного средства форме; или
дополнительно
• удаление или ослабление горького вкуса трамадола;
• обеспечение легкого получения, легкого изготовления или
• обеспечение большей гибкости в приготовлении или облегчение его изготовления,
• придание высокой растворимости, следовательно, обеспечение лучших скоростей растворения, в частности, при растворении в водном физиологическом окружении, или
• улучшение стабильности этой сокристаллической формы в сравнении с физической смесью трамадол/активный агент (NSAID) при том же самом соотношении;
• возможность новых способов введения;
также
• возможность - если необходимо - объединения трамадола с обычно химически несовместимым активным агентом в одной и той же готовой форме или даже в непосредственном контакте, без необходимости изолирования трамадола;
или, наконец
• минимизацию/уменьшение побочных действий, в частности, тяжелых побочных действий, приписываемых трамадолу.
Другие желаемые улучшения/преимущества этой новой применимой в качестве лекарственного средства формы могли бы включать в себя активность в заболеваниях или симптомах, в которых существующее в настоящее время лечение является недостаточным, таких как ишиалгия или плечелопаточный периартрит (синдром Дюплея).
Наиболее желательно, эти новые применимые в качестве лекарственных средств формы должны объединять в себе более одного, предпочтительно большую часть, из этих преимуществ.
Эта цель была достигнута обеспечением новых сокристаллических форм трамадола. Было обнаружено, что трамадол был способен образовывать сокристаллические формы с NSAID. Эти сокристаллические формы обнаруживают улучшенные свойства в сравнении с одним трамадолом, а также хорошую аналгезирующую активность. Полученные таким образом сокристаллические формы имеют специфическую стехиометрию, которая зависит от структуры каждого NSAID. При подходящих обстоятельствах еще одним преимуществом этих новых применимых в качестве лекарственных средств форм является, возможно, также достижение некоторой модуляции фармакологических эффектов. Хотя в течение нескольких лет признавалось обычно, что API (активные фармацевтические ингредиенты), подобные трамадолу, образуют кристаллические полиморфы, сольваты, гидраты и аморфные формы, имеется мало сведений о том, какие API будут образовывать сокристаллические формы. Сокристаллические формы являются особым типом кристаллической формы, которые обеспечивают новый путь для модуляции формы API и, следовательно, модуляции свойств API. Сокристаллические формы содержат API и по меньшей мере один другой компонент, которые кристаллизуются вместе. Выбор другого компонента помогает определить, будет ли образовываться сокристаллическая форма и какие свойства будет иметь эта сокристаллическая форма. Именно в том случае, когда полиморфная, сольватная, гидратная или аморфная форма API может модулировать стабильность, растворимость и гигроскопичность, сокристаллическая форма может модулировать те же самые свойства.
Таким образом, основной целью данного изобретения является сокристаллическая форма, содержащая трамадол в виде свободного основания или в виде физиологически приемлемой соли и по меньшей мере одно NSAID.
"Применимая в качестве лекарственного средства форма (трамадола)" определяется в данном контексте как любая форма (соль, аморфный кристалл, раствор, дисперсия, смесь и т.д.), которую может принять трамадол, которая все еще может быть изготовлена в виде фармацевтической готовой формы, применимой в качестве лекарственного средства для лечения заболевания или симптома, в частности, боли.
"Сокристаллическая форма” определяется в данном контексте как кристаллический материал, содержащий два или более соединений при температуре окружающей среды (20-25°C, предпочтительно 20°C), из которых по меньшей мере два удерживаются вместе слабым взаимодействием, причем по меньшей мере одно из этих соединений является сокристалл-образующим компонентом. Слабое взаимодействие определяется как взаимодействие, которое не является ни ионным, ни ковалентным и включает в себя, например: водородные связи, ван-дер-ваальсовы силы и взаимодействия π-π. Сольваты трамадола, которые не содержат дополнительно сокристалл-образующего компонента, не являются сокристаллами согласно данному изобретению. Однако эти сокристаллы могут включать в себя одну или несколько сольватных молекул в кристаллической решетке. Именно для ясности понимания это различие между кристаллической солью и сокристаллом должно быть подчеркнуто здесь. API, связанный с другим соединением с образованием соли посредством ионного взаимодействия, может считаться одним "соединением" согласно данному изобретению, но не может сам считаться двумя соединениями.
В настоящее время в научной литературе существует дискуссия в отношении правильного применения слова «сокристалл» (см., например, Desiraju, Cryst. Eng. Comm., 2003, 5(82), 466-467 and Dunitz, Cryst. Eng. Comm., 2003, 5(91), 506). Недавняя статья Zawarotko (Zwarotko, Crystal Growth & Design, Vol. 7, No. 1, 2007, 4-9) дает определение сокристалла, которое находится в соответствии с приведенным выше определением, и, следовательно, является также определением "сокристалла" в соответствии с этим изобретением. Согласно этой статье "сокристалл является многокомпонентным кристаллом, в котором все компоненты являются твердыми при температуре окружающей среды в их чистой форме. Эти компоненты состоят из молекулы-мишени или иона-мишени и молекулярного сокристалл-образующего компонента (компонентов); находясь в сокристалле, они сосуществуют на молекулярном уровне в пределах единого кристалла”.
"Сокристалл-образующий компонент" определяется в данном контексте как молекула, являющаяся активным агентом, выбранным из NSAID, и с которой трамадол способен образовывать сокристаллы.
"Активные агенты" являются API, которые обнаруживают фармацевтическое действие и, следовательно, могут быть идентифицированы как являющиеся фармацевтически активными. В более узком смысле, это определение включает в себя все API, находящиеся на рынке или в клиническом испытании для лечения заболеваний. "Активные агенты с аналгезирующей активностью" являются API (Активными Фармацевтическими Ингредиентами), которые обнаруживают эффективность в хорошо известных моделях боли животных, и, следовательно, могут быть идентифицированы как являющиеся анальгетиками. В более узком смысле, это определение включает в себя все API, находящиеся на рынке или в клиническом испытании для маркировки, включающей в себя показание, подпадающее под определение боли, в том числе мигрени. Эти указания могут включать в себя острую боль, хроническую боль, невропатическую боль, гипералгезию, аллодинию или раковую боль, в том числе диабетическую невропатию или диабетическую периферическую невропатию, остеоартрит или фибромиалгию и все их субформы. Примеры "активных агентов с аналгезирующей активностью" включают в себя NSAID, такие как напроксен или ибупрофен, прегабалин или трамадол и его N-дезметил-метаболит.
"Боль" определяется Международной Ассоциацией по изучению боли (IASP) как "неприятное сенсорное и эмоциональное ощущение, ассоциированное с фактическим или потенциальным повреждением ткани, или описанное в связи с таким повреждением” (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210). Даже хотя боль всегда является субъективной, ее причины или синдромы могут быть классифицированы.
Согласно IASP "аллодиния" определяется как "боль вследствие стимула, который обычно не провоцирует боль" (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210). Даже хотя симптомы аллодинии, наиболее вероятно, ассоциируются как симптомы невропатической боли, это необязательно имеет место, так что имеются симптомы аллодинии, не связанные с невропатической болью, хотя и приводящие к аллодинии в некоторых областях, более широких, чем невропатическая боль.
IASP описывает также следующее различие между "аллодинией", "гипералгезией" и "гиперпатией" (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212):
| Аллодиния | Пониженный порог | Стимул и способ реакции различаются |
| Гипералгезия | Увеличенная реакция | Стимул и степень реакции являются одинаковыми |
| Гиперпатия | Повышенный порог; увеличенная реакция | Стимул и степень реакции могут быть одинаковыми или различными |
Согласно IASP "невропатия" определяется как "первичное повреждение или дисфункция в нервной системе" (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 211). Невропатическая боль может иметь центральное или периферическое происхождение.
"Ишиалгия" или "ишиалгический неврит” определяется здесь как набор симптомов, включающих в себя боль, которая происходит из раздражения седалищного нерва или его корней.
"Плечелопаточный периартрит (синдром Дюплея)" или "слипчивый капсулит" определяется здесь как симптом, в котором соединительная ткань, окружающая плечевой сустав или саму капсулу сустава, вызывает хроническую боль, становится воспаленной и ригидной.
"Анкилозирующий спондилит" или "Болезнь Бехтерева" является хроническим воспалительным артритом и аутоиммунным заболеванием. Он поражает большей частью суставы в позвоночнике и крестцово-подвздошные кости в тазе, вызывая в конечном счете слияние позвоночного столба.
В одном предпочтительном варианте осуществления сокристаллической формы согласно этому изобретению, NSAID имеет по меньшей мере одну функциональную группу из группы, состоящей из групп простого эфира, простого тиоэфира, спирта, тиола, альдегида, кетона, тиокетона, нитратного эфира, фосфатного эфира, тиофосфатного эфира, сложного эфира, сложного тиоэфира, сульфатного эфира, карбоновой кислоты, фосфоновой кислоты, фосфиновой кислоты, сульфоновой кислоты, амида, первичного амина, вторичного амина, аммиака, третичного амина, тиоцианата, цианамида, оксима, нитрила, диазо, органогалогенида, нитро, S-гетероциклического кольца, тиофена, N-гетероциклического кольца, пиррола, О-гетероциклического кольца, фурана, эпоксида, пероксида, гидроксамовой кислоты, имидазола и пиридина;
предпочтительно, в которых NSAID имеет по меньшей мере одну функциональную группу, выбранную из группы, состоящей из групп спирта, тиола, сложного эфира, карбоновой кислоты, первичного амина, вторичного амина, третичного амина.
В другом варианте осуществления NSAID имеет по меньшей мере одну функциональную группу, выбранную из группы, состоящей из групп спирта, сложного эфира или карбоновой кислоты.
В одном дополнительном варианте осуществления сокристаллической формы согласно этому изобретению NSAID выбраны таким образом, что в сравнении с одним трамадолом или со смесью трамадола и соответствующих активных агентов:
• растворимость сокристаллической формы повышена; и/или
• зависимость доза-ответ сокристаллической формы усилена; и/или
• эффективность сокристаллической формы повышена; и/или
• растворимость сокристаллической формы увеличена; и/или
• биодоступность сокристаллической формы увеличена; и/или
• стабильность сокристаллической формы повышена; и/или
• гигроскопичность сокристаллической формы снижена; и/или
• разнообразие форм сокристаллической формы уменьшено и/или
• морфология сокристаллической формы модулируется.
"Смесь трамадола и соответствующего активного агента/соответствующих активных агентов" определяется как смесь представляющего интерес активного агента или представляющих интерес активных агентов (NSAID) с трамадолом, которая является только физической смесью без каких-либо связывающих сил между этими соединениями и, следовательно, не включает в себя ни соли, ни другой сокристаллической формы.
В следующем варианте осуществления сокристаллической формы по данному изобретению, молярное отношение между трамадолом и NSAID отличается от 1. Это может иметь преимущество возможности развития не-эквимолярного отношения между трамадолом и активным агентом/активными агентами в фиксированной дозе со всеми преимуществами сокристаллической формы.
NSAID имеют аналгезирующую активность в ряде болевых симптомов, с ацетилсалициловой кислотой, известной под ее товарным названием аспирин - несмотря на то, что она используется более 100 лет - являющейся выдающимся используемым фармацевтически средством. Наряду с аспирином, другие NSAID (и COX-INHIBITORS), применение которых обычно также направлено на противовоспалительное действие, такие как ибупрофен, напроксен или диклофенак, находятся среди наиболее часто применяемых во всем мире фармацевтических соединений. Основой их активности является ингибирование циклооксигеназы (СОХ), одной из двух активностей простагландин-эндопероксидсинтазы (PGHS). Она является ключевым ферментом в пути простагландина. Предпочтительными NSAID является NSAID с функцией карбоновой кислоты. Предпочтительные примеры включают в себя салицилаты, антранилаты, арилуксусные кислоты/арилалкановые кислоты и арилпропионовые кислоты.
В литературе обсуждается вопрос о том, должен ли парацетамол/ацетаминофен рассматриваться как NSAID. Таким образом - в одном варианте осуществления этого изобретения - парацетамол/ацетаминофен не считается NSAID и, следовательно, исключается/выводится из (списка) NSAID (сокристалл-образующих агентов) согласно этому изобретению.
В одном дополнительном варианте осуществления сокристаллической формы в соответствии с этим изобретением NSAID выбрано из:
- Ацетилсалициловой кислоты;
- Трифлузала;
- HTB (2-гидрокси-4-трифторметилбензойной кислоты);
- Дифлунизала;
- Меклофенамовой кислоты;
- Мефенамовой кислоты;
- Нифлумовой кислоты;
- Флуфенамовой кислоты;
- Диклофенака;
- Лоназолака;
- Ацеметацина;
- Индометацина;
- Толметина;
- Сулиндака;
- Этодолака;
- Кетеролака;
- Флурбипрофена;
- (RS)-Флурбипрофена;
- Эсфлурбипрофена;
- Ибупрофена;
- (RS)-Ибупрофена;
- S-(+)-Ибупрофена;
- Кетопрофена;
- (rac)-Кетопрофена;
- R-(-)-Кетопрофена;
- Бермопрофена;
- Пелубипрофена;
- Тенозала;
- Аценейраминовой кислоты;
- Пиразолака;
- Ксинопрофена;
- Флобуфена;
- Аниролака;
- Золипрофена;
- Бромфенака;
- Пемедолака;
- Декспемедолака;
- Биндарита;
- Ромазарита;
- Напроксена;
- (S)-Напроксена;
- (R)-Напроксена;
- Тиапрофеновой кислоты;
- Кеторолака;
- Фенбуфена;
- Фенопрофена;
- Флобуфена или
- Оксапрозина.
В общем, должно быть понятно, что все эти NSAID, которые имеют по меньшей мере один стереогенный центр, включены здесь в их рацемической форме или в виде диастереоизомеров или энантиомеров или их смесей.
В следующем варианте осуществления, NSAID является Коксибом, селективным ингибитором СОХ-2. Таким образом, другим предпочтительным вариантом этого изобретения является фармацевтическое соединение, содержащее трамадол и по меньшей мере один COX-ингибитор, выбранный из NSAID, являющегося Коксибом. Примерами Коксиба являются: целекоксиб, эторикоксиб, лумиракоксиб, парекоксиб, рофекоксиб, валдекоксиб и цимикоксиб.
Таким образом, особенно предпочтительным является фармацевтическое соединение, содержащее трамадол и целекоксиб, предпочтительно фармацевтическое соединение, содержащее (ras)-трамадол.HCl и целекоксиб.
В следующем варианте сокристаллической формы по данному изобретению, NSAID выбрано из:
- Ацетилсалициловой кислоты;
- Трифлузала;
- HTB (2-гидрокси-4-трифторметилбензойной кислоты);
- Дифлунизала;
- Меклофенамовой кислоты;
- Мефенамовой кислоты;
- Нифлумовой кислоты;
- Флуфенамовой кислоты;
- Диклофенака;
- Лоназолака;
- Ацеметацина;
- Индометацина;
- Толметина;
- Сулиндака;
- Этодолака;
- Кетеролака;
- Флурбипрофена;
- (RS)-Флурбипрофена;
- Эсфлурбипрофена;
- Ибупрофена;
- (RS)-Ибупрофена;
- S-(+)-Ибупрофена;
- Кетопрофена;
- (rac)-Кетопрофена;
- R-(-)-Кетопрофена;
- Бермопрофена;
- Пелубипрофена;
- Тенозала;
- Аценейраминовой кислоты;
- Пиразолака;
- Ксинопрофена;
- Флобуфена;
- Аниролака;
- Золипрофена;
- Бромфенака;
- Пемедолака;
- Декспемедолака;
- Биндарита;
- Ромазарита;
- Напроксена;
- (S)-Напроксена;
- (R)-Напроксена;
- Тиапрофеновой кислоты;
- Кеторолака;
- Фенбуфена;
- Фенопрофена;
- Флобуфена или
- Оксапрозина или
- Целекоксиба;
- Эторикоксиба;
- Лумиракоксиба;
- Парекоксиба;
- Рофекоксиба;
- Вальдекоксиба или
- Цимикоксиба.
Термин "соль” должен пониматься в значении любой формы трамадола или NSAID по этому изобретению, в которой эта форма предполагает ионную форму, или является заряженной или связанной с противоионом (катионом или анионом) или является раствором. Под этим термином понимаются также комплексы трамадола или NSAID с другими молекулами и ионами, в частности, комплексы, которые образуются через ионные взаимодействия. Этот термин включает в себя также физиологически приемлемую соль.
Термин "сольват” по этому изобретению должен пониматься в значении любой формы трамадола или NSAID, к которой это соединение присоединено через нековалентное связывание другой молекулы (наиболее вероятно, полярного растворителя), в частности, включающей в себя гидраты и сольваты спиртов, например сольват метанола.
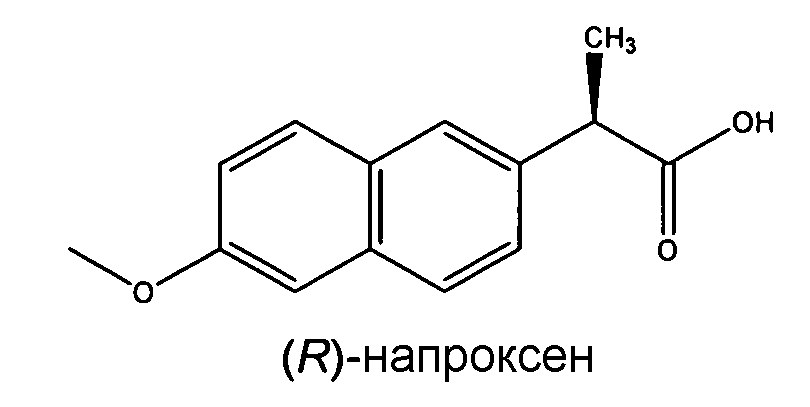
Представляющим большой интерес NSAID, которое должно быть сокристалл-образующим агентом с трамадолом, является продаваемое на рынке лекарственное средство напроксен. Химическим названием его (S)-энантиомера, продаваемого на рынке (S)-напроксена, является (S)-(6-метокси-2-нафтил)пропионовая кислота, которая также описана в качестве физиологически приемлемой соли. Она имеет эмпирическую формулу C14H14O3, точку плавления 153°C и pKa 4,2.
(R)-энантиомер, (R)-напроксен, химическим названием которого является (R)-(6-метокси-2-нафтил)пропионовая кислота, имеющий ту же самую формулу C14H14O3, точку плавления 153°C и pKa 4,2, обнаруживает следующую формулу.
Таким образом, другой очень предпочтительный аспект этого изобретения относится к сокристаллической форме согласно данному изобретению, в которой NSAID является напроксеном, его энантиомерами или солями. В частности, она относится к сокристаллической форме этого изобретения, в которой NSAID является (S)-напроксеном или (R)-напроксеном.
Другой вариант осуществления этого изобретения относится к сокристаллической форме по этому изобретению, в которой тремадолом является (-)-трамадол или (+)-трамадол.
Как иллюстрируется более подробно ниже, трамадол и, особенно, его энантиомеры (+)-трамадол и (-)-трамадол образуют сокристаллические формы с напроксеном, в частности, с (S)-напроксеном и (R)-напроксеном. Обычно полученные сокристаллические формы имеют конкретную стехиометрию, которая зависит от структуры каждого сокристалл-образующего NSAID. В каждом конкретном случае сокристаллической формы между трамадолом и напроксеном, являющимся сокристалл-образующим агентом, молекулярное отношение между трамадолом и напроксеном равно 1:2.
В следующем предпочтительном варианте осуществления этого изобретения, сокристаллическая форма по этому изобретению выбрана из:
• сокристаллической формы, содержащей (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (S)-напроксен;
• сокристаллической формы, содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен;
• смеси энантиомеров сокристаллических форм, содержащих (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (S)-напроксен, и сокристаллических форм, содержащих (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен;
• причем любая из вышеуказанных сокристаллических форм является сокристаллической формой сольвата спирта, наиболее предпочтительно является сокристаллической формой сольвата метанола.
В одном высокопредпочтительном варианте осуществления этих выбранных сокристаллических форм, молекулярное соотношение между трамадолом и напроксеном равно 1:2.
В одном предпочтительном варианте сокристаллической формы с молекулярным отношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением, содержащей (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (S)-напроксен или содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен или смесь энантиомеров этих сокристаллических форм, эта сокристаллическая форма обнаруживает картину порошковой дифракции рентгеновских лучей с пиками [2θ] при 4,3, 8,7, 9,5, 10,2, 10,6, 11,3, 12,1, 12,7, 13,2, 13,7, 14,3, 14,6, 14,8, 15,5, 15,7, 16,0, 16,2, 17,0, 17,4, 17,9, 18,1, 18,7, 19,1, 19,4, 19,7, 20,1, 20,5, 20,8, 21,1, 21,4, 21,6 и 21,8 [°].
Величины 2θ получали с использованием излучения меди (CuKα1 1,54060 Å).
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением, содержащего (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (S)-напроксен, или содержащего (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен, или смесь энантиомеров этих сокристаллических форм, эта сокристаллическая форма обнаруживает картину инфракрасной спектроскопии с Фурье-преобразованием (Fourier Transform Infra Red) с полосами поглощения при 3247, 2942, 1699, 1633, 1605, 1583, 1485, 1380, 1271, 1223, 1160, 1029, 851, 789 и 704 см-1.
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением, содержащей (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (S)-напроксен, или содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен, или энантиомерные смеси этих сокристаллических форм, эта сокристаллическая форма имеет моноклинную элементарную ячейку со следующими размерами:
a=9,512(2) Å
b=40,5736(11) Å
с=10,323(4) Å
α=90°
β=96,29(1)°
γ=90°.
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением, содержащей (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (S)-напроксен, или содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен или энантиомерные смеси этих сокристаллических форм, эндотермический пик этой сокристаллической формы, соответствующий точке плавления, имеет начало при 82°C.
В другом предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением, содержащей (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (S)-напроксен, или содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен или энантиомерные смеси этих сокристаллических форм, эндотермический пик этой сокристаллической формы, соответствующий точке плавления, имеет начало при 82°C-84°C.
В другом предпочтительном варианте осуществления сокристаллическая форма с молекулярным соотношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением, содержащая (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен, находится в виде сольвата метанола.
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением в форме сольвата метанола, содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен, эта сокристаллическая форма обнаруживает картину порошковой дифракции рентгеновских лучей с пиками [2θ] при 4,1, 6,6, 9,0, 9,2, 10,4, 11,0, 11,5, 12,3, 12,5, 12,7, 13,0, 13,2, 13,8, 14,9, 15,4, 16,2, 17,2, 17,6, 18,1, 18,5, 19,1, 19,3, 19,6, 19,9, 20,1, 20,4, 20,9, 21,0, 21,5, 22,0, 22,3 и 22,6 [°].
Величины 2θ получали с использованием излучения меди (CuKα1 1,54060 Å).
В другом предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между трамадолом и напроксеном 1:2 в соответствии с этим изобретением в форме сольвата метанола, содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и (R)-напроксен, эта сокристаллическая форма обнаруживает картину инфракрасной спектроскопии с Фурье-преобразованием (Fourier Transform Infra Red) с полосами поглощения при 3523, 3151, 2928, 2861, 2465, 1706, 1632, 1603, 1567, 1485, 1461, 1445, 1417, 1388 и 1362 см-1.
Как иллюстрировано более подробно ниже, трамадол образует сокристаллические формы с (S)-напроксеном. Обычно полученные сокристаллические формы имеют конкретную стехиометрию, которая зависит от структуры каждого сокристалл-образующего агента. В этом конкретном случае сокристаллической формы с (S)-напроксеном, являющимся NSAID, молекулярное соотношение между трамадолом и (S)-напроксеном равно 1:2.
Представляющими большой интерес NSAID, которые должны быть сокристалл-образующими агентами с трамадолом, являются Коксибы. Наболее важным из них является продаваемое на рынке лекарственное средство целекоксиб. Его химическим названием является 4-[5-(4-метилфенил)-3-(трифторметил)-пиразол-1-ил]бензолсульфонамид. Он имеет эмпирическую формулу C17H14F3N3O2S.
В другом варианте осуществления сокристаллической формы в соответствии с этим исследованием NSAID выбрано из:
- Целекоксиба,
- Эторикоксиба,
- Лумирикоксиба,
- Парекоксиба,
- Рофекоксиба,
- Вальдекоксиба или
- Цимикоксиба.
Другой очень предпочтительный аспект этого изобретения относится к сокристаллической форме в соответствии с данным изобретением, в которой NSAID является целекоксибом или его солями.
Как иллюстрировано более подробно ниже, трамадол - и особенно рацемат - образует сокристаллические формы с целекоксибом. Обычно полученные сокристаллические формы имеют конкретную стехиометрию, которая зависит от структуры каждого сокристалл-образующего NSAID. В этом конкретном случае сокристаллической формы между (rac)-трамадолом и целекоксибом, являющимся сокристалл-образующим агентом, молекулярное соотношение между трамадолом и целекоксибом равно 1:1.
В следующем предпочтительном варианте осуществления этого изобретения, сокристаллическая форма по этому изобретению выбрана из:
• сокристаллической формы, содержащей (rac-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и целекоксиб;
• сокристаллической формы, содержащей (+)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и целекоксиб;
• сокристаллической формы, содержащей (-)-трамадол в виде свободного основания или в виде физиологически приемлемой соли и целекоксиб; или предпочтительно
• сокристаллической формы, содержащей (rac)-трамадол.HCl (гидрохлоридную соль трамадола) и целекоксиб.
В высокопредпочтительном варианте осуществления этих выбранных сокристаллических форм молекулярное соотношение между (rac)-трамадол.HCl и целекоксибом равно 1:1.
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между (rac)-трамадол.HCl и целекоксибом 1:1 в соответствии с этим изобретением, эта сокристаллическая форма обнаруживает картину порошковой дифракции рентгеновских лучей с пиками [2θ] при 7,1, 9,3, 10,2, 10,7, 13,6, 13,9, 14,1, 15,5, 16,1, 16,2, 16,8, 17,5, 18,0, 19,0, 19,5, 19,9, 20,5, 21,2, 21,3, 21,4, 21,8, 22,1, 22,6, 22,7, 23,6, 24,1, 24,4, 25,2, 26,1, 26,6, 26,8, 27,4, 27,9, 28,1, 29,1, 29,9, 30,1, 31,1, 31,3, 31,7, 32,5, 32,8, 34,4, 35,0, 35,8, 36,2 и 37,2 [°].
Величины 2θ получали с использованием излучения меди (CuKα1 1,54060 Å).
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между (rac)-трамадол.HCl и целекоксибом 1:1 в соответствии с этим изобретением, эта сокристаллическая форма обнаруживает картину инфракрасной спектроскопии с Фурье-преобразованием (Fourier Transform Infra Red) с полосами поглощения при 3481,6 (м), 3133,5 (м), 2923,0 (м), 2667,7 (м), 1596,0 (м), 1472,4 (м), 1458,0 (м), 1335,1 (м), 1288,7 (м), 1271,8 (м), 1168,7 (с), 1237,3 (м), 1168,7 (с), 1122,6 (с), 1100,9 (м), 1042,2 (м), 976,8 (м), 844,6 (м), 820,1 (м), 786,5 (м) и 625,9 (м) см-1.
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между (rac)-трамадол.HCl и целекоксибом 1:1 в соответствии с этим изобретением, эта сокристаллическая форма имеет ромбическую элементарную ячейку со следующими размерами:
a=11,0323(7) Å
b=18,1095(12) Å
c=17,3206(12) Å
В одном предпочтительном варианте осуществления сокристаллической формы с молекулярным соотношением между (rac)-трамадол.HCl и целекоксибом 1:1 в соответствии с этим изобретением, эндотермический пик этой сокристаллической формы, соответствующий точке плавления, имеет начало при 164°C.
Другой вариант осуществления данного изобретения относится к способу получения сокристаллической формы в соответствии с этим изобретением, описанного выше, предусматривающему стадии:
(a) растворения или суспендирования NSAID в растворителе; необязательно нагревания этого раствора или дисперсии до температуры выше температуры окружающей среды и ниже точки кипения этого раствора или дисперсии;
(b) растворения вместе со стадией или после стадии, или перед стадией (а) трамадола в виде свободного основания или в виде соли в растворителе;
(c) добавления раствора (b) к раствору (a) и смешивания их;
(d) охлаждения смешанного раствора/смешанной дисперсии стадии (c) до температуры окружающей среды;
(e) необязательно выпаривания части или всего этого растворителя; и
(f) отфильтровывания полученных сокристаллических форм.
Другой вариант данного изобретения относится к способу получения сокристаллической формы в соответствии с этим изобретением, описанного выше, предусматривающему стадии:
(a) растворения или суспендирования NSAID в растворителе; необязательно нагревания этого раствора или дисперсии до температуры выше температуры окружающей среды и ниже точки кипения этого раствора или дисперсии;
(b) растворения вместе со стадией или после стадии, или перед стадией (а) трамадола в виде свободного основания или в виде соли в растворителе, необязательно вместе со стадией (а) растворением трамадола уже вместе с NSAID на стадии (а);
(c) необязательно добавления раствора (b) к раствору (a) и смешивания их;
(d) необязательно добавления растворителя к раствору (а), (b) или (с) и смешивания их;
(е) охлаждения смешанного раствора/смешанной дисперсии стадии (а), (b), (c) или (d) до температуры окружающей среды или ниже;
(f) необязательно выпаривания части или всего растворителя; и
(g) отфильтровывания полученных сокристаллических форм.
"Температура окружающей среды (комнатная температура)" определяется здесь как температура между 20 и 25°C, предпочтительно 20°C.
Растворители, применимые в этих способах, включают в себя воду или органические растворители, предпочтительно растворители, выбранные из ацетона, изобутилацетата, ацетонитрила, этилацетата, 2-бутанола, диметилкарбоната, хлорбензола, бутилового эфира, диизопропилового эфира, диметилформамида, этанола, воды, гексана (также циклогексана), изопропанола, метилэтилкетона (также метилизобутилкетона), метанола, метил-т-бутилового эфира, 3-пентанона, толуола и 1,1,1-трихлорэтана, наиболее предпочтительно включают в себя спирты, такие как этанол. Предпочтительно - но необязательно - растворители на стадиях (a) и (c) являются идентичными.
Молекулярное соотношение между трамадолом и NSAID находится между 4:1-1:4, предпочтительно 3:1-1:3 и более предпочтительно 1:1-1:2.
Предпочтительно, раствор трамадола на стадии (b) имеет концентрацию между 3 М и 0,01 М.
Части сокристаллической формы по этому изобретению являются хорошо известными лекарственными средствами с аналгезирующими свойствами, иногда используемыми в течение длительного времени во всем мире. Вследствие этого дополнительным предметом данного изобретения является лекарственное средство, содержащее сокристаллическую форму по этому изобретению.
Таким образом, это изобретение относится также к лекарственному средству, содержащему по меньшей мере одну сокристаллическую форму по этому изобретению, описанную выше, и необязательно один или несколько фармацевтически приемлемых эксципиентов.
Это изобретение относится также к фармацевтической композиции, которая содержит терапевтически эффективное количество сокристаллической формы по этому изобретению в физиологически приемлемой среде.
Ассоциация двух активных веществ лекарственного средства в одном и том же кристалле проявляет несколько преимуществ. Будучи связанными, они часто ведут себя как единая химическая частица, что облегчает обработки, приготовление, дозирование и т.д. Кроме этого, поскольку как трамадол, так и NSAID являются активными анальгетиками, эти сокристаллические формы высоко применимы в лечении боли, в частности, также без потери активности/массы вследствие добавления фармакологически бесполезных противоионов, как это имеет место в солях без API. Кроме того, эти два активных вещества дополняют друг друга в лечении, в частности, боли, но, возможно, также различных других заболеваний или симптомов. Таким образом, сокристаллические формы по этому изобретению действительно объединяют в себе большое число преимуществ относительно состояния этой области.
Другим преимуществом является то, что ассоциация двух активных веществ в один единственный препарат, по-видимому, делает возможной лучшую фармакокинетику/фармакодинамику (PKPD), в том числе также лучшее проникновение через гематоэнцефалический барьер, что способствует лечению боли.
В общем, в большинстве вариантов осуществления, в которых используют сокристаллические формы трамадола (например, для лечения боли или т.д.), эти сокристаллические формы могли бы быть приготовлены в виде подходящей фармацевтической готовой формы или лекарственного средства. Таким образом, желаемое преимущество сокристаллической формы трамадола могло бы обнаруживать улучшенные фармацевтические свойства и признаки, особенно в сравнении со свободным основанием или гидрохлоридом трамадола. Таким образом, желательно, чтобы сокристаллическая форма трамадола по данному изобретению могла обнаруживать по меньшей мере один, предпочтительно несколько, из следующих признаков:
• иметь очень малый размер частиц, например, от 300 мкм или менее; или
• быть и/или оставаться по существу не содержащей агломератов; или
• быть менее или не очень гигроскопичной; или
• способствовать приготовлению форм регулируемого высвобождения или немедленного высвобождения; или
• иметь высокую химическую стабильность; или
при введении пациенту
• уменьшать вариабельность в уровнях в крови между субъектами и в одном субъекте; или
• обнаруживать хорошую скорость абсорбции (например, увеличения уровней в плазме или AUC); или
• обнаруживать высокую максимальную концентрацию в плазме (например, Cмакс); или
• обнаруживать уменьшенное время до максимальных концентраций лекарственного средства в плазме (tмакс); или
• обнаруживать изменения времени полужизни соединения (t1/2), каким бы ни было направление этого изменения.
Лекарственное средство или фармацевтические композиции по данному изобретению могут быть в любой форме, подходящей для применения к человеку и/или животным, предпочтительно к людям, в том числе младенцам, детям и взрослым, и могут быть приготовлены стандартными процедурами, известными квалифицированным в данной области специалистам. Лекарственное средство данного изобретения может, например, вводиться парентерально, в том числе внутримышечной, внутрибрюшинной или внутривенной инъекцией, через слизистую оболочку или подъязычным введением; или перорально, в том числе введением в виде таблеток, шариков, гранул, капсул, лепешек, водных или масляных растворов, суспензий, эмульсий, спреев или в виде порошковой формы, воссоздаваемой жидкой средой.
Обычно, лекарственные средства по этому изобретению могут содержать 1-60 масс.% одной или нескольких сокристаллических форм, определенных здесь, и 40-99 масс.% одного или нескольких вспомогательных веществ (добавок/эксципиентов).
Композиции данного изобретения могут также вводиться местно или через суппозиторий.
Суточная доза для людей и животных может варьироваться в зависимости от факторов, которые имеют свою основу в соответствующих препаратах, или других факторов, таких как возраст, пол, масса или степень болезни и т.д. Суточная доза для людей находится в диапазоне 5-500 миллиграммов трамадола, подлежащих введению во время одного или нескольких приемов в день.
Дополнительный аспект этого изобретения относится к применению сокристаллической формы по этому изобретению, описанной выше, для лечения боли, предпочтительно острой боли, хронической боли, невропатической боли, гипералгезии, аллодинии или раковой боли, в том числе диабетической невропатии, остеоартрита или фибромиалгии. Дополнительный аспект этого изобретения относится к применению сокристаллической формы по этому изобретению, описанной выше, для лечения боли, предпочтительно острой боли, хронической боли, невропатической боли, сильной-умеренной боли, гипералгезии, аллодинии или раковой боли, в том числе диабетической невропатии, остеоартрита, фибромиалгии; ревматоидного артрита, анкилозирующего спондилита, плечелопаточного периартрита (синдрома Дюплея) или ишиалгии. Предпочтительно, эти применения обеспечиваются в форме лекарственного средства или фармацевтической композиции в соответствии с изобретением, описанных выше.
Другим предметом данного изобретения является способ лечения боли, предпочтительно острой боли, хронической боли, невропатической боли, гипералгезии, аллодинии или раковой боли, в том числе диабетической невропатии или остеоартрита, или фибромиалгии, предоставлением пациенту, нуждающемуся в этом, достаточного количества сокристаллической формы по этому изобретению, описанной выше. Предпочтительно, сокристаллическую форму по этому изобретению обеспечивают в физиологически приемлемой форме, например, в форме лекарственного средства или фармацевтической композиции в соответствии с этим изобретением, как описано выше.
Данное изобретение иллюстрируется ниже при помощи следующих фигур и примеров. Эти иллюстрации приведены только в качестве примера и не ограничивают это изобретение.
Краткое описание фигур:
Фигура 1: Картина порошковой дифракции рентгеновских лучей сокристаллической формы (-)-трамадола-(S)-напроксена 1:2.
Фигура 2:
DSC-анализ сокристаллической формы (-)-трамадол-(S)-напроксена 1:2.
Фигура 3:
TG-анализ сокристаллической формы (-)-трамадол-(S)-напроксена 1:2.
Фигура 4:
Структура элементарной ячейки сокристаллической формы (-)-трамадол-(S)-напроксена 1:2, полученная анализом SCXRD, показывающая четыре молекулы (S)-напроксена и две молекулы (-)-трамадола.
Фигура 5:
Картина порошковой рентгеновской дифракции сокристаллической формы сольвата метанола (+)-трамадол-(R)-напроксена 1:2.
Фигура 6:
DSC-анализ сокристаллической формы сольвата метанола (+)-трамадол-(R)-напроксена 1:2.
Фигура 7:
TG-анализ сокристалической формы сольвата метанола (+)-трамадол-(R)-напроксена 1:2.
Фигура 8:
Картина порошковой дифракции рентгеновских лучей сокристаллической формы (rac)-трамадол.HCl-целекоксиба 1:1.
Фигура 9:
DSC-анализ сокристаллической формы (rac)-трамадол.HCl-целекоксиба 1:1.
Фигура 10:
TG-анализ сокристаллической формы (rac)-трамадол.HCl-целекоксиба 1:1.
Фигура 11:
Структура элементарной ячейки сокристаллической формы (rac)-трамадол.HCl-целекоксиба 1:1, полученная анализом SCXRD, показывающая две молекулы целекоксиба и две молекулы трамадола.
ПРИМЕРЫ
Пример 1а: Способ получения сокристаллической формы (-)-трамадол-(S)-напроксена (1:2).
Раствор (S)-напроксена (2,14 г, 9,3 ммоль) в 20 мл метанола добавляли в течение 10 минут к перемешиваемому раствору (-)-трамадола (2,45 г, 9,5 ммоль) в 10 мл метанола. Полученный раствор перемешивали при комнатной температуре в течение 30 минут и растворитель выпаривали под вакуумом с получением светло-желтого масла. Это масло охлаждали до -197oC и давали нагреваться до комнатной температуры с получением аморфной соли (-)-трамадол-(S)-напроксена в виде белого твердого вещества (4,59 г, 100%).
Процедура: Полученную, как описано выше, аморфную соль (-)-трамадол-(S)-напроксена (1:1) (2,2 г, 4,46 ммоль) суспендировали в 10 мл диизопропилового эфира и перемешивали в течение 7 дней при комнатной температуре. Полученную суспензию отфильтровывали. Фильтрат промывали приблизительно 2 мл диизопропилового эфира и сушили под вакуумом при 40°C (10 мм Hg) в течение 24 часов с получением сокристаллической формы (-)-трамадол-(S)-напроксена в соотношении 1:2 в виде кристаллического белого твердого вещества (1,37 г, выход 85% относится к содержанию (S)-напроксена начальной смеси).
Пример 1b: Способ получения сокристаллической формы (-)трамадол-(S)-напроксена (1:2):
Раствор (-)-трамадола (0,58 г, 2,20 ммоль) в 2 мл изопропанола добавляли к перемешиваемой суспензии (S)-напроксена (1,02 г, 4,43 ммоль, 2 экв) в 2 мл изопропанола при 60°C. Полученный раствор охлаждали до комнатной температуры и треть растворителя выпаривали. В этот раствор добавляли в качестве затравочного кристалла 5-10 мг кристаллической сокристаллической формы (-)-трамадол-(S)-напроксена (1:2) и оставляли стоять при комнатной температуре в течение 48 часов без перемешивания. Полученную суспензию отфильтровывали, фильтрат промывали приблизительно 1 мл изопропанола и сушили под вакуумом (10 мм Hg) при 60°C в течение 24 часов с получением сокристаллической формы (-)-трамадол-(S)-напроксена в соотношении 1:2 в виде белого твердого вещества (1,31 г, 81%).
ХАРАКТЕРИСТИКА СОКРИСТАЛЛИЧЕСКОЙ ФОРМЫ:
Сокристаллическая форма (-)-трамадол-(S)-напроксена (1:2), полученная в соответствии с примером 1, была полностью охарактеризована при помощи 1H-ЯМР, FTIR, порошковой дифракции рентгеновских лучей, дифракции рентгеновских лучей на монокристалле, DSC и TG (см. фигуры 1-4).
Величина оптического вращения равна [α]23 D=+6° (c=1,00, MeOH)
Картина порошковой дифракции рентгеновских лучей (PXRD) сокристаллической формы (-)-трамадола и (S)-напроксена (1:2) (см фиг.1).
Картины порошковой дифракции получали на системе D8 Advance Series 2Theta/Theta порошковой дифракции с использованием CuKα-излучения в геометрии пропускания. Эта система оборудована детектором VANTEC-1, считающим отдельные фотоны PSD, монохроматором на основе германия, стеллажом автомата с 90 положениями, фиксированными щелями дивергенции и радиальным soller. Используемые программы: Сбор данных с DIFFRAC plus XRD Commander V.2.4.1 и оценивание с EVA V.12.0 (см. фигуру 1). Эти пики, выраженные в виде углов 2θ и d-величин, описаны подробно в таблице 1:
| Таблица 1 Перечень выбранных пиков, полученных порошковой дифракцией рентгеновских лучей сокристаллической формы (-)-трамадола и (S)-напроксена (1:2) |
||||||
| Угол 2θ1 | d-величина (Å) | Относительная интенсивность % | Угол 2θ1 | d-величина (Å) | Относительная интенсивность % | |
| 4,296 | 20,55171 | 8,9 | 16,176 | 5,47506 | 4,0 | |
| 8,659 | 10,20397 | 20,0 | 17,033 | 5,20140 | 9,1 | |
| 9,458 | 9,34300 | 36,6 | 17,449 | 5,07826 | 4,2 | |
| 10,209 | 8,65740 | 10,4 | 17,882 | 4,95625 | 3,1 | |
| 10,634 | 8,31301 | 12,5 | 18,131 | 4,88881 | 7,3 | |
| 11,302 | 7,82251 | 16,4 | 18,700 | 4,74132 | 100,0 | |
| 12,118 | 7,29783 | 9,3 | 19,060 | 4,65259 | 29,6 | |
| 12,693 | 6,96824 | 28,2 | 19,407 | 4,57012 | 15,7 | |
| 13,241 | 6,68136 | 9,4 | 19,705 | 4,50167 | 32,7 | |
| 13,754 | 6,43322 | 21,3 | 20,115 | 4,41077 | 41,6 | |
| 14,278 | 6,19841 | 2,4 | 20,525 | 4,32376 | 11,6 | |
| 14,626 | 6,05175 | 6,3 | 20,795 | 4,26805 | 12,1 | |
| 14,790 | 5,98498 | 7,3 | 21,097 | 4,20773 | 16,5 | |
| 15,551 | 5,69362 | 4,3 | 21,409 | 4,14714 | 13,2 | |
| 15,711 | 5,63613 | 4,3 | 21,579 | 4,11476 | 13,8 | |
| 16,015 | 5,52985 | 9,6 | 21,855 | 4,06355 | 8,4 | |
| 1 Величины 2θ получали с использованием излучения меди (CuKα 1,54060 Å) | ||||||
1
H-ЯМР-спектр сокристаллической формы (-)-трамадола и (S)-напроксена (1:2):
Анализы спектров протонного ядерного магнитного резонанса регистрировали в дейтерированном метаноле (MeOH-d4) в ЯМР-спектрометре Bruker Avance 400 Ultrashield, оборудованном z-градиентным зондом 5 мм BBO (Broadband Observe). Спектры получали растворением 2-10 мг пробы в 0,6 мл дейтерированного растворителя.
1H ЯМР-спектр (в d4-метаноле при 400 МГц) δ показывает пики при 1,47-1,96 (м, 8H), 1,51 (д, J=7 Гц, 6H), 2,17 (м, 1H), 2,55 (дд, J=2 Гц, J=13 Гц, 1H), 2,57 (с, 6H), 2,88 (дд, J=9 Гц, J=13 Гц, 1H), 3,78 (кв, J=7 Гц, 2H), 3,80 (с, 3H), 3,89 (с, 6H), 6,82 (дд, J=2 Гц, J=8 Гц, 1H), 7,07 (м, 4H), 7,19 (д, J=2 Гц, 2H), 7,29 (т, J=8 Гц, 1H), 7,45 (дд, J=2 Гц, J=8 Гц, 2H), 7,70 (м, 6H).
FT-IR-спектр сокристаллической формы (-)-трамадола и (S)-напроксена (1:2):
FTIR-спектры (ATR) сокристаллической формы (-)-трамадола-(S)-напроксена регистрировали с использованием Bruker Tensor 27, оборудованного системой MKII golden gate single reflection ATR, источником среднего инфракрасного излучения в качестве источника возбуждения и детектором DTGS. Эти спектры получали в 32 сканах при разрешении 4 см-1.
Проба сокристаллической формы (-)-трамадол-(S)-напроксена (1:2) показывает инфракрасный спектр с Фурье-преобразованием (ATR) c полосами поглощения υmax при 3247, 2942, 1699, 1633, 1605, 1583, 1485, 1380, 1271, 1223, 1160, 1029, 851, 789 и 704 см-1.
DSC-анализ сокристаллической формы (-)-трамадола и (S)-напроксена (1:2) (см. фиг.2)
DSC-анализы регистрировали в Mettler Toledo DSC822e. Пробы 1-2 мг взвешивали в алюминиевые тигли на 40 мкл с крышкой с точечным отверстием и нагревали в атмосфере азота (50 мл/мин), при 10°C/мин от 3 до 300°C.
Эндотермический пик DSC-анализа сокристаллической формы (-)-трамадол-(S)-напроксена (1:2) соответствует точке плавления с началом пика при 82°C, см. фигуру 2.
TG-анализ сокристаллической формы (-)-трамадола и (S)-напроксена (1:2) (см. фиг.3):
Термогравиметрические анализы регистрировали в Mettler Toledo SDTA851e. Пробы 3-4 мг взвешивали в алюминиевые тигли на 40 мкл с крышкой с точечным отверстием и нагревали при 10°C/мин от 30 до 500°C, в атмосфере азота (80 мл/мин).
Этот TG-анализ сокристаллической формы (-)-трамадол-(S)-напроксена (1:2) согласно этому изобретению не обнаруживает потери массы при температуре ниже точки плавления (см. фигуру 3).
XRD-анализ монокристалла сокристаллической формы (-)-трамадола и (S)-напроксена (1:2) (см. фиг.4):
Структуру кристалла определяли из данных дифракции рентгеновских лучей монокристалла. Этот измеряемый кристалл, полученный из приготовления согласно примеру 1, отбирали при помощи стереомикроскопа Zeiss с использованием поляризованного света и получали при инертных условиях с погружением в перфторполиэфир в качестве защищающего масла для манипулирования. Определение структуры кристалла проводили с использованием дифрактометра Bruker-Nonius, оборудованного детектором площади APPEX 2 4K CCD, вращающимся анодом FR591 с излучением MoKα, зеркалами Montel в качестве монохроматора и устройством Kryoflex для получения низкой температуры (T=100 K). Для сбора данных полной сферы выполняли омега- и фи-сканирования. Использовали следующие программы: сбора данных Apex2 V. 1.0-22 (Bruker-Nonius 2004), редукции данных Saint + Version 6.22 (Bruker-Nonius 2001) и коррекции поглощения SADABS V. 2.10 (2003). Выяснение структуры кристалла достигалось с использованием прямых способов, осуществляемых в SHELXTL Version 6.10 (Sheldrick, Universtitat Göttingen (Germany), 2000), и визуализацию выполняли с использованием программы XP. Отсутствующие атомы впоследствии локализовали из Фурье-синтеза различий и добавляли к списку атомов. Уточнение по методу наименьших квадратов на F0 2 с использованием всех измеренных интенсивностей проводили при помощи программы SHELXTL Version 6.10 (Sheldrick, Universtitat Göttingen (Germany), 2000). Все не являющиеся водородом атомы уточняли (очищали) с включением параметров анизотропного смещения. На фигуре 4 показана структура этой сокристаллической формы. Данные кристалла и уточнение структуры для сокристаллической формы (-)-трамадол-(S)-напроксена (1:2) приведены в следующей таблице 2.
| Таблица 2 Наиболее релевантные структурные данные анализа SCXRD сокристаллической формы (-)-трамадол-(S)-напроксена (1:2). |
|
| Кристаллографическая система | Моноклинная |
| Пространственная группа: | P21 |
| A (Å) | 9,512(2) |
| B (Å) | 40,5736(11) |
| C (Å) | 10,323(4) |
| α (°) | 90 |
| β (°) | 96,29(1) |
| γ (°) | 90 |
| Z | 2 |
| Объем (Å3) | 3959,9(16) |
Пример 2: Сокристаллическая форма (+)-трамадол-(R)-напроксена (1:2)
Способ получения сокристаллической формы (+)-трамадол-(R)-напроксена (1:2):
Раствор (R)-напроксена (751 мг, 3,26 ммоль) в 4 мл метанола добавляли к раствору (+)-трамадола (430 мг, 1,63 ммоль) в 1 мл метанола. Эту смесь перемешивали в течение 30 минут и растворитель выпаривали под вакуумом с получением масла, которое отверждали охлаждением до -197°C. Полученное твердое вещество суспендировали в 10 мл диизопропилового эфира и перемешивали в течение 7 дней при комнатной температуре. Полученную суспензию отфильтровывали. Фильтрат промывали приблизительно 5 мл диизопропилового эфира и сушили под вакуумом (10 мм Hg) при 40°C в течение 16 часов с получением сокристаллической формы (+)-трамадол-(R)-напроксена в соотношении 1:2 в виде кристаллического белого твердого вещества (620 мг, 53%).
ХАРАКТЕРИСТИКА СОКРИСТАЛЛИЧЕСКОЙ ФОРМЫ:
Сокристаллическая форма (+)-трамадол-(R)-напроксена (1:2), полученная в соответствии с примером 2, была полностью охарактеризована при помощи 1H-ЯМР, FTIR, порошковой дифракции рентгеновских лучей, DSC и TG.
Все полученные данные были идентичны данным, полученным для его энантиомера сокристаллической формы (-)-трамадол-(S)-напроксена (1:2) примера 1, причем единственным различием является величина оптического вращения [α]23 D=-7° (c=1,00, MeOH) и DSC (10°C/min): эндометрический пик, соответствующий точке плавления, с началом при 84°C.
Пример 3: Сокристаллическая форма сольвата метанола (+)-трамадол-(R)-напроксена (1:2)
Способ получения сокристаллической формы сольвата метанола (+)-трамадол-(R)-напроксена (1:2):
Раствор (R)-напроксена (925 мг, 4,02 ммоль) в 3 мл метанола добавляли к раствору (+)-трамадола (530 мг, 2,01 ммоль) в 1 мл метанола. Эту смесь перемешивали в течение 10 минут и приблизительно половину растворителя выпаривали. Полученный раствор оставляли стоять при комнатной температуре, и после 24 часов образовывалось твердое вещество. Это твердое вещество отфильтровывали, фильтрат промывали 2 мл метанола и сушили под вакуумом (10 мм Hg) в течение 4 часов с получением сольвата метанола 1:2 сокристаллической формы (+)-трамадол-(R)-напроксена в виде кристаллических белых игольчатых кристаллов (610 мг, 42%).
ХАРАКТЕРИСТИКА СОКРИСТАЛЛИЧЕСКОЙ ФОРМЫ:
Сокристаллическая форма сольвата метанола (+)-трамадол-(R)-напроксена (1:2), полученная в соответствии с примером 3, была полностью охарактеризована при помощи 1H-ЯМР, FTIR, порошковой дифракции рентгеновских лучей, DSC и TG (см. фигуры 5-8).
Величина оптического вращения равна [α]23 D=-5° (c=1,00, MeOH)
Картина порошковой дифракции рентгеновских лучей (PXRD) сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена (см фиг.5).
Картины порошковой дифракции получали на системе D8 Advance Series 2Theta/Theta порошковой дифракции с использованием CuKα-излучения в геометрии пропускания. Эта система оборудована детектором VANTEC-1 считающим отдельные фотоны PSD, монохроматором на основе германия, стеллажом автомата с 90 положениями, фиксированными щелями дивергенции и радиальным soller. Используемые программы: Сбор данных с DIFFRAC plus XRD Commander V.2.4.1 и оценивание с EVA V.12.0 (см. фигуру 5). Эти пики, выраженные в виде углов 2θ и d-величин, описаны подробно в таблице 3:
| Таблица 3 Перечень выбранных пиков, полученных порошковой дифракцией рентгеновских лучей сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена. |
||||||
| Угол 2θ1 | d-величина (Å) | Относительная интенсивность % | Угол 2θ1 | d-величина (Å) | Относительная интенсивность % | |
| 4,118 | 21,44081 | 12,1 | 17,204 | 5,15004 | 19,0 | |
| 6,606 | 13,37037 | 1,4 | 17,610 | 5,03216 | 10,4 | |
| 9,002 | 9,81544 | 3,7 | 18,124 | 4,89075 | 100,0 | |
| 9,190 | 9,61534 | 3,2 | 18,499 | 4,79232 | 30,4 | |
| 10,447 | 8,46109 | 49,5 | 19,080 | 4,64786 | 55,8 | |
| 11,043 | 8,00578 | 39,3 | 19,352 | 4,58308 | 12,5 | |
| 11,547 | 7,65723 | 2,5 | 19,643 | 4,51573 | 9,8 | |
| 12,266 | 7,21033 | 7,8 | 19,898 | 4,45840 | 12,6 | |
| 12,498 | 7,07682 | 8,9 | 20,074 | 4,41971 | 9,0 | |
| 12,671 | 6,98047 | 4,1 | 20,424 | 4,34491 | 8,3 | |
| 13,041 | 6,78342 | 4,6 | 20,881 | 4,25078 | 45,4 | |
| 13,191 | 6,70672 | 5,3 | 21,035 | 4,22003 | 28,5 | |
| 13,778 | 6,42196 | 6,0 | 21,552 | 4,11988 | 36,9 | |
| 14,907 | 5,93807 | 19,4 | 22,023 | 4,03290 | 13,3 | |
| 15,384 | 5,75499 | 6,6 | 22,263 | 3,98986 | 33,4 | |
| 16,195 | 5,46846 | 6,3 | 22,580 | 3,93462 | 7,6 | |
| 1 Величины 2θ получали с использованием излучения меди (CuKα 1,54060 Å) | ||||||
1
H-ЯМР-спектр сокристаллической формы сольвата метанола (1:2) (+)-трамадола-(R)-напроксена:
Анализы спектров протонного ядерного магнитного резонанса регистрировали в дейтерированном метаноле (MeOH-d4) в ЯМР-спектрометре Bruker Avance 400 Ultrashield, оборудованном z-градиентным зондом 5 мм BBO (Broadband Observe). Спектры получали растворением 2-10 мг пробы в 0,6 мл дейтерированного растворителя. 1H ЯМР-спектр (в d4-метаноле при 400 МГц) δ показывает пики при 1,41-1,93 (м, 8H), 1,51 (д, J=7 Гц, 6H), 2,13 (м, 1H), 2,52 (м, 7H), 2,87 (дд, J=9 Гц, J=13 Гц, 1H), 3,35 (2 × MeOH), 3,77 (кв, J=7 Гц, 2H), 3,79 (с, 3H), 3,88 (с, 6H), 6,81 (дд, J=2 Гц, J=8 Гц, 1H), 7,02 (д, J=7 Гц, 1H), 7,09 (м, 3H), 7,18 (д, J=2 Гц, 2H), 7,27 (т, J=8 Гц, 1H), 7,45 (дд, J=1 Гц, J=8 Гц, 2H), 7,66-7,74 (м, 6H).
FT-IR-спектр сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена:
FTIR-спектры (ATR) сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена регистрировали с использованием Bruker Tensor 27, оборудованного системой MKII golden gate single reflection ATR, источником среднего инфракрасного излучения в качестве источника возбуждения и детектором DTGS. Эти спектры получали в 32 сканах при разрешении 4 см-1. Проба сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена показывает инфракрасный спектр с Фурье-преобразованием (ATR) c полосами поглощения υmax при 3523, 3151, 2928, 2861, 2465, 1706, 1632, 1603, 1567, 1485, 1461, 1445, 1417, 1388 и 1362 см-1.
DSC-анализ сокристаллической формы сольвата метанола (1:2) (+)-трамадол- (R)-напроксена (см. фиг.6):
DSC-анализы регистрировали в Mettler Toledo DSC822e. Пробы 1-2 мг взвешивали в алюминиевые тигли на 40 мкл с крышкой с точечным отверстием и нагревали в атмосфере азота (50 мл/мин), при 10°C/мин от 3 до 300°C. Измеренные эндотермические пики сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена имели точки начала при 44°С и 60°С, см. фигуру 6.
TG-анализ сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена (см. фиг.7):
Термогравиметрические анализы регистрировали в Mettler Toledo SDTA851e. Пробы 3-4 мг взвешивали в алюминиевые тигли на 40 мкл с крышкой с точечным отверстием и нагревали при 10°C/мин от 30 до 500°C, в атмосфере азота (80 мл/мин). Этот TG-анализ сокристаллической формы сольвата метанола (1:2) (+)-трамадол-(R)-напроксена согласно этому изобретению действительно обнаруживает потерю массы 7,2% между 40 и 140°С с последующим разрушением, начинающимся при 160°С (см. фигуру 7).
Пример 4: Сокристаллическая форма (rac)-трамадол
.
HCl-целекоксиба (1:2)
Способ получения сокристаллической формы (rac)-трамадол
.
HCl-целекоксиба (1:1):
Пример 4а: (получение через измельчение с растворителем)
Реактор шаровой мельницы из нержавеющей стали на 5 мл загружали двумя шарами шаровой мельницы на 7 мм, гидрохлоридом (rac)-трамадола (48 мг, 0,166 ммоль), целекоксибом (61 мг, 0,16 ммоль, 1 экв) и 1 каплей метилизобутилкетона. Этот реактор перемешивали при 30 Гц в течение 45 минут. Следы растворителя удаляли в вакууме с получением сокристаллической формы (rac)-трамадол.HCl-целекоксиба в виде белого твердого вещества (109 мг, выход количественный).
Пример 4b: (крупномасштабный, с использованием кристаллизации)
К трехгорлой колбе на 1 л, снабженной механической мешалкой, капельной воронкой и холодильником, содержащей трамадол.HCl (26,54 г, 88,5 ммоль) и целекоксиб (33,74 г, 88,5 ммоль, 1 экв), добавляли 122 мл этанола. Полученную суспензию нагревали с обратным холодильником при дефлегмации (до полного растворения). К этому раствору медленно добавляли циклогексан (203 мл) при поддержании дефлегмации (в течение дополнительного времени 20 минут) и затем этот раствор медленно охлаждали до комнатной температуры с перемешиванием. В этот раствор вносили в качестве затравки в форму, полученную в примере 4а, и начинали кристаллизацию. Эту смесь охлаждали 2 часа при 0°С.
Белое твердое вещество фильтровали через воронку с фильтром из агломерированного стекла № 3 и промывали смесью растворителей при 0-5°C (1 объем, 60 мл, (0,6:1) EtOH/циклогексан). После сушки в течение 2 дней при комнатной температуре под вакуумом, получали сокристаллическую форму (rac)-трамадол.HCl-целекоксиб (1:1) в виде белого твердого вещества (54,6 г, выход 91%).
ХАРАКТЕРИСТИКА СОКРИСТАЛЛИЧЕСКОЙ ФОРМЫ:
Сокристаллическая форма (rac)-трамадол.HCl-целекоксиб (1:1), полученная в соответствии с примером 4, была полностью охарактеризована при помощи 1H-ЯМР, FTIR, порошковой дифракции рентгеновских лучей, DSC и TG (см. фигуры 8-10).
Картина порошковой дифракции рентгеновских лучей (PXRD) сокристаллической формы (rac)-трамадол
.
HCl-целекоксиба (1:1) (см фиг.8):
Анализ PXRD выполняли с использованием дифрактометра Philips X'Pert с Cu Kα-излучением в геометрии Bragg-Brentano. Эта система оборудована одномерным многополосным детектором реального времени. Параметры измерений были следующие: диапазон 2θ был 3°-40° при скорости сканирования 8,8° в минуту (см. фигуру 8). Пики, выраженные в виде углов 2θ и d-величин, описаны подробно в таблице 4:
| Таблица 4 Перечень выбранных пиков, полученных порошковой дифракцией рентгеновских лучей сокристаллической формы (rac)-трамадол.HCl-целекоксиба (1:1) |
||||||
| Угол 2θ1 | d-величина (Å) | Относительная интенсивность % | Угол 2θ1 | d-величина (Å) | Относительная интенсивность % | |
| 7,06 | 12,52 | 29 | 23,57 | 3,78 | 15 | |
| 9,32 | 9,49 | 1 | 24,11 | 3,69 | 13 | |
| 10,21 | 8,67 | 5 | 24,36 | 3,65 | 10 | |
| 10,69 | 8,27 | 2 | 25,20 | 3,53 | 6 | |
| 13,64 | 6,49 | 10 | 26,12 | 3,41 | 11 | |
| 13,86 | 6,39 | 14 | 26,58 | 3,35 | 2 | |
| 14,13 | 6,27 | 100 | 26,77 | 3,33 | 2 | |
| 15,53 | 5,71 | 3 | 27,45 | 3,25 | 5 | |
| 16,10 | 5,51 | 6 | 27,94 | 3,19 | 4 | |
| 16,25 | 5,45 | 5 | 28,13 | 3,17 | 3 | |
| 16,85 | 5,26 | 44 | 29,07 | 3,07 | 9 | |
| 17,50 | 5,07 | 12 | 29,91 | 2,99 | 3 | |
| 18,00 | 4,93 | 11 | 30,15 | 2,96 | 3 | |
| 19,05 | 4,66 | 38 | 31,11 | 2,88 | 3 | |
| 19,48 | 4,56 | 11 | 31,34 | 2,85 | 5 | |
| 19,91 | 4,46 | 25 | 31,74 | 2,82 | 1 | |
| 20,48 | 4,34 | 25 | 32,49 | 2,76 | 3 | |
| 21,18 | 4,19 | 11 | 32,83 | 2,73 | 2 | |
| 21,27 | 4,18 | 11 | 34,42 | 2,61 | 1 | |
| 21,44 | 4,14 | 8 | 35,04 | 2,56 | 2 | |
| 21,80 | 4,08 | 18 | 35,76 | 2,51 | 1 | |
| 22,14 | 4,02 | 3 | 36,24 | 2,48 | 2 | |
| 22,56 | 3,94 | 14 | 37,19 | 2,42 | 1 | |
| 22,73 | 3,91 | 32 | ||||
| 1 Величины 2θ получали с использованием излучения меди (CuKα 1,54060 Å) | ||||||
1
H-ЯМР-спектр сокристаллической формы (rac)-трамадол
.
HCl и целекоксиба (1:1):
Анализы спектров протонного ядерного магнитного резонанса регистрировали в дейтерированном метаноле-d4 в спектрометре Varian Mercury 400, оборудованном широкополосным зондом АТВ 1Н/19F/X 5 мм. Спектры получали растворением 5-10 мг пробы в 0,6 мл дейтерированного растворителя.
1H ЯМР-спектр (в d4-метаноле при 400 МГц) δ показывает пики при 7,97-7,90 (м, 2H); 7,53-7,46 (м, 2H); 7,30 (т, J=8,0 Гц, 1H); 7,22-7,14 (м, 4H); 7,12-7,09 (м, 1H); 7,07 (д, J=7,8 Гц, 1H); 6,90 (с, 1H); 6,83 (дд, J=2,7 Гц, J=8,2 Гц, 1H); 3,80 (с, 3H); 2,98 (дд, J=9,0 Гц, J=13,3 Гц, 1Н); 2,75-2,60 (м, 8Н); 2,35 (с, 3Н); 2,28-2,18 (м, 1Н); 2,00-1,46 (м, 8Н) ч.млн.
FT-IR-спектр сокристаллической формы (rac)-трамадол
.
HCl и целекоксиба (1:1):
FTIR-спектры регистрировали с использованием FT-IR Thermo Nicolet 870, оборудованного системой расщепителя пучка KBr, 35 мВ He-Ne-лазером в качестве источника возбуждения и детектором DTGS KBr. Эти спектры получали в 32 сканах при разрешении 4 см-1.
Проба (KBr-шарик) показывает инфракрасный спектр с Фурье-преобразованием (ATR) c полосами поглощения υmax при 3481,6 (м), 3133,5 (м), 2923,0 (м), 2667,7 (м), 1596,0 (м), 1472,4 (м), 1458,0 (м), 1335,1 (м), 1288,7 (м), 1271,8 (м), 1168,7 (с), 1237,3 (м), 1168,7 (с), 1122,6 (с), 1100,9 (м), 1042,2 (м), 976,8 (м), 844,6 (м), 820,1 (м), 786,5 (м), 625,9 (м) см-1.
DSC-анализ сокристаллической формы (rac)-трамадол
.
HCl и целекоксиба (1:1) (см. фиг.9)
DSC-анализы регистрировали в Mettler Toledo DSC822e. Пробу 1,6230 мг взвешивали в алюминиевые тигли на 40 мкл с крышкой с точечным отверстием и нагревали в атмосфере азота (50 мл/мин), при 10°C/мин от 3 до 200°C.
Новый тип кристалла данного изобретения характеризуется тем, что эндотермический острый пик, соответствующий точке плавления, имеет начало при 164,44°С (энтальпия слияния - 93,56 Дж/г), при измерении DSC-анализом (10°С/мин) (см. фигуру 9).
TG-анализ сокристаллической формы (rac)-трамадол
.
HCl и целекоксиба (1:1) (см. фиг.10):
Термогравиметрические анализы регистрировали в термогравиметрическом анализаторе Mettler TGA/SDTA851e. Пробу 3,0560 мг взвешивали в алюминиевый тигель на 70 мкл с крышкой с точечным отверстием и нагревали при 10°C/мин от 30 до 200°C, в атмосфере азота (50 мл/мин).
TG-анализ этой кристаллической формы по данному изобретению обнаруживает незначимую потерю массы между 30 и 200°С.
XRD-анализ монокристалла сокристаллической формы (rac)-трамадол
.
HCl и целекоксиба (1:1) (см. фиг.11):
Структуру кристалла определяли из данных дифракции рентгеновских лучей монокристалла. Из кристаллизации раствора с затравочным кристаллом в гептане и IPA в эквимолярных количествах сокристаллической формы гидрохлорида (rac)-трамадола и целекоксиба получали используемую бесцветную призму (0,33×0,16×0,11 мм).
Анализ выполняли при комнатной температуре с использованием дифрактометра Bruker Smart Apex c графитным монохроматированным излучением Mo Kα, оборудованным детектором CCD. Данные собирали с использованием фи- и омега-сканов (используемая программа: SMART 5.6). Не наблюдали значимого затухания стандартных интенсивностей. Использовали данные редукции (Lorentz и коррекции поляризации) и коррекции поглощения (используемой программой была программа Saint 5.0).
Структуру кристалла выясняли с использованием прямых способов, и проводили уточнение (очищение) по методу наименьших квадратов F0 2 против всех измеренных интенсивностей (с использованием программы SHELXTL-NT 6.1). Все не являющиеся водородом атомы уточняли (очищали) с использованием параметров анизотропного смещения. Данные кристалла и уточнение (очищение) структуры для сокристаллической формы (rac)-трамадол.HCl-целекоксиба (1:1) приведены в следующей таблице 5.
| Таблица 5 Наиболее релевантные структурные данные анализа SCXRD сокристаллической формы (rac)-трамадол.HCl-целекоксиба (1:1). |
|
| Кристаллографическая система | Ромбический кристалл |
| Пространственная группа | Pna21 |
| a (Å) | 11,0323(7) |
| b(Å) | 18,1095(12) |
| c(Å) | 17,3206(12) |
| Объем (Å3) | 3460,5(4) |
| Z | 4 |
| Dрассч. (мг/м3) | 1,308 |
| N. of refl. | 8336 |
| Refl. with I>2σ(I) | 5240 |
| R (I>2σ(I)) | 0,0584 |
Структура кристалла изображена на фигуре 12 (показана только половина содержимого элементарной ячейки кристалла, атомы водорода были опущены для ясности; использованной программой была программа: Mercury 2.2, C.F. Macrae, I.J. Bruno, J.A. Chisholm, P.R. Edgington, P. McCabe, E. Pidcock, L. Rodriguez-Monge, R. Taylor, J. van de Streek and P.A. Wood, J. Appl. Cryst., 41, 2008, 466-470).
Имитационное моделирование дифрактограммы XRPD из данных монокристалла дает почти идентичную диаграмму относительно представленной выше экспериментальной диаграммы.
Пример 4с: Определение биодоступности сокристаллической формы (rac)-трамадол
.
HCl-целекоксиба (1:1)
Целью является измерение подвергания плазмы в крысе воздействию сокристаллической формы (rac)-трамадол.HCl и целекоксиба (1:1) с использованием определения AUC сокристаллической формы (rac)-трамадол.HCl-целекоксиба (1:1) данного изобретения и сравнения ее с каждым активным веществом этой сокристаллической формы и фиксированной комбинацией этих двух активных веществ.
Биодоступность сокристаллической формы (rac)-трамадол.HCl-целекоксиба сравнивали с биодоступностью, полученной после введения крысам пероральным способом трамадола.HCl плюс целекоксиба, вместе и раздельно. Продукты с эквивалентным размером частиц вводят перорально при помощи капсул для грызунов при уровне дозы 25 мг/кг сокристаллической формы и при эквивалентном уровне дозы сравниваемых веществ (11 мг трамадол.HCl/кг, 14 мг целекоксиба/кг). Кровь из крыс берут в следующих временных точках: предварительная доза, 15, 30, 45 минут, 1, 1,5, 2, 3, 4, 5, 6, 8, и 24 часа. Плазму выделяют центрифугированием, очищают SPE и уровни в плазме определяют LC-MS-MS. Фармакокинетические параметры рассчитывают с использованием не-компартментализованного фармакокинетического анализа.
Эти результаты показывают увеличение действия целекоксиба при введении сокристаллической формы (rac)-трамадол.HCl-целекоксиба в сравнении с одним целекоксибом и с комбинацией обоих API (смесью трамадола и целекоксиба).
Claims (12)
1. Сокристаллическая форма, содержащая трамадол в виде свободного основания и напроксен, или сокристаллическая форма сольвата метанола, содержащая трамадол и напроксен, в которых молекулярное соотношение трамадола к напроксену составляет 1:2.
2. Сокристаллическая форма по п. 1, где напроксен является (S)-напроксеном или (R)-напроксеном.
3. Сокристаллическая форма по п. 1, где трамадол является (-)-трамадолом или (+)-трамадолом.
4. Сокристаллическая форма по п. 1, выбранная из:
- сокристаллической формы, содержащей (-)-трамадол в виде свободного основания и (S)-напроксен;
- сокристаллической формы, содержащей (+)-трамадол в виде свободного основания и (R)-напроксен;
- сокристаллической формы сольвата метанола.
- сокристаллической формы, содержащей (-)-трамадол в виде свободного основания и (S)-напроксен;
- сокристаллической формы, содержащей (+)-трамадол в виде свободного основания и (R)-напроксен;
- сокристаллической формы сольвата метанола.
5. Сокристаллическая форма по п. 1, содержащая (-)-трамадол в виде свободного основания и (S)-напроксен или (+)-трамадол в виде свободного основания и (R)-напроксен, отличающаяся тем, что она обнаруживает картину порошковой дифракции рентгеновских лучей с пиками [2θ] при 4,3, 8,7, 9,5, 10,2, 10,6, 11,3, 12,1, 12,7, 13,2, 13,7, 14,3, 14,6, 14,8, 15,5, 15,7, 16,0, 16,2, 17,0, 17,4, 17,9, 18,1, 18,7, 19,1, 19,4, 19,7, 20,1, 20,5, 20,8, 21,1, 21,4, 21,6 и 21,8 [°], причем величины 2θ получают с использованием излучения меди (CuKα1 1,54060 Ǻ).
6. Сокристаллическая форма по п. 1, содержащая (-)-трамадол в виде свободного основания и (S)-напроксен или (+)-трамадол в виде свободного основания и (R)-напроксен, отличающаяся тем, что она имеет моноклинную элементарную ячейку со следующими размерами:
a=9,512(2) Ǻ
b=40,5736(11) Ǻ
с=10,323(4) Ǻ
α=90°
β=96,29(1)°
γ=90°.
a=9,512(2) Ǻ
b=40,5736(11) Ǻ
с=10,323(4) Ǻ
α=90°
β=96,29(1)°
γ=90°.
7. Сокристаллическая форма по п. 1, содержащая (-)-трамадол в виде свободного основания и (S)-напроксен, отличающаяся тем, что эндометрический острый пик, соответствующий точке плавления, имеет начало при 82°С-84°С.
8. Сокристаллическая форма по п. 1, содержащая (+)-трамадол в виде свободного основания и (R)-напроксен, отличающаяся тем, что эндометрический острый пик, соответствующий точке плавления, имеет начало при 84°С.
9. Сокристаллическая форма по п. 1 в форме сольвата метанола, содержащего (+)-трамадол в виде свободного основания и (R)-напроксен, отличающаяся тем, что она обнаруживает картину порошковой дифракции рентгеновских лучей с пиками [2θ] при 4,1, 6,6, 9,0, 9,2, 10,4, 11,0, 11,5, 12,3, 12,5, 12,7, 13,0, 13,2, 13,8, 14,9, 15,4, 16,2, 17,2, 17,6, 18,1, 18,5, 19,1, 19,3, 19,6, 19,9, 20,1, 20,4, 20,9, 21,0, 21,5, 22,0, 22,3 и 22,6 [°], причем эти величины 2θ получают с использованием излучения меди (CuKα1 1,54060 Ǻ).
10. Способ получения сокристаллической формы по п. 1, включающий стадии:
(a) растворения или суспендирования напроксена или его энантиомера в спирте; необязательно нагревания этого раствора или дисперсии до температуры выше температуры окружающей среды и ниже точки кипения этого раствора или дисперсии;
(b) растворения одновременно со стадией или после стадии или перед стадией (а) трамадола в виде свободного основания в спирте, необязательно объединенного со стадией (а) растворения трамадола вместе с напроксеном или его энантиомером на стадии (a);
(c) необязательно добавления раствора (b) к раствору (а) и смешивания их;
(d) необязательно добавления растворителя к раствору (а), (b) или (с) и смешивания их;
(e) охлаждения смешанного раствора/смешанной дисперсии стадии (с) до или ниже температуры окружающей среды;
(f) необязательно выпаривания части или всего растворителя; и
(g) отфильтровывания полученной сокристаллической формы.
(a) растворения или суспендирования напроксена или его энантиомера в спирте; необязательно нагревания этого раствора или дисперсии до температуры выше температуры окружающей среды и ниже точки кипения этого раствора или дисперсии;
(b) растворения одновременно со стадией или после стадии или перед стадией (а) трамадола в виде свободного основания в спирте, необязательно объединенного со стадией (а) растворения трамадола вместе с напроксеном или его энантиомером на стадии (a);
(c) необязательно добавления раствора (b) к раствору (а) и смешивания их;
(d) необязательно добавления растворителя к раствору (а), (b) или (с) и смешивания их;
(e) охлаждения смешанного раствора/смешанной дисперсии стадии (с) до или ниже температуры окружающей среды;
(f) необязательно выпаривания части или всего растворителя; и
(g) отфильтровывания полученной сокристаллической формы.
11. Фармацевтическая композиция, пригодная для лечения боли, отличающаяся тем, что она содержит терапевтически эффективное количество сокристаллической формы по любому из пп. 1-9 в физиологически приемлемой среде.
12. Применение сокристаллической формы по любому из пп. 1-9 для лечения боли, предпочтительно острой боли, хронической боли, невропатической боли, тяжелой-умеренной боли, гипералгезии, аллодинии или раковой боли, в том числе диабетической невропатии или диабетической периферической невропатии и остеоартрита, фибромиалгии; ревматоидного артрита, анкилозирующего спондилита, плечелопаточного периартрита или ишиалгии.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08384012.4 | 2008-10-17 | ||
| EP20080384012 EP2177215A1 (en) | 2008-10-17 | 2008-10-17 | Co-crystals of tramadol and NSAIDs |
| PCT/EP2009/007451 WO2010043412A1 (en) | 2008-10-17 | 2009-10-16 | Co-crystals of tramadol and nsaids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011119608A RU2011119608A (ru) | 2012-11-27 |
| RU2599717C2 true RU2599717C2 (ru) | 2016-10-10 |
Family
ID=40673614
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011119608/04A RU2599717C2 (ru) | 2008-10-17 | 2009-10-16 | Сокристаллические формы трамадола и nsaid |
Country Status (27)
| Country | Link |
|---|---|
| US (10) | US20110257134A1 (ru) |
| EP (2) | EP2177215A1 (ru) |
| JP (1) | JP5645830B2 (ru) |
| KR (1) | KR101679400B1 (ru) |
| CN (1) | CN102186465B (ru) |
| AU (1) | AU2009304235B2 (ru) |
| BR (1) | BRPI0920358A2 (ru) |
| CA (1) | CA2737754C (ru) |
| CY (1) | CY1118374T1 (ru) |
| DK (1) | DK2349238T3 (ru) |
| ES (1) | ES2603962T3 (ru) |
| HR (1) | HRP20161526T1 (ru) |
| HU (1) | HUE030976T2 (ru) |
| IL (1) | IL211785A (ru) |
| IN (1) | IN2012DN01435A (ru) |
| LT (1) | LT2349238T (ru) |
| MX (1) | MX336318B (ru) |
| MY (1) | MY156285A (ru) |
| NZ (1) | NZ591873A (ru) |
| PL (1) | PL2349238T3 (ru) |
| PT (1) | PT2349238T (ru) |
| RU (1) | RU2599717C2 (ru) |
| SI (1) | SI2349238T1 (ru) |
| SM (1) | SMT201600439B (ru) |
| UA (1) | UA109534C2 (ru) |
| WO (1) | WO2010043412A1 (ru) |
| ZA (1) | ZA201102762B (ru) |
Families Citing this family (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2177215A1 (en) * | 2008-10-17 | 2010-04-21 | Laboratorios Del. Dr. Esteve, S.A. | Co-crystals of tramadol and NSAIDs |
| ES2402112T3 (es) * | 2009-10-16 | 2013-04-29 | Laboratorios Del Dr. Esteve, S.A. | Cocristales de tramadol y coxibs |
| EP2392319A1 (en) * | 2010-06-04 | 2011-12-07 | Laboratorios Del. Dr. Esteve, S.A. | Pharmaceutical compositions of co-crystals of tramadol and coxibs |
| KR20130129070A (ko) * | 2010-07-12 | 2013-11-27 | 융신 파마슈티칼 인더스트리얼 컴파니 리미티드 | 트라마돌의 디클로페낙 염 |
| DE102010063609A1 (de) * | 2010-12-20 | 2012-06-21 | Awd.Pharma Gmbh & Co. Kg | Neue Multikomponentenkristalle aus ([2-Amino-6-(4-fluoro-benzylamino)-pyridin-3yl)-carbamidsäureethylester und einer Arylpropionsäure |
| KR101888852B1 (ko) | 2011-12-02 | 2018-09-21 | 삼성전자주식회사 | 휴대용 단말기에서 다이버시티 서비스를 제공하기 위한 장치 및 방법 |
| GB201222287D0 (en) | 2012-12-11 | 2013-01-23 | Ct For Process Innovation Ltd | Methods for making active crystalline materials |
| ITMI20130210A1 (it) * | 2013-02-14 | 2014-08-15 | Menarini Lab | Composizioni farmaceutiche contenenti dexketoprofene e tramadolo |
| RU2542100C1 (ru) * | 2013-12-24 | 2015-02-20 | Федеральное государственное бюджетное учреждение науки Институт химии растворов им. Г.А. Крестова Российской Академии Наук (ИХС РАН) | Сокристаллическая форма теофиллина с дифлунисалом или диклофенаком |
| WO2016116942A1 (en) | 2015-01-20 | 2016-07-28 | Anlon Chemical Research Organization | Novel pharmaceutical compounds comprising ticagrelor with salts of aspirin |
| CN104592009B (zh) * | 2015-02-09 | 2017-02-22 | 黑龙江大学 | 萘普生药物共晶及其制备方法 |
| US9693949B1 (en) * | 2015-12-22 | 2017-07-04 | Revogenex Ireland Ltd | Intravenous administration of tramadol |
| MX2016006464A (es) * | 2016-05-18 | 2017-11-17 | Laboratorios Liomont S A De C V | Composicion farmaceutica de una combinacion de clorhidrato de tramadol-etoricoxib para el tratamiento del dolor. |
| BR112019018418A2 (pt) * | 2017-03-08 | 2020-04-14 | Intercept Pharmaceuticals Inc | formas cristalinas do ácido obeticólico |
| WO2019122982A1 (en) | 2017-12-21 | 2019-06-27 | Grünenthal GmbH | Pharmaceutical combination in a bilayer tablet form comprising ketorolac tromethamine and tramadol hydrochloride, and its use in pain treatment |
| MX2018013070A (es) | 2017-12-29 | 2019-10-15 | Gruenenthal Gmbh | Combinación farmacéutica que comprende clorhidrato de tramadol de liberación extendida y etoricoxib de liberación inmediata, y su uso para el tratamiento del dolor. |
| US11510926B2 (en) | 2018-05-31 | 2022-11-29 | The Royal Institution For The Advancement Of Learning/Mcgill University | Pharmaceutical salts/co-crystals of pentoxifylline, clonidine and linsidomine with caffeic, protocatechuic or alpha-lipoic acid an use thereof for treatment of pain |
| WO2020039456A1 (en) * | 2018-08-20 | 2020-02-27 | Mylan Laboratories Limited | Tramadol hbr-celecoxib co-crystal |
| WO2020121326A1 (en) | 2018-12-13 | 2020-06-18 | Mylan Laboratories Limited | Amorphous (rac)-tramadol.hcl-celecoxib (1:1) |
| WO2020229502A1 (en) * | 2019-05-14 | 2020-11-19 | Esteve Pharmaceuticals, S.A. | Use of co-crystals of tramadol and celecoxib for treating pain while reducing the abuse liability of tramadol |
| EP4169903A1 (en) * | 2021-10-25 | 2023-04-26 | Dompe' Farmaceutici S.P.A. | Co-crystals of nonsteroidal anti-inflammatory drugs, lysine and gabapentin, pharmaceutical compositions and their medical use |
| KR20240027436A (ko) * | 2022-08-23 | 2024-03-04 | 대원제약주식회사 | 펠루비프로펜 및 트라마돌의 이온결합 화합물, 이를 포함하는 조성물, 및 이의 제조 방법 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0546676A1 (en) * | 1991-10-30 | 1993-06-16 | Mcneilab, Inc. | Composition comprising a tramadol material and a non-steroidal anti-inflammatory drug |
| WO2004078163A2 (en) * | 2003-02-28 | 2004-09-16 | Transform Pharmaceuticals, Inc. | Pharmaceutical co-crystal compositions of drugs such as carbamazepine, celecoxib, olanzapine, itraconazole, topiramate, modafinil, 5-fluorouracil, hydrochlorothiazide, acetaminophen, aspirin, flurbiprofen, phenytoin and ibuprofen |
| RU2245136C2 (ru) * | 2001-07-27 | 2005-01-27 | Яманоути Фармасьютикал Ко., ЛТД | Композиция, включающая тонкодисперсные частицы с замедленным высвобождением для быстроразлагающихся в щечной полости таблеток, и способ ее получения |
| US20080031950A1 (en) * | 2007-04-27 | 2008-02-07 | Nectid Inc. | Novel anelgesic combination |
| WO2008064854A1 (de) * | 2006-11-28 | 2008-06-05 | Grünenthal GmbH | Arzneimittelzubereitung von tramadol und acetaminophen |
| EP2022778A1 (en) * | 2007-08-07 | 2009-02-11 | Laboratorios del Dr. Esteve S.A. | A crystalline form of (R,R)-tramadol-(S)-naproxene salt |
| RU2012120088A (ru) * | 2009-10-16 | 2013-11-27 | Лабораторьос Дель Др. Эстеве, С.А. | Сокристаллы трамадола и коксибов |
| RU2012151952A (ru) * | 2010-05-07 | 2014-06-20 | Кеафьюжин 2200, Инк. | Способ создания плевродеза |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3652589A (en) | 1967-07-27 | 1972-03-28 | Gruenenthal Chemie | 1-(m-substituted phenyl)-2-aminomethyl cyclohexanols |
| HU219332B (hu) | 1991-09-06 | 2001-03-28 | Mcneilab Inc | Transz-(+)-2-[(dimetil-amino)-metil]-1-(3-metoxi-fenil)-ciklohexanolt és acetaminofent tartalmazó szinergetikus gyógyszerkészítmények |
| US5516803A (en) | 1991-10-30 | 1996-05-14 | Mcneilab, Inc. | Composition comprising a tramadol material and a non-steroidal anti-inflammatory drug |
| US5474995A (en) | 1993-06-24 | 1995-12-12 | Merck Frosst Canada, Inc. | Phenyl heterocycles as cox-2 inhibitors |
| KR100229343B1 (ko) | 1993-11-30 | 1999-11-01 | 윌리암스 로저 에이 | 염증치료용 치환 피라졸일벤젠술폰아미드 |
| US5466823A (en) | 1993-11-30 | 1995-11-14 | G.D. Searle & Co. | Substituted pyrazolyl benzenesulfonamides |
| US5633272A (en) | 1995-02-13 | 1997-05-27 | Talley; John J. | Substituted isoxazoles for the treatment of inflammation |
| UA57002C2 (ru) | 1995-10-13 | 2003-06-16 | Мерк Фросст Кенада Енд Ко./Мерк Фросст Кенада Енд Сі. | Производное (метилсульфонил)фенил-2-(5н)-фуранона, фармацевтическая композиция и способ лечения |
| CN1098256C (zh) | 1996-04-12 | 2003-01-08 | G·D·瑟尔公司 | 作为cox-2抑制剂前药的取代的苯磺酰胺衍生物 |
| WO1998003484A1 (en) | 1996-07-18 | 1998-01-29 | Merck Frosst Canada Inc. | Substituted pyridines as selective cyclooxygenase-2 inhibitors |
| US5861419A (en) | 1996-07-18 | 1999-01-19 | Merck Frosst Canad, Inc. | Substituted pyridines as selective cyclooxygenase-2 inhibitors |
| CO4960662A1 (es) | 1997-08-28 | 2000-09-25 | Novartis Ag | Ciertos acidos 5-alquil-2-arilaminofenilaceticos y sus derivados |
| RS49982B (sr) | 1997-09-17 | 2008-09-29 | Euro-Celtique S.A., | Sinergistička analgetička kombinacija analgetičkog opijata i inhibitora ciklooksigenaze-2 |
| JP2002538176A (ja) * | 1999-03-01 | 2002-11-12 | オーソ−マクニール・フアーマシユーチカル・インコーポレーテツド | トラマドール物質および選択的cox−2阻害薬を含んで成る組成物 |
| DE19927688A1 (de) | 1999-06-17 | 2000-12-21 | Gruenenthal Gmbh | Mehrschichttablette zur Verabreichung einer fixen Kombination von Tramadol und Diclofenac |
| DE10108122A1 (de) | 2001-02-21 | 2002-10-02 | Gruenenthal Gmbh | Arzneimittel auf Basis von Tramadol |
| US7927613B2 (en) * | 2002-02-15 | 2011-04-19 | University Of South Florida | Pharmaceutical co-crystal compositions |
| US7790905B2 (en) | 2002-02-15 | 2010-09-07 | Mcneil-Ppc, Inc. | Pharmaceutical propylene glycol solvate compositions |
| DK1478366T3 (da) | 2002-02-19 | 2009-03-30 | Adcock Ingram Ltd | Farmaceutiske kombinationer af meloxicam, codeinphosphat og paracetamol |
| AU2003246718A1 (en) | 2002-07-17 | 2004-02-02 | S.O.I.Tec Silicon On Insulator Technologies | Method of fabricating substrates, in particular for optics, electronics or optoelectronics |
| CN1245968C (zh) | 2002-10-09 | 2006-03-22 | 新疆特丰药业股份有限公司 | 一种萘普生钠缓释片剂的制备方法 |
| JP4469846B2 (ja) | 2003-01-31 | 2010-06-02 | エラン ファーマ インターナショナル,リミティド | ナノ粒子状トピラメート製剤 |
| US20060172006A1 (en) * | 2003-10-10 | 2006-08-03 | Vincent Lenaerts | Sustained-release tramadol formulations with 24-hour clinical efficacy |
| CA2548281C (en) | 2003-12-09 | 2013-11-12 | Medcrystalforms, Llc | Method of preparation of mixed phase co-crystals with active agents |
| US8216610B2 (en) * | 2004-05-28 | 2012-07-10 | Imaginot Pty Ltd. | Oral paracetamol formulations |
| WO2008085674A1 (en) | 2007-01-04 | 2008-07-17 | Transform Pharmaceuticals, Inc. | Pharmaceutical compositions comprising celecoxib co-crystals |
| EP2291348A4 (en) | 2008-05-20 | 2013-05-15 | Neurogesx Inc | WATER-SOLUBLE ACETAMINOPHENANALOGA |
| ES2639019T3 (es) | 2008-09-06 | 2017-10-25 | Bionevia Pharmaceuticals Inc. | Nuevo cocristal de colina de epalrestat |
| EP2177215A1 (en) * | 2008-10-17 | 2010-04-21 | Laboratorios Del. Dr. Esteve, S.A. | Co-crystals of tramadol and NSAIDs |
| EP2311446A1 (en) | 2009-10-16 | 2011-04-20 | Laboratorios Del. Dr. Esteve, S.A. | Compositions comprising Tramadol and Celecoxib in the treatment of pain |
| CN104817501B (zh) | 2009-10-16 | 2017-09-22 | 埃斯蒂文博士实验室股份有限公司 | 曲马多与昔布类的共晶体 |
| EP2392319A1 (en) * | 2010-06-04 | 2011-12-07 | Laboratorios Del. Dr. Esteve, S.A. | Pharmaceutical compositions of co-crystals of tramadol and coxibs |
| WO2020229502A1 (en) * | 2019-05-14 | 2020-11-19 | Esteve Pharmaceuticals, S.A. | Use of co-crystals of tramadol and celecoxib for treating pain while reducing the abuse liability of tramadol |
-
2008
- 2008-10-17 EP EP20080384012 patent/EP2177215A1/en not_active Withdrawn
-
2009
- 2009-10-16 CA CA2737754A patent/CA2737754C/en active Active
- 2009-10-16 MX MX2011003612A patent/MX336318B/es unknown
- 2009-10-16 US US13/124,027 patent/US20110257134A1/en not_active Abandoned
- 2009-10-16 EP EP09736862.5A patent/EP2349238B1/en active Active
- 2009-10-16 NZ NZ591873A patent/NZ591873A/xx not_active IP Right Cessation
- 2009-10-16 SI SI200931565A patent/SI2349238T1/sl unknown
- 2009-10-16 AU AU2009304235A patent/AU2009304235B2/en not_active Ceased
- 2009-10-16 PT PT97368625T patent/PT2349238T/pt unknown
- 2009-10-16 KR KR1020117010637A patent/KR101679400B1/ko active IP Right Grant
- 2009-10-16 HU HUE09736862A patent/HUE030976T2/en unknown
- 2009-10-16 RU RU2011119608/04A patent/RU2599717C2/ru active
- 2009-10-16 BR BRPI0920358-3A patent/BRPI0920358A2/pt not_active Application Discontinuation
- 2009-10-16 JP JP2011531401A patent/JP5645830B2/ja not_active Expired - Fee Related
- 2009-10-16 PL PL09736862T patent/PL2349238T3/pl unknown
- 2009-10-16 ES ES09736862.5T patent/ES2603962T3/es active Active
- 2009-10-16 WO PCT/EP2009/007451 patent/WO2010043412A1/en active Application Filing
- 2009-10-16 CN CN200980141056.6A patent/CN102186465B/zh not_active Expired - Fee Related
- 2009-10-16 LT LTEP09736862.5T patent/LT2349238T/lt unknown
- 2009-10-16 DK DK09736862.5T patent/DK2349238T3/en active
-
2010
- 2010-04-19 IN IN1435DEN2012 patent/IN2012DN01435A/en unknown
- 2010-04-19 MY MYPI2012000675A patent/MY156285A/en unknown
- 2010-04-19 UA UAA201205792A patent/UA109534C2/ru unknown
- 2010-04-19 US US13/395,021 patent/US8598152B2/en active Active
-
2011
- 2011-03-17 IL IL211785A patent/IL211785A/en active IP Right Grant
- 2011-04-13 ZA ZA2011/02762A patent/ZA201102762B/en unknown
-
2013
- 2013-10-29 US US14/066,127 patent/US9012440B2/en active Active
-
2014
- 2014-07-07 US US14/324,448 patent/US9393220B2/en active Active
-
2015
- 2015-03-23 US US14/665,055 patent/US20150196503A1/en not_active Abandoned
- 2015-03-23 US US14/665,060 patent/US20150196504A1/en not_active Abandoned
-
2016
- 2016-07-12 US US15/207,694 patent/US10238668B2/en active Active
- 2016-08-09 US US15/231,915 patent/US10245276B2/en active Active
- 2016-11-18 HR HRP20161526TT patent/HRP20161526T1/hr unknown
- 2016-11-22 CY CY20161101201T patent/CY1118374T1/el unknown
- 2016-11-30 SM SM201600439T patent/SMT201600439B/it unknown
-
2019
- 2019-02-14 US US16/275,437 patent/US10548909B2/en active Active
- 2019-12-19 US US16/720,574 patent/US11478488B2/en active Active
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0546676A1 (en) * | 1991-10-30 | 1993-06-16 | Mcneilab, Inc. | Composition comprising a tramadol material and a non-steroidal anti-inflammatory drug |
| RU2245136C2 (ru) * | 2001-07-27 | 2005-01-27 | Яманоути Фармасьютикал Ко., ЛТД | Композиция, включающая тонкодисперсные частицы с замедленным высвобождением для быстроразлагающихся в щечной полости таблеток, и способ ее получения |
| WO2004078163A2 (en) * | 2003-02-28 | 2004-09-16 | Transform Pharmaceuticals, Inc. | Pharmaceutical co-crystal compositions of drugs such as carbamazepine, celecoxib, olanzapine, itraconazole, topiramate, modafinil, 5-fluorouracil, hydrochlorothiazide, acetaminophen, aspirin, flurbiprofen, phenytoin and ibuprofen |
| WO2008064854A1 (de) * | 2006-11-28 | 2008-06-05 | Grünenthal GmbH | Arzneimittelzubereitung von tramadol und acetaminophen |
| US20080031950A1 (en) * | 2007-04-27 | 2008-02-07 | Nectid Inc. | Novel anelgesic combination |
| EP2022778A1 (en) * | 2007-08-07 | 2009-02-11 | Laboratorios del Dr. Esteve S.A. | A crystalline form of (R,R)-tramadol-(S)-naproxene salt |
| WO2009018959A1 (en) * | 2007-08-07 | 2009-02-12 | Laboratorios Del Dr. Esteve S.A. | Salts of tramadol and naproxen and their crystal forms in the treatment of pain |
| RU2012120088A (ru) * | 2009-10-16 | 2013-11-27 | Лабораторьос Дель Др. Эстеве, С.А. | Сокристаллы трамадола и коксибов |
| RU2012151952A (ru) * | 2010-05-07 | 2014-06-20 | Кеафьюжин 2200, Инк. | Способ создания плевродеза |
Non-Patent Citations (2)
| Title |
|---|
| & WO 2009018959 A1WO 2004078163 A2, 16. 09.2004 REMENAR JULIUS F; ET AL,Celecoxib : Nicotinamide dissociation: Using excipients to capture the cocrystal's potential, Molecular Pharmaceuticals,Vol:4, Nr:3, Page(s):386 -; 400;US 2008031950 A1, 07. 02.2008EP 0546676 A1, 16.06.1993 & * |
| RU2012120088 A, приоритет 19.04.2010 SHAN N et al., The role of cocrystals in pharmaceutical science, DRUG DISCOVERY TODAY, 01.05.2008 Vol:13,Nr:9-10,Page(s):440 -; 446TRASK A. V., An overview of pharmaceutical cocrystals as intellectual property, MOLECULAR PHARMACEUTICS, 2007, Vol:4, Nr:3, Page(s):301 -; 309RU 2012151952 A, 27.06.2012CHU, KATHERINE A.et al.,Predicting aqueous solubility: the role of crystallinity, Current Drug Metabolism, decembre, 2009, 10(10), 1184-1191. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2599717C2 (ru) | Сокристаллические формы трамадола и nsaid | |
| JP2011520933A (ja) | 疼痛の治療用の、デュロキセチンとコックス阻害剤との共結晶 | |
| US8168679B2 (en) | Salts of Tramadol and Naproxen and their crystal forms in the treatment of pain | |
| JPS6112907B2 (ru) | ||
| RU2547830C2 (ru) | Сокристаллы трамадола и коксибов | |
| US20110105443A1 (en) | Salts of memantine and cox-inhibitors and their crystal form in the treatment of pain | |
| EP2199274A1 (en) | Co-crystals of tramadol and paracetamol | |
| US20110178174A1 (en) | Salts of tramadol and ibuprofen and their crystal form in the treatment of pain | |
| EP2325172A1 (en) | Co-crystals of celecoxib and L-proline | |
| EP2340818A1 (en) | Co-crystals of venlafaxine and celecoxib |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner |