RU2583056C2 - Фармацевтически приемлемая соль (е)-n-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2r)-1-метилпирролидин-2-ил]проп-2-енамида, способ ее получения и применение при лечении рака - Google Patents
Фармацевтически приемлемая соль (е)-n-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2r)-1-метилпирролидин-2-ил]проп-2-енамида, способ ее получения и применение при лечении рака Download PDFInfo
- Publication number
- RU2583056C2 RU2583056C2 RU2013143381/04A RU2013143381A RU2583056C2 RU 2583056 C2 RU2583056 C2 RU 2583056C2 RU 2013143381/04 A RU2013143381/04 A RU 2013143381/04A RU 2013143381 A RU2013143381 A RU 2013143381A RU 2583056 C2 RU2583056 C2 RU 2583056C2
- Authority
- RU
- Russia
- Prior art keywords
- pyridylmethoxy
- ethoxy
- quinolyl
- amino
- cyano
- Prior art date
Links
- SADXACCFNXBCFY-IYNHSRRRSA-N CCOc(c(NC(/C=C/[C@@H]1N(C)CCC1)=O)cc1c2Nc(cc3Cl)ccc3OCc3ccccn3)cc1ncc2C#N Chemical compound CCOc(c(NC(/C=C/[C@@H]1N(C)CCC1)=O)cc1c2Nc(cc3Cl)ccc3OCc3ccccn3)cc1ncc2C#N SADXACCFNXBCFY-IYNHSRRRSA-N 0.000 description 4
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/02—Sulfonic acids having sulfo groups bound to acyclic carbon atoms
- C07C309/03—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton
- C07C309/04—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing only one sulfo group
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/28—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C309/29—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton of non-condensed six-membered aromatic rings
- C07C309/30—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton of non-condensed six-membered aromatic rings of six-membered aromatic rings substituted by alkyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C57/00—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms
- C07C57/02—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms with only carbon-to-carbon double bonds as unsaturation
- C07C57/13—Dicarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C57/00—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms
- C07C57/02—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms with only carbon-to-carbon double bonds as unsaturation
- C07C57/13—Dicarboxylic acids
- C07C57/145—Maleic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
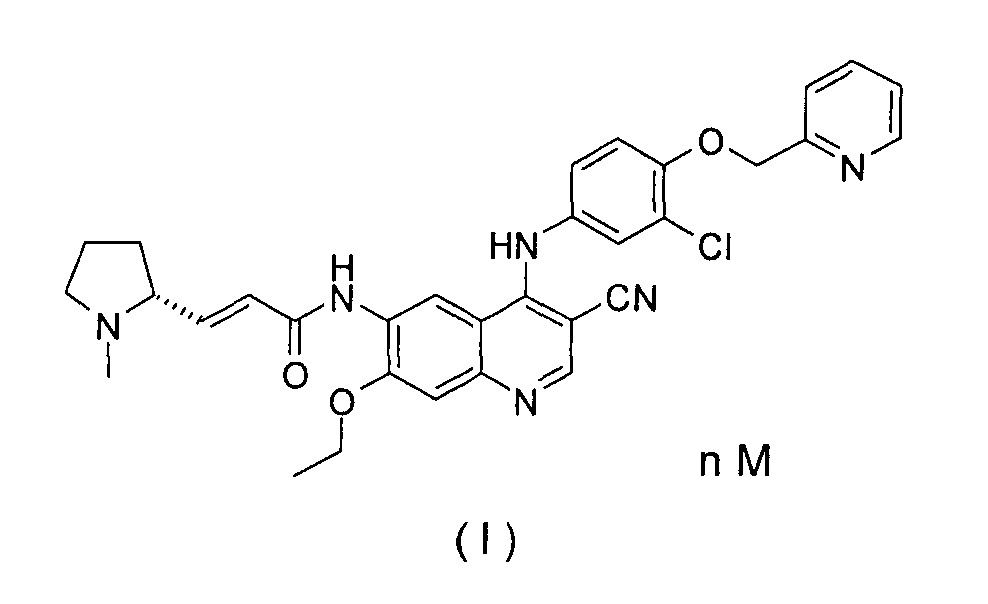
Изобретение относится к области органической химии, а именно к фармацевтически приемлемой соли (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида (формулы (I)), где n равен 1, 2 или 3; и М представляет собой молекулу кислоты, где указанная соль выбрана из группы, состоящей из гидрохлорида, пара-толуолсульфоната, метансульфоната, малеата, сукцината и L-малата. Также изобретение относится к способу получения соли соединения формулы (I), фармацевтической композиции на основе соли соединения формулы (I) и к применению соли соединения формулы (I). Технический результат: получены новые соли соединения формулы (I), полезные при лечении рака. 6 н. и 4 з.п. ф-лы, 7 табл., 13 пр.
Description
Область изобретения
Настоящее изобретение относится к фармацевтически приемлемой соли 6-аминохиназоолина или 3-цианохинолиновым производным, способу ее получения и медицинскому применению. В частности, настоящее изобретение относится к фармацевтически приемлемой соли (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида, способу ее получения и ее применению в качестве терапевтического агента, и в частности, в качестве ингибитора протеинкиназы.
Предшествующий уровень техники
Трансдукция сигнала представляет собой фундаментальный механизм, посредством которого внеклеточные стимулы передаются внутрь клеток, регулируя соответствующие физические ответы, включающие пролиферацию, дифференцировку и апоптоз. Большая часть этих процессов трансдукции сигнала использует процесс обратимого фосфорилирования белков, включающие специфические протеинкиназы и фосфатазы.
Существуют два класса протеинкиназ (PK): белковые тирозинкиназы (PTK) и серин-треониновые киназы (STK). PTK могут фосфорилировать тирозиновый остаток на белке. STK могут фосфорилировать сериновый или/и треониновый остаток. Тирозинкиназы могут быть разделены на тирозинкиназы рецепторного типа (рецепторная тирозинкиназа, RTK) или нерецепторного типа (нерецепторная тирозинкиназа). В настоящее время в человеческом геноме идентифицированы приблизительно 90 тирозинкиназ, из которых приблизительно 60 относятся к рецепторному типу и приблизительно 30 относятся к нерецепторному типу.
Семейство рецепторных тирозинкиназ (RTK) включает множество подсемейств, таких как (1) семейство рецептора EGF (эпидермального фактора роста), включающее EGFR, HER-2, HER-3 и HER-4; (2) семейство инсулинового рецептора, включающее инсулиновый рецептор (IR), рецептор инсулиноподобного фактора роста-I (IGF-IR) и инсулиноподобный рецептор (IRR); (3) семейство класса III, такие как рецептор фактора роста тромбоцитов (PDGFR), рецептор фактора стволовых клеток (SCF) (c-Kit) RTK, рецептор fms-связанной тирозинкиназы 3 (Flt3) и рецептор колониестимулирующего фактора 1 (CSF-1R) и т.п. Иначе, рецептор фактора роста гепатоцитов c-Met, фактор роста эндотелия сосудов (VEGFR) и т.п. также относятся к семейству RTK. Они играют критическую роль в контроле клеточного роста и дифференцировки, и представляют собой ключевые медиаторы клеточных сигналов, приводящих к продукции цитокинов, таких как факторы роста (Schlessinger and Ullrich, Neuron 1992, 9, 383).
Подсемейство EGFR (ErbB, HER) играет критическую роль в контроле клеточной пролиферации и выживания. Эти RTK состоят из внеклеточного гликозилированного связывающего лиганд домена, трансмембранного домена и внутриклеточного цитоплазматического каталитического домена. Ферментативная активность рецепторных тирозинкиназ может быть стимулирована путем опосредованной лигандами гомодимеризации или гетеродимеризации. Димеризация приводит в результате к фосфорилированию тирозиновых остаток на рецепторах в каталитическом домене, приводя впоследствии к сайту связывания. За ним следует активация внутриклеточных сигнальных путей, таких как пути, вовлекающие ассоциирующуюся с микротрубочками протеинкиназу (MAP киназу) и фосфатидилинозитол-3-киназу (PI3 киназу). Активация этих путей связана с регуляцией клеточного цикла и апоптоза. Обнаружили, что такие мутантные и сверхэкспрессированнные формы тирозинкиназ, такие как EGFR, HER-2, представлены в большой доле обычных видов рака человека, таких как рак молочной железы, рак предстательной железы, немелкоклеточный рак легкого, рак пищевода, рак яичников и рак поджелудочной железы и т.п. Преобладание и релевантность тирозинкиназ подтверждается в онкогенезе и раковом росте.
Предполагают синтезировать новые соединения, обладающие активностями против пролиферации опухолевых клеток. Ожидается, что эти соединения ингибируют одну или более чем одну RTK или STK, и полезны для лечения или уменьшения интенсивности физиологических расстройств с сверхпролиферацией клеток, опосредованных RTK или STK, и опосредованных ангиогенезом.
Описание настоящего изобретения относится к сериям фармацевтически приемлемых солей (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида и их применениям, в частности в качестве ингибиторов протеинкиназ.
Автор изобретения обнаружил, что свободное основание (E)-N-[4-[[3-хлор-4-(2-пиридилметокси) фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид плохо растворим в обычных растворителях и, таким образом, является не благоприятным для того, чтобы его готовили в медицинскую лекарственную форму, ограничивающую их биодоступность in vivo. Таким образом, существует острая потребность в улучшении их растворимости и фармакокинетическом поглощении для того, чтобы соответствовать обычному способу получения лекарственных форм. По сравнению со свободным основанием (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамидом растворимость и фармакокинетика фармацевтически приемлемых солей соединения значительно улучшается, и способ синтеза упрощается.
Настоящее изобретение относится к тому, чтобы предложить фармацевтически приемлемые соли соединений формулы (I), таким образом, улучшая их физические/химические свойства и фармакокинетические характеристики.
Краткое описание изобретения
Настоящее изобретение относится к тому, чтобы предложить фармацевтически приемлемую соль формулы (I) и способ ее получения. Предпочтительно, соль дималеат формулы (I) обладает преимуществами в растворимости, биодоступности и фармакокинетике по сравнению с самим соединением формулы (I) и другими его солями.
где
n равен 1, 2 или 3; и
М представляет собой молекулу кислоты.
В первом своем аспекте настоящее изобретение относится к фармацевтически приемлемой соли (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамиду формулы (I), где указанная соль представляет собой обычную неорганическую соль или органическую соль в области техники. Кроме того, указанная неорганическая соль выбрана из группы, состоящей из гидрохлорида, гидробромида, сульфата, нитрата и фосфата, предпочтительно гидрохлорида, более предпочтительно дигидрохлорида; где указанная органическая соль выбрана из группы, состоящей из пара-толуолсульфоната, метансульфоната, малеата, тартрата, сукцината, ацетата, трифторацетата, фумарата, цитрата, бензолсульфоната, бензоата, нафталинсульфоната, лактата и L-малата, предпочтительно L-яблочной кислоты, метансульфоната, сукцината, пара-толуолсульфоната или малеата, наиболее предпочтительно, малеата. В частности, соль малеат соединения формулы (I) обладает преимуществами в растворимости, биодоступности и фармакокинетике по сравнению с самим соединением формулы (I) и другими его солями.
Во втором своем аспекте настоящее изобретение относится к способу получения фармацевтически приемлемой соли (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида, и указанное соединение может быть получено в соответствии с обычным в области техники способом образования соли. В частности, в указанном способе осуществляют стадию взаимодействия (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида с соответствующей кислотой с образованием соли, где указанная кислота представляет собой неорганическую кислоту/органическую кислоту, выбранную из группы, состоящей из ортофосфорной кислоты, соляной кислоты, серной кислоты, азотной кислоты, бромистоводородной кислоты, пара-толуолсульфоновой кислоты, метансульфоновой кислоты, малеиновой кислоты, винной кислоты, янтарной кислоты, уксусной кислоты, трифторуксусной кислоты, фумаровой кислоты, лимонной кислоты, бензолсульфоновой кислоты, бензойной кислоты, нафталинсульфоновой кислоты, молочной кислоты и L-яблочной кислоты.
Фармацевтически приемлемые соли по настоящему изобретению как правило включают без ограничения:
| Пример № | Структура и название |
| 1 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид малеат | |
| 2 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дималеат |
| 3 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид L-малат | |
| 4 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид метансульфонат | |
| 5 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамиддиметансульфонат | |
| 6 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2- ил]проп-2-енамид триметансульфонат |
|
| 7 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид пара-толуолсульфонат | |
| 8 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид сукцинат | |
| 9 | |
| (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дигидрохлорид |
В третьем своем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество фармацевтически приемлемой соли (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида и фармацевтически приемлемые носители. Настоящее изобретение также относится к способу приготовления композиции, при котором осуществляют стадию комбинирования фармацевтически приемлемой соли с фармацевтически приемлемым носителем или разбавителем.
В четвертом своем аспекте настоящее изобретение относится к применению фармацевтически приемлемой соли (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида или его фармацевтической композиции в приготовлении лекарственного средства для лечения заболеваний, связанных с протеинкиназами, где указанные протеинкиназы выбраны из группы, состоящей из рецепторных тирозинкиназ EGFR и рецепторных тирозинкиназ HER-2.
В пятом своем аспекте настоящее изобретение относится к способу лечения заболеваний, связанных с протеинкиназами, при котором осуществляют введение терапевтически эффективного количества фармацевтически приемлемой соли (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида или его фармацевтической композиции субъекту, нуждающемуся в таком введении.
В шестом своем аспекте настоящее изобретение относится к применению фармацевтически приемлемой соли (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида или его фармацевтической композиции при приготовлении лекарственного средства на основе протеинкиназного ингибитора, где указанные протеинкиназы выбраны из группы, состоящей из EGFR и HER-2.
В седьмом своем аспекте настоящее изобретение относится к применению фармацевтически приемлемой соли (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида или фармацевтической композиции в качестве лекарственного средства для лечения заболеваний, связанных с протеинкиназами, где указанные заболевания представляют собой рак, выбранный из группы, состоящей из рака легкого, рака молочной железы, плоскоклеточного рака и рака желудка.
В восьмом своем аспекте настоящее изобретение относится к способу регуляции каталитической активности протеинкиназ, при котором осуществляют приведение в контакт указанной протеинкиназы с фармацевтически приемлемой солью (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида, где указанная протеинкиназа выбрана из группы, состоящей из рецепторной тирозинкиназы EGFR или рецепторной тирозинкиназы HER-2.
Подробное описание изобретения
Настоящее изобретение дополнительно описано при помощи следующих примеров, которые не предназначены для того, чтобы ограничить объем изобретения.
Примеры
Структуры всех соединений идентифицируют при помощи ядерного магнитного резонанса (NMR) и/или масс-спектрометрии (MS). Химический сдвиг NMR (δ) зарегистрирован в виде млн-1 (10-6). NMR осуществляют на спектрометре Bruker AVANCE-400. Растворитель для детекции представляет собой дейтерированный диметилсульфоксид (d-DMSO) с тетраметилсиланом (TMS) в качестве внутреннего стандарта, и химический сдвиг регистрируют в виде млн-1 (10-6).
MS определяют на масс-спектрометре FINNIGAN LCQAd (ESI (ионизация путем распыления электронов)) (Thermo, Model: Finnigan LCQ advantage MAX).
HPLC определяют на спектрометре/жидкостном хроматографе высокого давления Agilent 1200DAD (хроматографическая колонка Sunfire С18 150×4,6 мм) и спектрометре/жидкостном хроматографе высокого давления Waters 2695-2996 (хроматографическая колонка Gimini C18 150×4,6 мм).
В колоночной хроматографии в общем используют в качестве носителя силикагель Yantai Huanghai 200~300 меш.
Исходные вещества по настоящему изобретению известны и могут быть приобретены в ABCR GmbH & Со. KG, Acros Organics, Aldrich Chemical Company и т.п., или они могут быть получены при помощи обычных способов синтеза, известных в области техники.
Если не указано иное, то следующие взаимодействия осуществляют в атмосфере аргона или атмосфере азота.
Термин ″атмосфера аргона″ или ″атмосфера азота″ относится к тому, что реакционный сосуд оборудован баллоном, заполненным приблизительно 1 л аргона или азота.
Термин ″атмосфера водорода″ относится к тому, что реакционный сосуд оборудован баллоном, заполненным приблизительно 1 л водорода.
Если не указано иное, то раствор, используемый в примерах, относится к водному раствору.
Если не указано иное, то температура реакции представляет собой комнатную температуру.
Комнатная температура представляет собой наиболее подходящую температуру реакции, составляющую 20°C-30°C.
Процессы реакции в примерах контролируют при помощи тонкослойной хроматографии (TLC). Система проявляющих растворителей включает систему дихлорметана и метанола, систему н-гексана и этилацетата, систему петролейного эфира и этилацетата и ацетон.
Долю растворителя по объему корректируют в соответствии с полярностью соединений.
Элюирующая система для колоночной хроматографии содержит А:
систему дихлорметана, метанола и ацетона; Б: систему гексана и этилацетата. Долю растворителя по объему корректируют в соответствии с полярностью соединений, и иногда также может быть добавлено небольшое количество аммиака и уксусной кислоты.
Пример 1
(Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид малеат
Стадия 1
[(2R)-1-Метилпирролидин-2-ил]метаноллитий алюминий гидрид (230 мг, 6 ммоль) и N-трет-бутоксикарбонил-R-пролинол 1a (400 мг, 2 ммоль) растворяли в 10 мл безводного тетрагидрофурана в бане лед-вода партиями. После обнаружения того, что газ больше не выделяется, реакционную смесь нагревали до температуры дефлегмации в течение 2 часов. В реакционную смесь по каплям добавляли 5 мл метанола в бане лед-вода, а затем добавляли 5 мл воды, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения [(2R)-1-метилпирролидин-2-ил]метанола 1b (221 мг, выход 77,0%) в виде бесцветного масла.
MS m/z (ESI): 116 [M+1]
Стадия 2
(2R)-1-Метилпирролидин-2-формальдегид
Диметилсульфоксид (820 мкл, 11,46 ммоль) растворяли в 5 мл дихлорметана в бане с сухим льдом, а затем медленно добавляли по каплям оксалилхлорид (968 мг, 7,64 ммоль). После перемешивания в течение 45 минут к раствору добавляли раствор [(2R)-1-метилпирролидин-2-ил]метанола 1b (220 мг, 1,91 ммоль) в 2 мл дихлорметана. Реакционную смесь перемешивали в течение еще 45 минут, и добавляли триэтиламин (1,9 мл, 13,37 ммоль). Реакционную смесь перемешивали в течение 10 минут, затем нагревали до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь последовательно промывали водой (20 мл) и насыщенным рассолом (10 мл). Объединенные органические экстракты сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и образующиеся в результате остатки очищали при помощи колоночной хроматографии с щелочным оксидом алюминия с элюирующей системой А с получением указанного в заголовке соединения (2R)-1-метилпирролидин-2-формальдегида 1c (300 мг) в виде желтого твердого вещества, которое непосредственно использовали на следующей стадии без очистки.
Стадия 3
N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-2-диэтоксифосфорил-ацетамид
N,N′-Карбонилдиимидазол (487 мг, 3 ммоль) растворяли в 4 мл тетрагидрофурана. Смесь нагревали до 40°C в масляной бане, по каплям к смеси добавляли раствор диэтилфосфоноуксусной кислоты (588 мг, 3 ммоль) в тетрагидрофуране (4 мл) и перемешивали в течение 30 минут до следующей стадии.
6-Амино-4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-7-этокси-хинолин-3-карбонитрил 1d (446 мг, 1 ммоль, полученный при помощи хорошо известного способа: заявка на патент W02005028443) при 40°C растворяли в 4 мл тетрагидрофурана, а затем по каплям добавляли вышеописанный реакционный раствор. После перемешивания в течение 12 часов реакционную смесь концентрировали при пониженном давлении и экстрагировали дихлорметаном (50 мл × 3). Объединенные органические экстракты промывали насыщенным рассолом (30 мл × 2), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и образующиеся в результате остатки очищали при помощи колоночной хроматографии с силикагелем с элюирующей системой А с получением указанного в заголовке соединения N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-2-диэтоксифосфорил-ацетамида 1e (624 мг, выход 99,9%) в виде светло-желтого твердого вещества.
MS m/z (ESI): 624 [M+1]
Стадия 4
(E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид
N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-2-диэтоксифосфорил-ацетамид 1е (250 мг, 0,40 ммоль) растворяли в 10 мл безводного тетрагидрофурана в бане с сухим льдом, а затем по каплям добавляли раствор литий бис(триметилсилил)амида (1М) в толуоле (440 мкл, 0,44 ммоль). Реакционную смесь перемешивали в течение 30 минут, по каплям добавляли раствор (2R)-1-метилпирролидин-2-формальдегида 1с (90 мг, 0,80 ммоль) в тетрагидрофуране (5 мл) и перемешивали в течение 30 минут, затем нагревали до комнатной температуры и перемешивали в течение 12 часов. Реакционную смесь концентрировали при пониженном давлении, и образующиеся в результате остатки очищали при помощи колоночной хроматографии с силикагелем с элюирующей системой А с получением указанного в заголовке соединения (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида 1f (46 мг, выход 19,7%) в виде желтого твердого вещества.
MS m/z (ESI): 583,4 [M+1]
1H NMR (400 МГц, DMSO-d6): δ 9,16 (s, 1H), 8,63 (d, 1H), 8,56 (s, 1H), 8,26 (s, 1H), 7,83-7,80 (dd, 1H), 7,76-7,50 (m, 2H), 7,57-7,56 (m, 1H), 7,40 (s, 1H), 7,38 (s, 1H), 7,19 (d, 1H), 7,06-7,03 (m, 2H), 6,34-6,31 (d, 1H), 5,35 (s, 2H), 4,39 (m, 2H), 4,27-4,26 (m, 1H), 3,32 (m, 1H), 3,10 (m, 1H), 2,73 (s, 3Н), 2,37-2,36 (m, 2H), 2,07-2,01 (m,2H), 1,64 (t, 3H)
Стадия 5
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид малеат
(Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (500 мг, 0,86 ммоль) и малеиновую кислоту (109 мг, 0,94 ммоль) при перемешивании растворяли в 5 мл дихлорметана. После перемешивания в течение 1 часа при к.т. реакционную смесь концентрировали при пониженном давлении с получением (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид малеата 1 (609 мг, выход 100%) в виде желтого твердого вещества.
MS m/z (ESI): 584,4 [M+1-116]
1H NMR (400 МГц, CDCl3): δ 9,22 (s, 1H), 8,63 (m, 1H), 8,52 (m, 1H), 8,42 (s, 1H), 7,84 (m, 1H), 7,74 (m, 1H), 7,69 (m, 1H), 7,58 (m, 1H), 7,26 (m, 1H), 7,02 (m, 2H), 6,92 (m, 1H), 6,72 (m, 1H), 6,25 (s, 2H), 5,27 (s, 2H), 4,27 (m, 2H), 3,90 (m, 2H), 3,00 (m, 1H), 2,87 (m, 2H), 2,21 (m, 4H), 2,09 (m, 1H), 1,56 (t, 3H, J=8 Гц)
Пример 2
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дималеат
(E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дималеат
(E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (200 мг, 0,34 ммоль) при перемешивании растворяли в 6 мл этанола, а затем добавляли малеиновую кислоту (80 мг, 0,68 ммоль). После того, как реакционную смесь перемешивали в течение 0,5 часов и оставляли на 12 часов при к.т., в нее добавляли 10 мл диэтилового эфира и фильтровали. Твердое вещество промывали диэтиловым эфиром (20 мл) и сушили в вакууме с получением указанного в заголовке продукта (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дималеата 2 (220 мг, выход 78,6%) в виде желтого твердого вещества.
MS m/z (ESI): 583,4 [M+1-232]
1H NMR (400 МГц, CDCl3): δ 9,12 (s, 1H), 8,57 (m, 1H), 8,51 (m, 1H), 8,37 (s, 1H), 7,79 (m, 1H), 7,71 (m, 1H), 7,63 (m, 1H), 7,52 (m, 1H), 7,21 (m, 1H), 7,00 (m, 2H), 6,90 (m, 1H), 6,57 (m, 1H), 6,25 (s, 4H), 5,23 (s, 2H), 4,21 (m, 2H), 3,91 (m, 2H), 3,11 (m, 1H), 2,85 (m, 2H), 2,22 (m, 4H), 2,01 (m, 1H), 1,54 (t, 3H, J=8 Гц)
Пример 3
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид L-малат
Стадия 1
(Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид L-малат
(Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (300 мг, 0,51 ммоль) при перемешивании растворяли в 5 мл дихлорметана, а затем добавляли L-яблочную кислоту (75,9 мг, 0,56 ммоль). После перемешивания в течение 4 часов при к.т. реакционную смесь концентрировали при пониженном давлении и сушили в вакууме с получением (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид L-малата 3 (375 мг, выход 100%) в виде желтого твердого вещества.
MS m/z (ESI): 583,4 [M+1-134]
1H NMR (400 МГц, MeOD): δ 8,96 (s, 1H), 8,58 (m, 1H), 8,38 (s, 1H), 7,94 (m, 1H), 7,73 (m, 1H), 7,42 (m, 2H), 7,24 (s, 1H), 7,19 (m, 2H), 6,98 (m, 1H), 6,71 (m, 1H), 5,51 (s, 1H), 5,28 (m, 2H), 4,34 (m, 2H), 3,64 (m, 2H), 2,92 (m, 2H), 2,67 (m, 3Н), 2,58 (m, 1H), 2,31 (m, 1H), 2,17 (m, 1H), 2,09 (m, 2H), 1,98 (m, 1H), 1,58 (t, 3Н, J=8 Гц)
Пример 4
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид метансульфонат
Стадия 1
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид метансульфонат
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (150 мг, 0,26 ммоль) при перемешивании растворяли в 2 мл этанола, а затем добавляли метансульфоновую кислоту (1,67 мл, 0,26 ммоль). После перемешивания в течение 12 часов при к.т. в реакционную смесь добавляли 2 мл диэтилового эфира и фильтровали. Твердое вещество промывали диэтиловым эфиром (10 мл) и сушили в вакууме с получением указанного в заголовке продукта (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид метансульфоната 4 (120 мг, выход 69,0%) в виде желтого твердого вещества.
MS m/z (ESI): 583,4 [M+1-96]
1H NMR (400 МГц, DMSO-d6): δ 11,10 (m, 1H), 10,00 (s, 1H), 9,91 (m, 1H), 9,11 (s, 1H), 9,01 (s, 1H), 8,60 (d, 1H, J=4 Гц), 8,03 (m, 1H), 7,57 (m, 2H), 7,47 (m, 4H), 6,92 (m, 2H), 5,31 (s, 2H), 4,43 (m, 2H), 4,01 (m, 2H), 3,73 (m, 3H), 3,14 (s, 2H), 2,80 (m, 2H), 2,32 (m, 1H), 2,27 (m, 3H), 1,51 (t, 3H, J=8 Гц)
Пример 5
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамиддиметансульфонат
Стадия 1
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамиддиметансульфонат
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (200 мг, 0,34 ммоль) при перемешивании растворяли в 2 мл этанола, а затем добавляли метансульфоновую кислоту (4,45 мл, 0,68 ммоль). После перемешивания в течение 12 часов при к.т. в реакционную смесь добавляли 2 мл диэтилового эфира и фильтровали, твердое вещество промывали диэтиловым эфиром (10 мл) и сушили в вакууме с получением указанного в заголовке продукта (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид диметансульфоната 5 (180 мг, выход 67,7%) в виде желтого твердого вещества.
MS m/z (ESI): 583,4 [M+1-192]
1H NMR (400 МГц, DMSO-d6): δ 11,17 (m, 1H), 10,04 (s, 1H), 9,98 (m, 1H), 9,18 (s, 1H), 9,05 (s, 1H), 8,67 (d, 1H, J=4 Гц), 8,01 (m, 1H), 7,68 (m, 2H), 7,50 (m, 4H), 6,91 (m, 2H), 5,39 (s, 2H), 4,40 (m, 2H), 4,14 (m, 2H), 3,71 (m, 6H), 3,22 (s, 2H), 2,82 (m, 2H), 2,36 (m, 1H), 2,32 (m, 3Н), 1,52 (t, 3H, J=8 Гц)
Пример 6
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамидтриметансульФонат
Стадия 1
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамидтриметансульфонат
(E)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (150 мг, 0,26 ммоль) при перемешивании растворяли в 1 мл этанола, а затем добавляли метансульфоновую кислоту (5,00 мл, 0,78 ммоль). После перемешивания в течение 12 часов в реакционную смесь добавляли 2 мл диэтилового эфира и фильтровали, твердое вещество промывали диэтиловым эфиром (10 мл) и сушили в вакууме с получением указанного в заголовке продукта (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид триметансульфоната 6 (140 мг, выход 62,5%) в виде желтого твердого вещества.
MS m/z (ESI): 583,4 [M+1-288]
1H NMR (400 МГц, DMSO-d6): δ 10,97 (m, 1H), 9,99 (s, 1H), 9,89 (m, 1H), 9,27 (s, 1H), 9,08 (s, 1H), 8,71 (d, 1H, J=4 Гц), 7,93m, 1H), 7,62 (m, 2H), 7,51 (m, 4H), 6,94 (m, 2H), 5,27 (s, 2H), 4,37 (m, 2H), 4,09 (m, 2H), 3,67 (m, 9H), 3,19 (s, 2H), 2,78 (m, 2H), 2,31 (m, 1H), 2,27 (m, 3H), 1,52 (t, 3H, J=8 Гц)
Пример 7
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид пара-толуолсульфонат
Стадия 1
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид пара-толуолсульфонат
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (300 мг, 0,514 ммоль) при перемешивании растворяли в 3 мл смешанного растворителя н-пропанол/вода (3/1), а затем добавляли пара-толуолсульфоновой кислоты моногидрат (117 мг, 0,617 ммоль). После перемешивания в течение 0,5 часов при к.т. реакционную смесь концентрировали при пониженном давлении и сушили в вакууме с получением указанного в заголовке продукта (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид пара-толуолсульфоната 7 (410 мг, выход 98,0%) в виде желтого твердого вещества.
MS m/z (ESI): 584,2 [M+1-172]
1H NMR (400 МГц, MeOD): δ 8,56 (s, 1H), 8,46 (s, 1H), 8,26 (s, 1H), 7,85 (m, 1H), 7,65 (m, 4H), 7,40 (m, 5H), 7,12 (m, 1H), 7,00 (m, 2H), 6,81 (m, 2H), 5,12 (s, 2H), 4,14 (m, 4H), 3,54 (m, 7H), 2,83 (m, 3H), 2,33 (m, 6H), 1,56 (t, 3H, J=7,2 Гц)
Пример 8
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид сукцинат
Стадия 1
(E)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид сукцинат
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (400 мг, 0,69 ммоль) при перемешивании растворяли в 5 мл дихлорметана, а затем добавляли янтарную кислоту (89,0 мг, 0,75 ммоль). После перемешивания в течение 0,5 часов при к.т. реакционную смесь концентрировали при пониженном давлении и сушили в вакууме с получением указанного в заголовке продукта (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)сренил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид сукцината 8 (442 мг, выход 90,4%) в виде желтого твердого вещества.
MS m/z (ESI): 583,4 [M+1-118]
1H NMR (400 МГц, MeOD): δ 12,21 (s, 2H), 9,62 (s, 1H), 8,96 (s, 1H), 8,61 (s, 1H), 8,47 (m, 1H), 7,87 (m, 1H), 7,59 (m, 1H0,7,39 (m, 2H), 7,25 (m, 2H), 6,66 (m, 1H), 5,76 (m, 1H), 5,29 (s, 2H), 4,31 (m, 2H), 4,03 (m, 1H), 3,32 (m, 2H), 2,50 (m, 2H), 2,24 (m, 1H), 1,48 (t, 3H, J=7,2 Гц)
Пример 9
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дигидрохлорид
Стадия 1
(Е)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дигидрохлорид
(E)-N-[4-[[3-Хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид 1f (1000 мг, 1,71 ммоль) при перемешивании растворяли в 5 мл дихлорметана, а затем добавляли раствор соляной кислоты в диэтиловом эфире (1М, 3,42 мл, 3,42 ммоль). После перемешивания в течение 0,5 часов в ледяной бане реакционную смесь концентрировали при пониженном давлении и сушили в вакууме с получением указанного в заголовке продукта (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамид дигидрохлорида 9 (1500 мг, выход 100%) в виде желтого твердого вещества.
MS m/z (ESI): 583,2 [M+1-72]
1H NMR (400 МГц, CDCl3): δ 9,16 (s, 1H), 8,60 (s, 1H), 8,51 (s, 1H), 8,13 (s, 1H), 7,79 (m, 1H), 7,68 (m, 1H), 7,45 (m, 1H), 7,35 (s, 1H), 7,33 (d, 1H, J=4 Гц), 7,25 (m, 1H), 7,13 (m, 1H), 7,01 (m, 1H), 6,98 (m, 1H), 6,19 (m, 1H), 5,31 (s, 2H), 4,35 (dd, 2H, J=8 Гц, J=16 Гц), 4,24 (m, 1H), 3,19 (m, 1H), 2,85 (m, 1H), 2,33 (m, 4H), 2,09 (m, 1H), 1,60 (t, 3H, J=8 Гц)
Примеры тестов
Биологическая оценка
Пример 1: анализ ингибирования пролиферации клеток egfr
Следующий анализ in vitro предназначен для определения активности соединений по настоящему изобретению в отношении ингибирования пролиферации клеток человеческой эпидермоидной карциномы А431, имеющих высокий уровень экспрессии EGFR.
Следующий анализ in vitro предназначен для определения активности тестируемых соединений в отношении ингибирования пролиферации раковых клеток, обладающих высоким уровнем экспрессии EGFR. Активность представлена значением IC50 (средней ингибирующей концентрации). Общие процедуры анализа являются следующими: выбрали раковые клетки А431, имеющие высокий уровень экспрессии EGFR, и засевали в 96-луночный культуральный планшет с подходящей плотностью (например 5000 клеток/мл среды). Клетки затем инкубировали в инкубаторе с диоксидом углерода до достижения ими 85% конфлюэнтности. Затем клеточную культуральную среду заменяли на свежую среду, содержащую тестируемые соединения с сериями разведении (как правило, 6-7 концентраций). Клетки вновь помещали в инкубатор и непрерывно выращивали в течение 72 часов. Активность тестируемых соединений в отношении ингибирования клеточной пролиферации определяли с использованием способа с сульфородамином В (SRB). Значения IC50 рассчитывали в соответствии с уровнем ингибирования при различных концентрациях тестируемых соединений.
Активность соединений по настоящему изобретению:
Биологическую активность соединений по настоящему изобретению тестировали путем использования вышеописанного анализа. Значения IC50 рассчитывали и представили в следующей таблице:
| Пример № | IC50 (EGFR/A431) (мкМ) |
| 1f | 0,045 |
| 2 | 0,031 |
| 3 | 0,029 |
| 7 | 0,038 |
| 8 | 0,015 |
| 9 | 0,049 |
Заключение: малеат и другие соли, и свободное основание соединений формулы (I) обладают очевидной активностью в отношении ингибирования пролиферации клеток А431, обладающих высоким уровнем экспрессии EGFR.
Пример 2: Анализ киназной активности EGFR
Киназную активность EGFR in vitro тестировали при помощи следующего анализа.
Следующий анализ может быть использован для определения активности соединений по настоящему изобретению в отношении ингибирования киназной активности EGFR. Среднюю ингибирующую концентрацию IC50 (концентрацию тестируемого соединения, демонстрирующую 50% ингибирование ферментативной активности) для каждого соединения определяли путем инкубации нескольких различных концентраций тестируемых соединений со специфическим ферментом и субстратом. Киназа EGFR, используемая в этом анализе, представляет собой человеческий рекомбинантный белок, который инкубировали с пептидным субстратом при различных концентрациях тестируемых соединений в буферном растворе, содержащем 60 мМ HEPES (рН 7,5), 5 мМ MgCl2, 5 мМ MnCl2, 3 мкМ Na3VO4, 1,25 М DTT (дитиотреитол) (1000×) и 20 мкМ АТР (аденозинтрифосфат) при 25°C в течение 45 минут. Киназную активность EGFR количественно определяли путем использования способа флуоресценции с разрешением по времени.
Активность соединений по настоящему изобретению:
Биологическую активность соединений по настоящему изобретению тестировали путем использования вышеописанного анализа. Значения IC50 рассчитывали и представили в следующей таблице:
| Пример № | IC50 (EGFR/BIO) (мкМ) |
| 1f | 0,013 |
| 1 | 0,025 |
| 2 | 0,009 |
| 3 | 0,031 |
| 7 | 0,026 |
| 8 | 0,028 |
| 9 | 0,035 |
Заключение: малеат и другие соли, и свободное основание соединений формулы (I) обладают очевидной активностью в отношении ингибирования киназной активности EGFR.
Пример 3: анализ активности клеток Пег-2
Следующий анализ in vitro предназначен для определения активности соединений по настоящему изобретению в отношении ингибирования пролиферации клеток человеческой карциномы SK-BR-3, имеющих высокий уровень экспрессии HER-2
Следующий анализ in vitro предназначен для определения активности тестируемых соединений в отношении ингибирования ангиогенеза и пролиферации раковых клеток, обладающих высоким уровнем экспрессии HER-2. Активность представлена значением IC50. Общие процедуры анализа являются следующими: выбрали линию раковых клеток SK-BR-3, имеющих высокий уровень экспрессии HER-2, и засевали в 96-луночный культуральный планшет с подходящей плотностью. Клетки затем инкубировали в инкубаторе с диоксидом углерода до достижения ими 60% конфлюэнтности. Затем клеточную культуральную среду заменяли на свежую среду, содержащую тестируемые соединения в различных концентрациях (как правило, 6-7 концентраций). Клетки вновь помещали в инкубатор и непрерывно выращивали в течение 96 часов. Активность тестируемых соединений в отношении ингибирования клеточной пролиферации определяли с использованием способа с сульфородамином В (SRB). Значения IC50 рассчитывали в соответствии с уровнем ингибирования при различных концентрациях тестируемых соединений.
Активность соединений по настоящему изобретению:
Биологическую активность соединений по настоящему изобретению тестировали путем использования вышеописанного анализа. Значения IC50 рассчитывали и представили в следующей таблице:
| Пример № | IC50 (Her-2/SK-BR-3) (мкМ) |
| 1f | 0,059 |
| 1 | 0,064 |
| 2 | 0,049 |
| 3 | 0,056 |
| 7 | 0,045 |
| 8 | 0,078 |
| 9 | 0,069 |
Заключение: малеат и другие соли, и свободное основание соединений формулы (I) обладают очевидной активностью в отношении ингибирования пролиферации клеток SK-BR-3, обладающих высоким уровнем экспрессии Her-2.
Пример 4: Анализ киназной активности Her-2
Киназную активность Her-2 in vitro тестировали при помощи следующего анализа.
Следующий анализ может быть использован для определения активности соединений по настоящему изобретению в отношении ингибирования киназы Her-2. Среднюю ингибирующую концентрацию IC50 (концентрацию тестируемого соединения, демонстрирующую 50% ингибирование ферментативной активности) для каждого соединения определяли путем инкубации нескольких различных концентраций тестируемых соединений со специфическим ферментом и субстратом. Киназа Her-2, используемая в этом анализе, представляет собой человеческий рекомбинантный белок, который инкубировали с пептидным субстратом при различных концентрациях тестируемых соединений в буферном растворе, содержащем 60 мМ HEPES (pH 7,5), 5 мМ MgCl2, 5 мМ MnCl2, 3 мкМ Na3VO4, 1,25 М DTT (дитиотреитол) (1000×) и 20 мкМ АТР (аденозинтрифосфат) при 25°C в течение 45 минут. Киназную активность Her-2 определяли путем использования способа флуоресценции с разрешением по времени.
Активность соединений по настоящему изобретению:
Биологическую активность соединений по настоящему изобретению тестировали путем использования вышеописанного анализа. Значения IC50 рассчитывали и представили в следующей таблице:
| Пример № | IC50 (Her-2/SK-BR-3) (мкМ) |
| 1f | 0,065 |
| 1 | 0,053 |
| 2 | 0,028 |
| 3 | 0,071 |
| 7 | 0,064 |
| 8 | 0,053 |
| 9 | 0,046 |
Заключение: малеат и другие соли, и свободное основание соединений формулы (I) обладали очевидной активностью в отношении ингибирования киназной активности Her-2.
Анализ растворимости
В соответствии с обычным измерением растворимости, растворимость соединения формулы (I) и его солей определяли в трех различных системах: вода, физиологический раствор и метанол. Результаты представлены в таблице 1:
| Таблица 1 | |||
| Пример | Величина растворимости (мг/мл) | ||
| Физиологический раствор | 0,1М соляная кислота | Вода | |
| Пример 1f | 0,0026 | 1,43 | 0,008 |
| Пример 1 | 0,19 | 23,33 | 12,49 |
| Пример 2 | 0,36 | 54,88 | 1,52 |
| Пример 3 | 0,08 | 12,65 | 17,25 |
| Пример 7 | 0,10 | 31,93 | 5,39 |
| Пример 8 | 3,32 | 32,4 | 22,41 |
| Пример 9 | 0,2 | 16,59 | 0,15 |
Заключение: По сравнению со свободным основанием и другими солями соединения формулы (I) растворимость малеата соединения формулы (I) была значимо лучше.
Фармакокинетический анализ
Пример теста 1
Фармакокинетический анализ соединений по настоящему изобретению
1. Задача теста
В качестве тестируемых животных использовали крыс. Соединение формулы (I) и другие его соли вводили внутрижелудочно, малеат соединения формулы (I) инъецировали в хвостовую вену для определения концентрации лекарства в плазме крови в различные моменты времени при помощи способа LC/MS/MS (жидкостная хроматография/тандемная масс-спектрометрия). Фармакокинетическое поведение, характеристики и абсолютная биодоступность при пероральном введении соединений по настоящему изобретению исследовали и оценивали у крыс.
2. Протокол
2.1 Тестируемые образцы
Соединение 1f в качестве примера, соединения 1, 2, 4, 5, 6, 7 и 9 в качестве примера.
2.2 Тестируемые животные
28 здоровых взрослых крыс SD, самцы и самки поровну, приобретены в SINO-BRITSH SIPPR/BK LAB. ANIMAL LTD., CO, Номер лицензии: SCXK (Shanghai) 2008-0016 и разделены на 7 групп (по 4 крысы в каждой группе).
2.3 Оборудование
Тройной квадрупольный масс-спектрометр TSQ Quantum Ultra AM triple, Thermo Finnigan (US);
Система высокоэффективной жидкостной хроматографии Agilent 1200, Agilent (US).
2.4 Приготовление тестируемых соединений
Группа для внутривенной инъекции: подходящее количество соединений взвешивали, растворяли в DMSO (диметилсульфооксид) и разбавляли нормальным физиологическим раствором до конечного объема. Концентрация образца составляла 2,5 мг/мл.
Группа для внутрижелудочного введения: подходящее количество соединений взвешивали и добавляли в 0,5% CMC-Na с получением суспензии 2,5 мг/мл.
2.5 Введение
32 здоровые взрослые крысы SD, самцы и самки поровну, разделили на 7 групп (по 4 крысы в каждой группе). После ночного поста соединение 1f в качестве примера, соединение 1, 2, 4, 5, 6, 7 и 9 в качестве примера в дозе 25 мг/кг (рассчитанной по основной части) и объеме 10 мл/кг вводили внутрижелудочно или инъецировали в хвостовую вену.
2.6 Отбор образцов
В группе с внутривенной инъекцией образцы крови (0,2 мл) отбирали из орбитального синуса перед введением и через 2 мин, 15 мин, 30 мин, 1,0 ч, 2,0 ч, 4,0 ч, 6,0 ч, 8,0 ч, 12,0 ч, 24,0 ч и 36,0 ч после введения, хранили в гепаринизированных пробирках и центрифугировали в течение 10 минут при 3500 об./мин для отделения плазмы крови. Образцы плазмы крови хранили при -20°C.
В группе с внутрижелудочным введением образцы крови отбирали перед введением и через 0,5, 1,0, 2,0, 3,0, 4,0, 6,0, 8,0, 12,0, 24,0 и 36,0 часов после введения. Способ обработки образцов был таким же, как для группы с внутривенной инъекцией. Крыс кормили через 2 часа после введения.
3. Способ
50 мкл плазмы крови крысы добавляли в 50 мкл серии стандартных растворов соответственно с получением концентрации в плазме крови 50,0, 100, 200, 500, 1000, 2000 и 5000 нг/мл, затем образцы плазмы крови в различных концентрациях смешивали с 50 мкл метанола в течение 3 мин путем использования вортекса, и смесь центрифугировали в течение 10 минут (13500 об./мин). 10 мкл супернатанта анализировали при помощи LC-MS/MS (жидкостной хроматографии/тандемной масс-спектрометрии).
2.9 Расчет фармакокинетических параметров
4. Результаты фармакокинетических параметров
Фармакокинетические параметры соединений по настоящему изобретению представлены на таблице 2.
| Таблица 2 | ||||||||||||
| Соединение | F (%) | Cmax (мкг/мл) | AUC0-t (мкг·ч/мл) | t1/2 (ч) | MRT (ч) | CL/F (мл/мин/кг) | Vz/F (1/кг) | |||||
| Пример 1f | 42,2 | Желудочный зонд 6,47±1,81 | 52,81±23,59 | 3,4±0,45 | 7,66±0,75 | 0,53±0,18 | 2,6±0,94 | |||||
| Вена | 125,4±38,95 | 5,25±2,01 | 4,22±0,71 | 0,21±0,07 | 1,72±1,1 | |||||||
| Пример 1 | 47,1 | Желудочный зонд 8,99±4,87 | 104,58±56,54 | 4,4±1,3 | 8,93±1,39 | 0,31±0,16 | 1,91±1,24 | |||||
| Вена | 221,86±76,99 | 4,92±0,6 | 5,5±0,99 | 0,12±0,043 | 0,89±0,39 | |||||||
| Пример 2 | 48,3 | Желудочный зонд 10,19±4,41 | 116,48±67,23 | 4,45±1,63 | 8,03±0,99 | 0,29±0,19 | 1,84±1,19 | |||||
| Вена | 241,16±92,12 | 3,74±1,20 | 2,96±0,47 | 0,48±0,2 | 2,84±1,88 | |||||||
| Пример 4 | 63,2 | Желудочный зонд 6,92±1,82 | 92,27±36,97 | 3,67±0,83 | 8,4±0,65 | 0,32±0,16 | 1,6±0,54 | |||||
| Вена | 145,75±40,35 | 3,77±0,22 | 5,46±0,48 | 0,18±0,04 | 0,99±0,26 | |||||||
| Пример 5 | 72,1 | Желудочный зонд 7,88±2,51 | 81,53±40,46 | 3,46±0,56 | 7,95±0,61 | 0,38±0,19 | 1,81±0,84 | |||||
| Вена | 112,84±62,1 | 3,12±0,37 | 4,2±0,99 | 0,3±0,22 | 1,33±0,88 | |||||||
| Пример 6 | 50,5 | Желудочный зонд 6,27±1,58 | 81,72±22,16 | 4,15±0,09 | 8,59±0,22 | 0,32±0,09 | 1,95±0,57 | |||||
| Вена | 162,28±55,65 | 5,27±0,29 | 4,94±0,58 | 0,17±0,04 | 1,25±0,31 | |||||||
| Пример 7 | 39,2 | Желудочный зонд 5,16±1,64 | 44,34±16,01 | 3,52±0,69 | 7,9±0,74 | 0,63±0,27 | 3,23±1,65 | |||||
| Вена | 112,84±62,1 | 3,12±0,37 | 4,2±0,99 | 0,3±0,22 | 1,33±0,88 | |||||||
| Пример 9 | 57,6 | Желудочный зонд 5,87±1,61 | 66,12±17,17 | 3,47±0,18 | 7,96±0,7 | 0,4±0,12 | 1,99±0,49 | |||||
| Вена | 115,15±33,0 6 | 4,75±0,32 | 5,54±0,58 | 0,23±0,06 | 1,58±0,46 | |||||||
Заключение: По сравнению со свободным основанием и другими солями соединений формулы (I) малеат соединения формулы (I) значимо улучшает фармакокинетические характеристики и биодоступность и обладает очевидным фармакокинетическим преимуществом.
Для того чтобы продемонстрировать лучшую активность соединений по изобретению по сравнению с известными из уровня техники, Заявитель дополнительно осуществил сравнительные испытания соединений по изобретению и соединений, раскрытых в документе уровня техники CN 101824029. Приведенный ниже сравнительный эксперимент показывает, что хиральное соединение согласно настоящему изобретению (Пример 1f) и его соли имеют более сильный эффект, нежели рацемическое вещество, раскрытое в CN 101824029.
Для соединения согласно CN 101824029 и соединений согласно настоящему изобретению был проведен сравнительный анализ активности в отношении киназы EGFR in vitro и активности в отношении киназы HER-2 in vitro. Полученные результаты показаны ниже.
Как показано в таблице выше:
EGFR(BIO): Значения IC50 для солей согласно изобретению находятся в интервале 0,009-0,035 мкМ; для соединения 1f (R-изомер) это значение составляет 0,013 мкМ; в то время как для рацемата в CN 101824029 оно составляет 0,22 мкМ; то есть, активность указанных солей в 7-25 раз выше, чем активность соединения согласно CN 101824029, и активность соединения 1f в 17 раз выше активности соединения согласно CN 101824029;
HER2(BIO): Значения IC50 указанных солей находятся в интервале 0,045-0,078 мкМ; для соединения 1f (R-изомер) это значение составляет 0,097 мкМ; для рацемата согласно CN 101824029 оно составляет 0,19 мкМ; то есть, активность указанных солей в 2,4-4 раза выше, чем соединения согласно CN 101824029, и активность соединения 1f в 2 раза выше активности соединения согласно CN 101824029.
Таким образом, активность стереоизомерного соединения 1f и его солей согласно настоящему изобретению значительно выше по сравнению с активностью рацемического соединения согласно CN 101824029.
Claims (10)
1. Фармацевтически приемлемая соль (E)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида формулы (I):
где
n равен 1, 2 или 3; и
М представляет собой молекулу кислоты, где указанная соль выбрана из группы, состоящей из гидрохлорида, пара-толуолсульфоната, метансульфоната, малеата, сукцината и L-малата.
где
n равен 1, 2 или 3; и
М представляет собой молекулу кислоты, где указанная соль выбрана из группы, состоящей из гидрохлорида, пара-толуолсульфоната, метансульфоната, малеата, сукцината и L-малата.
2. Соль по п.1, где указанная неорганическая соль представляет собой гидрохлорид.
3. Соль по п.2, где n равен 2.
4. Соль по п.1, где указанная соль представляет собой малеат.
5. Соль по п.4, где n равен 2.
6. Способ получения соли по любому из пп.1-4, включающий стадию взаимодействия (Е)-N-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2R)-1-метилпирролидин-2-ил]проп-2-енамида с соответствующей кислотой, где указанная кислота представляет собой неорганическую кислоту или органическую кислоту, выбранную из группы, состоящей из пара-толуолсульфоновой кислоты, метансульфоновой кислоты, малеиновой кислоты, янтарной кислоты и L-яблочной кислоты с образованием соли.
7. Фармацевтическая композиция для лечения рака, включающая терапевтически эффективное количество фармацевтически приемлемой соли по любому из пп.1-5 и фармацевтически приемлемый носитель.
8. Способ получения фармацевтической композиции по п.7, включающий стадию комбинирования фармацевтически приемлемой соли по любому из пп.1-5 с фармацевтически приемлемым носителем или разбавителем.
9. Применение фармацевтически приемлемой соли по любому из пп.1-5 или фармацевтической композиции по п.7 для получения лекарственного средства для лечения заболеваний, связанных с протеинкиназами, где указанные протеинкиназы выбраны из группы, состоящей из рецепторных тирозинкиназ EGFR и рецепторных тирозинкиназ HER-2.
10. Применение фармацевтически приемлемой соли по любому из пп.1-5 или фармацевтической композиции по п.7 для получения лекарственного средства для лечения рака, где указанный рак выбран из группы, состоящей из рака легкого, рака молочной железы, плоскоклеточного рака и рака желудка.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2011100623598A CN102675287A (zh) | 2011-03-11 | 2011-03-11 | (e)-n-[4-[[3-氯-4-(2-吡啶基甲氧基)苯基]氨基]-3-氰基-7-乙氧基-6-喹啉基]-3-[(2r)-1-甲基吡咯烷-2-基]丙-2-烯酰胺的可药用的盐、其制备方法及其在医药上的应用 |
| CN201110062359.8 | 2011-03-11 | ||
| PCT/CN2012/071015 WO2012122865A2 (zh) | 2011-03-11 | 2012-02-10 | (e)-n-[4-[[3-氯-4-(2-吡啶基甲氧基)苯基]氨基]-3-氰基-7-乙氧基-6-喹啉基]-3-[(2r)-1-甲基吡咯烷-2-基]丙-2-烯酰胺的可药用的盐、其制备方法及其在医药上的应用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2013143381A RU2013143381A (ru) | 2015-04-20 |
| RU2583056C2 true RU2583056C2 (ru) | 2016-05-10 |
Family
ID=46807903
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013143381/04A RU2583056C2 (ru) | 2011-03-11 | 2012-02-10 | Фармацевтически приемлемая соль (е)-n-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2r)-1-метилпирролидин-2-ил]проп-2-енамида, способ ее получения и применение при лечении рака |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20130338190A1 (ru) |
| EP (1) | EP2684877B1 (ru) |
| JP (1) | JP6192544B2 (ru) |
| KR (1) | KR101871889B1 (ru) |
| CN (2) | CN102675287A (ru) |
| ES (1) | ES2605564T3 (ru) |
| HK (1) | HK1177461A1 (ru) |
| PL (1) | PL2684877T3 (ru) |
| PT (1) | PT2684877T (ru) |
| RU (1) | RU2583056C2 (ru) |
| TW (1) | TWI530288B (ru) |
| WO (1) | WO2012122865A2 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2777675C2 (ru) * | 2017-10-18 | 2022-08-09 | Цзянсу Хэнжуй Медисин Ко., Лтд. | Способ получения ингибитора тирозинкиназы и его промежуточного соединения |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103539783A (zh) * | 2012-07-12 | 2014-01-29 | 江苏恒瑞医药股份有限公司 | 一种酪氨酸激酶抑制剂的二马来酸盐的i型结晶及制备方法 |
| EP3378478B1 (en) * | 2016-01-27 | 2022-05-11 | Jiangsu Hengrui Medicine Co., Ltd. | Pharmaceutical composition comprising quinoline derivative or salt thereof |
| CN107405345A (zh) | 2016-01-27 | 2017-11-28 | 江苏恒瑞医药股份有限公司 | 一种含有喹啉衍生物或其盐的药物组合物的制备方法 |
| CN112426424A (zh) * | 2016-01-28 | 2021-03-02 | 江苏恒瑞医药股份有限公司 | 一种egfr/her2受体酪氨酸激酶抑制剂在制备治疗her2突变癌症药物中的用途 |
| CA3021471A1 (en) | 2016-04-28 | 2017-11-02 | Guaili Wu | Method for preparing tyrosine kinase inhibitor and derivative thereof |
| CN107638424B (zh) * | 2016-07-20 | 2022-05-27 | 江苏恒瑞医药股份有限公司 | 一种egfr/her2受体酪氨酸激酶抑制剂在制备治疗癌症的药物中的用途 |
| TW201827050A (zh) * | 2017-01-22 | 2018-08-01 | 大陸商江蘇恆瑞醫藥股份有限公司 | Egfr/her2抑制劑聯合嘧啶類抗代謝藥物的用途 |
| KR20200072491A (ko) | 2017-10-18 | 2020-06-22 | 지앙수 헨그루이 메디슨 컴퍼니 리미티드 | 티로신 키나제 억제제 및 이의 중간체의 제조 방법 |
| KR20200078561A (ko) | 2017-10-24 | 2020-07-01 | 지앙수 헨그루이 메디슨 컴퍼니 리미티드 | 퀴놀린 유도체를 함유하는 약학 조성물 |
| JP2021503506A (ja) * | 2017-11-20 | 2021-02-12 | テリジーン リミテッドTeligene Ltd. | (e)−n−(3−シアノ−7−エトキシ−4−((4−フェノキシフェニル)アミノ)キノリン−6−イル)−4−(ジメチルアミノ)ブタ−2−エンアミドのマレイン酸塩及びその結晶形態 |
| US10857146B2 (en) | 2018-08-21 | 2020-12-08 | Jiangsu Hengrui Medicine Co., Ltd. | Method for preventing or treating tumor diseases with a combination of tyrosine kinase inhibitor and CDK4/6 inhibitor |
| CN110960529A (zh) * | 2018-09-30 | 2020-04-07 | 江苏恒瑞医药股份有限公司 | 一种降低了毒性杂质含量的酪氨酸激酶抑制剂的原料药 |
| MX2021004600A (es) * | 2018-10-22 | 2021-06-15 | Jiangsu Hengrui Medicine Co | Forma cristalina del inhibidor de maleato de tirosina quinasa y metodo de preparacion para el mismo. |
| CN111821304A (zh) * | 2019-04-16 | 2020-10-27 | 江苏恒瑞医药股份有限公司 | 酪氨酸激酶抑制剂联合长春碱类药物在制备预防或治疗肿瘤疾病的药物中的用途 |
| TW202115027A (zh) * | 2019-08-30 | 2021-04-16 | 大陸商江蘇恒瑞醫藥股份有限公司 | 低雜質含量的酪胺酸激酶抑制劑 |
| CN112279838B (zh) * | 2020-10-29 | 2021-07-13 | 苏州富士莱医药股份有限公司 | 一种吡咯替尼的制备方法 |
| CN114409584A (zh) * | 2022-03-08 | 2022-04-29 | 重庆医药高等专科学校 | 一种1-甲基吡咯烷-2-甲醛的制备方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1259125A (zh) * | 1997-04-03 | 2000-07-05 | 美国氰胺公司 | 取代的3-氰基喹啉 |
| RU2309150C2 (ru) * | 2001-11-27 | 2007-10-27 | Уайт Холдингз Корпорейшн | 3-цианохинолины в качестве ингибиторов egf-r и her2 киназ |
| CN101824029A (zh) * | 2009-03-05 | 2010-09-08 | 厦门艾德生物医药科技有限公司 | 酪氨酸激酶不可逆抑制剂、其药物组合物及其用途 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100486394B1 (ko) * | 1999-11-16 | 2005-04-29 | 쉬바르츠파르마에이지 | 3,3-디페닐-프로필아민의 신규한 유도체의 안정한 염 |
| DE10307165A1 (de) * | 2003-02-20 | 2004-09-02 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Bicyclische Heterocyclen, diese Verbindungen enthaltende Arzneimittel, ihre Verwendung und Verfahren zu ihrer Herstellung |
| US7399865B2 (en) | 2003-09-15 | 2008-07-15 | Wyeth | Protein tyrosine kinase enzyme inhibitors |
| CN100540552C (zh) | 2007-02-01 | 2009-09-16 | 中国药科大学 | 3-氰基喹啉衍生物、其制备方法及其医药用途 |
| US8022216B2 (en) * | 2007-10-17 | 2011-09-20 | Wyeth Llc | Maleate salts of (E)-N-{4-[3-chloro-4-(2-pyridinylmethoxy)anilino]-3-cyano-7-ethoxy-6-quinolinyl}-4-(dimethylamino)-2-butenamide and crystalline forms thereof |
| CN102020639A (zh) * | 2009-09-14 | 2011-04-20 | 上海恒瑞医药有限公司 | 6-氨基喹唑啉或3-氰基喹啉类衍生物、其制备方法及其在医药上的应用 |
| CN107441058A (zh) * | 2009-11-09 | 2017-12-08 | 惠氏有限责任公司 | 包衣药物球状体及消除或减少病症如呕吐和腹泻的用途 |
-
2011
- 2011-03-11 CN CN2011100623598A patent/CN102675287A/zh active Pending
-
2012
- 2012-02-10 PL PL12757831T patent/PL2684877T3/pl unknown
- 2012-02-10 WO PCT/CN2012/071015 patent/WO2012122865A2/zh active Application Filing
- 2012-02-10 EP EP12757831.8A patent/EP2684877B1/en active Active
- 2012-02-10 RU RU2013143381/04A patent/RU2583056C2/ru active
- 2012-02-10 ES ES12757831.8T patent/ES2605564T3/es active Active
- 2012-02-10 JP JP2013556950A patent/JP6192544B2/ja not_active Expired - Fee Related
- 2012-02-10 PT PT127578318T patent/PT2684877T/pt unknown
- 2012-02-10 CN CN201280001564.6A patent/CN102933574B/zh active Active
- 2012-02-10 KR KR1020137025507A patent/KR101871889B1/ko active IP Right Grant
- 2012-02-10 US US14/001,778 patent/US20130338190A1/en not_active Abandoned
- 2012-02-24 TW TW101106172A patent/TWI530288B/zh active
-
2013
- 2013-04-17 HK HK13104640.1A patent/HK1177461A1/xx not_active IP Right Cessation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1259125A (zh) * | 1997-04-03 | 2000-07-05 | 美国氰胺公司 | 取代的3-氰基喹啉 |
| RU2309150C2 (ru) * | 2001-11-27 | 2007-10-27 | Уайт Холдингз Корпорейшн | 3-цианохинолины в качестве ингибиторов egf-r и her2 киназ |
| CN101824029A (zh) * | 2009-03-05 | 2010-09-08 | 厦门艾德生物医药科技有限公司 | 酪氨酸激酶不可逆抑制剂、其药物组合物及其用途 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2777675C2 (ru) * | 2017-10-18 | 2022-08-09 | Цзянсу Хэнжуй Медисин Ко., Лтд. | Способ получения ингибитора тирозинкиназы и его промежуточного соединения |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6192544B2 (ja) | 2017-09-06 |
| JP2014507448A (ja) | 2014-03-27 |
| ES2605564T3 (es) | 2017-03-15 |
| TWI530288B (zh) | 2016-04-21 |
| EP2684877A4 (en) | 2014-08-06 |
| TW201236684A (en) | 2012-09-16 |
| PL2684877T3 (pl) | 2017-05-31 |
| CN102675287A (zh) | 2012-09-19 |
| HK1177461A1 (en) | 2013-08-23 |
| WO2012122865A3 (zh) | 2012-11-08 |
| KR101871889B1 (ko) | 2018-06-27 |
| EP2684877A2 (en) | 2014-01-15 |
| EP2684877B1 (en) | 2016-10-19 |
| PT2684877T (pt) | 2017-01-18 |
| WO2012122865A2 (zh) | 2012-09-20 |
| RU2013143381A (ru) | 2015-04-20 |
| CN102933574B (zh) | 2014-10-01 |
| US20130338190A1 (en) | 2013-12-19 |
| KR20140009418A (ko) | 2014-01-22 |
| CN102933574A (zh) | 2013-02-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2583056C2 (ru) | Фармацевтически приемлемая соль (е)-n-[4-[[3-хлор-4-(2-пиридилметокси)фенил]амино]-3-циано-7-этокси-6-хинолил]-3-[(2r)-1-метилпирролидин-2-ил]проп-2-енамида, способ ее получения и применение при лечении рака | |
| JP6794609B2 (ja) | チェックポイントキナーゼ1(chk1)阻害剤として有用な3,5−二置換ピラゾール、並びにその調製及び用途 | |
| EP2252597B1 (en) | Pyrazine derivatives and their use as protein kinase inhibitors | |
| US9090588B2 (en) | Alkyne substituted quinazoline compound and methods of use | |
| JP2018511634A (ja) | B−rafキナーゼのマレイン酸塩、結晶形、調整方法、及びその使用 | |
| TWI555745B (zh) | 喹唑啉-7-醚化合物及其使用方法 | |
| KR20200035720A (ko) | 3-아자바이사이클로[3,1,1]헵탄 유도체 및 이를 포함하는 약제학적 조성물 | |
| JP5736452B2 (ja) | キナゾリン化合物 | |
| US20120295887A1 (en) | Pharmaceutically acceptable salts of pyrrolo-nitrogenous heterocyclic derivatives, preparation method and medical use thereof | |
| WO2019096112A1 (zh) | 一种取代的苯并咪唑化合物及包含该化合物的组合物 | |
| WO2017211248A1 (zh) | 一种取代的咪唑并喹唑啉化合物及其药物组合物 | |
| US20230121346A1 (en) | The salts of a compound and the crystalline forms thereof | |
| TW202140430A (zh) | 喹唑啉類化合物、製備方法及其應用 | |
| TW202434587A (zh) | B-raf激酶抑制劑的無定形形式、鹽酸鹽、甲磺酸鹽、2-羥基乙磺酸鹽、l-酒石酸鹽或草酸鹽及其用途 | |
| TW201228664A (en) | Pyrrolo-nitrogenous heterocyclic derivatives pharmaceutical salts, preparation process and pharmaceutical use thereof |