RU2553993C2 - Каталитический комплекс для реакций метатезиса олефинов, способ его приготовления и его применение - Google Patents
Каталитический комплекс для реакций метатезиса олефинов, способ его приготовления и его применение Download PDFInfo
- Publication number
- RU2553993C2 RU2553993C2 RU2012105770/04A RU2012105770A RU2553993C2 RU 2553993 C2 RU2553993 C2 RU 2553993C2 RU 2012105770/04 A RU2012105770/04 A RU 2012105770/04A RU 2012105770 A RU2012105770 A RU 2012105770A RU 2553993 C2 RU2553993 C2 RU 2553993C2
- Authority
- RU
- Russia
- Prior art keywords
- amino group
- alkyl
- group
- catalyst
- ligand
- Prior art date
Links
- 239000003054 catalyst Substances 0.000 title claims abstract description 61
- 238000000034 method Methods 0.000 title claims abstract description 37
- 238000005649 metathesis reaction Methods 0.000 title claims abstract description 9
- 150000001336 alkenes Chemical class 0.000 title claims abstract description 4
- 238000002360 preparation method Methods 0.000 title claims description 6
- 239000003446 ligand Substances 0.000 claims abstract description 95
- 239000002262 Schiff base Substances 0.000 claims abstract description 33
- 150000004753 Schiff bases Chemical class 0.000 claims abstract description 33
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 33
- 125000003277 amino group Chemical group 0.000 claims abstract description 33
- 229910052707 ruthenium Inorganic materials 0.000 claims abstract description 31
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 claims abstract description 29
- 239000012018 catalyst precursor Substances 0.000 claims abstract description 19
- 239000001257 hydrogen Substances 0.000 claims abstract description 19
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 19
- 239000002585 base Substances 0.000 claims abstract description 18
- 239000002243 precursor Substances 0.000 claims abstract description 16
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 15
- 150000002367 halogens Chemical class 0.000 claims abstract description 15
- 150000002431 hydrogen Chemical class 0.000 claims abstract description 15
- 238000005865 alkene metathesis reaction Methods 0.000 claims abstract description 12
- 239000012454 non-polar solvent Substances 0.000 claims abstract description 10
- 239000012634 fragment Substances 0.000 claims abstract 12
- 230000003197 catalytic effect Effects 0.000 claims description 31
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical group C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 30
- 238000006243 chemical reaction Methods 0.000 claims description 22
- 125000003860 C1-C20 alkoxy group Chemical group 0.000 claims description 11
- 238000006116 polymerization reaction Methods 0.000 claims description 11
- 238000007152 ring opening metathesis polymerisation reaction Methods 0.000 claims description 11
- 239000000463 material Substances 0.000 claims description 5
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 3
- 125000003545 alkoxy group Chemical group 0.000 claims description 2
- 238000009835 boiling Methods 0.000 claims description 2
- 229910052809 inorganic oxide Inorganic materials 0.000 claims description 2
- 229910003480 inorganic solid Inorganic materials 0.000 claims description 2
- 239000002808 molecular sieve Substances 0.000 claims description 2
- 229920000620 organic polymer Polymers 0.000 claims description 2
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 claims description 2
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 claims 1
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 claims 1
- 239000000178 monomer Substances 0.000 abstract description 9
- 230000004913 activation Effects 0.000 abstract description 6
- 230000000694 effects Effects 0.000 abstract description 6
- 239000000126 substance Substances 0.000 abstract description 3
- 229910052751 metal Inorganic materials 0.000 description 31
- 239000002184 metal Substances 0.000 description 31
- HECLRDQVFMWTQS-RGOKHQFPSA-N 1755-01-7 Chemical compound C1[C@H]2[C@@H]3CC=C[C@@H]3[C@@H]1C=C2 HECLRDQVFMWTQS-RGOKHQFPSA-N 0.000 description 26
- 229910052799 carbon Inorganic materials 0.000 description 25
- -1 cyclic olefins Chemical class 0.000 description 20
- 125000003118 aryl group Chemical group 0.000 description 18
- KQTXIZHBFFWWFW-UHFFFAOYSA-L disilver;carbonate Chemical compound [Ag]OC(=O)O[Ag] KQTXIZHBFFWWFW-UHFFFAOYSA-L 0.000 description 18
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 15
- 229910052762 osmium Inorganic materials 0.000 description 13
- SYQBFIAQOQZEGI-UHFFFAOYSA-N osmium atom Chemical compound [Os] SYQBFIAQOQZEGI-UHFFFAOYSA-N 0.000 description 13
- 239000011541 reaction mixture Substances 0.000 description 13
- 125000000129 anionic group Chemical group 0.000 description 11
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 description 11
- 230000000269 nucleophilic effect Effects 0.000 description 11
- 229910052760 oxygen Inorganic materials 0.000 description 11
- LKZMBDSASOBTPN-UHFFFAOYSA-L silver carbonate Substances [Ag].[O-]C([O-])=O LKZMBDSASOBTPN-UHFFFAOYSA-L 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- 238000005481 NMR spectroscopy Methods 0.000 description 10
- 125000001841 imino group Chemical group [H]N=* 0.000 description 10
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 9
- VRBHURBJIHILRI-UHFFFAOYSA-N 1H-inden-1-ylidene Chemical group C1=CC=C2[C]C=CC2=C1 VRBHURBJIHILRI-UHFFFAOYSA-N 0.000 description 8
- 125000001118 alkylidene group Chemical group 0.000 description 8
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 8
- 125000002573 ethenylidene group Chemical group [*]=C=C([H])[H] 0.000 description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 8
- 239000001301 oxygen Substances 0.000 description 8
- 125000001424 substituent group Chemical group 0.000 description 8
- 125000004104 aryloxy group Chemical group 0.000 description 7
- 125000004429 atom Chemical group 0.000 description 7
- 125000005842 heteroatom Chemical group 0.000 description 7
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical group [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 6
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 6
- 238000001994 activation Methods 0.000 description 6
- 125000004433 nitrogen atom Chemical group N* 0.000 description 6
- 229910052711 selenium Chemical group 0.000 description 6
- 239000011669 selenium Chemical group 0.000 description 6
- 229910052717 sulfur Inorganic materials 0.000 description 6
- 239000011593 sulfur Chemical group 0.000 description 6
- RUKVGXGTVPPWDD-UHFFFAOYSA-N 1,3-bis(2,4,6-trimethylphenyl)imidazolidine Chemical group CC1=CC(C)=CC(C)=C1N1CN(C=2C(=CC(C)=CC=2C)C)CC1 RUKVGXGTVPPWDD-UHFFFAOYSA-N 0.000 description 5
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 5
- 125000000304 alkynyl group Chemical group 0.000 description 5
- 125000001072 heteroaryl group Chemical group 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 125000003302 alkenyloxy group Chemical group 0.000 description 4
- 125000005133 alkynyloxy group Chemical group 0.000 description 4
- 150000007942 carboxylates Chemical class 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 230000000977 initiatory effect Effects 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 230000007935 neutral effect Effects 0.000 description 4
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 4
- 125000006735 (C1-C20) heteroalkyl group Chemical group 0.000 description 3
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 3
- 125000003358 C2-C20 alkenyl group Chemical group 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- BPELEZSCHIEMAE-UHFFFAOYSA-N salicylaldehyde imine Chemical class OC1=CC=CC=C1C=N BPELEZSCHIEMAE-UHFFFAOYSA-N 0.000 description 3
- ZXSQEZNORDWBGZ-UHFFFAOYSA-N 1,3-dihydropyrrolo[2,3-b]pyridin-2-one Chemical compound C1=CN=C2NC(=O)CC2=C1 ZXSQEZNORDWBGZ-UHFFFAOYSA-N 0.000 description 2
- FFNAZPAKHNTGBO-UHFFFAOYSA-N 2-[(4-tert-butylphenyl)iminomethyl]-4-methoxyphenol Chemical compound COC1=CC=C(O)C(C=NC=2C=CC(=CC=2)C(C)(C)C)=C1 FFNAZPAKHNTGBO-UHFFFAOYSA-N 0.000 description 2
- ZETADZMTJGUYAE-UHFFFAOYSA-N 2-[(4-tert-butylphenyl)iminomethyl]-5-methoxyphenol Chemical compound OC1=CC(OC)=CC=C1C=NC1=CC=C(C(C)(C)C)C=C1 ZETADZMTJGUYAE-UHFFFAOYSA-N 0.000 description 2
- XJXRASYXFGCILT-UHFFFAOYSA-N 4-methoxy-2-[(4-methylphenyl)iminomethyl]phenol Chemical compound COC1=CC=C(O)C(C=NC=2C=CC(C)=CC=2)=C1 XJXRASYXFGCILT-UHFFFAOYSA-N 0.000 description 2
- GNOUBIRWFVUVBL-UHFFFAOYSA-N 5-methoxy-2-[(4-methylphenyl)iminomethyl]phenol Chemical compound OC1=CC(OC)=CC=C1C=NC1=CC=C(C)C=C1 GNOUBIRWFVUVBL-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 239000002841 Lewis acid Substances 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- 239000012327 Ruthenium complex Substances 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 125000005210 alkyl ammonium group Chemical group 0.000 description 2
- 125000005600 alkyl phosphonate group Chemical group 0.000 description 2
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 2
- 150000008052 alkyl sulfonates Chemical class 0.000 description 2
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 2
- 125000004414 alkyl thio group Chemical group 0.000 description 2
- 239000012300 argon atmosphere Substances 0.000 description 2
- 125000005228 aryl sulfonate group Chemical group 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 150000001718 carbodiimides Chemical class 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 150000001923 cyclic compounds Chemical class 0.000 description 2
- 238000000113 differential scanning calorimetry Methods 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 238000001879 gelation Methods 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 239000012948 isocyanate Substances 0.000 description 2
- 150000002513 isocyanates Chemical class 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 229910001958 silver carbonate Inorganic materials 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 229910052716 thallium Inorganic materials 0.000 description 2
- BKVIYDNLLOSFOA-UHFFFAOYSA-N thallium Chemical compound [Tl] BKVIYDNLLOSFOA-UHFFFAOYSA-N 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- 125000000027 (C1-C10) alkoxy group Chemical group 0.000 description 1
- 125000003837 (C1-C20) alkyl group Chemical group 0.000 description 1
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 239000007848 Bronsted acid Substances 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 1
- 238000004639 Schlenk technique Methods 0.000 description 1
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 239000000010 aprotic solvent Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 239000010953 base metal Substances 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 150000001721 carbon Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 238000005260 corrosion Methods 0.000 description 1
- 230000007797 corrosion Effects 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000009477 glass transition Effects 0.000 description 1
- 125000004404 heteroalkyl group Chemical group 0.000 description 1
- JCYWCSGERIELPG-UHFFFAOYSA-N imes Chemical compound CC1=CC(C)=CC(C)=C1N1C=CN(C=2C(=CC(C)=CC=2C)C)[C]1 JCYWCSGERIELPG-UHFFFAOYSA-N 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- LJDZFAPLPVPTBD-UHFFFAOYSA-N nitroformic acid Chemical compound OC(=O)[N+]([O-])=O LJDZFAPLPVPTBD-UHFFFAOYSA-N 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000002952 polymeric resin Substances 0.000 description 1
- 239000012041 precatalyst Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 238000007151 ring opening polymerisation reaction Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-N sodium;hydron;carbonate Chemical compound [Na+].OC(O)=O UIIMBOGNXHQVGW-UHFFFAOYSA-N 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000005979 thermal decomposition reaction Methods 0.000 description 1
- 125000004001 thioalkyl group Chemical group 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000006478 transmetalation reaction Methods 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/002—Osmium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/0046—Ruthenium compounds
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Catalysts (AREA)
Abstract
Настоящее изобретение относится к способу приготовления каталитического комплекса, имеющего формулу
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C2-C20алкоксигруппы, галогена и аминогруппы, где если R1 или R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 или R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил. Способ включает стадию взаимодействия предшественника рутениевого катализатора с одним или двумя бидентатными лигандами класса Шиффовых оснований в неполярном растворителе и в присутствии слабого основания, где бидентатные лиганды класса Шиффовых оснований независимо находятся в количестве от 1,0 до 3,0 эквивалентов относительно количества предшественника катализатора (формулы предшественников и лигандов приведены в п.1 формулы изобретения). Также предложены каталитический комплекс, катализатор на носителе для реакций метатезиса олефинов и их применение в реакциях метатезиса олефинов. Изобретение позволяет получить катализатор, обладающий высокой активностью после активации, стабильностью в мономере, простым и безопасным способом. 4 н. и 7 з.п. ф-лы, 2 табл.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к каталитическому комплексу для реакций метатезиса олефинов, к способу его приготовления и его применению в реакциях метатезиса олефинов, в частности в реакциях метатезисной полимеризации с раскрытием цикла (ROMP).
Уровень техники
В последние годы метатезис олефинов получил широкое развитие и стал универсальным и эффективным инструментом в органическом синтезе.
Успех реакции метатезиса олефинов объясняется главным образом универсальностью и разработкой хорошо охарактеризованных рутениевых катализаторов, устойчивых к требуемым условиям реакции. Ввиду того, что данные катализаторы стали коммерчески доступными и применялись в большом количестве потенциально интересных применений, в области возникли новые проблемы, например латентность катализаторов. Идеальный латентный катализатор метатезиса олефинов не проявляет каталитической активности в присутствии мономера или носителя при комнатной температуре, но может быть количественно стимулирован в высокоактивную форму путем термической, химической или фотохимической активации для инициирования реакции метатезиса. К тому же, устойчивость катализатора к распаду или термическому разложению должна быть гарантирована тщательным подбором лигандного окружения.
Для промышленного применения в полимеризации дициклопентадиена (DCPD) требуются латентные катализаторы, проявляющие пониженные начальные скорости, позволяющие дольше хранить смесь мономер-катализатор до начала полимеризации.
Ван дер Шааф с сотрудниками разработал термически активируемый, медленно инициирующий метатезис олефинов катализатор (PR3)(Cl)2Ru(CH(CH2)2-C,N-2-C5H4N) (Схема 1), при этом температуры инициирования были настроены путем изменения схемы замещения пиридинового кольца (Van der Schaaf, Р.А.; Kolly, R.; Kirner, H.-J.; Rime, F.; Muhlebach, A.; Hafner, A.J. Organomet. Chem. 2000, 606, 65-74). К сожалению, активности предложенных комплексов были нежелательно низкими; ограничиваясь 12000 экв. DCPD. Позднее Унг предложил аналогичные настраиваемые каталитические системы, полученные путем частичной изомеризации транс-(SIMes)(Cl)2Ru(CH(CH2)2-C,N-2-C5H4N) (2) в цис аналог (, Т.; Hejl, A.; Grubbs, R.H.; Schrodi, Y. Organometallics 2004, 23, 5399-5401). Однако ни один из этих катализаторов не мог храниться в DCPD мономере длительное время, так как реакция метатезисной полимеризации с раскрытием цикла (ROMP) дициклопентадиена (DCPD) завершалась через 25 минут после введения катализатора.
В другом подходе к рационально конструированному термически стабильному катализатору метатезиса олефинов для полимеризации дициклопентадиена (DCPD) усилия были направлены на развитие Ru-карбеновых катализаторов, содержащих O,N-бидентатный лиганд класса Шиффовых оснований, разработанных Verpoort et al (Схема 2, 4, 5, L=SIMes). Было показано, что такие комплексы крайне неактивны при комнатной температуре в отношении полимеризации циклических олефинов с низкой деформацией, могут храниться в DCPD в течение месяцев и могут быть термически активированы для достижения повышенной активности для полимеризации в массе DCPD, но активности, сопоставимые с соответствующими комплексами без оснований Шиффа, достигнуты быть не могут (ЕР 1 468 004; Allaert, В.; Dieltiens, N.; Ledoux, N.; Vercaemst, С; Van Der Voort, P.; Stevens, C.V.; Linden, A.; Verpoort, F. J. Mol. Cat. A: Chem. 2006, 260, 221-226).
К тому же, активации катализатора способствует добавление больших объемов кислот Брэнстеда (напр., HCl), что приводит к высокой каталитической активности в отношении реакции ROMP дициклопентадиена (DCPD) (ЕР 1 577 282; ЕР 1 757 613; В. De Clercq, F. Verpoort, Tetrahedron Lett., 2002, 43, 9101-9104; (b) B. Allaert, N. Dieltens, N. Ledoux, C. Vercaemst, P. Van Der Voort, С.V. Stevens, A. Linden, F. Verpoort, J. Mol. Catal. A: Chem., 2006, 260, 221-226; (c) N. Ledoux, B. Allaert, D. Schaubroeck, S. Monsaert, R. Drozdzak, P. Van Der Voort, F. Verpoort, J. Organomet. Chem., 2006, 691, 5482-5486). Однако необходимость больших объемов HCl, из-за ее высокой летучести и проблем коррозии, делает их неприемлемыми для промышленного применения.
Недавно были синтезированы серии латентных катализаторов метатезиса олефинов, несущих бидентатные к2-(O,O) лиганды (Схема 2, 3). Оказалось, что комплекс 3 является неактивным для полимеризации без растворителя дициклопентадиена (DCPD). К тому же, было показано, что комплекс 3 (Схема 2, L=РСу3, SIMes) легко активируется при облучении смеси катализатор/мономер, содержащей фотокислотный генератор и пригоден для реакции ROMP дициклопентадиена (DCPD) (D. М. Lynn, Е. L. Dias, R Н. Grubbs, В. Mohr, 1999, WO 99/22865). Несмотря на то что облучение раствора дициклопентадиена (DCPD) 3 (L=SIMes) в минимальном количестве CH2Cl2 приводило к полному гелеобразованию в течение 1 ч, отвержденный и поперечно-сшитый мономер не был получен. Это указывает на низкую каталитическую активность и действие на низком количестве активных частиц. Более того, протокол синтеза для катализатора 3 имеет серьезный недостаток, а именно использование Т1(алкил-асас). Таллий и его производные чрезвычайно токсичны, поэтому этот способ не приемлем для промышленного применения. К тому же, использование Ag(Me6acac) приводило к полному лигандному обмену, но требуемый продукт 3 оказался устойчив к дальнейшей очистке, только лигандный обмен с использованием таллия как более эффективного элемента переметаллирования позволил получить требуемый чистый комплекс 3 с высоким выходом (К. Keitz, R. Н. Grubbs, J. Am. Chem. Soc., 2009,131, 2038-2039).
Таким образом, латентные катализаторы являются важными для метатезисной полимеризации с раскрытием цикла циклических олефинов с низкой деформацией, допуская смешивание мономера и катализатора без сопутствующего гелеобразования или микрокапсулирования прекатализатора. Получение латентного катализатора, стабильного в мономере, высоко активного после подходящего для производства способа активации и изготовленного безвредным для окружающей среды способом, остается открытой проблемой.
Раскрытие изобретения
Целью настоящего изобретения является получение каталитического комплекса для применения в реакциях метатезиса олефинов, который преодолевает указанные выше недостатки латентных катализаторов с основанием Шиффа, стабилен в составе мономера DCPD, легко и эффективно активируется количественными объемами слабой кислоты Льюиса с высокой активностью после активации и получен простым, эффективным, безопасным способом с высоким выходом.
Указанная цель достигается с помощью способа приготовления каталитического комплекса, состоящего из:
a. атома металла, выбранного из группы, состоящей из рутения и осмия;
b. двух бидентантных лигандов класса Шиффовых оснований, содержащих иминогруппу и скоординированных с металлом, в дополнение к атому азота указанной иминогруппы, через по меньшей мере один дополнительный гетероатом, выбранный из группы, состоящей из кислорода, серы и селена, связанный с указанным металлом;
c. нуклеофильного карбенового лиганда, связанного с указанным металлом; и
d. углеродсодержащего лиганда, связанного с указанным металлом, при этом указанный углеродсодержащий лиганд представляет собой замещенный или незамещенный алкилиденовый, винилиденовый или инденилиденовый лиганд;
при этом способ включает стадии взаимодействия предшественника рутениевого или осмиевого катализатора, состоящего из:
a. атома металла, выбранного из группы, состоящей из рутения и осмия;
b. двух анионных лигандов;
c. нуклеофильного карбенового лиганда, связанного с указанным металлом;
d. углеродсодержащего лиганда, связанного с указанным металлом, при этом указанный углеродсодержащий лиганд представляет собой замещенный или незамещенный алкилиденовый, винилиденовый или инденилиденовый лиганд; и
e. нейтрального лиганда или
предшественника рутениевого или осмиевого катализатора, состоящего из:
a. атома металла, выбранного из группы, состоящей из рутения и осмия;
b. одного анионного лиганда;
c. одного бидендатного лиганда класса Шиффовых оснований, содержащего иминогруппу и скоординированного с металлом, дополнительно к атому азота указанной иминогруппы, по меньшей мере через один дополнительный гетероатом, выбранный из группы, состоящей из кислорода, серы и селена, связанный с указанным металлом;
d. нуклеофильного карбенового лиганда, связанного с указанным металлом; и
е. углеродсодержащего лиганда, связанного с указанным металлом, при этом указанный углеродсодержащий лиганд представляет собой замещенный или незамещенный алкилиденовый, винилиденовый или инденилиденовый лиганд;
с 1.0-3.0 эквивалентами бидентатного лиганда класса Шиффовых оснований в неполярном растворителе и в присутствии слабого основания.
Кроме того, настоящее изобретение относится к каталитическому комплексу, который можно получить этим способом, т.е. каталитическому комплексу, состоящему из:
a. атома металла, выбранного из группы, состоящей из рутения и осмия;
b. двух бидентантных лигандов класса Шиффовых оснований, содержащих иминогруппу и скоординированных с металлом, дополнительно к атому азота указанной иминогруппы, по меньшей мере через один дополнительный гетероатом, выбранный из группы, состоящей из кислорода, серы и селена, связанный с указанным металлом;
c. нуклеофильного карбенового лиганда, связанного с указанным металлом; и
d. углеродсодержащего лиганда, связанного с указанным металлом, при этом указанный углеродсодержащий лиганд представляет собой замещенный или незамещенный алкилиденовый, винилиденовый или инденилиденовый лиганд.
Кроме того, настоящее изобретение относится к катализатору на носителе, содержащему указанный выше каталитический комплекс.
Таким образом, настоящее изобретение относится к применению указанного выше каталитического комплекса и катализатора на носителе в реакциях метатезиса олефинов и, в частности, в метатезисной полимеризации с раскрытием цикла.
Предпочтительные варианты настоящего изобретения описаны в зависимых пунктах формулы изобретения.
Осуществление изобретения
Каталитический комплекс согласно настоящему изобретению содержит атом металла, выбранный из группы, состоящей из рутения и осмия, в качестве базового металла. Предпочтительно, чтобы каталитический комплекс содержал рутений.
К тому же, каталитический комплекс содержит два бидентатных лиганда класса Шиффовых оснований, содержащих иминогруппу и скоординированных с металлом, в дополнение к атому азота указанной иминогруппы, по меньшей мере через один дополнительный гетероатом, выбранный из группы, состоящей из кислорода, серы и селена, связанный с указанным металлом. Предпочтительно, чтобы гетероатомом являлся кислород.
Подходящие бидентатные лиганды класса Шиффовых оснований описаны, например, в европейском патенте 1468004. Эти лиганды класса Шиффовых оснований имеют общую формулу:
где Z выбран из группы, состоящей из кислорода, серы и селена, и где каждый R′, R″ и R′″ представляет собой радикал, независимо выбранный из группы, состоящей из водорода, C1-6алкила, С3-8циклоалкила, арила и гетероарила, или R″ и R′″ вместе образуют арильный или гетероарильный радикал, причем каждый указанный радикал необязательно замещен одним или несколькими, предпочтительно 1-3 заместителями R5, каждый из которых независимо выбран из группы, состоящей из атомов галогена, C1-6алкила, C1-6алкоксигруппы, арила, алкилсульфоната, арилсульфоната, алкилфосфоната, арилфосфоната, алкиламмония и ариламмония.
Кроме того, бидентатные лиганды класса Шиффовых оснований для применения в каталитическом комплексе согласно настоящему изобретению раскрыты в находящихся на рассмотрении европейских заявках на патент ЕР 08290747 и 08290748.
Эти лиганды класса Шиффовых оснований получены из производных салицилальдимина общей формулы, показанной ниже:
где от S1 до S4 представляют собой заместители, которые выбраны таким образом, чтобы соединение имело рКа ≥6.2, и где
В представляет собой водород, С1-С20алкил, С1-С20гетероалкил или гетероарил, где каждая отличная от водорода группа может быть необязательно замещенной одной или несколькими группами, выбранными из группы, состоящей из C1-С10алкила и арила;
каждый Ro1, Ro2, Rm1, Rm2 и Rp выбран из группы, состоящей из водорода, C1-C20алкила, С1-С20гетероалкила, С1-С20алкоксигруппы, арила, арилоксигруппы, гетероарила, гетероциклоалкила, дисульфида, карбоната, изоцианата, карбодиимида, карбоалкокси, карбамата и галогена, простого тиоэфира, кетона, альдегида, сложного эфира, простого эфира, аминогруппы, амида, нитро, карбоновой кислоты, причем отличные от водорода группы необязательно замещены одной или несколькими группами, выбранными из группы, состоящей из C1-C20алкила, С1-С20алкокси и арила, причем Ro1, Ro2, Rm1, Rm2 и Rp вместе могут формировать конденсированное циклическое алифатическое или ароматическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из группы, состоящей из С1-С20алкила, С1-С20гетероалкила, С1-С20алкоксигруппы, арила, арилоксигруппы, гетероарила, гетероциклоалкила, дисульфида, карбоната, изоцианата, карбодиимида, карбоалкоксигруппы, карбамата и галогена, простого тиоэфира, кетона, альдегида, сложного эфира, простого эфира, амина, амида, нитро, карбоновой кислоты, причем отличные от водорода группы необязательно замещены одной или несколькими группами, выбранными из группы, состоящей из С1-С20алкила, С1-С20алкоксигруппы и арила.
Предпочтительно, чтобы заместители от S1 до S4 были выбраны из группы, состоящей из водорода, аминогруппы, замещенного или незамещенного моно- и диалкиламиногруппы, С1-С20алкила, тиоалкила, арила и арилоксигруппы.
Более предпочтительно, чтобы заместители от S1 до S4 были выбраны из группы, состоящей из водорода, метоксигруппы, метилтиогруппы, аминогруппы, диметиламиногруппы, трифторметила, трифторметоксигруппы, трет-бутила, фенила, феноксигруппы, хлора, брома, пиперидинила, 1-пирролидиногруппы, 4-трет-бутилфеноксигруппы и 2-пиридила.
Предпочтительно, чтобы Ro1, Ro2, Rm1, Rm2 и Rp были выбраны из группы, состоящей из водорода, метила, изопропила, трет-бутила, метоксигруппы, диметиламиногруппы и нитрогруппы.
Представлены определенные примеры таких лигандов класса Шиффовых оснований указанной выше общей формулы, в которой В представляет собой водород,
А представляет собойи от S1 до S4 и Ro1, Ro2, Rm1, Rm2 и Rp являются такими, которые определены ниже.
Каталитический комплекс согласно настоящему изобретению кроме того содержит нуклеофильный карбеновый лиганд, связанный с металлом рутением или осмием.
Подходящие нуклеофильные карбеновые лиганды описаны в европейском патенте 1468004.
Предпочтительно, чтобы нуклеофильный карбеновый лиганд представлял собой замещенное или незамещенное, насыщенное или ненасыщенное 1,3-дигетероатомное циклическое соединение, в котором гетероатомами являются атомы азота.
Такое 1,3-дигетероатомное циклическое соединение может иметь формулу
где Y и Y1 независимо выбраны из группы, состоящей из водорода, С1-С20алкила, С2-С20алкенила, С2-С20алкинила, С2-С20алкоксикарбонила, арила, С1-С20карбоксилата, С1-С20алкоксигруппы, С2-С20алкенилоксигруппы, С2-С20алкинилоксигруппы или арилоксигруппы; каждый Y и Y1 необязательно является замещенным С1-С5алкилом, галогеном, C1-С6алкоксигруппой или фенильной группой, замещенной галогеном, C1-С5алкилом или С1-С5алкоксигруппой и;
Z и Z1 независимо выбраны из группы, состоящей из водорода, С1-С20алкила, С2-С20алкенила, С2-С20алкинила, С2-С20алкоксикарбонила, арила, С1-С20карбоксилата, С1-С20алкоксигруппы, С2-С20алкенилоксигруппы, С2-С20алкинилоксигруппы или арилоксигруппы, каждый Z и Z1 необязательно является замещенным С1-С5алкилом, галогеном, C1-С6алкоксигруппой или фенильной группой, замещенной галогеном, С1-С5алкилом или С1-С5алкоксигруппой, и при этом кольцо может быть необязательно ароматическим путем введения дополнительной двойной связи в кольцо.
Предпочтительно, чтобы нуклеофильный карбеновый лиганд представлял собой SIMES или IMES, и более всего предпочтительно, чтобы нуклеофильный карбеновый лиганд представлял собой SIMES.
Каталитический комплекс согласно настоящему изобретению, кроме того, содержит углеродсодержащий лиганд, связанный с металлом рутением или осмием. Этот углеродсодержащий лиганд выбран из группы, состоящей из замещенных или незамещенных алкилиденовых, винилиденовых или инденилиденовых лигандов.
Такие алкилиденовые, винилиденовые или инденилиденовые лиганды описаны, например, в WO 00/15339.
Заместители для этих лигандов выбраны из группы, состоящей из С1-С10алкила, С2-С20алкинила, С1-С20алкоксигруппы, С2-С20алкоксикарбонила и арила.
Более всего предпочтительно, чтобы углеродсодержащий лиганд представлял собой фенилинденилиденовый лиганд.
Подходящие углеродсодержащие лиганды также описаны в Европейском патенте 1468004.
Предпочтительное семейство каталитических комплексов согласно настоящему изобретению имеет формулу:
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, галогена, C1-C20алкила, C2-C20алкенила, C2-C20алкинила, C2-C20алкоксикарбонила, арила, C1-C20карбоксилата, C1-C20алкоксигруппы, C2-C20алкенилоксигруппы, C2-C20алкинилоксигруппы, арилоксигруппы, C1-C20алкилтиогруппы, C1-C20алкилсульфонила, C1-C20алкилсульфинила, и при этом каждый из R1, R2, R3 и R4 может быть замещенным С1-С5алкилом, галогеном, C1-C10алкоксигруппой или арильной группой, замещенной С1-С5алкилом, С1-С5арилоксигруппой, галогеном или функциональной группой.
Особенно предпочтительный комплекс согласно настоящему изобретению имеет формулу:
Каталитический комплекс по настоящему изобретению может применяться как таковой или в форме катализатора на носителе, содержащего каталитический комплекс и носитель.
Носитель может быть выбран из группы, состоящей из пористых неорганических твердых веществ, таких как аморфные или паракристаллические материалы, кристаллические молекулярные сита и модифицированные слоистые материалы, включающие один или несколько неорганических оксидов, и органические полимерные смолы.
Каталитический комплекс приготовлен способом, который содержит стадию взаимодействия предшественника рутениевого или осмиевого катализатора, состоящего из:
a. атома металла, выбранного из группы, состоящей из рутения и осмия;
b. двух анионных лигандов;
c. нуклеофильного карбенового лиганда, связанного с указанным металлом;
d. углеродсодержащего лиганда, связанного с указанным металлом, при этом указанный углеродсодержащий лиганд представляет собой замещенный или незамещенный алкилиденовый, винилиденовый или инденилиденовый лиганд; и
e. нейтрального лиганда;
или предшественника рутениевого или осмиевого катализатора, состоящего из:
a. атома металла, выбранного из группы, состоящей из рутения и осмия;
b. одного анионного лиганда;
c. одного бидендатного лиганда класса Шиффовых оснований, содержащего иминогруппу и скоординированного с металлом, дополнительно к атому азота указанной иминогруппы по меньшей мере через один дополнительный гетероатом, выбранный из группы, состоящей из кислорода, серы и селена, связанный с указанным металлом;
d. нуклеофильного карбенового лиганда, связанного с указанным металлом; и
e. углеродсодержащего лиганда, связанного с указанным металлом, при этом указанный углеродсодержащий лиганд представляет собой замещенный или незамещенный алкилиденовый, винилиденовый или инденилиденовый лиганд;
с 1,0-3,0 эквивалентами бидентатного лиганда класса Шиффовых оснований в неполярном растворителе и в присутствии слабого основания.
Пригодные для применения в настоящем изобретении анионные лиганды выбраны из группы, состоящей из С1-20алкила, С1-20алкенила, С1-20алкинила, С1-20карбоксилата, С1-20алкоксигруппы, С1-20алкенилоксигруппы, С1-20алкинилоксигруппы, арила, арилоксигруппы, С1-20алкоксикарбонила, C1-8алкилтиогруппы, С1-20алкилсульфонила, С1-20алкилсульфинила, C1-20алкилсульфоната, арилсульфоната, С1-20алкилфосфоната, арилфосфоната, С1-20алкиламмония, ариламмония, атомов галогена и цианогруппы. Предпочтительно, чтобы анионные лиганды представляли собой хлоридные лиганды.
Предпочтительно, чтобы нейтральный лиганд представлял собой фосфин формулы PR3R4R5, где R3 представляет собой вторичный алкил или циклоалкил, и каждый из R4 и R5 представляет собой арил, C1-С10 первичный алкил, вторичный алкил или циклоалкил, каждый независимо от другого. Более предпочтительно, чтобы нейтральным лигандом был один из Р(циклогексил)3, Р(циклопентил)3, Р(изопропил)3 или Р(фенил)3.
Так как каталитический комплекс согласно настоящему изобретению и соединения, которые применяются в способе для его приготовления, являются чувствительными к воздуху, влаге и примесям, следует быть уверенным, что используемые исходные материалы, реагенты и растворители не содержат примесей и хорошо высушены.
Подходящие слабые основания для применения в способе согласно настоящему изобретению имеют величину pKb в диапазоне от 3,5 до 7. Примеры подходящих оснований для применения в настоящем изобретении включают Li2CO3, Na2CO3, K2CO3, CuCO3 и Ag2CO3. Ag2CO3 с величиной pKb 3,68 является особенно предпочтительным.
Дополнительные примеры слабых оснований, которые использовали в способе настоящего изобретении, включают карбоксилаты.
Для приготовления каталитического комплекса по настоящему изобретению предшественник катализатора, лиганд класса Шиффовых оснований и слабое основание, например Ag2CO3, предпочтительно предварительно смешивают и затем добавляют подходящий неполярный растворитель, который не взаимодействует ни с одним из компонентов предварительной смеси. В настоящем изобретении предпочтительно использовать апротонные растворители, которые не имеют кислотного водорода, с диэлектрической проницаемостью выше 3.
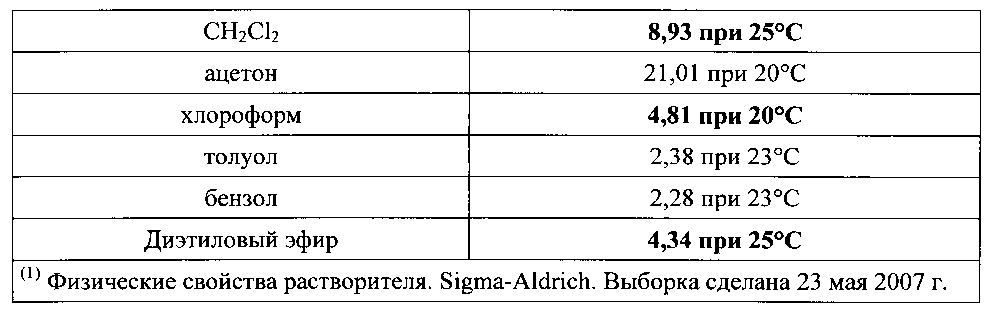
В целом, диэлектрическая проницаемость растворителя дает приблизительную оценку полярности растворителя. Растворители с диэлектрической проницаемостью меньше 15 в целом считаются неполярными. Технически, при помощи диэлектрической проницаемости можно оценить способность растворителя уменьшать напряженность электрического поля, окружающего заряженную частицу, погруженную в это поле. Примеры представлены ниже в Таблице 1.
Как указано выше, предпочтительные растворители для применения в настоящем изобретении имеют диэлектрическую проницаемость выше 3, и такие растворители включают тетрагидрофуран, метилендихлорид, хлороформ и диэтиловый эфир.
Наиболее предпочтительно, чтобы в качестве неполярного растворителя применялся тетрагидрофуран.
Реакционную смесь затем нагревают и перемешивают. Как правило, реакцию проводят при температуре в диапазоне от 20°C до температуры точки кипения применяемого неполярного растворителя, предпочтительно в диапазоне от 40°C до 60°C, особенно предпочтительно примерно при 40°C.
Как правило, время реакции составляет от 2 до 72 ч.
После завершения реакции реакционную смесь охлаждают примерно до 0°C для удаления любых побочных продуктов, образуемых при фильтрации. Затем растворитель удаляют выпариванием, обычно при пониженном давлении.
Количество слабого основания, которое применяется в способе согласно настоящему изобретению, как правило, находится в диапазоне от 0,5 до 2,0 эквивалентов.
Предпочтительно использовать слабое основание в количестве от 0,5 до 1 эквивалентов, более предпочтительно примерно 0,6 эквивалентов относительно количества предшественника катализатора в случае, когда предшественник содержит один анионный лиганд и используется один бидентатный лиганд класса Шиффовых оснований.
В случае, когда предшественник содержит два анионных лиганда, слабое основание предпочтительно использовать в количестве от 1,0 до 2,0 эквивалентов, предпочтительно примерно 1,1 эквивалентов относительно количества предшественника катализатора.
Количество лиганда класса Шиффовых оснований, применяющееся в способе согласно настоящему изобретению, как правило, составляет от 1.0 до 3.0 эквивалентов, предпочтительно от 1,0 до 1,5 эквивалентов и особенно предпочтительно примерно 1,1 эквивалент относительно количества предшественника катализатора в случае, когда предшественник содержит один лиганд класса Шиффовых оснований, и от 2,0 до 2,5 эквивалентов и особенно предпочтительно примерно 2,1 эквивалент относительно количества предшественника катализатора в случае, когда предшественник содержит два анионных лиганда.
Оптимальные выходы катализатора согласно настоящему изобретению достигаются тогда, когда 1 эквивалент предшественника катализатора взаимодействует с 2,1 эквивалентами лиганда класса Шиффовых оснований в присутствии 1,1 эквивалента слабого основания, предпочтительно Ag2CO3, в случае, когда предшественник содержит два анионных лиганда.
Оптимальные выходы катализатора согласно настоящему изобретению достигаются тогда, когда 1 эквивалент предшественника катализатора взаимодействует с 1,1 эквивалентом лиганда класса Шиффовых оснований в присутствии 0,6 эквивалентов слабого основания, предпочтительно Ag2CO3, в случае, когда предшественник содержит один анионный лиганд и один лиганд класса Шиффовых оснований.
Каталитический комплекс согласно настоящему изобретению проявляет отличную латентность в реакции метатезисной полимеризации с раскрытием цикла дициклопентадиена (DCPD) по сравнению с рутениевыми катализаторами в данной области. Более того, катализатор по настоящему изобретению является неактивным при комнатной температуре и даже после нагревания до 200°C, что подтверждено измерениями методом дифференциальной сканирующей калориметрии (DSC). Более того, катализатор согласно настоящему изобретению может быть активирован меньшим количеством кислоты Льюиса или Бронстеда, чем катализаторы известного уровня техники.
Более подробное описание настоящего изобретения представлено в следующих примерах, в которых манипуляции с чувствительными к кислороду и влаге материалами выполняли с использованием методики Шленка в атмосфере аргона. В качестве иллюстративного растворителя использовали THF.
Общая методика приготовления каталитических комплексов фенилинденилиден-основание Шиффа-рутений (Схема 3)
Стехиометрические количества предшественника фенилинденилиденового катализатора 1 (Схема 3, Способ А) или предшественники монооснований Шиффа 2 (Схема 3, Способ В), соответствующий лиганд класса Шиффовых оснований, карбонат серебра (I) добавляют в колбу Шленка (50-250 мл). Колбу вакуумируют и заполняют аргоном. Затем в колбу Шленка (все еще в атмосфере аргона) добавляют сухой THF (20 мл) и перемешивают в течение 6-72 ч. Реакционную смесь охлаждают до 0°C, при этом белый осадок PCy3AgCl (побочный продукт) удаляют фильтрацией. Фильтрат собирают в колбу Шленка (250 мл) и растворитель удаляют выпариванием при пониженном давлении. Неочищенный продукт суспендируют в гексане, хорошо перемешивают и фильтруют. Конечный продукт высушивают при пониженном давлении.
Комплекс 3. Способ А. Предшественник фенилинденилиденового катализатора 1 (Схема 3) (0.54 ммоль), 2-[(4-третбутилфенилимино)метил]-4-метоксифенол (1.134 ммоль), карбонат серебра(I) (0.594 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 72 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 3.
Комплекс 3. Способ В. Рутений[1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден]-[2-[[(4-третбутилфенилимино)метил]-4-метоксифенолил]-[3-фенил-1Н-инден-1-илиден] рутения(II) хлорид (0.54 ммоль), 2-[(4-третбутилфенилимино)метил]-4-метоксифенол (0.594 ммоль), карбонат серебра(I) (0.324 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 24 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 3.
Комплекс 4. Способ А. Предшественник фенилинденилиденового катализатора 1 (Схема 3) (0.54 ммоль), 2-[(4-третбутилфенилимино)метил]-5-метоксифенол (1.134 ммоль), карбонат серебра(I) (0.594 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 72 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 4.
Комплекс 4. Способ В. Рутений [1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден] - [2-[[(4-третбутил фенилимино)метил]-5-метоксифенолил] - [3-фенил-1Н-инден-1-илиден] рутения(II) хлорид (0.54 ммоль), 2-[(4-третбутилфенилимино)метил]-5-метоксифенол (0.594 ммоль), карбонат серебра(I) (0.324 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 72 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 4.
Комплекс 5. Способ А. Предшественник фенилинденилиденового катализатора 1 (Схема 3) (0.54 ммоль), 2-[(4-метилфенилимино)метил]-5-метоксифенол (1.134 ммоль), карбонат серебра(I) (0.594 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 72 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 5.
Комплекс 5. Способ В. Рутений[1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден] - [2-[[(4-третбутил фенилимино)метил]-5-метоксифенолил] - [3 -фенил-1Н-инден-1-илиден] рутения(II) хлорид (0.54 ммоль), 2-[(4-метилфениламино)метил]-5-метоксифенол (0.594 ммоль), карбонат серебра(I) (0.324 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 72 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 6.
Комплекс 6. Способ А. Предшественник фенилинденилиденового катализатора 1 (Схема 3) (0.54 ммоль), 2-[(4-метилфенилимино)метил]-5-метоксифенол (0.54 ммоль), карбонат серебра(I) (0.594 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 72 ч при комнатной температуре, затем добавляют 2-[(4-метилфенилимино)метил]-4-метоксифенол (0.594 ммоль). Полученная смесь реагирует еще в течение 48 ч. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 6.
Комплекс 6. Способ В. Рутений [1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден]-[2-[[(4-метилфенилимино)метил]-5-метоксифенолил]-[3-фенил-1Н-инден-1-илиден] рутения(II) хлорид (0.54 ммоль), 2-[(4-метилфенилимино)метил]-4-метоксифенол (0.594 ммоль), карбонат серебра(I) (0.324 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 24 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 6.
Комплекс 7. Способ А. Предшественник фенилинденилиденового катализатора 1 (Схема 3) (0.54 ммоль), 2-[(4-изопропилфенилимино)метил]-5-метоксифенол (1.134 ммоль), карбонат серебра(I) (0.594 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 72 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 7.
Комплекс 7. Способ В. Рутений [1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден] - [2-[[(4-изопропилфенилимино)метил]-5-метоксифенолил] - [3 -фенил-1Н-инден-1-илиден] рутения(II) хлорид (0.54 ммоль), 2-[(4-изопропилфенилимино)метил]-5-метоксифенол (0.594 ммоль), карбонат серебра(I) (0.324 ммоль) и THF (10 мл) вводят в реакцию, как описано выше, в течение 24 ч при комнатной температуре. Исследование реакционной смеси методом ЯМР на ядрах 1Н и 31Р выявило количественное превращение в комплекс 7.
Свойства катализатора
Рутениевый каталитический комплекс (4) согласно настоящему изобретению, как показано выше, был испытан в реакции ROMP дициклопентандиена (DCPD). Рутениевый катализатор (2а), содержащий только один бидентантный лиганд класса Шиффовых оснований, использовали в качестве эталонного катализатора:
Полученные результаты представлены в Таблице 2 ниже.
Салицилальдиминовый лиганд эталонного катализатора (2а) несет заместитель в opтo-положении анилинового фрагмента и рутениевые катализаторы этого типа, имеющие салицилальдиминовый лиганд с таким орто-заместителем, проявляют хорошую латентность в реакциях метатезисной полимеризации с раскрытием цикла дициклопентадиена.
Несмотря на отсутствие такого заместителя было обнаружено, что рутениевый каталитический комплекс 4 согласно настоящему изобретению является исключительным латентным катализатором в реакции ROMP дициклопентандиена (DCPD) (соотношение катализатор/мономер 1:15000), неактивным при комнатной температуре и даже после нагревания выше 200°C, что подтверждено измерениями методом DSC. Стабильность бис-замещенного каталитического комплекса 4 настоящего изобретения превосходит стабильность более реакционноспособного монозамещенного аналога и аналогична стабильности эталонного катализатора (2а) (см. Таблицу 2). Стабильность рутениевого катализатора 4 настоящего изобретения в реакции ROMP дициклопентандиена (DCPD) улучшена отчасти благодаря увеличению стерического затруднения вокруг рутениевого центра.
При его химической активации бис-салицилальдиминовый каталитический комплекс 4 согласно настоящему изобретению демонстрирует увеличенную инициацию по сравнению с эталонным катализатором (2а), так как требуется только менее 1 эквивалента PhSiCl3 для генерации высокоактивной системы. При катализировании реакции ROMP дициклопентандиена (DCPD) химически активированным комплексом 2а в таких же условиях (меньше, чем 1 эквивалент PhSiCl3) наблюдается низкая каталитическая активность. Даже после химической активации с использованием 45 эквивалентов PhSiCl3, эталонный катализатор (2а) все еще проявляет более медленную инициацию по сравнению с рутениевым комплексом 4 согласно настоящему изобретению.
Таким образом, после его активации рутениевый комплекс 4 согласно настоящему изобретению значительно превосходит эталонный катализатор (2а) с образованием полимера, обладающего улучшенными свойствами, такими как температура стеклования 171°C и 178°C, превосходящими свойства других латентных катализаторов.
Claims (11)
1. Способ приготовления каталитического комплекса, имеющего формулу
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C2-C20алкоксигруппы, галогена и аминогруппы, где если R1 или R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 или R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил;
где способ включает стадию взаимодействия предшественника рутениевого катализатора, имеющего формулу:
где Mes означает мезитилен, Су означает циклоалкил;
с двумя бидентатными лигандами класса Шиффовых оснований в неполярном растворителе и в присутствии слабого основания, где бидентатные лиганды класса Шиффовых оснований независимо находятся в количестве от 1,0 до 3,0 эквивалентов относительно количества предшественника катализатора, где один бидендатный лиганд класса Шиффовых оснований имеет формулу:
и другой бидендатный лиганд класса Шиффовых оснований имеет формулу
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C1-C20алкоксигруппы, галогена и аминогруппы, где если R1 или R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 или R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил;
или стадию взаимодействия предшественника рутениевого катализатора, имеющего формулу:
где R1, R2 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C1-C20алкоксигруппы, галогена и аминогруппы, где если R1 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил;
с бидентатным лигандом класса Шиффовых оснований в неполярном растворителе и в присутствии слабого основания, где бидентатный лиганд класса Шиффовых оснований присутствует в количестве от 1,0 до 3,0 эквивалентов относительно количества предшественника катализатора, где бидендатный лиганд класса Шиффовых оснований имеет формулу:
где R3 и R4 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C1-C20алкоксигруппы, галогена и аминогруппы, где если R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил.
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C2-C20алкоксигруппы, галогена и аминогруппы, где если R1 или R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 или R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил;
где способ включает стадию взаимодействия предшественника рутениевого катализатора, имеющего формулу:
где Mes означает мезитилен, Су означает циклоалкил;
с двумя бидентатными лигандами класса Шиффовых оснований в неполярном растворителе и в присутствии слабого основания, где бидентатные лиганды класса Шиффовых оснований независимо находятся в количестве от 1,0 до 3,0 эквивалентов относительно количества предшественника катализатора, где один бидендатный лиганд класса Шиффовых оснований имеет формулу:
и другой бидендатный лиганд класса Шиффовых оснований имеет формулу
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C1-C20алкоксигруппы, галогена и аминогруппы, где если R1 или R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 или R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил;
или стадию взаимодействия предшественника рутениевого катализатора, имеющего формулу:
где R1, R2 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C1-C20алкоксигруппы, галогена и аминогруппы, где если R1 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил;
с бидентатным лигандом класса Шиффовых оснований в неполярном растворителе и в присутствии слабого основания, где бидентатный лиганд класса Шиффовых оснований присутствует в количестве от 1,0 до 3,0 эквивалентов относительно количества предшественника катализатора, где бидендатный лиганд класса Шиффовых оснований имеет формулу:
где R3 и R4 независимо выбраны из группы, состоящей из водорода, C1-C20алкила, C1-C20алкоксигруппы, галогена и аминогруппы, где если R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил.
2. Способ по п.1, в котором слабым основанием является Ag2Co3.
3. Способ по п.1, в котором слабое основание используют в количестве от 1 до 2 эквивалентов, предпочтительно примерно 1,1 эквивалентов относительно количества предшественника катализатора, для случая когда указанный предшественник содержит два хлоридных лиганда, и используются два бидентатных лиганда класса Шиффовых оснований.
4. Способ по п.1, в котором слабое основание используют в количестве от 0,5 до 1 эквивалентов, предпочтительно примерно 0,6 эквивалентов относительно количества предшественника катализатора, для случая когда указанный предшественник содержит один хлоридный лиганд и используется один бидентатный лиганд класса Шиффовых оснований.
5. Способ по п.1, в котором неполярным растворителем является тетрагидрофуран.
6. Способ по п.1, в котором реакционную стадию проводят при температуре в диапазоне от 20°C до температуры точки кипения неполярного растворителя, предпочтительно примерно при 40°C.
7. Каталитический комплекс, полученный способом по п.1, имеющий формулу:
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, галогена, C1-C20алкила, C1-C20алкоксигруппы и аминогруппы, где если R1 или R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 или R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил.
где R1, R2, R3 и R4 независимо выбраны из группы, состоящей из водорода, галогена, C1-C20алкила, C1-C20алкоксигруппы и аминогруппы, где если R1 или R3 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой алкил, если R2 или R4 представляет собой аминогруппу, то аминогруппа необязательно замещена одним или большим количеством фрагментов, представляющих собой C1-C20алкил.
8. Катализатор на носителе для реакций метатезиса олефинов, содержащий каталитический комплекс по п.7 и носитель.
9. Катализатор на носителе по п.8, в котором носитель выбран из группы, состоящей из пористого неорганического твердого вещества, такого как аморфные или паракристаллические материалы, кристаллические молекулярные сита и модифицированные слоистые материалы, включая один или более неорганических оксидов и органических полимеров.
10. Применение каталитического комплекса по п.7 или катализатора на носителе по п.8 или 9 в качестве катализатора в реакциях метатезиса олефинов.
11. Применение по п.10, в котором метатезисной полимеризацией олефинов является метатезисная полимеризация с раскрытием цикла.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP09290578.5 | 2009-07-21 | ||
| EP09290578A EP2280017B1 (en) | 2009-07-21 | 2009-07-21 | Catalytic complex for olefin metathesis reactions, process for the preparation thereof and use thereof |
| PCT/EP2010/059719 WO2011009721A1 (en) | 2009-07-21 | 2010-07-07 | Catalytic complex for olefin metathesis reactions, process for the preparation thereof and use thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012105770A RU2012105770A (ru) | 2013-09-10 |
| RU2553993C2 true RU2553993C2 (ru) | 2015-06-20 |
Family
ID=41328724
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2012105770/04A RU2553993C2 (ru) | 2009-07-21 | 2010-07-07 | Каталитический комплекс для реакций метатезиса олефинов, способ его приготовления и его применение |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8519069B2 (ru) |
| EP (1) | EP2280017B1 (ru) |
| JP (1) | JP5690825B2 (ru) |
| CN (1) | CN102574881A (ru) |
| BR (1) | BR112012001257A2 (ru) |
| IN (1) | IN2012DN00806A (ru) |
| RU (1) | RU2553993C2 (ru) |
| WO (1) | WO2011009721A1 (ru) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2488474B1 (en) | 2009-10-12 | 2017-01-25 | Elevance Renewable Sciences, Inc. | Methods of refining and producing fuel from natural oil feedstocks |
| US9169447B2 (en) | 2009-10-12 | 2015-10-27 | Elevance Renewable Sciences, Inc. | Methods of refining natural oils, and methods of producing fuel compositions |
| US9382502B2 (en) | 2009-10-12 | 2016-07-05 | Elevance Renewable Sciences, Inc. | Methods of refining and producing isomerized fatty acid esters and fatty acids from natural oil feedstocks |
| US9000246B2 (en) | 2009-10-12 | 2015-04-07 | Elevance Renewable Sciences, Inc. | Methods of refining and producing dibasic esters and acids from natural oil feedstocks |
| US8735640B2 (en) | 2009-10-12 | 2014-05-27 | Elevance Renewable Sciences, Inc. | Methods of refining and producing fuel and specialty chemicals from natural oil feedstocks |
| US9365487B2 (en) | 2009-10-12 | 2016-06-14 | Elevance Renewable Sciences, Inc. | Methods of refining and producing dibasic esters and acids from natural oil feedstocks |
| US9175231B2 (en) | 2009-10-12 | 2015-11-03 | Elevance Renewable Sciences, Inc. | Methods of refining natural oils and methods of producing fuel compositions |
| US9222056B2 (en) | 2009-10-12 | 2015-12-29 | Elevance Renewable Sciences, Inc. | Methods of refining natural oils, and methods of producing fuel compositions |
| US9051519B2 (en) | 2009-10-12 | 2015-06-09 | Elevance Renewable Sciences, Inc. | Diene-selective hydrogenation of metathesis derived olefins and unsaturated esters |
| EP2460587B1 (en) | 2010-12-01 | 2017-10-18 | Rimtec Corporation | Ruthenium catalyst system for olefin metathesis |
| WO2012168149A1 (en) * | 2011-06-09 | 2012-12-13 | Rimtec Corporation | A field joint coating material and a process for making a field joint |
| US10946568B2 (en) | 2011-06-09 | 2021-03-16 | Rimtec Corporation | Field joint coating material and a process for making a field joint |
| CA2839757C (en) | 2011-06-17 | 2021-01-19 | Materia, Inc. | Adhesion promoters and gel-modifiers for olefin metathesis compositions |
| AT511852B1 (de) * | 2011-09-02 | 2016-11-15 | Technische Universität Graz | Olefinmetathese |
| PL220408B1 (pl) * | 2011-09-26 | 2015-10-30 | Inst Chemii Organicznej Polskiej Akademii Nauk | Kompleks rutentu, sposób jego wytwarzania oraz zastosowanie |
| US9777086B2 (en) * | 2012-09-26 | 2017-10-03 | Rimtec Corporation | Polymerizable composition and method of production of resin shaped article |
| US9388098B2 (en) | 2012-10-09 | 2016-07-12 | Elevance Renewable Sciences, Inc. | Methods of making high-weight esters, acids, and derivatives thereof |
| US9598531B2 (en) | 2013-02-27 | 2017-03-21 | Materia, Inc. | Olefin metathesis catalyst compositions comprising at least two metal carbene olefin metathesis catalysts |
| MX2015010583A (es) | 2013-02-27 | 2016-04-07 | Materia Inc | Composiciones catalizadoras de metátesis de olefina que comprenden por lo menos dos catalizadores de metátesis de olefina metal carbeno.. |
| US20160244632A1 (en) | 2013-06-24 | 2016-08-25 | Materia, Inc. | Thermal insulation |
| CN107250142B (zh) * | 2014-07-03 | 2020-10-30 | 光明创新(武汉)有限公司 | 第8族过渡金属催化剂及其制备方法和其在复分解反应中的应用 |
| US9856352B2 (en) | 2014-08-07 | 2018-01-02 | Ppg Industries Ohio, Inc. | Glass fiber sizing compositions, sized glass fibers, and polyolefin composites |
| EP2982709B1 (en) | 2014-08-07 | 2017-06-28 | Telene SAS | Curable composition and molded article comprising the composition |
| KR20170093793A (ko) | 2014-10-21 | 2017-08-16 | 스트라타시스 엘티디. | 링-오프닝 복분해 중합반응을 이용한 삼차원 잉크젯 프린팅 |
| CN106565866B (zh) * | 2016-01-29 | 2020-01-31 | 上海克琴科技有限公司 | 一种席夫碱配体钌金属催化剂及其制备和应用 |
| EP3199577A1 (en) | 2016-02-01 | 2017-08-02 | Telene SAS | Method for preparing a two-component article and article obtainable by the method |
| US11001725B2 (en) | 2016-02-05 | 2021-05-11 | Stratasys Ltd. | Three-dimensional inkjet printing using ring-opening metathesis polymerization |
| US11173653B2 (en) | 2016-02-05 | 2021-11-16 | Stratasys Ltd. | Three-dimensional inkjet printing using polyamide-forming materials |
| EP3202813A1 (en) | 2016-02-05 | 2017-08-09 | Telene SAS | Curable composition and molded article comprising the composition |
| WO2017134673A1 (en) | 2016-02-07 | 2017-08-10 | Stratasys Ltd. | Three-dimensional printing combining ring-opening metathesis polymerization and free radical polymerization |
| WO2017187434A1 (en) | 2016-04-26 | 2017-11-02 | Stratasys Ltd. | Three-dimensional inkjet printing using ring-opening metathesis polymerization |
| EP4267540A1 (en) | 2021-02-02 | 2023-11-01 | Apeiron Synthesis S.A. | Long shelf life stable organoruthenium complexes as (pre)catalysts for olefin metathesis |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5977393A (en) * | 1997-11-21 | 1999-11-02 | California Institute Of Technology | Schiff base derivatives of ruthenium and osmium olefin metathesis catalysts |
| EP1468004A1 (en) * | 2002-01-22 | 2004-10-20 | Universiteit Gent | Metal complexes for use in metathesis |
| RU2006134041A (ru) * | 2004-02-26 | 2008-04-10 | Университейт Гент (Be) | Комплексы металлов для использования в реакциях обмена олефинов и переноса атомов или групп |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6284852B1 (en) | 1997-10-30 | 2001-09-04 | California Institute Of Technology | Acid activation of ruthenium metathesis catalysts and living ROMP metathesis polymerization in water |
| DE69941219D1 (de) | 1998-09-10 | 2009-09-17 | Univ New Orleans Foundation | Katalysatorkomplex mit phenylindenyliden-ligand |
| CN1265882C (zh) * | 2001-08-01 | 2006-07-26 | 加州理工学院 | 六配位钌或锇金属卡宾易位催化剂 |
| JP4922558B2 (ja) * | 2002-08-01 | 2012-04-25 | カリフォルニア インスティテュート オブ テクノロジー | 環状オレフィンモノマーの環挿入重合による大環状ポリマーの合成 |
| JP2006076935A (ja) * | 2004-09-10 | 2006-03-23 | Mitsui Chemicals Inc | 不斉ルテニウム触媒及びそれを用いる光学活性アルコールの製造法 |
| GB0517137D0 (en) * | 2005-08-22 | 2005-09-28 | Viacatt N V | Multicoordinated metal complexes for use in metalthesis reactions |
| CA2620019A1 (en) * | 2005-08-22 | 2007-03-01 | Viacatt N.V. | Multicoordinated metal complexes for use in metathesis reactions |
| CN101328191B (zh) * | 2008-06-13 | 2013-06-05 | 中国科学院上海有机化学研究所 | 一类含氮配体过渡金属络合物、合成方法及其用途 |
| EP2151445B1 (en) | 2008-08-01 | 2015-02-18 | Rimtec Corporation | Process for the preparation of bidentate Schiff base ruthenium catalysts containing a salicylaldimine-type ligand |
| PL2151446T3 (pl) | 2008-08-01 | 2016-10-31 | Sposób wytwarzania dwukleszczowych katalizatorów rutenowych będących zasadą Schiffa zawierających ligand typu salicylaldehydoiminowego |
-
2009
- 2009-07-21 EP EP09290578A patent/EP2280017B1/en not_active Not-in-force
-
2010
- 2010-07-07 RU RU2012105770/04A patent/RU2553993C2/ru active
- 2010-07-07 WO PCT/EP2010/059719 patent/WO2011009721A1/en active Application Filing
- 2010-07-07 JP JP2012520988A patent/JP5690825B2/ja not_active Expired - Fee Related
- 2010-07-07 BR BR112012001257A patent/BR112012001257A2/pt not_active Application Discontinuation
- 2010-07-07 CN CN2010800329606A patent/CN102574881A/zh active Pending
- 2010-07-07 US US13/384,957 patent/US8519069B2/en active Active
-
2012
- 2012-01-27 IN IN806DEN2012 patent/IN2012DN00806A/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5977393A (en) * | 1997-11-21 | 1999-11-02 | California Institute Of Technology | Schiff base derivatives of ruthenium and osmium olefin metathesis catalysts |
| EP1468004A1 (en) * | 2002-01-22 | 2004-10-20 | Universiteit Gent | Metal complexes for use in metathesis |
| RU2006134041A (ru) * | 2004-02-26 | 2008-04-10 | Университейт Гент (Be) | Комплексы металлов для использования в реакциях обмена олефинов и переноса атомов или групп |
Non-Patent Citations (1)
| Title |
|---|
| SAMES J.S.M. et al, Bidentate N,O-prolinate ruthenium benzylidene catalyst highly active in RCM of disubstituted dienes, Chem. Commun., 2007, p. 2826-2828 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20120271019A1 (en) | 2012-10-25 |
| CN102574881A (zh) | 2012-07-11 |
| JP2012533591A (ja) | 2012-12-27 |
| EP2280017B1 (en) | 2013-01-02 |
| WO2011009721A1 (en) | 2011-01-27 |
| BR112012001257A2 (pt) | 2016-02-10 |
| EP2280017A1 (en) | 2011-02-02 |
| RU2012105770A (ru) | 2013-09-10 |
| IN2012DN00806A (ru) | 2015-06-26 |
| US8519069B2 (en) | 2013-08-27 |
| JP5690825B2 (ja) | 2015-03-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2553993C2 (ru) | Каталитический комплекс для реакций метатезиса олефинов, способ его приготовления и его применение | |
| US6613910B2 (en) | One-pot synthesis of group 8 transition metal carbene complexes useful as olefin metathesis catalysts | |
| EP2350105B1 (en) | Method for preparation of ruthenium-indenylidene carbene catalysts | |
| KR101835170B1 (ko) | Z-선택적 올레핀 복분해 촉매 및 이들의 합성 절차 | |
| JP5522941B2 (ja) | 有機金属ルテニウム錯体および関連する四置換および別の嵩高いオレフィンの製造方法 | |
| RU2674471C2 (ru) | Катализаторы на основе переходного металла 8 группы, способ их получения и способ их применения в реакции метатезиса | |
| JP5595486B2 (ja) | キレート化アルキリデン配位子を有するルテニウムベースのメタセシス触媒の製造方法 | |
| WO2015149068A1 (en) | Chiral ligand-based metal-organic frameworks for broad-scope asymmetric catalysis | |
| AU2003271713A1 (en) | Ruthenium complexes as (pre)catalysts for metathesis reactions | |
| AU2012206966A1 (en) | Z-selective olefin metathesis catalysts and their synthetic procedure | |
| JP6395714B2 (ja) | ルテニウムベースのメタセシス触媒、それらの製造用の前駆体およびそれらの使用 | |
| EP2550284A1 (en) | Ruthenium complexes for use in olefin metathesis | |
| EP1827688A1 (en) | Novel metathesis ruthenium catalyst | |
| JP4550413B2 (ja) | 新規遷移金属錯体及び遷移金属−触媒反応におけるその使用 | |
| Siano et al. | Activity and stereoselectivity of Ru-based catalyst bearing a fluorinated imidazolinium ligand | |
| EP1948671B1 (en) | Preparation of catalysts | |
| WO2014093687A1 (en) | Z-selective metathesis catalysts | |
| US9815765B2 (en) | Ruthenium polymerisation catalysts | |
| Dahcheh et al. | Bis-mixed-carbene ruthenium-thiolate-alkylidene complexes: synthesis and olefin metathesis activity | |
| Delaude et al. | Olefin Metathesis With Ruthenium-Arene Catalysts Bearing N-Heterocyclic Carbene Ligands |