RU2538688C2 - Биоразлагаемый каркас для регенерации мягких тканей и его применение - Google Patents
Биоразлагаемый каркас для регенерации мягких тканей и его применение Download PDFInfo
- Publication number
- RU2538688C2 RU2538688C2 RU2012103838/15A RU2012103838A RU2538688C2 RU 2538688 C2 RU2538688 C2 RU 2538688C2 RU 2012103838/15 A RU2012103838/15 A RU 2012103838/15A RU 2012103838 A RU2012103838 A RU 2012103838A RU 2538688 C2 RU2538688 C2 RU 2538688C2
- Authority
- RU
- Russia
- Prior art keywords
- biodegradable
- tissue
- lactide
- cells
- chr
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/0004—Closure means for urethra or rectum, i.e. anti-incontinence devices or support slings against pelvic prolapse
- A61F2/0031—Closure means for urethra or rectum, i.e. anti-incontinence devices or support slings against pelvic prolapse for constricting the lumen; Support slings for the urethra
- A61F2/0036—Closure means for urethra or rectum, i.e. anti-incontinence devices or support slings against pelvic prolapse for constricting the lumen; Support slings for the urethra implantable
- A61F2/0045—Support slings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/0063—Implantable repair or support meshes, e.g. hernia meshes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/02—Inorganic materials
- A61L27/12—Phosphorus-containing materials, e.g. apatite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/38—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/56—Porous materials, e.g. foams or sponges
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/58—Materials at least partially resorbable by the body
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L67/00—Compositions of polyesters obtained by reactions forming a carboxylic ester link in the main chain; Compositions of derivatives of such polymers
- C08L67/04—Polyesters derived from hydroxycarboxylic acids, e.g. lactones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/0057—Implements for plugging an opening in the wall of a hollow or tubular organ, e.g. for sealing a vessel puncture or closing a cardiac septal defect
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/20—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices containing or releasing organic materials
- A61L2300/23—Carbohydrates
- A61L2300/236—Glycosaminoglycans, e.g. heparin, hyaluronic acid, chondroitin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
- A61L2300/414—Growth factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/43—Hormones, e.g. dexamethasone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/60—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a special physical form
- A61L2300/602—Type of release, e.g. controlled, sustained, slow
- A61L2300/604—Biodegradation
Abstract
Изобретение относится к медицине. Описаны новые усиленные биоразлагаемые каркасы для регенерации мягких тканей, а также описаны способы поддержки, наращивания и регенерации живой ткани, где усиленный биоразлагаемый каркас применяют для лечения симптомов, где требуется повышенная прочность и устойчивость помимо необходимости регенерации живой ткани пациента. Описано применение каркасов вместе с клетками или тканевыми эксплантатами для регенерации мягких тканей в лечении медицинского пролапса, например, ректального или пролапса органов таза, или грыжи. Каркасы достаточно крепкие, чтобы быть пригодными для имплантации при медицинских состояниях, требующих структурной поддержки при повреждениях тканей. 13 з.п. ф-лы, 19 ил., 2 табл., 8 пр.
Description
Область изобретения
Данное изобретение относится к новым усиленным биоразлагаемым каркасам для регенерации мягких тканей, а также способам поддержки, наращивания и регенерации живой ткани, где усиленный биоразлагаемый каркас применяется для лечения симптомов, при которых требуются повышенная прочность и устойчивость помимо необходимости регенерации живой ткани пациента. Данное изобретение также относится к применению каркасов вместе с клетками или тканевыми эксплантатами для регенерации мягких тканей, такому как при лечении медицинского пролапса, например, ректального или пролапса органов таза, или грыжи, или недержания мочи.
Предпосылки изобретения
Каркасы - это структуры, такие как синтетические полимерные структуры, применяемые для проведения организации, роста и дифференциации клеток в процессе формирования новой функциональной ткани на участке тканевого дефекта, раны, обычно применяемые в сочетании с хирургическим вмешательством.
Для достижения цели тканевой реконструкции каркасы должны отвечать некоторым конкретным требованиям. Высокая пористость и адекватный размер пор необходимы для облегчения клеточного роста и диффузии по всей структуре как клеток, так и питательных веществ. Способность к биоразложению является существенной, так как нужно, чтобы каркасы поглощались окружающими тканями без необходимости хирургического удаления.
Множество различных материалов (натуральных и синтетических, биоразлагаемых и постоянных) были исследованы для применения в качестве каркасов. Большинство из этих материалов были известны в области медицины до появления тканевой инженерии в качестве исследовательской темы, будучи использованными как саморассасывающиеся швы. Примерами таких материалов являются коллаген или некоторые линейные алифатические сложные полиэфиры.
Состояния, такие как недержание мочи при напряжении и пролапс органов таза (POP), являются симптомами у женщин, испытываемыми в результате многоплодных родов, мышечной слабости из-за старения и гормональной недостаточности. Однако такие же симптомы наблюдаются и у молодых неактивных пациентов, которые никогда не рожали. С 1980-х годов применение синтетических сеток, изготовленных из полипропилена, было предпочтительным лечением. Примерами таких сеток являются Prolene (Ethicon), Polyform (Boston Scientific) и Pelvitex (Bard). За последние годы увеличилось количество побочных эффектов, отмеченных в до 10% случаев. Вагинальная эрозия и вагинальное сокращение являются некоторыми из наиболее серьезных [«Rising use of synthetic mesh in transvaginal pelvic reconstructive surgery: A review of the risk of vaginal erosion». E. Mistrangelo et al., J. Minimally Inasive Gynecology, 2007, 4, p.564-69].
Для преодоления этих побочных эффектов была разработана облегченная версия (меньше материала) из традиционной сетки и несколько, сделанных частично разлагаемыми путем объединения полипропилена с разлагаемым синтетическим подобным полимеру полилактидом (Ultrapro, Ethicon). Cook Inc. имеет ксенотрансплантатный подход, который является полностью разлагаемым, и основан на бесклеточном внеклеточном матриксе тонкого кишечника свиньи [Mantovani F., Trinchieri A., Castelnuovo C., Romano A.L., Pisani E. "Reconstructive urethroplasty using porcine acellular matrix." Eur Urol 2003;44:600-602].
Патент США № 2009024162 относится к рассасывающимся композитным медицинским компонентам, таким как хирургические сетки и плетеный шовный материал, которые демонстрируют два или более профиля рассасывания/биоразложения и сохранения прочности на разрыв.
Международная публикация WO 08083394 относится к усиленным сеткам для ретропубикальных имплантатов для лечения недержания мочи и/или нарушений тазового дна и связанных применений.
Международная публикация WO 08042057 относится к компонентам для тканевого усиления, в частности, к компонентам, имеющим как макропористую, так и микропористую структуру для обеспечения возможности клеточного роста и тканевой интеграции.
Международные публикации WO 2006044881 и WO 07117238 относятся к многослойному материалу, содержащему первый рассасывающийся нетканый материал и второй рассасывающийся тканый или вязаный материал, и способу его изготовления.
Европейский патент 1674048 относится к рассасываемому полимерному сеточному имплантату, который предназначен для применения в реконструкции дефектов мягких тканей. Сеточный имплантат содержит по меньшей мере первый и второй материал, в котором второй материал в основном разлагается в более поздний момент времени, чем первый материал после времени имплантации.
Патентный документ США № 20080241213 относится к биосовместимому тканевому имплантату, который может быть биопоглощаемым, и изготовлен из биосовместимой полимерной пены. Тканевой имплантат также включает биосовместимый усиливающий элемент. Полимерная пена и усиливающий элемент растворимы в общем растворителе.
Международная публикация WO 0222184 относится к тканевым сконструированным протезам, сделанным из переработанных тканевых матриц, полученных из нативных тканей, которые являются биосовместимыми с пациентом или хозяином, которому они имплантируются.
Патентный документ США № 2002062152 относится к медицинскому саморассасывающемуся имплантату, в частности, для приращения крестообразной связки, сконструированному как композитная структура в текстильной конструкции из по меньшей мере двух биосовместимых полимерных материалов, которые различаются своей химической композицией и/или полимерной структурой и которые являются разлагаемым имплантатом, имеющим заданную начальную прочность на растяжение и различное поведение разложения полимеров и/или текстильной конструкции, выбранной таким образом, что прочность на растяжение снижается во время разложения.
Международная публикация WO 06020922 относится к рассасывающимся полилактидным полимерным сократительным барьерным мембранам рубцовой ткани и раскрывает способы их применения.
Европейский патент 1216717 относится к биопоглощаемым, пористым, усиленным тканевым сконструированным имплантатным компонентам для применения в восстановлении повреждения мягких тканей, например, повреждение тазового дна, и способам изготовления подобных компонентов.
Цель изобретения
Целью вариантов осуществления данного изобретения является предоставить поддержку для регенерации мягкой ткани путем предоставления полностью разлагаемого каркаса для прорастания или повторного вырастания клеток, выращенных in vitro, клеток/тканей, собранных в операционной, либо прорастания или повторного вырастания клеток из окружающей ткани.
Соответственно, представлены каркасы с хорошими свойствами по отношению к тканевой реконструкции, которые в то же время достаточно крепкие, чтобы быть пригодными для имплантации при медицинских состояниях, требующих структурной поддержки, например, при повреждениях тканей, которые требуют хирургического вмешательства.
Краткое описание изобретения
Данным автором(ами) было установлено, что усиленный пористый каркас облегчает манипулирование в момент операции, то есть во время хирургической операции. Каркасы, изготовленные по данному изобретению, обеспечивают достаточную прочность в процессе манипулирования в сочетании со свойствами стимулирования регенерации тканей пациента, которому требуется имплантат, а также они достаточно крепкие, чтобы предоставить достаточную структурную поддержку на участке регенерации.
Следует понимать, что хирургические имплантаты, будучи оптимизированными в отношении свойств, обеспечивающих регенерацию мягких тканей у пациента, не всегда оптимальны для манипулирования или для обеспечения достаточной поддержки на участке имплантата. Это может быть особенно актуально при медицинских состояниях, включающих повреждения поддерживающих структурных мягких тканей, такие как, при медицинском пролапсе, например, пролапс органов таза, недержании мочи при напряжении или грыжах.
Данными изобретателями было установлено, что структурная поддержка и усиление могут быть приданы имплантату без ущерба для способности стимулировать регенерацию ткани пациента на участке повреждения.
Таким образом, в первом аспекте данное изобретение относится к биоразлагаемому хирургическому имплантату для поддержки, наращивания и регенерации живой ткани у субъекта, включающему:
a) синтетический биоразлагаемый гомогенный пласт каркаса;
b) одну или более биоразлагаемых армирующих деталей.
Во втором аспекте данное изобретение относится к способу поддержки, наращивания и регенерации живой ткани в субъекте, причем указанный способ включает имплантацию биоразлагаемого хирургического имплантата, включающего синтетический биоразлагаемый каркас вместе с образцом аутогенных клеток или тканевых эксплантатов, указанному субъекту на участок, где требуется поддержка, наращивание и регенерация живой ткани.
В третьем аспекте данное изобретение относится к способу приготовления биоразлагаемого хирургического имплантата, включающего синтетический биоразлагаемый каркас и аутогенные клетки или тканевые эксплантаты субъекта, подходящие для поддержки, наращивания и регенерации живой ткани у указанного субъекта, причем указанный способ включает ex vivo применение образца указанных аутогенных клеток или тканевых эксплантатов на или в указанном биоразлагаемом хирургическом имплантате, включающем синтетический биоразлагаемый каркас, до имплантации указанному субъекту на участок, где требуется поддержка, наращивание и регенерация живой ткани.
В следующем аспекте данное изобретение относится к биоразлагаемому хирургическому имплантату, включающему синтетический биоразлагаемый каркас для применения в способе поддержки, наращивания и регенерации живой ткани у субъекта, причем указанный способ включает имплантацию указанного биоразлагаемого хирургического имплантата, включающего синтетический биоразлагаемый каркас вместе с образцом аутогенных клеток или тканевых эксплантатов, указанному субъекту на участок, где требуется поддержка, наращивание и регенерация живой ткани.
В следующем аспекте данное изобретение относится к биоразлагаемому хирургическому имплантату, включающему синтетический биоразлагаемый каркас, для применения в способе поддержки, наращивания и регенерации живой ткани у субъекта, причем указанный способ включает этапы (i) отбора тканевого образца у субъекта; (ii) измельчения или разрушения тканевого образца; (iii) имплантирования каркаса и измельченного тканевого образца субъекту.
В следующем аспекте данное изобретение относится к набору, включающему:
a) биоразлагаемый хирургический имплантат, включающий синтетический биоразлагаемый каркас;
b) образец аутогенных клеток или тканевых эксплантатов; и
c) необязательно инструкции по применению способа поддержки, наращивания и регенерации живой ткани у субъекта, например, у субъекта с медицинским пролапсом, например, ректальным или пролапсом органов таза, или грыжей, причем указанный способ включает имплантацию указанного биоразлагаемого хирургического имплантата вместе с аутогенным образцом клеток или тканевых эксплантатов указанному субъекту на участок, где требуется поддержка, наращивание и регенерация живой ткани.
В следующем аспекте данное изобретение относится к набору, включающему:
a) синтетический биоразлагаемый каркас; и
b) компонент, подходящий для измельчения или разрушения тканевого образца.
В следующем аспекте данное изобретение относится к способу поддержки, наращивания и регенерации живой ткани у субъекта с медицинским пролапсом, таким как пролапс органов таза, или с грыжей, причем способ включает имплантацию биоразлагаемого хирургического имплантата, включающего синтетический биоразлагаемый гомогенный пласт каркаса вместе с образцом клеток или тканевых эксплантатов, субъекту на участок пролапса или грыжи.
В следующем аспекте данное изобретение относится к способу поддержки, наращивания и регенерации живой ткани у субъекта, способу, включающему имплантацию биоразлагаемого хирургического имплантата для поддержки, наращивания и регенерации живой ткани у субъекта, включающего:
a) синтетический биоразлагаемый гомогенный пласт каркаса,
b) один или более биоразлагаемых усиливающих элементов;
характеризующемуся тем, что синтетический биоразлагаемый гомогенный пласт каркаса является гидрофильным в субъекте.
В следующем аспекте данное изобретение относится к способу приготовления биоразлагаемого хирургического имплантата по данному изобретению, причем способ одновременно включает последовательные этапы:
a) приготовления синтетического биоразлагаемого гомогенного пласта каркаса;
b) приготовления и включения одного или нескольких биоразлагаемых усиливающих элементов в синтетический биоразлагаемый гомогенный пласт каркаса;
c) необязательно включения одного или нескольких компонентов, как определено в данном документе.
В следующем аспекте данное изобретение относится к набору, включающему:
a) биоразлагаемый хирургический имплантат по данному изобретению;
b) образец клеток или тканевых эксплантатов и
c) необязательно инструкции по применению способа поддержки, наращивания и регенерации живой ткани у субъекта с медицинским пролапсом, таким как пролапс органов таза, или грыжей, причем способ включает имплантацию биоразлагаемого хирургического имплантата вместе с образцом клеток или тканевых эксплантатов указанному субъекту на участок пролапса или грыжи.
В следующем аспекте данное изобретение относится к имплантату по данному изобретению для применения в качестве медикамента.
В следующем аспекте данное изобретение относится к имплантату по данному изобретению для применения в лечении заболевания, связанного с пролапсом органов таза и грыжей.
Подписи к фигурам
Фиг.1: SEM изображение поперечного среза каркаса, изготовленного лиофилизацией. Ориентация материала в направлении замораживания.
Фиг.2a: 40×40 мм каркасы. Слева: не модифицированный. Справа: сваренный по краям для дополнительной прочности.
Фиг 2b: Каркас, сваренный в виде сетчатой структуры для дополнительной прочности.
Фиг.3: Каркас, сваренный с подложкой из электроспряденного PLGA.
Фиг.4: Лиофилизированная структура, усиленная включением сетки из шовного материала.
Фиг.5: Иллюстрация изображает различные структуры, которые могут быть использованы для усиления каркаса за счет включения биоразлагаемых нитей.
Фиг.6: Рассматривается эластичность каркаса. На данной фигуре изображено, что, когда каркас, изготовленный из mPEG-PLGA, является сухим, он жесткий. С другой стороны, как только он намокает, то становится очень гибким. Это сравнивают с полипропиленовой сеткой, которая не становится менее жесткой после воздействия водой.
Фигура 7: Сетка с 200, 300 и 400 мкм удельной поверхности, припаянная к шайбам 8 мм удельной поверхности.
Фигура 8: Компонент высокого давления с резьбой (резьба не показана).
Фигура 9: Клапан; биоразлагаемый хирургический имплантат, включающий каркас.
Фигура 10: Слева: клетки нанесены. Справа: клапан закрыт и необязательно зашит.
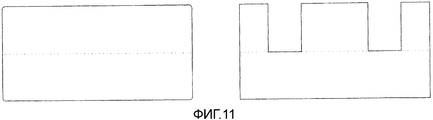
Фигура 11: Полноразмерные или сегментированные клапаны.
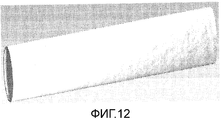
Фигура 12: Трубка; биоразлагаемый хирургический имплантат, включающий каркас, спроектированный в виде трубки.
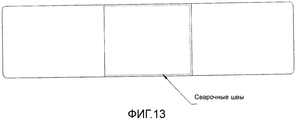
Фигура 13: Карман; биоразлагаемый хирургический имплантат, включающий каркас, спроектированный в виде кармана.
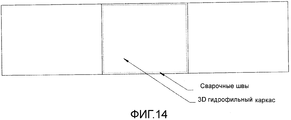
Фигура 14: Абсорбирующий 3D каркас, приваренный к материалу подложки.
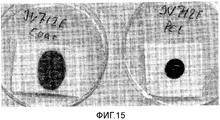
Фигура 15: Смачивание Е-спряденных пластов кровью (15 минут). Слева: PCL коаксиально покрытые MPEG-PLGA 2-30 50DL. Справа: простой PCL.
Фигура 16: A: Пористая губчатая структура MPEG-PLGA. Пунктирная линия отмечает границу между поверхностью и поперечным разрезом имплантата. B: вязаные структуры сетки Vicryl. Цифровые изображения темнопольной стереомикроскопии при 10-кратном увеличении. Шкала линейки: 1,0 мм.
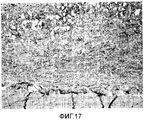
Фигура 17: MPEG-PLGA в сочетании с фрагментированными мышечными волокнами через 3 недели. Мышечная ткань расположена под имплантатом.
Фигура 18: MPEG-PLGA в сочетании с фрагментированными мышечными волокнами через 8 недель. Мышечная ткань находится там, где имплантат и фрагментированные мышечные волокна были ранее имплантированы.
Фигура 19: биоразлагаемый хирургический имплантат с плечами/расширениями для присоединения к структурам в области таза.
Подробное раскрытие изобретения
В данном контексте выражения "биоразлагаемый", "биопоглощаемый" и просто "разлагаемый", как используется в данном документе, относятся к полимеру, который исчезает в течение определенного периода времени после того, как введен в биологическую систему, которая может быть in vivo (например, в человеческом теле), как в данном изобретении, или in vitro (при культивировании с клетками); механизм, посредством которого он исчезает, может варьироваться, он может быть подвергнут гидролизу, разложен, биоразложен, биорассасан, биопоглощен, биоразъеден, растворен или иным образом исчезает из биологической системы. При применении в клиническом контексте это является огромным клиническим преимуществом, так как ничего не нужно удалять из восстановительного участка. Таким образом, вновь образованная ткань не нарушается или подвергается нагрузке из-за наличия или даже удаления временного каркаса. В некоторых вариантах осуществления каркас разлагается в течение от 1 дня до 4 лет, например, от 1 дня до года, например, в течение от 2 до 6 месяцев.
Выражение “биосовместимый” относится к композиции или соединению, которое, когда вставлено в тело млекопитающего, например, в тело пациента, в частности, когда вставлено в участок дефекта, не приводит к существенной токсичности или пагубному иммунному ответу у индивидуума.
Когда выражение "приблизительно" применяется в данном документе в сочетании с конкретным значением или диапазоном значений, это выражение применяется для обозначения как диапазона значений, так и упомянутых фактических относительных значений.
Выражение "культивирование in vitro", как используется в данном документе, относится к этапу способа по данному изобретению, где образец клеток или тканевых эксплантатов поддерживается в условиях in vitro, т.е. в условиях контролируемой среды вне живого млекопитающего. Альтернативно, квалифицированный специалист может применять фразы, такие как "клетки выращены" или "клетки пролиферированы" in vitro, также в значении "культивирование".
Выражение "удлинение при разрыве", как используется в данном документе, относится к % удлинения, где каркасный полимер или усиленный хирургический имплантат по данному изобретению разорвется, как измерено в случае, описанном в примере 3.
Выражение "предел прочности на разрыв", как используется в данном документе, относится к прочности каркасного полимера или усиленного хирургического имплантата по данному изобретению, как измерено в Н/м2 или в фунтах на квадратный дюйм в случае, описанном в примере 3.
Фраза "вертикальная пористая структура", как используется в данном документе, относится к пористой структуре каркасного полимера, применяемого по данному изобретению, в котором поры главным образом ориентированы в вертикальном направлении к пласту каркаса. Это позволит лучше поглощать жидкости и клетки на участке имплантации.
Выражение "взаимосвязанные поры", как используется в данном документе, относится к каркасному полимеру, применяемому по данному изобретению, который имеет пористую структуру с отверстиями между отдельными порами, такими как отверстия в горизонтальном направлении между отдельными порами главным образом с вертикальной ориентацией. Это позволит клеткам мигрировать в любом направлении через каркасный полимерный материал.
Выражение "ткань", как используется в данном документе, относится к твердой живой ткани, которая является частью живого индивидуума млекопитающего, например, человека. Ткань может быть твердой тканью (например, кость, сустав и хрящ) или мягкой тканью, включая сухожилия, связки, фасции, фиброзные ткани, жир, синовиальные оболочки и мускулы, нервы и кровеносные сосуды.
В специфических аспектах образец клеток или тканевых эксплантатов, например, образец жидкости организма, необязательно смешанный с культуральной средой, размещается на поверхности или по меньшей мере вместе с каркасом, как правило, на культуральной чашке или в колбе. Образец клеток или тканевых эксплантатов может быть помещен вместе с компонентом, который способствует клеточной адгезии, повторному росту и/или прорастанию через каркас.
В другом аспекте биопсии мышц помещаются в контейнер с соответствующим буфером, например, клеточной средой, PBS и т.д. Клетки и мышечные волокна выделяются из биопсий с помощью измельчителя ткани (например, Sigma-Aldrich). Затем суспензия мышц наносится на поверхность каркаса до или одновременно с имплантацией.
Суспензия мышц, примененная согласно аспектам данного изобретения, обычно высевается с плотностью в диапазоне 1-100 мг суспензии мышц на см2 каркасного пласта.
В другом аспекте мышечные волокна выделяются из биопсий либо рассечением мышцы с помощью, например, скальпелей, или растворением мышцы с применением ферментной обработки, например, коллагеназой, для получения отдельных волокон с сателлитными клетками. Эти волокна наносятся на поверхность каркаса перед имплантацией.
Соответственно, тканевые эксплантаты из мышечной ткани могут быть из мышц, рассеченных в мышечное пюре, например, с помощью скальпелей, или где мышечные волокна выделены из остальной ткани с применением механического или ферментативного способов, или где мышечная ткань измельчена в мышечную суспензию, все из которых включают популяцию миобластов и фибробластов, и/или мышечные клетки-предшественники в качестве сателлитных клеток.
Следует понимать, что как только образец жидкости организма был нанесен на синтетический биоразлагаемый каркас, клетки in situ на месте медицинского применения, или альтернативно клеткам, содержащиеся в образце жидкости организма, предоставляется возможность мигрировать и/или прорастать сквозь каркас для образования новой ткани, такой как новая соединительная и/или мышечная ткань. В одном варианте осуществления компонент, который способствует клеточной адгезии и/или прорастанию, одновременно наносится на каркас.
Каркас
Синтетический биоразлагаемый каркас, применяемый по данному изобретению, является пористой структурой, которая стимулирует и облегчает рост ткани и клеток. Каркас изготавливается из биосовместимых, разлагаемых материалов и применяется в имплантате для проведения организации, роста и дифференциации клеток в процессе формирования функциональной ткани на участке повреждения у пациента.
В большинстве аспектов данного изобретения синтетический биоразлагаемый каркас полностью или частично разложен in situ на месте медицинского применения в течение периода до приблизительно 48 месяцев, например, в течение периода до приблизительно 36 месяцев, например, в течение периода до приблизительно 24 месяцев, например, в течение периода до приблизительно 12 месяцев, например, в течение периода до приблизительно 10 месяцев, например, в течение периода до приблизительно 9 месяцев, например, в течение периода до приблизительно 6 месяцев, например, в течение периода до приблизительно 5 месяцев, например, в течение периода до приблизительно 4 месяцев, например, в течение периода до приблизительно 3 месяцев, например, в течение периода до приблизительно 2 месяцев, например, в течение периода до приблизительно 1 месяца, как измерено после медицинского применения.
В некоторых важных аспектах данного изобретения синтетический биоразлагаемый каркас не полностью или частично разложен in situ на месте хирургического применения до окончания периода приблизительно 1 месяц, например, после периода приблизительно 2 месяца, например, после периода приблизительно 3 месяца, например, после периода приблизительно 4 месяца, например, после периода приблизительно 5 месяцев, например, в течение периода приблизительно 6 месяцев, например, после периода приблизительно 9 месяцев, например, в течение периода приблизительно 12 месяцев, например, в течение периода приблизительно 24 месяца, например, в течение периода приблизительно 36 месяцев, как измерено после медицинского применения.
Фраза "полностью или частично разложен in situ" относится к синтетическому биоразлагаемому каркасу, являющемуся разложенным на месте медицинского применения под действием внутренних компонентов организма или внешних компонентов каркаса или образца жидкости тела, нанесенного на каркас. Это действие может быть эндогенной ферментативной активностью жидкостей организма или альтернативно активностью соединений, добавленных к каркасу.
В некоторых вариантах осуществления синтетический биоразлагаемый каркас разлагается до уровня по меньшей мере около 50%, например, по меньшей мере около 60%, например, по меньшей мере около 70%, например, по меньшей мере около 70%, например, по меньшей мере около 80%, например, по меньшей мере около 90%, например, по меньшей мере около 100% в течение данного периода времени.
Следует понимать, что каркасный материал со свойственным уровнем разложения может быть выбран для соответствия времени, необходимого для обеспечения достаточной поддержки и усиления на участке медицинского применения до тех пор, пока собственные ткани пациента не обеспечат необходимую поддержку и прочность.
В некоторых вариантах осуществления синтетический биоразлагаемый каркас выбран, чтобы быть частично или полностью разлагаемым клеточным разложением, т.е. разложенным под действием клеточных ферментов, например, ферментативного действия жидкостей организма пациента.
Следует понимать, что каркасный материал, чувствительный к клеточному разложению, может быть выбран для соответствия конкретному и подходящему периоду разложения.
В некоторых вариантах осуществления синтетический биоразлагаемый каркас стерилизуется путем применения облучения, такого как бета-облучение, или плазменной стерилизации.
Синтетический биоразлагаемый каркас перед имплантацией может быть обрезан или "подогнан по размеру" для соответствия конкретному дефекту - соответственно каркас может быть обрезан до конкретного очертания или формы для соответствия участку конкретного дефекта и/или желаемого очертания/формы новой ткани.
Синтетический биоразлагаемый каркас может быть применен в одном или нескольких слоях, в виде волокон, тканных и/или нетканых материалов, например, с пористой структурой.
В некоторых вариантах осуществления каркас является биосовместимым.
В одном варианте осуществления каркас включает полимер, который может быть выбран из группы, состоящей из: коллагена, альгината, полимолочной кислоты (PLA), полигликолевой кислоты (PGA), MPEG-PLGA или PLGA.
В одном варианте осуществления каркас включает полимер, который может быть выбран из группы, состоящей из: 1) гомо- или сополимеров: гликолида, L-лактида, DL-лактида, мезолактида, е-капролактона, 1,4-диоксан-2-она, d-валеролактона, β-бутиролактона, g-бутиролактона, е-декалактона, 1,4-диоксепан-2-она, 1, 5-диоксепан-2-она, 1,5,8,12-тетраоксациклотетрадекан-7-14-диона, 6,6-диметил-1,4-диоксан-2-она и триметиленкарбоната, 2) блок-сополимеров моно- или бифункционального полиэтиленгликоля и полимеров 1), упомянутых выше; 3) блок-сополимеров моно- или бифункционального полиалкиленгликоля и полимеров 1), упомянутых выше; 4) смесей вышеупомянутых полимеров и 5) полиангидридов и полиортоэфиров.
В некоторых вариантах осуществления каркас обладает способностью быть гидрофильным. Соответственно, каркас является смачиваемым в воде, изотонических буферах и/или крови и других жидкостях организма.
В одном варианте осуществления каркас в основном состоит из или включает полимер или полимеры, с молекулярным весом, например, средним молекулярным весом, более приблизительно 1 кДа, например, от приблизительно 1 кДа до приблизительно 1 млн кДа, например, от 25 кДа до 100 кДа.
Каркас предпочтительно сделан в виде пласта, который подходит для имплантации в диафрагму, брюшную полость или область тазового дна.
Каркасный пласт может быть выбран из группы, состоящей из мембраны, например, пористой мембраны, пласта, например, пористого пласта, пласта волокон, причем пласт может иметь различные двухмерные формы, например, имплантат, изготовленный на заказ, для вставки на участок дефекта, например, для соответствия хирургической реконструкции фасции организма млекопитающего, пены, пласт может быть тканым или нетканым, лиофилизированным полимером, например, лиофилизированными полимерными пластами или любой их комбинацией.
Альтернативно, каркас может быть изготовленной на заказ трехмерной конструкцией желаемого очертания, подходящего для имплантации на участке, требующем имплантации.
Соответственно, каркасы могут быть любого типа и размера, а также любой толщины каркаса, например, варьируя от тонких мембран, до каркасов толщиной несколько миллиметров, например, в диапазоне от приблизительно 0,1 мм до 6 мм, например, в диапазоне от приблизительно 0,2 мм до 6 мм, например, в диапазоне от приблизительно 0,5 мм до 6 мм.
В одном варианте осуществления каркас находится в форме пласта, который может быть предварительно обрезан или подогнан по размеру для соответствия дефекту. Такой каркас может быть толщиной, например, от приблизительно 0,2 мм до 6 мм.
Поры каркаса могут быть частично заняты компонентом, который способствует клеточной адгезии и/или прорастанию для регенерации ткани, например, компонентом, выбранным из группы, состоящей из эстрогена, производных эстрогена, ECM порошка, тромбина, хондроитинсульфата, гиалуронана, гепаринсульфата, гепарансульфата, дерматансульфата, факторов роста, фибрина, фибронектина, эластина, коллагена, желатина и аггрекана. Альтернативно, компоненты могут быть полностью или частично включены или встроены в каркас.
Как обсуждалось выше, каркасы могут состоять из или включать любой подходящий биологически приемлемый материал, однако в предпочтительном варианте осуществления каркас включает соединение, выбранное из группы, состоящей из: полилактида (PLA), поликапролактона (PCL), полигликолида (PGA), сополимера(D,L-лактида и гликолида) (PLGA), MPEG-PLGA (метоксиполиэтиленгликоля)-сополимера(D,L-лактида и гликолида), полигидроксикислот в целом. В этом отношении каркас, исключая поровое пространство и любые дополнительные компоненты, например, такие, которые способствуют клеточной адгезии и/или прорастанию для регенерации ткани, может включать, по меньшей мере 50%, например, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% одного или нескольких полимеров, предложенных в данном документе, включая смеси полимеров.
В некоторых вариантах осуществления каркас и усиливающий элемент изготовлены из поликапролактона (PCL), например, электроспряденного PCL, сополимеров капролактона и лактида или биоразлагаемых полиуретанов.
PLGA и MPEG-PLGA являются подходящими каркасными материалами.
В одном варианте осуществления синтетический биоразлагаемый каркас является каркасом, приготовленным по способу, раскрытому в международной публикации WO 07/101443. Способ особенно подходит для приготовления каркасов из PLGA и MPEG-PLGA полимеров.
В некоторых аспектах данного изобретения синтетический биоразлагаемый каркас является каркасом, приготовленным по способу, раскрытому в международной публикации WO 07/101443, способ которого включает этапы:
(a) растворения полимера, как определено в данном документе, в неводном растворителе так, чтобы получить раствор полимера;
(b) замораживания раствора, полученного на этапе (a), так, чтобы получить замороженный полимерный раствор; и
(c) лиофилизации замороженного полимерного раствора, полученного на этапе (b), так, чтобы получить биоразлагаемый пористый материал.
Неводный растворитель, примененный в способе, как раскрыто в международной публикации WO 07/101443, следует выбирать относительно температуры плавления так, чтобы он мог быть удобно заморожен. Типичными примерами этого являются диоксан (tпл 12°C) и диметилкарбонат (tпл 4°C).
В одном варианте способа, как раскрыто в международной публикации WO 07/101443, полимерный раствор после этапа (a) выше заливают или отливают в подходящую форму. Таким образом, можно получать трехмерные формы материала, специально спроектированного для конкретного применения.
В вариантах осуществления, где частицы компонентов из внеклеточного матрикса применяются в способах по данному изобретению, эти внеклеточные матриксные компоненты могут быть диспергированы в растворе, полученном на этапе (a), до того, как раствор (дисперсия) замораживается, как определено на этапе (b).
Компоненты из внеклеточного матрикса могут, например, быть растворены в подходящем растворителе, а затем добавлены к раствору, полученному на этапе (a). Путем смешивания с растворителем этапа (a), т.е. растворителем для полимера, определенным в данном документе, компоненты из внеклеточного матрикса будут вероятнее всего осаждаться так, чтобы формировать дисперсию.
В одном аспекте биоразлагаемый пористый материал, полученный на этапе (c), на последующем этапе погружается в раствор гликозаминогликана (например, гиалуронана), а затем снова лиофилизируется.
В некоторых альтернативных вариантах осуществления материалы присутствуют в форме волокна или волокнистой структуры, приготовленной из полимера, определенного в данном документе, возможно, в комбинации с компонентами из внеклеточного матрикса. Волокна или волокнистые материалы могут быть приготовлены с применением методик, известных специалисту в данной области, например, формованием из расплава, электропрядением, экструзией и т.д.
В предпочтительных вариантах осуществления синтетический биоразлагаемый каркас является биосовместимым. Даже если каркасная структура по данному изобретению является разлагаемой, продукты разложения каркаса могут все еще присутствовать на участке оригинального имплантата. Соответственно, это опять же может быть преимуществом применения биосовместимого каркасного материала.
Пористый каркасный материал может быть приготовлен по известным методикам, например, как раскрыто у Antonios G. Mikos, Amy J. Thorsen, Lisa A Cherwonka, Yuan Bao & Robert Langer. Preparation и characterization of poly(L-lactide) foams. Polymer 35, 1068-1077 (1994). Однако одной часто применимой методикой для приготовления пористых материалов является лиофилизация.
В некоторых вариантах осуществления каркас имеет пористость в диапазоне от 20% до 99%, например, по меньшей мере 50%, например, от 50 до 95% или от 75% до 95% или до 99%.
Высокая степень пористости может быть получена лиофилизацией.
В некоторых вариантах осуществления хирургический имплантат по данному изобретению не включает биологический полимер, т.е. биополимер, например, белок, полисахарид, полиизопрены, лигнин, полифосфат или полигидроксиалканоаты.
В других вариантах осуществления каркас дополнительно включает биологический полимер, т.е. биополимер, например, полипептид, белок, полисахарид, лигнин, полифосфат или полигидроксиалканоаты (например, как описано в патенте США № 6495152). Подходящие биополимеры могут быть выбраны из группы, состоящей из желатина, гиалуронана, гиалуроновой кислоты (НА), хондроитинсульфата, дерматансульфата, коллагена, например, коллагена типа I и/или типа II, альгината, хитина, хитозана, кератина, шелка, эластина, целлюлозы и их производных.
Каркас может быть приготовлен лиофилизацией раствора, включающего соединение, например, перечисленные выше, в растворе.
Компоненты из внеклеточного матрикса могут быть добавлены либо как частицы, которые гетерогенно диспергированы, либо как поверхностное покрытие. Концентрация компонентов из внеклеточного матрикса относительно синтетического полимера обычно находится в диапазоне 0,5-15% (вес./вес.), например, ниже 10% (вес./вес.). Более того, концентрация компонентов внеклеточного матрикса предпочтительно составляет самое большее 0,3% (вес./объем), например, самое большее 0,2 (вес./объем), по отношению к объему материала.
Требуемый тип каркасов, применяемых в контексте данного изобретения, должен быть каркасом, который не действует в качестве инородного тела в млекопитающих (включая человека), так, что может наблюдаться отсутствие иммунитета или минимум иммунитета, и каркасы, применяемые в данном контексте, не должны быть токсичными или существенно вредными для организма, в котором они помещены. Предпочтительно, чтобы каркасы не содержали каких-либо микроорганизмов или любых других вредных примесей.
Клетки или тканевые эксплантаты, применяемые в каркасе, могут быть встроены в гидрогель и могут быть способны к размещению на каркасе перед помещением каркаса в целевую область. Каркас может быть гидрофильным таким образом, чтобы клеточный материал довольно быстро поглощался каркасом. В других подходящих вариантах осуществления клеточный материал помещается в кармане, под клапаном или в трубке материала каркаса.
Каркас может быть гидрофильным, т.е. способен в течение 5 минут, например, в течение 2 минут при 30°С поглощать по крайней менее небольшое количество воды или водного раствора (например, композиции клеточной суспензии), например, поглощать по меньшей мере 1%, например, по меньшей мере 2%, например, по меньшей мере 5%, например, по меньшей мере 10%, например, по меньшей мере 20%, например, по меньшей мере 30%, например, по меньшей мере 50% воды от объема каркаса (или эквивалентного водного раствора) при помещении в водный раствор, например, физиологическую среду, буфер, воду, кровь или другие жидкости организма, особенно полезно то, что каркас может поглощать указанные количества клеточной суспензии в свою пористую структуру, тем самым обеспечивая относительно равномерное распределение клеток, например, эндогенных клеток или in vitro нанесенных клеток или тканевых эксплантатов по всему каркасу, как только он вставлен и зафиксирован на участке дефекта.
В других вариантах осуществления каркасный материал определен как "гидрофильный" способом, где капля плазмы или крови помещается на верхнюю часть пласта каркасного материала; наблюдают за нижней частью пласта каркасного материала, и пласт каркасного материала считается гидрофильными, если протекание жидкости обнаруживается в течение 15 минут.
В некоторых вариантах осуществления биоразлагаемый полимер является по меньшей мере частично гидрофильным, т.е. имеет компонент полимера, который может обоснованно считаться гидрофильным, например, MPEG часть сополимера MPEG-PLGA.
Выражение "гидрофильный" применяется взаимозаменяемо с выражением "полярный".
Одним способом улучшения гидрофильности каркасного полимера является предварительная обработка средством, которое облегчает поглощение эндогенных клеток на участке имплантата или клеток, нанесенных на каркас до имплантации, например, анионные, катионные, неионные поверхностно-активные вещества или амфифильные поверхностно-активные вещества, буферы или соли. Увлажняющие агенты могут также быть применены в сочетании с гидрофильными каркасами для дальнейшего улучшения клеточного проникновения в пористую структуру.
Биосовместимый каркас данного изобретения может содержать сложные полиэфиры. Включением сбалансированного гидрофильного блока в полимер биосовместимость полимера может быть улучшена, поскольку это улучшает характеристики смачиваемости материала, а начальная адгезия клеток нарушается на неполярных материалах.
В одном важном аспекте данного изобретения каркас является биоразлагаемым.
В некоторых вариантах осуществления каркас является пористым, например, имеет пористость по меньшей мере 25%, 50%, например, в диапазоне 50-99,5%. Пористость может быть измерена любым способом, известным в данной области, например, сравнением объема пор по сравнению с объемом твердого каркаса. Это может быть сделано путем определения плотности каркаса по сравнению с непористым образцом той же композиции, что и каркас. Альтернативно, может быть использована ртутная интрузионная порометрия или BET.
В очень интересном варианте осуществления данного изобретения биосовместимый каркас по данному изобретению состоит из или включает один или более полимеров, выбранных из группы, включающей поли(L-молочную кислоту) (PLLA), поли(D/L-молочную кислоту) (PDLLA), поли(капролактон) (PCL) и сополимер (молочной и гликолевой кислоты) (PLGA), а также их производные, в частности, производные, которые содержат соответствующие цепи полимера с добавлением замещающих групп или композиций, которые усиливают гидрофильную природу полимера, например, MPEG или PEG. Примеры представлены в данном документе и включают группу полимеров MPEG-PLGA.
В одном варианте осуществления каркас состоит из или содержит синтетический полимер.
Полимеры, использованные в приготовлении каркаса
Международная публикация WO 07/101443 раскрывает подходящие полимеры для применения в качестве каркасных материалов в данном изобретении, а также способы их приготовления.
Подходящие биоразлагаемые полимеры для применения в способе данного изобретения состоят из полиалкиленгликольного остатка и одного или двух остатков сополимера(молочной и гликолевой кислоты).
Следовательно, в одном аспекте данного изобретения каркас приготовлен из или содержит, или включает полимер общей формулы:
A-O-(CHR
1
CHR
2
O)
n
-B,
где
A является остатком сополимера(лактида и гликолида) с молекулярным весом по меньшей мере 4000 г/моль, молярным отношением (i) лактидных звеньев и (ii) гликолидных звеньев в остатке сополимера(лактида и гликолида) в диапазоне от 80:20 до 10:90, в частности, от 70:30 до 10:90, 60:40 до 40:60, например, приблизительно 50:50, например, 50:50.
B является либо остатком сополимера (лактида и гликолида), как определено для A, либо выбран из группы, состоящей из водорода, C1-6-алкила и защитных групп гидроксила,
один из R1 и R2 в каждом -(CHR1CHR2O)- звене выбран из водорода и метила, а другой из R1 и R2 в том же -(CHR1CHR2O)- звене является водородом,
n представляет среднее число -(CHR1CHR2O)- звеньев в полимерной цепи и является целым числом в диапазоне 10-1000, в частности, 16-250,
молярное отношение (iii) полиалкиленгликольных звеньев -(CHR1CHR2O)- к общему количеству (i) лактидных единиц и (ii) гликолидных единиц в остатке(остатках) сополимера(лактида и гликолида) составляет самое большее 20:80, и где молекулярный вес сополимера составляет по меньшей мере 10000 г/моль, предпочтительно по меньшей мере 15000 г/моль или даже по меньшей мере 20000 г/моль.
Следовательно, полимеры для применения в способе данного изобретения могут быть диблочного типа или триблочного типа.
В некоторых важных аспектах данного изобретения синтетический биоразлагаемый каркас разработан таким образом, чтобы иметь конкретную скорость разложения in vitro. Это может быть достигнуто путем изменения отдельных компонентов (или соотношения отдельных компонентов) в полимере.
В некоторых вариантах осуществления время разложения изменяется G-L-соотношением и молекулярным весом MPEG-PLGA полимеров. Время разложения сополимеров DL-лактида и гликолида может быть изменено путем изменения молярного соотношения лактида и гликолида. Чистый полигликолид имеет время разложения 6-12 месяцев, поли(D,L-лактид) - 12-16 месяцев, сополимер(D,L-лактида и гликолида) при молярном соотношении 85:15 - 2-4 месяца. Кратчайшее разложение получено с молярным соотношением 50:50 - 1-2 месяца. Также можно изменять время разложения путем изменения молекулярного веса, но этот эффект мал по сравнению с вариациями, возможными с соотношением L:G. Теоретически можно получить существенно более быстрое разложение материалов с очень низким молекулярным весом, но они обладают механическими свойствами, которые исключают их применение для большинства медицинских компонентов.
В одном конкретном варианте осуществления А в вышеприведенной формуле является остатком сополимера(лактида и гликолида) с молекулярным весом, по меньшей мере, 4000 г/моль, молярным соотношением (i) лактидных единиц и (ii) гликолидных единиц в остатке сополимера(лактида и гликолида) в диапазоне приблизительно 50:50 молярного соотношения.
Пористость полимера может составлять по меньшей мере 50%, например, находиться в диапазоне 50-99,5%.
Понятно, что полимер для применения в способе данного изобретения включает один или два остатка, то есть остаток(остатки) сополимера(лактида и гликолида). Установлено, что такие остатки должны иметь молекулярный вес по меньшей мере 4000 г/моль, более конкретно по меньшей мере 5000 г/моль или даже по меньшей мере 8000 г/моль.
Сополимер(лактида и гликолида) может быть разложен в физиологических условиях, например, в жидкостях организма и в тканях. Однако из-за молекулярного веса этих остатков (и других требований, изложенных в данном документе) считается, что разложение будет достаточно медленным, чтобы материалы и предметы, сделанные из полимера, смогли выполнить свою роль до полного разложения полимера.
Выражение "сополимер(лактида и гликолида)" охватывает ряд вариантов полимера, например, сополимер(стат.-лактид-гликолид), сополимер(DL-лактида и гликолида), сополимер(мезолактида и гликолида), сополимер(L-лактида и гликолида), сополимер(D-лактида и гликолида), последовательность лактида/гликолида в PLGA может быть либо статической, градиентной, либо блочной, и лактид может быть L-лактидом, DL-лактидом или D-лактидом.
Предпочтительно сополимер(лактида и гликолида) представляет собой сополимер(случайный лактид-гликолид) или сополимер(град.-лактид-гликолид).
Другой важной особенностью является то, что молярное отношение (i) лактидных единиц и (ii) гликолидных единиц в остатке(остатках) сополимера(лактида и гликолида) должно находиться в диапазоне от 80:20 до 10:90, в частности, от 70:30 до 10:90.
В целом было отмечено, что наилучшие результаты получают для полимеров, где молярное отношение (i) лактидных единиц и (ii) гликолидных единиц в остатке(остатках) сополимера(лактида и гликолида) составляет 70:20 или меньше. Однако неплохие результаты также наблюдались, когда полимер имел соответствующее молярное отношение до 80:20, при условии, чтобы молярное отношение (iii) полиалкиленгликольных единиц -(CHR1CHR2O)- к общему количеству (i) лактидных единиц и (ii) гликолидных единиц в остатке(остатках) сополимера(лактида и гликолида) составляло самое большее 8:92.
Как упомянуто выше, B является или остатком сополимера(лактида и гликолида), как определено для A, или выбран из группы, состоящей из водорода, C1-6-алкила и защитных групп гидроксила.
В одном варианте осуществления B является остатком сополимера(лактида и гликолида), как определено для A, т.е. полимером триблочного типа.
В другом варианте осуществления B выбирают из группы, состоящей из водорода, C1-6-алкила и защитных групп гидроксила, т.е. это полимер диблочного типа.
Наиболее типично (в данном варианте осуществления) В представляет собой С1-6-алкил, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, трет-бутил, 1-пентил и т.д., наиболее предпочтительно, метил. В случае, когда В является водородом, т.е. соответствует концевой ОН группе, полимер, как правило, получают с применением защитной группы гидроксила в качестве B. "Защитными группами гидроксила" являются группы, которые могут быть удалены после синтеза полимера, например, путем гидрогенолиза, гидролиза или другими подходящими способами без разрушения полимера, таким образом, на PEG-части остается свободная гидроксильная группа, смотри, например, учебники, описывающие известные из уровня техники процедуры, например, описанные Greene, T.W. и Wuts, P.G.M. (Protecting Groups in Organic Synthesis, третье или последующие издания). Особенно полезными их примерами являются бензил, тетрагидропиранил, метоксиметил и бензилоксикарбонил. Такие защитные группы гидроксила могут быть удалены для получения полимера, где В является водородом.
Один из R1 и R2 внутри каждого -(CHR1CHR2O)- звена выбран из водорода и метила, а другой из R1 и R2 в том же самом -(CHR1CHR2O)- звене является водородом. Следовательно, -(CHR1CHR2O)n- остаток может быть полиэтиленгликолем, полипропиленгликолем, или сополимером(этиленгликоль-пропиленгликоль). Предпочтительно, остаток -(CHR1CHR2O)n- представляет собой полиэтиленгликоль, т.е. оба из R1 и R2 в каждой единице являются водородом.
n представляет среднее число единиц -(CHR1CHR2O)- в полимерной цепи и является целым числом в диапазоне 10-1000, в частности, 16-250. Следует понимать, что n представляет среднее единиц -(CHR1CHR2O)- в общем количестве полимерных молекул. Это будет очевидным для специалиста в данной области. Молекулярный вес полиалкиленгликольного остатка (-(CHR1CHR2O)n-) типично находится в диапазоне 750-10000 г/моль, например, 750-5000 г/моль.
Остаток -(CHR1CHR2O)n- типично является неразлагаемым в физиологических условиях, но, с другой стороны, может быть секретирован in vivo, например, из организма человека.
Молярное отношение (iii) полиалкиленгликольных единиц -(CHR1CHR2O)- к общему количеству (i) лактидных единиц и (ii) гликолидных единиц в остатке(остатках) сополимера(лактида и гликолида) также играет определенную роль и должно составлять самое большее 20:80. Более типично, соотношение составляет самое большее 18:82, например, самое большее 16:84, предпочтительно самое большее 14:86 или самое большее 12:88, в частности, самое большее 10:90 или даже самое большее 8:92. Часто соотношение находится в диапазоне от 0,5:99,5 до 18:82, например, в диапазоне от 1:99 до 16:84, предпочтительно в диапазоне от 1:99 до 14:86 или в диапазоне от 1:99 до 12:88, в частности, в диапазоне от 2:98 до 10:90 или даже в диапазоне от 2:98 до 8:92.
Считается, что молекулярный вес сополимера не особенно важен, при условии, что он составляет по меньшей мере 10000 г/моль. Однако предпочтительно молекулярный вес составляет по меньшей мере 15000 г/моль. "Молекулярный вес" должен подразумеваться как средний молекулярный вес полимера, так как специалисту будет понятно, что молекулярный вес полимерных молекул в общем количестве полимерных молекул будет представлен значениями, распределенными вокруг среднего значения, например, представлен распределением Гаусса. Более типично, молекулярный вес находится в диапазоне 10000-1000000 г/моль, например, 15000-250000 г/моль или 20000-200000 г/моль. Особенно интересными полимерами, как выявили, являются те, которые имеют молекулярный вес по меньшей мере 20000 г/моль, например, по меньшей мере 30000 г/моль.
Полимерная структура может быть проиллюстрирована следующим образом (где R выбран из водорода, C1-6-алкила и защитных групп гидроксила, n является таким, как определено выше, и m, p и ran подобраны так, что выполняются вышеупомянутые положения для остатка(остатков) сополимера(лактида и гликолида)):
полимер диблочного типа,
полимер триблочного типа.
Следует учитывать, что для каждой из вышеуказанных полимерных структур (I) и (II) звенья лактида и гликолида, представленные р и m, могут быть случайным образом распределены в зависимости от исходных материалов и условий реакции.
Кроме того, учитывается, что лактидные единицы могут быть или D/L, или L, или D, обычно D/L или L.
Как упоминалось выше, остаток(остатки) сополимера(лактида и гликолида), т.е. остаток(остатки) сложного полиэфира, является/являются разлагаемым гидролитически в физиологических условиях, а полиалкиленгликольный остаток секретируется, например, из организма млекопитающих. Биоразлагаемость может быть оценена как указано в экспериментальном разделе.
Полимеры в принципе могут быть получены в соответствии с основными правилами, известными специалисту в данной области.
В принципе, полимер, где B не является остатком A (полимеры диблочного типа), может быть получен следующим образом:
В принципе, полимер, где B является остатком A (полимеры триблочного типа), может быть получен следующим образом:
Если только не применяются специальные условия, распределение лактидных единиц и гликолидных единиц будет случайно распределенным или градиентными в каждом остатке сополимера(лактида и гликолида).
Предпочтительно, отношение гликолидных единиц и лактидных единиц, присутствующих в полимере, примененном в каркасе, находится между верхним пределом приблизительно 80:20 и нижним пределом приблизительно 10:90, и более предпочтительным диапазоном является от приблизительно 60:40 до 40:60.
Предпочтительно, верхний предел содержания PEG составляет самое большее приблизительно 20 мольных %, например, самое большее приблизительно 15 мольных %, например, 1-15 мольных %, предпочтительно, 4-9 мольных %, например, приблизительно 6 мольных %.
Синтез полимеров по данному изобретению дополнительно проиллюстрирован в международной публикации патентной заявки WO 07/101443, содержание которой включено в данный документ в качестве ссылки во всей ее полноте.
В некоторых вариантах осуществления каркасный полимер, примененный по данному изобретению, имеет вертикальную пористую структуру. В некоторых вариантах осуществления вертикальная открытая пористая структура имеет значительное число отверстий в горизонтальном направлении между отдельными порами, то есть взаимосвязанные поры.
Усиливающий элемент имплантата
Как уже говорилось в других местах, биоразлагаемый каркас, применяемый в имплантате данного изобретения, является усиленным с целью обеспечения имплантата с требуемым усилением для удобства применения имплантата. Соответственно, усиливающий элемент может иметь более высокий предел прочности на разрыв, чем каркас, применяемый в имплантате данного изобретения.
Усиливающий элемент может быть в форме второго полимера, который отличается от полимера каркаса. В этом аспекте усиливающий элемент может иметь время разложения, которое отличается от времени разложения каркаса.
Альтернативно и в частных аспектах усиливающий элемент выполнен из того же полимера, что и каркас. В этих аспектах прочность обеспечивается наличием полимера в виде волокон или волокнистого материала, полученных с помощью техник, известных специалистам в данной области техники, например, путем формования из расплава, электропрядения, экструзии и др. Альтернативно, прочность обеспечивается с помощью соединительных швов каркасного полимерного материала. Усиливающий элемент может иметь время разложения, которое отличается от времени разложения каркаса, однако оно может быть также аналогичным или близким ему.
Плотность и объем усиливающего элемента должны быть достаточными для обеспечения необходимого усиления для удобства обращения с имплантатом и функциональности. В некоторых вариантах осуществления объемный % должен быть достаточным для обеспечения сшивания в имплантате без разрушения имплантата. Тем не менее, объемный % не должен быть настолько велик, чтобы воспрепятствовать гибкости или поставить под угрозу способность имплантата к поддержке регенерации ткани. Соответственно, в некоторых вариантах осуществления объемный % усиливающего элемента находится в диапазоне от меньше чем приблизительно 12%, например, меньше чем приблизительно 10%, например, меньше чем приблизительно 8%.
"Объемный %" усиливающего элемента можно оценить с помощью анализа изображения. Объем получают как процент от общего объема, занимаемый усиливающим элементом(элементами).
В некоторых вариантах осуществления усиленный имплантат по данному изобретению является эластичным при смачивании до насыщения жидкостью, как измерено анализом эластичности, который описан в примере 2.
Соответственно, выражение "эластичный", используемое в данном документе, относится к способности имплантата или каркаса в размере 1-2 см2 сгибаться, когда его берут с помощью пинцета.
Полимеры, подходящие для применения в качестве усиливающего элемента - это полимер, выполненный из полимера на основе сополимера(лактида и гликолида) PLGA, например, полимер, где молярное отношение (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке сополимера(лактида и гликолида) в диапазоне от 30:70 до 10:90, например, в диапазоне от 20:80 до 10:90, например, приблизительно 10:90. Альтернативно, можно применять поликапролактон, полилактид, сополимеры капролактона и лактида или биоразлагаемые полиуретаны.
В некоторых вариантах осуществления полимер для применения в качестве усиливающего элемента или объединенного каркаса и усиливающего элемента хирургического имплантата является в основном гидрофобным.
В частности, полимеры, подходящие для применения в качестве усиливающего элемента, будут разлагаться медленнее, чем синтетический биоразлагаемый гомогенный пласт каркаса. Как правило, полимеры, подходящие для применения в качестве усиливающего элемента, будут полностью разлагаться в течение 2-48 месяцев, например, в течение 2-36 месяцев, например, в течение 2-24 месяцев, например, в течение 2-12 месяцев применения in situ.
Каркас может быть усилен для облегчения врачам обращения с ним в операционной. Можно применять различные способы. Примером усиленного имплантата по данному изобретению может быть пористый каркас со сварными краями и/или со сварной структурой на каркасе. Эти сварные швы обеспечивают каркасу усиление и могут также применяться в качестве линии разреза хирургом, если он желает сформировать каркас под дефект.
Каркас может быть усилен путем присоединения каркаса к нетканой мембране, которая может быть получена путем электропрядения. Мембрана предпочтительно должна быть значительно тоньше каркаса. Мембрана может быть размещена в верхней части каркаса или в центре каркаса.
Каркас альтернативно может быть усилен за счет включения биоразлагаемых нитевидных швов. Нити могут быть или сварены, или связаны в месте пересечения. Квадраты в сетке в некоторых вариантах осуществления имеют размер по меньшей мере 1 см2. В другом варианте осуществления нити не имеют пересечений, и усиление возникает за счет, например, "улиткообразного" спирального шва внутри каркаса. В основном время разложения дольше для нитей, чем для каркаса.
Иллюстративные примеры фигуры 5 изображают различные структуры, которые можно применять с целью усиления каркаса за счет включения биоразлагаемых нитей.
В некоторых специфических вариантах осуществления усиленный имплантат по данному изобретению усилен посредством наличия сочетания биоразлагаемых нитевидных швов и сварных краев и/или сварной структуры.
Клетки и другие компоненты, которые можно наносить на каркас
В некоторых вариантах осуществления по данному изобретению синтетический биоразлагаемый каркас вводят с компонентом, который облегчает клеточную адгезию и/или прорастание, для образования ткани внутри синтетического биоразлагаемого каркаса, например, компонентом внеклеточного матрикса любой подходящей ткани, например, компонентами внеклеточного матрикса из мочевого пузыря, кишечника, кожи или мышцы.
В некоторых вариантах осуществления по данному изобретению синтетический биоразлагаемый каркас вводят с компонентами и/или клетками, получаемыми из крови, которые облегчают клеточную адгезию и/или прорастание для образования ткани внутри синтетического биоразлагаемого каркаса.
Используемое в данном документе "компоненты и/или клетки, получаемые из крови" относится к любому компоненту или клетке, например, тромбоцитам, лейкоцитам, сывороточным белкам и т.д., которые могут быть получены из образца крови.
Соответственно, в некоторых вариантах осуществления по данному изобретению синтетический биоразлагаемый каркас вводят с компонентом, который облегчает клеточную адгезию и/или прорастание, для образования у пациента ткани in situ внутри синтетического биоразлагаемого каркаса, например, компонентом, выбранным из группы, состоящей из: эстрогена, производных эстрогена, тромбина, порошка ECM (внеклеточный матрикс), хондроитинсульфата, гиалуронана, гиалуроновой кислоты (НА), гепаринсульфата, гепарансульфата, дерматансульфата, факторов роста, например, инсулиноподобных факторов роста (IGF), таких как IGF-1 или IGF-2, или трансформирующих факторов роста (TGF), таких как TGF-альфа или TGF-бета, или факторов роста фибробластов (FGF), таких как, FGF-1 и FGF-2, или тромбоцитарных факторов роста (PDGF), таких как, PDGF-АА, PDGF-BB или PDGF-AB, или механического фактора роста (MGF), или фактора роста нервов (NGF), или человеческого гормона роста (HGH); фибрина, фибронектина, эластина, коллагена, например, коллагена типа I и/или типа II, типа III, типа IV, типа V и/или типа VII, желатина и аггрекана, или любых других подходящих компонентов внеклеточного матрикса.
В одном отдельном варианте осуществления в синтетический биоразлагаемый каркас включена гиалуроновая кислота. В одном варианте осуществления гиалуроновая кислота присутствует в синтетическом биоразлагаемом каркасе в соотношении от приблизительно 0,1 до приблизительно 15 вес.%.
В следующем конкретном варианте осуществления в синтетический биоразлагаемый каркас включен каркас дерматансульфат. В одном варианте осуществления дерматансульфат присутствует в синтетическом биоразлагаемом каркасе в соотношении от приблизительно 0,1 до приблизительно 15 вес.%.
Обсуждаемые выше соединения, которые усиливают клеточную миграцию и/или тканевую регенерации, можно добавить до обработки к пористой каркасной структуре в виде чистых соединений или в виде растворов. Альтернативно, их можно добавить с покрытием или инкапсулированными в форме нано- или микрочастиц.
В некоторых вариантах осуществления по данному изобретению синтетический биоразлагаемый каркас вводят с суспензией клеток или ткани млекопитающих, например, стволовых клеток человека или других клеток или ткани человека, например, мышечных клеток, фибробластов и эндотелиальных клеток или мышечной ткани, например, клеток или ткани, полученных из гладкой, скелетной или сердечной мышцы. Обычно, это может быть суспензия мышечной ткани, например, биоптаты или выделенные мышечные волокна, полученные от пациента. Альтернативно это могут быть мышечные клетки или компоненты, полученные из мышечных клеток, пролиферирующих in vitro. Мышечную суспензию можно наносить на поверхность каркаса до имплантации или одновременно с ней. Мышечную суспензию, применяемую согласно аспектам данного изобретения, обычно высевают с плотностью в диапазоне 1-100 мг мышечной суспензии на см2 каркасного пласта. Мышечные волокна выделяют из биоптатов или рассечением мышцы при помощи, например, скальпелей, или растворением мышцы с применением ферментативной обработки, например, коллагеназой, с получением отдельных волокон с сателлитными клетками.
В других вариантах осуществления по данному изобретению синтетический биоразлагаемый каркас вводят с суспензией компонентов, производимых мышечными клетками, вместе с этими мышечными клетками.
В одном варианте осуществления суспензию клеток или ткани млекопитающего получены или происходят от живой особи млекопитающего, которой необходимо осуществление медицинского применения, т.е. она является аутогенной.
Клетки или ткань также могут быть гомологичными, т.е. совместимыми с тканью, на которую они наносятся, или могут быть получены из мультипотентных или даже плюрипотентных стволовых клеток, например, в форме аллогенных клеток. В одном варианте осуществления клетки или ткань не являются аутогенными. В одном варианте осуществления клетки негомологичны. В одном варианте осуществления клетки могут быть аллогенными, от другой подобной особи, или ксеногенными, то есть полученными от вида, отличающегося от подвергающегося лечению организма. Аллогенные клетки могут быть дифференцированными клетками, клетками-предшественниками или клетками, произошедшими от мультипотентных (например, эмбриональных или сочетания эмбриональной и взрослой специализированной клетки или клеток), плюрипотентных стволовых клеток (полученных из пуповинной крови, стволовых клеток взрослых и др.), сконструированных клеток путем либо замены, вставки, либо добавления генов из других клеток или генных конструктов, применения переноса ядра дифференцированных клеток в эмбриональные стволовые клетки или мультипотентные стволовые клетки, например, стволовые клетки, полученные из клеток пуповинной крови.
В одном варианте осуществления способ данного изобретения также охватывает применение стволовых клеток и клеток, происходящих от стволовых клеток, при этом клетки могут быть, предпочтительно, получены от того же вида, что и подвергаемая лечению особь млекопитающего, например, стволовые клетки человека или происходящие от них клетки.
Клетки млекопитающих, применяемые по данному изобретению, могут поставляться в форме клеточной суспензии или тканевых эксплантатов. Тканевые эксплантаты могут быть непосредственно взяты из других частей особи млекопитающего и, следовательно, могут быть в форме тканевых трансплантатов, например, трансплантат мышечной ткани, взятый из крупных мышц млекопитающего.
Клетки гладких или скелетных мышц человека или, альтернативно, фибробласты и другие соединительнотканные типы клеток, вводимые в синтетический биоразлагаемый каркас, будут особенно предпочтительными. Тем не менее, предполагается, что также можно применять стволовые клетки или любые другие подходящие клетки-предшественники, которые способны становиться или производить мышечные и/или соединительнотканные клетки. Обычно клетки, применяемые при этом нанесении, присутствуют в достаточном количестве клеток с тем, чтобы приводить к регенерации или восстановлению целевой ткани или дефекта, например, от приблизительно 0,1×104 до приблизительно 10×106 клеток/см2 или 0,1×106 клеток/см2 до приблизительно 10×106 клеток/см2.
В некоторых вариантах осуществления мышечные клетки, применяемые по данному изобретению, находятся в форме клеточных суспензий или тканевых эксплантатов.
В некоторых вариантах осуществления клетки млекопитающих, наносимые на синтетический биоразлагаемый каркас по данному изобретению, наносят в количестве от приблизительно 0,1×104 клеток до приблизительно 10×106 клеток на см2 синтетического биоразлагаемого каркаса.
В некоторых вариантах осуществления клетки млекопитающих или тканевые эксплантаты наносят на синтетический биоразлагаемый каркас по данному изобретению во время медицинского применения, например, во время хирургической операции. Следует понимать, что хирург может забирать тканевые эксплантаты для применения по способам данного изобретения до или во время операции.
В некоторых вариантах осуществления клетки млекопитающих или тканевые эксплантаты культивируют в синтетическом биоразлагаемом каркасе до медицинского применения, например, операции, на протяжении по меньшей мере 1 дня, по меньшей мере 3 дней, по меньшей мере 1 недели, например, по меньшей мере 2 недель, например, по меньшей мере 3 недель, например, по меньшей мере 6 недель.
Хирургический способ и пациент
“Живая особь млекопитающего” - это любая живая особь млекопитающего, подходящая для наложения синтетического усиленного биоразлагаемого каркаса по данному изобретению, и является, предпочтительно, человеком, типично, пациентом. Однако способы данного изобретения могут также быть применимы к другим млекопитающим, например домашним животным, включая собак, кошек и лошадей.
Способы наложения синтетического биоразлагаемого каркаса с повышенной прочностью по данному изобретению могут быть выполнены в качестве или во время способа хирургической операции, например способа эндоскопической, лапароскопической или другой минимально-инвазивной хирургической операции, или обычной или открытой хирургической операции.
В конкретных аспектах данного изобретения наложение усиленного синтетического биоразлагаемого каркаса по данному изобретению можно применять при любом медицинском состоянии, требующем реконструкционной хирургии, где требуется укрепление в участке хирургической операции.
В специфических аспектах данного изобретения наложение усиленного синтетического биоразлагаемого каркаса по данному изобретению применяют во время хирургической операции пролапса, например, пролапса органов таза, также называемой тазовой реконструктивной хирургией или хирургией недержания мочи при напряжении.
Следует понимать, что усиленный синтетический биоразлагаемый каркас по данному изобретению можно применять при реконструктивной хирургии, затрагивающей диафрагму, область тазового дна и брюшную полость. Однако предполагается, что усиленный синтетический биоразлагаемый каркас по данному изобретению можно применять при хирургических реконструкциях других фасциальных компонентов тела млекопитающего, включая плотную волокнистую соединительную ткань, которая пронизывает и окружает мышцы, кости, органы, нервы и кровеносные сосуды тела.
Соответственно, усиленный синтетический биоразлагаемый каркас по данному изобретению можно применять при лечении повышения давления в какой-либо анатомической полости, констриктивного перикардита, гемопневмоторакса, гемоторакса, травмы твердой мозговой оболочки и различных грыж, включая каркас для профилактики грыжи во всех хирургических операциях на брюшной полости.
Грыжи являются медицинскими состояниями, для которых может быть показан имплантат по данному изобретению. Используемый в данном документе термин “грыжа” включает абдоминальные грыжи, диафрагмальные грыжи и хиатальные грыжи (например, параэзофагеальная грыжа желудка), тазовые грыжи, например, запирательная грыжа, анальная грыжа, грыжи пульпозного ядра межпозвоночных дисков, внутричерепные грыжи, и грыжи спигелиевой линии.
Типы хирургических операций, обычно ассоциируемых с тазовой реконструктивной хирургией, включают лапароскопически ассистированную вагинальную гистерэктомию, полную лапароскопическую гистерэктомию, вагинальную гистерэктомию, лапароскопическое подвешивание вагинального свода, лапароскопическую сакрокольпопексию, лазерное вагинальное восстановление, конструкционную лазерную вагинопластику, вагинальный подход к лечению пролапса внедрением сетки, процедуры поддержания и лапароскопические паравагинальные репарации.
Используемое в данном документе выражение "пролапс органов таза" относится к любому медицинскому состоянию, включающему пролапс через стенку таза. Другие выражения, применяемые и включаемые в данное определение, - это маточный пролапс, генитальный пролапс, маточно-влагалищный пролапс, тазовая релаксация, дисфункции тазового дна, мочеполовой пролапс, пролапс вагинальной стенки, цистоцеле, пролапс мочевого пузыря, уретроцеле, энтероцеле, ректоцеле, вагинальный пролапс свода, пролапс тонкого кишечника, выпадение матки или пролапс уретры.
Один важный аспект данного изобретения относится к способу лечения или частичного снятия симптомов пролапса соединительной ткани, например, пролапса органов таза, у живой особи млекопитающего, например, человека, при этом способ включает этап наложения синтетического биоразлагаемого каркаса с повышенной прочностью по данному изобретению на участок дефекта или место требующейся хирургической операции.
Как описано выше, другой важный аспект данного изобретения относится к синтетическому биоразлагаемому каркасу с усиливающим элементом(элементами) по данному изобретению; для применения в качестве имплантата.
В одном варианте осуществления этот усиленный синтетический биоразлагаемый каркас по данному изобретению - для применения при лечении или для частичного снятия симптомов дефекта соединительной ткани у живой особи млекопитающего, например, человека.
В некоторых конкретных вариантах осуществления клетки получают от живой особи млекопитающего при операции и наносят на усиленный синтетический биоразлагаемый каркас до, и/или одновременно, и/или после наложения усиленного синтетического биоразлагаемого каркаса на участок дефекта. Изобретателями данного изобретения ожидается, что это будет способствовать поглощению и переносимости усиленного синтетического биоразлагаемого каркаса, и увеличит рост и реконструкцию ткани живой особи млекопитающего на участке операции, и, таким образом, увеличит скорость выздоровления подвергаемого лечению млекопитающего, например, пациента-человека. В некоторых вариантах осуществления клетки находятся в мышечной суспензии, которую наносят на поверхность или в каркас в связи с операцией и имплантацией имплантата по данному изобретению. Применяемую мышечную суспензию как правило высеивают с плотностью в диапазоне 1-100 мг мышечной суспензии на см2 каркасного пласта. Мышечные волокна можно выделить из биоптатов или рассечением мышцы с помощью, например, скальпелей, или растворением мышцы с помощью ферментативной обработки, например, коллагеназы, с получением отдельных волокон с сателлитными клетками. Следует понимать, что мышечный препарат может быть взят от того же самого пациента, который получает имплантат, т.е. аутогенный препарат.
В некоторых вариантах осуществления обработки по данному изобретению выполняют как часть хирургической операции, например, эндоскопической, лапароскопической или другой минимально инвазивной хирургической операции, а также обычной или обширной открытой хирургической операции.
В некоторых вариантах осуществления обработки по данному изобретению выполняют как часть реконструктивной хирургической операции.
Синтетический биоразлагаемый усиленный каркас по данному изобретению можно прикрепить к фасции швами, булавками и/или тканевым клеем различных типов. Предпочтительно такие средства прикрепления также являются биоразлагаемыми.
Комплект деталей
Как описано в другом месте, данное изобретение также предоставляет комплект деталей для лечения или для частичного снятия симптомов пролапса у живой особи млекопитающего, при этом набор включает усиленный синтетический биоразлагаемый каркас и инструкции по применению этого усиленного синтетического биоразлагаемого каркаса.
Также предоставлены наборы деталей для поддержки, наращивания и регенерации живой ткани в субъекте, например, у субъекта с медицинским пролапсом, например, ректальным или пролапсом органов таза, или грыжей, при этом набор включает биоразлагаемый хирургический имплантат, включающий синтетический биоразлагаемый каркас, и компонент, подходящий для измельчения или разрушения тканевого образца, или, альтернативно, образец аутогенных клеток или тканевых эксплантатов для применения в способах данного изобретения.
Конкретные варианты осуществления данного изобретения
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса является гидрофильным.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса имеет способность в течение 5 минут, например, в течение 2 минут при 30°C, поглощать воду в количестве по меньшей мере 10%, например, по меньшей мере 20%, например, по меньшей мере 30%, например, по меньшей мере 50% от объема каркаса.
В некоторых вариантах осуществления биоразлагаемый хирургический имплантат по данному изобретению имеет объемный % указанного усиливающего элемента менее 40%, например, менее 30%, например, менее 20%, например, менее 15%, например, менее 12% от имплантата.
Должно быть понятно, что баланс прочности, эластичности и биоразлагаемости сочетания усиливающего элемента и каркасного материала будет требоваться в зависимости от конкретного показания, подвергающегося лечению имплантатом. Соответственно, более высокая прочность будет требоваться для восстановления органов таза, чем, например, для лечения недержания мочи.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса демонстрирует относительное удлинение при разрыве в диапазоне приблизительно 10-200%, например, в диапазоне приблизительно 30-100%, например, в диапазоне приблизительно 30-70%, например, в диапазоне приблизительно 30-60%.
В некоторых вариантах осуществления данного изобретения хирургический имплантат демонстрирует относительное удлинение при разрыве в диапазоне приблизительно 20-1000%, например, в диапазоне приблизительно 20-800%, например, в диапазоне приблизительно 20-500%, например, в диапазоне приблизительно 20-400%, например, в диапазоне приблизительно 20-300%.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса демонстрирует предел прочности на разрыв в диапазоне приблизительно 5-40 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-30 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-20 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-16 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-14 фунтов на квадратный дюйм.
В некоторых вариантах осуществления данного изобретения хирургический имплантат демонстрирует предел прочности на разрыв в диапазоне приблизительно 300-50000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 500-30000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-20000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-10000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 5000-10000 фунтов на квадратный дюйм, или в диапазоне приблизительно 1000-8000 фунтов на квадратный дюйм.
В некоторых вариантах осуществления данного изобретения каркасный материал демонстрирует предел прочности на разрыв в диапазоне приблизительно 300-50000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 500-30000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-20000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-10000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-8000 фунтов на квадратный дюйм.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса демонстрирует эластичность при смачивании до насыщения жидкостью.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса имеет открытопористую структуру с размером в диапазоне 30-200 мкм.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса имеет в основном вертикальнопористую структуру.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса имеет открытопористую структуру с взаимосвязанными порами.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса получают лиофилизацией.
В некоторых вариантах осуществления данного изобретения биоразлагаемый усиливающий элемент имеет в основе волокна и/или нити с толщиной приблизительно 10 нм-1000 мкм, например, в диапазоне приблизительно 10 нм-800 мкм, например, в диапазоне приблизительно 10 нм-500 мкм.
В некоторых вариантах осуществления данного изобретения биоразлагаемый усиливающий элемент является пластом, выполненным из тканого материала, вязаного материала, сетки, нетканого войлока из нитей или штапельных волокон.
В некоторых вариантах осуществления данного изобретения биоразлагаемый усиливающий элемент является пластом, выполненным из тканого материала, вязаного материала, сетки, нетканого войлока из нитей или штапельных волокон, где пласт имеет толщину 30 мкм-5 мм, например, 3-5 мм, например, 1-4 мм.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса является полностью разлагаемым в течение 1-48 месяцев, например, 4-36, например, 6-24 или 1-12 месяцев in situ применения.
В некоторых вариантах осуществления данного изобретения биоразлагаемый усиливающий элемент способствует клеточному прикреплению и прорастанию клеток, происходящих от живой ткани указанного субъекта или от нанесения клеточных или тканевых эксплантатов.
В некоторых вариантах осуществления данного изобретения усиливающий биоразлагаемый элемент является полностью разлагаемым в течение 1-12 месяцев, например, в диапазоне 2-12 месяцев in situ применения.
В некоторых вариантах осуществления данного изобретения усиленный биоразлагаемый элемент выполнен из полимера на основе сополимера(лактида и гликолида) PLGA, например, полимера, где молярное отношение (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке сополимера(лактида и гликолида) находится в диапазоне от 90:10 до 10:90, например, в диапазоне от 80:20 до 10:90, например, приблизительно 10:90.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса является полимером с общей формулой:
A-O-(CHR
1
CHR
2
O)
n
-B,
где
A является остатком сополимера(лактида и гликолида) с молекулярным весом по меньшей мере 4000 г/моль, молярное отношение (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке сополимера(лактида и гликолида) находится в диапазоне от 80:20 до 10:90;
B является либо остатком сополимера(лактида и гликолида), как определено для A, либо он выбран из группы, состоящей из водорода, C1-6-алкила и защитных групп гидроксила,
один из R1 и R2 внутри каждого элементарного звена -(CHR1CHR2O)- выбран из водорода и метила, а другой из R1 и R2 внутри того же элементарного звена -(CHR1CHR2O)- является водородом,
n представляет среднее число элементарных звеньев -(CHR1CHR2O)- в полимерной цепи и является целым числом в диапазоне 10-1000; и где
молярное соотношение (iii) полиалкиленгликолевых элементарных звеньев -(CHR1CHR2O)- к объединенному количеству (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке(остатках) сополимера(лактида или гликолида) составляет самое большее 20:80;
и где молекулярный вес сополимера составляет по меньшей мере 10000 г/моль, предпочтительно по меньшей мере 15000 г/моль.
В некоторых вариантах осуществления данного изобретения как R1, так и R2 в каждом элементарном звене являются водородом.
В некоторых вариантах осуществления данного изобретения B является остатком сополимера(лактида или гликолида), как определено для A.
В некоторых вариантах осуществления данного изобретения B представляет собой C1-6-алкил.
В некоторых вариантах осуществления данного изобретения B является защитной группой гидроксила.
В некоторых вариантах осуществления данного изобретения B является гидроксигруппой.
В некоторых вариантах осуществления данного изобретения весовое процентное отношение (iii) полиалкиленгликолевых элементарных звеньев -(CHR1CHR2O)- к объединенному количеству (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке(остатках) сополимера(лактида или гликолида) находится в диапазоне 4%-10% вес./вес.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса получают лиофилизацией раствора, включающего биоразлагаемый полимер в растворе.
В некоторых вариантах осуществления данного изобретения усиливающий элемент выполнен из биоразлагаемых волокон и/или нитей.
В некоторых вариантах осуществления данного изобретения усиливающий элемент выглядит в виде структуры, выбранной из группы, состоящей из треугольников, кругов, соединяющихся волн, несоединяющихся волн и перекрывающихся волн.
В некоторых вариантах осуществления данного изобретения усиливающий элемент выполнен из сварочных швов синтетического биоразлагаемого гомогенного пласта каркаса, например, сварочных швов, обеспеченных в виде квадратной и гексагональной структуры или вдоль края имплантата.
В некоторых вариантах осуществления данного изобретения синтетический биоразлагаемый гомогенный пласт каркаса является полимером с молекулярным весом больше чем приблизительно 1 кДа, например, от приблизительно 1 кДа до приблизительно 1000000 кДа, например, от 25 кДа до 100 кДа.
В некоторых вариантах осуществления данного изобретения имплантат дополнительно содержит в каркасе один или более компонентов, которые облегчают клеточную адгезию и/или прорастание для восстановления ткани, например, компонент, выбранный из группы, состоящей из: эстрогена, производных эстрогена, тромбина, порошка ECM, хондроитинсульфата, гиалуронана, гиалуроновой кислоты (HA), гепаринсульфата, гепарансульфата, дерматансульфата, факторов роста, фибрина, фибронектина, эластина, коллагена, например, коллагена типа I и/или типа II, желатина и аггрекана или любого другого подходящего компонента внеклеточного матрикса.
В некоторых вариантах осуществления данного изобретения имплантат содержит в каркасе один или более компонентов, выбранных из группы, состоящей из факторов роста, например, инсулиноподобных факторов роста (IGF), таких как IGF-1 или IGF-2, или трансформирующих факторов роста (TGF), таких как TGF-альфа или TGF-бета, или факторов роста фибробластов (FGF), таких как FGF-1 или FGF-2, или тромбоцитарных факторов роста (PDGF), таких как PDGF-AA, PDGF-BB или PDGF-AB, или фактора роста нервов (NGF), или человеческого гормона роста (hGH) и механического фактора роста (MGF).
В некоторых вариантах осуществления данного изобретения имплантат содержит в указанном каркасе образец клеток или тканевых эксплантатов.
В некоторых вариантах осуществления данного изобретения имплантат сформирован в виде трубки и/или содержит клапан и/или карман, удобный для нанесения суспензии образца клеток или тканевых эксплантатов на имплантат.
В некоторых вариантах осуществления данного изобретения имплантат содержит две или более отдельных частей синтетических биоразлагаемых гомогенных пластов каркаса, например, 3, 4, 5 или 6 частей синтетических биоразлагаемых гомогенных пластов каркаса, прикрепленных к усиливающему элементу, например, сетке из другого полимера.
В некоторых вариантах осуществления данного изобретения имплантат содержит два или более, например, 4 или 6 плечей или выступов для прикрепления к структурам в месте имплантации, например, в области таза.
В некоторых вариантах осуществления способа по данному изобретению субъект страдает от медицинского пролапса, например, пролапса органов таза или грыжи.
В некоторых вариантах осуществления способа по данному изобретению способ включает имплантацию указанного биоразлагаемого хирургического имплантата вместе с образцом клеток или тканевых эксплантатов указанному субъекту на участке имплантации.
В некоторых вариантах осуществления образец клеток или тканевых эксплантатов берут у пациента в операционной и помещают на имплантат в участке имплантации во время хирургической операции. Альтернативно, клетки или тканевые эксплантаты, применяемые вместе с имплантатом, были взяты у пациента до хирургической операции. В другом варианте имплантат и клетки или тканевые эксплантаты обеспечивают в виде набора и применяют совместно во время хирургической операции.
В некоторых вариантах осуществления способов по данному изобретению клетки или тканевые эксплантаты являются аутогенными, гомологичными (аллогенными) или ксеногенными по происхождению относительно клеток указанной живой ткани у субъекта. В некоторых вариантах осуществления способа по данному изобретению клетки или тканевые эксплантаты являются аутогенными субъекту, имеющему имплантат.
В некоторых вариантах осуществления способов по данному изобретению синтетический биоразлагаемый каркас является гомогенным пластом.
В некоторых вариантах осуществления биоразлагаемый хирургический имплантат по данному изобретению применяется в способах данного изобретения.
В некоторых вариантах осуществления способов по данному изобретению субъект страдает от медицинского пролапса, например, пролапса органов таза, или грыжи, или недержания мочи.
В некоторых вариантах осуществления способов по данному изобретению количество клеток в указанном применяемом образце клеток или тканевых эксплантатах находится в диапазоне от приблизительно 0,1×104 клеток до приблизительно 10×106 клеток на см2 имплантата.
В некоторых вариантах осуществления способов по данному изобретению тканевые эксплантаты получены из мышечной ткани, стволовых клеток, например, стволовых клеток, способных к дифференцированию в миобласты или фибробласты; или их комбинаций.
В некоторых вариантах осуществления способов по данному изобретению клетки или тканевые эксплантаты получены от человека.
В некоторых вариантах осуществления способов по данному изобретению клетки или тканевые эксплантаты перед имплантацией культивируют in vitro в течение определенного количества времени на или внутри указанного синтетического биоразлагаемого гомогенного пласта каркаса.
В некоторых вариантах осуществления способов по данному изобретению клетки или тканевые эксплантаты перед имплантацией не культивируют in vitro.
В некоторых вариантах осуществления способов по данному изобретению клетки или тканевые эксплантаты собирают и используют согласно способу в операционной.
В некоторых вариантах осуществления способов по данному изобретению способ дополнительно включает нанесение на указанный биоразлагаемый хирургический имплантат композиции, включающей компонент, который облегчает клеточную адгезию и/или прорастание для регенерации ткани, например, компонент, выбранный из группы, состоящей из эстрогена, производных эстрогена, тромбина, порошка ECM, хондроитинсульфата, гиалуронана, гиалуроновой кислоты (HA), гепаринсульфата, гепарансульфата, дерматансульфата, факторов роста, фибрина, фибронектина, эластина, коллагена, например, коллагена типа I и/или типа II, желатина и аггрекана, или любого подходящего компонента внеклеточного матрикса.
В некоторых вариантах осуществления способов по данному изобретению способ дополнительно включает нанесение на указанный биоразлагаемый хирургический имплантат композиции, включающей компонент, выбранный из группы, состоящей из факторов роста, например, инсулиноподобных факторов роста (IGF), таких как IGF-1 или IGF-2, или трансформирующих факторов роста (TGF), таких как TGF-альфа или TGF-бета, или факторов роста фибробластов (FGF), таких как FGF-1 или FGF-2, или тромбоцитарных факторов роста (PDGF), таких как PDGF-AA, PDGF-BB или PDGF-AB, или фактора роста нервов (NGF), или человеческого гормона роста (hGH) и механического фактора роста (MGF).
В некоторых вариантах осуществления наборы по данному изобретению включают компонент, подходящий для измельчения или разрушения, при этом компонент включает отверстия или сетку для раздавливания указанного тканевого образца путем приложения давления, посредством чего тканевой образец продавливается через указанную сетку или отверстия.
В некоторых вариантах осуществления наборы по данному изобретению включают компонент, подходящий для измельчения или разрушения, на основе дробилки, ультразвуковой обработки, высокого давления или физического воздействия ножей или других инструментов, при этом одним примером является гомогенизатор с вращающимися ножами.
Перечисленные варианты осуществления данного изобретения
Биоразлагаемый хирургический имплантат для поддержки, наращивания и регенерации живой ткани субъекта, включающий:
синтетический биоразлагаемый гомогенный пласт каркаса;
один или более биоразлагаемых усиливающих элементов;
характеризующийся тем, что указанный синтетический биоразлагаемый гомогенный пласт каркаса является гидрофильным.
Биоразлагаемый хирургический имплантат по варианту осуществления 1, где указанный синтетический биоразлагаемый гомогенный пласт каркаса обладает способностью в течение 5 минут, например, в течение 2 минут при 30°C, поглощать воду в количестве по меньшей мере 10%, например, по меньшей мере 20%, например, по меньшей мере 30%, например, по меньшей мере 50%, от объема каркаса.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1 или 2, где объемный % указанного усиливающего элемента составляет менее 40% от имплантата.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-3, где указанный синтетический биоразлагаемый гомогенный пласт каркаса демонстрирует процент удлинения при разрыве в диапазоне приблизительно 10-200%, например, в диапазоне приблизительно 30-100%, например, в диапазоне приблизительно 30-70%, например, в диапазоне приблизительно 30-60%.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-4, где указанный хирургический имплантат демонстрирует процент удлинения при разрыве в диапазоне приблизительно 20-1000%, например, в диапазоне приблизительно 20-800%, например, в диапазоне приблизительно 20-500%, например, в диапазоне приблизительно 20-400%, например, в диапазоне приблизительно 20-300%.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-5, где указанный синтетический биоразлагаемый гомогенный пласт каркаса демонстрирует предел прочности на разрыв в диапазоне приблизительно 5-40 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-30 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-20 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-16 фунтов на квадратный дюйм, например, в диапазоне приблизительно 8-14 фунтов на квадратный дюйм.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-6, где указанный хирургический имплантат демонстрирует предел прочности на разрыв в диапазоне приблизительно 300-50000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 500-30000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-20000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-10000 фунтов на квадратный дюйм, например, в диапазоне приблизительно 1000-8000 фунтов на квадратный дюйм.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-7, где указанный синтетический биоразлагаемый гомогенный пласт каркаса демонстрирует эластичность при смачивании до насыщения жидкостью.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-8, где указанный синтетический биоразлагаемый гомогенный пласт каркаса имеет открытопористую структуру с размером в диапазоне 30-200 мкм.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-9, где указанный синтетический биоразлагаемый гомогенный пласт каркаса имеет в основном вертикальнопористую структуру.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-10, где указанный синтетический биоразлагаемый гомогенный пласт каркаса имеет открытопористую структуру с взаимосвязанными порами.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-11, где указанный синтетический биоразлагаемый гомогенный пласт каркаса получен с помощью лиофилизации.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-12, где указанный биоразлагаемый усиливающий элемент имеет в основе волокна и/или нити с толщиной приблизительно 10 нм-1000 мкм, например, в диапазоне приблизительно 10 нм-800 мкм, например, в диапазоне приблизительно 10 нм-500 мкм.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-13, где указанный биоразлагаемый усиливающий элемент является пластом, выполненным из тканого материала, вязаного материала, сетки, нетканого войлока из нитей или волокон.
Биоразлагаемый хирургический имплантат по варианту осуществления 14, где указанный пласт имеет толщину 30 мкм-5 мм, например, 3-5 мм, например, 1-4 мм.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-15, где указанный синтетический биоразлагаемый гомогенный пласт каркаса является полностью разлагаемым в течение 1-12 месяцев in situ применения.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-16, где указанный биоразлагаемый усиливающий элемент способствует клеточному прикреплению и прорастанию клеток, происходящих от живой ткани указанного субъекта или от нанесения клеточных или тканевых эксплантатов.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-17, где указанный усиливающий биоразлагаемый элемент является полностью разлагаемым в пределах 1-12 месяцев in situ применения.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-18, где указанный усиливающий биоразлагаемый элемент выполнен из полимера на основе сополимера(лактида и гликолида) PLGA, например, полимера, где молярное отношение (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке сополимера(лактида и гликолида) находится в диапазоне от 90:10 до 10:90, например, в диапазоне от 80:20 до 10:90, например, приблизительно 10:90.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-19, где указанный синтетический биоразлагаемый гомогенный пласт каркаса является полимером с общей формулой:
A-O-(CHR
1
CHR
2
O)
n
-B,
где
A является остатком сополимера(лактида и гликолида) с молекулярным весом по меньшей мере 4000 г/моль, молярное отношение (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке сополимера(лактида или гликолида) находится в диапазоне от 80:20 до 10:90;
B является либо остатком сополимера(лактида и гликолида), как определено для A, либо выбран из группы, состоящей из водорода, C1-6-алкила и защитных групп гидроксила;
один из R1 и R2 внутри каждого элементарного звена -(CHR1CHR2O)- выбран из водорода и метила, а другой из R1 и R2 внутри того же элементарного звена -(CHR1CHR2O)- является водородом;
n представляет среднее число элементарных звеньев -(CHR1CHR2O)- в полимерной цепи и является целым числом в диапазоне 10-1000; и где
молярное отношение (iii) полиалкиленгликолевых элементарных звеньев -(CHR1CHR2O)- к объединенному количеству (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке(остатках) сополимера(лактида или гликолида) составляет самое большее 20:80;
и где молекулярный вес сополимера составляет по меньшей мере 10000 г/моль, предпочтительно - по меньшей мере 15000 г/моль.
Биоразлагаемый хирургический имплантат по варианту осуществления 20, где как R1, так и R2 в каждом элементарном звене являются водородом.
Биоразлагаемый хирургический имплантат согласно варианту осуществления 20 или 21, где B является остатком сополимера(лактида или гликолида), как определено для A.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 20-22, где B является C1-6-алкилом.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 20-23, где B является защитной группой гидроксила.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 20-23, где B является гидроксигруппой.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 20-25, где весовое процентное отношение (iii) полиалкиленгликолевых элементарных звеньев -(CHR1CHR2O)- к объединенному количеству (i) элементарных звеньев лактида и (ii) элементарных звеньев гликолида в остатке(остатках) сополимера(лактида или гликолида) находится в диапазоне 4%-10% вес./вес.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-26, где указанный синтетический биоразлагаемый гомогенный пласт каркаса получен лиофилизацией раствора, включающего биоразлагаемый полимер в растворе.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-27, где указанный усиливающий элемент выполнен из биоразлагаемых шовных материалов и/или нитей.
Биоразлагаемый хирургический имплантат по варианту осуществления 28, где указанный усиливающий элемент выглядит в виде структуры, выбранной из группы, состоящей из: треугольников, кругов, соединяющихся волн, несоединяющихся волн и перекрывающихся волн.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-29, где указанный усиливающий элемент выполнен из сварочных швов синтетического биоразлагаемого гомогенного пласта каркаса, например, сварочных швов, выполненных в виде квадратной и гексагональной структуры или вдоль края имплантата.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-30, где указанный синтетический биоразлагаемый гомогенный пласт каркаса является полимером с молекулярным весом более чем приблизительно 1 кДа, например, от приблизительно 1 кДа до приблизительно 1000000 кДа, например, от 25 кДа до 100 кДа.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-31, при этом указанный имплантат дополнительно содержит в указанном каркасе один или более компонентов, которые облегчают клеточную адгезию и/или прорастание для регенерации ткани, например, компонент, выбранный из группы, состоящей из: эстрогена, производных эстрогена, тромбина, порошка ECM, хондроитинсульфата, гиалуронана, гиалуроновой кислоты (HA), гепаринсульфата, гепарансульфата, дерматансульфата, факторов роста, фибрина, фибронектина, эластина, коллагена, например, коллагена типа I и/или типа II, желатина и аггрекана или любого другого подходящего компонента внеклеточного матрикса.
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-32, при этом имплантат дополнительно содержит в указанном каркасе один или более компонентов, выбранных из группы, состоящей из факторов роста, например, инсулиноподобных факторов роста (IGF), таких как IGF-1 или IGF-2, или трансформирующих факторов роста (TGF), таких как TGF-альфа или TGF-бета, или факторов роста фибробластов (FGF), таких как FGF-1 или FGF-2, или тромбоцитарных факторов роста (PDGF), таких как PDGF-AA, PDGF-BB или PDGF-AB, или фактора роста нервов (NGF), или человеческого гормона роста (hGH) и механического фактора роста (MGF).
Биоразлагаемый хирургический имплантат по любому из вариантов осуществления 1-33, при этом имплантат дополнительно содержит в указанном каркасе образец клеток или тканевых эксплантатов.
Способ поддержки, наращивания и регенерации живой ткани в субъекте с медицинским пролапсом, например, пролапсом органов таза, или грыжей, при этом указанный способ включает имплантацию биоразлагаемого хирургического имплантата, включающего синтетический биоразлагаемый гомогенный пласт каркаса вместе с образцом клеток или тканевых эксплантатов, указанному субъекту в участке указанного пролапса или грыжи.
Способ поддержки, наращивания и регенерации живой ткани в субъекте, при этом указанный способ включает имплантацию биоразлагаемого хирургического имплантата по любому из вариантов осуществления 1-34 указанному субъекту.
Способ согласно варианту осуществления 36, где указанный субъект страдает от медицинского пролапса, например, пролапса органов таза, или грыжи.
Способ согласно вариантам осуществления 36 или 37, где указанный способ включает имплантацию указанного биоразлагаемого хирургического имплантата вместе с образцом клеток или тканевых эксплантатов указанному субъекту в участок имплантации.
Способ согласно вариантам осуществления 35 или 38, где указанные клетки или тканевые эксплантаты являются аутогенными, гомологичными (аллогенными) или ксеногенными по происхождению относительно клеток указанной живой ткани у субъекта.
Способ согласно любому одному из вариантов осуществления 35 или 38-39, где количество клеток в указанном примененном образце клеток или тканевых эксплантатов находится в диапазоне от около 0,1×104 клеток до около 10×106 клеток на см2 имплантата.
Способ согласно любому одному из вариантов осуществления 35 или 38-40, где тканевые эксплантаты являются таковыми из мышечной ткани, стволовых клеток, например, стволовых клеток, способных к дифференциации в миобласты, или фибробластов; или их комбинациями.
Способ согласно любому одному из вариантов осуществления 35 или 38-41, где указанные клетки или тканевые эксплантаты получены из человека.
Способ согласно любому одному из вариантов осуществления 35 или 38-42, где указанные клетки или тканевые эксплантаты культивируют in vitro в течение определенного количества времени на или внутри указанных синтетических биоразлагаемых однородных пластов каркаса до имплантации.
Способ согласно любому одному из вариантов осуществления 35-43, при этом способ дополнительно включает применение к указанному биоразлагаемому хирургическому имплантату композиции, включающей компонент, который облегчает клеточную адгезию и/или прорастание для регенерации ткани, например, компонент, выбранный из группы, состоящей из: эстрогена, производных эстрогена, тромбина, порошка ECM, хондроитинсульфата, гиалуронана, гиалуроновой кислоты (HA), гепаринсульфата, гепарансульфата, дерматансульфата, факторов роста, фибрина, фибронектина, эластина, коллагена, например, коллагена типа I и/или типа II, желатина и аггрекана или любого подходящего компонента внеклеточного матрикса.
Способ согласно любому одному из вариантов осуществления 35-44, при этом способ дополнительно включает применение к указанному биоразлагаемому хирургическому имплантату композиции, включающий компонент, выбранный из группы, состоящей из факторов роста, например, инсулиноподобных факторов роста (IGF), например, IGF-1 или IGF-2, или трансформирующих факторов роста (TGF), например, TGF-альфа или TGF-бета, или факторов роста фибробластов (FGF), например, FGF-1 или FGF-2, или тромбоцитарных факторов роста (PDGF), например, PDGF-AA, PDGF-BB или PDGF-AB, или фактора роста нервов (NGF), или человеческого гормона роста (hGH) и механического фактора роста (MGF).
Способ получения биоразлагаемого хирургического имплантата по любому одному из вариантов осуществления 1-34, при этом способ одновременно включает последовательные этапы:
получения указанных синтетических биоразлагаемых однородных пластов каркаса;
получения и включения указанной одной или нескольких биоразлагаемых усиливающих деталей в указанные синтетические биоразлагаемые однородные пласты каркаса;
необязательно включения одного или нескольких компонентов, как определено в любом одном из вариантов осуществления 32-34.
Набор, включающий:
биоразлагаемый хирургический имплантат по любому одному из вариантов осуществления 1-34;
образец клеток или тканевых эксплантатов; и
необязательно инструкции по применению способа поддержки, наращивания и регенерации живой ткани в субъекте с медицинским пролапсом, например, ректальным пролапсом или пролапсом органов таза, или грыжей, при этом указанный способ включает имплантацию указанного биоразлагаемого хирургического имплантата вместе с образцом клеток или тканевых эксплантатов указанному субъекту в участок указанного пролапса или грыжи.
Имплантат по любому одному из вариантов осуществления 1-34 для применения в качестве медикамента.
Имплантат по любому одному из вариантов осуществления 1-34 для применения в лечении заболевания, связанного с пролапсом органов таза и грыжей.
ПРИМЕРЫ
Пример 1
Сварочные швы
Каркасы представляют собой пласты лиофилизированных структур. Они изготовлены замораживанием/лиофилизацией раствора полимера. Это дает в результате открытопористую ячеистую структуру, в которой поры ориентированы в основном в направлении замораживания. Такую ориентацию можно увидеть на фиг.1.
Эта ориентация означает, что материал имеет очень низкую прочность на разрыв. Для укрепления материала добавляют сварные швы. Материал сжимается/расплавляется, таким образом теряя структуру, описанную выше, и приобретая прочность. Это означает, что материал может выдерживать напряжение при сшивании и обращении с ним. Это сваривание может быть выполнено с помощью импульсной сварки, лазерной сварки или подобной термической обработки.
Эти сварочные швы могут быть добавлены только по краям или в сетчатую структуру для еще большей прочности. Имея сетчатую структуру, можно будет обрезать каркас по размеру без потери прочности.
2-слойный каркас с различными временами разложения
Может оказаться желательным иметь слой компонента, который поддерживает клеточный рост и быстро разлагается, и слой, который остается дольше для поддержки и прочности. Каркас может быть 2-слойной структурой, изготовленной методом литья/лиофилизации 2-слойной структуры и последующего сваривания ее для прочности, или сваривания слоя, который разлагается медленнее, в сетчатую структуру и последующего присоединения слоя, который разлагается быстрее, к нему (например, сваркой). Комбинация полимеров, которая будет давать быстро/медленно разлагаемый состав, известна специалистам в данном уровне техники. Он также может быть изготовлен путем сварки каркаса, который разлагается быстрее, для опоры сетки, которая разлагается медленнее.
Установка каркаса на слой подложки
Еще одним способом укрепить каркас является прикрепление каркаса к более прочному материалу подложки.
Материал подложки может быть нетканым биоразлагаемым волокнистым материалом, например, покрытием из электроспряденного биоразлагаемого сложного полиэфира. Материал каркаса выполнен из материала, который быстро разлагается в организме (8 недель). Может оказаться желательным иметь материал подложки с более длительным временем разложения, например, 6 месяцев или дольше. Примерами материалов с более длительным временем разложения являются PLGA с содержанием гликолида >50 мол. %, PLGA с содержанием лактида >50 мол. %, поли(D,L-лактид), поли(L-лактид), поли(капролактон), поли(3-гидроксибутират). Другие подходящие материалы, которые могут быть применены, легко выбираются и применяются специалистом в данном уровне техники.
Каркас может быть зафиксирован на опоре с помощью сварки.
Усиление нитями
Путем включения сетки из биоразлагаемых швов можно усилить структуру каркаса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Каркасы
MPEG-PLGA 2-30 кДа с молярным соотношением G:L 50:50 растворяют до 4 % вес./объем в диоксане. Дно 10×10 см Alu-формы покрывают диоксаном и форму охлаждают до -5°C. Когда диоксан замерзает, 27 мл раствора полимера отливают на верхнюю часть замороженного слоя, и форму снова охлаждают до -5°C. Замороженный раствор полимера затем лиофилизируют и лиофилизированную структуру хранят в течение 5 дней в вакуумном эксикаторе.
2-слойный каркас с 2 различными временами разложения
MPEG-PLGA 2-30 кДа с молярным соотношением G:L 50:50 растворяют до 4% вес./объем в диоксане.
PDLLA растворяют до 4% вес./объем в диоксане.
Дно 10×10 см Alu-формы покрывают диоксаном и форму охлаждают до -5°C. Когда диоксан заморожен, 13,5 мл раствора PDLLA отливают на верхнюю часть замороженного слоя, и форму снова охлаждают до -5°C. Когда замерзает, 13,5 мл раствора MPEG-PLGA отливают на верхнюю часть замороженного слоя, и форму снова охлаждают до -5°C. Замороженную двухслойную структуру затем лиофилизируют. Каркас теперь состоит из 2 слоев с различными временами разложения. Слой MPEG-PLGA будет разлагаться за ~8 недель (in-vivo) и слой PDLLA будет разлагаться за ~12 месяцев (in-vivo).
Сварка
HAWO hpl450 устройство для импульсной сварки устанавливают на время сваривания 3, время охлаждения 7. Сварочный шов шириной 2 мм.
Электропрядение
2,5 г PLGA 10:90 (PURAC purasorb PLG® 1017) растворяют до 25 мл в гексафторизопропаноле и электропрядут в пласты.
6 г PDLLA (Phusis) растворяют в 20 г ацетона и электропрядут (1 кВ/см) в пласты.
ПРИМЕР 2
Эластичность
Относительно эластичности каркаса, который изображен на фигуре 6, когда каркас является сухим, он является жестким. С другой стороны, как только он намокает, он становится очень гибким. Это сравнивали с полипропиленовой сеткой, которая не становится менее жесткой после того, как подвергается воздействию воды.
ПРИМЕР 3
Определение прочности каркасов с и без сварных швов
Аппарат: прибор для испытания на растяжение Lloyd с динамометрическим датчиком 50 Н. Скорость: 100 мм/мин, разнос зажимного приспособления 20 мм.
Каркасы (40×40×2 мм) разрезают на полосы шириной 5 мм. На некоторых из них 3 мм сварной шов выполняют по всей длине полосы (этот сварной шов имеет толщину, приблизительно, 0,1 мм). Максимальное усилие и удлинение при разрыве измеряется как для немодифицированных, так и для сварных полос.
| Максимальная нагрузка, (Н) | Отклонение при разрыве, (мм) | % удлинения при разрыве | Н/м2 | Фунты на квадратный дюйм | |
| Немодифицированный | 0,91 | 10,28 | 51,39 | 9,13E+04 | 13 |
| Немодифицированный | 0,92 | 10,60 | 53,02 | 9,16E+04 | 13 |
| Немодифицированный | 0,70 | 8,74 | 43,71 | 6,99E+04 | 10 |
| Немодифицированный | 0,84 | 11,09 | 55,46 | 8,37E+04 | 12 |
| Сварной | 15,05 | 37,81 | 189,07 | 5,02E+07 | 7275 |
| Сварной | 13,51 | 59,49 | 297,44 | 4,50E+07 | 6533 |
| Сварной | 9,53 | 41,31 | 206,54 | 3,18E+07 | 4607 |
| Сварной | 11,19 | 44,28 | 221,38 | 3,73E+07 | 5409 |
ПРИМЕР 4
Применение мышечных биопсий в имплантате, включающем каркас
Мышечный биоптат помещают в контейнер с соответствующим буфером, например, средой для клеток, PBS и т.д. Клетки и мышечные волокна выделяют из биоптата с помощью измельчителя тканей (например, Sigma-Aldrich). Затем мышечную суспензию наносят на поверхность каркаса до имплантации.
В одной серии экспериментов мышечные волокна выделяли из биоптата либо путем рассечения мышц с помощью, например, скальпелей, либо путем растворения мышц с использованием ферментативной обработки, например, коллагеназы, для получения отдельных волокон с сателлитными клетками. Эти волокна наносят на поверхность каркаса перед имплантацией.
В еще одной серии экспериментов тканевые эксплантаты из мышечной ткани представляют собой таковыми из мышц, рассеченных в мышечное пюре при помощи, например, скальпелей, или где мышечные волокна выделены из оставшейся ткани с применением механического или ферментативного способов, или где мышечная ткань измельчена в мышечную суспензию, все из которых включают популяцию фибробластов, мышечные волокна, и мышечные клетки-предшественники в качестве сателлитных клеток, и миобласты.
ПРИМЕР 5
Способы раздавливания ткани
В некоторых вариантах осуществления по данному изобретению выращенные in vitro клетки могут быть высеяны на компонент, включающий каркас, до имплантации. Клетки для этой цели можно обеспечить путем взятия биопсии и извлечения и наращивания клеток in vitro до имплантации. Однако эта процедура является дорогостоящей и может иметь нормативные проблемы.
Вместо этого тканевое пюре (содержащее клетки), получаемое непосредственно в операционной, может быть нанесено компонентом, как описано далее.
Принцип действия состоит в том, что ткань из биоптата пропускается через сортирующую сетку под давлением. Это раздавливает образец в кашицу, которую можно нанести на каркас перед имплантацией
Сетка может быть круглой и может иметь усиление по краям, как показано на фиг.7.
Сетка может быть загружена в пластиковый шприц, который затем загружается тканью перед применением давления.
Однако компонент, где применяется более высокое давление, можно применять с преимуществом. Соответственно, можно применять металлический поршень в металлическом цилиндре, как показано на фигуре 8.
Альтернативно биоптат можно измельчать с помощью коммерческого измельчителя тканей или гомогенизатора с вращающимися ножами.
ПРИМЕР 6
Биоразлагаемый хирургический имплантат, включающий каркас, и, в частности, имплантат, применяемый для восстановления органов таза, примененный по данному изобретению, спроектирован для обеспечения нанесения клеток до имплантации. Дополнительно к формам, показанным в следующем примере, имплантату можно придать определенную форму для того, чтобы вставить в тазовую область.
Все модели могут быть усилены дополнительными сварными швами по краям в качестве усиления и точек крепления для швов при присоединении компонента к тазовому дну.
1. Клапан
Прямоугольный пласт нетканого материала с прикрепленным клапаном:
Клапан может быть любым из:
a) Тот же самый нетканый материал той же толщины. В данном случае компонент может быть вырезан из единого пласта материала. Линия сгиба может нуждаться в частичном разрезании или тиснении.
b) Тот же самый материал другой толщины. В данном случае клапан должен быть прикреплен к прямоугольнику подходящими средствами (предпочтительно сваркой).
c) Другой материал, но все еще нетканый, любой толщины. Как и ранее, клапан должен быть прикреплен.
d) Другой материал и другой процесс (например, лиофилизированный). Клапан прикрепляют сваркой.
Клетки наносят, клапан складывают поверх и конструкцию необязательно закрывают при помощи, например, швов, как показано ниже.
Клапан может быть частичным (фиг.9), полноразмерным (фиг.11 слева) или сегментированным (фиг.11 справа).
2. Трубка
Трубка, либо бесшовная, либо со швами.
Варианты для трубки похожи на таковые для клапана:
a) Единый материал, одна толщина. Может быть бесшовной или изготовленной с единственным сварным швом на прямоугольном пласте.
b) Единый материал, одна или две толщины. Два прямоугольника различной или одинаковой толщины, соединенные двумя сварными швами.
c) Два материала, одна или две толщины. Два прямоугольника из различных материалов с различной или одинаковой толщиной, соединенные двумя сварными швами.
Клетки вставляют в трубку и трубку сплющивают и имплантируют. Этап закрытия не нужен.
3. Карман
Вариант трубки и клапана. Прямоугольник приваривают к компоненту при помощи 3 швов. Все возможные варианты для клапана и трубки применяют и для карманов.
4. Абсорбирующий 3D-каркас
Гидрофильный 3D-каркас приваривают к сетке. Клетки наносят на каркас, и они поглощаются каркасом. Эта модель может рассматриваться как подгруппа других моделей. Модель может включать один каркас (как на фиг.14), зафиксированный на сетке, или 2 или более каркасов, зафиксированных на сетке.
5. Простой пласт
Простой прямоугольный пласт. Специальные приемы могут потребоваться для облегчения смачивания и/или прикрепления клеток к пласту:
1) Клей (например, фибрин) для прилипания клеток.
2) Модификация волокон для облегчения смачивания.
a) Коаксиальное прядение с наружным слоем из гидрофильного полимера.
b) Покрытие гидрофильным полимером.
c) Совместное прядение 2 различных волокон, одно из которых гидрофильное:
i) Смесь волокон.
ii) Слои, один гидрофильный, один гидрофобный.
iii) Градиент, начиная с гидрофобного и заканчивая гидрофильным.
iv) Все комбинации i, ii и iii.
3) Любая комбинация признаков из 1 и/или 2.
Пример пласта, модифицированного для облегчения смачивания, показан на фиг.15. Поли(ε-капролактон) является гидрофобным полимером, но с помощью покрытия волокна небольшим количеством (~3%) гидрофильного полимера (MPEG-PLGA 2-30 50DL) смачивание кровью ускоряется.
Все модели в примерах 1-5 могут дополнительно иметь плечи/выступы для прикрепления каркаса к структурам в тазовой области, как можно видеть на фиг.19.
ПРИМЕР 7
Применение имплантата для реконструктивной хирургии таза
Применяли рассасывающийся имплантат, состоящий из MPEG-PLGA (метоксиполиэтиленгликоль-сополимер молочной и гликолевой кислот). Его лиофилизировали и сделали более гидрофильным, чтобы способствовать прорастанию клеток и улучшению процесса восстановления. Фигура 16 иллюстрирует структуру.
Целью исследования было изучить биосовместимость и долговечность трех MPEG-PLGA имплантатов: простого, обогащенного внеклеточным матриксом (ECM, ACell, Inc.) или эстрогеном (эстрадиол, Sigma-Aldrich, Inc.).
Модель исследования, материалы и способы
Двадцать имплантатов каждого препарата размером 1×2 см были имплантированы подкожно на животе крыс, по два в каждой. В качестве контроля применяли участок симуляции с тупым отделением и одним стежком швом Vicryl. Эксплантацию проводили на 3 неделе (15 крыс) и на 8 неделе (15 крыс). Эксплантаты были зафиксированы в 10% растворе буфера и формалина, обработаны обычным образом для патологической гистологии и окрашены гематоксилином и эозином и по Гимза.
Воспаление, васкуляризацию и организацию соединительной ткани оценивали полуколичественно по шкале 0-4 (нет-значительно/тяжело). На 3 неделе производили оценку в имплантате. На 8 неделе там, где имплантат исчез, оценку производили в оставшейся грануляционной ткани на участке.
Толщину рубцовой ткани измеряли при 100х увеличении. Каждые 10 единиц измерения равнялись при этом увеличении 1,28 мм.
Два 3-недельных образца (оба из имплантатов, обогащенных эстрогеном) и один 8-недельный образец симуляции были исключены из-за ошибок, возникших при обработке для патологической гистологии.
Данные представлены как среднее значение и стандартная ошибка (SE) и проанализированы с помощью непараметрического дисперсионного анализа Крускала-Уоллиса с последующим U-тестом Манна-Уитни для парных сравнений между группами.
Результаты
На 3 неделе все имплантаты имели удовлетворительное прорастание клеток. Проросшие клетки были распределены по всему имплантату. Показатели воспаления значительно отличались между различными имплантатами. Уровни были выше в обогащенных ECM, чем в простых имплантатах (таблица 1). Показатели васкуляризации, организации соединительной ткани и толщины рубцовой ткани различались незначительно.
Никаких следов имплантатов не осталось на 8 неделе. Не было никакой реакции на инородное тело и признаков затяжной хронической воспалительной реакции. Возможные эффекты обогащения имплантата исчезли на 8 неделе (таблица 2). Никаких существенных различий не было найдено в толщине соединительной ткани после имплантатов по сравнению со срезами симуляции.
| Таблица 1 | ||||
| n | Воспаление | Наличие кровеносных сосудов | Соединительная ткань | Толщина |
| A: Простой имплантат 10 | 3,3 (0,15) | 1,9 (0,18) | 0,7 (0,26) | 12,8 (2,3) |
| B: Имплантат w/ ECM 10 | 3,9 (0,10)* | 1,5 (0,17) | 1,5 (0,27) | 11,8 (1,2) |
| C: Имплантат w/ эстроген 8 | 3,8 (0,16)** | 1,6 (0,26) | 1,3 (0,37) | 14,9 (2,0) |
| A по сравнению с B по сравнению с C p=0,02 | p=0,33 | p=0,12 | p=0,52 | |
| Оценки воспаления, наличия кровеносных сосудов и организации соединительной ткани после 3-х недель, 0-4 (нет-значительно/тяжело). Толщина в абсолютных значениях. Среднее (стандартная ошибка). *A по сравнению с B: p=0,02, ** A по сравнению с C: p=0,08 |
||||
| Таблица 2 | ||||
| n | Воспаление | Наличие кровеносных сосудов | Соединительная ткань | Толщина |
| A: Простой имплантат 10 | 1,4 (0,16) | 1,5 (0,17) | 3,0 (0,0) | 8,7 (1,3) |
| B: Имплантат w/ ECM 10 | 1,6 (0,16) | 1,6 (0,16) | 3,0 (0,0) | 9.1 (0.9) |
| C: Имплантат w/ эстроген 10 | 1,4 (0,16) | 1,6 (0,22) | 3,1 (0,1) | 11,1 (2,2) |
| D: Симуляция 9 | 1,0 (0,0) | 0,8 (0,20) | 3,0 (0,0) | 11,6 (2,3) |
| A по сравнению с B по сравнению с C p=0,72 | p=1,0 | p=1,0 | p=0,79 | |
| A по сравнению с B по сравнению с C по сравнению с D | p=1,0 | p=0,87 | ||
| Показатели воспаления, наличия кровеносных сосудов и организации соединительной ткани после 8-и недель, 0-4 (нет-значительно/тяжело). Толщина в абсолютных значениях. Среднее (стандартная ошибка). | ||||
Интерпретация результатов
Результаты на 3 неделе показали более прогрессивную стадию процесса заживления у имплантатов, обогащенных ECM. Начальные эффекты обогащения ECM исчезали на 8 неделю. Имплантаты MPEG-PLGA были полностью биосовместимыми, исчезая на 8 неделю и не оставляя следа. Качественно тканевой ответ на 8 неделе после имплантатов был таким же, как после хирургической симуляции.
Долговечность менее 8 недель была неожиданной и является слишком короткой для применения, как такового, в реконструктивной хирургии таза. Однако вследствие характеристик, представленных здесь, имплантат может играть роль в будущем в качестве носителя для клеток, например, стволовых клеток или клеток раздавленных мышц, способствуя их росту и не влияя на ткани хозяина.
Заключение
MPEG-PLGA во всех трех препаратах имели превосходную биосовместимость. Однако долговечность была неожиданно менее 8 недель, что делает имплантат лучшим образом подходящим для применения в тазовой реконструктивной хирургии при объединении с клетками, например, стволовыми клетками или раздавленной мышечной тканью, включающей миобласты и фибробласты.
ПРИМЕР 8
Применение аутогенных мышечных клеток и фрагментов мышечных волокон вместе с имплантатом для реконструктивной хирургии таза
Использовали рассасывающийся имплантат, состоящий из MPEG-PLGA (метоксиполиэтиленгликоль-сополимер молочной и гликолевой кислот). Он был лиофилизирован и сделан более гидрофильным, чтобы способствовать прорастанию клеток и улучшению процесса восстановления. Фигура 16 иллюстрирует структуру.
Целью исследования было изучить биосовместимость и долговечность полученных из мышц клеток и фрагментов мышечных волокон вместе с имплантатами MPEG-PLGA для поддержки регенерации мышцы.
Модель исследования, материалы и способы
Эксперименты на животных были проведены в виварии при институте Panum, Копенгаген, и одобрены Датской инспекцией экспериментов на животных разрешением № 2009/561-1585.
Экспериментальными животными были 30 исключенных из разведения самок крыс Sprague Dawley весом 300-420 г (Taconic, Дания). Размещение животных и уход за ними были предоставлены институтом Panum в соответствии с национальными руководствами.
Имплантаты были изготовлены из MPEG-PLGA. Три различных препарата были применены: A) чистый имплантат, B) имплантат с фрагментами аутогенных мышечных волокон (MFF), C) имплантат, обогащенный аутогенными мышечными клетками-предшественниками (MPC).
Каждый имплантат был протестирован в 10 крысах в течение 3 недель и в 10 крысах в течение 8 недель. Крысиная брюшная подкожная модель позволила тестирование двух частей имплантата на крысу.
Крысы были анестезированы при помощи Hypnorm/Dormicum. Был сделан разрез 4 см по средней линии на животе. После подкожного тупого отслоения имплантаты, имеющие размеры 10×20×1 мм, были размещены поверхностно на брюшную мышечную фасцию и прикреплены на месте одним стежком Vicryl 4-0 (Ethicon). Имплантаты были размещены продольно к средней линии. Кожа была закрыта с Vicryl 4-0. Антибиотикопрофилактика и обезболивающие препараты вводились в соответствии с ветеринарными рекомендациями. Крысы были подвергнуты эвтаназии на 3 и 8 неделе после имплантации.
Для имплантатов с MFF был сделан 2-см разрез на задней конечности крысы, и был взят мышечный биоптат диаметром 4 мм непосредственно перед абдоминальной хирургической операцией. MFF были подготовлены на стерильных чашках Петри двумя скальпелями путем изрезания биоптата в мелкую кашицу в капле физиологического раствора, а кожа была закрыта, как описано выше. Имплантат был помещен на MFF, которые немедленно прикреплялись к имплантату. При имплантации покрытая MFF сторона имплантата обращена к фасции.
MPC были выращены в Interface Biotech A/S, Дания, из биоптатов, полученных, как описано выше, но за 2 недели до хирургической операции.
Выделение и культивирование полученных из мышц клеток
За две недели до имплантации мышечные биоптаты были получены, как описано выше. Биопсии были перенесены в стерильную транспортную среду и оставлены на ночь при 4°C. Выделение проводили по модифицированному протоколу “Gene Delivery to Muscle” {Springer, 2002 250 /id}. Коротко: биоптат тщательно измельчали; 0,5 мл коллагеназы/диспазы/CaCl2 добавили и измельчение продолжали; смесь инкубировали при 37°С в течение 1 часа, центрифугировали в течение 5 минут при 350×g при комнатной температуре, супернатант удаляли, клетки вновь ресуспендировали в 10 мл среды культивирования на основе среды F-10 и размещали в покрытые коллагеном колбы. Клетки высевали в 25 см2 колбы.
Через 7 дней культивирования клетки трипсинизировали и перенесли в покрытые коллагеном колбы. Еще через 7 дней культивирования клетки трипсинизировали, провели подсчет клеток и высеяли в концентрации 2×106 клеток на имплантат. Клетки высеяли на имплантаты за 24 часа до имплантации, и имплантаты с клетками инкубировали в течение ночи и отправляли в виварий.
Имплантаты с окружающей по всей толщине тканью хозяина собирали, фиксировали в 10% буферном растворе формалина и в плановом порядке обрабатывали для патологической гистологии и иммуногистохимии. Толщина среза 5 мкм.
Характер роста и выживаемость MPC и MFF оценили иммуногистохимическим окрашиванием. Для выявления клеток скелетных мышц в отличие от гладкомышечных клеток применили два различных первичных антитела: моноклональное мышиное антитело к десмину человека (1:100, клон D33, DAKO, Дания) и моноклональное мышиное антитело к α-актину гладких мышц человека (SMA) (1:100, клон 1A4, DAKO). Известная перекрестная специфичность антител к эквивалентным белками у крыс была подтверждена позитивным и негативным контролями. Десмин окрашивал цитоплазму скелетных и гладкомышечных клеток, в то время как SMA окрашивал цитоплазму гладкомышечных клеток, но не клеток скелетных мышц. В качестве вторичных антител был применен набор Histostain ®-Plus (InVitrogen). AEC или DAB использовали в качестве хромогена для определения пероксидазной активности. Клеточные ядра были контрастно окрашены гематоксилином.
Если 8-недельные срезы, окрашенные десмином, были отрицательными относительно MPC и MFF, дополнительные 6 срезов с интервалом 30 мкм из этого образца были окрашены для того, чтобы убедиться, что нет остатков MPC или MFF в близлежащих областях образца.
Результаты
Хирургическая операция хорошо переносилась всеми животными. Эрозии или признаки инфекции не были замечены, и не было никаких признаков инкапсуляции имплантата.
После эксплантации все имплантаты были видны при макроскопическом исследовании на 3 неделе, и ни одного на 8 неделе. В последнем случае крошечная гранулема, представляющая шовный материал, была единственным показателем участка имплантации.
Характер роста установили иммуногистохимически с десмином и SMA.
На 3 неделе модель роста MPC и MFF была качественно другой при окрашивании десмином, поэтому количественная оценка десмин+ клеток не проводилось. Отрицательное окрашивание на SMA десмин+ структур в соответствующих срезах установило, что они были скелетномышечного типа.
Десмин+ клетки, как наблюдалось, были тонко распределены внутри имплантатов, на которые посеяли MPC. MFF идентифицировали как фрагментированную мышечную ткань с исчерченностью, неравномерно распределенной под имплантатами (фиг.17). MPEG-PLGA имел неспецифическое окрашивание десмином в различной степени, поэтому морфология была ключевым фактором в интерпретации окрашивания.
В одном из чистых имплантатов десмин+ клетки были обнаружены в конфигурации, характерной для имплантатов, засеянных MPC, однако в меньшей степени.
На 8 неделе MFF выжили и были определены как фрагментированная поперечно-полосатая мышечная ткань у 6 из 10 образцов (фиг.18). В дальнейшем два были сомнительными, так как морфология и расположение десмин+ структур отличались: это могут быть артефакты, представляющие искаженные/скрученные кожные мышцы. В одном образце была найдена однородная слабо положительная область, вероятно, представляющая мертвые MFF, съеденные макрофагами. Один образец был полностью отрицательным.
MPEG-PLGA сами по себе и MPC исчезли на 8 неделю.
В заключение MPEG-PLGA во всех трех препаратах имел превосходную биосовместимость и исчез в течение 8 недель в данной брюшной крысиной модели. Когда аутогенные мышечные клетки-предшественники были объединены с MPEG-PLGA, скелетные мышечные клетки идентифицировались через 3 недели, но не через 8 недель. В противоположность, скелетные мышцы идентифицировали через 3 и 8 недель, когда MPEG-PLGA сочетался с фрагментированными мышечными волокнами. Это показывает высокий уровень выживаемости для мышечных волокон в сочетании с MPEG-PLGA.
Claims (14)
1. Биоразлагаемый хирургический имплантат для поддержки, наращивания и регенерации живой ткани субъекта, страдающего от пролапса органов таза, включающий
a) синтетический биоразлагаемый однородный пласт каркаса,
b) один или более биоразлагаемый усиливающий элемент, выполненный из сварочных швов синтетического биоразлагаемого гомогенного пласта каркаса.
c) образец тканевых эксплантатов в указанном каркасе, причем указанный тканевый эксплантат выполнен из мышечной ткани, при этом имплантат образован в виде трубки и/или включает клапан и/или карман, подходящий для нанесения суспензии образца клеток или тканевых эксплантатов на указанный имплантат,
при этом указанный синтетический биоразлагаемый однородный пласт каркаса представляет собой полимер общей формулы:
А-О-(CHR1CHR2O)n-B,
где
А представляет собой остаток сополимера лактида и гликолида с молекулярным весом, по меньшей мере 4000 г/моль, при этом молярное отношение (i) лактидных элементарных звеньев и (ii) гликолидных элементарных звеньев в остатке сополимера лактида и гликолида находится в диапазоне от 80:20 до 10:90,
В представляет собой либо остаток сополимера лактида и гликолида, как определено для А, или выбран из группы, состоящей из водорода, C1-6-алкила и защитных групп гидроксила,
один из R1 и R2 внутри каждого элементарного звена -(CHR1CHR2O)- выбран из водорода и метила, и другой из R1 и R2 внутри того же элементарного звена -(CHR1CHR2O)- представляет собой водород,
n представляет среднее число элементарных звеньев -(CHR1CHR2O)- в полимерной цепи и является целым числом в диапазоне 10-1000; и где
молярное отношение (iii) элементарных звеньев полиалкиленгликоля - (CHR1CHR2O)- к общему количеству (i) лактидных элементарных звеньев и (ii) гликолидных элементарных звеньев в остатке(ах) сополимера лактида и гликолида составляет самое большее 20:80;
и где молекулярный вес сополимера составляет по меньшей мере 10000 г/моль, предпочтительно по меньшей мере 15000 г/моль.
a) синтетический биоразлагаемый однородный пласт каркаса,
b) один или более биоразлагаемый усиливающий элемент, выполненный из сварочных швов синтетического биоразлагаемого гомогенного пласта каркаса.
c) образец тканевых эксплантатов в указанном каркасе, причем указанный тканевый эксплантат выполнен из мышечной ткани, при этом имплантат образован в виде трубки и/или включает клапан и/или карман, подходящий для нанесения суспензии образца клеток или тканевых эксплантатов на указанный имплантат,
при этом указанный синтетический биоразлагаемый однородный пласт каркаса представляет собой полимер общей формулы:
А-О-(CHR1CHR2O)n-B,
где
А представляет собой остаток сополимера лактида и гликолида с молекулярным весом, по меньшей мере 4000 г/моль, при этом молярное отношение (i) лактидных элементарных звеньев и (ii) гликолидных элементарных звеньев в остатке сополимера лактида и гликолида находится в диапазоне от 80:20 до 10:90,
В представляет собой либо остаток сополимера лактида и гликолида, как определено для А, или выбран из группы, состоящей из водорода, C1-6-алкила и защитных групп гидроксила,
один из R1 и R2 внутри каждого элементарного звена -(CHR1CHR2O)- выбран из водорода и метила, и другой из R1 и R2 внутри того же элементарного звена -(CHR1CHR2O)- представляет собой водород,
n представляет среднее число элементарных звеньев -(CHR1CHR2O)- в полимерной цепи и является целым числом в диапазоне 10-1000; и где
молярное отношение (iii) элементарных звеньев полиалкиленгликоля - (CHR1CHR2O)- к общему количеству (i) лактидных элементарных звеньев и (ii) гликолидных элементарных звеньев в остатке(ах) сополимера лактида и гликолида составляет самое большее 20:80;
и где молекулярный вес сополимера составляет по меньшей мере 10000 г/моль, предпочтительно по меньшей мере 15000 г/моль.
2. Биоразлагаемый хирургический имплантат по п.1, где указанный синтетический биоразлагаемый однородный пласт каркаса является гидрофильным.
3. Биоразлагаемый хирургический имплантат по п.1, где указанный синтетический биоразлагаемый однородный пласт каркаса имеет способность в течение 5 минут, например, в течение 2 минут при 30°C, поглощать воду в количестве по меньшей мере 10%, например, по меньшей мере 20%, например, по меньшей мере 30%, например, по меньшей мере 50% от объема каркаса.
4. Биоразлагаемый хирургический имплантат по п.1, где объемный % указанной усиливающей детали составляет менее 40% от имплантата.
5. Биоразлагаемый хирургический имплантат по п.1, где указанный синтетический биоразлагаемый однородный пласт каркаса получен с помощью лиофилизации.
6. Биоразлагаемый хирургический имплантат по п.1, где указанный синтетический биоразлагаемый однородный пласт каркаса является полностью разлагаемым в течение 1-48 месяцев применения in situ.
7. Биоразлагаемый хирургический имплантат по п.1, где указанный биоразлагаемый усиливающий элемент способствует клеточному прикреплению и прорастанию клеток, происходящих от тканевых эксплантатов.
8. Биоразлагаемый хирургический имплантат по п.1, где указанный усиливающий биоразлагаемый элемент выполнен из полимера сополимера лактида и гликолида PLGA, например, полимера, где молярное отношение (i) лактидных элементарных звеньев и (ii) гликолидных элементарных звеньев в остатке сополимера лактида и гликолида находится в диапазоне от 90:10 до 10:90.
9. Биоразлагаемый хирургический имплантат по п.1, где весовое процентное отношение (iii) элементарных звеньев полиалкиленгликоля -(CHR1CHR2O)- к общему количеству (i) лактидных элементарных звеньев и (ii) гликолидных элементарных звеньев в остатке(ах) сополимера лактида и гликолида находится в диапазоне 4%-10% вес./вес.
10. Биоразлагаемый хирургический имплантат по п.1, где указанный синтетический биоразлагаемый однородный пласт каркаса получен с помощью лиофилизации раствора, включающего биоразлагаемый полимер в растворе.
11. Биоразлагаемый хирургический имплантат по п.1, при этом имплантат дополнительно включает в указанном каркасе один или более компонентов, которые облегчают клеточную адгезию и/или прорастание для регенерации ткани, например, компонент, выбранный из группы, состоящей из: эстрогена, производных эстрогена, тромбина, порошка ЕСМ, хондроитинсульфата, гиалуронана, гиалуроновой кислоты (НА), гепаринсульфата, гепарансульфата, дерматансульфата, факторов роста, фибрина, фибронектина, эластина, коллагена, например, коллагена типа I и/или типа II, желатина и аггрекана или любого подходящего компонента внеклеточного матрикса.
12. Биоразлагаемый хирургический имплантат по п.1, при этом имплантат дополнительно включает в указанном каркасе один или более компонентов, выбранных из группы, состоящей из факторов роста, например, инсулиноподобных факторов роста (IGF), например, IGF-1 или IGF-2, или трансформирующих факторов роста (TGF), например, TGF-альфа или TGF-бета, или факторов роста фибробластов (FGF), например, FGF-1 или FGF-2, или тромбоцитарных факторов роста (PDGF), например, PDGF-AA, PDGF-BB или PDGF-AB, или фактора роста нервов (NGF), или человеческого гормона роста (hGH) и механического фактора роста (MGF).
13. Биоразлагаемый хирургический имплантат по п.1, при этом имплантат включает две или более отдельных частей синтетических биоразлагаемых однородных пластов каркаса, прикрепленных к усиливающему элементу, например, сетке из отличающегося полимера.
14. Биоразлагаемый хирургический имплантат по п. 1, при этом имплантат включает два или более плечей или выступов для прикрепления к структурам в месте имплантации, например, в области таза.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DKPA200970054 | 2009-07-06 | ||
| DKPA200970054 | 2009-07-06 | ||
| PCT/DK2010/050176 WO2011003422A1 (en) | 2009-07-06 | 2010-07-06 | Biodegradable scaffold for soft tissue regeneration and use thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012103838A RU2012103838A (ru) | 2013-08-20 |
| RU2538688C2 true RU2538688C2 (ru) | 2015-01-10 |
Family
ID=41647195
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2012103838/15A RU2538688C2 (ru) | 2009-07-06 | 2010-07-06 | Биоразлагаемый каркас для регенерации мягких тканей и его применение |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20120165957A1 (ru) |
| EP (1) | EP2451490A1 (ru) |
| CN (1) | CN102470189A (ru) |
| BR (1) | BR112012000114A2 (ru) |
| IN (1) | IN2012DN00368A (ru) |
| RU (1) | RU2538688C2 (ru) |
| WO (1) | WO2011003422A1 (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2761018C1 (ru) * | 2018-05-24 | 2021-12-02 | Декслево Инк. | Композиция для восстановления ткани и способ ее изготовления |
| RU2800928C2 (ru) * | 2019-06-20 | 2023-08-01 | Датум Дентал Лтд. | Имплантат, содержащий коллагеновую мембрану |
Families Citing this family (94)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6902932B2 (en) | 2001-11-16 | 2005-06-07 | Tissue Regeneration, Inc. | Helically organized silk fibroin fiber bundles for matrices in tissue engineering |
| US20050137687A1 (en) | 2003-12-23 | 2005-06-23 | Sadra Medical | Heart valve anchor and method |
| US7959666B2 (en) * | 2003-12-23 | 2011-06-14 | Sadra Medical, Inc. | Methods and apparatus for endovascularly replacing a heart valve |
| DE102005003632A1 (de) | 2005-01-20 | 2006-08-17 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Katheter für die transvaskuläre Implantation von Herzklappenprothesen |
| US7896915B2 (en) | 2007-04-13 | 2011-03-01 | Jenavalve Technology, Inc. | Medical device for treating a heart valve insufficiency |
| BR112012021347A2 (pt) | 2008-02-26 | 2019-09-24 | Jenavalve Tecnology Inc | stent para posicionamento e ancoragem de uma prótese valvular em um local de implantação no coração de um paciente |
| US9044318B2 (en) | 2008-02-26 | 2015-06-02 | Jenavalve Technology Gmbh | Stent for the positioning and anchoring of a valvular prosthesis |
| US9204954B2 (en) | 2008-12-15 | 2015-12-08 | Allergan, Inc. | Knitted scaffold with diagonal yarn |
| RU2015108720A (ru) | 2008-12-15 | 2015-08-10 | Аллерган, Инк. | Вязаная хирургическая имплантируемая сетка |
| US9204953B2 (en) | 2008-12-15 | 2015-12-08 | Allergan, Inc. | Biocompatible surgical scaffold with varying stretch |
| US9326840B2 (en) | 2008-12-15 | 2016-05-03 | Allergan, Inc. | Prosthetic device and method of manufacturing the same |
| US9308070B2 (en) * | 2008-12-15 | 2016-04-12 | Allergan, Inc. | Pliable silk medical device |
| WO2010099463A2 (en) | 2009-02-27 | 2010-09-02 | University Of Pittsburgh-Of The Commonwealth System Of Higher Education | Joint bioscaffolds |
| WO2011080588A2 (en) | 2009-12-30 | 2011-07-07 | Vivasure Medical Limited | Closure system and uses thereof |
| BR112012029896A2 (pt) | 2010-05-25 | 2017-06-20 | Jenavalve Tech Inc | válcula cardíaca protética para endoprótese e endoprótese |
| MY168863A (en) | 2010-06-17 | 2018-12-04 | Univ Washington | Biomedical patches with aligned fibers |
| WO2012014205A1 (en) | 2010-07-27 | 2012-02-02 | Technion Research & Development Foundation Ltd. | Isolated mesenchymal progenitor cells and extracellular matrix produced thereby |
| EP2603185B1 (en) * | 2010-08-12 | 2016-10-05 | Nanyang Technological University | A glaucoma valve comprising a degradable polymer with a steroid |
| ITMI20110386A1 (it) * | 2011-03-11 | 2012-09-12 | Antonio Sambusseti | Cuffia riassorbibile per l'ampliamento vescicale in pazienti con bassa compliance |
| US10350431B2 (en) * | 2011-04-28 | 2019-07-16 | Gt Medical Technologies, Inc. | Customizable radioactive carriers and loading system |
| EP2550982A1 (en) * | 2011-07-27 | 2013-01-30 | Technion Research & Development Foundation Ltd. | Devices for surgical applications |
| WO2013026937A1 (en) * | 2011-08-25 | 2013-02-28 | Universität Zürich Prorektorat Mnw | A device for repair surgery of cylindrical organs, particularly ruptured tendons |
| WO2013106677A1 (en) * | 2012-01-13 | 2013-07-18 | The General Hospital Corporation | Isolated human lung progenitor cells and uses thereof |
| US9820839B2 (en) | 2012-04-10 | 2017-11-21 | Ethicon, Inc. | Single plane tissue repair patch having a locating structure |
| US9820837B2 (en) | 2012-04-10 | 2017-11-21 | Ethicon, Inc. | Single plane tissue repair patch |
| US9820838B2 (en) | 2012-04-10 | 2017-11-21 | Ethicon, Inc. | Single plane tissue repair patch |
| CN102631708B (zh) * | 2012-05-17 | 2014-01-15 | 重庆市畜牧科学院 | 盆底补片复合生物材料的制备方法及其产品 |
| US20130317540A1 (en) * | 2012-05-22 | 2013-11-28 | Krasimira Hristov | Universal bioabsorbable nasal implant kit |
| US10130346B2 (en) * | 2012-07-24 | 2018-11-20 | Omrix Biopharmaceuticals Ltd. | Device and method for the application of a curable fluid composition to a bodily organ |
| EP2878314B1 (en) * | 2012-07-27 | 2017-11-29 | Association For The Advancement Of Tissue Engineering And Cell Based Technologies & Therapies (A4TEC) | Polymeric mesh with selective permeability, for the repair and regeneration of tissues |
| BR112015006301B1 (pt) | 2012-09-21 | 2021-06-15 | Washington University | Sistema para produzir uma estrutura que inclui uma pluralidade de fibras, estrutura e método para reparar um defeito de um substrato |
| CN102920530A (zh) * | 2012-11-09 | 2013-02-13 | 无锡中科光远生物材料有限公司 | 防粘连可吸收疝气补片 |
| BR112015009502B1 (pt) * | 2012-11-14 | 2021-08-17 | Medprin Regenerative Medical Technologies Co., Ltd | Membrana fibrosa, membrana fibrosa compósita, método de preparação de membrana fibrosa, membrana implantável, método de preparação de membrana implantável, dispositivo médico implantável, mem brana fibrosa antiadesão, método de preparação de membrana fibrosa e uso de membrana fibrosa |
| WO2014125381A2 (en) | 2013-02-12 | 2014-08-21 | Ossdsign Ab | Mosaic implants, kits and methods for correcting bone defects |
| US9220597B2 (en) | 2013-02-12 | 2015-12-29 | Ossdsign Ab | Mosaic implants, kits and methods for correcting bone defects |
| US9492683B2 (en) | 2013-03-15 | 2016-11-15 | Gammatile Llc | Dosimetrically customizable brachytherapy carriers and methods thereof in the treatment of tumors |
| PL2983616T3 (pl) * | 2013-04-08 | 2019-05-31 | Regentys Corp | Sposób i kompozycja do leczenia nieswoistego zapalenia jelit bez kolektomii |
| CN105377154B (zh) * | 2013-07-09 | 2020-05-01 | Ams研究有限责任公司 | 包含细胞外基质材料的生物可降解产品和用于治疗盆底疾病的方法 |
| US11306326B2 (en) | 2013-08-23 | 2022-04-19 | Rutgers, The State University Of New Jersey | Biologically active synthetic nanoparticle constructs and methods of use thereof |
| JP6563394B2 (ja) | 2013-08-30 | 2019-08-21 | イェーナヴァルヴ テクノロジー インコーポレイテッド | 人工弁のための径方向に折り畳み自在のフレーム及び当該フレームを製造するための方法 |
| US20150104494A1 (en) * | 2013-10-11 | 2015-04-16 | Ohio State Innovation Foundation | Methods for repair of ear canal tissue defects |
| US10130457B2 (en) | 2014-03-05 | 2018-11-20 | Tela Bio, Inc. | Surgical attachment device |
| US10588732B2 (en) | 2014-03-07 | 2020-03-17 | IconLab USA, Inc. | Multipurpose implant with modeled surface structure for soft tissue reconstruction |
| RU2699811C1 (ru) | 2014-03-07 | 2019-09-11 | Айконлаб Инк. | Многоцелевой имплантат с заданной структурой поверхности для реконструкции мягких тканей |
| EP3119448B1 (en) | 2014-03-21 | 2020-04-22 | University of Pittsburgh- Of the Commonwealth System of Higher Education | Methods for preparation of a terminally sterilized hydrogel derived from extracellular matrix |
| GB2526542A (en) * | 2014-05-26 | 2015-12-02 | David Anthony Waghorn | Stem cell implanter and absorbable stem cell implant |
| TWI549702B (zh) * | 2014-07-22 | 2016-09-21 | 國立臺灣大學 | 由生物可分解之沾黏材料構成之醫療品 |
| KR20170043110A (ko) | 2014-08-14 | 2017-04-20 | 오에스에스디자인 아베 | 뼈 결함 교정을 위한 뼈 이식 |
| WO2016068292A1 (ja) * | 2014-10-31 | 2016-05-06 | 富士フイルム株式会社 | 管状構造物、管状構造物を製造するための装置、及び管状構造物の製造方法 |
| US11141142B2 (en) * | 2014-12-15 | 2021-10-12 | Vivasure Medical Limited | Implantable sealable member with mesh layer |
| WO2016096932A1 (en) | 2014-12-15 | 2016-06-23 | Vivasure Medical Limited | Closure apparatus with flexible sealable member and flexible support member |
| CN104524633B (zh) * | 2014-12-29 | 2018-05-11 | 东莞颠覆产品设计有限公司 | 一种基于肌肉的神经支架及其制备方法 |
| MA41413A (fr) * | 2015-01-30 | 2017-12-05 | Antonio Sambusseti | Greffon résorbable et biocompatible en pga à implanter consécutivement à l'excision de la plaque ipp |
| US9821174B1 (en) | 2015-02-06 | 2017-11-21 | Gammatile Llc | Radioactive implant planning system and placement guide system |
| CN104706442B (zh) * | 2015-03-16 | 2017-08-01 | 克力木·阿不都热依木 | 食管裂孔疝专用补片 |
| ES2621191B1 (es) * | 2015-03-25 | 2018-10-10 | Fundación Centro De Cirugía De Mínima Invasión Jesús Usón | Soporte quirúrgico con actividad biológica inmunomoduladora |
| CN106039405A (zh) * | 2015-04-08 | 2016-10-26 | 上海宏创医疗科技有限公司 | 一种细胞外基质复合生物补片的制备方法 |
| CN107530168B (zh) | 2015-05-01 | 2020-06-09 | 耶拿阀门科技股份有限公司 | 在心脏瓣膜替换中具有降低的起搏器比例的装置和方法 |
| US10307237B2 (en) * | 2015-05-15 | 2019-06-04 | Lifecell Corporation | Tissue matrices and methods of treatment |
| CN104963097A (zh) * | 2015-06-17 | 2015-10-07 | 广州迈普再生医学科技有限公司 | 一种增强电纺纤维膜及其制备方法 |
| CN104984396B (zh) * | 2015-06-29 | 2018-03-16 | 重庆市畜牧科学院 | 有机‑无机核鞘结构复合生物材料的制备方法及产品 |
| US10213284B2 (en) | 2015-06-30 | 2019-02-26 | Tela Bio, Inc. | Corner-lock stitch patterns |
| FR3039057B1 (fr) * | 2015-07-20 | 2017-08-11 | Edouard Pelissier | Protheses de reparation de hernies |
| WO2017015421A1 (en) | 2015-07-21 | 2017-01-26 | Tela Bio, Inc. | Compliance control stitching in substrate materials |
| WO2017031167A1 (en) * | 2015-08-17 | 2017-02-23 | The Johns Hopkins University | Fiber-hydrogel composite surgical meshes for tissue repair |
| US20180296313A1 (en) * | 2015-09-23 | 2018-10-18 | Novus Scientific Ab | Three-dimensional medical implant for regeneration of soft tissue |
| US11311650B2 (en) * | 2015-09-30 | 2022-04-26 | The Administrators Of The Tulane Educational Fund | Devices for supporting regeneration of body tissues, and methods of making and using them |
| EP3380046B1 (en) | 2015-11-24 | 2021-07-14 | OssDsign AB | Bone implants and methods for correcting bone defects |
| US11311280B2 (en) | 2015-12-15 | 2022-04-26 | Vivasure Medical Limited | Arteriotomy closure apparatus with slotted shoe for advantageous pressure distribution |
| CN105616040A (zh) * | 2016-03-18 | 2016-06-01 | 广州市健齿生物科技有限公司 | 一种多孔人工颞下颌关节结构及制造方法 |
| US9820843B2 (en) | 2016-04-26 | 2017-11-21 | Tela Bio, Inc. | Hernia repair grafts having anti-adhesion barriers |
| AU2016406314B2 (en) * | 2016-05-12 | 2021-09-23 | Acera Surgical, Inc. | Tissue substitute materials and methods for tissue repair |
| US10632228B2 (en) * | 2016-05-12 | 2020-04-28 | Acera Surgical, Inc. | Tissue substitute materials and methods for tissue repair |
| EP3454795B1 (en) | 2016-05-13 | 2023-01-11 | JenaValve Technology, Inc. | Heart valve prosthesis delivery system for delivery of heart valve prosthesis with introducer sheath and loading system |
| US10888710B1 (en) | 2016-11-29 | 2021-01-12 | Gt Medical Technologies, Inc. | Transparent loading apparatus |
| CN110392557A (zh) | 2017-01-27 | 2019-10-29 | 耶拿阀门科技股份有限公司 | 心脏瓣膜模拟 |
| US11426266B2 (en) | 2017-03-29 | 2022-08-30 | Novus Scientific Ab | Medical implant |
| GB201708233D0 (en) * | 2017-05-23 | 2017-07-05 | Orthox Ltd | Implantable tissue repair devices and methods for manufacturing the same |
| ES2695629B2 (es) * | 2017-07-03 | 2022-05-10 | Viscofan Sa | Parche para la regeneración de tejidos biológicos |
| EP3761963A4 (en) | 2018-03-09 | 2021-12-08 | Tela Bio, Inc. | SURGICAL REPAIR TRANSPLANT |
| IT201800007499A1 (it) * | 2018-07-25 | 2020-01-25 | Angiologica Bm Srl | Protesi parietale di supporto, in particolare per prolassi pelvici |
| BR112021006348A2 (pt) * | 2018-10-03 | 2021-07-06 | Estab Labs Sa | andaime para dispositivos médicos implantáveis e mé-todos de uso dos mesmos |
| US11701232B2 (en) * | 2019-01-15 | 2023-07-18 | University Of Maryland, College Park | Acellular bioactive scaffold device and methods of fabrication and treatment relating thereto |
| US10981018B2 (en) | 2019-02-14 | 2021-04-20 | Gt Medical Technologies, Inc. | Radioactive seed loading apparatus |
| WO2020185688A1 (en) | 2019-03-08 | 2020-09-17 | Tela Bio, Inc. | Textured medical textiles |
| US11298220B2 (en) | 2019-05-03 | 2022-04-12 | Lifecell Corporation | Breast treatment device |
| CN110559481A (zh) * | 2019-11-04 | 2019-12-13 | 深港产学研基地 | 用于妇科骨盆底肌肉力学修复的外科植入材料 |
| CN115135350A (zh) * | 2019-12-13 | 2022-09-30 | W.L.戈尔及同仁股份有限公司 | 增强的生物聚合物 |
| CN113576712A (zh) | 2020-04-30 | 2021-11-02 | 财团法人工业技术研究院 | 组织修复装置及其的使用方法 |
| TWI762291B (zh) * | 2020-04-30 | 2022-04-21 | 財團法人工業技術研究院 | 組織修復裝置及其之使用方法 |
| US11957815B2 (en) | 2020-07-17 | 2024-04-16 | Datt Life Sciences Private Limited | Ready to use biodegradable and biocompatible cell-based nerve conduit for nerve injury and a method of preparation thereof |
| US11826955B2 (en) | 2020-07-24 | 2023-11-28 | City University Of Hong Kong | Magnetically-drivable microrobot |
| CN113017905B (zh) * | 2021-05-24 | 2021-08-27 | 广州新诚生物科技有限公司 | 一种植入物 |
| IT202100017285A1 (it) | 2021-06-30 | 2022-12-30 | Evolving Healthcare S R L | Scaffold per la riparazione di difetti erniari |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2215542C2 (ru) * | 1998-02-23 | 2003-11-10 | Массачусетс Инститьют Оф Текнолоджи | Биоразлагающиеся полимеры, способные к восстановлению формы |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6495152B2 (en) | 2000-08-18 | 2002-12-17 | Tepha, Inc. | Sulfur containing polyhydroxyalkanoate compositions and method of production |
| DE10046119A1 (de) | 2000-09-15 | 2002-03-28 | Inst Textil & Faserforschung | Medizintechnisches bioresorbierbares Implantat, Verfahren zur Herstellung und Verwendung |
| CA2777791A1 (en) | 2000-09-18 | 2002-03-21 | Organogenesis Inc. | Methods for treating a patient using a bioengineered flat sheet graft prostheses |
| US6599323B2 (en) | 2000-12-21 | 2003-07-29 | Ethicon, Inc. | Reinforced tissue implants and methods of manufacture and use |
| US7368124B2 (en) | 2003-03-07 | 2008-05-06 | Depuy Mitek, Inc. | Method of preparation of bioabsorbable porous reinforced tissue implants and implants thereof |
| US8197837B2 (en) * | 2003-03-07 | 2012-06-12 | Depuy Mitek, Inc. | Method of preparation of bioabsorbable porous reinforced tissue implants and implants thereof |
| US11395865B2 (en) * | 2004-02-09 | 2022-07-26 | DePuy Synthes Products, Inc. | Scaffolds with viable tissue |
| WO2006020922A2 (en) | 2004-08-13 | 2006-02-23 | Mast Biosurgery Ag | Surgical prosthesis having biodegradable and nonbiodegradable regions |
| CN101137402B (zh) | 2004-10-20 | 2012-01-11 | 伊西康公司 | 供医疗装置用的加固可吸收多层织物及其制备方法 |
| PL1674048T3 (pl) | 2004-12-23 | 2010-03-31 | Novus Scientific Ab | Implant siatkowy do stosowania do rekonstrukcji ubytków tkanki miękkiej |
| US8709023B2 (en) | 2007-07-17 | 2014-04-29 | Poly-Med, Inc. | Absorbable / biodegradable composite yarn constructs and applications thereof |
| ES2338820T3 (es) * | 2006-03-09 | 2010-05-12 | Coloplast A/S | Copolimeros en bloque hidrofilos degradables con biocompatibilidad mejorada para la regeneracion de tejidos blandos. |
| JP2009533568A (ja) | 2006-04-10 | 2009-09-17 | エシコン・インコーポレイテッド | 医療器具に使用するための吸収性強化複層布および製造方法 |
| US20080082177A1 (en) | 2006-09-29 | 2008-04-03 | Chunlin Yang | Device for tissue reinforcement having microporous and macroporous structures |
| US8828092B2 (en) * | 2007-01-02 | 2014-09-09 | Boston Scientific Scimed, Inc. | Reinforced mesh for retropubic implants |
| EP2121061A2 (en) * | 2007-03-07 | 2009-11-25 | Coloplast A/S | Mesh comprising ecm |
| MX2009013725A (es) * | 2007-06-15 | 2010-01-25 | Ethicon Inc | Composiciones de fragmentos de tejido para el tratamiento de la incontinencia. |
-
2010
- 2010-07-06 EP EP10730698A patent/EP2451490A1/en not_active Withdrawn
- 2010-07-06 WO PCT/DK2010/050176 patent/WO2011003422A1/en active Application Filing
- 2010-07-06 US US13/382,359 patent/US20120165957A1/en not_active Abandoned
- 2010-07-06 IN IN368DEN2012 patent/IN2012DN00368A/en unknown
- 2010-07-06 CN CN2010800303911A patent/CN102470189A/zh active Pending
- 2010-07-06 BR BR112012000114A patent/BR112012000114A2/pt not_active Application Discontinuation
- 2010-07-06 RU RU2012103838/15A patent/RU2538688C2/ru not_active IP Right Cessation
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2215542C2 (ru) * | 1998-02-23 | 2003-11-10 | Массачусетс Инститьют Оф Текнолоджи | Биоразлагающиеся полимеры, способные к восстановлению формы |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2761018C1 (ru) * | 2018-05-24 | 2021-12-02 | Декслево Инк. | Композиция для восстановления ткани и способ ее изготовления |
| RU2805364C2 (ru) * | 2019-03-04 | 2023-10-16 | Ганс Ульрих БЕР | Биоразлагаемый сетчатый имплантат для восстановления мягких тканей, в частности герниопластики |
| RU2800928C2 (ru) * | 2019-06-20 | 2023-08-01 | Датум Дентал Лтд. | Имплантат, содержащий коллагеновую мембрану |
Also Published As
| Publication number | Publication date |
|---|---|
| US20120165957A1 (en) | 2012-06-28 |
| CN102470189A (zh) | 2012-05-23 |
| EP2451490A1 (en) | 2012-05-16 |
| WO2011003422A1 (en) | 2011-01-13 |
| BR112012000114A2 (pt) | 2016-11-01 |
| IN2012DN00368A (ru) | 2015-08-21 |
| RU2012103838A (ru) | 2013-08-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2538688C2 (ru) | Биоразлагаемый каркас для регенерации мягких тканей и его применение | |
| AU2004226996B2 (en) | Viable tissue repair implants and methods of use | |
| ES2672622T3 (es) | Preparación de armazones tisulares regenerativos | |
| EP2603248B1 (en) | Regenerative tissue scaffolds | |
| Xie et al. | Evaluation of stretched electrospun silk fibroin matrices seeded with urothelial cells for urethra reconstruction | |
| US8053559B2 (en) | Biodegradable scaffold with ECM material | |
| CN104353111B (zh) | 一种用于腹壁缺损的生物修复材料及其制备方法 | |
| US20220054703A1 (en) | Implantable Materials and Uses Thereof | |
| US8877223B2 (en) | Degradable hydrophilic block copolymers with improved biocompatibility for soft tissue regeneration | |
| US20110035023A1 (en) | Prosthesis for promoting the in vivo reconstruction of a hollow organ or a portion of a hollow organ | |
| US20100087839A1 (en) | Mesh comprising ecm | |
| US9636438B2 (en) | Fistula plug comprising ECM | |
| US20110014267A1 (en) | Biosynthetic cartilaginous matrix and methods for their production | |
| WO2011150328A1 (en) | Wet-electrospun biodegradable scaffold and uses therefor | |
| WO2013178229A1 (en) | A biodegradable non-woven mesh with glue points | |
| Seo et al. | Reinforced bioartificial dermis constructed with collagen threads | |
| WO2020109789A1 (en) | Scaffold | |
| WO2023086360A1 (en) | A surgical mesh implant for hernia repair and methods of use | |
| Gigliobianco | Developing a layer-by-layer coating to make materials angiogenic for urological applications Thesis submitted to the University of Sheffield for the degree of Doctor of Philosophy | |
| Saxena et al. | Vergleich von tubulären Kollagenpolymeren für den Einsatz in Tissue Engineering der Speiseröhre: In-situ Implantationsstudie an einem Schafmodell |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20150707 |