RU2512541C2 - Производные 8-оксихинолина в качестве модуляторов рецептора в2 брадикинина - Google Patents
Производные 8-оксихинолина в качестве модуляторов рецептора в2 брадикинина Download PDFInfo
- Publication number
- RU2512541C2 RU2512541C2 RU2009139087/04A RU2009139087A RU2512541C2 RU 2512541 C2 RU2512541 C2 RU 2512541C2 RU 2009139087/04 A RU2009139087/04 A RU 2009139087/04A RU 2009139087 A RU2009139087 A RU 2009139087A RU 2512541 C2 RU2512541 C2 RU 2512541C2
- Authority
- RU
- Russia
- Prior art keywords
- pyridin
- ylmethyl
- methyl
- yloxymethyl
- chloro
- Prior art date
Links
- 101710085045 B2 bradykinin receptor Proteins 0.000 title 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical class C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 109
- 238000000034 method Methods 0.000 claims abstract description 37
- 125000005843 halogen group Chemical group 0.000 claims abstract description 34
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 29
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 26
- 229910052717 sulfur Inorganic materials 0.000 claims abstract description 24
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 22
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 21
- 125000005842 heteroatom Chemical group 0.000 claims abstract description 16
- 239000000126 substance Substances 0.000 claims abstract description 13
- 230000000694 effects Effects 0.000 claims abstract description 12
- 238000011282 treatment Methods 0.000 claims abstract description 11
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 10
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 8
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract description 6
- -1 = O Chemical group 0.000 claims description 92
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 88
- 108020003175 receptors Proteins 0.000 claims description 59
- 102000005962 receptors Human genes 0.000 claims description 59
- 201000010099 disease Diseases 0.000 claims description 55
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 40
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 35
- 125000004404 heteroalkyl group Chemical group 0.000 claims description 35
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 32
- 208000035475 disorder Diseases 0.000 claims description 31
- 230000036407 pain Effects 0.000 claims description 30
- 208000002193 Pain Diseases 0.000 claims description 29
- 150000003839 salts Chemical class 0.000 claims description 29
- 125000001424 substituent group Chemical group 0.000 claims description 17
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 15
- 239000003814 drug Substances 0.000 claims description 13
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 10
- 239000000443 aerosol Substances 0.000 claims description 10
- 208000027866 inflammatory disease Diseases 0.000 claims description 10
- 230000001404 mediated effect Effects 0.000 claims description 10
- 125000006163 5-membered heteroaryl group Chemical group 0.000 claims description 9
- 208000010668 atopic eczema Diseases 0.000 claims description 9
- 239000000499 gel Substances 0.000 claims description 9
- 238000000338 in vitro Methods 0.000 claims description 9
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 9
- 206010030113 Oedema Diseases 0.000 claims description 8
- 230000000172 allergic effect Effects 0.000 claims description 8
- 239000006071 cream Substances 0.000 claims description 8
- 230000006378 damage Effects 0.000 claims description 8
- 238000004519 manufacturing process Methods 0.000 claims description 8
- 210000000214 mouth Anatomy 0.000 claims description 8
- 208000035473 Communicable disease Diseases 0.000 claims description 7
- 210000003169 central nervous system Anatomy 0.000 claims description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 7
- 208000024172 Cardiovascular disease Diseases 0.000 claims description 6
- 208000018522 Gastrointestinal disease Diseases 0.000 claims description 6
- 239000002775 capsule Substances 0.000 claims description 6
- 210000000232 gallbladder Anatomy 0.000 claims description 6
- 210000003734 kidney Anatomy 0.000 claims description 6
- 208000030159 metabolic disease Diseases 0.000 claims description 6
- 239000000243 solution Substances 0.000 claims description 6
- 210000001635 urinary tract Anatomy 0.000 claims description 6
- 208000014644 Brain disease Diseases 0.000 claims description 5
- 208000018501 Lymphatic disease Diseases 0.000 claims description 5
- 239000002671 adjuvant Substances 0.000 claims description 5
- 208000032625 disorder of ear Diseases 0.000 claims description 5
- 208000030533 eye disease Diseases 0.000 claims description 5
- 210000001752 female genitalia Anatomy 0.000 claims description 5
- 208000014951 hematologic disease Diseases 0.000 claims description 5
- 230000003054 hormonal effect Effects 0.000 claims description 5
- 208000026278 immune system disease Diseases 0.000 claims description 5
- 210000004185 liver Anatomy 0.000 claims description 5
- 210000000260 male genitalia Anatomy 0.000 claims description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 5
- 210000000496 pancreas Anatomy 0.000 claims description 5
- 210000003800 pharynx Anatomy 0.000 claims description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 5
- 208000023504 respiratory system disease Diseases 0.000 claims description 5
- 208000017520 skin disease Diseases 0.000 claims description 5
- 239000006188 syrup Substances 0.000 claims description 5
- 235000020357 syrup Nutrition 0.000 claims description 5
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 claims description 4
- 208000026350 Inborn Genetic disease Diseases 0.000 claims description 4
- 208000024556 Mendelian disease Diseases 0.000 claims description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 4
- 239000003550 marker Substances 0.000 claims description 4
- 210000002346 musculoskeletal system Anatomy 0.000 claims description 4
- 125000006514 pyridin-2-ylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 claims description 4
- WRHZVMBBRYBTKZ-UHFFFAOYSA-N pyrrole-2-carboxylic acid Chemical compound OC(=O)C1=CC=CN1 WRHZVMBBRYBTKZ-UHFFFAOYSA-N 0.000 claims description 4
- 206010019860 Hereditary angioedema Diseases 0.000 claims description 3
- 238000000099 in vitro assay Methods 0.000 claims description 3
- 230000005764 inhibitory process Effects 0.000 claims description 3
- 238000004020 luminiscence type Methods 0.000 claims description 3
- 239000008177 pharmaceutical agent Substances 0.000 claims description 3
- 239000006187 pill Substances 0.000 claims description 3
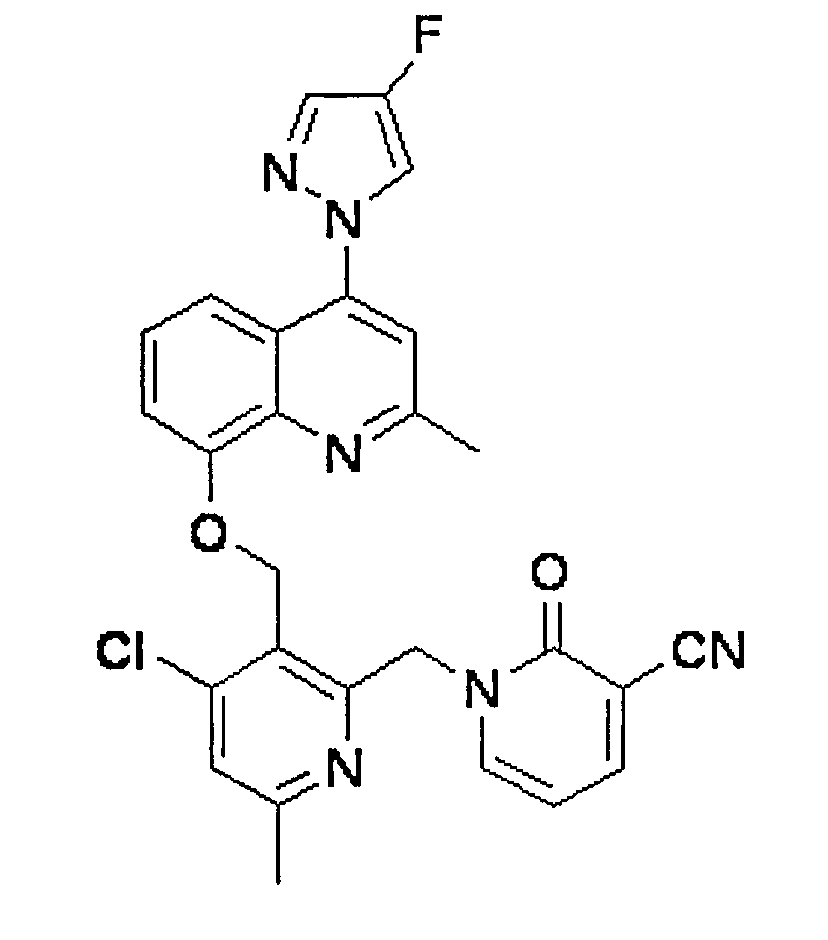
- NWLRNQDCSUDCMR-UHFFFAOYSA-N 1-[1-[4-chloro-3-[[2-methyl-4-(4-methyl-1h-pyrazol-5-yl)quinolin-8-yl]oxymethyl]pyridin-2-yl]ethyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1C(C)C1=NC=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NNC=C1C NWLRNQDCSUDCMR-UHFFFAOYSA-N 0.000 claims description 2
- TZDFPGDLEGERRU-UHFFFAOYSA-N 1-[1-[4-chloro-3-[[4-(4-hydroxy-1H-pyrazol-5-yl)-2-methylquinolin-8-yl]oxymethyl]pyridin-2-yl]ethyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1C(C)C1=NC=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NNC=C1O TZDFPGDLEGERRU-UHFFFAOYSA-N 0.000 claims description 2
- VAERQZSWYKACKT-UHFFFAOYSA-N 1-[[3-[[4-(5-chloro-1,3-thiazol-4-yl)-2-methylquinolin-8-yl]oxymethyl]-4-methoxypyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C=1C=CC2=C(C3=C(SC=N3)Cl)C=C(C)N=C2C=1OCC=1C(OC)=CC=NC=1CN1C=CC=C(C#N)C1=O VAERQZSWYKACKT-UHFFFAOYSA-N 0.000 claims description 2
- SZAQGFBWVDDXHV-UHFFFAOYSA-N 1-[[3-[[4-(5-chloro-1,3-thiazol-4-yl)-2-methylquinolin-8-yl]oxymethyl]-4-methoxypyridin-2-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound C=1C=CC2=C(C3=C(SC=N3)Cl)C=C(C)N=C2C=1OCC=1C(OC)=CC=NC=1CN1C=CC=C(C(F)(F)F)C1=O SZAQGFBWVDDXHV-UHFFFAOYSA-N 0.000 claims description 2
- ROMRTXMEQJYJJZ-UHFFFAOYSA-N 1-[[3-[[4-(5-chloro-1,3-thiazol-4-yl)-2-methylquinolin-8-yl]oxymethyl]-4-methylpyridin-2-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound C=12C=CC=C(OCC=3C(=NC=CC=3C)CN3C(C(=CC=C3)C(F)(F)F)=O)C2=NC(C)=CC=1C=1N=CSC=1Cl ROMRTXMEQJYJJZ-UHFFFAOYSA-N 0.000 claims description 2
- UIFWEJBXWYVQBJ-UHFFFAOYSA-N 1-[[3-[[4-[4-(2-aminoethoxy)-1h-pyrazol-5-yl]-2-methylquinolin-8-yl]oxymethyl]-4-methylpyridin-2-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound C=12C=CC=C(OCC=3C(=NC=CC=3C)CN3C(C(=CC=C3)C(F)(F)F)=O)C2=NC(C)=CC=1C1=NNC=C1OCCN UIFWEJBXWYVQBJ-UHFFFAOYSA-N 0.000 claims description 2
- SAVARCJSJGZUAU-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(4-chloro-1,3-thiazol-5-yl)-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C=1SC=NC=1Cl SAVARCJSJGZUAU-UHFFFAOYSA-N 0.000 claims description 2
- ZTMFMJMJGDWCGD-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(4-fluoropyrazol-1-yl)-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2N1C=C(F)C=N1 ZTMFMJMJGDWCGD-UHFFFAOYSA-N 0.000 claims description 2
- UCIHIGOSEXZBOP-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(4-fluoropyrazol-1-yl)-2-methylquinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C=12C=CC=C(OCC=3C(=NC=CC=3Cl)CN3C(C(C#N)=CC=C3)=O)C2=NC(C)=CC=1N1C=C(F)C=N1 UCIHIGOSEXZBOP-UHFFFAOYSA-N 0.000 claims description 2
- KJSWSAXUFCLNEA-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(4-hydroxy-1H-pyrazol-5-yl)-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NNC=C1O KJSWSAXUFCLNEA-UHFFFAOYSA-N 0.000 claims description 2
- FCIYVYKDPGWSMY-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(4-hydroxy-1H-pyrazol-5-yl)-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound C1=CC=C(C(F)(F)F)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NNC=C1O FCIYVYKDPGWSMY-UHFFFAOYSA-N 0.000 claims description 2
- XYSYTUVLOLNMNZ-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(5-chloro-1,3-thiazol-4-yl)-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C=1N=CSC=1Cl XYSYTUVLOLNMNZ-UHFFFAOYSA-N 0.000 claims description 2
- DCWFKKJQTHGLFC-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(5-chloro-1-methylimidazol-2-yl)-2-methylquinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound C=12C=CC=C(OCC=3C(=NC=CC=3Cl)CN3C(C(=CC=C3)C(F)(F)F)=O)C2=NC(C)=CC=1C1=NC=C(Cl)N1C DCWFKKJQTHGLFC-UHFFFAOYSA-N 0.000 claims description 2
- FTVFHNYZNLRYKK-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(5-cyano-1-methylpyrrol-2-yl)-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=CC=C(C#N)N1C FTVFHNYZNLRYKK-UHFFFAOYSA-N 0.000 claims description 2
- GBPCYJUJSYWIRR-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(5-cyano-1-methylpyrrol-2-yl)-2-methylquinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C=12C=CC=C(OCC=3C(=NC=CC=3Cl)CN3C(C(C#N)=CC=C3)=O)C2=NC(C)=CC=1C1=CC=C(C#N)N1C GBPCYJUJSYWIRR-UHFFFAOYSA-N 0.000 claims description 2
- LOXONZBJUOOVGY-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-(5-fluoro-1,3-thiazol-2-yl)-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NC=C(F)S1 LOXONZBJUOOVGY-UHFFFAOYSA-N 0.000 claims description 2
- WZLMZVJJWCUQOI-UHFFFAOYSA-N 1-[[4-chloro-3-[[4-[4-(hydroxymethyl)-1h-pyrazol-5-yl]-2-methylquinolin-8-yl]oxymethyl]-6-methylpyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=CC=C(C#N)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NNC=C1CO WZLMZVJJWCUQOI-UHFFFAOYSA-N 0.000 claims description 2
- DWYDLVGRIAZBEJ-UHFFFAOYSA-N 1-[[4-chloro-6-methyl-3-[[2-methyl-4-(3-methyl-1,2-oxazol-4-yl)quinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound CC1=NOC=C1C(C1=CC=C2)=CC(C)=NC1=C2OCC1=C(Cl)C=C(C)N=C1CN1C(=O)C(C#N)=CC=C1 DWYDLVGRIAZBEJ-UHFFFAOYSA-N 0.000 claims description 2
- QKSCNRHQHYQWNH-UHFFFAOYSA-N 1-[[4-chloro-6-methyl-3-[[2-methyl-4-(4-methyl-1h-pyrazol-5-yl)quinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C1=NNC(C=2C3=CC=CC(OCC=4C(=NC(C)=CC=4Cl)CN4C(C(C#N)=CC=C4)=O)=C3N=C(C)C=2)=C1C QKSCNRHQHYQWNH-UHFFFAOYSA-N 0.000 claims description 2
- XMGJMUWGWJARNY-UHFFFAOYSA-N 1-[[4-chloro-6-methyl-3-[[2-methyl-4-(4-methyl-1h-pyrazol-5-yl)quinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound CC1=CNN=C1C(C1=CC=C2)=CC(C)=NC1=C2OCC1=C(Cl)C=C(C)N=C1CN1C(=O)C(C(F)(F)F)=CC=C1 XMGJMUWGWJARNY-UHFFFAOYSA-N 0.000 claims description 2
- SEUVEYGZWHCLRP-UHFFFAOYSA-N 1-[[4-chloro-6-methyl-3-[[2-methyl-4-(5-methyl-1h-imidazol-4-yl)quinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound N1C=NC(C=2C3=CC=CC(OCC=4C(=NC(C)=CC=4Cl)CN4C(C(C#N)=CC=C4)=O)=C3N=C(C)C=2)=C1C SEUVEYGZWHCLRP-UHFFFAOYSA-N 0.000 claims description 2
- LWODHBLZMDOCDD-UHFFFAOYSA-N 1-[[4-methoxy-6-methyl-3-[[2-methyl-4-(4-methyl-1h-pyrazol-5-yl)quinolin-8-yl]oxymethyl]pyridin-2-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound C=1C=CC2=C(C=3C(=CNN=3)C)C=C(C)N=C2C=1OCC=1C(OC)=CC(C)=NC=1CN1C=CC=C(C(F)(F)F)C1=O LWODHBLZMDOCDD-UHFFFAOYSA-N 0.000 claims description 2
- UFWHCBPHGBDMNB-UHFFFAOYSA-N 1-[[5-chloro-2-methoxy-4-[[2-methyl-4-(2-methyl-1,2,4-triazol-3-yl)quinolin-8-yl]oxymethyl]pyridin-3-yl]methyl]-3-(trifluoromethyl)pyridin-2-one Chemical compound C1=CC=C(C(F)(F)F)C(=O)N1CC=1C(OC)=NC=C(Cl)C=1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NC=NN1C UFWHCBPHGBDMNB-UHFFFAOYSA-N 0.000 claims description 2
- PYRPYBMLJKMSAJ-UHFFFAOYSA-N 1-[[5-chloro-4-[[4-(5-cyano-1-methylpyrrol-2-yl)-2-methylquinolin-8-yl]oxymethyl]-2-oxo-1h-pyridin-3-yl]methyl]-2-oxopyridine-3-carbonitrile Chemical compound C=12C=CC=C(OCC=3C(=C(O)N=CC=3Cl)CN3C(C(C#N)=CC=C3)=O)C2=NC(C)=CC=1C1=CC=C(C#N)N1C PYRPYBMLJKMSAJ-UHFFFAOYSA-N 0.000 claims description 2
- ILAOVOOZLVGAJF-UHFFFAOYSA-N 1-methylpyrrole-2-carboxylic acid Chemical compound CN1C=CC=C1C(O)=O ILAOVOOZLVGAJF-UHFFFAOYSA-N 0.000 claims description 2
- FMEBVTQHYXUNEZ-UHFFFAOYSA-N 2-[8-[[4-chloro-6-methyl-2-[[2-oxo-3-(trifluoromethyl)pyridin-1-yl]methyl]pyridin-3-yl]methoxy]-2-methylquinolin-4-yl]-3-methylimidazole-4-carbonitrile Chemical compound C1=CC=C(C(F)(F)F)C(=O)N1CC1=NC(C)=CC(Cl)=C1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NC=C(C#N)N1C FMEBVTQHYXUNEZ-UHFFFAOYSA-N 0.000 claims description 2
- MUCGBKJLCLPALW-UHFFFAOYSA-N 2-[8-[[5-fluoro-2-methoxy-3-[[2-oxo-3-(trifluoromethyl)pyridin-1-yl]methyl]pyridin-4-yl]methoxy]-2-methylquinolin-4-yl]-3-methylimidazole-4-carbonitrile Chemical compound C1=CC=C(C(F)(F)F)C(=O)N1CC=1C(OC)=NC=C(F)C=1COC(C1=NC(C)=C2)=CC=CC1=C2C1=NC=C(C#N)N1C MUCGBKJLCLPALW-UHFFFAOYSA-N 0.000 claims description 2
- PAJFMPBNDFQMAI-UHFFFAOYSA-N 5-[8-[[4-chloro-2-[[2-oxo-3-(trifluoromethyl)pyridin-1-yl]methyl]pyridin-3-yl]methoxy]-2-methylquinolin-4-yl]-3-methylimidazole-4-carbonitrile Chemical compound C=12C=CC=C(OCC=3C(=NC=CC=3Cl)CN3C(C(=CC=C3)C(F)(F)F)=O)C2=NC(C)=CC=1C=1N=CN(C)C=1C#N PAJFMPBNDFQMAI-UHFFFAOYSA-N 0.000 claims description 2
- NYCCDIKBAPFQBJ-UHFFFAOYSA-N CC1=CC(=C2C=CC=C(C2=N1)OCC3=C(C=CN=C3CN4CC(=CC=C4)C(F)(F)F)Cl)C5=NC=C(N5C)C Chemical compound CC1=CC(=C2C=CC=C(C2=N1)OCC3=C(C=CN=C3CN4CC(=CC=C4)C(F)(F)F)Cl)C5=NC=C(N5C)C NYCCDIKBAPFQBJ-UHFFFAOYSA-N 0.000 claims description 2
- 150000001408 amides Chemical class 0.000 claims description 2
- PRBPWYQBNAQANU-UHFFFAOYSA-N n-[[5-[2-methyl-8-[[4-methyl-2-[[2-oxo-3-(trifluoromethyl)pyridin-1-yl]methyl]pyridin-3-yl]methoxy]quinolin-4-yl]-1h-pyrazol-4-yl]methyl]acetamide Chemical compound CC(=O)NCC1=CNN=C1C(C1=CC=C2)=CC(C)=NC1=C2OCC1=C(C)C=CN=C1CN1C(=O)C(C(F)(F)F)=CC=C1 PRBPWYQBNAQANU-UHFFFAOYSA-N 0.000 claims description 2
- SUQUOTFLUYTUTQ-UHFFFAOYSA-N n-[[5-[8-[[4-chloro-2-[[2-oxo-3-(trifluoromethyl)pyridin-1-yl]methyl]pyridin-3-yl]methoxy]-2-methylquinolin-4-yl]-1h-pyrazol-4-yl]methyl]acetamide Chemical compound C1=NNC(C=2C3=CC=CC(OCC=4C(=NC=CC=4Cl)CN4C(C(=CC=C4)C(F)(F)F)=O)=C3N=C(C)C=2)=C1CNC(=O)C SUQUOTFLUYTUTQ-UHFFFAOYSA-N 0.000 claims description 2
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 claims 1
- 125000005115 alkyl carbamoyl group Chemical group 0.000 claims 1
- 230000003042 antagnostic effect Effects 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 39
- 125000003342 alkenyl group Chemical group 0.000 abstract description 26
- 239000003795 chemical substances by application Substances 0.000 abstract description 15
- 229910052739 hydrogen Inorganic materials 0.000 abstract description 5
- 239000001257 hydrogen Substances 0.000 abstract description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 abstract description 3
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract 2
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 abstract 1
- 108091006082 receptor inhibitors Proteins 0.000 abstract 1
- 125000000217 alkyl group Chemical group 0.000 description 28
- 125000004432 carbon atom Chemical group C* 0.000 description 24
- 125000000304 alkynyl group Chemical group 0.000 description 23
- 125000003118 aryl group Chemical group 0.000 description 21
- 238000002360 preparation method Methods 0.000 description 20
- 239000004480 active ingredient Substances 0.000 description 19
- 208000006673 asthma Diseases 0.000 description 19
- 230000014509 gene expression Effects 0.000 description 19
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 18
- QXZGBUJJYSLZLT-UHFFFAOYSA-N H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH Natural products NC(N)=NCCCC(N)C(=O)N1CCCC1C(=O)N1C(C(=O)NCC(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CO)C(=O)N2C(CCC2)C(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CCCN=C(N)N)C(O)=O)CCC1 QXZGBUJJYSLZLT-UHFFFAOYSA-N 0.000 description 18
- 125000003710 aryl alkyl group Chemical group 0.000 description 18
- 101800004538 Bradykinin Proteins 0.000 description 17
- 102400000967 Bradykinin Human genes 0.000 description 17
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 17
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 15
- 125000005119 alkyl cycloalkyl group Chemical group 0.000 description 15
- 239000003086 colorant Substances 0.000 description 13
- 235000019441 ethanol Nutrition 0.000 description 13
- QXZGBUJJYSLZLT-FDISYFBBSA-N bradykinin Chemical compound NC(=N)NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NCC(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CO)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)CCC1 QXZGBUJJYSLZLT-FDISYFBBSA-N 0.000 description 12
- 208000011580 syndromic disease Diseases 0.000 description 12
- 239000003995 emulsifying agent Substances 0.000 description 11
- 229910052731 fluorine Inorganic materials 0.000 description 11
- 239000003755 preservative agent Substances 0.000 description 11
- 210000001519 tissue Anatomy 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- 206010061218 Inflammation Diseases 0.000 description 10
- 230000001154 acute effect Effects 0.000 description 10
- 239000000460 chlorine Substances 0.000 description 10
- 238000009472 formulation Methods 0.000 description 10
- 230000004054 inflammatory process Effects 0.000 description 10
- 239000000843 powder Substances 0.000 description 10
- 230000000699 topical effect Effects 0.000 description 10
- 206010020751 Hypersensitivity Diseases 0.000 description 9
- 125000004429 atom Chemical group 0.000 description 9
- 229910052801 chlorine Inorganic materials 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 239000001301 oxygen Substances 0.000 description 9
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 8
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 8
- 206010028980 Neoplasm Diseases 0.000 description 8
- 229910052799 carbon Inorganic materials 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 7
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 7
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 7
- 230000007815 allergy Effects 0.000 description 7
- 208000006752 brain edema Diseases 0.000 description 7
- 239000000796 flavoring agent Substances 0.000 description 7
- 239000011737 fluorine Substances 0.000 description 7
- 235000013355 food flavoring agent Nutrition 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- 238000001356 surgical procedure Methods 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 6
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 6
- 208000027418 Wounds and injury Diseases 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 208000026935 allergic disease Diseases 0.000 description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 6
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 6
- 229910052794 bromium Inorganic materials 0.000 description 6
- 235000014113 dietary fatty acids Nutrition 0.000 description 6
- 239000000194 fatty acid Substances 0.000 description 6
- 229930195729 fatty acid Natural products 0.000 description 6
- 150000004665 fatty acids Chemical class 0.000 description 6
- 208000014674 injury Diseases 0.000 description 6
- 239000000651 prodrug Substances 0.000 description 6
- 229940002612 prodrug Drugs 0.000 description 6
- 206010048962 Brain oedema Diseases 0.000 description 5
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 5
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 201000011510 cancer Diseases 0.000 description 5
- 230000001684 chronic effect Effects 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- 235000003599 food sweetener Nutrition 0.000 description 5
- 125000004475 heteroaralkyl group Chemical group 0.000 description 5
- 208000015181 infectious disease Diseases 0.000 description 5
- 230000002757 inflammatory effect Effects 0.000 description 5
- 239000006210 lotion Substances 0.000 description 5
- 239000002480 mineral oil Substances 0.000 description 5
- 208000010125 myocardial infarction Diseases 0.000 description 5
- 229910052698 phosphorus Inorganic materials 0.000 description 5
- 239000011574 phosphorus Substances 0.000 description 5
- 239000003380 propellant Substances 0.000 description 5
- 229940044551 receptor antagonist Drugs 0.000 description 5
- 239000002464 receptor antagonist Substances 0.000 description 5
- 201000009890 sinusitis Diseases 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 239000011593 sulfur Substances 0.000 description 5
- 239000003765 sweetening agent Substances 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- 208000035143 Bacterial infection Diseases 0.000 description 4
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 description 4
- 125000000041 C6-C10 aryl group Chemical group 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 4
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 4
- 239000004166 Lanolin Substances 0.000 description 4
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 4
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 4
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical group [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 4
- 206010040047 Sepsis Diseases 0.000 description 4
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 239000003963 antioxidant agent Substances 0.000 description 4
- 235000006708 antioxidants Nutrition 0.000 description 4
- 239000007900 aqueous suspension Substances 0.000 description 4
- 208000022362 bacterial infectious disease Diseases 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 239000007859 condensation product Substances 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 239000012467 final product Substances 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 4
- 150000002430 hydrocarbons Chemical group 0.000 description 4
- 235000019388 lanolin Nutrition 0.000 description 4
- 229940039717 lanolin Drugs 0.000 description 4
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 4
- 235000010446 mineral oil Nutrition 0.000 description 4
- 210000001331 nose Anatomy 0.000 description 4
- 239000003960 organic solvent Substances 0.000 description 4
- 201000008482 osteoarthritis Diseases 0.000 description 4
- 230000036961 partial effect Effects 0.000 description 4
- 230000008506 pathogenesis Effects 0.000 description 4
- 239000002304 perfume Substances 0.000 description 4
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 4
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 4
- 229920000053 polysorbate 80 Polymers 0.000 description 4
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 4
- 125000006413 ring segment Chemical group 0.000 description 4
- 229910052711 selenium Inorganic materials 0.000 description 4
- 229910052710 silicon Inorganic materials 0.000 description 4
- 239000010703 silicon Substances 0.000 description 4
- 239000000375 suspending agent Substances 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 206010010741 Conjunctivitis Diseases 0.000 description 3
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 206010016654 Fibrosis Diseases 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 201000005569 Gout Diseases 0.000 description 3
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 3
- 208000002158 Proliferative Vitreoretinopathy Diseases 0.000 description 3
- 208000003251 Pruritus Diseases 0.000 description 3
- 206010038934 Retinopathy proliferative Diseases 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 201000010105 allergic rhinitis Diseases 0.000 description 3
- 208000007474 aortic aneurysm Diseases 0.000 description 3
- 206010003246 arthritis Diseases 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000002490 cerebral effect Effects 0.000 description 3
- 230000007850 degeneration Effects 0.000 description 3
- 239000000032 diagnostic agent Substances 0.000 description 3
- 229940039227 diagnostic agent Drugs 0.000 description 3
- 239000002270 dispersing agent Substances 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 210000001508 eye Anatomy 0.000 description 3
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 3
- 239000006260 foam Substances 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 239000003906 humectant Substances 0.000 description 3
- 238000002513 implantation Methods 0.000 description 3
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 3
- 229940057995 liquid paraffin Drugs 0.000 description 3
- 208000021971 neovascular inflammatory vitreoretinopathy Diseases 0.000 description 3
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 3
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 239000004006 olive oil Substances 0.000 description 3
- 235000008390 olive oil Nutrition 0.000 description 3
- 125000004043 oxo group Chemical group O=* 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 230000006785 proliferative vitreoretinopathy Effects 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 239000011669 selenium Substances 0.000 description 3
- 230000035939 shock Effects 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 125000004434 sulfur atom Chemical group 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 206010044008 tonsillitis Diseases 0.000 description 3
- 239000008009 topical excipient Substances 0.000 description 3
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 3
- 235000015112 vegetable and seed oil Nutrition 0.000 description 3
- 239000008158 vegetable oil Substances 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical compound C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 2
- IHPYMWDTONKSCO-UHFFFAOYSA-N 2,2'-piperazine-1,4-diylbisethanesulfonic acid Chemical compound OS(=O)(=O)CCN1CCN(CCS(O)(=O)=O)CC1 IHPYMWDTONKSCO-UHFFFAOYSA-N 0.000 description 2
- IZHVBANLECCAGF-UHFFFAOYSA-N 2-hydroxy-3-(octadecanoyloxy)propyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)COC(=O)CCCCCCCCCCCCCCCCC IZHVBANLECCAGF-UHFFFAOYSA-N 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- 244000215068 Acacia senegal Species 0.000 description 2
- 206010063409 Acarodermatitis Diseases 0.000 description 2
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 208000008035 Back Pain Diseases 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 2
- 102000010183 Bradykinin receptor Human genes 0.000 description 2
- 108050001736 Bradykinin receptor Proteins 0.000 description 2
- 229910014033 C-OH Inorganic materials 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000511343 Chondrostoma nasus Species 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- 229910014570 C—OH Inorganic materials 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 206010015150 Erythema Diseases 0.000 description 2
- 208000010201 Exanthema Diseases 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 208000001034 Frostbite Diseases 0.000 description 2
- 206010017533 Fungal infection Diseases 0.000 description 2
- 241000233866 Fungi Species 0.000 description 2
- 208000010412 Glaucoma Diseases 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 206010019196 Head injury Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 2
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- 208000035154 Hyperesthesia Diseases 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- 208000004575 Infectious Arthritis Diseases 0.000 description 2
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical compound CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 208000019693 Lung disease Diseases 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 239000004909 Moisturizer Substances 0.000 description 2
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 2
- 208000030880 Nose disease Diseases 0.000 description 2
- 235000019483 Peanut oil Nutrition 0.000 description 2
- 208000029082 Pelvic Inflammatory Disease Diseases 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 102000029797 Prion Human genes 0.000 description 2
- 108091000054 Prion Proteins 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- 201000004681 Psoriasis Diseases 0.000 description 2
- 206010037423 Pulmonary oedema Diseases 0.000 description 2
- 206010039085 Rhinitis allergic Diseases 0.000 description 2
- 208000036071 Rhinorrhea Diseases 0.000 description 2
- 206010039101 Rhinorrhoea Diseases 0.000 description 2
- 241000447727 Scabies Species 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 201000002661 Spondylitis Diseases 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- 206010044302 Tracheitis Diseases 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 208000024780 Urticaria Diseases 0.000 description 2
- 206010046914 Vaginal infection Diseases 0.000 description 2
- 208000018756 Variant Creutzfeldt-Jakob disease Diseases 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 206010052428 Wound Diseases 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 201000009961 allergic asthma Diseases 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 235000013871 bee wax Nutrition 0.000 description 2
- 239000012166 beeswax Substances 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 2
- 230000008499 blood brain barrier function Effects 0.000 description 2
- 210000001218 blood-brain barrier Anatomy 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 229910052796 boron Inorganic materials 0.000 description 2
- 208000005881 bovine spongiform encephalopathy Diseases 0.000 description 2
- 208000029028 brain injury Diseases 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 239000012876 carrier material Substances 0.000 description 2
- 229960000541 cetyl alcohol Drugs 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 208000019425 cirrhosis of liver Diseases 0.000 description 2
- 210000001072 colon Anatomy 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- RWGFKTVRMDUZSP-UHFFFAOYSA-N cumene Chemical compound CC(C)C1=CC=CC=C1 RWGFKTVRMDUZSP-UHFFFAOYSA-N 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- BGTOWKSIORTVQH-UHFFFAOYSA-N cyclopentanone Chemical compound O=C1CCCC1 BGTOWKSIORTVQH-UHFFFAOYSA-N 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 239000003974 emollient agent Substances 0.000 description 2
- 206010014599 encephalitis Diseases 0.000 description 2
- 201000005884 exanthem Diseases 0.000 description 2
- 239000004744 fabric Substances 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 239000003349 gelling agent Substances 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 230000000004 hemodynamic effect Effects 0.000 description 2
- CBCIHIVRDWLAME-UHFFFAOYSA-N hexanitrodiphenylamine Chemical compound [O-][N+](=O)C1=CC([N+](=O)[O-])=CC([N+]([O-])=O)=C1NC1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O CBCIHIVRDWLAME-UHFFFAOYSA-N 0.000 description 2
- 229960001340 histamine Drugs 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- PQNFLJBBNBOBRQ-UHFFFAOYSA-N indane Chemical compound C1=CC=C2CCCC2=C1 PQNFLJBBNBOBRQ-UHFFFAOYSA-N 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 201000010659 intrinsic asthma Diseases 0.000 description 2
- 230000007803 itching Effects 0.000 description 2
- 208000017169 kidney disease Diseases 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 239000003094 microcapsule Substances 0.000 description 2
- 230000001333 moisturizer Effects 0.000 description 2
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 2
- 210000004400 mucous membrane Anatomy 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 244000045947 parasite Species 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000001991 pathophysiological effect Effects 0.000 description 2
- 239000000312 peanut oil Substances 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 206010035653 pneumoconiosis Diseases 0.000 description 2
- 229940068968 polysorbate 80 Drugs 0.000 description 2
- 208000007232 portal hypertension Diseases 0.000 description 2
- 208000005333 pulmonary edema Diseases 0.000 description 2
- 150000003248 quinolines Chemical class 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 238000003653 radioligand binding assay Methods 0.000 description 2
- 206010037844 rash Diseases 0.000 description 2
- 229940075993 receptor modulator Drugs 0.000 description 2
- 210000000664 rectum Anatomy 0.000 description 2
- 230000011514 reflex Effects 0.000 description 2
- 230000027425 release of sequestered calcium ion into cytosol Effects 0.000 description 2
- 230000029058 respiratory gaseous exchange Effects 0.000 description 2
- 201000000306 sarcoidosis Diseases 0.000 description 2
- 208000005687 scabies Diseases 0.000 description 2
- 230000037390 scarring Effects 0.000 description 2
- 201000001223 septic arthritis Diseases 0.000 description 2
- 230000001148 spastic effect Effects 0.000 description 2
- 238000005507 spraying Methods 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000008961 swelling Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 2
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 210000003708 urethra Anatomy 0.000 description 2
- 230000008728 vascular permeability Effects 0.000 description 2
- 230000002227 vasoactive effect Effects 0.000 description 2
- 230000024883 vasodilation Effects 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- 125000006716 (C1-C6) heteroalkyl group Chemical group 0.000 description 1
- FFJCNSLCJOQHKM-CLFAGFIQSA-N (z)-1-[(z)-octadec-9-enoxy]octadec-9-ene Chemical compound CCCCCCCC\C=C/CCCCCCCCOCCCCCCCC\C=C/CCCCCCCC FFJCNSLCJOQHKM-CLFAGFIQSA-N 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- KEIFWROAQVVDBN-UHFFFAOYSA-N 1,2-dihydronaphthalene Chemical compound C1=CC=C2C=CCCC2=C1 KEIFWROAQVVDBN-UHFFFAOYSA-N 0.000 description 1
- JPAFGYAMMPIDNU-UHFFFAOYSA-N 1-[diethylamino(propan-2-yl)amino]-1-N-ethyl-1-N',1-N',2-N-trimethylethane-1,1,2-triamine Chemical compound CNCC(N(C(C)C)N(CC)CC)(N(C)C)NCC JPAFGYAMMPIDNU-UHFFFAOYSA-N 0.000 description 1
- MMZYCBHLNZVROM-UHFFFAOYSA-N 1-fluoro-2-methylbenzene Chemical compound CC1=CC=CC=C1F MMZYCBHLNZVROM-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- JSOVGYMVTPPEND-UHFFFAOYSA-N 16-methylheptadecyl 2,2-dimethylpropanoate Chemical compound CC(C)CCCCCCCCCCCCCCCOC(=O)C(C)(C)C JSOVGYMVTPPEND-UHFFFAOYSA-N 0.000 description 1
- 125000000453 2,2,2-trichloroethyl group Chemical group [H]C([H])(*)C(Cl)(Cl)Cl 0.000 description 1
- FLPJVCMIKUWSDR-UHFFFAOYSA-N 2-(4-formylphenoxy)acetamide Chemical compound NC(=O)COC1=CC=C(C=O)C=C1 FLPJVCMIKUWSDR-UHFFFAOYSA-N 0.000 description 1
- AMRBZKOCOOPYNY-QXMHVHEDSA-N 2-[dimethyl-[(z)-octadec-9-enyl]azaniumyl]acetate Chemical compound CCCCCCCC\C=C/CCCCCCCC[N+](C)(C)CC([O-])=O AMRBZKOCOOPYNY-QXMHVHEDSA-N 0.000 description 1
- 125000005273 2-acetoxybenzoic acid group Chemical group 0.000 description 1
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 description 1
- RFVNOJDQRGSOEL-UHFFFAOYSA-N 2-hydroxyethyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCO RFVNOJDQRGSOEL-UHFFFAOYSA-N 0.000 description 1
- 125000004204 2-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- 125000004203 4-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000001889 Acid-Base Imbalance Diseases 0.000 description 1
- 208000002874 Acne Vulgaris Diseases 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 206010033646 Acute and chronic pancreatitis Diseases 0.000 description 1
- 206010001076 Acute sinusitis Diseases 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 208000035285 Allergic Seasonal Rhinitis Diseases 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 208000005952 Amniotic Fluid Embolism Diseases 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 206010002199 Anaphylactic shock Diseases 0.000 description 1
- 206010067010 Anaphylactoid syndrome of pregnancy Diseases 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 208000028185 Angioedema Diseases 0.000 description 1
- 208000003120 Angiofibroma Diseases 0.000 description 1
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 206010003011 Appendicitis Diseases 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 206010053555 Arthritis bacterial Diseases 0.000 description 1
- 208000033116 Asbestos intoxication Diseases 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 206010003645 Atopy Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 206010004663 Biliary colic Diseases 0.000 description 1
- 208000006386 Bone Resorption Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 201000006474 Brain Ischemia Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 206010066091 Bronchial Hyperreactivity Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 208000007596 Byssinosis Diseases 0.000 description 1
- 208000003643 Callosities Diseases 0.000 description 1
- 241001164374 Calyx Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 206010007269 Carcinogenicity Diseases 0.000 description 1
- 206010007270 Carcinoid syndrome Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 208000001387 Causalgia Diseases 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 206010007882 Cellulitis Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 208000005145 Cerebral amyloid angiopathy Diseases 0.000 description 1
- 206010008111 Cerebral haemorrhage Diseases 0.000 description 1
- 206010008120 Cerebral ischaemia Diseases 0.000 description 1
- 201000006082 Chickenpox Diseases 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 206010008635 Cholestasis Diseases 0.000 description 1
- 208000000094 Chronic Pain Diseases 0.000 description 1
- 206010009137 Chronic sinusitis Diseases 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 206010069729 Collateral circulation Diseases 0.000 description 1
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 description 1
- 208000013586 Complex regional pain syndrome type 1 Diseases 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 206010010726 Conjunctival oedema Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 206010011017 Corneal graft rejection Diseases 0.000 description 1
- 208000028006 Corneal injury Diseases 0.000 description 1
- 235000001543 Corylus americana Nutrition 0.000 description 1
- 240000007582 Corylus avellana Species 0.000 description 1
- 235000007466 Corylus avellana Nutrition 0.000 description 1
- 206010011224 Cough Diseases 0.000 description 1
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 description 1
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 description 1
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 206010063057 Cystitis noninfective Diseases 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 206010011985 Decubitus ulcer Diseases 0.000 description 1
- 208000016192 Demyelinating disease Diseases 0.000 description 1
- 206010012434 Dermatitis allergic Diseases 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 206010012442 Dermatitis contact Diseases 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 1
- 206010012688 Diabetic retinal oedema Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 206010056340 Diabetic ulcer Diseases 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 229940123907 Disease modifying antirheumatic drug Drugs 0.000 description 1
- 208000005171 Dysmenorrhea Diseases 0.000 description 1
- 208000000059 Dyspnea Diseases 0.000 description 1
- 206010013975 Dyspnoeas Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 239000001692 EU approved anti-caking agent Substances 0.000 description 1
- 206010014418 Electrolyte imbalance Diseases 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 201000009273 Endometriosis Diseases 0.000 description 1
- 208000004145 Endometritis Diseases 0.000 description 1
- 208000004232 Enteritis Diseases 0.000 description 1
- 206010014979 Epidemic typhus Diseases 0.000 description 1
- 206010053177 Epidermolysis Diseases 0.000 description 1
- 206010053155 Epigastric discomfort Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 201000000297 Erysipelas Diseases 0.000 description 1
- 241000588722 Escherichia Species 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 206010015946 Eye irritation Diseases 0.000 description 1
- 208000001640 Fibromyalgia Diseases 0.000 description 1
- 206010016936 Folliculitis Diseases 0.000 description 1
- 208000004262 Food Hypersensitivity Diseases 0.000 description 1
- 206010016952 Food poisoning Diseases 0.000 description 1
- 208000019331 Foodborne disease Diseases 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- 208000012895 Gastric disease Diseases 0.000 description 1
- 208000007882 Gastritis Diseases 0.000 description 1
- 208000012671 Gastrointestinal haemorrhages Diseases 0.000 description 1
- 241000699694 Gerbillinae Species 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 206010018612 Gonorrhoea Diseases 0.000 description 1
- 206010018634 Gouty Arthritis Diseases 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 241000606790 Haemophilus Species 0.000 description 1
- 206010062713 Haemorrhagic diathesis Diseases 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 208000028782 Hereditary disease Diseases 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 208000007514 Herpes zoster Diseases 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 240000005979 Hordeum vulgare Species 0.000 description 1
- 235000007340 Hordeum vulgare Nutrition 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- DRAJWRKLRBNJRQ-UHFFFAOYSA-N Hydroxycarbamic acid Chemical compound ONC(O)=O DRAJWRKLRBNJRQ-UHFFFAOYSA-N 0.000 description 1
- 206010020565 Hyperaemia Diseases 0.000 description 1
- 208000004454 Hyperalgesia Diseases 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 206010020649 Hyperkeratosis Diseases 0.000 description 1
- 206010020853 Hypertonic bladder Diseases 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 description 1
- 208000016300 Idiopathic chronic eosinophilic pneumonia Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000024781 Immune Complex disease Diseases 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 206010021531 Impetigo Diseases 0.000 description 1
- 206010021639 Incontinence Diseases 0.000 description 1
- 208000022535 Infectious Skin disease Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 206010065390 Inflammatory pain Diseases 0.000 description 1
- 208000006877 Insect Bites and Stings Diseases 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 208000005615 Interstitial Cystitis Diseases 0.000 description 1
- 206010022941 Iridocyclitis Diseases 0.000 description 1
- 206010060820 Joint injury Diseases 0.000 description 1
- 102000001399 Kallikrein Human genes 0.000 description 1
- 108060005987 Kallikrein Proteins 0.000 description 1
- 201000002287 Keratoconus Diseases 0.000 description 1
- 108010077861 Kininogens Proteins 0.000 description 1
- 102000010631 Kininogens Human genes 0.000 description 1
- 241000588748 Klebsiella Species 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- 208000004852 Lung Injury Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 208000016604 Lyme disease Diseases 0.000 description 1
- 208000007466 Male Infertility Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 201000005505 Measles Diseases 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 208000037093 Menstruation Disturbances Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 206010065838 Middle ear inflammation Diseases 0.000 description 1
- 208000019695 Migraine disease Diseases 0.000 description 1
- 208000004221 Multiple Trauma Diseases 0.000 description 1
- 208000023637 Multiple injury Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 208000005647 Mumps Diseases 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 206010028391 Musculoskeletal Pain Diseases 0.000 description 1
- 208000023178 Musculoskeletal disease Diseases 0.000 description 1
- 206010062207 Mycobacterial infection Diseases 0.000 description 1
- 208000031888 Mycoses Diseases 0.000 description 1
- 208000009525 Myocarditis Diseases 0.000 description 1
- AOMUHOFOVNGZAN-UHFFFAOYSA-N N,N-bis(2-hydroxyethyl)dodecanamide Chemical compound CCCCCCCCCCCC(=O)N(CCO)CCO AOMUHOFOVNGZAN-UHFFFAOYSA-N 0.000 description 1
- 206010029240 Neuritis Diseases 0.000 description 1
- 201000009053 Neurodermatitis Diseases 0.000 description 1
- 208000001294 Nociceptive Pain Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 206010030043 Ocular hypertension Diseases 0.000 description 1
- 206010030216 Oesophagitis Diseases 0.000 description 1
- 206010030348 Open-Angle Glaucoma Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010031252 Osteomyelitis Diseases 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 206010033078 Otitis media Diseases 0.000 description 1
- 206010033266 Ovarian Hyperstimulation Syndrome Diseases 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 208000009722 Overactive Urinary Bladder Diseases 0.000 description 1
- 239000007990 PIPES buffer Substances 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 206010034016 Paronychia Diseases 0.000 description 1
- 241000029132 Paronychia Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 206010034487 Pericarditis constrictive Diseases 0.000 description 1
- 201000005702 Pertussis Diseases 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- 201000007100 Pharyngitis Diseases 0.000 description 1
- 206010035148 Plague Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 241000224016 Plasmodium Species 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 206010036030 Polyarthritis Diseases 0.000 description 1
- 229920002701 Polyoxyl 40 Stearate Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 229920001219 Polysorbate 40 Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 208000004880 Polyuria Diseases 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 206010036376 Postherpetic Neuralgia Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000005107 Premature Birth Diseases 0.000 description 1
- 206010036590 Premature baby Diseases 0.000 description 1
- 206010036600 Premature labour Diseases 0.000 description 1
- 208000004210 Pressure Ulcer Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 206010036774 Proctitis Diseases 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 206010051482 Prostatomegaly Diseases 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 206010037075 Protozoal infections Diseases 0.000 description 1
- 201000001263 Psoriatic Arthritis Diseases 0.000 description 1
- 208000036824 Psoriatic arthropathy Diseases 0.000 description 1
- 208000029464 Pulmonary infiltrates Diseases 0.000 description 1
- 206010037596 Pyelonephritis Diseases 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 201000001947 Reflex Sympathetic Dystrophy Diseases 0.000 description 1
- 206010038419 Renal colic Diseases 0.000 description 1
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 1
- 208000037656 Respiratory Sounds Diseases 0.000 description 1
- 206010038687 Respiratory distress Diseases 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 208000036284 Rhinitis seasonal Diseases 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 206010049677 Salpingo-oophoritis Diseases 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 206010039587 Scarlet Fever Diseases 0.000 description 1
- 241000242680 Schistosoma mansoni Species 0.000 description 1
- 206010039705 Scleritis Diseases 0.000 description 1
- 201000010001 Silicosis Diseases 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 206010058679 Skin oedema Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 240000006394 Sorghum bicolor Species 0.000 description 1
- 206010063036 Spinal cord oedema Diseases 0.000 description 1
- 206010041660 Splenomegaly Diseases 0.000 description 1
- 208000007156 Spondylarthritis Diseases 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 208000007107 Stomach Ulcer Diseases 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 206010042241 Stridor Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 206010042496 Sunburn Diseases 0.000 description 1
- 208000002847 Surgical Wound Diseases 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 206010042674 Swelling Diseases 0.000 description 1
- 208000004760 Tenosynovitis Diseases 0.000 description 1
- GUGOEEXESWIERI-UHFFFAOYSA-N Terfenadine Chemical compound C1=CC(C(C)(C)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 GUGOEEXESWIERI-UHFFFAOYSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010043376 Tetanus Diseases 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 206010064996 Ulcerative keratitis Diseases 0.000 description 1
- 208000023915 Ureteral Neoplasms Diseases 0.000 description 1
- 206010046458 Urethral neoplasms Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 206010046543 Urinary incontinence Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 206010046798 Uterine leiomyoma Diseases 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- 206010046980 Varicella Diseases 0.000 description 1
- 206010046996 Varicose vein Diseases 0.000 description 1
- 241000700647 Variola virus Species 0.000 description 1
- 206010047095 Vascular pain Diseases 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 206010047139 Vasoconstriction Diseases 0.000 description 1
- 206010067275 Vasogenic cerebral oedema Diseases 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 206010069055 Vulvovaginal pain Diseases 0.000 description 1
- 208000000260 Warts Diseases 0.000 description 1
- 241000607734 Yersinia <bacteria> Species 0.000 description 1
- 241000607479 Yersinia pestis Species 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- WERKSKAQRVDLDW-ANOHMWSOSA-N [(2s,3r,4r,5r)-2,3,4,5,6-pentahydroxyhexyl] (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO WERKSKAQRVDLDW-ANOHMWSOSA-N 0.000 description 1
- KPCZJLGGXRGYIE-UHFFFAOYSA-N [C]1=CC=CN=C1 Chemical group [C]1=CC=CN=C1 KPCZJLGGXRGYIE-UHFFFAOYSA-N 0.000 description 1
- XOCUXOWLYLLJLV-UHFFFAOYSA-N [O].[S] Chemical compound [O].[S] XOCUXOWLYLLJLV-UHFFFAOYSA-N 0.000 description 1
- 208000002223 abdominal aortic aneurysm Diseases 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 239000003082 abrasive agent Substances 0.000 description 1
- 206010000269 abscess Diseases 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 229960000583 acetic acid Drugs 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- 208000005707 acquired angioedema Diseases 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 208000026816 acute arthritis Diseases 0.000 description 1
- 201000005661 acute cystitis Diseases 0.000 description 1
- 230000009692 acute damage Effects 0.000 description 1
- 208000005298 acute pain Diseases 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000005354 acylalkyl group Chemical group 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 125000005041 acyloxyalkyl group Chemical group 0.000 description 1
- 210000002534 adenoid Anatomy 0.000 description 1
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000004479 aerosol dispenser Substances 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 208000002029 allergic contact dermatitis Diseases 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 231100000360 alopecia Toxicity 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- SNAAJJQQZSMGQD-UHFFFAOYSA-N aluminum magnesium Chemical compound [Mg].[Al] SNAAJJQQZSMGQD-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229960005260 amiodarone Drugs 0.000 description 1
- 239000002280 amphoteric surfactant Substances 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- HSMPSHPWCOOUJH-UHFFFAOYSA-N anilinyl Chemical group [NH]C1=CC=CC=C1 HSMPSHPWCOOUJH-UHFFFAOYSA-N 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 201000004612 anterior uveitis Diseases 0.000 description 1
- 208000010123 anthracosis Diseases 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000843 anti-fungal effect Effects 0.000 description 1
- 230000001387 anti-histamine Effects 0.000 description 1
- 239000002518 antifoaming agent Substances 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 229940111121 antirheumatic drug quinolines Drugs 0.000 description 1
- 229940027991 antiseptic and disinfectant quinoline derivative Drugs 0.000 description 1
- 239000002216 antistatic agent Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 210000002565 arteriole Anatomy 0.000 description 1
- 125000005018 aryl alkenyl group Chemical group 0.000 description 1
- 125000005015 aryl alkynyl group Chemical group 0.000 description 1
- 125000004350 aryl cycloalkyl group Chemical group 0.000 description 1
- 206010003441 asbestosis Diseases 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 239000003212 astringent agent Substances 0.000 description 1
- 238000011914 asymmetric synthesis Methods 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 238000000376 autoradiography Methods 0.000 description 1
- MGHQUGUIYCOZKR-UHFFFAOYSA-N azanium;pentyl sulfate Chemical compound [NH4+].CCCCCOS([O-])(=O)=O MGHQUGUIYCOZKR-UHFFFAOYSA-N 0.000 description 1
- 208000019804 backache Diseases 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- KCXMKQUNVWSEMD-UHFFFAOYSA-N benzyl chloride Chemical compound ClCC1=CC=CC=C1 KCXMKQUNVWSEMD-UHFFFAOYSA-N 0.000 description 1
- 229940073608 benzyl chloride Drugs 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 208000015294 blood coagulation disease Diseases 0.000 description 1
- 230000024279 bone resorption Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 230000036427 bronchial hyperreactivity Effects 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229960001631 carbomer Drugs 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 229920003123 carboxymethyl cellulose sodium Polymers 0.000 description 1
- 229940063834 carboxymethylcellulose sodium Drugs 0.000 description 1
- 230000007670 carcinogenicity Effects 0.000 description 1
- 231100000260 carcinogenicity Toxicity 0.000 description 1
- 208000002458 carcinoid tumor Diseases 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- 229940073669 ceteareth 20 Drugs 0.000 description 1
- 229940081733 cetearyl alcohol Drugs 0.000 description 1
- 229940074979 cetyl palmitate Drugs 0.000 description 1
- 229940119217 chamomile extract Drugs 0.000 description 1
- 235000020221 chamomile extract Nutrition 0.000 description 1
- CEZCCHQBSQPRMU-UHFFFAOYSA-L chembl174821 Chemical compound [Na+].[Na+].COC1=CC(S([O-])(=O)=O)=C(C)C=C1N=NC1=C(O)C=CC2=CC(S([O-])(=O)=O)=CC=C12 CEZCCHQBSQPRMU-UHFFFAOYSA-L 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 208000003167 cholangitis Diseases 0.000 description 1
- 201000001352 cholecystitis Diseases 0.000 description 1
- 231100000359 cholestasis Toxicity 0.000 description 1
- 230000007870 cholestasis Effects 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 208000002849 chondrocalcinosis Diseases 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 201000003139 chronic cystitis Diseases 0.000 description 1
- 201000009323 chronic eosinophilic pneumonia Diseases 0.000 description 1
- 208000027157 chronic rhinosinusitis Diseases 0.000 description 1
- 235000019987 cider Nutrition 0.000 description 1
- 230000007882 cirrhosis Effects 0.000 description 1
- 208000018912 cluster headache syndrome Diseases 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 230000003930 cognitive ability Effects 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 208000014439 complex regional pain syndrome type 2 Diseases 0.000 description 1
- 230000003750 conditioning effect Effects 0.000 description 1
- 208000027744 congestion Diseases 0.000 description 1
- 201000010918 connective tissue cancer Diseases 0.000 description 1
- 208000000839 constrictive pericarditis Diseases 0.000 description 1
- 208000010247 contact dermatitis Diseases 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 208000021921 corneal disease Diseases 0.000 description 1
- 201000007717 corneal ulcer Diseases 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- XLJMAIOERFSOGZ-UHFFFAOYSA-M cyanate Chemical compound [O-]C#N XLJMAIOERFSOGZ-UHFFFAOYSA-M 0.000 description 1
- 150000003997 cyclic ketones Chemical class 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- FWFSEYBSWVRWGL-UHFFFAOYSA-N cyclohex-2-enone Chemical compound O=C1CCCC=C1 FWFSEYBSWVRWGL-UHFFFAOYSA-N 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 201000003146 cystitis Diseases 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 125000004855 decalinyl group Chemical group C1(CCCC2CCCCC12)* 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 238000002716 delivery method Methods 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 208000033679 diabetic kidney disease Diseases 0.000 description 1
- 201000011190 diabetic macular edema Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 125000006202 diisopropylaminoethyl group Chemical group [H]C([H])([H])C([H])(N(C([H])([H])C([H])([H])*)C([H])(C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229940008099 dimethicone Drugs 0.000 description 1
- 239000004205 dimethyl polysiloxane Substances 0.000 description 1
- 235000013870 dimethyl polysiloxane Nutrition 0.000 description 1
- 125000006222 dimethylaminomethyl group Chemical group [H]C([H])([H])N(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 239000002988 disease modifying antirheumatic drug Substances 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 230000035619 diuresis Effects 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000008406 drug-drug interaction Effects 0.000 description 1
- 208000000718 duodenal ulcer Diseases 0.000 description 1
- 210000000613 ear canal Anatomy 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 206010014665 endocarditis Diseases 0.000 description 1
- 210000003372 endocrine gland Anatomy 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 150000002084 enol ethers Chemical class 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 201000009580 eosinophilic pneumonia Diseases 0.000 description 1
- 208000028104 epidemic louse-borne typhus Diseases 0.000 description 1
- 208000001606 epiglottitis Diseases 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- 208000006881 esophagitis Diseases 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 210000001180 ethmoid sinus Anatomy 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 1
- 125000006534 ethyl amino methyl group Chemical group [H]N(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 231100000013 eye irritation Toxicity 0.000 description 1
- 201000005577 familial hyperlipidemia Diseases 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 230000003176 fibrotic effect Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000003897 fog Substances 0.000 description 1
- 235000020932 food allergy Nutrition 0.000 description 1
- 210000001214 frontal sinus Anatomy 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 208000024386 fungal infectious disease Diseases 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 238000013110 gastrectomy Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 208000030304 gastrointestinal bleeding Diseases 0.000 description 1
- 210000005095 gastrointestinal system Anatomy 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 230000035784 germination Effects 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 230000001434 glomerular Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 150000002327 glycerophospholipids Chemical class 0.000 description 1
- 229940074045 glyceryl distearate Drugs 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 229940075529 glyceryl stearate Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 229940074774 glycyrrhizinate Drugs 0.000 description 1
- LPLVUJXQOOQHMX-QWBHMCJMSA-N glycyrrhizinic acid Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@@H]1C([C@H]2[C@]([C@@H]3[C@@]([C@@]4(CC[C@@]5(C)CC[C@@](C)(C[C@H]5C4=CC3=O)C(O)=O)C)(C)CC2)(C)CC1)(C)C)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O LPLVUJXQOOQHMX-QWBHMCJMSA-N 0.000 description 1
- 208000001786 gonorrhea Diseases 0.000 description 1
- 208000010758 granulomatous inflammation Diseases 0.000 description 1
- 229920000591 gum Polymers 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000010370 hearing loss Effects 0.000 description 1
- 231100000888 hearing loss Toxicity 0.000 description 1
- 208000016354 hearing loss disease Diseases 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 244000000013 helminth Species 0.000 description 1
- 201000011066 hemangioma Diseases 0.000 description 1
- 230000009033 hematopoietic malignancy Effects 0.000 description 1
- 208000031169 hemorrhagic disease Diseases 0.000 description 1
- 208000014617 hemorrhoid Diseases 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 125000004474 heteroalkylene group Chemical group 0.000 description 1
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 1
- PXDJXZJSCPSGGI-UHFFFAOYSA-N hexadecanoic acid hexadecyl ester Natural products CCCCCCCCCCCCCCCCOC(=O)CCCCCCCCCCCCCCC PXDJXZJSCPSGGI-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-UHFFFAOYSA-N hexane-1,2,3,4,5,6-hexol Chemical compound OCC(O)C(O)C(O)C(O)CO FBPFZTCFMRRESA-UHFFFAOYSA-N 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 208000003906 hydrocephalus Diseases 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- 150000001261 hydroxy acids Chemical class 0.000 description 1
- UWYVPFMHMJIBHE-OWOJBTEDSA-N hydroxymaleic acid group Chemical group O/C(/C(=O)O)=C/C(=O)O UWYVPFMHMJIBHE-OWOJBTEDSA-N 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 230000000222 hyperoxic effect Effects 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000002390 hyperplastic effect Effects 0.000 description 1
- 208000024326 hypersensitivity reaction type III disease Diseases 0.000 description 1
- 230000001631 hypertensive effect Effects 0.000 description 1
- 230000036543 hypotension Effects 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 208000008384 ileus Diseases 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000005470 impregnation Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- QNXSIUBBGPHDDE-UHFFFAOYSA-N indan-1-one Chemical compound C1=CC=C2C(=O)CCC2=C1 QNXSIUBBGPHDDE-UHFFFAOYSA-N 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 208000036971 interstitial lung disease 2 Diseases 0.000 description 1
- 201000006334 interstitial nephritis Diseases 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 239000002563 ionic surfactant Substances 0.000 description 1
- 201000004614 iritis Diseases 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 208000002551 irritable bowel syndrome Diseases 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 150000002527 isonitriles Chemical class 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 206010023497 kuru Diseases 0.000 description 1
- 150000003951 lactams Chemical class 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 201000009837 laryngotracheitis Diseases 0.000 description 1
- 210000000867 larynx Anatomy 0.000 description 1
- 238000002430 laser surgery Methods 0.000 description 1
- 201000010260 leiomyoma Diseases 0.000 description 1
- 208000028454 lice infestation Diseases 0.000 description 1
- 210000003041 ligament Anatomy 0.000 description 1
- 210000000088 lip Anatomy 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 231100000515 lung injury Toxicity 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 201000003265 lymphadenitis Diseases 0.000 description 1
- 206010025226 lymphangitis Diseases 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 208000004396 mastitis Diseases 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 210000004086 maxillary sinus Anatomy 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 201000011475 meningoencephalitis Diseases 0.000 description 1
- 230000005499 meniscus Effects 0.000 description 1
- 230000009245 menopause Effects 0.000 description 1
- 231100000544 menstrual irregularity Toxicity 0.000 description 1
- 230000005906 menstruation Effects 0.000 description 1
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 1
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- LVWZTYCIRDMTEY-UHFFFAOYSA-N metamizole Chemical compound O=C1C(N(CS(O)(=O)=O)C)=C(C)N(C)N1C1=CC=CC=C1 LVWZTYCIRDMTEY-UHFFFAOYSA-N 0.000 description 1
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- JIQNWFBLYKVZFY-UHFFFAOYSA-N methoxycyclohexatriene Chemical compound COC1=C[C]=CC=C1 JIQNWFBLYKVZFY-UHFFFAOYSA-N 0.000 description 1
- 125000006533 methyl amino methyl group Chemical group [H]N(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 239000004200 microcrystalline wax Substances 0.000 description 1
- 235000019808 microcrystalline wax Nutrition 0.000 description 1
- 230000003228 microsomal effect Effects 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 206010027599 migraine Diseases 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000003020 moisturizing effect Effects 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 208000030194 mouth disease Diseases 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 208000010805 mumps infectious disease Diseases 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 208000017445 musculoskeletal system disease Diseases 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 208000027531 mycobacterial infectious disease Diseases 0.000 description 1
- 208000001491 myopia Diseases 0.000 description 1
- 230000004379 myopia Effects 0.000 description 1
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 229940097496 nasal spray Drugs 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 238000002663 nebulization Methods 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 208000004296 neuralgia Diseases 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 208000021722 neuropathic pain Diseases 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 150000002825 nitriles Chemical group 0.000 description 1
- NXFQHRVNIOXGAQ-YCRREMRBSA-N nitrofurantoin Chemical compound O1C([N+](=O)[O-])=CC=C1\C=N\N1C(=O)NC(=O)C1 NXFQHRVNIOXGAQ-YCRREMRBSA-N 0.000 description 1
- 229960000564 nitrofurantoin Drugs 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 230000001777 nootropic effect Effects 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- GYCKQBWUSACYIF-UHFFFAOYSA-N o-hydroxybenzoic acid ethyl ester Natural products CCOC(=O)C1=CC=CC=C1O GYCKQBWUSACYIF-UHFFFAOYSA-N 0.000 description 1
- 208000007892 occupational asthma Diseases 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000012053 oil suspension Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 201000005737 orchitis Diseases 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 208000020629 overactive bladder Diseases 0.000 description 1
- 238000012261 overproduction Methods 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 235000021400 peanut butter Nutrition 0.000 description 1
- 229940100460 peg-100 stearate Drugs 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 208000008494 pericarditis Diseases 0.000 description 1
- 201000001245 periodontitis Diseases 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 210000001428 peripheral nervous system Anatomy 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 206010034674 peritonitis Diseases 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- 208000001297 phlebitis Diseases 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 239000000419 plant extract Substances 0.000 description 1
- 208000008423 pleurisy Diseases 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010483 polyoxyethylene sorbitan monopalmitate Nutrition 0.000 description 1
- 239000000249 polyoxyethylene sorbitan monopalmitate Substances 0.000 description 1
- 235000010989 polyoxyethylene sorbitan monostearate Nutrition 0.000 description 1
- 239000001818 polyoxyethylene sorbitan monostearate Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229940101027 polysorbate 40 Drugs 0.000 description 1
- 229940113124 polysorbate 60 Drugs 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000012495 positive regulation of renal sodium excretion Effects 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 201000007094 prostatitis Diseases 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000022558 protein metabolic process Effects 0.000 description 1
- 201000001474 proteinuria Diseases 0.000 description 1
- 208000028172 protozoa infectious disease Diseases 0.000 description 1
- 230000004144 purine metabolism Effects 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000001525 receptor binding assay Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 201000002793 renal fibrosis Diseases 0.000 description 1
- 230000010410 reperfusion Effects 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 201000000980 schizophrenia Diseases 0.000 description 1
- 208000017022 seasonal allergic rhinitis Diseases 0.000 description 1
- 230000001932 seasonal effect Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 208000013220 shortness of breath Diseases 0.000 description 1
- 208000004003 siderosis Diseases 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 238000002603 single-photon emission computed tomography Methods 0.000 description 1
- 230000009759 skin aging Effects 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 201000010153 skin papilloma Diseases 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 description 1
- 235000010378 sodium ascorbate Nutrition 0.000 description 1
- 229960005055 sodium ascorbate Drugs 0.000 description 1
- 229910001467 sodium calcium phosphate Inorganic materials 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 239000008347 soybean phospholipid Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000019100 sperm motility Effects 0.000 description 1
- 210000003718 sphenoid sinus Anatomy 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 208000018556 stomach disease Diseases 0.000 description 1
- 208000003265 stomatitis Diseases 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- 125000005750 substituted cyclic group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000002636 symptomatic treatment Methods 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 208000006379 syphilis Diseases 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000003507 tetrahydrothiofenyl group Chemical group 0.000 description 1
- 125000005329 tetralinyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 230000003685 thermal hair damage Effects 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 201000005060 thrombophlebitis Diseases 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 230000007838 tissue remodeling Effects 0.000 description 1
- 210000002105 tongue Anatomy 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 206010044652 trigeminal neuralgia Diseases 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- UJMBCXLDXJUMFB-UHFFFAOYSA-K trisodium;5-oxo-1-(4-sulfonatophenyl)-4-[(4-sulfonatophenyl)diazenyl]-4h-pyrazole-3-carboxylate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)C1=NN(C=2C=CC(=CC=2)S([O-])(=O)=O)C(=O)C1N=NC1=CC=C(S([O-])(=O)=O)C=C1 UJMBCXLDXJUMFB-UHFFFAOYSA-K 0.000 description 1
- 201000008827 tuberculosis Diseases 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 208000025883 type III hypersensitivity disease Diseases 0.000 description 1
- 230000036269 ulceration Effects 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 208000000143 urethritis Diseases 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 208000027185 varicose disease Diseases 0.000 description 1
- 230000003966 vascular damage Effects 0.000 description 1
- 230000025033 vasoconstriction Effects 0.000 description 1
- 208000037997 venous disease Diseases 0.000 description 1
- 210000000264 venule Anatomy 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 208000009935 visceral pain Diseases 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/04—Drugs for disorders of the respiratory system for throat disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Pulmonology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Immunology (AREA)
- Endocrinology (AREA)
- Urology & Nephrology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Ophthalmology & Optometry (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Heart & Thoracic Surgery (AREA)
- Gastroenterology & Hepatology (AREA)
- Obesity (AREA)
- Dermatology (AREA)
- Cardiology (AREA)
- Reproductive Health (AREA)
- Otolaryngology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Изобретение относится к соединениям формулы (I), где А представляет собой 6-членный гетероарил, имеющий 1 атом азота в качестве гетероатома, замещенный 2-3 заместителями, такими, как указано в формуле изобретения, R5 представляет собой атом галогена, циано или C1-С6алкил, необязательно замещенный атомом галогена; R6 представляет собой C1-С6 алкил, необязательно замещенный ОН; C1-С3 алкенил; 5-членный гетероарил, имеющий 2-4 гетероатома, каждый из которых независимо выбран из N, О, или S, замещенный 0-2 заместителями, такими, как указано в формуле изобретения, R10 представляет собой 5-членный гетероарил, имеющий 2-3 гетероатома, каждый из которых выбран из N, О или S, замещенный 0-2 заместителями, представляющими собой C1-С3 алкил; R7, R8, R17 представляют собой атом водорода или галогена. Также изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении рецептора В2 ВК, которая содержит соединения формулы (I), способу ингибирования, способу локализации или детектирования рецептора В2 ВК в ткани, применению соединений или композиции для изготовления лекарственного средства, способам лечения. Технический результат - соединения формулы (I) в качестве ингибиторов рецептора В2 ВК. 10 н. и 12 з.п. ф-лы, 1 табл., 54 пр.
Description
Данное изобретение относится к новым производным 8-(гетероарилметокси)хинолина, содержащим их композициям и применению указанных соединений. Эти соединения действуют в качестве селективных модуляторов рецепторов В2 брадикинина (ВК), и поэтому их можно применять в фармацевтических композициях для лечения состояний, восприимчивых к модуляции рецептора В2 ВК. Соединения изобретения являются также применимыми в качестве зондов для локализации рецепторов В2 ВК и в качестве стандартов в анализах связывания рецептора В2 ВК.
Брадикинин (ВК) является вазоактивным нонапептидом, H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH, образованным действием различных ферментов плазмы, таких как калликреин, на кининогены. В некоторых аспектах он обладает некоторыми действиями, аналогичными действиям гистамина, и подобно гистамину высвобождается из венул, а не из артериол.
У млекопитающих идентифицировано два типа рецепторов ВК, В1 и В2 (Leeb-Lundberg, et al. Pharmacol. Rev. 2005, 57, 27-77). Действия ВК, опосредуемые рецептором В2, являются важными физиологическими функциями, такими как повышения в васкулярной проницаемости, модуляции воспалительных реакций и боли, а также вазоактивные действия (вазодилация, вазоконстрикция). Эти действия у рецептора В2 являются ответственными за роль ВК в многочисленных заболеваниях, таких как воспаление, сердечно-сосудистое заболевание и боль. Поэтому средства, которые блокируют связывание ВК с его рецептором В2, могут ингибировать или по меньшей мере ослаблять патогенные случаи.
Многочисленные пептидные и непептидные антагонисты рецептора В2 ВК описаны в известном уровне техники. Например, в WO 2006/40004, WO 03/103671, WO 03/87090, WO 00/23439, WO 00/50418, WO 99/64039, WO 97/41104, WO 97/28153, WO 97/07115, WO 96/13485, EP 0795547, EP 0796848, EP 0867432 и EP 1213289 описаны производные хинолина, которые являются антагонистами рецептора В2 ВК.
Ввиду тяжелых состояний, связанных с патофизиологическим уровнем брадикинина, как острых, так и хронических, все же существует потребность в высокоселективных модуляторах рецептора В2, обладающих улучшенными свойствами.
Следовательно, проблемой, лежащей в основе настоящего изобретения, является предложение высокоселективных модуляторов рецептора В2, предпочтительно обладающих улучшенными свойствами.
Проблема, лежащая в основе настоящего изобретения, разрешается посредством соединения, охарактеризованного прилагаемой формулой изобретения.
В первом аспекте проблема, лежащая в основе настоящей заявки, разрешается посредством соединением формулы (I)
или его фармакологически приемлемой соли, сольвата или гидрата, где
А представляет собой 6-членный гетероарил, имеющий от 1 до 3 гетероатомов, каждый из которых независимо выбран из N или О, где указанный 6-членный гетероарил замещен от 2 до 4 заместителями, каждый из которых независимо выбран из атома галогена, атома кислорода, гидрокси, циано, амино, нитро, меркапто, алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклоалкила, алкилциклоалкила, гетероалкилциклоалкила, арила, гетероарила, аралкила или гетероаралкила;
R5 представляет собой атом галогена, гидрокси, циано, нитро, меркапто, алкил, алкенил, алкинил или гетероалкил;
R6 представляет собой необязательно замещенный алкил; необязательно замещенный алкенил; 5-членный гетероциклоалкил, имеющий от 1 до 3 гетероатомов, каждый из которых независимо выбран из N, O или S, или циклоалкил, где указанный 5-членный гетероциклоалкил или циклоалкил замещен от 0 до 3 заместителями, каждый из которых независимо выбран из атома галогена, атома кислорода, гидрокси, циано, амино, нитро, меркапто, алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклоалкила, алкилциклоалкила, гетероалкилциклоалкила, арила, гетероарила, аралкила или гетероаралкила; 5-членный гетероарил, имеющий от 1 до 4 гетероатомов, каждый из которых независимо выбран из N, O или S, где указанный 5-членный гетероарил замещен от 0 до 3 заместителями, каждый их которых независимо выбран из атома галогена, атома кислорода, гидрокси, циано, амино, нитро, меркапто, алкила, алкенила, алкинила, гетероалкила, необязательно замещенного арила или необязательно замещенного гетероарила; или -S-R10;
R10 представляет собой 5-членный гетероциклоалкил, имеющий от 1 до 3 гетероатомов, каждый из которых независимо выбран из N, O или S, или циклоалкил, где указанный 5-членный гетероциклоалкил или циклоалкил замещен от 0 до 4 заместителями, каждый их которых независимо выбран из атома галогена, атома кислорода, гидрокси, циано, амино, нитро, меркапто, алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклоалкила, алкилциклоалкила, гетероалкилциклоалкила, арила, гетероарила, аралкила или гетероаралкила; или 5-членный гетероарил, имеющий от 1 до 4 гетероатомов, каждый из которых независимо выбран из N, O или S, где указанный 5-членный гетероарил замещен от 0 до 4 заместителями, каждый их которых независимо выбран из атома галогена, атома кислорода, гидрокси, циано, амино, нитро, меркапто, алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклоалкила, алкилциклоалкила, гетероалкилциклоалкила, арила, гетероарила, аралкила или гетероаралкила;
R7 представляет собой атом водорода, атом галогена, гидрокси, циано, амино, нитро, алкил или гетероалкил;
R8 представляет собой атом водорода или атом галогена и
R17 представляет собой атом водорода или атом галогена.
В варианте осуществления первого аспекта настоящего изобретения гетероарил А соединения содержит от 1 до 3 атомов азота.
В варианте осуществления первого аспекта настоящего изобретения А представляет собой
где
W представляет собой N, NO или CR9;
Y представляет собой N, NO или CR2;
Z представляет собой N, NO или CR3;
с условием, что по меньшей мере один из W, Y или Z представляет собой N или NO;
R1 представляет собой атом галогена, гидрокси, циано, амино, нитро, меркапто, алкил, алкенил, алкинил, гетероалкил или гетероалкилциклоалкил;
R2 представляет собой атом водорода, гидроксил, атом галогена, циано, нитро, меркапто, алкил, алкенил, алкинил или гетероалкил;
R3 представляет собой атом водорода, атом галогена, гидрокси, циано, амино, нитро, меркапто, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклоалкил, алкилциклоалкил, гетероалкилциклоалкил, арил, гетероарил, аралкил или гетероаралкил;
R4 представляет собой атом галогена, гидрокси, циано, амино, нитро, меркапто, алкил, алкенил, алкинил, гетероалкил, циклоалкил, гетероциклоалкил, алкилциклоалкил, гетероалкилциклоалкил, арил, гетероарил, аралкил или гетероаралкил и
R9 представляет собой атом водорода, атом галогена или С1-С6алкил.
В варианте осуществления первого аспекта настоящего изобретения R6 представляет собой
где
А1, А2, А3, А4 и А5, каждый независимо, выбраны из O, S, N, N-H, NO, C или C-H и
R11 и R12, каждый независимо, выбран из атома водорода, атома галогена, гидрокси, циано, амино, нитро, меркапто, алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклоалкила, алкилциклоалкила, гетероалкилциклоалкила, арила, гетероарила, аралкила или гетероаралкила.
В варианте осуществления первого аспекта настоящего изобретения R6 представляет собой
где
А1, А2, А3, А4 и А5, каждый независимо, выбраны из O, S, N, N-H, NO, C или C-H и
R11 и R12, каждый независимо, выбраны из атома водорода, атома галогена, гидрокси, циано, амино, нитро, меркапто, алкила, алкенила, алкинила, гетероалкила, циклоалкила, гетероциклоалкила, алкилциклоалкила, гетероалкилциклоалкила, арила, гетероарила, аралкила или гетероаралкила.
В варианте осуществления первого аспекта настоящего изобретения
R4 выбран из гетероалкила, гетероциклоалкила, гетероалкилциклоалкила, аралкила или гетероаралкила;
W представляет собой CR9;
Y представляет собой N, NO или CR2;
Z представляет собой N, NO или CR3;
с условием, что по меньшей мере один из Y или Z представляет собой N или NO;
R1 представляет собой атом галогена, гидрокси, циано, -О-С1-С6алкил или С1-С6алкил;
R2 представляет собой атом водорода, атом галогена, гидрокси, циано, -О-С1-С6алкил или С1-С6алкил и
R3 представляет собой атом водорода, атом галогена, гидрокси, циано, амино, нитро, -О-алкил или алкила.
В одном варианте осуществления первого аспекта настоящего изобретения R4 выбран из групп -S-Ya-L, -S-Ya-CO-NRaRb, -Ya-NRc-CO-NRaRb, -Ya-NRc-CO-O-Re, -Ya-NRc-CO-Re, -Ya-O-CO-NRaRb, -Ya-CO-NRaRb, -Ya-CO-NRcL, -O-Ya-CO-NRaRb, -Ya-NRc-CO-L, -Ya-L, -Ya-O-CO-O-Rc, -Ya-O-CO-Rc, -Ya-NRc-SO2-NRaRb, -Ya-SO2-NRaRb или -Ya-NRc-SO2-Re,
где
Ya представляет собой связь, С1-С6алкилен, С2-С6алкенилен или С2-С6алкинилен;
Ra представляет собой атом водорода, С1-С6алкил, С2-С6алкенил, С2-С6алкинил или соединяется с Rb с образованием 4-10-членного циклоалкила или гетероциклоалкила;
Rb представляет собой атом водорода, С1-С6алкил, С2-С6алкенил, С2-С6алкинил или Rb, взятый вместе с Ra, образует 4-10-членный циклоалкил или гетероциклоалкил;
Rc и Re, каждый независимо, выбраны из атома водорода, необязательно замещенного С1-С6алкила, необязательно замещенного С2-С6алкенила или необязательно замещенного С2-С6алкинила; и
L представляет собой циклоалкил, гетероциклоалкил, алкилциклоалкил, гетероалкилциклоалкил, арил, необязательно замещенный гетероарил, аралкил или гетероаралкил.
В варианте осуществления первого аспекта настоящего изобретения R4 представляет собой
где
Xa представляет собой N, O или CH;
Xb представляет собой C, S или S=O;
Xc представляет собой N, O или CH;
R13, если присутствует, представляет собой С1-С6алкил;
R14, если присутствует, представляет собой С1-С6алкил, С2-С6алкенил или R14 соединен с R15 с образованием
(i) 5-10-членного циклоалкила;
(ii) 5-10-членного гетероциклоалкила;
(iii) 5-10-членного гетероарила или
(iv) 6-10-членного арила;
R15 представляет собой алкил, алкенил или соединен с R14 с образованием
(i) 5-10-членного циклоалкила;
(ii) 5-10-членного гетероциклоалкила;
(iii) 5-10-членного гетероарила или
(iv) 6-10-членного арила; и/или
R15 взят вместе с R16 с образованием
(i) 4-10-членного циклоалкила;
(ii) 4-10-членного гетероциклоалкила;
(iii) 5-10-членного гетероарила или
(iv) 6-10-членного арила и
R16 представляет собой водород, алкил, алкенил, арил, гетероарил или R16, взятый вместе с R15, образует
(i) 4-10-членный циклоалкил;
(ii) 4-10-членный гетероциклоалкил;
(iii) 5-10-членный гетероарил или
(iv) 6-10-членный арил.
В варианте осуществления первого аспекта настоящего изобретения R4 представляет собой
где
R13 представляет собой атом водород или С1-С6алкил;
R18 и R19, каждый независимо, выбраны из атома водорода, атома галогена, гидрокси, циано, амино, нитро, С1-С6алкила, -О-С1-С6алкила, -СО-NRaRb или -SO2-NRaRb, где
Ra и Rb, каждый независимо, выбраны из атома водорода или С1-С6алкила.
В варианте осуществления первого аспекта настоящего изобретения R5 представляет собой атом галогена, циано или С1-С6алкил.
В варианте осуществления первого аспекта настоящего изобретения R7, R8 и R17, каждый независимо, выбраны из Н или F.
В варианте осуществления первого аспекта настоящего изобретения R5 представляет собой метил или этил.
В варианте осуществления первого аспекта настоящего изобретения R6 выбран из групп
В варианте осуществления первого аспекта настоящего изобретения
R1 представляет собой метил, Cl, F, CN или О-СН3;
W представляет собой СН;
Y представляет собой N, NO, CH, C-CH3, C-OH или C-OCH3;
Z представляет собой N, NO, CH, C-CH3, C-OH или C-OCH3 и
с условием, что по меньшей мере один из Y или Z представляет собой N или NO.
В варианте осуществления первого аспекта настоящего изобретения R4 представляет собой
где
R13 представляет собой атом водорода или метил;
R20 представляет собой Cl, F, циано или CF3 и
R21 представляет собой атом водорода или F.
В варианте осуществления первого аспекта настоящего изобретения R7, R8 и R17 представляют собой Н.
В варианте осуществления первого аспекта настоящего изобретения соединение согласно настоящему изобретению или его соль или сольват проявляет IC50 500 нМ или меньше в стандартном анализе in vitro опосредуемого В2-рецептором ВК.
Во втором аспекте проблема, лежащая в основе настоящего изобретения, разрешается посредством соединения, причем таким соединением предпочтительно является соединение согласно первому аспекту настоящего изобретения, которое представляет собой
1-{3-[4-(5-хлортиазол-4-ил)-2-метил-хинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-метил-3-[2-метил-4-(4-метил-2H-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлор-1-метил-1H-имидазол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{5-хлор-2-метокси-4-[2-метил-4-(2-метил-2H-[1,2,4]триазол-3-ил)хинолин-8-илоксиметил]пиридин-3-илметил}-3-трифторметил-1H-пиридин-2-он,
1-(3-{4-[4-(2-аминоэтокси)-1H-пиразол-3-ил]-2-метилхинолин-8-илоксиметил}-4-метилпиридин-2-илметил)-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(1,5-диметил-1H-имидазол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{3-[4-(4-гидроксиметил-2H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
N-(3-{2-метил-8-[4-метил-2-(2-оксо-3-трифторметил-2H-пиридин-1-илметил)пиридин-3-илметокси]хинолин-4-ил}-1H-пиразол-4-илметил)ацетамид,
1-{3-[4-(4-аминометил-1H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
N-(5-{8-[4-хлор-2-(2-оксо-3-трифторметил-2H-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1H-пиразол-4-илметил)ацетамид,
2-{8-[4-хлор-6-метил-2-(2-оксо-3-трифторметил-2H-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-3-метил-3H-имидазол-4-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(4-метил-2H-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(4-метил-1H-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
5-{8-[4-хлор-2-(2-оксо-3-трифторметил-2H-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-3-метил-3H-имидазол-4-карбонитрил,
1-{4-хлор-3-[4-(4-хлортиазол-5-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(5-циано-1-метил-1H-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-4-метоксипиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-циано-1-метил-1H-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
амид 5-{8-[4-хлор-6-метил-2-(2-оксо-3-трифторметил-2H-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1H-пиррол-2-карбоновой кислоты,
амид 5-{8-[4-хлор-2-(3-циано-2-оксо-2H-пиридин-1-илметил)-6-метилпиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1H-пиррол-2-карбоновой кислоты,
1-{4-хлор-3-[4-(4-гидроксиметил-2H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-гидрокси-1H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(4-гидрокси-1H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-фторпиразол-1-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-4-метоксипиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
2-{8-[5-фтор-2-метокси-3-(2-оксо-3-трифторметил-2H-пиридин-1-илметил)пиридин-4-илметокси]-2-метилхинолин-4-ил}-3-метил-3H-имидазол-4-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(5-метил-1H-имидазол-4-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[2-метил-4-(4-метил-1H-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[4-(4-гидрокси-1H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
амид 5-{8-[4-хлор-2-(3-циано-2-оксо-2H-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1H-пиррол-2-карбоновой кислоты,
1-{4-хлор-3-[4-(4-фторпиразол-1-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[4-(4-гидрокси-1H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(3-метилизоксазол-4-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{5-хлор-4-[4-(5-циано-1-метил-1H-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]-2-гидроксипиридин-3-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-метокси-6-метил-3-[2-метил-4-(4-метил-1H-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-гидроксиметил-1H-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(5-фтортиазол-2-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил.
В третьем аспекте проблема, лежащая в основе настоящего изобретения, разрешается посредством фармацевтической композиции, которая содержит одно или несколько соединений согласно первому и/или второму аспекту настоящего изобретения и необязательно по меньшей мере одно вещество-носитель, эксципиент и/или адъювант.
В варианте осуществления третьего аспекта фармацевтическую композицию изготовляют в виде аэрозоля, крема, геля, пилюли, капсулы, сиропа, раствора, чрескожного пластыря или устройства для доставки фармацевтического средства.
В четвертом аспекте проблема, лежащая в основе настоящего изобретения, разрешается посредством способа ингибирования связывания ВК с рецептором В2 ВК in vitro, причем способ включает контактирование рецептора В2 ВК по меньшей мере с одним соединением согласно первому и/или второму аспекту настоящего изобретения или его солью в условиях и в количестве, достаточном для поддающегося обнаружению ингибирования связывания ВК или любого другого вещества с рецептором В2 ВК.
В пятом аспекте проблема, лежащая в основе настоящего изобретения, разрешается посредством способа локализации или детектирования рецептора В2 ВК в ткани, предпочтительно части ткани, in vitro, включающего
(а) контактирование образца ткани, содержащего рецептор В2 ВК, с поддающимся обнаружению меченым соединением согласно первому и/или второму аспекту настоящего изобретения в условиях, которые позволяют соединению связываться с рецептором В2 ВК, и
(b) детектирование связанного соединения.
В варианте осуществления пятого аспекта соединение является меченым радиоактивным изотопом, меченым маркером флуоресценции или меченым маркером люминесценции или меченым антителом.
В шестом аспекте проблема, лежащая в основе настоящего изобретения, разрешается за счет применения соединения согласно первому и/или второму аспекту настоящего изобретения или фармацевтической композиции согласно третьему аспекту настоящего изобретения для изготовления лекарственного средства для лечения и/или предупреждения заболевания или состояния.
В варианте осуществления шестого аспекта настоящего изобретения состояние или заболевание является восприимчивым к модуляции рецептора В2 ВК.
В варианте шестого аспекта состоянием являются кожные нарушения, глазные заболевания; ушные заболевания, заболевания полости рта, горла и респираторные заболевания; желудочно-кишечные заболевания; заболевания печени, желчного пузыря и поджелудочной железы; заболевания мочевых путей и почек; заболевания мужских половых органов и женских половых органов; заболевания гормональной системы; метаболические заболевания; сердечно-сосудистые заболевания; болезни крови; лимфатические заболевания; нарушения центральной нервной системы; нарушения головного мозга; заболевания костно-мышечной системы; аллергические нарушения; боль; инфекционные заболевания; воспалительные нарушения; травмы; иммунологические нарушения; раковые заболевания; наследственные заболевания; или отек.
В седьмом аспекте проблема, лежащая в основе настоящего изобретения, разрешается за счет способа лечения субъекта, который нуждается в таком лечении, включающем введение соединения согласно первому и/или второму аспекту настоящего изобретения или фармацевтической композиции согласно третьему аспекту.
Предложенные здесь модуляторы рецептора В2 ВК проявляют высокую активность в отношении рецептора В2 ВК человека (т.е. имеют константу ингибирования (IC50) для конкуренции со связыванием меченого ВК с рецептором В2 ВК человека меньше чем 5 микромоль) или очень высокую активность в отношении рецептора В2 ВК человека (т.е. имеют IC50 для конкуренции со связыванием меченого ВК с рецептором В2 ВК человека предпочтительно меньше чем 50 наномоль). В некоторых вариантах осуществления такие модуляторы проявляют высокую активность в отношении рецепторов В2 ВК других, чем человек, видов, например крысы, мыши, песчанки, морской свинки, кролика, собаки, кошки, свиньи или собакоподобной обезьяны.
Активность и более определенно фармакологическая активность модуляторов рецептора В2 согласно настоящему изобретению можно анализировать с применением подходящих in vitro анализов. Например, величины IC50 модуляторов согласно настоящему изобретению для рецептора В2 можно определить с помощью анализа связывания радиолиганда, такого как анализ, представленный в примере 754, который, таким образом, является вариантом осуществления стандартного анализа in vitro опосредуемого рецептором В2 ВК. Ингибирующие действия модуляторов рецептора В2, предложенные здесь для рецептора В2, можно определить, например, с помощью анализа мобилизации кальция, такого как анализ, предложенный в примере 755.
Предпочтительные соединения изобретения имеют IC50 (полумаксимальная ингибирующая концентрация) приблизительно 5 микромоль или меньше, еще более предпочтительно IC50 приблизительно 500 нМ или меньше или даже 50 нМ или меньше, даже более предпочтительно IC50 приблизительно 10 нМ или меньше или даже 1 наномоль или меньше в указанных выше анализах.
Настоящее изобретение дополнительно относится в других аспектах к фармацевтическим композициям, содержащим по меньшей мере один модулятор рецептора В2 ВК, как здесь описано, в комбинации с физиологически приемлемым носителем или эксципиентом. Предложены также способы получения таких фармацевтических композиций. Такие композиции являются особенно применимыми при лечении опосредуемых рецептором В2 заболеваний, описываемых ниже.
Эти и другие аспекты настоящего изобретения станут очевидными после обращения к нижеследующему подробному описанию.
Соединения в общем описаны здесь с применением стандартной номенклатуры. В случае соединений, имеющих асимметричные центры, должно быть понятно (если не оговорено особо), что включены все оптические изомеры и их смеси. Соединения с двумя или более асимметричными элементами могут также присутствовать в виде смесей диастереомеров. Кроме того, соединения с углерод-углеродной двойной связью могут присутствовать в Z- и Е-формах, причем в настоящее изобретение включены все изомерные формы соединений, если не оговорено особо. Когда соединение существует в различных таутомерных формах, описанное соединение не ограничивается каким-либо одним определенным таутомером, но скорее предназначено для включения всех таутомерных форм. Далее предполагается, что описанные соединения включают в себя соединения, у которых один или несколько атомов заменены изотопом (т.е. атомом, имеющим такой же порядковый номер, но другое массовое число). В качестве общего примера и без ограничения указанным изотопы водорода включают в себя тритий и дейтерий и изотопы углерода включают в себя 11С, 13С и 14С.
Соединения согласно формулам, представленным здесь, которые имеют один или несколько стереогенных центров, имеют энантиомерный избыток по меньшей мере 50%. Например, такие соединения могут иметь энантиомерный избыток по меньшей мере 60%, 70%, 80%, 85%, 90%, 95% или 98%. В некоторых вариантах осуществления соединения имеют энантиомерный избыток по меньшей мере 99%. Должно быть очевидно, что индивидуальные энантиомеры (оптически активные формы) можно получить асимметричным синтезом, синтезом из оптически чистых предшественников или разделением рацематов. Разделение рацематов можно выполнить, например, общепринятыми способами, такими как кристаллизация в присутствии разделяющего агента или хроматография с применением, например, ВЭЖХ с хиральной колонкой.
Некоторые соединения здесь описаны с применением общей формулы, которая включает в себя символы (например, А, R1-R12, W, Y, Z). Если не оговорено особо, каждый символ в такой формуле имеет значение, независимое от любого другого символа, и любой символ, который встречается в формуле более чем один раз, имеет значение независимо для каждого случая. Так, например, если показано, что группа замещена 0-2 R*, группа может быть незамещенной или замещенной группами R* до двух и R* в каждом случае выбран независимо от определения R*. Кроме того, комбинации заместителей и/или символов являются допустимыми, только если такие комбинации приводят к стабильным соединениям (т.е. соединениям, которые можно выделить, характеризовать и испытать на биологическую активность).
Термин “8-(гетероарилметокси)хинолин”, применяемый здесь, относится к представленным здесь соединениям формулы (I), а также их солям и предпочтительно фармацевтически приемлемым солям. Должно быть очевидно, что такие соединения могут быть, как указано, дополнительно замещены.
“Фармацевтически приемлемой солью” описанного здесь соединения является соль кислоты или основания, которая обычно, как считается в данной области, является подходящей для применения в контакте с тканями людей или животных без избыточной токсичности или карциногенности и предпочтительно без раздражения, аллергической реакции или другой проблемы или осложнения. Такие соли включают в себя соли с минеральными и органическими кислотами основных остатков, таких как амины, а также соли с щелочными металлами или органическими основаниями кислотных остатков, таких как карбоновые кислоты.
Подходящие фармацевтические соли включают, но не ограничиваются перечисленным, соли кислот, таких как хлористоводородная, фосфорная, бромистоводородная, яблочная, гликолевая, фумаровая, серная, сульфаминовая, сульфаниловая, муравьиная, толуолсульфоновая, метансульфоновая, бензолсульфоновая, этандисульфоновая, 2-гидроксиэтилсульфоновая, азотная, бензойная, 2-ацетоксибензойная, лимонная, винная, молочная, стеариновая, салициловая, глутаминовая, аскорбиновая, памоевая, янтарная, фумаровая, малеиновая, пропионовая, гидроксималеиновая, иодистоводородная, фенилуксусная, алкановые кислоты, такие как уксусная, HOOC-(CH2)n-COOH, где n равно любому целому числу от 0 до 4 (т.е. 0, 1, 2, 3, или 4), и тому подобное. Аналогично этому,, фармацевтически приемлемые катионы включают, но не ограничиваются перечисленным, натрий, калий, кальций, алюминий, литий и аммоний. Средний специалист в данной области должен знать дальнейшие фармацевтически приемлемые соли для предложенных здесь соединений. В общем, фармацевтически приемлемую соль кислоты или основания можно синтезировать из “родительского” соединения, которое содержит основную или кислотную часть, любым общепринятым химическим способом. Вкратце, такие соли можно получить реакцией этих соединений в формах свободных кислот или оснований со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или смеси двух. Обычно предпочтительным является применение неводных сред, таких как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Должно быть очевидно, что каждое соединение формулы (I) может, если необходимо, присутствовать в виде гидрата, сольвата или нековалентного комплекса. Кроме того, в объеме настоящего изобретения имеются различные кристаллические формы и полиморфы, так же как пролекарства предложенных здесь соединений формулы (I).
“Пролекарство” является соединением, которое может не полностью удовлетворять структурные требования предложенных здесь соединений, но модифицируется in vivo после введения субъекту или пациенту с образованием предложенного здесь соединения формулы (I). Например, пролекарством может быть ацилированное производное предложенного здесь соединения. Пролекарства включают в себя соединения, у которых гидрокси, карбокси, амин или сульфгидрильные группы связаны с любой группой, которая при введении субъекту-млекопитающему отщепляется с образованием свободной гидрокси, карбокси, амино или сульфгидрильной группы соответственно. Примеры пролекарств включают в себя, но не ограничиваются перечисленным, ацетатные, формиатные, фосфатные и бензоатные производные спиртовых и аминовых функциональных групп в предложенных здесь соединениях. Пролекарства предложенных здесь соединений можно получить модификацией функциональных групп, присутствующих в соединениях, таким путем, чтобы модифицирующие группы отщеплялись in vivo с образованием “родительских” соединений.
Термин “заместитель”, применяемый здесь, относится к молекулярной части, которая ковалентно связана с атомом в представляющей интерес молекуле. Например, “заместителем кольца” может быть такая часть, как галоген, алкильная группа, галогеналкильная группа, гидрокси, циано, амино, нитро, меркапто или другой описанный здесь заместитель, который ковалентно связан с атомом (предпочтительно атомом углерода или азота), который является членом кольца. Термин “замещенный”, применяемый здесь, означает, что любой один или несколько атомов водорода на указанном атоме заменены с выбором из указанных заместителей, при условии что нормальная валентность указанного атома не превышена и что замещение приводит к образованию стабильного соединения (т.е. соединения, которое можно выделить, характеризовать и испытать на биологическую активность). Когда заместителем является оксо (т.е. =О), то на атоме заменяются 2 атома водорода. Оксогруппа, которая является заместителем ароматического атома углерода, приводит к превращению -СН- в -С(=О)- и потере ароматичности. Например, пиридильной группой, замещенной оксо, является пиридон.
Выражение алкил относится к насыщенной углеводородной группе с неразветвленной или разветвленной цепью, которая содержит от 1 до 20 атомов углерода, предпочтительно от 1 до 12 атомов углерода, более предпочтительно от 1 до 6 атомов углерода, например метильной, этильной, пропильной, изопропильной, н-бутильной, изобутильной, втор-бутильной, трет-бутильной, н-пентильной, н-гексильной, 2,2-диметилбутильной или н-октильной группе.
Выражения алкенил и алкинил относятся по меньшей мере к частично ненасыщенным углеводородным группам с неразветвленной или разветвленной цепью, которые содержат от 2 до 20 атомов углерода, предпочтительно от 2 до 12 атомов углерода, более предпочтительно от 2 до 6 атомов углерода, например этенильной, аллильной, ацетиленильной, пропаргильной, изопренильной или гекс-2-енильной группе. Алкенильные группы предпочтительно имеют одну или две (более предпочтительно одну) двойные связи и алкинильные группы имеют одну или две (более предпочтительно одну) тройные связи.
Кроме того, термины алкил, алкенил и алкинил относятся к группам, в которых один или несколько атомов водорода заменены, каждый независимо от других, атомом галогена (предпочтительно F или Cl), таким как 2,2,2-трихлорэтильная или трифторметильная группа.
Выражение гетероалкил относится к алкильной, алкенильной или алкинильной группе (например, гетероалкенильной, гетероалкинильной), в которой один или несколько (предпочтительно 1, 2 или 3) атомов углерода заменены, каждый независимо от других, атомом кислорода, азота, фосфора, бора, селена, кремния или серы (предпочтительно кислорода, серы или азота). Кроме того, выражение гетероалкил относится к карбоновой кислоте или группе, образованной из карбоновой кислоты, такой как, например, ацил, ацилалкил, алкоксикарбонил, ацилокси, ацилоксиалкил, карбоксиалкиламид, алкилкарбамоилалкил, алкилкарбамоилоксиалкил, алкилуреидоалкил или алкоксикарбонилокси.
Примерами гетероалкильных групп являются группы формул -S-Ya-L, -S-Ya-CO-NRaRb, -Ya-NR-CO-NRaRb, -Ya-NRc-CO-O-Rc, -Ya-NRc-CO-Rc, -Ya-O-CO-NRaRb, -Ya-CO-NRaRb, -O-Ya-CO-NaRb, -Ya-NRc-CO-L, -Ya-L, -Ya-O-CO-O-Rc, -Ya-O-CO-Rc, Rc-O-Ya-, Rc-S-Ya-, Ra-N(Rb)-Ya-, Rc-CO-Ya-, Rc-O-CO-Ya-, Rc-CO-O-Ya-, Rc-CO-N(Rb)-Ya-, Ra-N(Rb)-CO-Ya-, Rc-SO-Ya-, Rc-SO2-Ya-, -Ya-NRc-SO2-NRaRb, -Ya-SO2-NRaRb, -Ya-NRc-SO2-Rc, Ra-O-CO-N(Rb)-Ya-, Ra-N(Rb)-C(=NRd)-N(Rc)-Ya-, Rc-S-CO-Ya-, Rc-CO-S-Ya-, Rc-S-CO-N(Rb)-Ya-, Ra-N(Rb)-CO-S-Ya-, Rc-S-CO-O-Ya-, Rc-O-CO-S-Ya-, Rc-S-CO-S-Ya-; причем Ra представляет собой атом водорода, С1-С6алкил, С2-С6алкенил, С2-С6алкинкил или соединен с Rb с образованием 4-10-членного циклоалкила или гетероциклоалкила; Rb представляет собой атом водорода, С1-С6алкил, С2-С6алкенил или С2-С6алкинкил, или Rb, взятый вместе с Ra, образует 4-10-членный циклоалкил или гетероциклоалкил; Rc представляет собой атом водорода, необязательно замещенный С1-С6алкил, необязательно замещенный С2-С6алкенил или необязательно замещенный С2-С6алкинил; Rd представляет собой атом водорода, С1-С6алкил, С2-С6алкенил или С2-С6алкинил; L представляет собой циклоалкил, гетероциклоалкил, алкилциклоалкил, гетероалкилциклоалкил, арил, необязательно замещенный гетероарил, аралкил или гетероаралкил и Ya представляет собой связь, С1-С6алкиленовую, С2-С6алкениленовую или С2-С6алкиниленовую группу; каждая гетероалкильная группа содержит по меньшей мере один атом углерода и, возможно, один или несколько атомов водорода, которые заменены атомами фтора или хлора. Определенными примерами гетероалкильных групп являются метокси, трифторметокси, этокси, н-пропилокси, изопропилокси, трет-бутилокси, метоксиметил, этоксиметил, метоксиэтил, метиламино, этиламино, диметиламино, диэтиламино, изопропилэтиламино, метиламинометил, этиламинометил, диизопропиламиноэтил, простой эфир енола, диметиламинометил, диметиламиноэтил, ацетил, пропионил, бутирилокси, ацетилокси, метоксикарбонил, этоксикарбонил, изобутириламинометил, N-этил-N-метилкарбамоил и N-метилкарбамоил. Следующими примерами гетероалкильных групп являются нитрильная, изонитрильная, цианатная, тиоцианатная, изоцианатная, изотиоцианатная и алкилнитрильная группы. Примером гетероалкиленовой группы является группа формулы -СН2-СН(ОН)- или -CONH-.
Выражение циклоалкил относится к насыщенной или частично ненасыщенной циклической группе, которая содержит одно или несколько колец (предпочтительно 1 или 2), содержащих от 3 до 14 атомов углерода кольца, предпочтительно от 3 до 10 (более предпочтительно 3, 4, 5, 6 или 7) атомов углерода кольца. В варианте осуществления частично ненасыщенная циклическая группа имеет одну, две или более двойных связей, например является циклоалкенильной группой. Выражение циклоалкил, кроме того, относится к группам, в которых один или несколько атомов водорода заменены, каждый независимо от других, атомами фтора, хлора, брома или иода или группами ОН, =О, SH, =S, NH2, =NH, CN или NO2, так, например, циклическим кетоном, таким как, например, циклогексанон, 2-циклогексенон или циклопентанон. Следующими конкретными примерами циклоалкильной группы являются циклопропильная, циклобутильная, циклопентильная, спиро[4,5]деканильная, норборнильная, циклогексильная, циклопентенильная, циклогексадиенильная, декалинильная, бицикло[4.3.0]нонильная, тетралинильная, циклопентилциклогексильная, фторциклогексильная или циклогекс-2-енильная группа.
Выражение гетероциклоалкил относится к циклоалкильной группе, определение которой указывается выше и в которой один или несколько (предпочтительно 1, 2 или 3) атомов углерода кольца заменены, каждый независимо от других, атомом кислорода, азота, кремния, селена, фосфора или серы (предпочтительно кислорода, серы или азота). Гетероциклоалкильная группа предпочтительно имеет 1 или 2 кольца, содержащих от 3 до 10 (более предпочтительно 3, 4, 5, 6 или 7) атомов углерода кольца. Кроме того, выражение гетероциклоалкил относится к группам, у которых один или несколько атомов водорода заменены, каждый независимо от других, атомами фтора, хлора, брома или иода или группами ОН, =О, SH, =S, NH2, =NH, CN или NO2. Примерами являются пиперидильная, пиперазинильная, морфолинильная, уротропинильная, пирролидинильная, тетрагидротиофенильная, тетрагидропиранильная, тетрагидрофурильная или 2-пиразолинильная группа, а также лактам, лактон, циклический имид и циклический ангидрид.
Выражение алкилциклоалкил относится к группе, содержащей как циклоалкильную, так также и алкильную, алкенильную или алкинильную группу согласно указанным выше определениям, например, алкилциклоалкильной, циклоалкилалкильной, алкилциклоалкенильной, алкенилциклоалкильной и алкинилциклоалкильной группам. Алкилциклоалкильная группа предпочтительно содержит циклоалкильную группу, которая содержит системы одного или двух колец, имеющие от 3 до 10 (предпочтительно 3, 4, 5, 6 или 7) атомов углерода, и одну или две алкильные, алкенильные или алкинильные группы, имеющие от 1 или 2 до 6 атомов углерода, причем циклические группы являются необязательно замещенными.
Выражение гетероалкилциклоалкил относится к алкилциклоалкильным группам, определения которых указываются выше и у которых один или несколько (предпочтительно 1, 2 или 3) атомов углерода заменены, каждый независимо от других, атомом кислорода, азота, кремния, селена, фосфора или серы (предпочтительно кислорода, серы или азота). Гетероалкилциклоалкильная группа предпочтительно содержит системы 1 или 2 колец, имеющие от 3 до 10 (предпочтительно 3, 4, 5, 6 или 7) атомов кольца, и одну или две алкильные, алкенильные, алкинильные или гетероалкильные группы, имеющие от 1 или 2 до 6 атомов углерода. Примерами таких групп являются алкилгетероциклоалкил, алкилгетероциклоалкенил, алкенилгетероциклоалкил, алкинилгетероциклоалкил, гетероалкилциклоалкил, гетероалкилгетероциклоалкил и гетероалкилгетероциклоалкенил, причем циклические группы являются необязательно замещенными и насыщенными или моно-, ди- или триненасыщенными.
Выражение арил или Ar относится к ароматической группе, которая содержит одно или несколько колец, содержащих от 6 до 14 атомов углерода кольца, предпочтительно от 6 до 10 (более предпочтительно 6) атомов углерода кольца. Кроме того, выражение арил (или Ar) относится к группам, в которых один или несколько атомов водорода заменены, каждый независимо от других, атомами фтора, хлора, брома или иода или группами ОН, SH, NH2, CN или NO2. Примерами являются фенильная, нафтильная, бифенильная, 2-фторфенильная, анилинильная, 3-нитрофенильная или 4-гидроксифенильная группа.
Выражение гетероарил относится к ароматической группе, которая содержит одно или несколько колец, содержащих от 5 до 14 атомов кольца, предпочтительно от 5 до 10 (более предпочтительно 5 или 6) атомов кольца, и содержит один или несколько (предпочтительно 1, 2, 3 или 4) атомов кислорода, азота, фосфора или серы кольца (предпочтительно O, S или N). Кроме того, выражение гетероарил относится к группам, у которых один или несколько атомов водорода заменены, каждый независимо от других, атомами фтора, хлора, брома или иода или группами ОН, =О, SH, NH2, =NH, CN или NO2. Примерами являются 4-пиридил, 2-имидазолил, 3-фенилпирролил, тиазолил, оксазолил, триазолил, тетразолил, изоксазолил, индазолил, индолил, бензимидазолил, пиридазинил, хинолинил, пуринил, карбазолил, акридинил, пиримидил, 2,3'-бифурил, 3-пиразолил и изохинолинил.
Выражение аралкил относится к группе, содержащей как арильную, так также и алкильную, алкенильную, алкинильную и/или циклоалкильную группы согласно указанным выше определениям, такой как, например, арилалкильная, арилалкенильная, арилалкинильная, арилциклоалкильная, арилциклоалкенильная, алкиларилциклоалкильная и алкиларилциклоалкенильная группы. Конкретными примерами аралкилов являются толуол, ксилол, мезитилен, стирол, бензилхлорид, о-фтортолуол, 1Н-инден, тетралин, дигидронафталин, инданон, фенилциклопентил, кумол, циклогексилфенил, флуорен и индан. Аралкильная группа предпочтительно содержит системы одной или двух ароматических колец (1 или 2 кольца), содержащие от 6 до 10 атомов углерода, и одну или две алкильные, алкенильные и/или алкинильные группы, содержащие от 1 или 2 до 6 атомов углерода, и/или циклоалкильную группу, содержащую 5 или 6 атомов углерода кольца.
Выражение гетероаралкил относится к аралкильной группе, определение которой указывается выше, у которой один или несколько (предпочтительно 1, 2, 3 или 4) атомов углерода заменены, каждый независимо от других, атомом кислорода, азота, кремния, селена, фосфора, бора или серы (предпочтительно кислорода, серы или азота), то есть группам, содержащим как арильную или гетероарильную, так также и алкильную, алкенильную, алкинильную и/или гетероалкильную, и/или циклоалкильную, и/или гетероциклоалкильную группы согласно указанным выше определениям. Гетероаралкильная группа предпочтительно содержит системы одного или двух ароматических колец (1 или 2 кольца), содержащих от 5 или 6 до 10 атомов кольца, и одну или две алкильные, алкенильные и/или алкинильные группы, содержащие от 1 или 2 до 6 атомов углерода, и/или циклоалкильную группу, содержащую 5 или 6 атомов углерода кольца, причем 1, 2, 3 или 4 этих атомов углерода заменены, каждый независимо от других, атомами кислорода, серы или азота.
Примерами гетероалкильных групп являются арилгетероалкильная, арилгетероциклоалкильная, арилгетероциклоалкенильная, арилалкилгетероциклоалкильная, арилалкенилгетероциклоалкильная, арилалкинилгетероциклоалкильная, арилалкилгетероциклоалкенильная, гетероарилалкильная, гетероарилалкенильная, гетероарилалкинильная, гетероарилгетероалкильная, гетероарилциклоалкильная, гетероарилциклоалкенильная, гетероарилгетероциклоалкильная, гетероарилгетероциклоалкенильная, гетероарилалкилциклоалкильная, гетероарилалкилгетероциклоалкенильная, гетероарилгетероалкилциклоалкильная, гетероарилгетероалкилциклоалкенильная, гетероалкилгетероарилалкильная и гетероарилгетероалкилгетероциклоалкильная группы, причем циклические группы являются насыщенными или моно-, ди- или триненасыщенными. Конкретными примерами являются тетрагидроизохинолинильная, бензоильная, 2- или 3-этилиндолильная, 4-метилпиридино, 2-, 3- или 4-метоксифенильная, 4-этоксифенильная, 2-, 3- или 4-карбоксифенилалкильная группа.
Выражения циклоалкил, гетероциклоалкил, алкилциклоалкил, гетероалкилциклоалкил, арил, гетероарил, аралкил и гетероаралкил относится к группам, в которых один или несколько атомов водорода таких групп заменены, каждый независимо от других, атомами фтора, хлора, брома или иода или группами ОН, =О, SH, =S, NH2, =NH, CN или NO2.
Выражение “необязательно замещенный” относится к группам, в которых один или несколько атомов водорода заменены, каждый независимо от других, атомами фтора, хлора, брома или иода или группами ОН, =О, SH, =S, NH2, =NH, CN или NO2. Кроме того, это выражение относится к группам, в которых один или несколько атомов водорода заменены, каждый независимо от других, незамещенной С1-С6алкильной, незамещенной С2-С6алкенильной, незамещенной С2-С6алкинильной, незамещенной С1-С6гетероалкильной, незамещенной С3-С10циклоалкильной, незамещенной С2-С9гетероциклоалкильной, незамещенной С6-С10арильной, незамещенной С1-С9гетероарильной, незамещенной С7-С12аралкильной или незамещенной С2-С11гетероаралкильной группой.
Применяемое здесь выражаемое словами определение ограничивает диапазон длины цепи, такой диапазон, как например, “от 1 до 5”, означает любое целое число от 1 до 5, т.е. 1, 2, 3, 4 и 5. Другими словами предполагается, что любой диапазон, определяемый двумя точно указанными целыми числами, содержит и описывает любое целое число, определяемое указанными пределами, и любое целое число, включенное в указанный диапазон.
Настоящее изобретение содержит также все изотопы атомов описанных соединений. Изотопами являются атомы, имеющие одинаковый атомный номер, но разные массовые числа. Например, тритий и дейтерий являются изотопами водорода. Примерами изотопов углерода являются 11С, 13С и 14С.
Терапевтическое применение соединений формулы (I), их фармакологически приемлемых солей, сольватов или гидратов, а также содержащих их препаратов и фармацевтических композиций находится в объеме настоящего изобретения. Настоящее изобретение относится также к применению этих соединений формулы (I) в качестве активных ингредиентов при получении или изготовлении лекарственного средства.
Фармацевтические композиции согласно настоящему изобретению содержат по меньшей мере одно соединение формулы (I) и, необязательно, одно или несколько веществ-носителей, эксципиентов и/или адъювантов. Фармацевтические композиции могут дополнительно содержать, например, один или несколько компонентов из воды, буферов (например, нейтральный, забуференный физиологический раствор или забуференный фосфатом физиологический раствор), этанола, минерального масла, растительного масла, диметилсульфоксида, углеводов (например, глюкозу, маннозу, сахарозу или декстраны), маннита, белков, адъювантов, полипептидов или аминокислот, таких как глицин, антиоксидантов, хелатирующих агентов, таких как EDTA или глутатион и/или консервантов. Кроме того, в предложенные здесь фармацевтические композиции могут быть включены (но не обязательно) один или несколько других активных ингредиентов. Например, соединения изобретения можно подходящим образом применять в комбинации с антибиотиком, противогрибковым или противовирусным агентом, антигистамином, нестероидным противовоспалительным лекарственным средством, модифицирующим заболевание антиревматическим лекарственным средством, цитостатическим лекарственным средством, лекарственным средством с активностью, модулирующей активность гладких мышц, или смесями вышеуказанных компонентов.
Фармацевтические композиции можно изготовить в форме, подходящей для любого способа введения, включающего, например, местное (например, чрескожное или глазное), пероральное, трансбуккальное, назальное, вагинальное, ректальное или парентеральное введение. Применяемый здесь термин парентеральное введение включает в себя подкожную, внутрикожную, внутрисосудистую (например, внутривенную), внутримышечную, спинальную, внутричерепную, подоболочечную, внутриглазную, окологлазную, внутриглазничную, внутрисуставную и внутрибрюшинную инъекцию, а также любой подобный способ инъекции или инфузии. В некоторых вариантах осуществления предпочтительными являются композиции в форме, подходящей для перорального применения. Такие формы включают в себя, например, таблетки, пастилки, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсию, твердые или мягкие капсулы, или сиропы или эликсиры. В следующих других вариантах осуществления представленные здесь композиции могут быть изготовлены в виде лиофилизата. Для некоторых состояний (например, при лечении таких состояний кожи, как ожоги или зуд) может быть предпочтительным препарат для местного введения.
Композиции, предназначенные для перорального применения, могут дополнительно содержать один или несколько компонентов, таких как подслащивающие агенты, корригенты, окрашивающие агенты и/или консерванты для получения привлекательных по виду и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с физиологически приемлемыми эксципиентами, которые являются подходящими для изготовления таблеток. Такие эксципиенты включают в себя, например, инертные разбавители (например, карбонат кальция, карбонат натрия, лактозу, фосфат кальция или фосфат натрия), гранулирующие или дезинтегрирующие агенты (например, кукурузный крахмал или альгиновую кислоту), связывающие агенты (например, крахмал, желатин или аравийскую камедь) и смазывающие агенты (например, стеарат магния, стеариновую кислоту или тальк). Таблетки могут быть без покрытия или могут быть покрыты известными способами для замедления дезинтеграции и абсорбции в желудочно-кишечном тракте и тем самым обеспечения стойко поддерживаемого действия на протяжении более продолжительного периода времени. Можно применять, например, вещество для временной задержки, такое как глицерилмоностеарат или глицерилдистеарат.
Препараты для перорального применения можно также представить в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем (например, карбонатом кальция, фосфатом кальция или каолином) или мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой (например, арахисовым маслом, жидким парафином или оливковым маслом).
Водные суспензии содержат активный ингредиент(ы) в смеси с эксципиентами, подходящими для изготовления водных суспензий. Такие эксципиенты включают в себя суспендирующие агенты (например, натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и аравийскую камедь) и диспергирующие или смачивающие агенты (например, существующие в природе фосфатиды, такие как лецитин, продукты конденсации алкиленоксида с жирными кислотами, такие как полиоксиэтиленстеарат, продукты конденсации этиленоксида с алифатическими спиртами с длинной цепью, такие как гептадекаэтиленоксицетанол, продукты конденсации этиленоксида с неполными эфирами, образованными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбит, или продукты конденсации этиленоксида с неполными эфирами, образованными из жирных кислот и ангидридов гексита, такие как моноолеат полиоксиэтиленсорбитана). Водные суспензии могут содержать также один или несколько консервантов, например, этил- или н-пропил-п-гидроксибензоат, один или несколько окрашивающих агентов, один или несколько корригентов и один или несколько подслащивающих агентов, таких как сахароза или сахарин.
Масляные суспензии можно изготовить суспендированием активных ингредиентов в растительном масле (например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле) или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загущающий агент, такой как пчелиный воск, твердый парафин или цетиловый спирт. Подслащивающие агенты, такие как агенты, указанные выше, и/или корригент(ы), можно добавлять для обеспечения получения приятных по вкусу пероральных препаратов. Такие препараты можно предохранять от порчи добавлением антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии добавлением воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты иллюстрируются такими агентами, уже указанными выше. Могут также присутствовать дополнительные эксципиенты, такие как подслащивающие, окрашивающие агенты и корригенты.
Фармацевтические композиции могут быть также в форме эмульсий типа масло в воде. Масляной фазой может быть растительное масло (например, оливковое масло или арахисовое масло), минеральное масло (например, жидкий парафин) или их смесь. Подходящие эмульгирующие агенты включают в себя существующие в природе камеди (например, аравийская камедь или трагакантовая камедь), присутствующие в природе фосфатиды (например, соевый лецитин и эфиры или неполные эфиры, образованные из жирных кислот и гексита), ангидриды (например, моноолеат сорбитана) и продукты конденсации неполных эфиров, образованных из жирных кислот и гексита, с этиленоксидом (например, моноолеат полиоксиэтиленсорбитана). Эмульсия может содержать также один или несколько подслащивающих агентов и/или корригентов.
Сиропы и эликсиры могут быть изготовлены с подслащивающим агентами, такими как глицерин, пропиленгликоль, сорбит или сахароза. Такие препараты могут содержать также один или несколько деэмульгирующих агентов, консервантов, корригентов и/или окрашивающих агентов.
Соединения могут быть сформулированы в препараты для локального или местного введения, такого как местное нанесение на кожу или слизистые оболочки, такие как в глазах. Препараты для местного введения обычно содержат местный наполнитель, комбинированный с активным ингредиентом(ами), с дополнительными необязательными компонентами или без них. Подходящие местные наполнители и дополнительные компоненты являются хорошо известными в данной области и должно быть очевидно, что выбор наполнителя будет зависеть от конкретной физической формы и способа доставки. Местные наполнители включают в себя воду; органические растворители, такие как спирты (например, этанол или изопропиловый спирт) или глицерин; гликоли (например, бутилен-, изопрен- или пропиленгликоль); алифатические спирты (например, ланолин); смеси воды и органических растворителей и смеси органических растворителей, такие как спирт и глицерин; вещества на основе липидов, такие как жирные кислоты, ацилглицерины (в том числе масла, такие как минеральное масло, и жиры природного или синтетического происхождения), фосфоглицериды, сфинголипиды и воски; вещества на основе белков, такие как коллаген и желатин; вещества на основе силиконов (как нелетучие, так и летучие) и вещества на основе углеводородов, такие как микрогубки и полимерные матрицы. Композиция может дополнительно включать в себя одно или несколько компонентов, адаптированных для повышения стабильности или эффективности нанесенного препарата, такие как стабилизирующие агенты, суспендирующие агенты, эмульгирующие агенты, регуляторы вязкости, гелеобразующие агенты, консерванты, антиоксиданты, агенты, повышающие проникновение через кожу, увлажняющие агенты и вещества, обеспечивающие стойко поддерживаемое высвобождение. Примеры таких компонентов описаны в Martindale-The Extra Pharmacopoeia (Pharmaceutical Press, London 1993) и Martin (ed.), Remington's Pharmaceutical Sciences. Препараты могут содержать микрокапсулы, такие как микрокапсулы гидроксиметилцеллюлозы или желатина, липосомы, микросферы альбумина, микроэмульсии, наночастицы или нанокапсулы.
Препарат для местного применения можно получить в различных физических формах, включающих в себя, например, твердые формы, пасты, кремы, пены, лосьоны, гели, порошки, водные жидкости, эмульсии, спреи и кожные пластыри. Физический вид и вязкость таких форм можно регулировать присутствием и количеством эмульгатора(ов) и агента(ов), регулирующего вязкость, присутствующего в препарате. Твердые формы обычно являются плотными и не пригодными для наливания, их обычно изготавливают в форме пластин или палочек, или в форме частиц; твердые формы могут быть непрозрачными или прозрачными и необязательно могут содержать растворители, эмульгаторы, увлажнители, мягчители, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые повышают или усиливают эффективность конечного продукта. Кремы и лосьоны часто являются похожими друг на друга, различаясь в основном их вязкостью; как лосьоны, так и кремы могут быть непрозрачными, прозрачными или светлыми и часто содержат эмульгаторы, растворители и регулирующие вязкость агенты, а также увлажнители, умягчители, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые повышают или усиливают эффективность конечного продукта. Гели можно получить с диапазоном вязкости от высокой вязкости или вязкости, придающей густоту, до низкой вязкости или вязкости, делающей гель разжиженным. Эти препараты подобно лосьонам и кремам могут содержать также растворители, эмульгаторы, увлажнители, умягчители, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые повышают или усиливают эффективность конечного продукта. Жидкости являются более подвижными, чем кремы, лосьоны или гели и часто не содержат эмульгаторы. Жидкие местные продукты часто содержат растворители, эмульгаторы, увлажнители, умягчители, отдушки, красители/окрашивающие агенты, консерванты и другие активные ингредиенты, которые повышают или усиливают эффективность конечного продукта.
Подходящие эмульгаторы для применения в препаратах для местного введения включают в себя, но не ограничиваются перечисленным, ионогенные эмульгаторы, цетеариловый спирт, неионогенные эмульгаторы, подобные олеиловому эфиру полиоксиэтилена, стеарат ПЭГ-40, цетеарет-12, цетеарет-20, цетеарет-30, цетеарет-спирт, стеарат ПЭГ-100 и глицерилстеарат. Подходящие регулирующие вязкость агенты включают в себя, но не ограничиваются перечисленным, защитные коллоиды или неионогенные камеди, такие как гидроксиэтилцеллюлоза, ксантановая камедь, силикат магния-алюминия, диоксид кремния, микрокристаллический воск, пчелиный воск, парафин и цетилпальмитат. Гелевую композицию можно получить добавлением гелеобразующего агента, такого как хитозан, метилцеллюлоза, этилцеллюлоза, поливиниловый спирт, поликватернии, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбомер или аммонизированный глицирризинат. Подходящие поверхностно-активные вещества включают в себя, но не ограничиваются перечисленным, неионогенные, амфотерные, ионогенные и анионогенные поверхностно-активные вещества. Например, в местных препаратах можно применять один или несколько компонентов из диметиконсополиола, полисорбата 20, полисорбата 40, полисорбата 60, полисорбата 80, лаурамида DEA, кокамида DEA и кокамида МЕА, олеилбетаина, хлорида кокамидопропилфосфатидил-PG-димония и сульфата аммонийлаурета.
Подходящие консерванты включают в себя, но не ограничиваются перечисленным, противомикробные агенты, такие как метилпарабен, пропилпарабен, сорбиновую кислоту, бензойную кислоту и формальдегид, а также физические стабилизаторы и антиоксиданты, такие как витамин Е, смесь аскорбат натрия/аскорбиновая кислота и пропилгаллат. Подходящие увлажнители включают в себя, но не ограничиваются перечисленным, молочную кислоту и другие гидроксикислоты и их соли, глицерин, пропиленгликоль и бутиленгликоль. Подходящие умягчители включают в себя ланолиновый спирт, ланолин, производные ланолина, холестерин, петролатум, изостеарилнеопентаноат и минеральные масла. Подходящие ароматизирующие агенты и окрашивающие средства включают в себя, но не ограничиваются перечисленным, FD&C красный № 40 и FD&C желтый № 5. Другие подходящие дополнительные ингредиенты, которые можно включить в местный препарат, включают в себя, но не ограничиваются перечисленным, абразивы, абсорбенты, противослеживающие агенты, противопенящие агенты, антистатические агенты, вяжущие средства (например, экстракт лещины, спирт и экстракты растений, такие как экстракт ромашки), связывающие вещества/эксципиенты, буферные агенты, хелатирующие агенты, агенты, образующие пленку, кондиционирующие агенты, пропелленты, агенты, придающие непрозрачность, рН-регуляторы и вещества-протекторы.
Примером подходящего местного наполнителя для препарата в виде геля является система гидроксипропилцеллюлозы (2,1%); смеси 70/30 изопропиловый спирт/вода (90,9%); пропиленгликоля (5,1%) и полисорбата 80 (1,9%). Примером подходящего местного наполнителя для препарата в виде пены является смесь цетилового спирта (1,1%); стеарилового спирта (0,5%); кватерния 52 (1,0%); пропиленгликоля (2,0%); этанола 95 PGF3 (61,05%); деионизированной воды (30,05%); углеводородного пропеллента Р75 (4,30%). Все проценты являются массовыми.
Типичные способы доставки местных композиций включают в себя нанесение их с применением пальцев; нанесение с применением физического аппликатора, такого как материя, ткань, тампон, палочка или щеточка; разбрызгивания (в том числе разбрызгивания с образованием легкого тумана, аэрозоля или пены); нанесение каплями; посыпание; пропитывание и промывание. Можно также применять наполнители для регулируемого высвобождения и можно изготовить композиции для чрескожного введения, такие как чрескожный пластырь.
Фармацевтическую композицию можно изготовить в виде препаратов для ингаляции, включающих в себя спреи, легкие туманы или аэрозоли. Такие препараты являются особенно применимыми для лечения астмы или других респираторных состояний. Для ингаляционных препаратов соединения, предложенные здесь, можно доставить посредством любых способов ингаляции, известных специалисту в данной области. Такие способы и устройства для ингаляции включают в себя, но не ограничиваются перечисленным, ингаляторы с подачей измеренной дозы, содержащие такие пропелленты, как CFC или HFA, или пропелленты, которые являются физиологически приемлемыми и приемлемыми для окружающей среды. Другими подходящими устройствами являются ингаляторы для вдыхания, ингаляторы со многими дозами сухого порошка и аэрозольные распылители. Аэрозольные препараты для применения в рассматриваемом способе обычно включают в себя пропелленты, поверхностно-активные вещества и сорастворители, ими можно заполнять общепринятые аэрозольные контейнеры, которые закрывают подходящим дозирующим клапаном.
Композиции лекарственных форм для ингаляции могут содержать жидкие или порошкообразные композиции, содержащие активный ингредиент, который является подходящим для распыления и внутрибронхиального применения, или аэрозольные композиции, вводимые при помощи аэрозольного устройства, подающего измеренные дозы. Подходящие жидкие композиции содержат активный ингредиент в водном, фармацевтически приемлемом, вдыхаемом растворителе, например изотоническом физиологическом растворе или бактериостатической воде. Растворы вводят при помощи насоса или активируемого сдавливанием устройства для разбрызгивания или любым другим общепринятым способом, который вызывает подачу или делает возможным подачу требуемого дозированного количества жидкой композиции, которая ингаляцией вводится в легкие пациента. Препараты, в которых носителем является жидкость и которые являются подходящими для введения в виде, например, назального спрея или в виде назальных капель, включают в себя водные или масляные растворы активного ингредиента.
Препараты или композиции, подходящие для назального введения, в которых носитель является твердым, включают в себя крупнозернистый порошок, имеющий размер частиц, например, в диапазоне 20-500 микронов, который вводят способом, в котором лекарственный порошок вдыхают через нос (т.е. быстрой ингаляцией через носовой ход порошка из контейнера, который удерживают близко к носу). Подходящие порошкообразные композиции включают в себя, в качестве иллюстрации, порошкообразные препараты активного ингредиента, тщательно смешанного с лактозой или другими инертными порошками, приемлемыми для внутрибронхиального введения. Порошкообразные композиции можно вводить при помощи аэрозольного ингалятора или можно включать в разрушаемую капсулу, которую пациент может вставить в устройство, которое разбивает капсулу и продувает порошок в равномерном потоке, подходящем для ингаляции.
Фармацевтические композиции можно также получить в форме суппозиториев (например, для ректального введения). Такие композиции можно получить смешиванием лекарственного средства с подходящим не вызывающим раздражение эксципиентом, который является твердым при обычных температурах, но становится жидким при ректальной температуре и поэтому будет плавиться в прямой кишке с высвобождением лекарственного средства. Подходящие эксципиенты включают в себя, например, какао-масло и полиэтиленгликоли.
Фармацевтические композиции можно изготовить в виде препаратов со стойко поддерживаемым высвобождением (т.е. такого препарата, как капсула, которая осуществляет медленное высвобождение модулятора после введения). Твердые препараты обычно получают с применением хорошо известной технологии и вводят, например, пероральной, ректальной или подкожной имплантацией или имплантацией у требуемого места-мишени. Носители для применения в таких препаратах являются биосовместимыми и могут быть также биоразрушаемыми; препарат предпочтительно обеспечивает относительно постоянный уровень высвобождения модулятора. Количество модулятора, содержащегося в препарате со стойко поддерживаемым высвобождением, зависит, например, от места имплантации, скорости и ожидаемой продолжительности высвобождения и природы состояния, которое подвергают лечению или появление которого предотвращают.
Для предупреждения и/или лечения заболеваний, опосредуемых ВК или его аналогами, дозу биологически активного соединения согласно изобретению можно варьировать в широких пределах и можно регулировать для отдельных требований. Активные соединения согласно настоящему изобретению обычно вводят в терапевтически эффективном количестве. Предпочтительные дозы составляют от приблизительно 0,1 мг до приблизительно 140 мг на килограмм массы тела в день (от приблизительно 0,5 мг до приблизительно 7 г на пациента в день). Суточную дозу можно вводить в виде одной дозы или в виде многих доз. Количество активного ингредиента, которое можно комбинировать с веществами-носителями для получения одной лекарственной формы, будет варьировать в зависимости от подвергаемого терапии хозяина и конкретного способа введения. Дозированные лекарственные формы обычно содержат от приблизительно 1 мг до приблизительно 500 мг активного ингредиента.
Должно быть понятно, однако, что определенный уровень дозы для любого конкретного пациента будет зависеть от различных факторов, включающих в себя активность определенного применяемого соединения, возраст, массу тела, общее состояния здоровья, пол, питание пациента, время введения, путь введения и скорость экскреции, комбинацию лекарственных средств (т.е. комбинацию с другими лекарственными средствами, которые применяют для лечения пациента) и тяжести конкретного заболевания, подвергаемого терапии.
Предпочтительные соединения изобретения будут иметь определенные фармакологические свойства. Такие свойства включают в себя, но не ограничиваются указанным, пероральную биологическую доступность, так что предпочтительные пероральные лекарственные формы, обсуждаемые выше, могут обеспечить терапевтически эффективные уровни соединения in vivo.
8-(Гетероарилметокси)хинолины, предложенные здесь, можно использовать в качестве агонистов или (предпочтительно) антагонистов рецепторов В2 ВК при различных применениях, как in vitro, так и in vivo. Антагонисты рецептора В2 согласно настоящему изобретению можно применять для ингибирования связывания лигандов рецептора В2 ВК (например, ВК) с рецептором В2 ВК in vitro или in vivo. Модулятор(ы) рецептора В2 ВК, предложенный здесь, предпочтительно вводят пациенту (например, человеку) перорально или местно, и он присутствует по меньшей мере в одной жидкости или ткани тела пациента при модуляции активности рецептора В2 ВК.
Модуляторы рецептора В2 ВК согласно настоящему изобретению являются особенно применимыми для лечения, и/или предотвращения, и/или профилактики состояний или заболеваний, которые восприимчивы к модуляции рецептора В2 ВК, в том числе кожных заболеваний; ушных заболеваний; глазных заболеваний, заболеваний полости рта, горла и респираторных заболеваний; желудочно-кишечных заболеваний; заболеваний печени, желчного пузыря и поджелудочной железы; заболеваний мочевых путей и почек; заболеваний мужских половых органов и женских половых органов; заболеваний гормональной системы; метаболических заболеваний; сердечно-сосудистых заболеваний; болезней крови; лимфатических болезней; нарушений центральной нервной системы; нарушений головного мозга; заболеваний костно-мышечной системы; аллергических нарушений; боли; инфекционных болезней; воспалительных нарушений; травм; иммунологических нарушений; раковых заболеваний; наследственных заболеваний, отека или синдрома(ов) просачивания капилляров, и для применения в определенной методологии. В настоящем изобретении соединения согласно изобретению применяют в качестве диагностического агента или для изготовления диагностического агента, в результате чего такой диагностический агент пригоден для диагностики заболеваний и состояний, которые можно детектировать соединениями настоящего изобретения для описанных здесь терапевтических целей.
Ниже дополнительно описываются различные заболевания и состояния, которые являются восприимчивыми к модуляции рецептора В2 ВК, и применение соединений согласно настоящему изобретению в специальной методологии и диагностиках.
Кожные нарушения. В настоящей заявке термин “кожные нарушения” включает в себя, но не ограничивается перечисленным, такие нарушения, как старение кожи, гиперемия кожи, включая намины, пролежни, раздраженная, чувствительная и неэстетическая кожа, эритема, сыпь, отек кожи, псориаз, экзема, лишай, инфекционные заболевания кожи, индуцированные бактериями, вирусами, грибами и паразитами, включая фурункул, абсцесс, флегмону, рожистое воспаление, фолликулит и импетиго, педикулез, чесотка и простой герпес, акне, экзантема, дерматит, включая атопический дерматит, аллергический контактный дерматит (Scholzen, T.E.; Luger. T.A. Exp Dermatol. 2004; 13 Suppl 4:22-6) нейродерматит, радиационное повреждение, солнечный ожог, зуд, зудневая чесотка, крапивница (EP 0622361; Frigas, E.; Park, M. Immunol. Allergy Clin. North Am. 2006, 26, 739-51; Luquin, E.; Kaplan, A.P.; Ferrer, M. Clin. Exp. Allergy 2005, 35, 456-60; Kaplan, A.P.; Greaves, M.W.J. Am. Acad. Dermatol. 2005, 53, 373-88; quiz 389-92), псориаз, микоз, образование язвы на ткани, врожденный буллезный эпидермолиз, раны, в том числе заживление атипичных ран, ожоги (Nwariaku, F.E.; Sikes, P.J.; Lightfoot, E.; Mileski, W.J.; Baxter, C. Burns 1996, 22, 324-7; Neely, A.N.; Imwalle, A.R.; Holder, I.A. Burns 1996, 22, 520-3), отморожение, воспаление и отек кожи, вызванные ядом, алопеция, чешуйки волос, мозоль, бородавка и паронихия.
Заболевания глаз. В настоящей заявке термин “заболевания глаз” включает в себя, но не ограничивается перечисленным, воспалительные нарушения, такие как склерит, конъюнктивит, хемоз, ирит, иридоциклит, увеит, хориретинит, а также такие нарушения, как ретинохориоидальные циркуляторные нарушения, бактериальные инфекционные заболевания глаз, неспецифический конъюнктивит и раздражения глаз, ретинопатия раннего развития, пролиферативная витреоретинопатия, пятнистая дегенерация (включая связанную с возрастом пятнистую дегенерацию и включая как мокрые, так и сухие формы), заболевания роговицы, включающие в себя отторжение корнеального трансплантата, корнеальное повреждение, корнеальное рубцевание, корнеальная язва, корнеальное затемнение, кератоконус, глаукому (предпочтительно открытоугольную глаукому), миопию, глазную гипертензию, повреждение глазных сосудов, ангиогенез, глазной фиброз (например, передний субкапсулярный фиброз, задние субкапсулярные помутнения, задние капсулярные помутнения, корнеальное затемнение после лазерной хирургии, субконъюнктивальное рубцевание после хирургии глаукомы), пролиферативную витреоретинопатию (PVR), бактериальные глазные инфекционные заболевания, включающие в себя ячмень и птилоз.
Заболевания ушей. В настоящей заявке термин “заболевания ушей” включает в себя, но не ограничивается перечисленным, такие нарушения, как болезнь Миньера, воспаление среднего уха, воспаление наружного слухового прохода и острая тугоухость.
Заболевания полости рта, носа и респираторные заболевания. В настоящей заявке термин “заболевания полости рта, носа и респираторные заболевания” включает в себя, но не ограничивается перечисленным, такие нарушения, как воспаление слизистой оболочки и десен полости рта, включающее в себя афту и стоматит, пародонтит, эпиглоттит, фарингит, ларинготрахеит, тонзиллит, насморк, ангину, ринит, включая сезонный аллергический ринит или перенниальный аллергический ринит, ринорею, синусит любого типа, этиологии или патогенеза или синусит, который является синуситом, выбранным из группы, состоящей из гнойного или негнойного синусита, острого и хронического синусита и синусита пазухи решетчатой кости, лобной, верхнечелюстной или клиновидной пазухи, отхаркивание, пневмокониоз любого типа или генеза, включающий в себя, например, алюминоз, антракоз, асбестоз, халикоз, сидероз, силикоз, табачный пневмокониоз и особенно биссиноз, бронхит, кашель, трахеит, застой, пневмонию, эозинофильный легочный инфильтрат, хроническую эозинофильную пневмонию, идиопатический легочный фиброз и другие фиброзные легочные заболевания, связанное с лечением фибротическое легочное заболевание, например, связанное с излучением, терапией метотрексатом, химиотерапией, терапией амиодароном или нитрофурантоином, саркоидоз, острый респираторный дистресс-сидром (ARDS), астму любого типа (Akbary, A.M.; Wirth, K.J.; Scholkens, B.A. Immunopharmacology 1996, 33, 238-42; WO 00/75107 A2), этиологии или патогенеза или астму, которая является астмой, выбранной из группы неинфекционно-аллергической бронхиальной (атопической) астмы, неатопической астмы, аллергической и неаллергической астмы, приобретенной бронхиальной астмы, вызванной факторами окружающей среды, наследственной бронхиальной астмы, вызванной патофизиологическими нарушениями, бронхиальной астмы, IgE-опосредуемой астмы, эссценциальной астмы и эссенциальной астмы неизвестной или инаппарентной причины, истинной астмы, эмфизематозной астмы, астмы напряжения, профессиональной астмы, инфекционной астмы, вызванной бактериальной, грибковой, протозойной или вирусной инфекцией, начинающаяся астма, синдром стридорозного дыхания младенцев, бронхиальную повышенную реактивность, хроническое обструктивное заболевание легких (COPD), заболевание COPD, которое характеризуется необратимой закупоркой дыхательных путей, острый респираторный дистресс-синдром (ARDS) и обострение повышенной реактивности дыхательных путей вследствие другой лекарственной терапии, одышку, гипероксическое альвеолярное повреждение, легочную эмфизему, плеврит, туберкулез, воздействие высокогорья, т.е. острое болезненное состояние на высокогорье и предпочтительно отек легких на высокогорье (НАРЕ).
Желудочно-кишечные заболевания. В настоящей заявке термин “желудочно-кишечные заболевания” включает в себя, но не ограничивается перечисленным, нарушения, включающие в себя эзофагит, гастрит, раздражимый желудок, язву желудка и двенадцатиперстной кишки, илеус, синдром раздраженной толстой кишки, воспалительные заболевания кишечника, в том числе болезнь Крона и неспецифический язвенный колит, энтерит, гипертензивная гастро- и колопатия, колит, перитонит, аппендицит, проктит, желудочно-кишечное кровотечение, вызванное портальной гипертензий, коллатеральным кровообращением или гиперемией, синдром сбрасывания после гастрэктомии, дискомфорт усвоения пищи, диарею, геморрои, заболевания, вызванные гельминтами, абдоминальную спастическую боль и спастическую боль частей желудочно-кишечной системы.
Заболевания печени, желчного пузыря и поджелудочной железы (Cugno, M.; Salerno, F.; Nussberger, J.; Bottasso, B.; Lorenzano, E.; Agostoni, A. Clin. Sci. (Lond) 2001, 101, 651-7; WO 01/56995 Al; EP 0797997 Bl; Wirth, K.J.; Bickel, M.; Hropot, M.; Gunzler, V.; Heitsch, H.; Ruppert, D.; Scholkens, B.A. Eur J. Pharmacol. 1997, 337, 45-53). В настоящей заявке термин “заболевания печени, желчного пузыря и поджелудочной железы” включает в себя, но не ограничивается перечисленным, такие нарушения, как гепатит, цирроз печени, фиброз печени (например, вследствие вирусных (HBV/HCV) инфекций, токсинов (алкоголь), жирового перерождения печени, холестаза, гипоксии), портальная гипертензия, печеночно-почечный синдром, гепатогенный отек, холангит, холецистит, острый и хронический панкреатит и билиарная боль.
Заболевания мочевых путей и почек. В настоящей заявке термин “заболевания мочевых путей и почек” включает в себя, но не ограничивается перечисленным, инфекционные заболевания мочевых путей, такие как острый и хронический цистит, интерстициальный цистит (Campbell, D.J. Clin. Exp. Pharmacol. Physiol. 2001, 28, 1060-5; Meini, S.; Patacchini, R.; Giuliani, S.; Lazzeri, M.; Turini, D.; Maggi, C.A.; Lecci, A. Eur. J. Pharmacol. 2000, 388, 177-82; Zuraw, B. L.; Sugimoto, S.; Parsons, C.L.; Hugli, T.; Lotz, M.; Koziol, J.J. Urol. 1994, 152, 874-8; Rosamilia, A.; Clements, J.A.; Dwyer, P.L.; Kende, M.; Campbell, D.J.J. Urol. 1999, 162, 129-34), раздражимый желчный пузырь, гиперактивный мочевой пузырь (WO 2007003411 A2), недержание, включающее в себя, но не ограничивающееся перечисленным, стрессовое, императивное и рефлекторное недержание мочи, доброкачественную гиперплазию простаты (Srinivasan, D.; Kosaka, A.H.; Daniels, D.V.; Ford, A.P.; Bhattacharya, A. Eur J Pharmacol. 2004, 504(3):l55-67), уретрит, воспалительные заболевания почек, включающие в себя гломерулонефрит, гломерулярное заболевание почки, интерстициальный нефрит, пиелонефрит, диурез, протеинурию, натрийурез, кальцийурез, нарушение водного баланса, нарушения электролитного баланса, нарушения кислотно-основного равновесия и почечную колику, почечный фиброз и хроническую дисфункцию почечного аллотрансплантата.
Заболевания мужских половых органов и женских половых органов. В настоящей заявке термин “заболевания мужских половых органов и женских половых органов” включает в себя, но не ограничивается перечисленным, измененная подвижность спермы, мужская инфертильность, орхит, простатит, увеличение простаты, мастит, воспалительные заболевания таза, вагинальные инфекции и боль, аднексит, кольпит, мягкий шанр и боль, сифилис, гонорея и синдром гиперстимуляции яичников (Ujioka, T.; Matsuura, K.; Tanaka, N.; Okamura, H. Hum Reprod. 1998 Nov;13(11):3009-15).
Заболевания гормональной системы. В настоящей заявке термин “заболевания гормональной системы” включает в себя, но не ограничивается перечисленным, менструальные нарушения и боль, климактерическое нарушение, рвоту, преждевременные маточные сокращения и преждевременные роды, эндометриоз, эндометрит, миому.
Метаболические заболевания. В настоящей заявке термин “метаболические заболевания” включает в себя, но не ограничивается перечисленным, такие нарушения, как диабет, в том числе инсулиннезависимый сахарный диабет, диабетическую ретинопатию, диабетический макулярный отек (Speicher, M.A.; Danis, R.P.; Criswell, M.; Pratt, L. Expert Opin. Emerg. Drugs 2003, 8, 239-50; Gao, B.B.; Clermont, A.; Rook, S.; Fonda, S. J.; Srinivasan, V.J.; Wojtkowski, M.; Fujimoto, J.G.; Avery, R.L.; Arrigg, P.G.; Bursell, S.E.; Aiello, L.P.; Feener, E.P. Nat. Med. 2007, 13, 181-8; Tranos, P.G.; Wickremasinghe, S.S.; Stangos, N.T.; Topouzis, F.; Tsinopoulos, I; Pavesio, C.E. Surv. Ophthalmol 2004, 49, 470-90), диабетическую нефропатию и диабетическую нейропатию, инсулинорезистентность и диабетические язвы, нарушения белкового и пуринового метаболизма, такие как подагра, и нарушение липометаболизма.
Сердечно-сосудистые заболевания. В настоящей заявке термин “сердечно-сосудистые заболевания” включает в себя, но не ограничивается перечисленным, нарушения, включающие в себя васкулярную проницаемость, вазодилацию, нарушение периферического кровообращения, нарушения артериального кровообращения, включающие в себя аневризму аорты, аневризму абдоминальной аорты, аневризму аорты головного мозга, гипертензию и гипотензию, связанную с сепсисом, рестеноз после подкожной транслюминальной операции на коронарных сосудах, атеросклероз, включающий в себя разрыв атеросклеротических бляшек (Fernando, A.N.; Fernando, L.P.; Fukuda, Y.; Kaplan, A.P. Am J Physiol Heart Circ Physiol. 2005 Jul; 289(l):H251-7), гемангиому, ангиофиброму, венозные нарушения, такие как тромбоз, варикоз, флебит, тромбофлебит, флеботромбоз, кардиопатию, застойную сердечную недостаточность, карциноидный синдром, стенокардию, сердечную аритмию, воспалительные заболевания сердца, включающие в себя эндокардит, перикардит и констриктивный перикардит, миокардит, инфаркт миокарда, синдром постмиокардиального инфаркта, левую вентрикулярную дилатацию, повреждение после ишемической реперфузии, шок и коллапс, в том числе септический, аллергический, послетравматический и гемодинамический шок, эмболию околоплодными водами (Robillard, J.; Gauvin, F.; Molinaro, G.; Leduc, L.; Adam, A.; Rivard, G.E. Am J Obstet Gynecol. 2005 Oct;193(4):1508-12), синдром системной воспалительной реакции (SIRS), включая SIRS, вызванный сердечным шунтированием во время хирургической операции, сепсисом и внутренними и наружными осложнениями во время хирургии с экстракорпоральным кровообращением (включающими в себя, но не ограничивающимися перечисленным, побочные гемодинамические действия после отмены действия гепарина сульфатом протамина (Pretorius, M.; Scholl, F.G.; McFarlane, J.A.; Murphey, L.J.; Brown, N.J., Clin Pharmacol Ther. 2005 Nov;78(5):477-85).
Болезни крови. В настоящей заявке термин “болезни крови” включает в себя, но не ограничивается перечисленным, такие нарушения, как коагуляция, диссеминированная внутрисосудистая коагулопатия, кровоизлияние, геморрагический диатез, гиперхолестеринемия и гиперлипемия.
Лимфатические заболевания. В настоящей заявке термин “лимфатические заболевания” включает в себя, но не ограничивается перечисленным, спленомегалию, лимфангит, лимфаденит и гиперплазированные аденоиды.
Нарушения центральной нервной системы. В настоящей заявке термин “нарушения центральной нервной системы” включает в себя, но не ограничивается перечисленным, такие нарушения, как воспалительные заболевания центральной нервной системы, включающие в себя энцефалит, менингит, энцефаломиелит, менингоэнцефалит, гидроцефалия, боковой амиотрофический склероз, травма спинного мозга, отек спинного мозга, демиелинирующие заболевания нервной системы, рассеянный склероз, острые и хронические нейродегенеративные нарушения, включающие в себя болезнь Альцгеймера и болезнь Паркинсона, нейрит и периферическую невропатию, депрессии, анорексию, тревогу и шизофрению.
Нарушения головного мозга. В настоящей заявке термин “нарушения головного мозга” включает в себя, но не ограничивается перечисленным, нарушения, требующие улучшения ноотропной или познавательной способности, церебральную амилоидную ангиопатию, удар, травму головы и головного мозга, травматическое повреждение головного мозга (Marmarou, A.; Guy, M.; Murphey, L.; Roy, F.; Layani, L.; Combal, J.P.; Marquer, C.; American Brain Injury Consortium J Neurotrauma 2005 Dec; 22(12): 1444-55), церебральное тепловое повреждение, церебральную ишемию, кровоизлияние в головной мозг, послетравматический и послеишемический церебральный отек, общий отек головного мозга, острое болезненное состояние на высокогорье и предпочтительно церебральный отек на высокогорье (НАСЕ), цитотоксический отек головного мозга, вазогенный отек головного мозга, послехирургический отек головного мозга, отек головного мозга, связанный с метаболическими заболеваниями, повышение проницаемости гематоэнцефалического барьера или гематоэнцефалического барьера опухоли.
Заболевания костно-мышечной системы. В настоящей заявке термин “заболевания костно-мышечной системы” включает в себя, но не ограничивается перечисленным, такие нарушения, как воспалительные костно-мышечные нарушения, артроз, остеоартроз, остеоартрит, хондропороз после травмы суставов или относительно длительной неподвижности сустава после повреждений мениска или коленной чашечки или разрывы связок, ревматоидный артрит любого типа, этиологии или патогенеза, включающий в себя острый артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, вертебральный артрит, септический артрит, псориатический артрит, хронический полиартрит, ревматизм, синдром Шегрена, люмбаго, спондилит, спондилартрит, анкилозирующий спондилит, остеомиелит, растяжение, тендосиновит, индуцированная воспалением резорбция, перелом кости или тому подобное, остеопороз, костно-мышечная боль и отвердение, синдром межпозвоночного диска.
Аллергические нарушения. В настоящей заявке термин “аллергические нарушения” включает в себя, но не ограничивается перечисленным, такие нарушения, как общие аллергические реакции, пищевая аллергия, анафилактический шок, аллергическая контактная повышенная чувствительность, аллергические реакции кожи, аллергическая астма, весенний конъюнктивит и сезонный или хронический аллергический ринит (Summers, C.W.; Pumphrey, R.S.; Woods, C.N.; McDowell, G.; Pemberton, P.W.; Arkwright, P.D.J Allergy Clin Immunol. 2008).
Боль. В настоящей заявке термин “боль” включает в себя, но не ограничивается перечисленным, боль, опосредуемую центральной и периферической нервной системой, васкулярную боль, висцеральную боль, боль, опосредуемую воспалением, невралгическую боль, отраженную боль, ноцицептивную боль, рефлекторную боль, психосоматическую боль, острую боль, такую как боль, вызванная острым повреждением, травмой или хирургией костей, мышц, ткани, мягкой ткани, органов, боль после укусов насекомых, синдром боли после удара, боль после хирургической операции, боль, связанная с прогрессирующим заболеванием, хроническая боль, такая как боль, вызванная состояниями невропатической боли (включающей в себя, но не ограничивающейся синдромом комплексной локальной боли (WO 00/75107 A2; Yamaguchi-Sase, S.; Hayashi, L; Okamoto, H.; Nara, Y.; Matsuzaki, S.; Hoka, S.; Majima, M. Inflamm. Res. 2003, 52, 164-9; Petersen, M.; Eckert, A.S.; Segond von Banchet, G.; Heppelmann, B.; Klusch, A.; Kniffki, K.D. Neuroscience 1998, 83, 949-59; Birklein, F.; Schmelz, M.; Schifter, S.; Weber, M. Neurology 2001, 57, 2179-84; Weber, M.; Birklein, F.; Neundorfer, B.; Schmelz, M. Pain 2001, 91, 251-7), каузалгию, болезнь Судека, рефлекторную симпатическую дистрофию), диабетическую периферическую невропатию, послегерпетическую невралгию, невралгию тройничного нерва, боль, связанную с раком, боль, связанную с ревматоидным артритом, остеоартритом (Bond, A.P.; Lemon, M.; Dieppe, P.A.; Bhoola, K.D. Immunopharmacology 1997, 36, 209-16; Cassim, B.; Naidoo, S.; Ramsaroop, R.; Bhoola, K.D. Immunopharmacology 1997, 36, 121-5; Calixto, J.B.; Cabrini, D.A.; Ferreira, J.; Campos, M.M. Pain 2000, 87, 1-5; Kaneyama, K.; Segami, N.; Sato, J.; Fujimura, K.; Nagao, T.; Yoshimura, H. J. Oral. Maxillofac. Surg. 2007, 65, 242-7), тендосиновитом, подагрой, менструацией и ангиной, фибромиалгию, глазную боль, боль в спине, головную боль, “гистаминовую” головную боль, мигрень (Ebersberger, A.; Ringkamp, M.; Reeh, P.W.; Handwerker, H.O.J Neurophysiol. 1997 Jun; 77(6):3122-33), гипералгезией и лихорадкой. Кроме того, соединения изобретения являются применимыми в качестве аналгезирующего агента для применения во время общей и регулируемой анестезии.
Инфекционные заболевания. В настоящей заявке термин “инфекционные заболевания” включает в себя, но не ограничивается перечисленным, заболевания, включающие заболевания, опосредуемые бактериями, вирусами, грибами, паразитами, простейшими, прионами или микобактериальными инфекциями. В частности, настоящее изобретение является применимым для лечения бактериальных инфекций, вызванных Streptococcus, Escherichia, Salmonella, Staphylococcus, Klebsiella, Moracella, Haemophilus и Yersinia. Примеры бактериальных инфекций, предназначенных для включения в объем настоящего изобретения, включают в себя, но не ограничиваются перечисленным, такие заболевания, как чума, сепсис, эпидемический тиф, пищевое отравление, столбняк, скарлатина, коклюш, дифтерия. Примеры вирусных инфекций, предназначенные для включения в объем настоящего изобретения, включают в себя, но не ограничиваются перечисленным, такие заболевания, как ветряная оспа и опоясывающий лишай, СПИД, грипп, оспу и детские болезни, такие как корь, крапивница, эпидемический паротит, острый полиомиелит передних рогов спинного мозга. Настоящее изобретение является применимым для лечения протозойных и паразитарных инфекций, вызванных Schistosoma mansoni, Dermatofagoides farinae и Plasmodium, включающих в себя малярию. Примеры прионовых инфекций, предназначенные для включения в объем настоящего изобретения, включают в себя, но не ограничиваются перечисленным, такие заболевания, как коровья губчатая энцефалопатия (BSE), болезнь Крейтцфельдта-Якоба и куру.
Воспалительные нарушения. В настоящей заявке термин “воспалительные заболевания” включает в себя, но не ограничивается перечисленным, такие нарушения, как воспаление в острой фазе, локальное и системное воспаление и воспаление, вызванное другими заболеваниями любого типа, этиологии или патогенеза и вызванное воспалительными заболеваниями, указанными в данной заявке.
Повреждения. В настоящей заявке термин “повреждения” включает в себя, но не ограничивается перечисленным, множественную травму, травму головы, повреждения легких, наружные, внутренние и хирургические раны.
Иммунологические нарушения. В настоящей заявке термин “иммунологические нарушения” включает в себя, но не ограничивается перечисленным, такие нарушения, как гиперестезия, аутоиммунные нарушения, отторжение трансплантата при трансплантации, токсичность трансплантата, гранулематозное воспаление/ремоделирование ткани, тяжелую миастению, иммуносупрессию, болезнь иммунных комплексов, сверхпродуцирование и недостаточное продуцирование антител, васкулит.
Раковые заболевания. В настоящей заявке термин “раковые заболевания” включает в себя, но не ограничивается перечисленным, такие нарушения, как рак типа солидной опухоли, включающий в себя рак молочной железы, рак легких (немелкоклеточный рак легких и мелкоклеточный рак легких), рак простаты, раковые заболевания полости рта и глотки (губы, языка, рта, глотки), пищевода, желудка, тонкой кишки, толстой кишки, ободочной кишки, прямой кишки, желчного пузыря и желчных путей, поджелудочной железы, гортани, легкого, кости, остеосаркому, рак соединительной ткани, рак кожи, включающий в себя синдром Капоши, меланому и метастаз кожи, эпидермоидный рак, карциному базальных клеток, рак шейки матки, тела эндометрия, рака яичника, яичка, мочевого пузыря, мочеточника и мочеиспускающего канала, почки, глаза, головного мозга и центральной нервной системы, ложную опухоль головного мозга, саркому, саркоид щитовидной железы и других эндокринных желез (включающий в себя, но не ограничивающийся карциноидными опухолями), болезнь Ходжкина, не-ходжкинскую лимфому, множественную миелому, гемопоэтические злокачественности, включающие в себя лейкозы, и лимфомы, включающие в себя лимфоцитные, гранулоцитные и моноцитные лимфомы, прорастание опухоли, метастаз, асциты, рост опухоли и ангиогенез.
Наследственные заболевания. В настоящей заявке термин “наследственные заболевания” включает в себя, но не ограничивается перечисленным, такие нарушения, как наследственный ангионевротический отек (Davis, A.E. et al., 3rd Transfus. Apher. Sci. 2003, 29, 195-203; Zuraw, B. L. Immunol. Allergy Clin. North Am. 2006, 26, 691-708; Bas, M. et al. Allergy 2006, 61, 1490-2) и ангионевротический отек, хондрокальциноз, болезнь Хантингтона, муковисцидоз.
Отек. В настоящей заявке термин “отек” включает в себя, но не ограничивается перечисленным, общий отек и отек, вызванный воспалением, другими лекарственными средствами, например, индуцированный лекарственным средством ангионевротический отек (Mathelier-Fusade, P. Clin. Rev. Allergy Immunol. 2006, 30, 19-23; Finley, C.J. et al. Am. J. Emerg Med. 1992, 10, 550-2; Bielory, L. et al. Allergy Proc. 1992, 13, 85-7), особенно инфекцией, ожогами, повреждениями, травмой, обморожением, хирургией, искривлением, переломами, воздействием высокогорья (например, легочный отек на высокогорье (НАРЕ) и церебральный отек на высокогорье (НАСЕ)), наследственными, аутоиммунными и другими заболеваниями и нарушениями, особенно, но без ограничения указанным, нарушениями, указанными в данной заявке.
Синдром(ы) просачивания капилляров. В настоящей заявке термин “синдром просачивания капилляров” включает в себя, но не ограничивается перечисленным, синдром системного просачивания капилляров при сепсисе (Marx, G. Eur J Anaesthesiol. 2003 20(6):429-42; Traber, D.L. Crit Care Med. 2000, 28(3):882-3), ожоге (Jonkam, C.C; Enkhbaatar, P.; Nakano, Y.; Boehm, T.; Wang, J.; Nussberger, J. Esechie, A.; Traber, L.D.; Herndon, D.; Traber, D.L., Shock. 2007 Dec; 28(6):704-9), аллергии, состояниях, индуцированных лекарственным средством/токсином, трансплантацией органов и IL-2-цитокиновой терапией.
Методология и диагностики. Соединения изобретения можно метить изотопами, маркерами флуоресценции и люминесценции, антителами или фрагментами антител, любой другой меткой аффинности, подобной нанотелам, аптамерам, пептидами и т.д., ферментами или субстратами ферментов. Эти меченые соединения данного изобретения являются применимыми для картирования местоположения рецепторов брадикинина in vivo, ex vivo, in vitro и in situ (например, в срезах тканей при помощи ауторадиографии) и в качестве радиоактивных меток для получения изображения позитронной эмиссионной томографией (РЭТ), однофотонной эмиссионной компьютерной томографией (ОЭКТ) и тому подобное для характеризации этих рецепторов в живых субъектах или других материалах.
Настоящее изобретение относится также к способам для изменения сигнал-трансдуцирующей активности рецепторов брадикинина in vitro и in vivo. Например, соединения настоящего изобретения и их меченые производные можно применять в качестве стандарта и реагента при определении способности потенциального фармацевтического средства связываться с рецептором В2 ВК.
Настоящее изобретение относится также к способам локализации или детектирования рецептора В2 ВК в ткани, предпочтительно в срезе ткани, такие способы включают в себя контактирование тканевого образца, содержащего рецептор В2 ВК с поддающимся обнаружению меченым соединением согласно настоящему изобретению в условиях, которые позволяют соединению связываться с рецептором В2 ВК и позволяют детектировать связанное соединение. Такие способы и их соответствующие условия известны специалисту в данной области и включают в себя, например, анализ связывания радиолиганда, описанный в примере 754.
Настоящее изобретение относится также к способам ингибирования связывания ВК или любого другого лиганда рецептора В2 с рецептором В2 ВК, такие способы включают в себя контактирование раствора, содержащего описанное здесь соединение-антагонист рецептора В2 ВК, с клетками, экспрессирующими рецептор В2 ВК, в условиях и в количестве, достаточном для поддающегося обнаружению ингибирования связывания ВК или любого другого вещества с рецептором В2 ВК. Такие способы и их соответствующие условия известны специалисту в данной области и включают в себя, например, анализ мобилизации кальция, описанный в примере 755.
Настоящее изобретение далее относится к способам лечения пациентов, страдающих состояниями, восприимчивыми к модуляции рецептора В2 ВК, как указано выше. Применяемый здесь термин “лечение” включает в себя как модифицирующее заболевание лечение, так и симптоматическое лечение, любое из которых может быть профилактическим (т.е. перед началом появления симптомов, чтобы предотвратить, задержать появление или ослабить тяжесть симптомов) или терапевтическим (т.е. после начала появления симптомов, чтобы ослабить тяжесть и/или продолжительность проявления симптомов). Состояние является “восприимчивым к модуляции рецептора В2 ВК”, если модуляция активности рецептора В2 ВК приводит к облегчению состояния или его симптома. Пациенты могут представлять собой, но не ограничиваются перечисленным, приматов (особенно людей), домашних животных-компаньонов (таких как собаки, кошки, лошади) и домашний скот (такой как коровы, свиньи, овцы), для которых применяют описанные здесь дозы.
В настоящем изобретении соединения согласно изобретению применяют также в качестве диагностического средства или для изготовления диагностического средства, в результате чего такое диагностическое средство пригодно для диагностики заболеваний и состояний, которые можно детектировать соединениями настоящего изобретения для описанных здесь терапевтических целей.
Соединения формулы (I) согласно настоящему изобретению обладают улучшенными свойствами по сравнению с антагонистами рецептора В2 ВК, известными в уровне техники, особенно повышенной селективностью, низкой токсичностью, низким взаимодействием лекарственное средство - лекарственное средство, повышенной биологической доступностью (особенно при пероральном введении), повышенной метаболической стабильностью, повышенной стабильностью в анализе микросомной деградации, и повышенной растворимостью.
Настоящее изобретение теперь далее иллюстрируется нижеследующими примерами, из которых можно понять дополнительные признаки, варианты осуществления и преимущества настоящего изобретения.
ПРИМЕРЫ
Получение соединений
Соединения настоящего изобретения можно получить рядом путей, хорошо известных специалисту в области органического синтеза. Соединения настоящего изобретения можно синтезировать с применением способов, описанных ниже, вместе с синтетическими способами, известными в области синтетической органической химии, или их вариантами, признаваемыми специалистом в данной области. Предпочтительные способы включают в себя, но не ограничиваются ими, способы, описанные ниже. Каждая из ссылок, цитированных ниже, таким образом, включается здесь в качестве ссылки.
Аббревиатуры, применяемые в нижеследующих примерах, являются следующими:
ACN означает ацетонитрил,
ВК означает брадикинин,
BSA означает альбумин бычьей сыворотки,
cpm означает число импульсов в минуту,
DCM означает дихлорметан,
DIBAL означает диизобутилалюминийгидрид,
DIPEA означает этилдиизопропиламин,
ДМФА означает диметилформамид,
ДМСО означает диметилсульфоксид,
ЕА означает этилацетат,
ELISA означает твердофазный иммуноферментный анализ,
HBTU означает гексафторфосфат бензотриазол-1-ил(бисдиметиламинометилен)оксония;
HBSS означает сбалансированный солевой раствор Хенкса,
НОАс означает ледяную уксусную кислоту,
ВЭЖХ означает высокоэффективную жидкостную хроматографию,
LDA означает диизопропиламид лития,
NMP означает 1-метилпирролидин-2-он,
Pd(OAc)2 означает ацетат палладия(II),
PBS означает забуференный фосфатом солевой раствор,
PIPES означает пиперазин-N,N'-бис-(2-этансульфоновую кислоту),
p-TsOH означает толуол-4-сульфоновую кислоту,
КТ означает комнатную температуру,
ТГФ означает тетрагидрофуран,
ТНР означает тетрагидропиранил,
TFA означает трифторацетат или трифторуксусную кислоту,
насыщ. означает насыщенный,
WSC означает гидрохлорид (3-диметиламинопропил)этилкарбодиимида,
Pd(dppf)Cl2 означает (1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладий(II)·DCM
Соединения, показанные в нижеследующей таблице 1, являются репрезентативными примерами соединений формулы (I) согласно настоящему изобретению.
Таблица 1
Claims (22)
1. Соединение формулы (I)
или его фармакологически приемлемая соль, где
А представляет собой 6-членный гетероарил, имеющий 1 атом азота в качестве гетероатома, где указанный 6-членный гетероарил замещен 2-3 заместителями, каждый из которых независимо выбран из:
атома галогена,
атома кислорода,
гидрокси,
C1-С6алкила, необязательно замещенного 1-2 группами, выбранными из C1-С6алкокси, ОН, CN, атома кислорода;
С2-С6алкенила, замещенного ОН, CN;
гетероалкила, представляющего собой C1-С6алкокси или одну из групп: -S-Ya-L, -S-Ya-CO-NRaRb, -Ya-NRc-СО-NRaRb, -Ya-NRc-CO-Rc, -Ya-CO-NRa-Rb, -Ya-NRc-CO-L, -Ya-L, Ra-NRb-Ya- (необязательно замещенный гетероалкилом, выбранным из группы: -Ya-NRc-CO-Rc, -Ya-CO-NRaRb, Ra-NRb-Ya- или одной из групп: ОН, C1-C6 алкокси, NH2), Rc-S-Y3-, Rc-О-СО-Ya-, Rc-SO-Ya-, Rc-SO2-Ya, -Ya-NRc-SO2-Rc;
5-6-членного гетероалкилциклоалкила, содержащего 1-2 гетероатома, выбранных из N, О, необязательно замещенного группой, выбранной из циано, NH2 или =O;
гетероалкилгетероциклоалкила, где гетероалкил выбран из групп: Rc-O-CO-Ya-, -Ya-CO-NRaRb, Rb-NRb-Ya; гетероциклоалкил является 4-6-членным гетероциклоалкилом, содержащим атом N в качестве гетероатома;
5-членного гетероарила, содержащего атом О в качестве гетероатома;
где
Ra представляет собой атом водорода, C1-С6алкил, необязательно замещенный NH2;
Rb представляет собой атом водорода, C1-С6алкил, или Rb, взятый вместе с Ra, образует 4-10-членный циклоалкил, необязательно замещенный 1-2 заместителями, представляющими собой ОН или C1-С6алкил;
Rc представляет собой атом водорода, C1-С6алкил, необязательно замещенный CN; и
L представляет собой 5-9-членный гетероарил, содержащий 1-3 гетероатома, выбранных из N, S, О, необязательно замещенный 1-2 заместителями, выбранными из C1-С6алкила, фенила, =O, атома галогена и CN, или 4-6-членный гетероциклоалкил, содержащий 1-2 гетероатома, выбранных из N, О, и
Ya представляет собой связь, C1-С6алкиленовую или С2-С6алкениленовую группу;
R5 представляет собой атом галогена, циано или C1-С6алкил, необязательно замещенный атомом галогена;
R6 представляет собой C1-С6 алкил, необязательно замещенный ОН группой; C1-С3 алкенил; 5-членный гетероарил, имеющий 2-4 гетероатома, каждый из которых независимо выбран из N, О, или S, где указанный 5-членный гетероарил замещен 0-2 заместителями, каждый из которых независимо выбран из атома галогена, атома кислорода, гидрокси, циано, C1-С6 алкила, необязательно замещенного атомом галогена или одной из групп: ОН или NH2, фенила, гетероалкила, представляющего собой C1-С6 алкоксикарбонил, C1-С6алкокси, алкилкарбамоил или одной из групп: Rc-O-Ya, -Ya-NRc-CO-Rc, -Ya-NRc-SO2-Rc, Rc-O-CO-Ya, -Ya-CO-NRaNRb, -Ya-NR-CO-NRaRb, -Ya-NRc-СО-L, где Ra и Rb представляют собой атом водорода, Rc представляет собой C1-С6 алкил, необязательно замещенный ОН, NH2 или фенил, L представляет собой фенил, и Ya представляет собой связь, C1-С6 алкиленовую группу; или -S-R10;
R10 представляет собой 5-членный гетероарил, имеющий 2-3 гетероатома, каждый из которых выбран из N, О или S, где указанный 5-членный гетероарил замещен 0-2 заместителями, каждый из которых независимо выбран из C1-С3 алкила;
R7 представляет собой атом водорода или атом галогена;
R8 представляет собой атом водорода или атом галогена;
и
R17 представляет собой атом водорода или атом галогена.
или его фармакологически приемлемая соль, где
А представляет собой 6-членный гетероарил, имеющий 1 атом азота в качестве гетероатома, где указанный 6-членный гетероарил замещен 2-3 заместителями, каждый из которых независимо выбран из:
атома галогена,
атома кислорода,
гидрокси,
C1-С6алкила, необязательно замещенного 1-2 группами, выбранными из C1-С6алкокси, ОН, CN, атома кислорода;
С2-С6алкенила, замещенного ОН, CN;
гетероалкила, представляющего собой C1-С6алкокси или одну из групп: -S-Ya-L, -S-Ya-CO-NRaRb, -Ya-NRc-СО-NRaRb, -Ya-NRc-CO-Rc, -Ya-CO-NRa-Rb, -Ya-NRc-CO-L, -Ya-L, Ra-NRb-Ya- (необязательно замещенный гетероалкилом, выбранным из группы: -Ya-NRc-CO-Rc, -Ya-CO-NRaRb, Ra-NRb-Ya- или одной из групп: ОН, C1-C6 алкокси, NH2), Rc-S-Y3-, Rc-О-СО-Ya-, Rc-SO-Ya-, Rc-SO2-Ya, -Ya-NRc-SO2-Rc;
5-6-членного гетероалкилциклоалкила, содержащего 1-2 гетероатома, выбранных из N, О, необязательно замещенного группой, выбранной из циано, NH2 или =O;
гетероалкилгетероциклоалкила, где гетероалкил выбран из групп: Rc-O-CO-Ya-, -Ya-CO-NRaRb, Rb-NRb-Ya; гетероциклоалкил является 4-6-членным гетероциклоалкилом, содержащим атом N в качестве гетероатома;
5-членного гетероарила, содержащего атом О в качестве гетероатома;
где
Ra представляет собой атом водорода, C1-С6алкил, необязательно замещенный NH2;
Rb представляет собой атом водорода, C1-С6алкил, или Rb, взятый вместе с Ra, образует 4-10-членный циклоалкил, необязательно замещенный 1-2 заместителями, представляющими собой ОН или C1-С6алкил;
Rc представляет собой атом водорода, C1-С6алкил, необязательно замещенный CN; и
L представляет собой 5-9-членный гетероарил, содержащий 1-3 гетероатома, выбранных из N, S, О, необязательно замещенный 1-2 заместителями, выбранными из C1-С6алкила, фенила, =O, атома галогена и CN, или 4-6-членный гетероциклоалкил, содержащий 1-2 гетероатома, выбранных из N, О, и
Ya представляет собой связь, C1-С6алкиленовую или С2-С6алкениленовую группу;
R5 представляет собой атом галогена, циано или C1-С6алкил, необязательно замещенный атомом галогена;
R6 представляет собой C1-С6 алкил, необязательно замещенный ОН группой; C1-С3 алкенил; 5-членный гетероарил, имеющий 2-4 гетероатома, каждый из которых независимо выбран из N, О, или S, где указанный 5-членный гетероарил замещен 0-2 заместителями, каждый из которых независимо выбран из атома галогена, атома кислорода, гидрокси, циано, C1-С6 алкила, необязательно замещенного атомом галогена или одной из групп: ОН или NH2, фенила, гетероалкила, представляющего собой C1-С6 алкоксикарбонил, C1-С6алкокси, алкилкарбамоил или одной из групп: Rc-O-Ya, -Ya-NRc-CO-Rc, -Ya-NRc-SO2-Rc, Rc-O-CO-Ya, -Ya-CO-NRaNRb, -Ya-NR-CO-NRaRb, -Ya-NRc-СО-L, где Ra и Rb представляют собой атом водорода, Rc представляет собой C1-С6 алкил, необязательно замещенный ОН, NH2 или фенил, L представляет собой фенил, и Ya представляет собой связь, C1-С6 алкиленовую группу; или -S-R10;
R10 представляет собой 5-членный гетероарил, имеющий 2-3 гетероатома, каждый из которых выбран из N, О или S, где указанный 5-членный гетероарил замещен 0-2 заместителями, каждый из которых независимо выбран из C1-С3 алкила;
R7 представляет собой атом водорода или атом галогена;
R8 представляет собой атом водорода или атом галогена;
и
R17 представляет собой атом водорода или атом галогена.
4. Соединение или его фармацевтически приемлемая соль по п.1, где R5 представляет собой метил или этил.
6. Соединение или его фармацевтически приемлемая соль по п.1, где R7, R8 и R17 представляют собой Н.
7. Соединение по п.1 или его фармацевтически приемлемая соль, где соединение обнаруживает IC50 500 нМ или меньше в стандартном анализе in vitro опосредуемого В2-рецептором ВК.
8. Соединение по п.1, которое представляет собой 1-{3-[4-(5-хлортиазол-4-ил)-2-метил-хинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1Н-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-метил-3-[2-метил-4-(4-метил-2Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлор-1-метил-1Н-имидазол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1Н-пиридин-2-он,
1-{5-хлор-2-метокси-4-[2-метил-4-(2-метил-2Н-[1,2,4]триазол-3-ил)хинолин-8-илоксиметил]пиридин-3-илметил}-3-трифторметил-1H-пиридин-2-он,
1-(3-{4-[4-(2-аминоэтокси)-1H-пиразол-3-ил]-2-метилхинолин-8-илоксиметил}-4-метилпиридин-2-илметил)-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(1,5-диметил-1Н-имидазол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{3-[4-(4-гидроксиметил-2Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
N-(3-{2-метил-8-[4-метил-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]хинолин-4-ил}-1H-пиразол-4-илметил)ацетамид,
1-{3-[4-(4-аминометил-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
N-(5-{8-[4-хлор-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1Н-пиразол-4-илметил)ацетамид,
2-{8-[4-хлор-6-метил-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-3-метил-3Н-имидазол-4-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(4-метил-2Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(4-метил-1Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
5-{8-[4-хлор-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-3-метил-3Н-имидазол-4-карбонитрил,
1-{4-хлор-3-[4-(4-хлортиазол-5-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(5-циано-1-метил-1Н-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-4-метоксипиридин-2-илметил}-3-трифторметил-1Н-пиридин-2-он,
1-{4-хлор-3-[4-(5-циано-1-метил-1Н-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
амид 5-{8-[4-хлор-6-метил-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1Н-пиррол-2-карбоновой кислоты,
амид 5-{8-[4-хлор-2-(3-циано-2-оксо-2Н-пиридин-1-илметил)-6-метилпиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1Н-пиррол-2-карбоновой кислоты,
1-{4-хлор-3-[4-(4-гидроксиметил-2Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-фторпиразол-1-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-4-метоксипиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
2-{8-[5-фтор-2-метокси-3-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-4-илметокси]-2-метилхинолин-4-ил}-3-метил-3Н-имидазол-4-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(5-метил-1Н-имидазол-4-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[2-метил-4-(4-метил-1Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
амид 5-{8-[4-хлор-2-(3-циано-2-оксо-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1Н-пиррол-2-карбоновой кислоты,
1-{4-хлор-3-[4-(4-фторпиразол-1-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(3-метилизоксазол-4-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{5-хлор-4-[4-(5-циано-1-метил-1Н-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]-2-гидроксипиридин-3-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-метокси-6-метил-3-[2-метил-4-(4-метил-1Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-гидроксиметил-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(5-фтортиазол-2-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил или фармацевтически приемлемую соль указанных соединений.
1-{4-хлор-3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-метил-3-[2-метил-4-(4-метил-2Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(5-хлор-1-метил-1Н-имидазол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1Н-пиридин-2-он,
1-{5-хлор-2-метокси-4-[2-метил-4-(2-метил-2Н-[1,2,4]триазол-3-ил)хинолин-8-илоксиметил]пиридин-3-илметил}-3-трифторметил-1H-пиридин-2-он,
1-(3-{4-[4-(2-аминоэтокси)-1H-пиразол-3-ил]-2-метилхинолин-8-илоксиметил}-4-метилпиридин-2-илметил)-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(1,5-диметил-1Н-имидазол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{3-[4-(4-гидроксиметил-2Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
N-(3-{2-метил-8-[4-метил-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]хинолин-4-ил}-1H-пиразол-4-илметил)ацетамид,
1-{3-[4-(4-аминометил-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-4-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
N-(5-{8-[4-хлор-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1Н-пиразол-4-илметил)ацетамид,
2-{8-[4-хлор-6-метил-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-3-метил-3Н-имидазол-4-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(4-метил-2Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(4-метил-1Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
5-{8-[4-хлор-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-3-метил-3Н-имидазол-4-карбонитрил,
1-{4-хлор-3-[4-(4-хлортиазол-5-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(5-циано-1-метил-1Н-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-4-метоксипиридин-2-илметил}-3-трифторметил-1Н-пиридин-2-он,
1-{4-хлор-3-[4-(5-циано-1-метил-1Н-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
амид 5-{8-[4-хлор-6-метил-2-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1Н-пиррол-2-карбоновой кислоты,
амид 5-{8-[4-хлор-2-(3-циано-2-оксо-2Н-пиридин-1-илметил)-6-метилпиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1Н-пиррол-2-карбоновой кислоты,
1-{4-хлор-3-[4-(4-гидроксиметил-2Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-фторпиразол-1-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{3-[4-(5-хлортиазол-4-ил)-2-метилхинолин-8-илоксиметил]-4-метоксипиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
2-{8-[5-фтор-2-метокси-3-(2-оксо-3-трифторметил-2Н-пиридин-1-илметил)пиридин-4-илметокси]-2-метилхинолин-4-ил}-3-метил-3Н-имидазол-4-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(5-метил-1Н-имидазол-4-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[2-метил-4-(4-метил-1Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
амид 5-{8-[4-хлор-2-(3-циано-2-оксо-2Н-пиридин-1-илметил)пиридин-3-илметокси]-2-метилхинолин-4-ил}-1-метил-1Н-пиррол-2-карбоновой кислоты,
1-{4-хлор-3-[4-(4-фторпиразол-1-ил)-2-метилхинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-(1-{4-хлор-3-[4-(4-гидрокси-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-ил}этил)-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-6-метил-3-[2-метил-4-(3-метилизоксазол-4-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{5-хлор-4-[4-(5-циано-1-метил-1Н-пиррол-2-ил)-2-метилхинолин-8-илоксиметил]-2-гидроксипиридин-3-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-метокси-6-метил-3-[2-метил-4-(4-метил-1Н-пиразол-3-ил)хинолин-8-илоксиметил]пиридин-2-илметил}-3-трифторметил-1H-пиридин-2-он,
1-{4-хлор-3-[4-(4-гидроксиметил-1Н-пиразол-3-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил,
1-{4-хлор-3-[4-(5-фтортиазол-2-ил)-2-метилхинолин-8-илоксиметил]-6-метилпиридин-2-илметил}-2-оксо-1,2-дигидропиридин-3-карбонитрил или фармацевтически приемлемую соль указанных соединений.
9. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении рецептора В2 ВК, которая содержит одно или несколько соединений по любому из пп.1-8 или их фармацевтически приемлемую соль в терапевтически эффективном количестве и необязательно по меньшей мере одно вещество-носитель, эксципиент и/или адъювант.
10. Фармацевтическая композиция по п.9, изготовленная в виде аэрозоля, крема, геля, пилюли, капсулы, сиропа, раствора, чрескожного пластыря или устройства для доставки фармацевтического средства.
11. Способ ингибирования связывания ВК с рецептором В2 ВК in vitro, включающий контактирование рецептора В2 ВК по меньшей мере с одним соединением согласно любому из пп.1-8 или его солью в условиях и в количестве, достаточном для поддающегося обнаружению ингибирования связывания ВК или любого другого вещества с рецептором В2 ВК.
12. Способ локализации или детектирования рецептора В2 ВК в ткани, предпочтительно в срезе ткани, in vitro, включающий
(а) контактирование образца ткани, содержащего рецептор В2 ВК, с поддающимся обнаружению меченым соединением согласно любому из пп.1-8 в условиях, которые позволяют соединению связываться с рецептором В2 ВК, и
(b) детектирование связанного соединения.
(а) контактирование образца ткани, содержащего рецептор В2 ВК, с поддающимся обнаружению меченым соединением согласно любому из пп.1-8 в условиях, которые позволяют соединению связываться с рецептором В2 ВК, и
(b) детектирование связанного соединения.
13. Способ по п.12, где соединение является меченым радиоактивным изотопом, меченым маркером флуоресценции или меченым маркером люминесценции или меченым антителом.
14. Применение соединения или фармацевтической композиции по любому из пп.1-8 для изготовления лекарственного средства, проявляющего антагонистическую активность в отношении рецептора В2 ВК.
15. Применение по п.14, где лекарственное средство предназначено для лечения и/или предупреждения заболевания или состояния, которые представляют собой кожные нарушения; глазные заболевания; ушные заболевания, заболевания полости рта, горла и респираторные заболевания; желудочно-кишечные заболевания; заболевания печени, желчного пузыря и поджелудочной железы; заболевания мочевых путей и почек; заболевания мужских половых органов и женских половых органов; заболевания гормональной системы; метаболические заболевания; сердечно-сосудистые заболевания; заболевания крови; лимфатические заболевания; нарушения центральной нервной системы; нарушения головного мозга; заболевания костно-мышечной системы; аллергические нарушения; боль; инфекционные заболевания; воспалительные нарушения; травмы; иммунологические нарушения; раковые заболевания; наследственные заболевания или отек.
16. Способ ингибирования активности рецептора ВК В2 у нуждающегося в этом субъекта, включающий введение соединения по любому из пп.1-8.
17. Способ лечение воспалительного заболевания у субъекта, нуждающегося в таком лечении, включающий ведение субъекту терапевтически эффективного количества соединения по любому из пп.1-8.
18. Способ по п.17, где воспалительное заболевание представляет собой наследственный ангионевротический отек.
20. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении рецептора В2 ВК, которая содержит соединение по п.19 или его фармацевтически приемлемую соль в терапевтически эффективном количестве и необязательно по меньшей мере одно вещество-носитель, эксципиент и/или адъювант.
21. Фармацевтическая композиция по п.20, изготовленная в виде аэрозоля, крема, геля, пилюли, капсулы, сиропа, раствора, чрескожного пластыря или устройства для доставки фармацевтического средства.
22. Способ лечение наследственного ангионевротического отека у субъекта, нуждающегося в таком лечении, включающий ведение субъекту терапевтически эффективного количества соединения по п.19.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP07006089 | 2007-03-23 | ||
| EP07006089.2 | 2007-03-23 | ||
| PCT/EP2008/002316 WO2008116620A1 (en) | 2007-03-23 | 2008-03-22 | 8-oxy-quinoline derivatives as bradykinin b2 receptor modulators |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2009139087A RU2009139087A (ru) | 2011-04-27 |
| RU2512541C2 true RU2512541C2 (ru) | 2014-04-10 |
Family
ID=39473755
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2009139087/04A RU2512541C2 (ru) | 2007-03-23 | 2008-03-22 | Производные 8-оксихинолина в качестве модуляторов рецептора в2 брадикинина |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US8410134B2 (ru) |
| EP (2) | EP2144897B1 (ru) |
| KR (1) | KR20090125779A (ru) |
| CN (1) | CN101679375A (ru) |
| AR (1) | AR065844A1 (ru) |
| AT (1) | ATE485289T1 (ru) |
| AU (1) | AU2008232021B2 (ru) |
| BR (1) | BRPI0809231A2 (ru) |
| CA (1) | CA2681206C (ru) |
| DE (1) | DE602008003116D1 (ru) |
| DK (1) | DK2144897T3 (ru) |
| ES (1) | ES2356197T3 (ru) |
| IL (1) | IL200922A0 (ru) |
| MX (1) | MX2009010246A (ru) |
| PL (1) | PL2144897T3 (ru) |
| RU (1) | RU2512541C2 (ru) |
| TW (1) | TWI407960B (ru) |
| WO (1) | WO2008116620A1 (ru) |
| ZA (1) | ZA200906307B (ru) |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8314087B2 (en) | 2007-02-16 | 2012-11-20 | Amgen Inc. | Nitrogen-containing heterocyclyl ketones and methods of use |
| AR073304A1 (es) * | 2008-09-22 | 2010-10-28 | Jerini Ag | Moduladores del receptor de bradiquinina b2 de molecula pequena |
| WO2012122025A2 (en) * | 2011-03-04 | 2012-09-13 | Intrexon Corporation | Vectors conditionally expressing protein |
| EP2797416B1 (en) | 2011-12-28 | 2017-08-09 | Global Blood Therapeutics, Inc. | Substituted benzaldehyde compounds and methods for their use in increasing tissue oxygenation |
| ES2790358T3 (es) | 2011-12-28 | 2020-10-27 | Global Blood Therapeutics Inc | Compuestos de heteroaril aldehído sustituido y métodos para su uso en el aumento de la oxigenación tisular |
| CA2923980C (en) | 2012-09-13 | 2020-03-10 | British Columbia Cancer Agency Branch | Compositions targeting bradykinin receptor b1 for medical imaging of cancer and other disorders |
| HK1220136A1 (zh) * | 2013-03-14 | 2017-04-28 | Shire Human Genetic Therapies, Inc. | 治療b2-緩激肽受體介導的血管性水腫的方法 |
| US20140274961A1 (en) | 2013-03-15 | 2014-09-18 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulation of hemoglobin |
| SG11201507349TA (en) | 2013-03-15 | 2015-10-29 | Global Blood Therapeutics Inc | Compounds and uses thereof for the modulation of hemoglobin |
| BR112015021986A2 (pt) | 2013-03-15 | 2017-07-18 | Global Blood Therapeutics Inc | compostos e seus usos para a modulação de hemoglobina |
| US9422279B2 (en) | 2013-03-15 | 2016-08-23 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulation of hemoglobin |
| US8952171B2 (en) | 2013-03-15 | 2015-02-10 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulation of hemoglobin |
| US10266551B2 (en) | 2013-03-15 | 2019-04-23 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulation of hemoglobin |
| US9604999B2 (en) | 2013-03-15 | 2017-03-28 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulation of hemoglobin |
| WO2014145040A1 (en) | 2013-03-15 | 2014-09-18 | Global Blood Therapeutics, Inc. | Substituted aldehyde compounds and methods for their use in increasing tissue oxygenation |
| WO2014150261A1 (en) * | 2013-03-15 | 2014-09-25 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulaton of hemoglobin |
| US9458139B2 (en) | 2013-03-15 | 2016-10-04 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulation of hemoglobin |
| EA034922B1 (ru) | 2013-03-15 | 2020-04-07 | Глобал Блад Терапьютикс, Инк. | Соединения и их применения для модуляции гемоглобина |
| US9802900B2 (en) | 2013-03-15 | 2017-10-31 | Global Blood Therapeutics, Inc. | Bicyclic heteroaryl compounds and uses thereof for the modulation of hemoglobin |
| EA201992707A1 (ru) | 2013-11-18 | 2020-06-30 | Глобал Блад Терапьютикс, Инк. | Соединения и их применения для модуляции гемоглобина |
| SG11201510135XA (en) | 2014-02-07 | 2016-01-28 | Global Blood Therapeutics Inc | Crystalline polymorphs of the free base of 2-hydroxy-6-((2-(1-isopropyl-1h-pyrazol-5-yl)pyridin-3-yl)methoxy)benzaldehyde |
| CN115197098B (zh) * | 2014-12-24 | 2023-08-08 | 北京生命科学研究所 | 细胞坏死抑制剂 |
| BR112018011272A2 (pt) | 2015-12-04 | 2018-11-21 | Global Blood Therapeutics Inc | regimes de dosagem para 2-hidróxi-6-((2-(1-isopropil-1h-pirazol-5-il)piridin-3-il)metóxi)benzaldeído |
| TWI663160B (zh) | 2016-05-12 | 2019-06-21 | 全球血液治療公司 | 用於合成2-羥基-6-((2-(1-異丙基-1h-吡唑-5-基)-吡啶-3-基)甲氧基)苯甲醛之方法 |
| TW202332423A (zh) | 2016-10-12 | 2023-08-16 | 美商全球血液治療公司 | 包含2-羥基-6-((2-(1-異丙基-1h-吡唑-5-基)吡啶-3-基)甲氧基)-苯甲醛之片劑 |
| CN106866432A (zh) * | 2017-03-31 | 2017-06-20 | 九江善水科技股份有限公司 | 一种硝基苯酚及其中间体的合成工艺 |
| SI3713928T1 (sl) * | 2017-11-24 | 2022-09-30 | Pharvaris Netherlands B.V. | Novi antagonisti receptorja bradikinina B2 |
| WO2020072377A1 (en) | 2018-10-01 | 2020-04-09 | Global Blood Therapeutics, Inc. | Modulators of hemoglobin for the treatment of sickle cell disease |
| UY38706A (es) | 2019-05-23 | 2020-12-31 | Pharvaris Gmbh | Antagonistas cíclicos del receptor b2 de bradiquinina |
| AR118983A1 (es) | 2019-05-23 | 2021-11-17 | Pharvaris Gmbh | Antagonistas cíclicos del receptor b2 de bradiquinina |
| JP2024528195A (ja) | 2021-08-05 | 2024-07-26 | ファルバリス ゲーエムベーハー | ブラジキニンb2受容体拮抗薬を経口投与するための脂質ベースの組成物 |
| JP2025512818A (ja) | 2022-03-25 | 2025-04-22 | ファルバリス ゲーエムベーハー | 可溶化したブラジキニンb2受容体アンタゴニストを含む固体組成物 |
| TW202345810A (zh) | 2022-03-25 | 2023-12-01 | 瑞士商帕法瑞斯有限責任公司 | 包含緩激肽b2受體拮抗劑之固態延長釋放組成物 |
| WO2023180577A1 (en) | 2022-03-25 | 2023-09-28 | Pharvaris Gmbh | Therapeutic uses of bradykinin b2-receptor antagonists |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2135478C1 (ru) * | 1993-04-28 | 1999-08-27 | Фудзисава Фармасьютикал Ко., Лтд. | Гетероциклические соединения, способ их получения, фармацевтическая композиция и способ лечения |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE269310T1 (de) | 1994-10-27 | 2004-07-15 | Fujisawa Pharmaceutical Co | Pyridopyrimidinone, chinoline und anellierte n- heterozyklen als bradykinin-antagonisten |
| FR2737892B1 (fr) | 1995-08-17 | 1997-10-24 | Fournier Ind & Sante | Nouveaux composes de benzenesulfonamide, procede de preparation et utilisation en therapeutique |
| GB9519077D0 (en) * | 1995-09-18 | 1995-11-15 | Fujisawa Pharmaceutical Co | New heterocyclic compounds |
| GB9602029D0 (en) | 1996-02-01 | 1996-04-03 | Fujisawa Pharmaceutical Co | New heterocyclic compounds |
| DE19609827A1 (de) | 1996-03-13 | 1997-09-18 | Hoechst Ag | Aminoalkyl- und Acylaminoalkylether, Verfahren zu deren Herstellung und ihre Verwendung als Bradykinin-Rezeptorantagonisten |
| DE19610784A1 (de) | 1996-03-19 | 1997-09-25 | Hoechst Ag | Fluoralkyl- und Fluoralkoxysubstituierte heterocyclische Bradykinin-Antagonisten, Verfahren zu ihrer Herstellung und ihre Verwendung |
| DE19612067A1 (de) | 1996-03-27 | 1997-10-02 | Hoechst Ag | Verwendung von Bradykinin-Antagonisten zur Herstellung von Arzneimitteln zur Behandlung von chronisch fibrogenetischen Lebererkrankungen und akuten Lebererkrankungen |
| AUPN952696A0 (en) * | 1996-04-29 | 1996-05-23 | Fujisawa Pharmaceutical Co., Ltd. | New heterocyclic compounds |
| DE19712960A1 (de) | 1997-03-27 | 1998-10-01 | Hoechst Ag | Benzyloxy-substituierte, anellierte N-Heterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Bradykininrezeptorantagonisten |
| EP1085895A1 (en) | 1998-06-08 | 2001-03-28 | Advanced Medicine, Inc. | Bradykinin antagonists |
| JP3353784B2 (ja) | 1998-10-21 | 2002-12-03 | 藤沢薬品工業株式会社 | 公知のブラジキニン拮抗剤のガラス体 |
| FR2790260B1 (fr) | 1999-02-26 | 2001-05-04 | Fournier Ind & Sante | Nouveaux composes de n-(benzenesulfonamide), procede de preparation et utilisation en therapeutique |
| GB9913079D0 (en) | 1999-06-04 | 1999-08-04 | Novartis Ag | Organic compounds |
| WO2001056995A1 (en) | 2000-01-18 | 2001-08-09 | Nuerogen Corporation | Substituted imidazoles as selective modulators of bradykinin b2 receptors |
| CA2364178C (en) | 2000-12-05 | 2006-01-10 | Yasuhiro Katsu | N-benzenesulfonyl l-proline compounds as bradykinin antagonists |
| CA2481855A1 (en) | 2002-04-10 | 2003-10-23 | Ortho-Mcneil Pharmaceutical, Inc. | Novel heteroaryl alkylamide derivatives useful as bradykinin receptor modulators |
| ITMI20021247A1 (it) | 2002-06-07 | 2003-12-09 | Menarini Ricerche Spa | Antagonisti basici non peptidici della bradichinina e loro impiego informulazioni farmaceutiche |
| ITMI20041963A1 (it) | 2004-10-15 | 2005-01-15 | Luso Farmaco Inst | "antagonisti non-peptidici della bradichinina e loro composizioni farmaceutiche" |
| EP1741444A1 (en) | 2005-07-05 | 2007-01-10 | Jerini AG | Kinin antagonists for treating bladder dysfunction |
-
2008
- 2008-03-21 TW TW097110110A patent/TWI407960B/zh not_active IP Right Cessation
- 2008-03-22 WO PCT/EP2008/002316 patent/WO2008116620A1/en active Application Filing
- 2008-03-22 PL PL08716679T patent/PL2144897T3/pl unknown
- 2008-03-22 RU RU2009139087/04A patent/RU2512541C2/ru not_active IP Right Cessation
- 2008-03-22 AU AU2008232021A patent/AU2008232021B2/en not_active Ceased
- 2008-03-22 CN CN200880016505A patent/CN101679375A/zh active Pending
- 2008-03-22 US US12/532,703 patent/US8410134B2/en not_active Expired - Fee Related
- 2008-03-22 ES ES08716679T patent/ES2356197T3/es active Active
- 2008-03-22 EP EP08716679A patent/EP2144897B1/en active Active
- 2008-03-22 KR KR1020097019768A patent/KR20090125779A/ko not_active Ceased
- 2008-03-22 AT AT08716679T patent/ATE485289T1/de active
- 2008-03-22 MX MX2009010246A patent/MX2009010246A/es active IP Right Grant
- 2008-03-22 BR BRPI0809231-1A patent/BRPI0809231A2/pt not_active IP Right Cessation
- 2008-03-22 DE DE602008003116T patent/DE602008003116D1/de active Active
- 2008-03-22 CA CA2681206A patent/CA2681206C/en not_active Expired - Fee Related
- 2008-03-22 DK DK08716679.9T patent/DK2144897T3/da active
- 2008-03-22 EP EP10013778A patent/EP2305668A1/en not_active Withdrawn
- 2008-03-25 AR ARP080101208A patent/AR065844A1/es not_active Application Discontinuation
-
2009
- 2009-09-10 ZA ZA200906307A patent/ZA200906307B/xx unknown
- 2009-09-14 IL IL200922A patent/IL200922A0/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2135478C1 (ru) * | 1993-04-28 | 1999-08-27 | Фудзисава Фармасьютикал Ко., Лтд. | Гетероциклические соединения, способ их получения, фармацевтическая композиция и способ лечения |
Non-Patent Citations (1)
| Title |
|---|
| Voegtle Fritz at al.: "4-(dimethylamino)-8-hydroxychuinoline als neuer Chelatligand und als donorverstarkte Endgruppe in Podanden" Chemische berichte, verlag chemie gmbh., DE, 1985, vol.118, no.4, p.1556-1563. * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20100234344A1 (en) | 2010-09-16 |
| ES2356197T3 (es) | 2011-04-05 |
| AR065844A1 (es) | 2009-07-08 |
| AU2008232021B2 (en) | 2012-05-24 |
| DE602008003116D1 (de) | 2010-12-02 |
| EP2144897B1 (en) | 2010-10-20 |
| CA2681206C (en) | 2014-04-29 |
| CN101679375A (zh) | 2010-03-24 |
| ZA200906307B (en) | 2010-04-28 |
| US8410134B2 (en) | 2013-04-02 |
| MX2009010246A (es) | 2009-11-18 |
| EP2305668A1 (en) | 2011-04-06 |
| RU2009139087A (ru) | 2011-04-27 |
| TW200843767A (en) | 2008-11-16 |
| AU2008232021A1 (en) | 2008-10-02 |
| IL200922A0 (en) | 2010-05-17 |
| KR20090125779A (ko) | 2009-12-07 |
| ATE485289T1 (de) | 2010-11-15 |
| BRPI0809231A2 (pt) | 2014-09-02 |
| WO2008116620A1 (en) | 2008-10-02 |
| PL2144897T3 (pl) | 2011-04-29 |
| CA2681206A1 (en) | 2008-10-02 |
| DK2144897T3 (da) | 2011-02-07 |
| EP2144897A1 (en) | 2010-01-20 |
| TWI407960B (zh) | 2013-09-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2512541C2 (ru) | Производные 8-оксихинолина в качестве модуляторов рецептора в2 брадикинина | |
| KR102374844B1 (ko) | 이소퀴놀린-3-일 카르복스아마이드 및 이의 제제와 용도 | |
| RU2707870C2 (ru) | N-((гет)арилметил)-гетероарил-карбоксамидные соединения в качестве ингибиторов плазменного калликреина | |
| ES2605388T3 (es) | Compuesto inhibidor de Trk | |
| TWI433677B (zh) | 雜環化合物及其用途 | |
| WO2010031589A1 (en) | Small molecule bradykinin b2 receptor modulators | |
| DE60113543T2 (de) | Zusammensetzung und antivirale wirkung von substituierten indol-oxo-aceto-piperidin-derivaten | |
| ES2852351T3 (es) | Pirrolamidas como inhibidores de la integrina alfa V | |
| EP2976341B1 (en) | Acyclic cyanoethylpyrazolo pyridones as janus kinase inhibitors | |
| MXPA05005477A (es) | Pirimidinas 2,4,6-trisustituidas como inhibidores de fosfotidilinositol (pi) 3-cinasa y su uso en el tratamiento del cancer. | |
| CA2747677A1 (en) | Cyclic pyrimidin-4-carboxamides as ccr2 receptor antagonists for treatment of inflammation, asthma and copd | |
| KR20010042614A (ko) | 비트로넥틴 길항제로서 복소환식 글리실 베타-알라닌 유도체 | |
| WO2018228446A1 (zh) | 氨基嘧啶类化合物及其制备方法和应用 | |
| AU2011290727B2 (en) | Disubstituted tetrahydofuranyl compounds as antagonists of the bradykinin B1 receptor | |
| CA3176142A1 (en) | Phd inhibitor compounds, compositions, and use | |
| RU2775505C2 (ru) | Изохинолин-3-иловые карбоксамиды и их получение и применение | |
| RU2821520C2 (ru) | N-((гет)арилметил)-гетероарил-карбоксамидные соединения в качестве ингибиторов плазменного калликреина | |
| CN120289433A (zh) | 一类tyk2抑制剂及其制备方法和用途 | |
| AU2023268460A1 (en) | Inhibitors of human respiratory syncytial virus and metapneumovirus | |
| HK1138844A (zh) | 作為緩激肽b2受體調節劑的8-氧基-喹啉衍生物 | |
| HK40016863A (en) | N-((het)arylmethyl)-heteroaryl-carboxamides compounds as plasma kallikrein inhibitors | |
| HK40016863B (en) | N-((het)arylmethyl)-heteroaryl-carboxamides compounds as plasma kallikrein inhibitors | |
| HK1244268B (en) | N-((het)arylmethyl)-heteroaryl-carboxamides compounds as plasma kallikrein inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20150323 |