RU2422156C2 - Композиции конъюгатов сахаридов - Google Patents
Композиции конъюгатов сахаридов Download PDFInfo
- Publication number
- RU2422156C2 RU2422156C2 RU2007102016/15A RU2007102016A RU2422156C2 RU 2422156 C2 RU2422156 C2 RU 2422156C2 RU 2007102016/15 A RU2007102016/15 A RU 2007102016/15A RU 2007102016 A RU2007102016 A RU 2007102016A RU 2422156 C2 RU2422156 C2 RU 2422156C2
- Authority
- RU
- Russia
- Prior art keywords
- conjugate
- serogroup
- saccharide
- molar mass
- conjugates
- Prior art date
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 31
- 125000000837 carbohydrate group Chemical group 0.000 title abstract 2
- 241000588650 Neisseria meningitidis Species 0.000 claims abstract description 36
- 229960005486 vaccine Drugs 0.000 claims abstract description 36
- 238000004519 manufacturing process Methods 0.000 claims abstract description 6
- 150000001720 carbohydrates Chemical class 0.000 claims description 97
- 108010071134 CRM197 (non-toxic variant of diphtheria toxin) Proteins 0.000 claims description 17
- 102000004169 proteins and genes Human genes 0.000 claims description 15
- 108090000623 proteins and genes Proteins 0.000 claims description 15
- 239000002775 capsule Substances 0.000 claims description 14
- 108010078791 Carrier Proteins Proteins 0.000 claims description 11
- 102000014914 Carrier Proteins Human genes 0.000 claims description 11
- 238000000569 multi-angle light scattering Methods 0.000 abstract description 8
- 239000003814 drug Substances 0.000 abstract description 4
- 230000000694 effects Effects 0.000 abstract description 3
- 229940031348 multivalent vaccine Drugs 0.000 abstract description 3
- 238000005375 photometry Methods 0.000 abstract description 3
- 231100000699 Bacterial toxin Toxicity 0.000 abstract description 2
- 239000000688 bacterial toxin Substances 0.000 abstract description 2
- 238000004587 chromatography analysis Methods 0.000 abstract description 2
- 239000000126 substance Substances 0.000 abstract description 2
- 208000034628 Celiac artery compression syndrome Diseases 0.000 abstract 1
- 201000009906 Meningitis Diseases 0.000 abstract 1
- 239000003948 anatoxin Substances 0.000 abstract 1
- 238000009792 diffusion process Methods 0.000 abstract 1
- 238000002270 exclusion chromatography Methods 0.000 abstract 1
- 108091007433 antigens Proteins 0.000 description 33
- 102000036639 antigens Human genes 0.000 description 33
- 239000000427 antigen Substances 0.000 description 32
- 238000004458 analytical method Methods 0.000 description 21
- 238000000034 method Methods 0.000 description 21
- 238000005227 gel permeation chromatography Methods 0.000 description 10
- 230000014759 maintenance of location Effects 0.000 description 9
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 238000009826 distribution Methods 0.000 description 8
- 108010060123 Conjugate Vaccines Proteins 0.000 description 7
- 229940031670 conjugate vaccine Drugs 0.000 description 7
- 150000002482 oligosaccharides Polymers 0.000 description 7
- 241000921898 Neisseria meningitidis serogroup A Species 0.000 description 6
- 238000001542 size-exclusion chromatography Methods 0.000 description 6
- 241000606768 Haemophilus influenzae Species 0.000 description 5
- 229920002307 Dextran Polymers 0.000 description 4
- 241000947238 Neisseria meningitidis serogroup C Species 0.000 description 4
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 4
- 230000007062 hydrolysis Effects 0.000 description 4
- 238000006460 hydrolysis reaction Methods 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 229920001542 oligosaccharide Polymers 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 201000005702 Pertussis Diseases 0.000 description 3
- 241000193998 Streptococcus pneumoniae Species 0.000 description 3
- 238000006640 acetylation reaction Methods 0.000 description 3
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 3
- -1 cancer antigens) Chemical class 0.000 description 3
- 230000021615 conjugation Effects 0.000 description 3
- 229960003983 diphtheria toxoid Drugs 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 230000002538 fungal effect Effects 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 229920001519 homopolymer Polymers 0.000 description 3
- 238000006116 polymerization reaction Methods 0.000 description 3
- 229920001282 polysaccharide Polymers 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 125000005629 sialic acid group Chemical group 0.000 description 3
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 3
- 229960000814 tetanus toxoid Drugs 0.000 description 3
- 241000588832 Bordetella pertussis Species 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- 229920001503 Glucan Polymers 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 238000005903 acid hydrolysis reaction Methods 0.000 description 2
- 239000001361 adipic acid Substances 0.000 description 2
- 235000011037 adipic acid Nutrition 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 238000011088 calibration curve Methods 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 150000002016 disaccharides Chemical group 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 229930182830 galactose Natural products 0.000 description 2
- 229940045808 haemophilus influenzae type b Drugs 0.000 description 2
- 239000008241 heterogeneous mixture Substances 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 229940029583 inactivated polio vaccine Drugs 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 238000003908 quality control method Methods 0.000 description 2
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- 241000222122 Candida albicans Species 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- 241000193163 Clostridioides difficile Species 0.000 description 1
- 201000007336 Cryptococcosis Diseases 0.000 description 1
- 241000221204 Cryptococcus neoformans Species 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 102100037840 Dehydrogenase/reductase SDR family member 2, mitochondrial Human genes 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 101001122279 Escherichia coli (strain K12) Outer membrane porin N Proteins 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 241000709721 Hepatovirus A Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 229940124904 Menactra Drugs 0.000 description 1
- WPNJAUFVNXKLIM-UHFFFAOYSA-N Moxonidine Chemical compound COC1=NC(C)=NC(Cl)=C1NC1=NCCN1 WPNJAUFVNXKLIM-UHFFFAOYSA-N 0.000 description 1
- SQVRNKJHWKZAKO-PFQGKNLYSA-N N-acetyl-beta-neuraminic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-PFQGKNLYSA-N 0.000 description 1
- 241000588677 Neisseria meningitidis serogroup B Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 241000040340 Oat mosaic virus Species 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 101710188053 Protein D Proteins 0.000 description 1
- 101710132893 Resolvase Proteins 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 101710084578 Short neurotoxin 1 Proteins 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 241000193985 Streptococcus agalactiae Species 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 206010043376 Tetanus Diseases 0.000 description 1
- 101710182223 Toxin B Proteins 0.000 description 1
- 101710182532 Toxin a Proteins 0.000 description 1
- 102000002852 Vasopressins Human genes 0.000 description 1
- 108010004977 Vasopressins Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- FZLJPEPAYPUMMR-WLYGPBHPSA-N [(3S,4R,5S,6R)-3-[(2-deuterioacetyl)amino]-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl] dihydrogen phosphate Chemical compound P(=O)(O)(O)OC1[C@@H](NC(C[2H])=O)[C@@H](O)[C@H](O)[C@H](O1)CO FZLJPEPAYPUMMR-WLYGPBHPSA-N 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000037006 agalactosis Effects 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 229940095731 candida albicans Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229940047650 haemophilus influenzae Drugs 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 229960004443 hemophilus influenzae b vaccines Drugs 0.000 description 1
- 229930186900 holotoxin Natural products 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000006054 immunological memory Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000002356 laser light scattering Methods 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- RYRIMPODRHVEIW-UHFFFAOYSA-N n-(2-phenylethyl)nitramide Chemical compound [O-][N+](=O)NCCC1=CC=CC=C1 RYRIMPODRHVEIW-UHFFFAOYSA-N 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 108010021711 pertactin Proteins 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 229940080818 propionamide Drugs 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 229960003726 vasopressin Drugs 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/095—Neisseria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/646—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the entire peptide or protein drug conjugate elicits an immune response, e.g. conjugate vaccines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55544—Bacterial toxins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Virology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Spectrometry And Color Measurement (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
Abstract
Изобретение относится к области биотехнологии и касается композиций для производства вакцин против Neisseria meningitidis, представляющих собой конъюгаты различных серогрупп N.meningitidis с белком-носителем, выбранным из бактериальных токсинов или анатоксинов, с определенным размером, при определении гель-проникающей хроматографией (GPC) и/или с определенной молекулярной массой при определении эксклюзионной хроматографией с детектированием фотометрией многоуглового рассеяния света (SEC-MALS). Преимущество изобретения заключается в том, что конъюгаты заявленных размеров, представляющих собой фрагменты сахаридов, используются при объединении в поливалентную вакцину. 6 н.п. ф-лы, 14 ил.
Description
Все документы, упомянутые здесь, включены путем ссылки во всей своей полноте.
Область изобретения
Это изобретение относится к области анализа и контроля качества вакцин, которые включают бактериальные капсульные сахариды, конъюгированные с носителем.
Предшествующий уровень техники изобретения
Иммуногены, содержащие капсульные сахаридные антигены, конъюгированные с белками-носителями, широко известны в этой области. Конъюгирование превращает Т-независимые антигены в Т-зависимые антигены, таким образом усиливая вторичные иммунные ответы и позволяя защитному иммунитету развиваться, а прототипом конъюгированной вакцины послужила вакцина для Haemophilus influenzae типа b (Hib) [например, см. главу 14 ссылки 1]. Со времени Hib вакцины были разработаны конъюгированные сахаридные вакцины для защиты от Neisseria meningitidis (менингококк) и против Streptococcus pneumoniae (пневмококк). Другие организмы, для которых конъюгированные вакцины представляют интерес, это Streptococcus agalactia (группа В стрептококков) [2], Pseudomonas aeruginosa [3] и Staphylococcus aureus [4].
Вместо того, чтобы использовать полноразмерные капсульные сахариды, можно выбирать олигосахаридные фрагменты желаемого размера после стадии гидролиза [например, ссылка 5], и было показано, что конъюгаты, полученные с олигосахаридами средней длины цепи, дают улучшенную иммуногенность [например, ссылки 6 и 7]. Из трех конъюгированных вакцин N.meningitidis серогруппы С, которые были одобрены для использования на людях, Menjugate™ [8] и Meningitec™ основаны на олигосахаридах, тогда как NeisVac-C™ использует полноразмерный полисахарид.
Когда в вакцину включены конъюгаты, контроль качества по производству и выпуску обычно требует, чтобы они имели определенный размер молекулы и/или молярную массу, а также чтобы эти параметры соотносились между группами. Размер молекулы и молярная масса могут также быть использованы для контроля стабильности вакцины, поскольку конъюгаты могут агрегировать со временем, вызывая увеличение размера и массы.
Задача изобретения обеспечить новые и улучшенные методы для измерения молекулярного размера, молярной массы и родственных параметров для конъюгированных сахаридных антигенов, особенно для конъюгатов менингококковых сахаридов.
Раскрытие изобретения
Изобретатели обнаружили, что гель-проникающая хроматография и SEC-MALS (size exclusion chromatography with detection by multi-angle light-scattering photometry - эксклюзионная хроматография с детектированием фотометрией многоуглового рассеяния света) могут быть использованы для точного и достоверного измерения молекулярного размера и молярной массы, соответственно, конъюгатов сахаридов.
Таким образом, изобретение обеспечивает способ измерения молекулярного размера конъюгированного сахаридного антигена в образце, включающий стадию анализа образца с помощью гель-проникающей хроматографии. Время удерживания из хроматографического анализа может быть преобразовано в радиус вязкости (Rη), например, сравнением по калибровочной кривой, таким образом, позволяя просто вычислять молекулярный размер. Таким способом может быть легко определен средний молекулярный размер и/или распределение молекулярных размеров конъюгатов в образце.
Изобретение также обеспечивает способ измерения молярной массы конъюгированного сахаридного антигена в образце, включающий стадию анализа образца с помощью SEC-MALS. Время удерживания в эксклюзионной хроматографии может быть преобразовано в молярную массу. Таким способом могут быть легко определены средняя молярная масса и/или распределение молярных масс (полидисперсность) конъюгатов в образце. В ссылке 9 показано, что SEC-MALS ранее использовалась для измерения пре-конъюгированных пневмококковых и менингококковых сахаридов, но ни о каких данных пост-конъюгирования не сообщается.
Сахарид
Изобретение позволяет измерять параметры для конъюгированных сахаридных антигенов. Сахаридный антиген является типичным бактериальным капсульным сахаридом, например, из Neisseria meningitidis (серогруппы А, В, С, W135 или Y), Streptococcus pneumoniae (серотипы 4, 6В, 9V, 14, 18С, 19F или 23F), Streptococcus agalactiae (типы Ia, Ib, II, III, IV, V, VI, VII или VIII), Haemophilus influenzae (типируемые штаммы: a, b, с, d, e или f), Pseudomonas aeruginosa, Staphylococcus aureus и т.д. Остальные сахариды, определяемые при анализе, включают глюканы (например, грибковые глюканы, такие как глюканы в Candida albicans) и грибковые капсульные сахариды, например, из капсулы Cryptococcus neoformans. Изобретение особенно полезно для анализа капсульных сахаридов из серогрупп А, С, W135 и Y N.meningitidis.
Капсула N.meningitidis серогруппы А - это гомополимер (α1→6)-связанного N-ацетил-D-маннозамин-1-фосфата, с частичным O-ацетилированием в С3 и С4 положениях. Капсула N.meningitidis серогруппы А - это гомополимер (α2→8)-связанных сиаловых кислот. Капсульный сахарид N.meningitidis серогруппы С - это гомополимер (α2→9)-связанной сиаловой кислоты (N-ацетил нейраминовой кислоты или 'NeuNAc') с различным O-ацетилированием в позициях 7 и/или 8. Сахарид N.meningitidis серогруппы W135 - это полимер, состоящий из звеньев дисахарида сиаловая кислота-галактоза [→4)-D-Neup5Ac(7/9OAc)-α-(2→6)-D-Gal-α-(1→] с различным O-ацетилированием в 7 и 9 позициях сиаловой кислоты [10]. Сахарид N.meningitidis серогруппы Y аналогичен сахариду серогруппы W135 за исключением того, что повторяющееся звено дисахарида включает глюкозу вместо галактозы [→4)-D-Neup5Ac(7/9OAc)-α-(2→6)-D-Glc-α-(1→]. Капсульный сахарид H.influenzae типа b - это полимер рибозы, рибита и фосфата ['PRP', (поли-3-β-D-рибоза-(1,1)-D-рибитол-5-фосфат)].
Другие предпочтительные сахаридные антигены - это эукариотические антигены, например грибковые сахариды, растительные сахариды, человеческие сахариды (например, раковые антигены) и т.д. Другие предпочтительные сахариды - это липополисахариды и липоолигосахариды.
Сахаридный антиген может находиться в природной форме либо может происходить от, например, сахарида, который был подвергнут химическому изменению и/или деполимеризации. Изобретение, в частности, пригодно для анализа олигосахаридных фрагментов капсульных полисахаридов. Природные полисахариды в основном имеют степень полимеризации по меньшей мере 20 (например, 20, 30, 40, 50, 60 или больше), и они могут быть превращены в олигосахаридные фрагменты (например, со степенью полимеризации менее 20) с помощью деполимеризации, например, гидролизом.
Химический гидролиз сахаридов в основном включает обработку либо кислотой, либо основанием в стандартных условиях. Условия для деполимеризации капсульных сахаридов до составляющих их моносахаридов известны в этой области. Для сахаридов серогрупп W135 и Y предпочтителен кислотный гидролиз. Кислотный гидролиз с использованием ТФУ (трифторуксусной кислоты) может быть использован для гидролиза всех серогрупп С, W135 и Y, при этом для серогруппы С предпочтительна слегка более низкая температура инкубации, чтобы избежать деградации ее сиаловых кислот (90°С, а не 100°С). Типичная обработка ТФУ включает добавление ТФУ до конечной концентрации 2 М с последующим нагреванием до 90-100°С в течение 90 минут. Сахарид серогруппы С может быть гидролизован для анализа общего содержания сахаридов обработкой 100 мМ HCl при 80°С в течение 2 часов [11]. Другие типичные условия гидролиза включают миллимолярные концентрации слабой кислоты (например, уксусной кислоты) при повышенных температурах (например, 70-90°С).
Изобретение особенно полезно для использования с образцами конъюгатов, которые включают различные сахариды разных длин, например разные фрагменты одного и того же исходного сахарида.
Конъюгаты
Сахаридный антиген, который следует проанализировать, конъюгируют с носителем. Ковалентное конъюгирование используется для усиления иммуногенности сахаридов путем превращения их из Т-независимых антигенов в Т-зависимые антигены, обеспечивая, таким образом, примирование иммунологической памяти. Конъюгирование особенно полезно для педиатрических вакцин и является хорошо известным методом [описан, например, в ссылках с 12 по 21]. Сахариды могут пришиваться к носителям напрямую [22, 23], если не используются основные линкеры или спенсеры, например адипиновая кислота, β-пропионамидные [24], нитрофенил-этиламинные [25], галоацил галоидные [26], гликозидные связи [27], 6-аминокапроновая кислота [28], антидиуретический гормон [29], С4-C12 компоненты [30] и т.д.
Типичными белками-носителями в конъюгатах являются бактериальные токсины и анатоксины, такие как дифтерийный анатоксин или столбнячный анатоксин. Производное дифтерийного токсина CRM197 [31-33] является белком-носителем в Menjugate™ и Meningitec™, тогда как столбнячный анатоксин используется в NeisVac™. Дифтерийный анатоксин используется в качестве носителя в Menacra™. CRM197 является белком-носителем в Prevnar™. Другие известные белки-носители включают белок внешней мембраны N.meningitidis [34], синтетические пептиды [35, 36], белки теплового шока [37, 38], коклюшные белки [39, 40], цитокины [41], лимфокины [41], гормоны [41], факторы роста [41], искусственные белки, включающие множественные эпитопы человеческих CD4+ Т-клеток из различных антигенов патогенного происхождения [42], белок D из H.influenzae [43, 44], белок поверхности пневмококка PspA [45], белки захвата железа [46], токсин А или В из C.difficile [47] и т.д. Композиции могут использовать более одного белка-носителя, например, для уменьшения риска подавления носителя, а один белок-носитель может нести более одного сахаридного антигена [48]. В основном, конъюгаты имеют соотношение сахарид:белок (по массе) между 1:5 (т.е. избыток белка) и 5:1 (т.е. избыток сахарида). Композиции могут включать свободный белок-носитель дополнительно к конъюгатам [49].
Изобретение особенно подходит для анализа конъюгатов менингококковых сахаридов (серогруппы А, С, W135 и Y) с носителем CRM197. Такие конъюгаты могут быть приготовлены методами, раскрытыми в ссылках 50-53. Предпочтительными являются конъюгаты, приготовленные по ссылке 51, т.е. фрагменты олигосахаридов с носителем CRM197 и линкером на основе адипиновой кислоты.
Гель-проникающая хроматография
Гель-проникающая хроматография (GPC) является широко известным и стандартным методом. Изобретение в основном использует HPGPC (высокоэффективную GPC). Методы GPC используются по изобретению для определения гидродинамического размера (в смеси, средний размер и/или распределение размеров) конъюгата в образце.
Время удерживания на GPC колонке может быть преобразовано в радиус вязкости (Rη) с помощью стандартных методов. Обычно время удерживания определяется для стандартов известного молекулярного размера, что обеспечивает корреляцию этих двух параметров. Молекулярный размер конъюгата можно затем вывести из его времени удерживания на колонке. Например, калибровка колонки, используя декстраны известного молекулярного размера, и их времена удерживания могут быть соотнесены с радиусом вязкости, используя полиномиальное уравнение третьего порядка [54, 55]. Радиус вязкости использует внутреннюю вязкость и молекулярную массу для объяснения эффекта, что форма молекулы влияет на удерживание.
В гетерогенной смеси метод GPC может быть использован для определения как среднего молекулярного размера, так и распределения молекулярного размера в смеси.
SEC-MALS
Эксклюзионная хроматография (SEC) является широко известным методом. Результаты разделения могут быть проанализированы фотометрией многоуглового рассеяния света (MALS) и дифференциальной рефрактометрией. Этот метод может обеспечить информацией по распределению молярной массы и гидродинамического радиуса (молекулярного размера), конформации и другим физическим параметрам полимера, независимым от хроматографических параметров, таких как скорость потока и неподвижная фаза, и ненуждающимся в калибровке по молярной массе [9]. В отличие от необходимости калибровать по молярной массе, определение молекулярной массы с помощью MALS основано на предварительном определении специфического коэффициента преломления (dn/dc) для интересующего полимера в интересующем растворителе на интересующей длине волны и при интересующей температуре.
SEC-MALS может быть использован для определения молярной массы конъюгата. Молярная масса образца определяется на каждом участке данных SEC пика, как видно из типичного графика Дебая, при этом молярная масса определяется из отрезка графика, отсекаемого на координатной оси [56-58]. Сигнал коэффициента преломления, пропорциональный концентрации, и сигнал 90° MALS, пропорциональный концентрации и молярной массе, могут быть наложены друг на друга для определения распределений молярной массы.
В гетерогенной смеси метод SEC-MALS может быть использован для определения как средней молярной массы, так и распределения молярной массы (полидисперсности) в смеси.
Композиции конъюгатов
Изобретение обеспечивает композицию, содержащую конъюгат капсульного сахарида из серогруппы A N.meningitidis, где молекулярный размер конъюгата 57.1 Å и/или молярная масса конъюгата 88.5 кДа. Композиция может также включать конъюгат капсульного сахарида из серогруппы A N.meningitidis, где молярная масса конъюгата 190 кДа.
Изобретение обеспечивает композицию, содержащую конъюгат капсульного сахарида из серогруппы С N.meningitidis, где молекулярный размер конъюгата 57.0 Å и/или молярная масса конъюгата 85.2 кДа.
Изобретение обеспечивает композицию, содержащую конъюгат капсульного сахарида из серогруппы W135 N.meningitidis, где молекулярный размер конъюгата 68.7 Å и/или молярная масса конъюгата 110.1 кДа. Композиция может также включать конъюгат капсульного сахарида из серогруппы W135 N.meningitidis, где молярная масса конъюгата 347 кДа.
Изобретение обеспечивает композицию, содержащую конъюгат капсульного сахарида из серогруппы Y N.meningitidis, где молекулярный размер конъюгата 63.3 Å и/или молярная масса конъюгата 84.7 кДа. Композиция может также включать конъюгат капсульного сахарида из серогруппы Y N.meningitidis, где молярная масса конъюгата 486 кДа.
Несмотря на то что значения молекулярного размера и молярной массы даны как отдельные числа, изобретение распространяется на конъюгаты, у которых эти числа составляют ±20%, ±15%, ±10%, ±5%, ±2% и т.д.
Изобретение также обеспечивает композицию, содержащую два или более (т.е. 2, 3 или 4) конъюгатов серогрупп А, С, W 135 и Y, как описано выше.
Изобретение также обеспечивает способ приготовления поливалентной конъюгатной вакцины, включающий стадии (а) анализа двух или более конъюгатов, используя способ по изобретению, и (b) комбинирование проанализированных конъюгатов для получения поливалентной вакцины.
Изобретение также обеспечивает способ приготовления поливалентной конъюгатной вакцины, включающий стадии смешивания двух или более конъюгатов, которые были проанализированы, используя метод по изобретению.
Смешанные сахариды
Изобретение делает возможным анализ в композициях, которые включают конъюгаты капсульных сахаридов. В основном, изобретение следует использовать для образцов, содержащих один тип конъюгата (например, сахариды, полученные из одного и того же капсульного сахарида, пришитые к одному и тому же носителю). Поэтому для поливалентных вакцин (например, Menactra™, Prevnar™) изобретение в основном следует использовать на отдельных конъюгатах до того, как они будут комбинированы для получения конечного поливалентного продукта, а не на самом конечном продукте. Если два конъюгата имеют очень различающиеся молекулярные размеры и молярные массы, то в таком случае следует проводить параллельный анализ.
Стабильность во время хранения
Изобретение может быть использовано для контроля стабильности конъюгатов во время хранения. Таким образом, способы по изобретению могут быть применены для образцов из одного и того же материала в момент времени t1 и t2, a результаты анализа можно сравнить. Значительное изменение молярной массы и/или молекулярного размера указывает на то, что вакцина не совсем стабильна. Таким образом, изобретение может быть использовано для выбора стабильных вакцин и отклонения нестабильных вакцин.
Неконъюгатные компоненты
Наряду с анализом конъюгатов в композиции, способы изобретения могут включать анализ других компонентов или свойств, например осмотического давления, рН, степени полимеризации отдельных сахаридов или конъюгатов, содержания белка (особенно для белков-носителей), содержания алюминия, содержания детергента, содержания консерванта и т.д.
Изобретение обеспечивает способ приготовления композиции вакцины, включающий стадию анализа молярной массы и/или молекулярного размера конъюгата по изобретению и стадию измерения рН композиции, за которой при необходимости следует стадия приведения рН композиции к желаемому значению, например, между 6 и 7 или около 7.
Изобретение также обеспечивает метод приготовления композиции вакцины, включающий стадии: (а) подготовку одного или более конъюгатов, как описано выше; (b) приготовление из конъюгата(конъюгатов) стоковой вакцины (bulk vaccine); (с) анализ стоковой вакцины на рН и/или другие свойства; и, если результаты стадии (с) показывают, что стоковая вакцина применима для клинического использования, (d) приготовление и упаковка вакцины из стока для использования на людях. Стадия (с) может включать оценку минимальной концентрации сахарида, оценку соотношения неконъюгированный:конъюгированный сахарид и т.д. Стадия (d) может включать упаковку в форму единичной дозы или в форму многократной дозы, например в пузырьки или в шприцы. Обычная доза на человека для инъекции имеет объем 0.5 мл.
Изобретение также обеспечивает способ приготовления композиции вакцины, включающий стадии: (а) подготовку одного или более конъюгатов, как описано выше; и (b) смешивание конъюгированного сахарида с одним или более дополнительными антигенами, например, с
- капсульным сахаридным антигеном серогруппы С N.meningitidis;
- капсульным сахаридным антигеном серогруппы А N.meningitidis;
- белковым антигеном серогруппы В N.meningitidis;
- препаратами микровезикул N.meningitidis серогруппы В [59], 'нативными OMV' (везикулами внешней мембраны) [60], пузырьками или везикулами внешней мембраны [например, ссылки с 61 по 66 и т.д.];
- сахаридным антигеном из Haemophilus influenzae тип b;
- антигеном из Streptococcus pneumoniae, таким как поливалентные конъюгированные сахаридные антигены [например, ссылки с 67 по 69];
- антигеном из вируса гепатита А, таким как инактивированный вирус [например, 70, 71];
- антигеном из вируса гепатита В, таким как поверхностный антиген и/или антиген сердцевины [например, 71, 72];
- антигеном из Bordetella pertussis, таким как коклюшный холотоксин (РТ) и филаментный гемагглютинин (FHA) из B.pertussis, при необходимости в сочетании с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 73 и 74]. Могут быть использованы клеточные коклюшные антигены;
- антигеном дифтерии, таким как дифтерийный анатоксин [например, глава 3 ссылки 75], например мутантный CRM197 [например, 76];
- антигеном столбняка, таким как столбнячный анатоксин [например, глава 4 ссылки 75];
- антигеном(антигенами) полиомиелита [например, 77, 78], такими как IPV (инактивированная полиовакцина).
Такие антигены могут быть адсорбированы на адъювант - соль алюминия (например, гидроксид или фосфат), или они могут быть неадсорбированными (например, свободными в растворе).
Групповая совместимость
Способы изобретения надежны и совместимы и, следовательно, делают возможными адекватные сравнения различных групп конъюгатов. Таким образом, различные группы конъюгатов могут быть получены, исследованы, и совместимые группы могут быть отобраны для выделения и использования в приготовлении конъюгатных вакцин, тогда как аберрантные группы могут быть отклонены.
Изобретение обеспечивает две группы вакцины, где: (а) обе группы вакцины содержат (i) конъюгат капсульного сахарида серогруппы A Neisseria meningitidis; (ii) конъюгат капсульного сахарида серогруппы С Neisseria meningitidis; (iii) конъюгат капсульного сахарида серогруппы W135 Neisseria meningitidis, (iv) конъюгат капсульного сахарида серогруппы Y Neisseria meningitidis; (b) молекулярный размер сахарида серогруппы А в первой группе составляет А1, а молекулярный размер сахарида серогруппы А во второй группе составляет А2; (с) молекулярный размер сахарида серогруппы С в первой группе составляет С1, а молекулярный размер сахарида серогруппы С во второй группе составляет С2; (d) молекулярный размер сахарида серогруппы W135 в первой группе составляет W1, а молекулярный размер сахарида серогруппы W135 во второй группе составляет W2; (е) молекулярный размер сахарида серогруппы Y в первой группе составляет Y1, а молекулярный размер сахарида серогруппы Y во второй группе составляет Y2, (f) соотношения A1/A2, C1/C2, W1/W2 и Y1/Y2 каждое составляет величину между 0.90 и 1.10, а предпочтительно между 0.95 и 1.05.
Изобретение обеспечивает две группы вакцины, где: (а) обе группы вакцины содержат (i) конъюгат капсульного сахарида серогруппы A Neisseria meningitidis; (ii) конъюгат капсульного сахарида серогруппы С Neisseria meningitidis; (iii) конъюгат капсульного сахарида серогруппы W135 Neisseria meningitidis; (iv) конъюгат капсульного сахарида серогруппы Y Neisseria meningitidis; (b) молярная масса сахарида серогруппы А в первой группе составляет A1, а молярная масса сахарида серогруппы А во второй группе составляет А2; (с) молярная масса сахарида серогруппы С в первой группе составляет C1, а молярная масса сахарида серогруппы С во второй группе составляет С2; (d) молярная масса сахарида серогруппы W135 в первой группе составляет W1, а молярная масса сахарида серогруппы W135 во второй группе составляет W2; (е) молярная масса сахарида серогруппы Y в первой группе составляет Y1, а молярная масса сахарида серогруппы Y во второй группе составляет Y2; (f) соотношения A1/A2, C1/C2, W1/W2 и Y1/Y2 каждое составляет величину между 0.90 и 1.10, а предпочтительно между 0.95 и 1.05.
Соотношения, указанные в (f), могут быть основаны на сравнении одного образца из каждой группы, но обычно они основываются на средних значениях (например, средних) от нескольких образцов из каждой группы. Таким образом, у двух групп могут быть взяты несколько образцов, и каждый образец может быть подвергнут нескольким измерениям A1, A2, C1, C2, W1, W2, Y1, Y2, при этом для каждой группы вычисляются средние значения, а средние значения используются для вычисления необходимых соотношений.
Каждая группа (или лот) вакцины готовится отдельно. Например, две группы могут быть приготовлены путем раздельных смешиваний одних и тех же стоков отдельных конъюгатов или путем смешивания стоков отдельных конъюгатов, приготовленных раздельно. Различные образцы одной и той же стоковой смеси не являются различными группами, поскольку эти образцы не подвергаются варьированию между группами, что происходит из различий, появляющихся при приготовлении смесей различных конъюгатов.
Общие положения
Термин «содержащий» включает в себя «включающий», так же как «состоящий», например, композиция, «содержащая» X, может состоять исключительно из X, а может включать что-то дополнительно, например X+Y.
Термин «по существу» не исключает «полностью», например композиция, которая «по существу не содержит» Y, может полностью не содержать Y. Где необходимо, термин «по существу» может быть опущен из формулировки изобретения.
Термин «около» в отношении числах x означает, например, х±10%.
Краткое описание чертежей
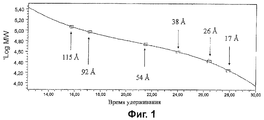
Фиг.1 показывает калибровочную кривую шести декстранов известных гидродинамических размеров.
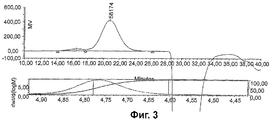
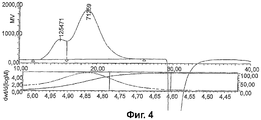
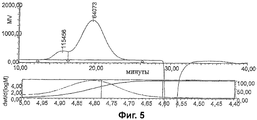
Фиг.2-5 показывают HPGPC анализ CRM197 конъюгатов из серогрупп А, С, W135 и Y.
Фиг.6 показывает приведенное выходное напряжение известных концентраций для калибровки dn/dc на Фиг.7 и 8.
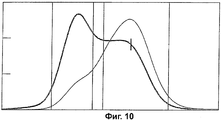
Фиг.9 показывает график Дебая из анализа SEC-MALS, а Фиг.10 показывает наложение сигнала R1 и сигнала 90° MALS.
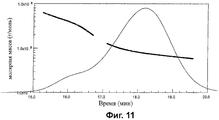
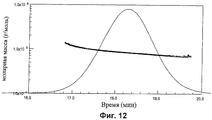
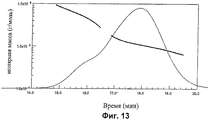
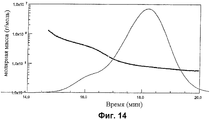
Фиг.11-14 показывают анализы молярной массы с помощью SEC-MALS для CRM197 конъюгатов из серогрупп А, С, W135 и Y.
Варианты осуществления изобретения
CRM197 конъюгаты олигосахаридов серогрупп А, С, W135 и Y менингококка были приготовлены по общему описанию в ссылке 51. Каждый из этих конъюгатов был проанализирован с помощью HPGPC и SEC-MALS по изобретению.
HPGPC анализ
Гликоконъюгатные вакцины в основном состоят из ряда гликоформ с набором сахаридов разных длин, присоединенных к белковому носителю в разных местах. HPGPC был использован для характеристики менингококковых гликоконъюгатов по молекулярному размеру путем определения их гидродинамического размера и распределения по размерам.
Калибровка использовала ряд из шести декстранов с гидродинамическими размерами в пределах от 17 до 115 Å. HPGPC анализ стандартов показан на Фиг.1.
Молекулярные массы стандартов и вычисленные молекулярные массы были следующими:
| Стандарт | 115360 | 54130 | 26000 | 91840 | 38560 | 17590 |
| Вычисленный | 115666 | 53847 | 25425 | 91514 | 39280 | 17767 |
Анализ декстранов был использован, чтобы соотнести радиус вязкости (Rη) с GPC временем удерживания, используя полиномиальное уравнение третьего порядка [54, 55]:
Rη (в Å)=(108)(30 Мр[η]/(π×6.023×1023))1/3
где Мр = пиковая Mw и [η] = внутренняя вязкость в dL/g.
Радиусы вязкости конъюгатов были вычислены по этому уравнению, которое использует внутреннюю вязкость и Mw для объяснения эффекта, что форма молекулы влияет на удерживание.
Анализы отдельных конъюгатов показаны на Фиг.2-5. Гидродинамические размеры были вычислены следующим образом:
| Серогруппа | А | С | W135 | Y |
| Размер (Å) | 57.1 | 57.0 | 68.7 | 63.3 |
| Полидисперсность | 1.032 | 1.018 | 1.040 | 1.035 |
В качестве примера условий анализа конъюгат серогруппы А был проанализирован в 50 мкл объеме инъекции на колонке TSK-Gel G4000SW (300×7,5 мм ID) с подвижной фазой 0.1 М фосфат натрия/0.2 М сульфат аммония, рН 7.0. Скорость потока была 0.5 мл/мин. Использовался детектор коэффициента преломления Waters 410.
SEC-MALS анализ
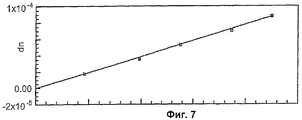
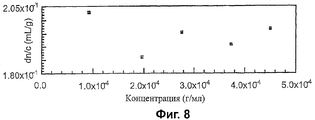
До SEC-MALS анализа были определены коэффициенты преломления (dn/dc) конъюгатов в условиях анализа. Пример выходного напряжения для ряда концентраций показан на Фиг.6. Этот выход дает стандартные кривые, показанные на Фиг.7 и 8. Вычисленные значения были следующими:
| Серогруппа | А | С | W135 | Y |
| dn/dc | 0.163 | 0.190 | 0.159 | 0.201 |
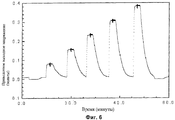
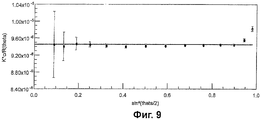
Конъюгаты были проанализированы с помощью SEC-MALS. Молярные массы образцов были определены на каждом участке данных SEC пика, как видно из типичного графика Дебая на Фиг.9. Молярная масса определялась по отрезку, отсекаемому на координатной прямой графика [56-58]. RI сигнал (синий), пропорциональный концентрации, и 90° MALS детектор (красный), пропорциональный концентрации и молярной массе, могут быть наложены (Фиг.10).
Анализы молярной массы (грамм на моль) показаны на Фиг.11-14. Анализы показывают, что гликоконъюгаты MenA, MenW135 и MenY имеют главный пик с плечом низкой концентрации большей Mw, тогда как конъюгат MenC имеет один пик более гомогенного материала.
Результаты анализов пиков (Mw в кДа; полидисперсность в Mw/Mn) были следующими:
| А | С | W135 | Y | ||
| Главный пик | Mw | 88.540 | 85.230 | 110.100 | 84.650 |
| Полидисперсность | 1.012 | 1.011 | 1.049 | 1.050 | |
| Плечо | Mw | 190.000 | - | 485.800 | 347.200 |
| Полидисперсность | 1.053 | - | 1.090 | 1.096 |
Следует понимать, что изобретение было описано только с помощью примеров, и могут быть сделаны модификации, которые при этом останутся в пределах объема и сущности изобретения.
Ссылки (содержание которых включено сюда путем ссылки)
[1] Vaccines (ред. Plotkin et al.) 4-е издание, ISBN: 0721696880.
[2] Baker et al. (2003) J Infect Dis 188:66-73.
[3] Theilacker et al. (2003) Infect Immun 71:3875-84.
[4] Неизвестный автор (2003) Drugs R D 4:383-5.
[5] Ravenscroft et al. (1999) Vaccine 17:2802-2816.
[6] Paoletti et al. (1992) J Clin Invest 89:203-9.
[7] Anderson et al. (1986) J Immunol 137:1181-6.
[8] Jones (2001) Curr Opin Investig Drugs 2:47-49.
[9] D'Ambra et al. (2000) Dev Biol Basel 103:241-242.
[10] WO 2005/033148.
[11] Jumel et al. (2002) Biotechnol Appl Biochem 36:219-226.
[12] Ramsay et al. (2001) Lancet 357(9251):195-196.
[13] Lindberg (1999) Vaccine 17 Suppl 2: S28-36.
[14] Buttery & Moxon (2000) J R Coil Physicians Lond 34: 163-168.
[15] Ahmad & Chapnick (1999) Infect Dis Clin North Am 13: 113-133, vii.
[16] Goldblatt (1998) J. Med. Microbiol. 47: 563-567.
[17] Европейский патент 0477508.
[18] Патент США 5306492.
[19] WO 98/42721.
[20] Conjugate Vaccines (ред. Cruse et al.) ISBN 3805549326, особенно том 10: 48-114.
[21] Hermanson (1996) Bioconjugate Techniques ISBN: 0123423368 или 012342335Х.
[22] Патент США 4761283.
[23] Патент США 4356170.
[24] WO 00/10599.
[25] Gever et al. Med. Microbiol. Immunol, 165: 171-288 (1979).
[26] Патент США 4057685.
[27] Патенты США 4673574; 4761283; 4808700.
[28] Патент США 4459286.
[29] Патент США 4965338.
[30] Патент США 4663160.
[31] Неизвестный автор (Янв. 2002) Research Disclosure, 453077.
[32] Anderson (1983) Infect Immun 39(1): 233-238.
[33] Anderson et al. (1985) J Clin Invest 76 (1): 52-59.
[34] EP-A-0372501.
[35] ЕР-А-0378881.
[36] ЕР-А-0427347.
[37] WO 93/17712.
[38] WO 94/03208.
[39] WO 98/58668.
[40] ЕР-А-0471177.
[41] WO 91/01146.
[42] Falugi et al. (2001) Eur J Immunol 31: 3816-3824.
[43] EP-A-0594610.
[44] WO 00/56360.
[45] WO 02/091998.
[46] WO 01/72337.
[47] WO 00/61761.
[48] WO 99/42130.
[49] WO 96/40242.
[50] WO 02/058737.
[51] WO 03/007985.
[52] Rennels et al. (2002) Pediatr Infect Dis J 21:978-979.
[53] Campbell et al. (2002) J Infect Dis 186:1848-1851.
[54] Kunitani et al. (1991) J Chrom 588:125ff.
[55] Kunitani et al. (1993) J Chrom 632:19ff.
[56] Wyatt (1997) Instrumentation Science & Technology 25(1):1ff.
[57] Wen et al. (1996) Anal Biochem 240:155ff.
[58] Rollings (1992) в Laser Light Scattering in Biochemistry, глава 19.
[59] WO 02/09643.
[60] Katial et al. (2002) Infect Immun 70:702-707.
[61] WO 01/52885.
[62] Европейский патент 0301992.
[63] Bjune et al. (1991) Lancet 338(8775):1093-1096.
[64] Fukasawa et al. (1999) Vaccine 17:2951-2958.
[65] WO 02/09746.
[66] Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333.
[67] Watson (2000) Pediatr Infect Dis J 19:331-332.
[68] Rubin (2000) Pediatr Clin North Am 47:269-285, v.
[69] Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207.
[70] Bell (2000) Pediatr Infect Dis J 19:1187-1188.
[71] Iwarson (1995) APMIS 103:321-326.
[72] Gerlich et al. (1990) Vaccine 8 Suppl: S63-68 & 79-80.
[73] Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355.
[74] Rappuoli et al. (1991) TIBTECH 9:232-238.
[75] Vaccines (1988) ред. Plotkin и Mortimer. ISBN 0-7216-1946-0.
[76] Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70.
[77] Sutter et al. (2000) Pediatr Clin North Am 47:287-308.
[78] Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126.
Claims (6)
1. Композиция для производства вакцин против Neisseria meningitidis, содержащая конъюгат капсульного сахарида серогруппы А N. meningitidis с белком-носителем CRM197, где молекулярный размер конъюгата составляет 57.1±2% Å и/или молярная масса конъюгата составляет 88.5+2% кДа.
2. Композиция для производства вакцин против Neisseria meningitidis, содержащая конъюгат капсульного сахарида серогруппы W135 N.meningitidis с белком-носителем CRM197, где молекулярный размер конъюгата составляет 68.7±2% Å и/или молярная масса конъюгата составляет 110.1±2% кДа.
3. Композиция для производства вакцин против Neisseria meningitidis, содержащая конъюгат капсульного сахарида серогруппы Y N.meningitidis с белком-носителем CRM197, где молекулярный размер конъюгата составляет 63.3±2% Å и/или молярная масса конъюгата составляет 84.7±2% кДа.
4. Композиция для производства вакцин против Neisseria meningitidis, содержащая два или более конъюгат, как определено в пп.1-3.
5. Вакцина против Neisseria meningitidis, содержащая: (i) конъюгат капсульного сахарида серогруппы A Neisseria meningitidis с белком- носителем CRM197, где молекулярный размер конъюгата составляет 57.1±2% Å; (ii) конъюгат капсульного сахарида серогруппы С Neisseria meningitidis с белком-носителем CRM197, где молекулярный размер конъюгата составляет 57.0±2% Å; (iii) конъюгат капсульного сахарида серогруппы W135 Neisseria meningitidis с белком-носителем CRM197, где молекулярный размер конъюгата составляет 68.7.±2% Å; (iv) конъюгат капсульного сахарида серогруппы Y Neisseria meningitidis; с белком-носителем CRM197, где молекулярный размер конъюгата составляет 63.3±2% Å.
6. Вакцина против Neisseria meningitidis, содержащая (i) конъюгат капсульного сахарида серогруппы A Neisseria meningitidis с белком-носителем CRM M197, где молярная масса конъюгата составляет 88,5±2% кДа; (ii) конъюгат капсульного сахарида серогруппы С Neisseria meningitidis с белком-носителем CRM 197, где молярная масса конъюгата составляет 85,2±2% кДа; (iii) конъюгат капсульного сахарида серогруппы W135 Neisseria meningitidis; с белком-носителем CRM197, где молярная масса конъюгата составляет 110.1±2% кДа; (iv) конъюгат капсульного сахарида серогруппы Y Neisseria meningitidis с белком-носителем CRM197, где молярная масса конъюгата составляет 84,7±2% кДа.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0413868.1 | 2004-06-21 | ||
| GBGB0413868.1A GB0413868D0 (en) | 2004-06-21 | 2004-06-21 | Dimensional anlaysis of saccharide conjugates |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2007102016A RU2007102016A (ru) | 2008-07-27 |
| RU2422156C2 true RU2422156C2 (ru) | 2011-06-27 |
Family
ID=32750313
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007102016/15A RU2422156C2 (ru) | 2004-06-21 | 2005-06-21 | Композиции конъюгатов сахаридов |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US8163296B2 (ru) |
| EP (2) | EP2374473B1 (ru) |
| JP (5) | JP2008503716A (ru) |
| CN (1) | CN1976725B (ru) |
| AU (1) | AU2005256961B2 (ru) |
| BR (1) | BRPI0512281A (ru) |
| CA (1) | CA2571565C (ru) |
| ES (2) | ES2443465T3 (ru) |
| GB (1) | GB0413868D0 (ru) |
| MX (2) | MXPA06015188A (ru) |
| NZ (1) | NZ552449A (ru) |
| RU (1) | RU2422156C2 (ru) |
| WO (1) | WO2006000920A2 (ru) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX339524B (es) | 2001-10-11 | 2016-05-30 | Wyeth Corp | Composiciones inmunogenicas novedosas para la prevencion y tratamiento de enfermedad meningococica. |
| GB0413868D0 (en) * | 2004-06-21 | 2004-07-21 | Chiron Srl | Dimensional anlaysis of saccharide conjugates |
| PT1896065E (pt) | 2005-06-27 | 2011-08-31 | Glaxosmithkline Biolog Sa | Processo para a preparação de vacinas |
| AR064642A1 (es) | 2006-12-22 | 2009-04-15 | Wyeth Corp | Polinucleotido vector que lo comprende celula recombinante que comprende el vector polipeptido , anticuerpo , composicion que comprende el polinucleotido , vector , celula recombinante polipeptido o anticuerpo , uso de la composicion y metodo para preparar la composicion misma y preparar una composi |
| TW201009337A (en) | 2008-05-30 | 2010-03-01 | Intervet Int Bv | Analytical method to monitor vaccine potency and stability |
| EP2437882A4 (en) | 2009-06-01 | 2016-11-23 | Waters Technologies Corp | HYBRID MATERIAL FOR CHROMATOGRAPHY SEPARATIONS |
| WO2012018596A2 (en) | 2010-07-26 | 2012-02-09 | Waters Technologies Corporation | Superficially porous materials comprising a substantially nonporous hybrid core having narrow particle size distribution; process for the preparation thereof; and use thereof for chromatographic separations |
| US8195405B2 (en) * | 2009-06-30 | 2012-06-05 | Wyatt Technology Corporation | Method for characterizing reversible association of macromolecules at high concentration |
| MX2012004851A (es) * | 2009-10-30 | 2012-05-22 | Novartis Ag | Purificacion de sacaridos capsulares de staphylococcus aureus tipo 5 y tipo 8. |
| EP4023330A1 (en) * | 2009-12-15 | 2022-07-06 | Waters Technologies Corporation | Device and methods for performing size exclusion chromatography |
| EP2575773A4 (en) * | 2010-05-26 | 2014-06-25 | Selecta Biosciences Inc | SYNTHETIC NANOTRÄGERKOMBINATIONSIMPFSTOFFE |
| AU2011294776B2 (en) | 2010-08-23 | 2016-02-04 | Wyeth Llc | Stable formulations of Neisseria meningitidis rLP2086 antigens |
| CA2809758C (en) | 2010-09-10 | 2021-07-13 | Wyeth Llc | Non-lipidated variants of neisseria meningitidis orf2086 antigens |
| EP4043029A1 (en) | 2012-03-09 | 2022-08-17 | Pfizer Inc. | Neisseria meningitidis compositions and methods thereof |
| SA115360586B1 (ar) | 2012-03-09 | 2017-04-12 | فايزر انك | تركيبات لعلاج الالتهاب السحائي البكتيري وطرق لتحضيرها |
| US10481164B2 (en) | 2012-03-26 | 2019-11-19 | Amgen Inc. | Method for using light scattering in real time to directly monitor and control impurity removal in purification processes |
| ES2685894T3 (es) | 2013-03-08 | 2018-10-15 | Pfizer Inc. | Polipéptidos de fusión inmunogénicos |
| MX369534B (es) | 2013-09-08 | 2019-11-11 | Pfizer | Composiciones de neisseria meningitidis y sus metodos. |
| RU2723045C2 (ru) | 2015-02-19 | 2020-06-08 | Пфайзер Инк. | Композиции neisseria meningitidis и способы их получения |
| EP4309670A3 (en) | 2016-09-02 | 2024-07-17 | Sanofi Pasteur, Inc. | Neisseria meningitidis vaccine |
| US11951165B2 (en) | 2016-12-30 | 2024-04-09 | Vaxcyte, Inc. | Conjugated vaccine carrier proteins |
| CN118662649A (zh) | 2016-12-30 | 2024-09-20 | Vaxcyte公司 | 具有非天然氨基酸的多肽-抗原缀合物 |
| MX2019009011A (es) | 2017-01-31 | 2019-09-26 | Pfizer | Composiciones de neisseria meningitidis y metodos respectivos. |
| CN109459504B (zh) * | 2017-09-06 | 2022-05-27 | 绿谷(上海)医药科技有限公司 | 一种测定聚古罗糖醛酸硫酸酯盐重均分子量和含量的方法 |
| CN109459523B (zh) * | 2017-09-06 | 2022-11-08 | 上海绿谷制药有限公司 | 一种测定酸性糖可溶性盐重均分子量和含量的方法 |
| JP7409055B2 (ja) * | 2019-12-05 | 2024-01-09 | 株式会社島津製作所 | 検出器の出力を補正する方法、および多角度光散乱検出器 |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4057685A (en) | 1972-02-02 | 1977-11-08 | Abbott Laboratories | Chemically modified endotoxin immunizing agent |
| US4356170A (en) | 1981-05-27 | 1982-10-26 | Canadian Patents & Development Ltd. | Immunogenic polysaccharide-protein conjugates |
| US4673574A (en) | 1981-08-31 | 1987-06-16 | Anderson Porter W | Immunogenic conjugates |
| US4459286A (en) | 1983-01-31 | 1984-07-10 | Merck & Co., Inc. | Coupled H. influenzae type B vaccine |
| US4663160A (en) | 1983-03-14 | 1987-05-05 | Miles Laboratories, Inc. | Vaccines for gram-negative bacteria |
| US4761283A (en) | 1983-07-05 | 1988-08-02 | The University Of Rochester | Immunogenic conjugates |
| US4808700A (en) | 1984-07-09 | 1989-02-28 | Praxis Biologics, Inc. | Immunogenic conjugates of non-toxic E. coli LT-B enterotoxin subunit and capsular polymers |
| JPH01125328A (ja) | 1987-07-30 | 1989-05-17 | Centro Natl De Biopreparados | 髄膜炎菌ワクチン |
| NL8802046A (nl) | 1988-08-18 | 1990-03-16 | Gen Electric | Polymeermengsel met polyester en alkaansulfonaat, daaruit gevormde voorwerpen. |
| DE3841091A1 (de) | 1988-12-07 | 1990-06-13 | Behringwerke Ag | Synthetische antigene, verfahren zu ihrer herstellung und ihre verwendung |
| CA2006700A1 (en) | 1989-01-17 | 1990-07-17 | Antonello Pessi | Synthetic peptides and their use as universal carriers for the preparation of immunogenic conjugates suitable for the development of synthetic vaccines |
| WO1991001146A1 (en) | 1989-07-14 | 1991-02-07 | Praxis Biologics, Inc. | Cytokine and hormone carriers for conjugate vaccines |
| IT1237764B (it) | 1989-11-10 | 1993-06-17 | Eniricerche Spa | Peptidi sintetici utili come carriers universali per la preparazione di coniugati immunogenici e loro impiego per lo sviluppo di vaccini sintetici. |
| SE466259B (sv) | 1990-05-31 | 1992-01-20 | Arne Forsgren | Protein d - ett igd-bindande protein fraan haemophilus influenzae, samt anvaendning av detta foer analys, vacciner och uppreningsaendamaal |
| ATE128628T1 (de) | 1990-08-13 | 1995-10-15 | American Cyanamid Co | Faser-hemagglutinin von bordetella pertussis als träger für konjugierten impfstoff. |
| US5153312A (en) | 1990-09-28 | 1992-10-06 | American Cyanamid Company | Oligosaccharide conjugate vaccines |
| IT1262896B (it) | 1992-03-06 | 1996-07-22 | Composti coniugati formati da proteine heat shock (hsp) e oligo-poli- saccaridi, loro uso per la produzione di vaccini. | |
| IL102687A (en) | 1992-07-30 | 1997-06-10 | Yeda Res & Dev | Conjugates of poorly immunogenic antigens and synthetic pepide carriers and vaccines comprising them |
| ATE400295T1 (de) | 1995-06-07 | 2008-07-15 | Glaxosmithkline Biolog Sa | Vakzine mit einem polysaccharide antigen- trägerprotein konjugat und freiem trägerprotein |
| US6299881B1 (en) | 1997-03-24 | 2001-10-09 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | Uronium salts for activating hydroxyls, carboxyls, and polysaccharides, and conjugate vaccines, immunogens, and other useful immunological reagents produced using uronium salts |
| GB9713156D0 (en) | 1997-06-20 | 1997-08-27 | Microbiological Res Authority | Vaccines |
| US7018637B2 (en) | 1998-02-23 | 2006-03-28 | Aventis Pasteur, Inc | Multi-oligosaccharide glycoconjugate bacterial meningitis vaccines |
| DE69941574D1 (de) | 1998-08-19 | 2009-12-03 | Baxter Healthcare Sa | Immunogenes beta-propionamido-gebundenes polysaccharid-protein konjugat geeignet als impfstoff und hergestellt bei verwendung von n-acryloyliertem polysaccharid |
| HU228499B1 (en) | 1999-03-19 | 2013-03-28 | Smithkline Beecham Biolog | Streptococcus vaccine |
| AU781027B2 (en) | 1999-04-09 | 2005-04-28 | Department Of Health & Human Services | Recombinant toxin a protein carrier for polysaccharide conjugate vaccines |
| DK1897555T3 (da) | 2000-01-17 | 2014-10-13 | Novartis Vaccines & Diagnostic | Kompletteret OMV-vaccine mod meningococcus |
| GB0007432D0 (en) | 2000-03-27 | 2000-05-17 | Microbiological Res Authority | Proteins for use as carriers in conjugate vaccines |
| US6936261B2 (en) | 2000-07-27 | 2005-08-30 | Children's Hospital & Research Center At Oakland | Vaccines for broad spectrum protection against diseases caused by Neisseria meningitidis |
| GB0103170D0 (en) | 2001-02-08 | 2001-03-28 | Smithkline Beecham Biolog | Vaccine composition |
| HU230490B1 (hu) * | 2001-01-23 | 2016-08-29 | Sanofi Pasteur Inc. | Multivalens, meningokokkusz-eredetű poliszaccharid és fehérje konjugátumát tartalmazó vakcina |
| AU2002309706A1 (en) * | 2001-05-11 | 2002-11-25 | Aventis Pasteur, Inc. | Novel meningitis conjugate vaccine |
| GB0115176D0 (en) * | 2001-06-20 | 2001-08-15 | Chiron Spa | Capular polysaccharide solubilisation and combination vaccines |
| HUE031886T2 (en) * | 2002-10-11 | 2017-08-28 | Glaxosmithkline Biologicals Sa | Polypeptide vaccines for extensive protection against hypervirulent meningococcal lines |
| CA2514328C (en) | 2003-01-30 | 2020-01-14 | Chiron Srl | Injectable vaccines against multiple meningococcal serogroups |
| GB0323103D0 (en) | 2003-10-02 | 2003-11-05 | Chiron Srl | De-acetylated saccharides |
| EP1670506B1 (en) * | 2003-10-02 | 2012-11-21 | Novartis AG | Liquid vaccines for multiple meningococcal serogroups |
| GB0408978D0 (en) | 2004-04-22 | 2004-05-26 | Chiron Srl | Meningococcal fermentation for preparing conjugate vaccines |
| GB0413868D0 (en) * | 2004-06-21 | 2004-07-21 | Chiron Srl | Dimensional anlaysis of saccharide conjugates |
-
2004
- 2004-06-21 GB GBGB0413868.1A patent/GB0413868D0/en not_active Ceased
-
2005
- 2005-06-21 CN CN2005800204436A patent/CN1976725B/zh active Active
- 2005-06-21 ES ES05770612.9T patent/ES2443465T3/es active Active
- 2005-06-21 CA CA2571565A patent/CA2571565C/en active Active
- 2005-06-21 MX MXPA06015188A patent/MXPA06015188A/es active IP Right Grant
- 2005-06-21 EP EP11163751.8A patent/EP2374473B1/en active Active
- 2005-06-21 AU AU2005256961A patent/AU2005256961B2/en active Active
- 2005-06-21 JP JP2007516078A patent/JP2008503716A/ja not_active Withdrawn
- 2005-06-21 US US11/630,545 patent/US8163296B2/en active Active
- 2005-06-21 WO PCT/IB2005/002532 patent/WO2006000920A2/en active Application Filing
- 2005-06-21 NZ NZ552449A patent/NZ552449A/en unknown
- 2005-06-21 ES ES11163751.8T patent/ES2688796T3/es active Active
- 2005-06-21 EP EP05770612.9A patent/EP1778291B1/en active Active
- 2005-06-21 RU RU2007102016/15A patent/RU2422156C2/ru active IP Right Revival
- 2005-06-21 BR BRPI0512281-3A patent/BRPI0512281A/pt not_active Application Discontinuation
-
2006
- 2006-12-20 MX MX2011011568A patent/MX344621B/es unknown
-
2011
- 2011-09-02 JP JP2011192126A patent/JP2011246490A/ja not_active Withdrawn
-
2012
- 2012-04-24 US US13/454,658 patent/US20120207781A1/en not_active Abandoned
-
2014
- 2014-03-11 JP JP2014047555A patent/JP6218327B2/ja active Active
-
2015
- 2015-07-21 JP JP2015143718A patent/JP2015180707A/ja active Pending
-
2017
- 2017-04-21 JP JP2017084454A patent/JP6661568B2/ja active Active
Non-Patent Citations (1)
| Title |
|---|
| JUMEL К. et al., Evaluation of meningococcal С oligosaccharide conjugate vaccines by size-exclusive chromatography/multi-angle laser light scattering, Biotechnol. and Applied Biochem., 2002, v.36, №3, pp.219-226. * |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2005256961B2 (en) | 2011-06-23 |
| US8163296B2 (en) | 2012-04-24 |
| GB0413868D0 (en) | 2004-07-21 |
| US20080248059A1 (en) | 2008-10-09 |
| JP2017134084A (ja) | 2017-08-03 |
| JP2008503716A (ja) | 2008-02-07 |
| JP2014111654A (ja) | 2014-06-19 |
| JP6218327B2 (ja) | 2017-10-25 |
| CA2571565A1 (en) | 2006-01-05 |
| MXPA06015188A (es) | 2007-03-27 |
| EP2374473B1 (en) | 2018-07-18 |
| MX344621B (es) | 2017-01-03 |
| US20120207781A1 (en) | 2012-08-16 |
| NZ552449A (en) | 2010-05-28 |
| CN1976725B (zh) | 2012-08-29 |
| JP2011246490A (ja) | 2011-12-08 |
| EP2374473A1 (en) | 2011-10-12 |
| BRPI0512281A (pt) | 2008-02-26 |
| RU2007102016A (ru) | 2008-07-27 |
| JP2015180707A (ja) | 2015-10-15 |
| CN1976725A (zh) | 2007-06-06 |
| AU2005256961A1 (en) | 2006-01-05 |
| CA2571565C (en) | 2014-08-12 |
| WO2006000920A3 (en) | 2006-03-30 |
| WO2006000920A2 (en) | 2006-01-05 |
| ES2443465T3 (es) | 2014-02-19 |
| EP1778291B1 (en) | 2013-10-30 |
| ES2688796T3 (es) | 2018-11-07 |
| EP1778291A2 (en) | 2007-05-02 |
| JP6661568B2 (ja) | 2020-03-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2422156C2 (ru) | Композиции конъюгатов сахаридов | |
| US8790893B2 (en) | Measuring degree of polymerisation for meningococcal capsular saccharides that contain sialic acid | |
| US8137680B2 (en) | Analysis of saccharide vaccines without interference | |
| MXPA06015185A (es) | Disco optico que tiene pluralidad de capas de grabacion y metodo y aparato para grabar datos en el mismo. | |
| ES2396153T3 (es) | Separación de componentes conjutados y no conjugados | |
| CAPANNOLI et al. | Sommaire du brevet 2571565 | |
| CAPANNOLI et al. | Patent 2571565 Summary | |
| AU2013206610A1 (en) | Analysis of saccharide vaccines without interference |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20110622 |
|
| NF4A | Reinstatement of patent |
Effective date: 20130410 |