JP2008503716A - Gpcおよびsec−malsによる結合体化糖の寸法分析 - Google Patents
Gpcおよびsec−malsによる結合体化糖の寸法分析 Download PDFInfo
- Publication number
- JP2008503716A JP2008503716A JP2007516078A JP2007516078A JP2008503716A JP 2008503716 A JP2008503716 A JP 2008503716A JP 2007516078 A JP2007516078 A JP 2007516078A JP 2007516078 A JP2007516078 A JP 2007516078A JP 2008503716 A JP2008503716 A JP 2008503716A
- Authority
- JP
- Japan
- Prior art keywords
- serotype
- conjugate
- sugar
- molecular weight
- batch
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 235000000346 sugar Nutrition 0.000 title claims abstract description 61
- 238000000569 multi-angle light scattering Methods 0.000 title claims abstract description 9
- 208000034628 Celiac artery compression syndrome Diseases 0.000 title claims 2
- 150000008163 sugars Chemical class 0.000 title description 16
- 238000004141 dimensional analysis Methods 0.000 title 1
- 150000001720 carbohydrates Chemical class 0.000 claims abstract description 67
- 239000000427 antigen Substances 0.000 claims abstract description 37
- 108091007433 antigens Proteins 0.000 claims abstract description 36
- 102000036639 antigens Human genes 0.000 claims abstract description 36
- 238000000034 method Methods 0.000 claims abstract description 35
- 238000005227 gel permeation chromatography Methods 0.000 claims abstract description 14
- 239000000203 mixture Substances 0.000 claims description 33
- 229960005486 vaccine Drugs 0.000 claims description 30
- 241000588650 Neisseria meningitidis Species 0.000 claims description 21
- 108010071134 CRM197 (non-toxic variant of diphtheria toxin) Proteins 0.000 claims description 14
- 102000004169 proteins and genes Human genes 0.000 claims description 9
- 108090000623 proteins and genes Proteins 0.000 claims description 9
- 150000002482 oligosaccharides Chemical class 0.000 claims description 8
- 108010053187 Diphtheria Toxin Proteins 0.000 claims description 5
- 102000016607 Diphtheria Toxin Human genes 0.000 claims description 5
- 229920001542 oligosaccharide Polymers 0.000 claims description 4
- 230000001580 bacterial effect Effects 0.000 claims description 3
- 230000021615 conjugation Effects 0.000 abstract description 7
- 238000004587 chromatography analysis Methods 0.000 abstract description 3
- 238000001514 detection method Methods 0.000 abstract description 2
- 238000005375 photometry Methods 0.000 abstract description 2
- 238000004458 analytical method Methods 0.000 description 19
- 230000014759 maintenance of location Effects 0.000 description 9
- 108010078791 Carrier Proteins Proteins 0.000 description 8
- 102000014914 Carrier Proteins Human genes 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 238000009826 distribution Methods 0.000 description 8
- 108010060123 Conjugate Vaccines Proteins 0.000 description 6
- 229940031670 conjugate vaccine Drugs 0.000 description 6
- 238000006460 hydrolysis reaction Methods 0.000 description 6
- 210000001744 T-lymphocyte Anatomy 0.000 description 5
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 5
- 230000007062 hydrolysis Effects 0.000 description 5
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 5
- 229920002307 Dextran Polymers 0.000 description 4
- 241000606768 Haemophilus influenzae Species 0.000 description 4
- 238000013365 molecular weight analysis method Methods 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 229920001503 Glucan Polymers 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 241000193998 Streptococcus pneumoniae Species 0.000 description 3
- 108010055044 Tetanus Toxin Proteins 0.000 description 3
- 230000002538 fungal effect Effects 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 229920001519 homopolymer Polymers 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 238000006116 polymerization reaction Methods 0.000 description 3
- 229920001282 polysaccharide Polymers 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 3
- 229940118376 tetanus toxin Drugs 0.000 description 3
- 241000588832 Bordetella pertussis Species 0.000 description 2
- 101710154643 Filamentous hemagglutinin Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 229940124904 Menactra Drugs 0.000 description 2
- 201000005702 Pertussis Diseases 0.000 description 2
- 108010081690 Pertussis Toxin Proteins 0.000 description 2
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 241000193985 Streptococcus agalactiae Species 0.000 description 2
- 238000006640 acetylation reaction Methods 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 2
- 238000011088 calibration curve Methods 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229940045808 haemophilus influenzae type b Drugs 0.000 description 2
- 239000008241 heterogeneous mixture Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 238000003908 quality control method Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- 241000222122 Candida albicans Species 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- 201000007336 Cryptococcosis Diseases 0.000 description 1
- 241000221204 Cryptococcus neoformans Species 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 102100037840 Dehydrogenase/reductase SDR family member 2, mitochondrial Human genes 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 241000709721 Hepatovirus A Species 0.000 description 1
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- SQVRNKJHWKZAKO-PFQGKNLYSA-N N-acetyl-beta-neuraminic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-PFQGKNLYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 241000040340 Oat mosaic virus Species 0.000 description 1
- 101710116435 Outer membrane protein Proteins 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 101710188053 Protein D Proteins 0.000 description 1
- 101710132893 Resolvase Proteins 0.000 description 1
- JVWLUVNSQYXYBE-UHFFFAOYSA-N Ribitol Natural products OCC(C)C(O)C(O)CO JVWLUVNSQYXYBE-UHFFFAOYSA-N 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 101710084578 Short neurotoxin 1 Proteins 0.000 description 1
- 241000193990 Streptococcus sp. 'group B' Species 0.000 description 1
- 206010043376 Tetanus Diseases 0.000 description 1
- 101710182223 Toxin B Proteins 0.000 description 1
- 101710182532 Toxin a Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- FZLJPEPAYPUMMR-WLYGPBHPSA-N [(3S,4R,5S,6R)-3-[(2-deuterioacetyl)amino]-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl] dihydrogen phosphate Chemical compound P(=O)(O)(O)OC1[C@@H](NC(C[2H])=O)[C@@H](O)[C@H](O)[C@H](O1)CO FZLJPEPAYPUMMR-WLYGPBHPSA-N 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- 208000002352 blister Diseases 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 229940095731 candida albicans Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000007073 chemical hydrolysis Effects 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940047650 haemophilus influenzae Drugs 0.000 description 1
- -1 haloacyl halide Chemical class 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229960004443 hemophilus influenzae b vaccines Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000006054 immunological memory Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000015654 memory Effects 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 229940031348 multivalent vaccine Drugs 0.000 description 1
- RYRIMPODRHVEIW-UHFFFAOYSA-N n-(2-phenylethyl)nitramide Chemical compound [O-][N+](=O)NCCC1=CC=CC=C1 RYRIMPODRHVEIW-UHFFFAOYSA-N 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 108010021711 pertactin Proteins 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 229940080818 propionamide Drugs 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000001448 refractive index detection Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- HEBKCHPVOIAQTA-ZXFHETKHSA-N ribitol Chemical compound OC[C@H](O)[C@H](O)[C@H](O)CO HEBKCHPVOIAQTA-ZXFHETKHSA-N 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/095—Neisseria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/646—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the entire peptide or protein drug conjugate elicits an immune response, e.g. conjugate vaccines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55544—Bacterial toxins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Virology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Spectrometry And Color Measurement (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
Abstract
Description
本発明は、ワクチンの分析および品質管理の分野にあり、このワクチンとしてはキャリアと結合体化した細菌の莢膜糖が挙げられる。
Vaccines(Plotkinら、編)第4版、ISBN:0721696880. Bakerら、J Infect Dis(2003)188:66−73 Theilackerら、Infect Immun(2003)71:3875−84 Anonymous Drugs RD(2003)4:383−5 Ravenscroftら、Vaccine(1999)17:2802−2816 Paolettiら、J Clin Invest(1992)89:203−9 Andersonら、J lmmunol(1986)137:1181−6 Jones、Curr Opin Investig Drugs(2001)2:47−49
本発明者らは、ゲル透過クロマトグラフィーおよびSEC−MALS(重角光散乱光度法による検出を備えたサイズ排除クロマトグラフィー)を使用して、糖結合体の分子サイズおよび分子量をそれぞれ正確かつ信頼性高く測定し得ることを発見した。
本発明は、結合体化糖抗原に関するパラメータの測定を可能にする。この糖抗原は、代表的に、細菌の莢膜糖であり、例えば、Neisseria meningitidis(血清型A、B、C、W135、またはY)、Streptococcus pneumoniae(血清型4、6B、9V、14、18C、19Fまたは23F)、Streptococcus agalactiae(型Ia、Ib、II、III、IV、V、VI、VIIまたはVIII)、Haemophilus influenzae(型分け可能な(typeable)株:a、b、c、d、eまたはf)、Pseudomonas aeruginosa、Staphylococcus aureus、などに由来する。他の糖分析物としては、グルカン(例えば、真菌性グルカン(例えば、Candida albicansにおけるグルカン))、および真菌性莢膜糖(例えば、Cryptococcus neoformans由来の莢膜糖)が挙げられる。本発明は、血清型A、C、W135およびYのN.meningitidisの莢膜糖由来の莢膜糖を分析するのに特に有用である。
分析されるべき糖抗原は、キャリアと結合体化される。T細胞非依存性の抗原からT細胞依存性の抗原へと糖を変換することによってその糖の免疫原性を増大させ、これによって免疫記憶を刺激する(prime)ことを可能にするため、共有結合性の結合体化が使用される。結合体化は、小児用ワクチンに特に有用であり、そしてこの結合体化は周知技術である(例えば、参考文献12〜21に概説される)。糖はキャリアに直接連結され得る[22、23]が、リンカーまたはスペーサー(例えば、脂肪酸、β−プロピオンアミド[24]、ニトロフェニル−エチルアミン[25]、ハロアシルハライド[26]、グリコシド結合[27]、6−アミノカプロン酸[28]、ADH[29]、C4〜C12部分[30]、など)が一般に使用される。
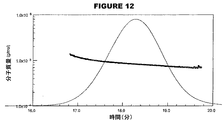
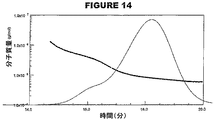
ゲル透過クロマトグラフィー(GPC)は、周知の標準的な技術である。本発明は、一般に、HPGPC(高性能GPC)を使用する。このGPC技術は、サンプル中の結合体の水力学的サイズ(混合物中の平均サイズおよび/またはサイズ分布)を決定するため、本発明に従って使用される。
サイズ除去クロマトグラフィー(SEC)は、周知技術である。分離の結果は、重角光散乱(MALS)光度法および示差屈折率検出法により分析され得る。この方法は、流速および固定相などのクロマトグラフィーのパラメータとは無関係に、そして分子量の検量の必要なしに、分子量の分布情報および水力学半径(分子サイズ)を、ポリマーの確認および他の物理的パラメータを提供する[9]。分子量の検量を必要とせずに、MALSによる分子量の決定は、目的のポリマーに関して、目的の溶媒中の目的の波長および温度における特定の屈折率(dn/dc)を予め決定することに基づく。
本発明は、血清型AのN.meningitidis由来の莢膜糖の結合体を含む組成物を提供する。ここで、その結合体の分子サイズは57.1Åであり、そして/またはその結合体の分子量は88.5kDaである。本組成物はまた、血清型AのN.meningitidis由来の莢膜糖の結合体を含み得、ここでその結合体の分子量は190kDaである。
本発明は、莢膜糖の結合体を含む組成物における分析を可能にする。一般的に、本発明は1つの型の結合体(すなわち、同じキャリアに繋がれた、同じ莢膜糖に由来する糖)を含むサンプルに対して使用される。従って、多価結合体ワクチン(例えば、MenactraTM、PrevnarTM)に関して、本発明は一般的に、最終的な多価産物を作製するために組み合わされる前の個々の結合体において使用され、その結合体自身の最終産物において使用されるのではない。しかしながら、2つの結合体が著しく異なる分子サイズおよび分子量を有する場合、並行した分析は真っ直ぐである。
本発明は、保存の間の結合体の安定性をモニタリングするために使用され得る。従って、本発明の方法は、同じ物質由来のサンプルについて時間t1およびt2において実施され得る。そして分析の結果が比較され得る。分子量および/または分子サイズの有意な変化は、そのワクチンが完全には安定でないことを示す。従って、本発明は、安定なワクチンを選択し、そして不安定なワクチンを却下するために使用され得る。
組成物中の結合体を分析することだけでなく、本発明のプロセスは他の成分または他の特性(例えば、浸透圧、pH、個々の糖または結合体の重合度、タンパク質(特にキャリアタンパク質に関する)含量、アルミニウム含量、界面活性剤含量、保存剤含量、など)の分析を含み得る。
(a)上記されたような1つ以上の結合体を提供する工程;および(b)この結合体化糖と1つ以上のさらなる抗原とを混合する工程、であって、この1つ以上のさらなる抗原としては、以下である:
−血清型CのN.meningitidis由来の莢膜糖抗原。
−血清型AのN.meningitidis由来の莢膜糖抗原。
−血清型BのN.meningitidis由来のタンパク質抗原。
−N.meningitidis血清型Bのミクロ微小胞[59]、「天然のOMV」[60]、小疱(bleb)または外膜小胞(vesicle)[例えば、参考文献61〜66、など]の調製物。
−Haemophilus influenzae b型由来の糖抗原。
−Streptococcus pneumoniae由来の抗原(例えば、多価結合体化糖抗原[例えば、引用文献67〜69])。
−A型肝炎ウイルス由来の抗原(例えば、不活性化ウイルス[引用文献70、71])。
−B型肝炎ウイルス由来の抗原(例えば、表面抗原および/またはコア抗原[例えば、71、72]。
−Bordetella pertussis由来の抗原(例えば、B.pertussis由来の百日咳毒素(PT)および糸状ヘマグルチニン(FHA)、また必要に応じてペルタクチンおよび/または凝集原2および凝集原3[例えば、参考文献73および74]と組み合わされる。細胞性百日咳抗原が使用され得る。
−ジフテリア抗原(例えば、ジフテリア毒素[例えば、参考文献75の第3章]、例えばCRM197変異体[例えば、76]。
−破傷風抗原(例えば、破傷風毒素[例えば、参考文献75の第4章]。
−ポリオ抗原[例えば、参考文献77、78]、(例えば、IPV)。
本発明のプロセスは信頼でき、一貫しており、従って異なるバッチの結合体の有効な比較を可能にする。従って、異なるバッチの結合体が調製され得、アッセイされ得、そして結合体ワクチンの調製における販売および使用のため、一貫性のあるバッチが選択され得、一方、逸脱したバッチは棄却され得る。
用語「含むこと(comprising)」は、「含むこと(including)」ならびに「構成すること(consisting)」を包含する。例えば、Xを「含む」組成物は、主としてXから構成されてよく、またはいくらかの付加物(例えば、X+Y)を含んでよい。
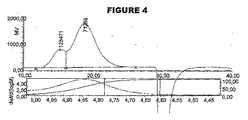
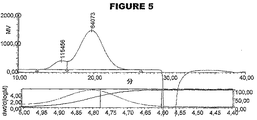
血清型A、血清型C、血清型W135および血清型Yの髄膜炎菌由来のオリゴ糖のCRM197結合体は、参考文献51に一般に記載されるように調製した。これらの結合体の各々を、本発明に従ってHPGPCおよびSEC−MALSによって分析した。
糖結合体ワクチンは、一般的に、複数の部位においてタンパク質キャリアと結合された、異なる長さの糖の範囲を有する糖形態のアレイから構成される。HPGPCを使用して、水力学的サイズおよびサイズ分布を決定することによって、分子サイズに関して髄膜炎糖結合体を特徴決定した。
ここで、Mp=頂部のMw、および[η]=固有粘度(dL/g単位)。
SEC−MALS分析の前に、分析条件の下で結合体の屈折率(dn/dc)を決定した。設定濃度に対する実施例の電圧出力を図6に示す。この出力は、図7および図8に示される標準曲線へと導いた。計算値は以下のとおりである:
Claims (14)
- サンプル内の結合体化糖抗原の分子サイズを測定するためのプロセスであって、ゲル透過クロマトグラフィーによりサンプルを分析する工程を包含する、プロセス。
- サンプル内の結合体化糖抗原の分子量を測定するためのプロセスであって、SEC−MALSによってサンプルを分析する工程を包含する、プロセス。
- 前記糖が細菌の莢膜糖である、請求項1または2に記載のプロセス。
- 前記莢膜糖が、Neisseria meningitidisの血清型A、C、W135、またはYに由来する、請求項3に記載のプロセス。
- 前記糖がオリゴ糖である、請求項4に記載のプロセス。
- 前記結合体がタンパク質キャリアを有する、請求項1〜5のいずれか1項に記載のプロセス。
- 前記タンパク質キャリアがCRM197またはジフテリア毒素である、請求項6に記載のプロセス。
- 血清型AのN.meningitidis由来の莢膜糖の結合体を含む組成物であって、該結合体の分子サイズが57.1ű20%であり、そして/または該結合体の分子量が88.5kDa±20%である、組成物。
- 血清型CのN.meningitidis由来の莢膜糖の結合体を含む組成物であって、該結合体の分子サイズが57.0ű20%であり、そして/または該結合体の分子量が85.2kDa±20%である、組成物。
- 血清型W135のN.meningitidis由来の莢膜糖の結合体を含む組成物であって、該結合体の分子サイズが68.7ű20%であり、そして/または該結合体の分子量が110.1kDa±20%である、組成物。
- 血清型YのN.meningitidis由来の莢膜糖の結合体を含む組成物であって、該結合体の分子サイズが63.3ű20%であり、そして/または該結合体の分子量が84.7kDa±20%である、組成物。
- 請求項8〜11に記載される前記結合体のうちの2つ以上を含む、組成物。
- 2つのバッチのワクチンであって、ここで:
(a)両方のバッチのワクチンは:
(i)血清型AのNeisseria meningitidis由来の莢膜糖の結合体;
(ii)血清型CのNeisseria meningitidis由来の莢膜糖の結合体;
(iii)血清型W135のNeisseria meningitidis由来の莢膜糖の結合体;
(iv)血清型YのNeisseria meningitidis由来の莢膜糖の結合体;
を含み;
(b)第一バッチの血清型Aの糖の分子サイズがA1であり、第二バッチの血清型Aの糖の分子サイズがA2であり;
(c)該第一バッチの血清型Cの糖の分子サイズがC1であり、該第二バッチの血清型Cの糖は分子サイズがC2であり;
(d)該第一バッチの血清型W135の糖の分子サイズがW1であり、該第二バッチの血清型W135の糖は分子サイズがW2であり;
(e)該第一バッチの血清型Yの糖の分子サイズがY1であり、該第二バッチの血清型Yの糖は分子サイズがY2であり;
(f)A1/A2の比率、C1/C2の比率、W1/W2の比率、およびY1/Y1の比率が各々、0.90〜1.10の間である、
ワクチン。 - 2つのバッチのワクチンであって、ここで:
(a)両方のバッチのワクチンは:
(i)血清型AのNeisseria meningitidis由来の莢膜糖の結合体;
(ii)血清型CのNeisseria meningitidis由来の莢膜糖の結合体;
(iii)血清型W135のNeisseria meningitidis由来の莢膜糖の結合体;
(iv)血清型YのNeisseria meningitidis由来の莢膜糖の結合体;
を含み;
(b)第一バッチの血清型Aの糖の分子量がA1であり、第二バッチの血清型Aの糖の分子量がA2であり;
(c)該第一バッチの血清型Cの糖の分子量がC1であり、該第二バッチの血清型Cの糖の分子量がC2であり;
(d)該第一バッチの血清型W135の糖の分子量がW1であり、該第二バッチの血清型W135の糖の分子量がW2であり;
(e)該第一バッチの血清型Yの糖の分子量がY1であり、該第二バッチの血清型Yの糖の分子量がY2であり;
(f)A1/A2の比率、C1/C2の比率、W1/W2の比率、およびY1/Y1の比率が各々、0.90〜1.10の間である、
ワクチン。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB0413868.1A GB0413868D0 (en) | 2004-06-21 | 2004-06-21 | Dimensional anlaysis of saccharide conjugates |
| PCT/IB2005/002532 WO2006000920A2 (en) | 2004-06-21 | 2005-06-21 | Dimensional analysis of saccharide conjugates with gpc & sec-mals |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011192126A Division JP2011246490A (ja) | 2004-06-21 | 2011-09-02 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008503716A true JP2008503716A (ja) | 2008-02-07 |
| JP2008503716A5 JP2008503716A5 (ja) | 2008-07-17 |
Family
ID=32750313
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007516078A Withdrawn JP2008503716A (ja) | 2004-06-21 | 2005-06-21 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
| JP2011192126A Withdrawn JP2011246490A (ja) | 2004-06-21 | 2011-09-02 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
| JP2014047555A Active JP6218327B2 (ja) | 2004-06-21 | 2014-03-11 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
| JP2015143718A Pending JP2015180707A (ja) | 2004-06-21 | 2015-07-21 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
| JP2017084454A Active JP6661568B2 (ja) | 2004-06-21 | 2017-04-21 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011192126A Withdrawn JP2011246490A (ja) | 2004-06-21 | 2011-09-02 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
| JP2014047555A Active JP6218327B2 (ja) | 2004-06-21 | 2014-03-11 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
| JP2015143718A Pending JP2015180707A (ja) | 2004-06-21 | 2015-07-21 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
| JP2017084454A Active JP6661568B2 (ja) | 2004-06-21 | 2017-04-21 | Gpcおよびsec−malsによる結合体化糖の寸法分析 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US8163296B2 (ja) |
| EP (2) | EP2374473B1 (ja) |
| JP (5) | JP2008503716A (ja) |
| CN (1) | CN1976725B (ja) |
| AU (1) | AU2005256961B2 (ja) |
| BR (1) | BRPI0512281A (ja) |
| CA (1) | CA2571565C (ja) |
| ES (2) | ES2443465T3 (ja) |
| GB (1) | GB0413868D0 (ja) |
| MX (2) | MXPA06015188A (ja) |
| NZ (1) | NZ552449A (ja) |
| RU (1) | RU2422156C2 (ja) |
| WO (1) | WO2006000920A2 (ja) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011522252A (ja) * | 2008-05-30 | 2011-07-28 | インターベツト・インターナシヨナル・ベー・ベー | ワクチンの効力および安定性を監視するための分析方法 |
| JP2013514538A (ja) * | 2009-12-15 | 2013-04-25 | ウオーターズ・テクノロジーズ・コーポレイシヨン | サイズ排除クロマトグラフィーを行うための装置および方法 |
| JP2017014217A (ja) * | 2010-05-26 | 2017-01-19 | セレクタ バイオサイエンシーズ インコーポレーテッドSelecta Biosciences,Inc. | 合成ナノキャリア混合ワクチン |
| US10092893B2 (en) | 2010-07-26 | 2018-10-09 | Waters Technologies Corporation | Superficially porous materials comprising a substantially nonporous hybrid core having narrow particle size distribution; process for the preparation thereof; and use thereof for chromatographic separations |
| KR20200097239A (ko) * | 2017-09-06 | 2020-08-18 | 상하이 그린벨리 파머수티컬 주식회사 | 중량평균 분자량 및 산성 당의 가용성 염의 함량 측정방법 |
| JP2021089234A (ja) * | 2019-12-05 | 2021-06-10 | 株式会社島津製作所 | 検出器の出力を補正する方法、および多角度光散乱検出器 |
| US11291974B2 (en) | 2009-06-01 | 2022-04-05 | Waters Technologies Corporation | Hybrid inorganic/organic materials having novel surface modification; process for the preparation of inorganic/organic hybrid materials; and use of said particles for chromatographic separations |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX339524B (es) | 2001-10-11 | 2016-05-30 | Wyeth Corp | Composiciones inmunogenicas novedosas para la prevencion y tratamiento de enfermedad meningococica. |
| GB0413868D0 (en) * | 2004-06-21 | 2004-07-21 | Chiron Srl | Dimensional anlaysis of saccharide conjugates |
| PT1896065E (pt) | 2005-06-27 | 2011-08-31 | Glaxosmithkline Biolog Sa | Processo para a preparação de vacinas |
| AR064642A1 (es) | 2006-12-22 | 2009-04-15 | Wyeth Corp | Polinucleotido vector que lo comprende celula recombinante que comprende el vector polipeptido , anticuerpo , composicion que comprende el polinucleotido , vector , celula recombinante polipeptido o anticuerpo , uso de la composicion y metodo para preparar la composicion misma y preparar una composi |
| US8195405B2 (en) * | 2009-06-30 | 2012-06-05 | Wyatt Technology Corporation | Method for characterizing reversible association of macromolecules at high concentration |
| MX2012004851A (es) * | 2009-10-30 | 2012-05-22 | Novartis Ag | Purificacion de sacaridos capsulares de staphylococcus aureus tipo 5 y tipo 8. |
| AU2011294776B2 (en) | 2010-08-23 | 2016-02-04 | Wyeth Llc | Stable formulations of Neisseria meningitidis rLP2086 antigens |
| CA2809758C (en) | 2010-09-10 | 2021-07-13 | Wyeth Llc | Non-lipidated variants of neisseria meningitidis orf2086 antigens |
| EP4043029A1 (en) | 2012-03-09 | 2022-08-17 | Pfizer Inc. | Neisseria meningitidis compositions and methods thereof |
| SA115360586B1 (ar) | 2012-03-09 | 2017-04-12 | فايزر انك | تركيبات لعلاج الالتهاب السحائي البكتيري وطرق لتحضيرها |
| US10481164B2 (en) | 2012-03-26 | 2019-11-19 | Amgen Inc. | Method for using light scattering in real time to directly monitor and control impurity removal in purification processes |
| ES2685894T3 (es) | 2013-03-08 | 2018-10-15 | Pfizer Inc. | Polipéptidos de fusión inmunogénicos |
| MX369534B (es) | 2013-09-08 | 2019-11-11 | Pfizer | Composiciones de neisseria meningitidis y sus metodos. |
| RU2723045C2 (ru) | 2015-02-19 | 2020-06-08 | Пфайзер Инк. | Композиции neisseria meningitidis и способы их получения |
| EP4309670A3 (en) | 2016-09-02 | 2024-07-17 | Sanofi Pasteur, Inc. | Neisseria meningitidis vaccine |
| US11951165B2 (en) | 2016-12-30 | 2024-04-09 | Vaxcyte, Inc. | Conjugated vaccine carrier proteins |
| CN118662649A (zh) | 2016-12-30 | 2024-09-20 | Vaxcyte公司 | 具有非天然氨基酸的多肽-抗原缀合物 |
| MX2019009011A (es) | 2017-01-31 | 2019-09-26 | Pfizer | Composiciones de neisseria meningitidis y metodos respectivos. |
| CN109459504B (zh) * | 2017-09-06 | 2022-05-27 | 绿谷(上海)医药科技有限公司 | 一种测定聚古罗糖醛酸硫酸酯盐重均分子量和含量的方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002058737A2 (en) * | 2001-01-23 | 2002-08-01 | Aventis Pasteur | Multivalent meningococcal polysaccharide-protein conjugate vaccine |
| WO2003007985A2 (en) * | 2001-06-20 | 2003-01-30 | Chiron Srl. | Capsular polysaccharide solubilisation and combination vaccines |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4057685A (en) | 1972-02-02 | 1977-11-08 | Abbott Laboratories | Chemically modified endotoxin immunizing agent |
| US4356170A (en) | 1981-05-27 | 1982-10-26 | Canadian Patents & Development Ltd. | Immunogenic polysaccharide-protein conjugates |
| US4673574A (en) | 1981-08-31 | 1987-06-16 | Anderson Porter W | Immunogenic conjugates |
| US4459286A (en) | 1983-01-31 | 1984-07-10 | Merck & Co., Inc. | Coupled H. influenzae type B vaccine |
| US4663160A (en) | 1983-03-14 | 1987-05-05 | Miles Laboratories, Inc. | Vaccines for gram-negative bacteria |
| US4761283A (en) | 1983-07-05 | 1988-08-02 | The University Of Rochester | Immunogenic conjugates |
| US4808700A (en) | 1984-07-09 | 1989-02-28 | Praxis Biologics, Inc. | Immunogenic conjugates of non-toxic E. coli LT-B enterotoxin subunit and capsular polymers |
| JPH01125328A (ja) | 1987-07-30 | 1989-05-17 | Centro Natl De Biopreparados | 髄膜炎菌ワクチン |
| NL8802046A (nl) | 1988-08-18 | 1990-03-16 | Gen Electric | Polymeermengsel met polyester en alkaansulfonaat, daaruit gevormde voorwerpen. |
| DE3841091A1 (de) | 1988-12-07 | 1990-06-13 | Behringwerke Ag | Synthetische antigene, verfahren zu ihrer herstellung und ihre verwendung |
| CA2006700A1 (en) | 1989-01-17 | 1990-07-17 | Antonello Pessi | Synthetic peptides and their use as universal carriers for the preparation of immunogenic conjugates suitable for the development of synthetic vaccines |
| WO1991001146A1 (en) | 1989-07-14 | 1991-02-07 | Praxis Biologics, Inc. | Cytokine and hormone carriers for conjugate vaccines |
| IT1237764B (it) | 1989-11-10 | 1993-06-17 | Eniricerche Spa | Peptidi sintetici utili come carriers universali per la preparazione di coniugati immunogenici e loro impiego per lo sviluppo di vaccini sintetici. |
| SE466259B (sv) | 1990-05-31 | 1992-01-20 | Arne Forsgren | Protein d - ett igd-bindande protein fraan haemophilus influenzae, samt anvaendning av detta foer analys, vacciner och uppreningsaendamaal |
| ATE128628T1 (de) | 1990-08-13 | 1995-10-15 | American Cyanamid Co | Faser-hemagglutinin von bordetella pertussis als träger für konjugierten impfstoff. |
| US5153312A (en) | 1990-09-28 | 1992-10-06 | American Cyanamid Company | Oligosaccharide conjugate vaccines |
| IT1262896B (it) | 1992-03-06 | 1996-07-22 | Composti coniugati formati da proteine heat shock (hsp) e oligo-poli- saccaridi, loro uso per la produzione di vaccini. | |
| IL102687A (en) | 1992-07-30 | 1997-06-10 | Yeda Res & Dev | Conjugates of poorly immunogenic antigens and synthetic pepide carriers and vaccines comprising them |
| ATE400295T1 (de) | 1995-06-07 | 2008-07-15 | Glaxosmithkline Biolog Sa | Vakzine mit einem polysaccharide antigen- trägerprotein konjugat und freiem trägerprotein |
| US6299881B1 (en) | 1997-03-24 | 2001-10-09 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | Uronium salts for activating hydroxyls, carboxyls, and polysaccharides, and conjugate vaccines, immunogens, and other useful immunological reagents produced using uronium salts |
| GB9713156D0 (en) | 1997-06-20 | 1997-08-27 | Microbiological Res Authority | Vaccines |
| US7018637B2 (en) | 1998-02-23 | 2006-03-28 | Aventis Pasteur, Inc | Multi-oligosaccharide glycoconjugate bacterial meningitis vaccines |
| DE69941574D1 (de) | 1998-08-19 | 2009-12-03 | Baxter Healthcare Sa | Immunogenes beta-propionamido-gebundenes polysaccharid-protein konjugat geeignet als impfstoff und hergestellt bei verwendung von n-acryloyliertem polysaccharid |
| HU228499B1 (en) | 1999-03-19 | 2013-03-28 | Smithkline Beecham Biolog | Streptococcus vaccine |
| AU781027B2 (en) | 1999-04-09 | 2005-04-28 | Department Of Health & Human Services | Recombinant toxin a protein carrier for polysaccharide conjugate vaccines |
| DK1897555T3 (da) | 2000-01-17 | 2014-10-13 | Novartis Vaccines & Diagnostic | Kompletteret OMV-vaccine mod meningococcus |
| GB0007432D0 (en) | 2000-03-27 | 2000-05-17 | Microbiological Res Authority | Proteins for use as carriers in conjugate vaccines |
| US6936261B2 (en) | 2000-07-27 | 2005-08-30 | Children's Hospital & Research Center At Oakland | Vaccines for broad spectrum protection against diseases caused by Neisseria meningitidis |
| GB0103170D0 (en) | 2001-02-08 | 2001-03-28 | Smithkline Beecham Biolog | Vaccine composition |
| AU2002309706A1 (en) * | 2001-05-11 | 2002-11-25 | Aventis Pasteur, Inc. | Novel meningitis conjugate vaccine |
| HUE031886T2 (en) * | 2002-10-11 | 2017-08-28 | Glaxosmithkline Biologicals Sa | Polypeptide vaccines for extensive protection against hypervirulent meningococcal lines |
| CA2514328C (en) | 2003-01-30 | 2020-01-14 | Chiron Srl | Injectable vaccines against multiple meningococcal serogroups |
| GB0323103D0 (en) | 2003-10-02 | 2003-11-05 | Chiron Srl | De-acetylated saccharides |
| EP1670506B1 (en) * | 2003-10-02 | 2012-11-21 | Novartis AG | Liquid vaccines for multiple meningococcal serogroups |
| GB0408978D0 (en) | 2004-04-22 | 2004-05-26 | Chiron Srl | Meningococcal fermentation for preparing conjugate vaccines |
| GB0413868D0 (en) * | 2004-06-21 | 2004-07-21 | Chiron Srl | Dimensional anlaysis of saccharide conjugates |
-
2004
- 2004-06-21 GB GBGB0413868.1A patent/GB0413868D0/en not_active Ceased
-
2005
- 2005-06-21 CN CN2005800204436A patent/CN1976725B/zh active Active
- 2005-06-21 ES ES05770612.9T patent/ES2443465T3/es active Active
- 2005-06-21 CA CA2571565A patent/CA2571565C/en active Active
- 2005-06-21 MX MXPA06015188A patent/MXPA06015188A/es active IP Right Grant
- 2005-06-21 EP EP11163751.8A patent/EP2374473B1/en active Active
- 2005-06-21 AU AU2005256961A patent/AU2005256961B2/en active Active
- 2005-06-21 JP JP2007516078A patent/JP2008503716A/ja not_active Withdrawn
- 2005-06-21 US US11/630,545 patent/US8163296B2/en active Active
- 2005-06-21 WO PCT/IB2005/002532 patent/WO2006000920A2/en active Application Filing
- 2005-06-21 NZ NZ552449A patent/NZ552449A/en unknown
- 2005-06-21 ES ES11163751.8T patent/ES2688796T3/es active Active
- 2005-06-21 EP EP05770612.9A patent/EP1778291B1/en active Active
- 2005-06-21 RU RU2007102016/15A patent/RU2422156C2/ru active IP Right Revival
- 2005-06-21 BR BRPI0512281-3A patent/BRPI0512281A/pt not_active Application Discontinuation
-
2006
- 2006-12-20 MX MX2011011568A patent/MX344621B/es unknown
-
2011
- 2011-09-02 JP JP2011192126A patent/JP2011246490A/ja not_active Withdrawn
-
2012
- 2012-04-24 US US13/454,658 patent/US20120207781A1/en not_active Abandoned
-
2014
- 2014-03-11 JP JP2014047555A patent/JP6218327B2/ja active Active
-
2015
- 2015-07-21 JP JP2015143718A patent/JP2015180707A/ja active Pending
-
2017
- 2017-04-21 JP JP2017084454A patent/JP6661568B2/ja active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002058737A2 (en) * | 2001-01-23 | 2002-08-01 | Aventis Pasteur | Multivalent meningococcal polysaccharide-protein conjugate vaccine |
| WO2003007985A2 (en) * | 2001-06-20 | 2003-01-30 | Chiron Srl. | Capsular polysaccharide solubilisation and combination vaccines |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011522252A (ja) * | 2008-05-30 | 2011-07-28 | インターベツト・インターナシヨナル・ベー・ベー | ワクチンの効力および安定性を監視するための分析方法 |
| US11291974B2 (en) | 2009-06-01 | 2022-04-05 | Waters Technologies Corporation | Hybrid inorganic/organic materials having novel surface modification; process for the preparation of inorganic/organic hybrid materials; and use of said particles for chromatographic separations |
| JP2018021929A (ja) * | 2009-12-15 | 2018-02-08 | ウオーターズ・テクノロジーズ・コーポレイシヨン | サイズ排除クロマトグラフィーを行うための装置および方法 |
| JP2013514538A (ja) * | 2009-12-15 | 2013-04-25 | ウオーターズ・テクノロジーズ・コーポレイシヨン | サイズ排除クロマトグラフィーを行うための装置および方法 |
| JP2017014217A (ja) * | 2010-05-26 | 2017-01-19 | セレクタ バイオサイエンシーズ インコーポレーテッドSelecta Biosciences,Inc. | 合成ナノキャリア混合ワクチン |
| JP2018052940A (ja) * | 2010-05-26 | 2018-04-05 | セレクタ バイオサイエンシーズ インコーポレーテッドSelecta Biosciences,Inc. | 多価合成ナノキャリアワクチン |
| US10092893B2 (en) | 2010-07-26 | 2018-10-09 | Waters Technologies Corporation | Superficially porous materials comprising a substantially nonporous hybrid core having narrow particle size distribution; process for the preparation thereof; and use thereof for chromatographic separations |
| US11478775B2 (en) | 2010-07-26 | 2022-10-25 | Waters Technologies Corporation | Superficially porous materials comprising a substantially nonporous hybrid core having narrow particle size distribution |
| KR20200097239A (ko) * | 2017-09-06 | 2020-08-18 | 상하이 그린벨리 파머수티컬 주식회사 | 중량평균 분자량 및 산성 당의 가용성 염의 함량 측정방법 |
| KR102338499B1 (ko) | 2017-09-06 | 2021-12-14 | 상하이 그린벨리 파머수티컬 주식회사 | 중량평균 분자량 및 산성 당의 가용성 염의 함량 측정방법 |
| US11366086B2 (en) | 2017-09-06 | 2022-06-21 | Shanghai Green Valley Pharmaceutical Co., Ltd. | Method for determining weight-average molecular weight and content of soluble salt of acidic carbohydrates |
| JP2021089234A (ja) * | 2019-12-05 | 2021-06-10 | 株式会社島津製作所 | 検出器の出力を補正する方法、および多角度光散乱検出器 |
| JP7409055B2 (ja) | 2019-12-05 | 2024-01-09 | 株式会社島津製作所 | 検出器の出力を補正する方法、および多角度光散乱検出器 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2005256961B2 (en) | 2011-06-23 |
| US8163296B2 (en) | 2012-04-24 |
| GB0413868D0 (en) | 2004-07-21 |
| US20080248059A1 (en) | 2008-10-09 |
| JP2017134084A (ja) | 2017-08-03 |
| JP2014111654A (ja) | 2014-06-19 |
| JP6218327B2 (ja) | 2017-10-25 |
| CA2571565A1 (en) | 2006-01-05 |
| MXPA06015188A (es) | 2007-03-27 |
| EP2374473B1 (en) | 2018-07-18 |
| MX344621B (es) | 2017-01-03 |
| US20120207781A1 (en) | 2012-08-16 |
| NZ552449A (en) | 2010-05-28 |
| CN1976725B (zh) | 2012-08-29 |
| JP2011246490A (ja) | 2011-12-08 |
| EP2374473A1 (en) | 2011-10-12 |
| BRPI0512281A (pt) | 2008-02-26 |
| RU2007102016A (ru) | 2008-07-27 |
| JP2015180707A (ja) | 2015-10-15 |
| CN1976725A (zh) | 2007-06-06 |
| AU2005256961A1 (en) | 2006-01-05 |
| CA2571565C (en) | 2014-08-12 |
| WO2006000920A3 (en) | 2006-03-30 |
| WO2006000920A2 (en) | 2006-01-05 |
| ES2443465T3 (es) | 2014-02-19 |
| EP1778291B1 (en) | 2013-10-30 |
| RU2422156C2 (ru) | 2011-06-27 |
| ES2688796T3 (es) | 2018-11-07 |
| EP1778291A2 (en) | 2007-05-02 |
| JP6661568B2 (ja) | 2020-03-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6661568B2 (ja) | Gpcおよびsec−malsによる結合体化糖の寸法分析 | |
| JP4692852B2 (ja) | 干渉を伴わない糖類ワクチンの分析 | |
| WO2020165711A1 (en) | Neisseria meningitidiscompositions and methods thereof | |
| Biemans et al. | Glycoconjugate vaccines, production and characterization | |
| MXPA06015185A (es) | Disco optico que tiene pluralidad de capas de grabacion y metodo y aparato para grabar datos en el mismo. | |
| US20220401544A1 (en) | Neisseria meningitidis compositions and methods thereof | |
| US20090176311A1 (en) | Separation of conjugated and unconjugated components | |
| CAPANNOLI et al. | Sommaire du brevet 2571565 | |
| RU2780425C2 (ru) | Композиции neisseria meningitidis и способы | |
| CAPANNOLI et al. | Patent 2571565 Summary |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080526 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080526 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110302 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110601 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110608 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110701 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110708 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110801 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110808 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110902 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120601 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20120719 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20120817 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140110 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140116 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140210 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140214 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20140311 |