RU2389501C2 - Применение модифицированных циклоспоринов для лечения заболеваний, вызванных hcv - Google Patents
Применение модифицированных циклоспоринов для лечения заболеваний, вызванных hcv Download PDFInfo
- Publication number
- RU2389501C2 RU2389501C2 RU2006110533/15A RU2006110533A RU2389501C2 RU 2389501 C2 RU2389501 C2 RU 2389501C2 RU 2006110533/15 A RU2006110533/15 A RU 2006110533/15A RU 2006110533 A RU2006110533 A RU 2006110533A RU 2389501 C2 RU2389501 C2 RU 2389501C2
- Authority
- RU
- Russia
- Prior art keywords
- cyclosporin
- hcv
- cyclosporine
- pharmaceutical composition
- use according
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
- A61K38/13—Cyclosporins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Virology (AREA)
- Molecular Biology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Abstract
Предложено применение циклоспорина для приготовления фармацевтической композиции, предназначенной для профилактики или лечения связанных с гепатитом С инфекций или индуцируемых HCV нарушений, где циклоспорин (а) связывается с человеческим рекомбинантным циклофилином, при этом константа связывания (КС) составляет менее 0,7, где КС представляет собой десятичный логарифм отношения значения ! IC50 циклоспорина и значения IC50 циклоспорина А в проводимом одновременно эксперименте при оценке с помощью конкурентного анализа ELISA; и (б) обладает активностью в реакции лимфоцитов в смешанной культуре, составляющей не более 5% по сравнению с активностью циклоспорина А, где циклоспорином является [MeIle]циклоспорин или соединение формулы I (варианты). Показано: заявленные соединения ингибируют HCV и при лечении не подавляют иммунную систему, могут использоваться в комбинации с другими сопутствующими агентами, имеющими анти- HCV-активность. 2 н. и 10 з.п. ф-лы, 2 ил.
Description
Настоящее изобретение относится к новому применению неиммуносупрессорных циклоспоринов.
Циклоспорины представляют собой класс отличающихся характерной структурой циклических поли-N-метилированных ундекапептидов, которые, как правило, обладают фармакологической, в частности иммуносупрессорной или противовоспалительной активностью. Первый из выделенных циклоспоринов представлял собой встречающийся в естественных условиях в грибах метаболит Ciclosporine или Cyclosporine, обозначаемый также как циклоспорин А.
Хорошо известно, что действие циклоспорина А обусловлено его влиянием на процесс Т-клеточной активации посредством блокады инициации транскрипции IL-2. Установлено, что циклоспорин А образует комплекс с цитозольным белком массой 17 кДа, называемым циклофилином, это происходит во многих типах клеток и, как известно, идентично действию пептидил-пролил-цис-транс-изомеразы, фермента, участвующего в осуществлении укладки белка.
Однако установлено, что связывание с циклофилином является необходимым, но недостаточным критерием для проявления иммуносупрессорной активности. Комплекс циклоспорин А/циклофилин может также связываться с клеточным белком, принадлежащим к суперсемейству фосфатаз, который называют кальцинеурином (CN). Связывание устраняет его фосфатазную активность, что приводит к «молчанию» фактора транскрипции NF-AT. Ингибирование пути CN/NF-AT является основным механизмом опосредуемой циклоспорином А иммуносупрессии.
Выявлены циклоспорины, которые характеризуются способностью связываться с высокой аффинностью с циклофилином, но не обладают иммуносупрессорной активностью. Считается, что циклоспорин не обладает иммуносупрессорным действием, если его активность в реакции лимфоцитов в смешанной культуре (MLR) составляет не более 5%, предпочтительно не более 2%, от активности циклоспорина А. Реакция лимфоцитов в смешанной культуре описана у Т. Мео в «Immunological Methods», под ред. L.Lefkovits и В.Peris, изд-во Academic Press, N.Y., 1979, сс.227-239. Клетки (0,5×106) селезенки мышей линии Balb/c (8-10-недельные самки) совместно инкубируют в течение 5 дней с облученными (2000 рад) или обработанными митомицином С клетками (0,5×106) селезенки мышей линии СВА (8-10-недельные самки). Облученные аллогенные клетки индуцируют пролиферативаный ответ в клетках селезенки мышей линии Balb/c, который можно оценить с помощью меченого предшественника, включенного в ДНК. Поскольку клетки-стимуляторы облучены (или обработаны митомицином С), они не отвечают на Balb/c-клетки пролиферативным ответом, но сохраняют свои антигенные свойства. Значение IC50, полученное для тестируемого соединения в MLR, сравнимо со значением IC50 для циклоспосрина А, полученным в параллельном эксперименте. Кроме того, у неиммуносупрессорных цикслоспоринов отсутствует способность ингибировать CN и последующий путь NF-AT.
В ЕР 0484281 А1 описано применение неиммуносупрессорных циклоспоринов для лечения СПИДа или связанных со СПИДом нарушений.
При создании изобретения неожиданно было установлено, что неиммуносупрессорные циклоспорины, которые связываются с циклофилином, оказывают ингибирующее действие на вирус гепатита С (HCV).
Считается, что персистентное заражение HCV, которое, как установлено, является основным этиологическим фактором гепатита не-А, не-В, тесно связано с болезнями печени, таким как хронический гепатит, цирроз печени и гепатоцеллюлярная карцинома. Развитие таких болезней печени является одной из основных проблем здравоохранения. Эффективная анти-HCV-терапия ограничена применением интерферона или комбинации интерферона и рибавирина. Однако поскольку при лечении с использованием указанных известных агентов примерно у половины зараженных HCV пациентов не происходит элиминация вируса из организма, все еще существует выраженная необходимость в альтернативных агентах, обладающих активностью в отношении HCV.
Таким образом, в настоящем изобретении предложено применение неиммуносупрессорного связывающегося с циклофилином циклоспорина для профилактики или лечения связанных с гепатитом С инфекций или индуцируемых HCV нарушений.
Связанные с гепатитом С инфекции или индуцируемые HCV нарушения представляют собой, например, хронический гепатит, цирроз печени или рак печени, например гепатоцеллюлярную карциному. Неиммуносупрессорные связывающиеся с циклофилином циклоспорины можно применять также, например, для профилактической обработки новорожденных детей матерей, зараженных HCV, или медицинских работников, имеющих контакт с вирусом, или реципиентов трансплантатов, например реципиентов трансплантатов органа или ткани, например трансплантата печени, для ликвидации возможного повторного заражения HCV после трансплантации.
Считается, что циклоспорин связывается с циклофилином, если его связывание с человеческим рекомбинантным циклофилином составляет, по меньшей мере, 1/5 по сравнению со связыванием циклоспорина А при оценке с помощью конкурентного анализа ELISA, описанного у Quesniaux в Eur. J. Immunol., 17, 1987, cc.1359-1365. В этом анализе циклоспорин, подлежащий тестированию, вносят в процессе инкубации циклофилина с сенсибилизированным БСА-циклоспорином и рассчитывают концентрацию, необходимую для 50%-ного ингибирования контрольной реакции без конкурирующего агента (IC50). Результаты выражают в виде коэффициента связывания (КС), который представляет собой десятичный логарифм (log) отношения значения IC50 тестируемого соединения и значения IC50, полученного в параллельном опыте с использованием только циклоспорина А. Так, значение КС, равное 1,0, свидетельствует о том, что тестируемое соединение связывается с человеческим циклофилином в 10 раз слабее, чем циклоспорин А, а отрицательное значение свидетельствует о более сильном связывании по сравнению с циклоспорином А. Циклоспорины, обладающие активностью в отношении HCV, характеризуются значением КС ниже 0,7, предпочтительно равным нулю или ниже нуля.
Примерами неиммуносупрессорных связывающихся с циклофилином циклоспоринов являются, например, соединения формулы 1
в которой
W обозначает MeBmt, дигидро-MeBmt, 8'-гидрокси-МeВmt или O-ацетил-MeBmt1,
Х обозначает αAbu, Val, Thr, Nva или O-метилтреонин (MeOThr),
R обозначает Pro, Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(О-ацетил),
Y обозначает MeLeu, тиоMeLeu, γ-гидрокси-MeLeu, MeIle, MeVal, MeThr, MeAla, MeaIle или MeaThr; N-этилVal, N-этилIlе, N-этилThr, N-этилРhе, N-этилTyr или N-этилThr(О-ацетил),
Z обозначает Val, Leu, MeVal или MeLeu,
Q обозначает MeLeu, γ-гидрокси-MeLeu, MeAla или Pro,
T1 обозначает (D)Ala или Lys,
T2 обозначает MeLeu или γ-гидрокси-MeLeu и
Т3 обозначает MeLeu или MeAla.
Предпочтительными соединениями формулы 1 являются, например, соединения формулы Ia
в которой
W' обозначает MeBmt, дигидро-MeBmt или 8'-гидрокси-MeBmt,
Х обозначает αAbu, Val, Thr, Nva или O-метил треонин (MeOThr),
R' обозначает Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(O-ацетил),
Y' обозначает MeLeu, γ-гидрокси-MeLeu, MeIle, MeVal, MeThr, MeAla, MeaIle или MeaThr, N-этилVal, N-этилIlе, N-этилThr, N-этилРhe, N-этилTyr или N-этилТhr (О-ацетил)
Z обозначает Val, Leu, MeVal или MeLeu и
Q' обозначает MeLeu, γ-гидрокси-MeLeu или MeAla.
Группы W', X, Y', Z, Q' и R' независимо друг от друга имеют следующие предпочтительные значения:
W' предпочтительно обозначает W'', где W'' обозначает MeBmt или дигидро-MeBmt,
Х предпочтительно обозначает X', где X' обозначает αAbu или Nva, более предпочтительно X'', где X'' обозначает αAbu,
R' предпочтительно обозначает R'', где R'' обозначает Sar,
Y' предпочтительно обозначает Y'', где Y'' обозначает γ-гидрокси-MeLeu, MeVal, MeThr, MeIle, N-этилIlе или N-этилVal,
Z предпочтительно обозначает Z', где Z' обозначает Val или MeVal, и Q' предпочтительно обозначает Q'', где Q'' обозначает MeLeu.
Предпочтительная группа соединений формулы Ia представляет собой соединения, в которых W' обозначает W”, Х обозначает X', Y' обозначает Y”, Z обозначает Z', Q' обозначает Q” и R' обозначает R”.
Примерами предпочтительных соединений формулы Ia являются, например:
а) [дигидро-MeBmt]1-[γ-гидрокси-MeLeu]4-циклоспорин; КС*=0,1; IR<1%,
б) [MeVal]4-циклоспорин; КС=0,1; IR<1%,
в) [MeIle]4-циклоспорин; КС=-0,2; IR<1%,
г) [MeThr]4-циклоспорин,
д) [γ-гидрокси-MeLeu]4-циклоспорин; КС=0,4; IR<1%,
4е) [этил-Ile]4-циклоспорин; КС=0,1; IR<2%,
ж) [этил-Val]4-циклоспорин; КС=0; IR<2%,
з) [Nva]2-[γ-гидрокси-MeLeu]4-циклоспорин,
и) [γ-гидрокси-MeLeu]4-[γ-гидрокси-MeLeu]6-циклоспорин,
к) [MeVal]5-циклоспорин; КС=0,4; IR=5,3%,
л) [MeOThr]2-[(D)MeAla]3-[MeVal]5-циклоспорин,
м) [8'-гидрокси-MeBmt]1-циклоспорин; КС=0,35; IR=1,8%,
н) [MeAla]6-циклоспорин; КС=-0,4; IR=3,2,
о) [γ-гидрокси-MeLeu]9-циклоспорин; КС=0,15; IR=2,9.
IR обозначает иммуносупрессорный коэффициент, выраженный в виде процента активности относительно активности циклоспорина А.
Дополнительными примерами неиммуносупрессорных циклоспоринов являются соединения, описанные в WO 98/28330, WO 98/28329 и WO 98/28328, содержание которых включено в настоящее описание в качестве ссылок, например, соединения формулы II
в которой
Wa обозначает
где Ra обозначает остаток формулы Ic или Id
в которой R4 обозначает С1-С4алкилтиогруппу, аминоС1-С4алкилтиогруппу, С1-С4алкиламино-С1-С4алкилтиогруппу, диС1-С4алкиламино-С1-С4алкилтиогруппу, пиримидинилтиогруппу, тиазолилтиогруппу, N-C1-С4алкилимидазолилтиогруппу, гидроксиС1-4алкилфенилтиогруппу, гидроксиС1-4алкилфеноксигруппу, нитрофениламиногруппу или 2-оксопиримидин-1-ил, и R'4 обозначает С1-C4алкил,
Ха обозначает Abu;
Ra обозначает -NMe-CH(Rb)-CO-, где Rb обозначает Н или -S-Alk-R0, где Alk-R0 обозначает метил; или Alk обозначает С2-С6алкилен или С3-С6циклоалкилен с прямой или разветвленной цепью и R0 обозначает Н; ОН; СООН; С2-С5алкоксикарбонил; NR1R2, где R1 и R2 каждый независимо друг от друга выбран из ряда, включающего Н, С1-С4алкил, С2-С4алкенил, С3-С6циклоалкил и фенил, каждый из которых необязательно замещен галогеном, С1-С4алкоксигруппой, С2-С5алкоксикарбонилом, аминогруппой, С1-С4алкиламиногруппой и/или диС1-С4алкиламиногруппой, и бензильный и гетероциклический радикал, где бензильные и гетероциклические радикалы могут быть насыщенными или ненасыщенными и содержат 5 или 6 кольцевых членов и 1-3 гетероатома, или R1 и R2 вместе с атомом азота, с которым они связаны, образуют 4-6-членный гетероцикл, который может содержать другой гетероатом, выбранный из азота, кислорода и серы, и который необязательно может быть замещен С1-С4алкилом, фенилом или бензилом; или R1 и R2 каждый независимо друг от друга обозначает радикал формулы Ib
в которой R1 и R2 имеют указанные выше значения, R3 обозначает Н или С1-С4алкил и n обозначает целое число от 2 до 4,
Ya обозначает MeLeu или γ-гидрокси-MeLeu,
Za обозначает Val, и
Qa обозначает MeLeu,
при условии, что Rb не обозначает Н, когда Ya обозначает MeLeu, или их фармацевтически приемлемые соли.
В формуле II, когда R1 и/или R2 обозначает гетероциклический остаток, то он может представлять собой пиридил, тетрагидропиридил, пиперидил, имидазолил, оксазолил или тиазолил. Когда R1 и R2 образуют гетероциклический остаток с атомом азота, с которым они связаны, то гетероциклический остаток может представлять собой, например, азетидинил, пиперидил, пиперазинил, N-метилпиперазинил, N-фенилпиперазинил, N-бензилпиперазинил, пиридил, имидазолил, морфолиногруппу, тиоморфолиногруппу, тетрагидропиридил, метилтетрагидропиридил (например, 4-метилтетрагидропиридил) или фенилтетрагидропиридил (например,
4-фенилтетрагидропиридил).
Соединения формулы I, Ia или II можно получать различными путями, которые можно классифицировать как:
1) ферментация
2) биотрансформация
3) дериватизация
4) частичный синтез
5) полный синтез,
согласно методам, описанным в ЕР 0484281 A1, WO 00/01715, WO 98/28330, WO 98/28329 или WO 98/28328, содержание которых включено в настоящее описание в качестве ссылки.
В числе дополнительных конкретных или альтернативных вариантов осуществления в настоящем изобретении предложены также:
1.1 Способ профилактики или лечения связанных с гепатитом С инфекций или индуцируемых HCV нарушений у нуждающегося в этом индивидуума, заключающийся в том, что индивидууму вводят терапевтически эффективное количество неиммуносупрессорного связывающегося с циклофилином циклоспорина, например, соединения формулы I, Ia или II.
Согласно изобретению неиммуносупрессорный связывающийся с циклофилином циклоспорин можно вводить в количестве, эффективном для облегчения или элиминации одного или нескольких признаков или симптомов гепатита С, например эффективном для снижения уровня РНК HCV, обнаруженной в образце сыворотки индивидуума.
1.2 Способ ингибирования репликации HCV в среде, заключающийся в том, что в эту среду вносят эффективное количество неиммуносупрессорного связывающегося с циклофилином циклоспорина, например, соединения формулы I, Ia или II.
1.3 Способ ингибирования репликации HCV в организме нуждающегося в этом пациента, заключающийся в том, что индивидууму вводят терапевтически эффективное количество неиммуносупрессорного связывающегося с циклофилином циклоспорина, например, соединения формулы I, Ia или II.
1.4.Способ профилактики повторного заражения HCV нуждающегося в этом реципиента трансплантата, заключающийся в том, что реципиенту вводят терапевтически эффективное количество неиммуносупрессорного связывающегося с цнклофилином циклоспорина, например, соединения формулы I, Ia или II.
2. Применение неиммуносупрессорного связывающегося с циклофилином циклоспорина, например, соединения формулы I, Ia или II, для приготовления фармацевтической композиции, предназначенной для применения в любом из указанных выше способов.
3. Фармацевтическая композиция, предназначенная для применения в любом из указанных выше способов, которая содержит неиммуносупрессорный связывающийся с циклофилином циклоспорин, например, соединения формулы I, Ia или II, в сочетании с одним или несколькими фармацевтически-приемлемыми разбавителями или носителями.
Применимость неиммуносупрессорных связывающихся с циклофилином циклоспоринов (далее обозначены как «циклоспорины, предлагаемые в изобретении») для лечения указанных выше болезней и состояний можно продемонстрировать с помощью стандартных опытов на животных или клинических опытов, например, с использованием описанных ниже методик.
А. In vitro
Клеточная культура: Клетки линии Huh-7 и МН-14, т.е. клетки, несущие репликон HCV, культивируют в модифицированной по способу Дульбекко среде Игла (DMEM) с добавлением 10% сыворотки плода коровы (FBS). Клетки линии РН5СН8 культивируют в смеси 1:1 среды DMEM и среды F12, дополненной 100 нг/мл эпидермального фактора роста, 10 мкг/мл инсулина, 0,36 мкг/мл гидрокортизона, 5 мкг/мл трансферрина, 5 мкг/мл линолевой кислоты, 20 нг/мл селена, 4 мкг/мл глюкагона, 10 нг/мл пролактина, 10 мкг/мл гентамицина, 200 мкг/мл канамицина и 2% FBS.
Анализ методом иммуноблоттинга: Анализ методом иммуноблоттинга осуществляют согласно методике, описанной у К.Watashi и др. в Virology, т.286, 2001, сс.391-402. В качестве первичных антител в этом эксперименте используют антитела к NS5A, антитела к NS5B и антитела к b-актину (фирма Sigma).
Непрямой иммунофлуоресцентный анализ: Непрямой иммунофлуоресцентный анализ осуществляют согласно методике, описанной у К.Watashi, выше. В качестве первичных антител в этом эксперименте используют антитела к NS5A и антитела к PDI (фирма StressGen).
Анализ с помощью полимеразной цепной реакции (ПЦР) с обратной транскрипцией (OT)
Общую РНК культивируемых клеток выделяют с помощью Sepasol-RNA I Super (фирма Nacalai Tesque) согласно рекомендациям производителя. ОТ-ПЦР-анализ осуществляют, используя набор для одноступенчатой ПЦР РНК (фирма Takara) согласно указаниям производителя. Праймеры, которые применяют для обнаружения мРНК 2',5'-олигоаденилатсинтетазы и зависящей от двухцепочечной РНК протеинкиназы, представляют собой 5'-CCGTGAAGTTTGAGGTCCAG-3', 5'-GACTAATTCCAAGACCGTCCG-3' и 5'-TGGCCGCTAAACTTGCATATC-3', 5'-GCGAGTGTGCTGGTCACTAAAG-3' соответственно.
Анализ методом Нозерн-блоттинга: Анализ методом Нозерн-блоттинга осуществляют согласно методике, описанной у Н.Kishine и др. в Biochem. Biophys. Res. Commun., 47, 2002, сс.119-125. Применяемый в этом эксперименте зонд, комплементарный последовательности NS5B, описан у Н.Kishine, выше.
ПЦР-анализ в реальном времени: 5'-UTR геномной РНК HCV оценивают количественно с помощью секвенатора типа ABI PRISM 7700 (фирма AppliedBiosystems) согласно методу, описанному у Т.Takeuchi и др., Gastroenterology, т.116, 1999, сс.636-642. Применяемые в этом эксперименте «прямой» и «обратный» праймеры представляют собой 5'-CGGGAGAGCCATAGTGG-3' и 5'-AGTACCACAAGGCCTTTCG-3' соответственно. Флуорогенный зонд представляет собой 5'-CTGCGGAACCGGTGAGTACAC-3'. В качестве внутреннего контроля также осуществляют количественную оценку рибосомной РНК с помощью реагентов для контроля рибосомной РНК (TaqMan Ribosomal RNA Control Reagents) (фирма Applied Biosystems).
Эксперимент по заражению HCV in vitro: Эксперимент по заражению HCV in vitro осуществляют в основном согласно методу, описанному у N.Kato и др. в Jpn. J.Cancer Res., т.87, 1996, cc.787-792 и у М. Ikada и др. в Virus Res., т.56, 1996, сс.157-167. Клетки линии РН5СН8 (1×105) заражают плазмой 1В-2 (эквивалент 104-105 копий РНК HCV), которую получают из HCV-позитивной донорской крови. Через 24 ч после инокуляции клетки трижды промывают забуференным фосфатом физиологическим раствором (ЗФР) и поддерживают в свежей среде.
Трансфекция и репортерный анализ: Трансфекцию клеток линий МН-14 и Н9 осуществляют с использованием реагента для трансфекции FuGENE 6 (фирма Rochе) и липофектамина 2000 (фирма Invitrogen) соответственно согласно протоколу производителя. Репортерный анализ осуществляют согласно методу, описанному у K.Watashi, выше. Применяемые в этом опыте репортерные плазмиды представляют собой pNFAT-Luc, pAPl-Luc, pNFKB-Luc (система PathDetect Reporter System; фирма Stratagcne) и pRL-TK (система для двойного репортерного анализа люциферазы (Dual-luciferase reporter assay system); фирма Promega).
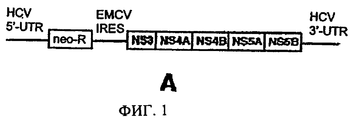
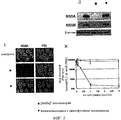
Воздействие различных циклоспоринов, предлагаемых в изобретении, на репликацию генома HCV изучают с использованием клеток линии МН-14, в которых происходит автономная репликация субгеномного репликона HCV, представленного на фиг.1А. Обработка циклоспорином, предлагаемым в изобретении, например, [MeIle]4-циклоспорином, например, в концентрации 1 мкг/мл, а также 100 ед./мл IFNα, который используют в качестве положительного контроля, в течение 7 дней приводит к снижению количества белков NS5A и NS5B HCV до уровней, которые нельзя обнаружить с помощью анализа методом иммуноблоттинга. С помощью непрямого иммунофлуоресцентного анализа установлено, что производство белка NS5A снижается во всех клетках, обработанных 1 мкг/мл циклоспорина, предлагаемого в изобретении, в то время как уровень протеиндисульфидизомеразы (PDI), которая является маркером эндоплазматического ретикулума, представляющей собой внутренний контроль, в этих условиях не изменяется. В этом анализе циклоспорины, предлагаемые в изобретении, снижают экспрессию белка HCV в клетках, несущих репликон HCV.
РНК репликона анализируют с помощью Нозерн-блоттинга в клетках линии МН-14, обработанных циклоспорином, предлагаемым в изобретении, или IFNα или обоими агентами в течение 7 дней. Обработка, например, 1 мкг/мл циклоспорина, предлагаемого в изобретении, например [MeIle]4-циклоспорина, снижает количество РНК репликона до уровня ниже обнаруживаемого. Обработка 100 ед./мл IFNα вызывает аналогичное действие. Кроме того, к 7-му дню титр постепенно снижается и концентрация РНК HCV снижается до уровня, составляющего примерно 1/400 от исходного. В случае совместной обработки с IFNα происходит дополнительное снижение в любой момент времени, когда проводят оценку (3-й, 5-й и 7-й день) по сравнению с обработкой только циклоспорином или IFNα: уровень РНК репликона в клетках линии МН-14, обработанных и циклоспорином, и IFNα в течение 7 дней, в значительной степени снижается по сравнению с уровнем в клетках, обработанных только IFNα.
Кроме того, клетки линии РН5СН8 (ненеопластическая линия гепатоцитов) обрабатывают HCV-позитивной плазмой, а затем количественно определяют с помощью ОТ-ПЦР в реальном времени титр геномной РНК HCV в различные моменты времени после инокуляции. В то время как титр геномной РНК HCV в клетках на 5-й день после инокуляции повышается примерно в 10 раз по сравнению с первым днем, в эти же моменты времени заметного повышения титра геномной РНК HCV не обнаружено в клетках, непрерывно обрабатываемых циклоспорином, предлагаемым в изобретении, например [MeIle]4-циклоспорином, или IFNα. Циклоспорины, предлагаемые в изобретении, ингибируют репликацию HCV в культуре зараженных гепатоцитов.
Результаты представлены на фиг.2Д, 2Е и 2Ж: анализ методом иммуноблоттинга (2Д), непрямой иммунофлуоресцентный анализ (2Е) и анализ методом ОТ-ПЦР в реальном времени (2Ж) осуществляют с использованием клеток линии МН-14, обработанных [MeIle]4-циклоспорином (■) или несвязывающимся с циклофилином циклоспорином (•), например 6-[[R-(E)]-6,7-дидегидро-N,4-диметил-3-оксо-L-2-аминооктановая кислота]-7-L-валинциклоспорином А. Контроль на фиг.2Д и 2Е (1-й ряд), без обработки; CysA на фиг.2Д, 1 мг/мл; [MeIle]4-циклоспорин на фиг.2Д (■) и 2Е (■), 1 мг/мл; несвязывающийся с циклофилином циклоспорин на фиг.2Д (•) и 2Е (•), 1 мг/мл.
Б. Клинический опыт
Всего в опыте, который проводили в течение 2 недель, участвовали 15 пациентов, страдающих хроническим гепатитом С. Каждому пациенту вводили циклоспорин, предлагаемый в изобретении, например [MeIle]4-циклоспорин, в дозе 7-15 мг/кг р.о. Уровни в сыворотке антигенов вируса гепатита С у каждого пациента определяли в день 0 и день 14.
У пациента, страдающего гепатитом С, в частности хроническим гепатитом, вызываемым HCV, может проявляться один или несколько из следующих признаков или симптомов: (а) повышенный уровень АЛТ (аланинаминотрансфераза), (б) положительный ответ на антитела к HCV, (в) присутствие HCV, продемонстрированное положительным ответом на РНК HCV, (г) клинические характерные признаки хронического заболевания печени, (д) гепатоцеллюлярное поражение. Указанные критерии можно использовать не только для диагностики гепатита С, но их можно применять также для оценки ответа пациента на лечение лекарственным средством.
Известно, что для гепатита С при отсутствии лечения характерны повышенные уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT) и полным ответом на лечение, как правило, считается нормализация этих сывороточных ферментов, прежде всего АЛТ (Davs и др., New Eng. J. Mcd., т.321, 1989, сс.1501-1506). АЛТ представляет собой фермент, который высвобождается, когда разрушаются клетки печени, и он является симптоматическим признаком заражения HCV.
Для оценки изменения репликации HCV у пациентов при лечении лекарственным средством можно измерять уровень РНК HCV в образцах сыворотки, например, с помощью групповой полимеразной цепной реакции, в которой применяют два набора праймеров, выведенных из неструктурных генных областей N53 и N54 генома HCV (Farci и др.. New Eng. J. Med., т.325, 1991, cc.98-104, Ulrich и др., J. din. Invest., т.86, 1990, cc.1609-1614).
Гистологическую оценку полученных с помощью биопсии образцов печени можно использовать в качестве второго критерия оценки (см., например, Knodell и др., Hepatology, т.1, 1981, cc.431-435, авторы предложили индекс гистологической активности (воспаление воротной вены, частичный некроз или некроз межклеточных мостиков, поражение долек и фиброз), представляющий собой балльную систему для оценки активности заболевания).
Суточные дозы, необходимые при воплощении на практике настоящего изобретения, могут варьироваться в зависимости, например, от применяемого неиммуносупрессорного связывающегося с циклофилином циклоспорина, хозяина, пути введения, серьезности состояния, подлежащего лечению. Предпочтительные суточные дозы составляют примерно от 1 до 50 мг/кг в день при использовании в виде однократной дозы или разделенных доз. Приемлемые суточные дозы для пациентов находятся в диапазоне, например, 1-20 мг/кг р.о. или i.v. Приемлемые формы стандартных доз для орального введения содержат примерно от 0,25 до 10 мг/кг действующего вещества, например, [MeIle]4-циклоспорина, в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или носителями.
Циклоспорины, предлагаемые в изобретении, можно вводить любым общепринятым путем, в частности энтерально, например орально, например в форме растворов для питья, таблеток или капсул, или парентерально, например в форме инъецируемых растворов или суспензий. Предпочтительными фармацевтическими композициями могут быть, например, композиции на основе микроэмульсий, описанные в UK 2222770 А.
Циклоспорины, предлагаемые в изобретении, можно вводить в виде единственного ингредиента или в сочетании с другими лекарственными средствами, например с лекарственными средствами, обладающими активностью в отношении HCV, такими как интерферон, например интерферон-α-2а или интерферон-α-2b, например IntronR, RoferonR, AvonexR, RebifR или BetaferonR, или интерферон, конъюгированный с водорастворимым полимером или человеческим альбумином, таким, например, как альбуферон, противовирусным агентом, таким, например, как рибавирин, ламивудин, NV08 или NM283, ингибитором кодируемых HCV факторов типа NS3/4А-протеазы, хеликазы или РНК-полимеразы, или пролекарством такого ингибитора, антифиброзным агентом, например N-фенил-2-пиримидинаминным производным, таким, например, как иматиниб, иммуномодулятором, таким, например, как микофенольная кислота, или ее соль или пролекарство, например, микофенолят натрия или микофенолят мофетила, или агонистом рецептора S1P, таким, например, как FTY720 или его аналог, необязательно фосфорилированный, например, с агентами, которые описаны в ЕР 627406 А1, ЕР 778263 А1, ЕР 1002792 А1, WO 02/18395, WO 02/76995, WO 02/06268, JP 2002316985, WO 03/29184, WO 03/29205, WO 03/62252 и WO 03/62248.
Подразумевается, что конъюгаты интерферона с водорастворимым полимером прежде всего представляют собой конъюгаты с гомополимерами полиалкиленоксида, такими как полиэтиленгликоль (ПЭГ) или полипропиленгликоли, полиоксиэтилированные полиолы, их сополимеры и блок-сополимеры. В качестве альтернативы полимерам на основе полиалкиленоксидов можно применять не обладающие антигенной эффективностью материалы, такие как декстран, поливинилпирролидоны, полиакриламиды, поливиниловые спирты, полимеры на основе углеводов и т.п. Такие конъюгаты интерферон-полимер описаны в US 4766106, 4917888, заявке на европейский патент 0236987, заявке на европейский патент 0510356 и в опубликованной международной заявке на патент WO 95/13090. Поскольку связанная с введением полимера модификация существенно снижает антигенные ответы, отсутствует необходимость в том, чтобы чужеродный антиген был полностью аутологичным. Интерфероны, которые применяют для создания конъюгатов с полимерами, можно получать из экстрактов из организма млекопитающих, например человеческий интерферон, интерферон жвачных животных или бычий интерферон, или их можно получать рекомбинантно. Предпочтительными являются конъюгаты интерферона с полиэтиленгликолем, которые известны также как пэгилированные интерфероны.
Особенно предпочтительными конъюгатами интерферона являются пэгилированные альфа-интерфероны, например пэгилированный интерферон-α-2а, пэгилированный интерферон-α-2b; пэгилированный консенсусный интерферон или пэгилированный продукт очищенного интерферона-α. Пэгилированный интерферон-α-2а описан в ЕР 593868, и он поступает в продажу, например, под товарным знаком PEGASYS® (фирма Hoffmann-La Roche). Пэгилированный интерферон-α-2b описан, например, в ЕР 975369, и он поступает в продажу, например, под товарным знаком PEG-INTRON А® (фирма Sobering Plough). Пэгилированный консенсусный интерферон описан в WO 96/11953. Предпочтительными пэгилированными интерферонами являются пэгилированный интерферон-α-2а и пэгилированный интерферон-α-2b. Также предпочтительным является пэгилированный консенсусный интерферон.
Суточные дозы применяемого сопутствующего агента могут варьироваться в зависимости, например, от применяемого соединения, хозяина, пути введения и серьезности заболевания, подлежащего лечению. Например, ламивудин можно применять в суточной дозе 100 мг. Пэгилированный интерферон можно вводить парентерально 1-3 раза в неделю, предпочтительно 1 раз в неделю, в общей недельной дозе 2-10 миллионов ME, более предпочтительно 5-10 миллионов ME, наиболее предпочтительно 8-10 миллионов ME.
Согласно вышеизложенному объектами настоящего изобретения являются также:
4. Фармацевтическая комбинация, содержащая а) первый агент, который представляет собой неиммуносупрессорный связывающийся с циклофилином циклоспорин, например соединение формулы I, Ia или II, и б) сопутствующий агент, например второе указанное выше лекарственное средство, например, для применения согласно описанному выше способу.
5. Указанный выше способ, заключающийся в том, что совместно вводят, например, одновременно или последовательно, терапевтически эффективное количество неиммуносупрессорного связывающегося с циклофилином циклоспорина, например, соединения формулы I, Ia или II, и сопутствующего агента, например указанного выше второго лекарственного средства.
Понятия «совместное введение» или «комбинированное введение» или т.п. в контексте настоящего описания означают введение выбранных терапевтических агентов одному пациенту и подразумевается, что они включают схемы введения, при которых агенты необязательно применять с помощью одного и того же пути введения или в одно и то же время.
Применение фармацевтической комбинации, предлагаемой в изобретении, обеспечивает полезное действие, например синергетическое терапевтическое действие, по сравнению с монотерапией, основанной на применении только одного из этих фармацевтических действующих веществ. Предпочтительная синергетическая комбинация представляет собой комбинацию неиммуносупрессорного связывающегося с циклофилином циклоспорина и интерферона, необязательно конъюгированного с полимером.
Еще одна предпочтительная комбинация представляет собой комбинацию неиммуносупрессорного связывающегося с циклофилином циклоспорина с микофенольной кислотой или ее солью или пролекарством, или с агонистом рецептора S1P, например FTY720.
[MeIle]4-циклоспорин или [MeVal]4-циклоспорин представляет собой предпочтительный неиммуносупрессорный связывающийся с циклофилином циклоспорин для применения согласно изобретению.
Claims (12)
1. Применение циклоспорина для приготовления фармацевтической композиции, предназначенной для профилактики или лечения связанных с гепатитом С инфекций или индуцируемых HCV нарушений, где циклоспорин (а) связывается с человеческим рекомбинантным циклофилином, при этом константа связывания (КС) составляет менее 0,7, где КС представляет собой десятичный логарифим отношения значения IC50 циклоспорина и значения IC50 циклоспорина А в проводимом одновременно эксперименте при оценке с помощью конкурентного анализа ELISA; и (б) обладает активностью в реакции лимфоцитов в смешанной культуре, составляющую не более 5% по сравнению с активностью циклоспорина А, в котором циклоспорин представляет собой соединение формулы I
в которой W обозначает MeBmt, дигидро-MeBmt или 8'-гидрокси-MeBmt,
Х обозначает αAbu, Val, Thr, Nva или О-метил треонин (MeOThr),
R' обозначает Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(О-ацетил),
Y' обозначает MeLeu, γ-гидрокси-MeLeu, McIle, MeVal, MeThr, MeAla, MeaIle или MeaThr; N-этилVаl, N-этилIlе, N-этилThr, N-этилPhe, N-этилTyr
или N-этилThr(О-ацетил),
Z обозначает Val, Leu, MeVal или MeLeu и
Q' обозначает MeLeu, γ-гидрокси-MeLeu или MeAla, или его фармацевтически приемлемые соли.
в которой W обозначает MeBmt, дигидро-MeBmt или 8'-гидрокси-MeBmt,
Х обозначает αAbu, Val, Thr, Nva или О-метил треонин (MeOThr),
R' обозначает Sar, (D)-MeSer, (D)-MeAla или (D)-MeSer(О-ацетил),
Y' обозначает MeLeu, γ-гидрокси-MeLeu, McIle, MeVal, MeThr, MeAla, MeaIle или MeaThr; N-этилVаl, N-этилIlе, N-этилThr, N-этилPhe, N-этилTyr
или N-этилThr(О-ацетил),
Z обозначает Val, Leu, MeVal или MeLeu и
Q' обозначает MeLeu, γ-гидрокси-MeLeu или MeAla, или его фармацевтически приемлемые соли.
2. Применение по п.1 для приготовления фармацевтической композиции для ингибирования репликации HCV.
3. Применение по п.1 для приготовления фармацевтической композиции, предназначенной для профилактики повторного заражения HCV у реципиента трансплантата.
4. Применение по п.1, где фармацевтическая композиция содержит циклоспорин в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или носителями.
5. Применение по п.1, где фармацевтическая композиция является фармацевтической комбинацией, которая содержит а) первый агент, который представляет собой циклоспорин, и б) сопутствующий агент, выбран из агентов, обладающих активностью в отношении HCV, антифиброзного агента, иммуномодулятора или агониста рецептора S1P.
6. Применение по п.5, где сопутствующий агент является сопутствующим агентом, обладающим активностью в отношении HCV.
7. Применение циклоспорина для приготовления фармацевтической композиции, предназначенной для профилактики или лечения связанных с гепатитом С инфекций или индуцируемых HCV нарушений, где циклоспорин (а) связывается с человеческим рекомбинантным циклофилином, при этом константа связывания (КС) составляет менее 0,7, где КС представляет собой десятичный логарифим отношения значения IC50 циклоспорина и значения IC50 циклоспорина А в проводимом одновременно эксперименте при оценке с помощью конкурентного анализа ELISA; и (б) обладает активностью в реакции лимфоцитов в смешанной культуре, составляющую не более 5% по сравнению с активностью циклоспорина А, где циклоспорином является (MeIl)циклоспорин.
8. Применение по п.7 для приготовления фармацевтической композиции для ингибирования репликации HCV.
9. Применение по п.7 для приготовления фармацевтической композиции, предназначенной для профилактики повторного заражения HCV у реципиента трансплантата.
10. Применение по п.7, где фармацевтическая композиция содержит циклоспорин в сочетании с одним или несколькими фармацевтически приемлемыми разбавителями или носителями.
11. Применение по п.7, где фармацевтическая композиция является фармацевтической комбинацией, которая содержит а) первый агент, который представляет собой циклоспорин, и б) сопутствующий агент, выбран из агентов, обладающих активностью в отношении HCV, антифиброзного агента, иммуномодулятора или агониста рецептора S1P.
12. Применение по п.11, где сопутствующий агент является сопутствующим агентом, обладающим активностью в отношении HCV.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB0320638.0A GB0320638D0 (en) | 2003-09-03 | 2003-09-03 | Organic compounds |
| GB0320638.0 | 2003-09-03 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2006110533A RU2006110533A (ru) | 2007-10-10 |
| RU2389501C2 true RU2389501C2 (ru) | 2010-05-20 |
Family
ID=28686843
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2006110533/15A RU2389501C2 (ru) | 2003-09-03 | 2004-09-02 | Применение модифицированных циклоспоринов для лечения заболеваний, вызванных hcv |
Country Status (30)
| Country | Link |
|---|---|
| US (1) | US7968518B2 (ru) |
| EP (2) | EP1663287B1 (ru) |
| JP (1) | JP4688806B2 (ru) |
| KR (1) | KR101116968B1 (ru) |
| CN (1) | CN1842343A (ru) |
| AU (2) | AU2004268382A1 (ru) |
| BR (1) | BRPI0414062B8 (ru) |
| CA (1) | CA2537137C (ru) |
| CY (1) | CY1110506T1 (ru) |
| DE (1) | DE602004022061D1 (ru) |
| DK (1) | DK1663287T3 (ru) |
| ES (1) | ES2328361T3 (ru) |
| GB (1) | GB0320638D0 (ru) |
| HK (1) | HK1091732A1 (ru) |
| HR (1) | HRP20090535T1 (ru) |
| IL (1) | IL173909A (ru) |
| IS (1) | IS2917B (ru) |
| MA (1) | MA28032A1 (ru) |
| MX (1) | MXPA06002394A (ru) |
| NO (1) | NO20061479L (ru) |
| NZ (1) | NZ545495A (ru) |
| PL (1) | PL1663287T3 (ru) |
| PT (1) | PT1663287E (ru) |
| RU (1) | RU2389501C2 (ru) |
| SG (1) | SG149063A1 (ru) |
| SI (1) | SI1663287T1 (ru) |
| TN (1) | TNSN06071A1 (ru) |
| TW (1) | TWI342782B (ru) |
| WO (1) | WO2005021028A1 (ru) |
| ZA (1) | ZA200601550B (ru) |
Families Citing this family (54)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1091975B1 (fr) | 1998-07-01 | 2005-12-14 | Debiopharm S.A. | Nouvelle cyclosporine ayant un profil d'activite ameliore |
| GB0320638D0 (en) | 2003-09-03 | 2003-10-01 | Novartis Ag | Organic compounds |
| GB0500020D0 (en) * | 2005-01-04 | 2005-02-09 | Novartis Ag | Organic compounds |
| CA2573207C (en) * | 2004-07-14 | 2013-04-16 | Novartis Ag | Use of a combination of cyclosporin and pegylated interferons for treating hepatitis c (hcv) |
| SG139750A1 (en) | 2004-10-01 | 2008-02-29 | Debiopharm Sa Ch | Use of [d-meala]3-[etval]4-cyclosporin for the treatment of hepatitis c infection and pharmaceutical composition comprising said [d-meala]3- [etval]4-cyclosporin |
| US7196161B2 (en) * | 2004-10-01 | 2007-03-27 | Scynexis Inc. | 3-ether and 3-thioether substituted cyclosporin derivatives for the treatment and prevention of hepatitis C infection |
| KR101309409B1 (ko) * | 2004-10-01 | 2013-09-23 | 싸이넥시스, 인크. | C형 간염 바이러스 감염의 치료 및 예방을 위한 3-에테르및 3-티오에테르 치환된 시클로스포린 유도체 |
| DE602005010607D1 (de) | 2004-11-22 | 2008-12-04 | Astellas Pharma Inc | Zyklosporinanalog |
| KR20070089954A (ko) * | 2004-12-23 | 2007-09-04 | 노파르티스 아게 | 플라비비리대 치료용 화합물 |
| NZ555143A (en) | 2004-12-23 | 2009-12-24 | Novartis Ag | Compositions for HCV treatment |
| AU2006259348B2 (en) | 2005-06-17 | 2010-07-22 | Novartis Ag | Use of sanglifehrin in HCV |
| US8329658B2 (en) | 2005-09-30 | 2012-12-11 | Scynexis, Inc. | Arylalkyl and heteroarylalkyl derivatives of cyclosporine A for the treatment and prevention of viral infection |
| CN101316606B (zh) * | 2005-09-30 | 2015-05-27 | 西尼克斯公司 | 治疗和预防丙型肝炎感染的方法和药物组合物 |
| NZ567262A (en) * | 2005-09-30 | 2011-12-22 | Scynexis Inc | Cyclosporin derivatives and their use for the treatment and prevention of hepatitis C infection |
| US7872097B2 (en) * | 2005-10-26 | 2011-01-18 | Astellas Pharma Inc. | Cyclic peptide compounds |
| US7696166B2 (en) | 2006-03-28 | 2010-04-13 | Albany Molecular Research, Inc. | Use of cyclosporin alkyne/alkene analogues for preventing or treating viral-induced disorders |
| US7696165B2 (en) | 2006-03-28 | 2010-04-13 | Albany Molecular Research, Inc. | Use of cyclosporin alkyne analogues for preventing or treating viral-induced disorders |
| CA2652662C (en) | 2006-05-19 | 2015-11-03 | Scynexis, Inc. | Methods for the treatment and prevention of ocular disorders |
| KR101089112B1 (ko) * | 2006-06-02 | 2011-12-06 | 피씨 제스띠옹 에스.아.에스. | 활성 전자 관리 |
| WO2008043797A1 (en) * | 2006-10-12 | 2008-04-17 | Novartis Ag | Use of modified cyclosporins |
| WO2008069917A2 (en) * | 2006-11-20 | 2008-06-12 | Scynexis, Inc. | Novel cyclic peptides |
| CA2674296C (en) * | 2007-01-04 | 2015-11-24 | Debiopharm Sa | Non-immunosuppressive cyclosporin for treatment of ullrich congenital muscular dystrophy |
| MX2009011512A (es) * | 2007-05-02 | 2009-11-12 | Astellas Pharma Inc | Nuevos compuestos peptidos ciclicos. |
| JPWO2009028418A1 (ja) * | 2007-08-24 | 2010-12-02 | 北海道公立大学法人 札幌医科大学 | シクロスポリンa結合タンパク質 |
| WO2010002428A2 (en) * | 2008-06-06 | 2010-01-07 | Scynexis, Inc. | Novel macrocyclic peptides |
| US20090306033A1 (en) * | 2008-06-06 | 2009-12-10 | Keqiang Li | Novel cyclic peptides |
| EP2307446A4 (en) * | 2008-07-30 | 2012-11-07 | Isotechnika Pharma Inc | NON-IMMUNOSUPPRESSIVE CYCLOSPORINE ANALOGOUS MOLECULES |
| WO2010035722A1 (ja) * | 2008-09-24 | 2010-04-01 | アステラス製薬株式会社 | ペプチド化合物およびその製造方法 |
| BRPI0920502A2 (pt) * | 2008-11-06 | 2015-12-22 | Debio Rech Pharma Sa | compostos cicloundecadepsipeptídeos e seu uso como medicamento |
| JP5780969B2 (ja) * | 2008-12-31 | 2015-09-16 | サイネクシス,インコーポレーテッド | シクロスポリンaの誘導体 |
| WO2010088573A1 (en) * | 2009-01-30 | 2010-08-05 | Enanta Pharmaceuticals, Inc. | Cyclosporin analogues for preventing or treating hepatitis c infection |
| US8481483B2 (en) | 2009-02-19 | 2013-07-09 | Enanta Pharmaceuticals, Inc. | Cyclosporin analogues |
| US8367053B2 (en) | 2009-07-09 | 2013-02-05 | Enanta Pharmaceuticals, Inc. | Cyclosporin analogues |
| US8349312B2 (en) | 2009-07-09 | 2013-01-08 | Enanta Pharmaceuticals, Inc. | Proline substituted cyclosporin analogues |
| US8685917B2 (en) | 2009-07-09 | 2014-04-01 | Enanta Pharmaceuticals, Inc. | Cyclosporin analogues |
| US20110117055A1 (en) | 2009-11-19 | 2011-05-19 | Macdonald James E | Methods of Treating Hepatitis C Virus with Oxoacetamide Compounds |
| CN102869367A (zh) | 2009-12-09 | 2013-01-09 | 西尼克斯公司 | 新颖的环肽 |
| US8623814B2 (en) | 2010-02-23 | 2014-01-07 | Enanta Pharmaceuticals, Inc. | Antiviral agents |
| AU2011311706B2 (en) | 2010-10-05 | 2015-11-12 | Debiopharm S.A. | New treatments of Hepatitis C virus infection |
| JP6110791B2 (ja) | 2010-11-30 | 2017-04-05 | ノバルティス アーゲー | C型肝炎ウイルス感染症の新規治療 |
| JO3337B1 (ar) | 2010-12-13 | 2019-03-13 | Debiopharm Sa | تركيبات صيدلية تشمل أليسبوريفير |
| RU2630690C9 (ru) | 2010-12-15 | 2017-12-28 | КонтраВир Фармасьютикалз, Инк. | МОЛЕКУЛЫ АНАЛОГОВ ЦИКЛОСПОРИНА, МОДИФИЦИРОВАННЫЕ ПО 1 и 3 АМИНОКИСЛОТЕ |
| JP2014509628A (ja) | 2011-03-31 | 2014-04-21 | ノバルティス アーゲー | C型肝炎ウイルス感染症を治療するためのアリスポリビル |
| PL2694087T3 (pl) | 2011-04-01 | 2015-06-30 | Novartis Ag | Leczenie zakażenia wirusem zapalenia wątroby typu B samego lub w połączeniu z zakażeniem wirusem zapalenia wątroby typu delta i towarzyszącymi chorobami wątroby |
| SG193908A1 (en) | 2011-04-13 | 2013-11-29 | Novartis Ag | Treatment of hepatitis c virus infection with alisporivir |
| EP2760461A1 (en) | 2011-09-27 | 2014-08-06 | Novartis AG | Alisporivr for treatment of hepatis c virus infection |
| CN104284671A (zh) | 2012-05-07 | 2015-01-14 | 诺华股份有限公司 | 使用阿拉泊韦的药代动力学调节 |
| CN104487449A (zh) | 2012-06-01 | 2015-04-01 | 阿勒根公司 | 环孢菌素a类似物 |
| WO2014085623A1 (en) | 2012-11-28 | 2014-06-05 | Enanta Pharmaceuticals, Inc. | Novel [n-me-4-hydroxyleucine]-9-cyclosporin analogues |
| WO2015008223A1 (en) | 2013-07-17 | 2015-01-22 | Novartis Ag | Treatment of hepatitis c virus infection with alisporivir and ribavirin |
| JP2016538317A (ja) | 2013-08-26 | 2016-12-08 | エナンタ ファーマシューティカルズ インコーポレイテッド | C型肝炎を防止または治療するための新規シクロスポリン類似体 |
| WO2015136455A1 (en) | 2014-03-13 | 2015-09-17 | Novartis Ag | New treatments of hepatitis c virus infection |
| WO2016073480A1 (en) | 2014-11-03 | 2016-05-12 | Enanta Pharmaceuticals, Inc. | Novel cyclosporin analogues for preventing or treating hepatitis c infection |
| TW201639873A (zh) | 2015-01-08 | 2016-11-16 | 歐樂根公司 | Mebmt側鏈已環化之環孢菌素衍生物 |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5639724A (en) * | 1984-07-24 | 1997-06-17 | Sandoz Ltd. | Cyclosporin galenic forms |
| US4917888A (en) | 1985-06-26 | 1990-04-17 | Cetus Corporation | Solubilization of immunotoxins for pharmaceutical compositions using polymer conjugation |
| US4766106A (en) | 1985-06-26 | 1988-08-23 | Cetus Corporation | Solubilization of proteins for pharmaceutical compositions using polymer conjugation |
| JP2514950B2 (ja) | 1986-03-10 | 1996-07-10 | エフ・ホフマン―ラ ロシユ アーゲー | 化学修飾蛋白質,その製造法および中間体 |
| KR0148748B1 (ko) | 1988-09-16 | 1998-08-17 | 장 크라메르, 한스 루돌프 하우스 | 사이클로스포린을 함유하는 약학조성물 |
| EP0484281B2 (en) * | 1990-11-02 | 2000-11-22 | Novartis AG | Cyclosporins |
| US5595732A (en) | 1991-03-25 | 1997-01-21 | Hoffmann-La Roche Inc. | Polyethylene-protein conjugates |
| US5382657A (en) | 1992-08-26 | 1995-01-17 | Hoffmann-La Roche Inc. | Peg-interferon conjugates |
| US6174868B1 (en) * | 1992-09-10 | 2001-01-16 | Isis Pharmaceuticals, Inc. | Compositions and methods for treatment of hepatitis C virus-associated diseases |
| DE122011100012I1 (de) | 1992-10-21 | 2011-10-20 | Mitsubishi Tanabe Pharma Corp | 2-Amino-1, 3-propandiolverbindung und immunosuppressium. |
| NZ276943A (en) | 1993-11-10 | 1998-02-26 | Schering Corp Substituted For | Alpha-interferon conjugated to a non-antigenic polymer (preferably a polyalkylene oxide) and its preparation |
| DE69524962T4 (de) | 1994-08-22 | 2003-08-28 | Mitsubishi Pharma Corp., Osaka | Benzolderivate und deren medizinische verwendung |
| US5824784A (en) | 1994-10-12 | 1998-10-20 | Amgen Inc. | N-terminally chemically modified protein compositions and methods |
| JP3786447B2 (ja) * | 1995-03-31 | 2006-06-14 | エーザイ株式会社 | C型肝炎の予防・治療剤 |
| US5908621A (en) | 1995-11-02 | 1999-06-01 | Schering Corporation | Polyethylene glycol modified interferon therapy |
| FR2757520B1 (fr) | 1996-12-24 | 1999-01-29 | Rhone Poulenc Rorer Sa | Derive de cyclosporine, sa preparation et les compositions pharmaceutiques qui le contiennent |
| FR2757522B1 (fr) | 1996-12-24 | 1999-01-29 | Rhone Poulenc Rorer Sa | Derives de cyclosporine, leur preparation et les compositions pharmaceutiques qui les contiennent |
| FR2757521B1 (fr) | 1996-12-24 | 1999-01-29 | Rhone Poulenc Rorer Sa | Nouveaux derives de cyclosporine, leur preparation et les compositions pharmaceutiques qui les contiennent |
| NZ500713A (en) | 1997-04-04 | 2000-07-28 | Yoshitomi Pharmaceutical | 2-aminopropane-1,3-diol compounds and medicinal use thereof |
| JPH1180026A (ja) * | 1997-09-02 | 1999-03-23 | Yoshitomi Pharmaceut Ind Ltd | 新規免疫抑制剤、その使用方法およびその同定方法 |
| GB9811854D0 (en) * | 1998-06-02 | 1998-07-29 | Ciba Geigy Ag | Organic compounds |
| EP1091975B1 (fr) * | 1998-07-01 | 2005-12-14 | Debiopharm S.A. | Nouvelle cyclosporine ayant un profil d'activite ameliore |
| CA2415678A1 (en) | 2000-07-13 | 2003-01-10 | Sankyo Company Limited | Amino alcohol derivatives |
| AU2001285331B2 (en) | 2000-08-31 | 2006-04-06 | Merck & Co., Inc. | Phosphate derivatives as immunoregulatory agents |
| EP1372695A2 (en) * | 2000-10-19 | 2004-01-02 | Fujisawa Pharmaceutical Co., Ltd. | Cell damage inhibitor |
| JP2002125683A (ja) * | 2000-10-27 | 2002-05-08 | Tokyoto Igaku Kenkyu Kiko | インターフェロンの有効性を予測する方法並びにそれに用いられるプライマー及びプローブ |
| DK1377593T3 (da) | 2001-03-26 | 2006-04-10 | Novartis Ag | 2-Amino-propanolderivater |
| JP2002316985A (ja) | 2001-04-20 | 2002-10-31 | Sankyo Co Ltd | ベンゾチオフェン誘導体 |
| DE60223699T2 (de) | 2001-09-27 | 2008-10-30 | Kyorin Pharmaceutical Co., Ltd. | Diarylsulfidderivat, dessen additionssalz und immunsuppressivum |
| DE60235900D1 (de) | 2001-09-27 | 2010-05-20 | Kyorin Seiyaku Kk | Osuppressivum |
| JP4709488B2 (ja) | 2002-01-18 | 2011-06-22 | メルク・シャープ・エンド・ドーム・コーポレイション | Edg受容体作動薬としてのN−(ベンジル)アミノアルキルカルボン酸化合物、ホスフィン酸化合物、ホスホン酸化合物およびテトラゾール類 |
| EP1470137B1 (en) | 2002-01-18 | 2009-09-02 | Merck & Co., Inc. | Edg receptor agonists |
| US20030213603A1 (en) | 2002-05-14 | 2003-11-20 | Fisher David B. | Dual use extension apparatus for a tool |
| WO2004002422A2 (en) | 2002-06-28 | 2004-01-08 | Idenix (Cayman) Limited | 2’-c-methyl-3’-o-l-valine ester ribofuranosyl cytidine for treatment of flaviviridae infections |
| GB0313444D0 (en) | 2003-06-11 | 2003-07-16 | Midland Medical Technologies L | Modular dysplasia cup |
| GB0320638D0 (en) | 2003-09-03 | 2003-10-01 | Novartis Ag | Organic compounds |
| SG139750A1 (en) | 2004-10-01 | 2008-02-29 | Debiopharm Sa Ch | Use of [d-meala]3-[etval]4-cyclosporin for the treatment of hepatitis c infection and pharmaceutical composition comprising said [d-meala]3- [etval]4-cyclosporin |
| NZ555143A (en) | 2004-12-23 | 2009-12-24 | Novartis Ag | Compositions for HCV treatment |
-
2003
- 2003-09-03 GB GBGB0320638.0A patent/GB0320638D0/en not_active Ceased
-
2004
- 2004-09-02 CN CNA2004800246044A patent/CN1842343A/zh active Pending
- 2004-09-02 EP EP04764762A patent/EP1663287B1/en not_active Expired - Lifetime
- 2004-09-02 PT PT04764762T patent/PT1663287E/pt unknown
- 2004-09-02 DE DE602004022061T patent/DE602004022061D1/de not_active Expired - Lifetime
- 2004-09-02 KR KR1020067004342A patent/KR101116968B1/ko active IP Right Grant
- 2004-09-02 JP JP2006525712A patent/JP4688806B2/ja not_active Expired - Fee Related
- 2004-09-02 CA CA2537137A patent/CA2537137C/en not_active Expired - Fee Related
- 2004-09-02 NZ NZ545495A patent/NZ545495A/en not_active IP Right Cessation
- 2004-09-02 EP EP06125649.1A patent/EP1797892B1/en not_active Expired - Lifetime
- 2004-09-02 ES ES04764762T patent/ES2328361T3/es not_active Expired - Lifetime
- 2004-09-02 PL PL04764762T patent/PL1663287T3/pl unknown
- 2004-09-02 AU AU2004268382A patent/AU2004268382A1/en not_active Abandoned
- 2004-09-02 TW TW093126578A patent/TWI342782B/zh not_active IP Right Cessation
- 2004-09-02 SG SG200809555-6A patent/SG149063A1/en unknown
- 2004-09-02 US US10/570,097 patent/US7968518B2/en active Active
- 2004-09-02 MX MXPA06002394A patent/MXPA06002394A/es active IP Right Grant
- 2004-09-02 WO PCT/EP2004/009804 patent/WO2005021028A1/en active Application Filing
- 2004-09-02 BR BRPI0414062A patent/BRPI0414062B8/pt not_active IP Right Cessation
- 2004-09-02 RU RU2006110533/15A patent/RU2389501C2/ru not_active IP Right Cessation
- 2004-09-02 SI SI200431200T patent/SI1663287T1/sl unknown
- 2004-09-02 DK DK04764762T patent/DK1663287T3/da active
-
2006
- 2006-02-22 ZA ZA200601550A patent/ZA200601550B/en unknown
- 2006-02-23 IL IL173909A patent/IL173909A/en active IP Right Grant
- 2006-03-02 TN TNP2006000071A patent/TNSN06071A1/en unknown
- 2006-03-10 MA MA28865A patent/MA28032A1/fr unknown
- 2006-03-24 IS IS8371A patent/IS2917B/is unknown
- 2006-03-31 NO NO20061479A patent/NO20061479L/no not_active Application Discontinuation
- 2006-11-09 HK HK06112329.1A patent/HK1091732A1/xx not_active IP Right Cessation
-
2008
- 2008-07-09 AU AU2008203031A patent/AU2008203031B2/en not_active Ceased
-
2009
- 2009-09-16 CY CY20091100955T patent/CY1110506T1/el unknown
- 2009-10-05 HR HR20090535T patent/HRP20090535T1/hr unknown
Non-Patent Citations (2)
| Title |
|---|
| с.3-4. * |
| ЭНЦИКЛОПЕДИЯ ЛЕКАРСТВ. - М., 2001 РЛС с.758-759. ГРЭХАМ-СМИТ Д.Г. и др. Оксфордский справочник по клинической фармакологии и фармакотерапии. - М.: Медицина, 2000, с.25-26, 136-137 СЭНФОРД Дж. и др. Антимикробная терапия. - М.: Практика, 1996 с.142-150. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2389501C2 (ru) | Применение модифицированных циклоспоринов для лечения заболеваний, вызванных hcv | |
| KR20070087624A (ko) | Hcv 치료용 조성물 | |
| AU2005322241B2 (en) | Compounds for flaviviridae treatment | |
| RU2463071C2 (ru) | Применение модифицированных циклоспоринов | |
| EP0666755B1 (en) | Inhibition of hiv-infection | |
| NZ576523A (en) | Use of modified cyclosporins | |
| KR20140070565A (ko) | C형 간염 바이러스 감염의 치료를 위한 알리스포리비르 | |
| WO2013137869A1 (en) | Combination therapy for treating hcv infection in an hcv-hiv coinfected patient population |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20200903 |