RU2312676C2 - Формула кошачьей вакцины - Google Patents
Формула кошачьей вакцины Download PDFInfo
- Publication number
- RU2312676C2 RU2312676C2 RU2002132832/13A RU2002132832A RU2312676C2 RU 2312676 C2 RU2312676 C2 RU 2312676C2 RU 2002132832/13 A RU2002132832/13 A RU 2002132832/13A RU 2002132832 A RU2002132832 A RU 2002132832A RU 2312676 C2 RU2312676 C2 RU 2312676C2
- Authority
- RU
- Russia
- Prior art keywords
- plasmid
- virus
- gene
- vaccine
- seq
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/295—Polyvalent viral antigens; Mixtures of viral and bacterial antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16711—Varicellovirus, e.g. human herpesvirus 3, Varicella Zoster, pseudorabies
- C12N2710/16722—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16711—Varicellovirus, e.g. human herpesvirus 3, Varicella Zoster, pseudorabies
- C12N2710/16734—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/13011—Gammaretrovirus, e.g. murine leukeamia virus
- C12N2740/13022—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/13011—Gammaretrovirus, e.g. murine leukeamia virus
- C12N2740/13034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15022—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14311—Parvovirus, e.g. minute virus of mice
- C12N2750/14322—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14311—Parvovirus, e.g. minute virus of mice
- C12N2750/14334—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20022—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20111—Lyssavirus, e.g. rabies virus
- C12N2760/20122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20111—Lyssavirus, e.g. rabies virus
- C12N2760/20134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20211—Vesiculovirus, e.g. vesicular stomatitis Indiana virus
- C12N2760/20222—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20211—Vesiculovirus, e.g. vesicular stomatitis Indiana virus
- C12N2760/20234—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/16011—Caliciviridae
- C12N2770/16034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/20011—Coronaviridae
- C12N2770/20022—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/20011—Coronaviridae
- C12N2770/20034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Wood Science & Technology (AREA)
- Microbiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Mycology (AREA)
- Immunology (AREA)
- Pulmonology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Изобретение относится к области генной инженерии, вирусологии и ветеринарии. Вакцина для кошек содержит плазмиду, включающую ген env, gag/pro или оба гена env и gag/pro вируса иммунодефицита кошек. Вакцина обеспечивает иммунизацию кошек против иммунодефицита кошек. Изобретение может быть использовано в ветеринарии. 5 з.п. ф-лы, 16 ил.
Description
Настоящее изобретение относится к формуле вакцины для вакцинации кошек против определенного числа патологий. Оно также относится к соответствующей методике вакцинации.
В прошлом уже были предложены сочетания вакцин против некоторых собачьих вирусов.
Сочетания, разработанные до настоящего времени, были созданы на основе инактивированных или живых вакцин и в некоторых случаях смесей таких вакцин. Их использование ставит проблемы совместимости валентности и стабильности. Действительно, необходимо обеспечить одновременно совместимость различных валентностей вакцины как в отношении различных используемых антигенов, так и в отношении самих составов, в частности в случае сочетания инактивированных вакцин и живых вакцин. Также возникает проблема хранения таких комбинированных вакцин и их безвредности, в частности в присутствии добавок. Эти вакцины в целом являются достаточно дорогими.
В заявках WO-A-90 11092, WO-A-93 19183, WO-A-94 21797 и WO-A-95 20660 описана недавно разработанная технология полинуклеотидных вакцин. Известно, что в этих вакцинах используют плазмиду, способную обеспечивать в клетках хозяина экспрессию встроенного в плазмиду антигена. Были предложены все пути введения (внутрибрюшинный, внутривенный, внутримышечный, чрезкожный, внутрикожный, через слизистую и т.д.) Также могут быть использованы различные средства вакцинации, такие как ДНК, помещенная на поверхность частиц золота и распыляемая таким образом, что проникает в кожу животного (Tang и др., Nature 356, 152-154, 1992), и жидкоструйные впрыскиватели, позволяющие осуществить трансфекцию одновременно в кожу, мышцы, жировые ткани и ткани молочных желез (Furth и др. Analytical Biochemistry, 205, 365-368, 1992).
В полинуклеотидных вакцинах можно использовать как неодетые ДНК, так и ДНК внутри липосом или катионных липидов.
Задачей изобретения является, таким образом, разработка формулы поливалентной вакцины, позволяющей осуществить вакцинацию против определенного числа патогенных собачьих вирусов.
Другой целью изобретения является разработка формулы вакцины, сочетающей различные валентности при сохранении всех критериев совместимости и стабильности валентности.
Другой целью изобретения является разработка формулы вакцины, позволяющей сочетать различные валентности в одном и том же носителе.
Другой целью изобретения является разработка вакцины, которая была бы проста в применении и не являлась бы дорогостоящей.
Еще одной целью изобретения является разработка методики вакцинации кошек, позволяющей добиться высокоэффективной и долговременной защиты, в т.ч. поливалентной, при хороших показателях безвредности.
Таким образом, объектом изобретения является формула вакцины для кошек, включающая, по меньшей мере, три валентности полинуклеотидной вакцины, каждая из которых включает плазмиду, содержащую ген (и обеспечивающую его экспрессию in vivo в клетках хозяина) валентности кошачьего патогена, причем эти валентности выбирают из группы, представленной вирусом лейкемии (FeLV), вирусом панлейкопении (FPV), вирусом инфекционного перитонита (FIPV), вирусом воспаления носовых пазух (FHV), вирусом калицивироза (FCV), вирусом кошачьего иммунодефицита (FIV) и, возможно, вирусом бешенства (rhabdovirus), а плазмиды включают в себя для каждой валентности один или несколько генов, выбранных из группы, представленной env и gag/pol для лейкемии кошек, VP2 для панлейкопении, измененным S (или S*) и М для инфекционного перитонита, gB и gD для воспаления носовых пазух, капсидом для калицивироза, env и gag/pro для кошачьего иммунодефицита и G для бешенства.
Под валентностью в рамках настоящего изобретения понимают, по меньшей мере, один антиген, обеспечивающий защиту против вируса определенного патогена, при этом валентность может содержать в качестве субвалентности один или несколько природных или измененных генов одного или нескольких штаммов данного патогена.
Под геном патогенного агента понимают не только полный ген, но и различные нуклеотидные последовательности, включая фрагменты, сохраняющие способность вызывать защитный ответ. В понятие гена входят нуклеотидные последовательности, эквивалентные в точности описанным в примерах, т.е. различные, но кодирующие один и тот же протеин, последовательности. В него также входят нуклеотидные последовательности других штаммов данного патогена, обеспечивающие перекрестную защиту или защиту, специфичную для штамма или группы штаммов. Также в него входят нуклеотидные последовательности, которые были изменены для облегчения экспрессии in vivo в организме животного-хозяина, но кодирующие тот же протеин.
Предпочтительно формула вакцины согласно изобретению включает валентности панлейкопении, воспаления носовых пазух и калицивироза.
Могут быть добавлены валентности лейкемии кошек, кошачьего иммунодефицита и/или инфекционного перитонита.
В отношении валентности воспаления носовых пазух предпочтительно используют оба гена, кодирующие gB и gD, в разных плазмидах или в одной плазмиде, или один из этих генов.
Для валентности лейкемии кошек используют предпочтительно оба гена env и gag/pol, встроенные в две разные плазмиды или в одну плазмиду, или только ген env.
Для валентности кошачьего иммунодефицита используют, предпочтительно, оба гена env и gag/pro, в разных плазмидах или в одной плазмиде, или один из этих генов. Еще предпочтительнее использовать ген env вируса FeLV-A или гены env вирусов FeLV-A и FeLV-B.
Для валентности инфекционного перитонита используют, предпочтительно, оба измененных гена М и S, в двух разных плазмидах или в одной плазмиде, или один из этих генов. S изменяют для инактивации облегчающих мажорных эпитопов, предпочтительно так, как описано в заявке PCT/FR 95/01128.
Объем дозы формулы вакцины согласно изобретению может составлять от 0,1 до 3 мл, и в частности от 0,5 до 1 мл.
Доза составляет в целом от 10 нг до 1 мг, предпочтительно от 100 нг до 500 мкг, еще лучше - от 1 до 250 мкг на тип плазмиды.
Предпочтительно используют неодетые вакцины, помещенные в вакционный носитель, которым может быть физиологический раствор (0,9% NaCl), ультрачистая вода, буфер ТЕ и т.п. Можно, разумеется, использовать любые формы полинуклеотидных вакцин, описанные до настоящего времени.
Каждая плазмида включает промотор, обеспечивающий экспрессию зависимого гена в клетках хозяина. Им является сильный эукариотический промотор и, в частности ранний промотор цитомегаловируса CMV-IE, происходящий от человека или мыши, или, возможно, от другого животного, такого как крыса, свинья, морская свинка.
В общем промотор может быть как вирусного, так и клеточного происхождения.
В качестве вирусного промотора можно назвать ранний или поздний промотор вируса SV 40 или промотор LTR вируса Саркомы Рауса. Это также может быть промотор вируса, от которого происходит ген, например собственный промотор данного гена.
В качестве клеточного промотора можно назвать промотор гена цитоскелета, например промотор десмина (Bolmont и др., Journal of Submicroscopic Cytology and Patology, 1990, 22, 117-122 и ZHENLIN и др. Gene, 1989, 78, 243-254) или промотор актина.
Если несколько генов находятся в одной плазмиде, они могут находиться в одной и той же единице транскрипции или в двух разных единицах.
Комбинация различных валентностей вакцины согласно изобретению предпочтительно может быть получена смешиванием полинуклеотидных плазмид, осуществляющих экспрессию одного или нескольких антигенов каждой валентности, но можно также обеспечить экспрессию антигенов нескольких валентностей с помощью одной плазмиды.
Также объектом изобретения являются формулы одновалентной вакцины, включающей в себя одну или несколько плазмид, кодирующих один или несколько генов одного из вышеназванных вирусов, причем эти гены эквивалентны описанным выше. Кроме их одновалентного характера, эти формулы могут обладать представленными выше характеристиками в том, что касается выбора генов, их комбинаций, композиции плазмид, объемов доз, доз и т.д.
Формулы одновалентной вакцины могут также использоваться
(i) для получения формулы поливалентной вакцины, как она описана выше,
(ii) в индивидуальном порядке против конкретной патологии,
(iii) в сочетании с вакциной другого типа (цельной живой или инактивированной, рекомбинантной, субъединичной) против другой патологии, или
(iv) в качестве вакцины для вторичной вакцинации после вакцины, описанной ниже.
Действительно, еще одним объектом настоящего изобретения является использование одной или нескольких плазмид согласно изобретению для получения вакцины, предназначенной для вакцинации кошек, первично вакцинированных с помощью первой классической вакцины (одновалентной или поливалентной) старого образца, выбранной, в частности, из группы, представленной цельной живой вакциной, цельной инактивированной вакциной, субъединичной вакциной, рекомбинантной вакциной, при этом данная, первая, вакцина несет (т.е. включает в себя или обеспечивает их экспрессию) один или несколько антигенов, кодируемых одной или несколькими используемыми плазмидами, или антигенов, обеспечивающих перекрестную защиту.
Замечательным фактором является то, что полинуклеотидная вакцина оказывает сильное действие в качестве второй вакцины, проявляющееся в усилении иммунного ответа и установлении длительного иммунитета.
В общем вакцины для первичной вакцинации могут быть выбраны из вакцин, выпускаемых на продажу различными производителями ветеринарных вакцин.
Объектом изобретения также является набор для вакцинации, в который входит вакцина для первичной вакцинации, как она описана выше, и формула вакцины согласно изобретению в качестве второй вакцины. Изобретение также относится к формуле вакцины согласно изобретению с приложенной к ней инструкцией, в которой описано использование этой формулы в качестве второй вакцины после первичной вакцинации, как она описана выше.
Также объектом настоящего изобретения является методика вакцинации кошек, включающая введение эффективной формулы вакцины, как она описана выше. Эта методика вакцинации включает в себя введение одной или нескольких доз формулы вакцины, причем эти дозы могут быть введены последовательно через короткие промежутки времени или последовательно через длительные промежутки времени.
Формулы вакцины согласно изобретению могут быть, в рамках данной методики вакцинации, введены различными путями введения, используемыми на практике для полинуклеотидной вакцинации, и с использованием любой известной техники введения.
Также объектом изобретения является методика вакцинации, заключающаяся в том, что проводят первичную вакцинацию, как описано выше, и вторичную вакцинацию формулой вакцины согласно изобретению.
Согласно предпочтительной форме осуществления способа данного изобретения сначала животному вводят эффективную дозу вакцины классического типа, в частности инактивированную, живую, ослабленную или рекомбинантную, или субъединичную вакцину, таким образом, чтобы обеспечить первичную вакцинацию, и, предпочтительно, через 2-6 недель вводят поливалентную или одновалентную вакцину согласно изобретению.
Эффективность антигенов в иммунной системе зависит от конкретных тканей. В частности, слизистые оболочки дыхательных путей служат барьером для патогенов и сочетаются с лимфоидными тканями, осуществляющими местный иммунитет. Введение вакцины через контакт со слизистыми оболочками, в особенности слизистыми оболочками ротовой полости, глотки и бронхиальной зоны, представляет большой интерес для вакцинации против респираторных патологий и патологий пищеварения.
Таким образом, введение через слизистые оболочки составляет часть предпочтительного способа введения согласно изобретению с использованием, в частности, пульверизации или спрея, или воды для питья. Формулы вакцины и методики вакцинации согласно изобретению могут быть применены в рамках этого способа.
Изобретение также относится к методике получения формул вакцины, а именно получения валентностей и их смесей, как следует из данного описания.
Далее изобретение описано более детально в виде способов осуществления изобретения с опорой на чертежи приложения.
СПИСОК ФИГУР
Фигура №1: Плазмида pVR1012
Фигура №2: Плазмида рРВ179
Фигура №3: Последовательность гена env FeLV-B
Фигура №4: Плазмида рРВ180
Фигура №5: Последовательность gag/pol вируса FeLV-A штамма Glasgow-1
Фигура №6: Плазмида рРВ181
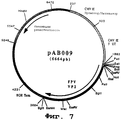
Фигура №7: Плазмида рАВ009
Фигура №8: Плазмида рАВ053
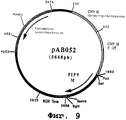
Фигура №9: Плазмида рАВ052
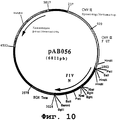
Фигура №10: Плазмида рАВ056
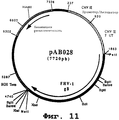
Фигура №11: Плазмида рАВ028
Фигура №12: Плазмида рАВ029
Фигура №13: Плазмида рАВ010
Фигура №14: Плазмида рАВ030
Фигура №15: Плазмида рАВ083
Фигура №16: Плазмида рАВ041
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ SEQ ID №
SEQ ID №1: Олигонуклеотид РВ247
SEQ ID №2: Олигонуклеотид РВ249
SEQ ID №3: Олигонуклеотид РВ281
SEQ ID №4: Олигонуклеотид РВ282
SEQ ID №5: Последовательность гена env вируса FeLV-B
SEQ ID №6: Олигонуклеотид РВ283
SEQ ID №7: Олигонуклеотид РВ284
SEQ ID №8: Последовательность гена gag/pol вируса FeLV-A
(Glasgow-1)
SEQ ID №9: Олигонуклеотид АВ021
SEQ ID №10: Олигонуклеотид АВ024
SEQ ID №11: Олигонуклеотид АВ103
SEQ ID №12: Олигонуклеотид АВ112
SEQ ID №13: Олигонуклеотид АВ113
SEQ ID №14: Олигонуклеотид АВ104
SEQ ID №15: Олигонуклеотид АВ101
SEQ ID №16: Олигонуклеотид АВ102
SEQ ID №17: Олигонуклеотид АВ106
SEQ ID №18: Олигонуклеотид АВ107
SEQ ID №19: Олигонуклеотид АВ061
SEQ ID №20: Олигонуклеотид АВ064
SEQ ID №21: Олигонуклеотид АВ065
SEQ ID №22: Олигонуклеотид АВ066
SEQ ID №23: Олигонуклеотид АВ025
SEQ ID №24: Олигонуклеотид АВ026
SEQ ID №25: Олигонуклеотид АВ067
SEQ ID №26: Олигонуклеотид АВ070
SEQ ID №27: Олигонуклеотид АВ154
SEQ ID №28: Олигонуклеотид АВ155
SEQ ID №29: Олигонуклеотид АВ011
SEQ ID №30: Олигонуклеотид АВ012
ПРИМЕРЫ
ПРИМЕР 1: Культура вирусов
Вирусы культивируют на соответствующей системе клеток до проявления цитопатического эффекта. Системы клеток, используемые для каждого вируса, хорошо известны специалистам. Говоря коротко, клетки, чувствительные к используемому вирусу, культивируемые в минимальной необходимой среде Игла (среда "MEM") или в другой подходящей среде, заражают исследуемым штаммом вируса, используя множественность заражения 1. Инфицированные клетки инкубируют при 37°С в течение времени, необходимого для проявления полного цитопатического эффекта (в среднем 36 часов).
ПРИМЕР 2: Экстракция геномных вирусных ДНК
После культивации собирают разрушенные клетки и их плавающие на поверхности обломки и центрифугируют суспензию вируса при 1000 g при +4°С в течение 10 минут для удаления обломков клеток. Вирусные частицы затем осаждают ультрацентрифугированием при 400000 g и +4°С в течение 1 часа. Осадок собирают в минимальном объеме буфера (Tris 10 мМ, EDTA 1 мМ). Эту концентрированную суспензию вируса обрабатывают протеиназой К (100 мкг/мл в конечной концентрации) в присутствии додецилсульфата натрия (SDS) (0,5% конечн.) в течение 2 часов при 37°С. Затем вирусную ДНК экстрагируют в смеси фенол/хлороформ, затем осаждают 2 объемами абсолютного этанола. Оставляют на ночь при -20°С и центрифугируют при 10000 g и при +4°С в течение 15 минут. Осажденную ДНК высушивают и собирают в минимальном объеме стерильной ультрачистой воды. Затем она может быть расщеплена ферментами рестрикции.
ПРИМЕР 3: Выделение геномных вирусных РНК
РНК-содержащие вирусы были очищены в соответствии с хорошо известными специалистам технологиями. Затем выделяли вирусную геномную РНК каждого вируса, используя технику экстракции "тиоцианат гуанидия/фенолхлороформ", описанную P.Chomczynski и N.Sacchi (Anal. Biochem. 1987. 162. 156-159).
ПРИМЕР 4: Технологии молекулярной биологии
Все плазмидные конструкции были получены с использованием стандартных технологий молекулярной биологии, описанных J.Sambrook и др. (Molecular Cloning: A Laboratory Manual. 2-е издание. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989). Все рестрикционные фрагменты, использованные в настоящем изобретении, были выделены с помощью набора "Geneclean" (BIO 101 Inc. La Jolla, CA).
ПРИМЕР 5: Технология полимеразной цепной реакции с обратной транскриптазой
Специфические олигонуклеотиды (содержащие на 5'-концах сайты рестрикции для облегения клонирования амплифицированных фрагментов) были синтезированы таким образом, что они полностью перекрывают кодирующие участки генов, которые должны быть амплифицированы (см. специфические примеры). Полимеразную цепную реакцию (ПЦР) с обратной транскриптазой (RT) и амплификацией проводили по стандартным технологиям (Sambrook J. и др. 1989). Каждую реакцию RT-ПЦР проводили с парой специфических амплимеров, используя в качестве матрицы экстрагированную РНК вирусного генома. Амплифицированную комплементарную ДНК экстрагировали смесью фенола/хлороформа/изоамилового спирта (25:24:1) перед ее расщеплением рестриктазами.
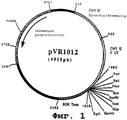
ПРИМЕР 6: Плазмида pVR1012
Плазмида pVR1012 (фиг. №1) была получена при Vical Inc. San Diego, CA, USA. Ее конструирование описано в J.Hartikka и др. (Human Gene Therapy. 1996. 7. 1205-1217).
ПРИМЕР 7: Конструирование плазмиды pPB179 (ген env вируса FeLV-A)
По технологии из примера 5 провели реакцию RT-ПЦР и РНК генома вируса лейкемии, кошек (FeLV-A) (Штамм Glasgow-1) (M.Stewart и др. J.Virol. 1986.58. 825-834), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
РВ247 (29 мер.) (SEQ ID №1)
5'-TTTGTCGACCATGGAAAGTCCAACGCACC-3'
PB249 (28 мер.) (SEQ ID №2)
5'-TTTGGATCCTCATGGTCGGTCCGGATCG-3',
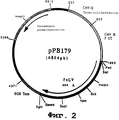
чтобы амплифицировать фрагмент из 1947 нп (нуклеотидных пар), содержащий ген, кодирующий гликопротеин Env вируса FeLV-A (штамм Glasgow-1), в виде фрагмента SalI-BamHI. После очистки продукт RT-ПЦР подвергали расщеплению с помощью Sall и BamHI, чтобы получить фрагмент SalI-BamHI (1935 нп).
Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью Sall и BamHI, и получали плазмиду рРВ179 (6804 нп) (фиг. №2).
ПРИМЕР 8: Конструирование плазмиды рРВ180 (ген env вируса FeLV-B)
По технологии из примера 5 провели реакцию RT-ПЦР с геномной РНК вируса лейкемии кошек (подтип FeLV-B), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
РВ281 (29 мер.) (SEQ ID №3)
5'-TTTGTCGACATGGAAGGTCCAACGCACCC-3'
РВ282 (32 мер.) (SEQ ID №4)
5'-TTGGATCCTCATGGTCGGTCCGGATCATATTG-3',
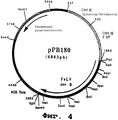
чтобы амплифицировать фрагмент (2005 нп), содержащий ген, кодирующий гликопротеин Env вируса FeLV-B (фиг. №3 и SEQ ID №5) в форме фрагмента SalI-BamHI. После очистки продукт RT-ПЦР расщепляли с помощью Sall и BamHI, чтобы получить фрагмент Sall и BamHI (1995 нп).
Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью Sall и BamHI, и получали плазмиду рРВ180 (6863 нп) (фиг. №4).
ПРИМЕР 9: Конструирование плазмиды рРВ181 (ген FeLV gag/pol)
По технологии из примера 5 провели реакцию RT-ПЦР с геномной РНК вируса лейкемии кошек (подтип FeLV-A) (штамм Glasgow-1), полученной по методике из примера 3, и со следующими олигонуклеотидами:
РВ283 (33 мер.) (SEQ ID №6)
5'-TTGTCGACATGTCTGGAGCCTCTAGTGGGACAG-3'
PB284 (40 мер.) (SEQ ID №7)
5'-TTGGATCCTTATTTAATTACTGCAGTTCCAAGGAACTCTC-3',
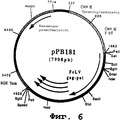
чтобы амплифицировать фрагмент (3049 нп), содержащий последовательность, кодирующую протеин Gag, и часть 5'-последовательности, кодирующую протеин Pol вируса FeLV-A (штамм Glasgow-1) (фиг. №5 и SEQ ID №8) в форме фрагмента SalI-BamHI. После очистки продукт RT-ПЦР расщепляют с помощью Sall и BamHI, чтобы получить фрагмент SalI-BamHI (3039 нп).
Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью Sail и BamHI, и получали плазмиду рРВ181 (7908 нп) (фиг. №6).
ПРИМЕР 10: Конструирование плазмиды рАВ009 (ген FPV VP2)
Провели реакцию ПЦР с геномной ДНК вируса панлейкопении кошек (штамм 193) (J.Martyn и др. J.Gen. Virol. 1990. 71. 2747-2753), полученной по технологии из примера 2, и со следующими олигонуклеотидами:
АВ021 (34 мер.) (SEQ ID №9)
5'-TGCTCTAGAGCAATGAGTGATGGAGCAGTTCAAC-3'
AB024 (33 мер.) (SEQ ID №10)
5'-CGCGGATCCATTAATATAATTTTCTAGGTGCTA-3'
для амплификации фрагмента (1776 нп), содердащего ген, кодирующий протеин капсида VP2 вируса FPV. После очистки продукт ПЦР расщепляли с помощью Xbal и BamHI, чтобы получить фрагмент XbaI-BamHI (1764 нп).
Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью Xbal и BamHI, и получали плазмиду рАВ009 (6664 нп) (фиг. №7).
ПРИМЕР 11: Конструирование плазмиды рАВ053 (ген FeLV S*)
По технологии из примера 5 проводили реакцию RT-ПЦР с геномной РНК вируса инфекционного перитонита кошек (PIF) (штамм 79-1146) (R.de Groot и др. J.Gen. Virol. 1987. 68. 2639-2646), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ103 (38 мер.) (SEQ ID №11)
5'-ATAAGAATGCGGCCGCATGATTGTGCTCGTAACTTGCC-3'
АВ112 (25 мер.) (SEQ ID №12)
5'-CGTACATGTGGAATTCCACTGGTTG-3',
чтобы амплифицировать последовательность на 5'-конце гена, кодирующего гликопротеин S вируса, в форме фрагмента Notl-EcoRI. После очистки продукт RT-ПЦР (492 нп) расщепляли с помощью NotI и EcoRI, чтобы освободить фрагмент NotI-EcoRI (467 нп) (фрагмент А).
Плазмиду pJCA089 (заявка PCT/FR 95/01128) расщепляли с помощью EcoRI и SpeI, чтобы высвободить фрагмент (3378 нп), содержащий центральную часть гена, кодирующего измененный гликопротеин S вируса PIF (фрагмент В).
По технологии из примера 5 провели реакцию RT-ПЦР с геномной РНК вируса PIF (штамм 79-1146), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ113 (25 мер.) (SEQ ID №13)
5'-AGAGTTGCAACTAGTTCTGATTTTG-3'
AB104 (37 мер.) (SEQ ID №14)
5'-ATAAGAATGCGGCCGCTTAGTGGACATGCACTTTTTC-3',
чтобы амплифицировать последовательность части 3'-гена, кодирующего гликопротеин S вируса PIF, в форме фрагмента SpeI-NotI. После очистки продукт RT-ПЦР (543 нп) расщепляли с помощью SpeI и NotI, чтобы высвободить фрагмент SpeI-NotI (519 нп) (фрагмент С).
Фрагменты А, В, С вместе сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью NotI, и получали плазмиду рАВ053 (9282 нп), содержащую измененный ген S в нужной ориентации по отношению к промотору (фиг. №8).
ПРИМЕР 12: Конструирование плазмиды рАВ052 (ген FIPV М)
По технологии из примера 5 проводили реакцию RT-ПЦР с геномной РНК вируса инфекционного перитонита кошек (PIF) (штамм 79-1146) (H.Vennema и др. Virology. 1991. 181. 327-335), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ101 (37 мер.) (SEQ ID №15)
5'-ACGCGTCGACCCACCATGAAGTACATTTTGCTAATAC-3'
AB102 (36 мер.) (SEQ ID №16)
5'-CGCGGATCCTTACACCATATGTAATAATTTTTCATG-3',
чтобы точно выделить ген, кодирующий гликопротеин М вируса PIF, в форме фрагмента SalI-BamHI. После очистки продукт RT-ПЦР (812 нп) расщепляли с помощью Sall и BamHI, чтобы высвободить фрагмент SalI-BamHI (799 нп). Затем этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью Sall и BamHI, и получали плазмиду рАВ052 (5668 нп) (фиг. №9).
ПРИМЕР 13: Конструирование плазмиды рАВ056 (ген FIPV N)
По технологии из примера 5 провели реакцию RT-ПЦР с геномной РНК вируса инфекционного перитонита кошек (PIF) (штамм 79-1146) (H.Vennema и др. Virology. 1991. 181. 327-335), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ106 (35 мер.) (SEQ ID №17)
5'-ACGCGTCGACGCCATGGCCACACAGGGACAACGCG-3'
AB107 (36 мер.) (SEQ-ID №18)
5'-CGCGGATCCTTAGTTCGTAACCTCATCAATCATCTC-3',
чтобы точно выделить ген, кодирующий протеин N вируса PIF в форме фрагмента SalI-BamHI. После очистки продукт RT-ПЦР (1156 нп) расщепляли с помощью SalI и BamHI, чтобы высвободить фрагмент SalI-BamHI (1143 нп). Затем этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью SalI и BamHI, и получали плазмиду рАВ056 (6011 нп) (фиг. №10).
ПРИМЕР 14: Конструирование плазмиды рАВ028 (ген FHV gB)
Проводили реакцию ПЦР с геномной ДНК кошачьего вируса герпеса (FHV-1) (штамм С27) (S.Spatz и др. Virology. 1993. 197. 125-36), полученной по технологии из примера 2, и со следующими олигонуклеотидами:
АВ061 (36 мер.) (SEQ ID №19)
5'-AAAACTGCAGAATCATGTCCACTCGTGGCGATCTTG-3'
AB064 (40 мер.) (SEQ ID №20)
5'-ATAAGAATGCGGCCGCTTAGACAAGATTTGTTTCAGTATC-3',
чтобы амплифицировать фрагмент (2856 нп), содержащий ген, кодирующий гликопротеин gB вируса FHV-1, в форме фрагмента PstI-NotI. После очистки продукт ПЦР был расщеплен с помощью PstI и NotI, чтобы получить фрагмент PstI-NotI (2823 нп).
Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью PstI и NotI, и получали плазмиду рАВ028 (7720 нп) (фиг. №11).
ПРИМЕР 15: Конструирование плазмиды рАВ029 (ген FHV gD)
Проводили реакцию ПЦР с геномной ДНК кошачьего вируса герпеса (FHV-1) (штамм С-27) (S.Spatz и др. J.Gen. Virol. 1994. 75. 1235-1244), полученной по технологии из примера 2, и со следующими олигонуклеотидами:
АВ065 (36 мер.) (SEQ ID №21)
5'-AAAACTGCAGCCAATGATGACACGTCTACATTTTTG-3'
AB066 (33 мер.) (SEQ ID №22)
5'-GGAAGATCTTTAAGGATGGTGAGTTGTATGTAT-3',
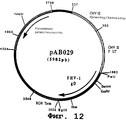
чтобы амплифицировать ген, кодирующий гликопротеин gD вируса FHV-1, в форме фрагмента PstI-BglII. После очистки продукт ПЦР (1147 нп) расщепляли с помощью PstI и BglII, чтобы изолировать фрагмент PstI-BglII (1129 нп). Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью PstI и BglII, и получали плазмиду рАВ029 (5982 нп) (фиг. №12).
ПРИМЕР 16: Конструирование плазмиды рАВОЮ (ген FCV С)
По технологии из примера 5 провели реакцию RT-ПЦР с геномной РНК кошачьего калицивируса (FCV) (штамм F9) (М.Carter и др. Virology. 1992. 190. 443-448), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ025 (33 мер.) (SEQ ID №23)
5'-ACGCGTCGACGCATGTGCTCAACCTGCGCTAAC-3'
АВ026 (31 мер.) (SEQ ID №24)
5'-CGCGGATCCTCATAACTTAGTCATGGGACTC-3',
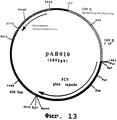
чтобы выделить ген, кодирующий протеин капсида вируса FCV, в форме фрагмента SalI-BamHI. После очистки продукт RT-ПЦР (2042 нп) расщепили с помощью SalI и BamHI, чтобы изолировать фрагмент SalI-BamHI (2029 нп). Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью Sail и BamHI, и получали плазмиду рАВ010 (6892 нп) (фиг. №13).
ПРИМЕР 17: Конструирование плазмиды рАВ0З0 (ген FIV env)
По технологии из примера 5 проводили реакцию RT-ПЦР с геномной РНК вируса кошачьего иммунодефицита (FIV) (штамм Petaluma) (R.Olmsted и др. Proc. Natl. Acad. Sci. USA 1989. 86. 8088-8096), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ067 (36 мер.) (SEQ ID №25)
5'-AAAACTGCAGAAGGAATGGCAGAAGGATTTGCAGCC-3'
AB070 (36 мер.) (SEQ ID №26)
5'-CGCGGATCCTCATTCCTCCTCTTTTTCAGACATGCC-3',
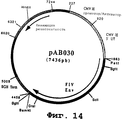
чтобы амплифицировать фрагмент (2592 нп), содержащий ген, кодирующий гликопротеин Env вируса FIV (штамм Petaluma), в форме фрагмента PstI-BamHI. После очистки продукт RT-ПЦР расщепляли с помощью PstI и BamHI, чтобы получить фрагмент PstI-BamHI (2572 нп). Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью PstI и BamHI, и получали плазмиду рАВ030 (7436 нп) (фиг. №14).
ПРИМЕР 18: Конструирование плазмиды рАВ083 (ген FIV gag/pro)
По технологии из примера 5 провели реакцию RT-ПЦР с геномной РНК вируса кошачьего иммунодефицита (FIV) (штамм Petaluma) (R.Olmsted и др. Proc. Natl. Acad. Sci. USA. 1989. 86. 8088-8096), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ154 (32 мер.) (SEQ ID №27)
5'-ACGCGTCGACATGGGGAATGGACAGGGGCGAG-3'
AB155 (33 мер.) (SEQ ID №28)
5'-TGAAGATCTTCACTCATCCCCTTCAGGAAGAGC-3',
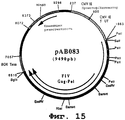
чтобы амплифицировать фрагмент (4635 нп), содержащий ген, кодирующий протеины Gag и Pro вируса FIV (штамм Petaluma), в форме фрагмента SalI-BglII. После очистки продукт RT-ПЦР расщепляли с помощью Sall и BglII, чтобы получить фрагмент SalI-BglII (4622 нп). Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью Sail и BglII, и получали плазмиду рАВ083 (7436 нп) (фиг. №15).
ПРИМЕР 19: Конструирование плазмиды рАВ041 (ген G вируса бешенства)
По технологии из примера 5 проводили реакцию RT-ПЦР с геномной РНК вируса бешенства (штамм ERA) (A.Anilionis и др. Nature. 1981. 294. 275-278), полученной по технологии из примера 3, и со следующими олигонуклеотидами:
АВ011 (33 мер.) (SEQ ID №29)
5'-AAAACTGCAGAGATGGTTCCTCAGGCTCTCCTG-3'
AB012 (34 мер.) (SEQ ID №30)
5'-CGCGGATCCTCACAGTCTGGTCTCACCCCCACTC-3',
чтобы амплифицировать фрагмент (1589 нп), содержащий ген, кодирующий гликопротеин G вируса бешенства. После очистки продукт RT-ПЦР расщепляли с помощью PstI и BamHI, чтобы получить фрагмент PstI-BamHI (1578 нп). Этот фрагмент сшивали с вектором pVR1012 (пример 6), предварительно расщепленным с помощью PstI и BamHI, и получали плазмиду рАВ041 (6437 нп) (фиг. №16).
ПРИМЕР 20: Получение и очистка плазмид
Для получения плазмид, предназначенных для вакцинации животных, можно применять любую технологию, позволяющую получить суспензию очищенных плазмид по большей части в сверхскрученной форме. Такие технологии хорошо известны специалистам. Можно назвать, в частности, технику щелочного лизиса с последующим двукратным центрифугированием в градиенте хлорида цезия в присутствии бромида этидия, как описано в J.Sambrook и др. (Molecular Cloning: A Laboratory Manual. 2-е издание. Cold Spring Harbor Laboratory. Cold Spring Harbor. New York. 1989). Можно также обратиться к материалам заявок РСТ WO 95/21250 и РСТ WO 96/02658, в которых описаны методы получения в промышленном масштабе плазмид для вакцинации. Для получения вакцин (см.пример 17) очищенные плазмиды помещают в суспензию таким образом, чтобы получить высококонцентрированные растворы (>2 мг/мл), пригодные для хранения. Для этого готовят суспензии плазмид в ультрачистой воде или в буфере ТЕ (Tris-HCl 10 мМ; EDTA 1 мМ, рН 8,0).
ПРИМЕР 21: Получение ассоциированных вакцин
Различные плазмиды, необходимые для получения ассоциированной вакцины, смешивают в их концентрированных растворах (пример 16). Смеси готовят таким образом, что конечная концентрация каждой плазмиды соответствует эффективной дозе каждой плазмиды. Для точной доводки конечной концентрации вакцины используют такие растворы, как раствор NaCl (0,9%) или буфер PBS.
Такие особые компоненты, как липосомы, катионные липиды, также могут использоваться для получения вакцин.
ПРИМЕР 22: Вакцинация кошек
Кошек вакцинируют дозами 10, 50 или 250 мкг на каждую плазмиду.
Инъекции проводят внутримышечно с помощью иглы. В этом случае вакцинные дозы вводят в объеме 1 мл.
Инъекции можно также проводить внутрикожно с помощью иглы. В этом случае вакционные дозы вводят в общем объеме 1 мл в 10 местах (по 0,1 мл) или в 20 местах (по 0,05 мл). Перед внутрикожной инъекцией выбривают на коже соответствующий участок (обычно боковую часть грудной клетки) или осуществляют инъекцию в относительно безволосый участок, например, на внутренней поверхности бедра.
Для внутрикожных инъекций можно также использовать жидкоструйный инъекционный аппарат (без иглы).
Claims (6)
1. Кошачья вакцина для индукции в организме хозяина, представляющего собой кошку, защитного ответа против вируса иммунодефицита кошек (FIV), содержащая плазмиду, включающую ген env, gag/pro или оба гена env и gag/pro вируса иммунодефицита кошек.
2. Вакцина по п.1, отличающаяся тем, что указанная плазмида включает ген env и вакцина содержит вторую плазмиду, включающую ген gag/pro.
3. Вакцина по п.1 или 2, отличающаяся тем, что плазмида включает ранний промотор цитомегаловируса CMV-IE.
4. Вакцина по п.1 или 2, отличающаяся тем, что плазмида включает промотор, выбранный из раннего промотора вируса SV40, позднего промотора вируса SV40, промотора LTR вируса саркомы Рауса, промотора гена цитоскелета.
5. Вакцина по одному из пп.1-4, отличающаяся тем, что она дополнительно содержит плазмиду, включающую ген патогена кошек, отличного от вируса иммунодефицита кошек.
6. Вакцина по п.5, отличающаяся тем, что указанный ген выбирают из генов env и gag/pol лейкемии кошек, VP2 панлейкопении, измененного S и М инфекционного перитонита, gB и gD острого ринита, капсидного гена калицивироза и G бешенства.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR9609337A FR2751223B1 (fr) | 1996-07-19 | 1996-07-19 | Formule de vaccin polynucleotidique felin |
| FR9609337 | 1996-07-19 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU99103209/13A Division RU99103209A (ru) | 1996-07-19 | 1997-07-15 | Формула кошачей полинуклеотидной вакцины |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2002132832A RU2002132832A (ru) | 2005-01-20 |
| RU2312676C2 true RU2312676C2 (ru) | 2007-12-20 |
Family
ID=9494449
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002132832/13A RU2312676C2 (ru) | 1996-07-19 | 2002-12-05 | Формула кошачьей вакцины |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US6348196B1 (ru) |
| EP (1) | EP0934416B1 (ru) |
| JP (1) | JP2001500112A (ru) |
| KR (1) | KR100687509B1 (ru) |
| AR (1) | AR007861A1 (ru) |
| AU (1) | AU3699297A (ru) |
| BR (2) | BR9715228B1 (ru) |
| CA (1) | CA2261345C (ru) |
| CZ (2) | CZ298613B6 (ru) |
| DE (1) | DE69736185T2 (ru) |
| FR (1) | FR2751223B1 (ru) |
| NZ (1) | NZ333781A (ru) |
| PL (1) | PL191551B1 (ru) |
| RU (1) | RU2312676C2 (ru) |
| WO (1) | WO1998003660A1 (ru) |
| ZA (1) | ZA976286B (ru) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2586504C1 (ru) * | 2015-04-29 | 2016-06-10 | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Саратовский государственный аграрный университет имени Н.И. Вавилова" | Набор синтетических олигонуклеотидных праймеров и способ его применения для индикации вирусов иммунодефицита и лейкемии кошек в клиническом материале методом мультиплексной полимеразной цепной реакции |
| RU2749717C2 (ru) * | 2015-11-24 | 2021-06-16 | Глэксосмитклайн Интеллекчуал Проперти Дивелопмент Лимитед | Способ временной трансфекции для продуцирования ретровируса |
| RU2752498C2 (ru) * | 2015-11-24 | 2021-07-28 | Глэксосмитклайн Интеллекчуал Проперти Дивелопмент Лимитед | Стабильные клеточные линии для продуцирования ретровирусов |
Families Citing this family (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2223029A1 (en) | 1997-02-12 | 1998-08-12 | Akzo Nobel Nv | Canine parvovirus dna vaccines |
| EP0863151A1 (en) * | 1997-02-12 | 1998-09-09 | Akzo Nobel N.V. | "Canine parvovirus dna vaccines" |
| US6770282B1 (en) | 1998-10-23 | 2004-08-03 | Heska Corporation | Cationic lipid-mediated enhancement of nucleic acid immunization of cats |
| FR2794648B1 (fr) * | 1999-06-10 | 2003-03-07 | Merial Sas | Vaccins adn pour animaux de compagnie et de sport |
| BR0011732B1 (pt) * | 1999-06-10 | 2014-02-04 | Vacinas de dna para animais de companhia e de esporte | |
| EP1074625A3 (en) * | 1999-06-14 | 2002-01-02 | Pfizer Products Inc. | DNA vaccine against feline immunodeficiency virus |
| ATE294857T1 (de) * | 1999-07-08 | 2005-05-15 | Mologen Forschungs Entwicklung | Impfstoff gegen infektionen mit lentiviren, wie dem felinen immunschwäche-virus der katze |
| FR2796397B1 (fr) * | 1999-07-16 | 2006-09-01 | Merial Sas | Genes de calicivirus felin et vaccins notamment vaccins recombines |
| US6541458B1 (en) | 1999-07-16 | 2003-04-01 | Merial | Feline calicivirus genes and vaccines in particular recombinant vaccines |
| FR2796396A1 (fr) * | 1999-07-16 | 2001-01-19 | Merial Sas | Gene de calicivirus felin et vaccin recombine les incorporant |
| US7078388B2 (en) | 2000-01-21 | 2006-07-18 | Merial | DNA vaccines for farm animals, in particular bovines and porcines |
| FR2829498B1 (fr) * | 2001-09-11 | 2003-11-28 | Merial Sas | Igf-1 comme adjuvant de vaccin felin, notamment contre les retrovirus felins |
| JP4411213B2 (ja) * | 2002-09-23 | 2010-02-10 | モロゲン・アーゲー | ネコ白血病ウィルスによるネコ感染症のようなオンコウィルス感染症に対するワクチン |
| EP1606419A1 (en) | 2003-03-18 | 2005-12-21 | Quantum Genetics Ireland Limited | Systems and methods for improving protein and milk production of dairy herds |
| US7468273B2 (en) | 2003-05-01 | 2008-12-23 | Meial Limited | Canine GHRH gene, polypeptides and methods of use |
| MXPA06005424A (es) | 2003-11-13 | 2007-01-25 | Univ Georgia Res Found | Metodos para caracterizar virus de enfermedad bursal infecciosa. |
| NZ549384A (en) | 2004-02-19 | 2008-08-29 | Univ Alberta | Leptin promoter polymorphisms and uses thereof |
| US7803612B2 (en) | 2005-04-25 | 2010-09-28 | Merial Limited | Nipah virus vaccines |
| US20080241184A1 (en) | 2005-08-25 | 2008-10-02 | Jules Maarten Minke | Canine influenza vaccines |
| CA2629522A1 (en) | 2005-11-14 | 2007-05-18 | Merial Limited | Gene therapy for renal failure |
| US7771995B2 (en) | 2005-11-14 | 2010-08-10 | Merial Limited | Plasmid encoding human BMP-7 |
| US7862821B2 (en) | 2006-06-01 | 2011-01-04 | Merial Limited | Recombinant vaccine against bluetongue virus |
| AU2007352618B2 (en) | 2007-05-02 | 2013-07-18 | Boehringer Ingelheim Animal Health USA Inc. | DNA plasmids having improved expression and stability |
| DK2414386T3 (en) | 2009-04-03 | 2016-02-22 | Merial Ltd | Birds of vaccines with newcastle disease virus vectors |
| WO2012030720A1 (en) | 2010-08-31 | 2012-03-08 | Merial Limited | Newcastle disease virus vectored herpesvirus vaccines |
| WO2012090073A2 (en) | 2010-12-30 | 2012-07-05 | The Netherlands Cancer Institute | Methods and compositions for predicting chemotherapy sensitivity |
| US20140287931A1 (en) | 2011-04-04 | 2014-09-25 | Stichting Het Nederlands Kanker Instituut - Antoni Van Leeuwenhoek Ziekenhuis | Methods and compositions for predicting resistance to anticancer treatment |
| AU2012240240A1 (en) | 2011-04-04 | 2013-05-09 | Netherlands Cancer Institute | Methods and compositions for predicting resistance to anticancer treatment with protein kinase inhibitors |
| US9216213B2 (en) | 2011-04-20 | 2015-12-22 | Merial, Inc. | Adjuvanted rabies vaccine with improved viscosity profile |
| EP2701736A1 (en) | 2011-04-25 | 2014-03-05 | Advanced Bioscience Laboratories, Inc. | Truncated hiv envelope proteins (env), methods and compositions related thereto |
| ES2674439T3 (es) | 2011-06-01 | 2018-06-29 | Merial, Inc. | Administración sin aguja de vacunas contra el VSRRP |
| ES2626297T3 (es) | 2011-08-12 | 2017-07-24 | Merial, Inc. | Preservación asistida por vacío de productos biológicos, en particular de vacunas |
| WO2013093629A2 (en) | 2011-12-20 | 2013-06-27 | Netherlands Cancer Institute | Modular vaccines, methods and compositions related thereto |
| WO2013138776A1 (en) | 2012-03-16 | 2013-09-19 | Merial Limited | Novel methods for providing long-term protective immunity against rabies in animals, based upon administration of replication-deficient flavivirus expressing rabies g |
| WO2014164697A1 (en) | 2013-03-12 | 2014-10-09 | Merial Limited | Reverse genetics schmallenberg virus vaccine compositions, and methods of use thereof |
| AU2015343369B2 (en) | 2014-11-03 | 2018-11-22 | Georgia Tech Research Corporation | Methods of using microneedle vaccine formulations to elicit in animals protective immunity against rabies virus |
| CA2990643C (en) | 2015-06-23 | 2023-10-17 | Merial, Inc. | Prrsv minor protein-containing recombinant viral vectors and methods of making and use thereof |
| CN112921122A (zh) * | 2021-03-26 | 2021-06-08 | 广西大学 | 猫常见病毒多重pcr快速检测试剂盒及其引物组 |
| CN112921123B (zh) * | 2021-04-06 | 2022-11-04 | 中国农业科学院哈尔滨兽医研究所(中国动物卫生与流行病学中心哈尔滨分中心) | 快速检测猫杯状病毒的方法及检测用引物和试剂盒 |
| CN115894716B (zh) * | 2022-11-23 | 2024-02-09 | 华中农业大学 | 一种重组融合蛋白纳米颗粒及其制备方法 |
| CN116121282B (zh) * | 2023-01-10 | 2023-09-22 | 浙江大学 | 一种表达猫疱疹病毒蛋白的mRNA疫苗及其制备方法 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5631154A (en) * | 1988-06-10 | 1997-05-20 | Therion Biologics, Incorporated | Self assembled, defective, non-self-propagating lentivirus particles |
| CA2020740A1 (en) * | 1989-07-12 | 1991-01-13 | Harry Vennema | Antigenically active proteins/peptides, and feline infectious peritonitis virus (fipv)-vaccines |
| DK0484382T3 (da) * | 1989-07-21 | 1995-07-24 | Upjohn Co | Felint calicivirus-capsid-protein og nucleotidsekvens |
| US5665362A (en) * | 1990-09-25 | 1997-09-09 | Cantab Pharmaceuticals Research Limited | Viral vaccines |
| WO1993015762A1 (en) * | 1992-02-18 | 1993-08-19 | Parhelion Corporation | Feline infectious peritonitis vaccine and method of preparation |
| AU5138293A (en) * | 1992-09-21 | 1994-04-12 | Chiron Viagene, Inc. | Recombinant retroviral vector against felv and/or fiv |
| GB2282601B (en) * | 1993-09-16 | 1998-04-15 | Solvay | Antigenically-active proteins/polypeptides and coronavirus vaccines containing the same |
| US6348449B1 (en) * | 1993-09-21 | 2002-02-19 | The Trustees Of The University Of Pennsylvania | Methods of inducing mucosal immunity |
| TW377373B (en) * | 1993-09-22 | 1999-12-21 | Wyeth Corp | Recombinant raccoon pox viruses and their use as an effective vaccine against feline infectious peritonitis virus disease |
| ATE475668T1 (de) * | 1994-01-27 | 2010-08-15 | Univ Massachusetts Medical | Immunisierung durch impfung von dns transkriptionseinheit |
| US5529780A (en) * | 1994-03-30 | 1996-06-25 | Virogenetics Corporation | Nucleotide and amino acid sequences of canine herpesvirus gB and gC |
| AU2234995A (en) * | 1994-04-29 | 1995-11-29 | Pharmacia & Upjohn Company | Feline immunodeficiency virus vaccine |
| FR2724385B1 (fr) * | 1994-08-29 | 1996-12-13 | Rhone Merieux | Vaccin de la peritonite infectieuse feline. |
-
1996
- 1996-07-19 FR FR9609337A patent/FR2751223B1/fr not_active Expired - Lifetime
-
1997
- 1997-07-11 AR ARP970103110A patent/AR007861A1/es active IP Right Grant
- 1997-07-15 DE DE69736185T patent/DE69736185T2/de not_active Expired - Lifetime
- 1997-07-15 NZ NZ333781A patent/NZ333781A/xx not_active IP Right Cessation
- 1997-07-15 WO PCT/FR1997/001315 patent/WO1998003660A1/fr active IP Right Grant
- 1997-07-15 CZ CZ0015999A patent/CZ298613B6/cs not_active IP Right Cessation
- 1997-07-15 CA CA2261345A patent/CA2261345C/en not_active Expired - Lifetime
- 1997-07-15 KR KR1019980710909A patent/KR100687509B1/ko active IP Right Grant
- 1997-07-15 AU AU36992/97A patent/AU3699297A/en not_active Abandoned
- 1997-07-15 JP JP10506629A patent/JP2001500112A/ja not_active Ceased
- 1997-07-15 BR BRPI9715228-5A patent/BR9715228B1/pt not_active IP Right Cessation
- 1997-07-15 PL PL331247A patent/PL191551B1/pl unknown
- 1997-07-15 CZ CZ20070505A patent/CZ304126B6/cs not_active IP Right Cessation
- 1997-07-15 BR BRPI9710497-3A patent/BR9710497B1/pt not_active IP Right Cessation
- 1997-07-15 EP EP97933746A patent/EP0934416B1/fr not_active Expired - Lifetime
- 1997-07-16 ZA ZA976286A patent/ZA976286B/xx unknown
-
1999
- 1999-01-15 US US09/232,278 patent/US6348196B1/en not_active Expired - Lifetime
-
2001
- 2001-08-30 US US09/943,443 patent/US7534559B2/en not_active Expired - Fee Related
-
2002
- 2002-12-05 RU RU2002132832/13A patent/RU2312676C2/ru active
Non-Patent Citations (1)
| Title |
|---|
| FLYNN J.N. et al. Involvement of gag- and env-specific cytotoxic Т lymphocytes in protective immunity to feline immunodeficiency virus. AIDS Res. Hum. Retroviruses. 1995 Sep; 11(9): 1107-13. * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2586504C1 (ru) * | 2015-04-29 | 2016-06-10 | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Саратовский государственный аграрный университет имени Н.И. Вавилова" | Набор синтетических олигонуклеотидных праймеров и способ его применения для индикации вирусов иммунодефицита и лейкемии кошек в клиническом материале методом мультиплексной полимеразной цепной реакции |
| RU2749717C2 (ru) * | 2015-11-24 | 2021-06-16 | Глэксосмитклайн Интеллекчуал Проперти Дивелопмент Лимитед | Способ временной трансфекции для продуцирования ретровируса |
| RU2752498C2 (ru) * | 2015-11-24 | 2021-07-28 | Глэксосмитклайн Интеллекчуал Проперти Дивелопмент Лимитед | Стабильные клеточные линии для продуцирования ретровирусов |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20000065257A (ko) | 2000-11-06 |
| CZ304126B6 (cs) | 2013-11-06 |
| AR007861A1 (es) | 1999-11-24 |
| CA2261345A1 (en) | 1998-01-29 |
| RU2002132832A (ru) | 2005-01-20 |
| CZ15999A3 (cs) | 1999-06-16 |
| KR100687509B1 (ko) | 2007-10-12 |
| BR9710497A (pt) | 1999-08-17 |
| US7534559B2 (en) | 2009-05-19 |
| PL191551B1 (pl) | 2006-06-30 |
| US6348196B1 (en) | 2002-02-19 |
| ZA976286B (en) | 1999-01-19 |
| DE69736185T2 (de) | 2007-04-19 |
| FR2751223A1 (fr) | 1998-01-23 |
| BR9710497B1 (pt) | 2011-04-05 |
| JP2001500112A (ja) | 2001-01-09 |
| CA2261345C (en) | 2010-09-14 |
| US20030017172A1 (en) | 2003-01-23 |
| BR9715228B1 (pt) | 2011-10-04 |
| AU3699297A (en) | 1998-02-10 |
| NZ333781A (en) | 2000-09-29 |
| DE69736185D1 (de) | 2006-08-03 |
| EP0934416B1 (fr) | 2006-06-21 |
| EP0934416A1 (fr) | 1999-08-11 |
| WO1998003660A1 (fr) | 1998-01-29 |
| FR2751223B1 (fr) | 1998-12-04 |
| PL331247A1 (en) | 1999-07-05 |
| CZ298613B6 (cs) | 2007-11-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2312676C2 (ru) | Формула кошачьей вакцины | |
| RU2319504C2 (ru) | Вакцина собак против бешенства (варианты), способ вакцинации (варианты), набор для вакцинации (варианты) | |
| CA2660355C (en) | Polynucleotide vaccine formulation against pathologies of the horse | |
| RU2305560C2 (ru) | Формула вакцины против респираторных патологий крупного рогатого скота | |
| RU2305559C2 (ru) | Вакцина свиней против респираторных патологий и патологий репродукции свиней | |
| AU735184B2 (en) | Avian polynucleotide vaccine formula | |
| US7294338B2 (en) | Polynucleotide vaccine formula against canine pathologies, in particular respiratory and digestive pathologies | |
| AU773266B2 (en) | Feline polynucleotide vaccine formula | |
| AU2004205140B2 (en) | Feline polynucleotide vaccine formula | |
| AU2004210602B2 (en) | Avian polynucleotide vaccine formula | |
| AU2008203549A1 (en) | Feline polynucleotide vaccine formula | |
| NZ506427A (en) | A canidae vaccine comprising the rabies G gene under the control of the CMV-IE promoter | |
| AU2007202367A1 (en) | Avian polynucleotide vaccine formula | |
| AU5427401A (en) | Polynucleotide vaccine formula for treating horse diseases | |
| AU4614101A (en) | Avian polynucleotide vaccine formula |