RU2135456C1 - Способ получения н-бутиральдегида и/или н-бутанола - Google Patents
Способ получения н-бутиральдегида и/или н-бутанола Download PDFInfo
- Publication number
- RU2135456C1 RU2135456C1 RU96116892A RU96116892A RU2135456C1 RU 2135456 C1 RU2135456 C1 RU 2135456C1 RU 96116892 A RU96116892 A RU 96116892A RU 96116892 A RU96116892 A RU 96116892A RU 2135456 C1 RU2135456 C1 RU 2135456C1
- Authority
- RU
- Russia
- Prior art keywords
- formula
- butadiene
- adduct
- reaction
- catalyst
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C41/00—Preparation of ethers; Preparation of compounds having groups, groups or groups
- C07C41/01—Preparation of ethers
- C07C41/32—Preparation of ethers by isomerisation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/17—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrogenation of carbon-to-carbon double or triple bonds
- C07C29/172—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrogenation of carbon-to-carbon double or triple bonds with the obtention of a fully saturated alcohol
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C41/00—Preparation of ethers; Preparation of compounds having groups, groups or groups
- C07C41/01—Preparation of ethers
- C07C41/05—Preparation of ethers by addition of compounds to unsaturated compounds
- C07C41/06—Preparation of ethers by addition of compounds to unsaturated compounds by addition of organic compounds only
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/51—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by pyrolysis, rearrangement or decomposition
- C07C45/511—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by pyrolysis, rearrangement or decomposition involving transformation of singly bound oxygen functional groups to >C = O groups
- C07C45/513—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by pyrolysis, rearrangement or decomposition involving transformation of singly bound oxygen functional groups to >C = O groups the singly bound functional group being an etherified hydroxyl group
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Способ получения н-бутиральдегида и/или н-бутанола, согласно которому а) 1,3-бутадиен подвергают взаимодействию со спиртом формулы RОН, в которой R означает алкил или алкенил с 2-20 атомами углерода, незамещенные или замещенные одной или двумя алкокси- или гидроксигруппами с 1-10 атомами углерода, арил с 6-10 атомами углерода или аралкил с 7-11 атомами углерода, или метил, при повышенных температуре и давлении в присутствии кислоты Бренстеда или в присутствии комплекса элемента из группы Iв, VIIв или VIIIв периодической системы элементов с фосфор- или азотсодержащими лигандами с получением смеси аддуктов формул II и III
б) аддукт формулы III подвергают изомеризации до аддукта формулы II, в) аддукт формулы II подвергают изомеризации в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл в газовой фазе, с получением простого енольного эфира формулы IV
и г) и получаемый енольный эфир формулы IV подвергают взаимодействию с водородом и водой или только водой в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением н-бутиральдегида и/или н-бутанола, с последующим высвобождением спирта формулы ROH и рециркуляцией последнего на реакцию а). Способ экономичен, пригоден для осуществления в крупнопромышленном масштабе, позволяет получить н-бутиладьдегид и/или н-бутанол с высоким выходом и высокой избирательностью. 6 з.п.ф-лы, 1 ил., 6 табл.
б) аддукт формулы III подвергают изомеризации до аддукта формулы II, в) аддукт формулы II подвергают изомеризации в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл в газовой фазе, с получением простого енольного эфира формулы IV
и г) и получаемый енольный эфир формулы IV подвергают взаимодействию с водородом и водой или только водой в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением н-бутиральдегида и/или н-бутанола, с последующим высвобождением спирта формулы ROH и рециркуляцией последнего на реакцию а). Способ экономичен, пригоден для осуществления в крупнопромышленном масштабе, позволяет получить н-бутиладьдегид и/или н-бутанол с высоким выходом и высокой избирательностью. 6 з.п.ф-лы, 1 ил., 6 табл.
Description
Изобретение относится к способу получения н-бутиральдегида и/или н-бутанола.
н-Бутиральдегид и н-бутанол являются веществами, получаемыми путем крупномасштабного производства и употребляемыми во многих целях. Например, мировое производство н-бутиральдегида превышает 4 миллиона тонн в год. Это вещество служит, среди другого, в качестве сырья для получения спиртов, служащих в качестве пластификаторов, н-бутанол используют в крупном масштабе в качестве растворителя, например, для лаков.
Ныне н-бутиральдегид в крупнопромышленном производстве производят практически исключительно путем гидроформилирования пропена, для чего известны разные способы, в которых в качестве катализатора гидроформилирования используют в основном кобальт или родий (см. Kirk-Othmer, Encyclopedia of Chemical Technology, 4-е изд., том 4, стр. 741 -746, издательство John Wiley & Sons, Нью-Йорк, 1992 г.).
н-Бутанол является одним из важнейших по количеству веществ, получаемых из н-бутиральдегида, а именно путем гидрирования. Другие способы получения н-бутанола, как, например, гидрирование кротонового альдегида, который со своей стороны получают путем альдольной конденсации ацетальдегида, ныне представляют интерес лишь с исторической точки зрения, или они имеют лишь регионально ограниченное значение, как, например, его микробиологическое получение путем сбраживания мелассы (см. Kirk-Othmer, Encyclopedia of Chemical Technology, 4-е изд., том 4, стр. 694 - 696, издательство John Wiley & Sons, Нью-Йорк, 1992 г.). Эти способы, в частности, гидроформилирование пропена, требуют больших капиталовложений, например, для создания высоконапорных установок для гидроформилирования с использованием кобальта в качестве катализатора, или для закупки дорогостоящего родия в качестве катализатора, для установок для его манипулирования при гидроформилировании и для обработки отработанных, родийсодержащих катализаторных растворов. Кроме того, для получения н-бутиральдегида путем гидроформилирования требуются установки для поставки синтез-газа, требуемого для гидроформилирования. Дальнейший недостаток способа гидроформилирования заключается в возникновении в качестве принудительного побочного продукта большого количества изобутиральдегида, который имеет небольшую экономическую ценность из-за немногочисленных возможностей его дальнейшего использования.
1,3-Бутадиен является основным химическим веществом, которое получают в большом количестве в установках для крекинга с водяным паром путем экстракции из фракции C4 установки, например, путем выделения с помощью н-метилпирролидона. Хотя 1,3-бутадиен имеется в распоряжении в больших количествах и является весьма дешевым сырьем, до сих пор еще не создан способный к осуществлению в крупнопромышленном масштабе способ для получения н-бутиральдегида или н-бутирола на основе 1,3-бутадиена. Одна из причин этому заключается в склонности 1,3-бутадиена к ди- и полимеризации, а также в образовании смесей 1,2- и 1,4-аддуктов в результате реакций присоединения. Причиной этого химического поведения является наличие двух конъюгированных двойных связей в 1,3-бутадиеновой молекуле (см. Kirk-Othmer, Encyclopedia of Chemical Technology, 4-е изд. , том 4, стр. 676 - 683, издательство John Wiley & Sons, Нью-Йорк, 1992 г.).
Из заявок США N 2922822 и DE N 2550902 известно, что в жидкой фазе спирты реагируют с 1,3-бутадиеном в присутствии кислых ионитов с образованием соответствующих ненасыщенных простых эфиров. Согласно заявке США N 2922 822 взаимодействие осуществляют в присутствии большого избытка метанола, что приводит к усиленному образованию нежелаемого диметилового эфира. Согласно способу, описанному в заявке DE N 2550902, в качестве главного продукта получают винилциклогексен. Согласно европейской заявке N 0 025240, присоединение спиртов к 1,3-бутадиену предпочтительно осуществляют в присутствии полярного, апротонного растворителя, который затем необходимо отгонять. Согласно заявке GB N 943160 присоединение спиртов осуществляют с использованием кислот Бренстеда в присутствии солей меди.
И комплексы переходных металлов с фосфином в качестве лиганда использовались в качестве катализаторов для присоединения спиртов к 1,3-бутадиену. Chauvin и др. (см. Bull Chim. Soc. France 652 (1974 г.) исследовали присоединение спиртов к 1,3-бутадиену с использованием комплексов никеля и палладия с триалкилфосфином соответственно триарилфосфином. Отчасти при этой реакции использовали алкоголяты, в частности, фенолаты в качестве сокатализаторов. Согласно заявке DD N 206989 для реакции изопрена со спиртами используют комплексы алкилпалладия(II) с триалкил- или триарилфосфином или -фосфитом в качестве лиганда в присутствии алкоголятов щелочных металлов. Kawazura и др. (см. J. Chem. Soc. Chem. Corn. 2213 (1972 г.)) используют хлорид родия(III) в качестве катализатора, также как и Dewhirst (см. J. Org. Chem. 22, стр. 1297 (1967 г.). Taylor (см. Symposium on new Routes to new Olefins: Division of Petroleum Chemistry, Inc. ; American Chemical Society, Boston Meeting, 1972 г.) исследовали присоединение спиртов к 1,3-бутадиену с использованием хлорида меди(I) и комплексов родия(I) и алкадиена. Jolly и др. (см. Syntesis 771 (1990 г.)) упоминают о реакции 1,3-бутадиена с комплексами триалкилфосфина и палладия. Во всех указанных реакциях образуются смеси 3-алкоксибут-1-енов и 1-алкоксибут-2-енов. Во многих из данных реакций согласно уровню техники конверсия и выход являются неудовлетворительными, и образуется большое количество олигомерных производных бутадиена, для которых практически нет возможности дальнейшего использования или которые можно дальше использовать в столь небольшом количестве, что основную часть данных принудительных побочных продуктов, которые образовались бы при крупномасштабном производстве, необходимо было бы удалять.
Для изомеризации простых аллиловых эфиров с получением простых енольных эфиров исследовали ряд реагентов. Согласно Baudry и др. (см. J. Chem. Soc. Chem. Comm. 694 (1978 г.)) при реакции 1-метоксибут-2-ена в присутствии катионного комплекса иридия образуется 1-метоксибут-1-ен. Tatsumi и др. (см. J. Organomet. Chem. 252, 105 (1983 г.)) для этой реакции используют комплекс молибдена, a Menicagli и др. (см. J. Org. Chem. 52, 5700 (1987 г.)) для изомеризации простых ацетальных аллиловых эфиров с получением простых ацетальных виниловых эфиров используют гибридокомплекс рутения и трифенилфосфина. Suzuki и др. (см. Tetrahedron Lett. 21, 4927 (1980 г.)) для изомеризации циклических ацеталей простого аллилового эфира с получением соответствующих ацеталей простого винилового эфира используют подобные комплексы рутения.
Кроме вышеуказанных гомогенных катализаторов для изомеризации простых аллиловых эфиров в жидкой фазе с получением простых енольных эфиров использовали также гетерогенные катализаторы. В результате перегруппировки простых аллилфенильных и -алкильных эфиров в присутствии палладия на активном угле в качестве катализатора согласно Boss и др. (см. Angew. Chem. 88. 578 (1976 г. )) получают соответствующий простой енольный эфир, из метилвиниловой группы которого затем в присутствии воды и кислоты освобождают пропиональдегид. В международной заявке, опубликованной под номером WO 91/03 449, описан способ изомеризации простых аллиловых эфиров до простых енольных эфиров с использованием рутениевого или родиевого катализатора на носителе в безводных условиях.
Не известно способа непосредственного одноступенного превращения простых аллиловых эфиров до соответствующих насыщенных спиртов.
Таким образом, в основу изобретения положена задача найти экономичный способ получения н-бутиральдегида и/или н-бутанола, пригодный для осуществления в крупнопромышленном масштабе и позволяющий получить данные вещества с высоким выходом и высокой избирательностью. В частности, количество образующихся в процессе побочных продуктов должно быть маленьким, или же данные побочные продукты должны сами представлять собой ценные торговые продукты. Кроме того, способ должен быть гибким с тем, чтобы можно было по выбору получать н-бутиральдегид и/или н-бутанол, в зависимости от имеющейся потребности. Способ должен быть независимым от наличия установки для получения синтез-газа и высоконапорных установок.
С учетом вышеизложенного был создан способ получения н-бутиральдегида и/или н-бутанола, который отличается тем, что а) 1,3-бутадиен подвергают взаимодействию со спиртом формулы (I)
ROH,
в которой R означает алкил или алкенил с 2 - 20 атомами углерода, незамещенные или замещенные одной или двумя алкокси- или гидроксигруппами с 1-10 атомами углерода, арил с 6-10 атомами углерода или аралкил с 7 - 11 атомами углерода, или метил,
при повышенных температуре и давлении в присутствии кислоты Бренстеда или в присутствии комплекса элемента из группы Ib, VIIb или VIIIb периодической системы элементов с фосфор- или азотсодержащими лигандами с получением смеси аддуктов формул (II)
и (III)
б) аддукт формулы (III) подвергают изомеризации до аддукта формулы (II),
в) аддукт формулы (II) подвергают изомеризации в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением енольного эфира формулы (IV),
и г) получаемый енольный эфир формулы (IV) подвергают взаимодействию с водородом и водой или только водой в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе с получением н-бутиральдегида и/или н-бутанола, с последующим высвобождением спирта формулы (I) и рециркуляцией последнего на реакцию а).
ROH,
в которой R означает алкил или алкенил с 2 - 20 атомами углерода, незамещенные или замещенные одной или двумя алкокси- или гидроксигруппами с 1-10 атомами углерода, арил с 6-10 атомами углерода или аралкил с 7 - 11 атомами углерода, или метил,
при повышенных температуре и давлении в присутствии кислоты Бренстеда или в присутствии комплекса элемента из группы Ib, VIIb или VIIIb периодической системы элементов с фосфор- или азотсодержащими лигандами с получением смеси аддуктов формул (II)
и (III)
б) аддукт формулы (III) подвергают изомеризации до аддукта формулы (II),
в) аддукт формулы (II) подвергают изомеризации в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением енольного эфира формулы (IV),
и г) получаемый енольный эфир формулы (IV) подвергают взаимодействию с водородом и водой или только водой в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе с получением н-бутиральдегида и/или н-бутанола, с последующим высвобождением спирта формулы (I) и рециркуляцией последнего на реакцию а).
Таким образом, предлагаемый способ включает четыре реакции а) - г). Реакции в) и г) могут по выбору проводиться отдельно, последовательно по меньшей мере в две стадии или практически одновременно в одну стадию. Подобное относится также к реакциям а) и б), причем изомеризация аддукта формулы (III) до аддукта формулы (II) согласно реакции б) после рециркуляции аддукта формулы (III) на присоединение спирта формулы ROH к 1,3-бутадиену проводится одновременно с присоединением согласно реакции а). Это позволяет простым образом приспосабливать условия осуществления предлагаемого способа к имеющимся на соответствующем предприятии условиям, например, тем, что уже имеющиеся на предприятии установки или узлы установки вовлекают в установку для осуществления предлагаемого способа. Кроме того, предлагаемый способ можно осуществлять без использования дорогих благородных металлов в качестве катализатора.
Понятие "стадия" в рамках данной заявки относится к узлу установки, в котором осуществляется одна из реакций а) - г) в присутствии катализатора или катализаторов, используемых в соответствующем узле, или в одном узле может одновременно осуществляться более одной, в частности, две реакции в присутствии катализатора или катализаторов, применяемых в соответствующем узле. Гидролиз соответственно комбинированные гидролиз и гидрирование простого енольного эфира формулы (IV) согласно реакции г) при этом рассматривают как одну отдельную реакцию, если в настоящей заявке ничего другого не указано.
В том случае, если используемый в соответствующем узле катализатор, или же каждый из катализаторов, используемых в одном узле, способен в конкретных условиях реакции к ускорению, например, изомеризации аддукта формулы (II) до простого енольного эфира формулы (IV) согласно реакции в) и гидролиза или гидрирования простого енольного эфира формулы (IV) до н-бутиральдегида и/или н-бутанола согласно реакции г), причем нельзя определить строгое пространственное расстояние осуществления этих реакций в узле, то в рамках данной заявке говорится об осуществлении реакций в) и г) в одну стадию. При этом один узел может включить или один реактор, или же несколько последовательно включенных реакторов, содержащих одинаковый катализатор, или, в случае необходимости, разные катализаторы и работающие на одинаковом режиме при одинаковых или различных температуре и давлении. При этом под режимом понимают осуществление реакции в жидкой фазе с использованием гомогенного катализатора или осуществление реакции в жидкой фазе с использованием гетерогенного катализатора, или же осуществление реакции в газовой фазе. Из этого следует, что в рамках настоящей заявки не говорят о "взаимодействии в одну стадию", если в отдельных последовательно включенных реакторов используют катализаторы, способные к ускорению лишь одной определенной реакции, или если в реакторах работают в разных режимах.
В нижеследующем предлагаемый способ описывается более подробно.
Согласно реакции а) 1,3-бутадиен подвергают взаимодействию со спиртом формулы (I) согласно уравнению (1)
в присутствии катализатора до 1,4-аддукта формулы (II) и 1,2-аддукта формулы (III). В получаемом 1,4-аддукте формулы (II) двойная связь может иметься в цис- или трансформе, что, однако, не имеет значения для дальнейшего осуществления способа. При этом аддукты формул (II) и (III) образуются в зависимости от условий реакции и используемого катализатора в общем в мольном соотношении от 1-1 до 1-3.
в присутствии катализатора до 1,4-аддукта формулы (II) и 1,2-аддукта формулы (III). В получаемом 1,4-аддукте формулы (II) двойная связь может иметься в цис- или трансформе, что, однако, не имеет значения для дальнейшего осуществления способа. При этом аддукты формул (II) и (III) образуются в зависимости от условий реакции и используемого катализатора в общем в мольном соотношении от 1-1 до 1-3.
Как правило, вид используемого для реакции спирта формулы (I) не является критическим для способа. Можно использовать и первичные, и вторичные спирты, однако предпочтительными являются первичные спирты. Можно применять алифатические, циклоалифатические, ароматические и аралифатические спирты, причем предпочтительными являются алифатические и аралифатические спирты. В общем для осуществления предлагаемого способа используют спирты формулы (I), в которых остаток R представляет собой алкил с 1 - 20 атомами углерода, алкенил с 2 - 10 атомами углерода, например, бут-2-енил, предпочтительно алкил с 1 - 4 атомами углерода, в частности, н-бутил, арил с 6-10 атомами углерода, предпочтительно фенил, или аралкил с 7 - 11 атомами углерода, предпочтительно бензил. В случае необходимости остаток R может быть замещенным алкоксигруппой с 1 - 10 атомами углерода и/или гидроксилом. Таким образом, в качестве спиртов формулы ROH можно также использовать диолы или триолы или алкоксиспирты. Так как эти заместители обычно критическим образом не влияют на реакцию, предпочтительно используют спирты формулы (I) с незамещенным остатком R. Само собой разумеется, что можно также использовать спирты с большим числом атомов углерода, однако такие высшие спирты обычно являются более дорогими, чем низшие спирты, и поэтому по экономическим причинам предпочитают низшие спирты.
Для осуществления реакции а) пригодно большое число катализаторов, например, кислоты Бренстеда или комплексы переходных металлов из групп Ib, VIIb или VIIIb периодической системы элементов с фосфином, в частности, комплексы палладия и никеля с фосфином.
В качестве кислот Бренстеда можно использовать, например, обычные, не подвергаемые окислению кислоты Бренстеда, как, например, галогенводородные кислоты, а именно соляную кислоту, серную кислоту, фосфорную кислоту, хлорную кислоту, фтористоводородную кислоту, тетрафторборную кислоту, метансульфокислоту или толуолсульфокислоту, однако предпочтительно используют твердые кислоты Бренстеда, в частности органические или неорганические катиониты.
Под органическими катионитами понимают полимерные полиэлектролиты в виде порошка или геля, или макропористые полиэлектролиты, на полимерной матрице имеющие функциональные группы кислоты Бренстеда, например сульфокислоты, фосфоновой кислоты, или карбоксигруппы, как, например, сульфонированные фенолформальдегидные смолы, сульфонированные сополимеры стирола и дивинилбензола, сульфонированный полистирол, поли(перфторалкилен)сульфокислоты или сульфонированные угли. В рамках предлагаемого способа эти катиониты можно использовать в виде имеющихся в торговле изделий, продаваемых, например, под названиями Amberlite, Dowex, Amberlyst, Lewatit, Wofatit, Permutit и Nation (все названия являются зарегистрированными товарными знаками). Целесообразно при осуществлении предлагаемого способа катиониты используют в их протонированной форме, т.н. водородной форме. Среди органических катионитов пригодны, например, торговые продукты Amberlite 200, Amberlite IR 120, Amberlite IR 132 E, Lewatit SC 102, Lewatit SC 104, Lewatit SC 108, Lewatit SPC 108, Lewatit SPC 112, Lewatit SPC 118 и Amberlyst 15.
Выгодных результатов можно достичь путем предлагаемого способа также при использовании модифицированных органических катионитов, например таких, которые дополнительно содержат Льюисовые кислоты, например, галогениды меди(II), в частности, хлорид, бромид или йодид меди(II), или соли меди(II), как, например, сульфат, нитрат или ацетат меди(II). Такие содержащие Льюисовые кислоты катиониты можно получать, например, по способу, описанному в заявке Великобритании N 943160. Предпочтительно содержащие Льюисовые кислоты иониты используют в форме, в которой лишь часть ионов водорода групп кислоты Бренстеда ионитов заменена катионом Льюисовой кислоты, в то время как остальные группы кислоты Бренстеда далее действуют в качестве кислот Бренстеда. В общем органические иониты содержат Льюисовую кислоту в количестве, при котором 5 - 15 моль.%, предпочтительно 10 - 40 моль.%, в частности, 15 - 30 моль. % ионов водорода имеющихся на ионите групп кислоты Бренстеда заменены соответствующей Льюисовой кислотой.
Вместо органических, кислых катионов в рамках предлагаемого способа можно также использовать действующие в качестве кислоты Бренстеда неорганические твердые вещества, как, например, β- цеолиты или Y-цеолиты в водородной форме, отбеливающие земли, как, например, бентониты, монтмориллониты или аттапульгиты, нецеолитные молекулярные сита на фосфорной основе, описанные, например, в заявках США NN 4 440 871, 4310 440, 4 567 029, 4 554 143 и 4 500 651 и в европейских заявках NN 158 976, 158 349 и 159 624, а также кислые или содержащие кислоту оксиды металлов, получение которых описано в заявке США N 4 873 017. Предпочтительными неорганическими твердыми кислотами Бренстеда являются β- цеолиты или Y-цеолиты в водородной форме, в частности, β- цеолиты в водородной форме, β- цеолиты можно получать, например, по способу, описанному в заявке США N 4 891 458.
Предпочтительно при осуществлении предлагаемого способа для присоединения спиртов формулы (I) к 1,3-бутадиену согласно реакции а) используют органические иониты.
В том случае, если для осуществления реакции а) предлагаемого способа "в качестве катализатора используют жидкие или растворенные кислоты Бренстеда, в частности, серную кислоту, фосфорную кислоту, толуолсульфокислоту, метансульфокислоту или тетрафторборную кислоту, то обычно спирт формулы ROH и 1,3-бутадиен в жидком или, предпочтительно, в газообразном виде вводят в находящуюся в реакторе кислоту, и образуемые аддукты формул (II) и (III) выделяют из реакционной смеси путем перегонки или отгонки. Для этого можно использовать обычные реакторы как барботажные колонны, снабженные рециркуляционной линией реакторы и др.
Целесообразно смесь спирта и 1,3-бутадиена подают в кислоту, например, с использованием струйных сопел. Аддукты формул (II) и (III) можно выделять из водного раствора кислоты Бренстеда также с помощью разделителя фаз. Вместо барботажной колонны или снабженного рециркуляционной линией реактора можно также использовать последовательно установленные реакторы с мешалкой, причем предпочтительно работают при давлении, при котором 1,3-бутадиен в выбранных условиях реакции имеется в жидком виде.
Однако в рамках предлагаемого способа предпочтительно используют твердые кислоты Бренстеда в виде вышеперечисленных органических или неорганических катализаторов, в частности органические иониты. Их предпочтительно размещают в твердом слое, через который жидкую реакционную смесь пропускают сверху или снизу. Твердый катализаторный слой можно также, например, размещать в трубчатых реакторах или последовательно установленных реакторах. Далее возможно пропускать реагенты через катализаторный слой в газообразном виде, но предпочтительно работают в жидкой фазе. Само собой разумеется, что присоединение спирта формулы ROH к 1,3-бутадиену согласно реакции а) можно осуществлять или непрерывно, или периодически.
Мольное соотношение спирта и 1,3-бутадиена может колебаться в широких пределах. В общем оно составляет 0,5 - 1 до 5- 1, предпочтительно 1- 1 до 2,5- 1, особенно предпочтительно 1,5- 1 до 2,5- 1. В случае осуществления предлагаемого способа в жидкой фазе взаимодействие спирта формулы ROH с 1,3-бутадиеном проводят обычно при температуре 20-150oC, предпочтительно 50-120oC, в частности 70-110oC, и при давлении 10-100 бар, предпочтительно 10-50 бар, в частности 20-30 бар. Целесообразно давление выбирают так, что 1,3-бутадиен имеется в жидком состоянии при температуре реакции. Приложение более высокого давления возможно. Целесообразно температуру, оптимальную с учетом используемой в качестве катализатора кислоты Бренстеда, определяют путем предварительного опыта. Если в качестве служащей в качестве катализатора кислоты Бренстеда используют минеральные кислоты или сильно кислые иониты, как, например, Nation (торговый продукт), то реакция проходит при такой низкой температуре, как комнатной.
В общем смесь спирта формулы ROH и 1,3-бутадиена пропускают через слой твердого катализатора со скоростью 0,01 - 0,5 г/см3 в час, предпочтительно 0,02 - 0,4 г/см3 в час, особенно предпочтительно 0,02 - 0,05 г/см3 в час. К реакционной смеси можно добавлять растворитель, однако добавление растворителя в общем не требуется, так как и используемый спирт, и аддукты формул (II) и (III) могут служить в качестве растворителя. Время пребывания смеси спирта формулы ROH и 1,3-бутадиена в реакторе обычно составляет 1 - 6 часов и, как правило, зависит от температуры реакции.
В случае, если присоединение спирта формулы ROH к 1,3-бутадиену осуществляют в газовой фазе, то обычно выбирают температуру нижу 120oC и давление ниже 20 бар. При необходимости газообразную реакционную смесь можно смешивать с газом, инертным в условиях реакции, например, азотом, но обычно ее используют без разбавления.
Согласно дальнейшей форме осуществления предлагаемого способа для присоединения спирта формулы ROH можно использовать катализатор, содержащий переходный металл из группы Ib, VIIb или VIIIb периодической системы элементов, например, медь, никель, родий, палладий, платину, рений или иридий, предпочтительно палладий или никель, в гомогенно растворенном в реакционной смеси виде или в гетерогенном виде.
Целесообразно данные катализаторы, содержащие переходный металл, в частности палладий- и никельсодержащие катализаторы, используют в виде комплекса, например, с фосфином, 2,2'-бипиридином или 1,10-фенантролином, гомогенно растворенного в реакционной среде. В рамках предлагаемого способа для этой цели для образования комплекса с металлом группы Ib, VIIb или VIIIb, в частности, палладия и никеля, можно использовать много разных фосфинов, 2,2'-бипиридинов или 1,10-фенантролинов. В качестве лигандов пригодны также монодендритные или многодендритные, в частности, дидендритные фосфины, например, триалкилфосфины, триарилфосфины, алкилдиарилфосфины, арилдиалкилфосфины, арилдифосфины, алкилдифосфины и арилалкилдифосфины. Содержащие алкилы фосфины могут включить одинаковые или различные алкилы или циклоалкилы с 1 - 10 атомами углерода, предпочтительно с 1 - 6 атомами углерода. Содержащие арилы фосфины могут включить одинаковые или различные арилы с 6 - 12 атомами углерода, в частности, фенил или нафтил, или же дифенилы. Кроме того, фосфины можно использовать для образования комплексов с элементами группы Ib, VIIb или VIIIb, вместе с другими алкилами или арилами содержащих гетероциклоалифатические группы, как, например, пирролидин, имидазолин, пиперидин, морфолин, оксазолидин, пиперази или триазолидин, или гетероароматические группы, как, например, пиррол, имидазол, оксазол, индол, пиридин, хинолин, пиримидин, пиразол, пиразин, пиридазин или хиноксалин. Алкильные или арильные группы лигандов могут быть незамещенными или замещенными инертными в условиях реакции заместителями, как, например, алкоксигруппой с 1 - 4 атомами углерода, диалкиламиногруппой с 1 - 4 атомами углерода в каждой алкильной части, алкилом с 1-6 атомами углерода, нитро, циано или сульфонатом.
Принципиально применение таких лигандов для образования комплексов с элементами группы Ib, VIIb или VIIIb, в частности палладия и никеля, не ограничено в рамках предлагаемого способа. Однако по причинам экономичности предпочтительно используют лиганды, которые можно получать простым образом.
В качестве примеров таких лигандов можно назвать триметилфосфин, триэтилфосфин, трипропилфосфин, триизопропилфосфин, трибутилфосфинн, триоктилфосфин, тридецилфосфин, трициклопентилфосфин, трициклогексилфосфин, трифенилфосфин, тритолилфосфин, циклогексилдифенилфосфин, тетрафенилдифосфинометан, 1,2-бис(дифенилфосфино)этан, тетраметилдифосфинометан, тетраэтилдифосфинометан, 1,3-бис(дифенилфосфино)пропан, 1,4-бис(дифенилфосфино)бутан, тетра-т-бутил-дифосфинометан, 1,2-бис-(диметилфосфино)этан, 1,2-бис(диэтилфосфино)этан, 1,2-бис(дипропилфосфино)этан, 1,2-бис(диизопропилфосфино)этан, 1,2-бис(дибутилфосфино)этан, 1,2-бис(ди-т-бутилфосфино)этан, 1,2-бис(дициклогексилфосфино)этан, а также бифосфины, описанные в европейских заявках N 279 018, N 311 619 и N71 281 и в международной заявке, опубликованной под номером WO 90/06 810. Наряду со способами, описанными в данных патентных заявках, алкилы и арилы в качестве лиганда можно получать известными методами, например, описанными в Houben-Weyl, Methoden der Organischen Chemie, том XII/1, 4-е издание, стр. 17-65 и 182- 186, издательство Tieme, г. Штуттгарт, DE, 1963 г. и том Е1, 4-е издание, стр. 106 -199, издательство Tieme, г. Штуттгарт, DE, 1982 г.
Кроме фосфинов в качестве лигандов можно использовать также 2,2'-бипиридин или 1,10-фенантролин, например, производные 2,2'-бипиридина или 1,10-фенантролина, замещенные алкилом или арилом, или анеллированные производные 2,2'-бипиридина или 1,10-фенантролина, замещенные алкилом или арилом, или анеллированные производные 2,2'-бипиридина или 1,10 фенантролина, содержащие ответственную за комплексообразующее свойство 2,2'-бипиридина или 1,10-фенантролина группу (-N= C-C=N-), например, 2,2'-бихинолин, 4,7-дифенил-1,10-фенантролин, 2,9-диметил-4,7-дифенил-1,10-фенантролин, 4,5-диазафлуорен, дипиридо[3,2-а:2',3'-с]феназин, 2,2',6',2''-терпиридин и т.п. Эти лиганды отчасти можно приобрести в торговле, например, 2,2'-бипиридин или 1,10-фенантролин, или их можно получать по методам, описанным в Synthesis 1, 1976 г. или Aust. J. Chem. 23, стр. 1023, 1970 г.
Пригодные для применения для осуществления реакции а) предлагаемого способа комплексы элементов группы Ib, VIIb или VIIIb, в частности, палладия и никеля, можно получать или непосредственно в реакционной смеси, или их можно добавлять к реакционной смеси в готовом виде. Для получения данных комплексов в реакционной смеси к последней обычно добавляют соединения элементов группы Ib, VIIb или VIIIb, например, их галогениды, предпочтительно их хлориды, бромиды или йодиды, нитраты, цианиды, сульфаты, или комплексные соединения данных металлов, как, например, ацетилацетонаты, карбоксилаты, карбонильные или олефиновые комплексы, как, например, этен- или бутадиеновые комплексы, вместе с соответствующим лигандом, после чего образуются комплексы, согласно изобретению требуемые для осуществления реакции а). Обычно комплексообразователь добавляют в мольном соотношении относительно элемента группы Ib, VIIb или VIIIb, составляющем 2 - 200, предпочтительно 2 - 10, в частности 2 - 4.
В общем при присоединении спирта формулы ROH к 1,3-бутадиену согласно реакции а) предлагаемого способа при использовании комплекса элемента группы Ib, VIIb или VIIIb в качестве катализатора, в частности, палладия, устанавливают соотношение 1,3-бутадиена к элементу группы Ib, VIIb или VIIIb, составляющее 100 - 1 до 100 000 - 1, предпочтительно 200 - 1 до 2000 - 1, особенно предпочтительно 400 - 1 до 1000 -1, причем в случае непрерывного осуществления способа указанное мольное соотношение относится к концентрации 1,3- бутадиена в жидкой реакционной смеси.
Мольное соотношение спирта формулы ROH и 1,3-бутадиена можно варьировать при данном варианте предлагаемого способа в широких пределах, оно, как правило, не является критическим. Например, подлежащий присоединению к 1,3-бутадиену спирт может служить не только как реагент, но и в качестве растворителя комплексного катализатора. Поэтому в общем в предлагаемом способе для осуществления реакции а) выбирают мольное соотношение спирта и 1,3-бутадиена от 0 - 1 до 10 - 1, предпочтительно от 1 - 1 до 5 - 1, особенно предпочтительно от 1 -1 до 2 - 1, причем в случае непрерывного осуществления реакции это соотношение относится к концентрации 1,3- бутадиена в жидкой реакционной смеси.
Присоединение спирта формулы ROH к 1,3-бутадиену согласно реакции а) предлагаемого способа с помощью вышеуказанных комплексных катализаторов осуществляют предпочтительно в жидкой фазе. В общем сначала катализатор подают в реактор в растворенном в жидкой реакционной среде виде, а затем 1,3-бутадиен в жидком или газообразном виде вводят в реакционную смесь вместе со спиртом. В качестве реакционной среды может служить подлежащий присоединению к 1,3-бутадиену спирт или инертный в условиях реакции растворитель, предпочтительно имеющий высокую точку кипения. В качестве растворителя пригодны, например, продукты конденсации, образующиеся при реакции, как, например, алкоксиоктадиены, алкоксидодекатриены, а также простые эфиры, как, например, дибутиловый эфир, диэтиленгликольдибутиловый эфир, низкомолекулярные полиэтиленгликолевые эфиры и сульфоны, а также сульфолан.
В случае периодического осуществления способа реакцию проводят обычно в снабженном мешалкой автоклаве. Целесообразно получаемые при этом аддукты формул (II) и (III) затем выделяют из реакционной смеси путем перегонки, причем гомогенный катализатор, содержащий элемент группы Ib, VIIb или VIIIb, в частности, палладий или никель, остается в кубе перегонки, в растворенном в высококипящем растворителе виде. Таким образом раствор катализатора, сохранившийся в кубе перегонки, можно использовать для дальнейших реакций.
В случае непрерывного осуществления способа 1,3-бутадиен предпочтительно вводят в жидком виде и под давлением в реакционную смесь, содержащую спирт формулы ROH и гомогенно растворенный катализатор, представляющий собой комплекс переходного металла, а также, в случае необходимости, высококипящий растворитель. Реакцию целесообразно осуществляют в трубчатом реакторе или, предпочтительно, в последовательно установленных реакторах. Непрореагировавший 1,3-бутадиен целесообразно циркулируют. Спирт формулы ROH целесообразно непрерывно добавляют к реакционной смеси в соответствии его конверсии по ходу реакции.
Согласно другому варианту непрерывного осуществления предлагаемого способа 1,3-бутадиен можно в газообразном виде пропускать через жидкую реакционную среду, содержащую катализатор, причем непрореагировавший 1,3-бутадиен служит для отгонки из реакционной смеси сравнительно легколетучих аддуктов формул (II) и (III), образовавшихся при реакции со спиртом. При этом спирт формулы ROH можно непрерывно добавлять к реакционной смеси в соответствии его конверсии по ходу реакции.
Присоединение спирта формулы ROH к 1,3-бутадиену в присутствии указанных комплексов элементов группы Ib, VIIb или VIIIb, в частности, палладия или никеля, в общем осуществляют при температуре 20 - 180oC, предпочтительно 50 - 150oC, особенно предпочтительно 80 - 120oC, и при давлении, составляющем предпочтительно 6-10 бар, а особенно предпочтительно при устанавливающемся давлении.
Согласно предлагаемому способу для присоединения спирта формулы ROH к 1,3-бутадиену согласно реакции а) можно использовать гетерогенные катализаторы, предпочтительно такие, в которых элемент группы Ib, VIIb или VIIIb, в частности, палладий или никель, присоединен к полимерной матрице. Такие полимерные матрицы могут представлять собой, например, смолы, как, например, стирол-дивинил-бензольные смолы или фенол-формальдегидные смолы, связанные к соответствующим хелатным лигандам, то есть фосфинам, 1,10-фенантролинам или 2,2'- бипиридинам, которые со своей стороны образуют комплексы с элементом группы Ib, VIIb или VIIIb, в частности, палладием или никелем, как будто демобилизуя их. В качестве гетерогенных матриц для связывания комплексов элементов группы Ib, VIIb или VIIIb, в частности, комплексов палладия и никеля, можно использовать также неорганические носители, которые предварительно подвергают гидрофобизации и химической модификации их поверхности с помощью органических реагентов. Такие гетерогенные, полимерно связанные комплексы элементов группы Ib, VIIb или VIIIb, в частности, комплексы палладия и никеля, можно получать, например, по методу, описанному Zhuangyu и др. (см. Reactive Polymers 9, стр. 249, 1988 г.). Связанные комплексы фосфина элементов группы Ib, VIIb или VIIIb можно получать, например, согласно методам, описанным Hartley (см. Adv. Organomet. Chem. 15, стр. 189, 1977 г.), F. R. Hartley (см. "Supported Metal Complexes", Riedel, Domdrecht, 1985 г.), К. Smith (см. "Solid Supports and Catalysis in Organic Synthesis", Ellis Horwood, Prentice Hall, Нью-Йорк, 1992 г.), С. Н. Pittman (см. "Polymer supported Reactions in Organic Synthesis, стр. 249, Wiley, Chichester, 1980 г., и J. Am. Chem. Soc. 98. стр. 5407, 1976 г.), и в Ann. N.Y. Acad. Sci 245. стр. 15, 1977 г. Преимущество использования таких гетерогенных катализаторов заключается, в частности, в возможности более легкого и щадящего отделения катализатора от продуктов реакции. Катализатор может иметься в твердом слое, через который пропускают реакционную смесь, или же в суспендированном в реакционной смеси виде, и после завершения реакции его отделяют механическим путем.
Вместо чистого 1,3-бутадиена в рамках предлагаемого способа в качестве сырья можно также использовать содержащие 1,3-бутадиен углеводородные потоки. Такие углеводородные потоки получают, например, в установках для крекинга с водяным паром в качестве т.н. фракции C4. Целесообразно данные углеводородные потоки перед их использованием в рамках предлагаемого способа очищают от возможно содержащихся в них ацетиленовых или алленических углеводородов путем их частичного гидрирования (см. Weissermel, Arpe, "Industrielle Organische Chemie, 3-е издание, издательство VCH Verlagsgesellschaft, г. Weinheim, DE, 1988 г.). Содержащие 1,3-бутадиен углеводородные потоки можно затем аналогичным подаче чистого 1,3-бутадиена образом подать на стадию а) предлагаемого способа. Целесообразно насыщенные или моноолефиновые углеводороды, содержащиеся в таких углеводородных потоках и не прореагировавшие при реакции в реакции а), удаляют из конечного продукта реакции а), например, с помощью сепаратора для отделения газа от жидкости. Аддукты формул (II) и (III), получаемые в результате взаимодействия углеводородных потоков согласно реакции а) предлагаемого способа, можно нижеописанным образом перерабатывать с получением н-бутиральдегида и/или н-бутанола таким же образом, как и аддукты формул (II) и (III), получаемые с использованием чистого 1,3-бутадиена согласно реакции а).
Конечный продукт реакции а) предлагаемого способа в общем содержит непрореагировавший 1,3-бутадиен, аддукты формул (II) и (III) и, возможно, в частности, в случае кислоты Бренстеда в качестве катализатора в реакции а), несколько изомеров соответствующего алкоксиоктадиена, которые в нижеследующем обобщенно обозначают как алкоксиоктадиен. Алкоксиоктадиен образуется при присоединении спирта формулы ROH к 1,3-бутадиену в побочной реакции, при которой сперва 1,3-бутадиен подвергается димеризации с получением октатриена, к которому затем присоединяется спирт формулы ROH с получением алкоксиоктадиена. Наряду с этими компонентами конечный продукт реакции а) может содержать небольшое количество других побочных продуктов, например, октатриен, винилциклогексен, алкоксидодекатриены, образуемые путем тримеризации 1,3-бутадиена до додекатетраена с последующим присоединением спирта формулы ROH, додекатетраен, диалкоксиоктен и диалкоксибутан. На образование этих побочных продуктов можно влиять путем выбора соответствующего режима осуществления реакции а), например, путем выбора соотношения 1,3-бутадиена и спирта формулы ROH в реакционной смеси, выбора температуры реакции и давления, и таким образом при желании количество побочных продуктов можно сократить до минимума.
Аддукт, требуемый для получения н-бутиральдегида и/или н-бутанола согласно предлагаемому способу, представляет собой 1-алкокси-бутен-2 формулы (II), который для получения целевых соединений в предлагаемом способе можно отделять от его изомера 3-алкокси-бутен-1 формулы (III), содержащегося в конечном продукте примерно в равном количестве. Так как аддукты формул (II) и (III) образуются при присоединении спирта формулы ROH к 1,3-бутадиену примерно в равном количестве, предлагаемый способ не был бы экономичным при осуществлении в крупнопромышленном масштабе, если бы не удалось экономичным образом превратить 3-алкокси-бутен-1 формулы (III) в желаемый 1-алкокси-бутен-2 формулы (II). Неожиданно выявилось, что превращение аддукта формулы (III) в желаемый аддукт формулы (II) можно осуществлять простым и экономичным образом.
Для этой цели аддукт формулы (III) сперва отделяют от изомерного аддукта формулы (II), содержащегося в конечном продукте реакции а), целесообразно путем ввода продукта реакции а) в перегонный аппарат (после предварительного отделения непрореагировавшего 1,3-бутадиена, например, с помощью сепаратора для отделения газа от жидкости) и отделения путем фракционной перегонки.
При фракционной перегонке от аддукта формулы (II) можно также отделять содержащиеся в продукте реакции а) побочные продукты, димеры и тримеры 1,3-бутадиена и их аддукты со спиртом формулы ROH, и возможно образовавшиеся неоднократно алкоксилированные побочные продукты. Так как данные побочные продукты в общем не мешают дальнейшим реакциям предлагаемого способа, их можно и не отделять. При перегонке можно кроме аддукта формулы (III) отделять лишь часть побочных продуктов, в частности, олефиновые димеры и тримеры 1,3-бутадиена и неоднократно алкоксилированные побочные продукты, причем другие побочные продукты, в частности, алкоксиоктадиен и, при желании, алкоксидодекатриен, не отделяют, а дальше перерабатывают в последующих реакциях вместе с аддуктом формулы (II), причем из этих побочных продуктов реакции а) в качестве конечных продуктов получают октанолы соответственно додеканолы, которые являются ценными пластификаторами.
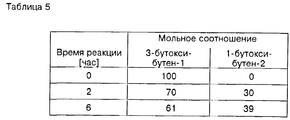
Отделение легче летучего аддукта формулы (III) от аддукта формулы (II) путем перегонки можно осуществлять простым образом, например, в обычных перегонных колоннах. Затем аддукт формулы (III), отделенный от желаемого аддукта, можно, как и непрореагировавший 1,3-бутадиен, рециркулировать на реакцию а) предлагаемого способа. Рециркуляция аддукта формулы (III) на реакцию а) предлагаемого способа приводит к изомеризации аддукта формулы (III) до аддукта формулы (II) на данной стадии и, в конечном счете, к предотвращению образования нежелаемого аддукта формулы (III), так что при применении метода рециркуляции как конечный результат образуется практически лишь желаемый аддукт формулы (II), а не его нежелаемый изомер формулы (III).
Альтернативно рециркуляции аддукта формулы (III) на реакцию а) предлагаемого способа его изомеризацию можно также осуществлять в отдельную стадию изомеризации тем, что аддукт формулы (III), отделенный от аддукта формулы (II), пропускают, например, через реактор, снабженный одним из катализаторов, пригодных для осуществления реакции а), получаемый в данном реакторе продукт, состоящий из смеси аддуктов формул (II) и (III), разделяют на аддукт формулы (II) и аддукт формулы (III), например, путем перегонки, новообразовавшийся аддукт формулы (II) перерабатывают до н-бутиральдегида и/или н-бутанола на дальнейших стадиях предлагаемого способа, а аддукт формулы (III) рециркулируют в данный реактор для изомеризации.
Изомеризацию аддукта формулы (III) до аддукта формулы (II) в реакторе для изомеризации можно осуществлять или в среде растворителя, или без растворителя. Предпочтительно данную реакцию проводят без растворителя. В том случае, если изомеризацию осуществляют в среде растворителя, то обычно используют высококипящие растворители, например, простые эфиры как, например, ди- или триэтиленгликольдиметиловый эфир, ди- или триэтиленгликольдибутиловый эфир, сульфоксиды, как, например, диметилсульфоксид, или сульфоны , как, например, сульфолан, высококипящие ароматические или алифатические углеводороды или галогенированные алифатические или ароматические растворители, например, дихлорбензол. Возможно также использовать низкокипящие растворители, однако это приводит, как правило, к увеличению затрат на разделение продукта из реактора для изомеризации на аддукты формул (II) и (III) путем перегонки.
В дальнейшем процессе осуществления предлагаемого способа для получения н-бутиральдегида и/или н-бутанола аддукт формулы (II) согласно реакции в) в присутствии катализатора подвергают изомеризации до енольного эфира формулы (IV), который затем согласно реакции г) в присутствии катализатора и воды подвергают гидролизу до н-бутиральдегида и/или в присутствии катализатора, воды и водорода переводят в н-бутанол. Согласно изобретению реакции в) и г) можно осуществлять по выбору или последовательно в две стадии, или последовательно в одном-единственном реакторе, или же, особенно выгодно, в одну стадию. Обе реакции в) и г) можно осуществлять или в газовой, или в жидкой фазе.
Как упомянуто выше, реакцию в), т.е. изомеризацию аддукта формулы (II) до енольного эфира формулы (IV), его взаимодействие с водой или водой и водородом до н-бутиральдегида и/или н-бутанола особенно предпочтительно осуществляют в одну стадию, которая, следовательно, включает следующие химические реакции согласно уравнению (2)
Последним шагом реакции, то есть гидролиз енольного эфира формулы (IV) до н-бутиральдегида с одной стороны или же комбинированные гидролиз/гидрирование енольного эфира формулы (IV) до н-бутанола с другой стороны, можно управлять путем выбора соответствующих условий реакции, в частности, катализатора и количества подаваемых на реакцию воды и водорода, так, что по выбору в качестве конечного продукта предлагаемого способа избирательно образуется н-бутиральдегид или н-бутанол, или же смесь обоих ценных продуктов.
Последним шагом реакции, то есть гидролиз енольного эфира формулы (IV) до н-бутиральдегида с одной стороны или же комбинированные гидролиз/гидрирование енольного эфира формулы (IV) до н-бутанола с другой стороны, можно управлять путем выбора соответствующих условий реакции, в частности, катализатора и количества подаваемых на реакцию воды и водорода, так, что по выбору в качестве конечного продукта предлагаемого способа избирательно образуется н-бутиральдегид или н-бутанол, или же смесь обоих ценных продуктов.
Неожиданно выявилось, что катализаторы, ускоряющие изомеризацию аддукта формулы (II) до енольного эфира формулы (IV), в общем также пригодны в качестве катализаторов для гидролиза енольного эфира формулы (IV) до н-бутиральдегида или для комбинированных гидролиза и гидрирования енольного эфира формулы (IV) до н-бутанола. Поэтому при осуществлении предлагаемого способа согласно особенно предпочтительному варианту, то есть осуществлении реакций в) и г) в одну стадию для получения н-бутиральдегида в качестве конечного продукта и для получения н-бутанола в качестве конечного продукта, можно использовать одинаковые катализаторы.
И изомеризацию аддукта формулы (II) до енольного эфира формулы (IV), и гидролиз енольного эфира формулы (IV) до н-бутиральдегида соответственно комбинированные гидролиз, и гидрирование енольного эфира формулы (IV) до н-бутанола можно осуществлять в газовой или жидкой фазе. При осуществлении этих реакций в одну стадию в жидкой фазе можно использовать гомогенные или гетерогенные катализаторы, а при работе в газовой фазе в общем предпочитают гетерогенные катализаторы.
В качестве гомогенных катализаторов для изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и его гидролиза соответственно комбинированных гидролиза и гидрирования до н-бутиральдегида и/или н-бутанола в одну стадию пригоден целый ряд соединений переходных металлов, в частности такие, которые содержат элементы из побочной группы 1, V, VI, VII, и VIII периодической системы элементов, причем предпочтительными являются медь, ванадий, хром, молибден, вольфрам, рений, железо, кобальт, никель, рутений, родий, палладий, платина, осмий и/или иридий.
В качестве катализатора пригодны, например, соли указанных переходных металлов, в частности, их растворимые в реакционной среде галогениды, нитраты, сульфаты, фосфаты, карбоксилаты, например, их карбоксилаты с 1 - 20 атомами углерода, как, например, формиаты, ацетаты, пропионаты, 2-этилгексаноаты, а также цитраты, тартраты, малаты, малонаты, малеинаты или фумараты, сульфонаты, как, например, метансульфонаты, бензолсульфонаты, нафталинсульфонаты, толуолсульфонаты или трифторметансульфонаты, цианиды, тетрафторбораты, перхлораты или гексафторфосфаты, а также растворимые соли оксокислот данных металлов, в частности, соли щелочного или щелочно-земельного металла, ониевые соли, как, например, аммониевые, фосфониевые, арсониевые или стибониевые соли, соли оксокислот ванадия или рения, или рениевая кислота, ангидриды данных кислот, в частности, гептоксид дирения, растворимые неорганические комплексные соединения данных элементов, в частности, их водные, амминовые, галогеновые, фосфиновые, фосфитовые комплексы, циано- или аминокомплексы, а также комплексы данных переходных металлов с образователями хелатов, а именно, ацетилацетоном, диоксименами, как, например, диацетилдиоксимом, фурилдиоксимом или бензилдиоксимом, этилендиаминтетрауксусную кислоту, нитрилотриуксусную кислоту, нитрилотриэтанол, мочевины или тиомочевины, бисфосфины, бисфосфиты, бипиридины, терпиридины, фенантролины, 8-гидроксихинолин, крауновые эфиры или полиалкиленгликоли, и органические металлосоединения этих переходных металлов, как, например, карбонильные комплексы как HRuCl(CO)(PPh3)3, HRuCl(CO)(гексилдифенилфосфин)3, RuH2(CO)(PPh3)3, RuH2(PPh)3, или IrCl(CO)(PPh3)3 (PPh3 означает трифенилфосфин), Fe2(CO)9 или Fe3(СО12), соединения органотриоксорения(VII) как, например, алкилтриоксорений(VII) с 1 - 4 атомами углерода в алкильной части, в частности, метилтриоксорений(VII), циклопентадиенилтриоксирений(VII), или фенилтриоксорений(VII).
Предпочтительными солеобразными гомогенными катализаторами являются галогениды, в частности, хлорирды, нитраты, сульфаты, сульфонаты, карбоксилаты и цианиды родия, рутения, палладия, платины, иридия, рения и ванадия, а также соли щелочных металлов и щелочно-земельных металлов, аммониевые, алкиламмониевые, ариламмониевые, арилфосфониевые и алкилфосфониевые соли кислот ванадия, в частности, их монованадаты, кислот рения, в частности, их ренаты(IV), ренаты(VI) и надренаты.
Дальнейшим пригодным гомогенным катализатором является гептоксид дирения (Re2O7).
В качестве неорганических комплексных соединений, которые используют предпочтительно в рамках предлагаемого способа для осуществления стадий в) и г), можно называть, например, трихлорид рутения или родия, или гексакводитозилат иридия.
Соединениями переходных металлов, которые согласно изобретению предпочтительно используют для осуществления реакций в) и г), являются, например, комплексы карбонила, например, HRh(PPh3)3(CO), HRuCl(CO)PPh3)3 или RuCl2(CO)2(PPh3)3, а также соединения органические соединения триоксорения формулы (V)
,
в которой R1 означает алкил с 1 - 10 атомами углерода, циклопентадиенил, незамещенный или замещенный 1 - 5 заместителями из группы, включающей алкилы с 1 - 4 атомами углерода, арил с 6 - 10 атомами углерода или аралкил с 7 - 11 атомами углерода. Получение этих органических соединений триоксорения описано в Angew. Chem. 100. стр. 420 (1988 г.), Angew. Chem. 103. стр. 183 (1991 г. ), J. Organomet. Chem. 297. С 5 (1985 г.), Angew. Chem. 100. стр. 1269 (1988 г.) и J. Organomet. Chem. 382. стр. 1 (1990 г.).
,
в которой R1 означает алкил с 1 - 10 атомами углерода, циклопентадиенил, незамещенный или замещенный 1 - 5 заместителями из группы, включающей алкилы с 1 - 4 атомами углерода, арил с 6 - 10 атомами углерода или аралкил с 7 - 11 атомами углерода. Получение этих органических соединений триоксорения описано в Angew. Chem. 100. стр. 420 (1988 г.), Angew. Chem. 103. стр. 183 (1991 г. ), J. Organomet. Chem. 297. С 5 (1985 г.), Angew. Chem. 100. стр. 1269 (1988 г.) и J. Organomet. Chem. 382. стр. 1 (1990 г.).
Особенно предпочтительными гомогенными катализаторами для осуществления реакций в) и г) в одну стадию являются комплексы указанных переходных металлов, в частности, кобальта, никеля, родия, рутения, палладия, платины и иридия с монодендритными или многодендритными, в частности дидендритными, фосфинами или фосфитами в качестве лиганда и/или с азотсодержащими лигандами, свойство в качестве комплексообразователя которых обусловлено наличием группы (-N=C-C=N-), например, 2,2'-бипиридин или 1,10- фенантролин, а также лиганды, производные от указанных основных структур путем замещения или анеллирования.
Пригодными фосфинами в качестве лигандов являются, например, лиганды, пригодные для осуществления реакции а) предлагаемого способа и указанные выше в связи с описанием реакции а). В качестве примеров 2,2'-бипиридина или 1,10-фенантролина в качестве лигандов можно также называть те лиганды, которые указаны выше для реакции а), и их указанные там же производные и структурные аналоги.
Пригодными фосфитами в качестве лигандов являются, например, триалкилфосфиты, алкилдиарилфосфиты, триарилфосфиты, алкил-бис-фосфиты, арил-бис-фосфиты, алкил-арил-бис-фосфиты. Несущие алкилы фосфиты в качестве лигандов могут содержать одинаковые или различные алкилы с 1 - 10 атомами углерода, предпочтительно с 1 - 6 атомами углерода, или циклоалкилы. Несущие арилы фосфиты в качестве лигандов могут содержать одинаковые или различные арилы с 6-12 атомами углерода, предпочтительно фенил или нафтил, а также дифенил. Кроме того, фосфиты можно использовать в качестве лигандов для образования комплексов с переходными металлами, несущими гетероциклоалифатические группы, как, например, пирролидин, имидазолидин, пиперидин, морфолин, оксазолидин, пиперазин или триазолидин, или гетероароматические группы, как, например, пиррол, имидазол, оксазол, индол, пиридин, хинолин, пиримидин, пиразол, пиразин, пиридазин или хиноксазолин, вместе с другими алкилами или арилами. Алкилы или арилы служащих в качестве лигандов фосфитов могут быть незамещенными или замещенными группами, инертными в условиях реакции, например, алкоксигруппой с 1-4 атомами углерода, диалкиламиногруппой с 1-4 атомами углерода в каждой алкильной части, алкилом с 1 - 6 атомами углерода, гидроксилом, нитрогруппой, цианогруппой или сульфонатом. Замещенные сульфонатом фосфиты в качестве лиганда и их комплексы обычно являются водорастворимыми. Пригодными фосфитами в качестве лигандов являются, например, триметилфосфит, триэтилфосфит, трипропилфосфит, триизопропилфосфит, трибутилфосфит, трициклопентилфосфит, трициклогексилфосфит, трифенилфосфит и моно- и бифосфиты, описанные в европейских заявках NN 472 071, 213639, 214622, 2261, 2821, 9115, 155508 и 353770, в заявке DE N 2733796 и в заявках США NN 4318845, 4204997 и 4362830.
В случае осуществления реакций в) и г) с использованием в качестве комплексов фосфина или фосфита, способных к гомогенному растворению в реакционной среде, может быть выгодным дополнительно добавлять к реакционной смеси фосфин или фосфит, предпочтительно фосфин или фосфит, служащий в качестве лиганда в используемом гомогенном катализаторе. Это может продлить срок службы гомогенного катализатора и, кроме того, может улучшить избирательность изомеризации аддукта формулы (II) до енольного эфира формулы (IV), а также избирательность при комбинированных гидролизе/гидрировании енольного эфира формулы (IV) до н-бутанола, тем самым улучшая и избирательность общего процесса. В подобной степени пригодный эффект может вызвать добавление окиси углерода к реакционной смеси, в частности, в случае использования карбонилсодержащих комплексов переходного металла в качестве гомогенных катализаторов.
Хотя для получения н-бутиральдегида как конечного продукта не требуется добавления водорода к реакционной смеси, добавление небольшого количества водорода, в случае необходимости вместе с добавлением небольшого количества окиси углерода при использовании карбонилсодержащих гомогенных катализаторов, может приводить к продлению срока службы этих гомогенных катализаторов. Целесообразно для этого можно применить синтез-газ.
Для достижения вышеуказанных результатов фосфин или фосфит обычно используют в количестве 2 - 100 моль, предпочтительно 2 - 20 моль, особенно предпочтительно 2 - 5 моль в пересчете на комплекс фосфина или фосфита с переходным металлом. В том случае, если комплекс переходных металлов получают в реакционной смеси, то целесообразно добавляют соответствующий избыток фосфина или фосфита в качестве лиганда.
Содержащие переходный металл катализаторы, гомогенно растворимые в реакционной среде, обычно используют в количестве, составляющем предпочтительно 0,05 - 0,2 моль.% в расчете на подаваемый в реактор аддукт формулы (II). Как естественно знает специалист, количество добавляемого гомогенного катализатора зависит от его каталитической активности. Поэтому в зависимости от вида используемого гомогенного катализатора может быть выгодным добавлять к реакционной смеси большее или меньшее количество гомогенного катализатора. Целесообразно оптимальное количество конкретно используемого гомогенного катализатора определяют путем предварительного опыта.
Проведение реакций в) и г) в одну стадию с применением указанных гомогенных катализаторов можно осуществлять или периодически, например, в снабженных мешалкой котлах, или непрерывно, например, в трубчатых реакторах, при температуре, обычно превышающей 80oC, и при давлении, обычно составляющем 5 - 100 бар, предпочтительно 10 - 60 бар. Изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и реакцию последнего с получением н-бутиральдегида и/или н-бутанола в одну стадию можно осуществлять в отсутствии или присутствии растворителя, например, алифатического или ароматического углеводорода, как, например, толуола, бензола или циклогексана, спирта, как, например, бутанола, в частности, н-бутанола, высшего спирта жирного ряда или гликоля, простого эфира, как, например, дибутилового эфира, тетрагидрофурана, диоксана или низкомолекулярного полиалкиленгликоля, галогенированного алифатического или ароматического углеводорода как, например, хлороформа, дихлорметана, хлорбензола, дихлорбензола, сульфоксида или сульфона, как, например, диметилсульфоксида или сульфолана.
Вместо одного из указанных обычных растворителей изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и реакцию последнего с получением н-бутиральдегида и/или н-бутанола можно осуществлять в расплаве фосфина. Это является выгодным в случае использования гомогенного катализатора, содержащего фосфин. Фосфин, как бы служащий в качестве растворителя, при этом можно выбрать свободно, однако предпочтительно для расплава используют тот фосфин, который имеется в качестве лиганда в комплексе переходного металла, служащего в качестве гомогенного катализатора.
В том случае, если к процессу реакции аддукта формулы (II) до н-бутиральдегида и/или н-бутанола в качестве конечных продуктов, осуществляемому в одну стадию, не добавляют дополнительного растворителя, то используемые согласно изобретению гомогенные катализаторы растворяются в самых реагентах, то есть аддукте формулы (II), енольном эфире формулы (IV) и воде, используемом для гидролиза енольного эфира формулы (IV).
Для получения конечных продуктов, то есть н-бутиральдегида и/или н-бутанола, к реакционной смеси добавляют воду в мольном соотношении в пересчете на подаваемый в реактор аддукт формулы (II), составляющем в общем 1 - 1 до 100 - 1, предпочтительно 2 - 1 до 20 - 1, особенно предпочтительно 5 - 1 до 10 - 1. При периодическом осуществлении реакции воду можно подать в реактор вместе с остальными реагентами, то есть с аддуктом формулы (II) и гомогенным катализатором, хотя может также быть выгодным подать воду в реактор лишь после начала реакции. Как в конце поступают в конкретном случае, зависит от используемого катализатора и выбранных давления и температуры. Целесообразно оптимальный подход для используемого в конкретном случае катализатора определяют путем предварительного опыта. Аналогичным образом при непрерывном осуществлении предлагаемого способа, например, в трубчатом реакторе или в последовательно установленных реакторах, воду можно подать в реактор или вместе с другими реагентами, или же после определенного времени пребывания реагентов в реакторе через отдельный впуск.
В том случае, если желаемым конечным продуктом является н-бутанол, то дополнительно к воде, требуемой для гидролиза енольного эфира формулы (IV), к реакционной смеси добавляют еще водород в мольном соотношении в пересчете на подаваемый в реактор аддукт формулы (II), составляющем в общем 1 - 1 до 100 - 1, предпочтительно 1- 1 до 10 -1, особенно предпочтительно 1 - 1 до 2- 1. При периодическом осуществлении реакции водород можно подать в реактор под давлением, или его можно диспергировать в реакционной среде, например, с помощью барботажных колонн или трубчатых реакторов, снабженных струйными соплами для диспергирования водорода. Добавление водорода можно осуществлять или при подаче в реактор остальных реагентов, то есть аддукта формулы (II), воды и гомогенного катализатора, однако может также быть выгодным подать водород в реактор после начала реакции. Как в конце поступают в конкретном случае, зависит от используемого катализатора и выбранных давления и температуры, а также от конструкции реактора. Целесообразно оптимальный подход определяют путем предварительного опыта. Аналогичным образом при непрерывном осуществлении предлагаемого способа, например, в трубчатом реакторе, в барботажной колонне или насадочном ректоре, водород можно подать в реактор или вместе с остальными реагентами, или же после определенного времени пребывания реагентов в реакторе через отдельный впуск.
В том случае, если желаемым конечным продуктом является смесь н-бутанола и н-бутиральдегида, то количественное соотношение данных продуктов в смеси можно устанавливать, например, через добавление водорода и/или выбранную температуру реакции. Если добавляют водород в количество ниже стехиометрического, то, естественно, исходное соединение гидрируется с получением н-бутанола лишь частично, и путем выбора низкой температуры реакции можно снижать скорость реакции гидрирования настолько, что лишь часть исходного соединения подвергается гидрированию до н-бутанола.
По завершении реакции продукт обычно выделяют путем перегонки, причем используемый гомогенный катализатор отделяют из куба перегонной колонны, и при желании его можно вновь использовать, например, путем рециркуляции катализаторного раствора на стадию изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и гидролиза и гидрирования последнего. Если катализатор желают рециркулировать в рамках предлагаемого способа, то к реакционной смеси можно целесообразно добавлять растворитель, точка кипения которого выше, чем точка кипения н-бутанола и н-бутиральдегида. В том случае, если гомогенный катализатор является химически и термически стабильным в условиях перегонки, то можно отказаться от добавления высококипящего растворителя, и гомогенный катализатор можно рециркулировать в реакцию в твердом виде. Кроме того, при переработке путем перегонки н-бутиральдегид и/или н-бутанол отделяется от спирта формулы ROH, высвободившегося на предыдущей стадии из енольного эфира формулы (IV), путем гидролиза или гидрирования, а спирт формулы ROH рециркулируют на первую стадию предлагаемого способа, а именно стадию присоединения спирта формулы ROH к 1,3-бутадиену. В качестве ценных побочных продуктов предлагаемого способа при обработке продукта реакции путем перегонки можно получить октанолы или додеканолы соответственно альдегиды, соответствующие этим спиртам, которые образовались вследствие частичной димеризации и тримеризации бутадиена.
Согласно особенно предпочтительному варианту предлагаемого способа изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и его гидролиз или гидрирование до н-бутиральдегида и/или н-бутанола осуществляют в одну стадию с использованием гетерогенного катализатора, причем способ можно осуществлять по выбору или в жидкой, или в газовой фазе.
Неожиданно выявилось, что в качестве катализаторов для изомеризации аддукта формулы (II) до енольного эфира формулы (IV), а также для гидролиза енольного эфира формулы (IV) до н-бутиральдегида или же для комбинированных гидролиза и гидрирования енольного эфира формулы (IV) до н-бутанола можно использовать в общем известные гетерогенные катализаторы гидрирования, в основном не поддающиеся растворению в реакционной среде. Среди них являются предпочтительными те, которые содержат один или несколько элементов группы Ib, VIb, VIIb и VIIIb периодической системы элементов, в случае необходимости в сочетании с одним или несколькими элементами группы Vb, в частности, медь, хром, молибден, вольфрам, рений, рутений, кобальт, никель, родий, иридий, палладий и/или платину, в случае необходимости в сочетании с железом.
К особенно активным катализаторам гидрирования, как, например, никелю или платиновым металлам, выгодно добавлять элементы главной группы периодической системы элементов, действующие в качестве антикатализатора, таким образом частично отравляя катализатор. Это позволяет повысить избирательность при комбинированных гидролизе и гидрировании енольного эфира формулы (IV) до н-бутанола. Пригодными элементами главной группы являются, например, халкогены, как, например, сера, селен и теллур, а также фосфор, мышьяк, сурьма, висмут, олово, свинец и таллий.
В рамках предлагаемого способа в качестве гетерогенных катализаторов можно использовать, например, т.н. соосажденные катализаторы. Такие катализаторы можно получать тем, что их каталитически активные компоненты осаждают из растворов их солей, в частности, из растворов их нитратов и/или ацетатов, например, путем добавления растворов гидроокиси и/или карбоната щелочных и/или щелочно-земельных металлов, например, в качестве труднорастворимых гидроокислов, гидратов окислов, щелочных солей или карбонатов, затем полученные осадки сушат и путем кальцинации при температуре 300 - 700oC, в частности 400 - 600oC, превращают в соответствующие оксиды, смешанные оксиды и/или смешанные относительно валентности оксиды, которые восстанавливают, например, путем обработки восстановительным агентом, например, водородом или водородсодержащим газом, при температуре 50 - 700oC, в частности, при температуре 100 - 400oC, до соответствующих металлов и/или окисных соединений низкой степени окисления, переводя их в каталитически активную форму. При этом, как правило, восстановление продолжают до того, как больше не образуется воды. При получении соосажденных катализаторов, содержащих носитель, осаждение каталитически активных компонентов можно осуществлять в присутствии соответствующего носителя. Однако является также выгодным осаждать каталитически активные компоненты из соответствующих солевых растворов одновременно с носителем.
Предпочтительно в рамках предлагаемого способа используют катализаторы гидрирования, которые содержат ускоряющие гидрирование металлы или соединения металла в осажденном на носителе виде. Кроме вышеуказанных соосажденных катализаторов, кроме каталитически активных компонентов, содержащих еще носитель, для осуществления предлагаемого способа в общем пригодны такие катализаторы на носителе, в которых каталитически активные компоненты нанесены на носитель, например, путем пропитки.
Форма нанесения каталитически активных металлов на носитель, как правило, не играет роли, то есть их можно наносить разными методами, например, путем пропитки раствором или суспензией солей или оксидов соответствующих элементов, сушки и последующего восстановления соединений металлов до соответствующих металлов или соединений с низкой степенью окисления с использованием восстановительного агента, предпочтительно водорода, водородсодержащих газов или гидразина. Другая возможность нанесения каталитически активных металлов на носитель заключается в пропитке носителей раствором солей, легко поддающихся термическому разложению, например, нитрата или поддающихся термическому разложению комплексных соединений, например, комплексов карбонила или гидрида каталитически активных металлов, а пропитанный носитель нагревают до температуры 300 - 600oC для термического разложения адсорбированных металлосоединений. Термическое разложение предпочтительно осуществляют в атмосфере защитного газа. Пригодными защитными газами являются, например, азот, двуокись углерода, водород или благородные газы. Кроме того, каталитически активные металлы можно наносить на носитель путем напаривания или пламенного напыления.
Содержание каталитически активных металлов в данных катализаторах на носителе принципиально не имеет значения для успешного осуществления предлагаемого способа. Для специалиста само собой разумеется, что большое содержание каталитически активных металлов в катализаторах приводит к повышению конверсии на единицу объема и времени по сравнению с низким содержанием. В общем используют катализаторы на носителе, содержание каталитически активных металлов которых составляет 0,1 - 80 вес.%, предпочтительно 0,5 - 30 вес.% в пересчете на общий вес катализатора. Так как эти цифры относятся к целому катализатору, включая носитель, причем, однако, разные носители имеют совсем различные удельный вес и удельную поверхность, действительная величина может находиться вне указанных пределов, без отрицательного влияния на достигаемый результат. Само собой разумеется, что на носитель может быть нанесенным несколько каталитически активных металлов. Кроме того, каталитически активные металлы можно нанести на носитель, например, по способу согласно заявке DE N 25 9817 или европейским заявкам NN 147219 и 285420. В катализаторах, описанных в указанных источниках, каталитически активные металлы имеются в виде сплавов, получаемых путем термообработки и/или восстановления солей или комплексов вышеуказанных металлов, нанесенных на носитель, например, путем пропитки.
Активацию соосажденных катализаторов, а также катализаторов на носителе, можно также осуществлять in situ в реакционной смеси с помощью имеющегося в ней водорода, однако предпочтительно эти катализаторы активируют перед их использованием в рамках предлагаемого способа.
В качестве материалов носителя пригодны, например, окислы алюминия и титана, двуокись циркония, двуокись кремния, кизельгур, силикагель, глиноземы, как, например, монтмориллониты, силикаты, как, например, силикаты магния или алюминия, цеолиты, как, например, цеолиты ZSM-5 или ZSM-10, а также активный уголь. Пригодными носителями являются окислы алюминия, двуокиси титана, двуокись циркония и активный уголь. Естественно, можно также использовать смесь указанных материалов в качестве носителя катализатора, используемого в рамках предлагаемого способа.
В качестве примеров гетерогенных катализаторов, пригодных для осуществления реакций в) и г) в одну стадию, можно назвать следующие катализаторы: двуокись платины, палладий на окиси алюминия, палладий на двуокиси кремния, палладий на сульфате бария, родий на активном угле, родий на окиси алюминия, рутений на двуокиси кремния или активном угле, никель на двуокиси кремния, кобальт на двуокиси кремния, кобальт на окиси алюминия, карбонильное железо в виде порошка, рениевый черный, рений Ренея, рений на активном угле, рений-палладий на активном угле, рений-платину на активном угле, медь на двуокиси кремния, медь на окиси алюминия, медь на активном угле, медь на кизельгуре, медь на силикагеле, медь на двуокиси титана, медь на двуокиси циркония, медь на силикате магния, медь на силикате алюминия, медь на монтмориллоните, медь на цеолите, медь Ренея, смеси окиси платины и окиси родия, платину-палладий на активном угле, хромит меди, хромит бария, окись никеля и хрома на окиси алюминия, гептоксид дирения (Re2O7), сульфид кобальта, сульфид никеля, сульфид молибдена(VI), катализаторы, содержащие медь, окись молибдена(VI), двуокись кремния и окись алюминия, палладий на активном угле, частично отравленный селеном или свинцем, а также катализаторы, описанные в заявках DE NN 3932332, 3904083, 2321101 и 2366264, заявке США N 3449445, европейских заявках NN 44444, 47219, 415202 и 100406.
Предпочтительно в рамках предлагаемого способа используют катализаторы для гидрирования, содержащие центры кислоты Бренстеда Льюисовой кислоты.
В качестве кислых центров Бренстеда или кислых Льюисовых центров могут действовать, например, сами каталитически активные металлы, если они не полностью восстанавливаются до соответствующих металлов при активации катализатора водородом или водородсодержащими газами. Это относится, например, к рений- и хромитсодержащим катализаторам, например, катализаторам, содержащим рений на носителе, и хромиту меди. В катализаторах, содержащих рений на носителе, рений имеется в качестве смеси металлического рения с рениевыми соединениями высших уровней окисления, причем последние могут развертывать действие Льюисовых кислот или кислот Бренстеда. Кроме того, такие кислые центры Бренстеда или кислые Льюисовые центры можно ввести в катализатор через используемый носитель. В качестве носителей, содержащих центры кислоты Бренстеда или Льюисовой кислоты, можно называть, к примеру, окиси алюминия, двуокиси титана, двуокись циркония, двуокись кремния, силикаты, глиноземы, цеолиты и активный уголь.
Поэтому особенно предпочтительно в рамках предлагаемого способа в качестве катализаторов гидрирования используют катализаторы на носителе, содержащие элементы I-й, VI-й, VII-й и/или VIII-й побочной группы периодической системы элементов, в частности, элементы I-й, VII-й и VIII-й побочной группы периодической системы элементов в нанесенном на действующем в качестве кислоты Бренстеда или Льюисовой кислоты носителе виде. Особенно предпочтительными катализаторами являются, например, рений на активном угле, рений на двуокиси циркония, рений на двуокиси титана, рений на двуокиси кремния, медь на активном угле, медь на двуокиси кремния, медь на кизельгуре, медь на силикагеле, медь на двуокиси титана, медь на двуокиси циркония, медь на силикате магния, медь на силикате алюминия, медь на отбеливающей земле, медь на цеолите, рутений на активном угле, рутений на окиси алюминия, рутений на двуокиси кремния, рутений на окиси магния, рутений на двуокиси циркония, рутений на двуокиси титана и палладий на активном угле, частично отравленный селеном или свинцом.
К катализаторам гидрирования, которые сами не имеют таких центров кислоты Бренстеда или Льюисовой кислоты, можно добавлять компоненты кислоты Бренстеда или Льюисовой кислоты, как, например, цеолиты, окиси алюминия или кремния, фосфорную кислоту или серную кислоту. Их обычно добавляют в количестве 0,01 - 5 вес.%, предпочтительно 0,05 - 0,5 вес.%, особенно предпочтительно 0,1 - 0,4 вес.% в пересчете на вес используемого катализатора.
Далее для изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и его гидролиза или гидрирования с получением н-бутиральдегида и/или н-бутанола в одну стадию пригодны также гетерогенные катализаторы, содержащие комплексные соединения переходных металлов группы Ib, VIb, VIIb и VIIIb периодической системы элементов, пригодные для гомогенного катализа этого процесса, в гетерогенной форме, например, такие, в которых соответствующий переходный металл закреплен на полимерной матрице.
Такие полимерные матрицы могут представлять собой смолы, например, стиролдивинилбензольные смолы или фенолформальдегидные смолы, с которыми ковалентно связаны соответствующие лиганды, служащие для комплексообразования переходного металла, то есть образующие комплексы с переходным металлом, таким образом практически связывая их. Такие гетерогенные, полимерно связанные катализаторы в виде комплекса переходного металла, содержащие в качестве лиганда 2,2'-бипиридин или 1,10-фенантролин, или гетерогенные фосфиновые или фосфитовые комплексы каталитически активных переходных металлов можно получать, например, по методам согласно литературным источникам, указанным в связи с описанием реакции а). Например, органические катализаторы, содержащие триоксорений(VII), можно согласно методу, описанному в заявке DE N 3902357, путем координационного связывания связывать с азотсодержащими полимерами, например, поливинилпирролидоном, поли(2-винилпиридином), (2-винилпиридин-) стирол-сополимерами, амидами полиакрильной кислоты, полиимидами и полиуретанами, таким образом гетерогенизуя их, и их можно использовать в качестве гетерогенного катализатора.
При использовании указанных гетерогенных катализаторов изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и его гидролиз или гидрирование до н-бутиральдегида и/или н-бутанола в одну стадию можно осуществлять или непрерывно, или периодически.
В том случае, если данную реакцию осуществляют в жидкой фазе, то гетерогенный катализатор можно или суспендировать в жидкой реакционной среде, или, предпочтительно, размещать его в виде слоя твердого вещества или нескольких слоев твердого вещества. При использовании гетерогенного катализатора, суспендированного в жидкой реакционной среде, реакцию можно осуществлять, к примеру, в снабженных мешалкой котлах или в снабженных рециркуляционной линией реакторах, а при использовании гетерогенного катализатора в виде слоя твердого вещества реагенты можно пропускать через данный слой сверху или снизу.
И гидрирование енольного эфира формулы (IV), а также его гидролиз или гидрирование можно осуществлять в реакторах, работающих адиабатически или изотермически. В общем при этом жидкий катализатор подают в реактор вместе с жидкой реакционной смесью с объемной скоростью, составляющей 0,01 - 40, предпочтительно 0,05 - 6, особенно предпочтительно 0,08 - 3 кг простого эфира на литр катализатора в час. В случае использования гетерогенных катализаторов реакцию можно осуществлять в присутствии или отсутствии растворителя. В качестве растворителя пригодны те растворители, которые пригодны также для осуществления способа с использованием гомогенного катализатора.
Как уже описано выше в связи с осуществлением реакций в) и г) предлагаемого способа относительно гомогенного катализа, воду, требуемую для получения конечных продуктов, то есть н-бутиральдегида и/или н-бутанола, можно подать в реактор или вместе с аддуктом формулы (II), и/или его можно вводить в катализаторный слой в разных местах по отдельным впускным линиям в виде одного или нескольких частичных потоков. То же самое относится к подаче воды и водорода в случае получения н-бутанола в качестве конечного продукта.
В случае осуществления способа с гетерогенным катализатором воду, требуемую для получения н-бутиральдегида, добавляют в мольном соотношении, в общем составляющем 1 - 100, предпочтительно 1 - 70, особенно предпочтительно 1 - 30 в пересчете на подаваемый в реактор аддукт формулы (II). Комбинированные изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и его гидролиз до н-бутиральдегида в одну стадию в жидкой фазе с использованием гетерогенного катализатора в общем осуществляют при температуре 20 - 400oC, предпочтительно 30 - 350oC, особенно предпочтительно 80 - 300oC, и при давлении, обычно составляющем 1 - 300 бар, предпочтительно 2-150 бар, в частности 5-100 бар.
Водород, дополнительно к воде требуемый для получения н-бутанола, в случае осуществления способа с гетерогенным катализатором добавляют в мольном соотношении, в общем составляющем 1 - 100, предпочтительно 1,5 - 80, в частности 2-40 в пересчете на подаваемый в реактор аддукт формулы (II). Комбинированные изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и его гидролиз/гидрирование до н-бутанола в одну стадию в жидкой фазе с использованием гетерогенного катализатора в общем осуществляют при температуре 20 - 400oC, предпочтительно 30 - 350oC, особенно предпочтительно 80 - 300oC, и при давлении, обычно составляющем 1 - 300 бар, предпочтительно 5 - 250 бар, в частности 20 - 200 бар. Само собой разумеется, что количество воды, требуемой для получения н-бутанола из аддукта формулы (II), соответствует количеству воды, требуемой для получения н-бутиральдегида из аддукта формулы (II).
В том случае, если желаемый конечный продукт представляет собой смесь н-бутиральдегида и н-бутанола, в общем воду и водород подают аналогично вышеописанному методу в количественном соотношении относительно аддукта формулы (II), обеспечивающем получение обоих конечных продуктов в желаемом соотношении. Кроме того, соотношение обоих конечных продуктов можно устанавливать путем применения определенных гетерогенных катализаторов, например, тем, что используют гетерогенные катализаторы, обладающие высокой способностью к ускорению гидролиза и - по сравнению с этим - низкой способностью к ускорению гидрирования. Для этой цели можно использовать, например, катализаторы, дезактивированные или частично отравленные относительно их способности к ускорению гидрирования, например, палладий на угле, частично отравленный селеном или свинцом.
Жидкий продукт данной стадии обычно обрабатывают путем перегонки аналогично методу, описанному выше в связи с осуществлением данной реакции с применением гомогенного катализатора. Естественно, при применении гетерогенных катализаторов отпадает рециркуляция катализатора, которая является целесообразной и выгодной в случае применения гомогенных катализаторов. Рециркуляцию освобождаемого на этой стадии спирта формулы ROH на стадию присоединения спирта формулы ROH к 1,3-бутадиену предпочтительно осуществляют путем метода, аналогичного методу, описанному в связи с осуществлением данной стадии с применением гомогенного катализатора.
Как уже указывалось, изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и гидролиз или гидрирование последнего до н-бутиральдегида и/или н-бутанола можно осуществлять в одну стадию, предпочтительно в газовой фазе. Для этого можно использовать в общем обычные реагенты для газофазных реакций, например, такие, при которых катализатор имеется в виде слоя твердого вещества или кипящего слоя. Реакторы могут работать адиабатически или изотермически. В случае наличия катализатора в виде слоя твердого вещества может иметься или один катализаторный слой, или, для улучшения отвода теплоты реакции, несколько, например, 2 - 10, предпочтительно 2 - 5, слоев. Если имеется несколько слоев твердого катализатора или если реактор работает адиабатически, то для повышения избирательности реакции может быть выгодным снизить температуру газообразной реакционной среды после выхода из предыдущего твердого слоя перед входом в последующий твердый слой путем промежуточного охлаждения газообразной реакционной среды и/или путем подачи с помощью сопел дополнительного количества холодных реагентов, например, водорода, воды, аддукта формулы (II) или енольного эфира формулы (IV) между отдельными твердыми слоями. Целесообразно в случае применения нескольких твердых слоев в отдельных твердых слоях перед последним твердым слоем реакцию проводят лишь с частичной конверсией, например, с конверсией от 50 до 98 %. При желании реакционные газы можно разбавлять инертным в условиях реакции газом, например, азотом, насыщенными углеводородами или аргоном.
Воду, требуемую для получения н-бутиральдегида в качестве конечного продукта, в случае осуществления способа в газовой фазе добавляют в мольном соотношении, в общем составляющем 1 - 100, предпочтительно 1 - 70, особенно предпочтительно 1-30 в пересчете на подаваемый в реактор аддукт формулы (II). Воду можно подать в реактор или вместе с аддуктом формулы (II), и/или, как выше указано, его можно подать в реактор в разных местах в виде нескольких частичных потоков. Катализатор обычно подают в реактор вместе с газообразной реакционной смесью, содержащей в общем аддукт формулы (II), воду и, в случае необходимости, инертный газ, со скоростью 0,01 - 10, предпочтительно 0,05 - 5, особенно предпочтительно 0,07 - 3 кг газообразной реакционной смеси на литр катализатора в час. Реакцию, включающую изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и гидролиз последнего, в общем осуществляют при температуре 70 - 400oC, предпочтительно 90 - 350oC, особенно предпочтительно 110- 330oC, и при давлении, обычно составляющем 0,5 -100 бар, предпочтительно 0,8 - 20 бар, особенно предпочтительно 1 -10 бар.
Водород, дополнительно к воде требуемый для получения н-бутанола, в случае осуществления способа в газовой фазе добавляют в мольном соотношении, в общем составляющем 1 - 200, предпочтительно 1,5 - 80, в частности 2 - 40 в пересчете на подаваемый в реактор аддукт формулы (II). Водород можно подать в реактор или вместе с аддуктом формулы (II) и/или, как выше указано, в качестве нескольких частичных потоков в разных местах реактора. Катализатор обычно подают в реактор вместе с газообразной реакционной смесью, содержащей в общем аддукт формулы (II), воду и, в случае необходимости, инертный газ, со скоростью 0,01 - 10, предпочтительно 0,05 - 5, особенно предпочтительно 0,07 - 3 кг газообразной реакционной смеси на литр катализатора в час. Реакцию, включающую изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и комбинированные гидролиз и гидрирование последнего, в общем осуществляют при температуре 20 - 400oC, предпочтительно 100 - 350oC, особенно предпочтительно 150 - 300oC, и при давлении, обычно составляющем 0,5 - 100 бар, предпочтительно 0,9 - 50 бар, особенно предпочтительно 1 - 30 бар.
Аналогично изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и его гидролизу или гидрированию до н- бутиральдегида и/или н-бутанола в жидкой фазе с применением гетерогенного катализатора, и реакцией в газовой фазе можно управлять путем добавления смеси, содержащей определенное количество воды и водорода, а также путем выбора катализатора, с тем чтобы обеспечить желаемое соотношение н-бутиральдегида и н-бутанола в конечном продукте, отходящего с данной стадии.
Для обработки газообразного продукта реакции его можно, в случае необходимости после снижения давления до атмосферного, непосредственно вводить в перегонную установку, где его разделяют на его отдельные компоненты.
В качестве катализаторов для изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и гидролиза или гидрирования последнего до н-бутиральдегида и/или н-бутанола, осуществляемых в газовой фазе в одну стадию можно принципиально применять те же гетерогенные катализаторы, которые используют и для реакции в жидкой фазе. Предпочтительно в случае осуществления реакции в газовой фазе используют чисто неорганические, минеральные катализаторы. Предпочтительными катализаторами являются, например, катализаторы на носителе, содержащие элементы побочной группы I, VI, VII и/или VIII, в случае необходимости в комбинации с одним или несколькими элементами побочной группы V периодической системы элементов, в частности, элементы побочной группы I, VII и VIII периодической системы элементов в нанесенном на носителе виде, причем носитель действует как кислота Бренстеда или Льюисовая кислота. Особенно предпочтительные катализаторы представляют собой, например, рений на активном угле, рений на двуокиси циркония, рений на двуокиси титана, рений на двуокиси кремния, медь на активном угле, медь на двуокиси кремния, медь на кизельгуре, медь на силикагеле, медь на двуокиси титана, медь на двуокиси циркония, медь на силикате магния, медь на силикате алюминия, медь на отбеливающей земле, медь на цеолите, рутений на активном угле, рутений на двуокиси кремния, рутений на окиси алюминия, рутений на двуокиси циркония, рутений на окиси магния, рутений на двуокиси титана и палладий на активном угле, частично отравленный селеном или свинцом.
Изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) и гидролиз или гидрирование последнего до н-бутиральдегида и/или н-бутанола в одну стадию с применением гетерогенного катализатора можно и в случае осуществления реакций в жидкой фазе, и в случае осуществления реакций в газовой фазе, если применяют один-единственный слой катализатора в твердом виде, проводить с использованием комбинированного катализаторного слоя, состоящего по меньшей мере из двух слоев разных гетерогенных катализаторов, отличающихся друг от друга относительно активности и, в случае необходимости, избирательности в отношении реакций в) и г). При этом, например, в первом слое, обращенном ко впуску реактора, по которому в него подают реагенты, сперва аддукт формулы (II) с высокой активностью и избирательностью подвергается изомеризации до енольного эфира формулы (IV), а последний при проходе через последующий(ие) слой(слои), обращенный(ые) к выпуску реактора и состоящий(ие) из катализатора(ов), обладающего(их) меньшей способностью к ускорению изомеризации, зато большей способностью к ускорению гидролиза и/или гидрирования, превращается в н-бутиральдегид и/или н-бутанол под сильным действием катализатора и с большой избирательностью.
Путем последовательного размещения в катализаторе нескольких слоев катализаторов разных активности и/или избирательности можно целенаправленно влиять на выделение теплоты при гидролизе соответственно комбинированных гидролизе и гидрировании енольного эфира формулы (IV), таким образом повышая общую избирательность реакции. Этот эффект можно далее усилить тем, что, например, воду и/или водород вводят в реактор не вместе с аддуктом формулы (II), а отдельно от него в зону катализаторного слоя, в котором осуществляется гидролиз или комбинированные гидролиз и гидрирование. Воду и водород можно вместе вводить в соответствующие зоны катализаторного слоя, или же их можно вводить отдельно в разные зоны катализаторного слоя. Вместо комбинированного слоя разные катализаторы, при данном варианте способа применяемые для ускорения разных реакторов, могут иметься отдельно в виде отдельных слоев.
Хотя предпочтительным вариантом предлагаемого способа является вышеописанное осуществление реакций в) и г) в одну стадию, в определенных ситуациях может быть выгодным осуществлять реакции отдельно, то есть осуществлять изомеризацию аддукта формулы (II) до енольного эфира формулы (IV), гидролиз енольного эфира формулы (IV) до н-бутиральдегида или гидрирование бутиральдегида до н-бутанола, в несколько стадий. Например, каждую отдельную из указанных реакций можно осуществлять в одну стадию тем, что сперва согласно одной реакции аддукт формулы (II) подвергают изомеризации до енольного эфира формулы (IV), затем енольный эфир формулы (IV) подвергают гидролизе до н-бутиральдегида, а после этого н-бутиральдегид подвергают гидрированию до н-бутанола. Или же изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) можно осуществлять отдельно в одну стадию, а затем енольный эфир формулы (IV) подвергают гидролизу или комбинированным гидролизу и гидрированию до н-бутанола или смеси н-бутанола и н-бутиральдегида. Другой вариант осуществления предлагаемого способа заключается в проведении изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и гидролиза последнего до н-бутиральдегида в одну стадию и осуществлении гидрирования получаемого н-бутиральдегида до н-бутанола на последующей стадии.
В случае осуществления реакций в) и г) на разных стадиях последние можно проводить в разных режимах. Например, изомеризацию аддукта формулы (II) до енольного эфира формулы (IV) можно по выбору осуществлять с применением гомогенного или гетерогенного катализатора, и гидролиз соответственно комбинированные гидролиз и гидрирование енольного эфира формулы (IV) до н-бутиральдегида и/или н-бутанола можно по выбору осуществлять в жидкой фазе с применением гомогенного или гетерогенного катализатора или в газовой фазе.
Кроме того, в случае осуществления реакций в) и г) на разных стадиях также возможно вместо вышеописанных катализаторов, ускоряющих и изомеризацию аддукта формулы (II) до енольного эфира формулы (IV), и гидролиз и гидрирование последнего, использовать на отдельных стадиях катализаторы, ускоряющие лишь соответствующую реакцию. Например, енольный эфир формулы (IV) можно подвергать гидролизу с получением н-бутиральдегида с применением в качестве катализатора кислот Бренстеда, например, минеральных кислот. как, например, галогенводородной кислоты, серной кислоты, разбавленной азотной кислоты, фосфорной кислоты или гетерогенных кислот Бренстеда, как, например, ионитов, цеолитов, отбеливающих земель или кислых фосфатов, например, фосфатов алюминия, или же н-бутиральдегид, полученный в одну стадию путем изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и гидролиза последнего, можно подвергать гидрированию с применением катализаторов, обладающих способностью к ускорению лишь гидрирования, а не гидролиза. Однако в данном случае для осуществления реакции в) можно также использовать катализатор, способствующий изомеризации, а не обладающий способностью к ускорению гидролиза или гидрирования.
Спирт формулы ROH, высвобождаемый из енольного эфира формулы (IV) при гидролизе или комбинированных гидролизе и гидрировании, предпочтительно рециркулируют на реакцию а). Возможность осуществления изомеризации аддукта формулы (II) до енольного эфира формулы (IV) и гидролиза соответственно комбинированных гидролиза и гидрирования последнего на разных стадиях повышает гибкость при строительстве установки для осуществления предлагаемого способа, что позволяет сберегать значительные суммы денег.
Предлагаемый способ в нижеследующем поясняется более подробно со ссылкой на схему предпочтительного варианта его осуществления, в рамках которого осуществляются присоединение спирта формулы ROH к 1,3-бутадиену, изомеризация аддукта формулы (II) до енольного эфира формулы (IV) и гидролиз или комбинированные гидролиз и гидрирование последнего до н-бутиральдегида и/или н-бутанола. Так как приложенная схема осуществления предлагаемого способа служит лишь для пояснения потоков сырья, промежуточных продуктов и конечных продуктов, во имя сохранения удобочитаемости не представлены подробности, наличие которых в установке само собой разумеется, как насосы, теплообменники, клапаны или реле.
По линии 1 в реактор 2 подают смесь 1,3-бутадиена и спирта формулы ROH, предпочтительно н-бутанола. 1,3-бутадиен соответственно спирт формулы ROH вводят в линию 1 по линиям 3, 4. В реакторе 2 спирт формулы ROH с применением катализатора, предпочтительно кислоты Бренстеда, добавляется к 1,3-бутадиену, в результате чего образуется смесь аддуктов формул (II) и (III). Конечный продукт реактора 2, в основном состоящий из аддуктов формул (II) и (III), высококипящих производных бутадиена и непрореагировавших 1,3-бутадиена и спирта ROH, по линии 5 подают на сепаратор 6 для отделения газа от жидкости, в котором газообразный 1,3-бутадиен отделяют от жидких компонентов конечного продукта реактора 2, после чего его или по линиям 7, 8 и 1 подают обратно в реактор 2, или его подают на сгорание на факеле по линиям 7, 9. Смесь жидкостей, отделяемых в разделителе 6, по линии 10 подают в перегонную колонну 11, в которой легче летучий аддукт формулы (III) отделяют путем перегонки от более труднолетучего аддукта формулы (II) и возможно еще имеющихся спирта формулы ROH и производных бутадиена, имеющих более высокую точку кипения. Аддукт формулы (III), непрореагировавший спирт формулы ROH и возможно еще имеющийся непрореагировавший 1,3-бутадиен затем по линиям 12 и 1 рециркулируют в реактор 2, где аддукт формулы (III) подвергается изомеризации до аддукта формулы (II) в присутствии свежедобавляемого 1,3-бутадиена и спирта формулы ROH. Легколетучие компоненты, с продуктом реактора 2 подаваемые на колонну 11, например, винилциклогексен, через выпуск 42 подают на факел, в случае необходимости вместе с остаточным бутадиеном, отделяемым в колонне 11. Вместо одной-единственной перегонной колонны 11 может иметься несколько последовательно включенных перегонных колонн, служащих для разделения жидкого продукта реактора 2. В случае наличия нескольких перегонных колонн вместо одной-единственной колонны 11 от аддукта формулы (II) можно отделять компоненты продукта реактора 2, имеющие более высокую точку кипения, например, простой дибутиловый эфир и, в случае необходимости, алкоксиоктадиены или алкоксидодекатриены, которые затем выводят из процесса.
Жидкий продукт колонны 11, освобожденный от более лекголетучего аддукта формулы (III) и легколетучих и, в случае необходимости, более труднолетучих побочных продуктов, по линии 13 подают в реактор 14, в котором в одну стадию аддукт формулы (II) в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, подвергается изомеризации до енольного эфира формулы (IV), и последний подвергается гидролизу до н-бутиральдегида соответственно путем комбинированных гидролиза и гидрирования превращается в н-бутанол и, при желании, в н-бутиральдегид. Требуемый для этой реакции водород подают в реактор 14 по линии 15, а воду - по линии 16. Вместо подачи водорода и воды по линиям 15 и 16 их можно подать в реактор по линиям 17 и 18. В том случае, если в установке желают получать исключительно н-бутиральдегид, то впускные линии 15 или 18 могут остаться закрытыми, или по этим линиям в реактор подают водород лишь в количестве, требуемом для продления срока службы катализатора. В случае необходимости для этой цели вместе с водородом в реактор можно подать окись углерода.
Жидкий продукт реактора 14, в общем содержащий н-бутиральдегид и/или н-бутанол, производные бутадиена, имеющие высокую точку кипения, например, октанолы или додеканолы, возможно имеющуюся избыточную воду и, если в реакторе 14 применяют гомогенный катализатор, катализаторный раствор, по линии 19 подают в перегонную колонну 20. Большую часть непрореагировавшего водорода выводят из реактора 14 по линии 21, и его или рециркулируют по линии 15 или 18, или же его подают на факел. При желании водород можно отделять с помощью сепаратора для отделения газа от жидкости, который может быть установлен между реактором 14 и перегонной колонной 20, после чего его обрабатывают вышеописанным образом.
В перегонной колонне 20 продукт реактора 14 путем перегонки разделяют /на его компоненты. Более легколетучий н-бутиральдегид выводят у головки по линии 22, в случае необходимости вместе с легколетучими побочными продуктами, и для дальнейшей очистки его подают в дополнительную перегонную колонну, не показанную на схеме. По линии 23 из колонны выводят новообразовавшийся н-бутанол и по линии 24 его подают на дальнейшее использование. Продукты, имеющие более высокую точку кипения, например, простой дибутиловый эфир, октанолы и додеканолы, выводят из нижней части колонны 20 по нескольким выпускам, обобщенно показанным на приложенном чертеже в виде выпуска 26. В том случае, если в реакторе 14 используется гомогенный катализатор, то катализаторный раствор выводят из куба колонны 20 по линии 27 и в случае необходимости после отделения частичного потока отработанного катализатора по линии 28 и добавления свежего катализаторного раствора по линии 29 его рециркулируют в реактор 14.
В случае необходимости реакцией в реакторе 14 можно управлять с обеспечением получения лишь н-бутанола, а не н-бутиральдегида. Согласно дальнейшему варианту изобретения н-бутиральдегид можно получать в реакторе 30, включенном параллельно реактору 14. В реактор 30 по линии 31 подают частичный поток выходящего из колонны 11 продукта. Подобно реактору 14 и в реакторе 30 аддукт формулы (II) в одну стадию подвергается изомеризации до енольного эфира формулы (IV), и последний подвергают гидролизу до н-бутиральдегида, а не гидрированию до н-бутанола. Требуемую для гидролиза воду подают в реактор 30 по линиям 32 и/или 33, в зависимости от вида и размещения катализатора в нем. Жидкий продукт, выходящий из реактора 30, по линии 34 подают в перегонную колонну 35, из которой по линии 36 выводят н-бутиральдегид. Н-бутанол, освобождаемый при гидролизе из енольного эфира формулы (IV), соответственно спирт формулы ROH, вместо н-бутанола используемый в реакторе 2, по линии 37 выводят из колонны и по линиям 25 и 1 его рециркулируют в реактор 2, где он снова подвергается взаимодействию со свежим 1,3-бутадиеном с получением аддуктов формул (II) и (III). Продукты с более высокой точкой кипения, например, димерные и тримерные производные бутадиена, по нескольким выпускам, на приложенном чертеже обобщенно представленным в качестве выпуска 38, выводят из нижней части колонны 35. В том случае, если в реакторе 30 используют гомогенный катализатор, то катализаторный раствор выводят из куба колонны 35 по линии 39, после чего его рециркулируют в реактор 30, в случае необходимости после отделения от него частичного потока отработанного катализатора по линии 40 и добавления свежего катализаторного раствора по линии 41.
В случае использования н-бутанола в качестве спирта формулы ROH, что является предпочтительным в рамках предлагаемого способа, н-бутанол, выделяемый в колонне 20, отводимый по линии 23 и состоящий из новообразовавшегося из 1,3-бутадиена н-бутанола и н-бутанола, первоначально подаваемого по линии 4 и вновь освободившегося в реакторе 14, разделяют на два частичных потока, причем новообразовавшийся н-бутанол по линии 24 подают на дальнейшее использование, а ту долю н-бутанола, которую первоначально использовали в качестве спирта формулы ROH, по линиям 25 и 1 рециркулируют в реактор 2. В случае использования другого спирта формулы ROH, чем н-бутанол, данный спирт выводят из колонны 20 по отдельному выпуску 43 в соответствии с его точкой кипения, и его рециркулируют в реактор 2 по линиям 25 и 1.
н-Бутанол, выводимый из колонны 20 по линии 23, или другой спирт формулы ROH, выводимый из колонны 20 через выпуск 43, в случае необходимости перед рециркуляцией в реактор 2 подвергают дальнейшей очистке путем перегонки (не показано на чертеже) для удаления возможно содержащейся в нем примеси, например, простого дибутилового эфира, и остаточной воды с реакции в реакторе 14. То же самое относится к дальнейшей перегонной очистке продуктов с более высокой точкой кипения, отводимых по выпуску 26. Перегонная очистка спирта формулы ROH, отводимого по линии 43, или н-бутанола, отводимого по линии 23, может быть необходимой в определенных условиях во избежание накопления примеси и воды в процессе. Перегонную очистку выходящего из колонны 20 продукта можно осуществлять известными методами, не представляющими собой объектом настоящего изобретения. Вышеизложенное также относится к продуктам, выводимым из колонны 35 по линиям 36, 37 и 38. В этой связи еще раз указывается на то, что выпуски колонн 11, 20 и 35 на приложенном чертеже показаны чисто схематически. Состав продуктов, подвергаемых перегонке в этих колоннах, варьирует в зависимости от метода осуществления реакций в реакторах 2, 14 и 30, и для любого специалиста в этой области будет легко настраивать перегонную колонну с обеспечением разделения конкретно имеющегося продукта.
Пример 1 (реакция а)). В снабженный мешалкой автоклав объемом 0,3 л подают 67,0 г (0,90 моль) н-бутанола и 15,0 г ионита марки Lewatit SPC 118 в водородной форме, предварительно промытого водой и н-бутанолом. Затем под давлением добавляют 47,9 г (0,88 моль) 1,3-бутадиена. По истечении 10 часов при температуре 90oC и давлении 9 бар при конверсии 46% обнаруживают избирательность относительно 3-бутокси- бут-1-ена, составляющую 48,4%, и избирательность относительно 1-бутокси-бут-1-ена, составляющую 41,1%.
Пример 2. В снабженный мешалкой автоклав объемом 0,3 л подают 67,0 г (0,90 моль) н-бутанола, 11,5 г ионита марки Lewatit SPC 118 в водородной форме, предварительно промытого водой и н-бутанолом, и 3,5 г ионита марки Lewatit SPC 118, легированного хлоридом меди(II). Затем под давлением добавляют 47,0 г (0,88 моль) 1,3-бутадиена. По истечении 10 часов при температуре 90oC и устанавливающемся давлении при конверсии 69,1% обнаруживают избирательность относительно 3-бутокси-бут-1-ена, составляющую 46,8%, и избирательность относительно 1-бутокси-бут-2-ена, составляющую 44,3%.
Пример 3. В обогреваемый трубчатый реактор объемом 1,4 л подают 1 кг гелеобразного ионита марки Amberlite IR 120 в водородной форме, предварительно промытого водой и н-бутанолом. 1,3-бутадиен и н-бутанол смешивают при давлении 20 бар в жидкой фазе перед реактором, а затем их непрерывно пропускают через слой ионита. Влияние параметров реакции, а именно температуры, скорости потока и мольного соотношения 1,3-бутадиена и н-бутанола, исследовали в широких пределах. Полученные при разных условиях результаты приведены в табл. 1 (см. табл. 1-6 в конце описания). Состав продукта исследуется с помощью калиброванной газовой хроматографии.
Пример 4. В снабженном мешалкой автоклаве объемом 0,3 л осуществляют серийные опыты по присоединению н-бутанола к 1,3-бутадиену в условиях, приведенных в таблицах 2, 3 и 4, причем достигают указанных в этих таблицах результатов. Табл. 2 относится к использованию разных кислых ионитов в качестве катализаторов, не смешанных с другим веществом, в табл. 3 приведены результаты опытов, в которых в качестве катализатора использованы разные смеси чистого ионита марки Lewatit SPC 118 с легированным хлоридом меди(II) ионитом Lewatit SPC 118, и в таблице 4 приведены результаты, достигаемые при использовании в качестве катализатора смесей ионитов, легированных разными солями меди(II), с чистыми ионитами.
Пример 5 (изомеризация аддукта формулы (III) до аддукта формулы (II)). В снабженный мешалкой автоклав подают 6,0 г н-бутанола, 2,0 г 3-бутокси-бут-1-ена и 1,2 г сушеного ионита Lewatit SPC 118 в водородной форме. Реакционную смесь нагревают до температуры 105oC и по истечении 2 соответственно 6 часов отбирают пробу. Путем газовой хроматографии определяют соотношение 3-бутоксибут-1-ена и 1-бутоксибут-2-ена в пробах. Изменение данного соотношения при изменении времени реакции видно в табл. 5.
Пример 6. В описанном в примере 3 аппарате перед реактором в жидкой фазе смешивают 1,3-бутадиен, н-бутанол и смесь бутоксибутенов, полученную при реакции присоединения н-бутанола к 1,3-бутадиену, причем из данной смеси предварительно путем перегонки отделили большую часть 1 -бутокси-2-ена. Полученную смесь при давлении 20 бар и при разных температурах непрерывно пропускают через слой ионита. Результаты этого опыта приведены в табл. 6. Все анализы осуществляют путем калиброванной газовой хроматографии.
Пример 7 (сравнение с примером 6). Повторяют пример 6 с той разницей, что в реактор подают лишь 1,3-бутадиен и н-бутанол без бутоксибутенов. Результаты данного примера также приведены в табл. 6.
При сравнении результатов примеров 6 и 7 согласно таблице 6 видно, что путем рециркуляции нежелаемого 3-бутокси-бут-1-ена, образовавшегося при присоединении н-бутанола к 1,3-бутадиену, на реакцию присоединения снижается количество новообразуемого 3-бутокси-бут-1-ена.
Пример 8. Присоединение н-бутанола к 1,3-бутадиену в присутствии цеолитного катализатора. а) Получение водородной формы цеолитов. Приобретенный в торговле Y-цеолит натриевой формы (модуль: 5) переводят в водородную форму следующим образом: 100 г цеолита при температуре 80oC обрабатывают раствором сульфата аммония для обмена ионов, затем промывают водой, сушат при температуре 110oC и подвергают кальцинации при температуре 500oC в течение 5 часов. Этот процесс повторяют раз. Получаемый Y-цеолит (в водородной форме) содержит 0,02 вес. % натрия, и его рентгенофрактограмм соответствует типическому рентгенофрактограмму Y-цеолита водородной формы (V-образная структура). Таким же методом обрабатывают Na -β- цеолит, получаемый согласно примеру 1 заявки США N 4891458. б) В снабженный мешалкой автоклав объемом 0,3 л подают 67,0 г (0,90 моль) н-бутанола и 5,0 г Y-цеолита водородной формы, полученного согласно стадии 8а). Затем под давлением добавляют 49,7 г (0,92 моль) 1,3-бутадиена. По истечении 6 часов при температуре 130oC и давлении 9 бар при конверсии 1,3-бутадиена, составляющей 35,9%, обнаруживают избирательность относительно образования 3-бутокси-бут-1-ена, составляющую 32,4%, и избирательность относительно образования 1-бутокси-бут-2-ена, составляющую 20,3%. в) Аналогичным стадии 8б) образом взаимодействию подвергают 0,90 моль н-бутанола и 0,88 моль 1,3-бутадиена в присутствии 5 г β- цеолита водородной формы, полученного согласно стадии 8а). При конверсии 40,0% 3-бутоксибут-1-ен образуется с избирательностью 42,5%, а 1-бутоксибут-2-ен - с избирательностью 16,5%.
Пример 9. Присоединение н-бутанола к 1,3-бутадиену в присутствии гомогенного катализатора, содержащего переходный металл. В снабженный мешалкой автоклав объемом 0,3 л в атмосфере азота подают 74,0 г (1,0 моль) н-бутанола, 0,205 г (0,66 ммоль) ацетонилацетоната палладия и 2,02 г (7,3 ммоль) 1-(ди-изопропил- фосфино)-3-(ди-трет.бутил-фосфино)пропана. Затем под давлением добавляют 34,7 г (0,64 моль) 1,3-бутадиена. По истечении 20 часов при температуре 80oC и давлении 9 бар реакцию оканчивают, и реакционную смесь подвергают анализу путем газовой хроматографии.
Результаты относительно конверсии бутадиена - 88%
Избирательность относительно образования 3-бутоксибут-1- ена - 64,5%
Избирательность относительно образования 1-бутоксибут-2- ена - 34,3%.
Избирательность относительно образования 3-бутоксибут-1- ена - 64,5%
Избирательность относительно образования 1-бутоксибут-2- ена - 34,3%.
Пример 10 (изомеризация аддукта формулы (II) до енольного эфира формулы (IV)). В атмосфере аргона при температуре 120o С и при размешивании в течение 200 мин взаимодействию подвергают 40 г (312 ммоль) 1-бутокси-бут-2-ена в расплаве 100 г (382 ммоль) трифенилфосфина (PPh3) и 5 г (5,4 ммоль) HRh(PPh3)3CO. После этого продукты поглощают в толуоле и подвергают анализу путем газовой хроматографии. Конверсия 1 -бутокси-бут-2-ена составляет 48,5%, избирательность относительно образования 1-бутоксибут-1-ена - 95,5%, а избирательность относительно образования 1-бутоксибут-3-ена - 4,5%.
Пример 11. Повторяют пример 10 с той разницей, что вместо аргона используют эквимолярную смесь окиси углерода и водорода. По истечении времени реакции, составляющей 240 мин, продукты поглощают в толуоле и подвергают анализу путем газовой хроматографии. Конверсия 1-бутокси-1-ена составляет 50,3%, избирательность относительно образования 1-бутоксибут-1-ена - 99,5%, а избирательность относительно образования 1 -бутоксибут-3-ена - 0,5%.
Пример 12 (изомеризация аддукта формулы (II) до енольного эфира формулы (IV) и гидролиз последнего до н-бутиральдегида в одну стадию в присутствии гомогенного катализатора). Смесь 2,0 г 1-бутоксибут-2-ена, 3,0 г воды и 0,20 г HRuCl(CO)(PPh3)3 в качестве катализатора подвергают реакции в снабженном мешалкой автоклаве при температуре 160oC при устанавливающемся давлении в течение 7 часов. При конверсии 69,3% избирательность относительно образования н-бутиральдегида составляет 85,6%. 1-бутанол освобождается из 1-бутокси-2-ена с избирательностью 96,1%.
Пример 13. Пример 12 повторяют с той разницей, что дополнительно добавляют 2,0 г простого диэтиленгликольдиметилового эфира в качестве растворителя. При конверсии 78,3% н-бутиральдегид образуется с избирательностью 86,5%.
Пример 14 (изомеризация аддукта формулы (II) до енольного эфира формулы (IV) и гидролиз/гидрирование последнего до н-бутанола в одну стадию в присутствии гомогенного катализатора). В смесь 3,0 г воды, 0,022 г HRuCl(CO)(PPh3)3 в качестве катализатора, 0,028 г трифенилфосфина и 2,02 г 1-бутоксибут-2-ена при температуре 120oC и при давлении 12 бар при размешивании вводят водород до прекращения поглощения водорода. По истечении 3 часов реакционную смесь подвергают анализу с помощью калиброванной газовой хроматографии. При конверсии 99% избирательность относительно образования н-бутанола составляет 97,7%.
Пример 15 (изомеризация аддукта формулы (II) до енольного эфира формулы (IV) и гидрирование последнего до н-бутанола в одну стадию в газовой фазе в присутствии гетерогенного катализатора). В реактор подают 200 мл меди на активном угле в качестве катализатора, содержание меди которого в пересчете на окись меди составляет 10 вес.%. Катализатор активируют в течение часа в водородном потоке при атмосферном давлении при температуре, в начале составляющей 150oC, а в конце - 260oC.
Затем реактор охлаждают до температуры 210oC, а через аппарат для предварительного нагревания, имеющий температуру 200oC, в реактор вводят и через него пропускают при атмосферном давлении 32,0 г воды и 9,4 г 1-бутокси-2-ена в час. Одновременно в реактор вводят поток водорода со скоростью 15 л в час. После охлаждения выходящий из реактора двухфазный, жидкий продукт подвергают анализу путем калиброванной газовой хроматографии. При конверсии 94% избирательность относительно образования н-бутанола составляет 95,8%, а избирательность относительно 1-бутиральдегида - 4,2%.
Claims (7)
1. Способ получения н-бутиральдегида и/или н-бутанола, отличающийся тем, что а) 1,3-бутадиен или содержащие 1,3-бутадиен углеводородные смеси подвергают взаимодействию со спиртом формулы I
ROH
в которой R означает алкил или алкенил с 2 - 20 атомами углерода, незамещенные или замещенные одной или двумя алкокси- или гидроксигруппами с 1 - 10 атомами углерода, арил с 6 - 10 атомами углерода или аралкил с 7 - 11 атомами углерода, или метил, при повышенных температуре и давлении в присутствии кислоты Бренстеда или в присутствии комплекса элемента из группы Ib, VIIb или VIIIb Периодической системы элементов с фосфор- или азотсодержащими лигандами с получением смеси аддуктов формул II
и III
б) аддукт формулы III подвергают изомеризации до аддукта формулы II в) аддукт формулы II подвергают изомеризации в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением енольного эфира формулы IV
и г) получаемый енольный эфир формулы IV подвергают взаимодействию с водородом и водой или только водой в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением н-бутиральдегида и/или н-бутанола, с последующим высвобождением спирта формулы I и рециркуляцией последнего на реакцию а).
ROH
в которой R означает алкил или алкенил с 2 - 20 атомами углерода, незамещенные или замещенные одной или двумя алкокси- или гидроксигруппами с 1 - 10 атомами углерода, арил с 6 - 10 атомами углерода или аралкил с 7 - 11 атомами углерода, или метил, при повышенных температуре и давлении в присутствии кислоты Бренстеда или в присутствии комплекса элемента из группы Ib, VIIb или VIIIb Периодической системы элементов с фосфор- или азотсодержащими лигандами с получением смеси аддуктов формул II
и III
б) аддукт формулы III подвергают изомеризации до аддукта формулы II в) аддукт формулы II подвергают изомеризации в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением енольного эфира формулы IV
и г) получаемый енольный эфир формулы IV подвергают взаимодействию с водородом и водой или только водой в присутствии гомогенного или гетерогенного катализатора, содержащего переходный металл, в жидкой фазе, или гетерогенного катализатора, содержащего переходный металл, в газовой фазе, с получением н-бутиральдегида и/или н-бутанола, с последующим высвобождением спирта формулы I и рециркуляцией последнего на реакцию а).
2. Способ по п.1, отличающийся тем, что взаимодействие 1,3-бутадиена со спиртом формулы ROH осуществляют в присутствии кислого ионита.
3. Способ по п.1, отличающийся тем, что взаимодействие 1,3-бутадиена со спиртом формулы ROH осуществляют в присутствии кислого ионита, легированного по меньшей мере одной Льюисовой кислотой.
4. Способ по п.1, отличающийся тем, что взаимодействие 1,3-бутадиена со спиртом формулы ROH осуществляют в присутствии цеолита в водородной форме, отбеливающей земли или кислого фосфата алюминия.
5. Способ по п.1, отличающийся тем, что взаимодействие 1,3-бутадиена со спиртом формулы ROH осуществляют в присутствии катализатора, представляющего собой алкильный, арильный или аралкил-фосфиновый комплекс переходного металла из группы Ib, VIIb или VIIIb Периодической системы элементов.
6. Способ по п.1, отличающийся тем, что взаимодействие 1,3-бутадиена со спиртом формулы ROH осуществляют в присутствии катализатора, представляющего собой алкильный, арильный или аралкил-фосфиновый комплекс родия, рутения, никеля, палладия, иридия или платины.
7. Способ по п.1, отличающийся тем, что изомеризацию аддукта формулы III до аддукта формулы II осуществляют в присутствии катализатора, который используют для ускорения присоединения спирта формулы ROH к 1,3-бутадиену согласно реакции а).
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DEP4400837.6 | 1994-01-14 | ||
| DE4400837A DE4400837A1 (de) | 1994-01-14 | 1994-01-14 | Verfahren zur Herstellung von n-Butyraldehyd und/oder n-Butanol |
| PCT/EP1995/000114 WO1995019334A1 (de) | 1994-01-14 | 1995-01-12 | VERFAHREN ZUR HERSTELLUNG VON n-BUTYRALDEHYD UND/ODER n-BUTANOL |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU96116892A RU96116892A (ru) | 1998-12-10 |
| RU2135456C1 true RU2135456C1 (ru) | 1999-08-27 |
Family
ID=6507859
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU96116892A RU2135456C1 (ru) | 1994-01-14 | 1995-01-12 | Способ получения н-бутиральдегида и/или н-бутанола |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US5705707A (ru) |
| EP (1) | EP0739332B1 (ru) |
| JP (1) | JPH09508109A (ru) |
| KR (1) | KR100335040B1 (ru) |
| CN (1) | CN1040204C (ru) |
| CA (1) | CA2180982A1 (ru) |
| DE (2) | DE4400837A1 (ru) |
| ES (1) | ES2122538T3 (ru) |
| RU (1) | RU2135456C1 (ru) |
| TW (1) | TW314509B (ru) |
| WO (1) | WO1995019334A1 (ru) |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4431528A1 (de) * | 1994-09-03 | 1996-03-07 | Basf Ag | Verfahren zur Herstellung von n-Butyraldehyd und/oder n-Butanol |
| DE19622497A1 (de) | 1996-06-05 | 1997-12-11 | Basf Ag | Verfahren zur Herstellung von Tetrahydrofuran aus Dialkoxybutenen |
| DE19637895A1 (de) * | 1996-09-17 | 1998-03-19 | Basf Ag | Verfahren zur Herstellung von n-Butylalkylethern |
| DE19637892A1 (de) * | 1996-09-17 | 1998-03-19 | Basf Ag | Verfahren zur Herstellung von Alkoxybutenen |
| DE19710994A1 (de) * | 1997-03-17 | 1998-09-24 | Basf Ag | Verfahren zur Herstellung von n-Butyraldehyd und/oder n-Butanol |
| DE19725873A1 (de) * | 1997-06-18 | 1998-12-24 | Basf Ag | Verfahren zur Herstellung von Butenylethern |
| DE19725872A1 (de) | 1997-06-18 | 1998-12-24 | Basf Ag | Verfahren zur Herstellung von Butenylethern |
| DE19838449A1 (de) * | 1998-08-25 | 2000-03-02 | Basf Ag | Verfahren zur Abtrennung von 1,3-Butadien und Wasser aus Stoffgemischen enthaltend 1,3-Butadien, 1-n-Butoxybuten-2, 3-n-Butoxybuten-1, n-Butanol, Di-n-butylether und Wasser |
| GB9823853D0 (en) | 1998-10-30 | 1998-12-23 | Bp Chem Int Ltd | A process for making n-butyl esters from butadiene |
| GB9823980D0 (en) * | 1998-11-02 | 1998-12-30 | Bp Chem Int Ltd | A process for making n-butyl ethers of glycols |
| DE19852006A1 (de) * | 1998-11-11 | 2000-05-18 | Basf Ag | Verfahren zur Herstellung substituierter Butene |
| GB9828338D0 (en) * | 1998-12-22 | 1999-02-17 | Bp Chem Int Ltd | A process for making butyraldehyde from butadiene |
| DE10231976A1 (de) * | 2002-07-15 | 2004-01-29 | Basf Ag | Strukturierte Katalysator-Schüttung |
| WO2004113262A2 (en) * | 2003-06-16 | 2004-12-29 | The University Of Southern Mississippi Research Foundation | Integrated process to produce derivatives of butadiene addition products |
| JP2009046469A (ja) * | 2007-07-26 | 2009-03-05 | Chiba Univ | 光学活性アリル化合物類の製造方法 |
| EP2277871A4 (en) | 2008-05-01 | 2011-12-28 | Kuraray Co | METHOD FOR PRODUCING A VINYL ETHER COMPOUND |
| CN102816049A (zh) * | 2012-08-09 | 2012-12-12 | 西安近代化学研究所 | 3,3,3-三氟丙醇的制备方法 |
| EP3515593A1 (de) * | 2016-09-23 | 2019-07-31 | Basf Se | Verfahren zur aktivierung eines katalysatorfestbetts, das monolithische katalysatorformkörper enthält oder aus monolithischen katalysatorformkörpern besteht |
| WO2018054740A1 (de) * | 2016-09-23 | 2018-03-29 | Basf Se | Verfahren zur bereitstellung eines katalysatorfestbetts, das dotierte strukturierte katalysatorformkörper enthält |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE821202C (de) * | 1949-03-29 | 1951-11-15 | Chemische Werke Huels G M B H | Verfahren zur Herstellung von Butyraldehyd |
| US2922822A (en) * | 1957-01-08 | 1960-01-26 | Exxon Research Engineering Co | Production of methyl butenyl ethers |
| FR82549E (fr) * | 1961-11-13 | 1964-02-28 | Monsanto Chemicals | Procédé de production d'éthers aromatiques |
| DE2550902A1 (de) * | 1975-11-13 | 1977-05-26 | Texaco Ag | Verfahren zur herstellung von 3-alkoxibuten-1 und alkyl-trans-butylaether |
| DE2751766A1 (de) * | 1977-11-19 | 1979-05-23 | Basf Ag | Verfahren zur isomerisierung von 3-buten-1-ol-verbindungen zu den entsprechenden 2-buten-1-ol-verbindungen |
| WO1991003449A1 (en) * | 1989-09-05 | 1991-03-21 | Gaf Chemicals Corporation | Isomerization of alk-2-enyl ethers |
-
1994
- 1994-01-14 DE DE4400837A patent/DE4400837A1/de not_active Withdrawn
-
1995
- 1995-01-12 RU RU96116892A patent/RU2135456C1/ru active
- 1995-01-12 CN CN95191229A patent/CN1040204C/zh not_active Expired - Fee Related
- 1995-01-12 WO PCT/EP1995/000114 patent/WO1995019334A1/de active IP Right Grant
- 1995-01-12 US US08/676,185 patent/US5705707A/en not_active Expired - Lifetime
- 1995-01-12 EP EP19950906933 patent/EP0739332B1/de not_active Expired - Lifetime
- 1995-01-12 ES ES95906933T patent/ES2122538T3/es not_active Expired - Lifetime
- 1995-01-12 CA CA 2180982 patent/CA2180982A1/en not_active Abandoned
- 1995-01-12 DE DE59503924T patent/DE59503924D1/de not_active Expired - Lifetime
- 1995-01-12 KR KR1019960703760A patent/KR100335040B1/ko not_active IP Right Cessation
- 1995-01-12 JP JP51884095A patent/JPH09508109A/ja not_active Ceased
- 1995-01-13 TW TW84100276A patent/TW314509B/zh active
Non-Patent Citations (2)
| Title |
|---|
| Kirk-othmer, Encyclopedia of Chemical Technoligy, 4-e изд., издательство John Wiley and Sons, Нью-Йорк, 1992, т.4, с.741 - 746, 694 - 696. * |
| Suzuki et al., Tetrahedron Lett., 1980, т.21, стр.4927. Houben-Weyl, Methoden der Organischen Chemie, 4-е изд., издательство Tieme, Штуттгарт, 1963, т.XII/I, с.17 - 65, 182 - 186. * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN1040204C (zh) | 1998-10-14 |
| CN1138849A (zh) | 1996-12-25 |
| US5705707A (en) | 1998-01-06 |
| CA2180982A1 (en) | 1995-07-20 |
| TW314509B (ru) | 1997-09-01 |
| EP0739332B1 (de) | 1998-10-14 |
| DE4400837A1 (de) | 1995-07-20 |
| KR100335040B1 (ko) | 2002-11-27 |
| JPH09508109A (ja) | 1997-08-19 |
| WO1995019334A1 (de) | 1995-07-20 |
| DE59503924D1 (de) | 1998-11-19 |
| ES2122538T3 (es) | 1998-12-16 |
| EP0739332A1 (de) | 1996-10-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2135456C1 (ru) | Способ получения н-бутиральдегида и/или н-бутанола | |
| US4238419A (en) | Hydroformylation of olefinic compounds | |
| US5892125A (en) | Preparation of n-butyraldehyde and/or n-butanol | |
| US6166265A (en) | Processes for the preparation of n-butyraldehyde, n-butanol and mixtures thereof | |
| EP0061791B1 (en) | Process for the preparation of glycol aldehyde | |
| US6245948B1 (en) | Preparation of tetrahydrofuran from dialkoxybutenes | |
| KR100502605B1 (ko) | 6-아미노카프로니트릴의 제조 방법 | |
| EP0150943B1 (en) | Hydroformylation of allyl alcohol | |
| US9174905B2 (en) | Process for telomerization of butadiene using a mono-orthoalkoxy substituted catalyst | |
| Ungvary | The preparation of acyltetracarbonylcobalt compounds from ketenes and hydridotetracarbonylcobalt | |
| JP2001500868A (ja) | n―ブチルアルキルエーテルの製造方法 | |
| MXPA99007576A (es) | Preparacion de n-butiraldehido y/o n-butanol | |
| CZ9903284A3 (cs) | Způsob výroby n-butyraldehydu a/nebo n-butanolu | |
| US6103939A (en) | Process for the preparation of 1,4-butanediol monoethers | |
| Halligudi | Hydroformylation of olefins catalyzed by transient montomorillonite rhodium (II) catalyst | |
| MXPA99002354A (es) | Preparacion de n-butilalquileteres | |
| CA2284521A1 (en) | Method for producing acetals |