KR960016340B1 - 전기화학발광 분석법 - Google Patents
전기화학발광 분석법 Download PDFInfo
- Publication number
- KR960016340B1 KR960016340B1 KR1019870701252A KR870701252A KR960016340B1 KR 960016340 B1 KR960016340 B1 KR 960016340B1 KR 1019870701252 A KR1019870701252 A KR 1019870701252A KR 870701252 A KR870701252 A KR 870701252A KR 960016340 B1 KR960016340 B1 KR 960016340B1
- Authority
- KR
- South Korea
- Prior art keywords
- analyte
- interest
- antibody
- reagent
- solution
- Prior art date
Links
- 238000003556 assay Methods 0.000 title abstract description 43
- 239000012491 analyte Substances 0.000 claims abstract description 104
- 150000001875 compounds Chemical class 0.000 claims abstract description 83
- 150000001413 amino acids Chemical class 0.000 claims abstract description 19
- 239000002773 nucleotide Substances 0.000 claims abstract description 13
- 125000003729 nucleotide group Chemical group 0.000 claims abstract description 13
- 125000005647 linker group Chemical group 0.000 claims abstract description 3
- 239000000243 solution Substances 0.000 claims description 219
- 239000003153 chemical reaction reagent Substances 0.000 claims description 158
- ZFXYFBGIUFBOJW-UHFFFAOYSA-N theophylline Chemical group O=C1N(C)C(=O)N(C)C2=C1NC=N2 ZFXYFBGIUFBOJW-UHFFFAOYSA-N 0.000 claims description 145
- 238000000034 method Methods 0.000 claims description 122
- 239000000523 sample Substances 0.000 claims description 96
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 88
- 229960000278 theophylline Drugs 0.000 claims description 78
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical compound N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 claims description 67
- 229940098773 bovine serum albumin Drugs 0.000 claims description 67
- 239000000126 substance Substances 0.000 claims description 67
- 108091003079 Bovine Serum Albumin Proteins 0.000 claims description 65
- 241000588724 Escherichia coli Species 0.000 claims description 63
- 230000005670 electromagnetic radiation Effects 0.000 claims description 59
- 238000006243 chemical reaction Methods 0.000 claims description 55
- 235000013305 food Nutrition 0.000 claims description 48
- 102000004190 Enzymes Human genes 0.000 claims description 45
- 108090000790 Enzymes Proteins 0.000 claims description 45
- 238000001514 detection method Methods 0.000 claims description 45
- 239000000463 material Substances 0.000 claims description 45
- 239000000047 product Substances 0.000 claims description 44
- 230000005855 radiation Effects 0.000 claims description 44
- 230000027455 binding Effects 0.000 claims description 43
- 231100000655 enterotoxin Toxicity 0.000 claims description 42
- 239000012528 membrane Substances 0.000 claims description 41
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical group CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 39
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 claims description 32
- -1 dimethylformamido, n-methylpyrrolidinone Chemical compound 0.000 claims description 28
- 239000004793 Polystyrene Substances 0.000 claims description 27
- 229920002223 polystyrene Polymers 0.000 claims description 27
- 239000007788 liquid Substances 0.000 claims description 26
- 238000005259 measurement Methods 0.000 claims description 26
- 239000000758 substrate Substances 0.000 claims description 23
- 230000001580 bacterial effect Effects 0.000 claims description 21
- 239000002244 precipitate Substances 0.000 claims description 19
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 claims description 18
- 235000001014 amino acid Nutrition 0.000 claims description 18
- 239000008101 lactose Substances 0.000 claims description 18
- YAYGSLOSTXKUBW-UHFFFAOYSA-N ruthenium(2+) Chemical compound [Ru+2] YAYGSLOSTXKUBW-UHFFFAOYSA-N 0.000 claims description 18
- 230000000295 complement effect Effects 0.000 claims description 17
- 150000001450 anions Chemical group 0.000 claims description 16
- 239000007864 aqueous solution Substances 0.000 claims description 15
- 239000000147 enterotoxin Substances 0.000 claims description 15
- 241000894007 species Species 0.000 claims description 14
- 235000021056 liquid food Nutrition 0.000 claims description 13
- 244000005700 microbiome Species 0.000 claims description 13
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 claims description 12
- 230000000890 antigenic effect Effects 0.000 claims description 10
- 230000012010 growth Effects 0.000 claims description 9
- 101710146739 Enterotoxin Proteins 0.000 claims description 8
- 239000002904 solvent Substances 0.000 claims description 7
- 239000004094 surface-active agent Substances 0.000 claims description 7
- CPYVWMZEWABQJJ-UHFFFAOYSA-N 2-(2,5-dioxopyrrol-1-yl)hexanoic acid;2-pyridin-2-ylpyridine Chemical compound N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1.CCCCC(C(O)=O)N1C(=O)C=CC1=O CPYVWMZEWABQJJ-UHFFFAOYSA-N 0.000 claims description 6
- 238000012546 transfer Methods 0.000 claims description 6
- 238000000926 separation method Methods 0.000 claims description 5
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 claims description 4
- 229930182817 methionine Natural products 0.000 claims description 4
- 238000012545 processing Methods 0.000 claims description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 3
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 claims description 3
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 claims description 3
- 235000018417 cysteine Nutrition 0.000 claims description 3
- 230000005611 electricity Effects 0.000 claims description 2
- 230000001939 inductive effect Effects 0.000 claims 5
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims 1
- 125000004432 carbon atom Chemical group C* 0.000 claims 1
- 238000007654 immersion Methods 0.000 claims 1
- 230000015572 biosynthetic process Effects 0.000 abstract description 8
- 238000003786 synthesis reaction Methods 0.000 abstract description 5
- 239000000543 intermediate Substances 0.000 abstract description 3
- 229940027941 immunoglobulin g Drugs 0.000 description 84
- 229910052707 ruthenium Inorganic materials 0.000 description 81
- 239000000203 mixture Substances 0.000 description 80
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 77
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 75
- 239000002953 phosphate buffered saline Substances 0.000 description 69
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 68
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 57
- 241000283973 Oryctolagus cuniculus Species 0.000 description 51
- 229940088598 enzyme Drugs 0.000 description 46
- 210000002966 serum Anatomy 0.000 description 43
- 238000004458 analytical method Methods 0.000 description 42
- 239000000872 buffer Substances 0.000 description 38
- 238000012360 testing method Methods 0.000 description 38
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 37
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 35
- 239000002609 medium Substances 0.000 description 34
- 238000003018 immunoassay Methods 0.000 description 33
- 241000894006 Bacteria Species 0.000 description 31
- 238000002360 preparation method Methods 0.000 description 31
- 210000004027 cell Anatomy 0.000 description 30
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 28
- 238000003756 stirring Methods 0.000 description 28
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 27
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 27
- 239000000460 chlorine Substances 0.000 description 27
- 239000002245 particle Substances 0.000 description 27
- 239000007787 solid Substances 0.000 description 27
- 239000000725 suspension Substances 0.000 description 27
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 25
- 239000007789 gas Substances 0.000 description 24
- 239000000427 antigen Substances 0.000 description 23
- 229960005156 digoxin Drugs 0.000 description 23
- 239000000020 Nitrocellulose Substances 0.000 description 22
- 108091007433 antigens Proteins 0.000 description 22
- 102000036639 antigens Human genes 0.000 description 22
- 238000004020 luminiscence type Methods 0.000 description 22
- 229920001220 nitrocellulos Polymers 0.000 description 22
- 108020004707 nucleic acids Proteins 0.000 description 21
- 102000039446 nucleic acids Human genes 0.000 description 21
- 150000007523 nucleic acids Chemical class 0.000 description 21
- 108090000623 proteins and genes Proteins 0.000 description 21
- 239000006228 supernatant Substances 0.000 description 21
- 210000004379 membrane Anatomy 0.000 description 20
- 108090000765 processed proteins & peptides Proteins 0.000 description 20
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 19
- 241000589248 Legionella Species 0.000 description 19
- 241000699666 Mus <mouse, genus> Species 0.000 description 19
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 19
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 19
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 18
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 18
- 239000011521 glass Substances 0.000 description 18
- ARQXEQLMMNGFDU-JHZZJYKESA-N 4-methylumbelliferone beta-D-glucuronide Chemical compound C1=CC=2C(C)=CC(=O)OC=2C=C1O[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O ARQXEQLMMNGFDU-JHZZJYKESA-N 0.000 description 17
- 208000007764 Legionnaires' Disease Diseases 0.000 description 17
- 235000018102 proteins Nutrition 0.000 description 17
- 102000004169 proteins and genes Human genes 0.000 description 17
- 239000003053 toxin Substances 0.000 description 17
- 231100000765 toxin Toxicity 0.000 description 17
- 108700012359 toxins Proteins 0.000 description 17
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 16
- ROOXNKNUYICQNP-UHFFFAOYSA-N ammonium persulfate Chemical compound [NH4+].[NH4+].[O-]S(=O)(=O)OOS([O-])(=O)=O ROOXNKNUYICQNP-UHFFFAOYSA-N 0.000 description 16
- 238000010790 dilution Methods 0.000 description 16
- 239000012895 dilution Substances 0.000 description 16
- 238000009396 hybridization Methods 0.000 description 16
- 239000012153 distilled water Substances 0.000 description 15
- 238000011534 incubation Methods 0.000 description 15
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 14
- 229910052786 argon Inorganic materials 0.000 description 14
- 230000002550 fecal effect Effects 0.000 description 14
- 229910052751 metal Inorganic materials 0.000 description 14
- 102000004196 processed proteins & peptides Human genes 0.000 description 14
- 241000283690 Bos taurus Species 0.000 description 13
- 239000008367 deionised water Substances 0.000 description 13
- 229910021641 deionized water Inorganic materials 0.000 description 13
- 238000004128 high performance liquid chromatography Methods 0.000 description 13
- 230000035945 sensitivity Effects 0.000 description 13
- 238000002965 ELISA Methods 0.000 description 12
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 12
- 241000700605 Viruses Species 0.000 description 12
- 238000002835 absorbance Methods 0.000 description 12
- 238000002474 experimental method Methods 0.000 description 12
- 238000009472 formulation Methods 0.000 description 12
- 239000003550 marker Substances 0.000 description 12
- 239000002184 metal Substances 0.000 description 12
- 239000011780 sodium chloride Substances 0.000 description 12
- 208000031886 HIV Infections Diseases 0.000 description 11
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 11
- 241000607142 Salmonella Species 0.000 description 11
- 229920004890 Triton X-100 Polymers 0.000 description 11
- 238000011984 electrochemiluminescence immunoassay Methods 0.000 description 11
- 230000008569 process Effects 0.000 description 11
- 238000005481 NMR spectroscopy Methods 0.000 description 10
- 239000013504 Triton X-100 Substances 0.000 description 10
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 239000000284 extract Substances 0.000 description 10
- 229910052762 osmium Inorganic materials 0.000 description 10
- 239000008363 phosphate buffer Substances 0.000 description 10
- 229910052697 platinum Inorganic materials 0.000 description 10
- 229920000642 polymer Polymers 0.000 description 10
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 10
- 230000009467 reduction Effects 0.000 description 10
- 239000011734 sodium Substances 0.000 description 10
- PUZPDOWCWNUUKD-UHFFFAOYSA-M sodium fluoride Chemical compound [F-].[Na+] PUZPDOWCWNUUKD-UHFFFAOYSA-M 0.000 description 10
- 229920001213 Polysorbate 20 Polymers 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 239000013078 crystal Substances 0.000 description 9
- 238000000855 fermentation Methods 0.000 description 9
- 230000004151 fermentation Effects 0.000 description 9
- 239000003921 oil Substances 0.000 description 9
- SYQBFIAQOQZEGI-UHFFFAOYSA-N osmium atom Chemical compound [Os] SYQBFIAQOQZEGI-UHFFFAOYSA-N 0.000 description 9
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 9
- 238000010992 reflux Methods 0.000 description 9
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 8
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 8
- BPBRCLYSUCQTPZ-UHFFFAOYSA-N 2-pyridin-2-ylpyridine;ruthenium(2+) Chemical compound [Ru+2].N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1 BPBRCLYSUCQTPZ-UHFFFAOYSA-N 0.000 description 8
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 8
- 239000005977 Ethylene Substances 0.000 description 8
- 108060003951 Immunoglobulin Proteins 0.000 description 8
- 241000699670 Mus sp. Species 0.000 description 8
- 102000029797 Prion Human genes 0.000 description 8
- 108091000054 Prion Proteins 0.000 description 8
- 241000726445 Viroids Species 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 229910001870 ammonium persulfate Inorganic materials 0.000 description 8
- 239000000356 contaminant Substances 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 238000000921 elemental analysis Methods 0.000 description 8
- 239000003480 eluent Substances 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 229940088597 hormone Drugs 0.000 description 8
- 239000005556 hormone Substances 0.000 description 8
- 102000018358 immunoglobulin Human genes 0.000 description 8
- 239000002207 metabolite Substances 0.000 description 8
- 125000002524 organometallic group Chemical group 0.000 description 8
- 238000007254 oxidation reaction Methods 0.000 description 8
- 238000000746 purification Methods 0.000 description 8
- 239000011550 stock solution Substances 0.000 description 8
- OHSRAWAUPZWNKY-UHFFFAOYSA-N 4-methyl-2-pyridin-2-ylpyridine Chemical compound CC1=CC=NC(C=2N=CC=CC=2)=C1 OHSRAWAUPZWNKY-UHFFFAOYSA-N 0.000 description 7
- 108090000288 Glycoproteins Proteins 0.000 description 7
- 102000003886 Glycoproteins Human genes 0.000 description 7
- 206010023126 Jaundice Diseases 0.000 description 7
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 7
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 7
- 229920005654 Sephadex Polymers 0.000 description 7
- 239000012507 Sephadex™ Substances 0.000 description 7
- 108010071390 Serum Albumin Proteins 0.000 description 7
- 102000007562 Serum Albumin Human genes 0.000 description 7
- 239000007983 Tris buffer Substances 0.000 description 7
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 7
- 239000012300 argon atmosphere Substances 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 238000007865 diluting Methods 0.000 description 7
- 239000003925 fat Substances 0.000 description 7
- 238000002875 fluorescence polarization Methods 0.000 description 7
- 150000004676 glycans Chemical class 0.000 description 7
- 239000003446 ligand Substances 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 238000005374 membrane filtration Methods 0.000 description 7
- 238000002156 mixing Methods 0.000 description 7
- 239000003960 organic solvent Substances 0.000 description 7
- 239000007800 oxidant agent Substances 0.000 description 7
- 229920001282 polysaccharide Polymers 0.000 description 7
- 239000005017 polysaccharide Substances 0.000 description 7
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 7
- 239000011541 reaction mixture Substances 0.000 description 7
- 230000009257 reactivity Effects 0.000 description 7
- 210000003296 saliva Anatomy 0.000 description 7
- 230000035939 shock Effects 0.000 description 7
- 239000013589 supplement Substances 0.000 description 7
- 238000004448 titration Methods 0.000 description 7
- 238000005406 washing Methods 0.000 description 7
- ADFXKUOMJKEIND-UHFFFAOYSA-N 1,3-dicyclohexylurea Chemical compound C1CCCCC1NC(=O)NC1CCCCC1 ADFXKUOMJKEIND-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- 241000701022 Cytomegalovirus Species 0.000 description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- 108090001030 Lipoproteins Proteins 0.000 description 6
- 102000004895 Lipoproteins Human genes 0.000 description 6
- 229910019142 PO4 Inorganic materials 0.000 description 6
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 6
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 6
- 238000010521 absorption reaction Methods 0.000 description 6
- 229940125717 barbiturate Drugs 0.000 description 6
- HQABUPZFAYXKJW-UHFFFAOYSA-N butan-1-amine Chemical compound CCCCN HQABUPZFAYXKJW-UHFFFAOYSA-N 0.000 description 6
- WHELTKFSBJNBMQ-UHFFFAOYSA-L dichlororuthenium;2-pyridin-2-ylpyridine;hexahydrate Chemical compound O.O.O.O.O.O.[Cl-].[Cl-].[Ru+2].N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1 WHELTKFSBJNBMQ-UHFFFAOYSA-L 0.000 description 6
- 235000014113 dietary fatty acids Nutrition 0.000 description 6
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 6
- 230000007613 environmental effect Effects 0.000 description 6
- 229930195729 fatty acid Natural products 0.000 description 6
- 239000000194 fatty acid Substances 0.000 description 6
- 150000004665 fatty acids Chemical class 0.000 description 6
- 230000001900 immune effect Effects 0.000 description 6
- 239000010410 layer Substances 0.000 description 6
- 238000002844 melting Methods 0.000 description 6
- 230000008018 melting Effects 0.000 description 6
- XELZGAJCZANUQH-UHFFFAOYSA-N methyl 1-acetylthieno[3,2-c]pyrazole-5-carboxylate Chemical compound CC(=O)N1N=CC2=C1C=C(C(=O)OC)S2 XELZGAJCZANUQH-UHFFFAOYSA-N 0.000 description 6
- 235000006408 oxalic acid Nutrition 0.000 description 6
- 239000010452 phosphate Substances 0.000 description 6
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 6
- 235000021251 pulses Nutrition 0.000 description 6
- 239000011347 resin Substances 0.000 description 6
- 229920005989 resin Polymers 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- BYNZKLMEELCCLR-UHFFFAOYSA-L ruthenium(2+);diperchlorate Chemical compound [Ru+2].[O-]Cl(=O)(=O)=O.[O-]Cl(=O)(=O)=O BYNZKLMEELCCLR-UHFFFAOYSA-L 0.000 description 6
- 150000003431 steroids Chemical class 0.000 description 6
- 238000000967 suction filtration Methods 0.000 description 6
- 235000000346 sugar Nutrition 0.000 description 6
- 150000008163 sugars Chemical class 0.000 description 6
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 6
- 239000011782 vitamin Substances 0.000 description 6
- 235000013343 vitamin Nutrition 0.000 description 6
- 229940088594 vitamin Drugs 0.000 description 6
- 229930003231 vitamin Natural products 0.000 description 6
- SPBDXSGPUHCETR-JFUDTMANSA-N 8883yp2r6d Chemical compound O1[C@@H](C)[C@H](O)[C@@H](OC)C[C@@H]1O[C@@H]1[C@@H](OC)C[C@H](O[C@@H]2C(=C/C[C@@H]3C[C@@H](C[C@@]4(O[C@@H]([C@@H](C)CC4)C(C)C)O3)OC(=O)[C@@H]3C=C(C)[C@@H](O)[C@H]4OC\C([C@@]34O)=C/C=C/[C@@H]2C)/C)O[C@H]1C.C1C[C@H](C)[C@@H]([C@@H](C)CC)O[C@@]21O[C@H](C\C=C(C)\[C@@H](O[C@@H]1O[C@@H](C)[C@H](O[C@@H]3O[C@@H](C)[C@H](O)[C@@H](OC)C3)[C@@H](OC)C1)[C@@H](C)\C=C\C=C/1[C@]3([C@H](C(=O)O4)C=C(C)[C@@H](O)[C@H]3OC\1)O)C[C@H]4C2 SPBDXSGPUHCETR-JFUDTMANSA-N 0.000 description 5
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 5
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 5
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 5
- 239000004677 Nylon Substances 0.000 description 5
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical group O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 5
- 229930013930 alkaloid Natural products 0.000 description 5
- 230000000903 blocking effect Effects 0.000 description 5
- 238000004587 chromatography analysis Methods 0.000 description 5
- 230000002860 competitive effect Effects 0.000 description 5
- 238000012790 confirmation Methods 0.000 description 5
- 238000001816 cooling Methods 0.000 description 5
- DHCWLIOIJZJFJE-UHFFFAOYSA-L dichlororuthenium Chemical compound Cl[Ru]Cl DHCWLIOIJZJFJE-UHFFFAOYSA-L 0.000 description 5
- 238000001378 electrochemiluminescence detection Methods 0.000 description 5
- 239000002158 endotoxin Substances 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 238000013095 identification testing Methods 0.000 description 5
- 238000002372 labelling Methods 0.000 description 5
- 229920006008 lipopolysaccharide Polymers 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 5
- 229920001778 nylon Polymers 0.000 description 5
- 150000002902 organometallic compounds Chemical class 0.000 description 5
- 230000003647 oxidation Effects 0.000 description 5
- 239000003208 petroleum Substances 0.000 description 5
- 230000000144 pharmacologic effect Effects 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 239000007981 phosphate-citrate buffer Substances 0.000 description 5
- 238000005424 photoluminescence Methods 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- 235000013024 sodium fluoride Nutrition 0.000 description 5
- 239000011775 sodium fluoride Substances 0.000 description 5
- 239000012064 sodium phosphate buffer Substances 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- OBTZDIRUQWFRFZ-UHFFFAOYSA-N 2-(5-methylfuran-2-yl)-n-(4-methylphenyl)quinoline-4-carboxamide Chemical compound O1C(C)=CC=C1C1=CC(C(=O)NC=2C=CC(C)=CC=2)=C(C=CC=C2)C2=N1 OBTZDIRUQWFRFZ-UHFFFAOYSA-N 0.000 description 4
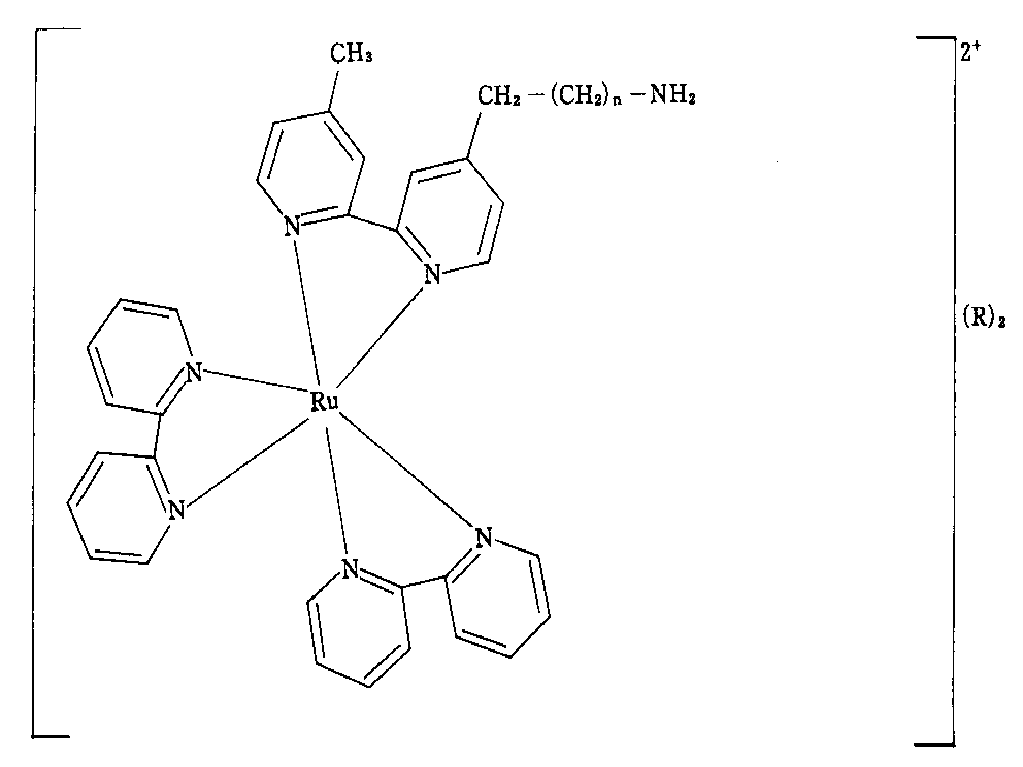
- MWZADJMZKSVTAF-UHFFFAOYSA-N 2-[4-(4-bromobutyl)pyridin-2-yl]-4-methylpyridine;2-pyridin-2-ylpyridine;ruthenium Chemical group [Ru].N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1.CC1=CC=NC(C=2N=CC=C(CCCCBr)C=2)=C1 MWZADJMZKSVTAF-UHFFFAOYSA-N 0.000 description 4
- QRXMUCSWCMTJGU-UHFFFAOYSA-N 5-bromo-4-chloro-3-indolyl phosphate Chemical compound C1=C(Br)C(Cl)=C2C(OP(O)(=O)O)=CNC2=C1 QRXMUCSWCMTJGU-UHFFFAOYSA-N 0.000 description 4
- FCNCGHJSNVOIKE-UHFFFAOYSA-N 9,10-diphenylanthracene Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 FCNCGHJSNVOIKE-UHFFFAOYSA-N 0.000 description 4
- 108090001008 Avidin Proteins 0.000 description 4
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N Butyraldehyde Chemical compound CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 description 4
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Chemical compound CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 4
- 229910013684 LiClO 4 Inorganic materials 0.000 description 4
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 108010090804 Streptavidin Proteins 0.000 description 4
- 230000000735 allogeneic effect Effects 0.000 description 4
- 150000001412 amines Chemical class 0.000 description 4
- 150000001540 azides Chemical class 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 235000020958 biotin Nutrition 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 238000004364 calculation method Methods 0.000 description 4
- 238000005119 centrifugation Methods 0.000 description 4
- 239000007795 chemical reaction product Substances 0.000 description 4
- 239000003638 chemical reducing agent Substances 0.000 description 4
- 238000012875 competitive assay Methods 0.000 description 4
- 239000002131 composite material Substances 0.000 description 4
- 238000011109 contamination Methods 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 4
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical group C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 238000000295 emission spectrum Methods 0.000 description 4
- 230000005284 excitation Effects 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 238000005755 formation reaction Methods 0.000 description 4
- 208000002672 hepatitis B Diseases 0.000 description 4
- 239000012535 impurity Substances 0.000 description 4
- 239000002751 oligonucleotide probe Substances 0.000 description 4
- 150000007524 organic acids Chemical class 0.000 description 4
- 235000005985 organic acids Nutrition 0.000 description 4
- 150000002894 organic compounds Chemical class 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 230000005180 public health Effects 0.000 description 4
- 239000000376 reactant Substances 0.000 description 4
- 238000011084 recovery Methods 0.000 description 4
- YYMBJDOZVAITBP-UHFFFAOYSA-N rubrene Chemical compound C1=CC=CC=C1C(C1=C(C=2C=CC=CC=2)C2=CC=CC=C2C(C=2C=CC=CC=2)=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 YYMBJDOZVAITBP-UHFFFAOYSA-N 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- JKSJUJYQRLQIRH-UHFFFAOYSA-N 2-[4-[3-(1,3-dioxolan-2-yl)propyl]pyridin-2-yl]-4-methylpyridine Chemical compound CC1=CC=NC(C=2N=CC=C(CCCC3OCCO3)C=2)=C1 JKSJUJYQRLQIRH-UHFFFAOYSA-N 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 3
- NGBYKZGOXFIONW-UHFFFAOYSA-N 4-(1,3-dimethyl-2,6-dioxo-7h-purin-8-yl)butanoic acid Chemical compound O=C1N(C)C(=O)N(C)C2=C1NC(CCCC(O)=O)=N2 NGBYKZGOXFIONW-UHFFFAOYSA-N 0.000 description 3
- YPWTYFNCPHJVKG-UHFFFAOYSA-N 4-[2-(4-methylpyridin-2-yl)pyridin-4-yl]butanoic acid;2-pyridin-2-ylpyridine;ruthenium Chemical group [Ru].N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1.CC1=CC=NC(C=2N=CC=C(CCCC(O)=O)C=2)=C1 YPWTYFNCPHJVKG-UHFFFAOYSA-N 0.000 description 3
- ZXLYKNKUQNVBPB-UHFFFAOYSA-N 4-[3-(1,3-dioxolan-2-yl)propyl]-4-methyl-2-pyridin-2-yl-3H-pyridine ruthenium Chemical compound [Ru].CC1(CC(=NC=C1)C1=NC=CC=C1)CCCC1OCCO1 ZXLYKNKUQNVBPB-UHFFFAOYSA-N 0.000 description 3
- 102000010183 Bradykinin receptor Human genes 0.000 description 3
- 108050001736 Bradykinin receptor Proteins 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 3
- 241000233866 Fungi Species 0.000 description 3
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 3
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 3
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- BELBBZDIHDAJOR-UHFFFAOYSA-N Phenolsulfonephthalein Chemical group C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 BELBBZDIHDAJOR-UHFFFAOYSA-N 0.000 description 3
- 229920002684 Sepharose Polymers 0.000 description 3
- 241000194017 Streptococcus Species 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 239000002250 absorbent Substances 0.000 description 3
- 230000002745 absorbent Effects 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- UMGDCJDMYOKAJW-UHFFFAOYSA-N aminothiocarboxamide Natural products NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 3
- 230000000721 bacterilogical effect Effects 0.000 description 3
- 239000012148 binding buffer Substances 0.000 description 3
- 244000309466 calf Species 0.000 description 3
- 150000003857 carboxamides Chemical class 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000012141 concentrate Substances 0.000 description 3
- 239000012043 crude product Substances 0.000 description 3
- 238000000502 dialysis Methods 0.000 description 3
- 238000007598 dipping method Methods 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- NLFBCYMMUAKCPC-KQQUZDAGSA-N ethyl (e)-3-[3-amino-2-cyano-1-[(e)-3-ethoxy-3-oxoprop-1-enyl]sulfanyl-3-oxoprop-1-enyl]sulfanylprop-2-enoate Chemical compound CCOC(=O)\C=C\SC(=C(C#N)C(N)=O)S\C=C\C(=O)OCC NLFBCYMMUAKCPC-KQQUZDAGSA-N 0.000 description 3
- 238000000695 excitation spectrum Methods 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 230000003100 immobilizing effect Effects 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 230000005291 magnetic effect Effects 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 150000002739 metals Chemical class 0.000 description 3
- 235000013336 milk Nutrition 0.000 description 3
- 239000008267 milk Substances 0.000 description 3
- 210000004080 milk Anatomy 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 150000003891 oxalate salts Chemical class 0.000 description 3
- 230000001590 oxidative effect Effects 0.000 description 3
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 3
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 3
- 229960003531 phenolsulfonphthalein Drugs 0.000 description 3
- 239000002504 physiological saline solution Substances 0.000 description 3
- 239000011148 porous material Substances 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 239000006152 selective media Substances 0.000 description 3
- 235000015170 shellfish Nutrition 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 239000012279 sodium borohydride Substances 0.000 description 3
- 229910000033 sodium borohydride Inorganic materials 0.000 description 3
- GGCZERPQGJTIQP-UHFFFAOYSA-N sodium;9,10-dioxoanthracene-2-sulfonic acid Chemical compound [Na+].C1=CC=C2C(=O)C3=CC(S(=O)(=O)O)=CC=C3C(=O)C2=C1 GGCZERPQGJTIQP-UHFFFAOYSA-N 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 238000010408 sweeping Methods 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 2
- RXYPXQSKLGGKOL-UHFFFAOYSA-N 1,4-dimethylpiperazine Chemical compound CN1CCN(C)CC1 RXYPXQSKLGGKOL-UHFFFAOYSA-N 0.000 description 2
- HCYFGRCYSCXKNQ-UHFFFAOYSA-N 2-(1,3-dimethyl-2,6-dioxo-7-purinyl)acetic acid Chemical compound O=C1N(C)C(=O)N(C)C2=C1N(CC(O)=O)C=N2 HCYFGRCYSCXKNQ-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 2
- VKIGAWAEXPTIOL-UHFFFAOYSA-N 2-hydroxyhexanenitrile Chemical compound CCCCC(O)C#N VKIGAWAEXPTIOL-UHFFFAOYSA-N 0.000 description 2
- BZSVVCFHMVMYCR-UHFFFAOYSA-N 2-pyridin-2-ylpyridine;ruthenium Chemical compound [Ru].N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1 BZSVVCFHMVMYCR-UHFFFAOYSA-N 0.000 description 2
- NHKTUSUPCAKVHT-UHFFFAOYSA-L 2-pyridin-2-ylpyridine;ruthenium(2+);dichloride;dihydrate Chemical compound O.O.Cl[Ru]Cl.N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1 NHKTUSUPCAKVHT-UHFFFAOYSA-L 0.000 description 2
- OVLLDIFWPZHRRQ-UHFFFAOYSA-N 3-chloro-2-(3-chloropyridin-2-yl)pyridine Chemical compound ClC1=CC=CN=C1C1=NC=CC=C1Cl OVLLDIFWPZHRRQ-UHFFFAOYSA-N 0.000 description 2
- LFMPLEMXVCGLMX-UHFFFAOYSA-N 4-[2-(4-methylpyridin-2-yl)pyridin-4-yl]butanoic acid Chemical compound CC1=CC=NC(C=2N=CC=C(CCCC(O)=O)C=2)=C1 LFMPLEMXVCGLMX-UHFFFAOYSA-N 0.000 description 2
- NBPGPQJFYXNFKN-UHFFFAOYSA-N 4-methyl-2-(4-methylpyridin-2-yl)pyridine Chemical compound CC1=CC=NC(C=2N=CC=C(C)C=2)=C1 NBPGPQJFYXNFKN-UHFFFAOYSA-N 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 2
- 206010005003 Bladder cancer Diseases 0.000 description 2
- 102000004506 Blood Proteins Human genes 0.000 description 2
- 108010017384 Blood Proteins Proteins 0.000 description 2
- 241000167854 Bourreria succulenta Species 0.000 description 2
- 102400000967 Bradykinin Human genes 0.000 description 2
- 101800004538 Bradykinin Proteins 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 108020003215 DNA Probes Proteins 0.000 description 2
- 239000003298 DNA probe Substances 0.000 description 2
- 108010001682 Dextranase Proteins 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 241000701959 Escherichia virus Lambda Species 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- QXZGBUJJYSLZLT-UHFFFAOYSA-N H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH Natural products NC(N)=NCCCC(N)C(=O)N1CCCC1C(=O)N1C(C(=O)NCC(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CO)C(=O)N2C(CCC2)C(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CCCN=C(N)N)C(O)=O)CCC1 QXZGBUJJYSLZLT-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 2
- 101000978840 Mus musculus Glycoprotein endo-alpha-1,2-mannosidase Proteins 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Natural products NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 239000003570 air Substances 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 235000011114 ammonium hydroxide Nutrition 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 239000004305 biphenyl Substances 0.000 description 2
- QXZGBUJJYSLZLT-FDISYFBBSA-N bradykinin Chemical compound NC(=N)NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NCC(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CO)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)CCC1 QXZGBUJJYSLZLT-FDISYFBBSA-N 0.000 description 2
- 229940045348 brown mixture Drugs 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 235000019693 cherries Nutrition 0.000 description 2
- 238000004140 cleaning Methods 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 238000002484 cyclic voltammetry Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- MGAJEYXQYJBLQL-UHFFFAOYSA-L dichlororuthenium;2-pyridin-2-ylpyridine Chemical compound Cl[Ru]Cl.N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1 MGAJEYXQYJBLQL-UHFFFAOYSA-L 0.000 description 2
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 2
- 229940043237 diethanolamine Drugs 0.000 description 2
- 229940043279 diisopropylamine Drugs 0.000 description 2
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 2
- 229940043264 dodecyl sulfate Drugs 0.000 description 2
- 238000002848 electrochemical method Methods 0.000 description 2
- 239000012149 elution buffer Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 238000009585 enzyme analysis Methods 0.000 description 2
- 239000006153 eosin methylene blue Substances 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000002523 gelfiltration Methods 0.000 description 2
- 229910021397 glassy carbon Inorganic materials 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 150000003949 imides Chemical class 0.000 description 2
- 230000000984 immunochemical effect Effects 0.000 description 2
- 238000010166 immunofluorescence Methods 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- 238000005342 ion exchange Methods 0.000 description 2
- 239000003456 ion exchange resin Substances 0.000 description 2
- 229920003303 ion-exchange polymer Polymers 0.000 description 2
- 229910052741 iridium Inorganic materials 0.000 description 2
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 2
- 238000005304 joining Methods 0.000 description 2
- 150000003951 lactams Chemical class 0.000 description 2
- 239000004816 latex Substances 0.000 description 2
- 229920000126 latex Polymers 0.000 description 2
- 238000012417 linear regression Methods 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- 239000006249 magnetic particle Substances 0.000 description 2
- 229910052750 molybdenum Inorganic materials 0.000 description 2
- 239000011733 molybdenum Substances 0.000 description 2
- 239000012452 mother liquor Substances 0.000 description 2
- JPXMTWWFLBLUCD-UHFFFAOYSA-N nitro blue tetrazolium(2+) Chemical group COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC(=CC=2)[N+]([O-])=O)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=C([N+]([O-])=O)C=C1 JPXMTWWFLBLUCD-UHFFFAOYSA-N 0.000 description 2
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- MQZFZDIZKWNWFX-UHFFFAOYSA-N osmium(2+) Chemical compound [Os+2] MQZFZDIZKWNWFX-UHFFFAOYSA-N 0.000 description 2
- 239000003973 paint Substances 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 229910000160 potassium phosphate Inorganic materials 0.000 description 2
- 239000008057 potassium phosphate buffer Substances 0.000 description 2
- 235000011009 potassium phosphates Nutrition 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 235000019833 protease Nutrition 0.000 description 2
- 239000005297 pyrex Substances 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 229910052702 rhenium Inorganic materials 0.000 description 2
- WUAPFZMCVAUBPE-UHFFFAOYSA-N rhenium atom Chemical compound [Re] WUAPFZMCVAUBPE-UHFFFAOYSA-N 0.000 description 2
- 229910052703 rhodium Inorganic materials 0.000 description 2
- 239000010948 rhodium Substances 0.000 description 2
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 2
- 238000002390 rotary evaporation Methods 0.000 description 2
- 150000003304 ruthenium compounds Chemical class 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000007974 sodium acetate buffer Substances 0.000 description 2
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 2
- 235000021055 solid food Nutrition 0.000 description 2
- 239000011343 solid material Substances 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 230000003595 spectral effect Effects 0.000 description 2
- 238000002798 spectrophotometry method Methods 0.000 description 2
- 239000012086 standard solution Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 201000005112 urinary bladder cancer Diseases 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- 239000002699 waste material Substances 0.000 description 2
- 229910052727 yttrium Inorganic materials 0.000 description 2
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- QYIXCDOBOSTCEI-QCYZZNICSA-N (5alpha)-cholestan-3beta-ol Chemical compound C([C@@H]1CC2)[C@@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@H](C)CCCC(C)C)[C@@]2(C)CC1 QYIXCDOBOSTCEI-QCYZZNICSA-N 0.000 description 1
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- VEFLKXRACNJHOV-UHFFFAOYSA-N 1,3-dibromopropane Chemical compound BrCCCBr VEFLKXRACNJHOV-UHFFFAOYSA-N 0.000 description 1
- GGZQLTVZPOGLCC-UHFFFAOYSA-N 2-(2-bromoethyl)-1,3-dioxolane Chemical compound BrCCC1OCCO1 GGZQLTVZPOGLCC-UHFFFAOYSA-N 0.000 description 1
- VJEZYZLITKUTFH-UHFFFAOYSA-N 2-(hydrazinecarbonyl)benzoic acid Chemical compound NNC(=O)C1=CC=CC=C1C(O)=O VJEZYZLITKUTFH-UHFFFAOYSA-N 0.000 description 1
- QBWVHZUSTRNLHR-UHFFFAOYSA-N 2-[4-(4-bromobutyl)pyridin-2-yl]-4-methylpyridine Chemical compound CC1=CC=NC(C=2N=CC=C(CCCCBr)C=2)=C1 QBWVHZUSTRNLHR-UHFFFAOYSA-N 0.000 description 1
- ICQVCXUCSYEVEU-UHFFFAOYSA-N 2-[4-(4-bromobutyl)pyridin-2-yl]-4-methylpyridine 2-pyridin-2-ylpyridine ruthenium(2+) Chemical compound [Ru+2].N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1.CC1=CC=NC(C=2N=CC=C(CCCCBr)C=2)=C1 ICQVCXUCSYEVEU-UHFFFAOYSA-N 0.000 description 1
- KZUZNWJDQZNLJS-UHFFFAOYSA-N 2-[4-[2-(4-methylpyridin-2-yl)pyridin-4-yl]butyl]isoindole-1,3-dione Chemical compound CC1=CC=NC(C=2N=CC=C(CCCCN3C(C4=CC=CC=C4C3=O)=O)C=2)=C1 KZUZNWJDQZNLJS-UHFFFAOYSA-N 0.000 description 1
- GHCZTIFQWKKGSB-UHFFFAOYSA-N 2-hydroxypropane-1,2,3-tricarboxylic acid;phosphoric acid Chemical compound OP(O)(O)=O.OC(=O)CC(O)(C(O)=O)CC(O)=O GHCZTIFQWKKGSB-UHFFFAOYSA-N 0.000 description 1
- GNCLXBRZMPJPTL-UHFFFAOYSA-N 2-pyridin-2-ylpyridine;ruthenium Chemical compound [Ru].N1=CC=CC=C1C1=CC=CC=N1.N1=CC=CC=C1C1=CC=CC=N1 GNCLXBRZMPJPTL-UHFFFAOYSA-N 0.000 description 1
- IITIZHOBOIBGBW-UHFFFAOYSA-N 3-ethyl-2h-1,3-benzothiazole Chemical compound C1=CC=C2N(CC)CSC2=C1 IITIZHOBOIBGBW-UHFFFAOYSA-N 0.000 description 1
- HIJQFTSZBHDYKW-UHFFFAOYSA-N 4,4-dimethyloxane-2,6-dione Chemical compound CC1(C)CC(=O)OC(=O)C1 HIJQFTSZBHDYKW-UHFFFAOYSA-N 0.000 description 1
- XZKIHKMTEMTJQX-UHFFFAOYSA-N 4-Nitrophenyl Phosphate Chemical compound OP(O)(=O)OC1=CC=C([N+]([O-])=O)C=C1 XZKIHKMTEMTJQX-UHFFFAOYSA-N 0.000 description 1
- HUDPLKWXRLNSPC-UHFFFAOYSA-N 4-aminophthalhydrazide Chemical group O=C1NNC(=O)C=2C1=CC(N)=CC=2 HUDPLKWXRLNSPC-UHFFFAOYSA-N 0.000 description 1
- FNLDCZCNGSQKIC-UHFFFAOYSA-N 5,6-diamino-1,3-dimethylpyrimidine-2,4-dione;hydrate Chemical compound O.CN1C(N)=C(N)C(=O)N(C)C1=O FNLDCZCNGSQKIC-UHFFFAOYSA-N 0.000 description 1
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 108010065511 Amylases Proteins 0.000 description 1
- 102000013142 Amylases Human genes 0.000 description 1
- 241001550224 Apha Species 0.000 description 1
- 240000003291 Armoracia rusticana Species 0.000 description 1
- 235000011330 Armoracia rusticana Nutrition 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- VLKSJYFGXZQSDX-UHFFFAOYSA-N BrC1=CC=C2NC(OP(O)(=O)O)=CC2=C1Cl Chemical compound BrC1=CC=C2NC(OP(O)(=O)O)=CC2=C1Cl VLKSJYFGXZQSDX-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- ZTBNJBRVZXGKJW-UHFFFAOYSA-M CC1=CC(C2=NC=CC(CCCC([O-])=O)=C2)=NC=C1.C1=CC(C2=NC=CC=C2)=NC=C1.C1=CC(C2=NC=CC=C2)=NC=C1.[Ru+2] Chemical compound CC1=CC(C2=NC=CC(CCCC([O-])=O)=C2)=NC=C1.C1=CC(C2=NC=CC=C2)=NC=C1.C1=CC(C2=NC=CC=C2)=NC=C1.[Ru+2] ZTBNJBRVZXGKJW-UHFFFAOYSA-M 0.000 description 1
- DRSHXJFUUPIBHX-UHFFFAOYSA-N COc1ccc(cc1)N1N=CC2C=NC(Nc3cc(OC)c(OC)c(OCCCN4CCN(C)CC4)c3)=NC12 Chemical compound COc1ccc(cc1)N1N=CC2C=NC(Nc3cc(OC)c(OC)c(OCCCN4CCN(C)CC4)c3)=NC12 DRSHXJFUUPIBHX-UHFFFAOYSA-N 0.000 description 1
- 241000589876 Campylobacter Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 241000588923 Citrobacter Species 0.000 description 1
- 235000005979 Citrus limon Nutrition 0.000 description 1
- 244000131522 Citrus pyriformis Species 0.000 description 1
- 241000193403 Clostridium Species 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 101100136092 Drosophila melanogaster peng gene Proteins 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 241000588914 Enterobacter Species 0.000 description 1
- 241000588722 Escherichia Species 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 208000019331 Foodborne disease Diseases 0.000 description 1
- 241000295146 Gallionellaceae Species 0.000 description 1
- 206010017916 Gastroenteritis staphylococcal Diseases 0.000 description 1
- 239000004366 Glucose oxidase Substances 0.000 description 1
- 108010015776 Glucose oxidase Proteins 0.000 description 1
- 108010056771 Glucosidases Proteins 0.000 description 1
- 102000004366 Glucosidases Human genes 0.000 description 1
- 108010060309 Glucuronidase Proteins 0.000 description 1
- 102000053187 Glucuronidase Human genes 0.000 description 1
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 1
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 1
- 102000006771 Gonadotropins Human genes 0.000 description 1
- 108010086677 Gonadotropins Proteins 0.000 description 1
- 238000003794 Gram staining Methods 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 1
- 102100024319 Intestinal-type alkaline phosphatase Human genes 0.000 description 1
- 101710184243 Intestinal-type alkaline phosphatase Proteins 0.000 description 1
- 108090000856 Lyases Proteins 0.000 description 1
- 102000004317 Lyases Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 102000005717 Myeloma Proteins Human genes 0.000 description 1
- 108010045503 Myeloma Proteins Proteins 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 108700005081 Overlapping Genes Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 235000016816 Pisum sativum subsp sativum Nutrition 0.000 description 1
- 229920002594 Polyethylene Glycol 8000 Polymers 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004353 Polyethylene glycol 8000 Substances 0.000 description 1
- 108010021757 Polynucleotide 5'-Hydroxyl-Kinase Proteins 0.000 description 1
- 102000008422 Polynucleotide 5'-hydroxyl-kinase Human genes 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108020004518 RNA Probes Proteins 0.000 description 1
- 239000003391 RNA probe Substances 0.000 description 1
- 239000012327 Ruthenium complex Substances 0.000 description 1
- 241000607121 Salmonella enterica subsp. enterica serovar Potsdam Species 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 208000008582 Staphylococcal Food Poisoning Diseases 0.000 description 1
- 108010088160 Staphylococcal Protein A Proteins 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000000389 T-cell leukemia Diseases 0.000 description 1
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 description 1
- 241000589262 Tatlockia micdadei Species 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 108010046334 Urease Proteins 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 241000607598 Vibrio Species 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- 241000607734 Yersinia <bacteria> Species 0.000 description 1
- YRXOGYTYGJRPFQ-UHFFFAOYSA-L [Ru++].[O-][Cl](=O)(=O)=O.[O-][Cl](=O)(=O)=O.c1ccc(nc1)-c1ccccn1.c1ccc(nc1)-c1ccccn1.Cc1ccnc(c1)-c1cc(CCCCBr)ccn1 Chemical compound [Ru++].[O-][Cl](=O)(=O)=O.[O-][Cl](=O)(=O)=O.c1ccc(nc1)-c1ccccn1.c1ccc(nc1)-c1ccccn1.Cc1ccnc(c1)-c1cc(CCCCBr)ccn1 YRXOGYTYGJRPFQ-UHFFFAOYSA-L 0.000 description 1
- GTDPSWPPOUPBNX-UHFFFAOYSA-N ac1mqpva Chemical compound CC12C(=O)OC(=O)C1(C)C1(C)C2(C)C(=O)OC1=O GTDPSWPPOUPBNX-UHFFFAOYSA-N 0.000 description 1
- 229940008309 acetone / ethanol Drugs 0.000 description 1
- PBCJIPOGFJYBJE-UHFFFAOYSA-N acetonitrile;hydrate Chemical compound O.CC#N PBCJIPOGFJYBJE-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical group C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 230000004520 agglutination Effects 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 230000001618 algogenic effect Effects 0.000 description 1
- QYIXCDOBOSTCEI-UHFFFAOYSA-N alpha-cholestanol Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(C)CCCC(C)C)C1(C)CC2 QYIXCDOBOSTCEI-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 235000019418 amylase Nutrition 0.000 description 1
- 229940025131 amylases Drugs 0.000 description 1
- 229940035674 anesthetics Drugs 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002788 anti-peptide Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 238000011091 antibody purification Methods 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- HSHNITRMYYLLCV-UHFFFAOYSA-N beta-methyl umbelliferone Natural products C1=C(O)C=CC2=C1OC(=O)C=C2C HSHNITRMYYLLCV-UHFFFAOYSA-N 0.000 description 1
- 238000005513 bias potential Methods 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 238000010876 biochemical test Methods 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 1
- 229910010277 boron hydride Inorganic materials 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- MSZJEPVVQWJCIF-UHFFFAOYSA-N butylazanide Chemical compound CCCC[NH-] MSZJEPVVQWJCIF-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 235000013351 cheese Nutrition 0.000 description 1
- 229940068911 chloride hexahydrate Drugs 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 210000001136 chorion Anatomy 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 238000002967 competitive immunoassay Methods 0.000 description 1
- 239000011365 complex material Substances 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical group NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000002498 deadly effect Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- SRBXXQDKBKTWOC-UHFFFAOYSA-J diazanium;hexachloroosmium(2-) Chemical compound [NH4+].[NH4+].[Cl-].[Cl-].[Cl-].[Cl-].[Cl-].[Cl-].[Os+4] SRBXXQDKBKTWOC-UHFFFAOYSA-J 0.000 description 1
- 239000006160 differential media Substances 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- ZOMNIUBKTOKEHS-UHFFFAOYSA-L dimercury dichloride Chemical class Cl[Hg][Hg]Cl ZOMNIUBKTOKEHS-UHFFFAOYSA-L 0.000 description 1
- VIYFPAMJCJLZKD-UHFFFAOYSA-L disodium;(4-nitrophenyl) phosphate Chemical group [Na+].[Na+].[O-][N+](=O)C1=CC=C(OP([O-])([O-])=O)C=C1 VIYFPAMJCJLZKD-UHFFFAOYSA-L 0.000 description 1
- KAKKHKRHCKCAGH-UHFFFAOYSA-L disodium;(4-nitrophenyl) phosphate;hexahydrate Chemical compound O.O.O.O.O.O.[Na+].[Na+].[O-][N+](=O)C1=CC=C(OP([O-])([O-])=O)C=C1 KAKKHKRHCKCAGH-UHFFFAOYSA-L 0.000 description 1
- WBZKQQHYRPRKNJ-UHFFFAOYSA-L disulfite Chemical compound [O-]S(=O)S([O-])(=O)=O WBZKQQHYRPRKNJ-UHFFFAOYSA-L 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000005518 electrochemistry Effects 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000006056 electrooxidation reaction Methods 0.000 description 1
- 244000088681 endo Species 0.000 description 1
- 231100000249 enterotoxic Toxicity 0.000 description 1
- 230000002242 enterotoxic effect Effects 0.000 description 1
- 239000003344 environmental pollutant Substances 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 230000001973 epigenetic effect Effects 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 210000003495 flagella Anatomy 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000002189 fluorescence spectrum Methods 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 235000012041 food component Nutrition 0.000 description 1
- 239000005417 food ingredient Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 239000013505 freshwater Substances 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 239000003193 general anesthetic agent Substances 0.000 description 1
- 239000011491 glass wool Substances 0.000 description 1
- 229940116332 glucose oxidase Drugs 0.000 description 1
- 235000019420 glucose oxidase Nutrition 0.000 description 1
- LEQAOMBKQFMDFZ-UHFFFAOYSA-N glyoxal Chemical compound O=CC=O LEQAOMBKQFMDFZ-UHFFFAOYSA-N 0.000 description 1
- 239000002622 gonadotropin Substances 0.000 description 1
- 239000010439 graphite Substances 0.000 description 1
- 229910002804 graphite Inorganic materials 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 231100001261 hazardous Toxicity 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 208000005252 hepatitis A Diseases 0.000 description 1
- VOAPTKOANCCNFV-UHFFFAOYSA-N hexahydrate;hydrochloride Chemical compound O.O.O.O.O.O.Cl VOAPTKOANCCNFV-UHFFFAOYSA-N 0.000 description 1
- 150000004687 hexahydrates Chemical class 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- QWPPOHNGKGFGJK-UHFFFAOYSA-N hypochlorous acid Chemical compound ClO QWPPOHNGKGFGJK-UHFFFAOYSA-N 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000013198 immunometric assay Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000002054 inoculum Substances 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- BYXYCUABYHCYLY-UHFFFAOYSA-N isoindole-1,3-dione;potassium Chemical compound [K].C1=CC=C2C(=O)NC(=O)C2=C1 BYXYCUABYHCYLY-UHFFFAOYSA-N 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 231100000225 lethality Toxicity 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- MHCFAGZWMAWTNR-UHFFFAOYSA-M lithium perchlorate Chemical compound [Li+].[O-]Cl(=O)(=O)=O MHCFAGZWMAWTNR-UHFFFAOYSA-M 0.000 description 1
- 229910001486 lithium perchlorate Inorganic materials 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 238000000504 luminescence detection Methods 0.000 description 1
- HWYHZTIRURJOHG-UHFFFAOYSA-N luminol Chemical group O=C1NNC(=O)C2=C1C(N)=CC=C2 HWYHZTIRURJOHG-UHFFFAOYSA-N 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 150000002690 malonic acid derivatives Chemical class 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 150000002736 metal compounds Chemical class 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- JBDAGYZKJPXEMC-UHFFFAOYSA-L methyl 2-(4-methoxycarbonylpyridin-2-yl)pyridine-4-carboxylate;ruthenium(2+);dichloride Chemical compound Cl[Ru]Cl.COC(=O)C1=CC=NC(C=2N=CC=C(C=2)C(=O)OC)=C1.COC(=O)C1=CC=NC(C=2N=CC=C(C=2)C(=O)OC)=C1 JBDAGYZKJPXEMC-UHFFFAOYSA-L 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000000010 microbial pathogen Species 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 238000011169 microbiological contamination Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- HOGDNTQCSIKEEV-UHFFFAOYSA-N n'-hydroxybutanediamide Chemical compound NC(=O)CCC(=O)NO HOGDNTQCSIKEEV-UHFFFAOYSA-N 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 229910000510 noble metal Inorganic materials 0.000 description 1
- 235000012149 noodles Nutrition 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 150000002907 osmium Chemical class 0.000 description 1
- 150000002908 osmium compounds Chemical class 0.000 description 1
- 229940039748 oxalate Drugs 0.000 description 1
- GSWAOPJLTADLTN-UHFFFAOYSA-N oxidanimine Chemical compound [O-][NH3+] GSWAOPJLTADLTN-UHFFFAOYSA-N 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-M perchlorate Inorganic materials [O-]Cl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-M 0.000 description 1
- 239000000447 pesticide residue Substances 0.000 description 1
- CAQLJSRXLNNKOR-UHFFFAOYSA-N phenyl(2-phenylphosphanylethenyl)phosphane Chemical group C=1C=CC=CC=1PC=CPC1=CC=CC=C1 CAQLJSRXLNNKOR-UHFFFAOYSA-N 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000001443 photoexcitation Effects 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 231100000719 pollutant Toxicity 0.000 description 1
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 235000019446 polyethylene glycol 8000 Nutrition 0.000 description 1
- 229940085678 polyethylene glycol 8000 Drugs 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- ZNNZYHKDIALBAK-UHFFFAOYSA-M potassium thiocyanate Chemical compound [K+].[S-]C#N ZNNZYHKDIALBAK-UHFFFAOYSA-M 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 238000012746 preparative thin layer chromatography Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical compound OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 1
- 238000000197 pyrolysis Methods 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 150000004728 pyruvic acid derivatives Chemical class 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 108700042226 ras Genes Proteins 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 239000001044 red dye Substances 0.000 description 1
- 235000021067 refined food Nutrition 0.000 description 1
- 239000012557 regeneration buffer Substances 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 108020004418 ribosomal RNA Proteins 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 235000013580 sausages Nutrition 0.000 description 1
- 238000007790 scraping Methods 0.000 description 1
- 238000011896 sensitive detection Methods 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229920002545 silicone oil Polymers 0.000 description 1
- 229910001961 silver nitrate Inorganic materials 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- BAZAXWOYCMUHIX-UHFFFAOYSA-M sodium perchlorate Chemical compound [Na+].[O-]Cl(=O)(=O)=O BAZAXWOYCMUHIX-UHFFFAOYSA-M 0.000 description 1
- 229910001488 sodium perchlorate Inorganic materials 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 201000002190 staphyloenterotoxemia Diseases 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000007863 steatosis Effects 0.000 description 1
- 231100000240 steatosis hepatitis Toxicity 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- 229910052713 technetium Inorganic materials 0.000 description 1
- GKLVYJBZJHMRIY-UHFFFAOYSA-N technetium atom Chemical compound [Tc] GKLVYJBZJHMRIY-UHFFFAOYSA-N 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- DPNGAWRBXKSTKZ-UHFFFAOYSA-J tetrabutylazanium tetrafluoride Chemical compound [F-].[F-].[F-].[F-].CCCC[N+](CCCC)(CCCC)CCCC.CCCC[N+](CCCC)(CCCC)CCCC.CCCC[N+](CCCC)(CCCC)CCCC.CCCC[N+](CCCC)(CCCC)CCCC DPNGAWRBXKSTKZ-UHFFFAOYSA-J 0.000 description 1
- MUUHXGOJWVMBDY-UHFFFAOYSA-L tetrazolium blue Chemical compound [Cl-].[Cl-].COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC=CC=2)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 MUUHXGOJWVMBDY-UHFFFAOYSA-L 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical group [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M thiocyanate group Chemical group [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 210000002105 tongue Anatomy 0.000 description 1
- 230000017105 transposition Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 239000011800 void material Substances 0.000 description 1
- 238000004832 voltammetry Methods 0.000 description 1
- 239000002351 wastewater Substances 0.000 description 1
- 238000004457 water analysis Methods 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 210000002268 wool Anatomy 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/74—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving hormones or other non-cytokine intercellular protein regulatory factors such as growth factors, including receptors to hormones and growth factors
- G01N33/76—Human chorionic gonadotropin including luteinising hormone, follicle stimulating hormone, thyroid stimulating hormone or their receptors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/531—Production of immunochemical test materials
- G01N33/532—Production of labelled immunochemicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/04—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms
- C07D473/06—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms with radicals containing only hydrogen and carbon atoms, attached in position 1 or 3
- C07D473/08—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms with radicals containing only hydrogen and carbon atoms, attached in position 1 or 3 with methyl radicals in positions 1 and 3, e.g. theophylline
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/002—Osmium compounds
- C07F15/0026—Osmium compounds without a metal-carbon linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/0046—Ruthenium compounds
- C07F15/0053—Ruthenium compounds without a metal-carbon linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/531—Production of immunochemical test materials
- G01N33/532—Production of labelled immunochemicals
- G01N33/533—Production of labelled immunochemicals with fluorescent label
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56911—Bacteria
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/582—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances with fluorescent label
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2458/00—Labels used in chemical analysis of biological material
- G01N2458/30—Electrochemically active labels
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Virology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Endocrinology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Reproductive Health (AREA)
- Toxicology (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pyridine Compounds (AREA)
- Peptides Or Proteins (AREA)
- Luminescent Compositions (AREA)
- Steroid Compounds (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
요약없음
Description
제1도는 용액에서 항원의 농도를 측정하기 위해 동종 면역 분석법을 위해 만들어진 전기화학발광 측정을 나타낸 것이다.
제2도는 균일한 ECL 테오필린 분석의 결과를 그래프로 나타낸 것이다.
제3도는 다양한 혈청에서 동종 테오필린 분석의 결과를 그래프로 나타낸 것이다.
●=정상 혈청.
■=용혈된 혈청.
◆=지방혈증의 혈청.
□=황달에 걸린 혈청.
제4도는 ECL 테오필린 분석법의 결과와 형광 극성화 테오필린 분석의 결과를 비교하여 그래프로 나타낸 것이다.
A 정상 혈청 : n=4 ; 기울기=.986 ; r=1.00
B 용혈된 혈청 : n=3 ; 기울기=.878 ; r=1.00
C 지방혈증의 혈청 : n=5 ; 기울기=.872 ; r=0.99
D 황달에 걸린 혈청 : n=4 ; 기울기=2.14 ; r=1.00
제5도는 ECL 테오필린 분석의 결과와 고압 액체 크로마토그래피 분석의 결과를 비교하여 그래프로 나타낸 것이다.
n=9 ; 기울기=1.197 ; r=0.98
제6도는 ECL 디곡신 면역분석에서 발생된 ECL 시그날의 변조를 그래프로 나타낸 것이다.
제7도는 ECL 디곡신 면역분석의 결과를 그래프로 나타낸 것이다.
■=블랭크
●=디곡신
제8도는 MBI 38-화합물 I의 다양한 농도에 따라 생겨난 ECL 시그날을 그래프로 나타낸 것이다.
제9도는 MBI 38-화합물 I의 잡종 형성/감수성 연구의 결과를 나타낸 것이다.
제10도는 MBI 38-화합물 I의 특이성 연구의 결과를 나타낸 것이다.
발명의 배경
본 출원내에서 몇몇 문헌들은 괄호안의 아라비아-숫자로 언급된다. 이 참고문헌에 대한 모든 인용문들은 이 명세서의 끝이면서 청구범위의 바로 앞부분에서 발견될 수 있다. 그들의 전체의 이들 문헌의 발표들을 이 특허에 관계된 분야의 상태들을 보다 완전히 기술하기 위해 이 출원에 참고로 포함시켰다.
화학, 생화학 및 생물학적 물질들을 감지하고 정량하는 신속하고 매우 특별한 방법에 대한 요구가 계속적으로 늘어왔다. 특히 가치있는 것은 소량의 제약, 대사물, 미생물 및 다른 진단가치가 있는 물질들을 측정하기 위한 방법이다. 그러한 물질로는 마취제 및 독물, 치료목적으로 투여되는 시약, 호르몬, 병원성 미생물 및 비루스, 항체, 대사물, 효소 및 핵산등이 있다.
이러한 물질들의 존재는 종종 많은 생화학적 및 생물학적 시스템의 특징을 나타내는 고도의 특이성을 이용하는 결합 방법들에 의해 측정될 수 있다. 때때로 사용되는 방법들은 예를들어 항원-항체 시스템, 핵산 잡종 형성 기술 및 단백질-리간드 시스템을 기준으로 한다. 이러한 방법들에서, 진단가치가 있는 복합체의 존재는 하나 이상의 복합 물질에 부착된 뚜렷한 "표지"의 존재나 부재에 의하여 통상적으로 나타난다. 선택된 특별한 표지화시키는 방법은 관심있는 물질을 감지하기 위한 특별한 시스템의 유용성과 다양성을 가리킨다. 바람직한 표지는 그 물질들의 중요한 결합 특성을 변경시키지 않으면서 광범위하게 다양한 화학적, 생화학적 및 생물학적 물질들에 효과적으로 부착될 수 있고, 값싸고 안정해야만 한다. 표지는 매우 특징적인 시그날을 제공해야만 하며 자연에서는 좀체로, 바람직하게는 전혀 발견되지 않아야만 한다. 표지는 몇달에 걸친 시간동안 수성 시스템에서 안정하고 검출가능해야만 한다. 표지의 검출은 값이 비싸고, 특별한 설비나 요원을 필요로 하지 않으면서 신속하고, 감수성이 있으며 재현성이 있어야만 한다. 표지의 정량화는 분석되는 혼합물의 조성 및 온도등과 같은 변수들에 대해 비교적 독립적이어야만 한다.
가장 유리한 표지는 동(同)종 시스템, 즉, 복합 및 비복합 표지된 물질의 분리가 필요하지 않은 시스템으로 사용될 수 있는 것이다. 이것은 표지된 물질이 특정 복합체내로 함입될때 표지의 검출가능성이 조절된다면 가능하다.
광범위한 표지가 각각 특별한 장점과 단점들을 지니면서 개발되어 왔다. 예를들어, 방사성 표지는 상당히 용도가 다양하며 매우 낮은 농도에서 검출될 수 있다. 그러나 그것들은 값이 비싸고, 위험하며, 사용할때 정교한 기구와 숙련된 요원이 필요하다. 더우기, 방사성 표지의 감수성은 검출가능한 결과가 그 근본 특성으로 표지된 물질에서 방사성 원자당 단지 1회만 일어날 수 있다는 사실에 의해 제한된다. 더구나, 방사성 표지는 동종 방법으로 사용될 수 없다. 그리하여 비-방사성 표지에 널리 관심이 집중되어 왔다. 이것들로는 분광광도, 스핀 공명 및 발광기법에 의해 관찰 가능한 물질과 그러한 물질들을 생성하는 효소가 있다. 유용한 것으로 비-방사성 표지 물질은 유기 금속 화합물이다. 생물학적 시스템에서 그러한 금속은 희귀하므로, 유리금속 화합물의 금속 성분을 특이적으로 분석하는 방법이 성공적으로 이용될 수 있다. 예를들어, 카이즈의 미합중국 특허 제4,205,952호(1980년)는 특정 항원을 정량하는데 사용하기 위해 특정 유기금속 화합물로 표지된 면역화학적으로 활성인 물질들의 사용을 기술한다. 선택된 금속을 검출하는 일반적인 방법은 이들 표지와 함께, 방출, 흡수 및 형광 분광광도법, 원자 흡수 및 중성자 방사화등이 사용될 수 있다. 이 방법들은 종종 감수성이 결여되어 있으며, 동종 시스템에 좀체 적용될 수 없으며, 원자 흡수와 함께 때때로 견본의 파괴를 일으킨다.
특히 흥미있는 것은 광화학, 화학 및 전기화학적인 수단을 통해 발광될 수 있는 표지이다. "광발광"이란 전자기 방사선을 흡수할때 발광을 낼수 있는 물질에 의한 공정이다. 형광과 인광은 광발광의 형태이다. "화학발광"공정들은 에너지의 화학적 이동으로 인한 발광종의 생성을 일으킨다. "전기화학발광"은 전기화학적으로 발광종의 생성을 일으킨다.
이러한 발광 시스템은 매우 중요하다. 예를들어 낸들의 미합중국 특허 제4,372,745(1983년)는 면역화학적 적용에서 화학발광 표지의 사용을 기술한다. 기술된 시스템에서, 표지와 H2O2및 옥살레이트와의 반응과 같은 화학적 방법에 의해 표지되는 발광 상태로 여기된다. 이러한 시스템에서, H2O2는 옥살레이트를 산화적으로 고에너지 유도체로 전환시키며, 이 유도체는 그후에 표지를 역기시킨다. 이 시스템은 대개 분석의 산화조건에서 안정한 임의의 발광 물질과 작동하며 고에너지 옥살레이트 유도체에 의해 여기될 수 있다. 불행하게도 이러한 바로 그 다양성의 기술의 주된 제한요인이다 : 또한 관심있는 분석물을 함유하는 통상적인 생물학적 유체는 발광의 높은 자연방사 수준을 유발시킬 수 있는 다수의 잠재적인 발광 물질들을 함유한다.
동일한 단점을 지닌 화학발광의 면역 화학적 사용의 다른예는 오보하트 일동의 미합중국 특허 제4,280,815호(1981년)에 현장에서의 화학발광종으로 표지된 면역 반응제에 근접한 산화제(예로 H2O2)의 전기화학적 발생이 기술되어 있다. 전기 발생 산화제는 화학발광종에 확산되며 그것을 화학적으로 산화시켜 하나 이상의 전자를 전기발생 산화제에 정미(正味)이동시킨다. 산화에 따라, 화학발광종은 광자를 낸다. 대조로, 본 발명은 전기화학 에너지의 근원으로부터 반복적으로 광자를 낼 수 있는 화학발광종에 전자를 직접 옮기는 것을 필요로 한다.
본 발명은 전기화학발광 표지에 관한 것이다. 적절한 표지들은 유기화합물과 유기 금속 화합물을 포함하는 전기화학발광 화합물을 포함한다. 표지된 물질의 존재를 측정하는 전기화학발광 방법은 많은 이유로 다른 방법들보다 바람직하다. 그것들은 특별한 표지의 존재의 매우 높은 진단, 감수성이 높고, 위험하지 않으며, 저렴하고, 광범위하게 적용되는데 사용될 수 있다. 적절한 전기화학 표지인 유기 화합물로는 예를들어 루브렌과 9,10-디페닐 안트라센이 있다. 많은 유기금속 화합물이 적절한 전기화학 표지이지만, 각별히 사용되는 것은 Ru-함유 및 Os-함유 화합물이다.
그리하여, 한가지 실시양태에서, 본 발명은 광범위한 방법으로 검출될 수 있는 Ru-함유 및 Os-함유 표지의 사용에 관한 것이다. 이 표지들은 이곳에 논의될 많은 이유로 인해 유리하다.
Ru-함유 및 Os-함유 유기금속 화합물들은 문헌에 논의되어 있다. 카이즈는 Ru와 같은 제VIII족의 귀금속을 포함하는 금속원소나 금속원소들의 혼합물이 원자 흡수 방법으로 검출될 수 있는 유기금속 표지의 적절한 성분이 된다고 기술하고 있다(카이즈, 컬럼 11, 제20행). 그러나 루테늄은 바람직한 금속은 아니며(카이즈), 오스뮴은 특별하게 언급되어 있지 않으며, 기술된 방법으로 Ru이나 Os를 사용한 것의 효율에 대한 자료는 존재하지 않으며, 검출, 원자 흡수의 바람직한 방법은 견본의 분해를 수반한다.
웨버의 미합중국 특허 제4,293,310호(1987년)는 면역분석법에서 분석물을 위한 전기화학표지로서 Ru-함유 및 Os-함유 복합체의 사용을 기술하고 있다. 기술된 복합체들은 분석물상의 아미노기에 티오우레아 결합을 통해 결합된다.
또한 웨버는 다른 분석물상에 표지와 히드록시기 사이에 카르복실레이트 에스테르를 형성할 가능성을 시사한다.
웨버에 따라, 표지된 물질의 존재는 광기구를 갖춘 전기화학 유동셀 및 쿠웬처(quencher)로 이루어진 방법 및 기구로 측정될 수 있다. 광여기에 따라 광전기화학적으로 활동적인 표지는 전자를 쿠엔처 분자에 전달하며 ; 이어서 산화된 분자는 적절한 전위상태의 유동셀의 전극으로부터 나온 전자로 인해 환원된다. 이 전자는 광전류로 측정된다. 시스템에서 자유 표지된 분석물의 양은 광전류 시그날에 의해 측정된다. 이 방법은 발광 물질의 전기화학발광 검출의 반대방법임을 유의하라.
차후의 보고에서 웨버일동은 Ru-함유 표지를 검출하기 위한 이 방법의 사용과 관련된 문제점에 대해 논의하고 있다(1). 웨버일동의 표 2(1)에서 트리스(비피리딜)루테늄(Ⅱ)에 대해 외삽된 검출 한계는 최적의 조건하에서 1.1×10-10몰/l이다.
이러한 표지들의 실제적이 사용이 복합체 혼합물의 존재를 측정하는 것을 수반하리라는 예상하에, 웨버일동은 그들의 시스템에서 전위 인터피어런트(interferents)에 대해 시험했다. 웨버일동의 표 3에는 디메틸알킬, 아민, EDTA, N-메틸모르폴린, N,N'-디메틸피페라진, 수산화물, 옥살레이트, 아스코르베이트, 요산 및 추측상 1.1×10-10몰/l 이상으로 본질적으로 실제적인 검출한계를 높일 수 있는 인터피어런트와 같은 혈청들이 기록되어 있다. 이러한 연구들은 단수한 Ru-함유 화합물을 가지고 수행된다. 그러나 웨버나 웨버일동의 보고서에 표지된 물질과 표지 사이의 티오우레아 결합이 분석의 조건하에서 안정한지의 여부나 Ru-함유 표지로 표지된 복합체 물질의 검출 한계를 고려한 연구는 기록되어 있지 않다.
본 발명과 관계가 있는 특별한 표지는 전기화학발광이다. 또한 그것들은 종종 화합물을 전자기 방사선에 노출시키던지 통상적인 옥살레이트-H2O2시스템에 의해 유발되는 것과 같은 화학 에너지원에 노출시킴으로써 산화나 환원없이 발광 상태로 여기될 수 있다. 이외에, 이 화합물들의 발광은 그들의 산화 및 환원을 수반하는 전기화학 방법에 의해 유도될 수 있다.
광대한 작업은 광발광, 화학발광 및 전기화학발광 기구를 사용하여 Ru(2,2'-비피리딘)3 2+를 검출하기 위한 방법에 대해 기록하고 있다(2,3). 이 작업은 밝은 오렌지색 화학발광이 화학적으로 생성되거나 전기적으로 생성된 Ru(bpy)3 3+(여기에서 "bpy"는 비피리딘 리간드를 나타낸다)와 옥살레이트 이온이나 다른 유기산의 산화에서 중간체로서 생산되는 강환원제의 수성 반응에 근거를 둘 수 있다고 보고되어 있다. 또한 발광은 전기적으로 발생된 또는 화학적으로 발생된 Ru(bpy)3 1+를 퍼옥시디설페이트의 환원동안에 생성된 강산화제와 반응시킴으로서 인해 유기 용매-H2O 용액속에서 얻을 수 있다. Ru(bpy)3 2+로부터 전기화학발광을 생산하기 위한 세번째 기작은 Ru(bpy)3 1+를 생산하는 상당히 네가티브인 전위와 Ru(bpy)3 3+를 생산하는 상당히 포지티브인 전위 사이에서의 전극 전위의 진동을 수반한다. 이러한 세가지 방법은 각각 "산화성-환원", "환원성-산화"및 "Ru(bpy)3 3+/+재생시스템"으로 불리운다.
산화성-환원 방법은 물에서 수행될 수 있으며, 산소나 불순물의 존재에 대해 비교적 둔감한 강하고, 효과적이며 안정한 발광을 생성한다. Ru(bpy)3 2+로부터의 이 발광은 산화적으로 Ru(bpy)3 3+종을 생산하는 기구, 옥살레이트나 피루베이트, 락테이트, 말로네이트, 타르트레이트 및 시트레이트와 같은 다른 유기산의 존재에 따른다. 이 산화는 PbO2나 Ce(Ⅳ)염등의 강 산화제에 의해 화학적으로 수행될 수 있다. 그것은 연속적으로 또는 간헐적으로 적용된 상당히 포지티브인 전위에 의해 전기화학적으로 수행될 수 있다. Ru(bpy)3 2+의 전기화학적 산화를 위해 적절한 전극으로는 예를들어, Pt, 열분해 그라파이트 및 유리질 탄소등이 있다.
옥살레이트나 다른 유기산이 화학발광동안에 소모되지만, 오랜시간동안의 강하고 일정한 화학발광은 과량의 소모된 물질의 존재나 소모된 물질을 반응실에 연속 공급함으로써 얻어질 수 있다.
환원성-산화 방법은 예를들어 아세토니트릴과 같은 유기 보조용제를 함유한 부분적으로 수성인 용액속에서 수행될 수 있다. 이 발광은 퍼옥시디설페이트의 존재나 환원적으로 Ru(bpy)3 1+종을 생성하는 기구에 따른다. 환원은 예를들어 마그네슘이나 다른 금속과 같은 강환원제에 의해 화학적으로 수행될 수 있다. 그것은 연속적으로 또는 간헐적으로 적용된 상당히 네가티브인 전위에 의해 전기화학적으로 수행될 수 있다. Ru(bpy)3 2+의 전기화학적 환원을 위해 적절한 전극으로는 예를들어, 연마된 유리질-탄소 전극이 있다. 산화적-환원 방법을 사용함에 따라, 연속적이고 강한 발광은 수년간 과량의 시약의 첨가나 반응 혼합물에 소모되 시약을 연속적으로 첨가함으로써 얻어질 수 있다.
Ru(bpy)3 3+/+재생시스템은 Ru(bpy)3 2+를 환원시키는 상당히 네가티브인 전위와 Ru(bpy)3 2+를 산화시키는 상당히 포지티브인 전위 사이에 전극 전위를 펄스시킴으로써 아세토니트릴과 같은 유기 용매나 부분적으로 수성인 시스템내에서 수행될 수 있다. 그러한 재생 시스템을 위해 적절한 전극은 예를들어 Pt 전극이다. 이 시스템은 화학적 시약을 소모하지 않으며 주로, 한정되지 않은 기간 동안에 진행한다.
발광 Ru-함유 화합물을 생산하는 이 세가지 방법은 공통으로 Ru-함유 화합물의 반복성 산화-환원이나 환원-산화를 갖는다. 그리하여 이러한 화합물을 함유하는 용액의 발광은 적용된 에너지원의 전기 전위에 매우 의존적이며 그리하여 Ru-함유 화합물의 존재를 고도로 진단한다.
맨들은 화학발광 적용에 가능한 표지로서 큐티스 일동(4)의 것을 인용한다. 큐티스 일동은 Ru 복합체가 옥살레이트/H2O2시스템에 의해 화학적으로 여기될때 빛을 내도록 유도될 수 있다는 유일한 공개되지 않은 관찰을 기록하고 있다(큐티스 일동. p.350).
맨들도 큐티스도 화학발광 적용에서 루테늄이나 오스뮴 복합체의 의외적인 유용성이나 전기화학발광 시스템의 유용성에 대해서는 인식하지 못했다. 스프링츠크닉 일동(5)는 옥타데칸올이나 디히드로콜레스테롤로 에스테르화된 트리스(2,2'-비피리딘)루테늄(Ⅱ)의 복합체에 대해 기재하고 있으며, 이러한 계면활성 복합체의 단층 필름을 만들어 왔다. 이 복합체들은 광발광성이다. 그러나 필름이 물에 노출된 후 빛에 노출된다면 Ru-복합체는 광발광을 내지 못한다. 이것은 빛의 존재시에 에스테르기가 광가수분해되기 때문이다.
다양한 흥미있는 분석물과 흥미있는 분석물에 결합되는 화학적 부분들이 아미드나 아민 결합을 통해 Ru-함유나 Os-함유 표지에 편리하게 부착될 수 있다는 것을 발견하였으며, 이곳에 기술하였다. 그후에 표지된 물질들은 다양한 기구들에 의해 측정될 수 있으나, 이제까지 가장 효과적이고 신뢰성 있으며 감수성이 있는 기구는 광발광, 화학발광 및 전기화학 발광기구이다. Ru-함유 및 Os-함유 표지와 루브렌 및 9,10-디페닐 안트라센등과 같은 유기 분자들을 포함하는 전기화학발광 표지가 특히 다용도이며 유리하다는 것이 또한 이곳에 기술되어 있다. 이러한 신규 표지된 물질을 사용할때와 이들을 검출하는 방법의 매우 큰 잇점을 이후에 더 자세히 논의한다.
수년동안, 식품산업은 원식품 성분 및 가공처리된 식품에서 생물학적 및 화학적 오염물질의 존재에 관한 것이었다. 식품 오염 및 그것으로 유발되는 식품 전염 질환 발발의 발생을 감소시키는데 기술적인 진보가 있어온데 비해, 식품 오염물의 확인 및 검출을 위한 신속하고 감수서 있는 방법을 개발하는데는 거의 진보가 보고되어 있지 않다. 식품에서 유해한 오염물질을 검출하기 위한 현재의 표준 방법들은 일반적으로 매우 시간이 소모되고, 노력이 요구되며 기술적으로 어렸다. 대개 그들을 분석하는 방법은 적절한 감수성을 지니고 있지만, 종종 검출방법을 실시하기 전의 긴 견본 제조공정은 문제의 오염물질이 적은 수율로 생성되므로 종종 부정적인 음성결과가 나타난다.
이들 문제점들을 설명하기 위해 도움을 주는 두가지 예들은 식품에서 살모넬라(Salmonella)와 포도상구균성 장독소의 존재를 검출하기 위해 통상적으로 인지되는 표준 방법이다. 식품에서 살모넬라의 검출은 이들 박테리아가 식품에 존재할때 일반적으로 소수로 존재하며, 종종 거의 치사량에 가깝게 유해하다는 사실로 인해 몇몇 증균 단계를 필요로 한다. 그리하여 살모넬라를 검출하는 방법은 감수성이 있어야만 하며 유해한 세포의 인공소생술 및 생장을 허가한다.
살모넬라 검출을 위한 두가지 방법은 미합중국 식품 및 의약국에 의해 통상적으로 권장된다. 이러한 방법들은 식품에 있어서의 세균학적 분석 편람(The Bacteriological Analytical Manual for Foods)(1984, 6차 편집) 오피샬 아날리티칼 케미스트의 연합, 워싱톤 D.C.에 나타난다. 한 방법은 예비증균, 선택적 증균 및 선택적 평판 배양을 수반하는 순수 배양 기법으로 추정 결과를 얻기 위해 4일, 완전한 결과들을 얻기위해 5-7일이 요구된다. 다른 방법은 선택적인 증균후에 면역형광을 수반한다. 이 공정은 보다 신속하지만, 시험에 사용된 다가 항혈청의 가교반응성의 문제로 인해 부정적인-양성 결과를 내는 경향이 클 수 있다(6,7).
식품에서 포도상구균성 장독소를 검출하기 위해 미합중국 식품 및 의약국에서 장려하고 있는 방법이 역시 식품에 있어서의 세균학적 분석편람(1984년), 6차 편집, 오피샬 아날리티칼 케미스트의 연합, 워싱톤 D.C.에 나와있다. 이 방법은 현미경용 받침 유리판 이중-면역확산 기술을 위한 견본을 제조하기 위해 약 100g 정도의 다량의 식품 견본의 추출물을 여러 투석 농출단계나 견본 추출물의 이온교환 컬럼 정제를 사용해 약 0.2ml 정도의 소량의 부피로 농축시키는 것을 필요로 한다. 일반적으로 이 공정을 수행하는데, 1주 이상의 시간이 요구된다.
최근에, 식품에서 세균, 독소, 항생물질 및 살충제 잔사등과 같은 다양한 오염물질들을 검출하기 위해 보다 신속한 시험들이 개발되어 왔다. 그러나 많은 경우에, 분석을 실시하기전에 견본 제조에 수고와 시간 소모가 계속 요구된다. 방사선 면역 검정법(RIA)와 효소-결합 면역흡수제 분석법(ELISA)는 그것의 분석 방법을 위해 실제시간을 단축시키거나, 여전히 집중적인 노력이 요구되며 간단하게 수행하는 것과는 거리가 멀다. 이외에, 이 방법들은 특이성과 감수성이 다양하며 일반적으로 주어진 식품 오염물을 실험하는데 적게 제공되는 폴리클로날(polyclonal)을 기초로 한다. ELISA 방법은 폴리클로날 항혈청보다 모노클로날 항체를 사용하는 식품 견본의 분석법으로 개발되어 왔다. 식품 오염물의 분석시스템에서 모노클로날 항체의 사용은 시험에 대한 특이성과 감수성을 변화시키지 않게 시약이 일정하게 공급되도록 한다. 모노클로날 항체는 살모넬라(8)와 포도상구균성 장독소(9)와 같은 식품 오염물질을 시험하기 위해 ELISA 시스템에서 사용되어 왔다. 살모넬라 검출을 위해 EIA 방법학(바이오-엔자비이드 스크린 키트, 리톤 바이오네틱스)와 DNA 탐침 기법(진-트랙, 인터그레이티드 제네틱스)을 사용하는 상업적으로 이용되는 시험은 시간이 많이 걸리며 노력이 많이 요구된다. 식품에서 포도상구균성 장독소를 검출하기 위해 역 피동 라텍스 응집반응(SET-RPLA 덴카 세이켄 사)와 EIA방법학(SET-EIA, Dr. W. 보멜리 레이보레이토리스)을 사용하는 상업적으로 이용가능한 시험도 역시 같은 한계때문에 어려움이 있다.
과거 100년동안, 세균 E. 콜리(Escherichia coli)와 대장균류 군들이 수질과 폐기물 오염율을 탐지하는데 지시체로서 일반적으로 사용되어 왔다.
E. 콜리 및 대장균류들을 검출하는 통상적인 방법학들은 락토우즈의 발효결과 생성되는 산이나 기체의 성질을 기초로 한다. 가장 널리 사용되는 방법으로는 최확수(Most Probable Number : (MPN)) 분석 및 막여과(MF) 시험이 있다. 두 기법은 물과 폐수(10)의 미생물학적 오염을 검출하기 위한 것으로 미국공중보건협회(APHA)와 환경보호국(EPA) 및 우유와 식품(11)의 세균학적 오염을 검출하기 위한 것으로 식품 및 의약품(FDA)에 의해 승인되어 있다.
MPN 방법은 실제적으로 세가지(12) 분리 분석법으로 이루어진다(10). 추정시험에서, 라우릴 설페이트 트립토우즈(LST) 태양액이나 락토우즈 배양액과 같은 비선택적 매질이 락토우즈의 발효결과 생성되는 기체를 검사하기 위해 사용된다. 그후에 기체가 생겨난 매질을 분의 대장균류를 위한 E. 콜리(EC) 배양액 및 대장균류를 위한 브릴란트 그린 락토우즈 빌(BGLB) 배양액의 하나 이상의 선택적인 매질로 2차 배양시키고, 다시 기체 생성 여부를 검사한다(확인 시험). 양성 확인 시험에서 나온 견본은 에오신 메틸렌블루(EMB) 아가나 엔도스 아가와 같은 선택적이고 차별적인 매질상에서 평판배양하고 이어서 지시세균의 존재를 확실하게 확인하기 위해 그람 염색 및 여러가지 생화학적 시험을 실시한다(확증 시험) 전체 MPN 분석을 완전히 실시하기 위해서는 5(5)일까지의 시간이 요구될 수 있으므로 ; 통상적인 물분석을 위해 대부분의 실험실은 MPN 분석법의 추정 및 확신시험만을 사용하는데, 그래도 역시 완전히 실시하는데 48시간-72시간이 요구된다. 물질의 관점에서 시간이 소모되고 가격이 비효율적으로 드는 것외에, 또한 MPN 분석법에서는 부정적인-양성 및 부정적인-음성 반응의 빈도가 통상적으로 나타난다(15,16,20).
물의 세균학적 오염을 검출하기 위한 MF 기법은 1950년 초에 도입되었다(12). 장황하며 시간의 소모를 요구하는 MPN 분석과는 다르게 MF 분석은 더 이상의 확인을 요구하지 않으면서 24시간내에 완결될 수 있다. 기본 MF 공정은 하기와 같다 : 일반적으로 100ml의 물 견본을 0.45μm 공극지름의 필터를 통해 여과한 후 선택적인 매질로 포화시킨 멸균 패드상에서 배양한다. 가장 자주 사용되는 두가지 매질은 35℃에서 대장균류에 대해 선택적인 mEndo 배양액과 44.5℃에서 분 대장균류에 대해 선태적인 mFC 배양액이다(10). 매질을 도입한 이래, 수많은 저자들은 mEndo와 mFC 배양액 모두는 매질의 선택성이나 배양액에 사용되는 고온(44.5℃)로 인해 존재하는 지시 세균의 실제수를 적게 평가하게 하는 경향이 있다고 보고하고 있다(21,22). 견본에서 유기물이 환경적 요소 및/또는 화합물질에 의해 거의 치사량에 가깝게 해를 입을때 부정적인 음성결과의 빈도가 특히 우세하다(17,18). 최근에, MPN 분석법으로서 각 여과기상에 10개 이상의 콜로니가 LST 배양액, 이어서 BGLB 배양액을 사용하여 기체 생성을 검사하는데 요구됨으로 인해, 확증 시험으로 MF 시험을 한층 더 잘 수행하기 위해 변형들이 EPA에 의해 제안되어왔다(14). 그러한 변형이 부정적인 음성 및 부정적인 양성 반응의 빈도를 감소시키기는 하지만 물질의 비용을 증가시키며, MF 분석시간을 24시간에서 72시간으로 3배정도로 증가시킨다.
1982년에 펭과 하트맨은 기질 4-메틸 엄벨리페론 글루쿠로니드(MUG)를 사용해 E. 콜리를 검출하기 위해 형광 발생 분석법을 도입하였다(13). E. 콜리 세포들은 형광발생 4-메틸 엄벨리페론 라디칼을 방출시키면서 기질을 분해시킬 수 있는 효소 베타-글루쿠로니다제를 생성한다(19). 추정 LST 매질속에 화합물 MUG를 함입시킴으로써, LST-MUG 매질의 단일튜브는 24시간안에 분 대장균류에 대한 추정자료(기체 발생) 및 확인자료(형광)을 모두 제공한다. MUG 분석법이 신속하고 간단하지만 E. 콜리의 단지 85%-95%(급원에 따라)만이 이 효소를 내므로 100% 신뢰할 수 있는 없다. 또한 이 시스템은 대장균류에는 적용할 수 없다.
현재, 견본에서 대장균류 및 분 대장균류의 검출 및 산출을 위해 적절한 분석법은 없다. 간단하고, 신속하며 신뢰성있는 검출법의 개선은 비용 및 시간의 절약뿐 아니라 물의 위생과 식품 가공처리 및 취급을 감지하는 효율을 증가시키는 것이다.
본 발명의 요약
본 발명은 하기(a)-(c)단계로 구성되는 약 10-3몰 농도 이하의 농도로 견본에 존재하는 관심있는 분석물을, 소정 부피의 다성분 액체 견본에서 검출하는 방법을 제공하는 것이다 :
a) 분석물과 시약이 결합하기에 적절한 조건하에서, 견본을 i) 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시킴에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며, ii) 관심있는 분석물과 결합할 수 있는 시약과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학 에너지에 노출시키고 ;
c) 그렇게 방출된 전자기 방사선을 검출함으로써 견본에서 분석물의 존재를 검출한다.
또한, 본 발명은 하기 (a)-(c)단계로 구성되는, 약 10-3몰 농도 이하의 농도로 견본에 존재하는 관심있는 분석물을, 소정 부피의 다성분 액체 견본에서 검출하기 위한 경쟁 방법을 제공한다.
a) 관심있는 분석물과 시약이 상보적 물질에 경쟁적으로 결합하기에 적절한 조건하에서, 견본을 상보적 물질 및 i) 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시킴에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며 ii) 정상적으로는 견본에 존재하지 않는 상보적 물질상의 결합부위에 대해 관심있는 분석물과 경쟁할 수 있는 시약과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시키고 ;
c) 그렇게 방출된 전자기 방사선을 검출함으로써 견본에서 관심있는 분석물의 존재를 탐지한다.
하기 (a)-(c)단계로 구성되는, 견본에 존재하는 관심있는 분석물의 양을 소정 부피의 다성분 액체 견본에서 정량적으로 측정하기 위한 방법이 부가적으로 제공된다 :
a) 분석물과 시약이 결합되기에 적절한 조건하에서, 견본을 i) 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시킴에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며, ii) 관심있는 분석물과 결합할 수 있는 공지된 양의 시약과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적당한 급원에서 나온 일정량의 화학에너지에 노출시키고 ;
c) 그렇게 방출된 전자기 방사선을 정량측정함으로써 견본에서 관심있는 분석물의 양을 정량적으로 측정한다.
본 발명은 견본에 존재하는 관심있는 분석물의 양을, 소정 부피의 다성분 액체 견본에서 정량적으로 측정하는 경쟁 방법을 제공한다. 이 방법은 하기 (a)-(c)단계로 구성된다 :
a) 관심있는 분석물과 시약이 상보적 물질에 경쟁적으로 결합하기에 적절한 조건하에서, 견본을 공지된 양의 상보적 물질 및 i) 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시킴에 따라 반복적으로 전자기 방사선을 방출시킬 수 있으며 ; ii) 정상적으로는 견본에 존재하지 않는 상보적 물질상의 결합부위에 대해 관심있는 분석물과 경쟁할 수 있는 공지된 양의 시약과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 형성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시키고 ;
c) 그렇게 방출된 방사선의 양을 정량적으로 측정함으로써 견본에 존재하는 관심있는 분석물의 양을 정량적으로 측정한다.
또한, 액체 식품이나 식품 호모게네이트에 존재하는 다양한 관심있는 분석물의 존재를 검출하고 확인하기 위한 방법을 제공한다. 이 방법은 하기 (a)-(c)단계로 구성된다 :
a) 액체나 고체 현탁액내로 침지시키기에 적절하고 그곳에 고정화된 다수의 시약(각각의 시약은 구별되고 확인가능한 지역에서 진단시약 호울더에 고정화되어 있으며, 관심있는 고정화된 시약-분석물 복합체를 형성할 수 있도록 관심있는 단일 분석물과 복합체를 형성할 수 있다.)을 갖는 진단 시약 호울더 일부분을 액체 식품이나 식품 호모게네이트에 침지시키고 ;
b) 액체 식품이나 식품 호모게네이트로부터 진단 시약 호울더를 제거하고 ;
c) 진단 시약 호울더를 적절한 헹굼 용액으로 헹구고 ;
d) 관심있는 고정화된 시약-분석물 복합체를 함유하는 진단 시약 호울더 일부분을, 관심있는 검출 시약 착물의 고정화된 시약-분석물을 형성할 수 있도록 관심있는 고정화된 시약-분석물 복합체와 착물을 형성할 수 있는 한가지 이상의 검출시약을 함유하는 검출용액 속에 침지시키고 ;
e) 시약이 고정화된 진단 시약 호울더의 확인할 수 있는 영역상에서 관심있는-검출 시약 복합체의 고정화된 시약-분석물의 존재를 검출함으로써 액체 음식이나 음식 호모게네이트에서 관심있는 다양한 분석물의 존재를 검출하고 확인한다.
본 발명은 또한 견본에서 다양한 장독소의 존재를 검출하고 확인하기 위해 유용한 키트를 제공한다. 이 키트는 하기 (a)-(f)로 이루어져 있다 :
a) 액체나 고체 현탁액내로 침지시키기에 적절한 표면적과 연결된 핸들이 장치된 진단 시약 호울더(여기에서 표면적은 그것에 부착된 하나 이상의 니트로셀룰로우즈 막을 가지며, 니트로셀룰로우즈 막은 그것위의 확인할 수 있는 영역에 분리적으로 구별되게 고정화된 다수의 모노클로날 항체를 가지며, 각각의 고정화된 모노클로날 항체는 한 장내독소상의 항원 결정군에 대해 특이하다) ;
b) 계면활성제를 함유하는 완충-수성 용액으로 이루어진 1차 헹굼 용액 ;
c) 하나 이상의 모노클로날 항체가, 상이하나 진단 시약 호울더에 부착된 니트로셀룰로우즈 막에 고정화된 모노클로날 항체가 특이성이 있는 각 장내독소에 위치되어 있는 항원 결정군에 대해 특이적인 모노클로날 항체 효소 배합체를 함유하는 검출제 ;
d) 완충-수성 용액을 함유하는 이차 헹굼 용액 ;
e) 검출용액 모노클로날 항체와 결합된 효소와 반응할 수 있는 효소 기질 ; 및
f) 무색 염료.
또한 본 발명에 의해 견본에서 하나 이상의 세균의 존재를 검출하기 위한 방법이 제공된다. 이 방법은 하기 (a)-(h)의 단계로 구성된다 :
a ) 견본을 개구(開口)가 장치되어 있으며 세균류의 성장을 지지하기 위해 적절한 매질을 함유하는 하나 이상의 리셉터클(receptacle)내로 접종시키고 ;
b) 리셉터클의 종단에 캡(cap)을 접합시키고(캡의 면은 리셉터클에 접합될때 세균의 최소한 한 성분을 고정화시키는데 적절한 면적을 갖춘 리셉터클의 내부에 노출되어 있다) ;
c) 매질에 접촉된 세균이 재생산 되도록 하는 조건하에서 접종된 매질을 배양하고 ;
d) 매질에 존재하는 세균의 성분이 리셉터클의 내부에 노출된 캡의 표면에 고정화되도록 하기에 적절한 시간동안 각각의 리셉터클을 뒤집고 ;
e) 뒤집힌 리셉터클을 다시 뒤집고 ;
f) 리셉터클로부터 캡을 분리시키고 ;
g) 고정화된 세균 성분-시약 복합체를 형성하도록 할 수 있는 조건하에서, 그것에 고정화된 세균의 성분을 갖는 캡의 표면을 세균의 고정화된 성분과 복합체를 형성할 수 있는 시약과 접촉시키고 ;
h) 고정화된 세균 성분-시약 복합체를 검출함으로써 견본안에 세균류의 존재를 검출한다.
또한 본 발명에 의해 견본에서 대장균류 세균의 존재를 검출하는 방법이 제공된다. 이 방법은 하기 (a)-(j)의 단계로 구성된다 ;
a) 견본을, 개구를 가지며 비-선택적 락토우즈 매질과 꺼꾸로된 듀램관을 함유하는 하나 이상의 리셉터클에 접종시키고 ;
b) 각 리셉터클의 개구에 폴리스티렌 인서어트가 갖춰진 캡을 접합하고 ;
c) 적어도 2시간동안 37℃에서 접종된 매질을 배양하고 ;
d) 각각의 리셉터클이 꺼꾸로된 듀램관내에 포착된 세균 발효에 의해 발생된 가스를 가지고 있는지의 여부를 측정하고 ;
e) 매질내 존재하는 대장균류 세균이 대장균-폴리스티렌 복합체를 형성하도록 적절한 시간동안 꺼꾸로된 듀램관안에 포착된 가스를 가지고 있는 리셉터클을 꺼꾸로 뒤집고 ;
f ) 꺼꾸로 된 리셉터클을 다시 뒤집고 ;
g) 리셉터클로부터 캡을 분리하고 ;
h) 분리된 캡의 폴리스티렌 인서어트를 결합하지 않는 부위를 블러킹시키기에 적절한 물질로 처리하고 ;
i) 항체-대장균류-폴리스티렌 복합체를 형성하도록 하는 조건하에서 결합되지 않은 부위를 블러킹하기에 적절한 물질로 처리된 캡의 폴리스티렌 인서어트를 검출가능한 마커(marker)로 표지되고 대장균류를 세균에 결합할 수 있는 하나 이상의 항-대장균류 미생물 항체로 처리하고 ;
j) 폴리스티렌 인서어트상에서 항체-대장균류를 폴리스티렌 복합체의 존재를 검출함으로써, 견본에서 대장균류 세균의 존재를 검출한다.
발명의 상세한 설명
본 발명은 하기 (a)-(c)단계로 구성되는 약 10-3몰농도 이하의 농도로 견본에 존재하는 관심있는 분석물을 다성분 액체 견본의 미리 결정된 부피에서 검출하는 방법을 제공한다.
a) 분석물과 시약이 결합되기에 적절한 조건하에서, 견본을 i) 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시킴에 따라 반복적으로 방사선을 방출할 수 있으며, ii) 관심있는 분석물과 결합될 수 있는 시약과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정한 양의 전기화학적 에너지에 노출시키고 ;
c) 그렇게 방출된 전자기 방사선을 검출함으로써 견본에서 관심있는 분석물의 존재를 검출한다.
이 출원에서 "몰농도"란 말은 1리터당 몰로 용액속의 분석물의 농도를 나타내거나 1리터당 입자나 단위로 액체 견본에 존재하는 미립물의 양을 나타내는 것을 의미한다. 예를들어, 1리터당 1×1023입자를 1몰농도로써 표시할 수 있다.
본 발명에 의해 이(理)종 분석법, 즉, 결합 표지된 시약을 전기화학적 에너지에 노출시키기 전에 결합 표지된 시약으로부터 비결합 표지된 시약을 분리하는 분석법 및 동(同)종 분석법, 즉, 비결합 표지된 시약과 결합 표지된 시약을 함께 전기화학 에너지에 노출시키는 분석법이 제공된다. 본 발명의 동종분석법에서 결합 표지된 시약에 의해 방출된 전자기 방사선은 비결합 표지된 시약에 의해 방출된 전자기 방사선과 구분되는데, 비결합 표지된 시약과 비교하여 결합 표지된 시약에 의해 방출된 전자기 방사선의 양은 많거나 적거나, 또는 상이한 파장의 전자기 방사선에 의해 구분된다. 따라서, 본 발명의 한가지 실시양태에서, 견본을 전기화학 에너지에 노출시키기 전에 관심있는 분석물과 결합되지 않은 시약을 견본으로부터 분리해낸다. 본 발명의 다른 실시양태에서, 견본을 시약과 접촉시키기 전에, 관심있는 분석물을 고정화시키기 위해 견본을 처리한다. 관심있는 분석물을 고정화시키는 방법은 본 분야에 잘 공지되어 있으며, 무기 분자, 유기 금속 분자, 합성 유기 분자, 비생물학적 중합체, 당, 아미노산, 비타민, 스테로이드, 알카로이드, 바르비투레이트, 신경안정제, 약물학적시약, 호르몬, 세포대사물, 펩티드, 당단백질, 다당류, 핵산, 지방산, 지방, 비로이드, 프리온, 비루스, 부세포 입자 또는 완전 세포로 피복된 표면, 폴리스티렌, 니트로셀룰로우즈나 나일론 표면과 견본을 접촉시키는 것이다. 이외에 흥미있는 분석물은 이물질들중 어느것이나 될 수 있다. 본 발명의 한가지 실시양태에서 관심있는 분석물은 테오필린이다. 본 발명의 또다른 실시양태에서 관심있는 분석물은 디곡신이다. 본 발명의 다른 실시양태에서, 관심있는 분석물은 인간 융모막이의 고나도트로핀(hCG)이다. 더구나, 흥미있는 분석물은 견본에 약 10-12몰농도 이하로 존재하는 완전세포, 부세포 입자, 비루스, 프리온, 비로이드, 핵산, 단백질, 지방단백질, 지방다당류, 당단백질, 펩티드, 호르몬, 약물학적 시약, 비생물학적 중합체, 합성 유기 분자, 유기 금속 분자나 무기 분자등이다. 그중에서 특히 관심있는 분석물은 약 10-15몰농도 이하의 농도로 존재하는 완전세포, 부세포입자, 비루스, 프리온, 비로이드나 핵산일 수 있다.
견본과 접촉된 시약은 완전세포, 부세포 입자, 비루스, 프리온, 비로이드, 지방, 지방산, 핵산, 다당류, 단백질, 지방단백질, 지방다당류, 당단백질, 펩티드, 세포 대사물, 호르몬, 약물학적 시약, 신경안정제, 바르비투레이트, 알카로이드, 스테로이드, 비타민, 아미노산, 당, 비생물학적 중합체, 합성 유기 분자, 유기 금속 분자, 무기 분자, 바이오틴, 아비딘 또는 스트렙트아비딘과 결합된 전기화학발광 화학 부분을 함유할 수 있다.
본 발명의 한가지 실시양태에서, 시약은 항체, 항원, 핵산, 합텐, 리간드나 효소, 또는 바이오틴, 아비딘 또는 스트렙트아비딘등과 결합된 전기화학발광 부분이다.
전기화학발광 화학 부분은 금속이 루테늄, 오스뮴, 레늄, 이리듐, 로듐, 백금, 팔라듐, 몰리브덴 및 테크네튬으로 이루어진 군으로부터 선택되는 금속- 함유 유기 화합물을 함유할 수 있다. 본 발명의 한가지 실시양태에서 금속은 루테늄이나 오스뮴이다. 본 발명의 다른 실시양태에서, 전기화학발광 화학 부분은 루브렌이나 9,10-디페닐안트라센이다. 본 발명의 여전히 다른 실시양태에서, 전기화학발광 화학부분은 비스[(4,4'-카르보메톡시)-2,2'-비피리딘] 2-[3-(4-메틸-2,2'-비피리딘-4-일)프로필]-1,3-디옥솔란 루테늄(Ⅱ)이다. 본 발명의 다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(부탄-1-알)-4'-메틸-2,2'-비피리딘]루테늄(Ⅱ)이다. 본 발명의 다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(4'-메틸-2,2'-비피리딘-4'-일)부티르산)]루테늄(Ⅱ)이다.
본 발명의 또다른 실시양태에서, 전기화학발광 화학 부분은 (2,2'-비피리딘)[시스-비스(1,2-디페닐 포스피노)에틸렌]{2-[3-(4-메틸-2,2'-비피리딘-4'-일)프로필]-1,3-디옥솔란}오스뮴(Ⅱ)이다.
본 발명의 다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘) 4-(4'-메틸-2,2'-비피리딘)부틸아민 루테늄(Ⅱ)이다.
본 발명의 다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘) 1-브로모-4(4'-메틸-2,2'-비피리딘-4-일)부탄 루테늄(Ⅱ)이다. 본 발명의 여전히 다른 실시양태에서, 전기화학발광 부분은 비스(2,2'-비피리딘)말레이미도헥산산, 4-메틸-2,2'-비피리딘-4'-부틸아미드 루테늄(Ⅱ)이다.
견본은 고체, 유탁액, 현탄액, 액체나 기체로부터 유도될 수 있다. 더 자세히 견본은, 물, 음식, 혈액, 혈청, 요, 분변, 조직, 타액, 기름, 유기 용매나 공기로부터 유도될 수 있다. 더우기 견본은 아세토니트릴, 디메틸설폭사이드, 디메틸포름아미드, n-메틸피롤리디논이나 3차-부틸 알코올을 함유할 수 있다. 견본은 환원제나 산화제를 함유할 수 있다.
또한 본 발명은 하기 (a)-(c)단계로 구성되는 약 10-3몰농도 이하의 농도로 견본에 존재하는 관심있는 분석물을 다성분, 액체 견본의 미리 결정된 부피에서 검출하는 경쟁방법을 제공한다 ;
a) 관심있는 분석물과 시약이 보출물에 경쟁적으로 결합할 수 있기에 적절한 조건하에서, 견본을 i) 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 방출시킴에 따라 반복적으로 전자기 방사선을 방출할 수 있으며, ii) 견본에 정상적으로 존재하지 않는 보층물상의 결합 부위에 대해 관심있는 분석물과 경쟁할 수 있는 시약 및 보충물과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을, 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학 에너지에 노출시키고 ;
c) 그렇게 방출된 전자기 방사선을 검출함으로써 견본에서 관심있는 분석물의 존재를 검출한다.
시약은 전기화학발광 화학 부분에 결합된 관심있는 분석물이나 전기화학발광 부분에 결합된 관심있는 분석물의 유사체일 수 있다. 부가적으로, 관심있는 분석물은 테오필린, 디곡신이나 hCG일 수 있다. 더우기 전기화학발광 화학 부분은 비스[(4,4'-카르보메톡시)-2,2'-비피리딘]-2-[3-(4-메틸-2,2'-비피리딘-4-일)프로필]-1,3-디옥솔란 루테늄(Ⅱ)일 수 있다. 본 발명의 다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(부탄-1-알)-4'-메틸-2,2'-비피리딘)루테늄(Ⅱ)이다. 본 발명의 또다른 실시양태에서 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(4-메틸-2,2'-비피리딘-4'-일)부티르산]루테늄(Ⅱ)이다. 본 발명의 여전히 다른 실시양태에서, 전기화학발광 화학 부분은 (2,2'-비피리딘)[시스-비스(1,2-디페닐포스티노)에틸렌]{2-[3-(4-메틸-2,2'-비피리딘-4'-일)프로필]-1,3-디옥솔란}오스뮴(Ⅱ)이다. 본 발명의 또다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(4'-메틸-2,2'-비피리딘)부틸아민]루테늄(Ⅱ)이다. 본 발명의 다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[1-브로모-4(4'-메틸-2,2'-비피리딘-4-일)부탄]루테늄(Ⅱ)이다. 본 발명의 또다른 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)말레이미도헥산산, 4-메틸-2,2'-비피리딘-4'-부틸아미드 루테늄(Ⅱ)이다.
보충물은 완전 세포, 부세포 입자, 비루스, 프리온, 비로이드, 지방, 지방산, 핵산, 다당류, 단백질, 지방단백질, 지방다당류, 당단백질, 펩티드, 세포 대사물, 호르몬, 약물학적 시약, 신경 안정제, 바르비튜레이트, 스테로이드, 비타민, 아미노산, 당, 비-생물학적 중합체, 합성 유기 분자, 유기 금속 분자나 무기 분자이다.
이곳에 제공된 방법은 본 출원의 영역내에서 관심있는 분석물을 정량하기 위해 수행될 수 있다. 따라서, 본 발명은 하기 (a)-(c) 단계로 구성되는, 견본에 존재하는 관심있는 분석물의 양을 다성분 액체 견본의 미리 결정된 부피내에서 정량적으로 분석하기 위한 방법을 제공한다 :
a) 시약이 반복적으로 방사선을 방출하도록 유도하기에 적절한 조건하에서, 견본을 i) 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학 에너지에 방출시킴에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며, ii) 관심있는 분석물과 결합될 수 있는 공지된 양의 시약과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 형성된 견본을, 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정한 양의 전기화학 에너지에 노출시키고 ;
c) 그렇게 방출된 방사선의 양을 정량적으로 측정함으로써, 견본에 존재하는 관심있는 분석물의 양을 정량적으로 측정한다.
이 방법은 이종 분석법이나 동종 분석법으로 수행될 수 있다. 본 발명의 한 실시양태에서, 견본을 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학 에너지에 노출시키기 전에 공지된 양의 시약과 접촉된 견본으로부터 관심있는 분석물과 결합되지 않은 시약을 분리한다. 본 발명의 다른 실시양태에서 견본을 시약과 접촉시키기 전에, 관심있는 분석물을 고정화시키기 위해 견본을 처리한다.
관심있는 분석물은 완전 세포, 부세포입자, 비루스, 프리온, 비로이드, 지방, 지방산, 핵산, 다당류, 단백질, 지방단백질, 지방다당류, 당단백질, 펩티드, 세포 대사물, 호르몬, 약물학적 시약, 신경안정제, 바르비튜레이트, 알카로이드, 스테로이드, 비타민, 아미노산, 당, 비-생물학적 중합체, 합성 유기 분자, 유기 금속 분자나 무기 분자등일 수 있다. 본 발명의 한 실시양태에서 관심있는 분석물은 테오필린이다. 본 발명의 다른 실시양태에서, 관심있는 분석물은 디곡신이다. 본 발명의 또다른 실시양태에서, 관심있는 분석물은 hCG이다.
견본이 접촉된 시약은 완전 세포, 부세포 입자, 비루스, 프리온, 비로이드, 지방, ,지방산, 핵산, 다당류, 단백질, 지방단백질, 지방다당류, 당단백질, 펩티드, 세포 대사물, 호르몬, 약물학적 시약, 신경안정제, 바르비튜레이트, 알카로이드, 스테로이드, 비타민, 아미노산, 당, 비-생물학적 중합체, 합성 유기 분자, 유기 금속 분자나 무기 분자에 결합된 전기화학발광 화학 부분일 수 있다.
본 발명의 한 실시양태에서, 시약은 항체, 항원, 핵산, 합텐, 리간드나 효소 또는 바이오틴, 아비딘이나 스트렙트아비딘에 결합된 전기화학발광 화학 부분이다.
전기화학발광 부분은 금속이 루테늄, 오스뮴, 레늄, 리이듐, 로듐, 백금, 팔라듐, 몰리브덴 및 데크니튬으로 이루어진 군으로부터 선택된 금속 함유 유기 화합물일 수 있다. 본 발명의 한 실시양태에서, 금속은 루테늄이나 오스뮴이다. 본 발명의 다른 실시양태에서 전기화학발광 화학 부분은 루브렌이나 9,10-디페닐안트라센이다. 본 발명의 또다른 실시형태에서, 전기화학발광 화학 부분은 비스[(4,4'-카르보메톡시)-2,2'-비피리딘] 2-[3-(4-메틸-2,2'-비피리딘-4-일)프로필]-1,3-디옥솔란 루테늄(Ⅱ)이다. 본 발명의 다른 실시형태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(부탄-1-알)-4'-메틸-2,2'-비피리딘]루테늄(Ⅱ)이다. 본 발명의 실시양태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(4-메틸-2,2'-비피리딘-4'-일)-부티르산]루테늄(Ⅱ)이다. 본 발명의 다른 실시형태에서, 전기화학발광 화학 부분은 (2,2'-비피리딘)[시스-비스(1,2-디페닐포스피노)에틸렌]{2-[3-(4-메틸-2,2'-비피리딘-4'-일)프로필]-1,3-디옥솔란}오스뮴(Ⅱ)이다. 또다른 실시형태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(4'-메틸-2,2'-비피리딘)-부틸아민]루테늄(Ⅱ)이다. 또다른 실시형태에서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[1-브로모-4(4'-메틸-2,2'-비피리딘-4-일)부탄]루테늄(Ⅱ)이다. 또다른 실시형태에서 전기화학발광 화학 부분은 비스(2,2'-비피리딘)말레이미도헥산산, 4-메틸-2,2'-비피리딘-4'-부틸아미드 루테늄(Ⅱ)이다.
견본은 고체, 유탁액, 현탁액, 액체 또는 기체로부터 유도될 수 있다. 관심있는 분석물을 포함하는 견본은 물, 음식, 혈액, 혈청, 요, 분변 조직, 타액, 기름, 유기 용매 또는 공기등으로부터 유도될 수 있다. 첨가로, 견본들은 아세토니트릴, 디메틸설폭사이드, 디메틸포름아미드, n-메틸피롤리돈 또는 3차-부틸 알코올을 함유할 수 있다. 게다가, 견본은 환원제 또는 산화제를 함유할 수 있다.
본 발명은 또한 견본에 존재하는 관심있는 분석물의 양을, 다성분, 액체 견본의 미리 결정된 부피에서 정량적으로 측정하는 경쟁 방법을 제공한다. 이 방법은 하기 a)-c)단계로 구성된다.
a) 관심있는 분석물과 시약이 보충물에 경쟁적으로 결합하기에 적절한 조건하에서, 견본을 i) 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시킴에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며, ii) 견본에서 정상적으로 존재하지 않는 보충물상의 결합 부위에 대해 관심있는 분석물과 경쟁할 수 있는 공지된 양의 시약 및 공지된 양의 보충물과 접촉시키고 ;
b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도되기에 적절한 조건하에서, 결과 형성된 견본을, 시약이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시키고 ;
c) 그렇게 방출된 방사선의 양을 정량적으로 측정함으로써 견본에 존재하는 관심있는 분석물의 양을 정량적으로 측정한다.
관심있는 분석물은 테오필린, 디곡신, 또는 hCG일 수 있다.
본 발명의 실시양태의 하나에 있어서, 시약은 전기화학발광 화학 부분에 결합된 관심있는 분석물이거나 전기화학발광 화학 부분에 결합된 관심있는 분석물의 유사체이다. 전기화학발광 화학 부분은 비스[(4,4'-카르보메톡시)-2,2'-비피리딘] 2-[3-(4-메틸-2,2'-비피리딘-4-일)프로필]-1,3-디옥솔란 루테늄(Ⅱ)이다. 본 발명의 또다른 실시양태에 있어서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(부탄-1-알)-4'-메틸-2,2'-비피리딘-루테늄(Ⅱ)이다. 본 발명의 더 나아간 실시양태에 있어서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(4-메틸-2,2'-비피리딘-4'-일)-부티르산]루테늄(Ⅱ)이다. 본 발명의 또다른 실시양태에 있어서, 전기화학발광 화학 부분은 (2,2'-비피리딘)[시스-비스(1,2-디페닐포스피노)에틸렌]{2-[3-(4-메틸-2,2'-비피리딘-4'-일)프로필]-1,3-디옥솔란}오스뮴(Ⅱ)이다. 본 발명의 또다른 실시양태에 있어서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[4-(4'-메틸-2,2'-비피리딘)부틸아민]루테늄(Ⅱ)이다. 본 발명의 또다른 실시양태에 있어서, 전기화학발광 화학 부분은 비스(2,2'-비피리딘)[1-브로모-4(4'-메틸-2,2'-비피리딘-4-일)부탄]루테늄(Ⅱ)이다. 본 발명의 또다른 실시양태에 있어서 전기화학발광 화학 부분은 비스(2,2'-비피리딘)말레이미도헥산산, 4-메틸-2,2'-비피리딘-4'-부틸아미드 루테늄(Ⅱ)이다.
보충물은 완전 세포, 부세포 입자, 비루스, 프리온, 비로이드, 지방, 지방산, 핵산, 다당류, 단백질, 지방단백질, 지방 다당류, 당단백질, 펩티드, 세포 대사물, 호르몬, 약물학적 시약, 신경안정제, 바르비튜레이트, 알카로이드, 스테로이드, 비타민, 아미노산, 당, 비생물학적 중합체, 합성 유기 분자, 유기 금속 분자 또는 무기 분자일 수 있다.
본 발명은 더 나아가 액체 음식이나 음식 호모게네이트에 존재하는 관심있는 다양한 분석물의 존재를 검출하고, 확인하기 위한 방법을 제공한다. 이 방법은 하기 a)-e)단계로 구성된다.
a) 액체 또는 고체 현탁액 내로 침지시키기에 적절하고 그곳에 고정화된 다수의 시약(각각의 시약은 구별되고 확인가능한 지역에서 진단시약 호울더에 고정되어 있으며 관심있는 복합체의 고정화된 시약 분석물을 형성하도록 하기 위해 흥미있는 단일 분석물과 복합체를 형성할 수 있다)을 갖는 진단시약 호울더의 일부분을 액체 음식이나 음식 호모게네이트에 침지시키고 ;
b) 액체 음식이나 음식 호모게네이트로부터 진단시약 호울더를 제거하고 ;
c) 진단시약 호울더를 적절한 용액으로 헹구고 ;
d) 관심있는 검출시약 복합체의 고정화된 시약-분석물을 형성할 수 있게 하기 위해서 관심있는 복합체의 고정화된 시약-분석물을 함유하는 진단 시약 호울더 일부분을, 관심있는 복합체의 고정화된 시약-분석물과 복합체를 형성할 수 있는 검출시약 1가지 이상을 함유하는 검출용액 속에 침지시키고 ;
e) 시약이 고정화된 진단시약 호울더의 확일할 수 있는 영역상에서 관심있는-검출시약 복합체의 고정화된 시약-분석물의 존재를 검출함으로써 액체 음식이나 음식 호모게네이트에서 관심있는 다양한 분석물의 존재를 검출하고 확인한다.
관심있는 분석물은 미생물일 수 있다. 미생물은 생존성이거나 비생존성일 수 있다. 첨가로, 미생물은 세균일 수 있다. 본 방법에 의해 검출될 수 있는 세균의 예는 하기의 것을 포함하는데 이들로만 한정되는 것은 아니다 : 살모넬라, 캄필로박터(Campylobacter), 에스체리키아(Escherichia), 예르시니아(Yersinia), 바실러스(Bacillus), 비브리오(Vibrio), 레지오넬라(Legionella), 클로스트리디움(Clostridium), 연쇄상구균(Streptococcus) 또는 포도상구균(Staphylococcus).
첨가로, 관심있는 분석물은 항원일 수 있다. 그러나 항원은 한정되는 것은 아니나 장독소 및 이-플라톡신이 포함된다.
고정화된 시약 및 검출시약은 폴리클로날 항체, 모노클로날 항체, 모노클로날 항체들의 혼합물, 또는 폴리클로날과 모노클로날 항체의 혼합물일 수 있다.
검출시약은 검출가능한 마커로 표지될 수 있다. 본 발명의 한 실시양태에 있어서, 검출시약은 동일의 검출가능한 마커로 각각 표지된다. 그러한 마커는 당 분야에서 잘 공지되어 있고 알칼리성 인산효소, 호르세라디쉬 페로시다제, 글루코스산화효소, 베타-칼락토시다제 또는 우레아제와 같은 효소, 플루오레스세인 이소티오시아네이트, 테트라메틸로다민 이소티오시아네이트, 디클로로트리아지닐아미노 플루오레스세인 또는 텍사스레드와 같은 형광 부분 또는 루미놀, 이소루미놀 또는 아크리디늄에스테르와 같은 화학발광 부분을 함유할 수 있다. 게다가, 검출가능한 마커는 부분이 반복적으로 방사선을 방출하도록 유도하기에 효과적인 적절한 급원에서 나온 일정량의 전기화학적 에너지에 노출시킴에 따라 반복적으로 전자기 방사선을 방출할 수 있도록 유도될 수 있는 전기화학발광 화학 부분일 수 있다. 이 전기화학발광 화학 부분은 루테늄 또는 오스뮴을 함유할 수 있다.
고정화된 시약은 진단시약 호울더에 부착된 니트로셀룰로우즈 막에 고정화될 수 있다.
본 발명은 또한 견본내에 다양한 장독소의 존재를 검출 및 확인하는데 유용한 키트를 제공한다. 이 키트는 하기 a)-f)로 구성된다 ;
a) 액체나 고체 현탁액내로 침지시키는데 적당한 표면적과 연결된 핸들이 장치된 진단시약 호울더(여기에서 상기 표면적은 그것에 부착된 하나 이상의 니트로셀룰로우즈 막을 가지며, 니트로셀룰로우즈 막은 그것위의 확인할 수 있는 영역에 분리적으로 구별되게, 고정화된 다수의 모노클로날 항체를 가지며, 각각의 고정화된 모노클로날 항체는 한 장독소상의 항원 결정군에 대해 특이적이다) ;
b) 계면활성제를 함유하는 완충수성용액을 함유한 1차 헹굼 용액 ;
c) 모노클로날 항체가 상이하나 진단시약 호울더에 부착된 니트로셀룰로우즈 막에 고정화된 모노클로날 항체가 특이성이 있는 각 장내 독소내에 위치되어 있는 항원 결정소에 대해 특이적인 하나 이상의 모노클로날 항체 효소 배합체를 함유하는 검출체 ;
d) 완충-수성 용액을 함유하는 이차 헹굼용액 ;
e) 검출 용액 모노클로날 항체와 결합된 효소와 반응할 수 있는 효소 기질 ; 및
f) 무색염료
본 발명의 한 실시양태에 있어서, 니트로셀룰로우즈 막은 그것에 분리적으로 구별되게 고정되어 있고, 다양한 포도상구균성 장독소상에서 항원 결정소에 대해 특이적인 모노클로날 항체를 제공한다. 본 발명의 또 다른 실시양태에 있어서, 니트로셀룰로우즈막은 그것에 분리적으로 구별되게 고정화되고 포도상구균성 장독소 A, B, D 및 E에 대해 특이적인 4개의 모노클로날 항체를 가지고 있다. 게다가 이 니트로셀룰로우즈막은 그것에 분리적으로 구별되게 고정화된 모노클로날 항체와 하나이상의 포도상구균성 장독소상에서 항원 결정소에 대해 특이적인 모노클로날 항체를 부가적으로 가지고 있을 수 있다. 이 장독소는 포도상구균성 장독소 C1, C2및 C3상에서 항원 결정소에 대하여 특이적일 수 있다. 상이하나, 니트로셀룰로우즈 고정화된 모노클로날 항체가 특이적인 각각의 포도상구균성 장독소에 위치한 항원 결정군에 대해 특이적인 모노클로날 항체에 결합된 이 키트의 효소는 알칼리성 인산효소일 수 있고 효소와 반응할 수 있는 효소 기질은 5-브로모, 4-클로로 인돌릴 포스페이트이고, 무색 염료는 니트로블루 테트라졸륨이다.
본 발명은 또한 액체 또는 고체 현탁액내 다양한 포도상구균성 장독소의 존재를 검출 및 확인하는 방법을 제공한다. 이 방법은 하기 a)-k)단계로 구성된다 :
a) 포도상구균성 장독소에 대해 특이적이며 그것에 분리적으로 구별되게 고정화된 다양한 모노클로날 항체를 함유한 진단시약 호울더를, 고정화된 모노클로날 항체 포도상구균성 장독소 복합체를 형성하기 위해 적당한 시간동안 액체 또는 고체 현탁액안에 침지시키고 ;
b) 견본으로 부터 진단시약 호울더를 제거하고 ;
c) 계면활성제를 함유하는 완충 수성 용액안에 진단 호울더를 침지시키고 ;
d) 계면활성제를 함유하는 완충 수성 용액으로 부터 진단시약 호울더를 제거시키고 ;
e) 고정화된 모노클로날 항체-포도상구균성 장독소-모노클로날 항체-알카리성 인산 효소 복합체를 형성하기 위해 적합한 시간동안 모노클로날 항체-알카리성 인산 효소 배합체를 함유하는 검출 용액안에 진단 시약 호울더를 침지시키고 ;
f) 검출 용액으로 부터 진단시약 호울더를 제거하고 ;
g) 완충 수성 용액안에 진단시약 호울더를 침지시키고 ;
h) 완충 수성 용액으로부터 진단시약 호울더를 제거하고 ;
i) 5-브로모, 4-클로로 인돌릴 포스페이트 및 니트로블루 테트라졸륨을 함유하는 용액안에 진단시약 호울더를 침지시키고 ;
j) 푸른색 침전물이 응집된 니트로셀룰로우즈막의 확인가능한 지대를 육안으로 검출하고 ;
k) 푸른색 침전물이 응집된 니트로셀룰로우즈막의 확인가능한 영역을 그 영역에 고정된 모노클로날 항체가 특이성이 있는 포도상구균성 장독소와 연관시킴으로써, 견본안의 다양한 포도상구균성 장독소의 존재 및 확인을 나타낸다.
또한 견본안에 적어도 한종의 세륜의 존재를 검출하는 방법을 제공한다. 이 방법은 하기 a)-h)로 구성된다 :
a) 개구를 갖고 있으며, 세균종들의 성장을 지지해 주기에 적합한 배지를 함유하는 적어도 하나의 리셉터클안에 견본을 접종시키고 ;
b) 리셉터클의 종단에 캡을 접합시키고(리셉터클에 접합시켰을 때, 캡의 면은 세균의 적어도 한 성분을 고정화시키기 위해 적합한 표면이 제공된 리셉터클의 내부에 노출되어 있다.) ;
c) 배지에 접종시킨 세균을 재생산시키기 위한 조건하에서, 접종된 배지를 배양시키고 ;
d) 배지안에 존재하는 세균의 성분들이 리셉터클의 내부에 노출된 캡의 표면에 고정화시키기 위해 적절한 시간동안 각 리셉터클을 거꾸로 뒤집고 ;
e) 거꾸로한 리셉터클을 다시 뒤집고 ;
f) 고정화된 세균 성분-시약 복합체를 형성시키기 위한 조건하에서 리셉터클로 부터 캡을 분리하고 ;
g) 그것에 고정화된 세균의 성분을 갖는 캡의 표면을 세균의 고정화된 성분과의 복합체를 형성할 수 있는 시약과 접촉시키고 ;
h) 고정화된 세균의 성분-시약 복합체를 검출함으로써, 견본안에 세균 종들의 존재를 검출한다.
본 출원에서의 "세균의 성분"은 제한된 것은 아니지만, 완전 세포, 세포벽 성분, 세포막 성분 및 플라젤라성분을 포함한다.
적어도 세균의 한 성분을 고정화시키기에 적절한 캡의 성분은 폴리스티렌 인서어트, 니트로셀룰로우즈막 또는 나일론막일 수 있다. 게다가, 표면은 폴리클로날 항체, 모노클로날 항체, 모노클로날 항체들의 혼합물 또는 폴리클로날 및 모노클로날 항체의 혼합물로 피복될 수 있다.
고정화된 세균 성분과 복합체를 형성할 수 있는 시약은 폴리클로날 항체, 모노클로날 항체, 모노클로날 항체들의 혼합물 또는 폴리클로날 및 모노클로날 항체의 혼합물일 수 있다. 게다가, 시약은 검출가능한 마커, 예컨대 검출가능한 효소, 형광 부분 또는 화학발광 부분으로 표지될 수 있다. 부가적으로, 검출가능한 마커는 전기화학발광 부분일 수 있다. 본 발명의 하나의 실시양태에 있어서, 전기화학발광 부분은 루테늄 또는 오스뮴을 함유한다.
본 발명의 또다른 실시양태에서, 고정화된 세균 성분-시약 복합체들을 고정화된 세균 성분-시약 복합체와 복합체를 형성할 수 있는 검출가능하게 마크된 두번째 시약으로 검출될 수 있다. 아직도 본 발명의 또다른 실시양태에서 시약은 폴리클로날 항체, 모노클로날 항체, 모노클로날 항체들의 혼합물, 또는 폴리클로날 및 모노클로날 항체의 혼합물일 수 있고, 두번째 시약은 시약에 직접적인 검출가능하게 마크된 항-항체일 수 있다.
세균이 검출될 수 있는 견본으로는 물과 음식이 있다.
본 발명의 하나의 실시양태에서, 세균 종들의 성장을 지지해 주기에 적합한 배지는 비선택적 락토우즈 배지이다. 본 발명의 한 실시양태에서, 배지는 비선택적 락토우즈 배지이며 검출되는 세균의 종들은 적어도 하나의 대장균류이다.
견본안에 대장균류 세균 존재를 검출하는 방법이 또한 본 발명에 의해 제공된다. 이 방법은 하기 a)-j)단계로 구성된다 :
a) 개구를 갖고 있으며, 비선택적 락토우즈 배지 및 거꾸로 된 듀램관을 함유하는 적어도 하나의 리셉터클안에 견본을 접종시키고 ;
b) 각 리셉터클의 개구에 폴리스티렌 인서어트가 갖추어져 있는 캡을 접합시키고 ;
c) 37℃에서 적어도 2시간 동안 접종된 배지를 배양하고 ;
d) 각 리셉터클이 거꾸로 된 듀램관 안에 포집된, 세균 발효에 의해 생성된 기체를 갖는 거의 여부의 결정하고 ;
e) 배지안에 존재하는 대장균류 세균이 대장균류 폴리스티렌 복합체를 형성시키게 하기 위해 적합한 시간동안 거꾸로 된 듀램관안에 포집된 기체를 갖는 리셉터클을 거꾸로 뒤집고 ;
f) 거꾸로 한 리셉터클을 다시 뒤집고 ;
g) 리셉터클로 부터 캡을 분리시키고 ;
h) 떼어낸 캡의 폴리스티렌 인서어트를 비결합 부위를 블러킹시키기 위해 적합한 물질로 처리하고 ;
i) 비결합 부위를 블러킹시키기에 적합한 물질로 처리된 캡의 폴리스티렌 인서어트를 항체-대장균류-폴리스티렌 복합체를 형성시키기 위한 조건하에 검출가능한 마아커로 표지되고, 대장균류 세균에 결합할 수 있는 적어도 하나의 항-대장균류 세균 항체로 처리하고 ;
j) 폴리스티렌 인서어트 상의 항체-대장균류-폴리스티렌 복합체의 존재를 검출함으로써, 견본안에 대장균류 세균의 존재를 검출한다.
본 발명의 한 실시양태에 있어서, 비선택적 락토우즈 배지는 페놀 레드(red) 배양액이다.
폴리스티렌 인서어트 상의 비결합 부위를 블러킹시키기에 적합한 물질은 소의 혈청 알부민일 수 있다.
검출가능한 마아커로 표지된 항-대장균류 세균 항체는 검출가능한 마아커로 표지된 모노클로날 항체일 수 있다. 검출가능한 마아커는 모노클로날 항체에 결합된 효소일 수 있다. 본 발명의 한 실시양태에서, 효소는 송아지 장의 알카리성 인산 효소이다. 본 발명의 또 다른 실시양태에서 검출가능한 마아커는 모노클로날 항체에 결합된 형광 부분이다. 여전히 본 발명의 또 다른 실시양태에서 검출가능한 마아커는 모노클로날 항체에 결합된 전기화학발광 부분이다. 전기화학발광 부분은 루테늄 또는 오스뮴을 함유할 수 있다.
본 발명의 한 실시양태에서 견본은 물이다. 본 발명의 또다른 실시양태에서 견본은 음식이다.
개구를 갖는 리셉터클은 병일 수 있다.
또한 물 견본안에서 대장균류 세균을 검출하는 키트가 제공된다. 이 키트는 하기 a)-g)로 구성되어 있다.
a) 비선택적 락토우즈 배지를 포함하는 적어도 하나의 병 ;
b) 적어도 하나의 듀램관 ;
c) 폴리스티렌 인서어트가 장치된 적어도 하나의 병의 캡 ;
d) 소의 혈청 알부민 용액 ;
e) 항-대장균류 세균 모노클로날 항체-효소 배합체 ;
f) 완충 수성세척 용액 ; 및
g) 효소기질용액.
본 발명의 한 실시양태에서 항 대장균류 세균 모노클로날 항체에 결합된 효소는 송아지 장의 알카리성 인산 효소이고, 효소 기질은 p-니트로페닐 포스페이트 디소듐이다.
또한 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 2이다. 더욱더, 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 2이다. 또한 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 2이다. 또한 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 R은 음이온이고 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 2이다. 이 화합물은 하기 구조를 갖는 조성물질을 포함할 수 있다.
X-(Y)n-Z
상기 식에서 X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산, 항체, 관심을 갖고 있는 분석물 또는 관심을 갖고 있는 분석물의 유사물질을 나타내고, n은 정수를 나타내며, Z는 본 발명에 의해 제공된 화합물을 나타낸다.
본 발명은 더욱더 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 R은 음이온이고 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 2이다. 이 화합물은 하기 구조를 갖는 조성물질을 포함할 수 있다.
X-(Y)n-Z
상기 식에서 X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산, 항체, 관심을 갖고 있는 분석물 또는 관심을 가지고 있는 분석물의 유사물질을 나타내고, n은 정수를 나타내고, Z는 본 발명에 의해 제공된 화합물을 나타낸다. 또한 하기 구조를 갖는 화합물이 제공된다.
상기 식에서 R은 음이온이고 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 3이다. 이 화합물은 하기 구조를 갖는 조성물질을 포함할 수 있다.
X-(Y)n-Z
상기 식에서 X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산, 항체, 관심을 가지고 있는 분석물 또는 관심을 가지고 있는 분석물의 유사물질을 나타내고, n은 정수를 나타내고 Z는 본 발명에 의해 제공된 화합물을 나타낸다.
본 발명은 더욱더 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 R은 음이온이고 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 3이다. 이 화합물은 하기 구조를 갖는 조성물질을 포함할 수 있다.
X-(Y)n-Z
상기 식에서 X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산, 항체, 관심을 갖는 분석물 또는 관심을 갖는 분석물의 유사물질을 나타내고, n은 정수를 나타내고, Z는 본 발명에 의해 제공된 화합물을 나타낸다.
또한 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 n은 정수이다. 본 발명의 실시양태에서 n은 3이다. 또한, 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 m과 n은 각각 같거나 다를 수 있는 정수이다. 본 발명의 하나의 실시양태에서, m과 n은 둘다 3이다. 더욱더 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 R은 음이온이고 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 2이다. 이 화합물은 하기 구조를 갖는 조성물질을 포함할 수 있다.
X-(Y)n-Z
상기 식에서 X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산, 항체, 관심을 갖는 분석물 또는 관심을 갖는 분석물의 유사물질을 나타내고 n은 정수를 나타내며, Z는 본 발명에 의해 제공된 화합물을 나타낸다.
본 발명은 더욱더 하기 구조를 갖는 화합물을 제공한다.
또한 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 R은 음이온이고 n은 정수이다. 본 발명의 하나의 실시양태에서 n은 2이다. 이 화합물은 하기 구조를 갖는 조성물질을 포함할 수 있다.
X-(Y)n-Z
상기 식에서 X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산, 항체, 관심을 갖는 분석물 또는 관심을 갖는 분석물의 유사물질을 나타내고, n은 정수를 나타내고 Z는 본 발명에 의해 제공된 화합물을 나타낸다.
본 발명은 더욱더 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 R은 음이온이고 m 과 n은 정수이다. 본 발명의 하나의 실시양태에서 m은 5이고 n은 3이다. 이 화합물은 하기 구조를 갖는 조성물질을 포함할 수 있다.
X-(Y)n-Z
상기 식에서, X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산, 항체, 관심을 갖는 분석물 또는 관심을 갖는 분석물의 유사물질을 나타내고, n은 정수를 나타내고, Z는 본 발명에 의해 제공된 화합물을 나타낸다.
본 발명의 하나의 실시양태에서 X는 테오필린이다.
본 발명의 또 하나의 실시양태에서 X는 디곡시게닌이다.
본 발명의 더 나아간 실시양태에서 X는 hCG에서 유도된 펩티드이다.
또한 본 발명에 의해 하기 구조를 갖는 조성물질이 제공된다.
X=CH=CH-CO-NH-(CH2)n-NH-CO-(CH2)m-Z
상기식에서 ; X는 같거나 다를 수 있는 하나 또는 그 이상의 뉴클레오티드를 나타내고 ; Z는 전기화학발광의 화학 성분을 나타내고 ; n은 1과 같거나 또는 1보다 더 큰 정수를 나타내고, m은 1과 같거나 또는 1보다 더 큰 정수를 나타낸다.
본 발명의 하나의 실시양태에서, X는 C5에 CH가 붙어있는 티미딘이고, n은 7이고 m은 3이다.
본 발명의 또 하나의 실시양태에서, Z는 비스(2,2'-비피리딘)[4-(부탄-1-일)-4'-메틸-2,2'-비피리딘]루테늄(Ⅱ)이다. 그러나 본 발명의 또 다른 실시양태에서, 티미딘 뉴클레오티드는 뉴클레오티드 서열에 붙어있는 3' 말단 뉴클레오티드이다.
TCACCAATAAACCGCAAACACCATCCCGTCCTGCCAG
또한 하기 구조를 갖는 조성물질이 제공된다.
[T-Y-Z]2+(R)2
상기 식에서, T는 테오필린을 나타내고, Y는 T와 Z사이에 붙어 있는 결합기를 나타내고, Z는 비스(2,2'-비피리딘)[4-메틸-2,2'-비피리딘-4'-일]루테늄(Ⅱ)를 나타내며 R은 음이온을 나타낸다.
본 발명의 하나의 실시양태에서, Y는 T의 8위치의 탄소원자에 붙어 있다. 본 발명의 또 하나의 실시양태에서, Y는 하기 구조를 갖는다.
(CH2)m-CO-NH-(CH2)n
상기 식에서 m과 n은 같거나 다를 수 있고, 1과 같거나 또는 1보다 큰 정수를 나타낸다.
본 발명의 또 다른 실시양태에서, m은 3이고 n은 4이다. 본 발명의 또 다른 실시양태에서, m과 n은 둘다 3이다. 그러나 본 발명의 또 다른 실시양태에서, Y는 하기 구조를 갖는다.
상기 식에서, m, n 및 r은 같거나 다를 수 있고, 1과 같거나 또는 1보다 더 큰 정수를 나타낸다.
본 발명의 하나의 실시양태에서, m은 1이고, n은 1이고 r은 4이다. 그러나 본 발명의 더 나아갈 실시양태에서, Y는 하기 구조를 갖는다.
상기 식에서, m, n 및 r은 같거나 다를 수 있고, 1과 같거나 또는 1보다 더 큰 정수를 나타낸다.
본 발명의 하나의 실시양태에서, m은 1이고, n은 1이고 r은 4이다. 그러나 본 발명의 또 하나의 실시양태에서, Y는 T의 7위치의 질소에 붙어있다.
본 발명의 하나의 실시양태에서, Y는 하기 구조를 갖는다.
(CH2)n
상기 식에서, n은 1과 같거나 또는 1보다 더 큰 정수이다. 그러나 본 발명의 또 다른 실시양태에서 n은 4이다.
본 발명은 더욱더 하기 구조를 갖는 화합물을 제공한다.
상기식에서 Y는 결합부분(arm)이다. 본 발명의 하나의 실시양태에서, Y는 하기 구조를 갖는다.
(CH2)m-NH-CO-(CH2)n
상기 식에서 m과 n은 같거나 다를 수 있고, 1과 같거나 또는 1보다 더 큰 정수이다.
본 발명의 하나의 실시양태에서, m은 3이고 n은 2이다. 또한 본 발명은 하기 구조를 갖는 화합물을 제공한다.
상기 식에서 m과 n은 같거나 다를 수 있는 정수이다.
본 발명의 하나의 실시양태에서 m과 n은 둘다 1이다. 더욱더, 본 발명은 하기 구조를 갖는 조성물질을 제공한다.
X-Z
상기 식에서 X는 서스테인 또는 메티오닌인 아미노산 최소한 하나를 포함하며, 같거나 다를 수 있는 하나 또는 그 이상의 아미노산을 나타내고, Z는 비스(2,2'-비피리딘)말레이미도헥산산, 시스테인 또는 메티오닌의 황치환기에 말레이미드의 C3또는 C4에 의해 붙어있는 4-메틸-2,2'-비피리딘-4'-부틸아미드 루테늄(Ⅱ)이다.
다음 실시예는 본 발명을 제한하는 것이 아니라, 본 발명을 예증하기 위해 제공하고, 본 발명은 명세서의 뒤를 잇는 특허청구 범위에 의해 정의된다.
각종 유기 용매속의 전기화학발광
트리스(2,2'-비피리딘) 루테늄(Ⅱ) 클로라이드 육수화물의 전기화학발광은 아래에 기재한 바와 같이 제조한 용액 10ml를 함유한 3-목의 밑바닥이 둥근 15ml 플라스크에서 측정했다 ; 1.5㎜×10㎜의 자기적으로 휘적어섞는 막대 ; 1.0㎜ 직경 은선의 준(準) 기준 전극 ; 28게이지의 백금선 카운터(counter) 전극 결합물 ; 과 0.1㎜ 두께의 1㎝×1㎝ 정방형 조각인 고도롤 연마된 백금박에 용접된 22 게이지 백금선으로 이루어진 작동 전극(이 작동 백금박 전극은 2.3812㎜(3/32in)의 등거리로 28 게이지 백금선 카운터 전극을 둘러싸고 있는 4.7625㎜(3/16in) 직경의 반원형으로 성형했다) 은선을 EG&G 모델 173 일정전위기(potentiostat)/갈바노스테트(galvanostat)의 EG&G 모델 178 전위계 탐침에 연결했다. 백금선 카운터 전극과 백금 활동 전극을 EG&G 모델 173 일정전위기의 음극과 양극에 각각 연결했다. 이 장치를 기초로 했다.
EG&G 모델 175 유니버설 프로그래머가 부착된 EG&G 모델 173 일정전위기로 순환 전압측정(Cyclic voltammetry)을 수행했다. 프로그래머를 +1.75v 양극과 -1.80v 음극 전위 사이에 100mv/초의 스위이프(sweep)를 위해 설치했다. 전기화학발광은 코닥 #23A 젤라틴(레드) 필터(filter)가 장치된 프로덕츠 포 리서치 모델(Products for Reserach Model) PR1402RF 증배형광전관(增倍型光電管) 하우징(housing)의 내부에 설치한 하마마추 R928 증배형광전관을 사용하여 검출했다. 증배형광전관 하우징을 오리엘 모델 7070 증배형광전관 검출 시스템에 연결했다. 순환 전압측정 기록은 휴스톤 인스트루먼트 모델 200X-Y 기록계상에서 기록했다.
순환 전압측정기록은 다음의 유기 용매를 가지고 제조한 1mM의 트리스(2,2'-비피리딘)루테늄(Ⅱ) 클로라이드 육수화물(알드리치 케미칼 컴퍼니), 0.1M의 테트라부틸알모늄 테트라플루오로보레이트(TBABF4)(알드리치 케미칼 컴퍼니)용액에 대해 발생시켰다 : 아세토니트릴 ; n-디메틸포름아미도 ; 디메틸설폭시드 및 1-메틸, 2-피롤리돈(알드리치 케미칼 컴퍼니) 또한 3차-부틸 알콜과 탈이온, 증류수(1 : 1 v/v)를 1mM의 트리스(2,2'-비피리딘)루테늄Ⅱ 클로라이드 육수화물과 0.1M의 TBABF4함유 용액을 제조하기 위해 사용했다.
결과로써 생성되는 전압측정기록은 트리스(2,2'-비피리딘)루테늄(Ⅱ) 클로라이드 육수화물이 유기 용매의 변화에 대해 어떠한 산화환원 전위의 변화도 나타내지 않았다. 전기화학발광의 시각 측정을 위해 용액은 다음과 같이 제조했다 : 트리스(2,2'-비피리딘)루테늄(Ⅱ) 클로라이드 육수화물과 TBABF4의 충분량을 각각 1mM과 0.1M의 최종 농도를 제공하기 위해 전술한 분광학적 구배의 유기용매(알드리치 케미칼 캄파니)속에 용해시켰다.
이후 결과로써 생성되는 용액 10ml을 3-목의 밑바닥이 둥근 15ml 플라스크에 첨가했다. 전극을 용액속에 담그고 작동 전극을 +1.75와 -1.45 볼트 전위사이에 펄스(pulse)시켜 전기화학발광을 발생시켰다.
전기화학발광은 전술한 각각의 용액속에서 시각적으로 관찰되었다. 용매 변화에 대한 전기화학발광의 효과를 정량적으로 측정하기 위해, 용액은 다음과 같이 제조했다 : 충분한 양의 트리스(2,2'-비피리딘)루테늄(Ⅱ) 클로라이드 육수화물과 TBABF4를 각각 2mM과 0.2M의 최종 농도를 제공하기 위해 전술한 유기 용매에 첨가했다. 이 용액의 분취량에 동부피의 강한 산화 과황산 암모늄 함유 탈이온, 증류수를 36mM의 농도로 첨가했다. 트리스(2,2'-비피리딘)루테늄(Ⅱ) 클로라이드 육수화물을 함유하지 않는 대조 표준 용액을 제조했다. 이후 결과로써 생성되는 용액 10ml을 3-목의 밑바닥이 둥근 15ml 플라스크에 첨가했다. 전기화학발광은 0 내지 -2.0 볼트 음극 전위에서 2초 간격으로 한번씩 펄스시켜 이룩했다.
전기화학발광 측정은 결과로써 생성되는 전기화학발광 증배형광전관 시그날(signal)을 미크론타 모델 22191 디지탈 멀티메타(multimeter)에 연결된 집적기를 사용하여 집적시켜 수행했다. 전기화학발광 시그날은 펄스시에 10초간 적분하고 밀리볼트로 기록했다. 결과는 하기 표 Ⅰ에 나타내고 용매변화가 루테늄(Ⅱ) 클로라이드 양자 효능에 영향을 미치는 것을 나타낸다.
[표 1]
* 모든 측정은 밀리볼트에서 한다.
실시예 2
루테늄이 표지된 토끼의 항(抗) 생쥐 면역글로불린 G(IgG) 항체의 전기화학발광 검출 감수성
4'4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딘)루테늄(Ⅱ)이 표지된 토끼의 항-생쥐 IgG 항체(루테늄이 표지된 토끼 항-생쥐 IgG 항체)의 전기화학발광은 아래에 나타낸 바와 같이 제조한 용액 10ml을 함유한 3-목의 밑바닥이 둥근 15ml의 플라스크속에서 측정했다 ; 1.5㎜×10㎜ 의 자기적으로 휘저어 섞는 막대 ; 1.0㎜ 직경의 은선 준 기준 전극 ; 28 게이지의 백금선 카운터 전극 결합물과 0.1㎜ 두께의 1㎝ ×10㎝ 정방형 조각인 고도로 연마된 백금박에 용접된 22 게이지 백금선으로 이루어진 작동전극(이 작동 백금박 전극은 2.3812㎜(3/32in)의 등거리로 28 게이지 백금선 카운터 전극을 둘러싸고 있는 4.7625㎜(3/16in) 직경의 반원형으로 성형했다) 은선을 EG&G 모델 173 일정전위기/갈바노스테트의 EG&G 모델 178 전위계 탐침에 연결했다. 백금선 카운터 전극과 백금 활동 전극을 EG&G 모델 173 일정전위기의 음극과 양극에 각각 연결했디. 이 장치를 기초로 했다.
루테늄-표지 토끼의 항-생쥐 IgG 항체 용액에서 방출된 전기화학발광은 코닥 #23A 젤라틴(레드)필터가 장치된 프로덕트 포 리서어취 모델 PR1402RF 증배형광전관 하우징의 내부에 설치한 하마마추 R928 증배형광전관을 사용하여 검출했다. 증배형광전관 하우징을 오리엘 모델 7070 증배형광전관 검출 시스템에 연결했다. 전기화학발광은 0 내지 -2.0 볼트의 음극 전위에서 1초 간격으로 펄스시켜 유도했다.
전기화학발광 측정은 미크론타 모델 22191 디지탈 멀티메타에 연결된 집적기를 사용하여 결과로써 생성되는 전기화학발광 증배형광전관 시그날을 집적시킴으로써 수행했다. 전기화학발광 시그날은 펄스시키는 동안 10초간 집적하여 밀리볼트로 기록했다. 1.25×10-7M의 루테늄이 표지된 토끼의 항-생쥐 IgG 항체의 원액은 표지된 항체의 농축용액(2㎎/ml 7.5Ru/ 항체)을 인산염 완충식염수(PBS)속에 희석시켜 제조했다. 이 용액의 분취량(80μl)을 반응용기내에 0.1M의 테트라부틸암모늄 사불화붕산염(TBABF4)와 180mM의 과황산 암모늄 함유 디메틸설폭시드(DMSO)/탈이온, 증류수(1 :1) 10ml에 첨가했다. 루테늄이 표지된 항체의 최종농도는 1×10-9M이었다. 전기화학발광은 앞서 기재한 바와 같이 측정했다. 루테늄 표지 토끼의 항-생쥐 IgG 항체 원액의 여러가지 희석액을 대표하는 용액을 더 제조하여 이 용액의 분취량(80μl))똑같은 반응용기속의 루테늄 표지 항체 용액에 증가량씩 첨가하여 하기 표지 항체 농도가 결과 형성되었다 ; 5×10-9M, 1×10-8M과 5×10-8M. 전술한 바와 같이 각각의 용액에 대해 전기화학발광 측정을 행했다. 이 측정치를 하기 표 Ⅱ에 나타낸다. 이들 결과는 표지 항체에 대한 전기화학발광 검출 감수성(1×10-9M)과 루테늄이 표지된 항-생쥐 IgG 항체농도에 따른 전기화학발광 강도의 의존성을 나타낸다.
[표 Ⅱ]
루테늄 표지 토끼의 항-생쥐 면역글로불린 G(IgG) 항체의 전기 화학발광(ECL)
실시예 3
고체상 효소가 결합된 면역흡수분석(ELISA)에서 루테늄이 표지된 소의 혈청 알부민(BSA)의 면역학적 반응성
폴리스티렌 미소적정량 판(microtiter plate)의 웰(well)을 4,4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딜)루테늄(Ⅱ)이 표지된 소의 혈청 알부민 즉 루테늄이 표지된 소의 혈청 알부민(6Ru/BSA, PBS 완충액내 20㎍/ml, 50μl/웰) 또는 표지시키지 않은 BSA(PBS 완충액내 20㎍/ml, 50μl/웰)포화 농도로 피복하여 실온에서 1시간동안 배양했다. 이러한 배양기간 후 판을 세척당 5분씩 PBS로 3번 세척했다. 6㎎/ml의 토끼의 항-BSA 항체 함유 용액을 PBS 속에서 1 : 20,000. 1 : 30,000, 1 : 40,000, 1 : 50,000 및 1 : 60,000으로 희석시키고 희석액을 루테늄이 표지된 BSA 또는 표지시키지 않은 BSA로 피복한 웰에 두배씩 첨가하고 판을 실온에서 1시간동안 배양했다. 상기와 같이 PBS로 3번 세척한 후, 염소의 항-토끼 IgG-과산화물 배합체(conjugate)(PBS 속의 1 : 1000희석액 0.5㎎/ml 용액, 50μl/웰)를 각각의 웰에 첨가하고 판을 실온에서 1시간동안 배양함으로써 결합된 토끼의 항-BSA 항체 존재를 측정했다. 판을 PBS, 0.5% 트윈-20으로 두번 세척하고 상기한 바와 같이 PBS로 두번 세척한후 과산화수소(30%)와 2,2'-아지노-디-[3-에틸-벤즈티아졸린 설포네이트](KPL 가이더즈버그, MD)를 같은 부피로 혼합하고 200μl를 판의 각 웰에 첨가했다. 실온에서 30분간 배양한 후, 414㎚에서 판을 분광광도계로 읽었다. 루테늄 표지 BSA 또는 비표지 BSA가 피복된 웰에 첨가한 각각의 토끼의 항-BSA 항체 희석액에 대한 두번의 읽은값 평균에서 대조평균 웰에서의 평균 자연 흡광도를 뺀다. 이러한 보정시킨 흡광도 값을 하기 표 Ⅴ에 나타낸다. 비표지 BSA와 루테늄 표지 BSA에 대해 얻은 곡선은 대략 0.6의 일정 비율로 두개의 곡선상의 각점에서 보정된 흡광도 값을 갖는 동시에 평행했다. 비슷한 결과는 전술한 바와 같은 활성 루테늄 복합체를 사용하여 제조하고 비슷한 Ru/BSA 표지 비율을 갖는 두개의 다른 루테늄 표지 BSA 롯트(lots)에서 얻었다. 이 결과는 루테늄 표지 BSA가 면역학적으로 활성이 있고, 비표지 BSA와 비교하여 루테늄으로 표지했을때 대략 60%의 면역활성을 유지함을 나타낸다.
[표 Ⅲ]
414㎚에서 흡광도
실시예 4
경쟁적인 고체상 효소가 결합된 면역흡수분석(ELISA)에 의한 루테늄 표지 토끼의 항-생쥐 면역글로불린(IgG) 항체의 면역학적 반응성
4'4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딘)루테늄(Ⅱ)가 표지된 토끼의 항-생쥐 IgG 항체(루테늄 표지 토끼의 항-생쥐 IgG 항체)를 생쥐 IgG에 결합하기 위해 효소-표지, 항-생쥐 IgG 항체와 경쟁하는 능력에 대해 비표지된 토끼의 항-생쥐 IgG 항체와 비교했다. 96-웰 폴리스티렌 미소적정량 판의 웰을 생쥐 IgG 용액(PBS 완충액내의 5㎍/ml)으로 피복하고 실온에서 60분간 배양하여 세척당 5분씩 PBS로 세번 세척했다. 두개의 용액을 제조했는데, 하나는 토끼의 항-생쥐 IgG-알카리성 인산효소 배합체와 토끼의 항-생쥐 IgG(1㎎/ml)의 혼합물을 함유하고 다른 하나는 토끼의 항-생쥐 IgG-알카리성 인산효소 배합체와 루테늄-표지 토끼의 항-생쥐 IgG(1㎎/ml , 7.5Ru/항체)의 혼합물을 함유한다. 이들 두개의 용액과 토끼의 항-생쥐 IgG-알카리성 인산효소 배합체를 함유한 세번째 용액을 0.5% 트윈-20 함유 PBS 속에서 1 : 6000, 1 : 7000, 1 : 8000, 1 : 9000, 1 : 10,000, 1 : 12,000, 1 : 14,000 및 1 : 16,000 으로 희석하고 결합된 생쥐의 IgG 함유 판의 격리된 열에 첨가(50μl/웰)했다. 판을 실온에서 60분간 배양하고 세척당 5분간 PBS-트윈-20으로 두번, PBS로 두번 세척했다. 효소의 기질인 p-니트로테닐 인산염(10% 디에탄올아민 완충액내 1.5㎎/ml pH 9.6)을 각각의 웰에 첨가(200μl/웰)하고 판을 실온에서 30분간 배양하여 405㎚에서 분광광도계로 읽는다. 3개 용액 각각을 희석한 것에 대한 두번의 읽은값 평균에서 대조표준 웰에서의 평균 자연 흡광도를 뺀다. 이 흡광도값을 하기 표 Ⅵ에 나타낸다.
3개의 평행곡선을 얻는데, 맨위의 곡선은 효소 배합체의 비억제된 결합을 나타내고, 두개의 밑에있는 곡선은 루테늄이 표지된 항-생쥐 IgG와 비표지 항-생쥐 IgG에 의한 억제를 나타낸다. 한 항목씩 비교할때 루테늄-표지 항-생쥐 IgG 곡선은 효소 배합체 곡선과 비교하여 비표지 항-생쥐 IgG 곡선보다 대략 81%만큼 낮다. 이 결과는 루테늄-표지, 항-생쥐 IgG 항체가 그의 항원(생쥐 IgG)에 대해 면역학적으로 반응성이 있고 생쥐 IgG와 결합하기 위해 효소-표지 항-생쥐 IgG 항체와 경쟁하는데 있어서 비표지된 항-생쥐 IgG 항체보다 대략 81%만큼 효과적임을 나타낸다.
표 Ⅳ
405㎚에서 흡광도
*(A-B/A-C)×100%
실시예 5
루테늄이 표지된 소의 혈청 알부민(BSA)의 전기화학발광
4'4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딘)루테늄(Ⅱ)으로 표지시킨 소의 혈청 알부민(BSA)(루테늄 표지 소의 혈청 알부민) 7.8×10-6M을 함유한 용액은 인산염-완충 식염수에서 루테늄 표지 BSA 원액(2.6㎎/ml, 6Ru/BSA)을 희석시켜 제조했다. 이 용액 26μl를 반응용기내에서 0.1M TBABF4와 18mM 과황산암모늄 함유 DMSO/탈이온, 증류수(1 : 1) 10ml에 첨가했다. 루테늄 표지 BSA 최종 농도는 2×10-8M이었다, 전기화학발광은 실시예 Ⅴ에 기술한 바와 같이 측정했다. 비슷한 방법으로, 비표지 BSA 7.8×10-6M 함유 용액을 제조하여 반응용기에 첨가하여 2×10-8M의 최종 비표지 BSA 농도를 얻었다. 이 용액과 BSA가 없는 비슷한 용액의 전기화학발광을 측정했다. 공유적으로 결합된 루테늄 표지 BSA와 비표지 BSA에 대한 전기화학발광 측정치는 하기표 Ⅴ에 나타낸다.
[표 Ⅴ]
루테늄 표지 BSA의 전기화학발광(ECL)
실시예 6
루테늄 표지 토끼의 항-생쥐 면역글로불린 G(IgG) 항체의 전기화학발광
4'4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딜)루테늄(Ⅱ)으로 표지시킨 토끼의 항-생쥐 IgG 항체(루테늄 표지, 토끼의 항-생쥐 IgG 항체) 1.25×10-6M 함유 용액은 인산염 완충식염수 속에서 루테늄 표지 토끼의 항-생쥐 IgG 항체 원액 (2㎎/ml, 7.5Ru/항체)을 희석시켜 제조했다. 이 용액 80μl를 반응용기속에서 0.1M TBABF4와 18mM 과황산암모늄 함유 DMSO/탈이온, 증류수(1 : 1) 10ml에 첨가했다. 루테늄-표지 항체의 최종농도는 1×10-8M이었다.
전기화학발광은 실시예 2에 기재한 바와 같이 측정했다.
비슷한 방법으로, 비표지된 토끼의 항-생쥐 IgG 항체 1.25×10-6M 함유 용액을 제조하여 반응용기에 첨가하여 1×10-8M의 비표지 항체의 최종 농도를 얻었다. 이 용액과 첨가된 항체가 없는 용액의 전기화학발광을 또한 기재한 바와 같이 측정했다. 공유적으로 결합한 루테늄 표지 토끼의 항-생쥐 IgG 항체와 비표지 토끼의 항-생쥐 IgG 항체에 대한 전기화학발광 측정은 하기표 Ⅷ에 나타낸다.
[표 Ⅵ]
루테늄 표지 토끼의 항-생쥐 면역글로불린 g(IgG) 항체의 전기화학발광(ECL)
실시예 7
소의 혈청 알부민에 대한 항체의 동종 전기화학발광 면역분석
4'4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딜)루테늄(Ⅱ)으로 표지시킨 소의 혈청 알부민(BSA)(루테늄 표지 소의 혈청 알부민) 7.8×10-6M 함유 용액은 인산염 완충 식염수(PBS)속에서 루테늄 표지 BSA 원액(2.5㎎/ml, 6Ru/BSA)을 희석시켜 제조했다. 이 용액 26μl를 반응용기 속에서 0.1M TBABF4와 18mM 과황산암모늄 함유 DMSO/탈이온, 증류수(1 : 1) 10ml에 첨가했다. 루테늄 표지 BSA의 최종농도는 2×10-8M이었다. 전기화학발광은 실시예 2에 기술한 바와 같이 측정했다.
비슷한 방식으로, 비표지 BSA 7.8×10-6M 함유 용액을 제조하여 반응용기에 첨가하여 5×10-8M의 비표지 BSA 최종농도를 얻었다. 이용액과 BSA가 없는 비슷한 용액의 전기화학발광을 측정했다. 3.75×10-5M의 토끼의 항-BSA 항체 함유용액은 BSA 속에서 토끼의 항-BSA 항체 원액(6.0㎎/ml)를 희석시켜 제조하고 분취량(26μl)을 반응 용기속에서 루테늄-표지 BSA 용액에 첨가하여 1×10-7M의 토끼의 항-BSA 항체 최종농도를 얻었다.
루테늄-표지 BSA 항원과 항체(토끼의 항-BSA)의 결과로써 생성되는 혼합물에 대한 전기화학발광을 측정했다. 하기표 Ⅶ에 나타난 결과는 토끼의 항-BSA 항체 첨가시에 루테늄-표지 BSA의 전기화학발광 감소를 나타내고 BSA에 대한 항체의 동종 전기화학발광 검출이 이루어질 수 있음을 증명한다. 이러한 결과를 근거로 하여 당분야에 숙련된 자들은 관심을 갖고 있는 그밖의 다른 분석물을 검출하기 위한 동종 전기화학발광 면역성분이 개발될 수 있음을 이해할 것이다.
[표 Ⅶ]
항체와 결합시에 루테늄-표지 소의 혈청 알부민에 대한 전기화학발광(ECL)의 감소
실시예 8
생쥐의 면역글로불린 G(IgG)에 대한 동종 전기화학발광 면역분석
4'4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딜)루테늄(Ⅱ)으로 표지시킨 토끼의 항-생쥐 IgG 항체(루테늄-표지 토끼의 항-생쥐 IgG 항체) 6.25×10-6M 함유 용액은 인산염 완충 식염수(PBS)에서 루테늄-표지 토끼의 항-생쥐 IgG 항체 원액(2.5㎎/ml, 7.5Ru/항체)을 희석하여 제조했다. 이 용액의 80μl를 반응 용기속에서 0.1M TBABF4와 18mM 과황산암모늄 함유 DMSO/탈이온, 증류수(1 : 1) 10ml에 첨가한다. 루테늄-표지 항체의 최종농도는 5×10-8M이었다. 전기화학발광은 실시예 2에 기술한 것과 같이 측정했다. 비슷한 방법으로, 비표지 토끼의 항-생쥐 IgG 항체 6.25×10-6M 함유 용액을 제조하고 반응용기에 이것을 첨가하여 5×10-8M의 비표지 항체의 최종 농도를 얻었다. 이 용액과 항체가 없는 비슷한 용액에 대한 전기화학발광을 측정했다.
2.5×10-5M의 생쥐 IgG 함유 용액은 PBS 속에서 생쥐의 IgG 원액(4.0㎎/ml)을 희석시켜 제조하고 이 용액의 다른 분취량(20μl와 40μl)을 반응 용기속에서 루테늄 표지, 항-생쥐 IgG 항체의 용액에 첨가하여 각각 5×10-8M과 1×10-7M의 생쥐 IgG 의 최종 농도를 얻었다. 루테늄-표지, 항-생쥐 IgG 항체와 항원(생쥐 IgG )의 결과로써 생성되는 혼합물에 대한 전기화학발광을 측정했다. 결과는 하기 표 Ⅷ에 나타낸다. 생쥐 IgG 항원의 농도에 따른 전기화학발광 측정치의 의존도는 제1도에 나타낸다. 이 결과는 항원첨가시에 루테늄-표지 항체의 전기화학발광의 감소를 증명한다. 이러한결과에 근거를 두고, 당분야에 숙력된 기술을 가진 자는 관심을 갖는 그밖의 다른 분석물의 농도를 결정하기 위한 동종 전기화학 발광면역검사가 개발될 수 있음을 이해할 것이다.
[표 Ⅷ]
항원과 결합시에 루테늄 표지 항체의 전기화학발광(ECL)의 감소
실시예 9
생쥐의 항-레지오넬라(Legionella) 면역글로불린 G(IgG) 항체와 루테늄-표지 토끼의 항-생쥐 면역글로불린 G(IgG) 항체를 사용한 레지오넬라에 대한 동종 전기화학발광 면역분석
세균 레지오넬라 믹다데이(Legionella micdadei)의 포르말린화시킨 현탁액을 PBS 완충액속에서 희석시켜 1.00의 광학적 밀도(425㎚에서)로 조절했다. 대략 3×109쎌을 원추형의 마이크로 원심분리관에 첨가했다. 쎌을 원심분리(10,000RPM에서 10분) 시키고 상등액을 가만히 따르고 쎌을 PBS(1ml) 속내의 레지오넬라 믹다데이 특이성 생쥐의 모노클로날 IgG 항체(1.45㎎/ml) 1 : 50 희석액에 재현탁시켰다. 실온에서 1시간동안 배양한 후 쎌을 원심분리시키고 상등액을 가만히 따르고 쎌을 PBS 완충액에 재현탁시켜 또다시 원심분리했다. 상등액을 가만히 따른 뒤에, 쎌을 4,4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비피리딜)루테늄(Ⅱ)으로 표지시킨 토끼의 항-생쥐 IgG 항체, 즉 루테늄-표지 토끼의 항-생쥐 IgG 항체(2㎎/ml, 7.5Ru/항체)의 1 : 50 희석액(PBS 속의)에 재현탁시켰다. 실온에서 1시간동안 배양한 후, 쎌을 원심분리시키고, 상등액을 가만히 따르고 쎌을 PBS 속에 재현탁시켜 상기한 바와 같이 원심분리하면서 두번 세척했다. 마지막 세척후 쎌을 PBS 200μl에 재현탁했다. 쌜 현탁액 100μl를 0.1M TBABF4와 18mM 과황산암모늄 함유 DMSO/탈이온, 증류수(1 : 1) 10ml 함유 반응용기에 첨가하고 반응용기에 옮겼다. 쎌 현탁액에 대해 전기화학발광을 측정했다. 쌜 현탁액 100μl을 또한번 반응용기에 첨가하여 전기화학발광을 측정했다. 실시예 2에 기재한 방법에 따른 대조표준으로 쎌이 없는 용액에 대해 전기화학발광을 측정했다. 하기 표 Ⅸ에 나타낸 결과는 루테늄-표지 토끼의 항-생쥐 IgG 항체를 사용한 레지오넬라에 대한 동종 전기 화학발명 면역분석이 성공적으로 수행됐음을 나타낸다.
[표 Ⅸ]
레지오넬라 믹다데이에 대한 동종 전기화학발광(ECL) 면역분석
실시예 10
생쥐의 항-레지오넬라 면역글로불린 G(IgG) 항체와 루테늄-표지 토끼의 항-생쥐 면역글로불린 G(IgG) 항체를 이용한 레지오넬라에 대한 동종 전기화학발광 면역분석
세균 레지오넬라 믹다데이 현탁액을 제조하고 실시예 9에 기재한 바와 같이 레지오넬라 특이성 생쥐의 모노클로날 IgG 항체와 함께 배양했다. 쎌을 원심분리, 세척 및 PBS 0.2ml에 재현탁했다. 4'4'-(디클로로메틸)-2,2'-비피리딜, 비스(2,2'-비필리딜)루테늄(Ⅱ)으로 표지시킨 토끼의 항-생쥐 IgG 항체, 즉 루테늄 표지 토끼의 항-생쥐 IgG 항체(1.25×10-6M)의 분취량(80μl)을 쎌 현탁액에 첨가하여 혼합물을 실온에서 2시간 동안 배양했다. 대조표준으로, 루테늄-표지 토끼의 항-생쥐 IgG 항체의 비슷한 희석액을 쎌 현탁액 없이 같은 방식으로 배양했다. 배양기간후, 표지시킨 항체 용액을 반응 용기속에서 0.1M TBABF4와 18mM 과황산암모늄 함유 DMSO/탈이온, 증류수(1 : 1) 10ml에 첨가하여 루테늄-표지 토끼의 항-생쥐 IgG 항체의 최종 농도 1×10-8M을 얻었다. 전기화학발광은 실시예 2에 기술한 바와 같이 측정했다. 첨가된 루테늄-표지 토끼의 항-생쥐 IgG 항체를 갖는 쎌 현탁액에 대해 똑같은 과정을 계속했다. 하기 표 Ⅹ에 나타낸 결과는 루테늄-표지 항-생쥐 IgG 항체와 레지오넬라에 결합한 생쥐의 모노클로날 항체의 상호작용에 따라 전기화학발광 방출의 감소와 레지오넬라 믹다데이에 대한 동종 전기화학발광 면역분서이 성공적으로 수행되었음을 나타낸다.
[표 Ⅹ]
레지오넬라 믹다데이에 대한 동종 전기화학발광(ECL) 면역분석
실시예 11
세균에 결합된 루테늄-표지 항체의 방출에 따른 전기화학발광의 증가
세균 레지오넬라 믹다데이의 포르말린화시킨 현탁액을 PBS 완충액으로 희석시켜 광학적 밀도(425㎚에서) 1.00으로 조절하여 이 현탁액 2ml을 원추형의 마이크로 원심분리관에 첨가했다. 쎌을 원심분리(10,000 RPM에서10분간) 시키고 상등액을 가만히 따르고 쎌을 PBS(0.5ml)내의 레지오넬라 믹다데이 특이성 생쥐의 모노클로날 IgG 항체(1.45㎎/ml) 1 : 10 희석액속에서 재현탁했다. 실온에서 1시간동안 배양한 후 상기한 바와 같이 쎌을 원심분리시키고, 상등액을 가만히 따라내어 쎌을 PBS 완충액속에서 재현탁시켜 또 한번 원심분리시켰다. 상등액을 가만히 따라낸뒤, 쎌을 루테늄-표지 토끼의 항-생쥐 IgG 항체(1ml, 7.5Ru/항체) 1 : 50 희석액(PBS내에서) 속에 재현탁시켰다. 실온에서 1시간 동안 배양한 후 쎌을 상기한 바와 같이 원심분리하여 상등액을 가만히 따라내고, 쎌을 PBS 속에 재현탁시키고 상기한 바와 같이 원심분리하면서 두번 세척했다. 마지막 세척에 뒤이어 쎌을 PBS 또는 1.0M의 초산--0.9% NaCl(생리식염수) 용액 100μl 속에 재현탁시키고 실온에서 40분간 배양했다. 원심분리한 후, 상등액 액체 100μl를 0.1M TBABF4와 18mM 과황산암모늄 함유 DMSO-탈이온, 증류수(1 : 1) 10ml과 함께 반응용기에 옮겼다. 초산/생리식염수의 쎌 상등액 액체 및 PBS 세척 쎌로부터 나온 상등액 액체에 대한, 전기화학발광을 실시예 2에 기재한 방법에 따라 측정했다. 전기화학발광 측정은 하기표 XI에 나타내고 1.0M의 초산-생리식염수(참고문헌 23)로 쎌을 처리함으로써 모노클로날 항체 피복 레지오넬라 세균으로부터 루테늄-표지 토끼의 항-생쥐 IgG 의 용출은 비결합 루테늄-표지 항체에 의해 발생된 전기화학발광의 증가를 야기한다는 것을 증명했다. 또한 이 결과는 루테늄 표지 항체가 모노클로날 항체-피복 레지오넬라에 결합되고 PBS 세척이 자연 시그날과 비교하여 ECL에서 증가를 야기하지 않음을 나타낸다.
[표 SI]
실시예 12
우린내프레그날-디올-3-글루쿠로나이드(PD3G)에 대한 동종 경쟁적 면역분석
프레그날-디올-3-글루쿠로나이드(PD3G)는, 견본속에 PD3G가 존재하고 PD3G-전기화학발광 성분이 항체상의 결합부위와 경쟁하도록 우린 견본과 알려진 양의 전기화학발광 성분이 표지된 PD3G 및 알려진 양의 항-PD3G 항체를 접촉시킴으로써 우린내에서 검출 및 정량할 수 있다. 적당한 시간후에, 결과로써 생성되는 견본은 전기화학발광 성분이 되풀이하여 전자기 방사를 방출하도록 유도하기에 효과적인 전기화학적 에너지원에 직접 노출시에, 되풀이하여 전자기 방사를 방출할 수 있도록 유도시킬 것이다. 방출된 방사선을 정량할 수 있고 견본내의 PD3G 존재양을 그것으로부터 결정할 수 있다.
실시예 13
트리스-루테늄 비피리딜-n-히드록시숙신이미드 에스테르로 핵산 표지
10mM의 트리스 히드로클로라이드(pH 8.0)-1mM의 EDTA내 핵산 견본(5 내지 25㎍)은 42℃에서 3시간동안 시토신 잔기를 에틸렌 디아민으로 이아황산염에 촉매 아미노기 전이시켜 열변성, 냉각 및 개질시킬수 있다. 5mM의 인산 나트륨 완충액(pH 8.5)으로 3번 교환하여 하루밤 동안 투석한 후, 견본을 한외 여과시켜 100μl로 농축할 수 있다. 이러한 개질 핵산(1 내지 10㎍)은 0.1M의 인산나트륨 완충액(pH 8.5)을 가지고 100μl로 희석할 수 있다.
트리스-루테늄 비피리딜-N-히드록시숙신이미드 에스테르 유도체는 당분야에 공지된 방법에 의해 N,N'-디메틸포름아미드(DMF)내 0.2M으로 원액으로 제조할 수 있다. 이 에스테르 용액 5μl를 0.1M의 인산나트륨 완충액(pH 8.5)내 개질된 핵산용액에 첨가할 수 있고 실온에서 1시간 동안 배양했다. 표지시킨 핵산 탐침물은 사용할때까지 4℃에서 저장시킨 150mM의 염화나트륨-10mM의 인산나트륨 완충액(pH 7.0)으로 최소한 3번 교환하여 투석시켜 정제할 수 있다.
실시예 14
혈액내 인간의 T-세포 백혈병 Ⅲ 비루스(HTLV-Ⅲ)에 대한 핵산 잡종형종 분석
HTLV-Ⅲ 비루스는 비루스 입자로부터 RNA가 방출되도록 혈액을 처리함으로써 전체 혈액에서 검출할 수 있다. HTLV-Ⅲ RNA 함유 견본을 HTLV-Ⅲ RNA와 보족적이고 전기화합발광 성분을 표지시킨 한가닥의 올리고뉴클레오티드 탐침물과 접촉시킨다. 적당한 시간후에 결과로써 생성되는 견본은 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출할 수 있도록 유도시킬 것이다. 방출된 방사선을 정량할 수 있고 견본내에 존재하는 HTLV-Ⅲ RNA의 양을 그것으로부터 결정할 수 있다.
실시예 15
임상견본내 레지오넬라 세균에 대한 동종 핵산 잡종형성 분석
레지오넬라 세균은 세균으로부터 리보조옴 RNA를 방출하도록 타액을 처리함으로써 타액과 같은 임상견본속에서 검출할 수 있다. 결과로써 생성되는 견본을 리보조옴 RNA내 서열과 보족적이고 레지오넬라 특이성이며 전기화학발광 성분을 표지시킨 한가닥의 올리고뉴클레오티드 탐침과 접촉시킨다. 적당한 시간 후에, 결과로써 생성되는 견본은 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출할 수 있도록 유도시킬 것이다. 방사된 방사선은 정량할 수 있고 견본내에 존재하는 레지오넬라 세균의 양은 그것으로부터 결정할 수 있다.
실시예 16
가닥 치환 방법에 의해 게놈 DNA로 집적시킨 시토메갈로비루스 DNA 검출에 대한 잡종형성 분석
시토메갈로비루스(Cytomegalovirus)(CMV) DNA는 DNA를 방출하도록 조직 견본 예컨대 림프구를 처리하고 제한효소로 DNA를 쪼개어 인간의 게놈 DNA에서 검출할 수 있다. 결과로써 생성되는 두가닥의 CMV 단편 함유 견본을 CMV DNA와 보족적이고, 전기화학발광 성분으로 표지시키며 DNA 중복유전자중 하나의 가닥을 치환시키기 쉬운 한가닥 올리고뉴클레오티드 탐침물과 접촉시킨다. 적당한 시간후에 결과로써 생성되는 견본을, 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도시키기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출할 수 있도록 유도시킬 것이다. 방출된 방사선을 정량하여 견본내 존재하는 시토메갈로비루스 RNA 양은 그것으로부터 결정할 수 있다.
실시예 17
이종 방법을 사용한 인간의 방광암 세포내 라스-발암 유전자(ras-oncogene) 검출에 대한 잡종형성 분석
라스-발암 유전자는 DNA를 방출하도록 조직견본을 처리하고, 제한효소로 DNA를 쪼개고, 한가닥으로 DNA를 용융시키고, 마니아티스 T.일행(24)이 앞서 기술한 바와같은 니트로셀룰로오즈지에 결합시킴으로해서 인간의 방광암 세포에서 검출할 수 있다. 단일 가닥에 결합된 여과지를 라스-발암 유전자 특이성, 전기화학발광 성분으로 표지시킨 올리고뉴클레오티드 탐침물과 접촉시킨다. 적당한 반응시킨후, 결과로써 생성되는 견본은 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출하도록 유도시킬 것이다. 방출된 방사능을 검출하여 견본내 라스-발암 유전자 RNA의 존재를 측정할 수 있다.
실시예 18
전기화학발광 중합체-기제 효소 분석
거대분자 효소 기질(예를들면 녹말, 덱스트린) 또는 합성적으로 제조한 거대분자 중합체를 전기화학발광성분으로 표지시킬 수 있다. 표지된 기질은 다성분계내에 존재하는 효소 존재를 측정 및 정량하는데 사용할 수 있다. 또한 표지된 기질은 항체, DNA 탐침물, RNA 탐침물, 스트렙트 아비딘, 아비딘, 또는 바이오틴에 결합된 효소의 양을 정량하는데 사용할 수 있다. 표지된 기질은 적당한 효소에 의해 선택적으로 더 작은 단편으로 쪼개질 수 있다. 어떠한 효소-기질 혼합물도 사용할 수 있다. 효소의 예는 글리코시다제, 글루코시다제, 아밀라제, 프로테아제, 엔도뉴클레아제, 리아제 및 덱스트란아제를 포함한다. 적당한 시간후에 결과로써 생성되는 견본은 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출하도록 유도시킬 것이다. 방출된 방사선은 정량할 수 있고 그것으로부터 견본내에 존재하는 효소양을 측정할 수 있다. 잇점은 전기화학발광 시그날의 증폭이 전기화학발광 성분이 표지된 각각의 쪼개진 단편으로부터 야기되는 점이다.
실시예 19
전기화학발광 효소 분석에 의한 연쇄상구균 검출
연쇄상구균 함유 견본을 전기화학발광 성분으로 표지시킨 합성 펩티드함유 반응 혼합물과 접촉시킨다. 펩티다제 특이성이 있는 합성 펩티드인 기질은 세균에 의해 생산된다. 합성 펩티드에 대한 펩티다제의 작용은 전기화학발광 성분을 표지시킨 단편을 생산시킨다. 적당한 시간후에, 결과로써 생성되는 견본을 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출할 수 있도록 유도시킬 것이다. 방출된 방사선을 정량할 수 있고, 그것으로부터 견본내 존재하는 연쇄상구균의 양을 측정할 수 있다.
실시예 20
전기화학발광에 근거를 둔 B형 간염 표면 항원에 대한 효소 면역 분석
B형 간염 표면 항원(HBsag)함유 혈액 견본을 HBsag 특이성 항체에 적당시간 동안 접촉시키고 덱스트린아제로 표지시킨다. HBsag에 결합되지 않은 항체를 제거하고 항원-항체 복합체를 전기화학발광 성분을 표지시킨 덱스트란 중합체에 접촉시킨다. 표지시킨 중합체에 대한 덱스트란아제의 작용은 전기화학발광 성분을 표지시킨 각각의 단편을 생산시킬 것이다. 적당한 시간후에, 결과로써 생성되는 견본을 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도시키기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출하도록 유발시킨다. 방출된 방사선을 정량할 수 있고 그것으로부터 견본내의 존재하는 B형 간염 표면 항원의 양을 측정할 수 있다.
실시예 21
전기화학발광 표지 브레이디키닌(bradykinin)을 사용한 브레이디키닌 수용체에 대한 동종 분석
브레이디키닌 수용체 함유 조직 견본을 적당하게 제조하여 전기화학발광 성분이 표지된 브레이디키닌과 접촉시킨다. 적당한 시간후에, 결과로써 생성되는 견본을 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출하도록 유도시킨다. 방출된 방사선을 정량하고 그것으로부터 견본내의 브레이디키닌 수용체 존재양을 측정한다. 또한 이 분석은 에스트로겐-에스트로겐 수용체와 같은 그밖의 다른 리간드-수용체 상호작용을 측정하는데도 사용할 수 있다. 첨가하여 이 분석은 경쟁적 결합 분석 포맷(format)을 사용하여 비 표지 리간드의 양을 측정 및 정량할 수 있다.
실시예 22
핵산 잡종(hybrids) 을 검출하기 위한 전기화학발광 성분의 이용
핵산 잡종(예컨대 이중 가닥 DNA, DNA-RNA 중복 유전자, 또는 이중 가닥 RNA) 함유 견본을, 특이하게 핵산 잡종에 삽입하는 전기화학발광 성분과 접촉시킨다. 적당한 시간후에, 결과로써 생성되는 견본을 되풀이하여 전자기 방사를 방출하도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지에 직접 노출시에 전자기 방사를 되풀이하여 방출하도록 유도시킨다. 방출된 방사선을 정량하고 그것으로부터 견본내 존재하는 핵산 잡종의 양을 측정한다.
실시예 23
전기화학발광을 이용한 동종 면역분석으로 타액내 항체에 복합체 형성된 인간의 T-세포 백혈병 비루스 Ⅲ(HTLV-Ⅲ)항원 검출
항체에 복합체 형성된 HTLV-Ⅲ 함유 타액 견본을 항원-항체 복합체를 붕괴시키기 위한 혼란가증제(chaotopic agent) 함유 용액에 접촉시킨다. 이후, 이 용액을 HTLV-Ⅲ 특이성 항체에 접촉시키고 전기화학발광 성분으로 표지시킨다. 혼란가증제는 표지 및 비표지 항체를 항원과 재결합시키기 위해 제거한다. 적당한 시간후에, 결과로써 생성되는 견본을 되풀이하여 전자기 방사를 방출시키도록 전기화학발광 성분을 유도하기에 효과적인 전기화학 에너지원에 직접 노출시에 되풀이하여 전자기 방사를 방출하도록 유도시킨다. 방출된 방사선을 정량하고 그것으로부터 견본내 존재하는 인간의 T-세포 백혈병 비루스 Ⅲ(HTLV-Ⅲ)항원의 양을 측정한다. 이 방법은 혈청내 간염 항원- 항체 복합체, 시토메갈로비루스-항체 복합체, 및 A형이 아니고 B형도 아닌 간염-항체 복합체와 같은 그밖의 다른 유형의 항원-항체 복합체 함유 견본에 적용할 수 있다.
실시예 24
포도상구균성 장내독소 중복도(Multiplicity)의 검출 및 동정을 위한 면역분석
포도상구균성 장내독소 A, B, C, D 및 E 각각에 대해 특이성이 있는 모노클로날 항체와 이들 장내독소에 대해 교대 반응성이 있은 모노클로날 항체를 정제했다. 각각의 항체는 복수(ascite)를 결합, 용출을 제공하는 아가로즈(agarose) 겔 지지 매트릭스에 결합된 포도상구균성 단백질 A 컬럼에 통과시킴에 의한 복수액체 및 모노클로날 항체 정제 시스템(바이오-레드 레이버러토리즈, 회사)의 일부로 재생산 완충액으로부터 정제했다. 정제 과정에서, ml당 전형적으로 모노클로날 항체 5-15㎎을 함유한 복수 유체 2ml을, 10ml의 주사기(벡톤 디켄슨 회사) 밑바닥내 두개의 F-13 분석 유지(쉘레이쳐와 슈엘, 회사) 사이의 메트리셀 맴브레인 필터(겔만 싸이언스, 회사)에 집어넣고 복수유체를 주사기에 도입하고, 플런저(plunger)를 삽입하고 복수 액체를 수집 용기에 여과시켜 예비여과했다. 여과물을 동량의 결합 완충액과 혼합하여 5ml의 단백질 A-아가로즈 컬럼에 적용했다. 이후 컬럼 반응물 저장소에 결합 완충액을 채워 용출공정을 시작했다. 용출물을 280㎚(A280)에서 흡광도를 측정하고 1ml의 분획물을 모았다. A280이 정상적인 기준선 값에 도달할때, 컬럼을 5배드(bed) 부피의 결합 완충액으로 세척하고 이후 용출 완충액을 사용하여 컬럼으로부터 정제된 면역 글로불린을 용출시킨다. 면역글로불린을 중화시키기 위해, 용출물을 1M의 트리스-HCI(pH 9.0) 0.3ml속에서 모은다.
A280이 또다시 안정한 기준선값에 도달할때, 컬럼을 5배드 부피의 용출 완충액으로 세척하고 뒤이어 재생산 완충액 10배도 부피와 결합 완충액 5배드 부피로 세척하여 컬럼을 다음의 정제 순환과정에 대해 준비시킨다. 정제 면역글로불린 함유 분획물을 모으고 휘어저 섞은 한외여과 쎌(아미콘 회사)을 사용하여 농축했다. 정제된 면역글로불린의 최종 농도는 전체 단백질에 대해 로우리 분석으로 측정했을때 5㎎/ml 보다 더 많았다. 정제된 항체는 4℃에서 48시간 동안 0.1%의 아지드 나트륨 함유 인산염-완충식염수(PBS)로 두번 교환하여 투석했다. 정제시킨 모노클로날 항체는 특이적 장내독소에 대한 항체의 면역학적 반응성을 측정하기 위해 96-웰의 미소적 정량 판 ELISA 시스템에서 적정했다. 얻어진 항체에 대한 최종 점의 적정량과 이전에 허용할 수 있는 각각의 항체롯트(lot)에 대한 기준 적정량값을 비교했다. 충분한 적정량을 갖는 항체는 진단 시약 호울더 예컨대 계량봉에 고정시키기 위한 또는 면역분석에서 탐침물로 사용하는 효소에 결합시키기 위한 면역학적 관능 피복 항체로 받아들인다.
붙어있는 니트로셀룰로즈 막을 갖는 진단 시약 호울더(계량봉)는 막을 실온에서 인산염-완충 식염수에 1시간 동안 첫번째 침지시켜 막의 습윤성을 향상시킴으로 해서 막 표면에 항체를 고정시켜 제조했다.
봉을 용액에서 제거하고 막을 공기 건조시켰다. 각각이 포도상구균성 장내독소 A, B, C, D 또는 E중 하나에 특이성이 있는 정제된 모노클로날 항체 용액과 비-특이성 대조 생쥐의 면역글로불린(잭슨 임뮤노 리서어치 레이버로토리즈, 회사)은 항체 용액 20μl를 직접 막 표면상에 점적하여 여러 막 지대에 적용했다. 사용한 각 항체의 농도는 니트로셀룰로오즈의 결합 부위를 포화시킨다고 알려진 농도이다 ; 3A 항체(A 독소 특이성) ml당 250㎍, 2B 항체(B 독소 특이성) ml당 50㎍, 1C3 항체(C1,C2및 C3 독소 특이성) ml당 300㎍, 3D 항체(D 독소 특이성) ml당 200㎍, 4E 항체(E 독소 특이성) ml당 250㎍ 및 비 특이성 대조 생쥐의 면역글로불린 ml당 200㎍ 계량봉을 실온에서 공기 건조시키고, 막상에 남아있는 단백질 결합 부위는 0.5% 트윈 20과 3%의 소의 혈청 알부민 함유 인산염 완충 식염수 용액에 계량봉을 침지시켜 차단했다. 실온에서 이차단 용액을 하룻밤 배양한 뒤, 봉을 공기 건조시켰다.
정제시킨 모노클로날 항체 2A(A 및 E 독소 특이성), 6B(B,C1,C2 및 C3 독소 특이성), 및 1D(D 독소 특이성)는 진단 시약 호울더인 계량봉의 막 표면에 고정된 항체에 결합되는 A, B, C1, C3, C2, D 및 E 독소존재를 결정하기 위한 결합 탐침물로 이용하는, 알카리성 인산효소에 공유적으로 결합한다. 각각의 배합체는 이관능 가교제로 글루타르알데히드를 이용하는 화학량론적으로 조절된 두단계 과정에 의해 제조된다. 이 과정에서는 EIA 등급의 알카리성 인산효소 0.47ml(2500U/㎎ 베링거만하임 회사)을 글루타르알데히드 수용액 13.4μl(25%, 시그마 케미칼 회사) 함유 50mM 인산 칼륨 완충액(ph 7.2) 1.2ml에 첨가한다. 혼합물을 실온에서 90분간 휘저어 섞어 글루타르알데히드를 효소분자의 유리 아미노기에 결합시킨다. 이러한 배양후에, 1㎎/ml의 농도로 정제시킨 모노클로날 항체 2ml 분취량을 첨가하고 혼합물을 90분 더 휘저어 섞어서 얼음위에 놓아 배합체 형성 반응을 중지시킨다. 배합체는 4℃에서 48시간 동안 0.1%의 아지드 나트륨 함유 인산염 완충 식염수를 두번 교환하여 투석시킨다. 4℃에서 연장된 저장시에 안정화시키는 동안 3%의 최종 농도로 소의 혈청 알부민을 투석물에 첨가한다. 항체-효소 배합체는 특정 장내독소에 대한 그의 면역학적 반응성을 측정하기 위해 96-웰 μl 판 ELISA 시스템에서 적정했다. 배합체가 얻은 최종 점의 적정량과 이전에 허용할 수 있는 각 롯트의 배합체에 대한 기준 적정량값을 비교한다. 충분한 적정량을 갖는 배합체를 포도상구균성 장내독소에 대한 계량봉 본석의 탐침물로 이용하기 위해 받아들인다.
포도상구균성 식품 중독 발생과 가장 흔히 관련되는 식품유형을 대표하는 햄, 소세지, 국수 및 치이즈와 같은 고형물 식품을 포도상구균성 장내독소에 대한 분석을 수행하기 위해 균질한 액체 현탁액으로 전환시킨다. 대표적인 추출에서 물 20μl를 식품 20g에 첨가하고, 혼합물을 스토마쳐 랩-혼합기(stomacher lab-blender)(테크마 회사)를 사용하여 30초간 균질화시킨다. 더욱 점성이 있는 식품을 위해, 2배 부피의 물을 사용한다. 포도상구균성 장내독소를 균질화 전 또는 후에 첨가한다. 식품 균등질은 전술한 진단용 시약 호울더 계량봉을 사용하여 직접 시험한다. 양성 결과는 낮은 수준의 장내독소를 첨가한 식품 견본에서 얻었다. 포도상구균성 장내독소 검출의 감수성을 향상시키기 위해 첨가적인 추출 단계를 식품 균등질에서 수행한다. 균등질은 전형적으로 6N의 HCI을 가지고 pH 4.5로 조절하고 20,000×g에서 20분간 원심분리시키고 상등액은 5N의 NaOH를 가지고 pH 7.5로 조절하고 20,000×g에서 20분간 또다시 원심분리하여 상등액을 계량봉분석에서 직접 사용한다. 이러한 방식으로 제조한 식품 추출물에 있어서 시험한 각 식품에서 각 독소에 대한 장내독소 검출 감수성은 추출물 ml당 1㎚였다. 우유와 같은 액체 식품은 액체 식품속에 진단 시약 호울더인 계량봉을 침지시키고 고형물 식품 균등질에서와 같은 방식으로 시험을 진행함으로써 직접 시험한다. 이러한 식품 시험에서, 또한 감수성은 전술한 첨가적인 추출단계를 수행함으로써 ml당 1㎚ 향상될 수 있음이 결정되었다. 개별적인 포도상구균성 장내독소 특이성의 모노클로날 항체가 고정된 니트로셀룰로즈 막이 있는 진단 시약 호울더(게량봉)을 액체 식품, 식품 균등질 또는 전술한 바와 같이 제조한 식품 추출물 1ml 함유 튜우브 또는 PBS 1ml 함유 튜우브 속에 침지시킨다. 각각의 이 용액은 첨가된 포도상구균성 장내독소 또는 장내독소 혼합물 1ng/ml(각각은 1ng/ml 농도이다)을 함유한다. 남아있는 계량봉을 회전식 진동기상에서 진동시키면서 실온에서 1시간의 배양기간 동안 이러한 견본 용액속에 침지시켰다. 이후 계량봉을 견본으로부터 제거하고 0.5% 트윈-20과 함께 PBS 속에서 5분 동안 진동시킨 후 PBS 속에서 5분 동안 두번 더 진동시키면서 세척했다. 전술한 바와같이 제조한 모노클로날항체-알칼리성 인산효소 배합체 혼합물은 다음과 같이 제조했다 : 2A 배합체(A 및 E 독소 특이성), 6B 배합체(B,C1,C2 및 C3 독소 특이성) 및 1D 배합체(D 독소 특이성)의 1 : 1000 희석액은 같은 용액(0.5% 트윈-20 및 3% BSA 함유 30ml내 각 배합체 30μl)에서 제조했다. 계량봉을 이 배합체 혼합물에 침지(봉당 2ml)시키고 진동시키면서 실온에서 30분 배양했다. 이 계량봉을 PBS-트윈속에서 두번 세척한 후 PBS 속에서 진동시키면서 3번 세척한 후(세척물당 5분)막 표면으로부터 비결합 모노클로날 항체-알칼리성 인산효소 배합체를 제거한다.
진단 시약 호울더인 계량봉으로부터 비결합 모노클로날 항체-효소 배합체를 제거한 뒤, 결합 배합체 존재는 계량봉을 5-브로모-4-클로로인돌릴 인산염(BCIP, 시그마 케미칼 회사)과 니트로블루 테트라졸륨(NBT, 시그마 케미칼 회사) 용액에 침지시킴으로써 나타났다. BCIP 와 NBT 용액은 개별적으로 다음과 같이 제조한다 : BCIP 3.2㎎을 0.1M의 트리스-HCl, 0.1M의 NaCl, 5mM의 MgCl210ml에 용해시키고 NBT 8.8㎎을 같은 용액 10ml에 용해시킨다. 이 용액은 사용하기 전에 즉시 함께 혼합한다. 계량봉을 진동시키면서 실온에서 30분간 기질 혼합물에 침지시킨 후, 물로 헹구고 공기로 건조시켜 분석결과의 영구 기록을 제공한다. 전체 분석 과정은 거의 피펫계량(pipetting) 단계없이 최소한의 실제 시간을 요구하고 대략 두시간내에서 수행할 수 있다. 효소 배합체, BCIP, 기질은 막상에서 독소에 결합된 배합체에 의해 가수분해되어, NBT를 계량봉상의 막에 결합한 불용성 청색 생성물로 환원시키는 반응 생성물을 산출한다. 막상에서 고정된 첫번째 모노클로날 항체에 의한 결합 및 두번째 모노클로날 항체-효소 배합체의 결합에 의해 검출된 견본내 포도상구균성 장내독소 존재는 니트로셀룰로즈 막상의 청색 반점 존재에 의해 나타난다. 포도상구균성 장내독소가 견본내에 존재하지 않으면, 니트로셀룰로즈 막은 흰색으로 남아 있다. 대조 생쥐의 면역글로불린이, 고정된 막의 면적은 각각의 경우 흰색으로 남아 있다. 존재하는 특정 포도상구균성 장내독소 : 즉 A, B, C, D 또는 E의 동정은 각각 다른 푸른 반점의 존재와 그 독소에 특이성이 있는 모노클로날 항체가 고정된 막의 확인할 수 있는 지대에 의해 나타난다. 진단 시약 호울더인 계량봉을 적용하는 이 방법은 액체 식품, 식품 균등질 또는 식품 추출물에서 포도상구균성 장내독소 여러 ml 또는 1ml당 1ng을 검출하기 쉽다.
실시예 25
대장균류 세균에 대한 효소 면역검사(EIA)
실험은 본 발명의 방법(CAP-EIA MPN)과 44.5℃에서 EC 배양액을 사용한 EPA 승인 MPN 확인 과정의 분 대장균류 검출효율을 비교하기 위해 실행했다.
실험은 다음과 같은 변화와 함께 표준 5개의 유리병(vial) MPN 분석을 수행한다. 라우릴 설페이트 트립토우즈(LST ; 디프코 랩, 디트로이트, MI) 배양액 또는 락토우즈 배양액(디프코 랩, 디트로이트, MI) 대신에, 4-메틸움벨리페론 글루쿠로나이드(MUG ; 시그마 케미칼 회사, St. 루이스, Mo) 80㎍/ml 함유 페놀레드 락토우즈 배양액(PRIB ; 디프코 랩, 디트로이트, MI)을 추정 매질로 사용했다. 페놀 레드 염료가 락토우즈 발효에서 나온 산 생성을 검출하기 때문에 PRLB를 선택했다. 락토우즈 발효에서 방출된 기체는 각각의 유리병 내부에 삽입시킨 뒤집어진 듀렘 유리병안에 갇힌다. MUG는 E. 콜리의 존재에 대한 예비 확인을 제공하기 위해 임의로 포함시킨다. 중요한 변 대장균류인 E. 콜리는 MUG를 분해하여 자외선하에 가시성 형광발생 라디칼을 방출할 수 있는 물속에 널리 있는 유일한 생물체이다.(4,10) CAP-EIA MPN 분석 포멧은 3종류의 자료를 제공한다 : 1) 락토우즈 발효로부터 산 및 기체 생산(대장균류 추정 분석) : 2) MUG 분해로 인한 형광 발생(E. 콜리 또는 변 대장균류에 대한 추정 확인) 및 3) CAP-효소 면역분석 확인(모노클로날 항체에 근거를 둔 확인 시험). 이후 MUG와 CAP-EIA 반응 결과는 EC 배양액(디프코 랩, 디트로이트, MI) 속에서 44.5℃의 상승 온도하에 락토우즈 발효에 근거를 둔 표준 방법(1)으로 얻은 결과와 비교한다.
실험은 다음과 같이 수행한다 : MPN 분석에 필요한 바와같은 3개의 연속 10-배 희석액을 얻기 위해, 개천 근처에서 수집한 하기 부피의 물 견본을 PRLB-MUG 10ml 함유유리병에 접종하기 위해 사용하고 유리병 캡이 내부에 있는 폴리스티렌 웰(well)을 장치한다.
A열-5개의 유리병, 1.00ml 접종재료
B열-5개의 유리병, 0.10ml 접종재료
C열-5개의 유리병, 0.01ml 접종재료
이후 모든 유리병을 35℃에서 대략 18-20시간 동안 하룻밤 배양시킨다. 그 다음날 모든 유리병을 산 및 기체 발생 뿐 아니라, 자외선 하에 형광성을 검사했다. 산 또는 기체반응은 개의치 않고 혼탁도(성장)를 나타내는 모든 유리병을 뒤집어서 세포-매질 현탁액이 폴리스티렌 웰 내부 폴리 캡을 채우도록 한다. 뒤집은 유리병은 35℃에서 1시간 동안 방치하여 세균(항원)이 폴리스티렌 캡-웰에 붙도록 한다. 항원 결합 캡-웰을 이후 유리병으로부터 제거하여 항체 기재 확인 시험을 계속한다. 분석의 EIA(효소 면역분석)부분을 실행하기 위해, 웰을 인산염-완충 식염수(PBS ; NaCl, 8.5g ; Na2HPO4, 1.02g ; NaH2PO4·H20, 0.386g ; 증류수 1000ml ; pH 7.2)내 3% 소의 혈청 알부민(BSA ; 시그마 케미칼 회사, St. 루이스, Mo) 용액으로 35℃에서 30분간 처리하여 폴리스티렌상의 어떠한 비결합 부위도 차단한다.
BSA 용액을 가만히 따르고, 웰을 PBS로 두번 세척한 후, E. 콜리 세포로 향하는 모노클로날 항체 함유 하이브리도마(hybridoma) 세포 상등액 50μl를 각 세포에 첨가하고 35℃에서 1시간 동안 배양하여 폴리스티렌에 결합한 특정 항원(E. 콜리 세포)과 항체가 상호작용하도록 한다. 항체 상등액을 가만히 따른 후, PBS-트윈 20 용액(PBS +0.05% 트윈 20, J.T. 베이커 케미칼 회사, 필즈버그, NJ)을 사용하여 웰을 3번 세척함으로써 어떠한 비결합 항체 흔적량도 제거한다. 친화성으로 정제시킨 알칼리성 인산효소가 포지된 생주 IgG에 대한 염소 항체(배합체 ; KPL, 게이더즈버그, MD)를 PBS 속에서 1 : 1000으로 희석하고 50μl 분취량을 각 웰에 첨가한다. 35℃에서 1시간 배양한 후, PBS-트윈 20 용액으로 세척함으로써 웰내의 어떠한 비결합 배합체도 제거한다. 검출에 사용한 알칼리성 인산 효소 기질은 10%의 디에탄올-아민 완충액(디에탄올 아민, 97ml ; NaH3; MgCl26H20, 100㎎ ; 및 증류수, 800ml, pH 9.8)내에서 최종 농도 1㎎/ml으로 제조한 나트륨 파라-니트로페닐 인산염 또는 시그마-104 기질(시그마 케미칼 회사, St. 루이스, Mo)이다. 기질은 웰당 100μl 분취량으로 첨가하고 뒤이어 35℃에서 30분간 배양하여 웰내의 반응을 시각적으로 관찰한다. 이 실시예에서 정량을 목적으로, 반응시킨 기질 용액을 미소 적정량 판으로 옮겨 405㎚필터가 장치된 타이터텍 멀티스칸(Titertek Multiscan)(플루오 레이버러 토리즈, 믹렌즈, VA)을 가지고 기계로 측정한다.
EC 배양액(디프코 랩, 디트로이트, MI)을 사용하여 변 대장균류에 대한 통상적인 확인 시험을 수행하기 위해, 하룻밤 지난 각각의 PRLB에서 나온 성장물을 루프 가득(loopful) 무균적으로 EC 배양액 10ml 함유관에 옮기고 뒤집은 듀렘 유리병을 장치했다. 관을 이후 표준 방법(1)에 명시된 바와같이 44.5℃에서 24-28시간 동안 배양시킨 후 락토우즈 발효의 증거(듀렘 유리관 내부의 가스 포집)를 검사했다. 유리병 내의 어떠한 가스 거품 흔적도 양성 반응으로 생각된다.
각각의 실험에 대한 요약된 자료는 하기 표 XII와 XIII에 나타낸다.
실험 1의 결과는 락토우즈에서의 가스 생산을 기초로 하여 551의 양성 조합을 얻고 이것은 통계적인 MPN 표에 따라 ml당 35개의 대장균류가 있음을 나타낸다(추정시험). 가스가 양성(+)을 나타낸 유리병중, 단지 4개(A2-A5)만이 MUG 분석에 의해 양성이므로 대부분을 아마도 E. 콜리를 함유할 것이다. (E. 콜리 또는 변 대장균류에 대한 추정확인). 확인 자료 중에서 통상적인 EC 시험은 5개의 관(A1-A5)이 변 대장균류에 대해 양성일 것이라고 나타나는 반면, CAP-EIA 방법에 의하면, 단지 4개의 유리병(A2-A5)만이 각각 양성 반응성을 나타낸다. 양성 EIA의 값은 0.55에서 1.06까지의 범위이며, 음성 반응은 0.20 정도이다. 양성 EIA 자료는 양성 MUG 자료에 의해 강하게 지지되는데, 여기에서 이들 두개의 시험은 같은 유리병(A2-A5)에서 변 대장균류 존재를 나타낸다. 유리병 A1이 MUG와 EIA에서 음성이지만 EC에 의해 양성인 사실은 통상적인 MPN 방법(15,16,20)과 보통 관련된 부정적(+)와 부정적(-)반응의 발생으로 인해 놀랄만하지 못하다. 상승된 배양온도와 함께 EC 매질의 감수성은 변 대장균류의 회수에 영향을 미친다고 공지되어 있다. 또한 약 7%의 변 대장균류(E. 콜리)는 EC에서 가스를 발생치 못하고(부정적 음성), 변이 아닌 대장균류 8%가 EC 배양액에서 가스를 성장 및 생성시킬 수 있음이 발견되었다(부정적 양성). 그러므로 A1관에서 발견된 EC 반응은 부정적 양성 반응일 수 있으며, 이것은 A1관에 대한 MUG와 EIA 결과와의 모순을 설명할 것이다. 같은 실험에서 그밖의 다른 유리병(B1-B5, C1-C5)에 관해, 훌륭한 상호관계가 모든 시험에서 관찰되었다. 바꾸어 말하면, MUG(-)인 유리병은 또한 EC(-) 및 EIA(-)이므로 이들 유리병에서 변 대장균류의 부재를 확증시킨다.
실험 2에서, 유리병에 접종시키는데 사용한 물 견본은 모든 추정 관이 가스 생성에 대해 양성이기 때문에, 더욱 심하게 오염된 것이었다. 통계적 MPN 표를 근거로 하여, 555의 양성 조합은 ml당 240개 이상의 대장균 존재를 나타내는 것이다. 확인 시험과 비교하여, 휼룡한 상호관계를 MUG, EC 및 EIA 기재 항체 사이에서 얻었다. 형광성을 나타내는 모든 유리병(MUG +)도 또한 EC 뿐 아니라 EIA에 의해 양성이다. EIA 반응은 0.46의 다소 약한 양성값(B2)에서 C4의 경우에 측정한 매우 강한 2.15값까지의 범위를 갖는다.
이들 두개의 실험결과는 본 발명의 CAP-EIA 시험 기재 항체가 변 대장균류 존재를 확인하는 EPA 승인 EC 시험 만큼 효율적이라는 것을 나타낸다. 첨가하여, 실험 1에서 유리병 A1의 경우에 나타낸 바와같이, CAP-EIA 시험은 항체-항원 반응의 특정 성질에 의해 부정적 양성 또는 음성 반응에 덜 민감하다. 더욱더, CAP-EIA 시험은 통상적인 MPN 시험보다 여러가지 뚜렷한 잇점을 제공한다. 즉 1) 간편함-추정 및 확인 모두가 첨가적인 이동 또는 매질이 필요없이 같은 유리병을 사용하여 행할 수 있다 : 2) 속도-CAP-EIA 시험은 통상적인 시험에 경우 필요한 시간의 1/3 내지 1/2으로 완성할 수 있다 ; 및 3) 특이성-항체가 그의 항원 표적에 대해 높은 특이성이 있다.
CAP-EIA의 이러한 잇점과 독특한 캠-웰 디자인은 같은 유리병으로부터 4개의 별도 자료(산, 가스, 형광성 및 EIA)를 제공할 수 있으며, 물 및/또는 식품견본에서 대장균류 및 변 대장균류를 분석하는데 있어서 통상적인 MPN 시험보다 더욱 우수한 대안이다. 유리병 또는 튜브 캡 함유 폴리스티렌 삽입물에서 EIA를 수행하는 개념은 대장균류 또는 변 대장균류를 분석에 한정되지 않고, 똑같이 그밖의 다른 세균에 검출에 적용할 수 있다.
실시예 26
2-[3-(4-메틸-2,2'-비피리딘-4'-일)-프로필]-1,3-디옥솔란의 제조
불활성 아르곤 분위기하에, 무수 테트라히드로푸란(THF) 30ml과 무수 디이소프로필아민(54.6mmol) 7.65ml을 휘저어 섞으면서 주사기에 의해 3-목, 600ml의 플라스크에 첨가했다. 용액은 낮은형 비이커내의 드라이아이스-이소프로판을 혼합물에 플라스크를 침지함으로써 -78℃를 냉각했다. 2.5M의 n-부틸 리튬(54mmol) 21.6ml을 플라스크에 서서히 첨가했다. 결과로써 생성되는 용액을 15분 동안 휘저어 섞고 무수 THF 300ml에 용해시킨 4,4'-디메틸-2,2'-비피리딘(52mmol) 9.58g 용액을 1시간에 걸쳐 휘저어 섞으면서 캐뉼라를 통해 적가했다. 결과로써 생성되는 갈색 혼합물을 -78℃에서 2시간 동안 더욱 휘저어 섞고 2-(2-브로모에틸)-1,3-디옥솔란(55mmol) 10g을 주사기를 통해 첨가하고 결과로써 생성되는 혼합물을 -78℃에서 5분간 휘저어 섞었다. 이후 반응 용기를 빙욕(10℃)속에 집어넣으면 30분 후 색이 변하기 시작한다. (1시간 후 색은 진보라색이고 ; 2시간 후 색은 청색이고 ; 2.5시간 후 색은 녹색이고 ; 3.25시간 후 색은 레몬의 노란색이다)
반응 혼합물을 포화 NaCl 30ml로 냉각시키고 뒤이어 물 10ml 및 에테르 50ml로 냉각시킨다. 수성상은 에테르 300ml로 두번 추출시키고 합한 에테르상은 물 100ml로 역축출시키고 무수 황산 나트륨으로 건조시킨다.
반응 생성물을 정제하기 위해, 견본을 알루미나(멀크) 90[활성 Ⅲ 중성]상에서 분리시킨다. 사용한 용출제는 석유 에테르/디에틸 에테르(2 : 1)에서 뒤이어 석유 에테르/디에틸 에테르(1 : 1)를 사용한다(출발 물질은 석유 에테르/디에틸 에테르(2 : 1)와 함께 완전히 용출하고 뒤이어 생성물이 용출된다.)
양자 NMR 분석은 분리시킨 반응생성물의 구조가 하기와 같음을 확인했다.
실시예 27
4-(부탄-1-알)-4'-메틸-2,2'-비피리딘의 제조 및 정제
2-[3-(4-메틸-2,2'-비피리딘-4'-일)-프로필]-1,3-디옥솔란 2g을 1N의 HCl 50ml에 용해시키고 50℃에서 2시간 동안 가열하였다. 용액을 냉각시키고 중탄산나트륨으로 pH 7 내지 8로 조절시키고 클로로포름 100ml로 두번 추출시킨다.
합한 클로로포름 상을 소량의 물로 세척하고, 황산 나트륨으로 건조시키고, 여과 및 회전증발시켜 노란색 오일을 얻었다.
노란색 오일을 용출제로 에틸 아세테이트/톨루엔(1 : 1)을 사용하여 실리카겔 컬럼상에서 정제하고, 불순물은 메탄올로 용출시킨다.
양자 NMR 분석[δ1.96-2.11(m,2H) ; 2.43(s,3H) ; 2.46-2.50)(t,2H) ; 2.53-2.80(m,2H) ; 7.12-7.14(m,2H) ; 8.17-8.21(br.s,2H) ; 8.52-8.58(m,2H) ; 9.89(s,1H)]은 반응 생성물의 구조를 다음과 같다고 확인했다.
실시예 28
4-(4-메틸-2,2'-비피리딘-4'-일)부티르산의 제조
4-(부탄-1-알)-4'-메틸-2,2'-비피리딘(2.0mmol) 0.5g을 순수한 아세톤 10ml에 용해시켰다. 미세하게 가루로 만든 과망간 칼륨(KMnO4; 1.42mmol)225㎎을 휘저어 섞으면서 용액에 부분씩 첨가했다. 얇은막 크로마토그라피(실리카 : 에틸 아세테이트/톨루엔 50 : 50)에 의해 반응을 수행하는데 이것은 알데히드가 서서히 사라질때 낮은 Rf 값을 갖는 비피리딘이 형성됨을 나타냈다. 반응이 종결된 후에, 물을 첨가하고 MnO2를 여과하고 소량의 Na2CO3(수성)으로 세척했다. 아세톤을 회전증발시키고 잔사를 CH2Cl2로 추출하여 비산성 비피리딘을 제거했다. 수용액은 1.0N의 HCl을 pH 4.8까지 주의해서 첨가하여 산성으로 만들었다. 용액은 이 pH에 도달할 때 부분적으로 뿌옇게 되었고, 현탁액은 더 낮은 pH에서 재용해시켰다. 혼합물을 동부피의 CH2Cl2로 5번 추출하고 Na2SO4로 건조시키고 오일로 회전증발시켜 진공상에서 재빨리 고화시켰다. 조(粗) 고형물은 클로로포름 ; 석유 에테르에서 재결정시켜 흰색 결정을 얻었다.
융점 ; 103.5℃-105.5℃ ; IR ; 1704cm-1양자 NMR 분석은 하기 구조와 일치했다.
실시예 29
비스(2,2'-비피리딘)[4-(부탄-1-알)-4'-메틸-2,2'-비피리딘]루테늄(Ⅱ) 디퍼클로레이트 : 화합물 Ⅰ의 제조
에틸렌 글리콜 50ml내 루테늄 비피리딜 디클로라이드 이수화물(0.48mmol)(스트렘) 250㎎을 끓을때까지 재빨리 가열한 후 실리콘 오일욕(130℃)속에 침지시켰다. 결과로써 생성되는 자주빛을 띤 오렌지색 용액에 에틸렌글리콜(10ml)내 2-[3-(4-메틸-2,2'-비피리딘-4'-일)프로필]-1,3-디옥솔란(0.53mmol) 150㎎을 첨가했다. 결과로써 생성되는 오렌지색 용액을 130℃에서 30분간 휘저어 섞고, 실온으로 냉각하고 증류수를 가지고 1 : 1로 희석했다.
물속에 농축 과염소산 나트륨 용액을 이 용액에 첨가하면, 매우 휼룡안 오렌지색 침전물이 야기된다. 혼합물을 하룻밤 냉동시켜, 여과하고 침전물을 물로 세척했다. 침전물을 뜨거운 물속에 용해시키고 과염소산울 용액에 첨가하여 밝은 오렌지색 결정을 생산한 후 여과하고, 차가운 물로 세척하고 건조함으로써 재결정시킨다. 이 재결정 과정을 반복하여 총 150㎎의 밝은 오렌지색 결정을 얻었다. NMR 분석은 다음과 같은 구조를 나타냈다.
본 명세서내에서, 상기 확인 화합물을 화합물 I 로 칭한다.
실시예 30
비스(2,2'-비피리딘)[4-(4-메틸-2,2'-비피리딘-4'-일)-부티르산]루테늄(II) 디헥사플루오로포스페이트 : 혼합물 II의 제조
4-(4-메틸-2,2'-비피리딘-4'-일)-부티르산(0.52mmol) 134mg을 물 50ml에 용해시켰다. 용액을 아르곤으로 가스제거하고 루테늄 비피리딜 디클로라이드 이수화물(스트렘) (0.48mmol) 250mg을 첨가했다. 혼합물을 아르곤하에서 4시간 동안 환류시켰다. 물은 회전증발시키고 잔사를 최소량의 물에 다시 용해시키고 SP-25-세파덱스 이온-교환 컬럼상에 올려놓았다. 물로 불순물을 용출시킨 후, 화합물은 0.2M의 NaCl용액으로 인해 붉은색 띠로 용출되어 NH4PF6포화 수용액의 첨가에 의해 헥사플루오로포스페이트로 분리되었다. 조생성물은 디에틸 에테르로 뜨거운 아세톤에서 두번 재침전시켰다.
분석 계산치(%) : C ; 43.80, H ; 3.36, N ; 8.76.
실측치(%) : C ; 43.82, H ; 3.54, N ; 8.55.
양자 NMR 분석은 하기 구조와 일치했다.
실시예 31
N-[4-(4-메틸-2,2'-비피리딘-4'-일)-부틸]-프탈이미드의 제조
불활성 아르곤 분위기하에, 무수 테트라히드로 푸란(THF) 30ml과 무수 디이소프로필아민(54.6mmol) 7.65ml을 주사기를 통해 3-목, 600ml 플라스크에 휘저어 섞으면서 첨가했다. 플라스크를 낮은 형태의 비이커내 드라이아이스-이소프로판을 혼합물내에 침지시켜 용액을 -78℃로 냉각했다. 2,5n-부틸 리튬(54mmol) 21.6ml을 플라스크에 서서히 첨가했다. 결과로써 생성되는 용액을 15분 동안 휘저어 섞고 무수 THF 300ml내에 용해시킨 4,4'-디메틸-2,2'-비피리딘(52mmol) 9.58mg의 용액을 캐뉼라를 통해 1시간에 걸쳐 휘저어 섞으면서 적가했다.
결과로써 생성되는 갈색 혼합물을 -78℃에서 2시간 동안 더 휘저어 섞고 1,3-디브로모프로판(0.495mmol) 100g을 재빨리 첨가하고 결과로써 생성되는 혼합물을 -78℃에서 1시간 동안 휘저어 섞었다. 이후 혼합물을 실온에서 2시간 동안 휘저어 섞었다. 혼합물의 색은 갈색에서 청색으로 청색에서 노란색으로 변화했다. 용매의 대부분을 회전 증발시키고 물 200ml을 첨가하여 2-상의 형성을 야기했다. 농축 HC1을 첨가하여 pH를 0으로 낮추었다. 유기층은 버렸다. 수성층은 에테르 100ml로 두번 세척했다. pH는 1 내지 2로 상승했다. 붉은색 오일을 분리시키고 CH2Cl2로 추출시켰다. 용액을 무수 Na2CO3로 건조시킨 후, CH2Cl2의 대부분을 회전 증발시켜 견본을 실리카겔 컬럼상에 옮겼다. 견본은 클로로포름으로 용출시켜 옅은 노란색 오일을 얻고 이것을 하룻밤 냉각시킨 후 결정화시켰다.(12.37g). 이렇게 하여 제조한 조 생성문 4-(4-브로모부틸)-4'-메틸-2,2'-비피리딘(13.3mmol) 4g을 이후 디메틸포름아미드(DMF) 60ml내 프탈이미드칼륨(13.3mmol 2.46g의 현탁액에 첨가했다. 이후 혼합물을 대략 50℃에서 2시간 동안 휘저어 섞었다. CHCl 90ml을 혼합물에 첨가하고 물 125ml을 뒤이어 첨가했다. CHCl3층을 분리하고 수성층은 클로로포름 50ml로 두번 추출했다. 합한 CHCl3층은 H2O 50ml로 세척하고, 무수 Na2SO4를 가지고 건조시키고 회전증발시키면 엷은 노란색 오일이 남는데 이것을 하룻밤 고화시켰다. 조생성물은 아세톤/에탄올부터 재결정하여 휜색 결정(융점, 114.5-117.8℃) 2.21g(44.5%)을 얻었다.
분석 계산치(%) : C ; 73.98, H ; 5.70, N ; 11.31.
실측치(%) : C ; 73.98, H ; 6.14, N ; 11.28.
IR ; 프탈이미드 카르보닐 스트레치(stretch) 1171과 1704cm-1양자 NMR 분석은 통상적인 비피리딜 유도체 시그날에 더하여 방향족 공명 (δ 7.75-7.85, m, 4H)을 나타냈다. 이들 자료는 하기 구조와 일치한다.
실시예 32
테오필린-8-부티르-[4-(4-메틸-2,2'-비피리딘-4'-일)-부틸]아미드 : 화합물 III의 제조
N-4-(4-메틸-2,2'-비피리딘-4'-일)-부틸-프탈이미드 370mg(1mmol)을 10ml의 에탄올속에서 슬러리시키고, 히드라진 수화물(720mg,1.4mmol)로 처리하고, 휘저어 섞고 4시간 동안 환류시켜 그동안 모든 고형물이 용액으로 되었다. 반응이 끝날 무렵 흰색 침전물이 생성되기 시작했다.
냉각후, 반응 혼합물은 50%의 NaOH로 염기성으로 만든후 물 100ml에 부었다. 결과로써 용액이 형성되었고 Na2CO3을 첨가하여 오일로 생성물이 분리되었다. 아민은 CH2Cl240ml 분량을 3번 사용하여 추출했다. 추출물은 CaSO4로 건조시키고, 여과 및 증발시켜 무색 오일로 아미노 비피리딘 유도체를 얻었다.(수율=0.135gm ; 56%)
4-[4-(1-아미노부틸)]4'-메틸-2,2'-비피리딘 1.34g(5.6mmol)과 테오필린-8-부티르산(1.18g ; 4.4mmol)응 실온에서 무수 피리딘 10ml에 용해시켰다. 이 용액에 디시클로헥실카르보디이미드 1.16g(5.6mmol)을 첨가했다. 실온에서 휘저어 섞기를 하룻밤 동안 계속했다. 알루미나 상 얇은막 크로마토그라피(유동상=15%의 메탄올/클로로포름)로부터 0.68의 Rf를 갖는 한가지 생성물 반점이 나타났다. 침전된 디시클로헥실우레아는 여과시켜 제거하고 피리딘올 스트립(strip)시켜 고형물을 얻었다. 이것을 에테르속에 배산(triturate)시키고 여과시켰다.(수율=2.13g ; 99%)
실시예 XV
비스-(2,2'-비피리딘)[테오필린-8-부티르-4-(4-메틸-2,2'-비피리딘-4'-일)부틸 아미드]루테늄(II) 디클로라이드 : Ru(II)-화합물 III 배합체의 제조.
비스-(2,2'-비피리딘) 루테늄(II) 디클로라이드 이무수물 154mg(0.296mmol)과 전술한 화합물 III 175mg(0.357mmol)의 혼합물을 에탄올/H2O(1 : 1, v/v) 40ml에 첨가했다. 이 혼합물을 어둠속에서 15분 동안 아르곤 가스제거시키고 아르곤하에 어둠속에서 3시간 동안 환류시켜, 투명한 체리빛 붉은색 용액을 얻었다. 결과로써 생성되는 투명한, 체리빛 붉은색 용액을 실온까지 냉각시키고 용액을 37℃ 또는 그 이하의 온도하에 어둠속에서 유지시키면서 용매는 회전증발기를 사용하여 스트립시켰다.
결과로써 생성되는 잔사를 대략 1-3ml의 메탄올에 용해시키고, 세파덱스 LH-20 크로마토그라피 컬럼(75cm×3cm)상에 옮기고 약 0.4-0.7ml/분의 흐름속도로 용출시켰다. 갈색의 비-발광 띠(불순물)와 두개의 발광 띠가 밝은 붉은색 띠(생성물)를 밀접히 뒤따른다. 붉은색 생성물띠는 갈색의 비발광띠에서 나온소량의 물질에 의해 오염되었음이 밝혀졌다. 이 오염물질은 비슷한 조건하에 견본을 두번째 세파덱스 LH-20 컬럼상에서 실험하여 생성물로부터 분리시켰다.
붉은색 생성물은 용매를 회전증발에 의해 스트립핑시킴으로써 얻었다. 결과로써 생성되는 고체 물질을 대략 1ml의 메탄올에 용해시키고 대략 75ml의 디에틸 에테르에 재침전시켜 오렌지색 가루를 산출하고 이것을 여과시켜 수집했다.
분석 계산치(%) : C ; 54.51, H ; 5.72, N ; 13.99, O ; 10.47, Cl ; 6.44
실측치(%) : C ; 55.04, H ; 6.35, H ; 13.18, O ; 10.62, Cl ; 6.68
실시예 34
테오필린 특이성 항체를 이용한 Ru(II)-화합물 III 배합체에 의해 발생된 전기화학발광 시그날의 변조(Modulation)
실시예 33에 기술한 Ru(II)-화합물 III 배합체는 0.35M의 불화 나트륨 함유 0.1M 인산염 완충액(PBF 완충액)을 사용하여 최종 농도 150nM으로 희석했다. 테오필린 특이성 모노클로날 항체(클론 9-49번, 복수롯트 WO399번, cat 046번)는 칼레스타드 래이버러 토리지 회사(챠스카, MN)에서 구입했다. 모노클로날 항체는 PBF 완충액을 사용하여 여러 농도(ml 당 단백질을 21.9㎍-700㎍)로 희석했다. 테오필린과 반응성이 없는 또다른 모노클로날 항체(대조표준 MAB)는 시그마(st.루이스, MO)에서 구입하고 PBF 완충액을 사용하여 ml당 단백질 21.9㎍-700㎍의 여러농도로 희석했다. 테오필린 표준 용액은 알드리치 케미칼 회사(밀워키, WI, cat 26-140-8번, 분자량 180.17)에서 나온 테오필린을 사용하여 제조했다. 테오필린을 PBF 완충액에 용해시켜 최종 농도 756μmol을 얻었고 이것을 분석에 사용하기 위해 PBF 완충액을 사용하여 6μmol로 희석했다. 전기화학발광을 측정하기전에, 250mM의 옥살산 및 5%(v/v)트리톤-X100(ECl 용액)함유용액을 반응 혼합물에 첨가했다. 두개의 백금 가제전극을 반응용액 함유 시험관에 배치하도록 개조한 베르톨드 발광측정기를 사용하여 측정했다. 전극을 일정전위기에 연결하고 500mV/초의 주사(走査)속도로 1.5내지 2.5볼트의 전극 넘어 적용된 전위를 스위이프(sweep) 시킴으로써 전기화학발광 측정을 행했다. 측정에 사용한 베르톨드 발광 측정기는 높은 이득이 붉은색 감지성 광전자중 배관을 갖는다. 기록기로의 발광 출력은 105카운트(count)/볼트로 조절했다. 측정치를 X-Y-Y' 기록장치에 기록하고 최고높이를 전기화학발광 측정치로 사용했다. 전극은 0.1M의 인산염, 0.1M의 구연산염, 0.025M의 옥살산 및 1%의 트리톤 X-100함유 완충액(pH 4.21로 헹구고 ; +2.2 내지 -2.2볼트에서 60초간, 뒤이어 +2.2볼트에서 10초간 전극을 이용액에 펄쓰시켜 측정하는 사이에 깨끗하게 했다. 다음에는 전극을 이 용액에서 제거하고 증류수에서 헹구고 건조하게 닦아냈다. 실험은 표 XIV에 나타낸 바와같이 수행했다.
대조표준 모노클로날 항체, 테오필린에 대한 항체 또는 PBF 완충액 용액을 한 세트의 시험관에 첨가했다(1단계), 이 튜우브에 테오필린 또는 PBF 완충액 용액을 첨가했다(2단계). 용액은 시험관을 짧게 흔들므로써 혼합하고 실온에서 25분간 반응시켰다. 이후 Ru(II) 화합물 III 배합체 용액을 튜우브에 첨가했다(3단계). 시험관을 흔들어 잘 섞고 실온에서 15분간 유지시켰다. 최종적으로 ECL 용액 100μl를 각 튜우브에 첨가하고 전기화학발광은 전술한 바와같이 측정했다. 결과는 하기 표 XV에 나타냈다.
[표 XIV]
전기화학발광에 대한 항체-Ru(II)-화합물 III 배합체 상호 작용 효과를 연구하기 위한 실험계획
[표 XV]
항체 및 테오필린이 Ru(II)-화합물 III 배합체의 전기화학발광에 미치는 효과
견본 한쌍의 전기화학발광은 전술한 바와같이 측정하였다. 상기 실험에 사용한 Ru(II)-화합물 III 배합체의 전기화학발광은 항체를 첨가하기 않고 완충액에서 측정했을때 57,200이었다. 오나충 혼합물의 자연 방사선은 5750이었다. 이 자료는 루테늄 화합물이 붙어있는 테오필린 유사체 예컨대 Ru(II)-화합물 III와 접촉했을때 특이하게 테오필린을 인지하는 모노클로날 항체가 전기화학발광을 감소시킨다고 나타낸다. 전기화학발광의 감소는 Ru(II)-화합물 III 배합체 농도가 일정할때 항체 농도에 비례한다. 테오필린과 반응하지 않는 항체를 사용하면, 전기화학발광에서 단지 적은 양의 감소만이 가장 높은 항체 농도에서 나타났다.
또한 자료는 테오필린이 항-테오필린 항체와 접촉한 후 Ru(II)-화합물 III 배합체를 혼합물에 첨가하면, 전기화학발광의 양이 더 증가한다고 나타낸다. 이것은 테오필린이 Ru(II)-화합물 III 배합체에 대한 항체와 결합하는 경쟁이 더 많은 양의 Ru(II)-화합물 III 배합체를 야기하고 이것은 전기화학발광을 생성할 수 있음을 증명한다.
실시예 35
동종 전기화학 면역분석 기제 혈청내 테오필린 검사
실시예 34에 나타낸 결과를 기초로 하여, 테오필린에 대한 도옹 면역분석은 경쟁적 결합 포멧으로 테오필린에 대한 항체와 실시예 33에 나타낸 Ru(II)-화합물 III 배합체를 사용하여 나타냈다. 사용한 물질은 PBF 완충액이 0.1M 불화나트륨 함유 0.1M 인산염 완충액(pH 6.0)인 것을 제외하고 실시예 324에 나타냈다. 이 분석에 있어서, 테오필린에 대한 모노클로날 항체의 특정 농도를 선택한다. 항체 농도는 55㎍/ml 이다. Ru(II)-화합물 III 배합체 농도를 175nm로 조절했다. 테오필린을 인간의 혈청에 첨가하여 테오필린의 최종 농동 2.5, 5, 10, 20 및 40㎍/혈청 ml 얻었다.
분석은 혈청 10μl를 항-테오필린 모노클로날 항체 290μl에 첨가하고 실온에서 25분간 유지시킴으로 해서 수행했다. 이후 Ru(II)-화합물 III 배합체 100μl를 각 튜우브에 첨가하여 최종 농도 35nM을 얻어 이 용액을 실온에서 15분간 유지시켰다. 실시예 34에 나타낸 ECL 용액 100μl를 이후 각 튜우브에 첨가하고 용액의 전기화학발광성을 50mV/초에서 1.5볼트-2.5V에 대한 사위이프방식을 사용하여 앞서 나타낸 바와 같이 측정했다. 자료는 제 2 도에 나타냈고 이 자료는 반응 혼합물이 방출한 전기화학발광의 양과 혈청 견본내 테오필린 농도 사아에 상호관계가 있음을 증명한다. 이러한 관찰은 테오필린에 대한 분석을 계발하는 것이 가능함을 증명한다.
이 결과를 기초로 하여, 당분야에 숙련된 자는 생물학적 매트릭스내의 관심을 갖는 분석물을 탐지 및 정량하는데 동종 전기화학발광 면역분석을 개발할 수 있을 것이다.
실시예 36-동종 전기화학발광 면역분석을 기초로 한 용혈된 혈청, 지방 혈증의 혈청, 황달에 걸린 혈청 및 정상 혈청 견본내의 테오필린에 대한 분석과 형광 극성화 분석과의 비교
여러 유형의 혈청 견본내의 테오필린 농도는 동종 전기화학발광 면역분석을 이용하여 측정했다. 분석에 대한 포멧은 테오필린 특이성 모노클로날 항체 및 실시예 33에 기재한 Ru(II)-화합물 III 배합체를 사용한 경쟁적 결합 분석이었다. 전기화학발광에 있어서 시약과 방법은 앞선 실시예에 나타냈다.
여러 혈청 견본내의 테오필린 농도를 측정하는데 사용한 형광극성화 분석은 아보트 레이버러토리즈(노우쓰 시카고, IL)에서 나온 자동차 TDX 기계를 사용하여 수행했다. 용혈된 혈청, 지방 혈증의 혈청, 황달에 걸린 혈청 및 정상 혈청을 분석에 사용하고 비정상 혈청에 대한 자료를 하기 표 XVI에 나타낸다.
[표 XVI]
잠재적으로 문제가 있는 혈청의 동종 테오필린 분석 특징
여러 양의 테오필린을 혈청 견본에 첨가하여 ml당 2.5㎍ 테오필린 내지 40㎍ 테오필린의 최종 농도를 얻었다.
동종 전기화학발광 면역분석의 결과를 하기 제 3 도에 나타낸다.
또한 각 혈청 견본의 테오필린 농동에 따른 형광 극성화 분석을 분석했다. 동종 전기화학발광 면역분석 및 형광 극성화 분석으로 측정한 테오필린 농도를 비교했다. 자료는 분산도로 도면을 만들어 제4A-D에 나타낸다. 자료의 점들은 선형 회귀법으로 분석하고 계수의 상호관계를 계산했다. 분석은 두개의 분석 사이에 훌륭한 상호관계를 증명했다. 상호관계 계수(r)는 0.98 내지 1.00이었다. 정상, 용혈 및 지방혈증 혈청에 경우 곡선의 기울기는 0.8 내지 1.2이었다. 이것은 이들 혈청 견본에서 훌륭한 테오필린 회수를 증명한다.
테오필린 함유 황달에 걸린 혈청 견본이 이 방출한 전가화학발광이 그밖의 다른 혈청 견본이 방출한 것보다 더 높지만, 이것은 각각의 테오필린 농도에서 비례하게 더 높다. 이것을 제4D도에서 볼 수 있다. 전기화학발광과 형광도 극성화를 비교하는 자료의 점에 있어서 상호관계계수는 1.00이었지만, 그러나 기울기는 2.14이며 이것은 황달에 걸린 혈청 견본내의 테오필린에 있어서 더 높은 회수를 증명한다. 이 결과를 기초로 하여 황달에 걸린 견본내의 테오필린 농도는 알려진 양의 Ru(II)-화합물 배합체를 황달에 걸린 혈청 분취량에 첨가함으로써 견본에 대한 표준곡선을 확립하여 결정할 수 있다. 이들 자료는 동종 전기화학발광 면역분석을 비정상 수준의 헤모글로빈, 지질 및 빌리루빈 함유 혈청 견본내의 테오필린 존재 농도를 측정하는데 사용할 수 있음을 증명한다. 동종 전기화학발광 면역분석은 ECL 검출법의 범위가 넓은 용도, 즉, 생물학적 분자의 더 높은 농도에서 더욱 민감한 검출에 의해 형광 극성화 방법에 의해 많은 잇점을 제공한다. 동종 전기화학발광 면역분석은 어떠한 입사광원도 필요치 않고, 전기적 여기상태만이 효과적인 광-발생에 대한 유일한 필요조건이기 때문에 형광 극성화 방법보다 더욱 유리하다. 결과적으로, 어떠한 졍교한 렌즈도 필요치 않다. 측정원리는 순전히 전기화학적 자극에 의해 유도된 특정 광자방출이기 때문에, 시스템의 감수성은 형광 극성화보다 잠재적으로 훨씬 더 크고, 더 넓은 역학적 범위를 얻을 수 있을 것이다. 또한, 훨씬 더 큰 범위의 분석물 측정이, 생체분자 인지결과 예컨대 항원-항체 상효작용에 의해 전기적으로 자극된 화학발광의 선택적 변조로 인해, 형광극성화 기법이 제공하는 것보다 동종 전기화학발광 면역분석으로 가능하다.
이러한 결과를 기초로 하여, 당분야에 숙련된 자는 비정상 혈청 견본내의 관심을 갖는 그밖의 다른 분석물에 대해 동종 전기화학발광 면역분석을 계발할 수 있다고 이해할 것이다.
실시예 37
동종 전기화학발광 면역분석에 기초를 둔 혈청내 테오필린 분석과 고압력 액체 크로마토그라피(HPLC)방법과 비교.
여러가지 양의 테오필린을 인간의 혈청 견본에 첨가하여 mg당 2.5㎍ 테오필린 내지 ml당 40㎍ 테오필린의 최종 농도를 얻었다. 이후 각 견본을 두 개의 분취량으로 나누고 견본내 테오필린의 농도를 동종 전기화학발광 면역분석으로 측정하고 HPLC 방법을 사용하여 같은 혈청 견본에 대해 얻은 결과를 비교했다. 동종 전기화학발광 면역분석에 있어서 포멧은 테오필린 특이성 모노클로날 항체와 Ru(II)-화합물 III 배합체를 사용한 경쟁적 결합분석이다. 이 분석법에 대한 시약과 방법은 전술한 실시예에 나타냈다. 여러 혈청 견본내 테오필린 농도를 측정하는데 사용한 HPLC 방법은 다음과 같다.
테오필린(1,3-디메틸크산틴)은 아세토니크릴로 형청 단백질을 침전시켜 혈청 단백질에서 분리했다. 테오필린 함유 상등액체는 워터즈 어쏘쎄이츠 마이크로 본다파크 C18 컬럼, (3.9mm×30cm)이 장치된 HPLC시스템에서 실험했다. 크로마토그람을 10분 이하로 완전히 용해시켰다.
다음 시약을 사용했다 : 초산 나트륨(시약용), 탈이온수(밀리포아밀리 Q시스템으로 정제), 아세토니트릴(HPLC용) 및 표준 테오필린(시그마)혈청 단백직을 침전시키는데 사용한 용매는 14%(V/V) 아세토니트릴 함유 20mM 초산 나트륨 완충액(pH 4.0)이었다. HPLC 유동상 완충액은 7%(V/V) 아세토니트릴 함유 10mM 초산나트륨 완충액(pH 4.0)이었다. 흐름 속도는 1.5ml/분이고 용출제는 270nm에 고정시킨 UV 분광광도계로 검사했다. UV 흡광도 검출기의 감수성은 0.02의 전규모 흡광 단위(AUFS)에 고정시켰다. 주위 온도는 전형적으로 22℃ 내지 24℃ 범위를 갖는다. 혈청내 테오필린은 농도를 측정하기 위한 동종 전기화학발광 면역분석과 HPLC 분석의 결과를 제 5 도에 나타낸다. 자료를 분산도로 도면을 만들어 자료의 점들을 선형 회귀법으로 분석했다. 상호관계 계수를 계산했다. 상호관계 계수(r)은 0.98이었고, 이것은 두개의 분석법 사이에 훌륭한 상호 관계를 증명한다.
곡선의 기울기는 1.197이었고, HPLC 기초 표준방법과 비교하여 동종, 전기화학발광 면역분석에 있어서 혈청 견본에서 테오필린의 훌륭한 회수를 증명한다. 동종 전기화학발광 분석은 복잡한 견본을 쉽게 취급할 수 있는 능력, 속도 및 감수성 때문에 HPLC 방법에 비해 더 많은 잇점을 제공한다. 이러한 결과를 기초로 하여, 당분야에 숙련된 자는 HPLC 및 유사한 방법으로 검출할 수 있는 관심을 갖는 분석물을 검출하는데 동종 전기화학발광 면역분석을 개발할 수 있음을 이해할 것이다.
실시예 38
테오필린-소의 혈청 알부민 배합체의 제조
테오필린-소의 혈청 알부민(BSA) 배합체는 다음 과정에 의해 테오필린-3-메틸-부티르산, 테오필린-8-부티르산 및 테오필린-7-초산으로부터 제조했다. BSA 50mg을 0.15M NaHCO3(pH 9.0) 1.5ml에 용해시켰다. 독립적으로 에틸 3,3'-디메틸 아미노 프로필 카르보디이미드 히드로클로라이드(EDCI) 16mg, N-히드록시 숙신이미드(NHS) 11mg과 테오필린-7-초산 17.8mg, 테오필린-8-부티르산 200mg 또는 디메틸설폭시드내에 용해시킨 테오필린-3-메틸-부티르산 20.9mg을 첨가하고 용액을 45℃에서 1-2 시간동안 가열시켰다. 용액을 BSA 용액을 적가하고 1시간동안 반응시켰다. BSA의 테오필린 배합체는 유동상으로 0.15M PBS/0.1% 아지드(pH 7.4)를 사용하여 세파덱스 G-25칼럼(1.6cm×38cm)상에서 30ml/시간의 흐름속도를 겔 여과 크로마토그라피시켜 정제했다.
실시예 39
테오필린-BSA 바이오맥(Biomag) 입자들의 제조
바이오맥-아민입자들(MA, 케임브리지, 어드번스트 마그네틱, Inc.) 4ml를 0.008%는 디뎃 P-40(NP-40)을 포함하는 pH 7.4의 인산염 완충 염수(시그마)(PBS) 20ml로 별개의 T-플라스크에서 2-3번 씻는다. PBS에 용해된 5% 글루타르알데히드(시그마) 10ml를 바이오맥 습윤 케이크에 첨가하고 회전 혼합기를 사용하여 3시간동안 활성화를 진행시킨다. 활성화된 바이오맥 입자들을상기한 바와같이 총 4번 씻고 T-PBS/NP-40 10ml내에 용해된, 실시예 38에 기술된 바와 같이 제조된 테오필린-BSA 6.8mg을 활성화된 바이오맥 습윤 케이크에 첨가한다. 반응을 4℃에서 혼합하면서 밤새 진행시킨다.
활성화된 바이오맥 습윤 케이크를 1% BSA/0.15M PBS/0.1% 아지드(pH 7.4) 20ml로 세번 씻고, 첫번째 세척물을 회전 혼합기를 사용하여 거의 30분간 혼합한다.
실시예 40
화합물 I - 항 테오필린 배합체
생쥐 항-테오필린 모노클론 항체(칼레스태드, 롯트 WO399번 ; 4.6mg/ml) 1.1ml를 10,000g에서 8분간 원심분리한다. 완충물을 아미콘 센트리콘 30 농축기(3000g에서 원심분리됨)를 사용하여 0.2M의 NaHCO3, 0.15M의 NaCl, 및 pH 9.0의 아지드와 교환한다. 항체 용액을 2ml로 희석하고 화합물 I 3.2mg을 첨가한다. 휘저으면서 실온에서 2시간동안 반응을 진행시키고 1mg/ml에서 수성 NaBH479μl를 첨가하고 용액을 30분간 휘젖는다.
형성된 용액을 트리스 완충액으로 미리 평형시킨 세파덱스 G-25(1.0cm×18.0cm)상에 적하하고 15ml/hr의 유동 속도로 용출시킨다. 화합물 I -항-테오필린 배합체를 포함하는 분류물을 한데 모아서 투석 튜우브에 옮기고 pH 6.9의 인산염/0.15M NaF(PBS)(41)에 대해 투석시킨다.
실시예 41
이종성 전기화학발광 분석을 기초로 하여 혈장내 테오필린의 분석
면역측정식 분석 포맷(format)을 사용하는, 테오필린의 이종 분석은 바이오맥 자기 입자들상에 고정된 테오필린 BSA 및 화합물 I로 표지된 항 -테오필린 항체를 사용하여 발전시킨다. 항체 농동는 20ug/ml이다. 자기 입자 농도는 1%의 고형물(wt/vol)이다. 테오필린을 형청 10 및 40㎍/ml의 최종농도에 첨가한다. 테오필린 혈창 표준을 PBF 완충물(pH 7.0의 인산나트륨 완충물, BSA 0.1%를 포함하는 불화나트륨0.1M)에서 1000배 희석시킨다.
희석 혈창 표준물 75μl를 화합물 I 에 배합된 항체 75μl에 첨가하고 이 용액을 실온에서 20분간 항온처리 함으로 분석을 수행한다. 테오필린-BSA-바이오맥 입자들 50μl를 첨가하고 이 현탁액을 5분간 정치시킨다. 입자들을 자기적으로 분리하고 상등액 100μl의 전기화학발광을 실시예 48에 기술된 바와같이 측정한다.
*10추당의 ECL을 계수한다.
++희석에 대해 보정한다.
이 결과를 기초로 하여, 당업자들은 생물학적 매트릭스에 있어 흥미로운 다른 분석물의 이종성 전기화학발광 면역분석을 발전시킬 수 있다.
실시예 42
화합물 II-디곡시게닌 배합체의 제조
화합물 II 100.2mg(0.104mmol), 디곡시게닌(시그마) 41mg(0.105mmol) 및 1,3-디시클로헥실카르보디이미드(DCC) 28mg(0.136mmol)을 젖개가 장치된 50ml들이 둥근 바닥 플래스크에 첨가한다. 형성된 혼합물에 18게이지 침을 갖는 주사기를 사용하여 무수피리딘(알드리히 슈어-시일) 8-10ml를 첨가한다. 플래스크를 테프론 테이프로 마개를 하여 밀폐하고 내용물을 살짝 휘저어서 적색 용액을 형성한다. 플래스크를 암소 후드내에서 휘저으면서 24시간동안 정치시키고 이때 디곡시게닌 6mg(0.015mmol) 및 DCC 20mg(0.097mmol)을 첨가한다. 용약을 캐핑시키고 실온의 암소에서 휘저어 섞는다. 다음날 디시클로헥실 우레아 침전이 관찰되지 않았다.
디곡시게닌 18mg(0.05mmol)과 DCC 103mg(0.50mmol)을 더 첨가한다. 플래스크를 다시 밀폐시키고, 암소에서 계속 휘저어 섞는다. 72시간 후에, DCC 103mg을 더 첨가하고 이 용액을 암소에서 3시간 휘저어 섞는다.
H2O 5-10 방울을 용액에 첨가하고 이를 암소의 회전 증발기에서 건조물로 스트립핑시켜서 적색 고형물을 생성한다.
형성된 적색 고형물을 알루미늄 포일로 씌우고 진공하데시케이터내의 CaSO4상에서 밤새 건조시킨다. 다음에 건조된 고형물을 메탄올 3-5ml에 용해시키고 거의 0.25g의 무수 고형물 LiClO4를 이 혼합물에 첨가한다. 일단 LiClO4를 용해시키고, 이 용액을 세파덱스 LH-20 컬럼(75cm×19mm)상에 적하시키고 7-10초/방울의 유동 속도로 메탄올로 용출시킨다.
크로마토그라피를 진행함에 따라 세개의 띠가 나타난다 : 연한 오렌지색(적색 발광) 첫번째 띠(분류물 1) ; 반응의 주요 부분을 나타내는 암적색 두번째 띠(분류물 2) ; 및 처음 두개의 띠를 뒤따른(비반응 출발 물질로 생각됨) 버려진 세번째 띠.
띠 1 및 2는 컬럼상에서 벗겨져 분리되기 때문에, 띠 2내의 임의의 오렌지색 생성물을 분류물 2의 메탄올 용액(15ml)을 무수 디에틸 에테르 거의 300ml(휘저어 섞음)에 침지시킴으로 분리한다. 형성된 침전물을 15ml 배지 프릿상에 흡입여과하여 수집하고 디에틸 에테르 15ml로 5번 씻는다. 진공 데시케이터내 CaSO4상에서 복합물을 밤새 건조시킴으로 잔류 에테르를 제거한다. 이 고형물질은 하기의 것으로 결정되었다.
실시예 43
화합물 II-디곡시게닌 배합체의 전기화학발광(ECL) ; 항-디곡신 항체에 의한 ECL 시그날의 변조
디곡신에 대한 모노클론 항체를 면역분석 완충물내에 1, 10, 50, 200, 400㎍/ml의 농도로 희석시킨다.
화합물 II-디곡시게닌 배합체(50㎛)를 면역분석 완충물(불화나트륨 0.1M을 포함하는 pH 6.0의 0.1M인산염 완충물)내에 150nM로 희석시킨다.
폴리프로필렌 튜우브(12mm×75mm)내에 면역분석 완충물 200μl에 여러가지 농도의 디곡신 항체 100μl와 화합물 II-디곡신게닌 배합(150nM) 100μl를 첨가한다. 튜우브를 와동기상에서 혼합시키고 실온에서 15분간 항온처리한다. 항온처리한 후, ECL 용액(상기한 것) 100μl를 첨가하고 전기화학발광을 측정한다.
결과 :
화합물 II-디곡시게닌 배합체 30nM에 대한 총 ECL 계수-113666(피이크 높이)
40㎍/튜우브의 농도에서, 시그날의 비특이전 변조는 디곡선의 비특이적 항체 존재하에서 36,000수에 비해 67,000수(카운트 : count)이다.
제6도에서 볼 수 있는 바와 같이, 화합물 II-디곡시게닌 배합체 고정 농도와 반응할 때 항-디곡신 항체의 농도가 증가하면 전기화학발광 시그날의 변조가 증가한다. 이 특성은 혈창 또는 원형질내의 디곡신을 측정하기 위한 동종 전기화학발광을 기본으로 하는 분석을 발달시키는데 사용할 수 있다.
실시예 44
동종 디곡신 분석
실시예 43에 기술된 결과를 기초로 하여, 디곡신의 동종 전기화학발광 면역분석을 경쟁적 결합분석 포맷을 사용하여 디곡신에 대한 항체 및 화합물 II-디곡시게닌 배합체를 사용하여 발전시킨다. 사용한 반응물들은 실시예 43에 기술되어 있다. 이 분석을 위해, 디곡신에 대한 모노클론 항체의 특이적 농도를 선택한다. 이 항체 농도는 75-100㎍/ml이다. 화합물 II-디곡시게닌 배합체 농도는 5-15nM(최종 농도)이다.
디곡신 표준물을 디곡신 0.1, 0.5, 1, 2, 4, 8 및 16ng/혈장 ml의 최종 농도를 얻도록 인간 혈장에 첨가한다.
항-디곡신 모노클론 항체 300ul에 혈장 10-30ul를 첨가하고 이 용액을 실온에서 30분간 유지시킴으로 분석을 수행한다. 최종 온도가 5-15nM 범위이도록 화합물 II-디곡시게닌 배합체 100μl를 각각의 튜우브에 첨가하고 이 용액을 실온에서 20분간 항온처리한다. 상기한 ECL 용액 100μl를 각각의 튜우브에 첨가하고 상기한 바와같이 ECL을 측정한다.
실시예 45
우바인-소 혈장 알부민 배합체의 제조
우바인 6수화물(알드리히) 50mg을 탈이온수 5ml에 용해시킨다. NaIO481mg을 용해된 우바인에 첨가하고 혼합물을 실온에서 2시간 동안 항온처리한다. 이 혼합물을 pH가 5-6이 될 때까지 탈이온수로 평행시킨 Dowex IX-8 이온교환수지 컬럼(5ml)에 통과시킴으로 반응을 정지시킨다. 산화된 우바인 분류물을 폐기용기에 들어가는 방울들이 혼합 표시를 나타낼 때 수집한다.
결정성의 냉동건조인 소 혈청 알부민(시그마)(BSA) 100mg을 아지드 0.05%를 포함하는 pH 7.4의 0.1M 인산칼륨 완충염수 5ml에 용해시킨다. 산화된 우바인 용액을 BSA 용액에 휘저으면서 적가한다. 형성된 용액을 실온에서 1시간동안 반응시킨 후 NaCNBH4(알드리히) 30mg을 첨가한다. 이 용액을 실온에서 밤새 휘저허 섞는다.
이 용액을 폴리에틸렌 글리콜-8000을 사용하여 농출시키고(11ml→4ml) 유리 우바인 및 과량의 붕소수소화물을 세파덱스 G-25(컬럼-0.6cm×37cm ; 용출제=K2PO40.1M/NaCl 0.15M, pH7.5, NaN30.05%)상에서 겔 여과하여 용액으로부터 분리한다. 분류물 11-17을 한데 모으고 280nm에서 흡광도를 측정하여 단백질 농도를(희석후에) 결정한다.
실시예 46
우바인-BSA-세파로스의 제조
시아노겔 브로마이드로 활성화된 세파로스 4B(팔마시아) 2g을 소결 디스크 깔대기 상에서 500ml씩 1mM HCl 400ml로 세척한다. 다음에 수지를 pH 9.0의 NaHCO40.1M, NaCl 0.5M 완충물(커플링 완충물 20ml로 씻는다. 수지를 폴리프로필렌 용기에 옮긴후, 커플링 완충물 15ml에 용해된)우바인-BSA 30mg을 첨가한다. 활성화된 수지를 회전 혼합하면서 2시간동안 우바인-BSA와 반응시킨다.
남은 활성 자리들을 실언에서 2시간동안 0.5M 에탄올아민(pH 8.0) 7ml와 반응시킨다. 소결된 디스크 깔대기를 사용하여, 커플링 완충물, 0.15M PBS, 1mM HCl, 커플링 완충물, PBS 내외 0.2% NP-40, 및 PBS 각각 10ml로 수지를 세척한다. 수지를 11ml로 재현탁시키고 충분한 양의 이 현탁액을 총 베드 부피 3.5ml를 얻도록 내부 직경 1.0cm 컬럼(팔미시아)에 첨가한다.
실시예 47
항-디곡신-화합물 배합체의 제조 및 친화성 정제
생쥐 항-디곡신 모노클론 항체(케임브리지 의학 진단, cat. no.200M-014, 롯트 MA 2507F번)의 1mg/ml 모액 450μl를 아미콘센트리콘 30 농축 유니트를 사용하여 100ul로 농축시킨다. 이 농축물에 pH 9.6의 0.2M 중탄산나트륨 완충물 900ul와 화합물 I 0.6mg을 첨가한다. 1.0M의 NaBH4(ag)(시그마) 30ul를 첨가하기전에 2시간 동안 실온에서 반응(아미드화)을 진행시킨다. 형성된 용액을 1시간 동안 정치시킨다.
과량의 화합물 I 및 다른 생산물을 세파덱스 G-25 크로마토그라피(컬럼=1.0cm ID×18cm ; 용출제-0.1M 인산염 완충 염수)에 의해 항체 배합체로부터 분리한다. 이 샘플을 20ml/hr의 유동속도로 1ml씩 분류하고 280nm에서의 흡광도를 2.0AUFS 및 0.5AUFS에서 감시한다.
분류물 5, 6, 7 및 8을 한데 모아서 예비세척된 우바인-BSA-세파로스 친화성 컬럼(직경 1cm의 컬럼 3.5ml)에 적하하고 15ml/hr의 유동속도에서 용출시킨다. 보유되지 않는 물질이 용출된 후, 용출물 20ml가 수집될 때까지 유동 속도를 30ml/hr로 높인다. 이동상의 염수 농도는 M로 증가시키고 컬럼을 용해 20를 더 용출시킨다.
우바인 특이적 항-디곡신-화합물 I 배합체를 KSCN 4M과 6M을 첨가함으로 제거한다. 항-디곡신-화합물 I 배합체에 상응하는 분류물들을 한데 모으고 10mM 인산염 완충 염수(41 ; pH 7.4)와 다음에 0.1N 인산염 완충물(41 ; pH 7.0)에 대해 투석시킨다.
실시예 48
디곡신에 대한 이종 전기화학발광 면역분석
고체 디곡신 10mg을 DMSO : H2O(8 : 2) 10ml에 용해시켜서 1mg/ml 디곡신 농도(이후의 모액 표준물)를 얻는다.
작업 표준물은 80ng/ml, 40ng/ml, 20ng/ml, 10ng/ml 5ng/ml 및 0ng/ml의 농도로 0.15M MaF와 0..1% BSA를 포함하는 pH 7.0의 0.15M 인산염 완충물(이후에는 ECL 완충물)내에서 모액 표준물로부터 제조한다.
각각의 표준물 75ul와 항-디곡신-화합물 I 배합체(1 : 90로 희석됨) 75㎕를 클래스 튜우브내로 피펫으로 옮기고 와동기상에서 혼합하고 실온에서 20분간 항온처리한다.
예비세척된 우바인-BSA-바이오맥 입자들 50㎕를 각각의 튜우브에 첨가하고 와동기상에서 혼합하고 실온에서 5분간 항온처리한다.
바이오맥 입자들을 분리하고 상등액을 별개의 투유브에 옮긴다.
상등액 100μl를 튜우브내의 0.125M 인산칼륨, 0.125M 구연산 ; 32mM 옥살산 ; 1.25% 트리톤 X-100 40μl와 혼합한다.
이 샘플을 버톨드 장비에 넣고 전기화학발광을 개방회로에서 2.2V까지 적용전위를 단계화하고 10초간의 광자수를 통합하는 것을 제외하고는 상기한 바와같이 측정한다.
다음과 같이 포스페이트-시트레이트 완충물을 사용하여 전극을 측정중간에 세정한다.
(a) 전극에 -2.2V와 +2.2V 사이를 3초 간격으로 교차하는 펄스를 1분간 보낸다.
(b) 전극에 +2.2V에 10초간 놔둔다.
(c) 전극을 탈이온수로 헹구고 블롯 건조시킨다.
결과는 제 7도에 나타냈다.
실시예 49
DNA를 전기화학발광 성분으로 표지화함.
다음의 두 방법을 사용하여 DNA를 전기화학발광 성분으로 표지화한다.
합성 A
1.0A 260의 관례적으로 합성된 38mer(MBI 38)
TCACCAATAAACCGCAAACACCATCCCGTCCTCCCAGT*
(여기서 T*은 탄소 5에서 -CH-CH-CO-NH-(CH2)7-NH2로 변형된 티미딘이다)을 8.7의 0.01M 인산염 완충물 100㎕, 비스(2,2'-비피리딘)[4-(부탄-1-알)-4'-메틸-2,2'-비피리딘]루테늄(II)디퍼클로레이트(화합물 I)(pH 8.87의 0.01M 인산칼륨 완충물 300μl내의 2.3mg)100ul에 용해시킨다. 내용물을 휘저어 섞고 실온에서 밤새 정치시킨다.
수소화붕소 나트륨의 포화 수용액 100ul를 혼합물에 첨가하여 가역적 이민 시프 염기 결합을 비가역적 아민 결합으로 전환시킨다. 반응을 실온에서 2시간동안 작동시킨다. 다음에 용액을 묽은 아세트산 수 방울로 조심스럽게 처리하여 수소화 붕소나트륨 과량을 소멸시킨다. 반응용액을 pH 6.77의 0.1M 트리에틸암모늄아세테이트로 미리 평형시킨 p-2 겔 여과컬럼(18in×1/2in)상에 적하한다. 컬럼을 동일한 완충물로 용출시키고 2ml 분류물을 유동속도 20ml/hr에서 수집한다. 분류물 9와 10에 용출된 DNA는 미반응된 류테늄 비피리딜 복합체로부터 잘 분리된다. 수집된 DNA 샘플은 전형적인 UV 흡수를 나타냈고, 부가적으로 450nm에서 여기될때 620nm에서 형광방출 스펙트럼을 보였다. 형광방출은 DNA 샘플내의 루테늄 비피리딜 성분의 존재를 나타낸다. 생성물은 폴리아크릴아미드 겔 전기영동상으 단일한 오랜지색 형광띠로 이동한다. 표지된 DNA(MBI 38-화합물 I 배합체)의 전기영동 이동성은 표지되지 않은 DNA와 거의 동일하다.
합성 B
루테늄 복합체를 무수 디메틸포름아미드 60μl에 3mg 용해시키고 이를 다시클로헥실카르보디이미드(DCC) 94mg 존재하에서 무수 DMF 200μl에 용해된 N-히드록시숙신아미드(52mg)의 용액으로 처리함으로 N-히드록시숙신이미드 유도체로 먼전 전환시킨다. 반응을 0℃에서 4시간동안 진행시킨다. 침전된 디시클로헥실우레아를 원심분리하여 제거하고 상등액(200μl)을 pH 8.77의 .01M 인산염 완충물(완충물 100μl내의 2A260)내에 용해된 아미노-결합 DNA(합성 A에 기술됨)의 용액에 첨가한다.
반응을 실온에서 밤새 진행시킨다. 상당한 양의 고체가 이 반응에서 나타났고 이는 글래스 울을 통해 여과하여 제거한다. 여과물을 농축하고 1M 트리에틸암모늄 아세테이트(pH 6.8) 0.5ml에 용해시킨다. 반응 혼합물을 합성 A에 기술된 바와같이 크로마토그라피한다. 표지된 DNA는 합성 A에서 제조된 물질에 대해 논의된 바와같은 모든 스펙트럼 및 전기영동적 특성을 나타낸다.
실시예 50
표지된 DNA의 전기에 의해 생성된 화학발광성
실시예 49 합성 A로부터의 표지된 DNA 샘플(MBI 38-화합물 I)을 사용하여 그 전기화학발광 성질을 연구한다. 여러가지 온도의 표지된 DNA를 0.1M 구연산염 25mM 옥살레이트 및 1.0% 트리톤 X-100을 포함하는 pH 4.2의 0.1M 인산염 완충물 0.5ml에 용해시키고 변형 버롤드 발광 측정기상에서 측정한다. 제 8 도는 여러가지 DNA 농도에 대한 전기화학발광 시그날의 반응을 보여준다.
실시예 51
화합물 I- 표지 올리고뉴클레오티드의 잡종형성연구
실시예 50에 기술된 38mer의 상보적 가닥은 ABI 모델 380 B DNA 합성기를 사용하여 합성하고 MGEN-38로 표시한다.
올리고뉴클레오티드에 대한 화합물 I 의 공유 결합이 MBI 38 올리고뉴클레오티드의 잡종형성에 영향을 미치는지를 설명하기 위해서 다음의 실험을 고안하였다. 여러가지 농도의 목적 단편(MGEN-38)을 겔만 RP 나일론막의 판상에 스폿팅하고, 고정하고 MBI 38 또는 MBI 39-화합물 I으로 탐침한다.두 단편들을 T4 폴리뉴클레오티드키나제 및 감마 32p[ATP]로 처리하고, 5' 말단에 32p로 표지한다. 다음에 DNA 및 화합물 I-표지 DNA 의 잡종형성 감수성을 비교한다.
50ng-0.05ng 범위의 농도의 MGEN-38DNA들을 나일론 막상에 스폿팅하고 공기 건조시킨다. 복제막들을 건다. 블록들을 DNA를 완전히 변형시키기 위해서 1.5M NaCl-0.5M NaOH ; 블롯을 중화시키기 위해서 1.5M NaCl-0.5M TRIS ; 및 마지막으로 2X SSC로 각각 2분간 처리한다. 블롯을 80℃의 진공오븐내에서 2시간동안 소부 처리한다.
잡종형성 탐침물을 다음과 같이 제조한다 :
MBI 28 및 MBI 38-화합물 I 3㎍을 T4 키나제 10단위와 감마32P-ATP를 사용하여 절단한다. DNA내로의 동위원소 함입 백분율을 결정하고 아래에 나타냈다.
예비잡종 형성 및 잡종형성 용액들을 만니아티스(24)에 따라 제조한다. 블롯을 50㎍/송아지 흉선 DNAml로 53℃에서 4시간동안 예비잡종 형성시킨다. 블롯들을 10,000,000cpm에서 각각의 탐침물을 함유하는 잡종형성 용액에 놓고 53℃에서 밤새(12hrs) 잡종형성시킨다. 다음날, 블롯들을 다음고 같이 씻는다 :
-2×SSC+0.1% SDS로 53℃에서 각각 15분간 두번 씻는다.
-0.2×SSC+0.1% SDS(상기와 동일하게) 두 번.
-0.16×SSC+0.1% SDS(상기와 동일하게) 두번, 블롯들을 공기 건조시키고 -70℃에서 코닥 X-omat 필름에 노출시킨다.
X-선 분석(제9도 참조)을 행하면 매우 유사한 잡종형성 패턴이 MBI 38 및 MBI 38-화합물 I 탐침물 사이에서 관찰된다. 두 경우에 있어서, 목적물 0.5ng에 대한 탐침물의 잡종형성이 관찰되었고 잡종형성의 회미한 흔적이 목적 DNA 0.05ng으로 관찰되었다. 탐침물에 의한 잡종형성은 음성 대조용 DNA (50ng으로 스폿팅된 파아지 람다 DNA)에 대해 검출되지 않았다.
실시예 52
화합물 I-표지 DNA 탐침 잡종형성 연구
만니아티스(24)에 기술된 방법에 따라 여러 E. 콜리 및 비 E. 콜리 균주들로부터 게놈 DNA를 분리한다.
사용된 유기체는 다음과 같다 :
E. 콜리 균주 EC8-중성 분리물
E. 콜리 균주 PC1A-장내병원생성 균주
E. 콜리 균주 10H07-장내독성생성 균주
E. 콜리 균주 EC50-중성 분리물
E. 콜리 균주 B-lab 균주
E. 콜리 균주 K12-lab 균주
엔터로박터 에어로겐스
시트로박터 후러운디
살모넬라 파라티피 B
살모넬라 포츠담
상기한 균주들로부터의 DNA를 S&S 니트로셀룰로오스 막과 겔만 RP 나일론 막상에 3㎍ 분취액으로 이중 스폿팅한다. 음성 재조용에 대해서는, 파아지 람다 DNA 50ng을 스폿팅한다. 양성 대조용은 50ng-0.5ng 범위의 여러가지 농도의 상보적 가닥, MGEN-38로 구성된다. 블롯들을 실시예 51에 기술된 바와 같이 제조하고 처리한다.
탐침 DNA는 방사능 활성을 함입시키기 위해서 감마32P-ATP 125μcu으로 T4 절단된 MBI-38-화합물 I 단편들 3.0㎍으로 구성된다. 하기의 양의 활성이 함입되었다.
이 분석을 위해, 각각의 필터를 탐침하기 위해 2,600,000cpm의 활성이 사용된다. 잡종형성 용액, 조건, 세척 용액 및 계획은 실시예 51에 기술된 것들과 같다.
블롯의 X-선 필름(제10도)은 두 양성 및 음성 대조용이 적절하게 반응하는 것을 보여준다. 람다 DNA는 잡종형성 활성이 검출되지 않았고 상보적 서열, MGEN-38은 0.5ng 농도로 강한 잡종형성이 관찰되었다. 이 발견은 감수성 연구의 결과에 전부 일치한다.
실시에 53
2,2'-비피리디늄-헥사클로로오스메이트(VI)의 제조
1.01g의 암모늄 헥사클로로오스메이트(VI), (NH4)2OsCl6(알파)(1.00당량)를 70℃에서 3N HCl(aq) 50ml에 용해시킨다. 고온의 휘저어 섞은 용액에 3N HCl(aq)에 용해된 2,2'-비피리딘의 용액을 적가한다. 562.2g/몰의 분자량을 갖는 하기 식의 적색 염(이후에는 (bpy H2 2+)OsCl6 2-)이 이 용액으로부터 침전한다.
용액을 2시간동안 빙욕내의 0℃에서 냉각시킴으로 침전을 완료한다. 유리 프릿 필터상에서 흡입 여과하여 생성물을 수집한다. 침전물을 물과 얼음같이 차거운 3N HCl(aq) 5-10ml로 계속적으로 씻는다. 무수 디에틸에테르 20ml로 최종적으로 씻은 후, 생성물을 48시간동안 진공하 70℃에서 건조시킨다. 수율=1.01g의 오렌지색 분말(NH4)2OsCl6를 기준으로 78%)이 생성물을 더욱 정제하지 않고 사용한다.
실시예 54
2,2'-비피리딘 테트라클로로오스메이트(VI)의 제조
실시에 53에서 제조된 (bpy H2 2+)(OsCl6 2-) 염 0.9g(1.60mmol)을 무게를 달아 파이렉스 시험관에 넣는다. 이 시험관을 아르곤 유입구 및 배출구와 온도계{최대 400℃까지 읽음)가 장치된 파이렉스 로(furnace) 튜우브에 넣는다.
전 화합물을 로 튜우브에 넣고 아르곤을 넘치게 넣는다. 로를 활성화하여 온도가 270-300℃가 되게 한다. 느린 아르곤류를 반응시 튜우브를 통과시킨다. 아르곤 베출구를 증기 후드로 굽게하여 생산된 HCl을 반응시 실험실로부터 밖으로 옮긴다. 거의 270℃의 온도에서 반응물의 열분해가 시작된다. HCl 기체가 고형물로부터 방출되는 것이 관찰되었다. 30분후에 HCl이 거세게 방출되는 것이 관찰되었고 서서히 잠잠해지기 시작했다. 6시간후에, 오븐을 끄고 샘플을 실온으로 냉각시킨다. 생성물, (bpy) OsCl4, 세분된 적갈색 고형물로 휘저어 섞은 3N HCl(aq) 용액에 12시간동안 현탁시키고 다음에 휘저어 섞은 무수 디에틸에티르에 6시간동안 현탁시킴으로 정제한다. 유리 프릿 필터상에서 흡입여과함으로 생성물을 분리하면 하기 식의 2,2'-비피리딘 테트라클로로오스메이트(VI)(bpy)OsCl4(MW=489.3g/몰)를 수율 0.75g(95%)로 얻는다.
이 생성물을 더 정제하지 않고 사용한다.
실시예 55
시스-(2,2'-비피리딘}[시스-비스(1,2-디페닐포스피노)에틸렌]-디클로로오스뮴(II)의 제조
젖개와 환류 응축기가 장치된 50ml들이 둥근 바닥 플래스크에 실시예 54에서 제조된 (bpy)OsCl4, 230mg(0.47mmol)과 시스-비스(1,2-디페닐포스피노(에틸렌(DPP 엔) 465mg(1.17mmol)을 첨가한다. 디글림 25ml를 첨가하고 내용물을 아르곤 대기하에서 5시간동안 환류시킨다. 어두운 암녹색 용액을 아르곤 분위기하에서 실온으로 냉각시키고 200ml들이 비이커에 옮긴다. 무수 디에틸에테르 80ml를 첨가하면 암녹색 침전물이 형성된다. 이 침전물을 유리 프릿 필터(다공성 매체)상에서 흡입 여과하여 수집하고 무수 디에틸에테르 20ml 5부분으로 세척한다. 다음에 침전물을 CH2Cl215ml에 용해시켜서 산림 녹색 용액을 얻는다. 이 용액을 유리 프릿 필터(다공성 매체)를 통해 거의 300ml의 휘저어 섞은 무수 디에틸에테르에 중력 적하시킨다. 회색-녹색의 시스-(2,2'-비피리딘)[시스-비스(1,2-디페닐포스피노)에틸렌-디클로로오스뮴 II 착화물(이후에는 시스-(bpy)(DPP 엔) OsCl2)로 언급)이 침전된다. 착화물을 유리 프릿 필터(다공성 매체)상에서 흡입 여과하여 수집한다. 생성물을 차거운 1 : 2 v/v 에탄올/물 20ml로 빠르게 씻고 다음에 디에틸에테르 30ml 7부분으로 씻는다. 암청회색 분말을 진공 데시케이터내 CaSO4상에서 밤새 건조시킨다.
수율 : 240mg((bpy)OsCl4; MW=814.4g/몰을 기준으로 63%)이 생성물을 더 정제하지 않고 사용한다.
실시예 56
(2,2'-비피리딘)[시스-비스(1,2-디페닐포스피노)에틸렌{2-[3-(4-메틸-2,2'-비피리딘-4'-일)프로필]-1,3-디옥소란}오스뮴(II) 디클로라이드의 제조
젓개와 환류 응축기가 장치된 100ml들이 둥근 바닥 플라스크에 실시예 55에서 제조된 시스-(bpy)(DPP엔) OsCl2129mg(0.158mmol)과 2-[3-(4-메틸-2,2-비피리딘-4-일)프로필]-1,3-디옥소란, 즉, 비피옥살 0.3g(1.0mmol)을 첨가한다. 여기에 에틸렌글리콜 15ml를 첨가한다. 이 현탁액을 아르곤 분위기하에서 3시간동안 환류시킨다. 실온으로 냉각시킨 후, 물 10ml를 플래스크 함유물에 첨가한다.
물에 용해된 SP-세파덱스 C-25이온 교환 수지의 컬럼(높이 30cm×i.d.19mm)을 제조한다. 반응 플래스크의 내용물을 컬럼상에 적하시킨다. 컬럼을 H2O(거의 500ml)로 용출시켜서 에틸렌글리콜과 과량의 비피옥살 리간드를 제거하고 0.25NaCl(aq)용액으로 용출시켜 작은 연한 황색 띠(장파장 UV 광에서 오렌지색 형광)를 분리하고 이어서 비-발광성 올리브 녹색 띠가 뒤따른다. 이 띠들은 반응의 부 생성물들을 나타낸다. 이들을 동정하기 위해서 어떠한 시도도 하지 않고 이들을 버린다. 일단 이 띠들을 컬럼으로부터 제거하고 0.5M NaCl(aq)로 용출을 시작한다. 3개의 띠들을 용출시킨다. 오렌지색 발광을 하는 첫번째 오렌지색 띠는 소요의 생성물 성분, (2,2'-비피리딘)[시스-비스](1,2-디페닐 포스피노)에틸렌]2-[3-(4-메틸-2, 2'-비피리딘-4'-일)프로필]-1,3-디옥소란 오스뮴(Ⅱ)(이후 (bpy)(DPP 엔)(bpy oxal)Os(Ⅱ)2+으로 언급)의 염화물 염으로 동정되었다. 흔적 황색 띠(녹색 발광) 및 갈색 띠(비발광)을 깨끗하게 분리한다.
(bpy)(DPP 엔)(비피옥살)Os(Ⅱ)2+를 포함하는 분류물에 용해된 용액의 부피(거의 400ml)를, 회전 증발기상에서 증발시켜 거의 50ml로 감소시킨다. 수성 NaCl 농축물을 CH2Cl250ml로 세번 추출한다. CH2Cl2추출물들을 합치고 무수 Na2SO4상에서 건조시키고 홈이 있는 여과기를 통해 중력 여과시킨다. 적색 CH2Cl2용액을 회전 증발기상에서 증발시켜서 부피 10ml로 농축시킨다. 그 CH2Cl2용액을 잘 섞인 석유 에테르 200ml에 서서히 담금으로 착화물을 오렌지색 고형물로 분리한다. 침전된 착화물을 유리 프릿 필터(다공성매체)상에서 흡입 여과함으로 수집한다. 생성물을 디에틸에테르 15ml로 3번 씻는다. 이 생성물을 진공 데시케이터내 CaSO4상에서 밤새 건조시킨다.
수율 : (bpy)(DPP 엔)(비피옥살)Os(Ⅱ)2+(Cl-)2·2H2O 110mg(시스-(bpy)(DPP 엔)OsCl2를 기초로 63%)
이 생성물을 이 수화물이고 분석학적으로 순수하다 : C57H54N4O4P2Cl2Os·2H2O(MW=1109.59g/몰)
이론치(%) : C ; 55.20, H ; 4.87, N ; 5.05, O ; 5.77, Cl ; 6.39
실측치(%) : C ; 56.03, H ; 5.18, N ; 4.88, O ; 6.87, Cl ; 7.07
실시예 57
시스-디클로로-비스-[(4,4'-카르보메톡시-2,2'-비피리딘]루테늄(Ⅱ)의 제조
젓개와 환류 응축기가 장치된 250ml들이 둥근 바닥 플라스크에 시스-테트라-(디메틸설폭사이드)디클로로루테늄(Ⅱ)(Ru(DMSO)4Cl2) 750mg(1.55mmol)과 에틸렌글리콜 100ml를 첨가한다. 플라스크의 내용물을 아르곤 분위기하에서 살며시 끊이고 (4,4'-카르보메톡시)-2,2'-비피리딘 756mg(3.09mmol)을 첨가한다. 아르곤하에서 5분간 계속 가열시킨다. 오렌지색 용액은 갈색/흑색이 되고 염화리튬 0.75g과 에틸렌글리콜 50ml를 첨가한다. 용액을 또 10분간 가열한다. 실온으로 냉각시킨 후, 거의 100ml의 물을 혼합물에 첨가한다. 혼합물을 CH2Cl2200ml로 5번 추출한다.
CH2Cl2추출물을 물 200ml로 6번 세척한다. 수층들을 각각 세척한 후 형광(적색)에 대해 시험하고 세척은, 필요에 따라 형광을 수성층에서 검출할 수 없을 때까지 계속한다. CH2Cl2추출물들을 무수 Na2SO4상에서 건조시킨다. 이 생성물의 CH2Cl2용액을 무수 디에틸에테르 섞여진 10-배 부피 초과물내로 증발시킴으로 생성물을 분리한다. 침전된 생성물을 흡입 여과하여 수집하고 디에틸에테르 30ml로 한번 씻고 진공 데시케이터내 CaSO4상에서 밤새 건조시킨다. 수율=어두운 금속성 녹색 결정 25%.
이 생성물은 분석학적으로 순수하다.
이론치(%) : C ; 44.57, H ; 4.01, N ; 7.43, Cl ; 9.40, O ; 21.21
실측치(%) : C ; 44.16, H ; 3.72, N ; 7.11, Cl ; 9.53 O ; 20.15
MW =754.5g/몰
실시예 58
비스[4,4'-카르보메톡시-2,2'-비피리딘]2-[3-(4-메틸-2,2'-비피리딘-4-일)프로필]-1,3-디옥소란 루테늄(Ⅱ) 디퍼클로레이트의 제조
메탄올/물(1: 1) 50ml에 용해된 비스(4,4'-카르보메톡시-2,2'-비피리딘)루테늄(Ⅱ) 디클로라이드 250mg(0.33mmol)에 2-[3-(4-메틸-2,2'-비피리딘-4'-일)프로필]-1,3-드옥소란(비피옥살) 105mg(0.37mmol)을 첨가하고 혼합물을 아르곤 분위기하에서 12시간동안 환류시킨다. 이 용액을 냉각시키고 70% HClO40.5ml를 첨가한다. 메탄올을 서서히 증발시킨다. 적색 결정들을 침전시키고 프릿 깔대기상에서 수집하고 소량의 냉수로 씻고 이어서 에탄올 씻고 진공 건조시킨다. 유사한 방법을 사용하여 비스(4,4'-디카르보메톡시-2,2'-비피리딘)루테늄(Ⅱ) 디클로라이드와 4-((4-메틸-2,2'-비피리딘-4'-일)-부티르산 또는 4-4'-메틸-2,2'-비피리딘으로 부터 착화물을 제조한다.
실시예 59
인간 IgG의 화합물 I 표지화
인간 IgG(2.5mg/ml) 2ml를 살며시 휘저으면서 4℃에서 밤새 pH 9.6의 0.2M 중탄산나트륨 완충액 2l에 대해 투석시킨다. 화합물 I을 단백질에 대해 100를 초과로 존재하도록(2.7mg/100μl 디메틸포름아미드) 조제하고 용해시킨다. 투석된 단백질을 실온에서 살며시 휘저으면서 2시간동안 태그-알데히드에 적가한다. 붕수소화 나트륨 100몰 초과량(단백질에 대해)(탈이온수에 용해된 용액 ml당 1.24mg의 100μl)을 용액에 첨가하고 실온에서 30분간 더 살며시 교반한다. 배합체를 pH 8.0의 0.2M 트리스로 실온에서 평형된 세파덱스 G-25 컬럼(1.0cm×18.0cm)상에 적하하고, 용출물을 280nm에서 감시한다. 공극 부피 피이크를 수집하고 한데 모으고 트리스 완충물 2ℓ에 대해 투석시킨다. 배합체를 표준 ELISA법으로 면역학적 활성을 시험하고 사용할 때까지 4℃에서 저장한다.
실시예 60
바이오맥*/소-항-인간 IgG 입자 제조
5% 바이오맥*-아민 말단 입자들(MA, 캐임브리지, 어드번스트 마그네틱스)의 2.5ml 불취액을 깨끗한 T-플래스크에 옮기고 인산염 완충 염수(PBS)로 5번 씻는다. 습윤 케이크를 5% 신선한 글루타르알데히드(시그마) 12.5ml에 다시 현탁시키고 주위 온도에서 3시간 동안 끝에서 끝으로 회전시킨다. 습윤 케이크를 두번째 T-플래스크에 옮기고 PBS로 3번 씻는다. 활성화된 입자들을 PBS로 12.5ml까지 다시 현탁시키고 15ml들이 원심분리관에 옮긴다. 이 현탁액에 PBS 2ml에 용해된 소-항-인간 IgG(H+L)(잭슨 랩) 12.5mg 을 첨가한다. 이 튜우브를 실온에서 3시간동안 다음에 4℃에서 밤새 끝에서 끝으로 회전시킨다. 다음날 입자들을 1%(w/v) 소 혈청 알부민(BSA)을 포함하는 PBS로 2번 씻고 다음에 사용할 때까지 4℃에서 0.1% BSA를 포함하는 PBS 12.5ml에 저장한다.
실시예 61
입자 분석을 기초로 한 바이오맥*자기를 사용하는 의사-동종 인간 IgG 전기화학발광 분석
화합물 I-인간 IgG 배합체를 0.1% BSA를 포함하는 0.15M 인산염 완충액으로 1 : 50으로 희석하고 250μl/튜우브로 분취한다.
희석물 150μl(상기한 바와 같은 PBw/BSA)를 튜우브에 첨가하고 다음에 희석물(음성 대조용) 또는 분석물(인간 IgG)의 여러가지 희석물을 첨가한다. 부가적으로 비-특이적 분석물(소 항-토끼 IgG)을 몇몇 튜우브에서 사용하여 분석 특이성을 검사한다. 소 항-인간 IgG(H&L)와 커플링된 1% 바이오맥*50μl를 각각의 튜우브에 첨가한다. 이 튜우브를 와류기상에서 혼합하고 살며시 휘저으면서 실온에서 15분간 항온처리한다. 입자들을 용액으로부터 자기적으로 제거하고 생성된 상등액 100μl를 버톨드 튜우브에 옮기고 여기에 시트레이트-옥살레이트-트리톤 X-100 용액 400㎕를 첨가한다. 이 뉴우브를 와류기상에서 혼합하고 전도성 도료로 피복된 폴리카보네이트 지지체로 지지되고 직경 0.01in의 백금선/은 도료 접착을 통해 전압원에 연결된 직경 0.29in의 고리 52 게이지 이중 백금망 전극이 장치된 변형 버톨드 발광측정기에서 읽어준다. 적용 전위를 +1.4~+2.15V로 단계화하고 10초간 통합시킨다. 읽어주는 중간에, 전극을 탈이온수로 헹구고 옥살산 및 트리톤 X-100을 포함하는 0.1M 인산염-구연산염 완충물에 담그고 적용 전위를 -2.2V-+2.2V(각각의 전위에서 3초로)로 2분 20초간 단계화하고 이어서 +2.2V에 10초간 놔둠으로 전기화학적으로 세정한다. 적극에서 세정 용액을 제거하고 탈이온수로 헹구고 흡수제 스위이프로 블롯 건조시킨다. 이 포맷에서, 전기화학발광 시그날은 분석물 농도에 직접적으로 비례한다.
실시예 62
비스(2,2'-비피리딘)말레이미도헥사노인산, 4-메틸-2,2'-비피리딘-4'-부틸아미드 루테늄(Ⅱ) 디퍼클로레이트 : 화합물 Ⅳ의 제조
프탈이미드 500mg(1.35×10-3몰)으로부터 실시예 32에 기술된 바와 같이 제조된, 4-[4-(1-아미노부틸)]-4'-메틸-2,2'-비피리딘을 말레이미드 헥사노인산 0.313g(1.48×10-3몰) 및 DCC 0.306g(1.48×10-3몰)을 갖는 무수 피리딘 5ml에 용해시킨다. 밤새 저장한 후, 디시클로헥실우레아를 여과하여 제거하고 피리딘을 진공하에서 스트립핑시킨다. 잔사를 컬럼 크로마토그라피(활성 Ⅱ 알루미나, 5% MeOH/CH2Cl2)로 정제하여 정제된 생성물을 얻는다. 수율 : 0.5g(95%)
말레이미도-헥사노인산, 4-메틸-2,2'-비피리딘-4'-부틸아미드 100mg( 2.3×10-4몰) 및 비스-(2,2'-비피리딘)루테늄 디클로라이드 2수화물 100mg(2.06×10-4몰)을 에탄올/물(1 : 1) 50ml에 용해시키고 아르곤으로 탈기시키고 4시간동안 환류시킨다. 생성된 맑은 오렌지색 용액을 고체 NaClO425ml, 에탄올 25ml 및 아세톤 25ml로 희석하고 진공하에서 서서히 증발시킨다. 건조시킬 때 물 25ml와 아세톤 25ml를 다시 첨가하고 용액을 회전 증발시켜서 약 15-20ml로 만든다. 침전된 고형물을 수집하고 물로 씻고 건조시킨다. 샘풀을 1 : 9의 메탄올/클로로포름을 사용하여 알루미나상에서 제조 TLC로 정제한다. 빠른 런닝 띠를 플레이트를 스크랩핑하여 분리하고 메탄올/클로로포름(1 : 1)에서 휘저어 섞음으로 화합물을 용출시킨다. 알루미나를 제거하기 위해 여과한 후, 오렌지색 용액을 건조물로 증발시켜 정제된 화합물(72%) 86.7mg을 얻는다. 구조를 NMR로 확정한다.
실시예 63
화합물 Ⅳ로 hCG 펩티드를 표지화함
인간 융모막 고나도프로핀(hCG) 펩티드(오이오 주립대학, 버논 스테븐스, JP 141, #109-145) 2mg을 pH6.0의 0.15M 구연산염 완충액 1ml에 현탁시키고 화합물 Ⅳ 1.13mg을 디메틸포름아미드 300μl에 용해시킨다. 펩티드 용액을 1분간 화합물 Ⅳ용액에 적가한다. 용액을 실온에서 1시간동안 살며시 휘저어 섞는다. 샘풀을 pH 8.5의 0.2M 트리스-염기로 실온에서 평형시킨 바이오-겔 P-2컬럼(바이오-래드 ; 1cm×45cm)에 유동 속도 15ml/hr로 적하하고 용출물을 280nm에서 감시한다. 작업의 공극 부피를 수집하고, 한데 모으고, pH 7.0의 50mM 트리스-HCl로 실온에서 평형시킨 QAE-세파덱스 A-25 컬럼(팔마시아 ; 1cm×10cm)상에 적하한다. 이를 수행하여 표지되지 않은 펩티드(이들은 양으로 하전된 수지에 흡착하고 ; 표지된 펩티드의 양전하는 더 처리됨이 없이 컬럼을 통과한다)를 제고한다. 용출물을 280nm에서 감시하고 첫번째 주요 피이크를 수집하고, 한데 모으고 냉동건조로 농축시킨다. 건조된 화합물을 PBF 최소 부피에 다시 현탁시킨다. hCG 펩티드-화합물Ⅳ 배합체를 사용할 때까지 4℃에서 저장한다.
실시예 64
DEAE AFFI-겔 블루우 크로마토그라피에 의한 토끼 항-hCG 펩티드의 정제
DEAE AFFI-겔 블루우(바이오-래드) 4ml를 pH 8.0의 0.028M NaCl을 포함하는 0.2M 트리스-HCI로 실온에서 평형시킨 크로마토그라피 컬럼(컬럼크기 1cm×10)의 유동 속도 40ml/hr로 1시간동안 붓는다. 유동 속도를 20ml/hr로 늦추고 컬럼 완충물에 대해 예비 투석된 토끼 항-hCG 펩티드(오시오 주립대학, 버논 스티븐스, 항 109-145) 1ml를 컬럼상에 적하한다. 1ml 분류물들을 수집하고 용출물을 280nm에서 감시한다. 공극 부피 피이크를 수집하고 여러 작업들로 부터의 것을 한데 모으고 폴리에틸렌 글리콜 6,000(시그마)로 둘러싸인 12K MWCO 투석색(sack)에 용출물을 놓아서 농축시킨다. 항체를 표준 ELISA 기술을 사용하여 면역반응성을 시험하고 HPLC로 순도를 시험하면 순수한 활성 조제물을 나타내는 하나의 주요 피이크를 생성한다.
실시예 65
정제 토끼 항-hCG 펩티드에 대해 hCG 펩티드-화합물 Ⅳ 배합체의 적정 : 전기화학발광 시그날 변조
hCG 펩티드-화합물 Ⅳ 배합체 pH 6.2의 0.1M 구연산염을 포함하는 0.1M 인산염 완충물로 희석한다. 이 혼합물의 분취액을 마이크로퓨지 튜우브에 놓는다. 미리 정제된 항-펩티드 항체를 여러가지 농도로 희석하고 이 튜우브에 첨가하고 와류기상에서 혼합하고 실온에서 1시간동안 항온처리한다. 전기화학발광을 읽기 바로전에 분취액을 버톨드 튜우브에 옮기고 여기에 옥살산 및 트리톤 X-100(시그마)을 첨가한다. 튜우브를 와류기상에서 혼합하고 이중 백금망 전극을 갖는 R-268 증배형광전관을 사용하여 버톨드 발광측정기 상에서 스위이프 방식(두번째 주사의 최대 높이를 값으로 취하는 3주사를 행하는 50mV/sec에서의 +1.5-2.5V)으로 읽는다. 읽는 중간에 전극을 먼저 탈이온수로 헹구고 다음에 옥살레이트 25mM과 1% 트리톤 X-100을 포함하는 pH 6.1의 0.1M 인산염-구연산염 완충물에 담가서 화학적으로 세정한다. 적용 전위를 +2.2V--2.2V사이의 각각의 전위에서 3초간씩 1분 50초간 키고, +2.2V에 10초간 나눈다. 전력을 끄고 전극을 세정 용액으로부터 꺼내 탈이온수로 씻고 흡수제 타월링하여 블롯 건조시킨다.
이 결과들은 전기화학발광 시그날이 펩티드에 대한 항체의 농도에 직접적으로 비례한다는 일반적인 경향을 보여준다. 이것은 전기화학발광 시그날이 전기화학발광 표지된 분석물이 항체와 접촉할 때 떨어지는 다른 실험과는 반대다.
실시예 66
전기화학발광 시그날 출력 : Ru(Ⅱ)-화합물 Ⅲ 배합체의 안정성 자료
Ru(Ⅱ)-화합물 Ⅲ 배합체를 1% 정상 인간 혈장(NHS)이 있거나 없이 pH 6.1의 0.1M 인산염-구연산염 완충물로 300nM로 희석시킨다. 각각의 완충물 유형중 하나를 4°,20°,37°및 55°에서 항온처리하고 항온처리 3,4 및 5일에 샘플화한다. 샘플들을 실온에서 평형화시키고 그 전기화학발광 시그날 출력을 평가한다. 샘플 400μl를 125mM옥살산-5% 트리톤 X-100 100μl와 튜우브내에서 혼합하고 하마마츄 R-268 증배형광전관과 이중망 백금 가제 전극이 있는 변형 버톨드 발광측정기에 놓는다. 3 사이클에 대해 50mV/초에서 1.5V-+2.5V의 적용 전위를 스위이핑함으로 읽고 두번째 사이클의 최대 높이를 기록하고 전기화학발광 카운트로 전환시킨다. 읽는 중간에 전극을 탈이온수로 헹구고, 전극을 25mM 옥살레이트와 1% 트리톤 X-100을 포함하는 0.1M 인산염-구연산염 왕충물에 담그고 1분 50초간 각각의 전위에서 3초 간격으로 -2.2V-+2.2V의 전위에 둠으로 전기화학적으로 세정한다. 전위를 +2.2V에서 10초간 놔두고 다음에 제거한다. 전극을 세정용액으로부터 꺼내서 탈이온수로 씻고 흡수제 타월링으로 블롯 건조시킨다. 이 결과들은 연구 과정중 각각의 완충물 유형에서 동일한 시그날이 있음을 보여준다. 이는 반응물의 안정성과 전기화학발광 시그날을 생성하는 능력을 나타낸다.
실시예 67
Ru(Ⅱ)-화합물 Ⅲ 배합체의 면역반응성 시험 : 안정성 연구
Ru(Ⅱ)-화합물 Ⅲ 배합체를희석하고 실시예 66에 기술된 바와 같은 조건하에서 항온처리한다. 샘플들을 3,4,5일째에 취하고 실온으로 냉각시키고 IL, 문델레인, 판덱스 Inc로 부터 구입한 판덱스 스크린 장치를 사용하여 입자 농도 형광면역분석(PCFIA)에 의해 면역반응성을 시험한다. PCFIA를 경쟁적 분석 포맷에 작동시킨다. 라텍스 입자들(판덱스)을 테오필린-BSA와 결합시킨다. 이 입자들 일정양을 Ru(Ⅱ)-화합물 Ⅲ 배합체 시험 용액과 혼합시켜 최종 농도의 항-테오필린 모노클론 항체(복수, 하이클론 cat #E-3120M, 롯트 #RD200) 및 일정양의 소 항-생쥐 IgG-FITC 배합체(판덱스, cat #33-020-1 롯트 #CO1)를 만든다. 항온처리후, 샘플들을 처리하고 판덱스 스크린 장치상에서 읽는다. 이 결과는 55℃에서 5일간 항온처리한 후 활성이 감지할 만큼 감소하지 않았음을 보여준다.
실시예 68
여러가지 루테늄 및 오스뮴 화합물의 전기화학발광성
여러가지 오스뮴 및 루테늄 화합물들의 전기화학을 전해질로서 0.1M테트라부틸 암모늄 테트라플루오로보레이트가 있는 질소-퍼어지 아세토니트릴 10ml에 용해된 1mM 용액들로 측정한다. 작업 전극은 IN. 웨스트 라파예테, 바이오어낼리시컬 시스템 Inc로 부터 구입한 백금 디스크 전극이다. 백금선 카운터 전극 및 1.0mm은 선을 기준 전극으로 사용한다. 100mV/초의 주사 속도에서 2.2V-+2.2V(Vs SCE)로 주사함으로 측정한다. 각각 전기화학 측정을 시행한 후, 포화 칼로멜 기준 전극(SCE)과 온선 사이의 전위차를 결정한다. 그리고 보고된 값들을 SCE에 대한 전위에 보정한다.
0.1M 인산염-구연산염 완충물(pH 4.2), 25mM 옥살산 및 1% 트리톤 X-100을 포함하는 수성용액 0.5ml로 전기화학발광(ECL)을 측정한다. 사용된 전극 시스템은 0.1mm백금선에 의해 라디오 샥 트랜지스터 소켓(Radio shack transistor socket)(#276-548)에 연결된 두 백금 가제(52 게이지) 전극들로 구성된다. 이 전극들을 셀룰로오스 아세테이트 플라스틱의 두께 60ml 단편의 외부에 세운다. 이 플라스틱을 1/4in 직경 구멍이 작업 및 카운터 기준 전극사이를 용액이 용이하게 하도록 장치한다. 이 전극들을 일정전위기에 연결하여 한 전극은 작업 전극(이것은 증배형광전관에 가까이 있다)으로 작용하고 한 전극은 카운터 및 기준 전극으로 작용하게 한다. 50mV초의 주사 속도에서 1.5V-2.5V(바이어스 전위)로 스위핑함으로 측정한다. ECL 측정치는 화합물의 주어진 농도에서 노이즈(noise)에 대한 시그날의 비, 즉 또는 기본에 대한 시그날의 비로 보고한다. 기본은 ECL 화합물이 첨가되지 않은 완충액으로 측정한 발광 카운트로 정의한다. 발광 측정치는 첫번째 또는 두번째 직선 스위이프시 관찰된 최대 광 출력이다.
각각의 용액의 전기화학발관(ECL) 및 고리형 전압측정식 측정 둘다는 잉글랜드 옥스포드, 울사 사이언티픽 인스트루먼트로부터의 이전위기 또는 EG&G 모델 273 일정전위기로 수행한다. 각각의 ECL 측정의 광자유동은 2 또는 3의 전극 시스템을 0.5ml측정 용액에 사용할 수 있도록 변형시킨, 서독, 와일배드로 부터의 버틀드 바이오루매트 LB 9500 발광측정기로 감시한다. 전기화학 및 전기화학발광 측정은 폴란드, 델프로 부터의 키프 & 조넨 모델 BD 91 X,Y,Y',기록 장치상에 기록한다.
형광 측정은 ECL용액 3.0ml에 또는 ECL용액에 불용성일때는 아세토니트릴에 용해된 소요의 화합물의 50μmole 용액으로 행한다.
퍼어킨-멜머 LS-5 형광 분광 광도계상에서 측정한다. 용액의 여기 및 방출 스펙트럼의 프레스칸은 최대 여기 파장에서 발광하면서 방출 스펙트럼을 측정할 수 있도록 여기 및 방출 스펙트럼을 기록하기 전에 수행하고 반대로 여기 스펙트럼은 최대 방출 파장을 감시하면서 기록할 수 있다.
1(S/N)은 시그날이 주어진 농도에서 화합물의 ECL 출력(발광 카운트)으로 정의되고 노이즈가 화합물이 용해된 완충물의 발광 카운트로 정의될때 노이즈에 대한 시그날의 비이다.
pH 4.2에서 측정한 다른 화합물들의 ECL과는 달리, 화합물 C)는 7.0의 생리학적 pH에서 중대한 ECL을 나타낸다.
a) 트리스(2,2'-비피리딘)루테늄2+
b) 트리스(4,4'-카르복실레이트-2,2'-비피리딘)루테늄2+
c) 트리스(4,4'-카르보에톡시-2,2'-비피리딘)루테늄2+
d) 비스(2,2'-비피리딘)[(테오필린-8-부티릭-4-(4-메틸-2,2'-비피리딘)-4'-일)-부틸 아미드]루테늄(Ⅱ) 디클로라이드
e) [비스-(2,2'-비피리딘){모노카르보닐}피리딜]오스뮴(Ⅱ) 디헥사플루오로포스페이트
f) (2,2'-비피리딘[시스-비스(1,2-디페닐포스핀)에틸렌]{2-[3-(4-메틸-2,2'-비퓨리딘-4'-일)프로필]-1,3-디옥소란}오스뮴(Ⅱ) 디클로라이드
실시예 69
비스(2,2'-비피리딘)[4-(4-메틸-2,2'-비피리딘)부틸 아민]루테늄(Ⅱ) 디퍼클로레이트의 제조
비스(2,2'-비피리딘)루테늄(Ⅱ) 디클로라이드 2 수화물(스트렘) 1.29g과 4-[4-(1-아미노부틸)]4'-메틸-2,2'-비피리딘(실시예 32에 기술됨) 0.719g을 50/50 에탄올/H2O 50ml에 현탁시키고 3시간 동안 아르곤하에서 환류시킨다. 반응 용액을 농축시키고 세파덱스(-25상에서 크로마토그라피 분리하고 먼저 증류수로 다음에 0.25M NaCl로 용출시킨다. 최종적으로 0.4M NaCl로 용출시킨다. 생성물을 포함하는 분류물을 약 100ml로 농축시키고 용액이 흐려질 때까지 과염소산을 첨가한다. 밤새 냉동시킬 때 생성물의 적색 오렌지색 결정들(1.215g)이 얻어진다. 원소 분석을 행하면 구조가 하기와 같이 확정된다.
실시예 70
테오필린-8-(3,3'-디메틸)부티르산의 제조
5,6-디아미노, N1,N3-디메틸 우라실 수화물(10g, 0.059몰)과 3,3-디메틸글루타르산 무수물(12.6g, 8.85×10-2몰)을 N,N-디메틸 아닐린 100ml에 용해시키고 딘-스타크 트랩을 사용하여 환류시킨다. 반응의 내용물은 가열후 점차 용해되고 오렌지빛 적색으로 변한다. 4시간동안 환류시킨 후, 물 1ml를 트랩에서 수집하고 이는 반응의 완료를 나타낸다. 반응물을 실온으로 냉각시키고 이때 전물질이 고체로 된다. 고형물을 프릿깔대기상에서 여과하고 색상이 연한 황색이 될 때까지 씻는다. DMF로 2번 결정화한 후, 중간체 락탐(융점 283.1-284.9℃)의 순수한 백색 결정을 얻는다. 락탐을 8시간 동안 물에서 끓인다. 냉각시, 용액은 순수한 백색 결정들(융점 218-220℃)을 생성한다. 양자 NMR 및 원소분석을 하기 구조와 일치한다.
실시예 71
비스(2,2'-비피리딘)[(테오필린-8-(3,3-디메틸부티릭-{4-(4-메틸-2,2'-비피리딘)-4'-일)-부틸}아미드]루테늄(Ⅱ) 디퍼클로레이트의 제조
테오필린-8-(3,3-디메틸)부티르산 100mg(0.34mmol)과 비스(2,2'-비피리딘)4-(4'-메틸-2,2'-비피리딘)부틸아민 루테늄(Ⅱ) 디퍼클로레이트 0.325g(0.34mmol)을 디시클로헥실카르보디이미드 0.351g(1.7mmol)과 함께 무수 피리딘 10ml에 용해시킨다. 반응물을 2일간 휘젓는다. 다량의 디시클로헥실우레아 침전물을 여과하여 제거하고 피리딘 용액을 진공하에서 농축시킨다. 잔사를 메탄올에 용해시키고 세파덱스 LH-20상에서 크로마토그라피시킨다. 소요의 분류물을 원심분리할때 생성물이 에테르로부터 침전하여 오렌지색 침전물이 얻어진다. 원소분석 및 양자 NMR은 하기 구조와 일치한다.
실시예 72
테오필린-8-프로필-8-프로필-(4-메틸-2,2'-비피리딘-4'-부틸)카르복사미드의 제조
8-(감마-아미노프로필)테오필린 프탈산 히드라지드 염 61.8mg(1.55×10-4mol)을 물 1ml에 용해시키고 HCI로 산성화한다. 침전된 프탈산 히드라지드를 여과하여 제거하고 수성 여과물을 증발시키고 진공하에서 건조하여 테오필린-8-프로필아민 히드로클로라이드 34.5mg(1.31×10-4몰)을 얻는다. 이 물질을 무수 피리딘 5ml에 용해시키고 4-(4-메틸-2,2'-비피리딘(4'-일)부티르산 36.9mg(1.44×10-4몰) 및 트리에틸아민 26.4mg(2.62×10-4몰)을 첨가한다. 최조적으로 디시클로헥실카르보디이미드 29.7mg(1.44×10-4몰)을 이 용액에 첨가한다. 형성된 흐린 용액을 밤새 휘젓는다. 침전된 염과 디시클로헥실우레아를 여과하여 제거하고 용액을 건조물로 스트립핑하여 백색 고형물을 얻고 이를 용출제로서 디클로로메탄내 5% 메탄올을 사용하여 알루미나상에서 크로마토그라피하여 백색 분말의 생성물(융점 215°-216.5℃) 44.2mg(71%)을 얻는다. 양자 NMR 및 원소분석을 하기 구조와 일치한다.
실시예 73
비스(2,2'-비피리딘)[테오필린-8-프로필(4-메틸-2,2'-비피리딘-4'-부틸)카르복사미드]루테늄(Ⅱ) 디클로라이드의 제조
비스(2,2'-비피리딘)루테늄 디클로라이드(스트렘) 100mg(2.06×10-4몰) 및 테오필린-8-프로필(4-메틸-2,2'-비피리딘-4'-부틸)카르복사미드 108mg(2.27×10-4몰)을 아르곤으로 탈기시킨 50%에탄올 50ml에 첨가한다. 이 용액을 환류 온도로 가열한다. 형성된 체리빛 적색 용액을 실온의 고 진공하에서 농축시킨다. 잔사를 용출제로서 메탄올을 사용하여 세파덱스 LH-20(75cm×19mm I.D.)상에서 크로마토그라피시킨다. 생성물 띠를 분리하고 증발시키고 무수 에테르내로 침전시킨다. 생성물의 수율은 156mg(75%)이다. 원소분석하면 생성물내에 메탄올이 4몰 존재한다는 것이 나타난다.
분석
이론치(%) : C ; 54.09, H ; 5.65, N ; 14.16, O ; 10.29, Cl ; 6.52
실측치(%) : C ; 53.30, H ; 5.22, N ; 14.56, O ; 10.63, Cl ; 6.95
실시예 74
비스(2,2'-비피리딘)[1-브로모-4-(4'-메틸-2,2'-비피리딘-4-일)부탄]루테늄(Ⅱ) 디퍼클로레이트의 제조
실시예 31에서 제조된 리간드 1-브로모-(4-14'-메틸-2,2'-비피리딘-4-일)부탄 0.29g과 비스(2,2'-비피리딘)루테늄(Ⅱ) 디클로라이드 0.32g을 에탄올/물 1 : 1 V/V 혼합물 60ml의 플래스크에 옮긴다. 이 용액을 15분간 질소로 탈기시킨다. 반응물을 시간동안 질소하에서 환류온도로 가열한다. NaClO4의 수성 포화 용액을 냉각된 적색 용액에 첨가한다. 진공하에서 용매를 제거하고 진한 적색 잔사를 용출제로서 아세토니트릴/톨루엔 1 : 1 V/V 를 사용하여 알루미나 칼럼(20cm×2.5cm, 머르크, 중화 활성 3)상에서 크로마토그라피한다. 생성물은 컬럼상에 암적색 띠(띠 #2)로 용출된다. 소요의 분류물을 농축시키고 거의 10ml부피의 디클로로메탄에 다시 용해시키고 무수 에틸에테르에 침전시키고 최종적으로 진공하에서 건조시켜서 생성물 320mg(53%)을 얻는다. 생성물의 구조를 원소분석과 스펙트럼 특성으로 확정하면 아래와 같이 나타난다.
실시예 75
비스(2,2'-비피리딘)테오필린-9-[4-(4-메틸-2,2'-비피리딘-4'-일)부탄]루테늄(Ⅱ) 디퍼클로레이트의 제조
테오필린의 은염을 테오필린의 암모니아 용액(농 NH4OH 25ml와 물 75ml에 용해된 2.168g)및 질산은의 암모니아 용액(농 NH4OH 10ml 및 물 30ml에 용해된 2.006g)을 함께 혼합함으로 제조하고 이 반응은 암소에서 수행한다. 두 용액을 혼합한 직후, 백색 생성물이 나타난다. 일단 생성물이 완전히 침전되면 60ml 매체유리 프릿상에서 여과하여 침전물을 수집한다. 침전물을 묽은 암모니아를 씻고 진공하에서 건조시킨다. 테오필린의 은염의 구조는 원소분석으로 지지된다.
테오필린의 은염 41mg과 비스(2,2'-비피리딘)[1-브로모-4-(4'-메틸-2,2'-비피리딘-4-일)부탄]루테늄(Ⅱ) 디퍼글로레이트 122mg을 무수 디메틸포름아미드(DMF) 15ml에 용해시키며 이 반응은 암소에서 수행한다. 형성된 적색 용액을 아르곤으로 탈기시키고 환류온도에서 24시간동안 가열하고 아르곤하에서 실온으로 냉각시킨다. 이 용액을 얼음 온도로 계속 냉각시키고 다음에 흑색 금속은 현탁액을 여과하고 아세톤 5ml로 씻는다.
적색 여과물을 과염소산 리튬 0.2g으로 처리하고 LiClO4을 용해시킨 후 이 용액을 진공하에서 증발시키고 적색 잔사를 진공하의 암소에서 밤새 건조시킨다. 샘플을 메탄올 3-5ml에 다시 용해시키고 무수 LiClO40.25g을 첨가하고 용해시킨다. 형성된 용액을 용출제로 메탄올을 사용하여 세파덱스 LH-20칼럼(75cm×19cm i.d.)상에서 크로마토그라피시킨다. 주요 생성물은 분류물 #2(암적색 띠)로 용출된다. 분류물 #2를 농출시키고, 메탄올에 다시 용해시키고 에틸에테르에 침전시킨다. 생성물을 진공하에서 건조시켜 원소 분석, 적외선 및 방출 스펙트럼으로 확정된 하기 구조의 물질 80mg(수율 50%)을 얻는다.
참고문헌
1. 웨버, S.G.일행의 광전기분석화학 : 간섭물 존재하에서의 트리스(2,2'-비피리딘) 루테늄(Ⅱ)의 선택적검출 및 혈장내의 가능한 간섭, 임상화학, 29, 1665-1672(1983).
2. 루빈스테인, I와 바아드, A,J., 전기생성 화학발광과학. 37. Ru(2,2'-비피리딘)와 옥살레이트 또는 유기산들을 기재로 한 수성 ECL 시스템, J. Am. Chem. Soc., 103, 512-516(1981).
3. 화이트, H.S.와 바아드, A,J., 전기생성 화학발광. 41. 아세토니트릴-물 용액내에서의 Ru(2,2'-bpy)-S2O8 -2시스템의 화학발광 및 전기생성 화학발광, J. Am. Chem. Soc., 104, 6891(1982).
4. 커티스 일행, 화학발광 ; 박층 크로마토그라피에 의해 분리되는 형광 화합물을 검출하는 새로운 방법, J. 크로마토그라피, 134, 343-350(1977).
5. 스프린쉬닉, G. 일행. 물-고체 계면에서 단일층 화합체내의 계면활성제 루테늄(Ⅱ) 착화물의 제조 및 광화학적 반응성, J. Am. Chem. Soc., 99, 4947-4954(1977).
6. 만니히, S.A. 일행, 식품, 응용 및 환경미생물에서 살모넬라 검출을 위한 효소 면역분석, 43, 1124-1127(1982).
7. 토마손, B.M., 살모넬라의 면역형광 방법론의 현상황. J. 식품 Prot., 44, 381-384(1981).
8. 마팅글, J.A., 골수종 단백질과 하이브리도마 항체의 조합물을 사용하는 모든 살모넬라의 검출을 위한 효소 면역분석, J. 면역학, Meth., 73, 147-156(1984).
9. 톰슨, N.E. 일행, 효소-결합 면역흡수체 분석 및 형광-면역분석에 의한 포도상구균성 장내독소의 검출 : 모노클론 및 폴리클론 항체 시스팀의 비교, 응용 및 환경 미생물, 근간 발행
10. 미 공중 보건협회, 물 및 폐수 검사를 위한 표준방법. 15th ed. 뉴욕 미 공중 보건협회, Inc.(1989).
11. 미 공중 보건협회, 식품의 미생물학적 검사법의 개요. D.C., 워싱톤, 미 공중 보건협회(1976).
12. 크라크, H.F., 겔드라이히, E.E., 레스터, H.L., 및 카브러, P.W., 위생 미생물학에 있어서의 막 여과기, 공중 보건 Rep. 66 : 951-957(1951).
13. 펭, P., 와 하트만, P.A., 이쉐리키아콜리의 직접적 확인을 위한 형광발생적분석, 응용 환경 미생물학, 43 : 1320-1329(1982).
14. 겔드라이히, E.E., 관례적인 대장균류 공정을 위한 표준법 개정(16판). IN : 미생물학 연수회, 음료수의 새로운 개발, 미생물학 미연합회의 85주년 연간 모임(1985).
15. 후송, D., 콜웰, R.R.,및 와이너 R.M., 조개류 및 민물고기류의 총 대장균류 최학수 분석으로부터의 부정적인-양성의 결과 발생 비율. 응용 환경 미생물학 40 : 981-983(1980).
16. 후성 D, 드라이어, JM., 와이너, R.M. 및 콜웰 R.R., 조개류 및 민물고기류의 부정적인-양성인 최확수 대장균인 시험결과와 관련된 박테리아. 응용 환경 미생물학 41 : 35-43(1981).
17. 린, S., 염소화된 두번째 유출물의 대장균류 시험 평가, J. 수오염, 대조용 Fed. 45 : 498-506(1973).
18. McKee, J.E., 막라우글린, R.T. 및 레스고울구어스, P. 9 오물 Ⅲ의 세균 분석에의 분자 필터 기술의 적용. 물리적 및 화학적 살균의 효과, 오물 공업 처리 30 : 245-252(1958).
19. 미드, J.A.R., 스미스, J.N. 및 윌리암스, R.T., 움벨리페론 및 4-메틸움벨리페론의 글루쿠로니드의 생합성 및 베타-글루쿠노이데이스의 형광측정 결정에의 이들의 사용, 생화학, J. 61 : 569-574(1954).
20. 올손, B.H. 최확수 방법을 변형시킴으로 해수에 있어서의 대장균류 시험의 증진된 정확성, 응용 환경미생물학, 36 : 438-444(1978).
21. 프레스넬, M.W. 민물내의 분 대장균류 및 대장균류를 계수하는 막 여과기 방법의 계수. Proc. 국가 조개류 위생 연수회. 1974 : 127-131(1974).
22. 프레스우드, W.G. 및 스트롬. D.K., 로졸릭산 계수에 의한 mFC 배지의 변형. 응용 환경 미생물학 36 : 90-94(1978).
23. 와르, G.W. 및 마크찰로니스, J.J. 항체의 정제. IN : 기구로서의 항체, NY, J. 월리 및 손스, pp. 59-96(1982).
24. 만니아티스, T., 프릿츠, E.F. 및 삼브룩, J., 분자 클로닝 : 래보레토리 매뉴얼, P. 150-160. NY. 콜드스프링 하버, 콜드 스프링 하보 프레스(1982).
Claims (20)
- (a) 분석물 및 시약이 결합하기에 적절한 조건하에서, 견본을, (i) 반복적으로 방사선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기 화학 에너지에 노출됨에 따라 반복적으로 전자기 방사선을 방출하도록 유도될수 있으며, (ii) 관심있는 분석물과 결합할 수 있는 시약과 접촉시키고 ; (b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기 화학 에너지에 노출시키며 ; (c) 그렇게 방출된 전자기 방사선을 검출함으로써 견본내의 관심있는 분석물의 존재를 검출하는 것으로 구성되는, 약 10-3몰 농도 이하의 농도로 견본에 존재하는 관심있는 분석물울, 소정 부피의 다성분 액체 견본에서 검출하는 방법.
- 제1항에 있어서, 견본이 아세토니트릴, 디메틸 설폭사이드, 디메틸포름아미도, n-메틸피롤리디논 또는 3차-부틸 알코올인 방법.
- (a) 관심있는 분석물 및 시약이 상보적 물질에 경쟁적으로 결합하기에 적절한 조건하에서, 견본을 상보적 물질 및, (i) 반복적으로 방사선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기화학 에너지에 노출됨에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며, (ii) 정상적으로는 견본에 존재하지 않는 상보적 물질 상의 결합 부위에 대해 관심있는 분석물과 경쟁할 수 있는 시약과 접촉시키고 ; (b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기 화학 에너지에 노출시키며 ; (c) 그렇게 방출된 전자기 방사선을 검출함으로써 견본에서 관심있는 분석물의 존재를 검출하는 것으로 구성되는, 약 10-3몰 농도 이하의 농도로 견본에 존재하는 관심있는 분석물을, 소정 부피의 다성분 액체 견본에서 검출하는 방법.
- (a) 분석물과 시약이 결합하기에 적절한 조건하에서, 견본을, (i) 반복적으로 방사선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기 화학 에너지에 노출됨에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며, (ii) 관심있는 분석물과 경쟁할 수 있는 공지된 양의 시약과 접촉시키고 ; (b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방서선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기 화학 에너지에 노출시키고 ; (c) 그렇게 방출된 전자기 방사선의 양을 정량적으로 측정하므로써 견본에 존재하는 관심있는 분석물의 양을 정량적으로 측정하는 것으로 구성되는, 견본에 존재하는 관심있는 분석물의 양을 소정 부피의 다성분 액체 견본에서 정량적으로 측정하는 방법.
- (a) 관심있는 분석물 및 시약이 상보적 물질에 경쟁적으로 결합하기에 적절한 조건하에서, 견본을 공지된 양의 상보적 물질 및, (i) 반복적으로 방사선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기 화학 에너지에 노출됨에 따라 반복적으로 전자기 방사선을 방출하도록 유도될 수 있으며, (ii) 정상적으로는 견본에 존재하지 않는 공지된 양의 상보적 물질 상의 결합 부위에 대해 관심있는 분석물과 결합할 수 있는 공지된 양의 시약과 접촉시키고 ; (b) 시약이 반복적으로 전자기 방사선을 방출하도록 유도하기에 적절한 조건하에서, 결과 생성된 견본을 시약이 반복적으로 방사선을 방출하도록 유도할 수 있는 적절한 급원에서 나온 일정량의 전기 화학 에너지에 노출시키며 ; (c) 그렇게 방출된 방사선의 양을 정량적으로 측정하므로써 견본에 존재하는 관심있는 분석물의 양을 정량적으로 측정하는 것으로 구성되는, 견본에 존재하는 관심있는 분석물의 양을 소정 부피의 다성분 액체 견본에서 정량적으로 측정하는 방법.
- (a) 견본을 단일 지지물 상에 고정화된 다양한 항체와 접촉시키고(여기에서 각각의 항체는 고정화된 항체와 관심있는 분석물 사이에서 복합체를 형성하도록 상이한 관심있는 분석물과 복합체를 형성할 수 있다) ; (b) 견본으로부터 고정화된 항체를 제거하고 ; (c) 비결합된 분석물을 제거하기 위해 고정화된 항체를 처리하고 ; (d) 고정화된 항체와 관심있는 분석물의 복합체를, 그 복합체와 결합할 수 있는 표지된 항체와 접촉시켜, 고정화된 항체와 관심있는 분석물의 복합체 및 표지된 항체 사이의 결합을 형성하고 ; (e) 표지된 항체의 존재를 검출하므로써 관심있는 분석물의 존재를 검출하는 것으로 구성되는, 단일의 액체 음식이나 음식 호모게네이트 견본에서 상이한 관심있는 분석물의 존재를 검출하는 방법.
- 견본재로 침지시키기 위한 표면을 갖는 하부 부분과, 그 표면에 부착된 하나 이상의 막 및, 막의 분리 영역에 고정화된 장독소상의 상이한 항원 결정소에 대해 특이적인 다양한 모노클로날 항체로 이루어진 진단 시약 호울더와 ; 계면활성제를 함유한 완충 수성 용액을 포함한 일차 헹굼 용액과 ; 막상에 고정화된 모노 클로날 항체가 특이성을 갖는 각각의 장독소상의 상이한 항원 결정소에 대하여 특이성을 가지며 효소와 결합된 모노클로날 항체를 함유하는 검출 용애과 ; 완충 수성 용액을 포함한 이차 헹굼 용액과 ; 효소에 의해 생성물로 전환되는 효소의 기질을 함유하는 용액 ; 및 효소에 의해 기질이 전환되어 형성된 생성물과의 반응과 따라 가시적인 착색 침전물을 생성하는 염료를 함유한 용액을 포함하여 구성되는, 하나의 견본에서 상이한 장독소들을 검출하기 위한 키트.
- (a) 고정화 지대 및 성장 지대가 갖추어진 단일 반응기의 성장 지대에 견본을 놓고 ; (b) 견본에 존재하는 미생물을 증식시키기 위해 성장 지대에서 견본을 처리하고 ; (c) 견본에 존재하는 미생물을 고정화시키기 위해 고정화 지대로 견본을 옮기고 ; (d) 고정화된 미생물을 별도로 회수하고 ; (e) 항체와 미생물 사이에 복합체를 형성하기 위해 미생물에 대해 특이적인 표지된 항체로 고정화된 미생물을 처리하며 ; (f) 표지된 항체를 함유하는 복합체의 존재를 검출하므로써 미생물을 검출하는 것으로 구성되는, 견본에서 미생물의 존재를 검출하기 위한 방법.
- (a) 비-선택성 락토우즈 매질을 함유하는 하나 이상의 바이얼(vial) ; (b) 하나 이상의 듀램관 ; (c) 폴리스티렌 인서어트가 장착된 하나 이상의 바이얼 캡 ; (d) 소의 혈청 알부민 용액 ; (e) 항-대장균류 세균 모노클로날 항체-효소 배합체 ; (f) 완충-수성 용액 ; 및 (g) 효소 기질 용액을 포함하여 구성되는, 물 견본에서 대장균류 세균의 존재를 검출하기 위한 키트.
- 하기 구조식X-T-Z(여기에서 X는 같거나 상이할 수 있는 하나 이상의 뉴클레오티드, 같거나 상이할 수 있는 하나 이상의 아미노산, 항체, 관심있는 분석물 또는 관심있는 분석물의 유사체를 나타내며 ; Y는 하나이상의 탄소원자를 가지며 X 및 Z에 부착된 결합기를 나타내고 ; Z는 제111항, 제113항, 제115항, 제117항, 제123항, 제126항 또는 제128항의 화합물을 나타낸다)를 갖는 화합물.
- 하기 구조X-CH=CH-CO-NH-(CH2)n-NH-CO-(CH2)m-Z(여기에서 X는 같거나 상이할 수 있는 하나 이상의 뉴클레오티드를 나타내고 ; z는 전기화학발광종인 화학적 물질을 나타내며 ; n은 1 이상의 정수를 나타내고 ; m은 1 이상의 정수를 나타낸다.)를 갖는 화합물.
- 하기 구조[T-Y-Z]2+(R)2(여기에서 T는 테오필린을 나타내고 ; Y는 T를 Z에 부착시키는 결합기를 나타내며 ; Z는 비스-(2,2'-비피리딘)[4-메틸-2,2'-비피리딘-4'-일]루테늄(Ⅱ)를 나타내고 ; R은 음이온을 나타낸다.)를 갖는 화합물.
- 하기 구조X-Z(여기에서 X는 시스테인이나 메티오닌인 아미노산을 하나 이상 함유하는 같거나 상이할 수 있는 하나 이상의 아미노산을 나타내며 ; Z는 말레이미드의 3이나 4위치의 탄소에 의해 시스테인이나 메티오닌의 황 치환체에 부착된 4-메틸-2,2'-비피리딘-4'-부틸아미드 류테늄(Ⅱ), 또는 비스(2,2'-비피리딘)말레이미도 헥손산이다.)를 갖는 화합물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US85835486A | 1986-04-30 | 1986-04-30 | |
| US858,354 | 1986-04-30 | ||
| PCT/US1987/000987 WO1987006706A1 (en) | 1986-04-30 | 1987-04-30 | Electrochemiluminescent assays |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR880701379A KR880701379A (ko) | 1988-07-26 |
| KR960016340B1 true KR960016340B1 (ko) | 1996-12-09 |
Family
ID=25328109
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019870701252A KR960016340B1 (ko) | 1986-04-30 | 1987-04-30 | 전기화학발광 분석법 |
Country Status (13)
| Country | Link |
|---|---|
| EP (3) | EP0265519B1 (ko) |
| JP (6) | JPH0737464B2 (ko) |
| KR (1) | KR960016340B1 (ko) |
| AT (2) | ATE127923T1 (ko) |
| AU (2) | AU644150B2 (ko) |
| CA (1) | CA1339465C (ko) |
| DE (2) | DE3752345T2 (ko) |
| DK (1) | DK173025B1 (ko) |
| FI (1) | FI102017B (ko) |
| HK (2) | HK1007442A1 (ko) |
| IL (1) | IL82411A0 (ko) |
| NO (1) | NO176071C (ko) |
| WO (1) | WO1987006706A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20110111399A (ko) * | 2008-12-15 | 2011-10-11 | 꼼미사리아 아 레네르지 아또미끄 에 오 에네르지 알떼르나띠브스 | 화학 원소의 비침투적 검출을 위한 방법 |
Families Citing this family (134)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6165729A (en) * | 1986-04-30 | 2000-12-26 | Hyperion Catalysis International, Inc. | Electrochemiluminescent reaction utilizing amine-derived reductant |
| US6881536B1 (en) * | 1986-04-30 | 2005-04-19 | Bioveris Corporation | Particle based electrochemiluminescent assays |
| US6451225B1 (en) | 1986-04-30 | 2002-09-17 | Igen International, Inc. | Electrochemiluminescent reaction utilizing amine-derived reductant |
| US5770459A (en) * | 1986-04-30 | 1998-06-23 | Igen International, Inc. | Methods and apparatus for improved luminescence assays using particle concentration, electrochemical generation of chemiluminescence detection |
| US6271041B1 (en) * | 1986-04-30 | 2001-08-07 | Igen International, Inc. | Electrochemiluminescent reaction utilizing amine-derived reductant |
| US5635347A (en) * | 1986-04-30 | 1997-06-03 | Igen, Inc. | Rapid assays for amplification products |
| US5935779A (en) * | 1988-11-03 | 1999-08-10 | Igen International Inc. | Methods for improved particle electrochemiluminescence assay |
| US6881589B1 (en) | 1987-04-30 | 2005-04-19 | Bioveris Corporation | Electrochemiluminescent localizable complexes for assay compositions |
| US6702986B1 (en) | 1988-04-29 | 2004-03-09 | Igen International, Inc. | Electrochemiluminescent reaction utilizing amine-derived reductant |
| US5705402A (en) * | 1988-11-03 | 1998-01-06 | Igen International, Inc. | Method and apparatus for magnetic microparticulate based luminescence assay including plurality of magnets |
| US5962218A (en) * | 1988-11-03 | 1999-10-05 | Igen International Inc. | Methods and apparatus for improved luminescence assays |
| US5746974A (en) * | 1988-11-03 | 1998-05-05 | Igen International, Inc. | Apparatus for improved luminescence assays using particle concentration, electrochemical generation of chemiluminescence and chemiluminescence detection |
| DE68928492T2 (de) * | 1988-11-03 | 1998-08-20 | Igen Inc | Elektrochemilumineszente reaktion unter verwendung eines von einem amin abgeleiteten reduktionsmittels |
| KR0143993B1 (ko) * | 1988-11-03 | 1998-07-15 | 리차아드 제이 매씨이 | 전기화학 발광성 분석 |
| JPH0363571A (ja) * | 1989-08-02 | 1991-03-19 | Chisso Corp | 大腸菌群の検査キット |
| ZA92803B (en) | 1991-02-06 | 1992-11-25 | Igen Inc | Method and apparatus for magnetic microparticulate based luminescene asay including plurality of magnets |
| IL100867A (en) * | 1991-02-06 | 1995-12-08 | Igen Inc | Method and device for improved luminescence testing |
| IL100866A (en) * | 1991-02-06 | 1995-10-31 | Igen Inc | Luminescence test method and device based on magnetic tiny particles, containing many magnets |
| ATE184320T1 (de) * | 1991-07-10 | 1999-09-15 | Igen Int Inc | Verfahren für verbesserte lumineszenz-assays unter verwendung von teilchenkonzentration und chemilumineszenznachweis |
| ES2146215T3 (es) * | 1991-11-15 | 2000-08-01 | Igen Int Inc | Ensayos rapidos para productos de amplificacion. |
| ZA929351B (en) * | 1991-12-11 | 1993-06-04 | Igen Inc | Electrochemiluminescent label for DNA assays. |
| FR2699170B1 (fr) * | 1992-12-15 | 1995-07-28 | Asulab Sa | Complexes d'un métal de transition à ligands 2,2'-bipyridine substitués par au moins un radical ammonium alkyle, leur procédé de fabrication et leur application comme médiateur redox. |
| US5541113A (en) * | 1993-09-22 | 1996-07-30 | Beckman Instruments, Inc. | Method for detecting an analyte using an electrochemical luminescent transition metal label |
| US5981286A (en) * | 1994-07-25 | 1999-11-09 | Roche Diagnostics, Gmbh | Hydrophilic metal complexes |
| WO1996028538A1 (en) * | 1995-03-10 | 1996-09-19 | Meso Scale Technologies, Llc | Multi-array, multi-specific electrochemiluminescence testing |
| US6319670B1 (en) | 1995-05-09 | 2001-11-20 | Meso Scale Technology Llp | Methods and apparatus for improved luminescence assays using microparticles |
| AU718767B2 (en) | 1995-06-07 | 2000-04-20 | Bioveris Corporation | Electrochemiluminescent enzyme immunoassay |
| JP3574457B2 (ja) * | 1995-09-12 | 2004-10-06 | エーザイ株式会社 | 電気化学発光検出方法と装置 |
| US8527026B2 (en) | 1997-03-04 | 2013-09-03 | Dexcom, Inc. | Device and method for determining analyte levels |
| US6862465B2 (en) | 1997-03-04 | 2005-03-01 | Dexcom, Inc. | Device and method for determining analyte levels |
| US7192450B2 (en) | 2003-05-21 | 2007-03-20 | Dexcom, Inc. | Porous membranes for use with implantable devices |
| US6001067A (en) | 1997-03-04 | 1999-12-14 | Shults; Mark C. | Device and method for determining analyte levels |
| US6613583B1 (en) | 1997-06-27 | 2003-09-02 | Igen International, Inc. | Electrochemiluminescent label based on multimetallic assemblies |
| DE19803528A1 (de) | 1998-01-30 | 1999-08-05 | Roche Diagnostics Gmbh | Verfahren zur Analyse einer Probe mittels eines Elektrochemolumineszenz-Bindungsreaktion-Tests |
| DE19811582A1 (de) * | 1998-03-17 | 1999-09-23 | Roche Diagnostics Gmbh | Stabilisierung und Verstärkung von Elektrochemilumineszenz-Signalen |
| DE19828441A1 (de) * | 1998-06-25 | 1999-12-30 | Roche Diagnostics Gmbh | Verwendung derivatisierter Reagenzien in Chemilumineszenz- und Elektrochemilumineszenz-Nachweisverfahren |
| US6214552B1 (en) | 1998-09-17 | 2001-04-10 | Igen International, Inc. | Assays for measuring nucleic acid damaging activities |
| US6312896B1 (en) | 1998-09-17 | 2001-11-06 | Igen Inaternational, Inc. | Assays for measuring nucleic acid binding proteins and enzyme activities |
| US7041807B1 (en) | 1999-06-23 | 2006-05-09 | Caprion Pharmaceuticals, Inc. | Antibodies to a YYX epitope of a mammalian prion protein |
| WO2003001889A2 (en) | 2001-06-29 | 2003-01-09 | Meso Scale Technologies, Llc. | Assay plates reader systems and methods for luminescence test measurements |
| US20030032874A1 (en) | 2001-07-27 | 2003-02-13 | Dexcom, Inc. | Sensor head for use with implantable devices |
| ATE471369T1 (de) | 2001-07-30 | 2010-07-15 | Meso Scale Technologies Llc | Assay-elektroden mit schichten aus immobilisiertem lipid/protein sowie verfahren zu deren herstellung und verwendung |
| US6919173B2 (en) | 2001-09-10 | 2005-07-19 | Meso Scale Technologies, Llc. | Assay buffer, compositions containing the same, and methods of using the same |
| US8260393B2 (en) | 2003-07-25 | 2012-09-04 | Dexcom, Inc. | Systems and methods for replacing signal data artifacts in a glucose sensor data stream |
| US9282925B2 (en) | 2002-02-12 | 2016-03-15 | Dexcom, Inc. | Systems and methods for replacing signal artifacts in a glucose sensor data stream |
| US8010174B2 (en) | 2003-08-22 | 2011-08-30 | Dexcom, Inc. | Systems and methods for replacing signal artifacts in a glucose sensor data stream |
| US7482116B2 (en) | 2002-06-07 | 2009-01-27 | Dna Genotek Inc. | Compositions and methods for obtaining nucleic acids from sputum |
| US20040072236A1 (en) | 2002-09-27 | 2004-04-15 | Neil Cashman | PrPSc -interacting molecules and uses thereof |
| US8423113B2 (en) | 2003-07-25 | 2013-04-16 | Dexcom, Inc. | Systems and methods for processing sensor data |
| US8160669B2 (en) | 2003-08-01 | 2012-04-17 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US7774145B2 (en) | 2003-08-01 | 2010-08-10 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US20080119703A1 (en) | 2006-10-04 | 2008-05-22 | Mark Brister | Analyte sensor |
| US20190357827A1 (en) | 2003-08-01 | 2019-11-28 | Dexcom, Inc. | Analyte sensor |
| US8761856B2 (en) | 2003-08-01 | 2014-06-24 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US8369919B2 (en) | 2003-08-01 | 2013-02-05 | Dexcom, Inc. | Systems and methods for processing sensor data |
| US7986986B2 (en) | 2003-08-01 | 2011-07-26 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US7591801B2 (en) | 2004-02-26 | 2009-09-22 | Dexcom, Inc. | Integrated delivery device for continuous glucose sensor |
| US20100168542A1 (en) | 2003-08-01 | 2010-07-01 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US8275437B2 (en) | 2003-08-01 | 2012-09-25 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US7778680B2 (en) | 2003-08-01 | 2010-08-17 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US20140121989A1 (en) | 2003-08-22 | 2014-05-01 | Dexcom, Inc. | Systems and methods for processing analyte sensor data |
| US8233959B2 (en) | 2003-08-22 | 2012-07-31 | Dexcom, Inc. | Systems and methods for processing analyte sensor data |
| US7920906B2 (en) | 2005-03-10 | 2011-04-05 | Dexcom, Inc. | System and methods for processing analyte sensor data for sensor calibration |
| US9247900B2 (en) | 2004-07-13 | 2016-02-02 | Dexcom, Inc. | Analyte sensor |
| WO2005051170A2 (en) | 2003-11-19 | 2005-06-09 | Dexcom, Inc. | Integrated receiver for continuous analyte sensor |
| DE602004029092D1 (de) | 2003-12-05 | 2010-10-21 | Dexcom Inc | Kalibrationsmethoden für einen kontinuierlich arbeitenden analytsensor |
| US11633133B2 (en) | 2003-12-05 | 2023-04-25 | Dexcom, Inc. | Dual electrode system for a continuous analyte sensor |
| US8364231B2 (en) | 2006-10-04 | 2013-01-29 | Dexcom, Inc. | Analyte sensor |
| US8423114B2 (en) | 2006-10-04 | 2013-04-16 | Dexcom, Inc. | Dual electrode system for a continuous analyte sensor |
| EP2316331B1 (en) | 2003-12-09 | 2016-06-29 | Dexcom, Inc. | Signal processing for continuous analyte sensor |
| US8808228B2 (en) | 2004-02-26 | 2014-08-19 | Dexcom, Inc. | Integrated medicament delivery device for use with continuous analyte sensor |
| ITTO20040372A1 (it) | 2004-06-01 | 2004-09-01 | Giuseppe Caputo | Composti luminescenti aventi un braccio di legame funzionalizzato. |
| JP5118964B2 (ja) * | 2004-06-23 | 2013-01-16 | ボード・オブ・リージエンツ,ザ・ユニバーシテイ・オブ・テキサス・システム | 2粒子複合体を用いた生物学的分子の検出のための方法及び組成物 |
| US20060270922A1 (en) | 2004-07-13 | 2006-11-30 | Brauker James H | Analyte sensor |
| US8452368B2 (en) | 2004-07-13 | 2013-05-28 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US7713574B2 (en) | 2004-07-13 | 2010-05-11 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US7857760B2 (en) | 2004-07-13 | 2010-12-28 | Dexcom, Inc. | Analyte sensor |
| JPWO2006038686A1 (ja) * | 2004-10-07 | 2008-05-15 | 松下電器産業株式会社 | 遺伝子検出方法、及び遺伝子検出装置 |
| US8211279B2 (en) | 2005-06-03 | 2012-07-03 | Board Of Regents Of The University Of Texas System | Electrochemistry and electrogenerated chemiluminescence with a single faradaic electrode |
| JPWO2007055302A1 (ja) * | 2005-11-10 | 2009-04-30 | 国立大学法人富山大学 | 生体物質と生体物質結合性物質との結合性評価方法 |
| US20080306434A1 (en) | 2007-06-08 | 2008-12-11 | Dexcom, Inc. | Integrated medicament delivery device for use with continuous analyte sensor |
| EP4159114B1 (en) | 2007-10-09 | 2024-04-10 | DexCom, Inc. | Integrated insulin delivery system with continuous glucose sensor |
| US8664396B2 (en) * | 2007-11-21 | 2014-03-04 | Bio-Rad Laboratories, Inc. | Photoluminescent metal complexes for protein staining |
| US8229535B2 (en) | 2008-02-21 | 2012-07-24 | Dexcom, Inc. | Systems and methods for blood glucose monitoring and alert delivery |
| SI2271938T1 (sl) | 2008-04-11 | 2014-07-31 | Board Of Regents Of The University Of Texas System | Postopek in naprava za ojačenje električno generirane kemiluminiscence nanodelcev |
| US8372652B2 (en) * | 2008-05-08 | 2013-02-12 | Board Of Regents Of The University Of Texas System | Luminescent nanostructured materials for use in electrogenerated chemiluminescence |
| AU2014203680B2 (en) * | 2008-05-08 | 2015-03-05 | Board Of Regents Of The University Of Texas System | Luminescent nanostructured materials for use in electrogenerated chemiluminescence |
| US8264347B2 (en) | 2008-06-24 | 2012-09-11 | Trelleborg Sealing Solutions Us, Inc. | Seal system in situ lifetime measurement |
| EP4374790A2 (en) | 2009-04-30 | 2024-05-29 | DexCom, Inc. | Performance reports associated with continuous sensor data from multiple analysis time periods |
| WO2012005588A2 (en) | 2010-07-07 | 2012-01-12 | Vereniging Voor Christelijk Hoger Onderwijs, Wetenschappelijk Onderzoek En Patiëntenzorg | Novel biomarkers for detecting neuronal loss |
| CN103370330B (zh) * | 2011-02-09 | 2016-12-07 | 霍夫曼-拉罗奇有限公司 | 用于ecl的新的基于铱的复合物 |
| EP2697650B1 (en) | 2011-04-15 | 2020-09-30 | Dexcom, Inc. | Advanced analyte sensor calibration and error detection |
| EP2721140B1 (en) | 2011-06-19 | 2016-11-23 | Abogen, Inc. | Devices, solutions and methods for sample collection |
| CA2840971A1 (en) * | 2011-07-07 | 2013-01-10 | Dupont Nutrition Biosciences Aps | Assay |
| US9075042B2 (en) | 2012-05-15 | 2015-07-07 | Wellstat Diagnostics, Llc | Diagnostic systems and cartridges |
| US9213043B2 (en) | 2012-05-15 | 2015-12-15 | Wellstat Diagnostics, Llc | Clinical diagnostic system including instrument and cartridge |
| US9625465B2 (en) | 2012-05-15 | 2017-04-18 | Defined Diagnostics, Llc | Clinical diagnostic systems |
| ES2602206T3 (es) | 2012-08-02 | 2017-02-20 | F. Hoffmann-La Roche Ag | Nuevos complejos de bis-iridio para la elaboración de marcajes EQL |
| US9481903B2 (en) | 2013-03-13 | 2016-11-01 | Roche Molecular Systems, Inc. | Systems and methods for detection of cells using engineered transduction particles |
| EP3699592A1 (en) | 2013-03-13 | 2020-08-26 | Geneweave Biosciences Inc. | Non-replicative transduction particles and transduction particle-based reporter systems |
| US9540675B2 (en) | 2013-10-29 | 2017-01-10 | GeneWeave Biosciences, Inc. | Reagent cartridge and methods for detection of cells |
| JP2017510284A (ja) * | 2014-04-10 | 2017-04-13 | ディーエヌエー ジェノテック インク | 過ヨウ素酸塩を用いる微生物溶解のための方法およびシステム |
| CN107003305B (zh) | 2014-12-08 | 2021-04-02 | 豪夫迈·罗氏有限公司 | 用于测量维生素d的方法 |
| CN107923911A (zh) | 2015-08-20 | 2018-04-17 | 豪夫迈·罗氏有限公司 | 使用聚乙二醇化分析物特异性结合剂的基于颗粒的免疫测定法 |
| US10351893B2 (en) | 2015-10-05 | 2019-07-16 | GeneWeave Biosciences, Inc. | Reagent cartridge for detection of cells |
| KR102437995B1 (ko) | 2016-03-07 | 2022-08-29 | 에프. 호프만-라 로슈 아게 | 항-p53 항체의 검출 |
| ES2974284T3 (es) | 2016-03-11 | 2024-06-26 | Roche Diagnostics Gmbh | Aminas de cadena ramificada en la detección de electroquimioluminiscencia |
| ES2865511T3 (es) | 2017-02-02 | 2021-10-15 | Hoffmann La Roche | Inmunoanálisis que usa al menos dos agentes de unión específica a analito pegilado |
| US11077444B2 (en) | 2017-05-23 | 2021-08-03 | Roche Molecular Systems, Inc. | Packaging for a molecular diagnostic cartridge |
| US11331022B2 (en) | 2017-10-24 | 2022-05-17 | Dexcom, Inc. | Pre-connected analyte sensors |
| EP3700416B1 (en) | 2017-10-24 | 2024-06-26 | Dexcom, Inc. | Pre-connected analyte sensors |
| JP2021522192A (ja) | 2018-04-18 | 2021-08-30 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 新規抗チミジンキナーゼ抗体 |
| WO2019223691A1 (zh) * | 2018-05-21 | 2019-11-28 | 博阳生物科技(上海)有限公司 | 一种化学发光分析测定方法及使用该方法的系统、试剂盒 |
| CN112639475A (zh) | 2018-08-31 | 2021-04-09 | 豪夫迈·罗氏有限公司 | Dlbcl的预后指数中的胸苷激酶(tk-1) |
| WO2021013786A1 (en) | 2019-07-22 | 2021-01-28 | F. Hoffmann-La Roche Ag | S100a6 as blood biomarker for the non-invasive diagnosis of endometriosis |
| BR112022000945A2 (pt) | 2019-07-22 | 2022-03-08 | Hoffmann La Roche | Métodos para avaliar se uma paciente tem endometriose ou está em risco de desenvolver endometriose, para selecionar uma paciente para terapia e para monitorar uma paciente que sofre de endometriose ou que está sendo tratada para endometriose |
| CN114144674A (zh) | 2019-07-22 | 2022-03-04 | 豪夫迈·罗氏有限公司 | P物质作为用于子宫内膜异位症的非侵入性诊断的血液生物标志物 |
| JP7315781B2 (ja) | 2019-07-22 | 2023-07-26 | エフ. ホフマン-ラ ロシュ アーゲー | 子宮内膜症の非侵襲的診断のための血液バイオマーカーとしてのs100a12 |
| KR20220016210A (ko) | 2019-07-22 | 2022-02-08 | 에프. 호프만-라 로슈 아게 | 자궁내막증의 비-침습적 진단용 혈액 생물표지자로써 s100a9 |
| EP4058459A1 (en) | 2019-11-15 | 2022-09-21 | F. Hoffmann-La Roche AG | Derivatization of beta-lactam antibiotics for massspec measurements in patient samples |
| IL300769A (en) | 2020-08-21 | 2023-04-01 | Meso Scale Technologies Llc | Electrochemical cells with auxiliary electrodes having a defined interface potential and methods of using them |
| EP4237441A1 (en) | 2020-11-02 | 2023-09-06 | F. Hoffmann-La Roche AG | Sars-cov-2 nucleocapsid antibodies |
| WO2022207628A1 (en) | 2021-03-30 | 2022-10-06 | F. Hoffmann-La Roche Ag | Scf as blood biomarker for the non-invasive diagnosis of endometriosis |
| WO2022207685A1 (en) | 2021-04-01 | 2022-10-06 | F. Hoffmann-La Roche Ag | Psp94 as blood biomarker for the non-invasive diagnosis of endometriosis |
| WO2022243210A1 (en) | 2021-05-17 | 2022-11-24 | F. Hoffmann-La Roche Ag | sFRP4 AS BLOOD BIOMARKER FOR THE NON-INVASIVE DIAGNOSIS OF ADENOMYOSIS |
| TW202340716A (zh) | 2021-08-13 | 2023-10-16 | 美商梅梭刻度技術公司 | 電化學電池裝置及製造方法 |
| WO2023072904A1 (en) | 2021-10-26 | 2023-05-04 | F. Hoffmann-La Roche Ag | Monoclonal antibodies specific for sars-cov-2 rbd |
| AU2023205230A1 (en) | 2022-01-04 | 2024-06-27 | Meso Scale Technologies, Llc. | Electrochemical cell devices and methods of manufacturing |
| WO2023131594A1 (en) | 2022-01-05 | 2023-07-13 | F. Hoffmann-La Roche Ag | Derivatization of compounds in patient samples for therapeutic drug monitoring (tdm) |
| WO2023247752A1 (en) | 2022-06-23 | 2023-12-28 | F. Hoffmann-La Roche Ag | Method for diagnosing endometriosis and for classifying the stage of endometriosis |
| WO2024017983A1 (en) | 2022-07-22 | 2024-01-25 | F. Hoffmann-La Roche Ag | Meteorin-like protein (metrnl) as (blood) biomarker for the diagnosis of polycystic ovarian syndrome |
| WO2024017985A1 (en) | 2022-07-22 | 2024-01-25 | F. Hoffmann-La Roche Ag | Fibroblast growth factor binding protein 1 (fgfbp1) as (blood) biomarker for the diagnosis of polycystic ovarian syndrome |
| WO2024017982A1 (en) | 2022-07-22 | 2024-01-25 | F. Hoffmann-La Roche Ag | Leukotriene a4 hydrolase (lta4h) as (blood) biomarker for the diagnosis of polycystic ovarian syndrome |
| CN116832862B (zh) * | 2023-05-23 | 2024-06-25 | 杭州师范大学 | 一种超薄金-锰纳米复合材料、制备方法及其在检测领域中的应用 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL49685A (en) * | 1976-05-31 | 1978-10-31 | Technion Res & Dev Foundation | Specific binding assay method for determining the concentration of materials and reagent means therefor |
| US4233144A (en) * | 1979-04-16 | 1980-11-11 | Technicon Instruments Corporation | Electrode for voltammetric immunoassay |
| US4280815A (en) * | 1979-06-18 | 1981-07-28 | Technicon Instruments Corporation | Electrochemiluminescent immunoassay and apparatus therefor |
| WO1981001883A1 (en) * | 1979-12-19 | 1981-07-09 | Electro Nucleonics | Chemical luminescence amplification substrate system for immunochemistry |
| US4293310A (en) * | 1980-03-14 | 1981-10-06 | University Of Pittsburgh | Photoelectrochemical immunoassay |
| AR231590A1 (es) * | 1981-04-29 | 1984-12-28 | Ciba Geigy Ag | Dispositivo de analisis inmunologico y procedimiento para obtenerlo |
| US4514508A (en) * | 1982-07-06 | 1985-04-30 | Biond Inc. | Assaying for a multiplicity of antigens or antibodies with a detection compound |
| GB2135773B (en) * | 1983-01-31 | 1985-12-04 | Boots Celltech Diagnostics | Enzyme inhibitor labelled immunoassay |
| EP0139373A1 (en) * | 1983-08-26 | 1985-05-02 | The Regents Of The University Of California | Multiple immunoassay system |
| IL75464A (en) * | 1984-06-12 | 1990-08-31 | Orgenics Ltd | Method and apparatus for multi-analyte assay |
| CA1340372C (en) * | 1984-07-09 | 1999-02-02 | John D. Clements | Production of e. coli lt-b enterotoxin subunit |
| DK365785A (da) * | 1984-09-17 | 1986-03-18 | Hoffmann La Roche | Metalcomplexer |
| US4617265A (en) * | 1984-09-19 | 1986-10-14 | Board Of Regents, University Of Texas System | Colony blot assay for enterotoxigenic bacteria |
| US5238808A (en) * | 1984-10-31 | 1993-08-24 | Igen, Inc. | Luminescent metal chelate labels and means for detection |
| US5120662A (en) * | 1989-05-09 | 1992-06-09 | Abbott Laboratories | Multilayer solid phase immunoassay support and method of use |
-
1987
- 1987-04-30 JP JP62503860A patent/JPH0737464B2/ja not_active Expired - Fee Related
- 1987-04-30 CA CA000536079A patent/CA1339465C/en not_active Expired - Lifetime
- 1987-04-30 EP EP87904151A patent/EP0265519B1/en not_active Expired - Lifetime
- 1987-04-30 AT AT87904151T patent/ATE127923T1/de not_active IP Right Cessation
- 1987-04-30 EP EP94120516A patent/EP0658564B1/en not_active Expired - Lifetime
- 1987-04-30 KR KR1019870701252A patent/KR960016340B1/ko not_active IP Right Cessation
- 1987-04-30 AT AT94120516T patent/ATE212030T1/de not_active IP Right Cessation
- 1987-04-30 DE DE3752345T patent/DE3752345T2/de not_active Expired - Lifetime
- 1987-04-30 WO PCT/US1987/000987 patent/WO1987006706A1/en active IP Right Grant
- 1987-04-30 EP EP94120254A patent/EP0647849A3/en not_active Ceased
- 1987-04-30 DE DE3751516T patent/DE3751516T2/de not_active Expired - Lifetime
- 1987-05-01 IL IL82411A patent/IL82411A0/xx not_active IP Right Cessation
- 1987-12-28 FI FI875732A patent/FI102017B/fi not_active IP Right Cessation
- 1987-12-29 NO NO875476A patent/NO176071C/no unknown
-
1991
- 1991-04-10 AU AU74338/91A patent/AU644150B2/en not_active Expired
-
1993
- 1993-02-12 DK DK199300162A patent/DK173025B1/da not_active IP Right Cessation
-
1994
- 1994-03-02 AU AU57540/94A patent/AU685071B2/en not_active Expired
- 1994-09-08 JP JP6251174A patent/JP2674957B2/ja not_active Expired - Lifetime
- 1994-11-09 JP JP27517494A patent/JP3349279B2/ja not_active Expired - Lifetime
-
1996
- 1996-06-26 JP JP8166280A patent/JP2648474B2/ja not_active Expired - Lifetime
-
1998
- 1998-06-24 HK HK98106428A patent/HK1007442A1/xx not_active IP Right Cessation
- 1998-07-06 JP JP19061598A patent/JP3476679B2/ja not_active Expired - Lifetime
- 1998-12-23 HK HK98115071A patent/HK1013653A1/xx not_active IP Right Cessation
-
2002
- 2002-07-12 JP JP2002204082A patent/JP3509812B2/ja not_active Expired - Lifetime
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20110111399A (ko) * | 2008-12-15 | 2011-10-11 | 꼼미사리아 아 레네르지 아또미끄 에 오 에네르지 알떼르나띠브스 | 화학 원소의 비침투적 검출을 위한 방법 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR960016340B1 (ko) | 전기화학발광 분석법 | |
| US6316607B1 (en) | Electrochemiluminescent assays | |
| US6468741B1 (en) | Electrochemiluminescent rhenium moieties | |
| US5731147A (en) | Luminescent metal chelate labels and means for detection | |
| EP0747706A1 (en) | Adduct protection assay | |
| US6916606B2 (en) | Electrochemiluminescent assays | |
| EP0674176B1 (en) | Luminescent rhenium complexes and methods of production | |
| Motson et al. | Potential applications for the use of lanthanide complexes as luminescent biolabels | |
| AU605158C (en) | Electrochemiluminescent assays | |
| DK172940B1 (da) | Fremgangsmåde til kvalitativ og kvantitativ elektrokemiluminescerende analysering af multikomponentvæsker | |
| IL101990A (en) | Conjugate of ruthenium- or osmium- containing electrochemiluminescent chemical moieties | |
| WO1997032886A1 (en) | Ecl labels having improved nsb properties |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| G160 | Decision to publish patent application | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20061201 Year of fee payment: 11 |
|
| EXPY | Expiration of term |