KR20200036004A - Jak 키나아제 억제제로서 피라졸로 및 트리아졸로 비시클릭 화합물 - Google Patents
Jak 키나아제 억제제로서 피라졸로 및 트리아졸로 비시클릭 화합물 Download PDFInfo
- Publication number
- KR20200036004A KR20200036004A KR1020207005956A KR20207005956A KR20200036004A KR 20200036004 A KR20200036004 A KR 20200036004A KR 1020207005956 A KR1020207005956 A KR 1020207005956A KR 20207005956 A KR20207005956 A KR 20207005956A KR 20200036004 A KR20200036004 A KR 20200036004A
- Authority
- KR
- South Korea
- Prior art keywords
- group
- compound
- pharmaceutically acceptable
- mmol
- acceptable salt
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/416—1,2-Diazoles condensed with carbocyclic ring systems, e.g. indazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/54—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings condensed with carbocyclic rings or ring systems
- C07D231/56—Benzopyrazoles; Hydrogenated benzopyrazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Dermatology (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
본 발명은 JAK 키나아제 억제제, 보다 구체적으로는 JAK1, JAK2 및 TYK2와 같은 JAK 키나아제 패밀리의 다른 구성원보다 JAK3에 대해 선택적인 JAK3 억제제로서 유용한, 피라졸로 및 트리아졸로 비시클릭 화합물에 관한 것이다. 본 발명은 또한 결정형, 상기 화합물을 포함하는 약학적 조성물, 상기 화합물을 사용하여 염증성 질환을 치료하는 방법, 및 상기 화합물을 제조하는데 유용한 방법 및 중간체에 관한 것이다.
궤양성 대장염은 결장의 만성 염증성 질환이다. 이 질환은 직장 점막층과 대장의 염증 및 궤양을 특징으로 한다. 일반적인 증상으로는 설사, 혈변 및 복통을 포함한다. 임상 과정은 간헐적이며, 악화와 완화의 교대 기간 (alternating periods)으로 표시된다. 개발 도상국보다 선진국에서 발생률이 더 큰 것으로 보인다. 주요 선진국에서 대략 120만 명이 궤양성 대장염으로 고통받고 있으며 인구 증가와 함께 숫자도 증가할 것으로 예상된다. 궤양성 대장염 환자는 결장 직장암 발병 위험이 높아진다. (예를 들어, Danese et al. N Engl J Med, 2011, 365, 1713-1725). 환자에서 궤양성 대장염 (UC)의 완화를 촉진하고 유지하기 위한 다양한 치료 옵션이 있지만, 이상적인 것은 없다. 만성, 전신 면역 억제로 인한 안전성 문제없이 중등도 내지 중증 UC의 완화를 촉진하고 유지하기 위한 효과적인 요법에 대한 의학적 요구가 여전히 충족되지 않고 있다.
UC의 정확한 병인은 불분명하지만, 염증유발 (proinflammatory) 사이토카인이 면역학적 반응에서 중추적인 역할을 하는 것이 명백하다 (Strober et al., Gastroenterol, 2011, 140, 1756-1767). UC에서 가장 일반적으로 상승된 많은 염증유발 사이토카인 (예를 들어, IL-4, IL-6, IL-13, IL-15, IL-23, IL-24, IFNγ 및 렙틴)은 신호 전달을 위한 티로신 키나아제의 JAK 패밀리 (즉, JAK1, JAK2, JAK3 및 Tyk2)에 의존한다.
JAK3 효소의 억제는 많은 주요 염증유발 사이토카인의 신호를 차단한다. 따라서 JAK3 억제제는 궤양성 대장염 및 다른 위장관 염증성 질환, 예컨대 크론병 및 면역 체크포인트 억제제 유도성 대장염의 치료에 유용할 것으로 보인다. JAK3 억제제는 또한 아토피성 피부염과 같은 염증성 피부 질환 및 알레르기성 비염, 천식 및 만성 폐쇄성 폐 질환 (COPD)과 같은 염증성 호흡기 질환의 치료에 유용할 것으로 보인다. 또한, JAK3 억제제는 포도막염, 당뇨병성 망막병증, 당뇨병성 황반부종, 안구 건조증, 노화 관련 황반 변성, 망막 정맥 폐색 (RVO) 및 아토피성 각결막염과 같은 염증이 주요한 역할을 하는 많은 안질환의 치료에 유용할 수 있다.
JAK1 보다 JAK3에 대한 선택성은 JAK3 선택성이 점막 치유에 관여하는 IL-10, 점액 장벽 보호 및 상피 재생에 관여하는 IL-22 및 장 상피 세포의 증식에 관여하는 IL-6와 같은 잠재적으로 유익한 사이토카인의 절약을 허용한다는 증거가 있기 때문에 유익할 것으로 예상된다. JAK2 보다 JAK3에 대한 선택성은 또한 에리트로포이에틴 (EPO) 및 트롬보포이에틴 (TPO) 신호의 절약을 허용한다. 따라서, JAK1, JAK2 및 TYK2와 같은 JAK 키나아제 패밀리의 다른 구성원에 비해 선택적 JAK3 억제제인 새로운 화합물을 제공하는 것이 바람직할 것이다.
마지막으로, 면역계에 대한 JAK/STAT 경로의 조절 효과로 인해, JAK 억제제에 대한 전신 노출은 유해 전신 면역 억제 효과를 가질 수 있다. 따라서, 유의한 전신 효과 없이 작용 부위에서 효과를 갖는 새로운 JAK3 억제제를 제공하는 것이 바람직할 것이다. 특히, 궤양성 대장염과 같은 위장관 염증성 질환의 치료를 위해, 경구로 투여될 수 있고 최소한의 전신 노출로 위장관에서 치료적으로 관련된 노출을 달성할 수 있는 새로운 JAK3 억제제를 제공하는 것이 바람직할 것이다. 피부 질환의 경우, 최소 전신 노출로 피부에 국소적으로 투여될 수 있는 새로운 JAK3 억제제를 제공하는 것이 바람직할 것이다.
따라서, JAK1, JAK2 및 TYK2와 같은 JAK 키나아제 패밀리의 다른 구성원에 비해 선택적 JAK3 억제제이고, 최소의 전신 노출을 갖는 새로운 화합물을 제공하는 것이 바람직하다.
일 양상에서, 본 발명은 JAK 키나아제 억제제, 보다 구체적으로 JAK3 억제제로서 활성을 갖는 신규한 화합물을 제공한다.
따라서, 본 발명은 하기 화학식 (I)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(I)
상기에서 X1 및 X2는 각각 독립적으로 N 및 CH로부터 선택되고;
X3은 N, CH, C-CH3, C-CF3, C-CHF2, C-CH2-O-CH3, C-SMe, C-NMe2, C-NH-CH3, C-Cl, C-CN 및 C-OMe로 이루어진 군으로부터 선택되며;
Ra, Rb, Rc 및 Rf는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되며;
Rd, Re, Rg, Rh, Ri, Rj, Rl, Rm, Rn 및 Ro는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되고, 상기 C1-3 알킬기는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있으며;
선택적으로 Rd 및 Re는 연결되어 시클로프로필 고리를 형성할 수 있고;
A는 (a) 하나의 질소 원자를 포함하고 선택적으로 N, S, S(O)2 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 10 원의 모노시클릭 헤테로시클릭기, 및
(b) 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 6 내지 10 원의 멀티시클릭 헤테로시클릭기로 이루어진 군으로부터 선택되며,
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 3 개의 Rk기로 선택적으로 치환되고;
각 Rk는 F, CN, C1-3 알콕시, 시클로프로필 및 C1-3 알킬로 이루어진 군으로부터 독립적으로 선택되며, 상기 C1-3 알킬기는 OH, OMe 또는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있고;
상기 Rp 및 Rq는 각각 독립적으로 H, C3-5 시클로알킬 및 C1-6 알킬로 이루어진 군으로부터 선택되고, 상기 C1-6 알킬기는 C1-3 알콕시 및 -S-C1-3 알킬로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환될 수 있거나,
또는 Rp 및 Rq는 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기를 형성하고, 상기 4 내지 6 원의 모노시클릭 헤테로시클릭기는 C1-6 알킬, C1-3 알콕시, -S-C1-3 알킬 및 -C1-3 알킬-C1-3 알콕시로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환되며;
R2는 H, Cl, OMe, Me 및 F로 이루어진 군으로부터 선택되고;
R3은 H 및 F로 이루어진 군으로부터 선택되며;
R4는 H 및 F로 이루어진 군으로부터 선택되고;
R5는 H, Me 및 F로 이루어진 군으로부터 선택된다.
본 개시내용은 또한 특정 화합물의 일부 결정형인, 결정형 1, 결정형 2, 결정형 2b, 결정형 3 및 결정형 4를 제공한다.
본 발명은 또한 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 본 개시내용의 결정형 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물을 제공한다.
본 발명은 또한 포유 동물에서 위장관 염증성 질환, 특히 궤양성 대장염을 치료하는 방법을 제공하고, 상기 방법은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 본 개시내용의 결정형 또는 본 개시내용의 약학적 조성물을 상기 포유 동물에게 투여하는 단계를 포함한다.
본 발명은 또한 포유 동물에서 피부의 염증성 질환 또는 장애를 치료하는 방법을 제공하고, 상기 방법은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 본 개시내용의 약학적 조성물을 상기 포유 동물의 피부에 적용하는 단계를 포함하는 방법을 제공한다.
본 발명은 또한 포유 동물에서 피부 T-세포 림프종을 치료하는 방법을 제공하고, 상기 방법은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염을 포함하는 약학적 조성물을 상기 포유 동물의 피부에 적용하는 단계를 포함한다.
다른 양상에서, 본 발명은 또한 본 개시내용의 화합물을 제조하는데 유용한 본원에 기재된 방법을 제공한다.
본 발명은 또한 의학적 치료에 사용하기 위한 본원에 기재된 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염뿐만 아니라 포유 동물에서 위장관 염증성 질환 또는 피부의 염증성 질환 치료용 제제 또는 의약의 제조에서 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형의 용도를 제공한다.
본 발명의 다양한 양상은 첨부 도면을 참조하여 예시된다.
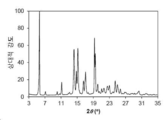
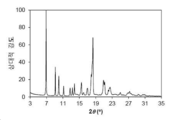
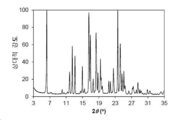
도 1은 화합물 3의 결정형 1 (이하 결정형 1)의 분말 X-선 회절 (powder x-ray diffraction: PXRD) 패턴을 나타낸다.
도 2는 결정형 1의 시차 주사 열량 측정 (differential scanning calorimetry: DSC) 서모그램을 나타낸다.
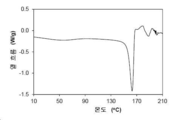
도 3은 결정형 1의 열 중량 분석 (thermal gravimetric analysis: TGA) 플롯을 나타낸다.
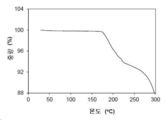
도 4는 약 25 ℃의 온도에서 관찰된 결정형 1의 동적 수분 흡착 (dynamic moisture sorption: DMS) 등온선을 나타낸다.
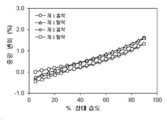
도 5는 화합물 3의 결정형 2 (이하 결정형 2)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
도 6은 결정형 2의 시차 주사 열량 측정 (DSC) 서모그램을 나타낸다.
도 7은 결정형 2의 열 중량 분석 (TGA) 플롯을 나타낸다.
도 8은 약 25 ℃의 온도에서 관찰된 결정형 2의 동적 수분 흡착 (DMS) 등온선을 나타낸다.
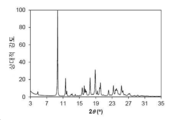
도 9는 화합물 1의 결정형 3 (이하 결정형 3)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
도 10은 결정형 3의 시차 주사 열량 측정 (DSC) 서모그램을 나타낸다.
도 11은 결정형 3의 열 중량 분석 (TGA) 플롯을 나타낸다.
도 12는 약 25 ℃의 온도에서 관찰된 결정형 3의 동적 수분 흡착 (DMS) 등온선을 나타낸다.
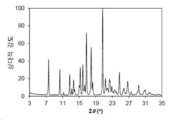
도 13은 화합물 1의 결정형 4 (이하 결정형 4)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
도 14는 결정형 4의 시차 주사 열량 측정 (DSC) 서모그램을 나타낸다.
도 15는 결정형 4의 열 중량 분석 (TGA) 플롯을 나타낸다.
도 16은 약 25 ℃의 온도에서 관찰된 결정형 4의 동적 수분 흡착 (DMS) 등온선을 나타낸다.
도 17은 화합물 3의 무수 결정형 (이하 결정형 2b)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
도 1은 화합물 3의 결정형 1 (이하 결정형 1)의 분말 X-선 회절 (powder x-ray diffraction: PXRD) 패턴을 나타낸다.
도 2는 결정형 1의 시차 주사 열량 측정 (differential scanning calorimetry: DSC) 서모그램을 나타낸다.
도 3은 결정형 1의 열 중량 분석 (thermal gravimetric analysis: TGA) 플롯을 나타낸다.
도 4는 약 25 ℃의 온도에서 관찰된 결정형 1의 동적 수분 흡착 (dynamic moisture sorption: DMS) 등온선을 나타낸다.
도 5는 화합물 3의 결정형 2 (이하 결정형 2)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
도 6은 결정형 2의 시차 주사 열량 측정 (DSC) 서모그램을 나타낸다.
도 7은 결정형 2의 열 중량 분석 (TGA) 플롯을 나타낸다.
도 8은 약 25 ℃의 온도에서 관찰된 결정형 2의 동적 수분 흡착 (DMS) 등온선을 나타낸다.
도 9는 화합물 1의 결정형 3 (이하 결정형 3)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
도 10은 결정형 3의 시차 주사 열량 측정 (DSC) 서모그램을 나타낸다.
도 11은 결정형 3의 열 중량 분석 (TGA) 플롯을 나타낸다.
도 12는 약 25 ℃의 온도에서 관찰된 결정형 3의 동적 수분 흡착 (DMS) 등온선을 나타낸다.
도 13은 화합물 1의 결정형 4 (이하 결정형 4)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
도 14는 결정형 4의 시차 주사 열량 측정 (DSC) 서모그램을 나타낸다.
도 15는 결정형 4의 열 중량 분석 (TGA) 플롯을 나타낸다.
도 16은 약 25 ℃의 온도에서 관찰된 결정형 4의 동적 수분 흡착 (DMS) 등온선을 나타낸다.
도 17은 화합물 3의 무수 결정형 (이하 결정형 2b)의 분말 X-선 회절 (PXRD) 패턴을 나타낸다.
다른 양상들 중에서, 본 발명은 JAK1, JAK2 및 TYK2와 같은 JAK 키나아제 패밀리의 다른 구성원에 비해 JAK3에 대해 선택적인 화학식 (I)의 JAK 키나아제 억제제, 이의 약학적으로 허용가능한 염 및 이의 제조를 위한 중간체를 제공한다.
일 양상에서, 본 발명은 JAK 키나아제 억제제, 특히 JAK3 키나아제 억제제로서 활성을 갖는 신규한 화합물을 제공한다.
따라서, 본 발명은 하기 화학식 (I)의 화합물 및 이의 약학적으로 허용가능한 염을 제공한다:
(I)
상기에서 X1 및 X2는 각각 독립적으로 N 및 CH로부터 선택되고;
X3은 N, CH, C-CH3, C-CF3, C-CHF2, C-CH2-O-CH3, C-SMe, C-NMe2, C-NH-CH3, C-Cl, C-CN 및 C-OMe로 이루어진 군으로부터 선택되며;
Ra, Rb, Rc 및 Rf는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되며;
Rd, Re, Rg, Rh, Ri, Rj, Rl, Rm, Rn 및 Ro는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되고, 상기 C1-3 알킬기는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있으며; 선택적으로 Rd 및 Re는 결합되어 시클로프로필 고리를 형성할 수 있고;
A는 (a) 하나의 질소 원자를 포함하고 선택적으로 N, S, S(O)2 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 10 원의 모노시클릭 헤테로시클릭기, 및
(b) 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 6 내지 10 원의 멀티시클릭 헤테로시클릭기로 이루어진 군으로부터 선택되며,
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 3 개의 Rk기로 선택적으로 치환되고;
각 Rk는 F, CN, C1-3 알콕시, 시클로프로필 및 C1-3 알킬로 이루어진 군으로부터 독립적으로 선택되며, 상기 C1-3 알킬기는 OH, OMe 또는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있고;
상기 Rp 및 Rq는 각각 독립적으로 H, C3-5 시클로알킬 및 C1-6 알킬로 이루어진 군으로부터 선택되고, 상기 C1-6 알킬기는 C1-3 알콕시 및 -S-C1-3 알킬로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환될 수 있거나,
또는 Rp 및 Rq는 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기를 형성하고, 상기 4 내지 6 원의 모노시클릭 헤테로시클릭기는 C1-6 알킬, C1-3 알콕시, -S-C1-3 알킬 및 -C1-3 알킬-C1-3 알콕시로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환되며;
R2는 H, Cl, OMe, Me 및 F로 이루어진 군으로부터 선택되고;
R3은 H 및 F로 이루어진 군으로부터 선택되며;
R4는 H 및 F로 이루어진 군으로부터 선택되고;
R5는 H, Me 및 F로 이루어진 군으로부터 선택된다.
일부 구체예에서, X3는 CH이다.
일부 구체예에서, Rp 및 Rq는 각각 독립적으로 H, 시클로부틸 및 C1-4 알킬로 이루어진 군으로부터 선택되고, 상기 C1-4 알킬기는 C1-2 알콕시 및 -S-C1-2 알킬로 이루어진 군으로부터 독립적으로 선택된 1 또는 2 개의 치환기로 선택적으로 치환될 수 있거나,
또는 Rp 및 Rq는 하나의 질소 원자를 포함하고 선택적으로 S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기를 형성하고, 상기 4 내지 6 원의 모노시클릭 헤테로시클릭기는 C1-3 알킬, C1-2 알콕시, -S-C1-2 알킬 및 -C1-3 알킬 -C1-2 알콕시로 이루어진 군으로부터 독립적으로 선택된 1 또는 2 개의 치환기로 선택적으로 치환된다.
일부 구체예에서, Rp 및 Rq는 각각 독립적으로 H, 시클로부틸 및 C1-4 알킬로 이루어진 군으로부터 선택되고, 상기 C1-4 알킬기는 OMe 및 -SEt로 이루어진 군으로부터 독립적으로 선택된 1 또는 2 개의 치환기로 선택적으로 치환될 수 있거나,
또는 Rp 및 Rq는 하나의 질소 원자를 포함하고 선택적으로 S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기를 형성하고, 상기 4 내지 6 원의 모노시클릭 헤테로시클릭기는 Me, OMe, CH2OMe 및 -SMe로 이루어진 군으로부터 독립적으로 선택된 1 또는 2 개의 치환기로 선택적으로 치환된다.
일부 구체예에서, R1은 하기로 이루어진 군으로부터 선택된다:
상기 6 내지 10 원의 멀티시클릭 헤테로시클릭기는 스피로-시클릭 (spiro-cyclic), 융합 (fused) 및/또는 브릿지 (bridged)될 수 있다.
일부 구체예에서, 상기 6 내지 10 원의 멀티시클릭 헤테로시클릭기는 스피로-시클릭 헤테로시클릭기이다. 일부 구체예에서, 상기 6 내지 10 원의 멀티시클릭 헤테로시클릭기는 융합된 헤테로시클릭기이다. 일부 구체예에서, 상기 6 내지 10 원의 멀티시클릭 헤테로시클릭기는 브릿지된 헤테로시클릭기이다.
일부 구체예에서, A는 (a) 하나의 질소 원자를 포함하고 선택적으로 N, S, S(O)2 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 8 원의 모노시클릭 헤테로시클릭기, 및
(b) 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 6 내지 10 원의 멀티시클릭 헤테로시클릭기로 이루어진 군으로부터 선택되며,
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 3 개의 Rk기로 선택적으로 치환된다.
일부 구체예에서, A는 (a) 하나의 질소 원자를 포함하고 선택적으로 N, S, S(O)2 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기, 및
(b) 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 6 내지 10 원의 멀티시클릭 헤테로시클릭기로 이루어진 군으로부터 선택되며,
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 3 개의 Rk기로 선택적으로 치환된다.
일부 구체예에서, A는 (a) 하나의 질소 원자를 포함하고 선택적으로 N, S, S(O)2 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기, 및
(b) 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 7 또는 8 원의 멀티시클릭 헤테로시클릭기로 이루어진 군으로부터 선택되며,
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 3 개의 Rk기로 선택적으로 치환된다.
일부 구체예에서, A는 아제티딘, 피롤리딘, 피페리딘, 모르폴린, 2-아자스피로[3.3]헵탄, 티오모르폴린 및 노르트로판 (nortropane)으로 이루어진 군으로부터 선택된다.
일부 구체예에서, X1 및 X2는 둘 다 CH이다. 일부 구체예에서, X1은 N이고 X2는 CH이다. 일부 구체예에서, X1 및 X2는 둘 다 N이다. 일부 구체예에서, X1은 CH이고 X2는 N이다.
일부 구체예에서, R2는 H이다. 일부 구체예에서, R2는 F이다. 일부 구체예에서, R2는 Cl이다. 일부 구체예에서, R2는 OMe이다. 일부 구체예에서, R2는 Me이다. 일부 구체예에서, R3은 H이다. 일부 구체예에서, R3은 F이다. 일부 구체예에서, R4는 H이다. 일부 구체예에서, R4는 F이다. 일부 구체예에서, R5는 H이다. 일부 구체예에서, R5는 F이다. 일부 구체예에서, R5는 Me이다.
본 발명은 또한 하기 화학식 (II)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(II)
상기에서 X1 및 X2는 모두 CH이거나, 또는 X1 및 X2는 모두 N이거나, 또는 X1은 N이고 X2는 CH이고;
Rc, Rd 및 Re는 각각 독립적으로 H 및 메틸로 이루어진 군으로부터 선택되고;
A는 아제티딘, 피롤리딘, 피페리딘 및 모르폴린으로 이루어진 군으로부터 선택되며;
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 2 개의 Rk기로 선택적으로 치환되며;
각 Rk는 독립적으로 F, CN, 메틸, 에틸 및 C1-2 할로알킬로 이루어진 군으로부터 선택되고;
R2는 H, Cl, 및 F으로 이루어진 군으로부터 선택된다.
일부 구체예에서, 상기 화합물은 하기 화학식을 갖는다:
일부 구체예에서, 상기 화합물은 하기 화학식을 갖는다:
본 개시내용은 또한 하기 화학식 (Ia) 또는 (IIa)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(Ia)
(IIa)
상기 변수는 상기 구체예에서 정의된 바와 같다.
본 개시내용은 또한 하기 화학식 (Ib) 또는 (IIb)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(Ib)
(IIb)
상기 변수는 상기 구체예에서 정의된 바와 같다.
본 개시내용은 또한 하기 화학식 (Ic) 또는 (IIc)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(Ic)
(IIc)
상기 변수는 상기 구체예에서 정의된 바와 같다.
본 개시내용은 또한 하기 화학식 (Id) 또는 (IId)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(Id)
(IId)
상기 변수는 상기 구체예에서 정의된 바와 같다.
본 개시내용은 또한 하기 화학식 (Ie) 또는 (IIe)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(Ie)
(IIe)
상기 변수는 상기 구체예에서 정의된 바와 같다.
본 개시내용은 또한 하기 화학식 (If), (IIf), (IIIf), (IVf), (Vf), (VIf), (VIIf) 또는 (VIIIf)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(If)
(IIf)
(IIIf)
(IVf)
(Vf)
(VIf)
(VIIf)
(VIIIf)
상기 변수는 상기 구체예에서 정의된 바와 같다.
본 발명은 또한 하기로 이루어진 군으로부터 선택된 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
본 발명은 또한 하기 화학식 (B)를 갖는 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(B)
상기 X1 및 X2는 각각 독립적으로 N 및 CH로부터 선택되고;
Rd 및 Re는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되며; 선택적으로 Rd 및 Re는 결합되어 시클로프로필 고리를 형성할 수 있고;
Rk1은 H, F, CN, OMe 및 C1-3 알킬로 이루어진 군으로부터 선택되며;
Rk2는 H 및 메틸로 이루어진 군으로부터 선택되고;
R2는 H, Cl 및 F로 이루어진 군으로부터 선택된다.
일부 구체예에서, Rd 및 Re는 각각 독립적으로 H 및 메틸로 이루어진 군으로부터 선택되고; 선택적으로 Rd 및 Re는 결합되어 시클로프로필 고리를 형성할 수 있으며; Rk1은 H, F, CN, OMe, 메틸 및 에틸로 이루어진 군으로부터 선택된다.
본 발명은 또한 하기 화학식 (C)를 갖는 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
(C)
상기 X1 및 X2는 모두 CH이거나, 또는 X1 및 X2는 모두 N이거나, 또는 X1은 N이고 X2는 CH이고;
Rd 및 Re는 각각 독립적으로 H 및 메틸로 이루어진 군으로부터 선택되며;
Rk는 H, CN, 메틸 및 에틸로 이루어진 군으로부터 선택되고;
R2는 H, Cl, 및 F로 이루어진 군으로부터 선택된다.
일부 구체예에서, 상기 화합물 또는 이의 약학적으로 허용가능한 염은 하기로 이루어진 군으로부터 선택된다:
본 발명은 또한 하기 화학식을 갖는 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
본 발명은 또한 하기 화학식을 갖는 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
본 발명은 또한 하기 화학식을 갖는 화합물 또는 이의 약학적으로 허용가능한 염을 제공한다:
본 발명은 또한 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물을 제공한다. 일부 구체예에서, 상기 약학적 조성물은 하나 이상의 다른 치료제를 추가로 포함한다. 일부 구체예에서, 상기 하나 이상의 다른 치료제는 위장관 염증성 질환, 피부의 염증성 질환, 폐의 염증성 질환 또는 눈의 염증성 질환을 치료하는데 유용하다. 일부 구체예에서, 상기 하나 이상의 다른 치료제는 위장관 염증성 질환을 치료하는데 유용하다. 일부 구체예에서, 상기 위장관 염증성 질환은 궤양성 대장염이다. 일부 구체예에서, 위장관 염증성 질환은 크론병이다.
또한, 일부 화합물은 때때로 토토머 (tautomeric) 형태로 존재할 수 있다. 구조가 특정 형태로 도시되거나 명명되었지만, 본 발명은 또한 이의 토토머를 포함하는 것으로 이해될 것이다.
본 발명의 화합물은 하나 이상의 키랄 (chiral) 중심을 포함할 수 있으므로, 이러한 화합물 (및 이의 중간체)은 라세미 (racemic) 혼합물; 순수한 입체 이성질체 (즉, 거울상 이성질체 또는 부분 입체 이성질체); 입체 이성질체-풍부 (stereoisomer-enriched) 혼합물 등으로 존재할 수 있다.
키랄 중심에서 정의된 입체 화학 없이 본원에 도시되거나 명명된 키랄 화합물은 달리 지시되지 않는 한 정의되지 않은 입체 중심에서 임의의 또는 모든 가능한 입체 이성질체 변이를 포함하는 것으로 의도된다. 특정 입체 이성질체의 묘사 또는 명명은, 도시되거나 명명된 화합물의 유용성이 다른 입체 이성질체의 존재에 의해 제거되지 않는다면, 달리 지시되지 않는 한 소량의 다른 입체 이성질체가 또한 존재할 수 있음을 이해하여 지시된 입체 중심이 지정된 입체 화학을 갖는다는 것을 의미한다.
본 발명은 또한 본 개시내용의 동위 원소-표지된 화합물, 예를 들어 동위 원소-표지된 화학식 (I), (II), (B), (C)의 화합물, 화합물 1, 화합물 3, 화합물 4, 즉 원자가 동일한 원자 번호를 갖지만 자연에서 지배적인 원자 질량과 다른 원자 질량을 갖는 원자로 대체되거나 풍부한 본 개시내용의 화합물 및 화학식 (I), (II), (B), (C)의 화합물, 화합물 1, 화합물 3, 화합물 4를 포함한다. 본 개시내용의 화합물 및 화학식 (I), (II), (B), (C)의 화합물, 화합물 1, 화합물 3, 화합물 4에 통합될 수 있는 동위 원소의 예는 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 35S 및 18F을 포함하나 이에 제한되지 않는다. 삼중 수소 또는 탄소-14가 풍부한 본 개시내용의 화합물 및 화학식 (I), (II), (B), (C)의 화합물, 화합물 1, 화합물 3 및 화합물 4가 특히 흥미로우며, 이러한 화합물은 예를 들어 조직 분포 연구에 사용될 수 있다. 또한, 특히 대사 부위에서 중수소가 풍부한 본 개시내용의 화합물 및 화학식 (I), (II), (B), (C)의 화합물, 화합물 1, 화합물 3, 화합물 4가 특히 흥미로우며, 이러한 화합물은 대사 안정성이 더 높을 것으로 예상된다. 또한, 11C, 18F, 15O 및 13N와 같은 양전자 방출 동위 원소가 풍부한 본 개시내용의 화합물 및 화학식 (I), (II), (B), (C)의 화합물, 화합물 1, 화합물 3, 화합물 4가 특히 흥미로우며, 이러한 화합물은 예를 들어, 양전자방출단층촬영 (Positron Emission Tomography: PET) 연구에서 사용될 수 있다.
정의
본 발명의 다양한 양상 및 구체예를 포함하여 본 발명을 설명할 때, 달리 지시되지 않는 한, 하기 용어는 하기의 의미를 갖는다.
용어 "알킬"은 선형 또는 분지형 또는 이들의 조합일 수 있는 1가 포화 탄화수소기를 의미한다. 달리 정의되지 않는 한, 이러한 알킬기는 전형적으로 1 내지 10 개의 탄소 원자를 포함한다. 대표적인 알킬기는 예를 들어 메틸 (Me), 에틸 (Et), n-프로필 (n-Pr) 또는 (nPr), 이소프로필 (i-Pr) 또는 (iPr), n-부틸 (n-Bu) 또는 (nBu), sec-부틸, 이소부틸, tert-부틸 (t-Bu) 또는 (tBu), n-펜틸, n-헥실, 2,2-디메틸프로필, 2-메틸부틸, 3-메틸부틸, 2-에틸부틸, 2,2-디메틸펜틸, 2-프로필펜틸 등을 포함한다.
용어 "할로알킬"은 하나 이상의 할로겐, 예를 들어 트리플루오로메틸, 디플루오로메틸, 트리클로로메틸, 2,2,2 트리플루오로에틸, 1,2 디플루오로에틸, 3 브로모 2 플루오로프로필, 1,2 디브로모에틸 등으로 치환된 상기 정의된 바와 같은 알킬기를 지칭한다.
특정 수의 탄소 원자가 특정 용어로 의도된 경우, 탄소 원자의 수는 용어 앞에 표시된다. 예를 들어, 용어 "C1-3 알킬"은 1 내지 3 개의 탄소 원자를 갖는 알킬기를 의미하며, 상기 탄소 원자는 선형 또는 분지형 구조를 포함하여 화학적으로 허용가능한 임의의 구조로 존재한다.
용어 "알콕시"는 1가 기 -O-알킬을 의미하며, 상기 알킬은 상기 정의된 바와 같다. 대표적인 알콕시기는 예를 들어 메톡시, 에톡시, 프로폭시, 부톡시 등을 포함한다.
용어 "시클로알킬"은 모노시클릭 또는 멀티시클릭일 수 있는 1가 포화 카보시클릭기를 의미한다. 달리 정의되지 않는 한, 이러한 시클로알킬기는 전형적으로 3 내지 10 개의 탄소 원자를 포함한다. 대표적인 시클로알킬기는 예를 들어 시클로프로필 (cPr), 시클로부틸, 시클로펜틸, 시클로헥실, 시클로헵틸, 시클로옥틸, 아다만틸 등을 포함한다.
용어 "헤테로사이클", "헤테로시클릭" 또는 "헤테로시클릭 고리"는 3 내지 10 개의 총 고리 원자를 갖는 포화 또는 부분 불포화 시클릭 비-방향족기를 의미하며, 상기 고리는 2 내지 9 개의 탄소 고리 원자 및 질소, 산소 및 황으로부터 선택된 1 내지 4 개의 고리 헤테로 원자를 포함한다. 헤테로시클릭기는 모노시클릭 또는 멀티시클릭 (즉, 융합, 스피로 또는 브릿지)일 수 있다. 헤테로시클릭기가 멀티시클릭인 경우, 적어도 하나 이상의 시클릭기가 헤테로 원자를 포함하나 모든 시클릭기가 반드시 헤테로 원자를 포함하지는 않는다. 대표적인 헤테로시클릭기는 예를 들어 피롤리디닐, 피페리디닐, 피페라지닐, 이미다졸리디닐, 모르폴리닐, 티오모르폴릴, 인돌린-3-일, 2-이미다졸리닐, 테트라히드로피라닐, 1,2,3,4-테트라히드로이소퀴놀린-2-일, 퀴누클리디닐, 7-아자노르보르나닐, 노르트로파닐 등을 포함하고, 여기서 부착점은 임의의 이용 가능한 탄소 또는 질소 고리 원자에 있다. 문맥이 헤테로시클릭기의 부착점을 명백하게 하는 경우, 이러한 기는 대안적으로 무가 (non-valent) 종, 즉, 피롤리딘, 피페리딘, 피페라진, 이미다졸, 테트라히드로피란 등으로 지칭될 수 있다.
용어 "치료적 유효량"은 치료가 필요한 환자에게 투여될 때 치료가 수행되기에 충분한 양을 의미한다.
본원에 사용된 용어 "치료"는 하기 중 하나 이상을 포함하는 포유 동물 (특히 인간)과 같은 환자에서 질환, 장애 또는 의학적 상태 (예를 들어, 위장관 염증성 질환)의 치료를 의미한다:
(a) 질환, 장애 또는 의학적 상태가 발생하는 것을 방지하는 것, 즉 질환 또는 의학적 상태의 재발을 방지하는 것 또는 질환 또는 의학적 상태에 걸리기 쉬운 환자의 예방적 치료;
(b) 질환, 장애 또는 의학적 상태를 개선하는 것, 즉 다른 치료제의 효과를 방해하는 것을 포함하여 환자에서 질환, 장애 또는 의학적 상태를 제거 또는 퇴행시키는 것;
(c) 질환, 장애 또는 의학적 상태를 억제하는 것, 즉 환자에서 질환, 장애 또는 의학적 상태의 발생을 늦추거나 정지시키는 것; 또는
(d) 환자에서 질환, 장애 또는 의학적 증상의 증상을 완화시키는 것.
용어 "약학적으로 허용가능한 염"은 환자 또는 포유 동물, 예컨대 인간에게 투여가 허용되는 염 (예를 들어, 주어진 투여 용법에 대해 허용 가능한 포유 동물 안전성을 갖는 염)을 의미한다. 대표적인 약학적으로 허용가능한 염은 아세트산, 아스코르브산, 벤젠설폰산, 벤조산, 캄포설폰산, 시트르산, 에탄설폰산, 에디실산, 푸마르산, 겐티스산, 글루콘산, 글루쿠론산, 글루탐산, 히푸르산, 브롬화수소산, 염산, 이세티온산, 락트산, 락토비온산, 말레산, 말산, 만델산, 메탄설폰산, 점액산, 나프탈렌설폰산, 나프탈렌-1,5-디설폰산, 나프탈렌-2,6-디설폰산, 니코틴산, 질산, 오로트산, 파모인산, 판토텐산, 인산, 숙신산, 황산, 타르타르산, p-톨루엔설폰산 및 시나포산 등을 포함한다.
용어 "이의 염"은 산의 수소가 금속 양이온 또는 유기 양이온 등과 같은 양이온으로 대체될 때 형성된 화합물을 의미한다. 예를 들어, 양이온은 화학식 (I)의 화합물의 양성자화 된 형태, 즉 하나 이상의 아미노기가 산에 의해 양성자화 된 형태일 수 있다. 전형적으로, 염은 약학적으로 허용가능한 염이지만, 이는 환자에게 투여하기 위한 것이 아닌 중간체 화합물의 염에는 필요하지 않다.
용어 "아미노-보호기"는 아미노 질소에서 원하지 않는 반응을 방지하는데 적합한 보호기를 의미한다. 대표적인 아미노-보호기는 포르밀; 아실기, 예를 들어 아세틸 및 트리-플루오로아세틸과 같은 알카노일기; tert-부톡시카르보닐 (Boc)과 같은 알콕시카르보닐기; 벤질옥시카르보닐 (Cbz) 및 9-플루오레닐메톡시카르보닐 (Fmoc)과 같은 아릴메톡시카르보닐기; 벤질 (Bn), 트리틸 (Tr) 및 1,1-디-(4'-메톡시페닐)메틸과 같은 아릴메틸기; 트리메틸실릴 (TMS), 트리이소프로필실릴 (TIPS), tert-부틸디메틸실릴 (TBS 또는 TBDMS), [2-(트리메틸실릴)-에톡시]메틸 (SEM)과 같은 실릴기; 등을 포함하나 이에 제한되지 않는다. 다수의 보호기 및 이들의 도입 및 제거는 T.W. Greene and P.G.M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York에 기재되어 있다.
일반적인 합성 절차
본 개시내용의 화합물 및 이의 중간체는 시판되거나 또는 통상적으로 제조된 출발 물질 및 시약을 사용하여 하기의 일반적인 방법 및 절차에 따라 제조될 수 있다. 하기 반응식에 사용된 치환기 및 변수 (예를 들어, A, X1, X2, R1, R2, R3, Ra, Rb 등)는 달리 지시되지 않는 한 본원에 정의된 것과 동일한 의미를 갖는다. 또한, 달리 지시되지 않는 한, 산성 또는 염기성 원자 또는 작용기를 갖는 화합물이 사용되거나 염으로서 생성될 수 있다 (일부 경우에, 특정 반응에서의 염의 사용은 반응을 수행하기 전에 일상적인 절차를 사용하여 염을 비-염 형태, 예를 들어, 유리 염기로 전환시키는 것이 필요할 것이다).
본 발명의 특정 구체예가 하기 절차에서 도시되거나 설명될 수 있지만, 당업자는 본 발명의 다른 구체예 또는 양상이 또한 이러한 절차를 사용하거나 다른 방법, 시약 및 당업자에게 공지된 출발 물질을 사용하여 제조될 수 있음을 알 것이다. 특히, 본 개시내용의 화합물은 반응물이 상이한 순서로 조합되어 최종 생성물을 생성하는 도중에 상이한 중간체를 제공하기 위해 다양한 공정 경로에 의해 제조될 수 있음을 이해할 것이다.
L이 하기로부터 선택되는 본 개시내용의 최종 화합물의 일반적인 제조 방법은 반응식 1에 예시되어 있다:
Rx 및 Ry가 동일하거나 상이할 수 있는 할로겐인 출발 물질 P1은 테트라히드로피란과 같은 보호기 PG로 보호되어 P2를 제공한다. 이어서 P2를 P3과 반응시켜 P4를 제공한다.
P3은 하기일 수 있고:
상기 Rz는 제 2 보호기, 예를 들어 Boc이다. 이 경우에, P3는 NaH와 같은 염기로 탈양성자화 되고 P2와 반응하여 P4를 제공한다.
대안적으로, P3은 하기일 수 있고:
상기 Rz는 제 2 보호기, 예를 들어 Boc이다. 이 경우, P3은 Pd(0) 및 염기의 존재와 같은 Buchwald 커플링 조건 하에서 P2와 반응하여 P4를 제공한다. 대안적으로, P3은 DIPEA와 같은 염기의 존재 하에서 P2와 반응하여 P4를 제공한다.
대안적으로, P3은 하기일 수 있고:
상기 Rz는 제 2 보호기, 예를 들어 Boc이다. 이 경우, P3은 Pd(0), 9-BBN 및 염기의 존재 하에서 P2와 반응하여 P4를 형성한다.
P4는 Pd(0) 및 염기의 존재 하에 보론산 P5 (스즈키 커플링)와 커플링되어 P6을 제공한다. P6은 탈보호되어 P7을 제공한다 (PG가 테트라히드로피란이고 Rz가 Boc인 경우, 아민의 동시 탈보호는 TFA 또는 HCl과 같은 강산의 존재 하에서 일어난다). 마지막으로, P7은 아미드 커플링 (HATU 또는 히드록시벤조트리아졸 (HOBT)과 같은 커플링제 존재 하의 산과의 반응) 또는 휘니그 염기 (Hunig's base)와 같은 염기의 존재 하에 아실 클로라이드와의 반응에 의해 아미드로 유도체화된다.
이 반응식에서, 반응 순서는 변경될 수 있다. 예를 들어, 스즈키 커플링은 A 고리를 포함하는 부분의 도입 전에 수행될 수 있다. 이것은 예를 들어 A 고리를 포함하는 부분이 Buchwald 커플링을 통해 도입되는 경우일 수 있다.
이 반응식에서, 아미노기 중 하나 또는 둘 다의 보호는 선택적이다. 동일한 합성식이 하나 또는 둘 다의 아미노기에 대해 아미노 보호없이 사용될 수 있지만 더 낮은 수율을 제공할 수 있다.
설포닐 링커는 상응하는 설파이드를 예를 들어 옥손 및 염기성 알루미나로 산화시켜 얻을 수 있다.
따라서, 일 방법 양상에서, 본 발명은 하기 화학식 (I)의 화합물 또는 이의 약학적으로 허용가능한 염을 제조하는 방법을 제공하고,
(I)
상기 방법은 화학식 (I)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공하기 위해 하기 화학식 (III)의 화합물을 (i) Cl-R1, 또는 (ii) HO-R1과 반응시키는 단계, 및 선택적으로 약학적으로 허용가능한 염을 형성하는 단계를 포함한다:
상기 R1, R2, R3, R4, X1, X2, L 및 A는 상기 정의된 바와 같다.
별개의 뚜렷한 양상에서, 본 발명은 변수가 상기 기재된 임의의 값을 취하는 화학식 (III)의 화합물을 제공한다.
결정형
일 양상에서, 본 발명은 하기 화학식 화합물의 결정형을 제공한다:
결정형 1
본 발명의 결정형 1은 화합물 3의 결정질 무수 유리 형태이다. 일 양상에서, 결정형 1은 5.65±0.20, 14.22±0.20, 15.16±0.20 및 19.31±0.20의 2θ 값에서 다른 피크 중에서도 현저한 회절 피크를 갖는 분말 X-선 회절 (PXRD) 패턴을 특징으로 한다. 결정형 1은 7.12±0.20, 10.02±0.20, 11.16±0.20, 17.06±0.20 및 24.43±0.20의 2θ 값에서 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 1은 13.10±0.20, 14.82±0.20, 16.55±0.20, 20.08±0.20, 21.08±0.20, 21.65±0.20, 22.51±0.20, 22.98±0.20, 25.02±0.20, 25.72±0.20, 26.80±0.20, 27.06±0.20, 28.31±0.20, 30.08±0.20, 30.31±0.20 및 32.08±0.20에서 선택된 2θ 값에서 3 개 이상 및 4 개 이상의 추가 회절 피크를 포함하는, 2 개 이상의 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 1은 5.65±0.20, 7.12±0.20, 10.02±0.20, 11.16±0.20, 14.22±0.20, 15.16±0.20, 17.06±0.20, 19.31±0.20 및 24.43±0.20에서 선택된 2θ 값에서 3, 4, 5 또는 6 개의 회절 피크를 갖는 PXRD 패턴을 특징으로 한다.
분말 X-선 회절 분야에서 잘 알려진 바와 같이, PXRD 패턴의 피크 위치는 상대적 피크 높이보다, 샘플 준비 및 기기 구조의 세부 사항과 같은 실험적 세부 사항에 상대적으로 덜 민감하다. 따라서, 일 양상에서, 결정형 1은 피크 위치가 도 1에 나타낸 것과 실질적으로 일치하는 분말 x-선 회절 패턴을 특징으로 한다.
다른 양상에서, 결정형 1은 고온에 노출될 때의 거동 (behavior)을 특징으로 한다. 도 2에서 나타낸 바와 같이, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 154.9 ℃에서의 개시 및 약 162.9 ℃에서의 피크를 갖는 용융 전이로 식별된 흡열성 열흐름의 피크를 나타낸다. 융해 직후 분해되었다.
결정형은 약 162.9 ℃에서 피크를 갖는 흡열성 열흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다. 결정형은 162.9±3 ℃에서 피크를 갖는 흡열성 열흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
결정형은 약 154.9 ℃ 내지 약 171 ℃의 온도, 또는 158 ℃ 내지 167 ℃의 온도에서 흡열성 열흐름에서 최대값를 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
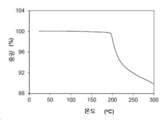
결정형 1 결정질 유리 형태의 대표적인 TGA 트레이스는 도 3에 도시되어 있다. 열 중량 분석 (TGA) 트레이스는 100 ℃에서 약 0.14 %의 작은 중량 손실을 나타낸다. 화합물은 약 175 ℃의 개시 온도에서 분해된다.
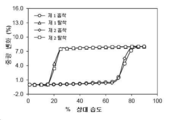
결정형 1 결정질 유리 형태에 대한 대표적인 DMS 트레이스는 도 4에 도시되어 있다. 결정형 1은 5 % 내지 90 % 상대 습도의 습도 범위에서 약 1.62 % 중량 증가를 나타낸다. 결정형 1은 약간 흡습성인 것으로 간주된다.
결정형 1은 화합물 3을 에탄올에서 무정형 형태로 용해시킨 후 약 20 ℃ 내지 약 25 ℃의 온도에서 교반한 후 여과 및 건조시켜 결정형 1을 제공함으로써 제조될 수 있다. 선택적으로, 상기 고체는 건조 전에 에탄올로 세척될 수 있다.
비정질 형태의 화합물에 아세톤을 첨가하고 약 20 ℃ 내지 약 25 ℃의 온도에서 교반한 후 시드 (seeds)를 첨가하여 결정형 1을 제조할 수 있다. 생성된 슬러리를 여과 및 건조시켜 결정형 1을 제공한다.
결정형 2
본 발명의 결정형 2는 화합물 3의 결정질 수화물 유리 형태이다. 일 양상에서, 결정형 2는 6.90±0.20, 9.15±0.20, 10.00±0.20 및 18.31±0.20 피크의 2θ 값에서 다른 피크 중에서도 현저한 회절 피크를 갖는 분말 X-선 회절 (PXRD) 패턴을 특징으로 한다. 결정형 2는 11.18±0.20, 15.51±0.20 및 20.90±0.20의 2θ 값에서 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 2는 12.76±0.20, 13.33±0.20, 13.82±0.20, 14.43±0.20, 16.04±0.20, 17.00±0.20, 17.90±0.20, 22.06±0.20, 22.51±0.20, 25.00±0.20, 26.92±0.20, 27.26±0.20, 27.61±0.20, 29.37±0.20, 30.53±0.20, 및 30.92±0.20에서 선택된 2θ 값에서 3 개 이상 및 4 개 이상의 추가 회절 피크를 포함하는, 2 개 이상의 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 2는 6.90±0.20, 9.15±0.20, 10.00±0.20, 11.18±0.20, 15.51±0.20, 18.31±0.20, 및 20.90±0.20에서 선택된 2θ 값에서 3, 4, 5 또는 6 개의 회절 피크를 갖는 PXRD 패턴을 특징으로 한다.
분말 X-선 회절 분야에서 잘 알려진 바와 같이, PXRD 패턴의 피크 위치는 상대적 피크 높이보다, 샘플 준비 및 기기 구조의 세부 사항과 같은 실험적 세부 사항에 상대적으로 덜 민감하다. 따라서, 일 양상에서, 결정형 2는 피크 위치가 도 5에 나타낸 것과 실질적으로 일치하는 분말 x-선 회절 패턴을 특징으로 한다.
다른 양상에서, 결정형 2는 고온에 노출될 때의 거동을 특징으로 한다. 도 6에서 나타낸 바와 같이, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 52.7 ℃에서의 개시 및 약 84.4 ℃에서의 피크를 갖는 탈용매화 흡열성 및 약 160.0 ℃에서의 개시 및 약 167.6 ℃에서의 피크를 갖는 융해 흡열성을 나타낸다. 융해 직후 분해되었다.
본 발명의 결정형 2 결정질 유리 형태의 대표적인 TGA 트레이스는 도 7에 도시되어 있다. 도 7의 열 중량 분석 (TGA) 트레이스는 75 ℃에서 약 6.73 %의 중량 손실을 나타낸다. 화합물은 약 25 ℃의 개시 온도에서 탈용매된다. 상기 화합물은 약 185 ℃의 개시 온도에서 분해된다.
본 발명의 결정형 2 결정질 유리 형태에 대한 대표적인 DMS 트레이스는 도 8에 도시되어 있다. 결정형 2는 65 % 초과의 RH에서 수화물 (결정형 2b)로 전환된다. 탈수는 15 % 이하의 RH에서 일어난다. 5 %-90 % RH 사이에서 총 수분 흡수량은 7.99 %이다.
결정형 2는 화합물 3을 메탄올에서 무정형 형태로 용해시킨 후, 물과 같은 반-용매를 약 1:2의 메탄올:물 비율로 첨가함으로써 제조될 수 있다. 선택적으로, 상기 혼합물을 초음파 처리한다. 이어서 상기 혼합물을 약 20 ℃ 내지 약 25 ℃의 온도에서 약 12 내지 24 시간 동안 교반한다. 이어서, 결정형 2는 여과 및 건조에 의해 분리된다. 선택적으로, 상기 고체는 메탄올로 세척될 수 있다.
결정형 2는 또한 약 10 부피의 알코올에 완전히 용해시킨 후, 운점 (cloud point)까지 약 8-10 부피의 물을 천천히 첨가함으로써 에탄올 및 물 또는 메탄올 및 물 중에 용해로 제조될 수 있다. 결정형 2의 시드를 첨가하여 시간이 지남에 따라 천천히 슬러리를 형성한다. 더 많은 물이 천천히 첨가되어 (약 10 부피) 고체를 제공하고, 여과 및 건조되어 결정형 2를 제공할 수 있다.
결정형 2b
본 발명의 결정형 2b는 화합물 3의 결정질 탈수된 유리 형태이다. 일 양상에서, 결정형 2b는 7.61±0.20, 16.76±0.20, 17.90±0.20 및 20.67±0.20의 2θ값에서 다른 피크 중에서도 현저한 회절 피크를 갖는 분말 X-선 회절 (PXRD) 패턴을 특징으로 한다. 결정형 2b는 10.33±0.20, 11.25±0.20, 12.71±0.20, 15.88±0.20의 2θ 값에서 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 2b는 13.23±0.20, 13.66±0.20, 13.90±0.20, 15.02±0.20, 15.27±0.20, 16.33±0.20, 18.26±0.20, 21.37±0.20, 21.92±0.20, 22.31±0.20, 22.90±0.20, 23.22±0.20, 23.61±0.20, 24.74±0.20, 25.78±0.20, 26.23±0.20, 26.73±0.20, 27.57±0.20, 29.10±0.20, 29.39±0.20, 30.72±0.20, 30.94±0.20, 31.69±0.20, 32.06±0.20, 33.76±0.20 및 34.35±0.20에서 선택된 2θ 값에서 3 개 이상 및 4 개 이상의 추가 회절 피크를 포함하는, 2 개 이상의 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 2b는 7.61±0.20, 10.33±0.20, 11.25±0.20, 12.71±0.20, 15.88±0.20, 16.76±0.20, 17.90±0.20 및 20.67±0.20에서 선택된 2θ 값에서 3, 4, 5 또는 6 개의 회절 피크를 갖는 PXRD 패턴을 특징으로 한다.
분말 X-선 회절 분야에서 잘 알려진 바와 같이, PXRD 패턴의 피크 위치는 상대적 피크 높이보다, 샘플 준비 및 기기 구조의 세부 사항과 같은 실험적 세부 사항에 상대적으로 덜 민감하다. 따라서, 일 양상에서, 결정형 2b는 피크 위치가 도 17에 나타낸 것과 실질적으로 일치하는 분말 x-선 회절 패턴을 특징으로 한다.
다른 양상에서, 본 발명은 하기 화학식 화합물의 결정형을 제공한다:
결정형 3
본 발명의 결정형 3은 화합물 1의 결정질 무수 유리 형태이다. 일 양상에서, 결정형 3은 9.67±0.20, 11.61±0.20, 17.61±0.20, 18.88±0.20 및 23.33±0.20의 2θ 값에서 다른 피크 중에서도 현저한 회절 피크를 갖는 분말 X-선 회절 (PXRD) 패턴을 특징으로 한다. 결정형 3은 4.82±0.20, 15.69±0.20 및 16.19±0.20의 2θ 값에서 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 3은 11.92±0.20, 12.98±0.20, 13.23±0.20, 16.45±0.20, 16.67±0.20, 19.39±0.20, 19.96±0.20, 20.14±0.20, 22.14±0.20, 23.84±0.20, 24.06±0.20, 24.29±0.20, 25.31±0.20, 25.63±0.20, 27.06±0.20, 27.31±0.20, 30.10±0.20 및 30.53±0.20에서 선택된 2θ 값에서 3 개 이상 및 4 개 이상의 추가 회절 피크를 포함하는, 2 개 이상의 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 3은 4.82±0.20, 9.67±0.20, 11.61±0.20, 15.69±0.20, 16.19±0.20, 16.19±0.20, 17.61±0.20, 18.88±0.20 및 23.33±0.20에서 선택된 2θ 값에서 3, 4, 5 또는 6 개의 회절 피크를 갖는 PXRD 패턴을 특징으로 한다.
분말 X-선 회절 분야에서 잘 알려진 바와 같이, PXRD 패턴의 피크 위치는 상대적 피크 높이보다, 샘플 준비 및 기기 구조의 세부 사항과 같은 실험적 세부 사항에 상대적으로 덜 민감하다. 따라서, 일 양상에서, 결정형 3은 피크 위치가 도 9에 나타낸 것과 실질적으로 일치하는 분말 x-선 회절 패턴을 특징으로 한다.
다른 양상에서, 결정형 3은 고온에 노출될 때의 거동을 특징으로 한다. 도 10에서 나타낸 바와 같이, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 197.7 ℃에서의 개시 및 약 201.3 ℃에서의 피크를 갖는 용융 전이로 식별된 흡열성 열흐름의 피크를 나타낸다. 융해 직후 분해되었다.
상기 결정형은 201.3 ℃±2 ℃에서 피크를 갖는 흡열성 열흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
상기 결정형은 198 ℃ 내지 204 ℃의 온도에서 흡열성 열흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
본 발명의 결정형 3 결정질 유리 형태의 대표적인 TGA 트레이스는 도 11에 도시되어 있다. 도 11의 열 중량 분석 (TGA) 트레이스는 약 195 ℃에서 분해 개시 미만의 온도에서 현저한 중량 손실을 보이지 않았다.
본 발명의 결정형 3 결정질 유리 형태에 대한 대표적인 DMS 트레이스는 도 12에 도시되어 있다. 결정형 3은 5 % 내지 90 % 상대 습도의 습도 범위에서 약 0.33 % 중량 증가를 나타낸다. 결정형 3은 비-흡습성인 것으로 간주된다.
결정형 3은 화합물 1을 아세토니트릴 및 이소프로판올의 1:1 혼합물에 무정형 형태로 현탁시켜 제조될 수 있다. 상기 생성된 현탁액을 약 50 ℃에서 약 1 일 동안 교반하고, 여과하고, 선택적으로 아세토니트릴 및 이소프로판올의 1:1 혼합물로 세척하고 몇 시간 동안 건조시켜 결정형 3을 제공한다.
결정형 3은 약 20 ℃ 내지 약 25 ℃의 온도에서 IPA에 무정형 유리 염기로서 화합물 1을 용해시킴으로써 제조될 수 있다. 동량의 아세토니트릴이 첨가된다. 포화 용액이 형성될 때까지 더 많은 화합물이 첨가될 수 있다. 시드를 첨가하고 혼합물을 밤새 교반하였다. 형성된 발생된 백색 슬러리를 여과하고 건조시켜 결정형 3을 수득한다.
결정형 4
본 발명의 결정형 4는 화합물 1의 결정질 수화물 유리 형태이다. 일 양상에서, 결정형 4는 6.26±0.20, 16.55±0.20, 16.94±0.20, 18.33±0.20, 23.61±0.20 및 24.24±0.20의 2θ 값에서 다른 피크 중에서도 현저한 회절 피크를 갖는 분말 X-선 회절 (PXRD) 패턴을 특징으로한다. 결정형 4는 11.86±0.20, 12.51±0.20, 13.16±0.20 및 14.98±0.20의 2θ 값에서 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 4는 17.61±0.20, 18.78±0.20, 19.39±0.20, 19.57±0.20, 19.84±0.20, 21.45±0.20, 21.82±0.20, 22.57±0.20, 24.67±0.20, 25.10±0.20, 25.39±0.20, 27.19±0.20, 27.39±0.20, 28.55±0.20 및 31.51±0.20에서 선택된 2θ 값에서 3 개 이상 및 4 개 이상의 추가 회절 피크를 포함하는, 2 개 이상의 추가 회절 피크를 갖는 PXRD 패턴을 추가로 특징으로 할 수 있다. 결정형 4는 6.26±0.20, 11.86±0.20, 12.51±0.20, 13.16±0.20, 14.98±0.20, 16.55±0.20, 16.94±0.20, 18.33±0.20, 23.61±0.20 및 24.24±0.20에서 선택된 2θ 값에서 3, 4, 5 또는 6 개의 회절 피크를 갖는 PXRD 패턴을 특징으로 한다.
분말 X-선 회절 분야에서 잘 알려진 바와 같이, PXRD 패턴의 피크 위치는 상대적 피크 높이보다, 샘플 준비 및 기기 구조의 세부 사항과 같은 실험적 세부 사항에 상대적으로 덜 민감하다. 따라서, 일 양상에서, 결정형 4는 피크 위치가 도 13에 도시된 것과 실질적으로 일치하는 분말 x-선 회절 패턴을 특징으로 한다.
다른 양상에서, 결정형 4는 고온에 노출될 때의 거동을 특징으로 한다. 도 14에서 나타낸 바와 같이, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 60.9 ℃에서의 개시 및 약 103.6 ℃에서의 피크를 갖는 탈용매화 흡열성 및 약 167.3 ℃에서의 개시 특징을 갖는 용융 흡열성을 나타낸다. 상기 화합물은 용융시 분해되고, 용융 흡열성 및 분해 발열성은 중첩된다.
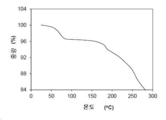
본 발명의 결정형 4 결정질 유리 형태의 대표적인 TGA 트레이스는 도 15에 도시되어 있다. 도 15의 열 중량 분석 (TGA) 트레이스는 100 ℃에서 약 3.54 %의 중량 손실을 나타낸다. 상기 화합물은 약 50 ℃의 개시 온도에서 탈용매된다. 상기 화합물은 약 165 ℃의 개시 온도에서 분해된다.
본 발명의 결정형 4 결정질 유리 형태에 대한 대표적인 DMS 트레이스는 도 16에 도시되어 있다. 결정형 4는 5 % 내지 90 % 상대 습도의 습도 범위에서 약 5.01 % 중량 증가를 나타낸다. 결정형 4는 적당히 흡습성이 있는 것으로 간주된다.
결정형 4는 화합물 1을 물에 현탁시켜 제조될 수 있다. 생성된 현탁액을 약 50 ℃에서 약 1 내지 2 일 동안 교반하고, 여과하고, 선택적으로 물로 세척하고, 약 20 ℃ 내지 약 25 ℃의 온도에서 약 2-6 시간 동안 건조시켜 결정형 4를 제공한다.
대안적으로, 결정형 4는 약 10 부피의 알코올에 완전히 용해시킨 후, 운점까지 약 8-10 부피의 물을 천천히 첨가함으로써 에탄올 및 물 또는 메탄올 및 물 중에 화합물 1의 용해에 의해 제조될 수 있다. 결정형 4의 시드를 첨가하여 생성된 슬러리가 시간이 지남에 따라 천천히 발생한다. 이어서, 더 많은 물이 천천히 첨가되어 (약 10 부피), 상기 고체가 여과되고 건조되어 결정형 4를 제공한다.
약학적 조성물
본 개시내용의 화합물 및 이의 약학적으로 허용가능한 염은 전형적으로 약학적 조성물 또는 제제의 형태로 사용된다. 이러한 약학적 조성물은 경구, 국소 (경피 포함), 직장, 비강, 흡입 및 비경구 투여 방식을 포함하나 이에 제한되지 않는 임의의 허용되는 투여 경로에 의해 환자에게 투여될 수 있다.
따라서, 이의 조성물 양상 중 하나에서, 본 발명은 약학적으로 허용가능한 담체 또는 부형제 및 화학식 (I), (II), (B), (C)의 화합물, 화합물 1, 화합물 3, 또는 화합물 4 또는 이의 약학적으로 허용가능한 염을 포함하는 약학적 조성물에 관한 것이다. 선택적으로, 이러한 약학적 조성물은 원하는 경우 다른 치료제 및/또는 제제를 포함할 수 있다. 조성물 및 이의 용도를 논의할 때, "본 발명의 화합물" 또는 "본 개시내용의 화합물"은 본 명세서에서 "활성제"로 지칭될 수도 있다. 본원에 사용된 용어 "본 개시내용의 화합물(들)"은 화학식 (I), (II), (B), (C), (Ia), (IIa), (Ib), (IIb), (Ic), (IIc), (Id), (IId), (Ie), (IIe), (If), (IIf), (IIIf), (IVf), (Vf), (VIf), (VIIf) 및 (VIIIf) 및 이의 약학적으로 허용가능한 염을 아우르는 모든 화합물을 포함하는 것으로 의도된다.
본 개시내용의 약학적 조성물은 전형적으로 본 개시내용의 화합물을 치료적 유효량으로 포함한다. 그러나, 당업자는 약학적 조성물이 치료적 유효량 초과, 즉 대용량 조성물, 또는 치료적 유효량 미만, 즉 치료적 유효량을 달성하기 위해 다중 투여로 설계된 개별 단위 용량을 포함할 수 있음을 인식할 것이다.
전형적으로, 이러한 약학적 조성물은 약 0.1 내지 약 95 중량 %의 활성제; 약 5 내지 약 70 중량 %의 활성제를 포함할 것이다.
임의의 통상적인 담체 또는 부형제가 본 발명의 약학적 조성물에 사용될 수 있다. 특정 담체 또는 부형제, 또는 담체 또는 부형제의 조합의 선택은 특정 환자 또는 의학적 상태 또는 질환 상태의 유형을 치료하기 위해 사용되는 투여 방식에 따라 달라질 것이다. 이와 관련하여, 특정 투여 방식에 적합한 약학적 조성물의 제조는 약학 분야의 기술자의 범위 내에 있다. 또한, 본 발명의 약학적 조성물에 사용되는 담체 또는 부형제는 상업적으로 이용가능하다. 추가의 예시로서, 통상적인 제제 기술은 Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); 및 H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999)에 기재되어 있다.
약학적으로 허용가능한 담체로서 제공할 수 있는 물질의 대표적인 예는 락토오스, 글루코오스 및 수크로오스와 같은 당; 옥수수 전분 및 감자 전분과 같은 전분; 미세 결정질 셀룰로오스와 같은 셀룰로오스 및 나트륨 카복시메틸 셀룰로오스, 에틸 셀룰로오스 및 셀룰로오스 아세테이트와 같은 이의 유도체; 분말 트라가칸트; 맥아; 젤라틴; 활석; 코코아 버터 및 좌제 왁스와 같은 부형제; 땅콩유, 면실유, 홍화유, 참기름, 올리브유, 옥수수유 및 대두유와 같은 오일; 프로필렌 글리콜과 같은 글리콜; 글리세린, 소르비톨, 만니톨 및 폴리에틸렌 글리콜과 같은 폴리올; 에틸 올리에이트 및 에틸 라우레이트와 같은 에스테르; 한천; 수산화 마그네슘 및 수산화 알루미늄과 같은 완충제; 알긴산; 피로젠-프리 (pyrogen-free) 물; 등장 식염수; 링거액; 에틸 알코올; 인산염 완충 용액; 및 약학적 조성물에 사용되는 다른 비-독성 호환성 물질을 포함하나 이에 제한되지 않는다.
약학적 조성물은 전형적으로 활성제를 약학적으로 허용가능한 담체 및 하나 이상의 임의의 성분과 철저하고 직접적으로 혼합 또는 블렌딩함으로써 제조된다. 결과적으로 균일하게 혼합된 혼합물은 통상적인 절차 및 장비를 사용하여 정제, 캡슐, 환제 등에 성형되거나 로딩될 수 있다.
본 개시내용의 약학적 조성물은 바람직하게는 단위 제형으로 포장된다. 용어 "단위 제형"은 환자에게 투여하기에 적합한 물리적 개별 단위, 즉, 원하는 치료 효과를 단독으로 또는 하나 이상의 추가 단위와 조합하여 산출하도록 계산된 미리 결정된 양의 활성제를 포함하는 각 단위를 지칭한다. 예를 들어, 이러한 단위 제형은 캡슐, 정제, 환제 등, 또는 비경구 투여에 적합한 단위 패키지일 수 있다.
일 구체예에서, 본 개시내용의 약학적 조성물은 경구 투여에 적합하다. 경구 투여에 적합한 약학적 조성물은 캡슐제, 정제, 환제, 로젠지 (lozenges), 카세제 (cachet), 드라제 (dragees), 산제, 과립제; 또는 수성 또는 비-수성 액체 중의 현탁액 또는 용액으로서; 또는 수중유 또는 유중수 액체 에멀젼으로서; 또는 엘릭시르 또는 시럽으로서; 등의 형태일 수 있고; 각각은 소정량의 본 개시내용의 화합물을 활성 성분으로서 포함한다.
고체 제형 (즉, 캡슐제, 정제, 환제 등)으로 경구 투여하고자 하는 경우, 본 개시내용의 약학적 조성물은 전형적으로 활성제 및 하나 이상의 약학적으로 허용가능한 담체를 포함할 것이다. 선택적으로, 이러한 고체 투여 형태는 전분, 미세 결정질 셀룰로오스, 락토오스, 인산 이칼슘, 수크로오스, 글루코오스, 만니톨 및/또는 규산과 같은 충전제 또는 증량제; 카복시메틸셀룰로오스, 알기네이트, 젤라틴, 폴리비닐 피롤리돈, 수크로오스 및/또는 아카시아와 같은 결합제; 글리세롤과 같은 보습제; 크로스카멜로오스 나트륨, 한천-한천, 탄산 칼슘, 감자 또는 타피오카 전분, 알긴산, 특정 실리케이트 및/또는 탄산나트륨과 같은 붕해제; 파라핀과 같은 용액 완염제; 4 차 암모늄 화합물과 같은 흡수 촉진제; 세틸 알코올 및/또는 글리세롤 모노스테아레이트와 같은 습윤제; 카올린 및/또는 벤토나이트 점토와 같은 흡수제; 활석, 스테아레이트 칼슘, 스테아레이트 마그네슘, 고체 폴리에틸렌 글리콜, 소듐 라우릴 설페이트 및/또는 이의 혼합물과 같은 윤활제; 착색제; 및 완충제를 포함할 수 있다.
방출제, 습윤제, 코팅제, 감미제, 향료 및 방향제, 방부제 및 항산화제가 또한 본 개시내용의 약학적 조성물에 존재할 수 있다. 약학적으로 허용가능한 항산화제의 예는 아스코르브산, 시스테인 히드로클로라이드, 소듐 비설페이트, 소듐 메타비설페이트, 소듐 술파이트 등과 같은 수용성 항산화제; 아스코르빌 팔미테이트, 부틸화 히드록시아니솔, 부틸화 히드록시톨루엔, 레시틴, 프로필 갈레이트, 알파-토코페롤 등과 같은 지용성 항산화제; 및 시트르산, 에틸렌디아민 테트라아세트산, 소르비톨, 타르타르산, 인산 등과 같은 금속-킬레이트제를 포함한다. 정제, 캡슐제, 환제 등의 코팅제는 셀룰로오스 아세테이트 프탈레이트, 폴리비닐 아세테이트 프탈레이트, 히드록시프로필 메틸셀룰로오스 프탈레이트, 메타크릴산, 메타크릴산 에스테르 공중합체, 셀룰로오스 아세테이트 트리멜리테이트, 카복시메틸 에틸 셀룰로오스, 히드록시프로필 메틸 셀룰로오스 아세테이트 숙시네이트 등과 같은 장용성 코팅에 사용되는 것들을 포함한다.
본 개시내용의 약학적 조성물은 또한 예를 들어 다양한 비율의 히드록시프로필 메틸셀룰로오스; 또는 다른 중합체 매트릭스, 리포좀 및/또는 마이크로스피어를 사용하여 활성제의 서방형 또는 제어된 방출을 제공하도록 제제화될 수 있다. 또한, 본 개시내용의 약학적 조성물은 선택적으로 불투명화제를 포함할 수 있고, 활성 성분을 위장관의 특정 부분에서, 선택적으로 지연된 방식으로만 또는 우선적으로 방출하도록 제제화될 수 있다. 사용될 수 있는 임베딩 (embedding) 조성물의 예는 중합체 물질 및 왁스를 포함한다. 활성제는 또한 적절한 경우 하나 이상의 상기 기재된 부형제와 함께 마이크로 캡슐화된 형태일 수 있다.
경구 투여에 적합한 액체 제형은 예를 들어, 약학적으로 허용가능한 에멀젼, 마이크로 에멀젼, 용액, 현탁액, 시럽 및 엘릭실제를 포함한다. 액체 투여 형태는 전형적으로 활성제 및 불활성 희석제, 예를 들어 물 또는 다른 용매, 가용화제 및 유화제, 예를 들어 에틸 알코올, 이소프로필 알코올, 에틸 카보네이트, 에틸 아세테이트, 벤질 알코올, 벤질 벤조에이트, 프로필렌 글리콜, 1,3-부틸렌 글리콜, 오일 (예를 들어, 목화씨, 땅콩, 옥수수, 세균, 올리브, 피마자 및 참기름), 올레산, 글리세롤, 테트라히드로푸릴 알코올, 폴리에틸렌 글리콜 및 소르비탄의 지방산 에스테르 및 이들의 혼합물을 포함한다. 대안적으로, 특정 액체 제제는 예를 들어 분무 건조에 의해 분말로 전환될 수 있으며, 이는 통상적인 절차에 의해 고체 투여 형태를 제조하는데 사용된다.
현탁액은 활성 성분 이외에, 예를 들어 에톡실화 이소스테아릴 알코올, 폴리옥시에틸렌 소르비톨 및 소르비탄 에스테르, 미세 결정질 셀룰로오스, 알루미늄 메타히드록시드, 벤토나이트, 한천-한천 및 트라가칸트, 및 이들의 혼합물과 같은 현탁제를 포함할 수 있다.
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 또한 비경구로 (예를 들어, 정맥 내, 피하, 근육 내 또는 복강 내 주사에 의해) 투여될 수 있다. 비경구 투여의 경우, 활성제는 전형적으로 예를 들어, 멸균 수용액, 식염수, 프로필렌 글리콜, 폴리에틸렌 글리콜, 식물성 오일, 젤라틴, 에틸 올리에이트와 같은 지방산 에스테르 등과 같은 저 분자량 알코올을 포함하여 비경구 투여에 적합한 비히클과 혼합된다. 비경구 제제는 또한 하나 이상의 항산화제, 가용화제, 안정화제, 보존제, 습윤제, 유화제, 완충제 또는 분산제를 포함할 수 있다. 이들 제제는 멸균 주사 가능한 배지, 멸균제, 여과, 조사 또는 열을 사용하여 멸균될 수 있다.
대안적으로, 본 발명의 약학적 조성물은 흡입 투여용으로 제제화된다. 흡입 투여용으로 적합한 약학적 조성물은 전형적으로 에어로졸 또는 분말 형태일 것이다. 이러한 조성물은 일반적으로 정량-용량 흡입기, 건조 분말 흡입기, 네뷸라이저 또는 유사한 전달 장치와 같은 잘 알려진 전달 장치를 사용하여 투여된다.
가압 용기를 사용하여 흡입에 의해 투여될 때, 본 개시내용의 약학적 조성물은 전형적으로 활성 성분 및 적합한 분사제, 예컨대 디클로로디플루오로메탄, 트리클로로플루오로메탄, 디클로로테트라플루오로에탄, 이산화탄소 또는 다른 적합한 가스를 포함할 것이다. 추가적으로, 약학적 조성물은 본 개시내용의 화합물 및 분말 흡입기에 사용하기에 적합한 분말을 포함하는 캡슐 또는 카트리지 (예를 들어, 젤라틴으로 제조)의 형태일 수 있다. 적합한 분말 베이스는 예를 들어 락토오스 또는 전분을 포함한다.
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 또한 연고 또는 크림으로서 피부에 국소 투여되도록 제제화될 수 있다. 연고 제제는 전형적으로 깨끗한 유성 또는 기름기있는 물질의 베이스를 갖는 반고체 제제이다. 연고 제제에 사용하기에 적합한 유성 물질은 바셀린 (petrolatum) (석유 젤리), 밀랍, 코코아 버터, 시어 버터 및 세틸 알코올을 포함한다. 연고는 경우에 따라 선택적으로 연화제 및 침투 증진제를 추가로 포함할 수 있다.
크림 제제는 전형적으로 정제수를 포함하는 유상 및 수성상을 포함하는 에멀젼으로 제조될 수 있다. 크림 제제의 성분은 바셀린, 미네랄 오일, 식물성 및 동물성 오일, 및 트리글리세리드와 같은 오일 베이스; 라놀린 알코올, 스테아르산 및 세토스테아릴 알코올과 같은 크림 베이스; 폴리비닐 알코올과 같은 겔 베이스; 프로필렌 글리콜 및 폴리에틸렌 글리콜과 같은 용매; 폴리소르베이트, 스테아레이트, 예컨대 글리세릴 스테아레이트, 옥틸히드록시스테아레이트, 폴리옥실 스테아레이트, PEG 스테아릴 에테르, 이소프로필 팔미테이트 및 소르비탄 모노스테아레이트와 같은 유화제; 다당류 및 아 황산나트륨과 같은 안정화제; 중쇄 트리글리세리드, 이소프로필 미리스테이트 및 디메티콘과 같은 완화제 (즉, 보습제); 세틸 알코올 및 스테아릴 알코올과 같은 강화제; 메틸파라벤, 프로필파라벤, 페녹시에탄올, 소르브산, 디아졸리디닐 우레아 및 부틸화 히드록시아니솔과 같은 항균제; N-메틸피롤리돈, 프로필렌 글리콜, 폴리에틸렌 글리콜 모노라우레이트 등과 같은 침투 증강제; 및 에데테이트 이나트륨과 같은 킬레이트제를 포함할 수 있다.
하기 비-제한적인 실시예는 본 발명의 대표적인 약학적 조성물을 예시한다.
정제 경구 고체 제형
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 미세 결정질 셀룰로오스, 폴리비닐 피롤리돈 및 크로스카멜로오스 나트륨과 4:5:1:1 비율로 건식 블렌딩되고 정제로 압축되어, 예를 들어, 정제당 5 mg, 20 mg 또는 40 mg 활성제의 단위 투여량을 제공한다.
캡슐 경구 고체 제형
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 습식 과립화에 의해 미세 결정질 셀룰로오스, 폴리비닐 피롤리돈 및 크로스카멜로오스 나트륨과 4:5:1:1 비율로 조합되고, 젤라틴 또는 히드록시프로필 메틸셀룰로오스 캡슐에 로딩되어, 예를들어, 캡슐당 5 mg, 20 mg 또는 40 mg 활성제의 단위 투여량을 제공한다.
액체 제제
본 개시내용의 화합물 (0.1 %), 물 (98.9 %) 및 아스코르브산 (1.0 %)을 포함하는 액체 제제는 본 개시내용의 화합물을 물 및 아스코르브산의 혼합물에 첨가함으로써 형성된다.
장용 코팅된 경구 제형
본 개시내용의 화합물을 폴리비닐 피롤리돈을 포함하는 수용액에 용해시키고 1:5 w/w 활성제:비드의 비율로 미세 결정질 셀룰로오스 또는 당 비드에 분무 코팅한 다음, 아크릴 공중합체, 예를 들어 상표명 Eudragit-L®; 및 Eudragit-S®로 입수 가능한 아크릴 공중합체의 조합, 또는 히드록시프로필 메틸셀룰로오스 아세테이트 숙시네이트를 포함하는 대략 5 % 중량 증가된 장용 코팅이 적용된다. 장용 코팅된 비드는 젤라틴 또는 히드록시프로필 메틸셀룰로오스 캡슐에 로딩되어, 캡슐 당 30 mg 활성제의 단위 투여량을 제공한다.
장용 코팅된 경구 제형
Eudragit-L®및 Eudragit-S®의 조합을 포함하는 장용 코팅, 또는 히드록시프로필 메틸셀룰로오스 아세테이트 숙시네이트는 상기 기재된 정제 경구 제형 또는 캡슐 경구 제형에 적용된다.
국소 투여용 연고 제제
본 개시내용의 화합물은 바셀린, C8-C10 트리글리세리드, 옥틸히드록시스테아레이트 및 N-메틸피롤리돈과 비율로 조합되어 0.05 중량% 내지 5 중량%의 활성제를 포함하는 조성물을 제공한다.
국소 투여용 연고 제제
본 개시내용의 화합물은 화이트 바셀린, 프로필렌 글리콜, 모노- 및 디-글리세리드, 파라핀, 부틸화된 히드록시톨루엔 및 에데테이트 칼슘 이나트륨과 비율로 조합되어 0.05 중량% 내지 5 중량%의 활성제를 포함하는 조성물을 제공한다.
국소 투여용 연고 제제
본 개시내용의 화합물은 미네랄 오일, 파라핀, 프로필렌 카보네이트, 백색 바셀린 및 백색 왁스와 조합되어 0.05 중량% 내지 5 중량%의 활성제를 포함하는 조성물을 제공한다.
국소 투여용 크림 제제
미네랄 오일은 본 개시내용의 화합물, 프로필렌 글리콜, 이소프로필 팔미테이트, 폴리소르베이트 60, 세틸 알코올, 소르비탄 모노스테아레이트, 폴리옥실 40 스테아레이트, 소르브산, 메틸파라벤 및 프로필파라벤과 조합되어 유상을 형성하며, 이는 전단 블렌딩 (shear blending)에 의해 정제수와 조합되어 0.05 중량% 내지 5 중량%의 활성제를 포함하는 조성물을 제공한다.
국소 투여용 크림 제제
본 개시내용의 화합물, 벤질 알코올, 세틸 알코올, 시트르산 무수물, 모노 및 디-글리세리드, 올레일 알코올, 프로필렌 글리콜, 소듐 세토스테아릴 설페이트, 소듐 히드록시드, 스테아릴 알코올, 트리글리세리드 및 물을 포함하는 크림 제제는 0.05 중량% 내지 5 중량%의 활성제를 포함한다.
국소 투여용 크림 제제
본 개시내용의 화합물, 세토스테아릴 알코올, 이소프로필 미리스테이트, 프로필렌 글리콜, 세토마크로골 1000, 디메티콘 360, 시트르산, 소듐 시트레이트 및 정제수를 방부제로서 이미다우레아, 메틸파라벤 및 프로필파라벤과 함께 포함하는 크림 제제는 0.05 중량% 내지 5 중량%의 활성제를 포함한다.
유용성
JAK3의 억제는 많은 주요 염증유발 사이토카인의 신호를 차단한다. 따라서, 본 개시내용의 화합물은 염증성 질환의 치료에 유용할 것으로 예상된다.
본 개시내용의 화합물은 JAK1, JAK2 및 TYK2보다 JAK3에 대해 선택적이도록 설계되었다. JAK1 보다 JAK3에 대한 선택성은 JAK3 선택성이 점막 치유에 관여하는 IL-10, 점액 장벽 보호 및 상피 재생에 관여하는 IL-22 및 장 상피 세포의 증식에 관여하는 IL-6와 같은 잠재적으로 유익한 사이토카인을 절약하도록 하는 몇 가지 증거가 있기 때문에 유익할 것으로 예상된다. JAK2 보다 JAK3에 대한 선택성은 에리트로포이에틴 (EPO) 및 트롬보포이에틴 (TPO) 신호를 절약할 수 있게 한다.
이러한 이론에 의해 제한되지 않고, 본 개시내용의 화합물은 JAK3에 존재하는 시스테인 (Cys909)과 공유 결합을 형성할 수 있는 친전자성 부분, 다른 3 개의 JAK 이소형에서 세린으로 대체된 잔기를 보유한다 (Goedken et al., J Biol Chem., 2015, 290, 8, 4573-89). JAK3에 대한 이러한 공유 결합은 보다 효과적인 효능으로 번역될 수 있는 확장된 표적 관여를 제공함으로써 유리할 수 있다. 실시예 부분에 기재된 바와 같이, 인간 JAK3에 공유 결합된 화합물 1, 3 및 4의 공-결정 구조가 얻어졌으며, 이는 이들 리간드 각각의 JAK3에 대한 비가역적 결합 성질을 확인시켜 준다.
본 개시내용의 일부 화합물은 유의한 전신 효과 없이 작용 부위에서 그의 효과를 갖도록 설계되어, 잠재적인 불리한 전신 면역 억제 효과를 피한다.
위장관 염증성 질환
JAK3의 강력한 억제를 제공하는 것 외에도, 본 개시내용의 일부 화합물은 전신 노출을 최소화하기 위해 잘 흡수되지 않도록 설계되었다. 이들 화합물은 작용 부위, 예를 들어 결장에서 효과를 갖도록 설계된다. 분석 6에 기재된 바와 같이, 특정 화합물은 약 5 x 10-6 cm/sec 미만의 Kp 값으로 낮은 투과성을 나타내며, 이는 전신 노출을 최소화하고 결장을 표적으로 하는데 유리한 것으로 간주된다. 특정 화합물은 약 10 x 10-6 cm/sec 미만의 Kp 값을 가지며, 이는 전신 노출을 최소화하고 결장을 표적으로 하기에 충분할 수 있다. 하기 분석 7에 기재된 바와 같이, 화합물 1, 2, 3, 4, 6, 7, 8, 21 및 22는 경구 투여시 혈장 노출에 대한 결장 노출 비율이 약 1250보다 큰 것으로 나타났다. 화합물 9, 5, 19 및 20은 약 200을 초과하는 결장 대 혈장 비를 나타냈다.
옥사졸론-유도된 대장염은 인간 궤양성 대장염과 조직학적으로 유사한 실험 모델이다. 분석 8에 기재된 바와 같이, 화합물 1, 2, 3, 4, 5, 6, 7, 8, 3-11, 5-10, 19, 15-1, 3-55, 3-34, 15-3, 21, 3-80, 3-81, 3-72, 3-57, 3-113 및 3-74는 마우스에서 옥사졸론-유도된 대장염 모델에서의 활성을 입증하였다. 추가로, 전신 기능 활성을 탐침하는 마우스의 면역 억제 모델인 분석 9에서 시험했을 때, 비장 NK 세포 수는 옥사졸론 모델에서 효능을 입증하는데 필요한 동일하거나 더 높은 용량에서 화합물 1, 2, 4, 5, 및 8에 의해 영향을 받지 않았다.
마지막으로, 화합물 1, 2, 3, 4, 5, 6, 7 및 8은 흉선에서 IL-2 유도된 pSTAT5 유도의 뮤린 모델에서 전신 활성의 부족을 입증하는 것으로 나타났다.
따라서, 이들 화합물은 전임상 모델에서 전신 효과를 나타내지 않으면서 항-대장염 활성을 입증하였다.
높은 결장 대 혈장 비율은 관련된 전신적으로-유발되는 부작용 없이, 견고하고 내강적으로-유발되는 항-염증 활성이 제공될 것으로 예상된다. 이러한 화합물은 염증성 장 질환, 궤양성 대장염 (직장구불창자염, 전대장염 (pancolitis), 궤양성 직장염 및 좌측 대장염), 크론병, 콜라겐성 대장염, 림프구성 대장염, 베체트병 (Behcet's disease), 셀리악병 (celiac disease), 면역 체크 포인트 억제제 유도 대장염, 회장염, 호산구성 식도염, 이식편 대 숙주 질환 관련 대장염 및 감염성 대장염을 포함하나 이에 제한되지 않는 다양한 위장관 염증성 징후에 유용하다. 궤양성 대장염 (Reimund et al., J Clin Immunology, 1996, 16, 144-150), 크론병 (Woywodt et al., Eur J Gastroenterology Hepatology, 1999, 11, 267-276), 콜라겐성 대장염 (Kumawat et al. , Mol Immunology, 2013, 55, 355-364), 림프구성 대장염 (Kumawat et al., 2013), 호산구성 식도염 (Weinbrand-Goichberg et al., Immunol Res, 2013, 56, 249-260), 이식편 대 숙주 질환 관련 대장염 (Coghill et al, Blood, 2001, 117, 3268-3276), 전염성 대장염 (Stallmach et al, Int J Colorectal Dis, 2004, 19, 308-315), 베체트병 (Zhou et al., Autoimmun Rev, 2012, 11, 699-704), 셀리악병 (de Nitto et al., World J Gastroenterol, 2009, 15, 4609-4614), 면역 체크 포인트 억제제 유도 대장염 (예를 들어, CTLA-4 억제제-유도 대장염); (Yano et al, J Translation Med, 2014, 12, 191), PD-1- 또는 PD-L1-억제제-유도 대장염) 및 회장염 (Yamamoto et al, Dig Liver Dis, 2008, 40, 253- 259)는 특정 염증유발 사이토카인 수준의 상승을 특징으로 한다. 많은 염증유발 사이토카인은 JAK 활성화를 통해 신호를 보내므로, 본 출원에 기재된 화합물은 염증을 완화시키고 증상 완화를 제공할 수 있다.
특히, 본 개시내용의 화합물은 궤양성 대장염의 완화의 유도 및 유지, 및 크론병, 면역 체크 포인트 억제제 유도 대장염 및 이식편 대 숙주 질환에서의 위장관 부작용의 치료에 유용할 수 있다.
따라서, 일 양상에서, 본 발명은 포유 동물 (예를 들어, 인간)에서 위장관 염증성 질환을 치료하는 방법을 제공하며, 상기 방법은 상기 포유 동물에게 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 약학적으로 허용가능한 담체 및 본 개시내용의 화합물, 또는 이의 약학적으로 허용가능한 염을 포함하는 약학적 조성물을 투여하는 단계를 포함한다.
본 발명은 추가로 포유 동물에서 궤양성 대장염을 치료하는 방법을 제공하며, 상기 방법은 상기 포유 동물에게 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 약학적으로 허용가능한 담체 및 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염을 포함하는 약학적 조성물을 투여하는 단계를 포함한다.
궤양성 대장염을 치료하는데 사용될 때, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 다른 투여 형태가 사용될 수 있지만, 전형적으로 1 일 1 회 용량 또는 하루에 다중 용량으로 경구 투여될 것이다. 투여당 투여되는 활성제의 양 또는 1 일당 투여되는 총량은 전형적으로 치료될 상태, 선택된 투여 경로, 투여된 실제 화합물 및 이의 상대 활성, 개별 환자의 연령, 체중 및 반응, 환자 증상의 중증도 등을 포함하는 관련 상황에 비추어 의사가 결정할 것이다.
궤양성 대장염 및 다른 위장관 염증성 장애를 치료하는데 적절한 투여량은 평균 70kg의 인간에 대해 활성제 약 5 내지 약 300mg/일 및 약 20 내지 약 70mg/일을 포함하는, 활성제 약 1 내지 약 400mg/일의 범위일 것으로 예상된다.
병용 요법
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 또한 위장관 염증성 장애의 치료에 영향을 주는 동일한 메커니즘 또는 상이한 메커니즘으로 작용하는 하나 이상의 활성제와 조합되어 사용될 수 있다. 상이한 활성제는 순차적으로 또는 동시에 (별도의 조성물로 또는 동일한 조성물로) 투여될 수 있다. 병용 요법에 유용한 클래스의 활성제는 아미노살리실레이트, 스테로이드, 전신 면역 억제제, 항-TNFα 항체, TNF 알파 리간드 억제제, TNF 결합제, 항-VLA-4 항체, 항-인테그린 α4β7 항체, 항-박테리아제, 글루코코르티코이드 작용제, 핵 인자 카파 B 억제제, 5-리폭시게나아제 억제제, 인테그린 알파-4/베타-7 길항제, 시클로옥시게나아제 억제제, IL-23 길항제, 류코트리엔 BLT 수용체 길항제, IL-6 길항제, IL-8 길항제, 인테그린 길항제, 니코틴 아세틸콜린 수용체 작용제, PPAR 감마 작용제, 스핑고신-1-포스페이트 수용체-1 조절제, B-림프구 항원 CD20 억제제, 칼시뉴린 억제제, CD3 길항제, 세포 부착 분자 억제제, 호산구 퍼옥시다아제 억제제, 헤파린 작용제, ICAM1 유전자 억제제, IL-13 길항제, IL-2 수용체 알파 서브유닛 억제제, 인슐린 증감제, 인터페론 베타 리간드, 인터페론 감마 수용체 길항제, 인터류킨-1 베타 리간드 조절제, MAdCAM 억제제, PDE 4 억제제, 스핑고신-1-포스페이트 수용체-1 작용제, TLR-9 작용제, 아세틸콜린에스테라아제 억제제, ACTH 수용체 작용제, 액티빈 수용체 길항제, CCR5 케모카인 길항제, CCR9 케모카인 길항제, 및 항-설사약을 포함하나 이에 제한되지 않는다.
본 JAK 억제제 화합물과 조합되어 사용될 수 있는 아미노살리실레이트는 메살라민, 오살라진 및 술파살라진을 포함하나, 이에 제한되지 않는다. 스테로이드의 예는 프레드니손, 프레드니솔론, 히드로코르티손, 부데소니드, 베클로메타손 및 플루티카손이 포함되나, 이에 제한되지 않는다. 염증성 장애의 치료에 유용한 전신 면역 억제제는 시클로스포린, 아자티오프린, 메토트렉세이트, 6-메르캅토퓨린 및 타크롤리무스를 포함하나, 이에 제한되지 않는다. 또한, 인플릭시맙, 아달리무맙, 골리무맙 및 세르톨리주맙을 포함하나 이에 제한되지 않는 항-TNFα 항체는 병용 요법에 사용될 수 있다. 다른 메카니즘에 의해 작용하는 유용한 화합물은 나탈리주맙과 같은 항-VLA-4 항체, 베돌리주맙과 같은 항-인테그린 α4β7 항체, 리팍시민과 같은 항-박테리아제 및 로페라미드와 같은 항-설사약을 포함한다. (Mozaffari et al. Expert Opin. Biol. Ther. 2014, 14, 583-600; Danese, Gut, 2012, 61, 918-932; Lam et al., Immunotherapy, 2014, 6, 963-971)
본 JAK 억제제 화합물과 조합되어 사용될 수 있는 다른 화합물은 오파가닙, 아바타셉트, 몬게르센, 필고티닙, LYC-30937, BI-655130, 미리키주맙, 아달리무맙, 타크롤리무스, 리툭시맙, GSK-2982772, 안데칼릭시맙, 날트렉손, 리산키주맙, QBECO, 알리카포르센, 에트롤리주맙, 포르알루맙, 오크렐리주맙, 베돌리주맙, 아미샐리모드, 오자니모드, 돌카나티드, 카트리데카코그, 부데소니드, STNM-01, 칸나비디올, 텔로트리스타트 에티프테이트, SHP-647, 카로테그라스트 메틸, 페그-일로데카킨, TOP-1288, 이베로가스트 N, PF-06480605, 페피시티닙, 베클로메타손, 재조합 인터페론 베타-1a, 인플릭시맙, 골리무맙, 트랄로키누맙, 우스테키누맙, 세르톨리주맙 페골, 탈리도미드, 우파다시티닙, 아프레밀라스트, 나탈리주맙, 인터페론 베타-1a, 리팍시민, RBX-2660, 에트라시모드, 질류톤, 핀골리모드, 코비톨리모드, 로피바카인, ABX-464, PF-06700841, 프레드니솔론, GLPG-0974, 발간시클로비르, 시클로스포린, VB-201, 툴린너셉트, MDGN-002, PTG-100, 덱사메타손, GED-0507-34-Levo, 베르틸리무맙, 브라지쿠맙, KHK-4083, 로시글리타존, 모크라비모드, 소트라스타우린, KAG-308, PUR-0110, E-6007, 발살라지드, 바실릭시맙, LP-02, ASP-3291, 돼지편충란, K(D)PT, 미디스마제, DNVX-078, 바텔리주맙, 알레쿠엘, 저 분자량 헤파린, 메텐케팔린, 트리데카티드, HMPL-004, SB-012, 올살라진, 발살라지드, 프로피오닐-L-카르니틴, 클로스트리듐 부티리쿰, 베클로메타손 및 아세만난을 포함하나, 이에 제한되지 않는다.
따라서, 또 다른 양상에서, 본 발명은 위장관 염증성 장애의 치료에 사용하기 위한 치료 조합을 제공하고, 상기 조합은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 및 상기 예시된 것들과 같은 위장관 염증성 장애를 치료하는데 유용한 하나 이상의 다른 치료제를 포함한다. 예를 들어, 본 발명은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 및 아미노살리실레이트, 스테로이드, 전신 면역 억제제, 항-TNFα 항체, 항-VLA-4 항체, 항-인테그린 α4β7 항체, 항-박테리아제 및 항-설사약으로부터 선택되는 하나 이상의 활성제를 포함하는 조합을 제공한다. 이차 활성제(들)가 포함되는 경우, 치료적 유효량, 즉 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염과 공동-투여될 때 치료적으로 유익한 효과를 생성하는 양으로 존재한다.
따라서, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형, 및 위장관 염증성 장애를 치료하는데 유용한 하나 이상의 다른 치료제를 포함하는 약학적 조성물이 또한 제공된다.
또한, 일 방법 양상에서, 본 발명은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형, 및 위장관 염증성 장애 치료에 유용한 하나 이상의 다른 치료제를 포유 동물에게 투여하는 단계를 포함하는 위장관 염증성 장애를 치료하는 방법을 제공한다.
병용 요법에 사용될 때, 상기 활성제는 상기 개시된 바와 같은 단일 약학적 조성물로 제제화될 수 있거나, 또는 동일하거나 상이한 투여 경로에 의해 동시에 또는 별도의 시간에 투여되는 별도의 조성물로 제공될 수 있다. 개별적으로 투여되는 경우, 상기 활성제는 원하는 치료 효과를 제공하도록 충분히 근접한 시간에 투여된다. 이러한 조성물은 개별적으로 포장될 수 있거나, 키트로서 함께 포장될 수 있다. 키트 내의 2 개 이상의 치료제는 동일한 투여 경로 또는 상이한 투여 경로로 투여될 수 있다.
염증성 피부 질환
아토피성 피부염 및 다른 염증성 피부 질환은 JAK-STAT 경로에 의존하는 염증유발 사이토카인의 상승과 관련이 있다. 따라서, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형은 아토피성 피부염, 원형 탈모증, 백반증, 건선, 피부 근육염, 피부 T 세포 림프종 (Netchiporouk et al., Cell Cycle. 2014; 13, 3331-3335) 및 아형 (세자리 증후군 (Sezary syndrome), 균상식육종, 파제드병모양그물증, 육아종 이완 피부, 림프종모양구진증, 만성 태선양 비강진, 급성 두창상 태선양 비강진, CD30+ 피부 T-세포 림프종, 이차 피부 CD30+ 대세포 림프종, 비-균상식육종 CD30- 피부 큰 T-세포 림프종, 다형성 T-세포 림프종, 레너트 림프종, 피하 T-세포 림프종, 혈관중심 림프종, 아구성 NK-세포 림프종), 결절성 양진, 편평태선, 일차 국소 피부 아밀로이드증, 수포성 유사천포창, 이식편 대 숙주 질환의 피부 징후, 유사천포창, 원판상 루푸스, 고리육아종, 만성단순태선, 외음부/음낭/항문 주위 가려움증, 경화태선, 대상포진 후 신경통 가려움증, 모낭성 편평태선 및 독발성 모낭염을 포함하나 이에 제한되지 않는 다수의 피부 염증 또는 소양증 증상에 유리할 수 있다. 특히, 아토피성 피부염 (Bao et al., JAK-STAT, 2013, 2, e24137), 원형 탈모증 (Xing et al., Nat Med. 2014, 20, 1043-1049), 백반증 (Craiglow et al, JAMA Dermatol. 2015, 151, 1110-1112), 결절성 양진 (Sonkoly et al., J Allergy Clin Immunol. 2006, 117, 411-417), 편평태선 (Welz-Kubiak et al., J Immunol Res. 2015, ID:854747), 일차 국소 피부 아밀로이드증 (Tanaka et al., Br J Dermatol. 2009, 161, 1217-1224), 수포성 유사천포창 (Feliciani et al., Int J Immunopathol Pharmacol. 1999, 12, 55-61) 및 이식편 대 숙주 질환의 피부 징후 (Okiyama et al., J Invest Dermatol. 2014, 134, 992-1000)는 JAK 활성화를 통해 신호를 보내는 특정 사이토카인의 상승을 특징으로 한다. 따라서, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형은 이들 사이토카인에 의해 유발된 관련된 피부 염증 또는 소양증을 완화시킬 수 있다. 특히, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형은 아토피성 피부염 및 다른 염증성 피부 질환의 치료에 유용할 것으로 예상될 수 있다.
따라서, 일 양상에서, 본 발명은 포유 동물 (예를 들어, 인간)에서 염증성 피부 질환을 치료하는 방법을 제공하며, 상기 방법은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형, 및 약학적 담체를 상기 포유 동물의 피부에 적용하는 단계를 포함한다. 일 양상에서, 상기 염증성 피부 질환은 아토피성 피부염이다.
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형은 또한 염증성 피부 질환을 치료하는데 유용한 하나 이상의 화합물과 조합하여 사용될 수 있다. 일부 구체예에서, 하나 이상의 화합물은 스테로이드, 히스타민 H1 수용체 길항제, 칼시뉴린 억제제, IL-13 길항제, PDE 4 억제제, G-단백질 결합 수용체-44 길항제, IL-4 길항제, 5-HT 1a 수용체 길항제, 5-HT 2b 수용체 길항제, 알파 2 아드레날린 수용체 작용제, 칸나비노이드 CB1 수용체 길항제, CCR3 케모카인, 길항제, 콜라게나아제 억제제, 시토졸 포스포리파아제 A2 억제제, 에오탁신 리간드 억제제, GATA 3 전사 인자 억제제, 히스타민 H4 수용체 길항제, IL-10 길항제, IL-12 길항제, IL-17 길항제, IL-2 길항제, IL-23 길항제, IL-4 수용체 조절제, IL-5 길항제, 면역 글로불린 E 길항제, 면역 글로불린 E 조절제, 인터페론 감마 수용체 길항제, 인터루킨 33 리간드 억제제, 인터루킨-31 수용체 길항제, 류코트리엔 길항제, 간 X 수용체 작용제, 간 X 수용체 베타 작용제, 핵 인자 카파 B 억제제, OX-40 수용체 길항제, PGD2 길항제, 포스포리파아제 A2 억제제, SH2 도메인 이노시톨 포스파타아제 1 자극제, 흉선 기질 림프 단백질 리간드 억제제, TLR 조절제, TNF 알파 리간드 조절제 또는 바닐로이드 VR1 길항제이다. 일부 구체예에서, 하나 이상의 화합물은 그람 양성 항생제, 예컨대 무피로신 또는 푸시드산이다. 일부 구체예에서, 하나 이상의 화합물은 트라닐라스트, 타크롤리무스, 에피나스틴, SB-011, AM-1030, ZPL-521, MM-36, FB-825, PG-102, 바이롬화, GBR-830, AVX-001, AMG-0101, E-6005, DMT-210, AX-1602, 베르틸리무맙, 로십터 아세테이트, Q-301, ANB-020, VTP-38543, ZPL-389, 레브리키주맙, 테제펠루맙, 펙소페나딘, 피메크롤리무스, 베포타스틴, 크리사보롤, 트랄로키누맙, 페비피프란트, 독시시클린, 데스로라타딘, ALX-101, 네몰리주맙, 아시바트렙, 시클로스포린, 메폴리주맙, 두필루맙, 세쿠키누맙, 티마피프란트 또는 우스테키누맙이다.
따라서, 일 양상에서, 본 발명은 포유 동물에서 염증성 피부 질환을 치료하는 방법을 제공하며, 상기 방법은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형 및 그람 양성 항생제를 상기 포유 동물의 피부에 적용하는 단계를 포함한다. 다른 양상에서, 본 발명은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형, 그람 양성 항생제 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물을 제공한다.
호흡기 질환
JAK-STAT 경로, 특히 IL-2, IL-3, IL 4, IL 5, IL-6, IL-9, IL-11, IL-13, IL-23, IL-31, IL-27을 통해 신호를 보내는 사이토카인, 흉선 기질 림포포이에틴 (TSLP), 인터페론-γ (IFNγ및 과립구-대식세포 콜로니-자극 인자 (GM-CSF)는 또한 천식 염증 및 다른 염증성 호흡기 질환에 연루되어 있다. 상기 기재한 바와 같이, 본 개시내용의 화합물은 JAK3의 강력한 억제제인 것으로 나타났으며, 세포 분석에서 IL-2 염증유발 사이토카인의 강력한 억제를 입증하였다.
JAK 억제제의 항-염증 활성은 천식의 전임상 모델에서 강력하게 입증되었다 (Malaviya et al., Int Immunopharmacol, 2010, 10, 829,-836; Matsunaga et al., Biochem and Biophys Res Commun, 2011, 404, 261-267; Kudlacz et al., Eur J Pharmacol, 2008, 582, 154-161). 따라서, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형은 천식과 같은 염증성 호흡기 질환의 치료에 유용할 수 있다. 폐의 염증 및 섬유증은 만성 폐쇄성 폐 질환 (COPD), 낭포성 섬유증 (CF), 폐렴, 간질성 폐질환 (특발성 폐 섬유증 포함), 급성 폐 손상, 급성 호흡곤란 증후군, 기관지염, 폐기종 및 폐쇄성 세기관지염과 같은 천식 외에 다른 호흡기 질환의 특징이다. 따라서, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 만성 폐쇄성 폐 질환, 낭포성 섬유증, 폐렴, 간질성 폐질환 (특발성 폐 섬유증 포함), 급성 폐 손상, 급성 호흡곤란 증후군, 기관지염, 폐기종, 폐쇄성 세기관지염, 폐쇄성 세기관지 기질화 폐렴 (COS라도고 함), 일차 이식편 장애 (PGD), 기질화 폐렴 (OP), 급성 거부반응 (AR), 림파구성 세기관지염 (LB), 만성 폐 동종 이식편 장애 (CLAD), 제한성 CLAD (rCLAD 또는 RAS), 호중구 동종 이식편 장애 및 사르코이드증의 치료에 유용할 수 있다.
따라서, 일 양상에서, 본 개시내용은 포유 동물 (예를 들어, 인간)에서 호흡기 질환을 치료하는 방법을 제공하며, 상기 방법은 상기 포유 동물에게 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형을 투여하는 단계를 포함한다.
일 양상에서, 상기 호흡기 질환은 천식, 만성 폐쇄성 폐 질환, 낭포성 섬유증, 폐렴, 만성 폐쇄성 폐 질환 (COPD), 낭포성 섬유증 (CF), 폐렴, 간질성 폐 질환 (특발성 폐 섬유증 포함), 급성 폐 손상, 급성 호흡곤란 증후군, 기관지염, 폐기종, 폐쇄성 세기관지염, 폐쇄성 세기관지 기질화 폐렴 (COS라고도 함), 일차 이식편 장애 (PGD), 기질화 폐렴 (OP), 급성 거부반응 (AR), 림파구성 세기관지염 (LB), 만성 폐 동종 이식편 장애 (CLAD), 제한성 CLAD (rCLAD 또는 RAS), 호중구 동종 이식편 장애, 알레르기성 비염 또는 사르코이드증이다. 다른 양상에서, 호흡기 질환은 천식 또는 만성 폐쇄성 폐 질환이다.
추가의 일 양상에서, 상기 호흡기 질환은 폐 감염, 기생충 감염, 폐동맥 고혈압, 사르코이드증, 림프관 평활근종증, 기관지 확장증 또는 침윤성 폐 질환이다. 또 다른 양상에서, 상기 호흡기 질환은 약물-유도성 폐렴, 진균 유도성 폐렴, 알레르기성 기관지폐 아스페르길루스증, 과민성 폐렴, 다발혈관염을 동반한 호산구 육아종증, 특발성 급성 호산구성 폐렴, 특발성 만성 호산구성 폐렴, 과호산구 증후군, 로플러 증후군 (Loffler syndrome), 폐쇄성 세기관지 기질화 폐렴 또는 면역 체크포인트 억제제 유도성 폐렴이다.
본 개시내용은 호흡기 질환을 치료하는 방법을 제공하며, 상기 방법은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형 및 약학적으로 허용가능한 담체를 포함하는 약학적 조성물을 상기 포유 동물에게 투여하는 단계를 포함한다.
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형은 또한 호흡기 질환에 유용한 하나 이상의 화합물과 조합하여 사용될 수 있다.
안질환
많은 안질환은 JAK-STAT 경로에 의존하는 염증유발 사이토카인의 상승과 관련이 있는 것으로 나타났다.
따라서, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형은 포도막염, 당뇨병성 망막 병증, 당뇨병성 황반 부종, 안구 건조증, 노인 황반 변성, 망막 정맥 폐색 (RVO) 및 아토피성 각결막염을 포함하나 이에 제한되지 않는 다수의 안질환의 치료에 유용할 수 있다.
특히 포도막염 (Horai and Caspi, J Interferon Cytokine Res, 2011, 31, 733-744), 당뇨병성 망막 병증 (Abcouwer, J Clin Cell Immunol, 2013, Suppl 1, 1-12), 당뇨병성 황반 부종 (Sohn et al., American Opthamology, 2011, 152, 686-694), 안구 건조증 (Stevenson et al, Arch Ophthalmol, 2012, 130, 90-100), 망막 정맥 폐색 (Shchuko et al, Indian Journal of Ophthalmology, 2015, 63(12), 905-911) 및 노인 황반 변성 (Knickelbein et al, Int Ophthalmol Clin, 2015, 55(3), 63-78)은 JAK-STAT 경로를 통해 신호전달하는 특정 염증유발 사이토카인의 상승을 특징으로 한다. 따라서, 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염은 관련된 안구 염증을 완화시키고 질환 진행을 역전시키거나 증상 완화를 제공할 수 있다.
따라서, 일 양상에서, 본 개시내용은 포유 동물에서 안질환을 치료하는 방법을 제공하며, 상기 방법은 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형 및 약학적인 담체를 포함하는 약학적 조성물을 상기 포유 동물의 안구에 투여하는 단계를 포함한다. 일 양상에서, 상기 안질환은 포도막염, 당뇨병성 망막 병증, 당뇨병성 황반 부종, 안구 건조증, 노인 황반 변성, 망막 정맥 폐색 또는 아토피성 각결막염이다. 일 양상에서, 상기 방법은 유리체내 주사에 의해 본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형을 투여하는 단계를 포함한다.
본 개시내용의 화합물, 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형은 또한 안질환에 유용한 하나 이상의 화합물과 조합하여 사용될 수 있다.
다른 질환
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 결정형은 다른 염증성 질환, 자가 면역 질환 또는 암과 같은 다른 질환을 치료하는데 유용할 수 있다.
본 개시내용의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 이의 결정형은 관절염, 류마티스 관절염, 소아 류마티스 관절염, 이식 거부반응, 안구 건조증, 건선성 관절염, 당뇨병, 인슐린 의존성 당뇨병, 운동 신경 질환, 골수이형성 증후군, 통증, 근육 감소증, 악액질, 패혈성 쇼크, 전신성 홍반 루푸스, 백혈병, 만성 림프구성 백혈병, 만성 골수성 백혈병, 급성 림프구성 백혈병, 급성 골수성 백혈병, 강직성 척추염, 골수섬유증, B-세포 림프종, 간세포 암종, 호지킨병, 유방암, 다발성 골수종, 흑색종, 비-호지킨 림프종, 비소 세포 폐암, 난소 투명 세포암, 난소 종양, 췌장 종양, 진성 다혈증, 쇼그렌 증후군, 연조직 육종, 육종, 비장 비대증, T-세포 림프종 및 지중해 빈혈증(thalassemia major) 중 하나 이상을 치료하는데 유용할 수 있다.
본 개시내용의 화합물은 JAK3 효소의 강력한 억제제이고, 효소 결합 분석에서 JAK1, JAK2 및 TYK2에 비해 JAK3에 대해 선택적이며, 하기 실시예에 기재된 바와 같은 세포 분석에서 JAK3에 대해 강력한 기능적 활성을 갖는 것으로 입증되었다.
실시예
하기 합성 및 생물학적 실시예는 본 발명을 설명하기 위해 제공되며, 본 발명의 범위를 제한하는 것으로 해석되어서는 안 된다. 하기 실시예에서, 하기 약어는 달리 지시되지 않는 한 하기의 의미를 갖는다. 하기에 정의되지 않은 약어는 일반적으로 허용되는 의미를 갖는다.
ACN
=
아세토니트릴
Calcd
=
계산된
Boc
=
tert-부틸옥시카보닐
d
=
일 (day(s))
DIPEA
=
N,N-디이소프로필에틸아민
DMF
=
N,N-디메틸포름아미드
DMSO
=
디메틸 설폭시드
EtOAc
=
에틸 아세테이트
EtOH =
에틸 알코올
h
=
시간 (hour(s))
HATU =
N,N,N',N'-테트라메틸-O-(7-아자벤조트리아졸-1-일)우로늄 헥사플루오로포스페이트
IPA
=
이소프로필 알코올
MeOH
=
메탄올
min
=
분 (minute(s))
RT 또는 rt
=
실온
SiG
=
실리카 겔
TEA
=
트리에틸아민
THF
=
테트라히드로푸란
THP
=
테트라히드로피란
TFA
=
트리플루오로아세트산
시약 및 용매는 상업적 공급 업체 (Aldrich, Fluka, Sigma 등)로부터 구입하여 추가 정제없이 사용하였다. 반응 혼합물의 진행을 박층 크로마토그래피 (TLC), 분석용 고성능 액체 크로마토그래피 (분석용 HPLC) 및 질량 분석법에 의해 모니터링하였다. 반응 혼합물은 각각의 반응에서 구체적으로 기재된 바와 같이 워크업 (work up)되었고; 일반적으로 이들은 추출 및 온도- 및 용매-의존적 결정화와 같은 다른 정제 방법 및 침전에 의해 정제되었다. 또한, 반응 혼합물을 통상적으로 C18 또는 BDS 컬럼 패킹 및 통상적인 용리제를 사용하여 컬럼 크로마토그래피 또는 분취용 HPLC에 의해 일상적으로 정제하였다. 전형적인 분취용 HPLC 조건은 하기에 기재되어 있다.
반응 생성물의 특성 분석은 질량 및 1H-NMR 분광법에 의해 일상적으로 수행되었다. NMR 분석을 위해, 샘플을 중수소화 용매 (예를 들어, CD3OD, CDCl3 또는 d 6-DMSO)에 용해시키고, 표준 관찰 조건하에 Varian Gemini 2000 기기 (400 MHz)로 1H-NMR 스펙트럼을 획득하였다. 화합물의 질량 분광계 분석은 자동 정제 시스템에 결합된 Applied Biosystems (Foster City, CA) 모델 API 150 EX 기기 또는 Waters (Milford, MA) 3100 기기와 함께 전자 분무 이온화 방법 (ESMS)에 의해 수행되었다.
달리 지시되지 않는 한, 하기 조건을 분취용 HPLC 정제에 사용하였다.
컬럼:
C18, 5 μm 21.2 x 150 mm 또는 C18, 5 μm 21 x 250 mm 또는 C14, 5 μm 21x150 mm
컬럼 온도:
실온
유속: 20.0 mL/분
이동상:
A = 물 + 0.05 % TFA
B = ACN + 0.05 % TFA,
주입 용량:
(100-1500 μL)
검출 파장:
214 nm
조 화합물 (crude compound)을 1:1의 물:아세트산에 약 50 mg/mL로 용해시켰다. 2.1 x 50 mm C18 컬럼을 사용하여 4 분 분석 스케일 테스트 실행을 수행한 후, 분석 스케일 테스트 실행의 % B 보유율에 기초한 구배로 100 μL 주입을 사용한 15 분 또는 20 분 분취 스케일 실행을 수행하였다. 정확한 구배는 샘플 의존적이었다. 최적의 분리를 위해 21 x 250 mm C18 컬럼 및/또는 21 x 150 mm C14 컬럼으로 밀착된 불순물이 있는 샘플을 검사했다. 원하는 생성물을 포함하는 분획을 질량 분석법으로 확인하였다.
분석용 HPLC 조건
방법 A
컬럼:
LUNA C18 (2), 150 x 4.60 mm, 3 μm
컬럼 온도:
37 ℃
유속:
1.0 mL/분
주입 용량:
5 μL
샘플 준비:
1:1의 ACN:물에 용해
이동상:
A = 물:ACN:TFA (98:2:0.05)
B = 물:ACN:TFA (2:98:0.05)
검출 파장:
250 nm
구배:
총 32 분 (시간 (분)/ % B): 0/2, 10/20, 24/90, 29/90, 30/2, 32/2
방법 B
컬럼:
LUNA C18 (2), 150 x 4.60 mm, 3 μm
컬럼 온도:
37 ℃
유속:
1.0 mL/분
주입 용량:
10 μL
샘플 준비:
1:1의 ACN:물에 용해
이동상:
A = 물:ACN:TFA (98:2:0.05)
B = 물:ACN:TFA (10:90:0.05)
검출 파장:
254 nm
구배:
총 35 분 (시간 (분)/ % B): 0/2, 20/25, 23/90, 26/90, 27/2, 35/2
분말 X-선 회절 패턴은 45 kV의 출력 전압 및 40 mA의 전류를 갖는 Cu-Kα 방사선 (λ = 1.54051 Å)을 사용하는 Bruker D8-Advance X-선 회절계로 얻었다. 이 기기는 샘플의 강도를 극대화하기 위해 입사, 발산 및 산란 슬릿이 설정된 Bragg-Brentano 형상으로 작동되었다. 측정을 위해, 소량의 분말 (5-25 mg)을 샘플 홀더에 부드럽게 눌러 매끄러운 표면을 형성하고 X-선 노출시켰다. 샘플을 단계 크기 0.02°및 단계 당 0.30°초의 스캔 속도로 2θ에서 2°내지 35°의 2θ-2θ모드에서 스캔하였다. 데이터 수집은 Bruker DiffracSuite 측정 소프트웨어로 제어하고 Jade 소프트웨어 (버전 7.5.1)로 분석했다. 기기는 ±0.02°2-쎄타 각도 내에서 커런덤 (corundum) 표준으로 교정되었다.
시차 주사 열량 측정 (DSC)은 열 분석기 제어 장치가 장착된 TA Instruments 모델 Q-100 모듈을 사용하여 수행되었다. TA Instruments 열 분석 소프트웨어를 사용하여 데이터를 수집하고 분석하였다. 각각의 결정 형태의 샘플을 커버된 알루미늄 팬으로 정확하게 계량하였다. 5 ℃에서 5 분 등온 평형 기간 후, 샘플을 0 ℃ 내지 300 ℃에서 10 ℃분의 선형 가열 램프를 사용하여 가열하였다.
고분해능 기능을 갖춘 TA Instruments 모델 Q-50 모듈을 사용하여 열 중량 분석 (TGA) 측정을 수행했다. TA Instruments 열 분석기 제어 장치를 사용하여 데이터를 수집하고 TA Instruments 유니버셜 분석 소프트웨어를 사용하여 분석했다. 계량된 샘플을 백금 팬에 놓고 주위 온도에서 300-350 ℃까지 10 ℃의 가열 속도로 스캔하였다. 균형 및 퍼니스 챔버는 사용 중에 질소 흐름으로 퍼지 (purge)되었다.
동적 수분 흡착 (DMS) 측정은 VTI 대기 마이크로밸런스, SGA-100 시스템 (VTI Corp., Hialeah, FL 33016)을 사용하여 수행되었다. 계량된 샘플을 사용하였고, 분석 시작시 습도는 가능한 가장 낮은 값 (0 % RH에 근접함)이었다. DMS 분석은 120 분 동안의 초기 건조 단계 (0 % RH)에 이어, 5 % RH 내지 90 % RH의 습도 범위에 걸쳐 5 % RH/단계의 스캔 속도로 2 회 수착 및 탈착 사이클로 구성되었다. DMS 실행은 25 ℃에서 등온적으로 수행되었다.
제조예
1 : 6
-
브로모
-4-
플루오로
-1-(
테트라히드로
-2H-피란-2-일)-1H-
인다졸
DCM (76 ml) 중 6-브로모-4-플루오로-1h-인다졸 (5g, 23.25mmol), 3,4-디히드로-2H-피란 (6.38ml, 69.8mmol) 및 p-톨루엔설폰산 모노히드레이트 (0.442g, 2.325mmol)의 혼합물을 실온에서 밤새 교반하였다. 반응물을 농축시키고, 생성된 잔류물을 0-60 % EtOAc/헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하여 원하는 생성물을 수득하였다 (6.08g, 87 % 수율).
제조예 2 : tert-부틸 3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트
소듐 히드라이드 (1.003g, 41.8mmol)을 0 ℃에서 N2 대기하에 DMF (60mL) 중 1-Boc-아제티딘-3-일-메탄올 (6.89g, 36.8mmol)의 교반 용액에 천천히 첨가하고, 반응물을 실온으로 가온시켰다. 거품 반응 혼합물을 실온에서 30 분 동안 교반한 후 다시 0 ℃로 냉각시켰다. DMF (20 mL) 중 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (5.00 g, 16.71 mmol)의 용액을 반응 혼합물에 천천히 캐뉼라로 첨가하고 (cannulated), 반응물을 실온으로 가온하고, 실온에서 2 시간 동안 교반하였다. H2O (150 mL) 및 EtOAc (100 mL)를 천천히 첨가하여 반응을 켄칭하고 5 분 동안 교반되도록 하였다. 추가의 물 (100 mL)을 첨가하고 2 상 혼합물을 EtOAc (3 x 100 mL)로 추출하였다. 이어서, 조합된 유기 분획을 1:1의 H2O:염수 (3 x 100 mL)로 세척하고 Na2SO4상에서 건조시켰다. 생성된 투명하고 약간 분홍색인 오일을 0-100 % EtOAc/헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하여 원하는 생성물을 투명한 무색 점성 오일로서 수득하였다 (7.34g, 15.74mmol, 94 % 수율). (m/z): C21H28BrN3O4에 대한 [M+H]+ 계산치 466.13, 실측치 466.1.
제조예 3 : tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트
디클로로[1,1'-비스(디페닐포스피노)페로센]팔라듐(II) 디클로로메탄 부가물 (1.93 g, 2.36 mmol)을 1,4-디옥산 (63.0 ml) 및 물 (15.74 ml) 중 4-히드록시벤젠보론산 (3.26 g, 23.61 mmol), tert-부틸 3-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트 (7.34 g, 15.74 mmol) 및 포타슘 포스페이트 (10.02 g, 47.2 mmol)의 용액에 첨가하였다. 반응 혼합물을 N2로 10 분 동안 가스를 제거한 후 110 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 진공내에서 약 5mL의 부피로 농축시켰다. 암모늄 클로라이드 (20 mL)의 포화 수용액을 첨가하고 혼합물을 메틸렌 클로라이드 (3 x 20 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 50 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트를 수득하였다 (7.55 g, 15.74 mmol, 100 % 수율). (m/z): C27H33N3O5에 대한 [M+H]+ 계산치 480.24, 실측치 480.1.
제조예 4 : 4-(4-(아제티딘-3-일메톡시)-1H-인다졸-6-일)페놀
디클로로메탄 (21.80 ml) 중 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트 (7.84 g, 16.35 mmol)의 용액에 TFA (10.90 ml)을 천천히 첨가하였다. 투명한 용액을 실온에서 5 시간 동안 교반하였다. 반응물을 진공내에서 농축시켜 TFA 염으로서 4-(4-(아제티딘-3-일메톡시)-1H-인다졸-6-일)페놀을 수득하였다 (6.69 g, 16.35 mmol, 100 % 수율). (m/z): C17H17N3O2에 대한 [M+H]+ 계산치 296.13, 실측치 296.1.
실시예 1A : (E)-4-(디메틸아미노)-1-(3-(((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-일)부트-2-엔-1-온
HATU (2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트, 817 mg, 2.150 mmol)를 DMF (2.00 mL) 중 (E)-4-(디메틸아미노)부트-2-엔산 히드로클로라이드 (405 mg, 2.44 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 5 분 동안 교반하였다. 4-(4-(아제티딘-3-일메톡시)-1H-인다졸-6-일)페놀 TFA 염 (800 mg, 1.954 mmol)에 이어서 DIPEA (1.707 ml, 9.77 mmol)를 첨가하고 실온에서 15 분 동안 반응 혼합물을 교반한 다음, 이어서 진공내에서 농축하여 황색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 20-80 % 아세토니트릴의 구배를 사용하여 예비 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (E)-4-(디메틸아미노)-1-(3-(((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-일)부트-2-엔-1-온을 수득하였다 (235.0 mg, 0.578 mmol, 29.6 % 수율). (m/z): C23H26N4O3에 대한 [M+H]+ 계산치 407.20, 실측치 407.2. 1H NMR (400MHz, DMSO-d 6) δ13.07 (s, 1H), 10.33 (s, 1H), 7.93 (s, 1H), 7.55 (d, J = 7.9Hz, 2H), 7.21 (S, 1H) , 6.86 (d, J = 8.6 Hz, 2H), 6.79 (s, 1H), 6.66 - 6.58 (m, 1H), 6.45 (d, J = 15.5 Hz, 1H), 4.45 - 4.36 (m, 2H), 4.17 - 4.07 (m, 2H), 3.91-3.83 (m, 3H), 3.22-3.10 (m, 2H), 2.75 (s, 6H).
실시예 1B : 결정질 (E)-4-(디메틸아미노)-1-(3-(((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-일)부트-2-엔-1-온 결정형 4
단계 1
DCM 200ml 중 6-브로모-4-플루오로-1H-인다졸 (20.0g, 93mmol)의 현탁액에 p-톨루엔설폰산 모노히드레이트 (1.769g, 9.30mmol)를 첨가하였다. 반응 혼합물은 현탁액으로 유지되었다. 이어서, 3,4-디히드로-2H-피란 (16.97 ml, 186 mmol)을 첨가하였다. 5 분 후에 고체의 완전한 용해가 관찰되었다. 반응 혼합물을 실온에서 밤새 교반하여 암색 용액을 형성하였다. 200mL의 수성 비카보네이트를 첨가하고, 상을 분리하여 유기층을 200ml의 염수로 세척하고 소듐 설페이트로 건조시켰다. 용액을 실리카 플러그를 통해 여과하여 암색을 제거하고 실리카를 300ml의 DCM으로 세척하였다. 용매를 증발시켜 25g의 생성물을 회백색 고체로서 제공하였다.
단계 2A
500ml 둥근 바닥 플라스크에 tert-부틸 3-(히드록시메틸)아제티딘-1-카복실레이트 (22.53g, 120mmol) 및 100ml의 디메틸아세트아미드 (DMAc)를 첨가하였다. 플라스크를 질소로 퍼지 (purge)하였다. 세슘 카보네이트 (39.2 g, 120 mmol)를 첨가하였다. 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (24g, 80mmol)을 첨가하고 반응 혼합물을 70 ℃에서 2 일 동안 교반하였다. 추가의 0.5eq의 tert-부틸 3-(히드록시메틸)아제티딘-1-카복실레이트 및 세슘 카보네이트를 첨가하고, 반응물을 70 ℃에서 밤새 가열하여 완전한 전환을 제공하였다. 반응 혼합물을 실온으로 냉각한 다음, 천천히 빙냉수 (700ml)에 부었다. 생성된 슬러리를 20 분 동안 교반한 다음 여과하고 건조시켜 32g의 생성물을 수득하였다. 흐려질 때까지 반용매로서 물을 천천히 첨가함으로써 생성물을 메탄올-물로부터 결정화시켰다. 시간이 지남에 따라 백색 슬러리가 발생하였다. 고체를 여과하고 건조시켜 순도 98 % 이상의 물질 28g을 수득하였다.
단계 2B
대안적으로, 포타슘 t-부톡시드를 0 ℃에서 DMAc 중 tert-부틸 3-(히드록시메틸)아제티딘-1-카복실레이트의 용액에 첨가하였다. 60 분 후, 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸을 0 ℃에서 첨가하고, 반응 혼합물을 실온으로 가온시켜 6 시간보다 낮은 시간에서 완전한 전환을 제공하였다.
단계 3
250 mL 쉬링크 (Schlenk) 플라스크에 tert-부틸 3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트 (10.0g, 21.44mmol) 및 80ml의 디옥산을 첨가하였다. (4-히드록시페닐)보론산 (4.44 g, 32.2 mmol)을 첨가하였다. 포타슘 포스페이트 삼염기 무수 (13.65 g, 64.3 mmol)에 20ml의 물을 첨가하고 반응 혼합물을 질소로 퍼지하였다. PdCl2(dppf)-CH2Cl2 부가물 (0.876 g, 1.072 mmol)을 첨가하고 응축기가 있는 플라스크에 질소를 3 회 다시 채웠다. 반응 혼합물을 110 ℃에서 2 시간 및 30 분 동안 가열하여 HPLC에 의한 완전한 전환을 나타내었다. 반응 혼합물을 실온으로 냉각시킨 후, 대부분의 디옥산을 제거하였다. 포화 암모늄 클로라이드 150ml에 이어서 에틸 아세테이트 150ml를 첨가하였다. 1M 수성 HCl로 pH를 중성으로 조정하였다. 상을 분리하고 유기층을 소듐 설페이트로 건조시킨 후 용매를 제거하였다. 조 생성물을 150ml의 DCM에 용해시키고 헥산 중 20-50 % 에틸 아세테이트로 용리하는 300g SiG 컬럼에 로딩하였다. 순수한 분획을 조합하고 용매를 증발시켰다. 100 ml의 MeTHF를 첨가한 후, 결정성 시드를 첨가하였다. 시간이 지남에 따라 슬러리가 생성되었다. DIIPE 100ml를 첨가하고 슬러리를 밤새 교반하였다. 여과 및 건조로 7.9g의 순수한 물질 (> 99 %)을 수득하였다.
단계 4
50mL 둥근 바닥 플라스크에 400ml의 메탄올 중 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트 (85g, 177mmol)를 첨가하였다. p-톨루엔설폰산 모노히드레이트 (101 g, 532 mmol)을 첨가하고 반응 혼합물을 실온에서 교반하여 2 일 후 약 90 % 전환율을 제공하였다. 반응 혼합물을 실온에서 추가 24 시간 동안 교반하여 약 96 % 전환율을 제공하였다. 400 ml의 디이소프로필 에테르를 첨가하고 생성된 슬러리를 실온에서 밤새 교반하여 밤새 결정질 염을 형성시켰다. 여과 및 질소하에 건조시켜 비스 PTSA 염으로서 > 99 % 순수한 물질 100g을 수득하였다.
단계 5
100mL 둥근 바닥 플라스크에 (E)-4-(디메틸아미노)부트-2-에노산, HCl (1.899g, 11.46mmol) 및 20ml의 DMF를 첨가하였다. HCTU o-(1h-6-클로로벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트 (4.91 g, 11.46 mmol)를 첨가하고 반응 혼합물을 실온에서 20 분 동안 교반하였다. 별도의 플라스크에 4-(4-(아제티딘-3-일메톡시)-1H-인다졸-6-일)페놀, 2TFA (5.0g, 9.55 mmol) 및 20ml의 DMF를 첨가하였다. 생성된 용액을 0 ℃로 냉각시킨 후, DIPEA (5 ml, 38.2 mmol, 3 당량)를 천천히 첨가하였다. 상기 용액을 사전 활성화된 산 반응 혼합물에 (5 분에 걸쳐) 첨가하고 반응 혼합물을 실온에서 15 분 동안 교반하였다. DIPEA의 하나의 추가 당량이 적가되었다. 실온에서 20 분 후 HPLC에 의해 완전한 전환이 관찰되었다. 반응 혼합물을 200ml의 교반수에 부었다. 끈적한 고체는 pH 약 7에서 침전되었다. pH는 수성 암모니아로 약 8로 조심스럽게 조정되었다. 용액을 100 ml의 MeTHF로 3 회 추출하였다. 조합된 유기층을 소듐 설페이트로 건조시킨 후 용매를 제거하였다. 조 유리 염기 생성물을 DCM 중 25ml의 10 % 메탄올에 용해시키고, 125g 실리카 겔 컬럼에 로딩하고 0.5 % 수성 암모니아를 포함하는 DCM 중 등용매 10 % 메탄올로 용리시켰다. 순수한 분획을 조합하고 용매를 증발시켰다. 아세톤으로부터 재결정화하여 > 98 % 순수한 물질을 수득하였다 (50 % 수율).
25 mg의 화합물 1을 1 mL의 물에 현탁시켰다. 생성된 현탁액을 50 ℃에서 2 일 동안 교반하고, 여과하고, 2mL의 물로 세척하고, 주위 조건하에서 몇 시간 동안 건조시켜 결정형 4를 제공 하였다.
대안적으로, 화합물 1을 10 부피의 알콜에 완전히 용해시킨 후, 운점까지 대략 8-10 부피의 물을 천천히 첨가함으로써 에탄올 및 물 또는 메탄올 및 물에 용해시켰다. 결정형 4의 시드를 첨가하고 시간이 지남에 따라 슬러리가 천천히 생성되었다. 이어서, 더 많은 물을 서서히 첨가하고 (약 10 부피), 고체를 여과하고 건조시켜 결정형 4를 수득하였다.
실시예 1C : 결정질 (E)-4-(디메틸아미노)-1-(3-(((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-일)부트-2-엔-1-온 결정형 3
결정형 3은 화합물 1의 무수 유리 염기 결정형이다.
150 mg의 화합물 1을 2 mL의 아세토니트릴 및 이소프로판올의 1:1 혼합물 2 mL에 현탁시켰다. 생성된 현탁액을 50 ℃에서 1 일 동안 교반하고, 여과하고, 아세토니트릴 및 이소프로판올의 1:1 혼합물 2mL로 세척하고 몇 시간 동안 주위 조건하에서 건조시켜 결정형 3을 제공하였으며, 이는 결정질 무수 유리 염기인 것으로 확인되었다.
대안적으로, 무정형 유리 염기로서 화합물 1 200mg을 RT에서 2ml의 IPA에 용해시켰다. 동량의 아세토니트릴을 첨가하였다. 포화 용액이 형성될 때까지 더 많은 화합물 (총 0.5g)을 첨가하였다. 시드를 첨가하고 혼합물을 밤새 교반하였다. 시간이 지남에 따라 백색 슬러리가 생성되었다. 여과 및 건조하여 결정형 3으로서 400mg의 생성물을 수득하였으며, 이는 무수 유리 염기인 것으로 확인되었다.
실시예
1D : 결정형 3의 특성 규명
결정형 3의 샘플을 분말 X-선 회절 (PXRD), 시차 주사 열량 측정 (DSC), 열 중량 분석 (TGA) 및 동적 수분 흡착 (DMS)에 의해 분석하였다.
분말 X-선 회절
결정형 3의 분말 X-선 회절 패턴은 도 9에 도시되어 있다.
관찰된 PXRD 2-쎄타 피크 위치 및 d-간격이 하기에 나타나 있다.
열 분석
본 발명의 결정형 3 결정질 유리 형태의 대표적인 DSC 서모그램은 도 10에 도시되어 있다. 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 197.7 ℃에서의 개시 및 약 201.3 ℃에서의 피크를 갖는 용융 전이로 식별되는 흡열성 열 흐름에서 피크를 나타낸다. 융해 직후 분해되었다.
상기 결정형은 약 201.3 ℃에서 피크를 갖는 흡열성 열 흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
상기 결정형은 약 197.7 ℃ 내지 약 204 ℃의 온도에서 흡열성 열 흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
본 발명의 결정형 3 결정질 유리 형태의 대표적인 TGA 트레이스는 도 11에 도시되어 있다. 도 11의 열 중량 분석 (TGA) 트레이스는 약 195 ℃에서 분해 개시 미만의 온도에서 현저한 중량 손실이 없음을 나타낸다.
동적 수분 흡착 평가
본 발명의 결정형 3 결정질 유리 형태에 대한 대표적인 DMS 트레이스는 도 12에 도시되어 있다.
결정형 3은 5 % 내지 90 % 상대 습도의 습도 범위에서 약 0.33 % 중량 증가를 나타내었다. 결정형 3은 비-흡습성인 것으로 간주된다.
실시예
1E : 결정형 4의 특성 규명
결정형 4의 샘플을 분말 X-선 회절 (PXRD), 시차 주사 열량 측정 (DSC), 열 중량 분석 (TGA) 및 동적 수분 흡착 (DMS)에 의해 분석하였다.
분말 X-선 회절
결정형 4의 분말 X-선 회절 패턴은 도 13에 도시되어 있다.
관찰된 PXRD 2-쎄타 피크 위치 및 d-간격이 하기에 나타나 있다.
열 분석
결정형 4 결정질 유리 형태의 대표적인 DSC 서모그램은 도 14에 도시되어 있다. 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 60.9 ℃에서의 개시 및 약 103.6 ℃에서의 피크를 갖는 탈용매화 흡열 및 약 167.3 ℃에서 개시되는 것을 특징으로 하는 용융 흡열을 나타낸다. 상기 화합물은 용융시 분해되고, 용융 흡열 및 분해 발열은 중첩된다.
결정형 4 결정성 유리 형태의 대표적인 TGA 트레이스는 도 15에 도시되어 있다. 도 15의 열 중량 분석 (TGA) 트레이스는 100 ℃에서 약 3.54 %의 중량 손실을 나타낸다. 상기 화합물은 약 50 ℃의 개시 온도에서 탈용매된다. 상기 화합물은 약 165 ℃의 개시 온도에서 분해된다.
동적 수분 흡착 평가
결정형 4 결정성 유리 형태에 대한 대표적인 DMS 트레이스는 도 16에 도시되어 있다.
결정형 4는 5 % 내지 90 % 상대 습도의 습도 범위에서 약 5.01 % 중량 증가를 나타내었다. 결정형 4는 적당히 흡습성이 있는 것으로 간주된다.
제조예 5 : tert-부틸 (3S)-3-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트
소듐 히드라이드 (0.201 g, 8.36 mmol)를 0 ℃에서 N2의 대기하에 DMF (12 ml) 중 (S)-N-boc-3-피리디놀 (1.25 g, 6.69 mmol)의 용액에 첨가하고 반응 혼합물을 실온에서 20 분 동안 교반하였다. 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (1.0 g, 3.34 mmol)을 첨가하고 반응 혼합물을 실온에서 1 시간 동안 교반하였다. 물 (1 mL)을 첨가하고 반응물을 진공내에서 농축시켰다. 조 물질을 헥산 중 40 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (3S)-3-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸)-4-일)옥시)피롤리딘-1-카복실레이트를 수득하였다 (1.40 g, 3.00 mmol, 90 % 수율). (m/z): C21H28BrN3O4에 대한 [M+H]+ 계산치 466.13, 실측치 466.1.
제조예 6 : tert-부틸 (3S)-3-((6-(3-클로로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트
팔라듐 아세테이트 (0.135 g, 0.600 mmol)를 1,4-디옥산 (12 ml) 및 물 (3.00 ml) 중 3-클로로-4-히드록시페닐보론산 (0.776 g, 4.50 mmol), tert-부틸 (3S)-3-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트 (1.40 g, 3.00 mmol), 1,1'-비스(디-t-부틸포스피노)페로센 (0.285 g, 0.600 mmol) 및 포타슘 포스페이트 (1.912 g, 9.01 mmol)의 용액에 첨가하였다. 반응 혼합물을 질소로 10 분 동안 가스를 제거시킨 후 110 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 진공내에서 약 5mL의 부피로 농축시켰다. 암모늄 클로라이드의 포화 수용액 (20 mL)을 첨가하고 혼합물을 메틸렌 클로라이드 (3 x 20 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 50 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (3S)-3-((6-(3-클로로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트를 투명한 황색 액체로서 수득하였다 (1.35 g, 2.63 mmol, 87 % 수율). (m/z): C27H32ClN3O5에 대한 [M+H]+ 계산치 514.20, 실측치 514.2.
제조예 7 : (S)-2-클로로-4-(4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀
디옥산 중 4.0N HCl (13.13 ml, 52.5 mmol)을 디옥산 (6 ml) 중 tert-부틸 (3S)-3-((6-(3-클로로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트 (1.35 g, 2.63 mmol)의 용액에 첨가하고, 반응 혼합물을 60 ℃에서 30 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 HCl 염으로서 (S)-2-클로로-4-(4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀을 수득하였다 (0.962 g, 2.63 mmol, 100 % 수율). (m/z): C17H16ClN3O2에 대한 [M+H]+ 계산치 330.09 실측치 330.2.
실시예 2 : (S)-1-(3-((6-(3-클로로-4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-엔-1-온
N,N-디이소프로필에틸아민 (4.59 ml, 26.3 mmol)을 0 ℃에서 DMF (13.0ml) 중 (S)-2-클로로-4-(4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀 HCl 염 (0.962g, 2.63mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (0.277ml, 3.41mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 다음, 약 2mL의 부피로 농축시켰다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 20-80 % 아세토니트릴의 구배를 사용하여 예비 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-1-(3-((6-(3-클로로-4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-엔-1-온을 수득하였다 (344 mg, 0.691 mmol, 26.3 % 수율). (m/z): C20H18ClN3O3에 대한 [M+H]+ 계산치 384.10, 실측치 384.1. 1H NMR (400MHz, DMSO-d 6) δ13.03 (s, 1H), 10.33 (s, 1H), 7.98 (s, 1H), 7.74-7.67 (m, 1H), 7.57-7.49 (m, 1H), 7.24 (s, 1H), 7.07 (d, J = 0.5Hz, 1H), 6.80 (s, 1H), 6.69 - 6.56 (m, 1H), 6.18-6.11 (m, 1H), 5.71-5.62 (m, 1H), 4.01-3.60 (m, 5H), 2.35-2.14 (m, 2H).
제조예 8 : tert-부틸 3-(2-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트
N2로 퍼지된 건조 신틸레이션 바이알에 tert-부틸 3-(2-히드록시프로판-2-일)아제티딘-1-카복실레이트 (374 mg, 1.74 mmol)를 첨가하고, 2.4 mL DMF에 용해시키고 용액을 0 ℃로 냉각시켰다. 미네랄 오일 중 60 중량 % 소듐 히드라이드 (134 mg, 3.34 mmol)를 교반 용액에 천천히 첨가하고, 첨가 후 반응물을 실온으로 가온시켰다. 거품 반응(frothy reaction)을 30 분 동안 교반한 후 다시 0 ℃로 냉각시켰다. 1mL DMF 중 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (400 mg, 1.34 mmol)의 용액을 유기소듐 용액을 포함하는 신틸레이션 바이알에 천천히 첨가하였다. 첨가 후, 반응물을 실온으로 가온하고 2 시간 동안 교반하고, 이때 LCMS는 출발 물질이 원하는 생성물로 완전히 전환되었음을 나타냈다. 1 mL H2O 및 1 mL EtOAc를 천천히 첨가하여 반응을 켄칭하고, 이를 5 분 동안 교반하였다. 이어서 2 상 용액을 분리 깔때기로 옮기고 추가의 5mL H2O를 첨가하였다. 혼합물을 EtOAc 10 mL의 3 배로 추출하고 수성층을 제거했다. 이어서, 조합된 유기 분획을 3x10 mL 1:1 H2O:염수로 세척하여 잔류 DMF를 제거하였다. 이어서, 유기물을 Na2SO4상에서 건조시키고, 여과하고, 연황색 오일로 농축시켰다. 이어서, 오일을 0-40 % EtOAc:헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하였다. 생성물을 투명하고 무색의 점성 오일로서 순수하게 분리하였다 (288 mg, 44 % 수율).
제조예
9 :
tert
-부틸 3-(2-((6-
브로모
-1-(
테트라히드로
-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트
팔라듐 아세테이트 (26.2 mg, 0.116 mmol) 및 1,1'-비스(디-t-부틸포스피노)페로센 (55.3 mg, 0.116 mmol)의 1:1 혼합물을 1,4-디옥산 (2.0 ml) 및 물 (0.50 ml) 중 3-클로로-4-히드록시벤젠보론산 (151 mg, 0.874 mmol), tert-부틸 3-(2-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (288 mg, 0.582 mmol) 및 포타슘 포스페이트 (371 mg, 1.747 mmol)의 용액에 첨가하였다. 반응 혼합물을 질소로 10 분 동안 가스를 제거시킨 후 110 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 진공내에서 약 5mL의 부피로 농축시켰다. 암모늄 클로라이드 포화 수용액 (5 mL)을 첨가하고 혼합물을 에틸 아세테이트 (2 x 5 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 40 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(2-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트를 수득하였다 (230 mg, 0.424 mmol, 73 % 수율). (m/z): C29H36N3O5에 대한 [M+H]+ 계산치 542.24, 실측치 542.3.
제조예 10 : 4-(4-((2-아제티딘-3-일)프로판-2-일)옥시)-1-H-인다졸-6-일)-2-클로로페놀
tert-부틸 3-(2-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (230 mg, 0.424 mmol)를 디클로로메탄 (1 ml)에 용해시키고 TFA (1 ml)를 천천히 첨가하였다. 투명한 용액을 실온에서 5 시간 동안 교반하였고, 이때 LCMS는 원하는 생성물로의 양호한 전환을 나타냈다. 반응물을 농축시켜 TFA 염으로서 4-(4-((2-아제티딘-3-일)프로판-2-일)옥시)-1-H-인다졸-6-일)-2-클로로페놀을 제공하였다 (100 % 수율). (m/z): C19H20N3O2에 대한 [M+H]+ 계산치 358.13, 실측치 358.1.
실시예 3A : (E)-1-(3-(2-((6-(3-클로로-4-히드록시페닐)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-일)-4-(디메틸아미노)부트-2-엔-1-온
HATU (2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트, 100 mg, 0.263 mmol)를 DMF (1 mL) 중 (E)-4-(디메틸아미노)부트-2-에노산 히드로클로라이드 (34 mg, 0.263 mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 5 분 동안 교반한 다음 4-(4-((2-아제티딘-3-일)프로판-2-일)옥시)-1-H-인다졸-6-일)-2-클로로페놀 TFA 염 (118 mg, 0.251 mmol)을 첨가한 후 DIPEA (0.438 ml, 2.507 mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 후, 진공내에서 농축시켜 황색 액체를 수득하였다. 조 액체를 액체 이산화탄소와 함께 메탄올을 사용하여 예비 규모 SFC (초임계 유체 크로마토그래피)를 통해 정제하여 (E)-1-(3-(2-((6-(3-클로로-4-히드록시페닐)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-일)-4-(디메틸아미노)부트-2-엔-1-온을 수득하였다 (41.3 mg, 0.084 mmol, 33 % 수율). (m/z): C25H29ClN4O3에 대한 [M+H]+ 계산치 469.20, 실측치 469.2. 1H NMR (400MHz, DMSO-d 6) δ 13.07 (s, 1H), 10.33 (s, 1H), 7.95 (s, 1H), 7.62 (d, J = 2.3Hz, 1H), 7.47 (dd, J = 8.5, 2.3 Hz, 1H), 7.34 (S, 1H), 7.04 (d, J = 8.5 Hz, 1H), 6.85 (d, J = 1.1 Hz, 1H), 6.63 - 6.53 (m, 1H), 6.39 (d, J = 15.3Hz, 1H), 4.37 - 4.23 (m, 2H), 4.11 - 3.91 (m, 2H), 3.69 (d, J = 6.4Hz, 2H), 3.02 - 2.90 (m, 1H), 2.62 (s, 9H), 1.32 (S, 9H).
실시예
3B : 결정질 (E)-1-(3-(2-((6-(3-
클로로
-4-
히드록시페닐
)-1H-
인다졸
-4-일)옥시)프로판-2-일)아제티딘-1-일)-4-(디메틸아미노)부트-2-엔-1-온 결정형 1
결정형 1은 화합물 3의 무수 유리 염기 결정형이다.
무정형 유리 염기로서 화합물 3 80 mg을 0.5 mL의 에탄올에 용해시켰다. 생성된 혼합물을 실온에서 하루 동안 교반하고 침전물을 수득하였다. 고체를 여과에 의해 분리하고, 1 mL의 에탄올로 세척하고 주위 조건하에 몇 시간 동안 건조시켜 결정형 1을 수득하였다.
대안적으로, 50mL 둥근 바닥 플라스크에 SiG로 정제된 화합물 3 (1.3g, 2.77mmol)을 첨가하였다. 10ml의 아세톤을 첨가하고 혼합물을 RT에서 교반했다. 결정질 유리 염기 결정형 1의 시드를 첨가하였다. 진한 백색 슬러리가 시간이 지남에 따라 생성되었다. 여과 및 건조로 > 98 % 순도의 1g의 결정질 유리 염기 결정형 1을 수득하였다.
실시예 3B : 결정질 (E)-1-(3-(2-((6-(3-클로로-4-히드록시페닐)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-일)-4-(디메틸아미노)부트-2-엔-1-온 결정형 2
결정형 2는 화합물 3의 유리 염기 수화물 결정형이다.
화합물 3의 무정형 유리 염기의 55 mg을 0.25 mL의 메탄올에 용해시켰다. 이 단계에서, 물은 반용매로서 약 1:2의 메탄올:물 비율로 첨가되었다. 생성된 혼합물을 실온에서 몇 분 동안 초음파 처리하여 침전물을 수득하였다. 생성된 현탁액을 실온에서 1 일 동안 교반하고, 여과하고, 1 mL의 메탄올로 세척하고 건조시켜 결정형 2를 제공하였다.
대안적으로, 화합물 3을 10 부피의 알코올에 완전히 용해시킨 후, 운점까지 대략 8-10 부피의 물을 천천히 첨가함으로써 에탄올 및 물 또는 메탄올 및 물에 용해시켰다. 결정형 2의 시드를 첨가하고 시간이 지남에 따라 슬러리가 천천히 생성되었다. 이어서, 더 많은 물을 서서히 첨가하고 (약 10 부피), 생성된 고체를 여과하고 건조시켜 결정형 2를 수득하였다.
실시예
3C : 결정형 1의 특성 규명
결정형 1의 샘플을 분말 X-선 회절 (PXRD), 시차 주사 열량 측정 (DSC), 열 중량 분석 (TGA) 및 동적 수분 흡착 (DMS)에 의해 분석하였다.
분말 X-선 회절
결정형 1의 분말 X-선 회절 패턴은 도 1에 도시되어 있다.
관찰된 PXRD 2-쎄타 피크 위치 및 d-간격이 하기에 나타나 있다.
열 분석
본 발명의 결정형 1 결정질 유리 형태의 대표적인 DSC 서모그램은 도 2에 도시되어 있다. 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 154.9 ℃에서의 개시 및 약 162.9 ℃에서의 피크를 갖는 용융 전이로서 식별된 흡열성 열 흐름에서 피크를 나타낸다. 융해 직후 분해되었다.
상기 결정형은 약 162.9 ℃에서 피크를 갖는 흡열성 열 흐름에서 최대값을 나타내는 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다. 상기 결정형은 162.9 ± 3 ℃에서 피크를 갖는 흡열성 열 흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
상기 결정형은 약 154.9 ℃ 내지 약 171 ℃의 온도에서 흡열성 열 흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 한다.
결정형 1 결정질 유리 형태의 대표적인 TGA 트레이스는 도 3에 도시되어 있다. 도 3의 열 중량 분석 (TGA) 트레이스는 100 ℃에서 약 0.14 %의 작은 중량 손실을 나타낸다. 상기 화합물은 약 175 ℃의 개시 온도에서 분해된다.
동적 수분 흡착 평가
결정형 1 결정질 유리 형태에 대한 대표적인 DMS 트레이스는 도 4에 도시되어 있다.
결정형 1은 5 % 내지 90 % 상대 습도의 습도 범위에서 약 1.62 % 중량 증가를 나타냈다. 결정형 1은 약간 흡습성인 것으로 간주된다.
실시예
3D : 결정형 2의 특성 규명
결정형 2의 샘플을 분말 X-선 회절 (PXRD), 시차 주사 열량 측정 (DSC), 열 중량 분석 (TGA) 및 동적 수분 흡착 (DMS)에 의해 분석하였다.
분말 X-선 회절
결정형 2의 분말 X-선 회절 패턴은 도 5에 도시되어 있다.
관찰된 PXRD 2-쎄타 피크 위치 및 d-간격이 하기에 나타나 있다.
열 분석
결정형 2 결정질 유리 형태의 대표적인 DSC 서모그램은 도 6에 도시되어 있다. 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 (DSC) 트레이스는 약 52.7 ℃에서의 개시 및 약 84.4 ℃에서의 피크를 갖는 탈용매화 흡열, 및 약 160.0 ℃에서의 개시 및 약 167.6 ℃에서의 피크를 갖는 용융 흡열을 나타낸다. 융해 직후 분해되었다.
본 발명의 결정형 2 결정질 유리 형태의 대표적인 TGA 트레이스는 도 7에 도시되어 있다. 도 7의 열 중량 분석 (TGA) 트레이스는 75 ℃에서 약 6.73 %의 중량 손실을 나타낸다. 상기 화합물은 약 25 ℃의 개시 온도에서 탈용매화된다. 상기 화합물은 약 185 ℃의 개시 온도에서 분해된다.
동적 수분 흡착 평가
본 발명의 결정형 2 결정질 유리 형태에 대한 대표적인 DMS 트레이스는 도 8에 도시되어 있다. 결정형 2는 65 % 초과의 RH에서 수화물 (결정형 2b)로 전환된다. 탈수는 15 % 미만의 RH에서 일어난다. 5 %-90 % RH 사이의 총 수분 흡수량은 7.99 %이다.
실시예
3E : 결정형 2b의 특성 규명
결정형 2b의 샘플을 분말 X-선 회절 (PXRD)에 의해 분석하였다.
분말 X-선 회절
결정형 2b의 분말 X-선 회절 패턴은 도 17에 도시되어 있다.
관찰된 PXRD 2-쎄타 피크 위치 및 d-간격이 하기에 나타나 있다.
제조예
11 : 4
,6-
디클로로
-1-(
테트라히드로
-2H-피란-2-일)-1H-
피라졸로[3,4-d]피리미딘
4,6-디클로로-1H-피라졸로[3,4-d]피리미딘 (2.50 g, 13.23 mmol)을 플라스크에 첨가하고 1,4-디옥산 (52.9 ml)에 용해시켰다. 이어서, p-톨루엔설폰산 모노히드레이트 (pTsOH, 0.25 g, 1.32 mmol)를 투명한 담황색 용액에 첨가한 다음 3,4-디히드로-2h-피란 (1.8 ml, 19.84 mmol)을 첨가하고 반응물을 40 ℃로 가열하여 밤새 교반했다. 이어서, 생성된 혼합물을 냉각시키고 진공내에서 농축시켰다. 조 물질을 0-100 % EtOAc:헥산 구배를 사용하여 플래쉬 컬럼 크로마토그래피로 정제하여 4,6-디클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘을 수득하였다 (2.6 g, 9.52 mmol, 72.0 % 수율). (m/z): C10H10Cl2N4O에 대한 [M+H]+ 계산치 274.0, 실측치 188.9 (THP 단편 손실).
제조예 12 : tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)아제티딘-1-카복실레이트
건조 둥근 바닥 플라스크에, 1-boc-아제티딘-3-일-메탄올 (1.96 g, 10.47 mmol)을 첨가하고 DMF (20.0 mL)에 용해시켰다. 교반 용액을 0 ℃로 냉각시키고 이어서 소듐 히드라이드 (0.762 g, 19.04 mmol)를 첨가하였다. 반응물을 실온으로 가온하고 30 분 동안 교반하여 연한 분홍색 거품 혼합물을 생성하였다. 혼합물을 0 ℃로 냉각시키고 DMF (10 mL) 중 4,6-디클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘 (2.6 g, 9.52 mmol)의 용액을 캐뉼라를 통해 첨가하였다. 반응물을 실온으로 가온하고 3 시간 동안 교반하였다. 이어서, 반응물을 120 mL H2O로 켄칭하고 30 mL EtOAc로 3 회 추출하였다. 이어서, 유기 용액을 100 mL 염수:H2O 용액 (1:1)으로 3 회 세척하였다. 유기물을 Na2SO4상에서 건조시키고, 여과하고, 담황색 오일로 농축시켰다. 조 물질을 0-50 % EtOAc:헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하여 tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)아제티딘-1-카복실레이트를 수득하였다 (1.95 g, 4.60 mmol, 48 % 수율).
제조예 13 : tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)아제티딘-1-카복실레이트
둥근 바닥 플라스크에서, tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)아제티딘-1-카복실레이트 (1.95 g, 4.60 mmol)를 1,4-디옥산 (23.0 ml)에 용해시켰다. 4-히드록시페닐보론산 (0.95 g, 6.90 mmol)에 이어서 물 (7.7 ml)을 첨가하였다. 디클로로[1,1'-비스(디페닐포스피노)페로센]팔라듐 (0.56 g, 0.69 mmol)을 첨가하고 플라스크에 환류 응축기를 장착하고, 질소하에 설정하고, 110 ℃로 가열하여 밤새 교반하였다. 이어서, 반응물을 실온으로 냉각시키고 유기 용매를 진공내에서 제거하였다. 잔류물에 H2O (20 mL)를 첨가하고 DCM (30 mL)으로 3 회 추출하였다. 유기물을 Na2SO4상에서 건조시키고, 여과하고, 검은색 오일로 농축시켰다. 조 물질을 0-100 % EtOAc:헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하여 황색/오렌지색 오일로서 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)아제티딘-1-카복실레이트를 수득하였다 (2.03 g, 4.22 mmol, 92 % 수율). (m/z): C25H31N5O5에 대한 [M+H]+ 계산치 482.2, 실측치 482.2.
제조예 14 : 4-(4-(아제티딘-3-일메톡시)-1H-피라졸로[3,4-d]피리미딘-6-일)페놀
둥근 바닥 플라스크에서 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)아제티딘-1-카복실레이트 (2.03 g, 4.22 mmol)를 DCM (10.0 ml)에 용해시키고 TFA (5.0 ml)를 실온에서 천천히 첨가하였다. 반응물을 18 시간 동안 교반하여 오렌지색/보라색 용액을 수득하였다. 반응물을 진공내에서 농축시켜 회색/오렌지색 고체를 수득하였다. 표제 화합물을 TFA 염으로서 100 % 수율 (1.25 g, 4.22 mmol)로 분리하였다. (m/z): C15H15N5O2에 대한 [M+H]+ 계산치 298.1, 실측치 298.3.
실시예 4 : 1-(3-(((6-(4-히드록시페닐)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)아제티딘-1-일)프로프-2-엔-1-온
둥근 바닥 플라스크에서, 4-(4-(아제티딘-3-일메톡시)-1H-피라졸로[3,4-d]피리미딘-6-일)페놀 트리플루오로아세트산 (1.25 g, 4.20 mmol)을 DMF (21.0 ml)에 용해시키고 디이소프로필에틸아민 (3.67 ml, 21.0 mmol)을 첨가하였다. 아크릴로일 클로라이드 (0.273 ml, 3.36 mmol)를 천천히 첨가하기 전에 반응물을 0 ℃로 냉각시키고, 5 분 동안 교반한 다음, 0 ℃에서 15 분 동안 교반하였다. 반응물을 실온으로 가온하고 진공내에서 농축시켰다. 조 물질을 1:1 MeCN:H2O에 용해시키고 20-80 % MeCN:H2O 구배를 사용하여 역상 분취용 HPLC에 의해 정제하였다. 원하는 분획을 조합하고 동결 건조하여 표제 화합물을 수득하였다 (434 mg, 1.235 mmol, 29 % 수율). (m/z): C18H17N5O3에 대한 [M+H]+ 계산치 352.1, 실측치 352.2. 1H NMR (400 MHz, DMSO-d 6) δ8.32 - 8.23 (d appt, 2H), 8.07 (s, 1H), 6.89 - 6.81 (d appt, 2H), 6.30 (dd, J = 17.0, 10.3 Hz, 1H ), 6.07 (dd, J = 17.0, 2.3Hz, 1H), 5.63 (dd, J = 10.3, 2.3Hz, 1H), 4.81 (d, J = 6.5Hz, 2H), 4.36 (t, J = 8.6Hz , 1H), 4.12 (dd, J = 8.6, 5.4 Hz, 1H), 4.06 (t, 1H), 3.82 (dd, J = 10.2, 5.5 Hz, 1H), 3.24 - 3.10 (m, 1H).
제조예 15 : tert-부틸 3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트
1-Boc-아제티딘-3-일-메탄올 (3.44 g, 18.39 mmol)을 오븐 건조 플라스크에 첨가하고 DMF (41.8 ml)에 용해시켰다. 용액을 0 ℃로 냉각시키고 10 분 동안 교반한 후 소듐 히드라이드 (0.50 g, 20.89 mmol)를 첨가하였다. 거품 혼합물 (frothy mixture)을 실온으로 가온하고 30 분 동안 교반하였다. 이어서, 반응물을 0 ℃로 냉각시키고 DMF (10mL) 중 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (2.5g, 8.36mmol)의 용액을 캐뉼라를 통해 첨가하였다. 반응물을 실온으로 가온하고 1.5 시간 동안 교반하였다. 120 mL의 H2O를 첨가하여 반응을 켄칭하고 50 mL EtOAc로 3 회 추출하였다. 유기상을 조합하고 100 mL 염수:H2O 용액 (1:1)으로 3 회 세척하였다. 이어서 유기상을 수집하고 Na2SO4상에서 건조시키고, 여과하고, 투명한 연황색 오일 (3.9 g, 8.36 mmol)로 농축시켰다. 조 생성물을 추가 정제없이 사용하였다. (m/z): C21H28BrN3O4에 대한 [M+H]+ 계산치 466.14, 실측치 466.1.
제조예 16 : tert-부틸 3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트
tert-부틸 3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트 (3.9 g, 8.36 mmol)를 플라스크에 첨가하고 1,4-디옥산 (44.6 ml)에 용해시켰다. 3-플루오로-4-히드록시페닐보론산 (1.96 g, 12.54 mmol)에 이어서 물 (11.2 ml) 및 포타슘 포스페이트, 삼염기성 (5.33 g, 25.09 mmol)을 첨가하였다. 디클로로[1,1'-비스(디페닐포스피노)페로센]팔라듐 (1.02 g, 1.25 mmol)을 첨가하고 플라스크에 환류 응축기를 장착하고 질소 대기하에 두었다. 반응물을 110 ℃로 가열하고 18 시간 동안 교반하였다. 실온으로 냉각되면, 유기 용매를 진공내에서 제거하여 검은색 오일을 수득하였다. 오일에 10 mL H2O를 첨가하고 용액을 40 mL DCM으로 3 회 추출하였다. 유기물을 수집하고 Na2SO4상에서 건조시키고, 여과하고, 검은색 오일로 농축시켰다. 오일을 0-100 % EtOAc:Hex 구배를 사용하여 플래쉬 컬럼 크로마토그래피를 통해 정제하여 투명한 황색 오일로서 tert-부틸 3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트를 수득하였다 (2.58 g, 5.19 mmol, 62 % 수율). (m/z): C27H32FN3O5에 대한 [M+H]+ 계산치 498.2, 실측치 498.2.
제조예 17 : 4-(4-(아제티딘-3-일메톡시)-1H-인다졸-6-일)-2-플루오로페놀
50 mL 둥근 바닥 플라스크에서, tert-부틸 3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트 (2.58 g, 5.19 mmol)를 DCM (10.0 ml)에 용해시켰다. TFA (5.00 ml)를 실온에서 투명한 황색 용액에 천천히 첨가하였다. 반응물을 24 시간 동안 교반하고 생성된 진한 황색/보라색 용액을 진공내에서 농축시켜 회색/황색 고체로서 4-(4-(아제티딘-3-일메톡시)-1H-인다졸-6-일)-2-플루오로페놀의 TFA 염 (3.46 g)을 수득하였다 (100 % 수율). (m/z): C17H16FN3O2에 대한 [M+H]+ 계산치 314.1, 실측치 314.2.
실시예 5 : (E)-4-(디메틸아미노)-1-(3-(((6-(3-플루오로-4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-일)부트-2-엔-1-온
(2E)-4-(디메틸아미노)부트-2-에노산 (464 mg, 2.80 mmol) 및 HATU (976 mg, 2.57 mmol)를 둥근 바닥 플라스크에 첨가하고, DMF (5.5 mL)에 용해시키고 15 분 동안 교반하였다. 이어서, DMF (5.5 mL) 중 4-(4-(아제티딘-3-일메톡시)-1H-인다졸-6-일)-2-플루오로페놀 (1.0 g, 2.34 mmol)의 용액을 교반 반응물에 천천히 첨가한 후 디이소프로필에틸아민 (2.0 ml, 11.70 mmol)을 첨가하였다. 반응물을 24 시간 동안 교반한 다음 진공내에서 농축시켰다. 조 물질을 1:1의 MeCN:H2O에 용해시키고 20-80 % MeCN:H2O 구배를 사용하여 역상 분취용 HPLC에 의해 정제하였다. 원하는 분획을 조합하고 동결 건조하여 표제 화합물의 TFA 염을 수득하였다 (271 mg, 0.50 mmol, 21 % 수율). (m/z): C23H25FN4O3에 대한 [M+H]+ 계산치 425.2, 실측치 425.2. 1H NMR (400MHz, MeOD-d 4) δ7.94 (d, J = 0.8Hz, 1H), 7.39 (dd, J = 12.5, 2.2Hz, 1H), 7.35 - 7.28 (m, 1H), 7.24 (t, J = 1.0 Hz, 1H), 7.03 - 6.93 (m, 1H), 6.80 - 6.68 (m, 2H), 6.53 (dt, J = 15.2, 1.1 Hz, 1H), 4.53 (t, J = 8.7 Hz, 1H ), 4.47 - 4.34 (m, 2H), 4.35 - 4.22 (m, 2H), 4.09 (dd, J = 10.8, 5.6Hz, 1H), 3.93 (dd, J = 7.2, 1.1Hz, 2H), 3.27 - 3.19 (m, 1H), 2.88 (s, 6H).
제조예 18 : 6-브로모-4-니트로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸
DCM (41.3 ml) 중 6-브로모-4-니트로-1H-인다졸 (3.00 g, 12.4 mmol), 3,4-디히드로-2H-피란, 97 % (3.40 ml, 37.2 mmol) 및 p-톨루엔설폰산 모노히드레이트 (pTsOH, 0.236 g, 1.24 mmol)을 실온에서 밤새 교반하였다. 반응물을 셀라이트 패드를 통해 여과하고 농축시켰다. 반응은 100 % 전환 (4.05 g) 인 것으로 가정되었고, 추가 정제없이 후속 반응으로 진행되었다.
제조예
19 : 6
-(4-((
tert
-
부틸디메틸실릴
)
옥시
)페닐)-4-니트로-1-(
테트라히드로
-2H-피란-2-일)-1H-인다졸
디옥산 (14.9 mL) 및 H2O (4.98 mL) 중 6-(4-((tert-부틸디메틸실릴)옥시)페닐)-4-니트로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (1.00 g, 3.07mmol), 4-(tert-부틸디메틸실릴옥시)페닐보론산 (1.16 g, 4.60 mmo) 및 포타슘 포스페이트 삼염기성 (1.30 g, 6.13 mmol)을 10 분 동안 N2로 퍼지하였다. 이어서 [1,1'-비스(디페닐포스핀)페로센]디클로로팔라듐(II) (0.224 g, 0.307mmol)을 첨가한 후, 플라스크를 밀봉하였다. 반응물을 110 ℃로 가열하고 1 시간 동안 교반하였다. LCMS를 통해 원하는 생성물로의 완전한 전환을 확인한 후, 반응물을 20mL H2O 및 20mL EtOAc로 켄칭하였다. 두 층 모두 셀라이트 패드를 통해 여과하고 분별 깔때기로 옮겼다. 혼합물을 20mL EtOAc로 3 회 추출하고, 수성층을 제거했다. 조합된 유기 분획을 농축시킨 후 0-10 % EtOAc:헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하였다. 생성물을 담황색 오일로서 순수하게 분리하였다 (1.03g, 74.4 % 수율). (m/z): C24H31N3O4Si에 대한 [M+H]+ 계산치 454.61, 실측치 454.3.
제조예 20 : 6-(4-((tert-부틸디메틸실릴)옥시)페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-아민
6-(4-((tert-부틸디메틸실릴)옥시)페닐)-4-니트로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (0.980g, 2.16mmol) 및 탄소상 팔라듐 10 중량% (습식) (0.980 g)를 THF (2.8 mL) 및 이소프로필 알코올 (11.2 mL)에 용해시켰다. 반응 용기를 5 분 동안 N2로 다시 충전한 후, 이를 밀봉하고 수소 대기하에 두었다. 반응 혼합물을 실온에서 3 시간 동안 교반되도록 두었다. LCMS가 원하는 생성물로의 완전한 전환을 나타내면, 반응 혼합물을 여과하였다. 이어서, 필터를 추가 THF로 세척하였다. 0-25 % EtOAC:헥산 구배를 사용하여 플래쉬 컬럼 크로마토그래피 (40g)로 농축 및 정제한 후, 생성물을 분리하였다 (0.562g, 61.5 % 수율). (m/z): C24H33N3O2Si에 대한 [M+H]+ 계산치 424.63, 실측치 424.4.
제조예 21 : tert-부틸 (2R)-2-((6-(4-((tert-부틸디메틸실릴)옥시)페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)카바모일)모르폴린-4-카복실레이트
(R)-N-boc-2-모르폴린카복실산 (0.819g, 3.54mmol) 및 1-[비스(디메틸아미노)메틸렌]-1H-1,2,3-트리아졸로[4,5-b]피리디늄 3-옥시드 헥사플루오로포스페이트 (HATU, 2.69g, 7.08mmol)를 DMF (11.8mL)에 용해시키고 실온에서 5 분 동안 교반되도록 두었다. 이어서 6-(4-((tert-부틸디메틸실릴)옥시)페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-아민 (1.00 g, 2.36 mmol)을 첨가하고, 반응 혼합물을 실온에서 2 시간 동안 교반되도록 두었다. LCMS는 원하는 생성물로의 완전한 전환을 나타냈다. 반응물을 10 mL H2O 및 10 mL DCM으로 켄칭하였다. 분별 깔대기로 옮긴 후, 혼합물을 10mL DCM으로 3 회 추출하고, 수성층을 제거했다. 조합된 유기 분획을 농축시킨 후 0-45 % EtOAc:헥산 구배를 사용하여 플래쉬 컬럼 크로마토그래피 (40g)로 정제하였다. 생성물을 담황색 오일로서 분리하였다 (1.01 g, 67 % 수율). (m/z): C34H48N4O6Si에 대한 [M+H]+ 계산치 637.87, 실측치 637.6.
제조예
22 : (R)-N-(6-(4-
히드록시페닐
)-1H-
인다졸
-4-일)모르폴린-2-카복사미드
tert-부틸 (2R)-2-((6-(4-((tert-부틸디메틸실릴)옥시)페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)카바모일)모르폴린-4-카복실레이트 (1.00 g, 1.58 mmol)를 MeOH (2.0 mL)에 용해시켰다. 교반하면서, 4.0M 디옥산 (12.1 mL, 48.5 mmol) 중 HCl 용액을 천천히 첨가하였다. 반응 혼합물을 60 ℃로 가열하고 30 분 동안 교반한 후, LCMS는 원하는 생성물로의 완전한 전환을 나타냈다. 혼합물을 농축시켜 생성물을 오렌지색 오일로서 제공하였다. 반응은 100 % 전환 (0.533 g) 인 것으로 가정되었고, 추가 정제없이 후속 반응으로 진행되었다.
실시예 6 : (R)-4-아크릴로일-N-(6-(4-히드록시페닐)-1H-인다졸-4-일)모르폴린-2-카복사미드
(R)-N-(6-(4-히드록시페닐)-1H-인다졸-4-일)모르폴린-2-카복사미드 (0.533g, 1.58mmol)를 DMF (7.9mL)에 용해시켰다. N,N-디이소프로필에틸아민 (DIPEA, 2.75 mL, 15.8 mmol)을 첨가한 다음, 아크릴로일 클로라이드 (0.0900 mL, 1.10 mmol)를 천천히 첨가하였다. 반응물을 실온에서 10 분 동안 교반한 후 LCMS에 의해 전환을 모니터링하였다. LCMS를 통해 완전한 전환이 지시된 후, 반응 혼합물을 농축시키고 10-50 % ACN:H2O 구배를 사용하여 역상 분취용 HPLC를 통해 정제하였다. 원하는 생성물의 분획을 수집하고 동결 건조를 통해 농축하였다. 생성물을 분리하였다 (130mg, 21 % 수율). (m/z): C21H20N4O4에 대한 [M+H]+ 계산치 393.42, 실측치 393.4. 1H NMR (400 MHz, 메탄올-d 4) δ8.13 (s, 1H), 7.74 (d, J = 16.3 Hz, 1H), 7.56 (d, J = 6.0 Hz, 2H), 7.51 (s, 1H), 6.91 (dd, J = 8.7, 2.9 Hz, 3H), 6.30 (dt, J = 16.8, 2.3 Hz, 1H), 5.84 (d, J = 10.6 Hz, 1H), 4.45 - 4.25 (m, 2H), 4.21 (d, J = 11.8Hz, 1H), 4.12-4.02 (m, 1H), 3.78 (t, J = 11.5Hz, 1H), 3.53 (m, 1H), 3.29 - 2.99 (m, 1H).
제조예 23 : tert-부틸 (3S)-3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트
소듐 히드라이드 (0.072 g, 3.01 mmol)를 0 ℃에서 N2의 대기하에 DMF (6 ml) 중 (Ss)-N-boc-피롤리딘-3-메탄올 (0.444 g, 2.21 mmol)의 용액에 첨가하고 반응 혼합물을 실온에서 20 분 동안 교반하였다. 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (0.600 g, 2.01 mmol)을 첨가하고 반응 혼합물을 실온에서 1 시간 동안 교반하였다. 물 (1 mL)을 첨가하고 반응물을 진공내에서 농축시켰다. 조 물질을 헥산 중 40 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (3S)-3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트를 수득하였다 (0.964 g, 1.87 mmol, 93 % 수율). (m/z): C22H30BrN3O4에 대한 [M+H]+ 계산치 480.15, 실측치 480.1.
제조예 24 : tert-부틸 (3S)-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트
팔라듐 아세테이트 (0.084 g, 0.375 mmol)를 1,4-디옥산 (12 ml) 및 물 (3.00 ml) 중 4-히드록시페닐보론산 (0.388 g, 2.81 mmol), tert-부틸 (3S)-3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트 (0.900 g, 1.87 mmol), 1,1'-비스(디-t-부틸포스피노)페로센 (0.178 g, 0.375 mmol) 및 포타슘 포스페이트 (1.193 g, 5.62 mmol)의 용액에 첨가하였다. 반응 혼합물을 질소로 10 분 동안 가스를 제거시킨 후 110 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 진공내에서 약 5mL의 부피로 농축시켰다. 암모늄 클로라이드 포화 수용액 (10 mL)을 첨가하고 혼합물을 메틸렌 클로라이드 (3 x 10 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 50 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 투명한 황색 액체로서 tert-부틸 (3S)-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트를 수득하였다 (0.800 g, 1.62 mmol, 87 % 수율). (m/z): C28H35N3O5에 대한 [M+H]+ 계산치 494.27, 실측치 494.2.
제조예 25 : (S)-4-(4-(피롤리딘-3-일메톡시)-1H-인다졸-6-일)페놀
디옥산 중 4.0N HCl (8.10 ml, 32.4 mmol)을 디옥산 (6 ml) 중 tert-부틸 (3S)-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)1H-인다졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트 (0.800 g, 1.62 mmol)의 용액에 첨가하고 반응 혼합물을 60 ℃에서 30 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 HCl 염으로서 ((S)-4-(4-(피롤리딘-3-일메톡시)-1H-인다졸-6-일)페놀을 수득하였다 (0.501 g, 1.62 mmol, 100 % 수율). (m/z): C18H19N3O2에 대한 [M+H]+ 계산치 310.16, 실측치 310.3.
실시예 7 : (S)-1-(3-((6-(3-클로로-4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-엔-1-온
N,N-디이소프로필에틸아민 (2.83 ml, 16.2 mmol)을 0 ℃에서 DMF (5ml) 중 (S)-4-(4-(피롤리딘-3-일메톡시)-1H-인다졸-6-일)페놀 HCl 염 (0.560 g, 1.62mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (0.171ml, 2.11mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 다음, 약 2mL의 부피로 농축시켰다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 30-90 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-1-(3-(((6-(4-히드록시페닐)-1H)-인다졸-4-일)옥시)메틸)피롤리딘-1-일)프로프-2-엔-1-온을 수득하였다 (226 mg, 0.473 mmol, 29.2 % 수율). (m/z): C21H21N3O3에 대한 [M+H]+ 계산치 364.17, 실측치 364.2. 1H NMR (400MHz, DMSO-d 6) δ13.00 (s, 1H), 10.31 (s, 1H), 8.04-7.94 (m, 1H), 7.59-7.48 (m, 1H), 7.18 (s, 1H), 6.89-6.79 (m, 1H), 6.76-6.70 (m, 1H), 6.65-6.54 (m, 1H), 6.13 (dd, J = 16.6, 1.7 Hz, 1H), 5.69-5.62 (m, 1H), 4.25-3.78 (m, 4H), 3.76-3.28 (m, 2H), 2.88-2.63 (m, 1H), 2.22-1.72 (m, 2H).
제조예 26 : tert-부틸 3-(2-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트
N2로 퍼지된 건조 신틸레이션 바이알에 tert-부틸 3-시아노-3-(히드록시메틸)아제티딘-1-카복실레이트 (851 mg, 4.01 mmol)를 첨가하고 5 mL DMF에 용해시키고 용액을 0 ℃로 냉각시켰다. 미네랄 오일 중 60 중량% 소듐 히드라이드 (267 mg, 6.69 mmol)를 교반 용액에 천천히 첨가하고, 첨가 후 반응물을 실온으로 가온시켰다. 거품 반응물을 30 분 동안 교반한 후 다시 0 ℃로 냉각시켰다. 2mL DMF 중 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (800mg, 2.67mmol)의 용액을 유기소듐 용액을 포함하는 신틸레이션 바이알에 천천히 첨가하였다. 첨가 후, 반응물을 실온으로 가온하고 2 시간 동안 교반하였고, 이때 LCMS는 출발 물질이 원하는 생성물로 완전히 전환되었음을 나타냈다. 2 mL H2O 및 2 mL EtOAc를 천천히 첨가하여 반응을 켄칭하고,이를 5 분 동안 교반하였다. 이어서 2 상 용액을 분리 깔때기로 옮기고 추가의 10mL H2O를 첨가하였다. 혼합물을 20 mL의 EtOAc로 3 회 추출하고 수성층을 제거했다. 이어서, 조합된 유기 분획을 3x10 mL의 1:1의 H2O:염수로 세척하여 잔류 DMF를 제거하였다. 이어서, 유기물을 Na2SO4상에서 건조시키고, 여과하고, 연황색 오일로 농축시켰다. 이어서, 오일을 0-40 % EtOAc:헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하였다. 생성물을 투명하고 무색의 점성 오일로서 순수하게 분리하였다 (1.096 g, 83 % 수율). (m/z): C22H27BrN4O4에 대한 [M+H]+ 계산치 491.13, 실측치 491.1.
제조예
27 :
tert
-부틸 3-
시아노
-3-(((6-(3-
플루오로
-4-
히드록시페닐
)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트
팔라듐 아세테이트 (25.1 mg, 0.112 mmol) 및 1,1'-비스(디-t-부틸포스피노)페로센 98 % (53.1 mg, 0.112 mmol)의 1:1 혼합물을 1,4-디옥산 (4.5 ml) 및 물 (1 ml) 중 3-플루오로-4-히드록시벤젠보론산 (262 mg, 1.679 mmol), tert-부틸 3-(2-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (550 mg, 1.119 mmol) 및 포타슘 포스페이트 (713 mg, 3.36 mmol)의 용액에 첨가하였다. 반응 혼합물을 질소로 10 분 동안 가스를 제거시킨 후 110 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켰다. 암모늄 클로라이드 포화 수용액 (5 mL)을 첨가하고 혼합물을 에틸 아세테이트 (2 x 5 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 40 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-시아노-3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란)-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트를 수득하였다 (267 mg, 0.511 mmol, 46 % 수율). (m/z): C28H31FN4O5에 대한 [M+H]+ 계산치 523.24, 실측치 523.4.
제조예 28 : 3-(((6-(3-플루오로-4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-3-카보니트릴
tert-부틸 3-시아노-3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)메틸)아제티딘-1-카복실레이트 (267 mg, 0.511 mmol)를 디클로로메탄 (1 ml)에 용해시키고 TFA (1 ml)를 천천히 첨가하였다. 투명한 용액을 실온에서 5 시간 동안 교반하였고, 이때 LCMS는 원하는 생성물로의 양호한 전환을 나타냈다. 반응물을 농축시켜 TFA 염으로서 3-(((6-(3-플루오로-4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-3-카보니트릴을 제공하였다 (100 % 수율). (m/z): C18H15FN4O2에 대한 [M+H]+ 계산치 339.13, 실측치 339.2.
실시예
8 : (E)-1-(4-(디메틸아미노)
부트
-2-
에노일
)-3-(((6-(3-
플루오로
-4-히드록시페닐)-1H인다졸-4-일)옥시)메틸)아제티딘-3-카보니트릴
HATU (2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 (121 mg, 0.318 mmol)을 DMF (2 mL) 중 (E)-4-(디메틸아미노)부트-2-에노산 히드로클로라이드 (41.1 mg, 0.318 mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 5 분 동안 교반한 다음 3-(((6-(3-플루오로-4-히드록시페닐)-1H-인다졸-4-일)옥시)메틸)아제티딘-3-카보니트릴 TFA 염 (160 mg , 0.354 mmol)을 첨가한 후, DIPEA (0.618 ml, 3.54 mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 후, 진공내에서 농축시켜 황색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 15-75 % 아세토니트릴을 사용하여 분취용 규모 Zorbax Bonus-RP (2.1x30mm, 1.8 마이크론) 컬럼 크로마토그래피를 통해 정제하여 (E)-1-(4-(디메틸아미노)부트-2-에노일)-3-(((6-(3-플루오로-4-히드록시페닐)-1H인다졸-4-일)옥시)메틸)아제티딘-3-카보니트릴을 수득하였다 (56.2 mg, 0.121 mmol, 34 % 수율). (m/z): C24H24FN5O3에 대한 [M+H]+ 계산치 450.19, 실측치 450.0. 1H NMR (400 MHz, DMSO-d 6) δ 9.94 (s, 1H), 9.77 (s, 1H), 7.85 (s, 1H), 7.47 (dd, J = 12.8, 2.2 Hz, 1H), 7.31 (dd , J = 8.4, 1.7 Hz, 1H), 7.22 (S, 1H), 6.99 - 6.90 (m, 1H), 6.78 (s, 1H), 6.59 - 6.48 (m, 1H), 6.31 (d, J = 15.4 Hz, 1H), 4.67 - 4.60 (m, 3H), 4.40 (d, J = 9.1Hz, 1H), 4.27 (d, J = 10.5Hz, 1H), 4.12 (d, J = 10.4Hz, 1H), 3.78 (d, J = 6.8Hz, 2H), 2.66 (S, 6H).
제조예 29 : tert-부틸 4-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)-4-메틸피페리딘-1-카복실레이트
N2로 퍼지된 건조 신틸레이션 바이알에 1-boc-4-메틸피페리딘-4-올 (567 mg, 2.63 mmol)을 첨가하고, 3 mL DMF에 용해시키고 용액을 0 ℃로 냉각시켰다. 미네랄 오일 중 60 중량% 소듐 히드라이드 (175 mg, 4.39 mmol)를 교반 용액에 천천히 첨가하고, 첨가 후 반응물을 실온으로 가온시켰다. 거품 반응물을 30 분 동안 교반한 후 다시 0 ℃로 냉각시켰다. 1 mL DMF 중 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (525 mg, 1.755 mmol)의 용액을 유기소듐 용액을 포함하는 신틸레이션 바이알에 천천히 첨가하였다. 첨가 후, 반응물을 실온으로 가온하고 2 시간 동안 교반하고, 이때 LCMS는 출발 물질이 원하는 생성물로 완전히 전환되었음을 나타냈다. 2 mL H2O 및 2 mL EtOAc를 천천히 첨가하여 반응을 켄칭하고, 이를 5 분 동안 교반하였다. 이어서 2 상 용액을 분리 깔때기로 옮기고 추가의 10mL H2O를 첨가하였다. 혼합물을 20 mL의 EtOAc로 3 회 추출하고 수성층을 제거했다. 이어서, 조합된 유기 분획을 3x10 mL의 1:1의 H2O:염수로 세척하여 잔류 DMF를 제거하였다. 이어서, 유기물을 Na2SO4상에서 건조시키고, 여과하고, 연황색 오일로 농축시켰다. 이어서, 오일을 0-40 % EtOAc:헥산 구배를 사용하는 플래쉬 컬럼 크로마토그래피로 정제하였다. 생성물을 투명하고 무색의 점성 오일로서 순수하게 분리하였다 (389 mg, 45 % 수율). (m/z): C23H32BrN3O4에 대한 [M+H]+ 계산치 494.17, 실측치 494.4.
제조예
30 :
tert
-부틸 4-((6-(4-
히드록시페닐
)-1-(
테트라히드로
-2H-피란-2-일)-1H-인다졸-4-일)옥시)-4-메틸피페리딘-1-카복실레이트
팔라듐 아세테이트 (9.1 mg, 0.040 mmol) 및 1,1'-비스(디-t-부틸포스피노)페로센 98 % (19.2 mg, 0.040 mmol)의 1:1 혼합물을 1,4-디옥산 (2 ml) 및 물 (0.5 ml) 중 4-히드록시벤젠보론산 (42 mg, 0.30 mmol), tert-부틸 4-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)-4-메틸피페리딘-1-카복실레이트 (100 mg, 0.202 mmol) 및 포타슘 포스페이트, 삼염기성, 97 %, 무수 (129 mg, 0.607 mmol)의 용액에 첨가하였다. 반응 혼합물을 질소로 10 분 동안 기체를 제거시킨 후 110 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켰다. 암모늄 클로라이드 포화 수용액 (5 mL)을 첨가하고 혼합물을 에틸 아세테이트 (2 x 5 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 40 % 에틸 아세테이트를 사용하여 콤비 플래쉬 컬럼 크로마토그래피 (12g)를 통해 정제하여 tert-부틸 4-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)-4-메틸피페리딘-1-카복실레이트를 수득하였다 (96 mg, 0.189 mmol, 94 % 수율). (m/z): C29H37N3O5에 대한 [M+H]+ 계산치 5098.28 실측치 508.3.
제조예 31 : 4-(4-((4-메틸피페리딘-4-일)옥시)-1H-인다졸-6-일)페놀
tert-부틸 4-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)-4-메틸피페리딘-1-카복실레이트 (96 mg 0.189 mmol)를 1,4-디옥산 (1 ml)에 용해시키고 1,4-디옥산 (1.18 ml, 4.73 mmol) 중 4N HCl을 천천히 첨가하였다. 투명한 용액을 실온에서 5 시간 동안 교반하였고, 이때 LCMS는 원하는 생성물로의 양호한 전환을 나타냈다. 반응물을 농축시켜 HCl 염으로서 4-(4-((4-메틸피페리딘-4-일)옥시)-1H-인다졸-6-일)페놀을 제공하였다 (100 % 수율). (m/z): C19H21N3O2에 대한 [M+H]+ 계산치 324.17, 실측치 324.3.
실시예 9 : (E)-4-(디메틸아미노)-1-(4-((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)-4-메틸피페리딘-1-일)부트-2-엔-1-온
HATU (2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트 (72 mg, 0.189 mmol)를 DMF (1 mL) 중 (E)-4-(디메틸아미노)부트-2-에노산 히드로클로라이드 (24 mg, 0.186 mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 5 분 동안 교반한 다음 4-(4-((4-메틸피페리딘-4-일)옥시)-1H-인다졸-6-일)페놀 HCl 염 (68.0 mg, 0.189 mmol)을 첨가하고, 이어서 DIPEA (0.330 ml, 1.890 mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 후, 진공내에서 농축시켜 황색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 5-65 % 아세토니트릴을 사용하여 분취용 규모 Zorbax Bonus-RP (2.1x30mm, 1.8 마이크론) 컬럼 크로마토그래피를 통해 정제하여 (E)-4-(디메틸아미노)-1-(4-((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)-4-메틸피페리딘-1-일)부트-2-엔-1-온을 수득하였다 (39.0 mg, 0.063 mmol, 34 % 수율). (m/z): C25H30FN4O3에 대한 [M+H]+ 계산치 435.24, 실측치 435.2. 1H NMR (400 MHz, DMSO-d 6) δ 12.99 (s, 1H), 9.66 (s, 1H), 8.02 (d, J = 0.9 Hz, 1H), 7.52 - 7.44 (m, 2H), 7.27 (s , 1H), 6.90 (d, J = 15.0Hz, 1H), 6.86 - 6.78 (m, 3H), 6.58 - 6.47 (m, 1H), 3.99 - 3.86 (m, 1H), 3.83 (d, J = 7.2 Hz, 2H), 3.78 - 3.55 (m, 2H), 2.74 (s, 6H), 1.40 (s, 3H).
제조예 32 : 4,6-디클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘
3,4-디히드로-2h-피란 (2.0 g, 24.07 mmol)을 메틸렌 클로라이드 (30 mL) 중 4,6-디클로로-1H-피라졸로[3,4-b]피리딘 (2.50 g, 13.23 mmol)의 용액에 첨가하고, 이어서 p-톨루엔설폰산 모노히드레이트 (0.275 g, 1.60 mmol)를 첨가한 다음, 반응 혼합물을 실온에서 1 시간 동안 교반하였다. 물 (50 mL)을 첨가하고 혼합물을 메틸렌 클로라이드 (3 x 50 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 조합하고 염수 (1 x 50 mL)로 세척하고 소듐 설페이트로 건조하고 농축하여 투명한 황색 액체를 수득하였다. 조 액체를 헥산 중 10 % EtOAc를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 4,6-디클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘을 수득하였다 (3.0 g, 11.1 mmol, 67 % 수율). (m/z): C11H11Cl2N3O에 대한 [M+H]+ 계산치 272.04, 실측치 272.21.
제조예 33 : tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트
NaH (미네랄 오일 중 60 % 분산액, 160 mg, 4.0 mmol)를 0 ℃에서 DMF (5 mL) 및 디에틸 에테르 (5 mL) 중 1-boc-아제티딘-3-일-메탄올 (760 mg, 4.0 mmol)의 용액에 첨가하였다. 0 ℃에서 반응 혼합물을 15 분 동안 교반하였다. 4,6-디클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘 (1.0 g, 3.7 mmol)을 첨가하고 반응 혼합물을 실온에서 1 시간 동안 교반하였다. 물 (10 mL)을 첨가하고 반응 혼합물을 메틸렌 클로라이드 (3 x 10 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 조합하고 염수 (1 x 10 mL)로 세척하고 소듐 설페이트로 건조하고 진공내에서 농축하여 투명한 황색 액체를 수득하였다. 조 액체를 헥산 중 30 % EtOAc를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트르르 수득하였다 (1.1 g, 2.60 mmol, 70 % 수율). (m/z): C20H27ClN4O4에 대한 [M+H]+ 계산치 423.18, 실측치 423.25.
제조예 34 : tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트
물 (4 mL) 중 소듐 카보네이트 (500 mg, 4.72 mmol)의 용액을 디옥산 (20 mL) 중 4-히드록시페닐보론산 (392 mg, 2.84 mmol) 및 tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트 (1.0 g, 2.36 mmol)에 첨가하고 반응 혼합물을 질소로 10 분 동안 기체를 제거시켰다. PdCl2(dppf).DCM (196 mg, 0.24 mmol)을 첨가하고 반응 혼합물을 추가로 5 분 동안 기체를 제거시킨 후 110 ℃에서 4 시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각한 다음 셀라이트 층을 통해 여과하였다. 여과된 물질을 메틸렌 클로라이드로 세척하고 여액을 조합하고 물 (1 x 10 mL), 염수 (1 x 10 mL)로 세척하고 소듐 설페이트로 건조하고 진공내에서 농축하여 투명한 갈색 액체를 수득하였다. 조 액체를 헥산 중 50 % EtOAc를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로)[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트를 수득하였다 (1.02 g, 2.12 mmol, 76 % 수율). (m/z): C26H32N4O5에 대한 [M+H]+ 계산치 481.25, 실측치 481.65.
제조예 35 : 4-(4-(아제티딘-3-일메톡시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀
0 ℃에서 메틸렌 클로라이드 (10 mL) 중 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트 (500 mg, 1.04 mmol)의 용액에 TFA (4.0 ml)을 천천히 첨가하고, 반응 혼합물을 실온에서 3 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 생성된 고체를 5 % 메탄올:메틸렌 클로라이드로 연화 처리하여 표제 화합물을 TFA 염으로서 수득하였다 (330 mg, 0.804 mmol, 77 % 수율). (m/z): C16H16N4O2에 대한 [M+H]+ 계산치 297.14, 실측치 297.15.
실시예 10 : 1-(3-(((6-(4-히드록시페닐)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-일)프로프-2-엔-1-일
DMF (1 mL) 중 4-(4-(아제티딘-3-일메톡시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀 TFA 염 (35.5 mg, 0.087 mmol)의 용액에 DIPEA (0.151 ml, 0.865 mmol)를 첨가한 후, 아크릴로일 클로라이드 (7.0 uL, 0.087 mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 후, 진공내에서 농축시켜 황색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 5-75 % 아세토니트릴을 사용하여 분취용 규모 Zorbax Bonus-RP (2.1x30mm, 1.8 마이크론) 컬럼 크로마토그래피를 통해 정제하여 1-(3-(((6-(4-히드록시페닐)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-일)프로프-2-엔-1-온을 수득하였다 (13.4 mg, 0.028 mmol, 33 % 수율). (m/z): C19H28N4O3에 대한 [M+H]+ 계산치 351.15, 실측치 351.1. 1H NMR (400 MHz, DMSO-d 6) δ 13.02 (s, 1H), 9.80 (s, 1H), 7.98 (d, J = 8.9 Hz, 3H), 7.13 (s, 1H), 6.85 (d, J = 8.7 Hz, 2H), 6.32 (dd, J = 17.0, 10.3 Hz, 1H), 6.09 (dd, J = 17.0, 2.3 Hz, 1H), 5.64 (dd, J = 10.3, 2.3 Hz, 1H), 4.55 (d, J = 6.7Hz, 1H), 4.38 (t, J = 8.5Hz, 1H), 4.15 - 4.02 (m, 2H), 3.80 (dd, J = 10.0.5.4Hz, 2H), 3.22 - 3.07 (m, 1H).
제조예 36 : 6-브로모-4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸
3,4-디히드로-2h-피란 (19.79mL, 216.5mmol)을 0 ℃에서 에틸 아세테이트 (200mL) 중 6-브로모-4-클로로-1H-인다졸 (10.0g, 43.3mmol)의 용액에 첨가하고, 이어서 p-톨루엔설폰산 모노히드레이트 (1.64 g, 8.66 mmol)을 첨가하고, 반응 혼합물을 50 ℃에서 4 시간 동안 교반하였다. 포화 수성 소듐 비카보네이트 (100 mL)을 첨가하고 혼합물을 에틸 아세테이트 (3 x 100 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 물 (1 x 100 mL), 염수 (1 x 100 mL)로 세척하고, 소듐 설페이트로 건조시키고 농축하여 황색 고체를 수득하였다. 조 액체를 n-펜탄 중 연화 처리를 통해 정제하여 6-브로모-4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸을 수득하였다 (13.0 g, 41.2 mmol, 95 % 수율). (m/z): C12H12BrClN2O에 대한 [M+H]+ 계산치 314.99, 실측치 314.93.
제조예 37 : 4-(4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-6-일)페놀
디옥산 (200 mL) 및 물 (50 mL) 중 소듐 카보네이트 (8.77g, 82.8mmol), 4-히드록시페닐보론산 (6.85g, 49.7mmol) 및 6-브로모-4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸의 용액 (13.0 g, 41.4 mmol)을 15 분 동안 질소로 가스를 제거시켰다. PdCl2(dppf).DCM (3.37 g, 4.14 mmol)을 첨가하고 반응 혼합물을 추가로 5 분 동안 가스를 제거시킨 후 125 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 에틸 아세테이트를 첨가하고 반응 혼합물을 셀라이트 층을 통해 여과하였다. 물을 첨가하고 (100 mL) 혼합물을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 투명한 갈색 액체를 수득하였다. 조 액체를 헥산 구배 중 0-30 % EtOAc를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 4-(4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-6-일)페놀을 수득하였다 (7.5 g, 22.9 mmol, 55 % 수율). (m/z): C18H17ClN2O2에 대한 [M+H]+ 계산치 329.11, 실측치 329.08.
제조예 38 : tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)(메틸)아미노)메틸)아제티딘-1-카복실레이트
팔라듐 아세테이트 (68.3 mg, 0.304 mmol) 및 2-(디-t-부틸포스피노)비페닐 (182.0 mg, 0.608 mmol)의 1:2 혼합물을 톨루엔 (15 ml) 중 4-(4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-6-일)페놀 (500 mg, 1.521 mmol), tert-부틸3-((메틸아미노)메틸)아제티딘-1-카복실레이트 (457 mg, 2.281 mmol) 및 > 99.9 % 의 소듐 tert-부톡시드 (731 mg, 7.60 mmol)의 용액에 첨가하였다. 반응 혼합물을 질소로 10 분 동안 가스를 제거시킨 후 110 ℃에서 16 시간 동안 교반하였다. 반응 혼합물을 진공내에서 약 5mL의 부피로 농축시켰다. 암모늄 클로라이드 포화 수용액 (5 mL)을 첨가하고 혼합물을 에틸 아세테이트 (2 x 5 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 50 % 에틸 아세테이트를 사용하여 콤비 플래쉬 컬럼 크로마토그래피 (24g)를 통해 정제하여 tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)(메틸)아미노)메틸)아제티딘-1-카복실레이트를 수득하였다 (368 mg, 0.747 mmol, 49 % 수율). (m/z): C28H36N4O4에 대한 [M+H]+ 계산치 493.28, 실측치 493.4.
제조예 39 : 4-(4-((아제티딘-3-일메틸)(메틸)아미노)-1H-인다졸-6-일)페놀
tert-부틸 3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)(메틸)아미노)메틸)아제티딘-1-카복실레이트 (368 mg, 0.747 mmol)을 디클로로메탄 (1.5 ml)에 용해시키고 TFA (1.5 ml)를 천천히 첨가하였다. 투명한 용액을 실온에서 5 시간 동안 교반하였고, 이때 LCMS는 원하는 생성물로의 양호한 전환을 나타냈다. 반응물을 농축시켜 TFA 염으로서 4-(4-((아제티딘-3-일메틸)(메틸)아미노)-1H-인다졸-6-일)페놀을 수득하였다 (100 % 수율). (m/z): C18H20N4O에 대한 [M+H]+ 계산치 309.17, 실측치 309.2.
실시예 11 : (E)-4-(디메틸아미노)-1-(3-(((6-(4-히드록시페닐)-1H-인다졸-4-일)(메틸)아미노)메틸)아제티딘-1-일)부트-2-엔-1-온
HATU (2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트, 59.5 mg, 0.157 mmol)를 DMF (1 mL) 중 (E)-4-(디메틸아미노)부트-2-에노산 히드로클로라이드 (34 mg, 0.263 mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 5 분 동안 교반한 다음, 4-(4-((아제티딘-3-일메틸)(메틸)아미노)-1H-인다졸-6-일)페놀 TFA 염 (63 mg, 0.149 mmol)을 첨가하고, 이어서 DIPEA (0.260 ml, 1.491 mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 후, 진공내에서 농축시켜 황색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 5-65 % 아세토니트릴을 사용하여 분취용 규모 Zorbax Bonus-RP (2.1x30mm, 1.8 마이크론) 컬럼 크로마토그래피를 통해 정제하여 (E)-4-(디메틸아미노)-1-(3-(((6-(4-히드록시페닐)-1H-인다졸-4-일)(메틸)아미노)메틸)아제티딘-1-일)부트-2-엔-1-온을 수득하였다 (47.6 mg, 0.086 mmol, 96 % 수율). (m/z): C24H29N5O2에 대한 [M+H]+ 계산치 420.24, 실측치 420.2.
제조예 40 : tert-부틸 (3S)-3-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)티오)피롤리딘-1-카복실레이트
DMSO (5 mL) 중 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (600 mg, 2.0 mmol) 및 tert-부틸 (S)-3-머캅토피롤리딘-1-카복실레이트 (488 mg, 2.20 mmol)의 교반된 용액에 Cs2CO3 (1.30 mg, 4.0 mmol)을 첨가하였다. 반응 혼합물을 120 ℃에서 16 시간 동안 교반하였다. 물을 첨가하고 반응 혼합물을 EtOAc (3 x 50 ml)로 추출하였다. EtOAc 추출물을 조합하고, 물 및 염수로 세척하고, 무수 소듐 설페이트상에서 건조시키고, 여과하고 진공내에서 농축시켜 조 중간 생성물을 투명한 점성 액체로서 수득하였다. 디옥산 (20 mL) 및 물 (4 ml) 중 조 중간체의 교반된 용액에 4-히드록시페닐보론산 (240 mg, 1.74 mmol) 및 Na2CO3 (461 mg, 4.35 mmol)을 첨가하고 반응 혼합물을 질소로 15 분 동안 기체를 제거시켰다. Pd(dppf)Cl2.DCM (118 mg, 0.0145 mmol)을 첨가하고 반응 혼합물을 추가로 5 분 동안 기체를 제거시킨 후 110 ℃에서 4 시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 물을 첨가하고, 반응 혼합물을 에틸 아세테이트 (3 x 50 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 투명한 갈색 액체를 수득하였다. 조 액체를 헥산 구배 중 30-50 % EtOAc를 사용하여 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (3S)-3-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)티오)피롤리딘-1-카복실레이트 (600 mg, 1.21 mmol, 61 %)를 수득하였다. (m/z): C27H33ClN3O4S에 대한 [M+H]+ 계산치 496.23, 실측치 496.42.
제조예 41 : (S)-4-(4-(피롤리딘-3-일티오)-1H-인다졸-6-일)페놀
디옥산 중 4.0N HCl (10.0 ml, 40.0 mmol)을 메탄올 (6 ml) 중 tert-부틸 (3S)-3-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)티오)피롤리딘-1-카복실레이트 (400 mg, 0.808 mmol)의 용액에 첨가하고, 반응 혼합물을 40 ℃에서 16 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 생성된 잔류물을 0.05 % 트리플루오로아세트산과 함께 물 중 20-80 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-4-(4-(피롤리딘-3-일티오)-1H-인다졸-6-일)페놀을 수득하였다 (175 mg, 0.411 mmol, 51 % 수율). (m/z): C17H17N3OS에 대한 [M+H]+ 계산치 312.12, 실측치 312.22.
실시예 12 : (S)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)티오)피롤리딘-1-일)프로프-2-엔-1-온
N,N-디이소프로필에틸아민 (0.079 ml, 0.450 mmol)을 0 ℃에서 DMF (0.2ml) 중 (S)-4-(4-(피롤리딘-3-일티오)-1H-인다졸-6-일)페놀 TFA 염 (38.5 mg, 0.091mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (8.0μL, 0.099mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반하고, 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)티오)피롤리딘-1-일)프로프-2-엔-1-온을 수득하였다 (17.1 mg, 0.046 mmol, 51 % 수율). (m/z): C20H19N3O2S에 대한 [M+H]+ 계산치 366.13, 실측치 366.1.
제조예
42 :
tert
-부틸 (3S)-3-((6-(4-
히드록시페닐
)-1-(
테트라히드로
-2H-피란-2-일)-1H-인다졸-4-일)설포닐)피롤리딘-1-카복실레이트
염기성 알루미나 (200mg) 및 옥손 (744mg, 2.42mmol)을 클로로포름 (50mL) 및 물 (1mL) 중 tert-부틸 (3S)-3-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)티오)피롤리딘-1-카복실레이트 (400mg, 0.80mmol)의 용액에 첨가하고, 반응 혼합물을 65 ℃에서 12 시간 동안 교반하였다. 반응 혼합물을 셀라이트 층을 통해 여과하고, 여과된 물질을 클로로포름으로 세척하였다. 여액을 조합하고, 물을 첨가하고, 혼합물을 클로로포름 (3 x 100 mL)으로 추출하였다. 클로로포름 추출물을 조합하고, 염수로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켰다. 조 액체를 헥산 중 30 % EtOAc를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (3S)-3-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)설포닐)피롤리딘-1-카복실레이트를 수득하였다 (200 mg, 0.379 mmol, 47 % 수율). (m/z): C27H33ClN3O6에 대한 [M+H]+ 계산치 528.22, 실측치 528.48.
제조예 43 : (S)-4-(4-(피롤리딘-3-일설포닐)-1H-인다졸-6-일)페놀
디옥산 중 4.0N HCl (10.0 ml, 40.0 mmol)을 메탄올 (2 ml) 중 (3S)-3-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)설포닐)피롤리딘-1-카복실레이트 (200 mg, 0.379 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 8 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 생성된 잔류물을 디에틸 에테르로 연화 처리하여 HCl 염으로서 ((S)-4-(4-(피롤리딘-3-일설포닐)-1H-인다졸-6-일)페놀을 수득하였다 (140 mg, 0.369 mmol, 97 % 수율). (m/z): C17H17N3O3S에 대한 [M+H]+ 계산치 344.11, 실측치 344.04.
실시예 13 : ((S)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)설포닐)피롤리딘-1-일)프로프-2-엔-1-온
N,N-디이소프로필에틸아민 (0.079 ml, 0.450 mmol)을 0 ℃에서 DMF (0.2ml) 중 (((S)-4-(4-(피롤리딘-3-일설포닐)-1H-인다졸-6-일)페놀 HCl 염 (31.0 mg, 0.082mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (8.0μL, 0.099mmol)를 첨가하였다. 반응 혼합물을 실온에서 10 분 동안 교반하고 조 액체를 0.05 % 트리플루오로 아세트산과 함께 물 중 아세토니트릴 구배를 사용한 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 ((S)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)설포닐)피롤리딘-1-일)프로프-2-엔-1-온을 수득하였다 (3.1 mg, 0.0061 mmol, 7 % 수율). (m/z): C20H19N3O4S에 대한 [M+H]+ 계산치 38.0.12, 실측치 398.0.
제조예 44 : tert-부틸 4-((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)메틸)피페리딘-1-카복실레이트
THF 중 9-BBN의 0.5M 용액 (7.92mL, 3.96mmol)을 tert-부틸 4-메틸렌피페리딘-1-카복실레이트 (468mg, 2.37mmol)에 첨가하고, 반응 혼합물을 80 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시킨 후, DMF (10.0 ml) 및 H2O (2.0 ml) 중 4-브로모-6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (500 mg, 1.58 mmol), 포타슘 카보네이트 (548 mg, 3.96 mmol) 및 Pd(dppf)Cl2.DCM (129 mg, 0.15 mmol)의 미리 형성된 용액에 캐뉼라를 통해 첨가하였다. 반응 혼합물을 80 ℃에서 16 시간 동안 교반하였다. 반응 혼합물을 셀라이트 층을 통해 여과하고, 여과된 물질을 에틸 아세테이트로 세척하였다. 여액을 조합하고, 물 (100 mL)을 첨가하고 혼합물을 에틸 아세테이트 (2 x 150 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 염수로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켰다. 조 액체를 헥산 중 30 % EtOAc를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 4-((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)메틸)피페리딘-1-카복실레이트를 수득하였다 (460 mg, 1.06 mmol, 67 % 수율). (m/z): C23H32ClN3O3에 대한 [M+H]+ 계산치 434.22, 실측치 434.47.
제조예 45 : tert-부틸 4-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)메틸)피페리딘-1-카복실레이트
4-히드록시페닐보론산 (195 mg, 1.41 mmol)을 디옥산 (10.0 mL) 및 물 (2.0 mL) 중 tert-부틸 4-((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)메틸)피페리딘-1-카복실레이트 (410 mg, 0.94 mmol)의 현탁액에 첨가하고, 이어서 포타슘 포스페이트 (401 mg, 1.88 mmol)을 첨가하고, 반응 혼합물을 질소로 15 분 동안 기체를 제거시켰다. 2'-(디메틸아미노)-2-비페닐릴-팔라듐 (II) 클로라이드 디노르보르닐포스핀 착물 (52 mg, 0.07 mmol)을 첨가하고 반응 혼합물을 100 ℃에서 1 시간 동안 마이크로파 조사하에 가열하였다. 반응 혼합물을 실온으로 냉각한 다음 셀라이트 층을 통해 여과하였다. 여액에 물 (100 mL)을 첨가한 후, 에틸 아세테이트 (3 x 100 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 물, 염수로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켰다. 조 액체를 헥산 중 50 % EtOAc를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 4-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)메틸)피페리딘-1-카복실레이트를 수득하였다 (300 mg, 0.610 mmol, 65 %). (m/z): C29H37N3O4에 대한 [M+H]+ 계산치 492.29, 실측치 492.46.
제조예 46 : 4-(4-(피페리딘-4-일메틸)-1H-인다졸-6-일)페놀
디옥산 중 4.0N HCl (10.0 ml, 40.0 mmol)을 메탄올 (2 ml) 중 tert-부틸 4-((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)메틸)피페리딘-1-카복실레이트 (300 mg, 0.610 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 8 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 생성된 잔류물을 디에틸 에테르로 연화 처리하여 HCl 염으로서 4-(4-(피페리딘-4-일메틸)-1H-인다졸-6-일)페놀을 수득하였다 (195 mg, 0.567 mmol, 93 % 수율). (m/z): C19H21N3O에 대한 [M+H]+ 계산치 308.18, 실측치 308.10.
실시예 14 : 1-(4-((6-(4-히드록시페닐)-1H-인다졸-4-일)메틸)피페리딘-1-일)프로프-2-엔-1-온
N,N-디이소프로필에틸아민 (0.079 ml, 0.450 mmol)을 0 ℃에서 DMF (0.2ml) 중 4-(4-(피페리딘-4-일메틸)-1H-인다졸-6-일)페놀 HCl 염 (27.5 mg, 0.080 mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (8.0μL, 0.099mmol)를 첨가하였다. 반응 혼합물을 실온에서 10 분 동안 교반하고, 조 액체를 0.05 % 트리플루오로 아세트산과 함께 물 중 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 1-(4-((6-(4-히드록시페닐)-1H-인다졸-4-일)메틸)피페리딘-1-일)프로프-2-엔-1-온을 수득하였다 (7.2 mg, 0.015 mmol, 19 % 수율). (m/z): C22H23N3O2에 대한 [M+H]+ 계산치 362.19, 실측치 362.1.
제조예 47 : tert-부틸 (R,E)-2-(3-에톡시-3-옥소프로프-1-엔-1-일)피롤리딘-1-카복실레이트
에틸 3-(트리페닐포스포라닐리덴)프로파노에이트 (3.64 g, 10.0 mmol)를 0 ℃에서 메틸렌 클로라이드 (40 mL) 중 tert-부틸 (R)-2-포르밀피롤리딘-1-카복실레이트 (2.0 g, 10.0 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 4 시간 동안 교반하였다. 물 (200 mL)을 첨가하고 반응 혼합물을 메틸렌 클로라이드 (2 x 100 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켰다. 조 액체를 헥산 중 5 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (R,E)-2-(3-에톡시-3-옥소프로프-1-엔-1-일)피롤리딘-1-카복실레이트를 수득하였다 (1.70 g, 6.31 mmol, 63 % 수율).
제조예 48 : 에틸 (R,E)-3-(1-메틸피롤리딘-2-일)아크릴레이트
디옥산 중 4M HCl (7.20 mL, 28.8 mmol)을 TFA (10.90 ml)의 용액에 첨가하고 디옥산 (40 mL) 중 tert-부틸 (R,E)-2-(3-에톡시-3-옥소프로프-1-엔-1-일)피롤리딘-1-카복실레이트 (1.70 g, 6.31 mmol)의 용액에 천천히 첨가한 다음, 반응 혼합물을 실온에서 2 시간 동안 교반하였다. 반응물을 진공내에서 농축시켜 조 중간체를 수득하였다. 0 ℃에서 물 중 37 % 포름알데히드 용액 (4.19mL, 41.4mmol)을 메틸렌 클로라이드 (50mL) 중의 조 중간체 용액에 첨가한 후, 소듐 트리아세톡시보로히드라이드 (5.26g, 24.8mmol)를 첨가하고, 반응 혼합물을 실온에서 16 시간 동안 교반하였다. 빙냉수 (20 mL)를 첨가하고 반응 혼합물을 메틸렌 클로라이드 (2 x 100 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 조합하고, 염수로 세척하고, 소듐 설페이트상에서 건조시키고, 진공내에서 농축시켜 에틸 (R,E)-3-(1-메틸피롤리딘-2-일)아크릴레이트를 수득하였다 (0.900 g, 4.915 mmol, 78 % 수율). (m/z): C10H17NO2에 대한 [M+H]+ 계산치 184.14, 실측치 184.0.
제조예 49 : (R,E)-3-(1-메틸피롤리딘-2-일)아크릴산
소듐 히드록시드 (294mg, 7.36mmol)를 2:1의 THF/물 (15 mL) 중 에틸 (R,E)-3-(1-메틸피롤리딘-2-일)아크릴레이트 (0.900g, 4.915mmol, 78 % 수율)의 용액에 첨가하고, 반응 혼합물을 실온에서 4 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 에틸 (R,E)-3-(1-메틸피롤리딘-2-일)아크릴산을 수득하였다 (668 mg, 4.30 mmol, 88 % 수율). (m/z): C8H13NO2에 대한 [M+H]+ 계산치 156.10, 실측치 156.26.
실시예
15 : (E)-1-((S)-3-((6-(4-
히드록시페닐
)-1H-
인다졸
-4-일)
옥시
)
피롤리딘
-1-일)-3-((R)-1-메틸피롤리딘-2-일)프로프-2-엔-1-온
DMF (0.1 mL) 중 HATU (0.031 g, 0.083 mmol)의 용액을 에틸 (R,E)-3-(1-메틸피롤리딘-2-일)아크릴산 (14.0 mg, 0.090 mmol)에 첨가한 후 (S)-4-(4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀 히드로클로라이드 (0.025 g, 0.075 mmol) 및 DIPEA (0.065 ml, 0.375 mmol)의 용액을 첨가하고, 반응 혼합물을 실온에서 15 분 동안 교반한 다음, 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 ((E)-1-((S)-3-((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)-3-((R)-1-메틸피롤리딘-2-일)프로프-2-엔-1-온을 수득하였다 (7.8 mg, 0.014 mmol, 19 % 수율). (m/z): C25H28N4O3에 대한 [M+H]+ 계산치 433.23, 실측치 433.1.
제조예 50 : tert-부틸 2-((디메틸아미노)메틸)아크릴레이트
파라포름알데히드 (1.20 g, 43.2 mmol)를 1,4-디옥산 (20 mL) 중 말론산 (2.0 g, 19.3 mmol) 용액에 첨가한 후 THF (9.60 mL, 19.2 mmol) 중 디메틸아민의 2M 용액을 첨가하고, 반응 혼합물을 70 ℃에서 1 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 조 생성물을 디에틸 에테르 및 아세톤을 사용하여 재결정화하여 중간체를 백색 고체로서 수득하였다. 중간체 백색 고체를 t-BuOH (100 mL)에 용해시키고 디-tert-부틸 디카보네이트 (4.60 mL, 20.7 mmol)를 반응 혼합물에 첨가한 후 4-디메틸아미노피리딘 (511 mg, 4.18 mmol) 및 반응 혼합물 실온에서 4 시간 동안 교반하였다. 메틸렌 클로라이드 (500 mL)를 첨가하고 반응 혼합물을 물 (2 x 500 mL)로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켰다. 조 잔류물을 메틸렌 클로라이드 중 2 % 메탄올을 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 2-((디메틸아미노)메틸)아크릴레이트를 수득하였다 (220 mg, 1.19 mmol, 6 % 수율).
제조예 51 : 2-((디메틸아미노)메틸)아크릴산
1N HCl 수용액 (5.0 mL, 5 mmol)을 tert-부틸 2-((디메틸아미노)메틸)아크릴레이트 (220 mg, 1.19 mmol)에 첨가하고 반응 혼합물을 100 ℃에서 15 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 생성된 잔류물을 톨루엔과 공비 혼합하고, 디에틸 에테르로 연화 처리하여 HCl 염으로서 2-((디메틸아미노)메틸)아크릴산을 수득하였다 (119 mg, 0.719 mmol, 60 % 수율). (m/z): C6H11NO2에 대한 [M+H]+ 계산치 130.09, 실측치 130.22.
실시예 16 : (S)-2-((디메틸아미노)메틸)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-엔-1-온
DMF (0.1 mL) 중 HATU (0.031 g, 0.083 mmol)의 용액을 2-((디메틸아미노)메틸)아크릴산 히드로클로라이드 (14.9 mg, 0.090 mmol)에 첨가한 후, (S)-4-(4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀 히드로클로라이드 (0.025 g, 0.075 mmol) 및 DIPEA (0.065 ml, 0.375 mmol)의 용액을 첨가한 다음, 반응 혼합물을 실온에서 15 분 동안 교반하고 조 액체를 0.05 % 트리플루오로 아세트산과 함께 물 중 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-2-((디메틸아미노)메틸)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-엔-1-온을 수득하였다 (2.6 mg, 0.005 mmol, 7 % 수율). (m/z): C23H26N4O3에 대한 [M+H]+ 계산치 407.21, 실측치 407.1.
실시예 17 : (S)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-인-1-온
DMF (0.1 mL) 중 HATU (0.031 g, 0.083 mmol)의 용액을 프로피올산 (6.0 mg, 0.090 mmol)에 첨가한 후, (S)-4-(4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀 히드로클로라이드 (0.025 g, 0.075 mmol) 및 DIPEA (0.065 ml, 0.375 mmol)의 용액을 첨가하고, 반응 혼합물을 실온에서 15 분 동안 교반하고 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-1-(3-((6-(4-히드록시페닐)-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-인-1-온을 수득하였다 (2.4 mg, 0.005 mmol, 7 % 수율). (m/z): C20H17N3O3에 대한 [M+H]+ 계산치 348.14, 실측치 348.0.
실시예 18 : (S)-4-(4-((1-(비닐설포닐)피롤리딘-3-일)옥시)-1H-인다졸-6-일)페놀
N,N-디이소프로필에틸아민 (0.052 ml, 0.301 mmol)을 0 ℃에서 DMF (0.2 ml) 중 (S)-4-(4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀 히드로클로라이드 (0.020 g, 0.060 mmol)의 용액에 첨가하고, 이어서 에텐설포닐 클로라이드 (8.4 mL, 0.066 mmol)를 첨가하였다. 반응 혼합물을 실온에서 10 분 동안 교반하고, 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-4-(4-((1-(비닐설포닐)피롤리딘-3-일)옥시)-1H-인다졸-6-일)페놀을 수득하였다 (8.2 mg, 0.016 mmol, 27 % 수율). (m/z): C19H19N3O4에 대한 [M+H]+ 계산치 386.12, 실측치 386.3.
제조예 52 : tert-부틸 3-(2-((6-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트
세슘 카보네이트 (6.33 g, 19.42 mmol)를 1,4-디옥산 (20.71 ml) 및 물 (5.18 ml) 중 tert-부틸 3-(2-((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (3.20 g, 6.47 mmol) 및 3-플루오로-4-히드록시벤젠보론산 (1.514 g, 9.71 mmol)의 용액에 첨가하고, 반응 혼합물을 질소로 10 분 동안 기체를 제거시켰다.
디클로로[1,1'-비스(디페닐포스피노)페로센]팔라듐(II) (0.793 g, 0.971 mmol)을 첨가하고 반응 혼합물을 110 ℃에서 2 시간 동안 교반하였다. 반응 혼합물을 진공내에서 약 5mL의 부피로 농축시켰다. 암모늄 클로라이드 포화 수용액 (20 mL)을 첨가하고 혼합물을 메틸렌 클로라이드 (2 x 20 mL)로 추출하였다. 메틸렌 클로라이드 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 50 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(2-((6-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트를 수득하였다 (2.30 g, 4.38 mmol, 68 % 수율). (m/z): C29H37FN3O5에 대한 [M+H]+ 계산치 526.27, 실측치 526.3.
제조예 53 : 4-(4-((2-아제티딘-3-일)프로판-2-일)옥시)-1-H-인다졸-6-일)-2-플루오로페놀
tert-부틸 3-(2-((6-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (3.10g, 5.90mmol)를 디클로로메탄 (10ml)에 용해시키고 TFA (10ml)를 천천히 첨가하였다. 투명한 용액을 실온에서 2 시간 동안 교반하였고, 이때 LCMS는 원하는 생성물로의 양호한 전환을 나타냈다. 반응물을 농축시켜 TFA 염으로서 4-(4-((2-아제티딘-3-일)프로판-2-일)옥시)-1-H-인다졸-6-일)-2-플루오로페놀을 제공하였다 (100 % 수율). (m/z): C19H21FN3O2에 대한 [M+H]+ 계산치 342.16, 실측치 342.3.
실시예 19 : (E)-1-(3-(2-((6-(3-플루오로-4-히드록시페닐)-1H-인다졸-4-일)옥시)프로판-2-일)아제티딘-1-일)-4-(디메틸아미노)부트-2-엔-1-온
HATU (2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트, 2.92 g, 7.07 mmol)를 DMF (10 mL) 중 (E)-4-(디메틸아미노)부트-2-에노산 히드로클로라이드 (1.07 g, 6.48 mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 10 분 동안 교반한 다음 4-(4-((2-아제티딘-3-일)프로판-2-일)옥시)-1-H-인다졸-6-일)-2-플루오로페놀 TFA 염 (2.01 g, 5.89 mmol)에 이어서 DIPEA (3.08 ml, 17.7 mmol)를 첨가하였다. 반응 혼합물을 실온에서 15 분 동안 교반한 후, 진공내에서 농축시켜 황색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 20-80 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (E)-4-(디메틸아미노)-1-(3-(2-((6-(3-플루오로-4-히드록시페닐)-1H-인다졸-4-일)옥시)프로판-2-일)시클로부틸)부트-2-엔-1-온을 수득하였다 (1.65 g, 3.65 mmol, 61.9 % 수율). (m/z): C25H30FN4O3에 대한 [M+H]+ 계산치 453.23, 실측치 453.3.
제조예
54 :
tert
-부틸 3-(2-((2,6-
디클로로피리딘
-4-일)
옥시
)프로판-2-일)아제티딘-1-카복실레이트
DMSO (10 mL) 중 tert-부틸 3-(2-히드록시프로판-2-일)아제티딘-1-카복실레이트 (6.5 g, 30.21 mmol)의 용액을 DMSO (15 mL) 중 미네랄 오일 (1.65g, 41.20 mmol) 중 60 중량% 소듐 히드라이드 용액에 적가하고, 반응 혼합물을 실온에서 10 분 동안 교반하였다. 생성된 현탁액에 DMSO (25 mL) 중 2,4,6-트리클로로피리딘 (5.0 g, 27.62 mmol)의 용액을 적가하고, 반응 혼합물을 60 ℃에서 16 시간 동안 교반하였다. 암모늄 클로라이드 포화 수용액을 사용하여 반응 혼합물을 켄칭하고 에틸 아세테이트로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 클로라이드 포화 수용액으로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 조 액체를 수득하였다. 조 액체를 헥산 중 5 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(2-((2,6-디클로로피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트를 수득하였다 (2.10 g, 5.80 mmol, 21.1 % 수율). (m/z): C16H23Cl2N2O3에 대한 [M+H]+ 계산치 361.11, 실측치 361.11.
제조예 55 : tert-부틸 3-(2-((6-클로로-1H-피라졸로[3,4-b]피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트
헥산 중 nBuLi의 2M 용액 (3.05mL, 6.11mmol)을 -78 ℃에서 THF (40 mL) 중 tert-부틸 3-(2-((2,6-디클로로피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (2.0 g, 5.55 mmol)의 용액에 적가하였다. DMF (0.64 mL, 8.33 mmol)를 한번에 첨가하고 반응 혼합물을 -78 ℃에서 10 분 동안 교반하였다. 디에틸 에테르 중 5 % 아세트산을 첨가하고 혼합물을 물로 추가로 희석하였다. 수성층을 에틸 아세테이트로 추출하였다 (3 회). 에틸 아세테이트 추출물을 조합하고, 소듐 클로라이드 포화 수용액으로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 조 중간체 tert-부틸 3-(2-((2,6-디클로로-3-포르밀피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트를 수득하였다. 히드라진 히드레이트 (1.0 mL, 20.56 mmol)를 THF (40 mL) 중 0 ℃에서 조 tert-부틸 3-(2-((2,6-디클로로-3-포르밀피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트의 용액에 적가하고, 반응 혼합물을 실온에서 2 시간 동안 교반하였다. 트리에틸아민 (1.45 mL, 10.28 mmol)을 첨가하고, 반응 혼합물을 60 ℃에서 16 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 생성된 잔류물을 물로 희석하고 에틸 아세테이트로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 클로라이드 포화 수용액으로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 조 액체를 수득하였다. 조 액체를 헥산 중 20 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(2-((6-클로로-1H-피라졸로[3,4-b]피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트를 수득하였다 (1.20 g, 3.27 mmol, 58.9 % 수율). (m/z): C17H23ClN4O3에 대한 [M+H]+ 계산치 367.15, 실측치 367.00.
제조예
56 :
tert
-부틸 3-(2-((6-(4-
히드록시페닐
)-1H-
피라졸로[3,4-b]피리딘
-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트
소듐 카보네이트 (636 mg, 6.00 mmol)를 4:1 디옥산/물 (15 mL) 중 tert-부틸 3-(2-((6-클로로-1H-피라졸로[3,4-b]피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (1.1 g, 3.00 mmol)의 용액에 첨가하고, 이어서 페놀보론산 (496 mg, 3.60 mmol)을 첨가하고, 반응 혼합물을 아르곤으로 10 분 동안 기체를 제거시켰다. 디클로로[1,1'-비스(디페닐포스피노)페로센]팔라듐(II) 디클로로메탄 부가물 (245 mg, 0.3 mmol)을 첨가하고, 반응 혼합물을 아르곤으로 5 분 동안 추가로 기체를 제거시키고, 반응 혼합물을 1 시간 동안 130 ℃에서 마이크로파 조사하에 교반하였다. 반응 혼합물을 물로 희석하고 에틸 아세테이트로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 포화 소듐 클로라이드 수용액으로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 조 액체를 수득하였다. 조 액체를 헥산 중 50 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(2-((6-(4-히드록시페닐)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트를 수득하였다 (650 mg, 1.53 mmol, 51.0 % 수율). (m/z): C23H29N4O4에 대한 [M+H]+ 계산치 425.22 실측치 425.21.
제조예 57 : 4-(4-((2-(아제티딘-3-일)프로판-2-일)옥시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀
tert-부틸 3-(2-((6-(4-히드록시페닐)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)프로판-2-일)아제티딘-1-카복실레이트 (630 mg 1,48 mmol)를 디클로로메탄 (10 ml)에 용해시키고 TFA (6.3 ml)를 천천히 첨가하였다. 투명한 용액을 실온에서 4 시간 동안 교반하였고, 이때 LCMS는 원하는 생성물로의 양호한 전환을 나타냈다. 반응물을 진공내에서 농축시키고 잔류물을 아세토니트릴 및 디에틸 에테르로 연화 처리하여 TFA 염으로서 4-(4-((2-(아제티딘-3-일)프로판-2-일)옥시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀을 수득하였다 (100 % 수율). (m/z): C18H21N4O2에 대한 [M+H]+ 계산치 325.17, 실측치 325.13.
실시예 20 : 1-(3-(2-((6-(4-히드록시페닐)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)프로판-2-일)아제티딘-1-일)프로프-2-엔-1-온
디이소프로필에틸아민 (0.298 ml, 1.711 mmol)을 0 ℃에서 DMF (3.00ml) 중 4-(4-((2-(아제티딘-3-일)프로판-2-일)옥시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀 TFA 염 (150mg, 0.342mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (0.031ml, 0.376mmol)를 첨가한 뒤, 반응 혼합물을 실온에서 15 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 10-70 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 1-(3-(2-((6-(4-히드록시페닐)-1H-피라졸로)[3,4-b]피리딘-4-일)옥시)프로판-2-일)아제티딘-1-일)프로프-2-엔-1-온을 수득하였다 (80.5 mg, 0.163 mmol, 47.8 % 수율). (m/z): C21H23N4O3에 대한 [M+H]+ 계산치 379.18, 실측치 379.3.
제조예 58 : tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-카복실레이트
소듐 히드라이드 (211 mg, 8.79 mmol)를 0 ℃에서 DMF (4.4 mL) 중 tert-부틸 3-(히드록시메틸)-3-메틸아제티딘-1-카복실레이트 (973 mg, 4.83 mmol)의 용액에 첨가하고 반응 혼합물을 실온에서 30 분 동안 교반하였다. 이어서, 반응 혼합물을 0 ℃에서 DMF (4.4mL) 중 4,6-디클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘 (1.20 g, 4.39 mmol)의 용액에 적가하고, 반응 혼합물을 실온에서 2 시간 동안 교반하였다. 물 (1 mL)을 첨가하여 반응을 켄칭하고, 생성된 혼합물을 진공내에서 농축시켜 연갈색 액체를 수득하였다. 물 (10 mL)을 첨가하고 혼합물을 에틸 아세테이트 (3 x 20 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 포화 소듐 클로라이드 수용액 (5 mL)으로 세척하고 소듐 설페이트상에서 건조시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 40 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-카복실레이트를 수득하였다 (1.06 g, 4.39 mmol, 54.9 % 수율). (m/z): C20H29ClN5O4에 대한 [M+H]+ 계산치 438.19, 실측치 438.6.
제조예 59 : tert-부틸 3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-카복실레이트
포타슘 포스페이트 삼염기성 (218mg, 1.03mmol)을 4:1의 디옥산/물 (1.71 mL) 중 tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-카복실레이트 (150 mg, 0.343 mmol)의 용액에 첨가하고, 이어서 3-플루오로-4-히드록시페닐보론산 (80.0 mg, 0.514 mmol)을 첨가하고 반응 혼합물을 질소로 10 분 동안 기체를 제거시켰다. 팔라듐 아세테이트 (15.4 mg, 0.069 mmol) 및 1,1'-비스(디-t-부틸포스피노)페로센 (32.5 mg, 0.069 mmol)을 첨가하고 반응 혼합물을 110 ℃에서 밤새 교반하였다. 반응 혼합물을 진공내에서 약 5mL의 부피로 농축시켰다. 암모늄 클로라이드 포화 수용액 (20 mL)을 첨가하고 혼합물을 에틸 아세테이트 (3 x 20 mL)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 헥산 중 40 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-카복실레이트를 수득하였다 (65 mg, 0.343 mmol, 37.0 % 수율). (m/z): C26H33FN5O5에 대한 [M+H]+ 계산치 514.25, 실측치 514.7.
제조예 60 : 2-플루오로-4-(4-((3-메틸아제티딘-3-일)메톡시)-1H-피라졸로[3,4-d]피리미딘-6-일)페놀
tert-부틸 3-(((6-(3-플루오로-4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-카복실레이트 (65 mg, 0.127 mmol)를 디클로로메탄 (0.56 ml)에 용해시키고 TFA (0.56 ml)를 첨가하고 반응 혼합물을 실온에서 4 시간 동안 교반하였다. 반응물을 진공내에서 농축시켜 TFA 염으로서 2-플루오로-4-(4-((3-메틸아제티딘-3-일)메톡시)-1H-피라졸로[3,4-d]피리미딘-6-일)페놀을 수득하였다 (100 % 수율). (m/z): C16H17FN5O2에 대한 [M+H]+ 계산치 330.14, 실측치 330.3.
실시예 21 : 1-(3-(((6-(3-플루오로-4-히드록시페닐)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-일)프로프-2-엔-1-온
디이소프로필에틸아민 (0.210 ml, 1.20 mmol)을 0 ℃에서 DMF (0.60 ml) 중 2-플루오로-4-(4-((3-메틸아제티딘-3-일)메톡시)-1H-피라졸로[3,4-d]피리미딘-6-일)페놀 TFA 염 (53.2 mg, 0.12 mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (9.75 μl, 0.120 mmol)를 첨가한 뒤, 반응 혼합물을 실온에서 15 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 조 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 10-60 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 1-(3-(((6-(3-플루오로-4-히드록시페닐)-1H-피라졸로[3,4-d]피리미딘-4-일)옥시)메틸)-3-메틸아제티딘-1-일)프로프-2-엔-1-온을 수득하였다 (10.5 mg, 0.120 mmol, 21.7 % 수율). (m/z): C19H19FN5O3에 대한 [M+H]+ 계산치 384.15, 실측치 384.3.
제조예 61 : tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)-3-에틸아제티딘-1-카복실레이트
미네랄 오일 중 60 중량% 소듐 히드라이드 (353 mg, 8.82 mmol)를 0 ℃에서 DMF (10 mL) 중 tert-부틸 3-에틸-3-(히드록시메틸)아제티딘-1-카복실레이트 (1.1 g, 4.85 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 40 분 동안 교반하였다. 0 ℃에서 DMF (5 mL) 중 4,6-디클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘 (1.20 g, 4.41 mmol)의 용액 및 반응 혼합물을 실온에서 1 시간 동안 교반하였다. 물을 첨가하여 반응을 켄칭하고 혼합물을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 물 및 포화 소듐 클로라이드 수용액으로 세척한 다음 소듐 설페이트상에서 건조시켜 조 잔류물을 수득하였다. 조 잔류물을 헥산 중 5 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)-3-에틸아제티딘-1-카복실레이트를 수득하였다 (900 mg, 4.39 mmol, 45.2 % 수율). (m/z): C22H32ClN4O4에 대한 [M+H]+ 계산치 451.21, 실측치 451.13.
제조예 62 : tert-부틸 3-에틸-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트
물 (2 mL) 중 페놀보론산 (413 mg, 2.99 mmol) 및 소듐 카보네이트 (421 mg 3.98 mmol)의 용액을 디옥산 (8 mL) 중 tert-부틸 3-(((6-클로로-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)-3-에틸아제티딘-1-카복실레이트 (900 mg, 1.99 mmol)에 첨가하고, 반응물을 아르곤으로 5 분 동안 기체를 제거시켰다.
디클로로[1,1'-비스(디페닐포스피노)페로센]팔라듐(II) 디클로로메탄 부가물 (162 mg, 0.19 mmol)을 첨가하고, 반응 혼합물을 아르곤으로 5 분 동안 추가로 제거시킨 후, 반응 혼합물을 110 ℃에서 1 시간 동안 교반하였다. 반응 혼합물을 에틸 아세테이트로 희석하고 셀라이트를 통해 여과하였다. 물을 첨가하고, 에틸 아세테이트 층을 분리하고 수성층을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 포화 소듐 클로라이드 수용액으로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 조 액체를 수득하였다. 조 액체를 헥산 중 30 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 3-에틸-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트를 수득하였다 (800 mg, 1.57 mmol, 79.0 % 수율). (m/z): C28H37N4O5에 대한 [M+H]+ 계산치 509.28, 실측치 509.29.
제조예 63 : 4-(4-((3-에틸아제티딘-3-일)메톡시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀
tert-부틸 3-에틸-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-카복실레이트 (800 mg, 1.57 mmol)를 디클로로메탄 (10 ml)에 용해시키고 TFA (10 ml)를 0 ℃에서 첨가하고 반응 혼합물을 실온에서 3 시간 동안 교반하였다. 반응물을 진공내에서 농축시키고, 생성된 잔류물을 디에틸 에테르로 연화 처리 하였다. 조 잔류물을 최소의 아세토니트릴에 용해시키고 디에틸 에테르로 침전시켜 TFA 염으로서 4-(4-((3-에틸아제티딘-3-일)메톡시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀을 수득하였다 (287 mg, 0.885 mmol, 56.3 % 수율). (m/z): C18H21N4O2에 대한 [M+H]+ 계산치 325.17, 실측치 325.07.
실시예 22 : 1-(3-에틸-3-(((6-(4-히드록시페닐)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-일)프로프-2-엔-1-온
디이소프로필에틸아민 (0.246 ml, 1.41 mmol)을 0 ℃에서 DMF (2.0ml) 중 4-(4-((3-에틸아제티딘-3-일)메톡시)-1H-피라졸로[3,4-b]피리딘-6-일)페놀 TFA 염 (124mg, 0.283mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (25μl, 0.311mmol)를 첨가한 뒤, 반응 혼합물을 실온에서 15 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 20-80 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 1-(3-에틸-3-(((6-(4-히드록시페닐)-1H-피라졸로[3,4-b]피리딘-4-일)옥시)메틸)아제티딘-1-일)프로프-2-엔-1-온을 수득하였다 (44.8 mg, 0.118 mmol, 41.9 % 수율). (m/z): C21H23N4O3에 대한 [M+H]+ 계산치 379.18, 실측치 379.3.
제조예 64 : 6-브로모-4-플루오로-1H-벤조[d][1,2,3]트리아졸
물 (50 mL) 중 소듐 니트라이트 (1.85 g, 26.8 mmol)의 용액을 물 (50 mL) 및 아세트산 (18.0 mL) 중 5-브로모-3-플루오로벤젠-1,2-디아민 (5.00 g, 24.4 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 15 분 동안 교반한 다음 85 ℃에서 1 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고 물을 생성된 잔류물에 첨가하였다. 혼합물을 에틸 아세테이트 (2 x 300 mL)로 추출하고, 에틸 아세테이트 추출물을 조합하고, 소듐 설페이트상에서 건조시키고, 진공내에서 농축시켜 6-브로모-4-플루오로-1H-벤조[d][1,2,3]트리아졸을 수득하였다 (5.0 g, 23.1 mmol, 94.0 % 수율). (m/z): C6H3BrFN3에 대한 [M-H]- 계산치 213.94, 실측치 213.94.
제조예
65 : 6
-
브로모
-4-
플루오로
-1-(
테트라히드로
-2H-피란-2-일)-1H-
벤조[d][1,2,3]트리아졸
p-톨루엔설폰산 (796 mg, 4.62 mmol)을 테트라히드로푸란 (200 mL) 중 6-브로모-4-플루오로-1H-벤조[d][1,2,3]트리아졸 (5.0 g, 23.1 mmol)의 용액에 첨가하고, 이어서 3,4-디히드로-2H-피란 (7.7 g, 92.6 mmol)을 첨가하고 반응 혼합물을 실온에서 4 시간 동안 교반하였다. 반응 혼합물을 진공내에서 농축시키고, 생성된 잔류물을 헥산 중 10 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸을 수득하였다 (3.8 g, 12.7 mmol, 55.4 % 수율). (m/z): C11H12BrFN3O에 대한 [M+H]+ 계산치 300.01, 실측치 300.09.
제조예 66 : tert-부틸 (3S)-3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트
세슘 카보네이트 (1.50 g, 4.64 mmol)를 0 ℃에서 DMSO (15 ml) 중 tert-부틸 (S)-3-(히드록시메틸)피롤리딘-1-카복실레이트 (564 mg, 2.80 mmol)의 용액에 첨가하고, 이어서 6-브로모-4-플루오로-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸 (700 mg, 2.34 mmol)를 첨가한 뒤, 반응 혼합물을 80 ℃에서 3 시간 동안 교반하였다. 물을 첨가하고 혼합물을 에틸 아세테이트 (3 x)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 물 및 소듐 클로라이드 수용액으로 세척하고, 소듐 설페이트상에서 건조시키고 진공내에서 농축시켜 조 잔류물을 수득하였다. 조 잔류물을 헥산 중 30 % 에틸 아세테이트를 사용하여 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (3S)-3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트를 수득하였다 (500 mg, 1.04 mmol, 45.6 % 수율). (m/z): C21H30BrN4O4에 대한 [M+H]+ 계산치 481.15, 실측치 481.2.
제조예 67 : tert-부틸 (3S)-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트
페놀보론산 (192 mg, 1.40 mmol)을 디옥산 (10 mL) 및 물 (2 mL) 중 tert-부틸 (3S)-3-(((6-브로모-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트 (450 mg, 0.93 mmol)의 용액에 첨가하고, 이어서 포타슘 포스페이트 (394 mg, 1.86 mmol)를 첨가한 뒤, 반응물을 아르곤으로 15 분 동안 기체를 제거시켰다. 2'-(디메틸아미노)-2-비페닐릴-팔라듐(II) 클로라이드 디노르보르닐포스핀 착물 (52 mg, 0.093 mmol)을 첨가하고, 반응 혼합물을 마이크로파 조사하에 110 ℃에서 40 분 동안 교반하였다. 반응 혼합물을 셀라이트를 통해 여과하였다. 물을 첨가하고 혼합물을 에틸 아세테이트 (3 x)로 추출하였다. 에틸 아세테이트 추출물을 조합하고, 포화 소듐 클로라이드 수용액으로 세척하고, 소듐 설페이트상에서 건조시키고, 진공내에서 농축시켜 조 잔류물을 수득하였다. 조 잔류물을 헥산 중 30 % 에틸 아세테이트를 사용하는 플래쉬 컬럼 크로마토그래피를 통해 정제하여 tert-부틸 (3S)-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트를 수득하였다 (300 mg, 0.607 mmol, 65.0 % 수율). (m/z): C27H35N4O5에 대한 [M+H]+ 계산치 495.26, 실측치 495.06.
제조예 68 : (S)-4-(4-(피롤리딘-3-일메톡시)-1H-벤조[d][1,2,3]트리아졸-6-일)페놀
디옥산 중 4M 히드로클로로산 (10.0 mL, 40 mmol)을 메탄올 (2. mL) 중 ((3S)-3-(((6-(4-히드록시페닐)-1-(테트라히드로-2H-피란-2-일)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-카복실레이트 (230 mg, 0.465 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 5 시간 동안 교반하였다. 반응물을 진공내에서 농축시키고, 생성된 잔류물을 디에틸 에테르로 연화 처리하여 히드로클로라이드 염으로서 (S)-4-(4-(피롤리딘-3-일메톡시)-1H-벤조[d][1,2,3]트리아졸-6-일)페놀을 수득하였다 (225 mg, 0.649 mmol, 85.0 % 수율). (m/z): C17H19N4O2에 대한 [M+H]+ 계산치 311.15, 실측치 311.06.
실시예 23 : (S)-1-(3-(((6-(4-히드록시페닐)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-일)프로프-2-엔-1-온
디이소프로필에틸아민 (0.083 ml, 0.475 mmol)을 0 ℃에서 DMF (0.475 ml) 중 (S)-4-(4-(피롤리딘-3-일메톡시)-1H-벤조[d][1,2,3]트리아졸-6-일)페놀 히드로클로라이드 염 (32.9 mg, 0.095 mmol)의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (7.7 μl, 0.095 mmol)를 첨가한 뒤, 반응 혼합물을 실온에서 15 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 갈색 액체를 수득하였다. 조 액체를 0.05 % 트리플루오로아세트산과 함께 물 중 5-75 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로서 (S)-1-(3-(((6-(4-히드록시페닐)-1H-벤조[d][1,2,3]트리아졸-4-일)옥시)메틸)피롤리딘-1-일)프로프-2-엔-1-온을 수득하였다 (2.5 mg, 0.068 mmol, 7.2 % 수율). (m/z): C20H21N4O3에 대한 [M+H]+ 계산치 365.16, 실측치 365.1.
제조예 69 : 6-브로모-4-플루오로-3-메틸-1-(테트라히드로-2H-피란-2-일)-1H-인다졸
p-톨루엔설폰산 (236 mg, 1.24 mmol)을 디클로로메탄 (41 mL) 중 6-브로모-4-플루오로-3-메틸-1H-인다졸 (2.84 g, 12.4 mmol)의 용액에 첨가한 후, 3,4-디히드로-2H-피란 (3.13 g, 37.2 mmol)을 첨가하고, 반응 혼합물을 실온에서 3 일 동안 교반하였다. 반응 혼합물을 실리카 겔 패드를 통해 여과하고 여액을 진공내에서 농축시켜 6-브로모-4-플루오로-3-메틸-1-(테트라히드로-2H-피란-2-일)-1H-인다졸을 수득하였다 (3.3 g, 10.5 mmol, 85 % 수율). (m/z): C13H14BrFN2NaO에 대한 [M+Na]+ 계산치 335.02, 실측치 335.4.
실시예 24 : (S)-1-(3-((6-(3-클로로-4-히드록시페닐)-3-메틸-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-엔-1-온
미네랄 오일 중 60 중량% 소듐 히드라이드 (319 mg, 7.98 mmol)를 0 ℃에서 DMF (16 mL) 중 (S)-1-boc-3-히드록시피롤리딘 (1.3 g, 6.94 mmol)의 용액에 첨가하고, 반응 혼합물을 실온에서 20 분 동안 교반하였다. 6-브로모-4-플루오로-3-메틸-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (1.00 g, 3.19 mmol)을 첨가하고 반응 혼합물을 실온에서 밤새 교반하였다. 물을 첨가하여 반응을 켄칭하고 혼합물을 진공내에서 농축시켜 조 중간체 tert-부틸 (3S)-3-((6-브로모-3-메틸-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트를 수득하였다.
2:1의 디옥산/물 (9.5 mL) 중 조 tert-부틸 (3S)-3-((6-브로모-3-메틸-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트의 용액에 3-클로로-4-히드록시페닐보론산 (0.484 g, 2.81 mmol) 및 포타슘 포스페이트 삼염기성 (1.19 g, 5.62 mmol)을 첨가하고, 반응 혼합물을 질소로 10 분 동안 기체를 제거시켰다. (2-디시클로헥실포스피노-2',4',6'-트리이소프로필-1,1'-비페닐)[2-(2'-아미노-1,1'-비페닐)]팔라듐(II) 메탄설포네이트, XPhos-G3-팔라다사이클 (95 mg, 0.112 mmol)을 첨가하고 반응 혼합물을 마이크로파 조사하에 110 ℃에서 3 시간 동안 교반하였다. 물을 첨가하고 혼합물을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 추출물을 조합하고 진공내에서 농축시켜 조 중간체 tert-부틸 (3S)-3-((6-(3-클로로-4-히드록시페닐)-3-메틸-1-(테트라히드로-2H-피란)-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트를 수득하였다.
디옥산 중 4.0N HCl (3.75 ml, 15.0 mmol)을 메탄올 (0.5 mL) 중 조 tert-부틸 (3S)-3-((6-(3-클로로-4-히드록시페닐)-3-메틸-1-(테트라히드로-2H-피란-2-일)-1H-인다졸-4-일)옥시)피롤리딘-1-카복실레이트에 첨가하고, 반응 혼합물을 60 ℃에서 30 분 동안 교반하였다. 반응 혼합물을 진공내에서 농축시켜 조 중간체 (S)-2-클로로-4-(3-메틸-4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀을 수득하였다.
N,N-디이소프로필에틸아민 (4.59 ml, 26.3 mmol)을 메틸렌 클로라이드 (3.75 ml) 중 조 중간체 (S)-2-클로로-4-(3-메틸-4-(피롤리딘-3-일옥시)-1H-인다졸-6-일)페놀의 용액에 첨가하고, 이어서 아크릴로일 클로라이드 (60.9 μL, 0.750 mmol)를 첨가하였다. 반응 혼합물을 실온에서 30 분 동안 교반한 다음 진공내에서 농축시켜 조 잔류물을 수득하였다. 조 잔류물을 0.05 % 트리플루오로아세트산과 함께 물 중 0-40 % 아세토니트릴의 구배를 사용하여 분취용 규모 C18 컬럼 크로마토그래피를 통해 정제하여 TFA 염으로 (S)-1-(3-((6-(3-클로로-4-히드록시페닐)-3-메틸-1H-인다졸-4-일)옥시)피롤리딘-1-일)프로프-2-엔-1-온을 수득하였다 (7.6 mg, 0.015 mmol, 0.98 % 수율). (m/z): C21H21ClN3O3에 대한 [M+H]+ 계산치 398.13, 실측치 398.3.
유사한 합성 방법을 사용하여 표 1-12의 화합물을 제조하였다.
표 1
표 2
표 3
표 4
표 5
표 6
표 7
표 8
표9
표 10
표 11
표 12
표 13
표 14
표 15
표16
표 17
표 18
생물학적 분석
본 개시내용의 화합물은 하기 생물학적 분석 중 하나 이상에서 특성 규명되었다.
분석 1 : 생화학적 JAK 및 Tyk2 키나아제 분석
4 개의 LanthaScreen JAK 생화학적 분석 패널 (JAK1, 2, 3 및 Tyk2)을 일반적인 키나아제 반응 완충액 (50mM HEPES, pH 7.5, 0.01 % Brij-35, 10mM MgCl2 및 1mM EGTA)에서 수행하였다. 재조합 GST-태그된 JAK 효소 및 GFP-태그된 STAT1 펩티드 기질은 Life Technologies로부터 입수하였다.
연속적으로 또는 이산적으로 희석된 화합물을 4 개의 JAK 효소 및 기질과 함께 주위 온도에서 1 시간 동안 화이트 384-웰 마이크로플레이트 (Corning)에서 전-배양하였다. 이어서 ATP를 첨가하여 1 % DMSO와 함께 총 부피 10㎕에서 키나아제 반응을 개시하였다. JAK1, 2, 3 및 Tyk2에 대한 최종 효소 농도는 각각 4.2 nM, 0.1 nM, 1 nM 및 0.25 nM이고; 사용된 상응하는 Km ATP 농도는 25 μM, 3 μM, 1.6 μM 및 10 μM 이며; 4 개 분석 모두에 대해 기질 농도는 200 nM이다. TR-FRET 희석 완충액 (Life Technologies)에서 EDTA (10mM 최종 농도) 및 Tb-항-pSTAT1 (pTyr701) 항체 (Life Technologies, 2nM 최종 농도)의 10 μL 물질을 첨가하기 전에 키나아제 반응을 주위 온도에서 1 시간 동안 진행시켰다. EnVision 판독기 (Perkin Elmer)에서 판독하기 전에 플레이트를 주위 온도에서 1 시간 동안 인큐베이션시켰다. 방출 비율 신호 (520 nm/495 nm)를 기록하여 DMSO 및 대조군에 기초하여 억제 백분율 값을 계산하는데 이용하였다.
용량-반응 분석을 위해, 억제 백분율 데이터를 화합물 농도에 대해 플롯팅하고, IC50 값을 프리즘 소프트웨어 (GraphPad Software)를 사용하여 4-파라미터 로버스트 (robust) 적합 모델로부터 결정하였다. 결과는 pIC50 (IC50의 음의 로그)으로 나타낸 후 Cheng-Prusoff 방정식을 사용하여 pKi (해리 상수의 음의 로그, Ki)로 변환되었다.
분석 2: 세포 JAK3 효능 분석: Tall-1 T 세포에서 IL-2 자극된 pSTAT5의 억제
인터루킨-2 (IL-2) 자극된 STAT5 인산화 억제에 대한 시험 화합물의 효능을 AlphaLisa를 사용하여 Tall-1 인간 T 세포주 (DSMZ)에서 측정하였다. IL-2는 JAK3을 통해 신호 전달하기 때문에, 이 분석은 JAK3 세포 효능의 척도를 제공한다.
인산화된 STAT5를 AlphaLISA SureFire Ultra pSTAT5 (Tyr694/699) 키트 (PerkinElmer)를 통해 측정하였다.
Tall-1 세포주로부터의 인간 T 세포를 15 % 열 불활성화된 우태아 혈청 (FBS, Life Technologies), 2mM Glutamax (Life Technologies), 25mM HEPES (Life Technologies) 및 1X Pen/Strep (Life Technologies)가 보충된 RPMI (Life Technologies)에서 37 ℃, 5 % CO2 가습 배양기에서 배양하였다. 화합물을 DMSO에 연속 희석하고 빈 웰에 음향적으로 분배하였다. 분석 배지 (10 % FBS (ATCC)가 보충된 페놀 레드-프리 DMEM (Life Technologies))를 분배하고 (4 μL/웰), 플레이트를 900rpm에서 10 분 동안 진탕시켰다. 세포를 분석 배지 (4 ㎕/웰)에 45,000 세포/웰로 시딩하고, 1 시간 동안 37 ℃, 5 % CO2에서 인큐베이션한 다음, IL-2 (R&D Systems; 최종 농도 300 ng/ml)를 30 분 동안 예열된 분석 배지 (4 μL)에 첨가하였다. 사이토카인 자극 후, 세포를 1x PhosStop 및 컴플리트 정제 (Roche)를 포함하는 6ul의 3x AlphaLisa 용해 완충액 (PerkinElmer)으로 용해시켰다. 용해물을 실온 (RT)에서 900rpm에서 10 분 동안 진탕시켰다. pSTAT5 AlphaLisa 키트 (PerkinElmer)를 통해 인산화된 STAT5를 측정하였다. 새롭게 제조된 수용체 비드 혼합물을 녹색 여과 <100 룩스 광 하에서 용해물 (5μL)에 분배하였다. 플레이트를 900rpm에서 2 분 동안 진탕시키고, 짧게 침전시키고, 실온의 어두운 곳에서 2 시간 동안 인큐베이션하였다. 공여체 비드를 녹색 여과 <100 룩스 광 하에서 분배하였다 (5μL). 플레이트를 900rpm에서 2 분 동안 진탕시키고, 짧게 침전시키고, 실온의 어두운 곳에서 밤새 인큐베이션하였다. 녹색 여과 <100 룩스 광 하에서 EnVision 플레이트 판독기 (PerkinElmer)를 사용하여 689 nm에서 여기시키고 570 nm에서 방출하여 발광성을 측정하였다.
IL-2에 반응하여 시험 화합물의 억제 효능을 결정하기 위해, pSTAT5에 결합된 비드의 평균 방출 강도를 인간 T 세포주에서 측정하였다. 신호 강도 대 화합물 농도의 억제 곡선의 분석으로부터 IC50 값을 결정하였다. 데이터는 pIC50 (음의 10 진 로그 IC50) 값 (평균 ± 표준 편차)으로 표시되었다.
분석 3: 뮤린 비장 세포로부터 분리된 CD4+ T 세포에서 IL-2 자극된 pSTAT5의 억제
인터루킨-2 (IL-2) 자극된 STAT5 인산화 억제에 대한 시험 화합물의 효능을 AlphaLisa를 사용하여 뮤린 비장 세포로부터 분리된 CD4+ T 세포에서 측정하였다. IL-2는 JAK3을 통해 신호 전달하기 때문에, 이 분석은 마우스에서 JAK3 세포 효능의 척도를 제공한다.
인산화된 STAT5를 AlphaLISA SureFire Ultra pSTAT5 (Tyr694/699) 키트 (PerkinElmer)를 통해 측정하였다.
CD4+ T 세포를 자기 컬럼 (Miltnyi Biotec)에서 음성 선택을 통해 뮤린 비장 세포로부터 분리하고 분석 배지 (10 % FBS (ATCC)가 보충된 페놀 레드-프리 DMEM (Life Technologies))에 재현탁시켰다. 분석 배지 (2 ㎕/웰)에서 세포를 50,000 세포/웰로 시딩하였다. 화합물을 DMSO에서 연속 희석하고 분석 배지에서 2x 최종 농도로 희석하였다. 화합물을 첨가하고 (4㎕/웰), 세포를 37 ℃, 5 % CO2에서 1 시간 동안 인큐베이션 한 후, 30분간 예열된 분석 배지 (2 μL)에 IL-2 (R&D Systems; 최종 농도 7ng/ml)를 첨가하였다. 사이토카인 자극 후, 세포를 2μl의 5x AlphaLisa 용해 완충액 (PerkinElmer)으로 용해시켰다. 용해물을 실온 (RT)에서 900rpm에서 10 분 동안 진탕시켰다. pSTAT5 AlphaLisa 키트 (PerkinElmer)를 통해 인산화된 STAT5를 측정하였다. 새롭게 제조된 수용체 비드 혼합물을 녹색 여과 <100 룩스 광 하에서 용해물 (5ul)에 분배하였다. 플레이트를 900rpm에서 2 분 동안 진탕시키고, 짧게 침전시키고, 실온의 어두운 곳에서 2 시간 동안 인큐베이션 하였다. 공여체 비드를 녹색 여과 <100 룩스 광 하에서 분배하였다 (5㎕). 플레이트를 900rpm에서 2 분 동안 진탕시키고, 짧게 침전시키고, 실온의 어두운 곳에서 밤새 인큐베이션 하였다. 녹색 여과 <100 룩스 광 하에서 EnVision 플레이트 판독기 (PerkinElmer)를 사용하여 689 nm에서 여기시키고 570 nm에서 방출하여 발광성을 측정하였다.
IL-2에 반응하여 시험 화합물의 억제 효능을 결정하기 위해, pSTAT5에 결합된 비드의 평균 방출 강도를 뮤린 비장 세포로부터 분리된 1 차 CD4+ T 세포에서 측정하였다. 신호 강도 대 화합물 농도의 억제 곡선의 분석으로부터 IC50 값을 결정하였다. 데이터는 pIC50 (음의 10 진 로그 IC50) 값 (평균 ± 표준 편차)으로 표시되었다.
화합물 1-10, 19, 20, 21 및 22는 모두 이 분석에서 6.0보다 큰 pIC50 값을 가졌다.
분석 4: 인간 PBMC CD4+ T 세포에서 IL-2 자극된 pSTAT5의 억제
인터루킨-2 (IL-2) 자극된 STAT5 인산화 억제에 대한 시험 화합물의 효능을 유세포 분석을 사용하여 인간 말초 혈액 단핵 세포 (PBMC) CD4+ T 세포에서 측정하였다. IL-2는 JAK3을 통해 신호 전달하기 때문에, 이 분석은 인간 1 차 세포에서 JAK3 세포 효능의 척도를 제공한다.
인산화된 STAT5는 CD4+ T 세포에서 pSTAT5 반응을 측정함으로써 (Becton Disckinson, AlexaFluor 647 마우스 항-인간 STAT5 (pY694) 및 PE 마우스 항-인간 CD4) 유세포 분석을 통해 측정되었다.
인간 PBMC를 피콜 구배를 통해 공여자로부터 분리하고 -80 ℃에서 동결시켰다. 냉동 PBMC를 10 % 열 비활성화 우태아 혈청 (FBS, Life Technologies), 2mM Glutamax (Life Technologies), 25mM HEPES (Life Technologies) 및 1X Pen/Strep (Life Technologies)가 보충된 RPMI (Life Technologies)에서 37 ℃, 5 % CO2 가습 배양기에서 1 시간 동안 해동 및 배양하였다. 세포를 4e6 세포/ml (50 μl/웰)로 2 ml 깊은 웰 플레이트에 시딩하였다. 화합물을 DMSO에서 연속 희석하고 분석 배지에서 2x 최종 농도로 희석하였다. 화합물을 첨가하고 (100㎕/웰), 세포를 37 ℃, 5 % CO2에서 1 시간 동안 인큐베이션 한 후, 30 분 동안 예열된 분석 배지 (50 μL/웰)에 IL-2 (R&D Systems; 최종 분석 농도 100ng/ml)를 첨가하였다. 사이토카인 자극 후, 세포를 37 ℃에서 10 분 동안 고정시켰다 (Becton Dickinson). 세포를 세척하고 Dulbecco 포스페이트 완충 식염수 (DPBS, Life Technologies)에 재현탁시켰다. 세포를 빙냉 Perm Buffer III (Becton Dickinson)으로 30 분간 투과시킨 후, 2 % 우태아 혈청 (염색 완충액, Life Technologies)을 포함하는 DPBS로 세척 및 재현탁시켰다. 염색 완충액에서 CD4 표면 마커 (PE 마우스 항-인간 CD4)의 50x 희석 및 pSTAT5 항체 (Becton Disckinson, AlexaFluor 647 마우스 항-인간 STAT5 (pY694))의 5x 희석으로 세포를 1 시간 동안 염색하였다. 4 ℃에서 보관하기 전에 세포를 세척하고 염색 완충액에 재현탁시켰다.
IL-2에 반응하여 시험 화합물의 억제 효능을 결정하기 위해, CD4+ 게이팅된 세포에서 pSTAT5의 중간 형광 강도를 FCS Express 6에서의 분석과 함께 BD LSRII로 인간 PBMC에서 측정하였다. 신호 강도 대 화합물 농도의 억제 곡선 분석으로부터 IC50 값을 측정하였다. 데이터는 pIC50 (음의 10 진 로그 IC50) 값 (평균 ± 표준 편차)으로 표시되었다.
화합물 1-6, 8 및 9를 이 분석에서 시험하였고, 분석 2에서 얻은 값 (Tal-1 T 세포 분석에서 IL-2 자극된 pSTAT5)과 매우 유사한 값을 나타냈다.
분석 5: JAK 세포 독성 분석
CellTiter-Glo 발광 세포 생존성/세포 독성 분석은 BEAS-2B 인간 폐 상피 세포 (ATCC)에서 정상 성장 조건하에 수행되었다.
세포를 10 % FBS (Hyclone), 100 U/mL 페니실린, 100 μg/mL 스트렙토마이신 (Life Technologies) 및 2mM GlutaMAX (Life Technologies)가 보충된 50 % DMEM/50 % F-12 배지 (Life Technologies)에서 37 ℃, 5 % CO2 가습 배양기에서 성장시켰다. 분석 1 일차에, 세포를 25 ㎕ 배지로 백색 384-웰 조직 배양 플레이트 (Corning)에 500 세포/웰 밀도로 시딩하고 배양기에서 밤새 부착시켰다. 분석 2 일차에, 시험 화합물의 용량-반응을 포함하는 5 ㎕의 배지를 첨가하고, 37 ℃에서 48 시간 동안 인큐베이션하였다. 이어서 30㎕의 CellTiter-Glo 검출 용액 (Promega)을 첨가하고, 오비탈 진탕기에서 5 분 동안 혼합하고, 추가 10 분 동안 인큐베이션 한 후 EnVision 판독기에서 판독하였다. 발광 신호를 기록하고 백분율 DMSO 대조군 값을 계산하였다.
용량-반응 분석을 위해, 각 데이터 점을 연결하는 선에 의해 용량-반응 곡선을 도출하기 위해 퍼센트 DMSO 대조군 데이터를 화합물 농도에 대해 플롯팅하였다. 각 곡선이 15 % 억제 임계값을 넘는 농도는 CC15로 정의된다. 결과는 CC15 값인 pCC15의 음의 로그로 나타내었다.
이 분석에서 더 낮은 pCC15 값을 나타내는 시험 화합물은 세포 독성을 유발할 가능성이 적을 것으로 예상된다. 이 분석에서 시험된 본 개시내용의 화합물은 전형적으로 5 내지 약 6의 pCC15 값을 나타냈다.
분석 6: Caco-2 투과 분석
Caco-2 투과 분석을 수행하여 경구 투여 후 시험 화합물이 장을 통과하고 혈류로 들어가는 능력을 모델링하였다. 용액 중의 시험 화합물이 인간 소장 단층의 밀착연접을 모방하도록 설계된 세포 단층에 투과하는 속도를 측정하였다.
CacoReady 24-웰 트랜스웰 플레이트는 ADMEcell (Alameda, CA)로부터 입수하였다. 화합물을 10 mM DMSO 스톡 용액으로부터 5 μM의 농도로 이중으로 평가하였다 (n=2). 시험된 화합물의 수동 투과성은 정점에서 기저측 (A-B) 방향으로 P-gp 수송 단백질을 억제하기 위해 베라파밀 (Verapamil) (25 μM)과 함께 Caco-2 세포 단층을 사용하여 평가되었다. 실험은 37 ℃, 5 % CO2 배양기에서 수행되었다. Caco-2 배양 배지는 표준 여과 DMEM, FCS 10 %, L-글루타민 1 % 및 PenStrep 1 %로 구성되었다. 750 μL의 수송 완충액을 A-B 웰에 첨가하여 기초 분석 플레이트를 제조하였다. 정점 웰로부터 Caco-2 배지를 제거하고 새로운 수송 배지 (총 3 회 세척을 위해 200 μL 반복)로 교체하여 CacoReady™ 플레이트를 제조하였다. 이어서, 블랭크 배지 (200 μL)를 A-B 웰에 대해 희석된 화합물로 교체하였다. 인큐베이션을 시작하기 위해, 기저판을 배양기에서 제거하고 정점 섹션을 그 위에 추가했다. 시간 제로 (t0) 동안 정점 및 기저 구획으로부터 샘플 (40 μL)을 수집하였다. 정점 및 기저 구획으로부터 120 분 (t120) 후에 샘플을 다시 수집하였다. 모든 샘플을 LC-MS/MS에 의한 생분석을 위해 희석하고 제조하였다. cm/sec의 투과 계수 (Kp, B + 베라파밀 파페어런트 (Papparent)에 대한 평균 A)는 dQ (플럭스)/(dt x 면적 x 농도)로 계산되었다.
이 분석에서, 약 5 x 10-6 cm/sec 미만의 Kp 값은 전신 노출을 최소화하고 결장을 표적으로하는 데 유리한 것으로 간주된다. 약 10 x 10-6 cm/sec 미만의 Kp 값은 또한 전신 노출을 최소화하고 결장을 표적으로 하기에 충분할 수 있다. 이에 비해, 체계적으로 이용 가능한 JAK3 억제제인 PF-06651600 (2-프로펜-1-온, 1-[(2S,5R)-2-메틸-5-(7H-피롤로[2,3-d]피리미딘-4)-일아미노)-1-피페리디닐])은 25의 Kp 값을 나타냈다.
인 비트로 (In Vitro)
분석 결과
실시예 1 내지 18 및 표 1 내지 12의 모든 화합물을 상기 기재된 하나 이상의 분석에서 시험하였다.
하기 표 13에서, JAK1, JAK 2, JAK3 및 TYK2 효소 분석의 경우, A는 pKi 값 ≥ 10 (Ki ≤ 0.1 nM)을 나타내고, B는 9와 10 사이의 pKi 값 (1 nM과 0.1 nM 사이의 Ki)을 나타내며, C는 8과 9 사이의 pKi 값 (10 nM과 1 nM 사이의 Ki)을 나타내고, D는 7과 8 사이의 pKi 값 (100 nM과 10 nM 사이의 Ki)을 나타내며, E는 7 이하의 pKi 값 (100 nM 이상의 Ki)을 나타낸다. Tall-1 효능 분석의 경우, A는 pIC50 값 ≥ 7.5 (IC50 ≤ 32nM)를 나타내고, B는 6.7 (포함) 내지 7.5 사이의 pIC50 값 (200nM 내지 32nM 사이의 IC50)을 나타내며, C는 6 내지 6.7 사이의 pIC50 값 (1μM 내지 200nM 사이의 IC50)을 나타낸다. JAK3 (pKi)-JAK1 (pKi) 값의 경우, A는 3 이상의 값을 나타내고, B는 2.3 내지 3의 값을 나타내며, C는 1.8 내지 2.3의 값을 나타낸다. Caco 분석에서, A는 5 x 10-6 cm/초 미만의 값을 나타내고, B는 5 x 10-6 내지 10 x 10-6 cm/초 사이의 값을 나타내며, C는 10 x 10-6 내지 22 x 10-6 cm/초 사이의 값을 나타낸다.
표 13
분석 7: 결장 및 혈장 마우스 약동학
6 마리 수컷 Balb/c 마우스에 PO 투여에 의해 1 % HPMC + 0.1 % 트윈-80에서 10 mg/kg의 화합물을 투여하였다. 용량 투여 후 0.5, 2 및 6 시간에, 동물을 마취시키고, 심장 천자에 의해 말단 혈액 샘플을 수집한 후, 결장 내용물 및 결장 조직을 수집하였다.
혈액 샘플을 K2EDTA에 수집하고 원심 분리 (4 ℃에서 12000 rpm)에 의해 혈장으로 처리될 때까지 습식 얼음 상에 저장하였다. 혈장 샘플을 클러스터 튜브로 옮기고 냉동실 보관 전에 드라이 아이스에 두었다. 각 동물로부터의 결장 내용물을 각각의 말기 혈액 수집 시점에서 수집하였다. 결장 조직을 식염수로 씻어 내고 두드리며 건조시켰다. 결장 및 결장 내용물 조직을 0.1 % 포름산 9:1 (물:조직, v/w)을 포함한 멸균수를 사용하여 균질화 하였다. 균질화된 조직 및 결장 내용물을 클러스터 튜브로 옮기고 냉동실 보관 전에 드라이 아이스에 두었다. 모든 샘플은 분석 표준에 대해 LC/MS/MS를 사용하여 분석되었다.
화합물의 복합 약동학적 파라미터는 Phoenix WinNonlin Version 6 (Certara, St. Louis, MO)을 사용하고 2마리의 동물/시점으로부터의 평균 값을 사용하여 비-구획 분석에 의해 결정되었다. 정량 한계 (BQL) 미만의 혈장 농도의 경우, 측정 가능한 최저 농도 또는 BLOQ (정량 한계 미만)가 사용되었다.
결장 대 혈장 비율은 결장 AUC 대 혈장 AUC의 비율로서 결정되었다. 화합물 1, 2, 3, 4, 6, 7, 8, 21 및 22는 약 1250 초과의 결장 대 혈장 비를 나타냈다. 화합물 9, 5, 19 및 20은 약 200 초과의 결장 대 혈장 비를 나타냈다.
대조적으로, 기준 화합물 (PF-06651600, 전신적으로 이용 가능한 JAK3 억제제) 2-프로펜-1-온, 1-[(2S,5R)-2-메틸-5-(7H-피롤로[2,3-d]피리미딘-4-일아미노)-1-피페리디닐]은 2.8의 결장 대 혈장 비율을 나타냈다.
분석 8:
옥사졸론
-유도 대장염의 마우스 모델
옥사졸론-유도 대장염은 인간 궤양성 대장염과 조직학적으로 유사한 실험 모델이다 (Heller et al. Immunology, 2002, 17, 629-638). Harlan의 성체 BALB/C 마우스를 분석에 사용하였다. 1 일째에, 옥사졸론 (4 %, 150 μL, 4:1 아세톤:올리브 오일 제제) 또는 비히클 용액을 피부 감작을 위해 천천히 적용하기 전에 이소플루란으로 동물을 가볍게 마취시키고, 어깨 사이의 모발을 조심스럽게 제거하였다. 피부 감작 7 일 후에, 마우스를 약 6 시간 전에 금식시키고 케타민/자일라진 주사로 마취시킨 뒤, 옥사졸론 용액으로 채워진 3.5-F 카테터가 장착된 1mL 주사기를 마우스의 결장에 약 4cm 조심스럽게 삽입하였다. 삽입 후, 50 μL의 옥사졸론 용액 (1:1 에탄올:물 제제 중 0.8 %)을 결장 내로 매우 천천히 (주입 펌프를 사용하여 30 초 이상) 주사하였다. 약물 치료 (PO, QD 또는 BID 또는 TID) 또는 비히클은 옥사졸론 직장 내 (IR) 투여 전날에 개시되었다. 옥사졸론 직장 내 투여 2 일 후, 질환은 기준 점수:대변 일관성 점수 (0, 정상; 2, 묽음 (loose); 4, 설사), 심한 출혈 점수 (0, 부존재; 2, 혈액 흔적; 4, 존재); 합산된 대변 점수 끝점 (end point) = 대변 일관성 점수 + 대변 혈액 점수에 따라 각 마우스에 대해 치료-맹검 실험자에 의해 평가되었다.
선택된 화합물을 분석에서 시험하였다. 모델에서의 효능은 비히클 처리된 동물의 점수와 비교하여 합산된 대변 점수 끝점의 통계적으로 유의미한 감소에 의해 입증된다.
화합물 1, 2, 3, 4, 5, 6, 7, 8, 3-11, 5-10, 19, 15-1, 3-55, 3-34, 15-3, 21, 3-80, 3-81, 3-72 및 3-57은 3mg/kg의 용량 (PO, BID)에서의 옥사졸론 모델에서 비히클 처리된 동물과 비교하여 합산된 대변 점수 끝점에서 통계적으로 유의미한 감소를 나타냈다. 화합물 3-113 및 3-74는 1 및 10 mg/kg의 용량 (PO, BID)에서만 옥사졸론 모델에서 비히클 처리된 동물과 비교하여 합산된 대변 점수 끝점에서 통계적으로 유의미한 감소를 나타냈다.
분석 9 : 마우스 비장 자연 살해 (NK) 세포의 면역 억제 효과
마우스 비장 세포의 고갈은 면역 억제 실험 모델이다 (Kudlacz et al., Am. J. of Transplantation, 2004, 4, 51-57). 옥사졸론-유도 대장염 모델 (분석 8)에서 사용된 것과 동일한 치료 패러다임에 따라 마우스 비장 세포 모델에서 선별된 화합물을 평가하였다.
Harlan의 성체 수컷 Balb/C 마우스를 연구에 사용하였다. 시험 화합물 및 Jak3 공유 억제제 표준 2-프로펜-1-온, 1-[(2S,5R)-2-메틸-5-(7H-피롤로[2,3-d]피리미딘-4-일아미노)-1-피페리디닐] (30 mg/kg, BID) 양성 대조군으로서 나이브 (naive) 마우스에 3 일 동안 경구 투여하였다. 마지막 용량 투여 후 4 시간까지 비장을 거둬들이고 세포 아형 염색을 위해 즉시 분쇄하였다. 고정하기 전에, CD19 (FITC; B 세포), CD3e (PE; pan T 세포) 및 CD49e (APC; NK 세포)에 대한 형광단-표지 항체를 각 동물의 비장 세포 샘플과 함께 인큐베이션하여 동시에, 유세포 분석기에서 다중 아형 % 분석을 가능하게 하였다. 각각의 동물에 대한 총 비장 세포의 수를 Scepter™2.0 핸드헬드 자동 세포 계수기로 측정하였다.
림프구 아형 집단 (예를 들어, 비장 B, T 및 NK 세포)의 절대 수는 각 동물에 대한 총 비장 세포의 각 아형의 백분율로부터 계산되었다. Fisher의 LSD 사후 시험과 함께 일원 분산 분석을 사용하여 비히클 및 시험 화합물 그룹의 비장 림프구 수를 비교했다. α 수준은 p<0.05로 설정되었다. 데이터는 각 그룹에 대한 평균 ± SEM으로 제시되었다.
양성 대조군인 PF-06651600은, 전신적으로 이용 가능한 JAK3 억제제 (2-프로펜-1-온, 1-[(2S,5R)-2-메틸-5-(7H-피롤로[2,3-d]피리미딘-4-일아미노)-1-피페리디닐]) (30 mg/kg PO, BID)로서, 비장 NK 세포 수를 유의적으로 감소시켰다. 비장 NK 세포 수는 300 mg/kg 용량 (PO, BID) (시험된 최대 용량)까지 화합물 1에 의해 영향을 받지 않았다. 비장 NK 세포 수는 100 mg/kg 용량 (PO, BID) (시험된 최대 용량)까지 화합물 4, 6 및 8에 의해 영향을 받지 않았다. 비장 NK 세포 수는 85 mg/kg 용량 (PO, BID) (시험된 최대 용량)까지 화합물 3에 의해 영향을 받지 않았다. 비장 NK 세포 수는 30 mg/kg 용량 (PO, BID) (시험된 최대 용량)까지 화합물 2에 의해 영향을 받지 않았다. 비장 NK 세포 수는 80 mg/kg 용량 (PO, BID) (시험된 최대 용량)까지 화합물 5에 의해 영향을 받지 않았다. 시험된 임의의 화합물에 의한 B 및 T 세포 집단에 대해서는 치료 효과가 관찰되지 않았다.
분석 10: 전신 표적 교합 분석: 흉선에서 IL-2 유도된 pSTAT5 유도의 뮤린 모델
IL-2는 과민성 장 질환 (IBD; Guan and Zhang. Mediators Inflamm, 2017; 4810258)과 같은 위장관 질환의 병리생리학에 기초한 중요한 사이토카인이다. IL-2는 Janus 패밀리의 키나아제 (JAK) 구성원, 특히 JAK3을 활성화시키는 세포 표면 수용체에 결합하며, 이는 이어서 STAT5를 인산화하여 추가의 전사 경로를 활성화시킨다. 이 모델에서, IL-2의 용량을 STAT5의 인산화 (pSTAT5)를 유도하기 위해 마우스에 전신적으로 전달한 다음, 끝점으로 측정하였다. 비히클 처리된 것과 비교하여 IL-2 유도된 pSTAT5의 유의한 억제를 나타내지 않는 이 분석에서 시험된 화합물; IL-2 투여된 대조군 동물은 전신 활성이 없음을 나타낸다.
Harlan의 성체 수컷 Balb/c 마우스를 분석에 사용하였다. 동물에게 연구 전날 오후에 그리고 연구하는 날 아침에 경구 위관 영양법 (PO, 단일 용량 연구의 경우 10 또는 30 mg/kg; 용량 반응 연구의 경우 10 - 60 mg/kg)을 통해 시험 화합물을 투여하였다. 두번째 PO 용량 투여 2 시간 후, 마우스에 100㎕의 적절한 IL-2 용량 (IL-2 배치에 따라 총 1 - 5㎍/마우스; R&D Systems)을 복강내 (i.p.) 주사하였다. IL-2 주입 후 90 - 120 분에 흉선 샘플을 거둬들였다. AlphaLISA (AlphaLISA®SureFire®Ultra™ p-STAT5 (Tyr694/699) HV (대용량))를 사용하여 흉선에서 인산화된 STAT5 (pSTAT5) 수준을 측정하였다. 모델에서의 활성은 IL-2 투여 후 1.5 - 2 시간에 처리된 동물의 흉선에 존재하는 pSTAT5의 수준의 유의한 억제의 부족에 의해 입증된다.
화합물 6 및 7을 10mg/kg으로 시험하였고, 비히클 처리된 IL-2 투여 대조군 동물과 비교하여 IL-2 유도된 pSTAT5의 유의한 억제를 나타내지 않았고, 따라서 전신 활성의 부족을 입증하였다. 화합물 1을 10, 30, 60 및 100 mg/kg에서 시험하였고, 비히클과 비교하여 IL-2 유도된 pSTAT5의 유의한 억제를 나타내지 않았다. 화합물 2를 10, 30 및 60 mg/kg에서 시험하였고, 비히클과 비교하여 IL-2 유도된 pSTAT5의 유의한 억제를 나타내지 않았다. 화합물 3을 30 및 100 mg/kg에서 시험하였고, 비히클과 비교하여 IL-2 유도된 pSTAT5의 유의한 억제를 나타내지 않았다. 화합물 8, 5 및 4를 30 mg/kg에서 시험하였고, 비히클과 비교하여 IL-2 유도된 pSTAT5의 유의한 억제를 나타내지 않았다.
대조적으로, 기준 화합물 (전신적으로 이용 가능한 JAK3 억제제인 PF-06651600) 2-프로펜-1-온, 1-[(2S,5R)-2-메틸-5-(7H-피롤로[2,3-d]피리미딘-4-일아미노)-1-피페리디닐]은 10, 30 및 50 mg/kg에서 흉선에서 pSTAT5 유도의 유의한 억제를 나타냈고, 전신 활성을 입증했다.
결정 구조
인간 JAK3에 각각 결합된 화합물 1, 3 및 4에 대해 공-결정 구조를 수득하였다. 복합 구조에 대한 분해능은 화합물 1, 화합물 3 및 화합물 4에 대해 각각 2.73Å, 2.80Å 및 2.64Å였다. 각각의 경우에, 리간드는 ATP 결합 부위에서 결합하는 것으로 관찰되었다. 공여체 및 수용체 원자의 3.5Å 미만의 거리에 기초하여, 각각의 리간드에 대해, 즉 Glu871의 측쇄 원자뿐만 아니라 Glu903, Leu905 및 Phe968의 주쇄 원자에 대해 4 개의 특정 수소 결합이 확인되었다. 화합물 1에 대해 Asp 912의 측쇄 원자에 대한 추가 수소 결합이 확인되었다. 특히, 리간드는 경첩 영역 바로 뒤에 위치한 JAK3의 Cys909에 각각 공유 결합되어 있다. 시스테인 잔기의 S-H 모이어티는 마이클 시스템 (Michael system)에 대한 부가 반응을 수행한다. 결정 구조에서 공유 결합 상호 작용의 관찰된 결과는 JAK3에 대한 이들 리간드 각각에 대한 비가역적 결합 성질을 확인시켜 준다.
본 발명은 특정 양상 또는 구체예를 참조하여 기재되었지만, 본 발명의 진정한 사상 및 범위를 벗어나지 않고 다양한 변경이 이루어질 수 있거나 균등물로 대체될 수 있다는 것이 당업자에게 이해될 것이다. 또한, 적용 가능한 특허 법령 및 규정에 의해 허용되는 한, 본원에 인용된 모든 간행물, 특허 및 특허 출원은 각각의 문서가 본원에서 개별적으로 참조된 것처럼 동일한 정도로 본원에 전체적으로 참조로 포함된다.
Claims (59)
- 하기 화학식 (I)의 화합물 또는 이의 약학적으로 허용가능한 염:
(I)
상기에서 X1 및 X2는 각각 독립적으로 N 및 CH로부터 선택되고;
X3은 N, CH, C-CH3, C-CF3, C-CHF2, C-CH2-O-CH3, C-SMe, C-NMe2, C-NH-CH3, C-Cl, C-CN 및 C-OMe로 이루어진 군으로부터 선택되며;
은
및 로 이루어진 군으로부터 선택되고;
Ra, Rb, Rc 및 Rf는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되며;
Rd, Re, Rg, Rh, Ri, Rj, Rl, Rm, Rn 및 Ro는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되고, 상기 C1-3 알킬기는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있으며;
선택적으로 Rd 및 Re는 결합되어 시클로프로필 고리를 형성할 수 있고;
A는 (a) 하나의 질소 원자를 포함하고 선택적으로 N, S, S(O)2 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 10 원의 모노시클릭 헤테로시클릭기, 및
(b) 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 6 내지 10 원의 멀티시클릭 헤테로시클릭기로 이루어진 군으로부터 선택되며,
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 3 개의 Rk기로 선택적으로 치환되고;
각 Rk는 독립적으로 F, CN, C1-3 알콕시, 시클로프로필 및 C1-3 알킬로 이루어진 군으로부터 선택되며, 상기 C1-3 알킬기는 OH, OMe 또는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있고;
R1은
및 으로 이루어진 군으로부터 선택되며,
상기 Rp 및 Rq는 각각 독립적으로 H, C3-5 시클로알킬 및 C1-6 알킬로 이루어진 군으로부터 선택되고, 상기 C1-6 알킬기는 C1-3 알콕시 및 -S-C1-3 알킬로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환될 수 있거나,
또는 Rp 및 Rq는 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기를 형성하고, 상기 4 내지 6 원의 모노시클릭 헤테로시클릭기는 C1-6 알킬, C1-3 알콕시, -S-C1-3 알킬 및 -C1-3 알킬-C1-3 알콕시로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환되며;
R2는 H, Cl, OMe, Me 및 F로 이루어진 군으로부터 선택되고;
R3은 H 및 F로 이루어진 군으로부터 선택되며;
R4는 H 및 F로 이루어진 군으로부터 선택되고;
R5는 H, Me 및 F로 이루어진 군으로부터 선택된다. - 청구항 1에 있어서, 상기 X3은 CH인 것인 화합물 또는 이의 약학적으로 허용가능한 염.
- 청구항 1 내지 4 중 어느 한 항에 있어서, 상기 A는 아제티딘, 피롤리딘, 피페리딘, 모르폴린, 2-아자스피로[3.3]헵탄, 티오모르폴린 및 노르트로판 (nortropane)으로 이루어진 군으로부터 선택되는 것인 화합물 또는 이의 약학적으로 허용가능한 염.
- 청구항 1 내지 7 중 어느 한 항에 있어서, 상기 X1 및 X2는 모두 CH인 것인 화합물 또는 이의 약학적으로 허용가능한 염.
- 청구항 1 내지 7 중 어느 한 항에 있어서, 상기 X1은 N이고, X2은 CH인 것인 화합물 또는 이의 약학적으로 허용가능한 염.
- 청구항 1 내지 7 중 어느 한 항에 있어서, 상기 X1 및 X2는 모두 N인 것인 화합물 또는 이의 약학적으로 허용가능한 염.
- 청구항 1 내지 7 중 어느 한 항에 있어서, 상기 X1은 CH이고, X2은 N인 것인 화합물 또는 이의 약학적으로 허용가능한 염.
- 청구항 1에 있어서, 하기 화학식 (II)를 갖는 것인 화합물 또는 이의 약학적으로 허용가능한 염:
(II)
상기 X1 및 X2는 모두 CH이거나, 또는 X1 및 X2는 모두 N이거나, 또는 X1은 N이고 X2는 CH이고;
는
및 으로 이루어진 군으로부터 선택되며;
Rc, Rd 및 Re는 각각 독립적으로 H 및 메틸로 이루어진 군으로부터 선택되고;
A는 아제티딘, 피롤리딘, 피페리딘 및 모르폴린으로 이루어진 군으로부터 선택되며;
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 2 개의 Rk기로 선택적으로 치환되며;
각 Rk는 독립적으로 F, CN, 메틸, 에틸 및 C1-2 할로알킬로 이루어진 군으로부터 선택되고;
R1은 또는 이며;
R2는 H, Cl, 및 F으로 이루어진 군으로부터 선택된다. - 청구항 17에 있어서,
상기 Rd 및 Re는 각각 독립적으로 H 및 메틸로 이루어진 군으로부터 선택되고; 선택적으로 Rd 및 Re는 결합되어 시클로프로필 고리를 형성할 수 있으며;
Rk1은 H, F, CN, OMe, 메틸 및 에틸로 이루어진 군으로부터 선택되는 것인 화합물 또는 이의 약학적으로 허용가능한 염. - 청구항 24에 있어서, 상기 분말 X-선 회절 패턴은 7.12±0.20, 10.02±0.20, 11.16±0.20, 17.06±0.20 및 24.43±0.20의 2θ 값에서 추가 회절 피크를 갖는 것을 추가로 특징으로 하는 것인 결정형.
- 청구항 25에 있어서, 상기 분말 X-선 회절 패턴은 13.10±0.20, 14.82±0.20, 16.55±0.20, 20.08±0.20, 21.08±0.20, 21.65±0.20, 22.51±0.20, 22.98±0.20, 25.02±0.20, 25.72±0.20, 26.80±0.20, 27.06±0.20, 28.31±0.20, 30.08±0.20, 30.31±0.20 및 32.08±0.20으로부터 선택된 2θ 값에서 2 개 이상의 추가 회절 피크를 갖는 것을 특징으로 하는 것인 결정형.
- 청구항 24에 있어서, 상기 결정형은 피크 위치가 도 1에 나타낸 패턴의 피크 위치와 실질적으로 일치하는 분말 X-선 회절 패턴을 특징으로 하는 것인 결정형.
- 청구항 24에 있어서, 상기 결정형은 162.9±3 ℃에서 피크를 갖는 흡열성 열 흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 하는 것인 결정형.
- 청구항 24에 있어서, 상기 결정형은 도 2에 나타낸 것과 실질적으로 일치하는 시차 주사 열량 측정 트레이스를 특징으로 하는 것인 결정형.
- 청구항 30에 있어서, 상기 분말 X-선 회절 패턴은 4.82±0.20, 15.69±0.20 및 16.19±0.20의 2θ 값에서 추가 회절 피크를 갖는 것을 추가로 특징으로 하는 것인 결정형.
- 청구항 31에 있어서, 상기 분말 X-선 회절 패턴은 11.92±0.20, 12.98±0.20, 13.23±0.20, 16.45±0.20, 16.67±0.20, 19.39±0.20, 19.96±0.20, 20.14±0.20, 22.14±0.20, 23.84±0.20, 24.06±0.20, 24.29±0.20, 25.31±0.20, 25.63±0.20, 27.06±0.20, 27.31±0.20, 30.10±0.20 및 30.53±0.20으로부터 선택된 2θ 값에서 2 개 이상의 추가 회절 피크를 갖는 것을 특징으로 하는 것인 결정형.
- 청구항 30에 있어서, 상기 결정형은 피크 위치가 도 9에 나타낸 패턴의 피크 위치와 실질적으로 일치하는 분말 X-선 회절 패턴을 특징으로 하는 것인 결정형.
- 청구항 30에 있어서, 상기 결정형은 201.3 ℃±2 ℃에서의 피크를 갖는 흡열성 열 흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 하는 것인 결정형.
- 청구항 30에 있어서, 상기 결정형은 198 ℃ 내지 204 ℃의 온도에서 흡열성 열 흐름에서 최대값을 나타내는, 분당 10 ℃의 가열 속도로 기록된 시차 주사 열량 측정 트레이스를 특징으로 하는 것인 결정형.
- 청구항 30에 있어서, 상기 결정형은 도 10에 나타낸 것과 실질적으로 일치하는 시차 주사 열량 측정 트레이스를 특징으로 하는 것인 결정형.
- 청구항 1 내지 23 항 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 청구항 24 내지 36 중 어느 한 항의 결정형 및 약학적으로 허용가능한 담체를 포함하는 것인 약학적 조성물.
- 청구항 37에 있어서, 위장관 염증성 질환을 치료하는데 유용한 하나 이상의 다른 치료제를 추가로 포함하는 것인 약학적 조성물.
- 포유 동물에서 위장관 염증성 질환의 치료에 사용하기 위한, 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 청구항 24 내지 36 중 어느 한 항의 결정형.
- 청구항 39에 있어서, 상기 위장관 염증성 질환은 면역 체크 포인트 억제제 유도 대장염, CTLA-4 억제제 유도 대장염, 이식편 대 숙주 질환 관련 대장염, 셀리악병 (celiac disease), 콜라겐성 대장염, 림프구성 대장염, 베체트병 (Behcet's disease), 회장염 (ileitis), 호산구성 식도염 및 감염성 대장염으로 이루어진 군으로부터 선택되는 것인 화합물 또는 이의 약학적으로 허용가능한 염, 또는 결정형.
- 청구항 39에 있어서, 상기 위장관 염증성 질환은 궤양성 대장염인 것인 화합물 또는 이의 약학적으로 허용가능한 염, 또는 결정형.
- 청구항 39에 있어서, 상기 위장관 염증성 질환은 크론병인 것인 화합물 또는 이의 약학적으로 허용가능한 염, 또는 결정형.
- 청구항 39에 있어서, 위장관 염증성 질환을 치료하는데 유용한 하나 이상의 다른 치료제와 조합하여 사용하기 위한 것인 화합물 또는 이의 약학적으로 허용가능한 염, 또는 결정형.
- 포유 동물에서 위장관 염증성 질환 치료용 의약의 제조를 위한, 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 청구항 24 내지 36 중 어느 한 항의 결정형의 용도.
- 청구항 44에 있어서, 상기 위장관 염증성 질환은 면역 체크 포인트 억제제 유도 대장염, CTLA-4 억제제-유도 대장염, 이식편 대 숙주 질환 관련 대장염, 셀리악병, 콜라겐성 대장염, 림프구성 대장염, 베체트병, 회장염, 호산구성 식도염 및 감염성 대장염으로 이루어진 군으로부터 선택되는 것인 용도.
- 청구항 44에 있어서, 상기 위장관 염증성 질환은 궤양성 대장염인 것인 용도.
- 청구항 44에 있어서, 상기 위장관 염증성 질환은 크론병인 것인 용도.
- 포유 동물에서 염증성 피부 질환의 치료에 사용하기 위한, 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염.
- 피부 T-세포 림프종의 치료에 사용하기 위한, 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염.
- 포유 동물에서 염증성 피부 질환 치료용 의약의 제조를 위한, 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 청구항 24 내지 36 중 어느 한 항의 결정형의 용도.
- 피부 T-세포 림프종 치료용 의약의 제조를 위한, 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 청구항 24 내지 36 중 어느 한 항의 결정형의 용도.
- 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염, 또는 청구항 24 내지 36 중 어느 한 항의 결정형, 및 약학적으로 허용가능한 담체를 포유 동물에게 투여하는 단계를 포함하는, 포유 동물에서 위장관 염증성 질환을 치료하는 방법.
- 청구항 52에 있어서, 상기 방법은 위장관 염증성 질환을 치료하는데 유용한 하나 이상의 다른 치료제를 투여하는 단계를 추가로 포함하는 것인 방법.
- 청구항 52에 있어서, 상기 위장관 염증성 질환은 면역 체크 포인트 억제제 유도 대장염, CTLA-4 억제제-유도 대장염, 이식편 대 숙주 질환 관련 대장염, 셀리악병, 콜라겐성 대장염, 림프구성 대장염, 베체트병, 회장염, 호산구성 식도염 및 감염성 대장염으로 이루어진 군으로부터 선택되는 것인 방법.
- 청구항 52에 있어서, 상기 위장관 염증성 질환은 궤양성 대장염인 것인 방법.
- 청구항 52에 있어서, 상기 위장관 염증성 질환은 크론병인 것인 방법.
- 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염을 포함하는 약학적 조성물을 포유 동물의 피부에 적용하는 단계를 포함하는, 포유 동물에서 염증성 피부 질환을 치료하는 방법.
- 청구항 1 내지 23 중 어느 한 항의 화합물 또는 이의 약학적으로 허용가능한 염을 포함하는 약학적 조성물을 포유 동물의 피부에 적용하는 단계를 포함하는, 포유 동물에서 피부 T-세포 림프종을 치료하는 방법.
- 하기 화학식 (I)의 화합물 또는 이의 약학적으로 허용가능한 염을 제조하는 방법으로서:
(I)
상기에서 X1 및 X2는 각각 독립적으로 N 및 CH로부터 선택되고;
X3은 N, CH, C-CH3, C-CF3, C-CHF2, C-CH2-O-CH3, C-SMe, C-NMe2, C-NH-CH3, C-Cl, C-CN 및 C-OMe로 이루어진 군으로부터 선택되며;
은
및 로 이루어진 군으로부터 선택되고;
Ra, Rb, Rc 및 Rf는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되며;
Rd, Re, Rg, Rh, Ri, Rj, Rl, Rm, Rn 및 Ro는 각각 독립적으로 H 및 C1-3 알킬로 이루어진 군으로부터 선택되고, 상기 C1-3 알킬기는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있으며;
선택적으로 Rd 및 Re는 결합되어 시클로프로필 고리를 형성할 수 있고;
A는 (a) 하나의 질소 원자를 포함하고 선택적으로 N, S, S(O)2 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 10 원의 모노시클릭 헤테로시클릭기, 및
(b) 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 6 내지 10 원의 멀티시클릭 헤테로시클릭기로 이루어진 군으로부터 선택되며,
상기 L은 A의 탄소 원자에 연결되고, A는 1 내지 3 개의 Rk기로 선택적으로 치환되고;
각 Rk는 독립적으로 F, CN, C1-3 알콕시, 시클로프로필 및 C1-3 알킬로 이루어진 군으로부터 선택되며, 상기 C1-3 알킬기는 OH, OMe 또는 1 내지 3 개의 할로겐으로 선택적으로 치환될 수 있고;
R1은
및 으로 이루어진 군으로부터 선택되며,
상기 Rp 및 Rq는 각각 독립적으로 H, C3-5 시클로알킬 및 C1-6 알킬로 이루어진 군으로부터 선택되고, 상기 C1-6 알킬기는 C1-3 알콕시 및 -S-C1-3 알킬로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환될 수 있거나,
또는 Rp 및 Rq는 하나의 질소 원자를 포함하고 선택적으로 N, S 및 O로부터 선택된 하나의 추가적인 헤테로 원자를 포함하는 4 내지 6 원의 모노시클릭 헤테로시클릭기를 형성하고, 상기 4 내지 6 원의 모노시클릭 헤테로시클릭기는 C1-6 알킬, C1-3 알콕시, -S-C1-3 알킬 및 -C1-3 알킬-C1-3 알콕시로 이루어진 군으로부터 독립적으로 선택된 1 내지 3 개의 치환기로 선택적으로 치환되며;
R2는 H, Cl, OMe, Me 및 F로 이루어진 군으로부터 선택되고;
R3은 H 및 F로 이루어진 군으로부터 선택되며;
R4는 H 및 F로 이루어진 군으로부터 선택되고;
R5는 H, Me 및 F로 이루어진 군으로부터 선택되며,
상기 방법은 화학식 (I)의 화합물 또는 이의 약학적으로 허용가능한 염을 제공하기 위해 하기 화학식 (III)의 화합물을 (i) Cl-R1 또는 (ii) HO-R1과 반응시키는 단계 및 선택적으로 약학적으로 허용가능한 염을 형성하는 단계를 포함하는 것인 방법:
(III) .
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762539642P | 2017-08-01 | 2017-08-01 | |
| US62/539,642 | 2017-08-01 | ||
| PCT/US2018/044508 WO2019027960A1 (en) | 2017-08-01 | 2018-07-31 | BICYCLIC PYRAZOLO AND TRIAZOLO COMPOUNDS AS JAK KINASE INHIBITORS |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200036004A true KR20200036004A (ko) | 2020-04-06 |
Family
ID=63209687
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207005956A KR20200036004A (ko) | 2017-08-01 | 2018-07-31 | Jak 키나아제 억제제로서 피라졸로 및 트리아졸로 비시클릭 화합물 |
Country Status (23)
| Country | Link |
|---|---|
| US (4) | US10392368B2 (ko) |
| EP (1) | EP3652169A1 (ko) |
| JP (2) | JP7098716B2 (ko) |
| KR (1) | KR20200036004A (ko) |
| CN (1) | CN111032646B (ko) |
| AR (1) | AR112348A1 (ko) |
| AU (1) | AU2018312349A1 (ko) |
| BR (1) | BR112020002265A2 (ko) |
| CA (1) | CA3069990A1 (ko) |
| CL (1) | CL2020000283A1 (ko) |
| CO (1) | CO2020001469A2 (ko) |
| EA (1) | EA038912B1 (ko) |
| IL (1) | IL272031A (ko) |
| MA (1) | MA49570A (ko) |
| MX (1) | MX2020001170A (ko) |
| MY (1) | MY200629A (ko) |
| PE (1) | PE20201028A1 (ko) |
| PH (1) | PH12020500201A1 (ko) |
| SG (1) | SG11202000602YA (ko) |
| TW (1) | TW201920150A (ko) |
| UA (1) | UA125318C2 (ko) |
| WO (1) | WO2019027960A1 (ko) |
| ZA (1) | ZA202000561B (ko) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MY200629A (en) | 2017-08-01 | 2024-01-06 | Theravance Biopharma R&D Ip Llc | Pyrazolo and triazolo bicyclic compounds as jak kinase inhibitors |
| EP3914348A1 (en) * | 2019-01-23 | 2021-12-01 | Theravance Biopharma R&D IP, LLC | Imidazo[1,5-a]pyridine, 1,2,4-triazolo[4,3-a]pyridine and imidazo[1,5-a]pyrazine as jak inhibitors |
| US11471442B2 (en) | 2020-05-14 | 2022-10-18 | Theravance Biopharma R&D Ip, Llc | Administration of gut-selective JAK3 inhibitor |
| WO2022033544A1 (zh) * | 2020-08-13 | 2022-02-17 | 广东东阳光药业有限公司 | 取代的杂芳基化合物及其组合物和用途 |
| WO2022053000A1 (zh) * | 2020-09-10 | 2022-03-17 | 四川海思科制药有限公司 | 一种碳环酰胺衍生物及其在医药上的应用 |
| WO2022199599A1 (zh) * | 2021-03-23 | 2022-09-29 | 凯复(苏州)生物医药有限公司 | 丙烯酰基取代的化合物、包含其的药物组合物及其用途 |
| JP2024514090A (ja) * | 2021-03-29 | 2024-03-28 | ブリストル-マイヤーズ スクイブ カンパニー | 6-(シクロプロパンカルボキサミド)-4-((2-メトキシ-3-(1-メチル-1h-1,2,4-トリアゾール-3-イル)フェニル)アミノ)-n-(メチル-d3)ピリダジン-3-カルボキサミドの結晶形態 |
| CN113061137B (zh) * | 2021-04-02 | 2022-08-02 | 广西医科大学 | 含氮杂环衍生物或其药学上可接受的盐和用途 |
| TW202308610A (zh) * | 2021-05-03 | 2023-03-01 | 美商英塞特公司 | 用於治療結節性癢疹之jak1途徑抑制劑 |
| CN116332961A (zh) * | 2021-12-23 | 2023-06-27 | 广东东阳光药业有限公司 | 取代的杂芳基化合物及其组合物和用途 |
| WO2023165562A1 (zh) * | 2022-03-02 | 2023-09-07 | 南京明德新药研发有限公司 | 含氮杂环类化合物及其应用 |
| GB202213164D0 (en) | 2022-09-08 | 2022-10-26 | Cambridge Entpr Ltd | Novel compounds, compositions and therapeutic uses thereof |
| GB202213163D0 (en) | 2022-09-08 | 2022-10-26 | Cambridge Entpr Ltd | Novel compounds, compositions and therapeutic uses thereof |
Family Cites Families (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| HUP0303801A2 (hu) | 2001-04-20 | 2004-03-01 | Wyeth | Heterociklusos alkoxi-, alkil-tio- és alkil-amino-benzazol-származékok, mint 5-hidroxi-triptamin-6 ligandumok, eljárás az előállításukra és ezeket tartalmazó gyógyszerkészítmények |
| FR2836915B1 (fr) | 2002-03-11 | 2008-01-11 | Aventis Pharma Sa | Derives d'aminoindazoles, procede de preparation et intermediaires de ce procede a titre de medicaments et compositions pharmaceutiques les renfermant |
| US20030139427A1 (en) * | 2002-08-23 | 2003-07-24 | Osi Pharmaceuticals Inc. | Bicyclic pyrimidinyl derivatives and methods of use thereof |
| CA2526430C (en) | 2003-05-22 | 2012-07-10 | Abbott Laboratories | Indazole, benzisoxazole, and benzisothiazole kinase inhibitors |
| EP1647549A1 (en) | 2004-10-14 | 2006-04-19 | Laboratoire Theramex | Indazoles, benzisoxazoles and benzisothiazoles as estrogenic agents |
| US20070104780A1 (en) | 2005-10-25 | 2007-05-10 | Lipari John M | Formulation comprising a drug of low water solubility and method of use thereof |
| US20090247554A1 (en) | 2006-03-30 | 2009-10-01 | Takeda San Diego, Inc. | Kinase inhibitors |
| KR100834758B1 (ko) | 2006-07-05 | 2008-06-05 | 삼성전자주식회사 | 컴퓨터 시스템 보안 장치 및 방법 |
| JP2009007342A (ja) | 2007-06-01 | 2009-01-15 | Mitsubishi Tanabe Pharma Corp | 医薬組成物 |
| US8648069B2 (en) | 2007-06-08 | 2014-02-11 | Abbvie Inc. | 5-substituted indazoles as kinase inhibitors |
| EP2280705B1 (en) | 2008-06-05 | 2014-10-08 | Glaxo Group Limited | Novel compounds |
| ES2383246T3 (es) | 2008-06-05 | 2012-06-19 | Glaxo Group Limited | 4-amino-indazoles |
| US8658635B2 (en) | 2008-06-05 | 2014-02-25 | Glaxosmithkline Intellectual Property Development Limited | Benzpyrazol derivatives as inhibitors of PI3 kinases |
| WO2010012121A1 (zh) | 2008-07-28 | 2010-02-04 | 江苏国华投资有限公司 | 芳烷基哌啶(嗪)衍生物及其在治疗精神分裂症中的应用 |
| TW201111385A (en) | 2009-08-27 | 2011-04-01 | Biocryst Pharm Inc | Heterocyclic compounds as janus kinase inhibitors |
| FR2951172B1 (fr) | 2009-10-13 | 2014-09-26 | Pf Medicament | Derives pyrazolopyridines en tant qu'agent anticancereux |
| WO2011067365A1 (en) | 2009-12-03 | 2011-06-09 | Glaxo Group Limited | Benzpyrazole derivatives as inhibitors of p13 kinases |
| JP2013512878A (ja) | 2009-12-03 | 2013-04-18 | グラクソ グループ リミテッド | 新規化合物 |
| TW201200518A (en) | 2010-03-10 | 2012-01-01 | Kalypsys Inc | Heterocyclic inhibitors of histamine receptors for the treatment of disease |
| PL2635299T3 (pl) | 2010-11-02 | 2020-03-31 | The Trustees Of Columbia University In The City Of New York | Sposoby leczenia zaburzeń utraty włosów |
| US8846712B2 (en) | 2011-09-12 | 2014-09-30 | Sanofi | 6-(4-hydroxy-phenyl)-3-styryl-1H-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| WO2013037390A1 (en) | 2011-09-12 | 2013-03-21 | Sanofi | 6-(4-hydroxy-phenyl)-3-styryl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| EP2567959B1 (en) | 2011-09-12 | 2014-04-16 | Sanofi | 6-(4-hydroxy-phenyl)-3-styryl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| CN102993201A (zh) * | 2011-09-14 | 2013-03-27 | 赛诺菲 | 作为激酶抑制剂的6-(4-羟基-苯基)-3-苯乙烯基-1H-吡唑并[3,4-b]吡啶-4-羧酸酰胺衍生物 |
| EP2760862B1 (en) | 2011-09-27 | 2015-10-21 | Sanofi | 6-(4-hydroxy-phenyl)-3-alkyl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| US20130102601A1 (en) | 2011-10-21 | 2013-04-25 | F. Hoffmann-La Roche Ltd | Pyrimidin-4-one derivatives and their use in the treatment, amelioration or prevention of a viral disease |
| WO2013060636A1 (en) | 2011-10-25 | 2013-05-02 | Sanofi | 6-(4-hydroxy-phenyl)-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| WO2013085802A1 (en) * | 2011-12-06 | 2013-06-13 | Merck Sharp & Dohme Corp. | Pyrrolopyrimidines as janus kinase inhibitors |
| US8377946B1 (en) * | 2011-12-30 | 2013-02-19 | Pharmacyclics, Inc. | Pyrazolo[3,4-d]pyrimidine and pyrrolo[2,3-d]pyrimidine compounds as kinase inhibitors |
| DK2830662T3 (da) | 2012-03-29 | 2019-01-02 | Univ Columbia | Fremgangsmåder til behandlng af hårtabsforstyrrelser |
| EP2847191B1 (en) * | 2012-05-09 | 2016-06-15 | Sanofi | Substituted 6-(4-hydroxy-phenyl)-1h-pyrazolo[3,4-b]pyridine derivatives as kinase inhibitors |
| TWI629275B (zh) * | 2013-03-13 | 2018-07-11 | 賽諾菲公司 | N-(4-(氮雜吲唑-6-基)-苯基)-磺醯胺及其作為醫藥之用途 |
| JP2016113366A (ja) * | 2013-03-29 | 2016-06-23 | 大鵬薬品工業株式会社 | アセトアミド基を有する1,2,4−トリアジン−6−カルボキサミド誘導体 |
| CN107417684A (zh) | 2013-12-05 | 2017-12-01 | 辉瑞公司 | 杂环丙烯酰胺 |
| EP3097091A1 (en) | 2014-01-24 | 2016-11-30 | AbbVie Inc. | 6-phenyl- or 6-(pyridin-3-yl)indazole derivatives and methods of use |
| EP3110820B1 (en) * | 2014-02-28 | 2022-04-06 | Nimbus Lakshmi, Inc. | Tyk2 inhibitors and uses thereof |
| EP3143021B1 (en) | 2014-05-14 | 2019-06-12 | Pfizer Inc | Pyrazolopyridines and pyrazolopyrimidines |
| US10519160B2 (en) | 2014-07-18 | 2019-12-31 | The General Hospital Corporation | Imaging agents for neural flux |
| US10590086B2 (en) | 2014-11-03 | 2020-03-17 | Iomet Pharma Ltd. | Pharmaceutical compound |
| CN105837574B (zh) | 2015-02-02 | 2018-03-02 | 四川大学 | N‑(3‑哌啶基)‑芳香胺衍生物及其制备方法和用途 |
| JP6761815B2 (ja) * | 2015-05-01 | 2020-09-30 | ファイザー・インク | ピロロ[2,3−d]ピリミジニル、ピロロ[2,3−b]ピラジニル、ピロロ[2,3−b]ピリジニルアクリルアミド、およびそのエポキシド |
| CN107847428A (zh) | 2015-05-07 | 2018-03-27 | 纽约市哥伦比亚大学理事会 | 用于促进毛发生长的方法和组合物 |
| PT3712152T (pt) | 2015-11-03 | 2021-04-15 | Topivert Pharma Ltd | Derivados de 4,5,6,7-tetrahidro-1h-imidazo[4,5-c]piridina e 1,4,5,6,7,8-hexahidroimidazo[4,5-d]azepina como inibidores de janus quinase |
| US10973913B2 (en) | 2016-02-16 | 2021-04-13 | Washington University | JAK inhibitors and uses thereof |
| MX2021009378A (es) | 2016-06-30 | 2022-06-29 | Daewoong Pharmaceutical Co Ltd | Derivados de pirazolopirimidina como inhibidor de cinasa. |
| WO2018049174A1 (en) | 2016-09-08 | 2018-03-15 | Synergistic Therapeutics, Llc | Topical hair growth formulation |
| AU2017345736B2 (en) | 2016-10-21 | 2022-04-07 | Takeda Pharmaceutical Company Limited | TYK2 inhibitors and uses thereof |
| US20180117148A1 (en) | 2016-10-28 | 2018-05-03 | Andrew J. Holman | Compounds, pharmaceutical compositions and methods of treatments of immune related diseases and disorders |
| KR102032418B1 (ko) * | 2017-06-15 | 2019-10-16 | 한국화학연구원 | 접합 피리미딘 유도체, 이의 제조방법 및 이를 유효성분으로 포함하는 브루톤티로신 키나제 활성 관련 질환의 예방 또는 치료용 약학적 조성물 |
| MY200629A (en) | 2017-08-01 | 2024-01-06 | Theravance Biopharma R&D Ip Llc | Pyrazolo and triazolo bicyclic compounds as jak kinase inhibitors |
| MX2020004946A (es) | 2017-11-03 | 2020-09-25 | Aclaris Therapeutics Inc | Inhibidores jak de pirrolopiridina sustituidos y metodos para producir y utilizar los mismos. |
| KR102577241B1 (ko) | 2017-12-28 | 2023-09-11 | 주식회사 대웅제약 | 카이네이즈 저해제로서의 아미노-플루오로피페리딘 유도체 |
| KR102577242B1 (ko) | 2017-12-28 | 2023-09-11 | 주식회사 대웅제약 | 카이네이즈 저해제로서의 아미노-메틸피페리딘 유도체 |
| CA3084962C (en) | 2017-12-28 | 2022-08-09 | Daewoong Pharmaceutical Co., Ltd. | Oxy-fluoropiperidine derivatives as kinase inhibitor |
| EP3914348A1 (en) * | 2019-01-23 | 2021-12-01 | Theravance Biopharma R&D IP, LLC | Imidazo[1,5-a]pyridine, 1,2,4-triazolo[4,3-a]pyridine and imidazo[1,5-a]pyrazine as jak inhibitors |
| US11471442B2 (en) * | 2020-05-14 | 2022-10-18 | Theravance Biopharma R&D Ip, Llc | Administration of gut-selective JAK3 inhibitor |
-
2018
- 2018-07-31 MY MYPI2020000251A patent/MY200629A/en unknown
- 2018-07-31 TW TW107126579A patent/TW201920150A/zh unknown
- 2018-07-31 MX MX2020001170A patent/MX2020001170A/es unknown
- 2018-07-31 US US16/050,227 patent/US10392368B2/en active Active
- 2018-07-31 SG SG11202000602YA patent/SG11202000602YA/en unknown
- 2018-07-31 MA MA049570A patent/MA49570A/fr unknown
- 2018-07-31 AR ARP180102151 patent/AR112348A1/es unknown
- 2018-07-31 EP EP18755621.2A patent/EP3652169A1/en not_active Withdrawn
- 2018-07-31 WO PCT/US2018/044508 patent/WO2019027960A1/en unknown
- 2018-07-31 CA CA3069990A patent/CA3069990A1/en not_active Abandoned
- 2018-07-31 BR BR112020002265-9A patent/BR112020002265A2/pt not_active Application Discontinuation
- 2018-07-31 CN CN201880050675.3A patent/CN111032646B/zh active Active
- 2018-07-31 AU AU2018312349A patent/AU2018312349A1/en not_active Abandoned
- 2018-07-31 UA UAA202001352A patent/UA125318C2/uk unknown
- 2018-07-31 EA EA202090413A patent/EA038912B1/ru unknown
- 2018-07-31 PE PE2020000171A patent/PE20201028A1/es unknown
- 2018-07-31 KR KR1020207005956A patent/KR20200036004A/ko not_active Application Discontinuation
- 2018-07-31 JP JP2020505224A patent/JP7098716B2/ja active Active
-
2019
- 2019-06-28 US US16/456,179 patent/US10538513B2/en active Active
- 2019-11-19 US US16/688,109 patent/US10968205B2/en active Active
-
2020
- 2020-01-14 IL IL272031A patent/IL272031A/en unknown
- 2020-01-27 PH PH12020500201A patent/PH12020500201A1/en unknown
- 2020-01-28 ZA ZA2020/00561A patent/ZA202000561B/en unknown
- 2020-01-31 CL CL2020000283A patent/CL2020000283A1/es unknown
- 2020-02-11 CO CONC2020/0001469A patent/CO2020001469A2/es unknown
-
2021
- 2021-02-22 US US17/249,128 patent/US20220119369A1/en not_active Abandoned
- 2021-03-17 JP JP2021043173A patent/JP2021098751A/ja not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| MX2020001170A (es) | 2020-03-12 |
| US10392368B2 (en) | 2019-08-27 |
| EP3652169A1 (en) | 2020-05-20 |
| US20190040043A1 (en) | 2019-02-07 |
| US10968205B2 (en) | 2021-04-06 |
| CN111032646B (zh) | 2023-01-03 |
| MA49570A (fr) | 2020-05-20 |
| WO2019027960A1 (en) | 2019-02-07 |
| MY200629A (en) | 2024-01-06 |
| JP7098716B2 (ja) | 2022-07-11 |
| JP2021098751A (ja) | 2021-07-01 |
| BR112020002265A2 (pt) | 2020-07-28 |
| EA202090413A1 (ru) | 2020-06-24 |
| US20220119369A1 (en) | 2022-04-21 |
| EA038912B1 (ru) | 2021-11-09 |
| CN111032646A (zh) | 2020-04-17 |
| PH12020500201A1 (en) | 2020-10-12 |
| PE20201028A1 (es) | 2020-10-05 |
| TW201920150A (zh) | 2019-06-01 |
| ZA202000561B (en) | 2022-04-28 |
| CO2020001469A2 (es) | 2020-05-29 |
| US20190315724A1 (en) | 2019-10-17 |
| US10538513B2 (en) | 2020-01-21 |
| IL272031A (en) | 2020-03-31 |
| UA125318C2 (uk) | 2022-02-16 |
| CA3069990A1 (en) | 2019-02-07 |
| JP2020529987A (ja) | 2020-10-15 |
| CL2020000283A1 (es) | 2020-06-12 |
| AR112348A1 (es) | 2019-10-16 |
| US20200216423A1 (en) | 2020-07-09 |
| SG11202000602YA (en) | 2020-02-27 |
| AU2018312349A1 (en) | 2020-02-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20200036004A (ko) | Jak 키나아제 억제제로서 피라졸로 및 트리아졸로 비시클릭 화합물 | |
| US11780852B2 (en) | Methods for treating Crohn's disease using 3-((1R,3s,5S)-3-((7-((5-methyl-1H-pyrazol-3-yl)amino)-1,6-naphthyridin-5-yl)amino)-8-azabicyclo[3.2.1]octan-8-yl)propanenitrile | |
| KR20190002591A (ko) | Jak 키나제 저해제로서 피리미딘 화합물 | |
| US11339160B2 (en) | Imidazole and triazole containing bicyclic compounds as JAK inhibitors | |
| US20240132520A1 (en) | Naphthyridine compounds as jak kinase inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITB | Written withdrawal of application |