KR20170100039A - 사이토메갈로바이러스 항원 및 이의 용도 - Google Patents
사이토메갈로바이러스 항원 및 이의 용도 Download PDFInfo
- Publication number
- KR20170100039A KR20170100039A KR1020177023123A KR20177023123A KR20170100039A KR 20170100039 A KR20170100039 A KR 20170100039A KR 1020177023123 A KR1020177023123 A KR 1020177023123A KR 20177023123 A KR20177023123 A KR 20177023123A KR 20170100039 A KR20170100039 A KR 20170100039A
- Authority
- KR
- South Korea
- Prior art keywords
- leu
- protein
- fragment
- complex
- pro
- Prior art date
Links
- 241000701022 Cytomegalovirus Species 0.000 title claims abstract description 128
- 239000000427 antigen Substances 0.000 title description 22
- 102000036639 antigens Human genes 0.000 title description 22
- 108091007433 antigens Proteins 0.000 title description 22
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 195
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 193
- 239000012634 fragment Substances 0.000 claims description 161
- 230000035772 mutation Effects 0.000 claims description 95
- 108091005804 Peptidases Proteins 0.000 claims description 59
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 claims description 59
- 239000004365 Protease Substances 0.000 claims description 58
- 239000000203 mixture Substances 0.000 claims description 51
- 125000000539 amino acid group Chemical group 0.000 claims description 49
- 102000039446 nucleic acids Human genes 0.000 claims description 39
- 108020004707 nucleic acids Proteins 0.000 claims description 39
- 150000007523 nucleic acids Chemical class 0.000 claims description 39
- 241000700605 Viruses Species 0.000 claims description 23
- 238000003776 cleavage reaction Methods 0.000 claims description 23
- 230000007017 scission Effects 0.000 claims description 23
- 230000028993 immune response Effects 0.000 claims description 22
- 241000701074 Human alphaherpesvirus 2 Species 0.000 claims description 20
- 230000002163 immunogen Effects 0.000 claims description 20
- 241001529453 unidentified herpesvirus Species 0.000 claims description 20
- 241000701085 Human alphaherpesvirus 3 Species 0.000 claims description 19
- 238000012217 deletion Methods 0.000 claims description 19
- 230000037430 deletion Effects 0.000 claims description 19
- 241000700588 Human alphaherpesvirus 1 Species 0.000 claims description 17
- 238000007792 addition Methods 0.000 claims description 16
- 238000006467 substitution reaction Methods 0.000 claims description 15
- 239000002671 adjuvant Substances 0.000 claims description 10
- 230000001939 inductive effect Effects 0.000 claims description 9
- 108091033319 polynucleotide Proteins 0.000 claims description 9
- 102000040430 polynucleotide Human genes 0.000 claims description 9
- 239000002157 polynucleotide Substances 0.000 claims description 9
- 238000003259 recombinant expression Methods 0.000 claims description 5
- 241001492322 Bovine alphaherpesvirus 5 Species 0.000 claims description 3
- 235000018102 proteins Nutrition 0.000 description 172
- 210000004027 cell Anatomy 0.000 description 108
- 235000019419 proteases Nutrition 0.000 description 53
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 39
- 108090000765 processed proteins & peptides Proteins 0.000 description 34
- 238000000034 method Methods 0.000 description 29
- 102000004196 processed proteins & peptides Human genes 0.000 description 29
- 229920001184 polypeptide Polymers 0.000 description 27
- 229960005486 vaccine Drugs 0.000 description 25
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 24
- 150000001413 amino acids Chemical class 0.000 description 23
- 238000004519 manufacturing process Methods 0.000 description 21
- 235000001014 amino acid Nutrition 0.000 description 20
- 108020004414 DNA Proteins 0.000 description 19
- 229940024606 amino acid Drugs 0.000 description 17
- 108010092854 aspartyllysine Proteins 0.000 description 17
- 230000002829 reductive effect Effects 0.000 description 17
- IBMVEYRWAWIOTN-UHFFFAOYSA-N L-Leucyl-L-Arginyl-L-Proline Natural products CC(C)CC(N)C(=O)NC(CCCN=C(N)N)C(=O)N1CCCC1C(O)=O IBMVEYRWAWIOTN-UHFFFAOYSA-N 0.000 description 16
- WUHBLPVELFTPQK-KKUMJFAQSA-N Leu-Tyr-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(O)=O WUHBLPVELFTPQK-KKUMJFAQSA-N 0.000 description 16
- 238000001262 western blot Methods 0.000 description 16
- 241000710929 Alphavirus Species 0.000 description 15
- 108010076504 Protein Sorting Signals Proteins 0.000 description 15
- 108010047857 aspartylglycine Proteins 0.000 description 15
- 239000013598 vector Substances 0.000 description 15
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 14
- 230000003472 neutralizing effect Effects 0.000 description 14
- YRTOMUMWSTUQAX-FXQIFTODSA-N Asn-Pro-Asp Chemical compound NC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(O)=O YRTOMUMWSTUQAX-FXQIFTODSA-N 0.000 description 13
- MTAOBYXRYJZRGQ-WDSKDSINSA-N Glu-Gly-Asp Chemical compound OC(=O)CC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O MTAOBYXRYJZRGQ-WDSKDSINSA-N 0.000 description 13
- CLODWIOAKCSBAN-BQBZGAKWSA-N Gly-Arg-Asp Chemical compound NC(N)=NCCC[C@H](NC(=O)CN)C(=O)N[C@@H](CC(O)=O)C(O)=O CLODWIOAKCSBAN-BQBZGAKWSA-N 0.000 description 13
- -1 aromatic amino acids Chemical class 0.000 description 13
- NGYHSXDNNOFHNE-AVGNSLFASA-N Arg-Pro-Leu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(O)=O NGYHSXDNNOFHNE-AVGNSLFASA-N 0.000 description 12
- HFPVRZWORNJRRC-UWVGGRQHSA-N Gly-Pro-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)CN HFPVRZWORNJRRC-UWVGGRQHSA-N 0.000 description 12
- XYLSGAWRCZECIQ-JYJNAYRXSA-N Lys-Tyr-Glu Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CCC(O)=O)C(O)=O)CC1=CC=C(O)C=C1 XYLSGAWRCZECIQ-JYJNAYRXSA-N 0.000 description 12
- LHALYDBUDCWMDY-CIUDSAMLSA-N Pro-Glu-Ala Chemical compound C[C@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CCCN1)C(O)=O LHALYDBUDCWMDY-CIUDSAMLSA-N 0.000 description 12
- FVFUOQIYDPAIJR-XIRDDKMYSA-N Ser-Trp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CO)N FVFUOQIYDPAIJR-XIRDDKMYSA-N 0.000 description 12
- DBOXBUDEAJVKRE-LSJOCFKGSA-N Val-Asn-Val Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](C(C)C)C(=O)O)N DBOXBUDEAJVKRE-LSJOCFKGSA-N 0.000 description 12
- ZBLQIYPCUWZSRZ-QEJZJMRPSA-N Ala-Phe-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](C)N)CC1=CC=CC=C1 ZBLQIYPCUWZSRZ-QEJZJMRPSA-N 0.000 description 11
- VUGWHBXPMAHEGZ-SRVKXCTJSA-N Arg-Pro-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CCCN=C(N)N VUGWHBXPMAHEGZ-SRVKXCTJSA-N 0.000 description 11
- CWJQMCPYXNVMBS-STECZYCISA-N Ile-Arg-Tyr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)N CWJQMCPYXNVMBS-STECZYCISA-N 0.000 description 11
- ILJREDZFPHTUIE-GUBZILKMSA-N Leu-Asp-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O ILJREDZFPHTUIE-GUBZILKMSA-N 0.000 description 11
- OJPHFSOMBZKQKQ-GUBZILKMSA-N Ser-Gln-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CO OJPHFSOMBZKQKQ-GUBZILKMSA-N 0.000 description 11
- 108010053037 kyotorphin Proteins 0.000 description 11
- 210000004899 c-terminal region Anatomy 0.000 description 10
- 208000015181 infectious disease Diseases 0.000 description 10
- 238000004113 cell culture Methods 0.000 description 9
- 230000000694 effects Effects 0.000 description 9
- 210000002919 epithelial cell Anatomy 0.000 description 9
- 239000002245 particle Substances 0.000 description 9
- 238000012163 sequencing technique Methods 0.000 description 9
- 241000272186 Falco columbarius Species 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 238000003780 insertion Methods 0.000 description 8
- 230000037431 insertion Effects 0.000 description 8
- 210000004962 mammalian cell Anatomy 0.000 description 8
- 108010087924 alanylproline Proteins 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 230000013595 glycosylation Effects 0.000 description 7
- 238000006206 glycosylation reaction Methods 0.000 description 7
- 241000701161 unidentified adenovirus Species 0.000 description 7
- 230000003612 virological effect Effects 0.000 description 7
- 241000699802 Cricetulus griseus Species 0.000 description 6
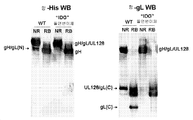
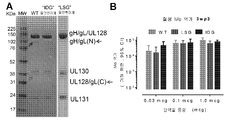
- 101150088904 UL130 gene Proteins 0.000 description 6
- 108010068380 arginylarginine Proteins 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 210000002889 endothelial cell Anatomy 0.000 description 6
- 230000002209 hydrophobic effect Effects 0.000 description 6
- 230000003053 immunization Effects 0.000 description 6
- 238000002649 immunization Methods 0.000 description 6
- 230000005847 immunogenicity Effects 0.000 description 6
- 239000008194 pharmaceutical composition Substances 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- 210000002845 virion Anatomy 0.000 description 6
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 5
- JSNWZMFSLIWAHS-HJGDQZAQSA-N Asp-Thr-Leu Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)O)NC(=O)[C@H](CC(=O)O)N)O JSNWZMFSLIWAHS-HJGDQZAQSA-N 0.000 description 5
- 241000282472 Canis lupus familiaris Species 0.000 description 5
- CLVUXCBGKUECIT-HJGDQZAQSA-N Leu-Asp-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O CLVUXCBGKUECIT-HJGDQZAQSA-N 0.000 description 5
- ZDJQVSIPFLMNOX-RHYQMDGZSA-N Leu-Thr-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N ZDJQVSIPFLMNOX-RHYQMDGZSA-N 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- YBAFDPFAUTYYRW-UHFFFAOYSA-N N-L-alpha-glutamyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CCC(O)=O YBAFDPFAUTYYRW-UHFFFAOYSA-N 0.000 description 5
- MQUZANJDFOQOBX-SRVKXCTJSA-N Ser-Phe-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(O)=O MQUZANJDFOQOBX-SRVKXCTJSA-N 0.000 description 5
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 5
- 108010040443 aspartyl-aspartic acid Proteins 0.000 description 5
- 229910002091 carbon monoxide Inorganic materials 0.000 description 5
- 125000002091 cationic group Chemical group 0.000 description 5
- 238000006386 neutralization reaction Methods 0.000 description 5
- 239000007764 o/w emulsion Substances 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 108010015385 valyl-prolyl-proline Proteins 0.000 description 5
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 4
- NYDBKUNVSALYPX-NAKRPEOUSA-N Ala-Ile-Arg Chemical compound C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CCCN=C(N)N NYDBKUNVSALYPX-NAKRPEOUSA-N 0.000 description 4
- QPBSRMDNJOTFAL-AICCOOGYSA-N Ala-Leu-Leu-Thr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QPBSRMDNJOTFAL-AICCOOGYSA-N 0.000 description 4
- FFZJHQODAYHGPO-KZVJFYERSA-N Ala-Pro-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](C)N FFZJHQODAYHGPO-KZVJFYERSA-N 0.000 description 4
- VDCIPFYVCICPEC-FXQIFTODSA-N Asn-Arg-Ala Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O VDCIPFYVCICPEC-FXQIFTODSA-N 0.000 description 4
- ULRPXVNMIIYDDJ-ACZMJKKPSA-N Asn-Glu-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CC(=O)N)N ULRPXVNMIIYDDJ-ACZMJKKPSA-N 0.000 description 4
- NCXTYSVDWLAQGZ-ZKWXMUAHSA-N Asn-Ser-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O NCXTYSVDWLAQGZ-ZKWXMUAHSA-N 0.000 description 4
- RXBGWGRSWXOBGK-KKUMJFAQSA-N Asp-Lys-Tyr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O RXBGWGRSWXOBGK-KKUMJFAQSA-N 0.000 description 4
- 206010011831 Cytomegalovirus infection Diseases 0.000 description 4
- NJCALAAIGREHDR-WDCWCFNPSA-N Glu-Leu-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O NJCALAAIGREHDR-WDCWCFNPSA-N 0.000 description 4
- RXGLHDWAZQECBI-SRVKXCTJSA-N Leu-Leu-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O RXGLHDWAZQECBI-SRVKXCTJSA-N 0.000 description 4
- RGUXWMDNCPMQFB-YUMQZZPRSA-N Leu-Ser-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O RGUXWMDNCPMQFB-YUMQZZPRSA-N 0.000 description 4
- OZVXDDFYCQOPFD-XQQFMLRXSA-N Lys-Val-Pro Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCCN)N OZVXDDFYCQOPFD-XQQFMLRXSA-N 0.000 description 4
- 241000710961 Semliki Forest virus Species 0.000 description 4
- 241000710960 Sindbis virus Species 0.000 description 4
- IGROJMCBGRFRGI-YTLHQDLWSA-N Thr-Ala-Ala Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(O)=O IGROJMCBGRFRGI-YTLHQDLWSA-N 0.000 description 4
- WFUAUEQXPVNAEF-ZJDVBMNYSA-N Thr-Arg-Thr Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)O)C(O)=O)CCCN=C(N)N WFUAUEQXPVNAEF-ZJDVBMNYSA-N 0.000 description 4
- JYVKKBDANPZIAW-AVGNSLFASA-N Val-Arg-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](C(C)C)N JYVKKBDANPZIAW-AVGNSLFASA-N 0.000 description 4
- 241000710959 Venezuelan equine encephalitis virus Species 0.000 description 4
- 230000005875 antibody response Effects 0.000 description 4
- 108010093581 aspartyl-proline Proteins 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 239000000539 dimer Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 210000002950 fibroblast Anatomy 0.000 description 4
- 108010073628 glutamyl-valyl-phenylalanine Proteins 0.000 description 4
- XBGGUPMXALFZOT-UHFFFAOYSA-N glycyl-L-tyrosine hemihydrate Natural products NCC(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 XBGGUPMXALFZOT-UHFFFAOYSA-N 0.000 description 4
- 108010087823 glycyltyrosine Proteins 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 108010051673 leucyl-glycyl-phenylalanine Proteins 0.000 description 4
- 238000012544 monitoring process Methods 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 4
- 229930182490 saponin Natural products 0.000 description 4
- 150000007949 saponins Chemical class 0.000 description 4
- 238000002864 sequence alignment Methods 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 241000894007 species Species 0.000 description 4
- BRPMXFSTKXXNHF-IUCAKERBSA-N (2s)-1-[2-[[(2s)-pyrrolidine-2-carbonyl]amino]acetyl]pyrrolidine-2-carboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1C(=O)CNC(=O)[C@H]1NCCC1 BRPMXFSTKXXNHF-IUCAKERBSA-N 0.000 description 3
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 3
- YLTKNGYYPIWKHZ-ACZMJKKPSA-N Ala-Ala-Glu Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O YLTKNGYYPIWKHZ-ACZMJKKPSA-N 0.000 description 3
- IXTPACPAXIOCRG-ACZMJKKPSA-N Ala-Glu-Cys Chemical compound C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CS)C(=O)O)N IXTPACPAXIOCRG-ACZMJKKPSA-N 0.000 description 3
- CBCCCLMNOBLBSC-XVYDVKMFSA-N Ala-His-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CO)C(O)=O CBCCCLMNOBLBSC-XVYDVKMFSA-N 0.000 description 3
- 108010011170 Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly Proteins 0.000 description 3
- XCIGOVDXZULBBV-DCAQKATOSA-N Ala-Val-Lys Chemical compound CC(C)[C@H](NC(=O)[C@H](C)N)C(=O)N[C@@H](CCCCN)C(O)=O XCIGOVDXZULBBV-DCAQKATOSA-N 0.000 description 3
- KJGNDQCYBNBXDA-GUBZILKMSA-N Arg-Arg-Cys Chemical compound C(C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CS)C(=O)O)N)CN=C(N)N KJGNDQCYBNBXDA-GUBZILKMSA-N 0.000 description 3
- NVCIXQYNWYTLDO-IHRRRGAJSA-N Arg-His-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CCCN=C(N)N)N NVCIXQYNWYTLDO-IHRRRGAJSA-N 0.000 description 3
- OVQJAKFLFTZDNC-GUBZILKMSA-N Arg-Pro-Asp Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(O)=O OVQJAKFLFTZDNC-GUBZILKMSA-N 0.000 description 3
- QMQZYILAWUOLPV-JYJNAYRXSA-N Arg-Tyr-Arg Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)CC1=CC=C(O)C=C1 QMQZYILAWUOLPV-JYJNAYRXSA-N 0.000 description 3
- VLIJAPRTSXSGFY-STQMWFEESA-N Arg-Tyr-Gly Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=C(O)C=C1 VLIJAPRTSXSGFY-STQMWFEESA-N 0.000 description 3
- JLNFZLNDHONLND-GARJFASQSA-N Asn-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)N)N JLNFZLNDHONLND-GARJFASQSA-N 0.000 description 3
- XOQYDFCQPWAMSA-KKHAAJSZSA-N Asn-Val-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XOQYDFCQPWAMSA-KKHAAJSZSA-N 0.000 description 3
- AITKTFCQOBRJTG-CIUDSAMLSA-N Asp-Leu-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC(=O)O)N AITKTFCQOBRJTG-CIUDSAMLSA-N 0.000 description 3
- MNQMTYSEKZHIDF-GCJQMDKQSA-N Asp-Thr-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O MNQMTYSEKZHIDF-GCJQMDKQSA-N 0.000 description 3
- PQHYZJPCYRDYNE-QWRGUYRKSA-N Cys-Gly-Phe Chemical compound [H]N[C@@H](CS)C(=O)NCC(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O PQHYZJPCYRDYNE-QWRGUYRKSA-N 0.000 description 3
- DGQJGBDBFVGLGL-ZKWXMUAHSA-N Cys-Val-Asp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CS)N DGQJGBDBFVGLGL-ZKWXMUAHSA-N 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- 102220510722 Dual specificity tyrosine-phosphorylation-regulated kinase 2_S98G_mutation Human genes 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- JSYULGSPLTZDHM-NRPADANISA-N Gln-Ala-Val Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O JSYULGSPLTZDHM-NRPADANISA-N 0.000 description 3
- QBLMTCRYYTVUQY-GUBZILKMSA-N Gln-Leu-Asp Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O QBLMTCRYYTVUQY-GUBZILKMSA-N 0.000 description 3
- PSERKXGRRADTKA-MNXVOIDGSA-N Gln-Leu-Ile Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O PSERKXGRRADTKA-MNXVOIDGSA-N 0.000 description 3
- WVWZIPOJECFDAG-AVGNSLFASA-N Glu-Phe-Cys Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCC(=O)O)N WVWZIPOJECFDAG-AVGNSLFASA-N 0.000 description 3
- FVGOGEGGQLNZGH-DZKIICNBSA-N Glu-Val-Phe Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 FVGOGEGGQLNZGH-DZKIICNBSA-N 0.000 description 3
- GWCRIHNSVMOBEQ-BQBZGAKWSA-N Gly-Arg-Ser Chemical compound [H]NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O GWCRIHNSVMOBEQ-BQBZGAKWSA-N 0.000 description 3
- WZSHYFGOLPXPLL-RYUDHWBXSA-N Gly-Phe-Glu Chemical compound NCC(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CCC(O)=O)C(O)=O WZSHYFGOLPXPLL-RYUDHWBXSA-N 0.000 description 3
- ABPRMMYHROQBLY-NKWVEPMBSA-N Gly-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)CN)C(=O)O ABPRMMYHROQBLY-NKWVEPMBSA-N 0.000 description 3
- GNNJKUYDWFIBTK-QWRGUYRKSA-N Gly-Tyr-Asp Chemical compound [H]NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O GNNJKUYDWFIBTK-QWRGUYRKSA-N 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- FFYYUUWROYYKFY-IHRRRGAJSA-N His-Val-Leu Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O FFYYUUWROYYKFY-IHRRRGAJSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- VEPIBPGLTLPBDW-URLPEUOOSA-N Ile-Phe-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N VEPIBPGLTLPBDW-URLPEUOOSA-N 0.000 description 3
- KBDIBHQICWDGDL-PPCPHDFISA-N Ile-Thr-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)O)N KBDIBHQICWDGDL-PPCPHDFISA-N 0.000 description 3
- SENJXOPIZNYLHU-UHFFFAOYSA-N L-leucyl-L-arginine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CCCN=C(N)N SENJXOPIZNYLHU-UHFFFAOYSA-N 0.000 description 3
- KFKWRHQBZQICHA-STQMWFEESA-N L-leucyl-L-phenylalanine Natural products CC(C)C[C@H](N)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 KFKWRHQBZQICHA-STQMWFEESA-N 0.000 description 3
- FJUKMPUELVROGK-IHRRRGAJSA-N Leu-Arg-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N FJUKMPUELVROGK-IHRRRGAJSA-N 0.000 description 3
- YOKVEHGYYQEQOP-QWRGUYRKSA-N Leu-Leu-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O YOKVEHGYYQEQOP-QWRGUYRKSA-N 0.000 description 3
- ZGUMORRUBUCXEH-AVGNSLFASA-N Leu-Lys-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZGUMORRUBUCXEH-AVGNSLFASA-N 0.000 description 3
- DPURXCQCHSQPAN-AVGNSLFASA-N Leu-Pro-Pro Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 DPURXCQCHSQPAN-AVGNSLFASA-N 0.000 description 3
- SQUFDMCWMFOEBA-KKUMJFAQSA-N Leu-Ser-Tyr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 SQUFDMCWMFOEBA-KKUMJFAQSA-N 0.000 description 3
- FDBTVENULFNTAL-XQQFMLRXSA-N Leu-Val-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N FDBTVENULFNTAL-XQQFMLRXSA-N 0.000 description 3
- DSWOTZCVCBEPOU-IUCAKERBSA-N Met-Arg-Gly Chemical compound CSCC[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CCCNC(N)=N DSWOTZCVCBEPOU-IUCAKERBSA-N 0.000 description 3
- JUXONJROIXKHEV-GUBZILKMSA-N Met-Cys-Arg Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CS)C(=O)N[C@H](C(O)=O)CCCNC(N)=N JUXONJROIXKHEV-GUBZILKMSA-N 0.000 description 3
- ZBLSZPYQQRIHQU-RCWTZXSCSA-N Met-Thr-Val Chemical compound CSCC[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O ZBLSZPYQQRIHQU-RCWTZXSCSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 3
- JIYJYFIXQTYDNF-YDHLFZDLSA-N Phe-Asn-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC1=CC=CC=C1)N JIYJYFIXQTYDNF-YDHLFZDLSA-N 0.000 description 3
- GCFNFKNPCMBHNT-IRXDYDNUSA-N Phe-Tyr-Gly Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)NCC(=O)O)N GCFNFKNPCMBHNT-IRXDYDNUSA-N 0.000 description 3
- NUZHSNLQJDYSRW-BZSNNMDCSA-N Pro-Arg-Trp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O NUZHSNLQJDYSRW-BZSNNMDCSA-N 0.000 description 3
- WPQKSRHDTMRSJM-CIUDSAMLSA-N Pro-Asp-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H]1CCCN1 WPQKSRHDTMRSJM-CIUDSAMLSA-N 0.000 description 3
- NMELOOXSGDRBRU-YUMQZZPRSA-N Pro-Glu-Gly Chemical compound OC(=O)CNC(=O)[C@H](CCC(=O)O)NC(=O)[C@@H]1CCCN1 NMELOOXSGDRBRU-YUMQZZPRSA-N 0.000 description 3
- XYSXOCIWCPFOCG-IHRRRGAJSA-N Pro-Leu-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O XYSXOCIWCPFOCG-IHRRRGAJSA-N 0.000 description 3
- FKYKZHOKDOPHSA-DCAQKATOSA-N Pro-Leu-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O FKYKZHOKDOPHSA-DCAQKATOSA-N 0.000 description 3
- SUENWIFTSTWUKD-AVGNSLFASA-N Pro-Leu-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O SUENWIFTSTWUKD-AVGNSLFASA-N 0.000 description 3
- LNICFEXCAHIJOR-DCAQKATOSA-N Pro-Ser-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O LNICFEXCAHIJOR-DCAQKATOSA-N 0.000 description 3
- FIODMZKLZFLYQP-GUBZILKMSA-N Pro-Val-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O FIODMZKLZFLYQP-GUBZILKMSA-N 0.000 description 3
- YDTUEBLEAVANFH-RCWTZXSCSA-N Pro-Val-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]1CCCN1 YDTUEBLEAVANFH-RCWTZXSCSA-N 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- JNQZPAWOPBZGIX-RCWTZXSCSA-N Thr-Arg-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)[C@@H](C)O)CCCN=C(N)N JNQZPAWOPBZGIX-RCWTZXSCSA-N 0.000 description 3
- AIISTODACBDQLW-WDSOQIARSA-N Trp-Leu-Arg Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)=CNC2=C1 AIISTODACBDQLW-WDSOQIARSA-N 0.000 description 3
- DLZKEQQWXODGGZ-KWQFWETISA-N Tyr-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 DLZKEQQWXODGGZ-KWQFWETISA-N 0.000 description 3
- PZXUIGWOEWWFQM-SRVKXCTJSA-N Tyr-Asn-Asn Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O PZXUIGWOEWWFQM-SRVKXCTJSA-N 0.000 description 3
- ZRPLVTZTKPPSBT-AVGNSLFASA-N Tyr-Glu-Ser Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O ZRPLVTZTKPPSBT-AVGNSLFASA-N 0.000 description 3
- QFXVAFIHVWXXBJ-AVGNSLFASA-N Tyr-Ser-Glu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(O)=O QFXVAFIHVWXXBJ-AVGNSLFASA-N 0.000 description 3
- 101150032047 UL131 gene Proteins 0.000 description 3
- ZLFHAAGHGQBQQN-GUBZILKMSA-N Val-Ala-Pro Natural products CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O ZLFHAAGHGQBQQN-GUBZILKMSA-N 0.000 description 3
- NZYNRRGJJVSSTJ-GUBZILKMSA-N Val-Ser-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O NZYNRRGJJVSSTJ-GUBZILKMSA-N 0.000 description 3
- BGTDGENDNWGMDQ-KJEVXHAQSA-N Val-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](C(C)C)N)O BGTDGENDNWGMDQ-KJEVXHAQSA-N 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000004599 antimicrobial Substances 0.000 description 3
- 108010077245 asparaginyl-proline Proteins 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 108010060199 cysteinylproline Proteins 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 230000003511 endothelial effect Effects 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 108010072405 glycyl-aspartyl-glycine Proteins 0.000 description 3
- 108010050848 glycylleucine Proteins 0.000 description 3
- 108010077515 glycylproline Proteins 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 239000000411 inducer Substances 0.000 description 3
- 229940079322 interferon Drugs 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 108010034529 leucyl-lysine Proteins 0.000 description 3
- 108010044056 leucyl-phenylalanine Proteins 0.000 description 3
- 108010073472 leucyl-prolyl-proline Proteins 0.000 description 3
- 108010000761 leucylarginine Proteins 0.000 description 3
- 108010057821 leucylproline Proteins 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 239000007908 nanoemulsion Substances 0.000 description 3
- 108010051242 phenylalanylserine Proteins 0.000 description 3
- 108010014614 prolyl-glycyl-proline Proteins 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 description 3
- 108010087967 type I signal peptidase Proteins 0.000 description 3
- 108010003137 tyrosyltyrosine Proteins 0.000 description 3
- 230000029812 viral genome replication Effects 0.000 description 3
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 2
- PIDRBUDUWHBYSR-UHFFFAOYSA-N 1-[2-[[2-[(2-amino-4-methylpentanoyl)amino]-4-methylpentanoyl]amino]-4-methylpentanoyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)CC(N)C(=O)NC(CC(C)C)C(=O)NC(CC(C)C)C(=O)N1CCCC1C(O)=O PIDRBUDUWHBYSR-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- SOBIAADAMRHGKH-CIUDSAMLSA-N Ala-Leu-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O SOBIAADAMRHGKH-CIUDSAMLSA-N 0.000 description 2
- 108010011667 Ala-Phe-Ala Proteins 0.000 description 2
- BVLPIIBTWIYOML-ZKWXMUAHSA-N Ala-Val-Asp Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O BVLPIIBTWIYOML-ZKWXMUAHSA-N 0.000 description 2
- KMSHNDWHPWXPEC-BQBZGAKWSA-N Arg-Asp-Gly Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O KMSHNDWHPWXPEC-BQBZGAKWSA-N 0.000 description 2
- XRLOBFSLPCHYLQ-ULQDDVLXSA-N Arg-Tyr-His Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N)O XRLOBFSLPCHYLQ-ULQDDVLXSA-N 0.000 description 2
- NECWUSYTYSIFNC-DLOVCJGASA-N Asp-Ala-Phe Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 NECWUSYTYSIFNC-DLOVCJGASA-N 0.000 description 2
- MFMJRYHVLLEMQM-DCAQKATOSA-N Asp-Arg-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(=O)O)N MFMJRYHVLLEMQM-DCAQKATOSA-N 0.000 description 2
- PXLNPFOJZQMXAT-BYULHYEWSA-N Asp-Asp-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC(O)=O PXLNPFOJZQMXAT-BYULHYEWSA-N 0.000 description 2
- VAWNQIGQPUOPQW-ACZMJKKPSA-N Asp-Glu-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O VAWNQIGQPUOPQW-ACZMJKKPSA-N 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 241000282465 Canis Species 0.000 description 2
- 208000003322 Coinfection Diseases 0.000 description 2
- NITLUESFANGEIW-BQBZGAKWSA-N Cys-Pro-Gly Chemical compound [H]N[C@@H](CS)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O NITLUESFANGEIW-BQBZGAKWSA-N 0.000 description 2
- 108010041986 DNA Vaccines Proteins 0.000 description 2
- 229940021995 DNA vaccine Drugs 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 206010066919 Epidemic polyarthritis Diseases 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- NSNUZSPSADIMJQ-WDSKDSINSA-N Gln-Gly-Asp Chemical compound NC(=O)CC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O NSNUZSPSADIMJQ-WDSKDSINSA-N 0.000 description 2
- ORYMMTRPKVTGSJ-XVKPBYJWSA-N Gln-Gly-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCC(N)=O ORYMMTRPKVTGSJ-XVKPBYJWSA-N 0.000 description 2
- FCKPEGOCSVZPNC-WHOFXGATSA-N Gly-Ile-Phe Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 FCKPEGOCSVZPNC-WHOFXGATSA-N 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101001090901 Homo sapiens Retroelement silencing factor 1 Proteins 0.000 description 2
- 101000864837 Homo sapiens SIN3-HDAC complex-associated factor Proteins 0.000 description 2
- 241000701041 Human betaherpesvirus 7 Species 0.000 description 2
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 2
- 241000701027 Human herpesvirus 6 Species 0.000 description 2
- HPCFRQWLTRDGHT-AJNGGQMLSA-N Ile-Leu-Leu Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O HPCFRQWLTRDGHT-AJNGGQMLSA-N 0.000 description 2
- XLXPYSDGMXTTNQ-UHFFFAOYSA-N Ile-Phe-Leu Natural products CCC(C)C(N)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=CC=C1 XLXPYSDGMXTTNQ-UHFFFAOYSA-N 0.000 description 2
- JZBVBOKASHNXAD-NAKRPEOUSA-N Ile-Val-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(=O)O)N JZBVBOKASHNXAD-NAKRPEOUSA-N 0.000 description 2
- YHFPHRUWZMEOIX-CYDGBPFRSA-N Ile-Val-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)O)N YHFPHRUWZMEOIX-CYDGBPFRSA-N 0.000 description 2
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- BQSLGJHIAGOZCD-CIUDSAMLSA-N Leu-Ala-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O BQSLGJHIAGOZCD-CIUDSAMLSA-N 0.000 description 2
- FIJMQLGQLBLBOL-HJGDQZAQSA-N Leu-Asn-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O FIJMQLGQLBLBOL-HJGDQZAQSA-N 0.000 description 2
- KGCLIYGPQXUNLO-IUCAKERBSA-N Leu-Gly-Glu Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCC(O)=O KGCLIYGPQXUNLO-IUCAKERBSA-N 0.000 description 2
- KOSWSHVQIVTVQF-ZPFDUUQYSA-N Leu-Ile-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(O)=O KOSWSHVQIVTVQF-ZPFDUUQYSA-N 0.000 description 2
- DSFYPIUSAMSERP-IHRRRGAJSA-N Leu-Leu-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N DSFYPIUSAMSERP-IHRRRGAJSA-N 0.000 description 2
- PDQDCFBVYXEFSD-SRVKXCTJSA-N Leu-Leu-Asp Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O PDQDCFBVYXEFSD-SRVKXCTJSA-N 0.000 description 2
- ADJWHHZETYAAAX-SRVKXCTJSA-N Leu-Ser-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N ADJWHHZETYAAAX-SRVKXCTJSA-N 0.000 description 2
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 2
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 2
- LXUJDHOKVUYHRC-KKUMJFAQSA-N Phe-Cys-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CC1=CC=CC=C1)N LXUJDHOKVUYHRC-KKUMJFAQSA-N 0.000 description 2
- YKUGPVXSDOOANW-KKUMJFAQSA-N Phe-Leu-Asp Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O YKUGPVXSDOOANW-KKUMJFAQSA-N 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 102100034981 Retroelement silencing factor 1 Human genes 0.000 description 2
- 241000710942 Ross River virus Species 0.000 description 2
- 102100030066 SIN3-HDAC complex-associated factor Human genes 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- AEGUWTFAQQWVLC-BQBZGAKWSA-N Ser-Gly-Arg Chemical compound [H]N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(O)=O AEGUWTFAQQWVLC-BQBZGAKWSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 2
- PKZVWAGGKFAVKR-UBHSHLNASA-N Trp-Cys-Cys Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CS)C(=O)O)N PKZVWAGGKFAVKR-UBHSHLNASA-N 0.000 description 2
- 108010028230 Trp-Ser- His-Pro-Gln-Phe-Glu-Lys Proteins 0.000 description 2
- TVOGEPLDNYTAHD-CQDKDKBSSA-N Tyr-Ala-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 TVOGEPLDNYTAHD-CQDKDKBSSA-N 0.000 description 2
- DVLWZWNAQUBZBC-ZNSHCXBVSA-N Val-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](C(C)C)N)O DVLWZWNAQUBZBC-ZNSHCXBVSA-N 0.000 description 2
- 108010087302 Viral Structural Proteins Proteins 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- 238000001261 affinity purification Methods 0.000 description 2
- 108010005233 alanylglutamic acid Proteins 0.000 description 2
- 108010011559 alanylphenylalanine Proteins 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 230000003190 augmentative effect Effects 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 229960002685 biotin Drugs 0.000 description 2
- 235000020958 biotin Nutrition 0.000 description 2
- 239000011616 biotin Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 2
- 238000006471 dimerization reaction Methods 0.000 description 2
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 101150015940 gL gene Proteins 0.000 description 2
- 108010049041 glutamylalanine Proteins 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 108010050343 histidyl-alanyl-glutamine Proteins 0.000 description 2
- 108010092114 histidylphenylalanine Proteins 0.000 description 2
- 230000028996 humoral immune response Effects 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- 229940121354 immunomodulator Drugs 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 238000005342 ion exchange Methods 0.000 description 2
- 230000021633 leukocyte mediated immunity Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 108010070643 prolylglutamic acid Proteins 0.000 description 2
- 108010090894 prolylleucine Proteins 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 235000004252 protein component Nutrition 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000001177 retroviral effect Effects 0.000 description 2
- 102200012486 rs111033669 Human genes 0.000 description 2
- 229940031439 squalene Drugs 0.000 description 2
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 2
- 238000012916 structural analysis Methods 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 238000011282 treatment Methods 0.000 description 2
- 108010027345 wheylin-1 peptide Proteins 0.000 description 2
- GJLXVWOMRRWCIB-MERZOTPQSA-N (2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-acetamido-5-(diaminomethylideneamino)pentanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanamide Chemical compound C([C@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=C(O)C=C1 GJLXVWOMRRWCIB-MERZOTPQSA-N 0.000 description 1
- BVAUMRCGVHUWOZ-ZETCQYMHSA-N (2s)-2-(cyclohexylazaniumyl)propanoate Chemical compound OC(=O)[C@H](C)NC1CCCCC1 BVAUMRCGVHUWOZ-ZETCQYMHSA-N 0.000 description 1
- LDUWTIUXPVCEQF-LURJTMIESA-N (2s)-2-(cyclopentylamino)propanoic acid Chemical compound OC(=O)[C@H](C)NC1CCCC1 LDUWTIUXPVCEQF-LURJTMIESA-N 0.000 description 1
- IYKLZBIWFXPUCS-VIFPVBQESA-N (2s)-2-(naphthalen-1-ylamino)propanoic acid Chemical compound C1=CC=C2C(N[C@@H](C)C(O)=O)=CC=CC2=C1 IYKLZBIWFXPUCS-VIFPVBQESA-N 0.000 description 1
- IGXNPQWXIRIGBF-KEOOTSPTSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-amino-3-(1h-imidazol-5-yl)propanoyl]amino]-3-(1h-imidazol-5-yl)propanoyl]amino]-3-(1h-imidazol-5-yl)propanoyl]amino]-3-(1h-imidazol-5-yl)propanoyl]amino]-3-(1h-imidazol-5-yl)propanoic acid Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1NC=NC=1)C(O)=O)C1=CN=CN1 IGXNPQWXIRIGBF-KEOOTSPTSA-N 0.000 description 1
- RSPOGBIHKNKRFJ-FSPLSTOPSA-N (2s,3s)-2-amino-2,3-dimethylpentanoic acid Chemical compound CC[C@H](C)[C@](C)(N)C(O)=O RSPOGBIHKNKRFJ-FSPLSTOPSA-N 0.000 description 1
- NUUYZLOGRAXQBP-UHFFFAOYSA-N 1,1-diphenoxyethanol Chemical compound C=1C=CC=CC=1OC(O)(C)OC1=CC=CC=C1 NUUYZLOGRAXQBP-UHFFFAOYSA-N 0.000 description 1
- ZADWXFSZEAPBJS-JTQLQIEISA-N 1-methyl-L-tryptophan Chemical compound C1=CC=C2N(C)C=C(C[C@H](N)C(O)=O)C2=C1 ZADWXFSZEAPBJS-JTQLQIEISA-N 0.000 description 1
- KSXTUUUQYQYKCR-LQDDAWAPSA-M 2,3-bis[[(z)-octadec-9-enoyl]oxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCC(=O)OCC(C[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC KSXTUUUQYQYKCR-LQDDAWAPSA-M 0.000 description 1
- ARSWQPLPYROOBG-ZETCQYMHSA-N 2-methylleucine Chemical compound CC(C)C[C@](C)(N)C(O)=O ARSWQPLPYROOBG-ZETCQYMHSA-N 0.000 description 1
- 108010036211 5-HT-moduline Proteins 0.000 description 1
- AAQGRPOPTAUUBM-ZLUOBGJFSA-N Ala-Ala-Asn Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(O)=O AAQGRPOPTAUUBM-ZLUOBGJFSA-N 0.000 description 1
- CXRCVCURMBFFOL-FXQIFTODSA-N Ala-Ala-Pro Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O CXRCVCURMBFFOL-FXQIFTODSA-N 0.000 description 1
- FXKNPWNXPQZLES-ZLUOBGJFSA-N Ala-Asn-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O FXKNPWNXPQZLES-ZLUOBGJFSA-N 0.000 description 1
- YIGLXQRFQVWFEY-NRPADANISA-N Ala-Gln-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O YIGLXQRFQVWFEY-NRPADANISA-N 0.000 description 1
- PCIFXPRIFWKWLK-YUMQZZPRSA-N Ala-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@H](C)N PCIFXPRIFWKWLK-YUMQZZPRSA-N 0.000 description 1
- VNYMOTCMNHJGTG-JBDRJPRFSA-N Ala-Ile-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O VNYMOTCMNHJGTG-JBDRJPRFSA-N 0.000 description 1
- YHKANGMVQWRMAP-DCAQKATOSA-N Ala-Leu-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YHKANGMVQWRMAP-DCAQKATOSA-N 0.000 description 1
- LBYMZCVBOKYZNS-CIUDSAMLSA-N Ala-Leu-Asp Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O LBYMZCVBOKYZNS-CIUDSAMLSA-N 0.000 description 1
- MEFILNJXAVSUTO-JXUBOQSCSA-N Ala-Leu-Thr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MEFILNJXAVSUTO-JXUBOQSCSA-N 0.000 description 1
- XRUJOVRWNMBAAA-NHCYSSNCSA-N Ala-Phe-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=CC=C1 XRUJOVRWNMBAAA-NHCYSSNCSA-N 0.000 description 1
- CQJHFKKGZXKZBC-BPNCWPANSA-N Ala-Pro-Tyr Chemical compound C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 CQJHFKKGZXKZBC-BPNCWPANSA-N 0.000 description 1
- ARHJJAAWNWOACN-FXQIFTODSA-N Ala-Ser-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O ARHJJAAWNWOACN-FXQIFTODSA-N 0.000 description 1
- YNOCMHZSWJMGBB-GCJQMDKQSA-N Ala-Thr-Asp Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O YNOCMHZSWJMGBB-GCJQMDKQSA-N 0.000 description 1
- BOKLLPVAQDSLHC-FXQIFTODSA-N Ala-Val-Cys Chemical compound C[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CS)C(=O)O)N BOKLLPVAQDSLHC-FXQIFTODSA-N 0.000 description 1
- REWSWYIDQIELBE-FXQIFTODSA-N Ala-Val-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O REWSWYIDQIELBE-FXQIFTODSA-N 0.000 description 1
- 239000012103 Alexa Fluor 488 Substances 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 101001073212 Arabidopsis thaliana Peroxidase 33 Proteins 0.000 description 1
- DPNHSNLIULPOBH-GUBZILKMSA-N Arg-Asn-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCCN=C(N)N)N DPNHSNLIULPOBH-GUBZILKMSA-N 0.000 description 1
- IGULQRCJLQQPSM-DCAQKATOSA-N Arg-Cys-Leu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(C)C)C(O)=O IGULQRCJLQQPSM-DCAQKATOSA-N 0.000 description 1
- FEZJJKXNPSEYEV-CIUDSAMLSA-N Arg-Gln-Ala Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O FEZJJKXNPSEYEV-CIUDSAMLSA-N 0.000 description 1
- VDBKFYYIBLXEIF-GUBZILKMSA-N Arg-Gln-Glu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O VDBKFYYIBLXEIF-GUBZILKMSA-N 0.000 description 1
- OHYQKYUTLIPFOX-ZPFDUUQYSA-N Arg-Glu-Ile Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O OHYQKYUTLIPFOX-ZPFDUUQYSA-N 0.000 description 1
- ZZZWQALDSQQBEW-STQMWFEESA-N Arg-Gly-Tyr Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZZZWQALDSQQBEW-STQMWFEESA-N 0.000 description 1
- OCDJOVKIUJVUMO-SRVKXCTJSA-N Arg-His-Gln Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N OCDJOVKIUJVUMO-SRVKXCTJSA-N 0.000 description 1
- YKBHOXLMMPZPHQ-GMOBBJLQSA-N Arg-Ile-Asp Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(O)=O YKBHOXLMMPZPHQ-GMOBBJLQSA-N 0.000 description 1
- NMRHDSAOIURTNT-RWMBFGLXSA-N Arg-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N NMRHDSAOIURTNT-RWMBFGLXSA-N 0.000 description 1
- OISWSORSLQOGFV-AVGNSLFASA-N Arg-Met-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCSC)NC(=O)[C@@H](N)CCCN=C(N)N OISWSORSLQOGFV-AVGNSLFASA-N 0.000 description 1
- URAUIUGLHBRPMF-NAKRPEOUSA-N Arg-Ser-Ile Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O URAUIUGLHBRPMF-NAKRPEOUSA-N 0.000 description 1
- BXLDDWZOTGGNOJ-SZMVWBNQSA-N Arg-Trp-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CCCN=C(N)N)N BXLDDWZOTGGNOJ-SZMVWBNQSA-N 0.000 description 1
- PSUXEQYPYZLNER-QXEWZRGKSA-N Arg-Val-Asn Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O PSUXEQYPYZLNER-QXEWZRGKSA-N 0.000 description 1
- 241000238421 Arthropoda Species 0.000 description 1
- CMLGVVWQQHUXOZ-GHCJXIJMSA-N Asn-Ala-Ile Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O CMLGVVWQQHUXOZ-GHCJXIJMSA-N 0.000 description 1
- KWQPAXYXVMHJJR-AVGNSLFASA-N Asn-Gln-Tyr Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 KWQPAXYXVMHJJR-AVGNSLFASA-N 0.000 description 1
- SEKBHZJLARBNPB-GHCJXIJMSA-N Asn-Ile-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O SEKBHZJLARBNPB-GHCJXIJMSA-N 0.000 description 1
- MVXJBVVLACEGCG-PCBIJLKTSA-N Asn-Phe-Ile Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O MVXJBVVLACEGCG-PCBIJLKTSA-N 0.000 description 1
- VLDRQOHCMKCXLY-SRVKXCTJSA-N Asn-Ser-Phe Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O VLDRQOHCMKCXLY-SRVKXCTJSA-N 0.000 description 1
- UXHYOWXTJLBEPG-GSSVUCPTSA-N Asn-Thr-Thr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O UXHYOWXTJLBEPG-GSSVUCPTSA-N 0.000 description 1
- DATSKXOXPUAOLK-KKUMJFAQSA-N Asn-Tyr-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(O)=O DATSKXOXPUAOLK-KKUMJFAQSA-N 0.000 description 1
- KVMPVNGOKHTUHZ-GCJQMDKQSA-N Asp-Ala-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KVMPVNGOKHTUHZ-GCJQMDKQSA-N 0.000 description 1
- SBHUBSDEZQFJHJ-CIUDSAMLSA-N Asp-Asp-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC(O)=O SBHUBSDEZQFJHJ-CIUDSAMLSA-N 0.000 description 1
- BFOYULZBKYOKAN-OLHMAJIHSA-N Asp-Asp-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O BFOYULZBKYOKAN-OLHMAJIHSA-N 0.000 description 1
- ZSVJVIOVABDTTL-YUMQZZPRSA-N Asp-Gly-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CC(=O)O)N ZSVJVIOVABDTTL-YUMQZZPRSA-N 0.000 description 1
- POTCZYQVVNXUIG-BQBZGAKWSA-N Asp-Gly-Pro Chemical compound OC(=O)C[C@H](N)C(=O)NCC(=O)N1CCC[C@H]1C(O)=O POTCZYQVVNXUIG-BQBZGAKWSA-N 0.000 description 1
- SNDBKTFJWVEVPO-WHFBIAKZSA-N Asp-Gly-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(O)=O SNDBKTFJWVEVPO-WHFBIAKZSA-N 0.000 description 1
- ICZWAZVKLACMKR-CIUDSAMLSA-N Asp-His-Ser Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CO)C(O)=O)CC1=CN=CN1 ICZWAZVKLACMKR-CIUDSAMLSA-N 0.000 description 1
- JNNVNVRBYUJYGS-CIUDSAMLSA-N Asp-Leu-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O JNNVNVRBYUJYGS-CIUDSAMLSA-N 0.000 description 1
- UJGRZQYSNYTCAX-SRVKXCTJSA-N Asp-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(O)=O UJGRZQYSNYTCAX-SRVKXCTJSA-N 0.000 description 1
- UMHUHHJMEXNSIV-CIUDSAMLSA-N Asp-Leu-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(O)=O UMHUHHJMEXNSIV-CIUDSAMLSA-N 0.000 description 1
- GYWQGGUCMDCUJE-DLOVCJGASA-N Asp-Phe-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C)C(O)=O GYWQGGUCMDCUJE-DLOVCJGASA-N 0.000 description 1
- BKOIIURTQAJHAT-GUBZILKMSA-N Asp-Pro-Pro Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 BKOIIURTQAJHAT-GUBZILKMSA-N 0.000 description 1
- YODBPLSWNJMZOJ-BPUTZDHNSA-N Asp-Trp-Arg Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)NC(=O)[C@H](CC(=O)O)N YODBPLSWNJMZOJ-BPUTZDHNSA-N 0.000 description 1
- PLNJUJGNLDSFOP-UWJYBYFXSA-N Asp-Tyr-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C)C(O)=O PLNJUJGNLDSFOP-UWJYBYFXSA-N 0.000 description 1
- 102100021277 Beta-secretase 2 Human genes 0.000 description 1
- 101710150190 Beta-secretase 2 Proteins 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 101100342815 Caenorhabditis elegans lec-1 gene Proteins 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000724252 Cucumber mosaic virus Species 0.000 description 1
- ZOLXQKZHYOHHMD-DLOVCJGASA-N Cys-Ala-Phe Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CS)N ZOLXQKZHYOHHMD-DLOVCJGASA-N 0.000 description 1
- CEZSLNCYQUFOSL-BQBZGAKWSA-N Cys-Arg-Gly Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(O)=O CEZSLNCYQUFOSL-BQBZGAKWSA-N 0.000 description 1
- ZIKWRNJXFIQECJ-CIUDSAMLSA-N Cys-Cys-Leu Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(C)C)C(O)=O ZIKWRNJXFIQECJ-CIUDSAMLSA-N 0.000 description 1
- LMXOUGMSGHFLRX-CIUDSAMLSA-N Cys-Gln-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CS)N LMXOUGMSGHFLRX-CIUDSAMLSA-N 0.000 description 1
- HHABWQIFXZPZCK-ACZMJKKPSA-N Cys-Gln-Ser Chemical compound C(CC(=O)N)[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CS)N HHABWQIFXZPZCK-ACZMJKKPSA-N 0.000 description 1
- MBRWOKXNHTUJMB-CIUDSAMLSA-N Cys-Pro-Glu Chemical compound [H]N[C@@H](CS)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O MBRWOKXNHTUJMB-CIUDSAMLSA-N 0.000 description 1
- XBELMDARIGXDKY-GUBZILKMSA-N Cys-Pro-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](CS)N XBELMDARIGXDKY-GUBZILKMSA-N 0.000 description 1
- YNJBLTDKTMKEET-ZLUOBGJFSA-N Cys-Ser-Ser Chemical compound SC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O YNJBLTDKTMKEET-ZLUOBGJFSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 229920002271 DEAE-Sepharose Polymers 0.000 description 1
- GUBGYTABKSRVRQ-WFVLMXAXSA-N DEAE-cellulose Chemical compound OC1C(O)C(O)C(CO)O[C@H]1O[C@@H]1C(CO)OC(O)C(O)C1O GUBGYTABKSRVRQ-WFVLMXAXSA-N 0.000 description 1
- 230000004543 DNA replication Effects 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- XZWYTXMRWQJBGX-VXBMVYAYSA-N FLAG peptide Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)CC1=CC=C(O)C=C1 XZWYTXMRWQJBGX-VXBMVYAYSA-N 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- YNNXQZDEOCYJJL-CIUDSAMLSA-N Gln-Arg-Asp Chemical compound C(C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)CN=C(N)N YNNXQZDEOCYJJL-CIUDSAMLSA-N 0.000 description 1
- TWHDOEYLXXQYOZ-FXQIFTODSA-N Gln-Asn-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N TWHDOEYLXXQYOZ-FXQIFTODSA-N 0.000 description 1
- WLODHVXYKYHLJD-ACZMJKKPSA-N Gln-Asp-Ser Chemical compound C(CC(=O)N)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CO)C(=O)O)N WLODHVXYKYHLJD-ACZMJKKPSA-N 0.000 description 1
- COYGBRTZEVWZBW-XKBZYTNZSA-N Gln-Cys-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](CS)NC(=O)[C@@H](N)CCC(N)=O COYGBRTZEVWZBW-XKBZYTNZSA-N 0.000 description 1
- NKCZYEDZTKOFBG-GUBZILKMSA-N Gln-Gln-Arg Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O NKCZYEDZTKOFBG-GUBZILKMSA-N 0.000 description 1
- KVXVVDFOZNYYKZ-DCAQKATOSA-N Gln-Gln-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O KVXVVDFOZNYYKZ-DCAQKATOSA-N 0.000 description 1
- PNENQZWRFMUZOM-DCAQKATOSA-N Gln-Glu-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O PNENQZWRFMUZOM-DCAQKATOSA-N 0.000 description 1
- HDUDGCZEOZEFOA-KBIXCLLPSA-N Gln-Ile-Ala Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C)C(=O)O)NC(=O)[C@H](CCC(=O)N)N HDUDGCZEOZEFOA-KBIXCLLPSA-N 0.000 description 1
- HWEINOMSWQSJDC-SRVKXCTJSA-N Gln-Leu-Arg Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O HWEINOMSWQSJDC-SRVKXCTJSA-N 0.000 description 1
- UWMDGPFFTKDUIY-HJGDQZAQSA-N Gln-Pro-Thr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O UWMDGPFFTKDUIY-HJGDQZAQSA-N 0.000 description 1
- XIYWAJQIWLXXAF-XKBZYTNZSA-N Gln-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O XIYWAJQIWLXXAF-XKBZYTNZSA-N 0.000 description 1
- OUBUHIODTNUUTC-WDCWCFNPSA-N Gln-Thr-Lys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O OUBUHIODTNUUTC-WDCWCFNPSA-N 0.000 description 1
- UTKUTMJSWKKHEM-WDSKDSINSA-N Glu-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H](N)CCC(O)=O UTKUTMJSWKKHEM-WDSKDSINSA-N 0.000 description 1
- ITYRYNUZHPNCIK-GUBZILKMSA-N Glu-Ala-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O ITYRYNUZHPNCIK-GUBZILKMSA-N 0.000 description 1
- ATRHMOJQJWPVBQ-DRZSPHRISA-N Glu-Ala-Phe Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O ATRHMOJQJWPVBQ-DRZSPHRISA-N 0.000 description 1
- RSUVOPBMWMTVDI-XEGUGMAKSA-N Glu-Ala-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CCC(O)=O)C)C(O)=O)=CNC2=C1 RSUVOPBMWMTVDI-XEGUGMAKSA-N 0.000 description 1
- GCYFUZJHAXJKKE-KKUMJFAQSA-N Glu-Arg-Tyr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O GCYFUZJHAXJKKE-KKUMJFAQSA-N 0.000 description 1
- PAQUJCSYVIBPLC-AVGNSLFASA-N Glu-Asp-Phe Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 PAQUJCSYVIBPLC-AVGNSLFASA-N 0.000 description 1
- ZZIFPJZQHRJERU-WDSKDSINSA-N Glu-Cys-Gly Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CS)C(=O)NCC(O)=O ZZIFPJZQHRJERU-WDSKDSINSA-N 0.000 description 1
- RFDHKPSHTXZKLL-IHRRRGAJSA-N Glu-Gln-Phe Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CCC(=O)O)N RFDHKPSHTXZKLL-IHRRRGAJSA-N 0.000 description 1
- CUXJIASLBRJOFV-LAEOZQHASA-N Glu-Gly-Ile Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(O)=O CUXJIASLBRJOFV-LAEOZQHASA-N 0.000 description 1
- VSRCAOIHMGCIJK-SRVKXCTJSA-N Glu-Leu-Arg Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O VSRCAOIHMGCIJK-SRVKXCTJSA-N 0.000 description 1
- MWMJCGBSIORNCD-AVGNSLFASA-N Glu-Leu-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O MWMJCGBSIORNCD-AVGNSLFASA-N 0.000 description 1
- YGLCLCMAYUYZSG-AVGNSLFASA-N Glu-Lys-His Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 YGLCLCMAYUYZSG-AVGNSLFASA-N 0.000 description 1
- TZXOPHFCAATANZ-QEJZJMRPSA-N Glu-Ser-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)O)N TZXOPHFCAATANZ-QEJZJMRPSA-N 0.000 description 1
- GPSHCSTUYOQPAI-JHEQGTHGSA-N Glu-Thr-Gly Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O GPSHCSTUYOQPAI-JHEQGTHGSA-N 0.000 description 1
- YQAQQKPWFOBSMU-WDCWCFNPSA-N Glu-Thr-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O YQAQQKPWFOBSMU-WDCWCFNPSA-N 0.000 description 1
- CQGBSALYGOXQPE-HTUGSXCWSA-N Glu-Thr-Phe Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CCC(=O)O)N)O CQGBSALYGOXQPE-HTUGSXCWSA-N 0.000 description 1
- UUTGYDAKPISJAO-JYJNAYRXSA-N Glu-Tyr-Leu Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 UUTGYDAKPISJAO-JYJNAYRXSA-N 0.000 description 1
- WGYHAAXZWPEBDQ-IFFSRLJSSA-N Glu-Val-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O WGYHAAXZWPEBDQ-IFFSRLJSSA-N 0.000 description 1
- MFVQGXGQRIXBPK-WDSKDSINSA-N Gly-Ala-Glu Chemical compound NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O MFVQGXGQRIXBPK-WDSKDSINSA-N 0.000 description 1
- KKBWDNZXYLGJEY-UHFFFAOYSA-N Gly-Arg-Pro Natural products NCC(=O)NC(CCNC(=N)N)C(=O)N1CCCC1C(=O)O KKBWDNZXYLGJEY-UHFFFAOYSA-N 0.000 description 1
- FSPVILZGHUJOHS-QWRGUYRKSA-N Gly-His-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CNC=N1 FSPVILZGHUJOHS-QWRGUYRKSA-N 0.000 description 1
- HAXARWKYFIIHKD-ZKWXMUAHSA-N Gly-Ile-Ser Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O HAXARWKYFIIHKD-ZKWXMUAHSA-N 0.000 description 1
- UUYBFNKHOCJCHT-VHSXEESVSA-N Gly-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)CN UUYBFNKHOCJCHT-VHSXEESVSA-N 0.000 description 1
- QAMMIGULQSIRCD-IRXDYDNUSA-N Gly-Phe-Tyr Chemical compound C([C@H](NC(=O)C[NH3+])C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C([O-])=O)C1=CC=CC=C1 QAMMIGULQSIRCD-IRXDYDNUSA-N 0.000 description 1
- HJARVELKOSZUEW-YUMQZZPRSA-N Gly-Pro-Gln Chemical compound [H]NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(O)=O HJARVELKOSZUEW-YUMQZZPRSA-N 0.000 description 1
- WNGHUXFWEWTKAO-YUMQZZPRSA-N Gly-Ser-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)CN WNGHUXFWEWTKAO-YUMQZZPRSA-N 0.000 description 1
- CUVBTVWFVIIDOC-YEPSODPASA-N Gly-Thr-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)CN CUVBTVWFVIIDOC-YEPSODPASA-N 0.000 description 1
- BAYQNCWLXIDLHX-ONGXEEELSA-N Gly-Val-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)CN BAYQNCWLXIDLHX-ONGXEEELSA-N 0.000 description 1
- 208000007514 Herpes zoster Diseases 0.000 description 1
- 241000700586 Herpesviridae Species 0.000 description 1
- MWWOPNQSBXEUHO-ULQDDVLXSA-N His-Arg-Tyr Chemical compound C([C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CN=CN1 MWWOPNQSBXEUHO-ULQDDVLXSA-N 0.000 description 1
- ZZLWLWSUIBSMNP-CIUDSAMLSA-N His-Asp-Ser Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O ZZLWLWSUIBSMNP-CIUDSAMLSA-N 0.000 description 1
- VFBZWZXKCVBTJR-SRVKXCTJSA-N His-Leu-Asp Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N VFBZWZXKCVBTJR-SRVKXCTJSA-N 0.000 description 1
- BXOLYFJYQQRQDJ-MXAVVETBSA-N His-Leu-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC1=CN=CN1)N BXOLYFJYQQRQDJ-MXAVVETBSA-N 0.000 description 1
- YAALVYQFVJNXIV-KKUMJFAQSA-N His-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC1=CN=CN1 YAALVYQFVJNXIV-KKUMJFAQSA-N 0.000 description 1
- FHKZHRMERJUXRJ-DCAQKATOSA-N His-Ser-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CN=CN1 FHKZHRMERJUXRJ-DCAQKATOSA-N 0.000 description 1
- CUEQQFOGARVNHU-VGDYDELISA-N His-Ser-Ile Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O CUEQQFOGARVNHU-VGDYDELISA-N 0.000 description 1
- FFKJUTZARGRVTH-KKUMJFAQSA-N His-Ser-Tyr Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O FFKJUTZARGRVTH-KKUMJFAQSA-N 0.000 description 1
- NBWATNYAUVSAEQ-ZEILLAHLSA-N His-Thr-Thr Chemical compound C[C@H]([C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N)O NBWATNYAUVSAEQ-ZEILLAHLSA-N 0.000 description 1
- XGBVLRJLHUVCNK-DCAQKATOSA-N His-Val-Ser Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O XGBVLRJLHUVCNK-DCAQKATOSA-N 0.000 description 1
- 101001123325 Homo sapiens Peroxisome proliferator-activated receptor gamma coactivator 1-beta Proteins 0.000 description 1
- 241001135569 Human adenovirus 5 Species 0.000 description 1
- 241001502974 Human gammaherpesvirus 8 Species 0.000 description 1
- VZIFYHYNQDIPLI-HJWJTTGWSA-N Ile-Arg-Phe Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N VZIFYHYNQDIPLI-HJWJTTGWSA-N 0.000 description 1
- YPQDTQJBOFOTJQ-SXTJYALSSA-N Ile-Asn-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)O)N YPQDTQJBOFOTJQ-SXTJYALSSA-N 0.000 description 1
- LEDRIAHEWDJRMF-CFMVVWHZSA-N Ile-Asn-Tyr Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 LEDRIAHEWDJRMF-CFMVVWHZSA-N 0.000 description 1
- NKRJALPCDNXULF-BYULHYEWSA-N Ile-Asp-Gly Chemical compound [H]N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O NKRJALPCDNXULF-BYULHYEWSA-N 0.000 description 1
- AQTWDZDISVGCAC-CFMVVWHZSA-N Ile-Asp-Tyr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)N AQTWDZDISVGCAC-CFMVVWHZSA-N 0.000 description 1
- HOLOYAZCIHDQNS-YVNDNENWSA-N Ile-Gln-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N HOLOYAZCIHDQNS-YVNDNENWSA-N 0.000 description 1
- WUKLZPHVWAMZQV-UKJIMTQDSA-N Ile-Glu-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](C(C)C)C(=O)O)N WUKLZPHVWAMZQV-UKJIMTQDSA-N 0.000 description 1
- MQFGXJNSUJTXDT-QSFUFRPTSA-N Ile-Gly-Ile Chemical compound N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)O MQFGXJNSUJTXDT-QSFUFRPTSA-N 0.000 description 1
- IOVUXUSIGXCREV-DKIMLUQUSA-N Ile-Leu-Phe Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 IOVUXUSIGXCREV-DKIMLUQUSA-N 0.000 description 1
- GVKKVHNRTUFCCE-BJDJZHNGSA-N Ile-Leu-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)O)N GVKKVHNRTUFCCE-BJDJZHNGSA-N 0.000 description 1
- YCKPUHHMCFSUMD-IUKAMOBKSA-N Ile-Thr-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(=O)O)C(=O)O)N YCKPUHHMCFSUMD-IUKAMOBKSA-N 0.000 description 1
- NAFIFZNBSPWYOO-RWRJDSDZSA-N Ile-Thr-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N NAFIFZNBSPWYOO-RWRJDSDZSA-N 0.000 description 1
- UYODHPPSCXBNCS-XUXIUFHCSA-N Ile-Val-Leu Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC(C)C UYODHPPSCXBNCS-XUXIUFHCSA-N 0.000 description 1
- 101710110377 Immediate early protein IE1 Proteins 0.000 description 1
- 101710205424 Immediate-early protein 1 Proteins 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- JTTHKOPSMAVJFE-VIFPVBQESA-N L-homophenylalanine Chemical compound OC(=O)[C@@H](N)CCC1=CC=CC=C1 JTTHKOPSMAVJFE-VIFPVBQESA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- LZDNBBYBDGBADK-UHFFFAOYSA-N L-valyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)C(C)C)C(O)=O)=CNC2=C1 LZDNBBYBDGBADK-UHFFFAOYSA-N 0.000 description 1
- NHTGHBARYWONDQ-JTQLQIEISA-N L-α-methyl-Tyrosine Chemical compound OC(=O)[C@](N)(C)CC1=CC=C(O)C=C1 NHTGHBARYWONDQ-JTQLQIEISA-N 0.000 description 1
- 241000446313 Lamella Species 0.000 description 1
- 101710192606 Latent membrane protein 2 Proteins 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 241000880493 Leptailurus serval Species 0.000 description 1
- CQQGCWPXDHTTNF-GUBZILKMSA-N Leu-Ala-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O CQQGCWPXDHTTNF-GUBZILKMSA-N 0.000 description 1
- PBCHMHROGNUXMK-DLOVCJGASA-N Leu-Ala-His Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 PBCHMHROGNUXMK-DLOVCJGASA-N 0.000 description 1
- QPRQGENIBFLVEB-BJDJZHNGSA-N Leu-Ala-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O QPRQGENIBFLVEB-BJDJZHNGSA-N 0.000 description 1
- HBJZFCIVFIBNSV-DCAQKATOSA-N Leu-Arg-Asn Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC(N)=O)C(O)=O HBJZFCIVFIBNSV-DCAQKATOSA-N 0.000 description 1
- GRZSCTXVCDUIPO-SRVKXCTJSA-N Leu-Arg-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(O)=O GRZSCTXVCDUIPO-SRVKXCTJSA-N 0.000 description 1
- HASRFYOMVPJRPU-SRVKXCTJSA-N Leu-Arg-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(O)=O)C(O)=O HASRFYOMVPJRPU-SRVKXCTJSA-N 0.000 description 1
- IBMVEYRWAWIOTN-RWMBFGLXSA-N Leu-Arg-Pro Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1CCC[C@@H]1C(O)=O IBMVEYRWAWIOTN-RWMBFGLXSA-N 0.000 description 1
- IGUOAYLTQJLPPD-DCAQKATOSA-N Leu-Asn-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N IGUOAYLTQJLPPD-DCAQKATOSA-N 0.000 description 1
- RFUBXQQFJFGJFV-GUBZILKMSA-N Leu-Asn-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O RFUBXQQFJFGJFV-GUBZILKMSA-N 0.000 description 1
- BPANDPNDMJHFEV-CIUDSAMLSA-N Leu-Asp-Ala Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(O)=O BPANDPNDMJHFEV-CIUDSAMLSA-N 0.000 description 1
- YKNBJXOJTURHCU-DCAQKATOSA-N Leu-Asp-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YKNBJXOJTURHCU-DCAQKATOSA-N 0.000 description 1
- MMEDVBWCMGRKKC-GARJFASQSA-N Leu-Asp-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N1CCC[C@@H]1C(=O)O)N MMEDVBWCMGRKKC-GARJFASQSA-N 0.000 description 1
- PNUCWVAGVNLUMW-CIUDSAMLSA-N Leu-Cys-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CO)C(O)=O PNUCWVAGVNLUMW-CIUDSAMLSA-N 0.000 description 1
- RVVBWTWPNFDYBE-SRVKXCTJSA-N Leu-Glu-Arg Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O RVVBWTWPNFDYBE-SRVKXCTJSA-N 0.000 description 1
- YVKSMSDXKMSIRX-GUBZILKMSA-N Leu-Glu-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O YVKSMSDXKMSIRX-GUBZILKMSA-N 0.000 description 1
- VZBIUJURDLFFOE-IHRRRGAJSA-N Leu-His-Arg Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O VZBIUJURDLFFOE-IHRRRGAJSA-N 0.000 description 1
- BKTXKJMNTSMJDQ-AVGNSLFASA-N Leu-His-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N BKTXKJMNTSMJDQ-AVGNSLFASA-N 0.000 description 1
- AVEGDIAXTDVBJS-XUXIUFHCSA-N Leu-Ile-Arg Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O AVEGDIAXTDVBJS-XUXIUFHCSA-N 0.000 description 1
- HNDWYLYAYNBWMP-AJNGGQMLSA-N Leu-Ile-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(C)C)N HNDWYLYAYNBWMP-AJNGGQMLSA-N 0.000 description 1
- QLDHBYRUNQZIJQ-DKIMLUQUSA-N Leu-Ile-Phe Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O QLDHBYRUNQZIJQ-DKIMLUQUSA-N 0.000 description 1
- JNDYEOUZBLOVOF-AVGNSLFASA-N Leu-Leu-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O JNDYEOUZBLOVOF-AVGNSLFASA-N 0.000 description 1
- QNBVTHNJGCOVFA-AVGNSLFASA-N Leu-Leu-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCC(O)=O QNBVTHNJGCOVFA-AVGNSLFASA-N 0.000 description 1
- XVZCXCTYGHPNEM-UHFFFAOYSA-N Leu-Leu-Pro Natural products CC(C)CC(N)C(=O)NC(CC(C)C)C(=O)N1CCCC1C(O)=O XVZCXCTYGHPNEM-UHFFFAOYSA-N 0.000 description 1
- FOBUGKUBUJOWAD-IHPCNDPISA-N Leu-Leu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(C)C)C(O)=O)=CNC2=C1 FOBUGKUBUJOWAD-IHPCNDPISA-N 0.000 description 1
- WXUOJXIGOPMDJM-SRVKXCTJSA-N Leu-Lys-Asn Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(O)=O WXUOJXIGOPMDJM-SRVKXCTJSA-N 0.000 description 1
- RZXLZBIUTDQHJQ-SRVKXCTJSA-N Leu-Lys-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O RZXLZBIUTDQHJQ-SRVKXCTJSA-N 0.000 description 1
- DDVHDMSBLRAKNV-IHRRRGAJSA-N Leu-Met-Leu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(C)C)C(O)=O DDVHDMSBLRAKNV-IHRRRGAJSA-N 0.000 description 1
- ZDBMWELMUCLUPL-QEJZJMRPSA-N Leu-Phe-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C)C(O)=O)CC1=CC=CC=C1 ZDBMWELMUCLUPL-QEJZJMRPSA-N 0.000 description 1
- PJWOOBTYQNNRBF-BZSNNMDCSA-N Leu-Phe-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCCCN)C(=O)O)N PJWOOBTYQNNRBF-BZSNNMDCSA-N 0.000 description 1
- UHNQRAFSEBGZFZ-YESZJQIVSA-N Leu-Phe-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N2CCC[C@@H]2C(=O)O)N UHNQRAFSEBGZFZ-YESZJQIVSA-N 0.000 description 1
- WMIOEVKKYIMVKI-DCAQKATOSA-N Leu-Pro-Ala Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(O)=O WMIOEVKKYIMVKI-DCAQKATOSA-N 0.000 description 1
- YUTNOGOMBNYPFH-XUXIUFHCSA-N Leu-Pro-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(O)=O YUTNOGOMBNYPFH-XUXIUFHCSA-N 0.000 description 1
- AKVBOOKXVAMKSS-GUBZILKMSA-N Leu-Ser-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(O)=O AKVBOOKXVAMKSS-GUBZILKMSA-N 0.000 description 1
- MVHXGBZUJLWZOH-BJDJZHNGSA-N Leu-Ser-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O MVHXGBZUJLWZOH-BJDJZHNGSA-N 0.000 description 1
- AMSSKPUHBUQBOQ-SRVKXCTJSA-N Leu-Ser-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)O)N AMSSKPUHBUQBOQ-SRVKXCTJSA-N 0.000 description 1
- LFXSPAIBSZSTEM-PMVMPFDFSA-N Leu-Trp-Phe Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)N[C@@H](CC3=CC=CC=C3)C(=O)O)N LFXSPAIBSZSTEM-PMVMPFDFSA-N 0.000 description 1
- SUYRAPCRSCCPAK-VFAJRCTISA-N Leu-Trp-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SUYRAPCRSCCPAK-VFAJRCTISA-N 0.000 description 1
- RDFIVFHPOSOXMW-ACRUOGEOSA-N Leu-Tyr-Phe Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O RDFIVFHPOSOXMW-ACRUOGEOSA-N 0.000 description 1
- AXVIGSRGTMNSJU-YESZJQIVSA-N Leu-Tyr-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N2CCC[C@@H]2C(=O)O)N AXVIGSRGTMNSJU-YESZJQIVSA-N 0.000 description 1
- FBNPMTNBFFAMMH-UHFFFAOYSA-N Leu-Val-Arg Natural products CC(C)CC(N)C(=O)NC(C(C)C)C(=O)NC(C(O)=O)CCCN=C(N)N FBNPMTNBFFAMMH-UHFFFAOYSA-N 0.000 description 1
- XZNJZXJZBMBGGS-NHCYSSNCSA-N Leu-Val-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O XZNJZXJZBMBGGS-NHCYSSNCSA-N 0.000 description 1
- YQFZRHYZLARWDY-IHRRRGAJSA-N Leu-Val-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCCCN YQFZRHYZLARWDY-IHRRRGAJSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 108010028921 Lipopeptides Proteins 0.000 description 1
- YIBOAHAOAWACDK-QEJZJMRPSA-N Lys-Ala-Phe Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 YIBOAHAOAWACDK-QEJZJMRPSA-N 0.000 description 1
- WXJKFRMKJORORD-DCAQKATOSA-N Lys-Arg-Ala Chemical compound NC(=N)NCCC[C@@H](C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@@H](N)CCCCN WXJKFRMKJORORD-DCAQKATOSA-N 0.000 description 1
- HIIZIQUUHIXUJY-GUBZILKMSA-N Lys-Asp-Gln Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O HIIZIQUUHIXUJY-GUBZILKMSA-N 0.000 description 1
- LMVOVCYVZBBWQB-SRVKXCTJSA-N Lys-Asp-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN LMVOVCYVZBBWQB-SRVKXCTJSA-N 0.000 description 1
- HEWWNLVEWBJBKA-WDCWCFNPSA-N Lys-Gln-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCCN HEWWNLVEWBJBKA-WDCWCFNPSA-N 0.000 description 1
- QKXZCUCBFPEXNK-KKUMJFAQSA-N Lys-Leu-His Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 QKXZCUCBFPEXNK-KKUMJFAQSA-N 0.000 description 1
- TVOOGUNBIWAURO-KATARQTJSA-N Lys-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCCCN)N)O TVOOGUNBIWAURO-KATARQTJSA-N 0.000 description 1
- IEVXCWPVBYCJRZ-IXOXFDKPSA-N Lys-Thr-His Chemical compound NCCCC[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 IEVXCWPVBYCJRZ-IXOXFDKPSA-N 0.000 description 1
- YKBSXQFZWFXFIB-VOAKCMCISA-N Lys-Thr-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CCCCN)C(O)=O YKBSXQFZWFXFIB-VOAKCMCISA-N 0.000 description 1
- FPQMQEOVSKMVMA-ACRUOGEOSA-N Lys-Tyr-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)NC(=O)[C@H](CCCCN)N)O FPQMQEOVSKMVMA-ACRUOGEOSA-N 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241000699673 Mesocricetus auratus Species 0.000 description 1
- WYEXWKAWMNJKPN-UBHSHLNASA-N Met-Ala-Phe Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CCSC)N WYEXWKAWMNJKPN-UBHSHLNASA-N 0.000 description 1
- ZAJNRWKGHWGPDQ-SDDRHHMPSA-N Met-Arg-Pro Chemical compound CSCC[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1CCC[C@@H]1C(=O)O)N ZAJNRWKGHWGPDQ-SDDRHHMPSA-N 0.000 description 1
- USBFEVBHEQBWDD-AVGNSLFASA-N Met-Leu-Val Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O USBFEVBHEQBWDD-AVGNSLFASA-N 0.000 description 1
- GGXZOTSDJJTDGB-GUBZILKMSA-N Met-Ser-Val Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O GGXZOTSDJJTDGB-GUBZILKMSA-N 0.000 description 1
- WOGNGBROIHHFAO-JYJNAYRXSA-N Met-Tyr-Met Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCSC)C(=O)O)N WOGNGBROIHHFAO-JYJNAYRXSA-N 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101100518501 Mus musculus Spp1 gene Proteins 0.000 description 1
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 1
- AUEJLPRZGVVDNU-UHFFFAOYSA-N N-L-tyrosyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CC1=CC=C(O)C=C1 AUEJLPRZGVVDNU-UHFFFAOYSA-N 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 108010066427 N-valyltryptophan Proteins 0.000 description 1
- BQVUABVGYYSDCJ-UHFFFAOYSA-N Nalpha-L-Leucyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)CC(C)C)C(O)=O)=CNC2=C1 BQVUABVGYYSDCJ-UHFFFAOYSA-N 0.000 description 1
- 101100342977 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) leu-1 gene Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102100028961 Peroxisome proliferator-activated receptor gamma coactivator 1-beta Human genes 0.000 description 1
- FPTXMUIBLMGTQH-ONGXEEELSA-N Phe-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=CC=C1 FPTXMUIBLMGTQH-ONGXEEELSA-N 0.000 description 1
- OPEVYHFJXLCCRT-AVGNSLFASA-N Phe-Gln-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O OPEVYHFJXLCCRT-AVGNSLFASA-N 0.000 description 1
- KJJROSNFBRWPHS-JYJNAYRXSA-N Phe-Glu-Leu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O KJJROSNFBRWPHS-JYJNAYRXSA-N 0.000 description 1
- PBXYXOAEQQUVMM-ULQDDVLXSA-N Phe-His-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CC2=CC=CC=C2)N PBXYXOAEQQUVMM-ULQDDVLXSA-N 0.000 description 1
- RORUIHAWOLADSH-HJWJTTGWSA-N Phe-Ile-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CC1=CC=CC=C1 RORUIHAWOLADSH-HJWJTTGWSA-N 0.000 description 1
- YCCUXNNKXDGMAM-KKUMJFAQSA-N Phe-Leu-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YCCUXNNKXDGMAM-KKUMJFAQSA-N 0.000 description 1
- HQPWNHXERZCIHP-PMVMPFDFSA-N Phe-Leu-Trp Chemical compound C([C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)C1=CC=CC=C1 HQPWNHXERZCIHP-PMVMPFDFSA-N 0.000 description 1
- QRUOLOPKCOEZKU-HJWJTTGWSA-N Phe-Met-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CC1=CC=CC=C1)N QRUOLOPKCOEZKU-HJWJTTGWSA-N 0.000 description 1
- IAOZOFPONWDXNT-IXOXFDKPSA-N Phe-Ser-Thr Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O IAOZOFPONWDXNT-IXOXFDKPSA-N 0.000 description 1
- BSTPNLNKHKBONJ-HTUGSXCWSA-N Phe-Thr-Gln Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)N)O BSTPNLNKHKBONJ-HTUGSXCWSA-N 0.000 description 1
- APZNYJFGVAGFCF-JYJNAYRXSA-N Phe-Val-Val Chemical compound CC(C)[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)Cc1ccccc1)C(C)C)C(O)=O APZNYJFGVAGFCF-JYJNAYRXSA-N 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- OOLOTUZJUBOMAX-GUBZILKMSA-N Pro-Ala-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O OOLOTUZJUBOMAX-GUBZILKMSA-N 0.000 description 1
- OLHDPZMYUSBGDE-GUBZILKMSA-N Pro-Arg-Cys Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CS)C(=O)O OLHDPZMYUSBGDE-GUBZILKMSA-N 0.000 description 1
- ORPZXBQTEHINPB-SRVKXCTJSA-N Pro-Arg-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H]1CCCN1)C(O)=O ORPZXBQTEHINPB-SRVKXCTJSA-N 0.000 description 1
- INXAPZFIOVGHSV-CIUDSAMLSA-N Pro-Asn-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H]1CCCN1 INXAPZFIOVGHSV-CIUDSAMLSA-N 0.000 description 1
- KPDRZQUWJKTMBP-DCAQKATOSA-N Pro-Asp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@@H]1CCCN1 KPDRZQUWJKTMBP-DCAQKATOSA-N 0.000 description 1
- HXOLCSYHGRNXJJ-IHRRRGAJSA-N Pro-Asp-Phe Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O HXOLCSYHGRNXJJ-IHRRRGAJSA-N 0.000 description 1
- XZONQWUEBAFQPO-HJGDQZAQSA-N Pro-Gln-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XZONQWUEBAFQPO-HJGDQZAQSA-N 0.000 description 1
- YSUZKYSRAFNLRB-ULQDDVLXSA-N Pro-Gln-Trp Chemical compound N([C@@H](CCC(=O)N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)C(=O)[C@@H]1CCCN1 YSUZKYSRAFNLRB-ULQDDVLXSA-N 0.000 description 1
- KIPIKSXPPLABPN-CIUDSAMLSA-N Pro-Glu-Asn Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CCCN1 KIPIKSXPPLABPN-CIUDSAMLSA-N 0.000 description 1
- NXEYSLRNNPWCRN-SRVKXCTJSA-N Pro-Glu-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O NXEYSLRNNPWCRN-SRVKXCTJSA-N 0.000 description 1
- JUJGNDZIKKQMDJ-IHRRRGAJSA-N Pro-His-His Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC1=CNC=N1)C(O)=O JUJGNDZIKKQMDJ-IHRRRGAJSA-N 0.000 description 1
- XQHGISDMVBTGAL-ULQDDVLXSA-N Pro-His-Phe Chemical compound C([C@@H](C(=O)[O-])NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1[NH2+]CCC1)C1=CC=CC=C1 XQHGISDMVBTGAL-ULQDDVLXSA-N 0.000 description 1
- LPGSNRSLPHRNBW-AVGNSLFASA-N Pro-His-Val Chemical compound C([C@@H](C(=O)N[C@@H](C(C)C)C([O-])=O)NC(=O)[C@H]1[NH2+]CCC1)C1=CN=CN1 LPGSNRSLPHRNBW-AVGNSLFASA-N 0.000 description 1
- AQGUSRZKDZYGGV-GMOBBJLQSA-N Pro-Ile-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(O)=O AQGUSRZKDZYGGV-GMOBBJLQSA-N 0.000 description 1
- FMLRRBDLBJLJIK-DCAQKATOSA-N Pro-Leu-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H]1CCCN1 FMLRRBDLBJLJIK-DCAQKATOSA-N 0.000 description 1
- CLJLVCYFABNTHP-DCAQKATOSA-N Pro-Leu-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O CLJLVCYFABNTHP-DCAQKATOSA-N 0.000 description 1
- FXGIMYRVJJEIIM-UWVGGRQHSA-N Pro-Leu-Gly Chemical compound OC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H]1CCCN1 FXGIMYRVJJEIIM-UWVGGRQHSA-N 0.000 description 1
- RPLMFKUKFZOTER-AVGNSLFASA-N Pro-Met-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCSC)NC(=O)[C@@H]1CCCN1 RPLMFKUKFZOTER-AVGNSLFASA-N 0.000 description 1
- JLMZKEQFMVORMA-SRVKXCTJSA-N Pro-Pro-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 JLMZKEQFMVORMA-SRVKXCTJSA-N 0.000 description 1
- KBUAPZAZPWNYSW-SRVKXCTJSA-N Pro-Pro-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 KBUAPZAZPWNYSW-SRVKXCTJSA-N 0.000 description 1
- POQFNPILEQEODH-FXQIFTODSA-N Pro-Ser-Ala Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O POQFNPILEQEODH-FXQIFTODSA-N 0.000 description 1
- PRKWBYCXBBSLSK-GUBZILKMSA-N Pro-Ser-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O PRKWBYCXBBSLSK-GUBZILKMSA-N 0.000 description 1
- GZNYIXWOIUFLGO-ZJDVBMNYSA-N Pro-Thr-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GZNYIXWOIUFLGO-ZJDVBMNYSA-N 0.000 description 1
- 108020005091 Replication Origin Proteins 0.000 description 1
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- ZUGXSSFMTXKHJS-ZLUOBGJFSA-N Ser-Ala-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(O)=O ZUGXSSFMTXKHJS-ZLUOBGJFSA-N 0.000 description 1
- WTWGOQRNRFHFQD-JBDRJPRFSA-N Ser-Ala-Ile Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O WTWGOQRNRFHFQD-JBDRJPRFSA-N 0.000 description 1
- WDXYVIIVDIDOSX-DCAQKATOSA-N Ser-Arg-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)CCCN=C(N)N WDXYVIIVDIDOSX-DCAQKATOSA-N 0.000 description 1
- WXUBSIDKNMFAGS-IHRRRGAJSA-N Ser-Arg-Tyr Chemical compound NC(N)=NCCC[C@H](NC(=O)[C@H](CO)N)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 WXUBSIDKNMFAGS-IHRRRGAJSA-N 0.000 description 1
- FIDMVVBUOCMMJG-CIUDSAMLSA-N Ser-Asn-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CO FIDMVVBUOCMMJG-CIUDSAMLSA-N 0.000 description 1
- BGOWRLSWJCVYAQ-CIUDSAMLSA-N Ser-Asp-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O BGOWRLSWJCVYAQ-CIUDSAMLSA-N 0.000 description 1
- KJMOINFQVCCSDX-XKBZYTNZSA-N Ser-Gln-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KJMOINFQVCCSDX-XKBZYTNZSA-N 0.000 description 1
- SMIDBHKWSYUBRZ-ACZMJKKPSA-N Ser-Glu-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O SMIDBHKWSYUBRZ-ACZMJKKPSA-N 0.000 description 1
- XXXAXOWMBOKTRN-XPUUQOCRSA-N Ser-Gly-Val Chemical compound [H]N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O XXXAXOWMBOKTRN-XPUUQOCRSA-N 0.000 description 1
- JEHPKECJCALLRW-CUJWVEQBSA-N Ser-His-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O JEHPKECJCALLRW-CUJWVEQBSA-N 0.000 description 1
- HEUVHBXOVZONPU-BJDJZHNGSA-N Ser-Leu-Ile Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HEUVHBXOVZONPU-BJDJZHNGSA-N 0.000 description 1
- VZQRNAYURWAEFE-KKUMJFAQSA-N Ser-Leu-Phe Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 VZQRNAYURWAEFE-KKUMJFAQSA-N 0.000 description 1
- PPNPDKGQRFSCAC-CIUDSAMLSA-N Ser-Lys-Asp Chemical compound NCCCC[C@H](NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPNPDKGQRFSCAC-CIUDSAMLSA-N 0.000 description 1
- GDUZTEQRAOXYJS-SRVKXCTJSA-N Ser-Phe-Asn Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CO)N GDUZTEQRAOXYJS-SRVKXCTJSA-N 0.000 description 1
- NUEHQDHDLDXCRU-GUBZILKMSA-N Ser-Pro-Arg Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCN=C(N)N)C(O)=O NUEHQDHDLDXCRU-GUBZILKMSA-N 0.000 description 1
- PPCZVWHJWJFTFN-ZLUOBGJFSA-N Ser-Ser-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPCZVWHJWJFTFN-ZLUOBGJFSA-N 0.000 description 1
- PYTKULIABVRXSC-BWBBJGPYSA-N Ser-Ser-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PYTKULIABVRXSC-BWBBJGPYSA-N 0.000 description 1
- NADLKBTYNKUJEP-KATARQTJSA-N Ser-Thr-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O NADLKBTYNKUJEP-KATARQTJSA-N 0.000 description 1
- VLMIUSLQONKLDV-HEIBUPTGSA-N Ser-Thr-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O VLMIUSLQONKLDV-HEIBUPTGSA-N 0.000 description 1
- BDMWLJLPPUCLNV-XGEHTFHBSA-N Ser-Thr-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O BDMWLJLPPUCLNV-XGEHTFHBSA-N 0.000 description 1
- WMZVVNLPHFSUPA-BPUTZDHNSA-N Ser-Trp-Arg Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CO)N)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)=CNC2=C1 WMZVVNLPHFSUPA-BPUTZDHNSA-N 0.000 description 1
- FHXGMDRKJHKLKW-QWRGUYRKSA-N Ser-Tyr-Gly Chemical compound OC[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=C(O)C=C1 FHXGMDRKJHKLKW-QWRGUYRKSA-N 0.000 description 1
- PLQWGQUNUPMNOD-KKUMJFAQSA-N Ser-Tyr-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(O)=O PLQWGQUNUPMNOD-KKUMJFAQSA-N 0.000 description 1
- PMTWIUBUQRGCSB-FXQIFTODSA-N Ser-Val-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O PMTWIUBUQRGCSB-FXQIFTODSA-N 0.000 description 1
- YEDSOSIKVUMIJE-DCAQKATOSA-N Ser-Val-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O YEDSOSIKVUMIJE-DCAQKATOSA-N 0.000 description 1
- ANOQEBQWIAYIMV-AEJSXWLSSA-N Ser-Val-Pro Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CO)N ANOQEBQWIAYIMV-AEJSXWLSSA-N 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 108091027544 Subgenomic mRNA Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 101710109576 Terminal protein Proteins 0.000 description 1
- LVHHEVGYAZGXDE-KDXUFGMBSA-N Thr-Ala-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C)C(=O)N1CCC[C@@H]1C(=O)O)N)O LVHHEVGYAZGXDE-KDXUFGMBSA-N 0.000 description 1
- XSLXHSYIVPGEER-KZVJFYERSA-N Thr-Ala-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O XSLXHSYIVPGEER-KZVJFYERSA-N 0.000 description 1
- VFEHSAJCWWHDBH-RHYQMDGZSA-N Thr-Arg-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(O)=O VFEHSAJCWWHDBH-RHYQMDGZSA-N 0.000 description 1
- OHAJHDJOCKKJLV-LKXGYXEUSA-N Thr-Asp-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O OHAJHDJOCKKJLV-LKXGYXEUSA-N 0.000 description 1
- ASJDFGOPDCVXTG-KATARQTJSA-N Thr-Cys-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(C)C)C(O)=O ASJDFGOPDCVXTG-KATARQTJSA-N 0.000 description 1
- WDFPMSHYMRBLKM-NKIYYHGXSA-N Thr-Glu-His Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N)O WDFPMSHYMRBLKM-NKIYYHGXSA-N 0.000 description 1
- YDWLCDQXLCILCZ-BWAGICSOSA-N Thr-His-Tyr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O YDWLCDQXLCILCZ-BWAGICSOSA-N 0.000 description 1
- PRNGXSILMXSWQQ-OEAJRASXSA-N Thr-Leu-Phe Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O PRNGXSILMXSWQQ-OEAJRASXSA-N 0.000 description 1
- VRUFCJZQDACGLH-UVOCVTCTSA-N Thr-Leu-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O VRUFCJZQDACGLH-UVOCVTCTSA-N 0.000 description 1
- PUEWAXRPXOEQOW-HJGDQZAQSA-N Thr-Met-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(N)=O)C(O)=O PUEWAXRPXOEQOW-HJGDQZAQSA-N 0.000 description 1
- DNCUODYZAMHLCV-XGEHTFHBSA-N Thr-Pro-Cys Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CS)C(=O)O)N)O DNCUODYZAMHLCV-XGEHTFHBSA-N 0.000 description 1
- JAJOFWABAUKAEJ-QTKMDUPCSA-N Thr-Pro-His Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)N)O JAJOFWABAUKAEJ-QTKMDUPCSA-N 0.000 description 1
- SGAOHNPSEPVAFP-ZDLURKLDSA-N Thr-Ser-Gly Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)NCC(O)=O SGAOHNPSEPVAFP-ZDLURKLDSA-N 0.000 description 1
- AHERARIZBPOMNU-KATARQTJSA-N Thr-Ser-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O AHERARIZBPOMNU-KATARQTJSA-N 0.000 description 1
- VBMOVTMNHWPZJR-SUSMZKCASA-N Thr-Thr-Glu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(O)=O VBMOVTMNHWPZJR-SUSMZKCASA-N 0.000 description 1
- BBPCSGKKPJUYRB-UVOCVTCTSA-N Thr-Thr-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O BBPCSGKKPJUYRB-UVOCVTCTSA-N 0.000 description 1
- KPMIQCXJDVKWKO-IFFSRLJSSA-N Thr-Val-Glu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O KPMIQCXJDVKWKO-IFFSRLJSSA-N 0.000 description 1
- SBYQHZCMVSPQCS-RCWTZXSCSA-N Thr-Val-Met Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCSC)C(O)=O SBYQHZCMVSPQCS-RCWTZXSCSA-N 0.000 description 1
- QNXZCKMXHPULME-ZNSHCXBVSA-N Thr-Val-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N)O QNXZCKMXHPULME-ZNSHCXBVSA-N 0.000 description 1
- MNYNCKZAEIAONY-XGEHTFHBSA-N Thr-Val-Ser Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O MNYNCKZAEIAONY-XGEHTFHBSA-N 0.000 description 1
- 108091036066 Three prime untranslated region Proteins 0.000 description 1
- 241000710924 Togaviridae Species 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- BOESUSAIMQGVJD-RYQLBKOJSA-N Trp-Met-Pro Chemical compound CSCC[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CNC3=CC=CC=C32)N BOESUSAIMQGVJD-RYQLBKOJSA-N 0.000 description 1
- DTPWXZXGFAHEKL-NWLDYVSISA-N Trp-Thr-Glu Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(O)=O DTPWXZXGFAHEKL-NWLDYVSISA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- CRWOSTCODDFEKZ-HRCADAONSA-N Tyr-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC2=CC=C(C=C2)O)N)C(=O)O CRWOSTCODDFEKZ-HRCADAONSA-N 0.000 description 1
- IIJWXEUNETVJPV-IHRRRGAJSA-N Tyr-Arg-Ser Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CO)C(=O)O)N)O IIJWXEUNETVJPV-IHRRRGAJSA-N 0.000 description 1
- DKKHULUSOSWGHS-UWJYBYFXSA-N Tyr-Asn-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC1=CC=C(C=C1)O)N DKKHULUSOSWGHS-UWJYBYFXSA-N 0.000 description 1
- MBFJIHUHHCJBSN-AVGNSLFASA-N Tyr-Asn-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O MBFJIHUHHCJBSN-AVGNSLFASA-N 0.000 description 1
- PEVVXUGSAKEPEN-AVGNSLFASA-N Tyr-Asn-Glu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O PEVVXUGSAKEPEN-AVGNSLFASA-N 0.000 description 1
- SCCKSNREWHMKOJ-SRVKXCTJSA-N Tyr-Asn-Ser Chemical compound N[C@@H](Cc1ccc(O)cc1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O SCCKSNREWHMKOJ-SRVKXCTJSA-N 0.000 description 1
- RCLOWEZASFJFEX-KKUMJFAQSA-N Tyr-Asp-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 RCLOWEZASFJFEX-KKUMJFAQSA-N 0.000 description 1
- MNMYOSZWCKYEDI-JRQIVUDYSA-N Tyr-Asp-Thr Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MNMYOSZWCKYEDI-JRQIVUDYSA-N 0.000 description 1
- NQJDICVXXIMMMB-XDTLVQLUSA-N Tyr-Glu-Ala Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O NQJDICVXXIMMMB-XDTLVQLUSA-N 0.000 description 1
- KOVXHANYYYMBRF-IRIUXVKKSA-N Tyr-Glu-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N)O KOVXHANYYYMBRF-IRIUXVKKSA-N 0.000 description 1
- PMDWYLVWHRTJIW-STQMWFEESA-N Tyr-Gly-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC1=CC=C(O)C=C1 PMDWYLVWHRTJIW-STQMWFEESA-N 0.000 description 1
- KCPFDGNYAMKZQP-KBPBESRZSA-N Tyr-Gly-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O KCPFDGNYAMKZQP-KBPBESRZSA-N 0.000 description 1
- KHCSOLAHNLOXJR-BZSNNMDCSA-N Tyr-Leu-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O KHCSOLAHNLOXJR-BZSNNMDCSA-N 0.000 description 1
- DAOREBHZAKCOEN-ULQDDVLXSA-N Tyr-Leu-Met Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(O)=O DAOREBHZAKCOEN-ULQDDVLXSA-N 0.000 description 1
- RGYCVIZZTUBSSG-JYJNAYRXSA-N Tyr-Pro-Val Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O RGYCVIZZTUBSSG-JYJNAYRXSA-N 0.000 description 1
- QFHRUCJIRVILCK-YJRXYDGGSA-N Tyr-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N)O QFHRUCJIRVILCK-YJRXYDGGSA-N 0.000 description 1
- AOIZTZRWMSPPAY-KAOXEZKKSA-N Tyr-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC2=CC=C(C=C2)O)N)O AOIZTZRWMSPPAY-KAOXEZKKSA-N 0.000 description 1
- UUJHRSTVQCFDPA-UFYCRDLUSA-N Tyr-Tyr-Val Chemical compound C([C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)NC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 UUJHRSTVQCFDPA-UFYCRDLUSA-N 0.000 description 1
- DJIJBQYBDKGDIS-JYJNAYRXSA-N Tyr-Val-Val Chemical compound CC(C)[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)Cc1ccc(O)cc1)C(C)C)C(O)=O DJIJBQYBDKGDIS-JYJNAYRXSA-N 0.000 description 1
- 206010046865 Vaccinia virus infection Diseases 0.000 description 1
- YFOCMOVJBQDBCE-NRPADANISA-N Val-Ala-Glu Chemical compound C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](C(C)C)N YFOCMOVJBQDBCE-NRPADANISA-N 0.000 description 1
- KKHRWGYHBZORMQ-NHCYSSNCSA-N Val-Arg-Glu Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N KKHRWGYHBZORMQ-NHCYSSNCSA-N 0.000 description 1
- HZYOWMGWKKRMBZ-BYULHYEWSA-N Val-Asp-Asp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC(=O)O)C(=O)O)N HZYOWMGWKKRMBZ-BYULHYEWSA-N 0.000 description 1
- TZVUSFMQWPWHON-NHCYSSNCSA-N Val-Asp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](C(C)C)N TZVUSFMQWPWHON-NHCYSSNCSA-N 0.000 description 1
- UEHRGZCNLSWGHK-DLOVCJGASA-N Val-Glu-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O UEHRGZCNLSWGHK-DLOVCJGASA-N 0.000 description 1
- BEGDZYNDCNEGJZ-XVKPBYJWSA-N Val-Gly-Gln Chemical compound CC(C)[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCC(N)=O BEGDZYNDCNEGJZ-XVKPBYJWSA-N 0.000 description 1
- HQYVQDRYODWONX-DCAQKATOSA-N Val-His-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CO)C(=O)O)N HQYVQDRYODWONX-DCAQKATOSA-N 0.000 description 1
- UMPVMAYCLYMYGA-ONGXEEELSA-N Val-Leu-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O UMPVMAYCLYMYGA-ONGXEEELSA-N 0.000 description 1
- AEMPCGRFEZTWIF-IHRRRGAJSA-N Val-Leu-Lys Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(O)=O AEMPCGRFEZTWIF-IHRRRGAJSA-N 0.000 description 1
- RFKJNTRMXGCKFE-FHWLQOOXSA-N Val-Leu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)CC(C)C)C(O)=O)=CNC2=C1 RFKJNTRMXGCKFE-FHWLQOOXSA-N 0.000 description 1
- IJGPOONOTBNTFS-GVXVVHGQSA-N Val-Lys-Glu Chemical compound [H]N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(O)=O IJGPOONOTBNTFS-GVXVVHGQSA-N 0.000 description 1
- QRVPEKJBBRYISE-XUXIUFHCSA-N Val-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C(C)C)N QRVPEKJBBRYISE-XUXIUFHCSA-N 0.000 description 1
- YLRAFVVWZRSZQC-DZKIICNBSA-N Val-Phe-Glu Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N YLRAFVVWZRSZQC-DZKIICNBSA-N 0.000 description 1
- XBJKAZATRJBDCU-GUBZILKMSA-N Val-Pro-Ala Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(O)=O XBJKAZATRJBDCU-GUBZILKMSA-N 0.000 description 1
- DOFAQXCYFQKSHT-SRVKXCTJSA-N Val-Pro-Pro Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 DOFAQXCYFQKSHT-SRVKXCTJSA-N 0.000 description 1
- VIKZGAUAKQZDOF-NRPADANISA-N Val-Ser-Glu Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCC(O)=O VIKZGAUAKQZDOF-NRPADANISA-N 0.000 description 1
- PZTZYZUTCPZWJH-FXQIFTODSA-N Val-Ser-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)O)N PZTZYZUTCPZWJH-FXQIFTODSA-N 0.000 description 1
- UJMCYJKPDFQLHX-XGEHTFHBSA-N Val-Ser-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](C(C)C)N)O UJMCYJKPDFQLHX-XGEHTFHBSA-N 0.000 description 1
- YQYFYUSYEDNLSD-YEPSODPASA-N Val-Thr-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O YQYFYUSYEDNLSD-YEPSODPASA-N 0.000 description 1
- GTACFKZDQFTVAI-STECZYCISA-N Val-Tyr-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)CC1=CC=C(O)C=C1 GTACFKZDQFTVAI-STECZYCISA-N 0.000 description 1
- ZLNYBMWGPOKSLW-LSJOCFKGSA-N Val-Val-Asp Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O ZLNYBMWGPOKSLW-LSJOCFKGSA-N 0.000 description 1
- LLJLBRRXKZTTRD-GUBZILKMSA-N Val-Val-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(=O)O)N LLJLBRRXKZTTRD-GUBZILKMSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 108700005077 Viral Genes Proteins 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 108020000999 Viral RNA Proteins 0.000 description 1
- 229940123627 Viral replication inhibitor Drugs 0.000 description 1
- ISXSJGHXHUZXNF-LXZPIJOJSA-N [(3s,8s,9s,10r,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-3-yl] n-[2-(dimethylamino)ethyl]carbamate;hydrochloride Chemical compound Cl.C1C=C2C[C@@H](OC(=O)NCCN(C)C)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 ISXSJGHXHUZXNF-LXZPIJOJSA-N 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 108010045023 alanyl-prolyl-tyrosine Proteins 0.000 description 1
- 108010041407 alanylaspartic acid Proteins 0.000 description 1
- 108010070944 alanylhistidine Proteins 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 1
- 150000001371 alpha-amino acids Chemical class 0.000 description 1
- 235000008206 alpha-amino acids Nutrition 0.000 description 1
- HRRYYCWYCMJNGA-ZETCQYMHSA-N alpha-methyl-L-histidine Chemical compound OC(=O)[C@](N)(C)CC1=CN=CN1 HRRYYCWYCMJNGA-ZETCQYMHSA-N 0.000 description 1
- HYOWVAAEQCNGLE-JTQLQIEISA-N alpha-methyl-L-phenylalanine Chemical compound OC(=O)[C@](N)(C)CC1=CC=CC=C1 HYOWVAAEQCNGLE-JTQLQIEISA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical class [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 230000001740 anti-invasion Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 108010060035 arginylproline Proteins 0.000 description 1
- 108010069205 aspartyl-phenylalanine Proteins 0.000 description 1
- 108010038633 aspartylglutamate Proteins 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- SWJXWSAKHXBQSY-UHFFFAOYSA-N benzo(c)cinnoline Chemical compound C1=CC=C2C3=CC=CC=C3N=NC2=C1 SWJXWSAKHXBQSY-UHFFFAOYSA-N 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 239000012148 binding buffer Substances 0.000 description 1
- 239000000227 bioadhesive Substances 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004900 c-terminal fragment Anatomy 0.000 description 1
- 102220427461 c.289A>G Human genes 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- SQQXRXKYTKFFSM-UHFFFAOYSA-N chembl1992147 Chemical compound OC1=C(OC)C(OC)=CC=C1C1=C(C)C(C(O)=O)=NC(C=2N=C3C4=NC(C)(C)N=C4C(OC)=C(O)C3=CC=2)=C1N SQQXRXKYTKFFSM-UHFFFAOYSA-N 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000011490 co-immunoprecipitation assay Methods 0.000 description 1
- 230000008045 co-localization Effects 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- NKLPQNGYXWVELD-UHFFFAOYSA-M coomassie brilliant blue Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=C1 NKLPQNGYXWVELD-UHFFFAOYSA-M 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000012149 elution buffer Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 230000037433 frameshift Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 108010078144 glutaminyl-glycine Proteins 0.000 description 1
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 1
- 108010079547 glutamylmethionine Proteins 0.000 description 1
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 1
- 108010050475 glycyl-leucyl-tyrosine Proteins 0.000 description 1
- YMAWOPBAYDPSLA-UHFFFAOYSA-N glycylglycine Chemical compound [NH3+]CC(=O)NCC([O-])=O YMAWOPBAYDPSLA-UHFFFAOYSA-N 0.000 description 1
- 108010037850 glycylvaline Proteins 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000003966 growth inhibitor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 108010036413 histidylglycine Proteins 0.000 description 1
- 108010025306 histidylleucine Proteins 0.000 description 1
- 239000012510 hollow fiber Substances 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- HOPZBJPSUKPLDT-UHFFFAOYSA-N imidazo[4,5-h]quinolin-2-one Chemical class C1=CN=C2C3=NC(=O)N=C3C=CC2=C1 HOPZBJPSUKPLDT-UHFFFAOYSA-N 0.000 description 1
- 229940124669 imidazoquinoline Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000001571 immunoadjuvant effect Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 239000000568 immunological adjuvant Substances 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 1
- 108010078274 isoleucylvaline Proteins 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 108010012058 leucyltyrosine Proteins 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 108010064235 lysylglycine Proteins 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 108010005942 methionylglycine Proteins 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 230000003232 mucoadhesive effect Effects 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 125000001446 muramyl group Chemical group N[C@@H](C=O)[C@@H](O[C@@H](C(=O)*)C)[C@H](O)[C@H](O)CO 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 210000004898 n-terminal fragment Anatomy 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 239000002077 nanosphere Substances 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 229960000470 omalizumab Drugs 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940023041 peptide vaccine Drugs 0.000 description 1
- 238000009521 phase II clinical trial Methods 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 108010073101 phenylalanylleucine Proteins 0.000 description 1
- 108010073025 phenylalanylphenylalanine Proteins 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 229920002627 poly(phosphazenes) Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920000056 polyoxyethylene ether Polymers 0.000 description 1
- 229940051841 polyoxyethylene ether Drugs 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 108010077112 prolyl-proline Proteins 0.000 description 1
- 108010031719 prolyl-serine Proteins 0.000 description 1
- 108010004914 prolylarginine Proteins 0.000 description 1
- 108010053725 prolylvaline Proteins 0.000 description 1
- 229940021993 prophylactic vaccine Drugs 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 239000002510 pyrogen Substances 0.000 description 1
- ZADWXFSZEAPBJS-UHFFFAOYSA-N racemic N-methyl tryptophan Natural products C1=CC=C2N(C)C=C(CC(N)C(O)=O)C2=C1 ZADWXFSZEAPBJS-UHFFFAOYSA-N 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960000329 ribavirin Drugs 0.000 description 1
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 1
- 102200017868 rs121434557 Human genes 0.000 description 1
- 102220088226 rs756434530 Human genes 0.000 description 1
- 210000003079 salivary gland Anatomy 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 108010069117 seryl-lysyl-aspartic acid Proteins 0.000 description 1
- 108010026333 seryl-proline Proteins 0.000 description 1
- 125000005629 sialic acid group Chemical group 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000012289 standard assay Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 150000003584 thiosemicarbazones Chemical class 0.000 description 1
- 108010061238 threonyl-glycine Proteins 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 108010080629 tryptophan-leucine Proteins 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 108010078580 tyrosylleucine Proteins 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 208000007089 vaccinia Diseases 0.000 description 1
- 108010073969 valyllysine Proteins 0.000 description 1
- 108010009962 valyltyrosine Proteins 0.000 description 1
- 210000003501 vero cell Anatomy 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 239000000277 virosome Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/245—Herpetoviridae, e.g. herpes simplex virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/081—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from DNA viruses
- C07K16/082—Hepadnaviridae, e.g. hepatitis B virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/245—Herpetoviridae, e.g. herpes simplex virus
- A61K39/25—Varicella-zoster virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/42—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum viral
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/081—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from DNA viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16111—Cytomegalovirus, e.g. human herpesvirus 5
- C12N2710/16122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16111—Cytomegalovirus, e.g. human herpesvirus 5
- C12N2710/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16111—Cytomegalovirus, e.g. human herpesvirus 5
- C12N2710/16151—Methods of production or purification of viral material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Communicable Diseases (AREA)
- Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Oncology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 명세서는 변형된 사이토메갈로바이러스 (CMV) gL 단백질 및 gL 단백질을 포함하는 복합체를 제공한다. 변형된 gL 단백질은 손상되지 않은 채 유지되며 다른 CMV 단백질과 복합체를 형성할 수 있다.
Description
서열 목록
본 출원은 ASCII 형식으로 전자 제출되고 그 전체가 본원에 참조로 통합된 서열 목록을 함유한다. 2016년 1월 14일 작성된 상기 ASCII 사본은 VN056504WO_SL.txt로 명명되며, 크기는 26,466 바이트이다.
발명의 기술 분야
본 발명은 백신에 사용될 수 있는 사이토메갈로바이러스 (CMV) 항원 분야에 속한다.
사이토메갈로바이러스는 헤르페스비리대 또는 헤르페스바이러스로서 공지된 바이러스 과에 속하는 바이러스의 속이다. 인간을 감염시키는 종은 인간 사이토메갈로바이러스 (HCMV) 또는 인간 헤르페스바이러스-5 (HHV-5)로서 일반적으로 알려져 있다. 헤르페스비리대 중에서 HCMV는 베타헤르페스비리내 아과에 속하며, 이는 또한 다른 포유동물로부터의 사이토메갈로바이러스를 포함한다.
이들은 전신에 걸쳐 발견될 수 있지만, HCMV 감염은 종종 타액선과 관련되어 있다. HCMV는 많은 일반 인구에서 항체의 존재에 의해 나타나는 바와 같이 미국 성인의 50% 내지 80%를 감염시킨다 (전세계 40%). HCMV 감염은 일반적으로 건강한 사람에게는 나타나지 않지만, HIV-감염자, 기관 이식 수용자, 또는 새로 태어난 신생아와 같은 면역력약화된 사람에게는 생명을 위협할 수 있다. HCMV는 발달중인 태아에게 가장 빈번하게 전달되는 바이러스이다. 감염 후, HCMV는 숙주의 일생 동안 신체 내부에 잠복한 채 남아있을 수 있는 능력을 가지며, 때로는 잠복기로부터 재활성화된다. 이러한 질병의 심각성 및 중요성을 감안할 때, 효과적인 백신을 얻는 것이 공중 보건의 최우선 사항으로 간주된다 (Sung, H., et al., (2010) Expert review of vaccines 9, 1303-1314; Schleiss, Expert Opin Ther Pat. Apr 2010; 20(4): 597-602).
20종 초과의 상이한 HCMV 균주의 게놈은 실험실 균주 및 임상 분리물 둘 모두의 게놈을 포함하여 시퀀싱되었다. 예를 들어, HCMV의 하기 균주가 시퀀싱되었다: Towne (GL239909366), AD169 (GI:219879600), Toledo (GL290564358) 및 Merlin (GI: 155573956). HCMV 균주 AD169, Towne 및 Merlin은 아메리칸 타입 컬쳐 콜렉션(American Type Culture Collection)으로부터 얻을 수 있다 (각각 ATCC VR538, ATCC VR977 및 ATCC VR1590).
사이토메갈로바이러스는 알려지지 않은 수의 막 단백질 복합체를 함유한다. 바이러스 엔벨로프에서 대략 30개의 공지된 당단백질 중 gH 및 gL은 여러 상이한 복합체에서 이들의 존재로 인해 특히 흥미로운 것으로 나타났다: 다이머 gH/gL, 트리머 gH/gL/gO (또는 gCIII 복합체로서 공지됨), 및 펜타머 gH/gL/pUL128/pUL130/pUL131 (pUL131은 또한 “pUL131A”, “pUL131a”, 또는 “UL131A”로 불림; pUL128, pUL130, 및 pUL131 서브유닛은 때때로 또한 UL128, UL130, UL131로 불림). CMV는 세포내이입 및 낮은 pH-의존성 융합에 의해 상피 세포 및 내피 세포로 진입하기 위해 펜타머 복합체를 사용하는 것으로 생각되지만, gH/gL 또는 가능하게는 gH/gL/gO 관련 과정에서 원형질막에 직접 융합함으로써 섬유아세포로 진입하는 것으로 생각된다. gH/gL 및/또는 gH/gL/gO 복합체(들)는 섬유아세포 감염에 충분한 반면, 내피 세포 및 상피 세포를 감염시키기 위해서는 펜타머 복합체가 필요하다.
펜타머 복합체는 CMV 백신화에 대한 주요 표적으로서 간주된다. 바이러스 유전자 UL128, UL130 및 UL131은 내피 진입에 필요하다 (Hahn, Journal of Virology 2004; 78:10023-33). 섬유아세포-적응된 비-내피 열대성 균주는 이들 3 가지 유전자 중 적어도 하나에 돌연변이를 함유한다. 예를 들어, Towne 균주는 UL130 유전자에서 프레임 이동을 초래하는 2개 염기 쌍 삽입을 함유하는 반면, AD169는 UL131 유전자에서 하나의 염기 쌍 삽입을 함유한다. Towne 및 AD169 둘 모두는 내피 세포에서의 성장에 적응할 수 있으며, 두 경우 모두 UL130 또는 UL131 유전자에서 프레임 이동 돌연변이가 복구되었다.
US7704510은 pUL131A가 상피 세포 친화성에 필요함을 기재한다. US7704510은 또한 pUL128 및 pUL130이 비리온에 혼입되는 gH/gL과의 복합체를 형성함을 기재한다. 이러한 복합체는 내피세포 및 상피세포는 감염시키는데 필요하나 섬유아세포를 감염시키는데 필요하지 않다. 항-CD46 항체는 상피 세포의 HCMV 감염을 억제하는 것으로 밝혀졌다.
임상 시험에서 평가된 CMV 백신은 Towne 백신, Towne-Toledo 키메라, 항원으로서 gB를 갖는 알파바이러스 레플리콘, gB/MF59 백신, GlaxoSmithKline에 의해 생산된 gB 백신, 및 gB 및 pp65를 사용한 DNA 백신을 포함한다. pp65는 CMV에 대해 유도된 CD8+ 반응의 강력한 유도인자인 바이러스 단백질이다. 이들 백신은 모두 내피/상피 세포로의 바이러스 진입을 차단하는 항체의 빈약한 유도인자이다 (Adler, S. P. (2013), British Medical Bulletin, 107, 57-68. doi:10.1093/bmb/ldt023).
CMV 백신의 임상전 동물 연구는 UL131 유전자가 복구된 비활성화된 AD169, 야생형 UL130 유전자를 사용하는 DNA 백신 및 pUL130 및 131로부터의 펩티드를 사용하는 펩티드 백신을 포함한다 (Sauer, A, et al., Vaccine 2011;29:2705-1, doi:10.1016).
CMV gB 항원은 내피/상피 세포 내로의 진입을 차단하는 항체의 빈약한 유도인자로 간주된다. II기 임상 시험에서, gB/MF59 백신은 집에 아이가 있는 젊은 여성들 중 1차 감염을 예방하는데 단지 50% 효과적이었다 (Pass, RF, et al., N Engl J Med 2009;360:1191-9).
따라서, gH/gL, gH/gL/gO 또는 펜타머 복합체 gH/gL/pUL128/pUL130/pUL131과 같은 다른 항원 표적을 포함하는 CMV 백신을 개발할 필요가 있다.
본원에 기재되고 예시된 바와 같이, 본 발명자들은 사이토메갈로바이러스 항원 gL이 재조합적으로 발현되고 포유동물 숙주 (예컨대, CHO 세포 또는 HEK 세포)로부터 정제되는 경우, gL의 상당 부분이 절단됨을 발견하였다. 손상되지 않은 gL 단백질의 재조합 발현 및 정제를 개선하기 위해, 돌연변이를 도입하여 gL의 프로테아제 절단을 감소시켰다. 돌연변이체는 재조합 생성 동안 프로테아제 절단에 대해 증가된 내성을 나타낸다.
따라서, 한 양태에서, 본 발명은 재조합 CMV gL 단백질, 또는 이의 복합체-형성 단편을 제공하며, 여기에서 상기 gL 단백질 또는 단편은 프로테아제 인식 부위에서 돌연변이를 포함하며, 상기 돌연변이는 대조군과 비교하여 상기 프로테아제 인식 부위에서 프로테아제 절단을 감소시킨다. 프로테아제 인식 부위는 잔기 91-102 (SEQ ID NO:1에 기초한 넘버링)를 나타낸다. 바람직하게는, 돌연변이는 프로테아제 인식 부위의 C-말단 부분의 2차 구조(β-가닥 형태를 갖는 것으로 여겨짐)를 변화시키지 않으면서 대조군과 비교하여 프로테아제 절단을 감소시킨다.
본원에 기재된 gL 단백질 또는 단편을 포함하는 CMV 복합체가 또한 본원에 제공된다. 이러한 복합체는 gH/gL 복합체, gH/gL/gO 복합체, 및 펜타머 복합체 gH/gL/pUL128/pUL130/pUL131일 수 있다.
또한, 본원에 기재된 바와 같이 CMV gL 단백질 및 이의 복합체-형성 단편을 엔코딩하는 핵산이 본원에 제공된다. 핵산은 핵산-기반 백신 (예를 들어, gL 또는 이의 복합체-형성 단편을 엔코딩하는 자가-복제 RNA 분자)으로서 사용될 수 있다. 핵산은 또한 gL 단백질 또는 단편, 또는 gL 단백질 또는 단편을 포함하는 CMV 복합체의 재조합 생산에 사용될 수 있다.
본 발명은 또한 본원에 기재된 핵산을 포함하는 숙주 세포를 제공한다. 핵산은 숙주 세포에 의해 gL 단백질 또는 이의 복합체-형성 단편, 또는 gL 또는 이의 복합체-형성 단편을 포함하는 CMV 복합체를 발현시키는데 사용될 수 있다. 바람직하게는, CMV 복합체는 숙주 세포로부터 분비될 수 있다. 바람직한 숙주 세포는 포유동물 숙주 세포, 예컨대 CHO 세포 또는 HEK-293 세포이다.
본 발명은 또한 본원에 기재된 숙주 세포를 포함하는 세포 배양물을 제공한다. 바람직하게는, 배양물의 크기는 적어도 20 리터이다. CMV 펜타머 복합체 gH/gL/pUL128/pUL130/pUL131을 발현시키는데 사용되는 경우, 펜타머 복합체의 수득량은 적어도 0.1 g/L인 것이 바람직하다.
본 발명은 또한 CMV에 대한 면역 반응을 유도하는 방법으로서, 본원에 기재된 바와 같이, 면역학적 유효량의 gL 단백질 또는 이의 복합체-형성 단편, 또는 gL 단백질 또는 단편을 포함하는 CMV 복합체를 CMV에 대한 면역 반응 유도가 필요한 대상체에 투여하는 것을 포함하는 방법을 제공한다. 본 발명은 또한 세포 내로의 사이토메갈로바이러스 (CMV) 진입을 억제하는 방법으로서, 세포를 본원에 기재된 바와 같은 gL 단백질 또는 이의 복합체-형성 단편, 또는 gL 단백질 또는 단편을 포함하는 CMV 복합체와 접촉시키는 것을 포함하는 방법을 제공한다.
또한, CMV에 대한 면역 반응을 유도하기 위한 본원에 기재된 조성물의 용도, 및 CMV에 대한 면역 반응을 유도하기 위한 의약의 제조에서 본원에 기재된 조성물의 용도가 제공된다.
도 1A는 프로테아제 인식 부위 근처에서 다양한 헤르페스 바이러스로부터의 gL 단백질의 부분 서열 정렬을 보여준다 (외관 순서대로 각각 SEQ ID NO 12-15). 도 1B는 HSV-2 및 VZV로부터의 gH/gL 복합체의 2차 구조를 보여준다. 화살표는 절단 부위를 나타낸다.
도 2A는 gL 돌연변이체의 부분 서열을 보여준다 (외관 순서대로 각각 SEQ ID NO 15-26). 도 2B는 항-gL 항체를 사용한 웨스턴 블롯의 결과를 보여준다. 도 2C는 항-His 항체를 사용한 웨스턴 블롯의 결과를 보여준다.
도 3은 비-환원(NR) 또는 환원 및 비등(RB) 단백질 샘플 중 어느 하나를 사용한 WT 및 LSG 돌연변이체 펜타의 웨스턴 블롯 분석을 보여준다.
도 4는 비-환원(NR) 또는 환원 및 비등(RB) 단백질 샘플 중 어느 하나를 사용한 WT 및 IDG 돌연변이체 펜타의 웨스턴 블롯 분석을 보여준다.
도 5A는 정제된 WT 펜타 및 IDG 및 LSG 돌연변이체 펜타를 보여준다. 도 5B는 MF59로 애주번트 처리된 WT, LSG 돌연변이체 또는 IDG 돌연변이체 펜타로 면역화된 마우스 혈청의 중화 항체 역가 (NAB)를 보여준다.
도 2A는 gL 돌연변이체의 부분 서열을 보여준다 (외관 순서대로 각각 SEQ ID NO 15-26). 도 2B는 항-gL 항체를 사용한 웨스턴 블롯의 결과를 보여준다. 도 2C는 항-His 항체를 사용한 웨스턴 블롯의 결과를 보여준다.
도 3은 비-환원(NR) 또는 환원 및 비등(RB) 단백질 샘플 중 어느 하나를 사용한 WT 및 LSG 돌연변이체 펜타의 웨스턴 블롯 분석을 보여준다.
도 4는 비-환원(NR) 또는 환원 및 비등(RB) 단백질 샘플 중 어느 하나를 사용한 WT 및 IDG 돌연변이체 펜타의 웨스턴 블롯 분석을 보여준다.
도 5A는 정제된 WT 펜타 및 IDG 및 LSG 돌연변이체 펜타를 보여준다. 도 5B는 MF59로 애주번트 처리된 WT, LSG 돌연변이체 또는 IDG 돌연변이체 펜타로 면역화된 마우스 혈청의 중화 항체 역가 (NAB)를 보여준다.
발명의 상세한 설명
1. 개요
본원에 기재되고 예시된 바와 같이, 본 발명자들은 사이토메갈로바이러스 항원 gL이 재조합적으로 발현되고 포유동물 숙주 (예컨대, CHO 세포 또는 HEK 세포)로부터 정제되는 경우, gL의 상당 부분이 알려지지 않은 프로테아제에 의해 절단(또한, "gL 클립핑"으로서 언급됨)됨을 발견하였다. 실제로, 3가지 상이한 CMV 복합체: gH/gL 복합체, gH/gL/gO 복합체, 및 펜타머 복합체 gH/gL/pUL128/pUL130/pUL131의 재조합 발현 및 정제 동안 gL 클립핑이 발생하는 것이 관찰되었다. gL의 클립핑은 항원 생성의 비-균일성, 및 gL-기반 항원에서 중화 부위의 잠재적 손실을 초래하였다.
웨스턴 블롯 및 N-말단 시퀀싱을 이용하여, 본 발명자들은 Merlin 균주 (SEQ ID NO:1) (도 1)의 gL 잔기 97과 98 사이의 펩티드 결합에 대한 절단 부위를 확인하고 맵핑하였다. 클립핑 문제를 해결하기 위해, 본 발명자들은 HSV1, HSV2 및 VZV를 포함하는 여러 관련된 헤르페스 바이러스로부터의 gL 단백질의 구조적 특징을 연구하였다. HSV1, HSV2 및 VZV의 gL 단백질은 클립핑 문제를 갖는 것으로 보이지 않는다. 구조 연구에 기초하여, 본 발명자들은 아미노산 잔기 91 및 102를 포함하는 돌연변이가 프로테아제 인식 부위에 도입되어 재조합적으로 발현된 gL의 프로테아제 절단을 감소시킬 수 있음을 발견하였다.
예를 들어, 본원에서 예시된 바와 같이, A96L/N97S/S98G 트리플 돌연변이("LSG" 돌연변이체) 및 A96I/N97D/S98G 트리플 돌연변이 ("IDG" 돌연변이체)는 gL 클립핑 문제를 실질적으로 제거하였다. 두개의 다른 돌연변이체, 즉 잔기 Asn97의 결실 (델타 Asp97) 및 A96S/N97S/S98T ("SST" 돌연변이체) 또한, gH와 gL이 공동-발현되는 경우 극적으로 감소된 gL 클립핑을 나타냈다.
다른 헤르페스 바이러스의 gL 단백질의 구조 분석을 기초로 하여 (도 1), 프로테아제 인식 부위는 N-말단으로부터 C-말단으로 가능한 짧은 α-헬릭스 (91VTPE94)(SEQ ID NO:27), 짧은 루프 (95AA96) 및 보존된 β-가닥 구조 (97NSVLLD102)(SEQ ID NO:7)를 취하는 것으로 드러났다. 절단은 β-가닥의 N-말단 단부에서 발생한다 (도 1). β-가닥은 단백질에서 β-시트의 구조 단위체이다. 이는 동일한 β-시트에서 다른 β-가닥과의 수소 결합을 형성하는 전형적으로 3 내지 10개의 아미노산 길이인 폴리펩티드 사슬의 연장된 스트레치이다. 도 1에 도시된 바와 같이, 이러한 β-가닥 (도 1에서 β4)은 gL로부터의 가닥 β5 및 β6과 함께, 뿐만아니라 gH로부터의 β-가닥과 함께 β-시트를 형성한다. 따라서, 바람직한 구체예에서, 돌연변이는 프로테아제 인식 부위의 C- 말단 부분의 2차 구조를 유지해야한다 (즉, β-가닥 입체형태가 보존되며, 예컨대, β4와 다른 β-가닥(들) 사이의 상호작용이 실질적으로 유지된다). β-가닥 구조의 유지는 CMV 복합체 (예컨대, 펜타머 복합체)의 어셈블리에 대한 임의의 부정적인 영향을 잠재적으로 감소시킬 수 있으며, 또한 중요한 면역원성 에피토프를 잠재적으로 보존할 수 있다. 예를 들어, 프로테아제 인식 부위로부터의 하나 이상의 잔기는 또 다른 헤르페스 바이러스 (예컨대, HSV-1, HSV-2 또는 VZV)로부터의 상응하는 잔기에 의해 치환될 수 있다. 도 1에 도시된 바와 같이, 서열 및 구조 분석은, CMV 잔기의 상응하는 HSV-1, HSV-2 또는 VZV 잔기로의 치환이 β-가닥 입체형태를 변화시키지 않는 반면 프로테아제 절단은 감소시킬 수 있음을 보여준다. 선택적으로, β-가닥 바로 앞에 있는 짧은 루프 구조 (도 1의 95AA96)가 또한 유지될 수 있다.
따라서, 한 양태에서, 본 발명은 재조합 사이토메갈로바이러스 (CMV) gL 단백질 또는 이의 복합체-형성 단편을 제공하며, 여기에서 상기 gL 단백질 또는 단편은 프로테아제 인식 부위에서 돌연변이를 포함하며, 상기 돌연변이는 대조군과 비교하여 상기 프로테아제 인식 부위에서 프로테아제 절단을 감소시킨다. 프로테아제 인식 부위는 잔기 91-102 (SEQ ID NO:1에 기초한 넘버링)를 나타낸다. 바람직하게는, 돌연변이는 프로테아제 인식 부위의 C-말단 부분에서 β-가닥 구조를 변화시키지 않으면서 대조군과 비교하여 프로테아제 절단을 감소시킨다.
본원에 기재된 gL 단백질 또는 단편을 포함하는 CMV 복합체가 또한 본원에 제공된다. 이러한 복합체는 gH/gL 복합체, gH/gL/gO 복합체, 및 펜타머 복합체 gH/gL/pUL128/pUL130/pUL131일 수 있다.
본원에 기재된 gL 단백질 또는 단편, 및 본원에 기재된 gL 단백질 또는 단편을 포함하는 CMV 복합체의 재조합 발현을 위한 숙주 세포가 또한 본원에 제공된다. 언급한 바와 같이, gL 클립핑은 재조합 생산 과정 동안 포유동물 숙주 세포에서 관찰되었다. 따라서, 본원에 기재된 돌연변이는 포유동물 숙주 (많은 생물 제제에 대해 선호되는 숙주임)에서의 CMV 백신의 재조합 생산에 특히 적합하다. 예를 들어, HEK-293 및 CHO 세포는 생물학적 생성의 상업적 생산에 오랫동안 사용되었다. 따라서, gL 절단을 감소시키는 돌연변이 혼입은 생산 효율 및 수율을 향상시킬 수 있고, 오염되고 부분적으로 분해된 생성물의 형성을 감소시킬 수 있다.
2. 정의
용어 사이토메갈로바이러스 (CMV) 단백질 (예컨대, gL)의 "복합체-형성 단편"은 또 다른 CMV 단백질과 복합체를 형성하는 능력을 보유하는 단백질의 임의의 부분 또는 일부를 지칭한다. 이러한 복합체는 예를 들어, gH/gL 다이머 복합체, gH/gL/gO 트리머 복합체, 또는 gH/gL/pUL128/pUL130/pUL131 펜타머 복합체를 포함한다. CMV 단백질 (예컨대, gL)의 "펜타머-형성 단편"은 gH/gL/pUL128/pUL130/pUL131 펜타머 복합체를 형성하는 능력을 보유하는 단백질의 임의의 부분 또는 일부를 지칭한다.
본원에 사용된 바와 같은, "펜타머 복합체" 또는 "펜타머"는 다섯개의 상이한 서브유닛 즉, gH, gL, pUL128, pUL130 및 pUL131을 포함하는 CMV 복합체를 지칭한다. 본 명세서에서 일반적으로 gH/gL/pUL128/pUL130/pUL131 펜타머 (또는 gH, gL, pUL128, pUL130 및 pUL131을 포함하는 펜타머 복합체)로서 언급되지만, 5개의 서브유닛 각각은 전장일 필요는 없다; 상기 용어는 또한 gH, gL, pUL128, pUL130 및 pUL131의 복합체-형성 단편에 의해 형성된 펜타머를 포함한다.
용어 "돌연변이"는 아미노산 잔기의 첨가, 결실 또는 치환을 나타낸다. 상기 용어는 또한, 비-자연 발생 아미노산 또는 아미노산 유사체를 폴리펩티드 사슬에 도입시키는 변형을 포함한다.
하전된 아미노산 잔기는 D, E, K, R 및 H를 포함한다. 극성의 비-하전된 잔기는 S, T, C, Y, N 및 Q를 포함한다. 비극성 또는 소수성 잔기는 A, V, L, I, M, W, F 및 P를 포함한다.
큰 측쇄를 포함하는 아미노산 잔기는 W, F, M, Y, Q, R, E, H 및 K를 포함한다. 측쇄가 없거나 작은 측쇄를 포함하는 아미노산 잔기는 G, A, V, S, T, C, D 및 N을 포함한다.
아미노산 잔기는 측쇄가 분지형 또는 환형 치환기를 포하는 경우 "벌키 측쇄(bulky side chain)"를 포함한다. 벌키 측쇄를 갖는 아미노산 잔기의 예는 트립토판, 티로신, 페닐알라닌, 호모페닐알라닌, 류신, 이소류신, 히스티딘, 1-메틸트립토판, α-메틸티로신, α-메틸페닐알라닌, α-메틸류신, α-메틸이소류신, α-메틸히스티딘, 사이클로펜틸알라닌, 사이클로헥실알라닌, 나프틸알라닌 등을 포함한다.
본 발명이 임의의 CMV 균주로부터 기원하는 gL 단백질에 적용가능 하지만, 이의 이해를 돕기 위해 본 명세서에서 아미노산 위치를 언급할 때, 달리 언급되지 않는 한, Merlin 균주로부터 기원하는 SEQ ID NO:1의 gL 단백질의 아미노산 서열과 관련하여 넘버링이 부여된다. 그러나, 본 발명은 Merlin 균주에 한정되지 않는다. 본 발명의 교시를 이용하여, 임의의 다른 CMV 균주의 gL 단백질에서 유사한 아미노산 위치가, 용이하게 이용가능하며 널리 공지된 정렬 알고리즘 (예컨대, 디폴트 세팅(default setting)을 이용하는 BLAST; 디폴트 세팅을 이용하는 ClustalW2; 또는 디폴트 파라미터를 이용하는 문헌 [Corpet, Nucleic Acids Research, 1998, 16 (22):10881-10890]에 기재된 알고리즘)을 이용하여 아미노산 서열을 정렬시킴으로써 당업자에 의해 결정될 수 있다. 따라서, "CMV gL 단백질"을 언급할 때, 이는 임의의 균주 (Merlin 균주 이외에)로부터의 CMV gL 단백질로서 이해되어야 한다. 실제 수는 실제 서열 정렬에 따라 다른 균주로부터의 gL 단백질에 대해 조정되어야 할 수 있다.
예를 들어, "프로테아제 인식 부위"는 특히 잔기 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101 및 102로 구성된 아미노산 잔기 91-102로 구성되는 것으로 정의된다. 이들 번호는 SEQ ID NO:1의 gL 단백질의 아미노산 서열과 관련된다. 다른 CMV 균주의 gL 단백질, 또는 다른 gL 돌연변이체 또는 변이체, 또는 gL의 단편으로부터의 프로테아제 인식 부위는 SEQ ID NO:1을 갖는 질의 서열을 정렬하는 표준 서열 정렬 프로그램을 사용하여 확인될 수 있으며, SEQ ID NO:1의 91-102에 매칭되는 잔기를 확인한다.
특정 아미노산 잔기 위치는 또한, SEQ ID NO:1에 따라 넘버링된다. 예를 들어, "S98"은 SEQ ID NO:1의 98번 위치 (이는 S임)일뿐만 아니라 서열을 SEQ ID NO:1과 정렬시킬 경우, SEQ ID NO:1의 S98과 매칭되는 다른 gL 서열 (또는 변이체 또는 단편)로부터의 상응하는 잔기를 나타낸다. 간단히 하기 위해, SEQ ID NO:1의 S98에 상응하는 gL 서열 (또는 변이체 또는 단편)으로부터의 임의의 잔기는 S98로서 불리며, 비록 그러한 잔기의 실제 위치는 98번일 수도 있고 아닐 수도 있으며, 실제 잔기는 S일 수 있거나 아닐 수도 있다. 예를 들어, 보존적 치환(예를 들어, T)이 SEQ ID NO:1의 S98과 정렬될 수 있다. 보존적 치환은 전형적으로 BLAST 2에 의해 "양성" 또는 "+"로서 확인된다.
유사하게는, 돌연변이는 또한 SEQ ID NO:1의 넘버링에 따라 식별된다. 예를 들어, S98G는 SEQ ID NO:1의 S98에 상응하는 gL 서열 (또는 변이체 또는 단편)의 임의의 잔기가 G로 돌연변이됨을 의미한다.
질의 서열의 아미노산 잔기는 질의 아미노산 서열을 기준 서열과 정렬시킴으로써 잔기의 위치가 설계된 위치와 매칭되는 경우 기준 서열의 설계된 위치 (예를 들어, SEQ ID NO:1의 S98)에 "상응한다". 이러한 정렬은 널리 공지된 서열 정렬 프로그램 예컨대, 디폴트 파라미터를 사용하는 "BLAST 2 Sequences" 또는 ClustalW2를 사용함으로써 또는 수동으로 수행될 수 있다.
""는 적어도 10개 아미노산 잔기 길이이고 SEQ ID NO:5와 적어도 50% 동일한 서열을 지칭한다. 도 1에 도시된 바와 같이, Merlin 균주로부터의 야생형 gL에 있어서, HSV1, HSV2 및 VZV와 비교하여 CMV gL에 고유한 17-잔기 단편이 확인되었다("η1"로 표시). 바람직하게는, 삽입 영역은 적어도 11개, 적어도 12개, 적어도 13개, 적어도 14개, 적어도 15개, 적어도 16개, 적어도 17개, 적어도 18개, 적어도 19개 또는 적어도 20개 잔기를 포함하고/거나 SEQ ID NO:5와 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 또는 100% 동일하다. 특정 구체예에서, 삽입 영역은 SEQ ID NO:5의 1 내지 8개 아미노산 잔기가 보존적으로 치환되는 서열을 포함한다.
"보존적으로 치환된"은 잔기가 생물학적으로 유사한 또 다른 잔기로 대체됨을 의미한다. 예로는 아미노산 잔기의 유사한 특징의 예를 들어, 작은 아미노산, 산성 아미노산, 극성 아미노산, 염기성 아미노산, 소수성 아미노산 및 방향족 아미노산으로의 치환을 포함한다. 보존적 아미노산 치환의 예는 하기 표 1의 것들, 및 유사한 특징을 갖는 비-천연 알파 아미노산에 의한 원래 잔기의 유사 치환을 포함한다.
표 1
달리 명시하지 않는 한, 두 서열의 동일성 퍼센트는 두 서열 중 더 짧은 서열의 전체 길이에 걸쳐 결정된다.
3. 변형된
CMV
gL
단백질 및 복합체
A. 변형된
gL
단백질
한 양태에서, 본 발명은 변형된 CMV gL 단백질 또는 이의 복합체-형성 단편을 제공하며, 이는 잔기 N97과 S98 사이의 펩티드 결합에서 클립핑(절단)을 감소시킨다.
인간 CMV 당단백질 L(gL)은 UL115 유전자에 의해 엔코딩된다. gL은 바이러스 복제에 필수적인 것으로 여겨지며, gL의 모든 공지된 기능적 특성은 이의 gH와의 다이머화와 직접 관련된다. gH/gL 복합체는 바이러스의 숙주 세포 내로의 진입을 유도하는, 바이러스 및 원형질 막의 융합에 필요하다. HCMV 균주 Merlin (GI:39842115, SEQ ID NO:1) 및 HCMV 균주 Towne (GI:239909463, SEQ ID NO:2)로부터의 gL은 278개 아미노산 길이인 것으로 보고되었다. HCMV 균주 AD169 (GI: 2506510, SEQ ID NO:3)로부터의 gL은 278개 아미노산 길이인 것으로 보고되었으며, 이의 N-말단 (아미노산 잔기 1-35)에서 신호 서열을 포함하고, 2개의 N-글리코실화 부위 (잔기 74 및 114)를 가지며, TM 도메인이 결여되어있다 (Rigoutsos, I, et al., Journal of Virology 77 (2003):4326-44). SEQ ID NO:1에서 N-말단 신호 서열은 아미노산 잔기 1-30을 포함하는 것으로 예측된다. SEQ ID NO:2는 SEQ ID NO:1과 98% 아미노산 동일성을 공유한다. 22 내지 39개 임상 분리물뿐만 아니라 실험실 균주 AD169, Towne 및 Toledo로부터 전장 gL 유전자의 시퀀싱은 분리물 중 아미노산 서열의 변동이 2% 미만임을 드러냈다 (Rasmussen, L, et al., Journal of Virology 76 (2002): 10841-10888).
전형적으로, gL 단백질의 N-말단 신호 서열은 숙주 세포 신호 펩티다제에 의해 절단되어 성숙한 gL 단백질을 생성한다. 본 발명의 HCMV 막 복합체에서 gL 단백질은 N-말단 신호 서열이 결여될 수 있다. N-말단 신호 서열이 결여된 gL 단백질의 예는 SEQ ID NO:4이며, 이는 N-말단 신호 서열이 결여되어 있으며 SEQ ID NO:1의 아미노산 잔기 31-278로 구성된다.
gL은 바이러스 복제에 필수적인 것으로 생각되지만, gL의 모든 공지된 기능적 특성은 이의 gH와의 다이머화와 직접 관련된다.
본 발명의 gL 단백질은 SEQ ID NO:1과 다양한 정도의 동일성을 갖는 예컨대, SEQ ID NO:1, SEQ ID NO:2 또는 SEQ ID NO:3에 열거된 서열과 적어도 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일한 gL 변이체일 수 있다. 본 발명의 gL 단백질은 SEQ ID NO:4와 다양한 정도의 동일성을 가질 수 있으며, 예컨대, SEQ ID NO:4에 열거된 서열과 적어도 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 동일하다. 특정 구체예에서, gL 변이체 단백질은 (i) 다이머 복합체 gH/gL의 일부를 형성하고; (ii) 트리머 gH/gL/gO 복합체의 일부를 형성하고; (iii) 펜타머 gH/gL/pUL128/pUL130/pUL131 복합체의 일부를 형성하고; (iv) SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 또는 SEQ ID NO:4로부터의 적어도 하나의 에피토프를 포함하고/거나 (v) CMV 비리온과 면역학적으로 교차 반응하는 항체를 생체 내에서 유발시킬 수 있다.
본원에 기재된 gL 단백질의 복합체-형성 단편이 또한 본 발명에 포함된다. gL의 복합체-형성 단편은 또 다른 CMV 단백질과 복합체를 형성하는 능력을 보유하는 gL 단백질의 임의의 부분 또는 일부일 수 있다. 특정 구체예에서, gL의 복합체-형성 단편은 다이머 복합체 gH/gL의 일부를 형성한다. 특정 구체예에서, gL의 복합체-형성 단편은 트리머 gH/gL/gO 복합체의 일부를 형성한다. 특정 구체예에서, gL의 복합체-형성 단편은 펜타머 gH/gL/pUL128/pUL130/pUL131 복합체의 일부를 형성한다. gL의 복합체-형성 단편은 당업계에 공지된 표준 검정 예컨대, 공동-면역침전 검정, 가교, 또는 형광 염색에 의한 공동-위치결정, 등에 의해 수득되거나 결정될 수 있다. 특정 구체예에서, gL의 복합체-형성 단편은 또한, (i) SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, 또는 SEQ ID NO:4로부터의 적어도 하나의 에피토프를 포함하고/거나 (ii) CMV 비리온과 면역학적으로 교차 반응하는 항체를 생체 내에서 유발시킬 수 있다.
특정 구체예에서, 본원에 기재된 gL 단백질, 또는 이의 복합체-형성 단편은 프로테아제 인식 부위 (잔기 91-102)에서 돌연변이를 포함하며, 여기에서 상기 돌연변이는 대조군과 비교하여 상기 프로테아제 인식 부위에서 프로테아제 절단을 감소시킨다.
다양한 대조군이 사용될 수 있다. 실질적으로 동일한 조건하에서 상응하는 야생형 gL의 (잔기 97과 98 사이의 펩티드 결합에서) 프로테아제 절단의 수준이 대조군으로서 이용될 수 있다. 대안적으로, 대조군은 소정 수준 또는 임계 수준 (예를 들어, 전체 gL 단백질의 20%, 25%, 또는 30%)일 수 있다. 백분율은 몰 백분율을 나타낸다.
예를 들어, 돌연변이는, 포유동물 숙주 세포에 대한 표준 배양 조건하에서 포유동물 숙주 세포에서 재조합적으로 발현시킬 경우, 야생형의 것과 비교하여, 잔기 97과 98 사이의 펩타이드 결합에서 프로테아제 절단의 적어도 10%, 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90% 또는 적어도 95% 등등의 감소를 발생시킬 수 있다.
대안적으로 또는 부가적으로, 포유동물 숙주 세포에 대한 표준 배양 조건하에서 포유동물 숙주 세포에서 재조합적으로 발현시킬 경우, 야생형의 것과 비교하여, 프로테아제 절단은 적어도 3배, 적어도 5배, 적어도 10배, 적어도 20배, 적어도 30배, 적어도 40배, 적어도 50배, 적어도 60배, 적어도 70배, 적어도 75배, 적어도 80배, 적어도 90배 또는 적어도 100배 감소된다.
대안으로 또는 부가적으로, 돌연변이는, 포유동물 숙주 세포에 대한 표준 배양 조건하에서 포유동물 숙주 세포에서 재조합적으로 발현시킬 경우, gL 분자 또는 이의 복합체-형성 단편의 약 35% 이하가 잔기 97과 98 사이의 펩티드 결합에서 절단되는 것일 수 있다. 예를 들어, 포유동물 숙주 세포에 대한 표준 배양 조건하에서 포유동물 숙주 세포에서 재조합적으로 발현시킬 경우, gL 분자, 또는 이의 복합체-형성 단편의 약 35% 이하, 약 30% 이하, 약 25% 이하, 약 20% 이하, 약 15% 이하, 약 10% 이하, 약 9% 이하, 약 8% 이하, 약 7% 이하, 약 6% 이하, 약 5% 이하, 약 4% 이하, 약 3% 이하, 약 2% 이하, 또는 약 1% 이하가 잔기 97과 98 사이의 펩티드 결합에서 절단되는 돌연변이가 발생할 수 있다. 백분율은 몰 백분율을 나타낸다.
통상적으로 사용되는 포유동물 숙주 세포에 대한 표준 배양 조건은 공지되어 있다. 예를 들어, CHO 세포의 경우 표준 배양 조건은 10% 이하의 CO2를 갖는 pH 7.0 배지에서 36.5℃의 온도일 수 있다. 한 특정 예에서, 37℃ 및 8% CO2하의 pH 7.0에서 3일 동안 펜타머 복합체 (gH/gL/pUL128/pUL130/pUL131)를 발현시키기 위해 Expi293 세포를 트랜스펙션시키고, 세포 배양물의 상청액을 하기 실시예에 제시된 바와 같이 친화성 정제하고, 웨스턴 블롯으로 분석하였다.
돌연변이는 아미노산 잔기의 부가, 결실, 치환 또는 이들의 조합을 포함한다. 바람직하게는, 돌연변이는 프로테아제 인식 부위의 C-말단 부분의 이차 구조를 실질적으로 보존한다. 특히, 도 1에 도시된 바와 같이, 상기 프로테아제 인식 부위의 C-말단 부분의 잔기는 β-가닥을 형성하며, 이는 다른 β-가닥과 상호작용하여 β-시트를 형성하는 것으로 여겨진다. 바람직하게는, 상기 돌연변이는 이러한 β-가닥 입체형태를 유지한다. 이차 구조를 유지하는 잠재적 이점은 예를 들어, gL-함유 복합체 (예를 들어, gH/gL, gH/gL/gO 또는 gH/gL/pIL128/pUL130/pUL131)의 조립을 촉진시키고 주요 면역원성 에피토프를 유지하는 것을 포함한다. 선택적으로, β-가닥 바로 앞에 있는 짧은 루프 구조가 또한 보존된다.
I-TASSER, HHpred, RaptorX, MODELLER, SWISS-MODEL, Robetta Beta, SPARKSx, PEP-FOLD, Phyre 및 Phyre2, RAPTOR, QUARK, Abalone, Foldit, 등등을 포함하는 많은 컴퓨터 프로그램 및 알고리즘이 이차 구조를 예측하는데 이용가능하다. 돌연변이가 프로테아제 인식 부위의 이차 구조를 변화시키는지의 여부는 이러한 도구를 사용하여 분석될 수 있다.
특정 구체예에서, 돌연변이는 하나 이상의 아미노산 잔기의 첨가를 포함한다. 예를 들어, 돌연변이는 2개 내지 5개 아미노산 잔기의 첨가를 포함할 수 있다. 특정 구체예에서, 2개 내지 5개 아미노산 잔기는 극성 잔기(들) 및 비-극성 잔기(들) 모두를 포함한다.
특정 구체예에서, 돌연변이는 잔기 N97과 S98 사이의 하나 이상의 잔기의 첨가를 포함한다. 실시예에 나타낸 바와 같이, N97과 S98 사이의 펩티드 결합은 프로테아제에 의해 절단되며; 따라서, N97과 S98 사이에 하나 이상의 추가 잔기를 도입하면 절단 저항성이 더 큰 돌연변이체 gL (또는 단편)을 발생시킬 수 있다. 예시적 구체예에서, 돌연변이는 잔기 97과 98 사이에 F, Q 또는 이들의 조합물의 첨가를 포함한다. 예시적 구체예에서, 돌연변이는 잔기 97과 98 사이에 FQ 또는 QF의 첨가를 포함한다.
특정 구체예에서, 돌연변이는 하나 이상의 아미노산 잔기의 결실, 예컨대, 1 내지 3개의 아미노산 잔기의 결실을 포함한다. 특정 구체예에서, 돌연변이는 하기로 구성된 군으로부터 선택된 적어도 하나의 잔기의 결실을 포함한다: V91, T92, P93, E94, A95, A96, N97, S98, V99, L100, L101, D102, 및 이들의 조합물. 특정 구체예에서, 돌연변이는 하기로 구성된 군으로부터 선택된 적어도 하나의 잔기의 결실을 포함한다: E94, A95, A96, N97, S98, V99, L100, L101, D102, 및 이들의 조합물. 예시적 구체예에서, 돌연변이는 하기로 구성된 군으로부터 선택된 적어도 하나의 잔기의 결실을 포함한다: A96, N97, S98, 및 이들의 조합물. 예시적 구체예에서, 돌연변이는 N97 결실을 포함한다.
특정 구체예에서, 돌연변이는 잔기를 또 다른 헤르페스 바이러스의 gL 단백질로부터의 상응하기 잔기로 치환하는 것을 포함한다. 헤르페스 바이러스 (헤르페스비리대) 과에는 예를 들어, 헤르페스 심플렉스 바이러스 1 및 2 (HSV-1 또는 HHV-1, HSV-2 또는 HHV-2), 수두대상포진 바이러스 (VZV 또는 HHV-3), 엡스타인-바르 바이러스 (EBV 또는 HHV-4), 인간 헤르페스바이러스 6 (HHV-6), 인간 헤르페스 바이러스 7 (HHV-7), 및 카포시 육종 관련 포진 바이러스 (HHV-8)를 포함한다. 특정 구체예에서, 또 다른 헤르페스 바이러스로부터의 gL 단백질은 HSV1, HSV2, VZV, EBV, PrV, 또는 소 헤르페스바이러스 5로부터의 gL 단백질이다.
CMV 잔기를 또 다른 헤르페스 바이러스로부터의 상응하는 잔기로 치환하는 것의 한 잠재적 이점은 프로테아제 인식 부위의 2차 구조가 보존될 가능성이 높다는 점이다. 도 1에 도시된 바와 같이, HSV-1, HSV-2 및 VZV는 모두 실질적으로 동일한 이차 구조를 공유하며, 특히 프로테아제 인식 부위의 C-말단 부분은 모두 β-가닥 구조를 채택한다.
다중 치환이 일어나는 경우, 이들이 동일한 헤르페스 바이러스로부터 유래할 필요는 없다. 예를 들어, 제 1의 CMV 잔기는 HSV-1로부터의 상응하는 잔기로, 제 2 잔기는 HSV-2로부터의 상응하는 잔기로, 및/또는 제 3의 CMV 잔기는 VZV로부터의 상응하는 잔기로 및 기타 등등으로 치환할 수 있다. 따라서, 돌연변이는 제 1의 다른 헤르페스 바이러스 gL 단백질로부터의 상응하는 잔기로 치환된 제 1 아미노산 잔기, 및 제 2의 다른 헤르페스 바이러스 gL 단백질로부터의 상응하는 잔기로 치환된 제 2 아미노산 잔기, 및/또는 제 3의 다른 헤르페스 바이러스 gL 단백질로부터의 상응하는 잔기로 치환된 제 3 아미노산 잔기, 등등을 포함할 수 있다.
특정 구체예에서, 돌연변이는 E94를 A로 치환하는 것을 포함한다.
특정 구체예에서, 돌연변이는 A95를 R, L, 또는 N으로 치환하는 것을 포함한다.
특정 구체예에서, 돌연변이는 A96를 W, F, 또는 M과 같은 큰 측쇄를 포함하는 잔기 또는 비-극성 잔기로 치환하는 것을 포함한다. 특정 구체예에서, 돌연변이는 A96를 I, L, 또는 S로 치환하는 것을 포함한다.
특정 구체예에서, 돌연변이는 N97을 극성 잔기 또는 비-극성 잔기로 치환하는 것을 포함한다. 극성 잔기는 작은 측쇄 또는 큰 측쇄를 포함할 수 있다. 특정 구체예에서, 돌연변이는 N97을 S, D, E, A, 또는 Y로 치환하는 것을 포함한다.
특정 구체예에서, 돌연변이는 S98을 G, A, V, S, T, C, D 또는 N과 같은 작은 측쇄를 갖는 아미노산 잔기로 치환하는 것을 포함한다. 특정 구체예에서, 돌연변이는 S98을 G, T, V 또는 I로 치환하는 것을 포함한다.
특정 구체예에서, 돌연변이는 V99를 I를 갖는 아미노산 잔기로 치환하는 것을 포함한다.
특정 구체예에서, 돌연변이는 L100를 F 또는 V를 갖는 아미노산 잔기로 치환하는 것을 포함한다.
특정 구체예에서, 돌연변이는 L101를 V를 갖는 아미노산 잔기로 치환하는 것을 포함한다.
본원에 기재된 첨가, 결실, 및 치환은 단독으로 또는 임의의 조합으로 이용될 수 있다. 예를 들어, gL 돌연변이체는 하나의 위치에서의 첨가, 제 2 위치에서의 결실, 및 제 3 위치에서의 치환을 포함할 수 있다.
특정 구체예에서, gL 단백질 또는 단편은 프로테아제 인식 부위의 N-말단에서 삽입 영역을 포함한다. 도 1에서 도시된 바와 같이, HSV-1, HSV-2 및 ZVZ로부터의 gL 단백질과 비교하여, CMV gL 단백질은 여분의 17-개 잔기 삽입물을 포함한다. 실시예에 나타낸 바와 같이, 이러한 17개-잔기 삽입물이 부분적으로 또는 완전히 결실될 경우, gL 단백질은 프로테아제 절단이 더욱 쉽게 일어난다. 따라서, 17-잔기 삽입물은 프로테아제 인식 부위로의 프로테아제 접근을 적어도 부분적으로 차단하는 것으로 보인다. 따라서, 프로테아제 인식 부위의 N-말단에서 삽입 영역을 유지하는 것이 바람직할 수 있다. "삽입 영역"은 적어도 10개 아미노산 잔기 길이여야 하며, SEQ ID NO:5 (이는 HSV1, HSV2, 및 VZV와 비교하여, CMV gL에 고유한 원래의 17-잔기 단편임)와 적어도 50% 동일하다.
특정 구체예에서, 돌연변이는 비-자연 발생 아미노산 잔기를 도입하는 것을 포함하며, 이는 프로테아제 절단을 감소시키는 것으로 여겨진다.
특정 구체예에서, 돌연변이는 벌키 측쇄를 포함하는 아미노산 잔기를 도입하는 것을 포함하며, 이는 프로테아제 인식 부위로의 프로테아제 접근을 적어도 부분적으로 차단하는 것으로 여겨지며, 프로테아제 절단을 감소시킨다.
B.
CMV
단백질 복합체
또 다른 양태에서, 본 발명은 본원에 기재된 변형된 CMV gL 단백질, 또는 이의 복합체-형성 단편을 포함하는 복합체를 제공한다. 이러한 복합체는 예를 들어, (i) 본원에 기재된 변형된 gL 단백질 또는 이의 복합체-형성 단편, 및 CMV 단백질 gH 또는 이의 복합체-형성 단편을 포함하는 분리된 다이머 복합체; (ii) 본원에 기재된 변형된 gL 단백질 또는 이의 복합체-형성 단편, 및 CMV 단백질 gH 또는 이의 복합체-형성 단편, 및 gO 또는 이의 복합체-형성 단편을 포함하는 분리된 트리머 복합체; 및 (iii) 본원에 기재된 변형된 gL 단백질 또는 이의 복합체-형성 단편, 및 CMV 단백질 pUL128 또는 이의 복합체-형성 단편, pUL130 또는 이의 복합체-형성 단편, pUL131 또는 복합체-형성 단편, 및 gH 또는 이의 복합체-형성 단편을 포함하는 분리된 펜타머 복합체를 포함한다. 또한, 구성요소로서 gL (또는 이의 복합체-형성 단편)을 포함하는 임의의 다른 복합체가 포함된다.
비록 gH, gL, gO, pUL128, pUL130, pUL131이 당단백질로서 언급될 수 있지만, 이러한 명명법은 이들 단백질이 본 발명에 사용될 때 글리코실화되어야 한다는 것을 의미하지는 않는다. 대조적으로, 본 발명의 일부 구체예에서, 폴리펩티드 중 하나 이상은 글리코실화되지 않는다. 그러나, 일반적으로, 본 발명의 복합체에서 하나 이상의 (또는 모든) 폴리펩티드는 글리코실화된다. 일부 구체예에서, 본 발명의 복합체에서 하나 이상의 (또는 모든) 폴리펩티드는 돌연변이된 포유동물 세포와 같은 배양된 세포의 글리코실화 돌연변이체에 의해 글리코실화된다. 이러한 글리코실화 돌연변이체는 야생형 글리코실화 패턴과 상이한 폴리펩티드 글리코실화 패턴을 생성하며, 즉, 생성된 폴리펩티드 글리코폼은 야생형 글리코폼과 상이하다.
특정 구체예에서, gL (또는 이의 복합체-형성 단편) 또는 gL (또는 이의 복합체-형성 단편)을 포함하는 복합체의 글리코실화 패턴은 포유동물 글리코실화 패턴을 가지며/거나 곤충 세포 글리코실화 패턴을 갖지 않는다. 일부 구체예에서, 복합체의 단백질 중 하나 이상은 말단으로부터 두 번째의 갈락토스 및 말단 시알 산을 갖는 복합체 N-연결된 측쇄를 함유한다.
단백질 복합체 (예컨대, 펜타머 복합체)의 재조합 생성을 위해, 복합체는 가용성인 것이 바람직할 수 있다. 서열 분석에 기초하여, CMV gH 단백질은 트랜스멤브레인 (TM) 도메인을 포함하나, gL, gO, pUL128, pUL130, 및 pUL131은 트랜스멤브레인 도메인을 갖지 않는다. 따라서, 가용성 복합체 (예를 들어, 펜타머 복합체)를 생성하기 위해, 펜타머 복합체의 gH 서브유닛은 TM 도메인이 결여될 수 있다. 예를 들어, gH의 N-말단 신호 서열 및 엑토도메인을 포함하나, TM 도메인을 포함하지 않는 gH 단편이 사용될 수 있다.
CMV 균주 Towne로부터의 gH는 SEQ ID NO:6 (GI:138314, 742개 아미노산 잔기)으로 나타내었다. Towne으로부터의 gH는 (i) 6개의 N-글리코실화 부위 (잔기 55, 62, 67, 192, 641 및 700); (ii) 이의 N-말단의 소수성 신호 서열 (아미노산 잔기 1-23); (iii) 세포외 공간으로 세포 밖으로 돌출된 엑토도메인 (잔기 24-717); (iv) 소수성 트랜스멤브레인 (TM) 도메인 (잔기 718-736); 및 (v) C-말단 세포질 도메인 (잔기 737-742)을 갖는 것으로 특성규정되었다. 다른 균주로부터의 gH 단백질, 또는 다른 gH 변이체 및 단편의 TM 도메인은 서열 정렬에 따라 식별될 수 있다.
용이한 생산을 위해, 재조합적으로 생성된 CMV 복합체 (예컨대, 펜타머 복합체)는 숙주 세포로부터 배양 배지로 분비될 수 있다.
특정 구체예에서, 상기 펜타머 복합체는 숙주 세포로부터 분비된다. 5개의 모든 서브유닛 즉, gH, gL, pUL128, pUL131 및 pUL131의 존재는 골지체로 운반되기 전에 ER에서 펜타머 복합체의 조립에 충분한 것으로 보고되었다. 문헌 [Ryckman et al., J Virol. Jan 2008; 82(1):60-70] 참조. 대안적으로 또는 부가적으로, 적절한 신호 펩티드는 5개 서브유닛 중 하나 이상에 사용될 수 있다 (예를 들어, 분비 신호를 갖는 융합 단백질을 제조함으로써). 분비 단백질을 생성하기 위한 신호 서열 (및 발현 카세트)은 종래 기술에 공지되어 있다. 일반적으로, 리더 펩티드는 5-30개 아미노산 길이이며, 전형적으로 새로 합성된 단백질의 N-말단에 존재한다. 신호 펩티드의 코어는 일반적으로, 단일 알파-헬릭스를 형성하는 경향을 갖는 소수성 아미노산의 긴 스트레치를 함유한다. 또한, 많은 신호 펩티드는 아미노산의 양으로 하전된 짧은 스트레치로 시작되며, 이는 전위 동안 폴리펩티드의 적절한 토폴로지를 강화하는데 도움을 줄 수 있다. 신호 펩티드의 말단에, 인식되어 신호 펩티다제에 의해 절단되는 아미노산의 스트레치가 전형적으로 존재한다. 신호 펩티다제는 전위 동안 또는 전위 완료 후 절단되어 자유 신호 펩티드 및 성숙 단백질을 생성할 수 있다.
C. 변형된
gL
단백질 및 복합체를
엔코딩하는
핵산
또 다른 양태에서, 본 발명은 본원에 기재된 변형된 gL 단백질 또는 이의 복합체-형성 단편을 엔코딩하는 서열을 포함하는 핵산을 제공한다. 핵산은 DNA 또는 RNA일 수 있다.
특정 구체예에서, 핵산은 DNA이다. 재조합 단백질의 발현 및 정제를 위한 DNA-기반 발현 시스템은 당업계에 잘 공지되어 있다. 예를 들어, 발현 시스템은 숙주 세포 예컨대, 포유동물 숙주 세포, 박테리아 숙주 세포, 또는 곤충 숙주 세포에서 변형된 gL 또는 gL 단편의 발현을 조절하는 발현 조절 서열에 작동가능하게 연결된, 본원에 기재된 변형된 gL 또는 gL 단편을 엔코딩하는 뉴클레오티드 서열을 포함하는 벡터일 수 있다. 발현 조절 서열은 예를 들어, 프로모터, 인핸서, 리보솜 진입 부위, 또는 폴리아데닐화 서열일 수 있다. 본 발명에 사용하기 위해 고려되는 다른 발현 조절 서열은 인트론 및 3' UTR 서열을 포함한다.
재조합적으로 발현된 변형된 gL 단백질 또는 이의 단편, 또는 변형된 gL 단백질 또는 이의 단편을 포함하는 복합체는 본원에 기재된 방법, 예컨대 WO 2014/005959에 기재된 정제 방법 또는 당업계에 공지된 다른 방법을 사용하여 정제될 수 있다.
특정 구체예에서, 핵산 분자는 아데노바이러스, 아데노-관련 바이러스, 렌티바이러스, 또는 알파바이러스로부터 유래된 벡터이다. 특정 구체예에서, 핵산 분자는 복제-결핍 바이러스 벡터이다.
특정 구체예에서, 핵산은 RNA이다. 특정 구체예에서, 핵산은 자가-복제 RNA 분자 예컨대, 알파바이러스-유래된 RNA 레플리콘이다.
자가-복제 RNA 분자는 당업계에 잘 공지되어 있으며, 예를 들어, 알파바이러스로부터 유래된 복제 엘리먼트를 사용하고 바이러스 구조 단백질을 관심 단백질을 엔코딩하는 뉴클레오티드 서열로 치환함으로써 생성될 수 있다. 자가-복제 RNA 분자는 전형적으로, 세포로 전달된 후 직접 번역될 수 있는 플러스-가닥 분자이며,이러한 번역은 RNA-의존성 RNA 중합효소를 제공하며, 이는 이어서 전달된 RNA로부터 안티센스 및 센스 전사물 둘 모두를 생성한다. 이와 같이, 전달된 RNA는 다중 도터 RNA의 생성으로 이어진다. 이러한 도터 RNA는 물론 공선의 서브게놈 전사물은 자체적으로 번역되어 엔코딩된 항원의 원위치 발현을 제공할 수 있거나, 번역되어 항원의 원위치 발현을 제공하는 전달된 RNA와 동일한 센스를 갖는 추가의 전사물을 제공하도록 전사될 수 있다. 전사의 이러한 서열의 전반적인 결과는 도입된 레플리콘 RNA의 수의 막대한 증폭이며, 따라서 엔코딩된 항원은 세포의 주요 폴리펩티드 생성물이 된다. 간단하게는, 자가-복제 RNA로 형질감염된 세포는 아폽토시스 사멸을 겪기 전에 항원을 생성한다. 이러한 사멸은 수지상 세포를 과다활성화시키는 것으로 또한 입증된, 필요한 이중-가닥(ds) RNA 중간체의 가능한 결과이다. 따라서, 자가-복제 RNA의 향상된 면역원성은 숙주 세포의 RNA-바이러스 감염을 모방하는 염증전 dsRNA의 생성의 결과일 수 있다.
이러한 방식으로 자가-복제를 달성하기에 적합한 한 시스템은 알파바이러스-기반의 레플리콘을 사용하는 것이다. 알파바이러스는 토가비리대 과의 유전적으로, 구조적으로 및 혈청학적으로 관련된 절지동물-매개 바이러스 세트를 포함한다. 신드비스 바이러스, 셈리키 삼림 바이러스, 로스 강 바이러스, 및 베네주엘라 말 뇌염 바이러스를 포함하는 26개의 공지된 바이러스 및 바이러스 아형이 알파바이러스 속으로 분류되었다. 이와 같이, 본 발명의 자가-복제 RNA는 셈리키 삼림 바이러스(SFV), 신드비스 바이러스(SIN), 베네주엘라 말 뇌염 바이러스(VEE), 로스 강 바이러스(RRV), 동부 말 뇌염 바이러스, 또는 알파바이러스 과에 속하는 다른 바이러스로부터 유래된 RNA 복제효소를 혼입시킬 수 있다.
알파바이러스-기반 "레플리콘" 발현 벡터가 본 발명에 사용될 수 있다. 레플리콘 벡터는 DNA, RNA 및 재조합 레플리콘 입자를 포함하는 여러 포맷으로 활용될 수 있다. 이러한 레플리콘 벡터는 예를 들어, 신드비스 바이러스(Xiong et al. (1989) Science 243:1188-1191; Dubensky et al., (1996) J. Virol. 70:508-519; Hariharan et al. (1998) J. Virol. 72:950-958; Polo et al. (1999) PNAS 96:4598-4603), 셈리키 삼림 바이러스(Liljestrom (1991) Bio/Technology 9:1356-1361; Berglund et al. (1998) Nat. Biotech. 16:562-565), 및 베네주엘라 말 뇌염 바이러스(Pushko et al. (1997) Virology 239:389-401)를 포함하는 알파바이러스로부터 유래되었다. 알파바이러스-유래된 레플리콘은 일반적으로 전반적인 특성(예를 들어, 구조, 복제)에 있어서는 상당히 유사하고, 개별적인 알파바이러스는 고유한 일부 특정 성질(예를 들어, 수용체 결합, 인터페론 감수성, 및 질병 프로파일)을 나타낼 수 있다. 따라서, 분기하는 바이러스 과로부터 만들어진 키메라 알파바이러스 레플리콘이 또한 유용할 수 있다.
일부 구체예에서, 본원에 기재된 CMV gL 단백질 (또는 이의 단편)은 알파바이러스 레플리콘 입자(VRP)를 사용하여 전달된다. "알파바이러스 레플리콘 입자"(VRP) 또는 "레플리콘 입자"는 알파바이러스 구조 단백질로 패키징된 알파바이러스 레플리콘이다.
알파바이러스-기반 RNA 레플리콘의 사용은 당업계에 공지되어 있다 (예를 들어, WO 2013006837, 단락 [0155] 내지 [0179] 참조). RNA 레플리콘은 그 안에 엔코딩된 단백질을 정제할 필요 없이 투여될 수 있다.
특정 구체예에서, 핵산 분자는 아데노바이러스로부터 유래된 벡터의 일부이다. 아데노바이러스 게놈은 각 가닥의 5' 말단에 공유 결합된 55-kDa 말단 단백질을 갖는 약 36,000개 염기 쌍의 선형 이중-가닥 DNA 분자이다. 아데노바이러스 ("Ad") DNA는 혈청형에 따라 정확한 길이의 약 100개 염기쌍의 동일한 역 말단 반복부(Inverted Terminal Repeat)("ITR")를 함유한다. 바이러스의 복제 기점은 정확하게 게놈 단부의 ITR 내에 위치한다. 본 발명에 사용하기 위한 아데노바이러스 벡터는 비제한적으로, 아데노바이러스의 40개 초과의 혈청형 균주 중 임의의 혈청형 예컨대, 혈청형 2, 5, 12, 40 및 41을 포함하는 임의의 다양한 아데노바이러스 혈청형으로부터 유래될 수 있다.
특정 구체예에서, 핵산 분자는 아데노 관련 바이러스(AAV)로부터 유래된 벡터의 일부이다. AAV 게놈은 대략 4681개의 뉴클레오티드를 함유하는 선형의 단일-가닥 DNA 분자이다. AAV 게놈은 일반적으로 역 말단 반복부(ITR)가 각 말단에 측면 인접한 내부 비반복형 게놈을 포함한다. ITR은 대략 145개 염기쌍 (bp) 길이이다. ITR은 DNA 복제 기점으로서 작용하고, 바이러스 게놈에 대한 패키징 신호로서 작용하는 것을 포함하는 다양한 기능을 갖는다. AAV는 헬퍼-의존적 바이러스이다; 즉, 이는 야생에서 AAV 비리온을 형성하기 위해 헬퍼 바이러스 (예를 들어, 아데노바이러스, 헤르페스바이러스 또는 백시니아)와의 공동-감염을 필요로 한다. 헬퍼바이러스와의 공동-감염의 부재시에, AAV는 바이러스 게놈이 숙주 세포 크로모좀 내로 삽입되지만, 감염성 비리온이 생성되지 않는 잠복된 상태를 확립한다. 헬퍼 바이러스에 의한 후속 감염은 통합된 게놈을 구제하여, 이를 복제하게 하고 이의 게놈을 감염성 AAV 비리온 내로 패키징되게 한다. AAV는 다른 종으로부터의 세포를 감염시킬 수 있지만, 헬퍼 바이러스는 숙주 세포와 동일한 종이어야 한다. 따라서, 예를 들어, 인간 AAV는 개 아데노바이러스와 공동-감염된 개 세포에서 복제될 것이다.
특정 구체예에서, 핵산 분자는 레트로바이러스로부터 유래된 벡터의 일부이다. 선택된 유전자는 당업계에 공지된 기술을 사용하여 벡터 내로 삽입되고 레트로바이러스 입자로 패키징될 수 있다. 이어서, 재조합 바이러스를 분리하여 생체 내 또는 생체 외에서 대상체의 세포로 전달될 수 있다. 다수의 레트로바이러스 시스템이 기재되어 있다. 예를 들어, 미국 특허 번호 5,219,740; 문헌 [Miller and Rosman (1989) BioTechniques 7:980-90; Miller, A. D. (1990) Human Gene Therapy 1:5-14; Scarpa et al. (1991) Virology 180:849-52; Burns et al. (1993) Proc. Natl. Acad. Sci. USA 90:8033-37; Boris-Lawrie and Temin (1993) Curr. Opin. Genet. Develop. 3:102-09] 참조.
본 발명은 또한 본원에 기재된 핵산 분자를 포함하는 숙주 세포를 제공한다. 핵산 분자를 잠복시키고/거나 재조합 단백질을 발현시키기에 적합한 숙주 세포, 및 적합한 숙주 세포 내로 핵산을 도입하는 방법은 당업계에 공지되어 있다.
4.
gL
단백질 및 복합체의 재조합 생성
본 발명은 또한 상기 기재된 gL 단백질 및 이의 단편을 엔코딩하는 핵산을 포함하는 숙주 세포를 제공한다.
바람직하게는, 숙주 세포는 포유동물 세포 (예를 들어, 인간, 인간 이외의 영장류, 말, 소, 양, 개, 고양이 및 설치류 (예를 들어, 햄스터), 조류 세포 (예를 들어, 닭, 오리 및 거위)이다. 적합한 포유동물 세포는 예를 들어, 중국 햄스터 난소 (CHO) 세포, 인간 배아 신장 세포 (전형적으로 전단된 아데노바이러스 유형 5 DNA로 형질전환된 HEK-293 세포), NIH-3T3 세포, 293-T 세포, Vero 세포, HeLa 세포, PERC.6 세포 (ECACC 기탁 번호 96022940), Hep G2 세포, MRC-5 (ATCC CCL-171), WI-38 (ATCC CCL-75), 태아 레수스 폐 세포 (ATCC CL-160), Madin-Darby 소 신장 ("MDBK") 세포, Madin-Darby 개 신장 ("MDCK") 세포 (예를 들어, MDCK (NBL2), ATCC CCL34; 또는 MDCK 33016, DSM ACC 2219), 베이비 햄스터 신장 (BHK) 세포 예컨대, BHK21-F, HKCC 세포, 및 기타 등등을 포함한다.
특정 구체예에서, 숙주 세포는 HEK-293 세포이다. 특정 구체예에서, 숙주 세포는 CHO 세포이다. 특정 구체예에서, 본원에 기재된 gL 단백질 (또는 이의 단편)을 엔코딩하는 폴리뉴클레오티드는 CHO 세포의 게놈 DNA 내로 통합된다. CMV 단백질 복합체의 재조합 생산을 위해, 복합체의 다른 서브유닛을 엔코딩하는 뉴클레오티드 서열은 또한, CHO 세포의 게놈 DNA 내로 통합되어야 한다.
따라서, 특정 구체예에서, 숙주 세포는 CMV 펜타머 복합체를 엔코딩하는 하나 이상의 폴리뉴클레오티드 서열을 포함하며, 상기 펜타머 복합체는 gH 또는 이의 펜타머-형성 단편, gL 또는 이의 펜타머-형성 단편, pUL128 또는 이의 펜타머-형성 단편, pUL130 또는 이의 펜타머-형성 단편, 및 pUL131 또는 이의 펜타머-형성 단편을 포함한다. 특정 구체예에서, CMV 펜타머 복합체를 엔코딩하는 하나 이상의 폴리뉴클레오티드 서열은 상기 숙주 세포의 게놈 DNA 내로 통합된다. 특정 구체예에서, 적합한 조건하에 배양되는 경우 숙주 세포는 상기 CMV 펜타머 복합체 (이는 바람직하게는 가용성이고/거나 숙주 세포로부터 분비됨)를 발현한다.
유럽 세포 배양 콜렉션 (European Collection of Cell Culture)(ECACC)에서 입수가능한 예시적인 CHO 세포주는 표 2에 열거되어 있다. 표 2에 열거된 임의의 CHO 세포가 사용될 수 있다.
표 2
또한, 다양한 CHO 세포주, 예컨대, CHO 세포주 hCBE11(ATCC® PTA-3357™), E77.4(ATCC® PTA-3765™), hLT-B:R-hG1 CHO #14(ATCC® CRL-11965™), MOR-CHO- MORAb-003-RCB(ATCC® PTA-7552™), AQ.C2 클론 11B(ATCC® PTA-3274™), AQ.C2 클론 11B(ATCC® PTA-3274™), CHO-DG44 중 hsAQC2(ATCC® PTA-3356™), xrs5(ATCC® CRL-2348™), CHO-K1(ATCC® CCL-61™), Lec1[원래 Pro-5WgaRI3C로 명명됨](ATCC® CRL-1735™), Pro-5(ATCC® CRL-1781™), ACY1-E(ATCC® 65421™), ACY1-E(ATCC® 65420™), pgsE-606(ATCC® CRL-2246™), CHO-CD36(ATCC® CRL-2092™), pgsC-605(ATCC® CRL-2245™), MC2/3(ATCC® CRL-2143™), CHO-ICAM-1(ATCC® CRL-2093™), 및 pgsB-618(ATCC® CRL-2241™)이 아메리칸 타입 컬쳐 콜렉션(ATCC)으로부터 입수가능하다. 이러한 CHO 세포주 중 어느 하나가 사용될 수 있다.
다른 상업적으로 입수가능한 CHO 세포주는 예를 들어, Life Technologies로부터의 FreeStyle™ CHO-S Cells 및 Flp-In™-CHO Cell Line를 포함한다.
기타 적합한 숙주 세포는 예를 들어, C12orf35 단백질의 발현 수준 또는 활성이 대조군과 비교하여 감소된 CHO 세포 (예를 들어, C12orf35 단백질의 발현 수준 또는 활성이 대조군과 비교하여 감소된 포유동물 세포의 상세한 설명을 제공하는, 본원에 참조로 통합된 WO2015/092735 참조), FAM60A 단백질의 발현 수준 또는 활성이 대조군과 비교하여 감소된 CHO 세포 (예를 들어, FAM60A의 발현 수준 또는 활성이 감소된 포유동물 세포의 상세한 설명을 제공하는, 본원에 참조로 통합된 WO2015/092737 참조); 마트립타제의 발현 수준 또는 활성이 대조군과 비교하여 감소된 CHO 세포 (마트립타제의 발현 수준 또는 활성이 감소된 포유동물 세포의 상세한 설명을 제공하는, 2014년 4월 29일 출원되고 본원에 참조로 통합된 미국 특허 가출원 번호 61/985,589, 및 2014년 5월 16일 출원되고 본원에 참조로 통합된 미국 특허 가출원 번호 61/994,310)를 포함한다.
일반적으로 CHO 세포에서 재조합 단백질을 발현시키는 방법은 기재되어 있다. 예를 들어, 미국 특허 번호 4,816,567 및 5,981,214를 참조하라.
2014년 10월 31일 출원된 유럽 특허 출원 EP14191385.5 (본원에 참조로 통합됨)는 포유동물 숙주 세포 특히, CHO 세포를 기재하고 있으며, 여기에서 CMV 단백질 gH, gL, pUL128, pUL130, pUL131 (또는 이의 복합체-형성 단편)을 엔코딩하는 서열(들)은 게놈 내로 안정적으로 통합된다.
본원에 기재된 숙주 세포를 포함하는 세포 배양물이 또한 본원에 제공된다. 세포 배양물은 대규모 예를 들어, 적어도 약 10 L, 적어도 약 20 L, 적어도 약 30 L, 적어도 약 40 L, 적어도 약 50 L, 적어도 약 60 L, 적어도 약 70 L, 적어도 약 80 L, 적어도 약 90 L, 적어도 약 100 L, 적어도 약 150 L, 적어도 약 200 L, 적어도 약 250 L, 적어도 약 300 L, 적어도 약 400 L, 적어도 약 500 L, 적어도 약 600 L, 적어도 약 700 L, 적어도 약 800 L, 적어도 약 900 L, 적어도 약 1000 L, 적어도 약 2000 L, 적어도 약 3000 L, 적어도 약 4000 L, 적어도 약 5000 L, 적어도 약 6000 L, 적어도 약 10,000 L, 적어도 약 15,000 L, 적어도 약 20,000 L, 적어도 약 25,000 L, 적어도 약 30,000 L, 적어도 약 35,000 L, 적어도 약 40,000 L, 적어도 약 45,000 L, 적어도 약 50,000 L, 적어도 약 55,000 L, 적어도 약 60,000 L, 적어도 약 65,000 L, 적어도 약 70,000 L, 적어도 약 75,000 L, 적어도 약 80,000 L, 적어도 약 85,000 L, 적어도 약 90,000 L, 적어도 약 95,000 L, 적어도 약 100,000 L 등일 수 있다.
특정 구체예에서, CMV 복합체 (예컨대, 펜타머 복합체)의 수득량은 적어도 약 0.01 g/L, 적어도 약 0.02 g/L, 적어도 약 0.03 g/L, 적어도 약 0.05 g/L, 적어도 약 0.06 g/L, 적어도 약 0.07 g/L, 적어도 약 0.08 g/L, 적어도 약 0.09 g/L, 적어도 약 0.1 g/L, 적어도 약 0.15 g/L, 적어도 약 0.20 g/L, 적어도 약 0.25 g/L, 적어도 약 0.3 g/L, 적어도 약 0.35 g/L, 적어도 약 0.4 g/L, 적어도 약 0.45 g/L, 적어도 약 0.5 g/L, 적어도 약 0.55 g/L, 적어도 약 0.6 g/L, 적어도 약 0.65 g/L, 적어도 약 0.7 g/L, 적어도 약 0.75 g/L, 적어도 약 0.8 g/L, 적어도 약 0.85 g/L, 적어도 약 0.9 g/L, 적어도 약 0.95 g/L, 또는 적어도 약 1.0 g/L이다.
또한, 사이토메갈로바이러스 (CMV) gL 단백질 또는 이의 단편, 또는 상기 gL 단백질 또는 단편을 포함하는 복합체를 생성하는 방법으로서, (i) 적합한 조건하에 본원에 기재된 숙주 세포를 배양하여 상기 gL 단백질 또는 이의 단편을 발현시키고; (ii) 상기 gL 단백질 또는 이의 단편, 또는 상기 gL 단백질 또는 단편을 포함하는 복합체를 배양물로부터 채취하는 것을 포함하는 방법이 본원에 제공된다.
특정 구체예에서, gL 단백질 (또는 이의 단편), 또는 본원에 기재된 상기 gL 단백질 또는 단편을 포함하는 복합체를 포함하는 복합체가 정제된다. gL 단백질 (또는 이의 단편)이 임의의 적합한 방법 예컨대, HPLC, 다양한 유형의 크로마토그래피 (예컨대, 소수성 상호작용, 이온 교환, 친화성, 킬레이팅, 및 크기 배제), 전기영동, 밀도 구배 원심분리, 용매 추출, 또는 기타 등등을 이용하여 정제될 수 있다.
예를 들어, 이온 교환이 gL 단백질 (또는 이의 단편), 또는 상기 gL 단백질 또는 단편을 포함하는 복합체를 포함하는 복합체를 정제하는데 이용될 수 있다. 이온 교환 크로마토그래피에 유용한 물질의 예로는 DEAE-셀룰로스, QAE-셀룰로스, DEAE-세팔로스, QAE-세팔로스, DEAE-토요펄(Toyopearl), QAE-토요펄, Mono Q, Mono S, Q 세파로스, SP 세파로스, 등등을 포함한다. 예시적인 한 구체예에서, 방법은 Mono S 칼럼을 사용한다. 또 다른 예시적 구체예에서, 방법은 Mono Q 칼럼을 사용한다.
대안적으로 또는 부가적으로, 친화성-기반 정제가 이용될 수 있다. 친화성-정제 태그의 예는 예를 들어, His 태그 (금속 이온에 결합), 항체 (단백질 A 또는 단백질 G에 결합), 말토스-결합 단백질 (MBP) (아밀로스에 결합), 글루타티온-S-트랜스퍼라제 (GST) (글루타티온에 결합), FLAG 태그 (Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys) (SEQ ID NO:8) (항-플래그 항체에 결합), Strep 태그 (스트렙타비딘 또는 이의 유도체에 결합)를 포함한다.
예시적인 한 구체예는 Strep 태그 (또는 스트렙타비딘 친화성 태그) 즉, 스트렙타비딘 또는 이의 유도체에 결합하는 태그, 예컨대, Strep-Tactin이다. Strep 태그는 9개 아미노산: Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly (SEQ ID NO:9), 또는 8개 아미노산 (또한, 스트렙-태그 II로 불림): Trp-Ser-His-Pro-Gln-Phe-Glu-Lys (SEQ ID NO:10)의 펩티드를 포함한다. 칼럼으로부터 스트렙-태그에 부착된 단백질의 용출은 바이오틴 또는 이의 유도체 또는 동족체, 예컨대, 데스티오바이오틴을 사용하여 수행될 수 있다.
친화성-정제 태그는 임의의 적합한 수단에 의해 부착될 수 있으며, 직접적으로 또는 간접적으로 부착될 수 있다. 예를 들어, 태그는 폴리펩티드 서열의 N-말단 또는 폴리펩티드 서열의 C-말단에 공유적으로 부착될 수 있다. 이는 폴리펩티드 및 태그를 포함하는 융합 단백질의 재조합 발현에 의해 또는 폴리펩티드를 태그에 연결시키는 표준 컨주게이션 기술에 의해 달성될 수 있다. 태그는 표준 컨주게이션 기술을 사용하여 폴리펩티드의 아미노산 잔기의 측쇄 작용기에 부착될 수 있다. 대안적으로, 태그는 비-공유적으로 부착될 수 있다.
태그의 부착은 직접적 또는 간접적 (링커를 통해)일 수 있다. 적합한 링커는 당업자에게 공지되어 있으며, 예를 들어, 직쇄 또는 분지쇄 탄소 링커, 헤테로사이클릭 탄소 링커, 탄수화물 링커 및 폴리펩티드 링커를 포함한다.
특정 구체예에서, 절단가능한 링커는 관심 분자를 태그에 부착시키는데 사용될 수 있다. 이는 예를 들어, 링커를 절단할 수 있는 제제의 첨가에 의해 정제된 복합체로부터 태그를 분리되게 한다. 많은 다양한 절단가능한 링커가 당업자에게 공지되어 있다. 이러한 링커는 예를 들어, 광불안정성 결합의 조사 또는 산-촉매된 가수분해에 의해 절단될 수 있다. 프로테아제 인식 부위가 혼입되고 적합한 프로테아제 효소의 첨가에 의해 절단될 수 있는 폴리펩티드 링커가 또한 존재한다.
gL 단백질 (또는 이의 단편)을 포함하는 복합체가 정제되는 경우, 태그는 복합체의 다른 성분(들)에 부착될 수 있다. 예를 들어, CMV 펜타머 복합체를 정제할 경우, 태그는 pUL128, pUL130 또는 pUL131에 부착될 수 있다.
5. 약학적 조성물 및 투여
본 발명은 또한, 본원에 기재된 CMV 단백질, 복합체, 및 핵산을 포함하는 약학적 조성물을 제공한다. 본 발명은 또한, 본원에 기재된 CMV 단백질을 엔코딩하는 핵산, 복합체, 및 핵산을 포함하는 약학적 조성물을 제공한다.
본원에 기재된 CMV 단백질, 복합체, 및 핵산은 면역원성 조성물, 또는 백신 조성물에 혼입될 수 있다. 이러한 조성물은 포유동물 (예를 들어, 인간)에서 항체를 발생시키는데 사용될 수 있다.
본 발명은 본원에 기재된 CMV 단백질, 복합체, 및 핵산을 포함하는 약학적 조성물, 및 본원에 기재된 CMV 단백질, 복합체, 및 핵산을 약학적으로 허용되는 담체와 조합시키는 것을 포함하는 약학적 조성물을 제조하는 방법을 제공한다. 본 발명의 약학적 조성물은 전형적으로 약학적으로 허용되는 담체를 포함하며, 이러한 담체의 철저한 논의는 문헌[Remington: The Science and Practice of Pharmacy]에서 입수가능하다.
조성물의 pH는 일반적으로 약 4.5 내지 약 11, 예컨대, 약 5 내지 약 11, 약 5.5 내지 약 11, 약 6 내지 약 11, 약 5 내지 약 10.5, 약 5.5 내지 약 10.5, 약 6 내지 약 10.5, 약 5 내지 약 10, 약 5.5 내지 약 10, 약 6 내지 약 10, 약 5 내지 약 9.5, 약 5.5 내지 약 9.5, 약 6 내지 약 9.5, 약 5 내지 약 9, 약 5.5 내지 약 9, 약 6 내지 약 9, 약 5 내지 약 8.5, 약 5.5 내지 약 8.5, 약 6 내지 약 8.5, 약 5 내지 약 8, 약 5.5 내지 약 8, 약 6 내지 약 8, 약 4.5, 약 5, 약 6.5, 약 6, 약 6.5, 약 7, 약 7.5, 약 8, 약 8.5, 약 9, 약 9.5, 약 10, 약 10.5, 약 11 등이다. 안정한 pH는 완충제 예를 들어, Tris 완충제, 시트레이트 완충제, 포스페이트 완충제, 또는 히스티딘 완충제의 사용에 의해 유지될 수 있다. 따라서, 조성물은 일반적으로 완충제를 포함할 것이다.
조성물은 무균일 수 있고/거나 발열원을 함유하지 않을 수 있다. 조성물은 인간에 대해 등장성일 수 있다.
조성물은 면역학적 유효량의 이의 항원(들)을 포함한다. "면역학적 유효량"은 대상체에 투여될 경우, 항원에 대한 항체 반응을 유발시키는데 유효한 양이다. 이러한 양은 치료할 개체의 건강과 신체 상태, 이들의 연령, 개체 면역계의 항체 합성 능력, 요망되는 보호 정도, 백신의 제형, 의료 상황에 대한 담당의의 평가, 및 기타 관련 요인에 따라 달라질 수 있다. 이러한 양은 관례적 시험을 통해 결정될 수 있는 상대적으로 넓은 범위에 해당할 것으로 예상된다. 본 발명의 조성물의 항원 함량은 일반적으로 투여량 당 단백질의 양으로 표현될 것이다. 항원 당 10-500 μg (예를 들어, 50 μg)의 투여량이 유용할 수 있다.
면역원성 조성물은 면역 애주번트를 포함할 수 있다. 예시적인 애주번트는 미네랄-함유 조성물; 오일 에멀젼; 사포닌 제형; 비로좀 및 바이러스-유사 입자; 박테리아 또는 미생물 유도체; 생체접착제 및 점막접착제; 리포좀; 폴리옥시에틸렌 에테르 및 폴리옥시에틸렌 에스테르 제형; 폴리포스파젠(pcpp); 무라밀 펩티드; 이미다조퀴놀론 화합물; 티오세미카르바존 화합물; 트립탄트린 화합물; 인간 면역조절제; 리포펩티드; 벤조나프티리딘; 미세입자; 면역자극 폴리뉴클레오티드 (예컨대, RNA 또는 DNA; 예를 들어, CpG-함유 올리고뉴클레오티드)를 포함할 수 있다.
예를 들어, 조성물은 알루미늄 염 애주번트, 수중유 에멀젼 (예를 들어, 스쿠알렌을 포함하는 수중유 에멀젼 예컨대, MF59 또는 AS03), TLR7 아고니스트 (예컨대, 이미다조퀴놀린 또는 이미퀴모드), 또는 이들의 조합물을 포함할 수 있다. 적합한 알루미늄 염은 하이드록시드(예를 들어, 옥시하이드록시드), 포스페이트(예를 들어, 하이드록시포스페이트, 오르토포스페이트), (예를 들어, 문헌 [chapters 8 & 9 of Vaccine Design (1995) eds. Powell & Newman. ISBN: 030644867X. Plenum] 참조), 또는 이들의 혼합물을 포함한다. 염은 임의의 적합한 형태 (예를 들어, 겔, 결정질, 비정질, 등)를 취할 수 있으며, 염으로의 항원 흡착이 한 예이다. 환자에 투여하기 위한 조성물 중의 Al+3의 농도는 5mg/ml 미만, 예를 들어, <4 mg/ml, <3 mg/ml, <2 mg/ml, <1 mg/ml, 등등일 수 있다. 바람직한 범위는 0.3 내지 1 mg/ml이다. 최대 0.85 mg/투여량이 바람직하다. 알루미늄 하이드록시드 및 알루미늄 포스페이트 애주번트가 본 발명에 사용하기에 적합하다.
적합한 한 면역 애주번트는 알루미늄 염에 흡착된, WO2011/027222에 정의된 바와 같은 화학식 (I)의 화합물 또는 이의 약학적으로 허용되는 염을 포함한다. 문헌 [Powell & Newman (1995)]에 기재된 것들 중 임의의 것을 포함하는 많은 추가의 애주번트가 사용될 수 있다.
조성물은 특히 다중 투여 형태로 패키징되는 경우 항미생물제를 포함할 수 있다. 항미생물제 예컨대, 티메로살 및 2 페녹시에탄올이 일반적으로 백신에서 발견되지만, 때때로 수은-비함유 보존제를 사용하거나 보존제를 전혀 사용하지 않는 것이 바람직할 수 있다.
조성물은 계면활성제(detergent) 예를 들어, 폴리소르베이트 예컨대, 폴리소르베이트 80을 포함할 수 있다. 계면활성제는 일반적으로 낮은 수준 예를 들어, 0.01% 미만으로 존재한다.
조성물은 소듐 염 (예를 들어, 소듐 클로라이드)를 포함하여 장성을 제공한다. 10 ± 2 mg/ml의 NaCl 농도 예를 들어, 약 9 mg/ml가 전형적이다.
또 다른 양태에서, 본 발명은 사이토메갈로바이러스 (CMV)에 대한 면역 반응을 유도하는 방법으로서, 이를 필요로 하는 대상체에 상기 기재된 바와 같은 단백질, DNA 분자, RNA 분자 (예를 들어, 자가-복제 RNA 분자), 또는 VRP를 포함하는, 면역학적 유효량의 본원에 기재된 면역원성 조성물을 투여하는 것을 포함하는 방법을 제공한다.
특정 구체예에서, 면역 반응은 CMV에 대한 중화 항체의 생성을 포함한다. 특정 구체예에서, 중화 항체는 보체-비의존적이다.
면역 반응은 체액성 면역 반응, 세포-매개된 면역 반응, 또는 이 둘 모두를 포함할 수 있다. 일부 구체예에서, 면역 반응은 각 전달된 CMV 단백질에 대해 유도된다. 세포-매개된 면역 반응은 헬퍼 T-세포 (Th) 반응, CD8+ 세포독성 T-세포(CTL) 반응, 또는 이 둘 모두를 포함할 수 있다. 일부 구체예에서, 면역 반응은 체액성 면역 반응을 포함하고, 항체는 중화 항체이다. 중화 항체는 세포의 바이러스 감염을 차단한다. CMV는 상피 세포 및 또한, 섬유아세포도 감염시킨다. 일부 구체예에서, 면역 반응은 두 세포 유형 모두의 감염을 감소 또는 예방한다. 중화 항체 반응은 보체-의존적 또는 보체-비의존적일 수 있다. 일부 구체예에서, 중화 항체 반응은 보체-비의존적이다. 일부 구체예에서, 중화 항체 반응은 교차-중화이고; 즉, 투여된 조성물에 대해 생성된 항체는 조성물에 사용된 균주 이외의 균주의 CMV 바이러스를 중화시킨다.
당업계에서 항체 효능의 유용한 척도는 "50% 중화 역가"이다. 50% 중화 역가를 결정하기 위해, 면역화된 동물로부터의 혈청을 희석하여 얼마나 희석된 혈청이 바이러스의 50%가 세포 내로 진입하는 것을 차단하는 능력을 여전히 보유할 수 있는지를 평가한다. 예를 들어, 700의 역가는 혈청이 700배 희석된 후 바이러스의 50%를 중화시키는 능력을 보유한다는 것을 의미한다. 따라서, 더 높은 역가는 더욱 강력한 중화 항체 반응을 나타낸다. 일부 구체예에서, 이러한 역가는 약 200, 약 400, 약 600, 약 800, 약 1000, 약 1500, 약 2000, 약 2500, 약 3000, 약 3500, 약 4000, 약 4500 약 5000, 약 5500, 약 6000, 약 6500 또는 약 7000의 하한을 갖는 범위이다. 50% 중화 역가 범위는 약 400, 약 600, 약 800, 약 1000, 약 1500, 약 2000, 약 2500, 약 3000, 약 3500, 약 4000, 약 4500, 약 5000, 약 5500, 약 6000, 약 6500, 약 7000, 약 8000, 약 9000, 약 10000, 약 11000, 약 12000, 약 13000, 약 14000, 약 15000, 약 16000, 약 17000, 약 18000, 약 19000, 약 20000, 약 21000, 약 22000, 약 23000, 약 24000, 약 25000, 약 26000, 약 27000, 약 28000, 약 29000 또는 약 30000의 상한을 가질 수 있다. 예를 들어, 50% 중화 역가는 약 3000 내지 약 25000일 수 있다. "약"은 언급된 값의 플러스 또는 마이너스 10%를 의미한다.
본 발명의 조성물은 일반적으로 대상체에 직접 투여될 것이다. 직접 전달은 비경구 주입 (예를 들어, 피하, 복강내, 정맥내, 근육내, 또는 조직의 간질 공간)에 의해 또는 임의의 다른 적합한 경로에 의해 달성될 수 있다. 예를 들어, 근육내 투여 예를 들어, 넓적다리 또는 위팔로의 투여가 이용될 수 있다. 주입은 바늘 (예를 들어, 피하 바늘)을 통해서 이루어질 수 있으나, 무침 주입이 대안적으로 이용될 수 있다. 전형적인 근육내 투여 용량은 약 0.5 ml이다.
투약은 단일 용량 스케줄 또는 다중 용량 스케줄에 의해 이루어질 수 있다. 다중 용량은 일차 면역화 스케줄 및/또는 부스터 면역화 스케줄에 이용될 수 있다. 다중 용량 스케줄에서, 다양한 용량이 동일하거나 상이한 경로, 예를 들어, 비경구 프라임(prime) 및 점막 부스트(boost), 점막 프라임 및 비경구 부스트, 등으로 제공될 수 있다. 다중 용량은 전형적으로, 적어도 1주 간격으로 (예를 들어, 약 2주, 약 3주, 약 4주, 약 6주, 약 8주, 약 10주, 약 12주, 약 16주 등) 투여될 것이다.
대상체는 동물 바람직하게는, 척추동물, 더욱 바람직하게는, 포유동물일 수 있다. 예시적인 대상체는 예를 들어, 인간, 소, 돼지, 닭, 고양이 또는 개를 포함할 수 있는데, 본원에서 다루는 병원체가 광범위한 종에 걸쳐 문제가 될 수 있기 때문이다. 백신이 예방용인 경우, 인간은 바람직하게는, 소아 (예를 들어, 토들러 또는 신생아), 십대, 또는 성인이며; 백신이 치료용인 경우, 인간은 바람직하게는, 십대 또는 성인이다. 또한, 소아를 대상으로 하는 백신이 예를 들어, 안전성, 투여량, 면역원성 등을 평가하기 위해 성인에게 투여될 수 있다.
본 발명의 백신은 예방적 (즉, 질병을 예방하기 위한) 또는 치료적 (즉, 질병의 증상을 감소시키거나 제거하기 위한)일 수 있다. 용어 예방적은 특정 병태의 중증도를 감소시키거나 이의 발병을 예방하는 것으로 간주될 수 있다. 의심의 여지를 피하기 위해, 용어 예방 백신은 또한, 예를 들어, 향후 감염의 중증도 또는 기간을 감소시킴으로써 이러한 감염의 효과를 완화시키는 백신을 지칭할 수 있다.
본원에 기재된 분리되고/거나 정제된 CMV 단백질, 복합체, 및 핵산은 단독으로 또는 혼합-양식 요법에서 프라임 또는 부스트로서 예컨대, RNA 프라임 후의 단백질 부스트로서 투여될 수 있다. RNA 프라임 단백질 부스트 전략의 이점은, 단백질 프라임 단백질 부스트 전략과 비교하여, 예를 들어, 증가된 항체 역가, 더욱 균형을 이룬 IgG1:IgG2a 서브타입 프로파일, 바이러스 입자의 것과 유사한 TH1-타입 CD4+ T 세포-매개된 면역 반응의 유도, 및 비-중화 항체의 감소된 생성을 포함한다. RNA 프라임은 이들이 애주번트를 함유하고 있는지의 여부와 무관하게 조성물의 면역원성을 증가시킬 수 있다.
RNA 프라임-단백질 부스트 전략에서, RNA 및 단백질은 동일한 표적 항원으로 향하게 된다. 적합한 RNA 전달 모드의 예는 바이러스-유사 레플리콘 입자(VRP), 알파바이러스 RNA, 리피드 나노입자(LNP)에 캡슐화된 레플리콘 또는 제형화된 RNA, 예컨대, 양이온성 나노에멀젼(CNE)으로 제형화된 레플리콘을 포함한다. 예를 들어, 오일 코어 (예를 들어, 스쿠알렌 포함) 및 양이온 리피드 (예를 들어, DOTAP, DMTAP, DSTAP, DC-콜레스테롤, 등)을 포함하는, 적합한 양이온 수중유 나노에멀젼이 WO2012/006380에 기재되어 있다.
WO2012/051211은 펜타머 복합체에 대한 항체가 펜타머 복합체의 단백질 성분을 엔코딩하는 제형화된 RNA (CNE 및 LNP) 및 VRP로 면역화된 마우스에서 생성됨을 기재하고 있다. 이들 항체는 상피 세포에서 CMV 감염을 중화시킬 수 있는 것으로 밝혀졌다. RNA 프라임-단백질 부스트 요법은 먼저 (예를 들어, 0-8주) 본 발명의 CMV 단백질 복합체의 단백질 구성요소 중 하나 이상을 엔코딩하는 RNA(VRP, LNP, CNE, 등으로서 전달될 수 있음)로 1회 이상 프라이밍 면역화(들)를 수행하는 것을 포함할 수 있으며, 이어서 나중에 (예를 들어, 24-58주) 애주번트와 선택적으로 제형화된 본 발명의 분리된 CMV 단백질 복합체 또는 애주번트와 선택적으로 제형화된 본 발명의 정제된 CMV 단백질 복합체로 1회 이상 부스팅 면역화(들)를 수행할 수 있다.
일부 구체예에서, RNA 분자는 양이온성 리피드, 리포좀, 코킬레이트, 비로솜, 면역-자극 복합체, 마이크로입자, 마이크로스피어, 나노스피어, 단일 라멜라 소포, 다중 라멜라 소포, 수중유 에멀젼, 유중수 에멀젼, 에멀젼, 다중양이온 펩티드, 양이온성 나노에멀젼, 또는 이들의 조합물 내에 캡슐화되거나, 이들에 결합되거나 이들 상에 흡착된다.
또한, 본원에 기재된 핵산 (예를 들어, RNA), 정제된 단백질, 및 정제된 복합체의 투여용 키트, 및 사용 설명서가 본원에 제공된다. 본 발명은 또한, 본원에 개시된 조성물 또는 백신으로 사전-충전된 전달 장치를 제공한다.
본원에 기재된 약학적 조성물은 하나 이상의 추가적인 치료제와 조합되어 투여될 수 있다. 추가적인 치료제는 비제한적으로, 항생제 또는 항균제, 항구토제, 항진균제, 항염증제, 항바이러스제, 면역 조절제, 사이토카인, 항우울제, 호르몬, 알킬화제, 항대사물질, 항종양 항생제, 항유사분열제, 국소이성화효소 억제제, 세포증식억제제, 항-침습제(anti-invasion agent), 항혈관형성제, 성장 인자 기능의 억제제, 바이러스 복제 억제제, 바이러스 효소 억제제, 항암제, α-인터페론, β-인터페론, 리바비린, 호르몬 및 기타 톨-유사 수용체 조절제, 면역글로불린 (Ig),및 Ig 기능을 조절하는 항체 (예컨대, 항-IgE (오말리주맙(omalizumab))를 포함할 수 있다.
특정 구체예에서, 본원에 기재된 조성물은 예를 들어, 면역 반응의 유도 또는 증강을 필요로 하는 대상체 예컨대, 포유동물에서 면역 반응을 유도하거나 증강시키는데 사용하기 위한 의약으로서 이용될 수 있다.
특정 구체예에서, 본원에 기재된 조성물은 면역 반응의 유도 또는 증강을 필요로 하는 대상체 예컨대, 포유동물에서 면역 반응을 유도하거나 증강시키기 위한 의약의 제조에 사용될 수 있다.
치료학적 치료의 효능을 확인하는 한 방법은 본원에 기재된 조성물 또는 백신의 투여 후에 병원체 감염을 모니터링하는 것을 포함한다. 예방학적 치료의 효능을 확인하는 또 다른 방법은 항원에 대한 면역 반응을 전신에서 (예컨대, IgG1 및 IgG2a 생산 수준 모니터링) 및/또는 점막에서 (예컨대, IgA 생산 수준 모니터링)을 모니터링하는 것을 포함한다. 전형적으로, 항원-특이적 혈청 항체 반응은 면역화 후 그러나, 챌린지 전(pre-challenge)에 결정되는 반면, 항원-특이적 점막 항체 반응은 면역화 후 및 챌린지 후에 결정된다.
본 발명은 하기 실시예에 의해 추가로 설명되며, 이는 제한하는 것으로서 해석되어서는 안된다.
실시예
실시예
1: 재료 및 방법
서열 및 구조 분석. CMV, VZV 및 HSV1 및 HSV2의 gL 서열을 CLUSTALW (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_clustalw.html)를 사용하여 정렬하고, 수동으로 조절하여 VZV 및 HSV2의 보존된 β-가닥에 기여하는 잔기를 정렬하였다.
펜타 및 gH / gL 복합체의 발현. 야생형(WT) 펜타머 복합체("펜타") 또는 gL 돌연변이 ("LSG" 및 "IDG" 돌연변이체)를 갖는 펜타를, 하나의 벡터에는 gH 및 gL을 가지며 나머지 다른 하나의 벡터에는 3개의 UL을 갖는 2개의 벡터 시스템을 사용하여 발현시켰다. IRES(내부 리보솜 진입 부위)의 서열은 각 벡터에서 다른 유전자를 분리한다. gH는 C-말단 6xHis 태그 (SEQ ID NO:11)를 가지며, UL130은 절단가능한 C-말단 스트렙-태그를 갖는다. 배양액 1리터당 1mg의 총 DNA를 갖는 두 벡터의 DNA를 제조업자의 프로토콜에 따라 Expifectamine 형질감염 키트(Life Technologies)를 사용하여 Expi293 세포 내로 형질감염시켰다. 세포를 쉐이커 플라스크에서 97% 초과의 생존율로 트렌스펙션 당일에 ~2.5x106 세포/mL로 성장시켰다. 형질감염된 세포를 37℃, 150rpm 및 8% CO2에서 작동되는 쉐이커 인큐베이터에서 ~60%의 생존율로 3일 동안 ~8x106 세포/mL로 성장시켰다. 발현 배지의 상청액을 4200 rpm에서 30분 동안 원심분리하여 채취하였다.
WT gH/gL 또는 gL 돌연변이를 갖는 gH/gL을 상기 기술된 것과 동일한 방식으로 gH 및 gL 둘 모두를 함유하는 벡터를 사용하여 발현시켰다.
N-말단 시퀀싱. N-말단 시퀀싱을, 친화성 정제된 WT 펜타의 SDS page 및 웨스턴 블롯 (WB)의해 가시화가능한 알려지지 않은 밴드를 확인하는데 이용하였다. SDS page 상의 펜타를 에탄올 활성화된 PVDF 막으로 옮기고, 이를 40% 메탄올 중의 0.02% Coomassie Brilliant 블루로 염색하고, 이어서 증류수로 여러 번 세척한 후 완전히 공기 건조시켰다. 관심 밴드를 절제하고 시퀀싱을 위해 Tufts University Protein Core Facility로 발송하였다.
정제 및 웨스턴 블롯 분석. 채취된 상청액을 농축하고 KrosFlo Research II TFF 시스템 및 중공 Fiber Cartridge (Spectrumlabs)를 사용하여 친화성 칼럼 결합 완충액 (50 mM Hepes pH7.0, 150 mM NaCl, 및 1 mM EDTA)으로 완충액 교환하였다. 농축된 상청액을 StrepTrap HP 카트리지 (GE Life Sciences)에 로딩하고, 용출 완충액 (50 mM Hepes pH 7.0, 150 mM NaCl, 2.5 mM 데스티오바이오틴, 및 1 mM EDTA)으로 용출하였다. 용출액으로부터의 피크 분획을 gH의 C-말단에 위치한 His-태그 또는 gL에 대한 항체를 사용하여 SDS-PAGE 및 웨스턴 블롯팅에 의해 분석하였다.
마우스에서 면역화 연구. 군 당 10마리 마우스를 3가지의 상이한 용량 0.03 μg, 0.1μg 및 1μg의, MF59로 애주번트 처리된 정제된 WT 또는 돌연변이 펜타머 복합체 gH/gL/pUL128/pUL130/pUL131로 3주 간격을 두고 3회 주사로 면역화시켰다. 혈청 샘플을 56℃에서 30분 동안 열-불활성화시키고, 2배 단계 (희석 당 2회 반복)로 연속 희석하고, 배지 ± 10% 기니아 피그 보완물 (Cedarlane Labs, Burlington, NC, USA)에서 200-250개 감염된 세포/계수 필드(counting field)의 표적 농도로 희석된 동일한 부피의 HCMV 바이러스와 혼합하고, 37℃/5% CO2에서 2시간 동안 인큐베이션하였다. 이러한 혈청/바이러스 샘플을 96-웰 반-면적 세포 배양 플레이트 (Corning Inc., Corning, NY, USA)에서 제조된 ARPE-19 세포 또는 MRC-5 세포에 첨가하였다. 감염된 단층을 37℃/5% CO2에서 48시간 (± 8시간) 동안 인큐베이션하고, 10% 완충 포르말린 (EMD Chemicals Inc., Gibbstown, NJ, USA)으로 1시간 동안 고정시키고, 세척 완충액 (PBS/0.05 % Tween-20)으로 3회 세척하고, PBS/2.5% 소태아 혈청, 0.5% 사포닌, 0.1% 소듐 아지드로 실온에서 1시간 동안 차단하였다. 플레이트를 3회 세척하고, 탭핑 건조(taped dry)시키고, 25℃ 습식 인큐베이터에서 1시간 동안 인큐베이션하였다. 이어서, 플레이트를 실온에서 1시간 동안 하이브리도마 L14 (사포닌 완충액에서 희석됨)로부터 유래된 항-HCMV IE1 항체와 인큐베이션하였다. 플레이트를 3회 세척하고, AlexaFluor 488 (사포닌 완충액으로 희석됨)과 컨주게이팅된 항-마우스 IgG와 1시간 동안 인큐베이션하고, 이어서 PBS/0.05% Tween-20으로 3회 세척하였다. Immunospot S5 UV Analyzer (Cellular Technology Limited, Shaker Heights, OH, USA)를 사용하여 형광 세포를 계수하고, (희석제 플러스 바이러스 대조군 웰에서 감염된 세포 계수와 비교하여) 감염된 세포 계수의 50% 감소를 초래하는 혈청 희석의 역수로서 규정된 50% 중화 역가를, 50% 값 초과 및 50% 값 미만의 평균 감염된 세포 계수를 산출하는 웰들을 사용하여 두 희석액 사이의 선형 회귀 보간법에 의해 계산하였다.
실시예
2: 결과
1.
gL
클립핑은
보존된 β-가닥 옆에 발생한다.
gL에 대한 항체를 사용하는 웨스턴 블롯에 의해 확인된 밴드가 gL 잔기 97로 시작됨이 N-말단 시퀀싱에 의해 밝혀졌다. 따라서, 포유동물 세포에서 발현된 gH/gL/pUL128/pUL130/pUL131 펜타머 복합체는 gL 잔기 Asn97과 Ser98 사이에서 클립핑된 gL 단백질 집단을 함유한다. 구조 기반 서열 정렬은, 클립핑 부위가 VZV 및 HSV-2 gH/gL 구조 둘 모두에서 보존된 β-가닥 옆의 루프 영역에 존재함을 추가로 드러냈다 (도 1).
이러한 클립핑 부위 부근에서 gL 서열로 도입된 다양한 돌연변이는 gL 클립핑 양의 감소를 유도하였다. 추가 돌연변이를 절단 부위 내로 극성 및 비극성 잔기가 혼합된 2개 내지 5개 잔기 사이에 삽입시켰다. 결실 돌연변이는 절단 부위 주변의 1 내지 3개 잔기를 결실시켰다. 치환 돌연변이는 Ala96을 소수성 잔기 또는 큰 측쇄를 지닌 잔기로 교환시키거나; Asn97을 더 작거나 더 큰 측쇄를 지닌 극성 잔기 또는 비극성 잔기로 교환시키거나; Ser98을 극성 또는 비극성 특성을 갖는 작은 측쇄를 지닌 잔기로 교환시켰다.
2. 다양한 돌연변이체
gH
/
gL과
야생형
gH
/
gL의
비교
도 2A는 평가된 다양한 돌연변이체 gL 단백질을 보여준다. 다양한 gL 돌연변이를 함유하는 gH/gL 복합체를 Expi293 세포에서 발현시키고 WT gH/gL과 비교하였다. 프로테아제 인식 부위에서의 돌연변이는 발현된 gH/gL 복합체에서 gL 클립핑을 감소시켰다. 예를 들어, WT 미처리 상청액의 항-gL 웨스턴 블롯은 N-말단 시퀀싱에 의해 결정된 바와 같이, 이의 N-말단에서 잔기 98을 지닌 gL 단편의 명확하게 가시화된 밴드를 보여주었다. 대조적으로, 유사한 밴드가 "LSG" 돌연변이체에서 검출되지 않았으며, "델타 Asn97" 및 "SST" 돌연변이체에서 검출되지 않거나 현저하게 감소되었다 (도 2).
클립핑 부위 부근에 도입된 3개의 잔기 변이체는 클립핑 부위 부근에서 단일 잔기 변이체보다 더 큰 정도로 클립핑을 감소시켰다. "LSG" 돌연변이체는 항-His 웨스턴 블롯에서 gL 클립핑 밴드의 강도를 가장 현저하게 감소시켰다. 또한, 17-잔기 삽입의 제거는 웨스턴 블롯에 의해 관찰된 gL 클립핑 밴드 즉, gH/gL(N)의 강도를 향상시켰으며, 이러한 삽입이 절단 부위를 보호할 수 있음을 암시한다 (도 2C).
3. "
LSG
" 및 "
IDG
" 돌연변이체 펜타와 야생형
펜타머의
비교
"LSG" 및 "IDG" 돌연변이체가 또한 gH/gL/pUL128/pUL130/pUL131 펜타머에서 gL 클립핑을 제거하거나 감소시켰는지의 여부를 분석하기 위해, 친화성 정제된 WT 및 돌연변이체 펜타머를 항-His 및 항-gL 웨스턴 블롯에 의해 분석하였다. WT 펜타머의 항-His 웨스턴 블롯에서, 전장 gH/gL보다 더 적은 분자량을 갖는 명백한 밴드가 존재하며, 이는 클립핑 후 gL의 N-말단 영역과 gH의 복합체와 일치한다. gL의 이러한 N-말단 단편은 항-gL 항체에 의해 인식되지 않음을 주지하라. 항-gL 웨스턴 블롯에서, N-말단 시퀀싱에 의해 결정된 바와 같이, 잔기 98로 시작되는 gL의 C-말단 영역은 비-환원 샘플에서 UL128과의 복합체를 형성한다. gL의 동일한 C-말단 단편 자체는 환원 샘플에서 관찰되었다. 비교해 보면, gL 클립핑으로부터 발생하는 이들 밴드는 "LSG" 또는 "IDG" 돌연변이체 펜타머에서 검출되지 않았다(도 3 및 4). "LSG" 및 "IDG" 돌연변이체 둘 모두는 WT 펜타머 복합체와 유사하게 행동하는 펜타머를 생성하였다. 따라서, 이러한 돌연변이는 gH/gL/pUL128/pUL130/pUL131 펜타머 복합체의 어셈블리에 영향을 미치지 않으나, gL 단백질의 단백질분해 클립핑을 제거하였다 (도 5A).
면역원성 분석은 LSG 및 IDG 돌연변이체가 gH/gL/pUL128/pUL130/pUL131 펜타머 복합체의 면역원성을 손상시키지 않았음을 보여주었다 (도 5B).
클립핑으로부터 발생한 gL의 단편은 gH/gL, gH/gL/gO (데이터 미도시됨) 및 gH/gL/pUL128/pUL130/pUL131 복합체의 발현 동안 검출되었다. 이러한 3가지의 복합체에서 클립핑 부위는 gL 잔기 97과 98 사이로 동일하다. 따라서, gH/gL의 발현 동안 gL 클립핑을 방지하는 돌연변이가 또한 gH/gL/gO 및 gH/gL/pUL128/pUL130/pUL131 펜타머 복합체의 발현 동안 gL 클립핑을 방지한다.
단지 3회의 잔기 치환 또는 단일 결실을 이용하여, gL 클립핑이 각각 제거되거나 현저하게 감소될 수 있다. 이러한 돌연변이의 위치는 이들 부근의 보존된 이차 구조에 영향을 미칠 것으로 예상되지 않는다. 이는 동종성 gH/gL/pUL128/pUL130/pUL131 펜타머로서, 이의 삼차원 구조, 및 항원성/면역원성은 크게 영향을 받지 않는 펜타머의 생성을 허용한다. 본 발명자들은 동종 서열을 갖는 클립핑 부위 부근에서의 서열을 돌연변이시키는 전략의 유효성을 입증한 것으로 결론 내렸다.
상기 개별 섹션에서 언급된 본 발명의 다양한 특징 및 구체예는 필요한 부분만 약간 수정하여 적절하게 다른 섹션에 적용된다. 결론적으로, 한 섹션에서 명시된 특징은 다른 섹션에서 명시된 특징과 적절하게 조합될 수 있다.
본 명세서는 본 명세서 내에 언급된 참고문헌의 교시의 관점에서 가장 잘 이해된다. 본 명세서 내의 구체예는 본 발명의 구체예의 실례를 제공하며, 본 발명의 범위를 제한하는 것으로 해석되어서는 안된다. 당업자는 많은 다른 구체예가 본 발명에 포함됨을 용이하게 인지한다. 본 기재내용에 언급된 모든 간행물 및 특허는 그 전체가 참조로서 통합된다. 참고문헌에 의해 통합된 내용이 본 명세서와 상충되거나 일관되지 않을 정도로, 본 명세서는 임의의 이러한 내용을 대신할 것이다. 본원에서 임의의 참고문헌의 인용은 이러한 참고문헌이 본 발명의 선행 기술임을 인정하는 것은 아니다.
본 발명의 실시는 달리 지시되지 않는 한, 당해 기술 내의 화학, 생화학, 분자 생물학, 면역학 및 약리학의 통상적인 방법을 이용할 것이다. 이러한 기술은 문헌에 충분히 설명되어 있다. 용어 "포함하는(comprising)"은 "포함하는(including)"은 물론 "구성하는"을 포함하며, 예를 들어, X를 "포함하는" 조성물은 X로 독점적으로 구성될 수 있거나 일부 추가적인 것 예를 들어, X + Y를 포함할 수 있다.
용어 "본질적으로 구성되는"은 조성물, 방법 또는 구조가 추가적인 성분, 단계 및/또는 부분을 포함할 수 있으며, 단 추가적인 성분, 단계 및/또는 부분은 청구된 조성물, 방법 또는 구조의 기본적 및 신규한 특징을 실질적으로 변경시키지 않아야 함을 의미한다. 일반적으로, 용어 "구성된"은, 청구된 바와 같은 본 발명이 청구범위에 구체적으로 인용된 요소들로 제한됨 (등가물의 학설이 적용되는 한 이들의 등가물을 포함할 수 있음)을 의미하는 것으로 간주된다.
당업자는 관례적인 실험만을 이용하여 본원에 기재된 본 발명의 특정 구체예에 대한 많은 균등물을 인식하거나 확인할 수 있을 것이다. 이러한 균등물은 하기 구체예에 의해 포함되는 것으로 의도된다.
1. 재조합 사이토메갈로바이러스 (CMV) gL 단백질, 또는 이의 복합체-형성 단편으로서, 상기 gL 단백질 또는 단편은 프로테아제 인식 부위 내에서 돌연변이를 포함하며, 상기 돌연변이는 대조군과 비교하여 상기 프로테아제 인식 부위에서 프로테아제 절단을 감소시키는, 재조합 CMV gL 단백질, 또는 이의 복합체-형성 단편.
2. 제 1 구체예에 있어서, 상기 돌연변이가 아미노산 잔기의 첨가, 결실, 치환, 또는 이들의 조합을 포함하는 gL 단백질 또는 단편.
3. 제 1 또는 제 2 구체예에 있어서, 상기 프로테아제 인식 부위의 3개 또는 그 초과의 잔기가 β-가닥을 형성하며, 상기 돌연변이가 β-가닥 입체형태를 유지하는 gL 단백질 또는 단편.
4. 제 1 내지 제 3 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 포유동물 숙주 세포에서 재조합 발현될 경우 상기 프로테아제 인식 부위에서 20% (몰 백분율) 이하의 절단된 gL을 발생시키는 gL 단백질 또는 단편.
5. 제 1 내지 제 4 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 하나 이상의 아미노산 잔기의 첨가를 포함하는 gL 단백질 또는 단편.
6. 제 1 내지 제 5 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 2 내지 5개의 아미노산 잔기의 첨가를 포함하는 gL 단백질 또는 단편.
7. 제 6 구체예에 있어서, 상기 2 내지 5개의 아미노산 잔기가 극성 잔기(들) 및 비-극성 잔기(들) 둘 모두를 포함하는 gL 단백질 또는 단편.
8. 제 1 내지 제 7 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 잔기 N97과 S98 사이에 하나 이상의 잔기의 첨가를 포함하는 gL 단백질 또는 단편.
9. 제 1 내지 제 8 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 잔기 N97과 S98 사이에 F, Q, FQ 또는 QF의 첨가를 포함하는 gL 단백질 또는 단편.
10. 제 1 내지 제 9 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 하나 이상의 아미노산 잔기의 결실을 포함하는 gL 단백질 또는 단편.
11. 제 1 내지 제 10 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 1 내지 3개의 아미노산 잔기의 결실을 포함하는 gL 단백질 또는 단편.
12. 제 1 내지 제 11 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 V91, T92, P93, E94, A95, A96, N97, S98, V99, L100, L101, D102 및 이들의 조합물로 구성된 군으로부터 선택된 잔기의 결실을 포함하는 gL 단백질 또는 단편.
13. 제 1 내지 제 12 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 A95, A96, N97 및 이들의 조합물로 구성된 군으로부터 선택된 잔기의 결실을 포함하는 gL 단백질 또는 단편.
14. 제 1 내지 제 13 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 N97을 결실시키는 것을 포함하는 gL 단백질 또는 단편.
15. 제 1 내지 제 14 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 잔기를 또 다른 헤르페스 바이러스의 gL 단백질로부터의 상응하기 잔기로 치환하는 것을 포함하는 gL 단백질 또는 단편.
16. 제 15 구체예에 있어서, 또 다른 헤르페스 바이러스로부터의 상기 gL 단백질이 HSV1, HSV2, VZV, EBV, PrV, 또는 소 헤르페스바이러스 5로부터의 gL 단백질인 gL 단백질 또는 단편.
17. 제 1 내지 제 16 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 g A96을 비극성 잔기 또는 큰 측쇄를 포함하는 잔기로 치환하는 것을 포함하는 gL 단백질 또는 단편.
18. 제 1 내지 제 17 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 A96을 I, L, V 또는 S로 치환하는 것을 포함하는 gL 단백질 또는 단편.
19. 제 1 내지 제 18 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 A95를 R, L, E 또는 N으로 치환하는 것을 포함하는 gL 단백질 또는 단편.
20. 제 1 내지 제 19 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 E94를 A 또는 L로 치환하는 것을 포함하는 gL 단백질 또는 단편.
21. 제 1 내지 제 20 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 N97을 극성 잔기 또는 비-극성 잔기로 치환하는 것을 포함하는 gL 단백질 또는 단편.
22. 제 21 구체예에 있어서, 상기 극성 잔기가 작은 측쇄를 포함하는 gL 단백질 또는 단편.
23. 제 21 구체예에 있어서, 상기 극성 잔기는 큰 측쇄를 포함하는 gL 단백질 또는 단편.
24. 제 1 내지 제 23 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 N97을 S, D, E, A, T 또는 Y로 치환하는 것을 포함하는 gL 단백질 또는 단편.
25. 제 1 내지 제 24 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 N97을 S 또는 D로 치환하는 것을 포함하는 gL 단백질 또는 단편.
26. 제 1 내지 제 25 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 S98을 작은 측쇄를 지닌 아미노산 잔기로 치환하는 것을 포함하는 gL 단백질 또는 단편.
27. 제 1 내지 제 26 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 S98을 G, T, V 또는 I로 치환하는 것을 포함하는 gL 단백질 또는 단편.
28. 제 1 내지 제 27 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 S98을 G 또는 T로 치환하는 것을 포함하는 gL 단백질 또는 단편.
29. 제 1 내지 제 28 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 V99를 I로 치환하는 것을 포함하는 gL 단백질 또는 단편.
30. 제 1 내지 제 29 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 L100을 F 또는 V를 지닌 아미노산 잔기로 치환하는 것을 포함하는 gL 단백질 또는 단편.
31. 제 1 내지 제 30 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 L101을 V 또는 I를 지닌 아미노산 잔기로 치환하는 것을 포함하는 gL 단백질 또는 단편.
32. 제 1 내지 제 31 구체예 중 어느 한 구체예에 있어서, 상기 gL 단백질 또는 단편이 프로테아제 인식 부위의 N-말단에서 삽입 영역을 포함하는 gL 단백질 또는 단편.
33. 제 1 내지 제 32 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 비-자연 발생 아미노산 잔기를 도입하는 것을 포함하는 gL 단백질 또는 단편.
34. 제 1 내지 제 33 구체예 중 어느 한 구체예에 있어서, 상기 돌연변이가 벌키 측쇄를 포함하는 아미노산 잔기를 도입하는 것을 포함하는 gL 단백질 또는 단편.
35. 제 1 내지 제 34 구체예 중 어느 한 구체예의 재조합 gL 단백질 또는 단편을 포함하는 CMV 복합체.
36. 제 35 구체예에 있어서, gH, gL, pUL128, pUL130, pUL131, gO, 이의 복합체-형성 단편, 및 이들의 조합물로 구성된 군으로부터 선택된 CMV 단백질을 포함하는 복합체.
37. 제 35 또는 제 36 구체예에 있어서, 상기 복합체가 gH 또는 이의 펜타머-형성 단편, gL 또는 이의 펜타머-형성 단편, pUL128 또는 이의 펜타머-형성 단편, pUL130 또는 이의 펜타머 형성 단편, 및 pUL131 또는 이의 펜타머-형성 단편을 포함하는 펜타머 복합체인 복합체.
38. 제 35 또는 제 36 구체예에 있어서, 상기 복합체가 gH 또는 이의 복합체-형성 단편, 및 gL 또는 이의 복합체-형성 단편을 포함하는 gH/gL 복합체인 복합체.
39. 제 35 또는 제 36 구체예에 있어서, 상기 복합체가 gH 또는 이의 복합체-형성 단편, gL 또는 이의 복합체-형성 단편, 및 gO 또는 이의 복합체 형성 단편을 포함하는 트리머 복합체인 복합체.
40. 제 1 내지 제 34 구체예 중 어느 한 구체예의 재조합 CMV gL 단백질 또는 단편, 또는 제 35 내지 제 39 구체예 중 어느 한 구체예의 복합체를 포함하는 면역원성 조성물.
41. 제 40 구체예에 있어서, 애주번트를 추가로 포함하는 면역원성 조성물.
42. 제 41 구체예에 있어서, 상기 애주번트가 알루미늄 염, TLR7 효능제, 수중유 에멀젼, 또는 이들의 조합물을 포함하는 면역원성 조성물.
43. 제 42 구체예에 있어서, 상기 수중유 에멀젼이 MF59인 면역원성 조성물.
44. 제 1 내지 제 34 구체예 중 어느 한 구체예의 재조합 CMV gL 단백질 또는 단편을 엔코딩하는 폴리뉴클레오티드 서열을 포함하는 분리된 핵산.
45. 제 44 구체예에 있어서, 상기 분리된 핵산이 RNA 바람직하게는, 자가-복제 RNA인 분리된 핵산.
46. 제 45 구체예에 있어서, 상기 자가-복제 RNA가 알파바이러스 레플리콘인 분리된 핵산.
47. 제 46 구체예의 알파바이러스 레플리콘을 포함하는 알파바이러스 복제 입자(VRP).
48. 제 44 내지 제 46 구체예 중 어느 한 구체예의 핵산을 포함하는 면역원성 조성물.
49. 제 47 구체예의 VRP를 포함하는 면역원성 조성물.
50. 제 48 또는 제 49 구체예에 있어서, 애주번트를 추가로 포함하는 면역원성 조성물.
51. 제 50 구체예에 있어서, 상기 애주번트가 알루미늄 염, TLR7 효능제, 수중유 에멀젼(예컨대, MF59), 또는 이들의 조합물을 포함하는 면역원성 조성물.
52. 제 44 내지 제 46 구체예 중 어느 한 구체예의 핵산을 포함하는 숙주 세포.
53. 제 52 구체예에 있어서, 상기 핵산이 DNA인 숙주 세포.
54. 제 53 구체예에 있어서, 상기 숙주 세포가 포유동물 세포인 숙주 세포.
55. 제 54 구체예에 있어서, 상기 포유동물 세포가 CHO 세포 또는 HEK-293 세포인 숙주 세포.
56. 제 53 내지 제 55 구체예 중 어느 한 구체예에 있어서, CMV gL 단백질 또는 이의 단편을 엔코딩하는 상기 DNA가 상기 숙주 세포의 게놈 DNA로 통합된 숙주 세포.
57. 제 52 내지 제 56 구체예 중 어느 한 구체예에 있어서, 상기 숙주 세포가 CMV 펜타머 복합체를 엔코딩하는 하나 이상의 폴리뉴클레오티드 서열을 포함하며, 상기 펜타머 복합체는 gH 또는 이의 펜타머-형성 단편, gL 또는 이의 펜타머-형성 단편, pUL128 또는 이의 펜타머-형성 단편, pUL130 또는 이의 펜타머-형성 단편, 및 pUL131 또는 이의 펜타머-형성 단편을 포함하는 숙주 세포.
58. 제 57 구체예에 있어서, 상기 CMV 펜타머 복합체를 엔코딩하는 하나 이상의 폴리뉴클레오티드 서열이 상기 숙주 세포의 게놈 DNA로 통합된 숙주 세포.
59. 제 57 또는 제 58 구체예에 있어서, 상기 세포가 적합한 조건하에서 배양되는 경우 상기 CMV 펜타머 복합체를 발현하는 숙주 세포.
60. 제 59 구체예에 있어서, 상기 펜타머 복합체가 분비되는 숙주 세포.
61. 제 52 내지 제 60 구체예 중 어느 한 구체예의 숙주 세포를 포함하는 세포 배양물로서, 상기 배양물이 적어도 20 리터 크기인 세포 배양물.
62. 제 52 내지 제 60 구체예 중 어느 한 구체예의 숙주 세포를 포함하는 세포 배양물로서, 상기 배양물이 적어도 100 리터 크기인 세포 배양물.
63. 제 57 내지 제 60 구체예 중 어느 한 구체예의 숙주 세포를 포함하는 세포 배양물로서, 상기 펜타머 복합체의 수득량이 적어도 0.05 g/L인 세포 배양물.
64. 제 63 구체예에 있어서, 상기 펜타머 복합체의 수득량이 적어도 0.1 g/L인 숙주 세포를 포함하는 세포 배양물.
65. 재조합 사이토메갈로바이러스 (CMV) gL 단백질, 또는 이의 복합체-형성 단편을 생성하는 방법으로서,
(i) 적합한 조건하에서 제 52 내지 제 60 구체예 중 어느 한 구체예의 숙주 세포를 배양하여 상기 gL 단백질 또는 이의 복합체-형성 단편을 발현시키고;
(ii) 상기 gL 단백질 또는 이의 복합체-형성 단편을 배양물로부터 채취하는 것을 포함하는 방법.
66. 사이토메갈로바이러스 (CMV)에 대한 면역 반응을 유도하는 방법으로서, 이를 필요로 하는 대상체에 면역학적 유효량의 제 40 내지 제 43 및 제 48 내지 제 51 구체예 중 어느 한 구체예의 면역원성 조성물을 투여하는 것을 포함하는 방법.
67. 제 66 구체예에 있어서, 면역 반응이 CMV에 대한 중화 항체의 생성을 포함하는 방법.
68. 제 67 구체예에 있어서, 중화 항체가 보체-비의존적인 방법.
69. 사이토메갈로바이러스 (CMV)가 세포 내로 진입하는 것을 억제하는 방법으로서, 세포를 제 40 내지 제 43 및 제 48 내지 제 51 구체예 중 어느 한 구체예의 면역원성 조성물과 접촉시키는 것을 포함하는 방법.
70. 사이토메갈로바이러스 (CMV)에 대한 면역 반응을 유도하는데 사용하기 위한 제 40 내지 제 43 및 제 48 내지 제 51 구체예 중 어느 한 구체예의 면역원성 조성물.
71. 사이토메갈로바이러스 (CMV)에 대한 면역 반응을 유도하기 위한 제 40 내지 제 43 및 제 48 내지 제 51 구체예 중 어느 한 구체예의 면역원성 조성물의 용도.
72. 사이토메갈로바이러스 (CMV)에 대한 면역 반응을 유도하기 위한 의약의 제조에서 제 40 내지 제 43 및 제 48 내지 제 51 구체예 중 어느 한 구체예의 면역원성 조성물의 용도.
서열
SEQUENCE LISTING
<110> GLAXOSMITHKLINE BIOLOGICALS SA
<120> CMV ANTIGEN AND USES THEREOFF
<130> VN056504 WO
<140>
<141>
<150> EP 15152221.6
<151> 2015-01-22
<160> 27
<170> PatentIn version 3.5
<210> 1
<211> 278
<212> PRT
<213> Human herpesvirus 5
<400> 1
Met Cys Arg Arg Pro Asp Cys Gly Phe Ser Phe Ser Pro Gly Pro Val
1 5 10 15
Ile Leu Leu Trp Cys Cys Leu Leu Leu Pro Ile Val Ser Ser Ala Ala
20 25 30
Val Ser Val Ala Pro Thr Ala Ala Glu Lys Val Pro Ala Glu Cys Pro
35 40 45
Glu Leu Thr Arg Arg Cys Leu Leu Gly Glu Val Phe Glu Gly Asp Lys
50 55 60
Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr Gly Arg Asp Gly
65 70 75 80
Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr Pro Glu Ala Ala
85 90 95
Asn Ser Val Leu Leu Asp Glu Ala Phe Leu Asp Thr Leu Ala Leu Leu
100 105 110
Tyr Asn Asn Pro Asp Gln Leu Arg Ala Leu Leu Thr Leu Leu Ser Ser
115 120 125
Asp Thr Ala Pro Arg Trp Met Thr Val Met Arg Gly Tyr Ser Glu Cys
130 135 140
Gly Asp Gly Ser Pro Ala Val Tyr Thr Cys Val Asp Asp Leu Cys Arg
145 150 155 160
Gly Tyr Asp Leu Thr Arg Leu Ser Tyr Gly Arg Ser Ile Phe Thr Glu
165 170 175
His Val Leu Gly Phe Glu Leu Val Pro Pro Ser Leu Phe Asn Val Val
180 185 190
Val Ala Ile Arg Asn Glu Ala Thr Arg Thr Asn Arg Ala Val Arg Leu
195 200 205
Pro Val Ser Thr Ala Ala Ala Pro Glu Gly Ile Thr Leu Phe Tyr Gly
210 215 220
Leu Tyr Asn Ala Val Lys Glu Phe Cys Leu Arg His Gln Leu Asp Pro
225 230 235 240
Pro Leu Leu Arg His Leu Asp Lys Tyr Tyr Ala Gly Leu Pro Pro Glu
245 250 255
Leu Lys Gln Thr Arg Val Asn Leu Pro Ala His Ser Arg Tyr Gly Pro
260 265 270
Gln Ala Val Asp Ala Arg
275
<210> 2
<211> 278
<212> PRT
<213> Human herpesvirus 5
<400> 2
Met Cys Arg Arg Pro Asp Cys Gly Phe Ser Phe Ser Pro Gly Pro Val
1 5 10 15
Ala Leu Leu Trp Cys Cys Leu Leu Leu Pro Ile Val Ser Ser Ala Thr
20 25 30
Val Ser Val Ala Pro Thr Val Ala Glu Lys Val Pro Ala Glu Cys Pro
35 40 45
Glu Leu Thr Arg Arg Cys Leu Leu Gly Glu Val Phe Gln Gly Asp Lys
50 55 60
Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr Arg Arg Asp Gly
65 70 75 80
Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr Pro Glu Ala Ala
85 90 95
Asn Ser Val Leu Leu Asp Asp Ala Phe Leu Asp Thr Leu Ala Leu Leu
100 105 110
Tyr Asn Asn Pro Asp Gln Leu Arg Ala Leu Leu Thr Leu Leu Ser Ser
115 120 125
Asp Thr Ala Pro Arg Trp Met Thr Val Met Arg Gly Tyr Ser Glu Cys
130 135 140
Gly Asp Gly Ser Pro Ala Val Tyr Thr Cys Val Asp Asp Leu Cys Arg
145 150 155 160
Gly Tyr Asp Leu Thr Arg Leu Ser Tyr Gly Arg Ser Ile Phe Thr Glu
165 170 175
His Val Leu Gly Phe Glu Leu Val Pro Pro Ser Leu Phe Asn Val Val
180 185 190
Val Ala Ile Arg Asn Glu Ala Thr Arg Thr Asn Arg Ala Val Arg Leu
195 200 205
Pro Val Ser Thr Ala Ala Ala Pro Glu Gly Ile Thr Leu Phe Tyr Gly
210 215 220
Leu Tyr Asn Ala Val Lys Glu Phe Cys Leu Arg His Gln Leu Asp Pro
225 230 235 240
Pro Leu Leu Arg His Leu Asp Lys Tyr Tyr Ala Gly Leu Pro Pro Glu
245 250 255
Leu Lys Gln Thr Arg Val Asn Leu Pro Ala His Ser Arg Tyr Gly Pro
260 265 270
Gln Ala Val Asp Ala Arg
275
<210> 3
<211> 278
<212> PRT
<213> Human herpesvirus 5
<400> 3
Met Cys Arg Arg Pro Asp Cys Gly Phe Ser Phe Ser Pro Gly Pro Val
1 5 10 15
Val Leu Leu Trp Cys Cys Leu Leu Leu Pro Ile Val Ser Ser Val Ala
20 25 30
Val Ser Val Ala Pro Thr Ala Ala Glu Lys Val Pro Ala Glu Cys Pro
35 40 45
Glu Leu Thr Arg Arg Cys Leu Leu Gly Glu Val Phe Gln Gly Asp Lys
50 55 60
Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr Arg Arg Asp Gly
65 70 75 80
Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr Pro Glu Ala Ala
85 90 95
Asn Ser Val Leu Leu Asp Asp Ala Phe Leu Asp Thr Leu Ala Leu Leu
100 105 110
Tyr Asn Asn Pro Asp Gln Leu Arg Ala Leu Leu Thr Leu Leu Ser Ser
115 120 125
Asp Thr Ala Pro Arg Trp Met Thr Val Met Arg Gly Tyr Ser Glu Cys
130 135 140
Gly Asp Gly Ser Pro Ala Val Tyr Thr Cys Val Asp Asp Leu Cys Arg
145 150 155 160
Gly Tyr Asp Leu Thr Arg Leu Ser Tyr Gly Arg Ser Ile Phe Thr Glu
165 170 175
His Val Leu Gly Phe Glu Leu Val Pro Pro Ser Leu Phe Asn Val Val
180 185 190
Val Ala Ile Arg Asn Glu Ala Thr Arg Thr Asn Arg Ala Val Arg Leu
195 200 205
Pro Val Ser Thr Ala Ala Ala Pro Glu Gly Ile Thr Leu Phe Tyr Gly
210 215 220
Leu Tyr Asn Ala Val Lys Glu Phe Cys Leu Arg His Gln Leu Asp Pro
225 230 235 240
Pro Leu Leu Arg His Leu Asp Lys Tyr Tyr Ala Gly Leu Pro Pro Glu
245 250 255
Leu Lys Gln Thr Arg Val Asn Leu Pro Ala His Ser Arg Tyr Gly Pro
260 265 270
Gln Ala Val Asp Ala Arg
275
<210> 4
<211> 248
<212> PRT
<213> Human herpesvirus 5
<400> 4
Ala Ala Val Ser Val Ala Pro Thr Ala Ala Glu Lys Val Pro Ala Glu
1 5 10 15
Cys Pro Glu Leu Thr Arg Arg Cys Leu Leu Gly Glu Val Phe Glu Gly
20 25 30
Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr Gly Arg
35 40 45
Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr Pro Glu
50 55 60
Ala Ala Asn Ser Val Leu Leu Asp Glu Ala Phe Leu Asp Thr Leu Ala
65 70 75 80
Leu Leu Tyr Asn Asn Pro Asp Gln Leu Arg Ala Leu Leu Thr Leu Leu
85 90 95
Ser Ser Asp Thr Ala Pro Arg Trp Met Thr Val Met Arg Gly Tyr Ser
100 105 110
Glu Cys Gly Asp Gly Ser Pro Ala Val Tyr Thr Cys Val Asp Asp Leu
115 120 125
Cys Arg Gly Tyr Asp Leu Thr Arg Leu Ser Tyr Gly Arg Ser Ile Phe
130 135 140
Thr Glu His Val Leu Gly Phe Glu Leu Val Pro Pro Ser Leu Phe Asn
145 150 155 160
Val Val Val Ala Ile Arg Asn Glu Ala Thr Arg Thr Asn Arg Ala Val
165 170 175
Arg Leu Pro Val Ser Thr Ala Ala Ala Pro Glu Gly Ile Thr Leu Phe
180 185 190
Tyr Gly Leu Tyr Asn Ala Val Lys Glu Phe Cys Leu Arg His Gln Leu
195 200 205
Asp Pro Pro Leu Leu Arg His Leu Asp Lys Tyr Tyr Ala Gly Leu Pro
210 215 220
Pro Glu Leu Lys Gln Thr Arg Val Asn Leu Pro Ala His Ser Arg Tyr
225 230 235 240
Gly Pro Gln Ala Val Asp Ala Arg
245
<210> 5
<211> 17
<212> PRT
<213> Human herpesvirus 5
<400> 5
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
1 5 10 15
Pro
<210> 6
<211> 742
<212> PRT
<213> Human herpesvirus 5
<400> 6
Met Arg Pro Gly Leu Pro Ser Tyr Leu Ile Val Leu Ala Val Cys Leu
1 5 10 15
Leu Ser His Leu Leu Ser Ser Arg Tyr Gly Ala Glu Ala Ile Ser Glu
20 25 30
Pro Leu Asp Lys Ala Phe His Leu Leu Leu Asn Thr Tyr Gly Arg Pro
35 40 45
Ile Arg Phe Leu Arg Glu Asn Thr Thr Gln Cys Thr Tyr Asn Ser Ser
50 55 60
Leu Arg Asn Ser Thr Val Val Arg Glu Asn Ala Ile Ser Phe Asn Phe
65 70 75 80
Phe Gln Ser Tyr Asn Gln Tyr Tyr Val Phe His Met Pro Arg Cys Leu
85 90 95
Phe Ala Gly Pro Leu Ala Glu Gln Phe Leu Asn Gln Val Asp Leu Thr
100 105 110
Glu Thr Leu Glu Arg Tyr Gln Gln Arg Leu Asn Thr Tyr Ala Leu Val
115 120 125
Ser Lys Asp Leu Ala Ser Tyr Arg Ser Phe Ser Gln Gln Leu Lys Ala
130 135 140
Gln Asp Ser Leu Gly Glu Gln Pro Thr Thr Val Pro Pro Pro Ile Asp
145 150 155 160
Leu Ser Ile Pro His Val Trp Met Pro Pro Gln Thr Thr Pro His Gly
165 170 175
Trp Thr Glu Ser His Thr Thr Ser Gly Leu His Arg Pro His Phe Asn
180 185 190
Gln Thr Cys Ile Leu Phe Asp Gly His Asp Leu Leu Phe Ser Thr Val
195 200 205
Thr Pro Cys Leu His Gln Gly Phe Tyr Leu Ile Asp Glu Leu Arg Tyr
210 215 220
Val Lys Ile Thr Leu Thr Glu Asp Phe Phe Val Val Thr Val Ser Ile
225 230 235 240
Asp Asp Asp Thr Pro Met Leu Leu Ile Phe Gly His Leu Pro Arg Val
245 250 255
Leu Phe Lys Ala Pro Tyr Gln Arg Asp Asn Phe Ile Leu Arg Gln Thr
260 265 270
Glu Lys His Glu Leu Leu Val Leu Val Lys Lys Asp Gln Leu Asn Arg
275 280 285
His Ser Tyr Leu Lys Asp Pro Asp Phe Leu Asp Ala Ala Leu Asp Phe
290 295 300
Asn Tyr Leu Asp Leu Ser Ala Leu Leu Arg Asn Ser Phe His Arg Tyr
305 310 315 320
Ala Val Asp Val Leu Lys Ser Gly Arg Cys Gln Met Leu Asp Arg Arg
325 330 335
Thr Val Glu Met Ala Phe Ala Tyr Ala Leu Ala Leu Phe Ala Ala Ala
340 345 350
Arg Gln Glu Glu Ala Gly Ala Gln Val Ser Val Pro Arg Ala Leu Asp
355 360 365
Arg Gln Ala Ala Leu Leu Gln Ile Gln Glu Phe Met Ile Thr Cys Leu
370 375 380
Ser Gln Thr Pro Pro Arg Thr Thr Leu Leu Leu Tyr Pro Thr Ala Val
385 390 395 400
Asp Leu Ala Lys Arg Ala Leu Trp Thr Pro Asn Gln Ile Thr Asp Ile
405 410 415
Thr Ser Leu Val Arg Leu Val Tyr Ile Leu Ser Lys Gln Asn Gln Gln
420 425 430
His Leu Ile Pro Gln Trp Ala Leu Arg Gln Ile Ala Asp Phe Ala Leu
435 440 445
Lys Leu His Lys Thr His Leu Ala Ser Phe Leu Ser Ala Phe Ala Arg
450 455 460
Gln Glu Leu Tyr Leu Met Gly Ser Leu Val His Ser Met Leu Val His
465 470 475 480
Thr Thr Glu Arg Arg Glu Ile Phe Ile Val Glu Thr Gly Leu Cys Ser
485 490 495
Leu Ala Glu Leu Ser His Phe Thr Gln Leu Leu Ala His Pro His His
500 505 510
Glu Tyr Leu Ser Asp Leu Tyr Thr Pro Cys Ser Ser Ser Gly Arg Arg
515 520 525
Asp His Ser Leu Glu Arg Leu Thr Arg Leu Phe Pro Asp Ala Thr Val
530 535 540
Pro Thr Thr Val Pro Ala Ala Leu Ser Ile Leu Ser Thr Met Gln Pro
545 550 555 560
Ser Thr Leu Glu Thr Phe Pro Asp Leu Phe Cys Leu Pro Leu Gly Glu
565 570 575
Ser Phe Ser Ala Leu Thr Val Ser Glu His Val Ser Tyr Val Val Thr
580 585 590
Asn Gln Tyr Leu Ile Lys Gly Ile Ser Tyr Pro Val Ser Thr Thr Val
595 600 605
Val Gly Gln Ser Leu Ile Ile Thr Gln Thr Asp Ser Gln Thr Lys Cys
610 615 620
Glu Leu Thr Arg Asn Met His Thr Thr His Ser Ile Thr Ala Ala Leu
625 630 635 640
Asn Ile Ser Leu Glu Asn Cys Ala Phe Cys Gln Ser Ala Leu Leu Glu
645 650 655
Tyr Asp Asp Thr Gln Gly Val Ile Asn Ile Met Tyr Met His Asp Ser
660 665 670
Asp Asp Val Leu Phe Ala Leu Asp Pro Tyr Asn Glu Val Val Val Ser
675 680 685
Ser Pro Arg Thr His Tyr Leu Met Leu Leu Lys Asn Gly Thr Val Leu
690 695 700
Glu Val Thr Asp Val Val Val Asp Ala Thr Asp Ser Arg Leu Leu Met
705 710 715 720
Met Ser Val Tyr Ala Leu Ser Ala Ile Ile Gly Ile Tyr Leu Leu Tyr
725 730 735
Arg Met Leu Lys Thr Cys
740
<210> 7
<211> 6
<212> PRT
<213> Human herpesvirus 5
<400> 7
Asn Ser Val Leu Leu Asp
1 5
<210> 8
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 8
Asp Tyr Lys Asp Asp Asp Asp Lys
1 5
<210> 9
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 9
Ala Trp Arg His Pro Gln Phe Gly Gly
1 5
<210> 10
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 10
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 11
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
6xHis tag"
<400> 11
His His His His His His
1 5
<210> 12
<211> 40
<212> PRT
<213> Herpes simplex virus 2
<400> 12
Asp Asp Val Ser Trp Arg Tyr Glu Ala Pro Ser Val Ile Asp Tyr Ala
1 5 10 15
Arg Ile Asp Gly Ile Phe Leu Arg Tyr His Cys Pro Gly Leu Asp Thr
20 25 30
Phe Leu Trp Asp Arg His Ala Gln
35 40
<210> 13
<211> 40
<212> PRT
<213> Herpes simplex virus 1
<400> 13
Asp Asp Leu Asp Trp Arg Tyr Glu Thr Pro Ser Ala Ile Asn Tyr Ala
1 5 10 15
Leu Ile Asp Gly Ile Phe Leu Arg Tyr His Cys Pro Gly Leu Asp Thr
20 25 30
Val Leu Trp Asp Arg His Ala Gln
35 40
<210> 14
<211> 39
<212> PRT
<213> Varicella zoster virus
<400> 14
Glu Ala Trp Asp Tyr Ala Ala Pro Pro Val Ser Asn Leu Ser Glu Ala
1 5 10 15
Leu Ser Gly Ile Val Val Lys Thr Lys Cys Pro Val Pro Glu Val Ile
20 25 30
Leu Trp Phe Lys Asp Lys Gln
35
<210> 15
<211> 58
<212> PRT
<213> Human herpesvirus 5
<400> 15
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Ala Asn Ser Val Leu Leu Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 16
<211> 41
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 16
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Glu Ala Leu Ser Gly Val Leu Leu Asp Glu Ala Phe Leu Asp Thr Leu
20 25 30
Ala Leu Leu Tyr Asn Asn Pro Asp Gln
35 40
<210> 17
<211> 48
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 17
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Glu Ala Leu Ser Gly Val Leu Leu Asp
20 25 30
Glu Ala Phe Leu Asp Thr Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
35 40 45
<210> 18
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 18
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Leu Ser Gly Val Leu Leu Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 19
<211> 57
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 19
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Ala Ser Val Leu Leu Asp Glu Ala Phe Leu Asp Thr Leu
35 40 45
Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 20
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 20
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Ser Ser Thr Val Leu Leu Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 21
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 21
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Leu Ser Gly Ile Leu Leu Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 22
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 22
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Ile Glu Val Val Leu Leu Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 23
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 23
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Ile Asp Gly Val Leu Leu Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 24
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 24
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Leu Ala Ile Val Leu Leu Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 25
<211> 60
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 25
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Asn Leu Tyr Phe Gln Gly Val Leu Leu Asp Glu Ala Phe Leu
35 40 45
Asp Thr Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55 60
<210> 26
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 26
Glu Gly Asp Lys Tyr Glu Ser Trp Leu Arg Pro Leu Val Asn Val Thr
1 5 10 15
Gly Arg Asp Gly Pro Leu Ser Gln Leu Ile Arg Tyr Arg Pro Val Thr
20 25 30
Pro Glu Ala Leu Ser Gly Ile Val Val Asp Glu Ala Phe Leu Asp Thr
35 40 45
Leu Ala Leu Leu Tyr Asn Asn Pro Asp Gln
50 55
<210> 27
<211> 4
<212> PRT
<213> Human herpesvirus 5
<400> 27
Val Thr Pro Glu
1
Claims (15)
- 재조합 사이토메갈로바이러스 gL 단백질 또는 이의 복합체-형성 단편으로서, 상기 gL 단백질 또는 단편이 프로테아제 인식 부위에서 돌연변이를 포함하며, 상기 돌연변이는 대조군과 비교하여 상기 프로테아제 인식 부위에서 프로테아제 절단을 감소시키는, 재조합 사이토메갈로바이러스 gL 단백질 또는 이의 복합체-형성 단편.
- 제 1항에 있어서, 상기 돌연변이가 아미노산 잔기의 첨가, 결실, 치환, 또는 이들의 조합을 포함하는 gL 단백질 또는 단편.
- 제 1항 또는 제 2항에 있어서, 상기 프로테아제 인식 부위의 잔기가 β-가닥을 형성하며, 상기 돌연변이가 β-가닥 입체형태를 유지하는 gL 단백질 또는 단편.
- 제 1항 내지 제 3항 중의 어느 한 항에 있어서, 상기 돌연변이가 포유동물 숙주 세포에서 재조합 발현될 경우 상기 프로테아제 인식 부위에서 20% (몰 백분율) 이하의 절단된 gL을 발생시키는 gL 단백질 또는 단편.
- 제 1항 내지 제 4항 중의 어느 한 항에 있어서, 상기 돌연변이가 2 내지 5개의 아미노산 잔기의 첨가를 포함하는 gL 단백질 또는 단편.
- 제 1항 내지 제 5항 중의 어느 한 항에 있어서, 상기 돌연변이가 1 내지 3개의 아미노산 잔기의 결실을 포함하는 gL 단백질 또는 단편.
- 제 1항 내지 제 6항 중의 어느 한 항에 있어서, 상기 돌연변이가 잔기를 또 다른 헤르페스 바이러스의 gL 단백질로부터의 상응하기 잔기로 치환하는 것을 포함하는 gL 단백질 또는 단편.
- 제 7항에 있어서, 또 다른 헤르페스 바이러스로부터의 상기 gL 단백질이 HSV1, HSV2, VZV, EBV, PrV 또는 소 헤르페스바이러스 5로부터의 gL 단백질인 gL 단백질 또는 단편.
- 제 1항 내지 제 8항 중의 어느 한 항의 재조합 gL 단백질 또는 단편을 포함하는 사이토메갈로바이러스 복합체.
- 제 9항에 있어서, 상기 복합체가 gH 또는 이의 펜타머-형성 단편, gL 또는 이의 펜타머-형성 단편, pUL128 또는 이의 펜타머-형성 단편, pUL130 또는 이의 펜타머-형성 단편, 및 pUL131 또는 이의 펜타머-형성 단편을 포함하는 펜타머 복합체인 복합체.
- 제 1항 내지 제 8항 중의 어느 한 항의 재조합 사이토메갈로바이러스 gL 단백질 또는 단편을 엔코딩하는 폴리뉴클레오티드 서열을 포함하는 분리된 핵산.
- 제 11항의 핵산을 포함하는 숙주 세포, 바람직하게는, 포유동물 숙주 세포.
- 제 12항에 있어서, 상기 숙주 세포가 사이토메갈로바이러스 펜타머 복합체를 엔코딩하는 하나 이상의 폴리뉴클레오티드 서열을 포함하며, 상기 펜타머 복합체는 gH 또는 이의 펜타머-형성 단편, gL 또는 이의 펜타머-형성 단편, pUL128 또는 이의 펜타머-형성 단편, pUL130 또는 이의 펜타머-형성 단편, 및 pUL131 또는 이의 펜타머-형성 단편을 포함하는, 숙주 세포.
- 제 1항 내지 제 8항 중의 어느 한 항의 재조합 사이토메갈로바이러스 gL 단백질 또는 단편, 또는 제 9항 또는 제 10항의 복합체를 포함하며, 애주번트를 선택적으로 포함하는 면역원성 조성물.
- 제 14항에 있어서, 사이토메갈로바이러스에 대한 면역 반응을 유도하는데 사용하기 위한 면역원성 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15152221.6A EP3048114A1 (en) | 2015-01-22 | 2015-01-22 | Cytomegalovirus antigens and uses thereof |
| EP15152221.6 | 2015-01-22 | ||
| PCT/IB2016/050335 WO2016116904A1 (en) | 2015-01-22 | 2016-01-22 | Cytomegalovirus antigens and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170100039A true KR20170100039A (ko) | 2017-09-01 |
Family
ID=52434568
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177023123A KR20170100039A (ko) | 2015-01-22 | 2016-01-22 | 사이토메갈로바이러스 항원 및 이의 용도 |
Country Status (24)
| Country | Link |
|---|---|
| US (2) | US10167321B2 (ko) |
| EP (3) | EP3048114A1 (ko) |
| JP (1) | JP6717836B2 (ko) |
| KR (1) | KR20170100039A (ko) |
| CN (1) | CN107531761B (ko) |
| AU (2) | AU2016210548B2 (ko) |
| BE (1) | BE1023087B1 (ko) |
| BR (1) | BR112017015567A2 (ko) |
| CA (1) | CA2974041C (ko) |
| DK (1) | DK3247722T3 (ko) |
| EA (1) | EA038250B1 (ko) |
| ES (1) | ES2937959T3 (ko) |
| FI (1) | FI3247722T3 (ko) |
| HR (1) | HRP20230177T1 (ko) |
| HU (1) | HUE061175T2 (ko) |
| IL (1) | IL253366B (ko) |
| LT (1) | LT3247722T (ko) |
| MX (1) | MX2017009538A (ko) |
| PL (1) | PL3247722T3 (ko) |
| PT (1) | PT3247722T (ko) |
| SG (1) | SG11201705740UA (ko) |
| SI (1) | SI3247722T1 (ko) |
| WO (1) | WO2016116904A1 (ko) |
| ZA (1) | ZA201704912B (ko) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK3333265T3 (da) * | 2010-05-14 | 2020-04-27 | Univ Oregon Health & Science | Rekombinante hcmv- og rhcmv-vektorer der koder for et heterologt antigen isoleret fra hepatitis b-virus og anvendelser deraf |
| WO2012170765A2 (en) | 2011-06-10 | 2012-12-13 | Oregon Health & Science University | Cmv glycoproteins and recombinant vectors |
| US10023626B2 (en) | 2013-09-30 | 2018-07-17 | Modernatx, Inc. | Polynucleotides encoding immune modulating polypeptides |
| KR101996427B1 (ko) | 2014-07-16 | 2019-07-04 | 오레곤 헬스 앤드 사이언스 유니버시티 | 외인성 항원을 포함하는 인간 시토메갈로바이러스 |
| KR20170136512A (ko) | 2015-02-10 | 2017-12-11 | 오레곤 헬스 앤드 사이언스 유니버시티 | 넌-캐노니컬 cd8+ t 세포 반응 생성에 유용한 방법 및 조성물 |
| US11364292B2 (en) | 2015-07-21 | 2022-06-21 | Modernatx, Inc. | CHIKV RNA vaccines |
| EP4218805A1 (en) | 2015-07-21 | 2023-08-02 | ModernaTX, Inc. | Infectious disease vaccines |
| MA46316A (fr) | 2015-10-22 | 2021-03-24 | Modernatx Inc | Vaccin contre le cytomégalovirus humain |
| WO2017070624A1 (en) | 2015-10-22 | 2017-04-27 | Modernatx, Inc. | Tropical disease vaccines |
| JP7133468B2 (ja) | 2015-11-20 | 2022-09-08 | オレゴン・ヘルス・アンド・サイエンス・ユニバーシティ | マイクロrna認識エレメントを含むcmvベクター |
| EP3423091A4 (en) | 2016-03-03 | 2019-10-30 | Duke University | COMPOSITIONS AND METHODS OF INDUCING HIV-1 ANTIBODIES |
| US11318197B2 (en) | 2016-03-03 | 2022-05-03 | Duke University | Compositions and methods for inducing HIV-1 antibodies |
| WO2018067580A1 (en) | 2016-10-03 | 2018-04-12 | Duke University | Methods to identify immunogens by targeting improbable mutations |
| EP3529363A4 (en) | 2016-10-18 | 2020-05-06 | Oregon Health & Science University | CYTOMEGALOVIRUS VECTORS, CALLING OUT T-CELLS, RESTRICTED BY A LARGE HISTOCOMPATIBILITY COMPLEX E-MOLECULE |
| CA3041307A1 (en) | 2016-10-21 | 2018-04-26 | Giuseppe Ciaramella | Human cytomegalovirus vaccine |
| EP3582790A4 (en) | 2017-02-16 | 2020-11-25 | ModernaTX, Inc. | VERY POWERFUL IMMUNOGENIC COMPOSITIONS |
| US20230248820A1 (en) | 2017-04-19 | 2023-08-10 | Glaxosmithkline Biologicals, S.A. | Modified cytomegalovirus proteins and stabilized complexes |
| WO2019055807A1 (en) | 2017-09-14 | 2019-03-21 | Modernatx, Inc. | RNA VACCINES AGAINST ZIKA VIRUS |
| WO2019070730A1 (en) | 2017-10-02 | 2019-04-11 | Duke University | MOSAIC ENVELOPES OF HIV-1 TO INDUCE ADCC RESPONSES |
| WO2019169120A1 (en) | 2018-02-28 | 2019-09-06 | University Of Washington | Self-asssembling nanostructure vaccines |
| WO2020079586A1 (en) | 2018-10-17 | 2020-04-23 | Glaxosmithkline Biologicals Sa | Modified cytomegalovirus proteins and stabilized complexes |
| CN109627330A (zh) * | 2018-12-18 | 2019-04-16 | 马鞍山史记动物健康管理有限公司 | 一种猪伪狂犬病毒高效价阳性血清制备方法 |
| WO2021014385A1 (en) | 2019-07-24 | 2021-01-28 | Glaxosmithkline Biologicals Sa | Modified human cytomegalovirus proteins |
| US11406703B2 (en) | 2020-08-25 | 2022-08-09 | Modernatx, Inc. | Human cytomegalovirus vaccine |
| WO2023144665A1 (en) | 2022-01-28 | 2023-08-03 | Glaxosmithkline Biologicals Sa | Modified human cytomegalovirus proteins |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5219740A (en) | 1987-02-13 | 1993-06-15 | Fred Hutchinson Cancer Research Center | Retroviral gene transfer into diploid fibroblasts for gene therapy |
| CA2045175C (en) | 1989-11-06 | 2003-03-18 | Arthur I. Skoultchi | Production of proteins using homologous recombination |
| WO2007146024A2 (en) | 2006-06-07 | 2007-12-21 | The Trustees Of Princeton University | Cytomegalovirus surface protein complex for use in vaccines and as a drug target |
| PE20141432A1 (es) * | 2008-07-16 | 2014-10-18 | Inst Research In Biomedicine | Anticuerpos neutralizantes de citomegalovirus humano |
| SG178954A1 (en) | 2009-09-02 | 2012-04-27 | Novartis Ag | Immunogenic compositions including tlr activity modulators |
| CA2804591C (en) | 2010-07-06 | 2019-01-22 | Novartis Ag | Cationic oil-in-water emulsions |
| ES2716243T3 (es) | 2010-10-11 | 2019-06-11 | Glaxosmithkline Biologicals Sa | Plataformas de suministro de antígenos |
| RU2649133C2 (ru) | 2011-07-06 | 2018-03-29 | Новартис Аг | Катионные эмульсии масло-в-воде |
| TWI570240B (zh) * | 2011-09-09 | 2017-02-11 | 默沙東公司 | 作為細胞巨大病毒疫苗之條件式複製cmv |
| CN104853771A (zh) | 2012-07-06 | 2015-08-19 | 诺华股份有限公司 | 巨细胞病毒蛋白的复合物 |
| ES2608637T3 (es) * | 2012-10-30 | 2017-04-12 | Pfizer Inc. | Vacunas basadas en partículas recombinantes contra la infección por el citomegalovirus humano |
| CN106029692A (zh) | 2013-12-20 | 2016-10-12 | 诺华股份有限公司 | 用于重组表达感兴趣产物的新型真核细胞和方法 |
| BR112016013420A2 (pt) | 2013-12-20 | 2017-09-26 | Novartis Ag | células eucarióticas e métodos para expressar recombinantemente um produto de interesse |
| EP3015475A1 (en) | 2014-10-31 | 2016-05-04 | Novartis AG | Mammalian cells expressing cytomegalovirus antigens |
| EP3047856A1 (en) | 2015-01-23 | 2016-07-27 | Novartis AG | Cmv antigens and uses thereof |
-
2015
- 2015-01-22 EP EP15152221.6A patent/EP3048114A1/en not_active Withdrawn
-
2016
- 2016-01-22 HU HUE16702210A patent/HUE061175T2/hu unknown
- 2016-01-22 FI FIEP16702210.2T patent/FI3247722T3/fi active
- 2016-01-22 BE BE2016/5050A patent/BE1023087B1/fr not_active IP Right Cessation
- 2016-01-22 US US15/544,730 patent/US10167321B2/en active Active
- 2016-01-22 CN CN201680017610.XA patent/CN107531761B/zh active Active
- 2016-01-22 SG SG11201705740UA patent/SG11201705740UA/en unknown
- 2016-01-22 CA CA2974041A patent/CA2974041C/en active Active
- 2016-01-22 PT PT167022102T patent/PT3247722T/pt unknown
- 2016-01-22 PL PL16702210.2T patent/PL3247722T3/pl unknown
- 2016-01-22 HR HRP20230177TT patent/HRP20230177T1/hr unknown
- 2016-01-22 KR KR1020177023123A patent/KR20170100039A/ko not_active Application Discontinuation
- 2016-01-22 MX MX2017009538A patent/MX2017009538A/es unknown
- 2016-01-22 DK DK16702210.2T patent/DK3247722T3/da active
- 2016-01-22 EP EP16702210.2A patent/EP3247722B1/en active Active
- 2016-01-22 EA EA201791562A patent/EA038250B1/ru unknown
- 2016-01-22 WO PCT/IB2016/050335 patent/WO2016116904A1/en active Application Filing
- 2016-01-22 ES ES16702210T patent/ES2937959T3/es active Active
- 2016-01-22 AU AU2016210548A patent/AU2016210548B2/en active Active
- 2016-01-22 JP JP2017538387A patent/JP6717836B2/ja active Active
- 2016-01-22 LT LTEPPCT/IB2016/050335T patent/LT3247722T/lt unknown
- 2016-01-22 EP EP22203406.8A patent/EP4180056A1/en active Pending
- 2016-01-22 SI SI201631665T patent/SI3247722T1/sl unknown
- 2016-01-22 BR BR112017015567A patent/BR112017015567A2/pt active Search and Examination
-
2017
- 2017-07-09 IL IL253366A patent/IL253366B/en unknown
- 2017-07-19 ZA ZA2017/04912A patent/ZA201704912B/en unknown
-
2018
- 2018-09-10 AU AU2018226521A patent/AU2018226521B2/en active Active
- 2018-11-15 US US16/192,347 patent/US20190276498A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2018226521B2 (en) | Cytomegalovirus antigens and uses thereof | |
| EP3230305B1 (en) | Cytomegalovirus antigens | |
| WO2015181142A1 (en) | Cytomegalovirus complexes and uses thereof | |
| EP3047856A1 (en) | Cmv antigens and uses thereof | |
| CN113151184A (zh) | 基于细胞膜展示冠状病毒免疫原以诱导中和抗体的方法 | |
| JP2023523423A (ja) | SARS-CoV-2に対するワクチン及びその調製物 | |
| WO2000043527A1 (en) | Varicella-zoster virus vaccines | |
| US20070003577A1 (en) | Purified trimeric S protein as vaccine against severe acute respiratory syndrome virus infections | |
| WO2023179514A1 (zh) | 冠状病毒疫苗组合物、方法及其使用 | |
| US10654899B2 (en) | Truncated glycoprotein G of herpes simplex virus 2 | |
| CN117062843A (zh) | 用于预防感染与治疗长期新冠肺炎的针对SARS-CoV-2变体的疫苗组合物 | |
| Ambagala | Interference with major histocompatibility complex class I pathway by animal alphaherpesviruses |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |