CN107531761B - 巨细胞病毒抗原及其用途 - Google Patents
巨细胞病毒抗原及其用途 Download PDFInfo
- Publication number
- CN107531761B CN107531761B CN201680017610.XA CN201680017610A CN107531761B CN 107531761 B CN107531761 B CN 107531761B CN 201680017610 A CN201680017610 A CN 201680017610A CN 107531761 B CN107531761 B CN 107531761B
- Authority
- CN
- China
- Prior art keywords
- protein
- complex
- fragment
- cmv
- mutation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 241000701022 Cytomegalovirus Species 0.000 title claims abstract description 124
- 239000000427 antigen Substances 0.000 title description 22
- 102000036639 antigens Human genes 0.000 title description 22
- 108091007433 antigens Proteins 0.000 title description 22
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 182
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 179
- 239000012634 fragment Substances 0.000 claims description 144
- 230000035772 mutation Effects 0.000 claims description 102
- 108091005804 Peptidases Proteins 0.000 claims description 59
- 239000004365 Protease Substances 0.000 claims description 59
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 claims description 56
- 239000000203 mixture Substances 0.000 claims description 50
- 102000039446 nucleic acids Human genes 0.000 claims description 38
- 108020004707 nucleic acids Proteins 0.000 claims description 38
- 150000007523 nucleic acids Chemical class 0.000 claims description 38
- 238000003776 cleavage reaction Methods 0.000 claims description 32
- 230000007017 scission Effects 0.000 claims description 32
- 230000002163 immunogen Effects 0.000 claims description 21
- 238000012217 deletion Methods 0.000 claims description 20
- 230000037430 deletion Effects 0.000 claims description 20
- 230000028993 immune response Effects 0.000 claims description 18
- 239000002671 adjuvant Substances 0.000 claims description 12
- 230000001939 inductive effect Effects 0.000 claims description 11
- 102000040430 polynucleotide Human genes 0.000 claims description 9
- 108091033319 polynucleotide Proteins 0.000 claims description 9
- 239000002157 polynucleotide Substances 0.000 claims description 9
- 102220510722 Dual specificity tyrosine-phosphorylation-regulated kinase 2_S98G_mutation Human genes 0.000 claims description 8
- 238000003780 insertion Methods 0.000 claims description 6
- 230000037431 insertion Effects 0.000 claims description 6
- 102200012486 rs111033669 Human genes 0.000 claims description 6
- 102220427461 c.289A>G Human genes 0.000 claims description 2
- 102220088226 rs756434530 Human genes 0.000 claims description 2
- 102220468215 Uromodulin-like 1_N97A_mutation Human genes 0.000 claims 1
- 102200017868 rs121434557 Human genes 0.000 claims 1
- 235000018102 proteins Nutrition 0.000 description 170
- 210000004027 cell Anatomy 0.000 description 111
- 235000019419 proteases Nutrition 0.000 description 53
- 125000000539 amino acid group Chemical group 0.000 description 47
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 40
- 238000006467 substitution reaction Methods 0.000 description 35
- 238000000034 method Methods 0.000 description 27
- 150000001413 amino acids Chemical class 0.000 description 25
- 229960005486 vaccine Drugs 0.000 description 24
- 241000700605 Viruses Species 0.000 description 23
- 238000004519 manufacturing process Methods 0.000 description 23
- 241000710929 Alphavirus Species 0.000 description 22
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 22
- 235000001014 amino acid Nutrition 0.000 description 21
- 108090000765 processed proteins & peptides Proteins 0.000 description 21
- 108020004414 DNA Proteins 0.000 description 19
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 19
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 19
- 229940024606 amino acid Drugs 0.000 description 18
- 102000004196 processed proteins & peptides Human genes 0.000 description 18
- 241000701085 Human alphaherpesvirus 3 Species 0.000 description 17
- 238000007792 addition Methods 0.000 description 17
- -1 aromatic amino acids Chemical class 0.000 description 17
- 238000001262 western blot Methods 0.000 description 17
- 241000701074 Human alphaherpesvirus 2 Species 0.000 description 16
- 229920001184 polypeptide Polymers 0.000 description 16
- 241000699802 Cricetulus griseus Species 0.000 description 15
- 108010076504 Protein Sorting Signals Proteins 0.000 description 15
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 15
- 241001529453 unidentified herpesvirus Species 0.000 description 15
- 239000013598 vector Substances 0.000 description 15
- 230000002829 reductive effect Effects 0.000 description 14
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 13
- 230000003472 neutralizing effect Effects 0.000 description 12
- 230000003362 replicative effect Effects 0.000 description 12
- 241000272186 Falco columbarius Species 0.000 description 11
- 208000015181 infectious disease Diseases 0.000 description 11
- 210000004899 c-terminal region Anatomy 0.000 description 10
- 238000004113 cell culture Methods 0.000 description 10
- 239000002245 particle Substances 0.000 description 10
- 210000002919 epithelial cell Anatomy 0.000 description 9
- 210000004962 mammalian cell Anatomy 0.000 description 9
- 210000001672 ovary Anatomy 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 238000006206 glycosylation reaction Methods 0.000 description 8
- 238000012163 sequencing technique Methods 0.000 description 8
- 108010011170 Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly Proteins 0.000 description 7
- 230000005875 antibody response Effects 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 230000013595 glycosylation Effects 0.000 description 7
- 238000002649 immunization Methods 0.000 description 7
- 238000006386 neutralization reaction Methods 0.000 description 7
- 239000008194 pharmaceutical composition Substances 0.000 description 7
- 101150088904 UL130 gene Proteins 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 210000002889 endothelial cell Anatomy 0.000 description 6
- 230000003053 immunization Effects 0.000 description 6
- 230000005847 immunogenicity Effects 0.000 description 6
- 230000037452 priming Effects 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 238000002864 sequence alignment Methods 0.000 description 6
- 241000701161 unidentified adenovirus Species 0.000 description 6
- 230000003612 virological effect Effects 0.000 description 6
- 241000700586 Herpesviridae Species 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- 230000003511 endothelial effect Effects 0.000 description 5
- 210000002950 fibroblast Anatomy 0.000 description 5
- 230000002209 hydrophobic effect Effects 0.000 description 5
- 239000007764 o/w emulsion Substances 0.000 description 5
- 210000002966 serum Anatomy 0.000 description 5
- 210000002845 virion Anatomy 0.000 description 5
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 4
- 206010011831 Cytomegalovirus infection Diseases 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- 241000710960 Sindbis virus Species 0.000 description 4
- 241000710959 Venezuelan equine encephalitis virus Species 0.000 description 4
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 4
- 229910052799 carbon Inorganic materials 0.000 description 4
- 125000002091 cationic group Chemical group 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 238000012544 monitoring process Methods 0.000 description 4
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 4
- 229930182490 saponin Natural products 0.000 description 4
- 150000007949 saponins Chemical class 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 239000006228 supernatant Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 108010009685 Cholinergic Receptors Proteins 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101001040075 Homo sapiens Glucagon receptor Proteins 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 102000007474 Multiprotein Complexes Human genes 0.000 description 3
- 108010085220 Multiprotein Complexes Proteins 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010090804 Streptavidin Proteins 0.000 description 3
- 108010028230 Trp-Ser- His-Pro-Gln-Phe-Glu-Lys Proteins 0.000 description 3
- 102000034337 acetylcholine receptors Human genes 0.000 description 3
- 238000001261 affinity purification Methods 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 239000000539 dimer Substances 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 239000000411 inducer Substances 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 230000021633 leukocyte mediated immunity Effects 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 230000003551 muscarinic effect Effects 0.000 description 3
- 239000007908 nanoemulsion Substances 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 238000003259 recombinant expression Methods 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 description 3
- 108010087967 type I signal peptidase Proteins 0.000 description 3
- 230000029812 viral genome replication Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- AUTOLBMXDDTRRT-JGVFFNPUSA-N (4R,5S)-dethiobiotin Chemical compound C[C@@H]1NC(=O)N[C@@H]1CCCCCC(O)=O AUTOLBMXDDTRRT-JGVFFNPUSA-N 0.000 description 2
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- 241001492322 Bovine alphaherpesvirus 5 Species 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 208000003322 Coinfection Diseases 0.000 description 2
- 108010041986 DNA Vaccines Proteins 0.000 description 2
- 229940021995 DNA vaccine Drugs 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 206010066919 Epidemic polyarthritis Diseases 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 102100040134 Free fatty acid receptor 4 Human genes 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- 102100040890 Glucagon receptor Human genes 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101000890668 Homo sapiens Free fatty acid receptor 2 Proteins 0.000 description 2
- 101000890672 Homo sapiens Free fatty acid receptor 4 Proteins 0.000 description 2
- 101001090901 Homo sapiens Retroelement silencing factor 1 Proteins 0.000 description 2
- 101000864837 Homo sapiens SIN3-HDAC complex-associated factor Proteins 0.000 description 2
- 241000701041 Human betaherpesvirus 7 Species 0.000 description 2
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 2
- 241001502974 Human gammaherpesvirus 8 Species 0.000 description 2
- 241000701027 Human herpesvirus 6 Species 0.000 description 2
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 2
- 108010091175 Matriptase Proteins 0.000 description 2
- 108060004795 Methyltransferase Proteins 0.000 description 2
- 108091028043 Nucleic acid sequence Proteins 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 102100034981 Retroelement silencing factor 1 Human genes 0.000 description 2
- 241000710942 Ross River virus Species 0.000 description 2
- 102100030066 SIN3-HDAC complex-associated factor Human genes 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- 238000012300 Sequence Analysis Methods 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 102100037942 Suppressor of tumorigenicity 14 protein Human genes 0.000 description 2
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 2
- 101150032047 UL131 gene Proteins 0.000 description 2
- 108010067390 Viral Proteins Proteins 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 229960000074 biopharmaceutical Drugs 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 235000013330 chicken meat Nutrition 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 238000006471 dimerization reaction Methods 0.000 description 2
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000037433 frameshift Effects 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 101150015940 gL gene Proteins 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 238000003306 harvesting Methods 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 230000028996 humoral immune response Effects 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 125000001165 hydrophobic group Chemical group 0.000 description 2
- 239000000568 immunological adjuvant Substances 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- 229940121354 immunomodulator Drugs 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- 238000005342 ion exchange Methods 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000011859 microparticle Substances 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 108010020615 nociceptin receptor Proteins 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000002335 preservative effect Effects 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 235000004252 protein component Nutrition 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000001177 retroviral effect Effects 0.000 description 2
- 229940031439 squalene Drugs 0.000 description 2
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000005945 translocation Effects 0.000 description 2
- 238000011282 treatment Methods 0.000 description 2
- 238000009966 trimming Methods 0.000 description 2
- 239000000277 virosome Substances 0.000 description 2
- BVAUMRCGVHUWOZ-ZETCQYMHSA-N (2s)-2-(cyclohexylazaniumyl)propanoate Chemical compound OC(=O)[C@H](C)NC1CCCCC1 BVAUMRCGVHUWOZ-ZETCQYMHSA-N 0.000 description 1
- LDUWTIUXPVCEQF-LURJTMIESA-N (2s)-2-(cyclopentylamino)propanoic acid Chemical compound OC(=O)[C@H](C)NC1CCCC1 LDUWTIUXPVCEQF-LURJTMIESA-N 0.000 description 1
- IYKLZBIWFXPUCS-VIFPVBQESA-N (2s)-2-(naphthalen-1-ylamino)propanoic acid Chemical compound C1=CC=C2C(N[C@@H](C)C(O)=O)=CC=CC2=C1 IYKLZBIWFXPUCS-VIFPVBQESA-N 0.000 description 1
- RSPOGBIHKNKRFJ-FSPLSTOPSA-N (2s,3s)-2-amino-2,3-dimethylpentanoic acid Chemical compound CC[C@H](C)[C@](C)(N)C(O)=O RSPOGBIHKNKRFJ-FSPLSTOPSA-N 0.000 description 1
- ZADWXFSZEAPBJS-JTQLQIEISA-N 1-methyl-L-tryptophan Chemical compound C1=CC=C2N(C)C=C(C[C@H](N)C(O)=O)C2=C1 ZADWXFSZEAPBJS-JTQLQIEISA-N 0.000 description 1
- KSXTUUUQYQYKCR-LQDDAWAPSA-M 2,3-bis[[(z)-octadec-9-enoyl]oxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCC(=O)OCC(C[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC KSXTUUUQYQYKCR-LQDDAWAPSA-M 0.000 description 1
- ARSWQPLPYROOBG-ZETCQYMHSA-N 2-methylleucine Chemical compound CC(C)C[C@](C)(N)C(O)=O ARSWQPLPYROOBG-ZETCQYMHSA-N 0.000 description 1
- QCDWFXQBSFUVSP-UHFFFAOYSA-N 2-phenoxyethanol Chemical compound OCCOC1=CC=CC=C1 QCDWFXQBSFUVSP-UHFFFAOYSA-N 0.000 description 1
- 108020005345 3' Untranslated Regions Proteins 0.000 description 1
- 239000012103 Alexa Fluor 488 Substances 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 241000272525 Anas platyrhynchos Species 0.000 description 1
- 241000272814 Anser sp. Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 102000017927 CHRM1 Human genes 0.000 description 1
- 102000017926 CHRM2 Human genes 0.000 description 1
- 102000017923 CHRM5 Human genes 0.000 description 1
- 101150046236 CNR1 gene Proteins 0.000 description 1
- 101100342815 Caenorhabditis elegans lec-1 gene Proteins 0.000 description 1
- 241000701157 Canine mastadenovirus A Species 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 102000018208 Cannabinoid Receptor Human genes 0.000 description 1
- 108050007331 Cannabinoid receptor Proteins 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000724252 Cucumber mosaic virus Species 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- GUBGYTABKSRVRQ-WFVLMXAXSA-N DEAE-cellulose Chemical compound OC1C(O)C(O)C(CO)O[C@H]1O[C@@H]1C(CO)OC(O)C(O)C1O GUBGYTABKSRVRQ-WFVLMXAXSA-N 0.000 description 1
- 230000004543 DNA replication Effects 0.000 description 1
- 241000710945 Eastern equine encephalitis virus Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- XZWYTXMRWQJBGX-VXBMVYAYSA-N FLAG peptide Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)CC1=CC=C(O)C=C1 XZWYTXMRWQJBGX-VXBMVYAYSA-N 0.000 description 1
- 102100040133 Free fatty acid receptor 2 Human genes 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 241000237891 Haliotidae Species 0.000 description 1
- 108010093488 His-His-His-His-His-His Proteins 0.000 description 1
- 101000782981 Homo sapiens Muscarinic acetylcholine receptor M1 Proteins 0.000 description 1
- 101000928929 Homo sapiens Muscarinic acetylcholine receptor M2 Proteins 0.000 description 1
- 101000720516 Homo sapiens Muscarinic acetylcholine receptor M5 Proteins 0.000 description 1
- 101500025005 Homo sapiens Neuropeptide Y Proteins 0.000 description 1
- 101000632994 Homo sapiens Somatostatin Proteins 0.000 description 1
- 241001135569 Human adenovirus 5 Species 0.000 description 1
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 1
- 101710110377 Immediate early protein IE1 Proteins 0.000 description 1
- 101710205424 Immediate-early protein 1 Proteins 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- JTTHKOPSMAVJFE-VIFPVBQESA-N L-homophenylalanine Chemical compound OC(=O)[C@@H](N)CCC1=CC=CC=C1 JTTHKOPSMAVJFE-VIFPVBQESA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- NHTGHBARYWONDQ-JTQLQIEISA-N L-α-methyl-Tyrosine Chemical compound OC(=O)[C@](N)(C)CC1=CC=C(O)C=C1 NHTGHBARYWONDQ-JTQLQIEISA-N 0.000 description 1
- 101710192606 Latent membrane protein 2 Proteins 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 108010028921 Lipopeptides Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 102000012301 Neuropeptide Y receptor Human genes 0.000 description 1
- 102100038878 Neuropeptide Y receptor type 1 Human genes 0.000 description 1
- 102100028646 Nociceptin receptor Human genes 0.000 description 1
- 108700001237 Nucleic Acid-Based Vaccines Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 101100409194 Rattus norvegicus Ppargc1b gene Proteins 0.000 description 1
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 108050001286 Somatostatin Receptor Proteins 0.000 description 1
- 102000011096 Somatostatin receptor Human genes 0.000 description 1
- 101710172711 Structural protein Proteins 0.000 description 1
- 108091027544 Subgenomic mRNA Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 101710109576 Terminal protein Proteins 0.000 description 1
- 241000710924 Togaviridae Species 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- VQQVWGVXDIPORV-UHFFFAOYSA-N Tryptanthrine Natural products C1=CC=C2C(=O)N3C4=CC=CC=C4C(=O)C3=NC2=C1 VQQVWGVXDIPORV-UHFFFAOYSA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 206010046865 Vaccinia virus infection Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 108010003533 Viral Envelope Proteins Proteins 0.000 description 1
- 108700005077 Viral Genes Proteins 0.000 description 1
- 230000010530 Virus Neutralization Effects 0.000 description 1
- ISXSJGHXHUZXNF-LXZPIJOJSA-N [(3s,8s,9s,10r,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-3-yl] n-[2-(dimethylamino)ethyl]carbamate;hydrochloride Chemical compound Cl.C1C=C2C[C@@H](OC(=O)NCCN(C)C)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 ISXSJGHXHUZXNF-LXZPIJOJSA-N 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 150000001370 alpha-amino acid derivatives Chemical class 0.000 description 1
- 235000008206 alpha-amino acids Nutrition 0.000 description 1
- HRRYYCWYCMJNGA-ZETCQYMHSA-N alpha-methyl-L-histidine Chemical compound OC(=O)[C@](N)(C)CC1=CN=CN1 HRRYYCWYCMJNGA-ZETCQYMHSA-N 0.000 description 1
- HYOWVAAEQCNGLE-JTQLQIEISA-N alpha-methyl-L-phenylalanine Chemical compound OC(=O)[C@](N)(C)CC1=CC=CC=C1 HYOWVAAEQCNGLE-JTQLQIEISA-N 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 159000000013 aluminium salts Chemical class 0.000 description 1
- 229910000329 aluminium sulfate Inorganic materials 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000003474 anti-emetic effect Effects 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 230000001740 anti-invasion Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229940125683 antiemetic agent Drugs 0.000 description 1
- 239000002111 antiemetic agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 239000003080 antimitotic agent Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- SWJXWSAKHXBQSY-UHFFFAOYSA-N benzo(c)cinnoline Chemical compound C1=CC=C2C3=CC=CC=C3N=NC2=C1 SWJXWSAKHXBQSY-UHFFFAOYSA-N 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 239000012148 binding buffer Substances 0.000 description 1
- 239000000227 bioadhesive Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000004900 c-terminal fragment Anatomy 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 230000005101 cell tropism Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 230000009920 chelation Effects 0.000 description 1
- SQQXRXKYTKFFSM-UHFFFAOYSA-N chembl1992147 Chemical compound OC1=C(OC)C(OC)=CC=C1C1=C(C)C(C(O)=O)=NC(C=2N=C3C4=NC(C)(C)N=C4C(OC)=C(O)C3=CC=2)=C1N SQQXRXKYTKFFSM-UHFFFAOYSA-N 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000011490 co-immunoprecipitation assay Methods 0.000 description 1
- 230000008045 co-localization Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- NKLPQNGYXWVELD-UHFFFAOYSA-M coomassie brilliant blue Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=C1 NKLPQNGYXWVELD-UHFFFAOYSA-M 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 230000001085 cytostatic effect Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000012149 elution buffer Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 210000002288 golgi apparatus Anatomy 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- XKWCTHKJQNUFOQ-HRPSIEBRSA-N gtpl1504 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 XKWCTHKJQNUFOQ-HRPSIEBRSA-N 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 239000012510 hollow fiber Substances 0.000 description 1
- 102000045305 human SST Human genes 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 229940124669 imidazoquinoline Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 230000002584 immunomodulator Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000005265 lung cell Anatomy 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000003232 mucoadhesive effect Effects 0.000 description 1
- 125000001446 muramyl group Chemical group N[C@@H](C=O)[C@@H](O[C@@H](C(=O)*)C)[C@H](O)[C@H](O)CO 0.000 description 1
- 210000004898 n-terminal fragment Anatomy 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 239000002077 nanosphere Substances 0.000 description 1
- 108010043412 neuropeptide Y-Y1 receptor Proteins 0.000 description 1
- 229960000470 omalizumab Drugs 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 229940023041 peptide vaccine Drugs 0.000 description 1
- 238000009521 phase II clinical trial Methods 0.000 description 1
- 229960005323 phenoxyethanol Drugs 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 229920002627 poly(phosphazenes) Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920000056 polyoxyethylene ether Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 229940021993 prophylactic vaccine Drugs 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- ZADWXFSZEAPBJS-UHFFFAOYSA-N racemic N-methyl tryptophan Natural products C1=CC=C2N(C)C=C(CC(N)C(O)=O)C2=C1 ZADWXFSZEAPBJS-UHFFFAOYSA-N 0.000 description 1
- 230000007420 reactivation Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960000329 ribavirin Drugs 0.000 description 1
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- 210000003079 salivary gland Anatomy 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 125000005629 sialic acid group Chemical group 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000012289 standard assay Methods 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 239000002691 unilamellar liposome Substances 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 208000007089 vaccinia Diseases 0.000 description 1
- 210000003501 vero cell Anatomy 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/245—Herpetoviridae, e.g. herpes simplex virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/081—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from DNA viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/081—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from DNA viruses
- C07K16/082—Hepadnaviridae, e.g. hepatitis B virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/245—Herpetoviridae, e.g. herpes simplex virus
- A61K39/25—Varicella-zoster virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/42—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum viral
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16111—Cytomegalovirus, e.g. human herpesvirus 5
- C12N2710/16122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16111—Cytomegalovirus, e.g. human herpesvirus 5
- C12N2710/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16111—Cytomegalovirus, e.g. human herpesvirus 5
- C12N2710/16151—Methods of production or purification of viral material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Communicable Diseases (AREA)
- Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Oncology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
本发明提供了经修饰的巨细胞病毒(CMV) gL蛋白和包含gL蛋白的复合物。所述经修饰的gL蛋白保持完整且能够与其它CMV蛋白形成复合物。
Description
序列表
本申请含有序列表,其已经以ASCII格式电子地提交,且特此通过引用整体并入本文。所述ASCII副本(创建于2016年1月14日)被命名为VN056504WO_SL.txt,且具有26,466字节的大小。
技术领域
本发明属于可以用于疫苗的巨细胞病毒(CMV)抗原的领域。
背景技术
巨细胞病毒是属于被称作疱疹病毒科(Herpesviridae)或疱疹病毒的病毒科的一个病毒属。感染人类的该物种通常被称作人巨细胞病毒(HCMV)或人疱疹病毒-5 (HHV-5)。在疱疹病毒科内,HCMV属于β疱疹病毒亚科,其也包括来自其它哺乳动物的巨细胞病毒。
尽管它们在全身各处都有发现,但是HCMV感染经常与唾液腺相关。如抗体在大量一般群体中的存在所指示的,HCMV感染50%至80%之间的美国成年人(全世界的40%)。HCMV感染在健康人中通常是不引人注意的,但对于免疫受损者(诸如HIV感染的人、器官移植接受者或新生婴儿)而言可以是危及生命的。HCMV是最频繁地传播给发育中的胎儿的病毒。感染后,HCMV能够在宿主终生在体内维持潜伏状态,偶尔从潜伏状态再激活。鉴于该疾病的严重程度和重要性,获得有效的疫苗被认为是公共卫生最应优先考虑的事(Sung, H.,等人, (2010) Expert review of vaccines 9, 1303-1314; Schleiss, Expert OpinTher Pat. Apr 2010; 20(4): 597-602)。
已经将超过20种不同HCMV毒株的基因组进行了测序,包括实验室毒株和临床分离物的那些。例如,已经对以下HCMV毒株进行了测序:Towne (GL239909366)、AD169 (GI:219879600)、Toledo (GL290564358)和Merlin (GI: 155573956)。HCMV毒株AD169、Towne和Merlin可以得自美国典型培养物保藏中心(分别是ATCC VR538、ATCC VR977和ATCCVR1590)。
巨细胞病毒含有未知数目的膜蛋白复合物。在病毒包膜中的约30种已知糖蛋白中,已经发现gH和gL具有特别的吸引力,因为它们存在于几种不同的复合物中:二聚体gH/gL、三聚体gH/gL/gO (也被称作gCIII复合物)和五聚体gH/gL/pUL128/pUL130/pUL131(pUL131也被称作“pUL131A”、“pUL131a”或“UL131A”;pUL128、pUL130和pUL131亚基,有时也被称作UL128、UL130、UL131)。CMV被认为使用五聚体复合物通过胞吞作用和低pH依赖性的融合进入上皮和内皮细胞,但是其被认为在涉及gH/gL或可能涉及gH/gL/gO的过程中在质膜处通过直接融合进入成纤维细胞。gH/gL和/或gH/gL/gO复合物对于成纤维细胞感染而言是足够的,但是五聚体复合物是感染内皮和上皮细胞所必需的。
五聚体复合物被视作CMV疫苗接种的主要靶标。内皮进入需要病毒基因UL128、UL130和UL131 (Hahn, Journal of Virology 2004; 78:10023-33)。适应成纤维细胞的非内皮向性的毒株含有在这三个基因中的至少一个中的突变。例如,Towne毒株含有造成UL130基因中的移码的双碱基对插入,而AD169含有在UL131基因中的单碱基对插入。Towne和AD169都适应在内皮细胞中的生长,且在两种情况下,修复了UL130或UL131基因中的移码突变。
US7704510公开了pUL131A是上皮细胞向性所必需的。US7704510还公开了pUL128和pUL130与gH/gL形成整合进病毒粒子中的复合物。该复合物是感染内皮和上皮细胞所必需的,但并非感染成纤维细胞所必需的。已经发现抗-CD46抗体会抑制上皮细胞的HCMV感染。
在临床试验中测试的CMV疫苗包括Towne疫苗、Towne-Toledo嵌合体、含有gB作为抗原的α病毒复制子、gB/MF59疫苗、由GlaxoSmithKline生产的gB疫苗、以及使用gB和pp65的DNA疫苗。pp65是为针对CMV的CD8+ 应答的有效诱导物的病毒蛋白。这些疫苗都是阻断病毒进入内皮/上皮细胞的抗体的差诱导物(Adler, S. P. (2013), British MedicalBulletin, 107, 57-68. doi:10.1093/bmb/ldt023)。
在CMV疫苗中的临床前动物研究包括灭活的已经在UL131基因中进行了修复的AD169、使用野生型UL130基因的DNA疫苗和使用来自pUL130和131的肽的肽疫苗(Sauer, A,等人, Vaccine 2011;29:2705-1, doi:10.1016)。
认为CMV gB抗原是阻断进入内皮/上皮细胞的抗体的差诱导物。在II期临床试验中,gB/MF59疫苗仅50%有效地预防在家陪伴儿童的年轻女性的原发性感染(Pass, RF, 等人, N Engl J Med 2009;360:1191-9)。
因此,需要开发包含其它抗原靶标(诸如gH/gL、gH/gL/gO或五聚体复合物gH/gL/pUL128/pUL130/pUL131)的CMV疫苗。
发明概述
如本文中公开和举例说明的,本发明人发现当从哺乳动物宿主(诸如CHO细胞或HEK细胞)重组地表达和纯化巨细胞病毒抗原gL时,gL的大部分被切掉。为了改善完整gL蛋白的重组表达和纯化,引入突变来减少gL的蛋白酶切割。所述突变体在重组生产过程中表现出增加的对蛋白酶切割的抗性。
因此,在一个方面,本发明提供了一种重组CMV gL蛋白或其复合物形成片段,其中所述gL蛋白或片段包含在蛋白酶识别位点处的突变,其中所述突变与对照相比减少在所述蛋白酶识别位点处的蛋白酶切割。蛋白酶识别位点表示残基91-102 (基于SEQ ID NO: 1进行编号)。优选地,所述突变与对照相比减少蛋白酶切割,而不改变蛋白酶识别位点的C-端部分的二级结构(认为其具有β-链构象)。
本文还提供了包含本文描述的gL蛋白或片段的CMV复合物。这样的复合物可以是gH/gL复合物、gH/gL/gO复合物和五聚体复合物gH/gL/pUL128/pUL130/pUL131。
如本文中所述,本文还提供了编码CMV gL蛋白和其复合物形成片段的核酸。所述核酸可以用作基于核酸的疫苗(例如,编码gL或其复合物形成片段的自主复制RNA分子)。所述核酸还可以用于重组生产gL蛋白或片段、或包含gL蛋白或片段的CMV复合物。
本发明还提供了包含本文描述的核酸的宿主细胞。所述核酸可以由宿主细胞用于表达gL蛋白或其复合物形成片段、或包含gL或其复合物形成片段的CMV复合物。优选地,所述CMV复合物可以从宿主细胞分泌。优选的宿主细胞是哺乳动物宿主细胞,诸如CHO细胞或HEK-293细胞。
本发明还提供了包含本文描述的宿主细胞的细胞培养物。优选地,所述培养物是至少20升大小。当用于表达CMV五聚体复合物gH/gL/pUL128/pUL130/pUL131时,优选的是,五聚体复合物的收率为至少0.1 g/L。
本发明还提供了诱导针对CMV的免疫应答的方法,所述方法包括:给有此需要的受试者施用免疫学上有效量的如本文中所述的gL蛋白、或其复合物形成片段、或包含gL蛋白或片段的CMV复合物。如本文中所述,本发明还提供了抑制巨细胞病毒(CMV)进入细胞中的方法,所述方法包括使所述细胞与如本文中所述的gL蛋白、或其复合物形成片段、或包含gL蛋白或片段的CMV复合物接触。
还提供了本文描述的组合物用于诱导针对CMV的免疫应答的用途,和本文描述的组合物在药物制备中的用途,所述药物用于诱导针对CMV的免疫应答。
附图简述
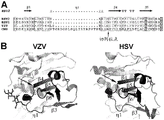
图1A显示了来自不同疱疹病毒的gL蛋白在蛋白酶识别位点附近的部分序列比对(分别是SEQ ID NO 12-15,以出现的次序)。图1B显示了来自HSV-2和VZV的gH/gL复合物的二级结构。箭头指示切割位点。
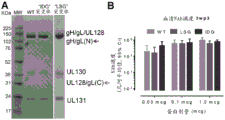
图2A显示了gL突变体的部分序列(分别是SEQ ID NO 15-26,以出现的次序)。图2B显示了使用抗-gL抗体的蛋白质印迹的结果。图2C显示了使用抗-His抗体的蛋白质印迹的结果。
图3显示了使用非还原的(NR)或还原的和煮沸的(RB)蛋白样品的WT和LSG突变体penta的蛋白质印迹分析。
图4显示了使用非还原的(NR)或还原的和煮沸的(RB)蛋白样品的WT和IDG突变体penta的蛋白质印迹分析。
图5A显示了经纯化的WT penta和IDG和LSG突变体penta。图5B显示了在MF59辅助下用WT、LSG突变体或IDG突变体penta免疫的小鼠血清的中和抗体滴度(NAB)。
发明详述
1. 概述
如本文中公开和举例说明的,本发明人发现,当从哺乳动物宿主(诸如CHO细胞或HEK细胞)重组地表达和纯化巨细胞病毒抗原gL时,gL的大部分被未知蛋白酶切掉(也被称作“gL裁剪”)。实际上,观察到,在以下三种不同CMV复合物的重组表达和纯化过程中发生gL裁剪:gH/gL复合物、gH/gL/gO复合物和五聚体复合物gH/gL/pUL128/pUL130/pUL131。所述gL的裁剪造成抗原生产的非同质性和在基于gL的抗原上的中和位点的潜在丧失。
使用蛋白质印迹和N-端测序,发明人鉴别出切割位点并将其映射至来自Merlin毒株的gL(SEQ ID NO:1)的残基97和98之间的肽键(图1)。为了解决裁剪问题,发明人研究了来自几种有关的疱疹病毒的gL蛋白(包括HSV1、HSV2和VZV)的结构特征。来自HSV1、HSV2和VZV的gL蛋白似乎不具有裁剪问题。基于结构研究,发明人发现,可以将突变引入包含氨基酸残基91和102的蛋白酶识别位点,以减少重组地表达的gL的蛋白酶切割。
例如,如在本文中举例说明的,A96L/N97S/S98G三突变(“LSG”突变体)和A96I/N97D/S98G三突变(“IDG”突变体)基本上消除了gL裁剪问题。两种其它的突变体,即残基Asn97的缺失(δAsp97)和A96S/N97S/S98T (“SST”突变体),在共表达gH和gL时也表现出急剧减少的gL裁剪。
基于来自其它疱疹病毒的gL蛋白的结构分析(图1),蛋白酶识别位点似乎从N-端至C-端采用可能的短α-螺旋(91VTPE94) (SEQ ID NO: 27)、短环(95AA96)和保守β-链结构(97NSVLLD102) (SEQ ID NO: 7)。切割发生在β-链的N-端端部(图1)。β-链是蛋白中的β-折叠的结构单元。这是通常3-10个氨基酸长的多肽链的延长段,其与相同β-折叠中的其它β-链形成氢键。如在图1中所示,该β-链(图1中的β4)与来自gL的链β5和β6、以及来自gH的β-链一起形成β-折叠。因此,在优选的实施方案中,所述突变应当维持蛋白酶识别位点的C-端部分的二级结构(即,β-链构象得到保留,诸如β4和其它β-链之间的相互作用基本上得到维持)。维持所述β-链结构可以潜在地减少对CMV复合物(诸如五聚体复合物)的组装的任何负面影响,并且还可以潜在地保留重要的免疫原性表位。例如,一个或多个来自蛋白酶识别位点的残基可以被来自另一种疱疹病毒(诸如HSV-1、HSV-2或VZV)的对应残基置换。如在图1中所示,序列和结构分析表明,用对应的HSV-1、HSV-2或VZV残基置换CMV残基不会改变β-链构象,而蛋白酶切割可以减轻。任选地,在β-链前面紧挨着的短环结构(图1中的95AA96)也可以得到维持。
因此,在一个方面,本发明提供了重组巨细胞病毒(CMV) gL蛋白或其复合物形成片段,其中所述gL蛋白或片段包含在蛋白酶识别位点处的突变,其中所述突变与对照相比减少在所述蛋白酶识别位点处的蛋白酶切割。蛋白酶识别位点表示残基91-102 (基于SEQID NO:1进行编号)。优选地,所述突变与对照相比减少蛋白酶切割,而不改变在蛋白酶识别位点的C-端部分处的β-链结构。
本文还提供了包含本文描述的gL蛋白或片段的CMV复合物。这样的复合物可以是gH/gL复合物、gH/gL/gO复合物和五聚体复合物gH/gL/pUL128/pUL130/pUL131。
本文还提供了宿主细胞,其用于重组表达本文描述的gL蛋白或片段和包含本文描述的gL蛋白或片段的CMV复合物。如指出的,在重组生产过程中在哺乳动物宿主细胞中观察到gL裁剪。因此,本文中公开的突变特别适合用于在哺乳动物宿主(其为许多生物制品的优选宿主)中重组生产CMV疫苗。例如,HEK-293和CHO细胞已经长期用于生物制品的商业生产。因此,掺入减轻gL切割的突变可以提高生产效率和收率,并减少污染性的、部分地降解的产物的形成。
2. 定义
术语巨细胞病毒(CMV)蛋白的“复合物形成片段”(诸如gL)表示所述蛋白的保留与另一种CMV蛋白形成复合物的能力的任何部件或部分。这样的复合物包括,例如,gH/gL二聚体复合物、gH/gL/gO三聚体复合物或gH/gL/pUL128/pUL130/pUL131五聚体复合物。CMV蛋白的“五聚体形成片段”(诸如gL)表示所述蛋白的保留形成gH/gL/pUL128/pUL130/pUL131五聚体复合物的能力的任何部件或部分。
本文中使用的“五聚体复合物”或“五聚体”表示包含以下5个不同亚基的CMV复合物:gH、gL、pUL128、pUL130和pUL131。尽管在本说明书中通常被称作gH/gL/pUL128/pUL130/pUL131五聚体(或包含gH、gL、pUL128、pUL130和pUL131的五聚体复合物),但是所述5个亚基中的每一个不需要是全长的;该术语也包括由gH、gL、pUL128、pUL130和pUL131的复合物形成片段形成的五聚体。
术语“突变”表示氨基酸残基的添加、缺失或置换。该术语也包括将非天然存在的氨基酸或氨基酸类似物引入多肽链中的修饰。
带电荷的氨基酸残基包括:D、E、K、R和H。极性的、不带电荷的残基包括:S、T、C、Y、N和Q。非极性的或疏水的残基包括:A、V、L、I、M、W、F和P。
包含大侧链的氨基酸残基包括:W、F、M、Y、Q、R、E、H和K。缺少侧链或包含小侧链的氨基酸残基包括:G、A、V、S、T、C、D和N。
当侧链包含支链或环状取代基时,氨基酸残基包含“庞大侧链”。具有庞大侧链的氨基酸残基的例子包括色氨酸、酪氨酸、苯丙氨酸、高苯丙氨酸、亮氨酸、异亮氨酸、组氨酸、1-甲基色氨酸、α-甲基酪氨酸、α-甲基苯丙氨酸、α-甲基亮氨酸、α-甲基异亮氨酸、α-甲基组氨酸、环戊基丙氨酸、环己基丙氨酸、萘基丙氨酸等。
尽管本发明适用于源自任何CMV毒株的gL蛋白,但是为了促进它的理解,当在本说明书中表示氨基酸位置时,除非另有说明,相对于源自Merlin毒株的SEQ ID NO:1的gL蛋白的氨基酸序列给出编号。但是,本发明不限于Merlin毒株。使用本发明的教导,本领域普通技术人员通过使用容易得到的和众所周知的比对算法(诸如BLAST,使用默认设置;ClustalW2,使用默认设置;或Corpet, Nucleic Acids Research, 1998, 16(22):10881-10890公开的算法,使用默认参数)比对氨基酸序列可以确定任意其它CMV毒株的gL蛋白中的可比较的氨基酸位置。因此,当提及“CMV gL蛋白”时,它应理解为来自任何毒株(除了Merlin毒株以外)的CMV gL蛋白。对于来自其它毒株的gL蛋白,可能必须根据实际序列比对调整实际数字。
例如,“蛋白酶识别位点”被定义为由氨基酸残基91-102组成,特别是由残基91、92、93、94、95、96、97、98、99、100、101和102组成。这些数字是相对于SEQ ID NO: 1的gL蛋白的氨基酸序列。来自其它CMV毒株的gL蛋白、或其它gL突变体或变体、或gL的片段的蛋白酶识别位点可以使用标准的序列比对程序确定,所述序列比对程序将查询序列与SEQ ID NO:1比对,并鉴别出匹配SEQ ID NO: 1的91-102的残基。
具体氨基酸残基位置也根据SEQ ID NO: 1编号。例如,“S98”表示SEQ ID NO: 1的位置98 (其为S),以及来自其它gL序列(或变体或片段)的当与SEQ ID NO: 1比对所述序列时与SEQ ID NO: 1的S98匹配的对应残基。为简洁起见,来自gL序列(或变体或片段)的与SEQ ID NO: 1的S98对应的任何残基被称作S98,尽管该残基的实际位置可以是或不是98,且实际的残基可以是或不是S。例如,保守置换(例如,T)可以与SEQ ID NO: 1的S98比对。保守置换通常被BLAST 2鉴别为“阳性的”或“+”。
类似地,还根据SEQ ID NO: 1的编号鉴别突变。例如,S98G是指,来自gL序列(或变体或片段)的与SEQ ID NO: 1的S98对应的任何残基被突变为G。
当通过将查询氨基酸序列与参照序列比对发现残基的位置匹配指定位置时,那么查询序列的氨基酸残基“对应于”参照序列的指定位置(例如,SEQ ID NO: 1的S98)。这样的比对可以手工完成,或通过使用众所周知的序列比对程序诸如ClustalW2或“BLAST 2序列”使用默认参数完成。
“”表示至少10个氨基酸残基长且与SEQ ID NO: 5具有至少50%同一性的序列。如在图1中所示,对于来自Merlin毒株的野生型gL,已经鉴别出与HSV1、HSV2和VZV相比CMV gL独有的17-残基片段(显示为“η1”)。优选地,插入物区域包含至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个或至少20个残基,和/或与SEQ ID NO: 5具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%同一性。在某些实施方案中,所述插入物区域包含这样的序列:其中SEQ IDNO: 5的1-8个氨基酸残基被保守地置换。
“保守地置换”是指,将残基用另一种生物学上类似的残基替换。例子包括具有类似特征的氨基酸残基的置换,例如小氨基酸、酸性氨基酸、极性氨基酸、碱性氨基酸、疏水氨基酸和芳族氨基酸。保守氨基酸置换的一个例子包括在下表1中的那些,和具有类似特征的非天然α氨基酸对原始残基的类似置换。
表1
除非另外指出,否则在两个序列中的较短者的整个长度上确定两个序列的同一性百分比。
3. 经修饰的CMV gL蛋白和复合物
A. 经修饰的gL蛋白
在一个方面,本发明提供了减轻在残基N97和S98之间的肽键处的裁剪(切割)的经修饰的CMV gL蛋白或其复合物形成片段。
人CMV糖蛋白L (gL)由UL115基因编码。gL被认为是病毒复制所必需的,且gL的全部已知功能特性都与它与gH的二聚化直接相关。gH/gL复合物是病毒膜与质膜的融合所必需的,所述融合导致病毒进入宿主细胞。已经报道来自HCMV毒株Merlin (GI:39842115,SEQ ID NO: 1)和HCMV毒株Towne (GI:239909463, SEQ ID NO: 2)的gL具有278个氨基酸的长度。已经报道来自HCMV毒株AD169 (GI:2506510, SEQ ID NO: 3)的gL具有278个氨基酸的长度,包括在其N端的信号序列(氨基酸残基1-35),具有两个N-糖基化位点(在残基74和114处),并缺少TM结构域(Rigoutsos, I, 等人, Journal of Virology 77 (2003):4326-44)。预测SEQ ID NO: 1中的N-端信号序列包含氨基酸残基1-30。SEQ ID NO: 2与SEQID NO: 1具有98%氨基酸同一性。对来自22-39个临床分离物以及实验室毒株AD169、Towne和Toledo的全长gL基因的测序揭示所述分离物的氨基酸序列中的小于2%差异(Rasmussen,L, 等人, Journal of Virology 76 (2002): 10841-10888)。
通常,gL蛋白的N-端信号序列被宿主细胞信号肽酶切割以产生成熟的gL蛋白。本发明的HCMV膜复合物中的gL蛋白可能缺少N-端信号序列。缺少N-端信号序列的gL蛋白的一个例子是SEQ ID NO: 4,其缺少N-端信号序列且由SEQ ID NO: 1的氨基酸残基31-278组成。
尽管认为gL是病毒复制所必需的,但是gL的全部已知功能特性都与它与gH的二聚化直接相关。
本发明的gL蛋白可以是与SEQ ID NO: 1具有不同同一性程度的gL变体,诸如与在SEQ ID NO: 1、SEQ ID NO: 2或SEQ ID NO: 3中列举的序列的至少60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。本发明的gL蛋白可以与SEQ ID NO: 4具有不同同一性程度,诸如与在SEQ ID NO: 4中列举的序列的至少60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。在某些实施方案中,所述gL变体蛋白:(i)形成二聚体复合物gH/gL的组成部分;(ii)形成三聚体gH/gL/gO复合物的组成部分;(iii)形成五聚体gH/gL/pUL128/pUL130/pUL131复合物的组成部分;(iv)包含来自SEQ IDNO: 1、SEQ ID NO: 2、SEQ ID NO: 3或SEQ ID NO: 4的至少一个表位;和/或(v)可以在体内引起抗体,所述抗体与CMV病毒粒子在免疫学上交叉反应。
本发明还包括本文描述的gL蛋白的复合物形成片段。gL的复合物形成片段可以是gL蛋白的保留与另一种CMV蛋白形成复合物的能力的任何部件或部分。在某些实施方案中,gL的复合物形成片段形成二聚体复合物gH/gL的组成部分。在某些实施方案中,gL的复合物形成片段形成三聚体gH/gL/gO复合物的组成部分。在某些实施方案中,gL的复合物形成片段形成五聚体gH/gL/pUL128/pUL130/pUL131复合物的组成部分。通过本领域已知的标准测定,诸如共免疫沉淀测定、交联或通过荧光染色的共定位等,可以得到或确定gL的复合物形成片段。在某些实施方案中,gL的复合物形成片段也(i)包含来自SEQ ID NO: 1、SEQ IDNO: 2、SEQ ID NO: 3或SEQ ID NO: 4的至少一种表位;和/或(ii)可以在体内引起抗体,所述抗体与CMV病毒粒子在免疫学上交叉反应。
在某些实施方案中,本文描述的gL蛋白或其复合物形成片段包含在蛋白酶识别位点(残基91-102)处的突变,其中所述突变与对照相比减少在所述蛋白酶识别位点处的蛋白酶切割。
可以使用多种对照。在基本上相同条件下对应野生型gL的蛋白酶切割(在残基97和98之间的肽键处)的水平可以用作对照。可选地,对照可以是预定的水平或阈值水平(例如,总gL蛋白的20%、25%或30%)。所述百分比表示摩尔百分比。
例如,当在哺乳动物宿主细胞的标准培养条件下在该宿主细胞中重组地表达时,所述突变可以导致在残基97和98之间的肽键处的蛋白酶切割与野生型的蛋白酶切割相比减轻至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%等。
可选地或另外地,当在哺乳动物宿主细胞的标准培养条件下在该宿主细胞中重组地表达时,所述蛋白酶切割与野生型的蛋白酶切割相比减轻至少3倍、至少5倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少75倍、至少80倍、至少90倍或至少100倍。
可选地或另外地,所述突变可以是这样的突变:其中当在哺乳动物宿主细胞的标准培养条件下在该宿主细胞中重组地表达时,不超过约35%的gL分子或其复合物形成片段在残基97和98之间的肽键处被切割。例如,当在哺乳动物宿主细胞的标准培养条件下在该宿主细胞中重组地表达时,所述突变可以导致不超过约35%、不超过约30%、不超过约25%、不超过约20%、不超过约15%、不超过约10%、不超过约9%、不超过约8%、不超过约7%、不超过约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%或不超过约1%的gL分子或其复合物形成片段在残基97和98之间的肽键处被切割。所述百分比表示摩尔百分比。
常用哺乳动物宿主细胞的标准培养条件是已知的。例如,对于CHO细胞,标准培养条件可以是在36.5℃的温度,在pH 7.0培养基中,具有≤10%CO2。在一个具体实施例中,将Expi293细胞转染以在37℃和在pH 7.0在8%CO2下表达五聚体复合物(gH/gL/pUL128/pUL130/pUL131) 3天,并将细胞培养物的上清液进行亲和纯化和用蛋白质印迹进行分析,如在下面实施例中所示。
所述突变包含氨基酸残基的添加、缺失、置换或它们的组合。优选地,所述突变基本上保留蛋白酶识别位点的C-端部分的二级结构。具体地,如在图1中所示,所述蛋白酶识别位点的C-端部分的残基形成β-链,其被认为与其它β-链相互作用以形成β-折叠。优选地,所述突变维持该β-链构象。维持二级结构的潜在优点包括,例如,促进含有gL的复合物(例如,gH/gL、gH/gL/gO或gH/gL/pIL128/pUL130/pUL131)的组装,和维持关键免疫原性表位。任选地,在β-链前面紧挨着的短环结构也得到维持。
许多计算机程序和算法可用于预测二级结构,包括I-TASSER、HHpred、RaptorX、MODELLER、SWISS-MODEL、Robetta Beta、SPARKSx、PEP-FOLD、Phyre and Phyre2、RAPTOR、QUARK、Abalone、Foldit等。使用这些工具可以分析突变是否改变蛋白酶识别位点的二级结构。
在某些实施方案中,所述突变包含一个或多个氨基酸残基的添加。例如,所述突变可以包含2-5个氨基酸残基的添加。在某些实施方案中,所述2-5个氨基酸残基包含极性的残基和非极性的残基。
在某些实施方案中,所述突变包含在残基N97和S98之间的一个或多个残基添加。如在实施例中所示,N97和S98之间的肽键被蛋白酶切割;因此,在N97和S98之间引入一个或多个另外残基可以产生更高切割抗性的突变体gL (或片段)。在一个示例性实施方案中,所述突变包含在残基97和98之间的F、Q或它们的组合的添加。在一个示例性实施方案中,所述突变包含在残基97和98之间的FQ或QF的添加。
在某些实施方案中,所述突变包含一个或多个氨基酸残基的缺失,诸如1-3个氨基酸残基的缺失。在某些实施方案中,所述突变包含至少一个残基的缺失,所述残基选自V91、T92、P93、E94、A95、A96、N97、S98、V99、L100、L101、D102和它们的组合。在某些实施方案中,所述突变包含至少一个残基的缺失,所述残基选自E94、A95、A96、N97、S98、V99、L100、L101、D102和它们的组合。在一个示例性实施方案中,所述突变包含至少一个残基的缺失,所述残基选自A96、N97、S98和它们的组合。在一个示例性实施方案中,所述突变包含缺失N97。
在某些实施方案中,所述突变包含将残基用来自另一种疱疹病毒的gL蛋白的对应残基置换。疱疹病毒(疱疹病毒科)科包括,例如,单纯疱疹病毒1和2 (HSV-1或HHV-1、HSV-2或HHV-2)、水痘带状疱疹病毒(VZV或HHV-3)、爱泼斯坦-巴尔病毒(EBV或HHV-4)、人疱疹病毒6 (HHV-6)、人疱疹病毒7 (HHV-7)和卡波西氏肉瘤-相关的疱疹病毒(HHV-8)。在某些实施方案中,来自另一种疱疹病毒的gL蛋白是来自HSV1、HSV2、VZV、EBV、PrV或牛疱疹病毒5的gL蛋白。
将CMV残基用来自另一种疱疹病毒的对应残基置换的一个潜在优点是,蛋白酶识别位点的二级结构可能被保留。如在图1中所示,HSV-1、HSV-2和VZV都具有基本上相同的二级结构,特别地,蛋白酶识别位点的C-端部分都采用β-链结构。
如果进行多个置换,它们不一定来自相同疱疹病毒。例如,可以将第一个CMV残基用来自HSV-1的对应残基置换,将第二个残基用来自HSV-2的对应残基置换,和/或将第三个CMV残基用来自VZV的对应残基置换,等。因此,所述突变可能包含用来自第一种其它疱疹病毒gL蛋白的对应残基置换的第一个氨基酸残基,和用来自第二种其它疱疹病毒gL蛋白的对应残基置换的第二个氨基酸残基,和/或用来自第三种其它疱疹病毒gL蛋白的对应残基置换的第三个氨基酸残基,等。
在某些实施方案中,所述突变包含用A置换E94。
在某些实施方案中,所述突变包含用R、L或N置换A95。
在某些实施方案中,所述突变包含用非极性的残基或用包含大侧链的残基(诸如W、F或M)置换A96。在某些实施方案中,所述突变包含用I、L或S置换A96。
在某些实施方案中,所述突变包含用极性的残基或非极性的残基置换N97。所述极性的残基可以包含小侧链或大侧链。在某些实施方案中,所述突变包含用S、D、E、A或Y置换N97。
在某些实施方案中,所述突变包含用具有小侧链的氨基酸残基(诸如G、A、V、S、T、C、D或N)置换S98。在某些实施方案中,所述突变包含用G、T、V或I置换S98。
在某些实施方案中,所述突变包含用氨基酸残基如I置换V99。
在某些实施方案中,所述突变包含用氨基酸残基如F或V置换L100。
在某些实施方案中,所述突变包含用氨基酸残基如V置换L101。
本文描述的添加、缺失和置换可以单独地或以任意组合使用。例如,gL突变体可以包含在一个位置处的添加、在第二个位置处的缺失和在第三个位置处的置换。
在某些实施方案中,所述gL蛋白或片段包含在蛋白酶识别位点的N-端处的插入物区域。如在图1中所示,相对于来自HSV-1、HSV-2和ZVZ的gL蛋白,所述CMV gL蛋白包含额外的17-残基插入物。如在实施例中所示,当该17-残基插入物被部分地或完全地删除时,所述gL蛋白变得更易于被蛋白酶切割。因此,所述17-残基插入物似乎至少部分地阻断蛋白酶向蛋白酶识别位点的接近。因此,维持在蛋白酶识别位点的N-端处的插入物区域可能是合乎需要的。“插入物区域”应当是至少10个氨基酸残基长,且与SEQ ID NO: 5 (与HSV1、HSV2和VZV相比,它是CMV gL独有的原始17-残基片段)具有至少50%同一性。
在某些实施方案中,所述突变包含引入非天然存在的氨基酸残基,其被认为会减轻蛋白酶切割。
在某些实施方案中,所述突变包含引入包含庞大侧链的氨基酸残基,其被认为至少部分地阻断蛋白酶向蛋白酶识别位点的接近,且减轻蛋白酶切割。
B. CMV蛋白复合物
在另一个方面,本发明提供了包含本文描述的经修饰的CMV gL蛋白或其复合物形成片段的复合物。这样的复合物包括,例如,(i)分离的二聚体复合物,其包含:本文描述的经修饰的gL蛋白或其复合物形成片段,和CMV蛋白gH或其复合物形成片段;(ii)分离的三聚体复合物,其包含:本文描述的经修饰的gL蛋白或其复合物形成片段,和CMV蛋白gH或其复合物形成片段,和gO或其复合物形成片段;和(iii)分离的五聚体复合物,其包含:本文描述的经修饰的gL蛋白或其复合物形成片段,和CMV蛋白pUL128或其复合物形成片段,pUL130或其复合物形成片段,pUL131或其复合物形成片段,和gH或其复合物形成片段。还包括包含gL(或其复合物形成片段)作为组分的任意其它复合物。
尽管gH、gL、gO、pUL128、pUL130、pUL131可以被称作糖蛋白,但是不应认为该命名是指这些蛋白当与本发明一起使用时必须被糖基化。相反,在本发明的某些实施方案中,一个或多个多肽是非糖基化的。但是,在本发明的复合物中的一个或多个(或全部)多肽经常是糖基化的。在某些实施方案中,在本发明的复合物中的一个或多个(或全部)多肽被培养的细胞的糖基化突变体(诸如突变的哺乳动物细胞)糖基化。这样的糖基化突变体生产不同于野生型糖基化模式的多肽糖基化模式,即得到的多肽糖型不同于野生型糖型。
在某些实施方案中,所述gL (或其复合物形成片段)或包含gL (或其复合物形成片段)的复合物的糖基化模式具有哺乳动物糖基化模式;和/或不具有昆虫细胞糖基化模式。在某些实施方案中,所述复合物中的一个或多个蛋白含有具有倒数第二个半乳糖和末端唾液酸的复杂N-连接的侧链。
为了重组生产蛋白复合物(诸如五聚体复合物),可能合乎需要的是,所述复合物是可溶性的。基于序列分析,CMV gH蛋白包含跨膜(TM)结构域,但是gL、gO、pUL128、pUL130和pUL131不具有跨膜结构域。所以,为了生产可溶性复合物(例如,五聚体复合物),五聚体复合物的gH亚基可以缺少TM结构域。例如,可以使用这样的gH片段:其包含gH的N-端信号序列和胞外结构域,但是不包含TM结构域。
来自CMV毒株Towne的gH显示为SEQ ID NO: 6 (GI:138314, 742氨基酸残基)。来自Towne的gH已经被表征为具有:(i) 6个N-糖基化位点(在残基55、62、67、192、641和700处);(ii)在它的N-端(氨基酸残基1-23)处的疏水信号序列;(iii)从细胞伸出到细胞外空间的胞外结构域(残基24-717);(iv)疏水跨膜(TM)结构域(残基718-736);和(v) C-端细胞质结构域(残基737-742)。根据序列比对,可以鉴别来自其它毒株的gH蛋白或其它gH变体和片段的TM结构域。
为了容易生产,重组地生产的CMV复合物(诸如五聚体复合物)可以从宿主细胞分泌进培养基中。
在某些实施方案中,从宿主细胞分泌所述五聚体复合物。已经报道,所有5个亚基gH、gL、pUL128、pUL131和pUL131的存在对于五聚体复合物在内质网(ER)中的组装而言是足够的,然后它被输出至高尔基体。参见,Ryckman等人, J Virol. 2008年1月; 82(1): 60-70。可选地或另外地,适当的信号肽可以用在5个亚基中的一个或多个中(例如,通过制备具有分泌信号的融合蛋白)。用于生产分泌蛋白的信号序列(和表达盒)是现有技术中已知的。一般而言,前导肽是5-30个氨基酸长,且通常存在于新合成的蛋白的N-端。信号肽的核心通常含有疏水氨基酸的长段,其具有形成单个α-螺旋的趋势。另外,许多信号肽以短的带正电荷的氨基酸段开始,这可以帮助在易位过程中实现多肽的适当拓扑学。在信号肽的末端,通常存在被信号肽酶识别和切割的氨基酸段。信号肽酶可以易位过程中或易位结束后切割以产生游离的信号肽和成熟蛋白。
C. 编码经修饰的gL蛋白和复合物的核酸
在另一个方面,本发明提供了一种核酸,其包含编码本文描述的经修饰的gL蛋白或其复合物形成片段的序列。所述核酸可以是DNA或RNA。
在某些实施方案中,所述核酸是DNA。用于表达和纯化重组蛋白的基于DNA的表达系统是本领域众所周知的。例如,所述表达系统可以是这样的载体:其包含编码本文描述的经修饰的gL或gL片段的核苷酸序列,所述核苷酸序列可操作地连接至表达控制序列,所述表达控制序列调节所述经修饰的gL或gL片段在宿主细胞(诸如哺乳动物宿主细胞、细菌宿主细胞或昆虫宿主细胞)中的表达。所述表达控制序列可以是例如启动子、增强子、核糖体进入位点或多腺苷酸化序列。预见到用于用在本发明中的其它表达控制序列包括内含子和3’UTR序列。
使用本文描述的方法,诸如在WO 2014/005959中公开的纯化方法或本领域已知的其它方法,可以纯化重组地表达的经修饰的gL蛋白或其片段、或包含经修饰的gL蛋白或其片段的复合物。
在某些实施方案中,所述核酸分子是从腺病毒、腺伴随病毒、慢病毒或甲病毒衍生出的载体。在某些实施方案中,所述核酸分子是复制-缺陷型病毒载体。
在某些实施方案中,所述核酸是RNA。在某些实施方案中,所述核酸是自主复制RNA分子,诸如甲病毒衍生的RNA复制子。
自主复制RNA分子是本领域众所周知的,且可以使用复制元件来生产,所述复制元件源自例如甲病毒,且用编码目标蛋白的核苷酸序列置换结构病毒蛋白。自主复制RNA分子通常是可以在递送至细胞以后直接翻译的正链分子,且该翻译会提供RNA依赖性的RNA聚合酶,该酶然后从递送的RNA产生反义和有义转录物。因而,递送的RNA导致多个子代RNA的产生。这些子代RNA、以及共线的亚基因组转录物可以自己翻译以提供编码的抗原的原位表达,或可以转录以提供其它转录物,所述其它转录物具有与递送的RNA(其被翻译以提供抗原的原位表达)相同的含义。这系列转录的总结果是引入的复制子RNA的数目的巨大扩大,所以编码的抗原变成细胞的主要多肽产物。用自主复制RNA转染的细胞在发生细胞凋亡性死亡之前短暂地产生抗原。该死亡可能是必要的双链(ds) RNA中间体的结果,所述中间体也已经被证实会超活化树突细胞。因而,自主复制RNA的增强的免疫原性可能是促炎症性dsRNA(其模仿宿主细胞的RNA-病毒感染)的产生的结果。
一种以此方式实现自我复制的合适系统是使用基于甲病毒的复制子。甲病毒包含一组在遗传上、在结构上和在血清学上有关的节肢动物传播的披膜病毒科病毒。在甲病毒属内已经归类26种已知的病毒和病毒亚型,包括辛德毕斯病毒、西门利克森林病毒、罗斯河病毒和委内瑞拉马脑炎病毒。这样,本发明的自主复制RNA可以掺入从西门利克森林病毒(SFV)、辛德毕斯病毒(SIN)、委内瑞拉马脑炎病毒(VEE)、罗斯河病毒(RRV)、东方马脑炎病毒或属于甲病毒科的其它病毒衍生出的RNA复制酶。
基于甲病毒的“复制子”表达载体可以用在本发明中。复制子载体可以以几种形式使用,所述形式包括DNA、RNA和重组复制子颗粒。这样的复制子载体已经从甲病毒衍生出,所述甲病毒包括,例如,辛德毕斯病毒(Xiong等人(1989) Science 243:1188-1191;Dubensky等人, (1996) J. Virol. 70:508-519; Hariharan等人(1998) J. Virol. 72:950-958; Polo等人(1999) PNAS 96:4598-4603)、西门利克森林病毒(Liljestrom (1991)Bio/Technology 9:1356-1361; Berglund等人(1998) Nat. Biotech. 16:562-565)和委内瑞拉马脑炎病毒(Pushko等人(1997) Virology 239:389-401)。甲病毒衍生的复制子通常在总特征(例如,结构、复制)上十分相似,个别甲病毒可能表现出独有的某种特别性质(例如,受体结合、干扰素敏感性和疾病谱)。因此,从不同病毒科制成的嵌合甲病毒复制子也可能是有用的。
在某些实施方案中,使用甲病毒复制子颗粒(VRP)递送本文描述的CMV gL蛋白(或其片段)。“甲病毒复制子颗粒”(VRP)或“复制子颗粒”是与甲病毒结构蛋白一起包装的甲病毒复制子。
基于甲病毒的RNA复制子的应用是本领域已知的,参见,例如,WO 2013006837,段落[0155]至[0179]。可以施用RNA复制子,而不需要纯化在其中编码的蛋白。
在某些实施方案中,所述核酸分子是从腺病毒衍生出的载体的组成部分。腺病毒基因组是大约36,000个碱基对的直链双链DNA分子,其具有与每条链的5' 末端共价地结合的55-kDa末端蛋白。腺病毒(“Ad”) DNA含有约100个碱基对的相同反向末端重复(“ITR”),精确长度取决于血清型。病毒复制起点位于刚好在基因组末端处的ITR内。用于与本发明一起使用的腺病毒载体可以源自多种腺病毒血清型中的任一种,包括、但不限于,腺病毒的超过40种血清型毒株(诸如血清型2、5、12、40和41)中的任一种。
在某些实施方案中,所述核酸分子是从腺伴随病毒(AAV)衍生出的载体的组成部分。所述AAV基因组是含有大约4681个核苷酸的直链单链DNA分子。所述AAV基因组通常包含在每个末端上侧接反向末端重复(ITR)的内部非重复基因组。ITR是大约145个碱基对(bp)的长度。所述ITR具有多种功能,包括充当DNA复制的起源和充当病毒基因组的包装信号。AAV是助手依赖性的病毒;也就是说,它需要辅助病毒(例如,腺病毒、疱疹病毒或牛痘)的共感染,以便在野外形成AAV病毒粒子。在没有辅助病毒共感染存在下,AAV建立潜伏状态,其中病毒基因组插入宿主细胞染色体中,但是不产生传染性病毒粒子。辅助病毒的随后感染会挽救整合的基因组,从而允许它复制并将它的基因组包装成传染性的AAV病毒粒子。尽管AAV可以感染来自不同物种的细胞,但是辅助病毒必须属于与宿主细胞相同的物种。因而,例如,人AAV将在被犬腺病毒共感染的犬细胞中复制。
在某些实施方案中,所述核酸分子是从逆转录病毒衍生出的载体的组成部分。使用本领域已知的技术,可以将选择的基因插入载体中并包装在逆转录病毒颗粒中。然后可以将重组病毒分离并在体内或离体递送给受试者的细胞。已经描述了许多逆转录病毒系统。参见,例如,美国专利号5,219,740; Miller和Rosman (1989) BioTechniques 7:980-90; Miller, A. D. (1990) Human Gene Therapy 1 :5-14; Scarpa等人(1991)Virology 180:849-52; Burns等人(1993) Proc. Natl. Acad. Sci. USA 90:8033-37;Boris-Lawrie和Temin (1993) Curr. Opin. Genet. Develop. 3 : 102-09。
本发明还提供了包含本文中公开的核酸分子的宿主细胞。适合用于携带核酸分子和/或用于表达重组蛋白的宿主细胞,和将核酸引入合适的宿主细胞中的方法,是本领域已知的。
4. gL蛋白和复合物的重组生产
本发明还提供了包含如上所述的编码gL蛋白及其片段的核酸的宿主细胞。
优选地,所述宿主细胞是哺乳动物细胞(例如,人、非人灵长类动物、马、牛、绵羊、狗、猫和啮齿动物(例如,仓鼠)、禽细胞(例如,鸡、鸭和鹅)。合适的哺乳动物细胞包括,例如,中国仓鼠卵巢(CHO)细胞、人胚胎肾细胞(HEK-293细胞,通常被剪切的腺病毒5型DNA转化)、NIH-3T3细胞、293-T细胞、Vero细胞、HeLa细胞、PERC.6细胞(ECACC保藏编号96022940)、Hep G2细胞、MRC-5 (ATCC CCL-171)、WI-38 (ATCC CCL-75)、胎儿恒河猴肺细胞(ATCC CL-160)、Madin-Darby牛肾(“MDBK”)细胞、Madin-Darby犬肾(“MDCK”)细胞(例如,MDCK (NBL2)、ATCC CCL34;或MDCK 33016、DSM ACC 2219)、幼仓鼠肾(BHK)细胞,诸如BHK21-F、HKCC细胞等。
在某些实施方案中,所述宿主细胞是HEK-293细胞。在某些实施方案中,所述宿主细胞是CHO细胞。在某些实施方案中,将编码本文描述的gL蛋白(或其片段)的多核苷酸整合进CHO细胞的基因组DNA中。为了重组生产CMV蛋白复合物,也可以将编码复合物的其它亚基的核苷酸序列整合进CHO细胞的基因组DNA中。
因此,在某些实施方案中,所述宿主细胞包含一个或多个编码CMV五聚体复合物的多核苷酸序列,所述五聚体复合物包含:gH或其五聚体形成片段、gL或其五聚体形成片段、pUL128或其五聚体形成片段、pUL130或其五聚体形成片段、和pUL131或其五聚体形成片段。在某些实施方案中,将一个或多个编码CMV五聚体复合物的多核苷酸序列整合进所述宿主细胞的基因组DNA中。在某些实施方案中,当在合适的条件下培养时,所述宿主细胞表达所述CMV五聚体复合物(其优选地是可溶性的和/或从宿主细胞分泌)。
在欧洲细胞培养物保藏中心(European Collection of Cell Cultures,ECACC)可得到的示例性CHO细胞系列举在表2中。可以使用在表2中列出的任何CHO细胞。
表2
| 细胞系名称 | 关键词 |
| CHO | 中国仓鼠卵巢 |
| CHO (PROTEIN FREE) | 中国仓鼠卵巢 |
| CHO-CHRM1 | 人胆碱能受体毒蕈碱样M1, CHRM1, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-CHRM2 | 人胆碱能受体毒蕈碱样M2, CHRM2, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-CHRM5 | 人胆碱能受体毒蕈碱样M5, CHRM5, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-CNR1 | 人大麻素受体I, CNR1基因ID 1268, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-FFAR2 | 人游离脂肪酸受体2, FFAR2, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-GPR120 | 人受体GPR120 (孤儿), GPR120, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-K1 | 中国仓鼠卵巢 |
| CHO-K1-AC-free | 中国仓鼠卵巢, 无血清 |
| CHO-K1/SF | 中国仓鼠卵巢(MEM适应的) |
| CHO-NPY1R | 人神经肽Y受体, NPY1R,基因ID 4886, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-OPRL1 | 人阿片剂受体-样1, OPRL1, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO-SSTR1 | 人生长抑素受体1, SSTR1 G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflexTM, CHO-K1宿主. |
| CHO/dhFr- | 中国仓鼠卵巢 |
| CHO/dhFr-AC-free | 中国仓鼠卵巢, 无血清 |
| RR-CHOKI | 中国仓鼠卵巢 |
| T02J-10/10 (CHO-GCGR (GCGR)) | 人胰高血糖素受体, GCGR, G蛋白偶联受体, GPCR, 转染的, InSCREENeX SCREENflex<sup>TM</sup>, CHO-K1宿主. |
多种CHO细胞系也可得自美国典型培养物保藏中心(American Type CultureCollection,ATCC),诸如CHO细胞系hCBE11 (ATCC®PTA-3357™)、E77.4 (ATCC®PTA-3765™)、hLT-B:R-hG1 CHO #14 (ATCC®CRL-11965™)、MOR-CHO- MORAb-003-RCB (ATCC®PTA-7552™)、AQ.C2克隆11B (ATCC®PTA-3274™)、AQ.C2克隆11B (ATCC®PTA-3274™)、在CHO-DG44中的hsAQC2 (ATCC®PTA-3356™)、xrs5 (ATCC®CRL-2348™)、CHO-K1 (ATCC®CCL-61™)、Lec1 [最初命名为Pro-5WgaRI3C] (ATCC®CRL-1735™)、Pro-5 (ATCC®CRL-1781™)、ACY1-E (ATCC®65421™)、ACY1-E (ATCC®65420™)、pgsE-606 (ATCC®CRL-2246™)、CHO-CD36 (ATCC®CRL-2092™)、pgsC-605 (ATCC®CRL-2245™)、MC2/3(ATCC®CRL-2143™)、CHO-ICAM-1 (ATCC®CRL-2093™)和pgsB-618 (ATCC®CRL-2241™)。可以使用这些CHO细胞系中的任一种。
其它商购可得的CHO细胞系包括,例如,来自Life Technologies的FreeStyle™CHO-S细胞和Flp-In™-CHO细胞系。
其它合适的宿主细胞包括,例如,CHO细胞,其中C12orf35蛋白的表达水平或活性与对照相比下降(参见,例如,WO2015/092735,通过引用并入本文,其提供了哺乳动物细胞的详细描述,其中C12orf35蛋白的表达水平或活性与对照相比下降);CHO细胞,其中FAM60A蛋白的表达水平或活性与对照相比下降(参见,例如,WO2015/092737,通过引用并入本文,其提供了哺乳动物细胞的详细描述,其中FAM60A蛋白的表达水平或活性下降);CHO细胞,其中matriptase的表达水平或活性与对照相比下降(2014年4月29日提交并通过引用并入本文的美国临时专利申请号61/985,589,和2014年5月16日提交并通过引用并入本文的美国临时专利申请号61/994,310,它们提供了哺乳动物细胞的详细描述,其中matriptase的表达水平或活性下降)。
已经一般地公开了用于在CHO细胞中表达重组蛋白的方法。参见,例如,美国专利号4,816,567和5,981,214。
在2014年10月31日提交的欧洲专利申请EP14191385.5 (通过引用并入本文)公开了哺乳动物宿主细胞,尤其是CHO细胞,其中编码CMV蛋白gH、gL、pUL128、pUL130、pUL131(或其复合物形成片段)的序列稳定地整合进基因组中。
本文还提供了包含本文描述的宿主细胞的细胞培养物。所述细胞培养物可以是大规模的,例如,至少约10 L、至少约20 L、至少约30 L、至少约40 L、至少约50 L、至少约60L、至少约70 L、至少约80 L、至少约90 L、至少约100 L、至少约150 L、至少约200 L、至少约250 L、至少约300 L、至少约400 L、至少约500 L、至少约600 L、至少约700 L、至少约800L、至少约900 L、至少约1000 L、至少约2000 L、至少约3000 L、至少约4000 L、至少约5000L、至少约6000 L、至少约10,000 L、至少约15,000 L、至少约20,000 L、至少约25,000 L、至少约30,000 L、至少约35,000 L、至少约40,000 L、至少约45,000 L、至少约50,000 L、至少约55,000 L、至少约60,000 L、至少约65,000 L、至少约70,000 L、至少约75,000 L、至少约80,000 L、至少约85,000 L、至少约90,000 L、至少约95,000 L、至少约100,000 L等。
在某些实施方案中,所述CMV复合物(诸如五聚体复合物)的收率是至少约0.01 g/L、至少约0.02 g/L、至少约0.03 g/L、至少约0.05 g/L、至少约0.06 g/L、至少约0.07 g/L、至少约0.08 g/L、至少约0.09 g/L、至少约0.1 g/L、至少约0.15 g/L、至少约0.20 g/L、至少约0.25 g/L、至少约0.3 g/L、至少约0.35 g/L、至少约0.4 g/L、至少约0.45 g/L、至少约0.5 g/L、至少约0.55 g/L、至少约0.6 g/L、至少约0.65 g/L、至少约0.7 g/L、至少约0.75g/L、至少约0.8 g/L、至少约0.85 g/L、至少约0.9 g/L、至少约0.95 g/L或至少约1.0 g/L。
本文还提供了生产巨细胞病毒(CMV) gL蛋白或其片段、或包含所述gL蛋白或片段的复合物的方法,所述方法包括:(i)在合适的条件下培养本文描述的宿主细胞,由此表达所述gL蛋白或其片段;和(ii)从所述培养物收获所述gL蛋白或其片段、或包含所述gL蛋白或片段的复合物。
在某些实施方案中,纯化本文描述的gL蛋白(或其片段)、或包含所述gL蛋白或片段的复合物。使用任意合适的方法,诸如HPLC、不同类型的色谱法(诸如疏水相互作用、离子交换、亲和力、螯合和尺寸排阻)、电泳、密度梯度离心、溶剂萃取等,可以纯化所述gL蛋白(或其片段)。
例如,可以使用离子交换来纯化所述gL蛋白(或其片段)或包含所述gL蛋白或片段的复合物。可用于离子交换色谱法的材料的例子包括DEAE-纤维素、QAE-纤维素、DEAE-cephalose、QAE-cephalose、DEAE-Toyopearl、QAE-Toyopearl、Mono Q、Mono S、Qsepharose、SP sepharose等。在一个示例性实施方案中,所述方法使用Mono S柱。在另一个示例性实施方案中,所述方法使用Mono Q柱。
可选地或另外地,可以使用基于亲和力的纯化。亲和纯化标签的例子包括,例如,His标签(结合金属离子)、抗体(结合蛋白A或蛋白G)、麦芽糖-结合蛋白(MBP) (结合直链淀粉)、谷胱甘肽-S-转移酶(GST) (结合谷胱甘肽)、FLAG标签(Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys) (SEQ ID NO: 8) (结合抗-flag抗体)、Strep标签(结合抗生蛋白链菌素或其衍生物)。
一个示例性实施方案是Strep标签(或抗生蛋白链菌素亲和标签),即结合抗生蛋白链菌素或其衍生物(诸如Strep-Tactin)的标签。Strep标签包含9个氨基酸的肽:Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly (SEQ ID NO: 9),或8个氨基酸的肽(也称为strep-标签II): Trp-Ser- His-Pro-Gln-Phe-Glu-Lys (SEQ ID NO: 10)。使用生物素或其衍生物或同系物,诸如脱硫-生物素,可以实现与strep-标签连接的蛋白从柱的洗脱。
所述亲和纯化标签可以通过任意合适的方式连接,且可以直接地或间接地连接。例如,所述标签可以共价地连接在多肽序列的N-端处或多肽序列的C-端处。这可以如下实现:重组表达包含所述多肽和所述标签的融合蛋白,或通过将所述多肽连接至所述标签的标准缀合技术。使用标准的缀合技术,可以将所述标签连接至所述多肽的氨基酸残基的侧链官能团。可选地,所述标签可以非共价地连接。
所述标签的连接可以是直接的或间接的(通过接头)。合适的接头是本领域技术人员已知的,且包括,例如,直链或支链碳接头、杂环碳接头、碳水化合物接头和多肽接头。
在一个特定实施方案中,可以使用可切割的接头将目标分子连接至所述标签。这允许所述标签与纯化的复合物分离,例如通过加入能够切割所述接头的试剂。许多不同的可切割的接头是本领域技术人员已知的。这样的接头可以例如通过光不稳定的键的辐照或酸催化的水解进行切割。还存在多肽接头,其包含蛋白酶识别位点且其可以通过加入合适的蛋白酶进行切割。
当纯化包含gL蛋白(或其片段)的复合物时,所述标签可以连接至所述复合物的其它组分。例如,当纯化CMV五聚体复合物时,标签可以连接至pUL128、pUL130或pUL131。
5. 药物组合物和施用
本发明还提供了包含本文描述的CMV蛋白、复合物和核酸的药物组合物。本发明还提供了药物组合物,其包含编码本文描述的CMV蛋白、复合物和核酸的核酸。
本文描述的CMV蛋白、复合物和核酸可以掺入免疫原性组合物或疫苗组合物中。这样的组合物可以用于在哺乳动物(例如人)中产生抗体。
本发明提供了包含本文描述的CMV蛋白、复合物和核酸的药物组合物,和用于制备药物组合物的方法,所述方法包括将本文描述的CMV蛋白、复合物和核酸与药学上可接受的载体组合。本发明的药物组合物通常包括药学上可接受的载体,并且这样的载体的细致讨论可得自Remington: The Science and Practice of Pharmacy。
所述组合物的pH经常是在约4.5至约11之间,诸如约5至约11之间、约5.5至约11之间、约6至约11之间、约5至约10.5之间、约5.5至约10.5之间、约6至约10.5之间、约5至约10之间、约5.5至约10之间、约6至约10之间、约5至约9.5之间、约5.5至约9.5之间、约6至约9.5之间、约5至约9之间、约5.5至约9之间、约6至约9之间、约5至约8.5之间、约5.5至约8.5之间、约6至约8.5之间、约5至约8之间、约5.5至约8之间、约6至约8之间、约4.5、约5、约6.5、约6、约6.5、约7、约7.5、约8、约8.5、约9、约9.5、约10、约10.5、约11等。通过使用缓冲液(例如Tris缓冲液、柠檬酸盐缓冲液、磷酸盐缓冲液或组氨酸缓冲液)可以维持稳定的pH。因此,组合物通常包括缓冲液。
组合物可以是无菌的和/或无热原的。组合物可以就人类而言是等渗的。
组合物包含免疫学上有效量的其抗原。“免疫学上有效量”是这样的量:其当施用给受试者时有效地引起针对所述抗原的抗体应答。该量可以随要治疗的个体的健康和身体状况、其年龄、该个体的免疫系统合成抗体的能力、期望的保护程度、疫苗的制剂、治疗医生对医学情况的评估和其它相关因素而变化。预见到,所述量将落入通过常规测试可以确定的相对宽范围内。本发明的组合物的抗原含量通常以每剂中蛋白质的质量来表示。10-500µg (例如50µg) /抗原的剂量可以是有用的。
免疫原性组合物可以包括免疫学佐剂。示例性的佐剂包括含矿物的组合物;油乳剂;皂苷制剂;病毒体和病毒样颗粒;细菌或微生物衍生物;生物粘着剂和粘膜粘着剂;脂质体;聚氧乙烯醚和聚氧乙烯酯制剂;聚膦腈(pcpp);胞壁酰基肽;咪唑并喹诺酮化合物;缩氨基硫脲化合物;色胺酮化合物;人免疫调节剂;脂肽;苯并萘啶;微粒;免疫刺激性的多核苷酸(诸如RNA或DNA;例如,含CpG的寡核苷酸)。
例如,所述组合物可以包括铝盐佐剂、水包油乳剂(例如包含角鲨烯诸如MF59或AS03的水包油乳剂)、TLR7激动剂(诸如咪唑并喹啉或咪喹莫特)或它们的组合。合适的铝盐包括氢氧化物(例如羟基氧化物)、磷酸盐(例如羟基磷酸盐、正磷酸盐)(例如参见VaccineDesign的第8和9章(1995). Powell和Newman编. ISBN: 030644867X. Plenum)或其混合物。所述盐可以呈任意适合形式(例如凝胶、结晶、无定形等),抗原向所述盐的吸附是一个实施例。用于施用给患者的组合物中的Al+3的浓度可以小于5mg/ml,例如<4 mg/ml、<3 mg/ml、<2 mg/ml、<1 mg/ml等。一种优选的范围是0.3-1mg/ml。0.85mg/剂的最大值是优选的。氢氧化铝和磷酸铝佐剂适合用于与本发明一起使用。
一种合适的免疫学佐剂包含吸附至铝盐的在WO2011/027222中定义的式(I)的化合物或其药学上可接受的盐。可以使用许多其它佐剂,包括在Powell和Newman(1995)中公开的那些中的任一种。
组合物可以包括抗微生物剂,特别是当以多次剂型包装时。抗微生物剂诸如硫柳汞和2-苯氧乙醇在疫苗中常见,但是有时可能合乎需要的是使用无汞防腐剂或根本不用防腐剂。
组合物可以包含去污剂例如聚山梨酯,诸如聚山梨酯80。去污剂通常以低水平(例如<0.01%)存在。
组合物可以包括钠盐(例如氯化钠)以提供张度。10±2 mg/ml NaCl的浓度是典型的,例如,约9 mg/ml。
在另一个方面,本发明提供了一种诱导针对巨细胞病毒(CMV)的免疫应答的方法,所述方法包括给有此需要的受试者施用免疫学上有效量的本文所述的免疫原性组合物,所述组合物包含如上所述的蛋白、DNA分子、RNA分子(例如,自主复制RNA分子)或VRP。
在某些实施方案中,所述免疫应答包含针对CMV的中和抗体的产生。在某些实施方案中,所述中和抗体是补体非依赖性的。
所述免疫应答可以包含体液免疫应答、细胞介导的免疫应答或二者。在某些实施方案中,针对每种递送的CMV蛋白诱导免疫应答。细胞介导的免疫应答可以包含辅助T-细胞(Th)应答、CD8+ 细胞毒性的T-细胞(CTL)应答或二者。在某些实施方案中,所述免疫应答包含体液免疫应答,且所述抗体是中和抗体。中和抗体会阻断细胞的病毒感染。CMV感染上皮细胞以及成纤维细胞。在某些实施方案中,所述免疫应答减轻或预防两种细胞类型的感染。中和抗体应答可以是补体依赖性的或补体非依赖性的。在某些实施方案中,所述中和抗体应答是补体非依赖性的。在某些实施方案中,所述中和抗体应答是交叉中和;即,针对一种施用的组合物产生的抗体会中和除了在所述组合物中使用的毒株以外的CMV病毒毒株。
本领域中抗体效能的一种有用量度是“50%中和滴度”。为了确定50%中和滴度,将来自经免疫的动物的血清稀释以评估哪种稀血清可以仍然保留阻断50%的病毒进入细胞中的能力。例如,700的滴度是指,血清在稀释700倍以后保留中和50%的病毒的能力。因而,较高滴度指示更有效的中和抗体应答。在某些实施方案中,该滴度是在具有约200、约400、约600、约800、约1000、约1500、约2000、约2500、约3000、约3500、约4000、约4500、约5000、约5500、约6000、约6500或约7000的下限的范围内。50%中和滴度范围可以具有约400、约600、约800、约1000、约1500、约2000、约2500、约3000、约3500、约4000、约4500、约5000、约5500、约6000、约6500、约7000、约8000、约9000、约10000、约11000、约12000、约13000、约14000、约15000、约16000、约17000、约18000、约19000、约20000、约21000、约22000、约23000、约24000、约25000、约26000、约27000、约28000、约29000或约30000的上限。例如,50%中和滴度可以是约3000至约25000。“约”是指列举的值±10%。
本发明的组合物通常直接施用给受试者。通过胃肠外注射(例如皮下、腹膜内、静脉内、肌肉内或注射至组织的间质间隙),或通过任意其它合适的途径,可以实现直接递送。例如,可以使用肌肉内施用,例如至大腿或上臂。注射可以是经由针头(例如皮下针头),但是可以可选地使用无针注射。一种典型肌肉内剂量体积是约0.5 ml。
给药可以是通过单剂量方案或多剂量方案。多剂量可以用在初次免疫接种方案中和/或强化免疫接种方案中。在多剂量方案中,所述多个剂量可以通过相同的或不同的途径施用,例如,胃肠外激发和粘膜强化,粘膜激发和胃肠外强化,等。通常间隔至少1周(例如,约2周、约3周、约4周、约6周、约8周、约10周、约12周、约16周等)施用多剂量。
所述受试者可以是动物,优选脊椎动物,更优选哺乳动物。示例性的受试者包括,例如,人、牛、猪、鸡、猫或狗,因为在其中隐蔽的病原体可以在宽范围的物种之间引起问题。在所述疫苗用于预防用途的情况下,人优选地是儿童(例如,幼儿或婴儿)、青少年或成年人;在所述疫苗用于治疗用途的情况下,人优选地是青少年或成年人。意图用于儿童的疫苗也可以施用给成年人,例如,以评估安全性、剂量、免疫原性等。
本发明的疫苗可以是预防性的(即以预防疾病)或治疗性的(即以减少或消除疾病的征状)。术语预防性的可以视作减轻特别病症的严重程度或预防特定病症的发作。为了避免疑惑,术语预防性疫苗也可以表示改善将来感染的效果的疫苗,例如通过减轻这样的感染的严重程度或持续时间。
本文描述的分离的和/或纯化的CMV蛋白、复合物和核酸可以单独施用,或在混合模态方案中作为激发或强化施用,诸如RNA激发并随后蛋白强化。与蛋白激发蛋白强化策略相比,RNA激发蛋白强化策略的益处包括,例如,增加的抗体滴度、更平衡的IgG1:IgG2a亚型比例、与病毒颗粒的免疫应答类似的TH1-型CD4+ T细胞介导的免疫应答的诱导和减少的非中和抗体的产生。RNA激发可以增加组合物的免疫原性,不论它们是否含有佐剂。
在RNA激发-蛋白强化策略中,RNA和蛋白针对相同靶抗原。合适的递送RNA的模式的例子包括病毒样复制子颗粒(VRP)、甲病毒RNA、包封在脂质纳米颗粒(LNP)中的复制子或配制的RNA,诸如用阳离子纳米乳液(CNE)配制的复制子。合适的阳离子水包油纳米乳液公开于WO2012/006380中,例如包含油核心(例如包含角鲨烯)和阳离子脂质(例如DOTAP、DMTAP、DSTAP、DC-胆固醇等)。
WO2012/051211公开了在已经用VRP和配制的RNA(CNE和LNP)免疫的小鼠中生产针对五聚体复合物的抗体,所述RNA编码所述五聚体复合物的蛋白组分。已经发现这些抗体能够中和上皮细胞中的CMV感染。RNA激发-蛋白强化方案可能包括首先(例如在第0-8周)用编码本发明的CMV蛋白复合物的一个或多个蛋白组分的RNA(其可作为VRP、LNP、CNE等递送)进行一次或多次激发免疫接种,并然后(例如在第24-58周)用以下物质进行一次或多次强化免疫接种:分离的本发明的CMV蛋白复合物(任选地用佐剂配制)或者纯化的本发明的CMV蛋白复合物(任选地用佐剂配制)。
在某些实施方案中,所述RNA分子包封于以下物质中、结合至以下物质或者吸附在以下物质上:阳离子脂质、脂质体、螺旋状物、病毒体、免疫刺激复合物、微粒、微球、纳米球、单层囊泡、多层囊泡、水包油乳剂、油包水乳剂、乳化体(emulsome)、聚阳离子肽、阳离子纳米乳液或它们的组合。
本文还提供了用于施用本文描述的核酸(例如,RNA)、纯化的蛋白和纯化的复合物的试剂盒和使用说明书。本发明还提供了用本文中公开的组合物或疫苗预充的递送装置。
本文描述的药物组合物可以与一种或多种另外的治疗剂联合施用。所述另外的治疗剂可以包括、但不限于:抗生素或抗细菌剂、止吐剂、抗真菌剂、抗炎剂、抗病毒剂、免疫调节剂、细胞因子、抗抑郁药、激素、烷化剂、抗代谢药、抗肿瘤抗生素、抗有丝分裂剂、拓扑异构酶抑制剂、细胞抑制剂、抗侵入剂、抗血管生成剂、生长因子功能抑制剂、病毒复制抑制剂、病毒酶抑制剂、抗癌剂、α-干扰素、β-干扰素、利巴韦林、激素和其它toll-样受体调节剂、免疫球蛋白(Ig)和调节Ig功能的抗体(诸如抗-IgE (奥马珠单抗))。
在某些实施方案中,本文中公开的组合物可以用作药物,例如,用于诱导或增强有此需要的受试者(诸如哺乳动物)中的免疫应答。
在某些实施方案中,本文中公开的组合物可以用在药物制备中,所述药物用于诱导或增强有此需要的受试者(诸如哺乳动物)中的免疫应答。
检查治疗性处理的效力的一种方式包括,在施用本文中公开的组合物或疫苗以后,监测病原体感染。检查治疗性处理的效力的另一种方式包括,全身性地(诸如监测IgG1和IgG2a产生水平)和/或粘膜地(诸如监测IgA产生水平)监测针对抗原的免疫应答。通常,在免疫接种后、但是攻击前确定抗原特异性的血清抗体应答,而在免疫接种后和攻击后确定抗原特异性的粘膜抗体应答。
本发明通过下述实施例进一步举例说明,下述实施例不应解释为限制。
实施例
实施例1: 材料和方法
序列和结构分析. 将CMV、VZV和HSV1和HSV2的gL序列使用CLUSTALW (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage= npsa_clustalw.html)进行比对并手工地调节以比对为VZV和HSV2中的保守β-链做出贡献的残基。
penta和gH/gL复合物的表达. 使用双载体系统表达野生型(WT)五聚体复合物(“penta”)或具有gL突变的penta (“LSG”和“IDG”突变体),所述双载体系统具有在一种载体中的gH和gL以及在另一种载体中的三个UL。IRES (内核糖体进入位点)的序列将每个载体中的不同基因分离。gH具有C-端6xHis标签(SEQ ID NO: 11),且UL130具有可切割的C-端strep-标签。按照生产商的方案,使用Expifectamine转染试剂盒(Life Technologies)将两种载体的DNA(对于每升培养物,1 mg总DNA)转染进Expi293细胞中。在转染当天在摇瓶中将细胞培养至~2.5x106个细胞/mL,具有>97%的生存率。在运行在37℃、150 rpm和8%CO2的振荡培养箱中将转染的细胞培养3天至~8x106个细胞/mL,具有生存率~60%。通过在4200 rpm离心30分钟,收获表达培养基的上清液。
以与上述相同的方式,使用含有gH和gL的载体表达WT gH/gL或具有gL突变的gH/gL。
N-端测序. 使用N-端测序来鉴别通过亲和纯化的WT penta的SDS page和蛋白质印迹(WB)可见的未知带。将SDS page上的penta转移至乙醇活化的PVDF膜,将其用40%甲醇中的0.02%考马斯亮蓝染色,然后在蒸馏水中洗涤几次,然后完全风干。将目标带切出并运送至Tufts University Protein Core Facility进行测序。
纯化和蛋白质印迹分析. 将收获的上清液浓缩,并使用KrosFlo Research IITFF系统和中空纤维筒(Spectrumlabs)缓冲液交换进亲和柱结合缓冲液(50 mM HepespH7.0, 150 mM NaCl,和1 mM EDTA)中。将浓缩的上清液加载至StrepTrap HP筒(GE LifeSciences),并用洗脱缓冲液(50 mM Hepes pH 7.0, 150 mM NaCl, 2.5 mM脱硫生物素,和1 mM EDTA)洗脱。将来自洗脱液的峰级分通过SDS-PAGE和蛋白质印迹法(使用针对gL或置于gH的C-端处的His-标签的抗体)进行分析。
在小鼠中的免疫接种研究. 将每组10只小鼠用加MF59佐剂的纯化的WT或突变体五聚体复合物gH/gL/pUL128/pUL130/pUL131在3个不同剂量0.03 μg、0.1 μg和1 μg免疫,以3周间隔注射3次。将血清样品在56℃热灭活30 min,在2倍步骤(每个稀释度2个副本)中系列稀释,与等体积的在培养基±10%豚鼠补体(Cedarlane Labs, Burlington, NC, USA)中稀释至200-250个被感染的细胞/计数场的靶浓度的HCMV病毒混合,并在37℃/5%CO2温育2 h。将这些血清/病毒样品加给在96-孔半面积细胞培养平板(Corning Inc.,Corning,NY, USA)中制备的ARPE-19细胞或MRC-5细胞。将受感染的单层在37℃/5%CO2温育48小时(±8 h),用10%缓冲的福尔马林(EMD Chemicals Inc., Gibbstown, NJ, USA)固定1小时,并用洗涤缓冲液(PBS/0.05%吐温-20)洗涤3次,用PBS/2.5%胎牛血清、0.5%皂苷、0.1%叠氮化钠在室温封闭1小时。将平板洗涤3次,敲干并在25℃恒湿培养箱中温育1小时。然后将平板与源自杂交瘤L14的抗-HCMV IE1抗体(在皂苷缓冲液中稀释)一起在室温温育1小时。将平板洗涤3次并与缀合至AlexaFluor 488的抗-小鼠IgG(在皂苷缓冲液中稀释)一起温育1小时,然后用PBS/0.05%吐温-20洗涤3次。使用Immunospot S5 UV Analyzer (CellularTechnology Limited, Shaker Heights, OH, USA)计数荧光细胞,并通过具有产生高于和低于50%值的平均受感染细胞计数的孔的两种稀释度之间的线性回归内插来计算50%中和滴度,其被定义为产生受感染细胞计数的50%减少(相对于稀释剂+病毒对照孔中的受感染细胞计数)的血清稀释度的倒数。
实施例2: 结果
1. gL裁剪在保守β-链之后发生
N-端测序确定,使用针对gL的抗体通过蛋白质印迹鉴别出的带开始于gL残基97。因而,在哺乳动物细胞中表达的gH/gL/pUL128/pUL130/pUL131五聚体复合物含有在gL残基Asn97和Ser98之间裁剪的gL蛋白群体。基于结构的序列比对进一步公开了裁剪位点是在VZV和HSV-2 gH/gL结构的保守β-链之后的环区域中(图1)。
引入在该裁剪位点附近的gL序列中的多个突变导致gL裁剪的量的减少。添加突变将2和5个残基(具有极性和非极性残基的混合物)插入在切割位点中。缺失突变在切割位点周围删除1-3个残基。置换突变将Ala96变为疏水残基或具有大侧链的残基;将Asn97变为具有较小或较大侧链的极性残基或变为非极性残基;或将Ser98变为具有极性的或非极性特性的具有小侧链的残基。
2. 各种突变体gH/gL与野生型gH/gL的对比
图2A显示了测试的各种突变体gL蛋白。将含有各种gL突变的gH/gL复合物在Expi293细胞中表达,并与WT gH/gL进行对比。在蛋白酶识别位点处的突变减少了表达的gH/gL复合物中的gL裁剪。例如,WT粗上清液的抗-gL蛋白质印迹表明在其N-端处具有残基98的gL片段的明显可见带,如通过N-端测序确定的。相反,类似带在“LSG”突变体中没有检测到,并且在“δAsn97”和“SST”突变体中没有检测到或显著地减少(图2)。
在裁剪位点附近引入的三残基变体比单残基变体更大程度地减少在裁剪位点附近的裁剪。在抗-His蛋白质印迹中,“LSG”突变体最显著地减少gL裁剪带的强度。另外,除去17-残基插入会增强通过蛋白质印迹观察到的gL裁剪带的强度,gH/gL(N),从而提示,该插入可能保护切割位点(图2C)。
3. “LSG”和“IDG”突变体penta与野生型五聚体的对比
为了分析“LSG和“IDG”突变体是否也会消除或减轻gH/gL/pUL128/pUL130/pUL131五聚体中的gL裁剪,通过抗-His和抗-gL蛋白质印迹分析了亲和纯化的WT和突变体五聚体。在WT五聚体的抗-His蛋白质印迹中,存在具有比全长gH/gL更小的分子量的显著带,这与gH和裁剪以后gL的N-端区域的复合物一致。应当指出,gL的该N-端片段不会被抗-gL抗体识别。在抗-gL蛋白质印迹中,gL的C-端区域(以残基98开始,通过N-端测序确定)与非还原样品中的UL128形成复合物。在还原的样品中观察到gL的相同C-端片段本身。与此相比,在“LSG”或“IDG”突变体五聚体中没有检测到由gL裁剪产生的那些带(图3和4)。“LSG”和“IDG”突变体都产生具有与WT五聚体复合物类似的表现的五聚体。因此,那些突变不会影响gH/gL/pUL128/pUL130/pUL131五聚体复合物的组装,但是消除了gL蛋白的蛋白水解性裁剪(图5A)。
免疫原性分析表明,LSG和IDG突变体没有损害gH/gL/pUL128/pUL130/pUL131五聚体复合物的免疫原性(图5B)。
在gH/gL、gH/gL/gO (数据未显示)和gH/gL/pUL128/pUL130/pUL131复合物的表达过程中检测到由裁剪产生的gL片段。这三种复合物中的裁剪位点是相同的,在gL残基97和98之间。因此,在gH/gL的表达过程中阻止gL裁剪的突变也会在gH/gL/gO和gH/gL/pUL128/pUL130/pUL131五聚体复合物的表达过程中阻止gL裁剪。
对于少至三残基置换或单缺失,分别可以消除或显著地减轻gL裁剪。没有预见到这些突变的位置会影响它们附近的保守二级结构。这允许生产具有它的三维结构的均匀gH/gL/pUL128/pUL130/pUL131五聚体,且抗原性/免疫原性在较大程度上未受影响。我们的结论是,用同源序列突变在裁剪位点附近的序列的策略被证实是有效的。
在以上各个部分中提及的本发明的各个特征和实施方案在适当时适用于其它部分,在细节上做必要的修正。因此,在一个部分中详细说明的特征在适当时可以与在其它部分中详细说明的特征组合。
考虑到在说明书内引用的参考文献的教导,会最透彻地理解说明书。在说明书内的实施方案提供了本发明的实施方案的例证,且不应解释为限制本发明的范围。技术人员容易地认识到,本发明包括许多其它实施方案。在本公开内容中引用的所有出版物和专利通过引用整体并入。在通过引用并入的材料与本说明书矛盾或不一致的情况下,本说明书将替代任何这样的材料。本文中对任何参考文献的引用并非承认这样的参考文献是本发明的现有技术。
除非另有说明,否则本发明的实践将采用化学、生物化学、分子生物学、免疫学和药理学的常规方法,这些方法在本领域技术范围内。这样的技术在文献中进行了充分解释。术语“包含”包括“包括”以及“由……组成”,例如“包含”X的组合物可以排它地由X组成,或者可以包括另外的某物,例如X + Y。
术语”基本上由……组成”表示组合物、方法或结构可以包括额外的成分、步骤和/或部件,但是前提是所述额外的成分、步骤和/或部件不会实质上改变要求保护的组合物、方法或结构的基础的和新颖的特征。术语”由……组成”通常用于指,要求保护的发明限于在权利要求中具体列出的那些要素(且可能包括它们的等同物,只要等同物的学说是适用的)。
本领域技术人员会认识到或仅仅使用例行实验就能够确定许多与本文所述的本发明的具体实施方案等效的方案。这样的等同方案意图被下述实施方案包括。
1. 一种重组巨细胞病毒(CMV) gL蛋白或其复合物形成片段,其中所述gL蛋白或片段包含在蛋白酶识别位点内的突变,其中所述突变与对照相比减少在所述蛋白酶识别位点处的蛋白酶切割。
2. 实施方案1的gL蛋白或片段,其中所述突变包含氨基酸残基的添加、缺失、置换或它们的组合。
3. 实施方案1或2的gL蛋白或片段,其中所述蛋白酶识别位点的三个或更多个残基形成β-链,且所述突变维持所述β-链构象。
4. 实施方案1-3中的任一个的gL蛋白或片段,其中当在哺乳动物宿主细胞中重组地表达时,所述突变导致不超过20%(摩尔百分比)的gL在所述蛋白酶识别位点处被切割。
5. 实施方案1-4中的任一个的gL蛋白或片段,其中所述突变包含一个或多个氨基酸残基的添加。
6. 实施方案1-5中的任一个的gL蛋白或片段,其中所述突变包含2-5个氨基酸残基的添加。
7. 实施方案6的gL蛋白或片段,其中所述2-5个氨基酸残基包含极性的残基和非极性的残基。
8. 实施方案1-7中的任一个的gL蛋白或片段,其中所述突变包含在残基N97和S98之间的一个或多个残基添加。
9. 实施方案1-8中的任一个的gL蛋白或片段,其中所述突变包含在残基N97和S98之间的F、Q、FQ或QF添加。
10. 实施方案1-9中的任一个的gL蛋白或片段,其中所述突变包含一个或多个氨基酸残基的缺失。
11. 实施方案1-10中的任一个的gL蛋白或片段,其中所述突变包含1-3个氨基酸残基的缺失。
12. 实施方案1-11中的任一个的gL蛋白或片段,其中所述突变包含残基的缺失,所述残基选自V91、T92、P93、E94、A95、A96、N97、S98、V99、L100、L101、D102和它们的组合。
13. 实施方案1-12中的任一个的gL蛋白或片段,其中所述突变包含残基的缺失,所述残基选自A95、A96、N97和它们的组合。
14. 实施方案1-13中的任一个的gL蛋白或片段,其中所述突变包含缺失N97。
15. 实施方案1-14中的任一个的gL蛋白或片段,其中所述突变包含将残基用来自另一种疱疹病毒的gL蛋白的对应残基置换。
16. 实施方案15的gL蛋白或片段,其中来自另一种疱疹病毒的gL蛋白是来自HSV1、HSV2、VZV、EBV、PrV或牛疱疹病毒5的gL蛋白。
17. 实施方案1-16中的任一个的gL蛋白或片段,其中所述突变包含用非极性的残基或用包含大侧链的残基置换A96。
18. 实施方案1-17中的任一个的gL蛋白或片段,其中所述突变包含用I、L、V或S置换A96。
19. 实施方案1-18中的任一个的gL蛋白或片段,其中所述突变包含用R、L、E或N置换A95。
20. 实施方案1-19中的任一个的gL蛋白或片段,其中所述突变包含用A或L置换E94。
21. 实施方案1-20中的任一个的gL蛋白或片段,其中所述突变包含用极性的残基或非极性的残基置换N97。
22. 实施方案21的gL蛋白或片段,其中所述极性的残基包含小侧链。
23. 实施方案21的gL蛋白或片段,其中所述极性的残基包含大侧链。
24. 实施方案1-23中的任一个的gL蛋白或片段,其中所述突变包含用S、D、E、A、T或Y置换N97。
25. 实施方案1-24中的任一个的gL蛋白或片段,其中所述突变包含用S或D置换N97。
26. 实施方案1-25中的任一个的gL蛋白或片段,其中所述突变包含用具有小侧链的氨基酸残基置换S98。
27. 实施方案1-26中的任一个的gL蛋白或片段,其中所述突变包含用G、T、V或I置换S98。
28. 实施方案1-27中的任一个的gL蛋白或片段,其中所述突变包含用G或T置换S98。
29. 实施方案1-28中的任一个的gL蛋白或片段,其中所述突变包含用I置换V99。
30. 实施方案1-29中的任一个的gL蛋白或片段,其中所述突变包含用氨基酸残基如F或V置换L100。
31. 实施方案1-30中的任一个的gL蛋白或片段,其中所述突变包含用氨基酸残基如V或I置换L101。
32. 实施方案1-31中的任一个的gL蛋白或片段,其中所述gL蛋白或片段包含在蛋白酶识别位点的N-端处的插入物区域。
33. 实施方案1-32中的任一个的gL蛋白或片段,其中所述突变包含引入非天然存在的氨基酸残基。
34. 实施方案1-33中的任一个的gL蛋白或片段,其中所述突变包含引入包含庞大侧链的氨基酸残基。
35. 一种CMV复合物,其包含实施方案1-34中的任一个的重组gL蛋白或片段。
36. 实施方案35的复合物,所述复合物包含选自以下的CMV蛋白:gH、gL、pUL128、pUL130、pUL131、gO、其复合物形成片段和它们的组合。
37. 实施方案35或36的复合物,其中所述复合物是包含以下的五聚体复合物:gH或其五聚体形成片段、gL或其五聚体形成片段、pUL128或其五聚体形成片段、pUL130或其五聚体形成片段和pUL131或其五聚体形成片段。
38. 实施方案35或36的复合物,其中所述复合物是包含以下的gH/gL复合物:gH或其复合物形成片段和gL或其复合物形成片段。
39. 实施方案35或36的复合物,其中所述复合物是包含以下的三聚体复合物:gH或其复合物形成片段、gL或其复合物形成片段和gO或其复合物形成片段。
40. 一种免疫原性组合物,其包含实施方案1-34中的任一个的重组CMV gL蛋白或片段或实施方案35-39中的任一个的复合物。
41. 实施方案40的免疫原性组合物,所述免疫原性组合物还包含佐剂。
42. 实施方案41的免疫原性组合物,其中所述佐剂包含铝盐、TLR7激动剂、水包油乳剂或它们的组合。
43. 实施方案42的免疫原性组合物,其中所述水包油乳剂是MF59。
44. 一种分离的核酸,其包含编码实施方案1-34中的任一个的重组CMV gL蛋白或片段的多核苷酸序列。
45. 实施方案44的分离的核酸,其中所述分离的核酸是RNA,优选自主复制RNA。
46. 实施方案45的分离的核酸,其中所述自主复制RNA是甲病毒复制子。
47. 一种甲病毒复制颗粒(VRP),其包含实施方案46的甲病毒复制子。
48. 一种免疫原性组合物,其包含实施方案44-46中的任一个的核酸。
49. 一种免疫原性组合物,其包含实施方案47的VRP。
50. 实施方案48或49的免疫原性组合物,所述免疫原性组合物还包含佐剂。
51. 实施方案50的免疫原性组合物,其中所述佐剂包含铝盐、TLR7激动剂、水包油乳剂(诸如MF59)或它们的组合。
52. 一种宿主细胞,其包含实施方案44-46中的任一个的核酸。
53. 实施方案52的宿主细胞,其中所述核酸是DNA。
54. 实施方案53的宿主细胞,其中所述宿主细胞是哺乳动物细胞。
55. 实施方案54的宿主细胞,其中所述哺乳动物细胞是CHO细胞或HEK-293细胞。
56. 实施方案53-55中的任一个的宿主细胞,其中所述编码CMV gL蛋白或其片段的DNA整合进所述宿主细胞的基因组DNA中。
57. 实施方案52-56中的任一个的宿主细胞,其中所述宿主细胞包含一种或多种编码CMV五聚体复合物的多核苷酸序列,所述五聚体复合物包含:gH或其五聚体形成片段、gL或其五聚体形成片段、pUL128或其五聚体形成片段、pUL130或其五聚体形成片段和pUL131或其五聚体形成片段。
58. 实施方案57的宿主细胞,其中所述一种或多种编码CMV五聚体复合物的多核苷酸序列整合进所述宿主细胞的基因组DNA中。
59. 实施方案57或58的宿主细胞,其中当在合适的条件下培养时,所述细胞表达所述CMV五聚体复合物。
60. 实施方案59的宿主细胞,其中分泌所述五聚体复合物。
61. 一种细胞培养物,其包含实施方案52-60中的任一个的宿主细胞,其中所述培养物是至少20升大小。
62. 一种细胞培养物,其包含实施方案52-60中的任一个的宿主细胞,其中所述培养物是至少100升大小。
63. 一种细胞培养物,其包含实施方案57-60中的任一个的宿主细胞,其中所述五聚体复合物的收率是至少0.05 g/L。
64. 一种细胞培养物,其包含实施方案63的宿主细胞,其中所述五聚体复合物的收率是至少0.1 g/L。
65. 一种生产重组巨细胞病毒(CMV) gL蛋白或其复合物形成片段的方法,所述方法包括:
(i)在合适的条件下培养实施方案52-60中的任一个的宿主细胞,由此表达所述gL蛋白或其复合物形成片段;和
(ii)从所述培养物收获所述gL蛋白或其复合物形成片段。
66. 一种诱导针对巨细胞病毒(CMV)的免疫应答的方法,所述方法包括:给有此需要的受试者施用免疫学上有效量的实施方案40-43和48-51中的任一个的免疫原性组合物。
67. 实施方案66的方法,其中所述免疫应答包含产生针对CMV的中和抗体。
68. 实施方案67的方法,其中所述中和抗体是补体非依赖性的。
69. 一种抑制巨细胞病毒(CMV)进入细胞中的方法,所述方法包括使所述细胞与实施方案40-43和48-51中的任一个的免疫原性组合物接触。
70. 用于诱导针对巨细胞病毒(CMV)的免疫应答的实施方案40-43和48-51中的任一个的免疫原性组合物。
71. 实施方案40-43和48-51中的任一个的免疫原性组合物用于诱导针对巨细胞病毒(CMV)的免疫应答的用途。
72.实施方案40-43和48-51中的任一个的免疫原性组合物在药物制备中的用途,所述药物用于诱导针对巨细胞病毒(CMV)的免疫应答。
序列
SEQ ID NO: 1 (gL来自HCMV毒株Merlin = GI:39842115)
MCRRPDCGFSFSPGPVILLWCCLLLPIVSSAAVSVAPTAAEKVPAECPELTRRCLLGEVFEGDKYESWLRPLVNVTGRDGPLSQLIRYRPVTPEAANSVLLDEAFLDTLALLYNNPDQLRALLTLLSSDTAPRWMTVMRGYSECGDGSPAVYTCVDDLCRGYDLTRLSYGRSIFTEHVLGFELVPPSLFNVVVAIRNEATRTNRAVRLPVSTAAAPEGITLFYGLYNAVKEFCLRHQLDPPLLRHLDKYYAGLPPELKQTRVNLPAHSRYGPQAVDAR
SEQ ID NO: 2 (gL来自HCMV毒株Towne = GI:239909463)
MCRRPDCGFSFSPGPVALLWCCLLLPIVSSATVSVAPTVAEKVPAECPELTRRCLLGEVFQGDKYESWLRPLVNVTRRDGPLSQLIRYRPVTPEAANSVLLDDAFLDTLALLYNNPDQLRALLTLLSSDTAPRWMTVMRGYSECGDGSPAVYTCVDDLCRGYDLTRLSYGRSIFTEHVLGFELVPPSLFNVVVAIRNEATRTNRAVRLPVSTAAAPEGITLFYGLYNAVKEFCLRHQLDPPLLRHLDKYYAGLPPELKQTRVNLPAHSRYGPQAVDAR
SEQ ID NO: 3 (gL来自HCMV毒株AD169 = GI:2506510)
MCRRPDCGFSFSPGPVVLLWCCLLLPIVSSVAVSVAPTAAEKVPAECPELTRRCLLGEVFQGDKYESWLRPLVNVTRRDGPLSQLIRYRPVTPEAANSVLLDDAFLDTLALLYNNPDQLRALLTLLSSDTAPRWMTVMRGYSECGDGSPAVYTCVDDLCRGYDLTRLSYGRSIFTEHVLGFELVPPSLFNVVVAIRNEATRTNRAVRLPVSTAAAPEGITLFYGLYNAVKEFCLRHQLDPPLLRHLDKYYAGLPPELKQTRVNLPAHSRYGPQAVDAR
SEQ ID NO: 4 (由SEQ ID NO: 1的氨基酸残基31-278组成的gL成熟蛋白)
AAVSVAPTAAEKVPAECPELTRRCLLGEVFEGDKYESWLRPLVNVTGRDGPLSQLIRYRPVTPEAANSVLLDEAFLDTLALLYNNPDQLRALLTLLSSDTAPRWMTVMRGYSECGDGSPAVYTCVDDLCRGYDLTRLSYGRSIFTEHVLGFELVPPSLFNVVVAIRNEATRTNRAVRLPVSTAAAPEGITLFYGLYNAVKEFCLRHQLDPPLLRHLDKYYAGLPPELKQTRVNLPAHSRYGPQAVDAR
SEQ ID NO: 5 (来自HCMV毒株Merlin的gL的17残基插入物)
GRDGPLSQLIRYRPVTP
SEQ ID NO: 6 (gH来自HCMV毒株Towne = GI:138314)
MRPGLPSYLIVLAVCLLSHLLSSRYGAEAISEPLDKAFHLLLNTYGRPIRFLRENTTQCTYNSSLRNSTVVRENAISFNFFQSYNQYYVFHMPRCLFAGPLAEQFLNQVDLTETLERYQQRLNTYALVSKDLASYRSFSQQLKAQDSLGEQPTTVPPPIDLSIPHVWMPPQTTPHGWTESHTTSGLHRPHFNQTCILFDGHDLLFSTVTPCLHQGFYLIDELRYVKITLTEDFFVVTVSIDDDTPMLLIFGHLPRVLFKAPYQRDNFILRQTEKHELLVLVKKDQLNRHSYLKDPDFLDAALDFNYLDLSALLRNSFHRYAVDVLKSGRCQMLDRRTVEMAFAYALALFAAARQEEAGAQVSVPRALDRQAALLQIQEFMITCLSQTPPRTTLLLYPTAVDLAKRALWTPNQITDITSLVRLVYILSKQNQQHLIPQWALRQIADFALKLHKTHLASFLSAFARQELYLMGSLVHSMLVHTTERREIFIVETGLCSLAELSHFTQLLAHPHHEYLSDLYTPCSSSGRRDHSLERLTRLFPDATVPTTVPAALSILSTMQPSTLETFPDLFCLPLGESFSALTVSEHVSYVVTNQYLIKGISYPVSTTVVGQSLIITQTDSQTKCELTRNMHTTHSITAALNISLENCAFCQSALLEYDDTQGVINIMYMHDSDDVLFALDPYNEVVVSSPRTHYLMLLKNGTVLEVTDVVVDATDSRLLMMSVYALSAIIGIYLLYRMLKTC
SEQ ID NO: 7 (来自HCMV毒株Merlin的gL的6残基插入物)
NSVLLD
SEQ ID NO: 8 (FLAG标签)
DYKDDDDK
SEQ ID NO: 9 (Strep标签)
AWRHPQFGG
SEQ ID NO: 10 (Strep标签II)
WSHPQFEK
SEQ ID NO: 11 (His标签)
HHHHHH
Claims (10)
1.一种重组巨细胞病毒gL蛋白,其中所述gL蛋白在根据SEQ ID NO: 1 编号的残基91-102的蛋白酶识别位点处进行突变,其中所述突变与对照相比减少在所述蛋白酶识别位点处的蛋白酶切割;其中所述突变选自:
a) 三重突变A96L/N97S/S98G;
b) 三重突变A96I/N97D/S98G;
c) 三重突变A96S/N97S/S98T;
d) 三重突变A96I/N97E/S98V;
e) 三重突变A96L/N97A/S98I;
f) 三重突变A96L/N97S/S98G;
g) 三重突变A96I/N97V/S98V;
h) 突变A95N/A96L/N97Y/S98G和残基97与98之间插入FQ;
i) 三重突变A96L/N97S/S98G和残基98与99之间插入I;或
j) 残基N97的缺失。
2.一种巨细胞病毒复合物,其包含权利要求1的重组gL蛋白。
3.权利要求2的复合物,其中所述复合物是进一步包含以下的五聚体复合物:gH或其不具有跨膜结构域的五聚体形成片段、pUL128、pUL130和pUL131。
4.一种分离的核酸,其由编码权利要求1的重组巨细胞病毒gL蛋白的多核苷酸序列表示。
5.一种宿主细胞,其包含权利要求4的核酸。
6.权利要求5的宿主细胞,其为哺乳动物宿主细胞。
7.权利要求5或6的宿主细胞,其中所述宿主细胞包含一种或多种编码巨细胞病毒五聚体复合物的多核苷酸序列,所述五聚体复合物包含:gH或其不具有跨膜结构域的五聚体形成片段、gL、pUL128、pUL130和pUL131。
8.一种免疫原性组合物,其包含权利要求2的复合物。
9.权利要求8的免疫原性组合物,其还包含佐剂。
10.权利要求8或9的免疫原性组合物,其用于诱导针对巨细胞病毒的免疫应答。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15152221.6A EP3048114A1 (en) | 2015-01-22 | 2015-01-22 | Cytomegalovirus antigens and uses thereof |
| EP15152221.6 | 2015-01-22 | ||
| PCT/IB2016/050335 WO2016116904A1 (en) | 2015-01-22 | 2016-01-22 | Cytomegalovirus antigens and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107531761A CN107531761A (zh) | 2018-01-02 |
| CN107531761B true CN107531761B (zh) | 2022-01-14 |
Family
ID=52434568
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201680017610.XA Active CN107531761B (zh) | 2015-01-22 | 2016-01-22 | 巨细胞病毒抗原及其用途 |
Country Status (24)
| Country | Link |
|---|---|
| US (2) | US10167321B2 (zh) |
| EP (3) | EP3048114A1 (zh) |
| JP (1) | JP6717836B2 (zh) |
| KR (1) | KR20170100039A (zh) |
| CN (1) | CN107531761B (zh) |
| AU (2) | AU2016210548B2 (zh) |
| BE (1) | BE1023087B1 (zh) |
| BR (1) | BR112017015567A2 (zh) |
| CA (1) | CA2974041C (zh) |
| DK (1) | DK3247722T3 (zh) |
| EA (1) | EA038250B1 (zh) |
| ES (1) | ES2937959T3 (zh) |
| FI (1) | FI3247722T3 (zh) |
| HR (1) | HRP20230177T1 (zh) |
| HU (1) | HUE061175T2 (zh) |
| IL (1) | IL253366B (zh) |
| LT (1) | LT3247722T (zh) |
| MX (1) | MX2017009538A (zh) |
| PL (1) | PL3247722T3 (zh) |
| PT (1) | PT3247722T (zh) |
| SG (1) | SG11201705740UA (zh) |
| SI (1) | SI3247722T1 (zh) |
| WO (1) | WO2016116904A1 (zh) |
| ZA (1) | ZA201704912B (zh) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK3333265T3 (da) * | 2010-05-14 | 2020-04-27 | Univ Oregon Health & Science | Rekombinante hcmv- og rhcmv-vektorer der koder for et heterologt antigen isoleret fra hepatitis b-virus og anvendelser deraf |
| WO2012170765A2 (en) | 2011-06-10 | 2012-12-13 | Oregon Health & Science University | Cmv glycoproteins and recombinant vectors |
| US10023626B2 (en) | 2013-09-30 | 2018-07-17 | Modernatx, Inc. | Polynucleotides encoding immune modulating polypeptides |
| KR101996427B1 (ko) | 2014-07-16 | 2019-07-04 | 오레곤 헬스 앤드 사이언스 유니버시티 | 외인성 항원을 포함하는 인간 시토메갈로바이러스 |
| KR20170136512A (ko) | 2015-02-10 | 2017-12-11 | 오레곤 헬스 앤드 사이언스 유니버시티 | 넌-캐노니컬 cd8+ t 세포 반응 생성에 유용한 방법 및 조성물 |
| US11364292B2 (en) | 2015-07-21 | 2022-06-21 | Modernatx, Inc. | CHIKV RNA vaccines |
| EP4218805A1 (en) | 2015-07-21 | 2023-08-02 | ModernaTX, Inc. | Infectious disease vaccines |
| MA46316A (fr) | 2015-10-22 | 2021-03-24 | Modernatx Inc | Vaccin contre le cytomégalovirus humain |
| WO2017070624A1 (en) | 2015-10-22 | 2017-04-27 | Modernatx, Inc. | Tropical disease vaccines |
| JP7133468B2 (ja) | 2015-11-20 | 2022-09-08 | オレゴン・ヘルス・アンド・サイエンス・ユニバーシティ | マイクロrna認識エレメントを含むcmvベクター |
| EP3423091A4 (en) | 2016-03-03 | 2019-10-30 | Duke University | COMPOSITIONS AND METHODS OF INDUCING HIV-1 ANTIBODIES |
| US11318197B2 (en) | 2016-03-03 | 2022-05-03 | Duke University | Compositions and methods for inducing HIV-1 antibodies |
| WO2018067580A1 (en) | 2016-10-03 | 2018-04-12 | Duke University | Methods to identify immunogens by targeting improbable mutations |
| EP3529363A4 (en) | 2016-10-18 | 2020-05-06 | Oregon Health & Science University | CYTOMEGALOVIRUS VECTORS, CALLING OUT T-CELLS, RESTRICTED BY A LARGE HISTOCOMPATIBILITY COMPLEX E-MOLECULE |
| CA3041307A1 (en) | 2016-10-21 | 2018-04-26 | Giuseppe Ciaramella | Human cytomegalovirus vaccine |
| EP3582790A4 (en) | 2017-02-16 | 2020-11-25 | ModernaTX, Inc. | VERY POWERFUL IMMUNOGENIC COMPOSITIONS |
| US20230248820A1 (en) | 2017-04-19 | 2023-08-10 | Glaxosmithkline Biologicals, S.A. | Modified cytomegalovirus proteins and stabilized complexes |
| WO2019055807A1 (en) | 2017-09-14 | 2019-03-21 | Modernatx, Inc. | RNA VACCINES AGAINST ZIKA VIRUS |
| WO2019070730A1 (en) | 2017-10-02 | 2019-04-11 | Duke University | MOSAIC ENVELOPES OF HIV-1 TO INDUCE ADCC RESPONSES |
| WO2019169120A1 (en) | 2018-02-28 | 2019-09-06 | University Of Washington | Self-asssembling nanostructure vaccines |
| WO2020079586A1 (en) | 2018-10-17 | 2020-04-23 | Glaxosmithkline Biologicals Sa | Modified cytomegalovirus proteins and stabilized complexes |
| CN109627330A (zh) * | 2018-12-18 | 2019-04-16 | 马鞍山史记动物健康管理有限公司 | 一种猪伪狂犬病毒高效价阳性血清制备方法 |
| WO2021014385A1 (en) | 2019-07-24 | 2021-01-28 | Glaxosmithkline Biologicals Sa | Modified human cytomegalovirus proteins |
| US11406703B2 (en) | 2020-08-25 | 2022-08-09 | Modernatx, Inc. | Human cytomegalovirus vaccine |
| WO2023144665A1 (en) | 2022-01-28 | 2023-08-03 | Glaxosmithkline Biologicals Sa | Modified human cytomegalovirus proteins |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102203133A (zh) * | 2008-07-16 | 2011-09-28 | 生物医学研究学会 | 人巨细胞病毒中和抗体及其应用 |
| WO2014005959A1 (en) * | 2012-07-06 | 2014-01-09 | Novartis Ag | Complexes of cytomegalovirus proteins |
| CN103889462A (zh) * | 2011-09-09 | 2014-06-25 | 默沙东公司 | 作为cmv疫苗的条件性复制型巨细胞病毒 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5219740A (en) | 1987-02-13 | 1993-06-15 | Fred Hutchinson Cancer Research Center | Retroviral gene transfer into diploid fibroblasts for gene therapy |
| CA2045175C (en) | 1989-11-06 | 2003-03-18 | Arthur I. Skoultchi | Production of proteins using homologous recombination |
| WO2007146024A2 (en) | 2006-06-07 | 2007-12-21 | The Trustees Of Princeton University | Cytomegalovirus surface protein complex for use in vaccines and as a drug target |
| SG178954A1 (en) | 2009-09-02 | 2012-04-27 | Novartis Ag | Immunogenic compositions including tlr activity modulators |
| CA2804591C (en) | 2010-07-06 | 2019-01-22 | Novartis Ag | Cationic oil-in-water emulsions |
| ES2716243T3 (es) | 2010-10-11 | 2019-06-11 | Glaxosmithkline Biologicals Sa | Plataformas de suministro de antígenos |
| RU2649133C2 (ru) | 2011-07-06 | 2018-03-29 | Новартис Аг | Катионные эмульсии масло-в-воде |
| ES2608637T3 (es) * | 2012-10-30 | 2017-04-12 | Pfizer Inc. | Vacunas basadas en partículas recombinantes contra la infección por el citomegalovirus humano |
| CN106029692A (zh) | 2013-12-20 | 2016-10-12 | 诺华股份有限公司 | 用于重组表达感兴趣产物的新型真核细胞和方法 |
| BR112016013420A2 (pt) | 2013-12-20 | 2017-09-26 | Novartis Ag | células eucarióticas e métodos para expressar recombinantemente um produto de interesse |
| EP3015475A1 (en) | 2014-10-31 | 2016-05-04 | Novartis AG | Mammalian cells expressing cytomegalovirus antigens |
| EP3047856A1 (en) | 2015-01-23 | 2016-07-27 | Novartis AG | Cmv antigens and uses thereof |
-
2015
- 2015-01-22 EP EP15152221.6A patent/EP3048114A1/en not_active Withdrawn
-
2016
- 2016-01-22 HU HUE16702210A patent/HUE061175T2/hu unknown
- 2016-01-22 FI FIEP16702210.2T patent/FI3247722T3/fi active
- 2016-01-22 BE BE2016/5050A patent/BE1023087B1/fr not_active IP Right Cessation
- 2016-01-22 US US15/544,730 patent/US10167321B2/en active Active
- 2016-01-22 CN CN201680017610.XA patent/CN107531761B/zh active Active
- 2016-01-22 SG SG11201705740UA patent/SG11201705740UA/en unknown
- 2016-01-22 CA CA2974041A patent/CA2974041C/en active Active
- 2016-01-22 PT PT167022102T patent/PT3247722T/pt unknown
- 2016-01-22 PL PL16702210.2T patent/PL3247722T3/pl unknown
- 2016-01-22 HR HRP20230177TT patent/HRP20230177T1/hr unknown
- 2016-01-22 KR KR1020177023123A patent/KR20170100039A/ko not_active Application Discontinuation
- 2016-01-22 MX MX2017009538A patent/MX2017009538A/es unknown
- 2016-01-22 DK DK16702210.2T patent/DK3247722T3/da active
- 2016-01-22 EP EP16702210.2A patent/EP3247722B1/en active Active
- 2016-01-22 EA EA201791562A patent/EA038250B1/ru unknown
- 2016-01-22 WO PCT/IB2016/050335 patent/WO2016116904A1/en active Application Filing
- 2016-01-22 ES ES16702210T patent/ES2937959T3/es active Active
- 2016-01-22 AU AU2016210548A patent/AU2016210548B2/en active Active
- 2016-01-22 JP JP2017538387A patent/JP6717836B2/ja active Active
- 2016-01-22 LT LTEPPCT/IB2016/050335T patent/LT3247722T/lt unknown
- 2016-01-22 EP EP22203406.8A patent/EP4180056A1/en active Pending
- 2016-01-22 SI SI201631665T patent/SI3247722T1/sl unknown
- 2016-01-22 BR BR112017015567A patent/BR112017015567A2/pt active Search and Examination
-
2017
- 2017-07-09 IL IL253366A patent/IL253366B/en unknown
- 2017-07-19 ZA ZA2017/04912A patent/ZA201704912B/en unknown
-
2018
- 2018-09-10 AU AU2018226521A patent/AU2018226521B2/en active Active
- 2018-11-15 US US16/192,347 patent/US20190276498A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102203133A (zh) * | 2008-07-16 | 2011-09-28 | 生物医学研究学会 | 人巨细胞病毒中和抗体及其应用 |
| CN103889462A (zh) * | 2011-09-09 | 2014-06-25 | 默沙东公司 | 作为cmv疫苗的条件性复制型巨细胞病毒 |
| WO2014005959A1 (en) * | 2012-07-06 | 2014-01-09 | Novartis Ag | Complexes of cytomegalovirus proteins |
Non-Patent Citations (2)
| Title |
|---|
| Characterization of the Human Cytomegalovirus gH/gL/UL128-131 Complex That Mediates Entry into Epithelial and Endothelial Cells;Brent J. Ryckman等;《Journal of Virology》;20071017;第82卷(第1期);第60-70页 * |
| Human cytomegalovirus gH/gL/UL128/UL130/UL131A complex elicits potently neutralizing antibodies in mice;Yingxia Wen等;《Vaccine》;20140514;第32卷(第30期);第3796-3804页 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107531761B (zh) | 巨细胞病毒抗原及其用途 | |
| ES2765484T3 (es) | Antígenos de citomegalovirus | |
| WO2015181142A1 (en) | Cytomegalovirus complexes and uses thereof | |
| EP3047856A1 (en) | Cmv antigens and uses thereof | |
| US20170119874A1 (en) | Human cytomegalovirus vaccine compositions and method of producing the same | |
| US20230174588A1 (en) | A vaccine against sars-cov-2 and preparation thereof | |
| JP2023506170A (ja) | 流行性耳下腺炎ウイルスおよび麻疹ウイルスの免疫原およびそれらの使用 | |
| WO2023179514A1 (zh) | 冠状病毒疫苗组合物、方法及其使用 | |
| US10654899B2 (en) | Truncated glycoprotein G of herpes simplex virus 2 | |
| KR20240052044A (ko) | 코로나바이러스과 바이러스에 의한 감염을 치료 또는 예방하기 위한 바이러스-유사 입자 | |
| CA3100236A1 (en) | Severe acute respiratory syndrome coronavirus dna vaccines | |
| TW202320845A (zh) | 用於預防及治療2019冠狀病毒病(COVID—19)之SARS—CoV—2多重表位肽/蛋白質疫苗 | |
| WO2023201263A1 (en) | Compositions and methods for the prevention and treatment of rabies virus infection |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |