KR20170040209A - 경피 크림 - Google Patents
경피 크림 Download PDFInfo
- Publication number
- KR20170040209A KR20170040209A KR1020177002451A KR20177002451A KR20170040209A KR 20170040209 A KR20170040209 A KR 20170040209A KR 1020177002451 A KR1020177002451 A KR 1020177002451A KR 20177002451 A KR20177002451 A KR 20177002451A KR 20170040209 A KR20170040209 A KR 20170040209A
- Authority
- KR
- South Korea
- Prior art keywords
- amount
- progesterone
- pharmaceutical composition
- estradiol
- heavy chain
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/24—Drugs for disorders of the endocrine system of the sex hormones
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Dermatology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 하나 이상의 용해제 및 침투 촉진제와 함께 프로게스테론을 함유하는 경피 약학적 조성물에 관한 것이고, 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다. 일부 구체예에서, 경피 약학적 조성물은 프로게스테론, 중쇄 오일, 및 d-리모넨을 함유한다. 일부 구체예에서, 경피 약학적 조성물은 프로게스테론, 중쇄 오일, 침투 촉진제 (예컨대, 프로필렌 글리콜, 프로필렌 글리콜의 지방산 에스테르, 글리콜 에테르), 및 임의로 d-리모넨을 함유한다. 특정 구체예에서, 약학적 조성물은 에스트라디올을 추가로 포함한다. 대상체에서 호르몬 결핍증과 관련된 병태를 치료하는 방법이 또한 기재된다.
Description
관련 출원의 전후-참조
본 출원은 2014년 7월 29일 출원된 미국 가특허 출원 62/030,540호, 및 2015년 4월 24일 출원된 미국 가특허 출원 62/152,674호에 대한 우선권을 주장하며, 이들 출원은 그 전문이 본원에 참조로서 포함된다.
호르몬 대체 요법(HRT)은 적절한 호르몬 생산이 부족한 여성에서 호르몬 수준을 증가시키도록 설계된 약물 그룹 중 하나 이상의 사용을 포함하는 의학적 치료이다. HRT는 폐경-전, 폐경-전후, 폐경, 또는 폐경-후 대상체에서 순환하는 에스트로겐 및 프로게스테론 호르몬의 감소로 인한 증상을 완화 및 예방할 수 있다.
P4 (프레근-4-엔-3,20-디온)로도 공지된 프로게스테론 (CAS# 57-83-0)은 여성 생리 주기, 임신, 및 인간 및 다른 종의 배아발생에 관여하는 C21 스테로이드 호르몬이다. 프로게스테론은 프로게스토겐이라는 호르몬의 부류에 속하고, 주요한 자연 발생, 내인성 인간 프로게스토겐이다. 프로게스테론 및 이의 유사체의 이용은 다수의 의학적 용도를 지니며, 둘 모두 급성 병태 뿐만 아니라 천연 프로게스테론 수준의 장기적인 감소를 다룬다. 폐경-전, 폐경-전후, 폐경, 및 폐경-후 여성에서 불규칙하거나, 일관되지 않거나, 감소된 호르몬 생산으로 인해 바람직하지 않은 부작용이 나타난다. 프로게스테론은 에스트로겐 정제를 복용 중인 자궁 절제술을 받지 않은 폐경후 여성에서 자궁내막 과형성의 예방에 사용하도록 처방된다. 프로게스테론은 또한 속발성 무월경에 사용하도록 처방된다.
17β-에스트라디올, 오에스트라디올, 또는 E2로도 공지된 에스트라디올 (CAS# 50-28-2)은 인체에서 내생적으로 발견되고 주된 여성 호르몬이다. 에스트라디올은 다른 과정 중에서도 암컷의 발정 및 월경 생식 주기의 조절, 생식 조직의 발생, 및 골 조직의 유지에 기여한다. 여성 대상체의 에스트라디올 결핍증은 조산, 수면 장애, 기분 변화, 외음부-질 위축, 및 골다공증과 같은 병태와 관련된다.
기존의 국소 경피 조성물은 높은 투여량의 호르몬이 투여되도록 제형화되고, 프로게스테론의 제한된 흡수 및 생체이용률의 문제를 겪는다. 따라서, 프로게스테론 및 에스트라디올을 포함하는 다른 호르몬의 보다 효과적인 전달을 위한 신규한 경피 약학적 조성물이 요구된다. 본원에 기재된 발명은 이러한 및 다른 요구를 충족시킨다.
발명의 간단 개요
한 양태에서, 프로게스테론, 중쇄(medium-chain) 오일, 및 d-리모넨을 함유하는 경피 약학적 조성물이 제공되고, 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다. 특정 구체예에서, 약학적 조성물은 에스트라디올을 추가로 포함한다.
또 다른 양태에서, 프로게스테론, 중쇄 오일을 함유하는 용해제, 및 침투 촉진제를 포함하는 경피 약학적 조성물이 제공되고, 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다. 특정 구체예에서, 약학적 조성물은 에스트라디올을 추가로 포함한다. 일부 구체예에서, 약학적 조성물은 d-리모넨을 추가로 포함한다. 관련 양태에서, 프로게스테론, 중쇄 오일, 및 프로필렌 글리콜; 프로필렌 글리콜의 지방산 에스테르; 및 글리콜 에테르로 구성된 군으로부터 선택되는 하나 이상의 구성원을 함유하는 경피 약학적 조성물이 제공되고; 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다. 몇몇 그러한 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜 모노라우레이트, 디에틸렌 글리콜 모노에틸 에테르, 및 프로필렌 글리콜을 함유한다. 일부 그러한 구체예에서, 조성물은 d-리모넨을 추가로 포함한다.
또 다른 양태에서, 대상체에서 프로게스테론 결핍증 또는 에스트라디올 결핍증과 같은 호르몬 결핍증과 관련된 병태를 치료하는 방법이 제공된다. 그러한 방법은 본원에 개시된 경피 약학적 제형을 대상체에 투여하는 것을 포함한다.
도 1은 본원에 기재된 경피 약학적 제형을 제조하기 위한 공정을 도시한다.
도 2는 본원에 기재된 경피 약학적 제형을 시험하기 위한 공정을 도시한다.
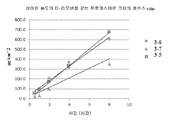
도 3은 상이한 농도의 d-리모넨을 갖는 프로게스테론 조성물에 대한 Franz 확산 세포 플럭스 데이터를 도시한다.
도 4는 d-리모넨을 갖는 프로게스테론 조성물 및 갖지 않는 프로게스테론 조성물에 대한 Franz 확산 세포 플럭스 데이터를 도시한다.
도 5A는 인간 대상체에서 예시적인 프로게스테론/에스트라디올 크림의 투여 후 프로게스테론 수준에서의 변화를 도시한다. 손가락끝 모세관 혈액, 타액 및 혈청 샘플로부터 결정된 기준선 프로게스테론 이상의 변화가 도시된다.
도 5B는 로그 스케일로 플롯팅된 데이터를 도시한다.
도 6A는 인간 대상체에서 예시적인 프로게스테론/에스트라디올 크림의 투여 후 에스트라디올 수준에서의 변화를 도시한다. 손가락끝 모세관 혈액, 타액 및 혈청 샘플로부터 결정된 기준선 에스트라디올 이상의 변화가 도시된다.
도 6B는 로그 스케일로 플롯팅된 데이터를 도시한다.
도 7A는 비-편광을 이용하여 복굴절 현미경으로 본 혼합된 크림을 도시한다 (10 x 40).
도 7B는 편광을 이용하여 복굴절 현미경으로 본 혼합된 크림을 도시한다 (10 x 40).
도 7C는 비-편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 I을 도시한다 (10 x 40).
도 7D는 편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 I을 도시한다 (10 x 40).
도 7E는 비-편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 II를 도시한다 (10 x 40).
도 7F는 편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 II를 도시한다 (10 x 40).
도 8은 난소절제 후 에스트라디올 또는 에스트라디올/프로게스테론으로 처리된 랫트에 대해 수집된 자궁 중량 데이터를 도시한다.
도 9는 난소절제 후 에스트라디올 또는 에스트라디올/프로게스테론으로 처리된 랫트로부터 수집된 자궁 조직 견본을 도시한다; 견본은 헤마톡실린 및 에오신으로 염색됨.
도 10은 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트로부터 수집된 질의 조직 견본을 도시한다; 견본은 헤마톡실린 및 에오신으로 염색됨.
도 11A는 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해, 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트의 혈장에서 관찰된 프로게스테론 수준을 도시한다.
도 11B는 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해, 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트의 침샘에서 관찰된 프로게스테론 수준을 도시한다.
도 11C는 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해, 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트의 자궁에서 관찰된 프로게스테론 수준을 도시한다. 기하 평균은 도 11C의 데이터에 대해 플롯팅된다.
도 2는 본원에 기재된 경피 약학적 제형을 시험하기 위한 공정을 도시한다.
도 3은 상이한 농도의 d-리모넨을 갖는 프로게스테론 조성물에 대한 Franz 확산 세포 플럭스 데이터를 도시한다.
도 4는 d-리모넨을 갖는 프로게스테론 조성물 및 갖지 않는 프로게스테론 조성물에 대한 Franz 확산 세포 플럭스 데이터를 도시한다.
도 5A는 인간 대상체에서 예시적인 프로게스테론/에스트라디올 크림의 투여 후 프로게스테론 수준에서의 변화를 도시한다. 손가락끝 모세관 혈액, 타액 및 혈청 샘플로부터 결정된 기준선 프로게스테론 이상의 변화가 도시된다.
도 5B는 로그 스케일로 플롯팅된 데이터를 도시한다.
도 6A는 인간 대상체에서 예시적인 프로게스테론/에스트라디올 크림의 투여 후 에스트라디올 수준에서의 변화를 도시한다. 손가락끝 모세관 혈액, 타액 및 혈청 샘플로부터 결정된 기준선 에스트라디올 이상의 변화가 도시된다.
도 6B는 로그 스케일로 플롯팅된 데이터를 도시한다.
도 7A는 비-편광을 이용하여 복굴절 현미경으로 본 혼합된 크림을 도시한다 (10 x 40).
도 7B는 편광을 이용하여 복굴절 현미경으로 본 혼합된 크림을 도시한다 (10 x 40).
도 7C는 비-편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 I을 도시한다 (10 x 40).
도 7D는 편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 I을 도시한다 (10 x 40).
도 7E는 비-편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 II를 도시한다 (10 x 40).
도 7F는 편광을 이용하여 복굴절 현미경으로 본 본원에 기재된 조성물 II를 도시한다 (10 x 40).
도 8은 난소절제 후 에스트라디올 또는 에스트라디올/프로게스테론으로 처리된 랫트에 대해 수집된 자궁 중량 데이터를 도시한다.
도 9는 난소절제 후 에스트라디올 또는 에스트라디올/프로게스테론으로 처리된 랫트로부터 수집된 자궁 조직 견본을 도시한다; 견본은 헤마톡실린 및 에오신으로 염색됨.
도 10은 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트로부터 수집된 질의 조직 견본을 도시한다; 견본은 헤마톡실린 및 에오신으로 염색됨.
도 11A는 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해, 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트의 혈장에서 관찰된 프로게스테론 수준을 도시한다.
도 11B는 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해, 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트의 침샘에서 관찰된 프로게스테론 수준을 도시한다.
도 11C는 에스트라디올/피하 프로게스테론으로 처리된 랫트 및 대조군에 비해, 에스트라디올/국소 프로게스테론으로 처리된 난소절제된 랫트의 자궁에서 관찰된 프로게스테론 수준을 도시한다. 기하 평균은 도 11C의 데이터에 대해 플롯팅된다.
발명의 상세한 설명
I.
도입
피부에 크림의 도포 후 경피적으로 흡수되는 용해되거나 부분적으로 용해된 프로게스테론을 포함하는 경피 약학적 크림 조성물이 본원에 제공된다. 조성물은, 예컨대 피부 또는 질 조직 및 주위 영역을 통해, 국소적으로 흡수될 수 있고 그 치료적 효과를 나타낼 수 있다. 일반적으로, 본원에 기재된 약학적 조성물은 프로게스테론-결핍 여성 대상체에서 유용하다. 조성물은 또한 에스트로겐 결핍증의 치료와 함께 이용될 수 있다. 본원에 기재된 크림은 시험관내 침투 모델 (Franz 확산 세포)에서 탁월한 프로게스테론 용해성 및 높은 프로게스테론 플럭스를 나타낸다. 크림은 높은 용량과 관련된 부작용을 최소화할 수 있고, 피부 및 다른 조직에 국소적으로 도포된 프로게스테론의 증가된 생체이용률을 제공할 수 있다. 놀랍게도, 본원에 기재된 조성물은 다른 투여 방식 (예컨대, 피하 투여를 통해)에 비해 낮은 수준의 프로게스테론 대사를 지닌 프로게스테론을 투여하는데 이용될 수 있다.
II.
정의
본원에서 사용되는 용어 "약학적 조성물"은 활성 약학적 성분 및 적어도 하나의 약학적으로 허용되는 부형제의 혼합물을 의미한다. 본원에 기재된 약학적 조성물은, 임의로 에스트라디올과 함께, 프로게스테론을 활성 약학적 성분으로 함유한다.
본원에서 사용되는 용어 "프로게스테론"은 프레근-4-엔-3,20-디온을 의미한다. 프로게스테론은 상호교환적으로 P4로도 불리며 인체에서 내생적으로 발견된다. 본원에서 사용되는 프로게스테론은 하기 구조를 갖는 인체에서 발견되는 프로게스테론의 생체-동일 또는 체내-동일 형태를 의미한다:
본원에서 사용되는 용어 "에스트라디올"은 (17β)-에스트라-1,3,5(10)-트리엔-3,17-디올을 의미한다. 에스트라디올은 상호교환적으로 17β-에스트라디올, 오에스트라디올, 또는 E2로도 불리며 인체에서 내생적으로 발견된다. 본원에서 사용되는 에스트라디올은 하기 구조를 갖는 인체에서 발견되는 에스트라디올의 생체-동일 또는 체내-동일 형태를 의미한다:
본 발명의 목적을 위해, 에스트라디올의 무수 형태 또는 헤미하이드레이트 형태는 널리 공지되고 이해된 기술에 따라 물 또는 물 부족을 고려하여 서로 대체될 수 있다.
본원에서 사용되는 용어 "용해제"는 프로게스테론 또는 에스트라디올을 용해시키거나 부분적으로 용해시키는 작용제 또는 작용제의 조합물을 의미한다. 예를 들어 및 비제한적으로, 적합한 용해제는 중쇄 오일을 포함한다. 하나 이상의 활성 약학적 성분, 예컨대 프로게스테론 또는 에스트라디올을 바람직한 정도로 가용화 또는 용해시키는 다른 용매 및 공-용매가 또한 용해제의 일부로서 포함될 수 있다. 본원에 기재된 제형에 사용하기 적합한 용해제는 약학적 등급 용해제 (예컨대, 약학적 등급 중쇄 오일)를 함유할 수 있다. 용해제(들) 또는 생성된 제형의 특성 또는 성능을 향상시키기 위해 다른 부형제 또는 성분이 용해제(들)에 첨가되거나 이와 혼합될 수 있음이 당업자에게 이해될 것이다. 그러한 부형제의 예는 비제한적으로 계면활성제, 에멀젼화제, 증점제, 착색제 등을 포함한다.
본원에서 사용되는 용어 "중쇄"는 지방산 함유 분자의 지방족 사슬 길이를 의미한다. "중쇄"는 구체적으로 6 (C6) 내지 14 (C14) 탄소 원자를 갖는 지방산 지방족 테일 또는 탄소 사슬을 함유하는 지방산, 지방산 에스테르, 또는 지방산 유도체를 의미한다.
용어 "중쇄 지방산" 및 "중쇄 지방산 유도체"는 본원에 기재된 범위를 포함하는, 6 내지 14개 탄소를 갖는 지방족 테일 (즉, 탄소 사슬)을 지닌 지방산 또는 지방산 유도체를 의미한다. 지방산은 적어도 하나의 말단 탄소 원자가 카르복실산 작용기에 존재하는, 분지되지 않은 지방족 탄소 사슬로 구성된다. 지방산 유도체는, 예를 들어, 비제한적으로 지방산으로부터 유래된 성분을 포함하는 모노-, 디-, 및 트리-글리세라이드를 포함하는 지방산 에스테르 및 지방산 함유 분자, 뿐만 아니라 에틸렌 글리콜 및 프로필렌 글리콜의 지방산 에스테르를 포함한다. 하나를 초과하는 지방산 에스테르가 백본, 예컨대 글리세롤 백본, 프로필렌 글리콜 백본, 폴리에틸렌 글리콜 백본 등에 존재할 때, 지방산 에스테르는 동일하거나 상이할 수 있음이 당업자에게 이해될 것이다. 예를 들어, 트리글리세라이드에서, 3개 모두의 지방산 에스테르는 동일할 수 있거나, 지방산 에스테르 중 2개는 동일하고 하나는 상이할 수 있거나, 3개 모두의 지방산 에스테르는 상이할 수 있다. 디글리세라이드에서, 2개의 지방산 에스테르는 동일하거나 상이할 수 있다. 지방산 에스테르가 동일하거나 상이한 것과 무관하게, 실질적으로 또는 대부분 모든 지방산 에스테르는 중쇄일 것이다. 당업자는 지방족 테일이 포화되거나 불포화될 수 있음을 이해할 것이다 (탄소 원자 사이에 하나 이상의 이중 결합 지님). 일부 구체예에서, 지방족 테일은 포화되며 (즉, 탄소 원자 사이에 이중 결합 지니지 않음); 예는 비제한적으로 카프로산, 카프릴산, 카프르산, 라우르산, 미리스트산, 및 이들의 유도체를 포함한다. 중쇄 지방산 또는 중쇄 지방산 유도체는 C6-C14, C6-C12, C8-C14, C8-C12, C6-C10, C8-C10, 또는 기타인 것들을 포함하는, 6-14개 탄소 원자를 갖는 지방족 탄소 사슬을 갖는 것들을 포함한다.
본원에서 사용되는 용어 "오일"은 본원에 기재된 마이크론화된 프로게스테론 또는 에스트라디올을 포함하는, 임의의 적합한 양의 프로게스테론 또는 에스트라디올, 출발 물질, 또는 전구체를 현탁시키거나 용해시킬 수 있는 땅콩유를 제외한 임의의 약학적으로 허용되는 오일을 의미한다.
본원에서 사용되는 용어 "중쇄 오일"은 오일의 지방산 분획의 조성이 실질적으로 중쇄 (즉, C6 내지 C14) 지방산이고, 즉, 오일의 지방산의 조성 프로파일이 실질적으로 중쇄인 오일을 의미한다. 오일의 지방 분획의 지방산은 유리 지방산 또는 지방산 에스테르로서 존재할 수 있다. 본원에서 사용되는 "실질적으로"는 오일의 지방산 분획의 20% 내지 100% (상한 및 하한 포함)가 중쇄 지방산, 즉, 6 내지 14개 탄소 원자를 갖는 지방족 탄소 사슬을 갖는 지방산으로 구성됨을 의미한다. 일부 구체예에서, 오일의 지방산 분획의 약 25%, 약 30%, 약 35%, 약 40%, 약 45%, 약 50%, 약 55%, 약 60%, 약 65%, 약 70%, 약 75%, 약 80%, 약 85%, 약 90%, 또는 약 95%는 중쇄 지방산으로 구성된다. 본원에서 사용되는 "대부분"은 오일의 지방산 분획의 50% 또는 50% 초과가 중쇄 지방산, 즉, 6 내지 14개 탄소 원자를 갖는 지방족 탄소 사슬을 갖는 지방산으로 구성됨을 의미한다. 당업자는 "알킬 함량" 또는 "알킬 분포"가 주어진 오일의 특성을 나타내는 용어 "지방산 분획"을 대신하여 사용될 수 있고, 이들 용어가 본원에서 상호교환적으로 이용됨을 용이하게 이해할 것이다. 이와 같이, 본원에 기재된 제형에 사용하기 적합한 중쇄 오일은 오일의 지방산 분획이 실질적으로 (또는 대부분) 중쇄 지방산인 중쇄 오일, 또는 오일의 알킬 함량 또는 알킬 분포가 실질적으로 (또는 대부분) 중쇄 알킬 (C6-C14 알킬)인 중쇄 오일을 포함한다. 본원에 기재된 제형에 사용하기 적합한 중쇄 오일은 약학적 등급임이 당업자에게 이해될 것이다. 중쇄 오일의 예는, 예를 들어 및 비제한적으로, 중쇄 지방산, 글리세롤(예컨대, 예를 들어, 모노-, 디- 및 트리글리세라이드)의 중쇄 지방산 에스테르, 프로필렌 글리콜의 중쇄 지방산 에스테르, 폴리에틸렌 글리콜의 중쇄 지방산 유도체, 및 이의 조합물을 포함한다. 본원에 기재된 제형에 사용된 중쇄 오일은 하나를 초과하는 중쇄 오일의 혼합물일 수 있음이 당업자에게 이해될 것이다. 중쇄 오일의 혼합물의 지방산 분획의 20% 내지 100% (상한 및 하한 포함)가 중쇄 지방산, 즉, 6 내지 14개 탄소 원자를 갖는 지방족 탄소 사슬을 갖는 지방산으로 구성된 경우 중쇄 오일의 임의의 혼합물이 이용될 수 있다. 예로서 및 비제한적으로, 중쇄 오일은 MIGLYOL 812 (카프릴/카프르 트리글리세라이드) 및 MIGLYOL 840 (프로필렌 글리콜 디카프릴레이트/디카프레이트)의 혼합물, CAPMUL MCM (카프릴/카프르 트리글리세라이드) 및 MIGLYOL 812 (카프릴/카프르 트리글리세라이드)의 혼합물, MIGLYOL 812, MIGLYOL 840 및 Capmul MCM의 혼합물 등일 수 있다.
본원에서 사용되는 용어 "중쇄 트리글리세라이드"는 각각의 글리세롤 하이드록실기가 본원에 기재된 중쇄 지방산으로 에스테르화된 글리세롤 (즉, 프로판-1,2,3-트리올) 백본을 갖는 화합물을 의미한다. 중쇄 트리글리세라이드의 예는 비제한적으로 카프로 트리글리세라이드, 카프릴 트리글리세라이드, 카프르 트리글리세라이드, 및 라우르 트리글리세라이드를 포함한다. 중쇄 트리글리세라이드는 글리세롤 백본에 2 또는 3개의 상이한 중쇄 지방산 에스테르를 갖는 혼합된 트리글리세라이드일 수 있다.
본원에서 사용되는 용어 "d-리모넨"은 (+)-4-이소프로페닐-1-메틸사이클로헥세 및 (+)-p-멘타-1,8-디엔을 포함하는 동의어로도 알려진 (4R)-1-메틸-4-(1-메틸에테닐)-사이클로헥센을 의미한다.
본원에서 사용되는 용어 "디에틸렌 글리콜 모노에틸 에테르"는 TRANSCUTOL®, CARBITOL™, 및 3,6-디옥사-1-옥탄올을 포함하는 동의어로도 알려진 2-(2-에톡시에톡시)에탄올, 및 이의 약학적으로 허용되는 염을 의미한다.
본원에서 사용되는 용어 "프로필렌 글리콜 모노라우레이트"는 1,2-프로판디올 모노라우레이트, 프로필렌 글리콜 모노도데카노에이트, EMALEX PGML, RIKEMAL PL 100, 및 LAURO글리콜™ 90을 포함하는 동의어로도 알려진 1,2-프로판 디올을 갖는 도데칸산의 모노에스테르를 의미한다.
본원에서 사용되는 용어 "스테아레이트"는 스테아르산, 즉, 옥타데칸산, 및 이의 에스테르를 의미한다. 스테아레이트는 비제한적으로 글리세롤 모노스테아레이트, 소듐 1-메틸 9-(설포옥시)스테아레이트, 펜타에리트리톨 모노스테아레이트, PEG-10 스테아레이트, PEG-14 스테아레이트, PEG-40 스테아레이트, PEG-2 스테아레이트, PEG-3 스테아레이트, PEG-4 스테아레이트, PEG-150 스테아레이트, PEG-6 스테아레이트, PEG-8 스테아레이트, PEG-8 스테아레이트, PEG-75 스테아레이트, PEG-75 디스테아레이트, PEG-3 디스테아레이트, PEG-6 디스테아레이트, PEG-8 디스테아레이트, PEG-2 디스테아레이트, PEG-4 디스테아레이트, PEG-12 디스테아레이트, PEG-20 디스테아레이트, PEG-32 디스테아레이트 등, 뿐만 아니라 이의 약학적으로 허용되는 염을 포함한다. "스테아레이트 혼합물"은 본원에 언급된 임의의 스테아레이트 중 2개 이상을 함유한다. 시판되는 스테아레이트 혼합물의 예는 GELOT™ 64를 포함한다.
본원에서 사용되는 용어 "세틸 알콜"은 팔미토일 알콜 및 n-헥사데실 알콜을 포함하는 동의어로도 알려진 1-헥사데칸올을 의미한다. 세틸 알콜 유도체는 비제한적으로 세테쓰-2, 세테쓰-4, 세테쓰-20, 세테쓰-8-포스페이트, PEG-13 세틸 에테르 카르복실산 등을 포함하는 세틸 알콜의 에틸렌 글리콜 및 폴리(에틸렌 글리콜) 에테르, 뿐만 아니라 이의 약학적 염을 포함한다. "세틸 알콜 혼합물"은 본원에 기재된 세틸 알콜 및 하나 이상의 세틸 알콜 유도체를 함유한다. 대안적으로, 세틸 알콜 혼합물은 본원에 기재된 2개 이상의 세틸 알콜 유도체를 함유한다. "세틸 알콜 혼합물"은 또한 스테아릴 알콜 (즉, 1-옥타데칸올)의 유도체, 예컨대 스테아릴 알콜의 에틸렌 글리콜 또는 폴리(에틸렌 글리콜) 에테르 (예컨대, 스테아레쓰-3, 스테아레쓰-20 등)를 함유할 수 있다. 시판되는 세틸 알콜 혼합물의 예는 EMULCIRE™ 61을 포함한다.
본원에서 사용되는 용어 "카르보머"는 가교되거나 비가교된 폴리(아크릴산) 폴리머 또는 코-폴리머를 의미한다. 카르보머의 예는 비제한적으로 카르보폴 제품, 예컨대 카르보폴® 934, 카르보폴® 940, 카르보폴® 941, 카르보폴® 980, 카르보폴® 981, 카르보폴® 1342, 및 카르보폴® 1382를 포함한다.
본원에서 사용되는 용어 "레시틴"은 식물 또는 동물 조직으로부터 얻은 임의의 지질 추출물을 의미한다. 예를 들어, 대두, 달걀, 및 기타 공급원으로부터 레시틴 제조물이 수득될 수 있다. 레시틴은 전형적으로 인지질, 당지질, 스핑고지질, 및 중성 지질을 포함하는 다수의 성분을 함유한다. 포스파티딜콜린 (예컨대, 디스테아로일-sn-포스파티딜콜린)은 전형적으로 가장 많은 레시틴 제조물의 대부분을 차지한다. 레시틴은, 예컨대 수소화를 통해 화학적으로 변형될 수 있다.
본원에서 사용되는 용어 "프로필렌 글리콜"은 이소프로필렌 글리콜 및 메틸에틸 글리콜을 포함하는 동의어로도 공지된 1,2-프로판디올을 의미한다.
본원에서 사용되는 용어 "메틸 파라벤"은 메타벤, 메틸 부텍스, 및 메틸 p-하이드록시벤조에이트를 포함하는 동의어로도 공지된 4-하이드록시벤조산 메틸 에스테르를 의미한다.
본원에서 사용되는 용어 "프로필 파라벤"은 프로타벤, 프로필 부텍스, 및 프로필 p-하이드록시벤조에이트를 포함하는 동의어로도 공지된 4-하이드록시벤조산 프로필 에스테르를 의미한다.
본원에서 사용되는 용어 "시트르산"은 2-하이드록시-1,2,3-프로판트리카르복실산 및 이의 약학적으로 허용되는 염 또는 수화물을 의미한다. 당업자는 본원에 기재된 조성물에 시트르산 대신 다른 약학적으로 허용되는 산이 이용될 수 있음을 이해할 것이다.
본원에서 사용되는 용어 "소듐 포스페이트"는 소듐 양이온 (즉, Na+) 및 포스페이트 음이온 (즉, PO4 3-)을 함유하는 염을 의미한다. 모노소듐 포스페이트 (디하이드레이트), 디소듐 포스페이트 (무수) 등을 포함하는 다수의 소듐 포스페이트 염 및 수화물이 본원에 기재된 조성물에 이용될 수 있다. 당업자는 본원에 기재된 조성물에 소듐 포스페이트 대신 다른 약학적으로 허용되는 염기가 이용될 수 있음을 이해할 것이다.
본원에서 사용되는 용어 "국소 투여"는 대상체의 피부 또는 다른 조직을 조성물과 접촉시킴에 의한 본원에 기재된 조성물의 투여를 의미한다. 조성물의 국소 투여는 또한 피부 또는 조직에서 조성물을 제거하는 것을 포함할 수 있다.
본원에서 사용되는 용어 "경피 약학적 조성물"은 국소 투여시 대상체의 피부 또는 다른 조직을 통해 전달되는 활성 약학적 성분을 함유하는 조성물을 의미한다.
본원에서 사용되는 용어 "치료" 및 "치료하는"은 감소; 완화; 증상을 감소시키거나 증상, 손상, 병리학 또는 병태를 환자가 더 잘 견딜 수 있게 하는 것; 증상 또는 병태의 빈도 또는 기간의 감소; 또는, 일부 경우에, 증상의 개시를 예방하는 것과 같은 임의의 객관적 또는 주관적 파라미터를 포함하는, 손상, 병리학, 병태, 또는 증상 (예컨대, 동통)의 전체 또는 부분 치료 또는 개선을 의미한다. 증상의 치료 또는 개선은 임의의 객관적 또는 주관적 파라미터 (예컨대, 신체 검사의 결과 포함)에 기반할 수 있다.
본원에서 사용되는 용어 "크림"은 피부 또는 다른 조직에 외부 도포하기 위해 의도된 연질, 반고체, 약학적 및 미용적으로 허용되는 제조물을 의미한다. 크림은 전형적으로 유중수 에멀젼으로서 또는 수중유 에멀젼으로서 제형화된 수성 기재를 포함한다.
본원에서 사용되는 용어 "대상체"는 비제한적으로 영장류 (인간 및 비-인간), 소, 양, 염소, 말, 개, 고양이, 토끼, 랫트, 마우스 등을 포함하는 포유동물과 같은 동물을 의미한다. 다양한 구체예에서, 대상체는 인간, 예컨대 자궁을 가진 여자이다.
본원에서 사용되는 용어 "호르몬 결핍증"은 대상체에서 하나 이상의 호르몬의 낮은 수준을 의미한다. 정상 호르몬 수준은 대상체마다 다를 것이고 공지된 방법을 통해 결정될 수 있다. 낮은 호르몬 수준은 비제한적으로 피로, 불규칙 출혈, 성욕 저하, 및 우울증을 포함하는 증상과 관련되거나 관련되지 않을 수 있다. 호르몬 결핍증과 관련된 병태는 자궁내막 과형성; 자궁내막증; 속발성 무월경; 대상체의 자궁경부가 짧을 때 조기 출산; 예를 들어, 혈관운동 증상 (예컨대, 안면 홍조 및 식은땀)을 포함하는 폐경-관련 증상; 예를 들어 및 비제한적으로 혈관운동 증상, 수면 장애, 기분 변화, 및 외음부-질 위축을 포함하는 에스트로겐 결핍증과 관련된 증상과 관련하여; 및 골다공증 및 보충적 프로게스테론 또는 에스트로겐으로 치료되는 다른 비-폐경기 질병 상태 또는 병태를 포함한다.
본원에서 사용되는 용어 "마이크론화된 프로게스테론" 및 "마이크론화된 에스트라디올"은 1 mm 미만 (예컨대, 500 μm 미만 또는 100 μm 미만)의 평균 입자 크기를 갖는 결정질 프로게스테론 또는 에스트라디올을 의미한다. 일부 구체예에서, 마이크론화된 에스트라디올 또는 마이크론화된 프로게스테론은 약 15 마이크론 (μm) 미만의 X50 입자 크기 값 또는 약 25 마이크론 미만의 X90 입자 크기 값을 갖는다. 일부 구체예에서, 마이크론화된 프로게스테론 또는 에스트라디올은 5 마이크론 미만의 X90 입자 크기를 갖는다. 용어 "X50"은 샘플 중 입자의 절반 (50%)이 주어진 수보다 직경이 더 작음을 의미한다. 예를 들어, 5 마이크론의 X50을 갖는 마이크론화된 프로게스테론은, 마이크론화된 프로게스테론의 주어진 샘플에 대해, 입자의 절반이 5 마이크론 미만의 직경을 지님을 의미한다. 유사하게, 용어 "X90"은 샘플 중 입자의 90 퍼센트 (90%)가 주어진 수보다 직경이 더 작음을 의미한다.
수치를 수식하기 위해 본원에서 사용되는 용어 "약"은 그 명시적인 값을 둘러싼 가까운 범위를 나타낸다. "X"가 수치인 경우, "약 X"는 0.9X 내지 1.1X의 값 또는 0.95X 내지 1.05X의 값을 나타낼 것이다. "약 X"에 대한 임의의 언급은 구체적으로 적어도 값 X, 0.95X, 0.96X, 0.97X, 0.98X, 0.99X, 1.01X, 1.02X, 1.03X, 1.04X, 및 1.05X를 나타낸다. 따라서, "약 X"는, 예컨대 "0.98X"의 청구 한계에 대한 서면 기재 증거를 교시하고 제공하기 위한 것이다.
본원에서 사용되는 용어 "또는"은 논리적 이접성(disjunction)으로 정의되는 것으로 이해되며 (즉, 및/또는), 용어 "어느 하나", "이 아닌 한", "대안적으로" 및 유사한 효과의 단어와 함께 그와 같이 명시적으로 표시되지 않는 한 배타적인 이접성을 나타내지 않을 것이다.
III.
경피 약학적 조성물
본원에 기재된 약학적 조성물은 프로게스테론을 용해시키거나 부분적으로 용해시키고 이의 경피 흡수를 촉진시키는 물질과 함께 프로게스테론을 함유한다. 조성물은 프로게스테론과 조합된 에스트라디올을 추가로 포함할 수 있다. 일부 구체예에서, 프로게스테론, 중쇄 오일을 함유하는 용해제, 및 침투 촉진제를 포함하는 경피 약학적 조성물이 제공되고, 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다. 관련 구체예에서, 프로게스테론, 중쇄 오일, 및 프로필렌 글리콜; 프로필렌 글리콜의 지방산 에스테르; 및 글리콜 에테르로 구성된 군으로부터 선택되는 하나 이상의 구성원을 함유하는 경피 약학적 조성물이 제공되고; 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다. 일부 구체예에서, 조성물은 테르펜을 추가로 포함한다. 일부 구체예에서, 테르펜은 d-리모넨이다.
관련 양태에서, 프로게스테론, 중쇄 오일, 및 테르펜 침투 촉진제를 함유하는 경피 약학적 조성물이 제공되고, 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다. 다양한 구체예는 프로게스테론, 중쇄 오일, 및 d-리모넨을 함유하는 경피 약학적 조성물을 제공하고, 여기서 약학적 조성물은 국소 투여용 크림으로서 제형화된다.
본원에 기재된 경피 약학적 조성물은 호르몬 결핍증을 치료하기에 적합한 임의의 양의 프로게스테론을 함유할 수 있다. 특정 구체예에서, 경피 약학적 조성물은 주어진 조성물의 총 중량을 기준으로 하여 약 1.5% (w/w) 내지 약 3.5% (w/w)의 프로게스테론을 함유한다. 조성물은, 예를 들어, 약 1.8% (w/w) 내지 약 3.2% (w/w), 또는 약 2.1% (w/w) 내지 약 2.9% (w/w), 또는 약 2.4% (w/w) 내지 약 2.7% (w/w), 또는 약 1.5% (w/w) 내지 약 2% (w/w), 또는 약 2% (w/w) 내지 약 2.5% (w/w), 또는 약 2.5% (w/w) 내지 약 3% (w/w), 또는 약 3% (w/w) 내지 약 3.5% (w/w)의 프로게스테론을 함유할 수 있다. 조성물은 약 1.5, 1.6, 1.7, 1.8, 1.9, 2.0, 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 또는 3.0% (w/w)의 프로게스테론을 함유할 수 있다. 일부 구체예에서, 경피 약학적 조성물은 약 1.5% (w/w) 내지 약 3.5% (w/w) 범위의 양의 프로게스테론을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 2% (w/w) 내지 약 3% (w/w) 범위의 양의 프로게스테론을 포함한다. 본원에 기재된 조성물은 또한 1.5% (w/w) 미만 및 3% (w/w) 초과 농도의 프로게스테론을 함유할 수 있다. 일부 구체예에서, 조성물은 약 0.1 mg 내지 약 200 mg 범위의 프로게스테론의 1일 용량을 제공하기에 충분한 양으로 프로게스테론을 함유한다.
본원에 기재된 경피 약학적 조성물은 호르몬 결핍증을 치료하기에 적합한 임의의 양의 에스트라디올을 함유할 수 있다. 특정 구체예에서, 경피 약학적 조성물은 주어진 조성물의 총 중량을 기준으로 하여 약 0.001% (w/w) 내지 약 0.5% (w/w)의 에스트라디올을 함유한다. 관련 구체예에서, 경피 약학적 조성물은 주어진 조성물의 총 중량을 기준으로 하여 약 0.005% (w/w)의 에스트라디올, 또는 약 0.05% (w/w)의 에스트라디올을 함유한다. 조성물은 조성물의 총 중량을 기준으로 하여, 예를 들어, 약 0.001% (w/w) 내지 약 0.002% (w/w)의 에스트라디올, 또는 약 0.002% (w/w) 내지 약 0.005% (w/w)의 에스트라디올, 또는 약 0.005% (w/w) 내지 약 0.01% (w/w)의 에스트라디올, 또는 약 0.01% (w/w) 내지 약 0.02% (w/w)의 에스트라디올, 또는 약 0.02% (w/w) 내지 약 0.05% (w/w)의 에스트라디올, 또는 약 0.05% (w/w) 내지 약 0.1% (w/w)의 에스트라디올, 또는 약 0.1% (w/w) 내지 약 0.2% (w/w)의 에스트라디올, 또는 약 0.2% (w/w) 내지 약 0.5% (w/w)의 에스트라디올, 또는 약 0.001% (w/w) 내지 약 0.5% (w/w)의 에스트라디올, 또는 약 0.002% (w/w) 내지 약 0.2% (w/w)의 에스트라디올, 또는 약 0.005% (w/w) 내지 약 0.1% (w/w)의 에스트라디올, 또는 약 0.01% (w/w) 내지 약 0.05% (w/w)의 에스트라디올을 함유할 수 있다. 일부 구체예에서, 조성물은 약 0.5 mg 내지 약 1.0 mg 범위의 에스트라디올의 1일 용량을 제공하기에 충분한 양으로 에스트라디올을 함유한다.
본원에 기재된 약학적 조성물은 용해된 프로게스테론 또는 부분적으로 용해된 프로게스테론을 포함할 수 있고, 여기서 프로게스테론 또는 이의 일부는 가용화되거나 용해된다. 일부 구체예에서, 프로게스테론은 "부분적으로 용해되고" 프로게스테론의 일부는 조성물에서 가용화되거나 용해되고 프로게스테론의 일부는 조성물에 현탁된다 (즉, 일부는 마이크론화된 채로 있다). 부분적으로 용해된 프로게스테론은 약 1% 용해된, 약 5% 용해된, 약 10% 용해된, 약 15% 용해된, 약 20% 용해된, 약 25% 용해된, 약 30% 용해된, 약 35% 용해된, 약 40% 용해된, 약 45% 용해된, 약 50% 용해된, 약 55% 용해된, 약 60% 용해된, 약 65% 용해된, 약 70% 용해된, 약 75% 용해된, 약 80% 용해된, 약 85% 용해된, 약 90% 용해된, 또는 약 95% 용해된 프로게스테론을 포함할 수 있다. 일부 구체예에서, 프로게스테론은 "완전히 용해되고" 프로게스테론의 전부 또는 거의 전부는 가용화되거나 용해된다. 완전히 용해된 프로게스테론은 약 96% 용해된, 약 97% 용해된, 약 98% 용해된, 약 99% 용해된, 또는 약 100% 용해된 프로게스테론을 포함할 수 있다.
본원에 기재된 조성물은 용해된 에스트라디올을 포함할 수 있고, 여기서 에스트라디올 또는 이의 일부는 가용화되거나 용해된다. 용해된 에스트라디올은 약 1% 용해된, 약 5% 용해된, 약 10% 용해된, 약 15% 용해된, 약 20% 용해된, 약 25% 용해된, 약 30% 용해된, 약 35% 용해된, 약 40% 용해된, 약 45% 용해된, 약 50% 용해된, 약 55% 용해된, 약 60% 용해된, 약 65% 용해된, 약 70% 용해된, 약 75% 용해된, 약 80% 용해된, 약 85% 용해된, 약 90% 용해된, 또는 약 95% 용해된 에스트라디올을 포함할 수 있다. 일부 구체예에서, 에스트라디올은 "완전히 용해되고" 에스트라디올의 전부 또는 거의 전부는 가용화되거나 용해된다. 완전히 용해화된 에스트라디올은 약 96% 용해된, 약 97% 용해된, 약 98% 용해된, 약 99% 용해된 또는 약 100% 용해된 에스트라디올을 포함할 수 있다.
일부 구체예에서, 프로게스테론 및 에스트라디올 중 하나 또는 둘 모두는 상기 기재된 대로 용해된다. 일부 구체예에서, 어느 하나의 에스트라디올, 프로게스테론, 또는 둘 모두는 상기 기재된 대로 완전히 용해된다.
다양한 구체예에서, 본원에 기재된 프로게스테론 및 에스트라디올 조성물은 용해제와의 블렌딩을 통해 제조된다. 특정 구체예에서, 용해제는 약학적으로 허용되는 오일을 함유한다. 일부 구체예에서, 용해제는 중쇄 오일을 포함한다. 일부 구체예에서, 용해제는 C6-C14 중쇄로 실질적으로 구성된 중쇄 오일을 함유하고, 예컨대, 오일에 존재하는 지방산 에스테르의 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 또는 적어도 90%는 C6-C14이다. 일부 구체예에서, 용해제는 C6-C12 중쇄 지방산 에스테르로 실질적으로 구성된 중쇄 오일을 함유하고, 예컨대, 오일에 존재하는 사슬의 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 또는 적어도 90%는 C6-C12이다. 일부 구체예에서, 오일은 적어도 하나의 중쇄 모노-, 디-, 또는 트리글리세라이드, 또는 이의 유도체, 또는 이의 조합물을 포함한다. 일부 구체예에서, 중쇄 오일은 적어도 하나의 중쇄 지방산 프로필렌 글리콜 모노에스테르 또는 디에스테르; 또는 적어도 하나의 중쇄 지방산 폴리에틸렌 글리콜 에스테르; 또는 적어도 하나의 중쇄 지방산 글리세라이드 모노에스테르, 디에스테르, 또는 트리에스테르를 포함한다. 글리세롤, 프로필렌 글리콜, 또는 폴리에틸렌 글리콜의 지방산 에스테르는 비제한적으로 카프로산 (C6), 에난트산 (C7), 카프릴산 (C8), 펠라르곤산 (C9), 카프르산 (C10), 운데실산 (C11), 라우르산 (C12), 트리데실산(C13), 또는 미리스트산 (C14)의 에스테르, 뿐만 아니라 이의 조합물을 포함할 수 있다. 일부 구체예에서, C6-C14 오일은 불포화된다. 일부 구체예에서, 용해제는 땅콩유를 함유하지 않는다.
일부 구체예에서, 용해제는 하나 이상의 모노-, 디-, 또는 트리글리세라이드 또는 이의 조합물을 갖는 중쇄 오일을 포함한다. 예시적인 글리세라이드는 카프릴/카프르 트리글리세라이드인 MIGLYOLs®을 포함한다 (SASOL Germany GMBH, Hamburg). MIGLYOLs는 MIGLYOL 810 (카프릴/카프르 트리글리세라이드), MIGLYOL 812 (카프릴/카프르 트리글리세라이드), MIGLYOL 816 (카프릴/카프르 트리글리세라이드), 및 MIGLYOL 829 (카프릴/카프르/석신 트리글리세라이드)를 포함한다. 용해제는 또한, 예를 들어: 카프로/카프릴/카프르/라우르 트리글리세라이드; 카프릴/카프르/리놀레 트리글리세라이드; 및 카프릴/카프르/석신 트리글리세라이드를 포함하는 다른 카프릴/카프르 트리글리세라이드를 포함할 수 있다. 예시적인 카프릴/카프르 모노-, 디-, 또는 트리글리세라이드는 비제한적으로 CAPMUL MCM, CAPMUL MCM C10, CAPMUL MCM C8, CAPMUL MCM C8 EP, 및 CAPMUL 708 G (CAPMUL® 브랜드는 ABITEC, Columbus, Ohio의 소유이다)를 포함한다. 분획화된 식물성 지방산의 다른 모노-, 디-, 및 트리글리세라이드, 및 이의 조합물 또는 유도체가 본원에 기재된 조성물에 사용될 수 있다. 예를 들어, 용해제는 포화된 코코넛 및 팜핵유의 1,2,3-프로판트리올 (글리세롤, 글리세린, 글리세린) 에스테르 및 이의 유도체일 수 있다.
일부 구체예에서, 시판되는 지방산 글리세롤 및 글리콜 에스테르는 천연 오일로부터 제조되므로 주로 용해제를 구성하고 특성화하는 지방산 에스테르 이외의 성분을 포함할 수 있다. 그러한 다른 성분은, 예컨대, 다른 지방산 모노-, 디-, 및 트리글리세라이드, 지방산 모노- 및 디에스테르 에틸렌 또는 프로필렌 글리콜, 유리 글리세롤 또는 글리콜, 또는 유리 지방산일 수 있다. 예를 들어, ABITEC에 의한 CAPMUL MCM C8에 대한 기술적 데이터 시트는 중쇄 지방산 (주로 카프릴)의 모노- 및 디글리세라이드로 구성된 CAPMUL MCM C8을 기재하고 ≤ 1% C6, ≥ 95% C8, ≤ 5% C10, 및 ≤ 1.5% C12 및 그 초과의 알킬 함량을 기재한다. 추가 예로서, MIGLYOL 812는 65-80% 카프릴(C8)산 및 20-35% 카프르(C10)산을 지닌 지방산 조성을 갖는 카프릴/카프르 트리글리세라이드로서 기재된다. 그러나, 이것은 또한 소량의 다른 지방산, 예컨대, 최대 약 2%의 카프로(C6)산 및 라우르(C12)산, 및 최대 약 1%의 미리스트(C14)산을 함유할 수 있다.
임의의 적합한 양의 중쇄 오일이 본원에 기재된 조성물에 사용될 수 있다. 일반적으로, 경피 약학적 조성물은 약 10% (w/w) 내지 약 30% (w/w)를 함유한다. 조성물은, 예를 들어, 약 14% (w/w) 내지 약 26% (w/w) 중쇄 오일, 또는 약 18% (w/w) 내지 약 22% (w/w) 중쇄 오일, 또는 약 10% (w/w) 내지 약 25% (w/w) 중쇄 오일, 또는 약 10% (w/w) 내지 약 20% (w/w) 중쇄 오일, 또는 약 10% (w/w) 내지 약 15% (w/w) 중쇄 오일, 또는 약 15% (w/w) 내지 약 20% (w/w) 중쇄 오일, 또는 약 20% (w/w) 내지 약 25% (w/w) 중쇄 오일, 또는 약 25% (w/w) 내지 약 30% (w/w) 중쇄 오일을 함유할 수 있다. 조성물은 약 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30% (w/w)의 중쇄 오일을 함유할 수 있다. 일부 구체예에서, 경피 약학적 조성물은 약 10% (w/w) 내지 약 30% (w/w) 범위의 양의 중쇄 오일을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 15% (w/w) 내지 약 25% (w/w) 범위의 양의 중쇄 오일을 포함한다.
일부 구체예에서, 중쇄 오일은 중쇄 트리글리세라이드의 혼합물을 포함한다. 일부 구체예에서, 중쇄 오일의 혼합물은 카프릴/카프르 트리글리세라이드를 함유한다. 중쇄 트리글리세라이드의 혼합물의 예는 MIGLYOL 812, MIGLYOL 840 등을 포함한다.
본원에 기재된 조성물은 용해제 외에 피부를 통한 호르몬의 경피 전달을 촉진시키는 하나 이상의 침투 촉진제를 일반적으로 함유한다. 적합한 침투 촉진제의 예는 비제한적으로 알킬 메틸 설폭사이드 (예컨대 디메틸 설폭사이드, 데실메틸 설폭사이드, 테트라데실메틸 설폭사이드 등); 피롤리돈 (예컨대 2-피롤리돈, N-메틸-2-피롤리돈, N-(2-하이드록시에틸)-피롤리돈 등); 라우로카프람; 아세톤; 디메틸 아세트아미드; 디메틸 포름아미드; 테트라하이드로푸르푸릴 알콜; 클로피브릭산 아미드; 헥사메틸렌 라우르아미드; 우레아; N,N-디에틸-m-톨루아미드; 프로필렌 글리콜; 프로필렌 글리콜의 지방산 에스테르; 폴리에틸렌 글리콜의 지방산 에스테르; 및 글리콜 에테르를 포함한다.
프로필렌 및 폴리에틸렌 글리콜의 예시적인 지방산 에스테르는 비제한적으로 프로필렌 글리콜 모노카프릴레이트 (예컨대, CAPMUL PG-8 또는 CAPMUL PG-8 NF); 프로필렌 글리콜 모노카프레이트 (예컨대, CAPMUL PG-10); 프로필렌 글리콜 모노라우레이트 (예컨대, CAPMUL PG-12 EP/NF, LAUROGLYCOL 90); 프로필렌 글리콜 디카프릴레이트; 프로필렌 글리콜 디카프레이트; 프로필렌 글리콜 디카프릴레이트/디카프레이트 (예컨대, MIGLYOL 840); 및 프로필렌 글리콜 디라우레이트 (예컨대, CAPMUL PG-2L EP/NF)를 포함한다. 예시적인 글리콜 에테르는 비제한적으로 2-이소프로폭시에탄올, 에틸렌 글리콜 모노부틸 에테르, 및 디에틸렌 글리콜 모노에테르 (예컨대, 부톡시디글리콜; 디프로필렌 글리콜 메틸 에테르; 2-(2-에톡시에톡시)에탄올로도 언급되는 디에틸렌 글리콜 모노에틸 에테르 및 TRANSCUTOL®, GATTEFOSSE SAS, Saint-Priest, France 등)을 포함한다.
특정 구체예에서, 본원에 기재된 조성물은 테르펜 또는 테르펜 유도체를 함유한다. 테르펜은 프로게스테론 및 에스트라디올의 용해성을 개선시켜, 조성물에서 결정의 형성을 방지할 수 있다. 테르펜은 또한 피부를 통한 호르몬의 경피 전달을 촉진하는 침투 촉진제로서 작용할 수 있다. 테르펜은 이소프렌 (즉, CH2=C(CH)3CH=CH2)으로부터 유래된 탄소 골격을 갖는 -종종 생물학적 기원의- 탄화수소 화합물이다. 테르펜 백본의 탄소 원자는 하이드록실, 옥소, 및 카르복시기와 같은 산소 치환기를 지닐 수 있다. 테르펜은 비제한적으로 C5 헤미테르펜, C10 모노테르펜, C15 세스퀴테르펜, 및 C20 디테르펜을 포함한다. 특수한 테르펜의 예는 미르센, 오시멘, 리날룰, 네롤, 게라니올, 시트로넬올, 리모넨, 테르피넨, 펠란드렌, 시멘, 아스카디올, 풀레곤, 비사볼롤, 캄퍼 및 피넨을 포함한다. 특정 구체예에서, 테르펜은 d-리모넨 (즉, (4R)-1-메틸-4-(1-메틸에테닐)-사이클로헥센)이다.
프로필렌 글리콜, 프로필렌 글리콜의 지방산 에스테르, 글리콜 에테르, 및 이의 조합물은 대상체에서 표적화된 조직으로의 전달을 위한 프로게스테론 및 에스트라디올의 침투를 향상시킬 수 있다. 일부 구체예에서, 본원에 기재된 조성물은 프로게스테론, 중쇄 오일, 및 프로필렌 글리콜을 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜, 및 프로필렌 글리콜의 지방산 에스테르를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 및 프로필렌 글리콜의 지방산 에스테르를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜의 지방산 에스테르, 및 글리콜 에테르를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 및 글리콜 에테르를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜, 프로필렌 글리콜의 지방산 에스테르, 및 글리콜 에테르를 함유한다. 그러한 구체예에서, 조성물은 또한 비제한적으로 세틸 알콜 혼합물, 스테아레이트 혼합물, 카르보머, 및 레시틴을 포함하는 추가적인 성분을 함유할 수 있다. 일부 그러한 구체예에서, 조성물은 또한 테르펜, 예컨대 d-리모넨을 포함할 수 있다.
일부 구체예에서, 프로필렌 글리콜, 프로필렌 글리콜 모노라우레이트, 디에틸렌 글리콜 모노에틸 에테르, 및 이의 조합물은 본원에 기재된 조성물에서 침투 촉진제로서 이용된다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 및 프로필렌 글리콜을 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜, 및 프로필렌 글리콜 모노라우레이트를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜, 및 디에틸렌 글리콜 모노에틸 에테르를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 및 프로필렌 글리콜 모노라우레이트를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜 모노라우레이트, 및 디에틸렌 글리콜 모노에틸 에테르를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 및 디에틸렌 글리콜 모노에틸 에테르를 함유한다. 일부 구체예에서, 조성물은 프로게스테론, 중쇄 오일, 프로필렌 글리콜, 프로필렌 글리콜 모노라우레이트, 및 디에틸렌 글리콜 모노에틸 에테르를 함유한다. 일부 그러한 구체예에서, 조성물은 또한 테르펜, 예컨대 d-리모넨을 포함할 수 있다.
임의의 적합한 양의 프로필렌 글리콜이 경피 조성물에 포함될 수 있다. 예를 들어, 조성물은 약 1% (w/w) 내지 약 10% (w/w)의 프로필렌 글리콜, 또는 약 2% (w/w) 내지 약 9% (w/w)의 프로필렌 글리콜, 또는 약 3% (w/w) 내지 약 8% (w/w)의 프로필렌 글리콜, 또는 약 4% (w/w) 내지 약 7% (w/w)의 프로필렌 글리콜, 또는 약 5% (w/w) 내지 약 6% (w/w)의 프로필렌 글리콜을 함유할 수 있다. 조성물은 약 1% (w/w) 내지 약 5% (w/w)의 프로필렌 글리콜, 또는 약 2% (w/w) 내지 약 5% (w/w)의 프로필렌 글리콜, 또는 약 3% (w/w) 내지 약 4% (w/w)의 프로필렌 글리콜을 함유할 수 있다. 조성물은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 약 10% (w/w)의 프로필렌 글리콜을 함유할 수 있다.
임의의 적합한 양의 프로필렌 글리콜의 지방산 에스테르가 경피 조성물에 포함될 수 있다. 예를 들어, 조성물은 약 1% (w/w) 내지 약 10% (w/w)의 프로필렌 글리콜의 지방산 에스테르, 또는 약 2% (w/w) 내지 약 9% (w/w)의 프로필렌 글리콜의 지방산 에스테르, 또는 약 3% (w/w) 내지 약 8% (w/w)의 프로필렌 글리콜의 지방산 에스테르, 또는 약 4% (w/w) 내지 약 7% (w/w)의 프로필렌 글리콜의 지방산 에스테르, 또는 약 5% (w/w) 내지 약 6% (w/w)의 프로필렌 글리콜의 지방산 에스테르를 함유할 수 있다. 조성물은 약 2% (w/w) 내지 약 7% (w/w)의 프로필렌 글리콜의 지방산 에스테르, 또는 약 3% (w/w) 내지 약 6% (w/w)의 프로필렌 글리콜의 지방산 에스테르를 함유할 수 있다. 조성물은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 약 10% (w/w) 프로필렌 글리콜의 지방산 에스테르를 함유할 수 있다. 일부 그러한 구체예에서, 프로필렌 글리콜의 지방산 에스테르는 프로필렌 글리콜 모노라우레이트이다.
임의의 적합한 양의 글리콜 에테르가 경피 조성물에 포함될 수 있다. 예를 들어, 조성물은 약 1% (w/w) 내지 약 10% (w/w)의 글리콜 에테르, 또는 약 1% (w/w) 내지 약 5% (w/w)의 글리콜 에테르, 또는 약 2% (w/w) 내지 약 4% (w/w)의 글리콜 에테르를 함유할 수 있다. 조성물은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 약 10% (w/w)의 글리콜 에테르를 함유할 수 있다. 일부 그러한 구체예에서, 글리콜 에테르는 디에틸렌 글리콜 모노에틸 에테르이다.
본원에 기재된 경피 약학적 조성물은 임의의 적합한 양의 테르펜, 예컨대 d-리모넨을 함유할 수 있다. 일반적으로, 조성물은 약 1% (w/w) 내지 약 12% (w/w)의 d-리모넨을 함유한다. 조성물은, 예를 들어, 약 2% (w/w) 내지 약 10% (w/w)의 d-리모넨, 또는 약 1% (w/w) 내지 약 4% (w/w)의 d-리모넨, 또는 약 4% (w/w) 내지 약 8% (w/w)의 d-리모넨, 또는 약 8% (w/w) 내지 약 12% (w/w)의 d-리모넨, 또는 약 1% (w/w) 내지 약 5% (w/w)의 d-리모넨, 또는 약 5% (w/w) 내지 약 10% (w/w)의 d-리모넨을 함유할 수 있다. 조성물은 약 2% (w/w) 내지 약 8% (w/w)의 d-리모넨, 또는 약 3% (w/w) 내지 약 7% (w/w)의 d-리모넨, 또는 약 4% (w/w) 내지 약 6% (w/w)의 d-리모넨을 함유할 수 있다. 조성물은 약 1, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 5.5, 6, 6.5, 7, 7.5, 8, 8.5, 9, 9.5, 10, 10.5, 11, 11.5, 또는 12% (w/w)의 d-리모넨을 함유할 수 있다. 일부 구체예에서, 경피 약학적 조성물은 약 1% (w/w) 내지 약 12% (w/w) 범위의 양의 d-리모넨을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 1.5% (w/w) 내지 약 10% (w/w) 범위의 양의 d-리모넨을 포함한다.
일부 구체예에서, 경피 약학적 조성물은 약 1.5% (w/w) 내지 약 3.5% (w/w) 범위의 양의 프로게스테론; 및 약 10% (w/w) 내지 약 30% (w/w) 범위의 양의 중쇄 오일을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 1.5% (w/w) 내지 약 3.5% (w/w) 범위의 양의 프로게스테론; 약 10% (w/w) 내지 약 30% (w/w) 범위의 양의 중쇄 오일; 및 약 1% (w/w) 내지 약 12% (w/w) 범위의 양의 d-리모넨을 포함한다.
일부 구체예에서, 경피 약학적 조성물은 약 2% (w/w) 내지 약 3% (w/w) 범위의 양의 프로게스테론; 및 약 15% (w/w) 내지 약 25% (w/w) 범위의 양의 중쇄 오일을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 2% (w/w) 내지 약 3% (w/w) 범위의 양의 프로게스테론; 약 15% (w/w) 내지 약 25% (w/w) 범위의 양의 중쇄 오일; 및 약 1.5% (w/w) 내지 약 10% (w/w) 범위의 양의 d-리모넨을 포함한다.
일부 구체예에서, 경피 약학적 조성물은 약 2.5% (w/w)의 양의 프로게스테론 및 약 15% (w/w)의 양의 중쇄 오일을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 2.5% (w/w)의 양의 프로게스테론; 약 15% (w/w)의 양의 중쇄 오일; 및 약 5% (w/w)의 양의 d-리모넨을 포함한다.
일부 구체예에서, 경피 약학적 조성물은 에스트라디올을 추가로 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 0.001% (w/w) 내지 약 0.5% (w/w) 범위의 양의 에스트라디올을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 0.01% (w/w) 내지 약 0.1% (w/w) 범위의 양의 에스트라디올을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 0.005% (w/w)의 양의 에스트라디올을 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 0.05% (w/w)의 양의 에스트라디올을 포함한다.
본원에 기재된 조성물은 각각의 전문이 본원에 참조로서 포함되는 미국 특허 5,453,279호; 6,056,972호; 6,238,284호; 및 7,404,965호에 기재된 것들을 비제한적으로 포함하는, 공지된 경피 호르몬 조성물에 사용되는 임의의 부형제를 추가로 함유할 수 있다. 일부 구체예에서, 조성물은 또한 비제한적으로 세틸 알콜 혼합물, 스테아레이트 혼합물, 카르보머, 및 레시틴을 포함하는 추가적인 성분을 함유할 수 있다. 조성물은 또한 비제한적으로 본원에 기재된 비이온성 또는 이온성 계면활성제, 에멀젼화제, 착색제, 보존제, 항산화제 등을 포함하는 추가적인 성분 및 부형제를 함유할 수 있다.
일부 구체예에서, 약학적 조성물은 하나 이상의 비이온성 또는 이온성 계면활성제를 추가로 포함한다. 일부 구체예에서, 비이온성 계면활성제는 중쇄 지방산 또는 장쇄 지방산의 글리세롤 및 폴리에틸렌 글리콜 에스테르, 예를 들어, GELUCIRE®로서 시판되는 라우로일 마크로골-32 글리세라이드 또는 라우로일 폴리옥실-32 글리세라이드, 예를 들어, GELUCIRE® 39/01 (포화된 C12-C18 지방산의 글리세롤 에스테르); GELUCIRE® 43/01 (hard fat NF/JPE); GELUCIRE® 44/14 (라우로일 마크로골-32 글리세라이드 EP, 라우로일 폴리옥실-32 글리세라이드 NF, 라우로일 폴리옥실글리세라이드 (USA FDA IIG)); 및 GELUCIRE® 50/13 (스테아로일 마크로골-32 글리세라이드 EP, 스테아로일 폴리옥실-32 글리세라이드 NF, 스테아로일 폴리옥실글리세라이드 (USA FDA IIG)) 중 하나 이상으로부터 선택된다.
일부 구체예에서, 비이온성 계면활성제는, 예를 들어 및 비제한적으로, 올레산, 리놀레산, 팔미트산, 및 스테아르산 중 하나 이상을 포함한다. 일부 구체예에서, 비이온성 계면활성제는 상표명 TWEEN® 80 (Sigma Aldrich, St. Louis, MO) 하에 시판되는 폴리소르베이트 80을 포함하는 폴리에틸렌 소르비톨 에스테르를 포함한다. 폴리소르베이트 80은 약 60%-70%의 올레산을 포함하고 나머지는 주로 리놀레산, 팔미트산, 및 스테아르산을 포함한다.
일부 구체예에서, 비이온성 계면활성제는, 예를 들어 MCM 대 TEFOSE® 63의 비가, 예를 들어, 8:2 또는 9:1인 CAPMUL MCM로 사용될 수 있는 TEFOSE® 63 (GATTEFOSSE SAS, Saint-Priest, France)로서 시판되는 PEG-6 팔미토스테아레이트 및 에틸렌 글리콜 팔미토스테아레이트를 포함한다. 다른 예시적인 용해제/비이온성 계면활성제 조합물은 비제한적으로 MIGLYOL 812:GELUCIRE® 50/13 또는 MIGLYOL 812:TEFOSE® 63을 포함한다.
비이온성 또는 이온성 계면활성제는 약 0.01% 초과의 농도, 예를 들어 약 0.01%-30.0%, 약 0.1% 내지 10.0%, 또는 약 1% 내지 10.0%, 10% 내지 30%의 농도로 이용될 수 있다. 일부 구체예에서, 약학적 조성물은 약 10.0 중량%의 계면활성제를 포함한다. 일부 구체예에서, 약학적 조성물은 약 15.0 중량%의 계면활성제를 포함한다. 일부 구체예에서, 약학적 조성물은 약 0.1 중량% 내지 약 5.0 중량%, 예컨대, 약 1.0 중량%의 계면활성제를 포함한다. 일부 구체예에서, 약학적 조성물은 약 5.0 중량% 내지 약 15.0 중량%의 계면활성제를 포함한다. 일부 구체예에서, 약학적 조성물은 약 10.0 중량% 내지 약 20.0 중량%의 계면활성제를 포함한다. 일부 구체예에서, 약학적 조성물은 30.0 중량% 미만, 29.0 중량% 미만, 28.0 중량% 미만, 27.0 중량% 미만, 26.0 중량% 미만, 25.0 중량% 미만, 24.0 중량% 미만, 23.0 중량% 미만, 22.0 중량% 미만, 21.0 중량% 미만, 20.0 중량% 미만, 19.0 중량% 미만, 18.0 중량% 미만, 17.0 중량% 미만, 16.0 중량% 미만, 15.0 중량% 미만, 14.0 중량% 미만, 13.0 중량% 미만, 12.0 중량% 미만, 11.0 중량% 미만, 10.0 중량% 미만, 9.0 중량% 미만, 8.0 중량% 미만, 7.0 중량% 미만, 6.0 중량% 미만, 5.0 중량% 미만, 4.0 중량% 미만, 3.0 중량% 미만, 2.0 중량% 미만, 또는 1.0 중량% 미만의 계면활성제를 포함한다.
상기 기재된 계면활성제는 본원에 기재된 조성물에서 에멀젼화제로서 작용할 수 있다. 적합한 에멀젼화제는 비제한적으로 소르비탄 에스테르 (Span™로도 언급됨), 폴리옥시에틸렌 소르비탄 에스테르 (폴리소르베이트; Tween™로도 언급됨), 및 글리세릴 에스테르를 포함한다. 소르비탄 에스테르의 예는 비제한적으로 소르비탄 모노올레에이트, 소르비탄 모노스테아레이트, 소르비탄 모노라우레이트, 소르비탄 트리올레에이트, 및 소르비탄 트리스테아레이트를 포함한다. 폴리옥시에틸렌 소르비탄 에스테르의 예는 폴리에틸렌 글리콜 (PEG) 소르비탄 에스테르, 예컨대 PEG-(5)-소르비탄 모노올레에이트, PEG-(4)-소르비탄 모노스테아레이트, PEG-(4)-소르비탄 모노라우레이트, PEG-소르비탄 트리올레에이트, 및 PEG-소르비탄 트리스테아레이트를 포함한다. 글리세릴 에스테르의 예는 글리세릴 모노스테아레이트, 글리세릴 모노라우레이트, 및 글리세릴 트리스테아레이트를 포함한다.
본 발명에 이용될 수 있는 다른 에멀젼화제는 레시틴, 콜레스테롤, 포스파티딜글리세롤, 알킬 알콜, 폴록사머 (Pluronic™/Synperonic™으로도 언급됨), 폴록사민 (Tetronic™으로도 언급된), 소듐 라우릴설페이트, 소듐 세틸스테아릴설페이트, 및 포타슘 올레에이트를 포함한다.
일부 구체예에서, 약학적 조성물은 또 하나의 다른 부형제, 예컨대-비제한적으로-착색제, 항료, 보존제, 항산화제, 텍스처 개질제, 점도 (레올로지) 개질제, 또는 완충제를 추가로 포함한다. 부형제의 선택은 크림 제형에서 성분의 용해성 및 안정성에 대한 부형제의 효과와 같은 인자에 크게 의존할 것이다. 착색제는, 예를 들어, 약 0.1 중량% 내지 약 2 중량% 범위의 양으로 이용될 수 있다. 보존제는, 예를 들어, 약 0.002 중량% 내지 약 0.05 중량%, 예컨대 약 0.005 중량% 내지 약 0.05 중량% 또는 약 0.002 중량% 내지 약 0.02 중량% 범위의 양으로 이용될 수 있다. 보존제는 비제한적으로 약 10:1의 비의 메틸 대 프로필 파라벤을 포함할 수 있다. 당업자는 특정 조성물 및 의도된 투여 방식에서 호르몬의 양을 포함하는 인자에 기초하여 특정 부형제 및 이의 양을 선택하는 방법을 알고 있을 것이다.
일부 구체예에서, 약학적 조성물은 하나 이상의 페놀산 알데하이드(들)를 추가로 포함한다. 본원에서 이용되는 페놀산 알데하이드는 비제한적으로 바닐린 (4-하이드록시-3-메톡시벤즈알데하이드), 메틸바닐린, 및 에틸바닐린 (3-에톡시-4-하이드록시벤즈알데하이드, 부르보날)을 포함한다.
일부 구체예에서, 약학적 조성물은 하나 이상의 항산화제를 추가로 포함한다. 적합한 항산화제의 예는 비제한적으로 부틸화된 하이드록시톨루엔 (BHT), 부틸화된 하이드록시아니솔, 3차-부틸 하이드로퀴논, 프로필 갈레이트, 옥틸 갈레이트, 도데실 갈레이트, 아스코르브산, 아스코르빌 팔미테이트, 에리토르브산, 4-헥실레조르시놀, α-토코페롤, β-토코페롤, γ-토코페롤, δ-토코페롤 및 이의 혼합물을 포함한다. 일부 구체예에서, 항산화제는 BHT이다. BHT의 포함은 조성물의 저장 및 사용 동안 d-리모넨의 산화를 방지할 수 있다.
일부 구체예에서, 약학적 조성물은 하나 이상의 겔화제를 추가로 포함한다. 적합한 겔화제는 비제한적으로 셀룰로스 유도체, 폴리아크릴산 유도체, 및 검을 포함한다. 셀룰로스 유도체의 예는 메틸셀룰로스, 에틸셀룰로스, 하이드록시에틸 셀룰로스, 및 카르복시메틸 셀룰로스를 포함한다. 폴리아크릴산 유도체의 예는 폴리아크릴산, 폴리메틸아크릴레이트, 및 폴리에틸아크릴레이트를 포함한다. 폴리아크릴산 유도체의 예는 가교된 폴리아크릴레이트 (예컨대, 카르보폴 980® NF 폴리머, LUBRIZOL, Wickliffe, Ohio)를 추가로 포함한다. 검의 예는 아가, 알긴산, 글루코만난, 아라비아 검, 소듐 알기네이트, 및 트래거칸트를 포함한다. 겔화제는 약학적 조성물의 점도를 높여서 조성물이 미용적으로 우수하고 의도된 용도에 적합한 유동 특성을 갖도록 보장하기 위해 이용될 수 있다.
특정 구체예에서, 약학적 조성물의 요망되는 pH를 달성하거나 유지하기 위해 완충제 시스템이 이용된다. 완충제 시스템은 당업자에게 잘 알려져 이고, 약학적 생성물에 적합하고 주어진 약학적 조성물에 적절한 임의의 완충제 시스템이 사용될 수 있다. 구체예에서, 완충제 시스템은 시트르산 및 이염기성 소듐 포스페이트의 조합물일 수 있다. 전형적으로, 정제수를 첨가하여 약학적 조성물이 최종 중량이 되게 한다.
일반적으로, 본원에 기재된 약학적 조성물에 이용된 용해제, 침투 촉진제, 계면활성제, 및 부형제는 무독성이고, 약학적으로 허용되며, 서로 상용가능하고, 약학적 조성물 및 다양한 성분의 안정성을 서로에 대해 유지한다. 추가로, 약학적 조성물을 구성하는 다양한 성분의 조합물은 대상체에 투여시 요망되는 치료적 효과를 발생시킬 것이다.
따라서, 일부 구체예에서, 경피 약학적 조성물은 약 2.5% (w/w)의 양의 프로게스테론; 약 15% (w/w)의 양의 중쇄 오일 (중쇄 오일은 중쇄 트리글리세라이드 (예컨대, 카프릴 트리글리세라이드 및 카프르 트리글리세라이드)를 포함함); 약 5% (w/w)의 양의 d-리모넨; 약 3% (w/w)의 양의 디에틸렌 글리콜 모노에틸 에테르; 약 5% (w/w)의 양의 프로필렌 글리콜 모노라우레이트; 약 7% (w/w)의 양의 스테아레이트 혼합물 (스테아레이트 혼합물은 글리세롤 모노스테아레이트 및 PEG-75 스테아레이트를 포함함); 약 3.5% (w/w)의 양의 세틸 알콜 혼합물 (세틸 알콜 혼합물은 세틸 알콜, 세테쓰-20, 및 스테아레쓰-20을 포함함); 약 0.2% (w/w)의 양의 카르보머; 약 3.% (w/w)의 양의 레시틴; 약 4.% (w/w)의 양의 프로필렌 글리콜; 약 0.2% (w/w)의 양의 메틸 파라벤; 약 0.02% (w/w)의 양의 프로필 파라벤; 약 0.5% (w/w)의 양의 시트르산; 약 0.8% (w/w)의 양의 소듐 포스페이트; 및 약 50.3% (w/w)의 양의 정제수를 포함한다. 일부 구체예에서, 경피 약학적 조성물은 약 0.1% (w/w)의 양의 부틸화된 하이드록시톨루엔을 추가로 포함한다. 특정 구체예에서, 경피 약학적 조성물은 약 0.05% (w/w)의 양의 에스트라디올을 추가로 포함한다. 특정 구체예에서, 경피 약학적 조성물은 약 0.005% (w/w)의 양의 에스트라디올을 추가로 포함한다. 특정 구체예에서, 경피 약학적 조성물은 약 0.06% (w/w)의 양의 에스트라디올을 추가로 포함한다. 당업자는 부틸화된 하이드록시톨루엔 및 에스트라디올과 같은 추가 성분이 조성물에 첨가될 때, 조성물 중 물의 양은 동일한 상대 % w/w를 유지하도록 조정될 수 있음을 이해할 것이다.
일부 구체예에서, 경피 약학적 조성물은 약 2.5% (w/w)의 양의 프로게스테론; 약 15% (w/w)의 양의 중쇄 오일 (중쇄는 중쇄 트리글리세라이드 (예컨대 카프릴/카프르 트리글리세라이드)를 포함함); 약 3% (w/w)의 양의 디에틸렌 글리콜 모노에틸 에테르; 약 5% (w/w)의 양의 프로필렌 글리콜 모노라우레이트; 약 7% (w/w)의 양의 스테아레이트 혼합물 (스테아레이트 혼합물은 글리세롤 모노스테아레이트 및 PEG-75 스테아레이트를 포함함); 약 3.5% (w/w)의 양의 세틸 알콜 혼합물 (세틸 알콜 혼합물은 세틸 알콜, 세테쓰-20, 및 스테아레쓰-20을 포함함); 약 0.2% (w/w)의 양의 카르보머; 약 3% (w/w)의 양의 레시틴; 약 4% (w/w)의 양의 프로필렌 글리콜; 약 0.2% (w/w)의 양의 메틸 파라벤; 약 0.02% (w/w)의 양의 프로필 파라벤; 약 0.5% (w/w)의 양의 시트르산; 약 0.8% (w/w)의 양의 소듐 포스페이트; 및 약 55.3% (w/w)의 양의 정제수를 포함한다. 일부 그러한 구체예에서, 조성물은 약 0.05% (w/w)의 양의 에스트라디올을 추가로 포함한다. 일부 그러한 구체예에서, 조성물은 약 0.005% (w/w)의 양의 에스트라디올을 추가로 포함한다. 일부 그러한 구체예에서, 조성물은 약 0.06% (w/w)의 양의 에스트라디올을 추가로 포함한다.
일부 구체예에서, 경피 약학적 조성물은 약 2.5% (w/w)의 양의 프로게스테론; 약 15% (w/w)의 양의 중쇄 오일 (중쇄는 중쇄 트리글리세라이드 (예컨대 카프릴/카프르 트리글리세라이드)를 포함함); 약 3% (w/w)의 양의 디에틸렌 글리콜 모노에틸 에테르; 약 5% (w/w)의 양의 프로필렌 글리콜 모노라우레이트; 약 0.1% (w/w)의 양의 부틸화된 하이드록시톨루엔; 약 7% (w/w)의 양의 스테아레이트 혼합물 (스테아레이트 혼합물은 글리세롤 모노스테아레이트 및 PEG-75 스테아레이트를 포함함); 약 3.5% (w/w)의 양의 세틸 알콜 혼합물 (세틸 알콜 혼합물은 세틸 알콜, 세테쓰-20, 및 스테아레쓰-20을 포함함); 약 0.2% (w/w)의 양의 카르보머; 약 3% (w/w)의 양의 레시틴; 약 4% (w/w)의 양의 프로필렌 글리콜; 약 0.2% (w/w)의 양의 메틸 파라벤; 약 0.02% (w/w)의 양의 프로필 파라벤; 약 0.5% (w/w)의 양의 시트르산; 약 0.8% (w/w)의 양의 소듐 포스페이트; 및 약 55.2% (w/w)의 양의 정제수를 포함한다.
본 발명에 따른 조성물은 비제한적으로 하기 표 1A에 개시된 조성물 I-IV 및 하기 표 1B에 개시된 조성물 A-J를 포함한다.
표 1A. 예시적인 호르몬 조성물
표 1B. 예시적인 호르몬 조성물
본원에 기재된 경피 약학적 크림 조성물은 기존 시판용 크림 조성물에 비해 높은 호르몬 용해성 및 개선된 생체이용률을 제공한다. 특정 구체예에서, 프로게스테론 및 에스트라디올은 실질적으로 또는 완전히 용해되어, 피부 또는 다른 조직, 예컨대 점막 (예컨대, 질) 조직을 통한 효율적인 전달을 발생시킨다. 특정 구체예에서, 호르몬은 다른 공지된 제형보다 큰 표면적에 걸쳐 투여될 수 있다. 높은 용해성 및 개선된 생체이용률이 달성되기 때문에, 낮은 용량 투여도 달성된다. 낮은 용량 투여에 의해, 투여된 프로게스테론의 높은 투여량으로부터 야기되는 부작용을 감소시킴으로써 전반적인 안전성이 개선된다. 또한, 크림 조성물은 자극받은 피부 또는 질 조직에 진정 작용을 하며, 용이하게 도포되고, 광택이 나는 만족스러운 외관을 나타내며, 저장 또는 적용 동안 최소의 에멀젼 분리는 나타낸다.
본 발명의 약학적 크림 조성물을 제조하기 위한 일반적인 방법(100)이 도 1에 요약되며, 하기 공정들(102-110)을 포함한다.
공정(102)은 적절한 양의 물을 약 65℃-75℃로 가열하는 것을 포함한다. 구체예에 따르면, 물은 0.1 M 시트르산 및 0.2 M Na2HPO4 용액을 포함한다. 수성상을 구성하는 성분 (즉, 수용해성을 갖는 성분; 예컨대, 카르보머)을 물에 첨가하고, 완전히 분산되고 균일해질 때까지 혼합한다.
공정(104)은 적절한 컨테이너 내로 오일상 성분 (예컨대, MIGLYOL 812, CREMOPHOR® A6 및 A25, 세틸 알콜)을 계량하거나 칭량하는 것을 포함한다. 성분을 약 65℃-75℃로 가열시킨다. 일부 구체예에서, 공정(104) 내에 프로게스테론, 에스트라디올, 또는 이의 조합물을 첨가하고, 용해될 때까지 혼합한다 (또는 일부 구체예에서 부분적으로 현탁되고 부분적으로 용해됨).
일단 오일 및 수성상 둘 모두가 요망되는 온도에 도달하면, 공정(106)은 열원으로부터 둘 모두의 상을 제거하는 것을 포함한다. 그 후, 약 1200 RPM에서 교반하면서 오일상을 수성상에 천천히 첨가한다. 약학적 크림 조성물의 온도가 ≤40℃일 때까지 교반을 계속한다.
공정(108)은 약학적 크림 조성물 온도가 ≤ 40℃일 때까지 대기한 다음, 추가 성분 (예컨대, TRANSCUTOL®, d-리모넨, LAUROGLYCOL® 90 등)을 조성물에 첨가하는 것을 포함한다. 약학적 크림 조성물의 온도가 ≤25℃일 때까지 혼합을 계속한다.
공정(110)은 약학적 크림 조성물을 당 분야에 공지된 적절한 교반기를 이용하여 적당한 시간 동안, 예를 들어 2-5분 동안 교반시키는 것을 포함한다.
조성물이 본 발명의 다른 조성물에 비해 추가의 또는 더 적은 부형제를 함유할 수 있기 때문에, 아래의 일반적인 제조 방법은 상이한 부형제, 계면활성제, 또는 각각의 약학적 조성물에 함유된 성분에 따라 달라진다. 완성된 제형은 다수의 편리한 컨테이너, 예컨대 튜브, 일회용 사쉐, 정량 펌프 등에서의 사용을 위해 패키징될 수 있다.
본원에 기재된 조성물의 호르몬 수송 특성을 측정하기 위한 방법(200)이 도 2에 요약된다. Franz 확산 세포를 방법(200)에 따라 이용한다. Franz 확산 세포는 연결부에 의해 연결된 도너 챔버 및 수용체 챔버로 일반적으로 구성된다. 공정(202)은 도너 챔버 내에, 또는 도너 챔버 및 수용체 챔버를 분리하는 매질 상에-또는 매질로 혼입된- 적절한 양의 조성물 (예컨대, 0.7 g의 프로게스테론 크림)을 넣는 것을 포함한다. 수용체 상은 적절한 온도 (예컨대, 37℃)로 유지되고, 수용체 챔버의 부피는 5.0 mL이며, 샘플 부피는 2.0 mL이다. 수용체 상은 5% 소듐 라우릴 설페이트 (SLS)와 같은 임의의 첨가제를 갖는 수용액을 전형적으로 포함한다.
공정(204)은 수용체 챔버 및 도너 챔버 사이의 연결부에 분리 매질을 넣는 것을 포함한다. 분리 매질은, 예를 들어, 0.45 μm 셀룰로스 아세테이트 막 또는 적합한 인간 카데바 피부일 수 있다.
공정(206)은 상이한 시점에 샘플을 수집하는 것을 포함한다. 샘플은 전형적으로 0.5, 1, 2, 4, 및 8시간에 수집된다. 샘플은 하기 절차에 따라 수집될 수 있다. 먼저, 수용체 챔버를 수용체 유체로 채우고, 막을 도너 및 수용체 챔버 사이에 둔다. 다음으로, 도너 챔버에 적절한 양의 프로게스테론 크림 (예컨대 0.7 g)을 부하시킨다. 그 후 샘플을 수집하고, 각각의 샘플링시에 신선한 부피의 샘플 용액 (예컨대, 2.0 mL)으로 교체한다. 샘플을 즉시 분석하지 않는 경우, 분석을 수행할 때까지 냉장고에 보관한다.
공정(208)은 고성능 액체 크로마토그래피 (HPLC) 분석을 위해 분석 실험실에 샘플을 제출하는 것을 포함한다. 공정(210)은 수송, 확산, 또는 투과성을 계산하거나 측정하는 것을 포함한다. 계산되거나 측정된 수송, 확산, 또는 투과성을 유사한 공정에 따라 측정되거나 계산된 기존의 시판용 크림 제품의 수송, 확산, 또는 투과성과 비교하였다.
IV.
호르몬 결핍증을 치료하기 위한 방법
관련 양태에서, 대상체에서 호르몬 결핍증과 관련된 병태를 치료하기 위한 방법이 제공된다. 상기 방법은 본원에 기재된 임의의 약학적 제형을 대상체에 투여하는 것을 포함한다.
일부 구체예에서, 본원에 기재된 약학적 조성물은 특히 자궁을 지닌 여성에 대해, 적어도 부분적으로, 호르몬 결핍증에 의해 야기된 대상체의 병태를 치료하는데 유용하다. 예를 들어, 일부 구체예에서, 본원에 기재된 약학적 조성물은 하기 병태 중 하나 이상의 치료에 유용하다: 자궁내막 과형성; 자궁내막증; 속발성 무월경; 대상체가 짧아진 자궁경부를 지닐 때, 조산; 예를 들어, 혈관운동 증상을 포함하는 폐경-관련 증상; 예를 들어 및 비제한적으로, 안면 홍조 및 식은땀 (혈관운동 증상), 수면 장애, 기분 변화 및 외음부 및 질 위축을 포함하는 에스트로겐 결핍증 관련 증상의 치료에 관해; 및 골다공증, 및 보충적인 프로게스테론 또는 에스트로겐으로 치료되는 다른 비-폐경기 질환 상태 또는 병태. 따라서, 일부 구체예에서, 본 발명은 주어진 병태를 치료하기에 적합한 투여량으로 본원에 기재된 프로게스테론 (또는 프로게스테론 및 에스트라디올)을 포함하는 조성물을 대상체에 투여함에 의해 그러한 병태를 치료하는 방법을 제공한다.
일부 구체예에서, 병태는 대상체에서 프로게스테론 결핍증과 관련된다. 일부 구체예에서, 병태는 대상체에서 에스트라디올 결핍증과 관련된다. 일부 구체예에서, 병태는 자궁내막 과형성, 자궁내막증, 속발성 무월경, 안면 홍조, 식은땀, 수면 장애, 기분 변화, 외음부-질 위축, 및 골다공증으로부터 선택된다.
일부 구체예에서, 본원에 기재된 프로게스테론 조성물은 에스트라디올 치료를 받는 대상체에서 에스트라디올의 효과에 대응하기 위해 이용될 수 있다.
본원에 기재된 대로, 임의의 적합한 양의 프로게스테론 또는 에스트라디올, 또는 프로게스테론 또는 에스트라디올을 함유하는 조성물은 치료될 병태에 따라 본원에 기재된 방법에 이용될 수 있다. 에스트라디올의 공-투여와 관련된 자궁내막 과형성에 대한 치료 또는 보호에 사용될 때, 프로게스테론은 일반적으로 일당 약 0.1 mg 내지 200 mg 범위의 양으로 대상체에 투여된다. 일부 구체예에서, 프로게스테론은 일당 약 0.1 mg 내지 100 mg 범위의 양으로 대상체에 투여된다. 예를 들어, 프로게스테론은 일당 약 0.1 내지 약 1 mg, 또는 일당 약 1 내지 약 10 mg, 또는 일당 약 10 내지 약 100 mg, 또는 일당 약 100 내지 약 200 mg의 양으로 투여될 수 있다. 프로게스테론은 일당 약 0.1 내지 약 50 mg, 또는 일당 약 0.5 내지 약 25 mg의 양으로 투여될 수 있다. 프로게스테론은 일당 약 0.1, 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 또는 50 mg의 양으로 투여될 수 있다. 다른 병태, 예를 들어 속발성 무월경은 당업자에게 공지된 바와 같이 비례적으로 더 많이 투여 될 것이다. 예를 들어, 속발성 무월경의 경우 프로게스테론의 경구 용량은 종종 자궁내막 과형성을 예방하기 위해 사용되는 투여량보다 150%-200% 더 많이 투여된다 (자궁내막 보호를 위해 매일 투여되는 200 mg의 프로게스테론 대 속발성 무월경을 위한 400 mg의 프로게스테론).
일반적으로, 에스트라디올은 일당 약 0.01 mg 내지 10 mg 범위의 양으로 대상체에 투여된다. 예를 들어, 에스트라디올은 일당 약 0.01 내지 약 0.1 mg, 또는 일당 약 0.1 내지 약 1 mg, 또는 일당 약 1 내지 약 10 mg의 양으로 투여될 수 있다. 에스트라디올은 일당 약 0.01 내지 약 10 mg, 또는 일당 약 0.1 내지 약 9 mg, 또는 일당 약 0.25 내지 약 7.5 mg, 또는 일당 약 0.5 내지 약 5.5 mg, 또는 일당 약 1 내지 약 3 mg, 또는 일당 약 1.5 내지 약 2.5 mg의 양으로 투여될 수 있다. 에스트라디올은 일당 약 0.01, 0.05, 0.1, 0.125, 0.15, 0.20, 0.25, 0.30, 0.35, 0.375, 0.40, 0.45, 0.50, 0.55, 0.60, 0.625, 0.65, 0.70, 0.75, 0.80, 0.85, 0.90, 0.95 1.00, 1.125, 1.25, 1.375, 1.50, 1.625, 1.75, 또는 2.00 mg의 양으로 투여될 수 있다.
본원에 기재된 조성물은 일당 1회 이상의 용량으로 투여될 수 있다. 일부 구체예에서, 본원에 기재된 조성물은 본원에 기재된 방법에서 일당 1회 투여된다. 본원에 기재된 조성물은 조성물을 복부, 다리, 안쪽 허벅지 또는 신체의 다른 적합한 부위에 화합물을 도포함에 의해 투여될 수 있다.
본원에 기재된 약학적 조성물은 조성물이 투여되는 대상체 (예컨대, 여성 대상체)에서 바람직한 약물동력학 파라미터를 제공하도록 제형화될 수 있다. 일부 구체예에서, 본원에 기재된 약학적 조성물은 대상체에서 프로게스테론에 대한 바람직한 약물동력학 파라미터를 생성한다. 일부 구체예에서, 본원에 기재된 약학적 조성물은 대상체에서 에스트라디올에 대한 바람직한 약물동력학 파라미터를 생성한다. 일부 구체예에서, 본원에 기재된 약학적 조성물은 대상체에서 프로게스테론 또는 에스트라디올의 하나 이상의 대사산물, 예를 들어 에스트론, 총 에스트론, 알로프레그나놀론, 또는 알로프레그나놀론 설페이트에 대한 바람직한 약물동력학 파라미터를 생성한다.
대상체에 프로게스테론 및 에스트라디올을 포함하는 조성물의 투여 후에, 프로게스테론 또는 에스트라디올의 농도 및 대사는 대상체로부터의 샘플 (예컨대, 혈액 샘플, 혈장 샘플, 모세관 혈액 샘플, 또는 타액 샘플)에서 측정될 수 있다. 본원에 기재된 약학적 조성물은 대상체 또는 대상체의 집단에 조성물의 투여 후에 프로게스테론, 에스트라디올, 또는 이의 대사산물의 하나 이상의 약물동력학 파라미터에 대해 특성화될 수 있다. 이러한 약물동력학 파라미터는 AUC, Cmax, 및 tmax를 포함한다. AUC는 가로축 (X-축)에 따른 시간에 대해 세로축 (Y-축)에 따른 약물의 샘플 농도를 플롯팅한 곡선하면적(AUC)의 계산이다. AUC는 잘 이해되어 있고, 약학적 분야에서 자주 사용되는 도구이며, 널리 기술되어 왔다. Cmax는 대상체로부터의 샘플 (예컨대, 타액 샘플) 중 최대 약물 농도에 대한 약어로서 당 분야에 잘 이해되어 있다. tmax는 대상체의 샘플 (예컨대, 타액 샘플) 중 시간 대 최대 약물 농도에 대한 약어로서 당 분야에 잘 이해되어 있다.
일부 구체예에서, 하나 이상의 약물동력학 파라미터, 예컨대, AUC, Cmax, 또는 tmax는 에스트라디올에 대해 측정된다. 일부 구체예에서, 하나 이상의 약물동력학 파라미터, 예컨대, AUC, Cmax, 또는 tmax는 프로게스테론에 대해 측정된다. 일부 구체예에서, 하나 이상의 약물동력학 파라미터, 예컨대, AUC, Cmax, 또는 tmax는 에스트론에 대해 측정된다. 일부 구체예에서, 하나 이상의 약물동력학 파라미터, 예컨대, AUC, Cmax, 또는 tmax는 총 에스트론에 대해 측정된다. 일부 구체예에서, 하나 이상의 약물동력학 파라미터, 예컨대, AUC, Cmax, 또는 tmax는 알로프레그나놀론에 대해 측정된다.
면역검정, 질량 분광분석법 (MS), 자외선 형광 검출에 의한 HPLC, 질량 분광분석법 (MS)과 함께 액체 크로마토그래피, 탠덤 질량 분광분석법 (MS/MS), 및 액체 크로마토 그래피-탠덤 질량 분광분석법 (LC-MS/MS)를 포함하는, 샘플 중 프로게스테론, 에스트라디올, 에스트론, 총 에스트론, 알로프레그나놀론, 또는 알로프레그나놀론 설페이트의 수준을 측정하기 위한 임의의 다양한 방법이 이용될 수 있다. 일부 구체예에서, 프로게스테론, 에스트라디올, 에스트론, 또는 총 에스트론의 수준은 검증된 LC-MS/MS 방법을 이용하여 측정된다. 호르몬 수준을 측정하는 방법은 문헌에 잘 설명되어 있다.
프로게스테론, 에스트라디올, 에스트론, 총 에스트론, 알로프레그나놀론, 또는 알로프레그나놀론 설페이트의 수준은 다수의 생물학적 샘플, 예컨대, 조직 또는 유체, 예컨대 혈액, 혈청, 혈장, 모세관 혈액, 타액, 또는 소변에서 측정될 수 있다. 일부 구체예에서, 프로게스테론, 에스트라디올, 에스트론, 총 에스트론, 알로프레그나놀론, 또는 알로프레그나놀론 설페이트의 수준은 투여한 지 약 0.0, 0.10, 0.20, 0.05, 0.30, 0.35, 0.40, 0.45, 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 또는 48시간 후에, 또는 각각의 호르몬 수준을 결정하는데 일반적이거나 유용한 임의의 다른 적절한 기간에 측정된다. 일반적으로, 프로게스테론, 에스트라디올, 에스트론, 총 에스트론, 알로프레그나놀론, 또는 알로프레그나놀론 설페이트의 수준을 결정하기 위한 검정은 투여 후 5, 10, 15, 20, 30, 60, 120, 360, 480, 720 또는 1440분마다 1회 이상 측정되거나, 이의 조합이다 (예컨대, 첫 번째 측정은 처음 1시간 동안은 매 15분마다, 그 후에는 매 120분마다 수행된다). 일부 구체예에서, 프로게스테론, 에스트라디올, 에스트론, 총 에스트론, 알로프레그나놀론, 또는 알로프레그나놀론 설페이트의 수준은 투여한 지 약 48시간 후에 측정된다. 구체예에서, 그러한 측정의 타이밍은 Cmax, tmax 또는 AUC를 정확하게 측정하도록 설계된다. 타이밍은 주어진 상황에 기반하여 조정될 수 있다 (즉, 한 제형은 더 신속한 Cmax를 유발할 수 있고, 이 경우에 Cmax, tmax 또는 AUC의 정확한 측정을 보장하기 위해 초기 시간들은 서로 가깝게 모이거나, 0 시간에 가깝거나, 둘 모두일 것이다). 검정 타이밍은 생물학적 샘플의 유형에 따라 상이할 수 있다: Cmax, tmax 또는 AUC는 검정하려는 생물학적 샘플의 유형에 따라 상이한 시점에 발생할 수 있다.
V.
실시예
실시예 1. 프로게스테론 용해성 연구
프로게스테론의 용해성은 과포화된 용액이 형성될 때까지 실온에서 특정 양의 용매에 점진적으로 프로게스테론을 첨가함으로써 시각적으로 결정되었다. 연구 결과는 표 2에 요약된다.
표 2: 상이한 용매 시스템에서 프로게스테론의 용해성
*용해성은 HPLC에 의해 결정되었다.
실시예 2. 플라시보 크림 제형
0.1M 시트르산 및 0.2M Na2HPO4를 함유하는 5.4-5.6의 목표 pH를 갖는 완충된 수용액을 제조하고 70℃로 가열시켰다. 카르보머가 조성물에 포함되는 경우, 카르보머를 수용액에 첨가하고, 완전히 용해되어 균일한 용액이 수득될 때까지 혼합시켰다. 오일 성분 (예컨대, MIGLYOL 812, CREMOPHOR A6, CREMOPHOR A25, 세틸 알콜, 추가적인 에멀젼화제)을 칭량하고 70℃로 가열시켰다. 오일 및 수성상이 요망되는 온도를 달성했을 때, 이들을 열에서 제거하고 Caframo BDC 2002 lab 믹서를 이용하여 600-1200 RPM으로 교반하면서 오일상을 수성상에 천천히 첨가하였다. 혼합물의 온도가 40℃ 이하가 될 때까지 계속 교반하였다. 요망되는 온도에 도달했을 때, 용매 및 다른 성분 (예컨대, 프로필렌 글리콜, TRANSCUTOL, d-리모넨, 및 추가적인 부형제)을 크림에 첨가하고, 크림의 온도가 25℃ 이하가 될 때까지 계속 혼합하였다. 크림을 IKA 균질화기를 이용하여 2-5분 동안 균질화시켰다. 플라시보 조성물을 표 3-5에 개시된 대로 제조하였다.
표 3. 플라시보 크림 조성물
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
표 4. 플라시보 크림 조성물
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
표 5. 플라시보 크림 조성물
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
실시예 3. 프로게스테론 크림 조성물.
프로게스테론 크림 조성물은 실시예 2에 기재된 대로 제형화되었고, 마이크론화된 프로게스테론은 유성상에 포함되었다. 크림은 표 6에 개시된 성분들로 제형화되었다.
표 6. 프로게스테론 크림 조성물.
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
조성물 3-1은 피부에 적용시 바람직한 않은 촉감을 나타내었다. 프로게스테론 입자 형성을 포함하는 입자 형성이 조성물 3-1, 3-2, 및 3-3에 대해 관찰되었다. 조성물 3-4는 균일한 크림으로서 수득되었고, 가시적인 프로게스테론 입자는 관찰되지 않았다.
추가적인 프로게스테론 크림은 표 7에 개시된 성분들로 제형화되었다.
표 7. 프로게스테론 크림 조성물
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
조성물 3-5, 3-6, 3-7, 및 3-8은 균일한 백색 크림으로서 수득되었다. 조성물 3-5, 3-6, 및 3-8은 약간의 불안정성을 나타내었고, 40℃에서 24시간 동안 저장 후 분리되었다. 조성물 3-7은 45℃에서 2일 동안 저장 후 불안정성을 나타내었다. 점성 크림이 조성물 3-9 및 3-10에 대해 수득되었다; 카르보머 농도는 후속 제형에서 감소하였다.
추가적인 프로게스테론 크림은 표 8에 개시된 성분들로 제형화되었다.
조성물 3-11은 바람직한 점도를 나타내었다; 프로게스테론 과립은 프로게스테론의 첨가시 관찰되었다. 조성물 3-12, 3-13, 3-14, 및 3-15는 불안정성을 나타내었다. 물리적 불안정성은 13일 동안 저장 후 조성물 3-12에 대해 관찰되었고, 물리적 불안정성은 45℃에서 2일 동안 저장 후 조성물 3-14에 대해 관찰되었다. 조성물 3-13의 제형은 안정한 에멀젼을 생성하지 못했다. 제형 3-16은 균일한 백색 크림으로서 수득되었다.
표 8. 프로게스테론 크림 조성물.
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
추가적인 프로게스테론 크림은 표 9에 개시된 성분들로 제형화되었다.
묽고, 덜 점성인 크림이 조성물 3-17 및 3-18에 대해 수득되었다. 걸쭉하고 점성인 균일한 크림이 조성물 3-19 및 3-20에 대해 수득되었다. 조성물 3-19는 40℃에서 16시간 동안 저장 후에 분리되기 시작했고, 조성물 3-20은 40℃에서 18시간 동안 저장 후에 분리되기 시작했다. 제형 3-21, 3-22, 및 3-23은 균일한 오프-화이트 내지 담황색 크림으로서 수득되었고, 이것은 40℃에서 저장시 안정하였다.
표 9. 프로게스테론 크림 조성물.
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
추가적인 프로게스테론 크림은 표 10에 개시된 성분들로 제형화되었다.
조성물 3-24 및 3-25는 균일한 크림으로서 수득되었다. 조성물 3-25의 점도는 매우 낮았고; 바람직한 점도를 얻기 위해 더 높은 농도의 카르보머가 이용되었다. 조성물 3-26의 적용은 피부에 바람직하지 않은 촉감을 주었고, 실온에서 1개월 동안 저장 후에 조성물에서 결정이 관찰되었다. 조성물 3-28 및 3-29는 광택이 있는 외형을 나타내지 않았고, 프로게스테론의 가시적인 입자를 함유하였다. 조성물 3-30은 광택이 있는 외형을 나타내었고, 프로게스테론의 가시적인 입자를 함유하였다.
표 10. 프로게스테론 크림 조성물.
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
실시예 4. Franz 확산 세포 연구
상이한 침투 촉진제 농도를 갖는 크림을 이용하여 프로게스테론의 침투를 연구하였다. 조성물에 대해 측정된 플럭스 값을 표 11에 요약한다.
표 11. 상이한 농도의 침투 촉진제를 갖는 크림 제형의 플럭스의 개요.
상이한 농도의 d-리모넨을 갖는 프로게스테론 크림의 플럭스를 연구하였다. 실험적 데이터는 도 3에 도시되며, 측정된 플럭스 값은 표 12에 요약된다.
표 12. 상이한 농도의 d-리모넨을 갖는 크림 제형의 플럭스의 개요
프로게스테론의 침투는 d-리모넨을 갖고 갖지 않는 크림 제형을 이용하여 연구되었다. 실험에 대한 데이터는 도 4에 도시되며, 표 13A에 요약된다. d-리모넨의 사용은 d-리모넨이 없는 조성물에 비해 프로게스테론 플럭스에서 100% 초과의 증가를 발생시켰다.
표 13A. 0.2% 카르보머에서 d-리모넨 유 & 무 크림 제형의 플럭스의 비교
Franz 세포 확산 연구에 의해 평가된 신규한 조성물에 대한 플럭스 특성을 1.6% (w/w) 프로게스테론을 함유하는 혼합된 크림과 비교하였다. 비교 결과는 표 13B에 요약되며, 이는 본 발명의 조성물이 비교 실시예에 비해 플럭스에서의 현저한 증가를 나타내었음을 제시한다.
표 13B. 프로게스테론 크림 제형의 Franz 확산 시험
실시예 5. 프로게스테론 2.5%/에스트라디올 0.005% 크림 제형
프로게스테론 및 에스트라디올을 함유하는 조성물은 표 14에 따라 제형화되었다. 오프 화이트 내지 담황색 크림이 수득되었다. 에스트라디올의 가시적인 입자는 관찰되지 않았다. 그릿-없는 부드러운 크림이 형성되었다.
표 14. 프로게스테론 2.5%/에스트라디올 0.005% 크림 제형 및 관찰
*물 = 5.4-5.6의 목표 pH를 제공하기 위한 0.1 M 시트르산 & 0.2 M Na2HPO4 용액
프로게스테론/에스트라디올 크림을 3세트의 상이한 조건 하에 저장 동안 연구하였다: (1) 25℃; (2) 40℃/75% RH; (3) 2-8℃. 안정성 연구의 결과를 표 15에 요약한다.
표 15. 프로게스테론 2.5% 에스트라디올 0.005% 크림의 안정성 시험
P= 프로게스테론 & E= 에스트라디올 *
14일 및 30일 후에 분석을 수행하였다. 그릿 또는 결정이 30일 후에 발견되지 않았다.
실시예 6. 프로게스테론 2.5% & 프로게스테론 2.5%/에스트라디올 0.005% 크림의 스케일 업
더 큰 배치의 프로게스테론 크림 및 프로게스테론/에스트라디올 크림이 표 16-19에 따라 제형화되었다.
표 16. 조성물 I. 프로게스테론 2.5% 크림 제형
표 17. 조성물 II. 프로게스테론 2.5% 크림 제형
표 18. 조성물 III. 프로게스테론 2.5%/에스트라디올 0.005% 크림 제형
TRANSCUTOL P는 에스트라디올 헤미하이드레이트를 용해시키기 위해 이용된다.
표 19. 조성물 IV. 프로게스테론 2.5%/에스트라디올 0.005% 크림 제형
(1) TRANSCUTOL P는 에스트라디올 헤미하이드레이트를 용해시키기 위해 이용된다.
안정성 시험은 25℃ 및 40℃/75%에서 4주 동안 저장된 크림 제형에 대해 수행되었다. 샘플을 2주 및 4주 후에 시험하여 크림 중 프로게스테론의 양을 결정하고 발생할 수 있는 임의의 분리를 관찰하였다. 결과는 표 20에 제시된다.
표 20. 프로게스테론 조성물의 안정성 시험
실시예 7. 프로게스테론 조성물의 현미경 특성.
상기 기재된 크림 제형을 복굴절 현미경을 이용하여 조사하여, 프로게스테론 결정의 존재 또는 부재를 결정하였다. 상기 기재된 제형을 또한 혼합된 프로게스테론 크림과 비교하였다. 혼합된 프로게스테론 크림 (도 7A 및 도 7B), 뿐만 아니라 조성물 II (d-리모넨이 없는 프로게스테론 크림 2.5%; 표 17; 도 7E 및 도 7F)에서 결정이 관찰되었다. 혼합된 프로게스테론 크림에서 조성물 II에 비해 더 많은 결정이 관찰되었다. 조성물 I에서는 결정이 관찰되지 않았다 (d-리모넨을 갖는 프로게스테론 크림 2.5%; 표 16; 도 7C 및 도 7D). 호르몬 생체이용률이 호르몬 용해성의 함수로서 증가할 수 있으므로 완전히 용해된 프로게스테론 (즉, 프로게스테론 결정 없음)을 갖는 제형이 바람직하다.
조성물 II로부터의 결정을 분리하고, 적외선 (IR) 마이크로분광현미경을 이용하여 조사하였다. IR 데이터로부터 도 7E 및 7F의 복굴절 결정이 프로게스테론으로 구성됨을 확인하였다. IR 분광학에 의해 관찰되는 결정 내 다른 화학 성분은 존재하지 않았다.
실시예 8. 경피 프로게스테론/에스트라디올 조성물의 도포 후 인간 대상체에서 호르몬 수준의 측정.
7명의 남성 대상체에 표 18에 개시된 제형을 갖는 1 그램의 조성물을 투여하였다. 대상체는 25 mg의 프로게스테론 및 50 μg의 에스트라디올을 수용하였다. 투여한 지 1, 2 및 8시간 후에 혈청, 타액, 및 손가락끝 모세관 혈액에서 호르몬 수준을 시험하였다. 시험은 공지된 방법을 이용하여 수행되었다. 크림 도포 전에 측정된 각 대상체의 기준선 수준에 비한 호르몬 수준에서의 변화를 각 시점에 측정하였다.
혈청, 타액, 및 모세관 혈액에서 프로게스테론 수준의 변화를 도 5에 플롯팅하고, 혈청, 타액, 및 모세관 혈액에서 에스트라디올 수준의 변화를 도 6에 플롯팅하였다. 투여 후 혈청 샘플 중 호르몬 수준에서의 현저한 변화는 관찰되지 않았다. 그러나, 도 5에 도시된 바와 같이 모세관 혈액 및 타액에 대해 기준선을 넘는 프로게스테론 농도의 큰 증가가 관찰되었다. 도 6에 도시된 바와 같이 모세관 혈액 및 타액에 대해 기준선을 넘는 에스트라디올 농도의 증가가 또한 관찰되었다. 크림 제형에 의해 나타난 높은 플럭스 및 크림의 도포시 호르몬 수준에서의 큰 증가는 본원에 기재된 경피 약학적 조성물이 호르몬 결핍증 및 관련 병태의 치료에 특히 적합함을 나타낸다.
실시예 9. 경피 프로게스테론/에스트라디올 조성물의 도포 후 인간 대상체에서 호르몬 수준의 측정.
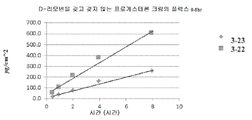
d-리모넨이 있고(조성물 III; 표 18) d-리모넨이 없는 조성물(조성물 IV; 표 19)을 비교하기 위해 추가 시험을 수행하였다. 타액 샘플을 t0에 수득한 다음 1g의 어느 한 크림을 5명의 대상체 각각의 상완에 투여하였다. 타액 샘플을 2, 4, 6, 및 8시간에 수집하고, 프로게스테론 함량에 대해 분석하였다. 결과는 표 21에 요약되며, 이는 d-리모넨을 갖고 갖지 않는 조성물이 프로게스테론의 효율적인 전달을 제공하였음을 나타낸다.
표 21. 개개 대상체에 대한 프로게스테론 타액 농도 AUC 값 (ng*hr/mL).
실시예 10. 경피 프로게스테론은 암컷 랫트의 생식 기관에 대한 에스트라디올의 효과를 반대한다
본 실시예는 경피 전달된 프로게스테론이 난소절제된 랫트에서 자궁내막 및 질에 대한 성장-관련 에스트로겐성 효과를 차단할 수 있음을 나타낸다. 본원에 기재된 제형을 이용하여 국소 적용시, 프로게스테론은 생식 기관에 임상적으로 관련된 세포 변화를 가져오고 에스트라디올에 의해 유도된 자궁내막 증식을 역전시키는 정도로 에스트라디올-유도된 자궁내막 증식의 모델에서 랫트의 피부에 성공적으로 침투하였다. 사용된 국소 제형은 표 16에 개시된다.
32마리의 8주령 암컷 Crl:CD® 랫트는 연구 시작하기 2주 전에 난소절제를 받았다. 랫트를 각각 8마리씩 4그룹으로 무작위 할당하였다. 그룹 중 셋은 8일 동안 피하적으로 (SC) 3 μg/kg/일의 에스트라디올, 뿐만 아니라 플라시보 크림, 10 mg/kg/일의 프로게스테론, SC, 또는 4일에 시작하는 3.125 mg/일의 프로게스테론을 경피적으로 수용하였다. 네 번째 그룹은 8일 동안 염수, SC 및 4일에 시작하는 플라시보 크림을 수용하였다. 8일의 최종 투여 2시간 후에, 랫트를 인도적으로 안락사시키고, 자궁 중량을 측정하고, 질 및 자궁 경부의 원위 부분을 조직학 및 컴퓨터-보조 형태계측을 위해 고정하고 처리하였다. 연구 파라미터는 표 22에 요약된다.
표 22. 국소 프로게스테론 제형의 생체내 연구를 위한 처리 스케쥴.
이 모델에 의해 예상된 대로, 호르몬 대체가 없는 난소절제는 자궁의 현저한 위축을 초래한 반면 반대항적(unopposed) 에스트라디올 처리는 기관 중량 측정 및 조직학에 의해 입증된 대로 비대를 발생시킨다.
에스트라디올-단독 처리군에 비해 프로게스테론을 수용한 둘 모두의 그룹에서 자궁 중량의 현저한 감소가 관찰되었다 (도 8). 자궁의 조직학적 이미지 (도 9)는 자궁 중량의 변화와 일관되었고, 질 조직학 이미지의 전체 크기 (도 10)도 처리와 일관되었다. 또한, 자궁 (예컨대, 원주 관강내 상피, 호산성 자궁내막) 및 질 (예컨대, 각화성 상피, 망상 돌출)에서 보여진 여러 에스트로겐-특이적 세포 양태는 프로게스테론을 SC 또는 경피로 수용한 그룹에서 검출되지 않았다. 표 23을 참조하라.
표 23. 국소 및 피하 프로게스테론으로 처리된 랫트로부터의 조직형태계측 데이터.
LSMean - 최소 제곱 평균; LSM s.e. - 최소 제곱 평균 표준 오차
b 0 μg/kg (SC 비히클)/0 mg/kg (피부 Prog)과 현저히 상이함; (p<0.01)
d 3 μg/kg (SC EST)/0 mg/kg (피부 Prog)과 현저히 상이함; (p<0.01)
f 3 μg/kg (SC Est)/10 mg/kg (SC Prog)과 현저히 상이함; (p<0.01)
프로게스테론의 투여는, SC 및 경피 둘 모두에서, 반대항적 에스트라디올에 비해 관강내 상피 세포 두께를 현저하게 감소시켰다. 자궁내막 샘 밀도의 현저한 증가는 반대항적 에스트라디올에 비해 프로게스테론-투여된 그룹에 대해 그리고 추가로 SC 프로게스테론에 비해 경피 투여시 관찰되었다. 이러한 데이터는 크림 제형이 피부에 침투할 수 있음은 물론, 이들이 표적 조직에 전달되어 요망되는 생물학적 효과를 나타냄을 입증한다.
실시예 11. 동물 모델에서 경피 프로게스테론의 노출, 조직 분포, 및 대사산물 프로파일
랫트에서 프로게스테론, 알로프레그나놀론 (ALLO), 및 ALLO-설페이트의 혈장, 자궁, 및 침샘 수준을 프로게스테론의 경피 및 피하 전달 후에 비교하였다. 연구 결과는 프로게스테론의 국소 전달이 프로게스테론의 낮은 혈장 수준 및 ALLO 및 ALLO-설페이트에 대한 낮은 대사율과 함께 피하 전달과 유사한 자궁에서의 호르몬 수준을 발생시켰음을 입증하였다.
32마리의 8주령 암컷 Crl:CD® 랫트는 연구 시작하기 2주 전에 난소절제를 받았다. 랫트를 각각 8마리씩 4그룹으로 무작위 할당하고 표 22에 요약된 스케쥴에 따라 처리하였다. 그룹 중 셋은 8일 동안 피하적으로 (SC) 3 μg/kg/일의 17β-에스트라디올, 뿐만 아니라 플라시보 크림, 10 mg/kg/일 (약 2.5 mg/랫트/일)의 프로게스테론, SC, 또는 4일에 시작하는 3.13 mg/랫트/일의 프로게스테론을 경피적으로 수용하였다. 경피 제형은 표 16에 개시된다. 추가적인 그룹은 8일 동안 비히클, SC, 및 4일에 시작하는 플라시보 크림을 수용하였다.
8일의 최종 투여 2시간 후에, 랫트를 인도적으로 안락사시키고, 혈장, 침샘, 및 자궁 경부의 내측 부분을 생물분석을 위해 냉동 또는 저장하였다. 혈장 및 조직 균질화물을 LC-MS/MS를 이용하여 프로게스테론, ALLO, 및 ALLO-설페이트에 대해 분석하였다.
국소 투여 후 혈장에서의 평균 프로게스테론 수준은 SC 투여된 5.4 ng/mL/mg 용량에 비해 2.0 ng/mL/mg 용량이었다. 국소 투여후 침샘 및 자궁에서 평균 프로게스테론 수준은 SC 투여된 각각 5.9 및 39 ng/mL/mg 용량에 비해 각각 10 및 24 ng/mL/mg 용량이었다. 자궁 대 혈장에서의 프로게스테론 수준의 비는 경피 및 SC 경로에 대해 각각 12 및 7.3이었다. 표 24 및 도 11을 참조하라.
표 24. 국소 및 피하 제형으로 처리된 랫트에서의 프로게스테론의 분포.
*기하 평균
비록 혈장 중 ALLO의 수준이 둘 모두의 투여 경로에서 유사하지만, ALLO-설페이트의 수준은 국소 투여에 비해 SC 투여에서 약 12배 더 높았다 (각각 7.6 및 0.61 ng/mL/mg 용량). 모든 경우에, ALLO 및 ALLO-설페이트 둘 모두의 평균 조직 수준은 국소 투여에 비해 SC 투여에서 더 높았다. 더욱이, 이러한 대사산물의 혈장 수준의 합계는 SC 투여 후 프로게스테론의 혈장 수준이 국소 투여 후 동등한 혈장 수준에 비해 2배였다. 표 25 및 표 26을 참조하라.
표 25. 국소 및 피하 제형으로 처리된 랫트에서의 알로프레그나놀론의 분포.
BQL = 정량 한계 미만; NC = 계산할 수 없음
표 26. 국소 및 피하 프로게스테론으로 처리된 랫트에서의 알로프레그나놀론-설페이트의 분포.
BQL = 정량 한계 미만; NC = 계산할 수 없음
실시예 12. 다수회 용량의 프로게스테론 크림 제형은 용량-반응성 혈장 및 자궁 농도를 나타낸다
소정 용량 범위의 d-리모넨을 갖고 갖지 않는 2개의 2.5% 프로게스테론 크림 제형의 적용 후 프로게스테론의 혈장 및 자궁 농도를 측정하였다. d-리모넨을 갖는 조성물이 표 27에 개시된다. d-리모넨을 갖지 않는 조성물이 표 28에 개시된다.
표 27. 2.5% 국소 프로게스테론 크림
표 28. 2.5% 국소 프로게스테론 크림
56마리의 8주령 암컷 SDHla®(SD)CVF® 랫트는 연구 시작하기 2주 전에 난소절제를 받았다. 랫트를 각각 8마리씩 7그룹으로 무작위 할당하였다. 모든 그룹은 8일 동안 피하적으로 (SC) 3 μg/kg/일의 17β-에스트라디올, 뿐만 아니라 하기 중 하나를 수용하였다: (a) 플라시보 크림; (b) 0.3, 1, 또는 3 mg/kg/일의 프로게스테론의 d-리모넨-함유 2.5% 프로게스테론 크림; 또는 (c) 4일에 시작하는 0.3, 1, 또는 3 mg/kg/일의 d-리모넨-비함유 2.5% 프로게스테론 크림. 표 29를 참조하라. 랫트 피부의 비례적 부위에 적용되는 2.5% 프로게스테론 크림의 양을 다양하게 함에 의해 상이한 용량의 프로게스테론이 달성되었다 (약 4.5 mg 크림/cm2 피부). 최종 투여 2시간 후 (8일), 랫트를 인도적으로 안락사시키고, 혈장 및 자궁 경부의 내측 부분을 생체분석을 위해 동결시켰다. 혈장 및 조직 균질액을 LC-MS/MS에 의해 프로게스테론에 대해 분석하였다.
표 29. 프로게스테론의 생체내 연구를 위한 처리 스케쥴
a d-리모넨 함유
b 표 27
c 표 28
혈장에서의 평균 프로게스테론 수준은 d-리모넨-함유 제형 (3.0, 1.0, 및 0.3 mg/kg/일에 대해 각각 17.9, 11.4, 및 4.07 ng/mL)에 적용된 프로게스테론의 용량에 의존적이었다. 유사하게, d-리모넨이 없는 제형은 일반적으로 용량-의존적인 혈장 수준을 나타내었다 (3.0, 1.0, 및 0.3 mg/kg/일에 대해 각각 19.4, 9.15, 및 7.45 ng/mL; 표 30). 둘 모두의 제형에 의해 자궁에서 검출된 프로게스테론의 농도는 또한 일반적으로 용량 반응성이었다 (d-리모넨 있음: 33.6, 27.1, 및 6.08 ng/g; d-리모넨 없음: 36.4, 15.5, 및 9.31 ng/g, 각각 3.0, 1.0, 및 0.3 mg/kg/일에 대해; 표 31).
표 30. 반복 투여 후 혈장 프로게스테론 수준
표 31. 반복 투여 후 자궁 프로게스테론 수준
실시예 13. 동물 모델에서 경피 프로게스테론의 독성 연구
2.5% 프로게스테론 크림 (표 27을 참조하라)의 피부 안전성 및 전신 노출을 Gottingen Minipigs®에 13주 동안 매일 피부 투여하는 동안 및 그 후에 평가하였다. 21마리의 4개월령 (어린) 암컷 미니피그를 각각 7마리씩 3그룹으로 무작위 할당하였다 (처리되지 않음, 플라시보 대조군, 및 2.5% 프로게스테론 크림). 플라시보 및 활성 크림을 4.5 mg 제형/cm2의 비율로 10%의 체표면적에 일당 1회 적용하였다 (약 4 mg 프로게스테론/체중 kg). 14일 및 90일에 평가된 파라미터는 임상 징후, 피부 자극, 체중, 검안경검사, 심전도, 임상 병리학, 독성동력학, 육안 병리학, 장기 중량 및 조직병리학을 포함하였다. 14일의 매일 투여 후, 1마리 동물/그룹의 중간 희생이 발생하였다. 최종 부검에서, 4마리 동물/그룹을 희생시켰고, 나머지 2마리 동물/그룹은 희생시키기 전에 14일의 회복 기간을 거쳤다.
프로게스테론의 혈장 수준은 모든 동물에 대해 1일차 투여 전의 검정의 정량 한계 (0.05 ng/mL)이거나 그에 가까웠다. 1일차 투여 후에, 프로게스테론 크림 그룹의 미니피그는 0.20 내지 0.77 ng/mL의 최대 혈장 농도를 나타내었다. 14일에, 전용량 수준은 0.56 내지 5.5 ng/mL의 범위였고, 이는 반복 투여시 프로게스테론의 누적 발생과 일치한다. 최대 혈장 농도는 전용량 수준보다 현저하게 높지 않았는데, 이는 프로게스테론이 거의 정상-상태 수준을 달성하였음을 시사한다. 연구는 국소-적용된 프로게스테론이 인간 피부 침투 모델인 미니피그의 피부에 성공적으로 침투한다는 것을 입증한다.
표 32. 미니피그 모델에서 프로게스테론 혈장 농도
*n = 7
SD = 표준 편차; NC = 계산할 수 없음
전술한 발명이 이해의 명료성을 위해 예시 및 예로서 일부 상세하게 기술되었으나, 당업자는 특정 변경 및 변형이 첨부된 청구항의 범위 내에서 실행될 수 있음을 이해할 것이다. 또한, 본원에 제공된 각각의 참고문헌은 각각의 참고문헌이 개별적으로 참조로서 포함되는 바와 동일한 정도로 그 전문이 참조로서 포함된다. 본 출원 및 본원에 제공된 참고문헌 간에 충돌이 있는 경우, 본 출원이 우선할 것이다.
Claims (39)
- 프로게스테론,
중쇄(medium-chain) 오일, 및
d-리모넨을 포함하는 경피 약학적 조성물로서,
약학적 조성물이 국소 투여용 크림으로서 제형화되는, 경피 약학적 조성물. - 제 1항에 있어서, 약 1.5% (w/w) 내지 약 3.5% (w/w) 범위의 양의 프로게스테론을 포함하는 경피 약학적 조성물.
- 제 2항에 있어서, 약 2% (w/w) 내지 약 3% (w/w) 범위의 양의 프로게스테론을 포함하는 경피 약학적 조성물.
- 제 1항에 있어서, 중쇄 오일이 중쇄 트리글리세라이드를 포함하고, 중쇄 트리글리세라이드가 카프릴 트리글리세라이드 및 카프르 트리글리세라이드를 실질적으로 포함하는 경피 약학적 조성물.
- 제 1항에 있어서, 약 1% (w/w) 내지 약 12% (w/w) 범위의 양의 d-리모넨을 포함하는 경피 약학적 조성물.
- 제 5항에 있어서, 약 1.5% (w/w) 내지 약 10% (w/w) 범위의 양의 d-리모넨을 포함하는 경피 약학적 조성물.
- 제 1항에 있어서,
약 1.5% (w/w) 내지 약 3.5% (w/w) 범위의 양의 프로게스테론;
약 10% (w/w) 내지 약 30% (w/w) 범위의 양의 중쇄 오일; 및
약 1% (w/w) 내지 약 12% (w/w) 범위의 양의 d-리모넨을 포함하는 경피 약학적 조성물. - 제 7항에 있어서,
약 2% (w/w) 내지 약 3% (w/w) 범위의 양의 프로게스테론;
약 15% (w/w) 내지 약 25% (w/w) 범위의 양의 중쇄 오일; 및
약 1.5% (w/w) 내지 약 10% (w/w) 범위의 양의 d-리모넨을 포함하는 경피 약학적 조성물. - 제 7항에 있어서,
약 2.5% (w/w)의 양의 프로게스테론;
약 15% (w/w)의 양의 중쇄 오일; 및
약 5% (w/w)의 범위의 양의 d-리모넨을 포함하는 경피 약학적 조성물. - 제 1항에 있어서, 에스트라디올을 추가로 포함하는 경피 약학적 조성물.
- 제 10항에 있어서, 약 0.001% (w/w) 내지 약 0.5% (w/w)의 범위의 양의 에스트라디올을 포함하는 경피 약학적 조성물.
- 제 10항에 있어서, 약 0.005% (w/w)의 양의 에스트라디올을 포함하는 경피 약학적 조성물.
- 제 10항에 있어서, 약 0.05% (w/w)의 양의 에스트라디올을 포함하는 경피 약학적 조성물.
- 제 1항에 있어서,
약 2.5% (w/w)의 양의 프로게스테론;
약 15% (w/w)의 양의 중쇄 오일로서, 중쇄 오일이 중쇄 트리글리세라이드를 포함하고, 중쇄 트리글리세라이드가 카프릴 트리글리세라이드 및 카프르 트리글리세라이드를 실질적으로 포함하는, 중쇄 오일;
약 5% (w/w)의 양의 d-리모넨;
약 3% (w/w)의 양의 디에틸렌 글리콜 모노에틸 에테르;
약 5% (w/w)의 양의 프로필렌 글리콜 모노라우레이트;
글리세롤 모노스테아레이트 및 PEG-75 스테아레이트를 포함하는, 약 7% (w/w)의 양의 스테아레이트 혼합물;
세틸 알콜, 세테쓰-20, 및 스테아레쓰-20을 포함하는, 약 3.5% (w/w)의 양의 세틸 알콜 혼합물;
약 0.2% (w/w)의 양의 카르보머;
약 3% (w/w)의 양의 레시틴;
약 4% (w/w)의 양의 프로필렌 글리콜;
약 0.2% (w/w)의 양의 메틸 파라벤;
약 0.02% (w/w)의 양의 프로필 파라벤;
약 0.5% (w/w)의 양의 시트르산;
약 0.8% (w/w)의 양의 소듐 포스페이트; 및
정제수를 포함하는 경피 약학적 제형. - 제 14항에 있어서, 약 0.005% (w/w)의 양의 에스트라디올을 추가로 포함하는 경피 약학적 제형.
- 제 1항에 있어서,
약 2.5% (w/w)의 양의 프로게스테론;
약 15% (w/w)의 양의 중쇄 오일로서, 중쇄 오일이 중쇄 트리글리세라이드를 포함하고, 중쇄 트리글리세라이드가 카프릴 트리글리세라이드 및 카프르 트리글리세라이드를 실질적으로 포함하는, 중쇄 오일;
약 5% (w/w)의 양의 d-리모넨;
약 3% (w/w)의 양의 디에틸렌 글리콜 모노에틸 에테르;
약 5% (w/w)의 양의 프로필렌 글리콜 모노라우레이트;
약 0.1% (w/w)의 양의 부틸화된 하이드록시톨루엔;
글리세롤 모노스테아레이트 및 PEG-75 스테아레이트를 포함하는, 약 7% (w/w)의 양의 스테아레이트 혼합물;
세틸 알콜, 세테쓰-20, 및 스테아레쓰-20을 포함하는, 약 3.5% (w/w)의 양의 세틸 알콜 혼합물;
약 0.2% (w/w)의 양의 카르보머;
약 3% (w/w)의 양의 레시틴;
약 4% (w/w)의 양의 프로필렌 글리콜;
약 0.2% (w/w)의 양의 메틸 파라벤;
약 0.02% (w/w)의 양의 프로필 파라벤;
약 0.5% (w/w)의 양의 시트르산;
약 0.8% (w/w)의 양의 소듐 포스페이트; 및
정제수를 포함하는 경피 약학적 제형. - 제 16항에 있어서, 약 0.005% (w/w)의 양의 에스트라디올을 추가로 포함하는 경피 약학적 제형.
- 프로게스테론,
중쇄 오일을 포함하는 용해제, 및
침투 촉진제를 포함하는 경피 약학적 조성물로서, 약학적 조성물이 국소 투여용 크림으로서 제형화되는, 경피 약학적 조성물. - 제 18항에 있어서, 침투 촉진제가 프로필렌 글리콜 모노라우레이트, 디에틸렌 글리콜 모노에틸 에테르, 및 프로필렌 글리콜을 포함하는 경피 약학적 조성물.
- 제 18항에 있어서, 침투 촉진제가 d-리모넨을 추가로 포함하는 경피 약학적 조성물.
- 제 18항에 있어서, 조성물이,
프로게스테론,
중쇄 오일,
프로필렌 글리콜 모노라우레이트,
디에틸렌 글리콜 모노에틸 에테르, 및
프로필렌 글리콜을 포함하고,
약학적 조성물이 국소 투여용 크림으로서 제형화되는 경피 약학적 조성물. - 제 21항에 있어서, 약 1.5% (w/w) 내지 약 3.5% (w/w) 범위의 양의 프로게스테론을 포함하는 경피 약학적 조성물.
- 제 22항에 있어서, 약 2% (w/w) 내지 약 3% (w/w) 범위의 양의 프로게스테론을 포함하는 경피 약학적 조성물.
- 제 18항에 있어서, 중쇄 오일이 중쇄 트리글리세라이드를 포함하고, 중쇄 트리글리세라이드가 카프릴 트리글리세라이드 및 카프르 트리글리세라이드를 실질적으로 포함하는 경피 약학적 조성물.
- 제 21항에 있어서,
약 1.5% (w/w) 내지 약 3.5% (w/w) 범위의 양의 프로게스테론; 및
약 10% (w/w) 내지 약 30% (w/w) 범위의 양의 중쇄 오일을 포함하는 경피 약학적 조성물. - 제 25항에 있어서,
약 2% (w/w) 내지 약 3% (w/w) 범위의 양의 프로게스테론; 및
약 15% (w/w) 내지 약 25% (w/w) 범위의 양의 중쇄 오일을 포함하는 경피 약학적 조성물. - 제 25항에 있어서,
약 2.5% (w/w)의 양의 프로게스테론; 및
약 15% (w/w)의 양의 중쇄 오일을 포함하는 경피 약학적 조성물. - 제 21항에 있어서, 에스트라디올을 추가로 포함하는 경피 약학적 조성물.
- 제 28항에 있어서, 약 0.001% (w/w) 내지 약 0.5% (w/w)의 범위의 양의 에스트라디올을 포함하는 경피 약학적 조성물.
- 제 29항에 있어서, 약 0.005% (w/w)의 양의 에스트라디올을 포함하는 경피 약학적 조성물.
- 제 29항에 있어서, 약 0.05% (w/w)의 양의 에스트라디올을 포함하는 경피 약학적 조성물.
- 제 21항에 있어서,
약 2.5% (w/w)의 양의 프로게스테론;
약 15% (w/w)의 양의 중쇄 오일로서, 중쇄 오일이 중쇄 트리글리세라이드를 포함하고, 중쇄 트리글리세라이드가 카프릴 트리글리세라이드 및 카프르 트리글리세라이드를 실질적으로 포함하는, 중쇄 오일;
약 3% (w/w)의 양의 디에틸렌 글리콜 모노에틸 에테르;
약 5% (w/w)의 양의 프로필렌 글리콜 모노라우레이트;
글리세롤 모노스테아레이트 및 PEG-75 스테아레이트를 포함하는, 약 7% (w/w)의 양의 스테아레이트 혼합물;
세틸 알콜, 세테쓰-20, 및 스테아레쓰-20을 포함하는, 약 3.5% (w/w)의 양의 세틸 알콜 혼합물;
약 0.2% (w/w)의 양의 카르보머;
약 3% (w/w)의 양의 레시틴;
약 4% (w/w)의 양의 프로필렌 글리콜;
약 0.2% (w/w)의 양의 메틸 파라벤;
약 0.02% (w/w)의 양의 프로필 파라벤;
약 0.5% (w/w)의 양의 시트르산;
약 0.8% (w/w)의 양의 소듐 포스페이트; 및
정제수를 포함하는 경피 약학적 제형. - 제 32항에 있어서, 약 0.005% (w/w)의 양의 에스트라디올을 추가로 포함하는 경피 약학적 제형.
- 제 32항에 있어서, 약 0.05% (w/w)의 양의 에스트라디올을 포함하는 경피 약학적 제형.
- 제 21항에 있어서,
약 2.5% (w/w)의 양의 프로게스테론;
약 15% (w/w)의 양의 중쇄 오일로서, 중쇄 오일이 중쇄 트리글리세라이드를 포함하고, 중쇄 트리글리세라이드가 카프릴 트리글리세라이드 및 카프르 트리글리세라이드를 실질적으로 포함하는, 중쇄 오일;
약 3% (w/w)의 양의 디에틸렌 글리콜 모노에틸 에테르;
약 5% (w/w)의 양의 프로필렌 글리콜 모노라우레이트;
약 0.1% (w/w)의 양의 부틸화된 하이드록시톨루엔;
글리세롤 모노스테아레이트 및 PEG-75 스테아레이트를 포함하는, 약 7% (w/w)의 양의 스테아레이트 혼합물;
세틸 알콜, 세테쓰-20, 및 스테아레쓰-20을 포함하는, 약 3.5% (w/w)의 양의 세틸 알콜 혼합물;
약 0.2% (w/w)의 양의 카르보머;
약 3% (w/w)의 양의 레시틴;
약 4% (w/w)의 양의 프로필렌 글리콜;
약 0.2% (w/w)의 양의 메틸 파라벤;
약 0.02% (w/w)의 양의 프로필 파라벤;
약 0.5% (w/w)의 양의 시트르산;
약 0.8% (w/w)의 양의 소듐 포스페이트; 및
정제수를 포함하는 경피 약학적 제형. - 제 35항에 있어서, 약 0.005% (w/w)의 양의 에스트라디올을 추가로 포함하는 경피 약학적 제형.
- 제 35항에 있어서, 약 0.05% (w/w)의 양의 에스트라디올을 추가로 포함하는 경피 약학적 제형.
- 제 1항에 따른 경피 약학적 제형을 대상체에 투여하는 것을 포함하는, 대상체에서 호르몬 결핍증과 관련된 병태를 치료하는 방법.
- 제 19항에 따른 경피 약학적 제형을 대상체에 투여하는 것을 포함하는, 대상체에서 호르몬 결핍증과 관련된 병태를 치료하는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462030540P | 2014-07-29 | 2014-07-29 | |
| US62/030,540 | 2014-07-29 | ||
| US201562152674P | 2015-04-24 | 2015-04-24 | |
| US62/152,674 | 2015-04-24 | ||
| PCT/US2015/042621 WO2016018993A1 (en) | 2014-07-29 | 2015-07-29 | Transdermal cream |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170040209A true KR20170040209A (ko) | 2017-04-12 |
Family
ID=55178912
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177002451A KR20170040209A (ko) | 2014-07-29 | 2015-07-29 | 경피 크림 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US10098894B2 (ko) |
| EP (1) | EP3174542A4 (ko) |
| JP (1) | JP2017523138A (ko) |
| KR (1) | KR20170040209A (ko) |
| AU (1) | AU2015296609A1 (ko) |
| BR (1) | BR112016029338A2 (ko) |
| CA (1) | CA2951284A1 (ko) |
| IL (1) | IL248984A0 (ko) |
| MX (1) | MX2016013693A (ko) |
| RU (1) | RU2016141135A (ko) |
| WO (1) | WO2016018993A1 (ko) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2782015C (en) | 2009-12-11 | 2020-08-25 | Neuron Systems, Inc. | Topical ophthalmic compositions and methods for the treatment of macular degeneration |
| LT2782584T (lt) | 2011-11-23 | 2021-09-10 | Therapeuticsmd, Inc. | Natūralios kombinuotos pakaitinės hormonų terapijos kompozicijos ir gydymas |
| US9301920B2 (en) | 2012-06-18 | 2016-04-05 | Therapeuticsmd, Inc. | Natural combination hormone replacement formulations and therapies |
| US10806697B2 (en) | 2012-12-21 | 2020-10-20 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US10806740B2 (en) | 2012-06-18 | 2020-10-20 | Therapeuticsmd, Inc. | Natural combination hormone replacement formulations and therapies |
| US10537581B2 (en) | 2012-12-21 | 2020-01-21 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US9180091B2 (en) | 2012-12-21 | 2015-11-10 | Therapeuticsmd, Inc. | Soluble estradiol capsule for vaginal insertion |
| US11266661B2 (en) | 2012-12-21 | 2022-03-08 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US10568891B2 (en) | 2012-12-21 | 2020-02-25 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US11246875B2 (en) | 2012-12-21 | 2022-02-15 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US10471072B2 (en) | 2012-12-21 | 2019-11-12 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| AU2015264003A1 (en) | 2014-05-22 | 2016-11-17 | Therapeuticsmd, Inc. | Natural combination hormone replacement formulations and therapies |
| US10328087B2 (en) * | 2015-07-23 | 2019-06-25 | Therapeuticsmd, Inc. | Formulations for solubilizing hormones |
| WO2017173071A1 (en) | 2016-04-01 | 2017-10-05 | Therapeuticsmd, Inc. | Steroid hormone pharmaceutical composition |
| US20170281647A1 (en) * | 2016-04-01 | 2017-10-05 | Therapeuticsmd, Inc. | Steroid hormone compositions in medium chain oils |
| US10286077B2 (en) | 2016-04-01 | 2019-05-14 | Therapeuticsmd, Inc. | Steroid hormone compositions in medium chain oils |
| KR20180123165A (ko) * | 2016-04-01 | 2018-11-14 | 쎄러퓨틱스엠디, 인코퍼레이티드 | 스테로이드 호르몬 약제학적 조성물 |
| CA3077362A1 (en) | 2017-10-10 | 2019-04-18 | Aldeyra Therapeutics, Inc. | Treatment of inflammatory disorders |
| WO2020028820A1 (en) * | 2018-08-03 | 2020-02-06 | Aldeyra Therapeutics, Inc. | Topical compositions and methods of preparation and use |
| US12006298B2 (en) | 2018-08-06 | 2024-06-11 | Aldeyra Therapeutics, Inc. | Polymorphic compounds and uses thereof |
| US12098132B2 (en) | 2019-05-02 | 2024-09-24 | Aldeyra Therapeutics, Inc. | Process for preparation of aldehyde scavenger and intermediates |
| CA3137301A1 (en) | 2019-05-02 | 2020-11-05 | Aldeyra Therapeutics, Inc. | Polymorphic compounds and uses thereof |
| US11633405B2 (en) | 2020-02-07 | 2023-04-25 | Therapeuticsmd, Inc. | Steroid hormone pharmaceutical formulations |
| EP4149470A4 (en) | 2020-05-13 | 2024-04-24 | Aldeyra Therapeutics, Inc. | PHARMACEUTICAL FORMULATIONS AND USES THEREOF |
| IT202200005462A1 (it) * | 2022-03-21 | 2023-09-21 | Green Innovation Gmbh | Veterinary topical composition for the antimicrobic treatment of dairy animal udders / composizione topica veterinaria per il trattamento antimicrobico delle mammelle degli animali da latte |
Family Cites Families (322)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB589946A (en) | 1945-04-05 | 1947-07-03 | Paul Alphonse Hubert Mossay | Improvements connected with controlling means for electric hoisting motors |
| GB848881A (en) | 1955-12-27 | 1960-09-21 | Upjohn Co | Improvements in or relating to hormone compositions and the preparation thereof |
| US3948254A (en) | 1971-11-08 | 1976-04-06 | Alza Corporation | Novel drug delivery device |
| US3971367A (en) | 1972-12-27 | 1976-07-27 | Alza Corporation | Intrauterine device having means for changing from uterine-retentive shape to nonuterine-retentive shape |
| US3921636A (en) | 1973-01-15 | 1975-11-25 | Alza Corp | Novel drug delivery device |
| FR2408345A1 (fr) | 1976-11-30 | 1979-06-08 | Besins Jean Louis | Nouvelle composition a action anti-conceptionnelle |
| US4310510A (en) | 1976-12-27 | 1982-01-12 | Sherman Kenneth N | Self administrable anti-fertility composition |
| GB1589946A (en) | 1977-12-14 | 1981-05-20 | Kali Chemie Pharma Gmbh | Enterally absorbable preparations and process for the production thereof |
| US4372951A (en) | 1979-10-11 | 1983-02-08 | Nichols Vorys | Vaginal delivery for physiologic follicular-luteal steroid treatment |
| US5140021A (en) | 1986-04-16 | 1992-08-18 | Genesis Systems Corporation | Method and dosage form for treatment of premenstrual syndrome |
| US6139868A (en) | 1986-08-28 | 2000-10-31 | Lts Lohmann Therapie-Systeme Gmbh & Co. Kg | Transdermal therapeutic system, its use and production process |
| US4865848A (en) | 1987-02-26 | 1989-09-12 | Alza Corporation | Skin permeation enhancer compositions using sucrose esters |
| US4788062A (en) | 1987-02-26 | 1988-11-29 | Alza Corporation | Transdermal administration of progesterone, estradiol esters, and mixtures thereof |
| US4900734A (en) | 1987-08-27 | 1990-02-13 | Maxson Wayne S | Novel pharmaceutical composition containing estradiol and progesterone for oral administration |
| US5064654A (en) | 1989-01-11 | 1991-11-12 | Ciba-Geigy Corporation | Mixed solvent mutually enhanced transdermal therapeutic system |
| US5474783A (en) | 1988-03-04 | 1995-12-12 | Noven Pharmaceuticals, Inc. | Solubility parameter based drug delivery system and method for altering drug saturation concentration |
| US5164416A (en) * | 1989-02-03 | 1992-11-17 | Lintec Corporation | Transdermal therapeutic formulation containing a limonene |
| US4973468A (en) | 1989-03-22 | 1990-11-27 | Cygnus Research Corporation | Skin permeation enhancer compositions |
| GB9113726D0 (en) | 1991-06-25 | 1991-08-14 | Inst Of Animal Physiology And | Artificial animal foster mothers |
| MX9301121A (es) | 1992-03-02 | 1993-09-01 | Schering Ag | Metodo y equipo para la contracepcion oral y regulacion de la menstruacion con estrogeno/progestina/aniprogestina. |
| US5843979A (en) | 1993-02-25 | 1998-12-01 | Bristol-Myers Squibb Company | Transdermal treatment with mast cell degranulating agents for drug-induced hypersensitivity |
| SE9301171D0 (sv) | 1993-04-07 | 1993-04-07 | Ab Astra | Pharmaceutical composition containing lipophilic drugs |
| US5595970A (en) | 1993-07-16 | 1997-01-21 | Schering Aktiengesellschaft | Treatment of climacteric disorders with nitric oxide synthase substrates and/or donors |
| US5543150A (en) | 1993-09-15 | 1996-08-06 | Columbia Laboratories, Inc. | Method of progesterone delivery and affect thereof |
| AU679794B2 (en) | 1993-09-29 | 1997-07-10 | Alza Corporation | Monoglyceride/lactate ester permeation enhancer for oxybutynin |
| DE4344463A1 (de) | 1993-12-22 | 1995-06-29 | Schering Ag | Kombinationsprodukt zur Kontrazeption |
| GB9405304D0 (en) | 1994-03-16 | 1994-04-27 | Scherer Ltd R P | Delivery systems for hydrophobic drugs |
| US5811416A (en) | 1994-06-06 | 1998-09-22 | Board Of Regents The University Of Texas System | Endothelin antagonist and/or endothelin synthase inhibitor in combination with a progestin, an estrogen, a cyclooxygenase inhibitor, or a nitric acid donor or substrate |
| FR2722102B1 (fr) | 1994-07-11 | 1996-08-23 | Cird Galderma | Utilisation de particules creuses deformables dans une composition cosmetique et/ou dermatologique, contenant des matieres grasses |
| US5633011A (en) | 1994-08-04 | 1997-05-27 | Alza Corporation | Progesterone replacement therapy |
| US6613757B1 (en) | 1994-09-22 | 2003-09-02 | Board Of Regents, The University Of Texas System | Combination of prostacyclin with an estrogen or progestin for the prevention and treatment of atherosclerotic vascular disease including preeclampsia and for the treatment of hypertension, and for hormone replacement therapy |
| US5565199A (en) | 1995-02-07 | 1996-10-15 | Page; Elliot W. | Systems and methods for the synthesis of natural base steroidal hormones and more especially estrogens and progesterone and estrogen-like and progesterone-like compounds and their derivatives derived as phytohormones from herbaceous plants |
| US5609617A (en) | 1995-02-21 | 1997-03-11 | C. Norman Shealy | Method for enhancement of dehydroepiandrosterone |
| FR2732223B1 (fr) | 1995-03-30 | 1997-06-13 | Sanofi Sa | Composition pharmaceutique pour administration transdermique |
| US5882676A (en) | 1995-05-26 | 1999-03-16 | Alza Corporation | Skin permeation enhancer compositions using acyl lactylates |
| US7833543B2 (en) | 1995-06-07 | 2010-11-16 | Durect Corporation | High viscosity liquid controlled delivery system and medical or surgical device |
| US5747058A (en) | 1995-06-07 | 1998-05-05 | Southern Biosystems, Inc. | High viscosity liquid controlled delivery system |
| US5780050A (en) | 1995-07-20 | 1998-07-14 | Theratech, Inc. | Drug delivery compositions for improved stability of steroids |
| DE19526864A1 (de) | 1995-07-22 | 1997-01-23 | Labtec Gmbh | Hormonpflaster |
| US5840327A (en) | 1995-08-21 | 1998-11-24 | Alza Corporation | Transdermal drug delivery device having enhanced adhesion |
| US5898038A (en) | 1996-03-19 | 1999-04-27 | Board Of Regents, The University Of Texas System | Treatment of osteoporosis and metabolic bone disorders with nitric oxide substrate and/or donors |
| FR2747042B1 (fr) | 1996-04-05 | 1998-06-05 | Besins Iscovesco Lab | Medicament a base de progesterone et d'oestradiol |
| EP0954260A1 (en) | 1996-05-22 | 1999-11-10 | Diversified Pharmaceuticals, Inc. | Compositions, methods and devices for the transdermal delivery of drugs |
| US5744463A (en) | 1996-06-03 | 1998-04-28 | Bair; Glenn O. | Treatment of side effects of progestins and progesterone analogues used for birth control |
| IT1283102B1 (it) * | 1996-06-06 | 1998-04-07 | Permatec Nv | Composizione terapeutica per la somministrazione transdermica di un principio attivo estrogeno o progestinico o di loro miscele |
| US6139873A (en) | 1996-07-10 | 2000-10-31 | Cedars-Sinai Medical Center | Combined pharmaceutical estrogen-androgen-progestin |
| US6228852B1 (en) | 1996-07-12 | 2001-05-08 | Carolyn V. Shaak | Transdermal application of naturally occurring steroid hormones |
| JP2002505736A (ja) | 1996-09-06 | 2002-02-19 | ネーデルランドセ・オルガニザテイエ・フール・テゲパスト―ナトウールベテンシヤツペリーク・オンデルツエク・テイエヌオー | 抗受胎薬またはエストロゲンおよび/またはプロゲステロンの置換もしくは補充の副作用のスクリーニング法 |
| ES2260802T3 (es) | 1996-10-18 | 2006-11-01 | Arizona Chemical Company | Geles de poliamida terminada en esteres. |
| US5985861A (en) | 1996-11-04 | 1999-11-16 | Columbia Laboratories, Inc. | Progesterone for treating or reducing ischemia |
| US5814329A (en) | 1996-11-12 | 1998-09-29 | Polytherapeutics, Inc. | Hydrophilic polystyrene graft copolymer vehicle for intravaginal administration of pharmacologically active agents |
| FR2759292B1 (fr) | 1997-02-10 | 2000-08-11 | Cird Galderma | Utilisation de retinoides en tant qu'agents induisant la pigmentation |
| US6056972A (en) | 1997-02-26 | 2000-05-02 | Dimera, Llc | Method for reducing coronary artery reactivity |
| IT1291362B1 (it) | 1997-05-13 | 1999-01-07 | Vectorpharma Int | Composizioni farmaceutiche multicomponente bifasiche contenenti sostanze atte a modificare la partizione dei principi attivi |
| US20040234606A1 (en) | 1997-09-12 | 2004-11-25 | Levine Howard L. | Localized vaginal delivery without detrimental blood levels |
| US5968919A (en) | 1997-10-16 | 1999-10-19 | Macrochem Corporation | Hormone replacement therapy drug formulations for topical application to the skin |
| US6306914B1 (en) | 1997-10-21 | 2001-10-23 | Columbia Laboratories, Inc. | Progestin therapy for maintaining amenorrhea |
| US6193991B1 (en) | 1997-10-29 | 2001-02-27 | Atul J. Shukla | Biodegradable delivery systems of biologically active substances |
| WO1999022680A1 (en) | 1997-11-03 | 1999-05-14 | Deschutes Medical Products, Inc. | Pessary with medicated cartridge |
| FR2772617B1 (fr) | 1997-12-19 | 2001-03-09 | Besins Iscovesco Lab | Comprime de progesterone et son procede de preparation |
| US6030948A (en) | 1997-12-19 | 2000-02-29 | Mann; Morris A. | Hair regeneration compositions for treatment of alopecia and methods of application related thereto |
| US6267984B1 (en) | 1997-12-22 | 2001-07-31 | Alza Corporation | Skin permeation enhancer compositions comprising a monoglyceride and ethyl palmitate |
| IT1298575B1 (it) | 1998-02-06 | 2000-01-12 | Vectorpharma Int | Composizioni farmaceutiche in forma di nanoparticelle comprendenti sostanze lipidiche e sostanze antifiliche e relativo processo di |
| FR2775599B1 (fr) | 1998-03-09 | 2001-08-17 | Besins Iscovesco Lab | Composition pharmaceutique a base de progesterone naturelle de synthese et d'oestradiol et son procede de preparation |
| FR2776191B1 (fr) | 1998-03-23 | 2002-05-31 | Theramex | Composition hormonale topique a effet systemique |
| FR2777784B1 (fr) | 1998-04-27 | 2004-03-19 | Arepa | Composition pharmaceutique a base d'estrogene et de progesterone |
| US6277418B1 (en) | 1998-06-02 | 2001-08-21 | Baylor College Of Medicine | Corn extract contraceptive |
| FR2779438B1 (fr) | 1998-06-03 | 2004-12-24 | Jean Marc Aiache | Gel stable, son procede de preparation, et compositions pharmaceutiques le comprenant |
| WO1999062497A1 (en) * | 1998-06-03 | 1999-12-09 | Aiache Jean Marc | Stable gel mixture in the form of a mixture of oleogel and aqueous gel |
| US6465445B1 (en) | 1998-06-11 | 2002-10-15 | Endorecherche, Inc. | Medical uses of a selective estrogen receptor modulator in combination with sex steroid precursors |
| DE19827732A1 (de) | 1998-06-22 | 1999-12-23 | Rottapharm Bv | Transdermales System vom Matrix-Typ zur Abgabe von Wirkstoffen mit einer hohen Abgaberate von Steroid-Hormonen und die Verwendung eines derartigen Systems zur Hormonersatztherapie |
| AU4972599A (en) | 1998-07-07 | 2000-01-24 | Transdermal Technologies, Inc. | Compositions for rapid and non-irritating transdermal delivery of pharmaceutically active agents and methods for formulating such compositions and delivery thereof |
| US6124362A (en) | 1998-07-17 | 2000-09-26 | The Procter & Gamble Company | Method for regulating hair growth |
| US7374779B2 (en) | 1999-02-26 | 2008-05-20 | Lipocine, Inc. | Pharmaceutical formulations and systems for improved absorption and multistage release of active agents |
| US6248363B1 (en) | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| US20030104048A1 (en) | 1999-02-26 | 2003-06-05 | Lipocine, Inc. | Pharmaceutical dosage forms for highly hydrophilic materials |
| US6294192B1 (en) | 1999-02-26 | 2001-09-25 | Lipocine, Inc. | Triglyceride-free compositions and methods for improved delivery of hydrophobic therapeutic agents |
| US20030236236A1 (en) | 1999-06-30 | 2003-12-25 | Feng-Jing Chen | Pharmaceutical compositions and dosage forms for administration of hydrophobic drugs |
| US6303132B1 (en) | 1999-07-16 | 2001-10-16 | Ardell H. Nelson | Administering progesterone using EMU oil |
| EP1217975A1 (en) | 1999-09-08 | 2002-07-03 | Watson Pharmaceuticals, Inc. | Using quaternary ammonium salts for transdermal drug delivery |
| US6610674B1 (en) | 1999-09-28 | 2003-08-26 | University Of Pennsylvania | Method of treating inflammatory conditions with progesterone analogs |
| US6479545B1 (en) | 1999-09-30 | 2002-11-12 | Drugtech Corporation | Formulation for menopausal women |
| US6720001B2 (en) | 1999-10-18 | 2004-04-13 | Lipocine, Inc. | Emulsion compositions for polyfunctional active ingredients |
| US20030180352A1 (en) | 1999-11-23 | 2003-09-25 | Patel Mahesh V. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| US7384650B2 (en) | 1999-11-24 | 2008-06-10 | Agile Therapeutics, Inc. | Skin permeation enhancement composition for transdermal hormone delivery system |
| US6708822B1 (en) | 1999-11-30 | 2004-03-23 | Cutispharma, Inc. | Compositions and kits for compounding pharmaceuticals |
| US6562370B2 (en) | 1999-12-16 | 2003-05-13 | Dermatrends, Inc. | Transdermal administration of steroid drugs using hydroxide-releasing agents as permeation enhancers |
| US6544553B1 (en) | 1999-12-28 | 2003-04-08 | Watson Pharmaceuticals, Inc. | Dosage forms and methods for oral delivery of progesterone |
| GB0000313D0 (en) | 2000-01-10 | 2000-03-01 | Astrazeneca Uk Ltd | Formulation |
| RU2342145C2 (ru) | 2000-01-28 | 2008-12-27 | Андорешерш, Инк. | Селективные модуляторы рецептора эстрогена в комбинации с эстрогенами |
| US6562790B2 (en) | 2000-02-05 | 2003-05-13 | Chein Edmund Y M | Hormone therapy methods and hormone products for abating coronary artery blockage |
| AU3982601A (en) | 2000-02-23 | 2001-09-03 | Orentreich Foundation For The | Methods and compositions for the treatment of alopecia and other disorders of the pilosebaceous apparatus |
| WO2001072262A2 (en) | 2000-03-27 | 2001-10-04 | Schott Glas | New cosmetic, personal care, cleaning agent, and nutritional supplement compositions comprising bioactive glass and methods of making and using the same |
| GB0015617D0 (en) | 2000-06-26 | 2000-08-16 | Vectura Ltd | Improved preparations for dermal delivery of active substances |
| US6420352B1 (en) | 2000-07-19 | 2002-07-16 | W. Roy Knowles | Hair loss prevention |
| JP2004504342A (ja) | 2000-07-24 | 2004-02-12 | ファルマシア・アンド・アップジョン・カンパニー | 極めて水不溶性の脂肪親和性薬剤用の自己乳化性ドラッグデリバリーシステム |
| US20020035070A1 (en) | 2000-07-26 | 2002-03-21 | The Procter & Gamble Company | Method of regulating hair growth using metal complexes of oxidized carbohydrates |
| US20020119174A1 (en) | 2000-07-26 | 2002-08-29 | Gardlik John Michael | Compositions useful for regulating hair growth containing metal complexes of oxidized carbohydrates |
| AR030312A1 (es) | 2000-08-03 | 2003-08-20 | Antares Pharma Ipl Ag | Composicion novedosa para la administracion transdermica y/o transmucosica de compuestos activos, que asegura adecuados niveles terapeuticos |
| FR2814074B1 (fr) | 2000-09-15 | 2003-03-07 | Theramex | Nouvelles compositions estro-progestatives topiques a effet systemique |
| US20040043043A1 (en) | 2000-09-20 | 2004-03-04 | Schlyter Jimmy Hirschsprung | Preparation of emulsions and concentrates thereof |
| US6635274B1 (en) | 2000-10-27 | 2003-10-21 | Biochemics, Inc. | Solution-based transdermal drug delivery system |
| US6682757B1 (en) | 2000-11-16 | 2004-01-27 | Euro-Celtique, S.A. | Titratable dosage transdermal delivery system |
| EP1333824B1 (en) | 2000-11-17 | 2005-09-07 | Warner-Lambert Company LLC | Treatment of sexual dysfunction with bombesin receptor antagonists |
| US6743448B2 (en) | 2000-12-11 | 2004-06-01 | Abraham H. Kryger | Topical testosterone formulations and associated methods |
| FR2818905A1 (fr) | 2000-12-28 | 2002-07-05 | Cll Pharma | Compositions pharmaceutiques colloidales micellaires renfermant un principe actif lipophile |
| US7381427B2 (en) | 2001-02-09 | 2008-06-03 | Mickey Miller | Seborrheic keratosis treatment |
| FR2821555B1 (fr) | 2001-03-01 | 2003-05-16 | Besins Int Lab | Progestatif co-micronise avec un tensioactif, composition pharmaceutique le comprenant, leurs procedes de fabrication et leurs utilisations |
| FR2828102B1 (fr) | 2001-03-28 | 2004-07-09 | Ifc Sa | Utilisation des lipoaminoacides dans une composition pharmaceutique comme promoteur et systeme disperse a usage pharmaceutique contenant de tels composes |
| US20040131670A1 (en) | 2001-04-17 | 2004-07-08 | Ping Gao | Pellicle-resistant gelatin capsule |
| US20070021360A1 (en) | 2001-04-24 | 2007-01-25 | Nyce Jonathan W | Compositions, formulations and kit with anti-sense oligonucleotide and anti-inflammatory steroid and/or obiquinone for treatment of respiratory and lung disesase |
| US20050209208A1 (en) | 2001-04-25 | 2005-09-22 | The Regents Of The University Of California | Use of estriol and other estranes, estrogens and estrogen receptor active compositions in the treatment of psoriasis and other autoimmune disorders |
| US20120322779A9 (en) | 2001-04-25 | 2012-12-20 | Rhonda Voskuhl | Estriol Therapy for Autoimmune and Neurodegenerative Diseases and Disorders |
| US7094228B2 (en) | 2001-07-31 | 2006-08-22 | Zars, Inc. | Methods and formulations for photodynamic therapy |
| EP1455888B1 (en) | 2001-08-29 | 2009-04-29 | PharmaKodex Limited | Topical administration device |
| AU2002340120A1 (en) | 2001-10-04 | 2003-04-14 | Cellegy Pharmaceuticals, Inc. | Semisolid topical hormonal compositions and methods for treatment |
| FR2832065B1 (fr) | 2001-11-13 | 2004-11-05 | Besins Int Belgique | Composition pharmaceutique a base de progesterone micronisee son procede de preparation et ses utilisations |
| DE10159120B4 (de) | 2001-12-01 | 2006-08-17 | Lts Lohmann Therapie-Systeme Ag | Steroidhormonhaltige transdermale therapeutische Systeme enthaltend Propylenglycolmonocaprylat und seine Verwendung |
| WO2003057128A2 (en) | 2001-12-11 | 2003-07-17 | Dor Biopharma, Inc. | Lipid particles and suspensions and uses thereof |
| ES2188426B1 (es) | 2001-12-12 | 2004-11-16 | Rosalia Pidal Fernandez | Composicion farmaceutica para el tratamiento de la psoriasis y otras dermopatias. |
| DE60222803T2 (de) | 2001-12-21 | 2008-07-17 | Supernus Pharmaceuticals, Inc. | Orale kapselformulierung mit verbesserter physikalischer stabilität |
| AU2003208679A1 (en) | 2002-02-08 | 2003-09-02 | Advanced Animal Technology Limited | Control of a biological function |
| EP1482946A1 (en) | 2002-03-14 | 2004-12-08 | Watson Pharmaceuticals, Inc. | Progesterone oral drug delivery system |
| IL164163A0 (en) | 2002-04-09 | 2005-12-18 | Pharmacia Corp | Process for preparing a finely self-emulsifiable pharmaceutical composition |
| CA2480268A1 (en) | 2002-04-23 | 2003-11-06 | Nutrition 21, Inc. | Chromium compositions and methods for using the same for inhibiting drug-induced insulin resistance |
| US20050131005A1 (en) | 2002-04-30 | 2005-06-16 | Jiabing Wang | 4-azasteroid derivatives as androgen receptor modulators |
| KR100533458B1 (ko) | 2002-07-20 | 2005-12-07 | 대화제약 주식회사 | 파클리탁셀의 가용화용 조성물 및 그의 제조 방법 |
| AU2002950713A0 (en) | 2002-08-09 | 2002-09-12 | Vital Health Sciences Pty Ltd | Carrier |
| US6967194B1 (en) | 2002-09-18 | 2005-11-22 | Susan Matsuo | Bio-identical hormones and method of use |
| US7704518B2 (en) | 2003-08-04 | 2010-04-27 | Foamix, Ltd. | Foamable vehicle and pharmaceutical compositions thereof |
| WO2004037843A2 (en) | 2002-10-25 | 2004-05-06 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Steroid compounds comprising superoxide dismutase mimic groups and nitric oxide donor groups, and their use in the preparation of medicaments |
| DE10249853A1 (de) | 2002-10-25 | 2004-05-13 | Liedtke, Rainer K., Dr. | Pflasterartige Chip-Systeme zur thermodynamischen Kontrolle topisch dermaler und transdermaler Systeme |
| US20070292359A1 (en) | 2002-10-25 | 2007-12-20 | Foamix Ltd. | Polypropylene glycol foamable vehicle and pharmaceutical compositions thereof |
| US7820145B2 (en) | 2003-08-04 | 2010-10-26 | Foamix Ltd. | Oleaginous pharmaceutical and cosmetic foam |
| US20070292461A1 (en) | 2003-08-04 | 2007-12-20 | Foamix Ltd. | Oleaginous pharmaceutical and cosmetic foam |
| US20080206161A1 (en) | 2002-10-25 | 2008-08-28 | Dov Tamarkin | Quiescent foamable compositions, steroids, kits and uses thereof |
| US20040138103A1 (en) | 2002-11-07 | 2004-07-15 | Procyte Corporation | Compositions containing peptide copper complexes and metalloproteinase inhibitors and methods related thereto |
| US20040115287A1 (en) | 2002-12-17 | 2004-06-17 | Lipocine, Inc. | Hydrophobic active agent compositions and methods |
| US20050031651A1 (en) | 2002-12-24 | 2005-02-10 | Francine Gervais | Therapeutic formulations for the treatment of beta-amyloid related diseases |
| FR2849380A1 (fr) | 2002-12-27 | 2004-07-02 | Ernest Loumaye | NOUVELLE UTILISATION D'UN AGONISTE DU GnRH |
| US7572780B2 (en) | 2003-01-21 | 2009-08-11 | Dimera, Incorporated | Method and kit for reducing the symptoms of peripheral vascular disease |
| US7858607B2 (en) | 2003-03-14 | 2010-12-28 | Mamchur Stephen A | System for use by compounding pharmacists to produce hormone replacement medicine customized for each consumer |
| US20040191207A1 (en) | 2003-03-31 | 2004-09-30 | Lipari John M. | Alpha-hydroxy acid ester drug delivery compositions and methods of use |
| EP1620060B1 (en) | 2003-04-29 | 2010-03-24 | The General Hospital Corporation | Methods and devices for the sustained release of multiple drugs |
| US20040253319A1 (en) | 2003-06-11 | 2004-12-16 | Shrirang Netke | Pharmaceutical compositions and method for alleviating side-effects of estrogen replacement therapy |
| PL1820494T3 (pl) | 2003-06-13 | 2010-07-30 | Skendi Finance Ltd | Mikrocząstki składające się z estradiolu i cholesterolu |
| US20040259852A1 (en) | 2003-06-18 | 2004-12-23 | White Hillary D. | Trandsdermal compositions and methods for treatment of fibromyalgia and chronic fatigue syndrome |
| US20110318405A1 (en) | 2003-06-25 | 2011-12-29 | Charles Erwin | Chemical Combination and Method for Increasing Delivery of Coenzyme Q10 |
| ES2237298B1 (es) | 2003-07-16 | 2006-11-01 | Italfarmaco, S.A. | Formulaciones mucoadhesivas semisolidas. |
| US20050020552A1 (en) | 2003-07-16 | 2005-01-27 | Chaim Aschkenasy | Pharmaceutical composition and method for transdermal drug delivery |
| US8795693B2 (en) | 2003-08-04 | 2014-08-05 | Foamix Ltd. | Compositions with modulating agents |
| US20080069779A1 (en) | 2003-08-04 | 2008-03-20 | Foamix Ltd. | Foamable vehicle and vitamin and flavonoid pharmaceutical compositions thereof |
| DK1660009T3 (en) | 2003-09-03 | 2015-04-27 | Miscon Trading S A | METHODS OF TREATING ENDOMETRIOSIS |
| HUP0303313A2 (hu) | 2003-10-09 | 2005-07-28 | Richter Gedeon Vegyészeti Gyár Rt. | Transzdermális gyógyszerkészítmények |
| TW200517114A (en) | 2003-10-15 | 2005-06-01 | Combinatorx Inc | Methods and reagents for the treatment of immunoinflammatory disorders |
| US20050101579A1 (en) | 2003-11-06 | 2005-05-12 | Shippen Eugene R. | Endometriosis treatment protocol |
| PT1530965E (pt) | 2003-11-11 | 2006-05-31 | Udo Mattern | Sistema de administracao de libertacao controlada de hormonas sexuais para aplicacao nasal |
| US20050186183A1 (en) | 2003-12-08 | 2005-08-25 | Deangelo Joseph | Stabilized products, processes and devices for preparing same |
| IL159729A0 (en) | 2004-01-06 | 2004-06-20 | Doron I Friedman | Non-aqueous composition for oral delivery of insoluble bioactive agents |
| US20050182105A1 (en) | 2004-02-04 | 2005-08-18 | Nirschl Alexandra A. | Method of using 3-cyano-4-arylpyridine derivatives as modulators of androgen receptor function |
| US7820702B2 (en) | 2004-02-04 | 2010-10-26 | Bristol-Myers Squibb Company | Sulfonylpyrrolidine modulators of androgen receptor function and method |
| MY142989A (en) | 2004-03-10 | 2011-02-14 | Bayer Schering Pharma Ag | Stabilised supersaturated solids of lipophilic drugs |
| WO2005087194A1 (en) | 2004-03-10 | 2005-09-22 | Schering Aktiengesellschaft | Compositions comprising drospirenone molecularly dispersed |
| US20050220825A1 (en) | 2004-03-10 | 2005-10-06 | Adrian Funke | Molecular dispersions of drospirenone |
| WO2005105107A2 (en) | 2004-04-21 | 2005-11-10 | Roby Russell R | Hormone treatment of multiple sclerosis |
| US20050239747A1 (en) | 2004-04-21 | 2005-10-27 | Pharmaceutical Industry Technology And Development Center | Compositions and methods of enhanced transdermal delivery of steroid compounds and preparation methods |
| US20050244522A1 (en) | 2004-04-30 | 2005-11-03 | Carrara Dario Norberto R | Permeation enhancer comprising genus Curcuma or germacrone for transdermal and topical administration of active agents |
| US20050250746A1 (en) | 2004-05-06 | 2005-11-10 | Matthew Iammatteo | Premenstrual dysphoric disorder medication |
| FR2870125B1 (fr) | 2004-05-12 | 2010-03-26 | Dermaconcept Jmc | Formulation du type spot-on utile en cosmetologie et en dermatologie |
| US20070196453A1 (en) | 2004-06-07 | 2007-08-23 | Jie Zhang | Two or more non-volatile solvent-containing compositions and methods for dermal delivery of drugs |
| US7879830B2 (en) | 2004-09-02 | 2011-02-01 | Wiley Teresa S | Hormone replacement composition and method |
| US20070167418A1 (en) | 2004-09-07 | 2007-07-19 | Ferguson Steven W | Progesterone/testosterone cream for erectile dysfunction |
| US8252321B2 (en) | 2004-09-13 | 2012-08-28 | Chrono Therapeutics, Inc. | Biosynchronous transdermal drug delivery for longevity, anti-aging, fatigue management, obesity, weight loss, weight management, delivery of nutraceuticals, and the treatment of hyperglycemia, alzheimer's disease, sleep disorders, parkinson's disease, aids, epilepsy, attention deficit disorder, nicotine addiction, cancer, headache and pain control, asthma, angina, hypertension, depression, cold, flu and the like |
| US20060058238A1 (en) | 2004-09-15 | 2006-03-16 | Lee Laurent-Applegate | Fetal skin cell protein compositions for the treatment of skin conditions, disorders or diseases and methods of making and using the same |
| WO2006036899A2 (en) | 2004-09-27 | 2006-04-06 | Corium International, Inc. | Transdermal systems for the delivery of estrogens and progestins |
| US20060110415A1 (en) | 2004-11-22 | 2006-05-25 | Bioderm Research | Topical Delivery System for Cosmetic and Pharmaceutical Agents |
| US20060134188A1 (en) | 2004-12-20 | 2006-06-22 | Hans-Peter Podhaisky | Transdermal pharmaceutical preparation with a progesterone A-specific ligand (PRASL) as active ingredient |
| US8703198B2 (en) | 2005-03-02 | 2014-04-22 | Aquatrove Biosciences | Water-based personal moisturizers and lubricants, in particular vaginal lubricants, and uses thereof |
| US7473687B2 (en) | 2005-03-24 | 2009-01-06 | Emory University | Methods for the treatment of a traumatic central nervous system injury |
| RU2429850C2 (ru) | 2005-04-15 | 2011-09-27 | Кларус Терапьютикс, Инк. | Фармацевтические системы доставки для гидрофобных лекарственных средств и композиций, их содержащих |
| US20060252049A1 (en) | 2005-05-04 | 2006-11-09 | Shuler Richard O | Growth-promoting and immunizing subcutaneous implant |
| ATE543489T1 (de) | 2005-05-26 | 2012-02-15 | Teva Womens Health Inc | Orale dosierformen mit progesteron und verwendungs- und herstellungsverfahren dafür |
| NZ563946A (en) | 2005-06-03 | 2012-02-24 | Acrux Dds Pty Ltd | Testosterone containing non-occlusive transdermal drug delivery composition for application to the arm pit / axilla |
| ITBO20050388A1 (it) | 2005-06-06 | 2006-12-07 | Alfa Wassermann Spa | Formulazione mucoadesive utili in dispositivi medici in preparazioni farmaceutiche |
| US20060280795A1 (en) | 2005-06-08 | 2006-12-14 | Dexcel Pharma Technologies, Ltd. | Specific time-delayed burst profile delivery system |
| US10137135B2 (en) | 2005-08-15 | 2018-11-27 | Allergan Sales, Llc | Formulations and methods for providing progestin-only contraception while minimizing adverse side effects associated therewith |
| US8372806B2 (en) | 2005-10-06 | 2013-02-12 | Pantec Biosolutions Ag | Transdermal delivery system for treating infertility |
| IE20050723A1 (en) | 2005-10-28 | 2007-05-30 | Patrick T Prendergast | Anti-mineralocorticoid therapy of infection |
| GB0524961D0 (en) | 2005-12-07 | 2006-01-18 | Pharmakodex Ltd | Transdermal administration of active agents for systemic effect |
| EP1976869A2 (en) | 2005-12-23 | 2008-10-08 | Partnership&Corp. Technology Transfer | Synthetic peptides for use as inhibitors of neurotransmitter secretion and as inducers of muscle relaxation |
| BRPI0706280A2 (pt) | 2006-01-05 | 2011-03-22 | Lifecycle Pharma As | produto de comprimido carregável desintegrante, e, método para a preparação de um comprimido carregável desintegrante |
| CA2637608A1 (en) | 2006-01-20 | 2007-07-26 | Pear Tree Pharmaceuticals, Inc. | Method of treating atrophic vaginitis |
| CA2645080A1 (en) | 2006-03-07 | 2007-09-13 | Novavax,Inc. | Nanoemulsions of poorly soluble pharmaceutical active ingredients and methods of making the same |
| CN101466355A (zh) | 2006-04-07 | 2009-06-24 | 诺瓦瓦克斯股份有限公司 | 具有抗细菌、抗真菌、抗酵母和/或抗病毒性质的纳米化组合物 |
| WO2007120868A2 (en) | 2006-04-14 | 2007-10-25 | Stanley Kepka | Bioavailability enhancement of lipophilic drug by use solvent system |
| EP2010145A2 (en) | 2006-04-25 | 2009-01-07 | Croda, Inc. | Modification of percutaneous absorption of topically active materials |
| WO2007143607A2 (en) | 2006-06-02 | 2007-12-13 | Pear Tree Women's Health Care | Method of treating atrophic vaginitis |
| US20080095831A1 (en) | 2006-08-10 | 2008-04-24 | Mc Graw Thomas L | Topical formulation of multilamellar vesicles composition for percutaneous absorption of pharmaceutically active agent |
| JP2010502690A (ja) | 2006-09-08 | 2010-01-28 | フォーミックス エルティーディー. | 有色または着色可能発泡性組成物 |
| PT2068825E (pt) | 2006-10-04 | 2011-02-11 | M & P Patent Ag | Sistema de administração de libertação controlada para aplicação nasal de neurotransmissores |
| CA2669094A1 (en) | 2006-11-08 | 2008-05-29 | Novavax,Inc. | Method of preparing solid dosage forms of multi-phasic pharmaceutical compositions |
| US20080260655A1 (en) | 2006-11-14 | 2008-10-23 | Dov Tamarkin | Substantially non-aqueous foamable petrolatum based pharmaceutical and cosmetic compositions and their uses |
| EP2097065A2 (en) | 2006-11-29 | 2009-09-09 | Foamix Ltd. | Foamable waterless compositions with modulating agents |
| CN101541326A (zh) | 2006-11-29 | 2009-09-23 | 惠氏公司 | 雌激素/选择性雌激素受体调节剂(serm)和雌激素/孕酮双层药片 |
| US20080132475A1 (en) | 2006-12-05 | 2008-06-05 | Charles Gerald Connor | Treatment for dry eye |
| US9918934B2 (en) | 2006-12-12 | 2018-03-20 | Edgar Joel Acosta-Zara | Linker-based lecithin microemulsion delivery vehicles |
| WO2008079898A1 (en) | 2006-12-20 | 2008-07-03 | Pharmwest, Inc. | Methods and topical formulations comprising colloidal metal for treating or preventing skin conditions |
| GB2445539A (en) | 2006-12-29 | 2008-07-16 | Ardana Bioscience Ltd | Bigel composition |
| CN101631536A (zh) | 2007-01-12 | 2010-01-20 | 惠氏公司 | 片中片组合物 |
| MX2009007742A (es) | 2007-01-22 | 2009-07-27 | Novavax Inc | Formulaciones farmaceuticas multi-fasicas de farmacos pobremente solubles en agua para una biodisponibilidad oral de variabilidad alimentada/en ayunas reducida y mejorada. |
| US8828981B2 (en) | 2007-02-06 | 2014-09-09 | George Creasy | Progesterone for the treatment or prevention of spontaneous preterm birth |
| IL181217A0 (en) | 2007-02-08 | 2007-07-04 | Haim Levy | Pharmaceuticalcompositions based on a microemulsion |
| EP2136787B1 (en) | 2007-03-22 | 2019-08-21 | Berg LLC | Topical formulations having enhanced bioavailability |
| US20090017120A1 (en) | 2007-03-23 | 2009-01-15 | Humco Holding Group, Inc. | Phase stable lecithin organogel composition |
| DK2148681T3 (en) | 2007-04-20 | 2016-07-04 | Preglem Sa | Selective progesteronmodulatorer in the treatment of uterine bleeding |
| WO2008140794A1 (en) | 2007-05-11 | 2008-11-20 | The Texas A & M University System | Hormone normalization therapy and uses thereof |
| US20080312197A1 (en) | 2007-06-14 | 2008-12-18 | Rodriguez Gustavo C | Pharmaceutical products containing hormones and a 25-hydroxy vitamin d compound |
| WO2008156365A1 (en) | 2007-06-21 | 2008-12-24 | Pantarhei Bioscience B.V. | Treatment of meconium aspiration syndrome with estrogens |
| CN101790379A (zh) | 2007-06-27 | 2010-07-28 | 萨摩斯药品有限责任公司 | 生物活性物质的多日传递 |
| US8636982B2 (en) | 2007-08-07 | 2014-01-28 | Foamix Ltd. | Wax foamable vehicle and pharmaceutical compositions thereof |
| US8268806B2 (en) | 2007-08-10 | 2012-09-18 | Endorecherche, Inc. | Pharmaceutical compositions |
| EP2205236A4 (en) | 2007-09-06 | 2012-08-22 | Regain Biotechnology Pvt Ltd | NEW MEANS FOR THE TREATMENT OF DISEASES AND FUNCTIONAL DISORDERS |
| AR068409A1 (es) | 2007-09-14 | 2009-11-18 | Drugtech Corp | Composiciones farmaceuticas, transdermicas sin alcohol |
| KR101083696B1 (ko) | 2007-09-20 | 2011-11-15 | 가부시키가이샤 시세이도 | 경피 흡수 제제 |
| WO2009040818A1 (en) | 2007-09-25 | 2009-04-02 | Solubest Ltd | Compositions comprising lipophilic active compounds and method for their preparation |
| CA2702082A1 (en) | 2007-10-08 | 2009-04-16 | Fovea Pharmaceuticals Sa | Aqueous ophthalmic formulations |
| US20090130029A1 (en) | 2007-11-21 | 2009-05-21 | Foamix Ltd. | Glycerol ethers vehicle and pharmaceutical compositions thereof |
| CA2744906A1 (en) | 2007-11-29 | 2009-06-04 | Gregg A. Jackson | Progesterone-containing compositions and devices |
| WO2010041141A2 (en) | 2008-10-07 | 2010-04-15 | Foamix Ltd. | Oil-based foamable carriers and formulations |
| WO2009090558A2 (en) | 2008-01-14 | 2009-07-23 | Foamix Ltd. | Poloxamer foamable pharmaceutical compositions with active agents and/or therapeutic cells and uses |
| GB0802403D0 (en) | 2008-02-08 | 2008-03-12 | Probiox Sa | Compositions for the treatment of oxidative stress |
| CN102056611A (zh) | 2008-04-14 | 2011-05-11 | Posi维森纳里解决方案有限责任公司 | 用于获得不同的治疗适应症所需要的血浆孕酮水平的方法和药物组合物 |
| ES2327201B1 (es) | 2008-04-23 | 2010-07-23 | Ignacio Umbert Millet | Composicion farmaceutica personalizada para el rejuvenecimiento de la piel que contiene acido retinoico. |
| TWI477276B (zh) | 2008-04-28 | 2015-03-21 | Repros Therapeutics Inc | 抗黃體素給藥方案 |
| GB0807605D0 (en) | 2008-04-28 | 2008-06-04 | Diurnal Ltd | Lipid composition |
| US20090285869A1 (en) | 2008-05-14 | 2009-11-19 | Humco Holding Group, Inc. | Salt stable lecithin organogel composition |
| US20100028360A1 (en) | 2008-07-26 | 2010-02-04 | Craig Stephen Atwood | Methods for the modulation of brain progestagen signaling in the prevention and treatment of neurological disorders and neurodegenerative diseases |
| TW201008569A (en) | 2008-08-08 | 2010-03-01 | Bayer Schering Pharma Ag | Progestin-containing drug delivery system |
| CA2734521A1 (en) | 2008-08-28 | 2010-03-04 | Dermtech International | Determining age ranges of skin samples |
| EP2218447B1 (en) | 2008-11-04 | 2017-04-19 | PharmaSol GmbH | Compositions containing lipid micro- or nanoparticles for the enhancement of the dermal action of solid particles |
| KR101181563B1 (ko) | 2008-11-14 | 2012-09-10 | 에스케이케미칼주식회사 | 고분자 미립구의 제조방법 및 그 방법에 의해 제조된 고분자 미립구 |
| JP5813511B2 (ja) | 2008-12-06 | 2015-11-17 | イントラ−セルラー・セラピーズ・インコーポレイテッドIntra−Cellular Therapies, Inc. | 有機化合物 |
| MA32940B1 (fr) | 2008-12-06 | 2012-01-02 | Intra Cellular Therapies Inc | Composes organiques |
| KR20110098730A (ko) | 2008-12-06 | 2011-09-01 | 인트라-셀룰라 써래피스, 인코퍼레이티드. | 유기 화합물 |
| JP5778582B2 (ja) | 2008-12-06 | 2015-09-16 | イントラ−セルラー・セラピーズ・インコーポレイテッドIntra−Cellular Therapies, Inc. | 有機化合物 |
| ES2551133T3 (es) | 2008-12-06 | 2015-11-16 | Intra-Cellular Therapies, Inc. | Compuestos de 4,5,7,8-tetrahidro-4-oxo-2H-imidazo[1,2-a]pirrolo[3,4-e]pirimidina como inhibidores de PDE1 |
| WO2010065151A1 (en) | 2008-12-06 | 2010-06-10 | Intra-Cellular Therapies, Inc. | Organic compounds |
| US9498431B2 (en) | 2008-12-10 | 2016-11-22 | Jianjian Xu | Controlled releasing composition |
| WO2010080543A1 (en) | 2008-12-18 | 2010-07-15 | Guthery B Eugene | Acne vulgaris treatment regimen |
| WO2010083239A2 (en) | 2009-01-13 | 2010-07-22 | Truitt Edward R Iii | Therapeutic modulation of vaginal epithelium boundary lubrication |
| WO2010088409A2 (en) | 2009-01-30 | 2010-08-05 | Emory University | Methods of neuroprotection using neuroprotective steroids and a vitamin d |
| US9005608B2 (en) | 2009-03-24 | 2015-04-14 | Adds Pharmaceuticals Llc | Stabilized solubility-enhanced formulations for oral delivery |
| WO2010111488A1 (en) | 2009-03-27 | 2010-09-30 | Agile Therapeutics, Inc. | Transdermal delivery |
| WO2010117873A2 (en) | 2009-04-06 | 2010-10-14 | Banner Pharmacaps, Inc. | Progesterone solutions for increased bioavailability |
| EP2419138A4 (en) | 2009-04-14 | 2013-08-21 | Medortus Uk Ltd | GEL COMPOSITIONS FOR THE ADMINISTRATION OF PHARMACEUTICALLY ACTIVE COMPOUNDS |
| US20100273730A1 (en) | 2009-04-27 | 2010-10-28 | Innopharmax, Inc. | Self-emulsifying pharmaceutical compositions of hydrophilic drugs and preparation thereof |
| GB0908129D0 (en) | 2009-05-12 | 2009-06-24 | Innovata Ltd | Composition |
| US8658628B2 (en) | 2009-06-18 | 2014-02-25 | Karan Y. Baucom | Hormone delivery system and method |
| FR2947178B1 (fr) | 2009-06-29 | 2012-07-06 | Effik | Composition pharmaceutique a base de progesterone micronisee et ses utilisations |
| CN101940790B (zh) | 2009-07-01 | 2012-07-25 | 润和生物医药科技(汕头)有限公司 | 一种新型促渗剂组合物及其在透皮给药系统中的应用 |
| US8618083B2 (en) | 2009-07-31 | 2013-12-31 | Duquesne University Of The Holy Spirit | Combination hormone replacement therapy (HRT) and melatonin to prevent and treat mammary cancer |
| CN102686205A (zh) | 2009-10-02 | 2012-09-19 | 弗艾米克斯有限公司 | 局部四环素组合物 |
| US20110086825A1 (en) | 2009-10-13 | 2011-04-14 | Chatroux Sylvia S | Therapeutic vaginal emollient |
| US10080760B2 (en) | 2009-10-27 | 2018-09-25 | Besins Healthcare Luxembourg Sarl | Transdermal pharmaceutical compositions comprising active agents |
| WO2011073995A2 (en) | 2009-12-14 | 2011-06-23 | Lincoln Pharmaceuticals Limited | Liquid vaginal spray of progesterone |
| BR112012014059B1 (pt) | 2009-12-17 | 2020-03-10 | The Population Council Inc. | Gel transdérmico de progestina / estradiol |
| WO2011112747A1 (en) | 2010-03-09 | 2011-09-15 | Catholic Healthcare West | Methods for inhibiting preterm labor and uterine contractility disorders and preventing cervical ripening |
| CA2794734C (en) | 2010-03-30 | 2017-12-12 | Phosphagenics Limited | Transdermal delivery patch |
| TW201138782A (en) | 2010-04-26 | 2011-11-16 | Besins Healthcare Lu Sarl | Low-oil pharmaceutical emulsion compositions comprising progestogen |
| US9763948B2 (en) | 2010-05-31 | 2017-09-19 | Intra-Cellular Therapies, Inc. | PDE1 inhibitory compounds and methods |
| US9434730B2 (en) | 2010-05-31 | 2016-09-06 | Intra-Cellular Therapies, Inc. | PDE1 inhibitor compounds |
| TW201206937A (en) | 2010-05-31 | 2012-02-16 | Intra Cellular Therapies Inc | Organic compounds |
| US9371327B2 (en) | 2010-05-31 | 2016-06-21 | Intra-Cellular Therapies, Inc. | PDE1 inhibitor compounds |
| BRPI1002601E2 (pt) | 2010-06-01 | 2020-06-30 | Embrapa Pesquisa Agropecuaria | composição nanoestruturada de uso veterinário para administração de fármacos |
| JP2012020991A (ja) | 2010-06-16 | 2012-02-02 | Takasago Internatl Corp | 経皮吸収促進剤、及びこれを含有する皮膚外用製剤 |
| BR112012031906A2 (pt) | 2010-06-17 | 2016-08-23 | Momenta Pharmaceuticals Inc | métodos e composições para modular o crescimento de cabelo e pelos. |
| US20110312928A1 (en) | 2010-06-18 | 2011-12-22 | Lipocine Inc. | Progesterone Containing Oral Dosage Forms and Related Methods |
| US20110312927A1 (en) | 2010-06-18 | 2011-12-22 | Satish Kumar Nachaegari | Progesterone Containing Oral Dosage Forms and Related Methods |
| US8741373B2 (en) | 2010-06-21 | 2014-06-03 | Virun, Inc. | Compositions containing non-polar compounds |
| BRPI1002486B1 (pt) | 2010-07-22 | 2017-07-18 | Evidence Soluções Farmacêuticas Ltda Epp | Stabilized topical composition and process of obtaining composition stable topic |
| US20120046264A1 (en) | 2010-08-17 | 2012-02-23 | Biosante Pharmaceuticals, Inc. | Commercial scale production methods for transdermal hormone formulations |
| US20120101073A1 (en) | 2010-10-22 | 2012-04-26 | Galleon Pharmaceutical, Inc. | Novel Method For Treating Breathing Disorders or Diseases |
| US20120295911A1 (en) | 2010-11-29 | 2012-11-22 | Galleon Pharmaceuticals, Inc. | Novel Compounds and Compositions for Treatment of Breathing Control Disorders or Diseases |
| BR112013014021A8 (pt) | 2010-12-06 | 2017-10-03 | Follica Inc | Métodos para tratamento de calvície e promoção de crescimento de cabelos |
| KR20140003573A (ko) | 2011-01-24 | 2014-01-09 | 안테리오스, 인코퍼레이티드 | 오일 조성물 |
| US20140031323A1 (en) | 2011-02-15 | 2014-01-30 | Ramiro M. Perez | Transdermal hormone composition and combined static-cyclic delivery |
| AU2012223720A1 (en) | 2011-03-03 | 2013-09-26 | Vanderbilt University | 6-alkyl-n-(pyridin-2-yl)-4-aryloxypicolinamide analogs as mGluR5 negative allosteric modulators and methods of making and using the same |
| WO2012127501A2 (en) | 2011-03-11 | 2012-09-27 | Sanzyme Limited | Composition for improving endometrial thickness during ovarian stimulation |
| KR20230041081A (ko) | 2011-05-15 | 2023-03-23 | 에이세러스 바이오파마 인크. | 비내용 테스토스테론 바이오-접착제 겔 제형 및 남성의 성선기능저하증을 치료하기 위한 그의 용도 |
| US9084797B2 (en) | 2011-05-23 | 2015-07-21 | Besins Healthcare Luxembourg Sarl | Progesterone treatment for improving sleep quality |
| WO2012166909A1 (en) | 2011-06-03 | 2012-12-06 | Galleon Pharmaceuticals, Inc. | Compositions and methods for treating breathing control disorders or diseases |
| WO2012171016A1 (en) | 2011-06-10 | 2012-12-13 | Intra-Cellular Therapies, Inc. | Organic compounds |
| EP2734189B1 (en) | 2011-07-20 | 2018-08-22 | Perrigo Israel Pharmaceuticals Ltd. | Topical oily foam compositions |
| US8951996B2 (en) | 2011-07-28 | 2015-02-10 | Lipocine Inc. | 17-hydroxyprogesterone ester-containing oral compositions and related methods |
| KR101494594B1 (ko) | 2011-08-30 | 2015-02-23 | 주식회사 종근당 | 약리학적 활성물질의 서방성 지질 초기제제 및 이를 포함하는 약제학적 조성물 |
| JP6316749B2 (ja) | 2011-11-04 | 2018-04-25 | アジル・セラピューティクス・インコーポレイテッドAgile Therapeutics, Inc. | 経皮送達のための組成物および方法 |
| US20130122051A1 (en) | 2011-11-15 | 2013-05-16 | Pharmaceutics International, Inc. | Methods of preparing progesterone pharmaceutical compositions |
| WO2013112947A1 (en) | 2012-01-26 | 2013-08-01 | Therapeuticsmd, Inc. | Transdermal hormone replacement therapies |
| US9301920B2 (en) | 2012-06-18 | 2016-04-05 | Therapeuticsmd, Inc. | Natural combination hormone replacement formulations and therapies |
| LT2782584T (lt) * | 2011-11-23 | 2021-09-10 | Therapeuticsmd, Inc. | Natūralios kombinuotos pakaitinės hormonų terapijos kompozicijos ir gydymas |
| US9334538B2 (en) | 2011-12-06 | 2016-05-10 | Annabelle Rodriguez Oquendo | Method for pre-screening and correlation of underlying SCARB1 gene variation to infertility in women and therapeutic use of progestational and other medications in treatment |
| US9282995B2 (en) | 2011-12-22 | 2016-03-15 | Previvo Genetics, Llc | Recovery and processing of human embryos formed in vivo |
| EP2630952A1 (en) | 2012-02-23 | 2013-08-28 | Novagali Pharma S.A. | Self-preserved oil dispersions comprising boric acid |
| US20130224268A1 (en) | 2012-02-27 | 2013-08-29 | Newgen Biopharma Corp. | Topical delivery of hormonal and non hormonal nano formulations, methods of making and using the same |
| US20130225412A1 (en) | 2012-02-28 | 2013-08-29 | Soroush Sardari Lodriche | Silicon nanocarrier for delivery of drug, pesticides and herbicides , and for waste water treatment |
| IN2014DN08088A (ko) | 2012-02-29 | 2015-05-01 | Braun Melsungen Ag | |
| WO2013149258A2 (en) | 2012-03-30 | 2013-10-03 | Charles Drew University of Medicine and Science | Compositions and methods for treating or preventing metabolic syndrome disorders |
| WO2013158454A2 (en) | 2012-04-18 | 2013-10-24 | Siemens Healthcare Diagnostics Inc. | Compounds and methods for preparation of conjugate reagents |
| EP2846755A1 (en) | 2012-05-09 | 2015-03-18 | SiO2 Medical Products, Inc. | Saccharide protective coating for pharmaceutical package |
| US10806697B2 (en) | 2012-12-21 | 2020-10-20 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| US10806740B2 (en) | 2012-06-18 | 2020-10-20 | Therapeuticsmd, Inc. | Natural combination hormone replacement formulations and therapies |
| US20130338122A1 (en) | 2012-06-18 | 2013-12-19 | Therapeuticsmd, Inc. | Transdermal hormone replacement therapies |
| EP3909586A1 (en) | 2012-06-18 | 2021-11-17 | TherapeuticsMD, Inc. | Soluble estradiol capsule for vaginal insertion |
| WO2014009434A1 (en) | 2012-07-11 | 2014-01-16 | Sandoz Ag | Self-microemulsifying drug delivery system of abiraterone or abiraterone acetate |
| US9220680B2 (en) | 2012-07-13 | 2015-12-29 | South Dakota State University | Compositions and methods for localized drug delivery through mammary papillae |
| NZ704247A (en) | 2012-07-27 | 2018-04-27 | Glia Llc | Compositions and treatment for eye diseases and disorders |
| AU2013295549B2 (en) | 2012-07-27 | 2018-04-19 | Izumi Technology, Llc | Efflux inhibitor compositions and methods of treatment using the same |
| WO2014052792A1 (en) | 2012-09-28 | 2014-04-03 | Sio2 Medical Products, Inc. | Halogenated or parylene polymer coating |
| WO2014076569A2 (en) | 2012-11-14 | 2014-05-22 | Trimel Biopharma Srl | Controlled release topical testosterone formulations and methods |
| US9180091B2 (en) | 2012-12-21 | 2015-11-10 | Therapeuticsmd, Inc. | Soluble estradiol capsule for vaginal insertion |
| US10537581B2 (en) | 2012-12-21 | 2020-01-21 | Therapeuticsmd, Inc. | Vaginal inserted estradiol pharmaceutical compositions and methods |
| KR101586789B1 (ko) | 2012-12-28 | 2016-01-19 | 주식회사 종근당 | 양이온성 약리학적 활성물질의 서방성 지질 초기제제 및 이를 포함하는 약제학적 조성물 |
-
2015
- 2015-07-29 AU AU2015296609A patent/AU2015296609A1/en not_active Abandoned
- 2015-07-29 JP JP2016571728A patent/JP2017523138A/ja active Pending
- 2015-07-29 KR KR1020177002451A patent/KR20170040209A/ko unknown
- 2015-07-29 CA CA2951284A patent/CA2951284A1/en not_active Abandoned
- 2015-07-29 EP EP15827543.8A patent/EP3174542A4/en not_active Withdrawn
- 2015-07-29 BR BR112016029338A patent/BR112016029338A2/pt not_active Application Discontinuation
- 2015-07-29 RU RU2016141135A patent/RU2016141135A/ru not_active Application Discontinuation
- 2015-07-29 MX MX2016013693A patent/MX2016013693A/es unknown
- 2015-07-29 WO PCT/US2015/042621 patent/WO2016018993A1/en active Application Filing
- 2015-07-29 US US14/812,179 patent/US10098894B2/en active Active
-
2016
- 2016-11-15 IL IL248984A patent/IL248984A0/en unknown
-
2018
- 2018-09-07 US US16/125,201 patent/US20190070197A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP3174542A1 (en) | 2017-06-07 |
| IL248984A0 (en) | 2017-01-31 |
| WO2016018993A1 (en) | 2016-02-04 |
| MX2016013693A (es) | 2017-10-31 |
| US10098894B2 (en) | 2018-10-16 |
| RU2016141135A3 (ko) | 2019-05-07 |
| BR112016029338A2 (pt) | 2017-08-22 |
| RU2016141135A (ru) | 2018-08-28 |
| US20190070197A1 (en) | 2019-03-07 |
| EP3174542A4 (en) | 2018-01-03 |
| JP2017523138A (ja) | 2017-08-17 |
| US20160030449A1 (en) | 2016-02-04 |
| CA2951284A1 (en) | 2016-02-04 |
| AU2015296609A1 (en) | 2016-12-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20190070197A1 (en) | Transdermal cream | |
| US10912783B2 (en) | Formulations for solubilizing hormones | |
| US11116717B2 (en) | Soluble estradiol capsule for vaginal insertion | |
| JP5727494B2 (ja) | 活性剤を含む経皮医薬組成物 | |
| US9931349B2 (en) | Steroid hormone pharmaceutical composition | |
| CA2207144C (en) | A novel composition for transdermal administration of an estrogen, a progestin or a mixture thereof | |
| US20050152956A1 (en) | Method of increasing testosterone and related steroid concentrations in women | |
| AU778889B2 (en) | Novel topical oestroprogestational compositions with systemic effect | |
| EP2861073B1 (en) | Soluble estradiol capsule for vaginal insertion | |
| JP2010511730A (ja) | テストステロンおよびプロゲスターゲンを用いたドライアイのための処置 | |
| KR20170005819A (ko) | 천연 복합 호르몬 대체 제형 및 요법 | |
| KR20030048021A (ko) | 여성의 테스토스테론 및 관련된 스테로이드의 농도를증가시키는 방법 | |
| DE60223795T2 (de) | Tetrahydroxyliertes Östrogen enthaltendes Arzneistoffverabreichungssystem zur Verwendung in der hormonalen Kontrazeption | |
| WO2008089405A1 (en) | Composition of multiple hormones delivered vaginally in a single cream | |
| WO2005018582A2 (en) | Compositions containing topical active agents and pentylene glycol | |
| RU2286787C2 (ru) | Способ повышения концентрации тестостерона и родственных стероидов у женщин | |
| PL214858B1 (pl) | Środek leczniczy na bazie noretysteronu lub jego farmaceutycznie dopuszczalnej pochodnej i estradiolu lub jego farmaceutycznie dopuszczalnej pochodnej |