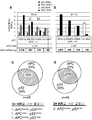
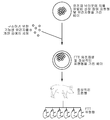
KR20170003585A - 돼지에서 멀티플렉스 유전자 편집 - Google Patents
돼지에서 멀티플렉스 유전자 편집 Download PDFInfo
- Publication number
- KR20170003585A KR20170003585A KR1020167032557A KR20167032557A KR20170003585A KR 20170003585 A KR20170003585 A KR 20170003585A KR 1020167032557 A KR1020167032557 A KR 1020167032557A KR 20167032557 A KR20167032557 A KR 20167032557A KR 20170003585 A KR20170003585 A KR 20170003585A
- Authority
- KR
- South Korea
- Prior art keywords
- gene
- cell
- cells
- animal
- embryo
- Prior art date
Links
- 241000282898 Sus scrofa Species 0.000 title claims description 14
- 238000010362 genome editing Methods 0.000 title description 29
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 288
- 241001465754 Metazoa Species 0.000 claims abstract description 183
- 238000000034 method Methods 0.000 claims abstract description 177
- 210000004027 cell Anatomy 0.000 claims description 303
- 108700028369 Alleles Proteins 0.000 claims description 153
- 210000001161 mammalian embryo Anatomy 0.000 claims description 98
- 108020004414 DNA Proteins 0.000 claims description 89
- 108010042407 Endonucleases Proteins 0.000 claims description 60
- 102100031780 Endonuclease Human genes 0.000 claims description 57
- 241000251539 Vertebrata <Metazoa> Species 0.000 claims description 49
- -1 IL2Rgy Proteins 0.000 claims description 47
- 102100022054 Hepatocyte nuclear factor 4-alpha Human genes 0.000 claims description 43
- 239000013611 chromosomal DNA Substances 0.000 claims description 43
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 38
- 241000282887 Suidae Species 0.000 claims description 35
- 244000144972 livestock Species 0.000 claims description 35
- 108091033409 CRISPR Proteins 0.000 claims description 34
- 210000002257 embryonic structure Anatomy 0.000 claims description 34
- 238000004519 manufacturing process Methods 0.000 claims description 32
- 210000002459 blastocyst Anatomy 0.000 claims description 26
- 230000002068 genetic effect Effects 0.000 claims description 26
- 206010016165 failure to thrive Diseases 0.000 claims description 25
- 238000010367 cloning Methods 0.000 claims description 22
- 241000283690 Bos taurus Species 0.000 claims description 19
- 241000894007 species Species 0.000 claims description 19
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 claims description 18
- 239000003550 marker Substances 0.000 claims description 18
- 238000006467 substitution reaction Methods 0.000 claims description 18
- 238000010354 CRISPR gene editing Methods 0.000 claims description 17
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 claims description 17
- 241000271566 Aves Species 0.000 claims description 16
- 108010017070 Zinc Finger Nucleases Proteins 0.000 claims description 15
- 238000011084 recovery Methods 0.000 claims description 15
- 230000006798 recombination Effects 0.000 claims description 14
- 238000005215 recombination Methods 0.000 claims description 14
- 108010043471 Core Binding Factor Alpha 2 Subunit Proteins 0.000 claims description 12
- 101000819074 Homo sapiens Transcription factor GATA-4 Proteins 0.000 claims description 12
- 102100021380 Transcription factor GATA-4 Human genes 0.000 claims description 12
- 238000000338 in vitro Methods 0.000 claims description 12
- 241000283707 Capra Species 0.000 claims description 11
- 102100022676 Nuclear receptor subfamily 4 group A member 2 Human genes 0.000 claims description 11
- 241000283973 Oryctolagus cuniculus Species 0.000 claims description 11
- 102100041030 Pancreas/duodenum homeobox protein 1 Human genes 0.000 claims description 11
- 241001494479 Pecora Species 0.000 claims description 11
- 210000000130 stem cell Anatomy 0.000 claims description 11
- 241000282472 Canis lupus familiaris Species 0.000 claims description 10
- 241000282326 Felis catus Species 0.000 claims description 10
- 102100027875 Homeobox protein Nkx-2.5 Human genes 0.000 claims description 10
- 101000632197 Homo sapiens Homeobox protein Nkx-2.5 Proteins 0.000 claims description 10
- 101000595674 Homo sapiens Pituitary homeobox 3 Proteins 0.000 claims description 10
- 102100036088 Pituitary homeobox 3 Human genes 0.000 claims description 10
- 101710183548 Pyridoxal 5'-phosphate synthase subunit PdxS Proteins 0.000 claims description 10
- 238000003209 gene knockout Methods 0.000 claims description 10
- 241000251468 Actinopterygii Species 0.000 claims description 9
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 claims description 9
- 238000010459 TALEN Methods 0.000 claims description 9
- 210000004102 animal cell Anatomy 0.000 claims description 9
- 102100030074 Dickkopf-related protein 1 Human genes 0.000 claims description 8
- 101000864646 Homo sapiens Dickkopf-related protein 1 Proteins 0.000 claims description 8
- 102100024755 T-box transcription factor TBX5 Human genes 0.000 claims description 8
- 108010017842 Telomerase Proteins 0.000 claims description 8
- 210000001671 embryonic stem cell Anatomy 0.000 claims description 8
- 230000021121 meiosis Effects 0.000 claims description 8
- 102100026234 Cytokine receptor common subunit gamma Human genes 0.000 claims description 7
- 102100036869 Diacylglycerol O-acyltransferase 1 Human genes 0.000 claims description 7
- 108050004099 Diacylglycerol O-acyltransferase 1 Proteins 0.000 claims description 7
- 102100022057 Hepatocyte nuclear factor 1-alpha Human genes 0.000 claims description 7
- 101001055227 Homo sapiens Cytokine receptor common subunit gamma Proteins 0.000 claims description 7
- 101000872170 Homo sapiens Polycomb complex protein BMI-1 Proteins 0.000 claims description 7
- 102100033566 Polycomb complex protein BMI-1 Human genes 0.000 claims description 7
- 241000700159 Rattus Species 0.000 claims description 7
- 108010043645 Transcription Activator-Like Effector Nucleases Proteins 0.000 claims description 7
- 102000002664 Core Binding Factor Alpha 2 Subunit Human genes 0.000 claims description 6
- 102100039579 ETS translocation variant 2 Human genes 0.000 claims description 6
- 102100030334 Friend leukemia integration 1 transcription factor Human genes 0.000 claims description 6
- 101000813735 Homo sapiens ETS translocation variant 2 Proteins 0.000 claims description 6
- 101001062996 Homo sapiens Friend leukemia integration 1 transcription factor Proteins 0.000 claims description 6
- 101001038339 Homo sapiens LIM homeobox transcription factor 1-alpha Proteins 0.000 claims description 6
- 101001109698 Homo sapiens Nuclear receptor subfamily 4 group A member 2 Proteins 0.000 claims description 6
- 102100040290 LIM homeobox transcription factor 1-alpha Human genes 0.000 claims description 6
- 102100025373 Runt-related transcription factor 1 Human genes 0.000 claims description 6
- 102100030810 Tumor necrosis factor receptor superfamily member EDAR Human genes 0.000 claims description 6
- 230000009036 growth inhibition Effects 0.000 claims description 6
- 102100032360 Alstrom syndrome protein 1 Human genes 0.000 claims description 5
- 102100023994 Beta-1,3-galactosyltransferase 6 Human genes 0.000 claims description 5
- 102100027321 Beta-1,4-galactosyltransferase 7 Human genes 0.000 claims description 5
- 102100033743 Biotin-[acetyl-CoA-carboxylase] ligase Human genes 0.000 claims description 5
- 102100022595 Broad substrate specificity ATP-binding cassette transporter ABCG2 Human genes 0.000 claims description 5
- 108010050543 Calcium-Sensing Receptors Proteins 0.000 claims description 5
- 102100035435 Ceramide synthase 3 Human genes 0.000 claims description 5
- 102100022204 DNA-dependent protein kinase catalytic subunit Human genes 0.000 claims description 5
- 102100035219 Epidermal growth factor receptor kinase substrate 8-like protein 3 Human genes 0.000 claims description 5
- 102100035650 Extracellular calcium-sensing receptor Human genes 0.000 claims description 5
- 102100031758 Extracellular matrix protein 1 Human genes 0.000 claims description 5
- 102100033365 Growth hormone-releasing hormone receptor Human genes 0.000 claims description 5
- 102100036738 Guanine nucleotide-binding protein subunit alpha-11 Human genes 0.000 claims description 5
- 101000937508 Homo sapiens Beta-1,4-galactosyltransferase 7 Proteins 0.000 claims description 5
- 101000619536 Homo sapiens DNA-dependent protein kinase catalytic subunit Proteins 0.000 claims description 5
- 101000876699 Homo sapiens Epidermal growth factor receptor kinase substrate 8-like protein 3 Proteins 0.000 claims description 5
- 101000914673 Homo sapiens Fanconi anemia group A protein Proteins 0.000 claims description 5
- 101000918487 Homo sapiens Fumarylacetoacetase Proteins 0.000 claims description 5
- 101001072407 Homo sapiens Guanine nucleotide-binding protein subunit alpha-11 Proteins 0.000 claims description 5
- 101000632178 Homo sapiens Homeobox protein Nkx-2.1 Proteins 0.000 claims description 5
- 101000856513 Homo sapiens Inactive N-acetyllactosaminide alpha-1,3-galactosyltransferase Proteins 0.000 claims description 5
- 101001076292 Homo sapiens Insulin-like growth factor II Proteins 0.000 claims description 5
- 101001026979 Homo sapiens Keratin, type II cuticular Hb5 Proteins 0.000 claims description 5
- 101000825740 Homo sapiens SLIT and NTRK-like protein 1 Proteins 0.000 claims description 5
- 101001041393 Homo sapiens Serine protease HTRA1 Proteins 0.000 claims description 5
- 101000948265 Homo sapiens Spliceosome-associated protein CWC15 homolog Proteins 0.000 claims description 5
- 101000941170 Homo sapiens U6 snRNA phosphodiesterase 1 Proteins 0.000 claims description 5
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 claims description 5
- 102100025509 Inactive N-acetyllactosaminide alpha-1,3-galactosyltransferase Human genes 0.000 claims description 5
- 102100025947 Insulin-like growth factor II Human genes 0.000 claims description 5
- 102100040445 Keratin, type I cytoskeletal 14 Human genes 0.000 claims description 5
- 102100037381 Keratin, type II cuticular Hb5 Human genes 0.000 claims description 5
- 102100024629 Laminin subunit beta-3 Human genes 0.000 claims description 5
- 102100040406 Lysophosphatidic acid receptor 6 Human genes 0.000 claims description 5
- 102100027320 Methylcrotonoyl-CoA carboxylase beta chain, mitochondrial Human genes 0.000 claims description 5
- 102000007530 Neurofibromin 1 Human genes 0.000 claims description 5
- 108010085793 Neurofibromin 1 Proteins 0.000 claims description 5
- 102100029331 Plakophilin-1 Human genes 0.000 claims description 5
- 102100029000 Prolactin receptor Human genes 0.000 claims description 5
- 102100030944 Protein-glutamine gamma-glutamyltransferase K Human genes 0.000 claims description 5
- 102000001183 RAG-1 Human genes 0.000 claims description 5
- 108060006897 RAG1 Proteins 0.000 claims description 5
- 108700008625 Reporter Genes Proteins 0.000 claims description 5
- 102100020890 Rho GTPase-activating protein 31 Human genes 0.000 claims description 5
- 102100022832 SLIT and NTRK-like protein 1 Human genes 0.000 claims description 5
- 102100021119 Serine protease HTRA1 Human genes 0.000 claims description 5
- 102100036029 Spliceosome-associated protein CWC15 homolog Human genes 0.000 claims description 5
- 102100033085 TERF1-interacting nuclear factor 2 Human genes 0.000 claims description 5
- 102100027881 Tumor protein 63 Human genes 0.000 claims description 5
- 102100031314 U6 snRNA phosphodiesterase 1 Human genes 0.000 claims description 5
- 108020000963 Uroporphyrinogen-III synthase Proteins 0.000 claims description 5
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 claims description 5
- 230000004069 differentiation Effects 0.000 claims description 5
- 108010058734 transglutaminase 1 Proteins 0.000 claims description 5
- KFVINGKPXQSPNP-UHFFFAOYSA-N 4-amino-2-[2-(diethylamino)ethyl]-n-propanoylbenzamide Chemical compound CCN(CC)CCC1=CC(N)=CC=C1C(=O)NC(=O)CC KFVINGKPXQSPNP-UHFFFAOYSA-N 0.000 claims description 4
- 102100034111 Activin receptor type-1 Human genes 0.000 claims description 4
- 102100036601 Aggrecan core protein Human genes 0.000 claims description 4
- 102100034452 Alternative prion protein Human genes 0.000 claims description 4
- 102100039109 Amelogenin, Y isoform Human genes 0.000 claims description 4
- 102100031323 Anthrax toxin receptor 1 Human genes 0.000 claims description 4
- 101001125931 Arabidopsis thaliana Plastidial pyruvate kinase 2 Proteins 0.000 claims description 4
- 102100027971 Arachidonate 12-lipoxygenase, 12R-type Human genes 0.000 claims description 4
- 102100036465 Autoimmune regulator Human genes 0.000 claims description 4
- 102100022976 B-cell lymphoma/leukemia 11A Human genes 0.000 claims description 4
- 102100040836 Claudin-1 Human genes 0.000 claims description 4
- 108090000600 Claudin-1 Proteins 0.000 claims description 4
- 102100031611 Collagen alpha-1(III) chain Human genes 0.000 claims description 4
- 102100024335 Collagen alpha-1(VII) chain Human genes 0.000 claims description 4
- 102100038199 Desmoplakin Human genes 0.000 claims description 4
- 102100024108 Dystrophin Human genes 0.000 claims description 4
- 101150031037 EDARADD gene Proteins 0.000 claims description 4
- 102100031947 EGF domain-specific O-linked N-acetylglucosamine transferase Human genes 0.000 claims description 4
- 102100030809 Ectodysplasin-A receptor-associated adapter protein Human genes 0.000 claims description 4
- 102100031785 Endothelial transcription factor GATA-2 Human genes 0.000 claims description 4
- 102100034411 H/ACA ribonucleoprotein complex subunit 2 Human genes 0.000 claims description 4
- 102100029138 H/ACA ribonucleoprotein complex subunit 3 Human genes 0.000 claims description 4
- 102100031249 H/ACA ribonucleoprotein complex subunit DKC1 Human genes 0.000 claims description 4
- 102100035961 Hematopoietically-expressed homeobox protein HHEX Human genes 0.000 claims description 4
- 108010061414 Hepatocyte Nuclear Factor 1-beta Proteins 0.000 claims description 4
- 101000799140 Homo sapiens Activin receptor type-1 Proteins 0.000 claims description 4
- 101000959107 Homo sapiens Amelogenin, Y isoform Proteins 0.000 claims description 4
- 101000796095 Homo sapiens Anthrax toxin receptor 1 Proteins 0.000 claims description 4
- 101000578469 Homo sapiens Arachidonate 12-lipoxygenase, 12R-type Proteins 0.000 claims description 4
- 101000904594 Homo sapiens Beta-1,3-galactosyltransferase 6 Proteins 0.000 claims description 4
- 101000871771 Homo sapiens Biotin-[acetyl-CoA-carboxylase] ligase Proteins 0.000 claims description 4
- 101000993285 Homo sapiens Collagen alpha-1(III) chain Proteins 0.000 claims description 4
- 101000909498 Homo sapiens Collagen alpha-1(VII) chain Proteins 0.000 claims description 4
- 101000920640 Homo sapiens EGF domain-specific O-linked N-acetylglucosamine transferase Proteins 0.000 claims description 4
- 101001066265 Homo sapiens Endothelial transcription factor GATA-2 Proteins 0.000 claims description 4
- 101000994912 Homo sapiens H/ACA ribonucleoprotein complex subunit 2 Proteins 0.000 claims description 4
- 101001124920 Homo sapiens H/ACA ribonucleoprotein complex subunit 3 Proteins 0.000 claims description 4
- 101001021503 Homo sapiens Hematopoietically-expressed homeobox protein HHEX Proteins 0.000 claims description 4
- 101001045751 Homo sapiens Hepatocyte nuclear factor 1-alpha Proteins 0.000 claims description 4
- 101000614436 Homo sapiens Keratin, type I cytoskeletal 14 Proteins 0.000 claims description 4
- 101001006895 Homo sapiens Krueppel-like factor 11 Proteins 0.000 claims description 4
- 101001088887 Homo sapiens Lysine-specific demethylase 5C Proteins 0.000 claims description 4
- 101001024131 Homo sapiens Magnesium transporter NIPA4 Proteins 0.000 claims description 4
- 101000581514 Homo sapiens Membrane-bound transcription factor site-2 protease Proteins 0.000 claims description 4
- 101000581533 Homo sapiens Methylcrotonoyl-CoA carboxylase beta chain, mitochondrial Proteins 0.000 claims description 4
- 101000615613 Homo sapiens Mineralocorticoid receptor Proteins 0.000 claims description 4
- 101001023043 Homo sapiens Myoblast determination protein 1 Proteins 0.000 claims description 4
- 101000973618 Homo sapiens NF-kappa-B essential modulator Proteins 0.000 claims description 4
- 101000780028 Homo sapiens Natriuretic peptides A Proteins 0.000 claims description 4
- 101000613495 Homo sapiens Paired box protein Pax-4 Proteins 0.000 claims description 4
- 101001126085 Homo sapiens Piwi-like protein 1 Proteins 0.000 claims description 4
- 101001125939 Homo sapiens Plakophilin-1 Proteins 0.000 claims description 4
- 101001003584 Homo sapiens Prelamin-A/C Proteins 0.000 claims description 4
- 101000893493 Homo sapiens Protein flightless-1 homolog Proteins 0.000 claims description 4
- 101001123986 Homo sapiens Protein-serine O-palmitoleoyltransferase porcupine Proteins 0.000 claims description 4
- 101001089248 Homo sapiens Receptor-interacting serine/threonine-protein kinase 4 Proteins 0.000 claims description 4
- 101000634060 Homo sapiens Sterol-4-alpha-carboxylate 3-dehydrogenase, decarboxylating Proteins 0.000 claims description 4
- 101000889890 Homo sapiens Testis-expressed protein 11 Proteins 0.000 claims description 4
- 101000685830 Homo sapiens Zinc transporter ZIP4 Proteins 0.000 claims description 4
- 102100027797 Krueppel-like factor 11 Human genes 0.000 claims description 4
- 102100033249 Lysine-specific demethylase 5C Human genes 0.000 claims description 4
- 102100035378 Magnesium transporter NIPA4 Human genes 0.000 claims description 4
- 102100027382 Membrane-bound transcription factor site-2 protease Human genes 0.000 claims description 4
- 102100021316 Mineralocorticoid receptor Human genes 0.000 claims description 4
- 101100408383 Mus musculus Piwil1 gene Proteins 0.000 claims description 4
- 102100035077 Myoblast determination protein 1 Human genes 0.000 claims description 4
- 102100038380 Myogenic factor 5 Human genes 0.000 claims description 4
- 102100032970 Myogenin Human genes 0.000 claims description 4
- 102100022219 NF-kappa-B essential modulator Human genes 0.000 claims description 4
- 102100034296 Natriuretic peptides A Human genes 0.000 claims description 4
- 102000002356 Nectin Human genes 0.000 claims description 4
- 108060005251 Nectin Proteins 0.000 claims description 4
- 102100040891 Paired box protein Pax-3 Human genes 0.000 claims description 4
- 102100040909 Paired box protein Pax-4 Human genes 0.000 claims description 4
- 108010077056 Peroxisomal Targeting Signal 2 Receptor Proteins 0.000 claims description 4
- 102100032924 Peroxisomal targeting signal 2 receptor Human genes 0.000 claims description 4
- 102100029364 Piwi-like protein 1 Human genes 0.000 claims description 4
- 102100026531 Prelamin-A/C Human genes 0.000 claims description 4
- 102100028119 Protein-serine O-palmitoleoyltransferase porcupine Human genes 0.000 claims description 4
- 101150067036 RBM20 gene Proteins 0.000 claims description 4
- 102100033734 Receptor-interacting serine/threonine-protein kinase 4 Human genes 0.000 claims description 4
- 102100029809 Small nuclear ribonucleoprotein E Human genes 0.000 claims description 4
- 102100029238 Sterol-4-alpha-carboxylate 3-dehydrogenase, decarboxylating Human genes 0.000 claims description 4
- 102000003441 UBR1 Human genes 0.000 claims description 4
- 101150118716 UBR1 gene Proteins 0.000 claims description 4
- 102100024118 Uroporphyrinogen decarboxylase Human genes 0.000 claims description 4
- 102100034397 Uroporphyrinogen-III synthase Human genes 0.000 claims description 4
- 102100023140 Zinc transporter ZIP4 Human genes 0.000 claims description 4
- 210000004504 adult stem cell Anatomy 0.000 claims description 4
- 230000014639 sexual reproduction Effects 0.000 claims description 4
- 102000009310 vitamin D receptors Human genes 0.000 claims description 4
- 108050000156 vitamin D receptors Proteins 0.000 claims description 4
- 102100031236 11-beta-hydroxysteroid dehydrogenase type 2 Human genes 0.000 claims description 3
- 102100037965 60S ribosomal protein L21 Human genes 0.000 claims description 3
- 102000013918 Apolipoproteins E Human genes 0.000 claims description 3
- 108010025628 Apolipoproteins E Proteins 0.000 claims description 3
- 102100026189 Beta-galactosidase Human genes 0.000 claims description 3
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 claims description 3
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 claims description 3
- 101150028614 CERS3 gene Proteins 0.000 claims description 3
- 101000841393 Candida albicans Probable NADPH dehydrogenase Proteins 0.000 claims description 3
- 102100029581 DDB1- and CUL4-associated factor 17 Human genes 0.000 claims description 3
- 102100024354 Dedicator of cytokinesis protein 6 Human genes 0.000 claims description 3
- 102100034573 Desmoglein-4 Human genes 0.000 claims description 3
- 102100030708 GTPase KRas Human genes 0.000 claims description 3
- 102100036621 Glucosylceramide transporter ABCA12 Human genes 0.000 claims description 3
- 102100021519 Hemoglobin subunit beta Human genes 0.000 claims description 3
- 102000012046 Hepatocyte Nuclear Factor 1-beta Human genes 0.000 claims description 3
- 101000845090 Homo sapiens 11-beta-hydroxysteroid dehydrogenase type 2 Proteins 0.000 claims description 3
- 101000866618 Homo sapiens 3-beta-hydroxysteroid-Delta(8),Delta(7)-isomerase Proteins 0.000 claims description 3
- 101000661708 Homo sapiens 60S ribosomal protein L21 Proteins 0.000 claims description 3
- 101000924727 Homo sapiens Alternative prion protein Proteins 0.000 claims description 3
- 101000928549 Homo sapiens Autoimmune regulator Proteins 0.000 claims description 3
- 101000903703 Homo sapiens B-cell lymphoma/leukemia 11A Proteins 0.000 claims description 3
- 101000765010 Homo sapiens Beta-galactosidase Proteins 0.000 claims description 3
- 101000917433 Homo sapiens DDB1- and CUL4-associated factor 17 Proteins 0.000 claims description 3
- 101001052950 Homo sapiens Dedicator of cytokinesis protein 6 Proteins 0.000 claims description 3
- 101000924320 Homo sapiens Desmoglein-4 Proteins 0.000 claims description 3
- 101000584612 Homo sapiens GTPase KRas Proteins 0.000 claims description 3
- 101000844866 Homo sapiens H/ACA ribonucleoprotein complex subunit DKC1 Proteins 0.000 claims description 3
- 101000899111 Homo sapiens Hemoglobin subunit beta Proteins 0.000 claims description 3
- 101000573901 Homo sapiens Major prion protein Proteins 0.000 claims description 3
- 101000697649 Homo sapiens Mitochondrial chaperone BCS1 Proteins 0.000 claims description 3
- 101001120753 Homo sapiens Oligodendrocyte transcription factor 1 Proteins 0.000 claims description 3
- 101001129191 Homo sapiens Omega-hydroxyceramide transacylase Proteins 0.000 claims description 3
- 101000721946 Homo sapiens Oral-facial-digital syndrome 1 protein Proteins 0.000 claims description 3
- 101000613490 Homo sapiens Paired box protein Pax-3 Proteins 0.000 claims description 3
- 101000830411 Homo sapiens Probable ATP-dependent RNA helicase DDX4 Proteins 0.000 claims description 3
- 101001123448 Homo sapiens Prolactin receptor Proteins 0.000 claims description 3
- 101000616556 Homo sapiens SH3 domain-containing protein 19 Proteins 0.000 claims description 3
- 101000625913 Homo sapiens T-box transcription factor TBX4 Proteins 0.000 claims description 3
- 101000687905 Homo sapiens Transcription factor SOX-2 Proteins 0.000 claims description 3
- 101000845269 Homo sapiens Transcription termination factor 1 Proteins 0.000 claims description 3
- 101000910482 Homo sapiens Uroporphyrinogen decarboxylase Proteins 0.000 claims description 3
- 102100027754 Mast/stem cell growth factor receptor Kit Human genes 0.000 claims description 3
- 101710087603 Mast/stem cell growth factor receptor Kit Proteins 0.000 claims description 3
- 102100027891 Mitochondrial chaperone BCS1 Human genes 0.000 claims description 3
- 102100026073 Oligodendrocyte transcription factor 1 Human genes 0.000 claims description 3
- 102100031247 Omega-hydroxyceramide transacylase Human genes 0.000 claims description 3
- 102100025410 Oral-facial-digital syndrome 1 protein Human genes 0.000 claims description 3
- 241000288906 Primates Species 0.000 claims description 3
- 235000011449 Rosa Nutrition 0.000 claims description 3
- 101150107526 Socs2 gene Proteins 0.000 claims description 3
- 108700005078 Synthetic Genes Proteins 0.000 claims description 3
- 102100024754 T-box transcription factor TBX4 Human genes 0.000 claims description 3
- 102000003568 TRPV3 Human genes 0.000 claims description 3
- 102100024270 Transcription factor SOX-2 Human genes 0.000 claims description 3
- 101150043371 Trpv3 gene Proteins 0.000 claims description 3
- 230000004992 fission Effects 0.000 claims description 3
- 108091006047 fluorescent proteins Proteins 0.000 claims description 3
- 102000034287 fluorescent proteins Human genes 0.000 claims description 3
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 claims description 2
- 101150068639 Hnf4a gene Proteins 0.000 claims description 2
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 claims description 2
- 101000929652 Homo sapiens Glucosylceramide transporter ABCA12 Proteins 0.000 claims description 2
- 101000720958 Homo sapiens Protein artemis Proteins 0.000 claims description 2
- 102100025918 Protein artemis Human genes 0.000 claims description 2
- 241000283984 Rodentia Species 0.000 claims description 2
- 101001045740 Homo sapiens Hepatocyte nuclear factor 4-alpha Proteins 0.000 claims 22
- 101001061851 Homo sapiens V(D)J recombination-activating protein 2 Proteins 0.000 claims 18
- 102100029591 V(D)J recombination-activating protein 2 Human genes 0.000 claims 18
- 102100033672 Deleted in azoospermia-like Human genes 0.000 claims 8
- 101000871280 Homo sapiens Deleted in azoospermia-like Proteins 0.000 claims 8
- 102100029115 Fumarylacetoacetase Human genes 0.000 claims 4
- 102100027893 Homeobox protein Nkx-2.1 Human genes 0.000 claims 4
- 108010014480 T-box transcription factor 5 Proteins 0.000 claims 4
- 102100035905 1-acylglycerol-3-phosphate O-acyltransferase ABHD5 Human genes 0.000 claims 2
- 101710137984 4-O-beta-D-mannosyl-D-glucose phosphorylase Proteins 0.000 claims 2
- 102100022534 Amiloride-sensitive sodium channel subunit gamma Human genes 0.000 claims 2
- 102100021394 CST complex subunit CTC1 Human genes 0.000 claims 2
- 102100027642 DNA-binding protein inhibitor ID-2 Human genes 0.000 claims 2
- 101800000026 Dentin sialoprotein Proteins 0.000 claims 2
- 102100029974 GTPase HRas Human genes 0.000 claims 2
- 102100039939 Growth/differentiation factor 8 Human genes 0.000 claims 2
- 101000929840 Homo sapiens 1-acylglycerol-3-phosphate O-acyltransferase ABHD5 Proteins 0.000 claims 2
- 101000999998 Homo sapiens Aggrecan core protein Proteins 0.000 claims 2
- 101000797795 Homo sapiens Alstrom syndrome protein 1 Proteins 0.000 claims 2
- 101000822373 Homo sapiens Amiloride-sensitive sodium channel subunit gamma Proteins 0.000 claims 2
- 101000894433 Homo sapiens CST complex subunit CTC1 Proteins 0.000 claims 2
- 101001081582 Homo sapiens DNA-binding protein inhibitor ID-2 Proteins 0.000 claims 2
- 101000641077 Homo sapiens Diamine acetyltransferase 1 Proteins 0.000 claims 2
- 101001053946 Homo sapiens Dystrophin Proteins 0.000 claims 2
- 101000866526 Homo sapiens Extracellular matrix protein 1 Proteins 0.000 claims 2
- 101000584633 Homo sapiens GTPase HRas Proteins 0.000 claims 2
- 101000997535 Homo sapiens Growth hormone-releasing hormone receptor Proteins 0.000 claims 2
- 101000886562 Homo sapiens Growth/differentiation factor 8 Proteins 0.000 claims 2
- 101001051093 Homo sapiens Low-density lipoprotein receptor Proteins 0.000 claims 2
- 101001038034 Homo sapiens Lysophosphatidic acid receptor 6 Proteins 0.000 claims 2
- 101000629402 Homo sapiens Mesoderm posterior protein 1 Proteins 0.000 claims 2
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 claims 2
- 101001074444 Homo sapiens Polycystin-1 Proteins 0.000 claims 2
- 101000684673 Homo sapiens Protein APCDD1 Proteins 0.000 claims 2
- 101000804792 Homo sapiens Protein Wnt-5a Proteins 0.000 claims 2
- 101000584743 Homo sapiens Recombining binding protein suppressor of hairless Proteins 0.000 claims 2
- 101001075563 Homo sapiens Rho GTPase-activating protein 31 Proteins 0.000 claims 2
- 101000653812 Homo sapiens Small nuclear ribonucleoprotein E Proteins 0.000 claims 2
- 101000713305 Homo sapiens Sodium-coupled neutral amino acid transporter 1 Proteins 0.000 claims 2
- 101000800312 Homo sapiens TERF1-interacting nuclear factor 2 Proteins 0.000 claims 2
- 101000653533 Homo sapiens Telomerase Cajal body protein 1 Proteins 0.000 claims 2
- 101000920026 Homo sapiens Tumor necrosis factor receptor superfamily member EDAR Proteins 0.000 claims 2
- 101000864342 Homo sapiens Tyrosine-protein kinase BTK Proteins 0.000 claims 2
- 101001103033 Homo sapiens Tyrosine-protein kinase transmembrane receptor ROR2 Proteins 0.000 claims 2
- 101000854879 Homo sapiens V-type proton ATPase 116 kDa subunit a 2 Proteins 0.000 claims 2
- 102100022743 Laminin subunit alpha-4 Human genes 0.000 claims 2
- 102100039809 Matrix Gla protein Human genes 0.000 claims 2
- 101710147263 Matrix Gla protein Proteins 0.000 claims 2
- 108010090306 Member 2 Subfamily G ATP Binding Cassette Transporter Proteins 0.000 claims 2
- 102100026822 Mesoderm posterior protein 1 Human genes 0.000 claims 2
- 101100398619 Notamacropus eugenii LGB gene Proteins 0.000 claims 2
- 102100024770 Probable ATP-dependent RNA helicase DDX4 Human genes 0.000 claims 2
- 102100023735 Protein APCDD1 Human genes 0.000 claims 2
- 102100030000 Recombining binding protein suppressor of hairless Human genes 0.000 claims 2
- 101001053942 Saccharolobus solfataricus (strain ATCC 35092 / DSM 1617 / JCM 11322 / P2) Diphosphomevalonate decarboxylase Proteins 0.000 claims 2
- 102100037310 Serine/threonine-protein kinase D1 Human genes 0.000 claims 2
- 102100030100 Sulfate anion transporter 1 Human genes 0.000 claims 2
- 102100030629 Telomerase Cajal body protein 1 Human genes 0.000 claims 2
- 101710140697 Tumor protein 63 Proteins 0.000 claims 2
- 102100029823 Tyrosine-protein kinase BTK Human genes 0.000 claims 2
- 102100039616 Tyrosine-protein kinase transmembrane receptor ROR2 Human genes 0.000 claims 2
- 102100020745 V-type proton ATPase 116 kDa subunit a 2 Human genes 0.000 claims 2
- 102000043366 Wnt-5a Human genes 0.000 claims 2
- 108010028309 kalinin Proteins 0.000 claims 2
- 108010008094 laminin alpha 3 Proteins 0.000 claims 2
- 102100029592 Activator of apoptosis harakiri Human genes 0.000 claims 1
- 102100034540 Adenomatous polyposis coli protein Human genes 0.000 claims 1
- 101150003775 HNF1A gene Proteins 0.000 claims 1
- 101100433776 Homo sapiens ABCA12 gene Proteins 0.000 claims 1
- 101000987827 Homo sapiens Activator of apoptosis harakiri Proteins 0.000 claims 1
- 101000924577 Homo sapiens Adenomatous polyposis coli protein Proteins 0.000 claims 1
- 101000958865 Homo sapiens Myogenic factor 5 Proteins 0.000 claims 1
- 101000589002 Homo sapiens Myogenin Proteins 0.000 claims 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 claims 1
- 241000589516 Pseudomonas Species 0.000 claims 1
- 102100029064 Serine/threonine-protein kinase WNK1 Human genes 0.000 claims 1
- 241001493546 Suina Species 0.000 claims 1
- 101710124574 Synaptotagmin-1 Proteins 0.000 claims 1
- 230000001448 gametogenic effect Effects 0.000 claims 1
- 235000020030 perry Nutrition 0.000 claims 1
- 229910052698 phosphorus Inorganic materials 0.000 claims 1
- 239000011574 phosphorus Substances 0.000 claims 1
- 230000000920 spermatogeneic effect Effects 0.000 claims 1
- 239000000463 material Substances 0.000 abstract description 3
- 230000034431 double-strand break repair via homologous recombination Effects 0.000 description 158
- 150000007523 nucleic acids Chemical class 0.000 description 76
- 102000039446 nucleic acids Human genes 0.000 description 62
- 108020004707 nucleic acids Proteins 0.000 description 62
- 230000014509 gene expression Effects 0.000 description 46
- 230000008569 process Effects 0.000 description 42
- 108020004999 messenger RNA Proteins 0.000 description 35
- 238000007894 restriction fragment length polymorphism technique Methods 0.000 description 35
- WZOGEMJIZBNFBK-CIUDSAMLSA-N His-Asp-Asn Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O WZOGEMJIZBNFBK-CIUDSAMLSA-N 0.000 description 32
- 102000004169 proteins and genes Human genes 0.000 description 32
- 235000018102 proteins Nutrition 0.000 description 28
- ACRYGQFHAQHDSF-ZLUOBGJFSA-N Asn-Asn-Asn Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O ACRYGQFHAQHDSF-ZLUOBGJFSA-N 0.000 description 26
- DXVMJJNAOVECBA-WHFBIAKZSA-N Asn-Gly-Asn Chemical compound NC(=O)C[C@H](N)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O DXVMJJNAOVECBA-WHFBIAKZSA-N 0.000 description 26
- 239000013598 vector Substances 0.000 description 24
- 101710163270 Nuclease Proteins 0.000 description 23
- 230000000694 effects Effects 0.000 description 23
- 210000001519 tissue Anatomy 0.000 description 23
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 20
- 108010019832 glycyl-asparaginyl-glycine Proteins 0.000 description 19
- 210000000349 chromosome Anatomy 0.000 description 18
- 230000006780 non-homologous end joining Effects 0.000 description 18
- 108091034117 Oligonucleotide Proteins 0.000 description 17
- 210000000287 oocyte Anatomy 0.000 description 17
- 230000001105 regulatory effect Effects 0.000 description 17
- PTSDPWIHOYMRGR-UGYAYLCHSA-N Asn-Ile-Asn Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(O)=O PTSDPWIHOYMRGR-UGYAYLCHSA-N 0.000 description 16
- 102000040945 Transcription factor Human genes 0.000 description 16
- 108091023040 Transcription factor Proteins 0.000 description 16
- 108700019146 Transgenes Proteins 0.000 description 16
- 230000001419 dependent effect Effects 0.000 description 16
- 238000003780 insertion Methods 0.000 description 16
- 230000037431 insertion Effects 0.000 description 16
- 210000002950 fibroblast Anatomy 0.000 description 15
- 210000000056 organ Anatomy 0.000 description 15
- 238000001890 transfection Methods 0.000 description 15
- 238000012546 transfer Methods 0.000 description 15
- 230000009261 transgenic effect Effects 0.000 description 15
- 238000012239 gene modification Methods 0.000 description 14
- 230000005017 genetic modification Effects 0.000 description 14
- 235000013617 genetically modified food Nutrition 0.000 description 14
- 238000003752 polymerase chain reaction Methods 0.000 description 14
- 108090000765 processed proteins & peptides Proteins 0.000 description 14
- OGTCOKZFOJIZFG-CIUDSAMLSA-N Asp-His-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(O)=O)C(O)=O OGTCOKZFOJIZFG-CIUDSAMLSA-N 0.000 description 13
- 230000015572 biosynthetic process Effects 0.000 description 13
- 239000012634 fragment Substances 0.000 description 13
- 229920001184 polypeptide Polymers 0.000 description 13
- 102000004196 processed proteins & peptides Human genes 0.000 description 13
- 102000005962 receptors Human genes 0.000 description 13
- 108020003175 receptors Proteins 0.000 description 13
- 101150096316 5 gene Proteins 0.000 description 12
- AYZAWXAPBAYCHO-CIUDSAMLSA-N Asn-Asn-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC(=O)N)N AYZAWXAPBAYCHO-CIUDSAMLSA-N 0.000 description 12
- 108010051219 Cre recombinase Proteins 0.000 description 12
- YJBMLTVVVRJNOK-SRVKXCTJSA-N His-Asp-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)N YJBMLTVVVRJNOK-SRVKXCTJSA-N 0.000 description 12
- 230000006698 induction Effects 0.000 description 12
- 230000001939 inductive effect Effects 0.000 description 12
- 238000013518 transcription Methods 0.000 description 12
- 230000035897 transcription Effects 0.000 description 12
- 102000001218 Rec A Recombinases Human genes 0.000 description 11
- 108010055016 Rec A Recombinases Proteins 0.000 description 11
- 210000003719 b-lymphocyte Anatomy 0.000 description 11
- 238000009395 breeding Methods 0.000 description 11
- 230000001488 breeding effect Effects 0.000 description 11
- 150000001875 compounds Chemical class 0.000 description 11
- 101150036876 cre gene Proteins 0.000 description 11
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 11
- 238000002474 experimental method Methods 0.000 description 11
- XLHLPYFMXGOASD-CIUDSAMLSA-N Asn-His-Asp Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CC(=O)N)N XLHLPYFMXGOASD-CIUDSAMLSA-N 0.000 description 10
- 102000053602 DNA Human genes 0.000 description 10
- 230000004568 DNA-binding Effects 0.000 description 10
- 210000001744 T-lymphocyte Anatomy 0.000 description 10
- 239000004098 Tetracycline Substances 0.000 description 10
- 238000013459 approach Methods 0.000 description 10
- 238000003556 assay Methods 0.000 description 10
- 230000000295 complement effect Effects 0.000 description 10
- 238000012217 deletion Methods 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 238000002347 injection Methods 0.000 description 10
- 239000007924 injection Substances 0.000 description 10
- 230000008439 repair process Effects 0.000 description 10
- 229960002180 tetracycline Drugs 0.000 description 10
- 229930101283 tetracycline Natural products 0.000 description 10
- 235000019364 tetracycline Nutrition 0.000 description 10
- 150000003522 tetracyclines Chemical class 0.000 description 10
- 108020004459 Small interfering RNA Proteins 0.000 description 9
- 230000037430 deletion Effects 0.000 description 9
- 230000004048 modification Effects 0.000 description 9
- 238000012986 modification Methods 0.000 description 9
- 210000000822 natural killer cell Anatomy 0.000 description 9
- 230000010076 replication Effects 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 108010001831 LDL receptors Proteins 0.000 description 8
- 102000018120 Recombinases Human genes 0.000 description 8
- 108010091086 Recombinases Proteins 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 230000027455 binding Effects 0.000 description 8
- 210000004700 fetal blood Anatomy 0.000 description 8
- 230000004927 fusion Effects 0.000 description 8
- 238000001727 in vivo Methods 0.000 description 8
- 230000035772 mutation Effects 0.000 description 8
- 239000013612 plasmid Substances 0.000 description 8
- VAXIVIPMCTYSHI-YUMQZZPRSA-N Gly-His-Asp Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)CN VAXIVIPMCTYSHI-YUMQZZPRSA-N 0.000 description 7
- 241000700605 Viruses Species 0.000 description 7
- 230000004913 activation Effects 0.000 description 7
- 230000009368 gene silencing by RNA Effects 0.000 description 7
- 238000010353 genetic engineering Methods 0.000 description 7
- 210000004602 germ cell Anatomy 0.000 description 7
- 238000002744 homologous recombination Methods 0.000 description 7
- 230000006801 homologous recombination Effects 0.000 description 7
- 238000010374 somatic cell nuclear transfer Methods 0.000 description 7
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 6
- KMCRKVOLRCOMBG-DJFWLOJKSA-N Asn-Ile-His Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CC(=O)N)N KMCRKVOLRCOMBG-DJFWLOJKSA-N 0.000 description 6
- GWTLRDMPMJCNMH-WHFBIAKZSA-N Asp-Asn-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O GWTLRDMPMJCNMH-WHFBIAKZSA-N 0.000 description 6
- 102100021277 Beta-secretase 2 Human genes 0.000 description 6
- 101710150190 Beta-secretase 2 Proteins 0.000 description 6
- MDCTVRUPVLZSPG-BQBZGAKWSA-N His-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@@H](N)CC1=CNC=N1 MDCTVRUPVLZSPG-BQBZGAKWSA-N 0.000 description 6
- 101000612089 Homo sapiens Pancreas/duodenum homeobox protein 1 Proteins 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 6
- 238000003776 cleavage reaction Methods 0.000 description 6
- 230000002950 deficient Effects 0.000 description 6
- 239000000203 mixture Substances 0.000 description 6
- 210000003101 oviduct Anatomy 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 238000012216 screening Methods 0.000 description 6
- 210000001082 somatic cell Anatomy 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 230000008685 targeting Effects 0.000 description 6
- 229910052725 zinc Inorganic materials 0.000 description 6
- 239000011701 zinc Substances 0.000 description 6
- SGKRLCUYIXIAHR-AKNGSSGZSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O SGKRLCUYIXIAHR-AKNGSSGZSA-N 0.000 description 5
- PCKRJVZAQZWNKM-WHFBIAKZSA-N Asn-Asn-Gly Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O PCKRJVZAQZWNKM-WHFBIAKZSA-N 0.000 description 5
- GWNMUVANAWDZTI-YUMQZZPRSA-N Asn-Gly-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CC(=O)N)N GWNMUVANAWDZTI-YUMQZZPRSA-N 0.000 description 5
- BUVNWKQBMZLCDW-UGYAYLCHSA-N Asp-Asn-Ile Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O BUVNWKQBMZLCDW-UGYAYLCHSA-N 0.000 description 5
- 102000016864 Deleted in azoospermia-like Human genes 0.000 description 5
- 108050006472 Deleted in azoospermia-like Proteins 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- CIMULJZTTOBOPN-WHFBIAKZSA-N Gly-Asn-Asn Chemical compound NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O CIMULJZTTOBOPN-WHFBIAKZSA-N 0.000 description 5
- GGEJHJIXRBTJPD-BYPYZUCNSA-N Gly-Asn-Gly Chemical compound NCC(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O GGEJHJIXRBTJPD-BYPYZUCNSA-N 0.000 description 5
- BGVYNAQWHSTTSP-BYULHYEWSA-N Gly-Asn-Ile Chemical compound [H]NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O BGVYNAQWHSTTSP-BYULHYEWSA-N 0.000 description 5
- QYZYJFXHXYUZMZ-UGYAYLCHSA-N Ile-Asn-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC(=O)N)C(=O)O)N QYZYJFXHXYUZMZ-UGYAYLCHSA-N 0.000 description 5
- UAVQIQOOBXFKRC-BYULHYEWSA-N Ile-Asn-Gly Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O UAVQIQOOBXFKRC-BYULHYEWSA-N 0.000 description 5
- UQXADIGYEYBJEI-DJFWLOJKSA-N Ile-His-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CC(=O)O)C(=O)O)N UQXADIGYEYBJEI-DJFWLOJKSA-N 0.000 description 5
- 108010093175 Member 2 Group A Nuclear Receptor Subfamily 4 Proteins 0.000 description 5
- 108700011259 MicroRNAs Proteins 0.000 description 5
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 5
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 5
- 108091027967 Small hairpin RNA Proteins 0.000 description 5
- 101150002402 Smcp gene Proteins 0.000 description 5
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 5
- 235000001014 amino acid Nutrition 0.000 description 5
- 150000001413 amino acids Chemical class 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 238000009826 distribution Methods 0.000 description 5
- 229960003722 doxycycline Drugs 0.000 description 5
- 229940088598 enzyme Drugs 0.000 description 5
- 230000001605 fetal effect Effects 0.000 description 5
- 230000002779 inactivation Effects 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 125000003729 nucleotide group Chemical group 0.000 description 5
- 210000001778 pluripotent stem cell Anatomy 0.000 description 5
- 230000035935 pregnancy Effects 0.000 description 5
- 108091008146 restriction endonucleases Proteins 0.000 description 5
- 239000004055 small Interfering RNA Substances 0.000 description 5
- 230000009466 transformation Effects 0.000 description 5
- 230000003612 virological effect Effects 0.000 description 5
- UQBGYPFHWFZMCD-ZLUOBGJFSA-N Asp-Asn-Asn Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O UQBGYPFHWFZMCD-ZLUOBGJFSA-N 0.000 description 4
- 108010090310 Ectodysplasin Receptors Proteins 0.000 description 4
- 101001096074 Homo sapiens Regenerating islet-derived protein 4 Proteins 0.000 description 4
- 206010028980 Neoplasm Diseases 0.000 description 4
- 108010016790 RNA-Induced Silencing Complex Proteins 0.000 description 4
- 102000000574 RNA-Induced Silencing Complex Human genes 0.000 description 4
- 108091030071 RNAI Proteins 0.000 description 4
- 102000002490 Rad51 Recombinase Human genes 0.000 description 4
- 108010068097 Rad51 Recombinase Proteins 0.000 description 4
- 102100037889 Regenerating islet-derived protein 4 Human genes 0.000 description 4
- 108020004682 Single-Stranded DNA Proteins 0.000 description 4
- 101710167708 T-box transcription factor TBX5 Proteins 0.000 description 4
- 230000000692 anti-sense effect Effects 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 230000003247 decreasing effect Effects 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 230000002183 duodenal effect Effects 0.000 description 4
- 235000013601 eggs Nutrition 0.000 description 4
- 238000004520 electroporation Methods 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 4
- 208000021267 infertility disease Diseases 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 230000002452 interceptive effect Effects 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 210000004698 lymphocyte Anatomy 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 239000002679 microRNA Substances 0.000 description 4
- 210000000496 pancreas Anatomy 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 230000007017 scission Effects 0.000 description 4
- 101710198494 Alstrom syndrome protein 1 Proteins 0.000 description 3
- 101710176164 Broad substrate specificity ATP-binding cassette transporter ABCG2 Proteins 0.000 description 3
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 241000701022 Cytomegalovirus Species 0.000 description 3
- 230000033616 DNA repair Effects 0.000 description 3
- 230000007018 DNA scission Effects 0.000 description 3
- 101100300807 Drosophila melanogaster spn-A gene Proteins 0.000 description 3
- 102000004533 Endonucleases Human genes 0.000 description 3
- 108010009900 Endothelial Protein C Receptor Proteins 0.000 description 3
- 102100030024 Endothelial protein C receptor Human genes 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- 101710127949 Extracellular matrix protein 1 Proteins 0.000 description 3
- 241000287828 Gallus gallus Species 0.000 description 3
- 101710198286 Growth hormone-releasing hormone receptor Proteins 0.000 description 3
- 102000019249 Growth/differentiation factor 8 Human genes 0.000 description 3
- 108050006583 Growth/differentiation factor 8 Proteins 0.000 description 3
- 108020005004 Guide RNA Proteins 0.000 description 3
- 108010020382 Hepatocyte Nuclear Factor 1-alpha Proteins 0.000 description 3
- 102100029237 Hexokinase-4 Human genes 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101001051313 Homo sapiens Laminin subunit beta-3 Proteins 0.000 description 3
- 101000987003 Homo sapiens Tumor protein 63 Proteins 0.000 description 3
- 101000984551 Homo sapiens Tyrosine-protein kinase Blk Proteins 0.000 description 3
- YPQDTQJBOFOTJQ-SXTJYALSSA-N Ile-Asn-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)O)N YPQDTQJBOFOTJQ-SXTJYALSSA-N 0.000 description 3
- 101710149751 Lysophosphatidic acid receptor 6 Proteins 0.000 description 3
- 108010020197 Myogenic Regulatory Factor 5 Proteins 0.000 description 3
- 108010056785 Myogenin Proteins 0.000 description 3
- 108700020796 Oncogene Proteins 0.000 description 3
- 240000007019 Oxalis corniculata Species 0.000 description 3
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 3
- 101710110514 Rho GTPase-activating protein 31 Proteins 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 101001059240 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Site-specific recombinase Flp Proteins 0.000 description 3
- 101710138942 TERF1-interacting nuclear factor 2 Proteins 0.000 description 3
- 102100032938 Telomerase reverse transcriptase Human genes 0.000 description 3
- 102000006601 Thymidine Kinase Human genes 0.000 description 3
- 108020004440 Thymidine kinase Proteins 0.000 description 3
- 102100027053 Tyrosine-protein kinase Blk Human genes 0.000 description 3
- 108010042591 activated protein C receptor Proteins 0.000 description 3
- 230000004075 alteration Effects 0.000 description 3
- 238000003975 animal breeding Methods 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 244000309464 bull Species 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 230000032823 cell division Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 235000013330 chicken meat Nutrition 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 238000006471 dimerization reaction Methods 0.000 description 3
- 230000005782 double-strand break Effects 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 230000004720 fertilization Effects 0.000 description 3
- 230000037433 frameshift Effects 0.000 description 3
- 238000003205 genotyping method Methods 0.000 description 3
- 108010020688 glycylhistidine Proteins 0.000 description 3
- 210000001173 gonocyte Anatomy 0.000 description 3
- 238000009396 hybridization Methods 0.000 description 3
- 229940068935 insulin-like growth factor 2 Drugs 0.000 description 3
- 102000043253 matrix Gla protein Human genes 0.000 description 3
- 108010057546 matrix Gla protein Proteins 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 210000005259 peripheral blood Anatomy 0.000 description 3
- 239000011886 peripheral blood Substances 0.000 description 3
- 201000008519 polycystic kidney disease 1 Diseases 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 239000002157 polynucleotide Substances 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 230000000644 propagated effect Effects 0.000 description 3
- 108020001580 protein domains Proteins 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 210000000952 spleen Anatomy 0.000 description 3
- 230000009469 supplementation Effects 0.000 description 3
- 101150065190 term gene Proteins 0.000 description 3
- 101150031434 tnp2 gene Proteins 0.000 description 3
- 230000001131 transforming effect Effects 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 241001529453 unidentified herpesvirus Species 0.000 description 3
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 2
- 102100036664 Adenosine deaminase Human genes 0.000 description 2
- 108010067219 Aggrecans Proteins 0.000 description 2
- LDSFSKFATNBTBV-UHFFFAOYSA-N Asn-Asn-Gly-His Chemical compound NC(=O)CC(N)C(=O)NC(CC(N)=O)C(=O)NCC(=O)NC(C(O)=O)CC1=CN=CN1 LDSFSKFATNBTBV-UHFFFAOYSA-N 0.000 description 2
- IOTKDTZEEBZNCM-UGYAYLCHSA-N Asn-Asn-Ile Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O IOTKDTZEEBZNCM-UGYAYLCHSA-N 0.000 description 2
- KLKHFFMNGWULBN-VKHMYHEASA-N Asn-Gly Chemical compound NC(=O)C[C@H](N)C(=O)NCC(O)=O KLKHFFMNGWULBN-VKHMYHEASA-N 0.000 description 2
- 102000014914 Carrier Proteins Human genes 0.000 description 2
- 108010078791 Carrier Proteins Proteins 0.000 description 2
- 101710146188 Ceramide synthase 3 Proteins 0.000 description 2
- 102000011022 Chorionic Gonadotropin Human genes 0.000 description 2
- 108010062540 Chorionic Gonadotropin Proteins 0.000 description 2
- 108010077544 Chromatin Proteins 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 2
- 101000834253 Gallus gallus Actin, cytoplasmic 1 Proteins 0.000 description 2
- 101710107035 Gamma-glutamyltranspeptidase Proteins 0.000 description 2
- 101710173228 Glutathione hydrolase proenzyme Proteins 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- 102100029100 Hematopoietic prostaglandin D synthase Human genes 0.000 description 2
- 102000006752 Hepatocyte Nuclear Factor 4 Human genes 0.000 description 2
- 102100022123 Hepatocyte nuclear factor 1-beta Human genes 0.000 description 2
- 101000972486 Homo sapiens Laminin subunit alpha-3 Proteins 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- 102100023915 Insulin Human genes 0.000 description 2
- 102100034343 Integrase Human genes 0.000 description 2
- 108010061833 Integrases Proteins 0.000 description 2
- 108010012048 Kisspeptins Proteins 0.000 description 2
- 102000013599 Kisspeptins Human genes 0.000 description 2
- 102100022744 Laminin subunit alpha-3 Human genes 0.000 description 2
- 102000003960 Ligases Human genes 0.000 description 2
- 108090000364 Ligases Proteins 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 108091092878 Microsatellite Proteins 0.000 description 2
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 2
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 2
- 108010073038 Penicillin Amidase Proteins 0.000 description 2
- 102000005877 Peptide Initiation Factors Human genes 0.000 description 2
- 108010044843 Peptide Initiation Factors Proteins 0.000 description 2
- 108091000080 Phosphotransferase Proteins 0.000 description 2
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 2
- 108010002519 Prolactin Receptors Proteins 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 238000002105 Southern blotting Methods 0.000 description 2
- 101710183280 Topoisomerase Proteins 0.000 description 2
- 108010073062 Transcription Activator-Like Effectors Proteins 0.000 description 2
- 108090000848 Ubiquitin Proteins 0.000 description 2
- 102000044159 Ubiquitin Human genes 0.000 description 2
- 108010027570 Xanthine phosphoribosyltransferase Proteins 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 101150063416 add gene Proteins 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 238000011888 autopsy Methods 0.000 description 2
- 230000001588 bifunctional effect Effects 0.000 description 2
- 108091008324 binding proteins Proteins 0.000 description 2
- 238000001574 biopsy Methods 0.000 description 2
- 244000309466 calf Species 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 210000003483 chromatin Anatomy 0.000 description 2
- 230000002759 chromosomal effect Effects 0.000 description 2
- 238000012761 co-transfection Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000009402 cross-breeding Methods 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 210000001771 cumulus cell Anatomy 0.000 description 2
- 238000005520 cutting process Methods 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 235000013365 dairy product Nutrition 0.000 description 2
- 230000003412 degenerative effect Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 230000003828 downregulation Effects 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 230000035558 fertility Effects 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 102000006640 gamma-Glutamyltransferase Human genes 0.000 description 2
- 238000010363 gene targeting Methods 0.000 description 2
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 2
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 108091008634 hepatocyte nuclear factors 4 Proteins 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- 230000036737 immune function Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 208000000509 infertility Diseases 0.000 description 2
- 230000036512 infertility Effects 0.000 description 2
- 231100000535 infertility Toxicity 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 239000012139 lysis buffer Substances 0.000 description 2
- 230000035800 maturation Effects 0.000 description 2
- 210000003716 mesoderm Anatomy 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 210000004940 nucleus Anatomy 0.000 description 2
- 210000004287 null lymphocyte Anatomy 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 102000020233 phosphotransferase Human genes 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 102000054765 polymorphisms of proteins Human genes 0.000 description 2
- 208000015768 polyposis Diseases 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 230000001850 reproductive effect Effects 0.000 description 2
- 230000001177 retroviral effect Effects 0.000 description 2
- 238000012340 reverse transcriptase PCR Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 210000000582 semen Anatomy 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 108010039827 snRNP Core Proteins Proteins 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 230000021595 spermatogenesis Effects 0.000 description 2
- PFNFFQXMRSDOHW-UHFFFAOYSA-N spermine Chemical compound NCCCNCCCCNCCCN PFNFFQXMRSDOHW-UHFFFAOYSA-N 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000005309 stochastic process Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 108700020534 tetracycline resistance-encoding transposon repressor Proteins 0.000 description 2
- 108091006106 transcriptional activators Proteins 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 230000014621 translational initiation Effects 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- SWWQQSDRUYSMAR-UHFFFAOYSA-N 1-[(4-hydroxyphenyl)methyl]-1,2,3,4-tetrahydroisoquinoline-6,7-diol;hydrochloride Chemical group Cl.C1=CC(O)=CC=C1CC1C2=CC(O)=C(O)C=C2CCN1 SWWQQSDRUYSMAR-UHFFFAOYSA-N 0.000 description 1
- 101150055869 25 gene Proteins 0.000 description 1
- LQGNCUXDDPRDJH-UHFFFAOYSA-N 3'-GMP Natural products C1C(O)C(O)CC2(C)C(C(O)CC3(C(C(C)(O)C(O)CCC(C)C)CCC33O)C)C3=CC(=O)C21 LQGNCUXDDPRDJH-UHFFFAOYSA-N 0.000 description 1
- OSJPPGNTCRNQQC-UWTATZPHSA-N 3-phospho-D-glyceric acid Chemical compound OC(=O)[C@H](O)COP(O)(O)=O OSJPPGNTCRNQQC-UWTATZPHSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- VIBDVOOELVZGDU-UHFFFAOYSA-N 4-(1h-indol-2-yl)benzene-1,3-dicarboximidamide Chemical compound NC(=N)C1=CC(C(=N)N)=CC=C1C1=CC2=CC=CC=C2N1 VIBDVOOELVZGDU-UHFFFAOYSA-N 0.000 description 1
- 108091006112 ATPases Proteins 0.000 description 1
- 101710196692 Actin A Proteins 0.000 description 1
- 102100022900 Actin, cytoplasmic 1 Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 102000057290 Adenosine Triphosphatases Human genes 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 102000007325 Amelogenin Human genes 0.000 description 1
- 108010007570 Amelogenin Proteins 0.000 description 1
- 108091093088 Amplicon Proteins 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 102100029470 Apolipoprotein E Human genes 0.000 description 1
- 101710095339 Apolipoprotein E Proteins 0.000 description 1
- 101100168911 Arabidopsis thaliana CUL4 gene Proteins 0.000 description 1
- 101100420776 Arabidopsis thaliana SYN1 gene Proteins 0.000 description 1
- YZXBAPSDXZZRGB-DOFZRALJSA-M Arachidonate Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC([O-])=O YZXBAPSDXZZRGB-DOFZRALJSA-M 0.000 description 1
- MQLZLIYPFDIDMZ-HAFWLYHUSA-N Asn-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H](N)CC(N)=O MQLZLIYPFDIDMZ-HAFWLYHUSA-N 0.000 description 1
- 101710145992 B-cell lymphoma/leukemia 11A Proteins 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 101710171939 Beta-1,3-galactosyltransferase 6 Proteins 0.000 description 1
- 101710145299 Biotin-[acetyl-CoA-carboxylase] ligase Proteins 0.000 description 1
- 101100228731 Bos taurus MSTN gene Proteins 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 101100450705 Caenorhabditis elegans hif-1 gene Proteins 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 102000013392 Carboxylesterase Human genes 0.000 description 1
- 108010051152 Carboxylesterase Proteins 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 108091060290 Chromatid Proteins 0.000 description 1
- 102100026098 Claudin-7 Human genes 0.000 description 1
- 108050007296 Claudin-7 Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108010017377 Collagen Type VII Proteins 0.000 description 1
- 102000004510 Collagen Type VII Human genes 0.000 description 1
- 108020004394 Complementary RNA Proteins 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- TVYMKYUSZSVOAG-ZLUOBGJFSA-N Cys-Ala-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(O)=O TVYMKYUSZSVOAG-ZLUOBGJFSA-N 0.000 description 1
- CVOZXIPULQQFNY-ZLUOBGJFSA-N Cys-Ala-Cys Chemical compound C[C@H](NC(=O)[C@@H](N)CS)C(=O)N[C@@H](CS)C(O)=O CVOZXIPULQQFNY-ZLUOBGJFSA-N 0.000 description 1
- DZLQXIFVQFTFJY-BYPYZUCNSA-N Cys-Gly-Gly Chemical compound SC[C@H](N)C(=O)NCC(=O)NCC(O)=O DZLQXIFVQFTFJY-BYPYZUCNSA-N 0.000 description 1
- OXOQBEVULIBOSH-ZDLURKLDSA-N Cys-Gly-Thr Chemical compound [H]N[C@@H](CS)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O OXOQBEVULIBOSH-ZDLURKLDSA-N 0.000 description 1
- FTTZLFIEUQHLHH-BWBBJGPYSA-N Cys-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CS)N)O FTTZLFIEUQHLHH-BWBBJGPYSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- VUDQSRFCCHQIIU-UHFFFAOYSA-N DIF1 Natural products CCCCCC(=O)C1=C(O)C(Cl)=C(OC)C(Cl)=C1O VUDQSRFCCHQIIU-UHFFFAOYSA-N 0.000 description 1
- 101150001108 DIF1 gene Proteins 0.000 description 1
- 238000007399 DNA isolation Methods 0.000 description 1
- 238000012270 DNA recombination Methods 0.000 description 1
- 102100033934 DNA repair protein RAD51 homolog 2 Human genes 0.000 description 1
- 102100027830 DNA repair protein XRCC2 Human genes 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 108010006124 DNA-Activated Protein Kinase Proteins 0.000 description 1
- 102000005768 DNA-Activated Protein Kinase Human genes 0.000 description 1
- 102000052510 DNA-Binding Proteins Human genes 0.000 description 1
- 108700020911 DNA-Binding Proteins Proteins 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 101710150441 DNA-invertase Proteins 0.000 description 1
- 241000238557 Decapoda Species 0.000 description 1
- 108010054576 Deoxyribonuclease EcoRI Proteins 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108091000074 Desmoplakin Proteins 0.000 description 1
- 102000002148 Diacylglycerol O-acyltransferase Human genes 0.000 description 1
- 108010001348 Diacylglycerol O-acyltransferase Proteins 0.000 description 1
- 101100168913 Dictyostelium discoideum culD gene Proteins 0.000 description 1
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 1
- 101710158332 Diuretic hormone Proteins 0.000 description 1
- 101710204261 Diuretic hormone class 2 Proteins 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 101100263436 Drosophila melanogaster vas gene Proteins 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 108010069091 Dystrophin Proteins 0.000 description 1
- 102000001039 Dystrophin Human genes 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010067770 Endopeptidase K Proteins 0.000 description 1
- 206010014950 Eosinophilia Diseases 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241001481760 Erethizon dorsatum Species 0.000 description 1
- 101001091269 Escherichia coli Hygromycin-B 4-O-kinase Proteins 0.000 description 1
- 102000012858 Eukaryotic Initiation Factor-4G Human genes 0.000 description 1
- 108010057192 Eukaryotic Initiation Factor-4G Proteins 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- 108010046276 FLP recombinase Proteins 0.000 description 1
- 102100027280 Fanconi anemia group A protein Human genes 0.000 description 1
- 108010075641 GATA2 Transcription Factor Proteins 0.000 description 1
- 102000011852 GATA2 Transcription Factor Human genes 0.000 description 1
- 108010001515 Galectin 4 Proteins 0.000 description 1
- 102100039556 Galectin-4 Human genes 0.000 description 1
- 240000005702 Galium aparine Species 0.000 description 1
- 235000014820 Galium aparine Nutrition 0.000 description 1
- 241000272496 Galliformes Species 0.000 description 1
- 108010021582 Glucokinase Proteins 0.000 description 1
- 102000030595 Glucokinase Human genes 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 101710167047 H/ACA ribonucleoprotein complex subunit DKC1 Proteins 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 101150092640 HES1 gene Proteins 0.000 description 1
- 101100412102 Haemophilus influenzae (strain ATCC 51907 / DSM 11121 / KW20 / Rd) rec2 gene Proteins 0.000 description 1
- 108091027305 Heteroduplex Proteins 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101000649306 Homo sapiens DNA repair protein XRCC2 Proteins 0.000 description 1
- 101001045758 Homo sapiens Hepatocyte nuclear factor 1-beta Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101001091205 Homo sapiens KiSS-1 receptor Proteins 0.000 description 1
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 1
- 101000949825 Homo sapiens Meiotic recombination protein DMC1/LIM15 homolog Proteins 0.000 description 1
- 101001123298 Homo sapiens PR domain zinc finger protein 14 Proteins 0.000 description 1
- 101001046894 Homo sapiens Protein HID1 Proteins 0.000 description 1
- 101000574648 Homo sapiens Retinoid-inducible serine carboxypeptidase Proteins 0.000 description 1
- 101000904787 Homo sapiens Serine/threonine-protein kinase ATR Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- 108010003272 Hyaluronate lyase Proteins 0.000 description 1
- 102000001974 Hyaluronidases Human genes 0.000 description 1
- 208000019758 Hypergammaglobulinemia Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 102000004195 Isomerases Human genes 0.000 description 1
- 108090000769 Isomerases Proteins 0.000 description 1
- 108010025815 Kanamycin Kinase Proteins 0.000 description 1
- 108010066321 Keratin-14 Proteins 0.000 description 1
- 102100034845 KiSS-1 receptor Human genes 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 108010021099 Lamin Type A Proteins 0.000 description 1
- 102000008201 Lamin Type A Human genes 0.000 description 1
- 102000003820 Lipoxygenases Human genes 0.000 description 1
- 108090000128 Lipoxygenases Proteins 0.000 description 1
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 102100025169 Max-binding protein MNT Human genes 0.000 description 1
- 102100035285 Meiotic recombination protein DMC1/LIM15 homolog Human genes 0.000 description 1
- 101710205093 Methylcrotonoyl-CoA carboxylase beta chain, mitochondrial Proteins 0.000 description 1
- 241001024304 Mino Species 0.000 description 1
- 241000713869 Moloney murine leukemia virus Species 0.000 description 1
- LRJUYAVTHIEHAI-UHFFFAOYSA-N Muristeron A Natural products C1C(O)C(O)CC2(C)C(C(O)CC3(C(C(C)(O)C(O)CCC(C)C)CCC33O)C)C3=CC(=O)C21O LRJUYAVTHIEHAI-UHFFFAOYSA-N 0.000 description 1
- LRJUYAVTHIEHAI-LHBNDURVSA-N Muristerone Chemical compound C1[C@@H](O)[C@@H](O)C[C@]2(C)[C@@H]([C@H](O)C[C@@]3([C@@H]([C@@](C)(O)[C@H](O)CCC(C)C)CC[C@]33O)C)C3=CC(=O)[C@@]21O LRJUYAVTHIEHAI-LHBNDURVSA-N 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- OVRNDRQMDRJTHS-RTRLPJTCSA-N N-acetyl-D-glucosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-RTRLPJTCSA-N 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 101800000287 Neutrophil defensin 2 Proteins 0.000 description 1
- 101150114527 Nkx2-5 gene Proteins 0.000 description 1
- 108020004485 Nonsense Codon Proteins 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 1
- 102100021057 Olfactory receptor 10A4 Human genes 0.000 description 1
- 102000043276 Oncogene Human genes 0.000 description 1
- 108010062618 Oncogene Proteins v-rel Proteins 0.000 description 1
- 108010069383 PAX3 Transcription Factor Proteins 0.000 description 1
- 102100028974 PR domain zinc finger protein 14 Human genes 0.000 description 1
- 101100049051 Penaeus vannamei vasa gene Proteins 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 241000286209 Phasianidae Species 0.000 description 1
- 108010057275 Plakophilins Proteins 0.000 description 1
- 102100029740 Poliovirus receptor Human genes 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 108091000054 Prion Proteins 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 108700040121 Protein Methyltransferases Proteins 0.000 description 1
- 102000055027 Protein Methyltransferases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108700020978 Proto-Oncogene Proteins 0.000 description 1
- 102000052575 Proto-Oncogene Human genes 0.000 description 1
- 102100029248 RNA-binding protein 20 Human genes 0.000 description 1
- 101710206022 RNA-binding protein 20 Proteins 0.000 description 1
- 241000713810 Rat sarcoma virus Species 0.000 description 1
- 102100025483 Retinoid-inducible serine carboxypeptidase Human genes 0.000 description 1
- 102000002278 Ribosomal Proteins Human genes 0.000 description 1
- 108010000605 Ribosomal Proteins Proteins 0.000 description 1
- 102100021782 SH3 domain-containing protein 19 Human genes 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 101100168914 Schizosaccharomyces pombe (strain 972 / ATCC 24843) pcu4 gene Proteins 0.000 description 1
- 102100023921 Serine/threonine-protein kinase ATR Human genes 0.000 description 1
- 108010052164 Sodium Channels Proteins 0.000 description 1
- 102000018674 Sodium Channels Human genes 0.000 description 1
- 229930182558 Sterol Natural products 0.000 description 1
- 101001091268 Streptomyces hygroscopicus Hygromycin-B 7''-O-kinase Proteins 0.000 description 1
- 101150080074 TP53 gene Proteins 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- 108020005038 Terminator Codon Proteins 0.000 description 1
- LYGKYFKSZTUXGZ-ZDLURKLDSA-N Thr-Cys-Gly Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)NCC(O)=O LYGKYFKSZTUXGZ-ZDLURKLDSA-N 0.000 description 1
- UZJDBCHMIQXLOQ-HEIBUPTGSA-N Thr-Cys-Thr Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N)O UZJDBCHMIQXLOQ-HEIBUPTGSA-N 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 108091028113 Trans-activating crRNA Proteins 0.000 description 1
- 108010048999 Transcription Factor 3 Proteins 0.000 description 1
- 102100038313 Transcription factor E2-alpha Human genes 0.000 description 1
- 102100031079 Transcription termination factor 1 Human genes 0.000 description 1
- 108010020764 Transposases Proteins 0.000 description 1
- 102000008579 Transposases Human genes 0.000 description 1
- 108060005989 Tryptase Proteins 0.000 description 1
- 102000001400 Tryptase Human genes 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 description 1
- 108010064978 Type II Site-Specific Deoxyribonucleases Proteins 0.000 description 1
- 108010064762 Uroporphyrinogen decarboxylase Proteins 0.000 description 1
- 210000001766 X chromosome Anatomy 0.000 description 1
- 210000002593 Y chromosome Anatomy 0.000 description 1
- 101710185494 Zinc finger protein Proteins 0.000 description 1
- 102100023597 Zinc finger protein 816 Human genes 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 101150084233 ago2 gene Proteins 0.000 description 1
- 230000009418 agronomic effect Effects 0.000 description 1
- 231100000360 alopecia Toxicity 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 102000006646 aminoglycoside phosphotransferase Human genes 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002155 anti-virotic effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 229940114078 arachidonate Drugs 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 108091092328 cellular RNA Proteins 0.000 description 1
- 229940015047 chorionic gonadotropin Drugs 0.000 description 1
- 210000004756 chromatid Anatomy 0.000 description 1
- 230000008711 chromosomal rearrangement Effects 0.000 description 1
- 208000029664 classic familial adenomatous polyposis Diseases 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 208000034557 congenital alopecia Diseases 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000005138 cryopreservation Methods 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 108010004073 cysteinylcysteine Proteins 0.000 description 1
- 230000003436 cytoskeletal effect Effects 0.000 description 1
- 210000004292 cytoskeleton Anatomy 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000000326 densiometry Methods 0.000 description 1
- 238000009795 derivation Methods 0.000 description 1
- 102000004419 dihydrofolate reductase Human genes 0.000 description 1
- 108020001096 dihydrofolate reductase Proteins 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000002224 dissection Methods 0.000 description 1
- 230000009881 electrostatic interaction Effects 0.000 description 1
- 210000002242 embryoid body Anatomy 0.000 description 1
- 230000002357 endometrial effect Effects 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 230000001973 epigenetic effect Effects 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 239000006277 exogenous ligand Substances 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 210000000604 fetal stem cell Anatomy 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 230000003325 follicular Effects 0.000 description 1
- 230000008217 follicular development Effects 0.000 description 1
- 210000001733 follicular fluid Anatomy 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 229960002963 ganciclovir Drugs 0.000 description 1
- IRSCQMHQWWYFCW-UHFFFAOYSA-N ganciclovir Chemical compound O=C1NC(N)=NC2=C1N=CN2COC(CO)CO IRSCQMHQWWYFCW-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 238000012637 gene transfection Methods 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 231100000722 genetic damage Toxicity 0.000 description 1
- 235000003869 genetically modified organism Nutrition 0.000 description 1
- 210000002980 germ line cell Anatomy 0.000 description 1
- 108010089804 glycyl-threonine Proteins 0.000 description 1
- 210000002503 granulosa cell Anatomy 0.000 description 1
- 239000005090 green fluorescent protein Substances 0.000 description 1
- 208000037824 growth disorder Diseases 0.000 description 1
- 210000004209 hair Anatomy 0.000 description 1
- 210000003780 hair follicle Anatomy 0.000 description 1
- 230000003779 hair growth Effects 0.000 description 1
- 210000003783 haploid cell Anatomy 0.000 description 1
- 230000012447 hatching Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 244000144980 herd Species 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 229940084986 human chorionic gonadotropin Drugs 0.000 description 1
- 229960002773 hyaluronidase Drugs 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000001157 hypermorphic effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 238000012296 in situ hybridization assay Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000009027 insemination Effects 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 108010093036 interleukin receptors Proteins 0.000 description 1
- 102000002467 interleukin receptors Human genes 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- KAHDONZOCXSKII-NJVVDGNHSA-N kisspeptin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H]1N(CCC1)C(=O)[C@H]1N(CCC1)C(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)O)C1=CN=CN1 KAHDONZOCXSKII-NJVVDGNHSA-N 0.000 description 1
- 238000011813 knockout mouse model Methods 0.000 description 1
- 108010025821 lamin C Proteins 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 231100000225 lethality Toxicity 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 238000007834 ligase chain reaction Methods 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 101150117702 lpl3 gene Proteins 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- 230000032965 negative regulation of cell volume Effects 0.000 description 1
- 229910052754 neon Inorganic materials 0.000 description 1
- GKAOGPIIYCISHV-UHFFFAOYSA-N neon atom Chemical compound [Ne] GKAOGPIIYCISHV-UHFFFAOYSA-N 0.000 description 1
- 210000000276 neural tube Anatomy 0.000 description 1
- 102000006255 nuclear receptors Human genes 0.000 description 1
- 108020004017 nuclear receptors Proteins 0.000 description 1
- 230000001293 nucleolytic effect Effects 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 230000005305 organ development Effects 0.000 description 1
- 230000002188 osteogenic effect Effects 0.000 description 1
- 108700025694 p53 Genes Proteins 0.000 description 1
- 230000015031 pancreas development Effects 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000008775 paternal effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 230000007030 peptide scission Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical group 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 210000004508 polar body Anatomy 0.000 description 1
- 108010048507 poliovirus receptor Proteins 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 230000003234 polygenic effect Effects 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000011045 prefiltration Methods 0.000 description 1
- 238000009597 pregnancy test Methods 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000014493 regulation of gene expression Effects 0.000 description 1
- 230000008263 repair mechanism Effects 0.000 description 1
- 230000033458 reproduction Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 239000013049 sediment Substances 0.000 description 1
- 238000005204 segregation Methods 0.000 description 1
- 238000009612 semen analysis Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000020509 sex determination Effects 0.000 description 1
- 230000032678 sex differentiation Effects 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 229940063675 spermine Drugs 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 230000035892 strand transfer Effects 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 208000034100 susceptibility to 1 basal cell carcinoma Diseases 0.000 description 1
- 230000001360 synchronised effect Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 101150024821 tetO gene Proteins 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 108091006107 transcriptional repressors Proteins 0.000 description 1
- 230000017105 transposition Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 102000003643 uroporphyrinogen-III synthase Human genes 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 238000002689 xenotransplantation Methods 0.000 description 1
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New or modified breeds of animals
- A01K67/027—New or modified breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New or modified breeds of animals
- A01K67/027—New or modified breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0276—Knock-out vertebrates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/873—Techniques for producing new embryos, e.g. nuclear transfer, manipulation of totipotent cells or production of chimeric embryos
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/90—Stable introduction of foreign DNA into chromosome
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/90—Stable introduction of foreign DNA into chromosome
- C12N15/902—Stable introduction of foreign DNA into chromosome using homologous recombination
- C12N15/907—Stable introduction of foreign DNA into chromosome using homologous recombination in mammalian cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/16—Hydrolases (3) acting on ester bonds (3.1)
- C12N9/22—Ribonucleases RNAses, DNAses
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/15—Animals comprising multiple alterations of the genome, by transgenesis or homologous recombination, e.g. obtained by cross-breeding
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/101—Bovine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/108—Swine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/02—Animal zootechnically ameliorated
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- Environmental Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Animal Husbandry (AREA)
- Biodiversity & Conservation Biology (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Mycology (AREA)
- Cell Biology (AREA)
- Medicinal Chemistry (AREA)
- Developmental Biology & Embryology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
본 발명은 세포에서 멀티플렉스 유전자 편집물을 제조하기 위한 물질 및 방법을 제시한다. 추가적인 방법은 동물 및 이의 제조 방법을 포함한다.
Description
관련 출원에 대한 교차 참조
본 출원은 2014년 4월 28일에 출원된 미국 가출원 61/985,327을 우선권으로 주장하며, 이는 원용에 의해 본 명세서에 포함된다.
기술분야
본 기술분야는 다중 부위에서의 유전자 편집, 척추동물 세포에서의 다중 유전자 편집물(edit) 및 이들의 용도에 관한 것이다.
세포, 및 이러한 세포로부터 제조된 동물에 대해 이루어지는 유전자 변형은 유전자 발현을 변화시키는 데 유용하다. 유전자 조작 분야는 매우 활동적이다.
단일 세대에서 이의 유전자 코드에 다중 변화를 가진 대형 척추동물을 제조하는 것이 매우 유용할 것이다. 본원에 개시되는 바와 같이, 이러한 제조는 세포 또는 배아에서 다중 유전자를 동시에 편집함으로써 가능하다. 다중 유전자는 척추동물 세포 또는 배아에서 표적화된 뉴클레아제 및 상동성 표적 복구(homology directed repair; HDR) 주형을 사용하여 편집되도록 표적화될 수 있다. 이들 세포 또는 배아는 모든 동물을 연구 또는 제조하는 데 사용될 수 있다. 다중 편집물은 예를 들어, 순차적으로 이루어지는 품종 개량 또는 유전자 조작 변화에 의해 단일 세대에서 제조될 수 있으며, 그렇지 않다면 제조되지 않을 수 있다.
도 1a는 단일 편집물을 사용하여 2개의 넉아웃에 대해 동형인 동물을 제조하는 방법을 도시하고 있다.
도 1b는 단일 편집물을 일시에 제조함으로써 다중 편집물을 가진 동물을 제조하는 가설적인 방법을 도시하고 있다.
도 2는 F0 세대에서 파운더(founder)를 구축하는 데 사용되는 멀티플렉스 유전자 편집을 도시하고 있다.
도 3은 돼지 RAG2 및 IL2Rγ의 멀티플렉스 유전자 편집을 도시하고 있다. 패널 a)는 형질감염 후 3일째에 세포 집단에서 비-상동성 말단 접합(non-homologous end joining; NHEJ) 및 상동성 의존적 복구 HDR의 효율을 확인하기 위한 서베이어(Surveyor) 및 RFLP 분석이다. 패널 b)는 형질감염 후 11일째에 세포 집단에 대한 상동성 의존적 복구의 RFLP 분석이다. 패널 c)는 IL2Rγ , RAG2 또는 둘 다에서 HDR에 양성인 콜로니의 백분율이다. 패널 a에서 "C"로 표시된 집단의 세포를 평판배양하였다. 패널 d)는 IL2Rγ 및 RAG2에 대해 2 ㎍ 및 1 ㎍ 양의 TALEN mRNA 및 각각에 대해 1 μM의 HDR 주형으로 형질감염시킨 세포의 콜로니 분석이다. 콜로니 유전자형의 분포는 하기에 나타나 있다.
도 4는 돼지 APC 및 p53의 멀티플렉스 유전자 편집이다. 패널 a)는 형질감염 후 3일째에 세포 집단에서 비-상동성 말단 접합(NHEJ) 및 상동성 의존적 복구 HDR의 효율을 확인하기 위한 서베이어 및 RFLP 분석이다. 패널 b)는 형질감염 후 11일째에 세포 집단에 대한 상동성 의존적 복구의 RFLP 분석이다. 패널 c) 및 패널 d)는 APC, p53 또는 둘 다에서 HDR에 대한 지시된 세포 집단(패널 a에서, "C" 및 "D"로 표시됨) 유래의 양성 콜로니의 백분율이다. 3개 이상의 HDR 대립유전자를 가진 콜로니는 하기에 열거되어 있다.
도 5는 5-유전자 멀티플렉스 HDR 효율에 미치는 올리고뉴클레오타이드 HDR 주형의 농도의 효과이다. 돼지 RAG2 , IL2Rγ , p53, APC 및 LDLR에 관한 TALEN mRNA를 지시된 양으로 2 μM(패널 a) 또는 1 μM(패널 b)의 각각의 동족 HDR 주형과 함께 돼지 섬유아세포 내에 공동-형질감염시켰다. NHEJ 및 HDR의 백분율을 서베이어 및 RFLP 검정에 의해 측정하였다.
도 6은 5-유전자 멀티플렉스 HDR 효율에 미치는 올리고뉴클레오타이드 HDR 주형의 농도의 효과에 대한 실험 데이터의 플롯을 보여주는 5-유전자 멀티플렉스 데이터 세트이다. 돼지 RAG2 , IL2Rγ , p53, APC 및 LDLR에 관한 TALEN mRNA를 지시된 양으로 2 μM(패널 a) 또는 1 μM(패널 b)의 각각의 동족 HDR 주형과 함께 돼지 섬유아세포 내에 공동-형질감염시켰다. NHEJ 및 HDR의 백분율을 서베이어 및 RFLP 검정에 의해 측정하였다. 5-유전자 멀티플렉스 HDR 유래의 콜로니 유전자형: 콜로니 유전자형을 RFLP 분석에 의해 평가하였다. 패널 a)에서 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형을 동정할 수 있었다; 이형접합 HDR 또는 동형접합 HDR의 예상된 RFLP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 이동을 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율은 각각의 컬럼 아래에 표시되어 있다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 총 수이다.
도 7은 5-유전자 멀티플렉스 HDR 효율에 미치는 올리고뉴클레오타이드 HDR 주형 농도의 효과를 수반하는 제2 실험에 대한 실험 데이터의 플롯을 보여주는 또 다른 5-유전자 멀티플렉스 데이터 세트이다. 제2의 5-유전자 멀티플렉스 시험의 콜로니 유전자형이다. 패널 a)에서, 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형을 동정할 수 있었다; 이형접합 HDR 또는 동형접합 HDR의 예상된 RFLP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 이동을 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율은 각각의 컬럼 아래에 표시되어 있다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 총 수이다.
도 8은 콜로니 유전자형을 보여주는 또 다른 5-유전자 멀티플렉스 시험 데이터 세트이다. 패널 a)에서, 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형을 동정할 수 있었다; 이형접합 HDR 또는 동형접합 HDR의 예상된 RFLP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 이동을 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율은 각각의 컬럼 아래에 표시되어 있다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 총 수이다.
도 9는 요망되는 유전자 넉아웃 또는 선택적인 대립유전자를 생성하는 표적화된 뉴클레아제를 가진 F0 세대 키메라의 제조 방법을 도시하고 있다.
도 10은 정상적인 표현형을 가진 F0 세대 동물, 및 성장 장애(failure to thrive; FTT) 표현형 및 유전자형을 가진 자손의 구축을 도시하고 있다.
도 11은 공여자 배아의 유전학을 가진 배우자를 포함하는 키메라 동물의 제조 방법을 도시하고 있다.
도 12는 NKX-2, GATA4 및 MESP1의 3개의 표적화된 유전자좌에서의 멀티플렉스 편집을 도시하고 있다. 패널 a)는 실험의 도식도이며, 패널 b)는 유전자의 표적화를 보여주고 있으며, NKX2-5, GATA4 및 MESP1은 각각 서열번호 1-3으로서 열거되어 있다. 패널 c)는 실험에 대한 검정 결과를 도시하고 있다. 각각의 표적 유전자에 대한 올리고 서열이 나타나 있다. 신규 뉴클레오타이드는 대문자로 표시된다. PTC는 박스 안에서 밝은 색상의 문자로 표시되어 있으며, 신규 HindIII RFLP 부위에는 밑줄이 그어져 있다.
도 13은 TALEN과 RGEN의 조합을 사용한 멀티플렉스 유전자-편집을 도시하고 있으며; RFLP에 의해 평가된 형질감염된 세포의 검정은 2개 부위 모두에서 HDR을 보여주었다.
도 1b는 단일 편집물을 일시에 제조함으로써 다중 편집물을 가진 동물을 제조하는 가설적인 방법을 도시하고 있다.
도 2는 F0 세대에서 파운더(founder)를 구축하는 데 사용되는 멀티플렉스 유전자 편집을 도시하고 있다.
도 3은 돼지 RAG2 및 IL2Rγ의 멀티플렉스 유전자 편집을 도시하고 있다. 패널 a)는 형질감염 후 3일째에 세포 집단에서 비-상동성 말단 접합(non-homologous end joining; NHEJ) 및 상동성 의존적 복구 HDR의 효율을 확인하기 위한 서베이어(Surveyor) 및 RFLP 분석이다. 패널 b)는 형질감염 후 11일째에 세포 집단에 대한 상동성 의존적 복구의 RFLP 분석이다. 패널 c)는 IL2Rγ , RAG2 또는 둘 다에서 HDR에 양성인 콜로니의 백분율이다. 패널 a에서 "C"로 표시된 집단의 세포를 평판배양하였다. 패널 d)는 IL2Rγ 및 RAG2에 대해 2 ㎍ 및 1 ㎍ 양의 TALEN mRNA 및 각각에 대해 1 μM의 HDR 주형으로 형질감염시킨 세포의 콜로니 분석이다. 콜로니 유전자형의 분포는 하기에 나타나 있다.
도 4는 돼지 APC 및 p53의 멀티플렉스 유전자 편집이다. 패널 a)는 형질감염 후 3일째에 세포 집단에서 비-상동성 말단 접합(NHEJ) 및 상동성 의존적 복구 HDR의 효율을 확인하기 위한 서베이어 및 RFLP 분석이다. 패널 b)는 형질감염 후 11일째에 세포 집단에 대한 상동성 의존적 복구의 RFLP 분석이다. 패널 c) 및 패널 d)는 APC, p53 또는 둘 다에서 HDR에 대한 지시된 세포 집단(패널 a에서, "C" 및 "D"로 표시됨) 유래의 양성 콜로니의 백분율이다. 3개 이상의 HDR 대립유전자를 가진 콜로니는 하기에 열거되어 있다.
도 5는 5-유전자 멀티플렉스 HDR 효율에 미치는 올리고뉴클레오타이드 HDR 주형의 농도의 효과이다. 돼지 RAG2 , IL2Rγ , p53, APC 및 LDLR에 관한 TALEN mRNA를 지시된 양으로 2 μM(패널 a) 또는 1 μM(패널 b)의 각각의 동족 HDR 주형과 함께 돼지 섬유아세포 내에 공동-형질감염시켰다. NHEJ 및 HDR의 백분율을 서베이어 및 RFLP 검정에 의해 측정하였다.
도 6은 5-유전자 멀티플렉스 HDR 효율에 미치는 올리고뉴클레오타이드 HDR 주형의 농도의 효과에 대한 실험 데이터의 플롯을 보여주는 5-유전자 멀티플렉스 데이터 세트이다. 돼지 RAG2 , IL2Rγ , p53, APC 및 LDLR에 관한 TALEN mRNA를 지시된 양으로 2 μM(패널 a) 또는 1 μM(패널 b)의 각각의 동족 HDR 주형과 함께 돼지 섬유아세포 내에 공동-형질감염시켰다. NHEJ 및 HDR의 백분율을 서베이어 및 RFLP 검정에 의해 측정하였다. 5-유전자 멀티플렉스 HDR 유래의 콜로니 유전자형: 콜로니 유전자형을 RFLP 분석에 의해 평가하였다. 패널 a)에서 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형을 동정할 수 있었다; 이형접합 HDR 또는 동형접합 HDR의 예상된 RFLP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 이동을 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율은 각각의 컬럼 아래에 표시되어 있다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 총 수이다.
도 7은 5-유전자 멀티플렉스 HDR 효율에 미치는 올리고뉴클레오타이드 HDR 주형 농도의 효과를 수반하는 제2 실험에 대한 실험 데이터의 플롯을 보여주는 또 다른 5-유전자 멀티플렉스 데이터 세트이다. 제2의 5-유전자 멀티플렉스 시험의 콜로니 유전자형이다. 패널 a)에서, 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형을 동정할 수 있었다; 이형접합 HDR 또는 동형접합 HDR의 예상된 RFLP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 이동을 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율은 각각의 컬럼 아래에 표시되어 있다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 총 수이다.
도 8은 콜로니 유전자형을 보여주는 또 다른 5-유전자 멀티플렉스 시험 데이터 세트이다. 패널 a)에서, 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형을 동정할 수 있었다; 이형접합 HDR 또는 동형접합 HDR의 예상된 RFLP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 이동을 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율은 각각의 컬럼 아래에 표시되어 있다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 총 수이다.
도 9는 요망되는 유전자 넉아웃 또는 선택적인 대립유전자를 생성하는 표적화된 뉴클레아제를 가진 F0 세대 키메라의 제조 방법을 도시하고 있다.
도 10은 정상적인 표현형을 가진 F0 세대 동물, 및 성장 장애(failure to thrive; FTT) 표현형 및 유전자형을 가진 자손의 구축을 도시하고 있다.
도 11은 공여자 배아의 유전학을 가진 배우자를 포함하는 키메라 동물의 제조 방법을 도시하고 있다.
도 12는 NKX-2, GATA4 및 MESP1의 3개의 표적화된 유전자좌에서의 멀티플렉스 편집을 도시하고 있다. 패널 a)는 실험의 도식도이며, 패널 b)는 유전자의 표적화를 보여주고 있으며, NKX2-5, GATA4 및 MESP1은 각각 서열번호 1-3으로서 열거되어 있다. 패널 c)는 실험에 대한 검정 결과를 도시하고 있다. 각각의 표적 유전자에 대한 올리고 서열이 나타나 있다. 신규 뉴클레오타이드는 대문자로 표시된다. PTC는 박스 안에서 밝은 색상의 문자로 표시되어 있으며, 신규 HindIII RFLP 부위에는 밑줄이 그어져 있다.
도 13은 TALEN과 RGEN의 조합을 사용한 멀티플렉스 유전자-편집을 도시하고 있으며; RFLP에 의해 평가된 형질감염된 세포의 검정은 2개 부위 모두에서 HDR을 보여주었다.
멀티플렉스 유전자 편집 과정이 기술되어 있다. 다중 유전자는 모든 동물의 연구 또는 제조에 사용될 수 있는 세포 또는 배아에서 변형될 수 있다. 다른 실시형태는 숙주 니치(host niche)의 선택적인 탈집단화에 의한 세포 또는 기관 소실의 보완을 수반한다. 이들 발명은 모델, 식품으로서, 및 산업 및 의학용 세포성 생성물 및 무세포성(acellular) 생성물의 공급원으로서 작용하기 위해 동물의 신속한 창조(creation)를 제공한다.
도 1a는, 단일 편집물을 사용하여, 편집된 대립유전자를 오직 2개만 가진 가축을 제조하는 데 수년이 소요되는 이유를 예시하는 시각표를 가지고 있으며, 시간은 소의 경우 약 6년이다. 이러한 맥락에서, 편집된다는 것은, 유전자를 선택하고 이를 변경시키는 것을 지칭한다. 우선, 표적화된 KO을 가진 이형접합 송아지를 제작하기 위해 클로닝된 배양된 체세포에서 관심 유전자를 편집, 예를 들어 넉아웃(KO)시켜야 한다. 이형접합체는 품종 개량을 위해 성숙하도록 소의 경우 약 2세가 될 때까지 길러져서, 제1세대(F1) 수컷 및 암컷 이형접합 송아지가 발생되며, 이들이 서로 품종 개량되어 동형접합 넉아웃 송아지(F2)가 발생될 것이다. 소에서 종래의 접근법을 이용하여 다중 표적화된 돌연변이에 관한 동형접합체를 발생시키는 것은 비실용적일 것이다. 추가적인 편집물을 제조하는 데 필요한 햇수 및 필요한 동물 수는 도 1b에 예시된 바와 같이 사용되는 특정 일정에 따라 대략 기하급수적인 방식으로 증가한다. 척추동물 중에서, 1 세대 당 자손의 수가 더 많고 소보다 임신 기간이 더 짧은 동물조차도 다중 편집물을 달성하기 위해서는 과도하게 긴 시간이 필요할 것이다. 더욱이, 공격적인 동계 교배에 의해 시간을 최소화하려는 계획은 다중 편집물에 대해서는 합리적으로 가능하지 않을 수 있다. 또한, 순차적인 클로닝은 과정 및 결과 관점에서, 특히 동물이 가축 또는 실험 모델로서 유용해야 한다면 바람직하지 못하다.
본 발명에 의해 제시되는 기회는 도 2에 예시되어 있으며, 도 2는 제1-세대 동물(F0)에서 제조되는 다중 편집물을 보여준다. 배아는 직접 제조되거나, 이형접합체 또는 동형접합체인 것으로 독립적으로 선택되는 2개 이상의 편집물을 사용함으로써 제조되며, 대리(surrogate) 암컷에 위치해서 임신이 이루어진다. 생성되는 동물은 F0 세대 파운더이다. 복수의 배아가 제조되어 하나 이상의 대리모에 위치되어, 2가지 성별 모두의 자손이 생성될 수 있거나, 잘 알려진 배아-분할 기술이 사용되어, 복수의 클로날 배아가 제조될 수 있다. 전형적으로 2가지 성별 모두의 한배새끼(litter)를 생성하는 돼지와 같은 가축이 교배되어 번식될 수 있다.
다수의 대립유전자는 본원에 기술된 바와 같이 세포 또는 배아에서, 표적화된 엔도뉴클레아제 및 상동성 표적 복구(HDR)를 사용하여 교란되거나 그렇지 않다면 편집될 수 있다. 일 실시형태는 척추동물 세포 또는 배아의 복수의 표적 염색체 DNA 부위에서 유전자 편집물을 제조하는 방법이며, 이러한 방법은, 제1 표적 염색체 DNA 부위에 관한 제1 표적화된 엔도뉴클레아제, 및 제1 표적 부위 서열에 상동성인 제1 상동성 표적 복구(HDR) 주형; 및 제2 표적 염색체 DNA 부위에 관한 제2 표적화된 엔도뉴클레아제, 및 제2 표적 부위 서열에 상동성인 제2 HDR 주형을 척추동물 세포 또는 배아 내로 도입하는 단계를 포함하며, 제1 HDR 주형 서열은 제1 표적 부위에서 본래의 염색체 DNA 서열을 대체하고, 제2 HDR 주형 서열은 제2 표적 부위 서열에서 본래의 염색체 DNA 서열을 대체한다.
넉아웃 또는 대체와 같은 다중 편집물이 수득될 수 있음을 아는 것은 예상치 못하였으며 놀랍고 예측하지 못한 결과였다. 하나의 이론화된 메커니즘은, 다중 편집물들에 수용적인 세포들이 소수 존재하며, 그 이유는 이들이 세포 주기의 특정 단계에 있기 때문이라는 것이다. 엔도뉴클레아제 및 HDR 주형에 노출 시, 이들은 쉽게 반응한다. 관련된 작동 이론은, HDR 주형화(templating) 과정 그 자체가 다중 치환에 적합하다는 것이며, 그 이유는 하나의 표적화된 부위에 대한 세포 복구 머시너리의 활성화가 마찬가지로 다른 부위에서도 복구 또는 HDR 주형화를 선호하기 때문이다. HDR은 역사적으로 효율이 낮은 과정이었으므로, 다중 HDR 편집물은 분명하게 시도, 관찰 또는 인지되지 않았다.
본원에서의 결과는, 너무 많거나 너무 적은 엔도뉴클레아제 및/또는 HDR 주형이 음성 효과를 가질 수 있음을 보여주며, 이러한 음성 효과는 이러한 영역에서의 선행 연구가 틀렸음을 입증할 수 있다. 사실상, 발명자들은, 표적화된 엔도뉴클레아제가 올바르게 디자인 및 제조될 수 있으나, 그럼에도 불구하고 너무 효율적이기 때문에 실패할 수 있음을 관찰하였다. 나아가, 성공적으로 변형된 세포 집단은 종종 시간이 지나도 개선되지 않는다. 세포를 변형시키는 당업자는 통상, 성공적인 클로닝 또는 다른 용도들을 위한 안정성 및 건강의 지표로서 변형 및 세포의 수명을 모색한다. 그러나, 이러한 예상은 종종 본원의 멀티플렉싱 과정에서는 유용하지 않았다. 더욱이, 발명자들은, 상동성 재조합(HR) 유전자이입 효율이 단일-유전자좌 유전자이입과 비교하여 멀티플렉스 접근법에서 가변적임을 관찰하였다. 일부 유전자좌들은 매우 민감하였으나, 다른 유전자좌들은 효율이 크게 하락하였다. 엔도뉴클레아제들 사이에 분명하게 방해(간섭)가 있으나, 순수(net) 효과는 예를 들어, 엔도뉴클레아제가 보편적인 자원(resource)에 대해 경쟁하고 있음을 가정함으로써 간단하게 설명될 수는 없다.
염색체 DNA의 복수의 위치들 내로 많은 유전자들을 무작위로 또는 부정확하게 삽입하거나, 복수의 유전자들을 교란시키는 무작위 편집물을 제조하기 위한 잘 알려진 기술들은 다양하게 존재한다. 입증되는 바와 같이, 무작위 또는 부정확한 과정은, 효과를 달성하기 위해 복수의 특이적으로 표적화된 유전자들을 편집해야 하는 과학자들에게 도움이 되지 못할 것이다. 이에, 본원에 교시된 HDR 과정들은, 편집물 및 생성되는 유기체가 의도되는 표적 부위에서만 만들어진다는 것에 의해 쉽게 구별될 수 있다. 하나의 차이는, 본 발명의 HDR 편집 실시형태가, 추가의 유전자 복사본 없이 및/또는 엔도뉴클레아제에 의해 표적화되는 것 이외의 유전자의 교란 없이, 수행될 수 있다는 것이다. 또한, 특이적인 편집물은, HDR 주형 서열이 적절한 상동성 없이는 부위 내로 복사되지 않기 때문에, 하나의 위치에서 만들어진다. 실시형태는, 외인성 대립유전자가 이의 동족 대립유전자 부위에서만 염색체 DNA 내로 복사되는 유기체 및 과정을 포함한다.
HDR-기재 편집의 이점은 편집물이 선택될 수 있다는 점이다. 이와는 대조적으로, 비-상동성 말단 접합(NHEJ) 과정에 의한 다른 시도들은, indel이 프레임 시프트(frame shift)를 만들지 않으면서 서로 취소시키도록, 다중 위치에서 indel을 만들 수 있다. 이러한 문제점은, 멀티플렉싱이 관여하는 경우 유의미해진다. 그러나, HDR의 성공적인 용도는, 바람직하다면 표적 유전자가 프레임 시프트를 가지는 것을 보장하기 위해 편집물이 만들어질 수 있음을 제공한다. 더욱이, 대립유전자 대체는 HDR을 필요로 하며, NHEJ, 핵산의 벡터-구동 삽입, 트랜스포존 삽입 등에 의해서는 달성될 수 없다. 더욱이, 원하지 않는 편집물을 포함하지 않는 유기체를 선택하는 것은 어려움의 정도를 더 높인다.
그러나, 일반적으로, 본원에 기술된 바와 같은 멀티플렉스 편집물이 가축 또는 대형 척추동물에 관련된 세포 또는 동물의 표적화된 부위에서 이미 달성되지 않은 것으로 여겨진다. 계대배양 수가 높은 세포로부터 동물을 클로닝하면, 유전적 손상이 너무 많아 실험 모델 또는 가축의 F0 파운더로서 유용하지 않은 동물이 제작된다는 것은 잘 알려져 있다.
유전자 편집은 확률적인 과정이며; 그 결과, 해당 분야는 전형적으로, 성공적으로 편집된 세포의 소수 백분율을 동정하기 위해 다양한 스크리닝 기술들을 강조하였다. 이는 확률적인 과정이기 때문에, 복수의 편집물의 제조 시의 어려움은, 의도되는 편집물의 수가 증가함에 따라, 당업자에 의해 기하급수적인 방식으로 증가할 것으로 예상될 수 있다.
본 발명의 일 실시형태는 본원에서 멀티플렉스 유전자 넉아웃 또는 편집으로 지칭되는 방법인, 단일 세포 또는 배아에서 다중 표적화된 유전자 넉아웃 또는 다른 편집물을 제조하는 방법을 제공한다. 표적화된 유전자라는 용어는, TALEN 또는 CRISPR과 같은 엔도뉴클레아제 시스템의 디자인에 의해 엔도뉴클레아제 공격을 받도록 선택되는 염색체 DNA 부위를 지칭한다. 용어 넉아웃, 불활성화 및 교란은, 표적화된 부위가 변해서 유전자 발현 생성물이 제거되거나 크게 감소되어, 유전자 발현이 더 이상 동물 전체에 유의미한 영향을 미치지 않음을 의미하기 위해 본원에서 상호호환적으로 사용된다. 이들 용어는 때때로, 유전자의 역할을 본질적으로 제거하지 않은 채 유전자의 역할을 눈에 띄게 감소시키는 것을 지칭하기 위해 어디에서나 사용된다.
본원에 사용되는 바와 같이, 유전자 편집은 유전자를 선택하고 이를 변경하는 것을 지칭한다. 무작위 삽입, 유전자 포획(trapping) 등은 유전자 편집이 아니다. 유전자 편집의 예는 표적화된 부위에서의, 유전자 넉아웃, 핵산 첨가, 핵산 제거, 모든 기능의 절개, 대립유전자의 유전자이입, 고차형 유전적 변경(hypermorphic alteration), 저차형 유전적 변경(hypomorphic alteration) 및 하나 이상의 대립유전자의 대체이다.
대립유전자 대체는 내인성 대립유전자보다 외인성 대립유전자를 복사하는 비-감수분열 과정을 지칭한다. 용어 대립유전자 대체는, 일부 경우 축퇴성 치환(degenerate substitution)을 제외하고는, indel 또는 다른 변화 없이 본래의 대립유전자로부터 외인성 대립유전자에 변화가 가해지는 것을 의미한다. 용어 축퇴성 치환은, 코딩되는 아미노산을 변화시키지 않으면서, 코돈 내 염기가 또 다른 염기로 변화됨을 의미한다. 축퇴성 치환은 엑손 또는 인트론에 존재하도록 선택될 수 있다. 축퇴성 치환의 하나의 용도는, 유전자 이입된 서열의 존재를 용이하게 시험하기 위해 제한효소 부위를 만드는 것이다. 내인성 대립유전자는 또한 본원에서, 본래의 대립유전자로 지칭된다. 용어 유전자는 광범위하며, 기능성 생성물을 제작하기 위해 발현되는 염색체 DNA를 지칭한다. 유전자는 대립유전자를 가진다. 특정 유전자좌에 2개의 동일한 대립유전자가 존재한다면 유전자형은 동형접합이며, 2개의 대립유전자가 서로 다르다면 이형접합으로 지칭된다. 대립유전자는, 특정 염색체의 특정 위치에 위치한 유전자의 대안적인 형태(하나의 쌍 중 하나의 구성원)이다. 대립유전자는 구별되는 특성을 결정한다. 대립유전자들은 (위치 또는 bp를 구별하는) 이들의 DNA 서열 내 특정 위치에서 염기쌍(bp) 차이를 가지며, 이로 인해 이들은 구별되는 특성을 가지며 서로 구별되며, 이러한 구별되는 위치들은 대립유전자 마커로서의 역할을 한다. 대립유전자는 보편적으로 기술되어 있으며, 본원에 기술되어 있고, 이들이 구별되는 위치들에서 동일한 염기를 가진다면 동일한 것이며; 동물은 본래 다른 위치들에서 다른 bp에서 소정의 변이를 가진다. 당업자는 대립유전자를 비교할 때, 천연 변이를 일상적으로 수용한다. 정확하게 일치한다라는 용어는 본원에서, DNA 정렬 시 bp 차이 또는 indel이 절대적으로 없음을 의미하는 데 사용된다.
대립유전자 동정을 위한 유사한 시험은, 변경된 유기체의 염색체 DNA를, 자연상에서 인지되는 대로의 외인성 대립유전자의 염색체 DNA와 정렬하는 것이다. 외인성 대립유전자는 하나 이상의 대립유전자 마커를 가질 것이다. 마커의 업스트림 및 다운스트림에서의 DNA 정렬은 특정한 경우 일치할 것이다. 요망되는 시험에 따라, 이러한 거리는 예를 들어, 10 bp 내지 4000 bp일 수 있다. HDR 주형이, 정확하게 일치하는 서열을 만드는 것으로 예상될 수 있긴 하지만, 주형화된 영역의 어느 한쪽 상의 염기는 물론 어느 정도의 자연적인 변이를 가질 것이다. 당업자는, 자연적인 변이의 존재에도 불구하고, 대립유전자를 일상적으로 구별한다. 당업자는, 예시적으로 언급된 경계 사이의 모든 범위 및 값들이 고려됨을 즉시 이해할 것이며, 하기 거리들 중 임의의 거리가 상한 또는 하한으로서 이용가능하다: 15, 25, 50, 100, 200, 300, 400, 500, 600, 800, 1000, 1200, 1400, 1600, 1800, 2000, 4000.
당업자는 또한, 유전자 편집물을, 유성 생식과는 대조적으로 유전자 편집의 결과인 대립유전자와 구별할 수 있다. 대립유전자가, 대립유전자들을 혼합하기 위해 유성생식할 수 없는 또 다른 종으로부터 유래되는 경우, 사소하다. 또한, 많은 편집물들은 자연상에서 간단히 발견되지 않는다. 또한, 대립유전자가 하나의 품종에서 다음 품종으로 이동될 때, 심지어 또 다른 품종에서 자연적으로 발견되는 대립유전자를 정확하게 복제하는 대체가 이루어질 때조차, 편집물은 쉽게 구별될 수 있다. 대립유전자는 대부분의 기간 동안 DNA 상에 안정하게 위치된다. 그러나, 배우자를 형성하는 동안 감수분열은 수컷 DNA와 암컷 DNA가 때때로 대립유전자를 서로 바꾸도록 하며(swap), 이를 교차(crossover)라 한다. 교차 빈도 및 유전자 지도는 광범위하게 연구 및 개발되어 왔다. 가축의 경우, 동물의 혈통은 많은 세대들 동안 보다 상세히 추적될 수 있다. 유전학에서, 센티모르간(cM, 지도 단위(map unit; m.u.)라고도 함)은 유전자 연관(genetic linkage)을 측정하는 단위이다. 이는, 단일 세대에서 개입 염색체 교차의 예상되는 평균 수가 0.01인, 염색체 위치(유전자좌 또는 유전자좌의 마커)들 사이의 거리로서 정의된다. 서로 근접한 유전자들은 염색체 상에서 서로 원거리에 있는 유전자들과 비교해 더 낮은 교차율을 가진다. 교차는, 2개의 유전자가 염색체 상에서 서로 바로 다음에 존재하는 경우에는 매우 드문 사건이다. 단일 대립유전자의 2개의 이웃하는 대립유전자들과 관련된 이러한 단일 대립유전자의 교차는 실현불가능하므로, 이러한 사건은 유전자 조작의 생성물이어야 한다. 심지어, 동일한 품종의 동물들이 관여하는 경우에조차, 자연적인 대립유전자 대체 대(versus) 조작된 대립유전자 대체는, 부모가 알려져 있는 경우 쉽게 확인될 수 있다. 또한, 혈통은 잠재적인 부모의 유전자형 분석(genotyping)에 의해 높은 정확도로 확인될 수 있다. 부모 확인은 동물떼(herd) 및 인간에서 일상적이다.
실시형태는, 동시적인 멀티플렉스 유전자 편집 방법을 포함한다. 동시적이라는 용어는, 순차적인 넉아웃 또는 순차적인 클로닝 또는 동물 품종 개량의 개입 주기에서와 같이 다중 편집물을 달성하기 위해 세포를 다수 회 처리하는 가설적인 과정과 대조적이다. 동시적이라는 것은, 유용한 농도로 동시에 존재하는 것, 예를 들어 다중 표적화된 엔도뉴클레아제가 존재하는 것을 의미한다. 과정들은 접합자 및 배아에 적용되어, 모든 세포 또는 본질적으로 모든 세포들이 편집된 대립유전자 또는 넉아웃을 가지는 유기체를 제작할 수 있다. 예를 들어, 넉아웃의 맥락에서 본질적으로 모든 세포란, 많은 세포들에서 유전자를 넉아웃시켜, 해당 유전자의 유전자의 유전자 생성물이 유기체의 기능 면에서 비효율적이기 때문에, 해당 유전자가 부재(absent)하는 것을 지칭한다. 이러한 과정들은 최소 수의 세포 분열 동안에, 바람직하게는 약 0회 내지 약 2회의 분열 동안에 세포, 및 배아 내 세포를 변형시킨다. 실시형태는, 신속한 과정, 또는 여러 회에 걸쳐 발생하거나 세포 분열 수가 고려되는, 예를 들어 0회 내지 20회 복제(세포 분열)로 고려되는 과정을 포함한다. 당업자는, 표현적으로 언급된 제한값들 내의 모든 값 및 범위들, 예를 들어, 약 0회 내지 약 2회의 복제, 약 0회 내지 약 3회의 복제, 약 4회 이하의 복제, 약 0회 내지 약 10회의 복제, 10회 내지 17회의 복제; 약 7일 미만, 약 1일 미만, 약 2일 미만, 약 3일 미만, 약 4일 미만, 약 5일 미만 또는 약 6일 미만, 약 0.5일 내지 약 18일 등이 고려됨을 즉시 이해할 것이다. 낮은 수의 계대배양이라는 용어는 약 20회 이하의 복제를 수행한 원발성 세포를 지칭한다.
어디에서나, 본 발명자들은, 단일 배아에서, 모계 대립유전자, 부계 대립유전자 또는 두 대립유전자 모두가 소의 배아 및 돼지의 배아에서 편집될 수 있으며, 따라서, 두 대립유전자 모두의 주형 편집이 배아에서 HDR을 사용하여 수행될 수 있음을 보여주었다. 이들 편집물은 동일한 유전자좌에서 형성되었다. 구체적으로는, 자매 염색분체 유래의 유전자이입이 검출되었다(문헌[Carlson et al., PNAS 43(109):17382-17387, 2012]).
도 3을 참조하여, 실시예 1은, 2개의 유전자를 한꺼번에 넉아웃시키기 위해 HDR 편집을 사용하는 것, 및 나아가 2개의 넉아웃 모두에 대해 동형접합성이거나 각각의 넉아웃에 대해 이형접합성인 세포를 선별할 수 있는 것을 성공적으로 시도한 실험들에 관해 기술하고 있다. 선별한다라는 용어는, 추가적인 용도를 위해 세포를 동정하고 단리하는 능력을 지칭하는 데 사용되며; 과정 중 어떠한 단계에서도 발현가능한 리포터 유전자가 존재하지 않았으며, 이는, 이러한 과정을 많은 다른 접근법들과 구별하는 고도로 유의미한 이점이다. 제1 유전자 표적(재조합 활성화 유전자 2, RAG2) 및 제2 유전자 표적(인터루킨 수용체 2, 감마, IL2Rg 또는 ILR2γ) 각각에 관한 제1 표적화된 엔도뉴클레아제 및 제2 표적화된 엔도뉴클레아제(각각은 TALEN 쌍임)를 도입하기 위해 세포를 처리하였다. TALEN은 의도되는 부위를 표적으로 하도록 디자인되고, 적절한 양으로 제조되어야 했다. 세포의 처리는 5분 미만이 소요되었다. 전기천공을 사용하였으나, 본원에 기술된 다른 많은 적합한 단백질 또는 DNA 도입-과정들이 존재하였다. 그런 다음, 세포를 배양하여, 세포가 개별 세포 콜로니를 형성하였으며, 이들 콜로니는 각각 단일 처리 세포로부터 유래된 것이었다. 3일 후 또는 11일 후에, 다양한 콜로니 유래의 세포를 시험하였다. RAG2의 넉아웃의 속도는 IL2Rg의 넉아웃 속도보다 약 6배 더 빨랐으며; 분명하게도 일부 유전자들은 다른 것들보다 넉아웃이 더 어렵다. 2개 유전자 모두를 넉아웃시키는 효율은 높았으며, 2개 넉아웃 모두에 대해 이형접합 또는 동형접합인 세포를 성공적으로 동정하였다. 유의미하게는, TALEN mRNA 및 HDR 주형의 투여량은 특이적인 효과 및 비-특이적인 효과를 가졌다. IL2Rg에 대한 TALEN mRNA의 증가는 IL2Rg에 대한 NHEJ 및 HDR을 둘 다 증가시켰으며, 한편, RAG2에 대한 NHEJ 수준은 변하지 않았다. IL2Rg HDR 주형의 증가는 RAG2 유전자좌에서 HDR을 감소시켰으며, 이는, 올리고뉴클레오타이드 농도 상승에 의한 상동성 표적 복구의 비특이적인 저해를 제시한다. 특히 이들 낮은 용량에서의 이러한 용량 민감성은 다른 것들을 멀티플렉스 과정의 목적으로부터 벗어날 수 있게 하였다. 실시예 1의 세포를 클로닝하였으며, 출원 시, 2가지의 동물이 동일 유래의 배아를 임신하고 있다.
도 4를 참조하여, 실시예 2는, 상이한 유전자를 제외하고는 멀티플렉스 HDR 편집의 동일한 목적을 가진 실험을 기술하고 있다. 제1 유전자 표적은 선종성 폴립증(adenomatous polyposis coli; APC)이었다. 제2 유전자 표적은 p53(TP53 유전자)이었다. 2개의 넉아웃 모두에 대해 동형접합인 세포 및 2개의 넉아웃 모두에 대해 이형접합인 세포를 검출하고, 단리하였다.
도 5 내지 8을 참조하여, 실시예 3은 2개 내지 5개의 유전자를 넉아웃하기 위한 멀티플렉스 HDR 편집을 기술하고 있다. 3개의 실험이 있었으며, 유전자형에 대해 시험된 세포 콜로니의 수는 각각의 실험에 대해 72개 내지 192개의 범위였다. 세포를, 유전자 APC, p53, RAG2, 저밀도 지질단백질 수용체(LDLR), IL2Rg, 키스펩틴(kisspeptin) 수용체(KISSR 또는 GPR54) 및 진핵 번역 개시 인자 4GI(EIF4GI)의 다양한 조합들의 멀티플렉스 넉아웃에 대해 처리하였다. 유전자 LDLR은 다른 유전자보다 변형에 일관적으로 덜 수용적이었다. 결과로부터 입증되는 바와 같이, 다수의 대립유전자는 TALEN-특이적인 상동성 표적 복구(HDR)을 사용하여 동시에 교란될 수 있다. 각각이 20% HDR/부위 초과 및 이들의 동족 HDR 주형을 초래한 5개의 TALEN 쌍을 3개의 조합들에서 동시에 공동-형질감염시켰다(표 A). 각각의 복제물 유래의 콜로니의 비율은 적어도 4개의 유전자에서 HDR 사건에 대해 양성이었으며, 복제물-A 유래의 2개의 콜로니는 모든 5개의 유전자들에서 HDR 사건을 가졌다. 5개의 유전자에서 indel의 동시적인 형성이 마우스 ES 세포에서 Cas9/CRISPR-자극된 NHEJ에 의해 언급되긴 하였지만, 표적화된 뉴클레아제-자극된 HDR에 의한 5개 유전자(7개 이하의 대립유전자)의 정확한 변형은 예상치 못한 것이며, 놀랍고, 대적할 만한 상대가 없는 것이다. 복제물의 TALEN이 Cas9/CRISPR(벡터는 발현을 위해 세포 내로 도입되었음)으로 대체되었을 때, 변형 수준은 검출 미만이었으며(데이터는 도시되지 않음); 그러나, 다른 데이터들은 예를 들어 하기 실시예 9와 같이 RGEN 멀티플렉스를 가리킨다. 4개의 유전자가 모든 실험에서 편집된 것으로 확인되었으며, 하나의 실험에서는 5개의 유전자가 편집된 것으로 확인되었다.
이러한 과정의 속도 및 효율은, 5개 초과의 유전자의 멀티플렉스 넉아웃이 과정의 성질을 변화시키지 않으면서 달성가능하도록, 그 자체가 규모-증가된다. 표 A와 관련하여, 약 72개 내지 192개의 세포를 시험하였으며; 현재, 이러한 과정은 구축되었으며, 보다 다수의 유전자/대립유전자의 멀티플렉스가 예상될 수 있기 위해서는, 시험 수를 훨씬 더 많은 수의 세포까지 증가시키는 것은 부당하지 않다. 멀티플렉스 유전자 또는 대립유전자의 수는 2 내지 25일 수 있으며; 당업자는, 표현적으로 언급된 경계 사이의 모든 범위 및 값들이 고려됨을 즉시 이해할 것이며, 상한 또는 하한으로서 이용가능한 하기들 중 임의의 수는 서로 조합된다: 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 20, 25.
입증된 바와 같이, 멀티플렉스 넉아웃을 포함하는 세포 및 배아뿐만 아니라 이로써 제조되는 동물은 본 발명의 실시형태이다.
실시예 4는 다양한 동물의 제조를 위한 어느 정도 상세한 과정들을 기술하고 있으며, 특정한 유전자를 예시로서 지칭한다. 실시예 5는 CRISPR/Cas9 디자인 및 제조의 실시예를 기술하고 있다.
실시예 6은 표적화된 뉴클레아제 구동 HDR 과정을 이용한 멀티플렉스 유전자 편집의 추가적인 실시예를 제공한다. GATA 결합 단백질 4(GATA4); 호메오박스 단백질 NKX2-5(NKX2-5) 및 뒤쪽 중배엽 단백질 1(MESP1)을, TALEN 및 HDR 주형을 이용하여 동시에 표적화하여, 각각의 유전자에 대해 프레임-시프트 돌연변이 및 조기(premature) 정지-코돈을 유도한다. 목적은, 보완 연구에 사용하기 위해 각각의 유전자에 대해 바이대립유전자 넉아웃을 만드는 것이었다. 2개의 클론이 각각의 유전자에서 의도된 바이대립유전자 HDR을 가졌기 때문에, 과정의 효율은 약 0.5%였다. 주어진 유전자 넉아웃은 단독적으로 또는 조합하여, 보완이 없는 성장 장애 유전자형 및 조기 배아 치사를 유발할 것이다. 당업자는, FTT 및 보완 연구를 위한 삼중 넉아웃(약 1/66 기회)을 수득하기 위해 개별적으로 이들 유전자의 넉아웃 및 이형접합체의 품종간 개량이 가축에서 실현가능하지 않음을 이해할 것이다.
실시예 7은 TALEN 및 Cas9/CRISPR이 혼합되어, 유전자의 멀티플렉스 편집을 수행할 수 있다는 데이터를 제공한다. 일부 유전자/대립유전자들은 TALEN 또는 Cas9/CRISPR에 의해 보다 쉽게 표적화되며, 멀티플렉싱이 이들 툴의 조합을 이용해 수행되어야 하는 이러한 상황이 유발될 수 있다. 이러한 실시예에서, 진핵 번역 개시 인자 4GI(EIF4GI)는 TALEN에 의해 표적화되었으며, p65(RELA) 유전자는 Cas9/CRISPR에 의해 표적화되었다. 세포를 HDR 사건을 가리키는 RELP 검정에 의해 분석하였으며, HDR은 2개 부위 모두에서 입증되었다. 이에, TALEN 및 RGEN은 예를 들어, 1, 2, 3 4, 5, 6, 7, 8, 9 또는 10개의 TALEN과 1, 2, 3 4, 5, 6, 7, 8, 9 또는 10개의 RGEN 시약을 임의의 조합으로 포함하는 멀티플렉싱 조합을 위해 함께 또는 개별적으로 사용될 수 있다.
키메라
숙주 배반포를 제조하고, 공여자 동물 유래의 공여자 세포를 첨가함으로써 키메라를 제조할 수 있다. 생성된 동물은, 숙주 및 공여자 둘 모두로부터 기원하는 세포를 가진 키메라일 것이다. 특정한 종류의 세포 및 세포 계통(lineage)을 제작하기 위해서는, 일부 유전자들이 배아에 필요하다. 이러한 유전자가 숙주 세포에서 넉아웃될 때, 미씽(missing) 유전자를 가진 공여자 세포의 도입은 이들 세포 및 세포 계통이 숙주 배아에 복구되도록 할 수 있으며; 복구된 세포는 공여자 유전자형을 가진다. 이러한 과정을 보완 과정이라고 한다.
문헌[Matsunari et al., PNAS 110:4557-4562, 2013]은 공여자-유래 돼지 췌장을 제조하기 위한 보완 과정을 기술하고 있었다. 이들은 기능성 췌장의 형성을 예방하기 위해 변경된 숙주 돼지 배반포를 형성하였다. 이들은 체세포 클로닝에 의해 숙주 배반포를 형성하였다. 체세포는 췌장 발달을 저해하는 것으로 알려진 Pdx1(췌장 및 십이지장 호메오박스 1)의 프로모터 하에 Hes1을 과발현하도록 변형되었다. 숙주 배반포에 첨가된 공여자 세포는 이러한 변형을 가지고 있지 않았으며; 세포 계통에 공급된 공여자 세포는 췌장을 형성할 필요가 있었다. 이들은 이미 어디에서나 언급되어 있었으며, 기능성 기관은 기관발생-불능 마우스 배아에서 배반포 보완에 의해 생체내에서 만능 줄기세포(PSC)로부터 발생될 수 있다. 이들은 인간 유도 PSC를 포함한 이종발생성(xenogenic) 만능 줄기세포(PSC)를 사용한 향후 연구를 제안하였다. 사실상, 이종 기관 이식(xenotransplantation)은 40년 넘게 기관/조직 부족에 대한 잠재적인 해결안으로 여겨져 왔다. 췌장 형성을 불능화시키기 위해 어떠한 유전자도 넉아웃되지 않았다는 사실은 유의미하다.
대형 척추동물에서 심지어 하나의 유전자를 넉아웃하는 것은, 종래의 과정을 사용한 상당한 자원 투자이다. 이와는 대조적으로, 세포에서 유전자 생성물의 과발현은 현재 당해 기술분야, 예를 들어 게놈 내에 다중 유전자 카세트 복사본을 위치시키는 플라스미드 또는 벡터를 사용하여 쉽게 달성된다. 유전자의 발현을 추가하는 것은 유전자를 표적으로 하는 것 및 유전자를 넉아웃시키는 것보다 더 용이하다. 유전자 생성물의 과발현에 의해 기관발생을 방지하는 능력은 이때, 통상적이지 않은 것으로 여겨진다. 사실상, 대형 동물 게놈을 조작하는 능력의 한계는 상당할 수 있다. 그렇지만, 돼지는 크기 및 생리학적 특성이 인간과 유사할 뿐만 아니라 생싱력 및 성장 속도가 높아서, 이종 기관 이식에 바람직한 공여자 동물이다.
도 9는 키메라의 맥락에서 적용된 바와 같은 유전자 넉아웃 또는 다른 유전자 편집물을 제조하기 위해 본원에 사용된 멀티플렉스 과정을 도시하고 있다. 넉아웃에 바람직한 이형접합성 및 동형접합성 분포를 정확하게 가진 세포를 단리한다. 이들 세포를 클로닝에 사용하여, 숙주 배반포로서 발달하도록 허용된 배아를 제조한다. 배반포라는 용어는 본원에서, 2개의 세포로부터 약 3주까지의 배아를 지칭하는 데 광범위하게 사용된다. 배아라는 용어는 접합자로부터 태어날 때까지의 동물을 지칭하는 데 광범위하게 사용된다. 공여자 배아가 구축되며, 공여자 세포의 공급원으로서 사용되며, 이는 유전자가 넉아웃에 의해 형성된 니치(niche)를 갖도록 제공한다. 공여자 세포를 숙주 배반포 내에 도입하여, 숙주 세포와 함께 복제하여, 숙주 세포 및 공여자 세포 둘 다를 가진 키메라를 형성한다. 배아를 대리 암컷에 전달하여, 임신시킨다. 숙주 세포가 배우자를 형성할 때, 키메라의 자손은 숙주 유전자형을 가진다. 키메라는 이의 숙주 배반포에 의해 결정되는 성별을 가진다.
도 10은 성장 장애 표현형(FTT) 보완 과정을 예시하고 있다. FTT는, 성적으로 성숙할 연령까지 생존할 것으로 예상되지 않는 동물을 지칭한다. FTT 유전자형 및 표현형을 가진 숙주 배아가 제공된다. 오로지 하나의 유전자의 넉아웃에 의해 이용가능한 FTT는 제한되어 있으며 일부 기관 및 조직들에 대해서는 알려져 있지 않기 때문에, 멀티플렉스 과정이 이상적이다. 공여자 세포는 FTT 내 미씽된 유전자를 제공하며, 미씽 세포 유형을 제공한다. 배아는 대형 척추동물일 수 있으며, 넉아웃은 멀티플렉스일 수 있으며, 예를 들어 2개 내지 25개의 유전자가 넉아웃될 수 있다. 더욱이, 표적화된 엔도뉴클레아제가 사용되어, 넉아웃을 달성할 수 있다. 면역결핍 실시형태에서, IL2Rg-/y RAG2-/- 넉아웃은, 숙주가 필수적으로 면역 기능을 갖고 있지 않기 때문에, FTT이다. 그러나, 공여자 세포는 이들 미씽 유전자를 갖고 있지 않으며, 생성되는 키메라는 필수적으로, 동물을 양육 및 유지시킬 수 있기 위해 정상 표현형을 가진다. 그러나, 지손은 FTT 표현형을 가진다. 따라서, 동물은 유지될 수 있으며, FTT 동물이 편리하게 생성된다. 키메라는 넉아웃의 이형접합과 동형접합의 임의의 조합일 수 있다. 따라서, 다른 과정들이 부가적인 세대 또는 그 이상을 필요로 할때, 성장 장애(FTT) 표현형을 생성하는 F0 세대 동물인, 키메라 제조 방법이 기술되어 있다.
키메라는 통상 숙주 세포의 유전학을 통과한다. 그러나, 본원에서는 공여자 세포의 유전적 특성을 자손에게 전달하지만 숙주 세포의 유전적 특성은 전달되지 않는 대안적인 키메라가 개시되어 있다. 유전적 승계(inheritance)를 스위칭하는 것은 일부 유용한 기회들을 만들 수 있는 것으로 나타나 있다. 도 11을 참조로 ㅎ여, G 숙주로 표지된 배아가 도시되어 있다. 이러한 배아는 비기능성 배우자를 이용하여 제조되었다. 공여자 배반포를 제조하고, 이를 공여자 세포의 공급원으로서 사용한다. 공여자 세포는 공여자 배우자를 만드는 데 필요한 유전자 및 세포 계통을 제공한다. 생성되는 키메라는 공여자 세포의 배우자를 가지며, 공여자 세포의 유전적 특성을 가진 자손을 생성한다. 예시에서, 숙주 배아는 수컷 브라만 황소(Brahman bull)이다. 공여자 세포는 더블-머슬드 황소(double-muscled bull)로부터 유래된다. 키메라는 브라만 황소 표현형을 가지지만, 이의 자손은 더블 머슬드이다. 숙주 및 공여자는 동일하거나 상이한 품종 또는 동일하거나 상이한 종으로부터 유래될 수 있다. 숙주는 불임이도록 만들어져 왔으며, 이는 숙주가 유성생식할 수 없음을 의미한다. 일부 불임 동물을 사용하여, 비기능성인, 예를 들어 부동성 정자인 배우자를 만드는 데 사용될 수 있거나, 예를 들어 조기 배우자형성이 교란된 배우자를 전혀 만들지 않는 데 사용될 수 있다. 공여자 세포는 예를 들어, 야생형 세포, 바람직한 형질을 가진 동물 품종의 세포 또는 유전적으로 변형된 세포일 수 있다.
본 발명의 실시형태는, 배우자 형성 또는 정자 형성을 방지하는 유전자 변형을 염색체에 가진 키메라 불임 동물, 예컨대 키메라 가축을 포함한다. 염색체는 X 염색체, Y 염색체 또는 상염색체일 수 있다. 변형은 기존의 유전자의 교란을 포함할 수 있다. 교란은, 유전자가 발현될 수 없도록 기존의 염색체 유전자를 변경함으로써 형성될 수 있거나, 유전자의 전사 또는 번역을 저해할 인자들을 유전적으로 발현시킴으로써 형성될 수 있다. 배우자 형성이라는 용어는, 각각이 각각의 부모의 생식세포주 유래의 부모의 유전적 컴플리먼트(genetic compliment)를 절반으로 가진 반수체 성세포(난자 및 정자)의 생성을 의미한다. 정자의 생성은 정자 발생이다. 수정 동안 정자와 난자의 융합에 의해, 이배체 게놈을 가진 접합자 세포가 형성된다. 배우자발생 세포라는 용어는 난자 또는 정자에 대한 전구체를 지칭하며, 전형적으로 생식 세포 또는 정조 세포를 지칭한다. 일 실시형태는, 숙주에서의 정조 줄기세포(SSC)의 넉아웃이다. 동물은 바람직한 유전적 특성을 가진 공여자 세포이며, 공여자 유전자형을 가진 배우자를 형성하는 SSC 세포를 공급한다. 일부 유전자들은 불임을 유발하는 하나 이상의 효과들을 발휘하도록 조합되어 교란된다: 예를 들어, Acr/H1.1/Smcp, Acr/Tnp2/Smcp, Tnp2/H1.1/Smcp, Acr/Hlt/Smcp, Tnp2/Hlt/Smcp(문헌[Nayernia K; Drabent B; Meinhardt A; Adham IM; Schwandt I; Muller C; Sancken U; Kleene KC; Engel W Triple knockouts reveal gene interactions affecting fertility of male mice. Mol. Reprod. Dev 70(4):406-16, 2005]). 실시형태는 제1 유전자 또는 유전자들의 넉아웃을 가진 제1 라인의 동물, 및 제2 유전자 또는 유전자들의 넉아웃을 가진 제2 라인의 동물을 포함하여, 이들 라인의 수컷 자손은 불임이다.
유전적으로 변형된 대형 척추동물을 형성하기 위해 유전자 조작을 사용하는 것은, 바람직한 형질을 가진 동물의 생성을 가속화할 것이다. 전형적인 가축 품종 개량은 비용이 많이 들며 시간 소모적인 과정으로서, 세대 번식(generational reproduction)을 위해서는 조심스런 유전자 형질 선택 및 기나긴 기다림이 수반된다. 형질 선택을 조심스럽게 한다고 하더라도, 유성 생식의 변화는 바람직한 형질 조합들을 개발하고 전달하는 데 있어서 상당한 도전을 제시한다. 그러나, 공여자 형질을 전달하는 키메라의 형성은, 바람직한 유전적 형질의 신속한 전파뿐만 아니라 형질의 독점적 통제(proprietary control)의 보호를 허용하는 동물 번식 방법을 이룬다. 실시형태는, 공여받은 유전 물질에 대한 숙주로서 작용할 수 있는 유전적으로 그리고 게놈적으로 불임인 동물의 생산을 포함한다. 숙주에 의한 성교는 공여자의 유전 물질을 번식시킬 것이다. 유전적으로 불임임 동물 그룹을 사용하여, 단일 공여자 유래의 동일한 유전자를 유성 생식에 의해 전파시킬 수 있으며, 이로써 많은 공여자 자손들이 신속하게 생성될 수 있다. 실시형태는, 오로지 하나의 성별을 가진 동물만 생성하도록 변형되어, 동물을 수용하는 사용자가 형질을 가진 동물을 쉽게 사육할 수 없을 동물을 포함한다.
실시형태는 배우자 형성 또는 정자 활성에 선택적인 유전자 또는 복수의 유전자를 불활성시키기 위해 세포 또는 배아에 유전자 변형을 일으키는 것을 포함한다. 유전자 변형의 하나의 과정은, 유전자에 특이적으로 결합하는 TALEN 쌍에 대한 Cas9/CRISPR 또는 mRNA와 같은 표적화된 뉴클레아제의 도입을 수반한다. 동물을 세포로부터 클로닝하거나, 변형된 배아를 직접 대리모에서 키운다. 동물은 가축 동물 또는 다른 동물일 수 있다. 배우자 형성은 조기 단계에 차단될 수 있다. 또는, 생식력에 필수적이나 동물에게는 필수적이지 않은 정자 활성이 교란될 수 있다. 따라서, 동물은 유성생식할 수 없기 때문에 불임이지만: 변형된 정자로부터 자손을 생성하기 위해 ART가 사용될 수 있다. (품종 개량 및/또는 유전자 조작 결과) 바람직한 유전적 형질을 가진 공여자 동물이 선별된다.
2개 이상의
넉아웃을
가진 F0 세대
파운더
동물 라인의 신속한 구축
대립유전자들의 요망되는 조합을 가진 F0 세대를 생성하기 위해, 멀티플렉스를 이용하여, 2개, 3개 또는 그 이상의 유전자(2개 내지 25개)를 동시에 넉아웃시킬 수 있다. 모든 넉아웃에 대한 동형접합성이 FTT를 생성한다면, 이러한 옵션은, 해당 상황에 대해 최소의 이형접합성이 있어야 하는 경우를 제외하고는, 파운더를 모든 넉아웃에 대해 동형접합이 되도록 만드는 것이다. 하나의 이형접합체 유전자는 비-FTT 표현형을 허용할 수 있다. 대안적으로, 멀티플렉스 넉아웃이, FTT 자손을 가진 번성하는 키메라를 만들기 위해, 보완과 조합하여 사용될 수 있다. 이러한 과정은 다중 넉아웃 동물의 생성 시, 세대들을 없앨 수 있다.
어느 경우에서든지, 이점은 크며, 많은 과정들을 실제로 달성하는 한 영역으로 이동시킨다. 종래의 품종 개량에 의해 2개의 유전자좌가 넉아웃된 동물을 생성하는 것은 비용면에서 엄두를 못내는데, 왜냐하면 자손 중 오로지 약 6%만이 F2 세대에서 요망되는 표현형을 가질 것이기 때문이다(표 B). 이와는 대조적으로, 멀티플렉스 접근법은 F0 세대에서 요망되는 유전자형을 생성할 수 있으며, 이는 종래의 넉아웃 및 품종 개량을 능가하는 큰 이점이다. 시간 및 동물의 절약은 이론학적이지 않음을 강조해야 하며: 실패 대신 성공이 예상되기 때문에, 몇몇 종류의 변형을 가능하게 하는 것이 발전이다. 더욱이, 실시예를 계속하기 위해서는, 하나 또는 2개의 키메라 RG-KO 부모들 사이의 품종 개량은 RG-KO 자손의 생산율을 각각 25% 및 100%까지 상당히 증가시킬 것이다(표 B).
면역결핍 동물
하나의 실시형태 그룹은 면역결핍 돼지 또는 다른 가축, 및 이들의 제조 방법에 관한 것이다. 이들 실시형태는 동형접합 및 이형접합 넉아웃 유전자형의 선별을 관리하는 기회를 이용하는 멀티플렉스 편집물, 예를 들어 넉아웃의 예들이다. 이들은, 파운더 라인을 신속하게 구축하는 멀티플렉스의 힘을 나타낸다. 이들은 또한, 키메라를 제조하는 것을 수반하는 본 발명의 추가적인 양태를 포함하기도 한다.
돼지는 인간의 크기 및 생리학적 특성을 모방하는 가장 관련이 깊은 비-영장류의 동물 모델이다. 불행하게도, 완전히 면역결핍된 돼지는 광범위하게 이용 가능하지 않은데, 왜냐하면, (1) 다중 유전자 넉아웃(KO)이 필요하며, (2) 다중-유전자좌 널(null) 동물을 제작하기 위한 이종 교배가 비용이 아주 많이 들며, Ko의 수에 따라 가능할 수 있고, (3) 오로지 작은 규모의 무균 설비들만이 돼지에 이용 가능하기 때문이다. 본원에서, 실시형태는 RAG2 및 IL2Rg가 둘 다 넉아웃(즉, RG-KO)된 대형 척추동물을 포함한다. 대형 척추동물이라는 용어는 시미안, 가축, 개 및 고양이를 지칭한다. 가축이라는 용어는 식용으로 관습적으로 사육되는 동물, 예컨대, 소, 양, 염소, 조류(닭, 칠면조), 돼지, 버팔로 및 어류를 지칭한다. 유전자는 체세포의 넉아웃일 수 있으며, 그런 다음, 이는 클로닝에 사용되어, 전체 동물을 생산한다. 대안적으로는, 유전자를 넉아웃시키기 위해 배아를 처리할 수 있으며, 동물은 배아로부터 직접 유래된다. 멀티플렉스 유전자-표적 플랫폼은 돼지에서 T 세포, B 세포 및 NK 세포의 발달을 동시에 교란시킬 수 있다. 이에, 이러한 세포들 없이 제조된 동물은 본원의 방법을 이용하여 F0 파운더로서 직접 제조될 수 있으나, 표현형은 FTT이다.
멀티플렉스 편집물용 농업적 표적
식용 동물 게놈의 편집은, 수많은 유전자좌들을 동시에 편집하고, 한번에 하나의 대립유전자를 발생시키는 대신에, 대립유전자들을 함께 발생시키는 데 필요할 동물 품종 개량 세대를 절약함으로써, 크게 가속화될 수 있다. 또한, 일부 농업 형질은 복잡하며, 이는, 이들 형질이 1개 초과(2개 내지 수백개)의 유전자에서 대립유전자의 영향의 결과로서 나타남을 의미한다. 예를 들어, DGAT, ABCG2에서의 다형성, 및 염색체 18 상에서의 다형성은 젖소에서 네트 데어리 메리트(Net Dairy Merit)의 변동의 대부분을 차지한다. 가축 세포 또는 배아는 다양한 농업적 표적들을 비롯한 수많은 유전자들의 멀티플렉스 편집을 받을 수 있다: 하나 이상의 AC AN, AMELY, BLG, BMP 1B(FecB), DAZL, DGAT, Eif4GI, GDF8, 혼-폴 유전자좌, IGF2, CWC15, KissR/GRP54, OFD1Y, p65, PRLR, Prmd14, PRNP, Rosa, Socs2, SRY, ZFY, β-락토글로불린, CLPG.
멀티플렉싱을
위한 질환
모델링
표적:
암과 같은 일부 형질들은 다중 유전자에서의 돌연변이를 토대로 유발된다(APC/p53 참조). 또한, 수많은 질환 형질들은 소위 복합 형질인데, 이는 1개 초과의 유전자에서 대립유전자의 영향의 결과로서 나타난다. 예를 들어, 당뇨병, 대사질환, 심장 질환 및 신경학적 질환은 복합 형질로 간주된다. 실시형태는 개별 대립유전자에 대해 이형접합 및 동형접합인 동물 모델, 또는 상이한 조합들에서 다른 유전자에서 대립유전자와 조합된 모델을 포함한다. 예를 들어, 젊은이에서 발병하는 성인형 당뇨병(mature onset diabetes of the young; MODY) 유전자좌는 개별적으로 그리고 부가적으로 당뇨병을 유발하며, 하기가 포함된다: MODY 1(HNF4α), MODY 2(GCK), MODY 3(HNF1α), MODY 4(Pdx1), MODY 5(HNF-1β), MODY 6(유로제닉 분화 1), MODY 7(KLF11), MODY 8(CEL), MODY 9(PAX4), MODY 10(INS), MODY 11(BLK). 가축 세포 또는 배아는 다양한 질환 모델링 표적들을 포함하여, 동물 모델링을 위해 수많은 유전자들의 멀티플렉스 편집을 받을 수 있다: APC, ApoE, DMD, GHRHR, HR, HSD11B2, LDLR, NF1, NPPA, NR3C2, p53, PKD1, Rbm20, SCNN1G, tP53, DAZL, FAH, HBB, IL2RG, PDX1, PITX3, Runx1, RAG2, GGTA. 실시형태는 상기 표적들 중 하나 이상이 편집된, 예를 들어 KO된 세포, 배아 및 동물을 포함한다.
하나의 종 내의 유전자들은 다른 종들에 오르토로그(ortholog)를 가진다. 인간의 유전자 및 마우스의 유전자는 가축, 특히 소, 돼지, 양, 염소, 닭 및 토끼에서 오르토로그를 일관적으로 가진다. 이들 종과 어류 사이의 유전적 오르토로그는 종종 유전자의 기능에 따라 일관된다. 생물학자들은 유전자 오르토로그를 찾는 과정에 친숙하므로, 유전자들은 다른 종들의 오르토로그를 열거하지 않으면서 종들 중 하나의 면에서 본원에 기술될 수 있다. 따라서, 유전자의 교란에 대해 기술하고 있는 실시형태는 다른 종들에서 동일하거나 상이한 명칭을 가진 오르토로그의 교란을 포함한다. 일반적인 유전적 데이터베이스뿐만 아니라 유전적 오르토로그의 동정에 특수화된 데이터베이스가 존재한다. 더욱이, 당업자들은 유전자에 대해 보편적으로 사용되는 약어에 친숙하며, 문맥을 사용하여, 어떤 유전자가 하나의 유전자에 대해 1개 초과의 약어로 지칭되는 경우, 또는 2개의 유전자가 동일한 약어로 지칭되는 경우를 확인한다.
정조 줄기세포는 가축의 제2 유전자 변형 방법을 제공한다. 유전자 변형 또는 유전자 편집물은 공여자 고환으로부터 단리된 정조 줄기세포에서 시험관내에서 실시될 수 있다. 변형된 세포는 수여자의 생식 세포-결실된 고환 내로 이식된다. 이식된 정조 줄기세포는 유전자 변형(들)을 가진 정자를 생산하며, 이는 인공 정액주입 또는 시험관내 수정(IVF)을 통해 품종 개량에 사용되어 파운더 동물을 유도할 수 있다.
숙주
니치의
선택적
탈집단화에
의한
널로모픽
(
nullomorphic
) 세포 또는 기관 소실의 보완.
티플렉스 편집을 사용하여, 특정 배아 또는 동물 니치로부터 세포 또는 기관을 의도적으로 제거하여, 보다 양호한 공여자 세포 통합, 증식 및 분화에 도움이 되는 환경을 만들어서, 배아, 태아 또는 동물에서 이종상동성(orthologous) 세포, 조직 또는 기관을 보완하여 이들의 기여를 증강시킬 수 있다. 비어있는 니치를 가진 동물은, 공여자 세포 및 유전자에 의해 충전될 수 있는 결핍을 가지도록 제작되었기 때문에, 결핍 캐리어이다. 구체적인 예로는, 수여자-삭제 및 배우자발생 세포 계통의 공여자-구출(DAZL, VASA, MIWI, PIWI 등)이 있다.
또 다른 실시형태에서, 멀티플렉스 유전자 편집을 사용하여, 선천성 탈모증을 유도할 수 있으며, 공여자 유래 세포에게 모발 모낭발생(folliculogeneis)에 참여할 기회를 제공할 수 있다. 탈모증을 유발하기 위해 멀티플렉스 유전자 편집되는 것으로 간주되는 유전자로는, OMIM 및 인간 표현형 온톨로지 데이터베이스에서 동정된 것들이 있다; DCAF17, VDR, PNPLA1, HRAS, 텔로머라제-vert, DSP, SNRPE, RPL21, LAMA3, UROD, EDAR, OFD1, PEX7, COL3A1, ALOX12B, HLCS, NIPAL4, CERS3, ANTXR1, B3GALT6, DSG4, UBR1, CTC1, MBTPS2, UROS, ABHD5, NOP10, ALMS1, LAMB3, EOGT, SAT1, RBPJ, ARHGAP31, ACVR1, IKBKG, LPAR6, HR, ATR, HTRA1, AIRE, BCS1L, MCCC2, DKC1, PORCN, EBP, SLITRK1, BTK, DOCK6, APCDD1, ZIP4, CASR, TERT, EDARADD, ATP6V0A2, PVRL1, MGP, KRT85, RAG2, RAG-1, ROR2, CLAUDIN1, ABCA12, SLA-DRA1, B4GALT7, COL7A1, HP2, GNA11, WNT5A, USB1, LMNA, EPS8L3, NSDHL, TRPV3, KRAS, TINF2, TGM1, DCLRE1C, PKP1, WRAP53, KDM5C, ECM1, TP63, KRT14, PvIPK4. 모낭발생 잠재성을 가진 공여자 세포가 가진 키메라 현상을 사용하여, 인간의 모낭을 성장시킬 수 있다. 돼지 또는 다른 척추동물에서 기관 또는 조직의 제거, 및 인간 기원의 기관 또는 조직의 성장이 특히, 의학적 기관 또는 조직의 공급원으로서 유용하다.
멀티플렉스를 위한 추가적인 보완 표적은 PRKDC, BCL11a, BMI1, CCR5, CXCR4, DKK1, ETV2, FLI1, FLK1, GATA2, GATA4, HHEX, KIT, LMX1A, MYF5, MYOD1, MYOG, NKX2-5, NR4A2, PAX3, PDX1, PITX3, Runx1, RAG2, GGTA, HR, HANDII, TBX5이다.
실시형태는 멀티플렉스 접근법 또는 다른 접근법에 의해 상기 표적들 중 1개, 2개 또는 그 이상(2개 내지 25개)을 표적화하는 것을 포함한다.
편집된 유전자
특정 표적 및 표적화된 엔도뉴클레아제와 관련하여 본원에 기술된 방법 및 발명은 광범위하게 적용 가능하다. 본 발명자들은 하기 유전자들 모두를 이용한 편집물을 이용하여 클로닝에 적합한 원발성 가축 세포를 제조하였다.
유전자 변형 동물
유전자 발현 마커를 제자리에 두어서 이것이 동물로부터 증식될 수 있게 하는 방법을 사용하거나, 이러한 마커를 동물에 위치시키지 않는 방법에 의해, 염색체 변형에 대해 모노-대립유전자형 또는 바이-대립유전자형인 동물을 제조할 수 있다. 예를 들어, 본 발명자들은 동물의 염색체에 변화를 주거나 외인성 유전자를 염색체에 삽입하기 위해, 상동성 의존적 재조합(HDR) 방법을 사용하였다. TALEN과 같은 툴 및 리컴비나제 융합 단백질, 뿐만 아니라 종래의 방법들은 본원 어디에서나 고찰되어 있다. 본원에 개시된 유전자 변형을 지지하는 실험 데이터 중 일부는 하기와 같이 요약된다. 발명자들은 이미, 변형된 세포의 폴리제닉 집단으로부터 클로닝할 때의 이례적인 클로닝 효율에 대해 언급하였으며, 단리된 콜로니에 대한 체세포 핵 트랜스퍼(SCNT)에 의한 클로닝 효율의 변동을 피하기 위해 이러한 접근법을 주장하였다(문헌[Carlson et al, 2011]). 그러나, 부가적으로는, TALEN-매개 게놈 변형뿐만 아니라 리컴비나제 융합 분자에 의한 변형은 단일 세대에서 달성되어야 하는 바이-대립유전자 변경을 제공한다. 예를 들어, 넉아웃된 유전자에 대해 동형접합인 동물은 SCNT에 의해 제조될 수 있으며, 동계 교배 개량 없이 동형접합체를 생산할 수 있다. 임신 기간, 및 돼지 및 소와 같은 가축에 대한 번식 연령으로의 성숙은 연구 및 생산에 대한 상당한 장벽이다. 예를 들어, 클로닝 및 품종 개량에 의한 이형접합 돌연변이체 세포(2개 성별 모두)로부터의 동형접합 넉아웃의 발생은 돼지 및 소 각각에 대해 16개월 및 30개월이 소요될 것이다. 주장컨대, 일부는 유전자 변형 및 SCNT의 순차적인 사이클을 이용하여 이러한 부담을 감소시켰으나(문헌[Kuroiwa et al., 2004]), 이는 둘 다 기술적으로 어렵고 비용면에서 꺼려지며, 더욱이, 대형 척추동물 실험 모델 또는 가축에 실제로 유용한 F0 동물을 제조하기 위한 순차적인 클로닝을 피하기 위한 많은 이유들이 존재한다. SCNT 전에, 바이-대립유전자 KO 세포를 일상적으로 생성하는 능력은 대형 동물 유전자 조작에서 상당한 진보이다. 바이-대립유전자 넉아웃은 ZFN 및 희석 클로닝과 같은 다른 과정들을 사용하여 불멸 세포주에서 달성되었다(문헌[Liu et al., 2010]). 또 다른 그룹은 최근, 상업적인 ZFN 시약을 사용한 돼지 GGTA1의 바이-대립유전자 KO에 관해 기술하였으며(문헌[Hauschild et al., 2011]), 여기서, 바이-대립유전자 널 세포는 GGTA1-의존적 표면 에피토프의 부재에 대해 FACS에 의해 농화(enrich)될 수 있었다. 이들 연구가 특정한 유용한 개념을 나타내긴 하지만, 이들 연구는, 간단한 클론 희석이 일반적으로 원발성 섬유아세포 단리물에 대해서는 실현가능하지 않으며(섬유아세포가 저밀도에서는 불량하게 성장함), 널 세포에 대한 생물학적 농화가 대부분의 유전자에 대해 이용가능하지 않기 때문에, 변형될 수 있었음을 보여주지 않는다.
표적화된 뉴클레아제-유도 상동성 재조합을 사용하여, 연결된 선별 마커에 대한 요구를 없앨 수 있다. TALEN은, 특정 대립유전자를 상동성 의존적 복구(HDR)에 의해 가축 게놈 내로 정확하게 트랜스퍼하는 데 사용될 수 있다. 파일럿 연구에서, 특정 11 bp 결실(벨지언 블루 대립유전자)(문헌[Grobet et al., 1997; Kambadur et al., 1997])을 소의 GDF8 유전자좌 내로 도입하였다(U.S. 2012/0222143 참조). 단독으로 형질감염될 때, btGDF8.1 TALEN 쌍은 표적 유전자좌에서 염색체 중 16% 이하를 절단하였다. 11 bp 결실을 가진 슈퍼코일드 상동성 DNA 복구 주형으로 공동-형질감염하면, 요망되는 사건에 대한 선별 없이도, 제3일에 유전자 전환 빈도(HDR)가 5% 이하로 달성되었다. 유전자 전환을, 스크리닝된 단리된 콜로니 중 1.4%에서 확인하였다. 이들 결과는, TALEN을 사용하여, 연결된 선별 마커의 도움 없이도 HDR을 효과적으로 유도할 수 있음을 나타내었다.
상동성 표적 복구(HDR)
상동성 표적 복구(HDR)는 세포에서 ssDNA 및 이중 가닥 DNA(dsDNA) 병변을 복구하기 위한 메커니즘이다. 이러한 복구 메커니즘은, 병변 부위에 대해 상당한 상동성을 가진 서열을 가진 HDR 주형이 존재할 때, 세포에 의해 사용될 수 있다. 생물학적 분야에서 보편적으로 사용되는 용어이니만큼 특이적인 결합은, 비-표적 조직과 비교하여 상대적으로 높은 친화성으로 표적에 결합하는 분자를 지칭하며, 일반적으로 복수의 비-공유 상호작용, 예컨대 정전기적 상호작용, 반데르발스 상호작용, 수소 결합 등을 수반한다. 특이적인 혼성화는 상보적 서열을 가진 핵산들 사이의 특이적인 결합 형태이다. 단백질은 또한, 예를 들어, TALEN 또는 CRISPR/Cas9 시스템에서 또는 Gal4 모티프에 의해 DNA에 특이적으로 결합할 수 있다. 대립유전자의 유전자이입은 주형-가이디드 과정을 이용하여 내인성 대립유전자를 외인성 대립유전자로 복사하는 과정을 지칭한다. 내인성 대립유전자는 사실상 절개되고, 일부 상황들에서 외인성 핵산 대립유전자에 의해 대체될 것이지만, 본 이론은 이러한 과정이 복사 메커니즘이라는 것이다. 대립유전자가 유전자 쌍이기 때문에, 이들 사이에 상당한 상동성이 존재한다. 대립유전자는 단백질을 인코딩하는 유전자일 것이거나, 대립유전자는 생물활성 RNA 사슬을 인코딩하는 기능 또는 조절 단백질이나 RNA를 수용하는 부위를 제공하는 것과 같은 다른 기능들을 가질 수 있다.
HDR 주형은 유전자이입되는 대립유전자를 포함하는 핵산이다. 주형은 dsDNA 또는 단일-가닥 DNA(ssDNA)일 수 있다. ssDNA 주형은 바람직하게는 약 20개 내지 약 5000개의 잔기를 가지지만, 다른 길이들도 사용될 수 있다. 당업자는, 예시적으로 언급된 범위 내의 모든 범위들 및 값들이 고려됨을 즉시 이해할 것이며; 예를 들어, 500개 내지 1500개의 잔기, 20개 내지 100개의 잔기 등. 주형은 내인성 대립유전자에 인접한 DNA 또는 대체되어야 하는 DNA에 상동성을 제공하는 측면(flanking) 서열을 추가로 포함할 수 있다. 주형은 또한, 표적화된 뉴클레아제 시스템에 결합되는 서열을 포함할 수도 있으며, 따라서, 시스템의 DNA-결합 구성원에 대한 동족 결합 부위이다. 동족이라는 용어는, 수용체 및 이의 리간드와 같이 전형적으로 상호작용하는 2개의 생체분자를 지칭한다. HDR 과정의 맥락에서, 생체분자들 중 하나는 의도되는, 즉, 동족 DNA 부위 또는 단백질 부위와 결합하는 서열을 이용하여 디자인될 수 있다.
표적화된
엔도뉴클레아제
시스템
전사 활성자-유사 효과기 뉴클레아제(TALEN) 및 아연 핑거 뉴클레아제(ZFN)와 같은 게놈 편집 툴은 생명공학, 유전자 요법, 및 많은 유기체들에서의 기능성 게놈 연구 분야에 영향을 미쳐 왔다. 보다 최근에는, RNA-가이디드 엔도뉴클레아제(RGEN)가 상보적 RNA 분자에 의해 이의 표적 부위로 향하게 된다. Cas9/CRISPR 시스템은 REGEN이다. tracrRNA는 또 다른 이러한 툴이다. 이들은 표적화된 뉴클레아제 시스템의 예들이며: 이들 시스템은 뉴클레아제를 표적 부위에 위치화시키는 DNA-결합 구성원을 가진다. 그런 다음, 이러한 부위는 뉴클레아제에 의해 절단된다. TALEN 및 ZFN은 DNA-결합 구성원에 융합된 뉴클레아제이다. Cas9/CRISPR은 표적 DNA 상에서 서로 발견하는 동족이다. DNA-결합 구성원은 염색체 DNA에 동족 서열을 가진다. DNA-결합 구성원은 전형적으로, 의도되는 동족 서열의 측면에서 디자인되어, 의도되는 부위에서 또는 의도되는 부위 근처에서 핵산분해(nucleolytic) 작용을 수득한다. 특정한 실시형태들이 제한 없이 이러한 시스템 모두에 적용 가능하며; 이러한 실시형태로는, 뉴클레아제 재-절단을 최소화하는 실시형태, 의도되는 잔기에서 정확하게 SNP를 제조하기 위한 실시형태, 및 DNA-결합 부위에서 유전자이입되는 대립유전자의 대체가 있다.
TALEN
본원에 사용되는 바와 같이, TALEN이라는 용어는 광범위하며, 또 다른 TALEN의 도움 없이 이중 가닥 DNA를 절단할 수 있는 단량체성 TALEN을 포함한다. TALEN이라는 용어는 또한, 동일한 부위에서 DNA를 절단하기 위해 함께 작동하도록 조작된 TALEN 쌍 중 하나의 구성원 또는 두 구성원 모두를 지칭하는 데 사용된다. 함께 작동하는 TALEN은 DNA 또는 TALEN-쌍의 대칭성(handedness)을 나타내는 좌측-TALEN 및 우측-TALEN으로 지칭될 수 있다.
TAL에 대한 암호(cipher)는 보고되어 왔으며(PCT 공개 WO 2011/072246), 여기서, 각각의 DNA 결합 반복부는 표적 DNA 서열에서 하나의 염기쌍을 인지하는 데 관여한다. 잔기는 DNA 서열을 표적으로 하도록 조립될 수 있다. 간략하게는, TALEN의 결합을 위한 표적 부위는 결정되어 있으며, 표적 부위를 인지하는 일련의 RVD 및 뉴클레아제를 포함하는 융합 분자가 형성된다. 결합 시, 뉴클레아제는 DNA를 절단하며, 이로 인해, 세포의 복구 머시너리가 작동하여, 절단된 말단들에서 유전자 변형을 형성할 수 있다.
TALEN이라는 용어는, 전사 활성자-유사(TAL) 효과기 결합 도메인 및 뉴클레아제 도메인을 포함하는 단백질을 의미하며, 그 자체가 기능성인 단량체성 TALEN뿐만 아니라 또 다른 단량체성 TALEN과의 이량체화를 필요로 하는 것들을 포함한다. 단량체성 TALEN 둘 다가 동일할 때, 이량체화에 의해 동종이량체성 TALEN이 형성될 수 있거나, 단량체성 TALEN들이 상이할 때, 이량체화에 의해 이종이량체성 TALEN이 형성될 수 있다. TALEN은 불멸화된 인간 세포에서 2개의 주요 진핵 DNA 복구 경로, 비-상동성 말단 접합(NHEJ) 및 상동성 표적 복구에 의해 유전자 변형을 유도하는 것으로 나타났다. TALEN은 종종 쌍으로 사용되지만, 단량체성 TALEN이 알려져 있다. TALEN (및 다른 유전자 툴)에 의해 처리될 세포로는, 배양된 세포, 불멸화된 세포, 원발성 세포, 원발성 체세포, 접합자, 생식 세포, 원시 생식 세포, 배반포 또는 줄기세포 등이 있다. 일부 실시형태에서, 다른 단백질 도메인들(예, 비-뉴클레아제 단백질 도메인)을 특이적인 뉴클레오타이드 서열에 표적화하기 위해, TAL 효과기가 사용될 수 있다. 예를 들어, TAL 효과기는 비제한적으로, DNA 20 상호작용 효소(예, 메틸라제, 토포이소머라제, 인테그라제, 트랜스포사제 또는 리가제), 전사 활성자 또는 억제제 유래의 단백질 도메인, 또는 히스톤과 같은 다른 단백질과 상호작용하거나 이를 변형시키는 단백질에 연결될 수 있다. 이러한 TAL 효과기 융합의 용도로는, 예를 들어, 에피유전학적(epigenetic) 조절 구성원을 형성하거나 변형시키는 것, DNA에서 부위-특이적 삽입, 결실 또는 복구를 만드는 것, 유전자 발현을 조절하는 것 및 염색질 구조를 변형시키는 것 등이 있다.
뉴클레아제라는 용어는 엑소뉴클레아제 및 엔도뉴클레아제를 포함한다. 엔도뉴클레아제라는 용어는 DNA 또는 RNA 분자, 바람직하게는 DNA 분자 내의 핵산들 사이에서 가수분해(절단)를 촉매할 수 있는 임의의 야생형 효소 또는 변이체 효소를 지칭한다. 엔도뉴클레아제의 비제한적인 예로는, 유형 II 제한효소 엔도뉴클레아제, 예컨대 FokI, HhaI, HindIII, NotI, BbvCl, EcoRI, BglII 및 AlwI이 있다. 엔도뉴클레아제는 또한, 전형적으로 길이가 약 12개 내지 45개의 염기쌍(bp), 보다 바람직하게는 14 bp 내지 45 bp인 폴리뉴클레오타이드 인지 부위를 가질 때, 희귀-절단 엔도뉴클레아제를 포함한다. 희귀-절단 엔도뉴클레아제는 정해진 유전자 좌에서 DNA 이중-가닥 절단부(DSB)를 유도한다. 희귀-절단 엔도뉴클레아제(rare-cutting endonuclease)는 예를 들어, 표적화된 엔도뉴클레아제, 조작된 아연-핑거 도메인과 Fok1과 같은 제한효소의 촉매 도메인과의 융합에 의해 형성된 키메라 아연-핑거 뉴클레아제(ZFN), 또는 화학적 엔도뉴클레아제일 수 있다. 화학적 엔도뉴클레아제에서, 화학적 절단기(cleaver) 또는 펩타이드성 절단기가, 특이적인 표적 서열을 인지하는 핵산 중합체 또는 또 다른 DNA에 공액됨으로써, 특이적인 서열에 대한 절단 활성을 표적으로 한다. 화학적 엔도뉴클레아제는 또한, 특이적인 DNA 서열에 결합하는 것으로 알려진 오르토페난트롤린의 컨쥬게이트와 같은 합성 뉴클레아제, DNA 절단 분자 및 트리플렉스-형성 올리고뉴클레오타이드(TFO)를 포함한다. 이러한 화학적 엔도뉴클레아제는 본 발명에 따른 "엔도뉴클레아제"라는 용어에 포함된다. 이러한 엔도뉴클레아제의 예로는, I-See I, I- Chu L I- Cre I, I- Csm I, PI-See L PI- Tti L PI- Mtu I, I- Ceu I, I-See IL 1-See III, HO, PI- Civ I, PI- Ctr L PI- Aae I, PI- Bsu I, PI- Dha I, PI- Dra L PI- Mav L PI- Meh I, PI- Mfu L PI- Mfl I, PI- Mga L PI- Mgo I, PI-Min L PI- Mka L PI- Mle I, PI- Mma I, PI-30 Msh L PI-Msm I, PI- Mth I, PI- Mtu I, PI- Mxe I, PI- Npu I, PI- Pfu L PI- Rma I, PI- Spb I, PI-Ssp L PI- Fae L PI- Mja I, PI- Pho L PI-태그 L PI-Thy I, PI- Tko I, PI- Tsp I, I-Msol가 있다.
TALEN 또는 다른 툴들에 의해 형성되는 유전자 변형은 예를 들어, 삽입, 결실, 외인성 핵산 단편의 삽입 및 치환으로 이루어진 목록으로부터 선택될 수 있다. 삽입이라는 용어는 광범위하게는, 문자 그대로 염색체 내로의 삽입, 또는 복구용 주형으로서 외인성 서열의 사용을 의미하는 데 사용된다. 일반적으로, 표적 DNA 부위가 동정되고, 이러한 부위에 특이적으로 결합할 TALEN-쌍이 생성된다. TALEN은, TALEN을 인코딩하는 단백질, mRNA로서 또는 벡터에 의해 세포 또는 배아에 전달된다. TALEN은 DNA를 절단하여, 이중-가닥 절단부를 만들고, 그런 다음 이를 복구시켜, 종종 indel을 형성하거나 또는 수반되는 외인성 핵산에 함유된 서열 또는 다형성을 혼입시키며, 이러한 외인성 핵산은 염색체에 삽입되거나 변형된 서열을 가진 절단부의 복구를 위한 주형으로서 작용한다. 이러한 주형-구동 복구는 염색체를 변화시키는 유용한 과정이며, 세포의 염색체에 효과적인 변화를 제공한다.
외인성 핵산이라는 용어는, 핵산이 세포에 자연적으로 존재하는 핵산 서열과 동일하거나 상이한 것과는 상관없이, 세포 또는 배아에 첨가되는 핵산을 의미한다. 핵산 단편이라는 용어는, 광범위하며, 염색체, 발현 카세트, 유전자, DNA, RNA, mRNA 또는 이들의 일부를 포함한다. 세포 또는 배아는 예를 들어, 비-인간 척추동물, 비-인간 영장류, 소, 말, 돼지, 양, 닭, 조류, 토끼, 염소, 개, 고양이, 실험 동물 및 어류로 이루어진 군으로부터 선택될 수 있다.
일부 실시형태는, TALEN-쌍에 의해 특이적으로 결합되는 부위에서 세포 또는 배아의 DNA에 유전자 변형을 유발하는 TALEN-쌍을 가축 및/또는 우제류 세포 또는 배아 내로 도입하는 단계, 및 상기 세포로부터 가축 동물/우제류를 생산하는 단계를 포함하는, 유전적으로 변형된 가축 및/또는 우제류를 제조하는 조성물 또는 방법을 수반한다. 직접 주사는 세포 또는 배아를 예를 들어, 접합자, 배반포 또는 배아에 도입하는 데 사용될 수 있다. 대안적으로는, TALEN 및/또는 다른 인자들은 단백질, RNA, mRNA, DNA 또는 벡터의 도입을 위한 많은 알려진 기술들 중 임의의 기술을 사용하여 세포 내로 도입될 수 있다. 유전적으로 변형된 동물은 공지된 과정들, 예를 들어 임신 숙주(gestational host) 내로의 배아의 이식 또는 다양한 클로닝 방법들에 따라 배아 또는 세포로부터 제조될 수 있다. "TALEN에 의해 특이적으로 결합되는 부위에서 세포의 DNA에 대한 유전자 변형"이라는 문구 등은, TALEN이 이의 표적 부위에 특이적으로 결합될 때, TALEN 상에서 뉴클레아제에 의해 절단되는 부위에서 유전자 변형이 이루어짐을 의미한다. 뉴클레아제는, TALEN-쌍이 결합하는 부위를 정확하게 절단하지 않으며, 그보다는 2개의 결합 부위들 사이의 한정된(defined) 부위에서 절단한다.
일부 실시형태는 동물을 클로닝하는 데 사용되는 세포의 조성물 또는 처리를 수반한다. 세포는 가축 및/또는 우제류 세포, 배양된 세포, 원발성 세포, 원발성 체세포, 접합자, 생식 세포, 원시 생식 세포 또는 줄기세포일 수 있다. 예를 들어, 일 실시형태는, 배양중인 복수의 원발성 세포들을 TALEN 단백질, 또는 TALEN이나 TALEN들을 인코딩하는 핵산에 노출시키는 단계를 포함하는, 유전자 변형을 형성하는 조성물 또는 방법이다. TALEN은 예를 들어, 벡터에서 mRNA 서열 또는 DNA 서열에 의해 인코딩되는 단백질 또는 핵산 단편으로서 도입될 수 있다.
아연
핑거
뉴클레아제
아연-핑거 뉴클레아제(ZFN)는 아연 핑거 DNA-결합 도메인을 DNA-절단 도메인에 융합시킴으로써 제조되는 인공적인 제한효소이다. 아연 핑거 도메인은 요망되는 DNA 서열을 표적화하도록 조작될 수 있으며, 이로써 아연-핑거 뉴클레아제는 복잡한 게놈 내의 독특한 서열을 표적화할 수 있다. 내인성 DNA 복구 머시너리를 이용함으로써, 이들 시약은 고등 유기체의 게놈을 변경하는 데 사용될 수 있다. ZFN은 유전자를 불활성화시키는 방법에 사용될 수 있다.
아연 핑거 DNA-결합 도메인은 약 30개의 아미노산을 가지며, 적합한 구조로 접힌다. 각각의 핑거는 본래 DNA 기질 내의 트리플렛(triplet)에 결합한다. 주요 위치에서의 아미노산 잔기는 DNA 부위와의 서열-특이적인 상호작용 대부분에 기여한다. 이들 아미노산은, 필수적인 구조를 보존하기 위해 잔여 아미노산을 유지하면서도 변화될 수 있다. 탠덤(tandem)에서 몇몇 도메인들을 연결함으로써, 보다 긴 DNA 서열에의 결합이 달성된다. 비-특이적 Fok1 절단 도메인(N), 전사 활성자 도메인(A), 전사 억제자 도메인(R) 및 메틸라제(M)와 같은 다른 작용기들이 ZFP에 융합되어, 각각 ZFN, 아연 핑거 전사 활성자(ZFA), 아연 핑거 전사 억제자(ZFR) 및 아연 핑거 메틸라제(ZFM)를 형성할 수 있다. 유전적으로 변형된 동물을 제조하기 위해 아연 핑거 및 아연 핑거 뉴클레아제를 사용하기 위한 물질 및 방법은 예를 들어, U.S. 8,106,255; U.S. 2012/0192298; U.S. 2011/0023159; 및 U.S. 2011/0281306에 개시되어 있다.
벡터 및 핵산
다양한 핵산들이 넉아웃 목적을 위해, 유전자의 불활성화를 위해, 유전자의 발현을 수득하기 위해 또는 다른 목적들을 위해 세포 내로 도입될 수 있다. 본원에 사용되는 바와 같이, 핵산이라는 용어는, 이중-가닥 또는 단일-가닥(즉, 센스 또는 안티센스 단일 가닥)인 DNA, RNA, 핵산 유사체 및 핵산을 포함한다. 핵산 유사체는 예를 들어, 핵산의 안정성, 혼성화 또는 용해성을 개선하기 위해, 염기 모이어티, 당 모이어티 또는 포스페이트 백본에서 변형될 수 있다. 데옥시리보스 포스페이트 백본은 변형되어 모르폴리노 핵산을 생성할 수 있으며, 이러한 핵산에서 각각의 염기 모이어티는 6-원의 모르폴리노 고리 또는 펩타이드 핵산에 연결되며, 여기서, 데옥시포스페이트 백본은 슈도펩타이드 백본에 의해 대체되고, 4개의 염기가 보유된다.
표적 핵산 서열은 프로모터와 같은 조절 영역에 작동적으로 연결될 수 있다. 조절 영역은 돼지의 조절 영역일 수 있거나, 다른 종의 조절 영역일 수 있다. 본원에 사용되는 바와 같이, 작동적으로 연결된다라는 것은, 표적 핵산의 전사를 허용하거나 촉진하는 방식으로, 핵산 서열에 대해 조절 영역을 위치화시키는 것을 지칭한다.
일반적으로, 임의의 유형의 프로모터가 표적 핵산 서열에 작동적으로 연결될 수 있다. 프로모터의 예로는, 비제한적으로, 조직-특이적인 프로모터, 구성적 프로모터, 유도성 프로모터, 및 특정 자극에 반응성이거나 불응성인 프로모터가 있다. 일부 실시형태에서, 유의미한 조직-특이성 또는 시간(temporal)-특이성 없이 핵산 분자의 발현을 촉진하는 프로모터가 사용될 수 있다(즉, 구성적 프로모터). 예를 들어, 닭 베타-액틴 유전자 프로모터, 유비퀴틴 프로모터, miniCAGs 프로모터, 글리세르알데하이드-3-포스페이트 데하이드로게나제(GAPDH) 프로모터 또는 3-포스포글리세레이트 키나제(PGK) 프로모터와 같은 베타-액틴 프로모터가 사용될 수 있으며, 뿐만 아니라 단순 헤르페스 바이러스 티미딘 키나제(HSV-TK) 프로모터, SV40 프로모터 또는 사이토메갈로바이러스(CMV) 프로모터와 같은 바이러스 프로모터가 사용될 수 있다. 일부 실시형태에서, 닭 베타 액틴 유전자 프로모터와 CMV 인핸서의 융합이 프로모터로서 사용된다. 예를 들어, 문헌[Xu et al., Hum. Gene Ther. 12:563, 2001; 및 Kiwaki et al., Hum. Gene Ther. 7:821, 1996]을 참조한다.
핵산 구축물에 유용할 수 있는 부가적인 조절 영역으로는, 폴리아데닐화 서열, 번역 조절 서열(예, 내부 리보좀 도입 절편, IRES), 인핸서, 유도성 요소 또는 인트론이 있으나, 이들로 한정되는 것은 아니다. 이러한 조절 영역들은 필수적이지 않을 수 있긴 하지만, 이들은 전사, mRNA의 안정성, 번역 효율 등에 영향을 미침으로써 발현을 증가시킬 수 있다. 이러한 조절 영역은, 세포(들)에서 핵산의 최적 발현을 수득하기 위해, 핵산 구축물에 요망되는 대로 포함될 수 있다. 그러나, 충분한 발현이 종종 이러한 부가적인 요소 없이도 수득될 수 있다.
신호 펩타이드 또는 선별가능한 발현 마커를 인코딩하는 핵산 구축물이 사용될 수 있다. 인코딩된 폴리펩타이드가 특정 세포 위치(예, 세포 표면)로 향하도록 신호 펩타이드가 사용될 수 있다. 선별가능한 마커의 비제한적인 예로는, 퓨로마이신, 간사이클로비르(ganciclovir), 아데노신 데아미나제(ADA), 아미노글리코사이드 포스포트랜스퍼라제(neo, G418, APH), 다이하이드로폴레이트 리덕타제(DHFR), 하이그로마이신-B-포스포트랜스퍼라제, 티미딘 키나제(TK) 및 잔틴-구아닌 포스포리보실트랜스퍼라제(XGPRT)가 있다. 이러한 마커는 배양중인 적합한 형질전환체를 선별하는 데 유용하다. 다른 선별가능한 마커로는, 형광 폴리펩타이드, 예컨대 녹색 형광 단백질 또는 황색 형광 단백질 등이 있다.
일부 실시형태에서, 선별가능한 마커를 인코딩하는 서열은 리컴비나제(recombinase), 예컨대 Cre 또는 Flp에 대한 인지 서열의 측면에 존재할 수 있다. 예를 들어, 선별가능한 마커는, 이러한 선별가능한 마커가 구축물로부터 절개될 수 있도록, loxP 인지 부위(Cre 리컴비나제에 의해 인지되는 34-bp 인지 부위) 또는 FRT 인지 부위의 측면에 존재할 수 있다. 문헌[Orban et al., Proc. Natl. Acad. Sci., 89:6861, 1992, for a review of Cre/lox technology, and Brand and Dymecki, Dev. Cell, 6:7, 2004]를 참조한다. 선별가능한 마커 유전자에 의해 방해받은 Cre-활성화가능한 이식유전자 또는 Flp-활성화가능한 이식유전자를 함유하는 트랜스포존 또한, 이식유전자의 조건적 발현을 가진 유전자 이식(transgenic) 동물을 수득하는 데 사용될 수 있다. 예를 들어, 마커/이식유전자의 발현을 구동하는 프로모터는 편재적(ubiquitous)이거나 조직-특이적일 수 있으며, 이로써 F0 동물(예, 돼지)에서 마커가 편재적으로 발현되거나 조직-특이적으로 발현될 것이다. 이식유전자의 조직 특이적인 활성화는 예를 들어, 마커-방해된 이식유전자를 편재적으로 발현하는 돼지를, Cre 또는 Flp를 조직-특이적인 방식으로 발현하는 돼지와 교배시킴으로써, 또는 마커-방해받은 이식유전자를 조직-특이적인 방식으로 발현하는 돼지를, Cre 또는 Flp 리컴비나제를 편재적으로 발현하는 돼지와 교배시킴으로써 달성될 수 있다. 이식유전자의 조절된 발현 또는 마커의 조절된 절개는 이식유전자를 발현시킬 수 있다.
일부 실시형태에서, 외인성 핵산은 폴리펩타이드를 인코딩한다. 폴리펩타이드를 인코딩하는 핵산 서열은, 인코딩된 폴리펩타이드의 후속적인 조작을 촉진하도록(예, 위치화 또는 검출을 촉진하도록) 디자인된 "태그"를 인코딩하는 태그 서열을 포함할 수 있다. 태그 서열은, 인코딩된 태그가 폴리펩타이드의 카르복실 말단 또는 아미노 말단에 위치되도록, 폴리펩타이드를 인코딩하는 핵산 서열에 삽입될 수 있다. 인코딩된 태그의 비제한적인 예로는, 글루타티온 S-트랜스퍼라제(GST) 및 FLAG™ 태그(Kodak, New Haven, CT)가 있다.
핵산 구축물은 예를 들어, 난모세포 또는 난자와 같은 생식 세포, 전구 세포, 성인 또는 배아 줄기세포, 원시 생식 세포, 신장 세포, 예컨대 PK-15 세포, 섬세포, 베타 세포, 간 세포 또는 섬유아세포, 예컨대 피부 섬유아세포를 비롯한 임의의 유형의 배아, 태아 또는 성인 우제류/가축 세포 내로 다양한 기술들을 사용해 도입될 수 있다. 이러한 기술의 비제한적인 예로는, 트랜스포존 시스템, 세포를 감염시킬 수 있는 재조합 바이러스, 또는 리포좀의 사용, 또는 다른 비-바이러스 방법, 예컨대 핵산을 세포에 전달할 수 있는 전기천공, 현미주사(microinjection) 또는 칼슘 포스페이트 침강 등이 있다.
트랜스포존 시스템에서, 핵산 구축물의 전사 단위, 즉, 외인성 핵산 서열에 작동적으로 연결된 조절 영역은 트랜스포존의 역반복부에 측면에 존재한다. 예를 들어, 슬리핑 뷰티(Sleeping Beauty)(US 6,613,752 및 US 2005/0003542 참조); 프로그 프린스(Frog Prince)(문헌[Miskey et al., Nucleic Acids Res., 31:6873, 2003] 참조); Tol2(문헌[Kawakami, Genome Biology, 8(Suppl.l):S7, 2007] 참조); 미노스(Minos)(문헌[Pavlopoulos et al., Genome Biology, 8(Suppl.l):S2, 2007] 참조); Hsmar1(문헌[Miskey et al., Mol Cell Biol., 27:4589, 2007] 참조); 및 패스포트(Passport)를 비롯한 몇몇 트랜스포존 시스템들이 핵산을 마우스 세포, 인간 세포 및 돼지 세포를 비롯한 세포 내로 도입하기 위해 개발되어 왔다. 슬리핑 뷰티 트랜스포존이 특히 유용하다. 트랜스포사제는 단백질로서 전달되며, 외인성 핵산과 동일한 핵산 구축물 상에서 인코딩될 수 있으며, 개별 핵산 구축물 상에 도입되거나 mRNA(예, 시험관내에서 전사되고 캡핑된 mRNA)로서 제공될 수 있다.
핵산은 벡터 내로 혼입될 수 있다. 벡터는, 캐리어로부터 표적 DNA 내로 이동하도록 디자인된 임의의 특이적인 DNA 절편을 포함하는 광범위한 용어이다. 벡터는 발현 벡터 또는 벡터 시스템으로서 지칭될 수 있으며, 이는 에피좀, 플라스미드 또는 심지어 바이러스/파지 DNA 절편과 같이 DNA를 게놈 또는 다른 표적화된 DNA 서열 내로 삽입하는 데 필요한 성분 세트이다. 동물에서 유전자 전달에 사용되는 벡터 시스템, 예컨대 바이러스 벡터(예, 레트로바이러스, 아데노-연관 바이러스 및 통합 파지 바이러스) 및 비-바이러스 벡터(예, 트랜스포존)는 2개의 기본적인 성분을 가진다: 1) DNA(또는 cDNA로 역전사되는 RNA)로 이루어진 벡터, 및 2) 벡터와 DNA 표적 서열을 둘 다 인지하고, 벡터를 표적 DNA 서열 내로 삽입하는 트랜스포사제, 리컴비나제 또는 다른 인테그라제 효소. 대부분의 벡터는 종종 하나 이상의 발현 조절 서열을 포함하는 하나 이상의 발현 카세트를 함유하며, 여기서, 발현 조절 서열은 또 다른 DNA 서열 또는 mRNA의 전사 및/또는 번역을 각각 조절 및 제어하는 DNA 서열이다.
많은 상이한 유형의 벡터들이 알려져 있다. 예를 들어, 플라스미드 및 바이러스 벡터, 예를 들어 레트로바이러스 벡터가 알려져 있다. 포유류의 발현 플라스미드는 전형적으로, 복제 기원, 적합한 프로모터 및 선택적인 인핸서를 포함하고, 또한 임의의 필수적인 리보좀 결합 부위, 폴리아데닐화 부위, 스플라이스 공여자 및 수용자 부위, 전사 종결 서열 및 5' 측면 비-전사 서열을 또한 포함한다. 벡터의 예로는, 플라스미드(또 다른 유형의 벡터의 캐리어일 수도 있음), 아데노바이러스, 아데노-연관 바이러스(AAV), 안티바이러스(예, 변형된 HIV-1, SIV 또는 FIV), 레트로바이러스(예, ASV, ALV 또는 MoMLV) 및 트랜스포존(예, 슬리핑 뷰티, P-요소, Tol-2, 프로그 프린스, piggyBac)이 있다.
본원에 사용되는 바와 같이, 핵산이라는 용어는 예를 들어, cDNA, 게놈 DNA, 합성(예, 화학적으로 합성된) DNA, 뿐만 아니라 자연 발생적인 핵산 및 화학적으로 변형된 핵산, 예를 들어 합성 염기 또는 대안적인 백본을 비롯한 RNA 및 DNA 둘 다를 지칭한다. 핵산 분자는 이중-가닥 또는 단일-가닥(즉, 센스 또는 안티센스 단일 가닥)일 수 있다. 유전자 이식이라는 용어는 본원에서 광범위하게 사용되며, 유전 물질이 유전자 조작 기술을 사용하여 변경된 유전적으로 변형적 유기체 또는 유전자 조작된 유기체를 지칭한다. 따라서, 넉아웃 우제류는, 외인성 유전자 또는 핵산이 동물 또는 이의 자손에서 발현되는지와 상관없이 유전자 이식된다.
유전적으로 변형된 동물
동물은 TALEN, 또는 리컴비나제 융합 단백질 또는 알려져 있는 다양한 벡터들을 비롯한 다른 유전자 조작 툴을 사용하여 변형될 수 있다. 이러한 툴에 의해 형성된 유전자 변형은 유전자의 교란을 포함할 수 있다. 유전자 교란이라는 용어는, 기능적인 유전자 생성물의 형성을 방지하는 것을 지칭한다. 유전자 생성물은, 이것이 이의 정상적인(야생형) 기능을 충족할 경우에만 기능적이다. 유전자 교란은 유전자에 의해 인코딩되는 기능적 인자들의 발현을 방지하고, 동물에서 유전자의 발현에 필수적인 유전자 및/또는 프로모터 및/또는 오퍼레이터에 의해 인코딩되는 서열 내 하나 이상의 염기들의 삽입, 결실 또는 치환을 포함한다. 교란된 유전자는 예를 들어, 동물의 게놈으로부터의 유전자의 적어도 일부의 제거, 유전자에 의해 인코딩되는 기능적 인자의 발현을 방지하기 위한 유전자의 변경, 간섭 RNA, 또는 외인성 유전자에 의한 우성 음성 인자(dominant negative factor)의 발현에 의해 교란될 수 있다. 동물을 유전적으로 변형시키는 물질 및 방법은 US 8,518,701; US 2010/0251395; 및 US 2012/0222143에 더 상세히 기술되어 있으며, 이들은 모든 목적을 위해 원용에 의해 본 명세서에 포함되어 있으며; 상충하는 경우, 본 명세서가 좌우한다. 트랜스액팅(trans-acting)이라는 용어는 상이한 분자들 유래의 표적 유전자에 작용하는 과정을 지칭한다(즉, 분자간(intermolecular)). 트랜스액팅 요소는 통상, 유전자를 함유하는 DNA 서열이다. 이러한 유전자는 표적 유전자의 제어에 사용되는 단백질(또는 microRNA 또는 다른 확산성(diffusible) 분자)을 코딩한다. 트랜스액팅 유전자는 표적 유전자와 동일한 염색체 상에 존재할 수 있으나, 이의 활성은 트랜스액팅 유전자가 인코딩하는 중개(intermediary) 단백질 또는 RNA를 통해서이다. 트랜스액팅 유전자의 실시형태는 예를 들어, 표적화 엔도뉴클레아제를 인코딩하는 유전자이다. 우성 음성을 사용한 유전자의 불활성화는 일반적으로 트랜스액팅 요소를 수반한다. cis-제어 또는 cis-액팅이라는 용어는 단백질 또는 RNA를 코딩하지 않는 작용을 의미하며; 유전자 불활성화의 맥락에서, 이는 일반적으로, 기능적 유전자의 발현에 필수적인 유전자, 또는 프로모터 및/또는 오퍼레이터의 코딩 부위의 불활성화를 의미한다.
당업계에 알려져 있는 다양한 기술들이 사용되어, 유전자를 불활성화시켜 넉아웃 동물을 제조하고/거나 핵산 구축물을 동물에 도입하여 파운더 동물을 생산하고 동물 라인을 제조할 수 있으며, 여기서, 넉아웃 또는 핵산 구축물이 게놈 내로 통합된다. 이러한 기술로는, 비제한적으로, 전핵(pronucleus) 현미주사(U.S. 4,873,191), 생식 계열 내로의 레트로바이러스 매개 유전자 트랜스퍼(문헌[Van der Putten et al., Proc. Natl. Acad. Sci. USA, 82:6148-6152, 1985] 참조), 배아 줄기세포 내로의 유전자 표적화(문헌[Thompson et al., Cell, 56:313-321, 1989] 참조), 배아의 전기천공(문헌[Lo, Mol. Cell. Biol., 3:1803-1814, 1983] 참조), 정자-매개 유전자 트랜스퍼(문헌[Lavitrano et al., Proc. Natl. Acad. Sci. USA, 99:14230-14235, 2002; Lavitrano et al., Reprod. Fert. Develop., 18:19-23, 2006] 참조) 및 체세포, 예컨대 난구(cumulus) 세포 또는 유방 세포, 또는 성인, 태아 또는 배아 줄기세포의 시험관내 형질전환과 후속적인 핵 이식(문헌[Wilmut et al., Nature, 385:810-813, 1997; 및 Wakayama et al., Nature, 394:369-374, 1998] 참조) 등이 있다. 전핵 현미주사, 정자-매개 유전자 트랜스퍼 및 체세포 핵 트랜스퍼가 특히 유용한 기술이다. 게놈적으로 변형되는 동물은, 생식 계열 세포를 비롯한 동물의 모든 세포들이 유전자 변형을 가지고 있는 동물이다. 유전자 변형에서 모자이크(mosaic)인 동물을 생산하는 방법이 사용되는 경우, 동물은 동계 교배될 수 있고, 게놈적으로 변형된 자손이 선별될 수 있다. 예를 들어, 동물 세포가 배반포 상태에서 변형된다면, 모자이크 동물을 제조하는 데에 클로닝이 사용될 수 있거나, 단일-세포가 변형되는 경우, 게놈 변형이 발생할 수 있다. 성적으로 성숙되지 않도록 변형되는 동물은, 사용되는 특정한 접근법에 따라 변형에 대해 동형접합 또는 이형접합일 수 있다. 특정 유전자가 넉아웃 변형에 의해 불활성화되는 경우, 동형접합성이 통상 필요할 것이다. 특정 유전자가 RNA 간섭 또는 우성 음성 전략에 의해 불활성화되는 경우, 이형접합성이 종종 적절하다.
전형적으로, 전핵 현미주사에서, 핵산 구축물은 수정란에 도입되며; 1개 또는 2개의 세포 수정란이 정자 머리로부터의 유전 물질을 함유하는 전핵으로서 사용되고, 난자는 원형질(protoplasm) 내에서 보이게 된다. 전핵 단계의 수정란은 시험관내 또는 생체내에서(즉, 공여자 동물의 난관으로부터 수술적으로 회수되어) 수득될 수 있다. 시험관내 수정란은 하기와 같이 생산될 수 있다. 예를 들어, 돼지의 난소를 도살장에서 수합할 수 있으며, 이송 동안 22℃ 내지 28℃에서 유지시킬 수 있다. 난소를 세척한 다음, 여포성 흡인(follicular aspiration)을 위해 단리할 수 있으며, 4 mm 내지 8 mm 범위의 여포(follicle)를 진공 하에 18 게이지 바늘을 사용하여 50 mL 코니칼 원심분리 튜브(conical centrifuge tube) 내로 흡인할 수 있다. 여포액 및 흡인된 난모세포를 상업적인 TL-HEPES(Minitube, Verona, WI)를 사용하여 프리-필터를 통해 헹굴 수 있다. 촘촘한 난구 덩어리(compact cumulus mass)에 의해 둘러싸인 난모세포를 선별하고, 38.7℃ 및 5% C02의 수분-보충된 분위기(humidified air)에서, 0.1 mg/mL 시스테인, 10 ng/mL 표피 성장 인자, 10% 돼지의 여포액, 50 μM 2-머캅토에탄올, 0.5 mg/ml cAMP, 각각 10 IU/mL의 임신 말 혈청 성선 자극 호르몬(pregnant mare serum gonadotropin; PMSG) 및 인간 융모성 성선 자극 호르몬(human chorionic gonadotropin; hCG)이 보충된 TCM-199 난모세포 성숙 배지(Minitube, Verona, WI)에 약 22시간 동안 둔다. 후속적으로, 난모세포를, cAMP, PMSG 또는 hCG를 함유하지 않을 새로운 TCM-199 성숙 배지로 옮길 수 있으며, 22시간 더 인큐베이션할 수 있다. 성숙된 난모세포를 0.1% 히알루로니다제에서 1분 동안 보텍싱(vortexing)하면서 난구 세포로부터 긁어낼 수 있다.
돼지의 경우, 성숙한 난모세포를 Minitube 5-웰 수정 디쉬 내의 500 ㎕ Minitube PORCPRO IVF 배지 시스템(Minitube, Verona, WI)에서 수정시킬 수 있다. 시험관내 수정(IVF)을 위한 준비 시, 새로-수합되거나 냉동된 수퇘지 정액을 세척하고, PORCPRO IVF 배지에서 4 x 105개 정자까지 재현탁시킬 수 있다. 정자의 농도를 컴퓨터 보조 정액 분석(SPERMVISION, Minitube, Verona, WI)에 의해 분석할 수 있다. 수퇘지에 따라, 1개 난모세포 당 약 40개의 이동성 정자의 최종 농도로 10 ㎕ 부피에서 마지막 시험관내 정액주입(insemination)을 수행할 수 있다. 모든 수정되는 난모세포를 38.7℃, 5.0% C02 분위기에서 6시간 동안 인큐베이션한다. 정액주입-후 6시간째에, 추정상(presumptive) 접합자를 NCSU-23에서 2회 세척하고, 0.5 mL의 동일한 배지에 옮길 수 있다. 이러한 시스템은 대부분의 수퇘지에 대해 대체로 20% 내지 30%의 배반포를 생산할 수 있으며, 이때 다정자(polyspermic) 정액주입 비율은 10% 내지 30%이다.
선형화된 핵산 구축물을 1개의 전핵 내로 주사할 수 있다. 그런 다음, 주사된 난자를 수여자 암컷에(예, 수여자 암컷의 난관 내로) 트랜스퍼할 수 있으며, 수여자 암컷에서 발생시켜, 유전자 이식 동물을 생산할 수 있다. 특히, 시험관내에서 수정된 배아를 15,000 X g에서 5분 동안 원심분리하여, 지질을 침강시켜, 전핵을 가시화시킬 수 있다. 배아를 Eppendorf FEMTOJET 인젝터를 사용하여 주사할 수 있으며, 배반포가 형성될 때까지 배양할 수 있다. 배아 절단과 배반포 형성의 속도 및 품질을 기록할 수 있다.
배아를 비동시성(asynchronous) 수여자의 자궁에 수술적으로 트랜스퍼할 수 있다. 전형적으로, 100개 내지 200개(예, 150개 내지 200개)의 배아를 5.5인치 TOMCAT® 카테터를 사용하여 난관의 자궁관팽대-자궁관잘룩 접합부(ampulla-isthmus junction) 내로 위치시킬 수 있다. 수술 후, 실시간 초음파 임신 검사를 수행할 수 있다.
체세포 핵 트랜스퍼에서, 상기 기술된 핵산 구축물을 포함하는 유전자 이식 우제류 세포(예, 유전자 이식 돼지 세포 또는 소 세포), 예컨대 배아 난할구, 태아 섬유아세포, 성인 귀 섬유아세포 또는 과립막 세포를 제핵(enucleated) 난모세포 내에 도입하여, 조합 세포를 구축할 수 있다. 난모세포는 극체 주위에서 부분 투명대 절개(partial zona dissection)에 의해 제핵될 수 있으며, 그런 다음, 절개 영역에서 세포질 밖으로 눌려질 수 있다. 전형적으로, 날카로운 비스듬한 팁(sharp beveled tip)을 가진 주사 파이펫을 사용하여, 유전자 이식 세포를 제2 감수분열에서 정지된 제핵 난모세포 내로 주사한다. 일부 관례에서, 제2 감수분열에서 정지된 난모세포를 난자라고 한다. (예, 난모세포의 융합 및 활성화에 의해) 돼지 배아 또는 소 배아를 생산한 후, 활성화 후 약 20시간 내지 24시간째에, 배아를 수여자 암컷의 난관으로 트랜스퍼한다. 예를 들어, 문헌[Cibelli et al., Science, 280:1256-1258, 1998]; 및 U.S. 6,548,741을 참조한다. 돼지의 경우, 배아 트랜스퍼 후 약 20일 내지 21일째에, 수여자 암컷에 대해 임신을 체크할 수 있다.
표준 품종 개량 기술을 사용하여, 초기 이형접합 파운더 동물로부터 외인성 핵산에 동형접합인 동물을 생산할 수 있다. 그러나, 동형접합성이 필요하지 않을 수 있다. 본원에 기술된 유전자 이식 돼지는 다른 관심 돼지와 함께 번식시킬 수 있다.
일부 실시형태에서, 관심 핵산 및 선별가능한 마커는 개별 트랜스포존 상에 제공되고 동등하지 않은 양으로 배아 또는 세포에 제공될 수 있으며, 여기서, 선별가능한 마커를 함유하는 트랜스포존의 양은 관심 핵산을 함유하는 트랜스포존의 양을 훨씬 더 초과한다(5배 내지 10배 초과). 관심 핵산을 발현하는 유전자 이식 세포 또는 동물은 선별가능한 마커의 존재 및 발현을 기재로 단리될 수 있다. 트랜스포존이 정확하고 관련성이 없는 방식으로(독립적인 전위(transposition) 사건) 게놈 내로 통합될 것이기 때문에, 관심 핵산 및 선별가능한 마커는 유전적으로 연결되지 않으며, 표준 품종 개량을 통한 유전적 격리(genetic segregation)에 의해 쉽게 분리될 수 있다. 따라서, 선별가능한 마커를 후속 세대에 보유하도록 강요되지 않는 유전자 이식 동물이 생산될 수 있으며, 이는 대중의 안전성 관점에서 약간의 염려가 되는 문제이다.
일단 유전자 이식 동물이 생산되면, 외인성 핵산의 발현은 표준 기술을 사용하여 평가될 수 있다. 서던 블롯 분석에 의해 초기 스크리닝을 달성하여, 구축물이 통합되었는지의 여부를 확인할 수 있다. 서던 분석에 대한 상세한 설명은 문헌[Sambrook et al., Molecular Cloning, A Laboratory Manual, second edition, Cold Spring Harbor Press, Plainview; NY., 1989]의 섹션 9.37-9.52를 참조한다. 폴리머라제 연쇄 반응(PCR) 기술 또한, 초기 스크리닝에 사용될 수 있다. PCR은, 표적 핵산이 증폭되는 절차 또는 기술을 지칭한다. 일반적으로, 관심 영역의 말단들로부터 또는 이를 지나서까지의 서열 정보가, 증폭되어야 하는 주형의 반대 가닥과 서열이 일치하거나 유사한 올리고뉴클레오타이드를 디자인하는 데 이용된다. PCR은 총 게놈 DNA 또는 총 세포 RNA 유래의 서열을 포함하여 DNA뿐만 아니라 RNA의 특이적인 서열을 증폭시키는 데 사용될 수 있다. 프라이머는 전형적으로 길이가 14개 내지 40개 뉴클레오타이드이지만, 10개의 뉴클레오타이드 길이부터 수백개의 뉴클레오타이드 길이까지의 범위일 수 있다. PCR은 예를 들어, 문헌[PCR Primer: A Laboratory Manual, ed. Dieffenbach and Dveksler, Cold Spring Harbor Laboratory Press, 1995]에 기술되어 있다. 핵산은 또한, 리가제 연쇄 반응, 가닥 치환 증폭, 자가-유지 서열 복제 또는 핵산 서열-기재 증폭에 의해 증폭될 수 있다. 예를 들어, 문헌[Lewis, Genetic Engineering News, 12:1, 1992; Guatelli et al., Proc. Natl. Acad. Sci. USA, 87:1874, 1990; 및 Weiss, Science, 254:1292, 1991]을 참조한다. 배반포 단계에서, 배아를 PCR, 서던 혼성화 및 스플링케렛 PCR(splinkerette PCR)에 의해 분석용으로 개별적으로 가공할 수 있다(예, 문헌[Dupuy et al., Proc Natl Acad Sci USA, 99:4495, 2002] 참조).
유전자 이식 돼지의 조직에서 폴리펩타이드를 인코딩하는 핵산 서열의 발현은 예를 들어, 동물로부터 수득된 조직 검체의 노던 블롯 분석, 인 시추 혼성화 분석, 웨스턴 분석, 면역검정, 예컨대 효소-연결 흡착 검정, 및 역전사효소 PCR(RT-PCR)을 비롯한 기술들을 사용하여 평가될 수 있다.
간섭 RNA
다양한 간섭 RNA(RNAi)들이 알려져 있다. 이중-가닥 RNA(dsRNA)는 상동성 유전자 전사체의 서열-특이적인 분해를 유도한다. RNA-유도 침묵 복합체(RISC)는 dsRNA를 작은 21개 내지 23개의 뉴클레오타이드로 이루어진 작은 간섭 RNA(siRNA)로 분해한다. RISC는 이중 가닥 RNAse(dsRNase, 예, 다이서(Dicer)) 및 ssRNase(예, Argonaut 2 또는 Ago2)를 함유한다. RISC는 절단가능한 표적을 찾기 위해 안티센스 가닥을 가이드로서 이용한다. siRNA 및 microRNA(miRNA) 둘 다 알려져 있다. 유전적으로 변형된 동물에서 유전자를 교란시키는 방법은, 표적 유전자 및/또는 핵산의 발현이 감소하도록, 표적 유전자 및/또는 핵산에 대해 RNA 간섭을 유도하는 단계를 포함한다.
예를 들어, 외인성 핵산 서열은 폴리펩타이드를 인코딩하는 핵산에 대해 RNA 간섭을 유도할 수 있다. 예를 들어, 표적 DNA에 상동성인 이중-가닥 작은 간섭 RNA(siRNA) 또는 작은 헤어핀 RNA(shRNA)가 사용되어, 해당 DNA의 발현을 감소시킬 수 있다. siRNA에 대한 구축물은 예를 들어, 문헌[Fire et al., Nature, 391:806, 1998; Romano and Masino, Mol. Microbiol., 6:3343, 1992; Cogoni et al., EMBO J., 15:3153, 1996; Cogoni and Masino, Nature, 399:166, 1999; Misquitta and Paterson Proc. Natl. Acad. Sci. USA, 96:1451, 1999; 및 Kennerdell and Carthew, Cell, 95: 1017, 1998]에 기술된 바와 같이 생성될 수 있다. shRNA에 대한 구축물은 문헌[Mclntyre and Fanning (2006) BMC Biotechnology 6:1]에 의해 기술된 바와 같이 생성될 수 있다. 일반적으로, shRNA는 상보적 영역을 함유하는 단일-가닥 RNA 분자로서 전사되며, 이는 어닐링되어 짧은 헤어핀을 형성할 수 있다.
특정 유전자에 대한 단일의 개별 기능성 siRNA 또는 miRNA를 찾을 가능성은 높다. 예를 들어, siRNA의 특정 서열의 예측가능성은 약 50%이지만, 간섭 RNA의 수는, 이들 중 적어도 하나는 효과적일 것이라는 양호한 신뢰 하에 제조될 수 있다.
실시형태는 유전자, 예를 들어 발생 단계에 대해 선택적인 유전자에 대한 RNAi를 발현하는 시험관내 세포, 생체내 세포 및 유전자 변형된 동물, 예컨대 가축 동물을 포함한다. RNAi는 예를 들어, siRNA, shRNA, dsRNA, RISC 및 miRNA로 이루어진 군으로부터 선택될 수 있다.
유도 시스템
유전자의 발현을 조절하기 위해 유도 시스템이 사용될 수 있다. 유전자의 발현을 시공간적으로 조절할 수 있는 다양한 유도 시스템들이 알려져 있다. 몇몇 시스템들은 유전자 이식 동물에서 생체내에서 기능적인 것으로 입증되었다. 유도 시스템이라는 용어는 전형적인 프로모터 및 유도성 유전자 발현 요소를 포함한다.
유도 시스템의 일례는 테트라사이클린(tet)-온 프로모터 시스템이며, 이는 핵산의 전사를 제어하는 데 사용될 수 있다. 이러한 시스템에서, 돌연변이화된 Tet 억제자(TetR)는 단순 헤르페스 바이러스 VP 16 트랜스-활성자 단백질의 활성화 도메인에 융합되어, 테트라사이클린-조절 전사 활성자(tTA)를 생성하며, 이는 tet 또는 독시사이클린(dox)에 의해 제어된다. 항생제의 부재 시, 전사는 최소화되며, 한편, tet 또는 dox의 존재 시, 전사가 유도된다. 대안적인 유도 시스템은 엑디손 또는 라파마이신 시스템을 포함한다. 엑디손은 곤충 탈피 호르몬으로서, 이의 생성은 엑디손 수용체의 헤테로이량체 및 울트라스피러클 유전자(ultraspiracle gene)(USP)의 생성물에 의해 조절된다. 엑디손, 및 뮤리스테론 A(muristerone A)와 같은 엑디손 유사체의 처리에 의해 발현이 유도된다. 유도 시스템을 유도하기 위해 동물에게 투여되는 작용제는 유도제로 지칭된다.
테트라사이클린-유도 시스템 및 Cre/loxP 리컴비나제 시스템(구성적 또는 유도성)은 보다 보편적으로 사용되는 유도 시스템이다. 테트라사이클린-유도 시스템은 테트라사이클린-조절된 트랜스활성자(tTA)/리버스 tTA(rtTA)를 수반한다. 생체내에서 이들 시스템을 사용하기 위한 방법은 유전적으로 변형된 동물의 2개 라인을 생산하는 단계를 수반한다. 하나의 동물 라인은 선택된 프로모터의 조절 하에 활성자(tTA, rtTA 또는 Cre 리컴비나제)를 발현시킨다. 또 다른 세트의 유전자 이식 동물은 수용자를 발현하며, 여기서, 관심 유전자(또는 변형되어야 하는 유전자)의 발현은 tTA/rtTA 트랜스활성자에 대한 표적 서열의 조절 하에 있다(또는 loxP 서열의 측면에 존재함). 2개의 마우스 계통을 교배시키는 것은 유전자 발현의 조절을 제공한다.
테트라사이클린-의존적 제어 시스템(tet 시스템)은 2개의 성분, 즉, 테트라사이클린-조절된 트랜스활성자(tTA 또는 rtTA), 및 다운스트림 cDNA의 발현을 조절하는 tTA/rtTA-의존적 프로모터에 테트라사이클린-의존적 방식으로 의존한다. 테트라사이클린 또는 이의 유도체(예, 독시사이클린)의 부재 시, tTA는 tetO 서열에 결합하여, tTA-의존적 프로모터의 전사 활성화를 가능하게 한다. 그러나, 독시사이클린의 존재 시, tTA는 이의 표적과 상호작용할 수 없으며, 전사가 발생하지 않는다. tTA를 사용하는 tet 시스템을 tet-OFF라고 하는데, 왜냐하면 테트라사이클린 또는 독시사이클린이 전사의 하향조절을 가능하게 하기 때문이다. 테트라사이클린 또는 이의 유도체를 투여하면, 생체내에서 이식유전자의 발현을 시간적으로 조절할 수 있다. rtTA는 독시사이클린의 부재 시에서는 기능적이지 않지만 트랜스활성화에 대한 리간드의 존재를 필요로 하는 tTA의 변이체이다. 따라서, 이러한 tet 시스템은 생체내에서, 예를 들어, 리포터 유전자, 종양유전자, 또는 신호전달 캐스케이드에 관여하는 단백질을 인코딩하는 몇몇 이식유전자들의 유도성 발현을 위해 사용되어 왔다.
Cre/lox 시스템은 Cre 리컴비나제를 사용하며, 이는 2개의 별개의 Cre 인지 서열들 사이, 즉 loxP 부위들 사이에서 교차에 의한 부위-특이적인 재조합을 촉매한다. 2개의 loxP 서열들 사이에 도입된 DNA 서열(플록스드(floxed) DNA라고 함)은 Cre-매개 재조합에 의해 절개된다. (조직-특이적 프로모터 또는 세포-특이적 프로모터를 이용한) 공간적 조절 또는 (유도 시스템을 이용한) 시간적 조절을 사용하여, 유전자 이식 동물에서 Cre 발현을 조절하면, 2개의 loxP 부위들 사이에서 DNA 절개를 조절한다. 하나의 용도는 조건적인 유전자 불활성화(조건적인 넉아웃)를 위한 것이다. 또 다른 접근법은 단백질 과발현이며, 여기서, 플록스드 정지 코돈이 프로모터 서열과 관심 DNA 사이에 삽입된다. 유전적으로 변형된 동물은, Cre가 발현될 때까지는 이식유전자를 발현하지 않아, 플록스드 정지 코돈의 절개를 초래한다. 이러한 시스템은 조직-특이적인 종양발생, 및 B-림프구에서 조절된 항원 수용체 발현에 적용되어 왔다. 유도성 Cre 리컴비나제 또한, 개발되어 왔다. 유도성 Cre 리컴비나제는 외인성 리간드의 투여에 의해서만 활성화된다. 유도성 Cre 리컴비나제는 오리지널 Cre 리컴비나제 및 특이적인 리간드-결합 도메인을 함유하는 융합 단백질이다. Cre 리컴비나제의 기능적인 활성은, 융합 단백질 내의 이러한 특이적인 도메인에 결합할 수 있는 외부(external) 리간드에 따라 다르다.
실시형태는, 유도 시스템의 조절 하에 유전자를 포함하는 시험관내 세포, 생체내 세포, 및 유전적으로 변형된 동물, 예컨대 가축 동물을 포함한다. 동물의 유전자 변형은 게놈성 또는 모자이크성일 수 있다. 유도 시스템은 예를 들어, Tet-On, Tet-Off, Cre-lox 및 Hif1알파로 이루어진 군으로부터 선택될 수 있다. 일 실시형태는 본원에 나타낸 유전자이다.
우성 음성
따라서, 유전자는 제거 또는 RNAi 억제뿐만 아니라, 해당 유전자 생성물의 정상적인 기능에 저해 효과를 가진 단백질의 우성 음성 변이체의 생성/발현에 의해 교란될 수 있다. 우성 음성(DN) 유전자의 발현은 표현형을 변경시킬 수 있으며, a) DN이 동일한 활성을 발휘하지 않으면서, 내인성 유전자의 협동 인자 또는 정상적인 표적에 대한 내인성 유전자 생성물과 수동적으로(PASSIVELY) 경쟁하는 적정 효과(titration effect), b) 우성 음성 유전자 생성물이 정상적인 유전자 기능에 필요한 과정을 능동적으로(ACTIVELY) 방해하는, 포이즌 필(poison pill)(또는 원숭이 렌치(monkey wrench)) 효과, c) DN이 유전자 기능의 음성 조절자를 능동적으로(ACTIVELY) 자극하는 피드백 효과에 의해 발휘될 수 있다.
파운더
동물, 동물 라인, 형질 및 번식
파운더 동물(F0 세대)은 본원에 기술된 클로닝 및 다른 방법에 의해 생산될 수 있다. 파운더는 유전자 변형에 대해 동형접합성일 수 있으며, 이러한 경우 접합자 또는 원발성 세포는 동형접합 변형을 받는다. 유사하게는, 이형접합인 파운더가 또한 제조될 수 있다. 파운더는 게놈적으로 변형될 수 있으며, 이는, 파운더의 게놈 내 세포가 변형을 수행함을 의미한다. 파운더는, 벡터가 전형적으로 배반포 단계의 배아 내의 복수의 세포들 중 하나의 세포에 도입될 때 발생할 수 있는 바와 같이, 변형에 대해 모자이크성일 수 있다. 게놈적으로 변형된 자손을 동정하기 위해, 모자이크 동물의 자손을 시험할 수 있다. 유성생식할 수 있거나 보조적인 번식 기술에 의해 번식될 수 있는 동물 풀이 제조되었을 때, 동물 라인이 구축되며, 이형접합성 또는 동형접합성 자손은 변형을 일관적으로 발현한다.
가축에서, 많은 대립유전자들이 생산 형질, 유형 형질, 작업성 형질 및 다른 기능적인 형질과 같은 다양한 형질들에 연결되는 것으로 알려져 있다. 당업자는 이들 형질을 모니터링하고 정량화하는 데 익숙하며, 예를 들어, 문헌[Visscher et al., Livestock Production Science, 40:123-137, 1994; U.S. 7,709,206; U.S. 2001/0016315; U.S. 2011/0023140; 및 U.S. 2005/0153317을 참조한다. 동물 라인은 생산 형질, 유형 형질, 작업성 형질, 생식력 형질, 마더링(motherinig) 형질 및 질환 내성 형질로 이루어진 군으로부터 선택되는 형질을 포함할 수 있다. 추가적인 형질은 재조합 유전자 생성물의 발현을 포함한다.
리컴비나제
본 발명의 실시형태는 리컴비나제(예, RecA 단백질, Rad51) 또는 DNA 재조합과 연관된 다른 DNA-결합 단백질과 함께, 표적화된 뉴클레아제 시스템을 투여하는 것을 포함한다. 리컴비나제는 핵산 단편과 필라멘트를 형성하며, 사실상 해당 서열에 실질적으로 상동성인 DNA 서열을 찾기 위해 세포의 DNA를 검색한다. 예를 들어, 리컴비나제는, HDR에 대해 주형으로서 작용하는 핵산 서열과 조합될 수 있다. 그런 다음, 리컴비나제는 HDR 주형과 조합되어 필라멘트를 형성하며, 세포 내로 위치된다. 리컴비나제, 및/또는 리컴비나제와 조합되는 HDR 주형은 세포 또는 배아에 단백질 또는 mRNA로서 위치되거나, 리컴비나제를 인코딩하는 벡터와 함께 위치될 수 있다. U.S. 2011/0059160(미국 특허 출원 12/869,232)의 개시내용은 모든 목적을 위해 본원에 원용에 의해 포함되며; 상충하는 경우, 본 명세서가 좌우한다. 리컴비나제라는 용어는, 세포에서 2개의 상대적으로 더 긴 DNA 가닥들 사이에 상대적으로 짧은 DNA 조각을 접합시키는 것을 효소적으로 촉매하는 유전자 재조합 효소를 지칭한다. 리컴비나제로는, Cre 리컴비나제, Hin 리컴비나제, RecA, RAD51, Cre 및 FLP가 있다. Cre 리컴비나제는 loxP 부위들 사이에서 DNA의 부위-특이적인 재조합을 촉매하는 PI 박테리오파지 유래의 유형 I 토포이소머라제이다. Hin 리컴비나제는 살모넬라 박테리아에서 발견되는 198개의 아미노산으로 이루어진 21 kD 단백질이다. Hin은 DNA 인버타제(invertase)의 세린 리컴비나제 패밀리에 속하며, 여기서, 이는 DNA 절단 및 재조합을 개시하기 위해 활성 부위 세린에 의존한다. RAD51은 인간 유전자이다. 이 유전자에 의해 인코딩되는 단백질은 DNA 이중 가닥 절단의 복구에 일조하는 RAD51 단백질 패밀리의 구성원이다. RAD51 패밀리 구성원은 박테리아의 RecA 및 효모의 Rad51에 상동성이다. Cre 리컴비나제는, loxP 부위의 측면에 존재하는 특이적인 서열을 결실시키기 위해 실험에 사용되는 효소이다. FLP는 빵 효모인 사카로마이세스 세레비시애(Saccharomyces cerevisiae)의 2μ 플라스미드 유래의 플리파제 재조합 효소(Flippase recombination enzyme; FLP 또는 Flp)를 지칭한다.
본원에서, "RecA" 또는 "RecA 단백질"은 동일한 기능, 특히: (i) 후속적으로 DNA 폴리머라제에 의한 신장을 위해, 상동성 표적 상에 올리고뉴클레오타이드 또는 폴리뉴클레오타이드를 적절하게 위치시키는 능력; (ii) DNA 합성을 위한 듀플렉스 핵산을 위상학적으로(topologically) 제조하는 능력; 및 (iii) 효율적으로 상보적 서열을 찾아 이에 결합하는 RecA/올리고뉴클레오타이드 또는 RecA/폴리뉴클레오타이드 복합체의 능력을 본질적으로 모두 또는 대부분 가진 RecA-유사 재조합 단백질 패밀리를 지칭한다. 최상으로 특징화된 RecA 단백질은 이. 콜라이(E. coli) 유래이며; 단백질의 오리지널 대립 형태 외에도, RecA803와 같은 다수의 돌연변이체 RecA-유사 단백질들이 동정되어 왔다. 나아가, 예를 들어, 효모, 초파리, 인간을 비롯한 포유류 및 식물을 포함한 많은 유기체들이 RecA-유사 가닥-트랜스퍼 단백질을 가지고 있다. 이들 단백질로는, 예를 들어, Ree1, Rec2, Rad51, Rad51B, Rad51C, Rad51D, Rad51E, XRCC2 및 DMC1이 있다. 재조합 단백질의 일 실시형태는 이. 콜라이의 RecA 단백질이다. 대안적으로, RecA 단백질은 이. 콜라이의 돌연변이체 RecA-803 단백질, 또 다른 박테리아 공급원 유래의 RecA 단백질 또는 또 다른 유기체 유래의 상동성 재조합 단백질일 수 있다.
조성물 및
키트
본 발명은 또한, 예를 들어, 부위-특이적인 엔도뉴클레아제, CRISPR, Cas9, ZNF, TALEN, RecA-gal4 융합, 이들의 폴리펩타이드를 인코딩하는 핵산 분자, 이러한 핵산 분자 또는 폴리펩타이드를 함유하는 조성물, 또는 조작된 세포주를 함유하는 조성물 및 키트를 제공한다. 지시된 대립유전자의 유전자이입에 효과적인 HDR이 또한, 제공될 수 있다. 이러한 물품(item)들은 예를 들어, 연구 툴로서 사용되거나 치료학적으로 사용될 수 있다.
실시예
방법은 다르게 언급되지 않는 한, 하기와 같다.
조직 배양 및 형질감염
37℃, 5% CO2에서, 10% 태아 소 혈청, 100 I.U./ml 페니실린 및 스트렙토마이신, 및 2 mM L-글루타민이 보충된 DMEM에서 돼지를 유지시켰다. 형질감염을 위해, 모든 TALEN 및 HDR 주형들을, NEON 형질감염 시스템(Life Technologies)을 사용하여 형질감염을 통해 전달하였다. 간략하게는, 100% 포화도(confluence)에 도달한 계대배양 수가 낮은 오싸보, 랜드레이스(Ossabaw, Landrace)를 1:2로 분할하고, 다음날 70% 내지 80% 포화도에서 수집하였다. 각각의 형질감염물은 TALEN mRNA 및 올리고와 혼합된 "R" 완충제에 현탁화된 500,000개 내지 600,000개 세포로 이루어졌으며, 하기 파라미터들에 의해 100 ㎕의 작동 부피를 제공하는 100 ㎕ 팁을 사용하여 전기천공하였다: 입력 전압; 1800 V; 펄스 폭; 20 ms; 및 펄스 수; 1. 전형적으로, 관심 유전자에 특이적인 1 ㎍ 내지 2 ㎍의 TALEN mRNA 및 1 μM 내지 4 μM의 HDR 주형(단일 가닥 올리고뉴클레오타이드)을 각각의 형질감염물에 포함시켰다. 이들 양으로부터의 편차는 도면 및 범례에 나타나 있다. 형질감염 후, 세포를 6-웰 디쉬에서 3일 동안 평판배양하고, 30℃에서 배양하였다. 3일 후, 세포 집단을 콜로니 분석을 위해 평판배양하고/거나 편집물의 안정성을 평가하기 위해 적어도 제10일까지 37℃에서 증식시켰다.
서베이어 돌연변이 검출 및 RFLP 분석.
의도되는 부위의 측면에서 PCR을, PLATINUM Taq DNA 폴리머라제 HiFi(Life Technologies)를 제조업체의 권고에 따라 사용하여 1 ㎕의 세포 용해물을 사용하여 수행하였다. 집단 내 돌연변이의 빈도를 상기 기술된 바와 같이, 서베이어 돌연변이 검출 키트(Transgenomic)를 제조업체의 권고에 따라 사용하여 10 ㎕의 PCR 생성물을 사용하여 분석하였다. 지시된 제한효소를 사용하여 10 ㎕의 상기 PCR 반응물 상에서 RFLP 분석을 수행하였다. 서베이어 및 RFLP 반응을 10% TBE 폴리아크릴아미드 겔 상에서 분석하고(resolve), 에티듐 브로마이드 염색에 의해 시각화하였다. 밴드의 밀도계측 측정을 IMAGEJ를 사용하여 수행하였고; 서베이어 반응의 돌연변이 비율을 문헌[Guschin et al., 2010(1)]에 기술된 바와 같이 계산하였다. 상동성 표적 복구(HDR)의 백분율을, RFLP 단편의 총 강도를 부모 밴드 + RFLP 단편의 총 강도로 나누어서 계산하였다. PCR 생성물을 1X MYTAQ RED MIX(Bioline)에 의해 증폭시키고 2.5% 아가로스 겔 상에서 분석하는 점을 제외하고는, 콜로니의 RFLP 분석을 유사하게 시험하였다.
희석
클로닝
.
형질감염 후 3일째에, 50개 내지 250개의 세포를 10 cm 디쉬에 접종하고, 개별 콜로니의 직경이 약 5 mm에 도달할 때까지 배양하였다. 이때, PBS에서 1:5 (vol/vol)로 희석된 TRYPLE(Life Technologies) 6 ml을 첨가하고, 콜로니를 흡인하고, 24-웰 디쉬의 웰에 트랜스퍼한 다음, 동일한 조건 하에 배양하였다. 포화도에 도달한 콜로니를 수합하고, 동결보존 및 유전형분석을 위해 분리하였다.
검체 준비.
제3일 및 제10일에 형질감염된 세포 집단을 6-웰 디쉬의 웰로부터 수합하고, 10% 내지 30%를 50 ㎕의 1X PCR 상용성 용해 완충제에 재현탁하였다: 200 ㎍/ml 프로테이나제 K가 새로 보충된 10 mM Tris-Cl pH 8.0, 2 mM EDTA, 0.45% TRYTON X-100(vol/vol), 0.45% TWEEN-20(vol/vol). 용해물을 하기 프로그램을 사용하여 서멀 사이클러(thermal cycler)에서 가공하였다: 55℃에서 60분, 95℃에서 15분. 희석 클로닝으로부터의 콜로니 검체를 20 ㎕ 내지 30 ㎕의 용해 완충제를 사용하여 상기와 같이 처리하였다.
실시예 1 멀티플렉스 유전자 편집
돼지 RAG2 및 IL2Rγ에 대한 TALEN mRNA 및 HDR 주형의 6개 조건들을 돼지 섬유아세포 내로 공동-형질감염시켰다. 고정된 양의 RAG2 mRNA 및 주형을 각각의 형질감염에 사용하였으며, 반면, IL2Rg TALEN mRNA 및 HDR 주형의 양을 지시된 바와 같이 각각의 조건에 대해 변경시킨다. TALEN mRNA 및 HDR 주형의 용량은 온 표적 효과 및 오프 표적 효과를 둘 다 가진다. IL2Rγ에 대한 TALEN mRNA의 증가는 IL2Rγ에 대한 NHEJ 및 HDR을 둘 다 증가시켰으며, 한편, RAG2에 대한 NHEJ 수준은 변하지 않았다. IL2Rγ HDR 주형의 증가는 RAG2 유전자좌에서 HDR을 감소시켰으며, 이는 올리고뉴클레오타이드의 농도 상승에 의한 상동성 표적 복구의 비-특이적인 저해를 제시한다. RAG2 및 IL2Rγ에서 바이-대립유전자 HDR을 가진 콜로니를 2개의 조건들로부터 4% 및 2%에서 수득하였으며(도 3 패널 c, 패널 d), 이는 2%의 예상된 빈도 이상이다. 예상된 빈도는, 각각의 HDR 대립유전자를 독립적인 사건으로서 취급하는 제3일의 HDR 수준의 곱에 의해 계산된다. 도 3의 돼지 RAG2 및 IL2Rγ의 멀티플렉스 유전자 편집을 참조로 한다. a) 형질감염 후 3일째에 세포 집단에서 비-상동성 말단 접합(NHEJ) 및 상동성 의존적 복구 HDR의 효율을 확인하기 위한 서베이어 및 RFLP 분석. b) 형질감염 후 11일째에 세포 집단에서 상동성 의존적 복구에 대한 RFLP 분석. c) IL2Rγ , RAG2 또는 둘 다에서 HDR에 양성인 콜로니의 백분율. 세포를 패널 a에서 "C"로 지시된 집단으로부터 평판배양하였다. 콜로니 유전자형의 분포를 하기와 같이 나타낸다. d) IL2Rγ 및 RAG2에 대해 2 ㎍ 및 1 ㎍의 TALEN mRNA, 및 각각에 대해 1 μM의 HDR 주형으로 형질감염시킨 세포로부터의 콜로니 분석. 콜로니 유전자형의 분포는 하기에 나타나 있다.
실시예 2 멀티플렉스 유전자 편집
돼지 APC 및 p53에 대한 TALEN mRNA 및 HDR 주형의 4개 조건들을 돼지 섬유아세포 내로 공동-형질감염시켰다. APC mRNA의 양을 좌측으로부터 우측까지 순차적으로 감소시켰으며(도 4 패널 b); 나머지 양들은 지시된 바와 같이 일정하게 유지시켰다. HDR 백분율은 APC mRNA가 감소함에 따라 선형 방식으로 감소하였다. APC TALEN의 용량이 변경되어도, p53 HDR에는 효과가 거의 없었다. 콜로니의 유전자형 분석은 제11일의 값과 비교하여 APC 및 p53 둘 다에서 HDR 대립유전자를 가진 콜로니의 예상된 유니온(union)보다 더 높게 나타났으며; 각각 도 4의 패널 c 및 도 4의 패널 d에서 18% 및 20% 대(versus) 13.7% alc 7.1%였다. 도 4의 돼지 APC 및 p53의 멀티플렉스 유전자 편집을 참조로 한다. a) 형질감염 후 3일째에 세포 집단에서 비-상동성 말단 접합(NHEJ) 및 상동성 의존적 복구 HDR의 효율을 확인하기 위한 서베이어 및 RFLP 분석. b) 형질감염 후 11일째에 세포 집단에서 상동성 의존적 복구에 대한 RFLP 분석. 패널 c) 및 d) APC, p53 또는 둘 다에서 HDR에 대한, 지시된 세포 집단 유래의 양성 콜로니의 백분율(패널 a에서, "C" 및 "D"로 표시됨). 3개 이상의 HDR 대립유전자를 가진 콜로니를 하기에 열거한다.
실시예 3 적어도 3개의 유전자를 가진 멀티플렉스
실시예 1에서, HDR의 비-특이적인 감소를 고농도의 HDR 올리고에서 관찰하였으며, 따라서, 2+ HDR 올리고가 HDR의 비-특이적인 저해 없이도 효과적일 수 있었는지는 알려지지 않았다. 각각의 표적 부위에 대해 1 μM 및 2 μM이라는 2개의 농도를 시험하였다. TALEN 활성은 2개의 조건들 사이에서 유의미하게 변경되지 않았으며, 한편, HDR은 각각의 주형에 대해 2 μM 농도에서 상당히 블런트(blunt)되었다. 1 μM 조건 유래의 콜로니는 다양한 유전자형들을 가졌으며, 이들 중 일부는 각각의 유전자에 편집물을 가졌으며 7개 이하의 대립유전자를 가졌다(도 6). 독립적인 사건으로 취급되는 경우, 7개의 대립유전자가 편집된 경우 "a"로 표시된 유전자형의 예상된 빈도는 0.001%이다. 이항식(binomial) 분포는 72라는 검체 크기에서 이러한 유전자형의 2+ 콜로니를 동정하는 가능성을 예측하며, 본원에서 수행된 바와 같이, 0.000026% 미만이다. 이러한 높은 성공율은 예측될 수 없었으며, 예상치 못해서 놀라운 것이다. 이러한 결과는 TALEN/HDR 주형의 2개의 첨가 조합을 사용하여 반복되었다(도 7 및 도 8). 제1 시도의 결과에서, 7개 이하의 대립유전자 및 4개 이하의 유전자에서 HDR 편집물을 가진 콜로니를 수득하였다(표 A). 몇몇 유전자형들은 우연하게 예상되는 것보다 훨씬 더 큰 빈도로 회수되었다. 몇몇 유전자좌들에서 이중 가닥을 동시에 절단하는 것에 관한 염려가 의도되지 않은 염색체 재배열을 유도하긴 하지만, 제3 시도의 세포로부터 시험된 50개의 핵형 중 50개는 정상이었다(데이터는 도시되지 않음).
도 5를 참조로 하여: 5-유전자 멀티플렉스 HDR 효율에 미치는 올리고뉴클레오타이드 HDR 주형 농도의 효과. 돼지 RAG2 , IL2Rg , p53, APC 및 LDLR에 대한 지시된 양의 TALEN mRNA를 2 μM(패널 a) 또는 1 μM(패널 b)의 각각의 동족 HDR 주형과 함께 돼지의 섬유아세포 내로 공동-형질감염시켰다. NHEJ 및 HDR의 백분율을 서베이어 및 RFLP 검정에 의해 계산하였다. 도 6을 참조로 하여: 5-유전자 멀티플렉스 HDR로부터의 콜로니 유전자형. 콜로니 유전자형을 RFLP 분석에 의해 평가하였다. 패널 a) 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형이 동정될 수 있었다; 이형접합 또는 동형접합 HDR의 예상된 RELP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 시프트를 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율을 각각의 컬럼 하단에 나타낸다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 수의 기록(tally)이다. 도 7을 참조로 하여: 제2의 5-유전자 멀티플렉스 시도의 콜로니 유전자형. 패널 a)에서, 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형이 동정될 수 있었다; 이형접합 또는 동형접합 HDR의 예상된 RELP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 시프트를 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율을 각각의 컬럼 하단에 나타낸다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 수의 기록이다. 도 8을 참조로 하여: 제3의 5-유전자 멀티플렉스 시도의 콜로니 유전자형. 패널 a)에서, 각각의 라인은 각각의 명시된 유전자좌에서 하나의 콜로니의 유전자형을 나타낸다. 3개의 유전자형이 동정될 수 있었다; 이형접합 또는 동형접합 HDR의 예상된 RELP 유전자형을 가진 것들뿐만 아니라 RFLP 양성 단편을 가진 것들, + 삽입 또는 결실(indel) 대립유전자를 가리키는 가시적인 크기 시프트를 가진 제2 대립유전자. 명시된 유전자좌에서 편집물을 가진 콜로니의 백분율을 각각의 컬럼 하단에 나타낸다. 패널 b)는 0개 내지 5개의 유전자좌에서 편집된 콜로니의 수의 기록이다.
실시예 4A 내지 실시예 4DD
실시예 4A: 멀티플렉스 유전자 편집에 의한 RAG2 / IL2Rg 널(RG-KO) 돼지 섬유아세포의 발달
수컷 돼지 태아 섬유아세포를, 발명자들의 이전에 정의된 방법을 사용하여 RAG2 및 IL2Rg의 교란을 위해 TALEN 및 올리고뉴클레오타이드 주형으로 형질감염시킬 것이다(문헌[Tan, W., et al., Efficient nonmeiotic allele introgression in livestock using custom endonucleases. PNAS, 110(41):16526-16531, 2013]). RG-KO 후보를, 시퀀싱에 의해 확인되는 바와 같이 예를 들어 제한효소 길이 다형성(RFLP)에 의해 동정할 것이다. 적어도 약 5개의 입증된 RG-KO 콜로니를 클로닝 및 키메라 생성을 위한 자원으로서 풀링(pooling)할 것이다.
실시예
4B:
RG
-KO 숙주
배반포를
사용한
키메라
배아의 생산
숙주 RG-KO 배아 및 암컷 EGFP-표지 공여자 세포를 염색질 트랜스퍼 기술을 사용하여 생산할 것이며, 이후, 시험관내에서 배반포 단계까지 배양할 것이다. 실시예 1의 RG-KO 세포를 사용할 수 있다. EGFP 배반포 유래의 제7일의 인터 셀 매스 덩어리(inter cell mass clump)를 제6일의 RG-KO 배아에 주사할 것이며, 이후, 동시통합된 암퇘지(synchronized sow)에 배아를 트랜스퍼할 것이다. 이러한 접근법을 사용하여, Nagashima 및 동료들은 출생된 새끼돼지들 중 50% 초과에서 키메라를 관찰하였다(문헌[Nagashima, H., et al., Sex differentiation and germ cell production in chimeric pigs produced by inner cell mass injection into blastocysts. Biol Reprod, 70(3):702-707, 2004]). 수컷 표현형은 마우스 및 돼지 둘 다에 대해 주사 키메라에서 우성이다. 따라서, 암컷 공여자 세포가 주사된 XY RG-KO 숙주는 수컷 숙주의 유전적 특성을 독점적으로 전달할 것이다. 임신 체크를 적절한 때, 예를 들어 제25일, 제50일 및 제100일에 수행할 것이다. 임신 후 약 100일째에 임신한 암퇘지를 매일 4회 모니터링할 것이며, 이후, 약 제114일까지 새끼돼지의 C-섹션 유도(C-section derivation)를 모니터링할 것이다.
실시예
4C: 비-
키메라
자손에서 T 세포, B 세포 및
NK
세포가 결핍되어 있는지 확인한다.
비-키메라 자손은 이들에서 T 세포, B 세포 및 NK 세포가 결핍되어 있는지 확인하기 위해 시험될 것이다. 하기 과정은 이를 위한 하나의 기술이다. C-섹션 유도는 추정상 키메라를 가진 각각의 암퇘지 및 야생형 새끼돼지를 가진 하나의 사육된 암퇘지 상에서 수행될 것이다. C-섹션 유도 직후, 제대혈을 각각의 새끼돼지로부터 단리할 것이다. 제대혈 백혈구를 T 세포, B 세포 및 NK 세포뿐만 아니라 공여자 유래 EGFP 발현에 대해, 형광-활성화된 세포 소팅(FACS)에 의해 평가할 것이다. 또한, 제대혈, 귀 및 꼬리 생검의 PCR에 의해 키메라 현상을 평가할 것이다. 비-키메라 새끼돼지를 밀접하게 모니터링하고 감염 징후 시 인도적으로 안락사시킬 수 있기 위해, 이러한 초기 분석을 생후 6시간 이내에 완료할 것이다. 비-키메라 동물의 일부 또는 면역 세포가 결핍된 것들은 부검을 위해 안락사시킬 것이다.
실시예 4D: 키메라 돼지를 동정하고, T 세포, B 세포 및 NK 세포의 기원을 확인한다.
키메라 돼지를 시험하여, T 세포, B 세포 및 NK 세포의 기원을 확인할 것이다. 하기 과정은 이를 위한 하나의 기술이다. 키메라 새끼돼지를 상기 방법을 사용하여 동정할 것이다. 순환중인 림프구 및 혈청의 면역글로불린을 매주 평가하여, 2개월에 걸쳐 키메라 새끼돼지, 비-키메라 새끼돼지 및 야생형 새끼돼지 사이에서 비교할 것이다. 소팅된 T 세포, B 세포 및 NK 세포의 집단에 대해 EGFP 발현을 평가하고 미소부수체(microsatellite) 분석을 수행하여, 공여자 기원을 확인할 것이다. 검체의 유지 및 키메라 돼지로부터의 정액 수합은 II상 펀딩이 이용가능할때까지 RCI에 의해 지원을 받을 것이다.
실시예 A 내지 실시예 D에 대한 검체 절차:
제대혈 및 말초 혈액
FACS
.
혈액 림프구 및 EGFP 키메라 현상의 평가를 돼지 표본에 대해 적용하여 전술한 바와 같이(2) 수행할 것이다. C-섹션 딜리버리 직후, 각각의 새끼돼지로부터 제대혈을 수합할 것이다. 제대혈의 일부를 가공하고 잠재적인 동종 이식편 처리를 위해 동결보존할 것이며, 한편, 나머지의 제대혈은 림프구의 FACS 분석에 사용할 것이다. 말초 혈액 검체를 표준 방법에 의해 2주령, 4주령, 6주령 및 8주령에서 수합할 것이다. RBS를 제거할 것이며, 대략 1-2E+5개의 세포를 튜브에 분배할 것이다. 분취물을 T 세포(CD4 및 CD8), B 세포(CD45RA ad CD3), NK 세포(CD 16 및 CD3) 및 골수성 세포(CD3)의 동정을 위해 항-돼지 항체로 표지할 것이다. 항원 발현을 LS RII 유세포분석기(BD Biosciences) 상에서 정량화할 것이다. 형광단을 조심스럽게 선별하여, 표면 항원과 함께 공여자 유래 EGFP 세포의 멀티플렉스 평가를 할 수 있다. 비장 유래의 단일 세포 현탁액을 동일한 방법에 의해 분석할 것이다.
검사
모든 주요 기관 및 조직들을 적절한 해부학적 발달에 대해 총괄적으로 검사할 것이며, 췌장, 간, 심장, 신장, 폐, 위장, 면역계(말초 림프절 및 점막 림프절 및 비장) 및 CNS를 비롯한 모든 주요 기관 및 조직들 유래의 적절한 검체들을 DNA 단리를 위해 수합할 것이다. FACS 분석을 위해 단일 세포 현탁액을 비장으로부터 제조할 것이다. 조직학적 검사를 위해 조직을 준비하여, 키메라 현상, 키메라 상태와 연관될 수 있는 임의의 변경, 및 임의의 기저 질환의 존재에 대해 추가로 평가할 것이다.
키메라
현상의 평가
EGFP 이식유전자에 특이적인 프라이머를 사용하여 제대혈, 귀 및 꼬리 생검에서 정량적 PCR을 수행하고, 알려진 비율의 EGFP : 야생형 세포의 표준 곡선과 비교할 것이다. 표본을 또한, 전술한 RFLP 검정을 통해 RG-KO 대립유전자에 대해 평가할 것이다. 부검 동안에 전체 동물 및 기관 상에서 EGFP+ 세포의 이식(engraftment)을 거시적으로 평가할 것이다. 주요 기관 유래의 조직을 EGFP 면역조직화학을 위해 박절하고, DAPI(4',6-다이아미디노-2-페닐인돌)로 대조염색하여, 공여자 : 숙주 세포의 비율을 확인할 것이다.
미소부수체
분석.
본 발명자들의 실험실에서 일상적으로 사용되는 것으로부터 숙주 및 공여자 유전 특성에 대한 정보적인 미소부수체에 대해 동물을 스크리닝할 것이다. 조직 및 혈액 유래의 검체(소팅된 림프구 또는 골수성 계통, EGFP 양성 및 음성)를 평가할 것이다. 공여자 대 숙주 세포의 상대적인 양을 MISEQ 장비(Illumina) 상에서 멀티플렉스드 앰플리콘 시퀀싱에 의해 평가할 것이다.
동물.
제대혈 및 말초 혈액에 T 세포, B 세포 및 NK 세포를 포함하지 않는 비-키메라 돼지를 제조할 것이다. 키메라 돼지는 거의 야생형 수준과 실질적으로 유사한 수준을 가질 것이다. 더욱이, T 세포, B 세포 및 NK 세포 양성 키메라는 실질적으로 정상적인 면역 기능을 가질 것이며, 표준 조건에서 사육 시 건강을 유지할 것이다.
실시예 5 CRISPR/Cas9 디자인 및 생성
유전자 특이적인 gRNA 서열을 Church lab gRNA 벡터(Addgene ID: 41824) 내로 이들의 방법에 따라 클로닝하였다. Cas9 뉴클레아제를, RCIScript-hCas9로부터 합성된 mRNA 또는 hCas9 플라스미드(Addgene ID: 41815)의 공동-형질감염에 의해 제공하였다. hCas9 플라스미드(hCas9 cDNA를 포함함) 유래의 Xbal-Agel 단편을 RCIScript 플라스미드 내로 서브클로닝하여, 이러한 RCIScript-hCas9를 구축하였다. mRNA의 합성을, 선형화를 KpnI을 사용하여 수행하는 점을 제외하고는, 상기와 같이 수행하였다.
실시예 6 표적화된 엔도뉴클레아제 및 HDR을 사용한 멀티플렉스 유전자 편집. 패널 (a)는 멀티플렉스 실험(음영을 교대로 함으로써 표시된 cDNA-엑손으로서 도시됨)에서 각각의 유전자의 도식이며, TALENS에 의해 표적화된 부위가 나타나 있다. 각각의 유전자에 대한 DNA 결합 도메인을 코딩하는 서열은 하기에 나타나 있다. 돼지 섬유아세포를, 각각의 유전자를 표적화하는 1 ㎍의 각각의 TALEN mRNA 및 0.1 nMol의 각각의 HDR 올리고(도 12 패널 b)를 사용하여 공동-형질감염시키고, 이들은 유전자형 분석을 위한 미성숙 종결 코돈뿐만 아니라 신규 HindIII RFLP 부위를 삽입하도록 디자인되었다. 총 384개의 콜로니를 유전자형 분석을 위해 단리하였다. GATA4 및 Nkx2-5 RFLP 검정을 수행하고(도 12 패널 c), MESP1을 시퀀싱에 의해 평가하였다(도시되지 않음). 2개의 콜로니(2/384, 0.52%)는 모든 3개의 유전자들에 대해 동형접합 HDR 넉아웃이었다. 트리플 넉아웃을 별표로 표지하였다(도 12 패널 c). 부가적인 유전자형을 패널 c에서 관찰할 수 있으며, 예를 들어, 콜로니 49는 HDR 편집물을 포함하지 않으며; 콜로니 52 및 콜로니 63은 NKX2-5에 대해 이형접합 편집물이었으며; 콜로니 59는 NKX2-5 및 GATA4 둘 다에 대해 이형접합 편집물이었다.
실시예 7 TALEN과 RGEN의 조합을 사용한 멀티플렉스 유전자-편집. 도 13을 참조한다. 돼지 섬유아세포를, 각각의 유전자에 대한 TALENS(1 ㎍ EIF4G 14.1 mRNA) + Cas9/CRISPR 성분(2 ㎍ Cas9 mRNA + 2 ㎍ p65 G1s 가이드 RNA) 및 02 nMol의 HDR 올리고로 공동-형질감염시켰다. 형질감염된 세포를 2개 부위 모두에서 HDR을 보여주는 RFLP 검정에 의해 평가하였다. 콜로니 단리를 위해 이러한 집단 유래의 세포를 평판배양할 것이며, 2개의 유전자 모두에서 편집물을 가진 단리물을 동정한다.
추가적인 개시내용
본원에서 인용되는 특허, 특허 출원, 공개공보 및 논문들은 원용에 의해 본 명세서에 포함되며; 상충하는 경우, 본 명세서가 좌우한다. 실시형태는 다양한 특징들을 가지며; 이러한 특징들은 기능적인 실시형태를 형성하기 위한 필요성에 따라 혼합 및 매칭될 수 있다. 주제 및 소주제는 편의상 제공되나, 실질적인 것이 아니며, 기술된 본 발명의 범위를 제한하지 않는다. 하기 숫자가 매겨진 서술들은 본 발명의 실시형태를 제시한다:
1A. 척추동물 세포 또는 배아 내 복수의 표적 염색체 DNA 부위에서 유전자 편집물을 제조하는 방법으로서,
제1 표적 염색체 DNA 부위에 관한 제1 표적화된 엔도뉴클레아제, 및 제1 표적 부위 서열에 상동성인 제1 상동성 표적 복구(HDR) 주형; 및
제2 표적 염색체 DNA 부위에 관한 제2 표적화된 엔도뉴클레아제, 및 제2 표적 부위 서열에 상동성인 제2 HDR 주형
을 척추동물 세포 또는 배아 내로 도입하는 단계를 포함하며,
제1 HDR 주형 서열은 제1 표적 부위에서 본래의 염색체 DNA 서열을 대체하고, 제2 HDR 주형 서열은 제2 표적 부위 서열에서 본래의 염색체 DNA 서열을 대체하는, 방법.
1B. 동물의 복수의 대립유전자를 편집하는 방법으로서,
각각이 상이한 대립유전자 유전자좌를 표적으로 하는 복수의 표적화된 뉴클레아제, 및 각각의 표적화된 대립유전자 유전자좌에 대한 상동성 표적 복구 주형을 원발성 가축 세포 또는 가축 배아 내로 도입하는 단계를 포함하며,
표적화된 엔도뉴클레아제는 복수의 표적화된 엔도뉴클레아제 각각과 동족인 대립유전자 유전자좌에 이중 가닥 절단을 형성하며, 세포는 각각의 HDR 주형과 동족인 유전자좌 내로 상동성 표적 복구(HDR) 주형 핵산 서열을 복사하여, 대립유전자를 편집하는, 방법.
2. 1에 있어서,
제3, 제4, 제5, 제6 및 제7의 표적 염색체 DNA 부위 각각에 대한 제3, 제4, 제5, 제6 및 제7의 표적화된 엔도뉴클레아제, 및
제3, 제4, 제5, 제6 및 제7의 표적 염색체 DNA 부위 각각에 상동성인 제3, 제4, 제5, 제6 및 제7의 HDR 주형
중 하나 이상을 세포 또는 배아 내로 도입하는 단계를 추가로 포함하는, 방법.
3. 1 또는 2에 있어서,
표적화된 엔도뉴클레아제가 TALEN을 포함하는, 방법.
4. 1 내지 3 중 어느 하나에 있어서,
표적화된 엔도뉴클레아제가 아연 핑거 뉴클레아제 또는 Cas9을 포함하는 방법.
5. 1 내지 3 중 어느 하나에 있어서,
적어도 제1 표적 염색체 DNA 부위가 대립유전자에 대한 유전자좌인, 방법.
6. 5에 있어서,
적어도 하나의 상기 HDR 주형이 이러한 주형과 동족인 DNA 표적 부위의 넉아웃을 인코딩하는, 방법.
7. 5에 있어서,
적어도 하나의 상기 HDR 주형이 이러한 주형과 동족인 DNA 표적 부위에서 대립유전자의 대체를 위한 외인성 대립유전자를 인코딩하는, 방법.
8. 1에 있어서,
세포 또는 배아가 제1 종 또는 제1 품종의 가축이고,
복수의 편집물들이 제2 종 또는 제2 품종의 동물 유래의 외인성 대립유전자로의 본래의 대립유전자의 대체를 포함하는, 방법.
9. 1에 있어서,
동물이, 본래의 대립유전자 중 적어도 3개가 제2 품종 또는 또 다른 종의 상응하는 외인성 대립유전자로 대체된 제1 품종의 동물이며,
상기 외인성 대립유전자가, 감수분열 재조합 없이, 상응하는 본래의 대립유전자의 대체이고,
동물이 외인성 마커 유전자를 포함하지 않는, 방법.
10. 2에 있어서,
적어도 3개, 4개, 5개, 6개 또는 7개의 표적 염색체 DNA 부위가 각각, 상이한 대립유전자에 대한 유전자좌인, 방법.
11. 10에 있어서,
하나 이상의 HDR 주형이 이러한 주형과 동족인 DNA 표적 부위의 넉아웃을 인코딩하는, 방법.
12. 10에 있어서,
적어도 하나의 상기 HDR 주형이 이러한 주형과 동족인 DNA 표적 부위에서 대립유전자의 대체를 위한 외인성 대립유전자를 인코딩하는, 방법.
13. 1 내지 12 중 어느 하나에 있어서,
세포 또는 배아가 표적 DNA 부위에서 복수의 유전자 편집에 대해 동형접합이고,
상기 편집물이 상기 표적 DNA 부위와 동족인 HDR 주형에 의해 인코딩되는, 방법.
14. 1 내지 12 중 어느 하나에 있어서,
세포 또는 배아가 표적 DNA 부위에서 복수의 유전자 편집에 대해 이형접합이고,
상기 편집물이 상기 표적 DNA 부위와 동족인 HDR 주형에 의해 인코딩되는, 방법.
15. 11 내지 14 중 어느 하나에 있어서,
유전자 편집이 넉아웃, 또는 또 다른 품종의 동물 또는 또 다른 종의 동물 유래의 대립유전자의 유전자이입을 포함하는, 방법.
16. 11 내지 14 중 어느 하나에 있어서,
세포 또는 배아가 제1 종 또는 제1 품종의 가축이고,
복수의 편집물들이 제2 종 또는 제2 품종의 동물 유래의 외인성 대립유전자로의 본래의 대립유전자의 대체를 포함하는, 방법.
17. 16에 있어서,
외인성 대립유전자의 DNA 서열과 본래의 대립유전자의 DNA 서열이 하나 이상의 위치에서 상이하며,
외인성 대립유전자로의 본래의 대립유전자의 대체가, 상기 위치들에 걸친 정렬에 의해 측정되는 바와 같이, 세포 또는 배아의 염색체 DNA 서열을, 상기 위치들 중 임의의 위치의 각각의 면 상의 적어도 200개의 염기쌍(bp)의 거리만큼 제2 품종의 동물 또는 제2 종과 일치시키는, 방법.
18. 17에 있어서,
거리가 200 bp 내지 2000 bp의 수인, 방법.
19. 1 내지 17 중 어느 하나에 있어서,
세포 또는 배아가 표적 DNA 부위에서 복수의 유전자 편집에 대해 동형접합이고,
상기 편집물이 상기 표적 DNA 부위와 동족인 HDR 주형에 의해 인코딩되는, 방법.
20. 1 내지 17 중 어느 하나에 있어서,
세포 또는 배아가 표적 DNA 부위에서 복수의 유전자 편집에 대해 이형접합이고,
상기 편집물이 상기 표적 DNA 부위와 동족인 HDR 주형에 의해 인코딩되는, 방법.
21. 1 내지 20 중 어느 하나에 있어서,
세포 또는 배아가 대형 척추동물, 가축, 시미안(simian), 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류로 이루어진 군으로부터 선택되는, 방법.
22. 1 내지 21 중 어느 하나에 있어서,
세포가 접합자, 줄기세포, 성인 줄기세포, 만능 세포, 전구 세포 및 원발성 세포로 이루어진 군으로부터 선택되는, 방법.
23. 1 내지 21 중 어느 하나에 있어서,
배아가 접합자, 배반포, 상실배이거나, 1개 내지 200개의 세포수를 가진 것인, 방법.
24. 1 내지 23 중 어느 하나에 있어서,
하나 이상의 엔도뉴클레아제 및/또는 하나 이상의 HDR 주형을 인코딩하는 mRNA를 도입하는 단계를 포함하는, 방법.
25. 1 내지 24 중 어느 하나에 있어서,
하나 이상의 엔도뉴클레아제가 단백질로서 세포 또는 배아 내로 도입되는, 방법.
26. 1 내지 25 중 어느 하나에 있어서,
엔도뉴클레아제 중 하나 이상(예, 각각)이 mRNA로서 제공되며, 0.1 ng/ml 내지 100 ng/ml의 농도를 가진 용액으로부터 세포 또는 배아 내로 도입되며;
당업자는, 표현적으로 언급된 한계 내의 모든 값들 및 범위들, 예를 들어 약 20, 약 1 내지 약 20, 약 0.5 내지 약 50 등이 고려됨을 즉시 이해할 것이고; 및/또는
HDR 주형 중 하나 이상(예, 각각)이 mRNA로서 제공되며, 약 0.2 μM 내지 약 20 μM의 농도를 가진 용액으로부터 세포 또는 배아 내로 도입되는, 방법.
27. 1 내지 26 중 어느 하나에 있어서,
엔도뉴클레아제 및/또는 HDR 주형의 도입을 위해 전기천공을 포함하는, 방법.
28. 1 내지 27 중 어느 하나에 있어서,
엔도뉴클레아제 및/또는 HDR이 화학-기재 방법, 비-화학적 방법, 입자-기재 방법 및 바이러스 방법으로 이루어진 군으로부터 선택되는 과정에 의해 도입되는, 방법.
29. 13 내지 28 중 어느 하나에 있어서,
하나 이상의 벡터를 세포 또는 배아 내로 도입하여, 엔도뉴클레아제 및/또는 HDR 주형을 발현시키는 방법.
30. 1 내지 29 중 어느 하나에 있어서,
표적화된 엔도뉴클레아제가 TALEN, CRISPR, 또는 TALEN과 CRISPR의 조합인, 방법.
31. 30에 있어서,
편집물이 유전자 넉아웃인, 방법.
32. 1 내지 31 중 어느 하나에 있어서,
하나 이상의 표적 부위 서열이 하기 목록으로부터 선택되거나,
하나 이상의 외인성 대립유전자 또는 본래의 대립유전자가 하기 목록: IL2Rgy/-, RAG2-/-, IL2Rg -/- ; RAG2 -/- , IL2Rgy/-, RAG2-/-, IL2Rg+/-, RAG2+/-, IL2Rg y/+ ; RAG2 +/- ; IL2Rg +/- ; RAG2 +/- ; DGAT(다이글리세리드 아실트랜스퍼라제), ABCG2(ATP-결합 카세트 서브-패밀리 G 구성원 2), ACAN(아그레칸(aggrecan)), AMELY(아멜로게닌(amelogenin), y-연결), BLG(프로게스타겐-연관 자궁내막 단백질), BMP 1B(FecB)(골 형성 단백질 수용체, 유형 IB), DAZL(무정자증 결실 유사(deleted in azoospermia like)), Eif4GI(진핵 번역 개시 인자 4 감마, 1), GDF8 (성장/분화 인자 8), 혼-폴 유전자좌, IGF2(인슐린-유사 성장 인자 2), CWC15(CWC15 스플라이스오좀(spliceosome) 연관 단백질), KissR/GRP54(키스펩틴(kisspeptin)), OFD1Y(Y-연결 입-얼굴-손발가락 증후군(oral-facial-digital syndrome) 1 슈도유전자), p65(v-rel 망내증 바이러스 종양유전자 호모로그 A), PRLR(프로락틴 수용체), Prmd14(PR 도메인 함유 14), PRNP(프리온 단백질), Rosa, Socs2(사이토카인 신호전달 억제제 2), SRY(Chr Y의 성 결정 영역), ZFY(아연 핑거 단백질, y-연결), β-락토글로불린, callipyg(CLPG), MODY 1(HNF4α)(간세포 핵 인자 4, 알파), MODY 2(GCK)(글루코키나제), MODY 3(HNF1α)(간세포 핵 인자 4, 알파), MODY 4(Pdx1)(췌장 및 십이지장 호메오박스(pancreatic and duodenal homeobox) 1), MODY 5(HNF-1β)(HNF1 호메오박스 B), MODY 6(유로제닉 분화 1), MODY 7(KLF11)(크로펠-유사 인자(Kruppel-like factor) 11), MODY 8(CEL)(카르복실 에스테르 리파제), MODY 9(PAX4)(페어드 박스(paired box) 4), MODY 10(INS)(인슐린), MODY 11(BLK)(BLK 프로토-종양유전자, Src 패밀리 티로신 키나제), APC(선종성 용종증), ApoE(아포지질단백질 E), DMD(디스트로핀 근육 이영양증), GHRHR(성장 호르몬 방출 호르몬 수용체), HR(모발 성장 연관), HSD11B2(하이드록시스테로이드(11-베타) 데하이드로게나제 2), LDLR(저밀도 지질단백질 수용체), NF1(뉴로피브로민(neurofibromin) 1), NPPA(나트륨이뇨 펩타이드 A), NR3C2(핵 수용체 서브패밀리 3, 그룹 C, 구성원 2), p53(세포성 종양 항원 p53-유사), PKD1(다낭성 신장 질환 1), Rbm20(RNA 결합 모티프 단백질 20), SCNN1G(나트륨 채널, 비-전압 게이티드 1 감마 서브유닛), tP53(종양 단백질 p53), FAH(푸마릴아세토아세테이트 하이드롤라제), HBB(헤모글로빈 베타), IL2RG(인터루킨 2 수용체, 감마 사슬), PDX1(췌장 및 십이지장 호메오박스 1), PITX3(페어드-유사 호메오도메인 전사 인자 3), Runx1(runt-관련 전사 인자 1), GGTA(이관능성 세팔로스포린 아실라제/감마-글루타밀트랜스펩티다제), VASA(vasa 단백질), MIWI(piwi-유사 RNA-매개 유전자 침묵 1), PIWI(전사체 CG6122-RA 유래의 CG6122 유전자 생성물), DCAF17(DDB1 및 CUL4 연관 인자 17), VDR(비타민 D 수용체), PNPLA1(파타틴-유사 포스포리파제 도메인 함유 1), HRAS(Harvey 랫 육종 바이러스 종양유전자 호모로그), 텔로머라제-vert, DSP(데스모플라킨(desmoplakin)), SNRPE(작은 핵 리보뉴클레오단백질 폴리펩타이드 E), RPL21(리보좀 단백질), LAMA3(라미닌, 알파 3), UROD(유로포르피리노겐(uroporphyrinogen) 데카르복실라제), EDAR(엑토디스플라신(ectodysplasin)-A 수용체), OFD1(입-얼굴-손발가락 증후군 1), PEX7(퍼옥시조말 생물발생 인자 7), COL3A1(콜라겐, 유형 III, 알파 1), ALOX12B(아라키도네이트 120 리폭시게나제 12R 유형), HLCS(홀로카르복실라제 신서타제(비오틴-(프로프리오닐-CoA-카르복실라제)ATP-가수분해성)) 리가제)), NIPAL4(NIPA-유사 도메인 함유 4), CERS3(세라마이드 신타제 3), ANTXR1(안트락스 톡신 수용체 1), B3GALT6(UDP-Gal:베타GAl 베타 1,3 갈락토실트랜스퍼라제 폴리펩타이드 6), DSG4(데스모글레인 4), UBR1(유비퀴틴 단백질 리가제 E3 성분 n-레코그닌 1), CTC1(CTS 텔로미어 유지 복합체 성분 1), MBTPS2(막-결합 전사 인자 펩티다제, 부위 2), UROS(유로포르피리노겐(uroporphyrinogen) III 신타제), ABHD5(아브하이드롤라제 도메인 함유 5), NOP 10(NOP 10 리보뉴클레오단백질), ALMS1(알스트롱 증후군(Alstrom syndrome) 단백질 1), LAMB3(라미닌, 베타 3), EOGT(EGF 도메인-특이적 O-연결 N-아세틸글루코스아민 (GlcNAc)), SAT1(스퍼민딘(spermindine)/스퍼민(spermine) Nl-아세틸트랜스퍼라제 1), RBPJ(면역글로불린 카파 J 영역에 대한 재조합 신호 결합 단백질), ARHGAP31(Rho GTPase 활성화 단백질 31), ACVR1(액티빈 A 수용체, 유형 I), IKBKG(B-세포에서 카파 경쇄 폴리펩타이드 유전자 인핸서의 저해제, 키나제 감마), LPAR6(리소포스파티드산 수용체 6), HR(모발 성장 연관), ATR(ATR 세린/트레오닌 키나제), HTRA1(HtrA 세린 펩티다제 1), AIRE(자가면역 조절인자), BCS1L(BC1(유비퀴놀-시토크롬 c 리덕타제) 합성-유사), MCCC2(메틸크로토노일-CoA 카르복실라제 2 (베타)), DKC1(선천성 각화부전증(dyskeratosis congenital) 1, 디스케린(dyskerin)), PORCN(포큐파인(porcupine) 호모로그), EBP(에모파밀 결합 단백질(스테롤 이소머라제)), SLITRK1(SLIT 및 NTRK-유사 패밀리, 구성원 1), BTK(부르톤 무감마글로불린혈증 티로신 키나제), DOCK6(세포질분열 데디케이터(dedicator) 6), APCDD1(선종성 용종증 하향-조절 1), ZIP4(아연 수송체 4 전구체), CASR(칼슘-감지 수용체), TERT(텔로머라제 역전사효소), EDARADD(EDAR(엑토디스플라신(ectodysplasin)-A 수용체)-연관 사멸 도메인), ATP6V0A2(ATPase, H+ 수송, 리소좀 V0 서브유닛 a2), PVRL1(폴리오바이러스 수용체-관련 1(헤르페스바이러스 도입 매개인자 C)), MGP(매트릭스 Gla 단백질), KRT85(케라틴 85, 유형 II), RAG2(재조합 활성화 유전자 2), RAG-1(재조합 활성화 유전자 1), ROR2(수용체 티로신 키나제-유사 희귀 수용체 2), CLAUDIN1(클라우딘 7), ABCA12(ATP-결합 카세트, 서브패밀리 A(ABC1), 구성원 12), SLA-DRA1(MHC 클래스 II DR-알파), B4GALT7(자일로실단백질 베타 1,4-갈락토실트랜스퍼라제, 폴리펩타이드 7), COL7A1(콜라겐 유형 VII, 알파 1), NHP2(NHP2 리보뉴클레오단백질), GNA11(구아닌 뉴클레오타이드 결합 단백질(g 단백질), 알파 11(Gq 클래스)), WNT5A(무시(wingless)-typ MMTV 통합 부위 패밀리 구성원 5A), USB1(U6 snRNA 생물발생 1), LMNA(라민 A/C), EPS8L3(EPS8-유사 3), NSDHL(NAD(P) 의존적 스테로이드 데하이드로게나제-유사), TRPV3(일시적인 수용체 잠재적 양이온 채널 서브패밀리 V, 구성원 3), KRAS(커스틴 랫 육종 바이러스 종양유전자 호모로그), TINF2(TERF 1-상호작용 핵 인자 2), TGM1(트랜글루타미나제 1), DCLREIC(DNA 가교 복구 1C), PKP1(플라코필린(plakophilin) 1), WRAP53(TP53에 대한 안티센스를 함유하는 WD 반복), KDM5C(라이신(k) 특이적 데메틸라제 5C), ECM1(세포외 매트릭스 단백질 1), TP63(종양 단백질 p63), KRT14(케라틴 14), RIPK4(수용체-상호작용 세린-트레오닌 키나제 4), PRKDC(단백질 키나제, DNA 활성화된, 촉매분해적 폴리펩타이드), BCL11a(B-세포 CLL/림프종 11A(아연 핑거 단백질)), BMI1(BMI1 프로토-종양유전자, 폴리콤 링 핑거(polycomb ring finger)), CCR5(케모카인(C-C 모티프) 수용체 5 (유전자/슈도유전자)), CXCR4(케모카인(C-X-C 모티프) 수용체 4), DKK1(dickkopf WNT 신호전달 경로 저해제 1), ETV2(ets 변이체 2), FLIi(fli-1 프로토-종양유전자, ETS 전사 인자), FLK1(키나제 인서트 도메인 수용체), GATA2(GATA 결합 단백질 2), GATA4(GATA 결합 단백질 4), HHEX(조혈모세포적으로 발현된(hematopoietically expressed) 호메오박스), KIT(kit 종양유전자), LMX1 A(LIM 호메오박스 전사 인자 1 알파), MYF5(근원성 인자 5), MYOD1(근원성 분화 1), MYOG(마이오제닌), NKX2-5(NK2 호메오박스 5), NR4A2(핵 수용체 서브패밀리 4, 그룹 A, 구성원 2), PAX3(페어드 박스(paired box) 3), PDX1(췌장 및 십이지장 호메오박스 1), PITX3(페어드-유사 호메오도메인 전사 인자 3), Runx1(runt-관련 전사 인자 1), RAG2(재조합 활성화 유전자 2), GGTA(이관능성 세팔로스포린 아실라제/감마-글루타밀트랜스펩티다제), HANDII(심장 및 신경관 유도체 발현된 단백질 2), TBX5(T-박스 5), ETV2(ets 변이체 2), PDX1(췌장 및 십이지장 호메오박스 1), TBX4(T-박스 4), ID2(DNA 결합 저해제 2), SOX2(SRY(성 결정 영역 Y)-박스 2), TTF1/NKX2-1(NK2 호메오박스 1), MESP1(뒤쪽 중배엽 1), NKX2-5(HK2 호메오박스 5), FAH(푸마릴아세토아세테이트 하이드롤라제), PR DC(단백질 키나제, DNA 활성화된, 촉매분해성 폴리펩타이드), RUNX1(runt 관련 전사 인자 1), FLI1(fli-1 프로토-종양유전자, ETS 전사 인자), PITX3(페어드-유사 호메오도메인 전사 인자 3), LMX1A(LIM 호메오박스 전사 인자 1 알파), DKK1(dickkopf WNT 신호전달 경로 저해제 1), NR4A2/NURR1(핵 수용체 서브패밀리 4, 그룹 A, 구성원 2), FLK1(키나제 인서트 도메인 수용체), HHEX1(조혈모세포적으로 발현된 호메오박스 단백질 HHEX), BCL11A(B-세포 CLL/림프종 11A(아연 핑거 단백질), RAG2(재조합 활성화 유전자 2), RAG1(재조합 활성화 유전자 1), IL2RG(인터루킨 2 수용체, 감마 사슬), c-KIT/SCFR(v-kit hardy-Zuckerman 4 고양이 육종 바이러스 종양유전자 호모로그), BMI1(BMI1 프로토-종양유전자 폴리콤 링 핑거), TBX5(T-박스 5), OLIG1(희돌기교세포 전사 인자 1), OLIG2(희돌기교세포 전사 인자 2), 이들의 이형접합체, 이들의 동형접합체 및 이들의 조합으로부터 선택되는, 방법.
33. 원발성 척추동물 세포 또는 배아에서 멀티플렉스 유전자 넉아웃을 제조하는 방법으로서,
상이한 표적 유전자에 상동성인 HDR 주형의 존재 하에, 상기 상이한 표적 유전자에 표적화된 복수의 TALEN을 세포 또는 배아 내로 도입하는 단계를 포함하는, 방법.
34. 1 내지 33 중 어느 하나에 있어서,
세포를 클로닝하거나, 배아를 임신중인 어미(gestational mother)에 위치시키는 단계를 추가로 포함하는, 방법.
35. 1 내지 34 중 어느 한 방법에 의해 제조되는 동물.
36. 1 내지 34 중 어느 한 방법에 의해 제조되는 키메라 배아 또는 동물로서,
세포가 편집되고,
세포를 클로닝하며, 세포 유래의 숙주 배아를 제조하고, 공여자 세포를 숙주 배아에 첨가하여, 키메라 배아를 형성하는 단계를 추가로 포함하는, 키메라 배아 또는 동물.
37. 숙주 세포 및 공여자 세포에 대한 척추동물 배아 키메라로서,
상이한 염색체 DNA 부위에 복수의 숙주 세포 유전자 편집물을 포함하는 숙주 배아, 및
키메라 배아를 형성하기 위해 숙주 세포와 통합되는 공여자 세포
를 포함하는, 척추동물 배아 키메라.
38. 상이한 염색체 DNA 유전자 부위에 복수의 멀티플렉스 유전자 편집물을 포함하는 배아를 포함하는 척추동물 결핍 캐리어로서,
편집물은 공여자 세포에 의한 보완을 위한 유전적 니치(genetic niche)를 제공하는, 척추동물 결핍 캐리어.
39. 37 또는 38에 있어서,
공여자 세포가 영장류, 설치류 또는 우제류 유래의 배아 줄기세포, 만능 줄기세포, 난할구 등인, 배아 또는 캐리어.
40. 37 내지 39 중 어느 하나에 있어서,
숙주 또는 캐리어 세포 유전자 편집물이 유전자의 넉아웃, 또는 또 다른 품종의 척추동물 또는 또 다른 종의 동물 유래의 대립유전자로의 본래의 대립유전자의 대체를 포함하는, 방법.
41. 37 내지 41 중 어느 하나에 있어서,
숙주 세포 유전자 편집물의 수가 적어도 2, 3, 4, 5, 6 또는 7인, 방법.
42. 37 내지 41 중 어느 하나에 있어서,
또 다른 품종의 척추동물 또는 또 다른 종의 동물의 외인성 대립유전자로의 본래의 대립유전자의 대체의 수가 적어도 2, 3, 4, 5, 6 또는 7인, 방법.
43. 37 내지 42 중 어느 하나에 있어서,
배아가, 발현가능한 리포터 유전자 및/또는 합성 유전자 및/또는 외인성 형광 단백질을 포함하지 않는, 방법.
44. 37 내지 43 중 어느 하나에 있어서,
모든 유전자 편집물들이 바이-대립유전자이며,
적어도 2개, 3개, 4개 또는 5개의 편집물들이 바이-대립유전자이고,
적어도 2개, 3개, 4개 또는 5개의 유전자 편집물들이 모노-대립유전자형 또는 이들의 임의의 조합인, 방법.
45. 37 내지 44 중 어느 하나에 있어서,
공여자 세포가 숙주 세포에 대한 보완물인, 방법.
46. 37 내지 45 중 어느 하나에 있어서,
숙주 배아가 성장 장애(FTT) 표현형을 갖도록 예정되어 있는, 방법.
47. 46에 있어서,
공여자 세포가 FTT 표현형으로부터 배아를 구조하는(rescue), 방법.
48. 37 내지 47 중 어느 하나에 있어서,
공여자 세포가 하나 이상의 유전자 편집물을 포함하는, 방법.
49. 37 내지 47 중 어느 하나에 있어서,
대형 척추동물, 가축, 시미안, 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류로 이루어진 군으로부터 선택되는, 방법.
50. 숙주 세포 및 공여자 세포에 대한 척추동물 키메라로서,
상이한 염색체 DNA 부위에 복수의 숙주 세포 유전자 편집물, 및
키메라 배아를 형성하기 위해 숙주 세포와 통합되는 공여자 세포
를 포함하는, 척추동물 키메라.
51. 50에 있어서,
대형 척추동물, 가축, 시미안, 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류로 이루어진 군으로부터 선택되는, 방법.
52. 숙주 세포 및 공여자 세포에 대한 척추동물 배아 키메라를 제조하는 방법으로서,
제1 표적 염색체 DNA 부위에 관한 제1 표적화된 엔도뉴클레아제, 및 제1 표적 부위 서열에 상동성인 제1 상동성 표적 복구(HDR) 주형; 및
제2 표적 염색체 DNA 부위에 관한 제2 표적화된 엔도뉴클레아제, 및 제2 표적 부위 서열에 상동성인 제2 HDR 주형
을 숙주 척추동물 세포 내로 도입하는 단계,
세포를 클로닝하여, 숙주 배아를 발생(develop)시키는 단계, 및
공여자 세포를 숙주 배아에 위치시키는 단계
를 포함하며,
제1 HDR 주형 서열은 제1 표적 부위에서 본래의 염색체 DNA 서열을 대체하고, 제2 HDR 주형 서열은 제2 표적 부위 서열에서 본래의 염색체 DNA 서열을 대체하는, 방법.
53. 52에 있어서,
세포가 원발성 세포인, 방법.
54. 52 또는 53에 있어서,
대형 척추동물, 가축, 시미안, 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류로 이루어진 군으로부터 선택되는, 방법.
55. 1 내지 54 중 어느 하나에 있어서,
발현가능한 리포터 유전자 및/또는 합성 유전자 및/또는 외인성 형광 단백질을 포함하지 않는, 방법, 세포, 배아 또는 동물.
56. 숙주 세포 및 공여자 세포를 포함하는 키메라성 대형 척추동물로서,
숙주 세포는 공여자 세포의 유전자에 의해 보완되는 배우자발생 유전자 또는 정자발생 유전자에 대한 적어도 하나의 비-감수분열 유전자 편집물을 포함하고,
동물은 공여자 세포의 유전자형을 가진 배우자를 포함하는, 동물.
57. 56에 있어서,
숙주 세포의 유전자형을 가진 기능성 배우자를 포함하지 않는, 동물.
58. 숙주 세포 및 공여자 세포를 포함하는 키메라성 대형 척추동물로서,
숙주 세포는 성장 장애(FTT) 숙주 세포 유전자형을 구축하기 위해 적어도 하나의 비-감수분열 유전자 편집물을 포함하고,
FTT 유전자형은 공여자 세포에 의해 보완되는, 동물.
59. 58에 있어서,
숙주 세포가, 성장 장애(FTT) 숙주 세포 유전자형을 구축하는 복수의 비-감수분열 유전자 편집물을 포함하는, 방법.
60. 58 또는 59에 있어서,
FTT 표현형이 면역결핍인, 방법.
61. 멀티플렉스 유전자 편집을 포함하는 대형 척추동물.
62. 61에 있어서,
적어도 3개의 본래의 대립유전자가 제2 품종 또는 또 다른 종의 상응하는 외인성 대립유전자로 대체된 제1 품종의 돼지 또는 제1 품종의 소이며,
상기 외인성 대립유전자가, 감수분열 재조합 없이, 상응하는 본래의 대립유전자의 대체이고,
동물이 외인성 마커 유전자를 포함하지 않는, 동물.
63. 61 또는 62에 있어서,
상기 외인성 대체 대립유전자를 적어도 3개, 4개, 5개, 6개 또는 7개로 포함하고,
각각이 감수분열 재조합을 포함하지 않는, 동물.
64. 61 내지 63 중 어느 하나에 있어서,
가축, 시미안, 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류로 이루어진 군으로부터 선택되는, 동물.
65. 61 내지 64 중 어느 하나에 있어서,
편집물의 수가 3 내지 25인, 동물.
66. 61 내지 65 중 어느 하나에 있어서,
멀티플렉스 편집물에 대한 F0 세대인, 동물.
67. 61 내지 66 중 어느 하나에 있어서,
대립유전자 대체의 수가 2 내지 25인, 동물.
68. 61 내지 66 중 어느 하나에 있어서,
KO 유전자 편집의 수가 2 내지 25인, 동물.
69. 61에 있어서,
적어도 3개의 본래의 대립유전자가 제2 품종 또는 또 다른 종의 외인성 대립유전자로 대체된 제1 품종의 돼지 또는 제1 품종의 소이며,
상기 외인성 대립유전자가, 감수분열 재조합 없이, 상응하는 본래의 대립유전자의 대체이고,
동물이 외인성 마커 유전자를 포함하지 않는, 동물.
70. 69에 있어서,
상기 외인성 대체 대립유전자를 적어도 3개, 4개, 5개, 6개 또는 7개로 포함하며,
각각이 감수분열 재조합을 포함하지 않는, 동물.
SEQUENCE LISTING
<110> Recombinetics, Inc.
<120> MULTIPLEX GENE EDITING
<130> 5054.28-WO-01
<150> 61/985,327
<151> 2014-04-28
<160> 38
<170> PatentIn version 3.5
<210> 1
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 1
ctcttttcgc aggcacaggt ctacgagctg gagcgacgct tctaagcttg cagcagcggt 60
acctgtcggc tcccgagcgt gaccagttgg 90
<210> 2
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 2
aaccctgtgt cgtttcccac ccagtagata tgtttgatga ctaagcttct cggaaggcag 60
agagtgtgtc aactgcgggg ccatgtccac 90
<210> 3
<211> 60
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 3
tgcggttgct cccccgcctc gtccccgtaa gcttgactcc tggtgcagcg ccccggccag 60
<210> 4
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 4
His Asp His Asp His Asp Asn Ile Asn Ile Asn Ile Asn Asn Asn Asn
1 5 10 15
Asn Gly Asn Gly His Asp Asn Ile Asn Asn Asn Gly Asn Asn Asn Gly
20 25 30
Asn Gly Asn Gly
35
<210> 5
<211> 40
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 5
His Asp His Asp Asn Ile Asn Ile Asn Asn Asn Gly Asn Asn His Asp
1 5 10 15
Asn Ile Asn Ile Asn Gly Asn Gly His Asp Asn Ile Asn Gly Asn Asn
20 25 30
Asn Gly Asn Ile His Asp Asn Gly
35 40
<210> 6
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 6
Asn Ile His Asp His Asp Asn Gly Asn Gly His Asp His Asp Asn Gly
1 5 10 15
His Asp His Asp Asn Gly His Asp Asn Gly His Asp His Asp Asn Asn
20 25 30
His Asp Asn Gly
35
<210> 7
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 7
His Asp Asn Gly Asn Ile Asn Ile Asn Asn His Asp Asn Gly Asn Asn
1 5 10 15
His Asp Asn Gly Asn Gly Asn Gly Asn Gly Asn Asn Asn Ile Asn Ile
20 25 30
Asn Gly
<210> 8
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 8
Asn Asn Asn Asn Asn Ile Asn Ile Asn Asn Asn Ile Asn Ile Asn Asn
1 5 10 15
Asn Gly Asn Ile Asn Gly His Asp Asn Ile Asn Asn His Asp His Asp
20 25 30
Asn Ile Asn Gly
35
<210> 9
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 9
Asn Asn Asn Ile His Asp His Asp His Asp Asn Ile Asn Asn Asn Ile
1 5 10 15
Asn Ile Asn Gly Asn Gly Asn Gly His Asp Asn Gly Asn Asn Asn Gly
20 25 30
<210> 10
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 10
Asn Asn Asn Asn His Asp Asn Ile His Asp His Asp His Asp Asn Asn
1 5 10 15
Asn Gly Asn Asn Asn Gly His Asp His Asp Asn Asn His Asp Asn Asn
20 25 30
His Asp
<210> 11
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 11
His Asp Asn Ile Asn Gly Asn Asn Asn Gly Asn Ile His Asp Asn Gly
1 5 10 15
His Asp Asn Gly Asn Asn Asn Ile His Asp Asn Gly Asn Gly
20 25 30
<210> 12
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 12
Asn Asn His Asp Asn Gly His Asp Asn Gly Asn Ile His Asp Asn Gly
1 5 10 15
His Asp Asn Gly Asn Ile His Asp His Asp His Asp His Asp
20 25 30
<210> 13
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 13
Asn Asn His Asp Asn Ile His Asp Asn Ile Asn Gly Asn Asn Asn Ile
1 5 10 15
Asn Ile Asn Asn Asn Gly His Asp Asn Asn His Asp His Asp His Asp
20 25 30
Asn Ile
<210> 14
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 14
His Asp His Asp Asn Asn Asn Gly His Asp His Asp Asn Gly Asn Gly
1 5 10 15
Asn Gly Asn Asn His Asp His Asp Asn Ile Asn Ile His Asp His Asp
20 25 30
Asn Gly Asn Gly
35
<210> 15
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 15
Asn Gly Asn Asn Asn Asn Asn Asn Asn Asn Asn Asn His Asp His Asp
1 5 10 15
His Asp Asn Ile His Asp Asn Asn Asn Asn Asn Gly Asn Gly Asn Asn
20 25 30
His Asp Asn Gly
35
<210> 16
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 16
His Asp Asn Gly His Asp His Asp Asn Gly Asn Ile His Asp Asn Ile
1 5 10 15
Asn Ile Asn Asn Asn Gly Asn Asn Asn Asn Asn Ile Asn Gly Asn Gly
20 25 30
Asn Gly
<210> 17
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 17
His Asp Asn Asn Asn Asn Asn Ile His Asp His Asp His Asp Asn Asn
1 5 10 15
Asn Gly His Asp His Asp Asn Gly Asn Gly Asn Asn His Asp Asn Ile
20 25 30
His Asp Asn Gly
35
<210> 18
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 18
Asn Asn Asn Asn Asn Ile His Asp Asn Gly Asn Asn Asn Ile His Asp
1 5 10 15
His Asp Asn Ile His Asp Asn Gly Asn Ile Asn Gly Asn Gly
20 25 30
<210> 19
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 19
Asn Ile Asn Asn Asn Ile Asn Asn Asn Ile Asn Ile Asn Gly Asn Asn
1 5 10 15
Asn Gly Asn Asn Asn Asn Asn Gly His Asp His Asp Asn Ile Asn Asn
20 25 30
His Asp
<210> 20
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 20
His Asp Asn Asn His Asp Asn Ile Asn Asn Asn Asn His Asp Asn Ile
1 5 10 15
His Asp Asn Ile Asn Asn Asn Asn Asn Gly His Asp Asn Gly Asn Ile
20 25 30
His Asp
<210> 21
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 21
Asn Ile His Asp His Asp Asn Asn His Asp Asn Gly Asn Asn His Asp
1 5 10 15
Asn Gly Asn Asn His Asp Asn Gly Asn Gly Asn Asn Asn Ile
20 25 30
<210> 22
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 22
Asn Asn His Asp Asn Asn Asn Asn Asn Gly Asn Gly Asn Asn His Asp
1 5 10 15
Asn Gly His Asp His Asp His Asp His Asp His Asp Asn Asn His Asp
20 25 30
His Asp
<210> 23
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 23
Asn Asn Asn Asn His Asp His Asp Asn Asn Asn Asn Asn Asn Asn Asn
1 5 10 15
His Asp Asn Asn His Asp Asn Gly Asn Asn His Asp Asn Ile His Asp
20 25 30
His Asp
<210> 24
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 24
Asn Ile Asn Gly Asn Asn Asn Gly Asn Gly Asn Gly Asn Asn Asn Ile
1 5 10 15
Asn Gly Asn Asn Asn Ile His Asp Asn Gly Asn Gly His Asp
20 25 30
<210> 25
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 25
Asn Asn Asn Asn His Asp His Asp His Asp His Asp Asn Asn His Asp
1 5 10 15
Asn Ile Asn Asn Asn Gly Asn Gly Asn Asn Asn Ile His Asp Asn Ile
20 25 30
His Asp
<210> 26
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Repeat-Variable Diresidue (RVD) Code
<400> 26
Cys Gly Thr Cys Ala Cys Cys Ala Ala Cys Gly Gly Thr Cys Thr Cys
1 5 10 15
Cys Thr Cys Thr Cys Gly Gly
20
<210> 27
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 27
ttccactcta ccccccccaa aggttcagtg ttttgtgtaa gcttcaatgt tgagtacatg 60
aattgcactt gggacagcag ctctgagctc 90
<210> 28
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 28
ctctaaggat tcctgccacc ttcctcctct ccgctaccca gactaagctt tgcacattca 60
aaagcagctt agggtctgaa aaacatcagt 90
<210> 29
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 29
ccagatcgcc aaagtcacgg aagaagtatc agccattcat ccctcccagt gaagcttaca 60
gaaattctgg gtcgaccacg gagttgcact 90
<210> 30
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 30
agctcgccac ccccgccggg cacccgtgtc cgcgccatgg ccatctaagc ttaaagaagt 60
cagagtacat gcccgaggtg gtgaggcgct 90
<210> 31
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 31
gtgctgcgtg ccctttactg ctctactcta ccccctacca gcctaagctt gtgctgggcg 60
acttcatgtg caagttcctc aactacatcc 90
<210> 32
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 32
cccagacttc actccgtcct ttgccgactt cggccgacca gcccttagca accgtgggcc 60
cccaaggggt gggccaggtg gggagctgcc 90
<210> 33
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 33
ccgagacggg aaatgcacct cctacaagtg gatttgtgat ggatccgaac accgagtgca 60
aggacgggtc cgctgagtcc ctggagacgt 90
<210> 34
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 34
aaagtggcct ggcccaaccc ctggactgac cactcgagta ttgaagcacg taagtatgct 60
ggaccacatt ctctatggct gtagacattc 90
<210> 35
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 35
ctcttttcgc aggcacaggt ctacgagctg gagcgacgct tctaagcttg cagcagcggt 60
acctgtcggc tcccgagcgt gaccagttgg 90
<210> 36
<211> 60
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 36
tgcggttgct cccccgcctc gtccccgtaa gcttgactcc tggtgcagcg ccccggccag 60
<210> 37
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 37
aaccctgtgt cgtttcccac ccagtagata tgtttgatga ctaagcttct cggaaggcag 60
agagtgtgtc aactgcgggg ccatgtccac 90
<210> 38
<211> 90
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Homology Directed Repair Template
<400> 38
gctcccactc ccctgggggc ctctgggctc accaacggtc tcctcccggg ggacgaagac 60
ttctcctcca ttgcggacat ggacttctca 90
Claims (41)
- 멀티플렉스 유전자 편집물을 포함하는 대형 척추동물.
- 제1항에 있어서,
동물이, 적어도 3개의 본래의(native) 대립유전자가 제2 품종 또는 또 다른 종의 상응하는 외인성 대립유전자로 대체된 제1 품종의 소 또는 제1 품종의 돼지이며,
상기 외인성 대립유전자가 감수분열 재조합 없이, 상응하는 본래의 대립유전자의 대체이며,
동물이 외인성 마커 유전자를 포함하지 않는, 동물. - 제2항에 있어서,
3개의 대립유전자가 각각 3개의 상이한 유전자에 대한 것인, 동물. - 제2항 또는 제3항에 있어서,
상기 외인성 대체 대립유전자 중 적어도 3개, 4개, 5개, 6개 또는 7개가 각각 감수분열 재조합을 포함하지 않는, 동물. - 제1항에 있어서,
동물이, 적어도 2개의 본래의 대립유전자가 제2 품종 또는 또 다른 종의 상응하는 외인성 대립유전자로 대체된 제1 동물이며,
상기 외인성 대립유전자가 감수분열 재조합 없이, 상응하는 본래의 대립유전자의 대체인, 동물. - 제1항 내지 제5항 중 어느 한 항에 있어서,
대립유전자 대체 수를 3 내지 25로 포함하거나, 넉아웃 유전자 편집물 수를 2 내지 25로 포함하는, 동물. - 제1항 내지 제6항 중 어느 한 항에 있어서,
상기 유전자 편집물이 동형접합 편집물, 이형접합 편집물 또는 이들의 조합을 포함하는, 동물. - 제1항 내지 제7항 중 어느 한 항에 있어서,
상기 동물이 숙주 동물 유래의 숙주 세포와 공여자 동물 유래의 공여자 세포의 키메라이며,
숙주 세포가 멀티플렉스 유전자 편집물을 포함하는, 동물. - 제8항에 있어서,
동물의 유성 생식이 공여자 세포의 유전자형을 가진 배우자를 자손에게 전달하는, 동물. - 제1항 내지 제9항 중 어느 한 항에 있어서,
마커 유전자를 포함하지 않는, 동물. - 제1항 내지 제10항 중 어느 한 항에 있어서,
동물이 가축, 시미안(simian), 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류(artiodactyl)로 이루어진 군으로부터 선택되는, 동물. - 제1항 내지 제11항 중 어느 한 항에 있어서,
멀티플렉스 유전자 편집물이 하기 유전자: IL2Rg-, RAG2, IL2Rg; RAG2 , IL2Rgy, RAG2, IL2Rg, RAG2, IL2Rg; RAG2 , IL2Rg; RAG2, DGAT, ABCG2, ACAN, AMELY, BLG, BMP1B(FecB), DAZL, DGAT, Eif4GI, GDF8, 혼-폴 유전자좌(Horn-poll locus), IGF2, CWC15, KissR/GRP54, OFD1Y, p65, PRLR, Prmd14, PRNP, Rosa, Socs2, SRY, ZFY, β-락토글로불린, CLPG, MODY 1(HNF4α), MODY 2(GCK), MODY 3(HNF1α), MODY 4(Pdx1), MODY 5(HNF-1β), MODY 6(eurogenic differentiation 1), MODY 7(KLF11), MODY 8(CEL), MODY 9(PAX4), MODY 10(INS), MODY 11(BLK), APC, ApoE, DMD, GHRHR, HR, HSD11B2, LDLR, NF1, NPPA, NR3C2, p53, PKD1, Rbm20, SCNN1G, tP53, DAZL, FAH, HBB, IL2RG, PDX1, PITX3, Runx1, RAG2, GGTA, DAZL, VASA, MIWI, PIWI, DCAF17, VDR, PNPLA1, HRAS, 텔로머라제-vert, DSP, SNRPE, RPL21, LAMA3, UROD, EDAR, OFD1, PEX7, COL3A1, ALOX12B, HLCS, NIPAL4, CERS3, ANTXR1, B3GALT6, DSG4, UBR1, CTC1, MBTPS2, UROS, ABHD5, NOP10, ALMS1, LAMB3, EOGT, SAT1, RBPJ, ARHGAP31, ACVR1, IKBKG, LPAR6, HR, ATR, HTRA1, AIRE, BCS1L, MCCC2, DKC1, PORCN, EBP, SLITRK1, BTK, DOCK6, APCDD1, ZIP4, CASR, TERT, EDARADD, ATP6V0A2, PVRL1, MGP, KRT85, RAG2, RAG-1, ROR2, CLAUDIN1, ABCA12, SLA-DRA1, B4GALT7, COL7A1, NHP2, GNA11, WNT5A, USB1, LMNA, EPS8L3, NSDHL, TRPV3, KRAS, TINF2, TGM1, DCLREIC, PKP1, WRAP53, KDM5C, ECM1, TP63, KRT14, RIPK4, PRKDC, BCL11a, BMI1, CCR5, CXCR4, DKK1, ETV2, FLI1, FLK1, GATA2, GATA4, HHEX, KIT, LMX1A, MYF5, MYOD1, MYOG, NKX2-5, NR4A2, PAX3, PDX1, PITX3, Runx1, RAG2, GGTA, HR, HANDII, TBX5, ETV2, PDX1, TBX4, ID2 SOX2, TTF1/NKX2-1, MESP1, GATA4, NKX2-5, FAH, PRKDC, RUNX1, FLU, PITX3, LMX1A, DKK1, NR4A2/NURR1, FLK1, HHEX1, BCL11A, RAG2, RAG1, IL2RG, c-KIT/SCFR, BMI1, HANDII, TBX5, GATA2, DAZL, OLIG1, OLIG2, 이들의 이형접합체, 이들의 동형접합체 및 이들의 조합 중 하나 이상으로부터 제조되는, 동물. - 시험관내에서 척추동물 세포 또는 배아 내 복수의 표적 염색체 DNA 부위에서 유전자 편집물을 제조하는 방법으로서,
제1 표적 염색체 DNA 부위에 관한 제1 표적화된 엔도뉴클레아제, 및 제1 표적 부위 서열에 상동성인 제1 상동성 표적 복구(HDR) 주형; 및
제2 표적 염색체 DNA 부위에 관한 제2 표적화된 엔도뉴클레아제, 및 제2 표적 부위 서열에 상동성인 제2 HDR 주형
을 척추동물 세포 또는 배아 내로 도입하는 단계를 포함하며,
제1 HDR 주형 서열은 제1 표적 부위에서 본래의 염색체 DNA 서열을 대체하고, 제2 HDR 주형 서열은 제2 표적 부위 서열에서 본래의 염색체 DNA 서열을 대체하는, 방법. - 제13항에 있어서,
제3, 제4, 제5, 제6 및 제7의 표적 염색체 DNA 부위 각각에 관한 제3, 제4, 제5, 제6 및 제7의 표적화된 엔도뉴클레아제, 및
제3, 제4, 제5, 제6 및 제7의 표적 염색체 DNA 부위 각각에 상동성인 제3, 제4, 제5, 제6 및 제7의 HDR 주형
중 하나 이상을 세포 또는 배아에 도입하는 단계를 추가로 포함하는, 방법. - 제13항 또는 제14항에 있어서,
표적화된 엔도뉴클레아제가 TALEN, 아연 핑거 뉴클레아제, RNA-가이디드 엔도뉴클레아제 또는 Cas9을 포함하는, 방법. - 제13항 내지 제15항 중 어느 한 항에 있어서,
적어도 제1 표적 염색체 DNA 부위가 대립유전자에 대한 유전자좌인, 방법. - 제16항에 있어서,
적어도 하나의 상기 HDR 주형이 이러한 주형과 동족인(cognate) DNA 표적 부위의 넉아웃을 인코딩하는, 방법. - 제16항에 있어서,
적어도 하나의 상기 HDR 주형이 이러한 주형과 동족인 DNA 표적 부위에서 대립유전자의 대체를 위한 외인성 대립유전자를 인코딩하는, 방법. - 제13항 내지 제18항 중 어느 한 항에 있어서,
세포 또는 배아가 제1 종 또는 제1 품종의 가축이고,
복수의 편집물들이 제2 종 또는 제2 품종의 동물 유래의 외인성 대립유전자로의 본래의 대립유전자의 대체를 포함하는, 방법. - 제13항 내지 제19항 중 어느 한 항에 있어서,
세포 또는 배아가 표적 DNA 부위에서 복수의 유전자 편집물들에 대해 동형접합성이며,
상기 편집물은 상기 표적 DNA 부위와 동족인 HDR 주형에 의해 인코딩되는, 방법. - 제13항 내지 제20항 중 어느 한 항에 있어서,
세포 또는 배아가 표적 DNA 부위에서 복수의 유전자 편집물들에 대해 이형접합성이며,
상기 편집물은 상기 표적 DNA 부위와 동족인 HDR 주형에 의해 인코딩되는, 방법. - 제13항 내지 제21항 중 어느 한 항에 있어서,
세포 또는 배아가 대형 척추동물, 가축, 시미안, 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류로 이루어진 군으로부터 선택되는, 방법. - 제13항 내지 제22항 중 어느 한 항에 있어서,
세포가 접합자, 줄기세포, 성인 줄기세포, 만능 세포(pluripotent cell), 전구 세포(progenitor cell) 및 원발성 세포(primary cell)로 이루어진 군으로부터 선택되는, 방법. - 제13항 내지 제22항 중 어느 한 항에 있어서,
배아가 접합자, 배반포, 상실배이거나, 1개 내지 200개의 세포수를 가진 것인, 방법. - 제13항 내지 제24항 중 어느 한 항에 있어서,
표적화된 엔도뉴클레아제가 TALEN과 CRISPR의 조합인, 방법. - 제13항 내지 제25항 중 어느 한 항에 있어서,
하나 이상의 표적 부위 서열이 하기 목록: IL2Rgy/-, RAG2-/-, IL2Rg -/- , RAG2 -/- , IL2Rgy/-, RAG2-/-, IL2Rg+/-, RAG2+/-, IL2Rg y /+ , RAG2 +/- , IL2Rg +/- , RAG2 +/- , DGAT, ABCG2, ACAN, AMELY, BLG, BMP1B(FecB), DAZL, DGAT, Eif4GI, GDF8, 혼-폴 유전자좌, IGF2, CWC15, KissR/GRP54, OFD1Y, p65, PRLR, Prmd14, PRNP, Rosa, Socs2, SRY, ZFY, β-락토글로불린, CLPG, MODY 1(HNF4α), MODY 2(GCK), MODY 3(HNF1α), MODY 4(Pdx1), MODY 5(HNF-1β), MODY 6(유로제닉 분화 1), MODY 7(KLF11), MODY 8(CEL), MODY 9(PAX4), MODY 10(INS), MODY 11(BLK), APC, ApoE, DMD, GHRHR, HR, HSD11B2, LDLR, NF1, NPPA, NR3C2, p53, PKD1, Rbm20, SCNN1G, tP53, DAZL, FAH, HBB, IL2RG, PDX1, PITX3, Runx1, RAG2, GGTA, DAZL, VASA, MIWI, PIWI, DCAF17, VDR, PNPLA1, HRAS, 텔로머라제-vert, DSP, SNRPE, RPL21, LAMA3, UROD, EDAR, OFD1, PEX7, COL3A1, ALOX12B, HLCS, NIPAL4, CERS3, ANTXR1, B3GALT6, DSG4, UBR1, CTC1, MBTPS2, UROS, ABHD5, NOP10, ALMS1, LAMB3, EOGT, SAT1, RBPJ, ARHGAP31, ACVR1, IKBKG, LPAR6, HR, ATR, HTRA1, AIRE, BCSIL, MCCC2, DKC1, PORCN, EBP, SLITRK1, BTK, DOCK6, APCDD1, ZIP4, CASR, TERT, EDARADD, ATP6V0A2, PVRL1, MGP, KRT85, RAG2, RAG-1, ROR2, CLAUDIN1, ABCA12, SLA-DRA1, B4GALT7, COL7A1, NHP2, GNA11, WNT5A, USB1, LMNA, EPS8L3, NSDHL, TRPV3, KRAS, TINF2, TGM1, DCLRE1C, PKP1, WRAP53, KDM5C, ECM1, TP63, KRT14, RIPK4, PRKDC, BCL11a, BMI1, CCR5, CXCR4, DKK1, ETV2, FLI1, FLK1, GATA2, GATA4, HHEX, KIT, LMX1A, MYF5, MYOD1, MYOG, NKX2-5, NR4A2, PAX3, PDX1, PITX3, Runx1, RAG2, GGTA, HR, HANDII, TBX5, ETV2, PDX1, TBX4, ID2 SOX2, TTF1/NKX2-1, MESP1, GATA4, NKX2-5, FAH, PRKDC, RUNX1, FLI1, PITX3, LMX1A, DKK1, NR4A2/NURR1, FLK1, HHEX1, BCL11A, RAG2, RAG1, IL2RG, c-KIT/SCFR, BMI1, HANDII, TBX5, GATA2, DAZL, OLIG1, OLIG2, 이들의 이형접합체, 이들의 동형접합체 및 이들의 조합으로부터 선택되는, 방법. - 원발성 척추동물 세포 또는 배아에서 멀티플렉스 유전자 넉아웃을 제조하는 방법으로서,
상이한 표적 유전자들에 대해 상동성을 가진 HDR 주형의 존재 하에, 상기 상이한 표적 유전자들로 표적화된 복수의 TALEN들을 세포 또는 배아 내로 도입하는 단계를 포함하는, 방법. - 숙주 세포 및 공여자 세포에 대해 키메라성인 척추동물 배아로서,
상이한 염색체 DNA 부위들에서 복수의 숙주 세포 유전자 편집물들을 가진 숙주 배아, 및
숙주 세포와 통합되어, 키메라 배아를 형성하는 공여자 세포
를 포함하는, 척추동물 배아. - 제28항에 있어서,
공여자 세포가 영장류, 설치류 또는 우제류 유래의 배아 줄기세포, 만능 줄기세포, 난할구 등인, 배아. - 제28항 또는 제29항에 있어서,
숙주 또는 캐리어 세포 유전자 편집물이, 유전자의 넉아웃, 또는 또 다른 품종의 척추동물 또는 또 다른 종의 동물의 외인성 대립유전자로의 본래의 대립유전자의 대체를 포함하는, 배아. - 제28항 내지 제30항 중 어느 한 항에 있어서,
숙주 세포 유전자 편집물의 수가 2, 3, 4, 5, 6 또는 7이거나 적어도 2, 3, 4, 5, 6 또는 7인, 배아. - 제28항 내지 제31항 중 어느 한 항에 있어서,
또 다른 품종의 척추동물 또는 또 다른 종의 동물의 외인성 대립유전자로의 본래의 대립유전자의 대체의 수가 2, 3, 4, 5, 6 또는 7이거나 적어도 2, 3, 4, 5, 6 또는 7인, 배아. - 제28항 내지 제32항 중 어느 한 항에 있어서,
배아가 발현가능한 리포터 유전자 및/또는 합성 유전자 및/또는 외인성 형광 단백질을 포함하지 않는, 배아. - 제28항 내지 제33항 중 어느 한 항에 있어서,
모든 유전자 편집물들이 바이-대립유전자형(bi-allelic)이거나, 적어도 2개, 3개, 4개 또는 5개의 편집물들이 바이-대립유전자형이거나, 적어도 2개, 3개, 4개 또는 5개의 유전자 편집물들이 모노-대립유전자형(mono-allelic)이거나, 이들의 임의의 조합인, 배아. - 제28항 내지 제34항 중 어느 한 항에 있어서,
숙주 배아가 성장 장애(failure to thrive; FTT) 표현형을 갖도록 결정되어 있는, 배아. - 숙주 세포 및 공여자 세포에 대해 키메라성인 척추동물로서,
상이한 염색체 DNA 부위들에서 복수의 숙주 세포 유전자 편집물들, 및
숙주 세포와 통합되어, 키메라 배아를 형성하는 공여자 세포
를 포함하는, 척추동물. - 숙주 세포 및 공여자 세포에 대해 키메라성인 척추동물 배아를 제조하는 방법으로서,
제1 표적 염색체 DNA 부위에 관한 제1 표적화된 엔도뉴클레아제, 및 제1 표적 부위 서열에 상동성인 제1 상동성 표적 복구(HDR) 주형; 및
제2 표적 염색체 DNA 부위에 관한 제2 표적화된 엔도뉴클레아제, 및 제2 표적 부위 서열에 상동성인 제2 HDR 주형
을 숙주 척추동물 세포 내로 도입하는 단계,
세포를 클로닝하여, 숙주 배아를 발생(develop)시키는 단계, 및
공여자 세포를 숙주 배아에 위치시키는 단계
를 포함하며,
제1 HDR 주형 서열은 제1 표적 부위에서 본래의 염색체 DNA 서열을 대체하고, 제2 HDR 주형 서열은 제2 표적 부위 서열에서 본래의 염색체 DNA 서열을 대체하는, 방법. - 제37항에 있어서,
세포가 원발성 세포인, 방법. - 제37항 또는 제38항에 있어서,
대형 척추동물, 가축, 시미안, 개, 고양이, 조류, 새, 어류, 토끼, 돼지, 소, 버팔로, 염소, 양 및 우제류로 이루어진 군으로부터 선택되는, 방법. - 숙주 세포 및 공여자 세포를 포함하는 키메라성 대형 척추동물로서,
숙주 세포는, 공여자 세포의 유전자에 의해 보완되는 배우자발생(gametogenic) 유전자 또는 정자발생(spermatogenic) 유전자에 대한 적어도 하나의 비-감수분열 유전자 편집물을 포함하며,
동물은 공여자 세포의 유전자형을 가진 배우자를 포함하는, 키메라성 대형 척추동물. - 숙주 세포 및 공여자 세포를 포함하는 키메라성 대형 척추동물로서,
숙주 세포는 성장 장애(FTT) 숙주 세포 유전자형을 구축하기 위해 적어도 하나의 비-감수분열 유전자 편집물을 포함하며,
FTT 유전자형은 공여자 세포에 의해 보완되는, 키메라성 대형 척추동물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461985327P | 2014-04-28 | 2014-04-28 | |
| US61/985,327 | 2014-04-28 | ||
| PCT/US2015/027995 WO2015168125A1 (en) | 2014-04-28 | 2015-04-28 | Multiplex gene editing in swine |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170003585A true KR20170003585A (ko) | 2017-01-09 |
Family
ID=53190022
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167032557A KR20170003585A (ko) | 2014-04-28 | 2015-04-28 | 돼지에서 멀티플렉스 유전자 편집 |
Country Status (13)
| Country | Link |
|---|---|
| US (3) | US20160029604A1 (ko) |
| EP (1) | EP3136850A1 (ko) |
| JP (1) | JP2017513510A (ko) |
| KR (1) | KR20170003585A (ko) |
| CN (2) | CN111647627A (ko) |
| AP (1) | AP2016009588A0 (ko) |
| AR (1) | AR100216A1 (ko) |
| AU (1) | AU2015253352A1 (ko) |
| BR (2) | BR122023023211A2 (ko) |
| CA (1) | CA2946881A1 (ko) |
| MX (1) | MX2016014066A (ko) |
| PH (1) | PH12016502162A1 (ko) |
| WO (1) | WO2015168125A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102270145B1 (ko) * | 2019-12-27 | 2021-07-01 | 서울대학교산학협력단 | Btk 넉아웃 질환모델용 돼지 및 이의 용도 |
Families Citing this family (79)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10920242B2 (en) | 2011-02-25 | 2021-02-16 | Recombinetics, Inc. | Non-meiotic allele introgression |
| US9528124B2 (en) | 2013-08-27 | 2016-12-27 | Recombinetics, Inc. | Efficient non-meiotic allele introgression |
| EP2734621B1 (en) | 2011-07-22 | 2019-09-04 | President and Fellows of Harvard College | Evaluation and improvement of nuclease cleavage specificity |
| US9163284B2 (en) | 2013-08-09 | 2015-10-20 | President And Fellows Of Harvard College | Methods for identifying a target site of a Cas9 nuclease |
| US9359599B2 (en) | 2013-08-22 | 2016-06-07 | President And Fellows Of Harvard College | Engineered transcription activator-like effector (TALE) domains and uses thereof |
| US9388430B2 (en) | 2013-09-06 | 2016-07-12 | President And Fellows Of Harvard College | Cas9-recombinase fusion proteins and uses thereof |
| US9526784B2 (en) | 2013-09-06 | 2016-12-27 | President And Fellows Of Harvard College | Delivery system for functional nucleases |
| US9340799B2 (en) | 2013-09-06 | 2016-05-17 | President And Fellows Of Harvard College | MRNA-sensing switchable gRNAs |
| KR101566498B1 (ko) * | 2013-11-13 | 2015-11-06 | 건국대학교 산학협력단 | 인터루킨 2 수용체 감마 유전자 적중벡터, 그 벡터가 도입된 면역세포 결핍 형질전환 미니 복제돼지 생산과 그 제조방법 및 활용 |
| US9840699B2 (en) | 2013-12-12 | 2017-12-12 | President And Fellows Of Harvard College | Methods for nucleic acid editing |
| CN111647627A (zh) | 2014-04-28 | 2020-09-11 | 重组股份有限公司 | 多重基因编辑 |
| CA2956224A1 (en) | 2014-07-30 | 2016-02-11 | President And Fellows Of Harvard College | Cas9 proteins including ligand-dependent inteins |
| BR112017005483A2 (pt) | 2014-09-23 | 2018-03-06 | Aggenetics Inc | materiais e métodos para a produção de animais com pelo curto |
| US11680268B2 (en) | 2014-11-07 | 2023-06-20 | Editas Medicine, Inc. | Methods for improving CRISPR/Cas-mediated genome-editing |
| BR112017018932A2 (pt) | 2015-03-03 | 2018-07-31 | Univ Minnesota | etv2 e usos do mesmo |
| RU2018103093A (ru) * | 2015-06-30 | 2019-07-31 | Реджентс Оф Зэ Юниверсити Оф Миннесота | Гуманизированная скелетная мышца |
| MX2018000071A (es) | 2015-06-30 | 2018-03-16 | Univ Minnesota | Musculo cardiaco humanizado. |
| EP3353296B1 (en) | 2015-09-24 | 2020-11-04 | Editas Medicine, Inc. | Use of exonucleases to improve crispr/cas-mediated genome editing |
| WO2017062756A1 (en) * | 2015-10-07 | 2017-04-13 | Recombinetics, Inc. | Method of generating sterile terminal sires in livestock and animals produced thereby |
| US10167457B2 (en) | 2015-10-23 | 2019-01-01 | President And Fellows Of Harvard College | Nucleobase editors and uses thereof |
| CN105567689B (zh) * | 2016-01-25 | 2019-04-09 | 重庆威斯腾生物医药科技有限责任公司 | CRISPR/Cas9靶向敲除人TCAB1基因及其特异性gRNA |
| WO2017165826A1 (en) | 2016-03-25 | 2017-09-28 | Editas Medicine, Inc. | Genome editing systems comprising repair-modulating enzyme molecules and methods of their use |
| US11236313B2 (en) | 2016-04-13 | 2022-02-01 | Editas Medicine, Inc. | Cas9 fusion molecules, gene editing systems, and methods of use thereof |
| EP3445388B1 (en) * | 2016-04-18 | 2024-04-17 | Vertex Pharmaceuticals Incorporated | Materials and methods for treatment of hemoglobinopathies |
| CN106191061B (zh) * | 2016-07-18 | 2019-06-18 | 暨南大学 | 一种特异靶向人ABCG2基因的sgRNA导向序列及其应用 |
| SG11201900907YA (en) | 2016-08-03 | 2019-02-27 | Harvard College | Adenosine nucleobase editors and uses thereof |
| CN109804066A (zh) | 2016-08-09 | 2019-05-24 | 哈佛大学的校长及成员们 | 可编程cas9-重组酶融合蛋白及其用途 |
| US11542509B2 (en) | 2016-08-24 | 2023-01-03 | President And Fellows Of Harvard College | Incorporation of unnatural amino acids into proteins using base editing |
| US20180084767A1 (en) * | 2016-09-21 | 2018-03-29 | Recombinetics, Inc. | Animal models for cardiomyopathy |
| SG11201903089RA (en) | 2016-10-14 | 2019-05-30 | Harvard College | Aav delivery of nucleobase editors |
| EP3541937A4 (en) * | 2016-11-18 | 2020-06-24 | Christopher Bradley | REPAIR OF MASSIVELY MULTIPLEXED HOMOLOGICAL TEMPLATE FOR FULL GENERATION |
| US10745677B2 (en) | 2016-12-23 | 2020-08-18 | President And Fellows Of Harvard College | Editing of CCR5 receptor gene to protect against HIV infection |
| JP7236398B2 (ja) | 2017-02-15 | 2023-03-09 | 2セブンティ バイオ インコーポレイテッド | ドナー修復鋳型多重ゲノム編集 |
| WO2018165504A1 (en) | 2017-03-09 | 2018-09-13 | President And Fellows Of Harvard College | Suppression of pain by gene editing |
| WO2018165629A1 (en) | 2017-03-10 | 2018-09-13 | President And Fellows Of Harvard College | Cytosine to guanine base editor |
| US11268082B2 (en) | 2017-03-23 | 2022-03-08 | President And Fellows Of Harvard College | Nucleobase editors comprising nucleic acid programmable DNA binding proteins |
| CN106987604B (zh) * | 2017-03-29 | 2021-05-28 | 北京希诺谷生物科技有限公司 | 一种制备动脉粥样硬化疾病模型犬的方法 |
| EP3610398A4 (en) * | 2017-03-30 | 2021-02-24 | Monsanto Technology LLC | SYSTEMS AND METHODS FOR USE IN IDENTIFYING MULTIPLE GENOMIC EDITIONS AND FOR PREDICTING THE AGGREGATED EFFECTS OF IDENTIFIED GENOMIC EDITIONS |
| WO2018195402A1 (en) | 2017-04-20 | 2018-10-25 | Egenesis, Inc. | Methods for generating genetically modified animals |
| WO2018197520A1 (en) * | 2017-04-24 | 2018-11-01 | Dupont Nutrition Biosciences Aps | Methods and compositions of anti-crispr proteins for use in plants |
| CN107974462A (zh) * | 2017-04-28 | 2018-05-01 | 中山大学 | 一种通过延迟基因的表达时间来提高猪瘦肉产量的方法 |
| CN107182940B (zh) * | 2017-05-09 | 2020-05-15 | 中国科学院动物研究所 | 一种抗寒及瘦肉型转基因猪及其制备方法 |
| WO2018209320A1 (en) | 2017-05-12 | 2018-11-15 | President And Fellows Of Harvard College | Aptazyme-embedded guide rnas for use with crispr-cas9 in genome editing and transcriptional activation |
| WO2019014564A1 (en) | 2017-07-14 | 2019-01-17 | Editas Medicine, Inc. | SYSTEMS AND METHODS OF TARGETED INTEGRATION AND GENOME EDITING AND DETECTION THEREOF WITH INTEGRATED PRIMING SITES |
| CN107937445B (zh) * | 2017-07-25 | 2021-05-04 | 北京希诺谷生物科技有限公司 | 利用体细胞克隆技术制备基因敲除犬的方法 |
| EP3658573A1 (en) | 2017-07-28 | 2020-06-03 | President and Fellows of Harvard College | Methods and compositions for evolving base editors using phage-assisted continuous evolution (pace) |
| US20190045761A1 (en) | 2017-08-11 | 2019-02-14 | Recombinetics, Inc. | Inducible disease models methods of making them and use in tissue complementation |
| WO2019139645A2 (en) | 2017-08-30 | 2019-07-18 | President And Fellows Of Harvard College | High efficiency base editors comprising gam |
| KR102207352B1 (ko) * | 2017-09-29 | 2021-01-26 | 서울대학교산학협력단 | Klotho 유전자 넉아웃 질환모델 동물 및 이의 용도 |
| US20210206814A1 (en) * | 2017-10-12 | 2021-07-08 | Mayo Foundation For Medical Education And Research | Methods and materials for gene editing |
| CN111757937A (zh) | 2017-10-16 | 2020-10-09 | 布罗德研究所股份有限公司 | 腺苷碱基编辑器的用途 |
| US11566236B2 (en) | 2018-02-05 | 2023-01-31 | Vertex Pharmaceuticals Incorporated | Materials and methods for treatment of hemoglobinopathies |
| CN108504685A (zh) * | 2018-03-27 | 2018-09-07 | 宜明细胞生物科技有限公司 | 一种利用CRISPR/Cas9系统同源重组修复IL-2RG缺陷基因的方法 |
| KR102158428B1 (ko) | 2018-08-16 | 2020-09-22 | (주)라트바이오 | 인위적 뉴클레아제를 생산하는 형질전환 배아 및 형질전환 동물의 제작 방법 |
| CN110846330B (zh) * | 2018-08-21 | 2021-08-27 | 中国科学院动物研究所 | 一种突变基因及其用于构建蹼足病小型猪模型的用途 |
| CN109321600A (zh) * | 2018-10-19 | 2019-02-12 | 中国农业大学 | 一种培育生产低致敏性牛奶的牛的方法及其应用 |
| CN109735630A (zh) * | 2019-01-05 | 2019-05-10 | 兰州大学 | 绵羊zfy基因单核苷酸多态性标记的检测方法及标记应用 |
| CN111484994B (zh) * | 2019-01-29 | 2022-04-19 | 四川大学华西医院 | CRISPR-Cas9特异性敲除猪Fah、Rag2双基因的方法 |
| CN109777834A (zh) * | 2019-02-25 | 2019-05-21 | 中国科学院广州生物医药与健康研究院 | 一种重度免疫缺陷猪模型及其构建方法和应用 |
| BR112021018607A2 (pt) | 2019-03-19 | 2021-11-23 | Massachusetts Inst Technology | Métodos e composições para editar sequências de nucleotídeos |
| US11859213B2 (en) | 2019-05-16 | 2024-01-02 | Regents Of The University Of Minnesota | Development of superior chimerism by hiPSC engineering and embryo aggregation |
| CN110452929B (zh) * | 2019-07-09 | 2021-07-20 | 中山大学 | 一种非嵌合基因编辑猪胚胎模型的构建方法 |
| US20220256821A1 (en) * | 2019-07-15 | 2022-08-18 | The General Hospital Corporation | Zebrafish deletion and compound mutants and uses thereof |
| CN110305872A (zh) * | 2019-07-17 | 2019-10-08 | 中国农业科学院北京畜牧兽医研究所 | 小型猪2型糖尿病模型的构建方法及应用 |
| EP4013859A4 (en) * | 2019-08-15 | 2023-10-11 | The Rockefeller University | CRISPR-BASED GENOME EDITING WITH CELL SURFACE DISPLAY TO PRODUCE HOMOZYGOTICLY ENGINEERED EUKARYOTIC CELLS |
| CN112538497B (zh) * | 2019-09-20 | 2023-02-28 | 南京启真基因工程有限公司 | CRISPR/Cas9系统及其在构建α、β和α&β地中海贫血模型猪细胞系中的应用 |
| EP4061338A1 (en) | 2019-11-22 | 2022-09-28 | President And Fellows Of Harvard College | Ionic liquids for drug delivery |
| JP2023525304A (ja) | 2020-05-08 | 2023-06-15 | ザ ブロード インスティテュート,インコーポレーテッド | 標的二本鎖ヌクレオチド配列の両鎖同時編集のための方法および組成物 |
| CN111334529B (zh) * | 2020-05-20 | 2020-09-29 | 中国农业大学 | 一种利用第三代碱基编辑器制备精准blg基因敲除牛的方法 |
| CN111534519B (zh) * | 2020-05-26 | 2021-12-14 | 中国农业科学院北京畜牧兽医研究所 | 识别猪eIF4G1基因的sgRNA及其编码DNA和应用 |
| CA3180217A1 (en) * | 2020-06-02 | 2021-12-09 | Gregory T. Bleck | Nucleic acid constructs for protein manufacture |
| CN113234722B (zh) * | 2021-04-30 | 2023-03-14 | 肇庆市瑞思元生物科技有限公司 | 利用碱基编辑修复与板层状鱼鳞病相关的tgm1 c607t突变的试剂和方法 |
| CN113583944B (zh) * | 2021-09-15 | 2023-07-21 | 广西壮族自治区水牛研究所 | 激活Wnt/β-catenin信号通路在提高水牛体外胚胎生产效率中的应用 |
| KR20240082406A (ko) | 2021-10-08 | 2024-06-10 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 약물 전달을 위한 이온성 액체 |
| WO2023077360A1 (zh) * | 2021-11-04 | 2023-05-11 | 云南农业大学 | 一种构建重症免疫缺陷和肝损伤双重猪模型的方法及应用 |
| WO2023114476A1 (en) * | 2021-12-17 | 2023-06-22 | Schmelzle Laurie | Systems and methods for generating and managing non-fungible digital representations of living, biological, or eukaryotic organisms |
| CN115341044A (zh) * | 2022-10-19 | 2022-11-15 | 佛山科学技术学院 | 一种利用微生物及其相关snp位点预测猪日增重的方法 |
| CN115786343B (zh) * | 2022-11-17 | 2024-08-30 | 石河子大学 | 一种猪Zfy基因的RNA干扰片段、表达载体及其应用 |
| CN116790604B (zh) * | 2023-08-18 | 2023-10-27 | 成都中科奥格生物科技有限公司 | 一种sgRNA、CRISPR/Cas9载体及其构建方法和用途 |
Family Cites Families (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4873191A (en) | 1981-06-12 | 1989-10-10 | Ohio University | Genetic transformation of zygotes |
| EP0821070A1 (en) | 1996-07-22 | 1998-01-28 | Carelli, Claude Marcel Henri | Pit-1 gene polymorphism and trait selection in animals |
| WO2000022098A1 (en) | 1998-10-12 | 2000-04-20 | Geron Bio-Med Limited | Porcine oocytes with improved developmental competence |
| WO2001030965A2 (en) | 1999-10-28 | 2001-05-03 | The Board Of Trustees Of The Leland Stanford Junior University | Methods of in vivo gene transfer using a sleeping beauty transposon system |
| JP4968498B2 (ja) | 2002-01-23 | 2012-07-04 | ユニバーシティ オブ ユタ リサーチ ファウンデーション | ジンクフィンガーヌクレアーゼを用いる、標的化された染色体変異誘発 |
| BR0317329A (pt) | 2002-12-31 | 2005-11-08 | Mmi Genomics Inc | Composições, métodos e sistemas para inferir traços bovinos |
| US7985739B2 (en) | 2003-06-04 | 2011-07-26 | The Board Of Trustees Of The Leland Stanford Junior University | Enhanced sleeping beauty transposon system and methods for using the same |
| US20050153317A1 (en) | 2003-10-24 | 2005-07-14 | Metamorphix, Inc. | Methods and systems for inferring traits to breed and manage non-beef livestock |
| US7420099B2 (en) * | 2004-04-22 | 2008-09-02 | Kirin Holdings Kabushiki Kaisha | Transgenic animals and uses thereof |
| NZ554824A (en) * | 2004-10-22 | 2010-10-29 | Revivicor Inc | Porcines that lack endogenous antibody chains and express exogenous immunoglobulins |
| US20070033666A1 (en) | 2005-06-24 | 2007-02-08 | Harris Reuben S | Using cytosine deaminases to diminish retroelement transfer from pigs to humans |
| WO2009042186A2 (en) * | 2007-09-27 | 2009-04-02 | Sangamo Biosciences, Inc. | Genomic editing in zebrafish using zinc finger nucleases |
| US8309791B2 (en) | 2008-07-16 | 2012-11-13 | Recombinectics, Inc. | Method for producing a transgenic pig using a hyper-methylated transposon |
| CN102625655B (zh) * | 2008-12-04 | 2016-07-06 | 桑格摩生物科学股份有限公司 | 使用锌指核酸酶在大鼠中进行基因组编辑 |
| US20110030072A1 (en) * | 2008-12-04 | 2011-02-03 | Sigma-Aldrich Co. | Genome editing of immunodeficiency genes in animals |
| US20110023140A1 (en) | 2008-12-04 | 2011-01-27 | Sigma-Aldrich Co. | Rabbit genome editing with zinc finger nucleases |
| US20110023159A1 (en) | 2008-12-04 | 2011-01-27 | Sigma-Aldrich Co. | Ovine genome editing with zinc finger nucleases |
| KR20100080068A (ko) | 2008-12-31 | 2010-07-08 | 주식회사 툴젠 | 신규한 징크 핑거 뉴클레아제 및 이의 용도 |
| US20120192298A1 (en) | 2009-07-24 | 2012-07-26 | Sigma Aldrich Co. Llc | Method for genome editing |
| CN102858985A (zh) * | 2009-07-24 | 2013-01-02 | 西格马-奥尔德里奇有限责任公司 | 基因组编辑方法 |
| WO2011017315A2 (en) | 2009-08-03 | 2011-02-10 | Recombinetics, Inc. | Methods and compositions for targeted gene modification |
| US8354389B2 (en) | 2009-08-14 | 2013-01-15 | Regeneron Pharmaceuticals, Inc. | miRNA-regulated differentiation-dependent self-deleting cassette |
| JP2013513389A (ja) | 2009-12-10 | 2013-04-22 | リージェンツ オブ ザ ユニバーシティ オブ ミネソタ | Talエフェクターに媒介されるdna修飾 |
| JP2013518602A (ja) * | 2010-02-09 | 2013-05-23 | サンガモ バイオサイエンシーズ, インコーポレイテッド | 部分的に一本鎖のドナー分子による標的化ゲノム改変 |
| BR112012020257A8 (pt) | 2010-02-11 | 2018-02-14 | Recombinetics Inc | métodos e aparelhos para produzir artiodátilos transgênicos |
| JP5841322B2 (ja) | 2010-04-22 | 2016-01-13 | オレゴン ヘルス アンド サイエンス ユニバーシティ | フマリルアセト酢酸ヒドロラーゼ(fah)欠損性ブタおよびその使用 |
| EP2560473A1 (en) * | 2010-04-23 | 2013-02-27 | Pioneer Hi-Bred International Inc. | Gene switch compositions and methods of use |
| EP2392208B1 (en) | 2010-06-07 | 2016-05-04 | Helmholtz Zentrum München Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH) | Fusion proteins comprising a DNA-binding domain of a Tal effector protein and a non-specific cleavage domain of a restriction nuclease and their use |
| EP2582230A1 (en) * | 2010-06-17 | 2013-04-24 | Kymab Limited | Animal models and therapeutic molecules |
| WO2012012738A1 (en) | 2010-07-23 | 2012-01-26 | Sigma-Aldrich Co., Llc | Genome editing using targeting endonucleases and single-stranded nucleic acids |
| US9528124B2 (en) | 2013-08-27 | 2016-12-27 | Recombinetics, Inc. | Efficient non-meiotic allele introgression |
| CN106417184A (zh) | 2011-02-25 | 2017-02-22 | 重组股份有限公司 | 经遗传修饰的动物及其生成方法 |
| JP6158170B2 (ja) | 2011-04-27 | 2017-07-12 | アミリス, インコーポレイテッド | ゲノム修飾のための方法 |
| MX2014009835A (es) | 2012-02-15 | 2014-12-08 | Mice With Horns Llc | Animales transgénicos con características personalizables. |
| HUE038850T2 (hu) | 2012-05-25 | 2018-11-28 | Univ California | Eljárások és kompozíciók cél-DNS RNS-irányított módosításához és transzkripció RNS-irányított modulálásához |
| AR091482A1 (es) * | 2012-06-21 | 2015-02-04 | Recombinetics Inc | Celulas modificadas geneticamente y metodos par su obtencion |
| US10058078B2 (en) | 2012-07-31 | 2018-08-28 | Recombinetics, Inc. | Production of FMDV-resistant livestock by allele substitution |
| US20140115728A1 (en) | 2012-10-24 | 2014-04-24 | A. Joseph Tector | Double knockout (gt/cmah-ko) pigs, organs and tissues |
| MX2015005255A (es) | 2012-10-30 | 2015-10-29 | Recombinetics Inc | Control de la maduracion sexual en animales. |
| ES2655442T3 (es) | 2012-11-05 | 2018-02-20 | Regeneron Pharmaceuticals, Inc. | Animales no humanos modificados genéticamente y métodos de uso de los mismos |
| KR101844123B1 (ko) | 2012-12-06 | 2018-04-02 | 시그마-알드리치 컴퍼니., 엘엘씨 | Crispr-기초된 유전체 변형과 조절 |
| US8697359B1 (en) | 2012-12-12 | 2014-04-15 | The Broad Institute, Inc. | CRISPR-Cas systems and methods for altering expression of gene products |
| AU2013359262C1 (en) | 2012-12-12 | 2021-05-13 | Massachusetts Institute Of Technology | CRISPR-Cas component systems, methods and compositions for sequence manipulation |
| CA2895155C (en) | 2012-12-17 | 2021-07-06 | President And Fellows Of Harvard College | Rna-guided human genome engineering |
| WO2014143381A1 (en) * | 2013-03-09 | 2014-09-18 | Agilent Technologies, Inc. | Methods of in vivo engineering of large sequences using multiple crispr/cas selections of recombineering events |
| US9234213B2 (en) | 2013-03-15 | 2016-01-12 | System Biosciences, Llc | Compositions and methods directed to CRISPR/Cas genomic engineering systems |
| WO2014161821A1 (en) | 2013-04-02 | 2014-10-09 | Bayer Cropscience Nv | Targeted genome engineering in eukaryotes |
| US20150013025A1 (en) | 2013-05-19 | 2015-01-08 | Mice With Horns, Llc | Transgenic animals with customizable traits |
| US20140359795A1 (en) | 2013-05-31 | 2014-12-04 | Recombinetics, Inc. | Genetic techniques for making animals with sortable sperm |
| US20140359796A1 (en) | 2013-05-31 | 2014-12-04 | Recombinetics, Inc. | Genetically sterile animals |
| US10704060B2 (en) | 2013-06-05 | 2020-07-07 | Duke University | RNA-guided gene editing and gene regulation |
| CN116042726A (zh) | 2013-07-09 | 2023-05-02 | 哈佛大学校长及研究员协会 | 多重rna向导的基因组工程 |
| US9670458B2 (en) | 2013-07-13 | 2017-06-06 | Aggenetics, Inc. | Methods for spermatogonial stem cell (SSC) transfer |
| US9163284B2 (en) | 2013-08-09 | 2015-10-20 | President And Fellows Of Harvard College | Methods for identifying a target site of a Cas9 nuclease |
| US20150064149A1 (en) | 2013-09-04 | 2015-03-05 | Mice With Horns, LLC. | Materials and methods for correcting recessive mutations in animals |
| WO2015052231A2 (en) | 2013-10-08 | 2015-04-16 | Technical University Of Denmark | Multiplex editing system |
| US10787684B2 (en) | 2013-11-19 | 2020-09-29 | President And Fellows Of Harvard College | Large gene excision and insertion |
| CA3075047C (en) | 2014-02-11 | 2022-02-01 | The Regents Of The University Of Colorado, A Body Corporate | Crispr enable method for multiplex genome editing |
| CN111647627A (zh) * | 2014-04-28 | 2020-09-11 | 重组股份有限公司 | 多重基因编辑 |
-
2015
- 2015-04-28 CN CN202010235249.6A patent/CN111647627A/zh active Pending
- 2015-04-28 MX MX2016014066A patent/MX2016014066A/es unknown
- 2015-04-28 BR BR122023023211-9A patent/BR122023023211A2/pt unknown
- 2015-04-28 JP JP2016565064A patent/JP2017513510A/ja active Pending
- 2015-04-28 US US14/698,561 patent/US20160029604A1/en not_active Abandoned
- 2015-04-28 AR ARP150101276A patent/AR100216A1/es unknown
- 2015-04-28 WO PCT/US2015/027995 patent/WO2015168125A1/en active Application Filing
- 2015-04-28 CN CN201580030358.1A patent/CN106535630B/zh active Active
- 2015-04-28 CA CA2946881A patent/CA2946881A1/en not_active Abandoned
- 2015-04-28 KR KR1020167032557A patent/KR20170003585A/ko unknown
- 2015-04-28 BR BR112016024945A patent/BR112016024945A2/pt active IP Right Grant
- 2015-04-28 EP EP15723593.8A patent/EP3136850A1/en not_active Withdrawn
- 2015-04-28 AU AU2015253352A patent/AU2015253352A1/en not_active Abandoned
- 2015-04-28 AP AP2016009588A patent/AP2016009588A0/en unknown
-
2016
- 2016-10-28 PH PH12016502162A patent/PH12016502162A1/en unknown
-
2018
- 2018-03-16 US US15/923,951 patent/US20180235194A1/en not_active Abandoned
-
2021
- 2021-07-19 US US17/379,898 patent/US12070022B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102270145B1 (ko) * | 2019-12-27 | 2021-07-01 | 서울대학교산학협력단 | Btk 넉아웃 질환모델용 돼지 및 이의 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3136850A1 (en) | 2017-03-08 |
| WO2015168125A1 (en) | 2015-11-05 |
| AU2015253352A1 (en) | 2016-12-08 |
| PH12016502162A1 (en) | 2017-02-06 |
| BR112016024945A2 (pt) | 2017-10-24 |
| BR122023023211A2 (pt) | 2024-01-23 |
| US12070022B2 (en) | 2024-08-27 |
| CA2946881A1 (en) | 2015-11-05 |
| CN106535630A (zh) | 2017-03-22 |
| CN111647627A (zh) | 2020-09-11 |
| US20160029604A1 (en) | 2016-02-04 |
| JP2017513510A (ja) | 2017-06-01 |
| MX2016014066A (es) | 2017-05-03 |
| US20220056482A1 (en) | 2022-02-24 |
| AP2016009588A0 (en) | 2016-11-30 |
| US20180235194A1 (en) | 2018-08-23 |
| AR100216A1 (es) | 2016-09-21 |
| CN106535630B (zh) | 2020-04-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12070022B2 (en) | Methods for making genetic edits | |
| US20200017882A1 (en) | Engineering of humanized car t-cell and platelets by genetic complementation | |
| US20190335725A1 (en) | Genetically sterile animals | |
| CA3003652A1 (en) | Compositions and methods for chimeric embryo-assisted organ production | |
| US20190223417A1 (en) | Genetically modified animals having increased heat tolerance | |
| US10893667B2 (en) | Non-meiotic allele introgression | |
| US20190254266A1 (en) | Engineering of Humanized Kidney by Genetic Complementation | |
| US20210037797A1 (en) | Inducible disease models methods of making them and use in tissue complementation | |
| NZ715540B2 (en) | Genetically sterile animals |