JP2017513510A - ブタにおける多重遺伝子編集 - Google Patents
ブタにおける多重遺伝子編集 Download PDFInfo
- Publication number
- JP2017513510A JP2017513510A JP2016565064A JP2016565064A JP2017513510A JP 2017513510 A JP2017513510 A JP 2017513510A JP 2016565064 A JP2016565064 A JP 2016565064A JP 2016565064 A JP2016565064 A JP 2016565064A JP 2017513510 A JP2017513510 A JP 2017513510A
- Authority
- JP
- Japan
- Prior art keywords
- gene
- cell
- cells
- animal
- embryo
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0276—Knockout animals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/873—Techniques for producing new embryos, e.g. nuclear transfer, manipulation of totipotent cells or production of chimeric embryos
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/90—Stable introduction of foreign DNA into chromosome
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/90—Stable introduction of foreign DNA into chromosome
- C12N15/902—Stable introduction of foreign DNA into chromosome using homologous recombination
- C12N15/907—Stable introduction of foreign DNA into chromosome using homologous recombination in mammalian cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/16—Hydrolases (3) acting on ester bonds (3.1)
- C12N9/22—Ribonucleases RNAses, DNAses
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/15—Animals comprising multiple alterations of the genome, by transgenesis or homologous recombination, e.g. obtained by cross-breeding
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/101—Bovine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/108—Swine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/02—Animal zootechnically ameliorated
Abstract
Description
本願は、2014年4月28日に出願された米国仮特許出願第61/985,327号明細書(ここで参照により本明細書中に援用される)に対する優先権を主張する。
キメラは、宿主胚盤胞を調製し、ドナー動物由来のドナー細胞を加えることによって作製され得る。得られた動物は、宿主およびドナーの双方に由来する細胞を有するキメラとなる。一部の遺伝子は、特定種の細胞および細胞系譜を作出するための胚にとって必要とされる。かかる遺伝子が宿主細胞内でノックアウトされると、欠損遺伝子を有するドナー細胞の導入により、それら細胞および細胞系譜が宿主胚に回復され、回復された細胞がドナー遺伝子型を有する事態が生じ得る。かかる方法は補完法と称される。
多重の場合、所望される組み合わせの対立遺伝子を有するF0世代を作製するため、2つ、3つ、またはそれより多くの遺伝子(2〜25)を同時にノックアウトしてもよい。ノックアウトのすべてについてのホモ接合性はFTTを作出し、次いで1つの選択肢は、ノックアウトの1つ(状況に応じて最低限のヘテロ接合性が必要であるべきあらゆる場合など)を除くすべてについてホモ接合性であるファウンダーを作製することである。その1つのヘテロ接合性遺伝子は、非FTT表現型を許容し得る。あるいは、FTT子孫を有するキメラを繁栄させるため、多重ノックアウトは相補性と併用され得る。この方法は、複数のノックアウト動物の作出において世代を排除させ得る。
実施形態の1群は、免疫不全ブタまたは他の家畜およびそれらを作製する方法に関する。これらの実施形態は、ホモ接合性およびヘテロ接合性のノックアウト遺伝子型の選択を管理するための機会を利用する、多重編集例、例えばノックアウトである。これらは、ファウンダー系統を迅速に樹立するための多重の能力を示している。それらはまた、キメラの作製を含む本発明の態様をさらに含む。
食用動物ゲノムの編集は、極めて多数の遺伝子座を同時に編集し、同時に1つでなく作製される対立遺伝子を結び付けることが必要となる動物の繁殖で世代を保存することにより、大いに促進され得る。さらに、一部の農業形質は複雑であり、2つ以上(2から数百)の遺伝子での対立遺伝子の影響の結果として顕現することをそれは意味する。例えば、DGAT、ABCG2での多型、および染色体18での多型は、併せて、乳牛におけるNet Dairy Meritの変動の大部分を占める。家畜の細胞または胚は、様々な農業標的、すなわち、ACAN、AMELY、BLG、BMP 1B(FecB)、DAZL、DGAT、Eif4GI、GDF8、Horn−poll locus、IGF2、CWC15、KissR/GRP54、OFD1Y、p65、PRLR、Prmd14、PRNP、Rosa、Socs2、SRY、ZFY、β−ラクトグロブリン、CLPGの1つ以上を含む、極めて多数の遺伝子の多重編集がなされ得る。
がんのような一部の形質は、複数の遺伝子での突然変異に基づいて引き起こされる(APC/p53を参照)。さらに、極めて多数の疾患形質は、2つ以上の遺伝子で対立遺伝子の影響の結果として現れる、いわゆる複合形質である。例えば、糖尿病、代謝、心疾患、および神経性疾患は複合形質と考えられる。実施形態は、個別の対立遺伝子において、または他の遺伝子での対立遺伝子と異なる組み合わせで組み合わせて、ヘテロ接合性およびホモ接合性である動物モデルを含む。例えば、MODY1(HNF4α)、MODY2(GCK)、MODY3(HNF1α)、MODY4(Pdx1)、MODY5(HNF−1β)、MODY6(神経原性分化1)、MODY7(KLF11)、MODY8(CEL)、MODY9(PAX4)、MODY10(INS)、MODY11(BLK)を含む、若年成人発症型糖尿病(MODY)の遺伝子座は、糖尿病を個別かつ相加的に引き起こす。家畜の細胞または胚は、様々な疾患モデリング標的を含む動物モデリングのため、極めて多数の遺伝子、すなわち、APC、ApoE、DMD、GHRHR、HR、HSD11B2、LDLR、NF1、NPPA、NR3C2、p53、PKD1、Rbm20、SCNN1G、tP53、DAZL、FAH、HBB、IL2RG、PDX1、PITX3、Runx1、RAG2、GGTAの多重編集が施され得る。実施形態は、上記標的の1つ以上が編集、例えばノックアウトされている、細胞、胚、および動物を含む。
多重編集は、細胞または器官を特定の胚または動物の微小環境から意図的に切り出し、より優れたドナー細胞の組込み、増殖、および分化に寄与する環境を作出し、胚、胎児または動物におけるオルソロガスな細胞、組織または器官での補完によりそれらの寄与を増強するように用いることができる。空の微小環境を有する動物は、ドナー細胞および遺伝子によって満たされ得る欠損を有するように作出されていることから、欠損キャリアである。具体的な例として、レシピエントの除去、および配偶子形成細胞系譜(DAZL、VASA、MIWI、PIWIなど)のドナーレスキュー(donor−rescue)を含む。
特定の標的および標的化エンドヌクレアーゼに関連する本明細書に記載の方法および発明は、幅広く適用可能である。本発明者らは、以下の遺伝子のすべてを用いた編集を伴うクローン化に適した初代家畜細胞を調製している。
遺伝的に発現可能なマーカーを定位置に残し、動物外でのその交配を可能とする方法を用い、または動物中にマーカーを配置しない方法により、染色体改変について単アレル性または両アレル性の動物が作製され得る。例えば、本発明者らは、動物の染色体の変化、または動物の染色体中への外因性遺伝子の挿入を作製するため、相同依存性組換え(HDR)の方法を用いている。TALENおよびリコンビナーゼ融合タンパク質などのツール、ならびに従来の方法が、本明細書の他の箇所で考察される。本明細書に開示の遺伝子改変を支持する実験データの一部が次のようにまとめられる。本発明者らは、改変細胞の多遺伝子集団からクローン化する場合の例外的なクローン化効率を先行的に実証し、単離コロニーについての体細胞核移植(SCNT)によるクローン化効率の変動を回避するためにこの手法を提唱している(Carlsonら,2011)。しかしさらに、TALEN媒介ゲノム改変、およびリコンビナーゼ融合分子による改変は、単一世代における両アレル改変の達成をもたらす。例えば、ノックアウト遺伝子についてホモ接合性の動物は、SCNTにより、ホモ接合性をもたらすための同系交配を伴わずに作製され得る。ブタおよびウシなどの家畜についての妊娠期間および生殖齢への成熟は、研究および生産に対する大きな障壁である。例えば、クローン化および交配によるヘテロ接合性突然変異細胞(両方の性)からのホモ接合性ノックアウトの作製には、ブタおよびウシの各々について16および30ヵ月が必要となる。一部は、遺伝子改変およびSCNT(Kuroiwaら、2004)の連続サイクルによりこの負荷を低減させているが、これは技術的に困難であり、法外な費用がかかり、その上、大型脊椎動物実験モデルまたは家畜に対して実際に有用であるべき、F0動物を作製するための連続クローニングを回避するのに多くの理由がある。SCNT前に両アレルKO細胞を定型的に作製する能力は、大型動物の遺伝子操作における大きな進歩である。両アレルノックアウトは、ZFNおよび希釈クローン化などの他の方法を用いて不死細胞系において達成されている(Liuら、2010)。別のグループは近年、市販のZFN試薬を用いてブタGGTA1の両アレルKOを実証し(Hauschildら、2011)、両アレルヌル細胞をGGTA1依存性表面エピトープの不存在についてFACSにより濃縮することができる。これらの研究は、ある有用な概念を実証する一方、彼らは動物または家畜が改変され得ることを示すものではない。というのは、簡易なクローン希釈は一般に初代線維芽細胞単離株に適しておらず(線維芽細胞は低密度における成長が不十分である)、ヌル細胞についての生物学的濃縮が大多数の遺伝子に利用可能でないためである。
相同性指向修復(HDR)は、ssDNAおよび二本鎖DNA(dsDNA)損傷を修復するための細胞内機構である。この修復機構は、損傷部位と有意な相同性を有する配列を有するHDR鋳型が存在する場合、細胞により用いられ得る。特異的結合は、生物学分野において一般に使用される用語であり、非標的組織と比べて相対的に高い親和性で標的に結合し、一般に複数の非共有結合性相互作用、例えば、静電相互作用、ファンデルワールス相互作用、水素結合などを含む分子を指す。特異的ハイブリダイゼーションは、相補配列を有する核酸間の特異的結合の形態である。タンパク質もまた、例えば、TALENもしくはCRISPR/Cas9系において、またはGal4モチーフによりDNAに特異的に結合し得る。対立遺伝子の遺伝子移入は、テンプレートガイド型プロセスを用いて内因性対立遺伝子を上回って外因性対立遺伝子をコピーするプロセスを指す。内因性対立遺伝子は実際に切り出され、一部の状況において外因性核酸対立遺伝子により置換され得るが、現行の理論では同プロセスはコピー機構であるということである。対立遺伝子は遺伝子対であるため、それらの間には有意な相同性が存在する。対立遺伝子は、タンパク質をコードする遺伝子であり得るか、あるいはそれは他の機能、例えば生物活性RNA鎖をコードすることまたは調節タンパク質もしくはRNAを受容するための部位を提供することを有し得る。
転写活性化因子様エフェクターヌクレアーゼ(TALEN)および亜鉛フィンガーヌクレアーゼ(ZFN)などのゲノム編集ツールは、バイオテクノロジー、遺伝子療法および多くの生物における機能的ゲノム研究の分野に影響を及ぼしている。ごく最近、RNAガイド型エンドヌクレアーゼ(RGEN)が、相補的RNA分子によりその標的部位に誘導される。Cas9/CRISPR系は、REGENである。tracrRNAは、別のそのようなツールである。これらは、標的化ヌクレアーゼ系の例であり:これらの系は、ヌクレアーゼを標的部位に局在化させるDNA結合メンバーを有する。次に、同部位はヌクレアーゼによって切断される。TALENおよびZFNは、DNA結合メンバーに融合されたヌクレアーゼを有する。Cas9/CRISPRは同族であり、標的DNA上で互いに遭遇する。DNA結合メンバーは、染色体DNA中に同族配列を有する。DNA結合メンバーは、典型的には、目的部位においても、その近傍においても核酸分解作用が生じないように意図される同族配列に照らして設計される。ある実施形態は、全てのかかる系、例として限定されないが、ヌクレアーゼ再切断を最小化する実施形態、目的残基において正確にSNPを作製するための実施形態、およびDNA結合部位において遺伝子移入されつつある対立遺伝子の配置に適用可能である。
TALENという用語は、本明細書で用いられるとき、広義であり、別のTALENからの支援なしで二本鎖DNAを切断し得る単量体TALENを含む。TALENという用語はまた、同一部位においてDNAを切断するために一緒に機能するように遺伝子操作されたTALENのペアの一方または両方のメンバーを指すために用いられる。一緒に機能するTALENは、DNAまたはTALENペアの掌性を参照する左側TALENおよび右側TALENと称される場合がある。
亜鉛フィンガーヌクレアーゼ(ZFN)は、亜鉛フィンガーDNA結合ドメインをDNA切断ドメインに融合させることにより生成される人工的制限酵素である。亜鉛フィンガードメインは、所望のDNA配列を標的化するように遺伝子操作することができ、これにより、亜鉛フィンガーヌクレアーゼが複合体ゲノム内のユニーク配列を標的化することが可能となる。内因性DNA修復機構を利用することにより、これらの試薬は、高等生物のゲノムを改変するために用いることができる。ZFNは、遺伝子を不活性化させる方法において用いてもよい。
種々の核酸は、ノックアウト目的のため、遺伝子の不活性化のため、遺伝子の発現を得るため、または他の目的のため、細胞に導入してもよい。本明細書で用いられるとき、核酸という用語は、DNA、RNA、および核酸アナログ、および二本鎖または一本鎖(すなわちセンスまたはアンチセンス一本鎖)である核酸を含む。核酸アナログは、例えば、核酸の安定性、ハイブリダイゼーション、または溶解度を改善するため、塩基部分、糖部分、またはリン酸骨格において改変され得る。デオキシリボースリン酸骨格は、各々の塩基部分が六員のモルホリノ環に連結しているモルホリノ核酸、またはデオキシリン酸骨格がシュードペプチド骨格により置換され、かつ4つの塩基が保持されたペプチド核酸を生産するように改変され得る。
動物は、TALENまたは他の遺伝子操作ツール、例として、リコンビナーゼ融合タンパク質、または公知の種々のベクターを用いて改変してもよい。かかるツールによって行われる遺伝子改変は、遺伝子の破壊を含んでもよい。遺伝子の破壊という用語は、機能的遺伝子産物の形成を阻止することを指す。遺伝子産物は、その正常な(野生型)機能を実行する場合に限り機能的である。遺伝子の破壊は、遺伝子によりコードされる機能的因子の発現を阻止し、遺伝子によりコードされる配列ならびに/または動物における遺伝子の発現に必要なプロモーターおよび/もしくはオペレーターの中での1つ以上の塩基の挿入、欠失、または置換を含む。破壊される遺伝子は、例えば、動物のゲノムからの遺伝子の少なくとも一部の除去、遺伝子によりコードされる機能的因子の発現を阻止するための遺伝子の改変、干渉RNA、または外因性遺伝子によるドミナントネガティブ因子の発現により破壊してもよい。遺伝子改変動物の材料および方法は、全ての目的のために参照により本明細書中に援用される、米国特許第8,518,701号明細書;米国特許出願公開第2010/0251395号明細書;および米国特許出願公開第2012/0222143号明細書にさらに詳述されており、矛盾する場合、本明細書が優先する。トランス作用性という用語は、異なる分子からの標的遺伝子に対して(すなわち分子間で)作用するプロセスを指す。トランス作用因子は通常、遺伝子を有するDNA配列である。この遺伝子は、標的遺伝子の調節において用いられるタンパク質(またはマイクロRNAもしくは他の拡散性分子)をコードする。トランス作用性遺伝子は、標的遺伝子と同じ染色体上に存在し得るが、活性は、中間タンパク質またはそれがコードするRNAを介するものである。トランス作用性遺伝子の実施形態は、例えば標的化エンドヌクレアーゼをコードする遺伝子である。ドミナントネガティブを用いた遺伝子の不活性化は、一般にトランス作用因子を含む。シス調節性またはシス作用性という用語は、タンパク質もRNAもコードしない場合の作用を意味する一方、遺伝子不活性化との関連では、これは一般に、遺伝子のコード部分、または機能的遺伝子の発現に必要なプロモーターおよび/もしくはオペレーターの不活性化を意味する。
種々の干渉RNA(RNAi)は公知である。二本鎖RNA(dsRNA)は、相同遺伝子転写物の配列特異的分解を誘導する。RNA誘導サイレンシング複合体(RISC)は、dsRNAを低分子の21〜23ヌクレオチドの低分子干渉RNA(siRNA)に代謝する。RISCは、二本鎖リボヌクレアーゼ(dsRNアーゼ、例えばダイサー)およびssRNアーゼ(例えば、Argonaut2またはAgo2)を有する。RISCは、切断可能な標的を見出すためのガイドとしてアンチセンス鎖を利用する。siRNAおよびマイクロRNA(miRNA)の双方は公知である。遺伝子改変動物における遺伝子を破壊する方法は、標的遺伝子および/または核酸の発現が低減するように、標的遺伝子および/または核酸に対するRNA干渉を誘導することを含む。
誘導性系は、遺伝子の発現を制御するため、用いてもよい。遺伝子の発現の時空間的調節を可能とする様々な誘導性系が公知である。幾つかは、トランスジェニック動物においてインビボで機能的であることが判明している。誘導性系という用語は、慣習的なプロモーターおよび誘導性遺伝子発現因子を含む。
したがって、遺伝子は、除去またはRNAi抑制だけでなく、その遺伝子産物の通常の機能に対して阻害効果を有するタンパク質のドミナントネガティブバリアントの作出/発現によっても破壊され得る。ドミナントネガティブ(DN)遺伝子の発現は、表現型の変更をもたらし得、a)タイトレーション効果;(DNは、同一の活性を構成せずに内因性遺伝子の協調的因子または通常標的のいずれかについて内因性遺伝子産物と受動的に競合する)、b)ドミナントネガティブ遺伝子産物が通常の遺伝子機能に要求されるプロセスと能動的に干渉するポイズンピル(またはモンキーレンチ)効果、c)DNが遺伝子機能の負の制御因子を能動的に刺激するフィードバック効果により発揮される。
ファウンダー動物(F0世代)は、クローン化および本明細書に記載の他の方法により作製してもよい。ファウンダーは、接合体または初代細胞がホモ接合性の改変を受ける場合のように、遺伝子改変についてホモ接合性であり得る。同様に、ファウンダーはまた、ヘテロ接合性に作製され得る。ファウンダーはゲノム的に改変されていてもよく、このことは、そのゲノムにおける細胞が改変を受けていることを意味する。ファウンダーは、ベクターが典型的には胚盤胞段階で胚における複数の細胞の1つに導入される場合に生じ得るように、改変についてモザイクであり得る。モザイク動物の子孫は、ゲノム的に改変されている子孫を同定するため、試験してもよい。動物系統は、有性生殖させることができ、または生殖補助技術により生殖させることができ、異種またはホモ接合性の子孫が常に改変を発現する動物のプールが作出されている場合、樹立される。
本発明の実施形態は、標的化ヌクレアーゼ系を、リコンビナーゼ(例えば、RecAタンパク質、Rad51)またはDNA組換えに関連する他のDNA結合タンパク質とともに投与することを含む。リコンビナーゼは、核酸断片とフィラメントを形成し、事実上、細胞DNAを探索してその配列と実質的に相同なDNA配列を見出す。例えば、リコンビナーゼは、HDRに対する鋳型として機能する核酸配列と複合し得る。次いで、リコンビナーゼはHDR鋳型と複合してフィラメントを形成し、細胞内に配置される。リコンビナーゼおよび/またはリコンビナーゼと複合するHDR鋳型は、細胞または胚の中に、タンパク質、mRNAとして、またはリコンビナーゼをコードするベクターを用いて配置され得る。米国特許出願公開第2011/0059160号明細書(米国特許出願第12/869,232号明細書)の開示は、本明細書によりあらゆる目的のために参照により本明細書中に援用され、矛盾する場合、本明細書が優先する。リコンビナーゼという用語は、細胞内で2つの比較的長いDNA鎖間での比較的短いDNA片の連結を酵素的に触媒する遺伝子組換え酵素を指す。リコンビナーゼとして、Creリコンビナーゼ、Hinリコンビナーゼ、RecA、RAD51、Cre、およびFLPが挙げられる。Creリコンビナーゼは、loxP部位間のDNAの部位特異的組換えを触媒するP1バクテリオファージ由来のI型トポイソメラーゼである。Hinリコンビナーゼは、サルモネラ(Salmonella)菌中に見出される198アミノ酸から構成される21kDのタンパク質である。Hinは、DNA切断および組換えの開始を活性部位セリンに依存するDNAインベルターゼのセリンリコンビナーゼファミリーに属する。RAD51はヒト遺伝子である。この遺伝子によりコードされるタンパク質は、DNA二本鎖分解の修復を支援するRAD51タンパク質ファミリーのメンバーである。RAD51ファミリーメンバーは、細菌RecAおよび酵母Rad51と相同である。Creリコンビナーゼは、loxP部位により隣接される特定の配列を欠失させるための実験において用いられる酵素である。FLPは、パン酵母の出芽酵母(Saccharomyces cerevisiae)の2μプラスミドに由来するフリッパーゼ組換え酵素(FLPまたはFlp)を指す。
本発明はまた、例えば、部位特異的エンドヌクレアーゼ、CRISPR、Cas9、ZNF、TALEN、RecA−gal4融合物をコードする核酸分子、そのポリペプチドを含有する組成物およびキット、かかる核酸分子もしくはポリペプチド、または遺伝子操作された細胞系を含有する組成物を提供する。示される対立遺伝子の遺伝子移入に対して有効なHDRもまた、提供され得る。かかるアイテムは、例えば研究ツールとして、または治療的に用いることができる。
ブタを、10%ウシ胎仔血清、100I.U./mlのペニシリンおよびストレプトマイシン、および2mMのL−グルタミンを添加したDMEM中、5%CO2、37℃で維持した。遺伝子導入においては、すべてのTALENおよびHDR鋳型を、NEON Transfer system(Life Technologies)を用いて遺伝子導入を介して送達した。つまり、100%コンフルエントに達した低継代のOssabaw、Landraceを1:2に分割し、70〜80%コンフルエントで翌日採取した。各遺伝子導入物は、TALEN mRNAおよびオリゴと混合した緩衝液「R」に再懸濁される500,000〜600,000個の細胞からなり、次のパラメータ、すなわち入力電位;1800V;パルス幅;20ms;およびパルス数;1により100μlの作動体積をもたらす100μlの先端部を用いて電気穿孔した。典型的には、目的の遺伝子に特異的な1〜2μgのTALEN mRNAおよび1〜4μMのHDR鋳型(一本鎖オリゴヌクレオチド)を各遺伝子導入物に含めた。それらの量からの偏差を図や説明文に表示する。遺伝子導入後、細胞を6ウェルディッシュのウェルに3日間蒔き、各々30℃で培養した。編集の安定性を評価するため、3日後、細胞集団をコロニー分析用に蒔いて、かつ/または37℃で少なくとも10日目まで展開した。
目的部位に隣接するPCRを、製造業者の推奨に従い、1μlの細胞ライセートを有する白金Taq DNAポリメラーゼHiFi(Life Technologies)を用いて行った。集団内での突然変異の頻度を、上記のように10μlのPCR産物を用いて、製造業者の推奨に従い、SURVEYOR突然変異検出キット(Transgenomic)を用いて分析した。RFLP分析は、表示の制限酵素を用いて、10μlの上記PCR反応物に対して実施した。SurveyorおよびRFLP反応は、10%TBEポリアクリルアミドゲル上で分解し、臭化エチジウム染色により可視化した。バンドのデンシトメトリー測定を、IMAGEJを用いて実施し、またGuschinら、2010(1)に記載の通りにSurveyor反応物の突然変異率を算出した。パーセント相同組換え修復(HDR)を、RFLP断片の強度和を親バンド+RFLP断片の強度和で除することによって算出した。コロニーのRFLP分析は、PCR産物が1×MYTAQ RED MIX(Bioline)により増幅され、2.5%アガロースゲル上で分解されたことを除けば、同様に扱った。
遺伝子導入後の3日目、50〜250個の細胞を、10cmのディッシュ上に播種し、個々のコロニーの直径が約5mmに達するまで培養した。この時点で、PBSで希釈した6mlのTRYPLE(Life Technologies)1:5(vol/vol)を添加し、コロニーを吸引し、24ウェルディッシュウェルのウェルに移し、同じ条件下で培養した。コンフルエントに達したコロニーを採取し、凍結保存および遺伝子型判定のために分割した。
3日目および10日目、遺伝子導入した細胞集団を6ウェルディッシュのウェルから採取し、10〜30%を、200μg/mlのプロテイナーゼKを新たに添加した、50μlの1×PCRに互換性の溶解用緩衝液:10mMのトリス−Cl pH8.0、2mMのEDTA、0.45%TRYTON X−100(vol/vol)、0.45%ツイーン−20(vol/vol)に再懸濁した。ライセートを、55℃で60分間、95℃で15分間というプログラムを用いて、サーマルサイクラー内で処理した。希釈クローニングからのコロニー試料を、上記のように20〜30μlの溶解用緩衝液を用いて処理した。
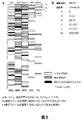
ブタRAG2およびIL2Rγに特異的な6つの条件のTALEN mRNAおよびHDR鋳型を、ブタ線維芽細胞に同時遺伝子導入した。各遺伝子導入に対して一定量のRAG2 mRNAおよび鋳型を用いたが、IL2Rg TALEN mRNAおよびHDR鋳型の量は、表示される各条件に応じて変更する。TALEN mRNAおよびHDR鋳型の用量は、的確な効果および的外れの効果の双方を有する。IL2Rγに対するTALEN mRNAの増加は、IL2Rγに対するNHEJおよびHDRの双方の増加をもたらしたが、RAG2に対するNHEJレベルは不変であった。IL2Rγ HDR鋳型の増加はRAG2遺伝子座でのHDRを低下させたが、これはオリゴヌクレオチドの濃度の増大による相同組換え修復の非特異的阻害を示唆している。RAG2およびIL2Rγに両アレルHDRを伴うコロニーが、2つの条件から4および2パーセント(予想された2パーセントの頻度とそれを超える頻度)で得られた(図3パネルc、パネルd)。予想された頻度は、各HDR対立遺伝子を独立事象として扱う、3日目のHDRレベルの掛け算により算出される。(図3を参照)ブタRAG2およびIL2Rγの多重遺伝子編集。a)遺伝子導入後3日目での細胞集団に対する非相同末端結合(NHEJ)および相同組換え修復HDRの効率を判定するためのSURVEYORおよびRFLP分析。b)遺伝子導入後11日目での細胞集団に対する相同組換え修復におけるRFLP分析。c)IL2Rγ、RAG2または双方でのHDRが陽性であるコロニーの百分率。細胞は、パネルa中の「C」で表示される集団から蒔いた。コロニー遺伝子型の分布を以下に示す。d)IL2RγおよびRAG2に対して2μgおよび1μgの量のTALEN mRNAならびに各々に対して1μMでのHDR鋳型を遺伝子導入した細胞からのコロニー分析。コロニー遺伝子型の分布を以下に示す。
ブタAPCおよびp53に特異的な4つの条件のTALEN mRNAおよびHDR鋳型を、ブタ線維芽細胞に同時遺伝子導入した。APC mRNAの量は、左から右へ順次減少し(図4パネルb)、その量以外は表示の通り一定のままであった。パーセントHDRは、APC mRNAの減少とともに、線形的に低下した。APC TALENの用量変更に伴うp53 HDRに対する効果はほとんど認められなかった。コロニーの遺伝子型判定によると、11日目の値に関連するAPCおよびp53の双方におけるクローンとHDR対立遺伝子との想定される結合より高く、図4パネルcおよび図4パネルdの場合、13.7および7.1パーセントに対して各々、18および20パーセントであることが示された。(図4を参照)ブタAPCおよびp53の多重遺伝子編集。パネルa)遺伝子導入後3日目での細胞集団に対する非相同末端結合(NHEJ)および相同組換え修復HDRの効率を判定するためのSURVEYORおよびRFLP分析。パネルb)遺伝子導入後11日目での細胞集団に対する相同組換え修復におけるRFLP分析。パネルc)およびd)APC、p53または双方でのHDRに対する表示される細胞集団(パネルaの「C」および「D」で表示される)由来の陽性コロニーの百分率。3以上のHDR対立遺伝子を有するコロニーを以下に示す。
実施例1では、HDRの非特異的低下が高濃度のHDRオリゴで認められ、それ故、2+HDRオリゴがHDRの非特異的阻害を伴わずに有効であり得るか否かは未知であった。各標的部位に対して2つの濃度、1uMおよび2uMについて試験した。TALEN活性は2つの条件間で有意に変化しなかったが、HDRは各鋳型に対して2uMの濃度で有意に平滑末端化された。1uMの条件に由来するクローンは種々の遺伝子型を有し、それらの一部は各遺伝子および最大で7つの対立遺伝子において編集を有した(図6)。独立事象として処理される場合、7つの対立遺伝子が編集された、「a」で表示される予想される遺伝子型の頻度は0.001パーセントである。二項分布は、かかる遺伝子型の2+コロニーを72のサイズの試料中に同定する尤度を予測し、この場合の予測では、0.000026パーセント未満である。この高い奏効率は予測できなかったが、想定外でかつ意外である。この結果は、TALEN/HDR鋳型の2つのさらなる組み合わせで繰り返された(図7および8)。最初の試験結果と同様、最大で7つの対立遺伝子および最大で4つの遺伝子においてHDR編集を伴うコロニーが得られた(表A)。幾つかの遺伝子型が偶然、予想をはるかに上回る頻度で回収された。幾つかの遺伝子座での同時二本鎖切断に関する懸念として意図しない染色体再配列の誘導が挙げられるが、試験3の細胞からの試験した50中50の核型が正常であった(データは示さず)。
実施例4A:多重遺伝子編集によりRAG2/IL2Rgヌル(RG−KO)ブタ線維芽細胞を発生させる。
雄ブタ胎児線維芽細胞に、本発明者らが先行的に規定した方法を用いて、RAG2およびIL2Rgの破壊のため、TALENおよびオリゴヌクレオチド鋳型を遺伝子導入することになる(Tan,W.,et al.,Efficient nonmeiotic allele introgression in livestock using custom endonucleases.PNAS,110(41):16526−16531,2013)。RG−KO候補は、配列決定によって確認される通り、例えば制限酵素長多型(RFLP)により同定することになる。少なくとも約5つの確認されたRG−KOコロニーは、クローン化およびキメラ作製における資源としてプールすることになる。
宿主RG−KO胚および雌EGFP標識ドナー細胞を、クロマチン移植技術とそれに続く胚盤胞段階までのインビトロ培養を用いて作製することになる。実施例1からのRG−KO細胞を用いてもよい。7日目のEGFP胚盤胞由来の細胞間凝集塊を、同期させた雌ブタへの胚移植前、6日目のRG−KO胚に注射することになる。この手法を用いて、Nagashimaおよび同僚は、50パーセントを上回る生産子ブタでキメラ化を認めた(Nagashima,H.,et al.,Sex differentiation and germ cell production in chimeric pigs produced by inner cell mass injection into blastocysts.Biol Reprod,70(3):702−707,2004)。雄表現型は、マウスおよびブタの双方におけるインジェクションキメラにおいて優性である。したがって、雌ドナー細胞を注射したXY RG−KO宿主は、雄宿主の遺伝的性質を排他的に伝えることになる。妊娠検査は、適切な時期、例えば25、50、および100日目に行うことになる。妊娠の約100日目の妊娠雌ブタは、約114日目までに、子ブタの帝王切開出産に先立ち1日4回監視することになる。
非キメラ子孫は、T、BおよびNK細胞が欠損しているか否かを判定するため、試験することになる。以下の方法は、そのための1つの技法である。帝王切開出産は、推定上のキメラを保有する各雌ブタおよび野生型子ブタを保有する1つの繁殖雌ブタに対して行うことになる。臍帯血は、帝王切開出産の直後、各子ブタから単離することになる。臍帯血白血球は、T、BおよびNK細胞集団ならびにドナーに由来するEGFP発現について、蛍光標示式細胞分取器(FACS)により評価することになる。さらに、キメラ化は、臍帯血、耳および尾の生検からPCRにより評価することになる。この初期分析は、非キメラ子ブタを密に監視し、感染の徴候とともに人道的に安楽死させることができるように、出生から6時間以内に完了することになる。非キメラ動物の一部、または免疫細胞が欠如したものは、剖検用に安楽死させることになる。
キメラブタは、T、BおよびNK細胞の起源を判定するため、試験することになる。以下の方法は、そのための1つの技法である。キメラ子ブタは、上記の方法を用いて同定することになる。リンパ球および血清免疫グロブリンの循環に関する週毎の評価では、キメラ、非キメラおよび野生型子ブタの間で2か月の期間にわたり比較することになる。選別されたT、BおよびNK細胞の集団は、ドナーの起源を確認するため、EGFP発現およびマイクロサテライト分析について評価することになる。キメラブタ由来の試料および精液収集物の維持は、第II相の資金提供が可能になるまで、RCIにより支持されることになる。
臍帯血および末梢血のFACS
血液リンパ球およびEGFPキメラ化に関する評価は、ブタ標本への適応とともに前述の(2)の通りに実施することになる。臍帯血は、帝王切開出産の直後、各子ブタから採取することになる。臍帯血の一部は、潜在的同種移植片処理のために処理し、凍結保存することになる一方、残りはリンパ球のFACS分析用に用いることになる。末梢血試料は、標準的方法により、2、4、6および8週齢目に採取することになる。RBCを除去し、1−2E+5個の細胞を管に分布させることになる。アリコートは、T細胞(CD4およびCD8)、B細胞(CD45RAおよびCD3)、NK細胞(CD16およびCD3)および骨髄系細胞(CD3)の同定のため、抗ブタ抗体で標識することになる。抗原発現は、LS RII Flow Cytometer(BD Biosciences)で定量化することになる。フルオロフォアは、表面抗原とともにドナー由来のEGFP細胞の多重評価を可能にするように慎重に選択することになる。脾臓由来の単一細胞懸濁液は、同じ方法により分析することになる。
すべての主要な器官および組織は、適切な解剖学的発生について全体的に試験することになり、また、膵臓、肝臓、心臓、腎臓、肺、胃腸、免疫系(末梢および粘膜リンパ節および脾臓)、およびCNSを含むすべての主要な器官および組織に由来する適切な試料は、DNA単離用に採取することになる。単一細胞懸濁液は、FACS分析用に脾臓から調製することになる。組織は、キメラ化をさらに評価するための組織学的検査のため、キメラ状態に関連し得る任意の改変のため、また任意の基礎疾患の存在について、調製することになる。
定量PCRは、臍帯血、耳、および尾の生検に対して、EGFP導入遺伝子に特異的なプライマーを用いて行い、野生型細胞に対するEGFPの既知の比を用いた検量線と比較することになる。標本におけるRG−KO対立遺伝子についても、前述のRFLPアッセイを介して評価することになる。EGFP+細胞の生着は、すべての動物および器官に対して剖検中に巨視的に評価することになる。宿主細胞に対するドナーの比を決定するため、主要な器官由来の組織は、EGFP免疫組織化学用に切片を作成し、DAPI(4’,6−ジアミジノ−2−フェニルインドール)で対比染色することになる。
動物は、宿主およびドナーの遺伝的性質に対して有益なマイクロサテライトについて、我々の研究室で通常用いるものからスクリーニングすることになる。組織および血液由来の試料(選別されたリンパ球または骨髄系統、EGFP陽性および陰性)を評価することになる。ドナー対宿主細胞の相対量は、MISEQ装置(Illumina)での多重化アンプリコン配列決定により評価することになる。
臍帯血中および末梢血中でT、BおよびNK細胞の不在を有する非キメラブタを作製することになる。キメラブタは、概ね野生型レベルに実質的に類似したレベルを有することになる。さらに、T、BおよびNK細胞が陽性のキメラは、標準的条件下で飼育する場合、実質的に正常な免疫機能を有し、かつ健常性を維持することになる。
遺伝子に特異的なgRNA配列を、Church lab gRNAベクター(Addgene ID:41824)に、その方法に従ってクローン化した。Cas9ヌクレアーゼを、hCas9プラスミド(Addgene ID:41815)またはRCIScript−hCas9から合成したmRNAの同時遺伝子導入のいずれかにより準備した。このRCIScript−hCas9は、XbaI−AgeI断片を(hCas9 cDNAを包含する)hCas9プラスミドからRCIScriptプラスミドへサブクローン化することにより構築した。mRNAの合成は、KpnIを用いて直線化を行ったこと以外は上記のように行った。
本明細書中に記載の特許、特許出願、出版物、および論文は、ここで参照により援用され、矛盾する場合、本明細書が優先する。本実施形態は、様々な特徴を有し、これらの特徴は、機能的な実施形態を作成する必要性によって導かれるものとして混合され、一致され得る。見出しおよび副見出しは、便宜的に提供されるが、本質的なものでなく、説明内容の範囲を限定するものではない。以下の番号付けされたステートメントは、本発明の実施形態を提示する。
1A.複数の標的染色体DNA部位で脊椎動物の細胞または胚における遺伝子編集を行う方法であって、
第1の標的染色体DNA部位に特異的な第1の標的化エンドヌクレアーゼおよび第1の標的部位配列に相同な第1の相同組換え修復(HDR)鋳型;および
第2の標的染色体DNA部位に特異的な第2の標的化エンドヌクレアーゼおよび第2の標的部位配列に相同な第2のHDR鋳型
を脊椎動物の細胞または胚に導入するステップを含み、
第1のHDR鋳型配列が第1の標的部位で天然染色体DNA配列を置換し、かつ第2のHDR鋳型配列が第2の標的部位配列で天然染色体DNA配列を置換する、
方法。
1B.動物の複数の対立遺伝子を編集する方法であって、
各々が異なる対立遺伝子の遺伝子座を標的にする複数の標的化ヌクレアーゼおよび各々の標的化された対立遺伝子の遺伝子座に対する相同組換え修復鋳型を、初代家畜細胞または家畜胚に導入するステップを含み、
標的化エンドヌクレアーゼは複数の標的化エンドヌクレアーゼの各々と同族の対立遺伝子の遺伝子座において二重鎖分解を作成し、かつ細胞は相同組換え修復(HDR)鋳型核酸配列を各々のHDR鋳型に同族の遺伝子座に複製し、それにより対立遺伝子を編集する、方法。
2.第3、第4、第5、第6および第7の標的染色体DNA部位に各々特異的な第3、第4、第5、第6および第7の標的化エンドヌクレアーゼ、ならびに
第3、第4、第5、第6および第7の標的染色体DNA部位に各々相同な第3、第4、第5、第6および第7のHDR鋳型
の1つ以上を細胞または胚に導入するステップをさらに含む、1のいずれかに記載の方法。
3.標的化エンドヌクレアーゼがTALENを含む、1〜2のいずれかに記載の方法。
4.標的化エンドヌクレアーゼが亜鉛フィンガーヌクレアーゼまたはCas9を含む、1〜3のいずれかに記載の方法。
5.少なくとも第1の標的染色体DNA部位が対立遺伝子における遺伝子座である、1〜4のいずれかに記載の方法。
6.前記HDR鋳型の少なくとも1つが、鋳型に同族のDNA標的部位のノックアウトをコードする、5に記載の方法。
7.前記HDR鋳型の少なくとも1つが、外因性対立遺伝子における、鋳型に同族のDNA標的部位での対立遺伝子の置換をコードする、5に記載の方法。
8.細胞または胚が家畜の第一種または第一品種であり、かつ複数の編集が天然対立遺伝子と動物の第二種または第二品種に由来する外因性対立遺伝子との置換を含む、1に記載の方法。
9.動物が第二品種または別種の対応する外因性対立遺伝子と置換された少なくとも3つの天然対立遺伝子を有する動物の第一品種であり、前記外因性対立遺伝子は減数分裂組換えを伴わない対応する天然対立遺伝子の置換であり、ここで動物は外因性マーカー遺伝子を含まない、1に記載の方法。
10.少なくとも3つ、4つ、5つ、6つ、または7つの標的染色体DNA部位が各々、異なる対立遺伝子における遺伝子座である、2に記載の方法。
11.HDR鋳型の1つ以上が、鋳型に同族のDNA標的部位のノックアウトをコードする、10に記載の方法。
12.前記HDR鋳型の少なくとも1つが、外因性対立遺伝子における、鋳型に同族のDNA標的部位での対立遺伝子の置換をコードする、10に記載の方法。
13.細胞または胚が標的DNA部位での複数の遺伝子編集についてホモ接合性であり、前記編集が前記標的DNA部位に同族のHDR鋳型によってコードされる、1〜12のいずれかに記載の方法。
14.細胞または胚が標的DNA部位での複数の遺伝子編集についてヘテロ接合性であり、前記編集が前記標的DNA部位に同族のHDR鋳型によってコードされる、1〜12のいずれかに記載の方法。
15.遺伝子編集が、動物の別品種または動物の別種に由来する対立遺伝子のノックアウトまたは遺伝子移入を含む、11〜14のいずれかに記載の方法。
16.細胞または胚が家畜の第一種または第一品種であり、かつ複数の編集が天然対立遺伝子と動物の第二種または第二品種に由来する外因性対立遺伝子との置換を含む、11〜14のいずれかに記載の方法。
17.外因性対立遺伝子および天然対立遺伝子のDNA配列が1つ以上の位置で異なり、ここで天然対立遺伝子と外因性対立遺伝子との置換により、動物の第二品種または第二種に対して同一の細胞または胚の染色体DNA配列が、前記位置にわたる整列化による評価によると、前記位置のいずれかの各側で少なくとも200塩基対(bp)の距離で作製される、16に記載の方法。
18.距離が200〜2000bpの間の数である、17に記載の方法。
19.細胞または胚が標的DNA部位での複数の遺伝子編集についてホモ接合性であり、前記編集が前記標的DNA部位に同族のHDR鋳型によってコードされる、1〜17のいずれかに記載の方法。
20.細胞または胚が標的DNA部位での複数の遺伝子編集についてヘテロ接合性であり、前記編集が前記標的DNA部位に同族のHDR鋳型によってコードされる、1〜17のいずれかに記載の方法。
21.細胞または胚が、大型脊椎動物、家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、1〜20のいずれかに記載の方法。
22.細胞が、接合体、幹細胞、成体幹細胞、多能性細胞、前駆細胞、および初代細胞からなる群から選択される、1〜21のいずれかに記載の方法。
23.胚が、接合体、胚盤胞、桑実胚であるか、または1〜200の多数の細胞を有する、1〜21のいずれかに記載の方法。
24.エンドヌクレアーゼの1つ以上および/またはHDR鋳型の1つ以上をコードするmRNAを導入するステップを含む、1〜23のいずれかに記載の方法。
25.エンドヌクレアーゼの1つ以上がタンパク質として細胞または胚に導入される、1〜24のいずれかに記載の方法。
26.エンドヌクレアーゼの1つ以上(例えばその各々)が、mRNAとして提供され、0.1ng/ml〜100ng/mlの濃度を有する溶液から細胞または胚に導入され(当業者は、明示される制限以内のすべての値および範囲、例えば、約20、約1〜約20、約0.5〜約50などが検討されることを直ちに理解するであろう);および/または
HDR鋳型の1つ以上(例えばその各々)が、mRNAとして提供され、約0.2μM〜約20μMの濃度を有する溶液から細胞または胚に導入される、
1〜25のいずれかに記載の方法。
27.エンドヌクレアーゼおよび/またはHDR鋳型の導入のためのエレクトロポレーションを含む、1〜26のいずれかに記載の方法。
28.エンドヌクレアーゼおよび/またはHDRが、化学に基づく方法、非化学的方法、粒子に基づく方法、およびウイルスによる方法からなる群から選択される方法によって導入される、1〜27のいずれかに記載の方法。
29.エンドヌクレアーゼおよび/またはHDR鋳型を発現させるため、1つ以上のベクターを細胞または胚に導入するステップを含む、13〜28のいずれかに記載の方法。
30.標的化エンドヌクレアーゼが、TALEN、またはCRISPR、またはTALENとCRISPRとの組み合わせである、1〜29のいずれかに記載の方法。
31.編集が遺伝子ノックアウトである、30に記載の方法。
32.標的部位配列の1つ以上が以下のリストから選択されるか、または外因性対立遺伝子または天然対立遺伝子の1つ以上が以下のリスト:IL2Rgy/−、RAG2−/−、IL2Rg−/−、RAG2−/−、IL2Rgy/−、RAG2−/−、IL2Rg+/−、RAG2+/−、IL2Rgy/+、RAG2+/−、IL2Rg+/−、RAG2+/−、DGAT(ジグリセリドアシルトランスフェラーゼ)、ABCG2(ATP結合カセットサブファミリーGメンバー2)、ACAN(アグリカン)、AMELY(アメロゲニン、Y連鎖性)、BLG(プロゲスターゲン関連子宮内膜タンパク質)、BMP1B(FecB)(骨形成タンパク質受容体、1B型)、DAZL(無精子症様における欠失)、Eif4GI(真核生物翻訳開始因子4γ、1)、GDF8(成長/分化因子8)、Horn−poll locus、IGF2(インスリン様成長因子2)、CWC15(CWC15スプライソゾーム関連タンパク質)、KissR/GRP54(キスペプチン)、OFD1Y(Y連鎖性口−顔−指症候群1型偽遺伝子)、p65(v−rel細網内皮症ウイルス癌遺伝子相同体A)、PRLR(プロラクチン受容体)、Prmd14(PRドメイン含有14)、PRNP(プリオンタンパク質)、Rosa、Socs2(サイトカインシグナル伝達2のサプレッサー)、SRY(Y染色体の性決定領域)、ZFY(亜鉛フィンガータンパク質、Y連鎖性)、β−ラクトグロブリン、callipyge(CLPG)、MODY1(HNF4α)(肝細胞核内因子4、α)、MODY2(GCK)(グルコキナーゼ)、MODY3(HNF1α)(肝細胞核内因子4、α)、MODY4(Pdx1)(膵臓および十二指腸ホメオボックス1)、MODY5(HNF−1β)(HNF1ホメオボックスB)、MODY6(神経原性分化1)、MODY7(KLF11)(クルッペル様因子11)、MODY8(CEL)(カルボキシルエステルリバーゼ)、MODY9(PAX4)(ペアードボックス4)、MODY10(INS)(インスリン)、MODY11(BLK)(BLK癌原遺伝子、Srcファミリーチロシンキナーゼ)、APC(腺腫症(大腸腺腫症))、ApoE(アポリポタンパク質E)、DMD(ジストロフィン筋ジストロフィー)、GHRHR(成長ホルモン放出ホルモン受容体)、HR(毛髪成長関連)、HSD11B2(ヒドロキシステロイド(11−β)デヒドロゲナーゼ2)、LDLR(低密度リポタンパク質受容体)、NF1(ニューロフィブロミン1)、NPPA(ナトリウム利尿ペプチドA)、NR3C2(核受容体サブファミリー3、グループC、メンバー2)、p53(細胞腫瘍抗原p53様)、PKD1(多発性嚢胞腎疾患1)、Rbm20(RNA結合モチーフタンパク質20)、SCNN1G(ナトリウムチャネル、非電位依存性1γサブユニット)、tP53(腫瘍タンパク質p53)、FAH(フマリルアセト酢酸ヒドロラーゼ)、HBB(ヘモグロビンβ)、IL2RG(インターロイキン2受容体、ガンマ鎖)、PDX1(膵臓および十二指腸ホメオボックス1)、PITX3(ペアード様ホメオドメイン転写因子3)、Runx1(runt関連転写因子1)、GGTA(二官能性セファロスポリンアシラーゼ/γ−グルタミルトランスペプチダーゼ)、VASA(脈管タンパク質)、MIWI(piwi様RNA媒介性遺伝子サイレンシング1)、PIWI(転写物CG6122−RA由来のCG6122遺伝子産物)、DCAF17(DDB1およびCUL4関連因子17)、VDR(ビタミンD受容体)、PNPLA1(パタチン様ホスホリパーゼドメイン含有1)、HRAS(ハーベイラット肉腫ウイルス癌遺伝子相同体)、Telomerase−vert、DSP(デスモプラキン)、SNRPE(小核リボ核タンパク質ポリペプチドE)、RPL21(リボソームタンパク質)、LAMA3(ラミニン、α3)、UROD(ウロポルフィリノーゲンデカルボキシラーゼ)、EDAR(エクトジスプラシンA受容体)、OFD1(口−顔−指症候群1)、PEX7(ペルオキシソーム生合成因子7)、COL3A1(コラーゲン、III型、α1)、ALOX12B(アラキドン酸120リポキシゲナーゼ12R型)、HLCS(ホロカルボキシラーゼシンテターゼ(ビオチン−(プロピオニル−CoA−カルボキシラーゼ)ATP−加水分解))リガーゼ))、NIPAL4(NIPA様ドメイン含有4)、CERS3(セラミドシンターゼ3)、ANTXR1(炭疽菌毒素受容体1)、B3GALT6(UDP−Gal:βGAlβ1,3ガラクトシルトランスフェラーゼポリペプチド6)、DSG4(デスモグレイン4)、UBR1(ユビキチンタンパク質リガーゼE3成分n−レコグニン1)、CTC1(CTSテロメア維持複合体成分1)、MBTPS2(膜結合転写因子ペプチダーゼ、部位2)、UROS(ウロポルフィリノーゲンIIIシンターゼ)、ABHD5(アブヒドロラーゼドメイン含有5)、NOP10(NOP10リボ核タンパク質)、ALMS1(アルストレーム症候群タンパク質1)、LAMB3(ラミニン、β3)、EOGT(EGFドメイン特異的O結合型N−アセチルグルコサミン(GlcNAc))、SAT1(スペルミジン/スペルミンN1−アセチルトランスフェラーゼ1)、RBPJ(免疫グロブリンκJ領域における組換えシグナル結合タンパク質)、ARHGAP31(Rho GTPアーゼ活性化タンパク質31)、ACVR1(アクチビンA受容体、I型)、IKBKG(B細胞内のκ軽ポリペプチド遺伝子エンハンサーの阻害剤、キナーゼγ)、LPAR6(リゾホスファチジン酸受容体6)、HR(毛髪成長関連)、ATR(ATRセリン/トレオニンキナーゼ)、HTRA1(HtrAセリンペプチダーゼ1)、AIRE(自己免疫調節遺伝子)、BCS1L(BC1(ユビキノール−チトクロームcレダクターゼ)合成様)、MCCC2(メチルクロトノイル−CoAカルボキシラーゼ2(β))、DKC1(角化異常症先天性1、ジスケリン)、PORCN(ヤマアラシ相同体)、EBP(エモパミル結合タンパク質(ステロールイソメラーゼ))、SLITRK1(SLITおよびNTRK様ファミリー、メンバー1)、BTK(ブルトン無ガンマグロブリン血症チロシンキナーゼ)、DOCK6(細胞質分裂のデディケイター6)、APCDD1(腺腫症(大腸腺腫症)下方制御1)、ZIP4(亜鉛トランスポーター4前駆体)、CASR(カルシウムセンシング受容体)、TERT(テロメラーゼ逆転写酵素)、EDARADD(EDAR(エクトジスプラシンA受容体)関連死ドメイン)、ATP6V0A2(ATPase、H+輸送性、リソソームV0サブユニットa2)、PVRL1(ポリオウイルス受容体関連1(ヘルペスウイルス侵入メディエーターC))、MGP(マトリックスGlaタンパク質)、KRT85(ケラチン85、II型)、RAG2(組換え活性化遺伝子2)、RAG−1(組換え活性化遺伝子1)、ROR2(受容体チロシンキナーゼ様オーファン受容体2)、CLAUDIN1(クローディン7)、ABCA12(ATP結合カセット、サブファミリーA(ABC1)、メンバー12)、SLA−DRA1(MHCクラスII DR−α)、B4GALT7(キシロシルプロテインβ1,4−ガラクトシルトランスフェラーゼ、ポリペプチド7)、COL7A1(コラーゲンVII型、α1)、NHP2(NHP2リボ核タンパク質)、GNA11(グアニンヌクレオチド結合タンパク質(gタンパク質)、α11(Gqクラス))、WNT5A(無翅型MMTV組込み部位ファミリーメンバー5A)、USB1(U6 snRNA生合成1)、LMNA(ラミンA/C)、EPS8L3(EPS8様3)、NSDHL(NAD(P)依存性ステロイドデヒドロゲナーゼ様)、TRPV3(一過性受容体電位カチオンチャネルサブファミリーV、メンバー3)、KRAS(カーステンラット肉腫ウイルス癌遺伝子相同体)、TINF2(TERF1相互作用核内因子2)、TGM1(トランスグルタミナーゼ1)、DCLRE1C(DNA架橋修復1C)、PKP1(プラコフィリン1)、WRAP53(TP53に対するWDリピート含有アンチセンス)、KDM5C(リジン(k)特異的デメチラーゼ5C)、ECM1(細胞外マトリックスタンパク質1)、TP63(腫瘍タンパク質p63)、KRT14(ケラチン14)、RIPK4(受容体相互作用セリン−トレオニンキナーゼ4)、PRKDC(タンパク質キナーゼ、DNA活性化、触媒ポリペプチド)、BCL11a(B細胞CLL/リンパ腫11A(亜鉛フィンガータンパク質))、BMI1(BMI1癌原遺伝子、ポリコームリングフィンガー)、CCR5(ケモカイン(C−Cモチーフ)受容体5(遺伝子/偽遺伝子))、CXCR4(ケモカイン(C−X−Cモチーフ)受容体4)、DKK1(ディックコップ(dickkopf)WNTシグナル伝達経路阻害剤1)、ETV2(ets変異体2)、FLI1(Fli−1癌原遺伝子、ETS転写因子)、FLK1(キナーゼ挿入ドメイン受容体)、GATA2(GATA結合タンパク質2)、GATA4(GATA結合タンパク質4)、HHEX(造血発現ホメオボックス)、キット(kit癌遺伝子)、LMX1A(LIMホメオボックス転写因子1α)、MYF5(筋原性因子5)、MYOD1(筋原性分化1)、MYOG(ミオゲニン)、NKX2−5(NK2ホメオボックス5)、NR4A2(核受容体サブファミリー4、グループA、メンバー2)、PAX3(ペアードボックス3)、PDX1(膵臓および十二指腸ホメオボックス1)、PITX3(ペアード様ホメオドメイン転写因子3)、Runx1(runt関連転写因子1)、RAG2(組換え活性化遺伝子2)、GGTA(二官能性セファロスポリンアシラーゼ/γ−グルタミルトランスペプチダーゼ)、HANDII(心臓および神経冠誘導体発現タンパク質2)、TBX5(Tボックス5)、ETV2(ets変異体2)、PDX1(膵臓および十二指腸ホメオボックス1)、TBX4(Tボックス4)、ID2(DNA結合の阻害剤2)、SOX2(SRY(性決定領域Y)−ボックス2)、TTF1/NKX2−1(NK2ホメオボックス1)、MESP1(中胚葉後方1)、NKX2−5(HK2ホメオボックス5)、FAH(フマリルアセト酢酸ヒドラーゼ)、PRKDC(タンパク質キナーゼ、DNA活性化、触媒ポリペプチド)、RUNX1(runt関連転写因子1)、FLI1(fli−1癌原遺伝子、ETS転写因子)、PITX3(ペアード様ホメオドメイン転写因子3)、LMX1A(LIMホメオボックス転写因子1α)、DKK1(ディックコップ(dickkopf)WNTシグナル伝達経路阻害剤1)、NR4A2/NURR1(核受容体サブファミリー4、グループA、メンバー2)、FLK1(キナーゼ挿入ドメイン受容体)、HHEX1(造血発現ホメオボックスタンパク質HHEX)、BCL11A(B細胞CLL/リンパ腫11A(亜鉛フィンガータンパク質)、RAG2(組換え活性化遺伝子2)、RAG1(組換え活性化遺伝子1)、IL2RG(インターロイキン2受容体、ガンマ鎖)、c−KIT/SCFR(v−キットハーディ−ズッカーマン(v−kit Hardy−Zuckerman)4ネコ肉腫ウイルス癌遺伝子相同体)、BMI1(BMI1癌原遺伝子ポリコームリングフィンガー)、TBX5(Tボックス5)、OLIG1(オリゴデンドロサイト転写因子1)、OLIG2(オリゴデンドロサイト転写因子2)、それらのヘテロ接合体、それらのホモ接合体、およびそれらの組み合わせ、から選択される、1〜31のいずれかに記載の方法。
33.初代脊椎動物の細胞または胚において多重遺伝子ノックアウトを作製する方法であって、細胞または胚に、異なる標的遺伝子に標的化された複数のTALENを、前記異なる標的遺伝子に対する相同性を有するHDR鋳型の存在下で導入するステップを含む、方法。
34.動物を作製する方法であって、1〜33のいずれかに記載の方法を含み、かつ細胞をクローン化するかまたは胚を代理母に配置するステップをさらに含む、方法。
35.1〜34のいずれかに記載の方法によって作製される動物。
36.細胞が編集され、またキメラ胚を形成するため、細胞をクローン化し、宿主胚を細胞から作製し、ドナー細胞を宿主胚に加えるステップをさらに含む、1〜34のいずれかに記載の方法によって作製されるキメラ胚または動物。
37.宿主細胞およびドナー細胞におけるキメラである脊椎動物胚であって、
異なる染色体DNA部位に複数の宿主細胞の遺伝子編集を伴う宿主胚、および
キメラ胚を形成するため、宿主細胞に組み込まれたドナー細胞
を含む、脊椎動物胚。
38.異なる染色体DNA遺伝子部位に複数の多重遺伝子編集を伴う胚を含む脊椎動物欠損キャリアであって、編集がドナー細胞による補完に遺伝的微小環境を提供する、脊椎動物欠損キャリア。
39.ドナー細胞が、霊長類、齧歯類、または偶蹄目に由来する胚性幹細胞、多能性幹細胞、割球などである、37〜38のいずれかに記載の胚またはキャリア。
40.宿主またはキャリア細胞の遺伝子編集が、遺伝子のノックアウトまたは天然対立遺伝子と脊椎動物の別品種もしくは動物の別種の外因性対立遺伝子との置換を含む、37〜39のいずれかに記載の胚。
41.宿主細胞の遺伝子編集の数が、2、3、4、5、6、もしくは7であるか、または少なくとも2、3、4、5、6、もしくは7である、37〜41のいずれかに記載の胚。
42.天然対立遺伝子と脊椎動物の別品種もしくは動物の別種の外因性対立遺伝子との置換の数が、2、3、4、5、6、もしくは7であるか、または少なくとも2、3、4、5、6、もしくは7である、37〜41のいずれかに記載の胚。
43.発現可能なレポーター遺伝子および/または合成遺伝子および/または外因性蛍光タンパク質を含まない、37〜42のいずれかに記載の胚。
44.遺伝子編集のすべてが両アレルであるか、編集の少なくとも2、3、4、もしくは5が両アレルであるか、遺伝子編集の少なくとも2、3、4、もしくは5が単アレルであるか、またはそれらの任意の組み合わせである、37〜43のいずれかに記載の胚。
45.ドナー細胞が宿主細胞に対する相補物である、37〜44のいずれかに記載の胚。
46.宿主胚が高度虚弱(FTT)表現型として運命づけられている、37〜45のいずれかに記載の胚。
47.ドナー細胞が胚をFTT表現型から救出する、46に記載の胚。
48.ドナー細胞が1つ以上の遺伝子編集を含む、37〜47のいずれかに記載の胚。
49.大型脊椎動物、家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、37〜47のいずれかに記載の胚。
50.宿主細胞およびドナー細胞におけるキメラである脊椎動物であって、
異なる染色体DNA部位に複数の宿主細胞の遺伝子編集、およびキメラ動物を形成するための宿主細胞に組み込まれたドナー細胞を含む、脊椎動物。
51.大型脊椎動物、家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、50に記載の動物。
52.宿主細胞およびドナー細胞におけるキメラである脊椎動物胚を作製する方法であって、
宿主の脊椎動物細胞に
第1の標的染色体DNA部位に特異的な第1の標的化エンドヌクレアーゼおよび第1の標的部位配列に相同な第1の相同組換え修復(HDR)鋳型;および
第2の標的染色体DNA部位に特異的な第2の標的化エンドヌクレアーゼおよび第2の標的部位配列に相同な第2のHDR鋳型
を導入するステップと、
宿主胚を発生させるため、細胞をクローン化するステップと、
ドナー細胞を宿主胚内に配置するステップと、
を含み、第1のHDR鋳型配列は第1の標的部位で天然染色体DNA配列を置換し、また第2のHDR鋳型配列は第2の標的部位配列で天然染色体DNA配列を置換する、方法。
53.細胞が初代細胞である、52に記載の方法。
54.大型脊椎動物、家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、52〜53のいずれかに記載の方法。
55.発現可能なレポーター遺伝子および/または合成遺伝子および/または外因性蛍光タンパク質を含まない、1〜54のいずれかに記載の方法、細胞、胚、または動物。
56.宿主細胞およびドナー細胞を含むキメラ大型脊椎動物であって、宿主細胞が、ドナー細胞の遺伝子によって補完される、配偶子形成または精子形成遺伝子に対する少なくとも1つの非減数分裂の遺伝子編集を含み、動物はドナー細胞の遺伝子型を有する配偶子を含む、キメラ大型脊椎動物。
57.宿主細胞の遺伝子型を有する機能的配偶子を含まない、56に記載の動物。
58.宿主細胞およびドナー細胞を含むキメラ大型脊椎動物であって、宿主細胞が高度虚弱(FTT)宿主細胞の遺伝子型を樹立するための少なくとも1つの非減数分裂の遺伝子編集を含み、FTT遺伝子型がドナー細胞によって補完される、キメラ大型脊椎動物。
59.宿主細胞が、高度虚弱(FTT)宿主細胞遺伝子型を樹立する、複数の非減数分裂の遺伝子編集を含む、58に記載の動物。
60.FTT表現型が免疫不全である、58または59のいずれかに記載の動物。
61.多重遺伝子編集を含む大型脊椎動物。
62.第二品種または別種の対応する外因性対立遺伝子で置換された少なくとも3つの天然対立遺伝子を有するブタの第一品種またはウシの第一品種であり、前記外因性対立遺伝子は減数分裂組換えを伴わない対応する天然対立遺伝子の置換であり、動物は外因性マーカー遺伝子を含まない、61に記載の動物。
63.前記外因性置換対立遺伝子の少なくとも3つ、4つ、5つ、6つ、または7つを含み、各々が減数分裂組換えを伴わない、61または62に記載の動物。
64.家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、61〜63のいずれかに記載の動物。
65.3〜25の数の編集を有する、61〜64のいずれかに記載の動物。
66.多重編集についてF0世代である、61〜65のいずれかに記載の動物。
67.2〜25の数の対立遺伝子置換を有する、61〜66のいずれかに記載の動物。
68.2〜25の数のKO遺伝子編集を有する、61〜67のいずれかに記載の動物。
69.第二品種または別種の対応する外因性対立遺伝子で置換された少なくとも3つの天然対立遺伝子を有するブタの第一品種またはウシの第一品種であり、前記外因性対立遺伝子は減数分裂組換えを伴わない対応する天然対立遺伝子の置換であり、動物は外因性マーカー遺伝子を含まない、61に記載の動物。
70.前記外因性置換対立遺伝子の少なくとも3つ、4つ、5つ、6つ、または7つを含み、各々が減数分裂組換えを伴わない、69に記載の動物。
Claims (41)
- 多重遺伝子編集を含む大型脊椎動物。
- 少なくとも3つの天然対立遺伝子を有するウシの第一品種またはブタの第一品種は第二品種または別種の対応する外因性対立遺伝子と置換され、前記外因性対立遺伝子は減数分裂組換えを伴わない前記対応する天然対立遺伝子の置換であり、ここで前記動物は外因性マーカー遺伝子を含まない、請求項1に記載の動物。
- 前記3つの対立遺伝子の各々が3つの異なる遺伝子に対応する、請求項2に記載の動物。
- 前記外因性置換対立遺伝子の少なくとも3つ、4つ、5つ、6つ、または7つを含み、各々が減数分裂組換えを伴わない、請求項2または3に記載の動物。
- 第二品種または別種の対応する外因性対立遺伝子で置換された少なくとも2つの天然対立遺伝子を有する第1の動物であり、前記外因性対立遺伝子は、減数分裂組換えを伴わない前記対応する天然対立遺伝子の置換である、請求項1に記載の動物。
- 3〜25の数の対立遺伝子置換を含むかまたは2〜25の数のノックアウト遺伝子編集を含む、請求項1〜5のいずれか一項に記載の動物。
- ホモ接合性編集、ヘテロ接合性編集、またはそれらの組み合わせを含む前記遺伝子編集を伴う、請求項1〜6のいずれか一項に記載の動物。
- 宿主動物由来の宿主細胞とドナー動物由来のドナー細胞とのキメラであり、前記宿主細胞は前記多重遺伝子編集を含む、請求項1〜7のいずれか一項に記載の動物。
- 前記動物の有性生殖により、前記ドナー細胞の遺伝子型を有する配偶子が子孫に伝えられる、請求項8に記載の動物。
- マーカー遺伝子を含まない、請求項1〜9のいずれか一項に記載の動物。
- 家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、請求項1〜10のいずれか一項に記載の動物。
- 前記多重遺伝子編集が、以下の遺伝子:IL2Rg−、RAG2、IL2Rg;RAG2、IL2Rgy、RAG2、IL2Rg、RAG2、IL2Rg;RAG2、IL2Rg;RAG2、DGAT、ABCG2、ACAN、AMELY、BLG、BMP1B(FecB)、DAZL、DGAT、Eif4GI、GDF8、Horn−poll locus、IGF2、CWC15、KissR/GRP54、OFD1Y、p65、PRLR、Prmd14、PRNP、Rosa、Socs2、SRY、ZFY、β−ラクトグロブリン、CLPG、MODY1(HNF4α)、MODY2(GCK)、MODY3(HNF1α)、MODY4(Pdx1)、MODY5(HNF−1β)、MODY6(神経原性分化1)、MODY7(KLF11)、MODY8(CEL)、MODY9(PAX4)、MODY10(INS)、MODY11(BLK)、APC、ApoE、DMD、GHRHR、HR、HSD11B2、LDLR、NF1、NPPA、NR3C2、p53、PKD1、Rbm20、SCNN1G、tP53、DAZL、FAH、HBB、IL2RG、PDX1、PITX3、Runx1、RAG2、GGTA、DAZL、VASA、MIWI、PIWI、DCAF17、VDR、PNPLA1、HRAS、Telomerase−vert、DSP、SNRPE、RPL21、LAMA3、UROD、EDAR、OFD1、PEX7、COL3A1、ALOX12B、HLCS、NIPAL4、CERS3、ANTXR1、B3GALT6、DSG4、UBR1、CTC1、MBTPS2、UROS、ABHD5、NOP10、ALMS1、LAMB3、EOGT、SAT1、RBPJ、ARHGAP31、ACVR1、IKBKG、LPAR6、HR、ATR、HTRA1、AIRE、BCS1L、MCCC2、DKC1、PORCN、EBP、SLITRK1、BTK、DOCK6、APCDD1、ZIP4、CASR、TERT、EDARADD、ATP6V0A2、PVRL1、MGP、KRT85、RAG2、RAG−1、ROR2、CLAUDIN1、ABCA12、SLA−DRA1、B4GALT7、COL7A1、NHP2、GNA11、WNT5A、USB1、LMNA、EPS8L3、NSDHL、TRPV3、KRAS、TINF2、TGM1、DCLRE1C、PKP1、WRAP53、KDM5C、ECM1、TP63、KRT14、RIPK4、PRKDC、BCL11a、BMI1、CCR5、CXCR4、DKK1、ETV2、FLI1、FLK1、GATA2、GATA4、HHEX、キット、LMX1A、MYF5、MYOD1、MYOG、NKX2−5、NR4A2、PAX3、PDX1、PITX3、Runx1、RAG2、GGTA、HR、HANDII、TBX5、ETV2、PDX1、TBX4、ID2SOX2、TTF1/NKX2−1、MESP1、GATA4、NKX2−5、FAH、PRKDC、RUNX1、FLI1、PITX3、LMX1A、DKK1、NR4A2/NURR1、FLK1、HHEX1、BCL11A、RAG2、RAG1、IL2RG、c−キット/SCFR、BMI1、HANDII、TBX5、GATA2、DAZL、OLIG1、OLIG2、それらのヘテロ接合体、それらのホモ接合体、およびそれらの組み合わせ、の1つ以上において行われる、請求項1〜11のいずれか一項に記載の動物。
- 脊椎動物の細胞または胚における複数の標的染色体DNA部位でインビトロでの遺伝子編集を行う方法であって、
第1の標的染色体DNA部位に特異的な第1の標的化エンドヌクレアーゼおよび第1の標的部位配列に相同な第1の相同組換え修復(HDR)鋳型;および
第2の標的染色体DNA部位に特異的な第2の標的化エンドヌクレアーゼおよび第2の標的部位配列に相同な第2のHDR鋳型
を脊椎動物の細胞または胚に導入するステップを含み、
前記第1のHDR鋳型配列が前記第1の標的部位で前記天然染色体DNA配列を置換し、かつ前記第2のHDR鋳型配列が前記第2の標的部位配列で前記天然染色体DNA配列を置換する、
方法。 - 第3、第4、第5、第6、および第7の標的染色体DNA部位に各々特異的な第3、第4、第5、第6、および第7の標的化エンドヌクレアーゼ、ならびに
第3、第4、第5、第6、および第7の標的染色体DNA部位に各々相同な第3、第4、第5、第6、および第7のHDR鋳型
の1つ以上を前記細胞または胚に導入するステップをさらに含む、請求項13に記載の方法。 - 前記標的化エンドヌクレアーゼが、TALEN、亜鉛フィンガーヌクレアーゼ、RNAガイドエンドヌクレアーゼ、またはCas9を含む、請求項13〜14のいずれか一項に記載の方法。
- 少なくとも第1の標的染色体DNA部位が対立遺伝子における遺伝子座である、請求項13〜15のいずれか一項に記載の方法。
- 前記HDR鋳型の少なくとも1つが前記鋳型に同族の前記DNA標的部位のノックアウトをコードする、請求項16に記載の方法。
- 前記HDR鋳型の少なくとも1つが、外因性対立遺伝子における前記鋳型に同族の前記DNA標的部位での対立遺伝子の置換をコードする、請求項16に記載の方法。
- 前記細胞または胚が家畜の第一種または第一品種であり、また複数の前記編集が天然対立遺伝子と動物の第二種または第二品種に由来する外因性対立遺伝子との置換を含む、請求項13〜18のいずれか一項に記載の方法。
- 前記細胞または胚が前記標的DNA部位での複数の遺伝子編集においてホモ接合性であり、前記編集が前記標的DNA部位に同族のHDR鋳型によってコードされる、請求項13〜19のいずれか一項に記載の方法。
- 前記細胞または胚が前記標的DNA部位での複数の遺伝子編集においてヘテロ接合性であり、前記編集が前記標的DNA部位に同族のHDR鋳型によってコードされる、請求項13〜20のいずれか一項に記載の方法。
- 前記細胞または胚が、大型脊椎動物、家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、請求項13〜21のいずれか一項に記載の方法。
- 前記細胞が、接合体、幹細胞、成体幹細胞、多能性細胞、前駆細胞、および初代細胞からなる群から選択される、請求項13〜22のいずれか一項に記載の方法。
- 前記胚が、接合体、胚盤胞、桑実胚であるか、または1〜200の数の細胞を有する、請求項13〜22のいずれか一項に記載の方法。
- 前記標的化エンドヌクレアーゼがTALENおよびCRISPRの組み合わせである、請求項13〜24のいずれか一項に記載の方法。
- 前記標的部位配列の1つ以上が、以下のリスト:IL2Rgy/−、RAG2−/−、IL2Rg−/−、RAG2−/−、IL2Rgy/−、RAG2−/−、IL2Rg+/−、RAG2+/−、IL2Rgy/+、RAG2+/−、IL2Rg+/−、RAG2+/−、DGAT、ABCG2、ACAN、AMELY、BLG、BMP1B(FecB)、DAZL、DGAT、Eif4GI、GDF8、Horn−poll locus、IGF2、CWC15、KissR/GRP54、OFD1Y、p65、PRLR、Prmd14、PRNP、Rosa、Socs2、SRY、ZFY、β−ラクトグロブリン、CLPG、MODY1(HNF4α)、MODY2(GCK)、MODY3(HNF1α)、MODY4(Pdx1)、MODY5(HNF−1β)、MODY6(神経原性分化1)、MODY7(KLF11)、MODY8(CEL)、MODY9(PAX4)、MODY10(INS)、MODY11(BLK)、APC、ApoE、DMD、GHRHR、HR、HSD11B2、LDLR、NF1、NPPA、NR3C2、p53、PKD1、Rbm20、SCNN1G、tP53、DAZL、FAH、HBB、IL2RG、PDX1、PITX3、Runx1、RAG2、GGTA、DAZL、VASA、MIWI、PIWI、DCAF17、VDR、PNPLA1、HRAS、Telomerase−vert、DSP、SNRPE、RPL21、LAMA3、UROD、EDAR、OFD1、PEX7、COL3A1、ALOX12B、HLCS、NIPAL4、CERS3、ANTXR1、B3GALT6、DSG4、UBR1、CTC1、MBTPS2、UROS、ABHD5、NOP10、ALMS1、LAMB3、EOGT、SAT1、RBPJ、ARHGAP31、ACVR1、IKBKG、LPAR6、HR、ATR、HTRA1、AIRE、BCS1L、MCCC2、DKC1、PORCN、EBP、SLITRK1、BTK、DOCK6、APCDD1、ZIP4、CASR、TERT、EDARADD、ATP6V0A2、PVRL1、MGP、KRT85、RAG2、RAG−1、ROR2、CLAUDIN1、ABCA12、SLA−DRA1、B4GALT7、COL7A1、NHP2、GNA11、WNT5A、USB1、LMNA、EPS8L3、NSDHL、TRPV3、KRAS、TINF2、TGM1、DCLRE1C、PKP1、WRAP53、KDM5C、ECM1、TP63、KRT14、RIPK4、PRKDC、BCL11a、BMI1、CCR5、CXCR4、DKK1、ETV2、FLI1、FLK1、GATA2、GATA4、HHEX、キット、LMX1A、MYF5、MYOD1、MYOG、NKX2−5、NR4A2、PAX3、PDX1、PITX3、Runx1、RAG2、GGTA、HR、HANDII、TBX5、ETV2、PDX1、TBX4、ID2SOX2、TTF1/NKX2−1、MESP1、GATA4、NKX2−5、FAH、PRKDC、RUNX1、FLI1、PITX3、LMX1A、DKK1、NR4A2/NURR1、FLK1、HHEX1、BCL11A、RAG2、RAG1、IL2RG、c−キット/SCFR、BMI1、HANDII、TBX5、GATA2、DAZL、OLIG1、OLIG2、それらのヘテロ接合体、それらのホモ接合体、およびそれらの組み合わせ、から選択される、請求項13〜25のいずれか一項に記載の方法。
- 初代脊椎動物の細胞または胚において多重遺伝子ノックアウトを行う方法であって、異なる標的遺伝子に標的化された複数のTALENを、前記異なる標的遺伝子に対する相同性を有するHDR鋳型の存在下で前記細胞または胚に導入するステップを含む、方法。
- 宿主細胞およびドナー細胞におけるキメラである脊椎動物胚であって、
異なる染色体DNA部位で複数の宿主細胞の遺伝子編集を伴う宿主胚、および
前記キメラ胚を形成するため、前記宿主細胞に組み込まれたドナー細胞
を含む、脊椎動物胚。 - 前記ドナー細胞が、霊長類、齧歯類、または偶蹄目に由来する胚性幹細胞、多能性幹細胞、割球などである、請求項28に記載の胚。
- 前記宿主またはキャリア細胞の遺伝子編集が、遺伝子のノックアウトまたは天然対立遺伝子と脊椎動物の別品種もしくは動物の別種の外因性対立遺伝子との置換を含む、請求項28〜29のいずれか一項に記載の胚。
- 前記宿主細胞の遺伝子編集の数が、2、3、4、5、6、もしくは7、または少なくとも2、3、4、5、6、もしくは7である、請求項28〜30のいずれか一項に記載の胚。
- 天然対立遺伝子と脊椎動物の別品種もしくは動物の別種の外因性対立遺伝子との置換の数が、2、3、4、5、6、もしくは7、または少なくとも2、3、4、5、6、もしくは7である、請求項28〜31のいずれか一項に記載の胚。
- 発現可能なレポーター遺伝子および/または合成遺伝子および/または外因性蛍光タンパク質を含まない、請求項28〜32のいずれか一項に記載の胚。
- 前記遺伝子編集のすべてが両アレルであるか、または前記編集の少なくとも2、3、4、もしくは5つが両アレルであるか、または前記遺伝子編集の少なくとも2、3、4、もしくは5つが単アレルであるか、またはそれらの任意の組み合わせである、請求項28〜33のいずれか一項に記載の胚。
- 前記宿主胚が高度虚弱(FTT)表現型として運命づけられている、請求項28〜34のいずれか一項に記載の胚。
- 宿主細胞およびドナー細胞におけるキメラである脊椎動物であって、異なる染色体DNA部位での複数の宿主細胞の遺伝子編集、および前記キメラ動物を形成するための前記宿主細胞に組み込まれたドナー細胞を含む、脊椎動物。
- 宿主細胞およびドナー細胞におけるキメラである脊椎動物胚を作製する方法であって、
宿主の脊椎動物細胞に、
第1の標的染色体DNA部位に特異的な第1の標的化エンドヌクレアーゼおよび前記第1の標的部位配列に相同な第1の相同組換え修復(HDR)鋳型;および
第2の標的染色体DNA部位に特異的な第2の標的化エンドヌクレアーゼおよび前記第2の標的部位配列に相同な第2のHDR鋳型
を導入するステップと、
宿主胚を発生させるため、前記細胞をクローン化するステップと、
ドナー細胞を前記宿主胚内に配置するステップと、
を含み、前記第1のHDR鋳型配列は前記第1の標的部位で前記天然染色体DNA配列を置換し、また前記第2のHDR鋳型配列は前記第2の標的部位配列で前記天然染色体DNA配列を置換する、方法。 - 前記細胞が初代細胞である、請求項37に記載の方法。
- 大型脊椎動物、家畜、サル、イヌ、ネコ、トリ、鳥類、魚類、ウサギ、ブタ、ウシ、水牛、ヤギ、ヒツジ、および偶蹄目からなる群から選択される、請求項37〜38のいずれか一項に記載の方法。
- 宿主細胞およびドナー細胞を含むキメラ大型脊椎動物であって、前記宿主細胞が、前記ドナー細胞の遺伝子によって補完される、配偶子形成または精子形成遺伝子に対する少なくとも1つの非減数分裂の遺伝子編集を含み、前記動物は前記ドナー細胞の遺伝子型を有する配偶子を含む、キメラ大型脊椎動物。
- 宿主細胞およびドナー細胞を含むキメラ大型脊椎動物であって、前記宿主細胞は、高度虚弱(FTT)宿主細胞の遺伝子型を樹立するための少なくとも1つの非減数分裂の遺伝子編集を含み、前記FTT遺伝子型は前記ドナー細胞によって補完される、キメラ大型脊椎動物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461985327P | 2014-04-28 | 2014-04-28 | |
| US61/985,327 | 2014-04-28 | ||
| PCT/US2015/027995 WO2015168125A1 (en) | 2014-04-28 | 2015-04-28 | Multiplex gene editing in swine |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017513510A true JP2017513510A (ja) | 2017-06-01 |
| JP2017513510A5 JP2017513510A5 (ja) | 2018-06-14 |
Family
ID=53190022
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016565064A Pending JP2017513510A (ja) | 2014-04-28 | 2015-04-28 | ブタにおける多重遺伝子編集 |
Country Status (13)
| Country | Link |
|---|---|
| US (3) | US20160029604A1 (ja) |
| EP (1) | EP3136850A1 (ja) |
| JP (1) | JP2017513510A (ja) |
| KR (1) | KR20170003585A (ja) |
| CN (2) | CN106535630B (ja) |
| AP (1) | AP2016009588A0 (ja) |
| AR (1) | AR100216A1 (ja) |
| AU (1) | AU2015253352A1 (ja) |
| BR (2) | BR122023023211A2 (ja) |
| CA (1) | CA2946881A1 (ja) |
| MX (1) | MX2016014066A (ja) |
| PH (1) | PH12016502162A1 (ja) |
| WO (1) | WO2015168125A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190038449A (ko) * | 2017-09-29 | 2019-04-08 | 서울대학교산학협력단 | Klotho 유전자 넉아웃 질환모델 동물 및 이의 용도 |
Families Citing this family (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10920242B2 (en) | 2011-02-25 | 2021-02-16 | Recombinetics, Inc. | Non-meiotic allele introgression |
| US9528124B2 (en) | 2013-08-27 | 2016-12-27 | Recombinetics, Inc. | Efficient non-meiotic allele introgression |
| CA2853829C (en) | 2011-07-22 | 2023-09-26 | President And Fellows Of Harvard College | Evaluation and improvement of nuclease cleavage specificity |
| US20150044192A1 (en) | 2013-08-09 | 2015-02-12 | President And Fellows Of Harvard College | Methods for identifying a target site of a cas9 nuclease |
| US9359599B2 (en) | 2013-08-22 | 2016-06-07 | President And Fellows Of Harvard College | Engineered transcription activator-like effector (TALE) domains and uses thereof |
| US9322037B2 (en) | 2013-09-06 | 2016-04-26 | President And Fellows Of Harvard College | Cas9-FokI fusion proteins and uses thereof |
| US9228207B2 (en) | 2013-09-06 | 2016-01-05 | President And Fellows Of Harvard College | Switchable gRNAs comprising aptamers |
| US9526784B2 (en) | 2013-09-06 | 2016-12-27 | President And Fellows Of Harvard College | Delivery system for functional nucleases |
| KR101566498B1 (ko) | 2013-11-13 | 2015-11-06 | 건국대학교 산학협력단 | 인터루킨 2 수용체 감마 유전자 적중벡터, 그 벡터가 도입된 면역세포 결핍 형질전환 미니 복제돼지 생산과 그 제조방법 및 활용 |
| US11053481B2 (en) | 2013-12-12 | 2021-07-06 | President And Fellows Of Harvard College | Fusions of Cas9 domains and nucleic acid-editing domains |
| BR122023023211A2 (pt) * | 2014-04-28 | 2024-01-23 | Recombinetics, Inc. | Método de fazer edições de genes multiplex em uma célula de vertebrado ou de embrião primário não-humano |
| WO2016022363A2 (en) | 2014-07-30 | 2016-02-11 | President And Fellows Of Harvard College | Cas9 proteins including ligand-dependent inteins |
| AU2015320738B2 (en) | 2014-09-23 | 2021-12-02 | Acceligen, Inc. | Materials and methods for producing animals with short hair |
| EP3215617A2 (en) | 2014-11-07 | 2017-09-13 | Editas Medicine, Inc. | Methods for improving crispr/cas-mediated genome-editing |
| MX2017011345A (es) * | 2015-03-03 | 2018-04-24 | Univ Minnesota | Gen de variante ets2 etv2 y usos del mismo. |
| US10874092B2 (en) | 2015-06-30 | 2020-12-29 | Regents Of The University Of Minnesota | Humanized skeletal muscle |
| WO2017004388A1 (en) * | 2015-06-30 | 2017-01-05 | Regents Of The University Of Minnesota | Humanized heart muscle |
| CA2999500A1 (en) | 2015-09-24 | 2017-03-30 | Editas Medicine, Inc. | Use of exonucleases to improve crispr/cas-mediated genome editing |
| US20170099813A1 (en) * | 2015-10-07 | 2017-04-13 | Recombinetics, Inc. | Method of generating sterile terminal sires in livestock and animals produced thereby |
| US10167457B2 (en) | 2015-10-23 | 2019-01-01 | President And Fellows Of Harvard College | Nucleobase editors and uses thereof |
| CN105567689B (zh) * | 2016-01-25 | 2019-04-09 | 重庆威斯腾生物医药科技有限责任公司 | CRISPR/Cas9靶向敲除人TCAB1基因及其特异性gRNA |
| WO2017165826A1 (en) | 2016-03-25 | 2017-09-28 | Editas Medicine, Inc. | Genome editing systems comprising repair-modulating enzyme molecules and methods of their use |
| US11236313B2 (en) | 2016-04-13 | 2022-02-01 | Editas Medicine, Inc. | Cas9 fusion molecules, gene editing systems, and methods of use thereof |
| SG10202010261YA (en) * | 2016-04-18 | 2020-11-27 | Crispr Therapeutics Ag | Materials and methods for treatment of hemoglobinopathies |
| CN106191061B (zh) * | 2016-07-18 | 2019-06-18 | 暨南大学 | 一种特异靶向人ABCG2基因的sgRNA导向序列及其应用 |
| IL308426A (en) | 2016-08-03 | 2024-01-01 | Harvard College | Adenosine nuclear base editors and their uses |
| CN109804066A (zh) | 2016-08-09 | 2019-05-24 | 哈佛大学的校长及成员们 | 可编程cas9-重组酶融合蛋白及其用途 |
| WO2018039438A1 (en) | 2016-08-24 | 2018-03-01 | President And Fellows Of Harvard College | Incorporation of unnatural amino acids into proteins using base editing |
| US20180084767A1 (en) | 2016-09-21 | 2018-03-29 | Recombinetics, Inc. | Animal models for cardiomyopathy |
| AU2017342543A1 (en) | 2016-10-14 | 2019-05-02 | President And Fellows Of Harvard College | AAV delivery of nucleobase editors |
| WO2018094291A1 (en) * | 2016-11-18 | 2018-05-24 | Christopher Bradley | Massively multiplexed homologous template repair for whole-genome replacement |
| WO2018119359A1 (en) | 2016-12-23 | 2018-06-28 | President And Fellows Of Harvard College | Editing of ccr5 receptor gene to protect against hiv infection |
| EP3583203B1 (en) * | 2017-02-15 | 2023-11-01 | 2seventy bio, Inc. | Donor repair templates multiplex genome editing |
| US11898179B2 (en) | 2017-03-09 | 2024-02-13 | President And Fellows Of Harvard College | Suppression of pain by gene editing |
| US11542496B2 (en) | 2017-03-10 | 2023-01-03 | President And Fellows Of Harvard College | Cytosine to guanine base editor |
| JP7191388B2 (ja) | 2017-03-23 | 2022-12-19 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 核酸によってプログラム可能なdna結合蛋白質を含む核酸塩基編集因子 |
| CN106987604B (zh) * | 2017-03-29 | 2021-05-28 | 北京希诺谷生物科技有限公司 | 一种制备动脉粥样硬化疾病模型犬的方法 |
| EP3610398A4 (en) * | 2017-03-30 | 2021-02-24 | Monsanto Technology LLC | SYSTEMS AND METHODS FOR USE IN IDENTIFYING MULTIPLE GENOMIC EDITIONS AND FOR PREDICTING THE AGGREGATED EFFECTS OF IDENTIFIED GENOMIC EDITIONS |
| US11732251B2 (en) * | 2017-04-24 | 2023-08-22 | Dupont Nutrition Biosciences Aps | Anti-CRISPR polynucleotides and polypeptides and methods of use |
| CN107974462A (zh) * | 2017-04-28 | 2018-05-01 | 中山大学 | 一种通过延迟基因的表达时间来提高猪瘦肉产量的方法 |
| CN107182940B (zh) * | 2017-05-09 | 2020-05-15 | 中国科学院动物研究所 | 一种抗寒及瘦肉型转基因猪及其制备方法 |
| US11560566B2 (en) | 2017-05-12 | 2023-01-24 | President And Fellows Of Harvard College | Aptazyme-embedded guide RNAs for use with CRISPR-Cas9 in genome editing and transcriptional activation |
| US11866726B2 (en) | 2017-07-14 | 2024-01-09 | Editas Medicine, Inc. | Systems and methods for targeted integration and genome editing and detection thereof using integrated priming sites |
| CN107937445B (zh) * | 2017-07-25 | 2021-05-04 | 北京希诺谷生物科技有限公司 | 利用体细胞克隆技术制备基因敲除犬的方法 |
| EP3658573A1 (en) | 2017-07-28 | 2020-06-03 | President and Fellows of Harvard College | Methods and compositions for evolving base editors using phage-assisted continuous evolution (pace) |
| WO2019033053A1 (en) | 2017-08-11 | 2019-02-14 | Recombinetics, Inc. | INDUCIBLE DISEASE MODELS, METHODS OF MAKING AND USING THEM IN TISSUE COMPLEMENTATION |
| US11319532B2 (en) | 2017-08-30 | 2022-05-03 | President And Fellows Of Harvard College | High efficiency base editors comprising Gam |
| US20210206814A1 (en) * | 2017-10-12 | 2021-07-08 | Mayo Foundation For Medical Education And Research | Methods and materials for gene editing |
| EP3697906A1 (en) | 2017-10-16 | 2020-08-26 | The Broad Institute, Inc. | Uses of adenosine base editors |
| US11566236B2 (en) | 2018-02-05 | 2023-01-31 | Vertex Pharmaceuticals Incorporated | Materials and methods for treatment of hemoglobinopathies |
| CN108504685A (zh) * | 2018-03-27 | 2018-09-07 | 宜明细胞生物科技有限公司 | 一种利用CRISPR/Cas9系统同源重组修复IL-2RG缺陷基因的方法 |
| CN110846330B (zh) * | 2018-08-21 | 2021-08-27 | 中国科学院动物研究所 | 一种突变基因及其用于构建蹼足病小型猪模型的用途 |
| CN109321600A (zh) * | 2018-10-19 | 2019-02-12 | 中国农业大学 | 一种培育生产低致敏性牛奶的牛的方法及其应用 |
| CN109735630A (zh) * | 2019-01-05 | 2019-05-10 | 兰州大学 | 绵羊zfy基因单核苷酸多态性标记的检测方法及标记应用 |
| CN111484994B (zh) * | 2019-01-29 | 2022-04-19 | 四川大学华西医院 | CRISPR-Cas9特异性敲除猪Fah、Rag2双基因的方法 |
| CN109777834A (zh) * | 2019-02-25 | 2019-05-21 | 中国科学院广州生物医药与健康研究院 | 一种重度免疫缺陷猪模型及其构建方法和应用 |
| DE112020001342T5 (de) | 2019-03-19 | 2022-01-13 | President and Fellows of Harvard College | Verfahren und Zusammensetzungen zum Editing von Nukleotidsequenzen |
| US11859213B2 (en) | 2019-05-16 | 2024-01-02 | Regents Of The University Of Minnesota | Development of superior chimerism by hiPSC engineering and embryo aggregation |
| CN110452929B (zh) * | 2019-07-09 | 2021-07-20 | 中山大学 | 一种非嵌合基因编辑猪胚胎模型的构建方法 |
| US20220256821A1 (en) * | 2019-07-15 | 2022-08-18 | The General Hospital Corporation | Zebrafish deletion and compound mutants and uses thereof |
| CN110305872A (zh) * | 2019-07-17 | 2019-10-08 | 中国农业科学院北京畜牧兽医研究所 | 小型猪2型糖尿病模型的构建方法及应用 |
| WO2021030735A1 (en) * | 2019-08-15 | 2021-02-18 | The Rockefeller University | Crispr genome editing with cell surface display to produce homozygously edited eukaryotic cells |
| CN112538497B (zh) * | 2019-09-20 | 2023-02-28 | 南京启真基因工程有限公司 | CRISPR/Cas9系统及其在构建α、β和α&β地中海贫血模型猪细胞系中的应用 |
| AU2020388387A1 (en) | 2019-11-22 | 2022-06-02 | President And Fellows Of Harvard College | Ionic liquids for drug delivery |
| KR102270145B1 (ko) * | 2019-12-27 | 2021-07-01 | 서울대학교산학협력단 | Btk 넉아웃 질환모델용 돼지 및 이의 용도 |
| JP2023525304A (ja) | 2020-05-08 | 2023-06-15 | ザ ブロード インスティテュート,インコーポレーテッド | 標的二本鎖ヌクレオチド配列の両鎖同時編集のための方法および組成物 |
| CN111334529B (zh) * | 2020-05-20 | 2020-09-29 | 中国农业大学 | 一种利用第三代碱基编辑器制备精准blg基因敲除牛的方法 |
| CN111534519B (zh) * | 2020-05-26 | 2021-12-14 | 中国农业科学院北京畜牧兽医研究所 | 识别猪eIF4G1基因的sgRNA及其编码DNA和应用 |
| KR20230021676A (ko) * | 2020-06-02 | 2023-02-14 | 카탈렌트 파마 솔루션즈, 엘엘씨 | 단백질 제조를 위한 핵산 구조체 |
| CN113234722B (zh) * | 2021-04-30 | 2023-03-14 | 肇庆市瑞思元生物科技有限公司 | 利用碱基编辑修复与板层状鱼鳞病相关的tgm1 c607t突变的试剂和方法 |
| CN113583944B (zh) * | 2021-09-15 | 2023-07-21 | 广西壮族自治区水牛研究所 | 激活Wnt/β-catenin信号通路在提高水牛体外胚胎生产效率中的应用 |
| CA3233824A1 (en) | 2021-10-08 | 2023-04-13 | Samir Mitragotri | Ionic liquids for drug delivery |
| WO2023077360A1 (zh) * | 2021-11-04 | 2023-05-11 | 云南农业大学 | 一种构建重症免疫缺陷和肝损伤双重猪模型的方法及应用 |
| WO2023114476A1 (en) * | 2021-12-17 | 2023-06-22 | Schmelzle Laurie | Systems and methods for generating and managing non-fungible digital representations of living, biological, or eukaryotic organisms |
| CN115341044A (zh) * | 2022-10-19 | 2022-11-15 | 佛山科学技术学院 | 一种利用微生物及其相关snp位点预测猪日增重的方法 |
| CN115786343A (zh) * | 2022-11-17 | 2023-03-14 | 石河子大学 | 一种猪Zfy基因的RNA干扰片段、表达载体及其应用 |
| CN116790604B (zh) * | 2023-08-18 | 2023-10-27 | 成都中科奥格生物科技有限公司 | 一种sgRNA、CRISPR/Cas9载体及其构建方法和用途 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010539931A (ja) * | 2007-09-27 | 2010-12-24 | サンガモ バイオサイエンシーズ, インコーポレイテッド | ジンクフィンガーヌクレアーゼを使用したゼブラフィッシュにおけるゲノム編集 |
| JP2012510812A (ja) * | 2008-12-04 | 2012-05-17 | サンガモ バイオサイエンシーズ, インコーポレイテッド | 亜鉛フィンガーヌクレアーゼを使用したラットのゲノム編集 |
| WO2012149470A1 (en) * | 2011-04-27 | 2012-11-01 | Amyris, Inc. | Methods for genomic modification |
| WO2013192316A1 (en) * | 2012-06-21 | 2013-12-27 | Recombinetics, Inc. | Genetically modified animals and methods for making the same |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4873191A (en) | 1981-06-12 | 1989-10-10 | Ohio University | Genetic transformation of zygotes |
| EP0821070A1 (en) | 1996-07-22 | 1998-01-28 | Carelli, Claude Marcel Henri | Pit-1 gene polymorphism and trait selection in animals |
| AU6218899A (en) | 1998-10-12 | 2000-05-01 | Geron Bio-Med Limited | Porcine oocytes with improved developmental competence |
| AU1100201A (en) | 1999-10-28 | 2001-05-08 | Board Of Trustees Of The Leland Stanford Junior University | Methods of in vivo gene transfer using a sleeping beauty transposon system |
| BR0307383A (pt) | 2002-01-23 | 2005-04-26 | Univ Utah Res Found | Mutagênese cromossomica alvo utilizando nucleases de ramificações de zinco |
| CN101405404A (zh) | 2002-12-31 | 2009-04-08 | 迈特默菲公司 | 用于推断牛的性状的组合物、方法和系统 |
| US7985739B2 (en) | 2003-06-04 | 2011-07-26 | The Board Of Trustees Of The Leland Stanford Junior University | Enhanced sleeping beauty transposon system and methods for using the same |
| US20050153317A1 (en) | 2003-10-24 | 2005-07-14 | Metamorphix, Inc. | Methods and systems for inferring traits to breed and manage non-beef livestock |
| EP1749102A4 (en) * | 2004-04-22 | 2009-02-25 | Kirin Pharma Kk | TRANSGENIC ANIMALS AND USES THEREOF |
| AU2005299413A1 (en) * | 2004-10-22 | 2006-05-04 | Revivicor, Inc. | Ungulates with genetically modified immune systems |
| NZ565337A (en) | 2005-06-24 | 2011-04-29 | Recombinetics Inc | Using cytosine deaminases to diminish retroelement transfer from pigs to humans |
| US20110023159A1 (en) | 2008-12-04 | 2011-01-27 | Sigma-Aldrich Co. | Ovine genome editing with zinc finger nucleases |
| US20110023140A1 (en) | 2008-12-04 | 2011-01-27 | Sigma-Aldrich Co. | Rabbit genome editing with zinc finger nucleases |
| US20110030072A1 (en) * | 2008-12-04 | 2011-02-03 | Sigma-Aldrich Co. | Genome editing of immunodeficiency genes in animals |
| KR20100080068A (ko) | 2008-12-31 | 2010-07-08 | 주식회사 툴젠 | 신규한 징크 핑거 뉴클레아제 및 이의 용도 |
| CN102858985A (zh) * | 2009-07-24 | 2013-01-02 | 西格马-奥尔德里奇有限责任公司 | 基因组编辑方法 |
| US20120192298A1 (en) | 2009-07-24 | 2012-07-26 | Sigma Aldrich Co. Llc | Method for genome editing |
| WO2011017315A2 (en) | 2009-08-03 | 2011-02-10 | Recombinetics, Inc. | Methods and compositions for targeted gene modification |
| KR102110725B1 (ko) | 2009-12-10 | 2020-05-13 | 리전츠 오브 더 유니버스티 오브 미네소타 | Tal 이펙터-매개된 dna 변형 |
| AU2011215557B2 (en) * | 2010-02-09 | 2016-03-10 | Sangamo Therapeutics, Inc. | Targeted genomic modification with partially single-stranded donor molecules |
| BR112012020257A8 (pt) | 2010-02-11 | 2018-02-14 | Recombinetics Inc | métodos e aparelhos para produzir artiodátilos transgênicos |
| RU2012149891A (ru) * | 2010-04-23 | 2014-05-27 | Пайонир Хай-Бред Интернэшнл, Инк. | Композиции переключения генов и способы их применения |
| CN105695415A (zh) * | 2010-06-17 | 2016-06-22 | 科马布有限公司 | 动物模型及治疗分子 |
| SG187075A1 (en) * | 2010-07-23 | 2013-03-28 | Sigma Aldrich Co Llc | Genome editing using targeting endonucleases and single-stranded nucleic acids |
| EP3461898A1 (en) | 2011-02-25 | 2019-04-03 | The University Court Of The University of Edinburgh | Genetically modified animals and methods for making the same |
| US10612043B2 (en) * | 2013-03-09 | 2020-04-07 | Agilent Technologies, Inc. | Methods of in vivo engineering of large sequences using multiple CRISPR/cas selections of recombineering events |
| BR122023023211A2 (pt) * | 2014-04-28 | 2024-01-23 | Recombinetics, Inc. | Método de fazer edições de genes multiplex em uma célula de vertebrado ou de embrião primário não-humano |
-
2015
- 2015-04-28 BR BR122023023211-9A patent/BR122023023211A2/pt unknown
- 2015-04-28 CN CN201580030358.1A patent/CN106535630B/zh active Active
- 2015-04-28 MX MX2016014066A patent/MX2016014066A/es unknown
- 2015-04-28 AU AU2015253352A patent/AU2015253352A1/en not_active Abandoned
- 2015-04-28 CN CN202010235249.6A patent/CN111647627A/zh active Pending
- 2015-04-28 AR ARP150101276A patent/AR100216A1/es unknown
- 2015-04-28 JP JP2016565064A patent/JP2017513510A/ja active Pending
- 2015-04-28 CA CA2946881A patent/CA2946881A1/en not_active Abandoned
- 2015-04-28 US US14/698,561 patent/US20160029604A1/en not_active Abandoned
- 2015-04-28 EP EP15723593.8A patent/EP3136850A1/en not_active Withdrawn
- 2015-04-28 KR KR1020167032557A patent/KR20170003585A/ko unknown
- 2015-04-28 AP AP2016009588A patent/AP2016009588A0/en unknown
- 2015-04-28 BR BR112016024945A patent/BR112016024945A2/pt active Search and Examination
- 2015-04-28 WO PCT/US2015/027995 patent/WO2015168125A1/en active Application Filing
-
2016
- 2016-10-28 PH PH12016502162A patent/PH12016502162A1/en unknown
-
2018
- 2018-03-16 US US15/923,951 patent/US20180235194A1/en not_active Abandoned
-
2021
- 2021-07-19 US US17/379,898 patent/US20220056482A1/en active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010539931A (ja) * | 2007-09-27 | 2010-12-24 | サンガモ バイオサイエンシーズ, インコーポレイテッド | ジンクフィンガーヌクレアーゼを使用したゼブラフィッシュにおけるゲノム編集 |
| JP2012510812A (ja) * | 2008-12-04 | 2012-05-17 | サンガモ バイオサイエンシーズ, インコーポレイテッド | 亜鉛フィンガーヌクレアーゼを使用したラットのゲノム編集 |
| WO2012149470A1 (en) * | 2011-04-27 | 2012-11-01 | Amyris, Inc. | Methods for genomic modification |
| WO2013192316A1 (en) * | 2012-06-21 | 2013-12-27 | Recombinetics, Inc. | Genetically modified animals and methods for making the same |
Non-Patent Citations (1)
| Title |
|---|
| TRANSGENIC RES. (FEB 2014) VOL.23, ISSUE 1, P.189(左欄), JPN6019014568, ISSN: 0004219572 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190038449A (ko) * | 2017-09-29 | 2019-04-08 | 서울대학교산학협력단 | Klotho 유전자 넉아웃 질환모델 동물 및 이의 용도 |
| KR102207352B1 (ko) | 2017-09-29 | 2021-01-26 | 서울대학교산학협력단 | Klotho 유전자 넉아웃 질환모델 동물 및 이의 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2016014066A (es) | 2017-05-03 |
| AR100216A1 (es) | 2016-09-21 |
| KR20170003585A (ko) | 2017-01-09 |
| US20220056482A1 (en) | 2022-02-24 |
| CN106535630A (zh) | 2017-03-22 |
| CA2946881A1 (en) | 2015-11-05 |
| BR112016024945A2 (pt) | 2017-10-24 |
| CN106535630B (zh) | 2020-04-24 |
| CN111647627A (zh) | 2020-09-11 |
| PH12016502162A1 (en) | 2017-02-06 |
| AU2015253352A1 (en) | 2016-12-08 |
| US20160029604A1 (en) | 2016-02-04 |
| US20180235194A1 (en) | 2018-08-23 |
| AP2016009588A0 (en) | 2016-11-30 |
| BR122023023211A2 (pt) | 2024-01-23 |
| EP3136850A1 (en) | 2017-03-08 |
| WO2015168125A1 (en) | 2015-11-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220056482A1 (en) | Methods for making genetic edits | |
| US20200017882A1 (en) | Engineering of humanized car t-cell and platelets by genetic complementation | |
| US20190335725A1 (en) | Genetically sterile animals | |
| AU2013277214B2 (en) | Genetically edited animals and methods for making the same | |
| CA3003652A1 (en) | Compositions and methods for chimeric embryo-assisted organ production | |
| US20190223417A1 (en) | Genetically modified animals having increased heat tolerance | |
| JP2018531003A6 (ja) | 向上した耐暑性を有する遺伝子改変動物 | |
| US20210037797A1 (en) | Inducible disease models methods of making them and use in tissue complementation | |
| US20190254266A1 (en) | Engineering of Humanized Kidney by Genetic Complementation | |
| JP2017533716A (ja) | 腫瘍抑制因子遺伝子のヘテロ接合性改変および神経線維腫症1型のブタモデル | |
| NZ715540B2 (en) | Genetically sterile animals |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180424 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180424 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190423 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190722 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190920 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200225 |