KR20160079933A - TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 - Google Patents
TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 Download PDFInfo
- Publication number
- KR20160079933A KR20160079933A KR1020167017366A KR20167017366A KR20160079933A KR 20160079933 A KR20160079933 A KR 20160079933A KR 1020167017366 A KR1020167017366 A KR 1020167017366A KR 20167017366 A KR20167017366 A KR 20167017366A KR 20160079933 A KR20160079933 A KR 20160079933A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- disease
- tnfα
- dose
- administered
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- C07K2316/96—
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 발명은, TNFα 항체를 포함하는 TNFα 억제제를 투여함을 포함하여, 크론병 및 건선을 포함하는 TNFα-관련 질환을 치료하는 다중-가변 투여 방법이 기술되어 있다. 다중-가변 투여 방법은 TNFα 억제제를 유도 단계 또는 로딩 단계 내에 투여한 후, 당해 제제를 유지 단계 또는 치료 단계 내에서 유도 단계 동안 보다 높은 용량으로 투여함을 포함한다.
Description
관련 출원
본 출원은 2004년 4월 9일자로 출원된 미국 가특허원 제60/561,139호; 2004년 4월 12일자로 출원된 미국 가특허원 제60/561,710호; 및 2004년 5월 7일자로 출원된 미국 가특허원 제60/569,100호의 우선권을 청구한다. 이들 특허원 각각의 전체 내용은 본원에 참조로 인용된다.
본 출원은 미국 특허 제6,090,382호, 제6,258,562호, 및 제6,509,015호에 관한 것이다. 당해 출원은 또한 2001년 3월 7일자로 출원된 미국 특허원 제09/801,185호; 2002년 11월 22일자로 출원된 미국 특허원 제10/302,356호; 2002년 6월 5일자로 출원된 미국 특허원 제10/163657호; 2002년 4월 26일자로 출원된 미국 특허원 제10/133715호; 2002년 8월 16일자로 출원된 미국 특허원 제10/222140호; 2003년 10월 24일자로 출원된 미국 특허원 제10/693233호; 2003년 7월 18일자로 출원된 미국 특허원 제10/622932호; 2003년 7월 18일자로 출원된 미국 특허원 제10/623039호; 2003년 7월 18일자로 출원된 미국 특허원 제10/623076호; 2003년 7월 18일자로 출원된 미국 특허원 제10/623065호; 2003년 7월 18일자로 출원된 미국 특허원 제10/622928호; 2003년 7월 18일자로 출원된 미국 특허원 제10/623075호; 2003년 7월 18일자로 출원된 미국 특허원 제10/623035호; 2003년 7월 18일자로 출원된 미국 특허원 제10/622683호; 2003년 7월 18일자로 출원된 미국 특허원 제10/622205호; 2003년 7월 18일자로 출원된 미국 특허원 제10/622210호; 2003년 7월 18일자로 출원된 미국 특허원 제10/623318호; 및 2003년 4월 24일자로 출원된 미국 특허원 제10/422287호에 관한 것이다. 이들 특허 및 특허원의 전체 내용은 본원에 참조로 인용된다.
인터루킨-1(IL-1) 및 종양 괴사 인자(TNF)를 포함하는 사이토킨은 염증 과정의 매개인자로서 확인된 단핵구 및 대식구와 같은 각종 세포에 의해 생산된 분자이다. TNF와 같은 사이토킨은 손상 또는 감염의 결과로서 발생하는 염증 반응의 강도 및 지속성을 조절한다. TNF의 증가된 수준은 병리학적 염증에서 중요한 역활을 한다. TNF는 또한 (TNFα)로 언급되며 패혈증, 감염, 자가면역 질환, 이식 거부 및 이식편-대-숙주병을 포함하는 각종의 사람 질병 및 질환의 병리생리학에 관련되어 있다[참조: Moeller et al (1990) Cytokine 2:162; 미국 특허 제5,231,024호(Moeller et al); 유럽 특허 공보 제260 610 Bl호(Moeller, A. et al.); Vasilli (1992) Annu. Rev. Immunol. 10:411; Tracey 및 Cerami (1994) Annu. Rev. Med. 45:491].
TNF는 건선에도 관련되어 있다. 병발되지 않은 피부가 아닌 판상 건선에서 TNF-유도된 단백질의 발현 및 활성화된 T 림프구의 존재는 당해 질병의 발병기전에 있어 이들의 관여를 제시한다. 경피 징후에 따라 수개 유형의 건선이 존재한다: 판상 건선, 방울 건선, 건선 홍피증, 전신 고름물집 건선 및 국소 고름물집 건선. 그러나, 판상 건선이 가장 일반적인 유형이다. 건선의 치료는 질병의 정도에 따른다. 국소 코르티코스테로이드가 경증 내지 중등증의 국소 증례에 대해 흔히 사용된다. 각질용해제 및 코울타르도 또한 국소 의약으로 사용되며, 광치료법은 더욱 만연한 질병에 일반적으로 사용된다. 메토트렉세이트 사이클로스포린 및 합성 레티노이드와 같은 기타 전신계 치료법이 효과적이나, 종종 이들의 가능한 누적 독성 효과로 인하여 교대로 투여된다.
TNF는 또한 크론병에 관여되어 있다. 크론병은 임상적, 내시경, 방사선 및 조직학적 범주를 기준으로 진단된다. 크론병의 치료는 시도중에 있다. 치료는 질병의 위치, 크기 및 중증도를 기준으로 한다. 현재의 화합물 및 요법은 염증 과정을 완전하게 완화시키지 못하며 큰 부작용을 지닌다.
TNFα 활성이 유해한 TNFα-관련 질환을 안정하고 효과적인 방식으로 치료하는 것이 요구되고 있다. 본 발명은 TNFα 활성이 유해한 TNFα-관련 질환의 개선된 치료를 위한 다중-가변 투여 방법을 포함한다.
본 발명은, 유도 단계 내에서 TNFα 억제제의 역치 수준이 달성되도록 유도 투여량의 TNFα억제제를 1회 이상 이를 필요로 하는 피험체에게 투여하고; 후속적으로, 치료가 이루어지도록, 치료 단계 내에 당해 피험체에게 치료 투여량의 TNFα 억제제를 1회 이상 투여함을 포함하여, TNFα 활성이 유해한 질병을 치료하기 위한 다중-가변 투여 방법을 기술한다.
본 발명은 또한, 유도 단계 내에서 TNFα 억제제의 역치 수준이 달성되도록 유도 투여량의 TNFα억제제를 1회 이상 이를 필요로 하는 피험체에게 투여하고; 후속적으로, 치료가 이루어지도록, 치료 단계 내에 당해 피험체에게 치료 투여량의 TNFα 억제제를 1회 이상 투여함을 포함하여, 크론병을 치료하기 위한 다중-가변 투여 방법을 기술한다. 본 발명의 다중-가변 투여 방법을 또한 사용하여 궤양성 결장염 또는 건선을 치료할 수 있다. 다른 양태에서, 본 발명의 다중-가변 투여 방법을 사용하여 건선 관절염과 합병증을 이룬 건선을 치료할 수 있다.
본 발명은, 유도 단계 내에서 TNFα 억제제의 역치 수준이 달성되도록 유도 투여량의 TNFα억제제를 1회 이상 이를 필요로 하는 피험체에게 투여하고; 후속적으로, 치료가 이루어지도록, 치료 단계 내에 당해 피험체에게 치료 투여량의 TNFα 억제제를 1회 이상 투여함을 포함하여, 크론병의 완화를 유도하는 다중-가변 투여 방법을 포함한다.
추가의 양태에서, 본 발명은, 유도 단계 내에서 TNFα 억제제의 역치 수준이 달성되도록 유도 투여량의 TNFα억제제를 1회 이상 이를 필요로 하는 피험체에게 투여하고; 후속적으로, 치료가 이루어지도록, 치료 단계 내에 당해 피험체에게 치료 투여량의 TNFα 억제제를 1회 이상 투여함을 포함하여, 판상 건선을 감소시키는 다중-가변 투여 방법을 포함한다.
하나의 양태에서, TNFα 억제제는 에타네르셉트(etanercept) 또는 인플릭시맙(infliximab)이다.
본 발명의 하나의 양태에서, TNFα 억제제는 TNFα 항체 또는 이의 항원-결합 단편이다. 본 발명의 다른 양태에서, TNFα 억제제는 사람 TNFα 항체 또는 이의 항원-결합 단편이다. 하나의 양태에서, 항체가, 표면 플라스몬 공명에 의한 측정시, 사람 TNFα로부터 1 x 10-8 M 이하의 Kd 및 1 x 10-3 s-l 이하의 Koff 속도 상수로 해리되고, 표준 시험관내 L929 검정에서 사람 TNFα 세포 독성을 1 x 10~ 7 M 이하의 IC50으로 중화시키는, 분리된 사람 항체 또는 이의 항원 결합부이다. 다른 양태에서, 항체는 다음 특성을 지닌다:
a) 표면 플라스몬 공명에 의한 측정시, 1 x 10-3 s-1 이하의 Koff 속도 상수로 사람 TNFα로부터 해리되고;
b) 서열번호 3의 아미노산 서열, 또는 서열번호 3으로부터 1, 4, 5, 7 또는 8번 위치에서 단일 알라닌 치환에 의해, 또는 1, 3, 4, 6, 7, 8 및/또는 9번 위치에서 1 내지 5개의 보존성 아미노산 치환에 의해 변형된 아미노산 서열을 포함하는 경쇄 CDR3 도메인을 가지며;
c) 서열번호 4의 아미노산 서열, 또는 서열번호 4로부터 2, 3, 4, 5, 6, 8, 9, 10 또는 11번 위치에서 단일 알라닌 치환에 의해, 또는 2, 3, 4, 5, 6, 8, 9, 10, 11 및/또는 12번 위치에서 1 내지 5개의 보존성 아미노산 치환에 의해 변형된아미노산 서열을 포함하는 중쇄 CDR3 도메인을 가진다.
또 다른 양태에서, 항체는 서열번호 1의 아미노산 서열을 포함하는 경쇄 가변 영역(LCVR) 및 서열번호 2의 아미노산 서열을 포함하는 중쇄 가변 영역(HCVR)을 갖는다. 추가의 양태에서, 항체는 D2E7이다.
본 발명은 방법은 자가면역 질환, 감염성 질환, 이식거부 또는 이식편-대-숙주병, 악성종양, 폐 질환, 장 질환, 심장 질환, 패혈증, 척추관절병증, 대사 장애, 빈혈, 통증, 간 질환, 피부 질환, 손발톱 장애, 혈관염으로 이루어진 그룹 중에서 선택된 TNFα-관련 질환을 치료하는데 사용할 수 있다. 하나의 양태에서, 자가면역 질환은 류마티스 관절염, 류마티스성 척추염, 골관절염, 통풍관절염, 알레르기, 다발경화증, 자가면역성 당뇨병, 자가면역성 포도막염 및 콩팥 증후군으로 이루어진 그룹 중에서 선택된다. 다른 양태에서, TNFα-관련 질환은 염증성 골 질환, 골 흡수병, 알콜성 간염, 바이러스성 간염, 전격간염, 응고 장애, 화상, 재관류 손상, 켈로이드 형성(keloid formation), 흉터 조직 형성, 발열, 치주병, 비만증 및 방사선 독성으로 이루어진 그룹 중에서 선택된다. 또 다른 양태에서, TNFα-관련 질환은 베체트병, 강직척추염, 천식, 만성 폐쇄성 폐질환(COPD), 특발성폐섬유증(IPF), 재협착, 당뇨병, 빈혈, 통증, 크론병-관련 장애, 소아 류마티스 관절염(JRA), C형 간염 바이러스 감염, 건선 관절염 및 만성 판상 건선으로 이루어진 그룹 중에서 선택된다.
본 발명의 하나의 양태에서, TNFα-관련 질환은 크론병이다. 다른 양태에서, 질환은 궤양성 결장염이다. 또 다른 양태에서, 질환은 건선이다. 또 다른 양태에서, 질환은 건선 관절염(PsA)과 합병증을 이룬 건선이다. 또 다른 양태에서, TNFα-관련 질환은 류마티스 관절염이다.
하나의 양태에서, 치료 투여량은 유도 투여량의 40 내지 60%이다.
하나의 양태에서, 본 발명의 다중 가변 투여 요법에 사용된 유도 투여량은 약 20 내지 200mg이다. 다른 양태에서, 유도 투여량은 약 80 내지 160mg의 범위이다.
본 발명의 하나의 양태에서, 본 발명의 다중 가변 투여 요법에 사용된 치료 투여량은 약 20 내지 120mg의 범위이다. 다른 양태에서, 치료 투여량은 약 40 내지 80mg의 범위이다.
본 발명의 하나의 양태에서, 유도 투여량은 약 160mg을 포함한다. 다른 양태에서, 치료 투여량은 약 80mg을 포함한다.
본 발명의 하나의 양태에서, 유도 투여량은 약 80mg을 포함한다. 또 다른 양태에서, 치료 투여량은 약 40mg을 포함한다.
하나의 양태에서, 본 발명의 다중 가변 투여 요법에 사용된 유도 투여량은 20 내지 200mg의 범위이다. 다른 양태에서, 유도 투여량은 80 내지 160mg의 범위이다. 하나의 양태에서, 본 발명의 다중 가변 투여 요법에 사용된 치료 투여량은 20 내지 120mg의 범위이다. 다른 양태에서, 치료 투여량은 40 내지 80mg의 범위이다.
본 발명의 또 다른 양태에서, 유도 투여량은 160mg을 포함한다. 또 다른 양태에서, 치료 투여량은 80mg을 포함한다.
본 발명의 하나의 양태에서, 유도 투여량은 80mg을 포함한다. 또 다른 양태에서, 치료 투여량은 40mg을 포함한다.
하나의 양태에서, 치료 투여량은 유도 투여량의 투여 후 약 2주째에 투여한다.
하나의 양태에서, TNFα 억제제는 피하 투여한다. 다른 양태에서, TNFα 억제제는 메토트렉세이트와 함께 투여한다. 메토트렉세이트는 예를 들면, 2.5mg 내지 30mg의 투여량으로 투여할 수 있다.
하나의 양태에서, 크론병 치료의 다중 투여 방법의 역치 수준은 피험체의 크론병 활성 지표(CDAI) 점수에 있어서의 감소로 측정한다.
하나의 양태에서, 건선 치료의 다중 투여 방법의 역치 수준은 판상 건선에있어서의 감소, 피험체의 건선 부위 중증도 지표(PASI)에 있어서의 개선, 피험체 담당의사의 총괄 평가(PGA) 점수에 있어서의 개선으로 이루어진 그룹 중에서 선택된 치료 효과로 측정한다.
본 발명은, TNFα 억제제의 역치 수준이 유도 단계 내에서 달성되도록 유도 투여량의 D2E7을 1회 이상 이를 필요로 하는 피험체에게 투여하고; 후속적으로, 치료가 이루어지도록, 치료 단계 내에서 D2E7의 치료 투여량을 1회 이상 상기 피험체에게 투여함을 포함하는, 크론 병의 완화를 유도하는 다중-가변 투여 방법을 기술한다.
다른 양태에서, 본 발명은, TNFα 억제제의 역치 수준이 유도 단계 내에서 달성되도록 유도 투여량의 D2E7을 1회 이상 이를 필요로 하는 피험체에게 투여하고; 후속적으로, 치료가 이루어지도록, 치료 단계 내에서 D2E7의 치료 투여량을 1회 이상 상기 피험체에게 투여함을 포함하는, 판상 건선을 감소시키는 다중-가변 투여 방법을 기술한다.
본 발명은,
a) TNFα 억제제의 유도 투여량을 포함하는 하나 이상의 용기;
b) TNFα 억제제의 치료 투여량을 포함하는 하나 이상의 용기; 및
c) 유도 단계에서 상기 유도 투여량을 투여하고 치료 단계에서 치료 투여량의 TNFα 억제제를 투여하기 위한 지침서를 포함하는, TNFα 활성이 유해한 질환 치료용 키트를 제공한다.
본 발명은 또한, 유도 단계에 유도 투여량을 투여하기 위한 지침서와 함께 포장된 TNFα 억제제의 유도 투여량을 포함하는 하나 이상의 용기를 포함하는, TNFα 활성이 유해한 질환의 치료용 키트를 기술한다.
본 발명은, 치료 단계에 치료 투여량을 투여하기 위한 지침서와 함께 포장된 TNFα 억제제의 치료 투여량을 포함하는 하나 이상의 용기를 포함하는, TNFα 활성이 유해한 질환의 치료용 키트를 기술한다.
본 발명의 하나의 양태에서, 당해 키트는 자가면역 질환, 감염성 질환, 이식거부 또는 이식편-대-숙주병, 악성종양, 폐 질환, 장 질환, 심장 질환, 패혈증, 척추관절병증, 대사 장애, 빈혈, 통증, 간 질환, 피부 질환, 손발톱 장애 및 혈관염으로 이루어진 그룹 중에서 선택된 질환을 치료하는데 사용할 수 있다. 하나의 양태에서, 자가면역 질환은 류마티스 관절염, 류마티스성 척추염, 골관절염, 통풍 관절염, 알레르기, 다발경화증, 자가면역성 당뇨병, 자가면역성 포도막염 및 콩팥 증후군으로 이루어진 그룹 중에서 선택된다. 또 다른 양태에서, TNFα-관련 질환은 베체트병, 강직척추염, 천식, 만성 폐쇄성 폐질환(COPD), 특발성폐섬유증(IPF), 재협착, 당뇨병, 빈혈, 통증, 크론병-관련 장애, 소아 류마티스 관절염(JRA), C형 간염 바이러스 감염, 건선 관절염 및 만성 판상 건선으로 이루어진 그룹 중에서 선택된다.
본 발명의 하나의 양태에서, 키트는 크론병, 궤양성 결장염, 건선 관절염과 합병증을 이룬 건선, 및 건선으로 이루어진 그룹 중에서 선택된 질병의 치료용으로 사용된다.
다른 양태에서, 키트 내 TNFα 억제제는 TNFα 항체 또는 이의 항원-결합 단편이다. 다른 양태에서, 항체가, 표면 플라스몬 공명에 의한 측정시, 사람 TNFα로부터 1 x 10-8 M 이하의 Kd 및 1 x 10-3 s-l 이하의 Koff 속도 상수로 해리되고, 시험관내 L929 검정에서 사람 TNFα 세포 독성을 1 x 10-7 M 이하의 IC50으로 중화시키는, 분리된 사람 항체 또는 이의 항원 결합부이다. 다른 양태에서, 항체는 다음 특성을 지닌다:
a) 표면 플라스몬 공명에 의한 측정시, 1 x 10-3 s-1 이하의 Koff 속도 상수로 사람 TNFα로부터 해리되고;
b) 서열번호 3의 아미노산 서열, 또는 서열번호 3으로부터 1, 4, 5, 7 또는 8번 위치에서 단일 알라닌 치환에 의해, 또는 1, 3, 4, 6, 7, 8 및/또는 9번 위치에서 1 내지 5개의 보존성 아미노산 치환에 의해 변형된 아미노산 서열을 포함하는 경쇄 CDR3 도메인을 가지며;
c) 서열번호 4의 아미노산 서열, 또는 서열번호 4로부터 2, 3, 4, 5, 6, 8, 9, 10 또는 11번 위치에서 단일 알라닌 치환에 의해, 또는 2, 3, 4, 5, 6, 8, 9, 10, 11 및/또는 12번 위치에서 1 내지 5개의 보존성 아미노산 치환에 의해 변형된 아미노산 서열을 포함하는 중쇄 CDR3 도메인을 가진다.
또 다른 양태에서, 항체는 서열번호 1의 아미노산 서열을 포함하는 경쇄 가변 영역(LCVR) 및 서열번호 2의 아미노산 서열을 포함하는 중쇄 가변 영역(HCVR)을 갖는다. 추가의 양태에서, 항체는 D2E7이다.
하나의 양태에서, 키트 내 제공된 TNFα 억제제는 에타네르셉트 또는 인플릭시맙이다.
하나의 양태에서, 키트 내 제공된 치료 투여량은 유도 투여량의 40 내지 60%이다.
하나의 양태에서, 키트 내 제공된 유도 투여량은 약 20 내지 200mg이다. 다른 양태에서, 키트 내 제공된 유도 투여량은 약 80 내지 160mg의 범위이다.
본 발명의 하나의 양태에서, 키트 내 제공된 치료 투여량은 약 20 내지 120mg의 범위이다. 다른 양태에서, 키트 내 제공된 치료 투여량은 약 40 내지 80mg의 범위이다.
하나의 양태에서, 본 발명의 키트내 제공된 유도 투여량은 약 160mg을 포함한다. 다른 양태에서, 치료 투여량은 약 80mg을 포함한다. 또 다른 양태에서, 유도 투여량은 약 80mg을 포함한다. 또 다른 양태에서, 치료 투여량은 약 40mg을 포함한다.
하나의 양태에서, 본 발명의 키트내 제공된 유도 투여량은 160mg을 포함한다. 다른 양태에서, 치료 투여량은 80mg을 포함한다. 또 다른 양태에서, 유도 투여량은 80mg을 포함한다. 또 다른 양태에서, 치료 투여량은 40mg을 포함한다.
본 발명의 또 다른 양태에서, 용기는 사전-충전된(pre-filled) 주사기이다. 또 다른 양태에서, 키트는 유도 투여량의 투여 후 약 2주째에 치료 투여량을 투여하기 위한 지침서를 포함한다.
본 발명은, 당해 질환이 치료되도록 단일 투여량의 TNFα 억제제를 이를 필요로 하는 피험체에 투여함을 포함하여, TNFα 활성이 유해한 질환을 치료하는 방법을 제공한다. 하나의 양태에서, TNFα 억제제는 항-TNFα 항체 또는 이의 항원 결합부이다. 다른 양태에서, TNFα 억제제는 사람 항-TNFα 항체 또는 이의 항원 결합부이며, 예를 들면, 표면 플라스몬 공명에 의한 측정시, 사람 TNFα로부터 1 x 10-8 M 이하의 Kd 및 1 x 10-3 s-l 이하의 Koff 속도 상수로 해리되고, 표준 시험관내 L929 검정에서 사람 TNFα 세포 독성을 1 x 10-7 M 이하의 IC50으로 중화시키는 분리된 사람 항체 또는 이의 항원 결합부이다. 하나의 양태에서, 상기 사람 항체 또는 이의 항원 결합부는, 사람 TNFα로부터 5 x 10-4 s-l 이하의 Koff 속도 상수로 해리되는 사람 항체 또는 이의 항원 결합부이다. 또 다른 양태에서, 상기 사람 항체 또는 이의 항원 결합부는, 사람 TNFα로부터 1 x 10-4 s-l 이하의 Koff 속도 상수로 해리된다. 또 다른 양태에서, 상기 사람 항체 또는 이의 항원 결합부는 표준 시험관내 L929 검정에서 사람 TNFα 세포 독성을 1 x 10-8 M 이하의 IC50으로 중화시키는 사람 항체 또는 이의 항원 결합부이다. 또 다른 양태에서, 상기 사람 항체 또는 이의 항원 결합부는 시험관내 L929 검정에서 사람 TNFα 세포 독성을 1 x 10-9 M 이하의 IC50으로 중화시키는 사람 항체 또는 이의 항원 결합부이다. 추가의 양태에서, 상기 사람 항체 또는 이의 항원 결합부는 표준 시험관내 L929 검정에서 사람 TNFα 세포 독성을 1 x 10~ 10 M 이하의 IC50으로 중화시키는 사람 항체 또는 이의 항원 결합부이다. 사람 항체 또는 이의 항원 결합부는 또한 재조합 항체, 또는 이의 재조합 항원 결합부일 수 있다. 하나의 양태에서, 상기 사람 항체 또는 이의 항원 결합부는 D2E7이다. 다른 양태에서, 단일 투여량은 약 80mg, 40mg, 및 20mg으로 이루어진 그룹 중에서 선택된다. 또 다른 양태에서, 투여는 피하 주사에 의한다. 본 발명의 하나의 양태에서, TNFα-관련 질환은 크론병이다. 다른 양태에서, 질환은 궤양성 결장염이다. 또 다른 양태에서, 질환은 건선이다. 또 다른 양태에서, 질환은 건선 관절염(PsA)과 합병증을 이룬 건선이다. 또 다른 양태에서, TNFα-관련 질환은 류마티스 관절염이다.
본 발명에 의해, TNFα 항체를 포함하는 TNFα 억제제를 투여함을 포함하는 다중-가변 투여 방법으로, 크론병 및 건선을 포함하는 TNFα-관련 질환을 효과적으로 치료할 수 있다.
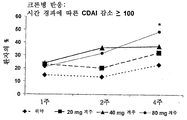
도 1은 다중-가변 투여 요법을 사용하여 시간 경과에 따라 크론병이 완화(CDAI < 150)된 환자의 퍼센트를 입증하는 결과를 제공한다.
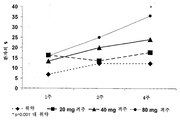
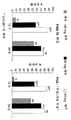
도 2는 다중 가변 투여 요법을 받은 크론병 환자에서 시간 경과에 따른 평균 CDAI 점수에 있어서의 감소 그래프를 도시한다.
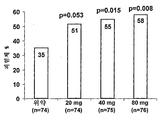
도 3은 다중 가변 투여 치료를 받은 크론병 환자에서 완화 및 임상 반응을 나타낸다. 도 3a는 4주째에 CDAI가 ≥ 70 점 감소된 환자의 퍼센트를 제공한다. P-값은 위약 그룹과의 비교를 나타낸다. 도 3b는 시간 경과에 따라 CDAI가 ≥70 점 감소된 환자의 퍼센트의 그래프를 제공한다; 위약 그룹에 대해 *p=0.015 및 위약 그룹에 대해 **p=0.008
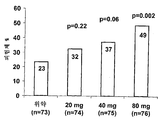
도 4는 다중 가변 투여 치료를 받은 크론병 환자에서 완화 및 임상 반응을 나타낸다. 도 4a는 4주째에 CDAI가 ≥100 점 감소된 환자의 퍼센트를 제공한다(p-값은 위약 그룹과의 비교를 나타낸다. 도 4b는 시간 경과에 따라 CDAI가 ≥100 점 감소된 환자의 퍼센트를 나타낸다; 위약 그룹에 대해 *p=0.002.
도 5는 위약 그룹에 대해 다중-가변 치료를 받은 크론병 환자에서 CRP 중간 값을 나타내는 결과를 제공한다.
도 6은 4주째에 IBDQ 점수로 측정시, 크론병의 치료시 다중-가변 투여 요법의 효능의 결과를 제공한다(P-값은 위약 그룹과의 비교를 나타낸다).
도 7은 각각의 다중 가변 D2E7 투여 및 위약을 사용한 치료후 12주째에 ≥PASI 50/75/90 반응을 갖는 건선 환자의 퍼센트를 나타낸다.
도 8은 12주 치료에 걸쳐 PASI(건선 부위 및 중증도 지표) 평균 퍼센트가 개선된 결과를 제공한다(eow = 격주; 위약 그룹에 대해 * = p<O.OOl).
도 9는 건선 및 PsA 환자에 대해 12주 및 24주째 효능 반응의 비교 그래프를 나타낸다.
도 10은 PsA가 없는 건선 환자에 대해 12 및 24주째에 효능 반응의 비교 그래프를 나타낸다.
도 2는 다중 가변 투여 요법을 받은 크론병 환자에서 시간 경과에 따른 평균 CDAI 점수에 있어서의 감소 그래프를 도시한다.
도 3은 다중 가변 투여 치료를 받은 크론병 환자에서 완화 및 임상 반응을 나타낸다. 도 3a는 4주째에 CDAI가 ≥ 70 점 감소된 환자의 퍼센트를 제공한다. P-값은 위약 그룹과의 비교를 나타낸다. 도 3b는 시간 경과에 따라 CDAI가 ≥70 점 감소된 환자의 퍼센트의 그래프를 제공한다; 위약 그룹에 대해 *p=0.015 및 위약 그룹에 대해 **p=0.008
도 4는 다중 가변 투여 치료를 받은 크론병 환자에서 완화 및 임상 반응을 나타낸다. 도 4a는 4주째에 CDAI가 ≥100 점 감소된 환자의 퍼센트를 제공한다(p-값은 위약 그룹과의 비교를 나타낸다. 도 4b는 시간 경과에 따라 CDAI가 ≥100 점 감소된 환자의 퍼센트를 나타낸다; 위약 그룹에 대해 *p=0.002.
도 5는 위약 그룹에 대해 다중-가변 치료를 받은 크론병 환자에서 CRP 중간 값을 나타내는 결과를 제공한다.
도 6은 4주째에 IBDQ 점수로 측정시, 크론병의 치료시 다중-가변 투여 요법의 효능의 결과를 제공한다(P-값은 위약 그룹과의 비교를 나타낸다).
도 7은 각각의 다중 가변 D2E7 투여 및 위약을 사용한 치료후 12주째에 ≥PASI 50/75/90 반응을 갖는 건선 환자의 퍼센트를 나타낸다.
도 8은 12주 치료에 걸쳐 PASI(건선 부위 및 중증도 지표) 평균 퍼센트가 개선된 결과를 제공한다(eow = 격주; 위약 그룹에 대해 * = p<O.OOl).
도 9는 건선 및 PsA 환자에 대해 12주 및 24주째 효능 반응의 비교 그래프를 나타낸다.
도 10은 PsA가 없는 건선 환자에 대해 12 및 24주째에 효능 반응의 비교 그래프를 나타낸다.
I. 정의
본 발명을 더욱 용이하게 이해할 수 있도록 하기 위하여, 특정의 용어를 유선 정의한다.
본원에 사용된 용어 "사람 TNFα" (hTNFα, 또는 단순히 hTNF로 약칭)은 17 kD의 분비된형 및 26 kD의 막 결합형으로 존재하며, 이의 생물학적 활성 형이 17 kD 분자에 비공유적으로 결합된 삼합체로 구성된 사람 사이토킨을 말하는 것으로 의도된다. hTNFα의 구조는 또한 예를 들면, 문헌[참조: Pennica, D., et al. (1984) Nature 312:724-729; Davis, J.M., et al. (1987) Biochemistry 26:1322-1326; 및 Jones, E.Y., et al. (1989) Nature 338:225-228]에 기술되어 있다. 용어 사람 TNFα는 재조합 사람 TNFα (rhTNFα)를 포함하는 것으로 의도되며, 이는 표준 재조합 발현 방법으로 제조하거나 상업적으로 입수할 수 있다[참조: 미네소타주 미네아폴리스 소재의 알 앤드 디 시스템스(R & D Systems) 제조원, 제품 번호 제210-TA호]. TNFα는 또한 TNF로도 언급된다.
용어 "TNFα 억제제"는 TNFα 활성을 방해하는 제제를 포함한다. TNFα 억제제의 예는 에타네르셉트[Enbrel®, 암젠(Amgen) 제조원], 인플릭시맙[Remicade®, 존슨 앤드 존슨(Johnson 및 Johnson) 제조원], 사람 항-TNF 모노클로날 항체[D2E7/HUMIRA®, 애보트 래보러토리즈(Abbott Laboratories) 제조원], CDP 571[셀테크(Celltech) 제조원], 및 CDP 870(셀테크 제조원), 및 TNFα 활성을 억제함으로써 TNFα 활성이 유해한 질환으로 고생하거나 이러한 질환으로 고생할 위험이 있는 피험체에게 투여하는 경우, 당해 질환이 치료되도록 하는 기타 화합물을 포함한다. 당해 용어는 또한 본원에 기술된 각각의 항--TNFα 사람 항체 및 항체 부위, 및 미국 특허 제6,090,382호; 제6,258,562호; 제6,509,015호, 및 미국 특허원 일련 번호 제09/801185호 및 제10/302356호(이들 각각은 본원에 참조로 인용된다)에 기술된 것들을 포함한다.
본원에 사용된 용어 "항체"는 4개의 폴리펩타이드 쇄, 즉 디설파이드 결합으로 내부 연결된 2개의 중쇄(H) 및 2개의 경쇄(L)로 구성된 면역글로불린 분자를 말하는 것으로 의도된다. 각각의 중쇄는 중쇄 가변 영역(본원에서 HCVR 또는 VH로 약칭) 및 중쇄 불변 영역으로 구성된다. 중쇄 불변 영역은 3개의 도메인, CHl, CH2 및 CH3으로 구성된다. 각각의 경쇄는 경쇄 가변 영역(본원에서 LCVR 또는 VL으로 약칭) 및 경쇄 불변 영역으로 구성된다. 경쇄 불변 영역은 1개의 도메인, CL로 구성된다. VH 및 VL 영역은, 골격 영역(FR)으로 명명된 보다 보존된 영역이 산재된, 상보성 결정 영역(CDR)으로 명명된 초가변성 영역으로 추가로 세분될 수 있다. 각각의 VH 및 VL은 3개의 CDR 및 4개의 FR로 구성되며, 이들은 다음 순서로 아미노-말단으로부터 카복시-말단으로 정렬되어 있다: FRl, CDRl, FR2, CDR2, FR3, CDR3, FR4. 본 발명의 항체는 이의 전문이 각각 본원에 참조로 인용된 미국 특허 제6,090,382호; 제6,258,562호; 및 제6,509,015호, 및 미국 특허원 일련번호 제09/801185호 및 제10/302356호에 보다 상세히 기술되어 있다.
본원에 사용된 것으로서, 용어 항체의 "항원 결합부"(또는 단순히 "항체 부위")는 항원(예: hTNFα)에 특이적으로 결합하는 능력을 지닌 항체의 하나 이상의 단편을 말한다. 항체의 항원-결합 기능은 완전한 길이의 항체의 단편으로 수행할 수 있음이 밝혀졌다. 용어 항체의 "항원 결합부"내 포함된 결합 단편의 예는 (i) VL, VH, CL 및 CH1 도메인으로 이루어진 일가 단편인 Fab 단편; (ii) 힌지(hinge) 영역에서 디설파이드 브릿지에 의해 연결된 2개의 Fab 단편을 포함하는 이가 단편인, F(ab')2 단편; (iii) VH 및 CH1 도메인으로 이루어진 Fd 단편; (iv) 항체의 단일 암(arm)의 VL 및 VH 도메인으로 이루어진 Fv 단편; (v) VH 도메인으로 이루어진 dAb 단편[참조: Ward et al., (1989) Nature 341:544-546]; 및 (vi) 분리된 상보성 결정 영역(CDR)을 포함한다. 또한, 비록 Fv 단편의 2개의 도메인인, VL 및 VH이 별개의 유전자에 의해 암호화되어 있다고 해도, 이들은 재조합 기술을 사용하여, VL 및 VH 영역이 쌍을 이루어 1가 분자를 형성하는 단일 단백질 쇄로서 제조되도록 할 수 있는 합성 링커에 의해 결합시킬 수 있다[일본쇄 Fv (scFv)로 공지; 참조: Bird et al. (1988) Science 242:423-426; 및 Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883]. 이러한 단일 쇄 항체는 또한 용어 항체의 "항원 결합부"내에 포함되는 것으로 의도된다. 디아보디(diabody)와 같은 단일 쇄 항체의 다른 형태가 또한 포함된다. 디아보디는 2가의 이특이적인 항체이며, 여기서, VH 및 VL 도메인은 단일 쇄 폴리펩타이드 쇄상에서 발현되나, 너무 짧아 동일한 쇄상에 2개의 도메인 사이에 쌍을 이루도록 링커를 사용함으로써 도메인이 다른 쇄의 상보성 도메인과 쌍을 이루어 2개의 항원 결합부를 생성하도록 한다[참조: Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444- 6448; Poljak, R.J., et al. (1994) Structure 2:1121-1123]. 본 발명의 항체 부위는 이의 전문이 본원에 참조로 인용된 미국 특허 제6,090,382호, 제6,258,562호, 제6,509,015호, 및 미국 특허원 일련번호 제09/801185호 및 제10/302356호에 상세히 기술되어 있다.
결합 단편은 재조합 DNA 기술, 또는 온전한 면역글로불린의 효소적 또는 화학적 분해에 의해 생산된다. 결합 단편은 Fab, Fab', F(ab')2, Fabc, Fv, 단일 쇄, 및 단일 쇄 항체를 포함한다. "이특이적" 또는 "이작용성" 면역글로불린 또는 항체외에, 면역 글로불린 또는 항체는 이의 결합 부위 각각이 동일한 것으로 이해된다. "이특이적" 또는 "이작용성 항체"는 2개의 상이한 중/경 쇄 쌍을 지니고 2개의 상이한 결합 부위를 갖는 인공의 하이브리드 항체이다. 이특이적 항체는 Fab' 단편의 연결 또는 하이브리도마의 융합을 포함하는 각종 방법으로 생산할 수 있다[참조: Songsivilai & Lachmann, Clin. Exp. Immunol. 79:315-321 (1990); Kostelny et ah, J. Immunol. 148, 1547-1553 (1992)].
본원에 사용된 것으로서, "보존성 아미노산 치환"은, 하나의 아미노산 잔기가 유사한 측쇄를 갖는 다른 아미노산 잔기로 치환된 것이다. 유사한 측쇄를 갖는 아미노산 잔기의 계열은 당해 분야에 정의되어 있으며 염기성 측쇄(예: 라이신, 아르기닌, 히스티딘), 산성 측쇄(예: 아스파르트산, 글루탐산), 하전되지 않은 극성 측쇄(예: 글라이신, 아스파라긴, 글루타민, 세린, 트레오닌, 타이로신, 시스테인), 비극성 측쇄(예: 알라닌, 발린, 루이신, 이소루이신, 프롤린, 페닐알라닌, 메티오닐, 트립토판), 베타-측쇄된 측쇄(예: 트레오닌, 발린, 이소루이신) 및 방향족 측쇄(예: 타이로신, 페닐알라닌, 트립토판, 히스티딘)을 포함한다.
본원에 사용된 것으로서, 용어 "사람 항체"는 사람 배선(germline) 면역글로불린 서열로부터 기원한 가변 및 불변 영역을 갖는 항체를 포함하는 것으로 이해된다. 본 발명의 사람 항체는 예를 들면, CDR 및 특히 CDR3내에서 사람 배선 면역글로불린 서열(예: 시험관내 무작위 또는 부위-특이적인 돌연변이유발에 의해 또는 생체내에서 체세포 돌연변이에 의해 도입된 돌연변이)에 의해 암호화되지 않은 아미노산 잔기를 포함할 수 있다. 그러나, 본원에 사용된 용어 "사람 항체"는 마우스와 같은 다른 포유동물 종의 배선으로부터 기원한 CDR 서열이 사람 골격 서열에 이식된 항체를 포함하는 것으로 이해되지 않는다.
본원에 사용된 것으로서, 용어 "재조합 사람 항체"는 숙주 세포내로 형질감염된 재조합 발현 벡터를 사용하여 발현된 항체(하기에 추가로 기술), 재조합체로부터 분리된 항체, 복합 사람 항체 라이브러리(하기에 추가로 기술), 사람 면역글로불린 유전자가 유전자전이된(transgenic) 동물(예: 마우스)로부터 분리된 항체[참조: Taylor, L.D. et al. (1992) Nucl. Acids Res. 20:6287] 또는 사람 면역글로불린 유전자 서열의 다른 DNA 서열로의 스플라이싱을 포함하는 기타 다른 수단으로 제조되거나, 발현되거나, 생성되거나 또는 분리된 항체와 같은, 재조합 수단에 의해 제조되거나, 발현되거나, 생성되거나 또는 분리된 모든 사람 항체를 포함하는 것으로 의도된다. 이러한 재조합 사람 항체는 사람 배선 면역글로불린 서열로부터 기원한 가변 및 불변 영역을 지닌다. 그러나, 특정 양태에서, 이러한 재조합 사람 항체는 시험관내 돌연변이유발(또는 사람 Ig 서열이 유전자전이된 동물을 사용하는 경우, 생체내 체세포 돌연변이유발)에 적용시킴으로써, 재조합 항체의 VH 및 VL 영역의 아미노산 서열은 사람 배선 VH 및 VL 서열로부터 기원하고 이에 관련되지만, 생체내에서 사람 항체 배선 레퍼토리내에 천연적으로 존재하지 않을 수 있는 서열이다.
본원에 사용된 것으로서 "분리된 항체"는 상이한 항원 특이성을 갖는 다른 항체가 실질적으로 부재하는 항체(예를 들면, hTNFα에 특이적으로 결합하는 분리된 항체는 hTNFα 이외의 항원에 특이적으로 결합하는 항체를 실질적으로 포함하지 않는다)를 말하는 것으로 의도된다. 그러나, hTNFα에 특이적으로 결합하는 분리된 항체는 다른 종으로부터의 TNFα 분자와 같이 다른 항원에 대해 교차-반응성을 지닐 수 있다(하기에 추가로 상세히 논의). 더우기, 분리된 항체는 다른 세포 물질 및/또는 화학물질을 실질적으로 포함할 수 있다.
본원에 사용된 것으로서, "중화 항체"(또는 "hTNFα 활성을 중화하는 항체")는 hTNFα에 대한 이의 결합이 hTNFα의 생물학적 활성을 억제하는 항체를 말하는 것으로 의도된다. hTNFα의 생물학적 활성의 억제는 hTNFα-유도된 세포독성(시험관내 또는 생체내), hTNFα-유도된 세포 활성화 및 hTNFα 수용체에 대한 hTNFα 결합과 같은 hTNFα 생물학적 활성의 하나 이상의 지시인자를 측정함으로써 평가할 수 있다. 이러한 hTNFα 생물학적 활성의 지시인자는 당해 분야에 공지된 하나 이상의 몇가지 표준 시험관내 또는 생체내 검정으로 평가할 수 있다(참조: 미국 특허 제6,090,382). 바람직하게는, hTNFα 활성을 중화시키는 항체의 능력은 L929 세포의 hTNFα-유도된 세포독성의 억제에 의해 평가한다. hTNFα 활성의 추가의 또는 대안적인 매개변수로서, hTNFα-유도된 세포 활성화의 척도로서의, HUVEC 상에서 ELAM-1의 hTNFα-유도된 발현을 억제하기 위한 항체의 능력을 평가할 수 있다.
본원에 사용된 것으로서, 용어 "표면 플라스몬 공명"은 예를 들면 BIA코어 시스템[뉴저지주 피츠카타웨이 및 스웨덴 업살라 소재의 파마시아 바이오센서 에이비(Pharmacia Biosensor AB) 제조원]을 사용하여 바이오센서 매트릭스내에서 단백질 농도에 있어서의 변형을 검출함으로써 실시간 생체특이적 상호작용의 분석을 허용하는 광학 현상을 말한다. 추가의 기술에 대해 미국 특허 제6,258,562호의 실시예 1 및 문헌[참조: Jonsson et al. (1993) Ann. Biol. Clin. 51:19; Jonsson et al. (1991) Biotechniques 11:620-627; Johnsson et al. (1995) J MoI. Recognit. 8:125; 및 Johnnson et al. (1991) Anal. Biochem. 198:268]을 참조한다.
본원에 사용된 것으로서, 용어 "Koff"는 항체/항원 복합체로부터의 항체의 해리를 위한 오프 속도 상수(off rate constant)를 말한다.
본원에 사용된 것으로서, 용어 "Kd"는 특정 항체-항원 상호작용의 해리 상수를 말하는 것으로 의도된다.
본원에 사용된 것으로서, 용어 "IC50"은 목적한 생물학적 결과를 억제하는데 요구되는, 예를 들면 세포독성 활성을 중화시키는데 요구되는 억제제의 농도를 말하는 것으로 의도된다.
본원에 사용된 것으로서, 용어 "핵산 분자"는 DNA 분자 및 RNA 분자를 포함하는 것으로 의도된다. 핵산 분자는 일본쇄 또는 이본쇄일 수 있으나, 바람직하게는 이본쇄 DNA일 수 있다.
hTNFα에 결합하는 항체 또는 항체 부위(예: VH, VL, CDR3)을 암호화하는 핵산을 참조하여 본원에 사용된 것으로서, 용어 "분리된 핵산 분자"는, 항체 또는 항체 부위를 암호화하는 뉴클레오타이드 서열이 hTNFα이외의 항원에 결합하는 항체 또는 항체 부위를 암호화하는 다른 뉴클레오타이드 서열을 포함하지 않는 핵산 분자를 말하는 것으로 의도되며, 상기 다른 서열은 사람 게놈 DNA에서 상기 핵산을 천연적으로 플랭킹(franking) 할 수 있다. 따라서, 예를 들어, 항-hTNFα 항체의 VH 영역을 암호화하는 본 발명의 분리된 핵산은 hTNFα 이외의 항원과 결합하는 다른 VH 영역을 암호화하는 다른 서열을 함유하지 않는다.
본원에 사용된 것으로서, 용어 "벡터"는 핵산 서열이 연결되어 있는 다른 핵산을 수송할 수 있는 핵산 분자를 말하는 것으로 의도된다. 한가지 유형의 벡터는 "플라스미드"이며, 이는 추가의 DNA 절편이 연결될 수 있는 환형의 이본쇄 DNA 루프을 말한다. 또 다른 유형의 벡터는 바이러스 벡터이며, 여기서, 추가의 DNA 절편은 바이러스 게놈에 연결될 수 있다. 특정의 벡터는, 이들이 도입된 숙주 세포에서 자가 복제할 수 있다(예를 들면, 세균 복제 오리진을 갖는 세균 벡터 및 에피솜 포유동물 벡터). 기타의 벡터(예: 비-에피솜 포유류 벡터)는 숙주 세포내로 도입되는 경우 숙주 세포의 게놈 내로 통합되며, 이에 따라 숙주 게놈과 함께 복제된다. 더우기, 특정의 벡터는, 이들이 작동적으로 결합된 유전자의 발현을 지시할 수 있다. 이러한 벡터는 본원에서 "재조합 발현 벡터"(또는 단순히 "발현 벡터")로 언급된다. 일반적으로, 재조합 DNA 기술에서 발현 벡터는 흔히 플라스미드 형태로 이용된다. 본 명세서에서, "플라스미드" 및 "벡터"는, 플라스미드가 벡터의 가장 일반적으로 사용된 형태이므로 상호교환적으로 사용될 수 있다. 그러나, 본 발명은 동등한 작용을 제공하는 바이러스 벡터(예: 복제 결함 레트로바이러스, 아데노바이러스 및 아데노-연합된 바이러스)와 같은 이러한 다른 형태의 발현 벡터를 포함하는 것으로 의도된다.
본원에 사용된 것으로서, 용어 "재조합 숙주 세포"(또는 단순히 "숙주 세포")는, 재조합 발현 벡터가 도입된 세포를 언급하는 것으로 의도된다. 이러한 용어들은 특정 피험체 세포만을 말하는 것이 아니라 이러한 세포의 자손 세포도 말하는 것으로 의도됨을 이해하여야 한다. 특정의 변형이 후대 세대에서 돌연변이 또는 환경 영향으로 인하여 발생할 수 있기 때문에, 이러한 자손 세포는 실제로 모 세포와 동일하지 않을 수 있으나, 본원에 사용된 용어 "숙주 세포"의 영역내에 여전히 포함된다.
본원에 사용된 것으로서, 용어 "투여량"은 피험체에 투여되는 TNFα 억제제의 양을 말한다.
용어 "다중-가변 투여량"은 치료학적 치료를 위해 피험체에 투여되는 TNFα 억제제의 상이한 투여량을 포함한다. "다중-가변 투여 요법" 또는 "다중-가변 투여 치료법"은 치료 과정 전체를 통해 다양한 시점에서 TNFα 억제제의 상이한 양을 투여하는 것을 토대로 하는 치료 스케쥴을 기술한다. 하나의 양태에서, 본 발명은 유도 단계 및 치료 단계를 포함하는 다중-가변 투여 치료법을 기술하며, 여기서, TNFα 억제제는 치료 단계보다는 유도 단계 동안 보다 많은 투여량으로 투여된다.
본원에 사용된 것으로서, 용어 "유도 단계" 또는 "로딩 단계"는 역치 수준을 획득하기 위하여 피험체에게 TNFα 억제제를 투여함을 포함하는 치료 기간을 말한다. 유도 단계 동안에, TNFα 억제제의 유도 투여량을 1회 이상 TNFα가 유해한 질환으로 고생하는 피험체에게 투여한다.
본원에 사용된 것으로서, 용어 "역치 수준"은 피험체내 TNFα 억제제의 치료학적 유효 수준을 언급한다. 역치 수준은 치료의 유도 단계 동안 1회 이상의 유도 투여량으로 투여함으로써 달성된다. 유도 투여량을 임의의 횟수로 투여하여 TNFα 억제제의 역치 수준을 달성할 수 있다. 역치 수준이 달성되면, 치료 단계를 개시한다.
본원에서 상호교환적으로 사용된 것으로서, 용어 "유도 투여량" 또는 "로딩 투여량"은 유지 또는 치료 투여량과 비교하여 보다 많은 TNFα 억제제의 제1 투여량을 말한다. 유도 투여량은 단일 투여량이거나, 또는 달리는 투여량 세트일 수 있다. 유도 투여량은 체내 약물을 정체기 상태 양으로 가져오는데 종종 사용되며 약물 수준을 신속하게 달성하는데 사용할 수 있다. 유도 투여량 투여 후, 후속적으로 TNFα 억제제의 보다 적은 투여량, 즉, 치료 투여량을 투여한다. 유도 투여량은 치료요법의 유도 단계 동안 투여한다. 본 발명의 하나의 양태에서, 유도 투여량은 제공된 치료 투여량의 적어도 2배의 양이다. 본 발명의 다른 양태에서, D2E7의 유도 투여량은 160 mg이다. 다른 양태에서, D2E7의 유도 투여량은 80 mg이다.
본원에 사용된 것으로서, 용어 "치료 단계" 또는 "유지 단계"는 목적하는 치료 효과를 유지하기 위하여 피험체에게 TNFα억제제를 투여함을 포함하는 치료 기간을 말한다. 치료 단계는 유도 단계에 이어 뒤따르므로, 일단 역치 수준이 달성되면 개시된다.
용어 "치료 투여량" 또는 "유지 투여량"은 목적하는 치료 효과를 유지하거나 지속하기 위해 피험체에 의해 취해진 TNFα억제제의 양이다. 치료 투여량은 유도 투여량에 이어 투여된다. 치료 투여량은 단일 투여량이거나, 또는 달리는 투여량 세트이다. 치료 투여량은 치료요법의 치료 단계 동안 투여된다. 치료 투여량은 유도 투여량보다 더 적으며 연속 투여하는 경우 서로 동일할 수 있다. 하나의 양태에서, 본 발명은 D2E7의 1회 이상의 약 160 mg의 유도 투여량에 이어, 1회 이상의 약 80 mg의 치료 투여량을 기술한다. 다른 양태에서, 본 발명은 D2E7의 1회 이상의 약 80 mg의 유도 투여량에 이어, 1회 이상의 약 40 mg의 치료 투여량을 기술한다. 또 다른 양태에서, 치료 투여량은 유도 투여량 투여 후 적어도 2주째에 투여한다.
"투약 용법" 또는 "투여 요법"은 측정된 세트의 투여량을 기초로 하는 치료 용법을 포함한다. 하나의 양태에서, 본 발명은 크론병의 치료를 위한 용량 용법을 기술하며, 여기서, D2E7는 유도 투여량으로서 우선 투여된 후 유도 투여량보다 적은 치료 투여량으로 투여된다.
본원에 사용된 것으로서, 용어 "투여"는 치료학적 목적(예: TNFα-관련 질환)을 달성하기 위한 물질(예: 항-TNFα-항체)의 투여를 말한다.
본원에 사용된 것으로서, 용어 "격주 투여 요법", "격주 투여(biweekly dosing)", 및 "격주 투여(biweekly administration)"는 치료학적 목적(예: TNFα-관련 질환의 치료)를 달성하기 위해 피험체에 물질(예: 항-TNFα 항체)를 투여하는 시기를 말한다. 격주 투여 요법은 매주 투여 요법을 포함하는 것으로 의도되지 않는다. 바람직하게는, 물질은 9 내지 19일 마다, 더욱 바람직하게는 11 내지 17일 마다, 심지어 더욱 바람직하게는 13 내지 15일 마다, 및 가장 바람직하게는 14일 마다 투여된다.
어구 "제2 제제와 배합된 제1 제제"에서 용어 "배합"은 예를 들면 동일한 약제학저으로 허용되는 담체속에 용해되거나 혼합될 수 있는 제1 제제 및 제2 제제의 공동-투여, 또는 제1 제제의 투여 후 제2 제제의 투여, 또는 제2 제제의 투여후 제1 제제의 투여일 수 있는 제1 제제 및 제2 제제의 공동-투여를 포함한다. 따라서, 본 발명은 배합 치료학적 치료 및 배합 약제학적 조성물의 방법을 포함한다.
어구 "동시 치료학적 치료"에서 용어 "동시"는 제2 제제의 존재하에 제제를 투여함을 포함한다. 동시 치료학적 치료법은, 제1, 제2, 제3 또는 추가의 제제를 공동-투여하는 방법을 포함한다. 동시 치료학적 치료법은 또한 제1 또는 추가의 제제를 제2 또는 추가의 제제의 존재하에서 투여하는 방법을 포함하며, 여기서, 예를 들면, 제2 또는 추가의 제제를 먼저 투여할 수 있다. 동시 치료학적 치료법은 상이한 시행자에 의해 단계적으로 수행될 수 있다. 예를 들면, 하나의 시행자는 피험체에게 제1 제제를 투여하고 제2 시행자는 피험체에게 제2 제제를 투여할 수 있으며, 투여 단계는, 제1 제제(및 추가의 제제)가 제2 제제(및 추가의 제제)의 존재하에 투여되는 한, 동시에, 또는 거의 동시에, 또는 시간을 두고, 수행될 수 있다. 시행자 및 피험체는 동일한 개체(예: 사람)일 수 있다.
본원에 사용된 것으로서, 용어 "배합 치료요법'은 2개 이상의 치료 물질, 예를 들면, 항-TNFα 항체 및 DMARD 또는 NSAID와 같은 다른 약물의 투여를 말한다. 다른 약물(들)은 항-TNFα 항체의 투여와 동시에, 투여전 또는 투여 후에 투여될 수 있다.
용어 "TNFα-매개된 상태" 또는 "TNFα-관련 질환"은, TNFα가 질환의 징후를 유도하는 주요 매개인자인 국소 및/또는 전신계 생리학적 질환을 말한다.
본원에 사용된 것으로서, 용어 "키트"는 TNFα-관련 질환의 치료를 위한 본 발명의 TNFα 항체를 투여하기 위한 성분들을 포함하는 포장된 제품을 말한다. 당해 키트는 바람직하게는 키트의 성분들을 유지하는 용기 또는 박스를 포함한다. 박스 또는 용기는 식품 의약국이 승인한 프로토콜 또는 표지가 첨부된다. 박스 또는 용기에는 플라스틱, 폴리에틸렌, 폴리프로필렌, 에틸렌 또는 프로필렌 용기내에 함유된 본 발명의 성분을 보유한다. 당해 용기는 뚜껑이 있는 튜브 또는 병일 수 있다. 키트는 또한 본 발명의 TNFα 항체를 투여하기 위한 지침서를 포함한다. 하나의 양태에서 본 발명의 키트는 제PCT/IB03/04502호 및 미국 특허원 제10/222140호에 기술된 것으로서 사람 D2E7을 포함하는 제형을 포함한다.
본 발명의 다양한 측면은 본원에 추가로 상세히 기술한다.
II. 본 발명의 TNFα 억제제
본 발명은 TNFα 억제제의 투여가 유익한 TNFα-관련 질환을 치료하는 다중-가변 투여 방법을 제공한다. 하나의 양태에서, 이들 방법은 사람 TNFα에 고 친화성 및 낮은 오프(off) 속도로 결합하고 높은 중화능을 갖는 분리된 사람 항체 또는 이의 항원 결합부의 투여를 포함한다. 바람직하게는, 본 발명의 사람 항체는 재조합의, 중화 사람 항-hTNFα 항체이다. 본 발명의 가장 바람직한 재조합, 중화 항체는 본원에서 D2E7로 지칭되며, 또한 HUMIRA® 및 아달리무맙(D2E7 VL 영역의 아미노산은 서열번호 1에 나타내며; D2E7 VH 영역의 아미노산은 서열번호 2에 나타낸다)로 지칭된다. D2E7 (HUMIRA®)의 특성은 본원에 각각 참조로 인용된 살펠트(Salfeld) 등의, 미국 특허 제6,090,382호, 제6,258,562호, 및 제6,509,015호에 기술되어 있다. TNFα 억제제의 다른 예는 류마티스 관절염의 치료용으로 임상 시험중인 키메라 및 사람화된 쥐 항-hTNFα 항체를 포함한다[참조: Elliott, M. J., et al. (1994) Lancet 344:1125-1127; Elliot, M.J., et al. (1994) Lancet 344:1105-1110; Rankin, E.C., et al. (1995) Br. J. Rheumatol. 34:334-342].
하나의 양태에서, 본 발명의 다중-가변 투여 방법은 D2E7 항체 및 항체 부위, D2E7-관련 항체 및 항체 부위, 및 hTNFα에 대한 높은 친화성 결합과 낮은 해리 역학 및 높은 중화능과 같은 D2E7와 동등한 특성을 갖는 다른 사람 항체 및 항체 부위를 투여하는 것을 포함한다. 하나의 양태에서, 본 발명은, 표면 플라스몬 공명에 의해 측정된 바, 사람 TNFα로 부터 1 x 10-8 M 이하의 Kd 및 1 x 10-3 s-l 이하의 Koff 속도 상수로 해리되고 표준 시험관내 L929 검정에서 사람 TNFα 세포독성을 1 x 10-7 M 이하로 중화시키는 분리된 사람 항체 또는 이의 항원 결합부를 사용한 다중-가변 투여 치료를 포함한다. 더욱 바람직하게는, 분리된 사람 항체 또는 이의 항원 결합부는 사람 TNFα 로부터 5 x 10-4 s-1 이하의 Koff 또는 심지어 더욱 바람직하게는 1 x 10-4 s-l 이하의 Koff 속도 상수로 해리된다. 더욱 바람직하게는, 분리된 사람 항체 또는 이의 항원 결합부는 표준 시험관내 L929 검정에서 사람 TNFα를 1 x 10-8 M 이하의 IC50, 심지어 더욱 바람직하게는 1 x 10-10 M 이하의 IC50으로 중화시킨다. 바람직한 양태에서, 항체는 분리된 사람 재조합 항체 또는 이의 항원 결합부이다.
항체 중쇄 및 경쇄 CDR3 도메인이 항원에 대한 항체의 결합 특이성/친화성에 있어서 중요한 역활을 한다는 사실은 당해 분야에 잘 공지되어 있다. 따라서, 다른 측면에서, 본 발명은, hTNFα와의 결합을 위한 느린 해리 반응속도를 가지며 구조적으로 D2E7의 것과 동일하거나 이와 관련된 경쇄 및 중쇄 CDR3 도메인을 갖는 사람 항체를 투여함에 의해 TNFα 활성이 유해한 TNFα-관련 질환을 치료하는 다중-가변 투여 방법에 관한 것이다. D2E7 VL CDR3의 9번 위치는 Koff에 실질적인 영향을 미치지 않으면서 Ala 또는 Thr에 의해 점유될 수 있다. 따라서, D2E7 VL CDR3에 대한 컨센서스 모티프(consensus motif)는 아미노산 서열: Q-R-Y-N-R-A-P- Y-(T/A) (서열번호 3)을 포함한다. 또한, D2E7 VH CDR3의 12번 위치는 실질적으로 Koff에 영향을 미치지 않으면서 Tyr 또는 Asn에 의해 점유될 수 있다. 따라서, D2E7 VH CDR3에 대한 컨센서스 모티프는 아미노산 서열: V-S-Y-L-S-T-A-S-S-L-D- (Y/N) (서열번호 4)을 포함한다. 또한, 미국 특허 제6,090,382호의 실시예 2에서 입증된 바와 같이, D2E7 중쇄 및 경쇄의 CDR3 도메인은 실질적으로 Koff에 영향을 미치지 않으면서 단일 알라닌 잔기(VL CDR3내 1, 4, 5, 7 또는 8번 위치 또는 VH CDR3내 2, 3, 4, 5, 6, 8, 9, 10 또는 11번 위치)로 치환될 수 있다. 여전히 또한, 당해 분야의 숙련가는, 제공된 D2E7 VL 및 VH CDR3 도메인의 알라닌에 의한 치환, CDR3 도메인내 다른 아미노산의 치환, 특히 보존성 아미노산으로의 치환이 항체의 낮은 off 속도 상수를 유지시키면서 가능할 수 있음을 인지할 것이다. 바람직하게는, 1 내지 5개 이하의 보존적 아미노산 치환이 D2E7 VL 및/또는 VH CDR3 도메인내에서 이루어진다. 더욱 바람직하게는, 1 내지 3개 이하의 보존적 아미노산 치환이 D2E7 VL 및/또는 VH CDR3 도메인내에서 이루어진다. 또한, 보존적 아미노산 치환은 hTNFα에 대한 결합에 중요한 아미노산 위치에서 이루어지지 않을 수 있다. D2E7 VL CDR3의 2번 및 5번 위치, 및 D2E7 VH CDR3의 1번 및 7번 위치는 hTNFα와의 상호작용에 중요한 것으로 여겨지므로, 보존적 아미노산 치환은 바람직하게는 이들 위치에서 이루어지지 않는다(비록 D2E7 VL CDR3의 5번 위치에서 알라닌 치환은 상기 기술한 바와 같이 가능하다고 해도)(참조: 미국 특허 제6,090,382호).
따라서, 다른 양태에서, 본 발명은 분리된 사람 항체 또는 이의 항원 결합부를 투여함으로써 TNFα-관련 질환을 치료하는 다중-가변 투여 방법을 제공한다. 항체 또는 이의 항원 결합부는 바람직하게는 다음 특성을 함유한다:
a) 표면 플라스몬 공명에 의해 측정된 바, 사람 TNFα로 부터 1 x 10-3 s-l 이하의 Koff 상수로 해리되고;
b) 서열번호 3의 아미노산 서열, 또는 서열번호 3으로부터 1, 4, 5, 7 또는 8번 위치에서 단일의 알라닌 치환에 의해 또는 1, 3, 4, 6, 7, 8 및/또는 9번 위치에서 1 내지 5개의 보존적 아미노산 치환에 의해 변형된 아미노산 서열을 포함하는 경쇄 CDR3 도메인을 가지며;
c) 서열번호 4의 아미노산 서열, 또는 서열번호 4로부터 2, 3, 4, 5, 6, 8, 9, 10 또는 11번 위치에서 단일의 알라닌 치환에 의해 또는 2, 3, 4, 5, 6, 8, 9, 10, 11 및/또는 12번 위치에서 1 내지 5개의 보존적 아미노산 치환에 의해 변형된 아미노산 서열을 포함하는 중쇄 CDR3 도메인을 가진다.
더욱 바람직하게는, 항체 또는 이의 항원 결합부는 사람 TNFα로부터 5 x 10-4 s-l 이하의 Koff로 해리된다. 훨씬 더 바람직하게는, 항체, 또는 이의 항체-결합 부위는 사람 TNFα로부터 1x10-4s-1 이하의 Koff로 해리된다.
다른 양태에서, 본 발명은 분리된 사람 항체 또는 이의 항원 결합부를 투여함으로써 TNFα-관련 질환을 치료하는 다중-가변 투여 방법을 제공한다. 항체 또는 이의 항원 결합부는 서열번호 3의 아미노산 서열 또는 서열번호 3으로부터 1, 4, 5, 7 또는 8번 위치에서 단일의 알라닌 치환에 의해 변형된 아미노산 서열을 포함하는 CDR3 도메인을 갖는 경쇄 가변 영역(LCVR), 및 서열번호 4의 아미노산 서열 또는 서열번호 4로부터 2, 3, 4, 5, 6, 8, 9, 10 또는 11번 위치에서 단일의 알라닌 치환으로 변형된 아미노산 서열을 포함하는 CDR3 도메인을 갖는 중쇄 가변 영역(HCVR)을 함유한다. 바람직하게는, LCVR은 또한 서열번호 5의 아미노산 서열(즉, D2E7 VL CDR2)을 포함하는 CDR2 도메인을 가지며, HCVR는 또한 서열번호 6의 아미노산 서열을 포함하는 CDR2 도메인(즉, D2E7 VH CDR2)을 갖는다. 심지어 더욱 바람직하게는, LCVR은 또한 서열번호 7의 아미노산 서열을 포함하는 CDRl 도메인(즉, D2E7 VL CDRl)을 가지며, HCVR은 서열번호 8의 아미노산 서열을 포함하는 CDRl 도메인(즉, D2E7 VH CDRl)을 갖는다. VL에 대한 골격 영역은 VκI 사람 배선 계열, 더욱 바람직하게는 A20 사람 배선 Vk 유전자 및 가장 바람직하게는 미국 특허 제6,090,382호의 도 1A 및 도 1B에 나타낸 D2E7 VL 골격 서열로부터 기원한다. VH에 대한 골격 영역은 VκI 사람 배선 계열, 더욱 바람직하게는 사람 배선 VH 유전자 및 가장 바람직하게는 미국 특허 제6,090,382호의 도 2A 및 도2B에 나타낸 D2E7 VH 골격 서열로부터 기원한다.
따라서, 다른 양태에서, 본 발명은 분리된 사람 항체 또는 이의 항원 결합부를 투여함으로써 TNFα-관련 질환을 치료하는 다중-가변 투여 방법을 제공한다. 항체 또는 이의 항원 결합부는 서열번호 1의 아미노산 서열을 포함하는 경쇄 가변 영역(LCVR)(즉, D2E7 VL) 및 서열번호 2의 아미노산 서열을 포함하는 중쇄 가변 영역(HCVR)(즉, D2E7 VH)를 함유한다. 특정 양태에서, 항체는 IgGl , IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 영역과 같은 중쇄 불변 영역을 포함한다. 바람직하게는 중쇄 불변 영역은 IgGl 중쇄 불변 영역 또는 IgG4 중쇄 불변 영역이다. 또한, 항체는 카파 경쇄 불변 영역 또는 람다 경쇄 불변 영역인 경쇄 불변 영역을 포함할 수 있다. 바람직하게는, 항체는 카파 경쇄 불변 영역을 포함한다. 달리는, 항체 부위는 예를 들면, Fab 단편 또는 단일쇄 Fv 단편일 수 있다.
또 다른 양태에서, 본 발명은 항-TNFα 항체의 투여가 분리된 사람 항체 또는 이의 항원 결합부의 유리한 투여인 TNFα-관련 질환을 치료하는 다중-가변 투여 방법을 제공한다. 항체 또는 이의 항원 결합부는 바람직하게는 D2E7-관련 VL 및 VH CDR3 도메인을 함유하며, 예를 들면, 항체 또는 이의 항원 결합부는 서열번호 3, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 14, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22, 서열번호 23, 서열번호 24, 서열번호 25 및 서열번호 26으로 이루어진 그룹 중에서 선택된 아미노산 서열을 포함하는 CDR3 도메인을 갖는 경쇄 가변 영역(LCVR) 또는 서열번호 4, 서열번호 27, 서열번호 28, 서열번호 29, 서열번호 30, 서열번호 31, 서열번호 32, 서열번호 33, 서열번호 34 및 서열번호 35로 이루어진 그룹 중에서 선택된 아미노산 서열을 포함하는 CDR3 도메인을 갖는 중쇄 가변 영역(HCVR)을 함유한다.
다른 양태에서, 본 발명의 TNFα 억제제는 에타네르셉트(제WO 91/03553호 및 제WO 09/406476호에 기술), 인플릭시맙(미국 특허 제5,656,272호에 기술), CDP571(사람화된 모노클로날 항-TNF-알파 IgG4 항체), CDP 870(사람화된 모노클로날 항-TNF-알파 항체 단편), D2E7(사람 항-TNF mAb), 가용성 TNF 수용체 제I형, 또는 페길화된 가용성 TNF 수용체 제I형(PEGs TNF-Rl)이다.
본 발명의 TNFα 항체는 변형시킬 수 있다. 일부 양태에서, TNFα 항체 또는 이의 항원 결합 단편은 화학적으로 개질시켜 목적한 효과를 제공한다. 예를 들어, 본 발명의 항체 및 항체 단편의 페길화를 예를 들면, 다음 문헌에 기술된 바와 같이 당해 분야에 공지된 어떠한 페길화 반응으로도 수행할 수 있다: Focus on Growth Factors 3:4-10 (1992); EP 제0 154 316호; 및 EP 제0 401 384호(이의 각각의 전문이 본원에 참조로 인용됨). 바람직하게는, 페길화는 반응성 폴리에틸렌 글리콜 분자(또는 유사 반응성의 수용성 중합체)와의 아실화 반응 또는 알킬화 반응을 통해 수행된다. 본 발명의 항체 및 항체 단편의 페길화용으로 바람직한 수용성 중합체는 폴리에틸렌 글리콜(PEG)이다. 본원에 사용된 것으로서, "폴리에틸렌 글리콜"은 모노(Cl-ClO) 알콕시- 또는 아릴옥시-폴리에틸렌 글리콜과 같은 다른 단백질을 유도체화하는데 사용된 PEG의 어떠한 형태도 포함함을 의미한다.
본 발명의 페길화된 항체 및 항체 단편을 제조하는 방법은 일반적으로 (a) 항체 또는 항체 단편을 PEG의 반응성 에스테르 또는 알데하이드 유도체와 같은 폴리에틸렌 글리콜과, 항체 또는 항체 단편이 하나 이상의 PEG 그룹에 부착되도록 하는 조건하에서 반응시키는 단계, 및 (b) 반응 생성물을 수득하는 단계를 일반적으로 포함할 것이다. 당해 분야의 통상의 기술을 가진 자에게는 공지된 매개변수 및 목적하는 결과를 바탕으로 하여 최적의 반응 조건 또는 아실화 반응을 선택하는 것이 명백할 것이다.
페길화 항체 및 항체 단편을 일반적으로 사용하여 본원에 기술된 TNFα 항체 및 항체 단편을 투여함으로써 본 발명의 TNFα-관련 질환을 치료할 수 있다. 일반적으로 페길화 항체 및 항체 단편은 비페길화된 항체 및 항체 단편과 비교하여 증가된 반감기를 갖는다. 페길화된 항체 및 항체 단편은 단독으로, 또는 다른 약제학적 조성물과 함께 또는 배합하여 사용될 수 있다.
본 발명의 또 다른 양태에서, TNFα 항체 또는 이의 단편은 변경시킬 수 있는데, 이때, 항체의 불변 영역은 변형되어 변형되지 않은 항체에 비해 하나 이상의 불변 영역-매개된 생물학적 효과인자 작용을 감소시킨다. 본 발명의 항체를 변형시켜 Fc 수용체에 대한 감소된 결합을 나타내도록 하기 위하여, 항체의 면역글로불린 불변 영역 절편을 Fc 수용체(FcR)에 필수적인 특정 영역에서 돌연변이시킬 수 있다[참조: Canfield, S.M. 및 S.L. Morrison (199I) J Exp. Med, 173:1483- 1491; 및 Lund, J. et al. (1991) J. of Immunol. 147:2657-2662]. 항체의 FcR 결합 능력에 있어서의 감소는 또한 옵소닌화 및 포식작용과 같은 FcR 상호작용 및 항원-의존적 세포 세포독성에 의존한 다른 효과인자 작용을 감소시킬 수 있다.
본 발명의 항체 또는 항체 부위는 다른 작용성 분자(예: 다른 펩타이드 또는 단백질)로 유도체화되거나 연결될 수 있다. 따라서, 본 발명의 항체 및 항체 부위는 본원에 기술된 사람 항--hTNFα 항체의 유도체화 형태 및 달리는 변형된 형태, 예를 들면, 면역부착 분자를 포함하는 것으로 의도된다. 예를 들어, 본 발명의 항체 또는 항체 부위는, 하나 이상의 다른 분자 물질, 예를 들면 다른 항체[예: 이특이적 항체 또는 디아보디(diabody)], 검출가능한 제제, 세포독성제, 약제학적 제제, 및/또는 항체 또는 항체 부위와 다른 분자의 연합을 매개할 수 있는 단백질 또는 펩타이드(예: 스트렙트아비딘 코어 영역 또는 폴리히스티딘 태그)에 작용적으로 연결(화학적 커플링, 유전적 융합, 비공유 결합 또는 기타에 의해)시킬 수 있다.
한가지 유형의 유도체화된 항체는 2개 이상의 항체(동일한 유형 또는 상이한 유형, 예를 들면, 이특이적 항체를 생성시키기 위한)를 가교결합시킴으로써 생성시킨다. 적합한 가교결합제는 적절한 스페이서에 의해 분리된 2개의 명백한 반응성 그룹을 갖는 헤테로이작용성 (예: m-말레이미도벤조일-N-하이드록시석신이미드 에스테르) 또는 호모이작용성(예: 디석신이미딜 수베레이트)인 것들을 포함한다. 이러한 링커는 일리노이주 록포드 소재의 피어스 케미칼 캄파니(Pierce Chemical Company)에서 시판된다.
본 발명의 항체 또는 항체 부분과 함께 유도체화될 수 있는 유용한 검출가능한 제제는 형광성 화합물을 포함한다. 예시적인 형광성의 검출가능한 제제는 플루오레세인, 플루오레세인 이소티오시아네이트, 로다민, 5-디메틸아민-1-나프탈렌설포닐 클로라이드, 피코에리트린 등을 포함한다. 항체는 또한 알칼린 포스파타제, 서양고추냉이 퍼옥시다제, 글루코즈 옥시다제 등과 같은 검출가능한 효소로 유도체화될 수 있다. 항체가 검출가능한 효소로 유도체화되는 경우, 이는, 효소가 검출가능한 반응성 생성물을 생산하기 위해 사용하는 추가의 시약을 첨가함에 의해 검출된다. 예를 들어, 검출가능한 제제인 서양고추냉이 퍼옥시다제가 존재하는 경우, 과산화수소 및 디아미노벤지딘의 첨가로 검출가능한 착색된 반응 생성물이 생성된다. 항체는 또한 바이오틴으로 유도체화시킬 수 있고, 아비딘 또는 스트렙트아비딘 결합의 간접적인 측정을 통해 검출할 수 있다.
본 발명의 항체 또는 항체 부위는 숙주 세포내에서 면역글로불린 경쇄 및 중쇄 유전자를 재조합 발현시켜 제조할 수 있다. 항체를 재조합적으로 발현시키기 위해, 숙주 세포를 항체의 면역글로불린 경쇄 및 중쇄를 암호화하는 DNA 단편을 수반하는 하나 이상의 재조합 발현 벡터로 형질감염시킴으로써 경쇄 및 중쇄가 숙주 세포내에서 발현되고, 바람직하게는, 숙주 세포가 배양되는 배지로 분비되면, 배지로부터 항체를 회수할 수 있다. 표준 재조합 DNA 기술을 사용하여 항체 중쇄 및 경쇄 유전자를 수득하여, 이들 유전자를 재조합 발현 벡터내로 도입시키고 벡터를 숙주내로 도입시킨다[참조: Sambrook, Fritsch 및 Maniatis (eds), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N. Y., (1989), Ausubel, F.M. et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) 및 보쓰(Boss) 등의 미국 특허 제4,816,397호].
D2E7 또는 D2E7-관련 항체를 발현시키기 위하여, 경쇄 및 중쇄 가변 영역을 암호화하는 DNA 단편을 우선 수득한다. 이들 DNA는 폴리머라제 쇄 반응(PCR)을 사용하여 배선 경쇄 및 중쇄 가변 서열을 증폭 및 변형시켜 수득할 수 있다. 사람 중쇄 및 경쇄 가변 영역 유전자에 대한 배선 DNA 서열은 당해 분야에 공지되어 있다[참조: "Vbase" human germline sequence database; see also Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH 공보 번호 제91-3242; Tomlinson, I.M., et al. (1992) "The Repertoire of Human Germline VH Sequences Reveals about Fifty Groups of VH Segments with Different Hypervariable Loops" J. MoI. Biol. 22T.116-198; 및 Cox, J.P.L. et al. (1994) "A Directory of Human Germ-line V 78 Segments Reveals a Strong Bias in their Usage" Eur. J. Immunol. 24:827-836; 이의 각각의 내용이 본원에 참조로 인용]. D2E7의 중쇄 가변 영역 또는 D2E7-관련 항체를 암호화하는 DNA 단편을 수득하기 위하여, 사람 배선 VH 유전자의 VH3 계열의 일원을 표준 PCR로 증폭시킨다. 가장 바람직하게는, DP-31 VH 배선 서열을 증폭시킨다. D2E7 또는 D2E7-관련 항체의 경쇄 가변 영역을 암호화하는 DNA 단편을 수득하기 위하여, 사람 배선 VH 유전자의 VKI 계열의 일원을 표준 PCR로 증폭시킨다. 가장 바람직하게는, A20 VL 배선 서열을 증폭시킨다. DP-31 배선 VH 및 A20 배선 VL 서열을 증폭시키는데 사용하기에 적합한 PCR 프라이머는 표준 방법을 사용하여 상기 인용한 참조문헌에 기술된 뉴클레오타이드 서열을 기초로 설계할 수 있다.
배선 VH 및 VL 단편이 수득되면, 이들 서열을 돌연변이시켜 본원에 기술된 D2E7 또는 D2E7-관련 아미노산 서열을 암호화할 수 있다. 배선 VH 및 VL DNA 서열에 의해 암호화된 아미노산 서열은 우선 D2E7 또는 D2E7-관련 VH 및 VL 아미노산 서열과 비교하여 배선과 상이한 D2E7 또는 D2E7-관련 서열내 아미노산 잔기를 확인할 수 있다. 이후에, 배선 DNA 서열의 적절한 뉴클레오타이드를 돌연변이시킴으로서 돌연변이된 배선 서열은, 어떠한 뉴클레오타이드 변화가 이루어졌는지를 측정하기 위한 유전자 코드를 사용하여 D2E7 또는 D2E7-관련 아미노산을 암호화하도록 한다. 배선 서열의 돌연변이유발은 PCR-매개된 돌연변이유발(여기서, 돌연변이된 뉴클레오타이드는 PCR 프라이머내로 도입시킴으로써 PCR 생성물이 돌연변이를 함유하도록 한다) 또는 부위-지시된 돌연변이유발과 같은 표준 방법으로 수행한다.
일단 D2E7 또는 D2E7-관련 VH 및 VL 분절을 암호화하는 DNA 단편이 수득되면(상기 기술된 바와 같이 배선 VH 및 VL 유전자의 증폭 및 돌연변이유발에 의해), 이들 DNA 단편을 또한 예를 들면 가변 영역 유전자를 완전한 길이의 항체 쇄 유전자, Fab 단편 유전자 또는 scFv 유전자로 전환시키기 위한 표준 재조합 DNA 기술에 의해 추가로 조작할 수 있다. 이러한 조작에서, VL- 또는 VH-암호화 DNA 단편은 항체 불변 영역 또는 가요성 링커와 같은 다른 단백질을 암호화하는 다른 DNA 단편에 작동적으로 연결시킨다. 본 내용에서 사용된 것으로서 용어 "작동적으로 연결된"은, 2개의 DNA 단편이 연결되어 이러한 2개의 DNA 단편에 의해 암호화된 아미노산 서열이 프레임내에 유지되도록 함을 의미하는 것으로 의도된다.
VH 영역을 암호화하는 분리된 DNA 단편은 VH-암호화 DNA를 중쇄 불변 영역(CHl, CH2 및 CH3)을 암호화하는 다른 DNA 분자에 작동적으로 연결시킴으로서 완전한 길이의 중쇄 유전자로 전환시킬 수 있다. 사람 중쇄 불변 영역의 서열은 당해 분야에 공지되어 있으며[참조: 예를 들면, Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH 공보 번호 제91-3242], 이러한 영역들을 포함하는 DNA 단편은 표준 PCR 증폭에 의해 수득할 수 있다. 중쇄 불변 영역은 IgGl, IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 영역일 수 있으나, 대부분 바람직하게는 IgGl 또는 IgG4 불변 영역이다. Fab 단편 중쇄 유전자의 경우, VH-암호화 DNA는 중쇄 CH1 불변 영역만을 암호화하는 다른 DNA 분자에 작동적으로 연결시킬 수 있다.
VL 영역을 암호화하는 분리된 DNA는 VL-암호화 DNA를 경쇄 불변 영역, CL을 암호화하는 다른 DNA 분자에 작동적으로 연결시킴으로써 완전한 길이의 경쇄 유전자(및 Fab 경쇄 유전자)로 전환시킬 수 있다. 사람 경쇄 불변 영역의 서열은 당해 분야에 공지되어 있으며[참조: Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH 공보 번호 제91-3242), 이들 영역을 포함하는 DNA 단편은 표준 PCR 증폭에 의해 수득할 수 있다. 경쇄 불변 영역은 카파 또는 람다 불변 영역일 수 있으나, 가장 바람직하게는 카파 불변 영역이다.
scFv 유전자를 제조하기 위하여, VH- 및 VL-암호화 DNA 단편을, 예를 들면 아미노산 서열 (Gly4-Ser)3을 암호화하는 가요성 링커을 암호화하는 다른 단편에 작동적으로 연결시킴으로써, VH 및 VL 서열이 연속의 단일쇄 단백질로서 발현될 수 있으며, 이때 VL 및 VH 영역은 가요성 링커에 의해 연결된다[참조: 예를 들면, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al, Nature (1990) 348:552-554].
본 발명의 항체 또는 항체 부위를 발현시키기 위하여, 위에서 기술한 바와 같이 수득한, 부분 또는 완전한 길이의 경쇄 및 중쇄를 암호화하는 DNA를 발현 벡터내로 삽입시킴으로써 유전자들이 전사 및 해독 조절 서열에 작동적으로 연결되도록 한다. 당해 문맥에서, 용어 "작동적으로 연결된"은, 항체 유전자가 벡터내로 연결됨으로써 벡터내 전사 및 해독 조절 서열이 항체 유전자의 전사 및 해독을 조절하는 요구된 자체 기능을 제공하도록 한다. 발현 벡터 및 발현 조절 서열은 사용된 발현 숙주 세포와 적합하도록 선택한다. 항체 경쇄 유전자 및 항체 중쇄 유전자는 별개의 벡터내로 삽입하거나, 또는 더욱 통상적으로 유전자 둘다를 동일한 발현 벡터내로 삽입시킨다. 항체 유전자는 표준 방법(예: 항체 유전자 단편 및 벡터상의 상보성 제한 부위의 연결, 또는 제한 부위가 존재하지 않을 경우 평활 말단 연결)에 의해 발현 벡터내로 삽입시킨다. D2E7 또는 D2E7-관련 경쇄 또는 중쇄 서열을 삽입시키기 전에, 발현 벡터는 항체 불변 영역 서열을 이미 수반할 수 있다. 예를 들어, D2E7 또는 D2E7-관련 VH 및 VL 서열을 완전한 길이의 항체 유전자로 전환시키기 위한 한가지 시도는 이들을 중쇄 불변 영역 및 경쇄 불변 영역 각각을 이미 암호화하는 발현 벡터내로 삽입시킴으로써, VH 절편이 벡터내에서 CH 절편에 작동적으로 연결되고 VL 분절이 벡터내에서 CL 절편에 작동적으로 연결되도록 한다. 추가로 또는 달리는, 재조합 발현 벡터는 숙주 세포로부터 항체 쇄의 분비를 촉진시키는 시그날 펩타이드를 암호화할 수 있다. 당해 항체 쇄 유전자는 벡터내로 클로닝시켜 단일 펩타이드가 프레임내에서 항체 쇄 유전자의 아미노 말단에 연결되도록 할 수 있다. 시그날 펩타이드는 면역글로불린 시그날 펩타이드 또는 이종 시그날 펩타이드(예: 비-면역글로불린 단백질로부터의 단일 펩타이드)일 수 있다.
항체 쇄 유전자외에, 본 발명의 재조합 발현 벡터는 숙주 세포내에서 항체 쇄 유전자의 발현을 조절하는 조절 서열을 수반한다. 용어 "조절 서열"은 항체 쇄 유전자의 전사 또는 해독을 조절하는 다른 발현 조절 성분(예: 폴리아데닐화 시그날), 인핸서 및 프로모터를 포함하는 것으로 의도된다. 이러한 조절 서열은 예를 들면, 문헌[참조: Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990)]에 기술되어 있다. 당해 분야의 숙련가에게는, 조절 서열의 선택을 포함하는, 발현 벡터의 설계가 형질전환될 숙주 세포의 선택, 목적하는 단백질의 발현 수준 등과 같은 인자에 의존할 수 있음이 익숙할 것이다. 포유동물 숙주 세포 발현을 위한 바람직한 조절 서열은, 사이토메갈로바이러스(CMV)로부터 기원한 프로모터 및/또는 인핸서(예: CMV 프로모터/인핸서), 원숭이(Simian) 바이러스 40(SV40)(예: SV40 프로모터/인핸서), 아데노바이러스[예: 아데노바이러스 주요 후기(late) 프로모터(AdMLP)] 및 폴리오마와 같은 포유동물 세포내에서 높은 수준의 단백질 발현을 지시하는 바이러스 성분을 포함한다. 바이러스 조절 성분 및 이의 서열의 추가 기술을 위해 스틴스키(Stinski) 등의 미국 특허 제5,168,062호, 벨(Bell) 등의 미국 특허 제4,510,245호 및 샤프너(Schaffner) 등의 미국 특허 제4,968,615호를 참조한다.
항체 쇄 유전자 및 조절 서열외에, 본 발명의 재조합 발현 벡터는 숙주 세포내에서 벡터의 복제를 조절하는 서열과 같은 추가의 서열(예: 복제 오리진) 및 선별가능한 마커 유전자를 수반할 수 있다. 선별가능한 마커 유전자는, 벡터가 도입되는 숙주 세포의 선택을 용이하게 한다[참조: 악셀(Axel) 등의 미국 특허 제4,399,216호, 제4,634,665호 및 제5,179,017호]. 예를 들어, 통상적으로 선별가능한 마커 유전자는, 벡터가 도입되는 숙주 세포상에서 G418, 하이그로마이신 또는 메토트렉세이트와 같은 약물에 대해 내성을 부여한다. 바람직한 선별가능한 마커 유전자는 디하이드로폴레이트 리덕타제(DHFR) 유전자[메토트렉세이트 선택/증폭을 사용한 dhfr- 숙주 세포에서의 사용을 위해) 및 neo 유전자 (G418 선택을 위해)을 포함한다.
경쇄 및 중쇄의 발현을 위해, 중쇄 및 경쇄를 암호화하는 발현 벡터를 표준 기술에 의해 숙주 세포내로 형질감염시킨다. 용어 "형질감염"의 각종 유형은 원핵 또는 진핵 숙주세포 내로 외인성 DNA의 도입을 위해 통상적으로 사용된 광범위한 기술, 예를 들면, 전기천공(electroporation), 칼슘-포스페이트 침전, DEAE-덱스트란 형질감염 등을 포함하는 것으로 의도된다. 비록 원핵 또는 진핵 숙주 세포내에서 본 발명의 항체를 발현하는 것이 이론적으로 가능하다고 해도, 진핵 세포 및 가장 바람직하게는 포유동물 숙주 세포내에서 항체의 발현이 가장 바람직한데, 이는, 진핵 세포, 및 특히 포유동물 세포가 원핵 세포보다 적절히 폴딩되고 면역학적으로 활성인 항체를 조립하여 분비하기 때문이다. 항체 유전자의 원핵 세포성 발현은 활성 항체의 고 수율 생산을 위해서는 덜 효과적인 것으로 보고되었다[참조: Boss, M. A. 및 Wood, C. R. (1985) Immunology Today 6:12-13].
본 발명의 재조합 항체를 발현시키기 위한 바람직한 포유동물 숙주 세포는 차이니즈 햄스터 난소(CHO 세포)[예를 들면, 문헌(R. J. Kaufman 및 P.A. Sharp (1982) Mol. Biol. 159:601-621)에 기술된 바와 같은 DHFR 선택성 마커와 함께 사용된 문헌(Urlaub 및 Chasin, (1980) Proc. Natl. Acad. Sd. USA 77:4216-4220)에 기술된 바와 같은 dhfr- CHO 세포를 포함], NSO 골수종 세포, COS 세포 및 SP2 세포를 포함한다. 항체 유전자를 포함하는 재조합 발현 벡터를 포유동물 숙주 세포내로 도입시키는 경우, 항체는, 숙주 세포내에서 항체를 발현시키거나, 더욱 바람직하게는 숙주 세포가 성장하는 배양 배지내로 항체를 분비하기에 충분한 기간 동안 숙주 세포를 배양함으로써 생산된다. 항체는 표준 단백질 정제 방법을 사용하는 배양 배지로부터 회수 할 수 있다.
숙주 세포는 또한 Fab 단편 또는 scFv 분자와 같은 완전한 항체의 일부를 생산하는데 사용할 수 있다. 상기 과정의 변형이 본 발명의 영역내에 있음은 이해된다. 예를 들어, 숙주 세포를 본 발명의 항체의 경쇄 또는 중쇄(이들 둘다는 아님)를 암호화하는 DNA로 형질감염시키는 것이 바람직할 수 있다. 재조합 DNA 기술을 또한 사용하여 hTNFα에 결합시키기에 필수적이지 않은 경쇄 및 중쇄중 어느 하나 또는 둘다를 암호화하는 DNA중 일부 또는 모두를 제거한다. 이러한 절두된(truncated) DNA 분자로부터 발현된 분자는 또한 본 발명의 항체에 의해 포함된다. 또한, 하나의 중쇄 및 경쇄가 본 발명의 항체이고 다른 중쇄 및 경쇄가 hTNFα 이외의 항원에 대해 특이적인 이작용성 항체는 본 발명의 항체를 표준 화학 가교결합 방법에 의해 제2 항체에 가교결합시킴으로써 생산할 수 있다.
본 발명의 항체 또는 이의 항원 결합부의 재조합 발현을 위한 바람직한 시스템에서, 항체 중쇄 및 항체 경쇄 둘다를 암호화하는 재조합 발현 벡터는 인산칼슘-매개된 형질감염에 의해 dhfr-CHO 세포내로 도입시킨다. 재조합 발현 벡터내에서, 항체 중쇄 및 경쇄 유전자는 각각 CMV 인핸서/AdMLP 프로모터 조절 성분에 작동적으로 연결시킴으로써 유전자의 높은 수준의 전사를 유도시킬 수 있다. 재조합 발현 벡터는 또한 DHFR 유전자를 수반하며, 당해 유전자는 메토트렉세이트 선택/증폭을 사용하여 벡터로 형질감염시킨 CHO 세포의 선택을 허용한다. 선택된 형질전환체 숙주 세포는 항체 중쇄 및 경쇄의 발현을 허용하도록 하기 위한 배양물이며 완전한 항체가 배양 배지로부터 회수된다. 표준 분자 생물학 기술을 사용하여 재조합 발현 벡터를 제조하고, 숙주 세포를 형질감염시키며, 재조합체를 선택하고, 숙주 세포를 배양하며 배양 배지로부터 항체를 회수할 수 있다.
본원에 기술된 D2E7 또는 이의 항원 결합부, D2E7-관련 항체 외에, 본 발명의 재조합체 사람 항체는 사람 림프구로부터 기원한 mRNA로부터 제조된 사람 VL 및 VH cDNA를 사용하여 제조된 재조합체 조합 항체 라이브러리, 바람직하게는 scFv 파아지 디스플레이 라이브러리를 스크리닝함으로서 분리할 수 있다. 이러한 라이브러리를 제조하고 스크리닝하는 방법은 당해 분야에 공지되어 있다. 파아지 디스플레이 라이브러리를 생성하기 위한 시판되는 키트[예: 파마시아 재조합체 파아지 항체 시스템(Pharmacia Recombinant Phage Antibody System), 제품 번호 제27-9400-01호; 및 스트라타젠 파아지 디스플레이 키트(Stratagene SurfZAPTM phage display kit), 제품 번호 제240612호]외에, 항체 디스플레이 라이브러리를 생성하고 선별하는데 사용하기 위해 특히 변형된 방법 및 시약의 예는 예를 들면, 문헌[참조: Ladner 등의 미국 특허 제5,223,409; 강(Kang) 등의 PCT 공보 제WO 92/18619호; 도버(Dower) 등의 PCT 공보 번호 제WO 91/17271호; 윈터(Winter) 등의 PCT 공보 번호 제WO 92/20791호; 마크랜드(Markland) 등의 PCT 공보 번호 제WO 92/15679호; 브라이틀링(Breitling) 등의 PCT 공보 번호 제WO 93/01288호; 맥카퍼티(McCafferty) 등의 PCT 공보 번호 제WO 92/01047호; 가라드(Garrard) 등의 PCT 공보 번호 제WO 92/09690호; Fuchs et al., (1991) Bio/Technology 9: 1370-1372; Hay et al., (1992) Hum Antibod Hybridomas 3:81-85; Huse et al., (1989) Science 246:1275- 1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J MoI Biol 226:889-896; Clackson et al (1991) Nature 352:624-628; Gram et al (1992) PNAS 89:3576-3580; Garrard et al (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; 및 Barbas et al. (1991) PNAS 88:7978-7982]에서 찾을 수 있다.
바람직한 양태에서, hTNFα에 대한 고 친화성 및 저 오프 속도 상수를 지닌 사람 항체를 분리하기 위하여, hTNFα에 대해 고 친화성 및 저 오프 속도 상수를 지닌 쥐 항-hTNFα 항체(예: MAK 195, 이에 대한 하이브리도마는 기탁 번호 제ECACC 87 050801호로 기탁되어 있다)를 우선 사용하여 hTNFα에 대해 유사한 결합 활성을 지닌 사람 중쇄 및 경쇄 서열을 문헌[참조: Hoogenboom et al, PCT 공보 번호 제WO 93/06213호]에 기술된 에피토프 임프린팅 방법(epitope imprinting method)으로 선택한다. 당해 방법에 사용된 항체 라이브러리는 문헌[참조: 맥카퍼티 등의, PCT 공보 번호 제WO 92/01047호, McCafferty et al, Nature (1990) 348:552-554; 및 Griffiths et al, (1993) EMBO J 12:725-734]에 기술된 바와 같이 제조되고 스크리닝된 scFv 라이브러리이다. scFv 항체 라이브러리는 바람직하게는 항원과 같은 재조합 사람 TNFα를 사용하여 스크리닝한다.
우선 초기 사람 VL 및 VH 절편을 분리한 후, 상이한 쌍의 초기 선택된 VL 및 VH 절편을 hTNFα 결합에 대해 스크리닝하는 "믹스 앤드 매치(mix and match)" 실험을 수행하여 바람직한 VL/VH 쌍 조합을 선택한다. 또한, hTNFα 결합에 대한 친화성 및/또는 보다 낮은 오프 속도 상수를 개선시키기 위하여, 바람직한 VL/VH 쌍의 VL 및 VH 절편을 바람직하게는 VH 및/또는 VL의 CDR3 영역내에서, 천연의 면역 반응 동안 항체의 친화성 성숙에 관여하는 생체내 체세포 돌연변이 과정과 유사한 과정으로 무작위적으로 돌연변이시킨다. 이러한 시험관내 친화성 성숙은 VH CDR3 또는 VL CDR3 각각에 대해 상보성인 PCR 프라이머를 사용하여 VH 및 VL 영역을 증폭시킴으로써 달성할 수 있으며, 당해 프라이머는 특정의 위치에서 4개의 뉴클레오타이드 염기의 무작위적 혼합물로 "스파이크(spike)"됨으로써, 수득되는 PCR 생성물이, 무작위적 돌연변이가 VH 및/또는 VL CDR3 영역내로 도입된 VH 및 VL 절편을 암호화하도록 한다. 이들 무작위적으로 돌연변이된 VH 및 VL 절편은 hTNFα에 대한 결합에 대해 재스크리닝될 수 있으며, hTNFα 결합에 대한 고 친화성 및 저 오프(off) 속도를 나타내는 서열을 선택할 수 있도록 한다.
재조합 면역글로불린 디스플레이 라이브러리로부터의 본 발명의 항-hTNFα 항체의 스크리닝 및 분리 후, 선택된 항체를 암호화하는 핵산을 디스플레이 패키지(예: 파아지 게놈)으로부터 회수하여 표준 재조합 DNA 기술에 의해 다른 발현 벡터내로 서브클로닝할 수 있다. 원한다면, 핵산을 또한 조작하여 본 발명의 다른 항체형을 제조할 수 있다(예를 들면, 추가의 불변 영역과 같은 추가의 면역글로불린 도메인을 암호화하는 핵산에 연결시킬 수 있다). 조합 라이브러리의 스크리닝에 의해 분리된 재조합 사람 항체를 발현시키기 위해, 항체를 암호화하는 DNA를 재조합 발현 벡터내로 클로닝시키고 상기 상세히 기술한 바와 같이 포유동물 숙주 세포내로 도입시킨다.
hTNFα에 대해 고 친화성 및 저 오프(off) 속도 상수를 지닌 사람 항체를 분리하는 방법은, 본원에 참조로 인용된 미국 특허 제6,090,382호, 제6,258,562호, 및 제6,509,015호에 기술되어 있다.
III. 본 발명의 TNFα 억제제의 용도
본 발명은 TNFα 활성이 유해한 질환으로 고생하는 피험체에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공한다. TNFα는 광범위한 질환의 병리생리학에 연관되어 있다[참조: Moeller, A., et al (1990) Cytokine 2: 162-169; 뮐러 에이.(Moeller, A.) 등의 미국 특허 제5,231,024호; 뮐러 에이. 등의 유럽 특허 공보 번호 제260 610 Bl호]. TNFα는 패혈증, 감염, 자가면역 질환, 이식 거부 및 이식편-대-숙주병을 포함하는 광범위한 TNFα-관련 질환의 병리생리학에 연관되어 있다[참조: Moeller, A., et al. (1990) Cytokine 2:162-169; 뮐러 등의 미국 특허 제5,231,024호; 뮐러 에이. 등의 유럽 특허 공보 번호 제260 610 B1; Vasilli, P. (1992) Annu. Rev. Immunol., 10:411-452; Tracey, K. J. 및 Cerami, A. (1994) Annu. Rev. Med, 45:491-503]. 본 발명은 TNFα-관련 질환으로 고생하는 환자에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공하며, 당해 방법은 피험체에게 초기 유도 투여량을 투여하고 후속적으로 치료 투여량의 항체, 항체 부위, 또는 기타 TNFα 억제제를 투여함으로써 TNFα 활성이 억제되도록 함을 포함한다. 바람직하게는, TNFα는 사람 TNFα이고 피험체는 사람 피험체이다. 하나의 양태에서, TNFα 억제제는 HUMIRA® (아달리무맙)로 언급되는 D2E7이다.
본원에 사용된 것으로서, 용어 "TNFα 활성이 유해한 질환"은, 질환을 겪는 피험체에서 TNFα의 존재가 질환의 병리생리학 또는 질환의 악화에 기여하는 인자에 관여하거나 또는 관여하는 것으로 예측되는 질병 및 기타 질환을 포함하는 것으로 의도된다. 따라서, TNFα 활성이 유해한 질환은, TNFα 활성의 억제가 질환의 증상 및/또는 진행을 완화시키는 것으로 예측되는 질환이다. 이러한 질환은 예를 들면, 당해 질환으로 고생하는 피험체의 생물학적 유액 속에서 TNFα의 농도에 있어서의 증가(예: 피험체의 혈청, 윤활액 등 속에서 TNFα 농도의 증가)로 입증되며, 이는 예를 들면, 위에서 기술한 바와 같은 항-TNFα 항체를 사용하여 검출할 수 있다. TNFα 활성이 유해한 질병의 예는 매우 많다. 다중-가변 투여 요법을 사용한 특정 질환의 치료시 본 발명의 항체 및 이의 항체 부위를 포함하는 TNFα 억제제의 사용은 하기에 또한 논의한다:
A. 패혈증
종양 괴사 인자는 저혈압, 심근 억제, 혈관 누출 증후근, 기관 괴사, 독성의 2차 매개인자 분비의 자극 및 응고 캐스케이드의 활성화를 포함하는 생물학적 효과를 나타내는 패혈증의 병리생리학에 있어 확립된 역활을 갖는다[참조: 예를 들면, Moeller, A., et al. (1990) Cytokine 2:162-169; 뮐러 등의 미국 특허 제5,231,024호; 뭘러 에이. 등의 유럽 특허 공보 번호 제260 610 Bl호; Tracey, KJ. 및 Cerami, A. (1994) Annu. Rev. Med. 45:491-503; Russell, D 및 Thompson, R.C. (1993) Curr. Opin. Biotech. 4:714-721]. 본 발명의 다중-가변 투여 방법을 사용하여 패혈증성 쇼크, 내독소 쇼크, 그람 음성 패혈증 및 독성 쇼크 증후군을 포함하는, 임상 셋팅중 어느 것에서도 패혈증을 치료할 수 있다.
또한, 패혈증을 치료하기 위해, 본 발명의 항-hTNFα 항체, 또는 항체 부위를 패혈증을 추가로 완화시킬 수 있는 하나 이상의 추가의 치료제, 예를 들면, 인터루킨-1 억제제(PCT 공보 제WO 92/16221호 및 제WO 92/17583호), 사이토킨 인터루킨-6(참조: PCT 공보 번호 제WO 93/11793호) 또는 혈소판 활성 인자의 길항제(예: 유럽 특허원 공보 번호 제EP 374 510호)와 함께 공동-투여될 수 있다. 패혈증을 치료하기 위한 다중-가변 투여 치료요법을 포함하는 다른 조합 치료요법은 부분단락 IV에서 추가로 논의된다. 바람직한 양태에서, 항-TNFα 항체 또는 항체 부위는, 치료 시기에 500 pg/ml 이상, 및 더욱 바람직하게는 1000 pg/ml의 IL-6의 혈청 또는 혈장 농도를 갖는 패혈증 환자의 아그룹내에서 사람 피험체에 투여된다[참조 문헌: PCT 공보 제WO95/20978호, Dawn, L., et al]
B. 자가면역 질환
종양 괴사 인자는 각종 자가면역 질환의 병리생리학에서 일정 역활을 담당하는 것으로 여겨진다. 예를 들면, TNFα는 류마티스 관절염에서 조직 염증을 활성화시키고 관절 파괴를 활성화시키는에 연관되어 있다[참조: Moeller, A., et al. (1990) Cytokine 2:162-169; 뭘러 등의 미국 특허 제5,231,024호; 뮐러 에이. 등의 유럽 특허 공보 번호 제260 610 Bl호; Tracey 및 Cerami, supra; Arend, W.P. 및 Dayer, J-M. (1995) Arth. Rheum. 38:151-160; Fava, R.A., et al. (1993) Clin. Exp. Immunol. 94:261-266]. TNFα는 또한 섬 세포(islet cell)의 사멸을 촉진하고 당뇨병에서 인슐린 내성을 매개하는데 연관되어 있다[참조: 트라세이(Tracey) 및 세라미(Cerami)의 상기 참조; PCT 공보 번호 제WO 94/08609호]. TNFα는 또한 올리고덴드로사이트에 대한 세포독성을 매개하고 다발경화증에서 염증 플라크를 유도하는데 연관되어 있다(참조: 트라세이 및 세라미의 상기 참조). 키메라 및 사람화된 쥐 항-hTNFα 항체는 류마티스 관절염의 치료를 위한 임상 시험중이다[참조: Elliott, M. J. , et al (1994) Lancet 344:1125-1127; Elliot, M.J., et al (1994) Lancet 344:1105-1110; Rankin, E.C., et al. (1995) Br. J. Rheumatol. 34:334-342].
사람 항체, 및 D2E7과 같은 항체 부위를 포함하는 TNFα 억제제는 다중-가변 투여 방법에서 자가면역 질환, 특히 염증과 관련된 자가면역 질환을 치료하는데 사용될 수 있다. 이러한 자가면역 상태의 예는 류마티스 관절염, 류마티스성 척수염, 골관절염 및 통풍 관절염, 알레르기, 다발경화증, 자가면역 당뇨병, 자가면역 포도막염 및 콩팥증후군을 포함한다. 자가면역 상태의 다른 예는 멀티시스템 자가면역 질환(multisystem autoimmune diseases) 및 자가면역 난청을 포함한다.
통상적으로, 항체 또는 항체 부위는, 비록 특정의 질환의 경우, 염증 부위에서 항체 또는 항체 부위의 국소 투여가 유리할 수 있다고 해도, 전신계적으로 투여한다 (예를 들면, 류마티스 관절염에서 관절에의 국소 투여 또는 당뇨성 궤양에의 국소 적용, 단독으로 또는 PCT 공보 번호 제WO 93/19751호에 기술된 것과 같은 사이클로헥산-일리덴 유도체와 함께). 사람 항체, 및 D2E7과 같은 항체 부위를 포함하는 TNFα 억제제는 소단락 IV에서 추가로 논의하는 바와 같이 자가면역 질환의 다중-가변 투여 치료에 유용한 하나 이상의 추가의 치료제와 함께 투여할 수 있다.
본 발명의 하나의 양태에서, 사람 TNFα 항체는 루푸스와 같은 자가면역 질환을 치료하기 위한 다중-가변 투여 치료법에서 사용된다. 루푸스는 TNF 활성과 관련있는 것으로 밝혀졌다[참조: Shvidel et al. (2002) Hematol J. 3:32; Studnicka-Benke et al. (1996) Br J Rheumatol. 35:1067]. 본원에 사용된 것으로서, 용어 "루푸스"는 피부, 관절 및 내부 기관을 포함하는 많은 기관계에 영향을 미칠 수 있는 홍반루푸스라 불리는 만성의 염증성 자가면역 질환을 말한다. 루푸스는 전신계 루푸스, 루푸스 신장염 및 루푸스 뇌염을 포함하는 다수의 특정 유형의 루푸스를 포함하는 일반 용어이다. 전신 루푸스(SLE)에서, 신체의 천연 방어는 신체에 대해 작동하며 로그(rogue) 면역 세포는 신체의 조직을 공격한다. 신체 혈액 세포, 기관 및 조직에 대해 반응할 수 있는 항체도 생산될 수 있다. 이러한 반응은 면역 세포가 영향받은 시스템을 공격하여 만성 질병을 생성하도록 한다. 루푸스 사구체 질병이라고도 또한 언급되는 루푸스 신장염은 일반적으로 SLE의 합병증이고 사구체에 대한 손상 및 신장 기능의 점진적인 상실을 특징으로 하는 신장 질환이다. 루푸스 뇌염은 뇌 및/또는 중추 신경계의 염증인, SLE의 다른 합병증을 말한다.
본 발명의 다중-가변 투여 치료를 사용하여 치료할 수 있는 다른 자가면역 질환은 크론병이며, 이는 장 질환 단락에서 하기 더욱 상세히 기술되어 있다.
C. 감염성 질환
종양 괴사 인자는 각종의 감염성 질환에서 관측되는 생물학적 효과를 매개하는데 연관되어 있다. 예를 들어, TNFα는 말라리아에서 뇌 염증 및 모세관 혈전증 및 경색증을 매개하는데 연관되어 있다. TNFα는 혈관-뇌 장벽의 파괴를 유도하고, 패혈성 쇼크 증후군을 유발(triggering)하며 수막염에서 정맥 경색증을 활성화하는데 연관되어 있다. TNFα는 또한 후천성 면역결핍증후군(AIDS)에서 중추 신경계 손상을 매개하고 바이러스 증식을 자극하며, 악액질을 유도하는데 연관되어 있다. 따라서, TNF에 대해 지시된 항체 및 항체 부위는 세균성 수막염(참조: 유럽 특허원 공보 제EP 585 705호), 대뇌 말라리아, AIDS 및 AIDS-관련 합병증(ARC)(참조: 유럽 특허원 공보 번호 제EP 230 574호), 및 이식에 대한 사이토메갈로바이러스 2차 감염[참조: Fietze et al. (1994) Transplantation 58:675]을 포함하는 감염성 질환의 다중-가변 투여 치료에 사용될 수 있다. 본 발명의 항체 및 항체 부위는 또한 감염(예: 인플루엔자)으로 인한 열 및 근육통을 포함하는 감염성 질환 및 감염에 대한 2차 악액질(예: AIDS 또는 ARC에 대한 2차 악액질)과 연관된 증상을 완화하는데 사용할 수 있다.
D. 이식
종양 괴사 인자는 동종이식 거부 및 이식편 대 숙주병(GVHD)의 주요 매개인자로서 및 T 세포 수용체 CD3 복합체에 대해 지시된 랫트 항체 OKT3를 신장 이식 거부를 억제하는데 사용되는 경우에 관측되는 부작용[참조: Eason et al. (1995) Transplantation 59:300; Suthanthiran 및 Strom (1994) New Engl. J. Med. 331:365]을 매개하는데 연관되어 있다. 따라서, 본 발명의 항체 및 항체 부위를 사용하여 동종이식 및 이종이식의 거부를 포함하는 다중-가변 투여 치료를 사용하는 이식 거부 및 GVHD를 억제할 수 있다. 비록 항체 또는 항체 부위를 단독으로 사용할 수 있다고 해도, 더욱 바람직하게 이는 동종이식에 대한 면역 반응을 억제하거나 GVHD를 억제하는 하나 이상의 기타 제제와 함께 사용된다. 예를 들어, 하나의 양태에서, 본 발명의 항체 또는 항체 부위는 OKT3와 함께 사용되어 OKT3-유도된 반응을 억제한다. 다른 양태에서, 본 발명의 항체 또는 항체 부위는 세포 표면 분자 CD25(인터루킨-2-수용체-α), CDl Ia (LFA-I), CD54 (ICAM-1), CD4, CD45, CD28/CTLA4, CD80 (B7-1) 및/또는 CD86 (B7-2)와 같은 면역 반응을 조절하는데 포함된 다른 표적에서 지시된 하나 이상의 항체와 함께 사용된다. 다른 양태에서, 본 발명의 항체 또는 항체 부위는 하나 이상의 일반적인 면역억제제, 예를 들면, 사이클로스포린 A 또는 FK506와 함께 사용된다.
E. 악성종양
종양 괴사 인자는 악액질을 유도하고, 종양 성장을 자극하며, 전이 잠재능을 증진시키고 악성종양에서 세포독성을 매개하는데 연관되어 있다. 따라서, TNF에 대해 지시된 항체 및 항체 부위는 악성종양의 다중-가변 투여 치료에서 사용될 수 있으며, 여기서, 치료는 종양 성장 또는 전이를 억제하고/하거나 악성종양에 대한 2차 악액질을 완화시킨다. 항체 또는 항체 부위는 전신계적으로,또는 종양부위에 대해 국소적으로 투여될 수 있다.
F. 폐 질환
종양 괴사 인자는 백혈구-내피세포 활성화를 자극하고, 폐세포에 대한 세포독성을 지시하고 혈관 유출 증후군을 유도하는 것을 포함하는 성인 호흡곤란증후군(ARDS)의 병리생리학에 연관되어 있다. 본 발명의 다중-가변 투여 방법은 성인 호흡곤란증후군, 폐 쇼크, 만성 폐 염증병, 폐 사르코이드증, 폐 섬유증 및 규폐증을 포함하는 각종의 폐 질환을 다중-가변 투여 치료(참조: PCT 공보 번호 제WO 91/04054)로 치료하는데 사용할 수 있다. 항체, 또는 항체 부위는 예를 들면 에어로졸과 같이 폐 표면에 전신계적으로 또는 국소적으로 투여할 수 있다. 항체 또는 항체 부위는 또한 소단락 IV에서 추가로 논의된 바와 같이 폐 질환의 다중-가변 투여 치료에서 유용한 하나 이상의 추가의 치료제를 사용하여 투여할 수 있다.
TNFα가 병리생리학에 연관되어 있는 폐 질환의 다른 예는 특발성 간질 폐 질병 및 만성 폐쇄성 기도 질환과 연관되어 있다[참조: Piquet et al (1989) J Exp Med. 170:655; Whyte et al (2000) Am J Respir Crit Care Med. 162:755; Anticevich et al (1995) Eur J Pharmacol 284 :221]. 본 발명은 또한 이러한 폐 질환으로 고생하는 피험체에서 TNFα 활성을 치료하는 방법을 제공하며, 당해 방법은 피험체에 항체, 항체 부위 또는 다른 TNFα 억제제를 다중 가변 투여 요법을 사용하여 투여함으로써 특발성 간질 폐 질병 또는 만성 폐쇄성 기도 질환으로 고생하는 피험체내 TNFα 활성이 억제되도록 함을 포함한다. TNFα 활성이 유해한 특발성 간질 폐 질병 및 만성 폐쇄성 기도 질환의 예는 하기에 추가로 논의한다.
1. 특발성 간질 폐 질병
하나의 양태에서, 본 발명의 TNFα 항체는 특발성 간질 폐 질병을 지닌 피험체를 치료하기 위한 다중-가변 투여 치료 용법에서 사용된다. 용어 "특발성 폐 섬유증" 또는 "IPF"는 염증 및 궁극적으로 심폐 조직의 흉터형성 및 짧은 호흡을 초래하는 것을 특징으로 하는 질환의 그룹을 말한다. IPF내 폐포(기낭) 및 이의 지지 구조(간질)에서의 흉터형성은 궁극적으로 작용성 폐포 단위 및 공기로부터의 산소의 혈액으로의 전달 감소를 초래한다. IPF는 또한 확산 실질 폐 질병; 폐포염; 잠복성 섬유화 폐포염(CFA); 특발성 폐 폐렴(IPP); 및 통상의 간질 폐렴(UIP)으로 지칭된다. IPF는 흔히 UI("IPF/UIP")와 동일한 의미로 사용되는데 그 이유는, UIP가 IPF의 병리학적 진단시 관측되는 가장 일반적인 세포 패턴이기 때문이다.
특발성 간질 폐 질병은 흔히 3가지 방법으로 폐에 영향을 미친다: 첫째로, 폐 조직은 일부 공지되거나 공지되지 않는 방식으로 손상되며; 두번째로, 폐내 기낭의 벽은 염증이 생기기 시작하고; 최종적으로 흉터형성(또는 섬유증)이 간질(또는 기낭사이의 조직)에 생기기 시작하여, 폐가 경직된다. 특발성 간질 폐 질병의 예는 특발성 폐 섬유증(IPF)을 포함한다. 종양 괴사 인자는 특발성 폐 섬유증(IPF)의 병리생리학에 연관되어 있다[참조: Piquet et al. (1989) J Exp Med. 170:655; Whyte et al. (2000) Am J Respir Crit Care Med 162:755 Corbett et al. (2002) Am J Respir Crit Care Med. 165:690]. 예를 들면, IPF 환자는 대식구에서 및 제II형 상피 세포내 TNF 발현 수준이 증가되어 있다[참조: Piquet et al. (1993) Am J Pathol 143:651; Nash et al. (1993) Histopathology 22:343; Zhang et al. (1993) J Immunol 150:4188]. 특정의 유전자 다형태 또한 증가된 TNF 발현과 관련이 있으며, IPF 및 규폐증에서 일정 역활을 담당하는 것으로 여겨진다[참조: Whyte et al, 상기 참조; Corbett et al, 상기 참조).
IPF를 지닌 환자는 흔히 마른 기침, 흉통 및/또는 짧은 호흡을 포함하는 특정의 증상을 나타낸다. IPF의 치료용으로 일반적으로 사용된 약물은, 비록 환자의 일부만이 이들 약물의 지속적 사용으로 개선된다고 해도, 프레드니손 및 사이톡산이다[참조: American Thoracic Society (2000) Am. J. Respir. Crit. Care Med. 161:646]. 산소 투여 및 폐의 이식은 치료를 위한 다른 선택이다. 하나의 양태에서, 본 발명의 다중-가변 투여 방법에서 사용된 항체는 특발성 폐 섬유증의 치료를 위해 예를 들면, 산소와 같은 다른 치료제와 함께 사용될 수 있다.
특발성 간질 폐 질병 및 만성 폐쇄성 기도 질환에 사용된 동물 모델의 예는 난알부민(OVA) 유도된 알레르기성 천식 마우스 및 흡연 유도된 만성 폐쇄성 폐 질병 마우스를 포함한다[참조: Hessel et al. (1995) Eur J Pharmacol. 293:401; Keast ef al. (1981) J. Pathol 135:249].
2. 만성 폐쇄성 기도 질환
하나의 양태에서, TNFα 항체는 만성 폐쇄성 기류 질환을 지닌 피험체를 치료하기 위한 다중-가변 투여 치료 용법에서 사용된다. 당해 질환에서, 기류 폐쇄는 만성일 수 있고 지속적이거나 또는 간헐적이고 재발될 수 있다. 기류 폐쇄는 일반적으로 강제 날숨 폐활량측정법(forced expiratory spirometry)으로 측정하며, 이는 최대 날숨 동안 내쉰 용적의 기록이다. 폐쇄된 기류를 지니지 않은 피험체에서, 완전한 강제 날숨은 일반적으로 3 내지 4초가 걸린다. 기류가 폐쇄된 만성 폐쇄성 기류 질환을 지닌 환자에서, 이는 15 내지 20초가 걸리며 짧은 호흡은 시간에 의해 제한될 수 있다. 날숨(FEV1)의 제1 초 중 통상의 강제 날숨 용적은 용이하게 측정되어 연령, 성별 및 신장을 기준으로 정확하게 예측된다. 강제 폐활량에 대한 FEV1의 비(FEV1/FVC)는 일반적으로 0.75를 초과한다. 강제 날숨 및 후속된 강제 들숨-유동-용적 루프- 동안 용적에 대한 기류의 기록은 주로 보다 하부 기도 협소화로부터 상부 기도를 구별하는데 유용하다. 만성 페쇄성 기도 질환의 예는 하기에 기술한다.
a. 천식
종양 괴사 인자는 천식의 병리생리학에 연관되어 있다[참조: Anticevich et al. (1995) Eur J Pharmacol. 284:221; Thomas et al. 1995. Am J Respir Crit Care Med. 152:76; Thomas and Heywood (2002) Thorax. 51:11 A). 예를 들어, 급성 천식 발작은 폐 호중구와 연관되어 있고 BAL TNF 수준을 상승시키는 것으로 밝혀졌다[참조: Ordonez et al. (2000) Am J Respir Crit Care Med 161 : 1185]. 천식 증상의 중증도는 집 먼지중 내독소 수준과 관련되어 있는 것으로 밝혀졌다. 랫트에서, 항-TNF 항체는 내독소-유도된 기도 변화를 감소시킨다[참조: Kips et al. (1992) Am Rev Respir Dis 145:332]
본원에 사용된 것으로서, 용어 "천식"은, 기도의 염증이 폐의 내부 및 외부로의 기류를 제한하는 질환을 말한다. 천식은 또한 기관지 천식, 운동-유도된 천식-기관지 및 반응성 기도병(RAD)로 지칭된다. 일부 예에서, 천식은 알레르기 및/또는 가족력과 연관되어 있다. 천식은 단기간에 걸친 기관지 기도의 직경 또는 내경의 광범위한 변동으로 인한 폐 기능의 변화로 특징화된다. 기류에 대한 수득되는 증가된 내성은 숨가뿜(호흡곤란), 흉부 수축 또는 "긴축" 및 쌕쌕거림을 초래한다.
NIH 안내서에 따라 특징화되는 천식 환자는 약간의 간헐성, 약간의 지속성, 중간의 지속성 및 심각한 지속성으로 기술된다[참조: NAEPP Expert Panel Report Guidelines for the Diagnosis 및 Management of Asthma- Update on Selected Topics 2002. JACI 2002; 110: S141-S209; Guidelines for the Diagnosis and Management of Asthma. NIH Publication 97-4051, July 1997]. 중간 지속성 천식으로 진단된 환자는 흡입성 코르티코스테로이드로 치료한다. 심감한 지속성 천식으로 진단된 환자는 흔히 고 투여량의 흡입성 코르티코스테로이드 및 경구 투여의 코르티코스테로이드로 치료한다.
b. 만성 폐쇄폐병(COPD)
종양 괴사 인자는 만성 폐쇄폐병의 병리생리학과 연관되어 있다[참조: Keatings (2000) Chest. 118:971; Sakao et al.( 2001) Am J Respir Crit Care Med. 163:420; Sakao et al (2002) Chest. 122:416]. 본원에서 상호교환적으로 사용된 용어 "만성 폐쇄폐병" 또는 "COPD"는 다양한 정도의 기낭 확장 및 폐 조직 파괴를 수반하는 제한된 기류에 의해 특징화되는 폐병의 그룹을 말한다. 용어 COPD는 만성 기관지염(점액 과다분비와 술잔 세포 점막밑샘 과다형성), 만성 폐쇄기관지염 또는 폐공기증(기도 실질의 파괴), 또는 이들 상태의 조합을 포함한다. 폐공기증과 만성 기관지염은 만성 폐쇄폐병의 가장 일반적인 형태이다. COPD는 비가역성 기류 폐쇄로 정의된다.
COPD에서, 만성 염증은 소 기도 및 폐 실질의 고정된 협소화 및 폐포 벽 파괴(폐공기증)을 초래한다. 이는 증가된 수의 폐포 대식구, 호중구 및 세포독성 T 림프구, 및 다수의 염증 매개인자(지질, 케모킨, 사이토킨, 성장 인자)의 방출을 특징으로 한다. 이러한 염증은 소 기도의 협소화 및 폐 실질 파괴과 함께 섬유증을 유발한다. 또한 이러한 염증을 증폭시킬 수 있는 높은 수준의 산화 스트레스도 존재한다.
G. 장 질환
종양 괴사 인자는 크론병을 포함하는 장염 질환의 병리생리학에 연관되어 있다[참조: Tracy et al. (1986) Science 234:470; Sun et al. (1988) J CHn. Invest. 81:1328; MacDonald et al. (1990) Clin. Exp. Immunol. 81:301]. 만성 쥐 항-hTNFα 항체는 크론병의 치료를 위한 임상 시험중이다[참조: van Dullemen et al (1995) Gastroenterology 109:129]. 본 발명은 사람 항체 또는 이의 항원-결합 단편을 사용하여 특발성 장염병과 같은 장 질환을 치료하기 위해 TNFα 억제제를 투여하는 것을 포함하는 다중-가변 투여 요법을 포함한다. 특발성 장염병은 2개의 증상, 크론병 및 궤양성 결장염을 포함한다. 하나의 양태에서, 본 발명의 다중-가변 투여 요법을 사용하여 IBD 및 크론병과 연관된 질환을 치료하는데 사용된다. 본원에서 상호교환적으로 사용된 것으로서, 용어 "장염 질환(IBD) 관련 질환" 또는 "크론병-관련 질환"은 IBD 및 크론병과 일반적으로 연관된 상태 및 합병증을 기술하는데 사용된다.
본 발명은 TNFα 억제제를 투여하여 크론병을 치료하는 것을 포함하는, 다중-가변 투여 요법을 포함한다. 크론병의 치료는 질병의 부위, 정도 및 중증도를 기초로 한다. 약리학적 조치는 소염제(아미노살리실레이트 및 코르티코스테로이드) 및 면역조절제(아자티오프린 및 6-머캅토퓨린[6-MP], 사이클로스포린, 메토트렉세이트 [MTX], 항생제, 및 생물학 제제)를 포함한다. C-반응성 단백질(CRP) 및 적혈구 침강율(ESR) 수준은 비-특이적인 급성 상 반응을 반영한다. 내시경검사는 크론병을 진단하는 주요 수단이다. 크론병의 방사선 특징은 바륨 검사로 밝혀졌으며, 점막 부종, 아프타 및 선형 궤양형성, 비대칭 협소화 및 협착, 및 장간막 비후에 의해 유발된 장의 인접 고리의 분리를 포함한다. 비정상은 병소적이고 비대칭이다. 주요 조직학적 병변은 아프타 궤양이다. 크론병을 지닌 피험체는 보다 심각한 질병 활성을 나타내는 보다 높은 점수를 갖는 질병의 중증도의 표준 척도인 크론병 활성 지표(CDAI)를 사용하여 평가할 수 있다.
본 발명의 방법을 사용하여 치료할 수 있는 크론병-관련 질환의 예는 방광, 질 및 피부에서의 누공(fistulas); 장 폐쇄; 고름집; 영양결핍; 코르티코스테로이드 사용으로부터의 합병증; 관절 염증; 결절 홍반; 괴저농피증; 및 눈의 병변을 포함한다. 크론병과 일반적으로 연관된 기타 질환은 크론병-관련 관절통, 크론병의 누공 형성, 미정 결장염 및 낭염을 포함한다.
H. 심장 질환
본 발명의 다중-가변 투여 방법을 또한 사용하여 심장 허혈을 포함하는 각종 심장 및 관상 질환[참조: 유럽 특허원 공보 번호 제EP 453 898호) 및 심부전(심근의 약화)(참조: PCT 공보 번호 제WO 94/20139호)를 치료할 수 있다. TNFα는 재협착의 병리생리학과 연관되어 있다[참조: Clausell et al. (1994), 상기 참조; Medall et al (1997) Heart 78:273].
본원에 사용된 것으로서, 용어 TNFα 활성이 유해한 심장 질환"은, 당해 질환으로 고생하는 피험체에서 TNFα의 존재가 질환의 병리생리학 또는 심혈관 질환, 예를 들면, 재협착을 포함하는 질환의 악화에 기여하는 인자에 관여하는 것으로 밝혀졌거나, 또는 관여하는 것으로 예측된 관상 및 심혈관병을 포함하는 것으로 의도된다. 본원에서 상호교환적으로 사용된 것으로서, 용어 "심혈관 질환" 또는 "관상 질환"은 심혈관 시스템, 예를 들면, 심장, 혈관 및/또는 혈액을 포함하는 모든 질병, 질환 또는 상태를 말한다. 관상 질환은 일반적으로 심장에 혈액과 산소를 공급하는 혈관(관상 동맥)의 협소화로 특징화된다. 관상 질병은 지방 물질 및 플라크의 축적으로 초래될 수 있다. 관상 동맥이 협소화되면서, 심장으로의 혈액 유동이 느려지거나 정지될 수 있다. 본 발명의 관상 질환은 구조적, 조직학적, 생화학적 또는 기타 다른 비정상이든 간에, 동맥의 어떠한 비정상에도 적용할 수 있다. 관상 심장병의 예는 재협착이다. 하나의 양태에서, 관상 질환은 심장의 허혈 및 심장 부전을 제외한 심혈관 시스템을 포함하는 모든 질병, 질환 또는 상태를 말한다.
TNFα 활성이 유해한 관상 질환은 흔히 동맥 내 차단으로 생성된다. 이러한 차단은 일반적으로 죽상경화증과 관련된 변화로부터 이미 협소화된 관상 동맥내에 일반적으로 형성되는 응괴(clot)에 의해 유발될 수 있다. 예를 들어, 동맥 벽내부에 죽상경화성 플라크가 균열되는 경우, 이는 혈전 또는 응괴의 형성을 자극(trigger)한다. 이러한 질환은 에를 들면, 질환으로 고생하는 환자의 생물학적 유액내 TNFα의 농도에 있어서의 증가(예: 피험체의 혈청, 혈장, 활액 등에서 TNFα의 농도의 증가)에 의해 입증될 수 있으며, 이는 예를 들면, 위에서 기술한 바와 같이, 항-TNFα 항체를 사용하여 검출할 수 있다. 관상 질환은 또한 예를 들면, 혈전에 의한 동맥압에 있어서의 불균형, 심장 기능장애, 또는 혈관의 폐색에 의해 유발될 수 있다. 관상 질환은 관상 동맥병 및 말초 혈관병 둘다를 포함한다.
TNFα 활성이 유해한 심장 질환에는 재협착을 포함하여 다수의 예가 있다. 특정의 관상 질환을 치료하기 위한 다중-가변 투여 요법에서 항체, 항체 부위 및 기타 TNFα 억제제의 사용은 하기에 추가로 논의된다. 특정의 양태에서, 항체, 항체 부위 또는 기타 TNFα 억제제는 피험체에 하기 기술한 바와 같은 다른 치료제와 함께 투여된다.
본 발명은 심장 질환을 지닌 피험체에서 TNFα 활성을 억제하기 위한 다중-가변 투여 방법을 제공한다. 본 발명은 관상 질환을 지닌 피험체에게 본 발명의 항체, 또는 항체 부위, 또는 기타 TNFα 억제제를 투여함으로써 피험체내 TNFα 활성이 억제되거나 감소되도록 함을 포함하여, 상기 피험체에서 TNFα 활성을 억제하거나 감소시키는 다중-가변 투여 방법을 제공한다. 바람직하게는, TNFα는 사람 TNFα이며 피험체는 사람 피험체이다. 달리는, 피험체는 본 발명의 항체와 교차-반응하는 TNFα를 발현하는 포유동물일 수 있다. 추가로 피험체는 hTNFα가 도입된(예를 들면, hTNFα를 투여하거나 hTNFα 전이유전자를 발현시킴에 의해) 포유동물일 수 있다. 본 발명의 항체는 사람 피험체에게 치료 목적으로 투여될 수 있다.
또한, 본 발명의 항체는 사람 질병의 동물 모델로서 또는 수의용으로 당해 항체가 교차-반응하는 TNFα를 발현하는 비-사람 포유동물(예: 영장류, 돼지 또는 마우스)에게 투여할 수 있다. 비-사람 포유동물과 관련하여, 이러한 동물 모델은 다중-가변 투여 치료 효능을 평가(예를 들면, 투여 용량 및 시간 경과의 시험)에 유용할 수 있다. 재협착을 포함하여, 관상 질환을 연구하기 위해 일반적으로 사용된 동물 모델은 랫트 또는 마우스 목 동맥 연결 모델 및 목 동맥 손상 모델을 포함한다[참조: Ferns et al. (1991) Science 253:1129; Clowes et al. (1983) Lab. Invest. 49:208; Lindner et al. (1993) Circ Res. 73:792]. 목 동맥 연결 모델에서, 동맥 혈류는 원외 분기 근처의 혈관의 연결에 의해 파열된다. 클로우스(Clowes) 등에 의해 기술된 바와 같이, 목 동맥 손상 모델은, 일반적인 목 동맥이 외부 목 동맥을 통해 도입된 벌룬 카테테르(balloon catheter)의 관내 통과에 의해 내피가 벗겨지도록 수행된다. 2주째에, 목 동맥은 평활근 세포 협착으로 인하여 현저히 협소화되나, 2 내지 12주 사이에 내막의 두께가 두 배가 되어 관의 크기를 감소시킨다. 당해 어떠한 모델도 사람에서 재협착의 예방 및 치료시 본 발명의 TNFα 항체의 잠재적인 치료학적 작용을 측정하는데 사용할 수 있다.
본 발명은 TNFα 활성이 유해한 심혈관 질환 치료용의 다중-가변 투여 요법을 포함하며, 여기서, TNFα 활성의 억제는 관상 질병의 증상 및/또는 진행을 완화시키거나 또는 관상 질병을 예방할 것으로 예측된다. 관상 질환으로 고생하거나 이러한 질환이 진행될 위험이 있는 피험체는 임상 증상을 통해 확인할 수 있다. 관상 질병에서 임상 증상은 흉통, 짧은 호흡, 쇠약, 실신 발작, 의식에 있어서의 변경, 극도의 통증, 발작 야간 호흡곤란, 일시적인 허혈성 발작 및 환자가 경험하는 다른 이러한 증상을 포함한다. 관상 질병의 임상적 징후는 또한 EKG 비정상, 변경된 말초 맥박, 동맥 잡음, 비정상적인 심장음, 심장 속도 및 쌕쌕거림, 목정맥 팽창, 신경학적 변경 및 임상의가 인지하는 다른 이러한 발견을 포함할 수 있다. 관상 질환은 또한 예를 들면, 당해 질환으로 고생하는 환자의 생물학적 유액에서 TNFα의 농도에 있어서의 증가(예: 피험체의 혈청, 혈장, 활액 등에서 TNFα의 농도에 있어서의 증가)에 의해 입증될 수 있다.
심혈관 질환의 예는 관상 동맥병, 협심증, 심근경색증, 심장 정지에 의해 유발된 심혈관 조직 손상, 심장 바이패스, 심장성 쇼크 및 고혈압에 의해 유발된 심혈관 조직 손상, 죽상경화증, 관상 동맥 경련, 관상동맥병, 판막증, 부정맥 및 심근병증 및 심장성 쇼크를 포함하나, 이에 한정되지 않는다. 특정의 심혈관 질병의 치료용 다중-가변 투여 요법에서 항체, 항체 부위 및 기타 TNFα 억제제의 사용은 하기에 추가로 논의한다. 특정 양태에서, 항체, 항체 부위 또는 기타 TNFα 항체는 피험체에게 하기 IV 단락에서 기술한 바와 같이 다른 치료제와 함께 투여된다.
1. 재협착
본원에 사용된 것으로서, 용어 "재협착"은 동맥의 협소화 또는 수축인 협착증의 재발을 말한다. 재협착은 흔히 질병이 있는 혈관에서 재수축 과정으로 진행되는 전폐색 병변(preocclusive lesion)으로서 발생한다. 당해 용어는 이미 존재하는 협착증의 재발에만 적용되는 것이 아니라, 혈관 바이패스 후에 부분 패색된 정상이었던 혈관에도 적용된다. 다른 양태에서, 본 발명은 본 발명의 항체 또는 이의 항체 결합 부위를 재협착증에 걸리거나 또는 재협착증으로 진행될 위험이 있는 피험체에게 투여함을 포함하여, 재협착을 치료하는 방법을 제공한다.
TNFα는 재협착의 병리생리학과 연관되어 있다[참조: Zhou et al. (2002) Atherosclerosis. 161 :153; Javed et al. (2002) Exp and Mol Pathol 73:104]. 예를 들어, 쥐 와이어 목(wire carotid) 모델에서, TNF -/- 마우스는 야생형 마우스와 비교하여 초기 과다형성에 있어서 7배의 감소를 입증하였다[참조: Zimmerman et al. (2002) Am JPhsiol Regul Integr Comp Physiol 283:R505]. 재협착은 관상 혈관계 또는 말초[참조: Colburn and Moore (1998) Myointimal Hyperplasia pp. 690-709 in Vascular Surgery: A Comprehensive Review Philadelphia: Saunders]에서든 모든 유형의 혈관 재수축의 결과로 발생할 수 있다. 예를 들어, 연구들은, 관상 혈관성형술 후, 30 내지 50%의 대증요법 재협착율을 보고하고 있다[참조: Berk 및 Harris (1995) Adv. Intern. Med. 40:455]. 목 동맥내막절제술후, 추가의 예로서, 연구된 환자중 20%는 50% 이상의 관강 협착을 지녔다[참조: Clagett et al. (1986) J. Vase. Surg. 3:10]. 재협착은 관련된 혈관의 특성, 잔류 질병의 정도 및 국소 혈류역학을 포함하는 인자들의 조합으로 인해 상이한 해부학적 위치에서 전폐색(preocclusive) 병변을 동반하는 상이한 정도의 증상학에서 입증되었다.
본원에 사용된 것으로서, "협착증"은 폐색성 질환 또는 재협착에서 관측되는 동맥의 협소화를 말한다. 협착증은 협소화된 동맥 분절을 통과하는 혈류량의 감소를 반영하는 증상이 동반될 수 있으며, 이 경우, 협착을 유발하는 당해 질환을 질병(즉, 폐색성 질병 또는 재협착 질병)으로 명명한다. 협착증은 혈관내에서 비대칭적으로 존재할 수 있으며, 혈관조영술 또는 혈관 랩 연구(vascular lab study)와 같은 진단적 조치에 의해서만 검출될 수 있다.
본 발명의 다중-가변 투여 방법을 사용하여 재협착으로 고생하거나 재협착으로 진행될 위험이 있는 환자를 치료할 수 있다. 재협착으로 진행될 위험이 있는 피험체는 PTCA를 겪는 피험체를 포함한다. 피험체는 또한 재협착을 예방하기 위해 삽입된 스텐트를 지닌다. TNFα 항체를 단독 또는 스텐트와 함께 사용하여 심혈관 질병으로 고생하는 피험체에서 협착증의 재발을 예방할 수 있다.
2. 울혈성 심부전
TNFα는 울혈성 심부전의 병리생리학과 연관되어 있다[참조: Zhou et al. (2002) Atherosclerosis 161:153]. TNFα의 혈청 수준은 질병의 중증도와 직접적으로 비례하는 방식으로 울혈성 심부전을 지닌 환자에서 증가된다[참조: Levine et al. (1990) N Engl J Med 323:236; Torre-Amione et al. (1996) J Am Coll Cardiol 27:1201]. 또한, TNFα이 억제제는 울혈성 심부전 증후군을 개선시키는 것으로 밝혀졌다[참조: Chung et al. (2003) Circulation 107:3133].
본원에 사용된 것으로서, 용어 "울혈성 심부전"은 신체의 산소 요구도를 공급하기 위한 심장의 감소된 능력을 특징으로 하는 상태를 포함한다. 울혈성 심부전의 증상 및 신호는 신체의 다양한 조직에 대한 감소된 혈류, 예를 들면, 심장이 대정맥, 운동 호흡곤란, 피로 및/또는 말초 부종, 예를 들면, 좌측 심실 기능상실으로부터 초래되는 말초 부종에 의해 심장으로 되돌아돈 혈액을 펌핑할 수 없는 경우, 각종 기관에서 과도한 혈액의 축적을 포함한다. 울혈성 심부전은 급성 또는 만성일 수 있다. 울혈성 심부전의 소견은 일반적으로 심장 기능의 일시적인 또는 영구적인 상실을 지닌 각종의 심장 또는 전신계 질환에 대해 2차적으로 일어난다. 이러한 질환의 예는 고혈압, 관상 동맥 질병, 판막 질병 및 심근병증, 예를 들면, 비대, 팽창성 또는 제한적 심장근육병증을 포함한다.
울혈성 심부전을 지니거나 이로 고생하는 피험체"는, 심장이 대사하는 조직의 요건을 충족하도록 혈액을 펌핑할 수 없거나, 상승된 충만압으로만 수행할 수 있는 심부전 펌핑의 일반 명명자에 의해 연결된 다양한 병인의 임상 증상을 포함하는 질환을 지닌 피험체이다. "울혈성 심부전이 진행될 위험이 있는 피험체"는 피험체의 심혈관 시스템에 영향을 미치는 특정 인자로 인하여 울혈성 심부전의 경향을 갖는 피험체이다. 이들 피험체에서 울혈성 심부전의 진행 위험성을 감소시키거나 이러한 진행을 예방하는 것이 바람직하다. 어구 "울혈성 심부전을 지닌"은, 심지어 이들이 아직 위험 인자로 인하여 고생하지 않을 수 있다하더라도, 일반적인 집단과 비교하여 당해 질환으로 고생할 위험이 있는 환자를 포함한다. 예를 들어, 고혈압이 치료되지 않은 환자는 울혈성 심부전으로 고생하지 않을 수 있으나, 환자의 고혈압 상태로 인하여 위험군일 수 있다. 본 발명의 하나의 양태에서, 항체 D2E7은 다중-가변 투여 치료를 사용하여 울혈성 심부전이 진행할 위험이 있는 환자를 치료하는데 사용된다.
3. 급성 관상 증후군
TNFα는 급성 관상 증후군의 병리생리학과 연관되어 있다[참조: Libby (1995) Circulation 91 :2844]. 급성 관상 증후군은 심장에 충분한 산소로 도달하지 않도록 하는 혈류 제한으로 인해 환자가 통증을 경험하게 되는 질환을 포함한다. 연구에서, TNFα는 급성 관상 증후군에 관여하는 것으로 밝혀졌다. 예를 들어, 하류 혈류역학 효과의 부재시 심근경색을 유발할 수 있는 신규한 랫트 이질성 심장-이식-관상 연결 모델에서, 가용성의 키메라 TNF 수용체(sTNFR)의 투여는 일시적인 LV 재구성 및 기능상실을 제거하였다[참조: Nakamura, et al. (2003) J Cardiol. 41 :41]. 또한 심근으로 sTNFR 발현 플라스미드의 직접적인 주사는 급성 심근 경색(AMI) 실험 랫트에서 경색 크기의 감소를 초래하였다[참조: Sugano et al. (2002) FASEB J 16:1421].
하나의 양태에서, TNFα 항체는 피험체에서 급성 관상 증구군을 치료 또는 예방하기 위한 다중-가변 투여 방법에서 사용되며, 여기서, 급성 관상 증추군은 심근경색 또는 협심증이다.
본원에 사용된 것으로서, 용어 "심근 경색" 또는 "MI"는 심장 발작(heart attack)을 말한다. 심근 경색은 부위내로 산소의 부적절한 공급으로 인하여 심장의 영역의 괴사 또는 영구적인 손상을 포함한다. 당해 괴사는 통상적으로 죽상경화증 또는 색전증으로부터 관상 동맥내 폐색에 의해 유발된다. 본 발명의 TNFα 항체에 의해 치료되는 MI는 둘다 Q-파 및 비-Q-파 심근 경색을 포함한다. 대부분의 심장 발작은 관상 동맥(심장 근육으로 혈액 및 산소를 운반하는 혈관)중 하나를 차단하는 응괴에 의해 유발된다. 예를 들어, 관상 동맥내에서 응괴는 심장 근육으로의 혈류 및 산소를 차단하여, 당해 부위내 심장 세포의 사멸을 초래한다. 손상된 심장 근육은 수축하는 자체 능력을 영구적으로 상실하며 나머지 심장 근육은 이를 상쇄하기 위해 요구된다. MI는 또한 개인에 있어 압도적인 스트레스에 의해 유발될 수 있다.
용어 "협심증"은 대부분이 심근의 무산소증으로 인해 발작적인 흉부 통증인 협심증으로 인지되는 연축, 기도폐색 또는 질식성 통증을 말한다. 협심증은 변이 협심증 및 운동 협심증 둘다를 포함한다. 협심증이 있는 피험체는 좌측 어깨로 및 좌측 팔을 따라 흔히 퍼지는 급작스럽고, 심각한, 가압 흉골하 통증에 의해 명백해지는 허혈성 심장병이다. TNFα는, TNFα 수준이 MI 및 안정한 협심증을 지닌 환자에서 상향조절되므로, 협심증과 연관되어 있다[참조: Balbay et al. (2001) Angiology 52109].
4. 죽상경화증
본원에 사용된 것으로서, "죽상경화증"는, 지방 물질이 동맥의 벽을 따라 침착하는 상태를 말한다. 당해 지방 물질은 동맥을 두껍게하고, 경화시키며, 궁극적으로 동맥을 차단시킬 수 있다. 죽상경화증은 또한 동맥경화증, 동맥의 경화 및 동맥 플라크 형성으로 지칭된다. TNFα에 대해 지시된 폴리클로날 항체는 토끼 죽상경화증 모델에서 염증 및 재협착을 초래하는 TNFα 활성을 중화시키는데 효과적인 것으로 밝혀졌다(참조: Zhou et al., 상기 참조). 따라서, TNFα는 본 발명의 다중-가변 투여 방법을 사용하여 죽상경화증으로 고통받거나 이러한 위험에 있는 피험체를 치료하거나 예방할 수 있다.
5. 심근병증
본원에 사용된 것으로서, 용어 "심근병증"은, 심장 근육 또는 심근이 약화되어 일반적으로 부적절한 심장 펌핑을 초래하는 심근의 질병을 정의하는데 사용된다. 심근병증은 바이러스 감염, 심장 발작, 알코올중독, 장기간의 심각한 고혈압(고 혈액압)에 의해, 또는 자가면역 원인으로 인해 유발될 수 있다.
심부전 환자중 대략 75 내지 80%에서 관상 동맥 질병이 심근병증의 근본 원인이며 "허혈성 심근병증"으로 지정된다. 허혈성 심근병증은 심장 발작에 의해 유발되는데, 이는 심장 근육 또는 심근내 흉터를 남긴다. 이후에 영향받은 심근은 심장 펌핑 기능에 기여할 수 없다. 흉터가 더욱 커지거나 심장 발작이 더욱 빈번해질 수록, 허혈성 심근병증으로 진행될 위험성이 더욱 높다.
심근병증은 선행의 관상 동맥 질병에 기여하지 않으며 "비-허혈성 심근병증"으로 지명된다. 비-허혈성 심근병증은 특발성 심근병증, 비대 심근병증, 알콜성 심근병증, 확장된 심근병증, 분만전후 심근병증 및 제한 심근병증을 포함하나, 이에 한정되지 않는다.
1. 척추관절병증
TNFα는 척추관절병증과 같은 염증병을 포함하는, 광범위한 질환의 병리생리학에 연관되어 있다[참조: Moeller et al. (1990) Cytokine 2:162; 미국 특허 제5,231,024호; 유럽 특허 공보 번호 제260 610호]. 본 발명은 피험체에게 항체, 항체 부위 또는 다른 TNFα 억제제를 초기에는 유도 투여량으로, 이후에는 치료 투여량으로 투여함으로써 척추관절병증으로 고생하는 환자에서 TNFα 활성이 억제되도록 함을 포함하여, 척추관절병증으로 고생하는 피험체에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공한다.
본원에 사용된 것으로서, 용어 "척추관절병증"은 척추의 관절에 영향을 미치는 몇몇 질병중 하나를 언급하는데 사용되며, 여기서, 당해 질병은 일반적인 임상, 방사선 및 조직학적 특징을 공유한다. 다수의 척추관절병증은 유전적 특징을 공유하는데, 즉, 이들은 HLA-B27 대립형질과 연관이 있다. 하나의 양태에서, 용어 척추관절병증은 강직척추염을 제외한, 척추의 관절에 영향을 미치는 일부 일병중 어느 하나를 언급하는데 사용되며, 여기서, 이러한 질병들은 공통의 임상적, 방사선 및 조직학적 특징을 공유한다. 척추관절병증의 예는 강직 척추염, 건선 관절염/척수염, 창자병성 관절염, 반응성 관절염 또는 라이터 증후군(Reiter's syndrome), 및 분화되지 않은 척추관절병증을 포함한다. 척추관절병증을 연구하는데 사용된 동물 모델의 예는 ank/ank 유전자전이된(transgenic) 마우스, HLA-B27 유전자전이된 랫트[참조: Taurog et al. (1998) The Spondylarthritides. Oxford:Oxford University Press]를 포함한다.
본 발명의 다중-가변 투여 방법을 또한 사용하여 다중-가변 투여 방법을 사용하는 척추관절병증으로 진행될 위험이 있는 피험체를 치료할 수 있다. 척추관절병증에 걸릴 위험이 있는 피험체의 예는 관절염으로 고생하는 사람을 포함한다. 척추간절병증은 류마티스 관절염을 포함하는 다른 형태의 관절염과 관련될 수 있다. 본 발명의 하나의 양태에서, 항체를 다중-가변 투여 방법에 사용하여 류마티스 관절염과 관련된 척추관절병증으로 고생하는 피험체를 치료한다. 본 발명의 다중-가변 투여 방법을 사용하여 TNFα 항체로 치료할 수 있는 척추관절병증의 예는 하기 기술한다:
1. 강직척추염(AS)
종양 괴사 인자는 강직척추염의 병리생리학에 연관되어 있다[참조: Verjans et al (1991) Arthritis Rheum. 34:486; Verjans et al. (1994) Clin Exp Immunol. 97:45; Kaijtzel et al. (1999) Hum Immunol. 60:140]. 강직척추염(AS)은 하나 이상의 척추골의 염증을 포함하는 염증 질환이다. AS는 척추의 척추골과 천장골 관절 사이의 관절, 및 척추와 골반 사이의 관절을 포함하는 축 골격 및/또는 주변 관절에 영향을 미치는 만성 염증병이다. AS는 궁극적으로 영향받은 척추가 함께 융합되거나 성장하도록 한다. AS를 포함하는 척추관절병증은 건선 관절염(PsA) 및/또는 궤양성 결장염 및 크론병을 포함하는, 염증성 장 질환(IBD)과 연관될 수 있다.
AS의 초기 징후는 CT 스캔 및 MRI 스캔을 포함하는 방사선 시험으로 측정할 수 있다. AS의 초기 징후는 흔히 음낭염 및 연골밑 뼈의 피질 모서리의 혼탁에 이은 짓무름 및 경화증에 의해 입증되는 바와 같이 천장골 관절내 변화를 포함한다. 피로는 또한 AS의 일반적인 증상으로 주목되어 왔다[참조: Duffy (2002) ACR 66th Annual Scientific Meeting Abstract]. 따라서, 본 발명의 항체 또는 이의 항원-결합 단편을 투여하는 것을 포함하는 다중-가변 투여 방법을 사용하여 AS를 치료할 수 있다.
하나의 양태에서, 본 발명의 다중-가변 투여 방법은 AS를 포함하는 IBD와 연관된 척추관절병증을 치료하는데 사용된다. AS는 흔히 아스피린 또는 인도메타신과 같은 비스테로이드성 소염 의약(NSAID)로 치료한다. 따라서, 본 발명의 다중-가변 투여 방법에서 사용된 TNFα 항체는 강직척추염과 일반적으로 연관된 염증 및 통증을 감소시키는데 사용된다.
2. 건선 관절염
종양 괴사 인자는 건선 관절염(PsA)의 병리생리학에 연관되어 있다[참조: Partsch et al. (1998) Ann Rheum Dis. 57:691; Ritchlin (1998) J Rheumatol. 25:1544]. 본원에서 언급된 것으로서, 건선 관절염 또는 피부와 관련된 건선은 신체에서 붉은 반점을 유발하는 일반적인 만성 피부 상태인 건선과 연합된 만성 염증 관절염을 말한다. 건선을 지닌 개인 20명 중 약 1명이 피부 상태에 따라 건선으로 진행될 것이며, 약 75%의 경우에서, 건선은 관절염으로 진행된다. PsA는 자체적으로 약한 관절염에서 심각한 관절염에 이르는 범위에서 다양한 방식으로 나타나는데, 여기서, 관절염은 일반적으로 손가락 및 척추에 영향을 미치다. 척추가 영향을 받으면, 증상은 상기한 강직척추염의 것과 유사하다. 본 발명의 TNFα 항체 또는 이의 항원-결합 단편은 PsA의 다중-가변 투여 치료에서 사용될 수 있다.
PsA는 때때로 절단 관절염과 관련이 있다. 절단 관절염은 관절을 절단하는 총체적인, 짓무른 변형을 초래하는 과도한 뼈 짓무름으로 특징화되는 질병을 말한다. 하나의 양태에서, 본 발명의 다중-투여 방법은 절단 관절염을 치료하는데 사용할 수 있다.
3. 반응성 관절염/라이터 증후군
종양 괴사 인자는 반응성 관절염의 병리생리학과 연관되어 있으며, 이는 또한 라이터 증후군으로 언급된다[참조: Braun et al. (1999) Arthritis Rheum. 42(10):2039]. 반응성 관절염(ReA)은, 흔히 장 또는 비뇨생식 감염 후, 체내 어느 부위에서의 감염을 악화시키는 관절염을 말한다. ReA는 흔히 관절의 염증(관절염), 요도염, 결막염 및 피부와 점막의 병변을 포함하는 특정의 임상 증후군으로 특징화된다. 또한, ReA는 클라미디아(chlamydia), 캄필로박터(Campylobacter), 살모넬라(salmonella), 또는 예르시니아(yersinia)를 포함하는 성행위로 전염된 질병 또는 이질성 감염 후 나타날 수 있다. 따라서, 본 발명의 다중-가변 투여 방법을 사용하여 ReA를 치료할 수 있다.
4. 미분화된 척추관절병증
하나의 양태에서, 본 발명의 다중-가변 투여 방법을 사용하여 미분화된 척추관절병증으로 고생하는 피험체를 치료한다[참조: Zeidler et al. (1992) Rheum Dis CHn North Am. 18:187]. 미분화된 척추관절병증을 기술하는데 사용된 다른 용어는 음성혈청반응성 올리고관절염(oligoarthritis) 및 미분화된 올리고관절염을 포함한다. 본원에 사용된 것으로서, 미분화된 척추관절병증은, 환자가 척추관절병증과 연관된 증상의 일부만을 나타내는 질병을 말한다. 당해 상태는 일반적으로 IBD, 건선, 또는 AS 또는 라이터 증후군의 전통적인 증상을 지니지 않은 성인에게서 관측된다. 일부 경우에, 미분화된 척추관절병증은 AS의 초기 증상이다. 하나의 양태에서, 본 발명의 다중-가변 투여 방법은 TNFα 항체 또는 이의 항원-결합 단편의 상이한 투여량을 투여하여 미분화된 척추관절병증을 치료하는 것을 포함한다.
J. 대사 질환
TNFα는 당뇨병 및 비만과 같은 대사 질환을 포함하는 각종의 질환의 병리생리학에 연관되어 있다[참조: Spiegelman 및 Hotamisligil (1993) Cell 73:625; Chu et al. (200O) Int J Obes RelatMetab Disord. 24:1085; Ishii et al. (2000) Metabolism. 49:1616]. 본원에 사용된 것으로서, 용어 "대사 질환"은, 신체가 생리학적 기능을 수행하기 위해 요구되는 물질을 분해하는 과정에 영향을 미치는 질병 또는 질환을 말한다. 대사 질환의 예는 당뇨병 및 비만을 포함하나, 이에 한정되지 않는다. 본 발명의 하나의 양태에서, 용어 "대사 질환"은 자가면역 당뇨병을 제외하고, 신체가 생리학적 기능을 수행하는데 요구되는 물질을 분해하는 과정에 영향을 미치는 질환을 지칭하는데 사용된다.
본 발명은 이러한 대사 질환으로 고생하는 피험체에게 유도 투여량에 이어 치료 투여량의 항체, 항체 부위 또는 기타 TNFα 억제제를 투여함으로써 대사 질환으로 고생하는 피험체내 TNFα 활성이 억제되도록 함을 포함하여, 이러한 대사 질환으로 고생하는 환자에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공한다. TNFα 항체를 또한 사용하여 본 발명의 다중-가변 투여 요법을 사용하여 대사 질환으로 진행할 위험이 있는 피험체를 치료할 수 있다.
대사 질환은 흔히 류마티스 관절염을 포함하는 관절염과 연관되어 있다. 하나의 양태에서, 항체와 같은 TNFα 억제제는 류마티스 관절염과 연관된 대사 질환으로 고생하는 피험체에서 다중-가변 투여 요법에 사용된다. 다른 양태에서, 본 발명의 다중-가변 용량 치료는 TNFα 항체를 투여하여 당뇨병 또는 비만과 연관된 질환을 치료하는 것을 포함한다.
대사 질환의 치료를 위해 TNFα 항체를 사용하는 다중-가변 투여 요법의 효능을 평가하기 위한 동물 모델의 예는 NOD 유전자전이된 마우스, 아키타 마우스(Akita mice), NSY 유전자전이된 마우스 및 ob/ob 마우스[참조: Baeder et al. (1992) Clin Exp Immunol. 89:174; Haseyama et al. (2002) Tohoku J Exp Med. 198:233; Makino et al (1980): Exp.Anim. 29:1; KoIb (1987) Diabetes/Metabolism Reviews 3:751; Hamada et al. (2001) Metabolism. 50:1282; Coleman, (1978) Diabetologia, 14:141; Bailey et al. (1982) Int. J. Obesity 6:11]을 포함한다. 혈관염을 연구하는데 사용된 동물 모델의 예는 마우스 HSV 모델[베체트병(Behcet's disease)], 마우스 엘. 카세이(L. casei) 모델[가와사키병(Kawasaki's disease)], 및 마우스 ANCA 모델(가와사키 병)을 포함한다. 혈관염의 다른 모델은 마우스의 McH5-lpr/lpr 종[참조: Nose et al. (1996) Am. J. Path. 149:1763] 및 마우스의 SCG/Kj 종[참조: Kinjoh et al (1993) Proc. Natl. Acad. ScL, USA 90:3413]를 포함한다. 이들 마우스 종은 초승달 사구체신염 및 비장, 위, 심장, 자궁 및 난소의 작은 동맥 및 소동맥의 괴사성 혈관염으로 급격하게 진행된다. 이들 동물은 고감마글로불린혈증 및 마이엘로퍼옥시다제(MPO)와 반응하는 ANCA 자가항체로 진행된다. 또한, 랫트를 사람 MPO로 면역화하는 것은 ANCA-관련 괴사 초승달사구체신염을 초래한다[참조: Brouwer et al. (1993) J. Exp. Med. 177:905].
대사 질환은 신체가 생리학적 기능을 수행하기 위해 요구되는 물질을 분해하는 과정에 영향을 미친다. 본 발명의 다수의 대사 질환은 특정의 특징을 공유하는데, 즉, 이들은 인슐린 내성, 혈당을 조절하는 능력의 결여, 체중 증가 및 체질량 지표의 증가와 연관되어 있다. 대사 질환의 예는 당뇨병 및 비만을 포함한다. 당뇨병의 예는 제1형 진성 당뇨병, 제2형 진성 당뇨병, 당뇨병신경병증, 말초 신경병, 당뇨망막병증, 당뇨병 궤양, 망막병증 궤양, 당뇨병 거대혈관병증 및 비만을 포함한다. TNFα 항체의 투여를 포함하여 다중-가변 투여 방법을 사용하여 치료할 수 있는 대사 질환의 예는 하기에 더욱 상세히 기술한다:
1. 당뇨병
종양 괴사 인자는 당뇨병의 병리생리학과 연관되어 있다[참조: Navarro et al . (2003) Am J Kidney Dis. 42:53; Daimon et al. (2003) Diabetes Care. 26:2015; Zhang et al (1999) J Tongji Med Univ. 19:203; Barbieri et al.(2003) Am J Hypertens. 16:537]. 예를 들어, TNFα는 인슐린 내성에 대한 병리생리학과 연관되어 있다. 위장암을 지닌 환자에서 혈청 TNF 수준은 인슐린 내성과 연관된 것으로 밝혀졌다[참조: McCall et al. (1992) Br. J. Surg. 79:1361].
본원에서 상호교환적으로 사용된 것으로서, 용어 "당뇨병" 또는 "당뇨 질환" 또는 "진성 당뇨병"은 혈중 당(글루코즈)의 증가된 수준으로 표시되는 질병을 말한다. 당뇨병은 아주 적은 인슐린(췌장에 의해 혈당을 조절하기 위해 생산된 화학물질), 인슐린 내성 또는 이들 둘다에 의해 유발될 수 있다. 당뇨병은 2개의 가장 일반적인 유형의 질환, 일명, 제I형 당뇨병 및 제II형 당뇨병을 포함하며, 이들은 둘다 신체의 인슐린 조절 무능력으로부터 초래된다. 인슐린은 혈중 혈당(글루코즈)의 증가된 수준에 대한 반응시 췌장에 의해 조절되는 호르몬이다.
본원에 사용된 것으로서, 용어 "제1형 당뇨병"은 혈당 수준을 적절히 조절하기 위한 인슐린을 췌장이 너무도 적게 생산하는데서 발생하는 만성 질병을 말한다. 제1형 당뇨병은 또한 인슐린-의존성 진성 당뇨병, IDMM, 소아 발병형 당뇨병 및 제I형 당뇨병으로 언급된다. 제1형 당뇨병 소견은 췌장 β-세포의 진행성 자가면역 파괴와 후속되는 인슐린 결핍의 결과이다.
용어 "제2형 당뇨병"은, 신체가 인슐린에 잘 반응하지 않음으로써 췌장이 혈중 글루코즈를 정상인 수준으로 유지하기 위해 충분한 인슐린을 제조하지 못하는 경우 발생하는 만성 질병을 말한다. 제2형 당뇨병은 또한 비인슐린-의존성 진성 당뇨병, NDDM 및 제II형 당뇨병을 말한다.
당뇨병은 글루코즈 내성 시험의 투여로 진단할 수 있다. 임상적으로, 당뇨병은 흔히 몇가지 기본 범주로 분류된다. 이들 범주의 주요 예는 자가면역 진성 당뇨병, 비-인슐린-의존성 진성 당뇨병(제1형 NDDM), 인슐린-의존성 진성 당뇨병(제2형 IDDM), 비-자가면역 진성 당뇨병, 비-인슐린-의존성 진성 당뇨병(제2형 NIDDM) 및 젊은이의 성인 당뇨병(MODY)을 포함한다. 흔히 제2라고 언급되는 추가의 범주는 당뇨 증상을 유발하거나 진행되도록 하는 일부 확인가능한 상태에 의해 유발되는 당뇨병을 말한다. 제2 범주의 예는 췌장 질병 또는 호르몬 불균형에 의해 유발된 당뇨병, 약물 또는 화학물질-유도된 당뇨병, 인슐린 수용체 비정상에 의해 유발된 당뇨병, 유전 증후군과 연관된 당뇨병 및 기타 원인의 당뇨병을 포함한다[참조: Harrison's (1996) 14th ed., New York, McGraw-Hill].
당뇨병은 흔히 식이요법, 인슐린 용법 및 본원에 기술된 각종 의약으로 치료한다. 따라서, TNFα 항체는 본 발명의 다중-가변 투여 방법에서 당뇨병과 통상적으로 연관된 통증 및 대사 질환을 치료하는데 일반적으로 사용된 제제와 함께 투여될 수 있다.
또한, 본원에 사용된 것으로서, 어구 "당뇨병과 관련된 질환"은 당뇨병과 일반적으로 연관되거나 관련된 상태 및 기타 질병을 언급한다. 당뇨병과 관련된 질환의 예는 예를 들면, 고혈당증, 고인슐린혈증, 고지질혈증, 인슐린 내성, 손상된 글루코즈 대사, 비만, 당뇨망막병증, 황반변성, 백내장, 당뇨병신장병증, 사구체 경화증, 당뇨병신경병증, 발기 기능장애, 월경전증후군. 혈관 재협착, 궤양성 결막염, 관상 심장병, 고혈압, 협심증, 심근 경색, 뇌졸증, 피부 및 결합조직 질환, 발 궤양, 대사산증, 관절염 및 골다공증을 포함한다. 하나의 양태에서, 본 발명의 다중-가변 투여 방법은 당뇨병과 연관된 질환을 치료하는데 사용할 수 있다.
당뇨병은 자체로 앞서의 범주에서 표시되며 다음 단락에서 논의하는 몇가지 합병증을 유발할 수 있다. 따라서, 본 발명의 항체 또는 이의 항원-결합 단편을 사용하여 당뇨병을 치료할 수 있다. 하나의 양태에서, TNFα 항체 또는 이의 항원-결합 단편을 사용하여 본 발명의 다중-가변 투여 방법을 사용하여 상기 정의한 범주와 관련된 당뇨병을 치료한다. 다른 양태에서, 본 발명은 하나의 양태에서, 본 발명은 TNFα 항체를 투여하여 당뇨병과 관련된 질환을 치료하는 다중-가변 투여 요법을 포함한다. 당뇨병은 다음 범주를 포함하는, 많은 합병증 및 당뇨병과 관련된 상태에서 자체로 표시된다.
a. 당뇨신경병증 및 말초 신경병증
종양 괴사 인자는 당뇨신경병증 및 말초 신경병증에 연관되어 있다[참조: Benjafield et al. (2001) Diabetes Care. 24:753; Qiang et al (1998) Diabetologia. 41:1321; Pfeiffer et al. (1997) Horm Metab Res. 29:111].
본원에 사용된 것으로서, 신경 손상-당뇨병으로 언급되는 용어 "신경병증"은 고혈당증(고 혈당 수준)의 결과로서 신경이 손상되는 당뇨병의 일반적인 합병증을 말한다. 각종의 당뇨신경병증, 예를 들면, 원위 감각운동 다발신경병증, 국소 운동 신경병증 및 자율신경계 신경병증이 인지되어 있다.
본원에 사용된 것으로서, 말초 신경병증 및 당뇨 신경병증으로 공지된 용어 "말초 신경병증"은 뇌 및 척수로부터 및 이로 정보를 운반하는 신경의 기능상실을 말한다. 말초 신경병증은 통증, 감각 상실 및 근육 조절 불능과 같은 증상을 유발한다. 일부 경우에, 혈관, 장 기능 및 기타 기관을 조절하는 신경의 기능상실은 비정상적인 혈압, 소화 및 다른 기본 불수의 과정의 상실을 초래한다. 말초 신경병증은 단일 신경 또는 신경 그룹(단발신경병증)에 대한 손상을 포함하거나 다발 신경(다발신경병증)에 영향을 미칠 수 있다.
교감 및 부교감 신경의 작은 말이집 및 민말이집 섬유에 영향을 미치는 신경병증은 "말초 신경병증"으로 알려져 있다. 또한, 말초 신경염 및 당뇨신경병증으로 공지된 말초 신경병증의 관련 질환은 뇌 및 척수로 및 이로부터 정보를 운반하는 신경의 기능상실을 말한다. 이는 통증, 감각 상실 및 근육 조절 불능과 같은 증상을 유발한다. 일부 경우에, 혈관, 장 기능 및 기타 기관을 조절하는 신경의 기능상실은 비정상적인 혈압, 소화 및 다른 기본 불수의 과정의 상실을 초래한다. 말초 신경병증은 단일 신경 또는 신경 그룹(단발신경병증)에 대한 손상을 포함하거나 다발 신경(다발신경병증)에 영향을 미칠 수 있다.
용어 "당뇨 신경병증"은 고혈당증(높은 혈당 수준)의 결과로서 신경이 손상된 당뇨병의 일반적인 합병증을 말한다. 당뇨 신경병증은 또한 신경병증 및 신경 손상-당뇨병으로 언급된다. 각종의 당뇨 신경병증, 예를 들면, 원위 감각운동 다발신경병증, 국소 운동 신경병증 및 자율신경계 신경병증이 인지되어 있다.
b. 당뇨망막병증
종양 괴사 인자는 당뇨망막병증의 병리생리학에 연관되어 있다[참조: Scholz et al., (2003) Trends Microbiol. 11:171]. 본원에 사용된 것으로서, 용어 "당뇨망막병증"은 장기간의 당뇨병으로 인해 유발된 눈 망막에 대한 진행성 손상을 말한다. 당뇨망막병증은 증식성 망막병증을 포함한다. 증식성 망막병증은 결국 신생혈관형성, 망막 출혈 및 망막 박리를 포함한다.
진행된 망막병증에서, 소 혈관은 망막의 표면에서 증식한다. 이들 혈관은 취약하며, 출혈하는 경향이 있고 망막 출혈을 유발할 수 있다. 출혈은 시야를 흐리게 할 수 있으며, 출혈이 재흡수되면서 섬유 조직이 망막 박리에 선행하여 형성되고 시력이 상실된다. 또한, 당뇨망막병증은 신생혈관형성, 망막 출혈 및 망막 박리를 포함하는 증식성 망막병증을 포함한다. 당뇨 망막병증은 또한 망막의 층과 함께 발행하는 변화를 포함하는 "배경 망막병증"을 포함한다.
c. 당뇨 궤양 및 망막병증 궤양
종양 괴사 인자는 당뇨 궤양의 병리생리학에 연관되어 있다[참조: Lee et al. (2003) Hum Immunol. 64:614; Navarro et al. (2003) Am J Kidney Dis. 42:53; Daimon et al (2003) Diabetes Care. 26:2015; Zhang et al (1999) J Tongji Med Univ. 19:203; Barbieri et al. (2003) Am JHypertens. 16:537; Venn et al. (1993) Arthritis Rheum. 36:819; Westacott et al (1994) J Rheumatol. 21:1710].
본원에 사용된 것으로서, 용어 "당뇨 궤양"은 당뇨병의 합병증으로서 초래되는 궤양을 말한다. 궤양은 염증, 감염성 질환, 악성 상태 또는 대사 질환에 의해 유발된 피부 또는 점막에서의 분화구형 병변이다. 통상적으로 당뇨 궤양은 사지 및 말단에서, 더욱 통상적으로는 발에서 발견할 수 있다. 당뇨 상태에 의해 유발된 신경병증 및 혈관 기능부전과 같은 궤양은 허혈 및 불량한 상처 치유를 초래할 수 있다. 더욱 심각한 궤양은 골수염으로 진행될 수 있다. 골수염으로 진행되면, 항체 단독을 사용하여 근절하기가 어려울 수 있으며 절단이 요구될 수 있다.
본원에 사용된 것으로서, 용어 "망막병증 궤양"은 눈 및 눈의 망막에 손상을 초래하거나 유발하는 궤양을 말한다. 망막병증 궤양은 망막병성 출혈을 지니는 것과 같은 상태를 포함할 수 있다.
d. 당뇨 거대혈관병증
종양 괴사 인자는 당뇨 거대혈관병증의 병리생리학에 연관되어 있다[참조: Devaraj et al. (2000) Circulation. 102:191; Hattori et al. (2000) Cardiovasc Res. 46:188; Clausell et al. (1999) Cardiovasc Pathol. 8:145]. 본원에 사용된 것으로서 "거대혈관 질병"으로 또한 언급된 용어 "당뇨 거대혈관병증"은 당뇨병으로 초래되는 혈관의 질병을 말한다. 당뇨 거대혈관병증 합병증은 예를 들면, 지방 및 혈액 응괴가 거대 혈관에서 생성되고 혈관 벽에 고착되는 경우에 발생한다. 당뇨 거대혈관병증은 관상 질병, 뇌혈관 질병 및 말초 혈관 질병, 고혈당증 및 심혈관 질병 및 뇌졸중을 포함한다.
2. 비만
종양 괴사 인자는 비만의 병리생리학에 연관되어 있다[참조: Pihlajamaki J et al. (2003) Obes Res.11 :912; Barbieri et al. (2003) Am J Hypertens. 16:537; Tsuda et al. (2003) JNutr. 133:2125]. 본원에 사용된 것으로서, 용어 "비만"은, 피험체가 마른 체 질량에 비해 상대적으로 과도한 체 지방을 지닌 상태를 말한다. 하나의 양태에서, 비만은, 개인의 체중이 이들의 신장에 대해 바람직한 최대치보다 약 20% 이상인 상태를 말한다. 성인이 100 파운드 이상의 과체중인 경우, 당해 사람은 "병적 비만"으로 고려된다. 다른 양태에서, 비만은 30kg/m2 이상의 BMI(체질량 지표)로서 정의된다. 비만은 개인의 질병 위험 및 당뇨, 뇌졸증, 관상 동맥병, 고혈압, 고 콜레스테롤, 및 신장과 담낭 질환으로 인한 사망 위험성을 증가시킨다. 비만은 또한 여러 유형의 암에 대한 위험을 증가시키고, 골관절염 및 수면 무호흡의 진행에 대한 위험 인자일 수 있다. 비만은 본 발명의 다중-가변 투여 방법을 사용하여 치료할 수 있다.
K. 빈혈
TNFα는 광범위한 빈혈의 병리생리학에 연관되어 있다[참조: Jongen-Lavrencic et al. (1997) J. Rheumatol. 24: 1504; Demeter et al. (2002) Ann Hematol 81:566; DiCato (2003) The Oncologist 8 (suppl 1):19]. 본 발명은 빈혈을 앓는 피험체에게 유도 투여량에 이어 치료 투여량의 TNFα 억제제(여기서, TNFα 억제제는 항체, 항체 부위이다)를 투여함으로서 빈혈로 고생하는 피험체에서 TNFα 활성을 억제함을 포함하여, 빈혈로 고생하는 피험체에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공한다. 하나의 양태에서, 빈혈은 류마티스 관절염과 관련되어 있다.
본원에 사용된 것으로서, 용어 "빈혈"은 비정상적으로 적은 수의 순환하는 적혈구 또는 혈액내 감소된 농도의 헤모글로빈을 말한다. 류마티스 관절염과 관련된 빈혈의 예는 예를 들면, 만성 질병, 철 결핍성 빈혈 및 자가면역 용혈 빈혈을 포함한다. 하나의 양태에서, 본 발명은 예를 들면 류마티스 관절염과 관련된 빈혈, 감염 및 만성 염증병의 빈혈, 철 결핍성 빈혈, 자가면역 용혈성 빈혈, 골수로성 빈혈, 무형성 빈혈, 저형성 빈혈, 순수한 적혈구 무형성 및 신부전 또는 내분비 질환과 연관된 빈혈, 거대적혈모구 빈혈, 헴 또는 글로빈 합성에 있어서의 결손, 적혈구 세포의 구조적 결손에 의한 빈혈, 예를 들면, 겸상 적혈구 빈혈, 및 철적모구 빈혈과 같은 공지되지 않은 기원의 빈혈, 말라리아, 파동편모충증, HIV, 간염 바이러스 또는 기타 바이러스와 같은 만성 감염과 관련된 빈혈, 및 골수 결핍에 의해 유발된 골수로성 빈혈과 관련된 빈혈을 치료하는 방법을 제공한다.
빈혈을 연구하기 위해 사용된 동물 모델의 예는 펩티도글리칸-폴리사카라이드 중합체를 접종한 랫트를 포함한다[참조: Coccia et ah, (2001) Exp Hematology. 29:1201-1209]. 통증을 연구하는데 사용된 동물 모델의 예는 당해 분야에 잘 공지되어 있으며 랫트 좌골 신경 연결 모델, 및 랫트 분절 척추 신경 연결 모델을 포함한다[참조: Bennett 및 Zie, (1988) Pain. 33:87-107; Kim 및 Chung, (1992) Pain 50:355-363].
L. 통증
TNFα는 광범위한 통증 증후군의 병리생리학에 연관되어 있다[참조: Sorkin (1997) Neuroscience. 81:255; Huygen (2002) Mediators Inflamm. ll:47; Parada (2003) Eur J Neurosci. 17: 1847]. 본원에 사용된 것으로서, 용어 "통증"은 모든 유형의 통증을 말한다. 당해 용어는 신경병증 통증 및 수술후 통증, 만성 등 하부 통증, 군발 두통, 헤르페스 신경통, 환지통, 중추성 통증, 치아 통증, 오피오이드-내성 통증(opioid-resistant pain), 내장 통증, 외과 통증, 골 손상 통증, 노동 및 이동중 통증, 일광화상을 포함하는 화상으로부터 유발되는 통증, 산후 통증, 편두통, 협심증 통증 및 방광염을 포함하는 비뇨생식관-관련 통증을 말한다. 당해 용어는 또한 통각수용 통증 또는 통각을 포함한다.
본 발명은 이러한 통증 질환으로 고생하는 피험체에게 유도 투여량에 이어 치료 투여량의 항체, 항체 부위 또는 기타 TNFα 억제제를 투여함으로써 통증으로 고생하는 피험체에서 TNFα 활성을 억제함을 포함하여, 이러한 통증 질환으로 고생하는 피험체에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공한다. 통증은 통각성 통증 및 신경병성 통증을 포함하는 각종 방법으로 정의된다. 통증으로부터 가장 일반적으로 경험하는 형태는 신경 말단에서의 자극의 효과로 정의되며, 이는 대뇌에 대한 충격의 전달을 초래한다. 통증은 또한 일반적으로 예를 들면, 류마티스 관절염을 포함하는 염증 질환과 관련되어 있다. 하나의 양태에서, 본 발명의 항체는 류마티스 관절염과 관련된 통증으로 고생하는 피험체를 치료하는데 사용된다. TNFα 활성이 유해한 통증 질환의 예는 하기에 추가로 논의한다.
1. 신경병성 통증
종양 괴사 인자는 신경병성 통증의 병리생리학과 연관되어 있다[참조: Sommer (1999) Schmerz. 13:315; Empl et al, (2001) Neurology. 56:1371; Schafers et al. (2003) J Neurosci. 23:3028]. 본원에 사용된 것으로서, 용어 "신경병성 통증"은 신경, 척수 또는 뇌에 대한 손상으로부터 초래되는 통증을 말하며, 흔히 뉴우런 과민감성을 포함한다. 신경병성 통증의 예는 만성 등 하부 통증, 관절염과 관련된 통증, 암-관련 통증, 헤르페스 신경통, 환지통, 중추성 통증, 오피오이드 내성 신경병성 통증, 골 손상 통증 및 노동 및 이동중 통증을 포함한다. 신경병성 통증의 다른 예는 수술후 통증, 군발 두통, 치아 통증, 외과적 통증, 심각한, 예를 들면, 3도의 화상으로부터 초래되는 통증, 산후 통증, 협심증 통증, 및 방광염을 포함하는 비뇨생식기관 관련 통증을 포함한다.
신경병성 통증은 통각성 통증으로부터 구별된다. 통각 메카니즘을 포함하는 통증은 일반적으로 조직 회복의 기간으로 한정되며 일반적으로 이용가능한 진통제 또는 오피오이드에 의해 완화된다[참조: Myers (1995) Regional - Anesthesia 20:173]. 신경병성 통증은 지속적인 자발통 및 일반적으로 고통이 없는 자극에 대한 통증이 있는 반응인 무해자극 통증을 포함할 수 있다. 신경병성 통증은 또한 통각과민으로 특징화될 수 있으며, 여기서, 바늘 통각 검사와 같은, 일반적으로 사소한 통증이 있는 자극에 대한 강화된 반응이 존재한다. 통각성 통증과는 달리, 신경병성 통증은 일반적으로 오피오이드 치료요법에 대해 내성이다(참조: Myers, supra, 1995). 따라서, 본 발명의 다중-가변 투여 방법을 사용하여 신경병성 통증을 치료할 수 있다.
2. 통각성 통증
본원에 사용된 것으로서, 용어 "통각성 통증"은 완전한 신경학적 경로를 통해 전달되는 통증, 즉, 신체에 대한 손상에 의해 유발된 통증을 말한다. 통각성 통증은 통증의 체성 감각 및 정상 기능을 포함하며 피험체에게 절박한 조직 손상을 알려준다. 통각성 경로는 피험체의 보호를 위해 존재한다(예를 들면, 화상에 대한 반응시 경험하는 통증). 통각성 통증은 골 통증, 내장 통증 및 연조직과 관련된 통증을 포함한다.
종양 괴사 인자는 내장 통증의 병리생리학에 연관되어 있다[참조: Coelho et al. (2000) Am J Physiol Gastrointest Liver Physiol. 279:G781 ; Coelho et al. (2000) Brain Res Bull. 52:223]. 내장 통증은 A-델타 및 C 신경 섬유에서 수용체에 의해 매개된 통각성 통증을 언급하는데 사용된다. A-델타 및 C 신경 섬유는 피부, 골, 결합 조직, 근육 및 내장에 위치하는 것이다. 내장 통증은 분산에 있어 모호하며, 근본적으로 연축성이고 근본적으로 깊고, 아프고, 쥐어짜며 급통증으로 기술된다. 내장 통증의 예는, 내장 통증이 팔, 목 및/또는 등에서 느껴질 수 있는 심장 발작과 관련된 통증, 및 내장 통증이 등 및/또는 우측 어깨에서 느껴질 수 있는 간 피막 통증을 포함한다. 따라서, 본 발명의 다중-가변 투여 방법을 사용하여 척추 통증을 치료할 수 있다.
M. 간 질환
TNFα는 광범위한 간 질환의 병리생리학에 연관되어 있다[참조: Colletti et αl. (1990) J Clin Invest. 85:1936; Tiegs (1997) Acta Gastroenterol Belg. 60:176; Fernandez et al. (2000) J Endotoxin Res. 6:321]. 본 발명은 이러한 간 질환으로 고생하는 피험체에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공한다.
본원에 사용된 것으로서, 용어 "TNFα 활성이 유해한 간 질환은, 당해 질환으로 고생하는 피험체내 TNFα의 존재가 당해 질환의 악화에 기여하는 인자 또는 질환의 병리생리학에 관여하는 것으로 밝혀지거나 예측된 간세포 손상 또는 담즙관 질환과 관련된 상태 또는 간의 질병, 또는 기타 질환을 포함하는 것으로 의도된다. 따라서, TNFα 활성이 유해한 간 질환은, TNFα 활성의 억제가 간 질환의 증상 및/또는 진행을 완화하는 것으로 예측되는 질환이다. 하나의 양태에서, 간 질환은 간염, 알콜성 간염 및 바이러스 간염을 제외한, 간세포 손상 또는 담즙관 질환과 관련된 사람 간 질병 또는 상태를 말한다.
다중-가변 투여 방법을 사용하여 간 질환을 치료하기 위한 제제의 치료 효능을 평가하는데 사용된 동물 모델의 예는 C형 간염 바이러스 침팬지 모델[참조: Shimizu et al. (1990) Proc Natl Acad Sci USA 87:6441]을 포함한다. 피부 및 손발톱 질환을 연구하는데 사용된 동물 모델의 예는 예를 들면, 심각하게 조합된 면역결핍성(SCID) 마우스 모델(건선) 및 스미스 라인(Smith line)(SL) 닭 및 탈색소 마우스(백반증)을 포함한다[참조: Nickoloff (2000) Investig Dermatol Symp Proc.5-.67; Austin et al. (1995) Am J Pathol. 146:1529; Lerner et al. (1986) J Invest Dermatol. 87:299].
간 질환은, 간이 부적절하게 작용하거나 작용을 중지하는 많은 질병 및 질환을 포함한다. 간세포 손상은 알콜성 간경화, α1 항트립신 결핍, 자가면역 간경화, 잠복 간경화, 적격 간염, B형 간염 및 C형 간염, 및 지방간염을 포함할 수 있다. 담즙관 질환의 예는 낭성 섬유증, 원발쓸개관간경화증, 경화 쓸개관염 및 담도폐쇄증을 포함할 수 있다[참조: Wiesner (1996) "Current Indications, Contra Indications and Timing for Liver Transplantation" in Transplantation of the Liver, Saunders (publ.); Busuttil 및 Klintmalm (eds.) Chapter 6; Klein (1998) Partial Hypertension: The Role of Liver Transplantation, Musby (publ.) in Current Surgical Therapy 6.sup.th Ed. Cameron, J. (ed)].
용어 "간염"은 간의 염증을 말한다. 간염은 세균, 바이러스(A형, B형, C형 간염 등) 또는 기생충을 포함하는 각종 유기체에 의한 감염으로 유발될 수 있다. 알코올, 약물 또는 독버섯과 같은 화학 독소도 또한 간을 손상시킬 수 있으며 간에 염증을 유발한다. 드물지만 극도로 위함한 간염 유발원은 과도한 아세트아미노펜(타이레놀)로 초래되며, 이는 치사적일 수 있다. 또한, 체내 면역 세포는 간을 공격하여 자가면역 간염을 유발할 수 있다. 간염은 빠르게 분해되거나(급성 간염), 또는 장기간 질병(만성 간염)을 유발할 수 있다. 일부 예에서, 진행성 간 손상 또는 간 기능상실이 초래될 수 있다. 간염의 출현 및 중증도는 간 손상의 원인 및 환자에서 직면한 병을 포함하는 많은 인자에 따라 변한다.
하나의 양태에서, 본 발명은 TNFα 활성이 유해한 간 질환을 치료하는 다중-가변 방법을 특징으로 하며, 이는 피험체에 유효량의 TNFα 억제제를 유도 투여량 및 후속적으로 치료 투여량으로 투여함으로써 상기 질환이 치료되도록 한다. 하나의 양태에서, 간염 질환은 C형 바이러스 간염, 자가면역 간염, 지방-간 질병, B형 바이러스 간염, 간독성 및 비-알코올성 지방간염(NASH)를 포함하는 비-알코올성 간염으로 이루어진 그룹 중에서 선택된다. 간염 질환의 예는 하기에 또한 기술한다.
1. C형 바이러스 간염(HCV)
종양 괴사 인자는 C형 바이러스 간염의 병리생리학에 연관되어 있다[참조: Gonzalez- Amaro. (1994) J Exp Med. 179:841; Nelson et al. (1997) DigDis Sci 42:2487; Kallinowski et al (1998) Clin Exp Immunol. 111 :269]. 당해 용어 "C형 바이러스 간염" 또는 "HCV"는 비-A, 비-B 간염의 유발원 제제인 간염 바이러스를 기술하는데 사용된다. C형 바이러스 간염은 간의 염증을 유발한다. HCV 감염은 C형 간염을 유발한다. 급성 단계에서 C형 간염은 일반적으로 B형 간염보다 심하지 않으나, 이러한 감염의 보다 많은 비율이 만성으로 된다. HCV는 간경화증 및 간암을 포함하는 급성 간염 및 만성 간 질병의 주요 원인이다. HCV는 바이러스(A형, B형, C형, D형, 및 E형) 중 하나이며, 이들 모두는 대부분의 경우의 바이러스 감염을 차지한다. 이는 협소한 숙주 범위를 갖는 것으로 여겨지는 플라비비리다에 과의 외피를 갖는 RNA 바이러스이다. 당해 바이러스의 중요 특징은 이의 게놈의 상대적 변이능이며, 이는 결국 만성 감염을 유도하는 높은 경향(80%)과 관련될 수 있다. HCV는 질병의 심각성 및 치료에 대한 반응을 측정하는데 있어 중요할 수 있는 몇가지 뚜렷한 유전형으로 그룹화된다. 하나의 양태에서, 본 발명은 HCV를 치료하기 위한 다중-가변 투여 방법을 제공한다.
2. 자가면역 간염(AIH)
종양 괴사 인자는 자가면역 간염의 병리생리학에 연관되어 있다[참조: Cookson et αl., (1999) Hepatology 30:851; Jazrawi et al, (2003) Liver Transpl. 9:377]). 본원에 사용된 것으로서, "자가면역 간염"은 외부 조직 또는 병원체(질병-유발제)에 대해 간의 정상 세포를 착오하는 변이 면역 세포에 의해 유발된 간의 염증으로 특징화되는 간염 질환을 말한다. 자가면역 간염은 흔히 치료되지 않고 방치될 경우 치사율이 높은 간 실질의 진행성 파괴에 관여한다[참조: Johnson et al. (1993) Hepatology, 18:998]. 자가면역 간염의 특징중 하나는 환자의 혈청중 거의 90%에서 순환하는 자가항체가 존재한다는 것이다. 이러한 항체는 자가면역 간염을 지닌 피험체를 확인하는데 사용할 수 있다.
환자간의 임상적 및 혈청학적 차이는 AIH를 2개 유형으로 분류한다. 제1형은 항-평활근(SMA) 및/또는 환자의 혈청중 항-핵 항체(ANA)의 존재로 특징화되는 반면, 제II형 환자로부터의 혈청은 항-간 신장 미세소체 제1형 항체(LKM1)를 나타낸다[참조: Homberg et al, (1987) Hepatology, 7:1333; Maggiore et al. (1993) J Pediatr. Gastroenterol Nutr. 17:376]. 혈청학적 마커인, 항-간 세포질 제I형 항체(LC1)는 AIH 제II형 환자의 30%에서 확인되었다. 또한, LCl는 시험한 환자의 10%에서 단지 혈청학적 마커인 것으로 입증되었다[참조: Martini et al. (1988) Hepatology, 8:1662]. 하나의 양태에서, 본 발명의 다중-가변 투여 방법은 AIH를 치료하는데 사용된다.
3. 지방-간 질병
종양 괴사 인자는 지방-간 질병의 병리생리학과 연관되어 있다[참조: Valenti et al, (2002) Gastroenerology 122:274; Li et al, (2003) Hepatology 37:343]. 지방-간 질병은, 지방(간세포)이 간내에 과도하게 축적된 질병을 말한다. 지방 간 질병은 영양과도, 알코올의 과도섭취, 당뇨병 및 약제의 투여로 인한 부작용으로 유발되는 것으로 여겨진다. 지방간 질병은 만성 간염 및 간 경화증과 같은 심각한 질병을 유발할 수 있다. 지방간 질병을 지닌 환자에서, 지질, 특히 중성 지방은 생리학적으로 허용되는 범위를 초과하는 양의 정도로 간세포내에 축정된다. 생물학적 측면에서, 지방간의 판단 표준은, 천연 지방의 중량이 간 조직의 습윤 중량의 약 10%(100 mg/g 습윤 질량) 이상인 경우이다. 하나의 양태에서, 본 발명의 다중-가변 투여 방법은 지방 간 질병을 치료하는데 사용된다.
4. B형 바이러스 간염(HBV)
종양 괴사 인자는 B형 바이러스 간염의 병리생리학과 연관되어 있다[참조: Kasahara et al, (2003) J Virol 77:2469; Wang (2003) World J Gastroenterol 9:641 ;Biermer et al. (2003) J Virol. 77:4033]. 용어, "B형 바이러스 간염" (HBV)은 사람에서 B형 바이러스 간염을 유발하는 바이러스(혈청 간염 바이러스)를 기술하는데 사용된다. 이는 짧은 배양 기간을 지닌 A형 바이러스 간염(감염성 간염 바이러스)와 대조적으로 장기간의 배양 기간(약 50 내지 160일)을 지닌 바이러스 질병이다. B형 간염 바이러스는 일반적으로 오염된 바늘, 랜싯(lancet) 또는 기타 장비의 사용을 통해서만 또는 감염된 혈액 또는 혈액 유도체의 주사에 의해서 일반적으로 전달된다. 임상적으로 및 병리학적으로, 당해 질병은 A형 바이러스 간염과 유사하나; 교차-보호 면역성이 없다. 바이러스 항원(HBAg)은 감염후 혈청에서 발견된다.
B형 바이러스 간염은 매우 높은 비율로 사람을 감염시킨다. B형 간염으로 감염된 대부분의 사람은 6개월내에 바이러스를 퇴치할 수 있으며, 여기서, 단기간 감염은 B형 간염의 경우 "급성"으로 알려져 있다. 약 3억명 이상의 사람들이 HBV이 만성 보균자인 것으로 추정된다. 바이러스로 인한 감염은 약간의 인플루엔자-유사 증상을 포함하는 임상 증상에서 사먕에 이르는 범위를 초래한다. 하나의 양태에서, 본 발명의 다중-가변 투여 방법을 사용하여 HBV 감염을 치료한다.
5. 간독성
종양 괴사 인자는 간독성의 병리생리학과 연관되어 있다[참조: Bruccoleri et al. (1997) Hepatology 25:133; Luster et al. (2000) Ann NY Acad Sci. 919:214; Simeonova et al. (2001) Toxicol Appl Pharmacol 177:112]. 용어 간독성은 의약 및 기타 화학물질 또는 약물에 의해 유발된 간 손상을 말한다. 피험체에서 간 독성을 확인하기 위한 최상의 지시인자는 AST(아스파테이트 아미노트랜스퍼라제), ALT(알라닌 아미노트랜스퍼라제), 및 GOT(글루타메이트 옥살아세테이트 트랜스미나제)와 같은 혈액내 특정의 효소 측정의 증가이다.
간독성은 영구적인 손상 및 사망을 유발할 수 있다. 간독성의 초기 증상은 급성 위장 증상, 예를 들면, 심각한 설사를 포함할 수 있다. 간독성의 제2 상태는 증상의 증상감소로 특징화된다. 이러한 명맥한 감퇴 동안, 간 손상의 생화학적 현상이 발생한다. 감뇨증(뇨 배출 감소)이 일반적으로 제2 상태에 일어난다. 맹백한 간 손상의 제3 상태는 황달의 출현과 함께 화학물질의 섭취후 대략 3 내지 5일째에 임상적으로 명백해진다. 신부전 또한 발생할 수 있다. 화학적으로-유도된(약물-유도된) 간염의 증상은 감염성 간염의 것과 유사하다. 하나의 양태에서, 본 발명의 다중-가변 투여 방법은 간독성을 치료하는데 사용된다.
6. 간 부전증(예: 만성 간 부전증)
종양 괴사 인자는 간 부전증(예: 만성 간부전)의 병리생리학에 연관되어 있다[참조: Takenaka et al, (1998) Dig Dis ScI 43:887; Nagaki et al. (1999) J Hepatol 31:997; Streetz et al, (2000) Gastroenterology. 119:446]. 만성 간 부전증을 포함하는 간부전은 일반적으로 과도한 기간동안 진행되며 기관을 서서히 손상시키는 간에 대한 반복된 손상(예: 알코올 남용 또는 간염 바이러스 감염)에 의해 유발된다. 일반적이지는 않지만, 간부전은 급성이며, 몇일 또는 몇주에 걸쳐 발생한다. 급성 간부전의 원인은 간염 바이러스 감염, 약물, 임신, 자가면역 질병 및 간으로의 급작스러운 저 혈류를 포함한다. 하나의 양태에서, 본 발명의 다중-가변 투여 방법을 간부전을 치료하는데 사용된다.
7. NASH를 포함하는 비-알코올성 간염
종양 괴사 인자는 비알코올성 지방간염을 포함하는 비-알코올성 간염의 병리생리학에 연관되어 있다[참조: Crespo et al, (2001) Hepatology. 34:1158;Pessayre (2002) 282(2):G193]. 용어 "비알코올성 지방간염" 또는 "NASH"는 알코올 남용의 부재하에, 과도한 알코올 섭취에 의해 유도된 것과 비교하여 간에서 조직학적 변화의 진행을 말한다. NASH는 거대 소포 및/또는 미세소포 지방증, 소엽 및 문맥 염증 및 때때로 섬유증 및 경화증을 지닌 말로리 소체(Mallory body)로 특징화된다. NASH는 또한 고지질혈증, 비만 및 제II형 진성 당뇨병과 일반적으로 연관되어 있다.
간 지방증 및 염증을 특징으로 하는 추가의 임상 상태는 과도한 절식, 공회장 바이패스, 전체 부모 영양, 만성 C형 간염, 윌슨병(Wilson's disease), 및 코르티코스테로이드, 칼슘 채널 차단제, 고 투여량의 합성 에스트로겐, 메토트렉세이트 및 아미오다론으로부터의 것과 같은 약물 부작용을 포함한다. 즉, 용어 "비알코올성 지방간염"은 이러한 생검 발견을 나타내고, (a) 현저한 알코올 소비, (b) 체중 감소를 위한 선행 수술, (c) 지방간염과 연관된 약물 사용력, (d) 유전적 간 질병의 근거 또는 (e) 만성 C형 간염의 부재와 연결시킬 수 있다[참조: Ludwig et ah, (1980) Mayo Clin. Proc. 55:434; Powell et ah (1990) Hepatol. 11 :74]. 하나의 양태에서, 본 발명의 다중-가변 투여 방법은 NASH를 치료하는데 사용된다.
N. 피부 및 손발톱 질환
종양 괴사 인자는 피부 및 손발톱 질환의 병리생리학에 연관되어 있다. 하나의 양태에서, TNFα 항체의 유도 투여량에 이어 후속적인 치료 투여량을 투여함을 포함하는 본 발명의 다중-가변 투여 방법을 사용하여 피부 및 손발톱 질환을 치료할 수 있다. 본원에 상호교환적으로 사용된 것으로서 용어 "피부 질환" 또는 "피부병"은 염증 상태를 유발하는 피부의 상처이외의 비정상을 언급한다. 하나의 양태에서, 본 발명의 피부 질환은 염증 피부 질환이며, 여기서, 피부는 모세관 확장, 백혈구 침윤, 발적, 열 및/또는 통증으로 특징화된다. 피부 질환의 예는 건선, 보통천포창, 공피증, 아토피 피부염, 사르코이드증, 결절홍반, 화농성한선염, 편평태선, 스위트 증후군(Sweet's syndrome) 및 백반증을 포함하나, 이에 한정되지 않는다. 본원에 사용된 것으로서, 용어 "TNFα 활성이 유해한 피부 및 손발톱 질환은 피부 및/또는 손발톱 질환 및 질환으로 고생하는 피험체내 TNFα의 존재가 질환의 병리생리학에 관여하거나 질환, 예를 들면, 건선의 악화에 기여하는 인자인 것으로 밝혀지거나 추측된 기타 질환을 포함하는 것으로 의도된다. 따라서, TNFα 활성이 유해한 피부 및 손발톱 질환은, TNFα 활성의 억제가 질환의 증상 및/또는 진행을 완화시키는 것으로 예측되는 질환이다. 특정 피부 및 손발톱 질환의 치료시 본 발명의 항체, 항체 부위 및 기타 TNFα 억제제의 사용은 하기에 추가로 논의한다. 특정의 양태에서, 본 발명의 치료 방법은 하기 IV 단락에 기술한 바와 같은 다른 치료제와 함께 수행된다. 하나의 양태에서, 다른 치료제와 함께 TNFα 항체를 투여함을 포함하는 본 발명의 다중-가변 치료 방법은 건선의 치료 및 관절염과 연관된 건선의 치료에 사용된다.
1. 건선
종양 괴사 인자는 건선의 병리생리학에 연관되어 있다[참조: Takematsu et al (1989) Arch Dermatol Res. 281:398; Victor 및 Gottlieb (2002; J Drugs Dermatol. 1:264]. 본원에 사용된 것으로서, 용어 "건선"은 표피 증식과 연관된 피부 질환을 말한다. 건선의 예는 만성 판상 건선, 방울 건선, 역위 건선, 고름물집 건선, 심상성 건선 및 홍피 건선을 포함하나, 이에 한정되지 않는다. 건선은 또한 염증성 장 질환(IBD) 및 류마티스 관절염(RA)을 포함하는 기타 염증 질환과 관련될 수 있다.
건선은 피부상에 발적, 소양 및 두껍고, 건조한 실버리 스케일(silvery scale)로서 기술된다. 특히, 상피 증식에 있어서 1차 및 2차 변경, 피부의 염증 반응, 및 림프구 및 염증 인자와 같은 조절 분자의 발현을 포함한 병변이 형성된다. 건선 피부는 상피 세포의 증가된 전환, 비후된 내피, 비정상적인 각질화, 기저 세포 주기에 있어서의 증가를 초래하는 내피내로의 염증 세포 침윤물에 의해 형태학적으로 특징화된다. 건선은 흔히 손발톱을 포함하며, 이는 흔히 함요, 손발톱의 분리, 비후화 및 탈색을 포함한다. 건선은 종종 다른 염증 질환, 예를 들면, 류마티스 관절염, 염증성 장 질환(IBD), 및 크론병과 관련되어 있다. 건선 환자중 대략 1/3은 또한 위에서 기술한 바와 같이 경직, 관절의 팽윤, 통증 및 감소된 범위의 운동을 유발하는 건선 관절염(PsA)을 지닌다[참조: Greaves et al. (1995) N. Eng. J. Med. 332:581].
건선의 증거는 동맥, 팔꿉, 무릎, 두피, 피부 주름 또는 손톱에서 가장 일반적으로 관측되나, 이는 피부의 어떠한 또는 모든 부위에 영향을 미칠 수 있다. 일반적으로, 이는 하부 층으로부터 표면으로 이동하기 위한 신규 피부 세포을 위해 약 1개월이 걸린다. 건선에서, 당해 과정은 단지 수일이 걸리며, 죽은 피부 세포의 보강 및 비후 스케일(scale)의 형성을 초래한다. 건선의 증상은 건조 또는 적색이고, 은빛 스케일로 덮여있고, 피부의 패치를 일으키며, 피부 경계를 동반하며, 균열이 질 수 있고 통증이 있을 수 있으며, 일반적으로 팔꿈치, 무릎, 몸통, 두피 및 손에 위치하는 피부 팻치(patch); 고름물집, 피부의 균열 및 피부 발적을 포함하는 피부 병변; 관절염, 예를 들면, 건선 관절염과 관련될 수 있는 관절 통증 또는 쑤심을 포함한다.
건선에 대한 치료는 흔히 국소 코르티코스테로이드, 비타민 D 유사체 및 국소 또는 경구 레티노이드, 또는 이의 조합물을 포함한다. 하나의 양태에서, 본 발명의 TNFα는 이들 일반적인 치료중 하나와 함께 또는 이들의 존재하에 투여된다. 건선 치료용의 본 발명의 TNFα 억제제와 조합될 수 있는 추가의 치료제는 하기 IV 단락에서 더욱 상세히 기술한다.
건선의 진단을 일반적으로 피부의 외관에 기초한다. 또한, 피부 생검 또는 피부 패치의 찰과 및 배양이 기타 피부 질환을 관리하기 위해 요구될 수 있다. x-선을 사용하여 관절 통증이 존재하고 지속되는 경우 건선 관절염에 대해 체크할 수 있다.
피험체내 건선에 있어서의 개선은 피험체의 건선 부위 및 중증도 지표 점수(PASI)로 모니터할 수 있다. PASI를 측정하기 위한 방법은 문헌[참조: Fredriksson 및 Pettersson (1978) Dermatologica 157:238 및 Marks et al (1989) Arch Dermatol 125:235]에 기술되어 있다. 요약하면, 당해 지표는 두부, 상지, 몸통 및 하지를 포함하는 4개의 해부학적 부위의 5점 규모(0= 증상 없음; 1=약간; 2=중간; 3=현저; 4= 매우 현저)를 사용하여 홍반, 경화 및 표피탈락에 대한 평가를 기초로 한다. 제공된 해부학적 부위내 병변의 정도를 기초로 하여, 영향받은 부위를 수치로 지정한다(0=0; 1 = < 10%; 2 = 10-29%; 3 = 30-49%; 4 = 50-69%; 5 = 70=89%; 6 = 90-100%). PASI 점수를 이후에 계산하는데, 여기서, PASI 점수의 가능한 범위는 심각한 정도의 완전한 홍색피부증을 나타내는 최대 점수는 0.0 내지 72.0이다.
본 발명의 양태에서, TNFα 억제제는 관상 판상 건선, 방울 건선, 역위 건선, 고름물집 건선, 보통천포창, 홍피 건선, 염증성 장 질환(IBD)와 관련된 건선, 및 류마티스 관절염(RA)과 관련된 건선을 포함하는, 건선의 다중-가변 투여 치료에 사용된다. 다른 양태에서, D2E7과 같은 TNFα 억제제는 PsA와 함께 건선이 있는 피험체를 치료하기 위한 다중 가변 투여 요법에서 사용된다. 본 발명의 치료 방법에 포함된 특정 유형의 건선은 하기에 상세히 기술한다.
a. 만성 판상 건선
종양 괴사 인자는 만성 판상 건선의 병리생리학과 연관되어 있다[참조: Asadullah et al. (1999) Br J Dermatol.141:94). 만성 판상 건선(또한 심상성 건선으로 언급됨)은 건선의 가장 일반적인 형태이다. 만성 판상 건선은 동전 크기 내지 거대 범위의 피부의 상승된 발적 패치에 의해 특징화된다. 만성 판상 건선에서, 플라크는 단일 또는 다수일 수 있으며, 이들은 약간의 밀리미터 내지 수 센티미터의 크기로 변할 수 있다. 플라크는 일반적으로 비늘 표면을 지닌 적색이고, 부드럽게 긁을 경우 빛을 반사하여 "은" 효과를 낸다. 만성 판상 건선으로부터의 병변(이는 종종 대칭이다)은 신체상의 모두 곳에서 발생하지만 무릎, 팔꿉치, 요천골 영역, 두피 및 손발톱을 포함하는 강한 표면을 편애한다. 때때로 만성 판상 건선은 페니스, 외음 및 굽이에서 발생할 수 있으나, 스케일링은 일반적으로 존재하지 않는다. 만성 판상 건선 환자의 진단은 일반적으로 하기 기술된 임상 특징을 기초로 하다. 특히, 만성 판상 건선에서 병변의 분포, 색상 및 대표적인 은 스케일링은 만성 판상 건선의 특징이다.
b. 방울 건선
방울 건선은 비늘 플라크 모양의 특징적인 물방울을 지닌 건선의 형태를 말한다. 방울 건선의 발적은 일반적으로 감염, 대부분 현저하게는 스트렙토코커스 인후 감염을 수반한다. 방울 건선의 진단은 일반적으로 피부의 외관과, 종종 최근 인후통 병력이 있는지를 기준으로 한다.
c. 역위 건선
역위 건선은, 환자가 적색의 염증이 있는 피부의 부드럽고, 일반적으로 축축한 부위를 갖는 건선의 형태이며, 이는 판상 건선과 관련된 스케일링과는 다르다. 역위 건선은 또한 인터티기너스(intertiginous) 건선 또는 자리바꿈 건선(flexural psoriasis)로 언급된다. 역위 건선은 대부분 겨드랑이, 샅고랑 부위, 유방밑 및 생식기와 엉덩이 주변의 기타 피부 겹침부위에서 대부분 발생하며, 부위의 위치로 인하여, 문지름 및 발한이 영향받은 부위를 자극할 수 있다.
d. 고름물집 건선
또한 손발바닥 건선으로 언급되는 고름물집 건선은 크기 및 위치가 다양한 고름이-찬 물집을 유발하는 건선의 형태이나, 흔히 손 및 발에 발생한다. 물집은 신체의 많은 부위에 위치하거나 이들 부위에 분산될 수 있다. 고름물집 건선은 압통 및 통증 둘다를 유발할 수 있으며, 열을 유발시킬 수 있다.
e. 기타 건선 질환
본 발명의 TNFα 항체로 치료할 수 있는 건선 질환의 다른 예는 홍피 건선, 사마귀, IBD와 관련된 건선, 및 류마티스 관절염을 포함하는 관절염과 관련된 건선을 포함한다.
2. 보통천포창
보통천포창은 경구 점막 및 피부에 흔히 영향을 미치는 심각한 자가면역 시스템 피부병이다. 보통천포창의 발병기전은 피부 및 경구 점막 결합체에서 지시된 자가면역 과정인 것으로 고려된다. 연속적으로, 세포는 각각 서로 부착하지 않는다. 당해 질환은 다량의 유액이 충전된 파열되는 경향의 수포로 표시되며, 명백한 조직학적 외관을 지닌다. 소염제가 고 치사율을 갖는 당해 질병에 대한 유일한 치료요법이다. 보통천포창으로 고생하는 환자에서 발생하는 합병증은 검출가능한 통증, 영양 및 유체 상실을 지닌 간섭 및 감염이다.
3. 아토피피부염/습진
아토피피부염(또한 습진으로 언급)는 비늘성 및 소양성 플라크로 범주화된 만성 피부 질환이다. 습진이 있는 사람은 흔히 천식, 건초열 또는 습진과 같은 알레르기 상태의 가족력을 지닌다. 아토피피부염은 피부에서 발생하는 과감작 반응(알레르기와 유사)이며, 만성 염증을 유발한다. 염증은, 피부가 비후해지도록 하며 가죽과 같은 감촉이 되도록 할 수 있다. 환경 자극에 대한 노출은 물, 온도, 변화 및 스트레스에 대한 노출시 피부를 건조시키므로, 증상을 악화시킬 수 있다.
아토피피부염을 가진 피험체는 흔히 심한 소양, 진물 및 겉껍질, 피부 발적 또는 수포주변의 염증, 발진, 건조한, 가죽과 같은 피부 부위, 긁기로 인한 피부의 거친 부위 및 이루/출혈을 포함하는, 특정 증상으로 확인될 수 있다.
4. 사르코이드증
사르코이드증은, 육아종 염증이 림프절, 폐, 간, 눈, 피부 및/또는 기타 조직에서 발생하는 질병이다. 사르코이드증은 피하 사르코이드증(피부의 사르코이드증) 및 결절 사르코이드증(림프절의 사르코이드증)을 포함한다. 사르코이드증을 지닌 환자는 흔히 일반적인 불쾌, 근심 또는 아픈 느낌; 열; 피부 병변을 포함하는 증상으로 확인될 수 있다.
5. 결절 홍반
결절 홍반은 피부하, 통상적으로 앞하지상의 압통, 적색 결절을 특징으로 하는 염증 질환을 말한다. 결절 홍반과 관련된 병변은 흔히 평편하지만 견고한, 선홍색의 고통스러운 덩어리(대략 1인치 직경)으로 시작된다. 수일내에, 당해 병변은 엷은 자주빛으로 된 후, 수주 후에 갈색의 평편한 판이 된다.
일부 경우에, 결절 홍반은 스트렙토코커스, 코키디오이도마이코시스, 투베르쿨로시스, B형 간염, 시필리스, 고양이 긁힘병, 야생토끼병, 예르시니아(yersinia), 렙토스피로시스 프시타코시스(leptospirosis psittacosis), 히스토플라스모시스(histoplasmosis), 모노뉴클레오시스(mononucleosis)(EBV)를 포함하는 감염과 관련될 수 있다. 다른 경우에, 결절 홍반은 경구피임제, 페니실린, 설폰아미드, 설폰, 바르비투레이트, 하이단토인, 페나세틴, 살리사이클레이트, 요오다이드 및 프로게스틴을 포함하는 특정의 의약에 대한 민감성과 연관될 수 있다. 결절 홍반은 흔히 백혈병, 사르코이드증, 류미티스 열 및 궤양성 결장염과 관련된다.
결절 홍반의 증상은 일반적으로 정강이 상에 자체로 존재하나, 병변들은 또한 엉덩이, 종아리, 발목, 넙다리 및 상부 팔다리를 포함하는 신체의 다른 부위에서도 발생할 수 있다. 결절 홍반 환자에 있어서 다른 증상은 열 및 권태감을 포함할 수 있다.
6. 화농성한선염(Hidradenitis suppurative)
화농성한선염은, 팽윤되고 통증이 있는 염증성 병변 또는 덩어리가 샅고랑 부위 및 때때로 팔아래 및 유방 아래에 진행되는 피부 질환이다. 화농성한선염은, 아포크린 선 배출구가 발한에 의해 차단되거나 불완전한 선 발달로 인하여 정상적으로 배출될 수 없는 경우 발생한다. 선내에 포착된 분비물은 발한 및 세균을 주변 조직으로 밀어내어, 피하 경화, 염증 및 감염을 유발한다. 화농성한선염은 아포크린 샘을 함유하는 신체의 부위로 한정된다. 이들 부위는 겨드랑이, 유두의 젖꽃판, 샅고랑부위, 회음, 항문주위 및 배꼽주위 영역이다.
7. 편평태선
종양 괴사 인자는 편평태선의 병리생리학과 연관되어 있다[참조: Sklavounou et al. (2000) J Oral Pathol Med. 29:370]. 편평태선은 염증, 소양증 및 뚜렷한 피부 병변을 초래하는 피부 및 점막의 질환을 말한다. 편평태선은 C형 간염 또는 특정의 의약과 관련될 수 있다.
8. 스위트 증후군(Sweet's syndrome)
종양 괴사 인자를 포함하는 염증 사이토킨은 스위트 증후군의 병리생리학과 연관되어 있다[참조: Reuss-Borst et al. (1993) Br J Haematol. 84:356]. 1964년 알. 이. 스위트(R.D. Sweet)에 의해 기술된 스위트 증후군은 열, 백혈구증가증 및 경피 발진의 갑작스러운 발병으로 특징화된다. 발진은 현미경적으로 농밀한 호중구 침윤물을 나타내는 압통의, 홍반성인, 잘-한정된 구진 및 플라크로 이루어진다. 이들 병변은 어디에서도 나타날 수 있으나, 얼굴을 포함하는 신체 상부를 선호한다. 개개의 병변은 흔히 슈도소포(pseudovesicular) 또는 슈도농포(pseudopustular)로 기술되나, 흔히 농포성, 물집성 또는 궤양성일 수 있다. 경구 및 눈 병발(결막염, 겉공막염)이 또한 스위트 증후군을 지닌 환자에서 흔히 보고되어 있다. 백혈병 또한 스위트 증후군과 관련되어 있다.
9. 백반증
백반증은 정상의 피부 감촉을 지닌 불규칙적인 백색 패치를 생성하는 피부 부위로부터의 색소가 상실된 피부 상태이다. 백반증의 특징적인 병변은 편평 탈색 부위로 여겨진다. 병변의 가장자리는 정의되나 불규칙적이다. 백반증이 있는 피험체에서 가장 영향받은 부위는 얼굴, 팔꿈치 및 무릎, 손 및 발, 및 생식기를 포함한다.
10. 공피증
종양 괴사 인자는 공피증의 병리생리학에 연관되어 있다[참조: Tutuncu et al. (2002) Clin Exp Rheumatol. 20(6 Suppl 28):S146; Mackiewicz et al. (2003) Clin Exp Rheumatol. 21 :41; Murota et al. (2003) Arthritis Rheum. 48:1117]. 공피증은 피부, 혈관, 골격근 및 내부 기관에서의 변화로 특징화되는 광범위 결합 조직 질병을 말한다. 공피증은 또한 CREST 증후군 또는 진행성 전신 공피증으로 언급되며, 일반적으로 30 내지 50세의 사람들에게 영향을 미친다. 여성은 남성보다 더욱 흔히 영향을 받는다.
공피증의 원인은 알려져 있지 않다. 당해 질병은 국소 또는 전신계 증상을 생산할 수 있다. 당해 질병의 과정 및 중증도는 영향받는 것에 따라 광범위하게 변한다. 피부 및 기타 기관에서 과도한 콜라겐 침착은 당해 증상을 생성한다. 피부 및 영향받은 기관내 소 혈관에 대한 손상이 또한 일어난다. 피부에서, 궤양, 석회화, 및 색소침착에 있어서의 변화가 일어날 수 있다. 전신계적 특징은 섬유증 및 심장, 폐, 신장 및 위장관의 변성을 포함할 수 있다.
공피증으로 고생하는 환자는 열 및 냉기에 대한 반응시 손 및 발가락의 창백화, 푸름 또는 붉음, 손가락 및 관절의 통증, 경직 및 팽윤, 피부 비후화 및 빛나는 손 및 아래팔, 식도 역류 또는 가슴쓰림, 연하 어려움 및 짧은 호흡을 포함하는 특정의 임상적 특징을 나타낸다. 공피증을 진단하는데 사용된 기타 임상 증상은 상승된 적혈구 침강율(ESR), 상승된 류마티스 인자(RF), 양성 항핵 항체 시험, 단백질 및 현미경적 혈액을 보이는 뇨검사, 섬유증을 나타낼 수 있는 흉부 X-선, 및 제한된 폐 질병을 나타내는 폐 기능 연구를 포함한다.
11. 손발톱 질환
손발톱 질환은 손발톱의 비정상을 포함한다. 본원에 사용된 것으로서, 용어 "손발톱 질환" 또는 "손발톱 질병"은, 손톱 또는 발톱이 비정상적인 색, 형태, 촉감 또는 두께로 되는 상태를 말한다. 특정의 손발톱 질환은 함요, 스푼형 손톱, 보우선(Beau's line), 손가락 손톱, 손발톱박리증, 황색 손발톱, 익상편(편평 태선에서 관측됨) 및 백색 손발톱을 포함하나, 이에 한정되지 않는다. 함요는 손발톱 표면상의 작은 함몰의 존재로 특징화된다. 능선 또는 선형 융기는 "길이" 또는 "가로" 방향으로 손발톱을 따라 발생하여 진행할 수 있다. 보우선은 손톱에서 "가로"(횡 방향) 방향으로 발생하는 직선 함몰이다. 백색손발톱은 손발톱상의 백색 줄무늬 또는 점을 나타낸다. 스푼형손톱은 손톱의 비정상적인 유형이며, 여기서, 손발톱은 가장자리가 올라와서 오목하게 된다. 스푼형손톱은 흔히 철 결핍과 관련되어 있다.
본 발명의 TNFα 항체로 치료할 수 있는 손발톱 질환은 또한 건선 손발톱을 포함한다. 건선 손발톱은 건선에 기여할 수 있는 손발톱내 변화를 포함한다. 일부 경우에, 건선은 신체 다른 부위를 제외한 단지 손발톱에서만 발생할 수 있다. 손발톱에서 건선 변화는 약한 정도에서 중증으로 다양하며, 일반적으로 손발톱 판, 손발톱 매트릭스, 즉, 손발톱이 성장하는 조직, 손발톱 층, 늑, 손발톱아래 조직 및 손발톱 기저부 피부의 건선 연루 정도를 반영한다. 건선의 농포 유형에 의한 손발톱 층에 대한 손상은 손발톱 상실을 초래할 수 있다. 건선에서 손발톱 변화는 낱개로 또는 전부 발생할 수 있는 일반적인 범주에 속한다. 건선 손발톱의 하나의 범주에서, 손발톱 판은 건선에 의해 유발된 손발톱 성장에 있어서의 결손으로 인하여 깊게 함요된다. 다른 범주에서, 손발톱은 손발톱 층의 건선 연루로 인하여 황색 내지 황색-핑크색으로 탈색된다. 건선 손발톱의 제3 유형은 손발톱 판하에서 나타나는 백색 부위로 특징화된다. 백색 부위는 실제로 점을 표시하는 공기 거품이며, 여기서, 손발톱 판은 손발톱 층으로부터 박리되기 시작한다. 또한 손발톱 주변 피부는 적색이 될 수 있다. 제4 범주는 손발톱 매트릭스내 건선 연루로 인한 황색 피치내 손발톱 판의 부서짐, 즉 손발톱이상증에 의해 확인된다. 제5 범주는 손발톱 매트릭스 및 손발톱 층이 건선 연루로 인한 이의 실체내 손발톱의 결여로 특징화된다.
본 발명의 다중-가변 투여 방법을 또한 사용하여 편평태선과 관련된 손발톱 질환을 치료할 수 있다. 편평태선을 지닌 피험체에서 손발톱은 세로방향의 가장자리 또는 익상편과 함께 손발톱 판의 비후 및 표면 거칠음을 흔히 나타낸다.
본 발명의 다중-가변 투여 방법을 사용하여 본원에 기술된 것과 같은 손발톱 질환을 치료할 수 있다. 흔히 손발톱 질환은 피부 질환과 관련되어 있다. 하나의 양태에서, 본 발명은 TNFα 항체를 사용한 손발톱 질환의 다중-가변 투여 치료 방법을 포함한다. 다른 양태에서, 손발톱 질환은 건선과 같은 피부 질환을 포함하는 다른 질환과 관련되어 있다. 다른 양태에서, 손발톱 질환과 관련된 질환은 건선관절염을 포함하는 관절염이다.
12. 다른 피부 및 손발톱 질환
본 발명의 다중-가변 투여 방법을 사용하여 만성 광선 피부염, 수포성 유천포창 및 원형탈모증과 같은 기타 피부 및 손발톱 질환을 치료할 수 있다. 만성 광선 피부염(CAD)는 또한 감광성 피부염/만성 활성 광선 과민 증후군(PD/ AR)으로 언급된다. CAD는, 피부, 특히 태양광 또는 인공 광에 노출된 부위에서 염증이 생기는 상태이다. 일반적으로, CAD 환자는 이들의 피부와 접촉하는 특정 물질, 특히 각종 꽃, 나무, 향, 선크림 및 고무 화합물에 대해 알레르기를 지닌다. 수포성 유천포창은 몸통 및 팔다리에 거대한 수포가 형성되는 것을 특징으로 하는 피부 질환을 말한다. 원형탈모증은 두피 및 수염에서 완전한 대머리의 원형 패치가 특징인 모발 손실을 말한다.
O. 맥관염
TNFα는 각종 맥관염의 병리생리학에 연관되어 있다[참조: Deguchi et al. (1989) Lancet. 2:745]. 하나의 양태에서, 본 발명은 TNFα 활성이 유해한 혈관염으로 고생하는 피험체에서 TNFα 활성을 억제하는 다중-가변 투여 방법을 제공한다.
본원에 상호교환적으로 사용된 것으로서, 용어 "혈관염" 또는 "맥관염"은 혈관의 염증을 특징으로 하는 질환의 그룹을 말한다. 모든 크기의 혈관은 체내 가장 큰 혈관(대동맥)으로부터 피부에서 가장 작은 혈관(모세혈관)에 까지 영향을 미칠 수 있다. 영향받는 혈관의 크기는 혈관염의 특정 유형에 따라 변한다. 본원에 사용된 것으로서, 용어 "TNFα 활성이 유해한 혈관염"은, 당해 질환으로 고생하는 피험체내 TNFα의 존재가 질환의 병리생리학 또는 질환의 악화에 기여하는 인자에 관여하는 것으로 밝혀지거나 관여하는 것으로 예측된 혈관염을 포함하는 것으로 의도된다. 이러한 질환은 예를 들면, 질환으로 고생하는 피험체의 생물학저 유액중 TNFα의 농도의 증가(예: 피험체의 혈청, 혈장, 활액 등에서 TNFα 농도의 증가)에 의해 입증될 수 있으며, 이러한 증가는 예를 들면, 위에서 기술한 바와 같은 항-TNFα 항체를 사용하여 검출할 수 있다.
TNFα 활성이 유해한 맥관염은 베체트병을 포함하여 많은 예가 존재한다. 특정 맥관염의 본 발명에 따른 다중-가변 투여 치료를 위한 항체, 항체 부분 및 기타 TNFα 억제제의 사용은 하기에 추가로 논의된다. 특정 양태에서, 본 발명의 항체, 항체 부위 또는 기타 TNFα 억제제는 하기 기술한 바와 같이 다른 치료제와 함께 피험체에 투여된다.
본 발명의 다중-가변 투여 요법을 사용하여 TNFα 활성이 유해한 혈관염을 치료할 수 있으며, 여기서, TNFα 활성의 억제는 혈관염의 증상 및/또는 진행을 완화시키거나 또는 혈관염을 예방하는 것으로 예측된다. 혈관염으로 고생하거나 이로 진행될 위험이 있는 피험체는 임상 증상 및 시험을 통해 확인할 수 있다. 예를 들어, 혈관염을 지닌 피험체는 흔히 호중구의 세포질내 특정 단백질에 대한 항체, 항호중구 세포질 항체(ANCA)를 생성한다. 즉, 일부 경우에, 혈관염은 ANCA 존재를 측정하는 시험(예: ELISA)에 의해 확인할 수 있다.
혈관염 및 이의 결과는 질병의 단독 표시일 수 있거나, 또는 이는 다른 1차 질병의 2차 성분일 수 있다. 혈관염은 단일 기관으로 한정될 수 있거나 또는 몇몇 기관에 동시에 영향을 미칠 수 있고, 증상에 따라, 모든 크기의 동맥 및 혈관이 영향을 받을 수 있다. 혈관염은 체내 어떠한 기관에도 영향을 미칠 수 있다.
혈관염에서, 혈관 내강은 일반적으로 손상되며, 이는 포함된 혈관에 의해 공급되는 조직의 허혈과 연관되어 있다. 이러한 과정으로부터 초래될 수 있는 광범위한 질환은, 혈관(예: 동맥, 정맥, 세동맥, 세정맥, 모세혈관)의 모든 유형, 크기 및 위치가 포함될 수 있다는 사실에 기인한다. 혈관염은 일반적으로 하기 기술하는 바와 같이, 영향받은 혈관의 크기에 따라 일반적으로 분류된다. 일부 작고 큰 혈관 맥관염이 중간-크기의 동맥을 포함할 수 있으나, 큰 및 중간-크기의 혈관 맥관염은 동맥보다 작은 혈관을 포함하지 않는다는 사실을 주목하여야 한다. 큰 혈관병은 또한 관자동맥염 또는 두개동맥염으로 또한 공지된 거세포 동맥염, 류마티스성 다발 근육통증 및 다카야수병 또는 대동맥활증후군, 젊은 여성 동맥염 및 무맥병으로 또한 공지된 동맥염을 포함하나, 이에 한정되지 않는다. 중간 혈관 질병은 전통적인 결절다발동맥염 및 점막피부 림프절 증후군으로서 또한 공지된 바와사키병을 포함하나, 이에 한정되지 않는다. 소 혈관병의 비-제한적 예는 베체트 증후군, 베그너 육아종증, 현미경적 여러혈관염, 피하 혈관염으로 또한 공지된 고감작성 혈관염, 작은 혈관 혈관염, 헤노호쉔라인 자색반, 알레르기 육아종증 및 또한 초그 스트라우스 증구군으로 공지된 혈관염이다. 기타 혈관염은 또한 폐쇄혈전혈관염으로 공지된 폐쇄성 혈전혈관염을 포함하나, 이에 한정되지 않는다. 전통적인 결절다발동맥염(PAN), 현미경적 PAN, 및 알레르기성 육아종증이 또한 흔히 함께 그룹화되며 전신계 괴사 혈관염으로 불린다. 혈관염의 추가 기술은 하기 기술한다:
1. 거대 혈관 혈관염
하나의 양태에서, 본 발명의 TNFα 항체는 거대 혈관 혈관염을 지닌 피험체를 치료하는데 사용된다. 본원에 사용된 것으로서, 용어 "거대 혈관(들)"은 대동맥 및 주요 신체 영역으로 뻗은 최대 분지를 말한다. 거대 혈관은 예를 들면, 대동맥을 포함하며, 이의 분지 및 상응하는 혈관, 예를 들어, 빗장밑동맥; 팔머리 동맥; 일반적인 목동맥; 무명 동맥; 내부 및 외부 목정맥; 폐 동맥 및 정맥; 대정맥; 신장 동맥 및 정맥; 넙다리 동맥 및 정맥; 및 목동맥을 포함한다. 거대 혈관 맥관염의 예는 하기에 기술한다.
a. 거세포 동맥염(GCA)
종양 괴사 인자는 거세포 동맥염의 병리생리학에 연관되어 있다[참조: Sneller (2002) Cleve. Clin. J. Med. 69:SII40; Schett et al. (2002) Ann. Rheum. Dis. 61 :463]. 거세포 동맥염(GCA)은 염증 및 혈관, 특히 목의 바깥 목동맥으로부터 분지된 거대 또는 중간 동맥에 대한 손상을 말한다. GCA는 또한 관자동맥염 또는 두개동맥염으로 언급되며 노인에 있어 가장 일반적인 일차적 혈관염이다. 이는 50세 이상의 개인에게 주로 가장 영향을 미치지만, 40세 및 그보다 젊은 환자의 경우도 잘 조사되어 있다. GCA는 바깥 목동맥에 일반적으로 영향을 미친다. GCA는 또한 관자 동맥을 포함하는 목 동맥의 분지에 영향을 미칠 수 있다. GCA는 또한 다수 위치에서 동맥을 포함할 수 있는 전신 질병이다.
조직학적으로, GCA는 흔히 랑게르한스 거대 세포 형성과 함께 혈관 벽내에 염증성 단핵 세포 침윤물을 지닌 전층동맥염이다. 내막의 증식, 육아종 염증 및 내부 엘라스틴 라미나의 단편화가 있다. 기관내 병리학적 발견은 포함된 혈관에 대한 허혈의 결과이다.
GCA로 고생하는 환자는 열, 두통, 빈혈, 고 적혈구 침강율(ESR)을 포함하는 특정의 임상 증상을 나타낸다. GCA의 다른 대표적인 지표는 턱 및 혀 절파행, 두피 압통, 체질 증상, 담색 시신경유두부종[특히, '찰키 화이트(chalky white)' 유두 부종] 및 시각 교란을 포함한다. 진단은 측두 동맥 생검으로 확인한다.
b. 류마티스성 다발성 근육통
종양 괴사 인자는 류마티스성 다발성 근육통의 병리생리학에 연관되어 있다[참조: Straub et al. (2002) Rheumatology (Oxford) 41 :423; Uddhammar et al. (1998) Br. J. Rheumatol.37:7 766]. 류마티스성 다발성 근육통은 대부분 아침에 인식가능한 심각한 근육 통증 및 목, 어깨 및 히프에서 경직에 대한 완화와 연관된, 류마티스 질환을 말한다. IL-6 및 IL-1β 발현은 또한 류마티스성 다발성근육통을 지닌 환자에서 순환하는 단핵세포의 대부분에서 검출된다. 류마티스성 다발성근육통은 별개로 발생할 수 있거나, 또는 혈관의 염증인 GCA와 동시에 또는 이에 앞서 존재할 수 있다.
c. 다카야스 관절염(Takayasu's Arteritis)
종양 괴사 인자는 다카야스 관절염의 병리생리학에 연관되어 있다[참조: Kobayashi 및 Numano (2002) Intern. Med. 41 :44; Fraga 및 Medina (2002) Curr. Rheumatol. Rep .4:30]. 다카야스 관절염은 대동맥 및 이의 주요 가지의 염증으로 특징화되는 혈관염을 말한다. 다카야스 관절염(또한 대동맥활 증후군, 젊은 여성 혈관염 및 무맥병으로 공지됨)은 흉부 및 복부 대동맥 및 이의 주요 가지 또는 폐 동맥에 영향을 미친다. 대동맥 벽 및 이의 가지(예: 목 동맥, 무명 동맥 및 빗장밑동맥)의 섬유성 비후는 대동맥 활로부터 발생하는 혈관의 관 크기의 감소를 초래한다. 당해 상태는 또한 통상적으로 신장 동맥에 영향을 미친다.
다카야스 관절염은 주로 일반적으로 20 내지 40세의 젊은 여성, 특히 아시아 내림에 영향을 미치며, 권태감, 관절통 및 극심한 절뚝거림의 점진적인 개시에 의해 표시될 수 있다. 대부분의 환자는 비대칭적으로 감소환 맥박과 함께 일반적으로 팔내 혈압 차를 지닌다. 관상 및/또는 신장 동맥 협착이 발생할 수 있다.
다카야스 관절염의 임상 특징은 조기 염증 질병의 특징 및 말기 질병의 특징으로 분리될 수 있다. 다카야스 질병의 조기 염증 상태의 임상 특징은 권태감, 낮은 수준의 열, 체중 감소, 근육통 및 다형 홍반이다. 다카야스 질병의 말기 단계는 동맥의 섬유성 협착 및 혈전증으로 특징화된다. 주요 초래되는 임상 특징은 허혈성 현상, 예를 들면, 약하고 비대칭적인 동맥 맥박, 팔사이의 혈압 불일치, 시각 교란, 예를 들면, 스코토마타(scotomata) 및 반부전마비, 현기증 및 실신을 포함하는 기타 신경학적 특징, 반부전마비 및 뇌졸증이다. 임상적 특징은 동맥 협착 및혈전증으로 인한 허혈로부터 생성된다.
2. 중간 혈관 질병
하나의 양태에서, 본 발명의 TNFα 항체는 중간 혈관 혈관염을 지닌 피험체를 치료하는데 사용된다. 용어 "중간 혈관(들)"은 주요 내장 동맥인 혈액 혈관을 언급하는데 사용된다. 중간 혈관의 예는 창자간 동맥 및 정맥, 엉덩동맥 및 정맥, 및 위턱 동맥 및 정맥을 포함한다. 중간 혈관 맥관염의 예는 하기 기술한다.
a. 결절다발동맥염
종양 괴사 인자는 결절다발동맥염의 병리생리학에 연관되어 있다[참조: DiGirolamo et al. (1997) J. Leukoc. Biol. 61:667]. 결절다발동맥염 또는 결절동맥주위염은, 작은 및 중간 크기 동맥이 변이 면역 세포에 의해 공격받기 때문에 팽윤되어 손상을 입는 심각한 혈액 혈관 질병인 혈관염을 말한다. 결절다발동맥염은 일반적으로 어린이보다 더욱 특히 성인에 영향을 미친다. 이는 적절한 혈액 공급없이 충분한 산소와 영양물을 제공받지 못하므로 영향받는 동맥에 의해 공급된 조직을 손상시킨다.
결절다발동맥염 환자에서 나타난 증상은 일반적으로 영향받은 기관, 흔히 피부, 심장, 신장 및 신경계에 대한 손상으로부터 초래된다. 결절다발동맥염의 일반 증상은 열, 피로, 쇠약, 식욕 상실 및 체중 감소를 포함한다. 근육 통증(근육통) 및 관절 통증(관절통)이 일반적이다. 결절다발동맥염 환자의 피부는 또한 발진, 팽윤, 궤양 및 종괴(결절성 병소)를 나타낼 수 있다.
전통적인 PAN(결절다발동맥염)은, 신장 및 내장 동맥의 병별이 일반적인 중간 근육 동맥염에 대한 전신계 동맥염이다. 복부 혈관은 PAN 환자중 50%에서 동맥류 및 폐색을 지닌다. 전통적인 PAN은, 비록 기관지 혈관이 포함될 수 있다고 해도 폐 동맥을 포함하지 않는다. 육아종, 현저한 호산구증가증 및 알레르기 체질은 증상의 일부가 아니다. 어떠한 기관도 포함될 수 있다 해도, 대부분의 일반적인 표시는 말초 말초 신경병증, 다발홑신경염, 장 허혈, 신장 허혈, 고환 통증 및 그물울혈반을 포함한다.
b. 가와사키병(Kawasaki's Disease)
종양 괴사 인자는 가와사키병의 병리생리학과 연관되어 있다[참조: Sundel (2002) Curr. Rheumatol. Rep. 4:474; Gedalia (2002) Curr. Rheumatol. Rep. 4:25]. 비록 가와사키병의 원인이 알려져 있지 않다고 해도, 이는 관상 동맥의 급성 염증과 관련되어 있으며, 이러한 질병과 관련된 조직 손상이 TNFα와 같은 전염증제에 의해 매개될 수 있음을 제안한다. 가와사키병은 점막, 림프절, 혈액 혈관의 내층 및 심장에 영향을 미치는 혈관염을 말한다. 가와사키병은 또한 점막피부 림프절 증후군, 점막피부 림프절 질병 및 영아 다발동맥염으로 언급된다. 가와사키병으로 고생하는 피험체는 심근염 및 심장막염을 초래할 수 있는 관상 동맥을 흔히 포함하는 혈관염으로 진행된다. 흔히, 급성 염증이 감소되면서, 관상 동맥은 동맥류, 혈전증으로 진행될 수 있고, 심근 경색을 초래한다.
가와사키병은 경부림프절, 뒤꿈치 갈라짐 및 "딸기혀"의 확장과 함께 손바닥내 및 발의 발바닥내 부종과 연관되어 있다. 비록 염증 반응이 신체 전체 혈관에서 발견된다고 해도, 말기-기관 손상의 가장 일반적인 부위는 관상 동맥이다. 가와사키병은 주로 5세 이하의 어린이에게 영향을 미친다. 최대 발병은 일본에서 이지만 서방에서 증가하는 것으로 인지되어 있으며 현재 미국 어린이중 후천성 심장병의 주요 원인이다. 가와사키병의 가장 심각한 합병증은 관상 동맥 및 제3의 치료받지 않은 환자에서 발생하는 동맥류 형성이다.
3. 작은 혈관병
하나의 양태에서, 본 발명의 TNFα 항체는 작은 혈관 혈관염을 지닌 피험체를 치료하는데 사용된다. 용어 "작은 혈관(들)"은 세동맥, 세정맥 및 모세관을 언급하는데 사용된다. 세동맥은 평활근 세포의 단지 1개 또는 2개 층을 함유하는 동맥이며 모세관 네트웍에 대해 말단 및 연속하여 존재한다. 세정맥은 혈액을 모세관 네트워그로부터 정맥 및 모세관 연결 세동맥 및 세정맥으로 이동한다. 작은 혈관 혈관염의 예는 하기에 기술한다.
a. 베체트병(Behcet's Disease)
종양 괴사 인자는 베체트 병의 병리생리학과 연관되어 있다[참조: Sfikakis (2002) Ann. Rheum. Dis. 61 :ii51-3; Dogan 및 Farah (2002) Oftalmologia. 52:23]. 베체트병은 신체 전체의 혈관의 염증을 포함하는 만성 질환이다. 베체트병은 또한 각종의 피부 병변, 관절염, 장 염증 및 수막염(뇌 및 척수의 막의 염증)을 유발할 수 있다. 베체트병의 결과로서, 당해 질환을 가진 피험체는 위장관, 중추 신경계, 혈관계, 폐 및 신장을 포함하는 신체 전체의 조직 및 기관에 염증을 지닐 수 있다. 베체트병은 여성보다 남성에게 3배 더 일반적이며 동부 지중해 및 일본에서 더욱 일반적이다.
베체트병을 지닌 피험체는 재발성 경구 궤양(재발 아프타 구내염), 재발 생식기 궤양 및 눈 염증을 포함하는 임상 증상일 나타낼 수 있다. 베체트병 환자에서 TNFα, IL-8, IL-1, IL-6, INF-γ 및 IL-12의 혈청 수준은 상승하며, 이들 인자들의 생산은 베체트병 환자의 단핵구에서 상승하는 것으로 밝혀졌다[참조: Inflammatory Disease of Blood Vessels (2001) Marcel Dekker, Inc., eds. G.S. Hoffman 및 CM. Weyand, p. 473].
b. 베게너 육아종증
종양 괴사 인자는 베게너 육아종증의 병리생리학에 연관되어 있다[참조: Marquez et al. (2003) Curr. Rheumatol. Rep. 5:128; Harman 및 Margo (1998) Surv. Ophthalmol. 42:458]. 베게너 육아종증은 상부호흡관(코, 굴, 귀), 폐 및 신장에서 혈관의 염증을 유발하는 혈관염을 말한다. 베게너 육아종증은 또한 중간선 육아종증으로 언급된다. 베게너 육아종증은 호흡관을 포함하고, 작은 내지 중간 크기의 혈관에 영향을 미치는 혈관염을 괴사시키는 육아종증 염증을 포함한다. 베게너 육아종증을 지닌 피험체는 또한 관절염(관절 염증)을 지닌다. 육아종증은 또한 영향받은 피험체에 존재할 수 있으나, 실질적으로 어떠한 기관도 포함될 수 있다.
베게너 육아종증으로 영향받은 환자는 통상적으로 재발성 굴염 또는 코피, 점막 궤양, 중이염, 기침, 객혈 및 호흡곤란을 포함하는 임상 증상을 나타낸다. 베그너 육아종증의 제1 증상은 흔히 상부 호흡기관 증상, 관절 통증, 쇠약 및 피로를 포함한다.
c. 초그-스트라우스 증후군(Churg-Strauss syndrome)
종양 괴사 인자는 초그-스트라우스 증후군의 병리생리학과 연관되어 있다[참조: Gross (2002) Curr. Opin. Rheumatol. 14:11; Churg (2001) Mod. Pathol. 14:1284]. 초그-스트라우스 증후군은 전신계이며 천식 및 호산구증가증의 조기 표시을 나타내는 혈관염을 말한다. 초그-스트라우스 증후군은 또한 알레르기 육아종증 및 혈관염(angiitis)으로 언급되며, 알레르기 비염, 천식 및 호중구증가증의 고착시 발생한다. 굴염 및 폐 침윤이 또한 초그-스트라우스 증후군에서 발생되며, 주로 폐 및 심장에 영향을 미친다. 말초 신경병, 관상 동맥염 및 위장 연루가 일반적이다.
초그-스트라우스 증후군으로 고생하는 환자는 미국 대학의 류마티스학과(ACR)에 의해 설립된 범주에 따라 진단될 수 있다. 이들 범주는 CSS를 다른 형태의 혈관염으로부터 구별하기위해 의도되었다. 모든 환자가 매 범주에 부합되지는 않는다. 실제로 일부는 단지 2 또는 3개 범주만을 지닐 수 있으나, 이들은 여전히 초그-스트라우스 증후군으로 분류된다. ACR은 다른 혈관염으로부터 초그-스트라우스 증후군을 가장 잘 구별하는 것들로서 6개의 질병 특징(범주)를 선택한다. 이들 범주는 1) 천식; 2) 호중구증가증[차등 WBC 수에 있어서 > 10%]; 3) 단발신경병증; 4) 흉부 X-선에서 일시적인 폐 침윤물; 5) 부비동 이상; 및 6) 혈관외 호중구를 지닌 혈관을 함유하는 생검.
P. 기타 TNFα-관련 질환
하나의 양태에서, 본 발명은, TNFα 활성이 유해한 TNFα-관련 질환을 치료하기 위한 다중-가변 투여 방법을 특징으로 하며, 이는 피험체에게 유도 투여량의 TNFα 억제제 및 후속적인 투여량의 TNFα 억제제를 투여함으로써 TNFα-관련 질환이 치료되도록 함을 포함한다. TNFα 활성이 유해한 TNFα-관련 질환의 예는 하기에 추가로 논의한다.
1. 소아 관절염
종양 괴사 인자는 소아 류마티스관절염을 포함하는 소아 관절염의 병리생리학에 연관되어 있다[참조: Grom et al. (1996) Arthritis Rheum. 39:1703; Mangge et al. (1995) Arthritis Rheum. 8:211]. 하나의 양태에서, 본 발명은 TNFα 항체는 소아 류마티스 관절염을 치료하는데 사용된다.
본원에 사용된 것으로서, 용어 "소아 류마티스 관절염" 또는 "JRA"는 관절 또는 결합 조직 손상을 유발할 수 있는 16세 이하에서 발생하는 만성의 염증 질병을 말한다. JRA는 또한 소아 만성 다발관절염 및 스틸씨병(Still's disease)으로 언급된다.
JRA는 16세 이하의 어린이에서 6주 이상 동안 관절 염증 및 경직을 유발한다. 염증은 관절내 발적, 팽윤, 온점 및 동통을 유발한다. 어떠한 관절도 영향받을 수 있으며, 염증은 영향받은 관절의 운동성을 제한할 수 있다. JRA의 하나의 유형은 또한 내부 기관에 영향을 줄 수 있다.
JRA는 흔히 관여된 관절의 수, 증상 및 혈액 검사에 의해 밝혀진 특정 항체의 존재 또는 부재에 의해 3개 유형으로 분류된다. 이러한 분류는 의사들이 내부 기관 또는 피부가 영향을 받는지 및 질병이 진행될 방식을 결정하는데 도움을 준다. JRA의 분류는 다음을 포함한다:
a. 소수관절성 JRA, 여기서, 환자는 영향받은 4개 이하의 관절을 지닌다. 소수관절은 JRA의 가장 일반적인 형태이며 통상적으로 무릎과 같은 큰 관절에 영향을 미친다.
b. 여러관절 HRA, 여기서, 5개 이상의 관절이 영향받는다. 손 및 발에서와 같은 작은 관절이 가장 통상적으로 포함되나, 질병은 또한 큰 관절에 영향을 미칠 수 있다.
c. 전신계 JRA는 관절 팽윤, 열, 약간의 피부 발진으로 특징화되며 또한 심장, 간, 비장 및 림프절과 같은 내부 기관에 영향을 미칠 수 있다. 전신계 JRA는 또한 스틸씨병으로 언급된다. 이들 어린이중 약간의 퍼센트는 많은 관절에서 관절염으로 진행되며 성인까지 지속되는 심각한 관절염을 지닐 수 있다.
2. 자궁내막증
종양 괴사 인자는 자구내막증의 병리생리학에 연관되어 있는데, 이는 자궁내막증을 지닌 여성에서 TNF의 복막내 수준이 상승하기 때문이다[참조: Eisermann et al. (1988) Fertil Steril 50:573; Halme (1989) Am J Obstet Gynecol 161:1718; Mori et al. (1991) Am J Reprod Immunol 26:62; .Taketani et al. (1992) Am J Obstet Gynecol 167:265; Overton et al. (1996) Hum Reprod 1996; 11 :380]. 하나의 양태에서, 본 발명의 TNFα 항체는 자궁내막증을 치료하는데 사용된다. 본원에 사용된 것으로서, 용어 "자궁내막증"은 일반적으로 자궁(내막)에 정렬된 조직이 신체의 다른 부위에서 성장하여, 통증, 불규칙적인 출혈 및 빈번한 유산을 유발하는 상태를 말한다.
3. 전립선염
종양 괴사 인자는 전립선염의 병리생리학에 연관되어 있는데, 이는 만성 전립선염 및 골반 통증을 지닌 남성이 대조군과 비교하여 정액내 TNF 및 IL-1의 수준이 현저히 높기 때문이다[참조: Alexander et al. (1998) Urology 52:744; Nadler et al. (2000) J Urol 164:214; Orhan et al. (2001) Int J Urol 8:495]. 또한, 전립샘의 랫트 모델에서 TNF 수준은 또한 대조군과 비교하여 증가하였다[참조: Asakawa et al. (2001) Hinyokika Kiyo 47:459; Harris et al. (2000) Prostate 44:25]. 하나의 양태에서, 본 발명의 TNFα 항체는 전립선염을 치료하는데 사용된다.
본원에 사용된 것으로서, 용어 "전립선염"은 전립선의 염증을 언급한다. 전립선염은 또한 골반 통증 증후군으로 언급된다. 전립샘 자체는 비세균성 전립선염, 급성 전립선염, 세균성 전립선염 및 만성 전립선염을 포함하는 다양한 형태로 표시된다. 급성 전립선염은 갑자기 진행되는 전립선의 염증을 말한다. 급성 전립선염은 일반적으로 전립선의 세균 감염으로 유발된다. 만성 전립선염은 점진적으로 장기간 지속되어 진행되는 전립선의 염증이며 통상적으로 미묘한 증상을 갖는다. 만성 전립선염은 또한 일반적으로 세균 감염에 의해 유발된다.
4. 맥락막 혈관신생
종양 괴사 인자는 맥락막 혈관신생의 병리생리학에 연관되어 있다. 예를 들어, 외과적으로 절개한 맥락막 신생혈관막에서, 신생혈관은 TNF 및 IL-1 둘다에 대해 양성으로 염색된다[참조:Oh H' et al. (1999) Invest Ophthalmol Vis Sci 40:1891]. 하나의 양태에서, 본 발명의 TNFα 항체는 맥락막 혈관신생을 치료하는데 사용된다. 본원에 사용된 용어 "맥락막 혈관신생은 바닥복합층내 파열을 통해 맥락막으로부터 망막 색소 상피(sub-RPE) 또는 망막 공간으로 새로운 혈관이 성장하는 것을 말한다. 맥락막 혈관신생(CNV)는 이러한 상태의 환자에서 시각 상실의 주요 원인이다.
5. 좌골신경통
종양 괴사 인자는 좌골신경통의 병리생리학에 연관되어 있다[참조: Ozaktay et al. (2002) Eur Spine J. 11 :467; Brisby et α/.(2002) Eur Spine J. 11 :62]. 하나의 양태에서, 본 발명은 TNFα 항체는 좌골신경통을 치료하는데 사용된다. 본원에 사용된 것으로서, 용어 "좌골신경통"은 좌골 신경에 대한 손상으로 유발된 다리의 운동 및/또는 감각의 손상을 포함하는 상태를 말한다. 좌골신경통은 또한 좌골신경 및 좌골신경 기능장애의 신경병으로 일반적으로 언급된다. 좌골신경통은 말초 신경병의 형태이다. 이는 다리의 뒷쪽에 위치하는 좌골 신경에 손상이 있는 경우 발생한다. 좌골 신경은 무릎 및 다리 아래쪽의 뒷부분 근육을 조절하며 접다리의 뒷부분, 다리 아래쪽 부분 및 발의 발바닥에 감각을 제공한다. 좌골신경통은 또한 허리헤르니아 디스크, 척주관협착증, 변성 디스크 질병, 협부 척추전방전위증 및 만상증후군((piniformis syndrome)을 포함하는 다른 질환의 지표일 수 있다.
6. 쇼그렌 증후군(Sjogren's syndrome)
종양 괴사 인자는 쇼그렌 증후군의 병리생리학에 연관되어 있다[참조: Koski et al. (2001) CHn Exp Rheumatol. 19:131]. 하나의 양태에서, 본 발명의 TNFα 항체는 쇼그렌 증후군을 치료하는데 사용된다. 본원에 사용된 것으로서, 용어 "쇼그렌 증후군은 마른 입, 눈물 감소 및 기타 건조 점막이 특징인 전신계적 염증 질병이며, 흔히 류마티스 관절염과 같은 자가면역 류마티스 질환과 관련된다. 안구 및 입의 건조는 당해 증후군의 가장 일반적인 증상이다. 당해 증후군은 단독으로 일어나거나, 류마티스 관절염 또는 기타 결합 조직 질병과 연합한 증후군으로 발생할 수 있다. 타액선의 확장과 관련될 수도 있다. 기타 기관이 영향받을 수도 있다. 당해 증후군은 류마티스 관절염, 전신홍반루푸스, 공피증 및 기타 질병과 연관될 수 있다.
7. 포도막염
종양 괴사 인자는 포도막염의 병리생리학에 연관되어 있다[참조: Wakefield 및 Lloyd (1992) Cytokine 4:1; Woon et al (1998) Curr Eye Res. 17:955]. 하나의 양태에서, 본 발명의 TNFα 항체는 포도막염을 치료하는데 사용된다. 본원에 사용된 것으로서 "포도막염"은 공막 및 망막사이의 층인 포도막의 염증을 말하며, 이는 홍채, 섬모체, 및 맥락막을 포함한다. 포도막염은 또한 일반적으로 홍채, 주변포도막염, 맥락막염, 맥락망막염, 급성앞포도막염 및 뒷쪽 포도막염으로 언급된다. 포도막염의 가장 일반적인 형태는 앞쪽 포도막염이며, 이는 안구의 앞쪽 부분에서의 염증을 포함하고, 일반적으로 홍채에 대해 분리된다. 당해 상태는 흔히 홍채염으로 명명된다. 하나의 양태에서, 용어, 포도막염은 자가면역 질환과 관련된 염증을 제외한, 예를 들면 자가면역 포도막염을 제외한, 포도막의 염증을 말한다.
8. 습윤 황반변성
종양 괴사 인자는 습윤 황반변성의 병리생리학과 연관되어 있다. 하나의 양태에서, 본 발명은 TNFα 항체는 습윤 황반변성을 치료하는데 사용된다. 본원에 사용된 것으로서, 용어 "습윤 황반변성"은 황반(눈의 망막의 중심 부분)에 영향을 미치고 시력 감소 및 중심 시야의 가능한 상실을 유발한다. 습윤 황반병성을 지닌 환자는 망막아래에 새로운 혈관을 생성하며, 이는 출혈, 팽윤 및 흉터 조직을 유발한다.
9. 골다공증
종양 괴사 인자는 골다공증의 병리생리학에 연관되어 있다[참조: Tsutsumimoto et al. (1999) J Bone Miner Res. 14:1751]. 골다공증은 골 밀도의 점진적인 상실 및 골 조직의 비후로 특징되는 질환을 말한다. 골다공증은, 신체가 새로운 뼈를 충분히 형성하지 못하거나, 또는 보다 많은 오래된 뼈가 신체에 의해 재흡수되는 못하는 경우 둘다에서 발생한다. 본 발명의 TNFα 항체 또는 이의 항원-결합 단편은 골다공증을 치료하는데 사용된다.
10. 골관절염
종양 괴사 인자는 골관절염의 병리생리학에 연관되어 있다[참조: Venn (1993) Arthritis Rheum. 36:819; Westacott et al. (1994) J Rheumatol. 21:1710]. 골관절염(OA)은 또한 비대 골관절염, 골관절염 및 퇴행성 관절 질병으로 언급된다. OA는 "궤양" 또는 가장자리에서 골의 함몰, 골극 형성, 비대의 진행과 간련된 관절 연골의 퇴행 및 비후, 및 영향받은 관절의 확장 및 윤활막내 변화를 포함하는 다수의 표시로 특징화된다. 또한, 골관절염은 특히 장기간의 활성후 통증 및 경직을 동반한다. 본 발명의 항체 또는 이의 항원-결합 단편은 골관절염을 치료하는데 사용할 수 있다. 골관절염의 특징적인 방사선 특징은 관절 공간 협소화, 연골밑 경화, 골증식증, 연골밑 난 형성, 느슨한 골체[또는 "관절 마우스(joint mouse)"]를 포함한다.
골관절염을 치료하는데 사용된 의약은 광범위한 비스테로이드성, 소염 약물(NSAID)을 포함한다. 또한, COX2 억제제, 예를 들면, 켈레브렉스, 비옥스 및 벡스트라 및 에토리콕시브가 또한 OA를 치료하는데 사용된다. 관절내로 직접 주사되는 스테로이드를 또한 사용하여 염증 및 통증을 완화시킬 수 있다. 본 발명의 하나의 양태에서, 본 발명의 TNFα 항체는 NSAID, COX2 억제제, 및/또는 스테로이드와 함께 투여된다.
11. 기타
본 발명의 방법은 또한 TNFα 활성이 유해한 각종의 다른 질환을 치료하는데 사용할 수 있다. TNFα 활성이 병리생리학에 연관됨으로써 본 발명의 항체, 또는 항체 부위를 사용하여 치료할 수 있는 다른 질병의 예는 염증성 골 질환, 골 재흡수 질병, 응고 장애, 화상, 재관류 손상, 켈로이드 형성, 흉터 조직, 발열, 치주병, 비만, 방사선 독성, 노화 관련 악액질, 알츠하이머병, 뇌 부종, 염증성 뇌 손상, 암, 만성 피로 증후군, 피부근육염, 약물 반응, 예를 들면, 스티븐스-존슨 증후군(Stevens-Johnson syndrome) 및 야리시-헤륵스하이머 반응(Jarisch-Herxheimer reaction), 척수내 및/또는 주변의 부종, 주기적 가족열(familial periodic fevers), 펠티 증후군(Felty's syndrome), 섬유증, 사구체신염(예: 후-스트렙토코커스 사구체신염 또는 IgA 콩팥병증), 인공보철물의 이완, 현미경적 다발혈관염, 혼합된 결합 조직 질환, 다발골수종, 암 및 악액질, 다수 기관 질환, 골수이형성 증후군, 고환 뼈용해, 급성 및 만성을 포함하는 췌장염, 및 이자 고름집, 다발근육염, 진행성 신장 기능상실, 가성통풍, 괴저 농피증, 재발성 다발신경병증, 류마티스심장병, 사르코이드증, 경화쓸개관염, 뇌졸증, 흉복부대동맥류복구(TAAA), TNF 수용체 관련 주기성 증후군(TRAPS), 황색열 백신화와 관련된 증후군, 귀와 관련된 염증병, 만성 귀 염증, 진주종과 함께 또는 단독이 만성 중이염, 소아 귀 염증, 골수증, 난소암, 직결장암, 치료요법 관련 유도된 염증 증후군(예: IL-2 투여후 증후군), 및 재관류 손상과 관련된 질환을 포함한다.
상기 언급한 TNFα-관련 질환 모두는 경우에 따라, 당해 질병의 성인 및 유아 형태 둘다를 포함하는 것으로 이해된다. 또한 상기 질환 모두는 질병의 만성 및 급성 형태 둘다를 포함하는 것으로 이해된다. 또한, 본 발명의 다중-가변 투여 방법을 사용하여 상기 언급된 TNFα-관련 질환 각각의 단독 또는 다른 질환을 함께 지닌 피험체, 예를 들면 포도막염과 루푸스로 고생하는 피험체를 치료하는데 사용할 수 있다.
IV. 약제학적 조성물 및 약제학적 투여
A. 조성물 및 투여
본 발명의 다중-가변 투여 방법에 사용하기 위한 항체, 항체-부위 및 기타 TNFα 억제제는 피험체에 투여하기 적합한 약제학적 조성물내로 혼입시킬 수 있다. 통상적으로 약제학적 조성물은 본 발명의 항체, 항체 부위 또는 기타 TNFα 억제제와 약제학적으로 허용되는 담체를 포함한다. 본원에 사용된 것으로서, "약제학적으로 허용되는 담체"는 생리학적으로 혼용성인 어떠한 및 모든 용매, 분산 매질, 피복물, 항세균제 및 항진균제, 등장성 및 흡수 지연제 등을 포함한다. 약제학적으로 허용되는 담체의 예는 하나 이상의 물, 염수, 포스페이트 완충 염수, 덱스트로즈, 글리세롤, 에탄올, 및 이의 조합물을 포함한다. 많은 경우에, 등장성 제제, 예를 들면, 당, 만니톨, 소르비톨 또는 염화나트륨과 같은 다가알콜을 조성물속에 포함하는 것이 바람직하다. 약제학적으로 허용되는 담체는 또한 미량의 보조 물질, 예를 들면, 습윤 또는 유화제, 방부제 또는 완충제를 포함할 수 있으며, 이들 제제는 항체, 항체 부위 또는 기타 TNFα 억제제의 반감기 또는 효능을 증진시킨다.
본 발명의 방법에 사용하기 위한 조성물은 다양한 형태일 수 있다. 이들은 예를 들면, 액체 용액(예: 주사가능하고 주입가능한 용액), 분산제 또는 현탁제, 정제, 환제, 산제, 리포좀 및 좌제와 같은 액체, 반-고체 및 고체 투여형을 포함한다. 바람직한 형은 투여 및 치료 적용의 요구되는 유형에 따른다. 대표적으로 바람직한 조성물은 다른 항체 또는 다른 TNFα 억제제와 사람의 수동 멱역화를 위해 사용된 것과 유사한 조성물과 같은 주사가능한 또는 주입가능한 용액의 형태이다. 바람직한 투여 유형은 비경구(예: 정맥내, 피하내, 복강내, 근육내)이다. 바람직한 양태에서, 항체 또는 기타 TNFα 억제제는 정맥내 주입 또는 주사로 투여된다. 다른 바람직한 양태에서, 항체 또는 기타 TNFα 억제제는 근육내 또는 피하 주사로 투여된다.
치료학적 조성물은 통상적으로 제조 및 저장 조건하에서 안정하고 멸균성이어야 한다. 당해 조성물은 용액, 미셍액, 분산액, 리포좀 또는 호 약물 농도에 적합한 기타 주문된 구조로 제형화될 수 있다. 멸균 주사가능한 용액은 할성 화합물(즉, 항체, 항체 부위 또는 기타 TNFα 억제제)의 요구량을 적절한 용매속에 경우에 따라, 상기 나열한 성분들중 하나 또는 조합물과 함께 혼입시킨 후 여과된 멸균으로 제조할 수 있다. 일반적으로, 분산제는 활성 화합물을, 기본 분산 매질 및 상기 나열한 것들로부터 요구되는 기타 성분들을 함유하는 멸균 비히클내로 혼입시켜 제조한다. 멸균 주사가능한 용액을 제조하기 위한 멸균 산제의 경우에, 바람직한 제조 방법은 활성 성분과 앞서의 멸균-여과된 이의 용액으로부터의 추가의 바람직한 성분들의 분말을 생성하는 진공 건조 및 동결-건조이다. 용액의 적절한 유동성은 예를 들면, 레시틴과 같은 피복물을 사용하고, 분산제의 경우 요구되는 입자 크기를 유지시키고, 및 표면활성제를 사용함에 의해 유지시킬 수 있다. 주사가능한 조성물의 연장된 흡수는 조성물중에 흡수를 지연시키는 제제, 예를 들면, 모노스테아레이트 염 및 젤라틴을 포함시킴으로써 유발할 수 있다.
보충 활성 화합물을 또한 조성물내로 혼입시킬 수 있다. 특정의 양태에서, 본 발명의 방법에 사용하기 위한 항체 또는 항체 부위는 하나 이상의 추가의 치료제와 함께 공제형시키고/시키거나 공투여한다. 예를 들어, 항-hTNFα 항체 또는 항체 부위는 하나 이상의 DMARD 또는 하나 이상의 NSAID 또는 다른 표적물과 결합하는 하나 이상의 추가의 항체(예: 다른 사이토킨에 결합하거나 세포 표면 분자에 결합하는 항체), 하나 이상의 사이토킨, 가용성 TNFα 수용체(참조: PCT 공보 번호 제WO 94/06476호) 및/또는 hTNFα 생산 또는 활성을 억제하는 하나 이상의 화학제(예: PCT 공보 번호 제WO 93/19751호에 기술된 바와 같은 사이클로헥산-일리덴 유도체) 또는 어떠한 이들이 조합물과 함께 공제형화하고/하거나 공투여할 수 있다. 또한, 본 발명의 하나 이상의 항체는 하나 이상의 앞서의 치료제와 함께 사용할 수 있다. 이러한 조합 치료요법은 투여된 치료제의 보다 적은 용량을, 가능한 부작용, 합병증 또는 각종 단독치료요법과 관련된 환자에 의한 낮은 반응 수준을 피하면서, 유리하게 이용할 수 있다.
하나의 양태에서, 본 발명은 유효량의 TNFα 억제제 및 약제학적으로 허용되는 담체를 포함하며, 여기서, TNFα 억제제의 유효량은 예를 들면, 크론병을 포함하는 TNFα-관련 질환을 다중 가변 투여 요법으로 치료하는데 효과적일 수 있다. 하나의 양태에서, 본 발명의 다중 가변 투여 방법에 사용하기 위한 항체 또는 항체 부위는 본원에 참조로 인용된 제PCT/IB03/04502호 및 미국 특허원 제10/222140호에 기술된 약제학적 제형내로 혼입된다. 당해 제형은 50 mg/ml의 항체 D2E7를 포함하여, 여기서, 하나의 사전-충전된 주사기는 피하 주사용 항체를 40 mg 함유한다.
본 발명의 항체, 항체-부위 및 기타 TNFα 억제제는, 비록 많은 치료학적 적용의 경우에 바람직한 투여 경로/유형이 피하 주사라고 해도, 당해 분야에 공지된 다양한 방법으로 투여할 수 있다. 다른 양태에서, 투여는 정맥내 주사 또는 주입이다. 당해 분야의 숙련가에게 인지되는 바와 같이, 투여 경로 및/또는 유형은 목적한 결과에 따라 변할 것이다. 특정 양태에서, 활성 화합물은 삽입물, 경피 패취 및 미세봉입 전달 시스템을 포함하는, 방출 조절 제형과 같이 신속한 방출에 대해 화합물을 보호할 담체와 함께 제조될 수 있다. 생분해가능한, 생적합성 중합체, 예를 들면, 에틸렌 비닐 아세테이트, 폴리무수물, 폴리글리콜산, 콜라겐, 폴리오르토에스테르, 및 폴리락트산을 사용할 수 있다. 이러한 제형을 제조하기 위한 많은 방법은 특허되어 있거나 일반적으로 당해 분야의 숙련가에게 공지되어 있다[참조: Sustained 및 Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978].
본 발명의 TNFα 항체는 피복된 입자를 형성하기 위해 중합체성 담체속에 봉입된 단백질 결정의 조합물을 포함하는 단백질 결정 제형의 형태로 투여할 수 있다. 단백질 결정 제형중 피복 입자는 구체 형태 및 직경이 500 마이크로 미터인 미세소체를 지닐 수 있거나 이들은 일부 다른 형태질 지닐 수 있고 미세입자이다. 단백질 결정의 증가된 농도는, 본 발명의 항체가 피하 전달되도록 한다. 하나의 양태에서, 본 발명의 TNFα 항체는 단백질 전달 시스템을 통해 전달되며, 여기서, 하나 이상의 단백질 결정 제형 또는 조성물이 TNFα-관련 질환을 가진 피험체에 투여된다. 전체 항체 결정 또는 항체 단편 결정의 안정한 제형을 제조하는 방법 및 조성물은 또한 본원에 참조로 인용된 제WO 02/072636호에 기술되어 있다. 하나의 양태에서, 본원에 참조로 인용된 제PCT/IB03/04502호 및 미국 특허원 제10/222140호에 기술된 결정화된 항체 단편을 포함하는 제형 본 발명의 다중-가변 투여 방법을 사용하여 TNFα-관련 질환을 치료하는데 사용된다.
특정의 양태에서, 본 발명의 항체, 항체 부위 또는 기타 TNFα 억제제는 에를 들면, 불활성 희석제 또는 동화할 수있는 식용 담체와 함께 경구 투여될 수 있다. 화합물(및 경우에 따라, 다른 성분)은 또한 경 또는 연질 껍질 젤라틴 캅셀속에 봉입되거나, 정제로 압착되거나, 또는 피험체의 식이내로 직접 혼입될 수 있다. 경우 치료학적 투여의 경우, 화합물은 성분들과 함께 혼입될 수 있으며 섭취가능한 정제, 볼 정제, 트로키제, 캅셀제, 엘릭서르제, 현탁제, 시럽제, 와이퍼제 등의 형태로 사용된다. 본 발명의 화합물을 비경구 투여외의 방법으로 투여하기 위해서는, 화합물을 이의 불활성화를 방지하는 물질로 피복하거나 당해 화합물을 이들 물질과 공-투여하는 것이 요구될 수 있다.
본 발명의 약제학적 조성물은 본 발명의 항체 또는 항체 부위의 "치료학적 유효량" 또는 "예방학적 유효량"을 포함할 수 있다. "치료학적 유효량"은 목적한 치료 효과를 달성하는데 필요한 용량 및 기간 동안 효과적인 양을 말한다. 항체, 항체 부위 또는 기타 TNFα 항체의 치료학적 유효량은 개개인의 질병 상태, 연령, 성별 및 체중, 및 개개인에서 바람직한 반응을 일으키는 항체, 항체 부위, 기타 TNFα 억제제의 능력에 따라 변할 수 있다. 치료학적 유효량은 또한 항체, 항체 부위 또는 기타 TNFα 억제제의 어떠한 독성 또는 유해한 효과가 치료학적으로 유리한 효과에 의해 상쇄되는 것이다. "예방학적 유효량"은 바람직한 예방학적 결과를 달성하는데 요구되는 용량 및 기간에서 효과적인 양을 말한다. 통상적으로, 예방학적 투여량은 질병중 또는 조기 단계 이전에 피험체에서 사용되므로, 예방학적 유효량은 치료학적 유효량보다 훨씬 적을 것이다.
용량 용법은 최적의 바람직한 반응(예: 치료학적 또는 예방학적 반응)을 제공하기 위해 조절할 수 있다. 예를 들어, 단일 환제를 투여할 수 있으며 몇개로 분리된 투여량은 시간에 걸쳐 투여하거나 투여량을 치료학적 상황의 위급에 의해 지시되는 것에 따라 적절히 감소시키거나 증가시킬 수 있다. 용이한 투여 및 용량 단일성을 위해 투여 단위 형태로 비경구 조성물을 제형화하는 것이 특히 유리하다. 본원에 사용된 것으로서 용량 단위형은 치료할 포유동물 피험체에 대한 단일 용량으로서 적합한 생리학적으로 분리된 단위를 말하며, 각각의 단위는 필요한 약제학적 담체와 함께 바람직한 치료 효과를 생성하기 위해 계산된 활성 화합물의 예정된 양을 함유한다. 본 발명의 용량 단위 형태를 위한 세부사항은 (a)활성 화합물의 유일한 특성, 및 (b) 개개인에서 민감성 치료를 위해 이러한 활성 화합물을 화합하는 당해 분야의 고유의 제한에 의해 결정되고 직접 의존한다.
예로서, 본 발명의 항체 또는 항체 부위의 치료학적 또는 예방학적 유효량의 비-제한적 범위는 10 내지 200 mg, 더욱 바람직하게는 20 내지 160 mg, 더욱 바람직하게는 40 내지 80 mg, 및 가장 바람직하게는 80 mg이다. 하나의 양태에서, 본 발명의 방법에서 사용하기 위한 항체 또는 이의 부위의 치료학적 유효량은 약 20mg이다. 다른 양태에서, 본 발명의 방법에서 사용하기 위한 항체 또는 이의 부위의 치료학적 유효량은 약 40mg이다. 또 다른 양태에서, 본 발명의 방법에서 사용하기 위한 항체 또는 이의 부위의 치료학적 유효량은 약 80mg이다. 하나의 양태에서, 본 발명의 방법에서 사용하기 위한 항체 또는 이의 부위의 치료학적 유효량은 약 120mg이다. 또 다른 양태에서, 본 발명의 방법에서 사용하기 위한 항체 또는 이의 부위의 치료학적 유효량은 약 160mg이다. 상기 인용한 용량에 대한 중간 범위, 예를 들면, 약 78.5 내지 약 81.5; 약 15 내지 약 25; 약 30 내지 약 50; 약 60 내지 약 100; 약 90 내지 약 150; 약 120 내지 약 200이 본 발명의 일부인 것으로 의도된다. 예를 들어, 상한치 및/또는 하한치로서 상기 인용한 값의 어떠한 조합을 사용한 범위도 포함되는 것으로 의도된다.
본 발명은 TNFα 활성이 유해한 질환을 치료하기 위한 다중-가변 투여 방법을 제공하며, 이는 이를 필요로하는 피험체에게 하나 이상의 유도 투여량의 사람 항체와 같은 TNFα 억제제를 투여함으로써 역치 수준의 TNFα 억제제를 유도 단계 내에 달성하고 후속적으로 피험체에게 치료 투여량의 사람 항체를 치료 단계 내에 투여함으로써 치료가 되도록 함을 포함한다.
본 발명의 다중-가변 투여 치료 방법은 치료제를 유도 단계에 이어 치료 단계 동안 치료제의 보다 적은 양을 투여함을 포함한다. 하나의 양태에서, 유도 투여량은 160mg 또는 80mg을 포함한다. 다른 양태에서, 유도 투여량은 TNFα 억제제 약 20 내지 약 200mg의 범위이다. 더욱 바람직하게는 유도 투여량은 TNFα 억제제 약 40 내지 약 160mg의 범위이다. 가장 바람직하게는 유도 투여량은 TNFα 항체 약 80 내지 약 160mg의 범위이다. 유도 단계는 치료제의 역치 수준이 달성되면 완료된다. 유도 단계는 단일 유도 투여량 또는 다중 유도 투여량을 포함할 수 있으며, 여기서, 동일하거나 상이한 양의 치료제가 사용된다. 1회 이상의 유도 투여량을 유도 단계 동안 투여할 수 있으며, 여기서, 예정된 기간의 시간 간격이 예를 들면, 1시간 간격, 1일 간격, 1주 간격, 2주 간격 등을 포함하는 유도 투여량사이에서 일어날 수 있다. TNFα 억제제의 역치 수준을 달성하는데 사용된 본 발명의 유도 단계 치료의 예로는 다음 방법을 포함하나, 이에 한정되지는 않는다: 160 mg의 투여량에 이은 80 mg의 투여량; 1회 이상의 160 mg의 투여량; 1회 이상의 80mg의 투여량; 2회 이상의 80 mg의 투여량; 및 2회의 80mg의 유도 투여량을 1주 간격으로.
역치 수준은, 예정된 치료 효과에 이른 후 달성된다. 예를 들여, 크론병의 치료를 위한 TNFα 억제제의 역치 수준은 피험체를 이들의 CDAI 지표에 있어서의 감소를 위해 치료의 유도 단계에서 모니터함으로써 측정할 수 있다. 다른 예에서, 건선을 치료하기 위한 TNFα 억제제의 역치 수준은 판상 건선에 있어서의 감소, 환자의 건선 부위 민감성 지표(PASI) 점수의 증가 또는 증가된 의사의 총괄 평가(Physician's Global Assessment: PGA) 점수로 측정할 수 있다. 여전히 다른 예에서, TNFα-관련 질환을 치료하기 위한 TNFα 억제제의 역치 수준은 TNFα 억제제의 안정한 혈액 혈장 혈청 농도를 달성함으로써 측정한다.
역치 수준이 달성되면, 치료 단계를 개시한다. 하나 이상의 치료 투여량을 치료 단계 동안 투여한다. 하나 이상의 치료 투여량을 치료 단계 동안 투여할 수 있으며, 여기서, 예정된 시간 간격은 예를 들면, 1시간 간격, 1일 간격, 1주 간격, 2주 간격 등을 포함하는 유도 투여량사이에 일어날 수 있다. 하나의 양태에서, 치료 투여량은 TNFα 억제제 약 20 내지 약 120mg의 범위이다. 가장 바람직하게는 치료 투여량은 TNFα 억제제 약 40 내지 약 80mg의 범위이다. 하나의 양태에서, 치료 단계는 TNFα 억제제 40mg을 투여하는 것을 포함한다. 다른 양태에서, 치료 단계는 TNFα 억제제 80mg을 투여하는 것을 포함한다.
본원에 기술된 다중-가변 투여 방법은 TNFα 억제제의 2개 이상의 상이한 투여량의 투여를 포함하는 치료 방법을 기초로 한다. 유도 투여량은 치료 투여량보다 다수 많을 수 있다. 예를 들어, 유도 투여량은 치료 투여량보다 2배 이상 많을 수 있다. 본 발명의 하나의 양태에서, 유도 투여량은 160mg이며, 치료 투여량은 80mg이다. 다른 양태에서, 유도 투여량은 80mg이며, 치료 투여량은 40mg이다. 또 다른 양태에서, 유도 투여량은 70mg이고, 치료 투여량은 35mg이다. 다른 예에서, 치료 투여량은 유도 투여량의 40% 내지 60%인데, 예를 들어, 유도 투여량은 160mg이고 치료 투여량은 64 내지 96mg이거나 유도 투여량은 80mg의 범위이고 치료 투여량은 32mg 내지 48mg이다.
용량 값은 완화될 상태의 유형 및 중증도에 따라 변할 수 있음을 주목하여야 한다. 특정의 피험체의 경우, 특정 용량 요법을 요구되는 개인 및 조성물을 투여하거나 이의 투여를 조절하는 사람의 전문적인 판단에 따라 시간에 걸쳐 조절되어야 하며, 본원에서 앞서 설정한 용량 범위는 단지 예이며 청구된 조성물의 범위 또는 실시를 제한하는 것으로 의도되지 않음을 또한 이해하여야 한다.
본 발명은 또한 본 발명의 다중-가변 투여 요법을 투여하기 위한 포장된 약제학적 조성물 또는 키트에 관한 것이다. 본 발명의 하나의 양태에서, 키트는 항체와 같은 TNFα 억제제, 및 치료를 위한 다중-가변 투여 방법에 따른 투여 지침을 포함한다. 하나의 양태에서, 본 발명의 키트는 TNFα이 유해한 특정 질환의 치료를 위한 유도 투여량 및/또는 치료 투여량을 포함한다. 당해 키트는 또한 유도 및/또는 치료 투여량의 투여에 관한 지침을 포함한다. 당해 지침은 방법, 예를 들면 피하내, 및 시기, 예를 들면 0주, 및 2주째, 및 치료를 위해 피험체에 투여될 TNFα 억제제의 상이한 투여량을 기술할 수 있다. 당해 지침은 또한 다중-가변 투여 치료의 유도 및 치료 단계 동안 TNFα 억제제의 투여를 기술할 수 있다.
본 발명의 방법에 사용될 키트는 일부, 전체 또는 다중-가변 투여 요법을 달성하기 위한 하나의 다른 것과 조합하여 사용할 수 있는 개별 투여량의 TNFα 억제제를 포함할 수 있다. 예를 들어, 키트는 TNFα 항체 D2E7을 함유하는, 다수의 사전-충전된 주사기(각각의 주사기는 TNFα 억제제의 40mg 용량을 함유한다)를 포함한다. 하나의 양태에서, 다중 가변 투여 요법은 TNFα 항체 D2E7의 160mg의 유도 투여량의 투여에 이어 후속적으로 유도 투여량 투여 후 적어도 2주째에 D2E7의 80mg의 투여량을 투여하여 크론병을 치료한다. 이러한 경우, 지침서는 유도 투여량의 경우 D2E7의 4회 주사의 투여에 이어 2주 이상 경과후 D2E7의 2회 주사의 투여를 기술한다. 크론병을 치료하기 위한 본 발명의 키트는 또한 D2E7과 함께 투여하기 위한 1회 투여량 또는 다수 투여량의 메토트렉세이트를 포함한다.
다른 예에서, 본 발명의 키트는 건선의 다중-가변 투여 치료를 위한 E2E7의 투여량을 포함할 수 있다. 하나의 양태에서, 키트는 80 mg의 D2E7, 및 1회 이상의 유지 투여량의 40 mg의 D2E7을 함유할 수 있다. 건선을 치료하기 위한 D2E7의 투여 지침서는 예를 들면, 1회의 80 mg의 투여량의 투여, 두번째로 80 mg 투여량을 1주 후, 및 40 mg의 투여량을 1주 후 및 후속적으로 격주 투여하는 지침서를 포함한다. 또 다른 양태에서, 지침서는 D2E7의 단일 80mg 투여, 이어서 1 주후 및 후속적으로 40mg의 치료 투여의 지시를 포함할 수 있다.
본 발명의 다른 측면은 항-TNFα 항체 및 약제학적으로 허용되는 담체, TNFα-관련된 질환 및 약제학적으로 허용되는 담체를 치료하는데 유용한 약물을 각각 포함하는 하나 이상의 약제학적 조성물을 함유하는 키트에 관한 것이다. 달리는, 당해 키트는 항-TNFα 항체, TNFα-관련 질환을 치료하는데 유용한 하나 이상의 약물 및 약제학적으로 허용되는 담체를 포함하는 단일 약제학적 조성물을 포함한다. 키트는 항-TNFα 항체, TNFα-관련 질환을 치료하는데 유용한 하나 이상의 약물 및 약제학적으로 허용되는 담체를 포함하는 단일의 약제학적 조성물을 포함한다. 당해 키트는 항-TNFα 항체의 투여가 유리한 TNFα-관련 질환, 예를 들면, 크론병 또는 건선을 치료하기 위한 약제학적 조성물을 투여하기 위한 지침을 함유한다.
포장 또는 키트는 또한 TNFα 항체를 함유할 수 있으며 이는 본원에 기술된 질환의 치료 또는 사용을 위해, 첨부된 정보를 통해 또는 포장내에서 사용하기 위해 장려될 수 있다. 포장된 약제 또는 키트는 또한 제2 제제(본원에 기술된 바와 같은)와 제1 제제(본원에 기술된 바와 같은)를 사용하기 위한 지침서와 함께 포장되거나 함께 장려된 제2 제제를 포함할 수 있다.
하나의 양태에서, 본 발명은, TNFα 활성이 유해한 질환을 치료하기 위한 단일 투여 방법을 제공하며, 이는 이를 필요로 하는 피험체에게 단일 투여량의 사람 항체와 같은 TNFα 억제제를 투여함을 포함한다. 하나의 양태에서, TNFα 억제제는 항-TNFα 항체 D2E7이다. 단일 투여량의 TNFα 억제제는 치료학적으로 또는 예방학적으로 유효한 양일 수 있다. 하나의 양태에서, 피험체는 약 20 mg, 40 mg, 또는 80 mg의 단일 투여량의 D2E7을 투여받는다. 단일 투여량은 예를 들면, 피하 투여를 포함하는,어떠한 경로를 통해서도 투여될 수 있다.
B. 추가의 치료제
본 발명은 다중-가변 투여 요법을 사용하여 TNFα-관련 질환을 치료하기 위한 약제학적 조성물 및 이의 사용 방법에 관한 것이다. 약제학적 조성물은 TNFα-관련 질환을 예방하거나 치료하는 제1 제제를 포함한다. 약제학적 조성물 및 사용 방법은 활성 약제학적 성분이 제2 제제를 포함할 수 있는데; 즉 제2 제제는 치료제이고 이의 작용은 약제학적 담체, 방부제, 희석제 또는 완충제와 같은 불활성 성분의 작용을 능가한다. 제2 제제는 TNFα-관련 질환을 치료 또는 예방하는데 유용할 수 있다. 제2 제제는 표적 질병과 연관된 하나 이상의 증상을 소멸시키거나 치료할 수 있다. 제1 및 제2 제제는 유사하거나 관련되지 않은 작용 메카니즘에 의해 자체의 생물학적 효과를 발휘할 수 있거나; 또는 하나 또는 둘다의 제1 및 제2 제제가 다수의 작용 메카니즘에 의해 자체의 생물학적 효과를 발휘할 수 있다. 약제학적 조성물은 심지어, 제3(및 제4 등) 화합물이 제2 제제와 동일한 특성을 지니는 경우에도 제3 화합물 또는 심지어 그 이상의 화합물을 포함할 수 있다.
본원에 기술된 약제학적 조성물은 동일한 약제학적으로 허용되는 담체 또는 상이한 약제학적으로 허용되는 담체중에 각각의 기술된 양태를 위해 제1 및 제2, 제3 또는 추가의 제제를 가질 수 있음을 이해하여야 한다. 제1, 제2, 제3 및 추가의 제제를 기술한 양태내에서 동시에 또는 연속적으로 투여할 수 있음을 또한 이해하여야 한다. 달리는, 제1 및 제2 제제는 동시에 투여되고, 제3 또는 추가의 제제는 처음 2개의 제제 전 또는 후에 투여될 수 있다.
본원에 기술된 방법 및 약제학적 조성물내에서 사용된 제제의 조합은 치료를 위해 표적된 상태(들) 또는 질병(들)에 치료학적인 추가 또는 상승 효과를 지닐 수 있다. 본원에 기술된 약제학적 조성물 또는 방법내에서 사용된 제제들의 조합은 또한 단독으로 또는 특정의 약제학적 조성물의 다른 제제(들)의 부재하에 투여되는 경우 하나 이상의 제제와 연합된 유해 효과를 감소시킬 수 있다. 예를 들어, 하나의 제제의 부작용의 독성은 조성물의 다른 제제에 의해 약화될 수 있으므로, 보다 높은 용량, 개선된 환자 순응도 및 개선된 치료학적 결과를 허용한다. 조성물의 부가적 또는 상승 효과, 잇점 및 장점은 구조적 또는 작용 부류이던 치료제의 부류에 또는 개개의 화합물 자체에 적용된다.
보충 활성 화합물이 또한 조성물내로 혼입될 수 있다. 특정의 양태에서, 본 발명의 항체 또는 항체 부위는 TNFα 활성이 유해한 TNFα-관련 질환을 치료하는데 유용한 하나 이상의 추가의 치료제와 공제형화되고/되거나 공투여된다. 예를 들어, 본 발명의 항-hTNFα-관련 항체, 항체 부위 또는 기타 TNFα 억제제는 다른 표적물에 결합하는 하나 이상의 추가의 항체(예: 다른 사이토킨과 결합하거나 세포 표면 분자와 결합하는 항체), 하나 이상의 사이토킨, 가용성 TNFα 수용체(참조: PCT 공보 번호 제WO 94/06476호) 및/또는 TNFα 생산 또는 활성을 억제하는 하나 이상의 화학제(예: PCT 공보 번호 제WO 93/19751호에 기술된 사이클로헥산-일리덴 유도체)와 공제형화되고/되거나 공투여될 수 있다. 또한, 본 발명의 하나 이사의 항체 또는 기타 TNFα 억제제는 2개 이상의 전술한 치료제와 함께 사용될 수 있다. 이러한 배합 치료요법은 투여된 치료제의 보다 적은 용량을 유리하게 이용함으로써 각종 단독치료요법과 연관된 가능한 독성 또는 합병증을 피할 수 있다. 특정 치료제(들)은 일반적으로 하기 논의된 바와 같이, 치료되는 특정 TNFα-관련 질환을 기초로 하여 선택된다.
본 발명의 다중 가변 투여 방법에서 조합할 수 있는 항체, 항체 부위 또는 기타 TNFα 억제제를 지닌 치료제의 비제한적 예는 다음을 포함한다: 비-스테로이드 소염 약물(들)(NSAIDs); 사이토킨 억제 소염 약물(들)(CSAIDs); CDP-571/BAY- 10-3356[사람화된 항-TNFα 항체; 셀테크/바이엘(Celltech/Bayer) 제조원]; cA2/인플릭시맙[키메라 항-TNFα 항체; 센토코르(Centocor) 제조원]; 75kd TNFR-IgG/에타네르셉트[75kD TNF 수용체-IgG 융합 단백질; 임뉴넥스(Immunex) 제조원; 참조: Arthritis & Rheumatism (1994) Vol. 37, S295; J. Invest. Med. (1996) Vol. 44, 235A]; 55kd TNF-IgG[55 kD TNF 수용체-IgG 융합 단백질; 호프만-라로슈(Hoffmann-LaRoche) 제조원]; IDEC-CE9.1/SB 210396[비-고갈 영장류화된 항-CD4 항체; IDEC/스미쓰클라인(SmithKline) 제조원; 참조: Arthritis & Rheumatism (1995) Vol. 38, S 185]; DAB 486-IL-2 및/또는 DAB 389-IL-2[IL-2 융합 단백질; 세라젠(Seragen) 제조원; 참조: Arthritis & Rheumatism (1993) Vol. 36, 1223]; 항-Tac[사람화된 항-IL-2Rα; 단백질 디자인 랩스/로슈(Protein Design Labs/Roche) 제조원]; IL-4 (소염 사이토킨; DNAX/쉐링(Schering) 제조원]; IL-IO (SCH 52000; 재조합 IL-10, 소염 사이토킨; DNAX/쉐링 제조원); IL-4; IL-10 및/또는 IL-4 효능제(예: 효능제 항체); IL-IRA[IL-I 수용체 길항제; 시너젤/암젠(Synergen/Amgen) 제조원]; 아나킨라(Kineret®/암젠 제조원); TNF-bp/s-TNF[가용성 TNF 결합 단백질; 참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S284; Amer. J. Physiol. - Heart and Circulatory Physiology (1995) Vol. 268, pp. 37-42]; R973401[포스포디에스테라제 제IV형 억제제; 참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282]; MK-966 (COX-2 억제제; 참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S81]; 일로프로스트[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S82]; 메토트렉세이트; 탈리도마이드[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282] 및 탈리도마이드-관련 약물(예: 켈젠); 레플루노마이드[소염제 및 사이토킨 억제제; 참조: anti-inflammatory 및 cytokine 억제제; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S131; Inflammation Research (1996) Vol. 45., pp. 103-107]; 트라넥사민산[플라스미노겐 활성화 억제제; 참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S284]; T-614 [사이토킨 억제제; 참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282]; 프로스타글란딘 El[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282]; 테니댑[비스테로이드성 소염 약물; 참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S280]; 나프록센[비-스테로이드성 소염 약물; 참조: Neuro Report (1996) Vol. 7, pp. 1209-1213]; 멜록시캄(비-스테로이드성 소염 약물); 이부프로펜(비스테로이드성 소염 약물); 피록시캄(비-스테로이드성 소염 약물); 디클로페낙(비스테로이드성 소염 약물); 인도메타신(비-스테로이드성 소염 약물); 술파살라진[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S281]; 아자티오프린[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S281]; ICE 억제제(인터루킨-lβ 전환 효소의 억제제); zap-70 및/또는 lck 억제제 (타이로신 키나제 zap-70 또는 lck의 억제제); VEGF 억제제 및/또는 VEGF-R 억제제 (혈관 내피세포 성장 인자 또는 혈관 내피세포 성장 인자 수용체 억제제; 혈관형성 억제제); 코르티코스테로이드 소염 약물{예: SB203580); TNF-콘버타제 억제제; 항-IL-12 항체; 항-IL-18 항체; 인터루킨-11[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S296]; 인터루킨-13[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S308]; 인터루킨-17 억제제[참조: Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S120]; 금; 페니실아민; 클로로퀸; 하이드록시클로로퀸; 클로람부실; 사이클로스포린; 사이클로포스파미드; 총 림프구 자극; 항-티로사이트 글로불린; 항-CD4 항체; CD5-독소; 경구-투여된 펩타이드 및 콜라겐; 로벤자리트 이나트륨; 사이토킨 조절제(CRAs) HP228 및 HP466[오프턴 파마슈티칼즈, 인코포레이티드(Houghten Pharmaceuticals, Inc.) 제조원]; ICAM-I 안티센스 포스포티오에이트 올리고데옥시뉴클레오타이드[ISIS 2302; 아이시스 파마슈티칼즈, 인코포레이티드(Isis Pharmaceuticals, Inc.) 제조원]; 가용성 상보체 수용체 1[TPlO; T 세포 사이언스, 인코포레이티드(Cell Sciences, Inc.) 제조원]; 프레드니손; 오르고테인; 글리코사미노글리칸 폴리설페이트; 미노사이클린; 항-IL2R 항체; 마린 및 식물 지질[어류 및 식물 종자 지방산; 참조: DeLuca et al. (1995) Rheum. Dis. Clin. North Am. 21:759-777]; 아우라노핀; 페닐부타존; 메클로페남산; 플루페남산; 정맥내 면역 글로불린; 질레우톤; 아자리빈; 마이코페놀산(RS-61443); 타크롤리무스(FK-506); 시롤리무스(라파마이신); 아미프리로즈(테라펙틴); 클라드리빈(2-클로로데옥시아데노신); 메토트렉세이트; 항바이러스제; 및 면역 조절제. 상술한 제제중 어느 제제도 본 발명의 TNFα 항체와 함께 본 발명의 다중 가변 투여 또는 단일 투여 방법을 사용하여 TNFα-관련 질환을 치료하는데 투여될 수 있다.
하나의 양태에서, 본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 방법을 사용하여 류마티스 관절염을 치료하기 위한 하나의 다음 제제와 함께 투여된다: KDR의 소 분자 억제제(ABT- 123), Tie-2의 소 분자 억제제; 메토트렉세이트; 프레드니손; 셀레콕시브; 엽산; 하이드록시클로로퀸 설페이트; 로페콕시브; 에타네르셉트; 인플릭시맙; 아나킨라(Kineret®/암젠 제조원); 레플루노마이드; 나프록센; 발데콕시브; 설파살라진; 이부프로펜; 메틸프레드니솔론; 멜록시캄; 메틸프레드니솔론 아세테이트; 금 나트륨 티오말레이트; 아스피린; 아자티오프린; 트리암시놀론 아세토나이드; 프록시펜 납실레이트/아파프; 폴레이트; 나부메톤; 디클로페낙, 피록시캄; 에토돌락; 디클로페낙 나트륨; 옥사프로진; 옥시코돈 hcl; 하이드로코돈 비타르트레이트/아파크/ 디클로페낙 나트륨/미소프로스톨; 페타닐; 아나킨라, 사람 재조합; 트라마돌 hcl; 살살레이트; 술린닥; 시아노코발라민/fa/피리독신; 아세트아미노펜; 알렌드로네이트 나트륨; 프레드니솔론; 모르핀 설페이트; 리도카인 하이드로클로라이드; 인도메타신; 글루코사민 설페이트/콘드로이틴; 사이클로스포린; 설파디아진; 아미트립틸린 hcl; 옥시코돈 hcl/아세트아미노펜; 올로파타딘 hcl; 미소프로스톨; 나트록센 나트륨; 오메프라졸; 마이코페놀레이트 포페틸; 사이클로포스파미드; 리툭시바브, IL-1 TRAP; MRA; CTLA4-IG; IL-18 BP; ABT-874; ABT-325 (항-IL 18); 항-IL 15; BIRB-796; SCIO-469; VX-702; AMG-548; VX-740; 로플루밀라스트; IC-485; CDC-801; 및 메소프람. 다른 양태에서, 본 발명의 TNFα 항체는 류마티스 관절염을 치료하기 위한 상기 언급한 제제중 하나와 함께 TNFα 관련 질환을 치료하기 위한 다중-가변 투여 방법을 사용하여 투여한다. 다른 양태에서, 상기 언급한 추가의 제제는 본 발명의 단일 투여 방법에서 TNFα 항체와 함께 사용된다.
하나의 양태에서, 본 발명의 TNFα 항체는 TNFα 활성이 유해한 TNFα-관련 질환을 치료하기 위한 하기 제제중 하나와 함께 다중 가변 투여 요법을 사용하여 투여한다: 항-IL12 항체 (ABT 874); 항-IL18 항체 (ABT 325); LCK의 소 분자 억제제; COT의 소 분자 억제제; 항-IL 1 항체; MK2의 소 분자 억제제; 항-CD 19 항체; CXCR3의 소 분자 억제제; CCR5의 소 분자 억제제; CCR11 항-E/L 셀렉틴 항체; P2X7의 소 분자 억제제; IRAK-4의 소 분자 억제제; 글루코코르티코이드 수용체의 소 분자 효능제; 항-C5a 수용체 항체; C5a 수용체의 소 분자 억제제; 항-CD32 항체; 및 치료 단백질로서의 CD32.
다른 양태에서, 본 발명의 TNFα 항체는 항생제 또는 항감염제와 함께 다중 가변 투여 요법을 사용하여 투여한다. 항감염제는 바이러스, 진균, 기생충 또는 세균 감염을 치료하기 위해 당해 분야에 공지된 제제를 포함한다. 본원에 사용된 것으로서, 용어 "항생제"는 미생물의 성장을 억제하거나, 미생물을 사멸시키는 화학 물질을 말한다. 당해 용어에는 미생물에 의해 생산된 항생제, 및 당해 분야에 공지된 합성 항생물질(예: 유사체)을 포함한다. 항생물질은 클라리트로마이신(Biaxin®), 키프로플록사신(Cipro®), 및 메트로니다졸(Flagyl®)을 포함하나, 이에 한정되지 않는다.
다른 양태에서, 본 발명의 TNFα 항체는 좌골신경통 또는 통증을 치료하기 위한 추가의 치료제와 배합된 다중 가변 투여 요법을 사용하여 투여한다. 좌골신경통 또는 통증을 감소시키거나 억제하는데 사용할 수 있는 제제의 예는 하이드로코돈 비타르트레이트/아파프, 로페콕시브, 사이클로벤자프린 hcl, 메틸프레드니솔론, 나프록센, 이부프로펜, 옥시코돈 hcl/아세트아미노펜, 셀레콕시브, 발데콕시브, 메틸프레드니솔론 아세테이트, 프레드니손, 코데인 포스페이트/아파프, 트라마돌 hcl/아세트아미노펜, 메탁살론, 멜록시캄, 메토카르바몰, 리도카인 하이드로클로라이드, 디클로페낙 나트륨, 가바펜틴, 덱사메타손, 카리소프로돌, 케토롤락 트로메타민, 인도메타신, 아세트아미노펜, 디아제팜, 나부메톤, 옥시코돈 hcl, 티자니딘 hcl, 디클로페낙 나트륨/미소프로스톨, 프로폭시펜 납실레이트/아파프, 아사/옥시코드/옥시코돈 테르, 이부프로펜/하이드로코돈 비트, 트라마돌 hcl, 에토돌락, 프로폭시펜 hcl, 아미트립틸린 hcl, 카리소프로돌/코데인 포스/아사, 모르핀 설페이트, 멀티비타민, 나프록센 나트륨, 오르페나드린 시트레이트, 및 테마제팜을 포함한다.
다른 양태에서, TNFα-관련 질환은 혈액투석과 함께 본 발명의 TNFα 항체를 사용한 다중 가변 투여 요법을 사용하여 치료한다.
다른 양태에서, 본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 크론병 또는 크론-관련 질환을 치료하는데 사용된 약물과 함께 사용된다. 크론병을 치료하는데 사용될 수 있는 치료제의 예는 메살라민, 프로드니손, 아자티오프린, 머캅토퓨린, 인플릭시맙, 부데소나이드, 설파살라진, 메틸프레드니솔론 나트륨 석시네이트, 디페녹실레이트/아트로프 설프, 로페라미드 하이드로클로라이드, 메토트렉세이트, 오메프라졸, 폴레이트, 시프로플록사신/덱스트로즈-물, 하이드로코돈 비타르트레이트/아파프, 테트라사이클린 하이드로클로라이드, 플루오키노나이드, 메트로니다졸, 티메로살/붕산, 효스시아민 설페이트, 콜레스티라민/슈크로즈, 시프로플록사신 하이드로클로라이드, 메페리딘 하이드로클로라이드, 미다졸람 하이드로클로라이드, 옥시코돈 hcl/아세트아미노펜, 프로메타진 하이드로클로라이드, 나트륨 포스페이트, 설파메톡사졸/트리메토프림, 셀레콕시브, 폴리카르보필, 프로폭시펜 납실레이트, 하이드로코르티손, 멀티비타민, 발살라자이드 이나트륨, 코데인 포스페이트/아파프, 콜레세벨람 hcl, 시아노코발라민, 엽산, 레보플록사신, 나탈리주마브, 메틸프로드니솔론, 인터페론-감마, 및 사르그라모스틴(GM-CSF)를 포함한다. 하나의 양태에서, 메토트렉세이트는 주당 2.5mg 내지 30mg의 투여량으로 크론병의 치료를 위해 투여된다.
다른 양태에서, TNFα 항체는 본 발명의 다중 가변 투여 요법에서 천식을 치료하기 위한 추가의 치료제와 함께 투여된다. 천식 증상을 완화시키거나 억제하는데 사용할 수 있는 제제의 예는 다음을 포함한다: 알부테롤; 살메테롤/플루티카손; 나트륨, 플루티카손 프로피오네이트; 부데소나이드; 프레드니손; 살메테롤 크시나포에이트; 레발부테롤 hcl; 설페이트/이프라트로피움; 프레드니솔론 나트륨 포스페이트/ 트리암시놀론 아세토나이드; 베클로메타손 디프로피오네이트; 이프라트로피움 브로마이드; 아지트로마이신; 피르부테롤 아세테이트; 프레드니솔론, 테오필린 무수물; 자피를루카스트; 메틸프레드니솔론 나트륨 석시네이트; 클라리트로마이신; 포르모테롤 푸마레이트; 인플루엔자 바이러스 백신; 메틸프로드니솔론; 트리하이드레이트; 알레르기 주사; 크로몰린 나트륨; 세프프로질; 펙소페나딜 하이드로클로라이드; 플루니솔라이드/멘톨; 레보플록사신; 아목실린/클라불라네이트, 흡입 보조 장치, 구아니페네신, 덱사메타손 나트륨 포스페이트; 목시플록사신 hcl; 하이클레이트; 구아니페네신/d-메토르판; 갈티플록사신; 페페드린/코드/클로르페니르; 세티리진 하이드로클로라이드; 모메타손 푸로에이트; 살메테롤 크시나포에이트; 벤조나테이트; 셀팔렉신; 페/하이드로코돈/클로르페니르; 세티리진 hcl/슈도에페드; 페닐에프린/코드/프로메타진; 코데인/프로메타진; 플루니솔라이드; 덱사메타손; 구아이페네신/슈도에페드린; 클로르페니라민/하이드로코돈; 네도크로밀 나트륨; 테르부탈린 설페이트; 에피네프린 및 메틸프로드니솔론, 메타프로테레놀 설페이트.
다른 양태에서, 본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 COPD를 치료하기 위한 추가의 치료제와 함께 투여된다. COPD의 증상을 완화시키거나 억제하는데 사용할 수 있는 제제의 예는 알부테롤 설페이트/이프라트로피움; 이프라트로피운 브로마이드; 살메테롤/플루티카손; 알부테롤; 살메테롤, 크시나포에이트/ 플루티카손 프로피오네이트; 프레드니솔; 테오필린 무수물; 레보플록사신; 메틸프레드니솔론 나트륨 석시네이트; 몬텔루카스트 나트륨; 부데소나이드; 포르모테롤 푸마레이트; 트리암시놀론 아세토나이드; 구아이페네신; 아지트로마이신; 베클로메타손; 디프로피오네이트; 레발부테롤 hcl; 플루니솔라이드; 나트륨, 트리하이드레이트; 가티플록사신; 카피를루카스트; 푸로에이트; 아목시실린/클라불라네이트; 플루니솔라이드/멘톨; 클로르페니르아민/하이드로코돈; 메타프로테레놀 설페이트; 메틸프레드니솔론; 에페드린/코드/클로프페니르; 피르부테롤 아세테이트; -에페드린/로라타딘; 테르부탈린 설페이트; 티오프로피움 브로마이드; (R,R)-포르모테롤; TgAAT; 실로밀라스트 및 로플루밀라스트를 포함한다.
다른 양태에서, 본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 IPF를 치료하기 위한 추가의 치료제와 함께 투여한다. IPF의 증상을 완화시키거나 억제하는데 사용할 수 있는 제제의 예는 프레드니손; 아자티오프린; 알부테롤; 콜치킨; 설페이트; 디곡신; 감마 인터페론; 메틸프레드니솔론 나트륨 석시네이트; 푸로세마이드; 리시노프릴; 니트로글리세린; 스피로놀락톤; 사이클로포스파미드; 이프라트로피움 브로마이드; 악티노마이신 d; 알테플라제; 플루티카손 프로피온네이트; 레보플록사신; 메타프로테레놀 설페이트; 모르핀 설페이트; 옥시코돈 hcl; 염화나트륨; 트리암시놀론 아세토나이드; 타크로리무스 무수물; 칼슘; 인터페론-알파; 메토트렉세이트; 마이코페놀레이트 모페틸을 포함한다.
본 발명의 하나의 양태에서, TNFα 항체는 본 발명의 다중 가변 투여 요법에서 척추관절병증을 치료하는데 일반적으로 사용되는 제제와 함께 투여된다. 이러한 제제의 예는 비스테로이드성, 소염 약물(NSAIDs), COX2 억제제, 예를 들면, Celebrex®, Vioxx®, 및 Bextra®, 및 에토리콕시브를 포함한다. 물리치료는 일반적으로 비-스테로이드성 염증 약물과 함께 척추관절병증을 치료하는데 일반적으로 사용된다.
다른 양태에서, 본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 강직척추염을 치료하기 위한 추가의 치료제와 함께 투여된다. 강직척추염의 증상을 완화시키거나 억제하는데 사용할 수 있는 제제의 예는 이부프로펜, 디클로페낙 및 미소프로스톨, 나프록센, 멜록시캄, 인도메타신, 디클로페낙, 셀레콕시브, 로페콕시브, 설파살라진, 프로드니손, 메토트렉세이트, 아자티오프린, 미노사이클린, 프레드니손, 에타네르셉트 및 인플릭시맙을 포함한다.
다른 양태에서, 본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 건선 관절염을 치료하기 위한 추가의 치료제와 함께 투여된다. 건선 관절염의 증상을 완화시키거나 억제하는데 사용될 수 있는 제제의 예는 메토트렉세이트; 에타네르셉트; 로페콕시브; 셀레콕시브; 엽산; 설파살라진; 나프록센; 레플루노마이드; 메틸프로드니솔론 아세테이트; 인도메타신; 하이드록시클로로퀸 설페이트; 술린닥; 프레드니솔; 증강된 베타메타손 디프로프; 인플릭시바브; 메토트렉세이트; 폴레이트; 프리암시놀론 아세토나이드; 디클로페낙; 디메틸설폭사이드; 피록시캄; 디클로페낙 나트륨; 케토프로펜; 멜록시캄; 프레드니손; 메틸프레드니솔론; 나부메톤; 톨메틴 나트륨; 칼시포트리엔; 사이클로스포린; 디클로페낙; 나트륨/미소프로스톨; 플루오시노나이드; 글루코사민 설페이트; 금 나트륨 티오말레이트; 하이드로코돈; 비타르트레이트/아파프; 이부프로펜; 리세드로네이트 나트륨; 설파디아진; 티오구아닌; 발데콕시브; 알레파셉트; 및 에팔리주마브를 포함한다.
하나의 양태에서, TNFα 억제제는 본 발명의 다중 가변 투여 요법에서 관상 심장병을 치료하기 위한 초기 과정후 투여된다. 이러한 과정의 예는 관상 동맥 바이패스 이식(CABG) 및 경피경혈관심장동맥확장술(PTCA) 또는 혈관성형술을 포함하나, 이에 한정되지 않는다. 하나의 양태에서, TNFα 억제제는 재발로부터 협착증을 예방하기 위하여 투여된다. 본 발명의 다른 양태에서, TNFα 억제제는 재협착증을 예방하거나 치료하기 위해 투여된다. 본 발명은 또한, TNFα 억제제가 관상 심장병을 치료하기 위한 수술을 받은 피험체의 동맥내 스텐트의 삽입 전, 삽입과 함께 또는 삽입 후 투여되는 방법을 제공한다. 하나의 양태에서, 스텐트는 CABG 또는 PTCA에 이어서 투여된다.
광범위한 스텐트 이식체를 목적한 치료 부위 및 특성에 따라 본 발명의 내용안에서 이용할 수 있다. 스텐트 이식은 예를 들면, 두갈래 또는 튜브형 이식체, 원통형 또는 첨형, 자가-확장가능하거나 또는 풍선-확장가능한, 단일체 또는 모듈러(modular)일 수 있다. 또한, 스텐트 이식체는 스텐트 이식체의 단지 근접한 말단에서 또는 전체를 따라 약물을 방출하도록 조절할 수 있다. 본 발명의 TNFα 억제제는 스텐트 상에서 또한 투여될 수 있다. 하나의 양태에서, 예를 들면, D2E7/HUMIRA®를 포함하는 본 발명의 TNFα 항체를 약물-용리 스텐트로 투여한다.
TNFα 항체는 본 발명의 다중 가변 투여 요법에서 재협착증을 치료하기 위한 추가의 치료제와 함께 투여될 수 있다. 재협착증을 치료하거나 예방하는데 사용할 수 있는 제제의 예는 시롤리무스, 파클리탁셀, 에버롤리무스, 타크롤리무스, ABT-578, 및 아세트아미노펜을 포함한다.
본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 심근경색을 치료하기 위한 추가의 치료제와 함께 투여할 수 있다. 심근경색을 치료하거나 예방하는데 사용할 수 있는 제제의 예는 아스피린, 니트로글리세린, 메토트롤롤 타르트레이트, 에녹사파린 나트륨, 헤파린 나트륨, 클로피도그렐 비설페이트, 카르베딜롤, 아테놀롤, 모르핀 설페이트, 메토프롤롤 석시네이트, 와르파린 나트륨, 리시노프릴, 이소소르바이드 모노니트레이트, 디곡신, 푸로세마이드, 심바스타틴, 라미프릴, 테넥테플라세, 에날라프릴 말레에이트, 토르세마이드, 레타바세, 로사르탄 칼륨, 쿠ㅏ나프릴 hcl/마그 카브, 부메타니드, 알테플라세, 에날라프릴라트, 아미노다론 하이드로클로라이드, 티로피반 hcl m-하이드레이트, 딜티아젬 하이드로클로라이드, 캅토프릴, 이르베사르탄, 발사르탄, 프로프라놀롤 하이드로클로라이드, 포시노프릴 나트륨, 리도카인 하이드로클로라이드, 에피티피바타ㅣ드, 세파졸린 나트륨, 아트로핀 설페이트, 아미노카프로산, 스피로놀락톤, 인터페론, 소탈롤 하이드로클로라이드, 염화나트륨, 도쿠세이트 나트륨, 도부타민 hcl, 알프라졸람, 프라바스타틴 나트륨, 아토르바스탄틴 칼슘, 미다졸람 하이드로클로라이드, 메페리딘 하이드로클로라이드, 이소소르바이드 디니트레이트, 에피네프린, 도파민 하이드로클로라이드, 비발리루딘, 로수바스타틴, 에제티미베/심바스타틴, 아바시미베, 압식시마브, 및 카리포라이드를 포함한다.
본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 협심증을 치료하기 위한 추가의 치료제와 함께 투여할 수 있다. 협심증을 치료하거나 예방하는데 사용할 수 있는 제제의 예는 아스피린; 니트로글리세린; 이소소르바이드 모노니트레이트; 아테롤롤; 메토프롤롤 석시네이트; 메토프롤롤 타르트레이트; 암로디핀 베실레이트; 디곡신; 딜리티아젬 하이드로프클로라이드; 이소소르바이드 디니트레이트; 클로피도그렐 비설페이트; 니페디핀; 아토르바스타틴 칼슘; 염화칼륨; 심바스타틴; 베라파밀 hcl; 푸로세마이드; 프로프라놀롤 hcl; 카르베딜로; 리시노프릴; 스프리오노락톤; 하이드로클로로티아자이드; 에날라프릴 말레이트; 마돌롤; 라미프릴; 에녹사파린 나트륨; 헤파린 나트륨; 발사르탄; 소탈롤 하이드로클로라이드; 페노피브레이트; 에제티미베; 부메타니드; 로사르탄 칼륨; 리시노프릴/하이드로클로로티아자이드; 펠로디핀; 카프토프릴; 및 비소프롤롤 푸마레이트를 포함한다.
본 발명의 하나의 양태에서, TNFα 항체는 본 발명의 다중 가변 투여 요법에서 C형 바이러스 간염을 치료하기 위해 일반적으로 사용된 제제와 함께 투여된다. 이러한 제제의 예는 인터페론-알파-2a, 인터페론-알파-2b, 인터페론-알파 con1, 인터페론-알파-n1, 페길화된 인터페론-알파-2a, 페길화된 인터페론-알파-2b, 리바비린, 페긴테르페론 알파-2b 및 리바비린, 우르소데옥시콜산, 글리시리즈산, 티말파신, 막사민 및 VX-497를 포함한다.
본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 건선을 치료하기 위한 국소 코르티코스테로이드, 비타민 D 유사체 및 국소 또는 경구 레티노이드, 또는 이의 배합물과 함께 투여된다. 또한, 본 발명의 TNFα 항체는 건선 치료용의 다음 제제중 하나와 함께 투여된다: KDR의 소 분자 억제제(ABT-123), Tie-2의 소 분자 억제제, 칼시포트리엔, 클로베타솔 프로피오네이트, 트리암시놀론 아세토나이드, 할로베타솔 프로피오네이트, 타카로텐, 메토트렉세이트, 플루오시노나이드, 증강된 베타메타손 디프로프, 플루오시놀론, 아세토나이드, 아시트레틴, 타르 삼푸, 베타메타손 발러레이트, 모메타손 푸로에이트, 케토코나졸, 프라목신/플루오시놀론, 하이드로코르티손 발러레이트, 플루란드레놀라이드, 우레아, 베타메타손, 클로베타솔 프로피오네이트/에놀, 플루티카손 프로피오네이트, 아지트로마이신, 하이드로코르티손, 습윤화 제형, 엽산, 데소나이드, 콜타르, 디플로라손 디아세테이트, 에타네르셉트, 폴레이트, 락트산, 메톡스살렌, hc/비스무쓰 수브갈/제녹스(znox_/레소르, 메틸프레드니솔론 아세테이트, 프레드니손, 선스크린, 살리사이클산, 할시노나이드, 안트랄린, 클로코르콜론 피발레이트, 숯 추출물, 콜타르/살리사이클산, 콜타르/살리사이클산/황, 데속시메타손, 디아제팜, 피부연화제, 광오일/카스터 오일/나 락트(na lact), 광오일/땅콩 오일, 석유/이소프로필 미리스테이트, 프소랄렌, 살리사이클산, 비누/트리브롬살란, 티메로살/붕산, 셀레콕시브, 인플릭시맙, 알레파셉트, 에팔리주마브, 타크로리무스, 피메크롤리무스, PUVA, UVB 및 기타 광치료요법, 및 설파살라진.
본 발명의 항체, 항체 부위 또는 기타 TNFα 억제제는 본 발명의 다중 가변 투여 요법에서 피부 상태를 치료하기 위한 기타 제제와 함께 사용될 수 있다. 예를 들어, 본 발명의 항체, 항체; 부위 또는 기타 TNFα 억제제는 PUVA 치료요법과 병용된다. PUVA는 프소랄렌(P) 및 많은 상이한 피부 장애를 치료하는데 사용된 장-파장의 자외선 조사(UVA)이다. 본 발명의 항체, 항체 부위, 또는 기타 TNFα 억제제는 피메크롤리무스와 배합될 수 있다. 다른 양태에서, 본 발명의 항체는 건선을 치료하는데 사용되며, 여기서, 항체는 타크롤리무스와 함께 투여된다. 추가의 양태에서, 타크롤리무스 및 TNFα 억제제는 메토트렉세이트 및/또는 사이클로스포린과 함께 투여된다. 또 다른 양태에서, 본 발명의 TNFα 억제제는 건선 치료용 엑시머 레이저 치료와 함께 투여된다.
TNFα 억제제가 피부 또는 손발톱 질환을 치료하기 위해 배합될 수 있는 기타 치료제의 비제한적 예는 본 발명의 다중 가변 투여 요법에서 UVA 및 UVB 광치료요법을 포함한다. TNFα 억제제와 함께 사용된 수 있는 기타 비제한적 예는 항-IL-12 및 항-IL-18 치료제, 예를 들면, 항체를 포함한다.
하나의 양태에서, 본 발명의 TNFα 항체는 본 발명의 다중 가변 투여 요법에서 베체트병의 치료시 추가의 치료제와 함께 투여된다. 베체트병을 치료하는데 사용될 수 있는 추가의 치료제는 프레드니손, 사이클로포스파미드(사이톡산), 아자티오프린(또한 이무란으로 명명됨), 메토트렉세이트, 티메토프림/설파메톡사졸(또한 박트림 또는 셉트라로 명명됨) 및 엽산을 포함하나, 이에 한정되지 않는다.
단독 또는 배합된 위에서 언급한 치료제중 어느 하나도 본 발명의 다중 가변 투여 치료 용법을 사용하여 TNFα 항체와 함께, TNFα가 유해한 TNFα-관련 질환으로 고생하는 피험체에 투여될 수 있다. 하나의 양태에서, 단독 또는 배합된, 위에서 언급한 치료제중 어느 것도 TNFα-관련 질환을 치료하기 위해 TNFα 항체외에 류마티스 관절염으로 고생하는 피험체에 투여될 수 있다. 추가의 치료제는 상술한 조합 치료요법에서 사용할 수 있으나, 또한 유익한 효과가 요구되는 본원에 기술된 다른 지침에서 사용될 수 있음을 이해하여야 한다.
또한, 상술한 추가의 제제를 본 발명의 단일 투여 치료 방법을 사용하여 TNFα-관련 질환을 치료하기 위한 TNFα 억제제, 예를 들면, TNFα 항체와 함께 사용할 수 있다.
본 발명은 또한 이로써 한정되지 않는 하기 실시예에 의해 추가로 나열된다. 본 명세서를 통해 인용된 모든 참조문헌, 특허 및 공개된 특허원의 내용은 본원에 참조로 인용된다.
실시예 1: 크론병의 치료를 위한 다중-투여 치료요법의 효능 연구
D2E7을 사용한 크론병의 다중-가변 투여 치료
TNFα 억제제, 즉, D2E7(또한 아달리무맙 및 Humira®로 언급됨)의 다중-가변 투여 요법의 크롬병을 치료하기 위한 효능을 측정하기 위해 연구를 수행하였다. 활성 크론병 환자를 치료하는데 있어서 D2E7의 효능 및 내성을 무작위적인 이중-맹검의, 위약-조절된 다중심 연구로 평가하였다.
당해 연구에서, TNF-길항제에 앞서 노출되지 않고 활성 크론병을 지닌 299명 환자를 선택하였다. 각각의 환자에서 크론병은 내시경 또는 방사선 평가로 확인하였다. 피험체를 4개의 치료 그룹중 하나와 동일하게 무작위로 처리하였다(3개의 치료 그룹 및 하나의 위약 그룹). 자격이 있는 피험체는 4개월 이상동안 크론병으로 진단된 18세 내지 75세의 남성 및 여성을 포함하였다. 또한, 선택된 환자들은 220 내지 450점의 크론병 활성 지표(CDAI)로 정의된, 활성 크론병을 지녔다.
기준선(0주째)에서, 피험체에게 D2E7의 로딩 투여량에 이어 2주째에 치료 투여량을 제공하였으며, 여기서, 치료 투여량은 초기 로딩 투여량보다 적었다. 0주째(기준선) 및 2주째(0주/2주)에 다중 가변 투여 치료 용법중 다음 하나를 환자에게 제공하였다: 160mg/80mg D2E7; 80mg/40mg D2E7; 40mg/20mg D2E7; 또는 위약/위약. 환자에게 D2E7 또는 위약 치료를 피하 투여하였다.
초기 2주 스크리닝 기간, 4주의 치료 기간(0주 내지 4주) 및 4주의 후속 기간을 포함하는 10주 이하의 연구를 수행하였다. 참여자를 4주째에 <150의 CDAI 점수로 정의된, 크론병의 임상적 완화 유도에 대해 평가하였다. ≥70 [Δ70] 또는 ≥100 점[Δ100])의 CDAI 기준선과 비교하여 CDAI에 있어서의 감소로 정의된 임상 반응을 또한 참여자에서 평가하였다. 다중-가변 투여 요법의 효능을 환자의 염증성 창자병 설문지(IBDQ) 점수에서의 개선, 및 배출 누공의 개선 또는 완화를 또한 평가하였다. 누공(fistula) 완화는 2회 이상의 연속된 방문 동안 기준선에서 배수되는 모든 누공의 폐쇄로 정의하였다. 누공 개선은 2회 이상의 연속된 방문 동안 배출 누공의 수에 있어서 ≥ 50%의 감소로 정의하였다. C-반응성 단백질(CRP) 수준은 체내 염증을 반응하므로, CRP 수준을 또한 평가하였다.
당해 연구의 결과는, 다중 가변 D2E7 용량 치료가 크론병 완화를 유도하는데 있어서 효과적임을 나타낸다. 표 1은 투여 요법의 4주째에 임상적으로 완화(CDAI < 150)된 환자의 퍼센트를 나타낸다. 표 1에 나타낸 바와 같이, 80/40 mg 또는 160/80 mg의 D2E7를 제공받은 환자의 30%가 위약을 제공받은 환자의 12%와 비교하여 임상적으로 완화되었다(p=0.004.). 최대 투여 그룹, 160/80 mg에서 환자는 12%의 위약 율에 대해 36%의 통계적으로 유의적인 완화율을 달성하였다.
| 위약 | 40/20 mg | 80/40 mg | 160/80 mg | |
| CDAI≤150 | 12% | 18% | 24% | 36%* |
| (*는 p=0.001) (위약 n=74; 20 mg n=74; 40 mg n= 75; 80 mg n=76) | ||||
각각의 용량 그룹으로부터 크론병(CDAI<150)의 완화 결과를 또한 도 1에 나타낸다(도 1, 및 도 2 내지 도 6에서 용량 참조는 치료 투여량을 말함을 주목하라, 즉, 40 mg은 80/40 치료 용법을 말한다).
각각의 투여 그룹에 대한 CDAI 지표에 있어서 중간 4주 변화(기준선 및 4주째 데이타를 사용한 점)는 다음과 같다: 위약, Δ-47 (n=67); 20 mg, Δ - 73 (n=70); 40 mg, Δ-90 (n=70); 및 80 mg, Δ -101 (n=73). D2E7의 다중 가변 투여 치료를 받은 환자에 대한 CDAI 지표에 있어서의 감소를 또한 도 2에 나타낸다. 4주째에 기준선으로부터 CDAI ≥ 70 점 및 ≥100 점 감소의 임상 반응 결과는 도 3 및 도 4에 각각 나타낸다. 즉, D2E7의 다중, 가변 투여량을 받은 환자, 특히 80/40 mg 및 160/80 mg을 제공받은 크론병 환자는 크론병의 완화를 나타내는 CDAI 지표에 있어 감소를 나타내었다. 또한, 도 5에 나타낸 바와 같이, 160/80 mg 투여 요법을 제공받은 환자는, CRP 수준에 있어 최대 감소를 나타내었으며, 위약 그룹은 최소의 감소를 나타내었다. 환자는 또한 도 6에 나타낸 바와 같이 이들의 IBDQ 점수에 있어서 전체적인 개선을 나타내었다. 또한, 지속적인 혈청 D2E7 농도는 다중 가변 투여 요법의 결과로서 치료 초기에 달성되었다.
부작용(AE)의 전체적인 출현은 낮으며 그룹간에 상이하지 않았다. 가장 일반적인 AE는 주사 부위 반응이며, 이들중 대부분은 온화하였다. 통계적으로 유의한 결과는 기준선 CRP 농도에 의존적이지 않았다.
요약하면, 다중 가변 투여량의 D2E7는 크론 병 환자에서 질병의 완화율을 유의적으로 증가시켰다. 조합하면, 80/40 mg 및 160/80 mg의 D2E7 투여량을 제공받은 환자의 30%는 단지 12%의 위약 피험체와 비교하여 완화되었다. 위약 그룹과 비교하여 매주마다 40 mg 및 80 mg 치료 투여량의 임상 반응(≥ 70 점의 CDAI 지표에 있어서의 감소) 및 IBDQ 점수는 현저히 증가하였다. 매주 80 mg의 D2E7 치료 투여량을 제공받은 치료 그룹에서, 피험체의 49%는 임상 반응을 달성하였다(≥ 100 점의 CDAI에 있어서의 감소).
실시예 2
크론병의 치료를 위한 다중 투여 치료요법의 효능의 추가 연구
D2E7을 사용한 크론병의 다중-가변 투여 치료
당해 연구는 이미 상이한 TNFα 억제제를 제공받아 이에 반응했던 성인 크론병 환자에서, TNFα 억제제, 특히 D2E7를 사용하는 다중-가변 투여 치료의 허용성 (tolerability) 및 임상적 잇점을 평가하기 위해 수행하였다. 당해 연구는 키메라 항-TNF 항체 인플릭시맙을 이미 제공받았으나, 인플릭시맙에 대해 지속적인 반응 및/또는 허용성을 지니지 않는 환자를 포함시켰다.
반응성을 상실하거나 과민증(급성 또는 지연된 주사 반응)이 진행된 환자를 0주째에 D2E7 80 mg 및 2주째에 40 mg으로 처리하였다. 모든 치료는 피하주사하였다. 인플릭시맙(ATI)에 대한 항체를 기준선에서 측정하였다[캘리포니아주 샌 디에고 소재의 프로메테우스 래보러토리즈(Prometheus Laboratories)]. 크론병 활성 지표(CDAI) 점수, 누공의 존재 및 C-반응성 단백질(CRP) 농도를 0주째 및 4주째에 측정하였다. 임상 반응(CDAI의 감소: >/= 100 점), 임상적 완화(CDAI </= 150 점), 누공 개선(폐쇄 >/= 50%의 개방 누공), 완전한 누공 폐쇄, 및 급성 및 지연된 과민성 반응을 연구 전체에서 기록하였다.
24명의 환자를 등록하고 다중-가변 투여 치료요법을 4주째에 완성하였다. 16명의 환자중 4명(25%)은 ATI에 대해 양성이었다. 0주째에 CDAI 점수가 >/= 220인 13명의 환자중 (46%)가 임상 반응을 달성하였고 1명(8%)가 4주째에 완화되었다. 항문 주위 및/또는 직장질 누공을 지닌 6명의 환자중, 4명(67%)에서 4주째에 누공 폐쇄가 완성되었다. 단지 6명의 환자(38%)가 정상 범위 이상의 CRP 값을 가졌다. 모든 환자들 중에서, 평균 +/- SD CRP 농도는 0주째에 17.0 +/- 29.3 mg/L로부터 4주째에 0 내지 11.3 +/- 17.3 mg/L로 감소하였다. D2E7을 사용한 치료동안 급성 또는 지연된 과민성 반응을 경험한 환자는 없었다(치료를 제한하는 급성 과민성 반응을 이미 경험했던 8명의 환자 및 인플릭시맙을 투여시 지연된 과민성 반응을 이미 경험한 3명의 환자를 포함해서).
요약하면, D2E7을 사용한 다중-가변 투여 치료는 허용성이 우수하며, 이전에 인플릭시맙을 제공받아 이에 반응했으나, 더 이상 인플릭시맙에 대해 지속적으로 반응성이지 않고 이에 대해 허용성을 보이지 않았던 크론병 환자에 있어 임상적으로 이로운 결과를 나타냈다.
실시예 3:
건선 치료용 TNFα 억제제를 사용한 다중-투여 치료요법의 효능
D2E7을 사용한 건선의 다중-투여 치료요법
당해 연구는 건선을 치료하기 위한 D2E7의 다중-가변 투여 양태의 효능을 측정하기 위해 수행하였다. 약한 내지 중증의 만성 판상 건선을 지닌 환자의 치료시 D2E7의 효능 및 내성을 무작위적이고, 이중-맹검인, 위약-조절된 다중심 연구로 평가하였다.
당해 연구에서, 약한 내지 중증의 건선을 지닌 148명의 성인 환자를 다중-가변 투여 치료를 제공하기 위해 선택하였다. 환자를 또한 ≥ 5%의 영향받은 신체 표면적(BSA)을 기초로 하여 선택하였다. 피험체를 3개 그룹중 하나에 동일하게 무작위 배열시켰다(2개의 치료 그룹 및 하나의 위약 그룹).
치료 그룹 둘다에서 기준선(0주째) 환자에게 80 mg의 D2E7 유도 투여량을 제공하였다. 제1 치료 그룹에서 환자에게 1주째에 40 mg의 D2E7의 치료 투여량에 이어 격주(eow)로 40mg을 3주째에 출발하여 제공하였다. 제2 치료 그룹에서 환자는 1주째에 D2E7 80mg의 유도 투여량(0주째에 초기 80mg에 이어)에 이어 2주째에 출발하여 매주 40 mg의 D2E7 치료 투여량을 제공받았다. 위약 그룹은 기준선에서 출발하여 매주 위약만을 제공받았다. 모든 치료를 사전-충전된 주사기를 사용하여 피하(sc)로 투여하였다. 상이한 용법의 요약을 하기 표 2에 기술한다:
| 용법 | 상세한 기술 |
| A | D2E7 80mg을 0주째에 피하 투여하고(기준선); D2E7 40mg의 피하 주사를 1주부터 출발하여 11주까지 투여하며 위약을 격주로 투여하였다. |
| B | D2E7 80mg을 0주째(기준선) 및 1주째(80/80)에 피하 투여하고; D2E7 40mg의 피하 주사를 12주부터 출발하여 11주까지 매주 투여하였다. |
| C | 위약을 기준선에서 피하 투여한 후 11주까지 매주 투여하며 1주 및 1주에 2회 주사하였다. |
맹검 연구를 유지하기 위해, 모든 피험체에게 기준선 및 1주째에 총 2회 주사를 제공하였다. 연구의 나머지 기간(2주 내지 12주) 동안, 피험체에게 주당 1회 주사하였다. 주사당 치료 투여량은 각각의 피험체에 대해 무작위적으로 지정된 투여 요법에 연관되어 있다.
다중-가변 투여 요법의 관여자의 PASI는 표준 방법(참조: Fredriksson 및 Pettersson, 상기 참조 및 Marls et al, 상기 참조)에 따라 측정하였다. 당해 연구의 주요 효능 종점은 12주째에 PASI 점수(≥ PASI 75)에서 75% 이상의 감소로 정의된 임상 반응을 달성한 피험체의 퍼센트였다.
제2 효능 측정은 12주째에 "명백한" 또는 "거의 명백한" 통계적인 의사의 총괄 평가(PGA)를 포함하였다. PGA는 의사의 평가 시기에 건선의 중증도를 측정하기 위해 사용된 7개의 점 규모에 따라 측정하였다. 사용된 질병의 기술은 다음을 포함한다: 중증 = 매우 많이 표시된 플라크 상승, 스케일링, 및/또는 홍반: 중간 내지 중증 = 현저한 플라크 상승, 스케일링 및/또는 홍반; 약함 내지 중간 = 중간과 약함사이의 중간; 약함 = 약간의 플라크 상승, 스케일링 및/또는 홍반; 거의 명백 = 약함 및 명백한의 중간; 및 명백한-건선의 징후 없음.
당해 결과는, 12주째에 통계적으로 유의적인 많은 퍼센트의 환자가 위약 처리시보다 D2E7에서 PASI 75 반응이 우수하였음을 나타낸다. 40 mg 치료 투여량의 D2E7 eow를 제공받은 환자의 경우, 53%는 75 이상의 PASI를 입증하였다. 또한, 40 mg의 치료 투여량의 D2E7를 매주 제공받은 환자의 80%는 위약 치료 그룹의 단지 4%(위약에 대해 p<0.001)와 비교하여 PASI가 75 이상 더 높음을 나타내었다. D2E7의 치료 용법 둘다에 대한 12주째에서의 반응율은 도 7에 나타낸 바와 같이, 위약의 경우보다 통계적으로 유의적으로 높았다.
전체적으로, D2E7 다중-가변 투여 치료요법에서 환자에 대한 PASI 점수에 있어서 평균 퍼센트 변화는 위약보다 통계적으로 유의적으로 높았다. 변화는 도 8에 나타낸 바와 같이, 초기 투여후 1주째로서 초기에 명백하였다. 12주 째에 40 mg eow를 제공받은 D2E7에 있어서의 환자중 49% 및 주마다 40 mg의 D2E7을 제공받은 환자중 76%가 위약 환자의 2%와 비교하여, "명백한" 또는 "거의 명백한" PGA를 달성하였다.
연구에 포함된 148명의 성인 환자중, 29%는 또한 건선 관절염(PsA)의 의학 기록을 가졌다. D2E7의 투여량 둘다는 PsA를 지닌 환자 및 지니지 않은 환자 둘다에서 건선 치료시 효과적이었다. PsA를 지닌 환자는 PsA를 지니지 않은 환자와 D2E7에 대해 유사한 효능 반응을 지녔다. PsA를 지닌 아그룹 및 PsA를 지니지 않은 아그룹 둘다의 경우, 12주째에 PASI가 75 반응 이상인 환자의 퍼센트는 위약과 비교하여 eow의 경우(PsA를 지닌 경우, 47%; PsA를 지니지 않은 경우, 57%) 및 주간 치료 약전의 경우(PsA를 지닌 경우, 58%; PsA를 지니지 않은 경우, 87%), 통계적으로 유의적이었다. 효능에 있어서의 지속된 개선은 eow 약전(PsA를 지닌 경우, 53%; PsA를 지니지 않은 경우, 70%)에서 24주에 걸쳐 관측되었다. 12 및 24주째에 PsA를 지닌 환자 및 지니지 않은 환자에서 효능 반응은 각각 도 9 및 도 10에 나타낸다.
결론적으로, 12주째에 투여된 D2E7는 만성 판상 건선에 대한 완화 치료시 효과적이었다. 40 mg eow시 환자중 53%가 위약 치료시 4%와 비교하여 ≥ PASI 75를 달성하였다. 매주 40 mg를 제공받은 환자중 80%는 ≥ PASI 75를 달성하였다. D2E7 40 mg eow 및 40 mg를 매주 제공받은 환자중 49% 및 76%는 각각 이들 건선이 "명백한" 또는 "거의 명백한"이었다. 또한, D2E7은 PsA가 있는 건선 환자 및 PsA가 없는 건선 환자를 치료하는데 동등하게 효과적이었다.
실시예 4
D2E7의 단일 투여 치료의 효능
류마티스 관절염(RA)을 치료하기 위한 D2E7의 단일 투여 요법의 효능을 측정하기 위해 연구를 수행하였다. 본 연구의 목적은 RA를 지닌 일본 및 백인종 피험체에서 D2E7의 3회 피하(sc) 투여량(20, 40 또는 80mg)의 단일-투여 안정성 및 효능을 측정하고 비교하였다.
D2E7는 유사한 설계-개방-표지, 평행 그룹의 2개의 별개의 임상 연구에서 RA를 지니고 중간 내지 중증의 기준선 질병 중증도에 잘 조화되는 40명의 일본인(일본) 및 36명의 백인종(미국) 환자에서 단일 피하 투여량(20, 40 또는 80mg)으로 투여하였다. 1, 15 및 29일째 연구에서, 안정성 평가는 신체 평가, 생명 징후, 및 실험실 평가를 포함시킴으로써 부작용(AEs), 및 CRP에 포함된 효능 평가, 질병 활성의 의사 및 피험체의 평가, 통증의 피험체의 평가, 건강 평가 질문서(DIHAQ)의 불일치 지표, 및 압통 및 팽윤 관절 수를 측정하였다.
당해 연구로부터의 결과는, 모든 일본인 치료 그룹이 1일째와 비교하여 15일째 및 29일째에 모든 ACR 성분(DIHAQ 제외)에 있어 통계학적으로 유의적으로 개선되었음을 나타내었다. 3개의 백인종 치료 그룹에서는 단지 80mg의 치료 그룹이 DIHAQ 점수를 제외하고는 모든 개개의 ACR 성분에 있어 29일째에 통계학적으로 유의적인 개선을 나타내었다. 비록 당해 연구 기간이 단지 29일이었지만, ACR20 반응은 일본인 환자중 47.5%(19/40)에서 및 백인종 환자중 30.6%(11/36)에서 달성되었다. 또한, 치료 그룹사이의 AE를 보고하는 피험체의 빈도에 있어서의 차이는 각각의 연구내에서 임상적으로 관련되지 않았다. 흥미롭게도, 보고하기 위한 시험자 문화 경향성 또는 민족간 차이를 반응할 수 있는 일본인 환자에서 AE의 출현은 증가하였다.
당해 결과는, 단일 치료 투여를 사용한 단기간 연구에서 그룹 둘다에 있어 RA 신호 및 증상에 있어서 비교가능한 정도의 개선을 입증한다. 이들 결과는 또한 일본인 및 백인종 피험체에서 ADA의 단일-투여량 피하주사 투여의 유사한 안정성을 제안한다.
현재의 기술의 일부를 형성하는 것은 첨부된 서열 목록이며, 이의 내용은 하기 표에 요약한다:
등가물
당해 분야의 숙련가는 더 이상의 정규 실험없이도 본원에 기술된 본 발명의 특정 양태에 대해 많은 등가물을 사용하여 인지하거나 추정할 수 있을 것이다. 이러한 등량물은 하기 청구의 범위에 포함되는 것으로 의도된다.
<110> Abbott Biotechnology Ltd., et al.
<120> Multiple-Variable Dose Regimen For Treating TNFa-Related Disorders
<130> BBI-210CPPC2
<150> 60/561139
<151> 2004-04-09
<150> 60/561710
<151> 2004-04-12
<150> 60/569100
<151> 2004-05-07
<160> 37
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 light chain variable region
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 2
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 heavy chain variable region
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 light chain variable region CDR3
<221> VARIANT
<222>)9
<223> Xaa = Thr or Ala
<400> 3
Gln Arg Tyr Asn Arg Ala Pro Tyr Xaa
1 5
<210> 4
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 heavy chain variable region CDR3
<221> VARIANT
<222> 12
<223> Xaa = Tyr or Asn
<400> 4
Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Xaa
1 5 10
<210> 5
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 light chain variable region CDR2
<400> 5
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 6
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 heavy chain variable region CDR2
<400> 6
Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val Glu
1 5 10 15
Gly
<210> 7
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 light chain variable region CDR1
<400> 7
Arg Ala Ser Gln Gly Ile Arg Asn Tyr Leu Ala
1 5 10
<210> 8
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> D2E7 heavy chain variable region CDR1
<400> 8
Asp Tyr Ala Met His
1 5
<210> 9
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> 2SD4 light chain variable region
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Ile Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Tyr
85 90 95
Ala Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 10
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> 2SD4 heavy chain variable region
<400> 10
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Ala Val Ser Arg Asp Asn Ala Lys Asn Ala Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Lys Ala Ser Tyr Leu Ser Thr Ser Ser Ser Leu Asp Asn Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 11
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> 2SD4 light chain variable region CDR3
<400> 11
Gln Lys Tyr Asn Ser Ala Pro Tyr Ala
1 5
<210> 12
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> EP B12 light chain variable region CDR3
<400> 12
Gln Lys Tyr Asn Arg Ala Pro Tyr Ala
1 5
<210> 13
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VL10E4 light chain variable region CDR3
<400> 13
Gln Lys Tyr Gln Arg Ala Pro Tyr Thr
1 5
<210> 14
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VL100A9 light chain variable region CDR3
<400> 14
Gln Lys Tyr Ser Ser Ala Pro Tyr Thr
1 5
<210> 15
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VLL100D2 light chain variable region CDR3
<400> 15
Gln Lys Tyr Asn Ser Ala Pro Tyr Thr
1 5
<210> 16
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VLL0F4 light chain variable region CDR3
<400> 16
Gln Lys Tyr Asn Arg Ala Pro Tyr Thr
1 5
<210> 17
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LOE5 light chain variable region CDR3
<400> 17
Gln Lys Tyr Asn Ser Ala Pro Tyr Tyr
1 5
<210> 18
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VLLOG7 light chain variable region CDR3
<400> 18
Gln Lys Tyr Asn Ser Ala Pro Tyr Asn
1 5
<210> 19
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VLLOG9 light chain variable region CDR3
<400> 19
Gln Lys Tyr Thr Ser Ala Pro Tyr Thr
1 5
<210> 20
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VLLOH1 light chain variable region CDR3
<400> 20
Gln Lys Tyr Asn Arg Ala Pro Tyr Asn
1 5
<210> 21
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VLLOH10 light chain variable region CDR3
<400> 21
Gln Lys Tyr Asn Ser Ala Ala Tyr Ser
1 5
<210> 22
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VL1B7 light chain variable region CDR3
<400> 22
Gln Gln Tyr Asn Ser Ala Pro Asp Thr
1 5
<210> 23
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VL1C1 light chain variable region CDR3
<400> 23
Gln Lys Tyr Asn Ser Asp Pro Tyr Thr
1 5
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VL0.1F4 light chain variable region CDR3
<400> 24
Gln Lys Tyr Ile Ser Ala Pro Tyr Thr
1 5
<210> 25
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VL0.1H8 light chain variable region CDR3
<400> 25
Gln Lys Tyr Asn Arg Pro Pro Tyr Thr
1 5
<210> 26
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LOE7.A light chain variable region CDR3
<400> 26
Gln Arg Tyr Asn Arg Ala Pro Tyr Ala
1 5
<210> 27
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> 2SD4 heavy chain variable region CDR3
<400> 27
Ala Ser Tyr Leu Ser Thr Ser Ser Ser Leu Asp Asn
1 5 10
<210> 28
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> VH1B11 heavy chain variable region CDR3
<400> 28
Ala Ser Tyr Leu Ser Thr Ser Ser Ser Leu Asp Lys
1 5 10
<210> 29
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> VH1D8 heavy chain variable region CDR3
<400> 29
Ala Ser Tyr Leu Ser Thr Ser Ser Ser Leu Asp Tyr
1 5 10
<210> 30
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> VH1A11 heavy chain variable region CDR3
<400> 30
Ala Ser Tyr Leu Ser Thr Ser Ser Ser Leu Asp Asp
1 5 10
<210> 31
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> VH1B12 heavy chain variable region CDR3
<400> 31
Ala Ser Tyr Leu Ser Thr Ser Phe Ser Leu Asp Tyr
1 5 10
<210> 32
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> VH1E4 heavy chain variable region CDR3
<400> 32
Ala Ser Tyr Leu Ser Thr Ser Ser Ser Leu His Tyr
1 5 10
<210> 33
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> VH1F6 heavy chain variable region CDR3
<400> 33
Ala Ser Phe Leu Ser Thr Ser Ser Ser Leu Glu Tyr
1 5 10
<210> 34
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> 3C-H2 heavy chain variable region CDR3
<400> 34
Ala Ser Tyr Leu Ser Thr Ala Ser Ser Leu Glu Tyr
1 5 10
<210> 35
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> VH1-D2.N heavy chain variable region CDR3
<400> 35
Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Asn
1 5 10
<210> 36
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> D2E7 light chain variable region
<400> 36
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtagggga cagagtcacc 60
atcacttgtc gggcaagtca gggcatcaga aattacttag cctggtatca gcaaaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccactt tgcaatcagg ggtcccatct 180
cggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag cctacagcct 240
gaagatgttg caacttatta ctgtcaaagg tataaccgtg caccgtatac ttttggccag 300
gggaccaagg tggaaatcaa a 321
<210> 37
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<223> D2E7 heavy chain variable region
<400> 37
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ccggcaggtc cctgagactc 60
tcctgtgcgg cctctggatt cacctttgat gattatgcca tgcactgggt ccggcaagct 120
ccagggaagg gcctggaatg ggtctcagct atcacttgga atagtggtca catagactat 180
gcggactctg tggagggccg attcaccatc tccagagaca acgccaagaa ctccctgtat 240
ctgcaaatga acagtctgag agctgaggat acggccgtat attactgtgc gaaagtctcg 300
taccttagca ccgcgtcctc ccttgactat tggggccaag gtaccctggt caccgtctcg 360
agt 363
1
Claims (26)
- 크론병의 치료를 필요로 하는 환자에게서 크론병을 치료하기 위한, 단리된 사람 항-TNFα 항체를 포함하는 의약으로, 상기 항체가
서열번호 8의 아미노산 서열을 포함하는 CDR1; 서열번호 6의 아미노산 서열을 포함하는 CDR2; 및 서열번호 4의 아미노산 서열을 포함하는 CDR3를 포함하는 중쇄; 및
서열번호 7의 아미노산 서열을 포함하는 CDR1; 서열번호 5의 아미노산 서열을 포함하는 CDR2; 및 서열번호 3의 아미노산 서열을 포함하는 CDR3를 포함하는 경쇄를 포함하며,
상기 의약이 하나 이상의 160 mg 용량의 항체를 포함하는 의약. - 궤양성 결장염의 치료를 필요로 하는 환자에게서 궤양성 결장염을 치료하기 위한, 단리된 사람 항-TNFα 항체를 포함하는 의약으로, 상기 항체가
서열번호 8의 아미노산 서열을 포함하는 CDR1; 서열번호 6의 아미노산 서열을 포함하는 CDR2; 및 서열번호 4의 아미노산 서열을 포함하는 CDR3를 포함하는 중쇄; 및
서열번호 7의 아미노산 서열을 포함하는 CDR1; 서열번호 5의 아미노산 서열을 포함하는 CDR2; 및 서열번호 3의 아미노산 서열을 포함하는 CDR3를 포함하는 경쇄를 포함하며,
상기 의약이 하나 이상의 160 mg 용량의 항체를 포함하는 의약. - 제1항 또는 제2항에 있어서, 상기 의약이 하나가 넘는 160 mg의 용량의 항체를 포함하는 의약.
- 제1항 또는 제2항에 있어서, 각각의 160 mg 용량의 항체가 하루 이내에 피험체에 투여되는 것인 의약.
- 제1항 또는 제2항에 있어서, 각각의 160 mg 용량의 항체가 40 mg 용량 4개의 세트로 피험체에 투여되는 것인 의약.
- 제1항 또는 제2항에 있어서, 각각의 160 mg 용량의 항체가 피하 주사로 피험체에 투여되는 것인 의약.
- 제6항에 있어서, 피하 주사가 사전-충전된(prefilled) 주사기를 사용하여 피험체에 투여되는 것인 의약.
- 제1항 또는 제2항에 있어서, 상기 의약이 하나 이상의 80 mg 용량의 항체를 추가로 포함하는 것인 의약.
- 제8항에 있어서, 하나 이상의 80 mg 용량이 하나 이상의 160 mg의 용량을 투여하고 이어서 투여되는 것인 의약.
- 제9항에 있어서, 하나 이상의 80 mg 용량이 하나 이상의 160 mg의 용량을 투여 후 2주에 투여되는 것인 의약.
- 제8항에 있어서, 하나 이상의 80 mg 용량의 항체가 40 mg 용량 2개의 세트로 피험체에 투여되는 것인 의약.
- 제8항에 있어서, 하나 이상의 80 mg 용량의 항체가 피하 주사로 피험체에 투여되는 것인 의약.
- 제12항에 있어서, 피하 주사가 사전-충전된 주사기를 사용하여 피험체에 투여되는 것인 의약.
- 제8항에 있어서, 상기 의약이 하나 이상의 40 mg 용량의 항체를 추가로 포함하는 것인 의약.
- 제14항에 있어서, 하나 이상의 40 mg 용량이 하나 이상의 80 mg의 용량을 투여하고 이어서 투여되는 것인 의약.
- 제15항에 있어서, 하나 이상의 40 mg 용량이 하나 이상의 80 mg의 용량을 투여 후 2주에 투여되는 것인 의약.
- 제3항에 있어서, 상기 의약이 하나 이상의 40 mg 용량의 항체를 추가로 포함하는 것인 의약.
- 제17항에 있어서, 하나 이상의 40 mg 용량이 하나가 넘는 160 mg의 용량을 투여하고 이어서 투여되는 것인 의약.
- 제18항에 있어서, 하나 이상의 40 mg 용량이 하나가 넘는 160 mg의 용량을 투여 후 2주에 투여되는 것인 의약.
- 제14항에 있어서, 하나 이상의 40 mg 용량의 항체가 피하 주사로 피험체에 투여되는 것인 의약.
- 제20항에 있어서, 피하 주사가 사전-충전된 주사기를 사용하여 피험체에 투여되는 것인 의약.
- 제17항에 있어서, 하나 이상의 40 mg 용량의 항체가 피하 주사로 피험체에 투여되는 것인 의약.
- 제22항에 있어서, 피하 주사가 사전-충전된 주사기를 사용하여 피험체에 투여되는 것인 의약.
- 제1항 또는 제2항에 있어서, 상기 항체가 서열번호 1의 아미노산 서열을 포함하는 경쇄 가변 영역(LCVR) 및 서열번호 2의 아미노산 서열을 포함하는 중쇄 가변 영역(HCVR)을 포함하는 것인 의약.
- 제24항에 있어서, 항체가 D2E7(아달리무맙)인 의약.
- 제1항 또는 제2항에 있어서, 상기 의약이 메토트렉세이트를 추가로 포함하는 것인 의약.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US56113904P | 2004-04-09 | 2004-04-09 | |
| US60/561,139 | 2004-04-09 | ||
| US56171004P | 2004-04-12 | 2004-04-12 | |
| US60/561,710 | 2004-04-12 | ||
| US56910004P | 2004-05-07 | 2004-05-07 | |
| US60/569,100 | 2004-05-07 | ||
| PCT/US2005/012007 WO2005110452A2 (en) | 2004-04-09 | 2005-04-11 | MULTIPLE-VARIABLE DOSE REGIMEN FOR TREATING TNFα-RELATED DISORDERS |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137022221A Division KR101636446B1 (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177008060A Division KR20170036138A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160079933A true KR20160079933A (ko) | 2016-07-06 |
Family
ID=35006312
Family Applications (8)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177008060A KR20170036138A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020167017366A KR20160079933A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020137022221A KR101636446B1 (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020067023531A KR101282801B1 (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여법 |
| KR1020187023479A KR20180094148A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020197009624A KR20190039349A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020127028692A KR101378873B1 (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020177036302A KR20170143008A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177008060A KR20170036138A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
Family Applications After (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137022221A KR101636446B1 (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020067023531A KR101282801B1 (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여법 |
| KR1020187023479A KR20180094148A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020197009624A KR20190039349A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020127028692A KR101378873B1 (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
| KR1020177036302A KR20170143008A (ko) | 2004-04-09 | 2005-04-11 | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 |
Country Status (22)
| Country | Link |
|---|---|
| US (16) | US8889136B2 (ko) |
| EP (4) | EP1737491B1 (ko) |
| JP (5) | JP5748317B2 (ko) |
| KR (8) | KR20170036138A (ko) |
| CN (5) | CN105106951A (ko) |
| AU (1) | AU2005244261B2 (ko) |
| BR (1) | BRPI0509326A (ko) |
| CA (4) | CA2970891A1 (ko) |
| CY (1) | CY1118564T1 (ko) |
| DK (1) | DK1737491T3 (ko) |
| ES (1) | ES2611286T3 (ko) |
| HK (1) | HK1104454A1 (ko) |
| HU (1) | HUE031558T2 (ko) |
| IL (3) | IL178430A (ko) |
| LT (1) | LT1737491T (ko) |
| MX (1) | MXPA06011677A (ko) |
| NZ (3) | NZ579302A (ko) |
| PL (1) | PL1737491T3 (ko) |
| PT (1) | PT1737491T (ko) |
| TW (4) | TWI439284B (ko) |
| WO (1) | WO2005110452A2 (ko) |
| ZA (1) | ZA200608097B (ko) |
Families Citing this family (121)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6090382A (en) * | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| RU2270030C2 (ru) * | 1996-02-09 | 2006-02-20 | Абботт Байотекнолоджи эЛтиди. | СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ ЧЕЛОВЕЧЕСКОГО TNFα (ВАРИАНТЫ), ПРИМЕНЕНИЕ ВЫДЕЛЕННОГО АНТИТЕЛА ЧЕЛОВЕКА ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА В КАЧЕСТВЕ КОМПОНЕНТА ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА (ВАРИАНТЫ) И ВЫДЕЛЕННОЕ ЧЕЛОВЕЧЕСКОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ |
| US7115557B2 (en) * | 1998-09-25 | 2006-10-03 | Sciaticon Ab | Use of certain drugs for treating nerve root injury |
| CA2868614A1 (en) | 2001-06-08 | 2002-12-08 | Abbott Laboratories (Bermuda) Ltd. | Methods of administering anti-tnf.alpha. antibodies |
| US20040009172A1 (en) * | 2002-04-26 | 2004-01-15 | Steven Fischkoff | Use of anti-TNFalpha antibodies and another drug |
| AU2003267999B2 (en) * | 2002-07-19 | 2010-03-11 | Abbvie Biotechnology Ltd | Treatment of TNFalpha related disorders |
| US20090280065A1 (en) * | 2006-04-10 | 2009-11-12 | Willian Mary K | Uses and Compositions for Treatment of Psoriasis |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| MY150740A (en) * | 2002-10-24 | 2014-02-28 | Abbvie Biotechnology Ltd | Low dose methods for treating disorders in which tnf? activity is detrimental |
| TWI439284B (zh) * | 2004-04-09 | 2014-06-01 | Abbvie Biotechnology Ltd | 用於治療TNFα相關失調症之多重可變劑量療法 |
| GB0414054D0 (en) | 2004-06-23 | 2004-07-28 | Owen Mumford Ltd | Improvements relating to automatic injection devices |
| WO2006041970A2 (en) * | 2004-10-08 | 2006-04-20 | Abbott Biotechnology Ltd. | Treatment of respiratory syncytial virus (rsv) infection |
| DK1836665T3 (da) * | 2004-11-19 | 2013-04-15 | Glaxosmithkline Llc | Fremgangsmåde til specialtilpasset afgivelse af medikamentkombinationsprodukter med variabel dosis til individualisering af terapier |
| NZ591701A (en) * | 2005-05-16 | 2012-11-30 | Abbott Biotech Ltd | Use of tnf inhibitor for treatment of erosive polyarthritis |
| US20070041905A1 (en) * | 2005-08-19 | 2007-02-22 | Hoffman Rebecca S | Method of treating depression using a TNF-alpha antibody |
| EP1948235B1 (en) * | 2005-11-01 | 2013-08-28 | AbbVie Biotechnology Ltd | Methods for determining efficacy of adalimumab in subjects having ankylosing spondylitis using ctx-ii and mmp3 as biomarkers |
| EP3620469A1 (en) | 2006-02-28 | 2020-03-11 | Biogen MA Inc. | Methods of treating inflammatory and autoimmune diseases with natalizumab |
| JP2009531304A (ja) * | 2006-02-28 | 2009-09-03 | エラン ファーマシューティカルズ,インコーポレイテッド | α−4阻害剤化合物を用いて炎症性疾患および自己免疫疾患を治療する方法 |
| CN101437541A (zh) * | 2006-03-03 | 2009-05-20 | 伊兰药品公司 | 用那他珠单抗治疗炎性疾病和自身免疫病的方法 |
| EP2035038A4 (en) * | 2006-04-03 | 2011-04-06 | Stowers Inst For Medical Res | COMPOSITIONS AND METHODS FOR TREATING POLYCYSTIC KIDNEY DISEASE |
| NZ611859A (en) | 2006-04-05 | 2014-12-24 | Abbvie Biotechnology Ltd | Antibody purification |
| US20090317399A1 (en) * | 2006-04-10 | 2009-12-24 | Pollack Paul F | Uses and compositions for treatment of CROHN'S disease |
| CA2564435A1 (en) * | 2006-04-10 | 2007-10-10 | Abbott Biotechnology Ltd. | Methods for monitoring and treating intestinal disorders |
| WO2007120656A2 (en) * | 2006-04-10 | 2007-10-25 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of rheumatoid arthritis |
| EP2012586A4 (en) | 2006-04-10 | 2010-08-18 | Abbott Biotech Ltd | USES AND COMPOSITIONS FOR THE TREATMENT OF ANKYLOSANTE SPONDYLARTHRITIS |
| US20080118496A1 (en) * | 2006-04-10 | 2008-05-22 | Medich John R | Uses and compositions for treatment of juvenile rheumatoid arthritis |
| US9624295B2 (en) | 2006-04-10 | 2017-04-18 | Abbvie Biotechnology Ltd. | Uses and compositions for treatment of psoriatic arthritis |
| EP2666478A3 (en) | 2006-04-10 | 2014-10-22 | AbbVie Biotechnology Ltd | Uses and compositions for treatment of psoriasis |
| WO2007120823A2 (en) * | 2006-04-10 | 2007-10-25 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of psoriasis |
| US9605064B2 (en) * | 2006-04-10 | 2017-03-28 | Abbvie Biotechnology Ltd | Methods and compositions for treatment of skin disorders |
| US20080131374A1 (en) * | 2006-04-19 | 2008-06-05 | Medich John R | Uses and compositions for treatment of rheumatoid arthritis |
| US20080311043A1 (en) * | 2006-06-08 | 2008-12-18 | Hoffman Rebecca S | Uses and compositions for treatment of psoriatic arthritis |
| US20100021451A1 (en) * | 2006-06-08 | 2010-01-28 | Wong Robert L | Uses and compositions for treatment of ankylosing spondylitis |
| TWI498137B (zh) * | 2006-06-30 | 2015-09-01 | Abbvie Biotechnology Ltd | 自動注射裝置 |
| CA2692428A1 (en) * | 2006-07-07 | 2008-01-10 | James R. Gorman | Methods for preventing, postponing or improving the outcome of invasive spinal procedures |
| BRPI0717335A2 (pt) | 2006-10-27 | 2013-12-10 | Abbott Biotech Ltd | Anticorpos anti-htnfalfa cristalinos |
| US20100303777A1 (en) * | 2006-12-14 | 2010-12-02 | Actogenix N.V. | Delivery of binding molecules to induce immunomodulation |
| EP2160475A4 (en) * | 2007-05-22 | 2011-02-09 | Centocor Ortho Biotech Inc | MARKERS AND METHOD FOR EVALUATING AND TREATING CROHN'S DISEASE AND ASSOCIATED DISORDERS |
| EP2679996A1 (en) * | 2007-05-31 | 2014-01-01 | AbbVie Inc. | Biomarkers predictive of the responsiveness to TNF-alfa inhibitors in autoimmune disorders |
| US8999337B2 (en) * | 2007-06-11 | 2015-04-07 | Abbvie Biotechnology Ltd. | Methods for treating juvenile idiopathic arthritis by inhibition of TNFα |
| WO2009011782A2 (en) * | 2007-07-13 | 2009-01-22 | Abbott Biotechnology Ltd. | METHODS AND COMPOSITIONS FOR PULMONARY ADMINISTRATION OF A TNFa INHIBITOR |
| US8753839B2 (en) | 2007-08-08 | 2014-06-17 | Abbvie Inc. | Compositions and methods for crystallizing antibodies |
| WO2009046168A1 (en) * | 2007-10-02 | 2009-04-09 | Avaxia Biologics, Inc. | Antibody therapy for use in the digestive tract |
| US8647626B2 (en) | 2007-10-02 | 2014-02-11 | Avaxia Biologics, Incorporated | Compositions comprising TNF-specific antibodies for oral delivery |
| CA2707483A1 (en) * | 2007-11-30 | 2009-06-11 | Wolfgang Fraunhofer | Protein formulations and methods of making same |
| US8883146B2 (en) | 2007-11-30 | 2014-11-11 | Abbvie Inc. | Protein formulations and methods of making same |
| SI2808343T1 (sl) | 2007-12-26 | 2019-10-30 | Xencor Inc | Fc-variante s spremenjeno vezavo na FcRn |
| WO2009086550A1 (en) * | 2008-01-03 | 2009-07-09 | Abbott Laboratories | Predicting long-term efficacy of a compound in the treatment of psoriasis |
| MX2010007728A (es) | 2008-01-15 | 2010-12-21 | Abbott Gmbh & Co Kg | Composiciones proteinicas en polvo y metodos para elaborar las mismas. |
| US20100183558A1 (en) | 2008-10-17 | 2010-07-22 | Zhennan Lai | Safe lentiviral vectors for targeted delivery of multiple therapeutic molecules |
| US8722860B2 (en) * | 2009-04-16 | 2014-05-13 | Abbvie Biotherapeutics Inc. | Anti-TNF-α antibodies and their uses |
| JP5677411B2 (ja) | 2009-04-29 | 2015-02-25 | アッヴィ バイオテクノロジー リミテッド | 自動注入機器 |
| RU2582401C2 (ru) * | 2009-12-15 | 2016-04-27 | Эббви Байотекнолоджи Лтд | Усовершенствованная пусковая кнопка для автоматического инъекционного устройства |
| AU2010330907A1 (en) | 2009-12-16 | 2012-06-14 | Bosch, Phillip | Methods of treating interstitial cystitis |
| US11287423B2 (en) | 2010-01-11 | 2022-03-29 | Biogen Ma Inc. | Assay for JC virus antibodies |
| HRP20221390T1 (hr) | 2010-01-11 | 2023-01-06 | Biogen Ma Inc. | Analiza za antitijela jc virusa |
| JP2013523153A (ja) * | 2010-04-07 | 2013-06-17 | アッヴィ・インコーポレイテッド | TNF−α結合タンパク質 |
| WO2011146727A1 (en) | 2010-05-19 | 2011-11-24 | Philip Bosch | Methods of treating interstitial cystitis |
| US8747854B2 (en) * | 2010-06-03 | 2014-06-10 | Abbvie Biotechnology Ltd. | Methods of treating moderate to severe hidradenitis suppurativa with anti-TNF-alpha antibodies |
| US20120076791A1 (en) * | 2010-09-29 | 2012-03-29 | Philip Bosch | Methods Of Treating Chronic Prostatitis/Chronic Pelvic Pain Syndrome |
| CN103154031A (zh) | 2010-10-08 | 2013-06-12 | 诺华有限公司 | 利用il-17拮抗剂治疗牛皮癣的方法 |
| CA2815689C (en) | 2010-11-11 | 2016-11-22 | Abbvie Biotechnology Ltd. | Improved high concentration anti-tnf.alpha. antibody liquid formulations |
| MX337208B (es) | 2011-01-24 | 2016-02-17 | Abbvie Biotechnology Ltd | Dispositivos de inyeccion automaticos que tienen superficies de agarre sobremoldeadas. |
| EP2702077A2 (en) | 2011-04-27 | 2014-03-05 | AbbVie Inc. | Methods for controlling the galactosylation profile of recombinantly-expressed proteins |
| JP2014516944A (ja) | 2011-04-29 | 2014-07-17 | ブリストル−マイヤーズ スクイブ カンパニー | Ip10抗体の用量漸増計画 |
| EP2786156A2 (en) | 2011-11-30 | 2014-10-08 | AbbVie Deutschland GmbH & Co KG | Methods and compositions for determining responsiveness to treatment with a tnf-alpha inhibitor |
| WO2013158628A1 (en) * | 2012-04-16 | 2013-10-24 | New York University | Modulation of angiotensin ii peceptors for the prevention and treatment of cerebral malaria |
| US9067990B2 (en) | 2013-03-14 | 2015-06-30 | Abbvie, Inc. | Protein purification using displacement chromatography |
| US9181572B2 (en) | 2012-04-20 | 2015-11-10 | Abbvie, Inc. | Methods to modulate lysine variant distribution |
| US9150645B2 (en) | 2012-04-20 | 2015-10-06 | Abbvie, Inc. | Cell culture methods to reduce acidic species |
| WO2013176754A1 (en) | 2012-05-24 | 2013-11-28 | Abbvie Inc. | Novel purification of antibodies using hydrophobic interaction chromatography |
| US9512214B2 (en) | 2012-09-02 | 2016-12-06 | Abbvie, Inc. | Methods to control protein heterogeneity |
| KR20150043523A (ko) | 2012-09-02 | 2015-04-22 | 애브비 인코포레이티드 | 단백질 불균일성의 제어 방법 |
| MX2015003541A (es) * | 2012-09-19 | 2015-10-26 | Abbvie Biotherapeutics Inc | Metodos para identificar los anticuerpos con inmunogenia reducida. |
| EP2830651A4 (en) | 2013-03-12 | 2015-09-02 | Abbvie Inc | HUMAN ANTIBODIES THAT BIND TNF-ALPHA AND PREPARATION METHODS |
| WO2014151878A2 (en) | 2013-03-14 | 2014-09-25 | Abbvie Inc. | Methods for modulating protein glycosylation profiles of recombinant protein therapeutics using monosaccharides and oligosacharides |
| WO2014159579A1 (en) | 2013-03-14 | 2014-10-02 | Abbvie Inc. | MUTATED ANTI-TNFα ANTIBODIES AND METHODS OF THEIR USE |
| US9017687B1 (en) | 2013-10-18 | 2015-04-28 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same using displacement chromatography |
| US10119976B2 (en) | 2013-05-28 | 2018-11-06 | Biogen Ma Inc. | Method of assessing risk of PML |
| US9598667B2 (en) | 2013-10-04 | 2017-03-21 | Abbvie Inc. | Use of metal ions for modulation of protein glycosylation profiles of recombinant proteins |
| AU2014337263B2 (en) | 2013-10-16 | 2019-12-12 | Outlook Therapeutics, Inc. | Buffer formulations for enhanced antibody stability |
| US8946395B1 (en) | 2013-10-18 | 2015-02-03 | Abbvie Inc. | Purification of proteins using hydrophobic interaction chromatography |
| US9085618B2 (en) | 2013-10-18 | 2015-07-21 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same |
| US9181337B2 (en) | 2013-10-18 | 2015-11-10 | Abbvie, Inc. | Modulated lysine variant species compositions and methods for producing and using the same |
| WO2015073884A2 (en) | 2013-11-15 | 2015-05-21 | Abbvie, Inc. | Glycoengineered binding protein compositions |
| US20170183376A1 (en) | 2014-06-24 | 2017-06-29 | Insight Biopharmaceuticals Ltd. | Methods of purifying antibodies |
| WO2016103093A1 (en) | 2014-12-23 | 2016-06-30 | Pfizer Inc. | Stable aqueous antibody formulation for anti tnf alpha antibodies |
| US9452344B2 (en) * | 2015-01-02 | 2016-09-27 | William J Ritter | Puck system |
| WO2016118707A1 (en) | 2015-01-21 | 2016-07-28 | Oncobiologics, Inc. | Modulation of charge variants in a monoclonal antibody composition |
| KR102622281B1 (ko) | 2015-03-31 | 2024-01-08 | 소리소 파마슈티컬스 인크. | 폴리펩티드 |
| EP3078675A1 (en) | 2015-04-10 | 2016-10-12 | Ares Trading S.A. | Induction dosing regimen for the treatment of tnf alpha mediated disorders |
| EP3307253A4 (en) | 2015-06-12 | 2018-11-21 | Georgia State University Research Foundation, Inc. | Compositions and methods for treating opioid tolerance |
| US20170104172A1 (en) * | 2015-10-12 | 2017-04-13 | The Regents Of The University Of Michigan | Organic Light Emitting Diode Having a Mixed Blocking Layer |
| CN105294863B (zh) * | 2015-11-13 | 2019-01-22 | 叶才果 | 双功能抗体及其用途 |
| GB201522394D0 (en) * | 2015-12-18 | 2016-02-03 | Ucb Biopharma Sprl | Antibodies |
| DK3402483T3 (da) | 2016-01-15 | 2024-01-02 | American Gene Tech Int Inc | Fremgangsmåder og sammensætninger til aktivering af gamma-delta-T-celler |
| US10137144B2 (en) | 2016-01-15 | 2018-11-27 | American Gene Technologies International Inc. | Methods and compositions for the activation of gamma-delta T-cells |
| WO2017136433A1 (en) | 2016-02-03 | 2017-08-10 | Oncobiologics, Inc. | Buffer formulations for enhanced antibody stability |
| US10465003B2 (en) * | 2016-02-05 | 2019-11-05 | Janssen Biotech, Inc. | Anti-TNF antibodies, compositions, methods and use for the treatment or prevention of type 1 diabetes |
| US10888613B2 (en) | 2016-02-08 | 2021-01-12 | American Gene Technologies International Inc. | Method of producing cells resistant to HIV infection |
| JP6741774B2 (ja) | 2016-03-08 | 2020-08-19 | メレオ バイオファーマ 1 リミテッド | 慢性閉塞性肺疾患の急性増悪の治療のための投与レジメン |
| KR20180119597A (ko) | 2016-03-08 | 2018-11-02 | 메레오 바이오파마 1 리미티드 | 염증 상태의 급성 악화의 치료를 위한 투약법 |
| WO2017156311A2 (en) | 2016-03-09 | 2017-09-14 | American Gene Technologies International Inc. | Combination vectors and methods for treating cancer |
| EP3468617A4 (en) * | 2016-06-08 | 2020-01-22 | American Gene Technologies International Inc. | INTEGRATED VIRAL ADMINISTRATION SYSTEM AND RELATED METHODS |
| JP6971492B2 (ja) | 2016-07-08 | 2021-11-24 | アメリカン ジーン テクノロジーズ インターナショナル インコーポレイテッド | Hiv予備免疫化および免疫療法 |
| JP7176756B2 (ja) | 2016-07-21 | 2022-11-22 | アメリカン ジーン テクノロジーズ インターナショナル インコーポレイテッド | パーキンソン病を処置するためのウイルスベクター |
| WO2018060453A1 (en) | 2016-09-30 | 2018-04-05 | Vhsquared Limited | Compositions |
| US11820999B2 (en) | 2017-04-03 | 2023-11-21 | American Gene Technologies International Inc. | Compositions and methods for treating phenylketonuria |
| US20200188482A1 (en) * | 2017-04-28 | 2020-06-18 | The Brigham And Women`S Hospital, Inc. | Targeting gamma-delta t cells in obesity and cachexia |
| KR20190024572A (ko) * | 2017-08-30 | 2019-03-08 | (주)셀트리온 | TNFα 관련 질환을 치료하기 위한 피하 투여 요법 |
| DE102017215154A1 (de) | 2017-08-30 | 2019-02-28 | Markus Bläss | Zusammensetzung zur topischen Behandlung von nicht-Mikroorganismus-verursachten entzündlichen Haut- und Schleimhauterkrankungen |
| ES2884789T3 (es) | 2017-12-11 | 2021-12-13 | Mereo Biopharma 1 Ltd | Uso de 3-[5-amino-4-(3-cianobenzoil)-pirazol-1-il]-N-ciclopropil-4-metilbenzamida en el tratamiento de exacerbaciones agudas de la enfermedad pulmonar obstructiva crónica |
| ES2882978T3 (es) | 2017-12-11 | 2021-12-03 | Mereo Biopharma 1 Ltd | Uso de 3-[5-amino-4-(3-cianobenzoil)-pirazol-1-il]-N-ciclopropil-4-metilbenzamida en la prevención de exacerbaciones agudas de la enfermedad de obstrucción pulmonar crónica |
| KR101982667B1 (ko) | 2018-12-24 | 2019-05-27 | 가톨릭대학교 산학협력단 | 신규한 유도체를 유효성분으로 포함하는 tnf-관련 질환 예방 또는 치료용 조성물 및 이를 이용한 tnf 활성 억제 방법 |
| AR118191A1 (es) * | 2019-02-28 | 2021-09-22 | Celltrion Inc | MÉTODOS PARA EL TRATAMIENTO DE ENFERMEDADES RELACIONADAS CON TNFa |
| EP3947450A4 (en) * | 2019-04-05 | 2023-05-31 | The Regents Of The University Of California | METHODS AND COMPOSITIONS INVOLVING CHIMERIC BINDING POLYPEPTIDES |
| CA3144566A1 (en) | 2019-06-21 | 2020-12-24 | Sorriso Pharmaceuticals, Inc. | Polypeptides |
| EP3986571A1 (en) | 2019-06-21 | 2022-04-27 | Sorriso Pharmaceuticals, Inc. | Polypeptides |
| WO2021096199A1 (ko) * | 2019-11-11 | 2021-05-20 | 에스케이케미칼 주식회사 | 피리메타민을 유효성분으로 포함하는 면역 관련 질환의 치료 또는 예방용 약학 조성물 |
| WO2021152587A1 (en) | 2020-01-30 | 2021-08-05 | Yeda Research And Development Co. Ltd. | Treating acute liver disease with tlr-mik inhibitors |
| WO2022010150A1 (ko) | 2020-07-07 | 2022-01-13 | (주)아이랩 | 신규한 tnf 활성 억제제 화합물 및 이의 약학적으로 허용가능한 염 |
Family Cites Families (119)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2859205A (en) * | 1954-08-06 | 1958-11-04 | Monsanto Chemicals | Process of making styrenated phenolformaldehyde resins |
| US4634665A (en) | 1980-02-25 | 1987-01-06 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US5179017A (en) | 1980-02-25 | 1993-01-12 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| AU560087B2 (en) | 1981-09-08 | 1987-03-26 | Rockefeller University, The | Lipoprotein lipase suppression by endotoxin-induced mediator (shock assay) |
| US4510245A (en) | 1982-11-18 | 1985-04-09 | Chiron Corporation | Adenovirus promoter system |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| EP0154316B1 (en) | 1984-03-06 | 1989-09-13 | Takeda Chemical Industries, Ltd. | Chemically modified lymphokine and production thereof |
| US5672347A (en) | 1984-07-05 | 1997-09-30 | Genentech, Inc. | Tumor necrosis factor antagonists and their use |
| IL73883A (en) | 1984-12-20 | 1990-12-23 | Yeda Res & Dev | Monoclonal antibodies against tnf-alpha,hybridomas producing them and method for the purification of tnf-alpha |
| US5168062A (en) | 1985-01-30 | 1992-12-01 | University Of Iowa Research Foundation | Transfer vectors and microorganisms containing human cytomegalovirus immediate-early promoter-regulatory DNA sequence |
| EP0212489B1 (en) | 1985-08-16 | 1994-11-30 | The Rockefeller University | Anabolic activity modulator and uses thereof |
| US4968615A (en) | 1985-12-18 | 1990-11-06 | Ciba-Geigy Corporation | Deoxyribonucleic acid segment from a virus |
| EP0230574A3 (en) | 1986-01-31 | 1989-03-22 | Yale University | Pharmaceutical compositions against infections caused by lav/htlv iii virus and the use thereof |
| DE3631229A1 (de) | 1986-09-13 | 1988-03-24 | Basf Ag | Monoklonale antikoerper gegen humanen tumornekrosefaktor (tnf) und deren verwendung |
| JP2638652B2 (ja) | 1988-07-18 | 1997-08-06 | カイロン・コーポレーション | カケクチンと反応するモノクロナール抗体 |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| DE68914244T2 (de) | 1988-10-24 | 1994-10-27 | Otsuka Pharma Co Ltd | Monoklonaler Antikörper. |
| DE68927671T2 (de) | 1988-12-19 | 1997-05-07 | American Cyanamid Co | Produkte zur Behandlung des Endotoxin -Schocks bei einem Säugetier |
| DE68925966T2 (de) | 1988-12-22 | 1996-08-29 | Kirin Amgen Inc | Chemisch modifizierte granulocytenkolonie erregender faktor |
| CA2003981C (en) | 1988-12-27 | 2000-06-13 | Hiroshi Ishimaru | Pharmaceutical compositions and use thereof in the treatment of psoriasis |
| EP0486526B2 (en) | 1989-08-07 | 2001-03-07 | Peptech Limited | Tumour necrosis factor binding ligands |
| WO1991003553A1 (en) | 1989-09-05 | 1991-03-21 | Immunex Corporation | TUMOR NECROSIS FACTOR-α AND -β RECEPTORS |
| GB8921123D0 (en) | 1989-09-19 | 1989-11-08 | Millar Ann B | Treatment of ards |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| DE4037604A1 (de) | 1990-04-25 | 1991-10-31 | Bayer Ag | Verwendung von anti-tnf-antikoerpern als arzneimittel bei der behandlung von ischaemien und deren folgen |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| GB9014932D0 (en) | 1990-07-05 | 1990-08-22 | Celltech Ltd | Recombinant dna product and method |
| DK0585287T3 (da) | 1990-07-10 | 2000-04-17 | Cambridge Antibody Tech | Fremgangsmåde til fremstilling af specifikke bindingsparelementer |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| ES2113940T3 (es) | 1990-12-03 | 1998-05-16 | Genentech Inc | Metodo de enriquecimiento para variantes de proteinas con propiedades de union alteradas. |
| GB2279077B (en) | 1990-12-21 | 1995-06-14 | Celltech Ltd | Therapeutic compositions comprising recombinant antibodies specific for the TNFalpha |
| GB9109645D0 (en) | 1991-05-03 | 1991-06-26 | Celltech Ltd | Recombinant antibodies |
| US5994510A (en) | 1990-12-21 | 1999-11-30 | Celltech Therapeutics Limited | Recombinant antibodies specific for TNFα |
| GB9028123D0 (en) | 1990-12-28 | 1991-02-13 | Erba Carlo Spa | Monoclonal antibodies against human tumor necrosis factor alpha |
| DE69233697T2 (de) | 1991-03-01 | 2008-01-24 | Dyax Corp., Cambridge | Verfahren zur Entwicklung von bindenden Mikroproteinen |
| SG47099A1 (en) | 1991-03-15 | 1998-03-20 | Amgen Boulder Inc | Pegylation of polypeptides |
| US20060246073A1 (en) | 1991-03-18 | 2006-11-02 | Knight David M | Anti-TNF antibodies and peptides of human tumor necrosis factor |
| US7192584B2 (en) | 1991-03-18 | 2007-03-20 | Centocor, Inc. | Methods of treating psoriasis with anti-TNF antibodies |
| US5656272A (en) | 1991-03-18 | 1997-08-12 | New York University Medical Center | Methods of treating TNF-α-mediated Crohn's disease using chimeric anti-TNF antibodies |
| DK0610201T4 (da) | 1991-03-18 | 2008-02-04 | Centocor Inc | Monoklonale og kimære antistoffer, der er specifikke for human tumornekrosefaktor |
| US20070298040A1 (en) | 1991-03-18 | 2007-12-27 | Centocor, Inc. | Methods of treating seronegative arthropathy with anti-TNF antibodies |
| US20040120952A1 (en) | 2000-08-07 | 2004-06-24 | Centocor, Inc | Anti-TNF antibodies and peptides of human tumor necrosis factor |
| DK0604418T3 (da) | 1991-03-29 | 1999-06-14 | Immunex Corp | Isolerede viralproteincytokinantagonister |
| DE69233750D1 (de) | 1991-04-10 | 2009-01-02 | Scripps Research Inst | Bibliotheken heterodimerer Rezeptoren mittels Phagemiden |
| DE4122599C2 (de) | 1991-07-08 | 1993-11-11 | Deutsches Krebsforsch | Phagemid zum Screenen von Antikörpern |
| DK0605522T3 (da) | 1991-09-23 | 2000-01-17 | Medical Res Council | Fremgangsmåde til fremstilling af humaniserede antistoffer |
| AU3244693A (en) | 1991-12-17 | 1993-07-19 | Schering Corporation | Use of the combination of anti-tumor necrosis factor plus interleukin-6 to treat septic shock |
| US5605923A (en) | 1992-04-02 | 1997-02-25 | Smithkline Beecham Corporation | Compounds useful for treating inflammatory diseases and inhibiting production of tumor necrosis factor |
| ATE172880T1 (de) | 1992-08-28 | 1998-11-15 | Bayer Ag | Verwendung von monoklonalen anti-tnf-antikörpern für die behandlung von bakteriellen meningitiden |
| NZ256293A (en) | 1992-09-15 | 1997-06-24 | Immunex Corp | Method of treating tumour necrosis factor - mediated inflammation by use of tnf antagonist |
| US6270766B1 (en) | 1992-10-08 | 2001-08-07 | The Kennedy Institute Of Rheumatology | Anti-TNF antibodies and methotrexate in the treatment of arthritis and crohn's disease |
| AU682156B2 (en) | 1992-10-15 | 1997-09-25 | Dana-Farber Cancer Institute, Inc. | Treatment of insulin resistance in obesity linked type II diabetes using antagonists to TNF-alpha function |
| DK0614984T4 (da) | 1993-03-05 | 2010-12-20 | Bayer Healthcare Llc | Humane monoklonale anti-TNF-alfa-antistoffer |
| DE4307508A1 (de) | 1993-03-10 | 1994-09-15 | Knoll Ag | Verwendung von anti-TNF-Antikörpern als Arzneimittel bei der Behandlung von Herzinsuffizienz (Herzmuskelschwäche) |
| GB2294267B (en) | 1993-06-03 | 1996-11-20 | Therapeutic Antibodies Inc | Anti-TNFalpha Fab fragments derived from polyclonal IgG antibodies |
| EP0659766A1 (en) | 1993-11-23 | 1995-06-28 | Schering-Plough | Human monoclonal antibodies against human cytokines and methods of making and using such antibodies |
| NZ278607A (en) | 1994-02-07 | 1999-05-28 | Knoll Ag | Use of tnf antagonists for treating disorders involving elevated serum levels of il-6 wherein the serum levels are 500pg/ml or above |
| WO1995023813A1 (en) | 1994-03-04 | 1995-09-08 | Merck & Co., Inc. | In vitro antibody affinity maturation using alanine scanning mutagenesis |
| AU2365795A (en) | 1995-04-20 | 1996-11-07 | Centocor Inc. | Multiple administrations of anti-tnf antibody |
| US6090382A (en) | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| RU2270030C2 (ru) | 1996-02-09 | 2006-02-20 | Абботт Байотекнолоджи эЛтиди. | СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ ЧЕЛОВЕЧЕСКОГО TNFα (ВАРИАНТЫ), ПРИМЕНЕНИЕ ВЫДЕЛЕННОГО АНТИТЕЛА ЧЕЛОВЕКА ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА В КАЧЕСТВЕ КОМПОНЕНТА ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА (ВАРИАНТЫ) И ВЫДЕЛЕННОЕ ЧЕЛОВЕЧЕСКОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ |
| EP0938334A4 (en) | 1996-07-26 | 2004-12-15 | Smithkline Beecham Corp | IMPROVED METHOD FOR TREATING IMMUNE-MEDIATED SYSTEMIC DISEASES |
| DE60003863T2 (de) | 1999-03-31 | 2004-04-22 | Pfizer Products Inc., Groton | Dioxocyclopentylhydroxamsäure |
| WO2001000229A1 (en) | 1999-06-24 | 2001-01-04 | Pharmacia Corporation | Combination of tumors necrocis factor (tnf) antagonists and cox-2 inhibitors for the treatment of inflammation |
| ES2330301T3 (es) | 1999-08-27 | 2009-12-09 | Genentech, Inc. | Dosificaciones para tratamiento con anticuerpos anti-erbb2. |
| AU6875900A (en) | 1999-09-08 | 2001-04-10 | Chugai Seiyaku Kabushiki Kaisha | Protein solution preparation and method of stabilizing the same |
| AU3082401A (en) | 1999-11-24 | 2001-06-04 | Centocor Inc. | Therapy of psoriasis |
| DE60137421D1 (de) * | 2000-06-29 | 2009-03-05 | Abbott Lab | Antikörper mit zwei spezifizitäten und verfahren zur deren herstellung und verwendung |
| DE10034390C2 (de) | 2000-07-14 | 2003-06-26 | Eads Deutschland Gmbh | Drucksensor und Verfahren zu seiner Herstellung, sowie Verbrennungskraftmaschine mit Drucksensor |
| US20060018907A1 (en) | 2000-08-07 | 2006-01-26 | Centocor, Inc. | Anti-TNF antibodies and peptides of human tumor necrosis factor |
| US20050249735A1 (en) | 2000-08-07 | 2005-11-10 | Centocor, Inc. | Methods of treating ankylosing spondylitis using anti-TNF antibodies and peptides of human tumor necrosis factor |
| UA81743C2 (uk) | 2000-08-07 | 2008-02-11 | Центокор, Инк. | МОНОКЛОНАЛЬНЕ АНТИТІЛО ЛЮДИНИ, ЩО СПЕЦИФІЧНО ЗВ'ЯЗУЄТЬСЯ З ФАКТОРОМ НЕКРОЗУ ПУХЛИН АЛЬФА (ФНПα), ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ, ЩО ЙОГО МІСТИТЬ, ТА СПОСІБ ЛІКУВАННЯ РЕВМАТОЇДНОГО АРТРИТУ |
| KR20030074693A (ko) | 2000-12-28 | 2003-09-19 | 알투스 바이올로직스 인코포레이티드 | 전항체 및 이의 단편의 결정과 이의 제조 및 사용 방법 |
| US20030012786A1 (en) | 2001-05-25 | 2003-01-16 | Teoh Leah S. | Use of anti-TNF antibodies as drugs in treating septic disorders of anemic patients |
| CA2868614A1 (en) | 2001-06-08 | 2002-12-08 | Abbott Laboratories (Bermuda) Ltd. | Methods of administering anti-tnf.alpha. antibodies |
| US20030161828A1 (en) | 2002-02-19 | 2003-08-28 | Abbott Gmbh & Co. Kg | Use of TNF antagonists as drugs for the treatment of patients with an inflammatory reaction and without suffering from total organ failure |
| US20030206898A1 (en) | 2002-04-26 | 2003-11-06 | Steven Fischkoff | Use of anti-TNFalpha antibodies and another drug |
| US20040009172A1 (en) | 2002-04-26 | 2004-01-15 | Steven Fischkoff | Use of anti-TNFalpha antibodies and another drug |
| US20090280065A1 (en) | 2006-04-10 | 2009-11-12 | Willian Mary K | Uses and Compositions for Treatment of Psoriasis |
| AU2003267999B2 (en) | 2002-07-19 | 2010-03-11 | Abbvie Biotechnology Ltd | Treatment of TNFalpha related disorders |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| MY150740A (en) | 2002-10-24 | 2014-02-28 | Abbvie Biotechnology Ltd | Low dose methods for treating disorders in which tnf? activity is detrimental |
| US7285256B2 (en) | 2003-04-04 | 2007-10-23 | Newmont Usa Limited | Precious metal recovery using thiocyanate lixiviant |
| TWI439284B (zh) * | 2004-04-09 | 2014-06-01 | Abbvie Biotechnology Ltd | 用於治療TNFα相關失調症之多重可變劑量療法 |
| WO2006041970A2 (en) | 2004-10-08 | 2006-04-20 | Abbott Biotechnology Ltd. | Treatment of respiratory syncytial virus (rsv) infection |
| NZ591701A (en) | 2005-05-16 | 2012-11-30 | Abbott Biotech Ltd | Use of tnf inhibitor for treatment of erosive polyarthritis |
| US20070041905A1 (en) | 2005-08-19 | 2007-02-22 | Hoffman Rebecca S | Method of treating depression using a TNF-alpha antibody |
| EP1948235B1 (en) | 2005-11-01 | 2013-08-28 | AbbVie Biotechnology Ltd | Methods for determining efficacy of adalimumab in subjects having ankylosing spondylitis using ctx-ii and mmp3 as biomarkers |
| NZ611859A (en) | 2006-04-05 | 2014-12-24 | Abbvie Biotechnology Ltd | Antibody purification |
| US9624295B2 (en) | 2006-04-10 | 2017-04-18 | Abbvie Biotechnology Ltd. | Uses and compositions for treatment of psoriatic arthritis |
| US9605064B2 (en) | 2006-04-10 | 2017-03-28 | Abbvie Biotechnology Ltd | Methods and compositions for treatment of skin disorders |
| EP2012586A4 (en) | 2006-04-10 | 2010-08-18 | Abbott Biotech Ltd | USES AND COMPOSITIONS FOR THE TREATMENT OF ANKYLOSANTE SPONDYLARTHRITIS |
| US20080118496A1 (en) | 2006-04-10 | 2008-05-22 | Medich John R | Uses and compositions for treatment of juvenile rheumatoid arthritis |
| WO2007120656A2 (en) | 2006-04-10 | 2007-10-25 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of rheumatoid arthritis |
| US20090317399A1 (en) | 2006-04-10 | 2009-12-24 | Pollack Paul F | Uses and compositions for treatment of CROHN'S disease |
| US20080131374A1 (en) | 2006-04-19 | 2008-06-05 | Medich John R | Uses and compositions for treatment of rheumatoid arthritis |
| US20080311043A1 (en) | 2006-06-08 | 2008-12-18 | Hoffman Rebecca S | Uses and compositions for treatment of psoriatic arthritis |
| US20100021451A1 (en) | 2006-06-08 | 2010-01-28 | Wong Robert L | Uses and compositions for treatment of ankylosing spondylitis |
| TWI498137B (zh) | 2006-06-30 | 2015-09-01 | Abbvie Biotechnology Ltd | 自動注射裝置 |
| AU2007294731B2 (en) | 2006-09-13 | 2014-04-17 | Abbvie Inc. | Cell culture improvements |
| BRPI0717335A2 (pt) | 2006-10-27 | 2013-12-10 | Abbott Biotech Ltd | Anticorpos anti-htnfalfa cristalinos |
| EP2679996A1 (en) | 2007-05-31 | 2014-01-01 | AbbVie Inc. | Biomarkers predictive of the responsiveness to TNF-alfa inhibitors in autoimmune disorders |
| WO2008150490A2 (en) | 2007-06-01 | 2008-12-11 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of psoriasis and crohn's disease |
| US8999337B2 (en) | 2007-06-11 | 2015-04-07 | Abbvie Biotechnology Ltd. | Methods for treating juvenile idiopathic arthritis by inhibition of TNFα |
| WO2009011782A2 (en) | 2007-07-13 | 2009-01-22 | Abbott Biotechnology Ltd. | METHODS AND COMPOSITIONS FOR PULMONARY ADMINISTRATION OF A TNFa INHIBITOR |
| US8753839B2 (en) | 2007-08-08 | 2014-06-17 | Abbvie Inc. | Compositions and methods for crystallizing antibodies |
| MX2010002269A (es) | 2007-08-28 | 2010-03-25 | Abbott Biotech Ltd | Composiciones y metodos que comprenden proteinas de union para adalimumab. |
| US8883146B2 (en) | 2007-11-30 | 2014-11-11 | Abbvie Inc. | Protein formulations and methods of making same |
| CA2707483A1 (en) | 2007-11-30 | 2009-06-11 | Wolfgang Fraunhofer | Protein formulations and methods of making same |
| WO2009086550A1 (en) | 2008-01-03 | 2009-07-09 | Abbott Laboratories | Predicting long-term efficacy of a compound in the treatment of psoriasis |
| EP2784089A1 (en) | 2008-01-15 | 2014-10-01 | AbbVie Inc. | Improved mammalian expression vectors and uses thereof |
| MX2010007728A (es) | 2008-01-15 | 2010-12-21 | Abbott Gmbh & Co Kg | Composiciones proteinicas en polvo y metodos para elaborar las mismas. |
| MX2010010503A (es) | 2008-03-24 | 2010-11-09 | Abbott Biotech Ltd | Metodos y composiciones para tratar perdida osea. |
| JP5677411B2 (ja) | 2009-04-29 | 2015-02-25 | アッヴィ バイオテクノロジー リミテッド | 自動注入機器 |
| RU2560701C2 (ru) | 2009-05-04 | 2015-08-20 | Эббви Байотекнолоджи Лтд. | Стабильные композиции с высокими концентрациями белков антител человека против tnf-альфа |
| US20120014956A1 (en) | 2010-02-02 | 2012-01-19 | Hartmut Kupper | Methods and compositions for predicting responsiveness to treatment with tnf-alpha inhibitor |
| US8747854B2 (en) | 2010-06-03 | 2014-06-10 | Abbvie Biotechnology Ltd. | Methods of treating moderate to severe hidradenitis suppurativa with anti-TNF-alpha antibodies |
-
2005
- 2005-04-08 TW TW094111276A patent/TWI439284B/zh active
- 2005-04-08 TW TW105115825A patent/TW201705980A/zh unknown
- 2005-04-08 TW TW103101889A patent/TWI556829B/zh active
- 2005-04-09 TW TW100135941A patent/TW201206478A/zh unknown
- 2005-04-11 ES ES05777317.8T patent/ES2611286T3/es active Active
- 2005-04-11 LT LTEP05777317.8T patent/LT1737491T/lt unknown
- 2005-04-11 JP JP2007507540A patent/JP5748317B2/ja active Active
- 2005-04-11 CA CA2970891A patent/CA2970891A1/en not_active Abandoned
- 2005-04-11 CA CA2504868A patent/CA2504868C/en active Active
- 2005-04-11 KR KR1020177008060A patent/KR20170036138A/ko not_active Application Discontinuation
- 2005-04-11 NZ NZ579302A patent/NZ579302A/en unknown
- 2005-04-11 KR KR1020167017366A patent/KR20160079933A/ko not_active Application Discontinuation
- 2005-04-11 AU AU2005244261A patent/AU2005244261B2/en active Active
- 2005-04-11 PL PL05777317T patent/PL1737491T3/pl unknown
- 2005-04-11 KR KR1020137022221A patent/KR101636446B1/ko active IP Right Grant
- 2005-04-11 EP EP05777317.8A patent/EP1737491B1/en active Active
- 2005-04-11 KR KR1020067023531A patent/KR101282801B1/ko active IP Right Grant
- 2005-04-11 CA CA 2847142 patent/CA2847142C/en active Active
- 2005-04-11 KR KR1020187023479A patent/KR20180094148A/ko not_active Application Discontinuation
- 2005-04-11 BR BRPI0509326-0A patent/BRPI0509326A/pt active Search and Examination
- 2005-04-11 CN CN201510459644.1A patent/CN105106951A/zh active Pending
- 2005-04-11 KR KR1020197009624A patent/KR20190039349A/ko not_active Application Discontinuation
- 2005-04-11 CN CN2012100807929A patent/CN102614512A/zh active Pending
- 2005-04-11 KR KR1020127028692A patent/KR101378873B1/ko active IP Right Grant
- 2005-04-11 EP EP10196132A patent/EP2338516A3/en not_active Withdrawn
- 2005-04-11 CN CN2013101166565A patent/CN103203019A/zh active Pending
- 2005-04-11 EP EP10196136A patent/EP2335731A3/en not_active Withdrawn
- 2005-04-11 CN CN2013101166334A patent/CN103251945A/zh active Pending
- 2005-04-11 DK DK05777317.8T patent/DK1737491T3/en active
- 2005-04-11 MX MXPA06011677A patent/MXPA06011677A/es active IP Right Grant
- 2005-04-11 CN CN201510461398.3A patent/CN105148273A/zh active Pending
- 2005-04-11 EP EP10196121A patent/EP2335732A3/en not_active Withdrawn
- 2005-04-11 NZ NZ549959A patent/NZ549959A/en unknown
- 2005-04-11 HU HUE05777317A patent/HUE031558T2/en unknown
- 2005-04-11 NZ NZ591362A patent/NZ591362A/xx unknown
- 2005-04-11 US US11/104,117 patent/US8889136B2/en active Active
- 2005-04-11 KR KR1020177036302A patent/KR20170143008A/ko not_active Application Discontinuation
- 2005-04-11 WO PCT/US2005/012007 patent/WO2005110452A2/en active Application Filing
- 2005-04-11 PT PT57773178T patent/PT1737491T/pt unknown
- 2005-04-11 CA CA2847331A patent/CA2847331A1/en not_active Abandoned
-
2006
- 2006-09-28 ZA ZA2006/08097A patent/ZA200608097B/en unknown
- 2006-10-03 IL IL178430A patent/IL178430A/en unknown
-
2007
- 2007-06-27 HK HK07106893.8A patent/HK1104454A1/zh unknown
-
2008
- 2008-01-07 US US12/008,064 patent/US20090304682A1/en not_active Abandoned
-
2011
- 2011-09-15 JP JP2011202171A patent/JP2012046524A/ja not_active Withdrawn
-
2012
- 2012-03-28 US US13/433,205 patent/US9061005B2/en active Active
- 2012-06-05 IL IL220192A patent/IL220192A/en active IP Right Grant
-
2014
- 2014-03-28 US US14/229,709 patent/US20140212430A1/en not_active Abandoned
- 2014-03-28 US US14/229,722 patent/US8961974B2/en active Active
- 2014-03-28 US US14/229,602 patent/US20140248275A1/en not_active Abandoned
- 2014-03-28 US US14/229,664 patent/US8961973B2/en active Active
- 2014-03-28 US US14/229,703 patent/US20140248276A1/en not_active Abandoned
- 2014-08-14 JP JP2014165187A patent/JP6145434B2/ja active Active
-
2015
- 2015-02-20 US US14/628,068 patent/US9187559B2/en active Active
- 2015-06-19 US US14/745,092 patent/US20170044249A1/en not_active Abandoned
- 2015-07-20 US US14/804,164 patent/US9499615B2/en active Active
- 2015-08-20 IL IL240740A patent/IL240740A0/en unknown
-
2016
- 2016-01-21 JP JP2016009605A patent/JP2016155801A/ja active Pending
- 2016-10-07 US US15/288,750 patent/US20170022271A1/en not_active Abandoned
- 2016-12-28 CY CY20161101350T patent/CY1118564T1/el unknown
-
2017
- 2017-05-22 JP JP2017100968A patent/JP2017197547A/ja active Pending
-
2018
- 2018-03-08 US US15/915,615 patent/US20190055308A1/en not_active Abandoned
-
2019
- 2019-02-25 US US16/284,798 patent/US20200017580A1/en not_active Abandoned
-
2020
- 2020-12-17 US US17/125,275 patent/US20210347875A1/en active Pending
- 2020-12-17 US US17/124,991 patent/US20210347874A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101636446B1 (ko) | TNFα-관련 질환을 치료하기 위한 다중-가변 투여 요법 | |
| KR20140058649A (ko) | TNFα 관련 질환의 치료 | |
| AU2013204275B2 (en) | Multiple-variable dose regimen for treating TNFalpha-related disorders |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| A107 | Divisional application of patent | ||
| WITB | Written withdrawal of application |