KR20140009259A - 피라졸로피리딘 및 tyk2 억제제로서 이의 용도 - Google Patents
피라졸로피리딘 및 tyk2 억제제로서 이의 용도 Download PDFInfo
- Publication number
- KR20140009259A KR20140009259A KR1020137015732A KR20137015732A KR20140009259A KR 20140009259 A KR20140009259 A KR 20140009259A KR 1020137015732 A KR1020137015732 A KR 1020137015732A KR 20137015732 A KR20137015732 A KR 20137015732A KR 20140009259 A KR20140009259 A KR 20140009259A
- Authority
- KR
- South Korea
- Prior art keywords
- alkylene
- alkyl
- halogen
- pyrazolo
- optionally substituted
- Prior art date
Links
- 0 CC1=C*C=N1 Chemical compound CC1=C*C=N1 0.000 description 7
- JQXFWGYLBVMJRE-UHFFFAOYSA-N C=Cc(cc1Cl)cc(C#N)c1-[n](cc12)nc1c(F)cnc2Br Chemical compound C=Cc(cc1Cl)cc(C#N)c1-[n](cc12)nc1c(F)cnc2Br JQXFWGYLBVMJRE-UHFFFAOYSA-N 0.000 description 1
- HIHJWZZKWYLFBX-UHFFFAOYSA-N CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1cc(C=C)ncn1)=O Chemical compound CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1cc(C=C)ncn1)=O HIHJWZZKWYLFBX-UHFFFAOYSA-N 0.000 description 1
- CULPECKMBLGQQY-UHFFFAOYSA-N CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1cc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2F)ncn1)=O Chemical compound CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1cc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2F)ncn1)=O CULPECKMBLGQQY-UHFFFAOYSA-N 0.000 description 1
- ROUBEUZXPGWUCC-UHFFFAOYSA-N CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1cc(Nc(c2c[n](-c(c(F)ccc3)c3Cl)nc22)ncc2F)nc(C)n1)=O Chemical compound CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1cc(Nc(c2c[n](-c(c(F)ccc3)c3Cl)nc22)ncc2F)nc(C)n1)=O ROUBEUZXPGWUCC-UHFFFAOYSA-N 0.000 description 1
- UFZJGGFVBAPLFO-UHFFFAOYSA-N CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1ncnc(Nc(c2c[n](-c(c(Cl)ccc3)c3Cl)nc22)ncc2Br)c1)=O Chemical compound CC(C)(C)OC(N(C(OC(C)(C)C)=O)c1ncnc(Nc(c2c[n](-c(c(Cl)ccc3)c3Cl)nc22)ncc2Br)c1)=O UFZJGGFVBAPLFO-UHFFFAOYSA-N 0.000 description 1
- RZWSIFMMHHTDAV-UHFFFAOYSA-N CC(C)(C)OC(Nc1ncnc(Nc(c2c[n](-c(c(Cl)ccc3)c3Cl)nc22)ncc2Br)c1)=O Chemical compound CC(C)(C)OC(Nc1ncnc(Nc(c2c[n](-c(c(Cl)ccc3)c3Cl)nc22)ncc2Br)c1)=O RZWSIFMMHHTDAV-UHFFFAOYSA-N 0.000 description 1
- SABUPXHGZMDPET-UHFFFAOYSA-N CC(c1ncnc(N)c1)O Chemical compound CC(c1ncnc(N)c1)O SABUPXHGZMDPET-UHFFFAOYSA-N 0.000 description 1
- RVMKLQAMFYLWTF-UHFFFAOYSA-N CNC(Nc(c1c2)nccc1n[n]2-c(c(Cl)ccc1)c1Cl)=O Chemical compound CNC(Nc(c1c2)nccc1n[n]2-c(c(Cl)ccc1)c1Cl)=O RVMKLQAMFYLWTF-UHFFFAOYSA-N 0.000 description 1
- RHAZNCHLINONLT-UHFFFAOYSA-N C[n+]1cc2c[n](-c(c(Cl)cc(C#N)c3)c3Cl)nc2c(F)c1 Chemical compound C[n+]1cc2c[n](-c(c(Cl)cc(C#N)c3)c3Cl)nc2c(F)c1 RHAZNCHLINONLT-UHFFFAOYSA-N 0.000 description 1
- FVGXXPPTJXSCPI-UHFFFAOYSA-N Cc1cc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2Cl)nc(N)n1 Chemical compound Cc1cc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2Cl)nc(N)n1 FVGXXPPTJXSCPI-UHFFFAOYSA-N 0.000 description 1
- OYADQTCFBGTGPO-UHFFFAOYSA-N Cc1cc(Nc(c2c[n](-c(c(F)ccc3)c3C#N)nc22)ncc2F)ncn1 Chemical compound Cc1cc(Nc(c2c[n](-c(c(F)ccc3)c3C#N)nc22)ncc2F)ncn1 OYADQTCFBGTGPO-UHFFFAOYSA-N 0.000 description 1
- XGKJKBGIZBRYNM-UHFFFAOYSA-N Cc1nc(NCCO)cc(N)n1 Chemical compound Cc1nc(NCCO)cc(N)n1 XGKJKBGIZBRYNM-UHFFFAOYSA-N 0.000 description 1
- GUVQKKAFFIGRDL-UHFFFAOYSA-N Cc1ncnc(Nc(c2c[n](-c(c(Cl)cc(F)c3)c3Cl)nc22)ncc2F)c1 Chemical compound Cc1ncnc(Nc(c2c[n](-c(c(Cl)cc(F)c3)c3Cl)nc22)ncc2F)c1 GUVQKKAFFIGRDL-UHFFFAOYSA-N 0.000 description 1
- NPRXGOMUSVFOAG-UHFFFAOYSA-N Fc(cccc1Cl)c1-[n]1nc(ccnc2Cl)c2c1 Chemical compound Fc(cccc1Cl)c1-[n]1nc(ccnc2Cl)c2c1 NPRXGOMUSVFOAG-UHFFFAOYSA-N 0.000 description 1
- GYPFGWYTHIORPF-UHFFFAOYSA-N N#Cc(cc1Cl)cc(Cl)c1-[n](cc12)nc1c(Cl)cnc2Br Chemical compound N#Cc(cc1Cl)cc(Cl)c1-[n](cc12)nc1c(Cl)cnc2Br GYPFGWYTHIORPF-UHFFFAOYSA-N 0.000 description 1
- NOPNFIKVIRCRRS-UHFFFAOYSA-N N#Cc1cccc(Cl)c1-[n](cc12)nc1c(F)cnc2Nc1ccc(C2CNC2)cn1 Chemical compound N#Cc1cccc(Cl)c1-[n](cc12)nc1c(F)cnc2Nc1ccc(C2CNC2)cn1 NOPNFIKVIRCRRS-UHFFFAOYSA-N 0.000 description 1
- VKHOCAJFBWIXLN-UHFFFAOYSA-N N#Cc1cccc(Cl)c1-[n]1nc2c(F)cncc2c1 Chemical compound N#Cc1cccc(Cl)c1-[n]1nc2c(F)cncc2c1 VKHOCAJFBWIXLN-UHFFFAOYSA-N 0.000 description 1
- HFYCYWURNCXFDM-UHFFFAOYSA-N Nc1ccc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2Cl)nn1 Chemical compound Nc1ccc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2Cl)nn1 HFYCYWURNCXFDM-UHFFFAOYSA-N 0.000 description 1
- WCHZFPONRPTPRO-UHFFFAOYSA-N Nc1ncnc(N(C2)CC2F)c1 Chemical compound Nc1ncnc(N(C2)CC2F)c1 WCHZFPONRPTPRO-UHFFFAOYSA-N 0.000 description 1
- HCAWGHQCVUVTMU-UHFFFAOYSA-N Nc1ncnc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2Cl)c1 Chemical compound Nc1ncnc(Nc(c2c3)nccc2n[n]3-c(c(Cl)ccc2)c2Cl)c1 HCAWGHQCVUVTMU-UHFFFAOYSA-N 0.000 description 1
- CRSXGRFELKLYHA-UHFFFAOYSA-N Nc1ncnc(Nc(c2c[n](-c(c(Cl)cc(C#N)c3)c3Cl)nc22)ncc2Cl)c1 Chemical compound Nc1ncnc(Nc(c2c[n](-c(c(Cl)cc(C#N)c3)c3Cl)nc22)ncc2Cl)c1 CRSXGRFELKLYHA-UHFFFAOYSA-N 0.000 description 1
- LWAYNJBMEOIKHQ-UHFFFAOYSA-N Nc1ncnc(Nc(c2c[n](-c(c(Cl)ccc3)c3Cl)nc22)ncc2Cl)c1 Chemical compound Nc1ncnc(Nc(c2c[n](-c(c(Cl)ccc3)c3Cl)nc22)ncc2Cl)c1 LWAYNJBMEOIKHQ-UHFFFAOYSA-N 0.000 description 1
- LWYNDDAUIAEHOA-UHFFFAOYSA-N O=C(C1CC1)Nc(c1c2)nccc1n[n]2-c(c(Cl)ccc1)c1Cl Chemical compound O=C(C1CC1)Nc(c1c2)nccc1n[n]2-c(c(Cl)ccc1)c1Cl LWYNDDAUIAEHOA-UHFFFAOYSA-N 0.000 description 1
- LSNBFATWINWCAX-UHFFFAOYSA-N O=Cc1cncc(Br)c1Cl Chemical compound O=Cc1cncc(Br)c1Cl LSNBFATWINWCAX-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
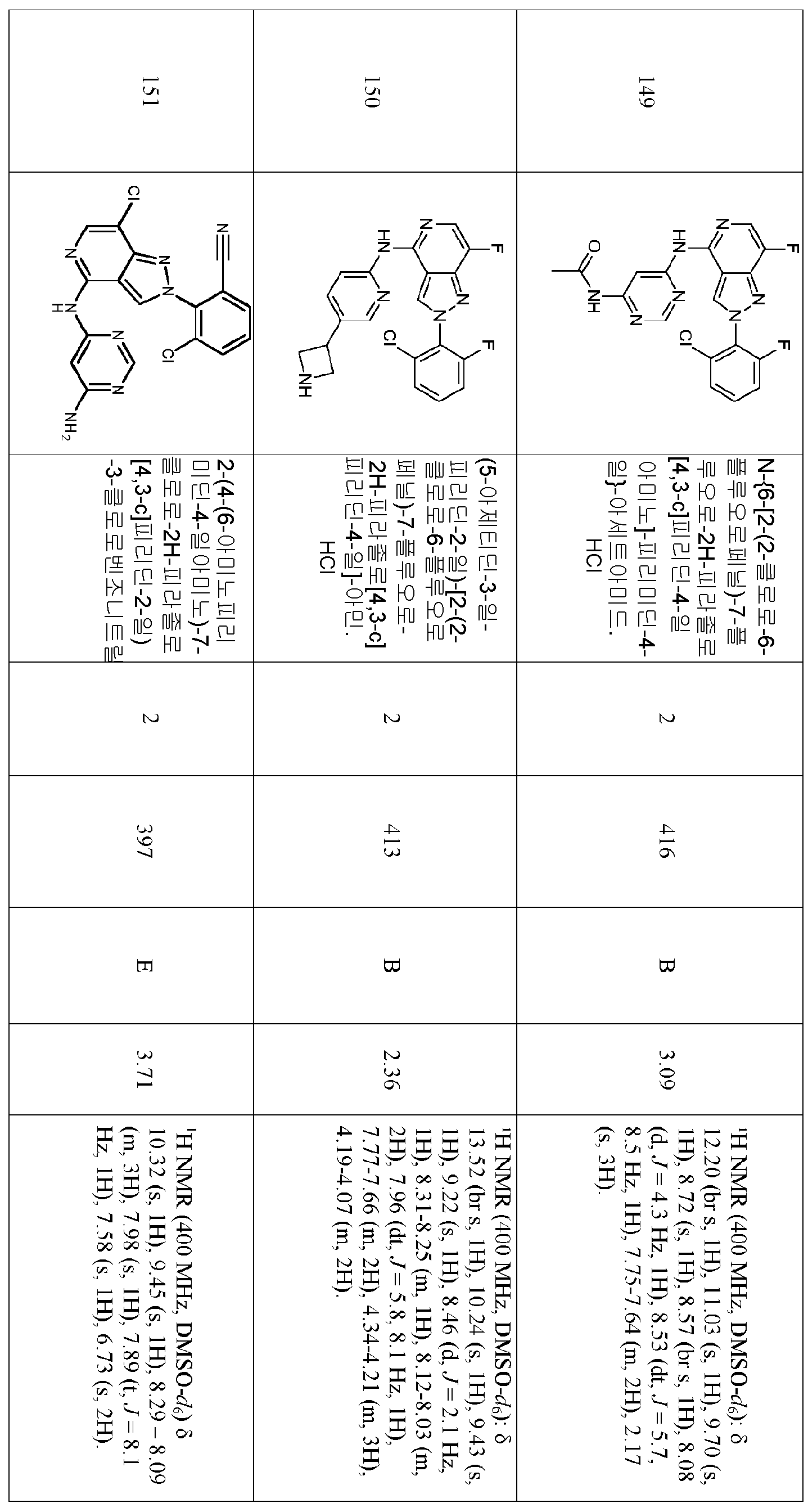
- Pulmonology (AREA)
- Dermatology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Otolaryngology (AREA)
- Hospice & Palliative Care (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
본 발명은 환자의 치료 및/또는 예방에 유용한 유기 화합물, 특히 TYK2 키나아제에 의해 매개된 질환을 치료하기에 유용한 TYK2 키나아제의 억제제에 관한 것이다.
사이토카인 경로는 염증 및 면역력의 다양한 면을 비롯한, 생물학적 기능의 광범위한 범위를 매개한다. JAK1, JAK2, JAK3을 비롯한 야누스 키나아제(Janus kinase: JAK) 및 타이로신 키나아제 2(Tyrosine kinase 2: TYK2)는 유형 I 및 유형 II 사이토카인 수용체와 관련되고 사이토카인 신호 형질도입을 조절하는 세포질의 단백질 키나아제이다. 동족 수용체와의 사이토카인 교합은 JAK 연관된 수용체의 활성을 촉발시키고 이는 신호 전달자 및 전사 활성제(STAT) 단백질의 JAK 매개된 티로신 인산화 및 궁극적으로 특정 유전자 집단의 전사 활성화를 야기한다. JAK1, JAK2 및 TYK2는 유전자 발현의 광범위한 패턴을 나타내는 반면, JAK3 발현은 백혈구에 제한된다. 사이토카인 수용체는 전형적으로 헤테로다이머로서 기능하고, 결과적으로, JAK 키나아제의 하나 이상의 유형은 일반적으로 사이토카인 수용체 착체와 관련된다. 상이한 사이토카인 수용체 착체와 관련된 특정 JAK는 많은 경우에 유전적 연구를 통해 밝혀지고 있고 다른 실험적인 증거에 의해 확증되고 있다.
JAK1은 유형 I 인터페론(예를 들어, IFNα), 유형 II 인터페론(예를 들어, IFNγ), IL-2 및 IL-6 사이토카인 수용체 착체와 기능적으로 및 물리적으로 관련된다. JAK1 녹아웃 마우스는 LIF 수용체 신호화의 결함으로 인해 출산 전후에 사망한다. JAK1 녹아웃 마우스로부터 유도된 조직의 특성화는 IFN, IL-10, IL-2/IL-4 및 IL-6 경로에서 이 키나아제에 대한 주요한 역할을 입증한다. IL-6 경로(토실리주맙)를 표적화하는 인간화된 단클론 항체는 최근에 중간 내지 중증 류마티스 관절염의 치료에 대한 유럽연합 집행위원회(European Commission)에 의해 승인되었다.
생화학적 및 유전적 연구는 JAK2와 단일쇄(예를 들어, EPO), IL-3 및 인터페론 γ 사이토카인 수용체 부류 사이의 관련성을 제시하였다. 이와 일치하게, JAK2 녹아웃 마우스는 빈혈증으로 사망한다. JAK2에서 키나아제 활성화 돌연변이(예를 들어, JAK2 V617F)는 인간에서 척수 증식성 질병(MPD)과 관련된다.
JAK3은 IL-2, IL-4, IL-7, IL-9, IL-15 및 IL-21 사이토카인 수용체 착체 중에 존재하는 통상의 γ 사이토카인 수용체 쇄와 배타적으로 관련된다. JAK3은 림프계 세포 발달 및 증식에 주요하고 JAK3에서 돌연변이는 중증 복합 면역결핍증(SCID)을 야기한다. 림프구를 조절하는 이의 역할에 근거하여, JAK3 및 JAK3 매개된 경로는 면역억제 지시(예를 들어, 이식 거부 및 류마티스 관절염)의 표적이 되고 있다.
TYK2는 유형 I 인터페론(예를 들어, IFNα), IL-6, IL-10, IL-12 및 IL-23 사이토카인 수용체 착체와 관련된다. 이와 일치하게, TYK2 결핍된 인간으로부터 유도된 1차 세포는 유형 I 인터페론, IL-6, IL-10, IL-12 및 IL-23 신호화에 결함이 있다. IL-12 및 Il-23 사이토카인(우스테키누맙)의 공유된 p40 아단위를 표적화하는 완전 인간 단클론 항체는 최근에 중간 내지 중증 판 건선의 치료에 대해 유럽연합 집행위원회에 의해 승인되었다. 게다가, IL-12 및 IL-23 경로를 표적화하는 항체는 크론병을 치료하기 위한 임상 목적을 수행하였다.
일 실시양태는 하기 화학식 I의 화합물 및 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 및 약학적으로 허용되는 염을 포함한다:
[화학식 I]
상기 식에서,
A, X, R1, R2, R4 및 R5는 본원에 정의된다.
또 다른 실시양태는 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염, 및 약학적으로 허용되는 담체, 보조제 또는 비히클을 포함하는 약학 조성물을 포함한다.
또 다른 실시양태는 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염의 키나아제를 억제하기에 효과적인 양을 세포에 도입하는 단계를 포함하는, 세포에서 TYK2 키나아제 활성을 억제하는 방법을 포함한다.
또 다른 실시양태는 환자에서 TYK2 키나아제 활성의 억제에 즉각 반응하는 질환 또는 상태의 중증도를 치료 또는 완화하는 방법을 포함한다. 상기 방법은 치료 효과량의 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염을 환자에게 투여함을 포함한다.
또 다른 실시양태는 치료에서 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염의 용도를 포함한다.
또 다른 실시양태는 치료에 사용되는 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염을 포함한다.
또 다른 실시양태는 TYK2 키나아제의 억제에 즉각 반응하는 질환의 치료용 약제의 제조에서 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염의 용도를 포함한다.
또 다른 실시양태는 TYK2 키나아제의 억제에 즉각 반응하는 질환의 치료에 사용되는 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염을 포함한다.
또 다른 실시양태는 면역학적 또는 염증 질환의 치료에서 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염의 용도를 포함한다.
또 다른 실시양태는 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염의 제조 방법을 포함한다.
또 다른 실시양태는 TYK2 키나아제의 억제에 즉각 반응하는 질환 또는 질병의 치료용 키트를 포함한다. 상기 키트는 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 또는 약학적으로 허용되는 염을 포함하는 제 1 약학 조성물 및 이를 사용하기 위한 설명서를 포함한다.
수반하는 구조 및 화학식으로 예시되는 특정 실시양태에 관해 자세히 언급될 것이다. 본 발명이 열거된 실시양태와 함께 기재되지만, 본 발명은 청구항에 의해 정의되는 본 발명의 범주내에 포함될 수 있는 모든 대안, 개질 및 등가물을 포괄하고자 한다. 당업자는 본원에 기재된 것과 유사하거나 동일한 방법 및 물질을 인지할 것이고, 이는 본 발명의 실시예에 사용될 수 있다.
정의
용어 "알킬"은 포화된 직쇄 또는 분지쇄 1가 탄화수소 라디칼을 지칭하고, 이때 알킬 라디칼은 독립적으로 본원에 기재된 하나 이상의 치환기로 임의적으로 치환될 수 있다. 일 예에서, 알킬 라디칼은 1 내지 18개의 탄소 원자(C1-C18)이다. 다른 예에서, 알킬 라디칼은 C0-C6, C0-C5, C0-C3, C1-C12, C1-C10, C1-C8, C1-C6, C1-C5, C1-C4 또는 C1-C3이다. C0은 결합을 지칭한다. 알킬 기의 예는 메틸(Me, -CH3), 에틸(Et, -CH2CH3), 1-프로필(n-Pr, n-프로필, -CH2CH2CH3), 2-프로필(i-Pr, i-프로필, -CH(CH3)2), 1-부틸(n-Bu, n-부틸, -CH2CH2CH2CH3), 2-메틸-1-프로필(i-Bu, i-부틸, -CH2CH(CH3)2), 2-부틸(s-Bu, s-부틸, -CH(CH3)CH2CH3), 2-메틸-2-프로필(t-Bu, t-부틸, -C(CH3)3), 1-펜틸(n-펜틸, -CH2CH2CH2CH2CH3), 2-펜틸(-CH(CH3)CH2CH2CH3), 3-펜틸(-CH(CH2CH3)2), 2-메틸-2-부틸(-C(CH3)2CH2CH3), 3-메틸-2-부틸(-CH(CH3)CH(CH3)2), 3-메틸-1-부틸(-CH2CH2CH(CH3)2), 2-메틸-1-부틸(-CH2CH(CH3)CH2CH3), 1-헥실(-CH2CH2CH2CH2CH2CH3), 2-헥실(-CH(CH3)CH2CH2CH2CH3), 3-헥실(-CH(CH2CH3)(CH2CH2CH3)), 2-메틸-2-펜틸(-C(CH3)2CH2CH2CH3), 3-메틸-2-펜틸(-CH(CH3)CH(CH3)CH2CH3), 4-메틸-2-펜틸(-CH(CH3)CH2CH(CH3)2), 3-메틸-3-펜틸(-C(CH3)(CH2CH3)2), 2-메틸-3-펜틸(-CH(CH2CH3)CH(CH3)2), 2,3-다이메틸-2-부틸(-C(CH3)2CH(CH3)2), 3,3-다이메틸-2-부틸(-CH(CH3)C(CH3)3, 1-헵틸 및 1-옥틸을 포함한다.
용어 "알케닐"은 하나 이상의 부위에서의 불포화, 즉, 탄소-탄소 이중 결합을 갖는 직쇄 또는 분지쇄 1가 탄화수소 라디칼을 지칭하고, 이때 알케닐 라디칼은 독립적으로 본원에 기재된 하나 이상의 치환기로 임의적으로 치환될 수 있고, "시스" 및 "트랜스" 배향, 또는 다르게는, "E" 및 "Z" 배향을 갖는 라디칼을 포함한다. 일 예에서, 알케닐 라디칼은 2 내지 18개의 탄소 원자(C2-C18)이다. 다른 예에서, 알케닐 라디칼은 C2-C12, C2-C10, C2-C8, C2-C6 또는 C2-C3이다. 예는 비제한적으로, 에테닐 또는 비닐(-CH=CH2), 프로프-1-에닐(-CH=CHCH3), 프로프-2-에닐(-CH2CH=CH2), 2-메틸프로프-1-에닐, 부트-1-에닐, 부트-2-에닐, 부트-3-에닐, 부타-1,3-다이에닐, 2-메틸부타-1,3-다이엔, 헥스-1-에닐, 헥스-2-에닐, 헥스-3-에닐, 헥스-4-에닐 및 헥사-1,3-다이에닐을 포함한다.
용어 "알키닐"은 하나 이상의 부위의 불포화, 즉, 탄소-탄소 삼중 결합을 갖는 선형 또는 분지형 1가 탄화수소 라디칼을 지칭하고, 이때 알키닐 라디칼은 독립적으로 본원에 기재된 하나 이상의 치환기로 임의적으로 치환될 수 있다. 일 예에서, 알키닐 라디칼은 2 내지 18개의 탄소 원자(C2-C18)이다. 다른 예에서, 알키닐 라디칼은 C2-C12, C2-C10, C2-C8, C2-C6 또는 C2-C3이다. 실시예는 비제한적으로, 에티닐(-C≡CH), 프로프-1-이닐(-C≡CCH3), 프로프-2-이닐(프로파르길, -CH2C≡CH), 부트-1-이닐, 부트-2-이닐 및 부트-3-이닐을 포함한다.
"알킬렌"은 모 알칸의 동일하거나 2개의 상이한 탄소 원자로부터 2개의 수소 원자의 제거에 의해 유도된 2개의 1가 라디칼 중심을 갖는 포화된 분지쇄 또는 직쇄 탄화수소 기를 지칭한다. 일 예에서, 2가 알킬렌 기는 1 내지 18개의 탄소 원자(C1-C18)이다. 다른 예에서, 2가 알킬렌 기는 C0-C6, C0-C5, C0-C3, C1-C12, C1-C10, C1-C8, C1-C6, C1-C5, C1-C4 또는 C1-C3이다. 알킬렌 기의 예는 메틸렌(-CH2-), 1,1-에틸(-CH(CH3)-), 1,2-에틸(-CH2CH2-), 1,1-프로필(-CH(CH2CH3)-), 2,2-프로필(-C(CH3)2-), 1,2-프로필(-CH(CH3)CH2-), 1,3-프로필(-CH2CH2CH2-), 1,1-다이메틸에트-1,2-일(-C(CH3)2CH2-), 1,4-부틸(-CH2CH2CH2CH2-) 등을 포함한다.
"알케닐렌"은 모 알켄의 동일하거나 2개의 상이한 탄소 원자로부터 2개의 수소 원자의 제거에 의해 유도된 2개의 1가 라디칼 중심을 갖는 불포화된 분지쇄 또는 직쇄 탄화수소 기를 지칭한다. 일 예에서, 알케닐렌 기는 2 내지 18개의 탄소 원자(C2-C18)이다. 다른 예에서, 알케닐렌 기는 C2-C12, C2-C10, C2-C8, C2-C6 또는 C2-C3이다. 알케닐렌 기의 예는 1,2-에틸렌(-CH=CH-)을 포함한다.
"알키닐렌"은 모 알킨의 동일하거나 2개의 상이한 탄소 원자로부터 2개의 수소 원자의 제거에 의해 유도된 2개의 1가 라디칼 중심을 갖는 불포화된 분지쇄 또는 직쇄 탄화수소 기를 지칭한다. 일 예에서, 알키닐렌 라디칼은 2 내지 18개의 탄소 원자(C2-C18)이다. 다른 예에서, 알키닐렌 라디칼은 C2-C12, C2-C10, C2-C8, C2-C6 또는 C2-C3이다. 알키닐렌 라디칼의 예는 아세틸렌(-C≡C-), 프로파르길(-CH2C≡C-) 및 4-펜티닐(-CH2CH2CH2C≡C-)을 포함한다.
"사이클로알킬"은 비-방향족 포화된 또는 부분적으로 불포화된 탄화수소 고리 기를 지칭하고, 이때 사이클로알킬 기는 독립적으로 본원에 기재된 하나 이상의 치환기로 임의적으로 치환될 수 있다. 일 예에서, 사이클로알킬 기는 3 내지 12개의 탄소 원자(C3-C12)이다. 다른 예에서, 사이클로알킬은 C3-C8, C3-C10 또는 C5-C10이다. 다른 예에서, 일환형으로서 사이클로알킬 기는 C3-C4, C3-C6 또는 C5-C6이다. 또 다른 예에서, 이환형으로서 사이클로알킬 기는 C7-C12이다. 일환형 사이클로알킬의 예는 사이클로프로필, 사이클로부틸, 사이클로펜틸, 1-사이클로펜트-1-에닐, 1-사이클로펜트-2-에닐, 1-사이클로펜트-3-에닐, 사이클로헥실, 1-사이클로헥스-1-에닐, 1-사이클로헥스-2-에닐, 1-사이클로헥스-3-에닐, 사이클로헥사다이에닐, 사이클로헵틸, 사이클로옥틸, 사이클로노닐, 사이클로데실, 사이클로운데실 및 사이클로도데실을 포함한다. 7 내지 12개의 고리 원자를 갖는 이환형 사이클로알킬의 예시적인 배열은 비제한적으로, [4,4], [4,5], [5,5], [5,6] 또는 [6,6] 고리 시스템을 포함한다. 가교된 이환형 사이클로알킬의 예는 비제한적으로, 바이사이클로[2.2.1]헵탄, 바이사이클로[2.2.2]옥탄 및 바이사이클로[3.2.2]노난을 포함한다. 또 다른 예에서, 스피로로서 사이클로알킬은 C5-C12이다. 스피로 사이클로알킬의 예는 비제한적으로, 스피로[2.2]펜탄, 스피로[2.3]헥산, 스피로[2.4]헵탄, 스피로[2.5]옥탄, 스피로[3.3]헵탄, 스피로[3.4]옥탄, 스피로[3.5]노난, 스피로[4.4]노난 및 스피로[4.5]데칸을 포함한다.
"아릴"은 독립적으로 본원에 기재된 하나 이상의 치환기로 임의적으로 치환된 환형 방향족 탄화수소 기를 지칭한다. 일 예에서, 아릴 기는 6 내지 20개의 탄소 원자(C6-C20)이다. 또 다른 예에서, 아릴 기는 C6-C10이다. 또 다른 예에서, 아릴 기는 C6 아릴 기이다. 아릴은 융합된 비-방향족 또는 부분적으로 포화된 고리를 갖는 방향족 고리를 포함하는 이환형 기를 포함한다. 아릴 기의 예는 비제한적으로, 페닐, 나프탈레닐, 안트라세닐, 인데닐, 인다닐, 1,2-다이하이드로나프탈레닐 및 1,2,3,4-테트라하이드로나프틸을 포함한다. 일 예에서, 아릴은 페닐을 포함한다. 치환된 페닐 또는 치환된 아릴은 1, 2, 3, 4 또는 5개의 치환기, 예를 들어 본원에 명시된 기로부터 선택된 1 또는 2개, 1 내지 3개 또는 1 내지 4개의 치환기로 치환된 페닐 기 또는 아릴 기를 의미한다. 일 예에서, 아릴 상의 임의의 치환기는 할로겐(F, Cl, Br, I), 하이드록시, 보호된 하이드록시, 시아노, 니트로, 알킬(예를 들어, C1-C6 알킬), 알콕시(예를 들어, C1-C6 알콕시), 벤질옥시, 카복시, 보호된 카복시, 카복시메틸, 보호된 카복시메틸, 하이드록시메틸, 보호된 하이드록시메틸, 아미노메틸, 보호된 아미노메틸, 트라이플루오로메틸, 알킬설포닐아미노, 알킬설포닐아미노알킬, 아릴설포닐아미노, 아릴설포닐아미노알킬, 헤테로사이클릴설포닐아미노, 헤테로사이클릴설포닐아미노알킬, 헤테로사이클릴, 임의적으로 치환된 페닐 또는 명시된 다른 기로부터 선택된다. 이들 치환기에서 하나 이상의 메틴(CH) 및/또는 메틸렌(CH2) 기는 상기 언급된 것과 유사한 기로 치환될 수 있다. 용어 "치환된 페닐"의 예는 모노 또는 다이(할로)페닐 기, 예컨대 2-클로로페닐, 2-브로모페닐, 4-클로로페닐, 2,6-다이클로로페닐, 2,5-다이클로로페닐, 3,4-다이클로로페닐, 3-클로로페닐, 3-브로모페닐, 4-브로모페닐, 3,4-다이브로모페닐, 3-클로로-4-플루오로페닐, 2-플루오로페닐 등; 모노 또는 다이(하이드록시)페닐 기, 예컨대 4-하이드록시페닐, 3-하이드록시페닐, 2,4-다이하이드록시페닐, 이의 보호된-하이드록시 유도체 등; 니트로페닐 기, 예컨대 3- 또는 4-니트로페닐; 시아노페닐 기, 예를 들어, 4-시아노페닐; 모노 또는 다이(저급 알킬)페닐 기, 예컨대 4-메틸페닐, 2,4-다이메틸페닐, 2-메틸페닐, 4-(이소프로필)페닐, 4-에틸페닐, 3-(n-프로필)페닐 등; 모노 또는 다이(알콕시)페닐 기, 예를 들어, 3,4-다이메톡시페닐, 3-메톡시-4-벤질옥시페닐, 3-에톡시페닐, 4-(이소프로폭시)페닐, 4-(t-부톡시)페닐, 3-에톡시-4-메톡시페닐 등; 3- 또는 4-트라이플루오로메틸페닐; 모노 또는 다이카복시페닐 또는 (보호된 카복시)페닐 기, 예컨대 4-카복시페닐, 모노 또는 다이(하이드록시메틸)페닐 또는 (보호된 하이드록시메틸)페닐, 예컨대 3-(보호된 하이드록시메틸)페닐 또는 3,4-다이(하이드록시메틸)페닐; 모노 또는 다이(아미노메틸)페닐 또는 (보호된 아미노메틸)페닐, 예컨대 2-(아미노메틸)페닐 또는 2,4-(보호된 아미노메틸)페닐; 또는 모노 또는 다이(N-(메틸설포닐아미노))페닐, 예컨대 3-(N-메틸설포닐아미노))페닐을 포함한다. 또한, 용어 "치환된 페닐"은 치환기가 상이한 이치환된 페닐 기, 예를 들어, 3-메틸-4-하이드록시페닐, 3-클로로-4-하이드록시페닐, 2-메톡시-4-브로모페닐, 4-에틸-2-하이드록시페닐, 3-하이드록시-4-니트로페닐, 2-하이드록시-4-클로로페닐 등, 및 치환기가 상이한 삼치환된 페닐 기, 예를 들어 3-메톡시-4-벤질옥시-6-메틸 설포닐아미노, 3-메톡시-4-벤질옥시-6-페닐 설포닐아미노, 및 치환기가 상이한 사치환된 페닐 기, 예컨대 3-메톡시-4-벤질옥시-5-메틸-6-페닐 설포닐아미노를 나타낸다. 특히 치환된 페닐 기는 2-클로로페닐, 2-아미노페닐, 2-브로모페닐, 3-메톡시페닐, 3-에톡시-페닐, 4-벤질옥시페닐, 4-메톡시페닐, 3-에톡시-4-벤질옥시페닐, 3,4-다이에톡시페닐, 3-메톡시-4-벤질옥시페닐, 3-메톡시-4-(1-클로로메틸)벤질옥시-6-메틸 설포닐 아미노페닐 기를 포함한다. 융합된 아릴 고리는 또한 치환된 알킬 기와 동일한 방식으로 본원에 명시된 임의의, 예를 들어 1, 2 또는 3개의 치환기로 치환될 수 있다.
"할로" 또는 "할로겐"은 F, Cl, Br 또는 I를 지칭한다.
용어 "헤테로사이클", "헤테로사이클릴" 및 "헤테로사이클 고리"는 본원에서 상호교환적으로 사용되고, 각각의 경우에, 하나 이상의 고리 원자가 독립적으로 질소, 산소, 인 및 황으로부터 선택된 헤테로원자이고, 잔여 고리 원자가 탄소인 (i) 포화된 또는 부분적으로 불포화된 환형 기(즉, 고리내에 하나 이상의 이중 및/또는 삼중 결합을 가짐)("헤테로사이클로알킬"), 또는 (ii) 방향족 환형 기("헤테로아릴")를 지칭한다. 헤테로사이클릴 기는 하기 기재된 하나 이상의 치환기로 임의적으로 치환될 수 있다. 일 실시양태에서, 헤테로사이클릴은 N, O, S 및 P로부터 선택된 헤테로원자인 잔여 고리 원자를 갖는 1 내지 9개의 탄소 고리 원(C1-C9)을 갖는 일환형 또는 이환형을 포함한다. 다른 예에서, 헤테로사이클릴은 N, O, S 및 P로부터 선택된 헤테로원자인 잔여 고리 원자를 갖는 C1-C5, C3-C5 또는 C4-C5를 갖는 일환형 또는 이환형을 포함한다. 또 다른 실시양태에서, 헤테로사이클릴은 독립적으로 N, O, S 및 P로부터 선택된 하나 이상의 헤테로원자를 함유하는, 3 내지 10 원 고리, 3 내지 7 원 고리 또는 3 내지 6 원 고리를 포함한다. 다른 예에서, 헤테로사이클릴은 독립적으로 N, O, S 및 P로부터 선택된 하나 이상의 헤테로원자를 함유하는, 일환형 3, 4, 5, 6 또는 7 원 고리를 포함한다. 또 다른 실시양태에서, 헤테로사이클릴은 N, O, S 및 P로부터 선택된 하나 이상의 헤테로원자를 함유하는, 이환형 또는 다환형, 스피로 또는 가교된 4, 5, 6, 7, 8 및 9 원 고리 시스템을 포함한다. 이환형 시스템의 예는 비제한적으로, [3,5], [4,5], [5,5], [3,6], [4,6], [5,6] 또는 [6,6] 시스템을 포함한다. 가교된 고리 시스템의 예는 비제한적으로 N, O, S 및 P로부터 선택된 1 내지 3개의 헤테로원자를 갖는 [2.2.1], [2.2.2], [3.2.2] 및 [4.1.0] 배열을 포함한다. 또 다른 실시양태에서, 헤테로사이클릴은 N, O, S 및 P로부터 선택된 1 내지 4개의 헤테로원자를 갖는 스피로 기를 포함한다. 헤테로사이클릴 기는 탄소-연결된 기 또는 헤테로원자-연결된 기일 수 있다. "헤테로사이클릴"은 사이클로알킬 기에 융합된 헤테로사이클릴 기를 포함한다.
헤테로사이클릴 기의 예는 비제한적으로, 옥시라닐, 아지리디닐, 티라닐, 아제티디닐, 옥세타닐, 티에타닐, 1,2-다이티에타닐, 1,3-다이티에타닐, 피롤리디닐, 피페리디닐, 모폴리닐, 티오모폴리닐, 티오자닐, 피페라지닐, 호모피페라지닐, 호모피페리디닐, 옥세파닐, 티에파닐, 옥사제피닐, 옥사제파닐, 다이아제파닐, 1,4-다이아제파닐, 다이아제피닐, 티아제피닐, 티아제파닐, 다이하이드로티에닐, 다이하이드로피라닐, 다이하이드로푸라닐, 테트라하이드로푸라닐, 테트라하이드로티에닐, 테트라하이드로피라닐, 테트라하이드로티오피라닐, 1-피롤리닐, 2-피롤리닐, 3-피롤리닐, 인돌리닐, 2H-피라닐, 4H-피라닐, 다이옥사닐, 1,3-다이옥솔라닐, 피라졸리닐, 피라졸리디닐, 다이티아닐, 다이티올라닐, 피라졸리디닐이미다졸리닐, 이미다졸리디닐, 3-아자바이사이클로[3.1.0]헥사닐, 3,6-다이아자바이사이클로[3.1.1]헵타닐, 6-아자바이사이클로[3.1.1]헵타닐, 3-아자바이사이클로[3.1.1]헵타닐, 3-아자바이사이클로[4.1.0]헵타닐 및 아자바이사이클로[2.2.2]헥사닐을 포함한다. 고리 원자가 옥소(=O)로 치환된 헤테로사이클릴 기의 예는 2H-피라졸로[4,3-c]피리딘-4(5H)-온일, 2H-피라졸로[3,4-d]피리미딘-4(5H)-온일, 피리미디노닐 및 1,1-다이옥소-티오모폴리닐이다. 본원의 헤테로사이클릴 기는 독립적으로 본원에 기재된 하나 이상의 치환기로 임의적으로 치환된다. 헤테로사이클은 문헌[Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry"(W.A. Benjamin, New York, 1968), particularly Chapters 1, 3, 4, 6, 7, and 9]; 문헌["The Chemistry of Heterocyclic Compoinds, A series of Monographs" (John Wiley & Sons, New York, 1950 to present), in particular Volumes 13, 14, 16, 19, and 28]; 및 문헌[J. Am . Chem . Soc . (1960) 82:5566]에 기재되어 있다.
용어 "헤테로아릴"은 하나 이상의 고리 원자가 독립적으로 질소, 산소 및 황으로부터 선택된 헤테로원자이고, 잔여 고리 원자가 탄소인 방향족 탄소환형 라디칼을 지칭한다. 헤테로아릴 기는 본원에 기재된 하나 이상의 치환기로 임의적으로 치환될 수 있다. 일 예에서, 헤테로아릴 기는 1 내지 9개의 탄소 고리 원자(C1-C9)를 함유한다. 다른 예에서, 헤테로아릴 기는 C1-C5, C3-C5 또는 C4-C5이다. 일 실시양태에서, 헤테로아릴 기의 예는 5 또는 6 원 고리, 또는 독립적으로 질소, 산소 및 황으로부터 선택된 하나 이상의 헤테로원자를 함유하는 일환형 방향족 5, 6 및 7 원 고리를 포함한다. 또 다른 실시양태에서, 헤테로아릴 기의 예는 하나 이상의 방향족 고리가 독립적으로 질소, 산소 및 황으로부터 선택된 하나 이상의 헤테로원자를 함유하는 9개 이하의 탄소 원자의 융합된 고리 시스템을 포함한다. "헤테로아릴"은 아릴, 사이클로알킬 또는 다른 헤테로사이클릴 기와 융합된 헤테로아릴 기를 포함한다. 헤테로아릴 기의 예는 비제한적으로, 피리디닐, 이미다졸릴, 이미다조피리디닐, 피리미디닐, 피라졸릴, 트라이아졸릴, 피라지닐, 테트라졸릴, 푸릴, 티에닐, 이속사졸릴, 티아졸릴, 옥사졸릴, 이소티아졸릴, 피롤릴, 퀴놀리닐, 이소퀴놀리닐, 인돌릴, 벤즈이미다졸릴, 벤조푸라닐, 신놀리닐, 인다졸릴, 인돌리지닐, 프탈라지닐, 피리다지닐, 트라이아지닐, 이소인돌릴, 프테리디닐, 푸리닐, 옥사다이아졸릴, 트라이아졸릴, 티아다이아졸릴, 푸라자닐, 벤조푸라자닐, 벤조티오페닐, 벤조티아졸릴, 벤즈옥사졸릴, 퀴나졸리닐, 퀴녹살리닐, 나프티리디닐, 티아졸로피리디닐, 피라졸로피리디닐, 피라졸로[4,3-c]피리디닐, 피라졸로[4,3-c]피리미디닐 및 푸로피리디닐을 포함한다.
특정 실시양태에서, 헤테로사이클릴 또는 헤테로아릴 기는 C-부착된다. 비제한적인 예를 들면, 탄소 결합된 헤테로사이클릴은 피리딘의 위치 2, 3, 4, 5 또는 6(예를 들어, 2-피리딜, 3-피리딜, 4-피리딜, 5-피리딜, 6-피리딜), 피리다진의 위치 3, 4, 5 또는 6, 피리미딘의 위치 2, 4, 5 또는 6, 피라진의 위치 2, 3, 5 또는 6, 푸란, 테트라하이드로푸란, 티오푸란, 티오펜, 피롤 또는 테트라하이드로피롤의 위치 2, 3, 4 또는 5, 옥사졸, 이미다졸 또는 티아졸의 위치 2, 4 또는 5, 이속사졸, 피라졸 또는 이소티아졸의 위치 3, 4 또는 5, 아지리딘의 위치 2 또는 3, 아제티딘의 위치 2, 3 또는 4, 퀴놀린의 위치 2, 3, 4, 5, 6, 7 또는 8, 또는 이소퀴놀린의 위치 1, 3, 4, 5, 6, 7 또는 8에서 결합하는 배열을 포함한다.
특정 실시양태에서, 헤테로사이클릴 또는 헤테로아릴 기는 N-부착된다. 비제한적인 예를 들면, 질소 결합된 헤테로사이클릴 또는 헤테로아릴 기는 아지리딘, 아제티딘, 피롤, 피롤리딘, 2-피롤린, 3-피롤린, 이미다졸, 이미다졸리딘, 2-이미다졸린, 3-이미다졸린, 피라졸, 피라졸린, 2-피라졸린, 3-피라졸린, 피페리딘, 피페라진, 인돌, 인돌린, 1H-인다졸의 위치 1, 이소인돌 또는 이소인돌린의 위치 2, 모폴린의 위치 4, 및 카바졸 또는 β-카볼린의 위치 9에서 결합하는 배열을 포함한다.
"이탈기"는 화학 반응 중 제 1 반응물로부터 대체된 화학 반응 중 제 1 반응물의 부분을 지칭한다. 이탈기의 예는 비제한적으로, 할로겐 원자, 알콕시 및 설포닐옥시 기를 포함한다. 설포닐옥시 기의 예는 비제한적으로, 알킬설포닐옥시 기(예를 들어, 메틸 설포닐옥시(메실레이트 기) 및 트라이플루오로메틸설포닐옥시(트라이플레이트 기)) 및 아릴설포닐옥시 기(예를 들어, p-톨루엔설포닐옥시(토실레이트 기) 및 p-니트로설포닐옥시(노실레이트 기))를 포함한다.
"치료하다" 및 "치료"는 대상체가 원치 않은 생리적 변화 또는 질병, 예컨대 암의 발달 또는 전이를 막거나 늦추는(완화하는), 치료책 및 예방책 둘다를 포함한다. 본 발명의 목적을 위해, 이로운 또는 목적한 임상 결과는 비제한적으로, 증상의 완화, 질환의 정도의 감소, 질환의 안정화된(즉, 악화되지 않은) 상태, 질환 진행의 지연 또는 감속, 질환 상태의 개선 또는 경감, (부분적 또는 전체적) 완화, 검출할 수 있거나 검출할 수 없는 완화의 유지 및 재발 억제를 포함한다. 또한, "치료"는 치료를 받지 않은 경우 예상된 생존에 비해 연장되는 생존을 의미할 수 있다. 치료를 필요로 하는 대상체는 상태 또는 질병을 이미 갖고 있는 대상체 뿐만 아니라 상태 또는 질병을 갖기 쉬운 대상체(예를 들어, 유전적 돌연변이를 통함) 또는 상태 또는 질병을 방지할 수 있는 대상체를 포함한다.
어구 "치료 효과량"은 (i) 특정 질환, 상태 또는 질병을 치료하거나 예방하거나, (ii) 특정 질환, 상태 또는 질병의 하나 이상의 증상을 약화하거나 개선하거나 제거하거나, (iii) 본원에 기재된 특정 질환, 상태 또는 질병의 하나 이상의 증상의 발병을 막거나 지연하는 본 발명의 화합물의 양을 의미한다. 암의 경우에, 약물의 치료 효과량은 암 세포의 수를 줄이고/거나; 종양 크기를 줄이고/거나; 말초 기관내로 암 세포 침윤을 억제하고/하거나(즉, 어느 정도까지 더디고 다르게는 멈춤); 종양 전이를 억제하고/하거나(즉, 어느 정도까지 더디고 다르게는 멈춤); 어느 정도까지, 종양 생장을 억제하고/하거나; 어느 정도까지 암과 관련된 하나 이상의 증상을 경감할 수 있다. 약물이 기존 암 세포의 생장 및 또는 사멸을 막을 수 있는 정도까지, 이는 세포분열억제 및/또는 세포독성일 수 있다. 예를 들어, 암 치료를 위해, 약효는 질환 진행에 대한 시간(TTP)을 평가함으로써 및/또는 반응 속도(RR)를 측정함으로써 측정될 수 있다. 면역학적 질병의 경우에, 치료 효과량은 알레르기 질병, 자가면역 및/또는 염증 질환의 증상, 또는 급성 염증 반응(예를 들어, 천식)의 증상을 줄이거나 완화하기에 충분한 양이다. 일부 실시양태에서, 치료 효과량은 B-세포의 활성 또는 수를 유의하게 줄이기에 충분한 본원에 기재된 화학 종의 양이다.
용어 "NSAID"는 "비스테로이드성 항염증 약물(non-steroidal anti-inflammatory drug)"의 약어이고, 진통제, 해열제(상승된 체온을 낮추고 의식의 약화없이 고통을 완화함) 및, 고용량에서 항염증 효과(염증 감소)를 갖는 치료제이다. 용어 "비스테로이드성"은 광범위한 범위의 효과 중 특히 유사한 에이코사노이드-침체화, 항염증 작용을 갖는 스테로이드로부터 이들 약물을 구별하기 위해 사용한다. 진통제로서, NSAID는 비마약성이라는 점에서 특이하다. NSAID는 아스피린, 이부프로펜 및 나프록센을 포함한다. NSAID는 일반적으로 통증 및 염증이 존재하는 급성 또는 만성 상태의 치료를 나타낸다. NSAID는 일반적으로 하기 상태의 징후의 경감을 나타낸다: 류마티스 관절염, 골관절염, 염증 관절증(예를 들어, 강직성 척추염, 건선성 관절염, 라이터 증후군, 급성 통풍, 월경곤란증, 전이 골형 통증, 두통 및 편두통, 수술 후 통증, 염증 및 조직 손상으로 인한 경중 통증, 발열, 장폐색 및 신산통. 대부분의 NSAID는 사이클로옥시게나제-1(COX-1) 및 사이클로옥시게나제-2(COX-2) 동위효소 둘다를 억제하는, 효소 사이클로옥시게나제의 비선택적 억제제로서 작용한다. 사이클로옥시게나제는 아라키돈산(그 자체가 포스포리파제 A2에 의해 세포의 인지질 이중층으로부터 유도됨)으로부터 프로스타글라딘 및 트롬복산의 형성을 촉진한다. 프로스타글란딘은 염증의 진행 중 (특히) 전달 분자로서 작용한다. COX-2 억제제는 셀레콕시브, 에토리콕시브, 루미라콕시브, 파레콕시브, 로페콕시브 및 발데콕시브를 포함한다.
용어 "암" 및 "암성"은 전형적으로 비규제된 세포 생장을 특징으로 하는 환자에서 생리적 상태를 지칭하거나 기재한다. "종양"은 하나 이상의 암성 세포를 포함한다. 암의 예는 비제한적으로, 암종, 림프종, 아세포종, 육종, 및 백혈병 또는 악성 림프종을 포함한다. 이러한 암의 보다 구체적인 예는 편평상피 세포암(예를 들어, 상피성 편평상피 세포 암), 폐암, 예컨대 소 세포 폐암, 비소 세포 폐암(NSCLC), 폐의 선암종 및 폐의 편평상피 암종, 복막의 암, 간세포암, 위장 또는 위암, 예컨대 위장관암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 간암, 유방암, 대장암, 직장암, 결장암, 자궁내막 또는 자궁 암종, 타액선 암종, 신장암, 전립선암, 외음부암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 및 두경부암을 포함한다.
"화학치료제"는 소정 질병, 예를 들어, 암 또는 염증 질환의 치료에 유용한 약품이다. 화학치료제의 예는 하기를 포함한다: NSAID; 호르몬, 예컨대 글루코코르티코이드; 코르티코스테로이드, 예컨대 하이드로코르티손, 하이드로코르티손 아세테이트, 코르티손 아세테이트, 틱소코르톨 피발레이트, 프레드니솔론, 메틸프레드니솔론, 프레드니손, 트라이암시놀론 아세토니드, 트라이암시놀론 알코올, 모메타손, 암시노니드, 부데소니드, 데소니드, 플루오시노니드, 플루오시놀론 아세토니드, 할시노니드, 베타메타손, 베타메타손 나트륨 포스페이트, 덱사메타손, 덱사메타손 나트륨 포스페이트, 플루오코르톨론, 하이드로코르티손-17-부티레이트, 하이드로코르티손-17-발레레이트, 아클로메타손 다이프로피오네이트, 베타메타손 발레레이트, 베타메타손 다이프로피오네이트, 프레드니카르베이트, 클로베타손-17-부티레이트, 클로베타솔-17-프로피오네이트, 플루오코르톨론 카프로에이트, 플루오코르톨론 피발레이트 및 플루프레드니덴 아세테이트; 면역 선택적 항염증 펩티드(ImSAID), 예컨대 페닐알라닌-글루타민-글리신(FEG) 및 이의 D-이성질체 형태(feG)(이뮬란 바이오테라퓨틱스 엘엘씨(IMULAN BioTerapeutics, LLC)); 항류마티즘 약물, 예컨대 아자티오프린, 시클로스포린(사이클로스포린 A), D-페니실라민, 금염, 하이드록시클로로퀸, 레플루노미드, 메토트렉세이트(MTX), 미노사이클린, 설파살라진, 사이클로포스파미드, 종양 괴사 인자 α(TNFα) 차단제, 예컨대 에타네르셉트(엔브렐(Enbrel)), 인플릭시맙(레이카드(Remicade)), 아달리무맙(휴미라(Humira)), 세르톨리주맙 페골(심지아(Cimzia)), 골리무맙(심포니(Simponi)), 인터루킨 1(IL-1) 차단제, 예컨대 아나킨라(키네레트(Kineret)), B 세포에 대한 단클론 항체, 예컨대 리툭시맙(리툭산(RITUXAN: 등록상표)), T 세포 공자극 차단제, 예컨대 아바타셉트(오렌시아(Orencia)), 인터루킨 6(IL-6) 차단제, 예컨대 토실리주맙; 호르몬 길항제, 예컨대 타목시펜, 피나스테리드 또는 LHRH 길항제; 방사선 동위원소(예를 들어, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사선 동위원소); 기타 연구용 시약, 예컨대 티오플라틴, PS-341, 페닐부티레이트, ET-18-OCH3 또는 파르네실 트랜스퍼라제 억제제(L-739749, L-744832); 폴리페놀, 예컨대 퀴에르세틴, 레스베라트롤, 피세아탄놀, 에피갈로카테킨 갈레이트, 테아플라빈, 플라바놀, 프로시아니딘, 베툴린산 및 이의 유도체; 자가 소화 억제제, 예컨대 클로로퀸; 알킬화제, 예컨대 티오페타 및 사이클로포스파미드(시톡산(CYTOXAN: 등록상표)); 알킬 설포네이트, 예컨대 부설판, 임프로설판 및 피포설판; 아지리딘, 예컨대 벤조도파, 카르보퀴온, 메투레도파 및 우레도파; 에틸렌이민 및 메틸아멜라민, 예컨대 알트레타민, 트라이에틸렌멜라민, 트라이에틸렌포스포라미드, 트라이에틸렌티오포스포라미드 및 트라이메틸로멜라민; 아세토게닌(특히 불라탁신 및 불라탁신온); δ-9-테트라하이드로칸나비놀(드로나비놀, 마리놀(MARINOL: 등록상표)); β-라파콘; 라파콜; 콜히친; 베툴린산; 캄프토테신(예컨대, 합성 유사체, 토포테칸(하이캄틴(HYCAMTIN: 등록상표)), CPT-11(이리노테칸, 캄프토사르(CAMPTOSAR: 등록상표)), 아세틸캄프토테신, 스코폴렉틴 및 9-아미노캄프토테신); 브리오스타틴; 칼리스타틴; CC-1065(예컨대, 이의 아도젤레신, 카르젤레신 및 바이젤레신 합성 유사체); 포도필로톡신; 포도필린산; 테니포시드; 크립토피신(특히, 크립토피신 1 및 크립토피신 8); 돌라스타틴; 튜오카르마이신(예컨대, 합성 유사체, KW-2189 및 CB1-TM1); 엘류테로빈; 판크라티스타틴; 사르코딕타인; 스폰기스타틴; 질소 머스타드, 예컨대 클로람부실, 클로르나파진, 클로로포스파미드, 에스트라무스틴, 이포스파미드, 메클로레타민, 메클로레타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비킨, 페네스테린, 프레드니무스틴, 트로포스파미드, 우라실 머스타드; 니트로소우레아, 예컨대 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴 및 라님누스틴; 항생제, 예컨대 에네다이인 항생제(예를 들어, 칼리케아미신, 특히 칼리케아미신 γ1I 및 칼리케아미신 εI1(예를 들어, 문헌[Nicolaou et al., Angew . Chem Intl . Ed . Engl ., 33: 183-186 (1994)] 참조); CDP323, 경구용 α-4 인테그린 억제제; 다이네미신, 예컨대 다이네미신 A; 에스페라미신; 및 네오카르지노스타틴 발색단 및 에네다이인 항생제 발색단에 연관된 색소 단백질), 아클라시노마이신, 액티노마이신, 아우트라마이신, 아자세린, 블레오마이신, 카티노마이신, 카라비신, 카르미노마이신, 카르지노필린, 크로모마이신, 다티노마이신, 다우노루비신, 데토루비신, 6-다이아조-5-옥소-L-노르류신, 독소루비신(예컨대, 아드리아마이신(ADRIAMYCIN: 등록상표)), 모폴리노-독소루비신, 시아노모폴리노-독소루비신, 2-피롤리노-독소루비신, 독소루비신 HCl 리포솜 주입(독실(DOXIL: 등록상표)), 리포소말 독소루비신 TLC D-99(마이오세트(MYOCET: 등록상표)), 페글리화된 리포소말 독소루비신(카에릭스(CAELYX: 등록상표)) 및 데옥시독소루비신), 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 예컨대 미토마이신 C, 마이코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포르피로마이신, 푸로마이신, 퀴엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투버르시딘, 우베니멕스, 지노스타틴, 조루비신; 항대사물질, 예컨대 메토트렉세이트, 겜시타빈(겜자르(GEMZAR: 등록상표)), 테가푸르(우프토랄(UFTORAL: 등록상표)), 카페시타빈(젤로다(XELODA: 등록상표)), 에포틸론 및 5-플루오로우라실(5-FU); 폴산 유사체, 예컨대 데노프테린, 메토트렉세이트, 프테롭테린, 트라이메트렉세이트; 푸린 유사체, 예컨대 플루다라빈, 6-머캅토푸린, 티아미프린, 티오구아닌; 피리미딘 유사체, 예컨대 안시타빈, 아자시티딘, 6-아자우리딘, 카르모푸르, 사이타라빈, 다이데옥시우리딘, 억시플우리딘, 에노시타빈, 플록스우리딘; 안드로겐, 예컨대 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 테스톨락톤; 항부신, 예컨대 아미노글루테티미드, 미토탄, 트라이로스탄; 폴산 보충물, 예컨대 프롤린산; 아세글라톤; 알도포스파미드 글리코시드; 아미노레불린산; 에닐우라실; 암사크린; 베스트라부실; 비산트렌; 에다트락세이트; 데포파민; 데메콜신; 다이아지퀴온; 엘포르니틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드 갈륨 니트레이트; 하이드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드, 예컨대 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피단몰; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속잔트론; 2-에틸하이드라지드; 프로카바진; PSK(등록상표) 폴리사카라이드 착체(제이에이치에스 내츄랄 프로덕츠(JHS Natural Products), 미국 오레곤주 유진 소재); 라족잔; 리족신; 시조피란; 스피로게르마늄; 테누아존산; 트라이아지퀴온; 2,2',2'-트라이클로로트라이에틸아민; 트라이코텐센(특히 T-2 톡신, 베라쿠린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신(엘디신(ELDISINE: 상표), 필데신(FILDESIN: 등록상표)); 다카르바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가사이토신; 아라비노시드(Ara-C); 티오페타; 탁소이드, 예를 들어, 파클리탁셀(탁솔(TAXOL: 등록상표)), 알부민-조작된 나노입자 제형의 파클리탁셀(아브라잔(ABRAXANE: 상표)) 및 도세탁셀(탁소테레(TAXOTERE: 등록상표)); 클로란부실; 6-티오구아닌; 머캅토푸린; 메토트렉세이트; 백금제, 예컨대 시스플라틴, 옥살리플라틴(예를 들어, 엘로잔틴(ELOXATIN: 등록상표)), 및 카보플라틴; 미소관의 형성으로부터 투불린 중합체화를 막는 빈카스, 예컨대 빈블라스틴(벨반(VELBAN: 등록상표)), 빈크리스틴(온코빈(ONCOVIN: 등록상표)), 빈데신(엘디신(상표), 필데신(등록상표), 및 비노렐빈(나벨빈(NAVELBINE: 등록상표)); 에토포시드(VP-16); 이포스파미드; 미톡산트론; 류코보린; 노반트론; 에다트렉세이트; 다우모마이신; 아미노프테린; 이반드로네이트; 토포이소머라제 억제제 RFS 2000; 다이플루오로메틸오르니틴(DMFO); 레티노이드, 예컨대 펜레티니드, 레티노산, 예컨대 벡사로텐(타겟인(TARGRETIN: 등록상표)); 비스포스포네이트, 예컨대 클로드로네이트(예를 들어, 모네포스(BONEFOS: 등록상표) 또는 오스탁(OSTAC: 등록상표)), 에티드로네이트(다이드록칼(DIDROCAL: 등록상표)), NE-58095, 졸레드론산/졸레드로네이트(조메타(ZOMETA: 등록상표)), 알렌드로네이트(포사맥스(FOSAMAX: 등록상표)), 파미드로네이트(아레디아(AREDIA: 등록상표)), 틸루드로네이트(스켈드(SKELD: 등록상표), 또는 리세드로네이트(악토넬(ACTONEL: 등록상표)); 트록사시타빈(1,3-다이옥솔란 뉴클레오시드 사이토신 유사체); 안티센스 올리고뉴클레오티드, 특히 이상한 세포 증식 중에 나타낸 신호화 경로 중 유전자의 발현을 억제하는 것, 예컨대, 예를 들어, PKC-α, Raf, H-Ras 및 상피 생장 인자 수용체(EGF-R); 백신, 예컨대, 테라토프(THERATOPE: 등록상표) 백신 및 유전자 치료 백신, 예를 들어, 알로벡틴(ALLOVECTIN: 등록상표) 백신, 류벡틴(LEUVECTIN: 등록상표) 백신 및 박시드(VAXID: 등록상표) 백신; 토포이소머라제 1 억제제(예를 들어, 루르토테칸(LURTOTECAN: 등록상표)); rmRH(예를 들어, 아바레릭스(ABARELIX: 등록상표)); BAY439006(소라페닙; 바이에르(Bayer)); SU-11248(서니티닙, 선텐트(SUTENT: 등록상표)), 화이자(Pfizer)); 페리포신, COX-2 억제제(예를 들어, 셀레콕시브 또는 에토리콕시브), 프로테오솜 억제제(예를 들어, PS341); 보르테조밉(벨카드(VELCADE: 등록상표)); CCI-779; 티피파르닙(R11577); 오라페닙, ABT510; Bcl-2 억제제, 예컨대 오블리메르센 나트륨(게나센스(GENASENSE: 등록상표)); 피잔트론; EGFR 억제제(하기 정의 참조); 파르네실트랜스퍼라제 억제제, 예컨대 로나파르닙(SCH 6636, 사라사르(SARASAR: 상표)); 및 상기의 임의의 약학적으로 허용되는 염, 산 또는 유도체; 및 상기의 2개 이상의 조합, 예컨대 CHOP(사이클로포스파미드, 독소루비신, 빈크리스틴 및 프레드니솔론의 조합 치료의 약어); 및 FOLFOX(5-FU 및 류코보린과 혼합된 옥살리플라틴(엘록사틴(ELOXATIN: 상표))을 사용한 식이양생법 치료의 약어).
본원에 정의된 추가 화학치료제는 암의 생장을 촉진할 수 있는 호르몬의 효과를 조절하거나 줄이거나 차단하거나 억제하도록 작용하는 "항호르몬제" 또는 "내분비 치료제"를 포함한다. 이는 비제한적으로 호르몬 자체, 예를 들어 혼합된 작용제/길항제 프로필을 갖는 항에스트로겐, 예컨대 타목시펜(놀바덱스(NOLVADEX: 등록상표)), 4-하이드록시타목시펜, 토레미펜(파레스톤(FARESTON: 등록상표)), 이독시펜, 드롤록시펜, 라록시펜(에비스타(EVISTA: 등록상표)), 트라이옥시펜, 케옥시펜, 및 선택적 에스트로겐 수용체 조절자(SERM), 예컨대 SERM3; 작용제 특성이 없는 순수 항에스트로겐, 예컨대 풀베스트란트(파슬로덱스(FASLODEX: 등록상표)), 및 EM800(이러한 약품은 에스트로겐 수용체(ER) 이합체화를 차단하고/하거나, DNA 결합을 억제하고/하거나, ER 전환을 증가하고/하거나, ER 수준을 억제할 수 있음); 아로마타제 억제제, 예컨대 스테로이드 아로마타제 억제제, 예컨대 포르메스탄 및 엑세메스탄(아로마신(AROMASIN: 등록상표)), 및 비스테로이드성 아로마타제 억제제, 예컨대 아나스트라졸(아리미덱스(ARIMIDEX: 등록상표)), 레트로졸(레마라(FEMARA: 등록상표)) 및 아미노글루테티미드일 수 있고, 다른 아로마타제 억제제는 보로졸(리베조르(RIVISOR: 등록상표)), 메게스트롤 아세테이트(MEGASE: 등록상표), 파드로졸 및 4(5)-이미다졸; 황체화 호르몬-방출 호르몬 작용제, 예컨대 류프롤리드(루프론(LUPRON: 등록상표) 및 엘리가드(ELIGARD: 등록상표)), 고세렐린, 부세렐린 및 트라이프테렐린; 성 스테로이드, 예컨대 프로게스틴, 예컨대 메게스트롤 아세테이트 및 메드록시프로게스테론 아세테이트, 에스트로겐, 예컨대 다이에틸스틸베스트롤 및 프레마린, 및 안드로겐/레티노이드, 예컨대 플루옥시메스테론, 모든 트랜스레티논산 및 펜레티니드; 오나프리스톤; 항프로게스테론; 에스트로겐 수용체 하향 조절자(ERD); 항안드로겐 예컨대 플루타미드, 닐루타미드 및 바이칼루타미드를 포함한다.
추가 화학치료제는 치료 항체, 예컨대 알렘투주맙(캄파쓰(Campath)), 베바시주맙(아바스틴(AVASTIN: 등록상표)), 제넨테크(Genentech)); 세툭시맙(에르비툭스(ERBITUX: 등록상표), 임클론(Imclone)); 파니투무맙(벡티빅스(VECTIBIX: 등록상표), 암겐), 리툭시맙(리툭산: 등록상표), 제넨테크/바이오겐 이데크(Biogen Idec)), 퍼투주맙(옴니타르그(OMNITARG: 등록상표)), 2C4, 제넨테크), 트라추주맙(헤르셉틴(HERCEPTIN: 등록상표), 제넨테크), 토시투모맙(벡사르(Bexxar), 코릭시아(Corixia)), 및 항체 약물 접합체, 겜투주맙 오조가미신(마이로타르그(MYLOTARG: 등록상표), 와이어쓰(Wyeth))를 포함한다. 본 발명의 화합물과 조합으로 약물로서 치료 잠재력을 갖는 추가 인간화된 단클론 항체는 아폴리주맙, 아셀리주맙, 아틸리주맙, 바피뉴주맙, 비바투주맙 메르탄신, 칸투주맙 메르탄신, 세델리주맙, 세르톨리주맙 페골, 시드푸시투주맙, 시드투주맙, 다클리주맙, 에쿨리주맙, 에팔리주맙, 에프라투주맙, 에를리주맙, 펠비주맙, 폰톨리주맙, 겜투주맙 오조가미신, 이노투주맙 오조가미신, 이필리무맙, 라베투주맙, 린투주맙, 마투주맙, 메폴리주맙, 모타비주맙, 모토비주맙, 나탈리주맙, 니모투주맙, 놀로비주맙, 무마비주맙, 오크렐리주맙, 오말리주맙, 팔리비주맙, 파르콜리주맙, 펙푸시투주맙, 펙투주맙, 페셀리주맙, 랄리비주맙, 란니비주맙, 레슬리비주맙, 레슬리주맙, 세리비주맙, 로벨리주맙, 루플리주맙, 시브로투주맙, 시플리주맙, 손투주맙, 타카투주맙 테트라제탄, 타도시주맙, 탈리주맙, 테피바주맙, 토실리주맙, 토랄리주맙, 투코투주맙 셀모류킨, 투쿠시투주맙, 우마비주맙, 우르토사주맙, 우스테키누맙, 비실리주맙, 및 인터루킨-12 p40 단백질을 인지하기 위해 유전적으로 개질된 배타적으로 재조합 인간-서열, 전장 IgG1 λ 항체인 항인터루킨-12(ABT-874/J695, 와이어쓰 리서치 앤드 아보트 래보라토리스(Wyeth Research and Abbott Laboratories))를 포함한다.
또한, 화학치료제는 EGFR에 결합하거나 그렇지 않으면 직접 상호작용하고 이의 신호화 활성을 막거나 줄이는 화합물을 지칭하는 "EGFR 억제제"를 포함하고, 다르게는 "EGFR 길항제"로서 지칭된다. 이러한 시약의 예는 EGFR에 결합하는 항체 및 작은 분자를 포함한다. EGFR에 결합하는 항체의 예는 MAb 579(ATCC CRL HB 8506), MAb 455(ATCC CRL HB8507), MAb 225(ATCC CRL 8508), MAb 528(ATCC CRL 8509)(미국특허 제 4,943,533 호, 문헌[Mendelsohn et al.] 참조) 및 이들의 변이체, 예컨대 키메라화된 225(C225 또는 세툭시맙(Cetuximab); 에르부틱스(ERBUTIX)) 및 재형성된 인간 225(H225)(국제특허출원공개 제 96/40210 호 참조, 임클론 시스템 인코포레이티드(Imclone System Inc.)); IMC-11F8, 완전 인간, EGFR-표적 항체(임클론); 유형 II 돌연변이 EGFR에 결합하는 항체(미국특허 제 5,212,290 호); 미국특허 제 5,891,996 호에 기재된 바와 같이 EGFR에 결합하는 인간화된 항체 및 키메라 항체; 및 EGFR에 결합하는 인간 항체, 예컨대 ABX-EGF 또는 파니투무맙(국제특허출원공개 제 98/50433 호 참조, 아브게닉스(Abgenix)/암겐); EMD 55900(문헌[Stragliotto et al . Eur . J. Cancer 32A:636-640(1996)]); EGFR 결합을 위해 EGF 및 TGF-α 둘다와 경쟁하는 EGFR에 대하여 유도된 인간화된 EGFR 항체인 EMD7200(마투주맙)(EMD/머크(Merck)); 인간 EGFR 항체, 휴맥스(HuMax)-EGFR(젠맵(GenMab)); E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6.3 및 E7.6.3으로서 공지되고 미국특허 제 6,235,883 호에 기재된 완전 인간 항체; MDX-447(메다렉스 인코포레이티드(Medarex Inc)); 및 mAb 806 또는 인간화된 mAb 806(문헌[Johns et al ., J. Biol . Chem . 279(29):30375-30384(2004)])을 포함한다. 항EGFR 항체는 세포독성제와 접합될 수 있고, 따라서 면역접합체를 생성한다(예를 들어, EP659,439A2, 머크 파텐트 게엠베하(Merck Patent GmbH) 참조). EGFR 길항제는 소분자, 예컨대 미국 특허 제 5,616,582 호, 제 5,457,105 호, 제 5,475,001 호, 제 5,654,307 호, 제 5,679,683 호, 제 6,084,095 호, 제 6,265,410 호, 제 6,455,534 호, 제 6,521,620 호, 제 6,596,726 호, 제 6,713,484 호, 제 5,770,599 호, 제 6,140,332 호, 제 5,866,572 호, 제 6,399,602 호, 제 6,344,459 호, 제 6,602,863 호, 제 6,391,874 호, 제 6,344,455 호, 제 5,760,041 호, 제 6,002,008 호 및 제 5,747,498 호, 및 하기 PCT 공보에 기재된 화합물을 포함한다: 국제특허출원공개 제 98/14451 호, 국제특허출원공개 제 98/50038 호, 국제특허출원공개 제 99/09016 호 및 국제특허출원공개 제 99/24037 호. 특정 소분자 EGFR 길항제는 OSI-774(CP-358774, 에를로티닙, 타르세바(TARCEVA: 등록상표)제넨테크/오에스아이 파마슈티칼스(Genentech/OSI Parmaceuticals)); PD 183805(CI 1033, 2-프로펜아미드, N-[4-[(3-클로로-4-플루오로페닐)아미노]-7-[3-(4-모폴리닐)프로폭시]-6-퀴나졸리닐]-다이하이드로클로라이드(화이자 인코포레이티드); ZD1839, 게피티닙(이레사(IRESSA)) 4-(3'-클로로-4'-플루오로아닐리노)-7-메톡시-6-(3-모폴리노프로폭시)퀴나졸린, 아스트라제네카(AstraZeneca); ZM 105180((6-아미노-4-(3-메틸페닐-아미노)-퀴나졸린, 제네카); BIBX-1382(N8-(3-클로로-4-플루오로-페닐)-N2-(1-메틸-피페리딘-4-일)-피리미도[5,4-d]피리미딘-2,8-다이아민, 뵈링거 잉겔하임(Boehringer Ingelheim)); PKI-166((R)-4-[4-[(1-페닐에틸)아미노]-1H-피롤로[2,3-d]피리미딘-6-일]-페놀); (R)-6-(4-하이드록시페닐)-4-[(1-페닐에틸)아미노]-7H-피롤로[2,3-d]피리미딘); CL-387785(N-[4-[(3-브로모페닐)아미노]-6-퀴나졸리닐]-2-부틴아미드); EKB-569(N-[4-[(3-클로로-4-플루오로페닐)아미노]-3-시아노-7-에톡시-6-퀴놀리닐]-4-(다이메틸아미노)-2-부텐아미드)(와이어쓰); AG1478(화이자); AG1571(SU 5271; 화이자); 이중 EGFR/HER2 티로신 키나아제 억제제, 예컨대 라파니팁(TYKERB: 등록상표), GSK572016 또는 N-[3-클로로-4-[(3 플루오로페닐)메톡시]페닐]-6[5[[[2메틸설포닐)에틸]아미노]메틸]-2-푸라닐]-4-퀴나졸린아민)을 포함한다.
또한, 화학치료제는 "티로신 키나아제 억제제", 예컨대 상기 단락에 요약된 EGFR-표적된 약물; 소분자 HER2 티로신 키나아제 억제제, 예컨대 다케다(Takeda)로부터 시판중인 TAK165; CP-724,714, ErbB2 수용체 티로신 키나아제(화이자 및 오에스아이)의 경구 선택적 억제제; 이중-HER 억제제, 예컨대 우선적으로 EGFR에 결합하지만 HER2 및 EGFR-과발현 세포를 둘다 억제하는 EKB-569(와이어쓰로부터 시판중임); 라파티닙(GSK572016; 글락소 스미스클라인으로부터 시판중임), 경구용 HER2 및 EGFR 티로신 키나아제 억제제; PKI-166(노바티스로부터 시판중임); 판-HER 억제제, 예컨대 카네르티닙(CI-1033; 파르마시아(Pharmacia)); Raf-1 억제제, 예컨대 Raf-1 신호화를 억제하는 안티센스 시약 ISIS-5132(이시스 파마슈티칼스(ISIS Pharmaceuticals)로부터 시판중임); 비-HER 표적된 TK 억제제, 예컨대 이마티닙 메실레이트(글리벡, 글락소 스미스클라인으로부터 시판중임); 다중-표적된 티로신 키나아제 억제제, 예컨대 서니티닙(수텐트(SUTENT: 등록상표), 화이자로부터 시판중임); VEGF 수용체 티로신 키나아제 억제제, 예컨대 바탈라닙(PTK787/ZK222584, 노바티스/쉐링 아게로부터 시판중임); MAPK 세포외 조절된 키나아제 I 억제제 CI-1040(파르마시아로부터 시판중임); 퀴나졸린, 예컨대 PD 153035,4-(3-클로로아닐리노) 퀴나졸린; 피리도피리미딘; 피리미도피리미딘; 피롤로피리미딘, 예컨대 CGP 59326, CGP 60261 및 CGP 62706; 피라졸로피리미딘, 4-(페닐아미노)-7H-피롤로[2,3-d] 피리미딘; 쿠르쿠민(다페룰로일 메탄, 4,5-비스(4-플루오로아닐리노)프탈리미드); 니트로티오펜 잔기를 함유하는 티르포스틴; PD-0183805(와너 람버(Warner-Lamber)); 안티센스 분자(예를 들어, HER-코드화 핵산에 결합하는 것); 퀸옥살린(미국특허 제 5,804,396 호); 트라이포스틴(미국특허 제 5,804,396 호); ZD6474(아스트라제네카); PTK-787(노바티스/쉐링 아게(Novartis/Schering AG)); 판-HER 억제제, 예컨대 CI-1033(화이자); 아피니탁(Affinitac)(ISIS 3521; 이시스/릴리(Isis/Lilly)); 이마티닙 메실레이트(글리벡(GLEEVEC)); PKI 166(노바티스); GW2016(글락소 스미스클라인(Glaxo SmithKline)); CI-1033(화이자); EKB-569(와이어쓰); 세마시닙(Semaxinib, 화이자); ZD6474(아스트라제네카); PTK-787(노바티스/쉐링 아게); INC-1C11(임클론), 라파마이신(시롤리무스, 라파뮨(RAPAMUNE: 등록상표)); 또는 임의의 하기 특허 공보에 기재된 것을 포함한다: 미국특허 제 5,804,396 호; 국제특허출원공개 제 1999/09016 호(아메리칸 시아나미드(American Cyanamid)); 국제특허출원공개 제 1998/43960 호(아메리칸 시아나미드); 국제특허출원공개 제 1997/38983 호(와너 람버); 국제특허출원공개 제 1999/06378 호(와너 람버); 국제특허출원공개 제 1999/06396 호(와너 람버); 국제특허출원공개 제 1996/30347 호(화이자, 인코포레이티드); 국제특허출원공개 제 1996/33978 호(제네카); 국제특허출원공개 제 1996/3397 호(제네카) 및 국제특허출원공개 제 1996/33980 호(제네카).
또한, 화학치료제는 천식 치료제, 예컨대 흡입용 코르티코스테로이드, 예컨대 플루티카손, 부데소니드, 모메타손, 플루니솔리드 및 베클로메타손; 류코트리엔 개질제, 예컨대 몬텔루카스트, 자피르루카스트 및 질류톤; 장-작용성 β 작용제, 예컨대 살메테롤 및 포름오테롤; 상기 치료제의 조합, 예컨대 플루티카손 및 살메테롤의 조합, 및 부데소니드 및 포름오테롤의 조합; 테오필린; 단-작용성 β 작용제, 예컨대 알부테롤, 레발부테롤 및 피르부테롤; 이프라트로퓸; 경구 및 정맥내 코르티코스테로이드, 예컨대 프레드니손 및 메틸프레드니솔론; 오말리주맙; 레브리키주맙; 항히스타민 및 충혈완화제 크로몰린 및 이프라트로퓸을 포함한다.
"임의적으로 치환된"은 달리 명시되지 않는 한, 치환기가 동일하거나 상이할 수 있는 기에 대해 나열된 하나 이상(예를 들어 0, 1, 2, 3 또는 4개)의 치환기에 의해 치환되거나 비치환될 수 있는 기를 의미한다. 실시양태에서 임의적으로 치환된 기는 1개의 치환기를 갖는다. 또 다른 실시양태에서 임의적으로 치환된 기는 2개의 치환기를 갖는다. 또 다른 실시양태에서 임의적으로 치환된 기는 3개의 치환기를 갖는다.
본원에 사용된 용어 "전구약물"은 모 약물에 비해 환자에게 덜 효과적이거나 종양세포에 세포독성이고, 더욱 활성인 모 형태로 효소적으로 또는 가수분해적으로 활성화 또는 전환될 수 있는 약학 활성 물질의 전구체 또는 유도체 형태를 지칭한다. 예를 들어, 문헌[Wilman, "Prodrug in Cancer ChemoTherapy" Biochemical Society transactions, 14, pp. 375-382, 615th Meeting Belfast (1986)] 및 문헌[Stella et al., "Prodrug: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press(1985)]을 참조한다. 본 발명의 전구약물은 비제한적으로, 포스페이트-함유 전구약물, 티오포스페이트-함유 전구약물, 설페이트-함유 전구약물, 펩티드-함유 전구약물, D-아미노산-개질된 전구약물, 글리코실화된 전구약물, β-락탐-함유 전구약물, 임의적으로 치환된 페녹시아세트아미드-함유 전구약물 또는 임의적으로 치환된 페닐아세트아미드-함유 전구약물, 5-플루오로사이토신, 및 더욱 활성인 세포독성이 없는 약물로 전환될 수 있는 다른 5-플루오로우리딘 전구약물을 포함한다. 본 발명에서 사용하기 위한 전구약물 형태로 유도될 수 있는 세포독성 약물의 예는 비제한적으로, 상기한 화학치료제를 포함한다.
용어 "포장 삽입물"은 치료 생성물의 상업적인 포장에 포함된 통상적인 지시사항을 지칭하기 위해 사용되고, 이는 상기 치료 생성물의 사용에 관련된 설명서, 용법, 복용량, 투여, 금기 및/또는 경고에 관한 정보를 함유한다.
용어 "입체이성질체"는 동일한 화학 구조를 갖지만, 공간 내 원자 또는 기의 배열과 관련하여 상이한 화합물을 지칭한다. 입체이성질체는 부분입체이성질체, 거울상이성질체, 형태이성질체 등을 포함한다.
"부분입체이성질체"는 분자 비대칭성의 2개 이상의 중심을 갖는 입체이성질체를 지칭하고, 이의 분자는 서로의 거울상이 아니다. 부분입체이성질체는 상이한 물리적 특성, 예를 들어 융점, 비점, 스펙트럼 특성 및 반응성을 갖는다. 부분입체이성질체의 혼합물은 고해상도 분석적 절차, 예컨대 전기영동 및 크로마토그래피하에 분리할 수 있다.
"거울상이성질체"는 서로의 포개질 수 없는 거울상인 화합물의 2개의 입체이성질체를 지칭한다.
본원에 사용된 입체화학적 정의 및 관례는 일반적으로 하기 문헌[S. P. Parker, Ed., McGraw - Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York]; 및 문헌[Eliel, E. and Wilen, S., "Stereochemistry of Organic Compound", John Wiley & Sons, Inc., New York, 1994]을 참조한다. 많은 유기 화합물이 광학적인 활성 형태로 존재하는데, 즉, 평면 편광의 평면에 회전할 수 있는 능력을 갖는다. 광학적인 활성 화합물의 기술에서, 접두사 D 및 L, 또는 R 및 S는 이의 키랄 중심에 관한 분자의 절대 배열을 나타내기 위해 사용된다. 접두사 d 및 l 또는 (+) 및 (-)는 화합물에 의해 평면 편광의 회전의 신호를 지정하기 위해 사용되고, (-) 또는 1을 갖는 것은 화합물이 좌선성임을 의미한다. (+) 또는 d로 접두된 화합물은 우선성이다. 소정의 화학 구조에 대하여, 이들 입체이성질체는 이들이 서로의 거울상인 것을 제외하고 동일하다. 또한, 특정 입체이성질체는 거울상이성질체로서 지칭될 수 있고, 이러한 이성질체의 혼합물은 종종 거울상이성질체 혼합물로서 지칭된다. 거울상이성질체의 50:50의 혼합물은 라세믹 혼합물 또는 라세미체로서 지칭되고, 이는 화학 반응 또는 공정에서 입체선택적 또는 입체특이성이 아닌 경우 발생할 수 있다. 용어 "라세믹 혼합물" 및 "라세미체"는 광학 활성이 없는 2개 거울상이성질체 종의 등몰 혼합물을 지칭한다.
용어 "호변이성질체" 또는 "호변이성질체 형태"는 낮은 에너지 장벽을 통해 상호전환할 수 있는 상이한 에너지의 구조적인 이성질체를 지칭한다. 예를 들어, 양성자 호변이성질체(양성자성 호변이성질체로도 공지됨)는 양성자의 이동을 통한 상호전환, 예컨대 케토-엔올 및 이민-엔아민 이성질체화를 포함한다. 호변이성질체 원자가는 결합 전자의 일부의 재편성에 의한 상호전환을 포함한다.
본원에 사용된 어구 "약학적으로 허용되는 염"은 화학식 I의 화합물의 약학적으로 허용되는 유기 또는 무기 염을 지칭한다. "약학적으로 허용되는 염"은 산 및 염기 부가 염 둘다를 포함한다. 염의 예는 비제한적으로, 설페이트, 시트레이트, 아세테이트, 옥살레이트, 클로라이드, 브로마이드, 요오다이드, 니트레이트, 바이설페이트, 포스페이트, 산 포스페이트, 이소니코티네이트, 락테이트, 살리실레이트, 산 시트레이트, 타르트레이트, 올레에이트, 탄네이트, 판토테네이트, 바이타르트레이트, 아스코르베이트, 숙시네이트, 말레에이트, 겐티시네이트, 푸마레이트, 글루코네이트, 글루쿠로네이트, 사카레이트, 포름에이트, 벤조에이트, 글루타메이트, 메탄설포네이트, 에탄설포네이트, 벤젠설포네이트, p-톨루엔설포네이트 및 파모에이트(즉, 1,1'-메틸렌비스-(2-하이드록시-3-나프토에이트)) 염을 포함한다. 약학적으로 허용되는 염은 또 다른 분자, 예컨대 아세테이트 이온, 숙시네이트 이온 또는 다른 반대 이온의 포함을 수반할 수 있다. 반대 이온은 모 화합물의 전하를 안정화하는 임의의 유기 또는 무기 잔기일 수 있다. 더욱이, 약학적으로 허용되는 염은 이의 구조에서 하나 초과의 하전된 원자를 가질 수 있다. 다중 하전된 원자가 약학적으로 허용되는 염의 부분인 경우는 다중 반대 이온을 가질 수 있다. 따라서, 약학적으로 허용되는 염은 하나 이상의 하전된 원자 및/또는 하나 이상의 반대 이온, 예를 들어 다이하이드로클로라이드 또는 다이포름에이트 염을 가질 수 있다.
"약학적으로 허용되는 산 부가 염"은 자유 염기의 생물학적 효과 및 특성을 보유하고, 생물학적으로 또는 그렇지 않으면 바람직하지 않지 않은 염으로서, 무기산, 예컨대 염산, 브롬화수소산, 황산, 질산, 탄산, 인산 등, 및 유기산, 예컨대 포름산, 아세트산, 프로피온산, 글리콜산, 글루콘산, 락트산, 피루브산, 옥살산, 말산, 말레산, 말론산, 숙신산, 푸마르산, 타르타르산, 시트르산, 아스파르트산, 아스코르브산, 글루탐산, 안트라닐산, 벤조산, 신남산, 만델산, 엠본산, 페닐아세트산, 메탄설폰산, 에탄설폰산, 벤젠설폰산, p-톨루엔설폰산, 살리실산 등의 지방족, 사이클로지방족, 방향족, 아르지방족, 헤테로사이클, 카복실, 및 설폰 부류에 의해 형성된 염을 지칭한다.
"약학적으로 허용되는 염기 부가 염"은 무기 염기, 예컨대 나트륨, 칼륨, 리튬, 암모늄, 칼슘, 마그네슘, 철, 아연, 구리, 망간, 알루미늄 염 등으로부터 유도된 것을 포함한다. 특히 염기 부가 염은 암모늄, 칼륨, 나트륨, 칼슘 및 마그네슘 염이다. 약학적으로 허용되는 유기 비독성 염기로부터 유도된 염은 1차, 2차 및 3차 아민, 천연적으로 발생하는 치환된 아민을 포함하는 치환된 아민, 환형 아민 및 염기성 이온 교환 수지, 예컨대 이소프로필아민, 트라이메틸아민, 다이에틸아민, 트라이에틸아민, 트라이프로필아민, 에탄올아민, 2-다이에틸아미노에탄올, 트로메타민, 다이사이클로헥실아민, 라이신, 아르기닌, 히스티딘, 카페인, 프로카인, 하이드라바민, 콜린, 베타인, 에틸렌다이아민, 글루코사민, 메틸글루카민, 테오브로민, 푸린, 피페리진, 피페리딘, N-에틸피페리딘, 폴리아민 수지 등의 염을 포함한다. 특히 유기 비독성 염기는 이소프로필아민, 다이에틸아민, 에탄올아민, 트로메타민, 다이사이클로헥실아민, 콜린 및 카페인이다.
"용매화물"은 하나 이상의 용매 분자 및 화학식 I의 화합물의 회합 또는 착체를 지칭한다. 용매화물을 형성하는 용매의 예는 비제한적으로, 물, 이소프로판올, 에탄올, 메탄올, DMSO, 에틸 아세테이트, 아세트산 및 에탄올아민을 포함한다. 용어 "수화물"은 용매 분자가 물인 착체를 지칭한다.
용어 "보호기" 또는 "Pg"는 화합물 상의 다른 작용기가 반응하는 동안 특정 작용기를 차단하거나 보호하기 위해 통상적으로 이용되는 치환기를 지칭한다. 예를 들어, "아미노-보호기"는 화합물 중 아미노 작용기를 차단하거나 보호하는 아미노 기에 부착된 치환기이다. 적합한 아미노-보호기는 아세틸, 트라이플루오로아세틸, 프탈리미도, t-부톡시카본일(BOC), 벤질옥시카본일(CBz) 및 9-플루오레닐메틸렌옥시카본일(Fmoc)을 포함한다. 유사하게, "하이드록시-보호기"는 하이드록시 작용기를 차단하거나 보호하는 하이드록시 기의 치환기를 지칭한다. 적합한 하이드록시-보호기는 아세틸, 트라이알킬실릴, 다이알킬페닐실릴, 벤조일, 벤질, 벤질옥시메틸, 메틸, 메톡시메틸, 트라이아릴릴메틸 및 테트라하이드로피라닐을 포함한다. "카복시-보호기"는 카복시 작용기를 차단하거나 보호하는 카복시 기의 치환기를 지칭한다. 통상의 카복시-보호기는 -CH2CH2SO2Ph, 시아노에틸, 2-(트라이메틸실릴)에틸, 2-(트라이메틸실릴)에톡시메틸, 2-(p-톨루엔설포닐)에틸, 2-(p-니트로페닐설페닐)에틸, 2-(다이페닐포스피노)-에틸, 니트로에틸 등을 포함한다. 보호기의 일반적인 설명 및 이들의 용도에 관하여, 문헌[T. W. Greene and P. Wuts, Protective Groups in Organic Synthesis, Third Ed., John Wiley & Sons, New York, 1999]; 및 문헌[P. Kocienski, Protecting Groups, Third Ed., Verlag, 2003]을 참조한다.
용어 "환자"는 인간 환자 및 동물 환자를 포함한다. 용어 "동물"은 반려 동물(예를 들어, 개, 고양이 및 말), 식품원 동물, 동물원 동물, 해양 동물, 조류 및 다른 유사한 동물 종을 포함한다. 일 예에서, 환자는 인간이다.
어구 "약학적으로 허용되는"은 물질 또는 조성물이 제형에 포함되는 다른 성분, 및/또는 상기 물질 또는 조성물로 처리되는 포유동물과 화학적으로 및/또는 독성학적으로 호환될 수 있어야 함을 나타낸다.
용어 "본 발명의 화합물"은 달리 명시하지 않으면 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 및 염(예를 들어, 약학적으로 허용되는 염)을 포함한다. 달리 언급하지 않으면, 본원에 도시된 구조는 하나 이상의 동위원소로 강화된 원자의 존재만이 상이한 화합물을 포함함을 또한 의미한다. 예를 들어, 하나 이상의 수소 원자가 중수소 또는 삼중수소로 대체되거나, 하나 이상의 탄소 원자가 13C 또는 14C 탄소 원자로 대체되거나, 하나 이상의 질소 원자가 15N 질소 원자로 대체되거나, 하나 이상의 황 원자가 33S, 34S 또는 36S 황 원자로 대체되거나, 하나 이상의 산소 원자가 17O 또는 18O 산소 원자로 대체된 화학식 I의 화합물이 본 발명의 범주 내에 있다.
TYK2
억제제 화합물
일 실시양태에서, 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 및 약학적으로 허용되는 염, 및 이의 약학 제형은 TYK2의 억제에 즉각 반응하는 질환, 상태 및/또는 질병의 치료에 유용한 것으로 제공된다.
또 다른 실시양태는 하기 화학식 I의 화합물 및 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 및 약학적으로 허용되는 염을 포함한다:
화학식 I
상기 식에서,
A는 CR3 또는 N이고;
X는 CR15 또는 N이고;
R1은 독립적으로 수소, 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, -CF3, -OR6, -SR6, -OCF3, -CN, -NO2, -C(O)R6, -C(O)OR6, -C(O)NR6R7, -S(O)1-2R6, -S(O)1-2NR6R7, -NR6SO2R7, -NR6SO2NR6R7, -NR6C(O)R7, -NR6C(O)OR7, -NR6C(O)NR6R7, -OC(O)NR6R7, -NR6R7, 3 내지 6 원 헤테로사이클릴 또는 페닐이되, R1은 둘다 동시에 수소일 수 없고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -CN, -OR6, -NR6R7, C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴 또는 페닐에 의해 임의적으로 치환되고, 상기 사이클로알킬, 헤테로사이클릴 및 페닐은 독립적으로 R10에 의해 임의적으로 치환되고;
R2 및 R3은 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR8, -(C0-C3 알킬렌)SR8, -(C0-C3 알킬렌)NR8R9, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R8, -(C0-C3 알킬렌)C(O)OR8, -(C0-C3 알킬렌)C(O)NR8R9, -(C0-C3 알킬렌)NR8C(O)R9, -(C0-C3 알킬렌)S(O)1-2R8, -(C0-C3 알킬렌)NR8S(O)1-2R9, -(C0-C3 알킬렌)S(O)1-2NR8R9, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R2 및 R3은 각각 독립적으로 R10에 의해 임의적으로 치환되고;
R4는 수소, -NR6-, -NR6R7, -NR6C(O)-, -NR6C(O)O-, -NR6C(O)NR7-, -NR6S(O)1-2- 또는 -NR6S(O)1-2NR7-이고;
R5는 존재하지 않거나, 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C10 사이클로알킬, C6-C10 아릴, 3 내지 10 원 헤테로사이클릴 또는 5 내지 10 원 헤테로아릴이고, 이때 R5는 R10에 의해 임의적으로 치환되고;
R6 및 R7은 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6사이클로알킬, 3 내지 10 원 헤테로사이클릴 또는 페닐이고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -CN, -OR6, -NR6R7, C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴 또는 페닐에 의해 임의적으로 치환되고, 상기 사이클로알킬, 헤테로사이클릴 및 페닐은 독립적으로 R10에 의해 임의적으로 치환되거나,
R6 및 R7은 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 10 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환되고;
R8 및 R9는 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, 페닐, 3 내지 10 원 헤테로사이클릴이고, 상기 알킬, 알케닐, 알키닐, 사이클로알킬, 페닐 및 헤테로사이클릴은 독립적으로 R10에 의해 임의적으로 치환되거나,
R8 및 R9는 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 10 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환되고;
R10은 독립적으로 수소, 옥소, C1-C12 알킬, C2-C12 알케닐, C2-C12 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR11, -(C0-C3 알킬렌)SR11, -(C0-C3 알킬렌)NR11R12, -(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C=NR11(R12), -(C0-C3 알킬렌)C=NR11(OR12), -(C0-C3 알킬렌)C(O)R11, -(C0-C3 알킬렌)C(O)OR11, -(C0-C3 알킬렌)C(O)NR11R12, -(C0-C3 알킬렌)NR11C(O)R12, -(C0-C3 알킬렌)S(O)1-2R11, -(C0-C3 알킬렌)NR11S(O)1-2R12, -(C0-C3 알킬렌)S(O)1-2NR11R12, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 10 원 헤테로사이클릴), -(C0-C3 알킬렌)C(O)(3 내지 10 원 헤테로사이클릴) 또는 -(C0-C3 알킬렌)(C6-C10 아릴)이고, 이때 R10은 독립적으로 할로겐, 옥소, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C12 알킬, 옥소 또는 할로겐에 의해 임의적으로 치환된 C2-C12 알케닐, 옥소 또는 할로겐에 의해 임의적으로 치환된 C2-C12 알키닐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR13, -(C0-C3 알킬렌)SR13, -(C0-C3 알킬렌)NR13R14, -(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R13, -(C0-C3 알킬렌)C(O)OR13, -(C0-C3 알킬렌)C(O)NR13R14, -(C0-C3 알킬렌)NR13C(O)R14, -(C0-C3 알킬렌)S(O)1-2R13, -(C0-C3 알킬렌)NR13S(O)1-2R14, -(C0-C3 알킬렌)S(O)1-2NR13R14, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)C(O)(3 내지 6 원 헤테로사이클릴) 또는 -(C0-C3 알킬렌)페닐에 의해 임의적으로 치환되고;
R11 및 R12는 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, 페닐 또는 3 내지 6 원 헤테로사이클릴이고, 상기 알킬, 알케닐, 알키닐, 사이클로알킬, 페닐 및 헤테로사이클릴은 독립적으로 할로겐, 옥소, -CN, -OR16, -NR16R17, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환되거나,
R11 및 R12는 이들이 부착된 원자와 함께 할로겐, 옥소, -OR16, -NR16R17, 또는 할로겐, 옥소 또는 OH에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R13 및 R14는 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이거나,
R13 및 R14는 이들이 부착된 원자와 함께 할로겐, 옥소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴이고;
R15는 수소, 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR18, -(C0-C3 알킬렌)SR18, -(C0-C3 알킬렌)NR18R19, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R18, -(C0-C3 알킬렌)C(O)OR18, -(C0-C3 알킬렌)C(O)NR18R19, -(C0-C3 알킬렌)NR18C(O)R19, -(C0-C3 알킬렌)S(O)1-2R18, -(C0-C3 알킬렌)NR18S(O)1-2R19, -(C0-C3 알킬렌)S(O)1-2NR18R19, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R15는 독립적으로 할로겐, 옥소, -CN, -CF3, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환되고;
R16 및 R17은 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이거나,
R16 및 R17은 이들이 부착된 원자와 함께 할로겐, 옥소, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴이고;
R18 및 R19는 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이다.
또 다른 실시양태는 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 및 약학적으로 허용되는 염을 포함하고, 이때
A는 CR3 또는 N이고;
X는 CR15 또는 N이고;
R1은 독립적으로 수소, 할로겐, C1-C3 알킬, C2-C3 알케닐, C2-C3 알키닐, C3-C4 사이클로알킬, -CF3, -OR6, -SR6, -OCF3, -CN, -NO2, -NR6SO2R7, -NR6C(O)R7 또는 -NR6R7이되, R1은 둘다 동시에 수소일 수 없고, 상기 알킬, 알케닐, 알키닐 및 사이클로알킬은 할로겐, OR6, -NR6R7 또는 페닐에 의해 임의적으로 치환되고;
R2 및 R3은 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR8, -(C0-C3 알킬렌)SR8, -(C0-C3 알킬렌)NR8R9, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R8, -(C0-C3 알킬렌)C(O)OR8, -(C0-C3 알킬렌)C(O)NR8R9, -(C0-C3 알킬렌)NR8C(O)R9, -(C0-C3 알킬렌)S(O)1-2R8, -(C0-C3 알킬렌)NR8S(O)1-2R9, -(C0-C3 알킬렌)S(O)1-2NR8R9, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R2 및 R3은 각각 독립적으로 R10에 의해 임의적으로 치환되고;
R4는 수소, -NH2, -NH-, -NR6R7, -NR6C(O)-, -NR6C(O)O-, -NR6C(O)NR7-, -NR6S(O)1-2- 또는 -NR6S(O)1-2NR7-이고;
R5는 존재하지 않거나, 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C10 사이클로알킬, C6-C10 아릴, 3 내지 10 원 헤테로사이클릴 또는 5 내지 10 원 헤테로아릴이고, 이때 R5는 R10에 의해 임의적으로 치환되고;
R6 및 R7은 각각 독립적으로 수소, C1-C3 알킬, C2-C6 알케닐, C2-C6 알키닐 또는 C3-C4 사이클로알킬이고, 상기 알킬, 알케닐, 알키닐 및 사이클로알킬은 독립적으로 할로겐, 옥소, -OR11 또는 -NR11R12에 의해 임의적으로 치환되거나,
R6 및 R7은 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -NR11R12 또는 C1-C3 알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R8 및 R9는 각각 독립적으로 수소, C1-C3 알킬, C3-C6 사이클로알킬, 페닐, 3 내지 6 원 헤테로사이클릴 또는 5 또는 6 원 헤테로아릴이고, 상기 알킬, 사이클로알킬, 페닐, 헤테로사이클릴 또는 헤테로아릴은 독립적으로 R10에 의해 임의적으로 치환되거나,
R8 및 R9는 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -NR11R12 또는 C1-C3 알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R10은 독립적으로 수소, 옥소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR11, -(C0-C3 알킬렌)SR11, -(C0-C3 알킬렌)NR11R12, -(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -C=NH(OR11), -(C0-C3 알킬렌)C(O)R11, -(C0-C3 알킬렌)C(O)OR11, -(C0-C3 알킬렌)C(O)NR11R12, -(C0-C3 알킬렌)NR11C(O)R12, -(C0-C3 알킬렌)S(O)1-2R11, -(C0-C3 알킬렌)NR11S(O)1-2R12, -(C0-C3 알킬렌)S(O)1-2NR11R12, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)C(O)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R10은 독립적으로 할로겐, 옥소, -CF3, -(C0-C3 알킬렌)OR13, -(C0-C3 알킬렌)NR13R14, -(C0-C3 알킬렌)C(O)R13, -(C0-C3 알킬렌)S(O)1-2R13, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환되고;
R11 및 R12는 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, 페닐, 5 내지 6 원 헤테로아릴 또는 3 내지 6 원 헤테로사이클릴, 상기 알킬, 알케닐, 알키닐, 사이클로알킬, 페닐, 헤테로아릴및 헤테로사이클릴은 독립적으로 할로겐, 옥소, -CN, -OR16, -NR16R17, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환되거나,
R11 및 R12는 이들이 부착된 원자와 함께 할로겐, 옥소, -OR16, -NR16R17, 또는 할로겐, 옥소 또는 OH에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R13 및 R14는 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이거나,
R13 및 R14는 이들이 부착된 원자와 함께 할로겐, 옥소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R15는 수소, 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR18, -(C0-C3 알킬렌)SR18, -(C0-C3 알킬렌)NR18R19, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R18, -(C0-C3 알킬렌)C(O)OR18, -(C0-C3 알킬렌)C(O)NR18R19, -(C0-C3 알킬렌)NR18C(O)R19, -(C0-C3 알킬렌)S(O)1-2R18, -(C0-C3 알킬렌)NR18S(O)1-2R19, -(C0-C3 알킬렌)S(O)1-2NR18R19, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R15는 독립적으로 할로겐, 옥소, -CF3, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환되고;
R16 및 R17은 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이거나,
R16 및 R17은 이들이 부착된 원자와 함께 할로겐, 옥소, 또는 할로겐에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R18 및 R19는 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이다.
특정 실시양태에서, 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체, 용매화물, 전구약물 및 약학적으로 허용되는 염은 화합물 2-(2-에틸페닐)-N-[4-(트라이플루오로메톡시)페닐]-2H-피라졸로[3,4-d]피리미딘-4-아민, 2-(2,4-다이클로로페닐)-N-[4-(트라이플루오로메톡시)페닐]-2H-피라졸로[3,4-d]피리미딘-4-아민, 2-(2-플루오로페닐)-N-[4-(트라이플루오로메톡시)페닐]-2H-피라졸로[3,4-d]피리미딘-4-아민 또는 2-(2,3-다이메틸페닐)-N-[4-(트라이플루오로메톡시)페닐]-2H-피라졸로[3,4-d]피리미딘-4-아민을 제외한 화합물을 포함한다.
특정 실시양태에서, A는 CR3이다.
특정 실시양태에서, A는 CR3이고, X는 CR15이다.
특정 실시양태에서, A는 CR3이고, X는 N이다.
특정 실시양태에서, A는 N이다.
특정 실시양태에서, A는 N이고, X는 CR15이다.
특정 실시양태에서, A는 N이고, X는 N이다.
특정 실시양태에서, R1은 독립적으로 할로겐이다. 일 실시양태에서, R1은 독립적으로 F 또는 Cl이다. 또 다른 실시양태에서, R1은 Cl이다.
특정 실시양태에서, R1은 독립적으로 할로겐이고, 기 -R4-R5는 -NHR5, -NR6C(O)R5, -NR6C(O)OR5 또는 -NR6C(O)NR7R5이고, 이때 R5는 수소가 아니다.
특정 실시양태에서, 하나의 R1은 할로겐이고, 다른 R1은 수소, 할로겐, C1-C3 알킬, C3-C4 사이클로알킬, -CF3, -OH, -O(C1-C3 알킬), -SH, -S(C1-C3 알킬), -OCF3, -CN, -NO2, -NHSO2CH3, -NHC(O)R7 또는 -NR6R7이고, 상기 알킬 및 사이클로알킬은 할로겐, OR8, -NR8R9 또는 페닐에 의해 임의적으로 치환된다.
특정 실시양태에서, 하나의 R1은 할로겐이고, 다른 R1은 수소, 할로겐, C1-C3 알킬, C3-C4 사이클로알킬, -CF3, -OH, -O(C1-C3 알킬), -SH, -S(C1-C3 알킬), -OCF3, -CN, -NO2, -NHSO2CH3, -C(O)OR6, -NHC(O)R7 또는 -NR6R7이고, 상기 알킬 및 사이클로알킬은 할로겐, OR8, -NR8R9 또는 페닐에 의해 임의적으로 치환된다.
특정 실시양태에서, 하나의 R1은 할로겐이고, 다른 R1은 수소, 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, -CF3, -OR6, -SR6, -OCF3, -CN, -NO2, -C(O)R6, -C(O)OR6, -C(O)NR6R7, -S(O)1-2R6, -S(O)1-2NR6R7, -NR6SO2R7, -NR6SO2NR6R7, -NR6C(O)R7, -NR6C(O)OR7, -NR6C(O)NR6R7, -OC(O)NR6R7, -NR6R7, 3 내지 6 원 헤테로사이클릴 또는 페닐이되, R1은 둘다 동시에 수소일 수 없고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -CN, -OR6, -NR6R7 C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴 또는 페닐에 의해 임의적으로 치환되고, 상기 사이클로알킬, 헤테로사이클릴 및 페닐은 독립적으로 R10에 의해 임의적으로 치환된다.
특정 실시양태에서, 하나의 R1은 할로겐이고, 다른 R1은 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, -CF3, -OR6, -SR6, -OCF3, -CN, -NO2, -C(O)R6, -C(O)OR6, -C(O)NR6R7, -S(O)1-2R6, -S(O)1-2NR6R7, -NR6SO2R7, -NR6SO2NR6R7, -NR6C(O)R7, -NR6C(O)OR7, -NR6C(O)NR6R7, -OC(O)NR6R7, -NR6R7, 3 내지 6 원 헤테로사이클릴 또는 페닐이되, R1은 둘다 동시에 수소일 수 없고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -CN, -OR6, -NR6R7 C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴 또는 페닐에 의해 임의적으로 치환되고, 상기 사이클로알킬, 헤테로사이클릴 및 페닐은 독립적으로 R10에 의해 임의적으로 치환된다.
특정 실시양태에서, 하나의 R1은 할로겐이고, 다른 R1은 할로겐, C1-C3 알킬, C3-C4 사이클로알킬, -CF3, -OH, -O(C1-C3 알킬), -SH, -S(C1-C3 알킬), -OCF3, -CN, -NO2, -NHSO2CH3, -NHC(O)R7 또는 -NR6R7이고, 상기 알킬 및 사이클로알킬은 할로겐, OR8, -NR8R9 또는 페닐에 의해 임의적으로 치환된다.
특정 실시양태에서, R1은 독립적으로 할로겐, C1-C3 알킬, C3-C4 사이클로알킬, -CF3, -OH, -O(C1-C3 알킬), -SH, -S(C1-C3 알킬), -OCF3, -CN, -NO2, -NHSO2CH3, -NHC(O)R7 또는 -NR6R7이고, 상기 알킬 및 사이클로알킬은 할로겐, OR8, -NR8R9 또는 페닐에 의해 임의적으로 치환된다.
특정 실시양태에서, R1은 독립적으로 수소, F, Cl, -CN, -CF3, -CH3 또는 -OCF3이되, R1은 둘다 동시에 수소일 수 없다.
특정 실시양태에서, R1은 독립적으로 수소, F, Cl, -CN, -CF3, -CH3, -C(O)OH 또는 -OCF3이되, R1은 둘다 동시에 수소일 수 없다.
특정 실시양태에서, R1은 독립적으로 수소, F, Cl, -CN, -CF3, -CH3, -C(O)OH 또는 -OCF3이되, R1은 둘다 동시에 수소일 수 없고, R4는 -NR6-이다.
특정 실시양태에서, R2는 수소 또는 할로겐이다.
특정 실시양태에서, R2는 수소이다.
특정 실시양태에서, R2는 할로겐이다. 특정 실시양태에서, R2는 F 또는 Cl이다. 특정 실시양태에서, R2는 F이다.
특정 실시양태에서, R2는 수소 또는 할로겐이고, R3은 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR8, -(C0-C3 알킬렌)SR8, -(C0-C3 알킬렌)NR8R9, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R8, -(C0-C3 알킬렌)C(O)OR8, -(C0-C3 알킬렌)C(O)NR8R9, -(C0-C3 알킬렌)NR8C(O)R9, -(C0-C3 알킬렌)S(O)1-2R8, -(C0-C3 알킬렌)NR8S(O)1-2R9, -(C0-C3 알킬렌)S(O)1-2NR8R9, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R3은 R10에 의해 임의적으로 치환된다.
특정 실시양태에서, R2는 수소이고, R3은 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR8, -(C0-C3 알킬렌)SR8, -(C0-C3 알킬렌)NR8R9, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R8, -(C0-C3 알킬렌)C(O)OR8, -(C0-C3 알킬렌)C(O)NR8R9, -(C0-C3 알킬렌)NR8C(O)R9, -(C0-C3 알킬렌)S(O)1-2R8, -(C0-C3 알킬렌)NR8S(O)1-2R9, -(C0-C3 알킬렌)S(O)1-2NR8R9, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R3은 R10에 의해 임의적으로 치환된다.
특정 실시양태에서, R3은 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -CN, -NR8R9, -NO2, -C(O)R8 또는 -S(O)1-2(C1-C3 알킬)이고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -OR11 또는 -NR11R12에 의해 임의적으로 치환된다. 일 실시양태에서, R3은 수소, 하이드록실메틸, -C(O)H, 에테닐, -CN, -NH2, F, Cl, I 또는 -S(O)2CH3이다. 일 실시양태에서, R3은 수소, -NH2, F 또는 -CN이다. 일 실시양태에서, R3은 수소이다. 일 실시양태에서, R3은 -CN이다.
특정 실시양태에서, A는 CR3이고, R2는 수소 또는 할로겐이고, R3은 수소, -CN, -NH2 또는 F이다.
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R4는 수소이고, R5는 존재하지 않는다.
특정 실시양태에서, R4는 -NR6-이다. 특정 실시양태에서, R4는 -NR6C(O)-이다. 특정 실시양태에서, R4는 -NR6C(O)O-이다. 특정 실시양태에서, R4는 -NR6C(O)NR7-이다. 특정 실시양태에서, R4는 -NH-이다. 특정 실시양태에서, R4는 -NHC(O)-이다. 특정 실시양태에서, R4는 -NHC(O)O-이다. 특정 실시양태에서, R4는 -NHC(O)NH-이다. 특정 실시양태에서, R4는 -NR6-, -NR6C(O)-, -NR6C(O)O- 또는 -NR6C(O)NR7-이다.
특정 실시양태에서, 기 -R4-R5는 -NHR5, -NHC(O)R5, -NHC(O)OR5 또는 -NHC(O)NHR5이다. 특정 실시양태에서, 기 -R4-R5는 -NHR5, -NHC(O)R5, -NHC(O)OR5 또는 -NHC(O)NHR5이고, 이때 R5는 수소가 아니다.
특정 실시양태에서, X는 CR15이고, 기 -R4-R5는 -NHR5, -NHC(O)R5, -NHC(O)OR5 또는 -NHC(O)NR7R5이다. 특정 실시양태에서, X는 CR15이고, R15는 수소이고, 기 -R4-R5는 -NHR5, -NHC(O)R5, -NHC(O)OR5 또는 -NHC(O)NHR5이고, 이때 R5는 수소가 아니다. 특정 실시양태에서, A는 CR3이고, X는 CR15이고, R15는 수소이고, 기 -R4-R5는 -NHR5, -NHC(O)R5, -NHC(O)OR5 또는 -NHC(O)NHR5이고, 이때 R5는 수소가 아니다.
특정 실시양태에서, R4는 -NH-, -NHC(O)- 또는 -NHC(O)NH-이다.
특정 실시양태에서, R4는 -NH2이고, R5는 존재하지 않는다.
특정 실시양태에서, R5는 4-트라이플루오로메톡시페닐이 아니다. 특정 실시양태에서, X는 CR15이고, R5는 4-트라이플루오로메톡시페닐이 아니다.
특정 실시양태에서, R5는 수소이다.
특정 실시양태에서, R4는 -NR6R7이고, R5는 존재하지 않고, R6 및 R7은 독립적으로 수소, C1-C3 알킬 또는 C3-C4 사이클로알킬이고, 상기 알킬 및 사이클로알킬은 독립적으로 할로겐, 옥소, -OR11 또는 -NR11R12에 의해 임의적으로 치환된다.
특정 실시양태에서, R5는 할로겐, 옥소에 의해 임의적으로 치환된 C1-C6 알킬, -OR11, -SR11, -C(O)R11 또는 -NR11R12이다. 특정 실시양태에서, R5는 메틸, 에틸, 이소프로필 또는 t-부틸이다.
특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 C3-C10 사이클로알킬이다. 특정 실시양태에서, R5는 할로겐에 의해 임의적으로 치환된 C3-C6 사이클로알킬이다. 특정 실시양태에서, R5는 할로겐에 의해 임의적으로 치환된 사이클로프로필이다. 특정 실시양태에서, R5는 사이클로프로필이다. 특정 실시양태에서, R5는 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 C6-C10 아릴이다. 특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 페닐로부터 선택된다.
특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 페닐이다. 특정 실시양태에서, R5는 페닐이다. 특정 실시양태에서, R5는 -O(CH2)2피롤리디닐에 의해 임의적으로 치환된 페닐이다.
특정 실시양태에서, X가 N인 경우, R5는 4-메톡시페닐을 제외한다. 특정 실시양태에서, X가 N인 경우, R5는 페닐을 제외한다.
특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 3 내지 10 원 헤테로사이클릴이다.
특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 3 내지 7 원 헤테로사이클릴이다. 특정 실시양태에서, 상기 헤테로사이클릴은 R10에 의해 임의적으로 치환된 피리디노닐 또는 피리미디노닐이다. 특정 실시양태에서, 상기 헤테로사이클릴은 C1-C6 알킬에 의해 임의적으로 치환된 피리디노닐 또는 피리미디노닐이다. 특정 실시양태에서, 상기 헤테로사이클릴은 1-메틸-2-옥소-피리니논-3-일 또는 피리미딘-4(3H)-온-2-일이다.
특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 5 내지 10 원 헤테로아릴이다. 특정 실시양태에서, R5는 피리디닐, 피리미디닐, 피라졸릴, 티아졸릴, 피라지닐, 피리다지닐, 옥사졸릴 또는 이속사졸릴이고, 이때 R5는 R10에 의해 임의적으로 치환된다.
특정 실시양태에서, R5는 C1-C6 알킬, C3-C6 사이클로알킬, 할로겐, -CN, -O(C0-C3 알킬), -CF3, -(C0-C3 알킬렌)NR11R12, -NR11C(O)R12, -C(O)NR11R12, -C(O)OR11, -(C0-C3 알킬렌)3 내지 6 원 헤테로사이클릴에 의해 임의적으로 치환된 피리디닐, 피리미디닐, 피라지닐 또는 피리다지닐이고, 상기 알킬은 할로겐 또는 OR11에 의해 임의적으로 치환되고, 상기 헤테로사이클릴은 옥소, 할로겐, OR11, 또는 할로겐 또는 OR11에 의해 임의적으로 치환된 C1-C3 알킬이다.
특정 실시양태에서, R5는 5 또는 6 원 헤테로아릴이고, 이때 R5는 R10에 의해 임의적으로 치환되고, 이때 R10은 C1-C6 알킬, 할로겐, -CN, -OR11, -SR11, -NR11R12, -CF3, -C(O)R11, -C(O)OR11, -C(O)NR11R12, -NR11C(O)R12, -S(O)1-2R11, -NR11S(O)1-2R12, -S(O)1-2NR11R12, C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴, -C(O)(3 내지 6 원 헤테로사이클릴), 5 또는 6 원 헤테로아릴 또는 페닐이고, 이때 R10은 독립적으로 할로겐, C1-C3 알킬, 옥소, -CF3, -OR13, -NR13R14, -C(O)R13 또는 -S(O)1-2R13에 의해 임의적으로 치환된다. 일 예에서, R5는 피리디닐, 피리미디닐, 피리다지닐, 피라지닐, 트라이아지닐, 티에닐, 피라졸릴, 피라닐, 트라이아졸릴, 이속사졸릴, 옥사졸릴, 이미다졸릴, 티아졸릴 또는 티아다이아졸릴이고, 이때 R5는 1, 2 또는 3개의 R10에 의해 임의적으로 치환된다.
특정 실시양태에서, R5는 C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR11, -(C0-C3 알킬렌)SR11, -(C0-C3 알킬렌)NR11R12, -(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -C=NH(OR11),-(C0-C3 알킬렌)C(O)R11, -(C0-C3 알킬렌)C(O)OR11, -(C0-C3 알킬렌)C(O)NR11R12, -(C0-C3 알킬렌)NR11C(O)R12, -(C0-C3 알킬렌)S(O)1-2R11, -(C0-C3 알킬렌)NR11S(O)1-2R12, -(C0-C3 알킬렌)S(O)1-2NR11R12,-(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)C(O)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐에 의해 임의적으로 치환된 피리디닐이고, 이때 R10은 독립적으로 할로겐, C1-C3 알킬, 옥소, -CF3, -(C0-C3 알킬렌)OR13, -(C0-C3 알킬렌)NR13R14, -(C0-C3 알킬렌)C(O)R13 또는 -(C0-C3 알킬렌)S(O)1-2R13에 의해 임의적으로 치환된다.
특정 실시양태에서, R5는 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R5는 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R5는 C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR11, -(C0-C3 알킬렌)SR11, -(C0-C3 알킬렌)NR11R12, -(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -C=NH(OR11),-(C0-C3 알킬렌)C(O)R11, -(C0-C3 알킬렌)C(O)OR11, -(C0-C3 알킬렌)C(O)NR11R12, -(C0-C3 알킬렌)NR11C(O)R12, -(C0-C3 알킬렌)S(O)1-2R11, -(C0-C3 알킬렌)NR11S(O)1-2R12, -(C0-C3 알킬렌)S(O)1-2NR11R12, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)C(O)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐에 의해 임의적으로 치환된 피리미디닐, 피리다지닐 또는 피라지닐이고, 이때 R10은 독립적으로 할로겐, C1-C3 알킬, 옥소, -CF3, -(C0-C3 알킬렌)OR13, -(C0-C3 알킬렌)NR13R14, -(C0-C3 알킬렌)C(O)R13 또는 -(C0-C3 알킬렌)S(O)1-2R13에 의해 임의적으로 치환된다.
특정 실시양태에서, R5는 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R5는 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R5는 피라졸릴, 이속사졸릴, 옥사졸릴, 이미다졸릴, 티아졸릴 또는 티아다이아졸릴이고, 이때 R5는 R10에 의해 임의적으로 치환되고, 이때 R10은 C1-C6 알킬, 할로겐, -CN, -OR11, -SR11, -NR11R12, -CF3, -C(O)R11, -C(O)OR11, -C(O)NR11R12, -NR11C(O)R12, -S(O)1-2R11, -NR11S(O)1-2R12, -S(O)1-2NR11R12, C3-C6사이클로알킬, 3 내지 6 원 헤테로사이클릴, -C(O)(3 내지 6 원 헤테로사이클릴), 5 또는 6 원 헤테로아릴 또는 페닐이고, 이때 R10은 독립적으로 할로겐, C1-C3 알킬, 옥소, -CF3, -OR13, -NR13R14, -C(O)R13 또는 -S(O)1-2R13에 의해 임의적으로 치환된다. 특정 실시양태에서, R5는 R10에 의해 임의적으로 치환된 피라졸릴이다.
특정 실시양태에서, R5는 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R5는 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R6 및 R7은 각각 독립적으로 수소 또는 R10에 의해 임의적으로 치환된 C1-C6알킬이거나, R6 및 R7은 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환된다.
특정 실시양태에서, R6 및 R7은 각각 독립적으로 수소, 메틸 또는 에틸이고, 상기 메틸 및 에틸은 독립적으로 R10에 의해 임의적으로 치환된다. 특정 실시양태에서, R6 및 R7은 각각 독립적으로 수소, 메틸 또는 에틸이다.
특정 실시양태에서, R8 및 R9는 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐이고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 R10에 의해 임의적으로 치환되거나, R8 및 R9는 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 10 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환된다.
특정 실시양태에서, R8은 수소이고, R9는 R10에 의해 임의적으로 치환된 C1-C6 알킬이다. 특정 실시양태에서, R8은 수소이고, R9는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C6알킬이다.
특정 실시양태에서, R8 및 R9는 각각 독립적으로 수소, C3-C6 사이클로알킬, 페닐 또는 3 내지 10 원 헤테로사이클릴이고, 상기 알킬, 알케닐, 알키닐, 사이클로알킬, 페닐 및 헤테로사이클릴은 독립적으로 R10에 의해 임의적으로 치환된다. 특정 실시양태에서, R8은 수소이고, R9는 R10에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴이다. 특정 실시양태에서, R8은 수소이고, R9는 R10에 의해 임의적으로 치환된 피리미디닐이다.
특정 실시양태에서, R8 및 R9는 수소이다.
특정 실시양태에서, R10은 독립적으로 할로겐이다. 특정 실시양태에서, R10은 독립적으로 F이다.
특정 실시양태에서, R10은 독립적으로 -CN이다.
특정 실시양태에서, R10은 독립적으로 C1-C6 알킬, C2-C6 알케닐 또는 C2-C6알키닐이고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -OR13 또는 -NR13R14에 의해 임의적으로 치환된다. 특정 실시양태에서, R10은 메틸, 에틸, 이소프로필, -CH2OH, -CH2CH2OH, -CH(OH)CH2OH, -C(CH3)2OH, -CH2NH2, -CH2N(CH3)2, -CF3, -C(O)NH2, -C(O)NHCH3, -C(O)N(CH3)2 또는 -C(O)모폴리닐이다. 특정 실시양태에서, R10은 메틸이다.
특정 실시양태에서, R10은 독립적으로 3 내지 6 원 헤테로사이클릴 또는 -C(O)(3 내지 6 원 헤테로사이클릴)이고, 상기 헤테로사이클릴은 독립적으로 -(C0-C3 알킬렌)OR13, -(C0-C3 알킬렌)NR13R14, 할로겐, -CN, 옥소, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C6 알킬에 의해 임의적으로 치환된다. 특정 실시양태에서, 상기 헤테로사이클릴은 모폴리닐, 티오모폴리닐, 피페리지닐, 피페리디닐 또는 아지리디닐이고, 상기 헤테로사이클릴은 독립적으로 옥소, -CH2OH, -CH2CH2OH, -OH, 메틸 또는 -CF3에 의해 임의적으로 치환된다. 특정 실시양태에서, R10은 독립적으로 하기 구조로부터 선택된다:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R10은 독립적으로 -(C0-C3 알킬렌)OR11 또는 -(C0-C3 알킬렌)SR11이다. 특정 실시양태에서, R10은 -OH, -OCH3, -CH2OH, -CH2CH2OH, -CH(OH)CH2OH 또는 -C(CH3)2OH이다. 특정 실시양태에서, R10은 -OH 또는 -OCH3이다.
특정 실시양태에서, R10은 독립적으로 -(C0-C3 알킬렌)NR11R12이다. 특정 실시양태에서, R10은 -NH2, -NHCH3, -NHC(O)CH3, -N(CH3)2, -N(CH2CH2OH)2, -NHCH2CH2OH, -N(CH3)CH2CH2OH, -NHCH2C(CH3)2OH, -N(CH3)CH2C(CH3)2OH, 4-하이드록시아지리딘-1-일, 모폴리닐, 다이옥소티오모폴리닐, 피페리디닐, 4-하이드록시피페리디닐, 4-메틸피페라지닐, 피롤리디닐 또는 4-(2-하이드록시에틸)피페라지닐이다.
특정 실시양태에서, R10은 독립적으로 -C(O)NR11R12이다. 특정 실시양태에서, R10은 -C(O)NH2, -C(O)NHCH3, -C(O)N(CH3)2 또는 -C(O)모폴리닐이다.
특정 실시양태에서, R10은 독립적으로 C1-C6 알킬, 할로겐, -CN, -OR11, -SR11, -NR11R12, -CF3, -C=NH(OR11), -C(O)OR11, C3-C6사이클로알킬, 3 내지 6 원 헤테로사이클릴, 5 또는 6 원 헤테로아릴 또는 페닐이고, 이때 R10은 독립적으로 할로겐, 옥소, -CF3, -OR13, -NR13R14, -C(O)R13, -S(O)1-2R13, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환된다.
특정 실시양태에서, R10은 독립적으로 F, -CN, 메틸, 에틸, 이소프로필, -CH2OH, -CH2CH2OH, -CH(OH)CH2OH, -C(CH3)2OH, -CH2NH2, -CH2N(CH3)2, -CF3, -OH, -OCH3, -NH2, -NHCH3, -NHC(O)CH3, -N(CH3)2, -N(CH2CH2OH)2, -NHCH2CH2OH, -N(CH3)CH2CH2OH-, -NHCH2C(CH3)2OH, -N(CH3)CH2C(CH3)2OH, -C(O)NH2, -C(O)NHCH3, -C(O)N(CH3)2, 로부터 선택되고, 이때 물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R10은 독립적으로 F, Cl, -CN, 메틸, 에틸, 이소프로필, -CH2OH, -CH2CH2OH, -CH(OH)CH2OH, -C(CH3)2OH, -CH2NH2, -CH2N(CH3)2, -CF3, -OH, -OCH3, -NH2, -NHCH3, -NHC(O)CH3, -N(CH3)2, -N(CH2CH2OH)2, -NHCH2CH2OH, -N(CH3)CH2CH2OH, -NHCH2C(CH3)2OH, -N(CH3)CH2C(CH3)2OH, -C(O)NH2, -C(O)NHCH3, -C(O)N(CH3)2, 로부터 선택되고, 이때 물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R11 및 R12는 독립적으로 수소 또는 할로겐, 옥소, -CN, -OR16 또는 -NR16R17에 의해 임의적으로 치환된 C1-C6 알킬이거나, 또는 이들이 부착된 원자와 함께 할로겐, 옥소, -OR16, -NR16R17, 또는 할로겐, 옥소 또는 OH에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성한다.
특정 실시양태에서, R11 및 R12는 독립적으로 수소, 메틸, -C(O)CH3, 2-하이드록시-2-메틸프로필 또는 2-하이드록시에틸이거나, 이들이 부착된 원자와 함께 할로겐, 옥소, 또는 옥소, 할로겐 또는 OH에 의해 임의적으로 치환된 C1-C3 알킬에 의해 임의적으로 치환된 아제티디닐, 피롤리디닐, 모폴리닐, 다이옥소티오모폴리닐, 피페라지닐 또는 피페리디닐 고리를 형성한다.
특정 실시양태에서, R11 및 R12는 독립적으로 수소, 메틸, -C(O)CH3, 2-하이드록시-2-메틸프로필 또는 2-하이드록시에틸이다.
특정 실시양태에서, R13 및 R14는 독립적으로 수소 또는 C1-C3 알킬이다. 특정 실시양태에서, R13 및 R14는 독립적으로 수소 또는 메틸이다.
특정 실시양태에서, R15는 수소, 할로겐, -CF3 , -CN, -O(C1-C6 알킬) 또는 C1-C6 알킬이고, 상기 알킬은 할로겐 또는 옥소 임의적으로 치환된다. 특정 실시양태에서, R15는 메틸이다. 특정 실시양태에서, R15는 할로겐이다. 특정 실시양태에서, R15는 F, Cl 또는 Br이다. 특정 실시양태에서, R15는 -O(C1-C6 알킬)이다. 특정 실시양태에서, R15는 -OCH3이다. 특정 실시양태에서, R15는 -CN이다.
특정 실시양태에서, R15는 수소, F, Cl, Br, -CN, -OCH3 또는 메틸이다.
특정 실시양태에서, X는 CR15이고, R15는 할로겐, -CN, -O(C1-C6 알킬) 또는 C1-C6 알킬이고, 상기 알킬은 할로겐 또는 옥소에 의해 임의적으로 치환되고, R1은 할로겐 또는 -CN이고, R2는 수소 또는 F이다.
특정 실시양태에서, X는 CR15이고, R15는 할로겐, -CN, -O(C1-C6 알킬) 또는 C1-C6 알킬이고, 상기 알킬은 할로겐 또는 옥소에 의해 임의적으로 치환되고, R1은 할로겐 또는 -CN이고, R2는 수소 또는 F이고, R4는 -NHR5, -NHC(O)R5, -NHC(O)OR5 또는 -NHC(O)NHR5이다.
특정 실시양태에서, R16 및 R17은 각각 독립적으로 수소 또는 C1-C3 알킬이다. 특정 실시양태에서, R16 및 R17은 각각 독립적으로 수소 또는 메틸이다.
특정 실시양태에서, R18 및 R19는 독립적으로 수소 또는 메틸이다.
특정 실시양태에서, A는 CR3이고, X는 CH이고; R1은 독립적으로 수소, -CN, -OCH3, -CF3, -OCF3, -CH3, Cl 또는 F이되, R1은 둘다 동시에 수소일 수 없고; R2는 수소이고; R3은 수소, 할로겐 또는 -CN이고; R4는 -NH-, -NHC(O)-, -NHC(O)NH- 또는 -NHC(O)O-이고, R5는 R10에 의해 임의적으로 치환된 C3-C6 사이클로알킬이다.
특정 실시양태에서, A는 CR3이고, X는 CH이고; R1은 독립적으로 수소, -CN, -OCH3, -CF3, -OCF3, -CH3, Cl 또는 F이되, R1은 둘다 동시에 수소일 수 없고; R2는 수소이고, R3은 수소, 할로겐 또는 -CN이고; R4는 -NH-, -NHC(O)-, -NHC(O)NH- 또는 -NHC(O)O-이고, R5는 R10에 의해 임의적으로 치환된 피리미디닐, 피리디닐, 피리다지닐 또는 피라지닐이다.
특정 실시양태에서, A는 CR3이고, X는 CR15이고, 하나의 R1은 할로겐이고; R2는 수소이고; R4는 -NH-, -NHC(O)-, -NHC(O)NH- 또는 -NHC(O)O-이고, R5는 F, Cl, -CN, 메틸, 에틸, 이소프로필, -CH2OH, -CH2CH2OH, -CH(OH)CH2OH, -C(CH3)2OH, -CH2NH2, -CH2N(CH3)2, -CF3, -OH, -OCH3, -NH2, -NHCH3, -NHC(O)CH3, -N(CH3)2, -N(CH2CH2OH)2, -NHCH2CH2OH, -N(CH3)CH2CH2OH, -NHCH2C(CH3)2OH, -N(CH3)CH2C(CH3)2OH, -C(O)NH2, -C(O)NHCH3, -C(O)N(CH3)2, 에 의해 임의적으로 선택된 피리미디닐, 피리디닐, 피리다지닐 또는 피라지닐이고, 이때, 물결선은 화학식 I의 부착점을 나타낸다.
특정 실시양태에서, R1은 독립적으로 수소, -CN 또는 할로겐이되, R1은 둘다 동시에 수소일 수 없고, R4는 -NH-, -NR6C(O)-, -NR6C(O)O- 또는 -NR6C(O)NR7-이다.
또 다른 실시양태는 하기 화합물로부터 선택된 화학식 I의 화합물, 이의 입체이성질체 또는 약학적으로 허용되는 염을 포함한다:
N-(2-(2, 6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)사이클로프로판카복스아미드;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]니코티노니트릴;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-N'-메틸피리미딘-4,6-다이아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-[6-(3-플루오로아제티딘-1-일)피리미딘-4-일]아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]카밤산 메틸 에스터;
1-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-3-메틸우레아;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리다진-3,6-다이아민;
N*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸-피리미딘-2,4-다이아민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-2-메톡시-피리미딘-4,6-다이아민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-2,4,6-트라이아릴민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-2-메틸-피리미딘-4,6-다이아민;
N*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6,N*2*-다이메틸피리미딘-2,4-다이아민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민;
사이클로프로판카복실산 [2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아미드;
6-[2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]이소니코티노니트릴;
4-브로모-2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘;
[2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
3,5-다이클로로-4-[4-(6-하이드록시메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3,5-다이클로로-4-[4-(6-플루오로메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
4-[4-(6-아제티딘-1-일메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
3,5-다이클로로-4-[4-(4-플루오로메틸피리미딘-2-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
4-[4-(6-아미노-2-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
4-[4-(6-아미노피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로-벤조니트릴;
사이클로프로판카복실산 {6-[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아미드;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)아민;
{6-[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(4-메틸피리딘-2-일)}메탄올;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-플루오로메틸피리미딘-4-일)아민;
3,5-다이클로로-4-[7-클로로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
{6-[7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
N-[7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민;
3,5-다이클로로-4-[7-플루오로-4-(6-메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
4-[4-(6-아미노-피리미딘-4-일아미노)-7-플루오로-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸-피리미딘-4-일)-아민;
4-[7-브로모-4-(6-메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
{6-[7-브로모-2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민;
2-(2,6-다이클로로페닐)-4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴;
4-(6-아미노피리미딘-4-일아미노)-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴;
N-[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민;
{6-[2-(2,6-다이클로로페닐)-7-메톡시-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]피리미딘-4-일아민;
2-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]이소니코티노니트릴;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-모폴린-4-일피리미딘-4-일)아민;
{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}메탄올;
2-(4-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}에탄올;
1-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}아제티딘-3-올;
{2-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리딘-4-일}메탄올;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(5-플루오로피리딘-2-일)아민;
6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-4-메틸니코티노니트릴;
6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-카보니트릴;
2-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-이소니코틴아미드;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메톡시피리미딘-4-일)아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리다진-3-일)아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(5-메틸피라진-2-일)아민;
6-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-카복실산 아미드;
N-{6-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아세트아미드;
2-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일아미노}에탄올;
1-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일아미노}-2-메틸프로판-2-올;
[2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)아민;
[2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
{6-[2-(2-클로로-6-플루오로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
{6-[2-(2,6-다이클로로-4-메탄설폰일페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}메탄올;
사이클로프로판카복실산 [2-(2,6-다이클로로-4-메탄설폰일페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미드;
3,5-다이클로로-4-[4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
사이클로프로판카복실산 [2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-]피리딘-4-일]아미드;
3,5-다이클로로-4-[4-(6-에틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3,5-다이클로로-4-[4-(6-사이클로프로필피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
3,5-다이클로로-4-[4-(6-다이메틸아미노메틸피리미딘-4-일아미노}피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
3,5-다이클로로-4-[4-(6-피페리딘-1-일메틸피리미딘-4-일아미노}피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(4-메틸피리딘-2-일)아민;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
(5-클로로피리딘-2-일)-[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아민;
3,5-다이클로로-4-[7-클로로-4-(6-하이드록시메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
3,5-다이클로로-4-[7-플루오로-4-(6-하이드록시메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
{6-[2-(2,6-다이클로로-페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
{6-[2-(2,6-다이클로로-4-플루오로-페닐)-7-플루오로-2H-피라올로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
N-4-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)피리미딘-4,6-다이아민;
2-((6-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)피리미딘-4-일)(메틸)아미노)에탄올;
2-(4-(6-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)피리미딘-4-일)피페라진-1-일)에탄올;
3-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)-1-메틸피리딘-2(1H)-온;
2-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)피리미딘-4(3H)-온;
2-(4-아미노-2,6-다이클로로페닐)-N-(6-메틸피리미딘-4-일)-2H-피라졸로[4,3-c]피리딘-4-아민;
N-4-(2-(4-아미노-2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)피리미딘-4,6-다이아민; 및
3-클로로-2-(4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)벤조니트릴.
또 다른 실시양태는 하기로 화합물로부터 선택된 화학식 I의 화합물 또는 이의 입체이성질체 또는 약학적으로 허용되는 염을 포함한다:
N-(2-(2, 6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)사이클로프로판카복스아미드;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]니코티노니트릴;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-N'-메틸피리미딘-4,6-다이아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-[6-(3-플루오로아제티딘-1-일)피리미딘-4-일]아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]카밤산 메틸 에스터;
1-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-3-메틸우레아;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리다진-3,6-다이아민
N*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸-피리미딘-2,4-다이아민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-2-메톡시-피리미딘-4,6-다이아민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-2,4,6-트라이아릴민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-2-메틸-피리미딘-4,6-다이아민;
N*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6,N*2*-다이메틸피리미딘-2,4-다이아민;
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민;
사이클로프로판카복실산 [2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아미드;
6-[2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]이소니코티노니트릴;
4-브로모-2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘;
[2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
3,5-다이클로로-4-[4-(6-하이드록시메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3,5-다이클로로-4-[4-(6-플루오로메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
4-[4-(6-아제티딘-1-일메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
3,5-다이클로로-4-[4-(4-플루오로메틸피리미딘-2-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
4-[4-(6-아미노-2-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
4-[4-(6-아미노피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로-벤조니트릴;
사이클로프로판카복실산 {6-[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아미드;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)아민;
{6-[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(4-메틸피리딘-2-일)}메탄올;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-플루오로메틸피리미딘-4-일)아민;
3,5-다이클로로-4-[7-클로로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
{6-[7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
N-[7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민;
3,5-다이클로로-4-[7-플루오로-4-(6-메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
4-[4-(6-아미노-피리미딘-4-일아미노)-7-플루오로-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸-피리미딘-4-일)-아민;
4-[7-브로모-4-(6-메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
{6-[7-브로모-2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민;
2-(2,6-다이클로로페닐)-4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴;
4-(6-아미노피리미딘-4-일아미노)-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴;
N-[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민;
{6-[2-(2,6-다이클로로페닐)-7-메톡시-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]피리미딘-4-일아민;
2-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]이소니코티노니트릴;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-모폴린-4-일피리미딘-4-일)아민;
{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}메탄올;
2-(4-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}에탄올;
1-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}아제티딘-3-올;
{2-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리딘-4-일}메탄올;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(5-플루오로피리딘-2-일)아민;
6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-4-메틸니코티노니트릴;
6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-카보니트릴;
2-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-이소니코틴아미드;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메톡시피리미딘-4-일)아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리다진-3-일)아민;
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(5-메틸피라진-2-일)아민;
6-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-카복실산 아미드;
N-{6-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아세트아미드;
2-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일아미노}에탄올;
1-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일아미노}-2-메틸프로판-2-올;
[2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)아민;
[2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
{6-[2-(2-클로로-6-플루오로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
{6-[2-(2,6-다이클로로-4-메탄설폰일페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}메탄올;
사이클로프로판카복실산 [2-(2,6-다이클로로-4-메탄설폰일페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미드;
3,5-다이클로로-4-[4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
사이클로프로판카복실산 [2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-]피리딘-4-일]아미드;
3,5-다이클로로-4-[4-(6-에틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3,5-다이클로로-4-[4-(6-사이클로프로필피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
3,5-다이클로로-4-[4-(6-다이메틸아미노메틸피리미딘-4-일아미노}피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
3,5-다이클로로-4-[4-(6-피페리딘-1-일메틸피리미딘-4-일아미노}피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(4-메틸피리딘-2-일)아민;
[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
(5-클로로피리딘-2-일)-[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아민;
3,5-다이클로로-4-[7-클로로-4-(6-하이드록시메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
3,5-다이클로로-4-[7-플루오로-4-(6-하이드록시메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
{6-[2-(2,6-다이클로로-페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
{6-[2-(2,6-다이클로로-4-플루오로-페닐)-7-플루오로-2H-피라올로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
N-4-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)피리미딘-4,6-다이아민;
2-((6-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)피리미딘-4-일)(메틸)아미노)에탄올;
2-(4-(6-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)피리미딘-4-일)피페라진-1-일)에탄올;
3-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)-1-메틸피리딘-2(1H)-온;
2-(2-(2-클로로-3,6-다이플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)피리미딘-4(3H)-온;
2-(4-아미노-2,6-다이클로로페닐)-N-(6-메틸피리미딘-4-일)-2H-피라졸로[4,3-c]피리딘-4-아민;
N-4-(2-(4-아미노-2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)피리미딘-4,6-다이아민;
3-클로로-2-(4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-5-하이드록시메틸 벤조니트릴;
{3,5-다이클로로-4-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]페닐}메탄올;
{4-[2-(2-클로로-6-플루오로-페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-6-메틸-피리미딘-2-일}-메탄올;
4-[4-(6-아미노피리미딘-4-일아미노)-7-클로로피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴;
N-[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]피리미딘-4,6-다이아민;
N-{6-[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아세트아미드;
1-{6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-에탄올;
(6-사이클로프로필피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘4-일]-아민;
3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3-클로로-2-{7-플루오로-4-[6-(1-하이드록시에틸)-피리미딘-4-일아미노]-피라졸로[4,3-c]피리딘-2-일}-벤조니트릴;
2-[4-(6-아미노-2-메틸피리미드-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴;
2-[4-(5-아제티딘-3-일-피리딘-2-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴;
[2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민;
5-아미노-3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
5-아미노-2-[4-(6-아미노피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴;
N-[2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민;
3-클로로-5-플루오로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
2-[4-(6-아미노-2-메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로-5-플루오로벤조니트릴;
3-클로로-5-플루오로-2-{7-플루오로-4-[6-(3-플루오로아제티딘-1-일)피리미딘-4-일아미노]피라졸로[4,3-c]피리딘-2-일}벤조니트릴;
3-클로로-5-플루오로-2-{7-플루오로-4-[6-(2-하이드록시에틸아미노)-2-메틸피리미딘-4-일아미노]피라졸로[4,3-c]피리딘-2-일}벤조니트릴;
2-[4-(2,6-다이메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-플루오로벤조니트릴;
N-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-2-메틸피리미딘-4,6-다이아민;
[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민;
{6-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일}-메탄올;
3,5-다이클로로-4-[7-플루오로-4-(6-하이드록시메틸피리미딘-4-일아미노)-피라졸로)-[4,3-c]피리딘-2-일]-벤조니트릴;
3,5-다이클로로-4-{7-플루오로-4-[6-(1-하이드록시에틸)-피리미딘-4-일아미노]-피라졸로)-[4,3-c]피리딘-2-일}-벤조니트릴;
[7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민;
2-(2,6-다이클로로페닐)-4-(6-하이드록시메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴;
3-클로로-2-[7-플루오로-4-(-6-하이드록시메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
N-{6-[2-(2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아세트아미드;
2-[4-(6-아미노피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴;
사이클로프로판카복실산 [2-(2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]아미드;
3-클로로-2-[4-(2,6-다이메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]벤조니트릴;
2-[4-(2-아미노-6-메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴;
3-클로로-2-[7-플루오로-4-(2-하이드록시메틸-6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3-클로로-2-[7-플루오로-4-(6-하이드록시메틸-2-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3-클로로-2-[4-(6-사이클로프로필피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
N-[2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-벤젠-1,3-다이아민;
{6-[2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올;
사이클로프로판카복실산 [2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-아미드;
사이클로프로판카복실산 [2-(4-아미노-2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-아미드;
[2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-4-일)-(6-메틸피리미딘-4-일)-아민;
3-클로로-5-플루오로-2-[7-플루오로-4-(6-하이드록시메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
2-[4-(6-아미노피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로-5-플루오로벤조니트릴;
3-클로로-2-[4-(6-사이클로프로필피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-5-플루오로벤조니트릴;
사이클로프로판카복실산 [2-(2-클로로-6-시아노-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]아미드;
3-클로로-2-[4-(2,6-다이메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-5-플루오로벤조니트릴;
2-[4-(2-아미노-6-메틸피리미딘-4-일아미노)-7-플루오로-피라졸로[4,3-c]피리딘-2-일]-3-클로로-5-플루오로-벤조니트릴;
3-클로로-5-플루오로-2-[7-플루오로-4-(2-하이드록시메틸-6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3-클로로-5-플루오로-2-[7-플루오로-4-(6-하이드록시메틸-2-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
2-[4-(6-아미노피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-플루오로벤조니트릴;
2-[4-(6-아미노-2-메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-플루오로벤조니트릴;
2-[4-(2-아미노-6-메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-플루오로벤조니트릴;
3-플루오로-2-[7-플루오로-4-(6-하이드록시메틸-2-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
3-플루오로-2-[7-플루오로-4-(2-하이드록시메틸-6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴;
{6-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]피리미딘-4-일}메탄올;
N*4*-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸피리미딘-2,4-다이아민;
2-{6-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일아미노}-에탄올;
N-{6-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아세트아미드;
(5-아제티딘-3-일-피리딘-2-일)-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-아민;
2-(4-(6-아미노피리미딘-4-일아미노)-7-클로로-2H-피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조니트릴;
3-클로로-2-(4-(6-(하이드록시메틸)피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
3-클로로-2-(7-클로로-4-(6-(하이드록시메틸)피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
5-아미노-2-(4-(6-아미노피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조니트릴;
2-(4-(6-아미노피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조산;
2-(4-(6-아미노피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)-3-플루오로벤조니트릴;
3-플루오로-2-(4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
3-클로로-5-(6-메틸피리미딘-4-일아미노)-2-(4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)벤조니트릴;
2-(4-아미노-2,6-다이클로로페닐)-N-(2,6-다이메틸피리미딘-4-일)-2H-피라졸로[4,3-c]피리딘-4-아민;
N-(7-클로로-2-(2-클로로-6-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일)사이클로프로판카복스아미드;
N-(2-(2-클로로-6-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일)사이클로프로판카복스아미드;
N-(2-(4-아미노-2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)사이클로프로판카복스아미드;
2-(4-아미노-2-클로로페닐)-N-(5-(모폴리노설포닐)피리딘-2-일)-2H-피라졸로[4,3-c]피리딘-4-아민;
6-(2-(4-아미노-2-클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노)-N,N-다이메틸피리딘-3-설폰아미드; 및
5-아미노-3-클로로-2-(4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-2-일)벤조니트릴.
화학식 I의 화합물은 비대칭 또는 키랄 중심을 함유할 수 있고, 따라서, 상이한 입체이성질체 형태로 존재할 수 있다. 부분입체이성질체, 거울상이성질체 및 아트로프이성질체 뿐만 아니라 이의 혼합물, 예컨대 라세믹 혼합물을 포함하지만 이로 제한되지 않는 화학식 I의 화합물의 모든 입체이성질체 형태가 본 발명의 부분을 형성하는 것으로 의도된다. 게다가, 본 발명은 모든 기하학적 및 위치적 이성질체를 포괄한다. 예를 들어, 화학식 I의 화합물이 이중 결합 또는 융합된 고리를 혼입하는 경우, 시스- 및 트랜스-형태 둘다 뿐만 아니라 혼합물은 본 발명의 범주내에 포괄된다. 단일 위치 이성질체 및 예를 들어, 피리미디닐 및 피로졸릴 고리의 N-산화로부터 야기되는 위치 이성질체의 혼합물 둘다, 또는 화학식 I의 화합물의 E 및 Z 형태(예를 들어, 옥심 잔기)는 또한 본 발명의 범주내에 있다.
본원에 나타낸 구조에서, 임의의 특정 키랄 원자의 입체화학이 명시되지 않은 경우, 모든 입체이성질체는 본 발명의 화합물로서 간주되고 포함된다. 특정 배열을 나타내는 쐐기형 선 또는 파선에 의해 명시되는 경우, 입체이성질체는 그렇게 명시되고 정의된다.
본 발명의 화합물은 비용매화된 형태뿐만 아니라 약학적으로 허용되는 용매, 예컨대 물, 에탄올 등으로 용매화된 형태로 존재할 수 있고, 청구항에 의해 정의되는 본 발명은 용매화된 형태 및 비용매화된 형태 둘다를 포괄하는 것으로 의도된다.
실시양태에서, 화학식 I의 화합물은 상이한 호변이성질체 형태로 존재할 수 있고, 모든 이러한 형태는 청구항에 의해 정의되는 본 발명의 범주내에 포괄된다. 용어 "호변이성질체" 또는 "호변이성질체 형태"는 낮은 에너지 장벽을 통해 상호전환할 수 있는 상이한 에너지의 구조적인 이성질체를 지칭한다. 예를 들어, 양성자 호변이성질체(양성자성 호변이성질체로서도 공지됨)는 양성자의 이동을 통한 상호전환, 예컨대 케토-엔올 및 이민-엔아민 이성질체화를 포함한다. 호변이성질체 원자가는 결합 전자의 일부의 재편성에 의한 상호전환을 포함한다.
또한, 본 발명은 본원에 언급된 것과 동일하지만, 하나 이상의 원자가 천연에서 일반적으로 발견된 원자 질량 또는 질량 수와 상이한 원자 질량 또는 질량 수를 가지는 원자에 의해 대체된 동위원소 표지된 화학식 I의 화합물을 포괄한다. 명시된 임의의 특정 원자 또는 원소의 모든 동위원소는 본 발명의 범주내에 고려된다. 화학식 I의 화합물내로 혼입될 수 있는 동위원소의 예는 수소, 탄소, 질소, 산소, 인, 황, 불소, 염소 및 요오드의 동위원소, 예컨대 각각 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I 및 125I를 포함한다. 특정 동위원소 표지된 화학식 I의 화합물(예를 들어, 3H 및 14C로 표지된 것)은 화합물 및/또는 기질 조직 분포 분석에 유용하다. 삼중수소(즉, 3H) 및 탄소-14(즉, 14C) 동위원소는 제조 용이성 및 검출능에 유용하다. 또한, 중질 동위원소, 예컨대 중수소(즉, 2H)로 치환은 더 큰 대사 안정성(예를 들어, 증가된 생체내 반감기 또는 감소된 복용 요건)으로부터 야기하는 특정 치료 장점을 수득할 수 있다. 양전자 방출 동위원소, 예컨대 15O, 13N, 11C 및 18F는 기질 수용체 점유를 조사하기 위한 양전자 방출 단층촬영(PET) 연구에 유용하다. 동위원소 표지된 화학식 I의 화합물은 일반적으로 비동위원소 표지된 시약을 동위원소 표지된 시약으로 치환함으로써 하기의 반응식 및/또는 실시예에 개시된 것과 유사한 과정에 따라 제조될 수 있다.
TYK2
억제제 화합물의 합성
화학식 I의 화합물은 본원에 기재된 합성 경로에 의해 합성될 수 있다. 특정 실시양태에서, 본원에 함유된 개시사항에 비추어 또는 이외에 화학 분야에 널리 공지된 방법이 사용될 수 있다. 출발 물질은 일반적으로 상업 공급원, 예컨대 알드리치 케미칼스(Aldrich Chemicals, 미국 위스콘신주 밀워키 소재)로부터 이용가능하거나 당업자에게 널리 공지된 방법을 사용하여 쉽게 제조된다(예를 들어, 일반적으로 문헌[Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, N.Y. (1967-1999 ed.)], 문헌[Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, including supplements(also available via the Beilstein online database)]), 또는 문헌[Comprehensive Heterocyclic Chemistry, Editors Katrizky and Rees, Pergamon Press, 1984]에 기재된 방법에 의해 제조됨).
화학식 I의 화합물은 단독으로 또는 2개 이상, 예를 들어 5 내지 1,000개의 화합물, 또는 10 내지 100개의 화학식 I의 화합물을 포함하는 화합물 라이브러리로서 제조될 수 있다. 화학식 I의 화합물의 라이브러리는 조합적 "분열 및 혼합" 접근에 의해, 액체상 또는 고체상 화학을 사용하여 다중 병렬 합성에 의해 또는 당업자에게 공지된 절차에 의해 제조될 수 있다. 따라서 본 발명의 추가 양상에 따라 2개 이상의 화학식 I의 화합물, 이의 거울상이성질체, 부분입체이성질체 또는 약학적으로 허용되는 염을 포함하는 화합물 라이브러리가 제공된다.
본 발명의 화합물의 제조에서, 중간체의 원격 작용기(예를 들어, 1차 또는 2차 아민)의 보호가 요구될 수 있다. 이러한 보호에 대한 요구는 원격 작용기의 특성 및 제조 방법의 상태에 따라 다를 것이다. 적합한 아미노-보호기(NH-Pg)는 아세틸, 트라이플루오로아세틸, t-부톡시카본일(BOC), 벤질옥시카본일(CBz) 및 9-플루오레닐메틸렌옥시카본일(Fmoc)을 포함한다. 이러한 보호에 대한 요구는 당업자에 의해 쉽게 결정된다. 보호기의 일반적인 개시사항 및 이의 용도에 대하여, 문헌[T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991]을 참조한다.
본 발명의 화합물은 본원에 예시된 일반적인 방법을 사용하여 시판중인 출발 물질로부터 제조될 수 있다.
예시적인 목적을 위해, 하기 도시된 반응식 1 내지 4는 화학식 I의 화합물 뿐만 아니라 주요 중간체를 합성하기 위한 경로를 제공한다. 개별적인 반응 단계의 보다 자세한 개시사항을 위해, 하기 실시예 섹션을 참고한다. 당업자는 다른 합성 경로가 이용가능하고 사용될 수 있음을 인지할 것이다. 비록 특정 출발 물질 및 시약이 반응식에 도시되고 하기에 기재되었을지라도, 다른 출발 물질 및 시약이 다양한 유도체 및/또는 반응 조건을 제공하기 위해 치환될 수 있다. 게다가, 하기 기재된 방법에 의해 제조된 많은 화합물은 당업자에게 공지된 통상적인 화학 물질을 사용하여 본원에 비추어 추가로 개질될 수 있다.
[반응식 1]
반응식 1(방법 1)은 화학식 5의 화합물 및 화학식 6의 화합물의 제조를 나타내고, 이때 R1, R2, A 및 R5는 화학식 I에 정의된 바와 같다. 시판중인 2-클로로-3-폼일-4-요오도피리딘을 에탄올 중 하이드라진으로 23 ℃에서 처리하여 피라졸 2를 수득한다. 피라졸 2를 K2CO3의 존재하에 아릴 플루오라이드로 가열시, 3 및 이의 구조이성질체 4가 둘다 생성된다. 이 혼합물을 실리카 겔 상에서 컬럼 크로마토그래피를 통해 분리할 수 있다. 중간체 3을 Pd-촉매화된 조건하에 아민 또는 아미드와 커플링하여 생성물, 예컨대 5 또는 6을 수득한다.
[반응식 2]
다른 과정은 반응식 2(방법 2)에 나타내고, 이때 X, A, R1, R2 및 R5는 화학식 I에 대하여 정의된 바와 같다. 시판중인 4-클로로피리딘 7로 합성을 시작하고, LDA로 탈양자화한 후, DMF로 급랭하여 알데하이드 8을 수득한다. 4-클로로피리딘-3-카복스알데하이드 8을 나트륨 아지드로 처리하여 4-클로라이드를 대체하여 9를 수득한다. 아지드 9가 TiCl4의 존재하에 아닐린과 축합될 경우, 생성된 이민 중간체는 단리되지 않지만, 톨루엔 중에서 직접 가열하여 폐환 반응시켜 10을 수득한다. 이어서, 메틸 레늄 트라이옥사이드의 촉매량의 존재하에 과산화수소를 사용하여 N-옥사이드를 형성한다. 이어서, N-옥사이드를 POCl3 또는 POBr3으로 처리하여 클로라이드 또는 브로마이드 11을 수득한다. 이어서, Pd-촉매화된 조건하에, 11을 아민 또는 아미드와 커플링하여 생성물 5 또는 6을 수득한다.
[반응식 3]
일부 기질을 위해, 아민은 반응식 3(방법 3)에 요약된 바와 같이, 염기, 예컨대 나트륨 하이드리드의 존재하에 SNAr-유형 반응을 통해 중간체 11과 커플링될 수 있다.
[반응식 4]
또한, 최종 생성물 5 또는 6은 반응식 4(방법 4)에 따라 제조될 수 있다. 반응식 2로부터의 중간체 11을 Pd-촉매화된 반응을 통해 t-부틸 카바메이트와 커플링한 후, 트라이플루오로아세트산으로 처리하여 아미노 중간체 13을 수득할 수 있다. 이어서, 중간체 13을 아릴- 또는 헤테로아릴-클로라이드 또는 브로마이드와 Pd-촉매화된 커플링을 통해 5로 변형할 수 있다. 또한, 아미노 중간체 13을 산 클로라이드와 커플링하여 아미드 6을 수득할 수 있다.
적절한 작용기가 존재할 경우, 다양한 화학식의 화합물 또는 이의 제조에 사용된 임의의 중간체가 축합, 치환, 산화, 환원 또는 분열 반응을 사용하는 하나 이상의 표준 합성 방법에 의해 추가로 유도체화될 수 있음이 인지될 것이다. 특정 치환법은 통상적인 알킬화, 아릴화, 헤테로아릴화, 아실화, 설포닐화, 할로겐화, 질화, 폼일화 및 커플링 과정을 포함한다.
각각의 예시적인 반응식에서 반응 생성물을 서로로부터 및/또는 출발 물질로부터 분리하는 것이 유리할 수 있다. 부분입체이성질체 혼합물은 당업자에게 널리 공지된 방법, 예컨대 크로마토그래피 및/또는 분별 결정화에 의해 이의 물리적 화학적 차이에 기초하여 이의 개별적인 부분입체이성질체로 분리될 수 있다. 거울상이성질체는 적절한 광학적인 활성 화합물(예를 들어, 키랄 보조제, 예컨대 키랄 알코올 또는 모셔(Mosher)의 산 클로라이드)과 반응함으로써 거울상이성질체 혼합물을 부분입체이성질체 혼합물로 전환하는 단계, 부분입체이성질체를 분리하는 단계 및 개별적인 부분입체이성질체를 상응하는 순수 거울상이성질체로 전환하는 단계(예를 들어, 가수분해화)에 의해 분리될 수 있다. 또한, 본 발명의 화합물의 일부는 아트로프이성질체(예를 들어, 치환된 바이아릴)일 수 있고 본 발명의 부분으로서 간주된다. 또한, 거울상이성질체는 키랄 HPLC 컬럼의 사용에 의해 분리될 수 있다.
단일 입체이성질체, 예를 들어 이의 입체이성질체가 실질적으로 존재하지 않는 거울상이성질체는 방법, 예컨대 광학적인 활성 분할제를 사용하여 부분입체이성질체를 형성하는 방법을 사용하여 라세믹 혼합물의 분할에 의해 수득될 수 있다(문헌[Eliel, E. and Wilen, S., Stereochemistry of Organic Compound , John Wiley & Sons, Inc., New York, 1994]; 문헌[Lochmuller, C. H., J. Chromatogr ., 113(3):283-302 (1975)]). 본 발명의 키랄 화합물의 라세믹 혼합물은 임의의 적합한 방법에 의해 분리되고 단리될 수 있다. 예컨대, (1) 키랄 화합물을 사용한 이온성 부분입체이성질체 염의 형성 및 분별 결정화 또는 다른 방법에 의한 분리, (2) 키랄 유도체화제를 사용한 부분입체이성질체 화합물의 형성, 부분입체이성질체의 분리, 및 순수 입체이성질체로의 전환, 및 (3) 키랄 조건하에 직접적으로 실질적으로 순수하거나 강화된 입체이성질체의 분리. 문헌[Drug Stereochemistry , Analytical Methods and Pharmacology, Irving W. Wainer, Ed., Marcel Dekker, Inc., New York(1993)]을 참조한다.
부분입체이성질체 염은 거울상이성질체적으로 순수한 키랄 염기, 예컨대 브루신, 퀴닌, 에페드린, 스트리크닌, -메틸-β-페닐에틸아민(암페타민) 등을 산성 작용기, 예컨대 카복실산 및 설폰산을 갖는 비대칭 화합물과 반응시켜 형성될 수 있다. 부분입체이성질체 염은 유도되어 분별 결정화 또는 이온 크로마토그래피에 의해 분리될 수 있다. 아미노 화합물의 광학 이성질체의 분리를 위해, 키랄 카복실산 또는 설폰산, 예컨대 캄포르설폰산, 타르타르산, 만델산 또는 락트산의 첨가가 부분입체이성질체 염의 형성을 초래할 수 있다.
다르게는, 분할될 기질은 키랄 화합물의 하나의 거울상이성질체와 반응하여 부분입체이성질체 쌍을 형성한다(문헌[Eliel, E. and Wilen, S., Stereochemistry of Organic Compound, John Wiley & Sons, Inc., New York, 1994, p. 322]). 부분입체이성질체 화합물은 비대칭 화합물을 거울상이성질체적으로 순수한 키랄 유도체화제, 예컨대 멘틸 유도체와 반응시킨 후, 부분입체이성질체의 분리 및 가수분해에 의해 순수하거나 강화된 거울상이성질체를 수득함으로써 형성될 수 있다. 광학 순도를 측정하는 방법은 키랄 에스터, 예컨대 멘틸 에스터, 예를 들어 염기의 존재하에 (-) 멘틸 클로로포름에이트, 또는 모셔 에스터, 라세믹 혼합물의 α-메톡시-α-(트라이플루오로메틸)페닐 아세테이트(문헌[Jacob, J. Org . Chem . 47:4165 (1982)])의 제조, 및 2개의 아트로프이성질성 거울상이성질체 또는 부분입체이성질체의 존재를 위한 NMR 스펙트럼의 분석을 수반한다. 아트로프이성질체 화합물의 안정한 부분입체이성질체는 아트로프이성질체 나프틸-이소퀴놀린의 분리를 위한 방법(국제특허출원공개 제 96/15111 호)에 따라 정상 및 역상 크로마토그래피에 의해 분리되고 단리될 수 있다. 방법 (3)에 의해, 2개의 거울상이성질체의 라세믹 혼합물은 키랄 정지상을 사용하는 크로마토그래피에 의해 분리될 수 있다(문헌[Chiral Liquid Chromatography W. J. Lough, Ed., Chapman and Hall, New York, (1989)]; 문헌[Okamoto, J. of Chromatogr .513:375-378 (1990)]). 강화되거나 정제된 거울상이성질체는 비대칭 탄소 원자, 예컨대 광학 회전 및 원평광 이색성을 갖는 다른 키랄 분자를 구별하기 위해 사용된 방법에 의해 구별될 수 있다
약학 조성물 및 투여
또 다른 실시양태는 본 발명의 화합물 및 치료적으로 불활성 담체, 희석제 또는 부형제를 함유하는 약학 조성물 또는 약제, 뿐만 아니라 상기 조성물 및 약제를 제조하기 위한 본 발명의 화합물의 사용 방법을 제공한다. 일 예에서, 화학식 I의 화합물은 상온에서 적절한 pH 및 목적한 순도로 생리적으로 허용되는 담체, 즉, 생약 투여 형태로 사용되는 투여량 및 농도에서 수용체에게 비독성인 담체와 혼합함으로써 제형화될 수 있다. 제형의 pH는 특정 용도 및 화합물의 농도에 따르고, 약 3 내지 약 8의 범위일 수 있다. 일 예에서, 화학식 I의 화합물은 pH 5에서 아세테이트 완충액 중에 제형화된다. 또 다른 실시양태에서, 화학식 I의 화합물 은 살균된다. 화합물은 예를 들어, 고체로서 또는 비정형 조성물로서, 동결건조된 제형으로서 또는 수용액으로서 저장될 수 있다.
조성물은 우수한 의료 행위와 일치하는 방식으로 제형화되고, 복용되고, 투여된다. 본원에서 고려되는 인자는 치료되는 특정 질병, 치료되는 특정 환자, 개별적인 환자의 임상 상태, 질병의 원인, 약물의 전달 부위, 투여 방법, 투여 스케쥴, 및 의사에게 공지된 다른 인자를 포함한다. 투여될 화합물의 "효과량"은 이러한 고려사항에 의해 통제될 것이고, TYK2 키나아제 활성을 억제하는데 필요한 최소량이다. 예를 들어, 이러한 양은 정상 세포, 또는 전체로서 환자에게 독성인 양의 미만일 수 있다.
투여하기 위한 약학 조성물 (또는 제형)은 약물을 투여하기 위해 사용된 방법에 따라 다양한 방식으로 포장될 수 있다. 일반적으로, 분배를 위한 제품은 약학 제형이 적절한 형태로 보관된 용기를 포함한다. 적합한 용기는 당업자에게 널리 공지되어 있고 물질, 예컨대 병(플라스틱 및 유리), 샤쉐(sachet), 앰플, 플라스틱 가방, 금속 실린더 등을 포함한다. 또한, 용기는 포장의 내용물에 부주의한 접근을 막기 위해 쉽게 조작할 수 없는 조립체를 포함할 수 있다. 게다가, 용기의 내용물을 기재하는 표지가 용기에 증착된다. 표지는 또한 적절한 경고를 포함할 수 있다.
지속 방출 제제가 제조될 수 있다. 지속 방출 제제의 적합한 예는 화학식 I의 화합물을 함유하는 고체 소수성 중합체의 반투과성 매트릭스를 포함하고, 이때 매트릭스는 성형품의 형태, 예를 들어 필름 또는 마이크로캡슐이다. 지속 방출 매트릭스의 예는 폴리에스터, 하이드로겔(예를 들어, 폴리(2-하이드록시에틸-메타크릴레이트), 또는 폴리(비닐알코올)), 폴리락티드, L-글루탐산 및 γ-에틸-L-글루타메이트의 공중합체, 비분해성 에틸렌-비닐 아세테이트, 분해성 락트산-글리콜산 공중합체, 예컨대 루프론 데포트(LUPRON DEPOT: 상표)(락트산-글리콜산 공중합체 및 류프롤리드 아세테이트로 이루어진 주입가능한 미소구체), 및 폴리-D-(-)-3-하이드록시부티르산을 포함한다.
일 예에서, 투여 당 비경구적으로 투여되는 본 발명의 화합물의 약학 효과량은 0.3 내지 15 mg/kg/일로 사용된 화합물의 전형적인 초기 범위로, 약 0.01 내지 100 mg/kg, 다르게는 약 0.1 내지 20 mg/kg(환자 체중)/일의 범위일 수 있다. 또 다른 실시양태에서, 경구 단위 투여량 형태, 예컨대 정제 및 캡슐은 약 5 내지 100 mg의 본 발명의 화합물을 함유한다.
본 발명의 화합물은 임의의 적합한 수단, 예컨대 경구, 국소(구강 및 설하 포함함), 직장, 질, 경피, 비경구, 피하, 복강내, 폐내, 피내, 척수내, 흡입 및 경막외 및 비강내에 의해 투여될 수 있고, 필요한 경우 국소 치료를 위해, 병소내 투여될 수 있다. 비경구 주입은 근육내, 정맥내, 동맥내, 복강내 또는 피하 투여를 포함한다.
본 발명의 화합물은 임의의 편리한 투여 형태, 예를 들어, 정제, 분말, 캡슐, 용액, 분산액, 현탁액, 시럽, 분무, 좌제, 겔, 에멀젼, 패치, 에어로졸 등으로 투여될 수 있다. 이러한 조성물은 약학 제제에서 통상적인 성분, 예를 들어, 희석제, 담체, pH 개질제, 감미료, 증량제 및 추가 활성제를 함유할 수 있다.
전형적인 제형은 본 발명의 화합물 및 담체 또는 부형제를 혼합하여 제조된다. 적합한 담체 및 부형제는 당업자에게 널리 공지되어 있고 예를 들어, 문헌[Ansel, Howard C., et al., Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems. Philadelphia: Lippincott, Williams & Wilkins, 2004]; 문헌[Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Philadelphia: Lippincott, Williams & Wilkins, 2000]; 및 문헌[Rowe, Raymond C. Handbook of Pharmaceutical Excipients. Chicago, Pharmaceutical Press, 2005]에 상세하게 기재되어 있다. 또한, 제형은 하나 이상의 완충액, 안정화제, 계면활성제, 습윤제, 윤활제, 에멀젼화제, 현탁제, 방부제, 산화방지제, 불투명화제, 활주제, 가공 보조제, 착색제, 감미료, 향미제, 방향제, 희석제, 및 약물(즉, 본 발명의 화합물 또는 이의 약학 조성물)의 우아한 제시를 제공하거나 약학 생성물(즉, 약제)의 제조에 도움을 주는 다른 공지된 첨가제를 포함할 수 있다.
적합한 경구 투여량 형태의 예는 약 90 내지 30 mg의 무수 락토스, 약 5 내지 40 mg의 나트륨 크로스카멜로스, 약 5 내지 30 mg의 폴리비닐피롤리돈(PVP) K30, 및 약 1 내지 10 mg의 마그네슘 스테아레이트로 제형화된 본 발명의 화합물 약 25 mg, 50 mg, 100 mg, 250 mg 또는 500 mg을 함유하는 정제이다. 분말화된 성분이 먼저 함께 혼합된 후 PVP의 용액과 혼합된다. 생성된 조성물은 통상적인 장비를 사용하여 건조되고, 과립화되고, 마그네슘 스테아레이트와 혼합되고, 정제 형태로 압축될 수 있다. 에어로졸 제형의 예는 예를 들어 5 내지 400 mg의 본 발명의 화합물을 적합한 완충액, 예를 들어 포스페이트 완충액 중에 용해하고, 필요한 경우, 긴장제, 예를 들어 나트륨 클로라이드를 첨가함으로써 제조될 수 있다. 용액은 예를 들어, 0.2 ㎛의 필터를 사용하여 여과되어 불순물 및 오염물을 제거할 수 있다.
일 실시양태에서, 약학 조성물은 또한 항증식제, 항염증제, 면역조절제, 신경생장 인자, 심혈관 질환을 치료하기 위한 약제, 간질환을 치료하기 위한 약제, 항바이러스제, 혈액 질병을 치료하기 위한 약제, 당뇨병을 치료하기 위한 약제 또는 면역 결핍 질환을 치료하기 위한 약제로부터 선택된 추가 화학치료제를 포함한다.
따라서, 일 실시양태는 화학식 I의 화합물, 또는 이의 입체이성질체 또는 약학적으로 허용되는 염을 포함하는 약학 조성물을 포함한다. 추가 실시양태는 화학식 I의 화합물, 또는 이의 입체이성질체 또는 약학적으로 허용되는 염과 함께 약학적으로 허용되는 담체 또는 부형제를 포함하는 약학 조성물을 포함한다.
또 다른 실시양태는 화학식 I의 화합물, 또는 이의 입체이성질체 또는 약학적으로 허용되는 염을 포함하는, 면역학적 또는 염증 질환의 치료에 사용하기 위한 약학 조성물을 포함한다. 또 다른 실시양태는 화학식 I의 화합물, 또는 이의 입체이성질체 또는 약학적으로 허용되는 염을 포함하는, 건선 또는 염증성 장 질환의 치료에 사용하기 위한 약학 조성물을 포함한다.
적응증 및 치료 방법
본 발명의 화합물은 TYK2 키나아제 활성을 억제한다. 따라서, 본 발명의 화합물은 특정 환자조직 및 세포에서 염증을 줄이는데 유용하다. 본 발명의 화합물은 TYK2 키나아제를 과발현하는 세포에서 TYK2 키나아제 활성을 억제하는데 유용하다. 다르게는, 본 발명의 화합물은 예를 들어, 유형 I 인터페론, IL-6, IL-10, IL-12 및 IL-23 신호화 경로가 파괴적이거나 비정상적인 세포에서, 예를 들어 TYK2 키나아제에 결합하고 이의 활성을 억제함으로써 TYK2 키나아제 활성을 억제하는데 유용하다. 다르게는, 본 발명의 화합물은 면역학적 또는 염증 질환의 치료에 사용될 수 있다.
또 다른 실시양태는 환자에서 TYK2 키나아제 활성의 억제에 즉각 반응하는 질환 또는 상태의 중증도를 치료 또는 완화하는 방법을 포함한다. 상기 방법은 치료 효과량의 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염을 환자에게 투여하는 단계를 포함한다.
일 실시양태에서, 화학식 I의 화합물은 TYK2 키나아제 활성의 억제에 즉각 반응하는 질환 또는 상태의 중증도를 치료 또는 완화하는 치료 효과량으로 환자에게 투여되고, 상기 화합물은 각각의 다른 야누스 키나아제 활성의 억제에 비해 TYK2 키나아제 활성의 억제에 15 배 이상, 다르게는 10 배 이상, 다르게는 5 배 이상 더 선택적이다.
또 다른 실시양태는 치료에서 사용하기 위한 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염을 포함한다.
또 다른 실시양태는 면역학적 또는 염증 질환의 치료에서 사용하기 위한 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염을 포함한다.
또 다른 실시양태는 건선 또는 염증성 장 질환의 치료에서 사용하기 위한 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염을 포함한다.
또 다른 실시양태는 면역학적 또는 염증 질환의 치료를 위한 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염의 용도를 포함한다.
또 다른 실시양태는 건선 또는 염증성 장 질환의 치료를 위한 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염의 용도를 포함한다.
또 다른 실시양태는 면역학적 또는 염증 질환의 치료용 약제의 제조에서 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염의 용도를 포함한다.
또 다른 실시양태는 건선 또는 염증성 장 질환의 치료용 약제의 제조에서 화학식 I의 화합물, 이의 입체이성질체, 호변이성질체 또는 염의 용도를 포함한다.
일 실시양태에서, 질환 또는 상태는 암, 뇌졸중, 당뇨병, 간비대, 심혈관 질환, 다발성 경화증, 알츠하이머 질환, 낭포성 섬유증, 바이러스 질환, 자가면역 질환, 면역학적 질환, 아테롬성 동맥경화증, 재협착증, 건선, 알레르기 질병, 염증 질환, 신경학적 질병, 호르몬-연관된 질환, 기관 이식과 관련된 상태, 면역 결핍 질병, 골 파괴 질병, 증식성 질병, 전염성 질환, 세포 사멸과 관련된 상태, 트롬빈-유도된 혈소판 응집, 간 질환, T 세포 활성화를 수반하는 병리학적 면역 상태, CNS 질병 또는 척수 증식성 질병이다.
일 실시양태에서, 질환 또는 상태는 암이다.
일 실시양태에서, 질환 또는 상태는 면역학적 질병이다.
일 실시양태에서, 질환은 척수 증식성 질병이다.
일 실시양태에서, 척수 증식성 질병은 진성 다혈구증, 필수 혈소판 증가증, 골수 섬유증 또는 만성 골수성 백혈병(CML)이다.
일 실시양태에서, 질환은 천식이다.
일 실시양태에서, 암은 유방암, 난소암, 자궁경부암, 전립선암, 고환암, 음경암, 비뇨생식기암, 정상피종, 식도암, 후두암, 위암, 위장암, 위장관암, 피부암, 각화극세포종, 여포성 암종, 흑색종, 폐암, 소 세포 폐암종, 비소 세포 폐암종(NSCLC), 폐 선암종, 폐의 편평상피 암종, 대장암, 췌장암, 갑상선암, 유두암, 방광암, 간암, 담즙관암, 신장암, 골암, 골수 질병, 림프 질병, 모발 세포암, 구강암 및 인두암 (경구), 입술암, 설암, 구강암, 타액선암, 인두암, 소장암, 대장암, 직장암, 항문암, 신장암, 전립선암, 음문암, 갑상선암, 대장암, 자궁내막암, 자궁암, 뇌암, 중추 신경계 시스템, 복막의 암, 간세포암, 두부암, 경부암, 홉킨스 병 또는 백혈병이다.
일 실시양태에서, 심혈관 질환은 재협착증, 심장비대, 아테롬성 동맥경화증, 심근경색 또는 울혈성 심부전이다.
일 실시양태에서, 신경변성 질환은 알츠하이머 질환, 파킨슨 질환, 근위축성 측색 경화, 헌팅톤 질환, 및 뇌 허혈, 및 외상성 손상, 글루타메이트 신경독성 또는 저산소증에 의해 야기된 신경변성 질환이다.
일 실시양태에서, 염증 질환은 천식, 염증성 장 질환, 크론병, 궤양성 대장염, 류마티스 관절염, 건선, 알레르기성 비염, 아토피성 피부염, 접촉성 피부염 또는 지연 과민 반응이다. 일 실시양태에서, 염증 질환은 염증성 장 질환이다. 일 실시양태에서, 염증 질환은 건선이다. 일 실시양태에서, 염증 질환은 천식이다.
일 실시양태에서, 자가면역 질환은 낭창 또는 다발성 경화증이다.
일 실시양태에서, 질환은 천식, 염증성 장 질환, 크론병, 맹낭염, 미세 장염, 궤양성 대장염, 류마티스 관절염, 건선, 알레르기성 비염, 아토피성 피부염, 접촉성 피부염, 지연 과민 반응, 낭창 또는 다발성 경화증이다.
본 발명의 화합물에 의한 약물-유도된 면역억제의 평가는 생체내 기능적 시험, 예컨대 유도된 관절염의 설치류 모델 및 질환 등급 평가를 위한 치료 또는 예방, T 세포-의존 항체 반응(TDAR), 및 지연형 과민증(DTH)을 사용하여 수행될 수 있다. 감염 또는 종양 내성에 대한 숙주 방어의 뮤린 모델을 포함하는 다른 생체내 시스템(문헌[Burleson GR, Dean JH, and Munson AE. Methods in Immunotoxicology, Vol . 1. Wiley-Liss, New York, 1995])은 관찰된 면역억제의 특징 및 기작을 설명하도록 고려될 수 있다. 생체내 시험 시스템은 면역 기능의 평가를 위한 확고한 생체외 또는 탈체 기능적 분석에 의해 보완될 수 있다. 이들 분석은 미토겐 또는 특정 항원에 대하여 B 또는 T 세포 증식, B 또는 T 세포 또는 불멸화된 B 또는 T 세포주에서 하나 이상의 야누스 키나아제 경로를 통한 신호화의 측정, B 또는 T 세포 신호화에 대하여 세포 표면 표지자의 측정, 자연 살해(NK) 세포 활성, 비만 세포 활성, 비만 세포 탈과립화, 대식세포 식균작용 또는 살해 활성, 및 호중구 산화 파열 및/또는 주화성을 포함할 수 있다. 각각의 이들 시험에서 특정 효과기 세포(예를 들어, 림프구, NK, 단핵 백혈구/대식세포, 호중구)에 의한 사이토카인 생성의 측정이 포함될 수 있다. 생체외 및 탈체 분석은 림프 조직 및/또는 말초 혈액을 사용하는 전임상 및 임상 시험 둘다에 적용될 수 있다(문헌[House RV. "Theory and practice of cytokine assessment in immunotoxicology" (1999) Methods 19:17-27]; 문헌[Hubbard AK. "Effects of xenobiotics on macrophage function: evaluation in vitro" (1999) Methods;19:8-16]; 문헌[Lebrec H, et al (2001) Toxicology 158:25-29]).
콜라겐-유도된 관절염(CIA)은 인간 류마티스 관절염(RA)의 동물 모델이다. CIA를 갖는 동물에서 발전하는 관절 염증은 류마티스 관절염(RA)을 갖는 환자에서 관찰된 염증과 매우 유사하다. 종양 괴사 인자(TNF)를 차단하는 것은 RA 환자의 치료에서 매우 효과적인 치료인 것과 마찬가지로 CIA의 효과적인 치료이다. CIA는 T-세포 및 항체(B-세포) 둘다에 의해 매개된다. 대식세포는 질환 발달 동안 조직 손상을 매개하는데 중요한 역할을 하는 것으로 추정된다. CIA는 동물을 완전 프로인트 보조제(CFA)로 에멀전화된 콜라겐으로 면역함으로써 유도된다. DBA/1 마우스 균주에서 가장 통상적으로 유도되지만, 질환은 또한 루이스 래트(Lewis rat)에서 유도될 수 있다.
T-세포 의존 항체 반응(TDAR)은 화합물의 잠재적인 면역독성 효과가 연구될 필요가 있을 경우, 면역 기능 시험에 대한 분석이다. 항원으로서 양 적혈구 세포(SRBC)를 사용하는 IgM-플라크 형성 세포(PFC) 분석은 현재 광범위하게 채택되고 입증된 표준 시험이다. TDAR은 미국 국립 독성 프로그램(NTP) 데이타베이스에 기초된, 마우스에서 성체 노출 면역독성 검출에 대한 분석이다(문헌[M.I. Luster et al., (1992) Fundam. Appl. Toxicol. 18:200-210]). 이 분석의 효용은 면역 반응의 여러 중요 성분을 수반하는 전체론적 측정이라는 사실로부터 기인한다. TDAR은 하기 세포 구분의 기능에 따른다: (1) 항원-제시 세포, 예컨대 대식세포 또는 수지상 세포; (2) 반응의 기원, 및 동형 스위칭(switching)에서 주요한 역할자인 T-헬퍼 세포; 및 (3) 궁극적인 효과기 세포이고 항체 생성에 책임이 있는 B-세포. 임의의 한 구분에서 화학적으로-유도된 변화는 전체 TDAR에서 유의한 변화를 야기할 수 있다(문헌[M.P. Holsapple In: G.R. Burleson, J.H. Dean and A.E. Munson, Editors, Modern Methods in Immunotoxicology , Volume 1, Wiley-Liss Publishers, New York, NY (1995), pp. 71-108]). 일반적으로, 이 분석은 가용성 항체의 측정을 위한 ELISA(문헌[R.J. Smialowizc et al., (2001) Toxicol. Sci. 61:164-175]) 또는 플라크(또는 항체) 형성 세포 분석(문헌[L. Guo et al., (2002) Toxicol. Appl. Pharmacol. 181:219-227])으로서 수행되어 항원 특이적 항체를 분비하는 혈장 세포를 검출한다. 전체 세포(예를 들어, 양 적혈구) 또는 가용성 단백질 항원(문헌[T. Miller et al., (1998) Toxicol. Sci. 42:129-135]) 중 항원이 선택된다.
화학식 I의 화합물은 치료될 질환 또는 상태에 적절한 임의의 경로에 의해 투여될 수 있다. 적합한 경로는 경구, 비경구(피하, 근육내, 정맥내, 동맥내, 피내, 척수내 및 경막외 포함함), 경피, 직장, 비강, 국소(구강 및 설하 포함함), 질, 복강내, 폐내, 및 비강내를 포함한다. 국소 면역억제 치료를 위해, 화합물은 병소내 투여(관류화 또는 그렇지 않으면 이식 전에 이식 부위를 억제제와 접촉시킴을 포함)에 의해 투여될 수 있다. 경로는 예를 들어 수용체의 상태에 따라 달라질 수 있음이 인지될 것이다. 화학식 I의 화합물이 경구적으로 투여되는 경우, 이는 약학적으로 허용되는 담체 또는 부형제와 알약, 캡슐, 정제 등으로서 제형화될 수 있다. 화학식 I의 화합물이 비경구적으로 투여되는 경우, 이는 약학적으로 허용되는 비경구 비히클과 투여될 수 있고 하기 상술된 바와 같이 주입가능한 형태의 단위 투여량으로 투여될 수 있다.
인간 환자를 치료하기 위한 투여량은 약 5 mg 내지 약 1000 mg의 화학식 I의 화합물일 수 있다. 전형적인 투여량은 약 5 mg 내지 약 300 mg의 화학식 I의 화합물일 수 있다. 투여량은 약동학 및 약역학 특성(특정 화합물의 흡수, 분포, 대사 및 배출을 포함함)에 따라 하루에 1회(QD), 하루에 2회(BID), 또는 더욱 빈번하게 투여될 수 있다. 게다가, 독성 인자는 투여량 및 투여 양생법에 영향을 미칠 수 있다. 경구적으로 투여된 경우, 알약, 캡슐, 또는 정제는 지정된 기간 동안 매일 또는 덜 빈번하게 섭취될 수 있다. 양생법은 치료 주기의 수에 대하여 반복될 수 있다.
조합 치료
화학식 I의 화합물은 본원에 기재된 질환 또는 질병, 예컨대 면역 질병(예를 들어, 건선 또는 염증) 또는 과증식성 질병(예를 들어, 암)의 치료를 위해 단독으로 또는 다른 치료제와 조합으로 이용될 수 있다. 특정 실시양태에서, 화학식 I의 화합물은 항염증 또는 항과증식성 특성을 갖거나, 염증, 면역 반응 질병, 또는 과증식성 질병(예를 들어, 암)의 치료에 유용한 제 2 치료 화합물과 조합 치료로서 약학 조합 제형 또는 복용 양생법으로 조합된다. 제 2 치료제는 NSAID 또는 다른 항염증제일 수 있다. 제 2 치료제는 화학치료제일 수 있다. 예를 들어 약학 조합 제형 또는 복용 양생법의 제 2 치료제는 서로 부정적인 영향을 끼치지 않도록 화학식 I의 화합물에 상보적인 활성을 갖는다. 이러한 화합물은 의도된 목적에 효과적인 양으로 조합하여 적합하게 존재한다. 일 실시양태에서, 본 발명의 조성물은 화학식 I의 화합물, 또는 이의 입체이성질체, 기하학적 이성질체, 호변이성질체, 용매화물, 대사물질, 또는 약학적으로 허용되는 염 또는 전구약물과 치료제, 예컨대 NSAID의 조합을 포함한다.
따라서, 또 다른 실시양태는 치료 효과량의 화학식 I의 화합물을 환자에게 투여하고, 추가로 제 2 치료제를 투여함을 포함하는, 환자에서 TYK2 키나아제의 억제에 즉각 반응하는 질환 또는 상태의 중증도의 치료 또는 완화 방법을 포함한다.
조합 치료는 동시 또는 순차적인 양생법으로서 투여될 수 있다. 순차적으로 투여될 경우, 조합은 2개 이상의 투여로 투여될 수 있다. 조합된 투여는 개별 제형 또는 단일 약학 제형을 사용하는 공투여, 및 임의의 순서의 연속적인 투여를 포함하고, 이는 예를 들어 둘다 (또는 모든) 활성제가 이들의 생물학적 활성을 동시에 발휘하는 동안의 기간이다.
임의의 상기 공투여된 약제에 대한 적합한 투여량은 현재 사용되는 것이고, 새롭게 동정된 약제 및 다른 화학치료제 또는 화학치료의 조합 작용(상승작용)으로 인해 낮아질 수 있다.
치료의 특정 실시양태에서, 화학식 I의 화합물, 또는 이의 입체이성질체, 기하학적 이성질체, 호변이성질체, 용매화물, 대사물질, 또는 약학적으로 허용되는 염 또는 전구약물은 다른 치료제, 호르몬제 또는 항체 시약, 예컨대 본원에 기재된 것, 뿐만 아니라 외과 치료 및 방사선치료와 조합될 수 있다. 따라서, 본 발명에 따른 조합 치료는 하나 이상의 화학식 I의 화합물, 또는 이의 입체이성질체, 기하학적 이성질체, 호변이성질체, 용매화물, 대사물질, 또는 약학적으로 허용되는 염 또는 전구약물의 투여, 및 하나 이상의 다른 암 치료 방법, 또는 면역학적 질병 방법의 사용을 포함한다. 화학식 I의 화합물 및 다른 약학 활성 면역제 또는 화학치료제의 양 및 투여의 상대 시간은 목적한 조합 치료 효과를 달성하기 위해 선택될 것이다.
일 실시양태에서, 본 발명의 화합물은 비제한적으로 항염증 약물, 예컨대 설파살라진, 메살라민 또는 코르티코스테로이드, 예컨대 부데소니드, 프레드니손, 코르티손 또는 하이드로코르티손, 면역 억제제, 예컨대 아자티오프린, 머캅토푸린, 인플릭시맙, 아달리무맙, 세르톨리주맙 페골, 메토트렉세이트, 사이클로스포린 또는 나탈리주맙, 항생제, 예컨대 메트로니다졸 또는 시프로플록사신, 지사제, 예컨대 사일륨 분말, 로퍼라미드 또는 메틸셀룰로스, 라자티브, 진통제, 예컨대 NSAID 또는 아세트아미노펜, 철 보충제, 비타민 B 보충제, 비타민 D 보충제 및 상기의 임의의 조합을 포함하는, 임의의 항-IBD 시약과 공투여된다. 또 다른 예에서, 본 발명의 화합물은 다른 항-IBD 치료, 예컨대 수술(예컨대 전, 동안 또는 후)과 함께 투여된다.
일 실시양태에서, 본 발명의 화합물은 비제한적으로 국소 코르티코스테로이드, 비타민 D 유사체, 예컨대 칼시포트리엔 또는 칼시트리올, 안트랄린, 국소 레티노이드, 예컨대 타자로텐, 칼시네우린 억제제, 예컨대 타크롤리무스 또는 피메크롤리누스, 살리실산, 콜타르, NSAID, 수분 크림 및 연고, 경구 또는 주입가능한 레티노이드, 예컨대 아시트레틴, 메토트렉세이트, 사이클로스포린, 하이드록시우레아, 면역조절자 약물, 예컨대 알레파셉트, 에타네르셉트, 인플릭시맙 또는 우스테키누맙, 티오구아닌, 및 상기 약제의 임의의 조합을 포함하는, 임의의 항건선제와 공투여된다. 또 다른 예에서, 본 발명의 화합물은 다른 항건선 치료, 예컨대 광 치료, 태양광 치료, UVB 치료, 협소-밴드 UVB 치료, 고에커만(Goeckerman) 치료, 광화학치료, 예컨대 솔라렌 플러스 자외선 A(PUVA), 엑시머 및 펄스 색소 레이저 치료, 또는 항건선제 및 항건선 치료의 임의의 조합(예를 들어 전, 동안 또는 후)과 함께 투여된다.
일 실시양태에서, 본 발명의 화합물은 비제한적으로 β2-아드레날린 작용제, 흡입용 및 경구 코르티코스테로이드, 류코트리엔 수용체 길항제 및 오말리주맙을 포함하는, 임의의 항천식제와 공투여된다. 또 다른 실시양태에서, 본 발명의 화합물은 NSAID, 플루티카손 및 살메테롤의 조합, 부데소니드 및 포름오테롤, 오말리주맙, 레브리키주맙의 조합 및 플루티카손, 부데소니드, 모메타손, 플루니솔리드 및 베클로메타손으로부터 선택된 코르티코스테로이드로부터 선택된 항천식제와 공투여된다.
제조 방법 및 제품
또 다른 실시양태는 하기 화학식 I의 화합물의 제조 방법을 포함한다. 상기 방법은 하기 단계를 포함한다:
(a) 하기 화학식 iii의 화합물을 형성하기에 충분한 조건하에 하기 화학식 i의 화합물을 하기 화학식 ii의 화합물과 반응시키는 단계:
[화학식 i]
[화학식 ii]
[화학식 iii]
상기 식에서,
Lv1 및 Lv2는 독립적으로 이탈기이고, 예를 들어 Lv1은 클로로이고, Lv2는 플루오로이고;
X, A, R1 및 R2는 화학식 I에 대하여 정의된 바와 같다.
일 예에서, 화학식 i의 화합물 및 화학식 ii의 화합물을 반응시키기 위한 조건은 약 50 내지 150 ℃, 다르게는 약 75 내지 100 ℃의 승온에서 가열하는 단계, 및 임의적으로 염기, 예컨대 비친핵성 염기, 예를 들어 탄산염 염기, 예컨대 탄산 칼륨의 존재하에 가열하는 단계(임의적으로 용매, 예를 들어 극성 비양자성 용매, 예를 들어 DMF를 포함)를 포함한다.
화학식 I의 화합물의 제조 방법은 하기 단계를 포함하는 다른 과정을 포함한다:
(c) 하기 화학식 vii의 화합물을 형성하기에 충분한 조건하에 하기 화학식 iv의 화합물을 하기 화학식 v의 화합물과 반응시키는 단계:
[화학식 iv]
[화학식 v]
[화학식 vii]
상기 식에서,
X, A, R1 및 R2는 화학식 I에 대하여 정의된 바와 같다.
일 예에서, 화학식 iv의 화합물 및 화학식 v의 화합물을 반응시키기 위한 조건은 상기 화합물을 촉매, 예를 들어 루이스산 촉매, 예컨대 전이 금속 촉매, 예를 들어, 금속 할라이드, 예컨대 티타늄 할라이드(예를 들어, TiCl4 또는 TiBr4) 또는 바나듐 테트라클로라이드, 또는 다른 루이스산 촉매, 예컨대 AlCl3과 접촉시키는 단계를 포함한다. 상기 조건은 임의적으로 일정 기간 촉매와 반응하는 동안 냉각시키는 단계를 포함하고, 임의적으로 약 50 내지 150 ℃, 다르게는 약 75 내지 100 ℃의 온도에서, 용매, 예를 들어 양성자성 용매, 예를 들어 클로로폼, 탄소 테트라클로라이드, 다이클로로메탄, 톨루엔 또는 자일렌 등 중에서 가열하는 단계를 추가로 포함한다.
화학식 I의 화합물의 제조 방법은 화학식 vii의 화합물을 산화시켜 화학식 viii의 화합물을 형성한 후, 할로겐화하여 화학식 iii의 화합물을 형성하는 단계, 또는 화학식 vii의 화합물을 직접 할로겐화하여 화합물 iii을 형성하는 단계를 포함하고, 이때 Lv는 할로겐이다. 산화 조건은 화학식 vii의 화합물을 퍼옥사이드 및 촉매, 예를 들어 루테늄 옥사이드, 예컨대 MeRuO3과 접촉시키는 단계를 포함한다:
[화학식 viii]
화합물 viii을 할로겐화 시약, 예를 들어 인 옥시할라이드, 예컨대 POBr3 또는 POCl3으로 할로겐화하여 화학식 iii의 화합물을 형성하고, 이때 Lv는 할로겐이다.
화학식 I의 화합물의 제조 방법은 생성물, 예컨대 화학식 I의 화합물을 형성하기에 충분한 조건하에 화학식 iii의 화합물을 화학식 H-R4-R5의 화합물과 반응시키는 단계; 및 임의적으로, 예를 들어 산, 예컨대 염산 또는 포름산과 반응시켜 이의 약학적으로 허용되는 염을 형성하여 상기 생성물을 추가로 작용화하는 단계를 추가로 포함한다.
특정 실시양태에서, 화학식 iii의 화합물을 화학식 H-R4-R5의 화합물과 반응시키기 위한 조건은 전이 금속 촉매화된 반응 조건을 포함한다. 일 실시양태에서, 전이 금속 촉매는 백금, 팔라듐 또는 구리 촉매로부터 선택된다. 일 실시양태에서, 촉매는 Pd(0) 촉매이다. 상기 방법에서 사용하기 위한 Pd(0) 촉매는 테트라키스(트라이-임의적으로 치환된 페닐)포스핀 팔라듐(0) 촉매를 포함하고, 이때 페닐상의 임의의 치환기는 -OMe, -CF3, -OCF3, -Me 및 -Et 및 다이팔라듐(0) 촉매, 예컨대 트리스(다이벤질이덴아세톤)다이팔라듐(0)으로부터 선택된다. 특정 실시양태에서, 상기 조건은 반응물을 염기성 조건, 예를 들어, 무기 염기, 예를 들어, 탄산 세슘, 탄산 칼륨, 탄산 암모늄, 또는 탄산 나트륨 또는 다이카본에이트 염기, 예를 들어 Cs2CO3의 존재하에 가열하는 단계를 포함한다. 특정 실시양태에서, 상기 조건은 전이 금속 촉매에 대한 리간드를 추가로 포함한다. 일 실시양태에서, 두자리 리간드가 포함되고, 예를 들어, 두자리 리간드 잔포스가 첨가된다.
또 다른 실시양태는 TYK2 키나아제의 억제에 즉각 반응하는 질환 또는 질병의 치료를 위한 키트를 포함한다. 상기 키트는 하기 (a) 및 (b)를 포함한다:
(a) 화학식 I의 화합물을 포함하는 제 1 약학 조성물; 및
(b) 사용 설명서.
또 다른 실시양태에서, 키트는 하기 (c)를 추가로 포함한다:
(c) 화학치료제를 포함하는 제 2 약학 조성물.
일 실시양태에서, 설명서는 상기 제 1 및 제 2 약학 조성물을 이를 필요로 하는 환자에게 동시에, 순차적으로 또는 개별적으로 투여하기 위한 설명서를 포함한다.
일 실시양태에서, 제 1 및 제 2 조성물은 개별 용기에 함유된다.
일 실시양태에서, 제 1 및 제 2 조성물은 동일 용기에 함유된다.
사용하기 위한 용기는 예를 들어, 병, 바이알, 주사기, 블리스터 팩 등을 포함한다. 용기는 다양한 물질, 예컨대 유리 또는 플라스틱으로부터 형성될 수 있다. 용기는 상태의 치료에 효과적인 화학식 I의 화합물 또는 이의 제형을 포함하고 살균된 접근 포트를 가질 수 있다(예를 들어, 용기는 피하주사기 주입 바늘에 의해 뚫릴수 있는 스토퍼를 갖는 정맥내 용액 백 또는 바이알일 수 있음). 용기는 하나 이상의 화학식 I의 화합물을 포함하는 조성물을 포함한다. 표지 또는 포장 삽입물은 선택된 상태, 예컨대 암을 치료하기 위해 사용됨을 나타낸다. 일 실시양태에서, 표지 또는 포장 삽입물은 화학식 I의 화합물을 포함하는 조성물이 질병을 치료하는데 사용될 수 있음을 나타낸다. 게다가, 표지 또는 포장 삽입물은 치료될 환자가 과활성 또는 불규칙한 키나아제 활성에 의해 특징화되는 질병을 가짐을 나타낼 수 있다. 또한, 표지 또는 포장 삽입물은 조성물이 다른 질병의 치료에 사용될 수 있음을 나타낼 수 있다.
제품은 화학식 I의 화합물이 함유된 제 1 용기; 및 (b) 제 2 약학 제형이 함유된 제 2 용기를 포함할 수 있고, 상기 제 2 약학 제형은 화학치료제를 포함한다. 본 발명의 이 실시양태에서 제품은 뇌졸중, 혈전 또는 혈전증 질병의 위험에서 환자를 치료하기 위해 사용될 수 있는 제 1 및 제 2 화합물을 나타내는 포장 삽입물을 추가로 포함할 수 있다. 다르게는, 또는 추가로, 제품은 약학적으로 허용되는 완충액, 예컨대 주입용 세균 발육 저지를 위한 물(BWFI), 포스페이트-완충된 염수, 링거 용액 및 덱스트로스 용액을 포함하는 제 2 (또는 제 3) 용기를 추가로 포함할 수 있다. 제품은 상업적인 관점 및 사용자 관점으로부터 바람직한 다른 물질, 예컨대 다른 완충액, 희석제, 필터, 바늘 및 주사기를 추가로 포함할 수 있다.
본 발명을 예시하기 위해, 하기 실시예가 포함된다. 그러나, 이들 실시예가 본 발명을 제한하지 않고 오직 본 발명을 실시하는 방법을 제안하기 위한 것으로 이해되어야 한다. 당업자는 기재된 화학 반응이 다른 화학식 I의 화합물을 제조하기 위해 쉽게 개조될 수 있고, 화학식 I의 화합물을 제조하기 위한 다른 방법이 본 발명의 범주내에 있음을 인지할 것이다. 예를 들어, 본 발명에 따라 예시되지 않은 화합물의 합성은 당업자에게 있어서 명백한 개질에 의해, 예를 들어, 방해 기를 적당하게 보호함으로써, 기재된 것 이외의 당해 분야에 공지된 다른 적합한 시약을 이용함으로써, 및/또는 반응 조건의 통상의 개질을 수행함으로써 성공적으로 수행될 수 있다. 다르게는, 본원에 개시되거나 당해 분야에 공지된 다른 반응은 다른 본 발명의 화합물을 제조하기 위한 적용성을 갖는 것으로서 인지될 것이다.
생물학적
실시예
화학식 I의 화합물을 생체외 및 생체 내에서 단백질 키나아제, 티로신 키나아제, 추가 세린/트레오닌 키나아제, 및/또는 이중 특이적 키나아제의 활성을 조절하는 능력에 대해 분석할 수 있다. 생체외 분석은 키나아제 활성의 억제를 측정하는 생화학 및 세포계 분석을 포함한다. 다른 생체외 분석은 키나아제에 결합하는 화학식 I의 화합물의 능력을 정량하고 결합 전 화학식 I의 화합물을 방사선표지화 단계, 화학식 I의 화합물/키나아제 착체를 단리하는 단계 및 방사성표지 결합의 양을 측정하는 단계에 의해, 또는 화학식 I의 화합물이 공지된 방사성표지된 리간드로 배양되는 경우 경쟁 실험을 수행하는 단계에 의해 측정될 수 있다. 이들 및 다른 유용한 생체외 분석은 당업자에게 널리 공지되어 있다.
일 실시양태에서, 화학식 I의 화합물은 티로신 키나아제 활성, 예를 들어 TYK2 키나아제 활성, 추가 세린/트레오닌 키나아제, 및/또는 이중 특이성 키나아제를 제어하거나 조절하거나 억제하기 위해 사용될 수 있다. 따라서, 이는 신규한 생물학적 시험, 분석의 발달 및 신규한 약리 약제의 연구에서 사용하기 위한 약리 표준으로서 유용하다.
실시예
A
JAK1
,
JAK2
및
TYK2
억제 분석 프로토콜
단리된 JAK1, JAK2 또는 TYK2 키나아제 도메인의 활성을 칼리퍼 랩칩(Caliper LabChip) 기술(칼리퍼 라이프 사이언시스(Caliper Life Sciences), 미국 매사추세츠주 홉킨스 소재)을 사용하여 5-카복시플루오레세인으로 N-말단 상에 형광 표지된 JAK3(Val-Ala-Leu-Val-Asp-Gly-Tyr-Phe-Arg-Leu-Thr-Thr)으로부터 유도된 펩티드의 인산화를 모니터링함으로써 측정하였다. 실시예 1 내지 165의 억제 상수(Ki)를 측정하기 위해, 화합물을 DMSO 중에 순차적으로 희석하고 2%의 최종 DMSO 농도에서 1.5 nM JAK1, 0.2 nM 정제된 JAK2 또는 1 nM 정제된 TYK2 효소, 100 mM Hepes(pH 7.2), 0.015% Brij-35, 1.5 uM 펩티드 기질, 25 uM ATP, 10 mM MgCl2, 4 mM DTT를 함유하는 50 μL의 키나아제 반응물에 첨가하였다. 반응물을 22 ℃에서 384-웰 폴리프로필렌 마이크로티터 플레이트 중에 30 분 동안 배양한 후 25 μL의 EDTA 함유 용액(100 mM Hepes(pH 7.2), 0.015% Brij-35, 150 mM EDTA)을 첨가하여 멈추어, 50 mM의 최종 EDTA 농도를 야기하였다. 키나아제 반응의 종결 후, 인산화된 생성물의 비는 제조업체의 설명서에 따라 칼리퍼 랩칩 3000을 사용하여 총 펩티드 기질의 분율로서 측정하였다. 이어서, Ki 값을 모리슨 타이트 결합 모델을 사용하여 측정하였다. 문헌[Morrison, J.F., Biochim . Biophys . Acta . 185:269-296 (1969)]; 문헌[William, J.W. and Morrison, J.F., Meth . Enzymol ., 63:437-467 (1979)].
실시예
B
JAK3
억제 분석 프로토콜
단리된 JAK3 키나아제 도메인의 활성을 칼리퍼 랩칩 기술(칼리퍼 라이프 사이언시스, 미국 매사추세츠주 홉킨스 소재)을 사용하여 5-카복시플루오레세인으로 N-말단 상에 형광 표지된 JAK3(Leu-Pro-Leu-Asp-Lys-Asp-Tyr-Tyr-Val-Val-Arg)으로부터 유도된 펩티드의 인산화를 모니터링함으로써 측정하였다. 실시예 1 내지 165의 억제 상수(Ki)를 측정하기 위해, 화합물을 DMSO 중에 순차적으로 희석하고 2%의 최종 DMSO 농도에서 5 nM 정제된 JAK3 효소, 100 mM Hepes(pH 7.2), 0.015% Brij-35, 1.5 uM 펩티드 기질, 5 uM ATP, 10 mM MgCl2, 4 mM DTT를 함유하는 50 μL 키나아제 반응물에 첨가하였다. 반응물을 22 ℃에서 384-웰 폴리프로필렌 마이크로티터 플레이트 중에 30 분 동안 배양한 후 25 μL의 EDTA 함유 용액(100 mM Hepes(pH 7.2), 0.015% Brij-35, 150 mM EDTA)을 첨가하여 멈추어, 50 mM의 최종 EDTA 농도를 야기하였다. 키나아제 반응의 종결 후, 인산화된 생성물의 비는 제조업체의 설명서에 따라 칼리퍼 랩칩 3000을 사용하여 총 펩티드 기질의 분율로서 측정하였다. 이어서, Ki 값을 모리슨 타이트 결합 모델을 사용하여 측정하였다. 문헌[Morrison, J.F., Biochim . Biophys. Acta . 185:269-296 (1969)]; 문헌[William, J.W. and Morrison, J.F., Meth. Enzymol ., 63:437-467(1979)].
실시예
C
세포계
약리 분석
화합물 1 내지 89의 활성을 야누스 키나아제 의존 신호화를 측정하기 위해 고안된 세포계 분석으로 측정하였다. 화합물을 DMSO 중에 순차적으로 희석하고 웰 당 50,000개 세포의 최종 세포 밀도 및 0.2%의 최종 DMSO 농도에서 384-웰 마이크로티터 플레이트에서 RPMI 배지 중에 NK92 세포(미국 미생물 보존 센터(ATCC); 미국 버지니아주 마나사스 소재)로 배양하였다. 이어서, 인간 재조합 IL-12(알앤드디 시스템스(R&D Systems); 미국 미네소타주 미네아폴리스 소재)를 30 ng/ml의 최종 농도에서 NK92 세포 및 화합물을 함유하는 마이크로티터 플레이트에 첨가하고 상기 플레이트를 45 분 동안 37 ℃에서 배양하였다. 다르게는, 화합물을 DMSO 중에 순차적으로 희석하고 384-웰 마이크로티터 플레이트에서 웰 당 100,000 개 세포의 최종 세포 밀도 및 0.2%의 최종 DMSO 농도에서 페놀 레드, 1% 챠콜/덱스트란 추출된 FBS, 0.1 mM NEAA, 1 MM 나트륨 피루베이트(인비트로겐 코포레이션(Invitrogen Corp.); 미국 캘리포니아주 칼즈배드 소재)가 없는 OptiMEM 배지 중에 TF-1 세포(ATCC)로 배양하였다. 이어서, 인간 재조합 EPO(인비트로젠 코포레이션)를 10 단위/ml의 최종 농도에서 첨가하여 TF-1 세포 및 화합물을 함유하는 마이크로티터 플레이트를 수득하고 상기 플레이트를 30 분 동안 37 ℃에서 배양하였다. 이어서, STAT4 또는 STAT5 인산화에 대한 화합물 매개된 효과를 제조업체의 프로토콜에 따라 메소 규모 발견(MSD) 기술(미국 매릴랜드주 가이터스버그)을 사용하여 배양된 세포의 용해물을 측정하고 EC50 값을 측정하였다.
실시예 1 내지 89의 화합물을 상기 분석으로 시험하고 TYK2 억제의 Ki 값(실시예 A)이 약 500 nM 미만임을 발견하였다. 실시예 1 내지 165의 화합물을 상기 분석으로 시험하고 TYK2 억제의 Ki 값(실시예 A)이 약 500 nM 미만임을 발견하였다. TYK2 억제의 실시예(실시예 A)는 하기 표 1에 나타낸다.
제조예
약어
BuOH t-부탄올
DAST 다이에틸아미노황 트라이플루오라이드
DCE 다이클로로에탄
DCM 다이클로로메탄
DIPEA 다이이소프로필에틸아민
DMA N,N-다이메틸아세트아미드
DMAP 4-다이메틸아미노피리딘
DME 에틸렌글리콜 다이메틸 에터
DMF N,N-다이메틸포름아미드
DMSO 다이메틸설폭사이드
HATU O-(7-아자벤조트라이아졸-1-일)-N,N,N′,N′-테트라메틸우 로늄 헥사플루오로포스페이트
HCl 염산
HPLC 고압 액체 크로마토그래피
IMS 공업용 변성 알코올
IPA 프로판-2-올
LCMS 액체 크로마토그래피 질량 분석법
mCPBA 3-클로로퍼벤조산
MeOH 메탄올
NH2 카트리지 아미노프로필 작용기와 화학적으로 결합된
이솔루트(Isolute: 등록상표) 실리카계 흡수제
NMP N-메틸-2-피롤리디논
RPHPLC 역상 고압 액체 크로마토그래피
RT 체류 시간
SCX-2 이솔루트 화학적으로 결합된 프로필설폰 작용기를 갖는 실리카계
(등록상표) 흡수제
TFA 트라이플루오로아세트산
THF 테트라하이드로푸란
Pd2(dba)3 트리스(다이벤질이덴아세톤)다이팔라듐(0)
잔포스 4,5-비스(다이페닐포스피노)-9,9-다이메틸잔텐
암겐(Amgen) 촉매 PdCl2{PtBu2(Ph-p-NMe2)}2
KP-NH 바이오타지(Biotage) PK-NH 플래시 SNAP 카트리지(등록 상표)
NMP 1-메틸-2-피롤리디논
PdCl2(dppf)2.DCM 1-1'-비스(다이페닐포스피노)페로센팔라듐(II)다이클로라 이드 다이클로로메탄 착체
Pd(dppf)Cl2.CHCl3 1,1'-비스(다이페닐포스피노)페로센팔라듐(II)다이클로라 이드 클로로폼 착체
Pd(PPh3)4 테트라키스(트라이페닐포스핀) 팔라듐(0)
TBME t-부틸 메틸 에터
일반적인 실험 조건
본 발명의 화합물은 본원에 도시된 일반적인 방법을 사용하여 시판중인 출발 물질로 제조될 수 있다. 특히, 2-클로로-3-폼일-4-요오도피리딘 및 3-브로모-4-클로로피리딘을 매트릭스 사이언티픽(매트릭스 사이언티픽(Matrix Scientific), 미국 사우스캐롤라이나주 콜럼비아 소재)으로부터 구입하였다. 1,3-다이클로로2-플루오로벤젠을 알파 아에사(Alfa Aesar, 미국 매사추세츠주 왈드 힐 소재)로부터 구입하였다. 4-클로로피리딘-3-카보알데하이드를 프론티어 사이언티픽(Frontier Scientific, 미국 유타주 로간 소재)으로부터 구입하였다. 4-클로로-3-플루오로피리딘, 2,6-다이클로로아닐린, 2,6-다이클로로4-니트로아닐린, 4-아미노-3,5-다이클로로벤조니트릴을 알드리치(Aldrich, 미국 미주리주 세인트 루이스 소재)로부터 구입하였다. 3,4-다이클로로피리딘 및 2,6-다이클로로-4-플루오로아닐린을 아폴로 사이언티픽(Apollo Scientific, 영국 체쉐어 스톡포트 소재)으로부터 구입하였다.
LCMS
분석 방법
방법 A: 220 nm 및 254 nm에서 모니터링하는 UV 검출기가 장착된 아질런트(Agilent) 6110 4중극 LC/MS 시스템, 및 ESI+ 이온화 방식 중 110 내지 800 amu를 스캐닝하는 질량 분석법으로 실험을 수행하였다. 컬럼: XBridge C18, 4.6 X 50 mm, 3.5 mm; 이동상: A 물(0.01% 암모니아), B CH3CN; 구배: 8.0 분 중 5% 내지 95% B; 유속: 1.2 mL/분; 오븐 온도 40 ℃.
방법 B: PDAUV 검출기가 장착된 워터스 악퀴티(Waters Acquity) UPLC 시스템에 연결된 워터스 마이크로매스(Micromass) ZQ2000 4중극 질량 분석기에서 실험을 수행하였다. 분석기는 양이온 및 음이온 방식에서 작동하는 전기분무 공급원을 갖는다. 이 시스템은 40 ℃에서 유지되는 악퀴티 BEH C18 1.7 μm 100 x 2.1 Mm 컬럼, 또는 40 ℃ 및 0.4 ml/분 유속에서 유지되는 악퀴티 BEH 실드(Shield) RP18 1.7 μm 100 x 2.1 Mm 컬럼을 사용한다. 초기 용매 시스템은 처음 0.4 분 동안 0.1% 포름산(용매 A)을 함유하는 95% 물 및 0.1% 포름산(용매 B)을 함유하는 5% 아세토니트릴이고, 이어서 다음 5.6 분간에 걸쳐서 5% 용매 A 및 95% 용매 B까지 구배이다. 이는 0.8 분 동안 유지된 후 다음 1.2 분간에 걸쳐서 95% 용매 A 및 5% 용매 B로 회복된다. 총 실행 시간은 8 분이었다.
방법 C: 다이오드 어레이 및 세덱스(Sedex) 85 증발 광 산란 검출기가 장착된 휴렛 팩카드(Hewlett Packard) HP1100 LC 시스템에 연결된 워터스 플랫폼(Platform) LC 4중극 질량 분석기에서 실험을 수행하였다. 분석기는 양이온 및 음이온 방식에서 작동하는 전기분무 공급원을 갖는다. 이 시스템은 페노메넥스 루나(Phenomenex Luna) 3㎛ C18(2) 30 x 4.6 mm 컬럼 및 2 ml/분 유속을 사용한다. 초기 용매 시스템은 처음 0.5 분 동안 0.1% 포름산(용매 A)을 함유하는 95% 물 및 0.1% 포름산(용매 B)을 함유하는 5% 아세토니트릴이고, 이어서 다음 4.0 분간에 걸쳐서 5% 용매 A 및 95% 용매 B까지의 구배이다. 이는 1 분 동안 유지된 후 다음 0.5 분간에 걸쳐서 95% 용매 A 및 5% 용매 B로 회복된다. 총 실행 시간은 6 분이었다.
방법 D: 워터스 996 다이오드 어레이 검출기 및 세덱스 85 증발 광 산란 검출기가 장착된 워터스 1525 LC 시스템에 연결된 워터스 ZMD 4중극 질량 분석기에서 실험을 수행하였다. 분석기는 양이온 및 음이온 방식에서 작동하는 전기분무 공급원을 갖는다. 이 시스템 루나 3 ㎛ C18(2) 30 x 4.6 mm 컬럼 및 2 ml/분 유속을 사용한다. 초기 용매 시스템은 처음 0.5 분 동안 0.1% 포름산(용매 A)을 함유하는 95% 물 및 0.1% 포름산(용매 B)을 함유하는 5% 아세토니트릴이고, 이어서 다음 4.0 분간에 걸쳐서 5% 용매 A 및 95% 용매 B까지의 구배이다. 이는 1 분 동안 유지된 후 다음 0.5 분간에 걸쳐서 95% 용매 A 및 5% 용매 B로 회복된다. 총 실행 시간은 6 분이었다.
방법 E: 220 nm 및 254 nm에서 모니터링하는 UV 검출기가 장착된 아질런트 1200 LC/MS 시스템, 및 ESI+ 이온화 방식 중 110 내지 800 amu를 스캐닝하는 질량 분석법으로 실험을 수행하였다. 컬럼: 아질런트 ZORBAX SD-C18, 2.1 X 30 mm, 1.8 μm; 이동상: A 0.05% TFA를 갖는 물, B 0.05% TFA를 갖는 CH3CN; 구배: 8.5 분 중 3% 내지 95% B; 유속: 0.4 mL/분; 컬럼 온도 40 ℃.
방법 F: 페노메넥스 루나 3 m C18(2) 30 x 4.6 mm 및 2 mL/분 유속을 사용하여, 다이오드 어레이 검출기 및 100 위치 오토샘플러가 장착된 휴렛 팩카드 HP1050 LC 시스템에 연결된 VG 플랫폼 II 4중극 질량 분석기에서 실험을 수행하였다. 이동상은 물(용매 A) 중 포름산 0.1% 및 아세토니트릴(용매 B) 중 포름산 0.1%로 이루어진다. 초기 용매 시스템은 처음 0.3 분 동안 95% 용매 A 및 5% 용매 B이고, 이어서, 다음 4 분간에 걸쳐서 5% 용매 A 및 95% 용매 B까지의 구배이다. 최종 용매 시스템은 추가 1 분 동안 지속되었다.
방법 G: 휴렛 팩카드 HP1100 LC 시스템에 연결된 양이온 및 음이온 방식에서 작동하는 전기분무 공급원을 갖는 워터스 콰트로 마이크로(Quattro Micro) 삼중항 4중극 질량 분석기에서 실험을 수행하였다. PDA 검출기를 사용하여 검출을 달성하였다. LC 컬럼은 22 ℃에서 유지되는 히긴스 클리페우스(Higgins Clipeus) 5 ㎛ C18 100 x 3.0 mm이었다. 유속은 1 mL/분이었다. 초기 용매 시스템은 1 분 동안 0.1% 포름산(용매 A)을 함유하는 95% 물 및 0.1% 포름산(용매 B)을 함유하는 5% 아세토니트릴이고, 이어서 다음 14 분간에 걸쳐서 5% 용매 A 및 95% 용매 B까지의 구배이다. 최종 용매 시스템은 추가 5 분 동안 지속되었다.
1H NMR 스펙트럼을 삼중항 공명 5 mm 탐침이 장착된 바리안 유니티 이노바(Varian Unity Inova, 400MHz) 분석기를 사용하여 상온에서 기록하였다. 화학 이동은 테트라메틸실란에 대한 ppm으로 나타내었다. 하기 약어가 사용되었다: br = 넓은 신호, s = 일중항, d = 이중항, dd = 이중 이중항, t = 삼중항, q = 사중항, m = 다중항.
단일 방식 공명기 및 동적 분야 튜닝(dynamic field tuning)을 사용하는 바이오타지 이니시에이터(Initiator) 60을 사용하여 마이크로파 실험을 수행하였다. 온도는 40 내지 250 ℃로 달성될 수 있고, 압력은 30 bar 이하로 도달될 수 있다.
방법 1:
실시예
1
N-(2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일)
사이클로프로판카복스아미드
단계 1:
2-클로로-4-요오도니코틴알데하이드
무수 THF(30 mL) 중 2-클로로-3-요오도피리딘(5.0 g, 21 mmol)의 혼합물을 무수 THF(50 mL) 중 리튬 다이이소프로필아미드(15 mL, 30 mmol)의 냉각된 용액(-78 ℃)에 천천히 첨가하였다. 생성된 혼합물을 3 시간 동안 이 온도에서 교반하였다. 이어서, 에틸 포름에이트(4.0 g, 54 mmol)를 첨가하였다. 1.5 시간 동안 동일한 온도에서 교반을 지속하였다. 물(10 mL)을 첨가하여 반응물을 급랭시킨 후, 생성된 혼합물 실온으로 가온하였다. 2 M HCl(50 mL)을 첨가한 후 THF를 감압하에 제거하였다. 수성 잔사를 에틸 아세테이트(2 x 50 mL)로 추출하였다. 합한 유기 추출물을 염수로 세척하고, Na2SO4 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔(다이에틸 에터:석유 에터 = 1:4)로 정제하여 황색 고체로서 목적 생성물 2-클로로-4-요오도니코틴알데하이드(3.0 g, 54% 수율)를 수득하였다.
단계 2:
4-클로로-1H-피라졸로[4,3-c]피리딘
에탄올(6.0 mL) 중 2-클로로-4-요오도니코틴알데하이드(1.0 g, 3.7 mmol)의 혼합물에 하이드라진(3.0 mL, 초과량)을 첨가하였다. 혼합물을 실온에서 15 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 물(30 mL)로 희석하고 다이클로로메탄(300 mL)으로 추출하였다. 유기 추출물을 염수로 세척하고, Na2SO4 상에서 건조하고, 감압하에 농축하였다. 잔사를 다이클로로메탄(5 mL) 중에 용해하고 5 분 동안 교반하였다. 침전된 고체를 여과로 단리하고 건조하여 회색 고체로서 목적 중간체인 4-클로로-1H-피라졸로[4,3-c]피리딘(110 mg, 19% 수율)을 수득하고, 이를 추가 정제 없이 다음 단계에서 사용하였다. LCMS(ESI) m/z: 154.1 [M+H+]
단계 3:
4-
클로로
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
무수 DMF(3.0 mL) 중 4-클로로-1H-피라졸로[4,3-c]피리딘(150 mg, 0.990 mmol), 1,6-다이클로로-2-플루오로벤젠(300 mg, 1.80 mmol) 및 탄산 칼륨(450 mg, 3.26 mmol)의 혼합물을 85 ℃에서 20 시간 동안 가열하였다. 반응물을 물(30 mL)로 급랭하고 에틸 아세테이트(3 x 20 mL)로 추출하였다. 합한 유기 추출물을 염수로 세척하고, Na2SO4 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔(에틸 아세테이트:석유 에터 = 1:10)로 정제하여 백색 고체로서 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(10 mg, 3.5% 수율) 및 백색 고체로서 4-클로로-1-(2,6-다이클로로페닐)-1H-피라졸로[4,3-c]피리딘(30 mg, 11% 수율)을 수득하였다.
4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘:
4-클로로-1-(2,6-다이클로로페닐)-1H-피라졸로[4,3-c]피리딘:
단계 4:
N
-(2-(2, 6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일)
사이클로프로판카복스아미드
무수 다이옥산(4.0 mL) 중 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(25 mg, 0.084 mmol), 사이클로프로판카복스아미드(16 mg, 0.19 mmol), 잔포스(14 mg, 0.024 mmol), Pd2(dba)3(14 mg, 0.016 mmol) 및 Cs2CO3(152 mg, 0.470 mmol)의 현탁액을 질소로 탈기한 후 마이크로파 바이알 중에 밀봉하였다. 혼합물을 160 ℃에서 60 분 동안 마이크로파로 조사한 후 실온으로 냉각하였다. 고체 물질을 여과를 통해 제거하고 여액을 분취용-HPLC(글리손(Gilson) GX 281, 심-팩(Shim-pack) PRC-ODS 250 mm x 20 mm x 2, 구배: CH3CN/10 mm/L NH4HCO3, 17 분)로 정제하여 백색 고체로서 N-(2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일)사이클로프로판카복스아미드(10 mg, 35% 수율)를 수득하였다.
LCMS(방법 A): RT = 5.50 분, m/z: 347.0 [M+H+].
방법 1:
실시예
2
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민
실시예 1에 나타낸 바와 유사한 과정으로, 이 화합물을 11% 수율로 제조하였다.
LCMS(방법 A): RT = 5.24 분, m/z: 385.0 [M+H+].
다르게는, 실시예 2는 방법 2에 의해서도 제조될 수 있다.
단계 1:
4-
아지도피리딘
-3-
카브알데하이드
나트륨 아지드(1.07 g, 16.5 mmol)를 DMF(15 mL) 중 4-클로로-3-폼일피리딘(2.22 g, 15.7 mmol)의 혼합물에 첨가하고 반응 혼합물을 18 시간 동안 교반하였다. 에틸 아세테이트를 첨가하고 유기층을 물 및 염수로 세척하였다. 합한 유기상을 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 60% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(2.02 g, 87% 수율)을 수득하였다.
단계 2:
[1-(4-
아지도피리딘
-3-일)
메트
-(E)-
일이덴
]-(2,6-
다이클로로페닐
)아민
티타늄 테트라클로라이드(1 M, 4.3 mL, 4.3 mmol)를 DCM(24 mL) 중 4-아지도피리딘-3-카브알데하이드(1.06 g, 7.2 mmol), 2,6-다이클로로아닐린(1.17 g, 7.2 mmol) 및 트라이에틸아민(3.0 mL, 21.6 mmol)의 냉각된 혼합물(0 ℃)에 질소하에 첨가하였다. 생성된 혼합물을 3 시간 동안 0 ℃에서 교반한 후 실온으로 가온하고 추가 3 시간 동안 교반하였다. 반응 혼합물을 감압하에 농축하였다. 잔사를 톨루엔 중에 현탁하고 셀라이트(Celite: 등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하고 건조하여 황색 고체로서 표제 화합물을 수득하였다. 이 조질 물질을 추가 정제 또는 분석 없이 다음 단계에서 사용하였다.
단계 3:
2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘
톨루엔(20 mL) 중 [1-(4-아지도피리딘-3-일)메트-(E)-일이덴]-(2,6-다이클로로페닐)아민(7.2 mmol)의 혼합물을 105 ℃로 18 시간 동안 가열하였다. 반응 혼합물을 냉각하고 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 70% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(1.30 g, 68% 수율)을 수득하였다.
LCMS(방법 D): RT = 3.46 분, m/z: 264 [M+H+].
단계 4:
2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘 5-옥사이드
DCM(20 mL) 중 mCPBA(7.2 mmol)의 건조된 용액을 DCM(30 mL) 중 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(1.28 g, 4.8 mmol)의 냉각된 용액(0 ℃)에 질소하에 첨가하였다. 반응 혼합물을 1 시간 동안 교반하고, 실온으로 가온하고, 추가 2 시간 동안 교반하였다. 티오황산 나트륨(포화 수용액)을 첨가하고 층을 나누었다. 유기층을 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 5 내지 10% 메탄올)로 정제하여 백색 고체로서 표제 화합물(1.22 g, 91% 수율)을 수득하였다.
단계 5:
4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘
2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘 5-옥사이드(1.12 g, 4 mmol)를 인 옥시클로라이드(8 mL)에 천천히 첨가하였다. 이어서, 테트라부틸염화 암모늄(1.11 g, 4 mmol)을 첨가하였다. 반응 혼합물을 80 ℃에서 5 시간 동안 가열한 후 실온으로 냉각하였다. 반응물을 에틸 아세테이트 및 탄산수소 나트륨(포화 수용액)의 혼합물에 붓고 층을 나누었다. 유기층을 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(590 mg, 49% 수율)을 수득하였다.
LCMS(방법 D): RT = 3.42 분, m/z: 298 [M+H+].
단계 6:
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민
다이옥산(5 mL) 중 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(200 mg, 0.57 mmol), 4-아미노-2,6-다이메틸피리미딘(95 mg, 0.77 mmol), Pd2(dba)3(16 mg, 0.018 mmol), 잔포스(39 mg, 0.067 mmol) 및 탄산 세슘(437 mg, 1.34 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고 150 ℃에서 25 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 60 내지 80% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(189 mg, 73% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.93 분, m/z: 385 [M+H+].
방법 2:
실시예
3
6-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]
니코티노니트릴
나트륨 하이드리드(12 mg, 0.30 mmol)를 DMF(2 mL) 중 6-아미노-3-피리딘카보니트릴(36 mg, 0.30 mmol)의 용액에 첨가하고, 생성된 혼합물을 5 분 동안 교반한 후 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(80 mg, 0.27 mmol)을 첨가하였다. 반응 바이알을 밀봉하고, 질소로 퍼징하고 마이크로파로 150 ℃에서 10 분 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 40% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(53 mg, 52% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.05 분, m/z: 381 [M+H+].
방법 2:
실시예
4
N
-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-
N
'
-
메틸피리미딘
-4,6-
다이아민
단계 1:
(6-클로로피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아민
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민에 대하여 상기 기재된 과정에 따라, 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘 및 4-아미노-6-클로로피리미딘을 반응시켜 황색 고체로서 표제 화합물(244 mg, 57% 수율)을 수득하였다.
LCMS(방법 D): RT = 2.40 분, m/z: 391 [M+H+].
단계 2:
N
-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-
N
'
-
메틸피리미딘
-4,6-
다이아민
NMP(2.0 mL) 중 (6-클로로피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아민(80 mg, 0.20 mmol) 및 메틸아민(THF 중 2 M, 300 μL, 0.60 mmol)의 용액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고 160 ℃에서 30 분 동안 마이크로파로 조사하였다. 추가 메틸아민(300 μL, 0.20 mmol)을 첨가하고 반응 혼합물을 170 ℃에서 30 분 동안 조사하였다. 생성된 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 4 내지 5 % 메탄올)로 정제하여 백색 고체로서 표제 화합물(35.0 mg, 45% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.99 분, m/z: 386 [M+H+].
방법 2:
실시예
5
[2(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-[6-(3-
플루오로아제티딘
-1-일)피리미딘-4-일]아민
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-N'-메틸피리미딘-4,6-다이아민에 대하여 기재된 과정에 따라, (6-클로로피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아민 및 DIPEA(103 μL, 0.6 mmol)가 첨가된 3-플루오로아제티딘을 반응시켜 황색 고체로서 표제 화합물(81 mg, 93 % 수율)을 수득하였다.
LCMS(방법 B): RT = 3.16 분, m/z: 430 [M+H+].
방법 2:
실시예
6
[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]카밤산
메틸
에스터
단계 1:
2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-N'-메틸피리미딘-4,6-다이아민에 대하여 기재된 과정에 따라, 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘 및 33% 수성 암모니아(1.5 mL)를 반응시켜 백색 고체로서 표제 화합물(139 mg, 53% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.54 분, m/z: 279 [M+H+].
단계 2:
[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]카밤산
메틸
에스터
DCM(2 mL) 중 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민(60mg, 0.21 mmol)의 용액에 DIPEA(51 μL, 0.3 mmol)를 첨가한 후 메틸 클로로포름에이트(19 μL, 0.25 mmol)를 첨가하였다. 반응물을 TLC에 의해 측정시 완료될 때까지 실온에서 교반하였다. 혼합물을 DCM과 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 40 내지 50% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(35 mg, 49% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.71 분, m/z: 337 [M+H+].
방법 2:
실시예
7
1-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-3-메틸우레아
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]카밤산 메틸 에스터에 대하여 기재된 과정에 따라, 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민 및 메틸 이소시아네이트를 반응시켜 백색 고체로서 표제 화합물(78% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.69 분, m/z: 336 [M+H+].
방법 2:
실시예
8
N
-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-
피리다진
-3,6-다이아민
다이옥산(2.5 mL) 중 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민(100 mg, 0.36 mmol), 3-아미노-6-클로로피리다진(57 mg, 0.44 mmol), Pd2(dba)3(8 mg, 0.009 mmol), 잔포스(21 mg, 0.036 mmol) 및 탄산 세슘(234 mg, 0.72 mmol)의 혼합물을 아르곤으로 탈기한 후 150 ℃에서 30 분 동안 마이크로파 반응기에서 가열하였다. 반응 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 4 내지 7% 메탄올)로 정제하여 베이지색 고체로서 표제 화합물(17 mg, 13% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.56 분, m/z: 372 [M+H+].
방법 2:
실시예
9
N
*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸-피리미딘-2,4-다이아민
단계 1:
(4-클로로-6-메틸-피리미딘-2-일)-비스-카밤산 t-부틸 에스터
DMAP(43 mg, 0.35 mmol)를 THF(40 mL) 중 2-아미노-6-클로로-4-메틸피리미딘(1.0 g, 7.0 mmol) 및 다이-t-부틸-다이카본에이트(3.3 g, 15.0 mmol)의 혼합물에 첨가하였다. 반응물을 실온에서 18 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 실리카 겔 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 회백색 고체로서 표제 화합물(1.64 g, 68% 수율)을 수득하였다.
단계 2:
{4-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-6-
메틸
-피리미딘-2-일}-
비스
-카밤산 t-부틸 에스터
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리다진-3,6-다이아민에 대하여 기재된 과정에 따라, 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민 및 (4-클로로-6-메틸-피리미딘-2-일)-비스-카밤산 t-부틸 에스터를 반응시켜 연황색 고체로서 표제 화합물(126 mg, 60% 수율)을 수득하였다. LCMS(방법 D): RT = 3.15 분, m/z: 586 [M+H+].
단계 3:
N
*4*-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-6-
메틸
-피리미딘-2,4-
다이아민
TFA(1 mL)를 DCM(3 mL) 중 {4-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-6-메틸-피리미딘-2-일}-비스-카밤산 t-부틸 에스터(121 mg, 0.21 mmol)의 용액에 첨가하고 실온에서 1.5 시간 동안 교반하였다. 반응 혼합물을 감압하에 농축하고 잔사를 DCM과 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 크로마토그래피(에틸 아세테이트 중 2% 메탄올)로 정제하여 백색 고체로서 표제 화합물(23 mg, 28% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.68 분, m/z: 386 [M+H+].
방법 2:
실시예
10
N
-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-2-
메톡시
-피리미딘-4,6-
다이아민
단계 1:
(6-클로로-2-메톡시-피리미딘-4-일)-비스-카밤산 t-부틸 에스터
(4-클로로-6-메틸-피리미딘-2-일)-비스-카밤산 t-부틸 에스터에 대하여 기재된 과정에 따라, 6-클로로-2-메톡시-피리미딘-4-일아민 및 다이-t-부틸-다이카본에이트를 반응시켜 무색 오일로서 표제 화합물(336 mg, 89% 수율)을 수득하였다.
단계 2:
{4-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-4-
메톡시
-피리미딘-6-일}-카밤산 t-부틸 에스터
N-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리다진-3,6-다이아민에 대하여 기재된 과정에 따라, 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민 및 (6-클로로-2-메톡시-피리미딘-4-일)-비스-카밤산 t-부틸 에스터를 반응시켜 백색 고체로서 표제 화합물(82 mg, 38% 수율)을 수득하였다. LCMS(방법 D): RT = 3.11 분, m/z: 602 [M+H+].
단계 3:
N
-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-2-
메톡시
-피리미딘-4,6-
다이아민
N*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸-피리미딘-2,4-다이아민에 대하여 기재된 과정에 따라, {4-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-4-메톡시-피리미딘-6-일}-카밤산 t-부틸 에스터를 반응시켜 백색 고체로서 표제 화합물(20 mg, 35% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.68 분, m/z: 386 [M+H+].
방법 2:
실시예 11
N
-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-2,4,6-트라이아릴민
단계 1:
(2-
비스
-t-
부톡시카본일아미노
-6-
클로로
-피리미딘-4-일)-
비스
-
카밤산
t-부틸 에스터
DMAP(12 mg, 0.10 mmol)를 THF(6 mL) 중 4-클로로-2,6-다이아미노피리미딘(145 mg, 1.0 mmol) 및 다이-t-부틸-다이카본에이트(960 mg, 4.4 mmol)의 혼합물에 첨가하고 생성된 혼합물을 실온에서 18 시간 동안 교반하였다. 반응 혼합물을 감압하에 농축하고 건조하고 생성된 잔사를 실리카 겔 크로마토그래피(사이클로헥산 중 10% 에틸 아세테이트)로 정제하여 무색 오일로서 표제 화합물(정량적 수율)을 수득하였다.
단계 2:
{2-
비스
-t-
부톡시카본일아미노
-6-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-
비스
-카밤산 t-부틸 에스터
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리다진-3,6-다이아민에 대하여 기재된 과정에 따라, 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민 및 (2-비스-t-부톡시카본일아미노-6-클로로-피리미딘-4-일)-비스-카밤산 t-부틸 에스터를 반응시켜 백색 고체로서 표제 화합물(176 mg, 62% 수율)을 수득하였다. LCMS(방법 D): RT = 3.95 분, m/z: 787 [M+H+].
단계 3:
N
-[2-(2,6-
다이클로로
-
페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-피리미딘-2,4,6-트
라이
아릴민
N*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸-피리미딘-2,4-다이아민에 대하여 기재된 과정에 따라, {2-비스-t-부톡시카본일아미노-6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터를 반응시켜 연황색 고체로서 표제 화합물(30 mg, 35% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.59 분, m/z: 387 [M+H+].
방법 2:
실시예 12
N
-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-2-메틸-피리미딘-4,6-다이아민
단계 1:
(6-클로로-2-메틸-피리미딘-4-일)-비스-카밤산 t-부틸 에스터
(4-클로로-6-메틸-피리미딘-2-일)-비스-카밤산 t-부틸 에스터에 대하여 기재된 과정에 따라, 6-클로로-2-메틸-피리미딘-4-일아민 및 다이-t-부틸-다이카본에이트를 반응시켜 백색 고체로서 표제 화합물(1.45 g, 정량적 수율)을 수득하였다.
단계 2:
{6-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-2-
메틸
-피리미딘-4-일}-카밤산 t-부틸 에스터
N-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리다진-3,6-다이아민에 대하여 기재된 과정에 따라, 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민 및 (6-클로로-2-메틸-피리미딘-4-일)-비스-카밤산 t-부틸 에스터를 반응시켜 백색 고체로서 표제 화합물(116 mg, 55% 수율)을 수득하였다. LCMS(방법 D): RT = 3.05 분, m/z: 586 [M+H+].
단계 3:
N
-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-2-메틸-피리미딘-4,6-다이아민
N*4*-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸-피리미딘-2,4-다이아민에 대하여 기재된 과정에 따라, {6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸-피리미딘-4-일}-카밤산 t-부틸 에스터를 반응시켜 백색 고체로서 표제 화합물(40 mg, 55% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.90 분, m/z: 386 [M+H+].
방법 2:
실시예
13
N
*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6,
N
*2*-다이메틸피리미딘-2,4-다이아민
단계 1:
(2-클로로-6-메틸피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아민
[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민에 대하여 기재된 과정에 따라, 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘 및 2-클로로-6-메틸피리미딘-4-일아민을 반응시켜 황색 고체로서 표제 화합물(256 mg, 57 % 수율)을 수득하였다.
LCMS(방법 D): RT = 2.50 분, m/z: 407 [M+H+].
단계 2:
N
*4*-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6,
N
*2*-다이메틸피리미딘-2,4-다이아민
N-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-N'-메틸피리미딘-4,6-다이아민에 대하여 기재된 과정에 따라, (2-클로로-6-메틸피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]아민 및 메틸아민을 반응시켜 황색 고체로서 표제 화합물(24 mg, 33 % 수율)을 수득하였다.
LCMS(방법 B): RT = 2.90 분, m/z: 400 [M+H+].
방법 2:
실시예
14
N
-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-피리미딘-4,6-다이아민
단계 1:
{6-[2-(2,6- 다이클로로페닐 )-2H- 피라졸로[4,3-c]피리딘 -4- 일아미노 ]-피리미딘-4-일}-카밤산 t-부틸 에스터
N-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리다진-3,6-다이아민에 대하여 기재된 과정에 따라, 2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민 및 (6-클로로-피리미딘-4-일)-비스-카밤산 t-부틸 에스터를 반응시켜 황색 유리로서 표제 화합물(453 mg, 55% 수율)을 수득하였다. LCMS(방법 D): RT = 2.98 분, m/z: 572 [M+H+].
단계 2:
N
-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-피리미딘-4,6-다이아민
N*4*-[2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-6-메틸-피리미딘-2,4-다이아민에 대하여 기재된 과정에 따라, {6-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-카밤산 t-부틸 에스터를 반응시켜 백색 고체로서 표제 화합물(148 mg, 50% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.85 분, m/z: 372 [M+H+].
방법 2:
실시예
15
사이클로프로판카복실산
[2-(2-
클로로
-6-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]아미드
단계 1:
[1-(4-아지도피리딘-3-일)메트-(E)-일이덴]-(2-클로로-6-플루오로페닐)아민
트라이에틸아민(7.1 mL, 51 mmol)을 DCM(60 mL) 중 4-아지도피리딘-3-카브알데하이드(2.52 g, 17 mmol) 및 2-클로로-6-플루오로아닐린(2.47 g, 17 mmol)의 냉각된 혼합물(0 ℃)에 질소하에 첨가하였다. 이어서, 티타늄 테트라클로라이드(1 M, 10.2 mL, 10.2 mmol)를 첨가하고 생성된 혼합물을 1 시간 동안 0 ℃에서 교반한 후 실온으로 가온하고 추가 4 시간 동안 교반하였다. 반응 혼합물을 감압하에 농축하였다. 잔사를 톨루엔 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하고 건조하여 황색 고체로서 표제 화합물을 수득하였다. 이 조질 물질을 추가 정제 또는 분석 없이 다음 단계에서 사용하였다.
단계 2:
2-(2-
클로로
-6-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
톨루엔(50 mL) 중 [1-(4-아지도피리딘-3-일)메트-(E)-일이덴]-(2-클로로-6-플루오로페닐)아민(17 mmol)의 용액을 105 ℃에서 18 시간 동안 가열하였다. 반응 혼합물을 냉각하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 60 내지 70% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(2.29 g, 54% 수율)을 수득하였다.
LCMS(방법 C): RT = 1.42, m/z: 248 [M+H+].
단계 3:
2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘 5-옥사이드
mCPBA(2.38 g, 13.88 mmol)를 DCM(55 mL) 중 2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘(2.27 g, 9.2 mmol)의 냉각된 용액(0 ℃)에 질소하에 첨가하였다. 반응물을 3 시간 동안 교반하고, 실온으로 가온하고, 추가 2 시간 동안 교반하였다. 티오황산 나트륨(포화 수용액)을 첨가하고 층을 나누었다. 유기층을 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 5 내지 10% 메탄올)로 정제하여 베이지색 고체로서 표제 화합물(2.13 g, 88% 수율)을 수득하였다.
단계 4:
4-클로로-2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘
2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘 5-옥사이드(2.13 g, 8.1 mmol)를 인 옥시클로라이드(16 mL) 중 테트라부틸염화 암모늄(2.24 g, 8.1 mmol)의 용액에 첨가하고 반응 혼합물을 85 ℃에서 5 시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각하고 에틸 아세테이트 및 탄산수소 나트륨(포화 수용액)의 혼합물에 부었다. 유기상을 분리하고, 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(606 mg, 27% 수율)을 수득하였다.
LCMS(방법 D): RT = 3.29 분, m/z: 282 [M+H+].
단계 5:
사이클로프로판카복실산
[2-(2-
클로로
-6-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]아미드
다이옥산(2 mL) 중 4-클로로-2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘(76 mg, 0.27 mmol), 사이클로프로필카복스아미드(26 mg, 0.31 mmol), Pd2(dba)3(7 mg, 0.007 mmol), 잔포스(16 mg, 0.027 mmol) 및 탄산 세슘(176 mg, 0.54 mmol)의 혼합물을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 150 ℃에서 20 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(38 mg, 43 % 수율)을 수득하였다.
LCMS(방법 B): RT = 2.77 분, m/z: 331 [M+H+].
방법 3:
실시예
16
6-[2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]이소니코티노니트릴
나트륨 하이드리드(12 mg, 0.30 mmol)를 DMF(2 mL) 중 2-아미노-4-시아노피리딘(36 mg, 0.30 mmol)의 용액에 마이크로파 바이알 중에 첨가하고 5 분 동안 교반하였다. 4-클로로-2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘(76 mg, 0.27 mmol)을 첨가한 후 바이알을 밀봉하고, 질소로 퍼징하고 150 ℃에서 10 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(10 mg, 10% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.98 분, m/z: 365 [M+H+].
방법 4:
실시예
17
단계 1:
4-브로모-2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘
0 ℃에서 DCE(18 mL) 중 2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘 5-옥사이드(740 mg, 2.8 mmol)의 현탁액에 인 옥시브로마이드(2.4 g, 8.4 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 15 분 동안 교반하고, 실온으로 가온하고, 추가 4.5 시간 동안 교반하였다. 생성된 혼합물을 DCM으로 희석하고, 탄산 나트륨(포화 수용액)으로 세척한 후 염수로 세척하였다. 유기상을 무수 황산 마그네슘 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 30% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(230 mg, 25% 수율)을 수득하였다. LCMS(방법 C): RT = 3.44 분, m/z: 327 [M+H+].
단계 2
[2-(2-
클로로
-6-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-
카밤산
t-부틸 에스터
톨루엔(5 mL) 및 물(1 mL) 중 4-브로모-2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘(166 mg, 0.51 mmol), t-부틸 카바메이트(297 mg, 2.54 mmol), Pd2(dba)3(23 mg, 0.025 mmol), 잔포스(29 mg,0.05 mmol) 및 인산 칼륨 3염기(216 mg, 1.02 mmol)의 혼합물을 아르곤으로 탈기한 후 60 ℃에서 1.5 시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각하고 에틸 아세테이트로 세척하면서 셀라이트(등록상표)를 통해 여과하였다. 여액을 물 및 염수로 세척하고, 황산 마그네슘 상에서 건조하고 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 35% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(137 mg, 74% 수율)을 수득하였다. LCMS(방법 C): RT = 2.30 분, m/z: 348 [M-C4H7 +].
단계 3
2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민
DCM(1 mL) 중 [2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-카밤산 t-부틸 에스터(137 mg)의 용액에 0 ℃에서 TFA(1 mL)를 첨가하였다. 반응 혼합물을 실온에서 1 시간 동안 교반한 후 감압하에 농축하였다. 생성된 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 무수 황산 마그네슘 상에서 건조하고, 여과하고 농축하여 무색 오일을 수득하였다. 다이에틸 에터로 마쇄하여 백색 고체로서 표제 화합물(100 mg, 91% 수율)을 수득하였다. LCMS(방법 C): RT = 0.34 분 및 1.79 분, m/z: 263 [M+H+].
단계 4
{6-[2-(2-
클로로
-6-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-
비스
-카밤산 t-부틸 에스터
다이옥산(2.5 mL) 중 2-(2-클로로-6-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민 (100 mg, 0.38 mmol), 6-클로로-피리미딘-4-일)-비스-카밤산 t-부틸 에스터 (153 mg, 0.46 mmol), Pd2(dba)3(8 mg, 0.009 mmol), 잔포스(22 mg, 0.04 mmol) 및 탄산 세슘(248 mg, 0.76 mmol)의 현탁액을 마이크로파 반응 바이알 중에 밀봉하고, 질소로 퍼징하고 150 ℃에서 30 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 40% 에틸 아세테이트)로 정제하여 연베이지색 고체로서 표제 화합물(65 mg, 31% 수율)을 수득하였다. LCMS(방법 C): RT = 2.93 분, m/z: 556 [M+H+].
단계 5
N
-[2-(2-
클로로
-6-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-피리미딘-4,6-다
이
아민.
HCl
HCl(IPA 중 1.25 N, 1.5 ml) 중 {6-[2-(2-클로로-6-플루오로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터(65 mg, 0.12 mmol)의 현탁액을 반응 바이알 중에 밀봉하고, 질소로 퍼징하고 50 ℃에서 18 시간 동안 교반하였다. 반응 혼합물을 냉각하고, IPA로 희석하고 생성된 고체를 여과하였다. 백색 고체를 IPA로 추가 세척하고 건조하여 회백색 고체로서 표제 화합물(35 mg, 84% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.71 분, m/z: 355 [M+H+].
방법 2:
실시예
18
[2-(2,6-
다이클로로
-4-
메탄설포닐페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-(2,6-다
이메틸피리
미딘-4-일)아민
단계 1:
[1-(4-아지도피리딘-3-일)메트-(E)-일이덴]-(2.6-다이클로로-4-메탄설포닐페닐)아민
트라이에틸아민(1.7 mL, 12.6 mmol)을 DCM(15 mL) 중 4-아지도피리딘-3-카브알데하이드(621 mg, 4.2 mmol) 및 2,6-다이클로로-4-(메틸설포닐)아닐린(1 g, 4.2 mmol)의 냉각된 혼합물(0 ℃)에 질소하에 첨가하였다. 이어서, 티타늄 테트라클로라이드(1 M, 2.5 mL, 2.5 mmol)를 첨가하고 생성된 혼합물을 1 시간 동안 교반하고 실온으로 가온하고, 추가 4 시간 동안 교반하였다. 반응 혼합물을 농축하여 감압하에 건조하였다. 잔사를 톨루엔 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하고 건조하여 황색 고체로서 표제 화합물을 수득하였다. 이 조질 물질을 추가 정제 또는 분석 없이 다음 단계에서 사용하였다.
단계 2:
2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘
톨루엔(15 mL) 중 [1-(4-아지도피리딘-3-일)메트-(E)-일이덴]-(2.6-다이클로로-4-메탄설포닐페닐)아민(4.21 mmol)의 혼합물을 105 ℃로 18 시간 동안 가열하였다. 반응 혼합물을 냉각한 후 감압하에 농축하였다. 잔사를 에틸 아세테이트로부터 재결정화하고 고체를 여과로 수집하여 베이지색 고체로서 표제 화합물(0.75 g, 52% 수율)을 수득하였다.
LCMS(방법 D): RT = 1.72 분, m/z: 342 [M+H+].
단계 3:
2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘-5-옥사이드
mCPBA(569 mg, 3.3 mmol)를 DCM(20 mL) 중 2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘(752 mg, 2.2 mmol)의 냉각된 용액(0 ℃)에 질소하에 첨가하였다. 반응물을 1 시간 동안 교반하고, 실온으로 가온하고, 추가 2 시간 동안 교반하였다. 추가 mCPBA(150 mg)를 첨가하고 반응 혼합물을 실온에서 4 시간 동안 교반한 후 티오황산 나트륨(수성)을 첨가하였다. 유기층을 분리하고, 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 5 내지 10% 메탄올)로 정제하여 백색 고체로서 표제 화합물(640 mg, 81% 수율)을 수득하였다.
LCMS(방법 D): RT = 2.13 분, m/z: 358 [M+H+].
단계 4:
4-클로로-2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘
2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘-5-옥사이드(640 mg, 1.79 mmol)를 인 옥시클로라이드(5 mL) 중 테트라부틸염화 암모늄(497 mg, 1.79 mmol)의 용액에 첨가하고 반응 혼합물을 85 ℃에서 4 시간 동안 가열하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 탄산수소 나트륨(포화 수용액) 사이에 나누었다. 유기상을 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 농축하여 감압하에 건조하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 40% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(238 mg, 35 % 수율)을 수득하였다.
LCMS(방법 D): RT = 3.19 분, m/z: 376 [M+H+].
단계 5:
[2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(2,6-다이메틸피리미딘-4-일)아민
다이옥산(2 mL) 중 4-클로로-2-(2,6-다이클로로-4-메탄설포닐페닐)-2H-피라졸로[4,3-c]피리딘(75 mg, 0.20 mmol), 4-아미노-2,6-다이메틸피리미딘(27 mg, 0.22 mmol), Pd2(dba)3(5 mg, 0.005 mmol), 잔포스(12 mg, 0.02 mmol) 및 탄산 세슘(130 mg, 0.40 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 150 ℃에서 30 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 1% 메탄올)로 정제하여 황색 고체로서 표제 화합물(55 mg, 59% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.80 분, m/z: 463 [M+H+].
방법 2:
실시예
19
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴
단계 1:
4-{[1-(4-아지도피리딘-3-일)메트-(E)-일이덴]아미노}-3,5-다이클로로벤조니트릴
트라이에틸아민(8.9 mL, 64.2 mmol)을 DCM(80 mL) 중 4-아지도피리딘-3-카브알데하이드(3.2 g, 21.4 mmol) 및 4-아미노-3,5-다이클로로벤조니트릴(4.0 g, 21.4 mmol)의 냉각된 혼합물(0 ℃)에 질소하에 첨가하였다. 티타늄 테트라클로라이드(1 M, 12.8 mL, 12.8 mmol)를 첨가한 후 반응 혼합물을 1 시간 동안 0 ℃에서 교반하였다. 실온으로 가온한 후, 반응물을 추가 2 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 톨루엔 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하고 건조하여 주황색 고체로서 표제 화합물을 수득하였다. 이 조질 물질을 추가 정제 또는 분석 없이 다음 단계에서 사용하였다.
단계 2:
3,5-다이클로로-4-피라졸로[4,3-c]피리딘-2-일벤조니트릴
톨루엔(80 mL) 중 4-{[1-(4-아지도피리딘-3-일)메트-(E)-일이덴]아미노}-3,5-다이클로로벤조니트릴(21.4 mmol)의 혼합물을 105 ℃로 1 시간 동안 가열하였다. 반응 혼합물을 냉각하고 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(4.10 g, 66% 수율)을 수득하였다.
LCMS(방법 D): RT = 1.66 분, m/z: 289 [M+H+].
단계 3:
3,5-다이클로로-4-(5-옥시피라졸로[4,3-c]피리딘-2-일)벤조니트릴
수성 과산화수소(30% 수성, 0.4 mL, 4.15 mmol)를 DCM(1.0 mL) 중 3,5-다이클로로-4-피라졸로[4,3-c]피리딘-2-일벤조니트릴(600 mg, 2.08 mmol) 및 메틸트라이옥소레늄(2.6 mg, 0.01 mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 2 시간 동안 교반한 후 감압하에 농축하고 건조하여 황색 고체로서 표제 화합물(633 mg, 정량적 수율)을 수득하였다.
LCMS(방법 D): RT = 2.26 분, m/z: 305 [M+H+].
단계 4:
3,5-다이클로로-4-(4-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴
3,5-다이클로로-4-(5-옥시피라졸로[4,3-c]피리딘-2-일)벤조니트릴(305 mg, 1.0 mmol) 및 인 옥시클로라이드(3.0 mL)의 용액을 85 ℃에서 1 시간 동안 가열하였다. 반응 혼합물을 냉각한 후 에틸 아세테이트와 탄산수소 나트륨(포화 수용액) 사이에 나누었다. 유기층을 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 30% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(137 mg, 42% 수율)을 수득하였다.
LCMS(방법 C): RT = 3.35, m/z: 323 [M+H+].
단계 5:
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴
다이옥산(2 mL) 중 3,5-다이클로로-4-(4-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴(65 mg, 0.20 mmol), 4-아미노-2,6-다이메틸피리미딘(27 mg, 0.22 mmol), Pd2(dba)3(5 mg, 0.005 mmol), 잔포스(12 mg, 0.02 mmol) 및 탄산 세슘(91 mg, 0.28 mmol)의 현탁액을 반응 바이알 중에 밀봉하고, 질소로 퍼징하고, 90 ℃에서 18 시간 동안 가열하였다. 반응 혼합물을 냉각하고, 여과하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 30 내지 100% 에틸 아세테이트)로 정제한 후, HPLC(구배: 0.1% 수산화 암모늄을 갖는 물 중 25 내지 98% 아세토니트릴)로 정제하여 백색 고체로서 표제 화합물(22 mg, 27% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.00 분, m/z: 410.15 [M+H+].
방법 2:
실시예
20
3,5-
다이클로로
-4-[4-(6-
하이드록시메틸
-피리미딘-4-
일아미노
)-
피라졸로[4,3-c]피리딘
-2-일]-
벤조니트릴
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, (6-아미노-피리미딘-4-일)-메탄올 및 3,5-다이클로로-4-(4-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴을 반응시켜 연황색 고체로서 표제 화합물(70 mg, 37% 수율)을 수득하였다.
LCMS(방법 D): RT = 2.05 분, m/z: 412 [M+H+].
방법 2:
실시예 21
3,5-다이클로로-4-[4-(6-플루오로메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴
DCM(5 mL) 중 3,5-다이클로로-4-[4-(6-하이드록시메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴(70 mg, 0.17 mmol)의 현탁액에 -25 ℃에서 DAST(34 μL, 0.25 mmol)를 첨가하였다. 반응 혼합물을 실온으로 1 시간에 걸쳐서 가온하였다. 반응 혼합물을 DCM과 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제한 후, HPLC(0.1% 수산화 암모늄을 갖는 물 중 5 내지 98% 아세토니트릴)로 정제하여 백색 고체로서 표제 화합물(10 mg, 14% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.96 분, m/z: 414 [M+H+].
방법 2:
실시예 22
4-[4-(6-아제티딘-1-일메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴
단계 1:
6-비닐피리미딘-4-일아민
다이옥산(11.5 mL) 및 물(11.5 mL) 중 4-아미노-6-클로로피리미딘(2.5 g, 19.2 mmol), 1,1'-비스(다이페닐포스피노)페로센 팔라듐 다이클로라이드(810 mg, 1.2 mmol), 탄산 나트륨(8.14 g, 76.8 mmol) 및 비닐 보란 피나콜 에스터(3.9 mL, 23 mmol)의 혼합물을 질소하에 100 ℃에서 20 시간 동안 가열한 후 상온으로 냉각하였다. 반응 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 10% 메탄올)로 정제하여 황색 고체로서 표제 화합물(1.87 g, 80% 수율)을 수득하였다.
단계 2:
(6-비닐피리미딘-4-일)비스-카밤산 t-부틸 에스터
나트륨 헥사메틸다이실라잔(THF 중 1 M, 24.7 mL, 24.7 mmol)을 THF(26 mL) 중 6-비닐피리미딘-4-일아민(1.87 g, 15.5 mmol)의 용액에 질소하에 10 분간에 걸쳐서 첨가하였다. THF(10 mL) 중 다이-t-부틸-다이카본에이트(5.05 g, 23.2 mmol)을 첨가하고 반응 혼합물을 상온에서 2.5 시간 동안 교반하였다. 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 농축하여 감압하에 건조하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 50% 에틸 아세테이트)로 정제하여 표제 화합물(1.57 g, 46% 수율)을 수득하였다.
단계 3:
(6-폼일피리미딘-4-일)비스-카밤산 t-부틸 에스터
오존을 DCM(40 mL) 및 메탄올(10 mL) 중 (6-비닐피리미딘-4-일)비스-카밤산 t-부틸 에스터(1.53 g, 4.8 mmol)의 용액을 통해 -78 ℃에서 1 시간 동안 발포한 후, 반응 혼합물을 공기 및 질소를 사용하여 퍼징하였다. 트라이페닐포스핀(1.25 g, 4.8 mmol)을 첨가하고 반응물을 실온에서 18 시간 동안 교반하였다. 혼합물을 감압하에 농축하고 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(965 mg, 58% 수율)을 수득하였다.
단계 4:
6-아제티딘-1-일메틸피리미딘-4-일아민
DCE(5 mL) 중 (6-폼일피리미딘-4-일)비스-카밤산 t-부틸 에스터(200 mg, 0.62 mmol) 및 아제티딘(33 mg, 0.68 mmol)의 용액을 실온에서 1.5 시간 동안 교반하였다. 나트륨 트라이아세톡시보로하이드리드(198 mg, 0.43 mmol)를 첨가하고 반응 혼합물을 실온에서 18 시간 동안 교반하였다. TFA(5 mL)를 첨가하고, 반응물을 추가 1 시간 동안 교반한 후, 혼합물을 감압하에 농축하였다. 잔사를 SCX-2 크로마토그래피(메탄올로 세척하고 메탄올 중 2 M 암모니아로 용리함)로 정제하여 황색 고체로서 표제 화합물(89 mg, 88% 수율)을 수득하였다.
단계 5:
4-[4-(6-
아제티딘
-1-
일메틸피리미딘
-4-
일아미노
)
피라졸로
[4,3-c]피리딘-2-일]-3,5-
다이클로로벤조니트릴
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, 3,5-다이클로로-4-(4-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴 및 6-아제티딘-1-일메틸피리미딘-4-일아민을 반응시켜 황색 고체로서 표제 화합물(14 mg, 17% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.29 분, m/z: 451 [M+H+].
방법 2:
실시예
23
3,5-다이클로로-4-[4-(4-플루오로메틸피리미딘-2-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴
단계 1:
(4-플루오로메틸피리미딘-2-일)카밤산 t-부틸 에스터
DCM(10 mL) 중 (4-하이드록시메틸피리미딘-2-일)카밤산 t-부틸 에스터(450 mg, 2.0 mmol)의 용액을 0 ℃에서 DAST(396 μL, 3.0 mmol)로 처리하고 10 분 동안 교반하였다. 반응 혼합물을 DCM과 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 크로마토그래피(사이클로헥산 중 50% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(144 mg, 32% 수율)을 수득하였다.
단계 2:
4-플루오로메틸피리미딘-2-일아민
DCM(2 mL) 중 (4-플루오로메틸피리미딘-2-일)카밤산 t-부틸 에스터(140 mg, 0.62 mmol) 및 TFA(2 mL)의 혼합물을 실온에서 1 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 SCX-2 크로마토그래피(메탄올로 세척하고 메탄올 중 2 M 암모니아로 용리함)로 정제하여 황색 고체로서 표제 화합물(78 mg, 정량적 수율)을 수득하였다.
단계 3:
3,5-
다이클로로
-4-[4-(4-
플루오로메틸피리미딘
-2-
일아미노
)
피라졸로
[4,3-c]피리딘-2-일]
벤조니트릴
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, 3,5-다이클로로-4-(4-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴 및 4-플루오로메틸피리미딘-2-일아민을 반응시켜 황색 고체로서 표제 화합물(6 mg, 5% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.04 분, m/z: 414 [M+H+].
방법 4:
실시예
24
4-[4-(6-아미노-2-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴
단계 1:
[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일]카밤산
t-부틸 에스터
톨루엔(100 mL) 및 물(20 mL) 중 3,5-다이클로로-4-(4-클로로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(3.23 g, 10 mmol), t-부틸 카바메이트(5.85 mg, 50 mmol), Pd2(dba)3(458 mg, 0.5 mmol), 잔포스(576 mg, 1.0 mmol) 및 인산 칼륨 3염기(4.24 g,20 mmol)의 혼합물을 아르곤으로 탈기한 후 90 ℃에서 30 분 동안 가열하였다. 반응물을 실온으로 냉각한 후 필터 패드를 세척하기 위해 에틸 아세테이트를 사용하여 셀라이트(등록상표)를 통해 여과하였다. 여액을 물 및 중탄산 나트륨(포화 수용액)으로 세척하고, 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 회백색 고체로서 표제 화합물(5.0 g, 잔류 t-부틸 카바메이트로 오염됨)을 수득하였다. LCMS(방법 D): RT = 2.44 분, m/z: 348 [M-C4H7 +].
단계 2:
4-(4-아미노피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴
[2-(2,6-다이클로로-4-시아노-페닐)-2H-피라졸로[4,3-c]피리딘-4-일]카밤산 t-부틸 에스터(5.0 g, 잔류 t-부틸 카바메이트로 오염됨) 및 HCl(다이옥산 중 4 N, 40 mL, 160 mmol)의 혼합물을 50 ℃에서 6 시간 동안 교반한 후 농축하여 감압하에 건조하였다. 생성된 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 분리하고, 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하고 건조하여 황색 고체로서 표제 화합물(1.17 g, 2 단계에 걸쳐서 39% 수율)을 수득하였다.
LCMS(방법 D): RT = 1.95 분, m/z: 304 [M+H+].
단계 3:
(6-
클로로
-2-
메틸피리미딘
-4-일)
비스
-카밤산 t-부틸 에스터
리튬 헥사메틸다이실라잔(THF 중 1 M, 1.85 mL, 1.85 mmol)을 THF(5 mL) 중 6-클로로-2-메틸피리미딘-4-일아민(106 mg, 0.74 mmol)의 냉각된 용액(0 ℃)에 첨가하였다. 혼합물을 15 분 동안 교반한 후 다이-t-부틸 다이카본에이트(354 mg, 1.62 mmol)를 첨가하였다. 반응물을 실온으로 가온하고 18 시간 동안 교반하였다. 혼합물을 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 0 내지 20% 에틸 아세테이트)로 정제하여 무색 오일로서 표제 화합물(정량적 수율)을 수득하였다.
단계 4:
{6-[2-(2,6-
다이클로로
-4-
시아노페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-2-
메틸피리미딘
-4-일}
비스
-카밤산 t-부틸 에스터
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, 4-(4-아미노피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴 및 (6-클로로-2-메틸피리미딘-4-일)비스-카밤산 t-부틸 에스터를 반응시켜 황색 고체로서 표제 화합물(47 mg, 23% 수율)을 수득하였다. LCMS(방법 D): RT = 3.12 분, m/z: 611 [M+H+].
단계 5:
4-[4-(6-아미노-2-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴
DCM(2 mL) 중 {6-[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일}비스-카밤산 t-부틸 에스터(47 mg, 0.08 mmol) 및 TFA(2 mL)의 혼합물을 실온에서 2 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 10% 메탄올)로 정제하여 황색 고체로서 표제 화합물(18 mg, 56% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.98 분, m/z: 411 [M+H+].
방법 4:
실시예
25
4-[4-(6-아미노피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로-벤조니트릴.HCl
단계 1:
{6-[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}비스-카밤산 t-부틸 에스터
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, 4-(4-아미노피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴 및 (6-클로로피리미딘-4-일)비스-카밤산 t-부틸 에스터를 반응시켜 황색 고체로서 표제 화합물(280 mg, 17% 수율)을 수득하였다. LCMS(방법 B): RT = 4.37 분, m/z: 597 [M+H+].
단계 2:
4-[4-(6-
아미노피리미딘
-4-
일아미노
)-
피라졸로[4,3-c]피리딘
-2-일]-3,5-
다이클로로
-
벤조니트릴
.
HCl
{6-[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}비스-카밤산 t-부틸 에스터(280 mg, 0.47 mmol) 및 HCl(다이옥산 중 4 N, 4.0 mL, 16 mmol)의 현탁액을 50 ℃에서 4 시간 동안 교반하였다. 반응 혼합물을 IPA로 희석하고 생성된 고체를 여과하였다. 연분홍색 고체를 IPA로 추가로 세척하고 건조하여 회백색 고체로서 표제 화합물(121 mg, 58% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.85 분, m/z: 397 [M+H+].
방법 2:
실시예
26
사이클로프로판카복실산
{6-[2-(2,6-
다이클로로
-4-
시아노페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-아미드
단계 1:
[6-(사이클로프로판카본일-아미노)-피리미딘-4-일]-
비스
-
카밤산
t-부틸 에스터
다이옥산(2 mL) 중 (6-클로로-피리미딘-4-일)-비스-카밤산 t-부틸 에스터(327 mg, 1.0 mmol), 사이클로프로판카복실산 아미드(127 mg, 1.5 mmol), Pd2(dba)3(27 mg, 0.03 mmol), 잔포스(36 mg, 0.06 mmol) 및 탄산 세슘(652 mg, 2.0 mmol)의 혼합물을 반응 바이알 중에 밀봉하고, 질소로 퍼징하고, 70 ℃에서 18 시간 동안 가열하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 분리하고 염수로 세척하고, Na2SO4 상에서 건조하고, 여과하고 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 0 내지 75% 다이에틸 에터)로 정제하여 무색 오일로서 표제 화합물(300 mg, 79% 수율)을 수득하였다. LCMS(방법 D): RT = 3.72 분, m/z: 379 [M+H+].
단계 2:
사이클로프로판카복실산
(6-
아미노피리미딘
-4-일)-아미드
DCM(3 mL) 중 [6-(사이클로프로판카본일-아미노)-피리미딘-4-일]-비스-카밤산 t-부틸 에스터(300 mg, 0.79 mmol)의 용액에 TFA(3 mL)를 첨가하였다. 반응 혼합물을 실온에서 2 시간 동안 교반한 후 감압하에 농축하였다. 생성된 잔사를 에틸 아세테이트과 탄산수소 나트륨(포화 수용액) 사이에 나누었다. 유기층을 분리하고 염수로 세척하고, Na2SO4 상에서 건조하고, 여과하고 농축하여 백색 고체로서 표제 화합물(123 mg, 87% 수율)을 수득하였다. LCMS(방법 D): RT = 1.02 분, m/z: 179 [M+H+].
단계 3:
사이클로프로판카복실산
{6-[2-(2,6-
다이클로로
-4-
시아노페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-아미드
다이옥산(2 mL) 중 3,5-다이클로로-4-(4-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴(132 mg, 0.41 mmol), 사이클로프로판카복실산(6-아미노-피리미딘-4-일)-아미드(80 mg, 0.45 mmol), Pd2(dba)3(19 mg, 0.02 mmol), 잔포스(24 mg, 0.04 mmol) 및 탄산 세슘(266 mg, 0.82 mmol)의 현탁액을 질소로 탈기한 후 마이크로파 바이알 중에 밀봉하였다. 혼합물을 150 ℃에서 30 분 동안 마이크로파로 조사한 후 실온으로 냉각하였다. 반응 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 유기층을 분리하고 염수로 세척하고, Na2SO4 상에서 건조하고, 여과하고 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제한 후, HPLC(구배: 0.1% 수산화 암모늄을 갖는 물 중 5 내지 98% 아세토니트릴)로 정제하여 회백색 고체로서 표제 화합물(49 mg, 26% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.17 분, m/z: 465 [M+H+].
방법 2:
실시예
27
[2-(2,6-
다이클로로
-4-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
메틸피리미딘
-4-일)아민
단계 1:
[1-(4-아지도피리딘-3-일)메트-(E)-일이덴]-(2,6-다이클로로-4-플루오로페닐)아민
티타늄 테트라클로라이드(1 M, 4.0 mL, 4.15 mmol)를 DCM(24 mL) 중 4-아지도피리딘-3-카브알데하이드(1.0 g, 6.75 mmol), 2,6-다이클로로-4-플루오로페닐아민(1.22 g, 6.75 mmol) 및 트라이에틸아민(2.8 mL, 20.3 mmol)의 냉각된 혼합물(0 ℃)에 질소하에 첨가하였다. 반응물을 30 분 동안 0 ℃에서 교반하고, 실온으로 가온하고, 추가 2 시간 동안 교반하고, 감압하에 농축하였다. 잔사를 톨루엔 중에 용해하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하고 건조하여 황색 고체로서 표제 화합물(2.09 g, 정량적)을 수득하였다. 이 조질 물질을 추가 정제 또는 분석 없이 다음 단계에서 사용하였다.
단계 2:
2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘
톨루엔(20 mL) 중 [1-(4-아지도피리딘-3-일)메트-(E)-일이덴]-(2,6-다이클로로-4-플루오로페닐)아민(2.09 g, 6.75 mmol)의 혼합물을 105 ℃로 45 분 동안 가열하였다. 반응물을 냉각하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 100% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(1.60 g, 84% 수율)을 수득하였다.
단계 3:
2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-5-옥사이드
DCM(30 mL) 중 2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘(1.6 g, 5.67 mmol)의 냉각된 용액(0 ℃)에 질소하에 mCPBA(1.47 g, 8.51 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 2 시간 동안 교반하고, 실온으로 가온하고, 추가 16 시간 동안 교반하였다. 티오황산 나트륨(포화 수용액)을 첨가하고 유기층을 분리하고, 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 농축하여 감압하에 건조하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 5 내지 10% 메탄올)로 정제하여 백색 고체로서 표제 화합물(1.4 g, 83% 수율)을 수득하였다.
단계 4:
4-
클로로
-2-(2,6-
다이클로로
-4-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-5-옥사이드(1.4 g, 4.7 mmol)를 인 옥시클로라이드(10 mL)에 천천히 첨가하였다. 이어서, 테트라부틸염화 암모늄(1.31 g, 4.7 mmol)을 첨가하고 반응 혼합물을 85 ℃에서 45 분 동안 가열하였다. 혼합물을 냉각하고 감압하에 농축하였다. 잔사를 에틸 아세테이트와 탄산수소 나트륨 사이에 나누었다. 유기층을 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 10 내지 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(706 mg, 47% 수율)을 수득하였다.
단계 5:
[2-(2,6-
다이클로로
-4-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
메틸피리미딘
-4-일)아민
다이옥산(3 ml) 중 4-클로로-2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘(70 mg, 0.22 mmol), 6-메틸피리미딘-4-일아민(26 mg, 0.24 mmol), Pd2(dba)3(10 mg, 0.011 mmol), 잔포스(12.8 mg, 0.022 mmol) 및 탄산 세슘(144 mg, 0.44 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고 150 ℃에서 25 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 100% 에틸 아세테이트)로 정제한 후, 다이에틸 에터:펜탄(1:1)으로 추가로 마쇄하여 황색 고체로서 표제 화합물(53 mg, 62% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.94 분, m/z: 389 [M+H+].
방법 2:
실시예
28
{6-[2-(2,6-
다이클로로
-4-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-(4-메
틸피리
딘-2-일)}메탄올
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, (6-아미노-피리미딘-4-일)-메탄올 및 4-클로로-2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘을 반응시켜 연황색 고체로서 표제 화합물(35 mg, 39% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.80 분, m/z: 405 [M+H+].
방법 2:
실시예
29
[2-(2,6-
다이클로로
-4-
플루오로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
플루오로메틸피리미딘
-4-일)아민
DAST(9 μL, 0.066 mmol)를 DCM(5 mL) 중 {6-[2-(2,6-다이클로로-4-플루오로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(4-메틸피리딘-2-일)}메탄올(18 mg, 0.044 mmol)의 용액에 첨가하고 실온에서 30 분 동안 교반하였다. 반응 혼합물을 DCM과 탄산수소 나트륨(포화 수용액) 사이에 나누었다. 유기층을 물 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 농축하여 감압하에 건조하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 20 내지 60% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(7.5 mg, 22% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.05 분, m/z: 407 [M+H+].
방법 2:
실시예
30
3,5-다이클로로-4-[7-클로로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴
단계 1:
4,5-다이클로로피리딘-3-카브알데하이드
THF(60 mL) 중 다이이소프로필아민(9.7 mL, 69.1 mmol)의 용액에 -30 ℃에서 n-부틸리튬(헥산 중 2.5 M, 27.6 mL, 69.1 mmol)을 첨가하였다. 반응 혼합물을 15 분 동안 교반한 후 -78 ℃로 냉각하였다. THF(20 mL) 중 3,4-다이클로로피리딘(8.53 g, 57.6 mmol)의 용액을 20 분간에 걸쳐서 적가한 후 혼합물을 -78 ℃에서 2.5 시간 동안 교반하였다. DMF(5.4 mL, 69.1 mmol)를 첨가하고 반응물을 실온으로 가온하였다. 반응 혼합물을 염화 암모늄(포화 수용액, 300 mL)으로 급랭하고 에틸 아세테이트(3 x 100 mL)로 추출하였다. 합한 유기 추출물을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 0 내지 30% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(6.78 g, 67% 수율)을 수득하였다.
단계 2:
4-
아지도
-5-
클로로피리딘
-3-
카브알데하이드
DMF(25 mL) 중 4,5-다이클로로피리딘-3-카브알데하이드(6.78 g, 38.5 mmol) 및 나트륨 아지드(2.62 g, 40.4 mmol)의 혼합물을 실온에서 18 시간 동안 교반하였다. 반응 혼합물을 염수(250 mL)로 급랭하고 에틸 아세테이트(3 x 100 mL)로 추출하였다. 합한 유기 추출물을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 0 내지 40% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(6.7 g, 96% 수율)을 수득하였다.
단계 3:
4-{[1-(4-
아지도
-5-
클로로피리딘
-3-일)
메트
-(E)-
일이덴
]아미노}-3,5-
다이클로로벤조니트릴
DCM(48 mL) 중 4-아지도-5-클로로피리딘-3-카보알데하이드(2.0 g, 10.95 mmol), 4-아미노-3,5-다이클로로벤조니트릴(2.05 g, 10.95 mmol) 및 트라이에틸아민(4.6 mL, 6.57 mmol)의 냉각된 용액(0 ℃)에 티타늄 테트라클로라이드(DCM 중 1 M, 6.6 mL, 6.57 mmol)를 10 분간에 걸쳐서 적가하였다. 반응 혼합물을 20 분 동안 교반하고, 실온으로 가온하고, 추가 30 분 동안 교반하였다. 생성된 혼합물을 감압하에 농축하고 건조하여 표제 화합물을 수득하고 이를 추가 정제 없이 사용하였다.
단계 4:
3,5-다이클로로-4-(7-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴
톨루엔(45 mL) 중 4-{[1-(4-아지도-5-클로로피리딘-3-일)메트-(E)-일이덴]아미노}-3,5-다이클로로벤조니트릴(3.8 g, 10.95 mmol)의 현탁액을 18 시간 동안 환류 가열한 후 실온으로 냉각하였다. 침전된 고체를 여과로 제거하고 순차적으로 톨루엔, 에틸 아세테이트 및 DCM으로 세척하였다. 여액을 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제한 후 다이에틸 에터로 마쇄하여 회백색 고체로서 표제 화합물(2.5 g, 71% 수율)을 수득하였다.
단계 5:
3,5-다이클로로-4-(7-클로로-5-옥시피라졸로[4,3-c]피리딘-2-일)벤조니트릴
DCM(5 mL) 중 3,5-다이클로로-4-(7-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴(2.5 g, 7.73 mmol) 및 메틸트라이옥소레늄(9.6 mg, 0.04 mmol)의 용액에 과산화수소(30% 수성, 1.5 mL, 15.46 mmol)를 첨가하고 반응 혼합물을 실온에서 66 시간 동안 교반하였다. 추가 메틸트라이옥소레늄(10 mg, 0.04 mmol)을 첨가하고 혼합물을 2 시간 동안 교반하였다. 촉매 망간 다이옥사이드를 첨가한 후 혼합물을 1 시간 동안 교반하고 감압하에 농축하였다. 잔사를 톨루엔으로 마쇄하고 감압하에 농축하고 건조하여 베이지색 고체로서 추가 정제 없이 다음 단계에서 사용된 표제 화합물(2.52 g, 96% 수율)을 수득하였다.
단계 6:
3,5-
다이클로로
-4-(4,7-
다이클로로피라졸로[4,3-c]피리딘
-2-일)
벤조니트릴
DCE(60 mL) 중 3,5-다이클로로-4-(7-클로로-5-옥시피라졸로[4,3-c]피리딘-2-일)벤조니트릴(2.52 g, 7.4 mmol)의 현탁액에 인 옥시클로라이드(3.4 mL, 37.1 mmol)를 20 분간에 걸쳐서 적가하였다. 반응 혼합물을 70 ℃에서 3 시간 동안 가열하고, 실온으로 냉각하고, 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 0 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(1.17 g, 44% 수율)을 수득하였다.
단계 7:
3,5-다이클로로-4-[7-클로로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴
다이옥산(3 mL) 중 3,5-다이클로로-4-(4,7-다이클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴(70 mg, 0.20 mmol), 6-메틸피리미딘-4-일아민(23 mg, 0.22 mmol), Pd2(dba)3(9 mg, 0.01 mmol), 잔포스(12 mg, 0.02 mmol) 및 탄산 세슘(130 mg, 0.40 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고 150 ℃에서 30 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 0 내지 80% 에틸 아세테이트)로 정제한 후, 에틸 아세테이트로 추가 마쇄하여 황색 고체로서 표제 화합물(37 mg, 43% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.69 분, m/z: 430 [M+H+].
방법 2:
실시예 31
{6-[7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올
단계 1:
[1-(4-
아지도
-5-
클로로피리딘
-3-일)-
메트
-(
E
)-
일이덴
]-(2,6-
다이클로로페닐
)-아민
4-{[1-(4-아지도-5-클로로피리딘-3-일)메트-(E)-일이덴]아미노}-3,5-다이클로로벤조니트릴에 대하여 기재된 과정에 따라, 4-아지도-5-클로로피리딘-3-카브알데하이드 및 2,6-다이클로로아닐린을 반응시켜 베이지색 고체로서 표제 화합물을 수득하고 이를 추가 정제 없이 사용하였다.
단계 2:
7-
클로로
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
3,5-다이클로로-4-(7-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴에 대하여 기재된 과정에 따라, [1-(4-아지도-5-클로로피리딘-3-일)-메트-(E)-일이덴]-(2,6-다이클로로페닐)-아민을 톨루엔 중에 환류 가열하여 갈색 고체로서 표제 화합물(2.7 g, 66% 수율)을 수득하였다. LCMS(방법 D): RT = 2.96 분, m/z: 298 [M+H+].
단계 3:
7-
클로로
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-5-
옥사이드
DCM(6 mL) 중 7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(2.7 g, 9.0 mmol) 및 메틸트라이옥소레늄(31 mg, 0.09 mmol)의 용액에 과산화수소(30% 수성, 1.75 mL, 18.0 mmol)를 첨가하고 생성된 혼합물을 실온에서 18 시간 동안 교반하였다. 촉매량의 MnO2를 혼합물에 첨가하고 1 시간 동안 계속하여 교반하였다. 반응 혼합물을 감압하에 농축하였다. 잔사를 톨루엔으로 마쇄하여 베이지색 고체로서 표제 화합물(2.5 g, 89% 수율)을 수득하였다. LCMS(방법 D): RT = 2.57 분, m/z: 314 [M+H+].
단계 4:
4 -브로모-7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘
DCE(50 mL) 중 7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-5-옥사이드(2.5 g, 8.0 mmol)의 냉각된 현탁액(0 ℃)에 인 옥시브로마이드(6.8 g, 24.0 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 30 분 동안 교반하고, 실온으로 가온하고, 추가 18 시간 동안 교반하였다. 반응 혼합물을 DCM과 탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(850 mg, 28% 수율)을 수득하였다. LCMS(방법 D): RT = 3.92 분, m/z: 377 [M+H+].
단계 5:
{6-[7-
클로로
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-메탄올
다이옥산(3 mL) 중 4-브로모-7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(200 mg, 0.53 mmol), (6-아미노-피리미딘-4-일)-메탄올(73 mg, 0.58 mmol), Pd2(dba)3(24 mg, 0.025 mmol), 잔포스(31 mg, 0.05 mmol) 및 탄산 세슘(347 mg, 1.1 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 마이크로파 반응기로 150 ℃에서 30 분 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 NH2 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 2% 메탄올)로 정제하여 연황색 고체로서 표제 화합물(57 mg, 34% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.19 분, m/z: 421 [M+H+].
방법 4:
실시예 32
N
-[7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민
단계 1:
[7-
클로로
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-카밤산 t-부틸 에스터
톨루엔(10 mL) 및 물(2.0 mL) 중 4-브로모-7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(400 mg, 1.06 mmol), t-부틸 카바메이트(619 mg, 5.3 mmol), Pd2(dba)3(48 mg, 0.05 mmol), 잔포스(61 mg, 0.1 mmol) 및 인산 칼륨 3염기(449 mg, 2.1 mmol)의 혼합물을 아르곤으로 퍼징하고 70 ℃에서 3 시간 동안 가열하였다. 반응 혼합물을 셀라이트(등록상표)를 통해 여과하고 에틸 아세테이트로 세척하였다. 여액을 물 및 염수로 세척하고, 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(531 mg, 잔류 t-부틸 카바메이트로 오염됨)을 수득하였다. LCMS(방법 D): RT = 3.76 분, m/z: 413 [M+H+].
단계 2:
7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민
DCM(10 mL) 중 [7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-카밤산 t-부틸 에스터(531 mg, 잔류 t-부틸 카바메이트로 오염됨) 및 TFA(10 mL)의 용액을 실온에서 2 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하고 건조하여 베이지색 고체로서 표제 화합물(100 g, 2 단계에 걸쳐서 30% 수율)을 수득하였다. LCMS(방법 D): RT = 2.15 분, m/z: 313 [M+H+].
단계 3:
N
-[7-
클로로
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-피리미딘-4,6-
다이아민
다이옥산(1 mL) 중 7-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민(100 mg, 0.32 mmol), (6-클로로피리미딘-4-일)비스-카밤산 t-부틸 에스터(115 mg, 0.35 mmol), Pd2(dba)3(15 mg, 0.016 mmol), 잔포스(18 mg, 0.032 mmol) 및 탄산 세슘(209 mg, 0.64 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 마이크로파 반응기로 150 ℃에서 30 분 동안 조사하였다. 반응 혼합물을 냉각하고, DCM 및 MeOH로 희석하고, MeOH로 세척된 SCX-2 카트리지 상에 로딩하였다. 생성물을 암모니아의 2 M 메탄올 용액으로 용리하였다. 용매를 감압하에 제거하고 생성된 잔사를 이소프로필 알코올 중 HCl의 1.25 M 용액 중에 취하였다. 반응 혼합물을 50℃에서 3 시간 동안 교반한 후 농축하였다. 생성된 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기상을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 NH2 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(30 mg, 23% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.23 분, m/z: 406 [M+H+].
방법 2:
실시예
33
3,5-다이클로로-4-[7-플루오로-4-(6-메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴
단계 1:
4-클로로-5-플루오로-피리딘-3-카브알데하이드
THF(50 mL) 중 다이이소프로필아민(6.4 mL, 45.6 mmol)의 용액에 -30 ℃에서 n-부틸리튬(헥산 중 2.5 M, 18.2 mL, 45.6 mmol)을 15 분간에 걸쳐서 첨가하고 생성된 혼합물을 15 분 동안 교반한 후 -78 ℃로 냉각하였다. THF(10 mL)중 4-클로로-3-플루오로-피리딘(5.0 g, 38.0 mmol)의 용액을 15 분간에 걸쳐서 적가한 후 생성된 혼합물을 -78 ℃에서 18 시간 동안 교반하였다. DMF(3.5 mL, 45.6 mmol)를 첨가하고 반응물을 실온으로 가온하였다. 혼합물을 염화 암모늄(포화 수용액, 300 mL)으로 급랭하고 에틸 아세테이트(3 x 100 mL)로 추출하였다. 합한 유기 추출물을 무수 황산 나트륨 상에서 건조하고 농축하여 감압하에 건조하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 40% 에틸 아세테이트)로 정제하여 연주황색 고체로서 표제 화합물(5.1 g, 84% 수율)을 수득하였다.
단계 2:
4-아지도-5-플루오로-피리딘-3-카브알데하이드
DMF(15 mL) 중 4-클로로-5-플루오로-피리딘-3-카브알데하이드(4.15 g, 26.0 mmol) 및 나트륨 아지드(1.86 g, 28.6 mmol)의 혼합물을 실온에서 18 시간 동안 교반하였다. 반응 혼합물을 염수(200 mL)로 급랭하고 에틸 아세테이트(3 x 75 mL)로 추출하였다. 합한 유기 추출물을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 회백색 고체로서 표제 화합물(3.61 g, 84% 수율)을 수득하였다.
단계 3:
4-{[1-(4-아지도-5-플루오로-피리딘-3-일)-메트-(E)-일이덴]-아미노}-3,5-다이클로로-벤조니트릴
DCM(48 mL) 중 4-아지도-5-플루오로-피리딘-3-카보알데하이드(2.0 g, 12.0 mmol), 4-아미노-3,5-다이클로로벤조니트릴(2.25 g, 12.0 mmol) 및 트라이에틸아민(5.0 mL, 36.1 mmol)의 냉각된 용액(0 ℃)에 티타늄 테트라클로라이드(DCM 중 1 M, 7.2 mL, 7.2 mmol)를 20 분간에 걸쳐서 적가하였다. 반응 혼합물을 20 분 동안 교반하고, 실온으로 가온하고, 추가 30 분 동안 교반하였다. 생성된 혼합물을 감압하에 농축하고 건조하여 표제 화합물을 수득하고, 이를 추가 정제 없이 사용하였다.
단계 4:
3,5-다이클로로-4-(7-플루오로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
톨루엔(50 mL) 중 4-{[1-(4-아지도-5-플루오로-피리딘-3-일)-메트-(E)-일이덴]-아미노}-3,5-다이클로로벤조니트릴(4.0 g, 12.0 mmol)의 현탁액을 1 시간 동안 환류 가열한 후 실온으로 냉각하였다. 침전된 고체를 여과로 제거하고 순차적으로 톨루엔, 에틸 아세테이트, 및 에틸 아세테이트:DCM(1:1)으로 세척하였다. 여액을 감압하에 농축하고 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 회백색 고체로서 표제 화합물(2.77 g, 75% 수율)을 수득하였다.
단계 5:
3,5-다이클로로-4-(7-플루오로-5-옥시-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
DCM(5 mL) 중 3,5-다이클로로-4-(7-플루오로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(1.0 g, 3.26 mmol) 및 메틸트라이옥소레늄(24 mg, 0.10 mmol)의 용액에 과산화수소(30% 수성, 0.6 mL, 6.51 mmol)를 첨가하고 생성된 혼합물 실온에서 3 시간 동안 교반하였다. 반응 혼합물을 DCM으로 희석하고 중탄산 나트륨(포화 수용액)으로 세척하였다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 80 내지 100% 에틸 아세테이트, 이어서 DCM 중 0 내지 10% 메탄올)로 정제하여 백색 고체로서 표제 화합물(889 mg, 84% 수율)을 수득하였다.
단계 6:
3,5-다이클로로-4-(4-클로로-7-플루오로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
DCE(25 mL) 중 3,5-다이클로로-4-(7-플루오로-5-옥시-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(889 mg, 2.7 mmol)의 현탁액에 인 옥시클로라이드(1.25 mL, 13.7 mmol)를 90 분간에 걸쳐서 적가하였다. 반응 혼합물을 70 ℃에서 3 시간 동안 가열하고, 실온으로 냉각하고, 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기상을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(456 mg, 49% 수율)을 수득하였다.
단계 7:
3,5-다이클로로-4-[7-플루오로-4-(6-메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴
3,5-다이클로로-4-[7-클로로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, 3,5-다이클로로-4-(4-클로로-7-플루오로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴 및 6-메틸피리미딘-4-일아민을 반응시켜 백색 고체로서 표제 화합물(35 mg, 41% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.39 분, m/z: 416 [M+H+].
방법 4:
실시예
34
4-[4-(6-아미노-피리미딘-4-일아미노)-7-플루오로-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴.HCl
단계 1:
3,5-다이클로로-4-(4-브로모-7-플루오로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
DCE(20 mL) 중 3,5-다이클로로-4-(7-플루오로-5-옥시-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(1.0 mg, 3.1 mmol)의 현탁액에 0 ℃에서 인 옥시브로마이드(2.4 g, 9.2 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 30 분 동안 교반하고, 실온으로 가온하고, 추가 3 시간 동안 교반하였다. 반응 혼합물을 DCM으로 희석하고 중탄산 나트륨(포화 수용액)으로 세척하였다. 유기상을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(370 mg, 31% 수율)을 수득하였다. LCMS(방법 D): RT = 3.66 분, m/z: 387 [M+H+].
단계 2:
2-(2,6-다이클로로-4-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-카밤산 t-부틸 에스터
톨루엔(10 mL) 및 물(2.0 mL) 중 3,5-다이클로로-4-(4-브로모-7-플루오로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(370 mg, 0.96 mmol), t-부틸 카바메이트(559 mg, 4.8 mmol), Pd2(dba)3(44 mg, 0.05 mmol), 잔포스(55 mg, 0.1 mmol) 및 인산 칼륨 3염기(405 mg, 1.9 mmol)의 혼합물을 아르곤으로 퍼징하고 60 ℃에서 1.5 시간 동안 가열하였다. 반응 혼합물을 셀라이트(등록상표)를 통해 여과하고 에틸 아세테이트로 세척하였다. 여액을 물 및 염수로 세척하고, 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(568 mg, 잔류 t-부틸 카바메이트로 오염됨)을 수득하였다. LCMS(방법 D): RT = 3.51 분, m/z: 366 [M-C4H8 +].
단계 3:
4-(4-아미노-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴
2-(2,6-다이클로로-4-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-카밤산 t-부틸 에스터(568 mg, 잔류 t-부틸 카바메이트로 오염됨) 및 HCl(다이옥산 중 4 N, 5.0 mL, 20 mmol)의 혼합물을 실온에서 18 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하고 건조하여 베이지색 고체로서 표제 화합물(272 g, 2 단계에 걸쳐서 88% 수율)을 수득하였다. LCMS(방법 D): RT = 2.04 분, m/z: 322 [M+H+].
단계 4:
{6-[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-7-플루오로피리미딘-4-일}비스-카밤산 t-부틸 에스터
3,5-다이클로로-4-[4-(2,6-다이메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, 4-(4-아미노-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴 및 (6-클로로피리미딘-4-일)비스-카밤산 t-부틸 에스터를 반응시켜 회백색 고체로서 표제 화합물(166 mg, 32% 수율)을 수득하였다. LCMS(방법 D): RT = 4.14 분, m/z: 615 [M+H+].
단계 5:
4-[4-(6-아미노-피리미딘-4-
일아미노
)-7-
플루오로
-
피라졸로[4,3-c]피리딘
-2-일]-3,5-
다이클로로벤조니트릴
{6-[2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-7-플루오로피리미딘-4-일}비스-카밤산 t-부틸 에스터(166 mg, 0.27 mmol) 및 HCl(다이옥산 중 4 N, 5.0 mL, 20 mmol)의 현탁액을 실온에서 18 시간 동안 교반하였다. 반응 혼합물을 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기상을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(29 mg, 26% 수율)을 수득하였다.
LCMS(방법 D): RT = 2.35 분, m/z: 415 [M+H+].
단계 6:
4-[4-(6-아미노피리미딘-4-일아미노)-7-플루오로-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴 하이드로클로라이드 염
4-[4-(6-아미노피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴(77 mg, 0.19 mmol) 및 HCl(다이옥산 중 4 N, 5.0 mL, 20 mmol)의 혼합물을 실온에서 2 시간 동안 교반하였다. 반응 혼합물을 감압하에 농축하고 잔사를 건조하여 회백색 고체로서 표제 화합물(81 mg, 96% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.16 분, m/z: 415 [M+H+].
방법 2:
실시예
35
[2-(2,6-
다이클로로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
메틸
-피리미딘-4-일)-아민
단계 1:
1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-(2,6-다이클로로페닐)-아민
DCM(100 mL) 중 4-아지도-5-플루오로피리딘-3-카보알데하이드(4.98 g, 30.0 mmol), 2,6-다이클로로아닐린(4.86 g, 30.0 mmol) 및 트라이에틸아민(12.5 mL, 90.0 mmol)의 냉각된 용액(0 ℃)에 질소하에 티타늄 테트라클로라이드(DCM 중 1 M, 18 mL, 18.0 mmol)를 20 분간에 걸쳐서 적가하였다. 반응 혼합물을 2 시간 동안 교반하고, 실온으로 가온하고, 추가 4 시간 동안 교반하였다. 생성된 혼합물을 감압하에 농축하였다. 잔사를 톨루엔 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하고 건조하여 황색 고체로서 표제 화합물을 수득하였다. 이 조질 물질을 추가 정제 또는 분석 없이 다음 단계에서 사용하였다.
단계 2:
2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
톨루엔(100 mL) 중 1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-(2,6-다이클로로-페닐)-아민(30.0 mmol)의 혼합물을 105 ℃로 18 시간 동안 가열하였다. 반응 혼합물을 냉각하고 감압하에 농축하였다. 생성된 잔사를 다이에틸에터로 마쇄하여 베이지색 고체로서 표제 화합물(5.44 g, 64% 수율)을 수득하였다. LCMS(방법 D): RT = 2.81 분, m/z: 282 [M)+H+].
단계 3:
2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘 5-옥사이드
DCM(100 mL) 중 2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(5.4 g, 19.1 mmol)의 냉각된 용액(0 ℃)에 mCPBA(5.2 g, 30.0 mmol)를 첨가하였다. 반응 혼합물을 1.5 시간 동안 교반하고, 실온으로 가온하고, 추가 16 시간 동안 교반하였다. 티오황산 나트륨(포화 수용액)을 첨가하고 층을 나누었다. 유기층을 탄산수소 나트륨(포화 수용액) 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 에터로 마쇄하여 베이지색 고체로서 표제 화합물(5.04 g, 89% 수율)을 수득하였다. LCMS(방법 C): RT = 2.45 분, m/z: 298 [M+H+].
단계 4:
4-
브로모
-2-(2,6-
다이클로로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
DCE(55 mL) 중 2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘 5-옥사이드(2.5 g, 8.4 mmol)의 냉각된 용액(0 ℃)에 질소하에 인 옥시브로마이드(7.2 g, 25.2 mmol)를 첨가하였다. 반응 혼합물을 30 분 동안 교반하고, 실온으로 가온하고, 추가 4 시간 동안 교반하였다. 반응물을 탄산 나트륨(포화 수용액)으로 급랭하고 층을 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(927 mg, 31% 수율)을 수득하였다. LCMS(방법 D): RT = 3.74 분, m/z: 360 [M+H+].
단계 5:
[2-(2,6-
다이클로로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
메틸
-피리미딘-4-일)-아민
다이옥산(10 mL) 중 4-브로모-2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3c]피리딘(271 mg, 0.75 mmol), 4-아미노-6-메틸피리미딘(90 mg, 0.083 mmol), Pd2(dba)3(17 mg, 0.019 mmol), 잔포스(43 mg, 0.075 mmol) 및 탄산 세슘(489 mg, 1.5 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고 150 ℃에서 1 시간 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 60% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(227 mg, 78% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.28 분, m/z: 389 [M+H+].
방법 2:
실시예
36
4-[7-
브로모
-4-(6-
메틸
-피리미딘-4-
일아미노
)-
피라졸로[4,3-c]피리딘
-2-일]-3,5-다
이클로로벤조니
트릴
단계 1:
5-브로모-4-클로로-피리딘-3-카브알데하이드
4,5-다이클로로피리딘-3-카보알데하이드에 대하여 기재된 과정에 따라, 3-브로모-4-클로로피리딘 및 DMF를 반응시켜 백색 고체로서 표제 화합물(3.74 g, 73% 수율)을 수득하였다.
단계 2:
4-아지도-5-브로모-피리딘-3-카브알데하이드
4-아지도-5-클로로-피리딘-3-카보알데하이드에 대하여 기재된 과정에 따라, 5-브로모-4-클로로피리딘-3-카브알데하이드 및 나트륨 아지드를 반응시켜 연황색 고체로서 표제 화합물(3.18 g, 83% 수율)을 수득하였다.
단계 3:
4-{[1-(4-아지도-5-브로모-피리딘-3-일)-메트-(E)-일이덴]-아미노}-3,5-다이클로로벤조니트릴
4-{[1-(4-아지도-5-클로로피리딘-3-일)메트-(E)-일이덴]아미노}-3,5-다이클로로벤조니트릴에 대하여 기재된 과정에 따라, 4-아지도-5-브로모-피리딘-3-카브알데하이드 및 4-아미노-3,5-다이클로로벤조니트릴을 반응시켜 추가 정제 없이 사용된 베이지색 고체로서 표제 화합물(정량적 수율)을 수득하였다.
단계 4:
4-(7-브로모-피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴
3,5-다이클로로-4-(7-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴에 대하여 기재된 과정에 따라, 4-{[1-(4-아지도-5-브로모-피리딘-3-일)-메트-(E)-일이덴]-아미노}-3,5-다이클로로벤조니트릴을 톨루엔 중에 환류 가열하여 베이지색 고체로서 표제 화합물(3.57 g, 70% 수율)을 수득하였다.
단계 5:
4-(7-브로모-5-옥시-피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴
DCM(2.8 mL) 중 4-(7-브로모-피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴(1.5 g, 4.1 mmol) 및 메틸트라이옥소레늄(5.1 mg, 0.02 mmol)의 용액에 과산화수소(30% 수성, 0.8 mL, 8.2 mmol)를 첨가하고 생성된 혼합물 실온에서 18 시간 동안 교반하였다. 추가 메틸트라이옥소레늄(10 mg, 0.04 mmol)을 첨가하고, 혼합물을 24 시간 동안 교반한 후 촉매 망간 다이옥사이드를 첨가하였다. 추가 1 시간 동안 교반한 후 혼합물을 DCM과 염수 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 농축하여 감압하에 건조하였다. 잔사를 실리카 겔 크로마토그래피(DCM 중 0 내지 10% 메탄올)로 정제하여 황색 고체로서 표제 화합물(295 mg, 19% 수율)을 수득하였다.
단계 6:
4-(7-브로모-4-클로로-피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴
3,5-다이클로로-4-(4,7-다이클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴에 대하여 기재된 과정에 따라, 4-(7-브로모-5-옥시-피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴 및 인 옥시클로라이드를 반응시켜 백색 고체로서 표제 화합물(101 mg, 33% 수율)을 수득하였다.
단계 7:
3,5-다이클로로-4-(4,7-다이브로모-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
프로피오니트릴(5 mL) 중 3,5-다이클로로-4-(4-클로로-7-플루오로-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(99 mg, 0.25 mmol) 및 트라이메틸실릴 브로마이드(161 μL, 1.22 mmol)의 혼합물을 22 시간 동안 환류 가열한 후 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 생성된 고체를 실리카 겔 크로마토그래피(사이클로헥산 중 0 내지 40% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(83 mg, 75% 수율)을 수득하였다.
단계 8:
4-[7-브로모-4-(6-메틸-피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴
다이옥산(3 mL) 중 3,5-다이클로로-4-(4,7-다이브로모-피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(70 mg, 0.16 mmol), 6-메틸피리미딘-4-일아민(18 mg, 0.17 mmol), Pd2(dba)3(7 mg, 0.008 mmol), 잔포스(9 mg, 0.016 mmol) 및 탄산 세슘(104 mg, 0.31 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 90 ℃에서 3.5 시간 동안 가열하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제한 후, 추가로 다이에틸 에터로 마쇄한 후 에틸 아세테이트로 마쇄하여 백색 고체로서 표제 화합물(42 mg, 57% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.75 분, m/z: 476 [M+H+].
방법 2:
실시예
37
{6-[7-브로모-2-(2,6-다이클로로-페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올
단계 1:
[1-(4-
아지도
-5-
브로모피리딘
-3-일)-
메트
-(
E
)-
일이덴
]-(2,6-
다이클로로페닐
)-아민
4-{[1-(4-아지도-5-클로로피리딘-3-일)메트-(E)-일이덴]아미노}-3,5-다이클로로벤조니트릴에 대하여 기재된 과정에 따라, 4-아지도-5-브로모피리딘-3-카브알데하이드 및 2,6-다이클로로아닐린을 반응시켜 베이지색 고체로서 표제 화합물을 수득하고 정제 없이 사용하였다.
단계 2:
7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘
3,5-다이클로로-4-(7-클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴에 대하여 기재된 과정에 따라, [1-(4-아지도-5-브로모피리딘-3-일)-메트-(E)-일이덴]-(2,6-다이클로로페닐)-아민을 톨루엔 중에서 환류 가열하여 갈색 고체로서 표제 화합물(7.5 g, 81% 수율)을 수득하였다. LCMS(방법 D): RT = 2.90 분, m/z: 344 [M+H+].
단계 3:
7-
브로모
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-5-
옥사이드
DCM(35 mL) 중 7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(3.43 g, 10 mmol) 및 메틸트라이옥소레늄(249 mg, 1.0 mmol)의 용액에 과산화수소(30% 수성, 1.95 mL, 20 mmol)를 첨가하고 생성된 혼합물을 실온에서 18 시간 동안 교반하였다. 반응 혼합물을 DCM과 중탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 크로마토그래피(DCM 중 0 내지 5% 메탄올)로 정제하여 베이지색 고체로서 표제 화합물(1.7 g, 47% 수율)을 수득하였다. LCMS(방법 D): RT = 2.46 분, m/z: 360 [M+H+].
단계 4:
4,7-
다이브로모
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
DCE(30 mL) 중 7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-5-옥사이드(1.7 g, 4.7 mmol)의 냉각된 현탁액(0 ℃)에 인 옥시브로마이드(4.0 g, 14.1 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 15 분 동안 교반하고, 실온으로 가온하고, 추가 2.25 시간 동안 교반하였다. 반응 혼합물을 DCM과 탄산 나트륨(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(1.07 g, 54% 수율)을 수득하였다. LCMS(방법 D): RT = 3.93 분, m/z: 422 [M+H+].
단계 5:
{6-[7-
브로모
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-메탄올
다이옥산(11 mL) 중 4,7-다이브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(317 mg, 0.75 mmol), (6-아미노-피리미딘-4-일)-메탄올(104 mg, 0.83 mmol), Pd2(dba)3(17 mg, 0.019 mmol), 잔포스(43 mg, 0.075 mmol) 및 탄산 세슘(489 mg, 1.5 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 마이크로파 반응기로 150 ℃에서 1 시간 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(229 mg, 66% 수율)을 수득하였다.
LCMS(방법 D): RT = 3.21 분, m/z: 467 [M+H+].
방법 2:
실시예
38
[7-
브로모
-2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
메틸피리미딘
-4-일)-아민
다이옥산(11 mL) 중 4,7-다이브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(317 mg, 0.75 mmol), 6-메틸피리미딘-4-일아민(90 mg, 0.83 mmol), Pd2(dba)3(17 mg, 0.019 mmol), 잔포스(43 mg, 0.075 mmol) 및 탄산 세슘(489 mg, 1.5 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 마이크로파 반응기로 150 ℃에서 1 시간 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 60% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(215 mg, 64% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.60 분, m/z: 449 [M+H+].
방법 2:
실시예
39
2-(2,6-다이클로로페닐)-4-(6-메틸피리미딘-4-일아미노)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴
DMA(1.0 mL) 중 [7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민(100 mg, 0.22 mmol), Zn(CN)2(52 mg, 0.44 mmol) 및 Pd(PPh3)4(25 mg, 0.022 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 마이크로파 반응기로 150 ℃에서 30 분 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 70% 에틸 아세테이트)로 정제하여 회백색 고체로서 표제 화합물(15 mg, 17% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.84 분, m/z: 396 [M+H+].
방법 4:
실시예
40
4-(6-아미노피리미딘-4-일아미노)-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴
단계 1:
7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아민
NMP(6.5 mL) 및 33% 수성 암모니아(3.5 mL) 중 4,7-다이브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(730 mg, 1.73 mmol)의 용액을 마이크로파 바이알 중에 밀봉하고 마이크로파 반응기로 160 ℃에서 2 시간 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 에터로 마쇄하여 베이지색 고체로서 표제 화합물(515 mg, 84% 수율)을 수득하였다. LCMS(방법 C): RT = 2.00 분, m/z: 357 [M+H+].
단계 2:
{6-[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-
비스
-카밤산 t-부틸 에스터 및 {6-[7-
브로모
-2-(2,6-
다이클
로로페닐)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-카밤산 t-부틸 에스터
다이옥산(10 mL) 중 4,7-다이브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(515 mg, 1.45 mmol), (6-클로로피리미딘-4-일)-비스-카밤산 t-부틸 에스터(560 mg, 1.7 mmol), Pd2(dba)3(33 mg, 0.036 mmol), 잔포스(83 mg, 0.144 mmol) 및 탄산 세슘(939 mg, 2.88 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 마이크로파 반응기로 150 ℃에서 30 분 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 제 1 표제 화합물(315 mg, 33% 수율)을 수득하였다; LCMS(방법 D): RT = 4.32 분, m/z: 650 [M+H+]. 또한, 황색 고체로서 제 2 화합물(97 mg, 12% 수율)을 수득하였다; LCMS(방법 D): RT = 3.10 분, m/z: 550 [M+H+].
단계 3:
4-(6-아미노-피리미딘-4-일아미노)-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-7-카보니트릴
DMA(3 mL) 중 {6-[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터(141 mg, 0.22 mmol), Zn(CN)2(52 mg, 0.44 mmol) 및 Pd(PPh3)4(25 mg, 0.022 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고, 마이크로파 반응기로 150 ℃에서 30 분 동안 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 2% 메탄올)로 정제하여 회백색 고체로서 표제 화합물(33 mg, 38% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.04 분, m/z: 397 [M+H+].
방법 4:
실시예 41
N
-[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민
DCM(2 mL) 및 TFA(1 mL) 중 {6-[7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-카밤산 t-부틸 에스터(95 mg, 0.18 mmol)의 용액을 실온에서 3 시간 동안 교반하였다. 용매를 제거하고 잔사를 DCM과 NaHCO3(포화 수용액) 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 70 내지 90% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(23 mg, 29% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.25 분, m/z: 450 [M+H+].
방법 2:
실시예 42
{6-[2-(2,6-
다이클로로페닐
)-7-
메톡시
-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-메탄올
단계 1:
2-(2,6-다이클로로-페닐)-7-메톡시-2H-피라졸로[4,3-c]피리딘 5-옥사이드
메탄올(10 mL) 중 2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-5-옥사이드(1.5 g, 5 mmol) 및 칼륨 메톡사이드(525 mg, 7.5 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고 150 ℃에서 30 분 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 에터로 마쇄하여 베이지색 고체로서 표제 화합물(1.32 g, 85% 수율)을 수득하였다. LCMS(방법 D): RT = 2.31 분, m/z: 310 [M+H+].
단계 2:
4-브로모-2-(2,6-다이클로로페닐)-7-메톡시-2H-피라졸로[4,3-c]피리딘
DCE(30 mL) 중 2-(2,6-다이클로로페닐)-7-메톡시-2H-피라졸로[4,3-c]피리딘 5-옥사이드(1.3 g, 4.2 mmol)의 냉각된 용액(0 ℃)에 질소하에 인 옥시브로마이드(2.4 g, 8.4 mmol)를 첨가하였다. 반응 혼합물을 30 분 동안 교반하고, 실온으로 가온하고, 추가 4 시간 동안 교반하였다. 추가 인 옥시브로마이드(1.8 g, 6.3 mmol)를 첨가하고 반응 혼합물을 추가 16 시간 동안 교반하였다. 온도를 80℃까지 올리고 2 시간 동안 교반하였다. 생성된 혼합물을 냉각하고, 탄산 나트륨(포화 수용액)으로 급랭하고 층을 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 30 내지 40% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(143 mg, 9% 수율)을 수득하였다. LCMS(방법 D): RT = 3.52 분, m/z: 372 [M+H+].
단계 3:
{6-[2-(2,6-다이클로로페닐)-7-메톡시-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-메탄올
다이옥산(3 mL) 중 4-브로모-2-(2,6-다이클로로페닐)-7-메톡시-2H-피라졸로[4,3-c]피리딘(135 mg, 0.36 mmol), (6-아미노피리미딘-4-일)메탄올(50 mg, 0.4 mmol), Pd2(dba)3(8 mg, 0.009 mmol), 잔포스(43 mg, 0.036 mmol) 및 탄산 세슘(235 mg, 0.72 mmol)의 현탁액을 마이크로파 바이알 중에 밀봉하고, 질소로 퍼징하고 150 ℃에서 1 시간 동안 마이크로파로 조사하였다. 반응 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 2% 메탄올)로 정제하여 황색 고체로서 표제 화합물(62 mg, 41% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.75 분, m/z: 417 [M+H+].
방법 2:
실시예
43
2-(2,6-
다이클로로
-4-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
메틸피리미딘
-4-일)-아민
단계 1:
[1-(4-아지도-5-플루오로피리딘-3-일)-메트-(
E
)-일이덴]-(2,6-다이클로로-4-플루오로페닐)-아민
DCM(50 mL) 중 4-아지도-5-플루오로-피리딘-3-카보알데하이드(2.44 g, 14.7 mmol), 2,6-다이클로로-4-플루오로페닐아민(2.65 g, 14.7 mmol) 및 트라이에틸아민(6.1 mL, 44 mmol)의 냉각된 용액(0 ℃)에 티타늄 테트라클로라이드(DCM 중 1 M, 8.8 mL, 8.8 mmol)를 적가하였다. 반응 혼합물을 0 ℃에서 1 시간 동안 교반하고, 실온으로 가온하고, 추가 4 시간 동안 교반하였다. 혼합물을 감압하에 농축하였다. 잔사를 톨루엔 중에 용해하고, 셀라이트(등록상표)를 통해 여과하였다. 여액을 감압하에 농축하고 건조하여 추가 정제 없이 사용된 표제 화합물을 수득하였다.
단계 2:
2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
톨루엔(40 mL) 중 [1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-(2,6-다이클로로-4-플루오로페닐)-아민(14.7 mmol)의 현탁액을 16 시간 동안 환류 가열한 후 실온으로 냉각하였다. 반응 혼합물을 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 회백색 고체로서 표제 화합물(3.38 g, 77% 수율)을 수득하였다. LCMS(방법 D): RT = 2.84 분, m/z: 300 [M+H+].
단계 3:
2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-5-옥사이드
DCM(50 mL) 중 2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(3.37 g, 11.2 mmol)의 냉각된 용액(0 ℃)에 질소하에 mCPBA(2.9 g, 16.8 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 2 시간 동안 교반하고, 실온으로 가온하고, 추가 5 시간 동안 교반하였다. 반응물을 티오황산 나트륨(포화 수용액), 탄산수소 나트륨(포화 수용액) 및 염수로 세척하였다. 이어서, 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄에 의해 정제하여 회백색 고체로서 표제 화합물(2.98 g, 84% 수율)을 수득하였다. LCMS(방법 D): RT = 2.48 분, m/z: 316 [M+H+].
단계 4:
4-
브로모
-2-(2,6-
다이클로로
-4-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
DCE(50 mL) 중 2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-5-옥사이드(2.95 g, 9.3 mmol)의 냉각된 현탁액(0 ℃)에 인 옥시브로마이드(8.0 g, 28 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 1 시간 동안 교반하고, 실온으로 가온하고, 추가 3 시간 동안 교반하였다. 반응 혼합물을 DCM으로 희석하고 탄산 나트륨(포화 수용액)으로 세척하였다. 유기층을 무수 황산 나트륨 상에서 건조하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(1.0 g, 28% 수율)을 수득하였다. LCMS(방법 D): RT = 3.82 분, m/z: 380 [M+H+].
단계 5:
2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민
3,5-다이클로로-4-[7-클로로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴에 대하여 기재된 과정에 따라, 4-브로모-2-(2,6-다이클로로-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘 및 6-메틸피리미딘-4-일아민을 반응시켜 백색 고체로서 표제 화합물(38 mg, 36% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.44 분, m/z: 407 [M+H+].
소정의 일반적인 합성 방법에 따라 제조된 추가 실시예 44 내지 89를 하기 표 2에 나타낸다.
방법 2:
실시예
90
4-[4-(6-
아미노피리미딘
-4-
일아미노
)-7-
클로로피라졸로[4,3-c]피리딘
-2-일]-3,5-다
이클로로벤조니
트릴
단계 1:
(6-아지도피리미딘-4-일)-비스-카밤산 t-부틸 에스터
DMF(10 mL) 중 (6-클로로피리미딘-4-일)-비스-카밤산 t-부틸 에스터(2.0 g, 6.0 mmol)의 혼합물에 나트륨 아지드(780 mg, 12.0 mmol)를 첨가하였다. 생성된 혼합물을 70 ℃에서 4 시간 동안 가열하였다. 실온으로 냉각한 후, 조질 혼합물을 물과 EtOAc 사이에 나누었다. 유기층을 염수로 2 회 세척하고, 황산 나트륨 상에서 건조하고 농축하여 건조하였다. 생성된 잔사를 사이클로헥산 중 20% EtOAc로 용리하는 실리카 겔 상에서 컬럼 크로마토그래피로 정제하여 연황색 고체로서 표제 화합물(1.33 g, 66% 수율)을 수득하였다.
단계 2:
(6-
아미노피리미딘
-4-일)-
비스
-카밤산 t-부틸 에스터
IMS(10 mL) 및 EtOAc(3.0 mL) 중 (6-아지도피리미딘-4-일)-비스-카밤산 t-부틸 에스터(1.33 g, 4.0 mmol) 및 5% Pd/C(1.0 g)의 현탁액을 수소 대기하에 18 시간 동안 실온에서 교반하였다. 이어서, 반응 혼합물을 EtOAc로 세척하면서 셀라이트(등록상표)를 통해 여과하였다. 여액을 감압하에 농축하고 건조하고 생성된 잔사를 다이에틸 에터로 마쇄하여 백색 고체로서 표제 화합물(1.21 g, 95% 수율)을 수득하였다.
단계 3:
4-(4-브로모-7-클로로피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴
프로피오니트릴(4.0 mL) 중 3,5-다이클로로-4-(4,7-다이클로로피라졸로[4,3-c]피리딘-2-일)벤조니트릴(250 mg, 0.70 mmol) 및 브로모트라이메틸실란(0.462 mL, 3.50 mmol)의 혼합물을 4 시간 동안 환류 가열하였다. 생성된 혼합물을 냉각하고 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 농축하여 베이지색 고체로서 표제 화합물(273 mg, 97% 수율)을 수득하였다.
단계 4:
{6-[7-
클로로
-2-(2,6-
다이클로로
-4-
시아노페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-일
아미
노]-피리미딘-4-일}-
비스
-카밤산 t-부틸 에스터
다이옥산(3.0 mL) 중 4-(4-브로모-7-클로로피라졸로[4,3-c]피리딘-2-일)-3,5-다이클로로벤조니트릴(270 mg, 0.67 mmol), (6-아미노피리미딘-4-일)-비스-카밤산 t-부틸 에스터(230 mg, 0.74 mmol), Pd2(dba)3(31 mg, 0.034 mmol), 잔포스(39 mg, 0.067 mmol) 및 탄산 세슘(439 mg, 1.35 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 70 ℃에서 18 시간 동안 가열하였다. 생성된 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 베이지색 고체로서 표제 화합물(321 mg, 76% 수율)을 수득하였다.
단계 5:
4-[4-(6-아미노피리미딘-4-일아미노)-7-클로로피라졸로[4,3-c]피리딘-2-일]-3,5-다이클로로벤조니트릴
HCl(다이옥산 중 4 N, 10.0 mL, 40 mmol) 중 {6-[7-클로로-2-(2,6-다이클로로-4-시아노페닐)-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터(321 mg, 0.51 mmol)의 용액을 50 ℃에서 18 시간 동안 가열하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 에틸 아세테이트와 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 KP-NH 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 회백색 고체로서 표제 화합물(176 mg, 80% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.28 분, m/z: 431 [M+H+].
방법 4:
실시예 91
N
-[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]피리미딘-4,6-다이아민
단계 1:
[2-(2,6-
다이클로로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-카밤산 t-부틸 에스터
톨루엔(15 mL) 및 물(3 mL) 중 4-브로모-2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(635 mg, 1.75 mmol), t-부틸 카바메이트(614 mg, 5.25 mmol), Pd2(dba)3(40 mg, 0.044 mmol), 잔포스(101 mg, 0.175 mmol) 및 인산 칼륨 3염기(742 mg, 3.5 mmol)의 현탁액을 탈기하고 아르곤으로 퍼징하고 반응 혼합물을 70 ℃에서 5 시간 동안 가열하였다. 혼합물을 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 연황색 고체로서 표제 화합물(396 mg, 57% 수율)을 수득하였다.
단계 2:
2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아민
TFA(2.0 ml)를 DCM(5 mL) 중 [2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-카밤산 t-부틸 에스터(390 mg, 1 mmol)의 혼합물에 첨가하고 반응 혼합물을 실온에서 3.5 시간 동안 교반하였다. 휘발성 물질을 감압하에 제거하고 생성된 잔사를 DCM 중에 용해하고 중탄산 나트륨 포화 수용액(2 회) 및 염수로 세척하였다. 유기층을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하여 회백색 고체로서 표제 화합물(226 mg, 74% 수율)을 수득하였다.
단계 3:
{6-[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}- 비스-카밤산 t-부틸 에스터
다이옥산(3.0 mL) 중 2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아민(223 mg, 0.75 mmol), (6-클로로피리미딘-4-일)-비스-카밤산 t-부틸 에스터(297 mg, 0.9 mmol), Pd2(dba)3(34 mg, 0.038 mmol), 잔포스(86 mg, 0.15 mmol) 및 탄산 세슘(489 mg, 1.5 mmol)의 현탁액을 탈기하고 질소로 퍼징하고 반응 혼합물을 150 ℃에서 마이크로파로 25 분 동안 가열하였다. 혼합물을 에틸 아세테이트와 물 사이에 나누고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 농축하여 연황색 고체로서 표제 화합물(155 mg, 35% 수율)을 수득하였다.
단계 4:
N
-[2-(2,6-
다이클로로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]피리미딘-4,6-
다이아민
TFA(2.0 mL)를 DCM(5.0 mL) 중 {6-[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터(150 mg, 0.25 mmol)의 혼합물에 첨가하고 반응 혼합물을 실온에서 2 시간 동안 교반하였다. 휘발성 물질을 감압하에 농축하고 잔사를 DCM과 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 80 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(52 mg, 53% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.10 분, m/z: 390 [M+H+].
방법 2:
실시예
92
N
-{6-[2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-아세트아미드
다이옥산(10 mL) 중 4-브로모-2-(2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(320 mg, 0.89 mmol), N-(6-아미노피리미딘-4-일)-아세트아미드(152 mg, 1.0 mmol), Pd2(dba)3(20 mg, 0.022 mmol), 잔포스(52 mg, 0.089 mmol) 및 탄산 세슘(580 mg, 1.78 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 150 ℃에서 마이크로파로 1 시간 동안 가열하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 80 내지 100% 에틸 아세테이트)로 정제하여 회백색 고체를 수득하였다. 이를 HPLC(구배: 물(0.1% 수산화 암모늄) 중 5 내지 98% 아세토니트릴(0.1% 수산화 암모늄))로 재정제하여 백색 고체로서 표제 화합물(31 mg, 10% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.20 분, m/z: 432 [M+H+].
방법 2:
실시예
93
1-{6-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-에탄올
단계 1:
(6-클로로피리미딘-4-일)-비스-카밤산 t-부틸 에스터
4-아미노-6-클로로피리미딘(10.0 g, 77.2 mmol)을 THF(450 mL) 중에 현탁하고 다이-t-부틸 다이카본에이트(36.4 g, 162 mmol)을 첨가한 후, DMAP(471 mg, 3.86 mmol)를 첨가하였다. 생성된 황색 용액을 실온에서 6 시간 동안 교반하였다. 혼합물을 감압하에 농축하고 잔사를 감압하에 밤새 건조하였다. 이를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 30% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(22.9 g, 90% 수율)을 수득하였다.
단계 2:
(6-비닐피리미딘-4-일)-비스-카밤산 t-부틸 에스터
4,4,5,5-테트라메틸-2-비닐-[1,3,2]다이옥사보롤란(1.24 mL, 7.28 mmol)을 다이옥산(4.0 mL) 및 물(4.0 mL) 중 (6-클로로피리미딘-4-일)-비스-카밤산 t-부틸 에스터(2.0 g, 6.08 mmol), PdCl2(dppf)2, DCM(2.56 g, 0.31 mmol) 및 탄산 나트륨(2.58 g, 24.3 mmol)의 혼합물에 첨가하였다. 반응 혼합물을 70 ℃에서 5.5 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 표제 화합물(1.6 g, 84% 수율)을 수득하였다.
단계 3:
(6-폼일피리미딘-4-일)-비스-카밤산 t-부틸 에스터
오존 가스를 DCM(60 mL) 중 (6-비닐피리미딘-4-일)-비스-카밤산 t-부틸 에스터(500 mg, 1.56 mmol)의 용액을 통해 -78 ℃에서 발포하여 청색 용액을 수득하였다. 1 시간 후, 반응 혼합물을 질소로 퍼징한 후 트라이페닐포스핀(406 mg, 1.56 mmol)을 첨가하였다. 반응 혼합물을 실온에서 2 시간 동안 교반한 후 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 30% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(243 mg, 48% 수율)을 수득하였다.
단계 4:
[6-(1-하이드록시에틸)-피리미딘-4-일)-
비스
-카밤산 t-부틸 에스터 및 [6-(1-하이드록시에틸)-피리미딘-4-일)-카밤산 t-부틸 에스터
메틸 마그네슘 브로마이드(다이에틸 에터 중 3 N, 0.98 mL, 2.94 mmol)를 다이에틸 에터(30mL) 중 (6-폼일피리미딘-4-일)-비스-카밤산 t-부틸 에스터(760 mg, 2.35 mmol)의 용액에 -12 ℃에서 첨가하였다. 반응 혼합물을 -12 ℃에서 15 분 동안 교반한 후, 실온에서 밤새 교반하였다. 혼합물을 -5 ℃로 냉각하고 포화 수용액 염화 암모늄 용액으로 급랭하였다. 층을 분리하고 수층을 에틸 아세테이트로 추출하였다. 합한 유기 추출물을 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 제 1 표제 화합물(200 mg, 25% 수율)을 수득하였다;
또한, 제 2 표제 화합물(198 mg, 25% 수율)을 수득하였다;
단계 5:
1-(6-아미노피리미딘-4-일)-에탄올
DCM(6.0 mL) 중 [6-(1-하이드록시에틸)-피리미딘-4-일)-비스-카밤산 t-부틸 에스터 및 [6-(1-하이드록시에틸)-피리미딘-4-일)-카밤산 t-부틸 에스터(200 mg + 198 mg, 1.45 mmol)의 용액을 0 ℃로 냉각하고 TFA(6.0 mL)를 첨가하였다. 반응 혼합물을 0 ℃에서 15 분 동안 교반한 후, 실온에서 2 시간 동안 교반하였다. 혼합물을 감압하에 농축하고 잔사를 중탄산 나트륨 포화 수용액과 2-메틸테트라하이드로푸란(2 회) 사이에 나누었다. 이어서, 수층을 에틸 아세테이트로 추출하였다. 합한 유기층을 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 20% 메탄올)로 정제하여 무색 오일로서 표제 화합물(195 mg, 96 % 수율)을 수득하였다.
단계 6:
1-{6-[2-(2,6-
다이클로로페닐
)-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-에탄올
다이옥산(3.5 mL) 중 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(133 mg, 0.445 mmol), 1-(6-아미노피리미딘-4-일)-에탄올(65 mg, 0.467 mmol), Pd2(dba)3(20 mg, 0.022 mmol), 잔포스(26 mg, 0.045 mmol) 및 탄산 세슘(290 mg, 0.89 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 150 ℃에서 마이크로파로 30 분 동안 가열하였다. 생성된 혼합물을 여과하고 다이옥산으로 세척하였다. 여액을 감압하에 농축하고 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 황색 고체를 수득하였다. 이를 HPLC(구배: 물(0.1% 수산화 암모늄) 중 5 내지 98% 아세토니트릴(0.1% 수산화 암모늄))로 재정제하여 백색 고체로서 표제 화합물(31 mg, 21% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.74 분, m/z: 401 [M+H+].
방법 2:
실시예
94
(6-사이클로프로필피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘4-일]-아민
단계 1:
(6-사이클로프로필피리미딘-4-일)-비스-카밤산 t-부틸 에스터
톨루엔(6.0 mL) 및 물(0.6 mL) 중 (6-클로로피리미딘-4-일)-비스-카밤산 t-부틸 에스터(200 mg, 0.60 mmol), 사이클로프로필 보론산(80 mg, 0.94 mmol) 및 탄산 세슘(410 mg, 1.26 mmol)의 혼합물을 탈기하고 아르곤(3 회)으로 퍼징하였다. 이어서, 암겐 촉매(36 mg, 0.05 mmol)를 첨가하고 반응 혼합물을 140 ℃에서 마이크로파로 30 분 동안 가열하였다. 생성된 혼합물을 아세트산 및 물로 희석하였다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 5 내지 10% 아세트산)로 정제하여 백색 고체로서 표제 화합물(130 mg, 64% 수율)을 수득하였다.
단계 2:
6-
사이클로프로필피리미딘
-4-
일아민
HCl(다이옥산 중 4 N, 3.0 mL, 12 mmol) 중 (6-사이클로프로필피리미딘-4-일)-비스-카밤산 t-부틸 에스터(256 mg, 0.764 mmol) 및 (6-사이클로프로필피리미딘-4-일)-카밤산 t-부틸 에스터(10 mg, 0.043 mmol)의 혼합물을 55 ℃에서 3 시간 동안 가열하였다. 추가 HCl(다이옥산 중 4 N, 1.0 mL, 4 mmol)을 첨가하고 반응 혼합물을 70 ℃에서 추가 1.5 시간 동안 가열한 후, 실온에서 밤새 교반하였다. 생성된 혼합물을 중탄산 나트륨 포화 수용액과 에틸 아세테이트 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 2 내지 5% 메탄올)로 정제하여 표제 화합물(84 mg, 78% 수율)을 수득하였다.
단계 3:
(6-사이클로프로필피리미딘-4-일)-[2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘4-일]-아민
다이옥산(1.5 mL) 중 4-클로로-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘(52 mg, 0.175 mmol), 6-사이클로프로필피리미딘-4-일아민(26 mg, 0.193 mmol), Pd2(dba)3(8 mg, 0.0088 mmol), 잔포스(10.1 mg, 0.0175 mmol) 및 탄산 세슘(114 mg, 0.35 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 120 ℃에서 마이크로파로 1 시간 동안 가열하였다. 생성된 혼합물을 여과하고 다이옥산으로 세척하였다. 여액을 감압하에 농축하고 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(30 mg, 43% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.17 분, m/z: 397 [M+H+].
방법 2:
실시예
95
3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴
단계 1:
2-{[1-(4-아지도-5-플루오로피리딘-3-일)-메트-(
E
)-일이덴]-아미노}-3-클로로벤조니트릴
DCM(60 mL) 중 4-아지도-5-플루오로피리딘-3-카브알데하이드(2.86 g, 17.2 mmol) 및 2-아미노-3-클로로벤조니트릴(2.62 g, 17.2 mmol)의 용액을 0 ℃로 질소 대기하에 냉각하였다. 트라이에틸아민(7.2 mL, 51.6 mmol)을 첨가한 후, 티타늄(IV) 클로라이드 용액(DCM 중 1 N, 10.3 mL, 10.3 mmol)을 적가하였다. 반응 혼합물을 0 ℃에서 2 시간 동안 교반한 후, 실온에서 밤새 교반하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 에틸 아세테이트 중에 용해하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하고 수득된 잔사를 추가 정제 없이 다음 단계에서 사용하였다.
단계 2:
3-클로로-2-(7-플루오로피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
톨루엔(60 mL) 중 2-{[1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-아미노}-3-클로로벤조니트릴(5.16 g, 17.2 mmol)의 용액을 105 ℃에서 5 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 5% 메탄올)로 정제하여 베이지색 고체로서 표제 화합물(2.57 g, 55% 수율)을 수득하였다.
단계 3:
3-
클로로
-2-(7-
플루오로
-5-
옥시피라졸로[4,3-c]피리딘
-2-일)-
벤조니트릴
3-클로로-2-(7-플루오로피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(2.49 g, 9.1 mmol)을 DCM(30 mL) 중에 용해하고, 메틸트라이옥소레늄(227 mg, 0.91 mmol)을 첨가한 후, 30% 과산화수소 수용액(1.2 mL, 18 mmol)을 적가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 생성된 혼합물을 DCM과 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 최소량의 메탄올 중에 용해하고 과량의 다이에틸 에터로 침전하였다. 고체를 여과하고 건조하여 베이지색 고체로서 표제 화합물(2.25 g, 86% 수율)을 수득하였다.
단계 4:
3-클로로-2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
3-클로로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(2.25 g, 25 mmol)을 DCE(40 mL) 중에 질소 대기하에 현탁하고, 인 옥시클로라이드(2.3 mL, 25 mmol)를 첨가하였다. 반응 혼합물을 70 ℃에서 4 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 추가의 1 N 탄산 나트륨 수용액으로 조심스럽게 급랭하였다. DCM을 첨가하고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 30 내지 40% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(893 mg, 37% 수율)을 수득하였다.
단계 5:
2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조니트릴
3-클로로-2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(890 mg, 2.9 mmol)을 프로피오니트릴(30 mL) 중에 질소 대기하에 현탁하고, 브로모트라이메틸실란(2.0 mL, 15 mmol)을 첨가하였다. 반응 혼합물을 110 ℃에서 3.5 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고, 에틸 아세테이트와 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하여 황색 고체로서 표제 화합물(980 mg, 96% 수율)을 수득하였다.
단계 6:
3-
클로로
-2-[7-
플루오로
-4-(6-
메틸피리미딘
-4-
일아미노
)-
피라졸로[4,3-c]피리딘
-2-일]-
벤조니트릴
다이옥산(3 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조니트릴(158 mg, 0.45 mmol), 4-아미노-6-메틸피리미딘(55 mg, 0.5 mmol), Pd2(dba)3(10 mg, 0.011 mmol), 잔포스(26 mg, 0.045 mmol) 및 탄산 세슘(293 mg, 0.9 mmol)의 혼합물을 탈기하고, 질소로 퍼징하고 반응 혼합물을 150 ℃에서 마이크로파로 30 분 동안 가열하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 80 내지 90% 에틸 아세테이트)로 정제하여 베이지색 고체로서 표제 화합물(81 mg, 47% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.04 분, m/z: 380 [M+H+].
방법 2:
실시예
96
3-클로로-2-{7-플루오로-4-[6-(1-하이드록시에틸)-피리미딘-4-일아미노]-피라졸로[4,3-c]피리딘-2-일}-벤조니트릴
다이옥산(4.0 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조니트릴(211 mg, 0.61 mmol), 1-(6-아미노피리미딘-4-일)-에탄올(92 mg, 0.66 mmol), Pd2(dba)3(14 mg, 0.015 mmol), 잔포스(35 mg, 0.06 mmol) 및 탄산 세슘(391 mg, 1.2 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 150 ℃에서 마이크로파로 30 분 동안 가열하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트)로 정제하여 베이지색 고체로서 표제 화합물(61 mg, 25% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.92 분, m/z: 410 [M+H+].
방법 2:
실시예
97
2-[4-(6-아미노-2-메틸피리미드-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴 하이드로클로라이드 염
단계 1:
(6-아지도-2-메틸피리미딘-4-일)-비스-카밤산 t-부틸 에스터
DMSO(10 mL) 중 (6-클로로-2-메틸피리미딘-4-일)-비스-카밤산 t-부틸 에스터(2.0 g, 5.8 mmol)의 혼합물에 나트륨 아지드(757 mg, 11.6 mmol)를 첨가하였다. 생성된 혼합물을 50 ℃에서 16 시간 동안 가열하였다. 실온으로 냉각한 후, 조질 혼합물을 물과 EtOAc 사이에 나누었다. 수층을 EtOAc로 2 회 세척하였다. 합한 유기 추출물을 염수로 2 회 세척하고, Na2SO4 상에서 건조하고 농축하고 건조하여 오일로서 표제 화합물(1.64 g, 80% 수율)을 수득하였다. LCMS(방법 D): RT = 3.76 분, m/z: 351 [M+H+].
단계 2:
(6-아미노-2-메틸피리미딘-4-일)-비스-카밤산 t-부틸 에스터
IMS(36 mL) 및 EtOAc(12 mL) 중 (6-아지도-2-메틸피리미딘-4-일)-비스-카밤산 t-부틸 에터(1.64 g, 4.7 mmol) 및 5% Pd/C(0.5 g)의 현탁액을 수소 대기하에 18 시간 동안 실온에서 교반하였다. 이어서, 반응 혼합물을 EtOAc로 세척하면서 셀라이트(등록상표)를 통해 여과하였다. 여액을 감압하에 농축하고 건조하고 생성된 잔사를 석유 에터(40 내지 60 ℃) 중 0 내지 60% EtOAc로 용리하는 실리카 겔 상에서 컬럼 크로마토그래피로 정제하여 백색 고체로서 표제 화합물(0.74 g, 49% 수율)을 수득하였다. LCMS(방법 D): RT = 2.72 분, m/z: 325 [M+H+].
단계 3:
{6-[2-(2-
클로로
-6-
시아노페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-2-
메틸피리미딘
-4-일}-
비스
-카밤산 t-부틸 에스터
다이옥산(8.0 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조니트릴(351 mg, 1.0 mmol), (6-아미노-2-메틸피리미딘-4-일)-비스-카밤산 t-부틸 에스터(389 mg, 1.2 mmol), Pd2(dba)3(23 mg, 0.025 mmol), 잔포스(58 mg, 0.1 mmol) 및 탄산 세슘(452 mg, 2.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하였다. 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 6 시간 동안 가열하였다. 실온으로 냉각한 후, 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 70% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(577 mg, 97% 수율)을 수득하였다.
단계 4:
2-[4-(6-아미노-2-메틸피리미드-4-일아미노)-7-플루오로-피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴 하이드로클로라이드 염
{6-[2-(2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일}-비스-카밤산 t-부틸 에스터(574 mg, 0.97 mmol)를 HCl(프로판-2-올 중 1.25 N, 35 mL)의 용액 중에 용해하고 반응 혼합물을 50 ℃에서 4 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각시키고, 여과하고 건조하여 황색 고체로서 표제 화합물(357 mg, 85% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.02 분, m/z: 395 [M+H+].
방법 2:
실시예
98
2-[4-(5-아제티딘-3-일-피리딘-2-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴 하이드로클로라이드 염
단계 1:
3-(6-클로로피리딘-3-일)-아제티딘-1-카복실산 t-부틸 에스터
DMA(2.3 mL) 중 아연 분말(912 mg, 14 mmol)의 탈기된 현탁액에 클로로트라이메틸실란 및 1,2-다이브로모에탄(0.1 mL, 7:5 v/v 비)의 용액을 적가하고 생성된 혼합물을 실온에서 15 분 동안 교반하였다. 이어서, 이 혼합물에 DMA(8.0 mL) 중 3-요오도아제티딘-1-카복실산 t-부틸 에스터(3.2 g, 11.3 mmol)의 용액을 적가하고 생성된 혼합물을 실온에서 15 분 동안 교반하였다. 이어서, 분리 플라스크에서, PdCl2(dppf)2.DCM(196 mg, 0.24 mmol) 및 구리 요오다이드(92 mg, 0.48 mmol)를 DMA(20 mL) 중 2-클로로-4-요오도피리딘의 탈기된 용액에 첨가하였다. 30 분 동안 숙성시킨 후, 상기 아연 현탁액을 요오도피리딘 용액에 첨가하고 반응 혼합물을 실온에서 2 시간 동안 교반시켰다. 생성된 혼합물을 포화된 염화 암모늄 용액을 첨가하면서 급랭한 후, TBME로 2 회 추출하였다. 합한 유기 세정액을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 25% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(1.2 g, 56%)을 수득하였다. LCMS(방법 F): RT = 3.71 분, m/z: 414 [M+H+].
단계 2:
3-[6-(
벤즈하이드릴이덴아미노
)-피리딘-3-일]-
아제티딘
-1-
카복실산
t-부틸 에스터
다이옥산(10 mL) 중 3-(6-클로로피리딘-3-일)-아제티딘-1-카복실산 t-부틸 에스터(274 mg, 1.0 mmol), 벤조페논 이민(0.2 mL, 1.2 mmol), Pd2(dba)3(22 mg, 0.025 mmol), 잔포스(58 mg, 0.10 mmol) 및 탄산 세슘(652 mg, 2.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각한 후, 이를 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 30 내지 40% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(293 mg, 70% 수율)을 수득하였다. LCMS(방법 C): RT = 3.31 분, m/z: 269 [M+H+].
단계 3:
3-(6-아미노피리딘-3-일)-아제티딘-1-카복실산 t-부틸 에스터
THF(20 mL) 중 3-[6-(벤즈하이드릴이덴아미노)-피리딘-3-일]-아제티딘-1-카복실산 t-부틸 에스터(400 mg, 0.97 mmol)의 용액에 시트르산(10 mL, 10% 수성)을 첨가하고 반응 혼합물을 실온에서 밤새 교반하였다. 생성된 혼합물을 탄산수소 나트륨 용액을 첨가하면서 급랭한 후 에틸 아세테이트로 2 회 추출하였다. 합한 유기 세정액을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 70 내지 100% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(183 mg, 76%). LCMS(방법 C): RT = 1.85 분, m/z: 250 [M+H+].
단계 4:
3-{6-[2-(2-
클로로
-6-
시아노페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일아미노]-피리딘-3-일}-
아제티딘
-1-
카복실산
t-부틸 에스터
다이옥산(3.0 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로벤조니트릴(106 mg, 0.3 mmol), 3-(6-아미노피리딘-3-일)-아제티딘-1-카복실산 t-부틸 에스터(57 mg, 0.35 mmol), Pd2(dba)3(7 mg, 0.0075 mmol), 잔포스(17 mg, 0.03 mmol) 및 탄산 세슘(196 mg, 0.6 mmol)의 혼합물을 탈기하고 질소로 퍼징하였다. 반응 혼합물을 80 ℃에서 밤새 가열하였다. 실온으로 냉각한 후, 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 60% 에틸 아세테이트)로 정제하여 갈색 고체로서 표제 화합물(100 mg, 64% 수율)을 수득하였다. LCMS(방법 C): RT = 2.54 분, m/z: 520 [M+H+].
단계 5:
2-[4-(5-아제티딘-3-일-피리딘-2-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴 하이드로클로라이드 염
3-{6-[2-(2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리딘-3-일}-아제티딘-1-카복실산 t-부틸 에스터(98 mg, 0.19 mmol)를 함유하는 환저 플라스크에 HCl(프로판-2-올 중 1.25 N, 10 mL)의 용액을 첨가하고 현탁액을 실온에서 16 시간 동안 교반한 후 50 ℃에서 4 시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각하고, 감압하에 농축하고 생성된 고체를 다이에틸 에터로 마쇄하고, 여과하고 건조하였다. 수득된 조질 잔사를 HPLC(구배: 물(0.1% NH4OH) 중 20 내지 98% MeOH(0.1% NH4OH))로 정제하고 냉동 건조하여 HCl(프로판-2-올 중 1.25 N, 5.0 mL)의 용액 중에 용해된 자유 염기의 표제 화합물을 수득하고, 4 시간 동안 교반한 후 감압하에 농축하였다. 생성된 잔사를 다이에틸 에터로 마쇄하고, 여과하고 건조하여 백색 고체로서 표제 화합물(30 mg, 35% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.29 분, m/z: 420 [M+H+].
방법 2:
실시예
99
[2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민
단계 1:
[1-(4-
아지도
-5-
플루오로피리딘
-3-일)-
메트
-(
E
)-
일이덴
]-(2,6-
다이클로로
-4-니트로페닐)-아민
DCM(60 mL) 중 4-아지도-5-플루오로피리딘-3-카브알데하이드(3.00 g, 18.07 mmol) 및 2,6-다이클로로-4-니트로아닐린(3.74 g, 18.07 mmol)의 용액을 0 ℃로 질소 대기하에 냉각하였다. 트라이에틸아민(7.56 mL, 54.2 mmol)을 첨가한 후, 추가 티타늄(IV) 클로라이드 용액(DCM 중 1 N, 10.8 mL, 10.8 mmol)을 적가하였다. 반응 혼합물을 0 ℃에서 3 시간 동안 교반한 후, 1 시간에 걸쳐서 실온에 도달하도록 하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 에틸 아세테이트 중에 용해하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하여 황색/갈색 고체로서 조질 표제 화합물(5.89 g, 92% 수율)을 수득하였다. LCMS(방법 C): RT = 4.08 분, m/z: 327 [M+H+-N2].
단계 2:
2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
톨루엔(80 mL) 중 [1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-(2,6-다이클로로-4-니트로페닐)-아민(5.89 g, 16.6 mmol)의 현탁액을 105 ℃에서 4 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 5% 메탄올)로 정제하여 표제 화합물(4.78 g, 81% 수율)을 수득하였다.
단계 3:
2-(2,6-
다이클로로
-4-
니트로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
5-옥사이드
2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(4.78 g, 14.62 mmol)을 DCM(90 mL) 중에 용해하고 DCM(60 mL, 무수 황산 나트륨 상에서 미리 건조되고 상 분리기를 통해 통과됨) 중 메타-클로로퍼벤조산(3.78 g, 21.93 mmol)의 용액을 0 ℃에서 첨가하였다. 반응 혼합물을 0 ℃에서 1 시간 동안 교반한 후 실온에서 4 시간 동안 교반하였다. DCM(20 mL, 상기한 바와 같이 건조됨) 중 메타-클로로퍼벤조산(1.26 g, 7.30 mmol)의 다른 부분을 첨가하고 반응 혼합물을 추가 1.25 시간 동안 실온에서 교반하였다. 생성된 혼합물을 순차적으로 티오황산 나트륨 포화 수용액, 중탄산 나트륨 포화 수용액 및 염수로 세척하였다. 합한 수성 추출물을 추가로 DCM으로 추출하고 합한 유기층을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 3 회 마쇄하고 고체를 여과로 수집하고 감압하에 건조하여 연황색 고체로서 표제 화합물(4.20 g, 84% 수율)을 수득하였다.
단계 4:
4-클로로-2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘 5-옥사이드(4.20 g, 12.24 mmol)를 DCE(60 mL) 중에 질소 대기하에 현탁하고 인 옥시클로라이드(3.61 mL, 39.2 mmol)를 첨가하였다. 반응 혼합물을 70 ℃에서 95 분 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 추가의 10% 탄산 나트륨 수용액으로 조심스럽게 급랭하였다. 층을 분리하고 수층을 DCM으로 4 회 추출하였다. 합한 유기층을 여과하여 불용성 고체를 제거하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 연황색 고체로서 표제 화합물(1.78 g, 40% 수율)을 수득하였다.
단계 5:
4-브로모-2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
4-클로로-2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(1.78 g, 4.93 mmol)을 프로피오니트릴(30 mL) 중에 질소 대기하에 현탁하고 브로모 트라이메틸실란(5.1 mL, 38.3 mmol)을 첨가하였다. 반응 혼합물을 105 ℃에서 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각하고 에틸 아세테이트와 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 수층을 추가로 에틸 아세테이트로 2 회 추출하였다. 합한 유기층을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 펜탄으로 마쇄하고 수득된 고체를 감압하에 건조하여 연황색 고체로서 표제 화합물(2.06 g, 정량적 수율)을 수득하였다.
단계 6:
[2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민
다이옥산(3 mL) 중 4-브로모-2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(200 mg, 0.49 mmol), 4-아미노-6-메틸피리미딘(60 mg, 0.55 mmol), Pd2(dba)3(11 mg, 0.012 mmol), 잔포스(28 mg, 0.049 mmol) 및 탄산 세슘(321 mg, 0.99 mmol)의 혼합물을 탈기하고 질소로 퍼징하였다. 반응 혼합물을 150 ℃에서 마이크로파로 30 분 동안 가열하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 수층을 추가로 에틸 아세테이트로 4 회 추출하고 합한 유기층을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 100% 에틸 아세테이트)로 정제하여 연황색 고체로서 표제 화합물(173 mg, 72% 수율)을 수득하였다.
단계 7:
[2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민
[2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민(173 mg, 0.40 mmol)을 에탄올(10 mL) 중에 용해하고, THF(4.0 mL) 및 물(1.0 mL)을 첨가한 후, 철 분말(325 메시, 112 mg, 2.0 mmol) 및 염화 암모늄(86 mg, 1.6 mmol)을 첨가하였다. 반응 혼합물을 70 ℃에서 4 시간 동안 가열하였다. 추가 철 분말(112 mg) 및 염화 암모늄(100 mg)을 첨가하고 혼합물을 70 ℃에서 추가 5 시간 동안 가열하였다. 생성된 혼합물을 냉각하고 셀라이트(등록상표)를 통해 여과하였다. 여액을 감압하에 농축하고 잔사를 물로 마쇄하였다. 수득된 고체를 감압하에 건조하고 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 5% 메탄올)로 정제하여 회백색 고체로서 표제 화합물(120 mg, 74% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.00 분, m/z: 404 [M+H+].
방법 2:
실시예
100
5-아미노-3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]벤조니트릴
단계 1:
2-{[1-(4-
아지도
-5-
플루오로피리딘
-3-일)-
메트
-(
E
)-
일이덴
]-아미노}-3-
클로로
-5-
니트로벤조니트릴
[1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-(2,6-다이클로로-4-니트로페닐)-아민(실시예 99, 단계 1)에 대하여 기재된 과정에 따라, 2-아미노-3-클로로-5-니트로벤조니트릴을 실온에서 교반하여 표제 화합물(6.07 g, 정량적 수율)을 수득하고 정제 없이 사용하였다. LCMS(방법 C): RT = 3.69 분, m/z: 318 [M+H+-N2].
단계 2:
3-클로로-2-(7-플루오로-피라졸로[4,3-c]피리딘-2-일)-5-니트로벤조니트릴
2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘에 대하여 기재된 과정에 따라, 2-{[1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-아미노}-3-클로로-5-니트로벤조니트릴을 107 ℃에서 3.5 시간 동안 가열하였다. 실리카 겔 크로마토그래피(DCM 중 0 내지 5% 메탄올)로 정제 후, 생성물을 다이에틸 에터/사이클로헥산(1:1)로 5 회 마쇄하여 황색 고체로서 표제 화합물(3.31 g, 58% 수율)을 수득하였다. LCMS(방법 C): RT = 2.89 분, m/z: 318 [M+H+].
단계 3:
3-
클로로
-2-(7-
플루오로
-5-
옥시피라졸로[4,3-c]피리딘
-2-일)-5-
니트로벤조니트릴
메틸 트라이옥소레늄(VII)(0.26 g, 1.04 mmol)을 DCM(35 mL) 중 3-클로로-2-(7-플루오로-피라졸로[4,3-c]피리딘-2-일)-5-니트로벤조니트릴(3.31 g, 10.4 mmol)의 용액에 첨가하였다. 이어서, 과산화수소 수용액(27 %, 1.48 mL, 20.6 mmol)을 적가하고 반응 혼합물을 실온에서 밤새 교반하였다. 추가 메틸 트라이옥소레늄(50 mg) 및 과산화수소 용액(0.3 mL)을 첨가하고 반응 혼합물을 실온에서 4 시간 동안 교반하였다. 생성된 고체를 경사분리(decantation)하고, 잔여 용액을 포화 수용액 중탄산 나트륨으로 세척하였다. 이어서, 수층을 DCM 및 DCM 중 10% 메탄올로 3 회 추출하였다. 합한 유기 세정액을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 상기 용액으로부터 경사분리된 고체와 합하고 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 10% 메탄올)로 정제하여 연황색 고체로서 표제 화합물(2.75 g, 79% 수율)을 수득하였다. LCMS(방법 C): RT = 2.45 분, m/z: 334 [M+H+].
단계 4:
3-
클로로
-2-(4-
클로로
-7-
플루오로피라졸로[4,3-c]피리딘
-2-일)-5-
니트로벤조니트릴
4-클로로-2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘에 대하여 기재된 과정에 따라, 3-클로로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)-5-니트로벤조니트릴을 70 ℃에서 밤새 가열하여 연황색 고체로서 표제 화합물(1.47 g, 51% 수율)을 수득하였다. LCMS(방법 C): RT = 3.57 분, m/z: 352 [M+H+].
단계 5:
2-(4-
브로모
-7-
플루오로피라졸로[4,3-c]피리딘
-2-일)-3-
클로로
-5-
니트로벤조니트릴
4-브로모-2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘에 대하여 기재된 과정에 따라, 3-클로로-2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-5-니트로벤조니트릴을 100 ℃에서 밤새 가열하여 연황색 고체로서 표제 화합물(1.38 g, 83% 수율)을 수득하였다. LCMS(방법 C): RT = 3.62 분, m/z: 396 [M+H+].
단계 6:
3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-5-니트로벤조니트릴
[2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민에 대하여 기재된 과정에 따라, 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로-5-니트로벤조니트릴을 80 ℃에서 밤새 가열하여 연황색 고체로서 표제 화합물(43 mg, 20% 수율)을 수득하였다. LCMS(방법 C): RT = 2.56 분, m/z: 425 [M+H+].
단계 7:
5-아미노-3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]벤조니트릴
[2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민에 대하여 기재된 과정에 따라, 3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-5-니트로벤조니트릴을 70 ℃에서 7 시간 동안 가열하여 연황색 고체로서 표제 화합물(27 mg, 30% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.88 분, m/z: 395 [M+H+].
방법 2:
실시예
101
5-아미노-2-[4-(6-아미노피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로벤조니트릴 포름에이트 염
단계 1:
{6-[2-(2-클로로-6-시아노-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-
일아미노
]-피리미딘-4-일}-
비스
-카밤산 t-부틸 에스터 및 {6-[2-(2-
클로로
-6-시
아
노-4-
니트로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-
피리미
딘-4-일}-카밤산 t-부틸 에스터
[2-(2,6-다이클로로-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민에 대하여 기재된 과정에 따라, 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로-5-니트로벤조니트릴 및 (6-아미노-피리미딘-4-일)-비스-카밤산 t-부틸 에스터를 80 ℃에서 밤새 가열하여 연황색 고체로서 제 1 표제 화합물(60 mg, 13% 수율)을 수득하였다.
또한, 연황색 고체로서 제 2 화합물(55 mg, 14% 수율)을 수득하였다.
단계 2:
{6-[2-(4-아미노-2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-
일아미노
]-피리미딘-4-일}-
비스
-카밤산 t-부틸 에스터 및 {6-[2-(4-아미노-2-클
로
로-6-
시아노페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-
피리미
딘-4-일}-카밤산 t-부틸 에스터
[2-(4-아미노-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)-아민에 대하여 기재된 과정에 따라, {6-[2-(2-클로로-6-시아노-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터 및 {6-[2-(2-클로로-6-시아노-4-니트로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-카밤산 t-부틸 에스터를 70 ℃에서 밤새 가열하여 연황색 고체로서 2개의 표제 화합물의 혼합물(66 mg, 60% 수율)을 수득하였다. LCMS(방법 C): RT = 3.97 분, m/z: 595 [M+H+], RT = 3.07 분, m/z: 495 [M+H+].
단계 3:
5-아미노-2-[4-(6-
아미노피리미딘
-4-
일아미노
)-7-
플루오로피라졸로[4,3-c]피리딘
-2-일]-3-
클로로벤조니트릴
포름에이트
염
HCl(다이옥산 중 4 N, 5.0 mL, 20 mmol) 중 {6-[2-(4-아미노-2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터 및 {6-[2-(4-아미노-2-클로로-6-시아노페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-카밤산 t-부틸 에스터(66 mg, 약 0.12 mmol)의 혼합물을 실온에서 밤새 교반하였다. 추가 HCl(다이옥산 중 4 N, 1.0 mL, 10 mmol)을 첨가하고 반응 혼합물을 40 ℃에서 7 시간 동안 가열하였다. 생성된 현탁액을 감압하에 농축하고 잔사를 다이에틸 에터로 마쇄하였다. 수득된 고체를 진공하에 건조하고, HPLC(구배: 물(0.1% 포름산) 중 5 내지 60% 아세토니트릴(0.1% 포름산))로 정제하여 백색 고체로서 표제 화합물(30 mg, 59% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.70 분, m/z: 396 [M+H+].
방법 2:
실시예 102
N
-[2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민
단계 1:
2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-5-옥사이드
트라이메틸보록신(0.348 mL, 2.5 mmol)을 다이옥산(11 mL) 중 7-브로모-2-(2,6-다이클로로페닐)-2H-피라졸로[4,3-c]피리딘-5-옥사이드(720 mg, 2.0 mmol), 탄산 칼륨(829 mg, 6.0 mmol) 및 Pd(PPh3)4(228 mg, 0.2 mmol)의 현탁액에 첨가하고, 반응 혼합물을 80 ℃에서 질소 대기하에 밤새 가열하였다. 추가 트라이메틸보록신(0.278 mL)을 첨가하고 반응 혼합물을 80 ℃에서 추가 2 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 여과하였다. 고체를 에틸 아세테이트 및 메탄올(9:1)로 세척하였다. 여액을 감압하에 농축하여 갈색 고체를 수득하였다. 이를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 20% 메탄올)로 정제하여 연황색 고체로서 표제 화합물(405 mg, 69% 수율)을 수득하였다. LCMS(방법 F): RT = 2.30 분, m/z: 294 [M+H+].
단계 2:
4-브로모-2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘
인(V) 옥시브로마이드(921 mg, 3.43 mmol)를 DCE(9.0 mL) 중 2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-5-옥사이드(404 mg, 1.37 mmol)의 현탁액에 0 ℃에서 질소 대기하에 천천히 첨가하였다. 반응 혼합물을 0 ℃에서 30 분 동안 교반한 후 실온에서 밤새 교반하였다. 주황색 현탁액을 탄산 나트륨 포화 수용액 위에 붓고 10 분 동안 교반하였다. 이를 DCM으로 추출하고 유기층을 염수로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 30% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(185 mg, 38% 수율)을 수득하였다.
단계 3:
{6-[2-(2,6-
다이클로로페닐
)-7-
메틸
-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-
비스
-카밤산 t-부틸 에스터 및 {6-[2-(2,6-
다이클로로페닐
)-7-
메
틸-2H-
피라졸로[4,3-c]피리딘
-4-
일아미노
]-피리미딘-4-일}-카밤산 t-부틸 에스터
다이옥산(2.0 mL) 중 4-브로모-2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘(95 mg, 0.27 mmol), (6-아미노피리미딘-4-일)-비스-카밤산 t-부틸 에스터(99 mg, 0.32 mmol), Pd2(dba)3(6 mg, 0.006 mmol), 잔포스(15 mg, 0.027 mmol) 및 탄산 세슘(174 mg, 0.53 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 150 ℃에서 마이크로파로 1 시간 동안 가열하였다. 생성된 혼합물을 다이옥산으로 희석하고 여과하였다. 고체를 다이옥산으로 세척하고 여액을 감압하에 농축하였다. 수득된 잔사를 고진공하에 건조하여 황색 고체로서 2개의 표제 화합물의 조질 혼합물을 수득하였다. LCMS(방법 C): RT = 3.08 분, m/z: 586 [M+H+], RT = 2.66 분, m/z: 486 [M+H+]. 이 조질 잔사를 추가 정제 없이 다음 단계에 직접 이용하였다.
단계 4:
N
-[2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-4-일]-피리미딘-4,6-다이아민
TFA(1.5 mL)를 DCM(1.5 mL) 중 {6-[2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-비스-카밤산 t-부틸 에스터 및 {6-[2-(2,6-다이클로로페닐)-7-메틸-2H-피라졸로[4,3-c]피리딘-4-일아미노]-피리미딘-4-일}-카밤산 t-부틸 에스터의 조질 혼합물에 0 ℃에서 질소 대기하에 천천히 첨가하였다. 반응 혼합물을 실온으로 2 시간에 걸쳐서 가온하면서 교반하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 다이에틸 에터로 마쇄하였다. 형성된 연황색 고체를 여과하고 다이에틸 에터로 세척하여 조질 표제 화합물(30 mg)을 수득하였다. 여액을 감압하에 농축하여 황색 오일로서 불순한 표제 화합물(220 mg)을 수득하였다. 2 회분을 에틸 아세테이트 중에 각각 용해한 후, 합하고, 중탄산 나트륨 포화 수용액으로 세척하였다. 유기층을 무수 황산 마그네슘 상에서 건조하고, 여과하고 농축하여 조질 잔사를 수득하였다. 이를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 10% 메탄올)로 정제한 후, HPLC(구배: 물(0.1% 수산화 암모늄) 중 5 내지 98% 아세토니트릴(0.1% 수산화 암모늄))로 정제하여 백색 분말로서 표제 화합물(14 mg, 14% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.05 분, m/z: 386 [M+H+].
방법 2:
실시예
103
3-클로로-5-플루오로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴
단계 1:
2-아미노-3-클로로-5-플루오로벤조니트릴
무수 DMF(84 mL) 중 2-브로모-6-클로로-4-플루오로아닐린(6.0 g, 26.7 mmol), 아연 시아나이드(11.42 g, 97.6 mmol) 및 Pd(PPh3)4(2.16 g, 1.92 mmol)의 혼합물을 80 ℃에서 아르곤 대기하에 24 시간 동안 가열하였다. 반응 혼합물을 냉각하고 염수로 희석하였다. 이 혼합물을 에틸 아세테이트로 3 회 추출하고 합한 유기층을 물로 2 회 세척하고, 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 20% 에틸 아세테이트)로 정제하여 연황색 고체로서 표제 화합물(3.29 g, 72% 수율)을 수득하였다.
2-아미노-3-
클로로
-5-
플루오로벤조니트릴에
대한 다른 과정
무수 아세토니트릴(300 mL) 중 2-아미노-5-플루오로벤조니트릴(15.0 g, 110 mmol)의 용액에 N-클로로숙신이미드(16.0 g, 120 mmol)를 적가하였다. 반응 혼합물을 80 ℃에서 18 시간 동안 질소하에 가열하였다. 생성된 혼합물을 냉각시키고, 감압하에 농축한 후 EtOAc와 물 사이에 나누었다. 수층을 에틸 아세테이트로 추출하고 합한 유기 추출물을 건조하고, 여과하고 감압하에 농축하였다. 조질 잔사를 실리카 겔 플래시 크로마토그래피(펜탄 중 10 내지 20% 다이에틸 에터)로 정제하여 회백색 고체로서 표제 화합물(9.6 g, 51% 수율)을 수득하였다.
단계 2:
2-{[1-(4-아지도-5-플루오로피리딘-3-일)-메트-(
E
)-일이덴]-아미노}-3-클로로-5-플루오로벤조니트릴
무수 DCM(20 mL) 중 4-아지도-5-플루오로-3-피리딘카복스알데하이드(1.0 g, 6.02 mmol) 및 2-아미노-3-클로로-5-플루오로벤조니트릴(1.03 g, 6.02 mmol)의 용액을 빙욕중에 냉각하고 트라이에틸아민(2.52 mL, 18.07 mmol)을 첨가한 후, 티타늄(IV) 클로라이드(DCM 중 1 N, 3.6 mL, 3.6 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 3 시간 동안 교반한 후 실온에서 밤새 교반하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 에틸 아세테이트 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하여 연갈색 고체로서 표제 화합물(1.67 g, 89% 수율)을 수득하고, 이를 정제 없이 다음 단계에서 직접 사용하였다. LCMS(방법 C): RT = 3.74 분, m/z: 291 [M+H+-N2].
단계 3:
3-클로로-5-플루오로-2-(7-플루오로피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
무수 톨루엔(25 mL) 중 2-{[1-(4-아지도-5-플루오로피리딘-3-일)-메트-(E)-일이덴]-아미노}-3-클로로-5-플루오로벤조니트릴(1.67 g, 5.25 mmol)의 용액을 4.5 시간 동안 환류 가열하였다. 생성된 혼합물을 실온으로 냉각시키고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 0 내지 5% 메탄올)로 정제하여 황색 고체로서 표제 화합물(1.41 g, 93% 수율)을 수득하였다. LCMS(방법 C): RT = 2.71 분, m/z: 291 [M+H+].
단계 4:
3-
클로로
-5-
플루오로
-2-(7-
플루오로
-5-
옥시피라졸로[4,3-c]피리딘
-2-일)-
벤조니트릴
3-클로로-5-플루오로-2-(7-플루오로피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(1.41 g, 4.84 mmol)을 DCM(16 mL) 및 메틸트라이옥소레늄(VI)(0.13 g, 0.48 mmol) 중에 용해한 후, 과산화수소(27% 수용액, 0.69 mL, 9.59 mmol)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 추가 메틸트라이옥소레늄(VI)(0.025 g) 및 과산화수소 용액(0.15 mL)을 첨가하고 반응 혼합물을 실온에서 5 시간 동안 교반하였다. 생성된 혼합물을 중탄산 나트륨 포화 수용액으로 세척하고 수층을 분리하고 DCM 내에 4 회 추출하였다. 합한 유기층을 건조하고, 여과하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 2 회 마쇄하고, 수득된 고체를 여과하고 감압하에 건조하여 황색 고체로서 표제 화합물(1.21 g, 82% 수율)을 수득하였다. LCMS(방법 C): RT = 2.35 분, m/z: 307 [M+H+].
단계 5:
3-
클로로
-2-(4-
클로로
-7-
플루오로피라졸로[4,3-c]피리딘
-2-일)-5-
플루오로벤조니트릴
3-클로로-5-플루오로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(1.21 g, 3.95 mmol)을 DCE(19 mL) 중에 현탁하고 인 옥시클로라이드(1.2 mL, 12.7 mmol)를 첨가하였다. 반응 혼합물을 70 ℃에서 밤새 가열하였다. 생성된 혼합물을 냉각하고 중탄산 나트륨 포화 수용액을 조심스럽게 첨가하였다. DCM을 첨가하고 층을 분리하였다. 수층을 DCM으로 3 회 추출하고 합한 유기층을 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(0.55 g, 43% 수율)을 수득하였다. LCMS(방법 C): RT = 3.51 분, m/z: 325 [M+H+].
단계 6:
3-클로로-5-플루오로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴
다이옥산(1.8 mL) 중 3-클로로-2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-5-플루오로벤조니트릴(80 mg, 0.28 mmol), 6-메틸피리미딘-4-일아민(30 mg, 0.27 mmol), Pd2(dba)3(11 mg, 0.012 mmol), 잔포스(14 mg, 0.028 mmol) 및 탄산 세슘(160 mg, 0.49 mmol)의 혼합물을 탈기하고 질소로 퍼징하였다. 반응 혼합물을 150 ℃에서 마이크로파로 30 분 동안 가열하였다. 생성된 혼합물을 에틸 아세테이트로 희석하고 물로 세척하였다. 유기층을 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 100% 에틸 아세테이트)로 정제하여 표제 화합물(35 mg, 36% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.20 분, m/z: 398 [M+H+].
방법 2:
실시예
104
2-[4-(6-아미노-2-메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로-5-플루오로벤조니트릴 하이드로클로라이드 염
단계 1:
2-(4-
브로모
-7-
플루오로피라졸로[4,3-c]피리딘
-2-일)-3-
클로로
-5-
플루오로벤조니트릴
3-클로로-2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-5-플루오로벤조니트릴(735 mg, 2.26 mmol)을 프로피오니트릴(44 mL) 중에 질소 대기하에 현탁하고 브로모트라이메틸실란(0.82 mL, 5.64 mmol)을 첨가하였다. 반응 혼합물을 80 ℃에서 5 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고, 에틸 아세테이트와 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하여 베이지색 고체로서 표제 화합물(834 mg, 100% 수율)을 수득하였다.
단계 2:
{6-[2-(2-클로로-6-시아노-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일}비스-카밤산 t-부틸 에스터
다이옥산(10 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로-5-플루오로벤조니트릴(365 mg, 1.0 mmol), (6-아미노-2-메틸피리미딘-4-일)-비스-카밤산 t-부틸 에스터(389 mg, 1.2 mmol), Pd2(dba)3(22 mg, 0.025 mmol), 잔포스(58 mg, 0.1 mmol) 및 탄산 세슘(652 mg, 2.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하였다. 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 냉각 후, 생성된 혼합물을 에틸 아세테이트로 희석하고 물로 세척하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20 내지 40% 에틸 아세테이트)로 정제하여 조질 잔사를 수득하고, 이를 추가 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 30% 에틸 아세테이트)로 정제하여 표제 화합물(296 mg, 48% 수율)을 수득하였다.
단계 2:
2-[4-(6-아미노-2-메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-클로로-5-플루오로벤조니트릴 하이드로클로라이드 염
{6-[2-(2-클로로-6-시아노-4-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일}비스-카밤산 t-부틸 에스터(296 mg, 0.48 mmol)에 HCl(프로판-2-올 중 1.25 N, 10 mL)을 첨가하고, 반응 혼합물을 50 ℃에서 밤새 가열하였다. 냉각 후, 용매를 감압하에 농축한 후, 다이에틸 에터를 첨가하였다. 침전물을 여과 제거하고 건조하여 베이지색 고체로서 표제 화합물(208 mg, 97% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.10 분, m/z: 413 [M+H+].
방법 2:
실시예
105
3-
클로로
-5-
플루오로
-2-{7-
플루오로
-4-[6-(3-
플루오로아제티딘
-1-일)피리미딘-4-
일아미노
]
피라졸로
[4,3-c]피리딘-2-일}
벤조니트릴
하이드로클로라이드
염
단계 1:
[6-(3-
플루오로아제티딘
-1-일)피리미딘-4-일]
비스
카밤산 t-부틸 에스터
(6-클로로피리미딘-4-일)-비스-카밤산 t-부틸 에스터(2.3 g, 7.0 mmol) 및 3-플루오로아제티딘 하이드로클로라이드(916 mg, 8.2 mmol)를 NMP(14 mL) 중에 용해하고, DIPEA(1.8 mL, 10.5 mmol)를 첨가하였다. 반응 혼합물을 80 ℃에서 밤새 가열하였다. 추가 DIPEA(1.0 mL, 6.0 mmol)를 첨가하고, 반응 혼합물을 80 ℃에서 추가 3 시간 동안 가열하였다. 실온으로 냉각 후, 혼합물을 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 40 내지 50% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(945 mg, 37% 수율)을 수득하였다.
단계 2:
6-(3-플루오로아제티딘-1-일)피리미딘-4-일아민
[6-(3-플루오로아제티딘-1-일)피리미딘-4-일]비스 카밤산 t-부틸 에스터(940 mg, 2.55 mmol)를 DCM(10 mL) 중에 용해하고 TFA(2.5 mL)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 용매를 감압하에 제거하고 잔사를 DCM 중에 용해하고 탄산수소 나트륨 포화 수용액으로 세척하였다. 유기층을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하여 백색 고체로서 표제 화합물(158 mg, 37% 수율)을 수득하였다.
단계 3:
3-클로로-5-플루오로-2-{7-플루오로-4-[6-(3-플루오로아제티딘-1-일)피리미딘-4-일아미노]피라졸로[4,3-c]피리딘-2-일}벤조니트릴 하이드로클로라이드 염
다이옥산(5 mL) 중 2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-5-플루오로벤조니트릴(185 mg, 0.5 mmol), 6-(3-플루오로아제티딘-1-일)피리미딘-4-일아민(100 mg, 0.6 mmol), Pd2(dba)3(11 mg, 0.0125 mmol), 잔포스(29 mg, 0.05 mmol) 및 탄산 세슘(326 mg, 1.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하였다. 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 냉각 후, 생성된 혼합물을 에틸 아세테이트로 희석하고 물로 세척하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 90 내지 100% 에틸 아세테이트)로 정제하여 조질 생성물을 수득하였다. 이 조질 생성물을 다이에틸 에터로 마쇄하고 수득된 고체를 여과로 수집하였다. 이 고체에 HCl(5 mL, 프로판-2-올 중 1.25 N)을 첨가하고 생성된 혼합물을 실온에서 2 시간 동안 교반하였다. 고체를 여과 제거하고 건조하여 회백색 고체로서 표제 화합물(95 mg, 39% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.31 분, m/z: 457 [M+H+].
방법 2:
실시예
106
3-
클로로
-5-
플루오로
-2-{7-
플루오로
-4-[6-(2-
하이드록시에틸아미노
)-2-
메틸피리미딘
-4-
일아미노
]
피라졸로
[4,3-c]피리딘-2-일}
벤조니트릴
하이드로클로라이드
염
단계 1:
2-(6-아미노-2-메틸피리미딘-4-일아미노)에탄올
6-클로로-2-메틸피리미딘-4-일아민(717 mg, 5.0 mmol) 및 에탄올아민(0.602 mL, 10.0 mmol)의 혼합물을 250 ℃에서 마이크로파로 30 초 동안 가열하였다. 냉각 후, 잔사를 소량의 메탄올을 함유하는 에틸 아세테이트 중에 용해하고 염수로 세척하였다. 유기층을 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하여 백색 고체로서 표제 화합물(334 mg, 40% 수율)을 수득하였다.
단계 2:
3-
클로로
-5-
플루오로
-2-{7-
플루오로
-4-[6-(2-
하이드록시에틸아미노
)-2-
메틸피리미딘
-4-
일아미노
]
피라졸로
[4,3-c]피리딘-2-일}
벤조니트릴
하이드로클로라이드
염
다이옥산(5 mL) 중 2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-5-플루오로벤조니트릴(185 mg, 0.5 mmol), 2-(6-아미노-2-메틸피리미딘-4-일아미노)에탄올(101 mg, 0.6 mmol), Pd2(dba)3(11 mg, 0.0125 mmol), 잔포스(29 mg, 0.05mmol) 및 탄산 세슘(326 mg, 1.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하였다. 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 냉각 후, 생성된 혼합물을 에틸 아세테이트로 희석하고 물로 세척하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 2% 메탄올)로 정제하여 조질 생성물을 수득하였다. 이 조질 생성물을 프로판-2-올 용액(10 mL) 중 1.25 N HCl 중에 용해하고 실온에서 1 시간 동안 교반하였다. 용매를 감압하에 농축하고, 다이에틸 에터를 첨가하고 혼합물을 5 분 동안 교반하였다. 침전물을 여과 제거하고 건조하여 회백색 고체로서 표제 화합물(68 mg, 28% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.13 분, m/z: 457 [M+H+].
방법 2:
실시예
107
3-플루오로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤조니트릴 하이드로클로라이드 염
단계 1:
2-{[1-(4-
아지도
-5-
플루오로피리딘
-3-일)
메트
-(
E
)-
일이덴
]아미노}-3-
플루오로벤조니트릴
DCM(73 mL) 중 4-아지도-5-플루오로피리딘-3-카브알데하이드(3.66 g, 22.1 mmol) 및 2-아미노-3-플루오로벤조니트릴(3.0 g, 22.05 mmol)의 용액을 0 ℃에서 질소 대기하에 냉각하였다. 트라이에틸아민(9.1 mL, 66.0 mmol)을 첨가한 후, 추가 티타늄(IV) 클로라이드 용액(DCM 중 1 N, 13.15 mL, 13.15 mmol)을 적가하였다. 반응 혼합물을 0 ℃에서 2 시간 동안 교반한 후, 실온에서 밤새 교반하였다. 생성된 혼합물을 감압하에 농축하여 베이지색 잔사로서 표제 화합물(5.19 g, 83% 수율)을 수득하였다. 이 물질을 정제 없이 다음 단계에서 사용하였다. LCMS(방법 C): RT = 3.49 분, m/z: 257 [M-N2].
단계 2:
3-
플루오로
-2-(7-
플루오로피라졸로[4,3-c]피리딘
-2-일)-
벤조니트릴
톨루엔(90 mL) 중 2-{[1-(4-아지도-5-플루오로피리딘-3-일)메트-(E)-일이덴]아미노}-3-플루오로벤조니트릴(5.19 g, 18.2 mmol)의 용액을 4 시간 동안 환류 가열하였다. 생성된 혼합물을 실온으로 냉각하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 50 내지 100% 에틸 아세테이트)로 정제하여 베이지색 고체로서 표제 화합물(4.02 g, 86% 수율)을 수득하였다. LCMS(방법 C): RT = 2.41 분, m/z: 257 [M+H+].
단계 3:
3-플루오로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)-벤조니트릴
3-플루오로-2-(7-플루오로피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(4.02 g, 15.7 mmol)을 DCM(50 mL) 중에 용해하고, 메틸트라이옥소레늄(391 mg, 1.57 mmol)을 첨가한 후, 27% 과산화수소 수용액(2.25 mL, 31.4 mmol)을 적가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 생성된 백색 현탁액을 추가의 DCM으로 희석하고 중탄산 나트륨 포화 수용액으로 세척하였다. 층을 분리하고 유기층을 중탄산 나트륨 포화 수용액으로 세척하고, 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하고 수득된 고체를 여과하고 건조하여 주황색 고체로서 표제 화합물(4.05 g, 95% 수율)을 수득하였다. LCMS(방법 C): RT = 2.13 분, m/z: 273 [M+H+].
단계 4:
2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-플루오로벤조니트릴
3-플루오로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)-벤조니트릴(4.05 g, 14.89 mmol)을 DCE(71 mL) 중에 질소 대기하에 현탁하고 인 옥시클로라이드(4.4 mL, 47.72 mmol)를 첨가하였다. 반응 혼합물을 70 ℃에서 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각하고, 감압하에 농축하고 톨루엔으로 공비하였다. 잔사를 에틸 아세테이트와 탄산수소 나트륨 수용액 사이에 나누었다. 수층을 에틸 아세테이트로 2 회 및 DCM으로 2 회 추출하였다. 합한 유기층을 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 0 내지 50% 에틸 아세테이트)로 정제하여 갈색 고체로서 표제 화합물(1.45 g, 33% 수율)을 수득하였다. LCMS(방법 F): RT = 3.24 분, m/z: 291 [M+H+].
단계 5:
2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-플루오로벤조니트릴
2-(4-클로로-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-플루오로벤조니트릴(520 mg, 1.79 mmol)을 프로피오니트릴(35 mL) 중에 질소 대기하에 현탁하고, 브로모트라이메틸실란(0.646 mL, 6.76 mmol)을 첨가하였다. 반응 혼합물을 80 ℃에서 4.5 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 감압하에 농축하였다. 잔사를 에틸 아세테이트와 중탄산 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 무수 황산 마그네슘 상에서 건조하고, 여과하고 감압하에 농축하여 고체로서 표제 화합물(600 mg, 100% 수율)을 수득하였다. 이를 정제 없이 다음 단계에서 사용하였다. LCMS(방법 F): RT = 3.30 분, m/z: 335 [M+H+].
단계 6:
3-플루오로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴
다이옥산(1.8 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-플루오로벤조니트릴(85 mg, 0.25 mmol), 4-아미노-6-메틸피리미딘(31 mg, 0.28 mmol), Pd2(dba)3(12 mg, 0.013 mmol), 잔포스(15 mg, 0.026 mmol) 및 탄산 세슘(166 mg, 0.51 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 150 ℃에서 밀봉된 바이알 중에 30 분 동안 가열하였다. 생성된 혼합물을 다이옥산으로 희석하고 여과하였다. 여액을 감압하에 농축하고 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 10 내지 100% 에틸 아세테이트)로 정제하여 갈색 고체로서 표제 화합물(47 mg, 51% 수율)을 수득하였다. LCMS(방법 C): RT = 2.25 분, m/z: 364 [M+H+].
단계 7:
3-
플루오로
-2-[7-
플루오로
-4-(6-
메틸피리미딘
-4-
일아미노
)
피라졸로
[4,3-c]피리딘-2-일]
벤조니트릴
하이드로클로라이드
염
프로판-2-올 용액(2.5 mL) 중 1.25 N HCl 중에서 3-플루오로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)-피라졸로[4,3-c]피리딘-2-일]-벤조니트릴(46 mg, 0.13 mmol)의 용액을 50 ℃에서 2 시간 동안 가열하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 50 ℃에서 고진공하에 밤새 건조하여 회백색 고체로서 표제 화합물(60 mg, 100% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.92 분, m/z: 364 [M+H+].
방법 2:
실시예
108
2-[4-(2,6-다이메틸피리미딘-4-일아미노)-7-플루오로피라졸로[4,3-c]피리딘-2-일]-3-플루오로벤조니트릴 하이드로클로라이드 염
단계 1:
2-[4-(2,6-
다이메틸피리미딘
-4-
일아미노
)-7-
플루오로피라졸로[4,3-c]피리딘
-2-일]-3-
플루오로벤조니트릴
.
HCl
다이옥산(2.5 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-플루오로벤조니트릴(131 mg, 0.39 mmol), 2,6-다이메틸피리미딘-4-일아민(48 mg, 0.39 mmol), Pd2(dba)3(18 mg, 0.019 mmol), 잔포스(22 mg, 0.039 mmol) 및 탄산 세슘(254 mg, 0.78 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 150 ℃에서 마이크로파로 30 분 동안 가열하였다. 생성된 혼합물을 여과하고 고체를 다이옥산으로 세척하였다. 여액을 감압하에 농축하고 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20 내지 100% 에틸 아세테이트)로 정제하여 황색 고체를 수득하였다. 이를 추가로 HPLC(구배: 물(0.1% 수산화 암모늄 중 10 내지 90% 아세토니트릴(0.1% 수산화 암모늄))로 정제하여 표제 화합물의 자유 염기를 수득하였다. 이에 HCl(프로판-2-올 중 1.25 N, 2.5 mL)을 첨가하고 현탁액을 50 ℃에서 1.5 시간 동안 가열하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 고진공하에 50 ℃에서 밤새 건조하여 백색 고체로서 표제 화합물(46 mg, 26% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.89 분, m/z: 378 [M+H+].
방법 2:
실시예
109
N-[2-(2-
클로로
-6-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-2-
메틸피리미딘
-4,6-
다이아민
하이드로클로라이드
염
단계 1:
[1-(4-아지도-5-플루오로피리딘-3-일)메트-(
E
)-일이덴]-(2-클로로-6-플루오로페닐)아민
DCM(200 mL) 중 4-아지도-5-플루오로피리딘-3-카브알데하이드(10.0 g, 60.0 mmol) 및 2-클로로-6-플루오로페닐아민(8.7 g, 60.0 mmol)의 용액을 0 ℃로 질소 대기하에 냉각하였다. 트라이에틸아민(25 mL, 180 mmol)을 첨가한 후, 티타늄(IV) 클로라이드 용액(DCM 중 1 N, 36 mL, 36 mmol)을 적가하였다. 반응 혼합물을 0 ℃에서 교반한 후 밤새 실온까지 도달시켰다. 생성된 혼합물을 감압하에 농축하고 잔사를 톨루엔 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하여 표제 화합물을 수득하고 정제 없이 다음 단계에서 사용하였다.
단계 2:
2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
톨루엔(250 mL) 중 [1-(4-아지도-5-플루오로피리딘-3-일)메트-(E)-일이덴]-(2-클로로-6-플루오로페닐)아민(약 60 mmol)의 용액을 3 시간 동안 환류 가열하였다. 생성된 혼합물을 실온으로 냉각하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하고 수득된 고체를 여과로 수집하고 건조하여 회백색 고체로서 표제 화합물(9.96 g, 2 단계에 걸쳐서 63% 수율)을 수득하였다.
단계 3:
2-(2-
클로로
-6-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
5
옥사이드
2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(9.95 g, 37.5 mmol)을 DCM(150 mL) 중에 0 ℃에서 현탁하고, 메타-클로로퍼벤조산(12.9 g, 75 mmol)을 첨가하였다. 반응 혼합물을 0 ℃에서 2 시간 동안 교반한 후 실온에 도달하도록 하고 추가 3 시간 동안 교반하였다. 생성된 혼합물을 티오황산 나트륨 포화 수용액으로 급랭하고 층을 분리하였다. 유기층을 중탄산 나트륨 포화 수용액 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하고 수득된 고체를 여과 제거하고 건조하여 백색 고체로서 표제 화합물(7.22 g, 68% 수율)을 수득하였다.
단계 4:
4-클로로-2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘 5 옥사이드(7.2 g, 25.6 mmol)를 DCE(130 mL) 중에 질소 대기하에 현탁하고 인 옥시클로라이드(7.2 mL, 77.0 mmol)를 첨가하였다. 반응 혼합물을 70 ℃에서 5 시간 동안 교반한 후 실온으로 냉각하였다. 생성된 혼합물을 교반하면서 탄산 나트륨 포화 수용액 위에 조심스럽게 붓고, 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(3.08 g, 40% 수율)을 수득하였다.
단계 5:
4-브로모-2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
4-클로로-2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(3.05 g, 10.1 mmol)딘을 프로피오니트릴(60 mL) 중에 질소 대기하에 현탁하고 브로모트라이메틸실란(4.0 mL, 30.0 mmol)을 첨가하였다. 반응 혼합물을 100 ℃에서 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각하고, 에틸 아세테이트로 희석하고 중탄산 나트륨 포화 수용액으로 세척하였다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하여 베이지색 고체로서 표제 화합물(3.5 g, 100% 수율)을 수득하였다. 이를 추가 정제 없이 다음 단계에서 직접 사용하였다.
단계 6:
{6-[2-(2-
클로로
-6-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일아미노]-2-
메틸피리미딘
-4-일}
비스
카밤산 t-부틸 에스터
다이옥산(5 mL) 중 4-브로모-2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(175 mg, 0.5 mmol), (6-아미노-2-메틸피리미딘-4-일)-비스-카밤산 t-부틸 에스터(194 mg, 0.6 mmol), Pd2(dba)3(11 mg, 0.013 mmol), 잔포스(29 mg, 0.05 mmol) 및 탄산 세슘(326 mg, 1.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각한 후, 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 40% 에틸 아세테이트)로 정제하여 황색 유리로서 표제 화합물(278 mg, 95% 수율)을 수득하였다.
단계 7:
N
-[2-(2-
클로로
-6-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-2-
메틸피리미딘
-4,6-
다이아민
하이드로클로라이드
염
프로판-2-올 중 {6-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일} 비스 카밤산 t-부틸 에스터(271 mg, 0.46 mmol)에 HCl(프로판-2-올 중 1.25 N, 6.0 mL)을 첨가하고, 반응 혼합물을 50 ℃에서 4 시간 동안 가열하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 다이에틸 에터로 마쇄하고 1 시간 동안 교반하였다. 수득된 고체를 여과로 수집하고 건조하여 표제 화합물(174 mg, 82% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.13 분, m/z: 388 [M+H+].
방법 2:
실시예
110
[2-(2-
클로로
-6-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-(2,6-다
이메틸피리
미딘-4-일)아민
하이드로클로라이드
염
다이옥산(5 mL) 중 4-브로모-2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(172 mg, 0.5 mmol), 4-아미노-2,6-다이메틸피리미딘(74 mg, 0.6 mmol), Pd2(dba)3(11 mg, 0.013 mmol), 잔포스(29 mg, 0.05 mmol) 및 탄산 세슘(326 mg, 1.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각한 후, 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트)로 정제하였다. 생성된 잔사를 HCl(프로판-2-올 중 1.25 N, 5.0 mL)로 1 시간 동안 교반하였다. 수득된 고체를 여과로 수집하고 건조하여 회백색 고체로서 표제 화합물(142 mg, 67% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.14 분, m/z: 387 [M+H+].
방법 2:
실시예
111
{6-[2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-2-메틸피리미딘-4-일}-메탄올 하이드로클로라이드 염
단계 1:
(2-메틸-6-비닐-아미노피리미딘-4-일)-비스-카밤산 t-부틸 에스터
nPrOH(40 mL) 중 (2-메틸-6-클로로-아미노피리미딘-4-일)-비스-카밤산 t-부틸 에스터(1.50 g, 4.4 mmol), 칼륨 비닐트라이플루오로보레이트(884 mg, 6.6 mmol) 및 트라이에틸아민(3.3 mL, 22 mmol)의 용액에 Pd(dppf)Cl2.CHCl3(180 mg, 0.22 mmol)을 첨가하였다. 반응 혼합물을 질소로 탈기한 후 100 ℃에서 30 분 동안 밀봉된 바이알 중에 가열하였다. 생성된 혼합물을 냉각한 후 에틸 아세테이트와 포화된 중탄산 나트륨 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 진공에서 농축하였다. 생성된 잔사를 사이클로헥산 중 10% 에틸 아세테이트로 용리하는 실리카 겔상에 컬럼 크로마토그래피로 정제하여 오일로서 표제 화합물(1.99 g, 93% 수율)을 수득하였다.
단계 2:
(6-
하이드록시메틸
-2-
메틸
-
아미노피리미딘
-4-일)-
비스
-
카밤산
t-부틸 에스터
오존 가스를 -78 ℃에서 60 분 동안(영구적인 청색이 생성될 때까지) DCM(50 mL) 및 MeOH(12 mL) 중 (2-메틸-6-비닐-아미노피리미딘-4-일)-비스-카밤산 t-부틸 에스터(1.98 g, 5.9 mmol)의 용액을 통해 발포하였다. 오존의 흐름을 멈춘 후 수소화붕소 나트륨(448 mg, 11.8 mmol)를 -78 ℃에서 첨가하였다. 반응 혼합물을 -78 ℃에서 10 분 동안 교반시킨 후 실온으로 가온시키고 추가로 60 분 동안 교반하였다. 이어서, 생성된 혼합물을 DCM과 물 사이에 나누었다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 진공에서 농축하였다. 생성된 잔사를 사이클로헥산 중 40 내지 60% 에틸 아세테이트로 용리하는 실리카 겔상에 컬럼 크로마토그래피로 정제하여 오일로서 표제 화합물(1.69 g, 84% 수율)을 수득하였다. LCMS(방법 E): RT = 3.19 분, m/z: 340 [M+H+].
단계 3:
(6-아미노-2-메틸피리미딘-4-일)-메탄올
TFA(5 mL)를 DCM(20 mL) 중 (6-하이드록시메틸-2-메틸-아미노피리미딘-4-일)-비스-카밤산 t-부틸 에스터(1.68 g, 5.0 mmol)의 용액에 첨가하고 반응 혼합물을 실온에서 16 시간 동안 교반하였다. 생성된 혼합물을 진공에서 농축하였다. 조질 잔사를 메탄올 중에 용해하고 MeOH로 세척된 이솔루트(등록상표) SCX-2 카트리지 위에 로딩한 후 생성물을 암모니아(MeOH 중 2 N)로 용리하였다. 합한 메탄올 암모니아 분획을 진공에서 농축하고 생성된 잔사를 다이에틸 에터로 마쇄하여 연분홍색 고체로서 표제 화합물(540 mg, 78% 수율)을 수득하였다.
단계 4:
{6-[2-(2-
클로로
-6-
플루오로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일아미노]-2-
메틸피리미딘
-4-일}-메탄올
하이드로클로라이드
염
다이옥산(5 mL) 중 4-브로모-2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(172 mg, 0.5 mmol), 4-아미노-2,6-다이메틸피리미딘(83 mg, 0.6 mmol), Pd2(dba)3(11 mg, 0.013 mmol), 잔포스(29 mg, 0.05 mmol) 및 탄산 세슘(326 mg, 1.0 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각한 후, 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 80 내지 100% 에틸 아세테이트)로 정제하였다. 생성된 잔사를 HCl(프로판-2-올 중 1.25 N, 5.0 mL)로 1 시간 동안 교반하였다. 생성된 혼합물을 감압하에 농축하고 수득된 고체를 다이에틸 에터로 마쇄하고, 여과하고 건조하여 백색 고체로서 표제 화합물(153 mg, 70% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.96 분, m/z: 403 [M+H+].
방법 2:
실시예
112
{4-[2-(2-클로로-6-플루오로-페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일아미노]-6-메틸-피리미딘-2-일}-메탄올 하이드로클로라이드 염
다이옥산(2.0 mL) 중 4-브로모-2-(2-클로로-6-플루오로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(100 mg, 0.29 mmol), (4-아미노-6-메틸피리미딘-2-일)-메탄올(42 mg, 0.31 mmol), Pd2(dba)3(13 mg, 0.015 mmol), 잔포스(17 mg, 0.03 mmol) 및 탄산 세슘(189 mg, 0.58 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 마이크로파 조사하에 150 ℃에서 45 분 동안 가열하였다. 생성된 혼합물을 실온으로 냉각한 후 추가 다이옥산으로 세척한 후 에틸 아세테이트로 세척하면서 셀라이트(등록상표)의 패드를 통해 여과하였다. 합한 세정액을 감압하에 농축하고 생성된 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 40 내지 100% 에틸 아세테이트)로 정제하였다. 생성된 잔사를 HPLC(구배: 물(0.1% NH4OH) 중 10 내지 98% MeOH(0.1% NH4OH))로 추가 정제하여 표제 화합물의 자유 염기를 수득하였다. 이 조질 잔사에 HCl의 용액(프로판-2-올 중 1.25 N, 2.0 mL)을 첨가하고 생성된 혼합물을 실온에서 1 시간 동안 교반하였다. 생성된 혼합물을 감압하에 농축하고 진공에서 건조하여 백색 고체로서 표제 화합물(42 mg, 33% 수율)을 수득하였다.
LCMS(방법 B): RT = 3.03 분, m/z: 403 [M+H+].
방법 2:
실시예
113
{3,5-다이클로로-4-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]페닐}메탄올 하이드로클로라이드 염
단계 1:
[1-(4-
아지도
-5-
플루오로피리딘
-3-일)
메트
-(
E
)-
일이덴
]-(4-
브로모
-2,6-
다이클로로페닐
)아민
DCM(200 mL) 중 4-아지도-5-플루오로피리딘-3-카브알데하이드(10.0 g, 60.0 mmol) 및 4-브로모-2,6-다이클로로페닐아민(14.4 g, 60.0 mmol)의 용액을 0 ℃로 질소 대기하에 냉각하였다. 트라이에틸아민(25 mL, 180 mmol)을 첨가한 후, 추가의 티타늄(IV) 클로라이드 용액(DCM 중 1 N, 36 mL, 36 mmol)을 적가하였다. 반응 혼합물을 0 ℃에서 교반한 후 밤새 실온에 도달하도록 하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 톨루엔 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하여 표제 화합물(정량적 수율)을 수득하였다. 이를 추가 정제 없이 다음 단계에서 사용하였다.
단계 2:
2-(4-브로모-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
톨루엔(200 mL) 중 [1-(4-아지도-5-플루오로피리딘-3-일)메트-(E)-일이덴]-(4-브로모-2,6-다이클로로페닐)아민(약 60 mmol)의 용액을 105 ℃에서 2 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하고 수득된 고체를 여과로 수집하고 건조하여 표제 화합물(14.5 g, 2 단계에 걸쳐서 67% 수율)을 수득하였다.
단계 3:
2-(4-
브로모
-2,6-
다이클로로페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
5 옥사이드
2-(4-브로모-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(14.5 g, 40 mmol)을 DCM(160 mL) 중에 0 ℃에서 현탁하고 메타-클로로퍼벤조산(12.4 g, 72 mmol)을 첨가하였다. 반응 혼합물을 0 ℃에서 2 시간 동안 교반한 후 실온에 도달하도록 하고 밤새 교반하였다. 추가 메타-클로로퍼벤조산(5 g, 30 mmol)을 첨가하고 반응 혼합물을 실온에서 추가 3 시간 동안 교반하였다. 생성된 혼합물을 티오황산 나트륨 포화 수용액으로 급랭하고 층을 분리하였다. 유기층을 포화된 다이카본에이트 수용액 및 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하고 수득된 고체를 여과하고 건조하여 베이지색 고체로서 표제 화합물(12.9 g, 86% 수율)을 수득하였다.
단계 4:
2-(2,6-
다이클로로
-4-
비닐페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
5
옥사이드
트라이에틸아민(3.5 mL, 25 mmol)을 프로판-1-올(50 mL) 중 2-(4-브로모-2,6-다이클로로페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘 5 옥사이드(1.88 g, 5.0 mmol), 칼륨 비닐 트라이플루오로보레이트(1.0 g, 7.5 mmol) 및 Pd(dppf)Cl2.CHCl3(408 mg, 0.5 mmol)의 혼합물에 첨가하고, 반응 혼합물을 100 ℃에서 1.5 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각한 후 에틸 아세테이트와 탄산수소 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 4 내지 5 % 메탄올)로 정제하여 베이지색 고체로서 표제 화합물(1.0 g, 62% 수율)을 수득하였다.
단계 5:
4-브로모-2-(2,6-다이클로로-4-비닐페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘
DCM(15 mL) 중 2-(2,6-다이클로로-4-비닐페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘 5 옥사이드(1.0 g, 3.1 mmol)의 현탁액에 질소 대기하에 0 ℃에서 인 옥시브로마이드(2.6 g, 9.0 mmol)를 첨가하였다. 반응 혼합물을 0 ℃에서 1 시간 동안 교반한 후 30 분간에 걸쳐서 실온에 도달하도록 하였다. 생성된 혼합물을 탄산수소 나트륨 포화 수용액으로 급랭하고 DCM으로 희석하였다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 백색 고체로서 표제 화합물(304 mg, 25% 수율)을 수득하였다.
단계 6:
[2-(2,6-
다이클로로
-4-
비닐페닐
)-7-
플루오로
-2H-
피라졸로[4,3-c]피리딘
-4-일]-(6-
메틸피리미딘
-4-일)아민
다이옥산(8.0 mL) 중 4-브로모-2-(2,6-다이클로로-4-비닐페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘(295 mg, 0.76 mmol), 6-메틸피리미딘-4-일아민(99 mg, 0.91 mmol), Pd2(dba)3(17 mg, 0.019 mmol), 잔포스(44 mg, 0.076 mmol) 및 탄산 세슘(495 mg, 1.52 mmol)의 혼합물을 탈기하고, 질소로 퍼징하고, 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각한 후, 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 70 내지 80% 에틸 아세테이트)로 정제하여 베이지색 고체로서 표제 화합물(197 mg, 62% 수율)을 수득하였다.
단계 7:
3,5-다이클로로-4-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤즈알데하이드
아세톤(10 mL) 및 물(2.5 mL) 중 [2-(2,6-다이클로로-4-비닐페닐)-7-플루오로-2H-피라졸로[4,3-c]피리딘-4-일]-(6-메틸피리미딘-4-일)아민(193 mg, 0.47 mmol)의 혼합물에 오시뮴(VIII) 옥사이드(t-부탄올 중 2.5 중량%, 0.465 mL)를 첨가한 후, 나트륨 페리오데이트(257 mg, 1.2 mmol)를 첨가하고 반응 혼합물을 실온에서 밤새 교반하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 80% 에틸 아세테이트)로 정제하여 황색 고체로서 표제 화합물(129 mg, 66% 수율)을 수득하였다.
단계 8:
{3,5-
다이클로로
-4-[7-
플루오로
-4-(6-
메틸피리미딘
-4-
일아미노
)
피라졸로
[4,3-c]피리딘-2-일]
페닐
}메탄올
하이드로클로라이드
염
에탄올(IMS 등급, 5 mL) 및 THF(2 mL) 중 3,5-다이클로로-4-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]벤즈알데하이드(125 mg, 0.3 mmol)의 용액에 수소화붕소 나트륨(14 mg, 0.36 mmol)를 첨가하고 반응 혼합물을 실온에서 2 시간 동안 교반하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 1% 메탄올)로 정제하여 고체를 수득하고, 이에 HCl(프로판-2-올 중 1.25 N, 10 mL)을 첨가하고 혼합물을 실온에서 1 시간 동안 교반하였다. 수득된 고체를 여과로 수집하고 건조하여 회백색 고체로서 표제 화합물(62 mg, 45% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.89 분, m/z: 419 [M+H+].
방법 2:
실시예
114
3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-5-하이드록시메틸 벤조니트릴
단계 1:
2-{[1-(4-아지도-5-플루오로피리딘-3-일)메트-(
E
)-일이덴]아미노}-5-브로모-3-클로로벤조니트릴
DCM(75 mL) 중 4-아지도-5-플루오로피리딘-3-카브알데하이드(3.75 g, 22.6 mmol) 및 2-아미노-5-브로모-3-클로로벤조니트릴(5.24 g, 22.6 mmol)의 용액을 0 ℃로 질소 대기하에 냉각하였다. 트라이에틸아민(9.5 mL, 68 mmol)을 첨가한 후, 티타늄(IV) 클로라이드 용액(DCM 중 1 N, 13.6 mL, 13.6 mmol)을 적가하였다. 반응 혼합물을 0 ℃에서 2 시간 동안 교반한 후 밤새 실온에 도달하도록 하였다. 생성된 혼합물을 감압하에 농축하고 잔사를 톨루엔 중에 현탁하고 셀라이트(등록상표)의 패드를 통해 여과하였다. 여액을 감압하에 농축하여 표제 화합물을 수득하고 추가 정제 없이 다음 단계에서 사용하였다.
단계 2:
5-
브로모
-3-
클로로
-2-(7-
플루오로피라졸로[4,3-c]피리딘
-2-일)
벤조니트릴
톨루엔(100 mL) 중 2-{[1-(4-아지도-5-플루오로피리딘-3-일)메트-(E)-일이덴]아미노}-5-브로모-3-클로로벤조니트릴(약 22.6 mmol)의 용액을 5 시간 동안 환류 가열하였다. 생성된 혼합물을 실온으로 냉각하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하고 수득된 고체를 여과로 수집하고 건조하여 회백색 고체로서 표제 화합물(4.61 g, 2 단계에 걸쳐서 58% 수율)을 수득하였다.
단계 3:
5-브로모-3-클로로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)벤조니트릴
5-브로모-3-클로로-2-(7-플루오로피라졸로[4,3-c]피리딘-2-일)벤조니트릴(4.6 g, 13.1 mmol)을 DCM(45 mL) 중에 용해하고 메틸트라이옥소레늄(324 mg, 1.3 mmol)을 첨가한 후, 30% 과산화수소 수용액(1.67 mL, 26.0 mmol)을 적가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 생성된 혼합물을 티오황산 나트륨 포화 수용액으로 급랭하고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 5 내지 10% 메탄올)로 정제하여 연황색 고체로서 표제 화합물(3.75 g, 78% 수율)을 수득하였다.
단계 4:
3-
클로로
-2-(7-
플루오로
-5-
옥시피라졸로[4,3-c]피리딘
-2-일)-5-
비닐벤조니트릴
트라이에틸아민(7.0 mL, 50 mmol)을 프로판-1-올(50 mL) 중 5-브로모-3-클로로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)벤조니트릴(3.68 g, 10.0 mmol), 칼륨 비닐 트라이플루오로보레이트(2.0 g, 15.0 mmol) 및 Pd(dppf)Cl2.CHCl3(408 mg, 0.5 mmol)의 혼합물에 첨가하고, 반응 혼합물을 100 ℃에서 1.5 시간 동안 가열하였다. 생성된 혼합물을 실온으로 냉각한 후 에틸 아세테이트와 탄산수소 나트륨 포화 수용액 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(DCM 중 4 내지 6% 메탄올)로 정제하여 갈색 유리로서 표제 화합물(945 mg, 30% 수율)을 수득하였다.
단계 5:
2-(4-
브로모
-7-
플루오로피라졸로[4,3-c]피리딘
-2-일)-3-
클로로
-5-
비닐벤조니트릴
인 옥시브로마이드(2.6 g, 9.0 mmol)를 DCM(15 mL) 중 3-클로로-2-(7-플루오로-5-옥시피라졸로[4,3-c]피리딘-2-일)-5-비닐벤조니트릴(936 mg, 3.0 mmol)의 용액에 첨가하고 반응 혼합물을 0 ℃에서 3 시간 동안 교반하였다. 생성된 혼합물을 탄산 나트륨 포화 수용액으로 급랭하고, DCM으로 희석하고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 20% 에틸 아세테이트)로 정제하여 황색 오일로서 표제 화합물(67 mg, 6% 수율)을 수득하였다.
단계 6:
3-
클로로
-2-[7-
플루오로
-4-(6-
메틸피리미딘
-4-
일아미노
)
피라졸로
[4,3-c]피리딘-2-일]-5-
비닐벤조니트릴
다이옥산(2.0 mL) 중 2-(4-브로모-7-플루오로피라졸로[4,3-c]피리딘-2-일)-3-클로로-5-비닐벤조니트릴(67 mg, 0.18 mmol), 6-메틸피리미딘-4-일아민(24 mg, 0.22 mmol), Pd2(dba)3(4 mg, 0.005 mmol), 잔포스(10 mg, 0.018 mmol) 및 탄산 세슘(117 mg, 0.36 mmol)의 혼합물을 탈기하고 질소로 퍼징하고 반응 혼합물을 80 ℃에서 밀봉된 바이알 중에 밤새 가열하였다. 생성된 혼합물을 실온으로 냉각한 후, 에틸 아세테이트와 물 사이에 나누었다. 층을 분리하고 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 70% 에틸 아세테이트)로 정제하여 갈색 유리로서 표제 화합물(42 mg, 58 % 수율)을 수득하였다.
단계 7:
3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-5-폼일벤조니트릴
오시뮴(VIII) 옥사이드(t-부탄올 중 2.5 중량%, 0.1 mL)를 아세톤(2.0 mL) 및 물(0.5 mL) 중 3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-5-비닐벤조니트릴(42 mg, 0.1 mmol)의 용액에 첨가하였다. 이어서, 나트륨 페리오데이트(47 mg, 0.22 mmol)를 첨가하고, 반응 혼합물을 실온에서 밤새 교반하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 실리카 겔 플래시 크로마토그래피(사이클로헥산 중 70 내지 80% 에틸 아세테이트)로 정제하여 황색 유리로서 표제 화합물(24 mg, 60% 수율)을 수득하였다.
단계 8:
3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-5-하이드록시메틸 벤조니트릴
에탄올(IMS 등급, 2.0 mL) 및 THF(2.0 mL) 중 3-클로로-2-[7-플루오로-4-(6-메틸피리미딘-4-일아미노)피라졸로[4,3-c]피리딘-2-일]-5-폼일벤조니트릴(24 mg, 0.06 mmol)의 용액에 수소화붕소 나트륨(4 mg, 0.1 mmol)을 첨가하고 반응 혼합물을 실온에서 2 시간 동안 교반하였다. 생성된 혼합물을 에틸 아세테이트와 물 사이에 나누고 층을 분리하였다. 유기층을 염수로 세척하고, 무수 황산 나트륨 상에서 건조하고, 여과하고 감압하에 농축하였다. 잔사를 다이에틸 에터로 마쇄하고 수득된 고체를 여과하고 건조하였다. 이어서, 이를 실리카 겔 플래시 크로마토그래피(에틸 아세테이트 중 0 내지 1% 메탄올)로 정제하여 백색 고체로서 표제 화합물(4.0 mg, 16% 수율)을 수득하였다.
LCMS(방법 B): RT = 2.78 분, m/z: 410 [M+H+].
비록 본 발명이 어느 정도 자세하게 기재되고 예시되었지만, 본 개시내용은 단지 예를 들어 개시된 것이고 청구항에 의해 정의되는 본 발명의 취지 및 범주에서 벗어나지 않고 당업자에 의해 조합 및 부분의 배열이 다양하게 변화될 수 있음이 이해된다.
Claims (24)
- 하기 화학식 I의 화합물 또는 이의 약학적으로 허용되는 염:
화학식 I
상기 식에서,
A는 CR3 또는 N이고;
X는 CR15 또는 N이고;
R1은 독립적으로 수소, 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, -CF3, -OR6, -SR6, -OCF3, -CN, -NO2, -C(O)R6, -C(O)OR6, -C(O)NR6R7, -S(O)1-2R6, -S(O)1-2NR6R7, -NR6SO2R7, -NR6SO2NR6R7, -NR6C(O)R7, -NR6C(O)OR7, -NR6C(O)NR6R7, -OC(O)NR6R7, -NR6R7, 3 내지 6 원 헤테로사이클릴 또는 페닐이되, R1은 둘다 동시에 수소일 수 없고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -CN, -OR6, -NR6R7, C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴 또는 페닐에 의해 임의적으로 치환되고, 상기 사이클로알킬, 헤테로사이클릴 및 페닐은 독립적으로 R10에 의해 임의적으로 치환되고;
R2 및 R3은 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR8, -(C0-C3 알킬렌)SR8, -(C0-C3 알킬렌)NR8R9, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R8, -(C0-C3 알킬렌)C(O)OR8, -(C0-C3 알킬렌)C(O)NR8R9, -(C0-C3 알킬렌)NR8C(O)R9, -(C0-C3 알킬렌)S(O)1-2R8, -(C0-C3 알킬렌)NR8S(O)1-2R9, -(C0-C3 알킬렌)S(O)1-2NR8R9, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)(5 또는 6 원 헤테로아릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R2 및 R3은 각각 독립적으로 R10에 의해 임의적으로 치환되고;
R4는 수소, -NR6-, -NR6R7, -NR6C(O)-, -NR6C(O)O-, -NR6C(O)NR7-, -NR6S(O)1-2- 또는 -NR6S(O)1-2NR7-이고;
R5는 존재하지 않거나, 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C10 사이클로알킬, C6-C10 아릴, 3 내지 10 원 헤테로사이클릴 또는 5 내지 10 원 헤테로아릴이고, 이때 R5는 R10에 의해 임의적으로 치환되고;
R6 및 R7은 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6사이클로알킬, 3 내지 10 원 헤테로사이클릴 또는 페닐이고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐, 옥소, -CN, -OR6, -NR6R7, C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴 또는 페닐에 의해 임의적으로 치환되고, 상기 사이클로알킬, 헤테로사이클릴 및 페닐은 독립적으로 R10에 의해 임의적으로 치환되거나,
R6 및 R7은 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 10 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환되고;
R8 및 R9는 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, 페닐, 3 내지 10 원 헤테로사이클릴이고, 상기 알킬, 알케닐, 알키닐, 사이클로알킬, 페닐 및 헤테로사이클릴은 독립적으로 R10에 의해 임의적으로 치환되거나,
R8 및 R9는 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 10 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐은 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환되고;
R10은 독립적으로 수소, 옥소, C1-C12 알킬, C2-C12 알케닐, C2-C12 알키닐, 할로겐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR11, -(C0-C3 알킬렌)SR11, -(C0-C3 알킬렌)NR11R12, -(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C=NR11(R12), -(C0-C3 알킬렌)C=NR11(OR12), -(C0-C3 알킬렌)C(O)R11, -(C0-C3 알킬렌)C(O)OR11, -(C0-C3 알킬렌)C(O)NR11R12, -(C0-C3 알킬렌)NR11C(O)R12, -(C0-C3 알킬렌)S(O)1-2R11, -(C0-C3 알킬렌)NR11S(O)1-2R12, -(C0-C3 알킬렌)S(O)1-2NR11R12, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 10 원 헤테로사이클릴), -(C0-C3 알킬렌)C(O)(3 내지 10 원 헤테로사이클릴) 또는 -(C0-C3 알킬렌)(C6-C10 아릴)이고, 이때 R10은 독립적으로 할로겐, 옥소, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C12 알킬, 옥소 또는 할로겐에 의해 임의적으로 치환된 C2-C12 알케닐, 옥소 또는 할로겐에 의해 임의적으로 치환된 C2-C12 알키닐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR13, -(C0-C3 알킬렌)SR13, -(C0-C3 알킬렌)NR13R14, -(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R13, -(C0-C3 알킬렌)C(O)OR13, -(C0-C3 알킬렌)C(O)NR13R14, -(C0-C3 알킬렌)NR13C(O)R14, -(C0-C3 알킬렌)S(O)1-2R13, -(C0-C3 알킬렌)NR13S(O)1-2R14, -(C0-C3 알킬렌)S(O)1-2NR13R14, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴), -(C0-C3 알킬렌)C(O)(3 내지 6 원 헤테로사이클릴) 또는 -(C0-C3 알킬렌)페닐에 의해 임의적으로 치환되고;
R11 및 R12는 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6사이클로알킬, 페닐 또는 3 내지 6 원 헤테로사이클릴이고, 상기 알킬, 알케닐, 알키닐, 사이클로알킬, 페닐 및 헤테로사이클릴은 독립적으로 할로겐, 옥소, -CN, -OR16, -NR16R17, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환되거나,
R11 및 R12는 이들이 부착된 원자와 함께 할로겐, 옥소, -OR16, -NR16R17, 또는 할로겐, 옥소 또는 OH에 의해 임의적으로 치환된 C1-C3알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R13 및 R14는 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이거나,
R13 및 R14는 이들이 부착된 원자와 함께 할로겐, 옥소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R15는 수소, 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, -(C0-C3 알킬렌)CN, -(C0-C3 알킬렌)OR18, -(C0-C3 알킬렌)SR18, -(C0-C3 알킬렌)NR18R19, -(C0-C3 알킬렌)CF3, -O(C0-C3 알킬렌)CF3, -(C0-C3 알킬렌)NO2, -(C0-C3 알킬렌)C(O)R18, -(C0-C3 알킬렌)C(O)OR18, -(C0-C3 알킬렌)C(O)NR18R19, -(C0-C3 알킬렌)NR18C(O)R19, -(C0-C3 알킬렌)S(O)1-2R18, -(C0-C3 알킬렌)NR18S(O)1-2R19, -(C0-C3 알킬렌)S(O)1-2NR18R19, -(C0-C3 알킬렌)(C3-C6 사이클로알킬), -(C0-C3 알킬렌)(3 내지 6 원 헤테로사이클릴) 또는 -(C0-C3 알킬렌)페닐이고, 이때 R15는 독립적으로 할로겐, 옥소, -CN, -CF3, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환되고;
R16 및 R17은 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이거나,
R16 및 R17은 이들이 부착된 원자와 함께 할로겐, 옥소, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C6알킬에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고;
R18 및 R19는 각각 독립적으로 수소, 또는 할로겐 또는 옥소에 의해 임의적으로 치환된 C1-C6 알킬이다. - 제 1 항에 있어서,
A가 CR3이고, X가 CR15인 화합물. - 제 1 항 또는 제 2 항에 있어서,
하나의 R1이 할로겐이고, 다른 R1이 수소, 할로겐, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C3-C6 사이클로알킬, -CF3, -OR6, -SR6, -OCF3, -CN, -NO2, -C(O)R6, -C(O)OR6, -C(O)NR6R7, -S(O)1-2R6, -S(O)1-2NR6R7, -NR6SO2R7, -NR6SO2NR6R7, -NR6C(O)R7, -NR6C(O)OR7, -NR6C(O)NR6R7, -OC(O)NR6R7, -NR6R7, 3 내지 6 원 헤테로사이클릴 또는 페닐이되, R1이 둘다 동시에 수소일 수 없고, 상기 알킬, 알케닐 및 알키닐이 독립적으로 할로겐, 옥소, -CN, -OR6, -NR6R7, C3-C6 사이클로알킬, 3 내지 6 원 헤테로사이클릴 또는 페닐에 의해 임의적으로 치환되고, 상기 사이클로알킬, 헤테로사이클릴 및 페닐이 독립적으로 R10에 의해 임의적으로 치환된 화합물. - 제 1 항 내지 제 3 항 중 어느 한 항에 있어서,
R1이 독립적으로 Cl, F 또는 -CN인 화합물. - 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,
R2가 수소인 화합물. - 제 1 항 내지 제 5 항 중 어느 한 항에 있어서,
R3이 수소, 하이드록실메틸, -C(O)H, 에테닐, -CN, -NH2, F, Cl, I 또는 -S(O)2CH3인 화합물. - 제 1 항 내지 제 7 항 중 어느 한 항에 있어서,
R4가 수소, -NR6-, -NR6C(O)-, -NR6C(O)O- 또는 -NR6C(O)NR7-인 화합물. - 제 1 항 내지 제 8 항 중 어느 한 항에 있어서,
R5가 C1-C6 알킬 또는 C3-C10 사이클로알킬, 페닐, 3 내지 10 원 헤테로사이클릴 또는 5 내지 10 원 헤테로아릴이고, 이때 R5가 R10에 의해 임의적으로 치환된 화합물. - 제 1 항 내지 제 10 항 중 어느 한 항에 있어서,
R6 및 R7이 각각 독립적으로 수소, 또는 R10에 의해 임의적으로 치환된 C1-C6 알킬이거나; R6 및 R7이 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 6 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐이 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환된 화합물. - 제 1 항 내지 제 11 항 중 어느 한 항에 있어서,
R8 및 R9가 각각 독립적으로 수소, C1-C6 알킬, C2-C6 알케닐 또는 C2-C6 알키닐이고, 상기 알킬, 알케닐 및 알키닐이 독립적으로 R10에 의해 임의적으로 치환되거나; R8 및 R9가 독립적으로 이들이 부착된 원자와 함께 할로겐, 옥소, -OR11, -NR11R12, C1-C6 알킬, C2-C6알케닐 또는 C2-C6 알키닐에 의해 임의적으로 치환된 3 내지 10 원 헤테로사이클릴을 형성하고, 상기 알킬, 알케닐 및 알키닐이 독립적으로 할로겐 또는 옥소에 의해 임의적으로 치환된 화합물. - 제 1 항 내지 제 12 항 중 어느 한 항에 있어서,
R10이 독립적으로 F, Cl, -CN, 메틸, 에틸, 이소프로필, -CH2OH, -CH2CH2OH, -CH(OH)CH2OH, -C(CH3)2OH, -CH2NH2, -CH2N(CH3)2, -CF3, -OH, -OCH3, -NH2, -NHCH3, -NHC(O)CH3, -N(CH3)2, -N(CH2CH2OH)2, -NHCH2CH2OH, -N(CH3)CH2CH2OH, -NHCH2C(CH3)2OH, -N(CH3)CH2C(CH3)2OH, -C(O)NH2, -C(O)NHCH3, -C(O)N(CH3)2, 또는 하기 구조식으로부터 선택된 화합물:
상기 식에서,
물결선은 화학식 I의 부착점을 나타낸다. - 제 1 항 내지 제 13 항 중 어느 한 항에 있어서,
R11, R12, R13, R14, R16, R17, R18 및 R19가 독립적으로 수소, 또는 옥소 또는 할로겐에 의해 임의적으로 치환된 C1-C6 알킬로부터 선택된 화합물. - 제 1 항 내지 제 14 항 중 어느 한 항에 있어서,
R15가 수소, F, Cl, Br, -CN, -OCH3 또는 메틸인 화합물. - 제 1 항에 있어서,
실시예 1 내지 165의 화합물 및 이의 약학적으로 허용되는 염으로부터 선택된 화합물. - 제 1 항 내지 제 16 항 중 어느 한 항의 화합물 및 약학적으로 허용되는 담체, 보조제 또는 비히클을 포함하는 약학 조성물.
- 제 1 항 내지 제 16 항 중 어느 한 항에 있어서,
치료에서 사용하기 위한 화합물. - 제 1 항 내지 제 16 항 중 어느 한 항에 있어서,
염증 질환의 치료를 위한 화합물. - 염증 질환의 치료에서 제 1 항 내지 제 16 항 중 어느 한 항의 화합물의 용도.
- 염증 질환의 치료 또는 예방용 약제의 제조를 위한 제 1 항 내지 제 16 항 중 어느 한 항의 화합물의 용도.
- 제 19 항 또는 제 20 항에 있어서,
염증 질환이 천식, 염증성 장 질환, 크론병, 맹낭염, 미세 장염, 궤양성 대장염, 류마티스 관절염, 건선, 알레르기성 비염, 아토피성 피부염, 접촉성 피부염, 지연 과민 반응, 낭창 또는 다발성 경화증인 화합물의 용도. - 상기 기재된 바와 같은 발명.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US41578210P | 2010-11-19 | 2010-11-19 | |
| US61/415,782 | 2010-11-19 | ||
| PCT/EP2011/070313 WO2012066061A1 (en) | 2010-11-19 | 2011-11-17 | Pyrazolopyridines and pyrazolopyridines and their use as tyk2 inhibitors |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140009259A true KR20140009259A (ko) | 2014-01-22 |
Family
ID=45093712
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137015732A KR20140009259A (ko) | 2010-11-19 | 2011-11-17 | 피라졸로피리딘 및 tyk2 억제제로서 이의 용도 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US9309240B2 (ko) |
| EP (1) | EP2640722B1 (ko) |
| JP (1) | JP2013542966A (ko) |
| KR (1) | KR20140009259A (ko) |
| CN (1) | CN103313987A (ko) |
| BR (1) | BR112013011520A2 (ko) |
| CA (1) | CA2817785A1 (ko) |
| MX (1) | MX2013005445A (ko) |
| RU (1) | RU2013126041A (ko) |
| WO (1) | WO2012066061A1 (ko) |
Families Citing this family (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2519517B1 (en) | 2009-12-29 | 2015-03-25 | Dana-Farber Cancer Institute, Inc. | Type ii raf kinase inhibitors |
| JP6106685B2 (ja) | 2011-11-17 | 2017-04-05 | ダナ−ファーバー キャンサー インスティテュート, インコーポレイテッド | C−jun−n−末端キナーゼ(jnk)の阻害剤 |
| US9944634B2 (en) * | 2012-10-31 | 2018-04-17 | Raqualia Pharma Inc. | Pyrazolopyridine derivatives as TTX-S blockers |
| HRP20220766T1 (hr) | 2012-11-08 | 2022-09-16 | Bristol-Myers Squibb Company | Amidom-supstituirani heterociklički spojevi korisni kao modulatori il-12, il-23 i/ili ifn alfa odgovora |
| WO2014146249A1 (en) | 2013-03-19 | 2014-09-25 | Merck Sharp & Dohme Corp. | Geminally substituted cyanoethylpyrazolo pyridones as janus kinase inhibitors |
| EA201591881A1 (ru) * | 2013-03-28 | 2016-04-29 | Такеда Фармасьютикал Компани Лимитед | Гетероциклическое соединение |
| WO2015171527A1 (en) * | 2014-05-05 | 2015-11-12 | Global Blood Therapeutics, Inc. | Pyrazolopyridine pyrazolopyrimidine and related compounds |
| US10870651B2 (en) | 2014-12-23 | 2020-12-22 | Dana-Farber Cancer Institute, Inc. | Inhibitors of cyclin-dependent kinase 7 (CDK7) |
| BR112017021408B1 (pt) | 2015-04-08 | 2022-05-17 | Bayer Cropscience Aktiengesellschaft | Derivados de heterociclo bicíclico condensado, método para controlar pragas animais, e formulação agroquímica |
| RU2018108149A (ru) | 2015-08-07 | 2019-09-09 | Байер Кропсайенс Акциенгезельшафт | 2-(гет)арил-замещенные конденсированные гетероциклические производные в качестве средства для борьбы с вредителями |
| JP7028766B2 (ja) | 2015-09-09 | 2022-03-02 | ダナ-ファーバー キャンサー インスティテュート, インコーポレイテッド | サイクリン依存性キナーゼの阻害剤 |
| MX2018005115A (es) | 2015-10-26 | 2018-05-28 | Bayer Cropscience Ag | Derivados de heterociclos biciclicos condensados como agentes de control de plagas. |
| WO2017093180A1 (de) | 2015-12-01 | 2017-06-08 | Bayer Cropscience Aktiengesellschaft | Kondensierte bicyclische heterocyclen-derivate als schädlingsbekämpfungsmittel |
| WO2017144341A1 (de) | 2016-02-23 | 2017-08-31 | Bayer Cropscience Aktiengesellschaft | Kondensierte bicyclische heterocyclen-derivate als schädlingsbekämpfungsmittel |
| EP3433615A1 (en) | 2016-03-21 | 2019-01-30 | Institut National de la Sante et de la Recherche Medicale (INSERM) | Methods for diagnosis and treatment of solar lentigo |
| WO2017174414A1 (de) | 2016-04-05 | 2017-10-12 | Bayer Cropscience Aktiengesellschaft | Naphthalin-derivate als schädlingsbekämpfungsmittel |
| EP3241830A1 (de) | 2016-05-04 | 2017-11-08 | Bayer CropScience Aktiengesellschaft | Kondensierte bicyclische heterocyclen-derivate als schädlingsbekämpfungsmittel |
| CN109153678B (zh) * | 2016-05-27 | 2020-04-14 | 石药集团中奇制药技术(石家庄)有限公司 | 作为fgfr4抑制剂的杂环化合物 |
| US10561145B2 (en) | 2016-07-19 | 2020-02-18 | Bayer Cropscience Aktiengesellschaft | Fused bicyclic heterocycle derivatives as pesticides |
| AU2017314083B2 (en) | 2016-08-15 | 2020-12-10 | Bayer Aktiengesellschaft | Condensed bicyclic heterocycle derivatives as pest control agents |
| AU2017328614B2 (en) | 2016-09-19 | 2022-01-13 | Bayer Aktiengesellschaft | Pyrazolo [1,5-a]pyridine derivatives and their use as pesticides |
| CA3039202A1 (en) * | 2016-10-14 | 2018-04-19 | Nimbus Lakshmi, Inc. | Tyk2 inhibitors and uses thereof |
| US11306070B2 (en) | 2016-11-22 | 2022-04-19 | Dana-Farber Cancer Institute, Inc. | Inhibitors of cyclin-dependent kinase 12 (CDK12) and uses thereof |
| US20180206726A1 (en) | 2016-12-07 | 2018-07-26 | Progenity Inc. | Gastrointestinal tract detection methods, devices and systems |
| AU2017378398B2 (en) | 2016-12-14 | 2023-02-02 | Biora Therapeutics, Inc. | Treatment of a disease of the gastrointestinal tract with a JAK inhibitor and devices |
| US11058115B2 (en) | 2017-01-10 | 2021-07-13 | Bayer Aktiengesellschaft | Heterocycle derivatives as pesticides |
| US11083199B2 (en) | 2017-01-10 | 2021-08-10 | Bayer Aktiengesellschaft | Heterocycle derivatives as pesticides |
| WO2018138050A1 (de) | 2017-01-26 | 2018-08-02 | Bayer Aktiengesellschaft | Kondensierte bicyclische heterocyclen-derivate als schädlingsbekämpfungsmittel |
| EP3305786A3 (de) | 2018-01-22 | 2018-07-25 | Bayer CropScience Aktiengesellschaft | Kondensierte bicyclische heterocyclen-derivate als schädlingsbekämpfungsmittel |
| JP2021514949A (ja) | 2018-02-21 | 2021-06-17 | バイエル・アクチエンゲゼルシヤフト | 有害生物防除剤としての縮合二環式ヘテロ環誘導体 |
| CA3090842A1 (en) | 2018-03-12 | 2019-09-19 | Abbvie Inc. | Inhibitors of tyrosine kinase 2 mediated signaling |
| WO2019246273A1 (en) | 2018-06-20 | 2019-12-26 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with a jak or other kinase inhibitor |
| WO2020092015A1 (en) | 2018-11-02 | 2020-05-07 | University Of Rochester | Therapeutic mitigation of epithelial infection |
| CN113164477A (zh) * | 2018-12-14 | 2021-07-23 | 达纳-法伯癌症研究所股份有限公司 | C-jun-n-末端激酶的吡唑并吡啶抑制剂及其用途 |
| US20220204499A1 (en) | 2019-02-26 | 2022-06-30 | Bayer Aktiengesellschaft | Condensed bicyclic heterocyclic derivatives as pest control agents |
| CN113710669A (zh) | 2019-02-26 | 2021-11-26 | 拜耳公司 | 作为农药的稠合双环杂环衍生物 |
| CN110343103A (zh) * | 2019-07-04 | 2019-10-18 | 深圳市格物致欣化学技术有限公司 | 吡唑并吡啶类化合物及其制备方法 |
| US20230107927A1 (en) | 2020-02-28 | 2023-04-06 | First Wave Bio, Inc. | Methods of treating iatrogenic autoimmune colitis |
| EP3944859A1 (en) | 2020-07-30 | 2022-02-02 | Assistance Publique Hôpitaux de Paris | Method for treating immune toxicities induced by immune checkpoint inhibitors |
| WO2023076161A1 (en) | 2021-10-25 | 2023-05-04 | Kymera Therapeutics, Inc. | Tyk2 degraders and uses thereof |
| CN116283993B (zh) * | 2021-12-20 | 2024-05-03 | 艾立康药业股份有限公司 | 一种嘧啶类化合物及其制备方法和应用 |
| WO2023233130A1 (en) | 2022-05-30 | 2023-12-07 | AdoRx Therapeutics Limited | Cd73 inhibitor compounds |
Family Cites Families (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CU22545A1 (es) | 1994-11-18 | 1999-03-31 | Centro Inmunologia Molecular | Obtención de un anticuerpo quimérico y humanizado contra el receptor del factor de crecimiento epidérmico para uso diagnóstico y terapéutico |
| ES517193A0 (es) | 1981-11-10 | 1983-12-01 | Wellcome Found | Un procedimiento para la preparacion de nuevos derivados de imidazo (4,5-c)piridina. |
| US4943533A (en) | 1984-03-01 | 1990-07-24 | The Regents Of The University Of California | Hybrid cell lines that produce monoclonal antibodies to epidermal growth factor receptor |
| CA2066428C (en) | 1989-09-08 | 2000-11-28 | Bert Vogelstein | Structural alterations of the egf receptor gene in human gliomas |
| AU661533B2 (en) | 1992-01-20 | 1995-07-27 | Astrazeneca Ab | Quinazoline derivatives |
| GB9314893D0 (en) | 1993-07-19 | 1993-09-01 | Zeneca Ltd | Quinazoline derivatives |
| ATE207366T1 (de) | 1993-12-24 | 2001-11-15 | Merck Patent Gmbh | Immunokonjugate |
| US5654307A (en) | 1994-01-25 | 1997-08-05 | Warner-Lambert Company | Bicyclic compounds capable of inhibiting tyrosine kinases of the epidermal growth factor receptor family |
| IL112249A (en) | 1994-01-25 | 2001-11-25 | Warner Lambert Co | Pharmaceutical compositions containing di and tricyclic pyrimidine derivatives for inhibiting tyrosine kinases of the epidermal growth factor receptor family and some new such compounds |
| IL112248A0 (en) | 1994-01-25 | 1995-03-30 | Warner Lambert Co | Tricyclic heteroaromatic compounds and pharmaceutical compositions containing them |
| EP0772609B1 (en) | 1994-07-21 | 1999-02-24 | Akzo Nobel N.V. | Cyclic ketone peroxide formulations |
| US5804396A (en) | 1994-10-12 | 1998-09-08 | Sugen, Inc. | Assay for agents active in proliferative disorders |
| US5543523A (en) | 1994-11-15 | 1996-08-06 | Regents Of The University Of Minnesota | Method and intermediates for the synthesis of korupensamines |
| DE69536015D1 (de) | 1995-03-30 | 2009-12-10 | Pfizer Prod Inc | Chinazolinone Derivate |
| GB9508565D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quiazoline derivative |
| GB9508538D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quinazoline derivatives |
| US5747498A (en) | 1996-05-28 | 1998-05-05 | Pfizer Inc. | Alkynyl and azido-substituted 4-anilinoquinazolines |
| AU6267896A (en) | 1995-06-07 | 1996-12-30 | Imclone Systems Incorporated | Antibody and antibody fragments for inhibiting the growth oftumors |
| BR9609617B1 (pt) | 1995-07-06 | 2010-07-27 | derivados de 7h-pirrol[2,3-d]pirimidina, e composição farmacêutica. | |
| US5760041A (en) | 1996-02-05 | 1998-06-02 | American Cyanamid Company | 4-aminoquinazoline EGFR Inhibitors |
| GB9603095D0 (en) | 1996-02-14 | 1996-04-10 | Zeneca Ltd | Quinazoline derivatives |
| CA2249446C (en) | 1996-04-12 | 2008-06-17 | Warner-Lambert Company | Irreversible inhibitors of tyrosine kinases |
| AU3766897A (en) | 1996-07-13 | 1998-02-09 | Glaxo Group Limited | Fused heterocyclic compounds as protein tyrosine kinase inhibitors |
| ID18494A (id) * | 1996-10-02 | 1998-04-16 | Novartis Ag | Turunan pirazola leburan dan proses pembuatannya |
| UA73073C2 (uk) | 1997-04-03 | 2005-06-15 | Уайт Холдінгз Корпорейшн | Заміщені 3-ціанохіноліни, спосіб їх одержання та фармацевтична композиція |
| US6002008A (en) | 1997-04-03 | 1999-12-14 | American Cyanamid Company | Substituted 3-cyano quinolines |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| JP4327259B2 (ja) | 1997-05-06 | 2009-09-09 | ワイス・ホールディングズ・コーポレイション | 多発性嚢胞腎の治療のためのキナゾリン化合物の使用 |
| ZA986729B (en) | 1997-07-29 | 1999-02-02 | Warner Lambert Co | Irreversible inhibitors of tyrosine kinases |
| ZA986732B (en) | 1997-07-29 | 1999-02-02 | Warner Lambert Co | Irreversible inhibitiors of tyrosine kinases |
| TW436485B (en) | 1997-08-01 | 2001-05-28 | American Cyanamid Co | Substituted quinazoline derivatives |
| NZ503991A (en) | 1997-11-06 | 2001-11-30 | American Cyanamid Co | Use of quinazoline derivatives as tyrosine kinase inhibitors for treating colonic polyps |
| NZ512189A (en) | 1998-11-19 | 2003-10-31 | Warner Lambert Co | N-[4-(3-chloro-4-fluoro-phenylamino)-7-(3-morpholin-4- yl-propoxy)-quinazolin-6-yl]-acrylamide useful as an irreversible inhibitor of tyrosine kinases |
| DK1221444T3 (da) | 1999-07-02 | 2005-11-14 | Eisai Co Ltd | Kondenserede imidazolforbindelser og lægemidler mod diabetes mellitus |
| TW200400034A (en) * | 2002-05-20 | 2004-01-01 | Bristol Myers Squibb Co | Pyrazolo-pyrimidine aniline compounds useful as kinase inhibitors |
| US7129239B2 (en) | 2002-10-28 | 2006-10-31 | Pfizer Inc. | Purine compounds and uses thereof |
| AU2003270701B2 (en) | 2002-10-31 | 2009-11-12 | Amgen Inc. | Antiinflammation agents |
| PL1713806T3 (pl) * | 2004-02-14 | 2013-09-30 | Irm Llc | Związki i kompozycje jako inhibitory kinaz białkowych |
| WO2005105803A2 (en) | 2004-04-28 | 2005-11-10 | Cv Therapeutics, Inc. | Purine derivatives as a1 adenosine receptor antagonists |
| GB0425035D0 (en) * | 2004-11-12 | 2004-12-15 | Novartis Ag | Organic compounds |
| WO2007019344A1 (en) | 2005-08-04 | 2007-02-15 | Sirtris Pharmaceuticals, Inc. | Imidazo [2,1-b] thiayole derivatives as sirtuin modulating compounds |
| WO2007039797A1 (en) | 2005-10-03 | 2007-04-12 | Pfizer Products Inc. | Use of cannabinoid receptor-1 antagonist for treating inflammation and arthritis |
| EP2032141B1 (en) | 2006-06-09 | 2012-10-31 | Merck Sharp & Dohme Corp. | Inhibitors of janus kinases |
| CA2676665A1 (en) * | 2007-01-30 | 2008-08-07 | Biogen Idec Ma Inc. | Modulators of mitotic kinases |
| CA2704711C (en) | 2007-09-24 | 2016-07-05 | Genentech, Inc. | Thiazolopyrimidine p13k inhibitor compounds and methods of use |
| CA2705138A1 (en) | 2007-11-08 | 2009-05-14 | Sirtris Pharmaceuticals, Inc. | Solubilized thiazolopyridines |
| EP3536687B8 (en) * | 2007-11-28 | 2021-09-08 | Dana-Farber Cancer Institute, Inc. | Small molecule myristate inhibitors of bcr-abl and methods of use |
| US8252791B2 (en) | 2008-08-13 | 2012-08-28 | Jenrin Discovery, Inc. | Purine compounds as cannabinoid receptor blockers |
| RU2011116928A (ru) | 2008-09-30 | 2012-11-20 | Астразенека Аб (Se) | Гетероциклические ингибиторы jак киназы |
| UA104010C2 (en) | 2008-12-18 | 2013-12-25 | Эли Лилли Энд Компани | Purine compounds |
| EA019685B1 (ru) | 2009-02-06 | 2014-05-30 | Янссен Фармасьютикалз, Инк. | Новые замещенные бициклические гетероциклические соединения в качестве модуляторов гамма-секретазы |
| TWI461425B (zh) | 2009-02-19 | 2014-11-21 | Janssen Pharmaceuticals Inc | 作為伽瑪分泌酶調節劑之新穎經取代的苯并唑、苯并咪唑、唑并吡啶及咪唑并吡啶衍生物類 |
| AU2010309882B2 (en) * | 2009-10-20 | 2016-01-28 | Cellzome Limited | Heterocyclyl pyrazolopyrimidine analogues as JAK inhibitors |
| CN102869359A (zh) * | 2010-03-17 | 2013-01-09 | 弗·哈夫曼-拉罗切有限公司 | 咪唑并吡啶和嘌呤化合物、组合物和使用方法 |
| BR112012027803A2 (pt) * | 2010-04-30 | 2016-08-09 | Cellzome Ltd | compostos de pirazol como inibidores de jak |
| US8697708B2 (en) * | 2010-09-15 | 2014-04-15 | F. Hoffmann-La Roche Ag | Azabenzothiazole compounds, compositions and methods of use |
-
2011
- 2011-11-17 WO PCT/EP2011/070313 patent/WO2012066061A1/en active Application Filing
- 2011-11-17 KR KR1020137015732A patent/KR20140009259A/ko not_active Application Discontinuation
- 2011-11-17 CA CA2817785A patent/CA2817785A1/en not_active Abandoned
- 2011-11-17 JP JP2013539251A patent/JP2013542966A/ja active Pending
- 2011-11-17 MX MX2013005445A patent/MX2013005445A/es not_active Application Discontinuation
- 2011-11-17 EP EP11790910.1A patent/EP2640722B1/en not_active Not-in-force
- 2011-11-17 RU RU2013126041/04A patent/RU2013126041A/ru not_active Application Discontinuation
- 2011-11-17 BR BR112013011520A patent/BR112013011520A2/pt not_active IP Right Cessation
- 2011-11-17 CN CN2011800652349A patent/CN103313987A/zh active Pending
-
2013
- 2013-05-16 US US13/896,024 patent/US9309240B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| MX2013005445A (es) | 2013-07-29 |
| EP2640722B1 (en) | 2015-11-04 |
| CN103313987A (zh) | 2013-09-18 |
| RU2013126041A (ru) | 2014-12-27 |
| JP2013542966A (ja) | 2013-11-28 |
| EP2640722A1 (en) | 2013-09-25 |
| WO2012066061A1 (en) | 2012-05-24 |
| US20130252941A1 (en) | 2013-09-26 |
| CA2817785A1 (en) | 2012-05-24 |
| BR112013011520A2 (pt) | 2019-09-24 |
| US9309240B2 (en) | 2016-04-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140009259A (ko) | 피라졸로피리딘 및 tyk2 억제제로서 이의 용도 | |
| US8697708B2 (en) | Azabenzothiazole compounds, compositions and methods of use | |
| KR20130001272A (ko) | 이미다조피리딘 및 푸린 화합물, 조성물 및 사용 방법 | |
| JP6847844B2 (ja) | 治療用ピリダジン化合物およびその使用 | |
| EP2742040B1 (en) | Indazole compounds, compositions and methods of use | |
| RU2561104C2 (ru) | Триазолопиридиновые соединения-ингибиторы jak и способы | |
| EP2348860B1 (en) | Pyrazolopyrimidine jak inhibitor compounds and methods | |
| WO2013007768A1 (en) | Tricyclic heterocyclic compounds, compositions and methods of use thereof as jak inhibitors | |
| WO2012085176A1 (en) | Tricyclic pyrazinone compounds, compositions and methods of use thereof as janus kinase inhibitors | |
| WO2013007765A1 (en) | Fused tricyclic compounds for use as inhibitors of janus kinases | |
| US20140206702A1 (en) | Imidazopyridine compounds, compositions and methods of use | |
| WO2016001341A1 (en) | Sulfonylaminopyridine compounds, compositions and methods of use | |
| CN107406418B (zh) | 4,5-二氢咪唑衍生物及其作为组蛋白脱甲基酶(kdm2b)抑制剂的用途 | |
| WO2016091916A1 (en) | Pyrazolylaminopurines as itk inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |