KR20120099154A - 암모늄 숙신산염을 함유하고 있는 발효 배지로부터의 숙신산의 정제 - Google Patents
암모늄 숙신산염을 함유하고 있는 발효 배지로부터의 숙신산의 정제 Download PDFInfo
- Publication number
- KR20120099154A KR20120099154A KR1020127020082A KR20127020082A KR20120099154A KR 20120099154 A KR20120099154 A KR 20120099154A KR 1020127020082 A KR1020127020082 A KR 1020127020082A KR 20127020082 A KR20127020082 A KR 20127020082A KR 20120099154 A KR20120099154 A KR 20120099154A
- Authority
- KR
- South Korea
- Prior art keywords
- succinic acid
- acid
- ion exchange
- succinate
- exchange resin
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C55/00—Saturated compounds having more than one carboxyl group bound to acyclic carbon atoms
- C07C55/02—Dicarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/42—Separation; Purification; Stabilisation; Use of additives
- C07C51/43—Separation; Purification; Stabilisation; Use of additives by change of the physical state, e.g. crystallisation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/42—Separation; Purification; Stabilisation; Use of additives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/42—Separation; Purification; Stabilisation; Use of additives
- C07C51/47—Separation; Purification; Stabilisation; Use of additives by solid-liquid treatment; by chemisorption
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C55/00—Saturated compounds having more than one carboxyl group bound to acyclic carbon atoms
- C07C55/02—Dicarboxylic acids
- C07C55/10—Succinic acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C55/00—Saturated compounds having more than one carboxyl group bound to acyclic carbon atoms
- C07C55/02—Dicarboxylic acids
- C07C55/14—Adipic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P1/00—Preparation of compounds or compositions, not provided for in groups C12P3/00 - C12P39/00, by using microorganisms or enzymes
- C12P1/04—Preparation of compounds or compositions, not provided for in groups C12P3/00 - C12P39/00, by using microorganisms or enzymes by using bacteria
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/40—Preparation of oxygen-containing organic compounds containing a carboxyl group including Peroxycarboxylic acids
- C12P7/44—Polycarboxylic acids
- C12P7/46—Dicarboxylic acids having four or less carbon atoms, e.g. fumaric acid, maleic acid
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/582—Recycling of unreacted starting or intermediate materials
Abstract
본 발명은 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산의 정제를 위한 프로세스에 관한 것이다. 본 발명에 기재된 숙신산의 정제를 위한 프로세스는 발효 배지 내에서의 암모늄 숙신산염을 쪼개기 위한 이온 교환 수지들의 사용을 포함한다. 양이온성 이온 교환 수지를 통한 발효 배지의 통과의 과정 동안, 상기 암모늄 숙신산염은 암모늄 양이온 및 숙신산염 음이온으로 쪼개진다. 상기 수지 표면 상에서의 양성자는 상기 암모늄 이온들에 대하여 교환되고 또한 상기 숙신산염 음이온은 상기 이온 교환 수지로부터 방출된 양성자들에 의해 숙신산으로 환원된다. 결합되어 있는 암모늄은 황산과 같은 강한 산의 첨가에 의해 상기 수지로부터 방출되며 또한 이에 의해 상기 이온 교환 수지는 후속적인 사용을 위하여 재생산된다. 이러한 프로세스의 재생산 단계로부터의 결과로서 암모늄 황산염 부산물은 비료의 소스로서 사용될 수 있다. 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산의 분리를 위한 프로세스는 또한 음이온성 이온 교환 수지로 수행될 수 있으며, 여기서는 상기 숙신산염 음이온은 이온 교환 수지의 표면 상에 보유되고 또한 후속적으로 재생산의 단계 동안에 상기 이온 교환 수지로부터 방출된다.
Description
본 출원은 2009년 12월 31일자로 출원된, 미국 가출원 번호 61/335,189에 대한 우선권을 주장한다.
발효 프로세스 기술에서의 발전에 의해 수반되는 미생물적 생물학적 경로에서의 유전적인 조작을 수행하는 우리의 능력에서의 발전은 농업적인 및 임업적인 재생산 가능한 원료 물질들(feedstocks)을 사용하여 상업적으로 현저한 양의 숙신산을 생산하는 것을 가능하게 하여왔다. 숙신산을 생산하도록 엔지니어링된 모든 미생물들은 좁은 pH 범위 내에서 최대 생산성에 도달한다. 이러한 이유 때문에, 숙신산의 발효적 생산 과정 동안, 발효 배지의 pH는 어떠한 중성화시키는 염기성 화합물들의 첨가에 의해 그 배지의 pH에서의 강하를 보상하는 수단으로써 중성의 pH로 유지된다. 이것은 숙신산의 염기성 염의 형태로서의 발효 배지 내에서의 숙신산의 축적(accumulation)의 결과를 가져온다. 따라서 상기 사용된 중성화시키는 염기의 특성에 따라, 숙신산은 발효 배지 내에서 소듐(sodium) 또는 포타슘(potassium) 또는 칼슘(calcium) 또는 암모늄(ammonium) 숙신산염으로서 축적된다. 이에 따라 발효 배지의 추가적인 하류 프로세싱(downstream processing of the fermentation broth)은 숙신산의 염기성 염을 함유하고 있는 발효 배지로부터 순수한 숙신산을 추출해 낼 것이 요구된다. 상기 중성화시키는 제재의 방출과 함께 상기 발효 배지로부터 숙신산을 회수하는 하류 프로세싱 방법은 상업적으로 성공적인 경로로서 숙신산을 제조하는데 있어서 바람직하다.
침전(precipitation), 증기 증류(steam distillation), 액체-액체 추출(liquid-liquid extraction), 역류 추출(counter-current extraction), 에스테르화 반응(esterification), 및 전기 투석과 추출의 조합(combination of electrodialysis and extraction)을 포함하는 몇 가지 다른 접근들이 발효 배지로부터 유기산들을 정제하기 위하여 후속되어져 왔다. 일반적으로, 상기 발효 배지는 숙신산을 회수하기 위한 어떤 특정한 프로세스 상에 놓여지기 이전에 세포상의 부스러기(cellular debris)를 제거하기 위하여 마이크로 여과(micro filtration) 및 한외 여과(ultrafiltration) 하에 놓여진다.
많은 수의 방법들이 숙신산의 염기성 염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위하여 보고되어져 왔다. 발효 배지로부터 숙신산을 회수하기 위한 모든 이러한 알려진 프로세스들은 상업적인 스케일 내에서 발효 배지로부터의 숙신산 생산에 대하여 길고 또한 고비용적인 것으로 알려져 있다.
미시간 바이오테크놀로지 인스티튜트(Michigan Biotechnology Institute)에양도된 미국 특허 번호 5,034,105는 소듐 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 제조하기 위한 프로세스를 제공한다. 이러한 프로세스는 수성의(aqueous) 그러나 불포화된 숙신산염 용액을 제조하기 위하여 상기 배지를 통상적인 전기 투석하에 놓는 것, 과포화된 숙신산 용액을 제조하기 위하여 상기 불포화된 숙신산염 용액을 물 분해 전기투석(Water Splitting Electrodialysis) 하에 놓는 것 및 다음으로 상기 과포화된 용액으로부터 숙신산을 결정화하는 단계들을 포함한다. 이 프로세스는 그것의 최근 20년의 존재 동안에 이 프로세스의 상업적 이용의 결여에 의하여 증명되는 바와 같이 대규모로서 발효 배지로부터의 숙신산의 정제를 위해서는 적합하지 못하다.
어플라이드 카보케미칼스(Applied CarboChemicals)에 양도된 미국 특허 번호들 5,958,744 및 6,265,190은 칼슘 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 방법을 제공한다. 이 방법에 따르면, 상기 발효 배지는 황산(sulfuric acid)의 첨가로서 산성화된다. 이러한 산성화 프로세스의 결과로서, 발효 배지로부터 숙신산염 음이온이 칼슘 숙신산염으로부터 방출되고, 양성자화되며(protonated) 및 그 결과로서 산성의 침전물들이 얻어진다. 숙신산을 획득하기 위하여 결과적인 침전물은 여과되고 또한 알콜로 세척(washing)된다. 이에 따라 생산된 숙신산이 요구되는 순도의 수준을 만족할 것인지 아닌지를 보여주는 것이 남아있다. 이에 더하여, 칼슘 황산염(calcium sulfate)(깁섬(gypsum))은 환경적으로 우려를 일으킨다.
로퀴에트 프레레(Roquette Freres)에 양도된 최근에 공개된 미국 특허 출원 공개 번호 US2010/0297715는 마그네슘 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 분리하고 또한 정제하기 위한 프로세스를 기재한다. 이러한 공개된 특허 출원 내에 기재된 분리 프로세스는 복잡하고 또한 고비용적이다. 상기 분리 프로세스는 재활용의 목적을 위한 시약들을 회수하기 위하여 바이폴라 전기 투석(bipolar electrodialysis), 증발 결정화(evaporative crystallization) 및 고온 처리(high temperature treatment)를 포함한다. 발효 배지로부터 숙신산의 회수에 관여되는 이러한 프로세스 단계들의 결과로서, 상업적인 스케일에서 이러한 프로세스를 사용하는 숙신산의 생산 비용은 매우 고비용적이 될 것이다.
BASF에 양도된 최근의 미국 특허 출원 공개 번호 2009/0137825는 발효 배지로부터 숙신산을 에스테르화하기 위한 반응성 증류 프로세스(reactive distillation process)를 개시하였다. 그러나, 상기 특허 출원 공개는 실행에 이르기까지 환원되어져 있는 발효 배지로부터 숙신산을 회수하기 위한 어떠한 실질적인 방법을 제공하지 않는다.
또한 많은 노력들이 이온 교환 수지와 관련되는 프로세스를 이용하여 발효 배지로부터 카르복실산을 회수하기 위하여 이루어져 왔다. 상기 이온 교환 수지는 카르복실산 염들을 포함하는 발효 배지로부터 카르복실산의 분리에 있어서 두 개의 다른 경로들에서 이용된다. 하나의 방법에 따르면, 상기 이온 교환 수지들은 이온 배제 모드(ion exclusion mode)에서 사용된다. 또 다른 방법에서, 이온 교환 수지들은 그 카르복실산 염들로부터 카르복실산의 분리에 도달하기 위하여 발효 배지 내에서의 카르복실산의 염들과 화학적으로 반응한다. 제1 방법은 이온 배제 크로마토그래피(ion exclusion chromatography)로 참조되고 또한 제2 방법은 이온 교환 크로마토그래피(ion exchange chromatography)로 참조된다.
미국 특허 번호 5,132,456은 수성의 원료 물질로부터 카르복실산을 회수하기 위한 방법을 제공하는데, 여기서 상기 카르복실산은 우선 염기성의 고체상의 흡착제(adsorbent) 또는 약간(moderately) 염기성인 이온 교환 수지 상으로 흡착되고, 또한 다음으로 그것을 알킬암모늄(alkylammonium) 또는 암모늄 카르복실산염(ammonium carboxylate)의 형성을 유도하는 수성의 알킬아민(alkylamine) 또는 암모니아(ammonia)로 처리하는 것에 의하여 상기 흡착제로부터 방출되고 이는 소망의 카르복실산 및 알킬아민 또는 암모니아로 분해된다.
미국 특허 번호 5,143,834는 매우 정제된 숙신산 생성물을 획득하기 위하여, 어떤 소듐 또른 다른 양이온들을 제거하기 위한 강한 산성의 이온 교환자 및 어떤 황산염 이온(sulfate ion) 또는 황산을 제거하기 위한 자유 염기(free base) 형태의 약한 염기성 이온에 의해 후속되는, 탈염화 전기 분해(desalting electrolysis) 및 물-쪼개짐 전기분해(water-splitting electrolysis)을 사용하는 발효 배지로부터 숙신산을 회수하기 위한 방법을 제공한다.
미국 특허 번호 5,168,055는 칼슘 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 방법을 제공한다. 제1 단계에서, 상기 발효 배지는 칼슘 숙신산염으로부터 숙신산을 방출하기 위하여 산성화된다. 이에 따라 방출된 숙신산은 매우 정제된 숙신산 생성물을 획득하기 위하여 강한 산성의 이온 교환 수지 및 약한 염기성의 이온 교환자를 통하여 통과한다. 양이온 교환자를 통과하는 통과의 과정 동안, 칼슘 및 다른 양이온들이 제거된다. 음이온성 교환 수지를 함유하고 있는 제2의 컬럼을 통과하는 후속적인 통과의 과정 동안, 황산염(sulfate) 및 다른 질소의 불순물들(nitrogenous impurities)과 같은 음이온성 불순물들이 제거된다.
미국 특허 번호 5,641,406은 강한 산성의 양이온 교환 수지 상에서의 이온 교환 크로마토그래피에 의해 락트산염을 함유하고 있는 발효 배지 리쿼로부터 순수한 락트산을 추출하기 위한 방법을 제공한다. 이 방법의 제1 단계에서, 상기 락트산염은, H+의 형태로서의 약한 산성의 양이온 교환자를 함유하고 있는 하나 또는 초과의 "예비적 컬럼들(preliminary columns)" 내에서의 진정의(genuine) 이온 교환의 방법에 의하여 자유산(free acid)으로 전환된다. 이 방법의 제2 단계에서, 상기 자유 락트산은, 하나 또는 초과의 "분리 컬럼들(seperation columns)" 내에서의 강한 산성의 이온 교환 수지를 사용하는 것에 의하여 상기 발효 용액 내에 존재하는 카르복실레이트(carboxylate) 및 다른 불순물들로부터 분리된다. 상기 프로세스는 50℃보다 높은 온도에서, 바람직하게는 70℃ 내지 80℃ 사이에서 수행된다.
미국 특허 번호들 5,068,418 및 5,068,419는 3차 아민(tertiary amine) 또는 피리딘 기능성 그룹들(pyridine functional groups)을 프로세싱하는 수-불용성 마크로 렉티큘러(water-insoluble macro reticular) 또는 젤 타입(gel type) 약한 염기성 음이온 교환 수지 또는 4차 아민 기능성 그룹들(tertiary amine functional groups)을 프로세싱하는 강한 염기성의 음이온성 교환 수지를 포함하는 흡착제를 사용하는 발효 배지로부터의 유기산의 분리를 위한 방법을 제공한다. 상기 유기산은 물 또는 황산과 같은 희석 무기산으로 상기 이온 교환 수지로부터 탈착된다.
미국 특허 번호 5,786,185는 락트산을 생산하기 위한 향상된 발효 프로세스를 제공한다. 이러한 프로세스에 의하면, 자유 락트산을 함유하고 있는 발효 배지는, 그것이 축적될 때에 락트산을 흡착하는 피리딘 그룹들을 포함하고 또한 처리된 플루이드 발효 배지를 상기 발효 용기로 되돌리는 고체-상의 폴리머의 효과적인 양과 함께 접촉된다.
미국 특허 번호 6,160,173은 락트산 및 락트산 염 혼합물을 포함하는 원료 용액으로부터 락트산을 회수하기 위한 물 비혼합성의 음이온 교환자(water immiscible anion exchanger)의 사용을 기재한다. 제1 단계에서, 상기 원료 용액은 음이온 교환자와 접촉되고 또한 음이온 교환자-락트산 첨가 생성물(aduuct)이 형성된다. 이 음이온 교환자-락트산 첨가 생성물으로부터, 락트산 에스테르 또는 아민이 축합 반응(condensation reaction)을 통하여 생성된다.
로퀴에트 프레레(Roquette Freres)에 양도된 미국 특허 번호 6,280,985는 양이온 교환 수지와 함께 이온 배제 크로마토그래피를 사용하는 발효 배지로부터 락트산의 분리 및 정제를 위한 방법을 개시한다. 이 방법은 양이온 교환 수지를 통한 크로마토그래피적인 분리 이외에 수 개 유닛의 작동들을 포함한다. 이에 따라, 상기 원래의 발효 배지는 85/15의 자유 락트산/암모늄 락트산염 비율에 도달하기 위하여 농축된 산으로의 산성화에 의해 후속되는 제1 단계에서 농축된다. 상기 산성화된 배지는 최대 25%의 락트산 염을 포함하는 분획(fraction)을 획득하기 위하여 적어도 4%의 디비닐벤젠(divinylbenzene)과 함께 교차-연결된(cross-linked) 폴리스티렌 술폰산 타입(polystyrene sulfonic acid)의 양이온 교환 수지를 통하여 통과된다. 상기 발효 배지 내에서 비소모된 슈거들 및 단백질들과 같은 불순물들 및 어떤 해리된 락트산에 대응하는 다가의(polyvalent) 이온들 칼슘, 마그네슘 및 어떤 염기를 포함하는 타입의 무기산 염들의 모두가 물로의 용출(elution)에 의하여 제1 분획내에서 제거된다. 그 다음의 분획은 원래의 발효 배지 내에 존재하는 락트산 염의 건조 중량으로 최대 25%의 자유 형태로의 락트산을 함유한다. 이 분획은 추가적으로 정제된, 농축된 락트산을 획득하기 위하여 바이폴라 분별 전기 투석(bipolar fractionating electrodialysis) 하에 놓여진다.
미국 특허 번호 6,284,904는 강한 염기성 음이온 용액 또는 음이온 수지에 대하여 결합된 유기산의 그것보다 낮는 pKa를 갖는 산에 의한 유기산의 치환(displacement)에 의해 후속되는, 숙신산과 같은 유기산이 음이온 수지에 대하여 결합되는, 음이온 교환 크로마토그래피를 사용하는 유기산들의 정제를 위한 방법을 개시한다.
미국 특허 번호 6,319,382는 암모늄 락트산염(ammonium lactate)을 함유하는 발효 배지로부터 락트산을 회수하기 위한 방법을 제시하는데, 여기서 상기 방법은 나노 여과(nanofiltration), 칼슘 및 마그네슘과 같은 2가의 양이온들을 예비적으로 제거하는 킬레이팅 수지를 사용하는 이온 교환 및 최종의 두-단계 전기 투석 과정의 단계들을 포함한다.
미국 특허 7,238,837은 양이온 교환 수지를 이용하는 방법을 통하여 소듐 락트산염의 락트산으로의 56%의 전환 효율을 갖는 락트산염을 함유하고 있는 수성의 용액으로부터 락트산을 회수하기 위한 방법을 제공한다.
미국 특허 7,439,392는 수-불용성, 마이크로 렉티큘러 또는 젤, 4차 또는 3차 아민 기능성 그룹들을 프로세싱하는 강한 또는 약한 염기성 음이온 교환자 수지를 포함하는 흡착제, 교차-연결된 아크릴성 또는 스티렌 수지 매트릭스를 포함하는 음이온성 교환 수지 및 물 또는 희석 황산을 포함하는 탈착제를 사용하는 것에 의하여 발효 배지로부터 시트르산을 분리하기 위한 방법을 제공한다. 상기 원료(feed)의 pH는 선택성을 유지하기 위하여 시트르산의 제1 이온화 상수(first ionization constant (pKal))보다 낮게 유지된다.
미국 특허 출원 공개 번호 2006/0276674는 발효 배지로부터 숙신산을 정제하기 위한 방법을 기재한다. 이 방법에 따르면, 숙신산을 함유하는 리퀴드 내에서의 불순물들은 어떤 양의 H-타입 강한 산성의 양이온-교환 수지를 사용하는 이온-교환과 우수한 수득률로서 높은 순도의 숙신산을 생산하기 위한 결정화 과정을 결합하는 것에 의하여 효과적으로 제거될 수 있었다.
특허 협정 조약 하에 공개된 국제 출원 번호 WO 2007/040458는 락트산을 함유하고 있는 발효 배지로부터 락트산을 회수하는 프로세스 내에서 이온 교환 수지를 사용하여 양이온성 및 음이온성의 불순물들을 제거하기 위한 방법을 제공한다. 그 암모늄 이온들은 강한 양이온성 교환 수지를 사용하여 제거되었고 또한 상기 음이온 교환 수지는 황산염 불순물을 제거하기 위하여 사용되었다.
특허 협정 조약 하에 공개된 및 아밀럼 벨지움(Amylum Belgium)에 양도된 국제 출원 번호 WO 98/30712는 양이온 교환 수지를 사용하는 암모늄 아스파트산염(ammonium aspartate) 로부터 결정화된 아스파트산을 회수하기 위한 방법을 제공한다.
발효 배지로부터 유기산들을 회수하기 위하여 지금까지 테스트된 다양한 방법들은 한계점들을 나타내었고 또한 이에 따라 향상에 대한 기회들을 제공한다.
모든 참조들은 독자의 편의를 위하여 하기에 기재된다. 각 참조 문헌은 그것의 전체로서 참조로서 포함된다.
베치쏠드, I.(Bechthold, I.), 브레츠, K.(Bretz, K.), 카바사이, S.(Kabasci, S.), 코피츠키, R.(Kopitzky, R.), 스프링거, A.(Springer, A.) (2008) 숙신산: 재생 가능한 리소스로부터의 생물적 베이스의 폴리머에 대한 새로운 플랫폼 화합물(Succinic acid: a new platform chemical for bio-based polymers from renewable resources). Chem. Eng. Technol. 5: 647-654.
데이비슨, B. H.(Davison, B. H.), 엔하임, N. P.(Nghiem, N. P.), 리차드슨, G. L.(Richardson, G. L.) (2004) 발효 배지로부터 숙신산 흡착 및 재생산(Succinic acid adsorption from fermentation broth and regeneration). App. Biochem. Biotechnol. 1 13-116: 653-669.
델홈, C(Delhomme, C.), 웨스터-보츠, D.(Weuster-Botz, D.), 쿤, F. E.(Kuhn, F. E.) (2009) 재생산 가능한 리소스로부터의 C4 빌딩-블럭 화합물로서의 숙신산-블럭 화합물-수성의 배지 내에서 촉매적 가능성에 대한 리뷰(Succinic acid from renewable resources as a C4 building-block chemical - a review of the catalytic possibilities in aqueous media). Green Chem. 1 1 : 13-26.
홍, Y. K.(Hong, Y. K.), 홍, W. H.(Hong, W. H.) (2000a) 다양한 희석물 내에서 트리프로피아민(TPA)으로의 숙신산의 반응성 추출(Reactive extraction of succinic acid with triprophyamine (TPA) in various diluents). Bioproc. Eng. 22:284-284.
홍, Y. K.( Hong, Y. K.), 홍, W. H.(Hong, W. H.) (2000b) 3차 아민들로의 수성의 용액으로부터 숙신산의 반응성 추출에 대한 평형 스터디(Equilibrium studies on reactive extraction of succinic acid from aqueous solutions with tertiary amines). Bioproc. Eng. 22: 477-481.
홍, Y. K.(Hong, Y. K.), 홍, W. H.(Hong, W. H.) (2000c) 혼합된 3차 아민의 1-옥탄올/n-헵탄 용액으로의 숙신산의 추출(Extraction of succinic acid with 1-octanol/n- heptane solutions of mixed tertiary amine). Biopro. Engineer. 23: 535-538.
홍, S. H.(Hong, S. H.), 리, S. Y.(Lee, S. Y.) (2001) 증폭된 말릭 효소 활성도로의 재조합 에셰키리아 콜리에 의한 숙신산 생산에 대한 대사적 흐름 분석(Metabolic flux analysis for succinic acid production by recombinant Escherichia coli with amplified malic enzyme activity). Biotechnol. Bioeng. 74: 89-95.
홍, Y. K.(Hong, Y. K.), 홍, W. H.(Hong, W. H.), 장, H. N.(Chang, H. N.) (2010) 숙신산 및 아세트산의 바이너리 혼합물로부터 숙신산의 선택적 추출(Selective extraction of succinic acid from binary mixture of succinic acid and acetic acid). Biotechnol. Lett. 22: 871-874.
허, Y. S.(Huh, Y.S.), 전, Y-S.(Jun, Y-S.), 홍, Y. K.(Hong, Y. K.), 송, H.(Song, H.), 리, S. Y.(Lee, S. Y.), 홍, W. H.(Hong, W. H.) (2006) 만하이머 숙시니프로듀슨스에 의해 생산된 발효 배지로부터의 숙신산의 효과적인 정제(Effective purification of succinic acid from fermentation broth produced by Mannheimia succiniproducens). Process Biochem. 41 : 1461-1465.
인시, I(Inci, I.) (2007) MIBK에 용해되어 있는 트리도데실아민에 의한 숙신산의 반응성 추출에 대한 선형 구조 에너지 관계 모델링 및 동력학 연구(Linear salvation energy relationship modeling and kinetic studies on reactive extraction of succinic acid by tridodecylamine dissolved in MIBK). Biotechnol Prog. 23: 1171-1179.
잔타마, K.(Jantama, K.), 홉트, M. J.(Haupt, M. J.), 스보로노스, S. A.(Svoronos, S. A.), 장, X.(Zhang, X.), 무어, J. C.(Moore, J. C.), 샨무감, K. T.(Shanmugam, K. T.), 인그람, L. O.(Ingram, L. O.) (2008a) 숙신산염 및 말산염을 생산하는 에셰리키아 콜리 C의 비재조합 스트레인을 개발하기 위한 대사적 엔지니어링 및 대사적 진화의 결합(Combining metabolic engineering and metabolic evolution to develop nonrecombinant strains of Escherichia coli C that produce succinate and malate). Biotechnol. Bioeng. 99: 1140-1153.
잔타마, K.(Jantama, K.), 장, X.(Zhang, X.), 무어, J. C.(Moore, J. C.), 샨무감, K. T.(Shanmugam, K. T.), 스보로노스, S. A.(Svoronos, S. A.), 인그람, L. O. (Ingram, L. O.) (2008b) 에셰리키아 콜리 C의 엔지니어링된 스트레인들 내에서 부산물을 제거하는 것 및 숙신산 수율을 향상시키는 것(Eliminating side products and increasing succinate yields in engineered strains of Escherichia coli C). Biotechnol. Bioeng. 101 : 881-893.
전, Y-S.(Jun, Y-S.), 허, Y. S.(Huh, Y.S.), 홍, W. H.(Hong, W. H.), 홍, Y. K.(Hong, Y. K.) (2005) 1-옥탄올 용액 내에서 트리-n-옥틸아민으로의 숙신산의 추출의 동력학(Kinetics of the extraction of succinic acid with tri-n-octylamine in 1-Octanol solution). Biotechnol. Prog. 21 : 1673-1679.
커즈락, T.(Kurzrock, T.), 웨스터-보츠, D.(Weuster-Botz, D.) (2010) 발효 배지로부터 숙신산의 회수(Recovery of succinic acid from fermentation broth). Biotechnol. Lett. 32: 331-339.
리, Q.(Li, Q.), 리, W-L(Li, W-L), 왕, D.(Wang, D.), 리우, B-b.(Liu, B-b.), 탕, H.(Tang, H.), 양, M-h.(Yang, M-h.), 리우, Q-f(Liu, Q-f), 씽, J-m.(Xing, J-m.), 수, Z-g.(Su, Z-g.) (2010) 음이온 교환 수지들 상에서의 숙신산 흡착 동안 pH 중성화(pH Neutrallization while succinic acid adsorption onto anion exchange resins). Appl. Biochem. Biotechnol. 160:438-445.
루쿠, R.(Luque, R.), 린, C. S.(Lin, C. S.), 두, C(Du, C), 맥쿼리, D. J.(Macquarrie, D. J.), 코우티나스, A. (Koutinas, A.), 왕, R.(Wang, R.), 웹, C(Webb, C), 클락, J. H.(Clark, J. H.) (2009) 새로운 직접적인 진공 증류-결정화 방법에 의한 발효 배지로부터 회수된 숙신산의 화학적 변형(Chemical transformations of succinic acid recovered from fermentation broths by a novel direct vacuum distillation-crystallization method). Green Chem. 11 : 193- 200.
송, H.(Song, H.), 허, Y. S.(Huh, Y.S.), 리, S. Y.(Lee, S. Y.), 홍, W. H.(Hong, W. H.), 홍, Y. K.(Hong, Y. K.) (2007) 대사적으로 엔지니어링된 만하이머 숙시니프로듀슨스 스트레인의 발효에 의해 생성된 숙신산의 회수(Recovery of succinic acid produced by fermentation of a metabolically engineered Mannheimia succiniproducens strain). J. Biotechnol. 132: 445-452.
본 발명의 목적은 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 상업적으로 실행 가능한 프로세스를 제공하는 것이다.
본 발명의 목적은 숙신산의 중성적 염의 형태로서 2 내지 10% 숙신산을 함유하고 있는 발효 배지로부터 상기 숙신산의 적어도 90%(w/w)을 회수하는 것이다. 이로써 회수되는 숙신산은 흰색의 결정의 외관을 가질 것이고 또한 99.5%(w/w) 또는 초과의 순도를 가질 것이다. 상기 숙신산 분획 내에서의 바람직한 황산염 농도는 100 ppm 미만이다. 본 발명의 프로세스에 따라 획득되는 숙신산 분획 내에서의 가장 바람직한 황산염 농도는 30 ppm 미만이다. 본 발명은 발효 배지 내에 존재하는 숙신산의 암모늄 염으로부터 숙신산을 제조하기 위한 프로세스들을 제공한다. 이 발명에 따르는 프로세스들은 상업적으로 현저한 양으로서 순수한 형태로의 숙신산의 회수에서 이온 교환 수지들의 사용을 포함한다. 본 발명이 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스를 상세하게 기술한다고 하더라도, 생물학적 원료 물질로부터 유기산을 생산하는 기술 분야에서의 지식이 있는 사람은 본 발명의 크로마토그래피적인 프로세스를 암모늄 숙신산염 이외의 염 형태들로 숙신산을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위하여 또한 비용-효과적인 방법으로 상업적으로 현저한 양으로 발효 배지로부터 어떤 다른 유기산 염들을 회수하는데 있어 적용할 수 있을 것이다.
본 발명에서, 상기 이온 교환 수지는 상기 발효 배지 내에 존재하는 암모늄 숙신산염으로부터 숙신산을 방출하는 목적을 위한 염 쪼개짐 반응(salt splitting reaction)을 매개하는데에 사용된다. 본 발명에 따르는 염 쪼개짐 반응(salt splitting reaction)은 음이온성 또는 양이온성 이온 교환 수지 중 어느 것을 사용하여 달성될 수 있다.
본 발명의 일 관점에서, 암모늄 숙신산염을 포함하는 용액으로부터 숙신산의 정제를 위한 이온 교환 프로세스는 양이온성 이온 교환 수지를 사용한다. 암모늄 숙신산염을 포함하는 수성의 용액으로부터 양이온성 이온 교환 수지를 사용하여 숙신산을 정제하기 위한 프로세스는 하기의 단계들을 포함한다: (a) 숙신산의 암모늄 염을 포함하는 수성의 용액을 제공하는 것; (b) 숙신산의 암모늄 염을 포함하는 수성의 용액과 양이온성 이온 교환 수지를 접촉시키는 것; (c) 수성의 용액 내에서 숙신산의 암모늄 염을 숙신산 및 암모늄 양이온으로 전환하는 것; (d) 수성의 용액으로부터 암모늄 양이온을 분리하고, 수성의 용액 내에 숙신산을 남겨두는 것; 및 (e) 수성의 용액 내에서 숙신산을 회수하는 것. 양이온성 이온 교환 수지와의 접촉에 따라, 상기 암모늄 숙신산염은 암모늄 이온 및 숙신산염 이온으로 쪼개진다. 이에 따라 염 쪼개짐 반응으로부터 생산된 암모늄 이온은 상기 양이온성 수지의 표면에 대하여 결합하고 및 이에 의해 상기 양이온성 이온 교환 수지는 암모늄 염 형태로 전환된다. 후속적으로, 그것의 암모늄 염 형태로서의 양이온성 이온 교환 수지는 그것을 염산(hydrochloric acid) 또는 황산(sulfuric acid)과 같은 강산으로 세척하는 것에 의하여 그것의 원래의 형태로 재생산된다. 상기 양이온성 이온 교환 수지의 재생산 단계로부터의 결과인 암모늄 염은 상업적인 사용으로 또는 발효 프로세스에 대하여 재활용되는 양자 중 어느 하나로 놓여질 수 있다. 암모늄 숙신산염을 포함하는 수성의 용액으로부터의 숙신산의 분리에 대한 최상의 효율에 도달하기 위하여, 양이온성 이온 교환 수지를 사용하는 연속적인 프로세스가 양이온성 이온 교환 수지를 사용하는 통상적인 컬럼 크로마토그래피를 포함하는 배치 프로세스에 비해 선호된다.
또한 본 발명의 다른 실시예에서, 음이온성 이온 교환 수지의 사용을 기반으로 하는 이온 교환 프로세스가 암모늄 숙신산염을 포함하는 수성의 용액으로부터 숙신산을 회수하기 위하여 사용된다. 양이온성 이온 교환 수지를 포함하는 이온 교환 크로마토그래피와의 경우에서와 같이, 음이온성 이온 교환 수지를 사용하는 암모늄 숙신산염을 포함하는 수성의 용액으로부터의 숙신산의 정제는 염 쪼개짐 반응을 포함한다. 암모늄 숙신산염은 상기 음이온성 이온 교환 수지의 표면 상에서 암모늄 양이온 및 숙신산 염 음이온으로 쪼개지고 또한 이에 따라 생산된 숙신산염 음이온은 상기 수지의 표면 상에서의 음이온성 종류에 대하여 교환된다. 따라서 숙신산의 음이온은 상기 수지의 표면 상에 잡혀 있고 반면 음이온성 이온 교환 수지로부터 방출된 음이온은 암모늄 양이온과 결합하여 상기 수성의 용액 내의 원래의 암모늄 숙신산염의 자리에서 새로운 암모늄 염을 생성한다. 상기 새롭게 형성된 암모늄 염은 라피네이트 분획 내에서 이온 교환 컬럼으로부터 용출된다. 상기 음이온성 이온 교환 수지에 대하여 결합된 숙신산염 이온은 후속적으로 강한 무기산의 첨가에 의해 상기 이온 교환 수지로부터 방출된다. 상기 이온 교환 수지로부터 숙신산을 방출하는 것 이외에 강한 무기산을 포함하는 이러한 세척 단계는, 상기 음이온성 이온 교환 수지를 그것의 원래의 형태로 재생산하여 이에 따라 그것은 암모늄 숙신산염을 포함하는 새로운 수성의 용액의 첨가와 함께 염 쪼개짐 반응을 한번 더 매개할 수 있다.
암모늄 숙신산염을 함유하고 있는 발효 프로세스로부터 숙신산의 회수를 위한 이온 교환 프로세스는 배치 모드로 또는 연속적인 모드로의 어느 하나로 작동된다. 연속적인 모드에서의 이온 교환 프로세스의 작동이 배치 모드에 비해 선호된다.
이온 교환 수지를 포함하는 이러한 연속적인 또는 배치 프로세스에서 사용되는 발효 배지는 숙신산의 회수를 향상시키기 위하여 하나 또는 초과의 경로에서 이온 교환 수지 프로세스에서의 사용 이전에 프로세싱 될 수 있다. 본 발명의 일 관점에서, 상기 발효 배지는 유기 용매들을 포함하는 탈수 프로세스(dehydration process) 하에 놓여진다. 본 발명의 다른 관점에서, 암모늄 숙신산염을 함유하고 있는 발효 배지는 그 산 형태로서의 숙신산의 회수를 향상시키고자 하는 목적을 가지고 그 발효 배지 내에서의 미립자 물질을 제거하기 위하여 마이크로 여과 및 한외 여과 하에 놓여진다.
상기 이온 교환 프로세스로부터 획득되는 숙신산은 결정화된 형태로서의 숙신산을 획득하기 위하여 결정화 프로세스 하에 놓여진다. 상기 이온 교환 프로세스 내에서 부산물로서 회수된 암모늄 황산염은 또한 결정화 또는 농축 프로세스 하에 놓여진다.
본 발명의 또 다른 실시예에서, 상기 이온 교환 프로세스로부터 회수되는 숙신산은 발효 배지로부터 회수되는 숙신산의 퀄리티를 향상시키기 위하여 폴리싱 프로세스(polishing process) 하에 놓여진다. 본 발명의 일 관점에서, 상기 이온 교환 프로세스로부터 회수되는 숙신산은 나노 여과(nanofiltration) 하에 놓여지고 이에 따라 상기 나노 여과 프로세스 후에 획득되는 숙신산 결정들은 바람직한 색상 및 최소한의 오염 수준을 갖는다.
본 발명의 목적은 숙신산의 중성적 염의 형태로서 2 내지 10% 숙신산을 함유하고 있는 발효 배지로부터 상기 숙신산의 적어도 90%(w/w)을 회수하는 것이다. 이로써 회수되는 숙신산은 흰색의 결정의 외관을 가질 것이고 또한 99.5%(w/w) 또는 초과의 순도를 가질 것이다. 상기 숙신산 분획 내에서의 바람직한 황산염 농도는 100 ppm 미만이다. 본 발명의 프로세스에 따라 획득되는 숙신산 분획 내에서의 가장 바람직한 황산염 농도는 30 ppm 미만이다. 본 발명은 발효 배지 내에 존재하는 숙신산의 암모늄 염으로부터 숙신산을 제조하기 위한 프로세스들을 제공한다. 이 발명에 따르는 프로세스들은 상업적으로 현저한 양으로서 순수한 형태로의 숙신산의 회수에 이온 교환 수지들의 사용을 포함한다.
도 1은 숙신산 하류 회수 프로세스(succinic acid downstream recovery process)에 대한 블록 플로우 다이아그램이다. 상기 발효 배지는 그것을 연속적인 이온 교환(continuous ion exchange (CIX)) 프로세스 하에 놓기 이전에 마이크로 여과(microfiltration) 및 한외 여과(ultra filtration) 하에 놓는다. 연속적인 이온 교환 프로세스로부터의 숙신산 분획(succinic acid fraction (SAC))은 증발(evaporation) 이전에 나노 여과(nanofiltraion)/폴리싱(polishing) 단계들 및 후속적으로 결정의 형태로서의 숙신산을 회수하기 위하여 결정화 단계들 하에 놓여진다. 연속적인 이온 교환 프로세스로부터의 암모늄 황산염(ammonium sulfate (AMS)) 분획은 암모늄 황산염 결정을 회수하기 위하여 증발 프로세스 하에 놓여진다.
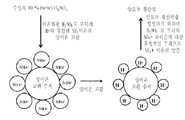
도 2 양이온 교환 및 양이온성 이온 교환 수지의 표면 상에서의 암모늄 숙신산염의 숙신산으로의 전환에 대한 도식적인 표현. 상기 양이온 교환 수지의 표면상에서, 암모늄 숙신산염은 숙신산염 음이온 및 암모늄 양이온으로 쪼개진다. 암모늄 양이온은 상기 양이온 교환 수지를 형성하는 양성자의 방출과 함께 상기 양이온 교환 수지의 표면 상에서 양성자에 대하여 교환된다. 상기 방출된 양성자는 상기 숙신산염 음이온과 결합하여 숙신산의 형성의 결과를 가져온다.
도 3 암모늄 황산염을 생산하기 위하여 H2SO4를 포함하는 양이온 교환 수지의 재생산에 대한 도식적인 표현. 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스의 제1 단계에서, 상기 발효 배지는 상기 양이온 교환 수지와 접촉하도록 놓여진다. 상기 암모늄 숙신산염은 상기 양이온 교환 수지의 표면상에서 쪼개지고 또한 그 결과적인 암모늄 양이온은 상기 양이온 교환 수지의 표면상에서의 양성자에 대하여 교환된다. 상기 양이온 교환 수지의 표면에 대하여 결합된 암모늄은 황산과 같은 강한 산을 사용하는 제2의 재생산 단계에서 방출된다. 상기 황산 처리에 의하여, 상기 수지의 표면 내의 암모늄 이온은 양성자에 대하여 교환된다. 이에 따라 상기 수지의 표면으로부터 방출된 암모늄 이온은 황산의 해리로부터의 결과인 황산염 이온과 결합하여 암모늄 황산염의 형성을 유도한다.
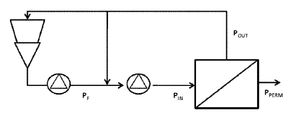
도 4 암모늄 숙신산염을 함유하고 있는 발효 배지의 설명 위한 도시. 사용된 약어들: PF=원료 압력(Feed pressure); PIN = 입구 멤브레인 압력(Inlet membrane pressure); POUT = 출구 멤브레인 압력(Outlet membrane pressure) (PF에 근접함); PPERM = 투과물 압력(Permeate pressure) (개방 밸브에 의해 조절됨); DP = PIN - POUT: 압력 강하(pressure drop) (약 1.5 bar); TMP = (PIN + POUT) / 2 - PPERM: 막관통 압력(Transmembrane pressure).
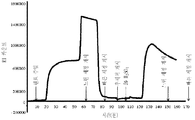
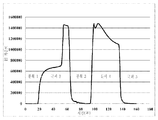
도 5 다우웩스(Dowex) G-26 H 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피적 프로파일. 양이온성 이온 교환 수지의 재생산이 5%(w/w) H2SO4로 수행되었다. 원료 스트림(feed stream)의 도입에 대한 시간점들(time points), 및 느린 세정(slow rinse), 빠른 세정(fast rinse), 후세척(backwash) 및 황산 첨가를 위한 개시점이 분(minutes)으로서의 시간을 보여주는 X-축 상의 하방향 포인팅 화살표들에 의해 표시된다. Y-축 상에서 보여지는 것은 크로마토그래피 컬럼으로부터 나오는 샘플들의 굴절률(refractive index)이다. 두 개의 구분된 피크들이 이러한 실험에서 얻어지는 용출 프로파일 내에서 보여진다. 제1 피크 내에서의 두 개의 다른 하위-피크들이 용이하게 인식될 수 있었다. 편평한 제1 하위-피크는 숙신산의 용출에 대응한다. 제1 하위-피크보다 높은 제2 하위-피크는 상기 컬럼으로부터 나오는 비-해리된 암모늄 숙신산염 분획에 대응한다. 이 도면에서 단지 부분적으로 전개된 제2 피크는 암모늄 황산염 분획에 대응한다.
도 6 도웩스(Dowex) G-26 H 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 원료 스트림(feed stream)의 도입에 대한 시간점들(time points), 및 느린 세정(slow rinse), 빠른 세정(fast rinse), 후세척(backwash) 및 황산 첨가를 위한 개시점이 분(minutes)으로서의 시간을 보여주는 X-축 상의 하방향 포인팅 화살표들에 의해 표시된다. Y-축 상에서 보여지는 것은 크로마토그래피 컬럼으로부터 나오는 샘플들의 굴절률(refractive index)이다. 편평한 제1 하위-피크는 숙신산의 용출에 대응한다. 제1 하위-피크보다 높은 제2 하위-피크는 상기 컬럼으로부터 나오는 비-해리된 암모늄 숙신산염 분획에 대응한다. 이 도면에서 단지 완전하게 전개된 제2 피크는 암모늄 황산염 분획에 대응한다.
도 7 도웩스(Dowex) G-26 H 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 이 도면에서 보여지는 것은 후속적인 분석을 위해 수집된 다섯 개의 다른 크로마토그래피적인 분획들에 대응하는 크로마토그램의 영역들이다.
도 8 란섹스(Lanxess) S100 H 양이온 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 여섯 개의 다른 크로마토그래픽적인 프로파일들은 표 5에서 보여지는 바와 같이 다른 원료 부피(feed volumes)를 사용하는 실험 1, 2, 3, 4, 5 및 6으로부터 획득되었다. 느린 세정 및 빠른 세정이 탈이온화된 물의 1 컬럼 부피로 수행되었다. 10%(w/w) 황산의 2 컬럼 부피들이 상기 수지를 재생산하는데에 사용되었고 상기 느린 세정 모드(slow rinse mode)에서의 탈이온화된 물의 3 컬럼 부피 및 상기 빠른 세정 모드(fast rinse mode)에서의 탈이온화된 물의 6 컬럼 부피의 부가에 의해 후속되었다.
도 9 란섹스(Lanxess) S100 H 양이온 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 원료(feed)의 1.5 컬럼 부피가 컬럼 상에 로딩되었다. 느린 세정(slow rinse) 및 빠른 세정(fast rinse)이 탈이온화된 물의 1 컬럼 부피로 수행되었다. 10%(w/w) 황산의 2 컬럼 부피들이 상기 수지를 재생산하는데에 사용되었고 상기 느린 세정 모드(slow rinse mode)에서의 탈이온화된 물의 3 컬럼 부피 및 상기 빠른 세정 모드(fast rinse mode)에서의 탈이온화된 물의 6 컬럼 부피의 부가에 의해 후속되었다.
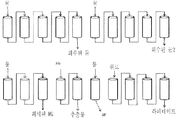
도 10 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산의 분리를 위한 음이온성 이온 교환 수지를 구비하는 연속적인 이온 교환 크로마토그래피에 대한 모듈들. 상기 연속적인 이온-교환 시퀀스는 음이온성 수지로 충진된 열 개의 컬럼들(각각 0.4 L) 상에서 수행된다. 그 파일럿이 4 개의 영역들로 나뉘어져 있고, 각자는 1 내지 3 컬럼들로 구성된다. 각각의 시퀀스는 상기 도면 내에서 보여지는 바와 같이 2 단계들로 나뉘어진다. 숙신산염이 음이온성 수지 상에 잡히고 또한 산 재생산의 과정 동안 방출된다. 재생산이 공동-흐름 모드(co-current mode)로 수행되었다. 암모늄 황산염은 라피네이트(raffinate) 에서 회수되고 또한 숙신산은 그 추출물(extract)에서 회수된다. 상기 연속적인 이온-교환 프로세스는 상기 이온-교환 컬럼들 내부로의 숙신산의 어떠한 결정화를 피하기 위하여 실험 과정 동안 50℃에서 수행된다.
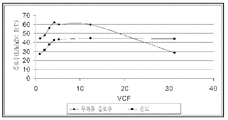
도 11 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 회수되는 숙신산으로의 나노 여과(nanofiltration) 프로세스를 위한 투과물 플로우 속도(permeate flow rate). X-축 내에서 보여지는 것은 부피로서의 농도 요소(volumetric concentration factor)이고 또한 Y-축 상에서는 L/m2/시간 및 온도 에서의 플로우 속도이다.
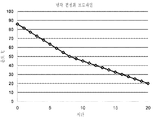
도 12 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 획득되는 숙신산의 결정화를 위한 냉각 프로파일. 숙신산은 85℃에서 420 g/L로 까지 농축되었다. 상기 결정화는 순수한 숙신산 결정 시드들(80 ㎛)으로 개시되었다. 85℃ 로부터 20℃ 까지의 온도 변화는 20 시간 내에 도달되었다.
도 13 음이온성 이온 교환 수지를 포함하는 연속적인 이온 교환 크로마토그래피적 장치로부터 얻어지는 숙신산 결정들의 주사 전자 현미경 사진들(Scanning electron micrographs). 왼쪽 상에서 보여지는 것은 나노 여과를 포함하는 폴리싱 단계 없이 얻어지는 결정들의 주사 전자 현미경 사진이다. 이 도면의 오른쪽 상에서 보여지는 것은 나노 여과를 포함하는 폴리싱 단계 후에 얻어지는 결정들의 주사 전자 현미경 사진이다.
도 14 암모늄 숙신산염을 함유하고 있는 발효 배지를 포함하는 이온 교환 크로마토그래피 프로세스로부터 회수되는 암모늄 황산염 결정들의 주사 전자 현미경 사진들.
도 2 양이온 교환 및 양이온성 이온 교환 수지의 표면 상에서의 암모늄 숙신산염의 숙신산으로의 전환에 대한 도식적인 표현. 상기 양이온 교환 수지의 표면상에서, 암모늄 숙신산염은 숙신산염 음이온 및 암모늄 양이온으로 쪼개진다. 암모늄 양이온은 상기 양이온 교환 수지를 형성하는 양성자의 방출과 함께 상기 양이온 교환 수지의 표면 상에서 양성자에 대하여 교환된다. 상기 방출된 양성자는 상기 숙신산염 음이온과 결합하여 숙신산의 형성의 결과를 가져온다.
도 3 암모늄 황산염을 생산하기 위하여 H2SO4를 포함하는 양이온 교환 수지의 재생산에 대한 도식적인 표현. 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스의 제1 단계에서, 상기 발효 배지는 상기 양이온 교환 수지와 접촉하도록 놓여진다. 상기 암모늄 숙신산염은 상기 양이온 교환 수지의 표면상에서 쪼개지고 또한 그 결과적인 암모늄 양이온은 상기 양이온 교환 수지의 표면상에서의 양성자에 대하여 교환된다. 상기 양이온 교환 수지의 표면에 대하여 결합된 암모늄은 황산과 같은 강한 산을 사용하는 제2의 재생산 단계에서 방출된다. 상기 황산 처리에 의하여, 상기 수지의 표면 내의 암모늄 이온은 양성자에 대하여 교환된다. 이에 따라 상기 수지의 표면으로부터 방출된 암모늄 이온은 황산의 해리로부터의 결과인 황산염 이온과 결합하여 암모늄 황산염의 형성을 유도한다.
도 4 암모늄 숙신산염을 함유하고 있는 발효 배지의 설명 위한 도시. 사용된 약어들: PF=원료 압력(Feed pressure); PIN = 입구 멤브레인 압력(Inlet membrane pressure); POUT = 출구 멤브레인 압력(Outlet membrane pressure) (PF에 근접함); PPERM = 투과물 압력(Permeate pressure) (개방 밸브에 의해 조절됨); DP = PIN - POUT: 압력 강하(pressure drop) (약 1.5 bar); TMP = (PIN + POUT) / 2 - PPERM: 막관통 압력(Transmembrane pressure).
도 5 다우웩스(Dowex) G-26 H 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피적 프로파일. 양이온성 이온 교환 수지의 재생산이 5%(w/w) H2SO4로 수행되었다. 원료 스트림(feed stream)의 도입에 대한 시간점들(time points), 및 느린 세정(slow rinse), 빠른 세정(fast rinse), 후세척(backwash) 및 황산 첨가를 위한 개시점이 분(minutes)으로서의 시간을 보여주는 X-축 상의 하방향 포인팅 화살표들에 의해 표시된다. Y-축 상에서 보여지는 것은 크로마토그래피 컬럼으로부터 나오는 샘플들의 굴절률(refractive index)이다. 두 개의 구분된 피크들이 이러한 실험에서 얻어지는 용출 프로파일 내에서 보여진다. 제1 피크 내에서의 두 개의 다른 하위-피크들이 용이하게 인식될 수 있었다. 편평한 제1 하위-피크는 숙신산의 용출에 대응한다. 제1 하위-피크보다 높은 제2 하위-피크는 상기 컬럼으로부터 나오는 비-해리된 암모늄 숙신산염 분획에 대응한다. 이 도면에서 단지 부분적으로 전개된 제2 피크는 암모늄 황산염 분획에 대응한다.
도 6 도웩스(Dowex) G-26 H 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 원료 스트림(feed stream)의 도입에 대한 시간점들(time points), 및 느린 세정(slow rinse), 빠른 세정(fast rinse), 후세척(backwash) 및 황산 첨가를 위한 개시점이 분(minutes)으로서의 시간을 보여주는 X-축 상의 하방향 포인팅 화살표들에 의해 표시된다. Y-축 상에서 보여지는 것은 크로마토그래피 컬럼으로부터 나오는 샘플들의 굴절률(refractive index)이다. 편평한 제1 하위-피크는 숙신산의 용출에 대응한다. 제1 하위-피크보다 높은 제2 하위-피크는 상기 컬럼으로부터 나오는 비-해리된 암모늄 숙신산염 분획에 대응한다. 이 도면에서 단지 완전하게 전개된 제2 피크는 암모늄 황산염 분획에 대응한다.
도 7 도웩스(Dowex) G-26 H 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 이 도면에서 보여지는 것은 후속적인 분석을 위해 수집된 다섯 개의 다른 크로마토그래피적인 분획들에 대응하는 크로마토그램의 영역들이다.
도 8 란섹스(Lanxess) S100 H 양이온 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 여섯 개의 다른 크로마토그래픽적인 프로파일들은 표 5에서 보여지는 바와 같이 다른 원료 부피(feed volumes)를 사용하는 실험 1, 2, 3, 4, 5 및 6으로부터 획득되었다. 느린 세정 및 빠른 세정이 탈이온화된 물의 1 컬럼 부피로 수행되었다. 10%(w/w) 황산의 2 컬럼 부피들이 상기 수지를 재생산하는데에 사용되었고 상기 느린 세정 모드(slow rinse mode)에서의 탈이온화된 물의 3 컬럼 부피 및 상기 빠른 세정 모드(fast rinse mode)에서의 탈이온화된 물의 6 컬럼 부피의 부가에 의해 후속되었다.
도 9 란섹스(Lanxess) S100 H 양이온 수지를 포함하는 크로마토그래피 컬럼 상에서의 암모늄 숙신산염을 함유하고 있는 발효 배지의 크로마토그래피 프로파일. 양이온성 이온 교환 수지의 재생산은 10%(w/w) H2SO4로 수행되었다. 원료(feed)의 1.5 컬럼 부피가 컬럼 상에 로딩되었다. 느린 세정(slow rinse) 및 빠른 세정(fast rinse)이 탈이온화된 물의 1 컬럼 부피로 수행되었다. 10%(w/w) 황산의 2 컬럼 부피들이 상기 수지를 재생산하는데에 사용되었고 상기 느린 세정 모드(slow rinse mode)에서의 탈이온화된 물의 3 컬럼 부피 및 상기 빠른 세정 모드(fast rinse mode)에서의 탈이온화된 물의 6 컬럼 부피의 부가에 의해 후속되었다.
도 10 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산의 분리를 위한 음이온성 이온 교환 수지를 구비하는 연속적인 이온 교환 크로마토그래피에 대한 모듈들. 상기 연속적인 이온-교환 시퀀스는 음이온성 수지로 충진된 열 개의 컬럼들(각각 0.4 L) 상에서 수행된다. 그 파일럿이 4 개의 영역들로 나뉘어져 있고, 각자는 1 내지 3 컬럼들로 구성된다. 각각의 시퀀스는 상기 도면 내에서 보여지는 바와 같이 2 단계들로 나뉘어진다. 숙신산염이 음이온성 수지 상에 잡히고 또한 산 재생산의 과정 동안 방출된다. 재생산이 공동-흐름 모드(co-current mode)로 수행되었다. 암모늄 황산염은 라피네이트(raffinate) 에서 회수되고 또한 숙신산은 그 추출물(extract)에서 회수된다. 상기 연속적인 이온-교환 프로세스는 상기 이온-교환 컬럼들 내부로의 숙신산의 어떠한 결정화를 피하기 위하여 실험 과정 동안 50℃에서 수행된다.
도 11 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 회수되는 숙신산으로의 나노 여과(nanofiltration) 프로세스를 위한 투과물 플로우 속도(permeate flow rate). X-축 내에서 보여지는 것은 부피로서의 농도 요소(volumetric concentration factor)이고 또한 Y-축 상에서는 L/m2/시간 및 온도 에서의 플로우 속도이다.
도 12 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 획득되는 숙신산의 결정화를 위한 냉각 프로파일. 숙신산은 85℃에서 420 g/L로 까지 농축되었다. 상기 결정화는 순수한 숙신산 결정 시드들(80 ㎛)으로 개시되었다. 85℃ 로부터 20℃ 까지의 온도 변화는 20 시간 내에 도달되었다.
도 13 음이온성 이온 교환 수지를 포함하는 연속적인 이온 교환 크로마토그래피적 장치로부터 얻어지는 숙신산 결정들의 주사 전자 현미경 사진들(Scanning electron micrographs). 왼쪽 상에서 보여지는 것은 나노 여과를 포함하는 폴리싱 단계 없이 얻어지는 결정들의 주사 전자 현미경 사진이다. 이 도면의 오른쪽 상에서 보여지는 것은 나노 여과를 포함하는 폴리싱 단계 후에 얻어지는 결정들의 주사 전자 현미경 사진이다.
도 14 암모늄 숙신산염을 함유하고 있는 발효 배지를 포함하는 이온 교환 크로마토그래피 프로세스로부터 회수되는 암모늄 황산염 결정들의 주사 전자 현미경 사진들.
도 1은 이러한 본 발명에 기재된 바와 같은 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산의 회수를 위한 블록 플로우 다이아그램을 제시한다. 많은 수의 미생물들이 생물학적 원료 물질들(feedstocks) 상에서 그들의 발효적 성장의 과정 동안 현저한 양의 숙신산을 생산하는 것으로 보고되어 왔다. 이러한 미생물들의 어떤 것은 상업적으로 현저한 양으로 숙신산 생산에 도달할 수 있도록 유전적으로 변형되어 왔다. 예로서, 공개 번호들 WO 2008/115958 및 WO 2010/115067 로서 특허 협정 조약 하에 공개된 국제 특허 출원들에 기재된 에셰리키아 콜리(Escherichia coli)의 KJ122 스트레인은 그것의 발효적 성장 과정 동안 상업적으로 현저한 양의 숙신산을 생산하는 것으로 보고되어져 있다. KJ122 스트레인은 잔타마 외(Jantama et al)(2008a, 2008b)에 의해 기재된 바와 같이 수많은 합리적으로 디자인된 유전학적 조작들 및 수 개의 다른 단계들에서의 대사적 진화의 프로세스를 통하여 이. 콜리 C(E. coli C) 스트레인 (ATCC 8739)로부터 유도될 수 있었다.
이. 콜리(E. coli)의 KJ122 스트레인은 발효적 경로를 통한 숙신산의 생산을 위해 이상적이다. KJ122는 발효 용기 내에서의 리터 당 70 내지 90 그램의 숙신산을 생산할 수 있는 능력을 가지는 것으로 보고되어져 있다. KJ122 외에, 미국 특허 번호들 5,770,435, 6,159,738, 6,455,284 및 7,223,567 및 미국 특허 출원 공개 번호 2007/011294에 기재된 바와 같이 숙신산을 생산하도록 유전적으로 변형된 다른 이. 콜리(E. coli) 스트레인들도 또한 상업적으로 현저한 양으로 숙신산을 생산하기 위하여 유용하다. 숙신산의 중성적인 염의 형태로서 숙신산을 함유하는 모든 이러한 이. 콜리(E. coli) 스트레인들로부터의 발효 배지는 본 발명에서의 사용에 대하여 적합하다.
이러한 유전적으로 변형된 이. 콜리(E. coli) 스트레인들 이외에, 수많은 자연적으로 발생하는 숙신산을 생산하는 미생물들이 또한 상업적으로 현저한 양으로서 숙신산의 발효적 생산을 대하여 확인되어져 있고 또한 개발되어 왔다. 예로서, 공개 번호들 WO 2009/065778 및 WO 2009/065780 로서 특허 협정 조약 하에 공개된 국제 특허 출원들은 숙신산을 생산하는 아스퍼질러스 나이거(Aspergillus niger) 및 사카로마이스 세레비시아(Saccharomyces cerevisiae)의 스트레인들을 기재한다. 상업적으로 현저한 양으로서 숙신산을 생산하는 것으로 보고되어져 있는 다른 미생물들의 리스트는 악티노바실러스 숙시노전스(Actinobacillus succinogens), 만하이머 숙시니프로듀슨스(Mannheimia succiniproducens), 코린박테리움 글루타미쿰(Corynebacterium glutamicum), 브레비박테리움 플라붐(Brevibacterium flavum) 및 언에어로비오스피릴움 숙시니프로듀슨스(Anaerobiospirilum succiniproducens)를 포함한다. 그들의 발효적 성장 과정 동안 이러한 미생물들의 어떤 것에 의해 생산된 숙신산은 본 발명에 기재된 프로세스의 하나 또는 초과를 사용하여 높은 수준의 순도로 회수될 수 있다.
숙신산의 산성적인 성질로 인하여, 미생물적 성장 배지 내에서의 숙신산의 계속되는 축적은 컬쳐 배지의 pH를 강하시키고 또한 궁극적으로 감소된 미생물의 성장 속도 및 숙신산 수율을 유발할 것으로 예상된다. 이러한 한계는 필요에 따라미생물적 성장 배지에 대해 어떤 pH를 중성화시키는 염기들을 첨가하는 수단에 의하여 극복된다. 미생물적 성장 배지에 대해 중성화시키는 염기들의 첨가는 중성의 염의 형태로서 숙신산의 축적의 결과를 가져온다. 따라서 암모늄 하이드록사이드(ammonium hydroxide)가 숙신산의 생산으로 인한 pH에서의 강하를 중성화시키기 위한 염기로서 사용될 때에, 암모늄 숙신산염이 그 발효 용기 내에 축적된다.
발효 실행의 종점에서, 그 배지는 숙신산의 염, 중금속, 착색화 물질(coloring matter), 대사적 부산물들(metabolic by-products), 상기 미생물들의 세포들 및 세포 파편들(cell fragments) 및 무기염들을 함유한다. 따라서, 상기 발효 배지의 직접적인 사용은 가능하지 않으며 및 상기 발효 배지로부터 순수한 숙신산을 추출해 내기 위하여 추가적인 프로세싱 단계들이 요구된다.
상기 발효 배지로부터 순수한 숙신산을 회수하기 위한 프로세스의 제1 단계에서, 물을 추출해 내는 것에 의해 상기 배지를 농축하는 것이 바람직하다. 이러한 농축 단계는 프로세싱되는 플루이드의 부피를 감소시킬 것이며 또한 궁극적으로 순수한 숙신산을 회수 하는데에서 요구되는 후속적인 유닛 작동들 각각에 대한 비용을 감소 시키는데에 도움을 줄 것이다. 숙신산의 염들을 함유하고 있는 발효 배지는 트리에틸아민(triethylamine), 디이소프로필 아민(diisopropyl amine), N, N-디에틸아민(N, N-diethylamine) 및 이들의 혼합물과 같은 낮은 분자량의 2차 및 3차 아민들을 사용하여 현저한 양의 물을 제거하는 수단에 의하여 농축될 수 있다. 30℃ 내지 50℃의 온도 범위에서, 이러한 유기 아민들은 숙신산의 염들을 함유하고 있는 발효 배지와 같은 희석된 수성의 용액들로부터 많은 양의 물을 추출할 수 있다. 이러한 낮는 온도 범위에서, 상기 유기 아민 상(phase)은 20-35%의 물 및 훨씬 감소된 양의 발효 염들을 함유한다. 물은 온도를 올리는 것에 의하여 상기 아민으로부터 사라질 수 있고 및 이에 따라 아민이 재활용되고 또한 추가적인 물을 추출하는데 있어서 재사용되는 것이 허용된다. 이러한 접근 방법을 사용하는 것으로부터, 통상적인 다단계, 역류 추출 과정(countercurrent extraction procedure)을 사용하여 3%의 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 82.5%의 물을 추출하는 것이 가능하며 결과적으로 15%의 암모늄 숙신산염을 함유하고 있는 5 배 농축된 발효 배지의 생산을 유도한다.
본 발명의 실행에 있어서, 숙신산의 염들을 함유하고 있는 발효 배지는 상기 발효 배지 내부에 존재하는 미립자 물질을 제거하여 정화된다. 발효 배지 내부의 세포성 및 단백질 성분들은 80℃ 내지 90℃에서의 고온의 처리에 의해서 제거될 수 있다. 상기 고온 처리는 미생물을 죽이며 또한 단백질을 응고시키는 알칼리 처리에 의하여 동반될 수 있다. 이러한 고온 및 알칼리 처리들로부터의 결과인 불용성 물질들은 여과 또는 원심 분리를 통하여 제거될 수 있다.
상기 고온 및 알칼리 처리들로부터의 결과로서 발효 배지는 추가적으로 마이크로 여과 및/또는 한외 여과 장치들을 사용하여 정화될 수 있다. 미생물적 발효 배지의 마이크로 여과 및 한외 여과를 위한 기술들은 산업적인 미생물학의 기술 분야에서 잘 알려져 있다. 미생물적 발효 배지의 마이크로 여과 및 한외 여과에 대하여 적합한 멤브레인들은 많은 수의 공급자들로부터 상업적으로 입수 가능하다. 원심 분리 단계는 마이크로 여과 단계를 대체할 수 있다. 상기 원심 분리 단계로부터의 상청액(supernatant)은 한외 여과 단계 하에 놓여질 수 있다. 이러한 여과 프로세스들로부터의 잔류물(retentate)은 폐기되거나 또는 재활용될 수 있으며 또한 숙신산 염으로 풍부해진 투과물(permeate)은 이온 교환 수지들을 사용하여 숙신산의 정제를 위한 소스로서 다음 단계에서 사용된다. 마이크로 여과 및/또는 한외 여과 프로세스 단계들로부터의 투과물은 그것을 이온 교환 수지들로 처리하기 이전에 미국 특허 번호 6,319,382에 기재되어 있는 바와 같이 칼슘 및 마그네슘과 같은 2가의 이온들과 예비적으로 결합하는 킬레이팅 수지를 통하여 선택적으로 통과될 수 있다.
본 발명에 따라 분명한 방법으로 발효 배지로부터 숙신산을 회수하기 위한 프로세스를 설명하는 방법으로서, 본 발명을 기재하는데 있어서 사용되는 하기의 다양한 용어들의 정의들이 최초로 제시된다.
"크로마토그래피(Chromatography)"는 고체 상(solid phase)에 대한 혼합물의 성분들 중에서의 선택적인 친화성에 의존하는 혼합물들 및 성분들의 화학적 분리에 대하여 사용되는 어떤 분석적인 기술들로서 참조된다. 예들은 흡착 크로마토그래피(adsorption chromatography), 이온 교환 크로마토그래피(ion exchange chromatography), 및 이온 배제 크로마토그래피(ion exclusion chromatography)를 포함한다. 본 발명은 이온 교환 크로마토그래피(ion exchange chromatography)의 사용에 대해 주목한다. 이온 배제 크로마토그래피(ion exclusion chromatography) 및 이온 교환 크로마토그래피(ion exchange chromatography) 사이를 구분하는 방법으로서, 하기의 정의들이 제시된다.
이온 배제는 그것에 의하여 이온-교환 수지들이 중성의 및 이온성의 종류들의 분획화(fractionation)에 대하여 사용되는 메카니즘을 기재하기 위하여 사용되는 용어이다. 분획되는 샘플 내에서의 이온성 화합물들은 수지에 의하여 배척되거 또한 그들은 컬럼의 허공 부피(void volume)로 용출된다. 비이온성 또는 약한 이온 성분들은 팩킹(packing)의 세공들(pores) 내부로 투과하고 또한 이에 따라 그들이 상기 수지 파티클들의 내부 및 외부의 리퀴드 사이에서 나뉘어짐에 따라 분리가 완성된다. 이온 배제 크로마토그래피는 또한 이온 배제 분할 크로마토그래피(ion exclusion partition chromatography), 이온 크로마토그래피-배제 모드(ion chromatography-exclusion mode), 및 도난 배제 크로마토그래피(Donnan exclusion chromatography)를 포함하는 수 개의 다른 이름들로서 참조된다.
본 발명에서 사용되는 바와 같은 용어 이온-교환 또는 이온 교환 크로마토그래피는 그에 의해 그것의 이온 교환 수지와의 인력에 의해 중성의 화합물 분자가 그것의 하전된(charged) 성분들로 쪼개어지는 메카니즘을 기재하는 데에 사용된다. 중성의 분자로부터 하전된 종류들을 생산하는 현상은 염-쪼개짐(salt-splitting)으로서 정의된다. 사용되는 수지의 성질을 기반으로 하여, 염-쪼개짐 반응으로부터의 결과로서 이온성 성분들 중 하나는 상기 수지에 대하여 결합하고 및 나머지 다른 분자는 상기 수지 파티클들로부터 떨어져 흘러간다. 양이온성 교환 수지가 사용될 때에, 염-쪼개짐 반응으로부터의 결과인 양전기적으로 하전된 이온은 상기 이온 교환 수지에 대하여 결합될 것이고 또한 음전기적으로 하전된 종류들은 상기 수지로부터 떨어져 흘러간다. 다른 한편, 음이온 교환 수지가 사용될 때에는, 염-쪼개짐 반응으로부터의 결과로서 음전기적으로 하전된 이온이 음이온 교환 수지에 대하여 결합되며 또한 양전기적으로 하전된 이온 종류들은 상기 수지로부터 떨어져 흘러간다. 본 발명의 이러한 이온 교환 프로세스는 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스로서 하기와 같이 설명된다.
암모늄 숙신산염 분자가 양이온성 교환 수지와 접촉할 때에, 상기 암모늄 숙신산염 분자는 양전기적으로 하전된 암모늄 양이온 및 음전기적으로 하전된 숙신산염 음이온으로 쪼개진다. 암모늄 양이온은 상기 수지에 대하여 결합하여 상기 수지 표면으로부터 수소 이온을 대체한다. 상기 양이온성 이온 교환 수지의 표면으로부터 이에 따라 방출되는 수소 이온은 상기 숙신산염 음이온과 결합하여 숙신산 분자를 생산한다. 상기 수지 표면에 대하여 결합된 암모늄 이온은 상기 이온 교환 수지를 그것의 고유의 형태로 또한 재생산하는 강한 산에 의해 상기 수지 표면으로부터 후속적으로 방출된다.
암모늄 숙신산염 분자가 음이온성 이온 교환 수지와 접촉될 때에, 암모늄 숙신산염 분자들은 양전기적 전하의 암모늄 양이온 및 음전기적으로 하전된 숙신산염 음이온으로 쪼개진다. 상기 음전기적으로 하전된 숙신산염 음이온은 수지 표면에 대하여 결합하고 및 이에 따라 상기 수지의 표면을 형성하는 황산염과 같은 음전기적으로 하전된 음이온을 대체한다. 상기 수지 표면으로부터 방출된 음전기적으로 하전된 황산염 음이온은 암모늄 양이온과 반응하여 라피네이트 분획 내에서 산출되는 암모늄 황산염을 생성한다. 상기 수지 표면에 대하여 결합된 숙신산염 이온은 상기 수지를 그것의 고유의 형태로 재생산하는 것 이외에 숙신산으로서 상기 수지의 표면으로부터의 숙신산염 이온을 방출하는 강한 산 처리에 의하여 상기 수지 표면으로부터 방출된다. 황산 및 염산이 이 목적을 위하여 적합하다.
"흡착제(Adsorbent)"는 그것에 대한 이동상(mobile phase) 성분이 선택적인 친화성을 나타내는 크로마토그래피에서 사용되는 고체상으로서 참조되는 것으로 여기서 일반적으로 사용된다. 그러한 친화성이 사이즈 배제(size exclusion)를 포함하는 흡착 이외의 다양한 형태를 취할 수 있기 때문에 상기 용어는 혼합물의 성분들을 흡착하는 고체상들로서 및 이동상으로부터의 성분들을 기술적으로 흡착하지 않는, 그러나 이는 그럼에도 불구하고 크로마토그래피 시스템 내에서의 다른 것에 상대적으로 하나의 성분의 이동 속도(migration velocity)를 늦추는 것에 의하여 흡착제와 같이 행동하는 고체상들로서 참조된다. 본 발명에서 사용되는 이온 교환 수지들은 흡착제에 대한 예이다. 본 발명의 이온 교환 흡착제의 구체적인 능력은 그것이 그것의 표면 상에 흡착되어 있는 중성의 분자를 그것의 이온성 성분으로 화학적으로 쪼갤 수 있으며 또한 그 전하를 바탕으로 하는 이온성 성분들 중 하나와 화학적으로 결합할 수 있다는 것이다.
용어 "정제된 것(purified)"은 그것의 상대적인 농도(그 혼합물 내에서의 모든 성분들 또는 분획들의 중량에 의하여 나뉘어지는 성분 또는 분획의 중량)가 적어도 20% 증가될 때에의 성분들(components) 또는 분획들(fractions)로서 참조된다. 성분 또는 분획은 또한 그로부터 그것이 정제되는 성분들의 상대적인 농도(그 혼합물 내에서의 모든 성분들 또는 분획들의 중량에 의하여 나뉘어지는 그로부터 그것이 정제되는 성분 또는 분획의 중량)가 적어도 20% 감소될 때에 정제되는 것으로서 언급될 수도 있다.
"원료 혼합물(feed mixture)"은 하나 또는 초과의 추출 성분들 및 크로마토그래피적인 프로세스에 의해 분리되는 하나 또는 초과의 라피네이트(raffinate) 성분들을 포함하는 혼합물이다. 용어 "원료 스트림(feed stream)"은 상기 프로세스 내에서 사용되는 흡착제에 대하여 통과하는 원료 혼합물의 스트림을 의미한다.
"추출물 성분(extract component)"은 "라피네이트 성분(raffinate componant)"이 덜 선택적으로 흡착되는 화합물 또는 화합물의 타입인 반면, 상기 흡착제에 의해 더욱 선택적으로 흡착되는 성분 또는 타입이다.
용어 "탈착제 물질(desorbent material)"은 일반적으로 추출 성분을 탈착시킬 수 있는 능력이 있는 물질을 의미할 것이다. 다른 의미로서, 상기 이온 교환 수지에 대하여 결합되어 있는 하전된 물질은 탈착제 물질에 의하여 그 이온 교환 수지의 표면으로부터 방출된다. 용어 "탈착제 스트림(desorbent stream)" 또는 "탈착제 주입 스트림(desorbent input stream)"은 그것을 통하여 탈착제 물질이 그 흡착제에 대하여 통과하는 스트림을 의미한다.
용어 "라피네이트 스트림(raffinate stream)" 또는 "라피네이트 배출 스트림(raffinate output stream)"은 그것을 통하여 라피네이트 성분이 그 흡착제로부터 제거되는 스트림을 의미한다. 상기 라피네이트 스트림의 조성은 필수적으로 100%의 탈착제 물질로부터 필수적으로 100%의 라피네이트 성분으로까지 변할 수 있다.
용어 "추출물 스트림(extract stream)" 또는 "추출물 배출 스트림(extract output stream)"은 그것을 통하여 탈착제 물질에 의해 탈착되었던 추출물 물질이 그 흡착제로부터 제거되는 스트림을 의미할 것이다. 상기 추출물 스트림의 조성은 필수적으로 100%의 탈착제 물질로부터 필수적으로 100%의 추출물 성분들로까지 변할 수 있다.
상기 추출물 스트림 및 바람직하게 상기 크로마토그래피의 컬럼으로부터 나오는 라피네이트 스트림의 적어도 일부는 추출물 생성물 및 라피네이트 생성물을 생성시키기 위하여 탈착제 물질의 적어도 일부가 분리되는 분획 수집자(fraction collector)와 같은 분리 장비를 통하여 통과된다. 용어들 "추출물 생성물(extract product)" 및 "라피네이트 생성물(raffinate product)"은 상기 추출물 스트림 및 라피네이트 스트림 내에서 발견되는 것들 보다 높은 농도들로서 추출물 성분 및 라피네이트 성분을 각각 포함하는, 프로세스에 의하여 생성되는 생성물들을 의미한다.
흡착제들의 특정한 특성들은 어떤 크로마토그래피적인 프로세스의 성공적인 작동을 위하여 필수적인 것으로 인식되어져 있다. 흡착제의 바람직한 특성은 하기와 같다: (1) 흡착제의 흡착성 성능(absorptive capacity), (2) 흡착제의 선택성(selectivity) 및 (3) 흡착 및 탈착의 비(Rate of adsorption and desorption).
추출물 성분들의 특정한 부피를 흡착하는 흡착제의 성능은 중요한 특성이다. 흡착제 성분에 대한 상기 흡착제의 성능이 더 높아질 수록 그 흡착제는 더 좋아진다. 흡착제에 대하여 증가된 흡착성 성능으로, 특정한 원료 혼합물 내에 함유되어져 있는 알려진 농도의 추출물 성분을 분리하는데 요구되는 흡착제의 양을 감소시키는 것이 가능하다.
제2의 요구되는 흡착제 특성은 원료의 성분들을 분리하는 흡착제의 능력이다. 다른 성분으로부터 하나의 성분을 분리하는 흡착제의 능력은 흡착적 선택성(adsorptive selectivity)으로서 참조된다. 상대적인 선택성은 다른 것과 비교할 때 하나의 원료 성분에 대해서 표현될 수 있는 것 뿐만 아니라 어떤 원료 혼합물 성분 및 탈착제 물질 사이에서 표현될 수 있다. 여기서 사용되는 바와 같은 흡착제 선택성(adsorbent selectivity)은 평형 조건들에서 비흡착된 상(unadsorbed phase) 내에서의 동일한 두 성분들의 비에 대하여 흡착된 상(adsorbed phase) 상에서의 두 성분들의 비로서 정의된다. 두 성분들의 선택성이 1.0에 도달될 때에 나머지 하나에 대하여 흡착제에 의한 하나의 성분의 선호되는 흡착이 존재하지 않는 것이고; 그들 양자는 서로에 대하여 거의 동일한 정도로 흡착된다(또는 비흡착된다). 상기 선택성이 1.0 미만이거나 또는 초과일 경우 다른 것에 대하여 하나의 성분의 선호되는 흡착이 존재한다. 라피네이트 성분에 대하여 추출물 성분에 대한 흡착제의 선택성이 1.0 보다 클 때에 라피네이트 성분으로부터 추출물 성분의 분리가 이론적으로 가능한 반면, 선택성이 2의 값에 도달하는 것이 바람직하다.
흡착제의 제3의 바람직한 특성은 그 흡착제에 의한 추출물 성분의 교환 속도에 관한 것이다. 이상적인 흡착제는 추출물 성분을 더 큰 속도로 흡착할 수 있어야 하는 것 뿐만 아니라 동시에 적합한 탈착제의 존재 하에서 용이하게 그 결합되어 있는 추출물 성분을 탈착할 수 있는 능력을 가져야 한다. 교환의 더 빠른 속도는 그 추출 성분을 제거 하는데에 요구되는 탈착제 물질의 양을 감소시키고 또한 이에 따라 상기 프로세스를 작동시키는 비용에서 있어서의 감소를 허용한다. 더 빠른 속도의 교환에 의하며, 더 적은 양의 흡착제 물질이 상기 프로세스를 통하여 펌핑되고 또한 상기 프로세스 내에서의 재사용을 위하여 추출물 스트림으로부터 분리될 것이다.
특정한 분리 프로토콜(separation protocol)에 대해 적합한 흡착제를 선택하기 위하여, 일 세트의 흡착제들이 동력학적 테스팅 장치(dynamic testing apparatus)를 사용하는 펄스 테스트(pulse test) 하에 놓여질 수 있다. 펄스 테스트를 수행하는 것에 의하여, 우리는 그들의 흡착성 능력, 선택성 및 교환 속도에 관한 선택되는 흡착제들의 특징적인 특성들을 결정할 수 있다.
상기 펄스 테스트를 수행하기 위한 장치들은 간단한 구성을 갖는 것일 수 있다. 상기 장치는 테스트 흡착제로 충진된 흡착제 챔버(adsorbent chamber)로 구성된다. 상기 흡착제 챔버는 직선형의 컬럼 또는 나선형의 컬럼일 수 있다. 상기 흡착제 챔버는 실온의 온도에서 작동될 수 있거나 또는 온도 조절된 환경 내부에서 유지될 수 있다. 최적의 조건들 하에서 크로마토그래피의 분리를 수행하는 것이 요구된다. 흡착제 챔버의 최적의 온도는 그 수지의 분리 성능에 있어서의 증가를 가져올 것이다. 최적의 온도는 또한 그 흡착제의 유용한 성능을 향상시킬 것이다. 온도 환경 이외에, 상기 흡착제 챔버는 일정하게 미리 정하여진 압력에서 상기 흡착제 챔버를 작동시키기 위하여 압력 조절 장비에 대하여 연결될 수 있다. 굴절계(refractometers), 편광계(polarimeters), 및 UV/가시 광선 분광 광도계( UV/visible spectrophotometers)와 같은 양적 및 질적인 분석적 장비들이 상기 흡착제 챔버의 출구 라인에 대하여 부착될 수 있고 또한 상기 흡착제 챔버를 떠나는 용출 스트림(elution stream) 내의 하나 또는 초과의 성분들을 양적으로 검출하는데에 사용될 수 있다.
상기 흡착제 챔버 내에서의 흡착제는 흡착제 챔버를 통하여 탈착제 물질을 통과시키는 것에 의하여 특정 탈착제 물질과 평형을 이루기 위하여 충진된다. 용이한 시간에서, 알려진 농도의 미량 성분(tracer) 및 특정 추출물 성분 또는 라피네이트 성분들 또는 양자, 모두 탈착제 내에 희석된, 를 함유하는 원료의 펄스가 수 분의 지연 동안 주입된다. 미량 성분은 흡착제와의 정해진 상호 작용을 갖는 것으로 알려져 있는 성분이다. 탈착제 플로우(desorbent flow)가 재개되고(resumed), 또한 상기 미량 성분 및 상기 추출물 성분 또는 상기 라피네이트 성분(또는 양자)이 용출된다. 상기 용출물(effluent)은 스트림 상(on stream)에서 분석될 수 있거나 또는 대체적으로, 용출물 샘플들은 주기적으로 수집될 수 있어 또한 나중에 분석될 수 있다.
상기 펄스 세트의 결과들로부터, 흡착제의 흡착 성능, 상기 흡착제의 표면 상에서의 특정 추출물 성분에 대한 흡착제의 선택성 및 특정 추출물 성분의 교환 속도가 결정될 수 있다. 상기 원료 혼합물 내에서의 및 상기 라피네이트 스트림 내에서의 추출물 성분의 양을 결정하고 또한 상기 흡착제 챔버 내의 흡착제의 양을 계산에 넣는 것에 의하여, 특정한 추출물 성분에 관한 특정한 흡착제의 흡착 성능을 결정하는 것이 가능하다.
라피네이트 성분에 있어서 특정한 추출물 성분에 대한 흡착제의 선택성은 상기 라피네이트 성분 피크 엔벨롭(envelope) 및 상기 미량 성분 피크 엔벨롭의 중심 사이에서의 거리에 대응하여 상기 추출물 성분 피크 엔벨롭(envelope) 및 상기 미량 성분 피크 엔벨롭(또는 다른 기준점)의 중심 사이에서의 거리의 비율로부터 결정될 수 있다.
탈착제로의 추출물 성분의 교환 속도는 일반적으로 중간 강도(half intensity)에서의 피크 엔벨롭들의 폭에 의해 특정화될 수 있다. 상기 피크 폭이 더 좁을수록, 상기 탈착 속도는 더 빨라진다. 탈착 속도는 또한 상기 미량 성분 피크 엔벨롭의 중심 및 이제 막 탈착되어진 추출물 성분의 사라짐 사이에서의 거리에 의해 특정화될 수 있다. 이 거리는 다시 이러한 시간 간격 동안 펌핑되어진 탈착제의 부피이다.
암모늄 숙신산염을 함유하고 있는 발효 배지로부터의 숙신산의 크로마토그래피적인 분리에 대하여 선택적인 흡착제는 조밀한 압축 베드(dense compact bed)를 구비하는 통상적인 컬럼 크로마토그래피에서 사용될 수 있다. 이러한 압축 고정된 베드 크로마토그래피 내에서는 정지된 베드 플루이드-솔리드 접촉(static bed fluid-solid contacting)에서 사용되는 어떠한 통상적인 장치가 사용될 수 있다. 이러한 압축 베드 크로마토그래피 내에서, 상기 흡착제는 원료 혼합물 및 탈착제 물질과 교대로 접촉된다. 본 발명의 일 실시예에서, 흡착제는 단일 정지 베드(single static bed)의 형태로서 사용되며 또한 상기 프로세스는 상기 원료가 단지 라피네이트 스트림 및 탈착제 스트림으로 교대되는 일정 시간 간격에서 상기 흡착제에 대하여 적용된다는 의미에서 단지 세미-연속적이다.
조밀한 압축 고정된 베드 크로마토그래피의 또 다른 실시예에서 두 개 또는 초과의 정지 베드들의 세트가 적합한 밸브들과 접촉하는 고정된 베드 내에서 사용될 수 있으며 이에 따라 상기 원료 혼합물이 하나 또는 초과의 흡착제 베드들을 통하여 통과되며 반면 탈착제 물질들은 그 세트 내에서의 하나 또는 초과의 다른 베드들을 통하여 통과될 수 있다. 원료 혼합물 및 탈착제 물질들의 플로우는 상기 탈착제를 통하는 상향(up) 또는 하향(down) 스트림 중 어느 것일 수 있다.
단일 컬럼 용출 크로마토그래피와 관련된 이슈들 중 하나는, 상기 컬럼 물질이 분리 구역(seperation zone), 상기 성분들이 분해되는 컬럼의 영역 내에서 효과적으로 활용되지 않는다는 점이다. 상기 분리 구역은 실질적으로 상기 성분들이 그것을 통해 흘러가면서 수축한다. 이러한 한계를 극복하기 위한 한 가지 방법은 상기 컬럼의 꼭대기 상에 다중의 샘플들을 후속적으로 첨가하는 것이다. 그러나, 그러한 후속적인 첨가는 이전의 샘플들과의 오버랩을 피하기 위하여 로딩 사이에서 주의 깊은 시간의 지연을 요구하며 또한 상기 컬럼의 효과적인 분리 구역 내에서의 단지 보잘것 없는 증가를 제공한다. 고체상은 매우 충분히 이용되지 않은 채로 남아있으며 및 상기 프로세스는 또한 과량의 용매를 요구한다. 단일 컬럼 용출 크로마토그래피과 관련된 이러한 한계들은 연속적인 이온 교환 크로마토그래피를 사용하는 것에 의하여 극복될 수 있다.
상기 연속적인 이온 교환 크로마토그래피는 고정된 흡착제 베드 시스템보다 훨씬 효율적이며 또한 본 발명의 실행에 있어 선호되는 실시예들이다. 상기 연속적인 이온 교환 크로마토그래피에서는, 흡착제 및 탈착제 작동들이 연속적으로 발생하며 또한 그 결과로서 연속적인 추출물 생산에 의해 동반되는 원료의 연속적인 사용이 존재한다.
연속적인 교환 크로마토그래피는 수 개의 다른 방법들로서 수행될 수 있다. 본 발명을 위해 적합한 연속적인 이온 교환 크로마토그래피는 두 개의 다른 모드들에서 작동될 수 있는데 즉 (1) 포트 시스템(port system)을 이동시키는 것 및 (2) 컬럼 시스템을 이동시키는 것이다. 포트 시스템을 이동시키는 것은 많은 수의 내부 연결된 부품들로 하위 구분된 수직의 컬럼으로 구성되며 또한 각 부품의 플루이드 입구들 및 출구들은 특별하게 디자인된 로터리 마스터 밸브(rotary master valve)에 의하여 조절된다. 컬럼 시스템을 이동시키는 것은 로터리 캐로우잘(rotary carousal) 상에 적재된 다중의 크로마토그래피 컬럼들을 포함한다.
본 발명의 프로세스 내에서 사용되는 흡착제들은 강한 염기성의 음이온 교환 수지, 약한 염기성의 음이온 교환 수지, 강한 산성의 양이온 교환 수지 및 약한 산성의 양이온 교환 수지를 포함할 것이다.
본 발명의 실행을 위해 적합한 음이온 교환 수지들은 교차-연결된 폴리머의 혼합물 내에 4차 암모늄, 3차 아민, 또는 피리딘 기능성, 예를 들면 디비닐벤젠 교차-연결된 아크릴의 또는 스티렌 수지들을 포함한다. 그들은 특히 비드 형태로 생산될 때에 적합하며 또한 높은 수준으로 균일한 폴리머의 다공성을 가지고 또한 화학적 및 물리적 안정성을 나타낸다. 상기 수지들은 젤 상의(gelular)(또는 "젤-타입의(gel-type)") 또는 "마이크로 렉티큘라(microrecticular)"일 수 있다. 본 발명에서의 사용에 적합한 음이온성 교환 수지들의 리스트는 앰버리트 IRA 400 및 900 시리즈 흡착제들(Amberlite IRA 400 and 900 series adsorbents), XE 275 (IRA-35), 및 롬 앤 하스 컴퍼니(Rohm and Haas Company)에 의해 제조되는 IRA-68 흡착제들, 바이오래드(BioRad)에 의해 제조되는 AG1, AG2, AGMP-1, AG3-X4A 및 AG4-X4 수지들 및 다우 1, 2, 11(Dowex 1, 2, 11), MSA-1 및 MSA-2와 같은 다우 케미칼 컴퍼니(Dow Chemical Company)에 의해 판매되는 유사 수지들을 포함한다.
본 발명의 강한 양이온성 이온 교환 크로마토그래피 물질은 바람직하게 하나 또는 초과의 크로마토그래피적인 서포트 물질들(즉, 정지상들(stationary phases))을 포함한다. 적합한 크로마토그래피적인 서포트 물질들은, 이에 제한되는 것은 아니나, 알루미나(alumina), 마그네슘 실리케이트(magnesium silicates), 실리카(silica), 글래스(glass), 조절된 포어의 글래스(controlled pore glass), 탄소(carbon), 다공성 흑연 탄소(porous graphitic carbon), 지르코늄 인산염(zirconium phosphate), 하이드록실아파티트(hydroxylapatite), 칼슘 인산염(calcium phosphate), 마그네슘 탄산염(magnesium carbonate), 및 폴리머들 또는 수지들을 포함한다. 적합한 폴리머들 또는 수지들은, 이에 제한되는 것은 아니나, 하이드록시알킬메타크릴레이트(hydroxyalkylmethacrylate), 폴리아크릴아민(polyacrylamine), 폴리아크릴레이트(polymacrylate), 폴리(하이드록시에틸마크릴레이트(poly (hydroxyethylmacrylate)), 폴리스티렌(polystyrene), 스티렌-디비닐벤젠 코폴리머들(styrene- divinylbenzine copolymers), 폴리(에틸렌글리콜디메타크릴레이트)(poly (ethyleneglycoldimethacrylate)), 폴리(비닐알콜)(poly (vinylalcohol)), 폴리(비닐아세테이트)(poly (vinylacetate)), 및 폴리(비닐피리딘)(poly (vinylpyridine))을 포함한다. 바람직한 것은 폴리머들 또는 수지들이다. 더욱 바람직한 것은 스티렌-디비닐벤젠 코폴리머들(styrene- divinylbenzine copolymers)이다.
본 발명의 강한 양이온성 교환 크로마토그래피 물질은 추가적으로 강한 이온 교환에 대하여 적합한 하나 또는 초과의 기능성 그룹들로부터 선택되는, 복수 개의 리간드들을 포함한다. 이들 기능성 그룹들은 이에 제한되는 것은 아니나, 술폰산(sulfonic acid), 알킬술폰산(alkylsulfonic acid), 페닐술폰산(phenylsulfonic acid), 알킬페닐술폰산(alkylphenylsulfonic acid) 및 이들의 염들을 포함한다. 바람직한 것은 술폰산 기능성 그룹들 및 이들의 염들이다.
사용될 수 있는 산성의 양이온성 교환 폴리머들의 구체적인 예들은 하기를 포함한다: 앰버리트 200(AMBERLITE 200), 앰버리트 IR-11bH(AMBERLITE IR-118H), 앰버리트 IR-120플러스(AMBERLITE IR-120PLUS), 앰버리트 IR-122(AMBERLITE IR-122), 앰버리트 IR-130C(AMBERLITE IR-130C), 앰버리트 16641(AMBERLITE 16641), 앰버리트 IRP-69(AMBERLITE IRP-69), 다우웩스 50X1-100(DOWEX 50X1-100), 다우웩스 50X2-100(DOWEX 50X2-100), 다우웩스 50X2-200(DOWEX 50X2-200), 다우웩스 50X2-400(DOWEX 50X2-400), 다우웩스 50X4-100(DOWEX 50X4-100), 다우웩스 50X4-200(DOWEX 50X4-200), 다우웩스 50X4-200R(DOWEX 50X4-200R), 다우웩스 50X4-400(DOWEX 50X4-400), 다우웩스 18880(DOWEX 18880), 다우웩스 50X8-100(DOWEX 50X8-100), 다우웩스 50X8-200(DOWEX 50X8-200), 다우웩스 50X8-400(DOWEX 50X8-400), 디어나이온 1-3561(DIAION 1- 3561), 디어나이온 1-3565(DIAION 1-3565), 디어나이온 1-3570(DIAION 1-3570), 디어나이온 1-3573(DIAION 1-3573), 디어나이온 1-3577(DIAION 1-3577), 디어나이온 1-3581(DIAION 1- 3581), 듀오리트 D 5427(DUOLITE D 5427), 및 듀오리트 D 5552(DUOLITE D 5552)이며, 이들은 시그마-알드리치 세인트 루이스 미주리, 미국(Sigma-Aldrich, St. Louis Missouri, U.S.A.)으로부터 입수 가능하다; 디어나이온 HPK25(DIAION HPK25), 디어나이온 PK208(DIAION PK208), 디어나이온 PK228(DIAION PK228), 디어나이온 SK1B(DIAION SK1B), 디어나이온 SK1BS(DIAION SK1BS), 디어나이온 SK104(DIAION SK104), 디어나이온 SKI 12(DIAION SKI 12), 디어나이온 SKI 16(DIAION SKI 16), 다우웩스 HCR-S(DOWEX HCR-S), 다우웩스 HCR-W2(DOWEX HCR-W2), 다우웩스 MSC-1(DOWEX MSC-1), 다우웩스 650C(DOWEX 650C), 다우웩스 G-26 H(DOWEX G-26 H), 다우웩스 88(DOWEX 88), 다우웩스 모노스피어 88(DOWEX MONOSPHERE 88), 다우웩스 모노스피어 99K/320(DOWEX MONOSPHERE 99K/320), 다우웩스 모노스피어 99K/350(DOWEX MONOSPHERE 99K/350), 다우웩스 모노스피어 99Ca/320(DOWEX MONOSPHERE 99Ca/320), 다우웩스 모노스피어 99Ca/350(DOWEX MONOSPHERE 99Ca/350), 다우웩스 마라톤 C(DOWEX Marathon C), 다우웩스- 032(DOWEX -032), 다우웩스- 406(DOWEX -406), 다우웩스- 437(DOWEX -437), 듀오리트 C-280(DUOLITE C-280), 및 듀오리트 C-291(DUOLITE C-291), 이들은 슈펠코, 주식회사, 벨레폰테, 펜실베니아, 미국(Supelco, Inc., Bellefonte, Pennsylvania, U.S.A.)으로부터 입수 가능하다; 앰버리트 IR-120(AMBERLITE IR-120), 앰버리트 IR-120B(AMBERLITE IR-120B), 앰버리트 IR- 200C(AMBERLITE IR- 200C), 앰버리트 CG 6000(AMBERLITE CG 6000), 디어나이온 SK-1B(DIAION SK-1B), 다우웩스 XUS 40406.00(DOWEX XUS 40406.00), 다우웩스 XUS 43518(DOWEX XUS 43518), 및 다우웩스 C500ES(DOWEX C500ES). 선호되는 것은 앰버리트 IR-120(AMBERLITE IR-120), 앰버리트 IR-120B(AMBERLITE IR-120B), 앰버리트 IR- 200C(AMBERLITE IR- 200C), 다우웩스 C500ES(DOWEX C500ES), 다우웩스 XUS 43518(DOWEX XUS 43518), 및 다우웩스 XUS 40406.00(DOWEX XUS 40406.00)이다. 가장 바람직한 것은 다우웩스 XUS 40406.00(DOWEX XUS 40406.00)이다. 르와티트TM S100(LEWATITTM S100), S109, SP112, SP120(베이어(Bayer)에 의해 제조됨) 등. 특히, UBK-530, UBK-550(미쓰비시 케미칼 코퍼레이션(Mitsubishi Chemical Cooperation)에 의해 제조됨)과 같은 산업적 크로마토그래피를 위한 좁은 파티클 사이즈 분포를 갖는 강한 산성의 양이온성 교환 수지들.
본 발명에 따르면, 크로마토그래피 컬럼 내에서의 흡착제는 이온 교환 모드로 기능한다. 크로마토그래피 컬럼 내에서의 흡착제가 이온 교환 수지로서 기능할 때에, 암모늄 숙신산염 또는 숙신산의 어떤 다른 염을 함유하고 있는 발효 배지는 어떤 화학적 처리없이 직접적으로 사용될 수 있다. 상기 숙신산 염은 상기 흡착제의 표면 상에서 "염-쪼개짐(salt splitting)" 반응 하에 놓여지며 또한 이러한 프로세스 내에서 방출되는 숙신산은 사용되는 수지의 화학적 성질에 의존적으로 라피네이트 스트림 내 또는 추출물 스트림 내 중 어느 것에서 회수된다. 따라서 본 발명에 따르면, 숙신산염을 함유하고 있는 발효 배지는 직접적으로 이온 교환 수지를 포함하는 크로마토그래피 컬럼에 대하여 적용된다. 이것은 이온 배제 크로마토그래피에서의 요구와는 반대되는 것이다. 숙신산의 분리를 위한 이온 배제 크로마토그래피의 경우에는, 숙신산의 염을 함유하고 있는 발효 배지는 일차적으로 숙신산을 침전시키기 위하여 산성화되며 또한 그 결과로서의 숙신산은 흡착제에 의한 전하 반발의 정도를 기반으로 하여 산성화된 발효 배지 내의 나머지 성분들로부터 분리된다.
도 2 및 3은 양이온성 이온 교환 수지의 표면 상에서의 염 쪼개짐 반응을 도시한다. 암모늄 숙신산염은 분리 및 정제의 단계들 후에 숙신산을 생산하는 목적으로서, 수성 상의 발효(aqueous phase fermentation)를 통하여 생산된다. 본 발명의 프로세스에서, 원료 스트림 내에 존재하는 암모늄 숙신산염은 수소 형태로서의 양이온 교환 수지의 컬럼을 지나 통과된다. 상기 원료 스트림이 컬럼을 통하여 흐를 때에, 양이온 교환이 일어나고, 여기서 상기 수지는 암모늄 숙신산염을 "쪼개며(splits)" 또한 방출된 암모늄 양이온(NH4+) 은 상기 수지에 결합되며 반면 처음에는 상기 수지 상에서의 수소 이온(H+)은 용액 내로 방출된다. 이러한 이온 교환 반응의 개략도가 도 2에 보여진다.
상기 양이온성 이온 교환 수지로부터 방출에 따라, 상기 수소 이온은 숙신산염 음이온과 결합하고, 숙신산을 형성한다. 숙신산은 따라서 일련의 물 세정들(water rinses)을 통하여 컬럼으로부터 나와 크로마토그래피의 피크 분획(chromatographic peak fraction)으로 흐른다.
"염 쪼개짐(salt splitting)" 이온 교환 크로마토그래피의 두번 째 단계에서, 결합된 암모늄 양이온은 희석된 황산 용액의 통과를 통하여 상기 수지로부터 방출된다. 이 프로세스는 후속적인 사용을 위한 양이온성 이온 교환 수지를 재생산한다. 이 재생산 단계의 과정 동안에, 제1 이온 교환 단계의 반대의 것(reverse)이 일어나고, 완전하게 이온화된 황산 용액으로부의 수소 이온은 이전에 결합되어 있는 암모늄 양이온의 동시적인 방출과 함께 상기 수지에 대하여 결합한다. 방출된 암모늄 양이온은 다음으로 상기 이온화된 황산의 황산염 음이온과 결합하여 용액 내에서의 암모늄 황산염을 수득한다. 일련의 순수한 물 세척들(water wasinhs)을 수행하는 방법에 의하여, 암모늄 황산염이 다음으로 상기 컬럼으로부터 나와 그것의 고유의 크로마토그래피 피크 분획(chromatographic peak fraction) 내로 세척된다. 암모늄 황산염의 생산과 함께인 양이온 교환 수지의 재생산에 대한 개략도가 도 3에 도시된다.
발효 배지 내에 존재하는 암모늄 숙신산염 분자들 상에서 "염 쪼개짐(salt splitting)" 반응을 수행하는 흡착제의 능력은 흡착제 및 암모늄 숙신산염 분자에 대한 산 해리 상수 값(acid dissociation constant values)에 의하여 결정된다. 상기 산 해리 상수(acid dissociation constant)는 또한 "pKa"로서 참조되며 및 이는 수성의 용액 내에서의 산의 구성하는 양이온 및 음이온으로의 해리에 대한 평형 상수에 관련된다. 본 발명의 일 실시예에서, 암모늄 숙신산염을 포함하는 수성의 용액은 암모늄 숙신산염의 산 해리 상수보다 적어도 0.5 적은 pKa 값을 갖는 산 이온 교환 수지와 접촉된다. "염 쪼개짐(salt splitting)" 반응의 결과로서 방출되는 암모늄 양이온은 이온 교환 수지에 대하여 결합된다. 상기 이온 교환 수지에 대하여 결합된 암모늄 이온은 그것의 염 형태에서 상기 이온 교환 수지에 대한 pKa 값보다 적어도 0.5 적은 pKa 값을 갖는 산을 포함하는 세척 단계에 의하여 방출될 수 있다.
본 발명의 또 다른 실시예에서, 음이온성 이온 교환 수지가 흡착제로서 사용된다. 상기 반응의 제1 단계에서, 암모늄 숙신산염으로부터 유도된 숙신산염 음이온은 숙신산 분자 및 상기 수지 상의 이온 교환 사이트들 사이에서의 이온 결합의 형성에 의하여 상기 강한 음이온 교환 수지에 대하여 흡착된다. 이 단계에서 중성의 또는 양이온성의 물질, 또는 거대 분자들 또는 세포성 부스러기들(cellular debris)의 대부분이 상기 수지를 통하여 통과한다. 다음 단계에서 상기 수지는 상기 이온 교환 수지 내에 트랩되어 있는 비결합된 오염원들을 제거하기 위하여 물로서 세척된다. 이 세척 단계에 후속하여, 상기 숙신산염 음이온은 더 강한 음이온성 이온에 대하여 상기 흡착된 숙신산 이온을 교환하는 것에 의하여 상기 수지로부터 치환된다. 상기 컬럼으로부터 숙신산의 제거 이후에, 상기 음이온 교환 수지는 상기 수지 상에서의 음이온 교환 사이트들을 재생하는 것에 의하여 숙신산 흡착의 추가적인 사이클을 위하여 준비된다. 이것은 상기 수지를 황산 또는 염산과 같은 강산으로 처리하는 것에 의하여 달성될 수 있으며, 이는 무기 음이온이 상기 숙신산염 음이온에 대하여 교환되는 것을 유발한다. 암모늄 숙신산염을 함유하고 있는 발효 배지와 함께 음이온 교환 수지를 사용하는 것의 전체적인 결과는 정제된 숙신산의 분리이다.
크로마토그래피적인 과정을 통하여 발효 배지로부터 이에 따라 회수된 숙신산은 추가적으로 나노 여과를 통하여 정제될 수 있다.
실시예
발효 배지의 설명
0.1μM의 포어 사이즈를 가지고 있는 마이크로 여과(microfiltration(MF))에 대하여 적합한 멤브레인 및 150 kDa의 컷-오프(cut-off) 값을 갖는 한외 여과(ultrafiltration (UF))에 대하여 적합한 또 다른 멤브레인이 암모늄 숙신산염을 함유하고 있는 발효 배지를 정화하는데(clarifying) 있어서의 그들의 효율성에 대하여 테스트되었다. 이러한 두 개의 다른 멤브레인들의 특징적인 특성들은 하기 표 1에서 보여진다.
이러한 두 개의 멤브레인들을 구비하는 정화 파일럿 개략도(clarification pilot scheme)가 도 4에서 제공된다. 투과물 플로우 속도(permeate flow rate)는 각 멤브레인에 대하여 막-관통 압력(trans -membrane pressure (TMP))의 성능으로서 측정되었다. 이 단계에 대하여, 상기 멤브레인을 통과하는 원료 배지 플로우(feed broth flows) 및 TMP가 투과물 회로(permeate circuit)를 개방시키는 것에 의하여 달라졌다. 잔류물 및 투과물 양자가 부피적인 농도 요소(volumetric concentration factor (VCF))를 1로 유지하기 위하여 일정하게 재-순환되었다. 상기 두 개의 멤브레인들로부터 얻어진 투과물은 상기 플로우 속도가 가장 넓은 멤브레인(컷 오프: 0.1μM)에서 더 높았음에도 불구하고 맑았다(clear). 0.1μM의 포어 직경을 갖는 멤브레인은 TMP=0.8 바(bars)와 함께 250 l/h/m2의 플로우 속도를 보였다. 150 kDa 컷-오프를 갖는 한외 여과의 다른 멤브레인은 TMP=1.6 바(bars)와 함께 300 l/h/m2의 플로우 속도를 보였다.
암모늄 숙신산염을 함유하고 있는 발효 배지의 후속적인 정화가 우수한 투과 퀄리티를 보장하고 또한 부착물 위험성(fouling risks)을 제한하기 위하여 150 kDa 컷-오프 멤브레인을 사용하여 35-39℃에서 배치 모드로 수행되었다. VCF의 농도 요소: 10이 143 l/h/m2의 평균 플로우 속도와 함께 TMP > 2 바(bars)에서의 파일럿 스케일에서 도달되었다. 측정된 숙신산염 회수는 VCF=10 에서의 정화 후에 87% 이었다. 부가적인 투석 여과(diafiltration)는 숙신산염 회수율을 94% 까지 증가시키도록 보조하였다. 산업적 스케일에서, 하기의 변수들에 의해 99% 까지의 숙신산염 회수에 도달하는 것이 가능하다: 자유 컬럼 부피(Free column volume (FCV) = 20 및 투석 여과 비 물/잔류물(Diafiltration ratio water/retentate) = 4.5 /1 (표 2).
양이온성 이온 교환 크로마토그래피
본 발명의 프로세스에서, 다우웩스 G-26(Dowex G-26) 또는 란섹스 르윗 모노플러스 S 100H(Lanxess Lewit MonoPlus S 100H)과 같은 강한 산성의 양이온 교환 수지를 함유하는 준비된 크로마토그래피 컬럼(1.6 cm 직경 x 100 cm 길이)이 암모늄 숙신산염 분자를 쪼개고 또한 각 숙신산염 분자에 대하여 두 개(2)의 수소 이온들(H+) 을 제공하기 위하여 사용되었다. 란섹스 수지 108H(Lanxess resin 108H)이 또한 란섹스 수지 100H(Lanxess resin 100H)을 대신하여 사용될 수 있다. 이러한 프로세스는 용액 내에서 숙신산을 생산하고 이는 다음으로 일련의 '느린(slow)' 및 '빠른(fast)' 순수한 물 세정들을 통하여 상기 컬럼으로부터 세척된다.
암모늄 숙신산염 분자가 강한 산성의 양이온 교환 수지를 통하여 쪼개질 때에, 그 암모늄 양이온(NH4 +) 은 상기 양이온 교환 수지에 대하여 결합된다. 순수한 물 세정이 숙신산을 세척해 내기 위해 수행된 이후에, 상기 수지 베드(resin bed)는 상기 양이온 수지 비드들을 재생산하기 위하여 적합한 농도의 황산으로 세척된다. 이 단계에서, 황산으로부터의 수소 이온(H+)이 이미 결합되어 있는 암모늄 이온(NH4 +)과 교환되어, 용액 상에서 암모늄 황산염 (NH4)2SO4을 생산한다. 상기 암모늄 황산염은 다음으로 일련의 '느린(slow)' 및 '빠른(fast)' 순수한 물 세정들을 통하여 상기 컬럼으로부터 나와 그것의 고유의 크로마토그래피 피크 분획(chromatographic peak fraction) 내로 세척된다.
이 프로세스를 위한 작동 사이클은 하기의 단계들을 포함한다: (1) 적당한 부피로 및 적당한 흐름 속도로 원료의 첨가. 상기 원료는 1.0 컬럼 부피(column volume (CV)) 내지 2.5 CV의 범위 내에서의 부피로 적용될 수 있다. 바람직한 실시예에서, 상기 원료는 1.2 CV 내지 2.2 CV의 범위 내에서 첨가되고 및 가장 바람직한 실시예에서, 상기 원료는 1.5 CV 내지 1.7 CV의 범위 내에서 첨가된다. 첨가되는 원료의 부피는 상기 원료 내의 암모늄 숙신산염의 농도 및 사용되는 이온 교환 수지의 흡착 능력에 매우 의존적이라는 점을 명심해야 한다. 상기 발효 배지 내에 존재하는 암모늄 숙신산염의 농도 및 사용되는 이온 교환 수지의 흡착 능력을 기반으로 하여, 첨가되는 원료의 적합한 부피가 계산될 수 있고 이에 따라 상기 원료에 존재하는 암모늄 숙신산염의 전체 양이 상기 이온 교환 수지의 표면 상에서 쪼개지고 또한 사용되는 이온 교환 수지의 타입에 의존적으로 암모늄 또는 숙신산염을 포함하는 이온 교환 수지의 포화 및 그 라피네이트 스트림 내에서의 암모늄 숙신산염의 오버 플로우의 문제가 발생하지 않는다. 유사하게, 원료 플로우 속도는 2 내지 4의 시간 당 베드 부피(bed volume per hour (BVH))의 범위 내일 수 있다. 바람직한 실시예에서, 상기 원료 플로우 속도는 2.5 내지 3.5 BVH의 범위 내일 수 있고 또한 가장 바람직한 실시예에서, 상기 원료 플로우 속도는 2.9 내지 3.2 BVH의 범위 내일 수 있다. (2) 느린 세정 단계로서 여기에서 상기 크로마토그래피의 컬럼은 1 내지 4 CV의 첨가되는 물로 1 내지 4 BVH의 흐름 속도에서 세척된다; (3) 빠른 세정 단계로서 여기에서 상기 크로마토그래피의 컬럼은 1 내지 4 CV의 물로 5 - 10 BVH의 흐름 속도에서 세척된다; 바람직한 실시예에서, 상기 빠른 세정은 7 내지 9 BVH의 흐름 속도에서 수행된다. (4) 재생산 단계로서 여기에서 상기 컬럼은 1 내지 4 CV의 적합한 농도에서의 강산으로 1 내지 4 BVH의 흐름 속도에서 세척된다. 본 발명에 대하여 적합한 강한 유기산은 염산(hydrochloric acid), 질산(nitric acid), 황산(sulfuric acid) 및 인산(phosphoric acid)으로 이루어지는 그룹으로부터 선택된다. 상기 강산의 농도는 상기 이온 교환 수지가 크로마토그래피적 프로파일에 의해 증명되는 바와 같은 짧은 시간의 주기 내에서 완전하게 재생산되는 그러한 방법으로 선택된다. (5) 느린 세정 단계로서 여기에서 상기 컬럼은 1-4 CV의 물로 1-4 BVH의 플로우 속도에서 세척된다; 및 (6) 빠른 세정 단계로서 여기에서 상기 컬럼은 6-10 CV의 물로 5-10 BVH의 플로우 속도에서 세척된다. 이러한 작동 조건들은 단지 예로서 제공된다. 이러한 작동 조건들은 매우 높은 수준의 순도를 갖는 숙신산의 최대의 회수에 도달하기 위하여 적합하게 변형될 수 있다.
양이온 교환 수지를 포함하는 컬럼으로부터 나오는 플루이드는 상기 크로마토그래피 컬럼으로부터 나오는 플루이드의 굴절률(refractive index)을 측정하기 위하여 굴절계(refractometer) (컨트롤 유닛 CBM-28(Control Unit CBM-28)을 구비하는 시마드주 RID-10(Shimadzu RID-10))을 통하여 통과되었다(도 5). 상기 굴절계로부터 나오는 플루이드 라인은 또한 210 nm 에서의 흡광도를 모니터링하기 위하여 UV 다이오드 어레이 분광 광도계(UV Diode array spectrophotometer)를 통하여 통과하였다. 크로마토그래피 컬럼으로부터 나오는 플루이드에 대한 이러한 광학적 측정들 이외에, 상기 크로마토그래피 컬럼으로부터 수집되는 분획들에 대하여 화학적 분석이 또한 수행되었다. 다섯 개의 다른 분획들이 표 3 및 도 7에서 보여지는 바와 같이 305 분의 시간 경과 동안 크로마토그래피의 컬럼으로부터 수집되었다.
표 3에서 기재된 바와 같이 수집된 다섯 개의 다른 분획들은 숙신산, 아세트산, SO4 2- 및 NH4 + 의 함량에 대하여 분석되었다. 상기 발효 배지 내에 존재하는 숙신산 및 다른 유기산 불순물들은 바이오래드 아미넥스 HPX-87H 컬럼(BioRad Aminex HPX-87H column)을 구비하는 에질런트 1200 HPLC 장치(Agilent 1200 HPLC apparatus ) 상에서 분석되었다. 바이오래드 마이크로가드 양이온 H+(BioRad Microguard Cation H+)이 가드 컬럼(guard column)으로서 사용되었다. HPLC 분석에 대한 기준은 0.008N 황산으로 준비되었다. 상기 HPLC 컬럼 온도는 50℃에서 유지되었다. 0.008N 농도에서의 황산은 0.6 ml/분의 플로우 속도에서의 이동상으로서 사용되었다. 다양한 성분들의 정량화가 210 nm에서의 그들의 흡착도를 측정하는 것에 의하여 수행되었다.
암모늄 이온 농도가 mv로 기록할 수 있는 측정계를 구비하는 메틀러 토레도(Mettler Toledo) 콤비네이션 NH4 + 이온 선택성 전극(ion selective electrode (ISE))을 사용하여 측정되었다. 표준 용액들(5000, 500, 50 및 5 ppm 암모늄)이 물에 암모늄 황산염을 용해시키는 것에 의하여 준비되었다. 테스트 샘플들은 순수한 물 내에 숙신산 결정들의 알고 있는 양을 용해시키는 것에 의하여 준비되었다.
황산염 분석은 환경 모니터링 시스템 실험실, 연구 및 개발 사무소, 미국 환경 보호 에이전시, 신시네티, 오하이오, 미국(Environmental Monitoring Systems Laboratory, Office of Research and Development, U. S. Environmental Protection Agency, Cincinnati, Ohio, USA)에 의해 제공되는 바와 같은 이온 크로마토그래피(개정 2.1. 1993년 8월)에 의하여 무기 이온들의 결정을 위한 메쏘드 300.0(Method 300.0)을 사용하여 수행되었다.
도웩스 G-26 H 수지(Dowex G-26 H resin)로 수행된 초기의 전개 작업(Initial development work)은 물로의 빠른 세정 후에 도웩스 G-26 H 수지(Dowex G-26 H resin)를 재생산하기 위하여 요구되는 황산의 농도를 최적화하는 데에 촛점이 맞추어 졌다. 도 5 및 6은 암모늄 숙신산염을 포함하는 초기의 염 쪼개짐 반응 이후에 양이온 교환 수지의 재생산에 대한 황산의 요구를 최적화하기 위한 실험들로부터의 결과를 보여준다. 이러한 두 개의 도면들은 두 개의 다른 실험들에서 초기의 160 분 동안 크로마토그래피 컬럼으로부터 나오는 용액의 굴절률에 대한 프로파일을 보여준다. 크로마토그래피의 작동 과정 동안에 다른 시간에서의 숙신산, 아세트산, SO4 2- 및 글리세롤의 측정이 또한 이루어졌다.
65 g/L의 초기 암모늄 숙신산 농도를 갖는 이. 콜리(E. coil)의 KJ122 스트레인을 사용하는 것으로부터 얻어진 발효 배지가 도웩스 G-26 H 수지(Dowex G-26 H resin)를 구비하는 크로마토그래피 컬럼 상에 로딩되었다. 2.36 CV의 원료가 상기 크로마토그래피 컬럼에 대하여 첨가되었다. 도 5에 기재된 실험에서, 64.69 g/L의 피크 숙신산 농도가 60 분에서 용출되는 분획에서 관찰되었다. 동일한 시간점에서, 그 컬럼으로부터 용출되는 분획 내에서의 글리세롤 농도는 1.67 g/L인 것으로 밝혀졌고 또한 아세트산 농도는 3.94 g/L인 것으로 밝혀졌다. 그러나, 그 굴절값(refractive value)는 80 분까지 계속하여 증가하였고 또한 60 내지 80 분 사이에서 구분되는 피크가 존재하였다. 60 내지 80 분 사이에서 제2의 피크는 양이온 교환 수지가 처음 60 분 동안의 염 쪼개짐 반응으로부터 유도되는 암모늄 양이온으로 완전히 포화된 후에 암모늄 숙신산염의 용출에 기인하는 브레이크쓰루(breakthrough) 피크를 나타낸다. 본 발명에서 정의되는 바로서, 용어 "브레이크쓰루(breakthrough)"는 이온 교환 수지가 황산염 이온으로 포화된 후에 컬럼으로부터 용출되는 분획에 상응한다. 다른 의미로서, 상기 브레이크쓰루(breakthrough) 피크는 원료 용액의 고유의 성분을 필수적으로 포함한다. 64 분에서 컬럼으로부터 용출되는 분획 내에는, 황산염 농도가 167.7 ppm 인 것으로 밝혀졌고, 또한 77 분에서 용출되는 분획 내에는 황산염이 검출되지 않았다. 85 분에서 용출되는 분획에서는, 숙신산 농도가 0.44 g/L였고 또한 숙신산 농도는 0.11 g/L의 수준으로까지 감소하였다. 이러한 관찰은 적합한 원료 농도를 최적화하는 방법에 의하여 원료 물질 내에서의 암모늄 숙신산염의 과량에 기인하는 제2의 피크를 제거하는 것이 가능하다는 것을 나타낸다.
우리는 도 6에 기재된 실험에서 유사한 크로마토그래피적 프로파일을 관찰하였다. 두 개의 다른 피크는 분리의 처음 80분 내에 검출 가능하다. 제1 피크는 더 이른 시간점들에서의 분획에서 숙신산의 높은 농도의 존재에 의하여 입증되는 바와 같이 숙신산의 용출에 기인한다. 상기 숙신산 농도는 45 분에서 용출된 분획에서 72.45 g/L이었고 이것은 55 분에서 용출된 분획에서 66.12 g/L의 수준으로까지 및 72 분에서 용출된 분획에서 0.55 g/L의 수준으로까지 감소하였다. 92분에서 용출하는 분획에서, 숙신산 농도는 0.07 g/L이었다. 45분에서 용출하는 분획에서, 황산염 농도는 810 ppm 인 것으로 밝혀졌고 이것은 72 분에서 용출하는 분획에서 18.2 ppm의 수준으로까지 감소하였다. 이러한 함께 수행된 관찰들은 도 5 및 도 6 양자에서 기록된 실험들에서, 제2 피크는 암모늄 숙신산염의 쪼개짐으로부터 유도되는 황산염으로의 양이온 이온 교환 수지의 포화로 인하여 상기 양이온 이온 교환 수지의 표면 상에서의 염 쪼개짐 반응 하에 놓여지지 않았던 암모늄 황산염의 용출에 기인한다는 것을 제시한다.
도 5에서 보여지는 실험에서, 양이온 교환 수지를 재생산하는 방법으로서, 2 CV의 5%(w/w) 황산이 재생산 프로세스를 개시하기 위하여 110분에서 첨가되었다. 이러한 재생산 프로세스는 황산의 첨가에 후속하여 크로마토그래피 컬럼으로부터 나오는 플루이드의 굴절률(refractive index) 에서의 증가에 의해 증명되는 바와 같이 암모늄 황산염을 방출할 것으로 기대된다. 160 분에서의 굴절률에 의해 나타내지는 바와 같이, 암모늄 황산염의 방출은 5%의 황산으로 수행되는 세척으로 160 분에서 완전하지 않았다. 150 분에서 용출하는 분획에서, 황산염 농도는 9585 ppm인 것으로 밝혀졌다. 그러나, 도 6에서 보여지는 바와 같이, 10%로 까지 황산 농도를 증가시키는 것에 의하여, 베이스 레벨(base level)에 이르는 굴절률 값에 의해 증명되는 바와 같이 양이온 교환 수지의 완벽한 재생산에 도달하는 것이 가능하다. 양이온 이온 교환 수지의 재생산을 위한 10%(w/w) 황산의 사용으로, 92분에서 용출하는 분획에서의 황산염 농도는 20128 ppm인 것으로 밝혀졌다. 139분에서 용출하는 분획에서의 황산염 농도는 2664 ppm인 것으로 밝혀졌고 또한 221분에서는, 황산염 농도가 36.6 ppm의 수준으로까지 감소하였다.
10%의 황산 농도가 완벽한 양이온 교환 수지의 재생산에 도달하기 위하여 최적이었음을 결정한 후에, 일곱 개의 추가적 실험들(실험 4-10)이 도웩스 G-26 H 수지(Dowex G-26 H resin)를 사용하여 수행되었다. 이러한 일곱 개의 실험들 중 하나에 대한 굴절률에 대한 프로파일이 도 7에 보여진다. 도 7은 또한 수집된 다양한 분획들에 상응하는 굴절률 프로파일의 영역들을 보여준다. 표 4는 도웩스 G-26 H 수지(Dowex G-26 H resin)으로 수행된 실험들 4-10 의 분획 F2에서의 숙신산의 순도 및 퍼센트 회수를 제공한다.
양이온 교환 수지를 재생산하기 위하여 요구되는 황산 농도를 최적화한 후에, 실험들은 브레이크쓰루 피크로부터 숙신산 피크의 분리에 도달하기 위한 원료 부피를 최적화하기 위하여 또 다른 양이온 교환 수지 란섹스 S100 H(Lanxess S100 H)로 수행되었다. 표 5에 보여지는 바와 같이, 여섯 개의 다른 실험들이 1.5 내지 2.16 CV이 범위 내에서의 원료 물질들의 다른 부피를 사용하여 수행되었다.
이러한 여섯 개의 실험들에 대한 굴절률 프로파일이 도 8에 보여진다. 도 8에서 보여지는 바와 같이, 1.5 CV로 까지 원료 부피를 낮추는 것에 의하여, 상기 브레이크쓰루 피크를 제거하고 또한 분명한 단일 피크로서의 숙신산 회수에 도달하는 것이 가능하다. 명확성을 위하여, 도 9는 1.5 CV의 원료를 사용하여 란섹스 S100 H(Lanxess S100 H) 양이온 교환 수지로 수행된 단지 테스트 5에 대한 굴절률의 프로파일을 보여준다. 표 6은 도 8에서 보여지는 피크 1 및 피크 2 분획들 내에서의 숙신산, 아세트산, SO4 2- 및 NH4 + 의 함량의 정량적인 분석에 대한 결과를 제공한다. 도 8 및 표 6에서 보여지는 결과들이 나타내는 바와 같이, 원료 부피를 조절하는 방법에 의하여, 브레이크쓰루 피크를 제거하고 또한 단일 피크로서 숙신산 회수에 도달하는 것이 가능하다. 이것은 테스트 5에서, 1.5 CV의 원료 첨가로, 단일 피크로서 숙신산을 회수하는 것이 가능하였다는 사실에 의하여 입증된다. 이러한 피크는 NH4 + 에 대하여 최소 값을 보여주었다. 테스트 5의 피크 1 분획 내에서의 NH4 + 의 양은 원료의 더 높은 부피가 사용되었던 다른 테스트들로부터의 피크 1 분획 내에서의 NH4 + 의 함량보다 100 배 낮았다. 이에 더하여 피크 1 분획에 대한 SO4 2- 값은 모든 테스트들에서 낮았는데 이것은 이러한 실험들에서 사용된 세정 프로토콜이 상기 컬럼을 다음 라운드의 원료 첨가로 제공하기 이전에 모든 불순물들을 제거하는데 최적이었음을 제시한다.
음이온 교환 수지에 의한 크로마토그래피에 대한 펄스 테스트(pulse test) 결과
연속적인 이온 교환 크로마토그래피에서 사용되는 음이온 교환 수지를 선택하기 위하여 발효 배지 및 세 개의 다른 음이온 교환 수지들에 대한 펄스 테스트가 수행되었다. 상기 발효 배지는 표 7에서 보여지는 바와 같은 조성을 가졌다.
본 발명에서 테스트되는 세 개의 다른 음이온 교환 수지들의 화학적 특성들이 표 8에 제공된다. 이러한 세 개의 음이온 교환 수지 각각을 구비하는 샘플 용출 일련의 프로파일이 표 9에 제공된다. 상기 컬럼들은(초기에 황산염 형태 하에서) 최대 수지 용량(maximum resin capacity)을 평가하기 위하여 표 9에서 제공되는 부피를 갖는 비가공 배지(raw broth)로 오버 로딩된다. 상기 컬럼은 물로 세정되었으며 10% 황산으로의 세척하는 것 및 물로의 세정을 포함하는 재생산 단계에 의하여 후속되었다. 본 발명에서 테스트되는 세 개의 수지들 각각에 대한 성능의 요약이 표 10으로 제공된다. 수지 XA 3121은 숙신산염 용량에 대하여 열악한 효율성을 보여주었다. 제1 사이클의 과정 동안 수지들 XA 4122 및 XA 3114는 전체 교환 용량 또는 요구되는 세정 부피(rinse volume) 중 어느 것에 대하여 매우 근접한 결과들을 주었다.
세 개의 다른 음이온성 교환 수지들로의 펄스 테스트로부터의 결과들을 검토한 후, XA 3114가 연속적인 이온-교환 실험들에 대하여 선택되었다. 연속적인 이온-교환 작동에 대한 XA 3114 수지의 이러한 선택은 두 가지 추리를 기반으로 ㅎ하였다: (1) 산업적 스케일에서, 재생산 속도는 화합물들의 소모를 최소화하도록 제한된다. 숙신산염에 대하여 라피네이트로의 허용 가능한 누수 값들 하에 머무르기 위하여, 실험실 스케일에서 측정된 최대 용량과 비교하여 수지의 작업 용량을 낮출 수 있다. 이에 따라, XA 4122보다 더 큰 용량을 갖는 XA 3114로 더 큰 이온 교환 용량에 도달할 수 있다. (2) 상기 XA 3114는 분리 효율성을 향상시키고 또한 세정 수의 부피를 최소화하는 것을 보조하는 모노스피어 타입의 수지(monosphere type resin)이다.
음이온 교환 수지를 갖는 연속적인 이온 교환 크로마토그래피
배치 모드와 비교하여, 연속적인 이온-교환은 숙신산 분획의 순도에서의 증가, 전체적인 화합물 조성의 감소 및 물 소모에서의 감소에 대하여 허용한다. 연속적인 이온-교환 크로마토그래피는 음이온 수지(0.4 L/컬럼) 로 충진된 열 개의 컬럼들 상에서 수행되었다. 그 파일럿은 4 개 영역들로 나뉘어졌고, 각각은 1 내지 3개의 컬럼들로 구성된다. 각 시퀀스는 도 10에서 보여지는 바와 같이 2개의 단계들로 나뉘어졌다. 숙신산염은 음이온적 수지 상에 잡혔고 또한 산 재생산 과정 동안 방출되었다. 재생산은 공동-흐름 모드(co-current mode)로 수행되었다. 암모늄 황산염은 라피네이트에서 회수되었고 또한 숙신산은 추출물에서 회수되었다.
연속적인 이온-교환 프로세스는 숙신산의 상기 이온-교환 컬럼들 내로의 어떤 결정화를 피하기 위하여 실험들의 과정 동안 50℃에서 수행되었다.
규칙적으로 입구 및 출구는 상기 수지의 역방향-흐름 치환(counter-current displacement)을 자극하기 위하여 하나의 컬럼으로부터 다음 것으로 이동되는 하향 스트림(downstream)이었다. 예로서, 도 10 상에서, 스텝의 종점에서, 컬럼 n°1은 다음 시퀀스에 대한 컬럼 n°4가 된다.
여섯 개의 다른 셋팅들에 상응하는 여섯 개의 다른 실험들이 회수 및 순도의 목표 양자에 도달하기 위하여 수행되었다. 주입된 생성물의 부피 및 원료 및 재생제(regenerant)의 농도가 각 셋팅에 대하여 달랐다. 표 11은 음이온 수지를 사용하는 연속적인 이온-교환에 대한 일련의 기재(sequential description)를 제공한다.
셋팅 1 내지 3에 대하여, 재생산의 출구는 두 개의 파트로 나뉘어졌다: 제1 파트가 추출 생성물로서 수집되고, 반면 수집의 최후의 것이 그 희석된 재생제의 스트림(dilute regenerant (DRG) stream)으로 보내어졌다. 셋팅 4 내지 6에 대하여 , 전체적인 출구 재생산이 추출 생성물로서 수집되었다.
재생제 농도는 컬럼 내부로의 산 결정화를 유도할 수 있는 추출물 분획으로의 너무 높은 숙신산 농도를 피하기 위하여 80 g/L H2SO4 로서 고정되었다. 이에 더하여, 상기 컬럼들은 50℃에서 온도 조절되었다.
이전의 셋팅들의 각각에 대응하는 다른 플로우들의 조성이 표 12에 기록되어 있다.
셋팅 1 내지 5에 대하여, 원료 숙신산염 농도는 55-60 g/L 였다. 셋팅 6으로부터, 음이온성 수지 상에서 황산염으로의 교환을 향상시키고 또한 라피네이트로의 숙신산염의 손실을 감소시키기 위하여 원료 생성물은 50 g/L 숙신산염으로 희석되었다. 이 마지막 셋팅은 2.8 g/L의 숙신산염 누수를 포함하여, 라피네이트 내에서의 80 g/L의 암모늄 황산염을 생산하였다. 상기 추출물은 41 g/L 숙신산으로 농도되었고 또한 다른 음이온들의 적은 양(1 g/L 황산염 미만)으로 오염되어 있었다.
희석된 원료 농도는 암모늄 숙신산염에서 2g/L 이었으나 그러나 3 g/ L의 황산염 음이온을 함유하였다. 이것은 정화 단계에서 투석-여과수(dia-filtrarion water)로서 사용될 수 있다.
희석된 재생제에서, 황산염 농도는 35 g/L에 도달하였다. 그것은 재생제를 다시 준비하기 위한 용매로서 직접적으로 사용될 수 있다. 그것은 대략적으로 2 g/L의 숙신산염을 포함하였고 이는 다음으로 상기 컬럼들에 대하여 재활용되며 손실되지 않는다. 매스 밸런스(mass balances)는 일반적으로 평형이 되며 또한 상기 결과들을 확인하였다. 상기 매스 밸런스는 덜 농출되었던 아세트산염(acetate)에 대하여 이루어지는 것이 더욱 어려웠다. 표 13은 각 셋팅에 대하여 계산된 성능들을 요약한 것이다.
숙신산의 로딩 및 회수 속도는 염화물 형태 하의 수지로 작업하는 것 및 H2SO4 대신에 HCl로 재생산하는 것에 의하여 더욱 높아질 것이라는 점이 주목된다. 사실, 상기 경쟁은 수지 상에서 양자 모두 2가인 숙신산염 및 황산염 사이에서 높다. 이것은 상기 두 종류의 것 사이에서의 교환이 생성 모드에서 더욱 어렵기 때문에 라피네이트로의 더 높은 숙신산염 누수의 결과를 가져온다. 다른 한편, 숙신산염 및 염화물 사이에서의 경쟁은 상기 수지가 1가의 것에 대해서 보다 2가의 종류에 대하여 더 큰 친화성을 가지고 있으므로 숙신산염에 대하여 선호되는 것으로 나타난다. 결과적으로, HCl로의 수지를 재생산하는 것은 라피네이트로의 더 낮은 숙신산염 누수 및 더 높은 회수율의 결과를 가져올 것이다. 이에 더하여, H2SO4 는 완전하지 않게 해리되는 산으로 여겨지며 이는 상기 수지가 완벽하게 해리되어 동일한 재생산 효율성에 도달하는 HCl에 의한 것보다 더 높은 H2SO4 재생 속도를 요구한다는 것을 의미한다.
폴리싱 실험
폴리싱 실험의 목적은 우수한 숙신산 결정 퀄리티를 보장하기 위하여 요구되는 디자인을 결정하는 것이다. 이 단계는 나노 여과(nanofiltration(NF))의 사용을 포함하며, 또한 상기 폴리싱 과정의 궁극적인 목적은 숙신산의 99.5%의 순수한 흰색의 결정을 획득하는 것이었다. 이온 교환 추출물은 결정화 단계로 그 생성물을 보내기 전에 색상을 제거하기 위하여 NF에 의하여 처리되었다. 상기 NF 투과물(탈색되어진 숙신산)은 결정화 단계로 보내어졌다. 상기 나노 여과에서 사용된 필터의 특성들은 표 15에서 제공된다.
이온 교환 추출물 셋팅 6으로부터의 원료 생성물이 폴리싱 실험의 과정 동안의 비가공 재료로서 사용되었다. FCV=31이 도달되었을 때에 낮은 잔류물 수준 때문에 실험은 중지되었다. 숙신산염의 회수율을 향상시키기 위하여 두 번의 최종 투석-여과(dia-filtrations) (물/잔류물 비=각각 1/1)가 수행되었다. 투과물 플로우 전개가 도 11에 기록되어 있다. 도 11에서 보여지는 바와 같이, 폴리싱 실험은 비통상적인 행위로 나타났다. 플로우 속도는 표준의 감소하는 경향을 보이기 전에 플로우 속도에서의 향상을 보였다. 이것은 병렬적으로 및 상대적으로 일정한 잔류물 조성에서 일어나는 온도 상승의 양자의 효과에 의하여 설명될 수 있을 것이다.
유출되는 조성물은 표 16에서 제공된다. 420 nm에서의 광학 밀도에 의해 측정되는 바와 같이, 원료 및 나노 여과로부터의 결과인 투과물 사이에서 86%의 광학 밀도 감소가 존재하였다.
예상되는 바와 같이, 대부분의 숙신산이 투과물에서 회수된다. 측정된 잔류율(retention rate) 및 그 투과물로 회수되는 원료 함량의 분율을 나타내는 투과 분율들이 표 17에 나타내어진다.
대부분 그들의 결합되어 있는 산 형태 하에서의 약한 유기 산들(숙신산염 및 락트산염)은 2.5의 pH에서 존재한다. 결과적으로, 그들은 대부분 이온화되지 않고 또한 그들의 워터 살베이션 넘버(water salvation number)는 낮다. 작은 분자들로서 그들은 용이하게 NF 멤브레인을 통하여 투과물 스트림으로 통과할 수 있다: 그들의 잔류율(retention rate)은 낮다(또는 심지어 락트산염에 대해서 마이너스임). VCF=31에서의 작동은 96%의 숙신산을 회수하는 것을 허용한다. 부가적인 투과-여과는 98% 회수에 도달하는 것을 보조한다. 이러한 속도는 또다시 용이하게 향상될 수 있다.
염들(황산염 및 암모늄)은 이온의 형태에서 더욱 잘 용해되며 또한 다음으로 특히 2가의 황산염 음이온의 경우 더 큰 부피를 차지한다. 나아가, 황산염 및 암모늄은 그 용액의 전기적 중성화를 위하여 결합된 상태로 존재한다. 그들의 잔류율(retention rates) 양자는 높다.
숙신산의 증발 및 결정화
연속적인 이온 교환 크로마토그래피로부터 회수되는 숙신산은 증발되어 결정화 단계를 개시하기 위한 적합한 숙신산 농도에 이르른다. 숙신산은 253℃의 끓는점을 갖는 반면 아세트산 및 락트산과 같은 숙신산 제조에 있어서 다른 잠재적인 유기산 오염원들은 더 낮는 끓는점을 갖는다. 아세트산의 끓는점은 118℃이고 또한 락트산의 끓는점은 122℃이다. 따라서 증발 단계를 사용하여, 숙신산은 상기 아세트산 및 락트산 오염원들의 일부를 제거하는 것 이외에 420 g/L로 까지 농축될 수 있었다.
상기 농축된 숙신산은 그 용기를 냉각하는 것에 의해 결정화될 수 있었다. 하기의 프로토콜이 결정화를 위하여 사용되었다: (1) 숙신산을 85℃에서 420 g/L로 까지 농축시키는 것. (2) 80㎛ 직경의 순수한 숙신산 결정 시드들로 결정화를 개시하는 것. (3) 도 12에서 보여지는 프로파일에 따라 20 시간 동안 85℃ 로 부터 20℃ 까지 생성물을 냉각하는 것. (4) 포화된 순수한 숙신산 용액으로 상기 최종 결정들을 세척하는 것.
결정화 과정은 하기의 숙신산의 다른 세 개의 제조물로 수행되었다. (1) 연속적인 이온 교환 크로마토그래피로부터의 비-폴리싱된 추출물 (2) 연속적인 이온 교환 크로마토그래피로부터의 NF-폴리싱된 추출물 (3) 25 g/L의 황산염 음이온을 함유하는 합성의 숙신산 제조물. 표 18은 이러한 세 개의 다른 숙신산 제조물로 수행된 결정화 실험의 결과들을 제공한다. 표 20의 표시로 보여지는 결과들과 같이, 99.85% 보다 큰 결정 순도가 테스트된 세 개의 샘플들 각각에 대하여 도달되었다. 결정화 수율은 89%로부터 93%까지의 범위였다.
상기 결정화된 숙신산의 색상은 최종 생성물의 여과된 100 g/L 용액의 광학 밀도를 측정하는 것에 의하여 결정되었다(표 19). 이온 교환 크로마토그래피의 비-폴리싱된 추출물로부터 유래되는 숙신산 결정들은 색상에 있어서 갈색이었다. 상기 결정들은 1-2 mm의 길이를 갖는 형태의 니들(needle)이었다. 도 13에서의 주사 전자 현미경 사진(scanning electron micrographs)에서 보여지는 바와 같이, NF 폴리싱된 결정들은 흰색이었고 비-폴리싱된 추출물로부터의 결정과 비교할 때 사이즈에 있어서 보다 컸다.
암모늄 황산염 유출물의 결정화
셋팅 2-4로 생산된 라피네이트 혼합물이 염 유출물 결정화 실험(salt effluents crystallization trials)에 대한 비가공 재료로서 사용되었다. 라피네이트는 꾸준한 증발에 의하여 95℃에서 결정화를 시작하기 전에 50x 로 까지 농축되었다. 라피네이트의 농축은 두 단계들에서 수행되었다. 제1 단계에서, 역 삼투(reverse osmosis)가 80 g/L 암모늄 황산염 농도로부터 160 g/L 암모늄 황산염 농도로까지 라피네이트를 농축시키는데 있어 사용되었다. 제2 단계에서, 추가적인 농축이 증발의 방법에 의하여 달성되었다.
표 20은 연속적인 이온 교환 크로마토그래피의 셋팅 2-4로 생산된 라피네이트로부터 얻어진 암모늄 황산염 결정들의 조성을 요약한 것이다. 유기 염 어떤 것도 결정 내에서 검출되지 않았다. 결정들은 색상에 있어서 갈색이었고 또한 도 14에서의 주사 전자 현미경 사진(scanning electron micrographs)에서 보여지는 바와 같이, 구분된 형상(distnct shape)을 가지고 있었다.
| UF/MF 멤브레인 특성들 | |||||
| 유형 | 컷-오프 (Cut-off) |
선형 속도 (Linear Speed) |
교환 표면 영역 | 온도 | 압력 |
| m/s | m2 | ℃ | 바(bars) | ||
| MF | 0.1μM DIAM | 5 | 0.25/mb | 35-38 | 1.5-3 |
| UF | 150 kDa | 5 | 0.25/mb | 35-38 | 1.5-3 |
| 정화 결과의 요약 | |||||
| 부피적 농도 요소 (Volumetric Concentration Factor)(VCF) |
투과 여과율 |
정화율 (Clarification rate) |
숙신산염 회수율 | TMP | |
| 물/잔류물 | % | % | 바(bars) | ||
| 실험실 결과 | 10 | 0/1 | 93 | 87 | >2 바 |
| 실험실 결과 | 10 | 1/1 | 93 | 94 | >2 바 |
| 산업적 추정치 | 20 | 4.5/1 | 93 | 99 | >2 바 |
| 크로마토그래피 컬럼으로부터 수집된 분획들 | |||
| 분획 번호 | 개시 시간 (분) |
중지 시간 (분) |
목적 |
| F1 | 0 | 18 | 이전 사이클로부터 SO4 2- 및 NH4 + 이온들의 이월(carryover)을 측정하기 위하여 |
| F2 | 18 | 70 | 숙신산 회수를 모니터하기 위하여 |
| F3 | 70 | 94 | 분획 F2로부터 유기산들 SO4 2- 및 NH4 + 의 과잉(spillover)을 측정하기 위하여 |
| F4 | 94 | 141 | 암모늄 황산염 분획을 회수하기 위하여 |
| F5 | 141 | 305 | 최종 세정 단계 후에 SO4 2- 및 NH4 + 의 수준을 측정하기 위하여 |
| 다우웩스 G-26 H 수지(Dowex G-26 H resin)으로부터 F2 분획 내에서의 숙신산의 순도 및 회수 | ||||
| wt. % | % 회수 | |||
| 테스트 4 |
숙신산 | 아세트산 | 숙신산 | 아세트산 |
| 93.1 | 4.9 | 90.2 | 79.7 | |
| 테스트 5 | 92.95 | 5.02 | 87.9 | 80.1 |
| 테스트 6 | 92.8 | 5.06 | 91.9 | 84.7 |
| 테스트 7 | 92.6 | 5.05 | 94.9 | 87.5 |
| 테스트 8 | 94.2 | 4.6 | 88.3 | 84.0 |
| 테스트 9 | 94.2 | 4.6 | 98.5 | 81.3 |
| 테스트 10 | 94.1 | 4.7 | 94.6 | 79.1 |
| 란섹스 S100 H(Lanxess S100 H) 양이온 교환 수지로의 컬럼 크로마토그래피에 대한 작동 조건들 | ||||||
| 테스트 # | 로딩된 원료 CVs | 느린 세정에 대한 CVs | 빠른 세정에 대한 CVs | 재생산 단계를 위한 10% H2SO4 의 CVs | 느린 세정에 대한 CVs | 빠른 세정에 대한 CVs |
| 1 | 2.16 | 1 | 1 | 2 | 3 | 6 |
| 2 | 2.10 | 1 | 1 | 2 | 3 | 6 |
| 3 | 2.09 | 1 | 1 | 2 | 3 | 6 |
| 4 | 2.0 | 1 | 1 | 2 | 3 | 6 |
| 5 | 1.5 | 1 | 1 | 2 | 3 | 6 |
| 6 | 1.75 | 1 | 1 | 2 | 3 | 6 |
| 란섹스 S100 H(Lanxess S100 H) 양이온 교환 수지로의 크로마토그래피로부터의 F2 분획 내에서의 숙신산 및 아세트산의 농도 및 피크 1 및 피크 2 분획 내에서의 NH4 + 및 SO4 2- 의 농도 | ||||||
| wt.% | % 회수 | |||||
| 테스트 1 |
숙신산 | 아세트산 | 숙신산 | 아세트산 | 피크 1/피크 2에서의 ppm NH4 + | 피크 1/피크 2에서의 ppm SO4 2- |
| 93.0 | 5.22 | 93.4 | 88.61 | 4531/15714 | 18/80730 | |
| 테스트 2 | 92.9 | 5.23 | 96.2 | 91.53 | 4146/16904 | 25/89771 |
| 테스트 3 | 93.1 | 5.44 | 86.6 | 85.57 | 4303/16532 | 11/80601 |
| 테스트 4 | 92.2 | 5.23 | 98.2 | 91.53 | 3099/15983 | 27/87628 |
| 테스트 5 | 93.0 | 5.44 | 98.0 | 85.57 | 33/13550 | 19/80177 |
| 테스트 6 | 91.1 | 5.23 | 99.0 | 91.53 | 1339/17289 | 32/96158 |
| 음이온 교환 수지를 사용하는 크로마토그래피에서 사용되는 발효 배지의 조성 | ||
| 특성/성분 | 단위 | 양 |
| 브릭스(Brix) | 용액의 100 그램 내에서의 수크로서의 1 그램 | 13.1 |
| pH | 7.62 | |
| 전도성 | [mS/cm] | 83 |
| 숙신산염 | g/L | 55.2-61.9 |
| 아세트산염 | g/L | 4.2-10.9 |
| SO4 | g/L | 0.24 |
| PO4 | g/L | 2.8 |
| 시트르산염 | g/L | 0.6 |
| NH4 | g/L | 27.7-32.6 |
| Na | g/L | 0.07 |
| K | g/L | 5 |
| 수지 특성들 | ||||
| 수지 | 구조 | 타입 | 용량(cq/L) | 부피(ml) |
| XA 4122/SO42- | 아크릴성 DVB-4차 아민 | 강한 염기성의 음이온(Strong Basic Anion)(SBA) 젤 타입 |
1.25 | 14.92 |
| XA 3114/45/SO42- | 아크릴성 DVB-3차 아민 | 약한 염기성의 음이온(Weak Basic Anion)(WBA) 젤 타입 |
1.6 | 14.92 |
| XA 3121/SO42- | 아크릴성 DVB | 약한 염기성의 음이온(Weak Basic Anion)(WBA) 젤 타입 |
2.48 | 14.92 |
| 샘플 용출 시퀀스 | ||||||
| 단계 | 유출물 | XA 4122 | XA 3114 | XA 3121 | 유량 | 코멘트 |
| 생성 |
암모늄 숙신산염 | 3 BV | 4.5 BV | 8 BV | 2 BVH | 다운 플로우 (Down flow) |
| 물 | 3 BV | 3 BV | 4 BV | 2 BVH | 다운 플로우 (Down flow) |
|
| 재생산 |
H2SO4 (10%) |
3 BV | 3 BV | 5 BV | 2 BVH | 다운 플로우 (Down flow) |
| 물 | 3 BV | 3 BV | 4 BV | 2 BVH | 다운 플로우 (Down flow) |
|
| 숙신산염 캡쳐에 대한 수지의 비교 | ||||
| XA 4122 | XA 3114 | XA 3121 | ||
| 로딩 | eq/L | 3.1 | 4.7 | 8.8 |
| 용량 | eq/L | 1.4 | 1.4 | 1.02 |
| 이론적 용량 | eq/L | 1.25 | 1.60 | 2.48 |
| 생성물 세정에 대해 요구되는 물 | BV (베드 부피(Bed volume)) |
1.3 | 1.3 | 1.3 |
| 재생산물 세정에 대해 요구되는 물 | BV | 2.7 | 2.7 | 2.8 |
| 연속적인 이온-교환에 대한 일련의 기재 | |||||||
| 셋팅 1 | 셋팅 2 | 셋팅 3 | 셋팅 4 | 셋팅 5 | 셋팅 6 | ||
| 생성 | 컬럼/면적 | 3 | 3 | 4 | 4 | 4 | 4 |
| 스윗트닝 오프(Sweetening off) | 컬럼/면적 | 1 | 1 | 1 | 1 | 1 | 1 |
| 재생산 | 컬럼/면적 | 2 | 2 | 2 | 2 | 2 | 2 |
| 세정 | 컬럼/면적 | 3 | 3 | 3 | 2 | 2 | 2 |
| 온도 | ℃ | 50 | 50 | 50 | 50 | 50 | 50 |
| 생성물 내부 | BV | 1 | 1 | 0.95 | 0.9 | 0.9 | 1.1 |
| 생성물 외부(라피네이트) | BV | 1 | 1 | 0.95 | 0.9 | 0.9 | 1.1 |
| 스윗트닝 오프(Sweetening off)를 위한 물 | BV | 0.95 | 0.75 | 0.65 | 0.4 | 0.4 | 0.4 |
| 희석된 원료(Dilute feed(DF)) | BV | 0.95 | 0.76 | 0.65 | 0.4 | 0.4 | 0.4 |
| 재생산 H2SO4 80 g/L | BV | 1.5 | 1.5 | 1.2 | 1.2 | 1.2 | 1.2 |
| 재생제 용출물(추출물) | BV | 1.2 | 1.3 | 1.1 | 1.2 | 1.2 | 1.2 |
| 희석된 재셍제(Dilute Regenerant(DRG)) | BV | 1.15 | 1.05 | 0.95 | 0.85 | 1.1 | 1.1 |
| 재생산 세정 | BV | 0.85 | 0.85 | 0.85 | 0.85 | 1.1 | 1.1 |
| 루프(RW1) | BV | 0.35 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
| 루프(RW2) | BV | 0.35 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
| 입구/출구 조성 및 매스 밸런스 | |||||||
| 셋팅 1 | 셋팅 2 | 셋팅 3 | 셋팅 4 | 셋팅 5 | 셋팅 6 | ||
| 원료 |
SO4(g/L) | 0.24 | 0.24 | 0.24 | 0.24 | 0.24 | 0.24 |
| NH4(g/L) | 32.4 | 32.4 | 32.4 | 27.7 | 27.7 | 23.6 | |
| SUCC(g/L) | 55.2 | 55.2 | 55.2 | 61.9 | 61.9 | 49.6 | |
| 아세트산염(g/L) | 10.9 | 10.9 | 10.9 | 4.2 | 4.2 | 3.5 | |
| 생성물 외부(라피네이트) |
SO4(g/L) | 43.3 | 62.5 | 62.6 | 63.7 | 63.8 | 57.2 |
| NH4(g/L) | 17.9 | 28.5 | 26.9 | 24.5 | 22.8 | 20.9 | |
| SUCC(g/L) | 6.3 | 3.2 | 8.4 | 4.7 | 2.8 | ||
| 아세트산염(g/L) | 6.0 | 5.3 | 2.7 | 1.05 | 0.07 | ||
| DF |
SO4(g/L) | 4.0 | 17.6 | 3.3 | 3.6 | 2.7 | 2.6 |
| NH4(g/L) | 5.0 | 1.5 | 1.7 | 1.7 | 1.3 | 1.3 | |
| SUCC(g/L) | 7.2 | 0.6 | n.a | 0.3 | 0.2 | 1.1 | |
| 0.5 | n.a | n.a | n.a | 0.005 | |||
| 재생제 용출물(추출물) |
SO4(g/L) | 0.9 | 26.4 | 0 | 0.15 | 0.9 | 0.3 |
| NH4(g/L) | 1.8 | 0.02 | 0.1 | 0.02 | 0.01 | 0.04 | |
| SUCC(g/L) | 3.3 | 39.2 | 38.1 | 33.7 | 31.9 | 40.8 | |
| 아세트산염(g/L) | 3.7 | 4.8 | 0 | 0.9 | 0.02 | ||
| DRG |
SO4(g/L) | 93.4 | 58.5 | 31.5 | 39.1 | 34.1 | 34.8 |
| NH4(g/L) | 0.06 | 0.04 | 0.1 | 0.15 | 0.08 | ||
| SUCC(g/L) | 20.4 | 0.3 | 7.7 | n.a | n.a | 1.7 | |
| 아세트산염(g/L) | n.a | n.a | n.a | n.a | 0.04 | ||
| 루프(RW1) |
SO4(g/L) | 0.2 | 0.2 | 0.1 | 0.5 | 0.9 | 0.4 |
| NH4(g/L) | 0.2 | 0.1 | 0.04 | 0.5 | 0.5 | 0.4 | |
| SUCC(g/L) | n.a | 0 | 0.4 | 0.2 | 0.3 | ||
| 아세트산염(g/L) | n.a | n.a | n.a | n.a | 0.005 | ||
| 루프(RW2) |
SO4(g/L) | 14.8 | 13.1 | 10.9 | 19.9 | 12.8 | 11.6 |
| NH4(g/L) | 0.4 | 1.7 | 2.8 | 4.8 | 2.1 | 1.1 | |
| SUCC(g/L) | n.a | n.a | n.a | n.a | 0 | ||
| 아세트산염(g/L) | n.a | n.a | n.a | n.a | 0.002 | ||
| 매스 밸런스 외부/내부 |
SO4(g/L) | 134 | 150 | 103 | 110 | 110 | 115 |
| NH4(g/L) | 77 | 95 | 93 | 106 | 92 | 95 | |
| SUCC(g/L) | 62 | 105 | 100 | 87 | 77 | 100 | |
| 아세트산염(g/L) | 0 | 102 | 99 | 64 | 55 | ||
| "n.a"는 그 값이 낮고 또한 정확한 정확도로서 측정되지 않았음을 의미한다. | |||||||
| 프로세스 성능(열 개의 컬럼들에 대하여 계산됨) | |||||||
| 셋팅 1 | 셋팅 2 | 셋팅 3 | 셋팅 4 | 셋팅 5 | 셋팅 6 | ||
| 사이클 시간 | 분 | 43.5 | 56 | 54 | 53 | 62 | 62 |
| 로딩 | Eq/L | 0.95 | 0.95 | 0.90 | 0.96 | 0.96 | 0.94 |
| 용량 | Eq/L | 0.95 | 0.84 | 0.85 | 0.83 | 0.89 | 0.89 |
| 숙신산염 회수 | % | 100.0 | 88.7 | 94.3 | 86.4 | 92.4 | 94.4 |
| 재생산 수준 | Eq/L | 1.875 | 1.875 | 1.5 | 1.5 | 1.5 | 1.5 |
| 재생산률 | % | 197 | 222 | 176 | 181 | 169 | 169 |
| 소모 H2SO4 (전체) |
Eq/L | 0.20 | 0.92 | 1.03 | 0.98 | 0.91 | 0.90 |
| 산 전환률 | % | -78.1 | 99.8 | 99.4 | 99.8 | 99.9 | 99.7 |
| 연속적인 이온 교환 특성들 | ||||
| 원료 | 추출물 | 라피네이트 | ||
| 부피 | BV | 1.1 | 1.1 | 1.2 |
| 브릭스(Brix) | 9 | 3.5 | 9.3 | |
| pH | [-] | 7.2 | 2.5 | 2.1 |
| 전도성 | [mS/cm] | 66 | 2.25 | 96 |
| 숙신산염 | g/L | 49.6 | 40.8 | 2.8 |
| 아세트산염 | g/L | 3.5 | 0.02 | 0.07 |
| SO4 | g/L | 0.3 | 57.2 | |
| NH4 | g/L | 23.5 | 0.04 | 20.9 |
| NF 멤브레인 특성들 | |||||
| 타입 | 잔류율 MgSO4 |
교환 표면 면적 | 온도 | 압력 | |
| % | M2 | ℃ | 바(bars) | ||
| NF | 퍼셉 1(Persep 1) | 미니멈 96% 확인된 것: 99.6% |
0.23 | 25-45 | 15 |
| 나노 여과의 과정 동안 생성물 전개 | ||||||||
| 이온 교환 추출물 | NF 잔류물 (NF Reten) |
NF 투과물 (NF perm) |
투석여과 1 후 NF 잔류물 (NF ret After Diaf1) |
투석여과 1 후 NF 투과물 (NF perm After Diaf1) |
투석여과 2 후 NF 잔류물 (NF ret After Diaf2) |
투석여과 2 후 NF 투과물 (NF perm After Diaf2) |
||
| 부피 | L | 23.45 | 0.75 | 22.45 | 0.7 | 0.7 | 0.7 | 0.7 |
| 농도 | mS/cm | 2.25 | 5.35 | 3 | 4.92 | 2.89 | 4.61 | 2.56 |
| pH | 2.5 | 2.3 | 2.4 | 2.4 | 2.5 | 2.4 | 2.4 | |
| 브릭스(Brix) | % | 3.5 | 4.3 | 3.9 | 3.3 | 2.9 | 2.5 | 2.2 |
| 420 nm 흡광도 | OD | 0.035 | 0.3 | 0.005 | ||||
| 숙신산 | g/L | 45.5 | 55.2 | 46 | 38 | 39.2 | 27.4 | 28.7 |
| 락트산 | mg/L | 88.2 | 88.9 | 86.5 | 712 | 714 | 536 | 583 |
| NH4 | mg/L | 38 | 205 | 29 | 197 | 91 | 177 | 83 |
| SO4 | mg/L | 152 | 1374 | 70 | 1273 | 374 | 1214 | 331 |
| 측정된 잔류율(Estimated retention rates) | |||||||||
| 투과물 색상 | 숙신산염 |
SO4 | NH4 | 락트산염 | |||||
| VCF | 광학 밀도 | 잔류율 | 투과 분율 | 잔류율 | 투과 분율 | 잔류율 | 투과 분율 | 잔류율 | 투과 분율 |
| 420 nm | % | % | % | % | % | % | % | % | |
| 2.0 | 0.001 | 3 | 49 | 90 | 9 | 64 | 23 | -0.4 | 50 |
| 3.1 | 8 | 65 | 89 | 19 | 74 | 34 | -0.3 | 68 | |
| 4.2 | 4 | 74 | 87 | 25 | 72 | 43 | -3.0 | 76 | |
| 5.3 | 0.003 | 2 | 79 | 85 | 33 | 69 | 51 | -2.3 | 81 |
| 12.3 | 0.004 | 6 | 91 | 81 | 59 | 66 | 73 | -0.9 | 92 |
| 31.3 | 0.005 | 5 | 96 | 74 | 80 | 58 | 88 | 0.4 | 97 |
| 투석 여과 1 | -3 | 98 | 71 | 84 | 54 | 90 | -0.3 | 98 | |
| 투석 여과 2 | -5 | 98 | 73 | 85 | 53 | 91 | -8.7 | 98 | |
| 숙신산 결정화 실험의 결과 | |||||||||
| 원료 타입 | 숙신산염 | SO4 | 아세트산염 | K | NH4 | 락트산염 | 총 중량 | ||
| 이온 교환 크로마토그래피-비폴리싱으로부터의 추출물 |
원료 | g/L | 423.2 | 41.8 | 0.001 | 3.3 | |||
| 모액(Mother liquor) | g/L | 51.9 | 62.3 | 0.15 | 5.3 | 1574 | |||
| 건조 세척된 결정 순도 | % | 99.8 | 0.01 | 0 | 0.001 | 1021 | |||
| 결정 수율 | % | 93 | 0.15 | ||||||
| 이온 교환 크로마토그래피-NF 폴리싱으로부터의 추출물 |
원료 | g/L | 426 | 1.97 | 0.09 | 0.1 | 0.62 | 2.65 | |
| 모액(Mother liquor) | g/L | 75.9 | 3.07 | 0.14 | 0.06 | 0.88 | 4.14 | 780 | |
| 건조 세척된 결정 순도 | % | 99.7 | 0 | 0 | 0.02 | 0.02 | 0 | 1325 | |
| 결정 수율 | % | 89 | 0.2 | 0 | 62 | 9.6 | |||
| 합성의 숙신산 용액 |
원료 | g/L | 420 | 25 | 0 | 0 | 0.4 | 5 | |
| 모액(Mother liquor) | g/L | 60.3 | 30.3 | 0 | 0 | 0.4 | 6.21 | 1400 | |
| 건조 세척된 결정 순도 | % | 99.85 | 0.14 | 0 | 0 | 0.01 | 0 | 734 | |
| 결정 수율 | % | 90 | 2.4 | 7.7 | 0 | ||||
| 상업적인 결정들 샘플 | 건조 세척된 결정 순도 | % | 99.99 | 0.01 | |||||
| 다른 결정 제조물의 색상의 비교표 | ||
| 원료 타입 | 색상 | 420 nm에서의 광학 밀도 (100 g/L 용액) |
| 농축된 추출물-비 폴리싱 | 갈색 | 0.020 |
| 농축된 추출물- 폴리싱 NF 이후 | 흰색 | 0.007 |
| 합성 용액 | 흰색 | 0.002 |
| 상업적인 결정들 샘플 | 흰색 | 0.001 |
| 암모늄 결정화 실험의 결과 | |||||||
| 숙신산염 | 황산염 | 아세트산염 | NH4 | K | 총 량(g) | ||
| 원료 50 Bx | g/L | 19.6 | 350.0 | 110.9 | 16.3 | ||
| 모액(Mother liquor) | g/L | 45.4 | 395 | 4.4 | 162.95 | 10.5 | 1657 |
| 건조된 결정 | % | 0 | 68 | 9 | 27 | 3 | 615 |
| 결정 총합 | g | 419.8 | 166.2 | 17.0 | |||
| 모액 총합 | g | 545.4 | 25.0 | 14.5 | |||
| 수율 | % | 43 | 42 | 54 | |||
Claims (12)
- 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스로서, 상기 프로세스는:
(a) 숙신산의 암모늄 염을 함유하는 수성의 용액을 제공하는 단계;
(b) 음이온성 이온 교환 수지를 숙신산의 암모늄 염을 함유하는 수성의 용액과 접촉시키는 단계;
(c) 수성의 용액 내에서 숙신산의 암모늄 염을 숙신산 및 암모늄 양이온으로 전환시키는 단계;
(d) 양성자에 대한 교환으로 이온 교환 수지의 표면상에서 수성의 용액으로부터 암모늄 양이온을 분리하는 단계로, 수성의 용액 내에 숙신산을 남겨 두며; 그리고
(e) 수성의 용액 내에서 숙신산을 회수하는 단계를 포함하되,
상기 전환시키는 단계 (c) 및 분리하는 단계 (d)는, 숙신산 및 비-수성의 암모늄 양이온을 함유하는 산성의 이온 교환 수지를 포함하는 수성의 용액을 형성하기 위하여, 숙신산의 암모늄 염을-함유하는 수성의 용액을 숙신산의 산 해리 상수에 비해 적어도 0.5 적은 산 해리 상수(pKa)를 갖는 산 이온 교환 수지와 접촉시키는 단계에 의해 달성되는 것
을 특징으로 하는 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스. - 제1항에 있어서,
(a) 암모늄 양이온을-함유하는 산성의 이온 교환 수지를, 이온 교환 수지의 산 해리 상수에 비해 적어도 0.5 적은 산 해리 상수(pKa)를 갖는 산으로 세척하는 단계; 및
(b) 암모늄 양이온 및 세척하는 산의 컨쥬게이트 염기(conjugate base)를 포함하는, 암모늄 염을 회수하는 단계
를 더 포함하는 것을 특징으로 하는 프로세스. - 제1항에 있어서,
암모늄 양이온을-함유하는 산성의 이온 교환 수지를 세척하기 위하여 사용되는 산은 황산, 인산, 염산 및 질산으로 이루어지는 그룹으로부터 선택되는 것을 특징으로 하는 프로세스. - 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스로서, 상기 프로세스는:
(a) 암모늄 숙신산염을 함유하고 있는 발효 배지 및 음이온성 이온 교환 수지를 제공하는 단계;
(b) 음이온성 이온 교환 수지를 암모늄 숙신산염을 함유하고 있는 발효 배지와 접촉시키는 단계;
(c) 발효 배지 내의 암모늄 숙신산염을 숙신산염 음이온 및 암모늄 양이온으로 전환시키는 단계;
(d) 숙신산염 음이온을 이온 교환 수지상에서의 음이온과 교환하는 단계;
(e) 이온 교환 수지에 대하여 결합된 숙신산염 음이온 이외의 다른 물질들을 제거하기 위하여 적합한 조건들 하에서 이온 교환 수지를 세척하는 단계;
(f) 숙신산염 음이온을 치환하기에 효과적인 양으로서의 숙신산염 음이온 보다 강한 음이온을 포함하는 산으로 상기 수지를 세척하는 것에 의하여 숙신산염 음이온을 상기 이온 교환 수지로부터 숙신산으로 치환하는 단계;
(g) 숙신산을 포함하는 분획들을 수집하는 단계
를 포함하는 것을 특징으로 하는 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스. - 제4항에 있어서,
암모늄 양이온을-함유하는 산성의 이온 교환 수지를 세척하기 위하여 사용되는 산은 황산, 인산, 염산, 및 질산으로 이루어지는 그룹으로부터 선택되는 것을 특징으로 하는 프로세스. - 제1항 또는 제4항에서와 같은 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스로서, 이온 교환 수지 및 발효 배지 사이에서의 접촉이 배치 모드(batch mode)로 달성되는 것을 특징으로 하는 프로세스.
- 제1항 또는 제4항에서와 같은 암모늄 숙신산염을 함유하고 있는 발효 배지로부터 숙신산을 회수하기 위한 프로세스로서, 이온 교환 수지 및 발효 배지 사이에서의 접촉이 연속적인 이온-교환 모드(continuous ion-exchange mode)로 달성되는 것을 특징으로 하는 프로세스.
- 제1항 또는 제4항에 있어서,
원심 분리, 고온 처리, 알칼리 처리, 마이크로 여과, 한외 여과 및 투석 여과로 이루어지는 그룹으로부터 선택되는 방법을 사용하여 암모늄 숙신산염을 함유하고 있는 수성의 용액을 정화하는 단계를 더 포함하는 것을 특징으로 하는 프로세스. - 제1항 또는 제4항에 있어서,
회수된 숙신산을 폴리싱(polishing)하는 단계를 더 포함하며, 여기서 상기 회수된 숙신산은 탈색화를 달성하기 위하여 나노 멤브레인을 통하여 여과되는 것을 특징으로 하는 프로세스. - 제1항 또는 제4항에 있어서,
증발 단계를 더 포함하며, 여기서 회수된 숙신산은 적어도 리터 당 100g의 숙신산 농도에 도달하도록 증발되는 것을 특징으로 하는 프로세스. - 제1항 또는 제4항에 있어서,
결정화 단계를 더 포함하며, 여기서 수성의 형태로서 회수된 숙신산은 결정화된 형태로 전환되는 것을 특징으로 하는 프로세스. - 제1항 또는 제4항에 있어서,
상기 프로세스로부터 회수된 숙신산은 100 ppm 미만의 황산염 농도를 가지는 것을 특징으로 하는 프로세스.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US33518909P | 2009-12-31 | 2009-12-31 | |
| US61/335,189 | 2009-12-31 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120099154A true KR20120099154A (ko) | 2012-09-06 |
Family
ID=44227170
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127020082A KR20120099154A (ko) | 2009-12-31 | 2010-12-31 | 암모늄 숙신산염을 함유하고 있는 발효 배지로부터의 숙신산의 정제 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9233906B2 (ko) |
| EP (2) | EP2519491A4 (ko) |
| JP (1) | JP2013516180A (ko) |
| KR (1) | KR20120099154A (ko) |
| CN (1) | CN102781900A (ko) |
| WO (1) | WO2011082378A2 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101540520B1 (ko) * | 2012-11-29 | 2015-07-30 | 롯데케미칼 주식회사 | 역삼투막을 이용한 숙신산 정제 방법 |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102010025167A1 (de) * | 2010-06-25 | 2011-12-29 | Uhde Gmbh | Verfahren zur Abtrennung, Gewinnung und Reinigung von Bernsteinsäure |
| DE102011120632A1 (de) | 2011-12-09 | 2013-06-13 | Thyssenkrupp Uhde Gmbh | Verfahren zur Aufreinigung von Carbonsäuren aus Fermentationsbrühen |
| SG11201406111YA (en) * | 2012-05-07 | 2014-10-30 | Archer Daniels Midland Co | Purification of succinic acid |
| EP2666763B1 (en) | 2012-05-24 | 2014-12-31 | Purac Biochem B.V. | Carboxylic acid recovery from magnesium carboxylate mixture |
| EP2745905A1 (en) | 2012-12-21 | 2014-06-25 | ThyssenKrupp Uhde GmbH | Process for the purification of carboxylic acids by subcritical or supercritical fluid chromatography |
| DE102013000027A1 (de) | 2013-01-03 | 2014-07-03 | Thyssenkrupp Industrial Solutions Ag | Verfahren zur Aufreinigung von Carbonsäuren aus Fermentationsbrühen |
| WO2015031112A1 (en) * | 2013-08-27 | 2015-03-05 | Purolite Corporation | Ion exchange resin regeneration method |
| JP2016534131A (ja) | 2013-09-03 | 2016-11-04 | ミリアント・コーポレイションMyriant Corporation | 1,3−プロパンジオールからアクリル酸、アクリロニトリルおよび1,4−ブタンジオールを製造する方法 |
| MY193588A (en) | 2014-02-07 | 2022-10-19 | Basf Se | Improved microorganisms for succinic acid production |
| CA2938583A1 (en) | 2014-02-07 | 2015-08-13 | Basf Se | Modified microorganism with improved biomass separation behaviour |
| FR3028864B1 (fr) | 2014-11-26 | 2018-05-18 | Roquette Freres | Procede de recuperation de cristaux d'acide succinique avec mise en œuvre de tensioactifs au cours de la cristallisation, cristaux obtenus et leurs utilisations |
| US10576467B2 (en) * | 2015-04-08 | 2020-03-03 | Invista North America S.A.R.L. | Materials and methods for the selective recovery of multivalent products |
| US20160297747A1 (en) * | 2015-04-08 | 2016-10-13 | Invista North America S.A.R.L. | Materials and methods for the selective recovery of monovalent products from aqueous solutions using continuous ion exchange |
| US11279955B2 (en) | 2017-05-19 | 2022-03-22 | Basf Se | Process for producing an organic compound |
| CN109206313B (zh) * | 2017-07-05 | 2021-06-11 | 中国石化扬子石油化工有限公司 | 丁二酸盐厌氧发酵液制备丁二酸的方法 |
| CA3076745A1 (en) * | 2017-10-02 | 2019-04-11 | Metabolic Explorer | Method for producing organic acid salts from fermentation broth |
| PL236607B1 (pl) * | 2017-11-09 | 2021-02-08 | Politechnika Poznanska | Sposób wydzielania kwasu bursztynowego z brzeczki fermentacyjnej |
| EP3502241A1 (en) | 2017-12-21 | 2019-06-26 | Basf Se | Modified microorganism for improved production of succinate |
| CN109612978B (zh) * | 2018-10-30 | 2022-02-25 | 欣旺达电子股份有限公司 | 锂离子电池电极膜片补锂量检测方法 |
| CN110204437A (zh) * | 2019-07-02 | 2019-09-06 | 安徽丰原发酵技术工程研究有限公司 | 一种生产l-苹果酸联产丁二酸的方法 |
| CN110194714A (zh) * | 2019-07-02 | 2019-09-03 | 安徽丰原发酵技术工程研究有限公司 | 一种分离苹果酸与丁二酸的方法 |
| WO2021248164A1 (en) * | 2020-06-04 | 2021-12-09 | Florida State University Research Foundation, Inc. | Large scale purification of castanospermine |
| IT202000017368A1 (it) | 2020-07-16 | 2022-01-16 | Radici Chimica S P A | Purificazione di acidi dicarbossilici alifatici prodotti mediante processi biotecnologici |
| US11952609B2 (en) | 2021-03-01 | 2024-04-09 | Battelle Energy Alliance, Llc | Methods of producing succinic acid from a biomass |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2664441A (en) * | 1951-07-19 | 1953-12-29 | Harry S Owens | Separation of organic acids |
| JPS58164541A (ja) * | 1982-03-25 | 1983-09-29 | Mitsubishi Chem Ind Ltd | 多価カルボン酸の精製方法 |
| US5143834A (en) | 1986-06-11 | 1992-09-01 | Glassner David A | Process for the production and purification of succinic acid |
| US5168055A (en) | 1986-06-11 | 1992-12-01 | Rathin Datta | Fermentation and purification process for succinic acid |
| EP0249773B1 (en) | 1986-06-11 | 1992-12-16 | Michigan Biotechnology Institute | A process for the production of succinic acid by anaerobic fermentation |
| US5068419A (en) * | 1986-12-18 | 1991-11-26 | Uop | Separation of an organic acid from a fermentation broth with an anionic polymeric adsorbent |
| WO1989005861A1 (en) | 1987-12-22 | 1989-06-29 | Willem Hemmo Kampen | Process and apparatus for manufacturing ethanol, glycerol, succinic acid and free flowing distiller's dry grain and solubles |
| US5068418A (en) | 1989-05-08 | 1991-11-26 | Uop | Separation of lactic acid from fermentation broth with an anionic polymeric absorbent |
| US5034105A (en) | 1989-07-27 | 1991-07-23 | Michigan Biotechnology Institute | Carboxylic acid purification and crystallization process |
| US5104492A (en) | 1990-07-11 | 1992-04-14 | The Regents Of The University Of California | Recovery of carboxylic acids from water by precipitation from organic solutions |
| US5412126A (en) | 1991-04-17 | 1995-05-02 | The Regents Of The University Of California | Carboxylic acid sorption regeneration process |
| US5132456A (en) * | 1991-05-07 | 1992-07-21 | The Regents Of The University Of California | Sorption of carboxylic acid from carboxylic salt solutions at PHS close to or above the pKa of the acid, with regeneration with an aqueous solution of ammonia or low-molecular-weight alkylamine |
| US5786185A (en) | 1991-09-13 | 1998-07-28 | Reilly Industries, Inc. | Process for producing and recovering lactic acid |
| AT398982B (de) | 1993-02-18 | 1995-02-27 | Vogelbusch Gmbh | Verfahren zur abtrennung und reinigung von milchsäure |
| IL108340A (en) | 1993-03-04 | 1996-10-16 | Innova Sa | Citric acid extraction |
| JP3750026B2 (ja) * | 1994-03-24 | 2006-03-01 | 日本コーンスターチ株式会社 | 水素化澱粉水解組成物 |
| JPH08176133A (ja) | 1994-12-26 | 1996-07-09 | Takeda Chem Ind Ltd | L−アスコルビン酸の精製法 |
| US5770435A (en) | 1995-11-02 | 1998-06-23 | University Of Chicago | Mutant E. coli strain with increased succinic acid production |
| IL119389A (en) | 1996-10-09 | 2001-10-31 | Cargill Inc | Process for the recovery of lactic acid by liquid-liquid extraction using a cation exchanger |
| US6160173A (en) | 1996-10-09 | 2000-12-12 | Cargill Incorporated | Process for the recovery of lactic acid esters and amides from aqueous solutions of lactic acid and/or salts thereof |
| NZ336852A (en) | 1996-12-23 | 2000-06-23 | Lactascan Aps | Production of lactic acid from whey proteins where electrodialysis causes less biofouling of the electrodialysis membrane |
| IL119986A (en) | 1997-01-09 | 2000-10-31 | Amylum Nv | Process for the production of crystalline aspartic acid |
| US5958744A (en) | 1997-08-18 | 1999-09-28 | Applied Carbochemicals | Succinic acid production and purification |
| US6284904B1 (en) | 1998-03-02 | 2001-09-04 | Michigan Biotechnology Institute | Purification of organic acids using anion exchange chromatography |
| ATE458040T1 (de) | 1998-04-13 | 2010-03-15 | Univ Georgia | Pyruvate carboxylase überexpression zur verstärkten produktion von oxalacetat abgeleiteten verbindungen in mikrobiellen zellen |
| US6159738A (en) | 1998-04-28 | 2000-12-12 | University Of Chicago | Method for construction of bacterial strains with increased succinic acid production |
| FR2799754A1 (fr) | 1999-10-18 | 2001-04-20 | Roquette Freres | Procede de separation et de purification d'acide lactique a partir d'un milieu de fermentation |
| MY137537A (en) | 2002-05-10 | 2009-02-27 | Mitsubishi Chem Corp | Method for producing organic acid |
| US7241918B1 (en) | 2003-03-18 | 2007-07-10 | Uop Llc | Separation of citric acid from gluconic acid in fermentation broth using a weakly or strongly basic anionic exchange resin adsorbent |
| JP4469568B2 (ja) | 2003-07-09 | 2010-05-26 | 三菱化学株式会社 | 有機酸の製造方法 |
| CN100575496C (zh) | 2003-08-28 | 2009-12-30 | 三菱化学株式会社 | 产生琥珀酸的方法 |
| WO2005026349A1 (ja) | 2003-09-17 | 2005-03-24 | Mitsubishi Chemical Corporation | 非アミノ有機酸の製造方法 |
| JP4631706B2 (ja) * | 2003-09-30 | 2011-02-16 | 味の素株式会社 | 発酵液からのコハク酸の精製方法 |
| EP3130676A1 (en) | 2004-08-27 | 2017-02-15 | Rice University | Mutant e. coli strain with increased succinic acid production |
| EP2388274A1 (en) * | 2005-06-17 | 2011-11-23 | Janssen Alzheimer Immunotherapy | Methods of purifying anti A Beta antibodies |
| JP4193820B2 (ja) | 2005-07-05 | 2008-12-10 | ブラザー工業株式会社 | 管理装置、およびプログラム |
| US8293940B2 (en) | 2005-10-06 | 2012-10-23 | Hyflux IP Resources Pte, Ltd. | Process for recovery and purification of lactic acid |
| BRPI0617491B1 (pt) | 2005-10-18 | 2021-04-27 | Ajinomoto Co., Inc | Processo para produção de ácido succínico |
| JP5365824B2 (ja) * | 2006-03-23 | 2013-12-11 | 独立行政法人産業技術総合研究所 | コハク酸ジアルキルの製造方法および1,4−ブタンジオールの製造方法 |
| EP1842843A1 (de) | 2006-04-04 | 2007-10-10 | Basf Aktiengesellschaft | Verfahren zur Herstellung eines Carbonsäurealkylesters |
| WO2008115958A2 (en) | 2007-03-20 | 2008-09-25 | University Of Florida Research Foundation, Inc. | Materials and methods for efficient succinate and malate production |
| JP3135606U (ja) | 2007-07-12 | 2007-09-20 | 株式会社ノルコーポレーション | 収納フレーム |
| ES2383473T3 (es) | 2007-11-20 | 2012-06-21 | Dsm Ip Assets B.V. | Producción de ácido dicarboxílico en eucariotas |
| FR2925068B1 (fr) | 2007-12-13 | 2010-01-08 | Roquette Freres | Procedes de production d'acide succinique |
| KR20090066958A (ko) | 2007-12-20 | 2009-06-24 | 한국과학기술원 | 배양액의 결정화에 의한 숙신산 정제방법 |
| CN101215583B (zh) * | 2008-01-18 | 2010-11-10 | 南京工业大学 | 一种发酵与膜分离单元耦合制备丁二酸的方法 |
| US20120058530A1 (en) | 2009-04-02 | 2012-03-08 | University Of Florida Research Foundation Inc. | Engineering the pathway for succinate production |
| WO2011064151A1 (en) * | 2009-11-24 | 2011-06-03 | Dsm Ip Assets B.V. | Process for the crystallization of succinic acid |
-
2010
- 2010-12-31 EP EP10841777.5A patent/EP2519491A4/en not_active Withdrawn
- 2010-12-31 JP JP2012547320A patent/JP2013516180A/ja active Pending
- 2010-12-31 KR KR1020127020082A patent/KR20120099154A/ko not_active Application Discontinuation
- 2010-12-31 EP EP15000821.7A patent/EP2918574A1/en not_active Withdrawn
- 2010-12-31 WO PCT/US2010/062635 patent/WO2011082378A2/en active Application Filing
- 2010-12-31 US US13/519,491 patent/US9233906B2/en not_active Expired - Fee Related
- 2010-12-31 CN CN201080059513XA patent/CN102781900A/zh active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101540520B1 (ko) * | 2012-11-29 | 2015-07-30 | 롯데케미칼 주식회사 | 역삼투막을 이용한 숙신산 정제 방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2011082378A3 (en) | 2011-11-03 |
| CN102781900A (zh) | 2012-11-14 |
| WO2011082378A2 (en) | 2011-07-07 |
| EP2519491A2 (en) | 2012-11-07 |
| EP2918574A1 (en) | 2015-09-16 |
| US9233906B2 (en) | 2016-01-12 |
| US20120289742A1 (en) | 2012-11-15 |
| EP2519491A4 (en) | 2014-10-08 |
| JP2013516180A (ja) | 2013-05-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9233906B2 (en) | Purification of succinic acid from the fermentation broth containing ammonium succinate | |
| US11377462B2 (en) | Process for the purification of a neutral human milk oligosaccharide (HMO) from microbial fermentation | |
| US5641406A (en) | Lactic acid extraction and purification process | |
| Din et al. | Lactic acid separation and recovery from fermentation broth by ion-exchange resin: A review | |
| EP1106602B1 (en) | Simulated moving bed chromatographic purification of amino acids | |
| CN102134189B (zh) | 从发酵液分离有机酸及氨基酸的方法 | |
| JP6303017B2 (ja) | 芳香族アミノ酸を精製する方法 | |
| JP2005298366A (ja) | アミノ酸とイミノジカルボン酸を分離回収する方法 | |
| WO2014025560A1 (en) | Mannose production from palm kernel meal using simulated moving bed separation | |
| WO2019138338A1 (en) | Process of separation and purification of glycerol derivatives | |
| CN112795710A (zh) | 制糖过程中离子交换树脂的再生方法 | |
| US2528047A (en) | Recovery of glutamic compounds from glutamine contained in an impure solution thereof | |
| US6147259A (en) | Process for producing glutamic acid | |
| JP4662421B2 (ja) | 有機酸の分離製造方法 | |
| WO2014158558A1 (en) | L-glucose production from l-glucose/l-mannose mixtures using simulated moving bed separation | |
| JP3243891B2 (ja) | ピルビン酸の精製方法 | |
| JP3879094B2 (ja) | アミノ酸の回収方法 | |
| JP4662419B2 (ja) | 有機酸を分離製造する方法 | |
| CN113121329B (zh) | 一种从乳酸盐的含水原料中耦合转化与提取乳酸的方法 | |
| CN114702379B (zh) | 一种红乳酸纯化方法 | |
| US10549238B2 (en) | Methods of regenerating a resin used to decolorize a biomass feedstream and related systems | |
| JP4662420B2 (ja) | アミノ酸とイミノジカルボン酸を分離回収する製造方法 | |
| PL244772B1 (pl) | Sposób odsalania brzeczki fermentacyjnej erytrytolu | |
| de Wit et al. | Hybridizing Simulated Moving Bed and Electrodialysis: Product Purification and Eluent Regeneration | |
| Pathapati et al. | Hybridizing Simulated Moving Bed and Electrodialysis: Product Purification and Eluent Regeneration |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |