KR20120069668A - 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 - Google Patents
밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 Download PDFInfo
- Publication number
- KR20120069668A KR20120069668A KR1020127004389A KR20127004389A KR20120069668A KR 20120069668 A KR20120069668 A KR 20120069668A KR 1020127004389 A KR1020127004389 A KR 1020127004389A KR 20127004389 A KR20127004389 A KR 20127004389A KR 20120069668 A KR20120069668 A KR 20120069668A
- Authority
- KR
- South Korea
- Prior art keywords
- particles
- density
- extracellular matrix
- bioresorbable
- tissue
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/3604—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix characterised by the human or animal origin of the biological material, e.g. hair, fascia, fish scales, silk, shellac, pericardium, pleura, renal tissue, amniotic membrane, parenchymal tissue, fetal tissue, muscle tissue, fat tissue, enamel
- A61L27/3633—Extracellular matrix [ECM]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/26—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/28—Materials for coating prostheses
- A61L27/34—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/40—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/58—Materials at least partially resorbable by the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/26—Materials or treatment for tissue regeneration for kidney reconstruction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/34—Materials or treatment for tissue regeneration for soft tissue reconstruction
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Dermatology (AREA)
- Transplantation (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Botany (AREA)
- Urology & Nephrology (AREA)
- Biophysics (AREA)
- Composite Materials (AREA)
- Materials Engineering (AREA)
- Virology (AREA)
- Cell Biology (AREA)
- Developmental Biology & Embryology (AREA)
- Immunology (AREA)
- Biotechnology (AREA)
- Materials For Medical Uses (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Prostheses (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 밀도가 다른 입자로 이루어진 조직 이식편 조성물, 환자의 조직 재생을 촉진시키기 위한 이들 조성물 제조방법, 및 사용방법을 개시한다.
Description
본 발명은 입자상 조직 이식편 조성물, 그것의 제조방법, 및 환자의 조직을 수복 또는 재생하기 위한 그것의 사용방법에 관한 것이다.
실활된 네이티브 조직으로 이루어진 조직 이식편 조성물은 환자의 손상, 변형, 또는 손실된 조직을 수복 또는 재생시키는데 널리 사용되어 왔다. 일반적으로, 이들 조성물은 조직의 세포외 기질, 예를 들면 장(SIS), 또는 방광(UBS)의 점막하 조직, 및 예를 들면 방광(UBM)의 상피 기저막으로 이루어져 있다. 이들 조성물은 총체적으로 세포외 기질 또는 ECM이라고 한다. SIS, UBS, 및 UBM에 대해서는 여기 참조로서 원용한 미국 특허 6,576,265호, 미국 특허 6,579,538호, 미국 특허 5,573,784호, 미국 특허 5,554,389호, 미국 특허 4,956,178호, 및 미국 특허 4,902,508호에 더 기재되어 있다.
간단하게는, SIS 및 UBS는 조직원의 다른 모든 층으로부터 점막하 조직을 박리하고 점막하 조직을 유지하여 조직 이식편 조성물을 형성함으로써 각각 위장 내 조직과 방광으로 이루어져 있다. UBM은 상피 기저막을 박리하고, 하나 이상의 심층을 방광의 상피세포로부터 박리하고 상피 기저막을 적어도 유지하여 조직 이식편 조성물을 형성함으로써 선택적으로 제조된다. 기타 조직은 예를 들면, 피부 및 식도, 위, 및 장과 같은 소화관 조직을 포함하지만 한정되는 것은 아니며, 또한 상피 기저막을 상피 세포 및 하나 이상의 조직원 심층으로 박리함으로써, 상피 기저막을 포함하는 ECM을 제조하는데 선택적으로 사용될 수 있다. 또 다른 네이티브 ECM은 건막, 힘줄, 인대, 평활근과 골격근, 및 특정 ECM의 치료 부위와 같은 결합조직으로 이루어질 수 있다.
예를 들면, ECM은 상피 조직을 재생시키는데 사용된다. 상피 조직의 재생은 상피와 상피 조직인 하층 연결 조직 요소의 재생을 필요로 한다. 상피 재생은 상피 기저막이 존재할 경우 빠르게 일어난다. 그러나, 연결 조직 요소의 재생은 손상된 상피 조직의 완전 재생을 연장시켜서 상피 조직 재생보다 느리다.
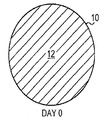
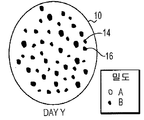
UBS, UBM, 및 SIS와 같은 기존 제품으로 알려진 ECM의 각각은 환자의 이식 부위에서 재흡수된다. 예를 들면, 방광 기질(UBN)의 단일 시트는 예를 들면, 국부적인 상처에 이식될 경우 일주일 이내로 재흡수될 수 있다. 도 1a-c는 환자의 조직 부위(10)에 이식된 기존 제품 ECM 재료(12)의 빠른 재흡수 분석결과를 묘사한다. 도 1A는 이식 day 0의 ECM(12) 시트를 나타낸다. 나타낸 바와 같이, ECM(12)은 전 조직 부위(10)를 채운다. 이식 후 day X에서, 도 1B는 도 1A의 ECM(12) 표면적과 비교하여 ECM(12)의 감소된 표면적에 의해 나타낸 바와 같이, ECM(12)은 조직 부위(10)에서 부분적으로 재흡수되었다는 것을 나타낸다. 이식 후 day Y에서, 도 1C는 ECM(12)이 잔류하지 않은 것으로 인해 조직 부위(10)에 의해 완전하게 재흡수되었다는 것을 나타낸다.
여기 개시된 본 발명은 빠르게 재흡수되고 더 이상 계속적으로 이용할 수 없는 기존 ECM 임플란트의 문제를 규정하고 해결하여 손상된 또는 손실된 상피 조직 및 하층 연결 조직 요소의 재생과 수복에 영향을 주었다. 기존 제품 ECM의 초기 빠른 재흡수는 재생 또는 수복을 필요로 하는 조직 부위와 반응하여 초기 재생에 있어서 이롭지만, 여기 개시된 본 발명은 기존 제품 ECM 보다 재흡수하는데 오래 걸리는 ECM 조성물을 재생 또는 수복을 필요로 하는 부위에 ECM 조성물을 제공함으로 인해, 조직 손상 부위에 수복과정상에 ECM의 영향을 연장하는데 유리하다. 따라서, 여기 개시된 본 발명은 빠르게 재흡수되는 하나 이상의 성분을 가진 ECM 조성물을 지향하여 초기 빠른 수복반응을 제공하지만, 좀 더 느리게 재흡수되는 하나 이상의 추가 성분을 가진 ECM 조성물을 지향하여 조직 손상 부위에 재생 과정상에 ECM 복합 조성물의 영향을 연장한다.
한 실시형태에 의해, 본 발명은 조직 수복 또는 조직 재생에 유용한 생체재흡수성 입자 조성물과 이들 조성물 사용방법에 관한 것이다. 이 조성물은 밀도가 다른 생체재흡수성 입자를 포함하여 다른 속도로 재흡수함으로써, 단일 밀도의 재료를 가진 조성물과 비교하여 수복을 가져오는 입자에 의해 제공되는 장시간 조절하는 능력을 제공한다.
한 실시형태에 의해, 본 발명은 생체재흡수성 입자의 조직 이식편 조성물을 포함한다. 본 발명의 한 실시형태에 있어서, 생체재흡수성 입자상 물질의 혼합물은 환자의 조직 부위에 이식하여 재흡수의 제 1 밀도 및 제 1 속도를 가진 제 1 복수의 생체재흡수성 입자와 환자의 조직 부위에 이식하여 재흡수의 제 2 밀도 및 제 2 속도를 가진 제 2 복수의 생체재흡수성 입자를 포함한다. 제 2 밀도는 제 1 밀도의 적어도 150%이다. 제 2 재흡수 속도는 제 1 재흡수 속도에 약 1~약 10배 범위이다. 제 1 복수의 생체재흡수성 입자 및 제 2 복수의 생체재흡수성 입자는 포유류 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시킨다.
한 실시형태에 있어서, 제 1 복수의 입자는 제 1 생체재흡수성 재료를 포함하고, 제 2 복수의 입자는 제 2 생체재흡수성 재료를 포함하는 반면에, 또 다른 실시형태에 있어서, 제 1 복수의 입자 및 제 2 복수의 입자는 동일한 생체재흡수성 재료를 포함한다. 제 1 생체재흡수성 재료 또는 제 2 생체재흡수성 재료는 예를 들면, 세포외 기질, 콜라겐, 생체재흡수성 폴리머, 또는 히알루론산으로 선택될 수 있다. 입자는 액체 매질 또는 겔 매질로 분산되거나 시트 폼으로 압축된 분말 형태이다. 입자 크기는 1㎛~1000㎛ 범위이다. 또 다른 실시형태에 있어서, 입자는 하나 이상의 생물 활성 인자, 약학적 제제, 또는 DNA 벡터를 들 수 있다. 제 1 복수의 입자 및 제 2 복수의 입자는 1:1 비율로 존재한다. 제 2 밀도는 제 1 밀도의 150%~500% 범위이다.
또 다른 실시형태에 있어서, 환자의 조직 부위에 이식되는 조직 이식편 조성물은 제 1 밀도와 제 2 밀도 보다 밀도가 높은 제 3 밀도 및 제 1 재흡수 속도와 제 2 재흡수 속도 보다 느린 제 3 재흡수 속도를 갖는 복수의 제 3 입자를 포함한다.
다른 실시형태에 의해, 본 발명은 밀도가 다른 생체재흡수성 입자 혼합물을 제조하는 방법을 포함한다. 한 실시형태에 있어서, 예를 들면, 밀도가 다른 생체재흡수성 입자상 물질의 혼합물을 제조하는 방법은 생체 재흡수의 제 1 밀도와 생체 재흡수의 제 1 속도를 갖는 생체재흡수성 물질의 제 1 시트를 제공하고, 제 1 복수의 입자로 시트를 밀링하는 것을 포함한다. 생체 재흡수의 제 2 밀도 및 생체 재흡수의 제 2 속도를 갖는 생체재흡수성 재료의 제 2 시트는 제 2 복수의 입자로 밀링된다. 제 1 복수의 입자의 소정량은 제 2 복수의 입자의 소정량과 혼합되고, 상기 제 2 복수의 입자의 밀도는 제 1 복수의 입자의 밀도의 적어도 150%이고, 상기 제 1 재흡수 속도는 제 2 재흡수 속도에 비해 1.5배 이상이다. 제 1 복수의 입자 및 제 2 복수의 입자가 포유류 환자의 조직 부위에 이식될 경우 조직 재생과 조직 수복을 촉진시킬 수 있다.
본 발명의 다른 실시형태에 의해, 제 1 시트는 밀링하기 전에 압축 또는 라미네이트 되어서 제 1 시트에 밀도를 증가시킨다. 또 다른 실시형태에 있어서, 제 1 시트는 밀링하기 전 동결건조되어서 제 2 시트에 밀도를 감소시킨다.
본 발명의 다른 실시형태에 의해, 시트는 파쇄, 제분, 쵸핑, 혼합, 미분쇄, 또는 절단됨으로써 입자로 밀링될 수 있다. 또 다른 실시형태에 있어서, 제 1 시트 또는 제 2 시트는 밀링하기 전 건조, 수화 또는 동결된다.
본 발명의 다른 실시형태에 의해, 생체재흡수성 재료는 세포외 기질, 히알루론산 또는 생체재흡수성 폴리머를 포함한다. 히알루론산 또는 생체재흡수성 폴리머는 밀링하기 전에 화학적으로 합성 또는 침강되어서 제 1 밀도의 시트 및 제 2 밀도의 시트를 형성한다.
또 다른 실시형태에 의해, 제 1 시트 및 제 2 시트는 동일한 생체재흡수성 재료를 포함한다, 한 실시형태에 있어서, 예를 들면, 제 1 시트 및 제 2 시트는 세포외 기질이다. 다른 실시형태에 있어서, 제 1 시트 및 제 2 시트는 건막이다. 또 다른 실시형태에 있어서, 제 1 시트 및 제 2 시트는 상이한 생체재흡수성 재료를 포함한다. 한 실시형태에 있어서, 예를 들면, 제 1 시트는 세포외 기질을 포함하고, 제 2 시트는 히알루론산을 포함한다. 다른 실시형태에 있어서, 또한 제 1 시트 또는 제 2 시트는 하나 이상의 약학적 제제, DNA 벡터, 또는 성장 인자와 같은 생물 활성 인자를 포함한다.
또 다른 실시형태에 있어서, 제 2 시트의 제 2 밀도는 제 1 밀도의 150%~500%이다.
또 다른 실시형태에 있어서, 상기 방법으로 제조된 제 1 밀도의 입자 및 제 2 밀도의 입자는 시트 폼으로 압축된다.
본 발명의 다른 실시형태에 있어서, 밀도가 다른 생체재흡수성 입자상 물질의 혼합물을 제조하는 방법은 제 1 밀도의 생체재흡수성 재료의 시트를 제공하고, 시트의 부분을 압축해서 포함하고, 그 부분은 제 1 밀도의 적어도 150% 또는 150%~500% 만큼만 제 2 밀도를 포함한다. 시트는 복수의 입자로 밀링된다. 다른 실시형태에 있어서, 생체재흡수성 재료는 ECM이다.
다른 실시형태에 있어서, 본 발명은 환자의 해부학적 부위에 조직 수복과 조직 재생을 촉진시키는 방법을 제공한다. 한 실시형태에 의해, 예를 들면, 수복 또는 재생을 필요로 하는 환자의 해부학적 부위에 조직 수복의 속도를 조정하는 방법은 제 1 밀도를 갖는 제 1 복수의 생체재흡수성 입자 및 제 1 밀도의 적어도 150%인 제 2 밀도를 가진 제 2 복수의 생체재흡수성 입자를 포함하는 혼합물을 환자 부위에 투여하는 것을 포함하고, 상기 제 2 복수의 생체재흡수성 입자는 제 1 복수의 생체재흡수성 입자의 흡수보다 느린 속도로 환자 조직에 의해 재흡수됨으로써, 부위에 제 2 복수의 입자의 치료 효과를 연장한다. 제 1 복수의 생체재흡수성 입자 및 제 2 복수의 생체재흡수성 입자는 포유류 환자의 해부학적 부위에 이식될 경우 조직 재생과 조직 수복을 촉진시킨다. 또 다른 실시형태에 있어서, 혼합물은 제 3 밀도를 가진 복수의 제 3 입자를 포함한다.
또 다른 실시형태에 있어서, 또한 상기 방법은 생체재흡수성 입자의 혼합물을 제조하는 단계를 포함하고, 이 단계는 (a) 환자 부위의 수복 또는 재생에 대한 재흡수성 조성물의 최적 흡수 속도를 결정, (b) 제 1 복수의 생체재흡수성 입자를 선택하여 환자의 부위에 이식하여 단계 (a)에 기초한 제 1 밀도와 제 1 흡수 속도를 갖음, 및 (c) 제 2 복수의 생체재흡수성 입자를 선택하여 제 1 복수의 입자의 밀도보다 밀도가 높은 제 2 밀도를 갖고, 환자의 부위에 이식하여 제 1 복수의 생체재흡수성 입자의 흡수 속도보다 느린 단계(a)와 단계(b)에 기초하여 흡수의 제 2 속도를 갖는 단계를 포함한다.
상기 방법의 한 실시형태에 의해, 생체재흡수성 입자는 세포외 기질, 콜라겐, 생체재흡수성 폴리머, 또는 히알루론산이다. 생체재흡수성 입자는 분말형태 또는 액체 매질 또는 겔 매질로 환자의 부위에 전달될 수 있다. 또한 생체재흡수성 입자는 환자의 부위에 주사될 수 있다. 생체재흡수성 입자는 하나 이상의 생물 활성 인자, DNA 벡터, 또는 약학적 제제를 함유한다.
상기 방법의 다른 실시형태에 있어서, 생체재흡수성 입자의 혼합물은 환자 부위에 의료장치 이식 전에, 의료 장치상에 혼합물을 코팅하여 환자에게 투여되는 반면, 또 다른 실시형태에 있어서, 혼합물은 일반적으로 부위에 투여된다. 또 다른 실시형태에 있어서, 혼합물은 뼈 대체 재료의 성분으로서 환자에게 투여된다.
상기 방법의 또 다른 실시형태에 의해, 환자의 수복 또는 재생을 필요로 하는 부위는 힘줄, 인대, 뼈, 신장, 간, 비장, 림프절, 방광, 수뇨관, 자궁, 혈관, 피부, 가슴, 심장, 또는 체강이다. 한 실시형태에 있어서, 환자는 인간이다.
다른 실시형태에 의해, 본 발명은 제 1 밀도의 세포외 기질의 입자를 포함하는 환자의 이식에 대한 이식 물질을 포함하고, 상기 입자가 삼차원 물체를 형성하여 압축될 경우, 환자의 제 1 재흡수 속도 및 제 2 밀도의 세포외 기질의 입자를 가지고, 환자의 제 2 재흡수 속도를 가진다. 제 1 밀도의 입자 및 제 2 밀도의 입자는 인간 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시킨다.
한 실시형태에 의해, 세포외 기질은 UBS, SIS, 또는 UBM이다. 다른 실시형태에 있어서, 제 1 밀도의 입자는 UBS이고, 제 2 밀도의 입자는 UBM이다. 임플란트의 다른 실시형태에 있어서, 제 1 밀도의 입자는 제 2 밀도 입자 보다 밀도가 크고, 제 1 밀도의 입자는 임플란트의 코어를 형성하고, 제 2 밀도 입자는 임플란트의 외면을 형성한다.
다른 실시형태에 있어서, 본 발명은 조직 수복을 필요로 하는 환자의 임플란트의 이식하는 것을 포함한다. 또 다른 실시형태에 있어서, 임플란트 부위는 힘줄, 인대, 뼈, 신장, 간, 비장, 림프절, 방광, 수뇨관, 자궁, 혈관, 피부, 가슴, 심장, 또는 체강이 될 수 있다.
또 다른 실시형태에 있어서, 본 발명은 세포외 기질 입자의 혼합물을 제조하는 방법을 포함하고 밀도가 같은 복수의 세포외 기질 입자를 제조하는 방법을 포함하고, 환자 흡수의 제 1 밀도 및 제 1 속도를 가진 코팅으로 복수의 입자의 제 1 부분을 코팅하고, 환자의 흡수의 제 2 밀도 및 제 2 속도를 가진 코팅으로 복수의 입자 부분을 코팅하고, 제 2 복수의 입자 부분과 제 1 복수의 입자 부분을 혼합한다. 복수의 입자가 포유류 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시킨다. 한 실시형태에 있어서, 세포외 기질의 입자는 비뇨 기저막(UBM)을 포함하고, 제 1 밀도를 가진 제 1 복수의 입자 부분의 코팅은 UBM, 및 제 2 밀도를 가진 제 2 복수의 입자 부분의 코팅은 소장 점막하 조직(SIS)이다.
또 다른 실시형태에 있어서, 본 발명은 세포외 기질의 조성물이다. 이 조성물은 세포외 기질의 제 1 시트, 세포외 기질의 제 2 시트, 및 제 1 밀도의 적어도 150%인 제 2 밀도를 가진 제 1 밀도와 제 2 복수의 세포외 기질 입자를 가진 제 1 복수의 세포외 기질 입자를 포함하고, 상기 제 1 복수의 입자 및 상기 제 2 복수의 입자는 세포외 기질의 제 1 시트와 제 2 시트 사이에 함유된다. 제 1 복수의 세포외 기질 입자와 제 2 복수의 세포외 기질 입자는 포유류 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시킨다.
또 다른 실시형태에 있어서, 또한 조성물은 제 1 밀도, 제 2 밀도 또는 제 3 밀도 중 하나의 밀도를 가지는 복수의 세포외 기질 입자를 포함하고, 또한, 상기 복수의 입자는 세포외 기질의 제 1 시트 또는 세포외 기질의 제 2 시트 중 한 면과 세포외 기질의 제 3 시트 사이에 위치된다.
도 1a-c는 포유류 환자 조직의 UBM, UBS, 또는 SIS와 같은 기존 제품 ECM의 생체 재흡수를 묘사한다. 도 1A는 이식 Day 0에 ECM을 묘사한다. 도 1B는 ECM이 환자 조직에 의해 부분적으로 재흡수된 경우를 이식 후인 Day X에 ECM을 묘사한다. 도 1C는 ECM이 환자 조직에 의해 완전히 재흡수된 경우를 이식 후인 Day Y에 ECM을 묘사한다.
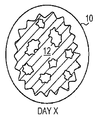
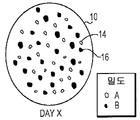
도 2a-c는 본 발명의 한 실시형태에 의한 밀도가 다른 2종 입자로 구성된 예시 입자상 조직 이식편의 생체 재흡수를 묘사한다. 오픈 원형()은 저밀도 입자를 나타내고, 솔리드 원형()은 고밀도 입자를 나타낸다. 도 2a는 이식 Day 0에 입자를 묘사한다. 도 2b는 저밀도 입자가 크기가 작다는 증거로서, 환자 조직에 의해 부분적으로 재흡수된 경우를 이식 후 Day X에 입자를 묘사한다. 도 2c는 저밀도 입자가 환자 조직에 의해 완전히 재흡수되고, 고밀도 입자가 환자 조직에 의해 완전히 재흡수되지 않은 경우를 이식 후 Day Y에 입자를 묘사한다.
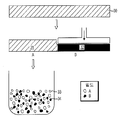
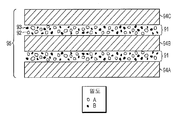
도 3은 밀도가 다른 2가지 입자일 경우를 본 발명의 한 실시형태에 의해 예시 ECM 입자의 조성물과 본 발명의 한 실시형태에 의해 예시 조성물 제조방법의 단계를 묘사한다. ECM의 두 시트는 밀도 A를 갖는 것과 밀도 B를 갖는 나머지 것으로 나타낸다. 그 시트는 세분화되어서 A 입자의 부분과 B 입자의 부분이 함께 혼합된다.
도 4는 밀도가 다른 2가지 입자일 경우를 본 발명의 한 실시형태에 의해 예시 ECM 입자의 조성물과 본 발명의 한 실시형태에 의해 예시 조성물 제조방법의 단계를 묘사한다. ECM 시트는 시트의 부분이 밀도 A를 갖고 시트의 제 2 부분이 밀도 B를 갖도록 처리된다. 이 시트는 세분화되어서 밀도가 다른 2가지 입자 조성물을 제조한다.
도 5는 입자가 밀도 A, B, 또는 C를 가질 경우를 본 발명의 한 실시형태에 의해 예시 ECM 입자의 조성물과 본 발명의 한 실시형태에 의해 예시 조성물 제조방법의 단계를 묘사한다. 밀도 A를 갖는 ECM의 제 1 시트 A는 밀도 B를 갖는 ECM의 제 2 시트 B에 부착된다. 이 시트는 세분화되어서 밀도 A를 가진 입자와 밀도 B를 가진 입자 및 시트 A와 B 모두의 성분을 가진 복합 입자인 밀도 C의 조성물을 제조한다.
도 6은 입자가 밀도가 같은 코어 입자를 가질 경우를 본 발명의 한 실시형태에 의한 예시 ECM 입자의 조성물을 묘사한다. 그러나, 밀도가 다른 A, B, 및 C를 갖는 상이한 재료로 코팅된다. 따라서, 코팅된 입자는 밀도가 다른 A, B, 및 C를 갖는다.
도 7은 밀도 A, B, 및 C를 갖는 ECM 입자가 ECM의 시트면(25)에 부착될 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 8a는 고밀도 B의 ECM 입자가 함께 압축되어서 저밀도 A의 입자로 코팅된 밀도 B의 코어 입자를 형성하거나 밀도 A의 입자층으로 층을 이뤄서 신장과 같은 포유류 인체 부분으로서 구조를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 8b는 고밀도 B의 ECM 입자가 함께 압축되어서 저밀도 A의 입자로 코팅된 밀도 B의 코어 입자를 형성하거나 밀도 A의 입자층으로 층을 이뤄서 인간의 코와 같은 포유류 인체 부분으로서 구조를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 9는 고밀도 B의 ECM 입자와 저밀도 A의 ECM 입자의 혼합물을 함께 압축하여서 인간의 코와 같은 포유류 인체 부분으로서 삼차원 구조를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 10은 고밀도 B의 ECM 입자와 저밀도 A의 ECM 입자의 혼합물을 함께 압축하여서 시트를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 11은 고밀도 B와 저밀도 A의 ECM 입자의 혼합물을 ECM 시트 사이에 협지시킬 경우를 본 발명의 한 실시형태에 의해 예시 다중 라미네이트 ECM 조성물을 묘사한다.
도 2a-c는 본 발명의 한 실시형태에 의한 밀도가 다른 2종 입자로 구성된 예시 입자상 조직 이식편의 생체 재흡수를 묘사한다. 오픈 원형()은 저밀도 입자를 나타내고, 솔리드 원형()은 고밀도 입자를 나타낸다. 도 2a는 이식 Day 0에 입자를 묘사한다. 도 2b는 저밀도 입자가 크기가 작다는 증거로서, 환자 조직에 의해 부분적으로 재흡수된 경우를 이식 후 Day X에 입자를 묘사한다. 도 2c는 저밀도 입자가 환자 조직에 의해 완전히 재흡수되고, 고밀도 입자가 환자 조직에 의해 완전히 재흡수되지 않은 경우를 이식 후 Day Y에 입자를 묘사한다.
도 3은 밀도가 다른 2가지 입자일 경우를 본 발명의 한 실시형태에 의해 예시 ECM 입자의 조성물과 본 발명의 한 실시형태에 의해 예시 조성물 제조방법의 단계를 묘사한다. ECM의 두 시트는 밀도 A를 갖는 것과 밀도 B를 갖는 나머지 것으로 나타낸다. 그 시트는 세분화되어서 A 입자의 부분과 B 입자의 부분이 함께 혼합된다.
도 4는 밀도가 다른 2가지 입자일 경우를 본 발명의 한 실시형태에 의해 예시 ECM 입자의 조성물과 본 발명의 한 실시형태에 의해 예시 조성물 제조방법의 단계를 묘사한다. ECM 시트는 시트의 부분이 밀도 A를 갖고 시트의 제 2 부분이 밀도 B를 갖도록 처리된다. 이 시트는 세분화되어서 밀도가 다른 2가지 입자 조성물을 제조한다.
도 5는 입자가 밀도 A, B, 또는 C를 가질 경우를 본 발명의 한 실시형태에 의해 예시 ECM 입자의 조성물과 본 발명의 한 실시형태에 의해 예시 조성물 제조방법의 단계를 묘사한다. 밀도 A를 갖는 ECM의 제 1 시트 A는 밀도 B를 갖는 ECM의 제 2 시트 B에 부착된다. 이 시트는 세분화되어서 밀도 A를 가진 입자와 밀도 B를 가진 입자 및 시트 A와 B 모두의 성분을 가진 복합 입자인 밀도 C의 조성물을 제조한다.
도 6은 입자가 밀도가 같은 코어 입자를 가질 경우를 본 발명의 한 실시형태에 의한 예시 ECM 입자의 조성물을 묘사한다. 그러나, 밀도가 다른 A, B, 및 C를 갖는 상이한 재료로 코팅된다. 따라서, 코팅된 입자는 밀도가 다른 A, B, 및 C를 갖는다.
도 7은 밀도 A, B, 및 C를 갖는 ECM 입자가 ECM의 시트면(25)에 부착될 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 8a는 고밀도 B의 ECM 입자가 함께 압축되어서 저밀도 A의 입자로 코팅된 밀도 B의 코어 입자를 형성하거나 밀도 A의 입자층으로 층을 이뤄서 신장과 같은 포유류 인체 부분으로서 구조를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 8b는 고밀도 B의 ECM 입자가 함께 압축되어서 저밀도 A의 입자로 코팅된 밀도 B의 코어 입자를 형성하거나 밀도 A의 입자층으로 층을 이뤄서 인간의 코와 같은 포유류 인체 부분으로서 구조를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 9는 고밀도 B의 ECM 입자와 저밀도 A의 ECM 입자의 혼합물을 함께 압축하여서 인간의 코와 같은 포유류 인체 부분으로서 삼차원 구조를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 10은 고밀도 B의 ECM 입자와 저밀도 A의 ECM 입자의 혼합물을 함께 압축하여서 시트를 형성할 경우를 본 발명의 한 실시형태에 의해 예시 ECM 조성물을 묘사한다.
도 11은 고밀도 B와 저밀도 A의 ECM 입자의 혼합물을 ECM 시트 사이에 협지시킬 경우를 본 발명의 한 실시형태에 의해 예시 다중 라미네이트 ECM 조성물을 묘사한다.
세포외 기질 재료(ECM)는 인간과 같은 포유류의 손상, 변형, 상처, 및 손실된 인체 조직의 수복 및 재생을 촉진하는데 사용되어왔다. 예를 들면, SIS 또는 UBM과 같은 ECM은 치료 부위에 이식되어서 상피조직 및 상피조직과 연관된 결합조직층을 포함하는 결합조직의 수복 및 재생을 촉진시킨다. 수복 또는 재생을 필요로 하는 조직 부위는 힘줄, 인대, 가슴, 뼈, 신장, 간, 비장, 림프절, 방광, 수뇨관, 자궁, 혈관, 장, 위, 피부, 심장, 또는 체강을 포함하지만 이것에 한정되는 것은 아니다. "재생하다", "재생된", "재생하는", 또는 "재생"이란 조직 기능과 구조가 주로 조직 이식편 조성물과 결합하여 환자의 내인성 조직 수복 메카니즘에 의해 원래 상태로 복귀되는 것을 의미한다.
SIS ,UBS, 및 UBM과 같은 ECM은 ECM이 이식될 경우에 주 조직에 의해 빠르게 재흡수된다. 재료가 주 조직에 의해 재흡수되면, ECM은 더 이상 이식 부위에 조직 재생 및 조직 수복에 걸쳐서 영향을 끼치지 않는다. ECM이 재흡수될 때, ECM은 ECM의 이식 부위에 조직 재생 및 조직 수복에 영향을 끼치는 네이티브 ECM의 자연적으로 존재하는 성장 인자 및 기타 생물 활성 성분과 같은 생물 활성 성분을 발생한다. ECM이 완전히 재흡수되면, 이런 성장 인자와 생물 활성 성분은 ECM에 의해 더 이상 이식 부위에서 발생되지 않고, 조직 수복 및 조직 재생에 영향을 끼친다. 조직의 수복동안 ECM에 의해 기여된 이들 인자 및 성분의 출현을 억제하기 위해서, 알려진 네이티브 ECM의 빠른 재흡수 시간과 다른 재흡수 시간을 가지는 ECM 입자의 조성물이 여기 개시되어 있다.
한 실시형태에 있어서, 본 발명은 밀도가 다양한 입자일 경우에 ECM 입자의 조직 이식편 조성물에 관한 것이다. 여기 사용된 "밀도"란 입자의 질량당 유닛 부피를 의미한다. 본 발명의 한 실시형태에 의해, ECM은 그들 밀도를 변경하도록 처리된 다음 자세하게 설명된다. 환자의 이식될 경우, 저밀도 입자가 밀도가 높은 입자 보다 더 빠른 속도로 환자에 의해 재흡수되므로, 입자는 그들 밀도와 관련 있는 속도로 재흡수된다. 저밀도 입자가 고밀도 입자보다 더 빠르게 재흡수되고, 성장 인자 및 기타 생물 활성 성분을 빠르게 발생시킴으로써, 조직 부위에 초기 수복 반응을 조정한다. 대조적으로,
고밀도 입자는 느리게 재흡수되고, 성장 인자 및 기타 생물 활성 성분을 더 느리게 발생시킴으로써, 저밀도 입자에 의해 발생되는 성장 인자 및 생물 활성 성분에 의해 영향을 받은 초기 수복 반응을 거쳐서 이식 부위에 수복 반응을 유지한다.
본 발명에 의해, 고밀도 입자 단독이 아니라 저밀도 입자와 고밀도 입자 모두를 가지는 것은 저밀도 입자에 의해 제공되어 발생되는 성장 요인 및 기타 생물 활성 성분을 허용하여 저밀도 입자의 빠른 재흡수로 인해 조직 부위에 빠른 초기 수복 반응을 조정한다. 이상적으로는, 상기 빠른 수복 반응은 재흡수가 느리기 때문에 고밀도 입자 단독으로 제공될 수 없으므로, 권장된 조직 수복 및 조직 재생의 재료로부터 생물 활성 성분의 발생 또한 느리다.
종래 ECM은 빠른 재흡수 시간을 가져서 조직 부위가 완전히 수복되기 전에 ECM이 조직 부위에 완전히 재흡수된다. 본 발명에 의해 제조된 증가된 밀도 ECM 입자 또는 밀도가 다른 ECM 입자 응집체는 재흡수 시간이 연장되므로, 종래 ECM 사용과 비교하여 상처 부위에 조직 수복과 조직 재생에 걸쳐서 확장된 영향력을 가질 수 있다. 다시 말해서, 본 발명에 의한 조직 이식편 조성물은 조직 이식편 조성물이 조직 부위에 생체 재흡수되기 전에 조직 부위가 완전하게 수복 또는 완전하게 클로즈하도록 해준다. 본 발명에 의해, ECM 입자의 조성물은 환자의 특정 조직 부위가 필요로 하는 재생에 맞춤된 특정 생체 재흡수 분석결과를 제공한다.
여기 기재된 본 발명은 환자의 이식 부위에 ECM 조직 이식편 구조를 수용하는 데 필요한 공간의 양을 감소시키는 이점을 갖는다. 예를 들면, 본 발명에 의한 조직 이식편 구조의 밀도를 증가시킴으로써, ECM 재료는 더 작은 부피로 포함될 수 있다. 또한, 본 발명에 의한 ECM 재료의 밀도를 증가시킴으로써, 환자의 두껍고, 밀도가 낮은 ECM 재료와 비교하여 이식 부위에 재흡수하는데 더 오래걸림으로써, 환자의 이식 부위에 조직 수복 및 조직 재생에 장기적인 영향을 끼친다.
본 발명에 의해, 조성물의 재흡수 속도는 ECM의 소정 부피에 필요한 날수에 기초하여 측정되어서 이식 부위에 주 조직에 의해 재흡수된다. 한 실시형태에 있어서, 본 발명에 의한 조성물은 예를 들면, 재흡수되는데 15일 걸리는 부피 100㎛2과 밀도 X를 갖는 저밀도 입자와, 재흡수되는데 45일 걸리는 부피 100㎛2을 갖고 밀도 2X를 갖는 고밀도 입자를 포함한다. 본 발명에 의해, 밀도와 재흡수 시간 사이에는 직선 관계가 필수적이지 않다. 이 실시예에 의해 나타난 바와 같이, 밀도가 낮은 제 1 입자의 밀도 보다 두배인 입자는 재흡수되는데 밀도가 낮은 제 1 입자의 재흡수 시간에 두배 더 걸린다.
상기 말한 바와 같이, 분야에서 알려진 ECM은 환자의 조직 부위에 이식될 경우 빠른 생체 재흡수 속도를 갖는다. 알려진 ECM에 의해 제시된 빠른 생체 재흡수 분석결과와 대조적으로, 본 발명에 의한 조성물은 조직 이식편 조성물의 입자 밀도에 기초하여 생체 재흡수 시간이 다르다. 예를 들면, 본 발명에 의한 도 2a-c는 밀도가 다른 입자의 조직 이식편 조성물의 다양한 생체 재흡수 분석결과를 제시한다. 조직 부위에 이식 날 Day 0에서, 도 2a는 ECM 입자(16)(도 1a-c에서 나타낸 ECM 보다 고밀도) 및 ECM 입자(14)(도 1a-c에서 나타난 ECM과 비교할 만한 밀도)를 나타낸다. 도 2B에서 나타낸 바와 같이, 이식 후 Day X에서, 저밀도 입자(14)는 그들 감소된 크기로 표시됨으로써 부분적으로 재흡수되어왔다. 밀도가 높은 입자(16)는 또한 완전히 재흡수되지 않는다. 도 2c에서 나타낸 바와 같이, 이식 후 Day Y까지, 저밀도 입자(14)는 완전히 재흡수되는 반면, 밀도가 높은 입자는 완전히 재흡수되지 않고 계속적으로 밀도가 높은 입자를 허용하여 조직부위(10)에 조직 수복 및 조직 재생을 촉진시킨다.
본 발명의 한 실시형태에 있어서, 입자의 조직 이식편 조성물은 밀도가 다른 제 1 밀도의 입자 및 제 2 밀도의 입자를 포함한다. 또 다른 실시형태에 있어서, 또한 조성물은 제 3 밀도의 입자; 제 3 밀도 및 제 4 밀도의 입자; 제 3 밀도, 제 4 밀도, 및 제 5 밀도의 입자; 또는 제 3 밀도, 제 4 밀도, 제 5 밀도, 및 제 6 밀도 등을 들 수 있다. 한 실시형태에 있어서, 예를 들면, 입자 조성물은 2가지 밀도의 입자; 또한, 3가지 밀도의 입자; 또한, 4가지 밀도의 입자; 또한, 5가지 밀도의 입자; 및 6가지 밀도의 입자를 갖는다. 본 발명의 한 실시형태에 의해, 조성물은 밀도가 다른 6가지 이상의 입자를 갖는다. 또 다른 실시형태에 있어서, 입자는 하나 이상의 복합 재료여도 좋다, 예를 들면, 밀도가 다른 상이한 각 ECM종의 혼합을 들 수 있다.
본 발명의 한 실시형태에 있어서, 제 2 밀도의 입자가 제 1 밀도의 입자 보다 밀도가 높을 경우 조성물은 밀도가 다른 제 1 밀도의 입자와 제 2 밀도의 입자를 갖는다. 또 다른 실시형태에 있어서, 제 2 밀도의 입자는 제 1 밀도 입자 밀도의 약 150% 이상(즉, 1.5배 밀도가 높다)이다. 밀도의 상이한 규모가 대단히 필수적이어서, 제 1 밀도 입자의 생체 재흡수 속도와 제 2 밀도의 입자의 생체 재흡수 속도 사이의 차이점은 조성물이 완전히 재흡수되기 전에 처리된 조직이 수복되도록 허용하기에 충분히 크다. 제 1 밀도의 약 150% 미만의 밀도를 가진 제 2 밀도의 입자는 제 1 밀도 입자의 생체 재흡수 분석결과와 상당히 다른 생체 재흡수 분석결과를 갖지 않아서 조성물이 완전히 재흡수되기 전에 조직 부위가 수복되도록 허용한다.
또 다른 실시형태에 있어서, 또한 조성물은 제 3 밀도의 입자를 포함한다. 제 3 밀도의 입자는 제 2 밀도의 입자 보다 밀도가 크고; 제 2 밀도의 입자는 제 1 밀도의 입자 보다 밀도가 높다. 특정 실시형태에 있어서, 제 3 밀도의 입자는 제 2 밀도 입자의 밀도의 약 150% 이상이고, 제 2 밀도의 입자는 제 1 밀도 입자의 밀도의 약 150% 이상(예를 들면, 1.5배 밀도가 높다)이다. 다시 말해서, 밀도에서의 차이 규모는 대단히 필수적이어서, 제 1 밀도, 제 2 밀도 입자, 및 제 3 밀도 입자 사이의 생체 재흡수 속도 간 차이점은 조성물이 완전히 재흡수되기 전에 처리된 조직이 수복되도록 허용하기에 충분히 크다.
또 다른 실시형태에 있어서, 예를 들면, 제 1 밀도의 입자 보다 밀도가 높은 제 2 밀도의 입자는 밀도가 낮은 제 1 입자의 재흡수 속도 보다 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 6배, 약 7배, 약 8배, 약 9배, 또는 약 10배의 재흡수 속도를 갖는다.
또 다른 실시형태에 있어서, 제 2 밀도의 입자는 제 1 밀도 입자의 밀도 보다 밀도가 높아서 약 2배, 2.5배, 3배, 3.5배, 4배, 4.5배, 또는 5배 이상이다. 또 다른 실시형태에 있어서, 제 3 밀도의 입자는 제 2 밀도의 입자보다 밀도가 높아서 약 2배, 2.5배, 3배, 3.5배, 4배, 4.5배, 또는 5배 이상이다.
바람직하게는, 제 2 밀도 입자는 낮은 제 1 밀도 입자의 밀도의 약 150-500% 이상이고, 보다 바람직하게는 낮은 제 1 밀도 입자의 밀도의 약 200-400%이고, 가장 바람직하게는 낮은 제 1 밀도 입자의 밀도의 약 200-300%이다.
본 발명의 한 실시형태에 의한 입자는 세포외 기질 입자(ECM)이다. 본 발명에 의해, 밀도가 다른 입자로 이루어진 ECM은 점막하 조직, 진피, 상피 기저막, 건막, 힘줄, 인대, 평활근과 골격근, 및 특정 ECM의 치료 부위를 포함하는 네이티브 조직으로부터 파생되지만 이것에 한정되는 것은 아니다. 예를 들면, 네이티브 조직원은 돼지, 소, 또는 양이 될 수 있다. 네이티브 조직원은 환자에게 동종, 자가, 또는 이종이 될 수 있다. 예를 들면, 환자가 인간이면, 네이티브 조직원은 다른 인간(동종) 또는 환자(자가)이다. 대체적으로, 환자가 인간이면, 네이티브 조직은 비인간종(이종)이다.
본 발명에 의한 ECM 입자는 약 150㎎/㎤~약 1800㎎/㎤ 밀도 범위이고, 보다 바람직하게는 약 150㎎/㎤~약 1200㎎/㎤, 및 가장 바람직하게는 약 150㎎/㎤~약 600㎎/㎤이다.
본 발명의 다른 실시형태에 있어서, 본 발명의 입자는 예를 들면, 콜라겐, 즉, 종 Ⅰ, Ⅱ, Ⅲ 및/또는 Ⅳ 콜라겐; 30폴리(L)젖산, 폴리(D)젖산, 폴리글리콜산, 폴리디옥사논, 또는 타이로신폴리카보네이트, 및/또는 히알루론산과 같은 생체재흡수성 폴리머로 이루어져 있다. 본 발명에 의한 콜라겐 입자는 약 150㎎/㎤~약 1800㎎/㎤ 범위의 밀도이고, 보다 바람직하게는 약 150㎎/㎤~약 1200㎎/㎤, 및 가장 바람직하게는 약 150㎎/㎤~약 600㎎/㎤이다. 본 발명에 의한 생체재흡수성 폴리머 입자는 약 150㎎/㎤~약 1800㎎/㎤ 밀도 범위이고, 보다 바람직하게는 약 150㎎/㎤~약 1200㎎/㎤, 및 가장 바람직하게는 약 150㎎/㎤~약 600㎎/㎤이다.
본 발명의 한 실시형태에 의해, 폴리머가 환자의 재흡수될 때, 성장 인자, DNA, 또는 기타 단백질과 같은 생물 활성 재료가 생체 재흡수가능한 폴리머 입자에 발생되기 위해서 첨가된다. 다른 실시형태에 있어서, ECM이 환자의 재흡수될 때, 성장 인자, DNA, 또는 기타 단백질과 같은 생물 활성 재료가 본 발명의 ECM 조성물에 발생되기 위해서 첨가된다.
본 발명에 의한 한 실시형태에 있어서, 제 1 밀도의 모든 입자는 제 1 출발재료로 이루어지고, 제 2 밀도의 모든 입자는 동일한 제 1 출발 재료로 이루어진다. 한 실시형태에 있어서, 예를 들면, 제 1 밀도의 모든 입자는 제 1 밀도를 가진 ECM 재료로 이루어져 있고, 제 2 밀도의 모든 입자는 동일한 ECM 재료의 입자이지만, 밀도가 다른 제 2 밀도를 갖도록 처리된다. 예를 들면, 제 1 밀도의 입자 및 제 2 밀도의 입자는 각 UBM 입자이다. 다른 실시형태에 있어서, 제 1 밀도의 모든 입자는 생체 재흡수가능한 폴리머이고, 제 2 밀도의 모든 입자는 동일한 생체 재흡수가능한 폴리머이다. 예를 들면, 제 1 밀도의 입자 및 제 2 밀도의 입자는 폴리(L)젖산이다.
다른 실시형태에 있어서, 제 1 밀도의 모든 입자는 제 1 재료로 이루어져 있고, 제 2 밀도의 모든 입자는 제 2 재료로 이루어져 있다. 예를 들면, 제 1 밀도의 모든 입자는 제 1 ECM 재료로 이루어져 있고, 제 2 밀도의 모든 입자는 제 2 ECM 재료로 이루어져 있다. 한 실시형태에 있어서, 예를 들면, 제 1 밀도의 입자는 UBM으로 이루어져 있는 반면, 제 2 밀도의 입자는 SIS로 이루어져 있다. 다른 실시형태에 있어서, 제 1 밀도의 모든 입자는 ECM 재료로 이루어져 있는 반면, 제 2 밀도의 모든 입자는 생체재흡수성 폴리머로 이루어져 있다. 다른 실시형태에 있어서, 제 1 재료는 UBM인 반면, 제 2 재료는 건막이다. 다른 실시형태에 있어서, 제 1 재료는 UBM인 반면, 제 2 재료는 간 기저막(LBM)이다. 또 다른 실시형태에 있어서, 제 1 재료는 UBM인 반면, 제 2 재료는 히알루론산이다. 또 다른 실시형태에 있어서, 제 1 재료는 UBM인 반면, 제 2 재료는 폴리(라틱코-글리콜산)(PLGA)이다.
본 발명의 한 실시형태에 의한 입자는 약 0.1㎛~약 2000㎛ 범위이다. 보다 바람직하게는, 입자는 약 1㎛~약 2000㎛ 크기의 범위이고, 훨씬 바람직하게는 약 1㎛~약 1000㎛, 및 가장 바람직하게는 예를 들면, 폭, 지름의 약 50㎛~약 750㎛이다.
본 발명의 한 실시형태에 의해, 밀도가 다른 입자의 혼합물은 분말 형태로 유지되는 반면, 다른 실시형태에 있어서는, 입자의 혼합물이 환자의 조직 부위에 이식을 위해 겔 매질 또는 액체 매질로 유지된다. 적합한 매질의 실시예는 히알루론산, 젤라틴, 레시틴, 콜라겐 겔, 및 염분을 포함하지만 이것에 한정되는 것은 아니다.
또 다른 실시형태에 있어서, 본 발명에 의한 입자는 성장 인자 및/또는 기타 생물학적 활성 분자를 함유한다. 예를 들면, ECM이 환자에 의해 생체 재흡수될 경우, ECM과 같은 입자는 자연적으로 이식 부위에서 발생되는 생물학적 활성 분자를 함유한다. 대체적으로는, 생물학적 활성 분자는 입자의 조성물에 첨가되어서, 입자로 이식 부위에 전달된다. 또 다른 실시형태에 있어서, 본 발명에 의한 입자는 생물학적 활성 분자로 코팅된다. 또 다른 실시형태에 있어서, 생체재흡수성 폴리머의 입자는 생물학적 활성 분자 존재시에 입자로 합성되고 형성되어서 생물학적 활성 분자가 생체재흡수성 폴리머 입자 내에 함유된다.
생물학적 활성 분자의 실시예는 표피 성장 인자, TGF-알파, TGF-베타, 섬유아세포 성장 인자, 유래된 혈소판 성장인자, 혈관 내피 성장 인자, 인슐린 유사 성장 인자, 케라티노사이트 성장 인자, 및 골 형성 촉진 단백질을 포함하지만 이것에 한정되는 것은 아니고, 두서너 가지 예를 들면, 약학적 제제, 및 DNA 벡터도 들 수 있다.
본 발명에 의해 입자는 시간 의존식의 생물학적 활성 분자를 발생한다. 예를 들면, 저밀도 입자가 고밀도 입자 보다 빠른 속도에서 환자 조직에 의해 생체 재흡수되면, 성장 인자 같은 생물학적 활성 분자는 고밀도 입자로부터의 발생과 비교하여 이식 후 상대적으로 빠르게 저밀도 입자로부터 발생된다. 고밀도 입자가 더 느리게 생체 재흡수되므로 저밀도 입자보다 더 오랜 시간에 걸쳐서 조직부위에서 생물학적 활성 분자를 발생함으로써, 조직 부위는 저밀도 입자가 존재하는 것보다 더 오랜 시간 동안 특정 생물학적 활성 분자에 노출된다.
다른 실시형태에 의해, 본 발명은 제 1종 입자가 제 1 밀도를 갖고, 제 2 종 입자가 제 2 밀도를 가질 경우에 입자의 혼합물을 제조하는 방법에 관한 것이다.
본 발명의 입자 혼합물을 제조하는 방법의 한 실시형태에 의해, ECM의 시트는 세분화되어서 밀도가 다른 입자의 혼합물을 제조한다. 도 3에 나타낸 바와 같이, 예를 들면, A 입자(14)가 B 입자(16) 보다 밀도가 직을 경우 A 입자(14) 및 B 입자(16)의 혼합물(24)은 밀도가 다른 2가지 ECM 시트(20, 22)로 이루어진다. 예를 들면, A시트(20)는 세분화되어서 쵸핑, 커팅, 분쇄, 밀링, 민싱, 또는 그라인딩하여 A 입자를 형성하고, A시트는 세분화되어서 분쇄기, 해머 밀, 나이프 밀, 원심 밀, 다이와 프레스 시스템, 또는 롤러 파쇄와 같은 입자를 형성하는 적합한 장치로 A시트(20)를 형성한다. B시트(22)는 세분화되어서 입자(16)를 형성하기 위한 적절한 장치로 B시트(22)를 쵸핑, 커팅, 분쇄, 밀링, 민싱, 또는 그라인딩하여 B 입자(16)를 형성한다. A 입자(14) 및 B 입자(16)는 상기 기재된 대로 크기 범위와 밀도 범위를 갖는다.
혼합물을 형성하기 위해서, A 입자(14)에 대한 B 입자(16)의 농도는 환자의 조직 부위에서 혼합물의 특정 소망된 재흡수 분석결과에 기초하여 사전 결정될 경우, 복수의 사전 결정된 A 입자(14)는 측정되고, 복수의 사전 결정된 B 입자(16)와 혼합되어서, A 입자(14)와 B 입자(16)의 복합 혼합물(24)을 형성한다. 예를 들면, 관절과 같이 수복되는데 오랜 시간이 걸리는 조직 부위에 대해서는, 밀도가 낮은 A 입자(14)가 조직부위에서 ECM의 연장된 재흡수를 제공하기 위해서 고밀도 B 입자(16) 수와 비교해서 선택된다. A 입자(14)와 B 입자(16)의 비율은(A:B) 1:1, 1:2, 1:3, 1:4:2:3, 3:4, 2:1, 3:1, 3:2, 4:3, 또는 4:1로 선택될 수 있고, 예를 들면, 특정 조직 부위에 따라서 조직 부위의 처리에 대한 입자의 재흡수 분석결과를 처리하고 소망한다.
본 발명의 또 다른 실시형태에 의해, 입자의 혼합물은 밀도가 다른 3종 입자를 포함한다. 예를 들면, 혼합물은 저밀도 입자, 중간밀도 입자, 및 고밀도 입자를 포함한다. 본 발명에 의해, 예를 들면, 제 3 밀도의 시트(C)는 세분화되어서 A시트(20)와 B시트(22)로 이루어진 입자의 밀도보다 높은 제 3 밀도(C)의 입자를 형성한다. 복수의 사전 결정된 제 3 밀도 입자는 덜어내고, A 입자(14) 및 B 입자(16)의 혼합물에 첨가된다. 제 3 밀도의 입자는 예를 들면, 1:1:1, 1:1:2, 1:1:3, 1:1:4, 1:2:1, 1:2:2, 1:2:3, 1:2:4, 1:3:1, 1:3:2, 1:3:3, 1:3:4, 1:4:1, 1:4:2, 1:4:3, 1:4:4, 2:1:1, 2:1:2, 2:1:3, 2:1:4, 2:2:1, 2:2:3, 2:3:1, 2:3:2, 2:3:3, 2:3:4, 2:4:1, 2:4:3, 3:1:1, 3:1:2:3:1:3, 3:1:4, 3:2:1, 3:2:2, 3:2:3, 3:2:4, 3:3:1, 3:3:2, 3:3:4, 3:4:1, 3:4:2, 3:4:3, 또는 3:4:4의 비율(A:B:C)로 선택될 수 있고, 특정 조직 부위에 따라서 조직부위를 처리하기 위한 입자의 재흡수 분석결과를 처리하고 사전 결정한다.
한 실시형태에 있어서, 예를 들면, 본 발명의 조성물은 2 부분 저밀도 입자에 대한 1 부분 고밀도 입자(2:1)를 갖고 상처 치료, 즉, 피부 및 피부 부속기의 사용된다. 상처에 도포될 경우, 저밀도 입자의 고농도는 생물 활성 성분의 빠른 유입을 제공하여 저밀도 입자가 생체 재흡수됨으로 인해 재생과정 및 수복과정을 활성화하고, 이어서 고밀도 입자가 오랜 시간이 걸려서 재흡수됨으로 인해 이식 부위에서 오랜 시간 생물 활성 성분을 발생한다. 또한, 특정 생물 활성 성분은 저밀도 입자 또는 고밀도 입자에 첨가될 수 있어서, 조직 부위에 재생 및 수복 단계에서 생물 활성 성분의 발생을 맞춤시킨다.
다른 실시형태에 있어서, 본 발명의 조성물은 1 부분 저밀도 입자에 대한 4 부분 고밀도 입자(1:4) 또는 1 부분 초저밀도 입자, 2 부분 저밀도 입자, 및 2 부분 초고밀도 입자(1:2:2)를 갖고, 힘줄 또는 인대 수복에 사용된다. 힘줄과 인대의 재생 및 수복은 일반적으로 혈관과 세포의 인체 부위에서 오래 걸린다. 따라서, 1:4 또는 1:2:2 밀도 분석결과 조성물은 종래 ECM과 비교하여 힘줄과 인대를 재생 또는 수복하기 위한 조성물의 오랜 재흡수 분석결과를 제공한다.
또 다른 실시형태에 있어서, 본 발명의 조성물은 2 부분 저밀도 입자에 대한 3 부분 고밀도 입자(2:3)를 갖고, 상처 재생 또는 성형수술 용도로 사용되어서 조속한 조직 재생 반응을 촉진하는 반면, 또한 연장된 생물 활성 성분이 부위에 발생되어서 오랜 시간에 걸쳐서 비대 흉터 형성을 방지하는데 도움을 준다.
또 다른 실시형태에 있어서, 본 발명의 조성물은 1 부분 저밀도 입자에 대한 2 부분 고밀도 입자(1:2)를 갖고, 연조직증가에 관련되는 용도로 사용된다. 또 다른 실시형태에 있어서, 본 발명의 조성물은 1 부분 저밀도 입자에 대한 3 부분 고밀도 입자(1:3)를 갖고, 안과학의 용도로 사용된다.
본 발명에 의해, ECM(20, 22)의 시트는 세분화되기 전 밀도를 변경하도록 처리될 수 있다. 예를 들면, ECM 시트의 밀도는 재료를 압축, 재료를 건조, 재료를 감압, 재료를 가교, 또는 재료를 동결건조함으로써 기계적으로 증가시킬 수 있다. 예를 들면, ECM 시트의 밀도는 수화, 감압 하에서 세공구조를 팽창, 기계적으로 재료를 팽창, 또는 물에 있어서 재료를 동결함으로써 감소시킬 수 있다.
제 1 밀도 A를 갖는 입자 및 제 2 밀도 B를 갖는 입자의 혼합물을 제조하는 방법의 다른 실시형태에 있어서, 밀도 A 및 밀도 B의 부분을 가진 ECM 시트로부터 입자상 물질은 ECM 시트로부터 제거되고 함께 혼합된다. 도 4에 나타낸 바와 같이, 예를 들면, 시트(30)는 부분적으로 압축되어서 제 1 저밀도 A(31) 부분 및 제 2 고밀도 B(32) 부분을 가진 시트(30)를 형성한다. 시트(30)는 밀링되어서 저밀도 A를 갖는 A(31) 부분으로부터의 입자(33) 및 고밀도 B를 갖는 B(32) 부분으로부터의 입자(34)를 제조한다.
본 발명의 한 실시형태에 의해, 압축되지 않거나 덜 압축된 부분과 비례하여 압축된 시트(30)의 부분은 환자의 소정 조직 부위에 입자에 대한 사전 결정된 생체 재흡수 분석결과에 기초하여 결정된다. 따라서, 예를 들면, A:B(저밀도:고밀도) 입자의 비 1:1이 소망된 생체 재흡수 분석결과를 달성하면, A와 B 밀도의 입자 혼합물로 시트를 세분화하기 전에 시트의 반을 소망된 밀도로 압축한다. 한 실시형태에 있어서, 시트(30)의 크기는 시트(30)의 부분의 압축 전에 선택되고, 전체 시트(30)는 압축 후 세분화된다. 다른 실시형태에 있어서, 대체적으로는, 시트(30)의 부분은 전체 시트(30)로부터 잘라진 후에 잘라진 부분이 세분화되어서 압축된다.
또 다른 실시형태에 있어서, 시트(30)의 부분은 압축되어서, 제 3 밀도 C를 갖는다. 시트(30)는 밀링되어서 밀도 A, 밀도 B, 및 제 3 밀도 C를 갖는 입자 혼합물을 제조한다. 제 3 밀도는 A 밀도 보다 높거나 A 밀도 및 B 밀도 보다 높다.
밀도가 다른 입자의 혼합물을 제조하는 방법의 다른 실시형태는 도 5에서 나타낸다. 한 실시형태에 의해, 제 1 밀도 A의 ECM 시트(40)는 제 2 밀도 B의 ECM 시트(41)와 결합되어서 복합 시트(45)를 형성한다. 복합 시트(45)는 세분화되어서 밀도가 다른 입자(46)의 혼합물을 제조한다. 예를 들면, 복합 시트(45)가 세분화될 경우, 혼합물은 시트 A로부터 유래된 저밀도 A 입자(42), 시트 B로부터 유래된 고밀도 B 입자(43), 및 A시트(40)와 B시트(41)의 인터페이싱 부분(47)으로 이루어진 중간 밀도의 C 입자(44)를 포함한다.
밀도가 다른 입자의 혼합물을 제조하는 방법의 또 다른 실시형태는 도 6에서 나타낸다. 이 실시형태에 의해, 입자(65)는 코어(61) 및 코팅부(62)를 갖는다. 코어(61)는 밀도 X를 갖고 다양한 밀도를 가진 다양한 코팅부(63, 64, 66) 중의 소정의 것과 코팅될 수 있다. 예를 들면, 소정 입자(65)는 제 1 밀도를 가진 제 1 재료(66)와 코팅된 코어(61)를 가져서 밀도 A를 가진 입자를 제조하는 반면, 다른 입자(63)는 제 2 밀도(63)를 가진 제 2 재료와 코팅된 코어(61)를 가져서 밀도 B를 가진 입자를 제조하는 반면, 또 다른 입자(65)는 제 3 밀도(64)를 가진 제 3 재료와 코팅된 코어(61)를 가져서 제 3 밀도 C를 가진 입자를 제조한다. 예를 들면, 코어(61)를 코팅하는 것은 롤 코터에 의해, 또는 조립기에 의해 용액으로부터 입자상에 코팅을 침전함으로써 수행될 수 있다. 코팅용 재료는, 예를 들면 ECM, UBM 겔 또는 SIS 겔과 같은 ECM으로 이루어진 겔, PLGA, 히알루론산, 또는 콜라겐을 들 수 있다. 입자(65)의 코어(61)는 예를 들면, 여기 기재된 바와 같이 ECM을 포함한다.
본 발명의 다른 실시형태에 있어서, 밀도가 다른 세분화된 입자의 혼합물은 환자에 이식하기 위한 합성의 상처 수복 기질 또는 자연적 상처 수복 기질과 같은 장치상에 코팅된다. 예를 들면, 도 7에서 나타낸 바와 같이, 저밀도 A 입자(52) 및 고밀도 B 입자(53)의 혼합물은 ECM의 시트(50)에 도포된다. 예를 들면, 입자(52, 53)는 압축 또는 접착제의 사용으로 시트에 접착된다. 따라서, 시트(50)가 환자의 조직 부위에 이식될 경우, 입자(52, 53)는 표면에 제공되어서 환자의 조직 부위와 접촉한다. A 입자(52) 및 B 입자(53)는 ECM 시트(50)보다 한 실시형태에 있어서 밀도가 크고, 시트(50)가 완전히 재흡수된 후, 조직은 입자(52)와 입자(53)의 존재할 경우 계속적으로 수복된다. 조성물의 입자(52, 53)가 완전히 재흡수되기 전에 나머지 입자(52, 53)는 조직이 수복되도록 허용시킨다.
또 다른 실시형태에 있어서, 합성적 상처 수복 기질 또는 자연적 상처 수복 기질과 같은 장치상에 코팅된 밀도가 다른 세분화된 입자의 혼합물은 접착 배리어로서의 용도로 환자에 이식된다. 예를 들면, 도 7에서 나타낸 바와 같이, 본 발명에 의한 시트 폼(50)에 있어서 기질은 밀도가 다른 입자(52, 53)로 한 면 상방을 코팅시키고 환자에 이식된다. 임플란트 부위에서 형성하는 소정 접착제는 기질의 입자상 면과 접착하고 입자(52, 53)가 재흡수됨으로 인해 접착제는 기질에 더 이상 접착되지 않지만, 입자 및 접착제는 계속적으로 재흡수된다. 다른 실시형태에 있어서, 본 발명에 의해 밀도가 다른 입자는 제 1 고밀도의 제 1 기질 시트 및 저밀도의 제 2 기질 시트 사이에 협지되어서 임플란트에 형성한다. 임플란트는 수복이 필요한 조직에 반하여 이식된 밀도가 높은 기질 시트 및 환자의 인체에 외표면 상의 밀도가 낮은 시트로 환자의 부위에 이식된다. 밀도가 낮은 시트의 외표면 상에 접착제 폼으로서는, 밀도가 낮은 시트는 소정의 접착제가 임플란트의 밀도가 높은 부분으로부터 미부착되도록 허용하여 재흡수되고, 접착제는 기질의 밀도가 낮은 시트를 따라 환자에 의해 이어서 재흡수된다.
한 실시형태에 있어서, 입자(52, 53)의 기질은 시트(50)의 한 면에 접착되는 반면, 다른 실시형태에 있어서, 입자(52, 53)의 혼합물은 시트(50)의 전면에 접착된다. 예를 들면, 시트(50)는 60일 이내로 환자에 있어서 생체 재흡수되고, 저밀도 A 입자는 7일 이내로 생체 재흡수되고, 고밀도 B 입자는 30일 이내로 환자에 있어서 생체 재흡수된다.
또 다른 실시형태에 있어서, 본 발명에 의한 세분화된 입자의 혼합물은 환자의 조직부위에서 장치 이식 전에 수술 의료 기기상에 코팅된다. 예를 들면, 저밀도 A 입자 및 고밀도 B 입자의 혼합물은 스텐트, 심장병 교합기, 봉합 재료, 또는 메쉬와 같은 의료 임플란트 상에 코팅되지만 이것에 한정되는 것은 아니다. 입자는 예를 들면, 화학결합, 펩티드 링커, 시아노 아크릴레이트 또는 피브린 글루와 같은 생체재흡수성 접착제에 의한 장치에 접착되거나, 장치상 입자의 동결건조 또는 장치상 입자를 압축하는 것과 같은 기계적인 수단에 의해서도 장치에 접착된다. 장치가 환자의 조직부위에 이식되면, 저밀도 A 입자는 환자의 조직부위에서 초기 재생 반응을 빠르게 제공하여 생체 재흡수되는 반면, 고밀도 B 입자는 조직부위가 완전하게 수복될 때까지 완전히 생체 재흡수되지 않는다. 예를 들면, 저밀도 A 입자는 예를 들면, 7일 이내로 환자에 의해 생체 재흡수되는 반면, 고밀도 B 입자는 예를 들면, 30일 이내로 환자에 의해 생체 재흡수된다.
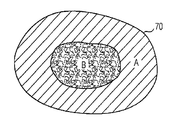
다른 실시형태에 있어서, 본 발명은 밀도가 다른 입자 응집체를 포함하고, 환자의 조직 부위에서 이식에 있어서 밀도가 다른 부분으로 임플란트를 형성한다. 본 발명에 의해, 도 8A 및 도 8B에 나타낸 바와 같이, 고밀도 입자(B)는 압축되어서 포유류, 예를 들면 인간에 있어서의 인체 부분 또는 인체 부분의 일부를 복제하는 형상를 형성하고, 임플란트(70, 72)의 코어(71a, 71b)를 형성한다. 그 다음, 저밀도 입자(A)는 압축되거나 B 입자의 코어(71a. 71b) 주위를 코팅하여 임플란트(70, 72)의 주변층을 형성한다. 도 8A에서 나타낸 바와 같이, A 및 B 입자는 원형 임플란트(70)를 형성하여, 예를 들면 신장 또는 간의 대체 또는 수복에 사용된다. 도 8B에서 나타낸 바와 같이, 주변부 A 및 코어 B 입자는 대부분 삼각형 임플란트(72)를 형성하여 예를 들면, 코의 대체 또는 수복에 사용된다.
예를 들면, 임플란트(70, 72)는 재생 또는 수복을 필요로 하는 부위에 환자에게 이식된다. 이식될 시, 저밀도를 가진 주변부 A 입자는 환자의 조직 부위에서 직접 수복반응 및 재생반응을 제공한다. 주변부 A 입자가 빠르게 생체 재흡수된 후, 고밀도 코어(71a, 71b) B 입자는 주변부 A 입자 단독보다 오랜 시간에 걸쳐서 환자의 조직 부위에 수복반응 및 재생반응을 제공한다. 코어(71a, 71b)B 입자는 일반적으로 조직 부분이 수복될 때까지 환자에 의해 완전히 재흡수되지 않는다. 예를 들면, 저밀도의 주변부 A 입자는 예를 들면, 14일 이내로 환자에 의해 생체 재흡수되는 반면, 고밀도의 코어 B 입자는 예를 들면, 60일 이내로 환자에 의해 생체 재흡수된다.
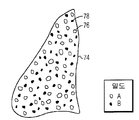
또 다른 실시형태에 있어서, 도 9에서 나타낸 바와 같이, 임플란트(74)는 고밀도 B 입자(78)와 저밀도 A 입자(76)의 혼합물을 압축함으로써 형성될 수 있다. 저밀도 입자(76)는 빠른 속도로 재흡수되어서 임플란트의 채널을 제조하고 인체 조직에 공간을 제공하여 임플란트로 성장하는 반면에, 고밀도 입자는 느리게 재흡수되어서 조직 재생 및 조직 수복이 일어날 때, 구조에 대한 구조적 지지를 제공하고 고밀도 입자가 재흡수될 때 오랜 시간 생물 활성 성분을 발생한다. 임플란트(74)는 신장, 비장, 코, 귀, 간 뼈 또는 기타 인체 기관과 같은 삼차원 형태의 소정 수로 압축될 수 있다.
본 발명의 다른 실시형태에 있어서, 다른 밀도의 압축된 입자의 삼차원 구조는 자연적 생체 조직 밀도를 모방하도록 제조되었다. 한 실시형태에 있어서, 예를 들면, 구조는 시트의 한 면상이 밀도가 높은 입자상 물질로 이루어져 있고, 예를 들면, 밀도가 높은 입자상 물질은 다른 면상에 위치된다. 상기 구조는 밀도가 높은 부분이 뼈 결손으로 삽입될 경우에 뼈 연골 인터페이스에서 사용될 수 있지만 밀도가 낮은 부분은 연골 결손 내에 배치된다. 느린 재흡수, 뼈로 구성된 밀도가 높은 조직 재생 결과로 골 형성의 느린 속도에 의해 고밀도 입자상 리모델링을 하는 반면, 밀도가 낮은 부분은 빠르게 리모델링하고 연골로 구성된 밀도가 낮은 조직 재생을 제조한다. 또한 본 발명은 예를 들면, 추간판 또는 근건 인터페이스의 네이티브 밀도 변화를 모방하도록 고안된 밀도가 다른 부분을 가진 압축된 입자상의 삼차원 구조를 고려한다.
또 다른 실시형태에 있어서, 도 10에서 나타낸 바와 같이, 시트(80)는 저밀도 A 입자(81)와 고밀도 B 입자(82)의 혼합물을 압축함으로써 이루어진다. 예를 들면, 시트(80)는 기계적인 힘 또는 감압의 용도에 의해 입자를 탈수하고 입자를 함께 압축하여 케이크 또는 웨이퍼형 구조를 형성함으로써 이루어진다. 시트(80)는 예를 들면, 피부의 국소적인 상처를 치료하는데 사용될 수 있지만, 크기로 시트를 커팅 및/또는 시트를 밴딩 또는 시트를 감싸서 임플란트 위치를 맞춤으로써 탈장, 장, 창자, 혈관, 심장, 또는 소정 기타 기관과 같은 인체의 다른 부분을 치료하는데에 또한 사용될 수 있다. 밀도가 다른 입자를 가진 시트(80)는 이식부위에서 조직 재생 및 조직 수복에 대한 상당한 표면 부분을 제공하여 저밀도 입자의 생체 재흡수의 결과로 인해 이식 상에 파괴가 일어날 것이다. 시트폼(82)은 이식부위에 적용하기 쉬운 장점을 갖고 있지만. 재료의 단밀도로 이루어진 시트와 대조적으로 입자(81, 82)가 다른 속도로 재흡수됨으로 인해 이식부위에 연장된 재생반응을 제공하는 능력을 가진다.
또 다른 실시형태에 있어서, 도 11에서 나타낸 바와 같이, 밀도가 다른 입자(91)의 혼합물, 즉, 제 1 밀도(92) A 입자 및 제 2 밀도(93) B 입자는 ECM의 시트(94) 사이에 협지된다. 예를 들면, 제 1 밀도 A(92) 및 제 2 밀도 B(93)의 입자의 분말형태 혼합물은 UBM 또는 SIS의 시트(94) 사이에 협지되어서 느슨한 입자(91) 및 시트(94)의 다중 라미네이트 구조(95)를 형성한다. 시트(94)의 교대 층의 소정 수 및 입자(92, 93)의 혼합물(91)은 본 발명에 의해 구조화될 수 있다. 한 실시형태에 있어서, 예를 들면, 제 1 시트(94A)는 입자 혼합물(91)로 커버화되고; 입자 혼합물(91)은 제 2 시트(94B)로 커버화되고; 제 2 시트(94B)는 입자 혼합물(91)로 커버화되고; 및 제 3 시트(94C)는 시트-입자-시트-입자-시트 다중 라미네이트 구조(95)를 형성하도록 도포된다. 환자의 부위에 이식될 경우, 다중 라미네이트 구조(95)의 시트는 부위에 조직 재생을 위한 미세구조를 제공하는 반면, 다른 속도로 파괴되는 입자(92, 93)는 생물 활성 인자의 계속적인 공급을 제공하여 이식 부위에 재생을 돕는다.
또 다른 실시형태에 있어서, 저밀도 A 입자 및 고밀도 B 입자는 예를 들면, 베타-트리칼슘포스페이트(ßTCP), 수산화인회석, 소결된 소뼈, 소결된 돼지뼈, 탈염화된 동종뼈, 또는 광물화된 동종뼈와 같은 뼈 대체 재료와 병합될 수 있다. 다른 실시형태에 있어서, 본 발명의 뼈 입자 및 밀도가 다른 ECM 입자는 접착제, 바인더, 또는 소정 기타 첨가제 없이 함께 혼합될 수 있다. 입자는 뼈 대체 재료상에 코팅 및/또는 뼈 대체 재료에 주사된다, 뼈 대체 재료가 환자의 조직부위에 이식될 경우, 뼈 대체 재료는 강성형태를 제공하여서 결함을 안정화하는 반면, 저밀도 입자는 부위에 빠른 조직 수복을 촉진시킨다. 오랜 시간 동안, 고밀도 입자가 저밀도 입자보다 느린 속도로 생체 재흡수될 때, 고밀도 입자는 이식 부위에서 조직 수복을 유지한다. 고밀도 입자는 일반적으로 조직부분이 수복될 때까지 완전히 생체 재흡수되지 않는다.
본 발명의 다른 실시형태에 의해, 저밀도 A 입자 및 고밀도 B 입자를 갖는 입자의 혼합물은 분말형태로 제공된다. 분말은 1~1000㎛의 입자를 갖는다. 일반적으로 분말은 예를 들면, 커트, 긁음, 절개, 또는 피부의 상처와 같은 환자의 조직 부위상에 스프링클러될 수 있거나, 조직부위가 수술시 노출되는 동안 분말형태는 조직부위에 스프링클러될 수 있다. 다른 실시형태에 있어서, 밀도가 다른 입자는 예를 들면, 천식 치료에 투여되도록 사용되는 것과 같이 흡입기의 사용을 개재해서 흡입을 통해 투여된다.
다른 실시형태에 있어서, 저밀도 A 입자 및 고밀도 B 입자의 혼합물은 액체, 겔 또는 페이스트 매질로 유지된다. 액체 또는 겔은 환자의 조직부위에서 주사기를 통해 주사된다. 대체적으로는, 액체 또는 겔은 튜브 내에 유지되고 튜브의 밀려나가서 조직부위에 도포된다. 또 다른 실시형태에 있어서, 분말, 액체, 겔, 또는 페이스트 조성물은 제 3 밀도의 입자를 포함한다.
다른 실시형태에 있어서, 본 발명은 수복 또는 재생을 필요로 하는 환자의 조직 부위에서 조직 재생의 속도를 조정하기 위한 방법을 포함한다. 이 방법은 밀도가 다른 입자의 2종 이상을 포함하는 혼합물을 환자의 부위에 투여하는 것을 필요로 하고, 입자의 1종은 입자의 다른 종보다 밀도가 높다. 밀도가 다른 입자는 그들 각각의 비오레 흡수 분석결과, 즉, 고밀도 입자는 루버 밀도의 입자보다 조직부위에 재흡수되는데 오래 걸리기 때문에 선택되고, 저밀도 입자는 조직 부위에 빠르게 재흡수되기 때문에 선택되는 것을 기초로 하여 혼합물을 형성하도록 선택된다. 본 발명에 의해, 특히 의사는 특정 조직부위에 맞춤인 생체 재흡수의 특정 속도의 입자를 가지는 혼합물을 수복 또는 재생시키기 위해 선택한다. 혼합물은 일반적으로 조직부위에 주사기를 통해 환자에게 투여되거나, 예를 들면, 조직부위에 수술적으로 전달된다.
본 발명에 의한 조성물로 처리할 수 있는 조직부위는 심장 내 구조, 코, 귀, 가슴, 또는 체강을 포함하는 머리와 목 구조, 활막, 관절 캡슐, 관절순, 관절내 인대 및 연골, 추간원판, 골반저근, 힘줄, 뼈, 인대, 신장, 비장, 간, 근육 조직, 방광, 수뇨관, 자궁, 장, 이자, 혈관, 피부와 피부 부속기, 심장을 포함하지만 이것에 한정되는 것은 아니다.
(실시예)
만성 피부암의 조직 재생
중량에 기초한 입자의 3:1 비에 있어서, ECM 입자의 혼합물은 약 0.05g/㎤의 밀도를 갖는 크기 50~1000㎛인 UBM 입자의 60㎎, 및 약 0.25g/㎤의 밀도를 갖는 크기 50~500㎛인 UBM 입자의 20㎎을 차지함으로써 제조된다. 혼합물은 일반적으로 만성피부암에 도포된다. 10일 이내, 0.05g/㎤ 입자는 재흡수되고, 조직 재생은 상처 부위에서 관찰된다. 30일 이내, 0.25g/㎤ 입자는 재흡수되고, 상처 부위에 조직은 완전히 재생된다.
신장의 조직 재생
ECM 입자의 혼합물은 종양이 존재하는 부위인 신장의 이식을 위해 준비된다. 중량에 기초한 입자의 1:5 비에 있어서, ECM 입자의 혼합물은 약 0.10g/㎤의 밀도를 갖는 크기 500~1000㎛인 UBM 입자의 200㎎, 및 약 0.35g/㎤의 밀도를 갖는 크기 50~500㎛인 UBM 입자의 1000㎎을 차지함으로써 제조된다. 혼합물은 주사기를 통해 환자의 수술적으로 이식된다. 20일 이내, 0.10g/㎤ 입자는 재흡수되고, 조직 재생은 자기공명영상을 통해 상처 부위에서 관찰된다. 60일 이내, 0.35g/㎤ 입자는 재흡수되고, 상처 부위에 조직은 자기공명영상을 통해 보여진대로 완전히 재생된다.
Claims (30)
- 복수의 자연적으로 회합된 네이티브 세포외 기질 성분을 포함하는 네이티브 세포외 기질을 포함하고, 제 1 밀도 및 환자의 부위에의 이식시 제 1 재흡수 속도를 갖는 제 1 복수의 생체재흡수성 입자; 및
상기 제 1 생체재흡수성 입자의 세포외 기질과 상이한 또 다른 세포외 기질 또는 비세포외 기질 재료를 포함하고, 제 2 밀도 및 환자의 부위에의 이식시 제 2 재흡수 속도를 갖는 제 2 복수의 입자를 포함하는 생체재흡수성 입자의 조성물로서:
상기 제 2 밀도는 상기 제 1 밀도의 적어도 150%이며, 상기 제 2 재흡수 속도는 상기 제 1 재흡수 속도의 약 1배~약 10배의 범위내이고, 상기 제 1 복수의 생체재흡수성 입자 및 상기 제 2 복수의 생체재흡수성 입자는 포유류 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시키는 것을 특징으로 하는 생체재흡수성 입자의 조성물. - 제 1 항에 있어서,
상기 제 2 생체재흡수성 재료는 또 다른 네이티브 세포외 기질, 콜라겐, 생체재흡수성 폴리머, 및 히알루론산으로 이루어진 군에서 선택되는 것을 특징으로 하는 생체재흡수성 입자의 조성물. - 제 1 항에 있어서,
상기 제 2 밀도는 상기 제 1 밀도의 150%~500%인 것을 특징으로 하는 생체재흡수성 입자의 조성물. - (a) 복수의 자연적으로 회합된 네이티브 세포외 기질 성분을 포함하는 네이티브 세포외 기질을 포함하고 제 1 밀도 및 제 1 재흡수 속도를 갖는 제 1 생체재흡수성 재료의 시트를 제공하고, 상기 시트를 제 1 복수의 입자로 밀링하는 단계;
(b) 상기 제 1 시트의 세포외 기질과 상이한 또 다른 세포외 기질 또는 비세포외 기질 재료를 포함하고 제 2 밀도와 제 2 재흡수 속도를 갖는 제 2 생체재흡수성 재료의 시트를 제공하고, 상기 시트를 제 2 복수의 입자로 밀링하는 단계;
(c) 상기 제 1 복수의 입자의 소정량을 제공하고, 상기 소정량을 상기 제 2 복수의 입자의 소정량과 혼합하는 단계를 포함하는 생체재흡수성 입자상 물질의 혼합물의 제조방법으로서:
상기 제 2 복수의 입자의 밀도는 상기 제 1 복수의 입자의 밀도의 적어도 150%이고, 상기 제 1 재흡수 속도는 상기 제 2 재흡수 속도의 적어도 1.5배이며;
상기 제 1 복수의 생체재흡수성 입자 및 상기 제 2 복수의 생체재흡수성 입자는 포유류 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시키는 것을 특징으로 하는 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 제 4 항에 있어서,
상기 제 2 시트를 밀링하기 전에 압축 또는 라미네이팅하여 상기 제 1 시트와 비교하여 그 밀도를 증가시키는 단계를 더 포함하는 것을 특징으로 하는 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 제 4 항에 있어서,
상기 제 1 시트를 밀링하기 전에 동결건조시켜서 상기 제 2 시트와 비교하여 그 밀도를 감소시키는 단계를 더 포함하는 것을 특징으로 하는 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 제 4 항에 있어서,
상기 제 2 밀도는 상기 제 1 밀도의 150%~500%인 것을 특징으로 하는 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 복수의 자연적으로 회합된 세포외 기질 성분을 포함하는 네이티브 세포외 기질을 포함하고 제 1 밀도를 갖는 생체재흡수성 재료의 시트를 제공하고, 상기 시트의 일부분을 상기 일부분이 상기 제 1 밀도의 적어도 150%인 제 2 밀도를 포함하도록 압축하는 단계; 및
상기 시트를 복수의 입자로 밀링하는 단계를 포함하는 밀도가 다른 생체재흡수성 입자상 물질의 혼합물의 제조방법으로서:
상기 생체재흡수성 재료의 혼합물은 포유류 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시키는 것을 특징으로 하는 밀도가 다른 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 복수의 자연적으로 회합된 네이티브 세포외 기질 성분을 포함하는 네이티브 세포외 기질을 포함하고 제 1 밀도를 갖는 제 1 복수의 생체재흡수성 입자 및 상기 제 1 복수의 생체재흡수성 입자와 상이한 또 다른 세포외 기질을 포함하고 상기 제 1 밀도의 적어도 150%인 제 2 밀도를 갖는 제 2 복수의 생체재흡수성 입자를 포함하는 혼합물을 환자의 부위에 투여하는 단계를 포함하는 수복 또는 재생을 필요로 하는 환자의 해부학적 부위에서의 조직 수복 속도의 조정방법으로서:
상기 제 2 복수의 생체재흡수성 입자는 상기 제 1 복수의 생체재흡수성 입자의 흡수보다 느린 속도로 환자의 조직에 의해 재흡수됨으로써 제 2 복수의 생체재흡수성 입자의 치료 효과가 상기 부위에서 연장되고, 상기 제 1 복수의 생체재흡수성 입자 및 제 2 복수의 생체재흡수성 입자는 포유류 환자의 해부학적 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시키는 것을 특징으로 하는 수복 또는 재생을 필요로 하는 환자의 해부학적 부위에서의 조직 수복 속도의 조정방법. - 제 9 항에 있어서,
(a) 환자의 부위의 수복 또는 재생용 재흡수성 조성물의 최적의 흡수 속도를 결정하는 단계;
(b) 환자의 부위로의 이식시 단계(a)에 기초한 상기 최적의 흡수 속도 및 제 1 밀도를 갖도록 제 1 복수의 생체재흡수성 입자를 선택하는 단계; 및
(c) 제 1 복수의 입자의 밀도보다 높은 제 2 밀도를 갖고, 환자의 부위로의 이식시 제 1 복수의 생체재흡수성 입자의 흡수 속도보다 단계(a) 및 단계(b)에 기초한 흡수 속도가 느리도록 제 2 복수의 생체재흡수성 입자를 선택하는 단계를 포함하는 생체재흡수성 입자의 혼합물을 제조하는 단계를 더 포함하는 것을 특징으로 하는 것을 수복 또는 재생을 필요로 하는 환자의 해부학적 부위에서의 조직 수복 속도의 조정방법. - 제 9 항에 있어서,
상기 생체재흡수성 입자는 액체 매질 또는 겔 매질 중에서 환자의 부위에 전달되는 것을 특징으로 하는 수복 또는 재생을 필요로 하는 환자의 해부학적 부위에서의 조직 수복 속도의 조정방법. - 제 9 항에 있어서,
상기 생체재흡수성 입자는 환자의 부위에 주사되는 것을 특징으로 하는 수복 또는 재생을 필요로 하는 환자의 해부학적 부위에서의 조직 수복 속도의 조정방법. - 제 9 항에 있어서,
상기 혼합물은 상기 부위에 국소적으로 투여되는 것을 특징으로 하는 수복 또는 재생을 필요로 하는 환자의 해부학적 부위에서의 조직 수복 속도의 조정방법. - 제 1 네이티브 세포외 기질의 복수의 세포외 기질 성분 및 제 1 밀도를 포함하는 제 1 입자를 제공하는 단계;
제 2 네이티브 세포외 기질 및 제 2 밀도의 제 2 입자를 제공하는 단계;
상기 제 1 입자 및 상기 제 2 입자를 함께 압축해서 환자의 해부학적 조직에 상응하는 삼차원 물체를 형성하는 단계를 포함하는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 14 항에 있어서,
상기 제 1 입자 및 상기 제 2 입자 중 하나의 세포외 기질은 UBS, SIS, 및 UBM로 이루어진 군에서 선택되는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 14 항에 있어서,
상기 제 1 밀도의 입자는 상기 제 2 밀도의 입자보다 밀도가 높고, 상기 제 1 밀도의 입자는 임플란트의 코어를 형성하고, 상기 제 2 밀도의 입자는 임플란트의 외면을 형성하는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 각각의 밀도가 같은 네이티브 세포외 기질의 복수의 입자를 제조하는 단계;
상기 복수의 입자를 제 1 군 및 제 2 군으로 분할하는 단계;
상기 복수의 입자의 제 1 군을 제 1 밀도를 갖고 세포외 기질, 폴리글리콜산, 히알루론산, 콜라겐, 또는 그 조합으로 이루어진 군에서 선택되는 재료를 포함하는 코팅으로 코팅하는 단계;
상기 복수의 입자의 제 2 군을 제 2 밀도를 갖고 세포외 기질, 폴리글리콜산, 히알루론산, 콜라겐, 또는 그 조합으로 이루어진 군에서 선택되는 재료를 포함하는 코팅으로 코팅하는 단계;
상기 입자의 제 1 군을 상기 입자의 제 2 군과 혼합하여 입자의 혼합물을 형성하는 단계를 포함하는 세포외 기질 입자의 혼합물의 제조방법으로서:
상기 입자의 혼합물은 포유류 환자의 조직 부위에 이식될 경우 조직 재생 및 조직 수복을 촉진시키는 것을 특징으로 하는 세포외 기질 입자의 혼합물의 제조방법. - 복수의 자연적으로 회합된 네이티브 세포외 기질 성분을 포함하는 네이티브 세포외 기질의 제 1 시트;
복수의 자연적으로 회합된 네이티브 세포외 기질 성분을 포함하는 네이티브 세포외 기질의 제 2 시트; 및
제 1 밀도를 갖는 제 1 복수의 세포외 기질 입자 및 상기 제 1 밀도의 적어도 150%인 제 2 밀도를 갖는 제 2 복수의 세포외 기질 입자를 포함하는 세포외 기질의 조성물로서:
상기 제 1 복수의 입자 및 상기 제 2 복수의 입자는 상기 제 1 세포외 기질의 시트 및 상기 제 2 세포외 기질의 시트 사이에 함유되는 것을 특징으로 하는 세포외 기질의 조성물. - 제 14 항에 있어서,
상기 제 1 입자를 상기 제 1 밀도를 갖는 코팅으로 코팅하는 단계;
상기 제 2 입자를 제 2 밀도를 갖는 코팅으로 코팅하는 단계를 더 포함하는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 14 항에 있어서,
상기 제 1 입자는 상기 제 2 입자의 네이티브 조직원과 상이한 네이티브 조직원으로부터 유래된 세포외 기질 성분을 포함하는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 20 항에 있어서,
상기 제 1 입자의 상기 네이티브 조직원은 방광을 포함하고, 상기 제 1 입자는 방광 상피 기저막을 포함하는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 14 항에 있어서,
상기 제 2 복수의 입자의 상기 세포외 기질은 상기 제 1 복수의 입자의 상기 세포외 기질과 상이한 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 8 항에 있어서,
상기 생체재흡수성 재료의 시트는 비가교형 세포외 기질을 포함하는 것을 특징으로 하는 밀도가 다른 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 제 14 항에 있어서,
상기 제 1 입자 및 상기 제 2 입자는 비가교형 세포외 기질을 포함하는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 17 항에 있어서,
상기 세포외 기질은 비가교형인 것을 특징으로 하는 세포외 기질 입자의 혼합물의 제조방법. - 제 8 항에 있어서,
상기 세포외 기질은 UBM을 포함하는 것을 특징으로 하는 밀도가 다른 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 제 14 항에 있어서,
상기 제 1 세포외 기질 및 상기 제 2 세포외 기질 중 하나는 UBM을 포함하는 것을 특징으로 하는 인간 환자에 이식되는 임플란트의 제조방법. - 제 17 항에 있어서,
상기 세포외 기질은 UBM을 포함하는 것을 특징으로 하는 세포외 기질 입자의 혼합물의 제조방법. - 제 4 항에 있어서,
상기 제 2 시트의 상기 제 1 시트는 비가교형 세포외 기질을 포함하는 것을 특징으로 하는 생체재흡수성 입자상 물질의 혼합물의 제조방법. - 제 4 항에 있어서,
상기 제 1 시트의 상기 세포외 기질 및 상기 제 2 시트의 상기 세포외 기질 중 적어도 하나는 UBM을 포함하는 것을 특징으로 하는 생체재흡수성 입자상 물질의 혼합물의 제조하는 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/507,311 US8652500B2 (en) | 2009-07-22 | 2009-07-22 | Particulate tissue graft with components of differing density and methods of making and using the same |
| US12/507,311 | 2009-07-22 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167036658A Division KR101794039B1 (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120069668A true KR20120069668A (ko) | 2012-06-28 |
Family
ID=42709107
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167036658A KR101794039B1 (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
| KR1020127004389A KR20120069668A (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
| KR1020187019501A KR101960694B1 (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
| KR1020177028050A KR101878236B1 (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167036658A KR101794039B1 (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187019501A KR101960694B1 (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
| KR1020177028050A KR101878236B1 (ko) | 2009-07-22 | 2010-07-21 | 밀도가 다른 성분을 가진 입자상 조직 이식편, 그것의 제조방법 및 사용방법 |
Country Status (10)
| Country | Link |
|---|---|
| US (7) | US8652500B2 (ko) |
| EP (2) | EP2456476B1 (ko) |
| JP (5) | JP6226524B2 (ko) |
| KR (4) | KR101794039B1 (ko) |
| CN (1) | CN102573939B (ko) |
| AU (1) | AU2010276271B2 (ko) |
| CA (2) | CA2768727C (ko) |
| DK (1) | DK2456476T3 (ko) |
| ES (1) | ES2749377T3 (ko) |
| WO (1) | WO2011011484A2 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150120986A (ko) * | 2013-02-22 | 2015-10-28 | 알로소스 | 연골 모자이크 조성물 및 방법 |
| KR20160110935A (ko) * | 2013-11-19 | 2016-09-23 | 코넬 유니버시티 | 조직 재생용 조직 지지체 재료 및 그 제조방법 |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7393339B2 (en) | 2003-02-21 | 2008-07-01 | C. R. Bard, Inc. | Multi-lumen catheter with separate distal tips |
| US20040243095A1 (en) | 2003-05-27 | 2004-12-02 | Shekhar Nimkar | Methods and apparatus for inserting multi-lumen spit-tip catheters into a blood vessel |
| US8992454B2 (en) | 2004-06-09 | 2015-03-31 | Bard Access Systems, Inc. | Splitable tip catheter with bioresorbable adhesive |
| WO2005121316A1 (en) * | 2004-06-11 | 2005-12-22 | Bernard O'brien Institute Of Microsurgery | Tissue material and muscle derived matrix |
| US20090319045A1 (en) * | 2004-10-12 | 2009-12-24 | Truncale Katherine G | Cancellous constructs, cartilage particles and combinations of cancellous constructs and cartilage particles |
| US7837740B2 (en) | 2007-01-24 | 2010-11-23 | Musculoskeletal Transplant Foundation | Two piece cancellous construct for cartilage repair |
| US20150359934A1 (en) * | 2007-05-10 | 2015-12-17 | CorMartix Cardiovascular, Inc. | Articles for Tissue Regeneration with Biodegradable Polymer |
| US8500939B2 (en) | 2007-10-17 | 2013-08-06 | Bard Access Systems, Inc. | Manufacture of split tip catheters |
| US8066660B2 (en) | 2007-10-26 | 2011-11-29 | C. R. Bard, Inc. | Split-tip catheter including lateral distal openings |
| US8292841B2 (en) | 2007-10-26 | 2012-10-23 | C. R. Bard, Inc. | Solid-body catheter including lateral distal openings |
| WO2009059220A1 (en) | 2007-11-01 | 2009-05-07 | C.R. Bard, Inc. | Catheter assembly including triple lumen tip |
| US9579485B2 (en) | 2007-11-01 | 2017-02-28 | C. R. Bard, Inc. | Catheter assembly including a multi-lumen configuration |
| US8652500B2 (en) | 2009-07-22 | 2014-02-18 | Acell, Inc. | Particulate tissue graft with components of differing density and methods of making and using the same |
| US10130736B1 (en) | 2010-05-14 | 2018-11-20 | Musculoskeletal Transplant Foundation | Tissue-derived tissuegenic implants, and methods of fabricating and using same |
| US9352003B1 (en) | 2010-05-14 | 2016-05-31 | Musculoskeletal Transplant Foundation | Tissue-derived tissuegenic implants, and methods of fabricating and using same |
| EP2793965B1 (en) | 2011-12-20 | 2019-02-20 | LifeCell Corporation | Flowable tissue products |
| AU2012355463C1 (en) * | 2011-12-20 | 2016-09-22 | Lifecell Corporation | Sheet tissue products |
| USD748252S1 (en) | 2013-02-08 | 2016-01-26 | C. R. Bard, Inc. | Multi-lumen catheter tip |
| KR102101689B1 (ko) | 2013-02-08 | 2020-04-17 | 아셀, 인크. | 세포외 기질 재료로부터의 생리활성 겔의 제조 방법 |
| US9878071B2 (en) | 2013-10-16 | 2018-01-30 | Purdue Research Foundation | Collagen compositions and methods of use |
| US20150283308A1 (en) * | 2014-04-03 | 2015-10-08 | Cook Biotech, Incorporated | Endoluminal device and method of implanting same |
| WO2016011091A1 (en) | 2014-07-14 | 2016-01-21 | C. R. Bard, Inc. | Apparatuses, systems, and methods for inserting split tip catheters having enhanced stiffening and guiding features |
| MY193650A (en) * | 2014-08-25 | 2022-10-21 | Celularity Inc | Extracellular matrix compositions |
| EP3185922A4 (en) * | 2014-08-27 | 2018-04-25 | Purdue Research Foundation Office of Technology Commercialization | Collagen-based therapeutic delivery systems |
| US9238090B1 (en) | 2014-12-24 | 2016-01-19 | Fettech, Llc | Tissue-based compositions |
| WO2016172365A1 (en) | 2015-04-21 | 2016-10-27 | Purdue Research Foundation Office Of Technology Commercialization | Cell-collagen-silica composites and methods of making and using the same |
| CA3177726A1 (en) | 2015-05-21 | 2016-11-24 | Musculoskeletal Transplant Foundation | Modified demineralized cortical bone fibers |
| KR20180134897A (ko) * | 2016-03-14 | 2018-12-19 | 리젠티스 코퍼레이션 | 염증성 장 질환을 치료하기 위한 방법 및 조성물 |
| US10881555B2 (en) * | 2016-03-30 | 2021-01-05 | Basf Se | Fluid-absorbent article |
| US10537417B2 (en) | 2016-07-07 | 2020-01-21 | Collagen Matrix, Inc. | Density gradient biopolymeric matrix implants |
| EP3615568A4 (en) | 2017-04-25 | 2021-01-20 | Purdue Research Foundation | TISSUE RESTORATION THREE-DIMENSIONAL (3D) ARTIFICIAL MUSCLE |
| CN109513044B (zh) * | 2019-01-29 | 2022-02-18 | 北京颢美细胞基因生物技术有限公司 | 用于微整形的再生组织基质微粒植入剂、制备方法及应用 |
| JP7256395B2 (ja) * | 2019-10-24 | 2023-04-12 | サミー株式会社 | 遊技機 |
| US11826490B1 (en) | 2020-12-29 | 2023-11-28 | Acell, Inc. | Extracellular matrix sheet devices with improved mechanical properties and method of making |
Family Cites Families (87)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AT261800B (de) | 1966-08-22 | 1968-05-10 | Braun Internat Gmbh B | Verfahren zur Herstellung von röhrenförmigen, glatten bzw. mit einem Gewinde versehenen Gewebe-Blutgefäß-Prothesen |
| US4439521A (en) | 1981-10-21 | 1984-03-27 | Ontario Cancer Institute | Method for producing self-reproducing mammalian pancreatic islet-like structures |
| US4801299A (en) | 1983-06-10 | 1989-01-31 | University Patents, Inc. | Body implants of extracellular matrix and means and methods of making and using such implants |
| MX163953B (es) | 1984-03-27 | 1992-07-03 | Univ New Jersey Med | Procedimiento para preparar una matriz biodegradable a base de colageno |
| US4829000A (en) | 1985-08-30 | 1989-05-09 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Reconstituted basement membrane complex with biological activity |
| US4780450A (en) | 1985-12-20 | 1988-10-25 | The University Of Maryland At Baltimore | Physically stable composition and method of use thereof for osseous repair |
| GB8618374D0 (en) | 1986-07-28 | 1986-09-03 | Hsc Res Dev Corp | Biological vascular prostheses |
| US4902528A (en) * | 1987-08-12 | 1990-02-20 | Nestec S.A. | Preparation of dried precooked rice product |
| US4776653A (en) | 1987-10-16 | 1988-10-11 | The Merton Company, Ltd. | Amusement device with kaleidoscope viewer |
| US4902508A (en) | 1988-07-11 | 1990-02-20 | Purdue Research Foundation | Tissue graft composition |
| US4956178A (en) | 1988-07-11 | 1990-09-11 | Purdue Research Foundation | Tissue graft composition |
| JPH02249556A (ja) * | 1988-10-25 | 1990-10-05 | Takao Yamamuro | 骨修復材および人工骨固定化剤 |
| US5425769A (en) * | 1990-04-23 | 1995-06-20 | Snyders, Jr.; Robert V. | Composition of material for osseous repair |
| US5336616A (en) | 1990-09-12 | 1994-08-09 | Lifecell Corporation | Method for processing and preserving collagen-based tissues for transplantation |
| DK0605428T5 (da) | 1991-06-24 | 2003-01-06 | Hcell Technology Inc | Hormonsecernerende pancreasceller opretholdt i langtidskultur |
| US5281422A (en) | 1991-09-24 | 1994-01-25 | Purdue Research Foundation | Graft for promoting autogenous tissue growth |
| US5800537A (en) | 1992-08-07 | 1998-09-01 | Tissue Engineering, Inc. | Method and construct for producing graft tissue from an extracellular matrix |
| US5352463A (en) | 1992-11-13 | 1994-10-04 | Badylak Steven F | Tissue graft for surgical reconstruction of a collagenous meniscus and method therefor |
| US5641518A (en) | 1992-11-13 | 1997-06-24 | Purdue Research Foundation | Method of repairing bone tissue |
| US5275826A (en) | 1992-11-13 | 1994-01-04 | Purdue Research Foundation | Fluidized intestinal submucosa and its use as an injectable tissue graft |
| AU1931495A (en) | 1994-03-14 | 1995-10-03 | Cryolife, Inc. | Treated tissue for implantation and preparation methods |
| US5891558A (en) * | 1994-11-22 | 1999-04-06 | Tissue Engineering, Inc. | Biopolymer foams for use in tissue repair and reconstruction |
| US6485723B1 (en) | 1995-02-10 | 2002-11-26 | Purdue Research Foundation | Enhanced submucosal tissue graft constructs |
| US5695998A (en) | 1995-02-10 | 1997-12-09 | Purdue Research Foundation | Submucosa as a growth substrate for islet cells |
| EP0820301B1 (en) | 1995-04-07 | 2002-07-24 | Purdue Research Foundation | Tissue graft for urinary bladder reconstruction |
| US5711969A (en) | 1995-04-07 | 1998-01-27 | Purdue Research Foundation | Large area submucosal tissue graft constructs |
| US5554389A (en) | 1995-04-07 | 1996-09-10 | Purdue Research Foundation | Urinary bladder submucosa derived tissue graft |
| CA2172917A1 (en) * | 1995-06-07 | 1996-12-08 | Hugh R. Mcmullin | Moldable collagen compositions for hard tissue repair and augmentation |
| JPH09122225A (ja) | 1995-10-31 | 1997-05-13 | Bio Eng Lab:Kk | 医用材料の原料膜材およびその製造方法 |
| JPH09122227A (ja) | 1995-10-31 | 1997-05-13 | Bio Eng Lab:Kk | 医用材料およびその製造方法 |
| ATE258810T1 (de) | 1995-11-09 | 2004-02-15 | Univ Massachusetts | Wiederherstellung der gewebeoberfläche mit zusammensetzungen aus hydrogel-zellen |
| US5869041A (en) | 1996-01-12 | 1999-02-09 | The Miriam Hospital | Delivery of bioactive compounds to an organism |
| US5755791A (en) | 1996-04-05 | 1998-05-26 | Purdue Research Foundation | Perforated submucosal tissue graft constructs |
| US6171344B1 (en) | 1996-08-16 | 2001-01-09 | Children's Medical Center Corporation | Bladder submucosa seeded with cells for tissue reconstruction |
| CZ54899A3 (cs) | 1996-08-23 | 1999-08-11 | Cook Biotech, Incorporated | Štěpová protéza, materiály s ní spojené a způsoby její výroby |
| EP0936930B1 (en) | 1996-11-05 | 2004-07-28 | Purdue Research Foundation | Myocardial graft constructs |
| DK1014895T3 (da) | 1996-12-10 | 2006-07-10 | Purdue Research Foundation | Kunstige karventiler |
| WO1998025545A1 (en) | 1996-12-10 | 1998-06-18 | Cook Biotech, Inc. | Stent grafts containing purified submucosa |
| JP4638562B2 (ja) | 1996-12-10 | 2011-02-23 | パーデュー・リサーチ・ファウンデーション | 脊椎動物肝臓組織由来の生物材料 |
| EP0961595B1 (en) | 1996-12-10 | 2003-09-10 | Purdue Research Foundation | Tubular submucosal graft constructs |
| US5866415A (en) | 1997-03-25 | 1999-02-02 | Villeneuve; Peter E. | Materials for healing cartilage and bone defects |
| JP2001520542A (ja) | 1997-04-11 | 2001-10-30 | クライオライフ・インコーポレーテッド | 組織の無細胞化 |
| ES2175753T3 (es) | 1997-06-27 | 2002-11-16 | Augustinus Bader | Injerto biosintetico y metodo para su produccion. |
| EP1042453A4 (en) | 1997-12-23 | 2003-05-21 | Purdue Research Foundation | BIOLOGICAL MATERIAL DERIVED FROM BASAL MEMBRANES OF FOLLICLES |
| MXPA00012063A (es) | 1998-06-05 | 2003-04-22 | Organogenesis Inc | Protesis de soporte de injerto vascular biodisenadas. |
| JP2002525043A (ja) | 1998-09-11 | 2002-08-13 | パーデュー・リサーチ・ファウンデーション | 改良粘膜下組織グラフト構成物 |
| CN1333818A (zh) | 1998-11-19 | 2002-01-30 | 奥加诺吉尼西斯公司 | 生物工程化的组织构建物、其制备方法及其应用 |
| JP2000223701A (ja) * | 1999-01-28 | 2000-08-11 | Mitsubishi Electric Corp | 半導体装置およびその製造方法 |
| US6322593B1 (en) | 1999-04-09 | 2001-11-27 | Sulzer Carbomedics Inc. | Method for treating cross-linked biological tissues |
| AU772484B2 (en) | 1999-04-30 | 2004-04-29 | Massachusetts General Hospital | Fabrication of vascularized tissue using microfabricated two-dimensional molds |
| AU782297B2 (en) * | 1999-06-30 | 2005-07-14 | Ethicon Inc. | Porous tissue scaffoldings for the repair or regeneration of tissue |
| US6454804B1 (en) | 1999-10-08 | 2002-09-24 | Bret A. Ferree | Engineered tissue annulus fibrosis augmentation methods and apparatus |
| US6432712B1 (en) | 1999-11-22 | 2002-08-13 | Bioscience Consultants, Llc | Transplantable recellularized and reendothelialized vascular tissue graft |
| US20090053279A1 (en) | 1999-12-22 | 2009-02-26 | Badylak Stephen F | Tissue regenerative composition |
| US6576265B1 (en) | 1999-12-22 | 2003-06-10 | Acell, Inc. | Tissue regenerative composition, method of making, and method of use thereof |
| DE60041611D1 (de) | 1999-12-22 | 2009-04-02 | Acell Inc | Zusammensetzung zur Geweberegeneration |
| US20040043006A1 (en) | 2002-08-27 | 2004-03-04 | Badylak Stephen F. | Tissue regenerative composition |
| US6579538B1 (en) | 1999-12-22 | 2003-06-17 | Acell, Inc. | Tissue regenerative compositions for cardiac applications, method of making, and method of use thereof |
| US6479064B1 (en) | 1999-12-29 | 2002-11-12 | Children's Medical Center Corporation | Culturing different cell populations on a decellularized natural biostructure for organ reconstruction |
| US6376244B1 (en) | 1999-12-29 | 2002-04-23 | Children's Medical Center Corporation | Methods and compositions for organ decellularization |
| US6962814B2 (en) | 2000-08-16 | 2005-11-08 | Duke University | Decellularized tissue engineered constructs and tissues |
| US6827966B2 (en) | 2001-05-30 | 2004-12-07 | Novartis Ag | Diffusion-controllable coatings on medical device |
| US8877233B2 (en) | 2001-06-29 | 2014-11-04 | Cook Biotech Incorporated | Porous sponge matrix medical devices and methods |
| US6613348B1 (en) | 2001-07-31 | 2003-09-02 | Manoj K. Jain | Process of controlling absorbency in collagen flakes |
| EP1446015B1 (en) | 2001-10-18 | 2018-03-14 | Lifecell Corporation | Remodeling of tissues and organs |
| AU2002340463A1 (en) | 2001-11-16 | 2003-06-10 | Children's Medical Center Corporation | Augmentation of organ function |
| US6849339B2 (en) * | 2001-11-27 | 2005-02-01 | Guardian Industries Corporation | Composite laminate structures especially useful for automotive trim components, and methods and tie layers employed to make the same |
| AU2003219916A1 (en) | 2002-02-22 | 2003-09-09 | University Of Washington | Bioengineered tissue substitutes |
| US6651637B1 (en) * | 2002-10-29 | 2003-11-25 | Transpo Electronics, Inc. | Vehicle ignition system using ignition module with reduced heat generation |
| US20040175366A1 (en) | 2003-03-07 | 2004-09-09 | Acell, Inc. | Scaffold for cell growth and differentiation |
| US8741352B2 (en) * | 2003-08-25 | 2014-06-03 | Cook Biotech Incorporated | Graft materials containing ECM components, and methods for their manufacture |
| US20050175659A1 (en) | 2004-02-09 | 2005-08-11 | Macomber Laurel R. | Collagen device and method of preparing the same |
| US20050283256A1 (en) | 2004-02-09 | 2005-12-22 | Codman & Shurtleff, Inc. | Collagen device and method of preparing the same |
| GB2429162B (en) | 2004-03-29 | 2009-03-25 | Cook Biotech Inc | Methods for producing medical graft products with differing regions |
| EP2093256A3 (en) | 2005-07-28 | 2009-10-14 | Carnegie Mellon University | Biocompatible polymers and methods of use |
| JP2009513207A (ja) | 2005-10-27 | 2009-04-02 | コロプラスト アクティーゼルスカブ | Ecm材料を伴う生分解性足場 |
| US7838022B2 (en) | 2006-05-01 | 2010-11-23 | Warsaw Orthopedic, Inc | Malleable implants containing demineralized bone matrix |
| US7771741B2 (en) | 2006-05-01 | 2010-08-10 | Warsaw Orthopedic, Inc | Demineralized bone matrix devices |
| US20080005250A1 (en) * | 2006-06-30 | 2008-01-03 | Ragip Dogan Oksum | Messaging System and Related Methods |
| WO2008008266A2 (en) | 2006-07-07 | 2008-01-17 | University Of Pittsburgh- Of The Commonwealth System Of Higher Education | Biohybrid elastomeric scaffolds and methods of use thereof |
| US20080026032A1 (en) | 2006-07-27 | 2008-01-31 | Zubery Yuval | Composite implants for promoting bone regeneration and augmentation and methods for their preparation and use |
| WO2008109407A2 (en) | 2007-03-02 | 2008-09-12 | University Of Pittsburgh-Of The Commonwealth System Of Higher Education | Extracellular matrix-derived gels and related methods |
| US7799793B2 (en) | 2007-04-27 | 2010-09-21 | Medtronic, Inc. | N-alkylated rifampin |
| WO2009076391A2 (en) * | 2007-12-10 | 2009-06-18 | Cook Biotech Incorporated | Medical materials including modified extracellular matrix materials |
| AU2008335196B2 (en) * | 2007-12-12 | 2012-04-26 | Mark K. Moser | Light source tracker |
| CN104491928A (zh) * | 2008-06-20 | 2015-04-08 | 库克生物科技公司 | 可压缩/可扩张医疗移植产品以及应用止血的方法 |
| US8652500B2 (en) | 2009-07-22 | 2014-02-18 | Acell, Inc. | Particulate tissue graft with components of differing density and methods of making and using the same |
-
2009
- 2009-07-22 US US12/507,311 patent/US8652500B2/en active Active
-
2010
- 2010-07-21 JP JP2012521747A patent/JP6226524B2/ja active Active
- 2010-07-21 KR KR1020167036658A patent/KR101794039B1/ko active IP Right Grant
- 2010-07-21 KR KR1020127004389A patent/KR20120069668A/ko active Search and Examination
- 2010-07-21 ES ES10737434T patent/ES2749377T3/es active Active
- 2010-07-21 CN CN201080042075.6A patent/CN102573939B/zh active Active
- 2010-07-21 WO PCT/US2010/042701 patent/WO2011011484A2/en active Application Filing
- 2010-07-21 KR KR1020187019501A patent/KR101960694B1/ko active IP Right Grant
- 2010-07-21 CA CA2768727A patent/CA2768727C/en active Active
- 2010-07-21 EP EP10737434.0A patent/EP2456476B1/en active Active
- 2010-07-21 KR KR1020177028050A patent/KR101878236B1/ko active IP Right Grant
- 2010-07-21 CA CA2986673A patent/CA2986673C/en active Active
- 2010-07-21 AU AU2010276271A patent/AU2010276271B2/en active Active
- 2010-07-21 DK DK10737434.0T patent/DK2456476T3/da active
- 2010-07-21 EP EP19194713.4A patent/EP3607975A1/en active Pending
-
2012
- 2012-11-20 US US13/681,610 patent/US8968761B2/en active Active
-
2014
- 2014-01-24 US US14/163,046 patent/US9056078B2/en active Active
-
2015
- 2015-05-14 US US14/712,084 patent/US9561307B2/en active Active
- 2015-07-23 JP JP2015145739A patent/JP6340346B2/ja active Active
-
2016
- 2016-11-17 US US15/354,236 patent/US11000628B2/en active Active
-
2017
- 2017-09-28 JP JP2017188962A patent/JP6640808B2/ja active Active
-
2018
- 2018-10-12 US US16/158,805 patent/US10898610B2/en active Active
- 2018-11-20 US US16/196,272 patent/US11013829B2/en active Active
-
2019
- 2019-07-19 JP JP2019134133A patent/JP2019193877A/ja active Pending
-
2020
- 2020-01-21 JP JP2020007232A patent/JP2020058884A/ja active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150120986A (ko) * | 2013-02-22 | 2015-10-28 | 알로소스 | 연골 모자이크 조성물 및 방법 |
| KR20160110935A (ko) * | 2013-11-19 | 2016-09-23 | 코넬 유니버시티 | 조직 재생용 조직 지지체 재료 및 그 제조방법 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11013829B2 (en) | Particulate tissue graft with components of differing density and methods of making and using the same | |
| DE602004013257T2 (de) | Implantate mit lebender Gewebe zur Reparatur von Gewebeschäden oder Gewebedefekten | |
| AU2005309469A1 (en) | In situ method for treatment and repair of meniscal injuries | |
| AU2020241892A1 (en) | Soft tissue supports, and methods of making and using same | |
| AU2013201872B2 (en) | Particulate tissue graft with components of differing density and methods of making and using the same | |
| Ikada | Why is the Clinical Application of Tissue Engineering So Slow? |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| A107 | Divisional application of patent | ||
| AMND | Amendment | ||
| J201 | Request for trial against refusal decision | ||
| J301 | Trial decision |
Free format text: TRIAL NUMBER: 2017101001015; TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20170302 Effective date: 20180620 |
|
| J121 | Written withdrawal of request for trial |