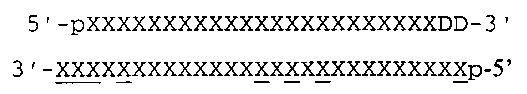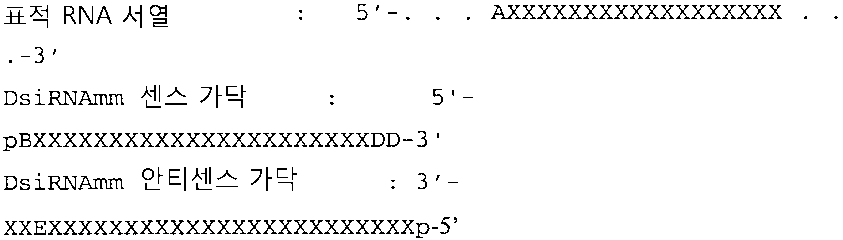KR20110110776A - 유전자 발현의 특이적 억제를 위한 연장된 다이서 기질 제제 및 방법 - Google Patents
유전자 발현의 특이적 억제를 위한 연장된 다이서 기질 제제 및 방법 Download PDFInfo
- Publication number
- KR20110110776A KR20110110776A KR1020117016689A KR20117016689A KR20110110776A KR 20110110776 A KR20110110776 A KR 20110110776A KR 1020117016689 A KR1020117016689 A KR 1020117016689A KR 20117016689 A KR20117016689 A KR 20117016689A KR 20110110776 A KR20110110776 A KR 20110110776A
- Authority
- KR
- South Korea
- Prior art keywords
- strand
- nucleotide
- ribonucleotides
- dsna
- nucleic acid
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1135—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against oncogenes or tumor suppressor genes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1131—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/12—Type of nucleic acid catalytic nucleic acids, e.g. ribozymes
- C12N2310/122—Hairpin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
- C12N2310/141—MicroRNAs, miRNAs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/321—2'-O-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/322—2'-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/342—Hemimers, i.e. of the type ====----
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/344—Position-specific modifications, e.g. on every purine, at the 3'-end
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/50—Physical structure
- C12N2310/53—Physical structure partially self-complementary or closed
- C12N2310/533—Physical structure partially self-complementary or closed having a mismatch or nick in at least one of the strands
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/50—Methods for regulating/modulating their activity
- C12N2320/52—Methods for regulating/modulating their activity modulating the physical stability, e.g. GC-content
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Biomedical Technology (AREA)
- Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Plant Pathology (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Oncology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Virology (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Saccharide Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
본 발명은 세포내 표적 유전자의 발현을 감소시키기 위한 유효량으로 분리된 이중 가닥 핵산(dsNA)와 세포를 접촉시킴을 포함하는, 세포내 표적 유전자의 발현을 감소시키기 위한 조성물 및 방법을 제공한다. 본 발명의 dsNA는 dsNA 분자내 다이서 효소 절단 부위를 지시하도록 디자인된 데옥시리보뉴클레오타이드 패턴(대부분의 양태에서, 상기 패턴은 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함한다)을 갖는다. 본 발명의 dsNA 분자의 데옥시리보뉴클레오타이드는 절단 부위를 통해 절단되어 더 이상 데옥시리보뉴클레오타이드 패턴(예를 들어, 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍)을 함유하지 않는 활성 siRNA 제제를 생성할 수 있는 dsNA 영역내에 위치한다. 상기 DNA 연장된 다이서 기질 siRNA(DsiRNA)는 상응하는 이중 가닥 RNA-연장된 DsiRNA 보다 효과적인 RNA 억제제인 것으로 입증되었다. DsiRNA 제제는 또한 가이드 가닥 미스매치에 관용성인 것으로 밝혀졌다.
Description
관련 출원에 대한 상호 참조
본 출원은 하기 출원들과 관련되고 35 U.S.C.§119(e)하에 이들에 대한 우선권을 주장한다: 2008년 12월 18일자로 출원된 미국 가특허 출원 번호 제61/138,946호; 2009년 4월 2일자로 출원된 미국 가특허 출원 번호 제61/166,227호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,505호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,514호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,521호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,525호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,532호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,538호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,544호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,549호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,554호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,556호; 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,558호; 및 2009년 4월 28일자로 출원된 미국 가특허 출원 번호 제61/173,563호. 상기 출원의 전체 교시는 본원에 참조로서 인용된다.
25 내지 35개 뉴클레오타이드의 가닥 길이를 갖는 이중 가닥 RNA(dsRNA) 제제는 포유동물 세포에서 표적 유전자 발현의 효과적인 억제제로서 보고되었다(문헌참조: Rossi et al., 미국 특허 공개 번호 제2005/0244858호 및 제2005/0277610호). 상기 길이의 dsRNA 제제는 RNA 간섭(RNAi) 경로의 다이서 효소에 의해 처리되는 것으로 사료되고 이에 의해 상기 제제는 "다이서 기질 siRNA"("DsiRNA") 제제로서 호칭된다. DsiRNA 제제의 특정 변형된 구조물이 이전에 보고되었다(문헌참조: Rossi et al., 미국 특허 공개 번호 제2007/0265220호).
강력한 서열 특이적 표적 유전자 사일런싱 효능이 25 내지 35개 뉴클레오타이드 길이의 dsRNA 제제에서 동정되었지만 시험관내 및 생체내 증진된 효능을 갖는 DsiRNA 제제의 디자인을 포함하여 상기 제제의 디자인을 개선시킬 필요가 있다.
발명의 간략한 요약
본 발명은 적어도 부분적으로, 센스 가닥의 3' 말단/안티센스 가닥의 5' 말단에서 또는 이의 근처에서 또는 센스 가닥의 5' 말단/안티센스 가닥의 3' 말단에서 또는 이의 근처에서 염기쌍을 형성한 데옥시리보뉴클레오타이드를 갖는 길이가 27 내지 39개의 뉴클레오타이드 범위인 가닥 길이를 갖는 이중 가닥 핵산 제제가 효과적인 RNA 간섭 제제라는 놀라운 발견을 기초로 한다. 실제로, 본 발명은 다이서 효소 절단을 통해 수득한 활성 siRNA로부터 절단된 다이서 기질 영역내에 염기쌍 형성된 데옥시리보뉴클레오타이드의 내포가 효과적인 억제제를 유도함을 입증하는 것에 관한 것이다. DsiRNA의 상기 영역내에 하나 이상의 염기쌍 형성된 데옥시리보뉴클레오타이드의 내포가 예를 들어, 증진된 효능(증진된 효력 및/또는 개선된 효과 지속성을 포함하는), DNA 결합 분자에 대한 인지 도메인의 디스플레이 및 DNA:DNA 이중나선 영역과 관련된 다른 특성을 포함하는, 상기 변형된 DsiRNA 분자에 특정 잇점을 부여할 수 있다. 실제로, 상기 이중 가닥의 DNA:DNA-연장된 DsiRNA 제제는 특히, 상응하는 이중 가닥 RNA:DNA- 또는 RNA:RNA-연장된 DsiRNA 제제와 상대적으로 개선된 효력을 포함하는, 증진된 효능을 갖는 것으로 입증되었다.
본 발명의 잇점중에서, DNA-연장된 DsiRNA 제제가 이중 나선 길이가 증가함에 따라 감소된 효능을 나타내지 않는다는 놀라운 발견은 예를 들어, 상기 이중 가닥 DNA-연장된 도메인을 함유하지 않는 상응하는 길이의 dsRNA 제제와 대비하여 DsiRNA의 추가의 기능성 그룹으로 부착을 위해 보다 큰 여유공간, 안정화 변형물(예를 들어, PS-NA 잔기) 또는 추가의 기능성을 부가할 수 있고/있거나 예를 들어, 상기 제제의 약력학, 약동력학 또는 생분포를 증진시킬 수 있는 다른 형태의 변형물의 내포/패턴화를 제공하면서 여전히 효과적인 RNA 억제제로서 유지되는 DsiRNA가 생성되게한다. 상기 dsRNA-연장 영역의 효과는 dsDNA 영역내에서 고유한 안정화 활성화로부터 비롯되는 것이 아니라 특이적으로 국소화된 데옥시리보뉴클레오타이드 잔기(제1 가닥의 돌출된 다이서 절단 부위의 3' 및 제2 가닥의 돌출된 다이서 절단 부위의 상응하는 5'에 위치하거나 제1 가닥의 돌출된 다이서 절단 부위의 5' 및 제2 가닥의 돌출된 다이서 절단 부위의 상응하는 3'에 위치함)가 다이서 절단을 지시하여 바람직한 절단 생성물 및/또는 절단 생성물 집단이 생성되고/되거나 보다 우세하도록 하는 능력에 기인할 수 있는 것으로 나타난다.
따라서, 특정 측면에서, 본 발명은 이전에 기재된 RNA 억제제 보다 큰 길이에서 증진된 효능(다이서 절단 반응 위치의 보다 정확한 지시를 통해)을 갖는 RNA 억제제의 디자인을 가능하게 하므로써 예를 들어, 성공적으로 제형화되거나, 활성 약물 분자 및/또는 페이로드(payload)에 부착되도록 하거나 또 다른 활성 핵산 분자에 부착되거나 검출 분자에 부착되거나 안정화 변형물 등을 갖도록 하는 개선된 능력 뿐만 아니라 증진된 효능, 전달, 약력학, 약동력학 및 생분포 성질을 갖는 dsRNA-함유 제제의 생성을 가능하게 한다.
하나의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고; 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고; 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고; 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제1 가닥의 1번 내지 9번은 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고; 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제1 가닥의 1번 내지 9번은 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제1 가닥의 1번 내지 9번은 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 양태에서, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 2개 이상, 4개 이상, 6개 이상, 8개 이상, 10개 이상, 12개 이상, 14개 이상, 16개 이상, 18개 이상, 또는 20개 이상의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다. 임의로, 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 제1 가닥의 데옥시리보뉴클레오타이드는 연속 데옥시리보뉴클레오타이드이다.
하나의 양태에서, 제1 가닥의 24번 내지 27번의 2개 이상의 연속 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다. 또 다른 양태에서, 제1 가닥의 24번 및 25번 각각은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
추가의 양태에서, 제1 올리고뉴클레오타이드 가닥의 24번 내지 27번의 각각의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
또 다른 양태에서, 제1 가닥은 길이가 29개 내지 49개인 뉴클레오타이드이다. 임의로, 제1 올리고뉴클레오타이드 가닥의 24번 내지 27번의 각각의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
하나의 양태에서, 제1 가닥은 길이가 31개 내지 49개인 뉴클레오타이드이다. 임의로, 제1 올리고뉴클레오타이드 가닥의 24번 내지 29번의 각각의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
추가의 양태에서, 제1 가닥은 길이가 33개 내지 49개인 뉴클레오타이드이다. 임의로, 제1 올리고뉴클레오타이드 가닥의 24번 내지 31번의 각각의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
또 다른 양태에서, 제1 가닥은 길이가 35개 내지 49개인 뉴클레오타이드이다. 임의로, 제1 올리고뉴클레오타이드 가닥의 24번 내지 33번의 각각의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
특정 양태에서, 제1 가닥은 길이가 37개 내지 49개인 뉴클레오타이드이다. 임의로, 제1 올리고뉴클레오타이드 가닥의 24번 내지 35번의 각각의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
하나의 양태에서, 제1 가닥은 길이가 39개 내지 49개인 뉴클레오타이드이다. 임의로, 제1 올리고뉴클레오타이드 가닥의 24번 내지 37번의 각각의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
추가의 양태에서, 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 제2 가닥의 데옥시리보뉴클레오타이드는 표적 RNA와 상보적이지 않다.
특정 양태에서, 제2 가닥은 길이가 1 내지 4개의 뉴클레오타이드인 3' 오버행을 갖는다. 관련 양태에서, 제2 가닥 3' 오버행의 뉴클레오타이드는 변형된 뉴클레오타이드를 포함한다. 임의로, 상기 변형된 뉴클레오타이드 잔기는 2'-O-메틸, 2'-메톡시에톡시, 2'-플루오로, 2'-알릴, 2'-O-[2-(메틸아미노)-2-옥소에틸], 4'-티오, 4'-CH2-O-2'-브릿지, 4'-(CH2)2-O-2'-브릿지, 2'-LNA, 2'-아미노 또는 2'-O-(N-메틸카바메이트)이다.
또 다른 양태에서, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 2'-O-메틸, 2'-메톡시에톡시, 2'-플루오로, 2'-알릴, 2'-O-[2-(메틸아미노)-2-옥소에틸], 4'-티오, 4'-CH2-O-2'-브릿지, 4'-(CH2)2-O-2'-브릿지, 2'-LNA, 2'-아미노 또는 2'-O-(N-메틸카바메이트)인 변형된 뉴클레오타이드를 추가로 갖는다.
하나의 양태에서, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기는 데옥시리보뉴클레오타이드이고 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 리보뉴클레오타이드이다.
또 다른 양태에서, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기(1번 위치 *)에 상보적인 제2 가닥의 뉴클레오타이드 잔기로부터 개시하여 제2 가닥은 제2 가닥의 20번 위치*에서 제2 가닥의 5' 말단 잔기까지의 모든 위치에서 변형되지 않은 뉴클레오타이드 잔기를 포함한다. 임의로, 제1 가닥의 3' 말단에서 제1 뉴클레오타이드(1번 위치*)에서 개시하여, 1번 위치 *, 2번 위치 * 및/또는 3번 위치*는 데옥시리보뉴클레오타이드이다.
하나의 양태에서, 제1 가닥은 제1 가닥의 3' 말단으로부터 1번 위치 *에서 데옥시리보뉴클레오타이드를 갖는다. 임의로, 제1 가닥은 제1 가닥의 3' 말단으로부터 1번 위치 * 및 2번 위치 *에서 데옥시리보뉴클레오타이드를 갖는다.
또 다른 양태에서, 제2 또는 제1 올리고뉴클레오타이드 가닥의 뉴클레오타이드는 다이서 절단의 배향을 지시하는 변형된 뉴클레오타이드로 치환된다.
추가의 양태에서, 제2 가닥의 3' 말단에서 제1 뉴클레오타이드(1번 위치 *)에서 개시하여, 제2 가닥의 3' 말단으로부터 1번 위치 *, 2번 위치 *, 및 3번 위치 *는 변형된 뉴클레오타이드이다.
임의로, 제1 가닥은 제2 가닥 뉴클레오타이드 서열과 적어도 60%, 70%, 80%, 90%, 95% 또는 100% 상보적인 뉴클레오타이드 서열을 갖는다.
특정 양태에서, 제1 가닥의 3' 말단 뉴클레오타이드 잔기는 뉴클레오타이드 서열에 의해 제2 가닥의 5' 말단 뉴클레오타이드 잔기에 부착된다. 임의로, 제1 가닥의 3' 말단 뉴클레오타이드 잔기 및 제2 가닥의 5' 말단 뉴클레오타이드 잔기에 부착되는 뉴클레오타이드 서열은 테트라 루프 또는 헤어핀 구조를 포함한다.
하나의 양태에서, 제1 및 제2 가닥은 화학적 링커에 의해 결합된다. 임의로, 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 화학적 링커에 의해 결합된다.
특정 양태에서, 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드까지 하나 이상은 변형되지 않은 데옥시리보뉴클레오타이드이다. 관련 양태에서, 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상 및 제2 가닥의 데옥시리보뉴클레오타이드 둘다는 변형되지 않은 데옥시리보뉴클레오타이드이다.
하나의 양태에서, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기로부터 개시하여, 제2 올리고뉴클레오타이드 가닥은 변형된 뉴클레오타이드 잔기와 변형되지 않은 뉴클레오타이드 잔기를 번갈아 가면서 포함한다.
추가의 양태에서, 미스매치는 3번 위치 내지 9번 위치중 임의의 하나 이상에서 DsiRNA에 존재한다. 또 다른 양태에서, 미스매치는 1번 위치 내지 7번 위치중 임의의 하나 이상에 존재한다. 추가의 양태에서, 미스매치는 3번 위치 내지 7번 위치중 임의의 하나 이상에 존재한다. 임의로, 미스매치는 6번 위치에 존재한다.
또 다른 양태에서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 2개 이상의 뉴클레오타이드를 갖는다. 임의로, 2번 위치 및 6번 위치는 제2 가닥과 미스매치이다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고; 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여, 제2 가닥의 5' 방향에서 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고; 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고; 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여, 제2 가닥의 5' 방향에서 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고; 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고; 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여, 제2 가닥의 5' 방향에서 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고; 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 양태에서, 제2 가닥의 3' 오버행의 뉴클레오타이드는 표적 RNA와 미스매치를 형성한다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고, 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 하나 또는 2개의 미스매치 염기쌍을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 양태에서, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 2개 이상, 4개 이상, 6개 이상, 8개 이상, 10개 이상, 12개 이상, 14개 이상, 16개 이상, 18개 이상, 또는 20개 이상의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
또 다른 양태에서, 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 제2 가닥의 데옥시리보뉴클레오타이드는 연속 데옥시리보뉴클레오타이드이다. 임의로 제2 가닥의 24번 내지 27번 위치의 2개 이상의 연속 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
하나의 양태에서, DsiRNA의 제2 가닥의 24번 및 25번 위치 각각은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다. 임의로, 제2 올리고뉴클레오타이드 가닥의 24번 내지 27번의 각각의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
하나의 양태에서, DsiRNA의 제2 가닥은 길이가 29개 내지 53개인 뉴클레오타이드이다. 임의로, 제2 올리고뉴클레오타이드 가닥의 24번 내지 27번 위치의 각각의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
또 다른 양태에서, DsiRNA의 제2 가닥은 길이가 31개 내지 53개인 뉴클레오타이드이다. 임의로, 제2 올리고뉴클레오타이드 가닥의 24번 내지 29번 위치의 각각의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
추가의 양태에서, DsiRNA의 제2 가닥은 길이가 33개 내지 53개인 뉴클레오타이드이다. 임의로, 제2 올리고뉴클레오타이드 가닥의 24번 내지 31번 위치의 각각의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
특정 양태에서, DsiRNA의 제2 가닥은 길이가 35개 내지 53개인 뉴클레오타이드이다. 임의로, 제2 올리고뉴클레오타이드 가닥의 24번 내지 33번 위치의 각각의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
또 다른 양태에서, DsiRNA의 제2 가닥은 길이가 37개 내지 53개인 뉴클레오타이드이다. 임의로, 제2 올리고뉴클레오타이드 가닥의 24번 내지 35번 위치의 각각의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
추가의 양태에서, DsiRNA의 제2 가닥은 길이가 39개 내지 53개인 뉴클레오타이드이다. 임의로, 제2 올리고뉴클레오타이드 가닥의 24번 내지 37번 위치의 각각의 뉴클레오타이드 잔기는 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이다.
하나의 양태에서. 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기는 1 내지 25개의 데옥시리보뉴클레오타이드 잔기를 포함하고, 여기서 제2 가닥의 데옥시리보뉴클레오타이드 잔기 각각은 제1 가닥의 데옥시리보뉴클레오타이드 잔기와 염기쌍을 형성한다.
또 다른 양태에서, 제1 가닥의 최외곽 5' 다이서 절단 부위의 3'에 바로 인접하게 위치하는 제1 올리고뉴클레오타이드 가닥의 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하는 제2 가닥은 제2 가닥의 20번 위치 *에서 5' 말단 잔기까지의 모든 위치에서 변형되지 않은 뉴클레오타이드 잔기를 포함한다.
추가의 양태에서, DsiRNA의 제2 가닥의 최외곽 3' 다이서 절단 부위의 5'에 바로 인접하게 위치하는 뉴클레오타이드(위치 A)로부터 개시하여, 제2 가닥의 5' 방향에서 상기 잔기로부터 위치 A, B 및 C는 변형된 뉴클레오타이드이다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함한다.
하나의 양태에서, 미스매치는 13번 내지 21번 위치 중 하나 이상에 존재한다. 임의로 미스매치는 14번 위치에 존재한다.
또 다른 양태에서, 제2 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 2개 이상의 뉴클레오타이드를 갖는다. 임의로, 제2 가닥의 14번 및 18번 위치는 제1 가닥과 미스매치이다.
본 발명의 또 다른 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단과 제2 가닥의 5' 말단은 평활 말단을 형성하고; 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제 1가닥의 5'말단 및 제 2가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단을 형성하며 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고; 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평할 말단을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여 제2 가닥의 5' 방향으로 1번 위치* 내지 9번 위치*는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PSNA)이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고, 포스포로티오에이트-변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여 제2 가닥의 5' 방향으로 1번 위치* 내지 9번 위치*는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PSNA)이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 5' 말단에서 제 1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고; 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여 제2 가닥의 5' 방향으로 1번 위치* 내지 9번 위치*는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고; 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 또 다른 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 또는 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 양태에서, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기중 2개 이상의 뉴클레오타이드 잔기는 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 PS-NA 잔기이다.
또 다른 양태에서, 제1 가닥의 PS-NA 잔기는 제2 가닥의 PS-NA 데옥시리보뉴클레오타이드와 염기쌍을 형성한다.
본 발명의 또 다른 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 측면에서 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 하나의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 또 다른 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함한다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함한다.
또 다른 측면에서 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하고; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
하나의 측면에서 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함한다.
추가의 측면에서 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하고; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
추가의 측면에서 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며; 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함한다.
또 다른 측면에서 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
본 발명의 추가의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며, 제1 가닥의 3' 말단의 맨끝 및 맨끝에 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함한다.
본 발명의 하나의 측면은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고, 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고, 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시킨다.
또 다른 측면에서, 본 발명은 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)을 제공하고, 여기서, 제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고; 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며, 제1 가닥의 3' 말단의 맨끝 및 맨끝에 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고, 제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함한다.
하나의 양태에서, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기 중 2개 이상의 뉴클레오타이드 잔기는 포스포로티오에이트 변혀된 뉴클레오타이드(PS-NA)이다. 임의로, 제2 가닥의 PS-NA 잔기는 제1 가닥의 PS-NA 데옥시리보뉴클레오타이드와 염기쌍을 형성한다.
하나의 양태에서, dsNA는 총 2개 이상, 3개 이상, 4개 이상, 5개 이상, 6개 이상, 7개 이상, 8개 이상, 9개 이상, 10개 이상, 11개 이상, 12개 이상, 13개 이상, 14개 이상 또는 15개 이상의 PS-NA 잔기를 갖는다. 임의로, dsNA는 하나의 가닥상에 또는 2개의 가닥상에 2개 이상, 3개 이상, 4개 이상, 5개 이상, 6개 이상, 7개 이상, 8개 이상, 9개 이상, 10개 이상, 11개 이상, 12개 이상, 13개 이상, 14개 이상 또는 15개 이상의 PS-NA 또는 다른 변형된 잔기를 갖는다. 추가의 양태에서, dsNA는 총 16개 이상, 17개 이상, 18개 이상, 19개 이상, 20개 이상, 21개 이상, 22개 이상, 23개 이상, 24개 이상, 25개 이상, 26개 이상, 27개 이상, 28개 이상, 29개 이상, 또는 30개 이상의 PS-NA 또는 다른 변형된 잔기를 갖는다.
또 다른 양태에서, dsNA는 다이서에 의해 포유동물 세포에서 내생적으로 절단된다. 추가의 양태에서, dsNA는 포유동물 세포에서 내생적으로 절단되어 길이가 19개 내지 23개인 이중 가닥 뉴클레오타이드 핵산이 생성되고 이는 표적 유전자 발현을 감소시킨다. 추가의 양태에서, 분리된 dsNA는 포스포네이트, 포스포로티오에이트 또는 포스포트리에스테르 포스페이트 골격 변형을 갖는다.
추가의 양태에서, dsNA는 시험관내 포유동물 세포에서 표적 유전자 발현을 10% 이상, 50% 이상, 또는 80-90% 이상 까지 감소시킨다. 임의로, dsNA는 포유동물 피검체 또는 포유동물 피검체의 세포 또는 조직에서 표적 유전자 발현을 5% 이상, 10% 이상, 15% 이상, 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 또는 95% 이상까지 감소시킨다. 특정 양태에서, 단일 또는 다중 용량 투여 후 상기 억제 수준의 지속기간은 포유동물 피검체, 조직 또는 세포에서 6시간, 12시간, 24시간, 2일, 3일, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일, 14일 이상이다.
하나의 양태에서, 포유동물 세포로 도입되는 경우 dsNA는 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 갖지 않는 참조 dsRNA와 비교하여 표적 유전자 발현을 감소시킨다.
또 다른 양태에서, 포유동물 세포로 도입되는 경우 dsNA는 1 nM 이하, 200 pM 이하, 100 pM 이하, 50 pM 이하, 20 pM 이하, 10 pM 이하, 5 pM 이하, 및 1 pM 이하로 이루어진 그룹으로부터 선택되는 농도에서 세포로 전달되는 경우 70% 이상까지 표적 유전자 발현을 감소시킨다.
추가의 양태에서, dsNA의 리보뉴클레오타이드 50% 이상은 변형되지 않은 리보뉴클레오타이드이다. 특정 양태에서, 제2 가닥의 리보뉴클레오타이드 50% 이상은 변형되지 않는 리보뉴클레오타이드이다. 임의로, dsNA의 모든 데옥시리보뉴클레오타이드 50% 이상은 변형되지 않은 데옥시리보뉴클레오타이드이다.
하나의 양태에서, 제1 가닥은 제2 가닥의 뉴클레오타이드 서열과 80%, 90%, 95% 또는 100% 이상 상보적인 뉴클레오타이드 서열을 갖는다.
특정 양태에서, 표적 RNA는 KRAS이다.
하나의 측면에서, 본 발명은 참조 dsRNA와 대비하여 세포에서 표적 유전자의 발현을 감소시키는 유효량으로 본원에 기재된 바와 같은 분리된 이중 가닥 NA(dsNA)와 세포를 접촉시킴을 포함하는, 세포에서 표적 유전자의 발현을 감소시키는 방법을 제공한다.
또 다른 측면에서, 본 발명은 참조 dsRNA와 대비하여 동물의 세포에서 표적 유전자의 발현을 감소시키는 유효량으로 본원에 기재된 바와 같은 분리된 이중 가닥 NA(dsNA)와 동물을 접촉시킴을 포함하는, 동물에서 표적 유전자의 발현을 감소시키는 방법을 제공한다.
하나의 양태에서, dsNA는 적당한 대조군 DsiRNA와 비교하여 증진된 약력학, 증진된 약동력학, 감소된 독성 또는 증진된 세포내 흡수를 갖는다.
추가의 측면에서, 본 발명은 참조 dsRNA와 대비하여 세포에서 표적 유전자의 발현을 감소시키는 유효량으로 존재하는, 본원에 기재된 바와 같은 분리된 이중 가닥 NA(dsNA)를 포함하고 추가로 약제학적으로 허용되는 담체를 포함하는, 피검체의 세포에서 표적 유전자의 발현을 감소시키기 위한 약제학적 조성물을 제공한다.
본 발명의 또 다른 측면은 dsNA의 화학적 또는 효소적 합성을 통해 본원에 기재된 바와 같은 이중 가닥 NA(dsNA)을 합성하는 방법을 제공한다.
본 발명의 추가의 측면은 본원에 기재된 바와 같은 dsNA 및 이의 사용 지침서를 포함하는 키트를 제공한다.
본 발명의 추가의 측면은 도 30 내지 43C에 도시된 바와 같이 분리된 이중 가닥 핵산(dsNA)을 제공한다.
도 1A는 다이서 기질 억제 RNA 제제("DsiRNA")의 프로세싱을 도시한다. 단백질 다이서는 대형 삼각형으로 나타내고 다이서의 PAZ (Piwi/Argonaute/Zwille) 도메인을 또한 나타낸다. 상기 PAZ 도메인은 가이드(안티센스) 가닥의 3' 말단에 2-염기 오버행 및 3'-OH(하이드록실 그룹)를 결합시키고 dsRNA 이중나선의 각각 가닥은 기질 RN아제 III 도메인(블랙 삼각형)에 의해 절단된다. 패신저(센스) 가닥의 3' 말단에서 RNA를 2개 염기의 DNA로 대체하여 2-염기 길이의 RNA/DNA 이중나선 평활 말단을 형성하고 이는 PAZ에 대한 결합 친화성을 감소시키거나 제거한다. DsiRNA의 절단은 전형적으로 각각의 말단에 2-염기 오버행을 갖는 19량체 이중나선을 생성시킨다. 도 1B는 DsiRNA로 4개 염기의 DNA 이중나선의 첨가가 다이서 절단시 어떠한 겉보기 억제 효과를 나타내지 않음을 보여준다. 항-HPRT DsiRNA의 상기 샘플로 삽입된 염기(중 블랙 바 및 화살표)는 HPRT 표적 서열에 상보적이지 않다.
도 2A는 안티센스 가닥의 다이서 절단 부위의 센스 가닥/5'의 다이서 절단 부위의 3'에 위치한 이중나선 영역에서 염기쌍이 형성된 데옥시리보뉴클레오타이드를 갖는 DsiRNA("우측-연장된 DsiRNA 제제")의 강한 효능을 보여주는 히스토그램 데이타를 제공한다. DsiRNA 듀플렉스를 2OnM의 고정된 농도로 HeLa 세포에 형질감염시키고, HPRT 발현 수준은 24시간 후에 측정하였다. 형질감염은 2회 수행하고 각각의 복제물을 qPCR로 HPRT 발현에 대해 3회 분석하였다. 오류 막대는 표준 오류이다. 듀플렉스 1은 HPRT를 표적화하고 문헌[참조: Rose et al. NAR 2005]에 기재된 바와 같이 RNA/평활 2-DNA 치환체를 오버행하는 25/27량체 형태이다. 모든 다른 듀플렉스는 HPRT 표적 영역에 상보적이지 않은 염기의 삽입으로 듀플렉스 1 보다 길었다. 삽입된 서열의 길이는 2개 염기(듀플렉스 2) 내지 8개 염기(듀플렉스 6, 7 및 8) 범위이다. 도 2B는 데이타가 도 2A에 제공되는 제제에 대한 듀플렉스 번호, 서열 및 화학적 변형 패턴을 보여준다 . 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA, 볼드체 소문자 = 포스포로티오에이트-변형된 DNA(PS-DNA). 각각의 듀플렉스 및 전체 형태에 대한 일반적인 기재는 우측에 나타낸다.
도 3A 및 3B는 DNA 연장된 DsiRNA 제제가 낮은 농도에서 상응하는 RNA 연장된 DsiRNA 제제 보다 효과적임을 보여준다. 최적화된 27/29량체 DsiRNA 듀플렉스 표적화 HPRT를 용량-반응 시리즈로 10.0 나노몰 (nM), 1.0 나노몰 (nM) 및 100 피코몰 (100 pM 또는 0.1 nM)에서 변형된 듀플렉스와 비교하고 HPRT mRNA 수준의 녹다운 효능을 HeLa 세포에서 평가하였다. 나타낸 듀플렉스 농도는 실시예에 기재된 바와 같은 형질감염 혼합물 및 배양 배지에서 올리고뉴클레오타이드의 최종 농도를 나타낸다. 듀플렉스 실체는 막대(1, 2, 3) 아래에 나타내고 "C" 막대는 비처리된 세포에서 기본 HPRT 발현을 나타낸다. 도 3B는 도 3A에 나타낸 듀플렉스들의 서열 및 화학적 변형 패턴을 보여준다. 대문자 = 변형되지 않은 RNA, 볼드체, 밀줄친 부분 = 2'-O-메틸 RNA, 및 소문자 = DNA. DsiRNA 1은 이전에 보고된 활성 25/27량체 DsiRNA 듀플렉스 (HPRT-I, Rose et al. NAR 2005, Collingwood et al. 2008, 또한 상기 도 2A 참조)의 유도체이지만, 각각의 가닥에 2개 염기의 삽입체를 함유하였고 상기 삽입체는 올리고뉴클레오타이드 듀플렉스를 27/29량체로 연장시켰다(중 블랙 막대는 삽입된 염기쌍을 나타낸다). 듀플렉스 2는 듀플렉스 1과 서열에서 동일하였지만 패신저 가닥(센스 서열) 및 가이드 가닥(안티센스 서열) 둘다의 2개의 추가의 뉴클레오사이드를 포함하는 2개의 염기쌍 삽입(중 블랙 막대)은 DNA로서 합성되었다. 따라서, 듀플렉스 2는 패신서(센스) 가닥의 3' 말단에서 이전에 보고된 2개의 염기 DNA 치환(Rose et al, 2005)과는 대조적으로 가이드 가닥의 5' 말단에 4 DNA bp(염기쌍)로 종결되어 있다. 듀플렉스 3 (미스매치 (MM) 대조군)은 최적화된 HPRT-1 듀플렉스로부터 유래하였지만 화살표로 나타낸 미스매치와 함께 합성되었다. 각각의 가닥의 염기 조성 및 화학적 변형 및 듀플렉스 3의 말단에서 염기서열 및 오버행 또는 평활 구조는 비표적화된 화학적 효과를 조절하기 위해 최적화된 HPRT-1 듀플렉스와 상대적으로 일정하게 유지되었다(하기 도 5 참조).
도 4A-4D는 2개 내지 8개 염기쌍의 데옥시리보뉴클레오사이드로 연장된 변형된 DsiRNA 듀플렉스가 상응하는 리보뉴클레오사이드-연장된 DsiRNA 제제 보다 HPRT 표적 mRNA 수준을 감소시키는데 보다 효과적임을 보여준다. 도 4A는 1nM 변형된 DsiRNA 제제로 처리된 세포에 대한 HPRT 표적 유전자 mRNA 수준을 보여준다. 도 4B는 100pM 변형된 DsiRNA 제제로 처리된 세포에 대한 HPRT 표적 유전자 mRNA 수준을 보여준다. 도 4C는 10pM 변형된 DsiRNA 제제로 처리된 세포에 대한 HPRT 표적 유전자 mRNA 수준을 보여준다. 도 4D는 도 4A-4C에 도시된 듀플렉스의 서열 및 화학적 변형 패턴을 보여준다. 삽입된 서열 (듀플렉스 아래 중 막대)은 HPRT mRNA 표적 영역과 일치하지 않았다. 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA. U = 비처리된 세포.
도 5A는 10OpM의 고정된 농도로 투여되는 증가하는 길이의 일련의 변형된 듀플렉스에 대한 HPRT 표적 mRNA 억제 결과를 보여준다.
도 5B는 데이타가 도 5A에 제공된 제제에 대한 듀플렉스 번호, 서열 및 화학적 변형 패턴을 보여준다. 듀플렉스 1은 화학적 변형, 가이드(안티센스) 가닥의 3' 말단에서 2-염기 오버행 및 패신저(센스) 가닥의 3' 말단에서 2개의 DNA 치환체 및 평활 말단을 함유하는 최적화된 25/27량체 DsiRNA이다(문헌참조: Collingwood et al. 2008). HPRT mRNA에 상보적이지 않은 염기는 RNA(듀플렉스 2 내지 5) 또는 DNA(듀플렉스 6 내지 9)로서 한번에 2개의 염기로 삽입되어 총 듀플렉스 형태를 27/29량체에서 33/35량체로 증가시킨다. 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA. U = 비처리된 세포. 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA.
도 6은 dsRNA 듀플렉스 서열내 미스매치 잔기(G:U)를 함유하는 "25/27량체 DsiRNA" 제제 (상부) 및 예시적인 "좌측 연장된" DsiRNA 제제 (하부)의 구조 및 예측된 다이서-변형된 프로세싱을 보여준다. 대문자 = RNA 잔기; 소문자 = DNA 잔기.
도 7은 일련의 DNA 연장된 듀플렉스의 구조를 보여주고 도시된 듀플렉스는 5개 염기쌍 DNA 서열과 함께 교호적으로 우측 또는 좌측 연장된다. 미스매치는 지적된 바와 같이 연장된 DsiRNA 제제의 2개 형태내에 도입되고 상기 미스매치의 넘버링은 다이서 절단 후 제2 가닥의 예측된 5' 말단 RNA 잔기인 제2 가닥의 1번 위치로부터 3' 방향으로 진행한다.
도 8은 도 7에 나타낸 우측 및 좌측 연장된 제제의 억제 활성에 대한 초기 라운드의 시험 결과를 도시한다. 우측 대 좌측 연장된 모 분자, 14번 위치에서 미스매치를 함유하는 우측 대 좌측 연장된 제제, 16번 위치에서 미스매치를 갖는 우측 대 좌측 연장된 제제 및 14번 및 18번 둘다의 위치에서 미스매치를 함유하는 우측 대 좌측 연장된 제제간의 비교에 있어서, 좌측 연장된 제제가 놀랍게도 상응하는 우측 연장된 제제 보다 유전자를 사일런싱하는데 보다 효과적인 것으로 관찰되었다. (각각의 지적된 듀플렉스 100 pM은 모든 상기 실험을 위해 HeLa 세포에 형질감염시키고 나머지 KRAS 표적 mRNA 잔류 %는 24시간째에 평가하였다)
도 9는 도 7에 나타낸 제제로 수행된 제2 라운드의 실험 결과를 도시하고 좌측 연장된 제제가, 좌측 연장된 제제를 선호하는 상기 개념을 보여주는 것으로 초기에 관찰된 4개의 경우중 3개에서 우측 연장된 제제 보다 재생적으로 보다 효과적인 표적 mRNA 사일런싱 제제임을 보여준다. 비-연장된 25/27량체 DsiRNA에 대한 억제 결과를 또한 나타낸다("Opt" 25/27량체).
도 10은 HPRT 표적 mRNA를 사일런싱하도록 디자인된 일련의 DsiRNA 제제의 구조 및 세포 배양에서 상기 제제의 억제 효능을 보여준다. 대문자는 리보뉴클레오타이드를 포함하고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 볼드체 소문자는 포스포로티오에이트(PS-NA)를 나타내고 볼드체 및 밑줄친 대문자는 2'-O-메틸 변형된 뉴클레오타이드를 나타내고; 제제 DP 1065P/DP 1067G의 볼드체 대문자는 DsiRNA 제제의 안티센스 가닥의 "씨드" 영역 서열 내 미스매치된 뉴클레오타이드(센스 가닥에 대해)의 부위를 나타낸다.
도 11은 포스포로티오에이트 변형된 "우측 연장된" DsiRNA가 표적 HPRT1 유전자 억제 효능을 보유함을 보여주고 또한 패신저 가닥 연장된 잔기가 표적 유전자 억제 활성을 보유하면서 가이드 가닥 연장된 잔기 보다 우수한 포스포로티오에이트 변형을 견딜 수 있음을 보여준다. 시험관내 다이서 절단 분석물(좌측 레인 = 비처리된; 우측 레인 = 다이서 효소 처리된)은 또한 모든 연장된 DsiRNA에 대해 나타낸다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다.
도 12는 KRAS 전사체내에서 "KRAS-200" 부위를 표적화화하는 대조군 및 본 발명의 "우측-연장된" DsiRNA의 구조를 도시한다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타낸다.
도 13은 시험관내 도 12의 DsiRNA 구조에 대해 관찰된 KRAS 억제 효능을 보여준다.
도 14는 KRAS 전사체내에서 "KRAS-909" 부위를 표적화하는 대조군 및 본 발명의 "우측 연장된" DsiRNA의 구조를 도시한다. 대문자는 리보뉴클레오타이드를 나타내고 소문자는 데옥시리보뉴클레오타이드를 나타낸다.
도 15는 시험관내 도 14의 DsiRNA 구조에 대해 관찰된 KRAS 억제 효능을 보여준다.
도 16은 KRAS 전사체내 "KRAS-249" 부위를 표적화하는, 대조군 및 상기 DsiRNA의 변형 패턴을 포함하는 본 발명의 "우측 연장된" DsiRNA의 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다. 밑줄친 대문자는 2'-O-메틸-변형된 리보뉴클레오타이드를 나타낸다.
도 17은 KRAS 전사체내에서 "KRAS-516" 부위를 표적화하는, 대조군 및 DsiRNA의 변형 패턴을 포함하는 "우측 연장된" DsiRNA의 구조를 도시한다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 소문자는 데옥시리보뉴클레오타이드를 나타내며 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다. 밑줄친 대문자는 2'-O-메틸-변형된 리보뉴클레오타이드를 나타낸다..
도 18은 KRAS 전사체내 "KRAS-909" 부위를 표적화하는, 대조군 및 DsiRNA의 변형 패턴을 포함하는 본 발명의 "우측 연장된" DsiRNA의 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다. 밑줄친 대문자는 2'-O-메틸-변형된 리보뉴클레오타이드를 나타낸다.
도 19는 도 16 내지 18의 "우측 연장된" DsiRNA에 대해 수득된 시험관내 KRAS 억제 효능 결과를 보여준다. 결과는 0.1 nM 농도에서 나타낸 DsiRNA와 접촉시키고 24시간 후 RNAiMAX™ 처리에서 분석한 HeLa 세포에서 수득하였다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다.
도 20은 미스매치 잔기 내성에 대해 평가된 25/27량체 "KRAS-249" 부위 표적화 DsiRNA의 구조를 도시한다. 폐쇄 화살표는 돌출된 다이서 효소 절단 부위를 나타내고 개방 화살표는 보여지는 패신저 가닥 DsiRNA 서열에 상응하는 표적 가닥 서열내에서 돌출된 Ago2 절단 부위를 나타낸다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타낸다. 볼드체 대문자는 DsiRNA 디자인 동안에 가이드와 패신저 가닥 사이에 개별 잔기들을 "플리핑"함에 의해 수득된 이러한 표적-미스매치된 잔기를 갖는 가이드 가닥의 표적 미스매치된 잔기(및 적용될 수 있는 경우 패신저 가닥의 상보적인 잔기)의 부위를 나타낸다. DP1301P/DP1302G 듀플렉스내에 수평 괄호는 상기 듀플렉스의 "씨드 영역"을 나타내고, 여기서 모든 다른 DsiRNA 구조의 씨드 영역은 동일한 수직 정렬된 위치에서 존재한다.
도 21은 도 20의 DsiRNA에 대해 수득된 시험관내 KRAS 억제 효능 결과를 보여준다. 결과는 0.1nM 농도에서 나타낸 DsiRNA와 접촉시키고 24시간 후 RNAiMAX™ 처리에서 분석된 HeLa 세포에서 수득되었다.
도 22는 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 간 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 23은 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 신장 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 24는 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 비장 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 25는 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 림프절 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 26은 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 간 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 27은 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 폐 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 28은 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 비장 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 29는 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 신장 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 30은 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 31은 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 32는 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 33은 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 34는 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 35는 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하고, 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 2가지 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 36은 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 37은 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 38은 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 39는 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 40은 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 중간 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 41은 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하고, 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 42A-42C는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고, 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방된 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 상부 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 충전된 삼각형은 다이서 절단의 돌출된 부위를 나타내고 또한 뉴클레오타이드 부위 넘버링을 또한 나타낸다.
도 43A-43C는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고, 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방된 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 상부 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 충전된 삼각형은 다이서 절단의 돌출된 부위를 나타내고 또한 뉴클레오타이드 부위 넘버링을 또한 나타낸다.
도 2A는 안티센스 가닥의 다이서 절단 부위의 센스 가닥/5'의 다이서 절단 부위의 3'에 위치한 이중나선 영역에서 염기쌍이 형성된 데옥시리보뉴클레오타이드를 갖는 DsiRNA("우측-연장된 DsiRNA 제제")의 강한 효능을 보여주는 히스토그램 데이타를 제공한다. DsiRNA 듀플렉스를 2OnM의 고정된 농도로 HeLa 세포에 형질감염시키고, HPRT 발현 수준은 24시간 후에 측정하였다. 형질감염은 2회 수행하고 각각의 복제물을 qPCR로 HPRT 발현에 대해 3회 분석하였다. 오류 막대는 표준 오류이다. 듀플렉스 1은 HPRT를 표적화하고 문헌[참조: Rose et al. NAR 2005]에 기재된 바와 같이 RNA/평활 2-DNA 치환체를 오버행하는 25/27량체 형태이다. 모든 다른 듀플렉스는 HPRT 표적 영역에 상보적이지 않은 염기의 삽입으로 듀플렉스 1 보다 길었다. 삽입된 서열의 길이는 2개 염기(듀플렉스 2) 내지 8개 염기(듀플렉스 6, 7 및 8) 범위이다. 도 2B는 데이타가 도 2A에 제공되는 제제에 대한 듀플렉스 번호, 서열 및 화학적 변형 패턴을 보여준다 . 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA, 볼드체 소문자 = 포스포로티오에이트-변형된 DNA(PS-DNA). 각각의 듀플렉스 및 전체 형태에 대한 일반적인 기재는 우측에 나타낸다.
도 3A 및 3B는 DNA 연장된 DsiRNA 제제가 낮은 농도에서 상응하는 RNA 연장된 DsiRNA 제제 보다 효과적임을 보여준다. 최적화된 27/29량체 DsiRNA 듀플렉스 표적화 HPRT를 용량-반응 시리즈로 10.0 나노몰 (nM), 1.0 나노몰 (nM) 및 100 피코몰 (100 pM 또는 0.1 nM)에서 변형된 듀플렉스와 비교하고 HPRT mRNA 수준의 녹다운 효능을 HeLa 세포에서 평가하였다. 나타낸 듀플렉스 농도는 실시예에 기재된 바와 같은 형질감염 혼합물 및 배양 배지에서 올리고뉴클레오타이드의 최종 농도를 나타낸다. 듀플렉스 실체는 막대(1, 2, 3) 아래에 나타내고 "C" 막대는 비처리된 세포에서 기본 HPRT 발현을 나타낸다. 도 3B는 도 3A에 나타낸 듀플렉스들의 서열 및 화학적 변형 패턴을 보여준다. 대문자 = 변형되지 않은 RNA, 볼드체, 밀줄친 부분 = 2'-O-메틸 RNA, 및 소문자 = DNA. DsiRNA 1은 이전에 보고된 활성 25/27량체 DsiRNA 듀플렉스 (HPRT-I, Rose et al. NAR 2005, Collingwood et al. 2008, 또한 상기 도 2A 참조)의 유도체이지만, 각각의 가닥에 2개 염기의 삽입체를 함유하였고 상기 삽입체는 올리고뉴클레오타이드 듀플렉스를 27/29량체로 연장시켰다(중 블랙 막대는 삽입된 염기쌍을 나타낸다). 듀플렉스 2는 듀플렉스 1과 서열에서 동일하였지만 패신저 가닥(센스 서열) 및 가이드 가닥(안티센스 서열) 둘다의 2개의 추가의 뉴클레오사이드를 포함하는 2개의 염기쌍 삽입(중 블랙 막대)은 DNA로서 합성되었다. 따라서, 듀플렉스 2는 패신서(센스) 가닥의 3' 말단에서 이전에 보고된 2개의 염기 DNA 치환(Rose et al, 2005)과는 대조적으로 가이드 가닥의 5' 말단에 4 DNA bp(염기쌍)로 종결되어 있다. 듀플렉스 3 (미스매치 (MM) 대조군)은 최적화된 HPRT-1 듀플렉스로부터 유래하였지만 화살표로 나타낸 미스매치와 함께 합성되었다. 각각의 가닥의 염기 조성 및 화학적 변형 및 듀플렉스 3의 말단에서 염기서열 및 오버행 또는 평활 구조는 비표적화된 화학적 효과를 조절하기 위해 최적화된 HPRT-1 듀플렉스와 상대적으로 일정하게 유지되었다(하기 도 5 참조).
도 4A-4D는 2개 내지 8개 염기쌍의 데옥시리보뉴클레오사이드로 연장된 변형된 DsiRNA 듀플렉스가 상응하는 리보뉴클레오사이드-연장된 DsiRNA 제제 보다 HPRT 표적 mRNA 수준을 감소시키는데 보다 효과적임을 보여준다. 도 4A는 1nM 변형된 DsiRNA 제제로 처리된 세포에 대한 HPRT 표적 유전자 mRNA 수준을 보여준다. 도 4B는 100pM 변형된 DsiRNA 제제로 처리된 세포에 대한 HPRT 표적 유전자 mRNA 수준을 보여준다. 도 4C는 10pM 변형된 DsiRNA 제제로 처리된 세포에 대한 HPRT 표적 유전자 mRNA 수준을 보여준다. 도 4D는 도 4A-4C에 도시된 듀플렉스의 서열 및 화학적 변형 패턴을 보여준다. 삽입된 서열 (듀플렉스 아래 중 막대)은 HPRT mRNA 표적 영역과 일치하지 않았다. 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA. U = 비처리된 세포.
도 5A는 10OpM의 고정된 농도로 투여되는 증가하는 길이의 일련의 변형된 듀플렉스에 대한 HPRT 표적 mRNA 억제 결과를 보여준다.
도 5B는 데이타가 도 5A에 제공된 제제에 대한 듀플렉스 번호, 서열 및 화학적 변형 패턴을 보여준다. 듀플렉스 1은 화학적 변형, 가이드(안티센스) 가닥의 3' 말단에서 2-염기 오버행 및 패신저(센스) 가닥의 3' 말단에서 2개의 DNA 치환체 및 평활 말단을 함유하는 최적화된 25/27량체 DsiRNA이다(문헌참조: Collingwood et al. 2008). HPRT mRNA에 상보적이지 않은 염기는 RNA(듀플렉스 2 내지 5) 또는 DNA(듀플렉스 6 내지 9)로서 한번에 2개의 염기로 삽입되어 총 듀플렉스 형태를 27/29량체에서 33/35량체로 증가시킨다. 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA. U = 비처리된 세포. 대문자 = 변형되지 않은 RNA, 볼드체, 밑줄친 부분 = 2'-O-메틸 RNA, 소문자 = DNA.
도 6은 dsRNA 듀플렉스 서열내 미스매치 잔기(G:U)를 함유하는 "25/27량체 DsiRNA" 제제 (상부) 및 예시적인 "좌측 연장된" DsiRNA 제제 (하부)의 구조 및 예측된 다이서-변형된 프로세싱을 보여준다. 대문자 = RNA 잔기; 소문자 = DNA 잔기.
도 7은 일련의 DNA 연장된 듀플렉스의 구조를 보여주고 도시된 듀플렉스는 5개 염기쌍 DNA 서열과 함께 교호적으로 우측 또는 좌측 연장된다. 미스매치는 지적된 바와 같이 연장된 DsiRNA 제제의 2개 형태내에 도입되고 상기 미스매치의 넘버링은 다이서 절단 후 제2 가닥의 예측된 5' 말단 RNA 잔기인 제2 가닥의 1번 위치로부터 3' 방향으로 진행한다.
도 8은 도 7에 나타낸 우측 및 좌측 연장된 제제의 억제 활성에 대한 초기 라운드의 시험 결과를 도시한다. 우측 대 좌측 연장된 모 분자, 14번 위치에서 미스매치를 함유하는 우측 대 좌측 연장된 제제, 16번 위치에서 미스매치를 갖는 우측 대 좌측 연장된 제제 및 14번 및 18번 둘다의 위치에서 미스매치를 함유하는 우측 대 좌측 연장된 제제간의 비교에 있어서, 좌측 연장된 제제가 놀랍게도 상응하는 우측 연장된 제제 보다 유전자를 사일런싱하는데 보다 효과적인 것으로 관찰되었다. (각각의 지적된 듀플렉스 100 pM은 모든 상기 실험을 위해 HeLa 세포에 형질감염시키고 나머지 KRAS 표적 mRNA 잔류 %는 24시간째에 평가하였다)
도 9는 도 7에 나타낸 제제로 수행된 제2 라운드의 실험 결과를 도시하고 좌측 연장된 제제가, 좌측 연장된 제제를 선호하는 상기 개념을 보여주는 것으로 초기에 관찰된 4개의 경우중 3개에서 우측 연장된 제제 보다 재생적으로 보다 효과적인 표적 mRNA 사일런싱 제제임을 보여준다. 비-연장된 25/27량체 DsiRNA에 대한 억제 결과를 또한 나타낸다("Opt" 25/27량체).
도 10은 HPRT 표적 mRNA를 사일런싱하도록 디자인된 일련의 DsiRNA 제제의 구조 및 세포 배양에서 상기 제제의 억제 효능을 보여준다. 대문자는 리보뉴클레오타이드를 포함하고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 볼드체 소문자는 포스포로티오에이트(PS-NA)를 나타내고 볼드체 및 밑줄친 대문자는 2'-O-메틸 변형된 뉴클레오타이드를 나타내고; 제제 DP 1065P/DP 1067G의 볼드체 대문자는 DsiRNA 제제의 안티센스 가닥의 "씨드" 영역 서열 내 미스매치된 뉴클레오타이드(센스 가닥에 대해)의 부위를 나타낸다.
도 11은 포스포로티오에이트 변형된 "우측 연장된" DsiRNA가 표적 HPRT1 유전자 억제 효능을 보유함을 보여주고 또한 패신저 가닥 연장된 잔기가 표적 유전자 억제 활성을 보유하면서 가이드 가닥 연장된 잔기 보다 우수한 포스포로티오에이트 변형을 견딜 수 있음을 보여준다. 시험관내 다이서 절단 분석물(좌측 레인 = 비처리된; 우측 레인 = 다이서 효소 처리된)은 또한 모든 연장된 DsiRNA에 대해 나타낸다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다.
도 12는 KRAS 전사체내에서 "KRAS-200" 부위를 표적화화하는 대조군 및 본 발명의 "우측-연장된" DsiRNA의 구조를 도시한다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타낸다.
도 13은 시험관내 도 12의 DsiRNA 구조에 대해 관찰된 KRAS 억제 효능을 보여준다.
도 14는 KRAS 전사체내에서 "KRAS-909" 부위를 표적화하는 대조군 및 본 발명의 "우측 연장된" DsiRNA의 구조를 도시한다. 대문자는 리보뉴클레오타이드를 나타내고 소문자는 데옥시리보뉴클레오타이드를 나타낸다.
도 15는 시험관내 도 14의 DsiRNA 구조에 대해 관찰된 KRAS 억제 효능을 보여준다.
도 16은 KRAS 전사체내 "KRAS-249" 부위를 표적화하는, 대조군 및 상기 DsiRNA의 변형 패턴을 포함하는 본 발명의 "우측 연장된" DsiRNA의 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다. 밑줄친 대문자는 2'-O-메틸-변형된 리보뉴클레오타이드를 나타낸다.
도 17은 KRAS 전사체내에서 "KRAS-516" 부위를 표적화하는, 대조군 및 DsiRNA의 변형 패턴을 포함하는 "우측 연장된" DsiRNA의 구조를 도시한다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 소문자는 데옥시리보뉴클레오타이드를 나타내며 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다. 밑줄친 대문자는 2'-O-메틸-변형된 리보뉴클레오타이드를 나타낸다..
도 18은 KRAS 전사체내 "KRAS-909" 부위를 표적화하는, 대조군 및 DsiRNA의 변형 패턴을 포함하는 본 발명의 "우측 연장된" DsiRNA의 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다. 밑줄친 대문자는 2'-O-메틸-변형된 리보뉴클레오타이드를 나타낸다.
도 19는 도 16 내지 18의 "우측 연장된" DsiRNA에 대해 수득된 시험관내 KRAS 억제 효능 결과를 보여준다. 결과는 0.1 nM 농도에서 나타낸 DsiRNA와 접촉시키고 24시간 후 RNAiMAX™ 처리에서 분석한 HeLa 세포에서 수득하였다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내며, 볼드체 소문자는 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 나타낸다.
도 20은 미스매치 잔기 내성에 대해 평가된 25/27량체 "KRAS-249" 부위 표적화 DsiRNA의 구조를 도시한다. 폐쇄 화살표는 돌출된 다이서 효소 절단 부위를 나타내고 개방 화살표는 보여지는 패신저 가닥 DsiRNA 서열에 상응하는 표적 가닥 서열내에서 돌출된 Ago2 절단 부위를 나타낸다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타낸다. 볼드체 대문자는 DsiRNA 디자인 동안에 가이드와 패신저 가닥 사이에 개별 잔기들을 "플리핑"함에 의해 수득된 이러한 표적-미스매치된 잔기를 갖는 가이드 가닥의 표적 미스매치된 잔기(및 적용될 수 있는 경우 패신저 가닥의 상보적인 잔기)의 부위를 나타낸다. DP1301P/DP1302G 듀플렉스내에 수평 괄호는 상기 듀플렉스의 "씨드 영역"을 나타내고, 여기서 모든 다른 DsiRNA 구조의 씨드 영역은 동일한 수직 정렬된 위치에서 존재한다.
도 21은 도 20의 DsiRNA에 대해 수득된 시험관내 KRAS 억제 효능 결과를 보여준다. 결과는 0.1nM 농도에서 나타낸 DsiRNA와 접촉시키고 24시간 후 RNAiMAX™ 처리에서 분석된 HeLa 세포에서 수득되었다.
도 22는 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 간 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 23은 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 신장 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 24는 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 비장 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 25는 변형되지 않은 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("K249"), 상기 25/27량체의 2'-O-메틸 변형된 형태("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249DNA", 도 16에서 "K249D"로서 나타냄; "5% Glu" = 5% 글루코스 대조군)에 대한 림프절 조직에서 단일 용량(10mg/kg)의 생체내 KRAS 억제 효능 결과를 보여준다.
도 26은 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 간 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 27은 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 폐 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 28은 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 비장 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 29는 2'-O-메틸 변형된 형태의 25/27량체 "KRAS-249" 부위 표적화 DsiRNA("KRAS-249M") 및 DNA-연장된 형태의 상기 변형된 DsiRNA("K249D", 도 16에서 나타냄)에 대한 신장 조직에서 다중 용량(2 mg/kg, 총 4회 투여됨, 각각의 투여는 3일 간격으로 수행됨) 생체내 KRAS 억제 효능 결과를 보여준다.
도 30은 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 31은 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 32는 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 33은 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고; [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 34는 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 35는 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하고, 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 2가지 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 36은 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 37은 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 38은 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 뉴클레오타이드 위치 넘버링을 또한 나타낸다.
도 39는 제1 가닥의 3' 말단과 제2 가닥의 5' 말단 사이에 평활 말단을 형성하고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 40은 제2 가닥의 5' 말단과 상대적으로 제1 가닥의 3' 말단 오버행을 갖고 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 중간 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 41은 제1 가닥의 3' 말단 및 상응하는 제2 가닥의 5' 말단에서 프레이(fray)를 형성하고, 또한 다이서 절단 후 간섭 제제 내 보유되도록 돌출된 안티센스 가닥 서열내 미스매치된 잔기를 갖는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고; 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 제1 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 채워진 삼각형은 다이서 절단의 돌출된 부위를 나타내고 [#]는 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함하는 길이가 4 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다. (또 다른 양태에서, [#]는 4개 이상의 데옥시리보뉴클레오타이드를 포함하지만 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 가질 필요가 없는 길이가 4개 내지 16개 이상인 염기쌍의 듀플렉스 영역을 나타낸다). 각각의 가닥의 뉴클레오타이드 위치 넘버링 뿐만 아니라 안티센스 가닥의 씨드 및 미스매치 영역을 또한 나타낸다. 하부 제제의 밑줄친 안티센스 잔기는 DsiRNA 제제의 센스 가닥과 염기쌍을 형성하지만 여전히 표적 RNA와 미스매치를 형성하기 위해 돌출된 뉴클레오타이드를 나타낸다.
도 42A-42C는 "우측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고, 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방된 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 상부 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 충전된 삼각형은 다이서 절단의 돌출된 부위를 나타내고 또한 뉴클레오타이드 부위 넘버링을 또한 나타낸다.
도 43A-43C는 "좌측 연장된" DsiRNA 제제의 예시적인 구조를 보여준다. 대문자는 리보뉴클레오타이드를 나타내고, 소문자는 데옥시리보뉴클레오타이드를 나타내고; 개방된 삼각형은 표적 RNA내 Ago2 절단 부위에 상응하는 상부 가닥(여기서는 센스 가닥)의 서열내 부위를 나타내고; 충전된 삼각형은 다이서 절단의 돌출된 부위를 나타내고 또한 뉴클레오타이드 부위 넘버링을 또한 나타낸다.
본 발명은 세포내 표적 유전자의 발현을 감소시키는 유효량으로 분리된 이중 가닥 핵산(dsNA)와 세포를 접촉시킴을 포함하는, 세포내 표적 유전자의 발현을 감소시키기 위한 조성물 및 방법을 제공한다. 본 발명의 dsNA는 dsNA 분자내 다이서 효소 절단 부위를 지시하도록 디자인된 데옥시리보뉴클레오타이드의 패턴(대부분의 양태에서, 상기 패턴은 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함한다)을 갖는다. 본 발명의 dsNA 분자의 데옥시리보뉴클레오타이드 패턴은 다이서 절단을 통해 절단되어 더이상 데옥시리보뉴클레오타이드 패턴(예를 들어, 대부분의 양태에서 데옥시리보뉴클레오타이드 패턴은 하나 이상의 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 포함한다)을 함유하지 않는 활성 siRNA 제제를 생성하는 dsNA의 영역내에 위치한다. 놀랍게도, 본원에서 입증된 바와 같이, DNA:DNA-연장된 다이서-기질 siRNAs (DsiRNA)는 상응하는 RNA:DNA- 또는 RNA:RNA-연장된 DsiRNA 보다 효과적인 RNA 억제제이다.
놀랍게도 dsRNA DsiRNA 제제의 제1 가닥의 5' 말단 및 상응하는 제2 가닥의 3' 말단에 위치한 DNA:DNA 연장부를 포함하는 DsiRNA(여기서, 제2 가닥은 RNAi 제제(표적 RNA에 대한 안티센스)의 효과적인 가이드 가닥 서열로서 작용하기에 충분한 영역의 표적 RNA 서열에 상보적이다)가 효과적이고 많은 경우 증진된 억제제임을 발견하였다.
DNA 연장된 DsiRNA 제제가 듀플렉스 길이가 증가함에 따라 효능이 감소하지 않는다는 놀라운 발견으로, 이중가닥 DNA 연장된 도메인을 함유하지 않는 상응하는 길이의 dsRNA 제제와 비교하여, 예를 들어, DsiRNA의 추가의 및/또는 구분된 기능성 그룹으로의 부착, 안정화된 변형체(예를 들어, PS-NA 잔기) 또는 추가의 기능성을 부가할 수 있고/있거나 예를 들어, 상기 제제의 약력학, 약동력학 또는 생분포 를 증진시킬 수 있는 또 다른 형태의 변형체의 내포/패턴화를 위해 보다 큰 공간을 제공하면서도 효과를 유지하는 DsiRNA의 생성이 가능하다.
유사한 길이의 dsRNA 듀플렉스 보다 큰 수준에서 다이서 가공처리 후 siRNA 제제의 활성을 유지하면서 DsiRNA 함유 dsNA 듀플렉스를 연장시키는 새롭게 밝혀진 능력에 의해 제공된 잇점은 본원에서 제공된 결과에 의해 분명하고 상기 결과는 이중가닥 DNA: 연장된 DsiRNA 제제의 DNA 영역의 모든 뉴클레오타이드의 완전한 포스포로티오에이트 (PS) 변형이 사일런싱 활성을 완전히 제거시킴을 보여준다 (도 2A 및 2B의 듀플렉스 #8 참조). RNA 사일런싱 활성에서 상응하는 감소를 나타내지 않고 DsiRNA 제제를 연장시키는 능력으로 또한 예를 들어, 여유공간이 가능하지 않은 (탠덤 시리즈-예를 들어, 탠덤 PS 또는 2'-O-메틸 변형에 존재하는 경우 특정 변형과 연관된 억제 효과 관점에서) 변형된 뉴클레오타이드로 성취될 수 있는 것 보다 여전히 RNA 사일런싱 활성을 보유하면서 단일 분자내 보다 변형된 뉴클레오타이드를 포함시킬 수 있다. 유사하게, RNA 억제 기능을 보유하면서 상기 DsiRNA 함유 제제에 보다 긴 듀플렉스 연장부를 함유하는 능력은 또한 촘촘한 형태로 존재하는 경우 RNA 사일런싱 활성을 간섭하는 기능성 그룹의 능력 때문에 달리 가능하지 않을 특정 기능성 그룹의 상기 제제로의 부착을 가능하게 할 수 있다.
정의
달리 정의되지 않는 경우, 본원에 사용된 모든 기술적 및 과학적 용어는 본 발명이 속하는 기술분야의 당업자가 통상적으로 이해하는 의미를 갖는다. 하기의 참조문헌은 본 발명에 사용된 많은 용어의 일반적인 정의를 당업자에게 제공한다: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991); and Hale & Marham, The Harper Collins Dictionary of Biology (1991). 본원에 사용된 바와 같이, 하기의 용어는 달리 특정되지 않는 경우 하기 이들에게 주어진 의미를 갖는다.
본원에 사용된 바와 같이, 용어 "핵산"은 데옥시리보뉴클레오타이드, 리보뉴클레오타이드 또는 변형된 뉴클레오타이드 및 단일 가닥 또는 이중 가닥 형태의 이의 중합체를 언급한다. 상기 용어는 공지된 뉴클레오타이드 유사체 또는 변형된 골격 잔기 또는 연결체를 함유하는 핵산을 포함하고, 이들은 합성되거나 천연적으로 존재하거나 비천연적으로 존재하는 것이고 표준 핵산과 유사한 결합 성질을 갖고 표준 뉴클레오타이드와 유사한 방식으로 대사된다. 상기 유사체의 예는 제한없이 포스포로티오에이트, 포스포르아미데이트, 메틸 포스포네이트, 키랄-메틸 포스포네이트, 2-O-메틸 리보뉴클레오타이드, 펩타이드-핵산 (PNA)을 포함한다.
본원에 사용된 바와 같이, "뉴클레오타이드"는 당업계에 인지되는 바와 같이 천연 염기(표준) 및 당업계에 널리 공지된 변형된 염기를 갖는 것들을 포함한다. 상기 염기는 일반적으로 뉴클레오타이드 당 잔기의 1' 위치에 존재한다. 뉴클레오타이드는 일반적으로 염기, 당 및 포스페이트 그룹을 포함한다. 상기 뉴클레오타이드는 변형되지 않거나 당, 포스페이트 및/또는 염기 잔기에서 변형될 수 있고 이는 또한 상호교환적으로 뉴클레오타이드 유사체, 변형된 뉴클레오타이드, 비-천연 뉴클레오타이드, 비-표준 뉴클레오타이드 등으로 언급된다[문헌참조: 예를 들어, Usman and McSwiggen, supra; Eckstein, et al., International PCT Publication No. WO 92/07065; Usman et al, International PCT Publication No. WO 93/15187; Uhlman & Peyman, supra, 이 모두는 본원에 참조로서 인용된다]. 당업계에 공지된 변형된 핵산 염기의 여러 예가 있고 이는 문헌[참조: Limbach, et al, Nucleic Acids Res. 22:2183, 1994]에 요약되어 있다. 핵산 분자로 도입될 수 있는 염기 변형체에 대한 비제한적인 예의 일부는 하이포크산틴, 퓨린, 피리딘-4-온, 피리딘-2-온, 페닐, 슈도우라실, 2,4,6-트리메톡시 벤젠, 3-메틸 우라실, 디하이드로우리딘, 나프틸, 아미노페닐, 5-알킬시티딘(예를 들어, 5-메틸시티딘), 5-알킬우리딘 (예를 들어, 리보티미딘), 5-할로우리딘(예를 들어, 5-브로모우리딘) 또는 6-아자피리미딘 또는 6-알킬피리미딘(예를 들어, 6-메틸우리딘), 및 프로핀 등을 포함한다(문헌참조: Burgin, et al., Biochemistry 35:14090, 1996; Uhlman & Peyman, supra). 상기 측면에서 "변형된 염기"는 1' 위치 또는 이들의 등가 위치에서 아데닌, 구아닌, 시토신 및 우라실 이외의 뉴클레오타이드 염기를 의미한다.
본원에 사용된 바와 같이, "이중 가닥 핵산" 또는 "dsNA"는 듀플렉스를 형성하는 2개의 올리고뉴클레오타이드 가닥을 포함하는 분자이다. dsNA는 리보뉴클레오타이드, 데옥시리보뉴클레오타이드, 변형된 뉴클레오타이드 및 이의 조합체를 함유할 수 있다. 본 발명의 상기 이중 가닥 NA는 RNA 간섭 경로에서 단백질 및 단백질 복합체, 예를 들어, 다이서 및 RISC에 대한 기질이다. 본 발명의 dsNA의 한가지 형태의 예시적인 구조는 도 1A에 나타내고 상기 구조는 특징적으로 다이서 기질 siRNA(DSiRNA)로서 작용할 수 있는 영역에서 RNA 듀플렉스 및 DsiRNA/DNA 제제의 제1 가닥의 돌출된 다이서 절단 부위의 3' 위치에 존재하고 DsiRNA/DNA 제제의 제2 가닥의 돌출된 다이서 절단 부위의 5' 영역에 위치한 제2 가닥의 동족 데옥시리보뉴클레오타이드와 쌍을 형성한 염기인 하나 이상의 데옥시리보뉴클레오타이드를 포함하는 DNA 듀플렉스를 포함한다. 또 다른 양태에서, 본 발명은 특징적으로, 다이서 기질 siRNA(DSiRNA)로서 작용할 수 있는 영역에서 RNA 듀플렉스 및 DsiRNA/DNA 제제의 제1 가닥의 돌출된 다이서 절단 부위의 5' 위치에 존재하고 DsiRNA/DNA 제제의 제2 가닥의 돌출된 다이서 절단 부위의 3' 영역에 위치한 제2 가닥의 동족 데옥시리보뉴클레오타이드와 쌍을 형성한 염기인 하나 이상의 데옥시리보뉴클레오타이드를 포함하는 DNA 듀플렉스를 포함하는 구조를 제공한다(예를 들어, 도 6의 "좌측 연장된" DsiRNA 제제를 참조한다).
특정 양태에서, 본 발명의 DsiRNA는 돌출된 다이서 효소 절단 부위에 바로 인접한 부위에서 데옥시리보뉴클레오타이드 잔기를 가질 수 있다. 예를 들어, 도 12에 나타낸 제2, 제4 및 제6 DsiRNA에서 데옥시리보뉴클레오타이드는 22번 위치 및 22번(예를 들어, 23번, 24번, 25번 등) 위치의 3' 부위(1번 위치로서 제1 가닥의 5' 말단 잔기에서 개시하여)에서 발견될 수 있다. 상응하게, 데옥시리보뉴클레오타이드는 또한 제1 가닥의 20번 위치에 상보적인 뉴클레오타이드 및 또한 상기 뉴클레오타이드의 5' 방향에 위치하는 제2 가닥상의 위치에서 개시하는 제2 가닥상에서 발견될 수 있다. 따라서, 본 발명의 특정 효과적인 DsiRNA는 상기 DsiRNA의 제1 가닥, 제2 가닥 및/또는 2개 가닥내에서 데옥시리보뉴클레오타이드의 도입 개시 전에 단지 19개의 이중나선 리보뉴클레오타이드를 갖는다. 본 발명의 DsiRNA의 돌출된 다이서 효소 절단 부위에 바로 인접한 데옥시리보뉴클레오타이드 위치에 관한 이전의 진술은 명백히 본 발명의 "우측 연장된" DsiRNA를 고려하고, 병행하는 데옥시리보뉴클레오타이드의 위치화는 본 발명의 "좌측 연장된" DsiRNA내에서 수행할 수 있다(예를 들어, 데옥시리보뉴클레오타이드는 "좌측 연장된" DsiRNA내 돌출된 다이서 효소 절단 부위에 바로 인접하게, 예를 들어, 상기 "좌측 연장된" DsiRNA의 센스 가닥상의 최외곽 5' 돌출된 다이서 절단 부위의 센스 가닥상의 5' 바로 인접하게 및/또는 상기 "좌측 연장된" DsiRNA의 안티센스 가닥상의 최외곽 3' 돌출된 다이서 절단 부위의 안티센스 가닥상의 3'에 바로 인접하게 위치할 수 있다).
본원에 사용된 바와 같이, "듀플렉스"는 2개의 단일 가닥 핵산의 상호작용에 의해 형성된 이중 나선 구조를 언급한다. 본 발명에 따라, 듀플렉스는 센스 및 안티센스 또는 표적 및 안티센스인 제1 및 제2 가닥을 함유할 수 있다. 듀플렉스는 전형적으로 서로가 역평행으로 배향되는 2개의 단일 가닥 핵산 사이에 염기의 쌍형성 수소 결합, 즉 "염기 쌍형성"에 의해 형성된다. 듀플렉스에서 염기 쌍형성은 일반적으로 왓슨-크릭 염기쌍 형성에 의해 발생하고, 예를 들어, 구아닌(G)는 DNA 및 RNA에서 시토신(C)과 염기쌍을 형성하고(따라서 구아닌 데옥시리보뉴클레오타이드의 동족 뉴클레오타이드는 시토신 데옥시리보뉴클레오타이드이고 그 반대의 경우도 그러하다), 아데닌(A)는 DNA에서 티민(T)와 염기쌍을 형성하고 아데닌(A)는 RNA에서 우라실(U)과 염기쌍을 형성한다. 이들 염기쌍이 형성될 수 있는 조건은 생리학적 또는 생물학적 관련 조건(예를 들어, 세포내: pH 7.2, 140mM 칼륨 이온; 세포외 pH 7.4, 145mM 나트륨 이온)을 포함한다. 추가로, 듀플렉스는 인접한 뉴클레오타이드간에 스택킹 상호작용에 의해 안정화된다. 본원에 사용된 바와 같이, 듀플렉스는 염기쌍 형성 또는 스택킹 상호작용에 의해 확립되고 유지될 수 있다. 듀플렉스는 실질적으로 상보적이거나 완전히 상보적(하기 참조)일 수 있는 2개의 상보적인 핵산 가닥에 의해 형성된다.
"상보적인" 또는 "상보성"은 핵산이 통상적인 왓슨 크릭 또는 후그스틴 염기 쌍형성에 의해 또 다른 핵산 서열과 수소 결합을 형성할 수 있음을 의미한다. 본 발명의 핵산 분자와 관련하여, 핵산 분자와 이의 상보적인 서열의 결합 자유 에너지는 핵산의 관련 기능이 예를 들어, RNAi 활성을 나타내도록 하기에 충분하다. 핵산 분자의 결합 자유 에너지의 측정은 당업계에 널리 공지되어 있다(문헌참조: 예를 들어, Turner, et al., CSH Symp. Quant. Biol. LII, pp. 123-133, 1987; Frier, et al., Proc. Nat. Acad. Sci. USA 83:9373-9377, 1986; Turner, et al., J. Am. Chem. Soc. 109:3783-3785, 1987). % 상보성은 제2 핵산 서열과 수소 결합(예를 들어, 왓슨 크릭 염기 쌍형성)을 형성할 수 있는 핵산 분자내 연속 잔기의 %를 지적한다(예를 들어, 제1 올리고뉴클레오타이드에서 총 10개의 뉴클레오타이드중 5, 6, 7, 8, 9, 또는 10개 뉴클레오타이드가 10개 뉴클레오타이드를 갖는 핵산 서열과 염기쌍을 형성하는 경우 각각 50%, 60%, 70%, 80%, 90%, 및 100% 상보적임을 나타낸다). % 상보성이 특정 % 이상인지를 결정하기 위해, 제2 핵산 서열과 수소 결합(예를 들어, 왓슨 크릭 염기 쌍형성)을 형성할 수 있는 핵산 분자내 연속 잔기의 %는 최근접 정수로 대략적으로 계산된다(예를 들어, 제1 올리고뉴클레오타이드 중 총 23개의 뉴클레오타이드중 12, 13, 14, 15, 16, 또는 17개의 뉴클레오타이드가 23개의 뉴클레오타이드를 갖는 제2 핵산 서열과 염기쌍을 형성하는 경우 각각 52%, 57%, 61%, 65%, 70%, 74%임을 나타내고 각각 50% 이상, 50%, 60%, 60%, 70%, 및 70% 상보성이다). 본원에 사용된 바와 같이, "실질적으로 상보적인"은 생리학적 조건하에 이들이 하이브리드화할 수 있는 가닥간의 상보성을 언급한다. 실질적으로 상보적인 서열은 60%, 70%, 80%, 90%, 95%, 또는 심지어 100% 상보성을 갖는다. 추가로, 뉴클레오타이드 서열을 조사함에 의해 2개의 가닥이 생리학적 조건하에 하이브리드화할 수 있는지의 여부를 결정하기 위한 기술은 당업계에 널리 공지되어 있다. 본 발명의 제제의 제1 및 제2 가닥(안티센스 및 센스 올리고뉴클레오타이드)는 완전히 상보적일 필요는 없다. 하나의 양태에서, 안티센스 가닥의 RNA 서열은 염기 유사체와 함께 하나 이상의 미스매치 또는 변형된 뉴클레오타이드를 함유한다. 예시적인 양태에서, 상기 미스매치는 안티센스 가닥의 RNA 서열의 3' 영역내(예를 들어, 표적 RNA내 돌출된 Argonaute 2(Ago2) 절단 부위의 5'에 위치한 안티센스의 RNA 서열내 - 예를 들어, 상기 미스매치 함유 영역의 예시적인 위치를 도시하는 도 6을 참조한다)에 존재한다. 하나의 측면에서, 염기 유사체와 약 2개의 미스매치 또는 변형된 뉴클레오타이드는 표적 RNA 서열이 하이브리드화하는 경우 표적 RNA 서열의 돌출된 Ago2 절단 부위의 안티센스 가닥에서 3'에 위치한 안티센스 가닥의 RNA 서열내 혼입된다.
미스매치 또는 감소된 열역학적 안정성의 사용(특히 siRNA의 센스 가닥의 3' 말단 잔기/안티센스 영역의 5' 말단 잔기에서 또는 이의 근방에서)은 추측컨대 RISC로의 siRNA의 진입에 존재하는 몇몇 율속 해리 단계(rate-limiting unwinding step)에 영향을 줌에 의해 안티센스 가닥의 RISC로의 진입을 촉진시키거나 호전시키는 것으로 제안되었다(문헌참조: Schwarz et al, 2003; Khvorova et al., 2003). 따라서, 말단 염기 조성은 활성 21량체 siRNA 듀플렉스를 선택하기 위한 디자인 알고리듬에 포함된다(문헌참조: Ui-Tei et al, 2004; Reynolds et al, 2004).
특정 양태에서, 미스매치(또는 염기 유사체로 변형된 뉴클레오타이드)는 다이서 절단 후 형성되는 돌출된 siRNA의 센스 가닥의 예측된 3' 말단 또는 이의 근처에서 모 DsiRNA(임의로 우측 또는 좌측 연장된 DsiRNA 제제)내에 위치할 수 있다. 상기 양태에서, 미스매치를 함유하는 작은 말단 서열은 안티센스 가닥과 쌍을 형성하지 않은 채로 유지되거나(3' 오버행의 일부가 된다) 최종 21량체 siRNA로부터 완전히 절단될 수 있다. 상기 양태에서, 본래의(비-다이서 가공처리된) 제제내 미스매치는 RISC의 최종 RNA 성분에서 미스매치로서 존속하지 않는다. 다이서 기질의 센스 가닥의 3' 말단에서 염기 미스매치 또는 절편의 불안정화는 추측컨대 다이서에 의한 가공처리를 촉진시킴에 의해 RNAi에서 합성 듀플렉스의 효능을 개선시키는 것으로 밝혀졌다(문헌참조: Collingwood et al, 2008).
몇몇 양태에서, 하나 이상의 미스매치는 표적 mRNA내 예측된 Ago2 절단 부위의 5'에 위치하는 표적 mRNA의 영역과 하이브리드화하는 DsiRNA 제제의 안티센스 가닥의 영역내의 위치에서 본 발명의 DsiRNA 제제(임의로 우측 또는 좌측 연장된 DsiRNA 제제)내에 위치한다(예를 들어, 도 7의 제제내 미스매치의 위치를 참조한다). 임의로, 2개 이상의 미스매치는 표적 RNA의 돌출된 Ago2 절단 부위의 5'(표적 RNA 절단이 발생하는)에 위치한 표적 RNA의 서열과 하이브리드화하는 안티센스 가닥의 상기 상대적 3' 영역내 본 발명의 우측 또는 좌측 연장된 DsiRNA 제제내에 위치한다. 본 발명의 DsiRNA 제제내 상기 미스매치의 내포는 상기 제제가 천연 miRNA의 것들과 유사한 억제 효과를 발휘하도록 할 수 있고 임의로 천연의 miRNA 표적 RNA(예를 들어, 표적 전사체의 3' UTR 영역) 뿐만 아니라 천연 길항성 miRNA가 존재하는 것으로 공지되지 않은 RNA 서열에 대해 지시될 수 있다. 예를 들어, miRNA와 유사하고/하거나 기능하도록 디자인된 미스매치된 염기쌍을 갖는 본 발명의 DsiRNA는 천연 miRNA에 의해 표적화될 수 없는 유전자/전사체내에 반복 서열(예를 들어, 노치(Notch) 단백질내 반복 서열은 표적화될 수 있고, 이때 노치내 개별 반복체는 핵산 수준에서 서로 상이할 수 있거나(축퇴성이거나) 미스매치를 허용하지만 또한 상응하는 완벽한 매치의 siRNA 제제 보다 더 유효한 억제 효과를 허용하는 miRNA 기작을 통해 효과적으로 표적화될 수 있다)을 표적화하도록 합성될 수 있다. 상기 양태에서, 표적 RNA 절단은 미스매치 함유 DsiRNA가 억제 효과를 발휘하기 위해 필요하거나 필요하지 않을 수 있다.
하나의 양태에서, 본 발명의 이중 가닥 핵산 분자는 마이크로RNA(miRNA)을 포함하거나 이로서 작용할 수 있다. "마이크로RNA" 또는 "miRNA"는 mRNA 절단, 해독 억압/억제 또는 이종염색질 사일런싱에 의해 표적 전령 RNA의 발현을 조절하는 소형 이중 나선 RNA를 의미한다(문헌참조: 예를 들어 Ambros, 2004, Nature, 431, 350-355; Bartel, 2004, Cell, 116, 281-297; Cullen, 2004, Virus Research., 102, 3-9; He et al., 2004, Nat. Rev. Genet., 5, 522-531; and Ying et al., 2004, Gene, 342, 25-28). 하나의 양태에서, 본 발명의 마이크로RNA는 miRNA 분자의 센스 가닥(예를 들어, 제1 가닥) 또는 센스 영역과 안티센스 가닥(예를 들어, 제2 가닥) 또는 안티센스 영역사이에 또는 miRNA의 안티센스 가닥 또는 안티센스 영역과 상응하는 표적 핵산 분자(예를 들어, 표적 mRNA) 사이에 부분적 상보성(즉, 100% 미만의 상보성)을 갖는다. 예를 들어, 부분적 상보성은 miRNA의 센스 가닥 또는 센스 영역과 안티센스 가닥 또는 안티센스 영역 사이에 또는 miRNA의 안티센스 가닥 또는 안티센스 영역과 상응하는 표적 핵산 분자사이에 생성되는 벌즈(bulge), 루프 또는 오버행을 유도할 수 있는 이중 가닥 핵산 분자 구조내에 다양한 미스매치 또는 비 염기 쌍형성 뉴클레오타이드(예를 들어, 1, 2, 3, 4, 5개 이상의 미스매치 또는 비염기 쌍 형성 뉴클레오타이드, 예를 들어, 뉴클레오타이드 벌즈)를 포함할 수 있다.
다수의 염기상에서 염기쌍을 형성하는 단일 가닥 핵산은 "하이브리드화한다"라고 일컬어 진다. 하이브리드화는 전형적으로 생리학적 또는 생물학적 관련 조건(예를 들어, 세포내: pH 7.2, 140 mM 칼륨 이온; 세포외 pH 7.4, 145 mM 나트륨 이온)하에 결정된다. 하이브리드화 조건은 일반적으로 1가 양이온 및 생물학적으로 허용되는 완충액을 함유하고 2가 양이온, 복합 음이온, 예를 들어, 칼륨 글루코네이트 기원의 글루코네이트, 슈크로스와 같은 비하전된 종 및 샘플, 샘플내 물의 활성을 감소시키는 불활성 중합체, 예를 들어, PEG를 함유하거나 함유하지 않을 수 있다. 상기 조건은 염기쌍을 형성할 수 있는 조건을 포함한다.
하이브리드화는 듀플렉스를 형성하는 단일 가닥 핵산을 해리시키는데 요구되는 온도, 즉, (용융 온도: Tm)에 의해 측정한다. 하이브리드화 조건은 또한 염기쌍을 형성할 수 있는 조건이다. 엄중성의 다양한 조건을 사용하여 하이브리드화를 결정할 수 있다(문헌참조: 예를 들어, Wahl, G. M. and S. L. Berger (1987) Methods Enzymol. 152:399; Kimmel, A. R. (1987) Methods Enzymol. 152:507). 엄중 온도 조건은 통상적으로 약 30℃이상, 보다 바람직하게는 약 37℃ 이상 및 가장 바람직하게는 약 42℃ 이상의 온도를 포함한다. 길이가 50개 미만의 염기쌍인 것으로 예상되는 하이브리드에 대한 하이브리드화 온도는 하이브리드의 용융 온도(Tm) 보다 5 내지 10℃ 미만이어야만 하고 이때 Tm은 하기의 방정식에 따라 결정한다. 길이가 18개 미만인 염기쌍의 하이브리드에 대해, Tm(°C)=2( A+T 염기 #)+4(G+C 염기 #). 길이가 18개 내지 49개 염기쌍인 하이브리드화에 대해, Tm(°C)=81.5+16.6(로그 10[Na+])+0.41 (% G+C)-(600/N)(여기서, N은 하이브리드에서 염기의 수이고 [Na+]은 하이브리드화 완충액에서 나트륨 이온의 농도 (1 x SSC = 0.165 M에 대한 [Na+])이다. 예를 들어, 하이드리드화 결정 완충액은 표 1에 나타낸다.
하이브리드화 조건상에서 유용한 변이는 당업자에게 자명할 것이다. 하이브리드화 기술은 당업자에게 널리 공지되어 있고 예를 들어, 문헌[참조: Benton and Davis (Science 196:180, 1977); Grunstein and Hogness (Proc. Natl. Acad. Sci., USA 72:3961, 1975); Ausubel et al. (Current Protocols in Molecular Biology, Wiley Interscience, New York, 2001); Berger and Kimmel (Antisense to Molecular Cloning Techniques, 1987, Academic Press, New York); 및 Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York]에 기재되어 있다.
본원에 사용된 바와 같이, "올리고뉴클레오타이드 가닥"은 단일 가닥의 핵산 분자이다. 올리고뉴클레오타이드는 리보뉴클레오타이드, 데옥시리보뉴클레오타이드, 변형된 뉴클레오타이드(예를 들어, 2' 변형을 갖는 뉴클레오타이드, 합성 염기 유사체 등) 또는 이의 조합체를 포함할 수 있다. 상기 변형된 올리고뉴클레오타이드는 예를 들어, 뉴클레아제의 존재하에 증진된 세포 흡수 및 증가된 안정성과 같은 성질때문에 본래의 형태 보다 바람직할 수 있다.
본 발명의 특정 dsNA는 키메라dsNA이다. 본원에서 "키메라 dsNA" 또는 "키메라"는 각각 하나 이상의 뉴클레오타이드로 이루어진 2개 이상의 화학적으로 독특한 영역을 함유하는 dsNA이다. 이들 dsNA는 전형적으로 다이서 기질 siRNA("DsiRNA") 분자를 형성하는 주로 리보뉴클레오타이드를 포함하는 (임의로 변형된 리보뉴클레오타이드를 포함하는) 하나 이상의 영역을 함유한다. 상기 DsiRNA 영역은 하나 이상의 이로운 성질을 부여하는 염기쌍 형성된 데옥시리보뉴클레오타이드("dsDNA 영역")을 포함하는 제2 영역에 공유적으로 부착된다(예를 들어, 증가된 효능, 예를 들어, DsiRNA 활성의 증가된 효능 및/또는 지속기간은 예를 들어, 배양물에서 세포 투여되거나 피검체에 투여되는 경우 상기 변형의 보다 바람직한 변형 및/또는 개선된 여유 공간을 허용하는 연장된 영역으로 기능하는 기능성 그룹, 폴리로드, 검출/검출가능한 잔기의 개선된 부착을 위해 연장 영역으로서 작용하는 특정 위치로 키메라 dsNA를 표적화하는 인지 도메인 또는 수단으로서 기능한다). 염기쌍 형성된 데옥시리보뉴클레오타이드를 포함하는 상기 제2 영역은 또한 변형되거나 합성 뉴클레오타이드 및/또는 변형되거나 합성 데옥시리보뉴클레오타이드를 포함할 수 있다.
본원에 사용된 바와 같이, 용어 "리보뉴클레오타이드"는 천연 및 합성, 변형된 및 비변형된 리보뉴클레오타이드를 포함한다. 변형은 올리고뉴클레오타이드에서 당 잔기의 변화, 염기 잔기의 변화 및/또는 리보뉴클레오타이드간에 연결체의 변화를 포함한다. 본원에 사용된 바와 같이, 용어 "리보뉴클레오타이드"는 구체적으로 2' 리보스 영역 위치에서 단일 양성자 그룹을 갖는 뉴클레오타이드인 데옥시리보뉴클레오타이드를 배제한다.
본원에 사용된 바와 같이, 상기 용어 "데옥시리보뉴클레오타이드"는 천연 및 합성, 변형된 및 비변형된 데옥시리보뉴클레오타이드를 포함한다. 변형은 올리고뉴클레오타이드에서 당 잔기의 변화, 염기 잔기의 변화 및/또는 데옥시리보뉴클레오타이드간에 연결체의 변화를 포함한다. 본원에 사용된 바와 같이, 용어 "데옥시리보뉴클레오타이드"는 또한 dsNA 제제의 다이서 절단을 허용하지 않는 변형된 리보뉴클레오타이드, 예를 들어, 상기 잔의 결합에서 다이서 절단을 허용하지 않는 2'-0-메틸 리보뉴클레오타이드, 포스포로티오에이트 변형된 리보뉴클레오타이드 잔기 등을 포함한다.
본원에 사용된 바와 같이, 용어 "PS-NA"는 포스포로티오에이트 변형된 뉴클레오타이드 잔기를 언급한다. 따라서 상기 용어 "PS-NA"는 포스포로티오에이트 변형된 리보뉴클레오타이드("PS-RNA") 및 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드("PS-DNA) 둘다를 포함한다.
특정 양태에서, 본 발명의 키메라 DsiRNA/DNA 제제는 모든 뉴클레오타이드의 50%이상이 변형되지 않은 리보뉴클레오타이드인 영역내에 23개 이상의 뉴클레오타이드의 하나 이상의 듀플렉스 영역을 포함한다. 본원에 사용된 바와 같이, 용어 "비변형된 리보뉴클레오타이드"는 리보스 당의 2' 위치에서 하이드록실(-OH) 그룹을 갖는 리보뉴클레오타이드를 언급한다.
특정 양태에서, 본 발명의 키메라 DsiRNA/DNA 제제는 제1 가닥상에 돌출된 다이서 절단 부위의 3' 및 제2 가닥상의 돌출된 다이서 절단 부위의 5'에 위치한 하나 이상의 영역을 포함하고 길이가 2개 이상의 염기쌍 형성 뉴클레오타이드 길이를 갖고 이때 길이가 2개 이상의 염기쌍 형성 뉴클레오타이드의 영역내 모든 뉴클레오타이드의 50% 이상은 변형되지 않은 데옥시리보뉴클레오타이드이다. 본원에 사용된 바와 같이, 용어 "변형되지 않은 데옥시리보뉴클레오타이드"는 리보스 당의 2' 위치에서 단일 양성자를 갖는 리보뉴클레오타이드를 언급한다.
본원에 사용된 바와 같이, "안티센스 가닥"은 표적 RNA의 서열과 상보적인 서열을 갖는 단일 가닥의 핵산 분자를 언급한다. 안티센스 가닥이 염기 유사체와 함께 변형된 뉴클레오타이드를 함유하는 경우, 이는 이의 전체 길이를 따라 근본적으로 상보적이진 않지만 적어도 표적 RNA와 하이브리드화해야 한다.
본원에 사용된 바와 같이, "센스 가닥"은 안티센스 가닥의 서열과 상보적인 서열을 갖는 단일 가닥의 핵산 분자를 언급한다. 안티센스 가닥이 염기 유사체로 변형된 뉴클레오타이드를 함유하는 경우, 센스 가닥은 안티센스 가닥의 전체 길이를 따라 상보적일 필요는 없지만 안티센스 가닥과 적어도 이중나선을 형성해야만 한다.
본원에 사용된 바와 같이, "가이드 가닥"은 RNA 간섭을 유발하는 표적 RNA의 서열과 충분히 상보적인 서열을 갖는 dsRNA 또는 dsRNA 함유 분자의 단일 가닥의 핵산 분자를 언급한다. 다이서에 의한 dsRNA 또는 dsRNA 함유 분자의 절단 후, 가이드 가닥의 단편은 RISC와 연합되어 유지되고 RISC의 복합체의 성분으로서 표적 RNA와 결합하고 RISC에 의한 표적 RNA의 절단을 촉진시킨다. 본원에 사용된 바와 같이, 가이드 가닥은 근본적으로 연속 단일 가닥의 핵산을 언급하지 않고 바람직하게는 다이서에 의해 절단된 부위에서 불연속성을 포함할 수 있다. 가이드 가닥은 안티센스 가닥이다.
본원에 사용된 바와 같이, "표적 RNA"는 표적화된 절단 또는 스테릭 차단과 같은 안티센스 가닥에 의해 유도된 조절에 적용되는 RNA를 언급한다. 표적 RNA는 예를 들어, 게놈 바이러스 RNA, mRNA, 전구-mRNA, 또는 비암호화 RNA일 수 있다. 바람직한 표적은 질환 관련 단백질, 예를 들어, ApoB, Bcl2, Hif-l알파, 수르비빈 또는 p21 ras, 예를 들어, Ha. ras, K-ras 또는 N-ras을 암호화하는 mRNA와 같은 mRNA이다.
본원에 사용된 바와 같이, "패신저 가닥"은 가이드 가닥의 서열과 상보적인 서열을 갖는 dsRNA 또는 dsRNA 함유 분자의 올리고뉴클레오타이드 가닥을 언급한다. 본원에 사용된 바와 같이, 패신저 가닥은 근본적으로 연속 단일 가닥의 핵산 분자를 언급하지 않고 다이서에 의해 절단되는 부위에서 불연속성을 포함할 수 있다. 패신저 가닥은 센스 가닥이다.
본원에 사용된 바와 같이, "다이서"는 dsRNA 또는 dsRNA-함유 분자, 예를 들어, 이중 가닥의 RNA(dsRNA) 또는 전구-마이크로 RNA(miRNA)를 약 길이가 19 내지 25개 뉴클레오타이드인 이중 가닥의 핵산 단편으로 절단하는 RNase III 계열내 엔도뉴클레아제를 언급하고 통상적으로 3' 말단상에 2-염기 오버행을 갖는다. 본 발명의 dsNA에 관하여, 본 발명의 dsNA의 dsRNA 영역에 의해 형성된 듀플렉스는 다이서에 의해 인지되고 듀플렉스의 하나 이상의 가닥상의 다이서 기질이다. 다이서는 RNA 간섭 경로에서 제1 단계를 촉매하고 이는 결과적으로 표적 RNA를 분해시킨다. 사람 다이서의 단백질 서열은 본원에 참조로서 인용된 승인 번호 제NP_085124하에 NCBI 데이타베이스에서 제공된다.
다이서 "절단"은 다음과 같이 결정한다(문헌참조: 예를 들어, Collingwood et al., Oligonucleotides 18:187-200 (2008)). 다이서 절단 분석에서, RNA 듀플렉스(100 pmol)는 20 μL의 20 mM Tris pH 8.0, 200 mM NaCl, 2.5 mM MgC12에서 재조합 사람 다이서 1유니트의 존재 또는 부재하에 18 내지 24시간 동안 37℃에서 항온처리한다(문헌참조: Stratagene, La Jolla, CA). 샘플을 Performa SR 96-웰 플레이트를 사용하여 탈염시킨다(Edge Biosystems, Gaithersburg, MD). 다이서를 사용한 처리 전 및 후에 듀플렉스 RNA의 전기분무-이온화 액체 크로마토그래피 질량 분광측정 (ESI-LCMS)은 ThermoFinnigan TSQ7000, Xcalibur 데이타 시스템, ProMass 데이타 프로세싱 소프트웨어 및 Paradigm MS4 HPLC로 이루어진 올리고 HTCS 시스템(Novatia, Princeton, NJ; Hail et al., 2004)을 사용하여 수행한다(Michrom BioResources, Auburn, CA). 상기 분석에서, 다이서 절단은 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 이상, 또는 심지어 100%의 다이서 기질 dsRNA{즉, 본원에 기재된 바와 같이 임의로 연장된 25-35 bp dsRNA, 바람직하게는 26 내지 30 bp dsRNA}가 보다 짧은 dsRNA(예를 들어, 19-23 bp dsRNA, 바람직하게는, 21-23 bp dsRNA)로 절단되는 경우 발생한다.
본원에 사용된 바와 같이, "다이서 절단 부위"는 다이서가 dsRNA(예를 들어, 본 발명의 dsNA의 dsRNA 영역)을 절단하는 부위를 언급한다. 다이서는 전형적으로 dsRNA의 센스 및 안티센스 가닥 둘다를 절단하는 2개의 RNase III 도메인을 함유한다. RNase III 도메인과 PAZ 도메인 사이의 평균 거리는 이것이 생성하는 짧은 이중 가닥의 핵산 단편의 길이를 결정하고 이러한 거리는 다양할 수 있다(문헌참조: Macrae I, et al. (2006). "Structural basis for double-stranded RNA processing by Dicer". Science 311 (5758): 195-8.). 도 1A에 나타낸 바와 같이, 다이서는 안티센스 가닥의 3' 말단으로부터 제거된 21번 및 22번 뉴클레오타이드 사이의 부위 및 센스 가닥의 5' 말단으로부터 제거된 21번 및 22번 뉴클레오타이드 사이에 상응하는 부위에서 2개 뉴클레오타이드 3' 오버행을 갖는 안티센스 가닥을 갖는 본 발명의 특정 이중 가닥의 핵산을 절단하도록 돌출된다. 도 1A에서 도시된 것들과는 구분된 dsNA 분자에 대한 상기 돌출되고/되거나 우세한 다이서 절단 부위는 문헌[참조: Macrae et al]에 기재된 것들을 포함하는 당업계 인지된 방법을 통해 유사하게 동정될 수 있다. 도 1A에 도시된 다이서 절단 반응은 21개 뉴클레오타이드 siRNA를 생성시키지만 dsNA(예를 들어, DsiRNA)의 다이서 절단은 길이가 19개 내지 23개인 뉴클레오타이드의 다이서 가공된 siRNA를 생성시킬 수 있음을 주지한다. 실제로, 하기 보다 상세하게 기재된 본 발명의 하나의 측면에서, 이중 가닥의 DNA 영역은 전형적으로 바람직하지 않은 19량체 siRNA의 우세한 다이서 절단을 지시할 목적으로 dsNA내에 포함된다.
본원에 사용된 바와 같이, "오버행"은 dsNA의 5' 말단 또는 3' 말단에서 2개 또는 4개의 유리 말단을 갖는 듀플렉스와 관련하여 쌍을 형성하지 않은 뉴클레오타이드를 언급한다. 특정 양태에서, 상기 오버행은 안티센스 가닥 또는 센스 가닥상의 3' 또는 5' 오버행이다.
본원에 사용된 바와 같이, "표적"은 발현 또는 활성이 조절되어야만 하는 임의의 핵산 서열을 언급한다. 특정 양태에서, 상기 표적은 RISC 복합체에서 안티센스 가닥인 단일 가닥의 핵산과 듀플렉스를 형성하는 RNA를 언급한다. 안티센스 가닥으로의 표적 RNA의 하이브리드화는 RISC 복합체에 의한 프로세싱을 유발한다. 결과적으로, RNA, 또는 RNA 예를 들어, mRNA에 의해 암호화된 단백질의 발현은 감소한다.
본원에 사용된 바와 같이, 용어 "RNA 프로세싱"은 하기에서 보다 상세하게 기술되는(하기 "RNA 프로세싱"을 참조한다) siRNA, miRNA 또는 RNase H 경로 (예를 들어, Drosha, 다이서, Argonaute2 또는 기타 RISC 엔도리보뉴클레아제, 및 RNaseH)의 성분에 의해 수행되는 프로세싱 활성을 언급한다. 상기 용어는 비-RISC- 또는 비-RNase H-매개된 공정을 통한 RNA의 5' 캡핑 및 RNA의 분해의 전사 후 공정으로부터 명백히 구분된다. 상기 RNA의 "분해"는 여러 형태, 예를 들어, 여러 엔도- 또는 엑소-뉴클레아제(예를 들어, RNase III, RNase P, RNase T1, RNase A(1, 2, 3, 4/5), 올리고뉴클레오타이드 등)중 임의의 하나에 의한 RNA 몸체의 일부 또는 전부의 탈아데닐화(3' 폴리(A) 꼬리의 제거) 및/또는 뉴클레아제 분해를 취할 수 있다.
본원에 사용된 바와 같이, "참조"는 표준 또는 대조군을 의미한다. 당업자에게 자명한 바와 같이, 적당한 참조는 단지 하나의 요소가 하나의 요소의 효과를 결정하기 위해 변화되는 경우이다.
본원에 사용된 바와 같이, "변형된 뉴클레오타이드"는 뉴클레오사이드, 뉴클레오염기, 펜토스 환 또는 포스페이트 그룹에 하나 이상의 변형을 갖는 뉴클레오타이드를 언급한다. 예를 들어, 변형된 뉴클레오타이드는 아데노신 모노포스페이트, 구아노신 모노포스페이트, 우리딘 모노포스페이트 및 시티딘 모노포스페이트를 함유하는 리보뉴클레오타이드 및 데옥시아데노신 모노포스페이트, 데옥시구아노신 모노포스페이트, 데옥시티미딘 모노포스페이트 및 데옥시시티딘 모노포스페이트를 포함하는 리보뉴클레오타이드를 배제한다. 상기 변형은 뉴클레오타이드를 변형시키는 효소, 예를 들어, 메틸 트랜스퍼라제에 의한 변형으로부터 비롯되는 천연의 것들을 함유한다. 변형된 뉴클레오타이드는 또한 합성 또는 비천연 뉴클레오타이드를 포함한다. 뉴클레오타이드에서 합성 또는 비천연 변형은 2' 변형, 예를 들어, 2'-메톡시에톡시, 2'-플루오로, 2'-알릴, 2'-O-[2-(메틸아미노)-2-옥소에틸], 4'-티오, 4'-CH2-O-2'-브릿지, 4'-(CH2)2-O-2'-브릿지, 2'-LNA, 및 2'-O-(N-메틸카바메이트)를 갖는 것들 또는 염기 유사체를 포함하는 것들을 포함한다. 본원에 기재된 바와 같은 2' 변형된 뉴클레오타이드와 관련하여, "아미노"란 변형되거나 변형되지 않을 수 있는 2'-NH2 또는 2'-0-NH2를 의미한다. 상기 변형된 그룹은 예를 들어, 문헌[참조: Eckstein et al., 미국 특허 제5,672,695호 및 Matulic-Adamic et al., 미국 특허 제6,248,878호]에 기재되어 있다.
상기 용어 "시험관내"는 예를 들어, 정제된 시약 또는 추출물, 예를 들어, 세포 추출물을 포함하는 당업계에 인지된 의미를 갖는다. 상기 용어 "생체내"는 또한 생존 세포, 예를 들어, 불멸화 세포, 원발성 세포, 세포주 및/또는 유기체내 세포를 포함하는, 당업계에 인지된 의미를 갖는다.
본원의 핵산 분자와 관련하여 변형은 dsNA의 가닥상에 패턴으로 존재할 수 있다. 본원에 사용된 바와 같이, "교호 위치(alternating position)"는 dsNA의 한정된 길이의 가닥(예를 들어, 5'-MNMNMN-3'; 3'-MNMNMN-5'; 여기서, M은 변형된 뉴클레오타이드이고 N은 변형되지 않은 뉴클레오타이드이다)상에서 하나 걸러 다른 뉴클레오타이드가 변형된 뉴클레오타이드이거나 하나 걸러 변형된 뉴클레오타이드사이에 변형되지 않은 뉴클레오타이드(예를 들어, 변형되지 않은 리보뉴클레오타이드)가 존재하는 패턴을 언급한다. 상기 변형 패턴은 본원에 기재된 임의의 위치 넘버링 규약에 따라 5' 또는 3' 말단에서 첫번째 뉴클레오타이드 위치로부터 개시한다(특정 양태에서, 1번 위치는 본 발명의 DsiRNA 제제의 돌출된 다이서 절단 반응 후 가닥의 말단 잔기를 언급하는 것으로 지적되고, 따라서 1번 위치는 본 발명의 예비 가공된 제제의 3' 말단 또는 5' 말단 잔기를 항상 구성하는 것은 아니다. 교호 위치에서 변형된 뉴클레오타이드의 패턴은 전장의 가닥을 따라 존재할 수 있지만 특정 양태에서는 각각 2, 3, 4, 5, 6 또는 7개 이상의 변형된 뉴클레오타이드를 함유하는 4, 6, 8, 10, 12 또는 14개 이상의 뉴클레오타이드를 포함한다. 본원에 사용된 바와 같이, "교호 쌍의 위치"는 2개의 연속 변형된 뉴클레오타이드가 dsNA의 한정된 길이의 가닥(예를 들어, 5'-MMNNMMNNMMNN-3'; 3'-MMNNMMNNMMNN-5'; 여기서, M은 변형된 뉴클레오타이드이고 N은 변형되지 않은 뉴클레오타이드이다)상에서 2개의 연속 변형되지 않은 뉴클레오타이드에 의해 분리되어 있는 패턴을 언급한다. 상기 변형 패턴은 본원에 기재된 임의의 위치 넘버링 규약에 따라 5' 말단 또는 3' 말단에 첫번째 뉴클레오타이드 위치로부터 개시한다. 교호 위치에서 변형된 뉴클레오타이드의 패턴은 전장의 가닥을 따라 존재할 수 있지만 바람직하게 각각 4, 6, 8, 10, 12 또는 14개이상의 변형된 뉴클레오타이드를 함유하는 8, 12, 16, 20, 24 또는 28개 이상의 뉴클레오타이드를 포함한다. 상기 변형 패턴은 예시적인 것이고 본 발명의 범위를 제한하는 것으로 의도되지 말아야 한다.
본원에 사용된 바와 같이, "염기 유사체"는 핵산 듀플렉스로 혼입될 수 있는 변형된 뉴클레오타이드내 뉴클레오타이드 당 잔기의 1' 위치(또는 핵산 듀플렉스로 혼입될 수 있는 뉴클레오타이드 당 잔기 치환에서 동등한 위치)에 존재하는 헤테로사이클릭 잔기를 언급한다. 본 발명의 dsNA에서, 염기 유사체는 일반적으로 통상의 염기 구아닌(G), 시토신(C), 아데닌(A), 티민(T) 및 우라실(U)을 제외한 퓨린 또는 피리미딘 염기이다. 염기 유사체는 dsRNA에서 다른 염기 또는 염기 유사체와 듀플렉스를 형성할 수 있다. 염기 유사체는 본 발명의 화합물 및 방법에 유용한 것들, 예를 들어, 본원에 참조문헌으로서 인용된 미국 특허 제5,432,272호 및 제6,001,983호(Benner) 및 미국 특허 공개공보 제20080213891호(Manoharan)에 기재된 것들을 포함한다. 염기의 비제한적인 예는 하이포크산틴 (I), 크산틴 (X), 3β-D-리보푸라노실-(2,6-디아미노피리미딘)(K), 3-β-D-리보푸라노실-(l-메틸-피라졸로[4,3-d]피리미딘-5,7(4H,6H)-디온)(P), 이소-시토신(iso-C), 이소-구아닌 (iso-G), l-β-D-리보푸라노실-(5-니트로인돌), 1-β-D-리보푸라노실-(3-니트로피롤), 5-브로모우라실, 2-아미노퓨린, 4-티오-dT, 7-(2-티에닐)-이미다조[4,5-b]피리미딘 (Ds) 및 피롤-2-카브알데하이드 (Pa), 2-아미노-6-(2-티에닐)퓨린 (S), 2-옥소피리딘 (Y), 디플루오로톨릴, 4-플루오로-6-메틸벤즈이미다졸, 4-메틸벤즈이미다졸, 3 -메틸 이소카보스티릴릴, 5-메틸 이소카보스티릴릴, 및 3-메틸-7-프로피닐 이소카보스티릴릴, 7-아자인돌릴, 6-메틸-7-아자인돌릴, 이미디조피리디닐, 9-메틸-이미디조피리디닐, 피롤로피리지닐, 이소카보스티릴릴, 7-프로피닐 이소카보스티릴릴, 프로피닐-7-아자인돌릴, 2,4,5-트리메틸페닐, 4-메틸인돌릴, 4,6-디메틸인돌릴, 페닐, 나프탈레닐, 안트라세닐, 페난트라세닐, 피레닐, 스틸벤질, 테트라세닐, 펜타세닐, 및 이의 구조적 유도체를 포함한다(문헌참조: Schweitzer et al., J. Org. Chem., 59:7238-7242 (1994); Berger et al., Nucleic Acids Research, 28(15):291 1-2914 (2000); Moran et al., J. Am. Chem. Soc, 119:2056-2057 (1997); Morales et al., J. Am. Chem. Soc, 121 :2323-2324 (1999); Guckian et al., J. Am. Chem. Soc, 118:8182-8183 (1996); Morales et al., J. Am. Chem. Soc, 122(6): 1001 -1007 (2000); McMinn et al., J. Am. Chem. Soc, 121 :11585-11586 (1999); Guckian et al., J. Org. Chem., 63:9652-9656 (1998); Moran et al., Proc. Natl. Acad. Sci., 94:10506-10511 (1997); Das et al., J. Chem. Soc, Perkin Trans., 1 :197-206 (2002); Shibata et al., J. Chem. Soc, Perkin Trans., 1 : 1605-1611 (2001); Wu et al., J. Am. Chem. Soc, 122(32):7621-7632 (2000); O'Neill et al., J. Org. Chem., 67:5869-5875 (2002); Chaudhuri et al., J. Am. Chem. Soc, 117:10434-10442 (1995); 및 미국 특허 제6,218,108호). 염기 유사체는 또한 범용 염기일 수 있다.
본원에 사용된 바와 같이, "범용 염기"는 변형된 뉴클레오타이드내 뉴클레오타이드 당 잔기의 1' 위치, 또는 핵산 듀플렉스에 존재하는 경우 이중 나선 구조(예를 들어, 포스페이트 골격 구조)를 변형시키는 것 없이 하나 이상 유형의 염기 반대편에 위치할 수 있는 뉴클레오타이드 당 잔기 치환에서 동등한 위치에 존재하는 헤테로사이클릭 잔기를 언급한다. 추가로, 범용 염기는 표적 핵산이 듀플렉스로 되도록 하는 단일 가닥의 핵산의 능력을 파괴하지 않는다. 표적 핵산이 듀플렉스를 형성하도록 하는 범용 염기를 함유하는 단일 가닥의 핵산 능력은 당업자에게 자명한 방법(예를 들어, UV 흡광도, 원편광2색성, 겔 전이, 단일 가닥 뉴클레아제 민감성 등)에 의해 분석될 수 있다. 추가로, 듀플렉스 형성이 관찰될 수 있는 조건, 예를 들어, 용융 온도(Tm)가 핵산 듀플렉스의 안정성과 상관관계에 있음으로 온도와 같은 조건을 다양하게 하여 듀플렉스 안정성 또는 형성을 결정할 수 있다. 정확하게 표적 핵산과 상보적인 참조 단일 가닥의 핵산과 비교하여 범용 염기를 함유하는 단일 가닥의 핵산은 상보적인 핵산과 함께 형성되는 듀플렉스 보다 낮은 Tm을 갖는 표적 핵산과 듀플렉스를 형성한다. 그러나, 범용 염기가 단일 미스매치를 형성하도록 대체된 참조 단일 가닥 핵산과 비교하여 범용 염기를 함유하는 단일 가닥의 핵산은 미스매치된 염기를 갖는 핵산과 함께 형성된 듀클렉스 보다 높은 Tm을 갖는 표적 핵산과 듀플렉스를 형성한다.
몇몇 범용 염기는 염기쌍 형성 조건하에서 범용 염기와 구아닌(G), 시토신(C), 아데닌(A), 티민(T) 및 우라실(U) 염기 모두와 수소 결합을 형성함에 의해 염기쌍을 형성할 수 있다. 범용 염기는 단지 하나의 단일 상보적 염기와 염기쌍을 형성하는 염기가 아니다. 듀플렉스에서, 범용 염기는 듀플렉스의 반대편 가닥상에 이에 반대되는 G, C, A, T 및 U 각각과 수소 결합을 형성하지 않거나 하나의 수소 결합을 형성하거나 하나 이상의 수소결합을 형성할 수 있다. 바람직하게, 범용 염기는 듀플렉스의 반대편 가닥상에 이와 반대되는 염기와 상호작용하지 않는다. 듀플렉스에서 범용 염기간의 염기쌍 형성은 포스페이트 골격의 이중 나선 구조를 변화시키는 것 없이 발생한다. 범용 염기는 또한 스택킹 상호작용에 의해 동일한 핵산 가닥상에서 인접한 뉴클레오타이드내 염기와 상호작용할 수 있다. 상기 스택킹 상호작용은 특히 범용 염기가 듀플렉스의 반대편 가닥상에 이와 반대편에 위치하는 염기와 염기와 임의의 수소 결합을 형성하지 않는 듀플렉스를 안정화시킨다. 범용 결합 뉴클레오타이드의 비제한적인 예는 이노신, l-β-D-리보푸라노실-5-니트로인돌, 및/또는 l-β-D-리보푸라노실-3-니트로피롤[문헌참조: 미국 특허원 공개 공보 제20070254362호(Quay et al.); Van Aerschot et al., An acyclic 5-nitroindazole nucleoside analogue as ambiguous nucleoside. Nucleic Acids Res. 1995 Nov 11;23(21):4363-70; Loakes et al., 3-Nitropyrrole and 5-nitroindole as universal bases in primers for DNA sequencing and PCR. Nucleic Acids Res. 1995 JuI 11;23(13):2361-6; Loakes and Brown, 5-Nitroindole as an universal base analogue. Nucleic Acids Res. 1994 Oct 11 ;22(20):4039-43)]을 포함한다.
본원에 사용된 바와 같이, "루프"는 핵산의 단일 가닥에 의해 형성되는 구조를 언급하고, 여기서, 특정 단일 가닥의 뉴클레오타이드 영역을 플랭킹하는 상보적 영역은 상보적 영역 사이의 단일 가작 뉴클레오타이드 영역이 듀플렉스 형성 또는 왓슨-크릭 염기쌍 형성으로부터 배제되는 방식으로 하이브리드화한다. 루프는 임의의 길이를 갖는 단일 가닥의 뉴클레오타이드 영역이다. 루프의 예는 헤어핀, 스템 루프 또는 연장된 루프와 같은 구조물에 존재하는 쌍을 이루지 않은 뉴클레오타이드를 포함한다.
본원에 사용된 바와 같이, dsRNA의 문헌에서 "연장된 루프"는 단일 가닥의 루프 및 추가로 루프를 플랭킹하는 1, 2, 3, 4, 5, 6 또는 20개 이하의 염기쌍 또는 듀플렉스를 언급한다. 연장된 루프에서, 5' 측면상에서 루프를 플랭킹하는 뉴클레오타이드는 3' 측면상에서 루프를 플랭킹하는 뉴클레오타이드와 듀플렉스를 형성한다. 연장된 루프는 헤어핀 또는 스템 루프를 형성할 수 있다.
본원에 사용된 바와 같이, dsRNA와 관련하여 "테트라루프"는 인접한 왓슨-크릭 하이브리드화된 뉴클레오타이드의 안정성에 기여하는 안정한 2차 구조물을 형성하는 4개의 뉴클레오타이드로 이루어진 루프(단일 가닥 영역)를 언급한다. 특정 이론에 제한되는 것 없이, 테트라루프는 스택킹 상호작용에 의해 인접한 왓슨-크릭 염기쌍을 안정화시킬 수 있다. 추가로 테트라루프중에 4개의 뉴클레오타이드중에 상호작용은 비-왓슨 크릭 염기쌍, 스택킹 상호작용, 수소 결합 및 접촉 상호작용을 포함하지만 이에 제한되지 않는다(문헌참조: Cheong et al, Nature 1990 Aug 16;346(6285):680-2; Heus and Pardi, Science 1991 JuI 12;253(5016):191-4). 테트라루프는 4개의 무작위 염기로 이루어진 단순한 모델 루프 서열로부터 예측되는 것 보다 높은 인접한 듀플렉스의 용융 온도(Tm)를 증가시킨다. 예를 들어, 테트라루프는 길이가 2개 이상의 염기쌍인 듀플렉스를 포함하는 헤어핀에 10mM NaHPO4에서 55℃ 이상의 용융 온도를 부여할 수 있다. 테트라루프는 리보뉴클레오타이드, 데옥시리보뉴클레오타이드, 변형된 뉴클레오타이드 및 이의 조합체를 함유할 수 있다. RNA 테트라루프의 예는 UNCG 계열의 테트라루프(예를 들어 UUCG), GNRA 계열의 테트라루프(예를 들어, GAAA), 및 CUUG 테트라루프를 포함한다(문헌참조: Woese et al., Proc Natl Acad Sci U S A. 1990 Nov;87(21): 8467-71; Antao et al., Nucleic Acids Res. 1991 Nov 11 ;19(21):5901-5). DNA 테트라루프의 예는 d(GNNA) 계열의 테트라루프(예를 들어, d(GTTA)), d(GNRA)) 게열의 테트라루프, d(GNAB) 계열의 테트라루프, d(CNNG) 계열의 테트라루프, d(TNCG) 계열의 테트라루프(예를 들어, d(TTCG))를 포함한다(문헌참조: Nakano et al. Biochemistry, 41 (48), 14281 -14292, 2002.; SHINJI et al. Nippon Kagakkai Koen Yokoshu VOL.78th; NO.2; PAGE.731 (2000))
본원에 사용된 바와 같이, "증가하다" 또는 "증진시키다"는 분석에서 참조물과 비교하여 5% 이상의 양성으로 변화시킴을 의미한다. 변화는 분석에서 참조물과 비교하여 5%, 10%, 25%, 30%, 50%, 75%, 또는 심지어 100% 까지일 수 있다. "다이서 절단을 증진시킨다"란 다이서에 의한 특정 양의 dsRNA 또는 dsRNA 함유 분자의 프로세싱이 보다 다이서 절단된 dsRNA 생성물을 유도하거나 다이서 절단 반응이 본원의 생체내 또는 시험관내 분석에서 동일한 양의 참조 dsRNA 또는 dsRNA 함유 분자의 프로세싱과 비교하여 보다 신속하게 일어나거나 다이서 절단이 dsNA내 특정 바람직한 부위를 절단하고/하거나 보다 우세한 바람직한 집단의 절단 생성물을 생성시킴(예를 들어, 본원에 기재된 바와 같은 DNA 잔기를 내포함에 의해)을 의미한다. 하나의 양태에서, dsNA 분자의 증진되거나 증가된 다이서 절단은 적당한 참조 dsNA 분자와 함께 관찰되는 수준 이상이다. 또 다른 양태에서, dsNA 분자의 증진되거나 증가된 다이서 절단은 불활성 또는 약화된 분자와 함께 관찰되는 수준 이상이다.
본원에 사용된 바와 같이 "감소시키다"는 분석에서 참조물과 비교하여 5% 이상 음성으로 변화시킴을 의미한다. 상기 변화는 분석에서 참조물과 비교하여 5%, 10%, 25%, 30%, 50%, 75%, 또는 심지어 100%일 수 있다. '발현을 감소시키다'란 유전자의 발현 또는 하나 이상의 단백질 또는 단백질 서브유니트를 암호화하는 RNA 분자 또는 동등한 RNA 분자의 수준 또는 표적 유전자에 의해 암호화된 하나 이상의 단백질 또는 단백질 서브유니트의 수준 또는 활성이 본원의 생체내 또는 시험관내 분석에서 핵산 분자(예를 들어, dsRNA 분자 또는 dsRNA 함유 분자)의 부재하에서 관찰되는 것 미만으로 감소됨을 의미한다. 하나의 양태에서, dsNA 분자와 함께 억제, 하향 조절 또는 감소는 불활성 또는 약화된 분자의 존재하에 관찰되는 수준 미만이다. 또 다른 양태에서, dsNA 분자와 함께 억제, 하향 조절 또는 감소는 예를 들어, 스크램블된 서열 또는 미스매치를 갖는 dsNA 분자의 존재하에 관찰되는 수준 미만이다. 또 다른 양태에서 본원의 핵산 분자와 함께 유전자 발현의 억제, 하향 조절 또는 감소는 이의 부재하에서 보다 상기 핵산 분자의 존재에서 보다 크다.
본원에 사용된 바와 같이, "세포"는 원핵 (예를 들어, 세균) 세포 및 진핵 (예를 들어, 포유동물 또는 식물) 세포 둘다를 포함함을 의미한다. 세포는 체세포 또는 배주 기원일 있고, 전능 또는 만능 세포일 수 있고 분열성 또는 비분열성일 수 있다. 세포는 또한 생식세포 또는 배아, 줄기 세포 또는 완전히 분화된 세포로부터 유래하거나 이를 포함할 수 있다. 따라서, 용어 "세포"는 이의 통상의 생물학적 의미를 갖고 예를 들어, 조류, 식물 및 포유동물(예를 들어, 사람, 소, 양, 유인원, 원숭이, 돼지, 개 및 고양이)과 같은 임의의 유기체에 존재할 수 있다. 특정 측면내에서, 용어 "세포"는 구체적으로 본원의 하나 이상의 분리된 dsNA 분자를 함유하는, 사람 세포와 같은 포유동물 세포를 언급한다. 특정 측면에서, 세포는 표적 핵산의 RNA 간섭을 유도하는 dsRNA 또는 dsRNA 함유 분자를 프로세싱하고 RNAi, 예를 들어, 다이서 및 RISC를 위해 요구되는 단백질 및 단백질 복합체를 함유한다. 본원에 사용된 바와 같이, "동물"은 포유동물, 특히 사람을 포함하는 다세포성 진핵 유기체를 의미한다. 일반적으로 본 발명의 방법은 본원에서 특정 화학식 구조의 제제와 같은 유효량의 제제를 이를 필요로 하는 포유동물, 특히 사람을 포함하는 피검체(예를 들어, 동물, 사람)에게 투여함을 포함한다. 상기 치료는 질환 또는 이의 증상으로부터 고통받거나 이를 갖거나 민감하거나 이의 위험에 처한 피검체, 특히 사람에게 적용된다.
"약제학적으로 허용되는 담체"란 이들의 목적하는 활성을 위해 가장 적합한 물리적 위치에서 본원의 핵산 분자의 효과적인 분포를 허용하는 조성물 또는 제형을 의미한다.
본 발명은 동일한 제제내에서 진핵 세포에서 표적 유전자의 발현을 감소시킬 수 있는 이중가닥 RNA("dsRNA") 듀플렉스 및 DNA 함유 연장된 영역(대부분의 양태에서 dsDNA 듀플렉스) 둘다를 포함하는 조성물 및 이들을 제조하는 방법에 관한 것이다. dsRNA 영역의 가닥중 하나는 표적 유전자로부터 전사된 RNA의 파괴를 지시할 수 있는 약 15개 내지 약 22개 뉴클레오타이드 범위의 길이를 갖는 뉴클레오타이드 서열 영역을 함유한다. 상기 제제의 dsDNA 듀플렉스 영역은 근본적으로 표적 RNA와 상보적이지 않고 따라서 상기 경우에 표적 RNA의 파괴를 지시할 수 있는 뉴클레오타이드 서열 영역의 표적 RNA 하이브리드화를 증진시키지 않는다. 본 발명의 이중 가닥 NA는 화학적으로 연결된 가닥을 갖거나 또한 제1 및 제2 가닥을 연결하는 테트라루프를 임의로 포함하는 연장된 루프를 가질 수 있다. 몇몇 양태에서, 테트라 루프를 함유하는 연장된 루프는 센스 가닥의 3'말단, 안티센스 가닥의 5' 말단 또는 양 말단에 존재한다.
하나의 양태에서, 본 발명의 dsNA는 18 내지 30개 길이의 뉴클레오타이드(예를 들어, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 및 30개의 뉴클레오타이드)를 포함하는 이중 가닥 RNA 듀플렉스 영역을 포함한다.
본 발명의 DsiRNA/dsDNA 제제는 dsDNA 영역이 부재인 DsiRNA와 상대적으로 상기 제제의 하기 특성을 증진시킬 수 있다: 시험관내 효능 (예를 들어, 효력 및 효과의 지속성), 생체내 효능(예를 들어, 효력, 효과의 지속성, 약력학, 약동력학, 세포내 취득, 감소된 독성). 특정 양태에서, 본 발명의 dsDNA 영역은 임의로 앞타머(aptamer) 또는 이의 단편과 같은 추가의 제제(또는 이의 단편); 비서열 선택적 또는 서열 특이적 방식으로 dsDNA에 결합할 수 있는 본래의 또는 외래 도입된 잔기에 대한 결합 부위(예를 들어, "decoy" 결합 부위)(예를 들어, 본 발명의 제제의 dsDNA 연장된 영역은 하나 이상의 전사 인자 인지 서열을 포함하도록 디자인할 수 있고/있거나 dsDNA 연장된 영역은 프로브, 마커 등에 대한 서열 특이적 인지 도메인을 제공할 수 있다)를 제공할 수 있다.
본원에 사용된 바와 같이, 용어 "약력학"은 약물이 신체에 의해 흡수되고 분포되고 대사되고 제거되는 과정을 언급한다. 본 발명의 특정 양태에서, 적당한 대조군 DsiRNA와 상대적으로 DsiRNA/dsDNA 제제의 증진된 약력학은 제제를 투여받은 피검체로부터 상기 제제의 증가된 흡수 및/또는 분포 및/또는 DsiRNA/dsDNA 제제의 느려진 대사 및/또는 제거를 언급한다.
본원에 사용된 바와 같이, 용어 "약동력학"은 생존 유기체에 대한 약물의 작용 또는 효과를 언급한다. 본 발명의 특정 양태에서, 적당한 대조군 DsiRNA에 상대적인 DsiRNA/dsDNA 제제의 증진된 약동력학은 적당한 대조군 DsiRNA에 상대적으로 피검체가 상기 제제를 투여받는 즉시 DsiRNA/dsDNA 제제의 증가된(예를 들어, 보다 강력하거나 보다 연장된) 작용 또는 효과를 언급한다.
본원에 사용된 바와 같이, 용어 "안정화"는 선택된 환경(예를 들어, 세포 또는 유기체)에서 제제의 증진된 존속 상태를 언급한다. 특정 양태에서, 본 발명의 DsiRNA/dsDNA 키메라 제제는 적당한 대조군 DsiRNA와 상대적으로 증진된 안정성을 나타낸다. 상기 증진된 안정성은 분해 효소(예를 들어, 뉴클레아제) 및 다른 제제에 대한 상기 제제의 증진된 내성을 통해 성취될 수 있다.
DsiRNA 디자인/합성
이전에 25개 내지 약 30개 뉴클레오타이드의 보다 긴 dsRNA 종(DsiRNA)이 예상치않게 19-23량체 siRNA 제제와 비교하여 작용 효력 및 지속성 관점에서 효과적인 RNA 억제 결과를 산출하는 것으로 나타났다. dsRNA 프로세싱 기작의 기본 이론에 얽매이지 않고 보다 긴 dsRNA 종이 세포의 세포질에서 다이서 효소에 대한 기질로서 작용하는 것으로 사료된다. 본 발명의 dsNA를 보다 짧은 절편으로 절단시키는 것 외에 다이서는 절단된 dsNA 기원의 단일 가닥의 절단 생성물의 세포질 RNA의 파괴에 관여하거나 표적 유전자로부터 기원하는 RISC 복합체로의 혼입을 촉진시키는 것으로 사료된다. 이전의 연구(문헌참조: Rossi et al., U.S. Patent Application No. 2007/0265220)는 다이서에 의한 dsRNA 종(구체적으로 DsiRNA 제제)의 절단능이 dsRNA 종의 증가된 효능 및 지속성에 상응하는 것으로 나타났다. 본 발명은 적어도 부분적으로 다이서 절단 부위를 지시하여 바람직한 종의 다이서 절단 생성물이 생성되도록 하는 RNA 억제제를 디자인하는 것에 관한 것이다.
DsiRNA 프로세싱의 한 모델은 도 1A에 제공된다. 간략하게, 다이서 효소는 DsiRNA 제제와 결합하여 DsiRNA 제제의 안티센스 가닥의 다이서 PAZ 도메인 연합된 3' 오버행 서열로부터 제거된 19번 내지 23번 뉴클레오타이드 위치에서 DsiRNA를 절단시킨다. 상기 다이서 절단 반응은 이전에 패신저(센스) 가닥의 3' 말단 및 가이드(안티센스) 가닥의 5' 말단에 위치한 이중나선의 핵산을 절단시킨다. (도 1A에 제시된 DsiRNA의 절단은 전형적으로 각각의 말단에 2-염기 오버행을 갖는 19량체 듀플렉스를 생성시킨다). 현재 도 1A에 도시된 바와 같이, 상기 다이서 절단 반응은 RISC 성분으로서 표적 mRNA의 서열 특이적 억제를 지시할 수 있는 21개 내지 23개 뉴클레오타이드 가이드(안티센스) 가닥을 생성시킨다.
본 발명의 DsiRNA 제제의 제1 및 제2 올리고뉴클레오타이드는 완전히 상보적일 필요는 없다. 실제로 하나의 양태에서, 센스 가닥의 3' 말단은 하나 이상의 미스매치를 함유한다. 하나의 측면에서, 약 2개의 미스매치는 센스 가닥의 3'말단에 혼입된다. 또 다른 양태에서, 본 발명의 DsiRNA는 각각이 길이가 27개 내지 35개 뉴클레오타이드 범위인 동일한 수의 뉴클레오타이드이고 서로 어닐링되는 경우 센스 가닥의 3' 말단(안티센스 가닥의 5' 말단)상에 평활 말단 및 2개의 뉴클레오타이드 미스매치를 갖는 2개의 RNA 올리고뉴클레오타이드를 함유하는 이중 가닥의 RNA 분자이다. 미스매치 또는 감소된 열역학적 안정성(특히 3' 센스/5' 안티센스 위치에서)의 사용은 추측컨대 siRNA의 RISC로의 진입과 함께 발생하는 몇몇 율속 해리 단계에 영향을 줌에 의해 안티센스 가닥의 RISC로의 진입을 촉진시키거나 호전시키는 것으로 제안되었다(문헌참조: Schwarz et al., 2003; Khvorova et al., 2003). 따라서, 말단 염기 조성은 활성 21량체 siRNA 듀플렉스를 선별하기 위한 디자인 알고리듬에 포함되었다(문헌참조: Ui-Tei et al., 2004; Reynolds et al, 2004). 상기 양태의 dsRNA 영역의 다이서 절단과 함께 미스매치를 함유하는 작은 말단 서열은 안티센스 가닥과 쌍을 이루지 않은 채로 유지되거나(3' 오버행의 일부가 됨) 최종 21량체 siRNA로부터 완전히 절단된다. 따라서 이들 특이적 형태의 "미스매치"는 RISC의 최종 RNA 성분에서 미스매치로서 존속하지 않는다. 다이서 기질의 센스 가닥의 3' 말단에서 염기 미스매치 및 불안정화가 추측컨대 다이서에 의한 프로세싱을 촉진시킴에 의해 RNAi내 합성 듀플렉스의 효능을 개선시킨다는 발견은 25-30량체 dsRNA(또한 본원에서 "DsiRNA'로 호칭됨; Rossi et al., U.S. Patent Application Nos. 2005/0277610, 2005/0244858 및 2007/0265220)의 디자인 및 용도를 기재하는 지난 연구의 놀라운 발견이다. 현재 동등하게 각각의 패신저 또는 가이드 가닥의 최외곽 3' 다이서 절단 부위의 3'인 것으로 예측되는 패신저(센스) 또는 가이드(안티센스) 가닥 위치에서 염기쌍을 이룬 데옥시리보뉴클레오타이드를 갖는 DsiRNA가 적어도 RNA-RNA 듀플렉스 연장된 DsiRNA 제제와 균등하게 효과적이라나는 것은 놀라운 일이다. 상기 제제는 또한 미스매치를 함유하고 상기 미스매치는 DsiRNA 제제의 센스 가닥의 서열(이들과 실제 또는 돌출된 하이브리드화) 또는 표적 RNA 서열과 관련하여 안티센스 가닥에 의해 형성된다. 미스매치를 갖는 제제의 예시적인 미스매치되거나 와블(wobble) 염기쌍은 G:A, C:A, C:U, G:G, A:A, C:C, U:U, I:A, I:U 및 I:C이다. 상기 제제의 염기쌍 강도는 또한 예를 들어, 구아닌 및 아데닌 뉴클레오타이드의 2-아미노- 또는 2,6-디아미노 변형을 포함하는 상기 제제의 뉴클레오타이드의 변형을 통해 감소될 수 있다.
DsiRNA 제제 조성의 예시적인 구조
하나의 측면에서, 본 발명은 돌출된 센스 가닥 다이서 절단 부위의 3' 및 상응하게 돌출된 안티센스 가닥 다이서 절단 부위의 5'에 위치하는 이중 가닥 핵산 (dsNA)내에 하나 이상의 염기쌍을 이룬 데옥시리보뉴클레오타이드를 갖는, RNA 간섭(RNAi)을 위한 조성물을 제공한다. 본 발명의 조성물은 전구체 분자인 dsRNA를 포함하고 즉, 본 발명의 dsNA는 생체내에서 프로세싱되어 활성의 작은 간섭 핵산(siRNA)을 생성시킨다. dsNA는 다이서에 의해 RISC로 혼입되는 활성 siRNA로 프로세싱된다.
특정 양태에서, 본 발명의 DsiRNA 제제는 하기의 예시적인 구조물 중 어느 하나를 가질 수 있다:
하나의 당해 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10개 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4개 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이고, "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로 1 내지 8이고, "N*"=0 내지 15 이상이지만 임의로는 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다.
관련 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10개 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4개 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이고, "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로 1 내지 8이고, "N*"=0 내지 15 이상이지만 임의로는 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다.
또 다른 상기 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "X"는 2'-O 메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10개 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4개 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이고, "Z"= DNA 또는 RNA이고 "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로 1 내지 8이고, "N*"=0 내지 15 이상이지만 임의로는 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또는, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
또 다른 당해 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "X"는 2'-O 메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이고, "Z"= DNA 또는 RNA이고 "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로 1 내지 8이고, "N*"=0 내지 15 이상이지만 임의로는 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
또 다른 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10개 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4개 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이고, "Z"= DNA 또는 RNA이고 "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로 1 내지 8이고, 하나 이상의 D1N은 상부 가닥에 존재하고 하부 가닥에서 상응하는 D2N과 염기쌍을 형성한다. 임의로 D1N과 D1N+1은 상응하는 D2N과 D2N+1과 염기쌍을 형성하고, D1N, D1N+1, 및 D1N+2는 상응하는 D2N, D1N+1, 및 D1N+2 등과 염기쌍을 형성한다. "N*"=0 내지 15 이상이지만 임의로는 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또는, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
상기 도시된 임의의 구조물에서 센스 가닥 또는 안티센스 가닥의 5' 말단은 임의로 포스페이트 그룹을 포함한다.
또 다른 양태에서, DNA:DNA-연장된 DsiRNA는 다이서 절단을 배향하는 작용을 하는 1 내지 3개의 미스매치된 잔기를 갖는 동일한 길이의 가닥을 포함한다(구체적으로, 3' 말단 잔기로부터 넘버링하는 경우 DsiRNA의 제1 가닥상에서 1, 2, 또는 3번 위치 중 하나 이상은 제1 및 제2 가닥이 서로 어닐링하는 경우 제2 가닥상의 5' 말단 영역의 상응하는 잔기와 미스매치된다). 2개의 말단 미스매치된 잔기를 갖는 예시적인 DNA:DNA-연장된 DsiRNA 제제는 다음과 같다:
상기식에서 "X"=RNA이고, "M"= 가닥이 어닐링하는 경우 달리 상보적인 가닥의 상응하는 "M" 잔기와 염기쌍(수소 결합)을 형성하지 않는 핵산 잔기(RNA, DNA 또는 비천연 또는 변형된 핵산)이고, "D"=DNA이고 "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로, 1 내지 8이다. "N*"= 0 내지 15 이상이지만 임의로 0, 1, 2, 3, 4, 5 또는 6개이다. 상기 제제의 임의의 잔기는 임의로 2'-O 메틸 RNA 단량체일 수 있고- 상기 도시된 제제에 대해 나타낸 바와 같이 하부(제2) 가닥의 3' 말단 잔기로부터 개시하여 번갈아 위치하는 2'-O-메틸 RNA 단량체가 또한 상기 '평활/프레이" DsiRNA 제제에 사용될 수 있다. 하나의 양태에서, 상부 가닥(제1 가닥)은 센스 가닥이고 하부 가닥(제2 가닥)은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다. 비대칭/오버행 제제에 대해 상기 나타낸 것들과 병행하는 변형 및 DNA:DNA 연장 패턴이 또한 상기 "평활/프레이" 제제에 혼입될 수 있다.
하나의 양태에서, 다이서 절단의 특이적 지시를 통해 기능하도록 모델링된 부위에 위치하는 데옥시리보뉴클레오타이드를 포함하지만 여전히 dsNA 구조물에서 염기쌍 데옥시리보뉴클레오타이드의 존재를 필요로 하지 않는 길이 연장된 DsiRNA 제제가 제공된다. 상기 분자에 대한 예시적인 구조는 다음과 같다:
상기식에서, "X"=RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10개 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4개 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다. 상기 구조는 다이서가 이의 주요 프로세싱 후 형태로서 최저의 21량체 듀플렉스를 절단하도록 하는 모델이 된다. 상기 구조물의 하부 가닥이 안티센스 가닥인 양태에서, 안티센스 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기에서 2개의 데옥시리보뉴클레오타이드 잔기가 위치하여 오프-표적 효과를 감소시킬 가능성이 높다(이전의 연구는 안티센스 가닥의 5' 말단으로부터 적어도 맨끝에서 2번째 위치의 2'-O-메틸 변형이 오프-표적 효과를 감소시킴을 보여주었다; 문헌참조: 예를 들어, US 2007/0223427).
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10개 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4개 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이고, "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로 1 내지 8이고, "N*"=0 내지 15 이상이지만 임의로는 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다.
관련 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA, 임의로 2'-O-메틸 RNA 단량체이고, "D"=DNA이고, "N"=l 내지 50 이상이지만 임의로 1 내지 15, 임의로 1 내지 8이다. "N*"=0 내지 15 이상이지만 임의로는 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다.
또 다른 상기 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA, 임의로 2'-O-메틸 RNA 단량체이다, "D"=DNA이고, "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로 1 내지 8이다. "N*" = 0 내지 15 이상지만 임의로 0, 1, 2, 3. 4. 5 또는 6이다. "Z"= DNA 또는 RNA이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
또 다른 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "X"=2'-O-메틸 RNA이고, "D"=DNA이고, "Z"=DNA 또는 RNA이고, "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는, 임의로, 1 내지 8이다. "N*"=0 내지 15 이상이지만 임의로 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
또 다른 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "X"=2'-O-메틸 RNA이고, "D"=DNA이고, "Z"=DNA 또는 RNA이고, "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는, 임의로, 1 내지 8이다. "N*"=0 내지 15개 이상이지만 임의로 0, 1, 2, 3, 4, 5 또는 6개이다. "Y"는 임의로 2'-O-메틸 RNA 단량체인 0 내지 10개의 RNA 단량체로 이루어진 임의의 오버행 도메인이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또는 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
또 다른 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "D"=DNA이고, "Z"=DNA 또는 RNA이고, "N"= l 내지 50 이상이지만 임의로 1 내지 15이거나 임의로 1 내지 8이고, 여기서, 하나 이상의 D1N은 상부 가닥에 존재하고 하부 가닥에서 상응하는 D2N과 염기쌍을 형성한다. 임의로, D1N과 D1N+1은 상응하는 D2N과 D2N+1과 염기쌍을 형성하고; D1N, D1N+1 및 D1N+2는 상응하는 D2N, D1N+1 및 D1N +2 등과 염기쌍을 형성한다. "N*"= 0 내지 15 이상이지만 임의로 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또는 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
관련 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "D"=DNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0 내지 10개 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, "N"= l 내지 50 이상이지만 임의로 1 내지 15 이거나, 임의로 1 내지 8이고, 여기서, 하나 이상의 D1N은 상부 가닥에 존재하고 하부 가닥에서 상응하는 D2N과 염기쌍을 형성한다. 임의로, D1N과 D1N+1은 상응하는 D2N과 D2N+1과 염기쌍을 형성하고; D1N, D1N+1 및 D1N+2은 상응하는 D2N, D1N+1 및 D1N+2 등과 염기쌍을 형성한다. "N*"= 0 내지 15개 이상이지만 임의로 0, 1, 2, 3, 4, 5 또는 6개이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이며, 2'-O-메틸 RNA 단량체는 현재 상기 도식에 도시된 하부 가닥 보다는 상부 가닥을 따라 존재하는 교호 잔기에 위치한다.
상기 도시된 임의의 구조물에서 센스 가닥 또는 안티센스 가닥의 5' 말단은 임의로 포스페이트 그룹을 포함한다.
또 다른 양태에서, DNA:DNA-연장된 DsiRNA는 다이서 절단을 배향하는 작용을 하는 1 내지 3개의 미스매치된 잔기를 갖는 동일한 길이의 가닥을 포함한다(구체적으로, 3' 말단 잔기로부터 넘버링하는 경우 DsiRNA의 제1 가닥상에서 1, 2, 또는 3번 위치 중 하나 이상은 제1 및 제2 가닥이 서로 어닐링하는 경우 제2 가닥상의 5' 말단 영역의 상응하는 잔기와 미스매치된다). 2개의 말단 미스매치된 잔기를 갖는 예시적인 DNA:DNA-연장된 DsiRNA 제제는 다음과 같다:
상기식에서 "X"=RNA이고, "M"= 가닥이 어닐링하는 경우 달리 상보적인 가닥의 상응하는 "M" 잔기와 염기쌍(수소 결합)을 형성하지 않는 핵산 잔기(RNA, DNA 또는 비천연 또는 변형된 핵산)이고, "D"=DNA이고 "N"=l 내지 50 이상이지만 임의로 1 내지 15 또는 임의로, 1 내지 8이다. "N*"= 0 내지 15 이상이지만 임의로 0, 1, 2, 3, 4, 5 또는 6개이다. 상기 제제의 임의의 잔기는 임의로 2'-O 메틸 RNA 단량체일 수 있고- 상기 도시된 제제에 대해 나타낸 바와 같이 하부(제2) 가닥의 3' 말단 잔기로부터 개시하여 번갈아 위치하는 2'-O-메틸 RNA 단량체가 또한 상기 '평활/프레이" DsiRNA 제제에 사용될 수 있다. 하나의 양태에서, 상부 가닥(제1 가닥)은 센스 가닥이고 하부 가닥(제2 가닥)은 안티센스 가닥이다. 또한, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다. 비대칭/오버행 제제에 대해 상기 나타낸 것들과 병행하는 변형 및 DNA:DNA 연장 패턴이 또한 "평활/프레이" 제제에 혼입될 수 있다.
또 다른 양태에서, 다이서 절단의 특이적 지시를 통해 기능하도록 모델링된 부위에 위치하는 데옥시리보뉴클레오타이드를 포함하지만 여전히 dsNA 구조물에서 염기쌍 데옥시리보뉴클레오타이드의 존재를 필요로 하지 않는 길이 연장된 DsiRNA 제제가 제공된다. 상기 분자의 예시적인 구조는 다음과 같다:
또는
상기식에서, "X"=RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 0-10개의 RNA 단량체로 이루어진 임의의 오버행 도메인이고, 특정 양태에서, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1-4개의 RNA 단량체로 이루어진 오버행 도메인이고, "D"=DNA이다. "N*"는 0 내지 15개 이상이지만 임의로 0, 1, 2, 3, 4, 5 또는 6이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또는 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다. 상기 구조는 다이서가 이의 주요 프로세싱 후 형태로서 최저의 21량체 듀플렉스를 절단하도록 하는 모델이 된다.
상기 구조물의 하부 가닥이 안티센스 가닥인 양태에서, 안티센스 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기에서 2개의 데옥시리보뉴클레오타이드 잔기가 위치하여 오프-표적 효과를 감소시킬 가능성이 높다(이전의 연구는 안티센스 가닥의 5' 말단으로부터 적어도 맨끝에서 2번째 위치의 2'-O-메틸 변형이 오프-표적 효과를 감소시킴을 보여주었다;문헌참조: 예를 들어, US 2007/0223427).
본 발명의 연장된 DsiRNA는 광범위한 변형 패턴(예를 들어, 연장된 DsiRNA 제제내 2'-O-메틸 RNA 패턴)을 가질 수 있다. 본 발명의 연장된 DsiRNA의 제2 가닥의 특정 바람직한 변형 패턴은 하기에 제공된다 - 많은 하기 구조물이 비-연장된 DsiRNA의 변형을 도시하고 있지만 당업자는 나타낸 변형 패턴이 또한 본원의 다른 문단에서 기재된 완전한 범위의 연장된 DsiRNA 구조물에 적용됨을 인지하는 것으로 주지된다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고 "D"는 DNA이다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또한 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다.
또 다른 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
또 다른 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
추가의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
추가의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
다른 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 는 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 는 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
추가의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
추가의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
특정 추가의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
추가의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
추가의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "Y"는 임의로 2'-O-메틸 RNA 단량체인 1 내지 4개 RNA 단량체로 이루어진 오버행 도메인이고, 밑줄친 잔기는 2'-O-메틸 RNA 단량체이고 "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
하나의 양태에서, DsiRNA는 다음을 포함한다:
상기식에서, "X"=RNA이고, "p"= 포스페이트 그룹이고, "X"= 2'-O-메틸 RNA이고, "D"=DNA이다. 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
또 다른 양태에서, DsiRNA는 다이서 절단을 배향하는 작용을 하는 1 내지 3개의 미스매치된 잔기를 갖는 동일한 길이의 가닥을 포함한다(구체적으로, 3' 말단 잔기로부터 넘버링하는 경우 DsiRNA의 제1 가닥상에서 1, 2, 또는 3번 위치 중 하나 이상은 제1 및 제2 가닥이 서로 어닐링하는 경우 제2 가닥상의 5' 말단 영역의 상응하는 잔기와 미스매치된다). 2개의 말단 미스매치된 잔기를 갖는 예시적인 27량체 DsiRNA 제제는 다음과 같다:
상기식에서 "X"=RNA이고, "p"가 포스페이트 그룹이고, "M"= 가닥이 어닐링하는 경우 달리 상보적인 가닥의 상응하는 "M" 잔기와 염기쌍(수소 결합)을 형성하지 않는 핵산 잔기(RNA, DNA 또는 비천연 또는 변형된 핵산)이다. 상기 제제의 임의의 잔기는 임의로 2'-O 메틸 RNA 단량체일 수 있고- 상기 도시된 비대칭 제제에 대해 나타낸 바와 같이 하부(제2) 가닥의 3' 말단 잔기로부터 개시하여 번갈아 위치하는 2'-O-메틸 RNA 단량체가 또한 상기 '평활/프레이" DsiRNA 제제에 사용될 수 있다. 하나의 양태에서, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다. 또는, 하부 가닥은 센스 가닥이고 상부 가닥은 안티센스 가닥이다.
본원에 사용된 바와 같이, "DsiRNAmm"은 DsiRNA의 센스 및 안티센스 가닥에 의해 형성된 듀플렉스의 1개, 2개, 3개 또는 4개의 미스매치된 염기쌍을 함유하는 "미스매치 내성 영역"을 갖는 DisRNA를 언급하고, 여기서, 상기 미스매치는 DsiRNA의 어느 한 말단의 2개 말단 염기쌍간의 위치에서 (따라서 상기 염기쌍을 포함하지 않음) DsiRNA내에 위치한다. 미스매치된 염기쌍은 본원에서 상응하는 표적 핵산의 돌출된 Ago2 절단 부위의 위치와 관련하여 본원에 정의된 "미스매치 내성 영역"내에 위치한다. 상기 미스매치 내성 영역은 표적 가닥의 돌출된 Ago2 절단 부위의 업스트림에 위치한다. 본원에서 "업스트림"은 DsiRNAmm 듀플렉스의 5' 최외곽 부분으로서 이해되고, 여기서, 5'는 DsiRNA 듀플렉스의 센스 가닥의 배향을 언급한다. 따라서, 미스매치 내성 영역은 표적 핵산의 돌출된 Ago2 절단 부위에 상응하는 센스(패신저) 가닥상의 염기의 업스트림이고(도 14 참조) 또는 DsiRNAmm의 안티센스(가이드) 가닥을 언급하는 경우, 미스매치 내성 영역은 또한 표적 핵산의 돌출된 Ago2 절단 부위, 즉 DsiRNAmm(여기서, 안티센스 가닥의 1번 위치는 안티센스 가닥의 5' 말단 뉴클레오타이드이고 도 20을 참조한다)의 안티센스 가닥의 3' 최외곽 부분에 상보적인 염기의 다운스트림에 위치하는 것으로서 기술될 수 있다.
예를 들어, 도 33에 도시된 바와 같은 하나의 양태에서, 미스매치 내성 영역은 듀플렉스의 센스 가닥의 5' 말단에서 개시하는 뉴클레오타이드로부터 넘버링되는 경우 염기쌍 3 내지 9번 사이에 위치하고 이들을 포함한다. 따라서, 본 발명의 DsiRNAmm은 우측방향으로 연장된 DsiRNA의 센스 가닥의 3, 4, 5, 6, 7, 8 또는 9번 위치중 임의의 하나에서 단일 미스매치된 염기쌍을 갖는다(여기서, 1번 위치는 센스 가닥의 5' 말단 뉴클레오타이드이고 9번 위치는 센스 가닥 서열에 상응하는 표적 RNA 서열의 돌출된 Ago2 절단 부위의 5'에 바로 인접한 센스 가닥의 뉴클레오타이드 잔기이다). 센스 가닥의 3, 4, 5, 6, 7, 8 또는 9번 위치중 어느 하나에서 미스매치된 염기쌍 뉴클레오타이드를 갖는 DsiRNAmm에 대한 특정 양태에서, 안티센스 가닥의 상응하는 미스매치된 염기쌍 뉴클레오타이드는 DsiRNAmm 센스 가닥 서열과 미스매치된 염기쌍을 형성할 뿐만 아니라 DsiRNAmm 표적 RNA 서열과 미스매치된 염기쌍을 형성한다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에 미스매치된 염기쌍에서 파괴되고 상보성은 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열사이에서 유사하게 파괴된다). 또 다른 양태에서, DsiRNAmm의 안티센스 가닥의 미스매치 염기쌍 뉴클레오타이드는 DsiRNAmm의 센스 가닥 서열의 상응하는 뉴클레오타이드와 유일하게 미스매치된 염기쌍을 형성하고 상응하는 표적 RNA 서열 뉴클레오타이드와는 염기쌍을 형성하지 않는다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에서 미스매치된 염기쌍에서 파괴되지만 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열간에 상보성은 유지된다).
상기된 바와 같은 미스매치 내성 영역(미스매치 영역)내에 단일 미스매치된 염기쌍을 갖는 본 발명의 DsiRNAmm(예를 들어, 센스 가닥의 3, 4, 5, 6, 7, 8 또는 9번 위치중 어느 하나에서 미스매치된 뉴클레오타이드 잔기를 함유하는 DsiRNAmm)은 추가로 1개, 2개 또는 3개의 추가의 미스매치된 염기쌍을 포함할 수 있다. 바람직한 양태에서, DsiRNAmm의 이들 1개, 2개 또는 3개의 추가의 미스매치된 염기쌍은 센스 가닥(및 안티센스 가닥의 상응하는 잔기에서)의 3, 4, 5, 6, 7, 8 및/또는 9번 위치에 존재한다. 하나의 추가의 미스매치된 염기쌍이 DsiRNAmm내에 존재하는 하나의 양태에서, 센스 가닥의 2개의 미스매치된 염기쌍은 예를 들어, 센스 가닥의 4번 위치 및 6번 위치 둘다의 뉴클레오타이드에서 존재할 수 있고 미스매치는 또한 안티센스 가닥의 상응하는 뉴클레오타이드 잔기에 존재한다..
2개의 미스매치된 염기쌍을 갖는 DsiRNAmm 제제에서, 미스매치는 연속으로 (예를 들어, 센스 가닥 뉴클레오타이드 서열을 따라 연속 위치에서) 존재할 수 있다. 또한, 안티센스 가닥 서열과 미스매치된 염기쌍을 형성하는 센스 가닥의 뉴클레오타이드에는 안티센스 가닥 서열과 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 4번 및 5번 위치에서가 아니라 3번 및 6번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 센스 가닥 3번 및 6번 위치의 미스매치된 잔기에는 안티센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 2개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 안티센스 가닥 서열과 미스매치된 염기쌍을 형성하는 센스 가닥의 2개의 잔기(센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍간에 위치하는 0, 1, 2, 3, 4 또는 5개의 매치된 염기쌍과 함께 존재할 수 있다.
3개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에서, 미스매치는 연속으로 (예를 들어, 센스 가닥 뉴클레오타이드 서열을 따라 3연속으로) 존재할 수 있다. 또한, 안티센스 가닥 서열과 미스매치된 염기쌍을 형성하는 센스 가닥의 뉴클레오타이드에는 안티센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 5번, 6번 및 7번 위치에서가 아니라 3번, 4번 및 8번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 센스 가닥 3번 및 4번 위치의 미스매치된 잔기는 서로 인접해 있고 센스 가닥 위치 4번 및 8번의 미스매치된 잔기에는 안티센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 3개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 안티센스 가닥 서열과 미스매치된 염기쌍을 형성하는 센스 가닥의 3개의 잔기(센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍의 임의의 2개 쌍간에 위치하는 0, 1, 2, 3 또는 4개의 매치된 염기쌍과 함께 존재할 수 있다.
4개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에서, 미스매치는 연속으로 (예를 들어, 센스 가닥 뉴클레오타이드 서열을 따라 4연속으로) 존재할 수 있다. 또는, 안티센스 가닥 서열과 미스매치된 염기쌍을 형성하는 센스 가닥의 뉴클레오타이드에는 안티센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 4번 및 6번 위치에서가 아니라 3번, 5번, 7번 및 8번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 센스 가닥 7번 및 8번 위치의 미스매치된 잔기는 서로 인접해 있고 센스 가닥 위치 3번 및 5번의 미스매치된 잔기에는 안티센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 1개의 뉴클레오타이드가 산재한다 - 유사하게 센스 가닥 위치 5번 및 7번의 미스매치된 잔기에는 또한 안티센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 하나의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 안티센스 가닥 서열과 미스매치된 염기쌍을 형성하는 센스 가닥의 4개의 잔기(센스 가닥의 미스매치 내성 영역내 위치하는)는 이들 미스매치된 염기쌍중 임의의 2개 염기쌍 사이에 위치하는 0, 1, 2, 또는 3개의 매치된 염기쌍과 함께 존재할 수 있다.
예를 들어, 도 39에 도시된 바와 같은 또 다른 양태에서, 본 발명의 DsiRNAmm은 좌측방향으로 연장된 DsiRNA의 안티센스 가닥의 13, 14, 15, 16, 17, 18, 19, 20 또는 21번 위치중 임의의 하나에서 단일 미스매치된 염기쌍 뉴클레오타이드를 갖는 미스매치 내성 영역을 포함한다(여기서, 1번 위치는 안티센스 가닥의 5' 말단 뉴클레오타이드이고 13번 위치는 안티센스 가닥 서열에 충분히 상보적인 표적 RNA 서열의 돌출된 Ago2 절단 부위의 안티센스 가닥에서 3'(다운스트림)에 바로 인접한 안티센스 가닥의 뉴클레오타이드 잔기이다). 특정 양태에서, DsiRNAmm의 센스 가닥과 관련하여 안티센스 가닥의 13, 14, 15, 16, 17, 18, 19, 20 또는 21번의 임의의 위치에서 미스매치된 염기 쌍 뉴클레오타이드를 갖는 DsiRNAmm에 대해 안티센스 가닥의 미스매치된 염기쌍 뉴클레오타이드는 DsiRNAmm 센스 가닥 서열과 미스매치된 염기쌍을 형성할 뿐만 아니라 DsiRNAmm 표적 RNA 서열과 미스매치된 염기쌍을 형성한다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에서 미스매치된 염기쌍에서 파괴되고 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열간에 상보성도 유사하게 파괴된다). 또 다른 양태에서, DsiRNAmm의 안티센스 가닥의 미스매치 염기쌍 뉴클레오타이드는 DsiRNAmm의 센스 가닥 서열의 상응하는 뉴클레오타이드와 미스매치된 염기쌍을 유일하게 형성하고 상응하는 표적 RNA 서열 뉴클레오타이드와 염기쌍을 형성하지 않는다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에서 미스매치된 염기쌍에서 파괴되지만 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열간에 상보성은 유지된다).
상기된 바와 같은 미스매치 내성 영역내에 단일 미스매치된 염기쌍을 갖는 본 발명의 DsiRNAmm(예를 들어, 안티센스 가닥의 13, 14, 15, 16, 17, 18, 19, 20 또는 21 위치에서 미스매치된 뉴클레오타이드 잔기를 함유하는 DsiRNAmm)은 추가로 1개, 2개 또는 3개의 추가의 미스매치된 염기쌍을 포함할 수 있다. 바람직한 양태에서, DsiRNAmm의 이들 1개, 2개 또는 3개의 추가의 미스매치된 염기쌍은 안티센스 가닥(및 센스 가닥의 상응하는 잔기에서)의 13, 14, 15, 16, 17, 18, 19, 20 및/또는 21번에 존재한다. 하나의 추가의 미스매치된 염기쌍이 DsiRNAmm내에 존재하는 하나의 양태에서, 안티센스 가닥의 2개의 미스매치된 염기쌍은 예를 들어, 안티센스 가닥의 14번 위치 및 18번 위치 둘다의 뉴클레오타이드에서 존재할 수 있고 미스매치는 또한 센스 가닥의 상응하는 뉴클레오타이드 잔기에 존재한다.
2개의 미스매치된 염기쌍을 갖는 DsiRNAmm 제제에서, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 연속 위치에서) 존재할 수 있다. 또는, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 14번 및 15번 위치에서가 아니라 13번 및 16번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 13번 및 16번 위치의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 2개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 2개의 잔기(센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍간에 위치하는 0, 1, 2, 3, 4, 5, 6 또는 7개의 매치된 염기쌍과 함께 존재할 수 있다.
3개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에 대해, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 3연속으로) 존재할 수 있다. 또는, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 15번, 16번 및 17번 위치에서가 아니라 13번, 14번 및 18번 위치에서 미스매치된 뉴클레오레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 13번 및 14번 위치의 미스매치된 잔기는 서로 인접해 있고 안티센스 가닥 위치 14번 및 18번의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 3개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 3개의 잔기(안티센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍의 임의의 2개 쌍간에 위치하는 0, 1, 2, 3, 4, 5 또는 6개의 매치된 염기쌍과 함께 존재할 수 있다.
4개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에 대해, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 4연속으로) 존재할 수 있다. 또한, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 14번 및 16번 위치에서가 아니라 13번, 15번, 17번 및 18번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 17번 및 18번 위치의 미스매치된 잔기는 서로 인접해 있고 안티센스 가닥 위치 13번 및 15번의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 1개의 뉴클레오타이드가 산재한다 - 유사하게 안티센스 가닥 위치 15번 및 17번의 미스매치된 잔기에는 또한 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 하나의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 4개의 잔기(안티센스 가닥의 미스매치 내성 영역내 위치하는)는 이들 미스매치된 염기쌍중 임의의 2개 염기쌍 사이에 위치하는 0, 1, 2, 3, 4 또는 5개의 매치된 염기쌍과 함께 존재할 수 있다.
예를 들어, 도 40에 도시된 바와 같은 추가의 양태에서, 본 발명의 DsiRNAmm은 좌측방향으로 연장된 DsiRNA의 안티센스 가닥의 11, 12, 13, 14, 15, 16, 17, 18 또는 19번 위치중 임의의 하나에서 단일 미스매치된 염기쌍 뉴클레오타이드를 갖는다(여기서, 1번 위치는 안티센스 가닥의 5' 말단 뉴클레오타이드이고 11번 위치는 안티센스 가닥 서열에 충분히 상보적인 표적 RNA 서열의 돌출된 Ago2 절단 부위의 안티센스 가닥에서 3'(다운스트림)에 바로 인접한 안티센스 가닥의 뉴클레오타이드 잔기이다). 특정 양태에서, DsiRNAmm의 센스 가닥과 관련하여 안티센스 가닥의 11, 12, 13, 14, 15, 16, 17, 18 또는 19번의 임의의 위치에서 미스매치된 염기 쌍 뉴클레오타이드를 갖는 DsiRNAmm에 대해 안티센스 가닥의 미스매치된 염기쌍 뉴클레오타이드는 DsiRNAmm 센스 가닥 서열과 미스매치된 염기쌍을 형성할 뿐만 아니라 DsiRNAmm 표적 RNA 서열과 미스매치된 염기쌍을 형성한다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에서 미스매치된 염기쌍에서 파괴되고 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열간에 상보성도 유사하게 파괴된다). 또 다른 양태에서, DsiRNAmm의 안티센스 가닥의 미스매치 염기쌍 뉴클레오타이드는 DsiRNAmm의 센스 가닥 서열의 상응하는 뉴클레오타이드와 미스매치된 염기쌍을 유일하게 형성하고 상응하는 표적 RNA 서열 뉴클레오타이드와 안티센스 가닥 뉴클레오타이드 염기쌍을 형성하지 않는다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에서 미스매치된 염기쌍에서 파괴되지만 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열간에 상보성은 유지된다).
상기된 바와 같은 미스매치 내성 영역내에 단일 미스매치된 염기쌍을 갖는 본 발명의 DsiRNAmm(예를 들어, 안티센스 가닥의 11, 12, 13. 14, 15, 16, 17, 18 또는 19번 위치에서 미스매치된 뉴클레오타이드 잔기를 함유하는 DsiRNAmm)은 추가로 1개, 2개 또는 심지어 3개의 추가의 미스매치된 염기쌍을 포함할 수 있다. 바람직한 양태에서, DsiRNAmm의 이들 1개, 2개 또는 3개의 추가의 미스매치된 염기쌍은 안티센스 가닥(및 센스 가닥의 상응하는 잔기에서)의 11, 12, 13. 14, 15, 16, 17, 18 및/또는 19번에 존재한다. 하나의 추가의 미스매치된 염기쌍이 DsiRNAmm내에 존재하는 하나의 양태에서, 안티센스 가닥의 2개의 미스매치된 염기쌍은 예를 들어, 안티센스 가닥의 14번 위치 및 18번 위치 둘다의 뉴클레오타이드에서 존재할 수 있고 미스매치는 또한 센스 가닥의 상응하는 뉴클레오타이드 영역에 존재한다.
2개의 미스매치된 염기쌍을 갖는 DsiRNAmm 제제에서, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 연속 위치에서) 존재할 수 있다. 또한, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 13번 및 14번 위치에서가 아니라 12번 및 15번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 12번 및 15번 위치의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 2개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 2개의 잔기(센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍간에 위치하는 0, 1, 2, 3, 4, 5, 6 또는 7개의 매치된 염기쌍과 함께 존재할 수 있다.
3개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에 대해, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 3연속으로) 존재할 수 있다. 또한, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 15번, 16번 및 17번 위치에서가 아니라 13번, 14번 및 18번 위치에서 미스매치된 뉴클레레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 13번 및 14번 위치의 미스매치된 잔기는 서로 인접해 있고 안티센스 가닥 위치 14번 및 18번의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 3개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 3개의 잔기(안티센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍의 임의의 2개 쌍간에 위치하는 0, 1, 2, 3, 4, 5 또는 6개의 매치된 염기쌍과 함께 존재할 수 있다.
4개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에 대해, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 4연속으로) 존재할 수 있다. 또한, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 14번 및 16번 위치에서가 아니라 13번, 15번, 17번 및 18번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 17번 및 18번 위치의 미스매치된 잔기는 서로 인접해 있고 안티센스 가닥 위치 13번 및 15번의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 1개의 뉴클레오타이드가 산재한다 - 유사하게 안티센스 가닥 위치 15번 및 17번의 미스매치된 잔기에는 또한 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 하나의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 4개의 잔기(안티센스 가닥의 미스매치 내성 영역내 위치하는)는 이들 미스매치된 염기쌍중 임의의 2개 염기쌍 사이에 위치하는 0, 1, 2, 3, 4 또는 5개의 매치된 염기쌍과 함께 존재할 수 있다.
예를 들어, 도 41에 도시된 바와 같은 추가의 양태에서, 본 발명의 DsiRNAmm은 좌측방향으로 연장된 DsiRNA의 안티센스 가닥의 15, 16, 17, 18, 19, 20, 21, 22 또는 23번 위치중 임의의 하나에서 단일 미스매치된 염기쌍 뉴클레오타이드를 갖는다(여기서, 1번 위치는 안티센스 가닥의 5' 말단 뉴클레오타이드이고 15번 위치는 안티센스 가닥 서열에 충분히 상보적인 표적 RNA 서열의 돌출된 Ago2 절단 부위의 안티센스 가닥에서 3'(다운스트림)에 바로 인접한 안티센스 가닥의 뉴클레오타이드 잔기이다). 특정 양태에서, DsiRNAmm의 센스 가닥과 관련하여 안티센스 가닥의 15, 16, 17, 18, 19, 20, 21, 22 또는 23번의 임의의 위치에서 미스매치된 염기 쌍 뉴클레오타이드를 갖는 DsiRNAmm에 대해 안티센스 가닥의 미스매치된 염기쌍 뉴클레오타이드는 DsiRNAmm 센스 가닥 서열과 미스매치된 염기쌍을 형성할 뿐만 아니라 DsiRNAmm 표적 RNA 서열과 미스매치된 염기쌍을 형성한다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에서 미스매치된 염기쌍에서 파괴되고 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열간에 상보성도 유사하게 파괴된다). 또 다른 양태에서, DsiRNAmm의 안티센스 가닥의 미스매치 염기쌍 뉴클레오타이드는 DsiRNAmm의 센스 가닥 서열의 상응하는 뉴클레오타이드와 미스매치된 염기쌍을 유일하게 형성하고 상응하는 표적 RNA 서열 뉴클레오타이드와 안티센스 가닥 뉴클레오타이드 염기쌍을 형성하지 않는다(따라서, 안티센스 가닥 서열과 센스 가닥 서열간의 상보성은 DsiRNAmm내에서 미스매치된 염기쌍에서 파괴되지만 DsiRNAmm의 안티센스 가닥 서열과 표적 RNA 서열간에 상보성은 유지된다).
상기된 바와 같은 미스매치 내성 영역내에 단일 미스매치된 염기쌍을 갖는 본 발명의 DsiRNAmm(예를 들어, 안티센스 가닥의 15, 16, 17, 18, 19, 20, 21, 22 또는 23번 위치에서 미스매치된 뉴클레오타이드 잔기를 함유하는 DsiRNAmm)은 추가로 1개, 2개 또는 심지어 3개의 추가의 미스매치된 염기쌍을 포함할 수 있다. 바람직한 양태에서, DsiRNAmm의 이들 1개, 2개 또는 3개의 추가의 미스매치된 염기쌍은 안티센스 가닥(및 센스 가닥의 상응하는 잔기에서)의 15, 16, 17, 18, 19, 20, 21, 22 및/또는 23번에 존재한다. 하나의 추가의 미스매치된 염기쌍이 DsiRNAmm내에 존재하는 하나의 양태에서, 안티센스 가닥의 2개의 미스매치된 염기쌍은 예를 들어, 안티센스 가닥의 16번 위치 및 20번 위치 둘다의 뉴클레오타이드에서 존재할 수 있고 미스매치는 또한 센스 가닥의 상응하는 뉴클레오타이드 잔기에 존재한다.
2개의 미스매치된 염기쌍을 갖는 DsiRNAmm 제제에서, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 연속 위치에서) 존재할 수 있다. 또는, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 17, 18 및 19번 위치에서가 아니라 16번 및 20번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 16번 및 20번 위치의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 3개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 2개의 잔기(센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍간에 위치하는 0, 1, 2, 3, 4, 5, 6 또는 7개의 매치된 염기쌍과 함께 존재할 수 있다.
3개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에 대해, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 3연속으로) 존재할 수 있다. 또는, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 18번, 19번 및 20번 위치에서가 아니라 16번, 17번 및 21번 위치에서 미스매치된 뉴클레오레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 16번 및 17번 위치의 미스매치된 잔기는 서로 인접해 있고 안티센스 가닥 위치 17번 및 21번의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 3개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 3개의 잔기(안티센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치된 염기쌍의 임의의 2개 쌍간에 위치하는 0, 1, 2, 3, 4, 5 또는 6개의 매치된 염기쌍과 함께 존재할 수 있다.
4개의 미스매치된 염기쌍을 갖는 특정 DsiRNAmm 제제에 대해, 미스매치는 연속으로 (예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 4연속으로) 존재할 수 있다. 또한, 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 센스 가닥 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 18번 및 20번 위치에서가 아니라 17번, 19번, 21번 및 22번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNAmm에 대해, 안티센스 가닥 21번 및 22번 위치의 미스매치된 잔기는 서로 인접해 있고 안티센스 가닥 위치 17번 및 19번의 미스매치된 잔기에는 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 1개의 뉴클레오타이드가 산재한다 - 유사하게 안티센스 가닥 위치 19번 및 21번의 미스매치된 잔기에는 또한 센스 가닥의 상응하는 잔기와 매치된 염기쌍을 형성하는 하나의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 센스 가닥 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 4개의 잔기(안티센스 가닥의 미스매치 내성 영역내 위치하는)는 이들 미스매치된 염기쌍중 임의의 2개 염기쌍 사이에 위치하는 0, 1, 2, 3, 4 또는 5개의 매치된 염기쌍과 함께 존재할 수 있다.
명확성때문에, 상기 DsiRNAmm 제제내 미스매치된 뉴클레오타이드 잔기의 위치는 상기 DsiRNAmm의 센스 또는 안티센스 가닥의 5' 말단 잔기를 기준으로 넘버링한다. 도 20, 21 및 22에 예시된 상이한 좌측 연장된 DsiRNAmm 제제에 대해 주지된 바와 같이, 안티센스 가닥의 미스매치 내성 영역(미스매치 영역)내에 위치의 넘버링은 돌출된 Ago2 절단 부위에 대한 안티센스 가닥의 5' 말단과 근접한 변형과 함께 변화할 수 있다. 따라서, 안티센스 가닥 또는 센스 가닥내 바람직한 미스매치 부위의 위치는 또한 돌출된 Ago2 절단 부위로의 상기 미스매치의 허용가능한 근접성으로서 동정될 수 있다. 따라서, 하나의 바람직한 양태에서, DsiRNAmm의 센스 가닥의 미스매치 뉴클레오타이드의 위치는 상응하는 표적 RNA 서열의 돌출된 Ago2 절단 부위의 바로 5'(업스트림)에 위치한다. 다른 바람직한 양태에서, DsiRNAmm의 센스 가닥의 미스매치 뉴클레오타이드는 돌출된 Ago2 절단 부위의 5'(업스트림)에서 2개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 5'(업스트림)에서 3개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 5'(업스트림)에서 4개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 5'(업스트림)에서 5개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 5'(업스트림)에서 6개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 5'(업스트림)에서 7개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 5'(업스트림)에서 8개의 뉴클레오타이드, 또는 돌출된 Ago2 절단 부위의 5'(업스트림)에서 9개의 뉴클레오타이드에 위치하는, 센스 가닥의 뉴클레오타이드 잔기에 위치한다.
예시적인 단일 미스매치 함유 25/27량체 DsiRNAs (DsiRNAmm)은 하기의 구조물을 포함한다(상기 미스매치 함유 구조물은 또한 본원에 나타낸 다른 예시적인 DsiRNA 구조물내로 혼입될 수 있다).
상기식에서, "X"=RNA이고, "D"=DNA이고, "p"= 포스페이트 그룹이고, "M"= 가닥이 어닐링하는 경우 다른 상보적인 가닥의 상응하는 "M" 잔기와 염기쌍(수소 결합)을 형성하지 않는 핵산 잔기(RNA, DNA 또는 비천연 또는 변형된 핵산)이다. 상기 제제의 임의의 잔기는 임의로 2'-O-메틸 RNA 단량체일 수 있고 - 상기된 바와 같이 하부 (제2) 가닥의 3' 말단 잔기에서 시작하여 번갈아 위치하는 2'-O-메틸 RNA 단량체는 또한 상기 DsiRNAmm 제제에 사용될 수 있다. 상기 미스매치 구조를 위해, 상부 가닥은 센스 가닥이고 하부 가닥은 안티센스 가닥이다.
특정 양태에서, 본 발명의 DsiRNA는 표적 RNA 서열을 기준으로 존재하지만 근본적으로 DsiRNA의 2개의 가닥내에 미스매치된 염기쌍으로서 존재하지 않는 미스매치를 함유할 수 있고 - 따라서 DsiRNA는 DsiRNA의 제1 및 제2 가닥 사이에 완벽한 상보성을 가질 수 있고 여전히 표적 RNA를 기준으로 미스매치된 잔기를 갖는다(이것은 특정 양태에서 효력 및/또는 효능 및/또는 효과의 지속성을 촉진시키는데 유리할 수 있다). 특정 양태에서, 미스매치가 안티센스 가닥과 표적 RNA 서열 사이에 존재하는 경우, 미스매치의 위치는 표적 영역의 돌출된 Ago2 절단 부위의 5'에 위치하는 센스 가닥의 서열에 상응하는 위치에서 안티센스 가닥 - 예를 들어, 표적 서열의 돌출된 Ago2 절단 부위에 상보적인 안티센스 잔기의 3'로 안티센스 가닥내에 위치하는 안티센스 가닥 잔기내에 위치한다(상기 영역은 예를 들어, 상기 DsiRNA의 돌출된 "씨드 영역"과는 명백히 구분된 "미스매치 영역"으로서 도 33에 지적된다).
표적 서열에 대해 단일 미스매치된 잔기를 함유하는 예시적인 25/27량체 DsiRNA는 하기의 바람직한 구조를 포함한다.
상기식에서, "X"=RNA이고, "D"=DNA이고, "p"= 포스페이트 그룹이고, "E"= 가닥이 어닐링하는 경우 다른 상보적인(표적) 가닥의 상응하는 "A" RNA잔기와 염기쌍(수소 결합)을 형성하지 않지만 상응하는 "B" 잔기(여기서, "B" 잔기는 또한 RNA, DNA 또는 비천연 또는 변형된 핵산이다)와 염기쌍을 형성하는 핵산 잔기(RNA, DNA 또는 비천연 또는 변형된 핵산)이다. 상기 제제의 임의의 잔기는 임의로 2'-O-메틸 RNA 단량체일 수 있고 - 예를 들어, 상기된 바와 같이 하부 (제2) 가닥의 3' 말단 잔기에서 시작하여 번갈아 위치하는 2'-O-메틸 RNA 단량체, 본원에 기재된 바와 같은 2'-O-메틸 및/또는 다른 변형이 또한 상기 DsiRNA 제제에 사용될 수 있다.
상기 예시된 구조물외에 본 발명의 DsiRNA는 표적 RNA 서열과 추가로 미스매치를 형성하는 1개, 2개 또는 3개의 추가의 잔기를 가질 수 있다. 상기 미스매치는 연속적일 수 있거나 표적 RNA 서열과 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다. 매치된 염기쌍을 형성하는 뉴클레오타이드가 산재하는 경우, 미스매치된 잔기는 상기 미스매치 형성 잔기간에 1개, 2개, 3개, 4개, 5개, 6개, 7개 또는 8개 염기쌍 뉴클레오타이드 간격으로 단일 가닥내에서 서로 이격되어 위치할 수 있다.
상기된 DsiRNAmm 제제에 대하여, 표적 RNA 서열과 미스매치된 염기쌍을 형성하는(그러나 상응하는 센스 가닥 뉴클레오타이드와 미스매치를 형성하거나 형성할 수 없는) 안티센스 가닥 뉴클레오타이드에 대한 DsiRNA내 바람직한 위치는 DsiRNA의 돌출된 Ago2 절단 부위에 상보적인 안티센스 가닥 서열의 3'(다운스트림)에 위치한 안티센스 가닥 영역내에 있다(예를 들어, 도 39에서, "미스매치 영역"으로 표지된 안티센스 가닥의 영역은 미스매치 형성 잔기를 위해 바람직하고 도 39에 나타낸 제제에 대한 안티센스 가닥의 13번 내지 21번 위치에 존재할 수 있다). 따라서, 하나의 바람직한 양태에서, DsiRNAmm의 안티센스 가닥의 미스매치 뉴클레오타이드의 위치(표적 RNA 서열과 상대적으로)는 상응하는 표적 RNA 서열의 돌출된 Ago2 절단 부위의 안티센스 가닥 서열내 3'(다운스트림)에 바로 인접하게 위치하는 안티센스 가닥의 뉴클레오타이드 잔기이다. 다른 바람직한 양태에서, DsiRNAmm의 센스 가닥의 미스매치 뉴클레오타이드는 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 2개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 3개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 4개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 5개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 6개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 7개의 뉴클레오타이드, 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 8개의 뉴클레오타이드, 또는 돌출된 Ago2 절단 부위의 3'(다운스트림)에서 9개의 뉴클레오타이드에 위치하는, 안티센스 가닥의 뉴클레오타이드 잔기에 위치한다.
안티센스 가닥의 2개의 미스매치 형성 뉴클레오타이드를 갖는 DsiRNA 제제(여기서, 미스매치 형성 뉴클레오타이드는 표적 RNA 서열과 상대적으로 형성되는 미스매치이다)에서, 미스매치는 연속으로(예를 들어, 안티센스 가닥 뉴클레오타이드 잔기를 따라 연속 위치에서) 존재할 수 있다. 또는 표적 RNA 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 표적 RNA 서열과 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 14번 및 15번 위치에서가 아니라 13번 및 16번 위치(도 39에 나타낸 구조물의 안티센스 가닥의 5' 말단으로 개시(1번 위치)하여)에서 미스매치 형성 뉴클레오타이드를 갖는 DsiRNA에 대해, 센스 가닥 13번 및 16번 위치의 미스매치된 잔기에는 표적 RNA 서열의 상응하는 잔기와 매치된 염기쌍을 형성하는 2개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 표적 RNA 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 2개의 잔기(안티센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치 형성 염기쌍 사이에 위치된 0. 1, 2, 3, 4 또는 5개의 매치된 염기쌍(표적 RNA 서열과 관련하여)과 함께 존재할 수 있다.
3개의 미스매치 형성 염기쌍(표적 RNA 서열에 대하여 미스매치 형성)을 갖는 특정 DsiRNA에 대하여, 미스매치 형성 뉴클레오타이드는 연속으로(예를 들어, 안티센스 가닥 뉴클레오타이드 서열을 따라 3중 연속으로) 존재할 수 있다. 또는 표적 RNA 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 표적 RNA 서열과 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 15, 16번 및 17번 위치에서가 아니라 13번, 14번 및 18번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNA에 대해, 안티센스 가닥 13번 및 14번 위치의 미스매치 형성 잔기는 서로 인접해 있고, 안티센스 가닥 14번 및 18번 위치의 미스매치 형성 잔기에는 표적 RNA의 상응하는 잔기와 매치된 염기쌍을 형성하는 3개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 표적 RNA 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 3개의 잔기(안티센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 미스매치 형성 염기쌍 사이에 위치된 0, 1, 2, 3 또는 4개의 매치된 염기쌍과 함께 존재할 수 있다.
4개의 미스매치 형성 염기쌍(표적 RNA 서열에 대하여 미스매치 형성)을 갖는 특정 DsiRNA에 대하여, 미스매치 형성 뉴클레오타이드는 연속으로(예를 들어, 센스 가닥 뉴클레오타이드 서열을 따라 4중 연속으로) 존재할 수 있다. 또는 표적 RNA 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 뉴클레오타이드에는 표적 RNA 서열과 염기쌍을 형성하는 뉴클레오타이드가 산재할 수 있다(예를 들어, 14번 및 16번 위치에서가 아니라 13번, 15번, 17번 및 18번 위치에서 미스매치된 뉴클레오타이드를 갖는 DsiRNA에 대해, 안티센스 가닥 17번 및 18번 위치의 미스매치 형성 잔기는 서로 인접해 있고, 안티센스 가닥 13번 및 15번 위치의 미스매치 형성 잔기에는 표적 RNA 서열의 상응하는 잔기와 매치된 염기쌍을 형성하는 1개의 뉴클레오타이드가 산재하고 - 유사하게 안티센스 가닥 15번 및 17번 위치의 미스매치 형성 잔기에는 표적 RNA 서열의 상응하는 잔기와 매치된 염기쌍을 형성하는 1개의 뉴클레오타이드가 산재한다). 예를 들어, 상응하는 표적 RNA 서열과 미스매치된 염기쌍을 형성하는 안티센스 가닥의 4개의 잔기(안티센스 가닥의 미스매치 내성 영역내에 위치하는)는 이들 임의의 2개의 미스매치 형성 염기쌍 사이에 위치된 0, 1, 2 또는 3개의 매치된 염기쌍과 함께 존재할 수 있다.
상기 DsiRNAmm 및 다른 DsiRNA 구조는 DsiRNAmm 및 DsiRNA 제제의 특정 구조를 예시하기 위해 기재된다. 상기 DsiRNAmm 및 DsiRNA 구조의 디자인은 예를 들어, 하기 나타낸 DsiRNAmm 형태의 DNA 연장된("DNA 핸들") DsiRNA 제제를 제조하기 위해 사용될 수 있다(도 14 내지 16 및 20 내지 22에 나타낸 바와 같은 미스매치 함유 DsiRNAmm 제제의 디자인을 포함). 상기 예시된 바와 같이, DsiRNA의 안티센스 가닥과 표적 서열 사이에 단일 미스매치(또는 2개, 3개 또는 4개의 미스매치)를 갖지만 임의로 DsiRNA의 센스 및 안티센스 가닥 서열 사이에 완벽한 상보성을 보유할 수 있는 DsiRNA를 또한 디자인할 수 있다.
추가로, 하기 예시된 DsiRNA 제제는 또한 이들의 이중 가닥 및/또는 표적 RNA 정렬된 구조내에 삽입/결실(in/del) 구조를 가질 수 있다. 따라서, 본 발명의 DsiRNA는 표적 RNA 서열과 대비되는 안티센스 가닥 서열 및/또는 센스 가닥 서열과 대비되는 안티센스 가닥 서열에서 in/del 변형을 갖도록 디자인할 수 있고, 상기 in/del 뉴클레오타이드에 대한 바람직한 위치는 미스매치되고/되거나 미스매치 형성 염기쌍에 대해 기재된 위치와 상응한다.
특정 양태에서, 상기 임의의 구조의 "D" 잔기는 하나 이상의 PS-DNA 또는 PS-RNA를 포함한다. 임의로, 상기 임의의 구조의 "D" 잔기는 다이서 절단을 억제하는 하나 이상의 변형된 뉴클레오타이드를 포함한다.
상기된 "DNA-연장된" DsiRNA 제제가 "좌측 연장된" 또는 "우측 연장된"으로서 분류될 수 있지만 단일 제제내에 좌측- 및 우측 연장된 DNA 함유 서열 둘다를 포함하는 DsiRNA 제제(예를 들어, 코어 dsRNA 구조를 둘러싸는 양쪽 플랭크는 dsDNA 연장부이다)를 또한 "우측 연장된" 및 "좌측 연장된" 제제에 대해 본원에 기재된 것들과 유사한 방식으로 제조하고 사용할 수 있다.
몇몇 양태에서, 본 발명의 DsiRNA는 DNA:DNA-연장된 DsiRNA 제제의 센스 및 안티센스 가닥을 연결하는 연결 잔기 또는 도메인을 추가로 포함한다. 임의로, 상기 연결 잔기 도메인은 센스 가닥의 3' 말단과 안티센스 가닥의 5' 말단을 연결한다. 상기 연결 잔기는 화학적(비뉴클레오타이드) 링커, 예를 들어, 올리고메틸렌디올 링커, 올리고에틸렌 글리콜 링커 또는 당업계 인지된 링커 잔기일 수 있다. 또는, 상기 링커는 임의로 연장된 루프 및/또는 테트라루프를 포함하는 뉴클레오타이드일 수 있다.
하나의 양태에서, DsiRNA 제제는 2 염기 3'-오버행과 함께(따라서 상기 DsiRNA 제제는 센스 가닥의 3' 말단/안티센스 가닥의 5' 말단에서 평활 말단을 갖는다), 27 염기쌍 길이를 갖는 센스 가닥, 29 뉴클레오타이드 길이를 갖는 안티센스 가닥 및 안티센스 가닥의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 센스 가닥의 24번 및 25번(센스 가닥의 5'에서 1번 위치로부터 넘버링하여)에 위치하는 데옥시리보뉴클레오타이드를 갖는 비대칭 구조를 갖는다. 또 다른 양태에서, 상기 DsiRNA 제제는 센스 가닥의 3' 말단에서 2개 데옥시리보뉴클레오타이드를 추가로 함유하는 비대칭 구조를 갖는다.
또 다른 양태에서, DsiRNA 제제는 센스 가닥의 3' 말단에 위치한 2 뉴클레오타이드 3' 오버행과 함께, 30 뉴클레오타이드 길이를 갖는 센스 가닥, 및 28 뉴클레오타이드 길이를 갖는 안티센스 가닥을 갖는 비대칭 구조를 갖는다. 상기 DsiRNA 제제의 안티센스 가닥의 3' 말단 및 센스 가닥의 5' 말단은 평활 말단을 형성하고 센스 가닥의 5' 말단에서 1번 위치에서 개시하여 1번 내지 5번 위치는 하이드리드화하여 안티센스 가닥의 3' 말단 영역의 동족 데옥시리보뉴클레오타이드와 듀플렉스를 형성하는 데옥시리보뉴클레오타이드이다. 임의로, 안티센스 가닥의 5' 말단에서 1번 위치로부터 개시하여, 안티센스 가닥의 11번 내지 21번(특정 양태에서 13번 내지 21번)은 센스 가닥의 상응하는 뉴클레오타이드 또는 안티센스 가닥과 표적 RNA 서열이 하이브리드화하여 듀플렉스를 형성하는 경우 표적 RNA 서열의 상응하는 뉴클레오타이드 또는 센스 가닥 및 표적 RNA 서열 둘다와 미스매치 염기쌍을 형성하는 하나 이상의 뉴클레오타이드를 함유한다. 임의로 센스 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 뉴클레오타이드 및 안티센스 가닥의 3'말단의 맨끝 및 맨끝에서 2번째 잔기는 하나 이상의 포스포로티오에이트(임의로 2개의 안티센스 가닥 데옥시리보뉴클레오타이드, 2개의 센스 가닥 데옥시리보뉴클레오타이드 또는 센스 가닥의 5' 말단 및 안티센스 가닥의 3' 말단 둘다의 맨끝 및 맨끝에서 2번째 잔기를 구성하는 모두 4개의 데옥시리보뉴클레오타이드는 포스포로티오에이트를 갖는다)를 포함한다.
DsiRNA의 변형
이중 나선 RNA("dsRNA")의 효과를 억제하는 한가지 주요 인자는 뉴클레아제에 의한 dsRNA의 분해물(예를 들어, siRNA 및 DsiRNA)이다. 3'-엑소뉴클레아제는 혈청에 존재하는 주요 뉴클레오타이드 활성이고 안티센스 DNA 올리고뉴클레오타이드의 3' 말단의 변형은 분해를 차단하는데 중요하다(문헌참조: Eder et al., 1991). RNase-T 계열 뉴클레아제는 siRNA의 조절 및 분해에 관여하는 3'에서 5' 엑소뉴클레오타이드 활성을 갖는 소위 ERI-1로 동정되었다(문헌참조: Kennedy et al., 2004; Hong et al., 2005). 상기 유전자는 또한 마우스에서 Thexl (NM_02067)으로서 또는 사람에 THEXl (NM_153332)로서 공지되어 있고 히스톤 mRNA의 분해에 관여하고; 이것은 또한 siRNA에서 3' 오버행의 분해를 매개하지만 듀플렉스 RNA를 분해하지는 않는다(문헌참조: Yang et al., 2006). 따라서, 본 발명의 DsiRNA를 함유하는 dsRNA의 3' 말단 안정화가 안정성을 개선시킬 것이라고 예측하는 것은 합리적일 수 있다.
XRNl (NM_019001)은 P-체에 있고 miRNA에 의해 표적화되는 mRNA의 분해에 관여하며(문헌참조: Rehwinkel et al., 2005) 또한 siRNA에 의해 지시된 바와 같이 내부 절단에 의해 개시되는 분해를 완료시키는데 관여하는 5'에서 3' 엑소뉴클레아제이다. XRN2 (NM _012255)은 핵 RNA 프로세싱에 관여하는 명백한 5'에서 3' 엑소뉴클레아제이다. 현재 siRNA 및 miRNA의 분해 또는 프로세싱과 연루되어 있지 않지만 이들 2개는 RNA를 분해할 수 있고 또한 고려하기에 중요할 수 있는 공지된 뉴클레아제이다.
RNase A는 RNA를 분해하는, 포유동물에서 주요 엔도뉴클레아제 활성이다. 이것은 ssRNA에 대해 특이적이고 피리미딘 염기의 3' 말단을 절단한다. RNase A 절단물과 일치하는 SiRNA 분해 산물은 혈청중에서 항온처리 후 질량 분광측정기로 검출할 수 있다(문헌참조: Turner et al., 2007). 3'-오버행은 RNase 분해에 대한 siRNA의 민감성을 증진시킨다. 혈청으로부터 RNase A의 결실은 siRNA의 분해를 감소시키고 상기 분해는 몇몇 서열 선호도를 나타내고 말단상에 폴리 A/U 서열을 갖는 서열에 대해서는 불량하다(문헌참조: Haupenthal et al., 2006). 이것은 듀플렉스의 보다 낮은 안정성 영역이 "호흡(breathe)"할 수 있고 RNase A에 의한 분해를 위해 가용한 일시적인 단일 가닥 종을 제공할 수 있음을 시사한다. RNase A 억제제는 혈청에 부가될 수 있고 siRNA의 수명 및 효능을 개선시킨다(문헌참조: Haupenthal et al., 2007).
21량체에서, 포스포로티오에이트 또는 보라노포스페이트 변형은 직접 뉴클레오타이드 상호 포스페이트 연결을 안정화시킨다. 보라노포스페이트 변형된 RNA는 고도로 뉴클레아제 내성이고 사일런싱 제제로서 효능이 있으며 비교적 비독성이다. 보라노포스페이트 변형된 RNA는 표준 화학적 합성 방법을 사용하여 제조될 수 없고 대신 시험관내 전사(IVT)에 의해 제조된다(문헌참조: Hall et al., 2004 and Hall et al., 2006). 포스포로티오에이트(PS) 변형은 임의의 목적하는 위치에서 RNA 듀플렉스내에 용이하게 위치할 수 있고 표준 화학적 합성 방법을 사용하여 제조될 수 있지만 RNA 사일런싱 활성을 보유하는 RNA 듀플렉스내 상기 변형을 사용하는 능력은 제한될 수 있다. 도 2에서 본원에 나타낸 바와 같이(듀플렉스 #8), 동족 반복 시리즈의 PS-변형된 데옥시리보뉴클레오타이드 잔기와 염기쌍을 형성하는 반복 시리즈 배위내에 다중 PS 변형된 데옥시리보뉴클레오타이드 잔기를 포함시키면 이들 잔기에 존재하는 단지 비변형된 데옥시리보뉴클레오타이드와는 활성이었던 제제의 RNA 사일런싱 활성을 제거하였다. PS 잔기는 RNA 듀플렉스 함유 제제내에 포함되는 경우 RNA 억제 활성을 보유하기 위해서는 보다 큰 공간을 필요로하기 때문에 본원에 기재된 것들과 같은 연장된 DsiRNA가, 상기 연장부가 전혀 사용되지 않았던 것 보다 단일 DsiRNA 제제내에 보다 많은 PS 변형(PS-DNA 또는 PS-RNA)을 포함하는 수단을 제공할 수 있다. 그러나, 상기 PS 변형은 용량 의존성 독성을 나타내어 대부분의 연구자들은 뉴클레아제로부터 보호가 가장 중요한 3' 말단을 실제로 선호하는 siRNA내 제한된 혼입을 추천했음을 주지한다(문헌참조: Harborth et al, 2003; Chiu and Rana, 2003; Braasch et al, 2003; Amarzguioui et al., 2003). 보다 광범위한 PS 변형은 강한 RNAi 활성과 양립할 수 있지만 당 변형(예를 들어, 2'-O-메틸 RNA)의 사용이 우세할 수 있다(문헌참조: Choung et al, 2006).
일반적으로 듀플렉스 안정성(Tm)을 증가시키는 리보스의 2'-위치에서 다양하게 치환될 수 있고 뉴클레아제 내성을 크게 개선시킬 수 있다. 2'-O-메틸 RNA는 포유동물 리보솜 RNA 및 전달 RNA에서 천연적으로 발견되는 변형이다. siRNA에서 2'-O-메틸 변형은 공지되어 있지만 듀플렉스내 변형된 염기의 정확한 위치는 효능을 보유시키는데 중요하고 RNA의 2'-O-메틸 RNA로의 완전한 치환은 siRNA를 불활성화시킬 것이다. 예를 들어, 번갈아 존재하는 2'-O-메틸 염기를 사용하는 패턴은 비변형된 RNA와 동등한 효능을 가질 수 있고 혈청에서 매우 안정하다(문헌참조: Choung et al., 2006; Czauderna et al., 2003).
2'-플루오로(2'-F) 변형은 또한 dsRNA(예를 들어, siRNA 및 DsiRNA) 기능과 양립할 수 있고; 이것은 대부분 통상적으로 피리미딘 부위(시약 비용 및 가용성 때문에)에 위치하고 퓨린 위치에서 2'-O-메틸 변형과 조합될 수 있고; 2'-F 퓨린이 가용하고 또한 사용될 수 있다. 이러한 종류의 상당히 변형된 듀플렉스는 시험관내에서 RNAi의 강한 유도제일 수 있고(문헌참조: Allerson et al., 2005; Prakash et al., 2005; Kraynack and Baker, 2006) 생체내에서 사용되는 경우 수행능을 개선시킬 수 있고 작용 지속시간을 연장시킬 수 있다(문헌참조: Morrissey et al., 2005a; Morrissey et al., 2005b). 대용 2'-F 및 2'-O-Me 염기를 함유하는 고도로 강력하고 뉴클레아제 안정하며 평활 19량체 듀플렉스는 알레슨(Allerson)에 의해 교시되었다. 상기 디자인에서, 대용 2'-0-Me 잔기는 차우데르나(Czauderna)에 의해 사용된 것과 동일한 패턴으로 위치하지만 나머지 RNA 잔기는 2'-F 변형된 염기로 전환된다. 모리세이(Morrissey)에 의해 사용된 고도로 강력한 뉴클레아제 내성 siRNA는 생체내에서 고도로 강력한 뉴클레아제 내성 siRNA를 사용하였다. 2'-O-Me RNA 및 2'-F RNA 뿐만 아니라, 상기 듀플렉스는 DNA, RNA, 역위된 비염기성 잔기 및 3'-말단 PS 뉴클레오사이드 상호 연결을 포함한다. 광범위한 변형이 특정 이득을 갖지만 듀플렉스의 보다 제한된 변형은 또한 생체내 수행능을 개선시킬 수 있고 제조하기가 보다 단순하고 저렴하다. 소우체크 등(Soutschek et al.) (2004)은 생체내 듀플렉스를 사용하였고 대부분 2개의 2'-O-Me RNA 염기 및 제한된 3'-말단 PS 뉴클레오사이드 상호 연결을 갖는 RNA이었다.
고정된 핵산(LNA)은 dsRNA(예를 들어, siRNA 및 DsiRNA)을 안정화시키는데 사용될 수 있는 상이한 부류의 2'-변형이다. 효능을 보유하는 LNA 혼입 패턴은 2'-O-메틸 또는 2'-F 염기 보다 제한적이고 이와같이 제한된 변형이 바람직하다(문헌참조: Braasch et al., 2003; Grunweller et al., 2003; Elmen et al., 2005). 제한된 혼입에도 불구하고 LNA 변형을 사용하므로써 생체내 dsRNA 수행능을 개선시킬 수 있고 또한 오프 표적 효과 프로필을 변화시키거나 개선시킬 수 있다(문헌참조: Mook et al., 2007).
세포 또는 생존 동물로 도입된 합성 핵산은 "외래 물질"로서 인지될 수 있고 면역 반응을 유발한다. 면역 자극은 실험적 결과를 급격히 변화시켜서 심지어 세포 사멸을 유발할 수 있는 주요 부류의 오프 표적 효과를 구성한다. 선천성 면역계는 이들 반응을 매개하고 이의 일부는 세포질내에 위치하고 엔도좀에 상주하는 DNA 및 RNA와 특이적으로 상호작용하는 수용체 분자 집단을 포함한다(문헌참조: Marques and Williams, 2005; Schlee et al., 2006). 양이온성 지질 또는 리포좀에 의한 siRNA의 전달은 세포질 및 엔도좀 격실에 siRNA를 노출시키고 시험관내 및 생체내에서 1형 인터페론(IFN) 반응을 유발할 위험성을 극대화시킨다(문헌참조: Morrissey et al., 2005b; Sioud and Sorensen, 2003; Sioud, 2005; Ma et al., 2005). 세포내에서 전사된 RNA는 덜 면역성이고(문헌참조: Robbins et al., 2006) 지질 기반 방법을 사용하여 전달되는 경우 면역성인 합성 RNA는 기계적 수단에 의해 세포내로 도입되는 경우, 심지어 생체내에서 면역 자극을 회피할 수 있다(문헌참조: Heidel et al., 2004). 그러나, 지질 기반 전달 방법은 간편하고 효과적이며 널리 사용된다. 면역 반응을 차단하기 위한 몇몇 일반적인 전략이 필요하고 특히 모든 세포 유형이 존재하고 면역 반응 생성할 위험성이 최고로 높은 생체내 적용을 위해 필요하다. 화학적으로 변형된 RNA의 사용은 상기 문제점의 대부분 또는 심지어 전부를 해결할 수 있다.
특정 서열 모티프가 다른 것들 보다 명백히 면역성이지만 선천적 면역계의 수용체는 일반적으로 원핵 RNA에서 보다 포유동물 RNA에서 보다 통상적으로 발견되는 특정 염기 변형의 존재 또는 부재를 구분하는 것으로 나타난다. 예를 들어, 슈도우리딘, N6-메틸-A, 및 2'-O-메틸 변형된 염기는 "자가"로서 인지되고 합성 RNA에서 이들 잔기의 내포는 면역 검출을 피하는데 일조할 수 있다(문헌참조: Kariko et al., 2005). 비변형된 RNA로서 강한 면역자극성인 서열의 광범위 2'-변형은 정맥내로 마우스에게 투여되는 경우 면역 반응을 차단할 수 있다(문헌참조: Morrissey et al., 2005b). 그러나 광범위 변형은 면역 검출을 피하는데 필요하지 않고 siRNA 듀플렉스의 단일 가닥에서 2개의 2'-O-메틸 염기와 같은 소수의 치환이 시험관내 및 생체내 둘다에서 1형 IFN 반응을 차단시키는데 충분할 수 있고 ; 변형된 U 및 G 염기는 가장 효과적이다(문헌참조: Judge et al., 2006). 부가된 이득으로서 2'-O-메틸 염기의 선택적 혼입은 오프 표적 효과 정도를 감소시킬 수 있다(문헌참조: Jackson et al., 2006). 따라서 2'-O-메틸 염기의 사용이 면역 반응을 차단하는 수단으로서 생체내 적용을 위해 의도된 모든 dsRNA에 대해 고려되어야만 하고 뉴클레아제 안정성을 개선시키고 오프-표적 효과의 가능성을 감소시키는 부가적인 이득을 갖는다.
세포 사멸이 면역 자극으로부터 비롯될 수 있지만 세포 생존성을 평가하는 것은 IFN 반응의 유도를 모니터링하기 위한 적절한 방법이 아니다. IFN 반응은 세포 사멸 없이 존재할 수 있고 세포 사멸은 IFN 유발 부재하에서 표적 녹다운으로부터 비롯될 수 있다(예를 들어, 표적된 유전자가 세포 생존을 위해 필요한 경우). 관련 사이토킨은 직접 배양 배지에서 측정할 수 있고 다양하게 시판되는 키트가 있고 이는 상기 분석이 통상적인 것이 되게한다. 다수의 상이한 면역 이펙터 분자가 측정될 수 있지만 형질감염 후 4시간 및 24시간째에 IFN-α, TNF-α, 및 IL-6의 시험 수준은 통상적으로 스크리닝 목적을 위해 충분하다. 양이온성 지질은 임의의 핵산 수송체(cargo)의 부재하에 특정 세포에서 면역 반응을 유발할 수 있으므로 "단지 대조군으로서 형질감염 시약"을 포함하는 것이 중요하다. IFN 경로 유도에 대한 대조군을 포함하는 것이 세포 배양 작업을 위해 고려되어야만 한다. IFN 반응을 유발할 가능성이 최고로 높은 생체내에서 핵산을 투여할때마다 어떠한 면역 자극 없이 시험하는 것이 필수적이다.
변형이 DsiRNA 제제가 다이서에 대한 기질로서 작용하도록 하는데 방해하지 않는 한 변형은 본 발명의 DsiRNA 제제에 포함될 수 있다. 실제로, 본 발명의 한가지 놀라운 발견은 염기쌍의 데옥시리보뉴클레오타이드가 이전에 기재된 DsiRNA 분자에 부착되어 증진된 RNAi 효능 및 지속성을 유도할 수 있다는 것이고 단, 상기 연장은 다이서 프로세싱을 방해하지 않는 연장된 분자의 영역에서 수행된다(예를 들어, 센스 가닥의 다이서 절단 부위의 3'/안티센스 가닥의 다이서 절단 부위의 5'). 하나의 양태에서, DsiRNA 제제의 다이서 프로세싱을 증진시키는 하나 이상의 변형이 만들어진다. 제2 양태에서, 보다 효과적인 RNAi 생성을 유도하는 하나 이상의 변형이 만들어진다. 제3 양태에서, 보다 큰 RNAi 효과를 지지하는 하나 이상의 변형이 만들어진다. 제4 양태에서, 세포로 전달되는 각각의 DsiRNA 제제당 보다 큰 효능을 유도하는 하나 이상의 변형이 만들어진다. 변형은 서열내 3' 말단 영역, 5' 말단 영역, 3' 말단 및 5' 말단 영역 둘다에서 또는 몇몇 경우에 다양한 위치에 혼입될 수 있다. 상기 주지된 제한을 염려하면서 임의의 수 및 조합된 변형이 DsiRNA 제제내로 혼입될 수 있다. 다중의 변형이 존재하는 경우, 이들은 동일하거나 상이할 수 있다. 염기, 당 잔기, 포스페이트 골격에 대한 변형 및 이들의 조합이 고려된다. 어느 하나의 5'-말단은 인산화될 수 있다.
포스페이트 골격에 대해 고려되는 변형의 예는 메틸포스포네이트 변형을 포함하는 포스포네이트 변형, 포스포로티오에이트 변형 및 알킬포스포트리에스테르 등과 같은 포스포트리에스트 변형을 포함한다. 당 잔기에 대해 고려되는 변형의 예는 2'-알킬 피리미딘, 예를 들어, 2'-O-메틸, 2'-플루오로, 아미노, 및 데옥시 변형 등을 포함한다(문헌참조: 예를 들어 Amarzguioui et al., 2003). 염기 그룹에 대해 고려되는 변형의 예는 비염기성 당, 2-O-알킬 변형된 피리미딘, 4-티오우라실, 5-브로모우라실, 5-요오도우라실, 및 5-(3-아미노알릴)-우라실 등을 포함한다. 고정된 핵산, 또는 LNA가 또한 혼입될 수 있다. 많은 다른 변형이 공지되어 있고 상기 기준이 충족되는 한 사용될 수 있다. 변형의 예는 또한 문헌[참조: 미국 특허 제5,684,143호, 제5,858,988호 및 제6,291,438호 및 미국 공개된 특허 출원 번호 제2004/0203145 A1호]에 기재되어 있다. 다른 변형은 문헌[참조: Herdewijn (2000), Eckstein (2000), Rusckowski et al. (2000), Stein et al. (2001); Vorobjev et al. (2001)]에 기재되어 있다.
고려되는 하나 이상의 변형은 어느 하나의 가닥으로 혼입될 수 있다. DsiRNA 제제내에 변형의 위치는 보다 큰 효능 및 안정성을 부여하는 것, 독성을 감소시키는 것, 다이서 프로세싱을 증진시키는 것, 면역 반응을 최소화는 것을 포함하는 DsiRNA 제제의 특성에 크게 영향을 줄 수 있다. 하나의 양태에서, 안티센스 가닥 또는 센스 가닥 또는 가닥 둘다는 하나 이상의 2'-O-메틸 변형된 뉴클레오타이드를 갖는다. 또 다른 양태에서, 안티센스 가닥은 2'-O-메틸 변형된 뉴클레오타이드를 포함한다. 또 다른 양태에서, 안티센스 가닥은 2'-O-메틸 변형된 뉴클레오타이드로 이루어진 3' 오버행을 포함한다. 안티센스 가닥은 또한 추가의 2'-O-메틸 변형된 뉴클레오타이드를 포함할 수 있다.
본 발명의 특정 양태에서, DsiRNA 제제는 다이서에 의해 이의 프로세싱을 증진시키는 하나 이상의 성질을 갖는다. 이들 양태에 따라, DsiRNA 제제는 활성 siRNA을 생성하고 하기의 특성중 하나 이상을 나타내도록 다이서에 의해 가공되기에 충분한 길이를 갖는다: (i) DsiRNA 제제는 비대칭이고 예를 들어, 안티센스 가닥상에 3' 오버행을 갖고 (ii) DsiRNA 제제는 다이서 결합의 배향 및 dsRNA 영역의 활성 siRNA로의 프로세싱을 지시하기 위해 센스 가닥상에 변형된 3' 말단을 갖는다. 특정 상기 양태에서, 다이서 효소 절단의 돌출된 부위의 3'에 있는 센스 가닥의 영역 및 다이서 효소 절단의 돌출된 부위의 5'에 있는 안티센스 가닥의 상응하는 영역내 하나 이상의 염기쌍 데옥시리보뉴클레오타이드의 존재는 또한 다이서 효소 절단의 적당한 방향성을 위해 상기 분자를 배향시키는 작용을 할 수 있다.
특정 양태에서, dsDNA 영역의 길이(또는 DNA:DNA 염기쌍을 포함하는 영역의 길이)는 1 내지 50 염기쌍, 임으로 2 내지 30개 염기쌍, 바람직하게는 2 내지 20개 염기쌍 및 보다 바람직하게는 2 내지 15개 염기쌍이다. 따라서, 본 발명의 DNA:DNA-연장된 DsiRNA는 길이가 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50 개 이상(예를 들어, 51 , 52, 53, 54, 55, 56, 57, 58, 59 또는 60개 이상)의 염기쌍인 dsDNA 영역을 가질 수 있다.
몇몇 양태에서, dsNA에서 가장 긴 가닥은 29 내지 43개 뉴클레오타이드를 포함한다. 하나의 양태에서, 상기 DsiRNA 제제는 비대칭이어서 센스 가닥의 3' 말단 및 안티센스 가닥의 5' 말단은 평활 말단을 형성하고 안티센스 가닥의 3' 말단은 센스 가닥의 5' 말단과 오버행을 형성한다. 특정 양태에서, 안티센스 가닥의 3' 오버행은 1 내지 10개 뉴클레오타이드이고 임의로 1 내지 4개의 뉴클레오타이드이고 예를 들어, 2개 뉴클레오타이드이다. 센스 가닥 및 안티센스 가닥 둘다는 또한 5' 포스페이트를 가질 수 있다.
특정 양태에서, 염기쌍의 데옥시리보뉴클레오타이드 잔기를 포함하는 본 발명의 DsiRNA의 센스 가닥은 전체 길이가 26개 뉴클레오타이드 내지 39개 이상의 뉴클레오타이드이다(예를 들어, 센스 가닥은 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50 개 이상(예를 들어, 51, 52, 53, 54, 55, 56, 57, 58, 59 또는 60 개 이상)의 뉴클레오타이드 길이를 갖는다). 특정 양태에서, 센스 가닥의 길이는 26개 뉴클레오타이드 내지 39개 뉴클레오타이드이거나, 임의로 27개 내지 35개 뉴클레오타이드이거나 임의로 27개 내지 33개 뉴클레오타이드 길이이다. 관련 양태에서, 안티센스 가닥은 27 내지 43개 이상의 뉴클레오타이드의 길이를 갖는다(예를 들어, 센스 가닥은 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50개 이상(예를 들어, 51, 52, 53, 54, 55, 56, 57, 58, 59 또는 60개 이상)의 뉴클레오타이드 길이를 갖는다). 특정 상기 양태에서, 안티센스 가닥은 27개 내지 43개 뉴클레오타이드 길이 또는 27개 내지 39개 뉴클레오타이드 길이 또는 27개 내지 35개 뉴클레오타이드 길이, 또는 28개 내지 37개 뉴클레오타이드 길이 또는 29개 내지 35개 뉴클레오타이드 길이를 갖는다.
특정 양태에서, 다이서 효소 절단의 돌출된 부위의 3'에 있는 센스 가닥의 영역 및 다이서 효소 절단 부위의 돌출된 부위의 5'에 있는 안티센스 가닥의 상응하는 영역에서 하나 이상의 염기쌍 형성 데옥시리보뉴클레오타이드의 존재는 상기 분자의 다이서 효소 절단을 지시하는 작용을 할 수 있다. 본 발명의 특정 예시된 제제는 센스 가닥의 5' 말단에서 1번 위치로부터 계수하는 경우 24번 이상의 3'에 위치하는 센스 가닥 데옥시리보뉴클레오타이드를 갖고 센스 가닥의 24번 이상의 3' 데옥시보뉴클레오타이드는 안티센스 가닥의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성하며 몇몇 양태에서 또한 다이서가 예를 들어, 센스 가닥의 20번 위치에서 데옥시리보뉴클레오타이드 잔기를 함유함을 통해 보다 짧은 생성물, 예를 들어 19량체 또는 20량체를 절단하도록 지시할 수 있다. 상기 20번 위치의 데옥시리보뉴클레오타이드는 안티센스 가닥의 상응하는 데옥시리보뉴클레오타이드와 염기쌍을 형성하여 가장 우세한 다이서 생성물로서 19량체의 다이서 매개된 절단을 지시한다(안티센스 가닥은 또한 상기 양태에서 센스 가닥의 20번 데옥시리보뉴클레오타이드 잔기와 염기쌍을 형성하는 안티센스 잔기의 3'에 바로 인접하여 1개 또는 2개의 데옥시리보뉴클레오타이드 잔기를 포함하여 안티센스 가닥의 다이서 절단을 추가로 지시함을 주지한다). 상기 양태에서, 이중 가닥 DNA 영역(다이서 절단을 차단하는 변형된 핵산을 포함하는)은 통상적으로 다이서 절단 생성물의 바람직하지 않은 길이인 것을 제조하도록 다이서 절단을 지시하기 위해 1개 또는 2개 초과의 염기쌍(예를 들어, 3개 내지 5개 염기쌍 이상) 길이를 갖는다. 평행 방법을 또한 사용하여 20량체 siRNA의 다이서 절단을 지시할 수 있고 센스 가닥의 제1 데옥시리보뉴클레오타이드 잔기는 21번 위치에 존재한다(센스 가닥의 5' 말단에서 1번 위치로부터 센스 가닥을 조사하는 경우).
특정 양태에서, DsiRNA 제제의 센스 가닥은 센스 가닥의 3' 말단에 위치하는 적합한 변형제에 의한 다이서 프로세싱을 위해 변형되는데, 즉 DsiRNA 제제는 센스 가닥 변형을 통해 다이서 결합 및 프로세싱의 배향을 지시하도록 디자인된다. 적합한 변형제는 데옥시리보뉴클레오타이드, 디데옥시리보뉴클레오타이드, 어사이클로뉴클레오타이드 등과 같은 뉴클레오타이드 및 입체 장애 분자, 예를 들어, 형광성 분자 등을 포함한다. 어사이클로뉴클레오타이드는 dNMP에 통상적으로 존재하는 2'-데옥시리보푸라노실 당의 2-하이드록시에톡시메틸 그룹을 치환한다. 다른 뉴클레오타이드 변형제는 3'-데옥시아데노신(코르디세핀), 3'-아지도-3'-데옥시티미딘 (AZT), 2',3'-디데옥시이노신(ddI), 2',3'-디데옥시-3'-티아시티딘 (3TC), 2',3'-디데하이드로-2',3'-디데옥시티미딘 (d4T) 및 3'-아지도-3'-데옥시티미딘(AZT), 2',3'-디데옥시-3'-티아시티딘 (3TC) 및 2',3'-디데하이드로-2',3'-디데옥시티미딘 (d4T)의 모노포스페이트 뉴클레오타이드를 포함할 수 있다. 하나의 양태에서, 데옥시리보뉴클레오타이드는 변형제로서 사용된다. 뉴클레오타이드 변형제가 사용되는 경우, 1 내지 3개 뉴클레오타이드 변형제, 또는 2개의 뉴클레오타이드 변형제가 센스 가닥의 3' 말단상에서 리보뉴클레오타이드를 대체한다. 입체 장애 분자가 사용되는 경우, 이들은 안티센스 가닥의 3' 말단에서 리보뉴클레오타이드에 부착된다. 따라서, 가닥의 길이는 변형제의 혼입과 함께 변화하지 않는다. 또 다른 양태에서, 본 발명은 DsiRNA 제제에서 2개의 DNA 염기를 대체하여 안티센스 가닥의 다이서 프로세싱의 배향을 지시하도록 함을 고려한다. 본 발명의 추가의 양태에서, 2개의 말단 DNA 염기는 센스 가닥의 3' 말단상의 2개의 리보뉴클레오타이드를 대체하여 센스 가닥의 3' 말단 및 안티센스 가닥의 5' 말단상에서 듀플렉스의 평활 말단을 형성하고 2개의 뉴클레오타이드 RNA 오버행은 안티센스 가닥의 3' 말단상에 위치한다. 이것은 평활 말단상에 DNA를 갖고 오버행 말단상에 RNA 염기를 갖는 비대칭 조성이다. 본 발명의 특정 양태에서, 센스 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 위치의 변형된 뉴클레오타이드(예를 들어, 데옥시리보뉴클레오타이드)는 안티센스 가닥의 상응하는 변형된 뉴클레오타이드(예를 들어, 데옥시리보뉴클레오타이드)와 염기쌍을 형성한다(임의로, 본 발명의 상기 DsiRNA 제제에서 맨끝 및 맨끝에서 2번째 잔기는 센스 가닥의 3' 말단 및 안티센스 가닥의 5' 말단에서 평활 말단을 갖는다).
본 발명의 DsiRNA 제제의 센스 및 안티센스 가닥은 세포의 세포질에서 발견되는 조건과 같은 생물학적 조건하에서 어닐링한다. 또한, DsiRNA 제제의 서열, 특히, 안티센스 가닥의 한 영역은 19개 이상의 뉴클레오타이드 서열 길이를 갖고 여기서 상기 뉴클레오타이드는 안티센스 가닥의 3'말단에 인접한 21개 뉴클레오타이드 영역에 있고 표적 유전자로부터 생성된 RNA의 뉴클레오타이드 서열과 충분히 상보적이어서 어닐링하고/하거나 상기 표적 RNA의 수준을 감소시킨다.
본 발명의 DsiRNA 제제는 센스 가닥의 돌출된 다이서 절단 부위의 3'에 위치하고 안티센스 가닥의 돌출된 다이서 절단 부위의 5'에 위치한 센스 및 안티센스 가닥의 임의의 위치에 하나 이상의 데옥시리보뉴클레오타이드 염기쌍을 가질 수 있다. 특정 양태에서, 센스 가닥의 24번 내지 27번(센스 가닥의 5' 말단에서 1번 위치로부터 개시하여)중 1개, 2개, 3개 또는 4개 모두는 데옥시리보뉴클레오타이드이고, 이의 각각의 데옥시리보뉴클레오타이드는 안티센스 가닥의 상응하는 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 특정 양태에서, 안티센스 가닥의 5' 영역(예를 들어, 소정의 DsiRNA 분자에 대한 돌출된 다이서 절단 부위의 5'에 위치한 안티센스 가닥의 영역)의 데옥시리보뉴클레오타이드는 DsiRNA 제제가 지시되는 표적 RNA와 상보적이지 않다. 관련 양태에서, DsiRNA 제제의 돌출된 다이서 절단 부위의 5'에 위치한 안티센스 가닥의 전체 영역은 DsiRNA 제제가 지시되는 표적 RNA와 상보적이지 않다. 특정 양태에서, DsiRNA 제제의 돌출된 다이서 절단 부위의 5'에 위치한 안티센스 가닥의 데옥시리보뉴클레오타이드 또는 전체 영역은 안티센스 가닥과 표적 RNA 사이에 어닐링을 허용하기에 충분한 조건하에서 안티센스 가닥이 표적 RNA에 어닐링되는 경우 표적 RNA에 대한 DsiRNA의 안티센스 가닥의 어닐링을 증진시키기 위해 충분히 표적 RNA와 상보적이지 않다(예를 들어, DNA 연장된 제제가 결핍된 "코어" 안티센스 가닥 서열은 동일한 "코어" 안티센스 가닥 서열이 또한 DNA 연장된 영역의 서열과 함께 연장되므로써 표적 DNA에 동등하게 잘 어닐링한다).
DsiRNA 제제는 또한 하기의 추가의 성질중 하나 이상을 가질 수 있다: (a) 안티센스 가닥은 전형적인 21량체로부터 우측 또는 좌측 전이를 갖고, (b) 상기 가닥은 완전히 상보적일 수 없고, 즉 상기 가닥은 단순한 미스매치 염기쌍을 함유할 수 있고 (c) 고정된 핵산과 같은 염기 변형은 센스 가닥의 5' 말단에 포함될 수 있다. "전형적인" 21량체 siRNA는 통상적인 기술을 사용하여 디자인한다. 하나의 기술에서, 다양한 부위가 통상적으로 병행하여 시험되거나 시약의 하나가 효과적일 것이라는 기대와 함께 동일한 표적에 특이적인 몇몇 구분되는 siRNA 듀플렉스를 함유하는 풀에서 통상적으로 시험된다(문헌참조: Ji et al., 2003). 다른 기술은 활성 RNAi 이펙터 분자를 수득할 가능성을 증가시키기 위한 디자인 법칙 및 알고리듬을 사용한다(문헌참조: Schwarz et al., 2003; Khvorova et al., 2003; Ui-Tei et al., 2004; Reynolds et al., 2004; Krol et al., 2004; Yuan et al., 2004; Boese et al., 2005). siRNA의 고속처리 선택법이 또한 개발되었다(문헌참조: 미국 공개 특허원 제2005/0042641 A1호). 잠재적인 표적 부위는 또한 2차 구조 예측에 의해 분석될 수 있다(문헌참조: Heale et al., 2005). 이어서 상기 21량체를 사용하여 21량체의 5' 말단상에서 3개 내지 9개의 추가의 뉴클레오타이드를 포함하도록 우측 전이를 디자인한다. 이들 추가의 뉴클레오타이드의 서열은 임의의 서열을 가질 수 있다. 하나의 양태에서, 부가된 리보뉴클레오타이드는 표적 유전자의 서열을 기준으로 한다. 상기 양태에서도, 표적 서열과 안티센스 siRNA의 완전한 상보성이 요구되지 않는다.
본 발명의 DsiRNA의 제1 및 제2 올리고뉴클레오타이드는 완전히 상보적일 필요는 없다. 이들은 단지 생리학적 조건하에서 어닐링하고 표적 서열에 충분히 상보적인 siRNA을 생성시키는 다이서에 대한 기질을 제공하도록 실질적으로 상보적일 필요만 있다. 고정된 핵산, 또는 LNA는 당업자에게 널리 공지되어 있다(문헌참조: Elman et al., 2005; Kurreck et al., 2002; Crinelli et al., 2002; Braasch and Corey, 2001 ; Bondensgaard et al., 2000; Wahlestedt et al., 2000). 하나의 양태에서, LNA는 센스 가닥의 5' 말단에 혼입된다. 또 다른 말단에서, LNA는 안티센스 가닥상에 3' 오버행을 포함하도록 디자인된 듀플렉스에서 센스 가닥의 5' 말단에 혼입된다.
특정 양태에서, 본 발명의 DsiRNA 제제는 비대칭 구조를 갖고, 센스 가닥은 27개 염기쌍을 길이를 갖고 안티센스 가닥은 29개 염기쌍 길이를 갖고 2개 염기 3'오버행을 갖는다. 상기 제제는 임의로 센스 가닥의 3' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 3' 영역)의 1개 내지 4개의 데옥시리보뉴클레오타이드를 가질 수 있고 이중의 하나 이상은 안티센스 가닥의 5' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 5' 영역)의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 다른 양태에서, 센스 가닥은 28개 염기상 길이를 갖고 안티센스 가닥은 2개 염기 3' 오버행을 갖는 30개 염기쌍 길이를 갖는다. 상기 제제는 임의로 센스 가닥의 3' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 3' 영역)의 1 내지 5개의 데옥시리보뉴클레오타이드를 가질 수 있고, 이중의 하나 이상은 안티센스 가닥의 5' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 5' 영역)의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 추가의 양태에서, 센스 가닥은 29개 염기쌍 길이를 갖고 안티센스 가닥은 31개 염기쌍 길이를 갖고 2개 염기 3' 오버행을 갖는다. 상기 제제는 임의로 센스 가닥의 3' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 3' 영역)의 1개 내지 6개 데옥시리보뉴클레오타이드를 가질 수 있고 이중 하나 이상은 안티센스 가닥의 5' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 5' 영역)의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 추가의 양태에서, 센스 가닥은 30개 염기쌍 길이를 갖고 안티센스 가닥은 32개 염기쌍 길이를 갖고 2개 염기 3'-오버행을 갖는다. 상기 제제는 임의로 센스 가닥의 3' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 3' 영역)의 1개 내지 7개 데옥시리보뉴클레오타이드를 가질 수 있고 이중 하나 이상은 안티센스 가닥의 5' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 5' 영역)의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 다른 양태에서, 센스 가닥은 31개 염기쌍 길이를 갖고 안티센스 가닥은 33개 염기쌍 길이를 갖고 2개 염기 3'-오버행을 갖는다. 상기 제제는 임의로 센스 가닥의 3' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 3' 영역)의 1개 내지 8개 데옥시리보뉴클레오타이드를 가질 수 있고 이중 하나 이상은 안티센스 가닥의 5' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 5' 영역)의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 추가의 양태에서, 센스 가닥은 32개 염기쌍 길이를 갖고 안티센스 가닥은 34개 염기쌍 길이를 갖고 2개 염기 3'-오버행을 갖는다. 상기 제제는 임의로 센스 가닥의 3' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 3' 영역)의 1개 내지 9개 데옥시리보뉴클레오타이드를 가질 수 있고 이중 하나 이상은 안티센스 가닥의 5' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 5' 영역)의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 특정 추가의 양태에서, 센스 가닥은 33개 염기쌍 길이를 갖고 안티센스 가닥은 35개 염기쌍 길이를 갖고 2개 염기 3'-오버행을 갖는다. 상기 제제는 임의로 센스 가닥의 3' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 3' 영역)의 1개 내지 10개 데옥시리보뉴클레오타이드를 가질 수 있고 이중 하나 이상은 안티센스 가닥의 5' 말단 영역(구체적으로 돌출된 다이서 절단 부위의 5' 영역)의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다. 여전히 다른 양태에서, 이들 DsiRNA 제제중 임의의 하나는 2개의 리보뉴클레오타이드 대신 센스 가닥의 3' 말단에서 2개의 데옥시리보뉴클레오타이드를 추가로 함유하는 비대칭 구조를 갖고; 임의로 이들 2개의 데옥시리보뉴클레오타이드는 안티센스 가닥의 동족 데옥시리보뉴클레오타이드와 염기쌍을 형성한다.
2개의 별도의 올리고뉴클레오타이드를 함유하는 특정 DsiRNA 제제 조성은 제3 구조물에 의해 연결될 수 있다. 제3 구조물은 DsiRNA 제제상에서 다이서 활성을 차단하지 않고 표적 유전자로부터 전사된 RNA의 지시된 파괴를 방해하지 않는다. 하나의 양태에서, 제3 구조물은 화학적 연결 그룹일 수 있다. 많은 적합한 화학적 연결 그룹은 당업계에 공지되어 있고 사용될 수 있다. 또는, 제3 구조물은 dsNA 조성을 구성하는 2개의 올리고뉴클레오타이드의 어닐링시 헤어핀 구조가 생성되도록 하는 방식으로 DsiRNA 제제의 2개의 올리고뉴클레오타이드를 연결하는 올리고뉴클레오타이드일 수 있다. 상기 헤어핀 구조는 DsiRNA 제제상에 다이서 활성을 차단하지 않고 표적 RNA의 지시된 파괴를 방해하지 않는다.
특정 양태에서, 본 발명의 DsiRNA 제제는 다이서에 의한 이의 프로세싱을 증진시키는 여러 성질을 갖는다. 상기 양태에 따라, 상기 DsiRNA 제제는 siRNA을 생성하고 하기의 특성중 하나 이상을 나타내도록 다이서에 의해 가공되기에 충분한 길이를 갖는다: (i) DsiRNA 제제는 비대칭이고 예를 들어, 센스 가닥상에 3' 오버행을 갖고 (ii) DsiRNA 제제는 다이서 결합의 배향 및 dsRNA 영역의 활성 siRNA로의 프로세싱을 지시하기 위해 안티센스 가닥상에 변형된 3' 말단을 갖는다. 이들 양태에 따르면 가장 긴 가닥은 25 내지 43개 뉴클레오타이드를 포함한다. 하나의 양태에서, 센스 가닥은 25개 내지 39개 뉴클레오타이드를 포함하고 안티센스 가닥은 26개 내지 43개 뉴클레오타이드를 포함한다. 수득한 dsNA는 센스 가닥의 3' 말단상에 오버행을 가질 수 있다. 상기 오버행은 1 내지 4개의 뉴클레오타이드이고 예를 들어, 2개 뉴클레오타이드이다. 상기 안티센스 또는 센스 가닥은 또한 5' 포스페이트를 가질 수 있다.
특정 양태에서, DsiRNA 제제의 센스 가닥은 센스 가닥의 3' 말단에 위치하는 적합한 변형제에 의한 다이서 프로세싱을 위해 변형되는데, 즉 DsiRNA 제제는 다이서 결합 및 프로세싱의 배향을 지시하도록 디자인된다. 적합한 변형제는 데옥시리보뉴클레오타이드, 디데옥시리보뉴클레오타이드, 어사이클로뉴클레오타이드 등과 같은 뉴클레오타이드 및 입체적으로 차단된 분자, 예를 들어, 형광성 분자 등을 포함한다. 어사이클로뉴클레오타이드는 dNMP에 통상적으로 존재하는 2'-데옥시리보푸라노실 당의 2-하이드록시에톡시메틸 그룹을 치환한다. 다른 뉴클레오타이드 변형제는 3'-데옥시아데노신(코르디세핀), 3'-아지도-3'-데옥시티미딘 (AZT), 2',3'-디데옥시이노신(ddI), 2',3'-디데옥시-3'-티아시티딘 (3TC), 2',3'-디데하이드로-2',3'-디데옥시티미딘 (d4T) 및 3'-아지도-3'-데옥시티미딘(AZT), 2',3'-디데옥시-3'-티아시티딘 (3TC) 및 2',3'-디데하이드로-2',3'-디데옥시티미딘 (d4T)의 모노포스페이트 뉴클레오타이드를 포함할 수 있다. 하나의 양태에서, 데옥시리보뉴클레오타이드는 변형제로서 사용된다. 뉴클레오타이드 변형제가 사용되는 경우, 1 내지 3개 뉴클레오타이드 변형제, 또는 2개의 뉴클레오타이드 변형제가 센스 가닥의 3' 말단상에서 리보뉴클레오타이드를 대체한다. 입체 장애 분자가 사용되는 경우, 이들은 안티센스 가닥의 3' 말단에서 리보뉴클레오타이드에 부착된다. 따라서, 가닥의 길이는 변형제의 혼입과 함께 변화하지 않는다. 또 다른 양태에서, 본 발명은 dsNA 제제에서 2개의 DNA 염기를 대체하여 다이서 프로세싱의 배향을 지시하도록 함을 고려한다. 추가의 양태에서, 2개의 말단 DNA 염기는 센스 가닥의 3' 말단상의 2개의 리보뉴클레오타이드를 대체하여 센스 가닥의 3' 말단 및 안티센스 가닥의 5' 말단상에서 듀플렉스의 평활 말단을 형성하고 2개의 뉴클레오타이드 RNA 오버행은 안티센스 가닥의 3' 말단상에 위치한다. 이것은 평활 말단상에 DNA를 갖고 오버행 말단상에 RNA 염기를 갖는 비대칭 조성이다.
특정 양태에서, DsiRNA 제제의 안티센스 가닥은 안티센스 가닥의 3' 말단에 위치하는 적합한 변형제에 의한 다이서 프로세싱을 위해 변형되는데, 즉 DsiRNA 제제는 다이서 결합 및 프로세싱의 배향을 지시하도록 디자인된다. 적합한 변형제는 데옥시리보뉴클레오타이드, 디데옥시리보뉴클레오타이드, 어사이클로뉴클레오타이드 등과 같은 뉴클레오타이드 및 입체 장애 분자, 예를 들어, 형광성 분자 등을 포함한다. 어사이클로뉴클레오타이드는 dNMP에 통상적으로 존재하는 2'-데옥시리보푸라노실 당의 2-하이드록시에톡시메틸 그룹을 치환한다. 다른 뉴클레오타이드 변형제는 3'-데옥시아데노신(코르디세핀), 3'-아지도-3'-데옥시티미딘 (AZT), 2',3'-디데옥시이노신(ddI), 2',3'-디데옥시-3'-티아시티딘 (3TC), 2',3'-디데하이드로-2',3'-디데옥시티미딘 (d4T) 및 3'-아지도-3'-데옥시티미딘(AZT), 2',3'-디데옥시-3'-티아시티딘 (3TC) 및 2',3'-디데하이드로-2',3'-디데옥시티미딘 (d4T)의 모노포스페이트 뉴클레오타이드를 포함할 수 있다. 하나의 양태에서, 데옥시리보뉴클레오타이드는 변형제로서 사용된다. 뉴클레오타이드 변형제가 사용되는 경우, 1 내지 3개 뉴클레오타이드 변형제, 또는 2개의 뉴클레오타이드 변형제가 안티센스 가닥의 3' 말단상에서 리보뉴클레오타이드를 대체한다. 입체 장애 분자가 사용되는 경우, 이들은 안티센스 가닥의 3' 말단에서 리보뉴클레오타이드에 부착된다. 따라서, 가닥의 길이는 변형제의 혼입과 함께 변화하지 않는다. 또 다른 양태에서, 본 발명은 dsNA에서 2개의 DNA 염기를 대체하여 다이서 프로세싱의 배향을 지시하도록 함을 고려한다. 추가의 발명에서, 2개의 말단 DNA 염기는 안티센스 가닥의 3' 말단상의 2개의 리보뉴클레오타이드를 대체하여 센스 가닥의 5' 말단 및 안티센스 가닥의 3' 말단상에서 듀플렉스의 평활 말단을 형성하고 2개의 뉴클레오타이드 RNA 오버행은 센스 가닥의 3' 말단상에 위치한다. 이것은 평활 말단상에 DNA를 갖고 오버행 말단상에 RNA 염기를 갖는 비대칭 조성이다.
센스 및 안티센스 가닥은 세포의 세포질에서 발견되는 조건과 같은 생물학적 조건하에서 어닐링한다. 또한, dsNA의 서열중 하나, 특히 안티센스 가닥의 영역은 19개 이상의 뉴클레오타이드 서열 길이를 갖고 여기서 상기 뉴클레오타이드는 안티센스 가닥의 3' 말단에 인접하고 표적 RNA의 뉴클레오타이드 서열과 충분히 상보적이어서 RNA 간섭을 지시한다.
추가로, DsiRNA 제제 구조는 다이서 절단으로부터 생성된 올리고뉴클레오타이드 절편이 유전자 발현을 억제하는데 가장 효과적인 올리고뉴클레오타이드의 일부가 되는 것을 보장하기 위해 최적화될 수 있다. 예를 들어, 본 발명의 하나의 양태에서, DsiRNA 제제 구조물중 27-35-bp 올리고뉴클레오타이드가 합성되고, 여기서유전자 발현을 억제하는 예상되는 21개 내지 22-bp 절편은 안티센스 가닥의 3' 말단상에 위치한다. 안티센스 가닥의 5' 말단상에 위치하는 나머지 염기는 다이서에 의해 절단되고 처분된다. 상기 절단된 부분은 상동성(즉, 표적 서열을 기준으로)이거나 비상동성일 수 있고 핵산 가닥을 연장시키기 위해 부가된다. 놀랍게도 본 발명에서 동정된 바와 같이, 상기 연장은 염기쌍 DNA 잔기(이중 가닥 DNA:DNA 연장)와 함께 수행되어 상응하는 이중 가닥 RNA:RNA 연장된 DsiRNA 제제 보다 개선된 효능 또는 지속적인 효과를 갖는 연장된 DsiRNA 제제를 수득할 수 있다.
US 2007/0265220은 27량체 DsiRNA가 화학적 변형이 부재임에 불구하고 상응하는 21량체 siRNA 조성물 보다 혈청중에서 개선된 안정성을 보여준다. US 2007/0265220 및 본원의 실시예에 상세히 기재된 바와 같은 패턴으로 안티센스 가닥에서 2'-O-메틸 RNA의 내포와 같은 DsiRNA 제제의 변형은 5' 포스페이트의 부가와 커플링되는 경우 DsiRNA 제제의 안정성을 개선시킬 수 있다. 합성 RNA 듀플렉스에서 모든 가닥으로의 5' 포스페이트의 부가는 일부 제한된 정도의 뉴클레아제 안정성을 부여하기 위해 저렴하고 생리학적 방법일 수 있다.
본 발명의 DsiRNA 제제의 화학적 변형 패턴은 상기 제제의 효능을 증진시키도록 디자인한다. 따라서, 상기 변형은 DsiRNA 제제의 효능 감소를 회피하거나; DsiRNA 제제의 다이서 프로세싱의 간섭을 회피하거나; DsiRNA 제제의 생물학적 유체내 안정성을 개선시키거나(뉴클레아제 민감성을 감소시키는) 선천적 면역계에 의한 검출을 차단하거나 회피하도록 디자인한다. 상기 변형은 또한 독성인 것을 피하고 비용 증가를 피하거나 본 발명의 DsiRNA 제제의 제조 용이함에 영향을 주도록 디자인한다.
RNA 프로세싱
siRNA
siRNA 매개된 RNAi의 공정은 세포내에서 긴 dsRNA 분자의 존재에 의해 유발된다. RNAi의 초기 단계 동안에, 이들 dsRNA 분자는 2개의 RNase III형 도메인을 함유하는 보존된 계열의 효소인 다이서에 의해 21개 내지 23개 뉴클레오타이드(nt) 소형 간섭 RNA 듀플렉스(siRNA)로 절단된다(문헌참조: Bernstein et al. 2001; Elbashir et al. 2001). 상기 siRNA는 각각의 가닥상에 19개 내지 21개 염기쌍 듀플렉스 영역 및 2개 뉴클레오타이드 3'오버행을 특징으로 한다. RNAi의 이펙터 단계 동안에, 상기 siRNA는 소위 RNA 유도된 사일런싱 복합체(RISC)로 불리우는 다량체성 단백질에 혼입되고, 여기서, 이들은 분해를 위해 완전히 상보적인 mRNA 기질을 선택하기 위한 가이드로서 작용한다. 분해는 siRNA에 상보적인 영역내에서 mRNA의 엔도핵산분해 절단에 의해 개시된다. 보다 정확하게, mRNA는 가이드 siRNA의 5' 말단으로부터 10번 위치의 뉴클레오타이드에서 절단된다(문헌참조: Elbashir et al. 2001 Genes & Dev. 15: 188-200; Nykanen et al. 2001 Cell 107: 309-321; Martinez et al. 2002 Cell 110: 563-574). 상기 절단에 관여하는 엔도뉴클레아제는 Argonaute2로서 동정되었다 (Ago2; Liu et al. Science, 305: 1437-41).
miRNA
대다수의 사람 miRNA(70%) - 및 추측컨대 다른 포유동물의 대다수의 miRNA-는 인트론 및/또는 엑손으로부터 전사되고 대략 30%가 유전자 상호 영역에 존재한다(문헌참조: Rodriguez et al., Genome Res. 2004, 14(10A), 1902-1910). 사람 및 동물에서, miRNA는 통상적으로 RNA 폴리머라제 II에 의해 전사되고(문헌참조: Farh et al. Science 2005, 370(5755), 1817-1821), 몇몇 경우에 pol III에 의해 전사된다(문헌참조: Borchert et al. Nat. Struct. MoI. Biol. 2006, 13(12), 1097-1 101). 특정 바이러스 암호화된 miRNA는 RNA 폴리머라제 III에 의해 전사되고(문헌참조: Pfeffer et al. Nat. Methods 2005, 2(4), 269-276; Andersson et al. J. Virol. 2005, 79(15), 9556-9565), 일부는 바이러스 유전자의 개방 판독 프레임내에 위치한다(Pfeffer et al. Nat. Methods 2005, 2(4), 269-276; Samols et al. J. Virol. 2005, 79(14), 9301-9305). miRNA 전사는 대형 모노시스트론, 바이시스트론 또는 폴리시스트론 1차 전사체(pri-miRNA)의 생성을 유도한다. 단일의 pri-miRNA는 길이가 대략 200개 뉴클레오타이드(nt)로부터 수 킬로베이스(kb)의 범위일 수 있고 5' 7-메틸구아노신 (m7) 캡 및 3' 폴리 (A) 테일 둘다를 갖는다. 특징적으로, 성숙한 miRNA 서열은 pri-miRNA내 불완전 스템-루프 서열의 영역에 위치한다(Cullen, Mol. Cell 2004, 16(6), 861-865).
핵에서 miRNA 성숙화의 제1 단계는 5' 말단에서 모노포스페이트를 갖고 3' 말단에서 하이드록실 그룹을 갖는 2-nt 오버행을 갖는 소위 pre-miRNA의 약 70nt의 헤어핀-함유 전구체 분자를 방출하는 RNAase III Drosha-DGCR8 핵 마이크로프로세서 복합체에 의한 pri-miRNA의 인지 및 절단이다(문헌참조: Cai et al. RNA 2004, 10(12), 1957-1966; Lee et al. Nature 2003, 425(6956), 415-419; Kim Nat. Rev. MoI. Cell. Biol. 2005, 6(5), 376-385). 다음 단계는 엑스포르틴(Exportin)-5인 운반체 단백질에 의한 pre-miRNA의 핵으로부터의 세포질내로의 핵 수송이다(문헌참조: Yi et al. Genes. Dev. 2003, 17(24), 3011 -3016, Bohnsack et al. RNA 2004, 10(2), 185-191). 엑스포르틴-5 및 GTP-결합된 형태의 이의 조인자 Ran은 함께 pre-miRNA이 특징인, 2개 뉴클레오타이드 3' 오버행 및 인접한 줄기를 인지하고 결합한다(문헌참조: Basyuk et al. Nucl. Acids Res. 2003, 31(22), 6593-6597, Zamore MoI. Cell. 2001, 8(6), 1158-1160). 세포질내에서, GTP 가수분해로 pre-miRNA가 방출되고 이는 이어서 세포 엔도뉴클레아제 III 효소 다이서에 의해 프로세싱된다(문헌참조: Bohnsack et al.). 다이서는 먼저 RNA 간섭(RNAi)을 매개하는 siRNA를 생성시키는 이의 역할때문에 인지된다. 다이서는 이의 조인자 TRBP(트랜스활성화 영역 결합 단백질; Chendrimata et al. Nature 2005, 436(7051), 740-744) 및 PACT (인터페론 유도성 이중 가닥 RNA 의존성 단백질 키나제 활성화제; Lee et al. EMBO J. 2006, 25(3), 522-532)와 협력하여 작용한다. 이들 효소는 pre-miRNA 헤어핀의 염기에서 3'의 2개 뉴클레오타이드 오버행에 결합하고 말단 루프를 제거하여 양 말단이 5' 모노포스페이트, 3' 2개 뉴클레오타이드 오버행 및 3' 하이드록실 그룹을 갖는 대략 21-nt miRNA 듀플렉스 중간체를 생성시킨다. miRNA 가이드 가닥(이의 5' 말단은 에너지학적으로 덜 안정하다)은 따라서 RISC(RNA-유도된 사일런싱 복합체)로의 혼입을 위해 선택되고 '패신저' 가닥은 방출되고 분해된다(문헌참조: Maniataki et al. Genes. Dev. 2005, 19(24), 2979-2990; Hammond et al. Nature 2000, 404(6775), 293-296). RISC의 조성은 완전히 정의되지 않은채 남아있지만 주요 성분은 Argonaute (Ago) 단백질 계열 구성원이다(문헌참조: Maniataki et al; Meister et al. Mol. Cell. 2004, 15(2), 185-197).
이어서 성숙한 miRNA는 RISC를 상보적인 mRNA 종으로 지시한다. 표적 mRNA가 miRNA-암 RISC와 완전한 상보성을 갖는 경우, mRNA는 절단되고 분해된다(문헌참조: Zeng et al. Proc. Natl. Acad. Sci. USA 2003, 100(17), 9779-9784; Hutvagner et al. Science 2002, 297(55 89), 2056-2060). 그러나, 포유동물 세포에서 가장 통상적인 상황으로서, miRNA는 불완전 상보성을 갖는 mRNA를 표적화하고 이들의 해독을 억제하여 상응하는 단백질의 발현을 감소시킨다(문헌참조: Yekta et al. Science 2004, 304(5670), 594-596; Olsen et al. Dev. Biol. 1999, 216(2), 671-680). 특히 소위 씨드 영역으로 불리우는 miRNA의 2번 내지 7번 또는 8번 뉴클레오타이드(5' 말단에서 1번 위치로부터 개시하여)에서 miRNA와 표적 서열간에 매치하는 miRNA의 5' 영역은 miRNA 표적화를 위해 필수적으로 중요하고 이러한 씨드 매치는 또한 miRNA 표적화의 컴퓨터 예측에 광범위하게 사용되는 주요 원리가 되었다(문헌참조: Lewis et al. Cell 2005, 120(1), 15-20; Brennecke et al. PLoS Biol. 2005, 3(3), e85). miRNA-mRNA 듀플렉스의 miRNA 조절은 주로 3' UTR에서 다중 상보적인 부위를 통해 매개되지만 많은 예외가 있다. miRNA는 또한 mRNA의 5' UTR 및/또는 암호화 영역에 결합하여 유사한 결과를 수득한다(문헌참조: Lytle et al. Proc. Natl. Acad. Sci. USA 2007, 104(23), 9667-9672).
RNase H
RNase H는 DNA/RNA 듀플렉스에서 RNA의 3'-O-P 결합을 절단하여 3'-하이드록실 및 5'-포스페이트 말단화된 생성물을 생성하는 리보뉴클레아제이다. RNase H는 비특이적 엔도뉴클레아제이고 효소 결합된 2가 금속 이온에 의해 지원되는 가수분해 기작을 통해 RNA의 절단을 촉매한다. RNase H 계열의 구성원은 고세균 및 원핵세포에서 진핵세포에 이르기까지 거의 모든 유기체에서 발견된다. DNA 복제동안에, RNase H는 오가자키 단편의 프라이밍 생성에 관여하는 RNA 프라이머를 절단하는 것으로 사료되지만 RNase H 효소는 보다 일반적으로 충분한 길이의 임의의 DNA:RNA 하이브리드 서열(예를 들어, 전형적으로 포유동물에서 4개 이상의 염기쌍 길이의 DNA:RNA 하이브리드 서열)을 절단시키는데 사용될 수 있다.
마이크로 RNA 및 마이크로RNA형 치료제
마이크로RNA(miRNA)는 주형 전사체의 3'UTR에 결합하고 통상적인 RNA 간섭과 관련되지만 이와는 명확히 다른 기작에 의해 주형 전사체가 암호화하는 단백질의 발현을 억제하는 작용을 하는 것으로 보고되었다. 구체적으로, miRNA는 이의 안정성을 감소시키는 것 보다는 표적 전사체의 해독을 감소시키는 작용을 하는 것으로 사료된다. 천연의 miRNA는 전형적으로 길이가 대략 22nt이다. 이들은 대략 70nt 길이인 소형의 일시적 RNA(stRNA)로서 공지된 대형 전구체로부터 유래하는 것으로 사료된다.
siRNA 및 보다 구체적으로 3'UTR내에(또는 표적 전사체의 그밖의 다른 곳, 예를 들어, 노치(Notch) 및/또는 노치 계열의 전사체의 반복 요소에서) 결합하여 해독을 억제하는 miRNA와 같은 간섭 제제가 siRNA/주형(miRNA/주형) 듀플렉스에서 다수의 미스매치를 허용할 수 있고 특히 듀플렉스의 중앙 영역내에 미스매치를 허용할 수 있다. 사실, 시험관내에서 해독을 억제하는 것으로 나타난 miRNA가 작용하는 바와 같이 천연의 stRNA가 흔히 상기 미스매치를 나타냄으로 일부 미스매치가 요망되거나 요구될 수 있다는 증거가 있다(문헌참조: Zeng et al., Molecular Cell, 9: 1-20). 예를 들어, 표적 전사체와 하이브리드화하는 경우, 상기 miRNA 는 흔히 미스매치 영역에 의해 분리된 2개의 완벽한 상보성 스트레치를 포함한다. 상기 하이브리드화된 복합체는 통상적으로 예를 들어, G:A, G:U, G:G, A:A, A:C, U:U, U:C, C:C, G:-, A:-, U:-, C:-, 등일 수 있는 적어도 단일 미스매치된 염기쌍 및 뉴클레오타이드 쌍을 포함하는 2개 영역의 완벽한 상보성(듀플렉스 부분)을 포함한다. 상기 미스매치된 뉴클레오타이드가 반복적으로(예를 들어, 2개, 3개 또는 4개의 뉴클레오타이드 영역의 미스매치) 존재하는 경우 이는 벌지(bulge)의 어느 하나의 플랭크상에 위치하는 듀플렉스 부분을 분리하는 벌지를 형성할 수 있다. 다양한 구조가 가능하다. 예를 들어, miRNA는 다중 영역의 비동일체(미스매치)를 포함할 수 있다. 비동일체 영역(미스매치)는 표적 및 miRNA 둘다가 쌍을 이루지 않은 뉴클레오타이드를 포함한다는 의미에서 대칭일 필요는 없다. 예를 들어, 단지 하나의 가닥이 쌍을 이루지 않은 뉴클레오타이드를 포함하는 구조가 보고되었다(문헌참조: Zeng et ai, 도 33). 전형적으로 miRNA 제제내 완벽한 상보성 스트레치는 길이가 5개 이상의 뉴클레오타이드, 예를 들어, 길이가 6 또는 7개 이상인 뉴클레오타이드이고, 미스매치 영역은 예를 들어, 길이가 1, 2, 3 또는 4개 뉴클레오타이드일 수 있다.
일반적으로, 임의의 특정 siRNA는 (i) "전형적인" siRNA 경로(여기서, 표적 전사체의 안정성은 감소되고 siRNA와 표적간의 완벽한 상보성이 흔히 바람직하다)를 통해 및 또한 (ii) "또 다른" 경로(일반적으로 동물에서 miRNA 경로로서 특징화되는)(여기서, 표적 전사체의 해독은 억제된다)에 의해 유전자 억제하는 작용을 할 수 있다. 일반적으로 기작 (i)를 통한 특정 siRNA에 의해 유발되는 전사체는 기작 (ii)를 통해 표적화된 전사체와는 구분될 수 있지만 단일 전사체는 전형적이고 또 다른 경로 둘다에 대한 표적으로 작용할 수 있는 영역을 포함할 수 있다. (용어 "전형적인" 및 "또 다른"은 단순히 편리를 위해 사용되고 일반적으로 동물 세포에서 상기 기작이 발견된 역사적 시점을 반영하지만 어느 하나의 기작의 중요성, 효과 또는 다른 특징을 반영하지는 않는다). siRNA 디자인의 하나의 공통된 목표는 잠재적으로 기작 (ii)을 통해 유발되는 효과들을 포함하는 오프-표적 효과를 최소화하면서 기작 (i)를 통해 큰 특이성으로 단일 전사체를 표적화하는 것이다. 그러나, 본 발명의 목표중 하나는 천연 miRNA의 활성을 모방할 목적으로 또는 어떠한 상응하는 miRNA가 현재 공지되지 않는 표적 RNA에 대해 지시된 제제를 제조할 목적으로 디자인에 의해 미스매치를 잔기를 갖고 상기 미스매치에 내성이고 능히 증진되는 상기 미스매치 함유 DsiRNA 제제(예를 들어, DsiRNAmm 제제)의 억제 및/또는 치료학적 효력/효능을 갖는 RNA 간섭 제제를 제공하는 것이다.
미스매치된 뉴클레오타이드에 대한 miRNA 제제의 내성(및 실제로 세포에서 상기 기작(ii)의 존재 및 천연 용도)은 기작 (i)를 통해 작용하는 완벽하게 상보성인 siRNA의 "전형적인" 용도 보다 이롭고/이롭거나 확장되는 방식의 miRNA의 용도를 시사한다. miRNA는 천연 분자이기 때문에 치료제로서 miRNA를 적용하는데 있어서 독특한 이점이 있을 가능성이 높다. miRNA는 이들 기능의 수십억년의 진화적 "파인 튜닝"으로부터 이익을 얻는다. 따라서, 서열 특이적 "오프 표적" 효과는 천연의 miRNA에서 문제가 되지 않고 보다 확대하여 천연적으로 miRNA를 모방하도록 디자인된 본 발명의 특정 합성 DsiRNA(예를 들어, DsiRNAmm 제제)에서도 문제가되지 말아야 한다. 또한, miRNA는 상향 조절 및 하향 조절(특정 경우에 다중 표적 RNA에 잡다하게 작용하는 단일 miRNA가 세포내에서 동시에 둘다의 기능을 수행하는) 둘다를 구동하는 유전자 그룹의 발현을 조절하도록 진화하였고, 그 결과 복잡한 세포 기능은 정확히 조절될 수 있다. 천연 miRNA의 상기 대체는 정상적인 증식, 아폽토시스, 세포 사이클 및 하나 이상의 miRNA의 하향 조절에 의해 영향받는 다른 세포성 기능을 회복하도록 하는 노력의 일환으로 합성 miRNA 또는 miRNA 모사체(예를 들어, 특정 DsiRNAmm)를 환부 조직으로 도입하는 것을 포함할 수 있다. 특정 경우에, 이들 miRNA-조절된 경로의 반응 활성화는 상당한 치료학적 반응을 나타낸다(예를 들어, 심장 비대증에 대한 한 연구에서, miRNA 발현 카세트의 아데노 바이러스 매개된 전달에 의한 miR-133의 과발현은 효능제 유도된 심장 비대증으로부터 동물을 보호하는 반면, 길항제에 의한 야생형 마우스에서 miR-133의 상호 감소는 비대성 마커에서 증가를 유발하였다(문헌참조: Care et al. Nat. Med. 13: 613-618)).
지금까지, 600개 이상의 miRNA가 사람 게놈내에 암호화된 것으로 동정되었고 상기 miRNA는 핵 및 세포질내에서 단백질 조합에 의해 발현되고 프로세싱된다. miRNA는 척추동물간에 고도로 보존되어 있고 모든 포유동물 유전자의 대략 2%를 차지한다. 각각의 miRNA는 다중, 예를 들어, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 심지어 10개에서 수백개의 상이한 유전자의 발현을 조절하는 것으로 나타났기 때문에 miRNA는 다중 세포 경로 및 프로세스를 효율적으로 조절하고 편성하는 "마스터-스위치"로서 작용할 수 있다. 다중 유전자의 발현을 편성함에 의해 배아 발달, 면역성, 염증 뿐만 아니라 세포 성장 및 증식에 주요 역할을 한다.
발현 및 기능 연구는 특정 miRNA의 변화된 발현은 다양한 사람 질환에 중요함을 시사한다. 많은 증거는 특정 miRNA의 질환 세포 및 조직으로의 도입이 호전적인 치료학적 반응을 유도할 수 있음을 지적한다(문헌참조: Pappas et al., Expert Opin Ther Targets. 12: 115-27). miRNA 치료 전망은 아마도 종양 서프레서로서 특정 miRNA의 분명한 역할 때문에 암에서 가장 크다. 예를 들어, 암에 대한 miRNA 기반의 이상적인 치료제는 적어도 부분적으로 하기의 관찰에 의해 지지된다:
(1) miRNA는 흔히 정상적인 조직과 비교하는 경우 환부 조직에서 잘못 조절되거나 변화된 수준으로 발현된다. 다수의 연구는 상응하는 정상적인 조직과 상대적으로 암 조직에서 miRNA 수준이 변화함을 보여주었다. 흔히, 변화된 발현은 특정 miRNA의 증가되거나 감소된 발현을 유도하는 유전자 돌연변이 결과이다. 독특한 miRNA 발현 상태를 갖는 질환은 진단 및 예후 마커로서 사용될 수 있고 본 발명의 DsiRNA(예를 들어, DsiRNAmm)에 표적이 될 수 있다.
(2) 잘못 조절된 miRNA는 발암 또는 종양 서프레서로 작용함에 의해 암 발달에 기여한다. 발암 유전자는 이의 과발현 또는 부적절한 활성화가 발암을 유발하는 유전자로서 정의된다. 종양 서프레서는 세포가 암이 되지 못하도록 요구되는 유전자이고; 종양 서프레서의 하향 조절 또는 불활성화는 공통된 암의 유도인자이다. 2개 유형의 유전자는 상기 표적화가 특이적으로 특정 암에 대해 분자적 기반에 특이적으로 작용할 수 있으므로 바람직한 약물 표적이다. 발암성 miRNA의 예는 miR-155 및 miR-17-92이고; let-7은 종양 억제 miRNA의 예이다.
(3) miRNA의 투여는 임상전 동물 연구에서 종양 성장을 차단하거나 감소시킴에 의해 치료학적 반응을 유도한다. 과학적 문헌은 miRNA 기능의 회복이 시험관내 또한 동물 모델에서 암 세포의 성장을 차단하거나 감소시킬 수 있음을 입증하는 개념 증거 연구를 제공한다. 널리 특징 규명된 예는 유방암 및 폐암 모델에서 let-7의 항-종양 활성이다. let-7을 모방하도록 디자인된 본 발명의 DsiRNAs (예를 들어, DsiRNAmms)는 상기 암을 표적화하는데 사용될 수 있고 또한 본원에 기재된 DsiRNA 디자인 파라미터를 사용하여 어떠한 대응하는 천연 miRNA가 공지되지 않은 표적 RNA(예를 들어, 노치 또는 다른 전사체내 반복체)에 대해 지시된 새로운 DsiRNA(예를 들어, DsiRNAmm) 제제를 제조하고 예를 들어, 임상전 동물 모델에서 종양 부하를 감소시킬 수 있는 제제인 치료학적 유도 화합물을 스크리닝할 수 있다.
(4) 소정의 miRNA는 다중 세포 경로를 조절하고 따라서 보다 우수한 치료학적 활성을 가질 수 있다. 이들의 생물학적 작용을 기준으로, miRNA는 다중 유전자 생성물을 조절하고 다중 경로를 편성하는 게놈의 "마스터 스위치"로서 작용할 수 있다. miRNA에 의해 조절되는 유전자는 통상적인 발암유전자 및 종양 서프레서를 암호화하는 유전자를 포함하고, 이들의 대다수는 개별적으로 약제학적 산업에서 약물 표적으로서 추구된다. 따라서, miRNA 치료제는 다중 질환 및/또는 암-관련 유전자를 표적화함에 의해 siRNA 및 다른 형태의 유도 화합물 보다 우수한 활성을 가질 수 있다. miRNA의 잘못된 조절이 흔히 종양 발생 과정에서 초기 반응인 것으로 관찰되는 경우, 상실된 miRNA를 대체하는 miRNA 치료제가 가장 적당한 치료제일 수 있다.
(5) miRNA는 천연 분자이고 따라서 비특이적 부작용을 유도할 경향이 적다. 수백년간의 진화는 miRNA의 조절 네트워크를 개발하고 표적 전령 RNA와 miRNA의 상호작용을 파인 튜닝하도록 도와주었다. 따라서, miRNA 및 miRNA 유도체(예를 들어, 천연 miRNA를 모방하도록 디자인된 DsiRNA)는 적당히 적용되는 경우 어떠한 경우라도 "오프-표적" 효과를 거의 갖지 않는다.
siRNA 및 miRNA의 물리적 특성은 유사하다. 따라서, siRNA(예를 들어, 본 발명의 DsiRNA)를 전달하는데 효과적인 기술은 또한 합성 miRNA(예를 들어, 본 발명의 특정 DsiRNAmm)를 전달하는데 효과적이다.
DsiRNA 제제의 접합 및 전달
특정 양태에서, 본 발명은 질환 또는 장애를 갖거나 발병할 위험에 처한 피검체를 치료하는 방법에 관한 것이다. 상기 양태에서, DsiRNA는 질환 또는 장애를 억제하기 위한 신규 치료학적 제제로서 작용할 수 있다. 상기 방법은 본 발명의 약제학적 조성물을 피검체(예를 들어, 사람)에게 투여하여 표적 RNA의 발현, 수준 및/또는 활성을 감소시킴을 포함한다. 표적 RNA에 의해 암호화된 폴리펩타이드의 발현, 수준 및/또는 활성은 또한 본 발명의 DsiRNA에 의해 감소시킬 수 있다.
질환 또는 장애의 치료에서, DsiRNA는 질환 또는 장애를 나타내거나 이와 연관된 세포 또는 조직과 접촉시킬 수 있다. 예를 들어, 표적 RNA 서열의 전부 또는 일부와 실질적으로 동일한 DsiRNA는 환부 또는 환부 관련 또는 감염된 세포와 생체내 또는 시험관내에 접촉시키거나 상기 세포로 도입할 수 있다. 유사하게, 표적 RNA 서열의 전부 또는 일부와 실질적으로 동일한 DsiRNA는 질환 또는 장애를 갖거나 이를 발병할 위험에 처한 피검체에 직접 투여할 수 있다.
본 발명의 DsiRNA 제제의 치료학적 용도는 다수의 상이한 DsiRNA 제제 서열을 포함하는 DsiRNA 제제의 제형의 사용을 포함할 수 있다. 예를 들어, 현재 기재된 제제의 2개 이상, 3개 이상, 4개 이상, 5개 이상 등을 배합하여 예를 들어, 하나 이상의 표적 RNA의 다수의 상이한 영역을 표적화하는 제형을 제조할 수 있다. 본 발명의 DsiRNA 제제를 또한 작제하여 DsiRNA 제제의 어느 한 가닥이 독립적으로 표적 RNA의 2개 이상의 영역을 표적화할 수 있도록 할 수 있다. 표적 핵산 분자의 하나 이상의 영역을 표적화하는 다기능성 DsiRNA 분자의 사용은 RNA 수준 및 발현의 강력한 억제를 제공할 것으로 예상된다. 예를 들어, 본 발명의 단일 다기능성 DsiRNA 작제물은 표적 핵산 분자의 보존 및 가변 영역 둘다를 표적화하여, 예를 들어, 단일 표적 유전자에 의해 암호화된 바이러스의 상이한 종의 변이체 또는 스플라이스 변이체의 하향 조절 또는 억제를 가능하게할 수 있다.
본 발명의 DsiRNA 제제는 또 다른 잔기(예를 들어, 펩타이드와 같은 비핵산 잔기), 유기 화합물(예를 들어, 염료, 콜레스테롤 등)에 접합되거나(예를 들어, 이의 센스 또는 안티센스 가닥의 5' 또는 3' 말단) 비접합될 수 있다. 상기 방식으로 DsiRNA 제제를 변형시켜 상응하는 비접합된 DsiRNA 제제와 비교하여 수득한 DsiRNA 제제 유도체의 세포 흡수를 개선시키거나 세포 표적화 활성을 증진시킬 수 있고 비접합된 DsiRNA 제제와 비교하여 세포에서 DsiRNA 제제 유도체를 추적하기 위해 유용하거나 상응하는 DsiRNA 제제 유도체를 개선시킬 수 있다.
DsiRNA 활성을 평가하기 위한 RNAi 시험관내 분석
세포 부재 시스템에서 RNAi를 반복적으로 시험하는 시험관내 분석을 사용하여 DsiRNA 작제물을 평가할 수 있다. 예를 들어, 상기 분석은 문헌[참조: Tuschl et al., 1999, Genes and Development, 13, 3191-3197 and Zamore et al., 2000, Cell, 101, 25-33, adapted for use with DsiRNA agents directed against target RNA]에 기재된 시스템을 포함한다. 다핵성 배반엽(syncytial blastoderm)으로부터 유래된 초파리 추출물을 사용하여 시험관내 RNAi 활성을 재구성한다. 표적 RNA는 T7 RNA 폴리머라제를 사용하여 적당한 플라스미드로부터 시험관내 전사를 통해 또는 화학적 합성을 통해 제조된다. 센스 및 안티센스 DsiRNA 가닥(예를 들어 각각 20 uM)은 90℃에서 1분동안 이어서 37℃에서 1시간동안 완충액(예를 들어, 100 mM 칼륨 아세테이트, 30 mM HEPES-KOH, pH 7.4, 2 mM 마그네슘 아세테이트)중에서 항온처리함에 이어서 용해 완충액(예를 들어, 100mM 칼륨 아세테이트, 30 mM HEPES-KOH(pH 7.4), 2 mM 마그네슘 아세테이트)중에서 희석시켜 어닐링한다. 어닐링은 TBE 완충액중에서 아가로스 겔상에 겔 전기영동하고 에티디움 브로마이드로 염색시켜 모니터링할 수 있다. 초파리 용해물은 탈염소화되고 용해된 호모 당밀 한천상에서 수거된 오레곤 알 플라이(Oregon R fly) 기원의 0 내지 2시간령 배아를 사용하여 제조한다. 상기 용해물을 원심분리하고 상등액을 분리한다. 상기 분석은 50% 용해물 [vol/vol], RNA (10-50 pM 최종 농도), 및 DsiRNA(10 nM 최종 농도)를 함유하는 10% [vol/vol] 용해 완충액을 함유하는 반응 혼합물을 포함한다. 상기 반응 혼합물은 또한 10 mM의 크레아틴 포스페이트, 10 ug/ml의 크레아틴 포스포키나제, 100 um GTP, 100 uM UTP, 100 uM CTP, 500 uM ATP, 5 mM DTT, 0.1 U/uL RNasin (Promega), 및 100 uM의 각각의 아미노산을 함유한다. 칼륨 아세테이트의 최종 농도는 100mM로 조정한다. 상기 반응은 빙상에서 예비 어셈블리하고 RNA를 첨가하기전에 10분동안 25℃에서 예비 항온처리함에 이어서 추가의 60분동안 25℃에서 항온처리한다. 4용적의 1.25 x 수동 용해 완충액(Promega)으로 반응을 켄칭시킨다. 표적 RNA 절단은 RT-PCR 분석 또는 당업계에 공지된 다른 방법에 의해 평가하고 DsiRNA가 반응으로부터 제외된 대조군 반응과 비교한다.
또는 분석을 위해 내부적으로 표지된 표적 RNA는 [알파-32P] CTP의 존재하에 시험관내 전사에 의해 제조하고, 스핀 크로마토그래피에 의해 G50 세파덱스 칼럼상에 통과시키고 추가의 정제없이 표적 RNA로서 사용한다. 임의로, 표적 RNA는 T4 폴리뉴클레오타이드 키나제 효소를 사용하여 5'-32P-말단 표지시킨다. 상기된 바와 같이 분석을 수행하고 RNAi에 의해 제조된 표적 RNA 및 특이적 RNA 절단 생성물을 겔의 자가방사선촬영에 의해 가시화한다. 절단 %는 온전한 대조군 RNA 또는 DsiRNA가 부재인 대조군 반응으로부터 유래된 RNA 및 상기 분석에 의해 제조된 절단 생성물을 나타내는 밴드의 PHOSPHOR IMAGER® (자가방사선촬영) 정량에 의해 결정한다.
핵산, 벡터 및 숙주 세포 도입 방법
본 발명의 DsiRNA 제제를 도입하는 방법은 직접 세포내로(즉 세포내로) 도입하거나; 강내, 간질 공간으로, 유기체의 순환계로 세포외로 도입하거나 세포 또는 유기체를, 핵산을 함유하는 용액중에 침지시킴에 의해 도입할 수 있다. 혈관 또는 혈관외 순환계, 혈액계 또는 림프계 및 뇌척수액은 핵산이 도입될 수 있는 부위이다.
본 발명의 DsiRNA 제제는 핵산을 함유하는 용액의 주사, 핵산으로 덮여진 입자에 의한 충격, 세포 또는 유기체의 핵산 용액중의 침지 또는 핵산의 존재하에 세포 막의 전기천공을 포함하는 당업계에 공지된 핵사 전달 방법을 사용하여 도입할 수 있다. 핵산을 세포로 도입하기 위해 당업계에 공지된 다른 방법, 예를 들어, 지질 매개 운반 수송, 화학적 매개된 수송 및 양이온 리포좀 형질감염(예를 들어, 인산칼슘) 등을 사용할 수 있다. 상기 핵산은 하기의 활성 중 하나 이상을 수행하는 다른 성분과 함께 도입할 수 있다: 세포에 의한 핵산 흡수를 증진시키거나 또한 표적 RNA의 억제를 증가시키는 것.
표적 RNA를 갖는 세포는 생식선 또는 체세포, 전능 또는 만능, 분열 또는 비분열, 실질조직(parenchyma) 또는 상피, 불멸화되거나 형질전환된 것 등으로부터 기원할 수 있다. 상기 세포는 줄기 세포 또는 분화된 세포일 수 있다. 분화된 세포 유형은 지방세포, 섬유아세포, 단구세포, 심근세포, 내피, 뉴런, 아교세포, 혈액 세포, 거핵세포, 림프구, 마크로파아지, 호중구, 호산구, 호염구, 비만 세포, 백혈구, 과립구, 각질형성세포, 연골세포, 조골세포, 파골세포, 간세포, 및 내분비 또는 외분비선 세포를 포함한다.
특정 표적 RNA 서열 및 전달되는 DsiRNA 제제 물질의 용량에 따라, 상기 방법은 표적 RNA의 기능을 부분적으로 또는 완전히 상실시킬 수 있다. 예를 들어, 표적화된 세포의 50%, 60%, 70%, 80%, 90%, 95% 또는 99% 이상에서 RNA 수준 또는 발현(RNA 발현 또는 암호화된 폴리펩타이드 발현)을 감소시키거나 상실시킨다. 표적 RNA 수준 또는 발현의 억제는 RNA 또는 RNA 암호화된 단백질의 수준의 부재(또는 관찰가능한 감소)를 언급한다. 특이성은 세포의 또 다른 유전자에 대한 명백한 효과 없이 표적 RNA를 억제하는 능력을 언급한다. 억제 결과는 세포 또는 유기체(하기 실시예에 제공된 바와 같이)의 외향 성질의 조사에 의해 또는 RNA 용액 하이브리드화, 뉴클레아제 보호, 노던 하이브리드화, 역 전사, 마이크로어레이를 사용한 유전자 발현 모니터링, 항체 결합, 효소 연결된 면역흡착 분석(ELISA), 웨스턴 블롯팅, 방사선면역분석(RIA), 기타 면역 분석 및 형광 활성화된 세포 분석(FACS)에 의해 확인할 수 있다. 본 발명의 DsiRNA 제제에 의한 표적 RNA의 억제는 생체내 또는 시험관내에서 또한 암 치료에 대한 종양 크기와 같은 측정가능한 표현형, 바이러스 감염 질환에 대한 바이러스 로드/역가 등에 대한 상기 DsiRNA 제제의 투여 효과를 기준으로 측정할 수 있다. 바이러스 감염 질환에 대해 바이러스 로드 또는 역가의 감소는 예를 들어, 50%, 60%, 70%, 80%, 90%, 95% 또는 99% 이상의 감소를 포함할 수 있고 흔히 대수적으로 측정되고 예를 들어바이러스 로드 또는 역가의 10-배, 100-배, 1000-배, 105-배, 106-배, 107-배 감소는 본 발명의 DsiRNA 제제를 세포, 조직 또는 피검체에 투여하여 성취할 수 있다.
세포주 또는 온전한 유기체내 RNA 매개된 억제에 대해, 단백질 생성물이 용이하게 분석되는 리포터 또는 약물 내성 유전자의 발현을 측정할 수 있다. 상기 리포터 유전자는 아세토하이드록시산 신타제(AHAS), 알칼린 포스파타제(AP), 베타 갈락토시다제(LacZ), 베타 글루코로니다제(GUS), 클로람페니콜 아세틸트랜스퍼라제(CAT), 녹색 형광 단백질(GFP), 서양고추냉이 퍼옥시다제(HRP), 루시퍼라제(Luc), 노팔린 신타제(NOS), 옥토핀 신타제(OCS), 및 이의 유도체를 포함한다. 암피실린, 블레오마이신, 클로람페니콜, 겐타르니신, 히그로마이신, 가나마이신, 린코마이신, 메토트렉세이트, 포스피노트리신, 푸로마이신 및 테트라사이클린에 대해 내성을 부여하는 다중 선택가능한 마커가 시판되고 있다. 분석에 따라, 유전자 발현의 정량은 당업자가 본 발명에 따라 처리되지 않은 세포와 비교하여 10%, 33%, 50%, 90%, 95% 또는 99% 초과의 억제 정도를 결정할 수 있게 해준다.
주사된 물질의 보다 낮은 용량 및 RNA 사일런싱 제제의 투여 후 보다 장 시간은 보다 작은 분획의 세포를 억제할 수 있다(예를 들어 표적화된 세포의 10%, 20%, 50%, 75%, 90%, 또는 95% 이상). 세포내 유전자 발현의 정량은 표적 RNA의 축적 수준 또는 표적 단백질의 해독 수준에서 유사한 정도의 억제를 나타낼 수 있다. 하나의 예로서, 억제 효능은 세포내 유전자 생성물의 양을 평가함에 의해 측정할 수 있고; RNA는 억제 DsiRNA에 대해 사용되는 영역 외부의 뉴클레오타이드 서열을 갖는 하이브리드화 프로브를 사용하여 검출할 수 있거나 해독된 폴리펩타이드는 상기 영역의 폴리펩타이드 서열에 대해 생성된 항체로 검출할 수 있다.
DsiRNA 제제는 세포당 하나 이상의 카피의 전달을 허용하는 양으로 도입할 수 있다. 물질의 보다 높은 용량(예를 들어, 세포당 5, 10, 100, 500 또는 1000 개 이상의 카피수)은 보다 효과적인 억제를 나타낼 수 있고, 보다 낮은 용량은 또한 특정 적용을 위해 유용할 수 있다.
RNA 간섭 기반 치료
공지된 바와 같이, RNAi 방법은 다양한 유기체의 광범위한 유전자에 적용될 수 있고 기재된 조성물 및 방법은 이들과 각각에 사용될 수 있다. 기재된 조성물 및 방법에 의해 표적화될 수 있는 유전자의 예는 세포 본래의 유전자인 내인성 유전자 또는 세포에 통상적인 본래의 유전자가 아닌 유전자를 포함한다. 제한 없이, 이들 유전자는 발암유전자, 사이토킨 유전자, 이디오형(Id) 단백질 유전자, 프리온 유전자, 혈관형성을 유도하는 분자를 발현하는 유전자, 접착 분자, 세포 표면 수용체, 전이에 관여하는 단백질, 프로테아제에 대한 유전자, 아폽토시스 유전자, 세포 주기 조절 유전자, EGF 및 EGF 수용체를 발현하는 유전자, 다중약물 내성 유전자, 예를 들어, MDR1 유전자를 포함한다.
보다 구체적으로, 본 발명의 표적 mRNA는 세포 단백질(예를 들어, 핵, 세포질, 막관통 또는 막 연합 단백질)의 아미노산 서열을 특정할 수 있다. 또 다른 양태에서, 본 발명의 표적 mRNA는 세포외 단백질(예를 들어, 세포외 매트릭스 단백질 또는 분비 단백질)의 아미노산 서열을 특정할 수 있다. 본원에 사용된 바와 같이, 용어 단백질의 "아미노산 서열을 특정한다"는 mRNA 서열이 유전자 코드 규칙에 따라 아미노산 서열로 해독된다는 것을 의미한다. 하기 부류의 단백질이 설명을 목적으로 열거된다: 발육 단백질(예를 들어, 접착 분자, 사이클린 키나제 억제제, Wnt 계열 구성원, Pax 계열 구성원, 윙 나선 계열 구성원, Hox 계열 구성원, 사이토킨/림포킨 및 이들의 수용체, 성장/분화 인자 및 이들의 수용체, 신경전달물질 및 이의 수용체); 발암유전자 암호화된 단백질(예를 들어, ABLI, BCLI, BCL2, BCL6, CBF A2, CBL, CSFIR, ERBA, ERBB, EBRB2, ETSI, ETSI, ETV6, FGR, FOS, FYN, HCR, HRAS, JUN, KRAS, LCK, LYN, MDM2, MLL, MYB, MYC, MYCLI, MYCN, NRAS, PIM I, PML, RET, SRC, TALI, TCL3, 및 YES); 종양 서프레서 단백질(예를 들어, APC, BRCAl , BRCA2, MADH4, MCC, NF I, NF2, RB I, TP53, 및 WTI); 및 효소 (예를 들어, ACC 신타제 및 옥시다제, ACP 데사투라제 및 하이드록실라제, ADP-글루코스 피로포릴라제, ATPase, 알콜 데하이드로게나제, 아밀라제, 아밀로글루코시다제, 카탈라제, 셀룰라제, 찰콘 신타제, 키티나제, 사이클로옥시게나제, 데카복실라제, 덱스트리이나제, DNA 및 RNA 폴리머라제, 갈락토시다제, 글루카나제, 글루코스 옥시다제, 과립 결합 전분 신타제, GTPase, 헬리카제, 헤르니셀룰라제, 인테그라제, 이눌린아제, 인버타제, 이소머라제, 키나제, 락타제, 리파제, 리폭시게나제, 리소자임, 나팔린 신타제, 옥토핀 신타제, 펙틴에스테라제, 퍼옥시다제, 포스파타제, 포스포리파제, 포스포릴라제, 피타제, 식물 성장 조절인자 신타제, 폴리갈락투로나제, 프로틴아제 및 펩티다제, 풀란아제, 리컴비나제, 역 전사효소, RUBISCO, 토포이소머라제 및 크실란아제).
하나의 측면에서, 본 발명의 표적 mRNA 분자는 병리학적 병태와 관련된 단백질의 아미노산 서열을 특정한다. 예를 들어, 상기 단백질은 병원체 관련 단백질(예를 들어, 숙주의 면역억제, 병원체 복제, 병원체의 전달 또는 감염 유지에 관여하는 바이러스 단백질) 또는 병원체의 숙주로의 진입, 병원체 또는 숙주에 의한 약물 대사, 병원체 게놈의 복제 또는 통합, 숙주내 감염 확립 또는 전파 또는 다음 세대의 병원체의 어셈블리를 촉진시키는 숙주 단백질일 수 있다. 병원체는 렌티바이러스를 포함하는 플라비바이러스, 피코르나바이러스, 라브도바이러스, 필로바이러스, 레트로바이러스와 같은 RNA 바이러스 또는 아데노바이러스, 폭스바이러스, 헤르페스 바이러스, 사이토메갈로바이러스, 헤파드나바이러스 등과 같은 DNA 바이러스를 포함한다. 추가의 병원체는 세균, 진균류, 기생충, 주혈흡충 및 트리파노소마를 포함한다. 다른 종류의 병원체는 포유동물 전위요소를 포함한다. 또한, 상기 단백질은 종양 관련 단백질 또는 자가면역 질환 관련된 단백질일 수 있다.
상기 표적 유전자는 임의의 유기체로부터 유래되거나 포함될 수 있다. 유기체는 식물, 동물, 원생동물, 세균, 바이러스 또는 진균류일 수 있다. 본원에 참조로서 인용되는 미국 특허 제6,506,559호를 참조한다.
약제학적 조성물
특정 양태에서, 본 발명은 본 발명의 DsiRNA 제제를 포함하는 약제학적 조성물을 제공한다. 상기 DsiRNA 제제 샘플은 적합하게는 제형화될 수 있고 발생해야만 하는 경우 유전자 사일런싱을 유도하기 위해 세포로 진입하기에 충분한 샘플 분획을 가능하게 하는 임의의 수단에 의해 세포 환경으로 도입될 수 있다. dsNA에 대한 많은 제형은 당업계에 공지되어 있고 dsNA가 표적 세포로 진입하여 작용할 수 있는 한 사용될 수 있다. 미국 공개 특허원 제2004/0203145 A1호 및 제2005/0054598 A1호를 참조한다. 예를 들어, 본 발명의 DsiRNA 제제는 완충 용액(예를 들어, 포스페이트 완충 식염 용액), 리포좀, 마이셀 구조 및 캡시드에 제형화될 수 있다. 양이온 지질과 DsiRNA 제제의 제형은 세포로 DsiRNA 제제의 형질감염을 촉진시키는데 사용될 수 있다. 예를 들어, 양이온성 지질, 예를 들어, 리포펙틴(미국 특허 제5,705,188호), 양이온성 글리세롤 유도체 및 다가양이온성 분자, 예를 들어, 폴리라이신(공개된 PCT 국제 특허원 WO 97/30731)이 사용될 수 있다. 적합한 지질은 올리고펙타민, 리포펙타민(Life Technologies), NC388 (문헌참조: Ribozyme Pharmaceuticals, Inc., Boulder, Colo.), 또는 FuGene 6 (Roche)를 포함하고 이 모두는 제조업자의 지침에 따라 사용될 수 있다.
상기 조성물은 전형적으로 핵산 분자 및 약제학적으로 허용되는 담체를 포함한다. 본원에 사용된 바와 같이, 용어 "약제학적으로 허용되는 담체"는 약제학적 투여에 적합한 식염수, 용매, 분산 매질, 피복물, 항세균 및 항진균류 제제, 등장성 및 흡수 지연제 등을 포함한다. 보충 활성 화합물이 또한 상기 조성물에 혼입될 수 있다.
약제학적 조성물은 이의 의도된 투여 경로와 양립할 수 있도록 제형화된다. 투여 경로의 예는 비경구, 예를 들어, 정맥내, 피내, 피하, 경구(예를 들어, 흡입), 경피(국소), 경점막, 및 직장 투여를 포함한다. 비경구, 피내 또는 피하 적용을 위해 사용되는 용액 또는 현탁액은 하기의 성분을 포함할 수 있다: 주사용수, 식염 용액, 비휘발성 오일, 폴리에틸렌 글리콜, 글리세린, 프로필렌 글리콜 또는 기타 합성 용매와 같은 멸균 희석제; 항세균제, 예를 들어, 벤질 알콜 또는 메틸 파라벤; 항산화제, 예를 들어, 아스코르브산 또는 이황화나트륨; 킬레이트제, 예를 들어, 에틸렌디아민테트라아세트산; 완충제, 예를 들어, 아세테이트, 시트레이트 또는 포스페이트; 및 긴장성의 조정을 위한 제제, 예를 들어, 염화나트륨 또는 덱스트로스. pH는 염산 또는 수산화나트륨과 같은 산 또는 염기로 조정할 수 있다. 비경구 제제는 유리 또는 플라스틱으로 이루어진 앰푸울, 1회용 주사기 또는 다중 용량 바이알에 봉입될 수 있다.
주사용으로 적합한 약제학적 조성물은 멸균 주사 용액 또는 분산액의 즉성 제조를 위한 멸균 수용액(수용성) 또는 분산액 및 멸균 분말을 포함한다. 정맥내 투여를 위해 적합한 담체는 생리 식염수, 세균억제 물, Cremophor EL.TM. (BASF, Parsippany, NJ.) 또는 포스페이트 완충 식염수(PBS)를 포함한다. 모든 경우에, 상기 조성물은 멸균되어야만 하고 용이한 주사능이 존재할 정도로 유동성이어야만 한다. 제조 및 저장 조건하에서 안정해야만 하고 세균 및 진균류와 같은 미생물의 오염 작용으로부터 보존되어야만 한다. 상기 담체는 예를 들어, 물, 에탄올, 폴리올(예를 들어, 글리세롤, 프로필렌 글리콜 및 액체 폴리에틸렌 글리콜 등) 및 이의 적합한 혼합물을 함유하는 용매 또는 분산 매질일 수 있다. 적당한 유동성은 예를 들어, 레시틴과 같은 피복물을 사용함에 의해, 분산의 경우에 요구되는 입자 크기를 유지시킴에 의해 및 계면활성제를 사용함에 의해 유지될 수 있다. 미생물 작용 예방은 다양한 항세균제 및 항진균제, 예를 들어, 파라벤, 클로로부탄올, 페놀, 아스코르브산, 티메로살 등에 의해 성취될 수 있다. 많은 경우에, 조성물중에 등장성 제제, 예를 들어, 당, 폴리알콜, 예를 들어, 만니톨, 소르비톨, 염화나트륨을 포함시키는 것이 바람직할 수 있다. 주사용 조성물의 연장된 흡수는 조성물중에 흡수를 지연시키는 제제, 예를 들어, 알루미늄 모노스테아레이트 및 젤라틴을 포함시킴에 의해 수행할 수 있다.
멸균 주사액은 적당한 용매중에 요구되는 양으로 활성 화합물을 요구되는 바와 같은 상기 열거된 요소중 하나 또는 이의 배합물과 함께 혼입시키고 이어서 여과멸균 시킴에 의해 제조할 수 있다. 일반적으로, 분산액은 활성 화합물을 염기성 분산 매질 및 상기 열거된 것들로부터 요구되는 다른 성분을 함유하는 멸균 비히클에 혼입시킴에 의해 제조한다. 멸균 주사 용액 제조용 멸균 분말의 경우에, 제조의 바람직한 방법은 진공 건조 및 동결 건조이고 이는 활성 성분 분말 및 이전에 멸균 여과된 용액으로부터 임의의 추가의 목적하는 성분을 생성시킨다.
경구 조성물은 일반적으로 불활성 희석제 또는 식용 담체를 포함한다. 경구 치료학적 투여 목적을 위해, 활성 화합물은 부형제와 함께 혼입될 수 있고 정제, 트로키제 또는 캅셀제, 예를 들어, 젤라틴 캅셀제의 형태로 사용될 수 있다. 경구 조성물은 또한 구강세척액으로서 사용하기 위한 유체 담체를 사용하여 제조할 수 있다. 약제학적으로 적합한 결합제 및/또는 보조제 물질은 조성물의 일부로서 포함될 수 있다. 정제 환제, 캅셀제 등은 임의의 하기의 성분 또는 유사 성질의 화합물을 함유할 수 있다: 결합제, 예를 들어, 미세결정 셀룰로스, 검 트라가칸트 또는 젤라틴; 부형제, 예를 들어, 전분 또는 락토스, 붕해제, 예를 들어, 알긴산, 프리모겔 또는 옥수수 전분; 윤활제, 예를 들어, 마그네슘 스테아레이트 또는 스테로테스; 활주제, 예를 들어, 콜로이드성 이산화규소; 감미제, 예를 들어, 슈크로스 또는 사카린; 또는 방향제, 예를 들어, 페퍼민트, 메틸 살리실레이트 또는 오렌지향.
흡입 투여를 위해, 상기 화합물은 적합한 추진제, 에를 들어, 가스, 예를 들어, 이산화탄소 또는 분무제를 함유하는 압착된 용기 또는 분배기로부터 에어로졸 분무 형태로 전달된다. 상기 방법은 미국 특허 제6,468,798호에 기재된 것들을 포함한다.
전신 투여는 또한 경점막 또는 경피 수단에 의해 수행할 수 있다. 경점막 또는 경피 투여를 위해, 투과될 장벽에 적당한 투과제는 상기 제형에 사용된다. 상기 투과제는 일반적으로 당업계에 공지되어 있고 예를 들어, 경점막 투여를 위해 세제, 담즙염 및 푸시드산 유도체를 포함한다. 경점막 투여는 비강 분무 또는 좌제의 사용을 통해 성취할 수 있다. 경피 투여를 위해, 활성 화합물은 당업계에 일반적으로 공지된 바와 같은 연고, 고약(salve), 겔 또는 크림으로 제형화한다.
상기 화합물은 또한 좌제 형태(예를 들어, 코코아 버터 및 기타 글리세라이드와 같은 통상적인 좌제 염기와 함께) 또는 직장 전달을 위한 정체 관장(retention enema) 형태로 제조할 수 있다.
상기 화합물은 또한 문헌[참조: McCaffrey et al. (2002), Nature, 418(6893), 38-9 (hydrodynamic transfection); Xia et al. (2002), Nature Biotechnol., 20(10), 1006-10 (viral-mediated delivery); or Putnam (1996), Am. J. Health Syst. Pharm. 53(2), 151-160, erratum at Am. J. Health Syst. Pharm. 53(3), 325 (1996)]에 기재된 방법을 포함하지만 이에 제한되지 않는 당업계에 공지된 방법을 사용한 형질감염 또는 감염에 의해 투여할 수 있다.
상기 화합물은 또한 핵산 제제, 예를 들어, DNA 백신의 투여용으로 적합한 임의의 방법에 의해 투여할 수 있다. 이들 방법은 유전자 총, 생물 주입기 및 피부 패취 및 미국 특허 제6,194,389호에 기재된 미세 입자 DNA 백신 기술 및 미국 특허 제6,168,587호에 기재된 바와 같은 분말 형태 백신을 사용한 포유동물 경피 무주사기 백신 접종과 같은 무주사기 방법을 포함한다. 추가로, 비강내 전달은 특히 문헌[참조; Hamajima et al. (1998), Clin. Immunol. Immunopathol., 88(2), 205-10]에 기재된 바와 같이 가능하다. 리포좀(예를 들어, 미국 특허 제6,472,375호에 기재된 바와 같이) 및 미세캅셀화가 또한 사용될 수 있다. 생분해가능한 표적화할 수 있는 미세입자 전달 시스템이 또한 사용될 수 있다(예를 들어, 미국 특허 제6,471,996호에 기재된 바와 같이).
하나의 양태에서, 상기 활성 화합물은 이식체 및 미세캅셀화된 전달 시스템을 포함하는 조절 방출 제형과 같이 체내로부터 급속히 제거되는 것으로 화합물을 보호하는 담체와 함께 제조한다. 에틸렌 비닐 아세테이트, 폴리무수물, 폴리글리콜산, 콜라겐, 폴리오르토에스테르 및 폴리락트산과 같은 생분해가능한 생물적합성 중합체가 사용될 수 있다. 상기 제형은 표준 기술에 의해 제조할 수 있다. 상기 물질은 또한 상업용으로 제조원[Alza Corporation 및 Nova Pharmaceuticals, Inc]으로부터 구입할 수 있다. 리포좀 현탁액(바이러스 항원에 대한 모노클로날 항체와 함께 감염 세포에 표적화된 리포좀을 포함하는)이 또한 약제학적으로 허용되는 담체로서 사용될 수 있다. 이들은 예를 들어, 미국 특허 제4,522,811호에 기재된 바와 같이 당업자에게 공지된 방법에 따라 제조할 수 있다.
상기 화합물의 독성 및 치료학적 효능은 예를 들어, LD50(집단중 50%에 치명적인 용량) 및 ED50(집단중 50%에 효과적인 치료학적 용량)을 측정하기 위한 세포 배양물 또는 실험 동물중에서 표준 약제학적 과정에 의해 결정할 수 있다. 독성 및 치료학적 효과간의 용량비는 치료학적 지수이고 LD50/ED50의 비로서 표현될 수 있다. 치료학적 지수가 높은 화합물이 바람직하다. 독성 부작용을 나타내는 화합물이 사용될 수 있지만 감염되지 않은 세포에 대한 잠재적인 손상이 최소화되어 부작용이 감소되도록 환부 조직의 부위로 상기 세포를 표적화하는 전달 시스템을 디자인해야 한다.
세포 배양 분석 및 동물 연구로부터 수득된 데이타는 사람에게 사용하기 위한 투여 범위를 제형화하는데 사용될 수 있다. 상기 화합물의 용량은 바람직하게 거의 독성이 없는 ED50을 포함하는 순환 농도 범위내에 있다. 상기 용량은 사용되는 용량 형태 및 사용되는 투여 경로에 따라 상기 범위내에서 다양할 수 있다. 본 발명의 방법에 사용되는 임의의 화합물에 대해, 치료학적 유효량은 처음에 세포 배양 분석으로부터 평가할 수 있다. 용량은 세포 배양에서 결정된 바와 같이 IC50(즉 증상의 절반 최대 억제를 성취하는 시험 화합물의 농도)을 포함하는 순환 혈장 농도 범위를 성취하기 위한 동물 모델에서 제형화할 수 있다. 상기 정보를 사용하여 사람에서 유용한 용량을 보다 정확하게 결정할 수 있다. 혈장내 수준은 예를 들어, 고성능 액체 크로마토그래피에 의해 측정할 수 있다.
본원에 정의된 바와 같이, 치료학적 유효량의 핵산 분자(즉, 유효 용량)는 선택된 핵산에 따라 다양하다. 예를 들어, DsiRNA 제제를 암호화하는 플라스미드가 선택되는 경우, 대략 1 pg 내지 1000 mg 범위의 단일 용량이 투여될 수 있고; 몇몇 양태에서, 10, 30, 100, 또는 1000 pg, 또는 10, 30, 100, 또는 1000 ng, 또는 10, 30, 100, 또는 1000 μg, 또는 10, 30, 100, 또는 1000 mg이 투여될 수 있다. 몇몇 양태에서, 1-5 g의 조성물이 투여될 수 있다. 상기 조성물은 하루 당 수회 내지 주당 수회 투여될 수 있고; 격일로 1회를 포함한다. 당업자는 질환 또는 장애의 중증도, 이전의 치료, 피검체의 일반적인 건강 및/또는 연령 및 기타 현존하는 다른 질환을 포함하지만 이에 제한되지 않는 특정 인자가 피검체를 효과적으로 치료하기 위해 요구되는 용량 및 타이밍에 영향을 줄 수 있음을 인지할 것이다. 더욱이, 치료학적 유효량의 단백질, 폴리펩타이드 또는 항체를 사용한 피검체의 치료는 단일 치료를 포함하거나 바람직하게 일련의 치료를 포함할 수 있다.
DsiRNA 제제를 세포 환경으로 도입하는 방법은 세포 유형 및 이의 환경 구성에 의존할 것으로 인지될 수 있다. 예를 들어, 세포가 액체내에서 발견되는 경우, 하나의 바람직한 제형은 리포펙타민에서와 같은 지질 제형이고 DsiRNA 제제는 세포의 액체 환경으로 직접 첨가할 수 있다. 액체 제형은 또한 예를 들어, 정맥내, 근육내 또는 복강내 주사, 또는 경구로 또는 흡입 또는 당업계게 공지된 다른 방법에 의해 동물에게 투여될 수 있다. 제형이 포유동물 및 보다 구체적으로 사람과 같은 동물로 투여하기에 적합한 경우 상기 제형은 또한 약제학적으로 허용가능한 것이다. 올리고뉴클레오타이드를 투여하기 위한 약제학적으로 허용되는 제형은 공지되어 있고 사용될 수 있다. 몇몇 경우에, 완충액 또는 식염 용액중에 DsiRNA 제제를 제형화하고 난세포를 사용한 연구에서와 같이 제형화된 DsiRNA 제제를 세포로 직접 주사하는 것이 바람직할 수 있다. DsiRNA 제제 듀플렉스의 직접적인 주사가 또한 수행될 수 있다. dsNA(예를 들어, DsiRNA 제제)를 도입하는 적합한 방법에 대해 문헌[참조: 미국 공개된 특허원 제 2004/0203145 A1호]를 참조한다.
DsiRNA 제제의 적합한 양이 도입되어야만 하고 이들 양은 표준 방법을 사용하여 경험적으로 결정할 수 있다. 전형적으로, 세포의 환경내에서 개별적인 DsiRNA 제제 종의 유효 농도는 약 50 나노몰 이하, 10 나노몰 이하이고 농도가 약 1나노몰 이하인 조성물이 사용될 수 있다. 또 다른 양태에서, 약 200피코몰 이하의 농도 및 심지어 약 50 피코몰 이하, 약 20 피코몰 이하, 약 10피코몰 이하 또는 약 5피코몰 이하의 농도를 사용한 방법은 많은 경우에 사용될 수 있다.
상기 방법은 세포가 생존할 수 있는 임의의 세포외 매트릭스에 DsiRNA 제제 조성물을 첨가하여 수행할 수 있고, 단 상기 DsiRNA 제제 조성물은 충분한 양의 DsiRNA 제제가 효과를 나타내도록 세포에 진입할 수 있도록 제형화된다. 예를 들어, 상기 방법은 액체 배양물 또는 세포 성장 배지와 같은 액체, 조직 외식편 또는 포유동물 및 특히 사람과 같은 온전한 유기체중에 존재하는 세포와 함께 사용하기에 적합할 수 있다.
표적 RNA의 수준 또는 활성은 당업계에 현재 공지되거나 이후 개발될 임의의 적합한 방법에 의해 결정할 수 있다. 표적 RNA 및/또는 표적 RNA의 발현을 측정하기 위해 사용되는 방법은 표적 RNA의 성질에 의존할 수 있음을 인지할 수 있다. 예를 들어, 표적 RNA가 단백질을 암호화하는 경우, 용어 "발현"은 단백질 또는 RNA/전사체가 표적 RNA로부터 유래함을 언급할 수 있다. 상기 경우에, 표적 RNA의 발현은 표적 RNA에 상응하는 RNA의 양을 측정하거나 단백질의 양을 측정함에 의해 결정할 수 있다. 단백질은 염색 또는 면역블롯팅과 같은 단백질 분석 또는 단백질이 측정될 수 있는 반응을 촉매하는 경우 반응율을 측정함에 의해 측정할 수 있다. 모든 상기 방법은 당업계에 공지되어 있고 사용될 수 있다. 표적 RNA 수준이 측정되어야만 하는 경우, RNA 수준을 검출하기 위해 임의의 당업계에 인지된 방법이 사용될 수 있다(예를 들어, RT-PCR, 노던 블롯팅 등). 본 발명의 DsiRNA 제제로 바이러스 RNA를 표적화하는데 있어서 또한 시험관내 또는 생체내 피검체, 조직, 세포 또는 세포 추출물에서 표적 바이러스의 수준을 감소시키는 것에 관한 DsiRNA 제제의 효능 측정이 또한 표적 바이러스 RNA 수준 정도를 측정하기 위해 사용될 수 있음이 또한 예상된다. 임의의 상기 측정은 세포, 세포 추출물, 조직, 조직 추출물 또는 임의의 적합한 공급원 물질에 대해 수행할 수 있다.
표적 RNA의 발현이 감소되었는지의 여부에 관한 결정은 RNA 수준의 변화를 신뢰할 수 있게 검출할 수 있는 임의의 적합한 방법에 의해 수행할 수 있다. 전형적으로 상기 결정은 세포의 환경으로 비분해된 DsiRNA를 도입하여 DSiRNA 제제의 적어도 일부가 세포질에 진입하도록 하고 이어서 표적 RNA의 수준을 측정함에 의해 수행된다. 상기 동일한 측정은 동일한 비처리된 세포상에서 수행하고 상기 측정으로부터 수득한 결과를 비교한다.
상기 DsiRNA 제제는 약제학적 유효량의 DsiRNA 제제 및 약제학적으로 허용되는 담체를 포함하는 약제학적 조성물로서 제형화될 수 있다. 약리학적으로 또는 치료학적 유효량은 의도된 약리학적, 치료학적 또는 예방적 결과를 나타내도록 하기에 효과적인 DsiRNA 제제의 양을 언급한다. 상기 용어 "약리학적 유효량" 및 치료학적 유효량" 또는 단순히 "유효량은 의도된 약리학적, 치료학적 또는 예방적 결과를 나타내도록 하기에 효과적인 RNA의 양을 언급한다. 예를 들어, 소정의 임상적 실험이 효과적인 것으로 간주되는 경우(질환 또는 장애와 관련된 측정가능한 파라미터가 20% 이상 감소된 경우), 질환 또는 장애의 치료를 위한 약물의 치료학적 유효량은 상기 파라미터에서 20% 이상의 감소를 유도하는데 필요한 양이다.
본 발명의 적합하게 제형화된 약제학적 조성물은 당업계에 공지된 임의의 수단, 예를 들어, 정맥내, 근육내, 복강내, 피하, 경피, 기도(분무), 직장, 질 및 국소(협측 및 설하를 포함하는) 투여를 포함하는 비경구 경로에 의해 투여될 수 있다. 몇몇 양태에서, 약제학적 조성물은 정맥내 또는 복강내 주입 또는 주사에 의해 투여된다.
일반적으로, dsNA의 적합한 용량 단위는 하루당 수용자의 체중 kg당 0.001 내지 0.25 밀리그램 범위, 또는 하루당 체중 kg당 0.01 내지 20마이크로그램 범위, 또는 하루당 체중 kg당 0.01 내지 10마이크로그램 범위, 또는 하루당 체중 kg당 0.10 내지 5 마이크로그램 범위, 또는 하루당 체중 kg당 0.1 내지 2.5마이크로그램이다. dsNA를 포함하는 약제학적 조성물은 하루에 1회 투여될 수 있다. 그러나, 치료학적 제제는 또한 하루에 걸쳐 적당한 간격으로 투여되는 2회, 3회, 4회, 5회, 또는 6회 이상의 서브-용량을 함유하는 용량 단위로 투여될 수 있다. 상기 경우에, 각각의 서브-용량으로 함유된 dsNA는 총 하루 용량 단위를 성취하기 위해 상응하게 보다 작아야만 한다. 상기 용량 단위는 또한 수일 기간에 걸쳐 dsNA의 지연되고 일정한 방출을 제공하는 통상적인 지연 방출 제형을 사용하는 수일에 걸친 단일 용량을 위해 혼합될 수 있다. 지연된 방출 제형은 당업계에 널리 공지되어 있다. 상기 양태에서, 상기 용량 단위는 상응하는 다중 하루 용량을 함유한다. 제형과는 상관 없이, 약제학적 조성물은 처리된 동물 또는 사람에서 표적 유전자의 발현을 억제하기에 충분한 양으로 dsNA를 함유해야만 한다. 상기 조성물은 dsNA의 다중 단위가 함께 충분한 용량을 함유하는 방식으로 혼합될 수 있다.
데이타는 사람에 대해 적합한 용량 범위를 제형화하기 위해 세포 배양 분석 및 동물 연구로부터 수득할 수 있다. 본 발명의 조성물의 용량은 바람직하게 거의 독성이 없는 ED50을 포함하는 순환 농도 범위내에 있다. 상기 용량은 사용되는 용량 형태 및 사용되는 투여 경로에 따라 상기 범위내에서 다양할 수 있다. 본 발명의 방법에 사용되는 임의의 화합물에 대해, 치료학적 유효량은 처음에 세포 배양 분석으로부터 평가할 수 있다. 용량은 세포 배양에서 결정된 바와 같이 IC50(즉 증상의 절반 최대 억제를 성취하는 시험 화합물의 농도)을 포함하는 순환 혈장 농도 범위를 성취하기 위한 동물 모델에서 제형화할 수 있다. 상기 정보를 사용하여 사람에서 유용한 용량을 보다 정확하게 결정할 수 있다. 혈장내 dsNA의 수준은 예를 들어, 고성능 액체 크로마토그래피에 의해 측정할 수 있다.
약제학적 조성물은 투여용 지침서와 함께 키트, 용기, 팩 또는 분배기내에 포함될 수 있다.
치료 방법
본 발명은 전반적으로 또는 부분적으로 표적 RNA의 발현 및/또는 상기 표적 RNA의 존재(예를 들어, 바이러스 감염, 바이러스 게놈의 표적 RNA, 캡시드, 숙주 세포 성분 등의 존재와 관련하여)에 의해 유발되는 질환 또는 장애의 위험(또는 이에 민감한)에 처한 피검체를 치료하는 예방학적 및 치료학적 방법 둘다를 제공한다.
본원에 사용된 바와 같은 "치료", 또는 "치료하는"은 질환 또는 장애, 질환 또는 장애의 증상 또는 질환에 대한 예비성향을 치료하거나 치유하거나 약화시키거나 경감시키거나 변화시키거나 치료하거나 완화시키거나 개선시키거나 영향을 줄 목적으로 치료학적 제제(예를 들어, DsiRNA 제제 또는 벡터 또는 이를 암호화하는 전이유전자)의 환자로의 적용 또는 투여, 또는 질환 또는 장애, 질환 또는 장애의 증상 또는 질환 또는 장애에 대한 예비성향을 갖는 환자 기원의 분리된 조직 또는 세포주로의 치료제의 적용 또는 투여로서 정의된다.
하나의 측면에서, 본 발명은 치료학적 제제(예를 들어, DsiRNA 제제 또는 벡터 또는 이를 암호화하는 전이유전자)를 피검체에게 투여함에 의해 상기된 바와 같은 질환 또는 장애를 피검체에서 예방하는 방법을 제공한다. 질환 위험에 처한 피검체는 예를 들어, 본원에 기재된 바와 같은 임의의 또는 조합된 진단 또는 예후 분석에 의해 동정될 수 있다. 예방학적 제제의 투여는 예를 들어, 피검체에서 바이러스 입자의 검출 또는 질환 또는 장애를 특징으로 하는 증상의 발병 전에 상기 질환 또는 장애가 예방되거나 다르게는 이의 진행이 지연되도록 수행할 수 있다.
본 발명의 또 다른 측면은 치료학적으로 피검체를 치료하는 방법, 즉 질환 또는 장애의 증상 개시를 변화시키는 방법에 관한 것이다. 이들 방법은 시험관 내 (예를 들어, 세포를 DsiRNA 제제로 항온처리함에 의해) 또는 대안적으로 생체내(예를 들어, DsiRNA 제제를 피검체에게 투여함에 의해) 수행할 수 있다.
예방학적 및 치료학적 치료 방법 둘다에 관하여, 상기 치료는 약제게놈학 분야로부터 수득된 지식을 토대로 특이적으로 조정하거나 변형시킬 수 있다. 본원에 사용된 바와 같은 "약제게놈학"은 임상 개발중에 있고 시판중에 있는 약물에 대해 유전자 서열분석, 통계학적 유전학 및 유전자 발현 분석과 같은 게놈 기술의 적용을 언급한다. 보다 구체적으로, 당해 용어는 약물(예를 들어, 환자의 "약물 반응 표현형" 또는 "약물 반응 유전자형")에 대한 반응을 결정하는 방법의 연구를 언급한다. 따라서, 본 발명의 또 다른 측면은 본 발명의 표적 RNA 분자 또는 개인의 약물 반응 유전자형에 따른 표적 RNA 조절제로 개인의 예방학적 또는 치료학적 치료를 조정하는 방법을 제공한다. 약제게놈학은 임상의 또는 의사가 치료로부터 가장 수혜를 받을 환자에게 예방학적 또는 치료학적 치료를 표적화하고 독성 약물 관련 부작용을 경험한 환자의 치료를 피할 수 있게 해준다.
치료학적 제제는 적당한 동물 모델에서 시험될 수 있다. 예를 들어, 본원에 기재된 바와 같은 DsiRNA 제제(또는 발현 벡터 또는 이를 암호화하는 전이유전자)가 상기 제제를 사용한 치료의 효능, 독성 또는 부작용을 결정하기 위한 동물 모델에서 사용될 수 있다. 또는, 치료학적 제제는 동물 모델에 사용하여 상기 제제의 작용 기작을 결정할 수 있다. 예를 들어, 제제를 동물 모델에 사용하여 상기 제제를 사용한 치료의 효능, 독성 또는 부작용을 결정할 수 있다. 또는 제제를 동물 모델에 사용하여 상기 제제의 작용 기작을 결정할 수 있다.
본 발명의 수행은 달리 지적되지 않는 경우 당업자의 기술수준내에 있는 화학, 분자 생물학, 미생물학, 재조합 DNA, 유전학, 면역학, 세포 생물학, 세포 배양 및 전이유전자 생물학의 통상적인 기술을 사용한다. 다음 문헌을 참조한다: Maniatis et al., 1982, Molecular Cloning (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y.); Sambrook et al., 1989, Molecular Cloning, 2nd Ed. (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.); Sambrook and Russell, 2001, Molecular Cloning, 3rd Ed. (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y.); Ausubel et al., 1992), Current Protocols in Molecular Biology (John Wiley & Sons, including periodic updates); Glover, 1985, DNA Cloning (IRL Press, Oxford); Anand, 1992; Guthrie and Fink, 1991; Harlow and Lane, 1988, Antibodies, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y.); Jakoby and Pastan, 1979; Nucleic Acid Hybridization (B. D. Hames & S. J. Higgins eds. 1984); Transcription And Translation (B. D. Hames & S. J. Higgins eds. 1984); Culture Of Animal Cells (R. I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); the treatise, Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods In Enzymology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and C. C. Blackwell, eds., 1986); Riott, Essential Immunology, 6th Edition, Blackwell Scientific Publications, Oxford, 1988; Hogan et al., Manipulating the Mouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y., 1986); Westerfield, M., The zebrafish book. A guide for the laboratory use of zebrafish (Danio reri), (4th Ed., Univ. of Oregon Press, Eugene, 2000).
달리 정의되지 않는 경우, 본원에 사용된 모든 기술적 및 과학적 용어는 본 발명이 속하는 당업자가 통상적으로 이해하는 바와 같은 동일한 의미를 갖는다. 본원에 기재된 것들과 유사하거나 동등한 방법 및 물질이 본 발명의 실시 또는 시험에 사용될 수 있지만 적합한 방법 및 물질이 하기에 기재된다. 본원에 언급된 모든 공보, 특허 출원, 특허 및 다른 참조문헌은 이의 전문이 참조로서 인용된다. 분쟁의 소지가 있는 경우 본원 명세서가 중재할 것이다. 또한 재료, 방법 및 실시예는 단지 설명을 목적으로 하는 것이지 제한하고자 하는 것은 아니다.
실시예
본 발명은 하기의 실시예를 참조로 기재하고 상기 실시예는 단지 설명을 위해 제공되고 어떠한 방식으로든지 본 발명의 범위를 제한하지 않는다. 당업자에게 널리 공지된 표준 기술 또는 하기에 구체적으로 기재된 기술이 사용된다.
실시예 1 - 방법
올리고뉴클레오타이드 합성, 시험관내 용도
개별 RNA 가닥을 표준 방법(Integrated DNA Technologies, Coralville, Iowa)에 따라 합성하고 HPLC 정제하였다. 모든 올리고뉴클레오타이드는 HPLC 분석 에 의한 화학적 순도 및 질량 분광측정 분석에 의한 전장 가닥 순도를 기준으로 판매되는 품질 관리된 것이다. 듀플렉스 RNA DsiRNA는 각각의 가닥의 동일한 양을 혼합하고 간략하게 RNA 완충액(IDT)에서 100℃까지 가열시킴에 이어서 혼합물을 실온으로 냉각시킴에 의해 사용 전에 제조하였다.
올리고뉴클레오타이드 합성, 생체내 용도
개별 RNA 가닥을 표준 방법(OligoFactory, Holliston, MA)에 따라 합성하고 HPLC 정제하였다. 모든 올리고뉴클레오타이드는 HPLC 분석 에 의한 화학적 순도 및 질량 분광측정 분석에 의한 전장 가닥 순도를 기준으로 판매되는 품질 관리된 것이다. 듀플렉스 RNA DsiRNA는 각각의 가닥의 동일한 양을 혼합하고 간략하게 RNA 완충액(IDT)에서 100℃까지 가열시킴에 이어서 혼합물을 실온으로 냉각시킴에 의해 사용 전에 제조하였다.
세포 배양 및 RNA 형질감염
HeLa 세포를 ATCC로 수득하고 10% 태아 소 혈청(HyClone)이 보충된 듈베코 변형된 이글 배지(HyClone)중에서 5% CO2하에 37℃에서 유지시켰다. 도 2의 RNA 형질감염을 위해, HeLa 세포를 최종 용적 2ml중에서 웰당 4 x 105 세포/밀도로 6웰 플레이트에서 밤새 분주하였다. 24시간 후, 세포를 Oligofectamine™ (Invitrogen)을 사용하여 20nM의 최종 농도로 특정된 바와 같은 DsiRNA 듀플렉스를 사용하여 제조업자의 지침에 따라 형질감염시켰다. 간략하게, 각각의 DsiRNA의 8μL의 5μM 스톡 용액을 200μL의 Opti-MEM® I (Invitrogen)와 혼합하였다. 별도의 튜브에서, 12μL의 Oligofectamine™을 48μL의 Opti-MEM® I와 혼합하였다. 실온(RT)에서 5분 항온처리 후, DsiRNA 및 Oligofectamine™ 적정액을 배합하고 약하게 볼텍싱하고 추가로 실온에서 20분동안 항온처리하여 DsiRNA: Oligofectamine™ 복합체(형질감염 혼합물)가 형성되도록 한다. 최종적으로, 배양 배지를 첨가하여 각각의 형질감염 혼합물의 최종 용적이 2ml가 되게한다. 6시간 항온처리 후, 각각의 웰중 형질감염/배양 배지를 새로운 배양 배지로 대체하고 세포를 추가로 18시간 동안 항온처리하였다.
도 3 내지 5의 RNA 형질감염을 위해, HeLa 세포를 Lipofectamine™ RNAiMAX (Invitrogen)을 사용하고 제조업자의 지침에 따라 최종 농도 0.1nM에서 지시된 바와 같은 DsiRNA로 형질감염시켰다. 간략하게, 각각의 DsiRNA 2.5μL의 0.02μM 스톡 용액을 46.5μL의 Opti-MEM I (Invitrogen) 및 lμL의 Lipofectamine™ RNAiMAX와 혼합하였다. 수득한 50μL의 혼합물을 12개 웰 플레이트의 개별 웰에 첨가하고 RT에서 20분동안 항온처리하여 DsiRNA:Lipofectamine™ RNAiMAX 복합체가 형성되도록 한다. 한편, HeLa 세포를 트립신처리하고 최종 농도 367 세포/μL로 배지에 재현탁시켰다. 최종적으로, 450μL의 세포 현탁액을 각각의 웰에 첨가하고(최종 용적 500μL) 플레이트를 24시간 동안 항온처리기에 위치시켰다.
RNA 분리 및 분석, 시험관내 예
세포를 2ml의 PBS로 1회 세척하고 총 RNA를 RNeasy 소형 Kit™ (Qiagen)를 사용하여 추출하였고 최종 용적 30μL로 용출시켰다. lμg의 총 RNA를 제조업자의 지침에 따라 트랜스크립터 1차 가닥 cDNA KitTM(Roche) 및 무작위 6량체를 사용하여 역전사시켰다. 1-30번째(0.66μL)의 수득한 cDNA를 3.33μL의 H2O 및 사람 유전자 HPRT-1(승인번호 NM_000194) 및 SFRS9(승인 번호 NM_003769) 유전자에 특이적인 2세트의 프라이머 및 프로브를 함유하는 lμL의 3μM 혼합물과 함께 5μL의 iQ™ 멀티플렉스 파우어 믹스(Bio-Rad)와 혼합하였다:
Hu HPRT 정배향 프라이머 F517 GACTTTGCTTTCCTTGGTCAG
Hu HPRT 역배향 프라이머 R591 GGCTTATATCCAACACTTCGTGGG
Hu HPRT 프로브 P554 Cy5-ATGGTCAAGGTCGCAAGCTTGCTGGT-IBFQ
Hu SFRS9 정배향 프라이머 F569 TGTGCAGAAGGATGGAGT
Hu SFRS9 역배향 프라이머 R712 CTGGTGCTTCTCTCAGGATA
Hu SFRS9 프로브 P644 HEX-TGGAATATGCCCTGCGTAAACTGGA-IBFQ
생체내 샘플 제조 및 주사
DsiRNA를 제조업자의 지침에 따라 (Invitrogen, Carlsbad, CA)에 따라 Invivofectamine™중에 제형화하였다. 간략하게, 사용되는 마우스의 N/그룹 및 체중을 측정하고 이어서 처리된 마우스 각 그룹에 필요한 DsiRNA의 양을 계산하였다. 1ml의 IVF-올리고는 10mg/kg의 용량에서 25g/마우스의 4마리 마우스를 위해 충분하였다. 1 mg의 DsiRNA를 1ml의 Invivofectamine™에 첨가하고 회전기상에서 30분동안 RT에서 혼합하였다. 14 ml의 5% 글루코스를 사용하여 제형화된 IVF-DsiRNA를 희석시키고 50kDa 분자량의 컷오프 스핀 농축기(Amicon)에 적용하였다. 상기 스핀 농축기는 IVF-DsiRNA의 용적이 1ml 미만이 될때까지 4℃에서 약 2시간동안 4000rpm에서 회전시켰다. 회수된 IVF-DsiRNA를 5% 글루코스로 1ml로 희석시키고 동물 주사용으로 준비하였다.
동물 주사 및 조직 수거
동물을 케타민/크실라진을 사용하여 복강내 주사함에 의해 수술 마취시켰다. 각각의 마우스는 주사 전에 무게를 재었다. 제형화된 IVF-DsiRNA를 체중 10g당 100㎕로 정맥내 주사하였다. 24시간 후, 마우스를 CO2 흡입에 의해 희생시켰다. 분석용 조직을 수거하고 2ml의 RNAlaterTM(Qiagen)을 함유하는 튜브에 위치시키고 4℃에서 밤새 항온처리하기 전에 30분동안 RT에서 회전시켰다. 상기 조직을 이어서 사용시때까지 -80℃에서 보관하였다.
조직 RNA 제조 및 정량
조직편 약 50-100 mg을 조직 Lyser™ (Qiagen)상의 1ml의 QIAzolTM(Qiagen)중에서 파쇄시켰다. 이어서 총 RNA를 제조업자의 프로토콜에 따라 분리하였다. 간략하게, 0.2 ml의 클로로포름(Sigma-Aldrich)을 QIAzol™ 용해물에 첨가하고 볼텍싱함에 의해 왕성하게 혼합하였다. 4℃에서 15분동안 14,000rpm에서 회전시킨 후, 수성상을 수거하고 0.5ml의 이소프로판올과 혼합하였다. 10분동안 14,000rpm에서 또 다른 원심분리 한 후, RNA 펠렛을 75% 에탄올로 1회 세척하고 간략하게 건조시켰다. 분리된 RNA를 100 ul RNase-부재 물에서 재현탁시키고 제조업자의 프로토콜에 따라 RNeasy™ 총 RNA 제조 키트 (Qiagen) 또는 SV 96 총 RNA 분리 시스템 (Promega)을 사용하여 세정하였다.
제1 가닥 cDNA 합성, 생체내 예
lμg의 총 RNA를 제조업자의 지침에 따라 트랜스크립터 1차 가닥 cDNA KitTM(Roche) 및 올리고-dT를 사용하여 역전사시켰다. 1-40번째(0.66μL)의 수득한 cDNA를 3.33μL의 H2O 및 마우스 유전자 HPRT-1(승인번호 NM_013556) 및 KRAS(승인 번호 NM_021284) 유전자에 특이적인 2세트의 프라이머 및 프로브를 함유하는 lμL의 3μM 혼합물과 함께 5μL의 IQ 멀티플렉스 파우어 믹스(Bio-Rad)와 혼합하였다:
Mm HPRT 정배향 프라이머 F576 CAAACTTTGCTTTCCCTGGT
Mm HPRT 역배향 프라이머 R664 CAACAAAGTCTGGCCTGTATC
Mm HPRT 프로브 P616 Cy5- TGGTTAAGGTTGCAAGCTTGCTGGTG-IBFQ
Mm KRAS 정배향 프라이머 F275 CTTTGTGGATGAGTACGACC
Mm KRAS 역배향 프라이머 R390 CACTGTACTCCTCTTGACCT
Mm KRAS 프로브 P297 FAM-ACGATAGAGGACTCCTACAGGAAACAAGT-IBFQ
정량 RT-PCR
C1000 열 순환기를 장착한 CFX96 실시간 시스템(Bio-Rad)을 증폭 반응을 위해 사용하였다. PCR 조건은 다음과 같다: 3분동안 95℃; 및 이어서 95℃에서 10초동안 순환; 55℃에서 1분동안 40회 순환. 각각의 샘플은 3회 시험하였다. HPRT 예에 대해, 상대적인 HPRT mRNA 수준을 SFRS9 mRNA 수준으로 정상화하고 형질감염 시약 + 대조군 미스매치 듀플렉스로 처리되거나 비처리된 대조군 샘플에서 수득된 mRNA 수준과 비교하였다. KRAS 예에 대해, 상대적 KRAS mRNA 수준을 HPRT-1 mRNA 수준으로 정상화하고 5% 글루코스로 처리된 마우스 기원의 대조군 샘플중에서 수득된 mRNA 수준과 비교하였다. 데이타는 Bio-Rad CFX 매니저 버젼 1.0 (시험관내 예) 또는 1.5 (생체내 예) 소프트웨어를 사용하여 분석하였다.
실시예 2 - DNA 듀플렉스 연장을 갖는 DsiRNA 제제의 효능
DNA 듀플렉스 연장을 갖는 DsiRNA 제제는 서열 특이적 표적 mRNA 억제 효능에 대해 조사하였다. 구체적으로, 연장된 RNA, 연장된 DNA 또는 혼합된 DNA- 및 RNA-연장된 구조를 갖는 HPRT-표적화 DsiRNA 듀플렉스를 20nM의 고정된 농도에서 HeLa 세포내로 형질감염시키고 HPRT 발현 수준을 24시간 후에 측정하였다(도 2A 및 2B). 형질감염은 2회 수행하고 각각의 복제물을 qPCR에 의한 HPRT 발현에 대해 3회 분석하였다. 이들 조건하에서(2OnM 듀플렉스, 올리고펙타민 형질감염), HPRT 유전자 발현을 듀플렉스 1 내지 6에 의해 30 내지 50%까지 감소시켰다. 듀플렉스 6은 가이드(안티센스) 가닥의 5' 말단에서 개시하는 10bp (염기쌍) 영역을 형성하고 최종 길이가 33/35량체 배위가 되도록 하는 DNA 치환을 포함하였다. 듀플렉스 7은 길이와 서열에 있어서 듀플렉스 6과 동일하였지만 단지 도 2B에 지적된 위치에서 4개의 뉴클레오사이드 변형을 포함했다. 놀랍게도, 듀플렉스 7은 듀플렉스 6보다 훨씬 적게 HPRT 발현을 감소시켰고 이것은 다이서가 DNA 염기간의 연장된 RNA 영역을 인지하고 상기 듀플렉스를 또 다른 종의 siRNA로 절단함을 시사한다. 또한 DsiRNA(듀플렉스 8)의 DNA:DNA 연장된 영역의 포스포로티오에이트 변형이 DNA 연장된 DsiRNA 제제의 RNA 억제 활성을 제거할 수 있는 것으로 관찰되었다. 듀플렉스 8 제제의 활성은 PS-DNA 잔기를 비변형된 DNA 잔기로 충분히 치환하여 회복될 수 있을 가능성이 있다. 실제로, 상기 듀플렉스에 대한 비변형된 DNA 잔기의 "부가-복귀"는 본 발명의 잇점을 부각시킨다 - 본 발명의 제제는 RNA 억제 활성을 여전히 보유하면서 비-연장된 제제 보다 더 변형을 수행하도록 만들어질 수 있고 이는 탠덤 및/또는 촘촘한 공간의 변형된 잔기의 존재가 유발할 수 있는 문제점의 관점에서 상당히 진전된 것이다(탠덤 염기쌍의 PS-DNA가 듀플렉스 8에 존재하는 경우 RNA 억제 활성을 완전히 제거하였다).
실시예 3 - 27/29량체 듀플렉스의 용량 반응 비교
감소된 농도에서 DNA 듀플렉스 연장된 DsiRNA의 효능을 시험하기 위해 , HPRT를 표적화하는 변형된 듀플렉스를 10.0 나노몰(nM), 1.0 나노몰 (nM) 및 100 피코몰 (100 pM 또는 0.1 nM) 농도의 일련의 용량 반응 실험에서 HeLa 세포에서 HPRT mRNA 수준의 녹다운에 대해 최적화된 27/29량체 듀플렉스와 비교하였다. 듀플렉스 DsiRNA 1은 활성으로서 이전에 보고된 25/27량체 DsiRNA 듀플렉스(HPRT-I, Rose et al. NAR 2005, Collingwood et al. 2008)의 유도체이지만 현재 듀플렉스(#1)는 올리고뉴클레오타이드 듀플렉스를 27/29량체로 연장시키는 각각 가닥에 삽입된 2개의 염기를 포함하였다. 듀플렉스 2는 듀플렉스 1과 서열에 있어서 동일하였지만 2개의 염기쌍 삽입 및 가이드 가닥(안티센스 서열)의 2개의 추가의 뉴클레오사이드는 DNA로서 합성하였다. 따라서, 듀플렉스 2는 이전에 보고된 패신저(센스) 가닥의 3' 말단에서 2개의 염기 DNA 치환과는 대조적으로 가이드 가닥의 5' 말단에서 4개의 DNA bp(염기쌍)으로 종결되어 있다(문헌참조: Rose et al, 2005). 듀플렉스 3(MM 대조군)은 최적화된 HPRT-1 듀플렉스로부터 유래하였지만 표적 RNA 서열과 상대적으로 미스매치와 함께 합성하였다. 각각의 가닥의 염기 조성 및 화학적 변형 및 듀플렉스 3의 말단에서 오버행 또는 평활 구조는 비표적화된 화학적 효과를 조절하기 위해 최적화된 HPRT-1 듀플렉스와는 상대적으로 일정하게 유지되었다 (도 5 참조). 비처리된 세포에서 기본 HPRT 발현을 또한 측정하였다(도 3A의 "C").
듀플렉스 1 및 2의 추정 다이서 프로세싱 생성물은 서로 동일하였고(도 1A 참조) 도 2B에 나타낸 듀플렉스의 다이서 프로세싱 생성물과 동일하였다. 10nM 및 1nM의 형질감염 농도에서, 듀플렉스 1 및 2 둘다는 적어도 95%까지 HPRT RNA 수준을 감소시켰고 이는 듀플렉스 2의 말단에서 이중 가닥 DNA의 부가가 HPRT mRNA에 대한 RISC 활성을 로딩하고 지시하는데 적합한 구조로의 듀플렉스의 다이서 결합 및 프로세싱을 방해하지 않았음을 시사한다. 100pM에서 듀플렉스 2는 HPRT 발현을 90%까지 감소시켰고 HPRT를 대략 75%까지 감소시키는 듀플렉스 1보다 2배 이상 활성임을 나타냈다.
실시예 4 - 2개, 6개 및 8개 DNA 염기쌍에 의해 연장된 듀플렉스의 비교
연장된 이중 가닥의 RNA의 상응하는 길이를 갖는 DsiRNA 제제와 비교하여 DNA 듀플렉스 연장된 DsiRNA의 효과의 효능 및/또는 지속성을 여전히 증진시키면서 DsiRNA 제제로 도입될 수 있는 이중 가닥 DNA 연장의 길이를 조사하기 위해, 일련의 이중 가닥의 핵산을 2개 염기쌍, 6개 염기쌍 및 8개 염기쌍 연장을 갖도록 제조하고 시험하였다(상기 연장의 수치적 길이는 또한 안티센스 가닥의 5' 말단의 동족 데옥시리보뉴클레오타이드 잔기와 염기쌍을 형성하는 센스 가닥의 3' 말단의 맨끝에 2번째 및 맨끝 데옥시리보뉴클레오타이드 잔기를 포함하여 도 4A 내지 4D의 "DNA 4bp" 듀플렉스 #4, "DNA 8bp" 듀플렉스 #5 및 "DNA 1Obp" 듀플렉스 #6을 수득하였다). 2개 염기쌍 DNA:RNA 이중 가닥 영역 및 6개 염기상 RNA:RNA 이중 가닥 영역을 포함하는 연장부를 포함하는 33/35량체인 듀플렉스 3에 의한 유전자 발현의 억제(도 4A 내지 4D 참조)는 듀플렉스 1 (2개의 염기쌍 RNA:RNA 이중 가닥 연장을 갖는 27/29량체) 및 듀플렉스 2(6개 염기쌍 RNA:RNA 이중 가닥 연장을 갖는 31/33량체)에 비해 감소하였고, 이는 증가하는 RNA 듀플렉스 길이가 RNAi 활성을 저하시킨다는 이전의 보고와 일치한다. 주지할만하게, RNA:RNA-연장된 듀플렉스 1, 2 및 3 모두는 이중 가닥 DNA:DNA 연장을 프로세싱하는 상응하는 듀플렉스 4, 5 및 6에 비해 감소된 활성을 나타내었다. RNA 삽입체/DNA 계열 및 DNA 계열간의 활성에 있어서 가장 큰 차이는 10OpM에서 관찰되었지만 10pM에서 여전히 검출가능하였다(도 4B 및 4C).
도 4에서 비교되는 듀플렉스는 1) 이것이 존재하는 경우 다이서 기질 듀플렉스의 확연한 프로세싱의 음성 효과를 증진시키고 2) HPRT mRNA의 RNase H-매개된 절단의 가능성을 제거하도록 디자인하였다. 도 4B에 나타낸 가이드(안티센스) 가닥의 3' 말단으로 시작하여, 정준 19 내지 23개 염기쌍 길이의 RNA 가닥을 생성시키지 않는 방식으로 프로세싱된 듀플렉스는 HPRT 표적 mRNA 수준에서 RISC 매개된 감소를 지시할 가능성이 적다. 긴 RNA 듀플렉스(예를 들어, 도 4D의 듀플렉스 3)의 잡다한 프로세싱은 씨드 영역에서 미스매치를 함유하는 가이드 가닥을 생성시킴에 이어서 표적에 대한 RISC 활성을 감소시킨다. 잡다한 프로세싱은 또한 패신저(센스) 올리고뉴클레오타이드가 로딩된 RISC를 생성시킬 수 있다. 듀플렉스 3은 낮은 농도에서 보다 짧은 RNA 종 보다 활성이 훨씬 적었고 적은 활성의 siRNA 종으로 프로세싱된다.
DNA를 함유하는 긴 듀플렉스(예를 들어, 도 4D의 듀플렉스 6)가 차등적으로 분해되고/되거나 부정확하게 프로세싱되는 경우, 10개 이하 염기의 안티센스 DNA를 함유하는 단일 가닥의 올리고뉴클레오타이드가 생성될 수 있다. 이론적으로, 상기 DNA 부분은 상보적인 표적 mRNA를 절단하도록 RNase H를 활성화시킬 수 있다. 듀플렉스 4, 5 및 6의 DNA 부분은 HPRT mRNA와 매치하지 않았고 따라서 HPRT mRNA의 관찰된 감소에 관여할 수 없다. 세포 흡수, 다이서에 의한 프로세싱 전에 또는 RISC로의 로딩 전에 듀플렉스의 차등적 분해는 또한 HPRT 감소에서 관찰된 차이를 유발할 수 있다. 듀플렉스 3은 상기 효과를 조절하기 위한 2개의 DNA 뉴클레오사이드(패신저 가닥의 3' 말단에서 계수하여 9번 및 10번 염기)의 내부적 치환을 포함하였다. DNA 치환이 뉴클레아제 분해로부터 듀플렉스를 단순히 안정화시킴에 의해 듀플렉스 활성을 증가시키는 경우, 듀플렉스 3은 듀플렉스 1 또는 2 보다 안정해야만 하고 잠재적으로 듀플렉스 4만큼 안정해야만 한다. 대신, 듀플렉스 3은 듀플렉스 1, 2 및 4 보다 덜 효과적으로 HPRT 표적 mRNA 수준을 감소시켰고 이는 이중 가닥 DNA:DNA 영역이 도입되는 경우 나타나는 증진 효과가 단순히 뉴클레아제 분해에 대한 증진된 내성때문이 아님을 지적한다. 유사한 경우로, DNA 염기쌍이 시험된 듀플렉스의 상당한 안정화를 유도하는 경우, 증가된 DNA 염기쌍 길이는 듀플렉스 4 내지 6에 걸쳐 점진적으로 증진된 활성을 유도했어야만 했다. 그러나 상기 점진적으로 증가하는 DNA 길이는 듀플렉스 활성을 증가시키지 못했다.
상기 결과 관점에서, 2개 내지 10개 염기쌍의 이중 가닥 DNA:DNA 연장된 영역을 프로세싱하는 DsiRNA 제제(여기서, 상기 연장은 돌출된 다이서 절단 부위의 3'에 있는 센스 가닥 영역 및 돌출된 다이서 절단 부위의 5'에 있는 안티센스 가닥의 상응하는 영역에 위치하였다)가 효과를 구성하고 특정 경우에 RNA 억제제를 증진시킨다는 결론을 내리게 되었다.
실시예 5 - 낮은 농도에서 이중 가닥 DNA:DNA 연장된 듀플렉스의 증진된 효능
증가하는 길이의 일련의 변형된 듀플렉스는 100pM의 고정된 농도에서 HPRT mRNA 발현을 감소시키는 것에 대해 평가하였다. 도 5A 및 도 5B의 듀플렉스 1은 화학적 변형, 가이드(안티센스) 가닥의 3'말단에서 2개 염기 오버행 및 패신저(센스) 가닥에서 2개의 DNA 치환 및 평활 말단을 함유하는 최적화된 25/2량체 다이서 기질이었다(문헌참조: Collingwood et al. 2008). HPRT mRNA에 상보적이지 않은 염기는 총 듀플렉스 구조를 27/2량체에서 33/35량체로 증가시키는 RNA (듀플렉스 2 내지 5) 또는 DNA(듀플렉스 6 내지 9; 도 5A 및 5B 참조)중 어느 하나로서 한번에 삽입된 2개의 염기였다.
듀플렉스 1은 RNA 염기쌍 부가에 의해 연장된 임의의 다른 "최적화된" 듀플렉스(듀플렉스 2 내지 5, 도 5A 참조) 보다 HPRT mRNA 수준을 감소시키는데 보다 효과적이었고 이는 보다 긴 듀플렉스가 하나 이상의 활성이 적은 가이드 종으로 프로세싱될 가능성이 있다는 개념을 지지한다. DNA 염기쌍 부가에 의해 연장된 모든 듀플렉스(듀플렉스 6 내지 9; 도 5A)는 듀플렉스 2 내지 5 보다 훨씬 더 활성이었고 듀플렉스 1과 활성이 대략적으로 동일하였다.
듀플렉스 6 내지 9는 이들의 HPRT mRNA 감소 정도에 있어서 차이가 없었다. 따라서, DNA 염기쌍 영역은 RNAi 활성을 증가시키는 뉴클레아제 내성 성질을 나타내지 않았다(듀플렉스 2 내지 5를 서로간에 비교하고 듀플렉스 1과 비교한다). 놀랍게도, DNA 부분의 길이를 증가시키면 HPRT 감소에 음성으로 영향을 주지않았다. 모든 DNA 듀플렉스는 동등한 활성을 갖고 상응하는 RNA 기본 듀플렉스 보다 큰 활성을 가졌다. 이들 결과는 듀플렉스 2 내지 5의 DNA 삽입이 최적화된 듀플렉스 1으로부터 프로세싱된 정준 가이드 가닥의 생성으로 다이서 활성을 제한시킴을 지적했다.
실시예 6 - 미스매치를 함유하는 DsiRNA 제제("DsiRNAmm")를 포함하는 좌측 연장된 DsiRNA 제제의 효능
효과적인 DsiRNA 제제가 또한 상기된 "우측 연장된" DsiRNA 제제와 같이 역("플립됨") 배향으로 DNA:DNA 연장을 가질 수 있는지의 여부를 조사하기 위해, "좌측 연장된" DsiRNA 제제를 합성하고 상기된 바와 같은 방법을 통해 시험하였다. 상기 "좌측 연장된" DsiRNA 제제(본 경우에, 도 7에 나타낸 바와 같이 센스 가닥의 5' 말단 영역과 안티센스 가닥의 3' 말단 영역 사이에 형성된 5개 염기쌍 DNA:DNA 연장을 갖는 30/28량체 제제)는 상응하는 28/30량체 "우측 연장된" DsiRNA 제제와 직접 비교하여 표적 RNA 억제 효능에 대해 시험하였다. 놀랍게도, "좌측 연장된" 제제는 KRAS 표적 mRNA 수준의 이들의 억제에서 "우측 연장된" 제제 보다 더 강력한 것으로 관찰되었다. 또한 놀라운 것은 미스매치 잔기가 제제의 억제 효능을 보유하면서 다른 위치가 아닌 특정 위치에서 "좌측 연장된" 및 "우측 연장된" DNA:DNA 연장된 DsiRNA 제제 둘다로 도입될 수 있다는 사실이었다. 구체적으로, DNA:DNA 연장된 "DsiRNAmm" 제제(본원에 사용된 바와 같이, 용어 "DsiRNAmm 제제"는 어느 한 가닥의 어느 한 말단의 2개 뉴클레오타이드 잔기 이외의 위치에 위치하는 하나 이상의 미스매치된 염기쌍을 포함하는 DsiRNA 제제를 지적한다)는 하기의 위치에서 미스매치된 염기쌍을 갖도록 합성하였다: 12번 단독, 14번 단독, 16번 단독, 14번 및 18번 함께 및 12번 및 16번 함께(돌출된 다이서 절단 후 DsiRNAmm 제제의 5' 말단 안티센스 잔기로서 1번 위치로부터 개시하여). 도 8 및 9에 나타낸 바와 같이, 14번 단독, 16번 단독 및 14번 및 18번 둘다의 위치에서 미스매치된 잔기를 갖는 DsiRNAmm 제제는 모두 효과적인 억제제였다. 놀랍게도, "모" DsiRNA 및 DsiRNAmm 둘다의 좌측 연장된 형태는 처음에 모 DsiRNA 제제 및 안티센스 가닥의ㅣ 14번 단독, 16번 단독 및 14번 및 18번 둘다의 위치(위치가 예측된 다이서 절단 후 DsiRNA 또는 DsiRNAmm 제제의 5' 말단 안티센스 잔기에서 1번 위치로부터 개시하여 3' 방향으로 (5'에서 3' 방향을 의미함) 넘버링되는 경우; 도 8 참조)에서 미스매치된 잔기를 갖는 DsiRNAmm 제제에 대한 우측 연장된 형태 보다 큰 억제 효능(HeLa 세포에서 100pM 형질감염 수준에서)을 갖는 것으로 동정되었다. 안티센스 가닥의 14번 및 18번 위치 둘다에서 미스매치된 잔기를 갖는 DsiRNA 제제를 제외하고, 우측 연장된 DsiRNA 또는 DsiRNAmm 제제와 비교하여 좌측 연장된 것에 대해 초기에 관찰된 100pM에서 보다 큰 효능이 재현가능하였다(도 9).
실시예 7 - 효과적인 DsiRNA 제제내 포스포로티오에이트 변형 및 DNA 잔기의 위치
본 발명의 DNA:DNA 연장된 서열이, DsiRNA 제제의 억제 효능을 보유하면서 유리한 변형이 위치할 수 있는 DsiRNA 제제내에 여분의 잔기를 제공하는지의 여부를 시험하기 위해, 다중 포스포로티오에이트 변형된 염기를 함유하는 DsiRNA 제제의 강력함을 조사하였다. 포스포로티오에이트 변형된 siRNA 제제의 사전 연구는 다중 포스포로티오에이트가 존재하는 경우 상기 제제가 세포에 세포독성일 수 있음을 밝혔고(문헌참조: Amarzguioui et al. Nucleic Acids Research, 31: 589-595), 안티센스 가닥의 5' 말단에서 또는 이의 근처에서 포스포로티오에이트 변형을 갖는 몇몇 siRNA 제제는 감소된 억제 활성을 갖는 것으로 관찰되었다. 도 10에 나타낸 바와 같이, DsiRNA 제제 "DNA 6bp(2PS)" 및 "DNA 6bp(4PS)"는 유사한 표적 mRNA(HPRT) 억제 효능을 나타내고 이는 이들 분자의 DNA 연장된 듀플렉스 영역이 이들 분자의 표적 RNA 억제 효능에 대해 치명적인 영향 없이 광범위하게 변형될 수 있음을 입증한다.
본 발명의 "우측 연장된" DsiRNA 제제내 안티센스 가닥의 돌출된 5' 다이서 절단 부위에서 또는 이의 근처에서 데옥시리보뉴클레오타이드 패턴을 또한 조사하였다. 도 10에 나타낸 바와 같이, 안티센스 가닥의 5' 말단에서 다이서 절단 후 안티센스 가닥의 5' 말단 뉴클레오타이드에 인접한 위치까자 연장된 안티센스 가닥 데옥시리보뉴클레오타이드를 갖는 DsiRNA 제제(참조: 제제 DP1055P/DP1057G 및 DP1058P/DP1060G)는 효과적인 RNA 간섭 제제였다. DP1055P/DP1057G 및 DP1058P/DP1060G DsiRNA 제제에 대한 결과는 이것이 이전에는 안티센스 가닥의 5' 말단 영역내에서 데옥시리보뉴클레오타이드 내포의 종결이 센스 가닥내 최외곽 3' 다이서 절단 부위의 안티센스 가닥내 5' 위치에 존재해야만 하는 것으로 사료되었기때문에 예측되지 않았다(참조: 제제 DP1055P/DP1056G 및 DP1058P/DP1059G). 또한 도 10에 나타낸 바와 같이, 좌측 연장된 DsiRNA 제제는 효과적인 억제제인 것으로 관찰되었고 상기 DsiRNA 제제의 안티센스 가닥의 "씨드" 영역내 U:G 미스매치의 내포는 약간의 감소된 수준의 억제 활성을 유발하는 것으로 관찰되었다.
본 발명의 "우측 연장된" DsiRNA 제제의 포스포로티오에이트 변형의 가닥 가중된 패턴의 효과를 또한 조사하였다. "우측 연장된" DsiRNA 제제 "DNA 6bp(2PS)" 및 "DNA 6bp(4PS)"의 포스포로티오에이트 변형된 올리고뉴클레오타이드 가닥은 재어셈블리하여 도 11에 나타낸 DP1061P/DP1064G 및 DP1062G/DP1063P DsiRNA 제제를 생성하였다. 놀랍게도, 패신저 가닥상에 4개의 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드 및 상응하는 가이드 가닥 잔기상에 단지 2개의 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 제공하는 DP1062G/DP1063P 듀플렉스는 "DNA 6bp(2PS)" 제제 만큼 또는 이보다 더 우수하게 작용한 반면 가이드 가닥상에 4개의 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드 및 상응하는 패신저 가닥 잔기상에 단지 2개의 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드를 함유하는 DP1061P/DP1064G 듀플렉스는 억제 분자로서 효과적이지 않았다. 상기 결과는 본 발명의 DsiRNA의 연장된 영역에 대해, 가이드 가닥에 상대적으로 패신저 가닥상의 상기 변형을 가중시키는 포스포로티오에이트 변형 패턴은 반대로 가중된 패턴과 비교하여 가장 큰 효능을 보유할 수 있음을 시사한다.
실시예 8 - 5개, 10개 및 12개 DNA 또는 RNA 염기쌍에 의해 연장된 듀플렉스의 비교
DsiRNA의 구조적 연장 효과를 추가로 조사하기 위해, KRAS 전사체를 표적화하는 여러 일련의 "우측 연장된" DsiRNA를 제조하고 시험관내 표적 녹다운 효능에 대해 평가하였다. 도 12는 KRAS 전사체내 "KRAS-200" 부위를 표적화하는 일련의 "우측 연장된" DsiRNA의 구조를 도시한다. 도 12의 제1 듀플렉스("DPI 174P/DP1175G" 또는 상응하는 데이타의 듀플렉스 "01", 도 13)는 패신저 가닥의 맨끝 및 맨끝에서 2번째 3' 말단 잔기에서만 데옥시리보뉴클레오타이드를 갖는 25/27량체 DsiRNA이다. 도 12의 제2 듀플렉스("DP1200P/DP1201G" 또는 상응하는 데이타의 듀플렉스 "02"; 도 13)는 패신저 가닥 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기에서 및 나타낸 가이드 가닥 돌출된 다이서 절단 부위의 5'에 위치한 모든 가이드 가닥에서 데옥시리보뉴클레오타이드를 갖는 25/27량체 DsiRNA이다. 도 12의 제3 듀플렉스("DP1202P/DP1203G" 또는 상응하는 데이타의 듀플렉스 "03"; 도 13)는 나타낸 바와 같이 "DP1174P/DP1175G" 듀플렉스에 상대적으로 5개 염기쌍의 리보뉴클레오타이드 서열 삽입을 갖는 30/32량체 DsiRNA이다(도 12의 제3 듀플렉스의 박스친 영역). 도 12의 제4 듀플렉스("DP1204P/DP1205G" 또는 상응하는 데이타의 듀플렉스 "04"; 도 13)는 나타낸 바와 같이 "DP1200P/DP1201G" 듀플렉스에 상대적으로 5개 염기쌍의 데옥시리보뉴클레오타이드 서열 삽입을 갖는 30/32 량체 DsiRNA이다(도 12의 제4 듀플렉스의 박스친 영역). 도 12의 제5 듀플렉스("DP1206P/DP1207G" 또는 상응하는 데이타의 듀플렉스 "05"; 도 13)는 나타낸 바와 같이 "DP1174P/DP1175G" 듀플렉스에 상대적으로 10개의 염기쌍 리보뉴클레오타이드 서열 삽입을 갖는 35/37량체 DsiRNA이다(도 12의 제5 듀플렉스의 박스친 영역). 도 12의 제6 듀플렉스("DP1208P/DP1209G" 또는 상응하는 데이타의 듀플렉스 "06"; 도 13)는 나타낸 바와 같이 "DP1200P/DP1201G" 듀플렉스에 상대적으로 10개의 염기쌍 데옥시리보뉴클레오타이드 서열 삽입을 갖는 35/37량체 DsiRNA이다(도 12의 제6 듀플렉스의 박스친 영역).
도 13은 도 12에 제공된 KRAS-200 부위 표적화 DsiRNA에 대한 KRAS 표적 유전자 억제 효능 결과를 보여준다. 도 13에 나타낸 바와 같이, 길이가 5개 또는 심지어 10개의 염기쌍인 RNA 듀플렉스 또는 DNA 듀플렉스 연장을 갖는 DsiRNA는 시험관내에서 강한 억제 효능을 보유하였다(도 13의 실험은 HeLa 세포에서 수행하였고 2회 RNAiMAX를 사용한 24시간동안 0.1 nM DsiRNA로의 처리를 포함하고; "13" 및 "14"는 각각 RNAiMAX 단독을 사용하여 수득되고 비처리된 세포에 대해 수득된 결과에 상응한다; 멀티플렉스 실험은 KRAS 및 HPRT1 수준 둘다를 평가하기 위해 수행하였다).
도 14는 KRAS 전사체내 "KRAS-909" 부위를 표적화하는 일련의 "우측 연장된" DsiRNA의 구조를 도시한다. 도 14의 제1 듀플렉스("DP1188P/DP1189G")는 패신저 가닥의 맨끝 및 맨끝에서 2번째 3' 말단 잔기에서만 데옥시리보뉴클레오타이드를 갖는 25/27량체 DsiRNA이다. 도 14의 제2 듀플렉스("DP1210P/DP1211G")는 패신저 가닥 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기에서 및 나타낸 가이드 가닥 돌출된 다이서 절단 부위의 5'에 위치한 모든 가이드 가닥에서 데옥시리보뉴클레오타이드를 갖는 25/27량체 DsiRNA이다. 도 14의 제3 듀플렉스("DP1212P/DP1213G")는 나타낸 바와 같이 "DP1188P/DP1189G" 듀플렉스에 상대적으로 5개 염기쌍의 리보뉴클레오타이드 서열 삽입을 갖는 30/32량체 DsiRNA이다(도 14의 제3 듀플렉스의 박스친 영역). 도 14의 제4 듀플렉스("DP1214P/DP1215G")는 나타낸 바와 같이 "DP1210P/DP1211G" 듀플렉스에 상대적으로 5개 염기쌍의 데옥시리보뉴클레오타이드 서열 삽입을 갖는 30/32 량체 DsiRNA이다(도 14의 제4 듀플렉스의 박스친 영역). 도 14의 제5 듀플렉스("DP1216P/DP1217G")는 나타낸 바와 같이 "DP1188P/DP1189G" 듀플렉스에 상대적으로 10개의 염기쌍 리보뉴클레오타이드 서열 삽입을 갖는 35/37량체 DsiRNA이다(도 14의 제5 듀플렉스의 박스친 영역). 도 14의 제6 듀플렉스("DP1218P/DP1219G")는 나타낸 바와 같이 "DP1210P/DP1211G" 듀플렉스에 상대적으로 10개의 염기쌍 데옥시리보뉴클레오타이드 서열 삽입을 갖는 35/37량체 DsiRNA이다(도 14의 제6 듀플렉스의 박스친 영역).
도 15는 도 14에 제공된 KRAS-909 부위 표적화 DsiRNA에 대한 KRAS 표적 유전자 억제 효능 결과를 보여준다. 도 15에 나타낸 바와 같이, 25/27량체 DsiRNA "1 188P/1189G" 및 30/32량체 "1212P/1213G"는 다른 조사된 DsiRNA 보다 약간 큰 표적 RNA 억제 효능을 나타내고, 길이가 5개 또는 심지어 10개의 염기쌍인 RNA 듀플렉스 또는 DNA 듀플렉스 연장을 갖는 DsiRNA는 시험관내에서 강한 억제 효능을 보유하였다(도 15의 실험은 HeLa 세포에서 수행하였고 2회 RNAiMAX를 사용한 24시간동안 0.1 nM DsiRNA로의 처리를 포함하고; 멀티플렉스 실험은 KRAS 및 HPRT1 수준 둘다를 평가하기 위해 수행하였다).
실시예 9 - "연장된" DsiRNA내 다수의 포스포로티오에이트 변형의 효과
도 10은 DsiRNA 분자의 데옥시리보뉴클레오타이드 연장이, 포스포로티오에이트 변형이 있다 해도 포스포로티오에이트 변형된 DsiRNA의 표적 전사체 억제 효능에 거의 영향 없이 표면을 제공할 수 있음을 입증한다. 도 16 내지 18은 포스포로티오에이트 변형의 보다 더 광범위한 수준이 연장된(여기서는, "우측 연장된") DsiRNA내에서 관용성일 수 있는지의 여부를 시험할 목적으로 합성된 DsiRNA 분자를 도시한다. 구체적으로, 도 16은 일련의 "KRAS-249" 부위 표적화 DsiRNA를 도시하고, 여기서,
- 제1 듀플렉스("K249M")는 패신저 가닥의 3' 말단에서 맨끝에서 2번째 및 맨끝 잔기에서만 데옥시리보뉴클레오타이드를 갖는 25/27량체이고 어떠한 포스포로티오에이트 변형을 갖지 않으며 나타낸 바와 같이 2'-O-메틸 변형 패턴을 갖는다(밑줄친 잔기는 2-O-메틸 변형된 잔기를 나타낸다).
- 제2 듀플렉스("K249D")는 패신저 가닥의 3' 말단/가이드 가닥의 5' 말단에서 위치한 총 8개의 데옥시리보뉴클레오타이드 염기쌍을 갖는 3l/33량체이고, 이는 어떠한 포스포로티오에이트 변형을 갖지 않고 나타낸 바와 같이 2'-O-메틸 변형 패턴을 갖는다.
- 제3 및 제4 듀플렉스("K249DNA8" 및 "K249DNA8p")는 나타낸 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기 및 나타낸 돌출된 다이서 절단 부위의 5'에 위치한 가이드 가닥의 모든 잔기에서만 전적으로 데옥시리보뉴클레오타이드를 갖는 33/35량체이다. 2'-O-메틸 변형 패턴은 상기된 "K249D" DsiRNA에 대해 사용된 것과 동일하다. 제4 듀플렉스("K249DNA8p")는 패신저 가닥의 3' 말단/가이드 가닥의 5' 말단을 포함하는 8개 염기쌍의 모든 뉴클레오타이드에서 포스포로티오에이트 변형을 갖는다.
- 제5 및 제6 듀플렉스("K249DNA12" 및 "K249DNA12p")는 나타낸 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기에서 및 나타낸 돌출된 다이서 절단 부위의 5'에 위치한 가이드 가닥의 모든 잔기에서 전적으로 데옥시리보뉴클레오타이드를 갖는 37/39량체이다. 2'-O-메틸 변형 패턴은 상기된 "K249D" DsiRNA에 대해 사용된 것과 동일하다. 제6 듀플렉스("K249DNA12p")는 패신저 가닥의 3' 말단/가이드 가닥의 5' 말단을 포함하는 12개 염기쌍의 모든 뉴클레오타이드에서 포스포로티오에이트 변형을 갖는다.
도 17은 일련의 "KRAS-516" 부위 표적화 DsiRNA를 나타내고, 여기서,
- 제1 및 제2 듀플렉스("K516DNA8" 및 "K516DNA8p")는 나타낸 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기에서 및 나타낸 돌출된 다이서 절단 부위의 5'에 위치한 가이드 가닥의 모든 잔기에서 전적으로 데옥시리보뉴클레오타이드를 갖는 33/35량체이다. 2'-O-메틸 변형된 뉴클레오타이드는 밑줄친 잔기로서 나타낸다. 제2 듀플렉스("K516DNA8p")는 패신저 가닥의 3' 말단/가이드 가닥의 5' 말단을 포함하는 8개 염기쌍의 모든 뉴클레오타이드에서 포스포로티오에이트 변형을 갖는다. 주목할만하게 K249의 4개의 염기쌍 데옥시리보뉴클레오타이드 서열은 이들 연장된 DsiRNA로 도입하였다("K249"로서 표지된 박스친 영역을 참조한다).
- 제3 및 제4 듀플렉스("K516DNA12" 및 "K516DNA12p")는 나타낸 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기에서 및 나타낸 돌출된 다이서 절단 부위의 5'에 위치한 가이드 가닥의 모든 잔기에서 전적으로 데옥시리보뉴클레오타이드를 갖는 37/39량체이다. 2'-O-메틸 변형 패턴은 상기된 "K516DNA8" 및 "K516DNA8p" DsiRNA에 대해 사용된 것과 동일하다. 제4 듀플렉스("K516DNA12p")는 패신저 가닥의 3' 말단/가이드 가닥의 5' 말단을 포함하는 12개 염기쌍의 모든 뉴클레오타이드에서 포스포로티오에이트 변형을 갖는다. "K516DNA8" 및 "K516DNA8p" DsiRNA에 대하여 K249의 4개의 염기쌍 데옥시리보뉴클레오타이드 서열은 이들 연장된 DsiRNA로 도입하였다("K249"로서 표지된 박스친 영역을 참조한다).
도 18은 일련의 "KRAS-909" 부위 표적화 DsiRNA를 나타내고, 여기서,
- 제1 및 제2 듀플렉스("K909DNA8" 및 "K909DNA8p")는 나타낸 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기에서 및 나타낸 돌출된 다이서 절단 부위의 5'에 위치한 가이드 가닥의 모든 잔기에서 전적으로 데옥시리보뉴클레오타이드를 갖는 33/35량체이다. 2'-O-메틸 변형된 뉴클레오타이드는 밑줄친 잔기로서 나타낸다. 제2 듀플렉스("K909DNA8p")는 패신저 가닥의 3' 말단/가이드 가닥의 5' 말단을 포함하는 8개 염기쌍의 모든 뉴클레오타이드에서 포스포로티오에이트 변형을 갖는다. K249의 4개의 염기쌍 데옥시리보뉴클레오타이드 서열은 이들 연장된 DsiRNA로 도입하였다("K249"로서 표지된 박스친 영역을 참조한다).
- 제3 및 제4 듀플렉스("K909DNA12" 및 "K909DNA12p")는 나타낸 돌출된 다이서 절단 부위의 3'에 위치한 모든 패신저 가닥 잔기에서 및 나타낸 돌출된 다이서 절단 부위의 5'에 위치한 가이드 가닥의 모든 잔기에서 전적으로 데옥시리보뉴클레오타이드를 갖는 37/39량체이다. 2'-O-메틸 변형 패턴은 상기된 "K909DNA8" 및 "K909DNA8p" DsiRNA에 대해 사용된 것과 동일하다. 제4 듀플렉스("K909DNA12p")는 패신저 가닥의 3' 말단/가이드 가닥의 5' 말단을 포함하는 12개 염기쌍의 모든 뉴클레오타이드에서 포스포로티오에이트 변형을 갖는다. "K909DNA8" 및 "K909DNA8p" DsiRNA에 대하여 K249의 4개의 염기쌍 데옥시리보뉴클레오타이드 서열은 이들 연장된 DsiRNA로 도입하였다("K249"로서 표지된 박스친 영역을 참조한다).
도 16 내지 18에 나타낸 연장된 DsiRNA는 시험관내 KRAS 표적 전사체 억제 효능을 위해 시험하였다. 상기 실험으로부터 데이타는 도 19에 나타낸다. 놀랍게도, 33/35량체 및 37/39량체 DNA-연장된 DsiRNA는 상당한 억제 효능을 나타내지만(도 19에서 KRAS-249, 516 및 909 표적 부위 각각에 대해 "DNA8" 및 "DNA12"를 언급한다); 연장된 영역의 가닥 양쪽상에 위치한 이들 DsiRNA의 DNA 연장 영역의 변형은 억제 효능을 감소시켰다(KRAS-249, 516 및 909 표적 부위 각각에 대해 "DNA8p" 및 "DNAl 2p" 결과를 참조한다). 따라서, 양쪽 가닥의 포스포로티오에이트 변형을 함유하는 2개 또는 심지어 4개 연속의 DNA 염기쌍의 패턴이 DNA 연장된 DsiRNA의 효능에 거의 영향을 주지않는 것으로 관찰되지만(도 10 참조), 도 19는 본 발명의 "연장된" DsiRNA내에 8개 또는 12개 연속 포스포로티오에이트 변형된 데옥시리보뉴클레오타이드 염기쌍(양쪽 가닥상에 포스포로티오에이트 변형된)의 삽입이 상기 "연장된" DsiRNA의 억제 효능을 감소시킬 수 있음을 보여준다.
상기 결과에도 불구하고, 본 발명의 연장된 DsiRNA의 이중 가닥 연장된 영역중 하나의 가닥상에서만 포스포로티오에이트 변형의 위치가 어떠한 상당한 효능 상실 없이 보다 오랜 포스포로티오에이트 변형의 도입을 허용하는 것으로 나타남을 주지한다. 예를 들어, 연장된 DsiRNA의 연장된 영역의 단지 하나의 가닥에서만 15개 이상의 연속 포스포로티오에이트 변형의 내포가 상기 변형된 연장된 DsiRNA의 상당한 효능 상실 없이 관용성인 것으로 나타났다(데이타는 나타내지 않음). 따라서, 도 19의 결과가 대체로 본 발명의 연장된 DsiRNA의 양쪽 가닥상에 긴 트랙의 포스포로티오에이트 변형을 포함하는 효과를 나타낸다 하더라도, 본 발명의 DsiRNA의 DNA 함유 연장된 영역은 광범위한 유리한 변형(예를 들어, 포스포로티오에이트, 2'-O-메틸 또는 본 발명의 연장된 DsiRNA의 안정성, 전달, 효능 및/또는 효력을 증진시킬 수 있는 다른 변형)이 예를 들어, 본 발명의 연장된 DsiRNA의 억제 효능에 음성으로 영향을 주는 것 없이 도입될 수 있는 구조를 제공하는 것으로 입증되었다.
실시예 10 - 비-씨드 영역의 DsiRNA내 위치 및 미스매치 수의 상대적인 효과
상기 실시예 6에서, 본 발명의 연장된 DsiRNA내 미스매치의 도입은 표적 서열과 완전히 상보적인 DsiRNA 프로세싱 서열과 유사한 억제 효능을 갖는 연장된 "DsiRNAmm" 제제를 생성할 수 있는 것으로 입증되었다. 특히, 도 7 내지 9에서 비-씨드 영역 미스매치 위치중에서 효능에 영향을 주는 미스매치 위치("12번 위치")가 또한 표적 가닥 서열의 돌출된 Ago2 절단 부위에 가장 인접하게 위치한 위치였음이 관찰되었다. 이들 결과에 추가로 돌출된 Ago2 절단 부위로부터 실질적으로 제거된 비-씨드 영역에서 25/27량체 DsiRNA 뉴클레오타이드내에 서열 미스매치의 도입 효과를 조사하였다. 도 20은 하나 이상의 미스매치 잔기의 영향을 평가하기 위해 합성된 일련의 25/27량체 DsiRNA의 구조를 보여주고(도 20의 DsiRNAmm 분자의 구조와 관련하여 미스매치가 단지 표적 서열과 관련된 것이고 상응하는 DsiRNA 패신저 가닥 서열 잔기와는 관련이 없음을 나타내고; 이것은 추가로 "표적-미스매치된" 뉴클레오타이드 또는 잔기가 표적 뉴클레오타이스 서열에 대해 미스매치를 형성하는 가이드 가닥 뉴클레오타이드로서 본 발명의 목적을 위해 한정되어 있지만 상응하는 DsiRNA 패신저 가닥 서열 뉴클레오타이드에 대해 필연적으로 미스매치된 것이 아닌 것으로 주지된다), 상기 미스매치는 가이드 가닥의 3' 말단으로부터 개시하거나 패신저 가닥의 5' 말단 잔기에 상보적인 가이드 가닥 위치로부터 개시한다. 도 21에 나타낸 바와 같이, 시험된 25/27량체 DsiRNA의 가이드 가닥의 3' 말단 영역은 놀랍게도 하나 이상의 표적 미스매치된 뉴클레오타이드의 도입에 관용성이었다. 실제로, 시험된 DsiRNA의 가이드 가닥의 3' 말단으로부터 개시하는 1개 및 3개 표적 미스매치된 뉴클레오타이드 사이에 도입이 표적 억제 효능에 실질적으로 상당한 영향을 유발하지 않음을 보여주고(듀플렉스 DP1301P/DP1303G, DP1301P/DP1304G 및 DP1305P/DP1306G 참조), 시험된 DsiRNA의 가이드 가닥의 3' 말단으로부터 개시하는 4개, 5개 또는 심지어 6개의 표적 미스매치된 뉴클레오타이드의 도입은 여전히 상당한 억제 활성을 보유하는 DsiRNA를 유도하였다(듀플렉스 DP1307P/DP1308G, DP1309P/DP1310G 및 DP1311P/DP1312G 참조). DsiRNA 패신저 가닥의 5' 말단 잔기에 상보적인 가이드 가닥 위치로부터 개시하는 가이드 가닥내 표적 미스매치된 잔기의도입은 가이드 가닥의 3' 말단으로부터 개시하는 표적 미스매치된 뉴클레오타이드의 도입에 대해 관찰된 것들과 일치하는 결과를 산출하였다. 구체적으로, DsiRNA 패신저 가닥의 5' 말단 잔기에 상보적인 가이드 가닥 위치로부터 개시하는 1개 및 4개의 표적 미스매치된 뉴클레오타이드 사이로의 도입은 가이드 가닥의 3' 말단으로부터 개시하는 3개 및 6개 표적 미스매치된 뉴클레오타이드 사이로의 도입에 대해 관찰된 것과 대략 동일한 정도로 DsiRNA 억제 효능에 영향을 주었다(이는 표적 미스매치된 뉴클레오타이드에 대한 3' 말단 가이드 가닥 서열의 맨끝 및 맨끝에서 2번째 뉴클레오타이드(또한 DsiRNA 패신저 가닥의 5' 말단 잔기에 상보적인 가이드 가닥 위치)에 대해 관찰된 관용성과 일치하였다).
실시예 11 -DsiRNA 제제의 생체내 효능, 단일 용량 결과
DNA 듀플렉스 연장부를 갖는 DsiRNA 제제는 서열 특이적 mRNA 억제의 생체내 효능에 대해 조사하였다. 구체적으로, 도 20("DP1301P/DP1302G" 듀플렉스)의 비변형된 KRAS-표적화 DsiRNA "K249", 2'-O-메틸-변형된 KRAS-표적화 DsiRNA "K249M" (도 16의 제1 듀플렉스) 및 2'-O-메틸-변형된 "우측 연장된" KRAS-표적화 DsiRNA "K249D" (도 16의 제2 듀플렉스; 도 22 내지 25에서 "K249DNA"로서 나타냄)을 Invivofectamine™중에 제형화하고 10mg/kg으로 CD1 마우스에 정맥내 주사하였다. 간, 신장, 비장 및 림프절 조직에서 KRAS의 발현은 KRAS 발현을 평가하기 위해 3회 수행되는 실시간 PCR(RT-PCR)을 사용하여 24시간 주사 후 측정하였다(각각 도 22 내지 25; 각각의 막대는 처리 그룹 당 4마리의 마우스에 대해 수득된 결과를 제공한다). 이들 조건하에, "우측 연장된" DsiRNA "K249DNA"는 조사된 모든 조직에서 상당한 수준의 KRAS 표적 유전자 억제를 나타냈다. "K249DNA" 표적화된 조직에서 관찰된 특이적 KRAS% 억제 수준 및 이들 관찰과 연관된 p-값은 다음과 같다: 간 (55%-87%, 평균 71%, p=0.010), 비장 (92%-98%, 평균 94%, P<O.001), 신장 (19%-53%, 평균 35%, P=0.009) 및 림프절 (47%-81%, 평균 59%, P=0.001). 따라서, 본 발명의 연장된 DsiRNA의 생체내 효능은 많은 조직 유형에 걸쳐 입증되었다.
실시예 12 - DsiRNA 제제의 생체내 효능, 다중 용량 결과
DNA 듀플렉스 연장부를 갖는 DsiRNA 제제는 실시예 11 보다 낮은 용량에서 반복되는 용량 프로토콜에서 서열 특이적 mRNA 억제의 생체내 효능에 대해 조사하였다. 구체적으로, 2'-O-메틸-변형된 KRAS-표적화 DsiRNA "K249M" (도 16의 제1 듀플렉스) 및 2'-O-메틸-변형된 "우측 연장된" KRAS-표적화 DsiRNA "K249D" (도 16의 제2 듀플렉스를 Invivofectamine™중에 제형화하고 총 4개의 용량이 각각의 마우스로 투여될때까지 3일 마다 2mg/kg으로 CD1 마우스에 정맥내 주사하였다. 간, 폐, 비장, 및 신장 조직에서 KRAS의 발현은 최종 주사가 투여된지 24시간 후에 KRAS 발현을 평가하기 위해 3회 수행되는 실시간 PCR(RT-PCR)을 사용하여 측정하였다(각각 도 26 내지 29; 각각의 막대는 처리 그룹 당 4마리의 마우스에 대해 수득된 결과를 제공한다). 이들 조건하에, KRAS 수준의 통계학적으로 유의적인 감소가 "우측 연장된" DsiRNA "K249D"가 투여된 마우스의 간 및 비장 조직에서 관찰되었다. 상기 "K249DNA" 처리된 조직에서 관찰된 특이적 KRAS% 억제 수준 및 이들 관찰과 연관된 p-값은 다음과 같다: 간 (46%-90%, 평균 78%, p=0.002), 비장 (36%-80%, 평균 62%, P=O.004), 신장 (0%, 평균 0%, P=0.814**) 및 폐 (17%-38%, 평균 26%, P=0.065**). 따라서, 다중 용량(낮은 용량) 치료계획에서 본 발명의 연장된 DsiRNA의 생체내 효능은 간 및 비장 조직에서 입증되었다.
실시예 13 - DsiRNA 제제의 생체내 효능의 추가의 평가
생체내 특이적 표적 유전자의 유전자 발현을 감소시키기 위한 본 발명의 연장된 다이서 기질 제제의 능력에 대한 추가의 입증은 본 발명의 DsiRNA를 마우스 또는 기타 포유동물 피검체에 전신 투여(예를 들어, 정맥내 또는 복강내 주사에 의해) 또는 조직의 직접적인 주사(예를 들어, 안구, 척추/뇌/CNS 등의 주사)를 통해 투여하여 수행하였다. 추가의 표적 RNA 수준의 평가는 표준 방법(예를 들어, Trizol® 제제 (구아니디늄 티오시아네이트-페놀-클로로포름) 후 qRT-PCR)에 의해 표적 세포에 대해 수행하였다(예를 들어, 간 및/또는 신장 세포에서 RNA 수준은 마수의 주사 후 분석하였고; 안구 세포는 피검체의 안구 주사 후 분석하였고 또는 척주/뇌/CNS 세포는 동일한 피검체의 직접적인 주사후 분석하였다).
임의의 추가의 생체내 실험에서, 본 발명의 연장된 다이서 기질 제제(예를 들어, 좌측 연장된 또는 우측 연장된 DsiRNA)는 본 발명의 연장된 다이서 기질 제제를 투여한 경우 적절한 대조군(예를 들어, 단독의 비히클 대조군, 무작위 듀플렉스 대조군, 상이한 표적 RNA에 대해 지시된 듀플렉스 대조군)과 비교하여 RNA 수준의 통계학적으로 유의적인 감소가 관찰되는 경우 생체내 효과적인 제제인 것으로 간주될 수 있다. 일반적으로, 상기 비교에 할당된 p-값(예를 들어, 1 테일된, 쌍을 이루지 않은 T-시험을 통해 생성되는)이 0.05미만인 경우, 본 발명의 연장된 다이서 기질 제제(예를 들어, 좌측 연장된 또는 우측 연장된 DsiRNA 제제)는 효과적인 RNA 간섭 제제인 것으로 간주된다. 또한, 효과적인 RNA 간섭 제제로서 본 발명의 연장된 다이서 기질 제제를 분류하기 위한 것 미만의 p값 역치를 0.01, 0.001, 등으로 설정하는 경우 보다 엄격한 필터링을 제공하고/하거나 보다 명백한 차이를 동정하고/하거나 다중의 추정 시험 등을 위해 조정할 수 있다. 절대 활성 수준 제한을 설정하여 효과적인 것과 비효과적인 연장된 다이서 기질 제제를 분간할 수 있다. 예를 들어, 특정 양태에서, 본 발명의 효과적인 연장된 다이서 기질 제제는 적절한 대조군과 비교하여 생체내에서 표적 RNA의 통계학적으로 유의적인 감소를 나타낼 뿐만 아니라 예를 들어, 적어도 대략 10% 감소, 대략 15% 감소, 적어도 대략 20% 감소, 대략 25% 감소,대략 30% 감소 등을 나타내는 것이다. 이로써 본 발명의 연장된 다이서 기질 제제(예를 들어, 좌측 연장되고 우측 연장된 DsiRNA 제제)의 추가의 생체내 효능 시험을 수행한다.
명세서에 언급된 모든 특허 문헌 및 공보는 본 발명이 속하는 당업자의 기술 수준을 지적한다. 본원에 인용된 모든 참조문헌은 개별 참조문헌이 이의 전문이 별개로 인용되는 것과 같이 동일한 정도로 본원에 참조로서 인용된다.
당업자는 본 발명이 본원의 특유한 것들 뿐만 아니라 언급된 목적을 수행하고 목표 및 잇점을 수득하기 위해 잘 적용됨을 용이하게 인지할 것이다. 현재 바람직한 양태를 나타내는 본원에 기재된 방법 및 조성물은 예시적인 것이고 본 발명의 범위를 제한하는 것으로 의도되지 않는다. 여기서의 변화 및 다른 사용이 당업자에게 가능한 것이고 이는 본 발명의 취지내에 포함되고 청구항의 범위에 의해 한정된다.
다양한 치환 및 변형이 본 발명의 범위 및 취지를 벗어나지 않고 본원 발명에 가해질 수 있음은 당업자에게 자명할 것이다. 따라서 상기 추가의 양태는 본 발명의 범위 및 하기의 청구항의 범위내에 있다. 본 발명은 당업자에게 본원에 기재된 화학적 변형의 다양한 조합 및/또는 치환을 시험하여 RNAi 활성을 매개하기 위한 개선된 활성과 함께 핵산 작제물을 생성하도록 교시한다. 상기 개선된 활성은 RNAi를 매개하는 세포 반응의 개선된 안정성, 개선된 생물유용성 및/또는 개선된 활성화를 포함할 수 있다. 따라서, 본원에 기재된 특이적 양태는 제한적이지 않고 당업자는 본원에 기재된 변형의 특이적 조합이 과도한 실험 없이 개선된 RNAi 활성을 갖는 DsiRNA 분자를 동정하는 방향으로 시험될 수 있음을 용이하게 인지할 수 있다.
본원에 예시적으로 기재된 발명은 구체적으로 본원에 기재되지 않은 임의의 요소 또는 요소들, 제한 또는 제한들의 부재하에 수행될 수 있다. 따라서, 예를 들어, 각각의 경우 본원의 용어 "포함하는", "필수적으로 이루어진" 및 "로 이루어진"은 다른 2개의 용어중 어느 하나로 대체될 수 있다. 사용된 용어 및 표현은 기재의 용어로서 사용되고 제한적이지 않으며 상기 용어 및 표현의 사용은 본원에 제시되고 기재된 특징의 임의의 등가물 또는 이의 일부를 배제하기 위한 의도가 없는 것이고 다양한 변형이 청구된 본 발명의 범위내에서 가능한 것으로 인지된다. 따라서, 본 발명이 바람직한 양태에 의해 구체적으로 기재되었지만 본원의 개념의 임의의 특징, 변형 및 변화가 당업자에 의해 수행될 수 있고 상기 변형 및 변화는 본원 명세서 및 첨부된 청구항에 의해 안정된 상기 범위내에서 있는 것으로 간주되는 것으로 이해되어야만 한다.
추가로, 본 발명의 특징 또는 측면이 마쿠시 그룹 또는 또 다른 대용물의 그룹으로 기재된 경우, 당업자는 본 발명이 또한 마쿠시 그룹 또는 다른 그룹의 개별 구성원 또는 구성원의 서브그룹 관점에서 기재되는 것임을 인지할 것이다.
본 발명을 기재하는 데 있어서(특히 하기 청구항의 관점에서) 용어 "a" 및 "an" 및 "the"의 사용은 본원에 달리 언급하지 않거나 본원에 의해 명백히 반박되지 않는 경우 단수 및 복수 모두를 포함하는 것으로 해석되어야만 한다. 용어 "포함하는", "갖는", "함유하는" 및 "포함하는"은 달리 언급되지 않는 경우 개방형(open-ended) 용어(즉, "포함하지만 이에 제한되지 않는"을 의미함)로서 간주되어야만 한다. 본원에 수치 범위의 인용은 본원에 달리 지적되지 않는 경우 단지 본 발명의 범위에 속하는 각각의 별도의 수치를 개별적으로 언급하는 약칭 방법으로 작용하는 것으로 의도되고 각각의 별도의 수치는 이것이 개별적으로 인용되는 것 처럼 본원 명세서에 혼입된다. 본원에 기재된 모든 방법은 달리 언급되지 않거나 명백히 반박되지 않는 경우 임의의 적합한 정도로 수행될 수 있다. 본원에 제공된 임의의 모든 실시예 또는 예시적 용어(예를 들어, "같은")의 사용은 단지 본 발명을 보다 잘 예시하기 위해 의도된 것이고 달리 청구되지 않는 다면 본 발명의 범위에 제한을 부과하지 않는다. 본원 명세서에서 어떠한 용도도 본 발명의 수행에 필수적인 임의의 비-청구된 요소를 지적하는 것으로 해석되지 말아야 한다.
본 발명의 양태는 본 발명을 수행하기 위해 본 발명자에게 공지된 최상의 양태를 포함하도록 본원에 기재된다. 상기 양태의 변화는 이전의 기재를 판독하는 즉시 당업자에게 자명해질 것이다. 본 발명자는 당업자가 적당히 상기 변화를 사용할 것으로 예상하고 본 발명자는 발명이 본원에서 구체적으로 기재된 것과는 다르게 수행됨을 이해한다. 따라서 본 발명은 적용되는 법에 의해 허용되는 바와 같이 여기에 첨부된 청구항에 인용된 주요 요지의 모든 변형 및 등가물을 포함한다. 더우기 모든 가능한 변형으로 상기된 요소들의 임의의 조합은 본원에 달리 지적되지 않거나 달리 반박되지 않는 경우 본 발명에 의해 포함된다.
SEQUENCE LISTING
<110> DICERNA PHARMACEUTICALS, INC.
<120> EXTENDED DICER SUBSTRATE AGENTS AND METHODS FOR THE SPECIFIC
INHIBITION OF GENE EXPRESSION
<130> 82783WO(301937)
<140> PCT/US2009/006636
<141> 2009-12-18
<150> 61/173,505
<151> 2009-04-28
<150> 61/173,514
<151> 2009-04-28
<150> 61/173,521
<151> 2009-04-28
<150> 61/173,525
<151> 2009-04-28
<150> 61/173,532
<151> 2009-04-28
<150> 61/173,538
<151> 2009-04-28
<150> 61/173,544
<151> 2009-04-28
<150> 61/173,549
<151> 2009-04-28
<150> 61/173,554
<151> 2009-04-28
<150> 61/173,556
<151> 2009-04-28
<150> 61/173,558
<151> 2009-04-28
<150> 61/173,563
<151> 2009-04-28
<150> 61/166,227
<151> 2009-04-02
<150> 61/138,946
<151> 2008-12-18
<160> 219
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 1
gactttgctt tccttggtca g 21
<210> 2
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 2
ggcttatatc caacacttcg tggg 24
<210> 3
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
probe
<400> 3
atggtcaagg tcgcaagctt gctggt 26
<210> 4
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 4
tgtgcagaag gatggagt 18
<210> 5
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 5
ctggtgcttc tctcaggata 20
<210> 6
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
probe
<400> 6
tggaatatgc cctgcgtaaa ctgga 25
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 7
caaactttgc tttccctggt 20
<210> 8
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 8
caacaaagtc tggcctgtat c 21
<210> 9
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
probe
<400> 9
tggttaaggt tgcaagcttg ctggtg 26
<210> 10
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 10
ctttgtggat gagtacgacc 20
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 11
cactgtactc ctcttgacct 20
<210> 12
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
probe
<400> 12
acgatagagg actcctacag gaaacaagt 29
<210> 13
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 13
gccagacuuu guuggauuug aaacctt 27
<210> 14
<211> 29
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 14
aagguuuca aauccaacaa agucuggcuu 29
<210> 15
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 15
gccagacuuu guuggauuug a 21
<210> 16
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 16
aaauccaaca aagucuggcu u 21
<210> 17
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 17
gccagacuuu guuggauuug aaatt 25
<210> 18
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 18
aauuucaaau ccaacaaagu cuggcuu 27
<210> 19
<211> 29
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 19
aagguuucaa auccaacaaa gucuggcuu 29
<210> 20
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 20
gccagacuuu guuggauuug aaaccaacat t 31
<210> 21
<211> 33
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 21
aauguugguu ucaaauccaa caaagucugg cuu 33
<210> 22
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 22
gccagacuuu guuggauuug aaacctt 27
<210> 23
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 23
aagguuucaa auccaacaaa gucuggcuu 29
<210> 24
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 24
gccagacuuu guuggauuug aaaccaacat t 31
<210> 25
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 25
aatgttgguu ucaaauccaa caaagucugg cuu 33
<210> 26
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 26
gccagacuuu guuggauuug aaaccaacag ctt 33
<210> 27
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 27
aagctgttgg uuucaaaucc aacaaagucu ggcuu 35
<210> 28
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 28
gccagacuuu guuggauuug aaaccaacag ctt 33
<210> 29
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 29
aagcuguugg uuucaaaucc aacaaagucu ggcuu 35
<210> 30
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 30
gcuagguugu uucagacuug aaatt 25
<210> 31
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 31
aauuucaagu cugaaacaac cuagcuu 27
<210> 32
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 32
agccagacuu uguuggauuu gaaaccaaca tt 32
<210> 33
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 33
gccagacuuu guuggauuug aaaccaatt 29
<210> 34
<211> 31
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 34
aauugguuuc aaauccaaca aagucuggcu u 31
<210> 35
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 35
gccagacuuu guuggauuug aaaccaacag ctt 33
<210> 36
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 36
gccagacuuu guuggauuug aaaccaatt 29
<210> 37
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 37
aattgguuuc aaauccaaca aagucuggcu u 31
<210> 38
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 38
ggagggcuuu cuuuguguau uugcc 25
<210> 39
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 39
ggcaaauaca caaagaaagc ccucccc 27
<210> 40
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 40
ggaccuuggg gagggcuuuc uuuguguacc 30
<210> 41
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 41
uacacaaaga aaguccuccc caaggtcc 28
<210> 42
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 42
ggagggcuuu cuuuguguac caaggtcc 28
<210> 43
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 43
ggaccuuggu acacaaagaa agcccucccc 30
<210> 44
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 44
uacacaaaga aagcccuccc caaggtcc 28
<210> 45
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 45
ggaccuuggu acacaaagaa ggcccucccc 30
<210> 46
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 46
uacacaaaga aggcccuccc caaggtcc 28
<210> 47
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 47
ggaccuuggu acacaaagaa aguccucccc 30
<210> 48
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 48
ggaccuuggu acacaaagaa agccuucccc 30
<210> 49
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 49
uacacaaaga aagccuuccc caaggtcc 28
<210> 50
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 50
ggaccuuggu acacaaagaa aguccuuccc 30
<210> 51
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 51
uacacaaaga aaguccuucc caaggtcc 28
<210> 52
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 52
ggaccuuggu acacaaagaa ggccuucccc 30
<210> 53
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 53
uacacaaaga aggccuuccc caaggtcc 28
<210> 54
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 54
gccagacuuu guuggauuug aaatt 25
<210> 55
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 55
aattucaaau ccaacaaagu cuggcuu 27
<210> 56
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 56
aatttcaaau ccaacaaagu cuggcuu 27
<210> 57
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 57
gccagacuuu guuggauuug aaacctt 27
<210> 58
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 58
aaggttucaa auccaacaaa gucuggcuu 29
<210> 59
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 59
aaggtttcaa auccaacaaa gucuggcuu 29
<210> 60
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 60
aggcaggtuu aagccagacu uuguuggauu uga 33
<210> 61
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 61
aaauccaaca aagucuggcu uaaacctgcc t 31
<210> 62
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 62
aaauucaaca aagucuggcu uaaacctgcc t 31
<210> 63
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 63
caggucaaga ggaguacagu gcaat 25
<210> 64
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 64
auugcacugu acuccucuug accugcu 27
<210> 65
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 65
caggucaaga ggaguacagu gcaat 25
<210> 66
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 66
attgcacugu acuccucuug accugcu 27
<210> 67
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 67
caggucaaga ggaguacagu gcagauacat 30
<210> 68
<211> 32
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 68
auguaucugc acuguacucc ucuugaccug cu 32
<210> 69
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 69
caggucaaga ggaguacagu gcagatacat 30
<210> 70
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 70
atgtatctgc acuguacucc ucuugaccug cu 32
<210> 71
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 71
caggucaaga ggaguacagu gcacaaugga uacat 35
<210> 72
<211> 37
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 72
auguauccau ugugcacugu acuccucuug accugcu 37
<210> 73
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 73
caggucaaga ggaguacagu gcacaatgga tacat 35
<210> 74
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 74
atgtatccat tgtgcacugu acuccucuug accugcu 37
<210> 75
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 75
ggugugaaac aaauuaauga agctt 25
<210> 76
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 76
aagcuucauu aauuuguuuc acaccaa 27
<210> 77
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 77
ggugugaaac aaauuaauga agctt 25
<210> 78
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 78
aagcttcauu aauuuguuuc acaccaa 27
<210> 79
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 79
ggugugaaac aaauuaauga agcgauactt 30
<210> 80
<211> 32
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 80
aaguaucgcu ucauuaauuu guuucacacc aa 32
<210> 81
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 81
ggugugaaac aaauuaauga agcgatactt 30
<210> 82
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 82
aagtatcgct tcauuaauuu guuucacacc aa 32
<210> 83
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 83
ggugugaaac aaauuaauga agccaaugga uactt 35
<210> 84
<211> 37
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 84
aaguauccau uggcuucauu aauuuguuuc acaccaa 37
<210> 85
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 85
ggugugaaac aaauuaauga agccaatgga tactt 35
<210> 86
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 86
aagtatccat tggcttcauu aauuuguuuc acaccaa 37
<210> 87
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 87
gaagcgauac tt 12
<210> 88
<211> 12
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 88
aaguaucgcu uc 12
<210> 89
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 89
gaagcgatac tt 12
<210> 90
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 90
aagtatcgct tc 12
<210> 91
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 91
gaagccaaug gauactt 17
<210> 92
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 92
aaguauccau uggcuuc 17
<210> 93
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 93
gaagccaatg gatactt 17
<210> 94
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 94
aagtatccat tggcttc 17
<210> 95
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 95
ggagggcuuu cuuuguguau uugccaacct t 31
<210> 96
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 96
aaggttggca aauacacaaa gaaagcccuc ccc 33
<210> 97
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 97
ggagggcuuu cuuuguguau utgccaacct tgg 33
<210> 98
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 98
ccaaggttgg caaauacaca aagaaagccc ucccc 35
<210> 99
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 99
ggagggcuuu cuuuguguau utgccaacct tggaacc 37
<210> 100
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 100
ggttccaagg ttggcaaaua cacaaagaaa gcccucccc 39
<210> 101
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 101
aaaacauaaa gaaaagauga gtgccaacct tgg 33
<210> 102
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 102
ccaaggttgg cactcaucuu uucuuuaugu uuucg 35
<210> 103
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 103
aaaacauaaa gaaaagauga gtgccaacct tggaacc 37
<210> 104
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 104
ggttccaagg ttggcactca ucuuuucuuu auguuuucg 39
<210> 105
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 105
ggugugaaac aaauuaauga atgccaacct tgg 33
<210> 106
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 106
ccaaggttgg cattcauuaa uuuguuucac accaa 35
<210> 107
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 107
ggugugaaac aaauuaauga atgccaacct tggaacc 37
<210> 108
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 108
ggttccaagg ttggcattca uuaauuuguu ucacaccaa 39
<210> 109
<211> 10
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 109
ugccaacctt 10
<210> 110
<211> 10
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 110
aaggttggca 10
<210> 111
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 111
tgccaacctt gg 12
<210> 112
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 112
ccaaggttgg ca 12
<210> 113
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 113
tgccaacctt ggaacc 16
<210> 114
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 114
ggttccaagg ttggca 16
<210> 115
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 115
ggcaaauaca caaagaaagc ccucccg 27
<210> 116
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 116
ggcaaauaca caaagaaagc ccuccag 27
<210> 117
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 117
cgagggcuuu cuuuguguau uugcc 25
<210> 118
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 118
ggcaaauaca caaagaaagc ccucgag 27
<210> 119
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 119
ccagggcuuu cuuuguguau uugcc 25
<210> 120
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 120
ggcaaauaca caaagaaagc ccuggag 27
<210> 121
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 121
ccugggcuuu cuuuguguau uugcc 25
<210> 122
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 122
ggcaaauaca caaagaaagc ccaggag 27
<210> 123
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 123
ccucggcuuu cuuuguguau uugcc 25
<210> 124
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 124
ggcaaauaca caaagaaagc cgaggag 27
<210> 125
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 125
ggcaaauaca caaagaaagc ccucgcc 27
<210> 126
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 126
ggcaaauaca caaagaaagc ccuggcc 27
<210> 127
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 127
ggcaaauaca caaagaaagc ccaggcc 27
<210> 128
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 128
ggcaaauaca caaagaaagc cgaggcc 27
<210> 129
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 129
gccagacuuu guuggauuug aaannnnnnn nnnnnnnnn 39
<210> 130
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 0 to 4 bases
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 130
nnnnnnnnnn nnnnnnuuuc aaauccaaca aagucuggcu uuu 43
<210> 131
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 131
gccagacuuu guuggauuug aaannnnnnn nnnnnnnnnc c 41
<210> 132
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (42)..(45)
<223> This region may encompass 0 to 4 bases
<220>
<221> modified_base
<222> (3)..(18)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 132
ggnnnnnnnn nnnnnnnnuu ucaaauccaa caaagucugg cuuuu 45
<210> 133
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 1 to 4 bases
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 133
gccagacuuu guuggauuug aaannnnnnn nnnnnnnnnu uuu 43
<210> 134
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 134
gccagacuuu guuggauuug aaannnnnnn nnnnnnnnng u 41
<210> 135
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (42)..(45)
<223> This region may encompass 0 to 4 bases
<220>
<221> modified_base
<222> (3)..(18)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 135
gunnnnnnnn nnnnnnnnuu ucaaauccaa caaagucugg cuuuu 45
<210> 136
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 136
ggagggcuuu cuuuguguac caannnnnnn nnnnnnnnn 39
<210> 137
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 0 to 4 bases
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 137
nnnnnnnnnn nnnnnnuugg uacacaaaga aaguccuccc ccc 43
<210> 138
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 138
ggagggcuuu cuuuguguac caannnnnnn nnnnnnnnnc c 41
<210> 139
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (42)..(45)
<223> This region may encompass 0 to 4 bases
<220>
<221> modified_base
<222> (3)..(18)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 139
ggnnnnnnnn nnnnnnnnuu gguacacaaa gaaaguccuc ccccc 45
<210> 140
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 140
ggaggacuuu cuuuguguac caannnnnnn nnnnnnnnn 39
<210> 141
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 1 to 4 bases
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 141
ggagggcuuu cuuuguguac caannnnnnn nnnnnnnnnu uuu 43
<210> 142
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 1 to 4 bases
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 142
ggaggacuuu cuuuguguac caannnnnnn nnnnnnnnnu uuu 43
<210> 143
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 143
ggagggcuuu cuuuguguac caannnnnnn nnnnnnnnng u 41
<210> 144
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (42)..(45)
<223> This region may encompass 0 to 4 bases
<220>
<221> modified_base
<222> (3)..(18)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 144
gunnnnnnnn nnnnnnnnuu gguacacaaa gaaaguccuc ccccc 45
<210> 145
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 145
ggaggacuuu cuuuguguac caannnnnnn nnnnnnnnng u 41
<210> 146
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 146
nnnnnnnnnn nnnnnnuuaa gccagacuuu guuggauuug a 41
<210> 147
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (26)..(41)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 147
tcaaauccaa caaagucugg cuuaannnnn nnnnnnnnnn n 41
<210> 148
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 148
aaauccaaca aagucuggcu uaannnnnnn nnnnnnnnn 39
<210> 149
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 1 to 4 bases
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 149
nnnnnnnnnn nnnnnnuuaa gccagacuuu guuggauuuu uuu 43
<210> 150
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (26)..(41)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 150
guaaauccaa caaagucugg cuuaannnnn nnnnnnnnnn n 41
<210> 151
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 151
nnnnnnnnnn nnnnnnuuaa gccagucuuu guuggauuug a 41
<210> 152
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (26)..(41)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 152
tcaaauccaa caaaggcugg cuuaannnnn nnnnnnnnnn n 41
<210> 153
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 153
nnnnnnnnnn nnnnnnuuaa gccugacuuu guuggauuug a 41
<210> 154
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (26)..(41)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 154
tcaaauccaa caaagucggg cuuaannnnn nnnnnnnnnn n 41
<210> 155
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 155
nnnnnnnnnn nnnnnnuuaa gccagccuuu guuggauuug a 41
<210> 156
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 156
nnnnnnnnnn nnnnnnuuaa gcccgacuuu guuggauuug a 41
<210> 157
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 1 to 4 bases
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 157
nnnnnnnnnn nnnnnnuuaa gccagucuuu guuggauuuu uuu 43
<210> 158
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (24)..(39)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 158
aaauccaaca aaggcuggcu uaannnnnnn nnnnnnnnn 39
<210> 159
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (40)..(43)
<223> This region may encompass 1 to 4 bases
<220>
<221> modified_base
<222> (1)..(16)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 159
nnnnnnnnnn nnnnnnuuaa gccagccuuu guuggauuuu uuu 43
<210> 160
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (26)..(41)
<223> a, c, t, g, unknown or other and this region may
encompass 4 to 16 bases
<400> 160
guaaauccaa caaagucggg cuuaannnnn nnnnnnnnnn n 41
<210> 161
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 161
gccagacuuu guuggauuug aaaccatt 28
<210> 162
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 162
aatgguuuca aauccaacaa agucuggcuu 30
<210> 163
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 163
gccagacuuu guuggauuug aaaccaactt 30
<210> 164
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 164
aagttgguuu caaauccaac aaagucuggc uu 32
<210> 165
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 165
gccagacuuu guuggauuug aaaccaacag tt 32
<210> 166
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 166
aactgttggu uucaaaucca acaaagucug gcuu 34
<210> 167
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 167
gccagacuuu guuggauuug aaaccaacag cctt 34
<210> 168
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 168
aaggctgttg guuucaaauc caacaaaguc uggcuu 36
<210> 169
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 169
gccagacuuu guuggauuug aaaccaacag ccatt 35
<210> 170
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 170
aatggctgtt gguuucaaau ccaacaaagu cuggcuu 37
<210> 171
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 171
gccagacuuu guuggauuug aaaccaacag ccagtt 36
<210> 172
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 172
aactggctgt tgguuucaaa uccaacaaag ucuggcuu 38
<210> 173
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 173
gccagacuuu guuggauuug aaaccaacag ccagctt 37
<210> 174
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 174
aagctggctg ttgguuucaa auccaacaaa gucuggcuu 39
<210> 175
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 175
gccagacuuu guuggauuug aaaccaacag ccagcatt 38
<210> 176
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 176
aatgctggct gttgguuuca aauccaacaa agucuggcuu 40
<210> 177
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 177
gccagacuuu guuggauuug aaaccaacag ccagcactt 39
<210> 178
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 178
aagtgctggc tgttgguuuc aaauccaaca aagucuggcu u 41
<210> 179
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 179
gccagacuuu guuggauuug aaaccaatt 29
<210> 180
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 180
aauugguuuc aaauccaaca aagucuggcu u 31
<210> 181
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 181
aattgguuuc aaauccaaca aagucuggcu u 31
<210> 182
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 182
gccagacuuu guuggauuug aaaccaatt 29
<210> 183
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 183
gccagacuuu guuggauuug aaaccaauu 29
<210> 184
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 184
gccagacuuu guuggauuug aaaccaagu 29
<210> 185
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 185
guttgguuuc aaauccaaca aagucuggc 29
<210> 186
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 186
aagggccaga cuuuguugga uuugaaacc 29
<210> 187
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 187
uuucaaaucc aacaaagucu guucctt 27
<210> 188
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 188
aacgggccag acuuuguugg auuugaaacc 30
<210> 189
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 189
uuucaaaucc aacaaagucu guuccgtt 28
<210> 190
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 190
aaacgggcca gacuuuguug gauuugaaac c 31
<210> 191
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 191
uuucaaaucc aacaaagucu guuccgttt 29
<210> 192
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 192
aagacgggcc agacuuuguu ggauuugaaa cc 32
<210> 193
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 193
uuucaaaucc aacaaagucu guuccgtctt 30
<210> 194
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 194
aagcacgggc cagacuuugu uggauuugaa acc 33
<210> 195
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 195
uuucaaaucc aacaaagucu guuccgtgct t 31
<210> 196
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 196
aagccacggg ccagacuuug uuggauuuga aacc 34
<210> 197
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 197
uuucaaaucc aacaaagucu guuccgtggc tt 32
<210> 198
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 198
aagcctacgg gccagacuuu guuggauuug aaacc 35
<210> 199
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 199
uuucaaaucc aacaaagucu guuccgtagg ctt 33
<210> 200
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 200
aagtcctacg ggccagacuu uguuggauuu gaaacc 36
<210> 201
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 201
uuucaaaucc aacaaagucu guuccgtagg actt 34
<210> 202
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 202
aagtgcctac gggccagacu uuguuggauu ugaaacc 37
<210> 203
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 203
uuucaaaucc aacaaagucu guuccgtagg cactt 35
<210> 204
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 204
aagctgccta cgggccagac uuuguuggau uugaaacc 38
<210> 205
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 205
uuucaaaucc aacaaagucu guuccgtagg cagctt 36
<210> 206
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 206
aacgctgcct acgggccaga cuuuguugga uuugaaacc 39
<210> 207
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 207
uuucaaaucc aacaaagucu guuccgtagg cagcgtt 37
<210> 208
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 208
aatcgctgcc tacgggccag acuuuguugg auuugaaacc 40
<210> 209
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 209
uuucaaaucc aacaaagucu guuccgtagg cagcgatt 38
<210> 210
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 210
aagtcgctgc ctacgggcca gacuuuguug gauuugaaac c 41
<210> 211
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 211
uuucaaaucc aacaaagucu guuccgtagg cagcgactt 39
<210> 212
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 212
aaacgggcca gacuuuguug gauuugaaac c 31
<210> 213
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 213
uuucaaaucc aacaaagucu guuccgutt 29
<210> 214
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 214
aaacgggcca gacuuuguug gauuugaaac c 31
<210> 215
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 215
uuucaaaucc aacaaagucu guuccgutt 29
<210> 216
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 216
aaacgggcca gacuuuguug gauuugaaac c 31
<210> 217
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 217
uuucaaaucc aacaaagucu guuccgttt 29
<210> 218
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 218
ugaaacgggc cagacuuugu uggauuugaa acc 33
<210> 219
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<400> 219
uuucaaaucc aacaaagucu guuccgtttu g 31
Claims (146)
- 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 상기 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는, 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는, 분리된 이중가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는, 분리된 이중가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 염기쌍을 이루어 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제1 가닥의 1번 내지 9번은 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는, 분리된 이중가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제1 가닥의 1번 내지 9번은 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는, 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택되는 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제1 가닥의 1번 내지 9번은 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는, 분리된 dsNA. - 제1항 내지 제6항 중 어느 한 항에 있어서, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 2개 이상, 4개 이상, 6개 이상, 8개 이상, 10개 이상, 12개 이상, 14개 이상, 16개 이상, 18개 이상, 또는 20개 이상의 뉴클레오타이드 잔기로 이루어진 그룹으로부터 선택되는 양으로 존재하고, 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 제1 가닥의 데옥시리보뉴클레오타이드가 연속 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 제1 가닥의 24번 내지 27번의 2개 이상의 연속 뉴클레오타이드 잔기가 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 제1 가닥의 위치 24번 및 제25번 각각이 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 제1 올리고뉴클레오타이드 가닥의 위치 24번 내지 제27번 뉴클레오타이드 잔기 각각이 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 제1 가닥이, 길이가 29 내지 49개인 뉴클레오타이드인 분리된 dsNA.
- 제12항에 있어서, 제1 올리고뉴클레오타이드 가닥의 위치 24번 및 제27번 뉴클레오타이드 잔기 각각이 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 제1 가닥이, 길이가 31 내지 49개인 뉴클레오타이드인 분리된 dsNA.
- 제12항 또는 제14항에 있어서, 제1 올리고뉴클레오타이드 가닥의 위치 24번 내지 제29번 각각의 뉴클레오타이드 잔기가 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 제1 가닥이, 길이가 33 내지 49개인 뉴클레오타이드인 분리된 dsNA.
- 제14항 또는 제16항에 있어서, 제1 올리고뉴클레오타이드 가닥의 위치 24번 내지 제31번 각각의 뉴클레오타이드 잔기가 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 제1 가닥이, 길이가 35 내지 49개인 뉴클레오타이드인 분리된 dsNA.
- 제16항 또는 제18항에 있어서, 제1 올리고뉴클레오타이드 가닥의 위치 24번 내지 제33번 각각의 뉴클레오타이드 잔기가 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 제1 가닥이, 길이가 37 내지 49개인 뉴클레오타이드인 분리된 dsNA.
- 제18항 또는 제20항에 있어서, 제1 올리고뉴클레오타이드 가닥의 위치 24번 내지 제35번 각각의 뉴클레오타이드 잔기가 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 제1 가닥이, 길이가 39 내지 49개인 뉴클레오타이드인 분리된 dsNA.
- 제20항 또는 제22항에 있어서, 제1 올리고뉴클레오타이드 가닥의 위치 24번 내지 제37번 각각의 뉴클레오타이드 잔기가 상기 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제23항 중 어느 한 항에 있어서, 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 제2 가닥의 데옥시리보뉴클레오타이드가 표적 RNA와 상보적이지 않은 분리된 dsNA.
- 제1항 내지 제24항 중 어느 한 항에 있어서, 제2 가닥이 길이가 1 내지 4개 인 뉴클레오타이드의 3' 오버행을 갖는 분리된 dsNA.
- 제25항에 있어서, 제2 가닥의 3' 오버행의 뉴클레오타이드가 변형된 뉴클레오타이드를 포함하는 분리된 dsNA.
- 제26항에 있어서, 변형된 뉴클레오타이드 잔기는 2'-O-메틸, 2'-메톡시에톡시, 2'-플루오로, 2'-알릴, 2'-O-[2-(메틸아미노)-2-옥소에틸], 4'-티오, 4'-CH2-O-2 '-브릿지, 4'-(CH2)2-O-2'-브릿지, 2'-LNA, 2'-아미노 및 2'-O-(N-메틸카바메이트)로 이루어진 그룹으로부터 선택되는 분리된 dsNA.
- 제1항 내지 제27항 중 어느 한 항에 있어서, 제1 가닥의 24번 위치에서 3' 말단까지의 하나 이상의 뉴클레오타이드 잔기가 2'-O-메틸, 2'-메톡시에톡시, 2'-플루오로, 2'-알릴, 2'-O-[2-(메틸아미노)-2-옥소에틸], 4'-티오, 4'-CH2-O-2'-브릿지, 4'-(CH2)2-O-2'-브릿지, 2'-LNA, 2'-아미노 및 2'-O-(N-메틸카바메이트)로 이루어진 그룹으로부터 선택되는 변형된 뉴클레오타이드를 추가로 포함하는 분리된 dsNA.
- 제1항, 제2항, 제4항, 제5항 및 제7항 내지 제28항 중 어느 한 항에 있어서, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기가 데옥시리보뉴클레오타이드이고 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기가 리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제29항 중 어느 한 항에 있어서, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여 제2 가닥이 상기 제2 가닥의 20번 위치*에서 5' 말단 잔기까지의 모든 위치에서 비변형된 뉴클레오타이드 잔기를 포함하는 분리된 dsNA.
- 제1항 내지 제30항 중 어느 한 항에 있어서, 제1 가닥의 3' 말단에서 제1 뉴클레오타이드(1번 위치 *)로부터 개시하여 1번 위치 *, 2번 위치 * 및/또는 3번 위치 *가 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제31항에 있어서, 제1 가닥이 제1 가닥의 3' 말단으로부터 1번 위치 *에서 데옥시리보뉴클레오타이드를 포함하는 분리된 dsNA.
- 제31항에 있어서, 제1 가닥이 상기 제1 가닥의 3' 말단으로부터 1번 위치 * 및 2번 위치 *에서 데옥시리보뉴클레오타이드를 포함하는 분리된 dsNA.
- 제1항 내지 제33항 중 어느 한 항에 있어서, 제2 또는 제1 올리고뉴클레오타이드 가닥의 뉴클레오타이드가 다이서 절단의 배향을 지시하는 변형된 뉴클레오타이드로 치환된 분리된 dsNA.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 제2 가닥의 3' 말단에서 제1 뉴클레오타이드(1번 위치 *)으로부터 개시하여, 상기 제2 가닥의 3' 말단으로부터 1번 위치 *, 2번 위치 * 및 3번 위치 *가 변형된 뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제35항 중 어느 한 항에 있어서, 제1 가닥이 제2 가닥 뉴클레오타이드 서열과 60%, 70%, 80%, 90%, 95% 또는 100% 이상 상보적인 뉴클레오타이드 서열을 갖는 분리된 dsNA.
- 제1항 내지 제36항 중 어느 한 항에 있어서, 제1 가닥의 3' 말단 뉴클레오타이드 잔기가 뉴클레오타이드 서열에 의해 상기 제2 가닥의 5' 말단 뉴클레오타이드 잔기에 부착된 분리된 dsNA.
- 제37항에 있어서, 제1 가닥의 3' 말단 뉴클레오타이드 잔기 및 제2 가닥의 5' 말단 뉴클레오타이드 잔기를 부착시키는 뉴클레오타이드 서열이 테트라루프 및 헤어핀으로 이루어진 그룹으로부터 선택되는 구조물을 포함하는 분리된 dsNA.
- 제1항 내지 제36항 중 어느 한 항에 있어서, 제1 및 제2 가닥이 화학적 링커에 의해 연결된 분리된 dsNA.
- 제39항에 있어서, 제1 가닥의 3' 말단 및 제2 가닥의 5' 말단이 화학적 링커에 의해 연결된 분리된 dsNA.
- 제1항 내지 제40항 중 어느 한 항에 있어서, 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 제1 가닥의 24번 위치에서 3' 말단까지 하나 이상의 뉴클레오타이드 잔기가 비변형된 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제41항에 있어서, 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 제1 가닥의 24번 위치에서 3' 말단까지 하나 이상의 뉴클레오타이드 잔기 및 상기 제2 가닥의 데옥시리보뉴클레오타이드 둘다가 비변형된 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제42항 중 어느 한 항에 있어서, 제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기로 부터 개시하는 제2 올리고뉴클레오타이드 가닥이 번갈아 가면서 변형된 및 비변형된 뉴클레오타이드 잔기를 포함하는 분리된 dsNA.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 미스매치가 3번 내지 9번 위치로 이루어진 그룹으로부터 선택되는 위치에 존재하는 분리된 dsNA.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 미스매치가 1번 내지 7번 위치로 이루어진 그룹으로부터 선택되는 위치에 존재하는 분리된 dsNA.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 미스매치가 3번 내지 7번 위치로 이루어진 그룹으로부터 선택되는 위치에 존재하는 분리된 dsNA.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 미스매치가 6번 위치에 존재하는 분리된 dsNA.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제1 가닥의 1번 내지 9번 위치가 제2 가닥과 미스매치를 형성하는 2개 이상의 뉴클레오타이드를 포함하는 분리된 dsNA.
- 제4항 내지 제6항 중 어느 한 항에 있어서, 2번 및 6번 위치가 제2 가닥과 미스매치인 분리된 dsNA.
- 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택되는 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여, 제2 가닥의 5' 방향에서 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여, 제2 가닥의 5' 방향에서 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개의 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5'말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여, 제2 가닥의 5' 방향에서 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 제50항 내지 제52항 중 어느 한 항에 있어서, 제2 가닥의 3' 오버행의 뉴클레오타이드가 표적 RNA와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 dsNA.
- 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고, 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고, 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 하나 또는 2개의 미스매치 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 제54항 내지 제59항 중 어느 한 항에 있어서, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 2개 이상, 4개 이상, 6개 이상, 8개 이상, 10개 이상, 12개 이상, 14개 이상, 16개 이상, 18개 이상, 및 20개 이상의 뉴클레오타이드 잔기로 이루어진 그룹으로부터 선택되는 양이 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제60항에 있어서, 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 제2 가닥의 데옥시리보뉴클레오타이드가 연속 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제61항 중 어느 한 항에 있어서, 제2 가닥의 24번 내지 27번 위치의 2개 이상의 연속 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제62항 중 어느 한 항에 있어서, 제2 가닥의 24번 및 25번 위치 각각이 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제 54항 내지 제 63항 중 어느 한 항에 있어서, 제2 올리고뉴클레오타이드 가닥의 24번 내지 27번의 각각의 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제64항 중 어느 한 항에 있어서, 제2 가닥이 길이가 29개 내지 53개인 뉴클레오타이드인 분리된 dsNA.
- 제65항에 있어서, 제2 올리고뉴클레오타이드 가닥의 24번 내지 27번 위치의 각각의 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제64항 중 어느 한 항에 있어서, 제2 가닥이 길이가 31개 내지 53개인 뉴클레오타이드인 분리된 dsNA.
- 제65항 또는 제67항에 있어서, 제2 올리고뉴클레오타이드 가닥의 24번 내지 29번 위치의 각각의 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제64항 중 어느 한 항에 있어서, 제2 가닥이 길이가 33개 내지 53개인 뉴클레오타이드인 분리된 dsNA.
- 제67항 또는 제69항에 있어서, 제2 올리고뉴클레오타이드 가닥의 24번 내지 31번 위치의 각각의 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제64항 중 어느 한 항에 있어서, 제2 가닥은 길이가 35개 내지 53개인 뉴클레오타이드인 분리된 dsNA.
- 제69항 또는 제71항에 있어서, 제2 올리고뉴클레오타이드 가닥의 24번 내지 33번 위치의 각각의 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제64항 중 어느 한 항에 있어서, 제2 가닥이 길이가 37개 내지 53개인 뉴클레오타이드인 분리된 dsNA.
- 제71항 또는 제73항에 있어서, 제2 올리고뉴클레오타이드 가닥의 24번 내지 35번 위치의 각각의 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제64항 중 어느 한 항에 있어서, 제2 가닥이 길이가 39개 내지 53개인 뉴클레오타이드인 분리된 dsNA.
- 제73항 또는 제75항에 있어서, 제2 올리고뉴클레오타이드 가닥의 24번 내지 37번 위치의 각각의 뉴클레오타이드 잔기가 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제54항 내지 제76항 중 어느 한 항에 있어서, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기가 1 내지 25개의 데옥시리보뉴클레오타이드 잔기를 포함하고, 여기서 제2 가닥의 데옥시리보뉴클레오타이드 잔기 각각이 제1 가닥의 데옥시리보뉴클레오타이드 잔기와 염기쌍을 형성하는 분리된 dsNA.
- 제54항 내지 제77항 중 어느 한 항에 있어서, 제1 가닥의 최외곽 5' 다이서 절단 부위의 3'에 바로 인접하게 위치하는 제1 올리고뉴클레오타이드 가닥의 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하는 제2 가닥이 제2 가닥의 20번 위치 *에서 5' 말단 잔기까지의 모든 위치에서 비변형된 뉴클레오타이드 잔기를 포함하는 분리된 dsNA.
- 제54항 내지 제78항 중 어느 한 항에 있어서, 제2 가닥의 최외곽 3' 다이서 절단 부위의 5'에 바로 인접하게 위치하는 뉴클레오타이드(위치 A)로부터 개시하여, 제2 가닥의 5' 방향에서 상기 잔기로부터 위치 A, B 및 C가 변형된 뉴클레오타이드인 분리된 dsNA.
- 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제1 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 이중 가닥 핵산(dsNA). - 제57항 내지 제59항 및 제80항 중 어느 한 항에 있어서, 미스매치가 13번 내지 21번 위치로 이루어진 그룹으로부터 선택된 위치에 존재하는 분리된 dsNA.
- 제57항 내지 제59항 및 제80항 중 어느 한 항에 있어서, 미스매치가 14번 위치에 존재하는 분리된 dsNA.
- 제57항 내지 제59항 및 제80항 중 어느 한 항에 있어서, 제2 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여, 제2 가닥의 11번 내지 21번 위치가 제1 가닥과 미스매치를 형성하는 2개 이상의 뉴클레오타이드를 포함하는 분리된 dsNA.
- 제57항 내지 제59항 및 제80항 중 어느 한 항에 있어서, 14번 및 18번 위치가 제1 가닥과 미스매치인 분리된 dsNA.
- 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단을 형성하며 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평할 말단을 형성하고,
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고,
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여 제2 가닥의 5' 방향으로 1번 위치* 내지 9번 위치*는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PSNA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고, 포스포로티오에이트-변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여 제2 가닥의 5' 방향으로 1번 위치* 내지 9번 위치*는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PSNA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고;
제1 가닥의 5' 말단에서 제 1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치 *)로부터 개시하여 제2 가닥의 5' 방향으로 1번 위치* 내지 9번 위치*는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고,
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 28 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고,
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고,
제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 하나 이상은 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고, 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고,
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제2 가닥의 하나 이상의 뉴클레오타이드는 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지의 데옥시리보뉴클레오타이드와 염기쌍을 형성하고 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이루어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 가닥의 5' 말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 9번 위치는 제2 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제1 가닥은 길이가 27 내지 49개인 뉴클레오타이드 잔기이고, 여기서, 제1 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제1 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제1 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 5' 말단 및 제2 가닥의 3' 말단은 평활 말단 및 1 내지 4개 뉴클레오타이드 3' 오버행으로 이로어진 그룹으로부터 선택된 구조물을 형성하며;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고, 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제1 올리고뉴클레오타이드 가닥의 5' 말단 뉴클레오타이드 잔기에 상보적인 제2 가닥의 뉴클레오타이드 잔기(1번 위치*)로부터 개시하여, 제2 가닥의 5' 방향으로 1번 위치 * 내지 9번 위치 *는 표적 RNA의 서열과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제2 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 제85항 내지 제105항 중 어느 한 항에 있어서, 제1 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기중 2개 이상의 뉴클레오타이드 잔기가 제2 가닥의 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 PS-NA 잔기인 분리된 dsNA.
- 제106항에 있어서, 제1 가닥의 PS-NA 잔기가 제2 가닥의 PS-NA 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 분리된 dsNA.
- 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 갖는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고,
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고,
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고 상기 제2 가닥의 11번 내지 21번은 상기 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고; 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고,
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고,
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고, 제2 가닥의 11번 내지 21번은 상기 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고,
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 상기 제2 가닥의 11번 내지 21번은 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개의 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 53개인 뉴클레오타이드 잔기이고 제2 가닥의 1번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 23개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 1 내지 4개 뉴클레오타이드 3' 오버행을 형성하며;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고,
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고, 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제1 가닥의 3' 말단의 맨끝 및 맨끝에 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고, 제2 가닥의 11번 내지 21번 위치는 제1 가닥과 미스매치를 형성하는 뉴클레오타이드를 포함하고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 충분히 상보적이어서 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하고; 제1 가닥의 3' 말단의 맨끝 및 맨끝에서 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키는 분리된 이중 가닥 핵산(dsNA). - 5' 말단 및 3' 말단을 갖는 제1 올리고뉴클레오타이드 가닥 및 5' 말단 및 3' 말단을 갖는 제2 올리고뉴클레오타이드 가닥을 포함하는 분리된 이중 가닥 핵산(dsNA)으로서, 여기서,
제2 가닥은 길이가 27 내지 53개인 뉴클레오타이드 잔기이고, 여기서, 제2 가닥의 5'말단에서 제1 뉴클레오타이드(1번 위치)로부터 개시하여 제2 가닥의 1번 내지 23번은 리보뉴클레오타이드이고;
제1 가닥은 길이가 27개 내지 49개인 뉴클레오타이드 잔기이고 제2 가닥의 3번 내지 23번 위치의 리보뉴클레오타이드와 염기쌍을 형성하여 듀플렉스를 형성하는 21개 연속 리보뉴클레오타이드를 포함하고;
제1 가닥의 3' 말단 및 제2 가닥의 5' 말단은 평활 말단을 형성하며; 제1 가닥의 3' 말단의 맨끝 및 맨끝에 2번째 잔기 및 제2 가닥의 5' 말단의 맨끝 및 맨끝에서 2번째 잔기는 1개 또는 2개의 미스매치된 염기쌍을 형성하고;
제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기까지 중 하나 이상은 제1 가닥의 포스포로티오에이트 변형된 뉴클레오타이드(PS-NA)와 염기쌍을 형성하는 데옥시리보뉴클레오타이드이고;
제2 가닥은 19개 이상의 리보뉴클레오타이드의 제2 가닥 길이를 따라 표적 RNA와 충분히 상보적이어서 이중가닥 핵산이 포유동물 세포로 도입되는 경우 표적 유전자 발현을 감소시키고, 이때 제2 가닥의 11번 내지 21번 위치는 표적 RNA의 뉴클레오타이드와 미스매치를 형성하는 뉴클레오타이드를 포함하는 분리된 이중 가닥 핵산(dsNA). - 제108항 내지 제125항 중 어느 한 항에 있어서, 제2 가닥의 24번 위치에서 3' 말단 뉴클레오타이드 잔기 중 2개 이상의 뉴클레오타이드 잔기가 포스포로티오에이트 변혀된 뉴클레오타이드(PS-NA)인 분리된 dsNA.
- 제126항에 있어서, 제2 가닥의 PS-NA 잔기가 제1 가닥의 PS-NA 데옥시리보뉴클레오타이드와 염기쌍을 형성하는 분리된 dsNA.
- 제85항 내지 제127항 중 어느 한 항에 있어서, dsNA는 총 2개 이상, 3개 이상, 4개 이상, 5개 이상, 6개 이상, 7개 이상, 8개 이상, 9개 이상, 10개 이상, 11개 이상, 12개 이상, 13개 이상, 14개 이상 및 15개 이상으로 이루어진 그룹으로부터 선택되는 총수의 PS-NA 잔기를 포함하는 분리된 dsNA.
- 제1항 내지 제128항 중 어느 한 항에 있어서, 다이서에 의해 포유동물 세포에서 내생적으로 절단되는 분리된 dsNA.
- 제1항 내지 제129항 중 어느 한 항에 있어서, 포유동물 세포에서 내생적으로 절단되어 표적 유전자 발현을 감소시키는 길이가 19개 내지 23개인 이중 가닥 뉴클레오타이드 핵산이 생성되는 분리된 dsNA.
- 제1항 내지 제130항 중 어느 한 항에 있어서, 포스포네이트, 포스포로티오에이트 및 포스포트리에스테르로 구성된 그룹으로부터 선택되는 포스페이트 골격 변형을 포함하는 분리된 dsNA.
- 제1항 내지 제131항 중 어느 한 항에 있어서, 시험관내 포유동물 세포에서 표적 유전자 발현을 10% 이상, 50% 이상, 및 80-90% 이상으로 이루어진 그룹으로부터 선택되는 양(%로 표현됨) 까지 감소시키는 분리된 dsNA.
- 제1항 내지 제132항 중 어느 한 항에 있어서, 포유동물 세포로 도입되는 경우 데옥시리보뉴클레오타이드-데옥시리보뉴클레오타이드 염기쌍을 갖지 않는 참조 dsRNA와 비교하여 표적 유전자 발현을 감소시키는 분리된 dsNA.
- 제1항 내지 제133항 중 어느 한 항에 있어서, 포유동물 세포로 도입될 때, 1 nM 이하, 200 pM 이하, 100 pM 이하, 50 pM 이하, 20 pM 이하, 10 pM 이하, 5 pM 이하, 및 1 pM 이하로 이루어진 그룹으로부터 선택되는 농도에서 세포로 전달되는 경우 70% 이상까지 표적 유전자 발현을 감소시키는 분리된 dsNA.
- 제1항 내지 제134항 중 어느 한 항에 있어서, dsNA의 리보뉴클레오타이드 잔기의 50% 이상이 변형되지 않은 리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제135항 중 어느 한 항에 있어서, 제2 가닥의 리보뉴클레오타이드 잔기의 50% 이상이 변형되지 않는 리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제136항 중 어느 한 항에 있어서, dsNA의 모든 데옥시리보뉴클레오타이드 50% 이상이 변형되지 않은 데옥시리보뉴클레오타이드인 분리된 dsNA.
- 제1항 내지 제137항 중 어느 한 항에 있어서, 제1 가닥이 제2 가닥의 뉴클레오타이드 서열과 80%, 90%, 95% 또는 100% 이상 상보적인 뉴클레오타이드 서열을 갖는 분리된 dsNA.
- 제1항 내지 제138항 중 어느 한 항에 있어서, 표적 RNA가 KRAS인 분리된 dsNA.
- 참조 dsRNA와 대비하여 세포에서 표적 유전자의 발현을 감소시키는 유효량으로 제1항 내지 제139항 중 어느 한 항에 따른 분리된 이중 가닥 NA(dsNA)와 세포를 접촉시킴을 포함하는, 세포에서 표적 유전자의 발현을 감소시키는 방법.
- 참조 dsRNA와 대비하여 동물의 세포에서 표적 유전자의 발현을 감소시키는 유효량으로 제1항 내지 제139항 중 어느 한 항에 따른 분리된 이중 가닥 NA(dsNA)으로 동물을 치료하는 것을 포함하는, 동물에서 표적 유전자의 발현을 감소시키는 방법.
- 제141항에 있어서, dsNA가 적당한 대조군 DsiRNA와 비교하여 증진된 약력학, 증진된 약동력학, 감소된 독성 및 증진된 세포내 흡수로 이루어진 그룹으로부터 선택된 속성을 갖는 방법.
- 참조 dsRNA와 대비하여 세포에서 표적 유전자의 발현을 감소시키는 유효량으로 존재하는, 제1항 내지 제139항 중 어느 한 항에 따른 분리된 이중 가닥 NA(dsNA)를 포함하고 추가로 약제학적으로 허용되는 담체를 포함하는, 피검체의 세포에서 표적 유전자의 발현을 감소시키기 위한 약제학적 조성물.
- 화학적으로 또는 효소적으로 dsRNA를 합성함을 포함하는, 제1항 내지 제139항 중 어느 한 항에 따른 이중 가닥 NA(dsNA)을 합성하는 방법.
- 제1항 내지 제139항 중 어느 한 항에 따른 dsNA 및 이의 사용 지침서를 포함하는 키트.
- 도 30 내지 43C 중 어느 하나에 나타낸 분리된 이중 가닥 핵산(dsNA).
Applications Claiming Priority (28)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13894608P | 2008-12-18 | 2008-12-18 | |
| US61/138,946 | 2008-12-18 | ||
| US16622709P | 2009-04-02 | 2009-04-02 | |
| US61/166,227 | 2009-04-02 | ||
| US17352509P | 2009-04-28 | 2009-04-28 | |
| US17355809P | 2009-04-28 | 2009-04-28 | |
| US17355609P | 2009-04-28 | 2009-04-28 | |
| US17353209P | 2009-04-28 | 2009-04-28 | |
| US17350509P | 2009-04-28 | 2009-04-28 | |
| US17354409P | 2009-04-28 | 2009-04-28 | |
| US17352109P | 2009-04-28 | 2009-04-28 | |
| US17353809P | 2009-04-28 | 2009-04-28 | |
| US17351409P | 2009-04-28 | 2009-04-28 | |
| US17356309P | 2009-04-28 | 2009-04-28 | |
| US17355409P | 2009-04-28 | 2009-04-28 | |
| US17354909P | 2009-04-28 | 2009-04-28 | |
| US61/173,554 | 2009-04-28 | ||
| US61/173,514 | 2009-04-28 | ||
| US61/173,549 | 2009-04-28 | ||
| US61/173,505 | 2009-04-28 | ||
| US61/173,521 | 2009-04-28 | ||
| US61/173,558 | 2009-04-28 | ||
| US61/173,544 | 2009-04-28 | ||
| US61/173,532 | 2009-04-28 | ||
| US61/173,556 | 2009-04-28 | ||
| US61/173,525 | 2009-04-28 | ||
| US61/173,563 | 2009-04-28 | ||
| US61/173,538 | 2009-04-28 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167026999A Division KR101728655B1 (ko) | 2008-12-18 | 2009-12-18 | 유전자 발현의 특이적 억제를 위한 연장된 다이서 기질 제제 및 방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110110776A true KR20110110776A (ko) | 2011-10-07 |
Family
ID=42312114
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167026999A KR101728655B1 (ko) | 2008-12-18 | 2009-12-18 | 유전자 발현의 특이적 억제를 위한 연장된 다이서 기질 제제 및 방법 |
| KR1020117016689A KR20110110776A (ko) | 2008-12-18 | 2009-12-18 | 유전자 발현의 특이적 억제를 위한 연장된 다이서 기질 제제 및 방법 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167026999A KR101728655B1 (ko) | 2008-12-18 | 2009-12-18 | 유전자 발현의 특이적 억제를 위한 연장된 다이서 기질 제제 및 방법 |
Country Status (8)
| Country | Link |
|---|---|
| US (4) | US8513207B2 (ko) |
| EP (1) | EP2379083B1 (ko) |
| JP (2) | JP5855463B2 (ko) |
| KR (2) | KR101728655B1 (ko) |
| CN (2) | CN105907756A (ko) |
| AU (1) | AU2009336191B2 (ko) |
| CA (2) | CA3151965A1 (ko) |
| WO (1) | WO2010080129A2 (ko) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016006846A1 (ko) * | 2014-07-09 | 2016-01-14 | 서울대학교산학협력단 | 목적 유전자의 발현 억제 특이성이 증가된 siRNA 분자 |
| KR102379204B1 (ko) * | 2020-12-18 | 2022-03-24 | 이화여자대학교 산학협력단 | 유전자 침묵 활성이 증가된 핵산 분자 및 이의 이용 |
| WO2023219479A1 (ko) * | 2022-05-13 | 2023-11-16 | 서울대학교산학협력단 | Dicer에 의한 dsrna 가공의 서열 결정 인자 |
Families Citing this family (128)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9181551B2 (en) | 2002-02-20 | 2015-11-10 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| US9657294B2 (en) | 2002-02-20 | 2017-05-23 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| EP2265291B1 (en) * | 2008-03-17 | 2016-10-19 | The Board of Regents of The University of Texas System | Identification of micro-rnas involved in neuromuscular synapse maintenance and regeneration |
| US11408003B2 (en) | 2008-12-18 | 2022-08-09 | Dicerna Pharmaceuticals, Inc. | Extended dicer substrate agents and methods for the specific inhibition of gene expression |
| WO2010080129A2 (en) | 2008-12-18 | 2010-07-15 | Dicerna Pharmaceuticals, Inc. | Extended dicer substrate agents and methods for the specific inhibition of gene expression |
| WO2010093788A2 (en) | 2009-02-11 | 2010-08-19 | Dicerna Pharmaceuticals, Inc. | Multiplex dicer substrate rna interference molecules having joining sequences |
| JP5257796B2 (ja) * | 2009-12-28 | 2013-08-07 | 株式会社村田製作所 | 固体電解コンデンサ素子及びその製造方法 |
| US9045751B2 (en) * | 2010-04-28 | 2015-06-02 | The Regents Of The University Of California | Modified small activating RNA molecules and methods of use |
| EP3766975A1 (en) | 2010-10-29 | 2021-01-20 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of gene expression using short interfering nucleic acid (sina) |
| AU2012325997C1 (en) | 2011-10-18 | 2018-07-05 | Dicerna Pharmaceuticals, Inc. | Amine cationic lipids and uses thereof |
| CA2878314A1 (en) * | 2012-07-16 | 2014-01-23 | Kyowa Hakko Kirin Co., Ltd. | Rnai pharmaceutical composition for suppressing expression of kras gene |
| SG11201506805QA (en) | 2013-02-28 | 2015-09-29 | Arrowhead Res Corp | Organic compositions to treat epas1-related diseases |
| KR102310921B1 (ko) | 2013-03-14 | 2021-10-13 | 다이서나 파마수이티컬, 인크. | 음이온성 약제를 제형화하는 방법 |
| PT2999785T (pt) * | 2013-05-22 | 2018-07-09 | Alnylam Pharmaceuticals Inc | Composições de irna de serpina1 e métodos de uso das mesmas |
| JP2016528887A (ja) | 2013-07-03 | 2016-09-23 | ダイセルナ ファーマシューティカルズ, インコーポレイテッドDicerna Pharmaceuticals, Inc. | 二本鎖RNAによるα−1アンチトリプシンの特異的阻害のための方法及び組成物 |
| CA2919088A1 (en) | 2013-08-07 | 2015-02-12 | Arrowhead Research Corporation | Polyconjugates for delivery of rnai triggers to tumor cells in vivo |
| US10150965B2 (en) | 2013-12-06 | 2018-12-11 | Dicerna Pharmaceuticals, Inc. | Methods and compositions for the specific inhibition of transthyretin (TTR) by double-stranded RNA |
| RS61892B1 (sr) | 2013-12-27 | 2021-06-30 | Dicerna Pharmaceuticals Inc | Postupci i kompozicije za specifičnu inhibiciju glikolat oksidaze (hao1) pomoću dvolančane rnk |
| CA2952121A1 (en) | 2014-06-13 | 2015-12-17 | Childrens' Medical Center Corporation | Products and methods to isolate mitochondria |
| TW201620526A (zh) | 2014-06-17 | 2016-06-16 | 愛羅海德研究公司 | 用於抑制α-1抗胰蛋白酶基因表現之組合物及方法 |
| WO2016057932A1 (en) | 2014-10-10 | 2016-04-14 | Dicerna Pharmaceuticals, Inc. | Therapeutic inhibition of lactate dehydrogenase and agents therefor |
| WO2016094845A2 (en) | 2014-12-12 | 2016-06-16 | Woolf Tod M | Compositions and methods for editing nucleic acids in cells utilizing oligonucleotides |
| JP7105065B2 (ja) * | 2014-12-15 | 2022-07-22 | ダイセルナ ファーマシューティカルズ, インコーポレイテッド | リガンド修飾二本鎖核酸 |
| US10036017B2 (en) | 2015-02-17 | 2018-07-31 | Dicerna Pharmaceuticals, Inc. | Methods and compositions for the specific inhibition of complement component 5(C5) by double-stranded RNA |
| US9803201B2 (en) | 2015-03-17 | 2017-10-31 | Arrowhead Pharmaceuticals, Inc. | Disulfide-containing alkyne linking agents |
| MX2017011422A (es) | 2015-03-17 | 2017-11-10 | Arrowhead Pharmaceuticals Inc | Composiciones y metodos para inhibir la expresion del gen del factor xii. |
| US10689647B2 (en) | 2015-05-08 | 2020-06-23 | Dicerna Pharmaceuticals, Inc. | Methods and compositions for the specific inhibition of antithrombin 3 (AT3) by double-stranded RNA |
| TWI761305B (zh) | 2015-05-29 | 2022-04-21 | 美商愛羅海德製藥公司 | 抑制Hif2α基因表現之組合物及方法 |
| CN107614002B (zh) | 2015-05-29 | 2022-01-04 | 箭头药业股份有限公司 | 生物学可切割四肽连接剂 |
| CA2991639A1 (en) | 2015-08-07 | 2017-02-16 | Arrowhead Pharmaceuticals, Inc. | Rnai therapy for hepatitis b virus infection |
| JOP20210043A1 (ar) | 2015-10-01 | 2017-06-16 | Arrowhead Pharmaceuticals Inc | تراكيب وأساليب لتثبيط تعبير جيني للـ lpa |
| JPWO2017068791A1 (ja) * | 2015-10-23 | 2018-08-09 | レナセラピューティクス株式会社 | 少なくとも1つのバルジ構造を有する核酸複合体 |
| JP6593106B2 (ja) * | 2015-10-29 | 2019-10-23 | サミー株式会社 | ぱちんこ遊技機 |
| WO2017095940A1 (en) | 2015-11-30 | 2017-06-08 | Flagship Pioneering, Inc. | Methods and compositions relating to chondrisomes from cultured cells |
| JP6872560B2 (ja) | 2016-05-06 | 2021-05-19 | エム. ウルフ、トッド | プログラム可能ヌクレアーゼのあるゲノム編集及びプログラム可能ヌクレアーゼのないゲノム編集のための改善された方法 |
| CN109312403B (zh) | 2016-06-17 | 2023-06-27 | 豪夫迈·罗氏有限公司 | 体外肾毒性筛选测定法 |
| US11105794B2 (en) | 2016-06-17 | 2021-08-31 | Hoffmann-La Roche Inc. | In vitro nephrotoxicity screening assay |
| MA45496A (fr) | 2016-06-17 | 2019-04-24 | Hoffmann La Roche | Molécules d'acide nucléique pour la réduction de l'arnm de padd5 ou pad7 pour le traitement d'une infection par l'hépatite b |
| CN107630015B (zh) | 2016-07-19 | 2021-03-09 | 上海市东方医院 | 一种稳定的dna-rna双链结构 |
| JOP20170161A1 (ar) | 2016-08-04 | 2019-01-30 | Arrowhead Pharmaceuticals Inc | عوامل RNAi للعدوى بفيروس التهاب الكبد ب |
| CA3034369A1 (en) | 2016-08-19 | 2018-02-22 | Whitehead Institute For Biomedical Research | Methods of editing dna methylation |
| EP4101859A1 (en) | 2016-09-02 | 2022-12-14 | Dicerna Pharmaceuticals, Inc. | 4'-oxymethylphosphonate nucleotide analogs and oligonucleotides comprising the same |
| CN109890962A (zh) | 2016-09-07 | 2019-06-14 | 旗舰创业股份有限公司 | 用于调节基因表达的方法和组合物 |
| TWI788312B (zh) | 2016-11-23 | 2023-01-01 | 美商阿尼拉製藥公司 | 絲胺酸蛋白酶抑制因子A1 iRNA組成物及其使用方法 |
| JP2019535839A (ja) | 2016-11-29 | 2019-12-12 | ピュアテック ヘルス エルエルシー | 治療剤の送達のためのエクソソーム |
| WO2018129544A1 (en) | 2017-01-09 | 2018-07-12 | Whitehead Institute For Biomedical Research | Methods of altering gene expression by perturbing transcription factor multimers that structure regulatory loops |
| IL267959B2 (en) | 2017-01-10 | 2024-07-01 | Arrowhead Pharmaceuticals Inc | Alpha-1 antitrypsin (AAT) RNAi agents, preparations containing AAT RNAi agents and their uses |
| EP3638797A1 (en) | 2017-06-13 | 2020-04-22 | Flagship Pioneering Innovations V, Inc. | Compositions comprising curons and uses thereof |
| JP7208911B2 (ja) | 2017-10-11 | 2023-01-19 | 日東電工株式会社 | 核酸分子発現の調節 |
| UA126931C2 (uk) | 2017-10-16 | 2023-02-22 | Ф. Хоффманн-Ля Рош Аг | МОЛЕКУЛИ НУКЛЕЇНОВИХ КИСЛОТ ДЛЯ ЗМЕНШЕННЯ РІВНЯ мРНК PAPD5 І PAPD7 ДЛЯ ЛІКУВАННЯ ІНФЕКЦІЙНОГО ГЕПАТИТУ B |
| EP3672980A4 (en) * | 2017-10-18 | 2021-06-16 | Dicerna Pharmaceuticals, Inc. | BETA-CATENIN NUCLEIC ACID INHIBITOR MOLECULE |
| IL282881B1 (en) | 2017-10-20 | 2024-06-01 | Dicerna Pharmaceuticals Inc | Methods for treating hepatitis B infection |
| CN108197432B (zh) * | 2017-11-29 | 2021-04-02 | 东北电力大学 | 一种基于基因表达数据的基因调控网络重构方法 |
| JP2021508490A (ja) | 2017-12-15 | 2021-03-11 | フラッグシップ パイオニアリング イノベーションズ シックス,エルエルシー | 環状ポリリボヌクレオチドを含む組成物及びその使用 |
| MX2020007066A (es) | 2018-01-05 | 2020-09-09 | Dicerna Pharmaceuticals Inc | Reduccion de la expresion de beta-catenina e ido para potenciar la inmunoterapia. |
| AU2019209324A1 (en) | 2018-01-16 | 2020-07-09 | Dicerna Pharmaceuticals, Inc. | Compositions and methods for inhibiting ALDH2 expression |
| PE20211197A1 (es) | 2018-02-09 | 2021-07-01 | Genentech Inc | Oligonucleotidos para modular la expresion de tmem106b |
| CA3097544A1 (en) | 2018-04-05 | 2019-10-10 | F. Hoffmann-La Roche Ag | Use of fubp1 inhibitors for treating hepatitis b virus infection |
| CN111971051A (zh) * | 2018-04-13 | 2020-11-20 | 迪克纳制药公司 | 用增加tm的核苷酸修饰的双链核酸抑制剂分子 |
| JP2021522808A (ja) | 2018-05-07 | 2021-09-02 | ロシュ イノベーション センター コペンハーゲン エーエス | オリゴヌクレオチド治療剤の超並列発見方法 |
| MX2020013366A (es) | 2018-07-03 | 2021-03-09 | Hoffmann La Roche | Oligonucleotidos para modular la expresion de tau. |
| BR112021000538A2 (pt) | 2018-07-13 | 2021-04-06 | F. Hoffmann-La Roche Ag | Oligonucleotídeos para modular a expressão de rtel1 |
| CN113365607A (zh) | 2019-01-25 | 2021-09-07 | 豪夫迈·罗氏有限公司 | 用于口服药物递送的脂质囊泡 |
| CA3128059A1 (en) | 2019-02-12 | 2020-08-20 | Dicerna Pharmaceuticals, Inc. | Methods and compositions for inhibiting expression of cyp27a1 |
| BR112021018739A2 (pt) | 2019-03-29 | 2022-05-03 | Dicerna Pharmaceuticals Inc | Composições e métodos para o tratamento de doenças ou distúrbios associados a kras |
| MX2021012126A (es) | 2019-04-04 | 2022-01-06 | Dicerna Pharmaceuticals Inc | Composiciones y métodos para inhibir la expresión génica en el sistema nervioso central. |
| MX2021013418A (es) | 2019-05-03 | 2021-12-10 | Dicerna Pharmaceuticals Inc | Moleculas inhibidoras de acido nucleico bicatenario con cadenas de sentido acortadas. |
| CN110540992B (zh) * | 2019-08-21 | 2021-02-09 | 武汉泽智生物医药有限公司 | 增强靶基因沉默效率的siRNA分子及其应用 |
| CN114729376A (zh) | 2019-09-23 | 2022-07-08 | 欧米茄治疗公司 | 用于调节肝细胞核因子4α(HNF4α)基因表达的组合物和方法 |
| WO2021061707A1 (en) | 2019-09-23 | 2021-04-01 | Omega Therapeutics, Inc. | Compositions and methods for modulating apolipoprotein b (apob) gene expression |
| WO2021067744A1 (en) | 2019-10-02 | 2021-04-08 | Dicerna Pharmaceuticals, Inc. | Chemical modifications of small interfering rna with minimal fluorine content |
| TW202132567A (zh) | 2019-11-01 | 2021-09-01 | 美商阿尼拉製藥公司 | 亨汀頓蛋白(HTT)iRNA劑組成物及其使用方法 |
| TW202140509A (zh) | 2019-12-13 | 2021-11-01 | 美商阿尼拉製藥公司 | 人類染色體9開讀框72(C9ORF72)iRNA劑組成物及其使用方法 |
| CN112980840A (zh) * | 2019-12-17 | 2021-06-18 | 南京大学 | 用于癌症治疗的多靶向siRNA |
| WO2021122921A1 (en) | 2019-12-19 | 2021-06-24 | F. Hoffmann-La Roche Ag | Use of cops3 inhibitors for treating hepatitis b virus infection |
| CN114829599A (zh) | 2019-12-19 | 2022-07-29 | 豪夫迈·罗氏有限公司 | Scamp3抑制剂用于治疗乙型肝炎病毒感染的用途 |
| JP2023506550A (ja) | 2019-12-19 | 2023-02-16 | エフ. ホフマン-ラ ロシュ エージー. | B型肝炎ウイルス感染症を処置するためのsbds阻害剤の使用 |
| CN114901821A (zh) | 2019-12-19 | 2022-08-12 | 豪夫迈·罗氏有限公司 | Sept9抑制剂用于治疗乙型肝炎病毒感染的用途 |
| WO2021122993A1 (en) | 2019-12-19 | 2021-06-24 | F. Hoffmann-La Roche Ag | Use of saraf inhibitors for treating hepatitis b virus infection |
| JP2023509872A (ja) | 2019-12-24 | 2023-03-10 | エフ. ホフマン-ラ ロシュ アーゲー | Hbvを標的とする抗ウイルス剤及び/又はhbvの処置のための免疫調節剤の医薬組合せ |
| TW202137987A (zh) | 2019-12-24 | 2021-10-16 | 瑞士商赫孚孟拉羅股份公司 | 用於治療hbv之靶向hbv的治療性寡核苷酸及tlr7促效劑之醫藥組合 |
| TW202140043A (zh) | 2020-01-15 | 2021-11-01 | 美商戴瑟納製藥股份有限公司 | 4’-o-亞甲基膦酸酯核酸及其類似物 |
| EP4096682A1 (en) | 2020-01-29 | 2022-12-07 | Flagship Pioneering Innovations VI, LLC | Compositions for translation and methods of use thereof |
| CA3173528A1 (en) | 2020-03-11 | 2021-09-16 | Omega Therapeutics, Inc. | Compositions and methods for modulating forkhead box p3 (foxp3) gene expression |
| BR112022018667A2 (pt) | 2020-03-18 | 2022-11-29 | Dicerna Pharmaceuticals Inc | Composições e métodos para inibir a expressão de ang-ptl3 |
| WO2021231204A1 (en) | 2020-05-11 | 2021-11-18 | Genentech, Inc. | Complement component 4 inhibitors for treating neurological diseases, and related compositons, systems and methods of using same |
| CN115605592A (zh) | 2020-05-11 | 2023-01-13 | 基因泰克公司(Us) | 用于治疗神经系统疾病的补体组分c1r抑制剂以及相关的组合物、系统和使用它们的方法 |
| WO2021231211A1 (en) | 2020-05-11 | 2021-11-18 | Genentech, Inc. | Complement component c1s inhibitors for treating a neurological disease, and related compositions, systems and methods of using same |
| TW202221120A (zh) | 2020-08-04 | 2022-06-01 | 美商黛瑟納製藥公司 | 用於治療代謝症候群之組成物及方法 |
| WO2022031433A1 (en) | 2020-08-04 | 2022-02-10 | Dicerna Pharmaceuticals, Inc. | Systemic delivery of oligonucleotides |
| JP2023538284A (ja) | 2020-08-04 | 2023-09-07 | ダイセルナ ファーマシューティカルズ, インコーポレイテッド | Plp1発現を阻害するための組成物及び方法 |
| KR20230043912A (ko) | 2020-08-05 | 2023-03-31 | 다이서나 파마수이티컬, 인크. | Lpa 발현을 저해하기 위한 조성물 및 방법 |
| IL300340A (en) | 2020-08-05 | 2023-04-01 | Hoffmann La Roche | Treatment with oligonucleotides in hepatitis B patients |
| EP4200419A2 (en) | 2020-08-21 | 2023-06-28 | F. Hoffmann-La Roche AG | Use of a1cf inhibitors for treating hepatitis b virus infection |
| IL303892A (en) | 2020-12-23 | 2023-08-01 | Flagship Pioneering Innovations V Inc | In vitro assembly of RNA-encapsulating enalavirus capsids |
| KR20230146048A (ko) | 2021-02-12 | 2023-10-18 | 알닐람 파마슈티칼스 인코포레이티드 | 슈퍼옥사이드 디스뮤타제 1(sod1) irna 조성물 및 슈퍼옥사이드 디스뮤타제 1- (sod1-) 관련 신경퇴행성 질환을 치료하거나 예방하기 위한 이의 사용 방법 |
| WO2022182864A1 (en) | 2021-02-25 | 2022-09-01 | Alnylam Pharmaceuticals, Inc. | Prion protein (prnp) irna compositions and methods and methods of use thereof |
| EP4305169A1 (en) | 2021-03-12 | 2024-01-17 | Alnylam Pharmaceuticals, Inc. | Glycogen synthase kinase 3 alpha (gsk3a) irna compositions and methods of use thereof |
| MX2023011466A (es) | 2021-03-29 | 2024-02-01 | Alnylam Pharmaceuticals Inc | Composiciones de agentes de ácido ribonucleico de interferencia (arni) de huntingtina (htt) y métodos de uso de estas. |
| WO2022218941A2 (en) | 2021-04-12 | 2022-10-20 | Boehringer Ingelheim International Gmbh | Compositions and methods for inhibiting ketohexokinase (khk) |
| CA3216732A1 (en) * | 2021-04-13 | 2022-10-20 | Adarx Pharmaceuticals, Inc. | Rna silencing agents and methods of use |
| KR20230171431A (ko) | 2021-04-14 | 2023-12-20 | 다이서나 파마수이티컬, 인크. | Pnpla3 발현을 조절하기 위한 조성물 및 방법 |
| WO2022223515A2 (en) | 2021-04-19 | 2022-10-27 | Novo Nordisk A/S | Compositions and methods for inhibiting nuclear receptor subfamily 1 group h member 3 (nr1h3) expression |
| MX2023013504A (es) | 2021-05-28 | 2024-02-23 | Novo Nordisk As | Composiciones y métodos para inhibir la expresión del componente 1 de reducción de amidoxima mitocondrial (marc1). |
| WO2022256351A1 (en) * | 2021-05-29 | 2022-12-08 | 1Globe Health Institute Llc | Asymmetric short duplex dna as a novel gene silencing technology and use thereof |
| KR20240017911A (ko) | 2021-06-04 | 2024-02-08 | 알닐람 파마슈티칼스 인코포레이티드 | 인간 염색체 9 개방 해독 프레임 72(C9orf72) iRNA 제제 조성물 및 이의 사용 방법 |
| WO2023283359A2 (en) | 2021-07-07 | 2023-01-12 | Omega Therapeutics, Inc. | Compositions and methods for modulating secreted frizzled receptor protein 1 (sfrp1) gene expression |
| WO2023027759A1 (en) | 2021-08-25 | 2023-03-02 | Dicerna Pharmaceuticals, Inc. | Compositions and methods for inhibiting αlpha-1 antitrypsin expression |
| KR20240090727A (ko) | 2021-10-22 | 2024-06-21 | 세일 바이오메디슨스, 인크. | Mrna 백신 조성물 |
| EP4423272A2 (en) | 2021-10-29 | 2024-09-04 | Alnylam Pharmaceuticals, Inc. | Huntingtin (htt) irna agent compositions and methods of use thereof |
| IL312635A (en) | 2021-11-11 | 2024-07-01 | Hoffmann La Roche | Pharmaceutical combinations for the treatment of HBV |
| WO2023096858A1 (en) | 2021-11-23 | 2023-06-01 | Senda Biosciences, Inc. | A bacteria-derived lipid composition and use thereof |
| AU2022402155A1 (en) | 2021-12-01 | 2024-05-09 | Dicerna Pharmaceuticals, Inc. | Compositions and methods for modulating apoc3 expression |
| WO2023111210A1 (en) | 2021-12-17 | 2023-06-22 | F. Hoffmann-La Roche Ag | Combination of oligonucleotides for modulating rtel1 and fubp1 |
| WO2023122080A1 (en) | 2021-12-20 | 2023-06-29 | Senda Biosciences, Inc. | Compositions comprising mrna and lipid reconstructed plant messenger packs |
| WO2023141314A2 (en) | 2022-01-24 | 2023-07-27 | Alnylam Pharmaceuticals, Inc. | Heparin sulfate biosynthesis pathway enzyme irna agent compositions and methods of use thereof |
| WO2023177866A1 (en) | 2022-03-18 | 2023-09-21 | Dicerna Pharmaceuticals, Inc. | Decarboxylative acetoxylation using mn(ii) or mn(iii) reagent for synthesis of 4'-acetoxy- nucleoside and use thereof for synthesis of corresponding 4'-(dimethoxyphosphoryl)methoxy- nucleotide |
| US20230374522A1 (en) | 2022-04-15 | 2023-11-23 | Dicerna Pharmaceuticals, Inc. | Compositions and methods for modulating scap activity |
| AR129311A1 (es) | 2022-05-12 | 2024-08-14 | Dicerna Pharmaceuticals Inc | Composiciones y métodos para inhibir la expresión de mapt |
| US20230416743A1 (en) | 2022-05-13 | 2023-12-28 | Dicerna Pharmaceuticals, Inc. | Compositions and methods for inhibiting snca expression |
| WO2023220729A2 (en) | 2022-05-13 | 2023-11-16 | Flagship Pioneering Innovations Vii, Llc | Double stranded dna compositions and related methods |
| TW202400193A (zh) | 2022-06-24 | 2024-01-01 | 丹麥商諾佛 儂迪克股份有限公司 | 抑制跨膜絲胺酸蛋白酶6(tmprss6)表現的組成物及方法 |
| WO2024040041A1 (en) | 2022-08-15 | 2024-02-22 | Dicerna Pharmaceuticals, Inc. | Regulation of activity of rnai molecules |
| WO2024102434A1 (en) | 2022-11-10 | 2024-05-16 | Senda Biosciences, Inc. | Rna compositions comprising lipid nanoparticles or lipid reconstructed natural messenger packs |
| WO2024107993A1 (en) | 2022-11-16 | 2024-05-23 | Dicerna Pharmaceuticals, Inc. | Stat3 targeting oligonucleotides and uses thereof |
| WO2024159172A1 (en) | 2023-01-27 | 2024-08-02 | Senda Biosciences, Inc. | A modified lipid composition and uses thereof |
| US20240285805A1 (en) | 2023-02-17 | 2024-08-29 | Flagship Pioneering Innovations Vii, Llc | Dna compositions comprising modified uracil |
| US20240293582A1 (en) | 2023-02-17 | 2024-09-05 | Flagship Pioneering Innovations Vii, Llc | Dna compositions comprising modified cytosine |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5864026A (en) * | 1990-06-11 | 1999-01-26 | Nexstar Pharmaceuticals, Inc. | Systematic evolution of ligands by exponential enrichment: tissue selex |
| WO1995000657A1 (en) | 1993-06-21 | 1995-01-05 | The Uab Research Foundation | Anti-sickling hemoglobin |
| US20040142895A1 (en) * | 1995-10-26 | 2004-07-22 | Sirna Therapeutics, Inc. | Nucleic acid-based modulation of gene expression in the vascular endothelial growth factor pathway |
| US6506559B1 (en) * | 1997-12-23 | 2003-01-14 | Carnegie Institute Of Washington | Genetic inhibition by double-stranded RNA |
| WO2002081628A2 (en) * | 2001-04-05 | 2002-10-17 | Ribozyme Pharmaceuticals, Incorporated | Modulation of gene expression associated with inflammation proliferation and neurite outgrowth, using nucleic acid based technologies |
| US20050282188A1 (en) * | 2001-05-18 | 2005-12-22 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using short interfering nucleic acid (siNA) |
| US20050148530A1 (en) * | 2002-02-20 | 2005-07-07 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of vascular endothelial growth factor and vascular endothelial growth factor receptor gene expression using short interfering nucleic acid (siNA) |
| WO2003006477A1 (en) * | 2001-07-12 | 2003-01-23 | University Of Massachusetts | IN VIVO PRODUCTION OF SMALL INTERFERING RNAs THAT MEDIATE GENE SILENCING |
| US20040014956A1 (en) * | 2002-02-01 | 2004-01-22 | Sequitur, Inc. | Double-stranded oligonucleotides |
| US7935812B2 (en) * | 2002-02-20 | 2011-05-03 | Merck Sharp & Dohme Corp. | RNA interference mediated inhibition of hepatitis C virus (HCV) expression using short interfering nucleic acid (siNA) |
| AU2003283951A1 (en) * | 2002-05-23 | 2004-03-03 | Ceptyr, Inc. | Modulation of biological signal transduction by rna interference |
| TR201708347T4 (tr) * | 2002-08-05 | 2019-02-21 | Silence Therapeutics Gmbh | Müdahaleci rna moleküllerinin diğer yeni biçimleri. |
| US7892793B2 (en) * | 2002-11-04 | 2011-02-22 | University Of Massachusetts | Allele-specific RNA interference |
| DK2284266T3 (da) * | 2002-11-14 | 2014-01-13 | Thermo Fisher Scient Biosciences Inc | sIRNA-MOLEKYLE MOD TP53 |
| US20070265220A1 (en) | 2004-03-15 | 2007-11-15 | City Of Hope | Methods and compositions for the specific inhibition of gene expression by double-stranded RNA |
| AU2005222965B8 (en) * | 2004-03-15 | 2010-07-01 | City Of Hope | Methods and compositions for the specific inhibition of gene expression by double-stranded RNA |
| US20090170794A1 (en) * | 2004-09-10 | 2009-07-02 | Somagenics Inc. | Small interfering rnas that efficiently inhibit viral expression and methods of use thereof |
| US20060223777A1 (en) * | 2005-03-29 | 2006-10-05 | Dharmacon, Inc. | Highly functional short hairpin RNA |
| EP1891216B1 (en) * | 2005-05-25 | 2012-02-22 | The University Of York | Hybrid interfering rna |
| CN101305095B (zh) * | 2005-09-12 | 2012-09-26 | 索马根尼科斯公司 | 利用小干扰rna抑制病毒基因表达 |
| WO2007038788A2 (en) | 2005-09-29 | 2007-04-05 | The Cleveland Clinic Foundation | Small interfering rnas as non-specific drugs |
| EP1943265B1 (en) * | 2005-10-01 | 2012-09-12 | Charles Stout | Regulatable fusion promoters |
| JP2009514877A (ja) * | 2005-11-04 | 2009-04-09 | エムディーアールエヌエー,インコーポレイテッド | siRNAの送達媒体としてのペプチド−ダイザ基質RNA抱合体 |
| AU2007286059A1 (en) * | 2006-08-18 | 2008-02-21 | Mdrna, Inc. | Dicer substrate RNA peptide conjugates and methods for RNA therapeutics |
| JP5876637B2 (ja) * | 2006-10-18 | 2016-03-02 | マリーナ バイオテック,インコーポレイテッド | ニックまたはギャップの入った核酸分子およびそれらの使用 |
| EP2137205A2 (en) * | 2007-02-26 | 2009-12-30 | Quark Pharmaceuticals, Inc. | Inhibitors of rtp801 and their use in disease treatment |
| US20090082217A1 (en) * | 2007-07-16 | 2009-03-26 | California Institute Of Technology | Selection of nucleic acid-based sensor domains within nucleic acid switch platform |
| US20110288147A1 (en) | 2008-09-22 | 2011-11-24 | Bob Dale Brown | Compositions and methods for the specific inhibition of gene expression by DSRNA containing a tetraloop |
| WO2010080129A2 (en) | 2008-12-18 | 2010-07-15 | Dicerna Pharmaceuticals, Inc. | Extended dicer substrate agents and methods for the specific inhibition of gene expression |
| WO2010093788A2 (en) | 2009-02-11 | 2010-08-19 | Dicerna Pharmaceuticals, Inc. | Multiplex dicer substrate rna interference molecules having joining sequences |
| WO2012173994A2 (en) * | 2011-06-15 | 2012-12-20 | Dicerna Pharmaceuticals, Inc. | Phase changing formulations of nucleic acid payloads |
-
2009
- 2009-12-18 WO PCT/US2009/006636 patent/WO2010080129A2/en active Application Filing
- 2009-12-18 CN CN201610032723.9A patent/CN105907756A/zh active Pending
- 2009-12-18 US US12/642,371 patent/US8513207B2/en active Active
- 2009-12-18 CA CA3151965A patent/CA3151965A1/en active Pending
- 2009-12-18 JP JP2011542140A patent/JP5855463B2/ja active Active
- 2009-12-18 CA CA2747013A patent/CA2747013C/en active Active
- 2009-12-18 KR KR1020167026999A patent/KR101728655B1/ko active IP Right Grant
- 2009-12-18 CN CN200980157015.6A patent/CN102325534B/zh active Active
- 2009-12-18 AU AU2009336191A patent/AU2009336191B2/en active Active
- 2009-12-18 EP EP09837721.1A patent/EP2379083B1/en active Active
- 2009-12-18 US US12/642,404 patent/US20100184841A1/en not_active Abandoned
- 2009-12-18 KR KR1020117016689A patent/KR20110110776A/ko not_active Application Discontinuation
-
2013
- 2013-08-20 US US13/971,507 patent/US20140221454A1/en not_active Abandoned
-
2014
- 2014-07-10 US US14/328,162 patent/US10131912B2/en active Active
-
2015
- 2015-07-02 JP JP2015133410A patent/JP2015213512A/ja active Pending
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016006846A1 (ko) * | 2014-07-09 | 2016-01-14 | 서울대학교산학협력단 | 목적 유전자의 발현 억제 특이성이 증가된 siRNA 분자 |
| KR102379204B1 (ko) * | 2020-12-18 | 2022-03-24 | 이화여자대학교 산학협력단 | 유전자 침묵 활성이 증가된 핵산 분자 및 이의 이용 |
| WO2023219479A1 (ko) * | 2022-05-13 | 2023-11-16 | 서울대학교산학협력단 | Dicer에 의한 dsrna 가공의 서열 결정 인자 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2747013C (en) | 2022-05-31 |
| US20100184841A1 (en) | 2010-07-22 |
| CN105907756A (zh) | 2016-08-31 |
| EP2379083A2 (en) | 2011-10-26 |
| KR101728655B1 (ko) | 2017-04-19 |
| WO2010080129A3 (en) | 2010-09-16 |
| CA3151965A1 (en) | 2010-07-15 |
| US20140221454A1 (en) | 2014-08-07 |
| KR20160118377A (ko) | 2016-10-11 |
| JP2012512651A (ja) | 2012-06-07 |
| JP2015213512A (ja) | 2015-12-03 |
| US20140350074A1 (en) | 2014-11-27 |
| US20100173974A1 (en) | 2010-07-08 |
| CN102325534B (zh) | 2016-02-17 |
| US10131912B2 (en) | 2018-11-20 |
| WO2010080129A2 (en) | 2010-07-15 |
| CN102325534A (zh) | 2012-01-18 |
| EP2379083B1 (en) | 2017-08-16 |
| US8513207B2 (en) | 2013-08-20 |
| EP2379083A4 (en) | 2013-03-27 |
| JP5855463B2 (ja) | 2016-02-09 |
| AU2009336191B2 (en) | 2017-08-24 |
| AU2009336191A1 (en) | 2011-07-07 |
| CA2747013A1 (en) | 2010-07-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101728655B1 (ko) | 유전자 발현의 특이적 억제를 위한 연장된 다이서 기질 제제 및 방법 | |
| US20210062189A1 (en) | Extended dicer substrate agents and methods for the specific inhibition of gene expression | |
| JP5986928B2 (ja) | 遺伝子発現の特異的阻害のためのダイサー基質剤及び方法 | |
| AU2014284298B2 (en) | Methods and compositions for the specific inhibition of alpha-1 antitrypsin by double-stranded RNA | |
| EP3587579B1 (en) | Methods and compositions for the specific inhibition of beta-catenin by double-stranded rna | |
| EP3077511A1 (en) | Methods and compositions for the specific inhibition of transthyretin (ttr) by double-stranded rna | |
| US20100173973A1 (en) | Extended dicer substrate agents and methods for the specific inhibition of gene expression | |
| EP2931746A2 (en) | Methods and compositions for the specific inhibition of ckap5 by double-stranded rna | |
| US11597929B2 (en) | Extended dicer substrate agents and methods for the specific inhibition of gene expression | |
| WO2012100172A2 (en) | Methods and compositions for the specific inhibition of hif-1a by double stranded rna |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |