KR20070064415A - 알파-2 아드레날린성 수용체 아고니스트의 안내 임플란트및 시각을 향상시키는 방법 - Google Patents
알파-2 아드레날린성 수용체 아고니스트의 안내 임플란트및 시각을 향상시키는 방법 Download PDFInfo
- Publication number
- KR20070064415A KR20070064415A KR1020067022639A KR20067022639A KR20070064415A KR 20070064415 A KR20070064415 A KR 20070064415A KR 1020067022639 A KR1020067022639 A KR 1020067022639A KR 20067022639 A KR20067022639 A KR 20067022639A KR 20070064415 A KR20070064415 A KR 20070064415A
- Authority
- KR
- South Korea
- Prior art keywords
- implant
- eye
- alpha
- adrenergic receptor
- retinal
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/148—Materials at least partially resorbable by the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/498—Pyrazines or piperazines ortho- and peri-condensed with carbocyclic ring systems, e.g. quinoxaline, phenazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
- A61K9/0051—Ocular inserts, ocular implants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyethylene oxide, poloxamers
- A61K9/204—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/58—Materials at least partially resorbable by the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/06—Macromolecular materials obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L67/00—Compositions of polyesters obtained by reactions forming a carboxylic ester link in the main chain; Compositions of derivatives of such polymers
- C08L67/04—Polyesters derived from hydroxycarboxylic acids, e.g. lactones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/432—Inhibitors, antagonists
- A61L2300/436—Inhibitors, antagonists of receptors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/60—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a special physical form
- A61L2300/602—Type of release, e.g. controlled, sustained, slow
- A61L2300/604—Biodegradation
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
생체적합성 안내 임플란트는 알파-2 아드레날린성 수용체 아고니스트 및 알파-2 아드레날린성 수용체 아고니스트와 결합된 폴리머를 포함하여, 장기간 동안 알파-2 아드레날린성 수용체 아고니스트가 눈으로 방출되는 것을 용이하게 한다. 알파-2 아드레날린성 수용체 아고니스트는 두가지 생분해성 폴리머의 매트릭스와 같은 생분해성 폴리머 매트릭스와 결합될 수 있다. 임플란트를 눈에 넣어서 안 혈관병증 또는 녹내장 등과 같은 하나이상의 안질환을 처치하거나 정상 눈의 시력을 향상시킬 수 있다.
Description
교차 참조
본 출원은 본 명세서에 전체가 참조로 병합되어 있는 2004년 4월 30일 출원된 미국 특허출원 번호 10/836,911의 일부계속 출원이다.
본 발명은 일반적으로 환자의 눈을 처치하기 위한 장치 및 방법에 관한 것으로, 더욱 구체적으로는 임플란트가 배치된 눈에 치료학적 제제를 연장 방출할 수 있는 안내 임플란트에 관한 것이며, 안 혈관병증(ocular vasculopathies)을 처치하거나 일반적으로 시각을 향상키는 이러한 임플란트를 제조 및 사용하는 방법에 관한 것이다.
브리모니딘, 5-브로모-6-(2-이미다졸리디닐리덴아미노)퀴녹살린은 안방수 생성을 감소시키고 포도막공막 유출을 향상시켜서 개방각 녹내장을 처치하는 데 효과적인 알파-2-선택적 아드레날린성 수용체 아고니스트이다. 브리모니딘은 두가지 화학형, 브리모니딘 타르트레이트 및 브리모니딘 유리 염기로서 이용가능하다. 브리모니딘 타르트레이트(Alphagan P®)는 녹내장을 처치용으로서 Allergan으로부터 상업적으로 입수가능하다. 국소 안과용 브리모니딘 조성물, 0.15% Alphagan P® (Allergan, 캘리포니아 이르빈)이 개방각 녹내장 처치요응로서 현재 상업적으로 입수가능하다. 물에 대한 브리모니딘 유리염기의 용해도는 무시할 정도인 반면에, 브리모니딘 타르트레이트의 물에 대한 용해도는 34mg/ml이다.
최근 연구들은 브리모니딘이 망막 및/또는 시신경에서 알파-2-아드레날린성 수용체를 활성화시켜서 손상된 망막 신경절 신경 세포의 생존을 촉진시킬 수 있다는 것을 제안하였다. 예를 들어, 브리모니딘은 허혈 및 녹내장의 몇가지 모델에서 상해 뉴런을 보호하여 더욱 손상되지 않게 할 수 있다. 미국 특허 5,856,329; 6,248,741 및 6,465,464 참조.
녹내장-유발 신경절 세포 변성(degeneration)은 실명을 일으키는 원인 중의 하나이다. 이점은 치료 요법의 평가된 결과로서 신경보호 및 안압 감소가 나타나는 브리모니딘을 녹내장 관리의 새로운 치료학적 접근에 사용할 수 있다는 것을 시사한다. 그러나, 브리모니딘이 시신경을 보호하려면, 치료학적 레벨로 후안부에 접근할 수 있어야 한다. 브리모니딘을 후안부에 투여하기 위해 현재 사용가능한 기술은 이러한 논점을 다루기에 충분치 않다.
눈에 넣기 위한 생적합성 임플란트가, 미국특허 4,521,210; 4,853,224; 4,997,652; 5,164,188; 5,443,505; 5,501 ,856; 5,766,242; 5,824,072; 5,869,079; 6,074,661 ; 6,331 ,313; 6,369,116; 및 6,699,493와 같은 여러 특허에 개시되어 있다.
안내 임플란트와 같은, 지속된 또는 제어된 속도로 장기간 동안 음성적인 부 작용이 거의 없거나 전형 없는 양으로 치료학적 제제를 방출할 수 있는, 눈에 임플란트 가능한 약물 송달 시스템, 및 이러한 시스템을 사용하는 방법을 제공하는 것이 이점이 있다.
개요
본 발명은 눈으로의 약물을 연장 또는 지속 방출하여, 예를 들어, 하나 이상의 원하는 치료학적 효과를 달성하기 위한 새로운 약물 송달 시스템, 및 이러한 시스템을 제조 및 사용하는 방법을 제공한다. 약물 송달 시스템은 눈에 넣을 수 있는 임플란트 또는 임플란트 구성요소의 형태일 수 있다. 본 시스템 및 방법은 하나 이상의 치료제를 장기간 방출시키는 것이 유리하다. 즉, 눈에 임플란트를 넣은 환자는 제제의 추가적인 투여 없이도 치료학적인 양의 제제를 장기간 또는 연장된 기간동안 수용하게 된다. 예를 들어, 환자는 눈의 지속적인 처치를 위해 사용가능한, 실질적으로 지속적인 레벨의 치료학적으로 활성인 제제를 비교적 장기간, 예를 들어, 적어도 약 일주일 정도, 예를 들어, 임플란트를 이식한 후에 약 2 내지 약 6개월동안 수용한다. 이렇게 방출 시간이 연장되므로, 성공적인 처치 결과를 얻기가 쉽다.
본 개시에 따른 안내 임플란트는 치료학적 구성성분 및 치료학적 구성성분과 결합된 약물 방출 지속 구성성분을 포함한다. 본 발명에 따르면, 치료학적 구성성분은, 알파-2 아드레날린성 수용체 아고니스트로 구성되거나, 본질적으로 구성된다. 알파-2 아드레날린성 수용체 아고니스트는 예를 들어, 알파-1 아드레날린성 수용체와 같은 다른 타입의 아드레날린성 수용체보다는 알파-2 아드레날린성 수용체에 결합하여, 알파-2 아드레날린성 수용체를 선택적으로 활성화시키는 아고니스트 또는 제제일 수 있다. 선택적 활성화는 상이한 조건들 하에서 달성될 수 있으나, 바람직하게, 선택적인 활성화는 사람 또는 동물 환자의 눈과 관련된 조건과 같은 생리학적 조건하에서 결정될 수 있다. 약물 방출 지속 구성성분은 치료학적 구성성분과 결합하여, 임플란트가 이식된 눈으로 일정량의 알파-2 아드레날린성 수용체 아고니스트를 지속방출한다. 일정량의 알파-2 아드레날린성 수용체 아고니스트가 임플란트를 눈에 이식한 후 약 일주일 이상의 기간동안 눈으로 방출되며, 혈관폐색과 같은 안 혈관병증을 방지 또는 감소시키는 데 효과적이다.
일 실시형태에서, 안내 임플란트는 알파-2 아드레날린성 수용체 아고니스트 및 생분해성 폴리머 매트릭스로 구성된다. 알파-2 아드레날린성 수용체 아고니스트는 안 혈관폐색을 감소 또는 방지하기에 충분한 시간동안 일정량의 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 분해되는 생분해성 폴리머 매트릭스와 결합된다. 안내 임플란트는 생분해성 또는 생침식성이며, 일주일 이상, 예를 들어, 약 3개월 이상 및 약 6개월 이상과 같은 연장된 기간동안 눈으로의 알파-2 아드레날린성 수용체 아고니스트의 지속 방출을 제공한다. 어떤 임플란트에서는, 알파-2 아드레날린성 수용체 아고니스트가 약 30-35일 이하로 방출된다. 다른 임플란트에서는, 알파-2 아드레날린성 수용체 아고니스트가 40일 이상 방출된다.
상기한 임플란트의 생분해성 폴리머 구성성분은 생분해성 폴리머들의 혼합물일 수 있으며, 하나 이상의 생분해성 폴리머가 분자량 64 킬로달톤(kD) 이하의 폴리악틱산(polyactic acid) 폴리머이다. 추가적으로 또는 이와 달리, 상기한 임플란트는 폴리악틱산의 제 1 생분해성 폴리머, 및 폴리악틱산의 상이한 제 2 생분해성 폴리머를 포함할 수 있다. 또한, 상기한 임플란트는 상이한 생분해성 폴리머들의 혼합물을 포함할 수 있으며, 각각의 생분해성 폴리머는 약 0.3 데시리터/그램(dl/g) 내지 약 1.0 dl/g 범위의 고유점도를 가진다.
본 명세서에 개시한 임플란트의 알파-2 아드레날린성 수용체 아고니스트는 퀴녹살린 유도체 또는 안질환을 처치하는 데 효과적인 다른 아고니스트 를 포함할 수 있다. 적합한 퀴녹살린 유도체의 일례로는 브리모니딘 또는 브리모니딘 타르트레이트가 있다. 또한, 본 임플란트의 치료학적 구성성분은 안질환을 처치하는 데 효과적일 수 있는 하나 이상의 추가적인 또는 상이한 치료학적 제제를 포함할 수 있다.
본 임플란트를 제조하는 방법은 알파-2 아드레날린성 수용체 아고니스트를 생분해성 폴리머 또는 폴리머들과 조합 또는 혼합하는 것을 포함한다. 그리고 나서, 혼합물을 압출성형 또는 압착하여 단일 조성물을 형성한다. 그리고 나서, 단일 조성물을 환자의 눈에 이식하기에 적합한 개별 임플란트로 성형하는 가공을 할 수 있다.
임플란트를 눈 부위에 이식하여, 전안부 또는 후안부에 영향을 미치는 안 혈관병증과 같은 질환을 포함하는 다양한 안질환을 처치할 수 있다. 임플란트는 예를 들어, 이에 제한되지는 않지만, 혈관 폐색과 관련된 질환을 포함하는 눈의 여러 질환을 처치하는 데 사용할 수 있다.
본 발명과 관련된 키트(kit)는 하나 이상의 본 발명의 임플란트 및 임플란트 사용 설명서를 포함할 수 있다. 예를 들어, 설명서는 환자에 임플란트를 투여하는 방법 및 임플란트로 처치할 수 있는 질환의 종류를 설명할 수 있다.
본 발명은 또한 시각을 향상시키는 생분해성 안내 임플란트를 포함한다. 이 임플란트는 알파-2 아드레날린성 수용체 아고니스트 및 생분해성 폴리머를 포함한다. 이 임플란트는 임플란트를 유리체내에 위치시켜 폴리머로부터 임플란트가 이식된 눈의 시각을 향상시키는 데 효과적인 양으로 알파-2 아드레날린성 수용체 아고니스트를 방출한다. 알파-2 아드레날린성 수용체 아고니스트는 (2-이미다졸린-2-일아미노)퀴녹살린, 5-브로모-6-(2-이미다졸린-2-일아미노)퀴녹살린과 같은 퀴녹살린, 이의 유도체 및 이들의 혼합물일 수 있다. 즉, 알파-2 아드레날린성 수용체 아고니스트는 브리모니딘 또는 이의 염 또는 이의 혼합물일 수 있다. 예를 들어, 알파-2 아드레날린성 수용체 아고니스트는 브리모니딘 타르트레이트이다.
알파-2 아드레날린성 수용체 아고니스트가 임플란트의 생분해성 폴리머 중에 분산될 수 있다. 생분해성 폴리머는 폴리악틱산의 제 1 생분해성 폴리머, 및 폴리악틱산의 상이한 제 2 생분해성 폴리머의 혼합물을 포함할 수 있다. 폴리머는 눈의 유리체에 임플란트를 이식한 시점으로부터 1개월이상 또는 40일 이상 또는 35일 이하 동안 임플란트로부터 일정량의 알파-2 아드레날린성 수용체 아고니스트를 지속 방출하기에 효과적인 속도로 약물을 방출할 수 있다.
본 발명의 실시형태는 알파-2 아드레날린성 수용체 아고니스트와 생분해성 폴리머 구성성분을 압출성형하여, 임플란트가 이식된 눈의 시각을 향상시키기에 효과적인 기간동안 임플란트로부터 일정량의 알파-2 아드레날린성 수용체 아고니스트를 지속방출하기에 효과적인 속도로 약물을 방출시키는 생분해성 재료를 형성하는 생분해성 안내 임플란트 제조방법에 관한 것이다.
본 발명의 또다른 실시형태는 생분해성 폴리머와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함하여 시각을 향상 또는 유지시키는 생분해성 안내 임플란트를 눈의 유리체에 이식하여 시각을 향상 또는 유지시키기 위한 방법에 관한 것이다. 이러한 방법은, 황반변성, 황반부종, 망막 동맥 폐색 질환, 중심성 망막 정맥 폐색, 파종성 혈관내응고증 (disseminated intravascular coagulopathy), 망막 분지 정맥 폐색(branch retinal vein occlusion), 고혈압성 안저변화(hypertensive fundus changes), 안허혈 증후군(ocular ischemic syndrome), 망막 동맥 미세혈관류(retinal arterial microaneurysms), 반측 망막정맥폐색(hemi-retinal vein occlusion), 중심성 망막 동맥 폐색(central retinal artery occlusion), 망막 분지 동맥 폐색(branch retinal artery occlusion), 경동맥 질환(CAD), 일스 병(Eales disease), 당뇨병과 관련된 혈관병증, 비-삼출성 노인성 황반 변성, 삼출성 노인성 황반변성, 맥락막 혈관신생(choroidal neovasculariza tion), 당뇨병성 망막증, 급성 황반성 신경망막병증 (acute macular neuroretino pathy), 중심성 장액성 맥락망막병증(central serous chorioretinopathy), 낭포성 황반부종, 당뇨병성 황반부종, 급성 다발성 판상색소 상피증(acute multifocal placoid epitheliopathy), 베체트 병, 버드샷 망막맥락막증(birdshot retinochoroidopathy), 매독, 라임병, 결핵, 톡소플라스마증, 중간포도막염, 다소성 맥락막염(multifocal choroiditis), 다발성 소실성 백반증후군(multiple evanescent white dot syndrome), 눈의 사르코이드증(ocular sarcoidosis), 후공막염(posterior scleritis), 사행성 맥락막염(serpiginous choroiditis), 망막하 섬유화 및 포도막염 증후군(subretinal fibrosis and uveitis syndrome), 보그트-고야나기-하라다 증후군(Vogt-Koyanagi-and Harada syndrome), 코우츠 병(Coat's disease), 중심오목부근 모세혈관확장증(parafoveal telangiectasis), 유두정맥염(papillophlebitis), 언가지모양혈관염(frosted branch angiitis), 겸상세포 망막증(sickle cell retinopathy) 및 다른 혈색소병증(hemoglobinopathie), 혈관무늬 망막증(angioid streaks), 가족성 삼출 유리체망막증(familial exudative vitreoretinopathy), 교감성안염(sympathetic ophthalmia), 포도막 망막 질환, 망막 박리, 외상, 레이저로 인한 질환, 광역동요법, 광응고술(photocoagulation), 수술 중 저관류(hypoperfusion), 방사선 망막증(radiation retinopathy), 골수 이식 망막증, 증식성 유리체 망막증과 망막전막(epiretinal membranes), 증식성 당뇨병성 망막증, 안 히스토플라즈마증, 안 톡소카라증, 추정 안 히스토플라즈마증 증후군(presumed ocular histoplasmosis syndrome), 내안구염(endophthalmitis), 톡소플라즈마증, HIV 감염과 관련된 망막 질환, HIV 감염과 관련된 맥락막 질환, HIV 감염과 관련된 포도막 질환, 바이러스성 망막염, 급성 망막 괴사, 진행성 외부 망막괴사, 진균성 망막 질환, 안 매독, 안 결핵, 광범위 일측 아급성 신경망막염(diffuse unilateral subacute neuroretinitis), 구더기증(myiasis), 색소성 망막염, 망막 이영양증(retinal dystrophies)과 관련된 전신질환, 선천성 정지형 야맹증(congenital stationary night blindness), 추체 이영양증(cone dystrophies), 스타르가르트병(Stargardt's disease) 및 노란점 안저(fundus flavimaculatus), 베체트 병, 망막 색소 상피의 패턴 이영양증(pattern dystrophy of the retinal pigmented epithelium), X-염색체관련 망막층간분리(X-linked retinoschisis), 소르스비 안저 이영양증(Sorsby's fundus dystrophy), 양성 동심성 황반병증(benign concentric maculopathy), 비에티 결정 이영양증(Bietti's crystalline dystrophy), 탄성섬유 가성 황색종(pseudoxanthoma elasticum), 망막 박리, 황반 원공, 거대 망막 열공, 종양과 관련된 망막 질환, 망막 색소 상피의 선천성 비후(congenital hypertrophy), 후부 포도막 흑색종(posterior uveal melanoma), 맥락막 혈관종(choroidal hemangioma), 맥락막 골종(choroidal osteoma), 맥락막 전이, 망막 및 망막 색소 상피의 복합 과오종(combined hamartoma of the retina and retinal pigmented epithelium), 망막아세포종, 안저의 혈관증식성 종양(vasoproliferative tumors of the ocular fundus), 망막별아교세포종(retinal astrocytoma), 안내 림프성 종양, 점상내층맥락막병증(punctate inner choroidopathy), 급성 후부 다발성 판상색소 상피증(acute posterior multifocal placoid pigment epitheliopathy), 근시성 망막 변성, 및 급성 망막 색소 상피염(retinal pigement epitheliitis)와 같은 안질환을 처치하는 데 사용할 수 있다.
특히, 본 방법은 정상 눈의 시각을 향상시킬 수 있다. 정상 눈은 질환이나 손상이 없는 눈을 말한다. 예를 들어, 본 방법은 정상 눈에서 약 56%까지 시각을 향상시킬 수 있다(시력의 향상에 의해서). 본 방법은 또한 안질환이 있는 눈의 시각을 향상시킨다. 예를 들어, 본 방법은 안질환이 있는 눈에서 약 23%까지 시각을 향상시킬 수 있다. 이러한 안질환은 혈관병증일 수 있다. 이와 달리, 안질환은 증가된 안압에 의한 것일 수 있으며, 및/또는 안질환은 망막 허혈성 손상일 수 있다.
임플란트는 유리체내에 이식될 때 약 90일에 동안 폴리머로부터 알파-2 아드레날린성 수용체 아고니스트를 방출할 수 있다. 특히, 알파-2 아드레날린성 수용체 아고니스트는 유리체 내에 머무는 것보다 더 오랜 기간동안 망막에 머무를 수 있다. 본 발명의 실시형태는 시각을 향상, 유지, 회복 또는 교정하는 방법에 관한 것으로, 이 방법은 눈의 유리체에 생분해성 폴리머와 결합된 브리모니딘을 포함하는 생분해성 안내 임플란트를 넣어 시각을 향상, 유지, 회복 또는 교정하는 단계를 포함한다.
본 명세서에 기재된 각각의 모든 특징 및 두가지 이상의 이러한 특징의 각각 또는 모든 조합이, 이러한 조합에 포함된 특징들이 상호 불일치하는 것이 아니라면, 본 발명의 범주에 포함된다. 또한, 어떤 특징 또는 특징들의 조합은 본 발명의 어떤 실시형태로부터 특별히 배제될 수 있다.
본 발명의 추가적인 실시형태 및 이점을 특히 첨부된 도면과 연합하여 고려하면서, 하기의 상세한 설명 및 청구범위에서 설명한다.
상세한 설명
본 명세서에 설명한 바와 같이, 하나 이상의 안내 임플란트를 사용한 치료학적 제제의 제어된 및 지속된 투여를 통하여 바람직하지 못한 안질환의 처치를 향상시킬 수 있다. 임플란트는 약제학적으로 허용가능한 폴리머 조성물을 포함하며, 연장된 기간 동안 알파-2 아드레날린성 수용체 아고니스트와 같은 약제학적으로 활성인 제제를 하나 이상 방출하도록 조성된다. 임플란트는 치료학적으로 효과적인 투여량의 제제 또는 제제들을 눈 부위에 직접 제공하여 하나 이상의 바람직하지 못한 안질환을 처치 또는 방지하기에 효과적이다. 따라서, 환자에게 반복 주사하거나 자가-투여 점안액의 경우에 활성 제제 또는 제제들에 단지 제한적으로 한꺼번에 노출되는, 효과가 없는 처치보다는, 단일 투여하여, 치료학적 제제를 필요한 부위에 사용가능하도록 제조할 것이며, 제제는 연장된 기간동안 유지될 것이다.
본 명세서의 개시에 따른 안내 임플란트는 치료학적 구성성분 및 상기 치료학적 구성성분과 결합한 약물 방출 지속 구성성분을 포함한다. 본 발명에 따르면, 치료학적 구성성분은, 알파-2 아드레날린성 수용체 아고니스트로 구성되거나, 본질적으로 구성되거나, 이를 포함한다. 약물 방출 지속 구성성분은 치료학적 구성성분과 결합하여 치료학적으로 효과적인 양의 알파-2 아드레날린성 수용체 아고니스트를 임플란트가 이식된 눈으로 지속 방출한다. 눈에 임플란트를 이식한 후 약 1 주일 이상의 기간동안 치료학적인 양의 알파-2 아드레날린성 수용체 아고니스트가 눈으로 방출된다.
정의
본 상세한 설명에서는, 단어의 문맥상 상이한 의미를 나타내지 않는 한, 하기의 용어들을 본 섹션에서 정의한 대로 사용한다.
본 명세서에서 사용할 때, "안내 임플란트"는 눈에 넣도록 된 구조, 크기이거나 구성인 장치 또는 구성요소를 일컫는다. 안내 임플란트는 일반적으로 눈의 생리학적 조건에 생체적합성이 있으며, 유해한 부작용을 일으키지 않는다. 안내 임플란트는 눈의 시각을 해치지 않으면서 눈에 넣을 수 있다.
본 명세서에 사용할 때, "치료학적 구성성분"은 눈의 의학적 질환을 처치하는 데 사용되는 하나 이상의 치료학적 제제 또는 물질을 포함하는 안내 임플란트의 일부분을 일컫는다. 치료학적 구성성분은 안내 임플란트의 분리된 개별 영역일 수 있으며, 또는 임플란트 전체에 균질하게 분포될 수 있다. 치료학적 구성요소의 치료학적 제제는 전형적으로 안과적으로 허용가능하며, 눈에 임플란트를 넣을 때 유해한 반응을 야기하지 않는 형태로 제공된다.
"약물 방출 지속 구성성분"은 임플란트의 치료학적 제제를 지속 방출하는 데 효과적인 안내 임플란트의 일부분이다. 약물 방출 지속 구성성분은 생분해성 폴리머 매트릭스일 수 있으며, 또는 치료학적 구성성분을 포함하는 임플란트의 코어부를 감싸는 코팅일 수 있다.
본 명세서에 사용할 때, "~와 결합한(associated with)"은 ~와 혼합한, ~ 중에 분산된, ~와 커플링한, 감싸는, 또는 둘러싸는 것을 의미한다.
본 명세서에 사용할 때, "눈 영역(ocular region)" 또는 "눈 부위(ocular site)"라는 용어는 일반적으로 안구의 어떤 영역을 일컬으며, 눈의 전안부(anterior segment) 및 후안부(posterior segment)를 포함하고, 일반적으로 안구에서 발견되는 어떤 기능적(예를 들어, 시각을 위한) 또는 구조적 조직 또는 부분적으로 또는 전체가 안구의 안쪽 또는 바깥쪽에 있는 조직 또는 세포층을 포함하나 이에 제한되지는 않는다. 눈 부위에서 안구 영역의 특정 실시예로는 전안방, 후안방, 유리체강, 맥락막, 맥락막위 공간, 결막, 결막하 공간, 공막바깥공간, 각막내 공간, 각막바깥공간, 공막, 평면부(the pars plana), 수술적으로-유도된 무혈관 영역(surgically-induced avascular, regions), 황반 및 망막이 포함된다.
본 명세서에 사용될 때, 안질환은 눈 또는 눈의 일부분 또는 한 영역에 영향을 주거나 관련된 질병, 병 또는 질환이다. 넓은 의미로, 눈은 안구 및 안구를 구성하는 조직과 체액, 눈주위 근육(사근 및 직근과 같은), 및 안구 내의 또는 안구에 인접한 시신경 부분을 포함한다.
전안부 안질환은 수정체 피막(lens capsule)의 후벽 또는 모양체근의 앞쪽에 위치하는 눈주위 근육, 눈꺼풀 또는 안구 조직 또는 체액과 같은 전안(즉, 눈의 앞쪽) 영역 및 부위에 영향을 주거나 관련된 질병, 병 또는 질환이다. 즉, 전안부 안질환은 결막, 각막, 전안방, 홍채, 후안방(망막 뒤쪽이지만 수정체 피막의 후벽 앞쪽), 수정체 또는 수정체 피막 및 전안 영역 또는 부위를 지나는 혈관 및 신경에 일차적으로 영향을 주거나 관련된다.
전안부 질환은 예를 들어, 무수정체; 가성수정체; 난시; 안검경련; 백내장; 결막 질병; 결막염; 각막 질환; 각막궤양; 안구건조증; 눈꺼풀 질병; 눈물기관 질병; 누관폐쇄(Lacrimal Duct Obstruction); 근시; 노안; 동공 질병; 굴절 장애 및 사시와 같은 질병, 병 또는 질환을 포함할 수 있다. 녹내장 처치의 임상 목표는 눈의 전안방에서 안방수(aquous fluid)의 고압을 감소(즉, 안압의 감소)시키는 것이기 때문에, 녹내장을 또한 전안부 질환으로 여길 수 있다.
후안부 질환은 맥락막 또는 공막(수정체 피막의 후벽을 지나는 평면 뒤쪽에 위치), 유리체, 유리체방(vitreous chamber), 망막, 시신경(즉, 시신경 유두), 및 후안 영역 또는 부위를 지나는 혈관 및 신경과 같은 후안 영역 및 부위에 일차적으로 영향을 주거나 관련된 질병, 병 또는 질환이다.
따라서, 후안부 질환은 예를 들어, 급성 황반성 신경망막병증; 베체트 병; 맥락막 혈관신생; 당뇨병성 포도막염; 히스토플라즈마증; 진균 또는 바이러스-유발 감염과 같은 감염; 급성 황반변성과 같은 황반 변성; 비삼출성 노인성 황반변성 및 삼출성 노인성 황반변성; 황반부종, 낭포성 황반부종 및 당뇨병성 황반부종과 같은 부종; 다소성 맥락막염; 후안부 또는 위치에 영향을 주는 눈의 외상; 눈의 종양; 중심성 망막 정맥 폐색, 당뇨병성 망막증(증식성 당뇨병성 망막증을 포함), 증식성 유리체 망막증(PVR), 망막 동맥 폐색 질환, 망막 박리, 포도막 망막질병과 같은 망막장애; 교감성 안염; 보그트-고야나기-하라다(VKH) 증후군; 포도막 확산(uveal diffusion); 안 레이저 처치에 의해 야기되거나 영향을 받은 후안부 질환; 광역동요법, 광응고술, 방사선 망막증, 망막전막 장애, 망막 분지 정맥 폐색, 전방 국소빈혈성 시신경장애, 비-망막병증 당뇨병성 망막 기능부전, 색소성 망막염, 및 녹내장에 의해 야기되거나 영향을 받은 후안부 질환과 같은 질병, 병 또는 질환을 포함할 수 있다. 치료 목적이 시각의 손실을 방지하거나 손상으로 인해 시력의 손실, 또는 망막 세포 또는 시신경 세포의 손실이 발생하는 것을 감소(즉, 신경보호)시키는 것이기 때문에 녹내장을 후안부 질환으로 여길 수 있다.
"생분해성 폴리머"라는 용어는 생체 내에서 분해하는 폴리머 또는 폴리머들을 일컬으며, 시간이 지남에 따라 폴리머 또는 폴리머들이 침식되고, 이에 수반되어 또는 이어서 치료학적 제제가 방출된다. 특히, 폴리머 팽창을 통해 약물을 방출하도록 작용하는 메틸셀룰로오스와 같은 하이드로젤은 특히 "생분해성 폴리머"에서 배제된다. "생분해성" 및 "생침식성"은 동등한 의미로서 본 명세서에서는 상호교환가능하게 사용된다. 생분해성 폴리머는 호모폴리머, 코폴리머, 또는 둘 이상의 상이한 폴리머 유닛을 포함하는 폴리머일 수 있다.
본 명세서에서 사용되는 "처치하다(treat)" 또는 "처치하는(treating)" 또는 "처치(treatment)"라는 용어는 안질환, 눈의 외상 또는 손상의 소산(resolution), 감소 또는 방지 또는 외상 또는 손상된 안조직의 치유를 촉진하는 것을 일컫는다.
본 명세서에서 사용되는 "치료학적으로 효과적인 양"은 눈 또는 눈의 영역에 심각한 부정적인 또는 유해한 부작용을 야기하지 않고, 안질환을 처치하거나 눈의 외상 또는 손상을 감소 또는 방지하는 데 필요한 제제의 레벨 또는 양을 일컫는다.
개발된 안내 임플란트는 다양한 기간에 걸쳐 약물 부하를 방출할수 있다. 이러한 임플란트는, 눈의 유리체와 같은 눈에 삽입시, 연장된 기간(예를 들어, 약 1주일 이상)동안 치료학적 레벨의 알파-2 아드레날린성 수용체 아고니스트를 제공한다. 개시된 임플란트는 후안부 질환과 같은 안질환을 처치하는 데 효과적이다.
본 발명의 일 실시형태에서, 안내 임플란트는 생분해성 폴리머 매트릭스를 포함한다. 생분해성 폴리머 매트릭스는 약물 방출 지속 구성성분의 한 형태이다. 생분해성 폴리머 매트릭스는 생분해성 안내 임플란트를 형성하는 데 효과적이다. 생분해성 안내 임플란트는 생분해성 폴리머 매트릭스와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함한다. 매트릭스는 임플란트를 눈의 유리체와 같은 안 영역 또는 안 부위에 이식한 때로부터 약 일주일보다 더 긴 시간 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 지속 방출하는 데 효과적인 속도로 분해된다.
임플란트의 알파-2 아드레날린성 수용체 아고니스트는 전형적으로 알파-1 아드레날린성 수용체보다는 알파-2 아드레날린성 수용체를 선택적으로 활성화시킨다. 특정 임플란트에서, 알파-2 아드레날린성 수용체 아고니스트는 알파-2 아드레날린성 수용체들의 서브타입을 선택적으로 활성화시킨다. 예를 들어, 이러한 아고니스트는 생리학적 조건과 같은 특정한 조건하에서 하나 이상의 알파-2a, 알파-2b, 또는 알파-2c 수용체를 하나 이상 선택적으로 활성화시킬 수 있다. 다른 조건하에서, 임플란트의 아고니스트는 알파-2 아드레날린성 수용체 서브타입에 대하여 선택적이지 않을 수 있다. 이러한 아고니스트는 수용체에 결합하여, 또는 다른 매카니즘에 의해서 수용체를 활성화시킬 수 있다.
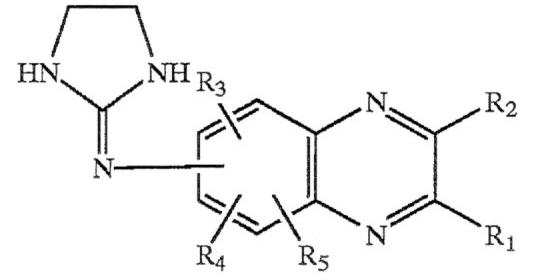
특정한 임플란트에서, 알파-2 아드레날린성 수용체 아고니스트는 퀴녹살린 유도체이다. 본 발명의 임플란트에 유용한 퀴녹살린 유도체는 하기의 화학식을 갖는 퀴녹살린 유도체, 이의 약제학적으로 허용가능한 산부가염, 및 이의 혼합물이다.
여기서, R1 및 R2는 H, 탄소수 1 내지 4의 알킬 라디칼 및 탄소수 1 내지 4의 알콕시 라디칼로 구성된 그룹에서 독립적으로 선택된다. 2-이미다졸린-2-일아미노 그룹이 퀴녹살린 모핵의 5-, 6-, 7- 및 8-위치 중에 올 수 있으며, 6-위치가 바람직하다. R3, R4 및 R5 각각은 퀴녹살린 모핵의 나머지 5-, 6-, 7- 또는 8-위치 중 어느 하나에 위치하며, Cl, Br, H 및 탄소수 1 내지 3의 알킬 라디칼로 구성된 그룹에서 독립적으로 선택된다. R3은 퀴녹살린 모핵의 5-위치가 바람직하며, R4 및 R5는 모두 H가 바람직하다. 특히 유용한 실시형태에서, R3는 Br이다.
적어도 하나의 임플란트에서, R1은 H이고, R2는 탄소수 1 내지 4의 알킬 라디칼로부터 선택된다. R3는 퀴녹살린 모핵의 5-위치가 유리하며, H 및 탄소수 1 내지 3의 알킬 라디칼로부터 선택된다. 하나 이상의 현재 유용한 화합물의 제한에 따르는 모든 입체이성질체, 호변이성체 및 이들의 혼합물이 본 발명의 범주에 포함된다.
본 발명의 화합물의 약제학적으로 허용가능한 산 부가염은, 하이드로클로라이드, 하이드로브로마이드, 하이드로요오다이드, 설페이트, 또는 비설페이트, 포스페이트 또는 산 포스페이트, 아세테이트, 말레이트, 푸마레이트, 옥살레이트, 락테이트, 타르테이트, 시트레이트, 글루코네이트, 사카레이트 및 p-톨루엔 설포네이트 염과 같은 약제학적으로 허용가능한 음이온을 포함하는 비-독성 부가염을 형성하는 산으로부터 형성된 것이다.
더욱 특이적인 임플란트에서, 퀴녹살린 유도체는 하기의 화학식을 가진다.
또다른 임플란트에서, 알파-2 아드레날린성 수용체 아고니스트는 하기의 화학식을 가지는 염으로서 제공된다.
상기 염은 브리모니딘 타르트레이트(AGN 190342-F, 5-브로모-6-(2-이미다졸리디닐딘아미노)퀴녹살린 타르트레이트)이고, Allergan, Inc.으로부터 Alphagan-P®라는 상표명으로 공개적으로 입수가능하다. 브리모니딘, 유기 염기는 브리모니딘 타르트레이트 염 또는 브리모니딘 유리염기로서 공개적으로 입수가능하다. 타르트레이트 염은 유리염기보다 여러 수성 매질에 더 잘 녹는다. 타르트레이트 염 및 유리염기는 모두 화학적으로 안정하며, 녹는점이 200℃ 이상이기 때문에, 본 발명의 임플란트를 형성하는 데 적합하다.
즉, 임플란트는 브리모니딘 타르트레이트와 같은 브리모니딘 염, 브리모니딘 유리염기, 또는 이들의 혼합물로 구성되거나, 본질적으로 구성되거나, 이를 포함하는 치료학적 구성성분을 포함할 수 있다.
알파-2 아드레날린성 수용체 아고니스트는 입자 또는 분말의 형태로 생분해성 폴리머 매트릭스에 잡혀 있을 수 있다. 보통, 알파-2 아드레날린성 수용체 아고니스트 입자는 유효 평균 크기가 약 3000 나노미터 이하이다. 특정한 임플란트에서, 입자들은 3000 나노미터보다 몇 배 더 작은 유효 평균 크기를 가진다. 예를 들어, 입자들은 약 500 나노미터 이하의 유효 평균 입자 크기를 가진다. 또다른 임플란트에서, 입자들은 약 400 나노미터 이하의 유효 평균 입자 크기를 가지며, 또다른 실시형태에서, 크기는 약 200 나노미터보다 작다.
임플란트의 알파-2 아드레날린성 수용체 아고니스트는 임플란트의 약 10 중량% 내지 약 90 중량%인 것이 바람직하다. 더욱 바람직하게, 알파-2 아드레날린성 수용체 아고니스트는 임플란트의 약 20 중량% 내지 약 80 중량%이다. 바람직한 실시형태에서, 알파-2 아드레날린성 수용체 아고니스트는 임플란트의 약 20 중량%(즉, 15%-25%)이다. 또다른 실시형태에서, 알파-2 아드레날린성 수용체 아고니스트는 임플란트의 약 50 중량%이다.
임플란트에 사용하기에 적합한 폴리머 재료 또는 조성물은 눈의 기능 또는 생리를 실질적으로 방해하지 않도록 눈에 대한 적합성, 즉, 생적합성이 있는 재료를 포함한다. 이러한 재료는 바람직하게 적어도 부분적으로, 더욱 바람직하게 실질적으로 완전히 생분해성 또는 생침식성이다.
유용한 폴리머 재료의 예로는, 이에 제한되지는 않지만, 분해시 생리학적으로 허용가능한 분해산물을 얻는, 모노머를 포함하는, 유기 에스테르 및 유기 에테르에서 유래하거나 및/또는 이를 포함하는 재료를 포함한다. 또한, 무수물, 아미드, 오르소에테르등으로부터 유래하거나 및/또는 이를 포함하는 폴리머 재료는 그 자체로 또는 다른 모노머와 조합하여 사용할 수 있다. 폴리머 재료는 부가 또는 축합 폴리머일 수 있으며, 축합 폴리머가 유리하다. 폴리머 재료는 교차-결합 또는 비-교차-결합될 수 있으며, 예를 들어, 폴리머 재료의 약 5% 이하, 또는 약 1% 이하가 교차-결합되는 것와 같이 가볍게 교차-결합되는 것 이하일 수 있다. 대부분, 탄소 및 수소 외에, 폴리머는 적어도 하나의 산소 및 질소를 포함할 수 있으며, 산소가 유리하다. 산소는 옥시, 예를 들어, 히드록시 또는 에테르, 카르보닐, 예를 들어, 카르복실산 에스테르와 같은 비-옥소-카르보닐 등일 수 있다. 질소는 아미드, 시아노 및 아미노로서 존재할 수 있다. 이는 제어된 약물 송달을 위한 인캡슐레이션(encapsulation)을 기재한 Heller, Biodegradable Polymers in Controlled Drug Delivery, In: CRC Critical Reviews in Therapeutic Drug Carrier Systems, Vol. 1 , CRC Press, Boca Raton, FL 1987, pp 39-90에서 설명된 폴리머들을 본 발명의 임플란트에 사용할 수 있다.
또한 흥미로운 폴리머로는 히드록시지방족 카르복실산, 호모폴리머 또는 코폴리머, 및 폴리사카라이드가 있다. 폴리에스테르는 D-락트산, L-락트산, 라세미 락트산, 글리콜산, 폴리카프로락톤, 및 이들의 혼합물을 포함한다. 일반적으로, L-락테이트 또는 D-락테이트를 사용하여, 천천히 침식하는 폴리머 또는 폴리머 재료를 달성하며, 침식은 실질적으로 락테이트 라세메이트를 사용하여 향상된다.
유용한 폴리사카라이드는 이에 제한되지는 않지만 칼슘 알기네이트, 및 기능성 셀룰로오스, 특히 물에 녹지않으며, 분자량이 예를 들어 약 5kD 내지 500kD인 특징을 가지는 카르복시메틸셀룰로오스 에스테르를 포함한다.
흥미로운 다른 폴리머로는, 이에 제한되지는 않지만 폴리비닐 알콜, 폴리세스테르, 폴리에테르 및 이들의 혼합물이 포함되며 이들은 생체적합성이며 생분해성 및/또는 생침식성이다.
본 발명에 사용하기 위한 폴리머 또는 폴리머 재료의 몇가지 바람직한 특징으로는 생체 적합성, 치료학적 구성성분과의 적합성, 본 발명의 약물송달시스템을 제조하는 데 폴리머를 사용함에 있어서의 용이성, 생리학적 환경에서의 반감기가 적어도 약 6시간, 바람직하게 약 1일일 것, 유리체의 점도를 심하게 증가시키지 않을 것, 및 물에 녹지 않을 것 등이다.
매트릭스를 형성하는 데 포함되는 생분해성 폴리머 재료는 바람직하게 효소 또는 가수분해에 불안정하다. 수용성 폴리머는 가수분해성 또는 생분해성 불안정 교차-결합으로 교차-결합되어 유용한 비수용성 폴리머를 제공할 수 있다. 안정성 정도는 모노머의 선택, 호모폴리머 또는 코폴리머를 사용하는지, 폴리머 혼합물을 사용하는 지 및 폴리머가 말단 산 그룹을 포함하는 지에 따라 광범위하게 달라질 수 있다.
폴리머의 생분해성을 제어하는 것이 역시 중요하며, 따라서, 임플란트의 연장된 방출 프로파일은 임플란트에 사용된 폴리머 조성물의 상대 평균 분자량에 달렸다. 상이한 분자량의 동일한 또는 상이한 폴리머 조성물이 방출 프로파일을 조정하도록 임플란트에 포함될 수 있다. 특정 임플란트에서, 폴리머의 상대 평균 분자량은 약 9 내지 약 64kD의 범위, 보통 약 10 내지 약 54kD, 더욱 통상적으로 약 12 내지 약 45 kD이다.
몇몇 임플란트에서, 글리콜산 및 락트산 코폴리머를 사용하며, 글리콜산 대 락트산의 비율로 생분해 속도를 조절한다. 가장 신속하게 분해되는 코폴리머는 글리콜산과 락트산의 양이 거의 동일하다. 호모폴리머, 또는 동일하지 않은 다른 비율의 코폴리머는 분해되기가 더 어렵다. 글리콜산 대 락트산의 비율은 또한 임플란트의 취약성(brittleness)에 영향을 줄 것이며, 더 큰 형태를 위해서는 더욱 유연한 임플란트가 바람직하다. 폴리락트산 폴리글리콜산(PLGA) 코폴리머에서 폴리락트산의 %는 0-100%일 수 있으며, 바람직하게 약 15-85%, 더욱 바람직하게 약 35-65%이다. 몇몇 임플란트에서는 50/50 PLGA 코폴리머가 사용된다.
안내 임플란트를 위한 생분해성 폴리머 매트릭스는 둘 이상의 생분해성 폴리머의 혼합물을 포함할 수 있다. 예를 들어, 임플란트는 제 1 생분해성 폴리머 및 상이한 제 2 생분해성 폴리머를 포함할 수 있다. 하나 이상의 생분해성 폴리머들이 말단 산 그룹을 가질 수 있다.
침식성 폴리머로부터 약물이 방출되는 것은 몇 가지 메커니즘 또는 메커니즘들이 조합된 결과이다. 이러한 메커니즘의 일부로서 임플란트 표면으로부터의 이탈, 용해, 수화된 폴리머의 다공성 채널을 통한 확산 및 침식이 포함된다. 침식은 대규모로, 또는 표면에서 나타날 수 있으며 두가지가 함께 나타날 수 있다. 본 명세서에서 논의할 때, 안내 임플란트의 매트릭스는 눈에 임플란트 이식 후 1주일 이상동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 지속 방출하기에 효과적인 속도로 약물을 방출할 수 있다. 특정 임플란트에서, 치료학적인 양의 알파-2 아드레날린성 수용체 아고니스트가 이식후 약 30-35일 이상동안 방출된다. 예를 들어, 임플란트는 브리모니딘 타르트레이트를 포함할 수 있으며, 임플란트의 매트릭스는 눈에 이식후 약 1개월동안 치료학적인 양의 브리모니딘 타르트레이트를 지속방출하기에 효과적인 속도로 분해된다. 다른 예로서, 임플란트는 브리모니딘 타르트레이트를 포함할 수 있으며, 매트릭스는 약 6개월동안과 같이, 40일 이상동안치료학적으로 효과적인 양의 브리모니딘 타르트레이트의 지속 방출에 효과적인 속도로 약물을 방출한다.
생분해성 안내 임플란트의 일례는 생분해성 폴리머 매트릭스와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함하며, 상이한 생분해성 폴리머들의 혼합물을 포함한다. 적어도 하나의 생분해성 폴리머가 분자량 약 63.3 kD의 폴리락타이드이다. 제 2 생분해성 폴리머는 분자량 약 14 kD의 폴리락타이드이다. 이러한 혼합물은 눈에 임플란트 이식후 약 1개월 이상의 기간동안 치료학적으로 효과적인 양의 알파-2 아드레날린성 수용체 아고니스트를 지속방출하기에 효과적이다.
다른 예의 생분해성 안내 임플란트는 생분해성 폴리머 매트릭스와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함하며, 상이한 생분해성 폴리머들의 혼합물을 포함하고, 각각의 생분해성 폴리머는 약 0.16 dl/g 내지 약 1.0 dl/g의 고유점도를 가진다. 예를 들어, 생분해성 폴리머 중 하나가 약 0.3 dl/g의 고유점도를 가지고, 제 2 생분해성 폴리머는 약 1.0 dl/g의 고유점도를 가질 수 있다. 상기 고유 점도는 25℃에서의 0.1% 클로로포름 중에서 결정할 수 있다.
특정한 한 임플란트는 두가지 상이한 폴리락타이드 폴리머의 조합과 결합된 브리모니딘 타르트레이트를 포함한다. 브리모니딘 타르트레이트는 임플란트 중에 약 20 중량%로 존재한다. 한 폴리락타이드 폴리머는 약 14kD의 분자량 및 약 0.3 dl/g의 고유 점도를 가지며, 다른 폴리락타이드 폴리머는 약 63.3 kD의 분자량 및 약 1.0 dl/g의 고유 점도를 가진다. 두가지 폴리락타이드 폴리머가 임플란트 중에 1:1의 비율로 존재한다. 이러한 임플란트는 본 명세서에 설명한 바와 같이 생체 외에서 2개월 이상 동안 브리모니딘의 방출을 제공한다. 임플란트는 압출성형 공정에서 생성되는 로드 모양 또는 필라멘트 모양으로 제공된다.
생분해성 폴리머 매트릭스를 포함하는 안내 임플란트로부터 알파-2 아드레날린성 수용체 아고니스트의 방출은 폭발적인 초기 방출과 그 후 알파-2 아드레날린성 수용체 아고니스트의 방출량이 점진적으로 증가하는 것을 포함하거나, 또는 방출은 알파-2 아드레날린성 수용체 아고니스트의 초기에 방출이 미뤄지고, 그 후 방출이 증가되는 것을 포함할 수 있다. 임플란트가 실질적으로 완전히 분해되면, 분해된 알파-2 아드레날린성 수용체 아고니스트의 퍼센트가 약 100%가 된다. 기존의 임플란트와 비교하여, 본 명세서에 기재한 임플란트는 눈에 이식한 1주일 후까지도완전히 분해되지 않거나, 또는 약 100%의 알파-2 아드레날린성 수용체 아고니스트를 방출하지 않는다.
임플란트의 수명 동안 알파-2 아드레날린성 수용체 아고니스트가 임플란트로부터 비교적 일정한 속도로 방출되게 하는 것이 바람직하다. 예를 들어, 알파-2 아드레날린성 수용체 아고니스트가 임플란트의 수명 동안 1일당 약 0.01㎍ 내지 약 2㎍의 양으로 방출되는 것이 바람직하다. 그러나, 생분해성 폴리머 매트릭스의 조성에 따라 방출 속도를 증가시키거나 감소시켜 변화시킬 수 있다. 또한, 알파-2 아드레날린성 수용체 아고니스트의 방출 프로파일은 하나 이상의 직선형 부분 및/또는 하나 이상의 비-직선형 부분을 포함할 수 있다. 바람직하게, 일단 임플란트가 분해 또는 침식되기 시작하면 방출 속도는 0 이상이다.
임플란트는 모놀리식, 즉, 활성 제제 또는 제제들이 폴리머 매트릭스에 균질하게 분포 또는 캡슐화(encapsulate)된 형태일 일 수 있으며, 활성 제제의 저장소가 폴리머 매트릭스에 캡슐화되어 있을 수 있다. 제조가 쉽기 때문에, 모놀리식 임플란트는 보통 전체적으로 캡슐화된 형태가 바람직하다. 그러나, 치료학적 레벨의 약물이 짧은 기간에 집중되는, 캡슐화된, 저장소-형태 임플란트에 의해서 더 크게 제어되는 것이 몇몇 상황에서 장점이 될 수 있다. 또한, 알파-2 아드레날린성 수용체 아고니스트를 포함하는, 치료학적 구성성분이 비-균질 패턴으로 매트릭스 내에 분포될 수 있다. 예를 들어, 임플란트는 제 2 임플란트 부분과 비교하여 더 높은 농도의 알파-2 아드레날린성 수용체 아고니스트를 가지는 제 1 부분을 포함할 수 있다.
본 명세서에 설명한 안내 임플란트는 약 5 ㎛ 내지 약 2 mm 사이의 크기이거나, 또는 니들로 투여하기 위해서 약 10 ㎛ 내지 약 1mm의 크기이거나, 또는 수술적인 이식으로 투여하기 위해서는, 3 mm 또는 10mm까지에 이르는 것과 같이, 1 mm 이상, 또는 2 mm 이상일 수 있다. 사람의 유리체방은 예를 들어 길이가 1 내지 10 mm인 다양한 형태의 비교적 큰 임플란트를 수용할 수 있다. 임플란트는 지름이 약 2mm X 0.75 mm인 실린더형 펠릿(예를 들어, 로드)일 수 있다. 또는, 임플란트는 길이가 약 7 mm 내지 약 10mm이고 지름이 약 0.75 mm 내지 약 1.5 mm인 실린더형 펠릿일 수 있다.
임플란트는 또한 유리체와 같은 눈에 임플란트를 삽입하기 용이하면서 임플란트를 수용하기에 용이하도록 적어도 다소 플렉서블한 것일 수 있다. 임플란트의 총 중량은 보통 약 250-5000 ㎍, 더욱 바람직하게는 약 500-1000 ㎍이다. 예를 들어, 임플란트는 약 500㎍, 또는 약 1000㎍일 수 있다. 비-사람 개체에 대해서는, 개체의 종류에 따라 임플란트의 크기 및 총 중량이 더 크거나 더 작을 수 있다. 예를 들어, 사람은 유리체 부피가 약 3.8 ml인데 비하여 말은 약 30 ml이고 코끼리는 약 60-100 ml이다. 예를 들어, 말에 대해는 약 8배 더 크게, 코끼리에 대해서는 약 26배 더 크게, 사람에게 사용하기 위한 크기의 임플란트를 다른 동물에 맞도록 규모를 늘이거나 줄일 수 있다.
따라서, 중심부가 한 재료로 되어 있고, 표면은 동일한 또는 상이한 조성물의 하나 이상의 층으로 되어 층들이 교차-결합되거나, 또는 상이한 분자량, 상이한 밀도 또는 다공성 등을 가지도록 임플란트를 제조할 수 있다. 예를 들어, 약물을 초기에 덩어리로 재빨리 방출하는 것이 바람직한 경우, 초기 분해 속도를 향상시키시 위해서 중심부는 폴리락테이트-폴리글리콜레이트 코폴리머로 코팅된 폴리락테이트일 수 있다. 이와 달리, 폴리락테이트 외피가 분해하는 동안 중심부가 용해되어 재빨리 눈에서 씻겨나가도록, 중심부가 폴리락테이트로 코팅된 폴리비닐 알콜일 수 있다.
임플란트는 섬유, 시트, 필름, 마이크로스피어, 구형, 원형 디스크, 플랙(plaque) 등을 포함하는 어떤 형태일 수 있다. 임플란트 크기의 상한은 임플란트에 대한 내성, 삽입시 크기 제한, 취급 용이성 등의 인자들에 의해서 결정된다. 시트 또는 필름을 사용하는 경우, 취급이 용이하도록 시트 또는 필름은 약 0.1-1.0 mm 두께로 적어도 약 0.5 mm x 0.5 mm, 보통 약 3-10 mm x 5-10 mm의 범위이다. 섬유를 사용하는 경우, 섬유 지름은 일반적으로 약 0.05 내지 3 mm의 범위이고, 섬유 길이는 일반적으로 약 0.5-10 mm 범위이다. 구형은 지름이 0.5 ㎛ 내지 4 mm의 범위이고, 다른 모양의 입자들과 비슷한 부피이다.
임플란트의 크기 및 모양은 또한 방출 속도, 처치 기간 및 이식부위의 약물 농도를 제어하는 데 사용될 수 있다. 임플란트가 클수록 비례하여 더 많은 투여량이 송달되지만, 표면 대 질량 비율에 따라, 방출속도는 더 느리다. 이식 부위에 적합하도록 특정한 크기 및 모양의 임플란트를 선택한다.
알파-2 아드레날린성 수용체 아고니스트, 폴리머 및 다른 수정제(modifier)의 비율은 다양한 비율의 몇가지 임플란트를 조성하여 경험적으로 결정한다. 용해 및 방출 테스트 방법이 입증된 미국특허를 사용하여 방출 속도를 측정할 수 있다(USP 23; NF 18 (1995) pp.1790-1798). 예를 들어, 무한 싱크법(infinite sink method)을 사용하여, 정량된 임플란트 샘플을 측정된 부피의 물 중에 0.9 % NaCl을 포함하는 용액에 가하고, 용액 부피는 방출 후 약물 농도가 포화상태의 5% 이하가 되도록 한다. 혼합물을 37℃로 유지하고 천천히 교반하여 임플란트가 현탁액으로 유지되게 한다. 시간의 함수로서 용해된 약물의 상태를, 분광광도법적으로, HPLC, 질량 분석법 등과 같은 당해 분야에 공지된 다양한 방법으로 흡수가 일정해질 때까지 또는 90% 이상의 약물이 방출될 때까지 관찰할 수 있다.
본 명세서에 기재된 안내 임플란트에 포함되는 알파-2 아드레날린성 수용체 아고니스트 또는 알파-2 아드레날린성 수용체 아고니스트들 외에도, 안내 임플란트는 또한 하나 이상의 추가적인 안과적으로 허용가능한 치료학적 제제를 포함할 수 있다. 예를 들어, 임플란트는 하나 이상의 항히스타민제, 하나 이상의 항생제, 하나 이상의 베타 차단제, 하나 이상의 스테로이드, 하나 이상의 항종양제, 하나 이상의 면역억제제, 하나 이상의 항바이러스제, 하나 이상의 항산화제 및 이들의 혼합물을 포함할 수 있다.
본 시스템에 사용할 수 있는 약학 또는 치료학적 제제는 이에 제한되지는 않지만 미국 특허 4,474,451, 컬럼 4-6 및 4,327,725 컬럼 7-8에 기재된 것들을 포함할 수 있다.
항히스타민제의 예로는, 이에 제한되지는 않지만, 로라다틴, 히드록시진, 디펜히드라민, 클로로페니라민, 브로모페니라민, 시프로헵타딘, 테르페나딘, 클레마스틴, 트리프롤리딘, 카르비녹사민, 디페닐피랄린, 페닌다민, 아자타딘, 트리펠렌나민, 덱스클로르페니라민, 덱스브롬페니라민, 메스딜라진(methdilazine) 및 트림프라진 독실라민, 페니라민, 피릴아민, 키오르시클리진(chiorcyclizine), 손질아민(thonzylamine) 및 이들의 유도체가 포함된다.
항생제의 예로는, 이에 제한되지는 않지만, 세파졸린, 세프라딘, 세파클로르, 세파피린, 세프티족심, 세포페라존, 세포테탄, 세푸톡심(cefutoxime), 세포탁심, 세파드록실, 세프타지딤, 세팔렉신, 세팔로틴, 세파만돌, 세폭시틴, 세포니시드, 세포라니드, 세프트리악손, 세파드록실, 세프라딘, 세푸록심, 암피실린, 아목시실린, 시클라실린, 암피실린, 페니실린 G, 페니실린 V 포타슘, 피페라실린, 옥사실린, 바캄피실린, 크록사실린, 티카르실린, 아즐로실린, 카르베니실린, 메티실린, 나프실린, 에리스로마이신, 테트라시클린, 독시시클린, 미노시클린, 아즈트레오남, 클로람페니콜, 시프로플록사신 하이드로클로라이드, 클린다마이신, 메트로니다졸, 젠타마이신, 린코마이신, 토브라마이신, 반코마이신, 폴리마이신 B 설페이트, 콜리스티메테이트, 콜리스틴, 아지스로마이신, 오구멘틴, 술파메톡사졸, 트리메토프림, 및 이들의 유도체가 포함된다.
베타 차단제의 예로는, 이에 제한되지는 않지만, 아세부톨롤, 아테놀롤, 라베탈롤, 메토프로롤, 프로프라놀롤, 티몰롤 및 이의 유도체가 포함된다.
스테로이드의 예로는, 이에 제한되지는 않지만, 코르티손, 프레드니솔론, 플루오로메톨론, 덱사메타손, 메드리손, 로테프레드놀, 플루아자코르트, 하이드로코르티손, 프레드니손, 베타메타손, 프레드니손, 메틸프레드니솔론, 리암시놀론 헥사카토나이드(riamcinolone hexacatonide), 파라메타손 아세테이트, 디플로라손, 플루오시노나이드, 플루오시놀론, 트리암시놀론, 이들의 유도체 및 이의 혼합물이 포함된다.
항종양제의 예로는, 이에 제한되지는 않지만, 아드리아마이신, 시클로포스파미드, 액티노마이신, 블레오마이신, 두아노루비신, 독소루비신, 에피루비신, 미토마이신, 메토트렉세이트, 플루오로우라실, 카르보플라틴, 카르무스틴(BCNU), 메틸-CCNU, 시스플라틴, 에토포시드, 인터페론, 캄프토테신 및 이들의 유도체, 페네스테린, 탁솔 및 이들이 유도체, 탁소테레 및 이의 유도체, 빈블라스틴, 빈크리스틴, 타목시펜, 에토포시드, 피포술판, 시클로포스파미드 및 플루타미드, 및 이들의 유도체가 포함된다.
면역억제제의 예로는, 이에 제한되지는 않지만, 시클로스포린, 아자티오프린, 타크로리무스, 및 이들의 유도체가 포함된다.
항바이러스제의 예로는, 이에 제한되지는 않지만, 인터페론 감마, 지도부딘, 아만타딘 하이드로클로라이드, 리바비린, 아시클로비르, 발시클로비르, 디데옥시시티딘, 포스포노포름산, 간시클로비르 및 이들의 유도체가 포함된다.
항산화제의 예로는, 이에 제한되지는 않지만, 아스코베이트, 알파-토코페롤, 만니톨, 환원 글루타티온, 다양한 카로테노이드류, 시스테인, 요산, 타우린, 티로신, 수퍼옥사이드 디스뮤타아제, 루테인, 제악산틴, 크리오트프산틴 (cryotpxanthin), 아스타잔틴, 라이코펜, N-아세틸-시스테인, 카르노신, 감마-글루타밀시스테인, 퀘르시틴, 락토페린, 디하이드로리포산, 시트레이트, 은행나무(Ginko Biloba) 추출물, 차 카테킨, 빌베리 추출물, 비타민 E 또는 비타민 E의 에스테르, 레티닐 팔미테이트, 및 이들의 유도체가 포함된다.
다른 치료학적 제제로는 스쿠알라민, 카보닉 안하이드라아제 억제제, 알파 아고니스트, 프로스타마이드, 프로스타글란딘, 구충제, 항진균제 및 이들의 유도체를 포함한다.
개별적으로 또는 조합하여 임플란트에 사용되는 활성 제제 또는 제제들의 양은 필요한 유효 투여량 및 바람직한 임플란트 방출속도에 따라 광범위하게 달라질 것이다. 보통, 제제는 임플란트의 적어도 약 1, 더욱 통상적으로는 적어도 약 10 중량%이고, 보통 임플란트의 약 80, 더욱 통상적으로는 약 40 중량%를 넘지 않는다.
치료학적 구성성분 외에, 본 명세서에 기재된 안내 임플란트는 유효량의 완충제, 방부제 등을 포함할 수 있다. 적합한 수용성 완충제로는, 이에 제한되지는 않지만, 소듐 포스페이트, 시트레이트, 보레이트, 아세테이트, 비카르보네이트, 카르보네이트 등과 같은 알칼리 및 알칼리토 카보네이트, 포스페이트, 비카르보네이트, 시트레이트, 보레이트, 아세테이트, 숙시네이트 등을 포함한다. 이러한 제제는 약 2 내지 약 9 사이로 시스템의 pH를 유지하는 데 충분한 양으로 존재하는 것이 유리하며, 약 4 내지 약 8이 더욱 바람직하다. 이러한 완충제는 전체 임플란트의 약 5 중량%만큼일 수 있다. 적합한 수용성 방부제로는 소듐 비설파이트, 소듐 비설페이트, 소듐 티오설페이트, 아스코르베이트, 벤즈알코늄 클로라이드, 클로로부탄올, 티메로살, 페닐머큐릭 아세테이트, 페닐머큐릭 보레이트, 페닐머큐릭 니트레이트, 파라벤, 메틸파라벤, 폴리비닐 알콜, 벤질 알콜, 페닐에탄올 등 및 이들의 혼합물이 포함된다. 이러한 제제들은 0.001 내지 약 5 중량%, 바람직하게는 0.01 내지 약 2 중량%의 양으로 존재할 수 있다. 적어도 하나의 본 임플란트에, 예를 들어, 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘인 경우, 퓨라이트(purite) 방부제가 임플란트에 제공된다. 따라서, 이러한 임플란트는 치료학적으로 효과적인 양의 Alphagan-P®를 포함할 수 있다.
몇몇 상황에서, 동일한 또는 상이한 생리학적 제제를 사용할 때 임플란트의 혼합물을 사용할 수 있다. 이러한 경우, 단일 투여를 통해 2상 또는 3상 방출을 제공하는 방출 프로파일의 칵테일이 달성되며, 방출 패턴은 상당히 다양할 수 있다.
또한, 미국 특허 5,869,079에 기재된 것과 같은 방출 조절제를 임플란트에 포함시킬 수 있다. 사용되는 방출 조절제의 양은 원하는 방출 프로파일, 조절제의 활성에 따라 다르며, 조절제가 없을 때의 알파-2 아드레날린성 수용체 아고니스트의 방출 프로파일에 따라 다르다. 소듐 클로라이드 및 포타슘 클로라이드와 같은 전해질이 또한 임플란트에 포함된다. 완충제 또는 강화제가 친수성인 경우, 방출 촉진제로서도 작용할 수 있다. 친수성 첨가제는 약물 입자를 둘러싸는 재료가 더 빨리 용해되도록 하고, 노출되는 약물의 표면적 증가로 약물 생침식 속도가 증가되도록 함으로써 방출 속도를 증가시키는 작용을 한다. 유사하게, 소수성 완충제 또는 강화제는 더욱 천천히 용해되어, 약물 입자의 노출을 느리게 함으로써 약물 생침식 속도를 늦춘다.
특정한 임플란트에서, 브리모니딘 또는 브리모니딘 타르트레이트 및 생분해성 폴리머 매트릭스를 포함하는 임플란트는 눈에 이식후 약 3-6 개월동안 약 0.1 mg 내지약 0.5 mg의 양의 브리모니딘을 방출 또는 송달할 수 있다. 임플란트는 로드 모양 또는 웨이퍼 모양일 수 있다. 로드-모양 임플란트는 720㎛ 노즐로부터 압출성형된 필라멘트를 1 mg 크기로 잘라서 얻을 수 있다. 웨이퍼-모양 임플란트는 지름이 약 2.5 mm, 두께가 약 0.127 mm, 무게가 약 1 mg인 원형 디스크일 수 있다.
제안된 3-개월 방출 조성물은 멸균될 수 있으며, 생침식가능하고, PLA 매트릭스 또는 POE 매트릭스 중에 브리모니딘 타르트레이트를 포함하는 막대, 웨이퍼 또는 마이크로스피어 형태이다. 임플란트는 약물의 클리어런스(clearance)를 지체시키고 3-개월간 반복 이식의 필요를 감소시켜 합병증의 위험성을 낮추도록 디자인된다.
다양한 기술을 사용하여 본 명세서에 설명한 임플란트를 제공할 수 있다. 유용한 기술로는, 필수적인 것은 아니지만, 용매 증발법, 상분리법, 계면법, 몰딩법, 주입 몰딩법, 압출성형법, 공압출성형법, 카버 프레스법(carver press method), 다이 커팅법, 열압착법, 이들의 조합 등이 포함된다.
특정한 방법이 미국특허 4,997,652에 논의되었다. 제조시 용매의 필요성을 제거하기 위해서 압출성형법이 사용될 것이다. 압출성형법을 사용하는 경우, 제조에 필요한 온도, 보통 적어도 약 85℃에서 안정하도록 폴리머 및 약물을 선택한다. 압출성형법은 약 25℃ 내지 약 150℃의 온도를 사용하며, 더욱 바람직하게는 약 65℃ 내지 약 130℃이다. 임플란트는 약 0 내지 1시간, 0 내지 30분, 또는 5-15분의 기간동안 약물/폴리머 혼합물에 대하여 온도를 약 60℃ 내지 약 150℃, 예를 들어, 약 130℃가 되게 제공된다. 예를 들어, 시간은 약 10분, 바람직하게는 약 0 내지 5분이다. 그리고 나서, 임플란트를 약 60℃ 내지 약 130℃, 예를 들어, 약 75℃의 온도에서 압출성형한다.
또한, 임플란트는 임플란트를 제조하는 동안 코어 영역 위로 코팅이 형성되도록 공압출성형될 수 있다.
압착법을 임플란트 제조에 사용할 수 있으며, 전형적으로 압출성형법보다 더 신속한 방출 속도를 가지는 임플란트를 얻을 수 있다. 압착법은 약 50-150 psi, 더욱 바람직하게는 약 70-80 psi, 훨씬 더 바람직하게는 76 psi의 압력을 사용할 수 있으며, 약 0℃ 내지 약 115℃, 더욱 바람직하게는 약 25℃의 온도를 사용할 수 있다.
본 발명의 임플란트는 공막을 2-3 mm 절개한 후 포셉 또는 트로카로 넣는 것을 포함하는 다양한 방법으로 눈, 예를 들어, 눈의 유리체방에 삽입될 수 있다. 눈에 임플란트를 삽입하는 데 사용할 수 있는 장치의 일례가 미국특허공개 2004/0054374에 개시되어 있다. 배치 방법은 치료학적 구성성분 또는 약물 방출 동력학에 영향을 줄 수 있다. 예를 들어, 트로카를 사용하여 임플란트를 수송하면 포셉을 사용하는 것보다 임플란트가 유리체에 더 깊게 배치되어, 임플란트가 유리체의 모서리에 더 가깝게 배치된다. 임플란트의 위치는 치료학적 구성성분 또는 약물을 둘러싸는 구성요소의 농도 그레디언트에 영향을 줄 수 있으며, 따라서 방출 속도에 영향을 줄 수 있다(예를 들어, 구성요소가 유리체의 모서리에 더 가깝게 배치될수록 방출 속도가 느리게 된다).
본 임플란트는 일정시간 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 눈에 방출하여 망막 혈관 폐색과 같은 혈관 폐색을 최소화하도록 구성된다. 망막 혈관 폐색은 망막 동맥 폐색 질환, 중심성 망막 정맥 폐색, 파종성 혈관내응고증 (disseminated intravascular coagulopathy), 망막 분지 정맥 폐색(branch retinal vein occlusion), 고혈압성 안저변화(hypertensive fundus changes), 안허혈 증후군(ocular ischemic syndrome), 망막 동맥 미세혈관류(retinal arterial microaneurysms), 반측 망막정맥폐색(hemi-retinal vein occlusion), 중심성 망막 동맥 폐색(central retinal artery occlusion), 망막 분지 동맥 폐색(branch retinal artery occlusion), 경동맥 질환(CAD), 일스 병(Eales disease) 및 당뇨병과 관련된 혈관병증과 같은 다양한 질환의 결과로 나타날 수 있다. 알파-2 아드레날린성 수용체 아고니스트-함유 임플란트를 눈의 유리체에 이식함으로써, 아고니스트가 눈에 위치한 혈관내의 폐색을 감소시는데 작용하는 것으로 여겨진다.
또한, 본 임플란트는 알파-2 아드레날린성 수용체 아고니스트를 환자의 녹내장을 처치하는 데 효과적인 기간동안 치료학적으로 효과적인 양으로 방출하도록 구성된다.
본 명세서에 개시된 임플란트는 또한, 상기한 바와 같이, 하기와 같은 질병 또는 질환을 처치하는 데 효과적인 추가적인 치료학적 제제를 방출하도록 구성될 수 있다:
황반병증(maculopathy)/망막 변성: 비-삼출성 노인성 황반 변성(ARMD), 삼출성 노인성 황반변성(ARMD), 맥락막 혈관신생(choroidal neovasculariza tion), 당뇨병성 망막증, 급성 황반성 신경망막병증 (acute Macular Neuroretino pathy), 중심성 장액성 맥락망막병증(central serous chorioretinopathy), 낭포성 황반부종, 당뇨병성 황반부종.
포도막염/망막염/맥락막염: 급성 다발성 판상색소 상피증(acute multifocal placoid epitheliopathy), 베체트 병, 버드샷 망막맥락막증(birdshot retinochoroidopathy), 전염병 (매독, 라임병, 결핵, 톡소플라스마증), 중간포도막염(평면부염), 다소성 맥락막염(multifocal choroiditis), 다발성 소실성 백반증후군(multiple evanescent white dot syndrome; MEWDS), 눈의 사르코이드증(ocular sarcoidosis), 후공막염(posterior scleritis), 사행성 맥락막염(serpiginous choroiditis), 망막하 섬유화 및 포도막염 증후군(subretinal fibrosis and uveitis syndrome), 보그트-고야나기-하라다 증후군(Vogt-Koyanagi-and Harada syndrome).
혈관 질환/삼출성 질환: 코우츠 병(Coat's disease), 중심오목부근 모세혈관확장증(parafoveal telangiectasis), 유두정맥염(papillophlebitis), 언가지모양혈관염(frosted branch angiitis), 겸상세포 망막증(sickle cell retinopathy) 및 다른 혈색소병증(hemoglobinopathie), 혈관무늬 망막증(angioid streaks), 가족성 삼출 유리체망막증(familial exudative vitreoretinopathy).
외상성/수술성 질환: 교감성안염(sympathetic ophthalmia), 포도막 망막 질환, 망막 박리, 외상, 레이저로 인한 질환, PDT, 광응고술(photocoagulation), 수술 중 저관류(hypoperfusion), 방사선 망막증(radiation retinopathy), 골수 이식 망막증.
증식성 질환: 증식성 유리체 망막증과 망막전막(epiretinal membranes), 증식성 당뇨병성 망막증.
감염성 질환: 안 히스토플라즈마증, 안 톡소카라증, 추정 안 히스토플라즈마증 증후군(presumed ocular histoplasmosis syndrome, POHS), 내안구염(endophthalmitis), 톡소플라즈마증, HIV 감염과 관련된 망막 질환, HIV 감염과 관련된 맥락막 질환, HIV 감염과 관련된 포도막 질환, 바이러스성 망막염, 급성 망막 괴사, 진행성 외부 망막괴사, 진균성 망막 질환, 안 매독, 안 결핵, 광범위 일측 아급성 신경망막염(diffuse unilateral subacute neuroretinitis), 구더기증(myiasis).
유전성 질환: 색소성 망막염, 망막 이영양증(retinal dystrophies)과 관련된 전신질환, 선천성 정지형 야맹증(congenital stationary night blindness), 추체 이영양증(cone dystrophies), 스타르가르트병(Stargardt's disease) 및 노란점 안저(fundus flavimaculatus), 베체트 병, 망막 색소 상피의 패턴 이영양증(pattern dystrophy of the retinal pigmented epithelium), X-염색체관련 망막층간분리(X-linked retinoschisis), 소르스비 안저 이영양증(Sorsby's fundus dystrophy), 양성 동심성 황반병증(benign concentric maculopathy), 비에티 결정 이영양증(Bietti's crystalline dystrophy), 탄성섬유 가성 황색종(pseudoxanthoma elasticum).
망막 열공/원공(retinal tears/holes): 망막 박리, 황반 원공, 거대 망막 열공.
종양: 종양과 관련된 망막 질환, 망막 색소 상피의 선천성 비후(congenital hypertrophy), 후부 포도막 흑색종(posterior uveal melanoma), 맥락막 혈관종(choroidal hemangioma), 맥락막 골종(choroidal osteoma), 맥락막 전이, 망막 및 망막 색소 상피의 복합 과오종(combined hamartoma of the retina and retinal pigmented epithelium), 망막아세포종, 안저의 혈관증식성 종양(vasoproliferative tumors of the ocular fundus), 망막별아교세포종(retinal astrocytoma), 안내 림프성 종양.
다양한 다른 질환: 점상내층맥락막병증(punctate inner choroidopathy), 급성 후부 다발성 판상색소 상피증(acute posterior multifocal placoid pigment epitheliopathy), 근시성 망막 변성, 및 급성 망막 색소 상피염(retinal pigement epithelitis) 등.
일 실시형태에서, 본 명세서에 개시된 임플란트와 같은 임플란트는 사람 또는 동물 환자, 바람직하게, 살아있는 사람 또는 동물의 후안부에 투여된다. 적어도 하나의 실시형태에서, 임플란트는 눈의 망막하 공간에 접근하지 않고 투여된다. 예를 들어, 환자를 처치하는 방법은 임플란트를 직접 후안방에 넣는 것을 포함할 수 있다. 다른 실시형태에서, 환자를 처치하는 방법은 적어도 한번의 유리체내 주사, 결막하 주사, 테논낭하(sub-tenon) 주사, 후구(retrobulbar) 주사 및 맥락막상 주사를 통하여 임플란트를 환자에 투여하는 것을 포함한다.
적어도 하나의 실시형태에서, 환자에서 망막 혈관 폐색을 감소시키는 방법은 하나 이상의 알파-2 아드레날린성 수용체 아고니스트를 포함하는 하나 이상의 임플란트를 본 명세서에 설명한 바와 같이 적어도 하나의 유리체내 주사, 결막하 주사, 테논낭하(sub-tenon) 주사, 후구(retrobulbar) 주사 및 맥락막상 주사를 통하여 환자에 투여하는 것을 포함한다. 사람 또는 동물의 후안부에 조성물을 주사하기 위해서 적절한 크기의 니들, 예를 들어, 27 게이지 니들 또는 30 게이지 니들을 포함하는 시린지 장치를 효과적으로 사용할 수 있다. 알파-2 아드레날린성 수용체 아고니스트가 임플란트로부터 연장된 기간동안 방출되기 때문에 보통 반복 주사는 필요하지 않다.
또다른 본 발명의 실시형태에서는, a) 브리모니딘 유리염기 또는 브리모니딘 타르트레이트(예를 들어, Alphagan-P)와 같은 알파-2 아드레날린성 수용체 아고니스트를 포함하는 치료학적 구성성분 및 약물 방출 지속 구성성분을 포함하는 연장 방출 임플란트를 포함하는 컨테이너; 및 b) 사용 설명서를 포함하는 눈의 안질환을 처치하기 위한 키트가 제공된다. 설명서는 임플란트 취급방법, 임플란트를 눈영역에 이식하는 방법 및 임플란트를 사용하여 얻을 수 있는 효과를 포함할 수 있다.
도 1은 37℃의 0.9% 포스페이트 완충된 염수에서 결정된, 생분해성 브리모니딘 타르트레이트 포함 임플란트의 누적 방출 프로파일을 나타내는 그래프이다.
도 2는 상이한 조합의 생분해성 폴리머를 포함하는 생분해성 브리모니딘 유리염기의 누적 방출 프로파일을 나타내는, 도 1과 유사한 그래프이다.
도 3은 상이한 농도의 브리모니딘 타르트레이트를 가지는 생분해성 브리모니 딘 타르트레이트 포함 임플란트의 누적 방출 프로파일을 나타내는, 도 1과 유사한 그래프이다.
도 4는 상이한 농도의 브리모니딘 타르트레이트 및 폴리머 혼합물을 가지는 생분해성 브리모니딘 타르트레이트 포함 임플란트의 누적 방출 프로파일을 나타내는, 도 1과 유사한 그래프이다.
도 5는 상이한 농도의 브리모니딘 타르트레이트 및 폴리머 혼합물을 가지는 생분해성 브리모니딘 유리염기 포함 임플란트의 누적 방출 프로파일을 나타내는, 도 4와 유사한 그래프이다.
도 6은 상이한 농도의 브리모니딘 타르트레이트 및 폴리머 조합을 가지는 브리모니딘 타르트레이트 포함 임플란트(웨이퍼)의 누적 방출 프로파일을 나타내는 그래프이다.
도 7은 상이한 농도의 브리모니딘 타르트레이트 및 폴리머 혼합물을 가지는 생분해성 브리모니딘 유리염기 포함 임플란트의 누적 방출 프로파일을 나타내는, 도 6과 유사한 그래프이다.
도 8은 상이한 농도의 브리모니딘 타르트레이트 및 폴리머 혼합물을 가지는 생분해성 브리모니딘 유리염기 포함 임플란트의 누적 방출 프로파일을 나타내는, 도 4와 유사한 그래프이다.
도 9는 생분해성 브리모니딘 유리염기 포함 웨이퍼 임플란트의 누적 방출 프로파일을 나타내는, 도 5와 유사한 그래프이다.
도 10은 브리모니딘 타르트레이트 포함 생분해성 임플란트 또는 플래시보 임플란트를 수용한 원숭이에서, 시간에 따른 망막 분지 정맥 폐색(BRVO) 후 혈관조영술 동안 소듐 플루오레세인의 충전 지속시간을 나타낸다.
도 11은 BRVO를 경험한, 브리모니딘 타르트레이트 포함 생분해성 임플란트 또는 플래시보 임플란트를 수용한 원숭이에서, 시간의 함수로서 중심와 두께(foveal thickness)의 그래프이다.
도 12는 BRVO를 경험한, 브리모니딘 타르트레이트 포함 생분해성 임플란트 또는 플래시보 임플란트를 수용한 원숭이에서, 시간의 함수로서 안압의 그래프이다.
도 13은 BRVO를 경험한, 브리모니딘 타르트레이트 포함 생분해성 임플란트 또는 플래시보 임플란트를 수용한 원숭이에서, 시간에 대한 함수로서의 다국소 망막전위도검사(multifocal ERG)에 대한 상측/하측 반응 퍼센트의 그래프이다.
도 14는 BRVO를 경험한, 브리모니딘 타르트레이트 포함 생분해성 임플란트 또는 플래시보 임플란트를 수용한 원숭이에서, 시간에 대한 함수로서의 혈류의 그래프이다.
도 15는 브리모니딘 임플란트 또는 플래시보 임플란트의 유리체내 투여 2주후 정상 래빗 우측 눈(X-축)에서 시력(처치하지 않은 [대조구] 좌측 눈 시력의 퍼센트로서)(Y-축)에 대한 효과를 나타내는 막대 그래프이다.
도 16은 우측 눈에 브리모니딘 임플란트 또는 플래시보 임플란트의 유리체내 투여 3주후 및 동일한 우측 눈의 VEGF 유도 손상 일주일 후(X-축), 시력(처치하지 않은 [대조구] 좌측 눈 시력의 퍼센트로서)(Y-축)에 대한 효과를 나타내는 막대 그 래프이다.
도 17은 우측 눈에 브리모니딘 임플란트 또는 플래시보 임플란트의 유리체내 투여 12주후 및 동일한 우측 눈의 유도된 허혈성 손상 11개월 후(X-축), 시력(처치하지 않은 [대조구] 좌측 눈 시력의 퍼센트로서)(Y-축)에 대한 효과를 나타내는 막대 그래프이다.
실시예 1
브리모니딘과
생분해성
폴리머
매트릭스를 포함하는 임플란트의 제조 및 테스트
스테인리스 스틸 모르타르(mortar)에서 브리모니딘 타르트레이트 또는 브리모니딘 유리염기를 생분해성 폴리머 조성물과 조합하여 생분해성 임플란트를 제조하였다. 조합물을 96 RPM으로 설정된 터뷸러 쉐이커(Tubula shaker)로 15분간 혼합하였다. 파우더 블렌드를 모르타르의 벽에서 긁어낸 다음 추가로 15분간 다시 혼합하였다. 혼합된 파우더 블렌드를 특정 온도로 총 30분간 반쯤 녹은 상태로 가열하여 폴리머/약물 용융물을 생성하였다.
9 게이지 폴리테트라플루오로에틸렌(PTFE) 배관을 사용하여 폴리머/약물 용융물을 펠렛화하고, 펠렛을 배럴에 채우고 특정 코어 압출성형 온도에서 재료를 필라멘트로 압출성형하여 로드(rod)를 제조하였다. 그리고 나서, 필라멘트를 약 1mg 크기임플란트 또는 약물 송달 시스템으로 절단하였다. 로드는 약 2 mm 길이 x 0.72 mm 지름의 크기를 가졌다. 로드 임플란트는 약 900 ㎍ 내지 1100 ㎍로 칭량 되었다.
특정 온도에서 카버 프레스를 사용하여 폴리머 용융물을 평평하게 하여 웨이퍼를 성형하고 평평하게 된 재료를 각각 약 1 mg으로 칭량되는 웨이퍼로 절단하였다. 웨이퍼는 지름이 약 2.5 mm이고 두께가 약 0.13 mm이었다. 웨이퍼 임플란트는 약 900 ㎍ 내지 1100㎍으로 칭량되었다.
초기에는 6벌, 나중에는 4벌로 각 벌의 임플란트(로드 또는 웨이퍼)에 대하여 생체외 방출 테스트를 실시하였다. 각각의 임플란트를 37℃에서 10ml의 포스페이트 완충된 염수용액이 들어있는 24ml 스크류 캡 바이알에 넣고, 1, 4, 7, 14, 28 일 및 그 후에는 2주에 한번씩 1ml 분취량을 버리고 동일한 부피의 신선한 매질로 대체하였다.
Waters 2690 분리 모듈(또는 2696) 및 Waters 2996 광다이오드 어레이 검출기로 구성된 HPLC로 약물 에세이를 실시하였다. 울트라스피어, C-18(2), 5㎛; 30℃로 가열된 4.6 x 150 mm 컬럼을 분리에 사용하고, 검출기를 264 nm로 설정하였다. 이동상은 유속이 1ml/min이고 총 런타임이 샘플당 12min인, (10:90) MeOH-완충된 이동상이었다. 완충된 이동상은 (68:0.75:0.25:31) 13mM 1-헵탄 술폰산, 소듐염-빙초산-트리에틸아민-메탄올로 구성되었다. 시간에 따라 소정 부피의 매질 중에 방출되는 약물의 양을 계산하여 ㎍/일로 방출 속도를 결정하였다.
임플란트를 위해 선택된 폴리머는 베링거 잉겔하임에서 입수하였다. 폴리머는: RG502, RG752, R202H, R203 및 R206, 및 Purac PDLG (50/50)이었다. RG502는 (50:50) 폴리(D,L-락타이드-코-글리콜리드)이고, RG752는 (75:25) 폴리(D,L-락타이 드-코-글리콜리드)이고, R202H는 산 종말기 또는 말단 산 그룹을 가지는 100% 폴리(D,L-락타이드)이고, R203 및 R206는 둘다 100% 폴리(D,L-락타이드)이다. Purac PDLG (50/50)은 (50:50) 폴리(D,L-락타이드-코-글리콜리드)이다. RG502, RG752, R202H, R203, R206 및 Purac PDLG의 고유점도는 각각 0.2, 0.2, 0.2, 0.3, 1.0 및 0.2 dl/g이다. RG502, RG752, R202H, R203, R206, 및 Purac PDLG의 평균 분자량은 각각 11700, 11200, 6500, 14000, 63300, 및 9700 달톤이다.
전체 53개의 조성물, 31개 로드 및 22개 웨이퍼를 제조하였다. 로드 조성물 중에서, 4개는 방출기간이 3개월보다 더 길었고 3개는 방출기간이 6개월보다 더 길었다. 웨이퍼 조성물 중에서, 7개는 방출기간이 3개월보다 더 길었고, 4개는 방출기간이 4개월보다 더 길었다.
로드 조성물의 리스트를 표 1에 나타내었고, 웨이퍼 조성물의 리스트를 표 2에 나타내었다.
로드 조성물
첫번째 10개의 조성물을 5개의 상이한 폴리머, RG752, RG502, R203, R206, 및 R202H를 사용하여 브리모니딘 타르트레이트 및 브리모니딘 유리염기 모두에 대해서 각각 50% w/w 약물 부하로 제조하였다. 방출 프로파일을 브리모니딘 타르트레이트에 대해서 도 1에, 브리모니딘 유리염기에 대하여 도 2에 나타내었다.
대부분의 케이스에서, RG502를 제외하고는 동일한 폴리머를 사용하여 브리모니딘 유리염기로 제조된 것보다 브리모니딘 타르트레이트를 사용하여 제조한 조성물이 더욱 신속한 초기의 폭발적인 방출을 나타내었다. 데이터는 또한 폴리(D,L-락타이드)매트릭스 (R203, R206, 및 R202H) 중에서 조성되는 경우, 브리모니딘 타르트레이트는 첫날(F5 및 F7)에 완전히 방출된 반면에, 브리모니딘 유리염기는 약 30일의 지속 시간을 가진다는 것을 나타낸다. 이것은 임플란트의 표면 상에서 브리모니딘 타르트레이트가 신속히 용해하기 때문일 것이다.
약물 용량이 50% 이하인 R203 및 R206을 사용한 몇가지 조성물을 제조하고, 방출 프로파일을 도 3에 나타내었다. 약물 부하가 50%에서 25%로 낮아진 경우 극적인 효과가 관찰되었다. 예를 들어, 조성물 #9는 R206 중의 25% 브리모니딘 타르트레이트를 사용하여 제조하였고, 안정상태가 되기 전 105일 후 총 방출 89%를 제공하였다. 이것을 R206 중의 50% 브리모니딘 타르트레이트인 조성물 #7과 비교하면, 이것은 하루에 100% 방출되었다. 유사하게, 조성물 #10은 R203 중의 25% 브리모니딘 타르트레이트를 사용하여 제조하였고, 안정상태가 되기 전 105일 후 총 방출 90%를 제공하였다. 이것을 조성물 #5와 비교하면, 조성물 #5는 1일에 74%가 방출되었다.
R206 중의 20% 브리모니딘 타르트레이트(F24)에서는, 방출 시작 전에 14일 지속 시간이 존재하며 134일 후에 결국 89.5% 방출에 도달한다. R206 중의 15% 브리모니딘 타르트레이트(F16)에서는, 방출 시작 전의 지속시간이 28일로 증가되고, 175일 후에 결국 97.6% 방출에 도달한다.
조성물 #9 및 #10의 방출 프로파일은 정반대지만 상호보완적인 방식으로 나타난다. 즉, 한 폴리머가 빠른 방출을 나타내는 반면에 다른 것은 지체된 방출을 나타내지만, 둘은 동일한 시간에 동일한 종말점에 도달한다. 두가지 폴리머가 모두 낮은 약물 부하로 조합된 경우, 도 4에 나타낸 바와 같이 더욱 직선적이고 더욱 긴 방출 프로파일이 얻어진다.
데이터는 20% 브리모니딘 타르트레이트/(1:1) R203/R206, 조성물 #17이 6개월 방출 임플란트를 위한 바람직한 생체외 방출 프로파일을 가진다는 것을 보여준다. 이것은 175일 후에 약 90% 브리모니딘 타르트레이트를 방출하였다. 또한, R203과 R206의 비율을 달리하면 동일한 약물 부하(조성물 #17, #18 및 #53)라도, 상이한 방출 프로파일을 얻게 되는 것으로 나타났다.
더욱 직선형인 방출 프로파일을 얻을 수 있는 지 알아보기 위해서 폴리머 블렌드로 브리모니딘 유리염기 조성물을 또한 제조하였다. 수성 매질에서의 낮은 용해도와 각 폴리머에서의 방출 특성을 알고 있으므로, RG502 - RG752, 및 RG502 - R203의 상이한 조합을 제조하였고, 방출 프로파일을 도 5에 나타내었다.
3개 조성물 모두에 대하여 방출 지속시간이 약 2 개월이었지만, 3개 모두 1 내지 2 주의 지속 시간을 나타내었다. Purac 폴리머, PDLG(50/50)-Mw 9700와 하나는 브리모니딘 타르트레이트, 하나는 브리모니딘 유리염기를 사용하여2개의 조성물(F32 및 F33)을 제조하였다. 조성물 둘다 높은 표준편차로 신속한 방출을 나타내었으며; 방출 테스트는 7일 후에 중단하였다.
웨이퍼 조성물
3개의 기존 로드 조성물로부터 첫번째 세트의 웨이퍼 조성물을 제조하였다. 특히, 조성물 #9, #17 및 #18은 각각 105일 후에 89.4%, 175일 후에 89.2%, 175일 후에 102% 방출에 도달하였다. 첫번째 3개의 웨이퍼 조성물의 방출 프로파일을 도 6에 나타내었다.
유사한 로드 조성물은 3 내지 4개월 지속되는 방출 기간을 가지는 반면에, 이러한 3개의 조성물은 단지 2 내지 3주 지속되는 방출 기간을 가졌다. 이는 로드에 비하여 웨이퍼에서 표면적이 더 증가되기 때문일 것이다. 웨이퍼 형태에서, 또한 약물 부하가 약물 방출의 지속시간을 결정한다. 따라서, 약물 부하를 20-25%에서 15% 및 10%로 줄였을 때, 방출 프로파일을 도 7 및 8에 나타내었다.
15% 약물 부하에서, 조성물 #7은 35일 후에 누적 방출 51.4%을 가졌고, 반면에 조성물 #47, 49 및 52는 99일 후에 각각 93.2%, 92.8% 및 88.5%의 누적방출을 가졌다. 나중의 조성물 3개는 4-개월 약물 송달 시스템으로서 효과적일 것이다.
10% 약물 부하에서, 조성물 #46, #48, #50 및 #51은 133일 후 각각 83.8%, 98.0%, 92.7% 및 89.2%의 누적 방출을 가졌다. 이러한 4개의 조성물은 5-개월 약물 송달 시스템으로서 효과적일 것이다. 도 7 및 8은 둘다, 얻어지는 약물 부하를 낮추면 방출의 지속시간이 길어질 뿐 아니라 모든 조성물에 대해 더욱 직선형인 방출 프로파일을 얻는다는 것을 입증한다. 도면은 또한 R206과 같은 단일 폴리머만을 사용하는 대신에 폴리머 블렌드를 사용하면 더 낮은 표준 편차로 더욱 직선형인 방출 프로파일을 얻는다는 것을 보여준다.
앞의 개의 로드 조성물 #26, #27 및 #28로부터 3개의 웨이퍼 조성물을 제조하였고, 방출 프로파일을 도 9에 나타내었다. 28일에서 3개의 웨이퍼 조성물은 유사한 로드 조성물보다 다소 더 빠르게 방출하였고, 31일 내지 51일에 방출이 완료될 것으로 기대되었다.
결론
브리모니딘 타르트레이트로 제조된 15개의 로드 조성물 중에서, 3개의 조성물(F9, F10 및 F53)은 3개월이상 긴 방출기간을 가졌고, 2개의 조성물(F24 및 F25)은 4개월이상 긴 방출기간을 가졌고, 3개의 조성물(F16, F17 및 F18)은 6개월이상 긴 방출기간을 가졌다. 브리모니딘 유리염기로 제조된 8개의 로드 조성물 중에, 3개(F26, F27 및 F28)는 2개월이상 긴 방출기간을 가졌다.
22개의 웨이퍼 조성물 중에, 11개는 브리모니딘 타르트레이트로 제조하였고, 11개는 브리모니딘 유리염기로 제조하였다. 브리모니딘 타르트레이트로 제조된 11개 웨이퍼 조성물중에, 3개(F47, F49 및 F52)는 약 4개월의 방출기간을 가졌고, 4개(F46, F48, F50 및 F51)는 4 내지 5 개월 사이의 방출기간을 가졌다. 브리모니딘 유리염기로 제조된 11개의 웨이퍼 조성물 중에, 4개(F35, F36, F38 및 F39)는 3 내지 4개월 사이의 방출기간을 가졌고, 5개(F34, F37, F41, F42 및 F43)는 1 내지 2 개월 사이의 방출기간을 가졌다.
일반적으로, 브리모니딘 타르트레이트 또는 브리모니딘 유리염기로 제조된 웨이퍼 조성물은 유사한 로드 조성물보다 더 빠른 방출을 나타내었다.
실시예 2
브리모니딘 및 생분해성 폴리머 매트릭스를 포함하는 안내 임플란트의 생체 내 시험
사이노몰구스(cynomologous) 원숭이를 무작위로 배정하여 플래시보(n=2) 또는 브리모니딘(n=2) 조성 안내 임플란트를 넣었다. 임플란트하기 3일 전, 및 임플란트하고 10일 후에, 안압(IOP), mfERG, 레이저 도플러 스캐닝 지형도검사/유량측정(HRT/HRF), 광학적 간섭성 단층촬영(optical coherence tomography), 인도시아닌 그린 혈관조영술(ICG) 및 플루오레세인 혈관조영술(FA)을 사용하여 기준선 측정을 실시하였다.
각각 200㎍ 브리모니딘 또는 플래시보로 조성된, 3개의 임플란트(실시예 1에 기재된 조성물 #17)를 MVR 블래이드(OS)로 만든 포트를 통해 눈의 유리체 내로 임플란트하고, 포트를 봉합하여 닫았다. 광각 콘택트 렌즈 안저활영으로 임플란트의 총수 및 위치를 확인하였다.
532nm, 600mW, 50um 스폿 사이즈, 1.6x 반전 콘택트렌즈의 0.01 sec 펄스 모드의 옴니 간섭 다이오드 레이저를 사용한 열 조사 후에 1ml의 20mg/kg 로즈 벵갈을 정맥 주사하여 망막 분지 정맥 폐색(BRVO)을 달성하였다. 정맥부가 폐쇄될때까지 레이저 펄스를 전달하였다. 브리모니딘 처치된 원숭이 한마리에 235 펄스를 가하고, 나머지 한마리는 78 펄스를 가하였다. 플래시보 처치된 원숭이 한마리에 43 펄스를 가하고, 나머지 한마리는 31펄스를 가하였다. 시신경 두부(head)로부터 약 1 디스크 지름의 상측 아케이드(superior arcade)에 정맥의 혈관폐색이 유도되었다. 레이저 후 안저촬영으로 폐색을 확인하였다.
BRVO 후 1일에 안저검사 관찰결과, 플래시보 임플란트를 사용한 2마리 원숭이 모두에서 극적인 망막병증 및 혈관병증-현저한 망막 부종 및 도트 블럿 출혈, 혈관 비틀림, 면화반이 나타났다. 플루오레세인 혈관조영술 결과, 혈관폐색이 확인되었고, 레이저 조사된 영역으로부터 위쪽으로의 혈액 흐름이 정체되어 있었으며, 망막 모세혈관으로부터 후기 플루오레세인 누출 및 풀링이 명백하게 나타났다. 브리모니딘 임플란트를 사용한 원숭이들은 5개 이하의 작은 도트 블럿출혈이 있었고, 약간의 망막 부종이 상측 망막에 국한되어 나타났다. 브리모니딘 원숭이에서의 플루오레세인 혈관조영에서는 최소로 지체된 혈류로 일단 폐색된 정맥이 재관류(reperfusion)하는 것으로 나타났다.
도 10에 나타낸 바와 같이 브리모니딘 함유 임플란트는 혈관폐색을 감소시켰다. 폐색된 정맥의 플루오레세인 충전의 지속을 Metamorph 6.0 소프트웨어로 정량 하였다. 충전의 지속정도 및 플루오레세인 클리어런스의 관찰된 지속정도를 정량하기 위하여, 플루오레세인 혈관조영술의 조기 및 후기에, 관심있는 미리 결정된 영역에서 세기 측정을 하였다. 폐색된 정맥에서 기준선 플루오레세인 혈관조영술 충전으로부터 플루오레세인의 조기 충전의 지속정도(초)를 도 10에 나타내었다.
OCT 단일선 스캔(6mm)으로부터 중심와(fovea) 두께를 측정한 결과, 플래시보 그룹에서는 혈관 폐색의 결과로 망막 부종이 증가한 것으로 나타났다. 브리모니딘 함유 임플란트는 혈관 폐색과 관련된 망막 부종의 크기를 감소시켰다. 일련의 선 스캔(3mm2을 커버함)은 폐색된 정맥을 둘러싸는 상측 영역 망막의 두께 변화를 하측 망막의 두께 변화와 직접 비교한다. 플래시보 원숭이에서의 망막 부종은 꽤 심하여, 망막의 하측 영역에서 체액 축적이 발생하였다. 대조적으로, 도 11에 나타낸 바와 같이, 브리모니딘 그룹은 기준선과 비교하여 하측 망막 부종에 별로 변화가 없었다.
임플란트한 후 및 모든 추적 전기생리학 및 망막 이미지화 방법 전에 3번 반복하여 각 그룹에서 안압(IOP)을 기록하였다(OD 및 OS). 도 12에 나타낸 바와 같이, 브리모니딘 임플란트는 BRVO 전 또는 그 동안 눈의 IOP를 별로 감소시키지 않았다.
VERIS 5.0 시스템을 사용하여 다초점(multi-focal) ERG를 실시하였다. 상측 망막 및 중심 망막 와(central retina fovea)의 반응을 기록하기 위하여 241개의 육각형 자극 필드를 위치시켰다. 플래시보 그룹에서는 BRVO 유도 후 3-4주에 걸쳐 중심와 반응이 없던 반면에, 브리모니딘 그룹에서는 BRVO 후 1일에 다소 낮지만 뚜렷한 반응이 있었고, 나머지 연구 동안 회복 및/또는 높은 중심와 반응이 있었다. 도 13의 그래프는 두 그룹 모두의 상측/하측 반응%를 나타낸다. 플래시보로 처치된 원숭이의 BRVO는, 브리모니딘 임플란트를 사용시 비교적 일정한 망막 기능과 대비하여, 회복이 늦은 경향의 덜 반응성인 망막 기능을 가졌다.
레이저 도플러 유량측정(HRF)을 사용하여 중심와, 상측 및 하측 망막 영역의 혈류를 측정하였다. 도 14의 그래프는 중심와를 중심으로 한 10-20도 존(zone)에서 얻은 혈류 측정 결과를 나타낸다. BRVO 후 브리모니딘 그룹에서는 중심와의 혈류는 변화가 없는 것으로 보이지만, 플래시보 그룹에서는 BRVO 후 1일에 급격히 증가되었다.
세가지 브리모니딘 안내 임플란트의 유리체내 적용은 원숭이의 국지적 혈관 폐색 및 관련 혈관병증과 망막병증의 크기 및 지속시간을 감소시켰다.
또한, 정맥에 가까울 필요가 있는 레이저 화상(burns)의 양은 플래시보 그룹에서보다 브리모니딘 그룹에서 더 높았다(브리모니딘:157±79, n=2; 플래시보:34±6, n=2). 이와 함께, 이러한 데이터는 브리모니딘이 존재함으로써 망막 혈관을 막기 어렵게 하고 폐색의 지속시간을 감소시킨다는 것을 보여준다.
실시예 3
생분해성
폴리머
매트릭스와
결합된
브리모니딘을
포함하는 안내 임플란트를 사용한 녹내장의 치료
68세의 여성이 주치의에게 점점 보이지 않는다고 호소하였다. 주치의는 이 환자의 안압 레벨이 증가한 것을 측정하고, 녹내장으로 진단하였다. 브리모니딘 타르트레이트 200㎍ 및 생분해성 폴리머의 조합(상기 실시예 1에 기재된 것과 같이, 중량비율 1:1의 리소머 R203 및 R206) 800㎍을 포함하는 임플란트를 트로카를 사용하여 이 환자의 양쪽 눈의 유리체에 넣었다. 2일 후에, 환자는 아마도 안압의 감소때문에 자신의 눈에 변화가 왔다고 말하기 시작했다. 임플란트 수술 후 약 5개월 동안 시각의 손실이 방지되었다.
실시예 4
다양한 활성 제제를 사용한 안질환의 치료
상기한 실시예에서 설명한 방법에 따라서, 명세서에 기재된 제제들을 포함하는 다양한 활성 제제로 임플란트를 조성할 수 있다. 이러한 임플란트는 활성 제제의 방출 기간 동안 또는 모든 활성 제제가 임플란트로부터 방출된 후 및 치료학적인 양의 활성 제제가 임플란트가 배치된 안 부위에 더 이상 존재하지 않는 동안 안질환에 대한 연장된 치료학적 처치를 제공할 수 있다. 즉, 클로니딘, 아프라크로니딘, 또는 브리모니딘(캘리포니아 이르빈 소재 알러간 사에서 상표명 Alphagan-P®의 브리모니딘 타르트레이트 안과용액으로 입수가능)과 같은, 알파-2 아드레날린성 수용체 아고니스트를 포함하는 임플란트를 제조할 수 있다. 따라서, 예를 들어, 바람직한 연장된 치료 효과를 위하여 브리모니딘 연장 방출 치료학적 처치 임플란트를 안질환이 있는 환자의 눈 부위(즉, 유리체 내)로 임플란트할 수 있다. 임플란트는 임플란트의 크기에 따라 약 50㎍ 내지 약 500㎍의 Alphagan 또는 Alphagan-P를 포함할 수 있다. 안질환은 포도막염과 같은 염증질환일 수 있으나, 환자는 하기한 하나 이상의 질환을 앓고 있을 수 있다: 황반변성(비-삼출성 노인성 황반변성 및 삼출성 노인성 황반변성); 맥락막 혈관신생; 급성 황반성 신경병증; 황반부종(낭포성 황반부종 및 당뇨병성 황반부종 포함); 베체트 병; 당뇨병성 망막증(증식성 당뇨병성 망막증 포함); 망막 동맥 폐색 질환; 중심성 망막 정맥 폐색; 포도막 망막 질환; 망막 박리; 망막병증; 망막전막 질환; 망막 분지정맥 폐색; 전방 허혈성 시신경병증; 비-망막병증성 당뇨병성 망막 기능장애; 색소성 망막염 및 녹내장. 트로카 임플란트법과 같은 방법을 사용하여 임플란트를 유리체 내에 삽입할 수 있다. 임플란트는 치료학적인 양의 활성 제제를 방출하여, 연장된 기간 동안 치료학적 효과를 제공 및 유지함으로써 안질환의 증상을 처치할 수 있다. 예를 들어, 임플란트는 시력(visual acuity), 비주얼 컨트랙트 민감성(visual contract sensitivity) 또는 이 두가지를 모두 향상시키는 데 효과적일 수 있다.
실시예 5
시력 강화, 회복 및/또는 향상에 사용되는 안내 알파-2
아드레날린성
수용체 아고니스트 임플란트
안내 임플란트를 사용하여 포유류의 눈에서 실험을 하였다. 즉, 활성 성분으로서 안내 알파-2-아드레날리성 수용체 아고니스트를 포함하는 분해성 폴리머 임플란트를 정상 래빗 및 손상되거나 질환이 있는 래빗(모델 시스템)의 눈의 유리체에 넣었다. 실험 결과, 안내 알파-2 아드레날린성 수용체 아고니스트 임플란트는: (1) 정상 눈에서 시력을 향상시키고, 및; (2) 질환이 있거나 손상된 눈에서 시력을 회복시키는 것으로 나타났다.
실시예 1의 조성물 #17을 이번 실시예 5의 실험에 사용하였다. 즉, 사용된 임플란트는 고체, 생분해가능한 로드(약 1 mg으로 칭량)로서 조성된 알파-2 아드레날린성 수용체 아고니스트 브리모니딘 타르트레이트를 포함하여 지속 방출 약물 송달 장치(즉, 임플란트)를 형성하였다. 임플란트는 브리모니딘 타르트레이트 200㎍ 및 중량비율 1:1의 리소머 R203 및 R206의 폴리-락타이드 코-폴리머 혼합물 800㎍으로 구성되었다. 플래시보 임플란트는 중량비율 1:1의 리소머 R203 및 R206의 폴리-락타이드 코-폴리머로 제조된 혼합물 1mg 로드 임플란트였다.
본 출원인은, 임플란트를 래빗의 유리체 내에 투여하면, 얻어진 시력이 향상되거나 정상화되는 것을 알아내었다. 시력은 소인 시유발 전위 스레스홀드(sweep visual evoked potential threshold)로서 측정하였다. 3가지 상이한 눈의 조건 각각에서 시력이 향상된 것으로 측정되었다:
1) 정상 래빗 눈;
2) VEGF 손상된 래빗 눈. 이러한 래빗 눈은 유리체내에 500ng의 VEGF로 처치하여 시신경 두부 팽창(optic nerve head swelling), 망막 혈관 누출, 확장 및 비틀림을 유도함으로써, 황반 부종, 시신경 두부 부종(optic nerve head edema), 당뇨병성 망막증 및 혈관신생과 같은 안질환에서 흔하게 나타나는 증상들을 시뮬레이션하였다, 및;
3) 임플란트를 사용하기 8개월 전에 IOP이 증가되는 일과성 허혈증에 의해 유도된 외측 망막 손상이 있는 래빗 눈.
특히: (a) 상기한 눈의 조건 2)에서, 임플란트는 VEGF 처치와 관련된 혈관병증(비틀림, 누출, 확장)을 감소시키지 않으면서 시력을 향상시켰고; (b) 상기한 눈의 조건 3)에서, 임플란트는 이러한 허혈성 손상 눈에서 망막의 임상적 외형을 변화시키지 않으면서 시력을 향상시켰다. 이는 임플란트에 의해서 방출된 알파-2 아고니스트 활성 성분이, 눈의 조건 2) 및 3)에서 유도된 손상 또는 질환 상태 후에 남아있는 기능성 망막 뉴런 세포의 강장 활성(tonic activity)을 증가시켰다는 것을 시사한다. 남아있는 정상 세포가 더욱 잘 기능하여, 질환 상태가 여전히 존재함에도 불구하고, 시각을 보완 및 향상시켰다고 가정할 수 있다.
망막 허혈 손상을 유도하는 방법
래빗을 이소플루오레인으로 마취시키고, 45분간 120 mmHg로 OD 눈에서 IOP를 높여서 일측성 급성 망막 허혈을 준비시켰다. 이렇게 하기 위해서, PBS 저장기를 눈에서 65인치 위에 매달고, 각막을 통해 전안방으로 삽입되는 30 게이지 니들을 연결하였다. 니들을 삽입하기 전에 국소 마취제(프로파라카인)을 각막에 넣었다. 그리고, 니들을 뺀 직후에 항염제(Pred-G)를 각막에 넣었다.
시력 측정 방법
소인 시유발 전위(sweep visual evoked potential; swVEP)를 사용하여 의식이 있는 래빗에서 시력을 측정하였다. swVEP는 전형적으로 스넬렌 시력표를 읽지 못하는 어린 아이들에게 사용하는 시력을 평가용 전기생리학 기술이다. 증가하는 공간 주파수의 패턴 반전 이미지가 황반부에 투사하면서, 동시에 두피로부터 전기활성(VEP)을 기록한다. 낮은 공간 주파수를 가지는 이미지는, 신호 = 잡음이 될때까지, 공간 주파수가 증가함에따라 점점 작아지는 큰 신호를 생성한다; 이 스레스홀드가 시력이다. 래빗에 사용하는 방법에서는 신호 강도를 향상시키고 추적 방문(follow-up visits)시 동일한 위치에서 기록이 가능하도록 영구 전극을 두피에 임플란트하는 것이 필요하다. 치료되도록 한지 2주 후에 , 시력을 측정을 할 수 있다.
임플란트법을 위해서 래빗을 케타민 및 자일라진으로 마취하였다. 두피를 무균 처리하고 4개의 스테인리스 스틸 스크류(#0-80 x3/8)를 임플란트하였다. 두개의 활성 전극을 정중선으로부터 각 측으로 6mm, 브레그마(bregma) 6mm 위에 배치하고; 1개의 접지 전극을 정중선, 활성 전극 6mm 위에 배치하고, 1개의 기준 전극을 정중선, 접지 전극 6mm 위에 배치하였다.
시력 측정을 위하여, 1% 트로피카미드 및 10% 페닐에프린을 사용하여 눈을 완전히 뜨게 하였다. 래빗을 스테인리스 스틸 구속기(restrainer)에 넣어서, 패턴 반전 이미지를 시각 스트리크(visual streak)에 투사할 수 있게 한다. 래빗은 완전히 의식이 있었다. PowerDiva 소프트웨어 버전 1.8.5.의 제어 하에, 특별히 고안된 기저부 카메라 자극기(fundus camera stimulator)를 통해 이미지를 투사하였다. 래빗의 눈이 카메라 50mm 앞에 위치하도록 각각의 래빗을 배치하였고, 이는 21인치 CRT 모니터로부터 50cm 떨어진 것과 동일하다. 기록하는 전극을 하기 사양의 Grass Neurodata Acquisition System(Model 12CA)에 연결하였다:
OD 눈을 위한 채널 1 및 OS 눈을 위한 채널 2.
3 내지 100 Hz의 필터 범위.
증폭 : 50 K
선 주파수 필터 = OFF
시간 주파수 7.5 Hz, 공간 주파수 0.1 내지 5 주기/도(cycle per degree) 범위에서 수직 안정-상태 패턴-반전 소인 자극(vertical steady-state pattern-reversal sweep stimulus)을 평균 휘도 600 cd/m2 및 80%의 콘트라스트로 눈에 적용하였다. 각 눈에 대해 각각 10초씩 5회 내지 40회 시도한 기록을 수집하였다. 시도 횟수는 신호-대-잡음 비에 기초하였다. 시도들을 평균내고 소프트웨어를 사용하거나 손으로 신호-대-잡음 비를 2.5 이상으로 피팅하여 스레스홀드(시력)를 결정하였다. 그리고 나서, 반대쪽 눈에 대한 퍼센트로서 표현하여 스레스홀드 값을 정상화하였다.
하기에 설명한 3가지 눈 상태의 6개의 상이한 래빗 눈 그룹에서 브리모니딘 임플란트 대 플래시보의 시력에 대한 효과를 연구하였다. 3 그룹의 래빗 각각에서, 임플란트를 유리체에 이식하였다. 임플란트는 2004.12.23 출원된 미국 특허출원 11/021,947에 설명된 어플리케이터(22 게이지 니들을 가진)를 사용하여 유리체 내에 삽입하였다.
(A) 첫번째 연구에서는, 정상(처치되지 않은) 눈의 래빗 두 그룹을 사용하였다. 그룹 1(N=7)의 각 래빗의 각 왼쪽 눈에 하나의 브리모니딘 임플란트를 유리체 내로 임플란트하였다. 동일한 방법으로, 그룹 2(N=7)의 각각의 래빗의 각 왼쪽눈에는 플래시보 임플란트를 유리체내로 임플란트하였다. 그룹 1과 그룹 2 모두에서 각 래빗의 오른쪽 눈은 처치하지 않고 얻어진 데이터를 정상화하기 위한 대조구로 제공하였다. 두 그룹에 대해 래빗의 양쪽 눈에서 시력을 측정하여, 도 15에 반대쪽(오른쪽) 정상 눈의 시력에 대한 퍼센트로서 나타내었다.
도 15는 래빗의 정상 눈의 시력에 대한 브리모니딘 임플란트 및 플래시보 임플란트의 효과를 나타낸다. 도 15의 결과는 브리모니딘 임플란트 또는 플래시보 임플란트를 임플란트 한지 2주 후에 기록하였으며, 플래시보 임플란트는 시력의 변화를 별로 가져오지 않았다. 즉, 플래시보 임플란트는 단지 1.5%±6%의 시력 변화만을 야기하였다. 그러나, 브리모니딘 임플란트를 사용한 경우에는 정상 래빗 눈의 시력이 상당히 향상되었다. 즉, 브리모니딘 임플란트는 44%±12%의 시력 향상을 야기하였다(정상눈에서 56%까지 시각 향상). 독립 학생 T-검정(unpaired Student's 'T' test)을 사용하여 플래시보 임플란트에 대한 반응과 브리모니딘 임플란트에 대한 반응을 비교한 결과 통계학적 차이가 P 값 0.003으로 나타났다.
(B) 두번째 연구에서, 두 그룹의 래빗 눈을 사용하였다. 그룹 1(N=7)의 각 래빗의 각 왼쪽 눈에 하나의 브리모니딘 임플란트를 유리체 내로 임플란트하였다. 동일한 평면부(pars plana) 삽입 방법으로, 그룹 2(N=7)의 각각의 래빗의 각 왼쪽눈에는 플래시보 임플란트를 유리체내로 임플란트하였다. 그룹 1과 그룹 2 모두에서 각 래빗의 오른쪽 눈은 처치하지 않고 얻어진 데이터를 정상화하기 위한 대조구로 제공하였다. 임플란트한 지 2주 후에, 각각의 임플란트된 눈에 유리체내로 500ng의 혈관 내피 인자(VEGF)(R & D systems로부터 상품명 293-VE-50으로 입수가능)를 50㎕ 볼루스로서 투여하였다. 두 그룹에 대해 래빗의 양쪽 눈에서 시력을 측정하여, 도 16에 반대쪽(오른쪽) 눈의 시력에 대한 퍼센트로서 나타내었다.
도 16은 VEGF 처치된 래빗 눈에서 시력에 대한 브리모니딘 임플란트 및 플래시보 임플란트의 효과를 나타낸다. 도 16의 결과는 브리모니딘 임플란트 또는 플래시보 임플란트를 임플란트 한지 3주 후, VEGF를 투여한지 1주 후에 기록하였다. 도 16의 결과에서 플래시보 임플란트, VEGF 처치된 눈의 시력 손실이 약 25%±4%로 나타났다. 또한, 도 16의 결과에서 브리모니딘 임플란트, VEGF 처치된 눈의 시력 향상은 약 14%±8%로 나타났다(혈관병증이 있는 눈에서 22%까지 시각 향상). 즉, VEGF로 처치한 눈에서 혈관병증이 있음에도 불구하고 브리모니딘 임플란트가 시력을 정상화시켰다. 브리모니딘 임플란트는 VEGF로 야기된 혈관병증을 감소시키지는 않았지만, VEGF 처치로 유도된 감각신경 망막 결손(neurosensory retina deficit)을 감소시켰다. 독립 학생 T-검정을 사용하여 플래시보 임플란트에 대한 반응과 브리모니딘 임플란트에 대한 반응을 비교한 결과 통계학적 차이가 P 값 0.0007로 나타났다.
(C) 세번째 연구에서, 두 그룹의 래빗 눈을 사용하였다. 그룹 1(N=5)의 각 래빗의 각 왼쪽 눈에 하나의 브리모니딘 임플란트를 유리체 내로 임플란트하였다. 동일한 방법으로, 그룹 2(N=5)의 각각의 래빗의 각 왼쪽눈에는 플래시보 임플란트를 유리체내로 임플란트하였다. 그룹 1과 그룹 2 모두에서 각 래빗의 오른쪽 눈은 처치하지 않고 얻어진 데이터를 정상화하기 위한 대조구로 제공하였다. 0일에 두 그룹의 각각의 래빗의 왼쪽 눈에 허혈성 손상을 유도하였다. 32주 후에, 그룹 1의 각 래빗의 각 허혈성 손상 왼쪽 눈에 플래시보 임플란트를 임플란트하고, 그룹 2의 각 래빗의 각 허혈성 손상 왼쪽 눈에 브리모니딘 임플란트를 임플란트하였다. 44주에, 두 그룹에 대해 래빗의 양쪽 눈에서 시력을 측정하여, 도 17에 정상 또는 처치하지 않은 반대쪽(오른쪽) 눈의 시력에 대한 퍼센트로서 나타내었다.
도 17은 허혈성 이벤트로 손상을 입은 래빗의 눈에서 시력에 대한 브리모니딘 임플란트 및 플래시보 임플란트의 효과를 나타낸다. 조직학상, 이러한 방법은 광수용체, RPE 및관련 조직에 외측 망막 손상을 가져온다. 일시적인 허혈성 방법으로 왼쪽에 시력 손실을 준 래빗을 두 그룹으로 무작위화하였다. 데이터는 반대쪽 정상 눈에 대한 퍼센트로서 나타내었다. 도 17의 결과는 브리모니딘 임플란트 또는 플래시보 임플란트를 임플란트한 지 12주 후, 각각의 임플란트된 눈에 허혈성 이벤트를 유도한 지는 11개월 후에 기록하였다. 도 17의 결과는 플래시보 임플란트, 허혈성 손상 눈에서 37%±8%의 시력 감소가 있었음을 나타낸다. 도 17의 결과는 또한 브리모니딘 임플란트, 허혈성 손상 눈에서는 14%±9% 시력 향상이 있었음을 나타낸다. 즉, 브리모니딘 임플란트는 외측 망막 손상이 있는(허혈성 손상이 유도된) 래빗눈에서 시력을 회복 또는 향상시켰다. 독립 학생 T-검정을 사용하여 플래시보 임플란트에 대한 반응과 브리모니딘 임플란트에 대한 반응을 비교한 결과 통계학적 차이가 P 값 0.001로 나타났다.
이러한 실험들은 국부적으로(즉, 유리체내로) 투여된 알파-2 아드레날린성 수용체 아고니스트가 정상눈에서 시각을 향상(시력을 강화)시키는 데 사용될 수 있다는 것을 시사한다. 이러한 실험들은 또한 국부적으로(즉, 유리체내로) 투여된 알파-2 아드레날린성 수용체 아고니스트가 염증, 혈관신생, 종양, 혈관폐색, 및/또는 녹내장을 포함하는 시신경 질환 또는 상태와 같은 안질환이 있는 눈에서 시각을 향상, 회복 또는 교정하는 데 사용될 수 있다는 것을 시사한다.
약동학 데이터를 얻기 위하여 별도 그룹의 래빗을 연구하였다. 이들 래빗에서는, 하기와 같이 실시하는 수술적 유리체내 임플란트법을 사용하여 임플란트를 삽입하였다: 결막을 절제하고, 20-게이지 MVR 블레이드를 사용하여 공막절개를 하였다. 공막절개는 오른쪽 눈에서는 10시 및 12시 방향 사이, 왼쪽 눈에서는 12시 및 2시 방향 사이의 배측 직근(dorsal rectus muscle)의 가장자리 및 옆으로부터 3mm에서 하였다. 멸균된 포셉을 사용하여, 공막 절제부를 통해 시험물을 삽입하였다. 9-0 프롤린 봉합재를 사용하여 공막 절제부를 닫았다. 임플란트법 실시 후에 멸균된 안윤활제를 눈에 넣었다. 8, 31, 58, 91, 136 또는 184일에, 안락사/부검 전에 래빗으로부터 혈액을 수집하였다. 액체 크로마토그래피-질량분석법/질량 분석법(LC-MS/MS)을 사용하여 래빗에서 얻은 안방수, 유리액, 수정체, 망막 및 혈장 샘플을 분석하였다.
표 3은 이러한 약동학 연구에서 얻어진 데이터를 나타낸다. 알비노 래빗 눈에 200㎍ 브리모니딘 임플란트(조성물 #17)의 유리체내(유리체중간으로) 임플란트 후 다양한 시점(표 3의 왼쪽 칼럼의 "일")에서 안방수, 홍체-모양체, 수정체, 망막, 유리액 및 혈장에서의 안내 브리모니딘 농도를 측정하였다. 표 3에 나타낸 바와 같이, 조성물 #17 브리모니딘 임플란트를 유리체내 임플란트한 후:
1. 브리모니딘 임플란트가 임플란트된 래빗 눈의 안방수에서는 어떤 시점에서도 브리모니딘이 검출되지 않았다.
2. 높은 망막 농도가 나타난 것으로 보아, 브리모니딘은 유리체내 임플란트에서 방출된 후, 전방 클리어런스와 대립되는 후방 클리어런스를 가졌다.
3. 적어도 90일의 기간동안 검출가능한 레벨의 브리모니딘이 임플란트로부터 유리체로 방출되었다.
4. 브리모니딘이 임플란트로부터 방출되는 것보다 약 2배 더 길게 치료학적 레벨의 브리모니딘이 망막에 존재하였다: 임플란트로부터 브리모니딘이 약 91일 내지 약 120일간 방출되었음에도 불구하고, 브리모니딘은 적어도 184일간 망막에 존재하였다.
5. 임플란트는 브리모니딘의 망막-내 저장소가 형성되게 하였다.
NC, 평균에 기여하는 >50%의 농도가 BLQ(정량한도 아래)이기 때문에 계산불가
데이터는 평균±SEM(샘플링 시간마다 N=4개 눈 및 N=2개 혈장)로 나타내었다.
BLQ = 정량한도 아래(안방수 및 유리액:<10 ng/mL; 수정체, 망막 및 홍체-유리체:<0.5ng; 혈장:<0.05ng/mL).
a N=4. 1개의 샘플이 BLQ(평균 계산시 0으로 포함)
b N=4. 2개의 샘플이 BLQ(평균 계산시 0으로 포함)
c N=3. 1개의 샘플이 결정되지 않음(평균 계산에 포함안함)
d N=2. 2개의 샘플이 ALQ(정량한도 위)(괄호안에 추정평균치)
결론적으로, 이 결과는 알파-2 아고니스트(비-선택적 또는 수용체 서브타입 선택적) 유리체내 임플란트를 사용하여 포유류 눈의 시력을 강화, 교정, 회복 또는 향상시킬 수 있다는 것을 시사한다.
특히, 본 실험은 정상 눈과 질환이 있는 눈 모두에서 유리체내 브리모니딘 임플란트를 사용하여 시력을 향상시킬 수 있다는 것을 보여준다. VEGF 처치된 눈에 대해 본 명세서에서 제공된 결과는 시력 손실을 방지하기 위한 예방약으로서 임플란트를 사용할 수 있다는 것을 보여준다. 손상된/질환이 있는(즉, 허혈성) 눈에 대해 본 명세서에서 제공된 결과는 임플란트를 사용하여 눈의 손상/질환의 경감 또는 소멸이 없이도 눈의 시력을 향상시킬 수 있다는 것을 보여준다. 즉, 임플란트는 남아있는 정상 망막 세포의 기능을 향상시켜, 망막에서 눈의 손상/질환의 정도를 감소시키지 않고도, 시각을 보완 및 향상시키는 것으로 보인다.
본 발명의 범주에 속하는 임플란트를 다음과 같이 사용할 수 있다:
1. 망막 장애와 관련된 성향 또는 위험 인자를 가진 환자에서의 망막 장애를 포함하는 다양한 안질환에서, 임박한 망막 감각신경 기능장애를 완화시키기 위한 예방법으로서 사용.
2. 황반 변성(노인성 황반 변성과 같은), 황반 부종과 같은 안 부종, 혈관 폐색 질환, 시신경변증 또는 망막 신경병증, 및/또는 망막 종양과 같은 망막 변성과 관련된 망막 질환과 같은 후안부 질환을 처치하기 위한 치료제(단독으로 또는 하나 이상의 추가적인 활성 제제와 조합하여)로서 사용. 예를 들어, IOP를 낮추거나 및/또는 시력을 향상시키기 위한 알파 2 아고니스트 및 염증을 감소시키기 위한 스테로이드(덱사메타손 또는 트리암시놀론과 같은)를 포함하도록 임플란트를 제조할 수 있다.
3. 망막 박리가 나타나는 망막 질환 및 장애에 유용한 치료제(단독으로 또는 하나 이상의 추가적인 활성 제제와 조합하여)로서 사용.
4. 유리체절제 및 망막에 안좋은 충격을 줄 수 있는 조작이 요구되는 망막 수술법에 유용한 치료제(단독으로 또는 하나 이상의 추가적인 활성 제제와 조합하여)로서 사용.
5. 비타민 A 결핍과 같은 영양 결핍이 있는 망막 질환을 처치하기 위한 치료제(단독으로 또는 하나 이상의 추가적인 활성 제제와 조합하여)로서 사용.
6. 수술용 현미경 광 또는 산업용 레이저와 같은 우발적인 광 노출로 인한 망막 손상을 처치하기 위한 치료제(단독으로 또는 하나 이상의 추가적인 활성 제제와 조합하여)로서 사용.
7. 안 염증 또는 황반 또는 시신경 부종을 감소시키기 위하여 스테로이드를 사용하는 경우, 망막 질환을 처치하기 위한 스테로이드에 부가하여 사용.
8. 망막 및 관련 조직 혈관의 누출과 관련된 망막 질환을 처치하기 위하여 PDT를 사용하는 경우, 광역동요법(PDT)에 부가하여 사용
9. 황반 부종 또는 혈관신생을 처치하기 위하여 사용되는 레이저 광응고술과같은 다른 타입의 전자기 방사선 및 맥락막 혈관신생(CNV)을 처치하기 위해 사용되는 동공경유온열요법(TTT)에 부가하여 사용.
10. 황반병증 및 유두병증을 야기하는 방사선요법 또는 화학요법이 황반 망막아세포종 및 맥락막 골종과 같은 안종양을 처치하기 위하여 사용되는 경우, 이에 부가하여 사용.
11. 눈의 부종 및 혈관신생성 이상을 처치하기 위한 전자기 방사선 및 스테로이드에 부가하여 사용.
실시예 6
두가지
상이한 안내
브리모니딘
임플란트를 사용한 급성
열공성
황반
박리성
망막 박리의 처치
급성 열공성 황반 박리성 망막 박리(acute rhegmatogenous Macular-Off Retinal Detachment)를 처치하기 위하여 환자에 각각 50㎍ 및 200㎍의 브리모니딘 후안부(즉, 유리체내) 임플란트를 임플란트하였다. 환자는 조기 치료 당뇨병성 망막병증 연구(ETDRS))에 사용되는 연구대상 눈에서 기준선으로부터 적어도 15-레터 증가를 경험하였다. 최대교정시력(BCVA)(조기 치료 당뇨병성 망막병증 연구(ETDRS)를 사용한 연구대상 눈에서기준선으로부터 적어도 15-레터 증가를 경험한 환자의 비율로 측정)의 향상을 얻는 데는 50㎍ 브리모니딘 후안부 임플란트보다 200㎍ 브리모니딘 후안부 임플란트가 더욱 효과적이었다. 50㎍ 및 200㎍ 브리모니딘 후안부 임플란트는 허용가능한 안정성 프로파일을 가졌다.
환자는 기준선 및 무작위화 방문을 위한 0일, 및 1, 3, 6, 9, 12개월(마스크된 상태) 및 15, 18 및 24 개월(연장 상태)에 관찰되었다. 모든 재-처치에 따른 1일 및 7일의 추가 방문은 안정 방문(safty visit)으로서 지정되었다. 55명의 환자가 참여하였다. 각 환자의 적어도 한쪽 눈은 공막 버클(scleral buckle) 및 레이저 광응고술로 치료하기에 적합한 급성 열공성 황반 박리성 망막 박리를 가졌다.
환자의 참여 기준 다음을 포함한다: 연령 18세 이상; 최대교정 E-ETDRS 시력 점수가 >=20 레터(즉, 약 20/400 또는 그보다 좋음) 및 <=65 레터(즉, 약 20/50 또는 그보다 나쁨); 한쪽 눈이 급성 열공성 황반 박리성 망막 박리로 진단.
프리젠테이션의 12시간 동안 박리가 일어났고, 조사자의 의견으로는, 유리체 절제술이나 기체망막유착술을 실시할 필요없이 공막 버클 배치 및 망막 열공(retinal break)의 외부 레이저 광응고술로 치료가 가능하였다. 수술적 치료는 48시간 이내의 박리: 미디어 투명도(media clarity); 동공확대, 및; 알맞은 안저촬영에 대한 환자의 충분한 협조로 계획되었다.
연구 조성물은:(1) 실시예 1의 조성물 #17(고체, 생분해가능한 로드(브리모니딘 타르트레이트 200㎍ 및 1:1 중량비 레소머 R203 및 R206의 폴리-락타이드 코-폴리머 혼합물 800㎍으로 구성되는, 약 1mg으로 칭량되는 임플란트), 및; (2) 고체, 생분해가능한 로드(브리모니딘 타르트레이트 50㎍ 및 1:1 중량비 레소머 R203 및 R206의 폴리-락타이드 코-폴리머 혼합물 9500㎍으로 구성되는, 약 1mg으로 칭량되는 임플란트)였다.
연구대상 눈에서 6개월에 ETDRS법을 사용해 측정한 결과, 상당수의 환자에서 기준선으로부터 15 레터 이상의 BCVA 증가가 나타났다. 따라서, 급성 열공성 황반 박리성 망막 박리를 처치하는 데 유리체내 브리모니딘 임플란트를 사용할 수 있다.
실시예 7
두가지 상이한 유리체내 브리모니딘 임플란트를 사용한 만성 망막 손상의 처치
만성 망막 손상을 처치하기 위하여 환자에 각각 50㎍ 및 200㎍의 브리모니딘 후안부(즉, 유리체내) 임플란트를 임플란트하였다. 환자는 조기 치료 당뇨병성 망막병증 연구(ETDRS))에 사용되는 연구대상 눈에서 기준선으로부터 적어도 15-레터 증가를 경험하였다. 최대교정시력(BCVA)(조기 치료 당뇨병성 망막병증 연구(ETDRS)를 사용한 연구대상 눈에서 기준선으로부터 적어도 15-레터 증가를 경험한 환자의 비율로 측정)의 향상을 얻는 데는 50㎍ 브리모니딘 후안부 임플란트보다 200㎍ 브리모니딘 후안부 임플란트가 더욱 효과적이었다. 50㎍ 및 200㎍ 브리모니딘 후안부 임플란트는 허용가능한 안정성 프로파일을 가졌다.
환자는 기준선 및 무작위화 방문을 위한 0일, 및 1, 3, 6, 9, 12개월(마스크된 상태) 및 15, 18 및 24 개월(오픈 라벨)에 관찰되었다. 모든 재-처치에 따른 1일 및 7일의 추가 방문이 안정 방문(safty visit)으로서 지정되었다. 각 환자의 적어도 한쪽 눈은 기준선에서 하나이상의 하기 형태의 망막 손상을 가졌다: 벽판망막 변성, 당뇨병성 황반병증으로 인한 황반 허혈, 또는 이전의 급성 열공성 황반 박리성 망막 박리.
환자의 참여 기준 다음을 포함한다: 연령 18세 이상; 적어도 한쪽 눈(연구대상 눈)이 벽판망막 변성, 당뇨병성 황반병증으로 인한 황반 허혈, 또는 급성 열공성 황반 박리성 망막 박리 만성 망막 손상으로 진단; 벽판망막 변성이 있는 환자에 대해서는 진단이 임상적 시야 및 망막전기측정 조사 모두에 기초하고, 시야 손실이 중앙의 10도 이내이다; 당뇨병성 황반병증으로 인한 황반 허혈 환자에 대해서는 최대교정 E-ETDRS 시력 점수가 >=35 레터(즉, 약 20/200 또는 그보다 좋음) 및 <=65 레터(즉, 약 20/50 또는 그보다 나쁨)이고, 감소된 시력은 허혈과 직접적으로 관련되며 황반 부종 또는 이전의 레이저 광응고술로 인한 것이 아니다; 황반 박리가 있는 환자에 대해서는, 황반 박리가 치료전에 48시간 이상 나타나지 않았으며, 박리의 치료가 기준선 방문의 적어도 6개월 전에 발생하였으며, 최대교정 E-ETDRS 시력 점수가 >=35 레터(즉, 약 20/200 또는 그보다 좋음) 및 <=65 레터(즉, 약 20/50 또는 그보다 나쁨)이고, 적어도 3개월간 시력이 안정적이며(스넬른 시력의 한 선 내에 있음), 박리의 치료가 해부학적 성공으로 간주된다; 미디어 투명도(media clarity); 동공확대, 및; 알맞은 안저촬영에 대한 환자의 충분한 협조.
본 연구 조성물은:(1) 실시예 1의 조성물 #17(고체, 생분해가능한 로드(브리모니딘 타르트레이트 200㎍ 및 1:1 중량비 레소머 R203 및 R206의 폴리-락타이드 코-폴리머 혼합물 800㎍으로 구성되는, 약 1mg으로 칭량되는 임플란트), 및; (2) 고체, 생분해가능한 로드(브리모니딘 타르트레이트 50㎍ 및 1:1 중량비 레소머 R203 및 R206의 폴리-락타이드 코-폴리머 혼합물 9500㎍으로 구성되는, 약 1mg으로 칭량되는 임플란트)였다.
연구대상 눈에서 12개월에 ETDRS법을 사용해 측정한 결과, 상당수의 환자에서 기준선으로부터 15 레터 이상의 BCVA 증가가 나타났다. 따라서, 만성 망막 손상을 처치하는 데 유리체내 브리모니딘 임플란트를 사용할 수 있다.
상기한 모든 참조문헌, 기사, 공보, 특허 및 특허출원은 본 명세서에 전체가 참조로 병합되어 있다.
본 발명을 다양한 특정 실시예 및 실시형태에 대하여 설명하였으나, 본 발명이 이에 제한되지 않으며 하기의 청구범위의 범주 내에서 다양하게 실시될 수 있는 것으로 이해되어야 한다.
Claims (66)
- 임플란트를 눈에 배치한 후 적어도 약 1주일인, 임플란트가 배치된 눈에서 안혈관 폐색을 감소시키기에 효과적인 시간동안, 일정량의 알파-2 아드레날린성 수용체 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 약물을 방출하는 생분해성 폴리머 매트릭스와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함하여 이루어지는 생분해성 안내 임플란트.
- 제 1 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 퀴녹살린, (2-이미다졸린-2-일아미노)퀴녹살린, 5-브로모-6-(2-이미다졸린-2-일아미노)퀴녹살린, 이들의 유도체 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘, 이의 염 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘 타르트레이트인 것을 특징으로 하는 임플란트.
- 제 4 항에 있어서, 방부제를 더욱 포함하는 것을 특징으로 하는 임플란트.
- 제 5 항에 있어서, 상기 방부제가 퓨라이트(purite)인 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 추가적인 안과적으로 허용가능한 치료학적 제제를 더욱 포함하는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 생분해성 폴리머 매트릭스 내에 분산되어 있는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 매트릭스가 폴리락트산의 제 1 생분해성 폴리머와 폴리락트산의 상이한 제 2 생분해성 폴리머의 혼합물을 포함하여 이루어지는 것을 특징으로 하는 임플란트.
- 제 9 항에 있어서, 상기 제 1 생분해성 폴리머의 고유점도가 약 0.3dl/g인 것을 특징으로 하는 임플란트.
- 제 10 항에 있어서, 상기 제 2 생분해성 폴리머의 고유점도가 약 1.0dl/g인 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 매트릭스가 임플란트가 눈의 유리체에 배치된 시점으로부터 1개월 이상 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 약물을 방출하는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 매트릭스가 임플란트가 눈의 유리체에 배치된 시점으로부터 40일 이상 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 약물을 방출하는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 매트릭스가 임플란트가 눈의 유리체에 배치된 시점으로부터 35일 이하 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 약물을 방출하는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘이고, 상기 매트릭스가 약 3개월동안 치료학적으로 효과적인 양의 브리모니딘을 지속방출하기에 효과적인 속도로 약물을 방출하는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 임플란트가 눈의 유리체 내에 배치할 수 있는 구조로 되어 있는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 임플란트의 약 20 중량%의 양으로 제공된 브리모니딘 타르트레이트이고, 상기 생분해성 폴리머 매트릭스가 두가지 상이한 폴리락타이드 폴리머의 조합을 포함하여 이루어지는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 상기 매트릭스가 생분해성 폴리머의 혼합물을 포함하여 이루어지며, 적어도 하나의 생분해성 폴리머가 분자량이 약 64kD인 폴리락타이드인 것을 특징으로 하는 임플란트.
- 제 18 항에 있어서, 혼합물이 분자량이 약 14kD인 폴리락타이드의 제 2 폴리머를 포함하여 이루어지는 것을 특징으로 하는 임플란트.
- 제 1 항에 있어서, 압출성형법으로 성형되는 것을 특징으로 하는 임플란트.
- 눈에 임플란트를 배치한 후 적어도 1 주일 동안인 임플란트가 배치된 눈에서 안혈관 폐색을 감소시키는 데 효과적인 시간 동안 임플란트로부터 일정량의 알파-2 아드레날린성 수용체 아고니스트를 지속 방출하기에 효과적인 속도로 약물을 방출 하는 생분해성 재료를 형성하도록, 알파-2 아드레날린성 수용체 아고니스트 및 생분해성 폴리머 구성성분의 혼합물을 압출성형하는 단계를 포함하는, 생분해성 안내 임플란트를 제조하는 방법.
- 제 21 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 퀴녹살린, (2-이미다졸린-2-일아미노)퀴녹살린, 5-브로모-6-(2-이미다졸린-2-일아미노)퀴녹살린, 이들의 유도체 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 방법.
- 제 21 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘, 이의 염 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 방법.
- 제 21 항에 있어서, 압출성형하는 단계 전에 상기 알파-2 아드레날린성 수용체 아고니스트와 상기 폴리머 구성성분을 혼합하는 단계를 더욱 포함하는 것을 특징으로 하는 방법.
- 제 21 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트 및 상기 폴리머 구성성분이 분말 형태인 것을 특징으로 하는 방법.
- 제 21 항에 있어서, 상기 폴리머 구성성분이 적어도 하나의 생분해성 폴리머가 분자량이 약 64kD인 폴리락타이드인 생분해성 폴리머들의 혼합물을 포함하는 것을 특징으로 하는 방법.
- 제 21 항에 있어서, 상기 폴리머 구성성분이 고유점도가 약 0.3dl/g인 생분해성 폴리머 하나와 고유점도가 약 1.0dl/g인 다른 생분해성 폴리머의 두가지 상이한 생분해성 폴리머의 혼합물을 포함하는 것을 특징으로 하는 방법.
- 상기 청구항 1의 임플란트를 환자의 눈에 배치하여, 치료학적으로 효과적인 양의 알파-2 아드레날린성 수용체 아고니스트를 적어도 일주일동안 환자에 제공하여 환자의 눈에서 안폐색을 감소시키기 위한 임플란트 의약품.
- 제 28 항에 있어서, 상기 의약품이 망막 동맥 페색 질환, 중심성 망막 정맥 폐색, 파종성 혈관내응고증(disseminated intravascular coagulopathy), 망막 분지정맥 폐색, 망막 분지 정맥 폐색(branch retinal vein occlusion), 고혈압성 안저변화(hypertensive fundus changes), 안허혈 증후군(ocular ischemic syndrome), 망막 동맥 미세혈관류(retinal arterial microaneurysms), 반측 망막정맥폐색(hemi-retinal vein occlusion), 중심성 망막 동맥 폐색(central retinal artery occlusion), 망막 분지 동맥 폐색(branch retinal artery occlusion), 경동맥 질환(CAD), 일스 병(Eales disease) 및 당뇨병과 관련된 혈관병증으로 구성된 그룹에 서 선택된 안질환을 방지하기에 효과적인 것을 특징으로 하는 의약품.
- 제 28 항에 있어서, 상기 임플란트를 후안부에 배치하는 것을 특징으로 하는 의약품.
- 제 28 항에 있어서, 상기 임플란트를 트로카를 사용하여 눈에 배치하는 것을 특징으로 하는 의약품.
- 제 28 항에 있어서, 상기 임플란트를 시린지(syringe)를 사용하여 눈에 배치하는 것을 특징으로 하는 의약품.
- 제 28 항에 있어서, 환자에게 알파-2 아드레날린성 수용체 아고니스트 외의 치료학적 제제를 투여하는 단계를 더욱 포함하는 것을 특징으로 하는 의약품.
- 생분해성 폴리머와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함하는 생분해성 안내 임플란트를 눈에 배치하여 녹내장을 처치하는 녹내장 처치용 생분해성 임플란트인 것을 특징으로 하는 의약품.
- 제 34 항에 있어서, 치료학적으로 효과적인 양의 알파-2 아드레날린성 수용체 아고니스트가 눈의 유리체내에 배치된 후 약 35일 이하로 방출되도록, 상기 알 파-2 아드레날린성 수용체 아고니스트가 생분해성 폴리머 매트릭스와 결합되는 것을 특징으로 하는 의약품.
- 제 34 항에 있어서, 치료학적으로 효과적인 양의 알파-2 아드레날린성 수용체 아고니스트가 눈의 유리체내에 배치된 후 약 40일 이하로 방출되도록, 상기 알파-2 아드레날린성 수용체 아고니스트가 생분해성 폴리머 매트릭스와 결합되는 것을 특징으로 하는 의약품.
- 제 34 항에 있어서, 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘, 이의 염 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 의약품.
- 생분해성 폴리머와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함하는 생분해성 안내 임플란트를 눈에 배치하여 환자의 시각을 향상 또는 유지하는, 시각 향상 또는 유지용 생분해성 임플란트인 의약품.
- 제 38 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘, 이의 염 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 의약품.
- 제 38 항에 있어서, 눈에 상기 임플란트를 배치하는 것이 비-삼출성 노인성 황반 변성, 삼출성 노인성 황반변성, 맥락막 혈관신생(choroidal neovasculariza tion), 당뇨병성 망막증, 급성 황반성 신경망막병증 (acute macular neuroretino pathy), 중심성 장액성 맥락망막병증(central serous chorioretinopathy), 낭포성 황반부종, 당뇨병성 황반부종, 급성 다발성 판상색소 상피증(acute multifocal placoid epitheliopathy), 베체트 병, 버드샷 망막맥락막증(birdshot retinochoroidopathy), 매독, 라임병, 결핵, 톡소플라스마증, 중간포도막염, 다소성 맥락막염(multifocal choroiditis), 다발성 소실성 백반증후군(multiple evanescent white dot syndrome), 눈의 사르코이드증(ocular sarcoidosis), 후공막염(posterior scleritis), 사행성 맥락막염(serpiginous choroiditis), 망막하 섬유화 및 포도막염 증후군(subretinal fibrosis and uveitis syndrome), 보그트-고야나기-하라다 증후군(Vogt-Koyanagi-and Harada syndrome), 코우츠 병(Coat's disease), 중심오목부근 모세혈관확장증(parafoveal telangiectasis), 유두정맥염(papillophlebitis), 언가지모양혈관염(frosted branch angiitis), 겸상세포 망막증(sickle cell retinopathy) 및 다른 혈색소병증(hemoglobinopathie), 혈관무늬 망막증(angioid streaks), 가족성 삼출 유리체망막증(familial exudative vitreoretinopathy), 교감성안염(sympathetic ophthalmia), 포도막 망막 질환, 망막 박리, 외상, 레이저로 인한 질환, 광역동요법, 광응고술(photocoagulation), 수술 중 저관류(hypoperfusion), 방사선 망막증(radiation retinopathy), 골수 이식 망막증, 증식성 유리체 망막증과 망막전막(epiretinal membranes), 증식성 당뇨병 성 망막증, 안 히스토플라즈마증, 안 톡소카라증, 추정 안 히스토플라즈마증 증후군(presumed ocular histoplasmosis syndrome), 내안구염(endophthalmitis), 톡소플라즈마증, HIV 감염과 관련된 망막 질환, HIV 감염과 관련된 맥락막 질환, HIV 감염과 관련된 포도막 질환, 바이러스성 망막염, 급성 망막 괴사, 진행성 외부 망막괴사, 진균성 망막 질환, 안 매독, 안 결핵, 광범위 일측 아급성 신경망막염(diffuse unilateral subacute neuroretinitis), 구더기증(myiasis), 색소성 망막염, 망막 이영양증(retinal dystrophies)과 관련된 전신질환, 선천성 정지형 야맹증(congenital stationary night blindness), 추체 이영양증(cone dystrophies), 스타르가르트병(Stargardt's disease) 및 노란점 안저(fundus flavimaculatus), 베체트 병, 망막 색소 상피의 패턴 이영양증(pattern dystrophy of the retinal pigmented epithelium), X-염색체관련 망막층간분리(X-linked retinoschisis), 소르스비 안저 이영양증(Sorsby's fundus dystrophy), 양성 동심성 황반병증(benign concentric maculopathy), 비에티 결정 이영양증(Bietti's crystalline dystrophy), 탄성섬유 가성 황색종(pseudoxanthoma elasticum), 망막 박리, 황반 원공, 거대 망막 열공, 종양과 관련된 망막 질환, RPE의 선천성 비후(congenital hypertrophy), 후부 포도막 흑색종(posterior uveal melanoma), 맥락막 혈관종(choroidal hemangioma), 맥락막 골종(choroidal osteoma), 맥락막 전이, 망막 및 망막 색소 상피의 복합 과오종(combined hamartoma of the retina and retinal pigmented epithelium), 망막아세포종, 안저의 혈관증식성 종양(vasoproliferative tumors of the ocular fundus), 망막별아교세포종(retinal astrocytoma), 안내 림 프성 종양, 점상내층맥락막병증(punctate inner choroidopathy), 급성 후부 다발성 판상색소 상피증(acute posterior multifocal placoid pigment epitheliopathy), 근시성 망막 변성, 및 급성 망막 색소 상피염(retinal pigement epithelitis)으로 구성된 그룹에서 선택된 하나 이상의 질환을 처치하는 데 효과적인 것을 특징으로 하는 의약품.
- 알파-2 아드레날린성 수용체 아고니스트, 및 임플란트를 눈에 배치한 후 적어도 약 1주일 동안 임플란트로부터 알파-2 아드레날린성 수용체 아고니스트를 지속 방출하기에 효과적인 속도로 약물을 방출하는 생분해성 폴리머 매트릭스를 포함하여 이루어지는 생분해성 안내 임플란트.
- 제 42 항에 있어서, 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘, 이의 염 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 임플란트.
- 임플란트가 안내에 배치된 동안 임플란트가 배치된 눈의 시각을 향상시키기에 효과적인 양으로 알파-2 아드레날린성 수용체 아고니스트를 폴리머로부터 방출할 수 있는, 알파-2 아드레날린성 수용체 아고니스트 및 생분해성 폴리머를 포함하여 이루어지는, 시각 향상용 생분해성 안내 임플란트.
- 제 43 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 퀴녹살린, (2-이미다졸린-2-일아미노)퀴녹살린, 5-브로모-6-(2-이미다졸린-2-일아미노)퀴녹살린, 이들의 유도체 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 임플란트.
- 제 43 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘, 이의 염 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 임플란트.
- 제 43 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘 타르트레이트인 것을 특징으로 하는 임플란트.
- 제 43 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 생분해성 폴리머 내에 분산되어 있는 것을 특징으로 하는 임플란트.
- 제 43 항에 있어서, 상기 생분해성 폴리머가 폴리락트산의 제 1 생분해성 폴리머와 폴리락트산의 상이한 제 2 생분해성 폴리머의 혼합물을 포함하여 이루어지는 것을 특징으로 하는 임플란트.
- 제 43 항에 있어서, 상기 폴리머가 임플란트가 눈의 유리체에 배치된 시점으 로부터 1개월 이상 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 약물을 방출하는 것을 특징으로 하는 임플란트.
- 제 43 항에 있어서, 상기 폴리머가 임플란트가 눈의 유리체에 배치된 시점으로부터 40일 이상 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 약물을 방출하는 것을 특징으로 하는 임플란트.
- 제 43 항에 있어서, 상기 폴리머가 임플란트가 눈의 유리체에 배치된 시점으로부터 35일 이하 동안 일정량의 알파-2 아드레날린성 수용체 아고니스트를 임플란트로부터 지속 방출하기에 효과적인 속도로 약물을 방출하는 것을 특징으로 하는 임플란트.
- 임플란트가 배치된 눈에서 눈의 시력을 향상시키는 데 효과적인 시간 동안 임플란트로부터 일정량의 알파-2 아드레날린성 수용체 아고니스트를 지속 방출하기에 효과적인 속도로 약물을 방출하는 생분해성 재료를 형성하도록, 알파-2 아드레날린성 수용체 아고니스트 및 생분해성 폴리머 구성성분의 혼합물을 압출성형하는 단계를 포함하는, 생분해성 안내 임플란트를 제조하는 방법.
- 제 53 항에 있어서, 상기 알파-2 아드레날린성 수용체 아고니스트가 퀴녹살린, (2-이미다졸린-2-일아미노)퀴녹살린, 5-브로모-6-(2-이미다졸린-2-일아미노)퀴녹살린, 이들의 유도체 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 방법.
- 생분해성 폴리머와 결합된 알파-2 아드레날린성 수용체 아고니스트를 포함하는 생분해성 안내 임플란트를 눈의 유리체 내에 배치하여 환자의 시각을 향상 또는 유지하는, 시각 향상 또는 유지용 생분해성 임플란트인 의약품.
- 제 54 항에 있어서, 상기 의약품이 비-삼출성 노인성 황반 변성, 삼출성 노인성 황반변성, 맥락막 혈관신생(choroidal neovasculariza tion), 당뇨병성 망막증, 급성 황반성 신경망막병증 (acute macular neuroretino pathy), 중심성 장액성 맥락망막병증(central serous chorioretinopathy), 낭포성 황반부종, 당뇨병성 황반부종, 급성 다발성 판상색소 상피증(acute multifocal placoid epitheliopathy), 베체트 병, 버드샷 망막맥락막증(birdshot retinochoroidopathy), 매독, 라임병, 결핵, 톡소플라스마증, 중간포도막염, 다소성 맥락막염(multifocal choroiditis), 다발성 소실성 백반증후군(multiple evanescent white dot syndrome), 눈의 사르코이드증(ocular sarcoidosis), 후공막염(posterior scleritis), 사행성 맥락막염(serpiginous choroiditis), 망막하 섬유화 및 포도막염 증후군(subretinal fibrosis and uveitis syndrome), 보그트-고야나기-하라다 증후군(Vogt-Koyanagi- and Harada syndrome), 코우츠 병(Coat's disease), 중심오목부근 모세혈관확장증(parafoveal telangiectasis), 유두정맥염(papillophlebitis), 언가지모양혈관염(frosted branch angiitis), 겸상세포 망막증(sickle cell retinopathy) 및 다른 혈색소병증(hemoglobinopathie), 혈관무늬 망막증(angioid streaks), 가족성 삼출 유리체망막증(familial exudative vitreoretinopathy), 교감성안염(sympathetic ophthalmia), 포도막 망막 질환, 망막 박리, 외상, 레이저로 인한 질환, 광역동요법, 광응고술(photocoagulation), 수술 중 저관류(hypoperfusion), 방사선 망막증(radiation retinopathy), 골수 이식 망막증, 증식성 유리체 망막증과 망막전막(epiretinal membranes), 증식성 당뇨병성 망막증, 안 히스토플라즈마증, 안 톡소카라증, 추정 안 히스토플라즈마증 증후군(presumed ocular histoplasmosis syndrome), 내안구염(endophthalmitis), 톡소플라즈마증, HIV 감염과 관련된 망막 질환, HIV 감염과 관련된 맥락막 질환, HIV 감염과 관련된 포도막 질환, 바이러스성 망막염, 급성 망막 괴사, 진행성 외부 망막괴사, 진균성 망막 질환, 안 매독, 안 결핵, 광범위 일측 아급성 신경망막염(diffuse unilateral subacute neuroretinitis), 구더기증(myiasis), 색소성 망막염, 망막 이영양증(retinal dystrophies)과 관련된 전신질환, 선천성 정지형 야맹증(congenital stationary night blindness), 추체 이영양증(cone dystrophies), 스타르가르트병(Stargardt's disease) 및 노란점 안저(fundus flavimaculatus), 베체트 병, 망막 색소 상피의 패턴 이영양증(pattern dystrophy of the retinal pigmented epithelium), X-염색체관련 망막층간분리(X-linked retinoschisis), 소르스비 안저 이영양증(Sorsby's fundus dystrophy), 양성 동심성 황반병증(benign concentric maculopathy), 비에티 결정 이영양증(Bietti's crystalline dystrophy), 탄성섬유 가성 황색종(pseudoxanthoma elasticum), 망막 박리, 황반 원공, 거대 망막 열공, 종양과 관련된 망막 질환, RPE의 선천성 비후(congenital hypertrophy), 후부 포도막 흑색종(posterior uveal melanoma), 맥락막 혈관종(choroidal hemangioma), 맥락막 골종(choroidal osteoma), 맥락막 전이, 망막 및 망막 색소 상피의 복합 과오종(combined hamartoma of the retina and retinal pigmented epithelium), 망막아세포종, 안저의 혈관증식성 종양(vasoproliferative tumors of the ocular fundus), 망막별아교세포종(retinal astrocytoma), 안내 림프성 종양, 점상내층맥락막병증(punctate inner choroidopathy), 급성 후부 다발성 판상색소 상피증(acute posterior multifocal placoid pigment epitheliopathy), 근시성 망막 변성, 및 급성 망막 색소 상피염(retinal pigement epithelitis)으로 구성된 그룹에서 선택된 안질환을 처치하는 데 효과적인 것을 특징으로 하는 의약품.
- 제 54 항에 있어서, 알파-2 아드레날린성 수용체 아고니스트가 브리모니딘, 이의 염 및 이들의 혼합물로 구성된 그룹에서 선택된 것임을 특징으로 하는 의약품.
- 제 54 항에 있어서, 상기 의약품이 정상 눈의 시각을 향상시킬 수 있는 것을 특징으로 하는 의약품.
- 제 54 항에 있어서, 상기 의약품이 정상 눈의 시각을 약 56%까지 향상시킬 수 있는 것을 특징으로 하는 의약품.
- 제 54 항에 있어서, 상기 의약품이 안질환이 있는 눈의 시각을 향상시킬 수 있는 것을 특징으로 하는 의약품.
- 제 59 항에 있어서, 상기 의약품이 안질환이 있는 눈의 시각을 약 23%까지 향상시킬 수 있는 것을 특징으로 하는 의약품.
- 제 59 항에 있어서, 상기 안질환이 혈관병증인 것을 특징으로 하는 의약품.
- 제 59 항에 있어서, 상기 안질환이 증가된 안압에 의한 것임을 특징으로 하는 의약품.
- 제 59 항에 있어서, 상기 안질환이 망막 허혈성 손상인 것을 특징으로 하는 의약품.
- 제 54 항에 있어서, 상기 임플란트가 임플란트가 안내에 배치된 약 90일의 기간 동안 폴리머로부터 알파-2 아드레날린성 수용체 아고니스트를 방출하는 것을 특징으로 하는 의약품.
- 제 54 항에 있어서, 의약품이 유리체 내에 유지되는 기간 동안 알파-2 아드레날린성 수용체 아고니스트가 망막에 유지되는 것을 특징으로 하는 의약품.
- 생분해성 폴리머와 결합된 브리모니딘을 포함하는 생분해성 안내 임플란트를 눈의 유리체에 배치하여 시각을 향상, 유지, 회복 또는 교정하는, 시각 향상, 유지, 회복 또는 교정용 생분해성 임플란트 의약품.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/836,911 | 2004-04-30 | ||
| US10/836,911 US20050244463A1 (en) | 2004-04-30 | 2004-04-30 | Sustained release intraocular implants and methods for treating ocular vasculopathies |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20070064415A true KR20070064415A (ko) | 2007-06-20 |
Family
ID=34967610
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020067022639A KR20070064415A (ko) | 2004-04-30 | 2005-04-26 | 알파-2 아드레날린성 수용체 아고니스트의 안내 임플란트및 시각을 향상시키는 방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (7) | US20050244463A1 (ko) |
| EP (2) | EP2305261B1 (ko) |
| JP (2) | JP2007535552A (ko) |
| KR (1) | KR20070064415A (ko) |
| CN (1) | CN1950067A (ko) |
| AT (1) | ATE516033T1 (ko) |
| AU (2) | AU2005244149A1 (ko) |
| BR (1) | BRPI0510504A (ko) |
| CA (1) | CA2565067C (ko) |
| DK (1) | DK1758552T3 (ko) |
| ES (1) | ES2367804T3 (ko) |
| MX (1) | MXPA06012291A (ko) |
| NZ (1) | NZ550009A (ko) |
| WO (1) | WO2005110368A1 (ko) |
Families Citing this family (81)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050101582A1 (en) | 2003-11-12 | 2005-05-12 | Allergan, Inc. | Compositions and methods for treating a posterior segment of an eye |
| US20090148527A1 (en) * | 2007-12-07 | 2009-06-11 | Robinson Michael R | Intraocular formulation |
| US20070224278A1 (en) | 2003-11-12 | 2007-09-27 | Lyons Robert T | Low immunogenicity corticosteroid compositions |
| DE602005011928D1 (de) | 2004-01-20 | 2009-02-05 | Allergan Inc | Zusammensetzungen für die lokalisierte therapie des auges, vorzugsweise enthaltend triamcinolon-acetonid und hyaluronsäure |
| US8722097B2 (en) | 2004-04-30 | 2014-05-13 | Allergan, Inc. | Oil-in-water method for making polymeric implants containing a hypotensive lipid |
| US20050244463A1 (en) | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Sustained release intraocular implants and methods for treating ocular vasculopathies |
| US8147865B2 (en) | 2004-04-30 | 2012-04-03 | Allergan, Inc. | Steroid-containing sustained release intraocular implants and related methods |
| US9498457B2 (en) | 2004-04-30 | 2016-11-22 | Allergan, Inc. | Hypotensive prostamide-containing biodegradable intraocular implants and related implants |
| US7993634B2 (en) | 2004-04-30 | 2011-08-09 | Allergan, Inc. | Oil-in-oil emulsified polymeric implants containing a hypotensive lipid and related methods |
| US8529927B2 (en) * | 2004-04-30 | 2013-09-10 | Allergan, Inc. | Alpha-2 agonist polymeric drug delivery systems |
| US7799336B2 (en) | 2004-04-30 | 2010-09-21 | Allergan, Inc. | Hypotensive lipid-containing biodegradable intraocular implants and related methods |
| US20070212395A1 (en) * | 2006-03-08 | 2007-09-13 | Allergan, Inc. | Ocular therapy using sirtuin-activating agents |
| US8673341B2 (en) | 2004-04-30 | 2014-03-18 | Allergan, Inc. | Intraocular pressure reduction with intracameral bimatoprost implants |
| US8119154B2 (en) | 2004-04-30 | 2012-02-21 | Allergan, Inc. | Sustained release intraocular implants and related methods |
| US8425929B2 (en) | 2004-04-30 | 2013-04-23 | Allergan, Inc. | Sustained release intraocular implants and methods for preventing retinal dysfunction |
| US20080038316A1 (en) * | 2004-10-01 | 2008-02-14 | Wong Vernon G | Conveniently implantable sustained release drug compositions |
| WO2006094014A2 (en) | 2005-02-28 | 2006-09-08 | The Regents Of The University Of California | Methods for diagnosis and treatment of endometrial cancer |
| US8318906B2 (en) | 2005-04-15 | 2012-11-27 | The Regents Of The University Of California | EMP2 antibodies and their therapeutic uses |
| US7931909B2 (en) * | 2005-05-10 | 2011-04-26 | Allergan, Inc. | Ocular therapy using alpha-2 adrenergic receptor compounds having enhanced anterior clearance rates |
| EP1924292A2 (en) | 2005-09-16 | 2008-05-28 | Allergan, Inc. | Compositions and methods for the intraocular transport of therapeutic agents |
| US20070202186A1 (en) | 2006-02-22 | 2007-08-30 | Iscience Interventional Corporation | Apparatus and formulations for suprachoroidal drug delivery |
| US8197435B2 (en) | 2006-05-02 | 2012-06-12 | Emory University | Methods and devices for drug delivery to ocular tissue using microneedle |
| US20070260203A1 (en) * | 2006-05-04 | 2007-11-08 | Allergan, Inc. | Vasoactive agent intraocular implant |
| ITMI20061538A1 (it) * | 2006-08-02 | 2008-02-03 | Mediolanum Pharmaceuticals Ltd | Impianti sottocutanei in grado di rilasciare il principio attivo per un periodo prolungato di tempo |
| US8969415B2 (en) * | 2006-12-01 | 2015-03-03 | Allergan, Inc. | Intraocular drug delivery systems |
| US20080293728A1 (en) * | 2007-05-18 | 2008-11-27 | Mcintire Gregory L | Complexes Comprising alpha2-Adrenergic Receptor Agonists and Compositions |
| WO2008157614A2 (en) * | 2007-06-21 | 2008-12-24 | Yale University | Sustained intraocular delivery of drugs from biodegradable polymeric microparticles |
| US9072727B2 (en) * | 2008-04-18 | 2015-07-07 | Warsaw Orthopedic, Inc. | Alpha adrenergic receptor agonists for treatment of degenerative disc disease |
| US8524267B2 (en) * | 2008-04-18 | 2013-09-03 | Warsaw Orthopedic, Inc. | Dexamethasone formulations in a biodegradable material |
| US9877973B2 (en) | 2008-05-12 | 2018-01-30 | University Of Utah Research Foundation | Intraocular drug delivery device and associated methods |
| CN102026599A (zh) | 2008-05-12 | 2011-04-20 | 犹他大学研究基金会 | 眼内药物递送装置及相关方法 |
| US9095404B2 (en) | 2008-05-12 | 2015-08-04 | University Of Utah Research Foundation | Intraocular drug delivery device and associated methods |
| US10064819B2 (en) | 2008-05-12 | 2018-09-04 | University Of Utah Research Foundation | Intraocular drug delivery device and associated methods |
| US8821870B2 (en) | 2008-07-18 | 2014-09-02 | Allergan, Inc. | Method for treating atrophic age related macular degeneration |
| WO2010014552A1 (en) | 2008-08-01 | 2010-02-04 | Alpha Synergy Development, Inc. | Vasoconstriction compositions and methods of use |
| CN103937797B (zh) | 2008-09-15 | 2021-09-21 | 弗·哈夫曼-拉罗切有限公司 | 调节细胞摩尔渗透压浓度的组合物和方法 |
| US20100098772A1 (en) * | 2008-10-21 | 2010-04-22 | Allergan, Inc. | Drug delivery systems and methods for treating neovascularization |
| US9095506B2 (en) | 2008-11-17 | 2015-08-04 | Allergan, Inc. | Biodegradable alpha-2 agonist polymeric implants and therapeutic uses thereof |
| WO2010085609A2 (en) * | 2009-01-23 | 2010-07-29 | Surmodics Pharmaceuticals, Inc. | Controlled release systems from polymer blends |
| US8617583B2 (en) * | 2009-07-17 | 2013-12-31 | Warsaw Orthopedic, Inc. | Alpha adrenergic receptor agonists for prevention or treatment of a hematoma, edema, and/or deep vein thrombosis |
| US20110097375A1 (en) * | 2009-10-26 | 2011-04-28 | Warsaw Orthopedic, Inc. | Formulation for preventing or reducing bleeding at a surgical site |
| US20110129516A1 (en) * | 2009-10-30 | 2011-06-02 | Aton Pharma, Inc. | Ocular drug delivery devices |
| WO2011057129A2 (en) | 2009-11-09 | 2011-05-12 | Allergan, Inc. | Compositions and methods for stimulating hair growth |
| EP3348277A1 (en) | 2009-11-20 | 2018-07-18 | The Regents of The University of California | Epithelial membrane protein-2 (emp2) and proliferative vitreoretinopathy (pvr) |
| US8529492B2 (en) | 2009-12-23 | 2013-09-10 | Trascend Medical, Inc. | Drug delivery devices and methods |
| TW201141477A (en) * | 2010-01-21 | 2011-12-01 | Allergan Inc | Alpha-2 adrenergic agonist having long duration of intraocular pressure-lowering effect |
| WO2011103599A2 (en) | 2010-02-19 | 2011-08-25 | The Regents Of The Universith Of California | Epithelial membrane protein 2 (emp2) binding reagents and their therapeutic uses in ocular diseases |
| ES2730411T3 (es) * | 2010-03-26 | 2019-11-11 | Galderma Res & Dev | Composiciones mejoradas que comprenden brimonidina para un tratamiento seguro y eficaz de la telangiectasia |
| US8653123B2 (en) * | 2010-09-16 | 2014-02-18 | Allergan, Inc. | Ester pro-drugs of [3-(1-(1H-imidazol-4-yl)ethyl)-2-methylphenyl] methanol for treating retinal diseases |
| BR112013009205A2 (pt) | 2010-10-15 | 2016-07-26 | Iscience Interventional Corp | dispositivo para colocação na esclera de um olho, método para acessar o espaço supracoroidal de um olho, para acessar o espaço subretinal de um olho e para colocar um orifício dentro de um trato escleral em um olho. |
| KR102134117B1 (ko) | 2010-11-16 | 2020-07-15 | 알러간, 인코포레이티드 | (3-(1-(1h-이미다졸-4-일)에틸)-2-메틸페닐)메탄올을 포함하는 약제학적 조성물 |
| US20140023692A1 (en) * | 2010-11-26 | 2014-01-23 | Lisa Claire Du Toit | Drug delivery device |
| US8349005B2 (en) | 2011-01-03 | 2013-01-08 | Masatoshi Murata | Method for burying implant to choroid |
| EP2709672B1 (en) | 2011-05-18 | 2019-12-18 | The Regents of The University of California | Compositions and methods for treating retinal diseases |
| WO2013016072A1 (en) * | 2011-07-22 | 2013-01-31 | Allergan, Inc. | Pharmaceutical compositions comprising 4-bromo-n-(imidazolidin-2-ylidene)-1h-benzimidazol-5-amine for treating skin diseases |
| US20130046003A1 (en) * | 2011-07-22 | 2013-02-21 | Mohammed I. Dibas | Pharmaceutical compositions comprising 4-bromo-n-(imidazolidin-2-ylidene)-1h-benzimidazol-5-amine for treating retinal diseases |
| AU2012324544B2 (en) * | 2011-10-19 | 2016-11-24 | Galderma S.A. | Method for treating capillary hemangiomas |
| US9095576B2 (en) | 2011-11-21 | 2015-08-04 | Allergan, Inc. | Pharmaceutical compositions comprising 4-[1-(2,3-dimethylphenyl)ethyl]-3H-imidazole derivatives for treating retinal diseases |
| US20130137724A1 (en) | 2011-11-28 | 2013-05-30 | Allergan, Inc. | Pharmaceutical compositions comprising 7-(1h-imidazol-4-ylmethyl)-5,6,7,8-tetrahydro-quinoline for retinal neuroprotection |
| KR102107482B1 (ko) | 2012-02-14 | 2020-05-08 | 더 리젠츠 오브 더 유니버시티 오브 캘리포니아 | 심혈관 질환 및 다른 증상에 대한 파라크린 유전자의 전신 전달 및 조절 발현 |
| JP6487848B2 (ja) | 2012-11-08 | 2019-03-20 | クリアサイド バイオメディカル,インコーポレイテッド | ヒト被験体における眼部障害の処置のための方法およびデバイス |
| WO2014127243A1 (en) * | 2013-02-15 | 2014-08-21 | Allergan, Inc. | Sustained drug delivery implant |
| RU2015133365A (ru) | 2013-03-14 | 2017-04-18 | Аллерган, Инк. | Альфа-2 адренергический агонист для лечения внутриглазного давления и заболеваний глаз путем введения в стекловидное тело и внутрикамерно |
| BR112015027762A2 (pt) | 2013-05-03 | 2017-08-29 | Clearside Biomedical Inc | Aparelho e métodos para injeção ocular |
| WO2014197317A1 (en) | 2013-06-03 | 2014-12-11 | Clearside Biomedical, Inc. | Apparatus and methods for drug delivery using multiple reservoirs |
| US9492316B2 (en) | 2013-10-31 | 2016-11-15 | Allergan, Inc. | Prostamide-containing intraocular implants and methods of use thereof |
| US20170182129A1 (en) | 2014-04-03 | 2017-06-29 | The Regents Of The University Of California | Systemic delivery of virus vectors encoding urocortin-2 and related genes to treat diabetes-related cardiac dysfunctions and congestive heart failure |
| JP2017524419A (ja) | 2014-06-20 | 2017-08-31 | クリアサイド バイオメディカル,インコーポレイテッド | 薬剤送達のための挿入深さを制御するための可変径カニューレ及び方法 |
| IL293029B2 (en) | 2015-03-16 | 2023-06-01 | Magic Leap Inc | Augmented reality signal oximeter |
| JP2018533596A (ja) | 2015-11-12 | 2018-11-15 | グレイバグ ビジョン インコーポレイテッド | 医学療法のための凝集マイクロ粒子 |
| CN105935442A (zh) * | 2016-01-08 | 2016-09-14 | 新昌县大成生物科技有限公司 | 一种治疗青光眼的药物组合物 |
| IL299497B2 (en) | 2016-04-08 | 2024-02-01 | Magic Leap Inc | Augmented reality systems and methods with variable focus lens elements |
| WO2017192565A1 (en) | 2016-05-02 | 2017-11-09 | Clearside Biomedical, Inc. | Systems and methods for ocular drug delivery |
| US10973681B2 (en) | 2016-08-12 | 2021-04-13 | Clearside Biomedical, Inc. | Devices and methods for adjusting the insertion depth of a needle for medicament delivery |
| IL268630B2 (en) | 2017-02-23 | 2023-09-01 | Magic Leap Inc | Display system with variable power reflector |
| WO2018175922A1 (en) * | 2017-03-23 | 2018-09-27 | Graybug Vision, Inc. | Drugs and compositions for the treatment of ocular disorders |
| JP2020519585A (ja) | 2017-05-10 | 2020-07-02 | グレイバグ ビジョン インコーポレイテッド | 医学療法のための延長放出マイクロ粒子及びその懸濁液 |
| WO2018226640A1 (en) | 2017-06-05 | 2018-12-13 | The Regents Of The University Of The University Of California | Compositions for treating retinal diseases and methods for making and using them |
| MX2021002112A (es) * | 2018-08-21 | 2021-07-16 | Allergan Inc | Uso de agonistas del receptor alfa-2-adrenergico para mejorar la vision. |
| JP2022538347A (ja) | 2019-06-27 | 2022-09-01 | レイヤーバイオ,インコーポレーテッド | 眼用デバイス送達方法およびシステム |
| CN117571883B (zh) * | 2024-01-15 | 2024-03-19 | 四川智强医药科技开发有限公司 | 一种酒石酸溴莫尼定滴眼液的质量检测方法 |
Family Cites Families (155)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2194704A (en) | 1938-04-15 | 1940-03-26 | Du Pont | Unsaturated ketones and process for producing them |
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US3916899A (en) | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| SE390255B (sv) * | 1974-02-18 | 1976-12-13 | N G Y Torphammar | Upprullningsanordning foretredesvis for ett sekerhetsbelte i ett fordon |
| GB1478759A (en) * | 1974-11-18 | 1977-07-06 | Alza Corp | Process for forming outlet passageways in pills using a laser |
| US3966749A (en) * | 1975-02-10 | 1976-06-29 | Interx Research Corporation | Novel synthesis of optically active m-acyloxy-α-[(methylamino)methyl]benzyl alcohols, the pharmaceutically acceptable acid addition salts thereof and intermediate useful in the preparation thereof |
| US4014335A (en) * | 1975-04-21 | 1977-03-29 | Alza Corporation | Ocular drug delivery device |
| US4144317A (en) * | 1975-05-30 | 1979-03-13 | Alza Corporation | Device consisting of copolymer having acetoxy groups for delivering drugs |
| US4052505A (en) * | 1975-05-30 | 1977-10-04 | Alza Corporation | Ocular therapeutic system manufactured from copolymer |
| US4057619A (en) | 1975-06-30 | 1977-11-08 | Alza Corporation | Ocular therapeutic system with selected membranes for administering ophthalmic drug |
| US4063064A (en) | 1976-02-23 | 1977-12-13 | Coherent Radiation | Apparatus for tracking moving workpiece by a laser beam |
| US4186184A (en) * | 1977-12-27 | 1980-01-29 | Alza Corporation | Selective administration of drug with ocular therapeutic system |
| US4190642A (en) * | 1978-04-17 | 1980-02-26 | Alza Corporation | Ocular therapeutic system for dispensing a medication formulation |
| US4200098A (en) * | 1978-10-23 | 1980-04-29 | Alza Corporation | Osmotic system with distribution zone for dispensing beneficial agent |
| US4285987A (en) * | 1978-10-23 | 1981-08-25 | Alza Corporation | Process for manufacturing device with dispersion zone |
| US4303637A (en) | 1980-04-04 | 1981-12-01 | Alza Corporation | Medication indicated for ocular hypertension |
| US4281654A (en) * | 1980-04-07 | 1981-08-04 | Alza Corporation | Drug delivery system for controlled ocular therapy |
| US4396625A (en) * | 1980-05-13 | 1983-08-02 | Sumitomo Chemical Company, Limited | Treatment of glaucoma or ocular hypertension and ophthalmic composition |
| US4425346A (en) * | 1980-08-01 | 1984-01-10 | Smith And Nephew Associated Companies Limited | Pharmaceutical compositions |
| US4304765A (en) | 1980-10-14 | 1981-12-08 | Alza Corporation | Ocular insert housing steroid in two different therapeutic forms |
| US4327725A (en) * | 1980-11-25 | 1982-05-04 | Alza Corporation | Osmotic device with hydrogel driving member |
| US4494247A (en) * | 1981-12-28 | 1985-01-22 | Trace Athletic Corporation | Knee/elbow guard treated to increase durability and a process for producing same |
| JPS58126435U (ja) * | 1982-02-19 | 1983-08-27 | オリンパス光学工業株式会社 | Ttlオ−トストロボ用絞り制御回路 |
| US4599353A (en) * | 1982-05-03 | 1986-07-08 | The Trustees Of Columbia University In The City Of New York | Use of eicosanoids and their derivatives for treatment of ocular hypertension and glaucoma |
| DE3220156C2 (de) * | 1982-05-28 | 1990-01-25 | Heida Houston Tex. Thurlow | Mit Metallgriffen, insbesondere Edelstahlgriffen, versehenes Koch- und Bratgeschirr mit Deckel |
| US4649151A (en) * | 1982-09-27 | 1987-03-10 | Health Research, Inc. | Drugs comprising porphyrins |
| US4478818A (en) * | 1982-12-27 | 1984-10-23 | Alza Corporation | Ocular preparation housing steroid in two different therapeutic forms |
| US4521210A (en) * | 1982-12-27 | 1985-06-04 | Wong Vernon G | Eye implant for relieving glaucoma, and device and method for use therewith |
| US6309669B1 (en) | 1984-03-16 | 2001-10-30 | The United States Of America As Represented By The Secretary Of The Army | Therapeutic treatment and prevention of infections with a bioactive materials encapsulated within a biodegradable-biocompatible polymeric matrix |
| US4693885A (en) * | 1984-07-18 | 1987-09-15 | Nippon Petrochemicals Co., Ltd. | Tetrapyrrole therapeutic agents |
| US4675338A (en) * | 1984-07-18 | 1987-06-23 | Nippon Petrochemicals Co., Ltd. | Tetrapyrrole therapeutic agents |
| US4935495A (en) * | 1984-12-21 | 1990-06-19 | Oncogen | Monoclonal antibodies to the L6 glycolipid antigenic determinant found on human non-small cell lung carcinomas |
| FR2577509B1 (fr) | 1985-02-21 | 1987-05-07 | Nirvana Espar Systems Sa | Mat de bateau a voile |
| US4656186A (en) * | 1985-04-30 | 1987-04-07 | Nippon Petrochemicals Co., Ltd. | Tetrapyrrole therapeutic agents |
| US4668506A (en) * | 1985-08-16 | 1987-05-26 | Bausch & Lomb Incorporated | Sustained-release formulation containing and amino acid polymer |
| FR2594438B1 (fr) * | 1986-02-14 | 1990-01-26 | Labaz Sanofi Nv | Derives d'indolizine, leur procede de preparation ainsi que les compositions en contenant |
| US4959217A (en) * | 1986-05-22 | 1990-09-25 | Syntex (U.S.A.) Inc. | Delayed/sustained release of macromolecules |
| US4863457A (en) * | 1986-11-24 | 1989-09-05 | Lee David A | Drug delivery device |
| US5089509A (en) * | 1988-09-15 | 1992-02-18 | Allergan, Inc. | Disubstituted acetylenes bearing heteroaromatic and heterobicyclic groups having retinoid like activity |
| US4981871A (en) * | 1987-05-15 | 1991-01-01 | Abelson Mark B | Treatment of ocular hypertension with class I calcium channel blocking agents |
| DE3734223A1 (de) | 1987-10-09 | 1989-04-20 | Boehringer Ingelheim Kg | Implantierbares, biologisch abbaubares wirkstofffreigabesystem |
| US4997652A (en) * | 1987-12-22 | 1991-03-05 | Visionex | Biodegradable ocular implants |
| US4853224A (en) * | 1987-12-22 | 1989-08-01 | Visionex | Biodegradable ocular implants |
| US4865846A (en) * | 1988-06-03 | 1989-09-12 | Kaufman Herbert E | Drug delivery system |
| US4968715A (en) | 1988-07-06 | 1990-11-06 | Health Research, Inc. | Use of purified hematoporphyrin trimers in photodynamic therapy |
| US5190966A (en) * | 1988-07-06 | 1993-03-02 | Health Research, Inc. | Purified hematoporphyrin dimers and trimers useful in photodynamic therapy |
| US5198460A (en) * | 1988-07-20 | 1993-03-30 | Health Research Inc. | Pyropheophorbides and their use in photodynamic therapy |
| US5002962A (en) * | 1988-07-20 | 1991-03-26 | Health Research, Inc. | Photosensitizing agents |
| US5093349A (en) * | 1988-07-20 | 1992-03-03 | Health Research Inc. | Photosensitizing agents |
| ATE101342T1 (de) | 1988-09-06 | 1994-02-15 | Kabi Pharmacia Ab | Prostaglandinderivate zur behandlung des gruenen stars oder einer okularen hypertension. |
| US4935498A (en) * | 1989-03-06 | 1990-06-19 | Board Of Regents, The University Of Texas System | Expanded porphyrins: large porphyrin-like tripyrroledimethine-derived macrocycles |
| US5457183A (en) | 1989-03-06 | 1995-10-10 | Board Of Regents, The University Of Texas System | Hydroxylated texaphyrins |
| US5171741A (en) | 1989-04-21 | 1992-12-15 | Health Research, Inc. | Bacteriochlorophyll-a derivatives useful in photodynamic therapy |
| US5173504A (en) | 1989-04-21 | 1992-12-22 | Health Research, Inc. | Bacteriochlorophyll-a derivatives useful in photodynamic therapy |
| US5019400A (en) * | 1989-05-01 | 1991-05-28 | Enzytech, Inc. | Very low temperature casting of controlled release microspheres |
| US5034413A (en) * | 1989-07-27 | 1991-07-23 | Allergan, Inc. | Intraocular pressure reducing 9,11-diacyl prostaglandins |
| US5268178A (en) | 1989-09-25 | 1993-12-07 | The Board Of Regents, The University Of Texas System | Biodegradable antibiotic implants and methods of their use in treating and preventing infections |
| US5503721A (en) * | 1991-07-18 | 1996-04-02 | Hri Research, Inc. | Method for photoactivation |
| US5164188A (en) | 1989-11-22 | 1992-11-17 | Visionex, Inc. | Biodegradable ocular implants |
| US5075115A (en) | 1990-04-02 | 1991-12-24 | Fmc Corporation | Process for polymerizing poly(lactic acid) |
| US5232844A (en) * | 1990-05-15 | 1993-08-03 | New York Blood Center | Photodynamic inactivation of viruses in cell-containing compositions |
| US5100431A (en) * | 1990-09-27 | 1992-03-31 | Allergan, Inc. | Single stitch suture needle and method |
| KR0185215B1 (ko) * | 1990-11-30 | 1999-05-01 | 요시다 쇼오지 | 서방성 안구삽입용 약제 |
| US5378475A (en) * | 1991-02-21 | 1995-01-03 | University Of Kentucky Research Foundation | Sustained release drug delivery devices |
| ATE142460T1 (de) * | 1991-06-21 | 1996-09-15 | Genetics Inst | Osteogene proteine enthaltende arzneimittel |
| US5356629A (en) * | 1991-07-12 | 1994-10-18 | United States Surgical Corporation | Composition for effecting bone repair |
| US5169638A (en) | 1991-10-23 | 1992-12-08 | E. R. Squibb & Sons, Inc. | Buoyant controlled release powder formulation |
| US5543154A (en) * | 1991-12-27 | 1996-08-06 | Merck & Co., Inc. | Controlled release nifedipine delivery device |
| US5656297A (en) * | 1992-03-12 | 1997-08-12 | Alkermes Controlled Therapeutics, Incorporated | Modulated release from biocompatible polymers |
| IT1263116B (it) | 1992-04-09 | 1996-07-30 | Rotta Research Lab | Derivati basici dell'acido glutammico ed acido aspartico, procedimento per la loro preparazione e loro uso farmaceutico |
| US5655832A (en) * | 1992-04-16 | 1997-08-12 | Tir Technologies, Inc. | Multiple wavelength light processor |
| US5244914A (en) * | 1992-04-27 | 1993-09-14 | American Cyanamid Company | Stable porfimer sodium compositions and methods for their manufacture |
| US5178635A (en) * | 1992-05-04 | 1993-01-12 | Allergan, Inc. | Method for determining amount of medication in an implantable device |
| US6217869B1 (en) * | 1992-06-09 | 2001-04-17 | Neorx Corporation | Pretargeting methods and compounds |
| US5688819A (en) | 1992-09-21 | 1997-11-18 | Allergan | Cyclopentane heptanoic acid, 2-cycloalkyl or arylalkyl derivatives as therapeutic agents |
| US5972991A (en) * | 1992-09-21 | 1999-10-26 | Allergan | Cyclopentane heptan(ene) oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents |
| US5922773A (en) * | 1992-12-04 | 1999-07-13 | The Children's Medical Center Corp. | Glaucoma treatment |
| JP3000187B2 (ja) * | 1993-02-26 | 2000-01-17 | 参天製薬株式会社 | 生体分解性強膜プラグ |
| US5707643A (en) * | 1993-02-26 | 1998-01-13 | Santen Pharmaceutical Co., Ltd. | Biodegradable scleral plug |
| WO1995003009A1 (en) | 1993-07-22 | 1995-02-02 | Oculex Pharmaceuticals, Inc. | Method of treatment of macular degeneration |
| WO1995003807A1 (en) * | 1993-07-27 | 1995-02-09 | The University Of Sydney | Treatment of age-related macular degeneration |
| US5504074A (en) * | 1993-08-06 | 1996-04-02 | Children's Medical Center Corporation | Estrogenic compounds as anti-angiogenic agents |
| US5385887A (en) * | 1993-09-10 | 1995-01-31 | Genetics Institute, Inc. | Formulations for delivery of osteogenic proteins |
| US5443505A (en) | 1993-11-15 | 1995-08-22 | Oculex Pharmaceuticals, Inc. | Biocompatible ocular implants |
| US6051576A (en) * | 1994-01-28 | 2000-04-18 | University Of Kentucky Research Foundation | Means to achieve sustained release of synergistic drugs by conjugation |
| DE4403326C1 (de) * | 1994-02-03 | 1995-06-22 | Hans Reinhard Prof Dr Koch | Intraokulare Linsenanordnung zur Astigmatismuskorrektur |
| US5798349A (en) * | 1994-03-14 | 1998-08-25 | The General Hospital Corporation | Use of green porphyrins to treat neovasculature in the eye |
| US5466233A (en) | 1994-04-25 | 1995-11-14 | Escalon Ophthalmics, Inc. | Tack for intraocular drug delivery and method for inserting and removing same |
| US6447796B1 (en) | 1994-05-16 | 2002-09-10 | The United States Of America As Represented By The Secretary Of The Army | Sustained release hydrophobic bioactive PLGA microspheres |
| US6290991B1 (en) * | 1994-12-02 | 2001-09-18 | Quandrant Holdings Cambridge Limited | Solid dose delivery vehicle and methods of making same |
| US6270492B1 (en) * | 1994-09-09 | 2001-08-07 | Cardiofocus, Inc. | Phototherapeutic apparatus with diffusive tip assembly |
| US6369116B1 (en) * | 1995-06-02 | 2002-04-09 | Oculex Pharmaceuticals, Inc. | Composition and method for treating glaucoma |
| US5869079A (en) * | 1995-06-02 | 1999-02-09 | Oculex Pharmaceuticals, Inc. | Formulation for controlled release of drugs by combining hydrophilic and hydrophobic agents |
| ATE267587T1 (de) | 1995-06-09 | 2004-06-15 | Euro Celtique Sa | Formulierungen und verfahren für eine verlängerte lokalanästhesie |
| US5856329A (en) | 1995-06-28 | 1999-01-05 | Allergan | Method of using (2-imidazolin-2-ylamino) quinoxalines in treating ocular neural injury |
| US6194415B1 (en) | 1995-06-28 | 2001-02-27 | Allergan Sales, Inc. | Method of using (2-imidazolin-2-ylamino) quinoxoalines in treating neural injury |
| US5906920A (en) * | 1995-08-29 | 1999-05-25 | The Salk Institute For Biological Studies | Methods for the detection of ligands for retinoid X receptors |
| US5776699A (en) * | 1995-09-01 | 1998-07-07 | Allergan, Inc. | Method of identifying negative hormone and/or antagonist activities |
| US5958954A (en) * | 1995-09-01 | 1999-09-28 | Allergan Sales, Inc. | Synthesis and use of retinoid compounds having negative hormone and/or antagonist activities |
| US5827072A (en) * | 1996-02-21 | 1998-10-27 | Neufer; David J. | Graphic, sports-related instruction board |
| US5877207A (en) * | 1996-03-11 | 1999-03-02 | Allergan Sales, Inc. | Synthesis and use of retinoid compounds having negative hormone and/or antagonist activities |
| GB9616672D0 (en) * | 1996-08-08 | 1996-09-25 | Scherer Ltd R P | Pharmaceutical compositions |
| AU4582797A (en) * | 1996-09-13 | 1998-04-02 | Regents Of The University Of California, The | Methods for treatment of retinal diseases |
| US5913884A (en) * | 1996-09-19 | 1999-06-22 | The General Hospital Corporation | Inhibition of fibrosis by photodynamic therapy |
| US6270749B1 (en) * | 1996-12-11 | 2001-08-07 | Pharmacyclics, Inc. | Use of Texaphyrin in ocular diagnosis and therapy |
| US6274614B1 (en) * | 1997-02-11 | 2001-08-14 | Qlt Inc. | Methods, compositions and articles for reducing or preventing the effects of inflammation |
| US5919970A (en) * | 1997-04-24 | 1999-07-06 | Allergan Sales, Inc. | Substituted diaryl or diheteroaryl methanes, ethers and amines having retinoid agonist, antagonist or inverse agonist type biological activity |
| AU727080B2 (en) * | 1997-06-30 | 2000-11-30 | Allergan, Inc. | Calcium blockers to treat proliferative vitreoretinopathy |
| KR20010014384A (ko) | 1997-07-02 | 2001-02-26 | 모리타 다카카즈 | 폴리락트산 공막 플러그 |
| JPH1170138A (ja) * | 1997-07-02 | 1999-03-16 | Santen Pharmaceut Co Ltd | ポリ乳酸強膜プラグ |
| US6306426B1 (en) * | 1997-08-11 | 2001-10-23 | Allergan Sales, Inc. | Implant device with a retinoid for improved biocompatibility |
| DE69827138T2 (de) * | 1997-08-11 | 2006-02-23 | Allergan, Inc., Irvine | Steriles Retinoid enthaltendes biodegradierbares Implantat mit verbesserter Biokompatibilität und Verfahren zu dessen Herstellung |
| US6271220B1 (en) * | 1998-03-11 | 2001-08-07 | Allergan Sales, Inc. | Anti-angiogenic agents |
| AU4645099A (en) * | 1998-07-09 | 2000-02-01 | Yoram Harth | Apparatus and method for efficient high energy photodynamic therapy of acne vulgaris and seborrhea |
| WO2000030532A1 (en) | 1998-11-20 | 2000-06-02 | University Of Connecticut | Generic integrated implantable potentiostat telemetry unit for electrochemical sensors |
| US6410045B1 (en) | 1999-02-22 | 2002-06-25 | Clyde Lewis Schultz | Drug delivery system for antiglaucomatous medication |
| US6217895B1 (en) * | 1999-03-22 | 2001-04-17 | Control Delivery Systems | Method for treating and/or preventing retinal diseases with sustained release corticosteroids |
| US6482854B1 (en) | 1999-03-25 | 2002-11-19 | Massachusetts Eye And Ear Infirmary | Glaucoma treatment |
| US6290713B1 (en) * | 1999-08-24 | 2001-09-18 | Thomas A. Russell | Flexible illuminators for phototherapy |
| US6317616B1 (en) | 1999-09-15 | 2001-11-13 | Neil David Glossop | Method and system to facilitate image guided surgery |
| US6331313B1 (en) | 1999-10-22 | 2001-12-18 | Oculex Pharmaceticals, Inc. | Controlled-release biocompatible ocular drug delivery implant devices and methods |
| US6319273B1 (en) | 1999-12-16 | 2001-11-20 | Light Sciences Corporation | Illuminating device for treating eye disease |
| US20010049369A1 (en) | 2000-02-10 | 2001-12-06 | Jablonski Monica M. | Brimonidine compositions and methods for retinal degeneration |
| CA2714081C (en) * | 2000-02-10 | 2013-08-06 | Massachusetts Eye And Ear Infirmary | Methods and compositions for treating conditions of the eye |
| EP1263434A1 (en) | 2000-03-17 | 2002-12-11 | Alcon, Inc | Compounds with 5-ht 2 and 5-ht 1a agonist activity for treating glaucoma |
| US20040208910A1 (en) | 2000-04-26 | 2004-10-21 | Control Delivery Systems, Inc. | Sustained release device and method for ocular delivery of adrenergic agents |
| US6692759B1 (en) * | 2000-06-28 | 2004-02-17 | The Regents Of The University Of California | Methods for preparing and using implantable substance delivery devices |
| US6726918B1 (en) * | 2000-07-05 | 2004-04-27 | Oculex Pharmaceuticals, Inc. | Methods for treating inflammation-mediated conditions of the eye |
| MXPA02008930A (es) * | 2000-07-14 | 2003-03-31 | Allergan Inc | Composiciones que contienen componentes agonistas alfa-2-adrenergicos. |
| US6357568B1 (en) * | 2000-09-27 | 2002-03-19 | Shou Mao Chen | Structure for protecting a luggage shell |
| WO2002058730A2 (en) * | 2000-11-01 | 2002-08-01 | Allergan, Inc. | Compositions for treatment of ocular neovascularization |
| JP2004514702A (ja) | 2000-11-29 | 2004-05-20 | オキュレックス ファーマシューティカルズ, インコーポレイテッド | 眼における移植拒絶を予防するための眼内インプラント |
| US6595945B2 (en) * | 2001-01-09 | 2003-07-22 | J. David Brown | Glaucoma treatment device and method |
| US6713081B2 (en) * | 2001-03-15 | 2004-03-30 | The United States Of America As Represented By The Department Of Health And Human Services | Ocular therapeutic agent delivery devices and methods for making and using such devices |
| US7563255B2 (en) * | 2001-05-03 | 2009-07-21 | Massachusetts Eye And Ear Infirmary | Implantable drug delivery device and use thereof |
| TWI298257B (en) | 2001-05-31 | 2008-07-01 | Allergan Inc | Hypotensive lipid and timolol compositions and methods of using same |
| US6713268B2 (en) * | 2001-06-26 | 2004-03-30 | Allergan, Inc. | Methods of identifying ocular hypotensive compounds having reduced hyperpigmentation |
| US6765012B2 (en) * | 2001-09-27 | 2004-07-20 | Allergan, Inc. | 3-(Arylamino)methylene-1,3-dihydro-2H-indol-2-ones as kinase inhibitors |
| ES2329346T3 (es) | 2001-11-14 | 2009-11-25 | Durect Corporation | Composicion de deposito inyectable. |
| CA2479351C (en) * | 2002-03-18 | 2012-05-15 | Novartis Ag | Topical composition comprising a cyclofructan, a carrier and a drug |
| US7091232B2 (en) | 2002-05-21 | 2006-08-15 | Allergan, Inc. | 4-(substituted cycloalkylmethyl) imidazole-2-thiones, 4-(substituted cycloalkenylmethyl) imidazole-2-thiones, 4-(substituted cycloalkylmethyl) imidazol-2-ones and 4-(substituted cycloalkenylmethyl) imidazol-2-ones and related compounds |
| US20040266776A1 (en) | 2003-06-25 | 2004-12-30 | Gil Daniel W. | Methods of preventing and reducing the severity of stress-associated conditions |
| ES2295647T3 (es) * | 2002-07-15 | 2008-04-16 | Alcon, Inc. | Composiciones de implante farmaceuticas lipofilas, no polimeras, para uso intraocular. |
| US7468065B2 (en) | 2002-09-18 | 2008-12-23 | Allergan, Inc. | Apparatus for delivery of ocular implants |
| US6899717B2 (en) | 2002-09-18 | 2005-05-31 | Allergan, Inc. | Methods and apparatus for delivery of ocular implants |
| MXPA05004927A (es) * | 2002-11-06 | 2005-09-08 | Alza Corp | Formulaciones de deposito de liberacion controlada. |
| SI1592408T1 (sl) * | 2003-01-24 | 2010-01-29 | Psivida Inc | Naprava s podaljšanim sproščanjem in postopek za okularno dajanje adrenergičnih sredstev |
| US20050059664A1 (en) | 2003-09-12 | 2005-03-17 | Allergan, Inc. | Novel methods for identifying improved, non-sedating alpha-2 agonists |
| US20050244463A1 (en) * | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Sustained release intraocular implants and methods for treating ocular vasculopathies |
| US8529927B2 (en) * | 2004-04-30 | 2013-09-10 | Allergan, Inc. | Alpha-2 agonist polymeric drug delivery systems |
| US8425929B2 (en) * | 2004-04-30 | 2013-04-23 | Allergan, Inc. | Sustained release intraocular implants and methods for preventing retinal dysfunction |
| US20050244458A1 (en) | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Sustained release intraocular implants and methods for treating ocular neuropathies |
| US7589057B2 (en) | 2004-04-30 | 2009-09-15 | Allergan, Inc. | Oil-in-water method for making alpha-2 agonist polymeric drug delivery systems |
| US7247836B2 (en) * | 2004-12-16 | 2007-07-24 | Micron Technology, Inc. | Method and system for determining motion based on difference image correlation |
| US7931909B2 (en) * | 2005-05-10 | 2011-04-26 | Allergan, Inc. | Ocular therapy using alpha-2 adrenergic receptor compounds having enhanced anterior clearance rates |
-
2004
- 2004-04-30 US US10/836,911 patent/US20050244463A1/en not_active Abandoned
-
2005
- 2005-04-26 CA CA2565067A patent/CA2565067C/en not_active Expired - Fee Related
- 2005-04-26 KR KR1020067022639A patent/KR20070064415A/ko active IP Right Grant
- 2005-04-26 ES ES05741206T patent/ES2367804T3/es active Active
- 2005-04-26 NZ NZ550009A patent/NZ550009A/en not_active IP Right Cessation
- 2005-04-26 BR BRPI0510504-8A patent/BRPI0510504A/pt not_active Application Discontinuation
- 2005-04-26 CN CNA2005800135737A patent/CN1950067A/zh active Pending
- 2005-04-26 JP JP2007510974A patent/JP2007535552A/ja active Pending
- 2005-04-26 DK DK05741206.6T patent/DK1758552T3/da active
- 2005-04-26 AT AT05741206T patent/ATE516033T1/de not_active IP Right Cessation
- 2005-04-26 WO PCT/US2005/014607 patent/WO2005110368A1/en not_active Application Discontinuation
- 2005-04-26 MX MXPA06012291A patent/MXPA06012291A/es active IP Right Grant
- 2005-04-26 EP EP10184295.3A patent/EP2305261B1/en not_active Not-in-force
- 2005-04-26 AU AU2005244149A patent/AU2005244149A1/en not_active Abandoned
- 2005-04-26 EP EP05741206A patent/EP1758552B1/en active Active
- 2005-04-29 US US11/119,021 patent/US8293741B2/en active Active
-
2008
- 2008-01-31 US US12/024,010 patent/US9161938B2/en active Active
- 2008-01-31 US US12/024,017 patent/US8580292B2/en active Active
- 2008-01-31 US US12/024,014 patent/US8506986B2/en active Active
-
2011
- 2011-05-12 AU AU2011202200A patent/AU2011202200B2/en not_active Ceased
-
2012
- 2012-10-16 JP JP2012228958A patent/JP5696121B2/ja not_active Expired - Fee Related
-
2015
- 2015-10-19 US US14/886,376 patent/US10201641B2/en not_active Expired - Lifetime
-
2019
- 2019-02-11 US US16/272,508 patent/US20190167858A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8293741B2 (en) | Intraocular implants and methods for improving vision | |
| US8529927B2 (en) | Alpha-2 agonist polymeric drug delivery systems | |
| US9144543B2 (en) | Sustained release intraocular implants and methods for preventing retinal dysfunction | |
| JP2007535539A (ja) | β−アドレナリン受容体拮抗薬を含む持続放出眼内インプラントおよび眼の神経障害の治療方法 | |
| AU2013200321A1 (en) | Intraocular implants of alpha-2 adrenergic receptor agonists and methods for improving vision | |
| AU2018203587A1 (en) | Intraocular implants of alpha-2 adrenergic receptor agonists and methods for improving vision |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| J201 | Request for trial against refusal decision | ||
| B701 | Decision to grant | ||
| NORF | Unpaid initial registration fee |