KR101623997B1 - syk 또는 JAK 키나제 억제제로서의 2,6-디아미노-피리미딘-5-일-카르복스아미드 - Google Patents
syk 또는 JAK 키나제 억제제로서의 2,6-디아미노-피리미딘-5-일-카르복스아미드 Download PDFInfo
- Publication number
- KR101623997B1 KR101623997B1 KR1020107025540A KR20107025540A KR101623997B1 KR 101623997 B1 KR101623997 B1 KR 101623997B1 KR 1020107025540 A KR1020107025540 A KR 1020107025540A KR 20107025540 A KR20107025540 A KR 20107025540A KR 101623997 B1 KR101623997 B1 KR 101623997B1
- Authority
- KR
- South Korea
- Prior art keywords
- pyrimidine
- phenylamino
- carboxamide
- cyclopropylamino
- delete delete
- Prior art date
Links
- 0 C*[Tl]C=CCCN Chemical compound C*[Tl]C=CCCN 0.000 description 13
- AFVUJJNEILZYJQ-UHFFFAOYSA-N CC(N(CC1)CCN1c(cc1)ccc1N)=O Chemical compound CC(N(CC1)CCN1c(cc1)ccc1N)=O AFVUJJNEILZYJQ-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Cc1ccccc1 Chemical compound Cc1ccccc1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- SVCUIRPPYPPRFV-UHFFFAOYSA-N CCOc(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O Chemical compound CCOc(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O SVCUIRPPYPPRFV-UHFFFAOYSA-N 0.000 description 2
- RWXZXCZBMQPOBF-UHFFFAOYSA-N Cc1ccc2nc[nH]c2c1 Chemical compound Cc1ccc2nc[nH]c2c1 RWXZXCZBMQPOBF-UHFFFAOYSA-N 0.000 description 2
- QIVCYKWAIPQWCY-DCTVYNGHSA-N C/C(/NCC(CCC1)CN1C(OCc1ccccc1)=O)=C(\C=N)/C(N)=O Chemical compound C/C(/NCC(CCC1)CN1C(OCc1ccccc1)=O)=C(\C=N)/C(N)=O QIVCYKWAIPQWCY-DCTVYNGHSA-N 0.000 description 1
- NQRYJNQNLNOLGT-UHFFFAOYSA-N C1CCNCC1 Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 1
- FQUYSHZXSKYCSY-UHFFFAOYSA-N C1CNCCNC1 Chemical compound C1CNCCNC1 FQUYSHZXSKYCSY-UHFFFAOYSA-N 0.000 description 1
- GLUUGHFHXGJENI-UHFFFAOYSA-N C1NCCNC1 Chemical compound C1NCCNC1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 1
- PSSHWNRPVJAAGC-UHFFFAOYSA-N CC(N(CC1)CC(C(N)=O)N1c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O)=O Chemical compound CC(N(CC1)CC(C(N)=O)N1c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O)=O PSSHWNRPVJAAGC-UHFFFAOYSA-N 0.000 description 1
- DLWPKHGMXNUHCI-UHFFFAOYSA-N CC(N(CC1)CCN1c(cc1)ccc1Nc(nc1)nc(Nc2c(cn[n]3C)c3ccc2)c1C(N)=O)=O Chemical compound CC(N(CC1)CCN1c(cc1)ccc1Nc(nc1)nc(Nc2c(cn[n]3C)c3ccc2)c1C(N)=O)=O DLWPKHGMXNUHCI-UHFFFAOYSA-N 0.000 description 1
- MOKJIVAXPBBGCJ-UHFFFAOYSA-N CCOC(C(C=N)=C(C)C)=O Chemical compound CCOC(C(C=N)=C(C)C)=O MOKJIVAXPBBGCJ-UHFFFAOYSA-N 0.000 description 1
- IMPPGHMHELILKG-UHFFFAOYSA-N CCOc(cc1)ccc1N Chemical compound CCOc(cc1)ccc1N IMPPGHMHELILKG-UHFFFAOYSA-N 0.000 description 1
- HFMKUHRBRPFVDI-UHFFFAOYSA-N CN(C(C1CC1)=O)c(cc1)ccc1Nc(nc1)nc(NC2CCC2)c1C(N)=O Chemical compound CN(C(C1CC1)=O)c(cc1)ccc1Nc(nc1)nc(NC2CCC2)c1C(N)=O HFMKUHRBRPFVDI-UHFFFAOYSA-N 0.000 description 1
- NDAYFFOMJMCZME-UHFFFAOYSA-N CN(C(OC)=O)c(cc1)ccc1Nc(nc1)nc(NC2CCC2)c1C(N)=O Chemical compound CN(C(OC)=O)c(cc1)ccc1Nc(nc1)nc(NC2CCC2)c1C(N)=O NDAYFFOMJMCZME-UHFFFAOYSA-N 0.000 description 1
- TYCGJCLIPUJCPW-UHFFFAOYSA-N CN(CC1)CCN1c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O Chemical compound CN(CC1)CCN1c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O TYCGJCLIPUJCPW-UHFFFAOYSA-N 0.000 description 1
- ULZCOWMSBOJCLT-UHFFFAOYSA-N CN(CC1)CCS1(=O)=O Chemical compound CN(CC1)CCS1(=O)=O ULZCOWMSBOJCLT-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N CN(CCC1)C1=O Chemical compound CN(CCC1)C1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- KPPXKJQYVNTBLE-UHFFFAOYSA-N CN1c(cc(cc2)Nc(nc3)nc(NC4CCC4)c3C(N)=O)c2OCC1=O Chemical compound CN1c(cc(cc2)Nc(nc3)nc(NC4CCC4)c3C(N)=O)c2OCC1=O KPPXKJQYVNTBLE-UHFFFAOYSA-N 0.000 description 1
- GYBIDWVELLPIOZ-UHFFFAOYSA-N CNC(C(CC1)CCN1c(cc1)ccc1Nc(nc1)nc(NC2CCC2)c1C(N)=O)=O Chemical compound CNC(C(CC1)CCN1c(cc1)ccc1Nc(nc1)nc(NC2CCC2)c1C(N)=O)=O GYBIDWVELLPIOZ-UHFFFAOYSA-N 0.000 description 1
- DJRMNLGNKKXXAY-IBGZPJMESA-N CNC([C@H](CCCC1)N1c(cc1)ccc1Nc1ncc(C(N)=O)c(NC2CCCC2)n1)=O Chemical compound CNC([C@H](CCCC1)N1c(cc1)ccc1Nc1ncc(C(N)=O)c(NC2CCCC2)n1)=O DJRMNLGNKKXXAY-IBGZPJMESA-N 0.000 description 1
- YXQVTLSZASOYQR-UHFFFAOYSA-N COCCNS(c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O)(=O)=O Chemical compound COCCNS(c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O)(=O)=O YXQVTLSZASOYQR-UHFFFAOYSA-N 0.000 description 1
- DXHHGKKZXAXBBM-INIZCTEOSA-N COC[C@H](CCC1)N1c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O Chemical compound COC[C@H](CCC1)N1c(cc1)ccc1Nc(nc1)nc(NC2CC2)c1C(N)=O DXHHGKKZXAXBBM-INIZCTEOSA-N 0.000 description 1
- KEXUHJIBWLBOFW-LBPRGKRZSA-N C[C@@H](C[N-](CC1)S(C)(=O)=O)N1c(cc1)ccc1Nc(nc1)nc(NCC(F)(F)F)c1C(N)=O Chemical compound C[C@@H](C[N-](CC1)S(C)(=O)=O)N1c(cc1)ccc1Nc(nc1)nc(NCC(F)(F)F)c1C(N)=O KEXUHJIBWLBOFW-LBPRGKRZSA-N 0.000 description 1
- VKVFDPQDGZSLJK-UHFFFAOYSA-N Cc(cc1)c[n]2c1ncc2 Chemical compound Cc(cc1)c[n]2c1ncc2 VKVFDPQDGZSLJK-UHFFFAOYSA-N 0.000 description 1
- AYTGARGOCPEHGL-UHFFFAOYSA-N Cc(cc1)cc2c1OCCO2 Chemical compound Cc(cc1)cc2c1OCCO2 AYTGARGOCPEHGL-UHFFFAOYSA-N 0.000 description 1
- SEBIXVUYSFOUEL-UHFFFAOYSA-N Cc(cc1)cc2c1[s]cn2 Chemical compound Cc(cc1)cc2c1[s]cn2 SEBIXVUYSFOUEL-UHFFFAOYSA-N 0.000 description 1
- NPDACUSDTOMAMK-UHFFFAOYSA-N Cc(cc1)ccc1Cl Chemical compound Cc(cc1)ccc1Cl NPDACUSDTOMAMK-UHFFFAOYSA-N 0.000 description 1
- CRVSPZLEZPJWMY-UHFFFAOYSA-N Cc1cc2ccc(Cc3cc4n[s]nc4cc3)nc2cc1 Chemical compound Cc1cc2ccc(Cc3cc4n[s]nc4cc3)nc2cc1 CRVSPZLEZPJWMY-UHFFFAOYSA-N 0.000 description 1
- HMMPHXCOTBASBC-UHFFFAOYSA-N Cc1ccc(cn[nH]2)c2c1 Chemical compound Cc1ccc(cn[nH]2)c2c1 HMMPHXCOTBASBC-UHFFFAOYSA-N 0.000 description 1
- IVKILQAPNDCUNJ-UHFFFAOYSA-N Cc1ccc2nc[s]c2c1 Chemical compound Cc1ccc2nc[s]c2c1 IVKILQAPNDCUNJ-UHFFFAOYSA-N 0.000 description 1
- UVTFPNSDJDAOGZ-UHFFFAOYSA-N NC(c(cn1)c(NCC(CCC2)CN2C(OCc2ccccc2)=O)nc1ON(c1ccccc1N)N)=O Chemical compound NC(c(cn1)c(NCC(CCC2)CN2C(OCc2ccccc2)=O)nc1ON(c1ccccc1N)N)=O UVTFPNSDJDAOGZ-UHFFFAOYSA-N 0.000 description 1
- KNALDSQTJPPEKT-UHFFFAOYSA-N NC(c1c(NC2CC2)nc(Nc(cc2)ccc2N(CCC2)CC2(F)F)nc1)=O Chemical compound NC(c1c(NC2CC2)nc(Nc(cc2)ccc2N(CCC2)CC2(F)F)nc1)=O KNALDSQTJPPEKT-UHFFFAOYSA-N 0.000 description 1
- KLIJBGIQCPNQBE-UHFFFAOYSA-N NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2Cl)nc1)=O Chemical compound NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2Cl)nc1)=O KLIJBGIQCPNQBE-UHFFFAOYSA-N 0.000 description 1
- CKXXNGXJRXNCJN-UHFFFAOYSA-N NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2N2CCCCC2)nc1)=O Chemical compound NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2N2CCCCC2)nc1)=O CKXXNGXJRXNCJN-UHFFFAOYSA-N 0.000 description 1
- FKHNCBAAOWRPTH-UHFFFAOYSA-N NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2N2CCN(CCO)CC2)nc1)=O Chemical compound NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2N2CCN(CCO)CC2)nc1)=O FKHNCBAAOWRPTH-UHFFFAOYSA-N 0.000 description 1
- WMXCQMPHRJRDHY-UHFFFAOYSA-N NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2N2CCNCC2)nc1)=O Chemical compound NC(c1c(NC2CCC2)nc(Nc(cc2)ccc2N2CCNCC2)nc1)=O WMXCQMPHRJRDHY-UHFFFAOYSA-N 0.000 description 1
- QVYQEZQWYDXQOS-UHFFFAOYSA-N NC(c1c(NCc2ccccc2)nc(Nc(cc2)ccc2OCCN2CCCC2)nc1)=O Chemical compound NC(c1c(NCc2ccccc2)nc(Nc(cc2)ccc2OCCN2CCCC2)nc1)=O QVYQEZQWYDXQOS-UHFFFAOYSA-N 0.000 description 1
- MDHCBCUAZUGCKI-UHFFFAOYSA-N NC(c1c(Nc2c(cc[nH]3)c3ccc2)nc(Nc(cc2)ccc2OCCN2CCCC2)nc1)=O Chemical compound NC(c1c(Nc2c(cc[nH]3)c3ccc2)nc(Nc(cc2)ccc2OCCN2CCCC2)nc1)=O MDHCBCUAZUGCKI-UHFFFAOYSA-N 0.000 description 1
- IPOVLZSJBYKHHU-UHFFFAOYSA-N NCC1CNCCC1 Chemical compound NCC1CNCCC1 IPOVLZSJBYKHHU-UHFFFAOYSA-N 0.000 description 1
- JYGFTBXVXVMTGB-UHFFFAOYSA-N O=C(C1)Nc2c1cccc2 Chemical compound O=C(C1)Nc2c1cccc2 JYGFTBXVXVMTGB-UHFFFAOYSA-N 0.000 description 1
- ACZGCWSMSTYWDQ-UHFFFAOYSA-N O=C(C1)Oc2c1cccc2 Chemical compound O=C(C1)Oc2c1cccc2 ACZGCWSMSTYWDQ-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N c(cc1)cc2c1nn[nH]2 Chemical compound c(cc1)cc2c1nn[nH]2 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- IOJUPLGTWVMSFF-UHFFFAOYSA-N c1nc(cccc2)c2[s]1 Chemical compound c1nc(cccc2)c2[s]1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/48—Two nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
Abstract
본 발명은 syk 및/또는 JAK 키나제의 억제제인 화학식 I-II의 화합물 및 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체에 관한 것이다. 본 발명은 또한 상기 화합물의 제조에 사용되는 중간체, 상기 화합물의 제법, 상기 화합물을 함유하는 제약 조성물, syk 및/또는 JAK 키나제 활성의 억제 방법, 혈소판 응집의 억제 방법, 및 syk 및/또는 JAK 키나제 활성에 의해 적어도 부분적으로 매개되는 수많은 장애, 예컨대 심혈관 질환, 염증 질환, 자가면역 질환 및 세포 증식 장애, 혈전증, 알레르기, 천식, 류마티스양 관절염, 백혈병 또는 비-호지킨 림프종의 예방 또는 치료 방법에 관한 것이다.
<화학식 I>
<화학식 I>
Description
관련 출원에 대한 상호 참조
본 출원은 미국 임시 특허 출원 번호 61/120,348 (2008년 12월 5일 출원); 미국 임시 특허 출원 번호 61/120,344 (2008년 12월 5일 출원); 미국 임시 특허 출원 번호 61/045,406 (2008년 4월 16일 출원); 및 미국 임시 특허 출원 번호 61/045,417 (2008년 4월 16일 출원)의 이익을 주장하며; 그의 전체 공개물이 본원에 참조로 포함된다.
기술 분야
본 발명은 비장 티로신 키나제 (syk) 및/또는 JAK 키나제의 억제제로 작용하는 피리미딘-5-카르복스아미드 화합물에 관한 것이다. 또한, 본 발명은 피리미딘-5-카르복스아미드 화합물을 함유하는 제약 조성물, 및 바람직하지 않은 혈전증을 특징으로 하는 질병을 치료하기 위한 상기 화합물 또는 조성물의 사용 방법에 관한 것이다. 본 발명은 또한 본원에 기재된 화합물의 제조 방법에 관한 것이다.
선행 기술
단백질 키나제는 세포내 각종 신호 전달 과정의 제어를 담당하는 구조적으로 관련된 효소들의 거대 패밀리를 구성한다 (예를 들어, 문헌 [Hardie and Hanks, The Protein Kinase Facts Book, I and II, Academic Press, San Diego, Calif., 1995] 참조). 단백질 키나제는 이들의 구조 및 촉매적 기능의 보존으로 인해, 공통의 선조 유전자로부터 진화된 것으로 판단된다. 거의 모든 키나제는 유사한 250 내지 300개의 아미노산 촉매 도메인을 함유한다. 키나제는 이들이 인산화하는 기질 (예를 들어, 단백질-티로신, 단백질-세린/트레오닌, 지질 등)에 의해 패밀리로 분류될 수 있다. 각각의 이들 패밀리에 일반적으로 상응하는 서열 모티프들이 확인되었다 (예를 들어, 문헌 [Hanks & Hunter, (1995), FASEB J. 9:576-596; Knighton et al., (1991), Science 253:407-414]; [Hiles et al., (1992), Cell 70:419-429]; [Kunz et al., (1993), Cell 73:585-596]; [Garcia-Bustos et al., (1994), EMBO J. 13:2352-2361] 참조).
수많은 질환이 단백질 키나제-매개 사건에 의해 유발되는 비정상 세포 반응에 관련되어 있다. 이러한 질환에는, 자가면역 질환, 염증 질환, 골 질환, 대사 질환, 신경학적 및 신경퇴행성 질환, 암, 심혈관 질환, 알레르기, 천식, 알츠하이머병 및 호르몬-관련 질환이 포함된다. 따라서, 의약화학에서는 치료제로 사용하기 위한 단백질 키나제의 억제제를 찾기 위해 상당히 노력해 왔다.
면역수용체 티로신 활성화 모티프 (ITAM)-매개 신호전달은 인간 병리를 담당하는 신호전달 경로에서의 일차 이벤트로 나타난다. ITAM-매개 신호전달은 면역 세포 내의 전형적 면역 수용체 (예컨대, T-세포 수용체, B-세포 수용체, Fc 수용체) 및 혈소판 내의 GPVI 및 FcγRIIa에서 시작된 활성화 신호를 세포내 하류 분자 (예컨대, syk 및 ZAP-70)로 중계하는 역할을 한다 (문헌 [Underhill, D.M and Goodridge, H. S., Trends Immunol., 28:66 73, 2007]).
ITAM-함유 수용체에의 리간드의 결합은 Src 패밀리로 불리는 비수용체 티로신 키나제의 패밀리로부터 단백질을 보충하도록 하는 신호전달 이벤트를 일으킨다. 이들 키나제는 syk 또는 ZAP-70 상의 탄뎀 SH2 도메인과 상호 작용하는 영역인 ITAM 서열 내의 티로신 잔기를 인산화시킨다.
Syk는 Zap-70과 함께 단백질 티로신 키나제의 syk 패밀리의 구성원이다. syk 또는 ZAP-70과 이인산화 ITAM 서열의 상호작용은 키나제 자체가 티로신 인산화되도록 하는 키나제에서의 입체 형태 변화를 유발한다. 인산화 Syk 패밀리 구성원은, 76 kDa (SLP-76)의 백혈구-특이적 인단백질을 함유하는 Src 상동성 2 (SH2) 도메인, T-세포의 활성화 링커 (LAT) 및 PLC (포스포리파제 C)γ2를 포함하는 다수의 하류 신호전달 경로 단백질을 활성화시킨다.
ITAM-매개 신호전달 기능장애로 인한 인간 병리에는 자가면역 질환, 예컨대 류마티스양 관절염, 전신성 루푸스, 다발성 경화증, 용혈성 빈혈, 면역-혈소판감소증 자반증 및 헤파린-유도 혈소판감소증 및 동맥경화증이 포함된다. 흥미롭게도, 상기 언급한 질환 중 다수는 염증 반응에서 역할을 하는 세포 매개자를 방출시키는 비만 세포, 호염기성 세포 및 다른 면역 세포의 신호전달 캐스케이드를 syk를 통해 활성화시키는 항체에 의한 Fc 수용체의 가교를 통해 발생하는 것으로 생각된다. 비만 세포 및 호염기성 세포로부터의 IgE-자극-의존성 알레르기 및 염증 반응에서의 매개자 방출 및 시토킨 생성은 syk의 티로신 키나제 활성을 억제함으로써 제어할 수 있다 (문헌 [Rossi, A.B. et al., J Allergy Clin Immunol., 118:749-755, 2006]). 면역-혈소판감소증에서, 항체 결합 혈소판은 비장에서 Fc 수용체/ITAM/syk-매개 과정에 의해 제거된다 (문헌 [Crow, A.R. et al., Blood, 106:abstract 2165, 2005]). 혈소판 FcγRIIa를 활성화시키는 헤파린-혈소판 인자 4 면역 복합체에 의해 유발되는 약물-유도 혈소판 감소증은 또한 수용체 결합 (engagement)의 syk 하류 신호전달을 수반한다 (문헌 [Reilly, M.P., Blood, 98:2442-2447, 2001]).
혈소판 효능제는 세포내-외 (inside-out) 인테그린 신호전달을 유도하여 피브리노겐 결합 및 혈소판 응집을 일으킨다. 이는 세포외-내 (outside-in) 신호전달을 개시하여 추가의 혈소판 자극을 일으킨다. syk는 인테그린 신호전달의 두 단계 모두 중에 활성화되며, syk를 억제하면 고정 단백질에 대한 혈소판의 부착이 억제된다 (문헌 [Law, D.A. et al., Blood, 93:2645-2652, 1999]). 콜라겐에 의해 유도되는 혈소판 응집, 및 아라키돈산 및 세로토닌의 방출은 syk 결핍 마우스로부터 유도된 혈소판에서 현저히 억제된다 (문헌 [Poole, A. et al., EMBO J., 16:2333-2341, 1997]). 따라서, syk 억제제는 또한 항응고 기능을 가질 수 있다.
syk가 Ig-유도 혈소판 활성화에서 담당하는 역할 때문에, 이는 동맥경화증과 재협착에서 중요할 수 있다. 동맥경화증은 동맥 혈관벽의 증점 및 경화를 특징으로 하는 질환의 부류이다. 모든 혈관이 상기 중증의 퇴행성 질병에 영향받기 쉽지만, 가장 흔히 심장으로 가는 대동맥과 관상 동맥이 영향을 받는다. 동맥경화증이 심장 마비, 심근 경색증, 뇌졸중 및 동맥류의 위험을 증가시킬 수 있기 때문에 동맥경화증은 깊은 임상적 중요성을 갖는다.
동맥경화증에 대한 통상적 치료에는 중증도가 덜한 폐색에 대한 혈관 재소통 처리 및 주요 폐색에 대한 관상 동맥 우회술이 포함된다. 유의한 수의 치료 개체에서 나타나는 혈관내 처리의 심각한 결점은, 치료한 혈관의 일부 또는 모두가 재협착되는 것이다 (즉, 다시 좁아짐). 예를 들면, PTCA 후의 죽상경화 심장 동맥의 재협착은 상기 처리를 받은 환자의 10 내지 50%에서 발생하고, 또한 후속적으로 추가적 혈관 성형술 또는 관상 동맥 우회로 이식술을 요구한다. 게다가, 스텐트 시술 후의 죽상경화 심장 동맥의 재협착은 상기 처리를 받은 환자의 10 내지 20%에서 발생하고, 후속적으로 시술 동맥을 통한 적당한 혈류를 유지하기 위한 반복된 치료를 요구한다. 재협착은 일반적으로 치료 후에 비교적 짧은 시간 주기 (예컨대, 대략 6달 미만)로 발생한다.
재협착을 촉진하는 정확한 호르몬과 세포 과정은 결정되지 않았지만, 재협착은 부분적으로 풍선 카테터 또는 다른 혈관내 장치에 의해 야기되는 혈관벽의 기계적 손상에 기인하는 것으로 생각된다. 예를 들면, 폐색 동맹 개방 이외에도, PTCA 과정은 상주 관상 동맥 평활근 세포 (SMC)를 손상시킨다. 이 손상에 반응하여, 부착 혈소판, 침윤 대식세포, 백혈구 또는 평활근 세포는 스스로 세포-유도 성장 인자, 예컨대 혈소판-유도 성장 인자 (PDGF)를 방출하고, 이어서 내막 SMC를 증식시키고 내부 탄성층을 통해 혈관 내막 영역으로 이동시킨다. 또한, 내막 SMC의 증식 및 과다형성, 및 가장 중요하게는 3 내지 6달의 기간에 걸친 다량의 세포외 매트릭스 생성은, 혈류를 현저하게 차단시키기에 충분하도록 혈관 공간을 충만화시키고, 협소화시킨다.
syk가 Ig-유도 혈소판 활성화에서 담당하는 역할 이외에도, syk는 콜라겐-매개 신호전달에서 매우 중요한 역할을 한다. 혈소판 부착 및 활성화에 대한 역할을 하는 1차 부착 단백질은 콜라겐이다. 콜라겐은 플라크 파열 중에 혈액에 노출되는 죽종의 섬유 캡 내에 함유되어 있는 필라멘트형 단백질이다. 콜라겐은 1차적으로 혈소판 막 GPIb에 결합하여 혈소판을 계류하는 폰빌레브란트인자에 결합함으로써 기능한다. 2차적으로, 콜라겐은 혈소판, GPVI 및 인테그린 α2β1 상의 2개의 콜라겐 수용체에 결합함으로써 기능한다.
GPVI는 FcRγ와의 복합체로서 (GPVI의 발현에 필요한 상호작용) 혈소판 막에 존재한다. 혈소판 상의 FcγRIIa의 활성화는 혈소판 형상 변화, 분비 및 혈전증을 초래한다. GPVI/FcRγ 복합체에 의한 신호전달은 FCRγ의 ITAM 도메인의 티로신 인산화에 의해 개시된 후, syk를 보충한다. GPVI의 활성화는, 확고한 혈소판 부착을 달성하기 위한 인테그린 α2β1, 및 혈소판 응집 및 혈전증 성장을 매개하는 GP IIb-IIIa의 활성화; 혈관벽에 염증성 단백질, 예컨대 CD40L, RANTES 및 TGFβ가 전달되도록 하는 혈소판 분비; 및 백혈구를 보충하도록 하는 P-셀렉틴의 발현을 비롯한 다양한 혈소판 기능을 유도한다. 그러므로, syk 억제제가 혈소판 부착, 활성화 및 응집에 의해 매개된 혈전성 이벤트를 억제할 수 있는 것으로 여겨진다.
syk 결핍 마우스로부터의 대식세포에서 FcγR, IgG 항체에 대한 수용체의 자극에 의해 유발된 세포내 단백질의 티로신 인산화 (활성화), 및 FcγR에 의해 매개되는 포식작용이 상당히 억제되는 것으로 보고된 바 있다 (문헌 [Crowley, M.T. et al., J. Exp. Med., 186:1027-1039, 1997]). 이는 syk가 대식세포의 FcγR-매개 포식작용에서 두드러지게 중요한 역할을 가지고 있음을 시사한다.
또한, syk의 안티센스 올리고뉴클레오티드가 GM-CSF에 의해 유발된 호산구의 아폽토시스 억제를 막는다는 것이 보고되었고 (문헌 [Yousefi, S. et al., J. E. Med., 183:1407-1414, 1996]), 이는 syk가 GM-CSF 등에 의해 유발되는 호산구의 수명 연장 신호에 필수적이라는 것을 보여준다. 호산구의 수명 연장이 알레르기성 장애, 예컨대 천식에서 질환을 만성 상태로 전이시키는 것과 밀접하게 관련되기 때문에, syk 억제제는 또한 만성 호산구성 염증을 위한 치료제의 역할을 할 수 있다.
Syk는 B-세포 항원 수용체를 통한 B-세포의 활성화에 있어서 중요하며, 항원 수용체 자극에 의해 유발되는 세포내 칼슘 농도의 증가 및 포스파티딜이노시톨 대사와 관련된다 (문헌 [Hutchcroft, J E. et al., J. Biol. Chem., 267:8613-8619, 1992]; 및 [Takata, M. et al., EMBO J., 13:1341-1349, 1994]). 그러므로, syk 억제제는 B-세포의 기능을 조절하는데 사용될 수 있고, 따라서 항체-관련 질환을 위한 치료제로서 작용할 것으로 기대된다.
Syk는 T-세포 항원 수용체에 결합하고, 수용체의 가교결합 통해 빠르게 티로신 인산화되고, Src 티로신 키나제, 예컨대 Lck에 의해 매개되는 세포내 신호에 상승작용적으로 작용한다 (문헌 [Couture, C. et al., Proc. Natl. Acad. Sci. USA, 91:5301-5305, 1994]; 및 [Couture, C. et al., Mol. Cell. Biol., 14:5249-5258, 1994]). syk는 성숙 T-세포 집단, 예컨대 상피내 γδ T-세포 및 미감작 αβ T-세포에 존재하며, TCR 신호전달 캐스케이드의 여러 구성 요소를 인산화시킬 수 있는 것으로 보고되었다 (문헌 [Latour, S. et. al., Mol Cell Biol., 17:4434-4441, 1997]). 따라서, syk 억제제는 T-세포 항원 수용체에 의해 매개되는 세포 면역을 억제하기 위한 작용제의 역할을 할 수 있다.
최근 비교 유전자 혼성화 연구에서는 외투 세포 림프종 (MCL)의 발병에서 중요한 또다른 유전자로서의 syk를 동정하였다 (문헌 [Chen, R. et al. Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings (Post-Meeting Edition).Vol 25, No 18S (June 20 Supplement), 2007: 8056]). MCL은 전체 비-호지킨 림프종의 5 내지 10%로 나타나고, 이는 치료가 어려운 림프종의 형태이다. 이는 B 세포 림프종 중에서 가장 나쁜 예후를 나타낸다 (3년의 평균 생존 기간을 가짐). Syk가 MCL에서 과다발현되고 (문헌 [Rinaldi, A, et.al, Br. J. Haematol., 2006; 132:303-316]), Syk가 여포성 림프종, 외투 세포 림프종, 버킷 림프종 및 미만성 거대 B-세포 비-호지킨 림프종에서 mTOR (라파마이신의 포유동물 표적) 생존 신호를 매개한다는 것이 보고되었다 (문헌 [Leseux, L., et. al, Blood, 2006; 108:4156-4162]).
여러 방면의 증거는 많은 B-세포 림프종이 B-세포 수용체 (BCR)-매개 생존 신호에 의존한다는 것을 시사한다. BCR 신호전달은 SRC 패밀리 키나제에 의한 Igα 및 β 면역수용체 티로신-기반 활성화 모티프의 인산화 및 수용체 올리고머화를 유도한다. ITAM 인산화는 하류 이벤트를 개시하고 최초 BCR 신호를 증폭하는 syk의 보충 및 활성화를 유발한다. 정상 B 세포의 긴장성 BCR 신호전달 및 비-호지킨 림프종 세포주의 syk-의존성 생존의 역할 (시험관내)로 인해 (문헌 [Chen, L., et.al, Blood, 2006; 108:3428-3433)]), syk 억제는 특정 B-세포 림프종 및 만성 림프구성 백혈병 (CLL)을 위한 유망한 합리적 치료 표적이다 (문헌 [Stefania Gobessi, Luca Laurenti, Pablo Longo, Laura Carsetti, Giuseppe Leone, Dimitar G. Efremov, Constitutive activation of the protein tyrosine kinase Syk in Chronic Lymphocytic Leukemia B-cells, Blood, 2007, 110, Abstract 1123]). 최근 데이터는, syk를 억제하는 멀티키나제 억제제의 투여가 CLL 환자에서 중요한 임상적 활성을 가질 수 있음을 나타낸다 (문헌 [Friedberg JW et al, Blood 2008; 112(11), Abstract 3]).
비장 티로신 키나제 (Syk)의 종양원성 잠재력은 수많은 다양한 셋팅에서 기재되었다. 임상적으로, Syk 과다-발현이 외투 세포 림프종에서 보고되었으며 (문헌 [Rinaldi, A, et.al, Br. J. Haematol., 2006; 132:303-316]), 염색체 전좌 (t(9;12)(q22;p12))에 의해 생성된 TEL-Syk 융합 단백질 (전좌된 ETS 백혈병)은 Syk 활성을 상승시키고, 골수이형성 증후군과 관련된다 (문헌 [Kuno, Y., et.al, Blood, 2001; 97:1050-1055]). 마우스에서 백혈병은 인간 TEL-Syk를 발현하는 골수 세포를 입양 전달함으로써 유도된다 (문헌 [Wossning, T., JEM, 2006; 203:2829-2840]). 또한, 마우스 1차 골수 세포에서, Syk의 과다-발현은 배양물의 IL-7 비의존성 성장을 초래한다 (문헌 [Wossning, T., et.al, JEM, 2006; 203:2829-2840]).
흥미롭게도, Syk 신호전달은 인간 및 마우스에서 B-세포 발생 및 생존을 위해 필요한 것으로 나타난다. B-세포 수용체 (문헌 [Lam, K., et.al, Cell, 1997; 90:1073-1083]) 또는 Igα (문헌 [Kraus, M., et.al, Cell, 2004; 117:787-800)])의 유도가능한 손실은 마우스에서 말초 B-세포를 손실시킨다. Syk 활성을 음성 조절하는 것으로 알려져 있는 단백질 티로신 포스파타제 PTP-RO의 과다-발현은 증식을 억제하고, 비-호지킨 림프종에서 유래된 세포주에서 아폽토시스를 유발한다 (문헌 [Chen, L., et.al, Blood, 2006; 108:3428-3433]). 최종적으로, B-세포 림프종은 거의 BCR 발현의 손실을 나타내지 않고 항-개별특이형 요법은 거의 내성으로 이어지지 않는다 (문헌 [Kuppers, R. Nat Rev Cancer, 2005; 5:251-262]).
항원-특이적 B 세포 수용체 (BCR)의 결합은 다중 신호전달 경로를 활성화시킨다 (생존 및 클론 확장을 촉진하여 궁극적으로 세포 활성화 상태를 조절함). BCR을 통한 신호전달은 면역글로불린 초거대-패밀리의 다른 두 구성원인 Igα 및 Igβ (각각 면역-티로신 기반 활성화 모티프 (ITAM)를 가짐)와 그의 회합에 의해 가능하게 된다 (문헌 [(Jumaa, Hendriks et al. Annu Rev Immunol 23: 415-45 (2005)]). ITAM 도메인은 BCR 결합에 반응하여 Src 패밀리 키나제에 의해 직접적으로 인산화된다. 비장 티로신 키나제 (Syk)는 그의 키나제 활성을 증진시키는 방법인 ITAM에 도킹하고 이를 인산화시켜, Syk 자가인산화 및 다중 하류 기질의 티로신 인산화를 일으킨다 (문헌 [Rolli, Gallwitz et al. Mol Cell 10(5): 1057-69 (2002)]). 이 신호전달 경로는 새롭게 형성된 프리-BCR이 발현될 때 프로-에서 프리-B 세포 단계로 발생이 전이가 시작되는 B 세포에서 활성이다. 실제로, Syk 넉아웃 마우스의 프로-B 세포 단계에서 B 세포 발생을 정지시켰다 (문헌 [Cheng, Rowley et al. 1995; Turner, Mee et al. Nature 378(6554): 303-6 (1995)]). B 세포 수용체 (문헌 [Lam, Kuhn et al. Cell 90(6): 1073-83 (1997)]) 또는 Igα (문헌 [Kraus, Alimzhanov et al. Cell 117(6): 787-800 (2004)])의 유도가능한 손실은 마우스에서 말초 B 세포의 손실을 초래한다. 인간 B 세포는 또한 증식과 생존을 위해 Syk를 필요로 하는 것으로 나타난다. Syk 활성의 음성 조절자인 단백질 티로신 포스파타제 PTP-RO의 과다-발현은 증식을 억제하고, 비-호지킨 림프종 (NHL)에서 유래된 세포주에서 아폽토시스를 유발한다 (문헌 [Chen, Juszczynski et al. Blood 108(10): 3428-33 (2006)]). NHL 세포주 SUDHL-4에서의 siRNA에 의한 Syk의 녹다운은 세포 주기의 G1/S 전이의 차단을 유발한다 (문헌 [Gururajan, Dasu et al. J Immunol 178(1): 111-21 (2007)]). 그와 함께, 이들 데이터는 Syk 신호전달이 발생, 증식 및 심지어 인간과 마우스 B 세포의 생존에 필요하다는 것을 시사한다.
반대로, Syk의 종양원성 잠재력은 수많은 다양한 셋팅에서 기재되었다. 임상적으로, Syk 과다-발현이 외투 세포 림프종에서 보고되었고 (문헌 [Rinaldi, Kwee et al. Br J Haematol 132(3): 303-16 (2006)]), 염색체 전좌 (t(9;12)(q22;p12))에 의해 생성된 TEL-Syk 융합 단백질 (전좌된 ETS 백혈병)은 Syk 활성을 상승시키고, 골수이형성 증후군과 관련된다 (문헌 [Kuno, Abe et al. Blood 97(4): 1050-5 (2001)]). 마우스에서 백혈병은 인간 TEL-Syk를 발현하는 골수 세포를 입양 전달함으로써 유도된다 (문헌 [Wossning, Herzog et al. J Exp Med 203(13): 2829-40 (2006)]). 또한, 마우스 1차 골수 세포에서, Syk의 과다-발현은 배양물의 IL-7 비의존성 성장을 초래한다 (문헌 [Wossning, Herzog et al. 2006]). 일관되게, Syk가 여포성 림프종, 외투 세포 림프종, 버킷 림프종 및 미만성 거대 B-세포 NHL에서 mTOR (라파마이신의 포유동물 표적) 생존 신호를 매개한다는 것이 보고되었다 (문헌 [Leseux, Hamdi et al. Blood 108(13): 4156-62 (2006)]). 추가적 최근 연구는 또한 Syk-의존성 생존 신호가 DLBCL, 외투 세포 림프종 및 여포성 림프종을 비롯한 B-세포 악성종양에서 역할을 할 수 있음을 시사한다 (문헌 [Gururajan, Jennings et al. 2006; Irish, Czerwinski et al. J Immunol 176(10): 5715-9 (2006)]). 정상 B 세포의 긴장성 BCR 신호전달 및 NHL 세포주의 Syk-의존성 생존 (시험관내)으로 인해, Syk의 특이적 억제는 특정 B-세포 림프종의 치료를 위해 유망하게 판명될 수 있다.
최근에, R406 (리겔 파마슈티컬즈 (Rigel Pharmaceuticals))은 FcεR1 및 BCR 유도 Syk 활성화를 비롯한 다양한 자극에 반응하여 ITAM 신호전달을 억제하는 것으로 보고되었다 (문헌 [Braselmann, Taylor et al. J Pharmacol Exp Ther 319(3): 998-1008 (2006)]). 흥미롭게도, 상기 Syk의 ATP-경쟁적 억제제는 또한 Flt3, cKit 및 JAK 키나제에 대하여, 뿐만 아니라 Src 키나제에 대하여 활성이었다 (문헌 [Braselmann, Taylor et al. 2006]). Flt3에 대한 활성화 돌연변이는 AML과 관련되고, 이 키나제의 억제는 현재 임상 개발하에 있다 (문헌 [Burnett and Knapper Hematology Am Soc Hematol Educ Program 2007: 429-34 (2007)]). 티로신 키나제 cKit의 과다-활성화는 또한 혈액 악성종양 및 암 요법을 위한 표적과 관련된다 (문헌 [Heinrich, Griffith et al. Blood 96(3): 925-32 (2000)]). 유사하게, JAK3 신호전달은 백혈병과 림프종과 관련되고, 잠재적 치료 표적으로서 현재 이용된다 (문헌 [Heinrich, Griffith et al. 2000]). 중요하게, R406의 다중-키나제 억제 활성은 림프종 세포주 및 1차 인간 림프종 샘플에서 BCR 신호전달을 약화시켜, 전자의 아폽토시스를 유발한다 (문헌 [Chen, Monti et al. Blood 111(4): 2230-7 (2008)]). 또한, 제II 상 임상 시험에서는 불응성 NHL 및 만성 림프구성 백혈병에서 상기 화합물에 의한 유리한 결과가 보고되었다 (문헌 [Friedberg JW et al, Blood 2008; 112(11), Abstract 3]). R406에 대한 작용의 정확한 메카니즘이 명백하지는 않지만, 데이터는 림프구에서 생존 신호전달을 매개하는 키나제의 억제가 임상적으로 유익함을 시사한다.
추가적 최근 연구는 또한 syk-의존성 생존 신호가 DLBCL, 외투 세포 림프종 및 여포성 림프종을 비롯한 B-세포 악성종양에서 역할을 할 수 있음을 시사한다 (예를 들어, 문헌 [S. Linfengshen et al. Blood, Feb. 2008; 111: 2230-2237]; [J. M. Irish et al. Blood, 2006; 108: 3135-3142]; [A. Renaldi et al. Brit J. Haematology, 2006; 132: 303-316]; [M. Guruoajan et al. J. Immunol, 2006; 176: 5715-5719]; [L. Laseux et al. Blood, 2006; 108: 4156-4162] 참조).
JAK 키나제 (야누스 (Janus) 키나제)는 JAK1, JAK2, JAK3 및 TYK2를 비롯한 세포질 단백질 티로신 키나제의 패밀리이다. JAK는 시토킨 신호전달에 있어서 중요한 역할을 한다. 다수의 JAK 키나제가 특정 시토킨 또는 신호 전달 경로의 영향을 받을 수 있지만, JAK 키나제 각각은 특정 시토킨의 수용체에 대해 선택적이다. 연구에 따르면, JAK3은 다양한 시토킨 수용체의 공통적인 시토킨 수용체 감마 쇄 (Fcγ 또는 γc)와 회합하는 것을 시사한다. 특히, JAK3은 수용체에 선택적으로 결합하며, 이는 IL-2, IL-4, IL-7, IL-9, IL-15 및 IL-21에 대한, 그리고 이들에 의해 활성화되는 시토킨 신호전달 경로의 일부이다. JAK1은 특히 시토킨 IL-2, IL-4, IL-7, IL-9 및 IL-21에 대한 수용체와 상호작용하며, JAK2는 특히 IL-9 및 TNF-α에 대한 수용체와 상호작용한다. 특정 시토킨이 그의 수용체와 결합하면 (예를 들어, IL-2, IL-4, IL-7, IL-9, IL-15 및 IL-21), 수용체 올리고머화가 발생하고, 회합된 JAK 키나제의 세포질 꼬리가 근접하게 되어 JAK 키나제 상의 티로신 잔기의 트랜스-인산화가 용이해진다. 이러한 트랜스-인산화는 JAK 키나제의 활성화를 일으킨다.
JAK 키나제 패밀리의 하류 기질에는 전사 (STAT) 단백질의 활성화제, 신호 변환제가 포함된다. 인산화된 JAK 키나제는 다양한 STAT (신호 변환제 및 전사 활성화제) 단백질에 결합한다. 티로신 잔기의 인산화에 의해 활성화된 DNA 결합 단백질인 STAT 단백질은 신호 전달 분자 및 전사 인자 둘 다로서 기능하며, 궁극적으로는 시토킨-반응성 유전자의 프로모터 내에 존재하는 특정 DNA 서열에 결합한다 (문헌 [Leonard et al., (2000), J. Allergy Clin. Immunol. 105:877-888]).
JAK/STAT 신호 전달은 수많은 비정상적인 면역 반응, 예컨대 알레르기, 천식, 자가면역 질환, 예컨대 이식 (동종이식) 거부 반응, 류마티스양 관절염, 근위축성 측삭 경화증 및 다발성 경화증의 매개에 관여할 뿐 아니라, 고형 및 혈액 악성종양, 예컨대 백혈병 및 림프종에 관여한다. JAK/STAT 경로의 제약학적 개입의 검토를 위해서는 문헌 [Frank, (1999), Mol. Med. 5:432:456] 및 [Seidel et al., (2000), Oncogene 19:2645-2656]을 참조한다.
특히, JAK3은 각종 생물학적 과정에 관여한다. 예를 들면, IL-4와 IL-9에 의해 유발된 뮤린 비만 세포의 증식 및 생존은 JAK3- 및 감마 쇄-신호전달에 의존하는 것으로 나타났다 (문헌 [Suzuki et al., (2000), Blood 96:2172-2180]). JAK3은 또한 IgE 수용체-매개 비만 세포 탈과립 반응에서 결정적인 역할을 하며 (문헌 [Malaviya et al., (1999), Biochem. Biophys. Res. Commun. 257:807-813]), JAK3 키나제의 억제는 아나필락시스를 비롯한 제I형 과민 반응을 방지하는 것으로 나타났다 (문헌 [Malaviya et al., (1999), J. Biol. Chem. 274:27028-27038]). JAK3 억제는 또한 동종이식편 거부반응에 대한 면역 억제를 일으키는 것으로 나타났다 (문헌 [Kirken, (2001), Transpl. Proc. 33:3268-3270]). JAK3 키나제는 또한 초기 단계 및 말기 단계의 류마티스양 관절염 (문헌 [Muller-Ladner et al., (2000), J. Immunal. 164:3894-3901]); 가족성 근위축성 측삭 경화증 (문헌 [Trieu et al., (2000), Biochem Biophys. Res. Commun. 267:22-25]); 백혈병 (문헌 [Sudbeck et al., (1999), Clin. Cancer Res. 5:1569-1582]); 균상 식육종, T-세포 림프종의 형태 (문헌 [Nielsen et al., (1997), Prac. Natl. Acad. Sci. USA 94:6764-6769]); 및 비정상적 세포 성장 (문헌 [Yu et al., (1997), J. Immunol. 159:5206-5210]; [Catlett-Falcone et al., (1999), Immunity 10:105-115])과 관련된 메카니즘에 연루된다.
JAK3이 주로 조혈 세포에서 발현되는 반면, JAK1, JAK2 및 TYK2는 어디에서나 발현된다. JAK3을 비롯한 JAK 키나제는 가장 일반적인 형태의 소아 암인 급성 림프모구성 백혈병을 앓는 어린이로부터의 1급 백혈병 세포에서 풍부하게 발현되며, 연구에서는 특정 세포에서의 STAT 활성화를 아폽토시스 조절 신호와 관련시켰다 (문헌 [Demoulin et al., (1996), Mol. Cell. Biol. 16:4710-6]; [Jurlander et al., (1997), Blood. 89:4146-52]; [Kaneko et al., (1997), Clin. Exp. Immun. 109:185-193]; 및 [Nakamura et al.,(1996), J. Biol. Chem. 271: 19483-8]). 이들은 또한, 림프구 분화, 기능 및 생존에 있어서 중요한 것으로 알려져 있다. 특히, JAK-3은 림프구, 대식세포 및 비만 세포의 기능에서 필수적인 역할을 한다. 이러한 JAK 키나제의 중요성으로 인해, JAK 경로를 조절하는 화합물, 예를 들어 JAK3에 대해 선택적인 화합물은 림프구, 대식세포 또는 비만 세포의 기능이 관여하는 질환 또는 질병의 치료를 위해 유용할 수 있다 (문헌 [Kudlacz et al., (2004) Am. J. Transplant 4:51-57]; [Changelian (2003) Science 302:875-878]). JAK 경로의 표적화 또는 JAK 키나제, 특히 JAK3의 조절이 치료적으로 유용할 것으로 고려되는 질병에는 백혈병, 림프종, 이식편 거부반응 (예를 들어, 췌장섬 이식편 거부반응), 골수 이식 용도 (예를 들어, 이식편 대 숙주 질환), 자가면역 질환 (예를 들어, 당뇨병, 류마티스양 관절염, 루푸스, 건선) 및 염증 (예를 들어, 천식, 알레르기성 반응)이 포함된다. JAK3 억제로부터 유익할 수 있는 질병은 하기에서 보다 상세하게 논의된다. JAK 억제에 대한 최근 데이터는 CP-690,550으로 치료한 신장 동종이식편 환자에서 보고되었고, 동종이계 반응의 마커 (인터페론 감마)가 감소될 수 있다는 것을 보여주었다 (문헌 [Van Gurp EA et al (2009) Transplanatation 87:79-86]).
JAK 경로 조절을 비롯한 치료가 유익할 것으로 고려되는 수많은 질병에 비추어 볼 때, JAK 경로를 조절하는 신규 화합물 및 이들 화합물의 사용 방법이 광범위한 환자에게 실질적인 치료적 이익을 제공한다는 것은 매우 명백하다. JAK 경로의 표적화 또는 JAK 키나제, 특히 JAK3의 억제가 치료학적으로 유용한 질병의 치료에 사용하기 위한 신규한 2,4-피리미딘디아민 화합물이 본원에 제공된다.
JAK 경로의 조절과 관련된 특허 및 특허 출원에는 미국 특허 번호 5,728,536; 6,080,747; 6,080,748; 6,133,305; 6,177,433; 6,210,654; 6,313,130; 6,316,635; 6,433,018; 6,486,185; 6,506,763; 6,528,509; 6,593,357; 6,608,048; 6,610,688; 6,635,651; 6,677,368; 6,683,082; 6,696,448; 6,699,865; 6,777,417; 6,784,195; 6,825,190; 6,506,763; 6,784,195; 6,528,509; 6,608,048; 7,105,529; 6,699,865; 6,825,190; 6,815,439; 6,949,580; 7,056,944; 6,998,391; 7,074,793; 6,969,760; 미국 특허 출원 공보 번호 2001/0007033 A1; 2002/0115173 A1; 2002/0137141 A1; 2003/0236244 A1; 2004/0102455 A1; 2004/0142404 A1; 2004/0147507 A1; 및 2004/0214817 A1; 및 국제 특허 출원 WO 95/03701A1; WO 99/15500A1; WO 00/00202A1; WO 00/10981A1; WO 00/47583A1; WO 00/51587A2; WO 00/55159A2; WO 01/42246A2; WO 01/45641A2; WO 01/52892A2; WO 01/56993A2; WO 01/57022A2; WO 01/72758A1; WO 02/00661A1; WO 02/43735A1; WO 02/48336A2; WO 02/060492A1; WO 02/060927A1; WO 02/096909A1; WO 02/102800A1; WO 03/020698A2; WO 03/048162A1; WO 03/101989A1; WO 2004/016597A2; WO 2004/041789A1; WO 2004/041810A1; WO 2004/041814A1; WO 2004/046112A2; WO 2004/046120A2; WO 2004/047843A1; WO 2004/058749A1; WO 2004/058753A1; WO 2004/085388A2; WO 2004/092154A1; WO 2005/009957A1; WO 2005/016344A1; WO 2005/028475A2; 및 WO 2005/033107A1이 포함된다.
치환된 피리미딘디아민 화합물을 기재하는 특허 및 특허 출원에는 2003년 1월 31일 출원된 미국 출원 일련 번호 10/355,543 (US2004/0029902A1), 2003년 1월 31일 출원된 국제 출원 일련 번호 PCT/US03/03022 (WO 03/063794), 2003년 7월 29일 출원된 미국 출원 일련 번호 10/631,029, 국제 출원 일련 번호 PCT/US03/24087 (WO 04/014382), 2004년 7월 30일 출원된 미국 출원 일련 번호 10/903,263 및 국제 출원 일련 번호 PCT/US2004/24716 (WO 05/016893)이 포함되며, 이들 개시 내용은 본원에 참조로 포함된다. 치환된 피리미딘디아민 화합물은 또한 국제 특허 출원 공보 번호 WO 02/059110, WO 03/074515, WO 03/106416, WO 03/066601, WO 03/063794, WO 04/046118, WO 05/016894, WO 05/122294, WO 05/066156, WO 03/002542, WO 03/030909, WO 00/39101, WO 05/037800 및 미국 특허 공보 번호 2003/0149064에 기재되어 있다.
본 분야에서 진전이 이루어져 왔지만, syk 및/또는 JAK 키나제를 억제하는 화합물, 뿐만 아니라 환자에서의 질병, 예컨대 이러한 억제로부터 유익할 수 있는 재협착, 혈전증 및/또는 염증을 치료하는 방법에 대한 필요성은 당업계에 여전히 남아있다. 더욱이, 다른 키나제에 비해 이들 키나제 중 하나를 선택적으로 억제하는 화합물의 이용가능성도 바람직하다. 본 발명은 상기 필요성 및 여타 필요성을 충족시킨다.
본 발명의 간단한 요약
본 발명은 syk 활성의 억제제 (또한 본원에서 "syk 억제제"로 지칭됨), 및/또는 JAK 키나제 활성의 억제제 (또한 "JAK 억제제"로 지칭됨)로서의 활성을 갖는 신규한 화합물, 뿐만 아니라 그의 제조 및 사용 방법, 및 상기 화합물을 함유하는 제약 조성물을 제공한다. 상기 화합물 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체는 하기 구조 I을 갖는다.
<화학식 I>
상기 식에서, D1, R1, Y1 및 R2는 하기 정의되어 있다.
또한, 본 발명은 치료적 유효량의 화학식 I의 화합물 또는 그의 제약상 허용되는 염, 및 제약상 허용되는 담체 및/또는 희석제를 포함하는 제약 조성물을 제공한다.
본 발명의 화합물은 광범위에 걸친 치료 용도에 있어서 유용성을 가지며, 여성 및 남성, 뿐만 아니라 대개의 포유동물 (또한 본원에서 "대상체"로 지칭됨)에서 syk 활성에 의해 적어도 부분적으로 매개되는 다양한 질병을 치료하는데 사용될 수 있다. 예를 들어, 이러한 질병에는 심혈관 질환, 염증 질환 또는 자가면역 질환과 관련된 것들이 포함되지만, 여기에 한정되지는 않는다. 보다 구체적으로는, 본 발명의 화합물은 재협착, 혈전증, 염증, 헤파린 유도 혈소판감소증, 확장성 심근병증, 겸상 적혈구 질환, 아테롬성동맥경화증, 심근 경색증, 혈관 염증, 불안정형 협심증, 급성 관상 동맥 증후군, 알레르기, 천식, 류마티스양 관절염, B-세포 매개 질환, 예컨대 비 호지킨 림프종, 항-인지질 증후군, 루푸스, 건선, 다발성 경화증, 말기 신장 질환, 용혈성 빈혈, 면역 혈소판감소성 자반증 및 만성 림프구성 백혈병을 비롯한 (이들에 한정되지는 않음) 질병 또는 장애를 치료하는데 유용성을 갖는다. 따라서, 한 실시양태에서, 상기 질병 또는 장애의 치료가 필요한 대상체에게 유효량의 화학식 I의 화합물을 통상적으로 제약 조성물의 형태로 투여하는 것을 포함하는 방법을 개시한다.
심혈관 질환과 관련된 질병은 급성 관상 동맥 증후군, 심근 경색, 불안정형 협심증, 난치성 협심증, 혈전용해 요법 후 또는 관상 혈관성형술 후 발생하는 폐색성 관상 혈전증, 혈전성 매개된 뇌혈관 증후군, 색전성 뇌졸중, 혈전성 뇌졸중, 일과성 허혈 발작, 정맥 혈전증, 깊은 정맥 혈전증, 폐동맥 색전증, 응고병증, 파종성 혈관내 응고, 혈전성 혈소판감소성 자반증, 폐쇄혈전혈관염, 헤파린-유도 혈소판감소증과 관련된 혈전성 질환, 체외 순환과 관련된 혈전성 합병증, 심장 또는 다른 혈관내 카테터 삽입, 대동맥내 풍선 펌프, 관상동맥 스텐트 또는 심장 판막과 같은 기구 사용과 관련된 혈전성 합병증, 및 보철 장치의 삽입이 필요한 질병으로 이루어진 군으로부터 선택된다.
본 발명은 또한 혈액 샘플을 본 발명의 화합물과 접촉시키는 것을 포함하는, 혈액 샘플의 syk 활성을 억제하는 방법을 제공한다.
또한, 본 발명은 정제된 형태의 화합물, 및 화학적 중간체를 제공한다.
본 발명의 이들 및 다른 측면, 목적, 특징 및 이점은 하기 상세한 설명 및 도면을 참조하여 명백해질 것이다. 이를 위해, 보다 상세한 특정 배경 정보, 절차, 화합물 및/또는 조성물을 기재하는 여러 참고문헌이 본원에 기재되어 있고, 이들 각각의 전문은 본원에 참조로 포함된다.
도 1은 Syk가 세포 생물학 및 다양한 질환에서 신호전달을 매개하는 Fc 수용체의 주요 매개자로서 어떻게 작용하는지를 나타낸다.
도 2는 Syk가 동맥 혈소판 생물학에서의 주요 매개자 및 동맥 혈전증을 치료하기 위한 선택적 표적으로 작용하는 것을 나타내는, Syk의 유전자 표적화 방법을 나타낸다.
도 3은 본 발명의 화합물의 일반적 합성을 나타낸다.
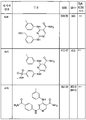
도 4는 본 발명의 화합물 및 syk IC50을 설명하는 표 1을 제공한다.
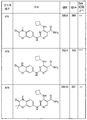
도 5는 본 발명의 화합물 및 syk IC50을 설명하는 표 2를 제공한다.
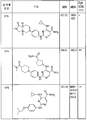
도 6은 본 발명의 화합물 및 syk IC50을 설명하는 표 3을 제공한다.
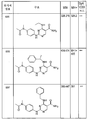
도 7a 및 b는 본 발명의 화합물 및 syk IC50을 설명하는 표 4a 및 4b를 제공한다.
도 8A, 8B 및 8C는 정제 키나제 분석에서 Syk를 선택적으로 억제하기 위해 동정한 일련의 화합물을 나타낸다. 도 8A) Syk-특이적 시리즈로부터의 화합물 (P459-72 및 P505-15) 및 멀티-키나제 시리즈로부터의 화합물 (실시예 100a)을 300 nM에서 밀리포어 (Millipore) 정제 키나제 패널 (10 μM ATP로 시험한 270개 키나제)에 대해 스크리닝하여, Syk에 대한 효능 및 선택성을 결정하였다. 데이터는 하기 정의한 열-지도로 나타냈다. 도 8B) 임의의 3개의 화합물에 의해 >80% 억제되는 정제 키나제의 하위세트. P459-72는 단독으로 Syk 및 MLK1을 억제하였다. P505-15는 50 nM (그의 Syk IC50보다 약 10배 넘게 큼)에서 단독으로 Syk를 억제하였다. 실시예 100b는 Syk, JAK2 및 JAK3을 비롯한 다양한 키나제를 억제하였다. Syk 억제의 IC50은 열 지도 좌측에 각각의 화합물에 대해 나타냈다. 키나제 억제율 (%)은 열-지도 내부의 각각의 패널에 제시하였다.
도 9A, 9B 및 9C는 비-호지킨 림프종 세포주에서의 Syk의 선택적 억제를 나타낸다. B 세포를 지시된 농도의 Syk 특이적 억제제인 P459-72 및 P505-15 (도 9A 및 도 9B), 또는 이중 Syk/JAK 억제제인 실시예 100b (도 9C)의 존재하에 항-BCR 항체로 자극하였다. 이어서, 전세포 용해물의 웨스턴 블롯 분석을 수행하여, Syk 키나제 활성 (pBLNK Y84 및 총 BLNK; 상단의 두 겔) 및 Src 키나제 활성 (pSyk Y352 및 총 Syk; 하단의 두 겔)을 평가하였다. 실험은 각각 2 내지 3회 수행하였고, 막대 그래프를 pBLNK Y84의 평균 ± 표준편차로 나타냈다. 계산된 Syk 키나제 억제의 IC50을 그래프의 상단에 표시하였다.
도 10A 및 10B에서 NHL 세포주에서의 Syk-특이적 억제 및 이중 Syk/JAK 억제를 비교하였다. B 세포를 항-BCR (도 10A) 또는 IL-4 (도 10B)로 15분 동안 지시된 바와 같은 다양한 농도의 각각의 억제제의 존재하에 자극하였다. 이어서, 세포를 포스포-유세포측정에 의해 신호전달 경로의 억제에 대해 평가하였다. 도 10A) 다양한 처리 조건하의 BCR 자극 후의 Src 활성 (pSyk Y352 MFI) 및 Syk 활성 (pERK Y204 MFI)을 나타내는 막대 그래프 (평균 ± 표준편차, n=3). 도 10B) 지시된 바와 같은 다양한 농도의 각각의 억제제의 존재하에 IL-4로 자극한 후의 pSTAT-6 Y641 MFI를 도시하는 막대 그래프 (평균 ± 표준편차, n=3).
도 11A 및 11B는 Syk-특이적 억제제가 NHL 세포주에서 아폽토시스를 유도하고, 그의 증식 및 생존을 중단시키는 방법을 나타낸다. Syk-의존성 "BCR 유형" 및 Syk-비의존성 "비-BCR 유형"의 NHL 세포주는 앞서 기재된 바 있다 (문헌 [Polo, Juszczynski et al. Proc Natl Acad Sci U S A 104(9): 3207-12 (2007)]). 도 11A) 세포를 1 및 3 μM의 Syk-특이적 억제제 P505-15로 72시간 동안 처리하였다. 아폽토시스를 활성 카스파제 3의 FACS 분석에 의해 측정하였고; 데이터를 히스토그램으로 나타냈다. 도 11B) 추가의 세포주를 Syk 특이적 (P459-72 및 P505-15) 억제 대 이중 Syk/JAK (실시예 100b) 억제에 대한 민감도에 대해 시험하였다. 막대 그래프는 각각의 조건에 따른 카스파제 3 양성 세포의 비율 (%)의 평균 ± 표준편차 (n=3)를 나타낸다.
도 2는 Syk가 동맥 혈소판 생물학에서의 주요 매개자 및 동맥 혈전증을 치료하기 위한 선택적 표적으로 작용하는 것을 나타내는, Syk의 유전자 표적화 방법을 나타낸다.
도 3은 본 발명의 화합물의 일반적 합성을 나타낸다.
도 4는 본 발명의 화합물 및 syk IC50을 설명하는 표 1을 제공한다.
도 5는 본 발명의 화합물 및 syk IC50을 설명하는 표 2를 제공한다.
도 6은 본 발명의 화합물 및 syk IC50을 설명하는 표 3을 제공한다.
도 7a 및 b는 본 발명의 화합물 및 syk IC50을 설명하는 표 4a 및 4b를 제공한다.
도 8A, 8B 및 8C는 정제 키나제 분석에서 Syk를 선택적으로 억제하기 위해 동정한 일련의 화합물을 나타낸다. 도 8A) Syk-특이적 시리즈로부터의 화합물 (P459-72 및 P505-15) 및 멀티-키나제 시리즈로부터의 화합물 (실시예 100a)을 300 nM에서 밀리포어 (Millipore) 정제 키나제 패널 (10 μM ATP로 시험한 270개 키나제)에 대해 스크리닝하여, Syk에 대한 효능 및 선택성을 결정하였다. 데이터는 하기 정의한 열-지도로 나타냈다. 도 8B) 임의의 3개의 화합물에 의해 >80% 억제되는 정제 키나제의 하위세트. P459-72는 단독으로 Syk 및 MLK1을 억제하였다. P505-15는 50 nM (그의 Syk IC50보다 약 10배 넘게 큼)에서 단독으로 Syk를 억제하였다. 실시예 100b는 Syk, JAK2 및 JAK3을 비롯한 다양한 키나제를 억제하였다. Syk 억제의 IC50은 열 지도 좌측에 각각의 화합물에 대해 나타냈다. 키나제 억제율 (%)은 열-지도 내부의 각각의 패널에 제시하였다.
도 9A, 9B 및 9C는 비-호지킨 림프종 세포주에서의 Syk의 선택적 억제를 나타낸다. B 세포를 지시된 농도의 Syk 특이적 억제제인 P459-72 및 P505-15 (도 9A 및 도 9B), 또는 이중 Syk/JAK 억제제인 실시예 100b (도 9C)의 존재하에 항-BCR 항체로 자극하였다. 이어서, 전세포 용해물의 웨스턴 블롯 분석을 수행하여, Syk 키나제 활성 (pBLNK Y84 및 총 BLNK; 상단의 두 겔) 및 Src 키나제 활성 (pSyk Y352 및 총 Syk; 하단의 두 겔)을 평가하였다. 실험은 각각 2 내지 3회 수행하였고, 막대 그래프를 pBLNK Y84의 평균 ± 표준편차로 나타냈다. 계산된 Syk 키나제 억제의 IC50을 그래프의 상단에 표시하였다.
도 10A 및 10B에서 NHL 세포주에서의 Syk-특이적 억제 및 이중 Syk/JAK 억제를 비교하였다. B 세포를 항-BCR (도 10A) 또는 IL-4 (도 10B)로 15분 동안 지시된 바와 같은 다양한 농도의 각각의 억제제의 존재하에 자극하였다. 이어서, 세포를 포스포-유세포측정에 의해 신호전달 경로의 억제에 대해 평가하였다. 도 10A) 다양한 처리 조건하의 BCR 자극 후의 Src 활성 (pSyk Y352 MFI) 및 Syk 활성 (pERK Y204 MFI)을 나타내는 막대 그래프 (평균 ± 표준편차, n=3). 도 10B) 지시된 바와 같은 다양한 농도의 각각의 억제제의 존재하에 IL-4로 자극한 후의 pSTAT-6 Y641 MFI를 도시하는 막대 그래프 (평균 ± 표준편차, n=3).
도 11A 및 11B는 Syk-특이적 억제제가 NHL 세포주에서 아폽토시스를 유도하고, 그의 증식 및 생존을 중단시키는 방법을 나타낸다. Syk-의존성 "BCR 유형" 및 Syk-비의존성 "비-BCR 유형"의 NHL 세포주는 앞서 기재된 바 있다 (문헌 [Polo, Juszczynski et al. Proc Natl Acad Sci U S A 104(9): 3207-12 (2007)]). 도 11A) 세포를 1 및 3 μM의 Syk-특이적 억제제 P505-15로 72시간 동안 처리하였다. 아폽토시스를 활성 카스파제 3의 FACS 분석에 의해 측정하였고; 데이터를 히스토그램으로 나타냈다. 도 11B) 추가의 세포주를 Syk 특이적 (P459-72 및 P505-15) 억제 대 이중 Syk/JAK (실시예 100b) 억제에 대한 민감도에 대해 시험하였다. 막대 그래프는 각각의 조건에 따른 카스파제 3 양성 세포의 비율 (%)의 평균 ± 표준편차 (n=3)를 나타낸다.
본원에 사용된 하기 용어들은 달리 명시하지 않는 한, 하기 의미를 갖는다.
1. 약어 및 정의
본원에 사용된 약어는 달리 정의하지 않는 한, 통상적이다. 하기 약어를 사용하였다. AcOH = 아세트산, AIBN = 아조비스이소부티로니트릴 (또한 아조비스이소부틸로니트릴), aq. = 수성, Boc = t-부틸카르복시, Bz - 벤질, BOP = 벤조트리아졸-1-일옥시트리스(디메틸아미노)-포스포늄 헥사플루오로포스페이트, BPO = 벤조일 퍼옥시드, nBuOH = n-부탄올, CBr4 = 테트라브로모메탄, mCPBA = m-클로로퍼옥시벤조산, CH2Cl2 또는 DCM = 디클로로메탄, Cs2CO3 = 탄산세슘, CuCl2 = 염화구리; DIBAL = 디이소부틸알루미늄 히드라이드, DIEA = 후니그 염기 또는 디이소프로필 에틸아민, DME = 디메틸 에테르, DMF = 디메틸 포름아미드, DMSO = 디메틸 술폭시드, DPPA = 디페닐 포스포릴 아지드, Et3N = 트리에틸아민, EtOAc = 에틸 아세테이트, g = 그램, HATU = 2-(1H 7-아자벤조트리아졸-1-일)-1,1,3,3-테트라메틸 우로늄 헥사플루오로포스페이트, H2 = 수소; H2O = 물; HBr = 브롬화수소; HCl = 염화수소, HIV = 인간 면역결핍 바이러스, HPLC = 고압 액체 크로마토그래피, h = 시간, IgE = 면역글로불린 E, IC50 = 시험관내에서 효소를 50% 억제하는데 필요한 억제제의 농도, IPA = 이소프로필 알콜, kg = 킬로그램, KCN = 시안화칼륨, KOH = 수산화칼륨, K2PO4 = 인산칼륨, LDA = 리튬 디이소프로필아민, LiAlH4 = 수소화리튬알루미늄; LiOH = 수산화리튬; MeCN = 아세토니트릴; MS = 질량 분광측정법, m/z = 질량 대 전하 비, MHz = 메가 헤르쯔, MeOH = 메탄올, μM = 마이크로몰랄, ㎕ = 마이크로리터, mg = 밀리그램, mm = 밀리미터, mM = 밀리몰랄, mmol = 밀리몰, mL = 밀리리터, mOD/분 = 분 당 밀리 광학 밀도, min = 분, M = 몰랄, Na2CO3 = 탄산나트륨, ng = 나노그램, NaHCO3 = 중탄산나트륨; NaNO2 = 아질산나트륨; NaOH = 수산화나트륨; Na2S2O3 = 중황산나트륨; Na2SO4 = 황산나트륨; NBS = N-브로모숙신아미드; NH4Cl = 염화암모늄; NH4OAc = 암모늄 아세테이트; NaSMe = 나트륨 메틸티올레이트, NBS = N-브로모숙신아미드, n-BuLi = n-부틸 리튬, nm = 나노미터, nM = 나노몰랄, N = 노르말, NMP = N-메틸피롤리딘, NMR = 핵 자기 공명, Pd/C = 탄소 상 팔라듐, Pd(PPh3)4 = 테트라키스-(트리페닐-포스핀)-팔라듐, pM = 피코몰랄, Pin = 피나콜라토, PEG = 폴리에틸렌 글리콜, PPh3 또는 Ph3P = 트리페닐 포스핀, RLV = 라우셔 백혈병 바이러스, Ra-Ni = 라니 니켈, SOCl2 = 티오닐 클로라이드, RT = 실온, TEA = 트리에틸아민, THF = 테트라히드로푸란, TFA = 트리플루오로아세트산, TLC = 박막 크로마토그래피, TMS = 트리메틸실릴, Tf = 트리플루오로메틸술포닐 및 TSC = 트리나트륨 시트레이트.
본 명세서 및 첨부된 청구의 범위에서 사용된 단수 형태 ("a," "an" 및 "the")는 문맥상 명확하게 달리 나타내지 않는 한 복수형의 언급을 포함한다는 것을 주의한다.
달리 언급하지 않는 한, 그 자체 또는 또다른 치환기의 일부로서의 "알킬"은 지정된 수의 탄소 원자를 갖는 직쇄 또는 분지쇄의 완전 포화된 지방족 탄화수소 라디칼을 의미한다. 예를 들어, "C1 - 8알킬"은 모 알칸의 단일 탄소 원자로부터 하나의 수소 원자를 제거하여 유도된, 1 내지 8개의 탄소 원자를 함유하는 선형 또는 분지형 탄화수소 라디칼을 지칭한다. 어구 "비치환된 알킬"은 완전 포화 지방족 탄화수소 라디칼이 아닌 기를 함유하지 않는 알킬기를 지칭한다. 따라서, 상기 어구에는 직쇄 알킬기, 예컨대 메틸, 에틸, 프로필, 부틸, 펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실, 운데실, 도데실 등이 포함된다. 또한 상기 어구에는 직쇄 알킬기의 분지쇄 이성질체, 예컨대 이소프로필, t-부틸, 이소부틸, sec-부틸 등이 포함된다. 대표적인 알킬기에는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 12개의 탄소 원자를 갖는 직쇄 및 분지쇄 알킬기가 포함된다. 추가의 대표적인 알킬기에는 1, 2, 3, 4, 5, 6, 7 또는 8개의 탄소 원자를 갖는 직쇄 및 분지쇄 알킬기가 포함된다.
그 자체 또는 또다른 치환기의 일부로서의 "알케닐"은 지정된 수의 탄소 원자를 갖는 단일- 또는 다중불포화될 수 있는 직쇄 또는 분지쇄를 지칭한다. 예를 들어, "C2-C8 알케닐"은 모 알칸의 단일 탄소 원자로부터 하나의 수소 원자를 제거하여 유도된, 2, 3, 4, 5, 6, 7 또는 8개의 원자를 갖는 알케닐 라디칼을 의미한다. 그 예에는 비닐, 2-프로페닐, 즉 -CH=C(H)(CH3), -CH=C(CH3)2, -C(CH3)=C(H)2, -C(CH3)=C(H)(CH3), -C(CH2CH3)=CH2, 부타디에닐, 예컨대 2-(부타디에닐), 펜타디에닐, 예컨대 2,4-펜타디에닐 및 3-(1,4-펜타디에닐), 및 헥사디에닐 등, 및 고급 동족체 및 그의 입체이성질체가 포함되나 그에 제한되지는 않는다. "치환된" 알케닐기에는 비-탄소 또는 비-수소 원자가 또다른 탄소에 이중 결합된 탄소에 결합된 알케닐기, 및 비-탄소 또는 비-수소 원자 중 하나가 또다른 탄소의 이중 결합에 관여하지 않는 탄소에 결합된 알케닐기가 포함된다. 불포화의 각 위치는 이중 결합(들)에 대해 시스 또는 트랜스 배위일 수 있다.
그 자체 또는 또다른 치환기의 일부로서의 용어 "알키닐"은 지정된 수의 탄소 원자를 갖는 단일- 또는 다중불포화된 직쇄 또는 분지쇄 탄화수소 라디칼을 의미한다. 예를 들어, "C2-C8 알키닐"은 모 알칸의 단일 탄소 원자로부터 하나의 수소 원자를 제거하여 유도된 2 내지 8개의 탄소 원자를 갖는 알키닐 라디칼을 의미한다. "비치환된 알키닐"은 2개의 탄소 원자 사이에 하나 이상의 삼중 결합이 존재한다는 것을 제외하고는 상기 정의한 비치환된 알키닐에 대해 정의한 바와 같은 직쇄 또는 분지쇄 기를 지칭한다. 그 예에는 에티닐, 예컨대 -C≡C(H), 1-프로피닐, 예컨대 -C≡C(CH3), -C≡C(CH2CH3), -C(H2)C≡C(H), -C(H)2C≡C(CH3) 및 -C(H)2C≡C(CH2CH3) 등, 및 고급 동족체 및 그의 이성질체가 포함되나, 그에 제한되지는 않는다. "치환된" 알키닐기에는 비-탄소 또는 비-수소 원자가 또다른 탄소에 삼중 결합된 탄소에 결합된 알키닐기, 및 비-탄소 또는 비-수소 원자가 또다른 탄소의 삼중 결합에 관여하지 않는 탄소에 결합된 알키닐기가 포함된다.
그 자체 또는 또다른 치환기의 일부로서의 "알킬렌"은 알칸으로부터 유도된 2가 라디칼, 예컨대 -CH2CH2CH2CH2-를 의미한다. 전형적으로, 알킬렌기는 모 알킬의 단일 탄소 원자로부터 하나의 수소 원자를 제거하여 유도된 1, 2, 3, 4, 5, 6, 7 또는 8개의 탄소 원자를 가질 것이다.
달리 언급하지 않는 한, 그 자체의 또는 다른 용어와 조합된 "시클로알킬" 또는 "카르보사이클"은 모든 고리 원자가 탄소인 "알킬", "알케닐" 및 "알키닐"의 시클릭 버전을 나타낸다. "시클로알킬" 또는 "카르보사이클"은 모노- 또는 폴리시클릭기를 지칭한다. 시클로알킬 치환기와 함께 사용되는 경우, 용어 "폴리시클릭"은 본원에서 융합 및 비-융합 알킬 시클릭 구조를 지칭한다. "시클로알킬" 또는 "카르보사이클"은 가교 고리 또는 스피로 고리를 형성할 수 있다. 시클로알킬기는 하나 이상의 이중 또는 삼중 결합(들)을 가질 수 있다. 용어 "시클로알케닐"은 하나 이상의 위치의 고리 정점 사이의 알케닐 불포화를 갖는 시클로알킬기를 지칭한다. 용어 "시클로알키닐"은 하나 이상의 위치의 고리 정점 사이의 알키닐 불포화를 갖는 시클로알킬기를 지칭한다. "시클로알킬"이 C3 - 8시클로알킬C3 - 8알킬렌-에서와 같이 "알킬"과 함께 사용된 경우, 알킬렌 부분이 1 내지 8개의 탄소 원자를 갖는 반면 시클로알킬 부분은 언급된 수의 탄소 원자 (예컨대, 3 내지 8개의 탄소 원자)를 갖는 것을 의미한다. 전형적인 시클로알킬 치환기는 3 내지 8개의 고리 원자를 갖는다. 시클로알킬의 예에는 시클로펜틸, 시클로헥실, 1-시클로헥세닐, 3-시클로헥세닐, 시클로헵틸 등이 포함된다.
그 자체 또는 또다른 치환기의 일부로서의 "아릴"은 단일 고리이거나, 또는 서로 융합되거나 공유적으로 연결된 다중 고리 (3개 이하의 고리)일 수 있는, 6 내지 14개의 탄소 원자를 함유하는 다중불포화된 방향족 탄화수소기를 지칭한다. 따라서, 상기 어구에는, 예를 들어 페닐, 바이페닐, 안트라세닐, 나프틸과 같은 기가 포함되나, 이에 제한되지는 않는다. 비치환된 아릴기의 비제한적인 예에는 페닐, 1-나프틸, 2-나프틸 및 4-바이페닐이 포함된다. "치환된 아릴기"에는, 예를 들어 -CH2OH (하나의 탄소 원자 및 탄소 원자를 대체하는 하나의 헤테로원자) 및 -CH2SH가 포함된다. 그 자체 또는 또다른 치환기의 일부로서의 용어 "헤테로알킬렌"은 헤테로알킬로부터 유도된 2가 라디칼, 예를 들어 -CH2-CH2-S-CH2CH2- 및 -CH2-S-CH2-CH2-NH-CH2-를 의미한다. 헤테로알킬렌 기의 경우, 헤테로 원자는 또한 쇄 말단 중의 어느 하나 또는 둘 다를 차지할 수 있다 (예를 들어, 알킬렌옥시, 알킬렌디옥시, 알킬렌아미노, 알킬렌디아미노 등). 또한, 알킬렌 및 헤테로알킬렌 연결기의 경우, 연결기의 배향이 암시되지는 않는다.
용어 "헤테로사이클", "헤테로시클릴" 또는 "헤테로시클릭"은 하나 이상의 헤테로원자를 함유하는 포화 또는 불포화된 비-방향족 시클릭기를 지칭한다. 본원에 사용된 용어 "헤테로원자"는 산소 (O), 질소 (N), 황 (S) 및 규소 (Si)를 포함하는 의미이다. 각각의 헤테로사이클은 임의의 이용가능한 고리 탄소 또는 헤테로원자에 부착될 수 있다. 각각의 헤테로사이클은 하나 이상의 고리를 가질 수 있다. 다중 고리가 존재하는 경우, 이는 서로 융합되거나, 또는 공유적으로 연결될 수 있다. 각각의 헤테로사이클은 전형적으로 1, 2, 3, 4 또는 5개의 독립적으로 선택된 헤테로원자를 함유한다. 바람직하게는, 이들 기는 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10개의 탄소 원자, 0, 1, 2, 3, 4 또는 5개의 질소 원자, 0, 1 또는 2개의 황 원자, 및 0, 1 또는 2개의 산소 원자를 함유한다. 보다 바람직하게는, 이들 기는 1, 2 또는 3개의 질소 원자, 0 내지 1개의 황 원자 및 0 내지 1개의 산소 원자를 함유한다. 헤테로사이클기의 비제한적인 예에는 모르폴린-3-온, 피페라진-2-온, 피페라진-1-옥시드, 피리딘-2-온, 피페리딘, 모르폴린, 피페라진, 이속사졸린, 피라졸린, 이미다졸린, 피라졸-5-온, 피롤리딘-2,5-디온, 이미다졸리딘-2,4-디온, 피롤리딘, 테트라히드로퀴놀리닐, 데카히드로퀴놀리닐, 테트라히드로벤조옥사제피닐, 디히드로디벤조옥세핀 등이 포함된다.
"헤테로아릴"은 N, O 및 S로부터 선택된 1개 내지 5개의 헤테로원자를 함유하는 시클릭 또는 폴리시클릭 방향족 라디칼을 지칭하는데, 여기서 질소 및 황 원자는 임의로 산화되고, 질소 원자(들)은 임의로 4급화 된다. 헤테로아릴기는 헤테로원자 또는 탄소 원자를 통해 분자의 나머지 부분에 부착될 수 있고, 5 내지 10개의 탄소 원자를 함유할 수 있다. 헤테로아릴기의 비제한적인 예에는 1-피롤릴, 2-피롤릴, 3-피롤릴, 1-피라졸릴, 3-피라졸릴, 2-이미다졸릴, 4-이미다졸릴, 피라지닐, 2-옥사졸릴, 4-옥사졸릴, 5-옥사졸릴, 3-이속사졸릴, 4-이속사졸릴, 5-이속사졸릴, 2-티아졸릴, 4-티아졸릴, 5-티아졸릴, 2-푸릴, 3-푸릴, 2-티에닐, 3-티에닐, 2-피리딜, 3-피리딜, 4-피리딜, 2-피리미딜 및 4-피리미딜이 포함된다. 구체적으로 언급하지 않는 한, 각각의 상기 언급한 아릴 및 헤테로아릴 고리계에 대한 치환기는 본원에 기재된 허용되는 치환기의 군으로부터 선택된다. "치환된 헤테로아릴"은, 치환된 알킬기 및 치환된 아릴기에 대해 상기 기재한 바와 같이 하나 이상의 고리 구성원이 비-수소 원자에 결합된 상기 정의한 바와 같은 비치환된 헤테로아릴기를 지칭한다. 대표적인 치환기에는 직쇄 및 분지쇄 알킬기-CH3, -C2H5, -CH2OH, -OH, -OCH3, -OC2H5, -OCF3, -OC(=O)CH3, -OC(=O)NH2, -OC(=O)N(CH3)2, -CN, -NO2, -C(=O)CH3, -CO2H, -CO2CH3, -CONH2, -NH2, -N(CH3)2, -NHSO2CH3, -NHCOCH3, -NHC(=O)OCH3, -NHSO2CH3, -SO2CH3, -SO2NH2 및 할로가 포함된다.
"바이시클릭 헤테로아릴"은 N, O 및 S로부터 선택된 1개 내지 5개의 헤테로원자를 함유하는 바이시클릭 방향족 라디칼을 지칭하는데, 여기서 질소 및 황 원자는 임의로 산화되고, 질소 원자(들)은 임의로 4급화 된다. 바이시클릭 헤테로아릴기는 헤테로원자 또는 탄소 원자를 통해 분자의 나머지 부분에 부착될 수 있고, 5 내지 10개의 탄소 원자를 함유할 수 있다. 바이시클릭 헤테로아릴기의 비제한적인 예에는 5-벤조티아졸릴, 푸리닐, 2-벤즈이미다졸릴, 벤조피라졸릴, 5-인돌릴, 아자인돌, 1-이소퀴놀릴, 5-이소퀴놀릴, 2-퀴녹살리닐, 5-퀴녹살리닐, 3-퀴놀릴 및 6-퀴놀릴이 포함된다. 구체적으로 언급하지 않는 한, 각각의 상기 언급한 아릴 및 헤테로아릴 고리계에 대한 치환기는 본원에 기재된 허용되는 치환기의 군으로부터 선택된다.
각각의 상기 실시양태에서, 지정된 수의 원자, 예컨대 "C1 -8"은 하나 이상 더 적은 수의 원자를 갖는 모든 가능한 실시양태를 포함하는 의미이다. 비제한적인 예에는 C1 -7, C2 -8, C2 -7, C3 -8, C3 -7 등이 포함된다.
달리 나타내지 않는 한, 본원의 각각의 용어 (예컨대, "알킬", "헤테로알킬", "아릴" 및 "헤테로아릴")는 나타낸 라디칼의 "비치환된" 형태 및 임의로 "치환된" 형태 모두를 포함하는 의미이다. 달리 나타내지 않는 한, 각각의 라디칼은 전형적으로 0, 1, 2, 3, 4 또는 5개의 치환기로 치환된다. 각각의 유형의 라디칼에 대한 치환기의 예가 하기에 제공된다.
"치환된"은 탄소(들) 또는 수소(들)에 대한 하나 이상의 결합이 비-수소 및 비-탄소 원자 "치환기", 예를 들어 (이들로 제한되지는 않음) 할로겐 원자, 예컨대 F, Cl, Br 및 I; 기 중의 산소 원자, 예컨대 히드록실기, 알콕시기, 아릴옥시 및 아실옥시기; 기 중의 황 원자, 예컨대 티올기, 알킬 및 아릴 술파이드기, 술폰기, 술포닐기 및 술폭시드기; 기 중의 질소 원자, 예컨대 아미노, 알킬아민, 디알킬아민, 아릴아민, 알킬아릴아민, 디아릴아민, 알콕시아미노, 히드록시아미노, 아실아미노, 술포닐아미노, N-옥시드, 이미드 및 엔아민; 및 다양한 다른 기 중의 다른 헤테로원자에 대한 결합으로 대체된, 본원에 정의한 바와 같은 기를 지칭한다. 또한, "치환기"에는 탄소(들) 또는 수소(들) 원자에 대한 하나 이상의 결합이 헤테로원자 (예컨대 옥소, 아실, 아미도, 알콕시카르보닐, 아미노카르보닐, 카르복실 및 에스테르기 중의 산소; 이민, 옥심, 히드라존 및 니트릴과 같은 기 중의 질소)에 대한 고차원 결합 (예컨대, 이중 또는 삼중-결합)으로 대체된 기가 포함된다. 또한, "치환기"에는 탄소(들) 또는 수소(들) 원자에 대한 하나 이상의 결합이 시클로알킬, 헤테로시클릴, 아릴 및 헤테로아릴기에 대한 결합으로 대체된 기가 포함된다. 대표적인 "치환기" 중에는 탄소 또는 수소 원자에 대한 하나 이상의 결합이 플루오로, 클로로 또는 브로모기에 대한 하나 이상의 결합으로 대체된 기가 포함된다. 또다른 대표적인 "치환기"는 트리플루오로메틸기, 및 트리플루오로메틸기를 함유하는 다른 기이다. 다른 대표적인 "치환기"에는, 치환된 알킬기가 히드록실, 알콕시 또는 아릴옥시기를 함유하는 것과 같이 탄소 또는 수소 원자에 대한 하나 이상의 결합이 산소 원자에 대한 결합으로 대체된 것이 포함된다. 다른 대표적인 "치환기"에는 아민, 또는 치환 또는 비치환된 알킬아민, 디알킬아민, 아릴아민, (알킬)(아릴)아민, 디아릴아민, 헤테로시클릴아민, 디헤테로시클릴아민, (알킬)(헤테로시클릴)아민 또는 (아릴)(헤테로시클릴)아민기를 갖는 알킬기가 포함된다. 또다른 대표적인 "치환기"에는 탄소(들) 또는 수소(들) 원자에 대한 하나 이상의 결합이 알킬, 시클로알킬, 아릴, 헤테로아릴 또는 헤테로시클릴기에 대한 결합으로 대체된 것이 포함된다.
본원에 정의된 기는 추가적으로 잘 알려진 치환기를 만들어내기 위해 당업계에서 통상적으로 사용되는 접두사 및/또는 접미사를 포함할 수 있다. 예를 들어, "알킬아미노"는 화학식 -NRaRb의 기를 지칭한다. 달리 언급하지 않는 한, Ra, Rb, Rc, Rd 및 Re를 함유하는 하기 기에 대해: Ra 및 Rb는 각각 H, 알킬, 알콕시, 티오알콕시, 시클로알킬, 아릴, 헤테로아릴 또는 헤테로시클릴로부터 독립적으로 선택되거나, 또는 임의로 그들이 부착된 원자(들)와 함께 결합하여 시클릭기를 형성한다. Ra 및 Rb가 동일한 질소 원자에 부착된 경우, 이들은 질소 원자와 함께 5-, 6- 또는 7-원 고리를 형성할 수 있다. 예를 들어, -NRaRb는 1-피롤리디닐 및 4-모르폴리닐을 포함하는 의미이다.
Rc, Rd, Re 및 Rf는 각각 본원에 정의된 바와 같은 알킬, 알케닐, 알키닐, 시클로알킬, 시클로알케닐, 아릴, 헤테로아릴, 헤테로시클릴 또는 알킬렌아릴로부터 독립적으로 선택된다.
전형적으로, 특정 라디칼은 0, 1, 2 또는 3개의 치환기를 가질 것이며, 2개 이하의 치환기를 갖는 이들 기가 본 발명에서 바람직하다. 보다 바람직하게는, 라디칼은 비치환되거나, 또는 일치환될 것이다. 가장 바람직하게는, 라디칼은 비치환될 것이다.
알킬 및 헤테로알킬 라디칼 (뿐만 아니라, 알킬렌, 알케닐, 헤테로알킬렌, 헤테로알케닐, 알키닐, 시클로알킬, 헤테로시클릴로 지칭되는 이들 기)에 대한 "치환기"는 0 내지 3개 범위의 수의 -ORa, =O, =NRa, =N-ORa, -NRaRb, -SRa, 할로겐, -SiRaRbRc, -OC(O)Ra, -C(O)Ra, -CO2Ra, -CONRaRb, -OC(O)NRaRb, -NRbC(O)Ra, -NRa-C(O)NRbRc, -NRa-SO2NRbRc, -NRbCO2Ra, -NH-C(NH2)=NH, -NRaC(NH2)=NH, -NH-C(NH2)=NRa, -S(O)Ra, -SO2Ra, -SO2NRaRb, -NRbSO2R, -CN 및 -NO2로부터 선택된 다양한 기일 수 있으며, 0, 1 또는 2개의 치환기를 갖는 이들 기가 특히 바람직하다.
일부 실시양태에서, 알킬 및 헤테로알킬 라디칼에 대한 "치환기"는 -ORa, =O, -NRaRb, -SRa, 할로겐, -SiRaRbRc, -OC(O)Ra, -C(O)Ra, -CO2Ra, -CONRaRb, -OC(O)NRaRb, -NRbC(O)Ra, -NRbCO2Ra, -NRa-SO2NRbRc, -S(O)Ra, -SO2Ra, -SO2NRaRb, -NRcSO2R, -CN 및 -NO2 (Ra 및 Rb는 상기 정의된 바와 같음)로부터 선택된다. 일부 실시양태에서, 치환기는 -ORa, =O, -NRaRb, 할로겐, -OC(O)Ra, -CO2Ra, -CONRaRb, -OC(O)NRaRb, -NRbC(O)Ra, -NRbCO2Ra, -NRa-SO2NRbRc, -SO2Ra, -SO2NRaRb, -NR"SO2R, -CN 및 -NO2로부터 선택된다.
치환된 알킬의 예에는 -(CH2)3NH2, -(CH2)3NH(CH3), -(CH2)3NH(CH3)2, -CH2C(=CH2)CH2NH2, -CH2C(=O)CH2NH2, -CH2S(=O)2CH3, -CH2OCH2NH2, -CO2H가 있다. 치환된 알킬의 치환기의 예에는 -CH2OH, -OH, -OCH3, -OC2H5, -OCF3, -OC(=O)CH3, -OC(=O)NH2, -OC(=O)N(CH3)2, -CN, -NO2, -C(=O)CH3, -CO2H, -CO2CH3, -CONH2, -NH2, -N(CH3)2, -NHSO2CH3, -NHCOCH3, -NHC(=O)OCH3, -NHSO2CH3, -SO2CH3, -SO2NH2 및 할로가 있다.
유사하게, 아릴 및 헤테로아릴기에 대한 "치환기"는 다양하며, -할로겐, -ORa, -OC(O)Ra, -NRaRb, -SRa, -Ra, -CN, -NO2, -CO2Ra, -CONRaRb, -C(O)Ra, -OC(O)NRaRb, -NRbC(O)Ra, -NRbC(O)2Ra, -NRa-C(O)NRbRc, -NH-C(NH2)=NH, -NRaC(NH2)=NH, -NH-C(NH2)=NRa, -S(O)Ra, -S(O)2Ra, -S(O)2NRaRb, -N3, -CH(Ph)2, 퍼플루오로C1- 8알콕시 및 퍼플루오로C1 - 8알킬로부터 0 내지 방향족 고리계 상의 개방 원자가 (open valence)의 총 수 범위의 수로 선택되고; 여기서 Ra, Rb 및 Rc는 수소, C1 - 6알킬 및 헤테로알킬, 비치환된 아릴 및 헤테로아릴, (비치환된 아릴)-C1 - 8알킬 및 (비치환된 아릴)옥시-C1 - 8알킬로부터 독립적으로 선택된다.
아릴 또는 헤테로아릴 고리의 인접한 원자 상의 2개의 "치환기"는 화학식 -T-C(O)-(CH2)q-U- (여기서, T 및 U는 독립적으로 -NH-, -O-, -CH2 - 또는 단일 결합이고, q는 0, 1 또는 2임)의 치환기로 임의로 대체될 수 있다. 별법으로, 아릴 또는 헤테로아릴 고리의 인접한 원자 상의 2개의 치환기는 화학식 -A-(CH2)r-B- (여기서, A 및 B는 독립적으로 -CH2 -, -O-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NRa- 또는 단일 결합이고, r은 1, 2 또는 3임)의 치환기로 임의로 대체될 수 있다. 그와 같이 형성된 신규 고리의 단일 결합 중 하나는 임의로 이중 결합으로 대체될 수 있다. 별법으로, 아릴 또는 헤테로아릴 고리의 인접한 원자 상의 2개의 치환기는 화학식 -(CH2)s-X-(CH2)t- - (여기서, s 및 t는 독립적으로 0 내지 3의 정수이고, X는 -O-, -NRa-, -S-, -S(O)-, -S(O)2- 또는 -S(O)2NRa-임)의 치환기로 임의로 대체될 수 있다. -NRa- 및 -S(O)2NRa- 내의 치환기 Ra는 수소 또는 비치환된 C1 - 6알킬로부터 선택된다. 다르게는, R'은 상기 정의한 바와 같다.
달리 나타내지 않는 한, 본원에서 명시적으로 정의되지 않은 치환기의 명명법은 관능기의 말단부, 이어서 인접 관능기를 거쳐 부착 지점을 향하여 명명함으로써 완성된다. 예를 들어, 치환기 "아릴알킬옥시카르보닐"은 (아릴)-(알킬)-O-C(O)-를 지칭한다.
용어 "아실"은 기 -C(=O)Rc (여기서, Rc는 알킬, 알케닐, 알키닐, 시클로알킬, 시클로알케닐, 아릴, 헤테로아릴 또는 헤테로시클릴임)를 지칭한다. 아실에는 "아세틸" 기 (-C(=O)CH3)가 포함된다.
"아실아미노-"는 기 -NRaC(=O)Rc (여기서, Rc는 알킬, 알케닐, 알키닐, 시클로알킬, 시클로알케닐, 아릴, 헤테로아릴 또는 헤테로시클릴임) 를 지칭한다.
"아실옥시"는 -OC(=O)-Rc (여기서, Rc는 알킬, 알케닐, 알키닐, 시클로알킬, 시클로알케닐, 아릴, 헤테로아릴 또는 헤테로시클릴임)를 지칭한다.
"알콕시"는 -ORd (여기서, Rd는 본원에 정의된 바와 같은 알킬임)를 지칭한다. 알콕시기의 대표적인 예에는 메톡시, 에톡시, t-부톡시, 트리플루오로메톡시 등이 포함된다.
"알콕시아미노"는 -NHORd (여기서, Rd는 알킬임)를 지칭한다.
"알콕시카르보닐"은 -C(=O)ORd (여기서, Rd는 알킬임)를 지칭한다. 대표적인 알콕시카르보닐기에는, 예를 들어 하기 나타낸 것들이 포함된다.
이들 알콕시카르보닐기는 본원의 개시내용과 관련된 유기 및 의약 화학 분야의 숙련자들에게 명확한 바와 같이 추가로 치환될 수 있다.
"알콕시카르보닐아미노"는 -NRaC(=O)ORd (여기서, Rd는 알킬임)를 지칭한다.
"알콕시술포닐아미노"는 기 -NRaS(=O)2-ORd (여기서, Rd는 알킬임)를 지칭한다.
"알킬카르보닐"은 기 -C(=O)Rc (여기서, Rc는 알킬임)를 지칭한다.
"알킬카르보닐옥시"는 -OC(=O)-Rc (여기서, Rc는 알킬임)를 지칭한다.
"알킬카르보닐아미노"는 -NRaC(=O)Rc (여기서, Rc는 알킬임)를 지칭한다. 대표적인 알킬카르보닐아미노기에는, 예를 들어 -NHC(=O)CH3, -NHC(=O)CH2CH3, -NHC(=O)CH2NH(CH3), -NHC(=O)CH2N(CH3)2 또는 -NHC(=O)(CH2)3OH가 포함된다.
"알킬술파닐", "알킬티오" 또는 "티오알콕시"는 기 S-Rd (여기서, Rd는 알킬임)를 지칭한다.
"알킬술포닐"은 -S(=O)2Re (여기서, Re는 알킬임)를 지칭한다. 본 발명의 화합물에 사용된 알킬술포닐기는 전형적으로 C1 - 6알킬술포닐기이다.
"알킬술포닐아미노"는 -NRaS(=O)2-Re (여기서, Re는 알킬임)를 지칭한다.
"알키닐옥시"는 기 -O-알키닐 (여기서, 알키닐은 본원에 정의된 바와 같음)을 지칭한다. 예로서, 알키닐옥시에는, 에티닐옥시, 프로피닐옥시 등이 포함된다.
"아미디노"는 기 -C(=NRa)NRbRc를 지칭하고, 여기서 Rb 및 Rc는 수소, 알킬, 치환된 알킬, 알케닐, 알키닐, 아릴, 시클로알킬, 시클로알케닐, 헤테로아릴, 헤테로시클릭으로 이루어진 군으로부터 독립적으로 선택되고, Rb 및 Rc는 이들에게 결합된 질소와 함께 임의로 결합하여, 헤테로시클릭 또는 치환된 헤테로시클릭기를 형성한다. Ra는 수소, 알킬, 알케닐, 알키닐, 시클로알키닐, 아릴, 시클로알킬, 시클로알케닐, 헤테로아릴, 헤테로시클릭, 치환된 헤테로시클릭, 니트로, 니트로소, 히드록시, 알콕시, 시아노, -N=N-N-알킬, -N(알킬)SO2-알킬, -N=N=N-알킬, 아실 및 -SO2-알킬로 이루어진 군으로부터 선택된다.
"아미노"는 1가 라디칼 -NRaRb 또는 2가 라디칼 -NRa-를 지칭한다. 용어 "알킬아미노"는 기 -NRaRb (여기서, Ra는 알킬이고, Rb는 H 또는 알킬임)를 지칭한다. 용어 "아릴아미노"는 기 -NRaRb (여기서, Ra 또는 Rb 중 적어도 하나는 아릴임)를 지칭한다. 용어 "(알킬)(아릴)아미노"는 기 -NRaRb (여기서, Ra는 알킬이고, Rb는 아릴임)를 지칭한다. 부가적으로, 디알킬아미노기의 경우, 알킬 부분은 동일하거나 상이할 수 있고, 또한 각각이 부착된 질소 원자와 함께 조합되어 3 내지 7-원 고리를 형성할 수 있다. 따라서, -NRaRb로 나타낸 기는 피페리디닐, 피롤리디닐, 모르폴리닐, 아제티디닐 등을 포함하는 의미이다.
"아미노카르보닐" 또는 "아미노아실"은 아미드 -C(=O)-NRaRb를 지칭한다. 용어 "알킬아미노카르보닐"은 본원에서 기 -C(=O)-NRaRb (여기서, Ra는 알킬이고, Rb는 H 또는 알킬임)를 지칭한다. 용어 "아릴아미노카르보닐"은 본원에서 기 -C(=O)-NRaRb (여기서, Ra 또는 Rb는 아릴임)를 지칭한다. 대표적인 아미노카르보닐기에는, 예를 들어 하기 나타낸 것들이 포함된다. 이들 아미노카르보닐기는 본원의 개시내용과 관련된 유기 및 의약 화학 분야의 숙련자들에게 명확한 바와 같이 추가로 치환될 수 있다.
"아미노카르보닐아미노"는 기 -NRaC(O)NRaRb (여기서, Ra는 수소 또는 알킬이고, Ra 및 Rb는 수소, 알킬, 알케닐, 알키닐, 아릴, 시클로알킬, 시클로알케닐, 헤테로아릴, 헤테로시클릭으로 이루어진 군으로부터 독립적으로 선택되고, Ra 및 Rb는 이들에게 결합된 질소와 함께 임의로 결합하여 헤테로시클릭 또는 치환된 헤테로시클릭기를 형성함)를 지칭한다.
"아미노술포닐"은 -S(O)2NRaRb (여기서, R은 수소, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 아릴, 치환된 아릴, 시클로알킬, 치환된 시클로알킬, 시클로알케닐, 치환된 시클로알케닐, 헤테로아릴, 치환된 헤테로아릴, 헤테로시클릭, 치환된 헤테로시클릭으로 이루어진 군으로부터 독립적으로 선택되고, Ra 및 Rb는 이들에게 결합된 질소와 함께 임의로 결합하여 헤테로시클릭 또는 치환된 헤테로시클릭기를 형성하고, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 시클로알킬, 치환된 시클로알킬, 시클로알케닐, 치환된 시클로알케닐, 아릴, 치환된 아릴, 헤테로아릴, 치환된 헤테로아릴, 헤테로시클릭 및 치환된 헤테로시클릭은 본원에 정의된 바와 같음)를 지칭한다.
"아미노술포닐옥시"는 기 -O-SO2NRaRb (여기서, Ra 및 Rb는 수소, 알킬, 알케닐, 알키닐, 아릴, 시클로알킬, 시클로알케닐, 헤테로아릴 및 헤테로시클릭으로 이루어진 군으로부터 독립적으로 선택되고; Ra 및 Rb는 이들에게 결합된 질소와 함께 임의로 결합하여 헤테로시클릭 또는 치환된 헤테로시클릭기를 형성함)를 지칭한다.
"아미노술포닐아미노"는 -NRa-SO2NRbRc (여기서, Ra는 수소 또는 알킬이고, Rb 및 Rc는 수소, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 아릴, 치환된 아릴, 시클로알킬, 치환된 시클로알킬, 시클로알케닐, 치환된 시클로알케닐, 헤테로아릴, 치환된 헤테로아릴, 헤테로시클릭 및 치환된 헤테로시클릭으로 이루어진 군으로부터 독립적으로 선택되고, Rb 및 Rc는 이들에게 결합된 질소와 함께 임의로 결합하여 헤테로시클릭 또는 치환된 헤테로시클릭기를 형성하고, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 시클로알킬, 치환된 시클로알킬, 시클로알케닐, 치환된 시클로알케닐, 아릴, 치환된 아릴, 헤테로아릴, 치환된 헤테로아릴, 헤테로시클릭 및 치환된 헤테로시클릭은 본원에 정의된 바와 같음)를 지칭한다.
"아미노티오카르보닐"은 기 -C(S)NRaRb (여기서, Ra 및 Rb는 수소, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 아릴, 치환된 아릴, 시클로알킬, 치환된 시클로알킬, 시클로알케닐, 치환된 시클로알케닐, 헤테로아릴, 치환된 헤테로아릴, 헤테로시클릭 및 치환된 헤테로시클릭으로 이루어진 군으로부터 독립적으로 선택되고, Ra 및 Rb는 이들에게 결합된 질소와 함께 임의로 결합하여 헤테로시클릭 또는 치환된 헤테로시클릭기를 형성하고, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 시클로알킬, 치환된 시클로알킬, 시클로알케닐, 치환된 시클로알케닐, 아릴, 치환된 아릴, 헤테로아릴, 치환된 헤테로아릴, 헤테로시클릭 및 치환된 헤테로시클릭은 본원에 정의된 바와 같음)를 지칭한다.
"아미노티오카르보닐아미노"는 기 -NRaC(S)NRaRb (여기서, Ra는 수소 또는 알킬이고, Rb 및 Rc는 이들에게 결합된 질소와 함께 임의로 결합하여 헤테로시클릭 또는 치환된 헤테로시클릭기를 형성함)를 지칭한다.
"아릴카르보닐"는 기 -C(=O)Rc (여기서, Rc는 아릴임)를 지칭한다.
"아릴카르보닐아미노"는 -NRaC(=O)Rc (여기서, Rc는 아릴임)를 지칭한다.
"아릴카르보닐옥시"는 -OC(=O)-Rc (여기서, Rc는 아릴임)를 지칭한다.
"아릴옥시"는 -ORd (여기서, Rd는 아릴임)를 지칭한다. 아릴옥시기의 대표적인 예에는 페녹시, 나프톡시 등이 포함된다.
"아릴옥시카르보닐"은 -C(=O)ORd (여기서, Rd는 아릴임)를 지칭한다.
"아릴옥시카르보닐아미노"는 -NRaC(=O)ORd (여기서, Rd는 아릴임)를 지칭한다.
"아릴술파닐", "아릴티오" 또는 "티오아릴옥시"는 기 S-Rd (여기서, Rd는 아릴임)를 지칭한다.
"아릴술포닐"은 -S(=O)2Re (여기서, Re는 아릴임)를 지칭한다.
"아릴술포닐아미노"는 -NRaS(=O)2-Re (여기서, Re는 아릴임)를 지칭한다.
"아릴티오"는 기 -S-아릴 (여기서, 아릴은 본원에 정의된 바와 같음)을 지칭한다. 다른 실시양태에서, 황은 -S(O)- 또는 -SO2- 잔기로 산화될 수 있다. 술폭시드는 하나 이상의 입체이성질체로 존재할 수 있다.
"아지도"는 -N3을 지칭한다.
"결합"이 마커시 (Markush) 기 중의 요소로 사용되는 경우, 이는 상응하는 기가 존재하지 않으며 양 측의 기가 직접 연결되는 것을 의미한다.
"카르보닐"은 2가 기 -C(=O)-를 지칭한다.
"카르복시" 또는 "카르복실"은 기 -CO2H를 지칭한다.
"카르복실 에스테르" 또는 "카르복시 에스테르"는 기 -C(=O)ORc를 지칭한다.
"(카르복실 에스테르)아미노"는 기 -NRa-C(O)ORc (여기서, Ra는 알킬 또는 수소임)를 지칭한다.
"(카르복실 에스테르)옥시" 또는 "카르보네이트 에스테르"는 기 -O-C(=O)ORc를 지칭한다.
"시아노"는 -CN을 지칭한다.
"시클로알콕시"는 -ORd (여기서, Rd는 시클로알킬임)를 지칭한다.
"시클로알콕시카르보닐"은 -C(=O)ORd (여기서, Rd는 시클로알킬임)을 지칭한다.
"시클로알콕시카르보닐아미노"는 -NRaC(=O)ORd (여기서, Rd는 시클로알킬임)을 지칭한다.
"시클로알킬알킬렌"은 라디칼 -RxRy (여기서, Rx는 알킬렌기이고, Ry는 본원에 정의된 바와 같은 시클로알킬기임), 예컨대 시클로프로필메틸, 시클로헥세닐프로필, 3-시클로헥실-2-메틸프로필 등을 지칭한다.
"시클로알킬카르보닐"은 기 -C(=O)Rc (여기서, Rc는 시클로알킬임)를 지칭한다.
"시클로알킬카르보닐아미노"는 -NRaC(=O)Rc (여기서, Rc는 시클로알킬임)를 지칭한다.
"시클로알킬카르보닐옥시"는 -OC(=O)-Rc (여기서, Rc는 시클로알킬임)를 지칭한다.
"시클로알킬술포닐아미노"는 -NRaS(=O)2-Re (여기서, Re는 시클로알킬임)를 지칭한다.
"시클로알킬티오"는 -S-시클로알킬을 지칭한다. 다른 실시양태에서, 황은 -S(O)- 또는 -SO2- 잔기로 산화될 수 있다. 술폭시드는 하나 이상의 입체이성질체로 존재할 수 있다.
"시클로알케닐옥시"는 -O-시클로알케닐을 지칭한다.
"시클로알케닐티오"는 -S-시클로알케닐을 지칭한다. 다른 실시양태에서, 황은 술피닐 또는 술포닐 잔기로 산화될 수 있다. 술폭시드는 하나 이상의 입체이성질체로 존재할 수 있다.
"에스테르"는 -C(=O)ORd (여기서, Rd는 알킬, 시클로알킬, 아릴, 헤테로아릴 또는 헤테로시클릴임)를 지칭한다.
"구아니디노"는 기 -NHC(=NH)NH2를 지칭한다.
달리 언급하지 않는 한, 그 자체 또는 또다른 치환기의 일부로서의 "할로" 또는 "할로겐"은 불소, 염소, 브롬 또는 요오드 원자를 의미한다. 부가적으로, "할로알킬"과 같은 용어는 하나 이상의 수소가 동일하거나 상이할 수 있는 할로겐 원자를 1 내지 허용되는 할로겐의 최대 수 이하, 예를 들어 알킬에 대해 (2m'+1) (여기서, m'은 알킬기 내 탄소 원자의 총 개수임)개 범위의 수로 치환된 알킬을 포함하는 의미이다. 예를 들어, 용어 "할로C1 - 8알킬"은 트리플루오로메틸, 2,2,2-트리플루오로에틸, 4-클로로부틸, 3-브로모프로필 등을 포함하는 의미이다. 달리 언급하지 않는 한, 용어 "퍼할로알킬"은 (2m'+1) (여기서, m'은 알킬기 내 탄소 원자의 총 개수임)개의 할로겐 원자로 치환된 알킬을 의미한다. 예를 들어, 용어 "퍼할로C1 - 8알킬"은 트리플루오로메틸, 펜타클로로에틸, 1,1,1-트리플루오로-2-브로모-2-클로로에틸 등을 포함하는 의미이다. 부가적으로, 용어 "할로알콕시"는 하나 이상의 할로겐 원자로 치환된 알콕시 라디칼을 지칭한다.
"헤테로알킬"은 시아노, -ORw, -NRxRy 및 -S(O)nRz (여기서, n은 0 내지 2의 정수임)로부터 독립적으로 선택된 1, 2 또는 3개의 치환기를 갖는 본원에 정의된 바와 같은 알킬 라디칼을 의미하며, 헤테로알킬 라디칼의 부착점이 헤테로알킬 라디칼의 탄소 원자를 통한다는 것을 이해해야 한다. Rw는 수소, 알킬, 시클로알킬, 시클로알킬-알킬, 아릴, 아라알킬, 알콕시카르보닐, 아릴옥시카르보닐, 카르복스아미도, 또는 모노- 또는 디-알킬카르바모일이다. Rx는 수소, 알킬, 시클로알킬, 시클로알킬-알킬, 아릴 또는 아라알킬이다. Ry는 수소, 알킬, 시클로알킬, 시클로알킬-알킬, 아릴, 아라알킬, 알콕시카르보닐, 아릴옥시카르보닐, 카르복스아미도, 모노- 또는 디-알킬카르바모일, 또는 알킬술포닐이다. Rz는 수소 (단, n은 0임), 알킬, 시클로알킬, 시클로알킬-알킬, 아릴, 아라알킬, 아미노, 모노-알킬아미노, 디-알킬아미노 또는 히드록시알킬이다. 대표적인 예에는, 예를 들어 2-히드록시에틸, 2,3-디히드록시프로필, 2-메톡시에틸, 벤질옥시메틸, 2-시아노에틸 및 2-메틸술포닐-에틸이 포함된다. 상기 각각의 경우, Rw, Rx, Ry 및 Rz는 아미노, 불소, 알킬아미노, 디-알킬아미노, OH 또는 알콕시로 추가로 치환될 수 있다. 부가적으로, 탄소 원자의 개수를 나타내는 접두사 (예컨대, C1-C10)는 시아노, -ORw, -NRxRy 또는 -S(O)nRz 부분을 제외한 헤테로알킬기 부분의 탄소 원자의 총 개수를 지칭한다.
"헤테로아릴카르보닐"은 기 -C(=O)Rc (여기서, Rc는 헤테로아릴임)를 지칭한다.
"헤테로아릴카르보닐아미노"는 -NRaC(=O)Rc (여기서, Rc는 헤테로아릴임)를 지칭한다.
"헤테로아릴카르보닐옥시"는 -OC(=O)-Rc (여기서, Rc는 헤테로아릴임)를 지칭한다.
"헤테로아릴옥시"는 -ORd (여기서, Rd는 헤테로아릴임)를 지칭한다.
"헤테로아릴옥시카르보닐"은 -C(=O)ORd (여기서, Rd는 헤테로아릴임)를 지칭한다.
"헤테로아릴옥시카르보닐아미노"는 -NRaC(=O)ORd (여기서, Rd는 헤테로아릴임)를 지칭한다.
"헤테로아릴술포닐아미노"는 -NRaS(=O)2-Re (여기서, Re는 헤테로아릴임)를 지칭한다.
"헤테로아릴티오"는 기 -S-헤테로아릴을 지칭한다. 다른 실시양태에서, 황은 -S(O)- 또는 -SO2- 잔기로 산화될 수 있다. 술폭시드는 하나 이상의 입체이성질체로 존재할 수 있다.
"헤테로시클릴알킬" 또는 "시클로헤테로알킬-알킬"은 라디칼 -RxRy (여기서, Rx는 알킬렌기이고, Ry는 본원에 정의된 바와 같은 헤테로시클릴기, 예컨대 테트라히드로피란-2-일메틸, 4-(4-치환된-페닐)피페라진-1-일메틸, 3-피페리디닐에틸 등임)를 의미한다.
"헤테로시클록시카르보닐아미노"는 -NRaC(=O)ORd (여기서, Rd는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴카르보닐"은 -C(=O)Rc (여기서, Rc는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴카르보닐아미노"는 -NRaC(=O)Rc (여기서, Rc는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴카르보닐옥시"는 -OC(=O)-Rc (여기서, Rc는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴옥시"는 -ORd (여기서, Rd는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴옥시카르보닐"은 -C(=O)ORd (여기서, Rd는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴술포닐"은 -S(=O)2Re (여기서, Re는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴술포닐아미노"는 -NRaS(=O)2-Re (여기서, Re는 헤테로시클릴임)를 지칭한다.
"헤테로시클릴티오"는 기 -S-헤테로시클릴을 지칭한다. 다른 실시양태에서, 황은 -S(O)- 또는 -SO2- 잔기로 산화될 수 있다. 술폭시드는 하나 이상의 입체이성질체로 존재할 수 있다.
"히드록시" 또는 "히드록실"은 기 -OH를 지칭한다.
"히드록시아미노"는 기 -NHOH를 지칭한다.
"니트로"는 -NO2를 지칭한다.
"니트로소"는 기 -NO를 지칭한다.
명세서 전반에 걸쳐 사용된 용어 "임의의" 또는 "임의로"는 이어서 기재되는 사건 또는 상황이 발생할 수 있으나 반드시 발생할 필요는 없으며, 기재한 것이 상기 사건 또는 상황이 발생하는 경우와 발생하지 않는 경우를 포함하는 것을 의미한다. 예를 들어, 알킬기로 임의로 일치환 또는 이치환된 헤테로시클로기는 알킬이 존재할 수 있지만 반드시 존재할 필요는 없으며, 기재한 것이 헤테로시클로기가 알킬기로 일치환 또는 이치환된 경우와 헤테로시클로기가 알킬기로 치환되지 않은 경우를 포함하는 것을 의미한다.
"임의로 치환된"은 독립적으로 치환기로 임의로 치환된 고리를 의미한다. 비치환된 기의 부위는 수소로 치환될 수 있다.
"옥소"는 2가 기 =O를 지칭한다.
"술파닐"은 기 -SRf (여기서, Rf는 본원에 정의된 바와 같음)를 지칭한다.
"술피닐"은 기 -S(=O)-Re (여기서, Re는 본원에 정의된 바와 같음)를 지칭한다.
"술폰산"은 기 -S(O)2-OH를 지칭한다.
"술포닐"은 기 -S(O)2-Re (여기서, Re는 본원에 정의된 바와 같음)를 지칭한다.
"술포닐아미노"는 -NRaS(=O)2-Re (여기서, Ra는 수소, 알킬, 알케닐, 알키닐, 아릴, 시클로알킬, 시클로알케닐, 헤테로아릴 및 헤테로시클릴로 이루어진 군으로부터 선택되고, Re는 본원에 정의된 바와 같음)를 지칭한다.
"술포닐옥시"는 기 -OSO2-Rc를 지칭한다.
동일한 분자식을 갖지만, 그의 원자의 결합의 특성 또는 순서, 또는 공간상 그의 원자의 배열이 상이한 화합물은 "이성질체"라고 칭한다. 공간상 그의 원자의 배열이 상이한 이성질체는 "입체이성질체"라고 칭한다. "입체이성질체" 및 "입체이성질체들"이 하나 이상의 비대칭 중심 또는 비대칭 치환이 있는 이중 결합을 갖는 경우, 이는 상이한 입체이성질체 형태로 존재하는 화합물을 지칭하며, 따라서 이는 개별 입체이성질체 또는 혼합물로 제조될 수 있다. 입체이성질체에는 거울상이성질체 및 부분입체이성질체가 포함된다. 서로 거울상 이미지가 아닌 입체이성질체는 "부분입체이성질체"라고 칭하며, 서로 겹쳐질 수 없는 거울상 이미지인 입체이성질체는 "거울상이성질체"라고 칭한다. 예를 들어, 화합물이 비대칭 중심을 갖는 경우, 이는 4개의 상이한 기에 결합되고, 한 쌍의 거울상이성질체가 가능하다. 거울상이성질체는 그의 비대칭 중심의 절대 배위를 특징으로 할 수 있고, 칸 (Cahn) 및 프렐로그 (Prelog)의 R- 및 S-순서 규칙, 또는 분자가 편광면을 회전하는 방식 [우선성 또는 좌선성으로 (즉, 각각 (+) 또는 (-)-이성질체로) 나타냄]으로 기재한다. 키랄 화합물은 개별 거울상이성질체 또는 그의 혼합물로 존재할 수 있다. 동일한 비율의 거울상이성질체를 함유하는 혼합물을 "라세미 혼합물"이라고 부른다. 달리 나타내지 않는 한, 본 기재는 개별 입체이성질체 뿐만 아니라 혼합물을 포함하는 의도이다. 하나 이상의 입체 중심의 키랄성이 다른 입체이성질체의 입체화학의 결정 방법 및 분리 방법은 당업계에 널리 알려져 있다 (문헌 [ADVANCED ORGANIC CHEMISTRY, 4th edition J. March, John Wiley and Sons, New York, 1992]의 챕터 4의 디스커션 참조).
"티오아실"은 기 Ra-C(S)-를 지칭한다.
"티올"은 기 -SH를 지칭한다.
"호변이성질체"는 양성자의 위치가 상이한 분자의 대안적인 형태, 예컨대 엔올-케토 및 이민-엔아민 호변이성질체, 또는 -N=C(H)-NH- 고리 원자 배열을 함유하는 헤테로아릴기의 호변이성질체 형태, 예컨대 피라졸, 이미다졸, 벤즈이미다졸, 트리아졸 및 테트라졸을 지칭한다. 당업자는 다른 호변이성질체 고리 원자 배열이 가능하다는 것을 인지할 것이다.
상기 정의된 모든 치환된 기들에 있어서, 추가의 치환기를 갖는 치환기를 자기 자신으로 정의함으로써 완성되는 중합체 (예를 들어, 치환된 아릴이 치환된 아릴기를 치환기로서 가지며, 그 치환기 자체가 치환된 아릴기로 치환되고, 그것 역시 치환된 아릴기로 치환되는 것 등)는 본원에서 포함할 의도가 아니라는 것을 이해해야 한다. 이러한 경우, 상기 치환의 최대 수는 3이다. 예를 들어, 치환된 아릴기의 연속 치환은 -치환된 아릴-(치환된 아릴)-치환된 아릴로 제한된다.
"보호기"는 분자 내의 반응성 관능기에 부착된 경우에 관능기의 반응성을 차폐, 감소 또는 방지하는 원자단을 지칭한다. 통상적으로, 보호기는 합성 과정 동안에 필요에 따라 선택적으로 제거될 수 있다. 보호기의 예는 문헌 [Greene and Wuts, Protective Groups in Organic Chemistry, 3rd Ed., 1999, John Wiley & Sons, NY] 및 [Harrison et al., Compendium of Synthetic Organic Methods, Vols. 1-8, 1971-1996, John Wiley & Sons, NY]에서 찾아볼 수 있다. 대표적인 아미노 보호기에는 포르밀, 아세틸, 트리플루오로아세틸, 벤질, 벤질옥시카르보닐 ("CBZ"), tert-부톡시카르보닐 ("Boc"), 트리메틸실릴 ("TMS"), 2-트리메틸실릴-에탄술포닐 ("TES"), 트리틸 및 치환 트리틸 기, 알릴옥시카르보닐, 9-플루오레닐메틸옥시카르보닐 ("FMOC"), 니트로-베라트릴옥시카르보닐 ("NVOC") 등이 포함되나, 이에 제한되지는 않는다. 대표적인 히드록시 보호기에는 히드록시기가 아실화 또는 알킬화되어 있는 것들, 예컨대 벤질 및 트리틸 에테르, 뿐만 아니라 알킬 에테르, 테트라히드로피라닐 에테르, 트리알킬실릴 에테르 (예컨대, TMS 또는 TIPPS 기) 및 알릴 에테르가 포함되나, 이에 제한되지는 않는다.
용어 "제약상 허용되는 염"은 본원에 기재된 화합물 상에서 발견되는 특정 치환기에 따라, 비교적 비독성의 산 또는 염기로 제조되는 활성인 화합물의 염을 포함한다. 본 발명의 화합물이 상대적으로 산성인 관능기를 함유하는 경우, 염기 부가 염은 그 화합물의 중성 형태를 충분량의 원하는 염기와 단독으로 또는 적합한 불활성 용매 중에서 접촉시켜 수득할 수 있다. 제약상 허용되는 무기 염기에서 유도된 염의 예에는 알루미늄, 암모늄, 칼슘, 구리, 제2철, 제1철, 리튬, 마그네슘, 망간, 아망간, 칼륨, 나트륨, 아연 등이 포함된다. 제약학상 허용되는 유기 염기에서 유도된 염에는 치환된 아민, 시클릭 아민, 자연 발생적 아민 등을 비롯한 1급, 2급, 및 3급 아민, 예를 들면 아르기닌, 베타인, 카페인, 콜린, N,N'-디벤질에틸렌디아민, 디에틸아민, 2-디에틸아미노에탄올, 2-디메틸아미노에탄올, 에탄올아민, 에틸렌디아민, N-에틸모르폴린, N-에틸피페리딘, 글루카민, 글루코사민, 히스티딘, 히드라바민, 이소프로필아민, 리신, 메틸글루카민, 모르폴린, 피페라진, 피페리딘, 폴리아민 수지, 프로카인, 퓨린, 테오브로민, 트리에틸아민, 트리메틸아민, 트리프로필아민, 트로메타민 등이 포함된다. 본 발명의 화합물이 상대적으로 염기성인 관능기를 함유하는 경우, 산 부가 염은 그 화합물의 중성 형태를 충분량의 원하는 산과 단독으로 또는 적합한 불활성 용매 중에서 접촉시켜 수득할 수 있다. 제약학상 허용되는 산 부가염의 예에는 무기 산, 예를 들면 염산, 브롬화수소산, 질산, 탄산, 일수소탄산, 인산, 일수소인산, 이수소인산, 황산, 일수소황산, 요오드화수소산, 아인산 등으로부터 유도된 것, 뿐만 아니라 비교적 비독성의 유기산, 예를 들면 아세트산, 프로피온산, 이소부티르산, 말론산, 벤조산, 숙신산, 수베르산, 푸마르산, 만델산, 프탈산, 벤젠술폰산, p-톨릴술폰산, 시트르산, 타르타르산, 메탄술폰산 등으로부터 유도된 염이 포함된다. 또한 아르기네이트 등과 같은 아미노산의 염, 및 글루쿠론산 또는 갈락투노르산 등의 유기산의 염, 및 글루쿠론산 또는 갈락투론산 등과 같은 유기산의 염이 포함된다 (예를 들어, 문헌 [Berge, S.M. et al., "Pharmaceutical Salts," Journal of Pharmaceutical Science, 66:1-19, 1977] 참조). 본 발명의 일부 특정 화합물은 화합물이 염기 또는 산 부가염으로 전환될 수 있도록 하는 염기성 및 산성 관능기를 모두 함유한다.
염을 염기 또는 산과 접촉시키고, 모 화합물을 통상적인 방식으로 단리함으로써 화합물의 중성 형태를 재생성시킬 수 있다. 화합물의 모 형태는 특정 물성, 예를 들어 극성 용매 중의 용해도에 있어서 다양한 염 형태마다 차이가 있지만, 그 외에는 염은 본 발명의 목적을 위한 화합물의 모 형태와 동등하다.
염 형태에 추가하여, 본 발명은 전구약물 형태의 화합물을 제공한다. 본원에 기재된 화합물의 "전구약물"은 생리적 조건하에서 쉽게 화학적 변화를가 일으켜 본 발명의 화합물을 제공하는 이들 화합물이다. 추가로, 전구약물은 생체외 환경에서 화학적 또는 생화학적 방법을 통해 본 발명의 화합물로 전환될 수 있다. 예를 들어, 전구약물은 경피 패치 저장소 내에 적합한 효소 또는 화학 시약과 함께 배치된 경우, 본 발명의 화합물로 천천히 변환될 수 있다. 반드시 그런 것은 아니나, 전구약물은 종종 활성 약물로 전환될 때까지 약학적으로 불활성이다. 전구약물은 전형적으로, 활성을 위해 일부 필요한 것으로 믿어지는 약물 중의 관능기를 전구기 (하기 정의됨)로 차폐시켜 전구잔기를 형성함으로써 수득되며, 상기 전구잔기는 명시된 사용 조건하에 변형, 예컨대 절단되어, 상기 관능기를 방출시키고, 그에 따라 활성 약물을 방출시킨다. 전구잔기의 절단은, 예컨대 가수분해 반응에 의해 자발적으로 진행될 수 있거나, 또는 또다른 작용제, 예컨대 효소, 빛, 산, 또는 물리적 또는 환경적 변수의 변화 또는 그에 노출, 예컨대 온도 변화에 의해 촉매되거나 유도될 수 있다. 상기 제제는 전구약물이 투여되는 세포에 존재하는 효소, 또는 위장의 산성 조건과 같은 사용 조건에 내인성일 수 있거나, 또는 외인성으로 공급될 수 있다.
"전구기"는 전구잔기를 형성하기 위하여 활성 약물 내의 관능기를 차폐하는 데에 사용되는 경우에 약물을 전구약물로 전환시키는 유형의 보호기를 지칭한다. 전구기는 통상적으로 특정 사용 조건하에서 절단가능한 결합을 통하여 약물의 관능기에 부착된다. 따라서, 전구기는 특정 사용 조건하에서 절단되어 관능기를 해제하는 전구잔기의 부분이다. 구체적인 예로서, 화학식 -NH-C(O)CH3의 아미드 전구잔기는 전구기 -C(O)CH3을 포함한다.
활성 syk 및/또는 JAK 선택적 억제 화합물 내의 관능기를 차폐하여 전구약물을 수득하는데 적합한 다양한 전구기 뿐만 아니라, 생성된 전구잔기가 당업계에 널리 공지되어 있다. 예를 들어, 히드록실 관능기는 술포네이트, 에스테르 (예컨대, 아세테이트 또는 말레에이트) 또는 카르보네이트 전구잔기로 차폐될 수 있으며, 이는 생체내에서 가수분해되어 히드록실기를 제공할 수 있다. 아미노 관능기는 아미드, 카르바메이트, 이민, 우레아, 포스페닐, 포스포릴 또는 술페닐 전구잔기로 차폐될 수 있으며, 이는 생체내에서 가수분해되어 아미노기를 생성할 수 있다. 카르복실기는 에스테르 (메틸, 에틸, 피발로일옥시메틸, 실릴 에스테르 및 티오에스테르), 아미드 또는 히드라지드 전구잔기로 차폐될 수 있으며, 이는 생체내에서 가수분해되어 카르복실기를 제공할 수 있다. 본 발명은 또한 지속-방출 또는 전구약물 제제로 사용하기 위해 용해도 또는 가수분해 특성을 변경하기 위한, 당업계에 공지되어 있는 이들 에스테르와 아실기를 포함한다. 적합한 전구기 및 그들 각각의 전구잔기의 다른 구체적인 예는 당업자에게 명백할 것이다.
본 발명의 특정 화합물을 비용매화된 형태뿐만 아니라 수화된 형태를 비롯한 용매화된 형태로도 존재할 수 있다. "용매화물"은 용매 분자 및 용질의 이온 또는 분자의 조합에 의해 형성되는 복합체를 지칭한다. 상기 용매는 유기 화합물, 무기 화합물 또는 이 둘의 혼합물일 수 있다. 용매의 몇몇 예에는 메탄올, N,N-디메틸포름아미드, 테트라히드로푸란, 디메틸술폭시드 및 물이 포함되나, 이에 제한되는 것은 아니다. 일반적으로, 용매화된 형태는 용매화되지 않은 형태와 동등하며, 본 발명의 범위 내에 포함되는 의도이다. 본 발명의 특정 화합물은 다양한 결정질 또는 무정형 형태로 존재할 수 있다. 일반적으로, 모든 물리적 형태는 본 발명에서 고려되는 용도에서 동등하며, 본 발명의 범위 내에 포함되는 의도이다.
본 발명의 특정 화합물은 비대칭 탄소 원자 (광학 중심) 또는 이중 결합을 가지며, 라세미체, 부분입체이성질체, 기하 이성질체, 위치이성질체 및 개별 이성질체 (예를 들어, 별개의 거울상이성질체)는 모두 본 발명의 범위 내에 포함되는 의도이다. 이러한 이성질체는 통상적인 방법을 이용하여 분해되거나 비대칭적으로 합성되어, "광학적으로 순수한" 이성질체, 즉 그의 다른 이성질체가 실질적으로 없는 이성질체를 수득할 수 있다. 예를 들어, 본 발명의 화합물의 특정 거울상이성질체가 바람직한 경우에 이는, 비대칭 합성 또는 키랄 보조물을 사용한 유도에 의해 제조할 수 있다 (여기서, 생성된 부분입체이성질체 혼합물을 분리하고, 보조물을 절단하여 바람직한 순수 거울상이성질체를 수득함). 별법으로, 분자가 염기성 관능기, 예컨대 아미노, 또는 산성 관능기, 예컨대 카르복실, 부분입체이성질체 염을 함유하는 경우에는, 적절한 광학 확성 산 또는 염기를 사용하여 부분입체이성질체를 형성한 후, 이를 당업계에 널리 공지되어 있는 분별 결정화 또는 크로마토그래피 방법에 의해 분리하고, 이어서 순수 거울상이성질체를 회수한다.
본 발명의 화합물은 또한 이러한 화합물을 구성하는 1개 이상의 원자에서 비천연 비율의 원자 동위원소를 함유할 수도 있다. 예를 들어, 화합물에 방사성 동위원소, 예컨대 트리튬 (3H), 요오드-125 (125I) 또는 탄소-14 (14C)로 방사표지할 수 있다. 본 발명의 화합물의 모든 동위원소 변형물은 그것이 방사성이든지 아니든지 간에 발명의 범위 내에 포함되는 의도이다.
용어 "투여하는"은 대상체에 대한 경구 투여, 좌제로서의 투여, 국소 접촉, 정맥내, 복강내, 근육내, 병변내, 비내 또는 피하 투여, 또는 서방 장치, 예컨대 미니-삼투 펌프의 이식을 지칭한다. 투여는 비경구 및 경점막을 비롯한, 임의의 경로 (예를 들면, 협측, 설하, 구개, 치은, 비강, 질, 직장 또는 경피)에 의한다. 비경구 투여는, 예를 들어 정맥내, 근육내, 동맥내, 피내, 피하, 복강내, 뇌실내 및 두개내 투여를 포함한다. 전달의 다른 모드에는 리포좀 제제, 정맥내 주입, 경피 패치 등의 사용이 포함되나, 여기에 한정되지는 않는다.
"효능제" 또는 "활성화제"는 본 발명의 수용체에 결합하여 본 발명의 수용체의 활성화 또는 효소적 활성을 자극, 증가, 개시, 활성화, 촉진, 강화시키거나, 또는 본 발명의 수용체의 활성을 감작화 또는 상승조절하는 작용제 또는 분자를 지칭한다.
"길항제" 또는 "억제제"는 본 발명의 수용체를 억제하거나, 그에 결합하여 본 발명의 수용체의 자극 또는 활성을 부분적으로 또는 완전히 차단하거나, 본 발명의 수용체의 활성화 또는 효소적 활성을 감소, 종료, 방지, 지연시키거나, 본 발명의 수용체의 활성을 불활성화, 탈감작화 또는 하향조절하는 작용제 또는 분자를 지칭한다. 본원에 사용된 "길항제"는 또한 역 효능제 또는 반대 효능제를 포함한다.
본원에 사용된 용어 "syk 및/또는 JAK의 조절에 반응성인 질병 또는 장애", 및 관련 용어 및 어구는 부적절한, 예를 들어 정상보다 작거나 큰 syk 및/또는 JAK 활성과 관련된, 그리고 syk 및/또는 JAK의 조절에 적어도 부분적으로 반응성이거나 그에 의해 영향을 받는 (예를 들어, syk 및/또는 JAK 길항제 또는 효능제가 적어도 일부의 환자에서 환자의 안녕의 일부 개선을 야기하는) 질병 또는 장애를 지칭한다. syk 및/또는 JAK의 부적절한 기능적 활성은 수용체를 정상적으로 발현하지 않는 세포에서의 syk 및/또는 JAK 발현 (syk 및/또는 JAK의 정상적 생성보다 많이, 또는 syk 및/또는 JAK, 또는 그의 활성 대사물질의 정상적 대사 불활성화 또는 제거보다 천천히), 또는 syk 및/또는 JAK의 발현 또는 세포내 활성화 정도의 증가 (예컨대, 염증 및 면역 관련 장애 및 질병 유발), 또는 syk 및/또는 JAK의 발현의 감소의 결과로서 일어날 수 있다. syk 및/또는 JAK와 관련된 질병 또는 장애는 "syk 및/또는 JAK 매개 질병 또는 장애"를 포함할 수 있다.
본원에 사용된 어구 "syk 또는 JAK 키나제 활성에 의해 적어도 부분적으로 매개되는 질병 또는 장애", 및 관련 어구 및 용어는 부적절한 (예컨대, 정상보다 큰) syk 및/또는 JAK 활성을 특징으로 하는 질병 또는 장애를 지칭한다. 부적절한 syk 및/또는 JAK 기능적 활성은 syk 및/또는 JAK를 정상적으로 발현하지 않는 세포에서의 syk 및/또는 JAK 발현, 또는 syk 및/또는 JAK 발현 또는 세포내 활성화 정도의 증가 (예컨대, 염증 및 면역 관련 장애 및 질병 유발)의 결과로서 일어날 수 있다. syk 또는 JAK 키나제 활성에 의해 적어도 부분적으로 매개되는 질병 또는 장애는 부적절한 syk 및/또는 JAK 기능적 활성에 의해 완전히 또는 부분적으로 매개될 수 있다. 그러나, syk 또는 JAK 키나제 활성에 의해 적어도 부분적으로 매개되는 질병 또는 장애는 syk 및/또는 JAK의 조절이 기저가 되는 질병 또는 장애에 일부 효과를 야기하는 것이다 (예를 들어, syk 및/또는 JAK 길항제가 적어도 일부의 환자에서 환자의 안녕의 일부 개선을 야기함).
본원에 사용된 용어 "염증"은 재협착에 대해 치료되고 있는 영역에 백혈구 (예컨대, 백혈구, 단핵구 등)가 침투하는 것을 지칭한다.
용어 "개입"은 효과를 생산하거나, 질환 진행의 추이를 변경하도록 의도되는 작용을 지칭한다. 예를 들어, "혈관 개입"은 막힌 혈관을 열기 위해 혈관내 절차 (예컨대, 혈관성형술 또는 스텐트)를 이용하는 것을 지칭한다.
용어 "혈관내 장치"는 막힌 혈관을 통해 혈류를 복원시키는 혈관 재소통 절차에 유용한 장치를 지칭한다. 혈관내 장치의 예에는 스텐트, 풍선 카테터, 자가조직 정맥/동맥 이식물, 보철 정맥/동맥 이식물, 혈관 카테터 및 혈관 션트가 포함되나, 이에 제한되지는 않는다.
본원에 사용된 용어 "JAK"는 시험관내 또는 생체내에서 유전자 발현을 매개할 수 있는 야누스 키나제 (RefSeq 기탁 번호 P-43408) 또는 그의 변형체를 지칭한다. JAK 변형체에는 미감작 JAK와 실질적으로 상동성인 단백질, 즉 하나 이상의 자연적으로 또는 비-자연적으로 발생하는 아미노산 결손, 삽입 또는 치환을 갖는 단백질 (예컨대, JAK 유도체, 동족체 및 단편)이 포함된다. JAK 변형체의 아미노산 서열은 바람직하게는 미감작 JAK와 약 80% 이상 동일하고, 보다 바람직하게는 약 90% 이상 동일하고, 가장 바람직하게는 약 95% 이상 동일하다.
용어 "백혈구"는 핵 및 세포질을 가지며, 전혈의 원심분리시 얇은 백색 층으로 분리되고, 감염 및 질환으로부터의 신체 보호를 돕는 임의의 다양한 혈액 세포를 지칭한다. 백혈구의 예에는 호중구, 호산구, 호염기구, 림프구 및 단핵구가 포함되나, 이에 제한되지는 않는다.
용어 "포유동물"에는 인간, 가축 (예를 들어, 개 또는 고양이), 축산 동물 (소, 말 또는 돼지), 원숭이, 토끼, 마우스 및 실험용 동물이 포함되나, 이에 제한되지 않는다.
용어 "조절하다", "조절" 등은 syk 및/또는 JAK의 기능 및/또는 발현을 증가 또는 감소시키는 화합물의 능력을 지칭하고, 여기서 이러한 기능은 전사 조절 활성 및/또는 단백질-결합을 포함할 수 있다. 조절은 시험관내 또는 생체내에서 일어날 수 있다. 본원에 기재된 "조절"은 syk 및/또는 JAK와 관련된 기능 또는 특성의 직접적이거나 간접적인 억제, 길항작용, 부분적 길항작용, 활성화, 효능작용 또는 부분적 효능작용 및/또는 syk 및/또는 JAK의 발현의 직접적이거나 간접적인 상향조절 또는 하향조절을 포함한다. 바람직한 실시양태에서, 조절은 직접적이다. 억제제 또는 길항제는, 예를 들어 결합되어 부분적 또는 전적으로 자극을 차단하거나, 활성화를 감소, 방지, 억제, 지연시키거나, 신호 전달을 불활성화, 탈감작화 또는 하향조절하는 화합물이다. 활성화제 또는 효능제는, 예를 들어 결합되어 활성화를 자극, 증가, 개시, 활성화, 촉진, 강화시키거나, 신호 전달을 활성화, 감작화 또는 상향조절하는 화합물이다. syk 및/또는 JAK의 기능을 억제하는 화합물의 능력은 생화학적 분석, 예를 들어 결합 분석 또는 세포-기반 분석, 예컨대 일시적 트랜스펙션 분석으로 증명할 수 있다.
활성의 "조절제"는 활성에 대한 시험관내 또는 생체내 분석을 이용하여 단리한 "리간드", "길항제" 및 "효능제", 및 그의 동족체 및 모방체를 지칭하는데 사용한다. 조절제에는 천연 발생의 합성 리간드, 길항제, 효능제, 분자 등이 포함된다. 길항제 및 효능제를 단리하기 위한 분석에는, 예를 들어 본 발명의 수용체의 존재 또는 부재하에 세포에 추정 조절제 화합물을 적용한 후, 수용체에 대한 본 발명의 활성의 기능적 효과를 측정하는 것이 포함된다. 잠재적 활성화제, 억제제 또는 조절제로 처리한 본 발명의 수용체를 포함하는 샘플 또는 분석을 억제제, 활성화제 또는 조절제가 없는 대조군 샘플과 비교하여 효과의 정도를 실험한다. 대조군 샘플 (조절제로 처리하지 않음)에 100%의 상대적 활성 값을 지정한다. 본 발명의 수용체의 활성 값이 대조군과 비교하여 약 80%, 임의로 50% 또는 25-1%인 경우에 억제가 달성된다. 본 발명의 수용체의 활성 값이 대조군과 비교하여 110%, 임의로 150%, 임의로 200 내지 500%, 또는 1000 내지 3000% 더 높은 경우에 활성화가 달성된다.
"환자"는 인간 및 비-인간 동물, 특히 포유동물을 지칭한다. 환자의 예에는 인간, 소, 개, 고양이, 염소, 양, 돼지 및 토끼가 포함되나, 이에 한정되지는 않는다.
본 발명의 조성물에 대해 전환하여, 용어 "제약상 허용되는 담체 또는 부형제"는 일반적으로 안전하고, 비-독성이고, 생물학적으로 또는 달리 바람직하지 못한 것이 아닌, 제약 조성물의 제조에 유용한 담체 또는 부형제를 의미하며, 수의학적 및 인간 제약적 용도에 적합한 담체 또는 부형제를 포함한다. 본 명세서 및 청구의 범위에서 사용된 "제약상 허용되는 부형제"는 상기 담체 또는 부형제가 1종인 경우 및 2종 이상인 경우 모두를 포함한다.
용어 "제약적 유효량", "치료적 유효량" 또는 "치료적 유효 용량"은 조직, 시스템, 동물 또는 인간에 있어서 연구자, 수의사, 의사 또는 다른 임상의가 추구하는 생물학적 또는 의학적 반응을 유도할 대상 화합물의 양을 지칭한다. 용어 "치료적 유효량"은 투여시 치료되는 질병 또는 장애의 하나 이상의 증상의 발생을 예방하거나 어느 정도 경감시키는데 충분한 화합물의 양을 포함한다. 치료적 유효량은 화합물, 장애 또는 질병, 및 그의 중증도, 및 치료되는 포유동물의 연령, 체중 등에 따라 달라질 것이다.
용어 "혈소판"은 혈액 응고를 촉진시키는 기능을 하는, 포유동물의 혈장에서 발견되는 미세한 무핵의 원반형 세포를 지칭한다.
본원에 사용된 용어 "예방하다", "예방하는", "예방" 및 그의 문법적 변형은 장애 또는 질병, 및/또는 하나 이상의 그의 부수적 증상의 발병 또는 재발을 부분적으로 또는 완전히 지연시키거나 방지하거나, 대상체에서의 장애 또는 질병의 획득 또는 재획득을 막거나, 또는 장애 또는 질병, 또는 하나 이상의 그의 부수적 증상의 획득 또는 재획득에 대한 대상체의 위험을 감소시키는 방법을 지칭한다.
용어 "재소통"은 가로막힌 신체의 통로, 예컨대 혈관을 재결합하거나 그에 대한 흐름을 복원시키는 과정을 지칭한다.
용어 "재협착"은 치료 (예컨대, 혈관성형술 또는 스텐트 절차)가 행해진 동일 부위에서 동맥이 다시 좁아지거나 막히는 것을 지칭한다.
수용체에 결합하는 것에 대해 언급할 때, 어구 "선택적으로" 또는 "특이적으로"는 수용체의 존재하에 (주로 수용체 및 다른 생물물질의 이종성 군집으로) 한정적인 결합 반응을 지칭한다. 따라서, 지정된 조건하에서 화합물은 2배 이상의 백그라운드, 보다 통상적으로는 10 내지 100배 초과의 백그라운드에서 특정 수용체와 결합한다. 이러한 조건하의 화합물의 특이적 결합은 특정 수용체에 대한 그의 특이성에 대해 선택된 화합물을 필요로 한다. 예를 들어, 유기 소분자는, 선택된 수용체에 특이적으로 또는 선택적으로 결합하며 다른 수용체 또는 단백질과는 결합하지 않는 이들 화합물만을 얻기 위해 스크리닝될 수 있다. 다양한 분석 포맷을 이용하여 특정 수용체에 대해 선택적인 화합물을 선택할 수 있다. 예를 들어, 통상적으로 초고속 스크리닝 분석을 이용하여 특정 수용체에 대해 선택적인 화합물을 선택한다.
본원에 사용된 용어 "겸상 적혈구성 빈혈"은 헤모글로빈 대립유전자 모두가 겸상 헤모글로빈 (S) 단백질을 암호화하는 (즉, S/S 유전자형) 적혈구의 유전성 장애를 지칭한다. 비정상적 헤모글로빈의 존재는 통상적이지 않은 형태의 세포 생성을 일으키고, 이는 혈액 순환의 통상적 기간을 생존하지 못한다. 이에 따라, 빈혈이 발생한다. "빈혈"은 혈액 중 과량의 적혈구 및/또는 헤모글로빈이 감소하는 것을 지칭한다.
본원에 사용된 용어 "겸상 적혈구 질환"은 하나의 헤모글로빈 대립유전자가 겸상 헤모글로빈 (S) 단백질을 암호화하고, 다른 하나의 대립유전자가 또다른 비정상적 헤모글로빈 단백질 (예컨대, 헤모글로빈 (S), (C), (D), (E) 및 (βThal)을 암호화하는 적혈구의 유전성 장애를 지칭한다. 겸상 적혈구 질환 유전자형의 예에는 S/S, S/C, S/D, S/E 및 S/βThal 유전자형이 포함되나, 이에 제한되지는 않는다. 가장 통상적인 유형의 겸상 적혈구 질환에는 겸상-헤모글로빈 C 질환, 겸상 베타-플러스 지중해빈혈 및 겸상 베타-제로 지중해빈혈이 포함된다.
"대상체"는 본원에서 영장류 (예컨대, 인간), 소, 양, 염소, 말, 개, 고양이, 토끼, 래트, 마우스 등을 비롯한 (이에 제한되지는 않음) 포유동물과 같은 동물을 포함하는 것으로 정의한다. 바람직한 실시양태에서, 대상체는 인간이다.
본원에 사용된 용어 "syk"는 시험관내 또는 생체내에서 T-세포 수용체에 대한 세포 반응을 매개할 수 있는 비장 티로신 키나제 (RefSeq 기탁 번호 P-043405) 또는 그의 변형체를 지칭한다. syk 변형체에는 미감작 syk와 실질적으로 상동성인 단백질, 즉 하나 이상의 자연적으로 또는 비-자연적으로 발생하는 아미노산 결손, 삽입 또는 치환을 갖는 단백질 (예컨대, syk 유도체, 동족체 및 단편)이 포함된다. syk 변형체의 아미노산 서열은 바람직하게는 미감작 JAK와 약 80% 이상 동일하고, 보다 바람직하게는 약 90% 이상 동일하고, 가장 바람직하게는 약 95% 이상 동일하다.
용어 "syk 억제제"는 비장 티로신 키나제의 촉매적 활성을 억제하는 임의의 작용제를 지칭한다.
용어 "혈전증"은 세포의 응괴에 의해 야기된 혈관의 차단 또는 응고로 인해 혈류가 막히는 것을 지칭한다. 용어 "혈전증"은 혈관 내에 형성된 응고물을 지칭한다.
본원에 사용된 용어 "치료하다", "치료하는", "치료" 및 그의 문법적 변형은 장애 또는 질병의 하나 이상의 부수적 증상의 강도를 부분적으로 또는 완전히 지연, 경감, 완화 또는 감소시키고/거나 장애 또는 질병의 하나 이상의 원인을 경감, 완화 또는 방지하는 것을 포함한다. 본 발명에 따른 치료는 예방적, 방지적, 완화적 또는 개선적으로 적용될 수 있다.
용어 "혈관"은 유체를 운반하는 임의의 채널, 예컨대 동맥 또는 정맥을 지칭한다. 예를 들어, "혈관"은 이를 통해 혈액을 신체에서 순환시키는 임의의 관이다. 혈관의 내강은 내부 개구 공간 또는 혈관의 공동을 지칭한다.
2. 본 발명의 실시양태
a. 화합물
한 실시양태에서, 본 발명은 하기 화학식 I을 갖는 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 I>
상기 식에서,
D1은
(a) C1 - 8알킬, 아미노, 히드록시, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 페닐 및 헤테로시클릴C1 - 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1개 내지 4개의 치환기로 임의로 치환된 C3 - 8시클로알킬;
(b) 아미노, 옥소, C1 - 8알콕시, C2 - 8알키닐, 시아노, 아미노카르보닐, C1 - 8할로알킬, 히드록시, 할로겐, C3 - 8시클로알킬 및 페닐로 이루어진 군으로부터 독립적으로 선택된 1개 내지 4개의 치환기로 임의로 치환된 C1 - 8알킬;
(c) C1 - 8알킬, C1 - 8알킬카르보닐; C1 - 8알킬술포닐; 아미노카르보닐로 이루어진 군으로부터 독립적으로 선택된 1개 내지 4개의 치환기로 임의로 치환된 C1 - 8알킬C3 - 8헤테로시클릴;
(d) C1 - 8알킬, C2 - 8알케닐, C2 - 8알키닐, C1 - 8할로알킬, 카르복시, 아실, 아실아미노, 시아노, 아미노, 아미노카르보닐, 아미노술포닐, 술포닐, 니트로, 히드록시, C1 - 8알콕시, 아릴옥시, 할로, 술포닐아미노, C3 - 8시클로알킬, 아릴, 헤테로시클릴C1- 8알킬술포닐, C1 - 8알킬카르보닐헤테로시클릴 및 헤테로아릴로 이루어진 군으로부터 독립적으로 선택된 1개 내지 4개의 치환기로 임의로 치환된 아릴;
(e) C1 - 8알킬, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐, 아미노, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 히드록실, C1 - 8알콕시, C1 - 8알킬술포닐, 옥소, 할로, 페닐 및 헤테로시클릴C1 - 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1개 내지 4개의 치환기로 임의로 치환된 헤테로아릴;
(f) C1 - 8알킬, C1 - 8알콕시카르보닐 및 옥소로 이루어진 군으로부터 독립적으로 선택된 1개 내지 4개의 치환기로 임의로 치환된 C3 - 8헤테로시클릴
로 이루어진 군으로부터 선택되고;
R1은 H, C1 - 8알킬, 아미노, 아미노카르보닐, 히드록실, C1 - 8알콕시, C1 - 8할로알킬, C2 - 8알케닐, C2 - 8알키닐, 옥소, 시아노, C1 - 8알콕시카르보닐, C3 - 8시클로알킬, 아릴 및 헤테로시클릴로 이루어진 군으로부터 선택되고; 각각의 헤테로시클릴은 C1-8알킬, 할로, 옥소, 아미노, C1 - 8알콕시, C1 - 8알킬카르보닐, 아릴C1 - 8알콕시카르보닐, 아미노카르보닐, 아릴C1 - 8알킬렌카르보닐 및 C1 - 8알킬술포닐로 이루어진 군으로부터 선택된 1개 내지 4개의 치환기로 임의로 치환되고;
Y1은
(a) C1 - 8알킬, C1 - 8알콕시C1 - 8알킬, 아미노카르보닐-, 히드록실, 옥소, 할로겐, 히드록시, C1 - 8알콕시 및 C1 - 8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1개 내지 3개의 치환기 R4a로 임의로 치환된 아릴;
(b) C1 - 8알킬, C1 - 8알콕시C1 - 8알킬, 아미노카르보닐-, 히드록실, 옥소, 할로겐, 히드록시, C1 - 8알콕시 및 C1 - 8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1개 내지 3개의 치환기 R4a로 임의로 치환된 헤테로아릴
로 이루어진 군으로부터 선택되고;
R2는 헤테로시클릴, 헤테로시클릴아미노술포닐, 헤테로시클릴카르보닐, 헤테로시클릴카르보닐C1- 8알콕시, 헤테로시클릴C1 - 8알콕시, 헤테로아릴, 아미노술포닐, C1-8알킬술피닐, C1 - 8할로알콕시, C1 - 8알콕시카르보닐아미노, C1 - 8알콕시아미노카르보닐, 아미노카르보닐C1 - 8알킬아미노, 아미노술포닐헤테로시클릴 및 알킬카르보닐헤테로시클릴로 이루어진 군으로부터 선택되고;
여기서, R2는 추가로 C1 - 8알킬, C1 - 8알콕시, 할로, 아미노카르보닐, 옥소, 히드록실, 아미노C1 - 8알킬렌, C1 - 8알콕시C1 - 8알킬렌, C1 - 8알킬카르보닐, C3 - 8시클로알킬카르보닐, 헤테로시클릴카르보닐, C1 - 8알킬카르보닐아미노, C3 - 8시클로알킬카르보닐아미노, 헤테로시클릴카르보닐아미노, C1 - 8알킬술포닐, C3 - 8시클로알킬술포닐, 헤테로시클릴술포닐, C3 - 8시클로알킬, C1 - 8알킬시클로알킬렌, 헤테로아릴로 이루어진 군으로부터 독립적으로 선택된 1개 내지 2개의 치환기 R4c로 임의로 치환된다.
한 군의 실시양태에서, Y1이 아릴이다. 또다른 군의 실시양태에서, Y1이 페닐이다. 또다른 군의 실시양태에서, Y1이 헤테로아릴이다. 또다른 군의 실시양태에서, Y1이 피리디닐이다.
한 군의 실시양태에서, Y1이 아릴이다. 또다른 군의 실시양태에서, Y1이 페닐이다. 또다른 군의 실시양태에서, Y1이 헤테로아릴이다. 또다른 군의 실시양태에서, Y1이 피리디닐이다.
한 군의 실시양태에서, R2가 헤테로시클릴이다. 또다른 군의 실시양태에서, R2가 헤테로시클릴아미노술포닐이다. 또다른 군의 실시양태에서, R2가 헤테로시클릴카르보닐이다. 또다른 군의 실시양태에서, R2가 헤테로시클릴카르보닐C1 - 8알콕시이다. 또다른 군의 실시양태에서, R2가 헤테로시클릴C1 - 8알콕시이다. 또다른 군의 실시양태에서, R2가 헤테로아릴이다. 또다른 군의 실시양태에서, R2가 아미노술포닐이다. 또다른 군의 실시양태에서, R2가 C1 - 8알킬술피닐이다. 또다른 군의 실시양태에서, R2가 C1 - 8할로알콕시이다. 또다른 군의 실시양태에서, R2가 C1 - 8알콕시카르보닐아미노이다. 또다른 군의 실시양태에서, R2가 C1 - 8알콕시아미노카르보닐이다. 또다른 군의 실시양태에서, R2가 아미노카르보닐C1 - 8알킬아미노이다.
한 군의 실시양태에서, R2가 헤테로시클릴 또는 헤테로아릴인 경우, 이는 아미노C1- 8알킬-, C1 - 8알콕시C1 - 8알킬-, 옥소-, C1 - 8알킬카르보닐, C3 - 8시클로알킬카르보닐, 헤테로시클릴카르보닐, C1 - 8알킬카르보닐아미노, C3 - 8시클로알킬카르보닐아미노, 헤테로시클릴카르보닐아미노, C1 - 8알킬술포닐, C3 - 8시클로알킬술포닐 및 헤테로시클릴술포닐로 이루어진 군으로부터 선택된 하나 이상의 기 R3으로 치환된다.
또다른 군의 실시양태에서, D1이 C1 - 8알킬이다. 또다른 군의 실시양태에서, D1이 C1 - 8알킬C3 - 8헤테로시클릴이다.
또다른 군의 실시양태에서, D1이 아릴이다. 또다른 군의 실시양태에서, D1이 페닐이다.
또다른 군의 실시양태에서, D1이 헤테로아릴이다.
또다른 군의 실시양태에서, 본 발명은 화학식 I의 화합물의 헤테로아릴기가 로 이루어진 군으로부터 선택되고; 이들 각각이 C1 - 8알킬, 아미노, 히드록실, 옥소, 할로, C1 - 8알콕시, 히드록시C1 - 8알킬-, 아미노C1 - 8알킬, C1 - 8알킬카르보닐, 할로C1 - 8알킬, C3 - 8시클로알킬, C1 - 8아미노시클로알킬, 아미노C1 - 8알킬렌카르보닐, 아미노카르보닐, C1-8알킬렌아미노C1 - 8알킬렌카르보닐, C1 - 8알콕시C1 - 8알킬렌카르보닐, 히드록시C1 - 8알킬렌카르보닐, 히드록시C1- 8알콕시카르보닐, C1 - 8알콕시카르보닐아미노, 아릴, 아릴C1 - 8알콕시카르보닐아미노, C1 - 8알킬술포닐, 아미노C1 - 8알킬렌술포닐, 아미노술포닐, C1 - 8알킬렌아미노C1 - 8알킬렌술포닐, C1 - 8알콕시C1 - 8알킬렌술포닐, 히드록시C1 - 8알킬렌술포닐, 히드록시C1 - 8알콕시술포닐, 아미노술포닐 및 C1 - 8알킬헤테로시클릴로 이루어진 군으로부터 독립적으로 선택된 1 내지 2개의 치환기로 임의로 치환되는 것인 화합물을 제공한다.
또다른 군의 실시양태에서, 본 발명은 화학식 I의 화합물의 헤테로아릴기가 C1 - 8알킬, C1 - 8알킬카르보닐, C1 - 8아미노시클로알킬, 아미노C1 - 8알킬렌카르보닐, 아미노카르보닐, C1 - 8알킬렌아미노C1 - 8알킬렌카르보닐, C1 - 8알콕시C1 - 8알킬렌카르보닐, 히드록시C1- 8알킬렌카르보닐, 히드록시C1 - 8알콕시카르보닐, 아미노카르보닐, 아미노, C1-8알콕시카르보닐아미노, 아릴, 아릴C1 - 8알콕시카르보닐아미노, 히드록실, C1 - 8알콕시, C1 - 8알킬술포닐, 아미노C1 - 8알킬렌술포닐, 아미노술포닐, C1 - 8알킬렌아미노C1 -8알킬렌술포닐, C1 - 8알콕시C1 - 8알킬렌술포닐, 히드록시C1 - 8알킬렌술포닐, 히드록시C1 - 8알콕시술포닐, 아미노술포닐, 옥소, 할로, 페닐 및 C1 - 8알킬헤테로시클릴로 이루어진 군으로부터 독립적으로 선택된 1 내지 3개의 치환기로 임의로 치환된, 로 이루어진 군으로부터 선택된 폴리시클릭 헤테로아릴기 (물결선이 분자의 나머지 부분에 부착되는 지점을 나타냄)인 화합물을 제공한다.
또다른 군의 실시양태에서, 본 발명은 D1이 바이시클릭 헤테로아릴인 화합물을 제공한다. 또다른 군의 실시양태에서, D1이, C1 - 8알킬, C1 - 8알킬카르보닐, C1 - 8아미노시클로알킬, 아미노C1 - 8알킬렌카르보닐, 아미노카르보닐, C1 - 8알킬렌아미노C1 -8알킬렌카르보닐, C1 - 8알콕시C1 - 8알킬렌카르보닐, 히드록시C1- 8알킬렌카르보닐, 히드록시C1- 8알콕시카르보닐, 아미노카르보닐, 아미노, C1 - 8알콕시카르보닐아미노, 아릴, 아릴C1- 8알콕시카르보닐아미노, 히드록실, C1 - 8알콕시, C1 - 8알킬술포닐, 아미노C1 - 8알킬렌술포닐, 아미노술포닐, C1 - 8알킬렌아미노C1 - 8알킬렌술포닐, C1 - 8알콕시C1 - 8알킬렌술포닐, 히드록시C1 - 8알킬렌술포닐, 히드록시C1 - 8알콕시술포닐, 아미노술포닐, 옥소, 할로, 페닐 및 C1 - 8알킬헤테로시클릴로 이루어진 군으로부터 독립적으로 선택된 1 내지 3개의 치환기로 임의로 치환된 (물결선이 분자의 나머지 부분에 부착되는 지점을 나타냄)로 이루어진 군으로부터 선택된다.
또다른 군의 실시양태에서, 본 발명은 D1이 C3 - 8헤테로시클릴인 화합물을 제공한다. 한 군의 실시양태에서, 화학식 I의 임의의 헤테로시클릴기가 로 이루어진 군으로부터 선택된다.
또다른 군의 실시양태에서, D1이 (물결선이 분자의 나머지 부분에 부착되는 지점을 나타냄)로 이루어진 군으로부터 선택되고; 이들 각각이 C1 - 8알킬, C1 - 8알콕시카르보닐 및 옥소로 이루어진 군으로부터 독립적으로 선택된 1 내지 3개의 치환기로 임의로 치환된다.
한 실시양태에서, 본 발명은 하기 화학식 I을 갖는 화합물, 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체를 제공한다.
<화학식 I>
상기 식에서,
D1은
(a) C1 - 8알콕시, C2 - 8알키닐, 시아노, 아미노카르보닐, C1 - 8할로알킬, 히드록시, C3 - 8시클로알킬, C3 - 8헤테로시클릴 및 페닐로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 C1 - 8알킬;
(b) C1 - 8알킬, 아미노, 히드록시, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 페닐 및 헤테로시클릴C1 - 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 C3 - 8시클로알킬;
(c) C1 - 8알킬, C2 - 8알케닐, C2 - 8알키닐, C1 - 8할로알킬, 카르복시, 아실, 아실아미노, 시아노, 아미노, 아미노카르보닐, 아미노술포닐, 술포닐, 니트로, 히드록시, C1 - 8알콕시, 아릴옥시, 할로, 술포닐아미노, C3 - 8시클로알킬, 아릴, 헤테로시클릴C1- 8알킬술포닐, C1 - 8알킬카르보닐헤테로시클릴 및 헤테로아릴로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 아릴;
(d) C1 - 8알킬, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐, 아미노, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 히드록실, C1 - 8알콕시, C1 - 8알킬술포닐, 옥소, 할로, 페닐 및 헤테로시클릴C1 - 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 헤테로아릴;
(e) C1 - 8알킬, C1 - 8알콕시카르보닐 및 옥소로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 C3 - 8헤테로시클릴
로 이루어진 군으로부터 선택되고;
R1은 H, C1 - 8알킬, 아미노, 아미노카르보닐, 히드록실, C1 - 8알콕시, C1 - 8할로알킬, C2 - 8알케닐, C2 - 8알키닐, 옥소, 시아노, C1 - 8알콕시카르보닐, C3 - 8시클로알킬, 아릴 및 헤테로시클릴로 이루어진 군으로부터 선택되고; 각각의 헤테로시클릴은 C1-8알킬, 할로, 옥소, 아미노, C1 - 8알콕시, C1 - 8알킬카르보닐, 아릴C1 - 8알콕시카르보닐, 아미노카르보닐, 아릴C1 - 8알킬렌카르보닐 및 C1 - 8알킬술포닐로 이루어진 군으로부터 선택된 1 내지 4개의 치환기로 임의로 치환되고;
Y1은
(a) C1 - 8알킬, C1 - 8알콕시C1 - 8알킬, 아미노카르보닐-, 히드록실, 옥소, 할로겐, 히드록시, C1 - 8알콕시 및 C1 - 8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1 내지 3개의 치환기 R4a로 임의로 치환된 아릴;
(b) C1 - 8알킬, C1 - 8알콕시C1 - 8알킬, 아미노카르보닐-, 히드록실, 옥소, 할로겐, 히드록시, C1 - 8알콕시 및 C1 - 8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1내지 3개의 치환기 R4a로 임의로 치환된 헤테로아릴
로 이루어진 군으로부터 선택되고;
R2는 아미노술포닐, C1 - 8알킬술피닐, C1 - 8할로알콕시, C1 - 8알콕시카르보닐아미노 및 헤테로시클릴로 이루어진 군으로부터 선택되고;
여기서, R2가 헤테로시클릴인 경우, 이는 아민 C1 - 8알킬-, C1 - 8알콕시C1 - 8알킬-, 옥소-, C1 - 8알킬카르보닐, C3 - 8시클로알킬카르보닐, 헤테로시클릴카르보닐, C1 -8알킬카르보닐아미노, C3 - 8시클로알킬카르보닐아미노, 헤테로시클릴카르보닐아미노, C1-8알킬술포닐, C3 - 8시클로알킬술포닐, 헤테로시클릴술포닐로 이루어진 군으로부터 선택된 하나 이상의 기 R3으로 치환되고; 여기서, R2는 추가로 C1 - 8알킬, C1 - 8알콕시, 할로, 아미노카르보닐, 옥소, 히드록실, 아미노C1 - 8알킬렌, C1 - 8알콕시C1 - 8알킬렌, C1 - 8알킬카르보닐, C3 - 8시클로알킬카르보닐, 헤테로시클릴카르보닐, C1 - 8알킬카르보닐아미노, C3 - 8시클로알킬카르보닐아미노, 헤테로시클릴카르보닐아미노, C1 - 8알킬술포닐, C3 - 8시클로알킬술포닐, 헤테로시클릴술포닐, C3 - 8시클로알킬 및 C1 - 8알킬시클로알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1 내지 2개의 치환기 R4c로 임의로 치환된다.
또다른 실시양태에서, 본 발명은
잔기 -Y1-R2가
Y2가 N, CH 또는 C이고;
R4a가 H 및 C1 - 8알킬로 이루어진 군으로부터 선택되고;
각각의 R4c가 H, C1 - 8알킬, C1 - 8알콕시C1 - 8알킬, 아미노카르보닐-, 히드록실, 옥소, C1 - 8알콕시 및 할로로 이루어진 군으로부터 독립적으로 선택되고;
각각의 R4b가 H, C1 - 8알킬, 아미노, C1 - 8알콕시 및 헤테로시클릴로 이루어진 군으로부터 독립적으로 선택되고;
X가 할로이고;
아래첨자 p가 0, 1, 2 또는 3이고;
물결선이 분자의 나머지 부분에 부착되는 지점을 나타내는
것인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 잔기 -Y1-R2가
또다른 실시양태에서, 본 발명은 하기 화학식 Ia를 갖는 화합물, 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체를 제공한다.
<화학식 Ia>
또다른 실시양태에서, 본 발명은 하기 화학식 Ib를 갖는 화합물, 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체를 제공한다.
<화학식 Ib>
또다른 실시양태에서, 본 발명은 하기 화학식 Ic를 갖는 화합물, 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체를 제공한다.
<화학식 Ic>
또다른 실시양태에서, 본 발명은 하기 화학식 Id를 갖는 화합물, 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체를 제공한다.
<화학식 Id>
또다른 실시양태에서, 본 발명은 하기 화학식 Id1를 갖는 화합물, 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체를 제공한다.
<화학식 Id1>
또다른 실시양태에서, 본 발명은 하기 화학식 Id2를 갖는 화합물, 또는 그의 제약상 허용되는 호변이성질체, 염 또는 입체이성질체를 제공한다.
<화학식 Id2>
또다른 실시양태에서, 본 발명은
D1이 C1 - 8알콕시, C2 - 8알키닐, CN, 아미노카르보닐, C1 - 8할로알킬, -히드록실, -C3-8시클로알킬, -C3 - 8헤테로시클릴 및 페닐로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 C1 - 8알킬이고;
R1이 H, C1 - 8알킬, 아미노, 히드록실, C1 - 8알콕시, C1 - 8할로알킬, C2 - 8알케닐, C2-8알키닐, 옥소, CN, C1 - 8알콕시카르보닐, C3 - 8시클로알킬, 아릴, 헤테로시클릴로 이루어진 군으로부터 선택되고; 각각의 헤테로시클릴이 알킬, 할로, 옥소, 아미노, 알콕시, C1 - 8알킬카르보닐, 아릴C1 - 8알콕시카르보닐, 아미노카르보닐 및 C1 - 8알킬술포닐로 이루어진 군으로부터 선택된 1 내지 4개의 치환기로 임의로 치환되는
것인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 C1 - 8알킬, 아미노, 히드록시, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 페닐 및 헤테로시클릴C1 - 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 시클로알킬인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 시클로프로필인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 시클로부틸인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 시클로펜틸인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 C1 - 8알킬, C1 - 8알킬술포닐, C1 - 8알킬카르보닐헤테로시클릴, 할로 및 C1 - 8알킬카르보닐아미노- 및 C1 - 8알콕시로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 페닐인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은
잔기 -Y1-R2가
Y2가 N 또는 C이고;
각각의 R4a가 H 및 할로로 이루어진 군으로부터 선택되고;
각각의 R4c가 H 및 C1 - 8알킬로 이루어진 군으로부터 독립적으로 선택되고;
각각의 R4b가 H 및 C1 - 8알킬로 이루어진 군으로부터 독립적으로 선택되고;
X가 할로이고;
아래첨자 p가 0, 1, 2 또는 3이고;
물결선이 분자의 나머지 부분에 부착되는 지점을 나타내는
것인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은
잔기 -Y1-R2가
Y2가 N 또는 C이고;
각각의 R4a가 H 및 C1 - 8알킬로 이루어진 군으로부터 선택되고;
각각의 R4c가 H, C1 - 8알킬, C1 - 8알콕시C1 - 8알킬, 아미노카르보닐-, 히드록실, 옥소, C1 - 8알콕시 및 할로로 이루어진 군으로부터 독립적으로 선택되고;
각각의 R4b가 H, C1 - 8알킬, 아미노, C1 - 8알콕시 및 헤테로시클릴로 이루어진 군으로부터 독립적으로 선택되고;
X가 할로이고;
아래첨자 p가 0, 1, 2 또는 3이고;
물결선이 분자의 나머지 부분에 부착되는 지점을 나타내는
것인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 C1 - 8알킬, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐, 아미노, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 히드록실, C1 - 8알콕시, C1 - 8알킬술포닐, 옥소, 할로, 페닐 및 헤테로시클릴C1- 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 헤테로아릴인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 C1 - 8알킬, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐, 아미노, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 히드록실, C1 - 8알콕시, C1 - 8알킬술포닐, 옥소, 할로, 페닐 및 헤테로시클릴C1- 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 바이시클릭 헤테로아릴인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이
(물결선이 분자의 나머지 부분에 부착되는 지점을 나타냄)로 이루어진 군으로부터 선택되며, 이들 각각이 C1 - 8알킬, C1 - 8알킬카르보닐, 아미노카르보닐, C1 - 8알콕시카르보닐, 아미노, C1 - 8알콕시카르보닐아미노, 아릴C1 - 8알콕시카르보닐아미노, 히드록실, C1 - 8알콕시, C1 - 8알킬술포닐, 옥소, 할로, 페닐 및 헤테로시클릴C1 - 8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환되는 것인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이
또다른 실시양태에서, 본 발명은 D1이
또다른 실시양태에서, 본 발명은 D1이
또다른 실시양태에서, 본 발명은 D1이
또다른 실시양태에서, 본 발명은
D1이 C1 - 8알킬, C1 - 8알콕시카르보닐 및 옥소로 이루어진 군으로부터 독립적으로 선택된 1 내지 4개의 치환기로 임의로 치환된 헤테로시클릴이고;
R1이 H, C1 - 8알킬, 아미노, 히드록실, C1 - 8알콕시, C1 - 8할로알킬, C2 - 8알케닐, C2-8알키닐, 옥소, CN, C1 - 8알콕시카르보닐, C3 - 8시클로알킬, 아릴 및 헤테로시클릴로 이루어진 군으로부터 선택되고; 여기서 헤테로시클릴이 알킬, 할로, C1 - 8알킬카르보닐, 아릴C1 - 8알킬렌카르보닐, 아미노카르보닐 및 C1 - 8알킬술포닐로 이루어진 군으로부터 선택된 1 내지 4개의 치환기로 임의로 치환되는 것인
화합물을 제공한다.
또다른 군의 실시양태에서, 본 발명은 D1이
또다른 실시양태에서, 본 발명은 D1이 (물결선이 분자의 나머지 부분에 부착되는 지점을 나타냄)로 이루어진 군으로부터 선택되고; 이들 각각이 C1 - 8알킬, C1-8알콕시카르보닐 및 옥소로 이루어진 군으로부터 독립적으로 선택된 1 내지 3개의 치환기로 임의로 치환되는 것인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 하기 화학식을 갖는 화합물 또는 그의 제약상 허용되는 염을 제공한다.
또다른 실시양태에서, 본 발명은 하기 화학식을 갖는 화합물 또는 그의 제약상 허용되는 염을 제공한다.
한 실시양태에서, 본 발명은 하기 화학식 Ie의 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 Ie>
상기 식에서,
D1a는 C3 - 8시클로알킬이고;
R1a는 H, C1 - 8알킬, C1 - 8알킬아미노카르보닐, C1 - 8알킬카르보닐아미노, 아미노카르보닐, 카르보닐아미노, C3 - 8시클로알킬카르보닐아미노, C3 - 8시클로알킬아미노카르보닐, 헤테로아릴, 헤테로시클릴, 히드록시C1 - 8알킬렌아미노카르보닐로 이루어진 군으로부터 선택되고;
R2a는 H, 히드록시, 할로, C1 - 8알킬술포닐 및 헤테로아릴로 이루어진 군으로부터 선택되거나; 또는 R1a 및 이들이 부착된 원자와 함께 *-NH-CH=CH- 및 *-N=CH-CH=N- (여기서, *은 R2의 부착점을 나타냄)으로 이루어진 군으로부터 선택된 헤테로시클릭 잔기를 형성하고; 여기서, R1a 및 R2a 중 적어도 하나는 H가 아니고;
각각의 헤테로아릴 또는 헤테로시클릴은
이들 각각은 C1 - 8알킬, 히드록시C1 - 8알킬렌, C1 - 8알콕시C1 - 8알킬렌, 아미노, 아미노카르보닐, C1 - 8알킬아미노카르보닐, C1 - 8알킬카르보닐, 카르복시, 히드록시, 할로 및 C1 - 8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1개 내지 2개의 치환기로 임의로 치환된다.
또다른 실시양태에서, 본 발명은 하기 화학식 If의 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 If>
상기 식에서,
D1b는 C3 - 8시클로알킬이고;
R1b는 헤테로아릴, 헤테로시클릴, 헤테로시클릴카르보닐 및 헤테로시클릴술포닐로 이루어진 군으로부터 선택되고;
R2b는 H 또는 할로로 이루어진 군으로부터 선택되고;
각각의 헤테로아릴 또는 헤테로시클릴은
이들 각각은 히드록실, 히드록시C1 - 8알킬렌, C1 - 8알콕시C1 - 8알킬렌, C1 - 8알킬카르보닐, C1 - 8알킬아미노카르보닐, 카르복시 및 C1 - 8알킬술포닐아미노로 이루어진 군으로부터 독립적으로 선택된 1개 내지 2개의 치환기로 치환된다.
또다른 실시양태에서, 본 발명은 하기 화학식 Ig의 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 Ig>
상기 식에서,
D1c는 C3 - 8시클로알킬이고;
또다른 실시양태에서, 본 발명은 R1b가 아미노카르보닐 및 C1 - 8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1 내지 2개의 치환기로 치환된 헤테로시클릴인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1a, D1b 또는 D1c가 시클로프로필 또는 시클로부틸인 화합물을 제공한다. 또다른 실시양태에서, 본 발명은 D1a, D1b 또는 D1c가 시클로프로필인 화합물을 제공한다. 또다른 실시양태에서, 본 발명은 D1a, D1b 또는 D1c가 시클로부틸인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 하기 화학식을 갖는 화합물 또는 그의 제약상 허용되는 염을 제공한다.
또다른 실시양태에서, 본 발명은 하기 화학식 Ih의 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 Ih>
상기 식에서,
D1은 C3 - 8시클로알킬이고;
R1은 H, 아미노, C1 - 8알콕시카르보닐아미노, C1 - 8알킬카르보닐아미노, C1 - 8알콕시, 아미노카르보닐, 헤테로아릴, 헤테로시클릴, C1 - 8알킬티오, C1 - 8알킬술포닐 및 헤테로시클릴C1- 8알킬렌으로 이루어진 군으로부터 선택되고; 여기서 각각의 헤테로아릴 또는 헤테로시클릴은
이들 각각은 C1 - 8알킬, -CONH2, 히드록시, 할로, C1 - 8알킬술포닐 및 헤테로아릴로 이루어진 군으로부터 독립적으로 선택된 1개 내지 2개의 치환기로 임의로 치환되고;
R2는 H, C1 - 8알킬, 할로, C1 - 8알콕시 및 헤테로아릴로 이루어진 군으로부터 선택되거나; 또는 R1 및 이들이 부착된 원자와 함께 -NH-N=CH-*, -CH=N-NH-*, -O-CH2-CH2-O-*; -NH-CH=CH-*, -N=CH-CH=CH-* (여기서, *은 R2의 부착점을 나타냄)로 이루어진 군으로부터 선택된 헤테로시클릭 잔기를 형성한다.
또다른 실시양태에서, 본 발명은 하기 화학식 Ii의 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 Ii>
상기 식에서,
D1은 C3 - 8시클로알킬이고;
또다른 실시양태에서, 본 발명은 R1이 C1 - 8알킬술포닐인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 R2가 H인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 하기 화학식 Ij를 갖는 화합물 또는 그의 제약상 허용되는 염을 제공한다.
<화학식 Ij>
상기 식에서,
D1은 C3 - 8시클로알킬이다.
또다른 실시양태에서, 본 발명은 D1이 시클로프로필 또는 시클로부틸인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 시클로프로필인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 D1이 시클로부틸인 화합물을 제공한다.
또다른 실시양태에서, 본 발명은
로 이루어진 군으로부터 선택되는 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 실시예에 나타낸 화합물을 제공한다.
또다른 실시양태에서, 본 발명은 표에 나타낸 구조를 갖는 화합물을 제공한다.
또다른 군의 실시양태에서, 임의의 상기 실시양태가 또한 본원에 기재된 다른 실시양태와 조합되어 본 발명의 다른 실시양태를 형성할 수 있음을 이해해야 한다.
b. 합성 방법
본 발명의 화합물은 실시예에 보다 상세히 기재되어 있는 방법을 비롯한 공지되어 있는 유기 합성 기술에 의해 제조할 수 있다. 일반적으로, 상기 구조 I의 화합물 (여기서, 달리 나타내지 않는 한 모든 치환기는 상기 정의된 바와 같음)은 하기 도 3에 의해 제조할 수 있다.
화학식 I을 갖는 화합물을 도 3에 따라 제조할 수 있다. 카르복실산 1.1을 염소화 작용제, 예컨대 티오닐 클로라이드로의 처리에 의한 1-단계 절차를 통해 산 클로라이드 1.2로 전환시키고, 하기 기재된 것과 유사한 조건을 이용하면서 알콜, 예컨대 에탄올을 사용하여 에스테르화시켜, 화합물 1.3을 형성한다. 에스테르 1.3을 염소화제, 예컨대 옥시염화인으로 이염소화시킨다. 염기성 조건하에 (예컨대, 디이소프로필아민 (DIA) 사용) 2,4-디클로로피리미딘의 4-클로로 기를 적절한 아민, 예컨대 R1-D1-NH2 (상업적으로 입수가능하거나, 또는 당업자에게 공지되어 있는 방법을 이용하여 합성)으로 선택적으로 대체하여, 화학식 1.5의 화합물을 생성한다. 후속으로, 에스테르를 가수분해하고, 제2 클로로 기를 EDC로 대체하고, 암모니아로 처리하여, 화합물 1.7을 수득한다. 벤조트리아졸릴 에테르 화합물 1.7은 또한 선형 경로를 통해 제조할 수 있다. 벤조트리아졸릴 에테르기를 적절한 아민, 예컨대 R2-Y1-NH2 (상업적으로 입수가능하거나, 또는 당업자에게 공지되어 있는 방법을 이용하여 합성)으로 대체하여, 바람직한 생성물 I (여기서, R1 및 R2는 상기 정의한 바와 같음)을 수득한다.
당업자는, 특정 실시양태의 구조 I에서 R1-D1 또는 R2-Y1이 말단 헤테로원자를 포함하는 경우에 이것이 보호기 전략에 사용하기에 유리할 수 있다는 것을 인지할 것이다. 당업자에게 공지되어 있는 방법을 이용하여 보호기를 제거함으로써, 구조 1의 화합물을 수득할 수 있다.
본 발명의 화합물은 일반적으로 유리 염기로서 사용될 수 있다. 별법으로, 본 발명의 화합물은 하기 기재된 바와 같은 산 부가염의 형태로 사용될 수 있다.
c.
syk
및
JAK
키나제의
억제
JAK 키나제의 억제제로서의 특정 화합물의 활성을 시험관내 또는 생체내에서 평가할 수 있다. 일부 실시양태에서, 특정 화합물의 활성을 세포 분석으로 시험할 수 있다. 또한, 단리된 키나제를 사용한 생화학 분석으로 선택성을 확인할 수 있다.
유사한 유형의 분석을 이용하여 JAK 키나제 억제 활성을 평가하고, syk 키나제와 비교하여 특정 화합물의 선택성 정도를 결정할 수 있다. 이러한 억제를 분석하는 한 수단은 하류 유전자 생성물의 상향조절에 대한 본 발명의 화합물의 효과를 검출하는 것이다. 라모스(Ramos)/IL4 분석에서, B-세포를 사이토카인 인터류킨-4 (IL-4)로 자극하여, JAK 패밀리 키나제인 JAK1 및 JAK3의 인산화를 통한 JAK/Stat 경로의 활성화를 유도하고, 이는 전사 인자 Stat-6을 인산화 및 활성화시킨다. 활성화된 Stat-6에 의해 상향조절된 유전자 중의 하나가 낮은 친화성 IgE 수용체인 CD23이다. JAK1 및 JAK3 키나제에 대한 억제제 (예를 들어, 본원에 기재된 2,4-치환된 피리미딘디아민 화합물)의 효과를 연구하기 위해, 인간 라모스 B 세포를 인간 IL-4로 자극한다. 자극 10' 후, 세포를 세포내 유세포측정하여, STAT-6 인산화의 정도를 측정한다. 자극 20 내지 24시간 후, CD23의 상향조절에 대해 세포를 염색하고, 유세포측정을 이용하여 분석한다. 대조군 조건에 비해 존재하는 인산화된 STAT-6 및/또는 세포 표면 CD23의 양이 감소한 것은, 시험 화합물이 JAK 키나제 경로를 활성적으로 억제함을 나타낸다.
부가적으로, 라모스 B-세포의 IL-6 자극은 JAK 1, 2 및 Tyk2를 유도하여 Stat-3 및 Erk 인산화를 일으킨다. 자극 10' 후, 세포를 세포내 유세포측정하여, 이들 인산화 이벤트를 억제하는 화합물의 능력을 측정한다. JAK2의 활성을 명확하게 측정하기 위해, Stat5에 의해 제어되는 베타-락타마제 정보제공 유전자를 발현하는 셀센서 (CellSensor) irf1-bla HEL 세포주를 사용할 것이다 (인비트로겐 (Invitrogen), 캘리포니아주, 칼스배드). 이들 세포는 골수증식성 신생물에서 자연적으로 발견되는 구성적으로 활성인 JAK2 돌연변이 (JAK2V617F)를 발현한다 (문헌 [Constantinescu, S., et.al, Trends Biochem Sci., 2008; 33:122-31]). 베타-락타마제 정보제공 유전자 발현량의 감소는 화합물의 JAK2 억제 활성의 측정에 이용된다.
본 발명의 화합물의 활성은 또한 A549 폐 상피 세포 및 U937 세포에 대해 본원에 기재된 본 발명의 화합물의 효과를 분석함으로써 특징화될 수 있다. A549 폐 상피 세포 및 U937 세포는 다양한 여러 자극에 반응하여 ICAM-1 (CD54) 표면 발현을 상향조절한다. 따라서, 판독물로서 ICAM-1 발현을 이용하여, 여러 신호 전달 경로에 대한 시험 화합물 효과를 동일한 세포 유형에서 평가할 수 있다. IL-1β 수용체를 통해 IL-1β로 자극하면, TRAF6/NFκB 경로가 활성화되어, ICAM-1이 상향조절된다. IFN.감마는 JAK1/JAK2 경로의 활성화를 통해 ICAM-1 상향조절을 유도한다. ICAM-1의 상향조절은 화합물 용량 곡선을 통한 유세포측정에 의해 정량화될 수 있고, EC50 값을 계산한다.
본 발명의 화합물의 활성은 또한 A549 폐 상피 세포 및 U937 세포에 대해 본원에 기재된 본 발명의 화합물의 효과를 분석함으로써 특징화될 수 있다. A549 폐 상피 세포 및 U937 세포는 다양한 여러 자극에 반응하여 ICAM-1 (CD54) 표면 발현을 상향조절한다. 따라서, 판독물로서 ICAM-1 발현을 이용하여, 여러 신호 전달 경로에 대한 시험 화합물 효과를 동일한 세포 유형에서 평가할 수 있다. IL-1β 수용체를 통해 IL-1β로 자극하면, TRAF6/NFκB 경로가 활성화되어, ICAM-1이 상향조절된다. IFN.감마는 JAK1/JAK2 경로의 활성화를 통해 ICAM-1 상향조절을 유도한다. ICAM-1의 상향조절은 화합물 용량 곡선을 통한 유세포측정에 의해 정량화될 수 있고, EC50 값을 계산한다. 이러한 유형의 예시적인 분석은 실시예에서 더욱 상세하게 기재된다
본원에 기재된 활성 화합물은 일반적으로 본원에 기재된 분석으로 측정시 JAK 키나제 경로를 약 1 mM 이하 범위의 IC50으로 억제한다. 물론, 당업자는 더 낮은 (예를 들어, 순서상 100 μM, 75 μM, 50 μM, 40 μM, 30 μM, 20 μM, 15 μM, 10 μM, 5 μM, 1 μM, 500 nM, 100 nM, 10 nM, 1 nM, 또는 더 낮은) IC50을 나타내는 화합물이 치료학적 적용에서 특히 유용할 수 있음을 인식할 것이다. 특정 세포 유형에 대해 특이적인 활성이 필요한 경우, 목적하는 세포 유형으로 활성에 대해 화합물을 분석하고, 다른 세포 유형에 대해 활성의 결여를 역으로 스크리닝할 수 있다. 이러한 역 스크리닝에서 목적하는 정도의 "불활성" 또는 목적하는 활성 대 불활성 비는 여러 상황에서 달라질 수 있으며, 사용자에 의해 선택될 수 있다.
활성 화합물은 또한 전형적으로 B-세포에서 CD23의 IL-4 자극된 발현을 약 20 μM 이하의 범위, 전형적으로 약 10 μM, 1 μM, 500 nM, 100 nM, 10 nM, 1 nM, 또는 더 낮은 범위의 IC50으로 억제한다. 이용될 수 있는 적합한 분석은 실시예 "IL-4로 자극된 라모스 B-세포주에 대한 분석"에 기재된 분석이다. 특정 실시양태에서, 본 발명의 활성 화합물은 실시예에 기재된 분석에서 5 μM 이하, 5 μM 초과 20 μM 미만, 20 μM 초과, 또는 20 μM 초과 50 μM 미만의 IC50을 갖는다.
활성 화합물은 또한 전형적으로 U937 또는 A549 세포에서 IFN. 감마 노출에 의해 유도된 ICAM1 (CD54)의 발현을 약 20 μM 이하의 범위, 전형적으로 약 10 μM, 1 μM, 500 nM, 100 nM, 10 nM, 1 nM, 또는 더 낮은 범위의 IC50으로 억제한다. IFN.감마 자극된 세포에서 ICAM (CD54)의 발현에 대한 IC50은 단리된 A549 또는 U937 세포주를 이용하는 기능적 세포 분석으로 측정할 수 있다. 이용될 수 있는 적합한 분석은 각각 실시예 "IFNγ로 자극된 A549 상피 세포주" 및 "U937 IFN.감마 ICAM1 FACS 분석"에 기재된 분석이다. 특정 실시양태에서, 본 발명의 활성 화합물은 실시예에 기재된 분석에서 20 μM 이하, 20 μM 초과, 또는 20 μM 초과 50 μM 미만의 IC50을 갖는다.
d. 조성물 및 투여 방법
본 발명은 또한 하나 이상의 화학식 I의 화합물 또는 그의 제약상 허용되는 염, 에스테르 또는 전구약물, 및 제약상 허용되는 담체 또는 희석제를 포함하는 조성물을 제공한다. 본 발명의 화학식 I의 화합물이 관능기에서 유도체화되어 생체내에서 모 화합물로 다시 전환될 수 있는 전구약물 유도체를 생성할 수 있음을 인식할 것이다. 이러한 전구약물의 예에는 생리학상 허용되고, 대사적으로 불안정한 에스테르 유도체 (화합물의 히드록실기로부터 유도), 예컨대 메톡시메틸 에스테르, 메틸티오메틸 에스테르, 또는 피발로일옥시메틸 에스테르, 또는 카르바모일 잔기 (화합물의 아미노기로부터 유도)가 포함된다. 부가적으로, 생체내에서 화학식 I의 모 화합물을 생성할 수 있는, 대사적으로 불안정한 에스테르 또는 카르바메이트와 유사한 화학식 I의 화합물의 임의의 생리학상 허용되는 등가물은 본 발명의 범위 내에 있다.
본원에 사용된 용어 "제약상 허용되는 염"은 반대 이온이 염의 제약적 투여에서 환자에 비-독성인 임의의 산 또는 염기 부가염을 지칭한다. 다수의 제약상 허용되는 염은 제약 업계에 널리 공지되어 있다. 본 발명의 제약상 허용되는 화합물의 염이 이러한 조성물에 사용되는 경우, 이들 염은 바람직하게는 무기산 또는 유기산, 및 염기로부터 유도된다. 이러한 산 염 중에는 아세테이트, 아디페이트, 알기네이트, 아스파르테이트, 벤조에이트, 벤젠 술포네이트, 비술페이트, 부티레이트, 시트레이트, 캄포레이트, 캄포르 술포네이트, 시클로펜탄프로피오네이트, 디글루코네이트, 도데실술페이트, 에탄술포네이트, 푸마레이트, 루코헵타노에이트, 글리세로포스페이트, 헤미술페이트, 헵타노에이트, 헥사노에이트, 히드로클로라이드, 히드로브로마이드, 히드로요오다이드, 2-히드록시에탄술포네이트, 락테이트, 말레에이트, 메탄술포네이트, 2-나프탈렌술포네이트, 니코티네이트, 옥살레이트, 파모에이트, 펙티네이트, 퍼술페이트, 3-페닐-프로피오네이트, 피크레이트, 피발레이트, 프로피오네이트, 숙시네이트, 타르트레이트, 티오시아네이트, 토실레이트, 운데카노에이트, 히드로 할라이드 (예를 들어, 히드로클로라이드 및 히드로브로마이드), 술페이트, 포스페이트, 니트레이트, 술파메이트, 말로네이트, 살리실레이트, 메틸렌-비스-b-히드록시나프토에이트, 겐티세이트, 이세티오네이트, 디-p-톨루오일타르트레이트, 에탄술포네이트, 시클로헥실술파메이트, 퀴네이트 등이 포함된다. 제약상 허용되는 염기 부가염에는 알칼리 금속 또는 알칼리 토금속 염기, 또는 통상적 유기 염기, 예컨대 트리에틸아민, 피리딘, 피페리딘, 모르폴린, N-메틸모르폴린, 암모늄 염, 알칼리 금속 염, 예컨대 나트륨 및 칼륨 염, 알칼리 토금속 염, 예컨대 칼슘 및 마그네슘 염, 유기 염기와의 염, 예컨대 디시클로헥실아민 염, N-메틸-D-글루카민, 및 아미노산 (예컨대 아르기닌, 리신)과의 염 등이 포함되나, 이에 제한되지는 않는다.
또한, 염기성 질소-함유 기는 저급 알킬 할라이드, 예컨대 메틸, 에틸, 프로필 및 부틸 클로라이드, 브로마이드 및 요오다이드; 디알킬 술페이트, 예컨대 디메틸, 디에틸, 디부틸 및 디아밀 술페이트, 장쇄 할라이드, 예컨대 데실, 라우릴, 미리스틸 및 스테아릴 클로라이드, 브로마이드 및 요오다이드, 아르알킬 할라이드, 예컨대 벤질 및 페네틸 브로마이드 등과 같은 작용제를 사용하여 4급화될 수 있다. 이에 따라 수용성 또는 유용성, 또는 수분산성 또는 유분산성 생성물이 수득된다.
본 발명의 조성물 및 방법에 사용된 화합물을 또한 적절한 관능기의 부가에 의해 변형시켜, 생물학적 특성을 선택적으로 개선할 수 있다. 이러한 변형은 당업계에 공지되어 있으며, 주어진 생물학적 시스템 (예를 들어, 혈액, 림프계, 중추신경계 등)으로의 생물학적 침투를 증가시키는 것, 생체이용률을 증가시키는 것, 용해도를 증가시켜 주사에 의한 투여를 가능하게 하는 것, 대사를 변경시키는 것 및 분비 속도를 변경시키는 것을 포함한다.
본 발명의 제약학적 조성물은 당업계에 널리 공지되어 있는 방법, 예를 들면 통상적인 과립화, 혼합, 용해, 캡슐화, 동결건조 또는 에멀젼화 공정 등에 의해 제조될 수 있다. 조성물은 과립, 침전물, 또는 입자, 동결 건조, 회전 건조 또는 분무 건조된 분말을 비롯한 분말, 무정형 분말, 정제, 캡슐, 시럽, 좌제, 주사, 에멀젼, 엘릭시르, 현탁액 또는 용액을 비롯한 다양한 형태로 생성될 수 있다. 제제는 임의로 안정화제, pH 변형제, 계면활성제, 생체이용률 변형제 및 그의 조합물을 함유할 수 있다.
용어 "단위 투여 형태"는 인간 대상체 및 다른 포유동물에 대한 1회분 투여량으로 적합한 물리적으로 불연속인 단위를 지칭하며, 각 단위는 목적하는 개시, 내성 및/또는 치료 효과를 내도록 계산된 예정된 양의 약물을 적합한 제약 부형제와 함께 함유한다 (예컨대, 앰플). 또한, 보다 농축된 조성물을 제조할 수 있으며, 후속으로 그로부터 보다 희석된 단위 투여 조성물을 제조할 수 있다. 따라서, 보다 농축된 조성물은 실질적으로 보다 많은 (예컨대 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10배 또는 그 이상) 양의 하나 이상의 syk 및/또는 JAK 억제제를 함유할 것이다.
이러한 투여 형태를 제조하는 방법은 당업자에게 공지되어 있다 (예를 들어, 문헌 [REMINGTON'S PHARMACEUTICAL SCIENCES, 18TH ED., Mack Publishing Co., Easton, PA (1990)] 참조). 또한, 합성 유기 화학의 당업자에게 공지되어 있는 표준 절차, 및 예를 들어 문헌 [J. March, Advanced Organic Chemistry: Reactions, Mechanisms and Structure, 4th Ed. (New York: Wiley-Interscience, 1992)]에 기재된 절차를 이용하여 본 발명의 syk 및/또는 JAK 억제제의 제약상 허용되는 염 (예컨대, 산 부가염)을 제조하고, 조성물 내에 포함시킬 수 있다.
조성물은 전형적으로 통상적인 제약적 담체 또는 부형제를 포함하며, 다른 의약 작용제, 담체, 보조제, 희석제, 조직 침투 증진제, 가용화제 등을 추가로 포함할 수 있다. 바람직하게는, 조성물은 약 0.01% 내지 약 90%, 바람직하게는 약 0.1% 내지 약 75%, 보다 바람직하게는 약 0.1% 내지 50%, 보다 더 바람직하게는 약 0.1% 내지 10% (중량 기준)의 하나 이상의 syk 및/또는 JAK 억제제를 함유할 것이다 (나머지 부분은 적합한 제약적 담체 및/또는 부형제로 구성됨). 적절한 부형제는 당업계, 예를 들어 상기 문헌 [REMINGTON'S PHARMACEUTICAL SCIENCES]에 널리 공지되어 있는 방법에 의해 특정 조성물 및 투여 경로에 맞게 맞출 수 있다.
제약학상 허용되는 담체에는 이온 교환기, 알루미나, 알루미늄 스테아레이트, 레시틴, 인간 혈청 알부민과 같은 혈청 단백질, 완충제 물질, 예컨대 포스페이트, 글리신, 소르브산, 칼륨 소르베이트, 포화 식물 지방산의 부분 글리세리드 혼합물, 물, 염 또는 전해질, 예컨대 황산프로타민, 인산수소이나트륨, 인산수소칼륨, 염화나트륨, 아연염, 콜로이드성 실리카, 마그네슘 트리실리케이트, 폴리비닐 피롤리돈, 셀룰로오스-기재 물질, 폴리에틸렌 글리콜, 나트륨 카르복시메틸 셀룰로오스, 폴리아크릴레이트, 왁스, 폴리에틸렌-폴리옥시프로필렌-블록 중합체, 폴리에틸렌 글리콜 및 양모지가 포함된다.
적합한 부형제의 예에는 락토스, 덱스트로스, 수크로스, 소르비톨, 만니톨, 전분, 아카시아 검, 인산칼슘, 알기네이트, 트라가칸트, 젤라틴, 칼슘 실리케이트, 미정질 셀룰로스, 폴리비닐피롤리돈, 셀룰로스, 물, 염수, 시럽, 메틸셀룰로스, 에틸셀룰로스, 히드록시프로필메틸셀룰로스 및 폴리아크릴산, 예컨대 카르보폴 (Carbopol)이 포함되나, 이에 제한되지는 않는다. 조성물은 추가로 윤활제, 예컨대 활석, 마그네슘 스테아레이트 및 광유; 습윤제; 유화제; 현탁화제; 보존제, 예컨대 메틸-, 에틸- 및 프로필-히드록시-벤조에이트; pH 조절제, 예컨대 무기 및 유기산, 및 염기; 감미제; 및 향미제를 포함할 수 있다.
유리하게는, 하나 이상의 syk 및/또는 JAK 억제제를 하나 이상의 적합한 제약적 부형제와 함께 포함하는 조성물의 투여는 임의의 허용되는 투여 방식을 통해 수행될 수 있다. 따라서, 투여는 예를 들어 경구, 국소, 정맥내, 피하, 경피 (transcutaneous), 경피 (transdermal), 근육내, 관절내, 비경구, 동맥내, 피내, 뇌실내, 두개내, 복강내, 병변내, 비내, 직장, 질내로, 흡입이 의해, 또는 이식된 저장소를 통해 행해질 수 있다. 본원에 사용된 용어 "비경구적"은 피하, 정맥내, 근육내, 관절내, 활액내, 흉골내, 수막강내, 간내, 병변내 및 두개내 주사 또는 주입 기술을 포함한다. 바람직하게는, 조성물은 경구적으로 또는 정맥내로 투여된다. 본 발명의 제제는 단기-작용, 빠른-방출 또는 장기-작용으로 설계될 수 있다. 나아가, 화합물은 지속 방출 제제로서의 투여 (예를 들면, 주입)와 같이 전신 투여보다는 국소적으로 투여될 수 있다. 대표적인 실시양태에 따라, 본 발명의 조성물은 포유동물, 바람직하게는 인간에게 제약학적으로 투여하기 위해 제제화된다.
하나 이상의 syk 및/또는 JAK 억제제를 함유하는 본 발명의 조성물은 반복적으로, 예를 들어 적어도 2, 3, 4, 5, 6, 7, 8회 또는 그 이상 투여될 수 있거나, 또는 조성물은 지속적인 주입에 의해 투여될 수 있다. 적합한 투여 부위에는 피부, 기관지, 위장, 항문, 질, 눈 및 귀가 포함되나, 이에 제한되지는 않는다. 제제는 고체, 반고체, 동결건조 분말 또는 액체 투여 형태, 예컨대 정제, 환제, 캡슐, 분말, 용액, 현탁액, 에멀젼, 좌제, 정체관장제, 크림, 연고, 로션, 겔, 에어로졸 등의 형태, 바람직하게는 정확한 투여량의 단순한 투여에 적합한 단위 투여 형태를 취할 수 있다.
본 발명의 제약 조성물은 정제, 캡슐, 사셰, 에멀젼, 현탁액, 용액, 시럽, 엘릭시르, 스프레이, 볼루스, 로젠지, 분말, 과립 및 지속-방출 제제를 비롯한 임의의 경구적으로 허용되는 투여 형태일 수 있다. 경구 투여에 적합한 부형제에는 제약 등급의 만니톨, 락토스, 전분, 마그네슘 스테아레이트, 나트륨 사카린, 활석, 셀룰로스, 글루코스, 젤라틴, 수크로스, 마그네슘 카르보네이트 등이 포함된다. 경구 사용을 위한 정제의 경우에, 통상적으로 사용되는 담체에는 락토스 및 옥수수 전분이 포함된다. 스테아르산마그네슘과 같은 윤활제도 전형적으로 첨가된다. 캡슐제 형태의 경우에 유용한 희석제에는 락토스 및 건조된 옥수수 전분이 포함된다. 경구 사용을 위해 수성 현탁액이 필요한 경우에는 활성 성분을 유화제 및 현탁화제와 합한다. 원한다면, 특정 감미제, 향미제 또는 착색제가 첨가될 수도 있다.
일부 실시양태에서, 조성물은 환제, 정제 또는 캡슐의 형태를 취하므로, 조성물은 하나 이상의 syk 및/또는 JAK 억제제와 함께 희석제, 예컨대 락토스, 수크로스, 제2인산칼슘 등; 붕해제, 예컨대 전분 또는 그의 유도체; 윤활제, 예컨대 마그네슘 스테아레이트 등; 및/또는 결합제, 예컨대 전분, 아카시아검, 폴리비닐피롤리돈, 젤라틴, 셀룰로스 및 그의 유도체를 함유할 수 있다. 정제는 당업자에게 공지되어 있는 임의의 압축 또는 성형 방법에 의해 제조할 수 있다. 압축 정제는, 자유-유동 형태, 예컨대 분말 또는 과립의 syk 및/또는 JAK 억제제를, 임의로 보조 성분, 예컨대 결합제, 윤활제, 희석제, 붕해제 또는 분산제와 혼합하여 적합한 기계 내에서 압축함으로 제조할 수 있다. 성형된 정제는 분말화된 syk 및/또는 JAK 억제제 및 임의의 적합한 담체의 혼합물을 적합한 기계 내에서 성형함으로 제조할 수 있다.
별법으로, 본 발명의 제약 조성물은 직장 투여용 좌제 형태일 수 있다. 이들은 실온에서는 고체이나 직장의 온도에서는 액체이기 때문에 직장내에서 녹아 약물을 방출하는, 자극이 없는 적합한 부형제와 약제를 혼합하여 제조할 수 있다. 이러한 물질에는 코코아 버터, 밀랍, 폴리에틸렌 글리콜 (PEG), 경질 지방 및/또는 수소화된 코코아글리세리드가 포함된다. 직장 투여에 적합한 조성물은 또한 하나 이상의 syk 및/또는 JAK 억제제, 및 직장 및/또는 결장과 생리학적으로 융화성인 제약상 허용되는 비히클 (예컨대, 50% 수성 에탄올 또는 수성 염 용액)을 함유하는 직장 관장제 단위를 포함할 수 있다. 직장 관장제 단위는, 불활성의 덮개에 의해 보호되고, 바람직하게는 폴리에틸렌으로 구성되고, 백색 바셀린과 같은 윤활제로 윤활되고, 바람직하게는 분배된 제제의 역류를 방지하기 위한 한-방향 밸브에 의해 보호된 적용기 팁 (tip)을 함유한다. 직장 관장제 단위는 또한 항문을 통해 결장으로 삽입되는 충분한 길이 (바람직하게는, 2인치)의 것이다.
액체 조성물은 하나 이상의 syk 및/또는 JAK 억제제 및 임의로 하나 이상의 제약상 허용되는 보조제를, 예를 들어 수성 염수, 수성 덱스트로스, 글리세롤, 에탄올 등과 같은 담체 중에 용해시키거나 분산시켜, 예를 들어 경구, 국소 또는 정맥내 투여용 용액 또는 현탁액을 형성함으로써 제조할 수 있다. 제약 제제는 무균 액체, 예를 들면 오일, 물, 알콜 및 이들의 조합물을 이용하여 액체 현탁액 또는 용액으로 제조할 수 있다. 제약상 적합한 계면활성제, 현탁제 또는 유화제는 경구 또는 비경구 투여용으로 첨가될 수 있다. 현탁액에는 땅콩 오일, 참기름, 면실유, 옥수수 오일 및 올리브 오일과 같은 오일이 포함될 수 있다. 현탁액 제제는 또한 지방산의 에스테르, 예를 들면 에틸 올레에이트, 이소프로필 미리스테이트, 지방산 글리세리드 및 아세틸화된 지방산 글리세리드를 함유할 수 있다. 현탁액 제제에는 또한 알콜, 예를 들면 에탄올, 이소프로필 알콜, 헥사데실 알콜, 글리세롤 및 프로필렌 글리콜이 포함될 수 있다. 에테르, 예를 들면 폴리(에틸렌글리콜), 석유 탄화수소, 예를 들면 광유 및 석유, 및 물 또한 현탁액 제제에 사용될 수 있다.
또한, 본 발명의 제약 조성물은, 특히 치료 표적이 눈, 피부 또는 하부 장관을 비롯한 국소 적용에 의해 쉽게 접근 가능한 부위 또는 기관을 포함하는 경우에, 국소 형태일 수도 있다. 적합한 국소 제제는 각각의 이들 부위 또는 기관용으로 손쉽게 제조된다. 국소 투여를 위해, 하나 이상의 syk 및/또는 JAK 억제제를 함유하는 조성물은 에멀젼, 로션, 겔, 포말, 크림, 젤리, 용액, 현탁액, 연고 및 경피 패치 형태일 수 있다.
하부 장관에 대한 국소 투여는 직장 좌약 제제 (상기 참조) 또는 적합한 관장제로 수행될 수 있다. 국소적인 경피 패치 또한 사용될 수 있다. 국소 투여를 위해서, 제약 조성물은 하나 이상의 담체 중에 현탁되거나 용해된 활성 성분을 함유하는 적합한 연고로 제제화될 수 있다. 본 발명의 화합물의 국소 투여용 담체에는, 광유, 액체 바셀린, 백색 바셀린, 프로필렌 글리콜, 폴리옥시에틸렌, 폴리옥시프로필렌 화합물, 유화하는 왁스 및 물이 포함되나, 이에 제한되지는 않는다. 별법으로, 제약 조성물은 하나 이상의 제약학상 허용되는 담체 중에 현탁되거나 용해된 활성 성분을 함유하는 적합한 로션 또는 크림으로 제제화될 수 있다. 적합한 담체에는 광유, 소르비탄 모노스테아레이트, 폴리소르베이트 60, 세틸 에스테르, 왁스, 세틸 알콜, 2-옥틸도데카놀, 벤질 알콜 및 물이 포함된다.
또한, 본 발명의 제약 조성물은 비강 에어로졸 또는 흡입에 의해 또한 투여될 수 있다. 흡입에 의한 전달을 위해, 조성물은 건조 분말로서 또는 연무기를 통해 액체 형태로 전달될 수 있다. 이러한 조성물은 제약 제제의 업계에 공지된 기술에 따라 제조되고, 염수, 사용하는 벤질 알콜 또는 다른 적합한 보존제, 생체이용률 향상을 위한 흡수 촉진제, 플루오로카본 및/또는 다른 통상적인 가용화제 또는 분산제 중의 용액으로서 제조될 수 있다.
안과 용도로, 제약 조성물은 등장의 pH 조절된 무균 염수 중 미분화된 현탁액으로서, 또는 바람직하게는 벤질알코늄 클로라이드와 같은 보존제를 포함하거나 포함하지 않는 등장의 pH 조절된 무균 식염수 중 용액으로서 제제화될 수 있다. 별법으로, 안과 용도로, 제약 조성물은 바셀린 같은 연고로 제제화될 수 있다.
비경구 투여용 조성물은 무균 주사가능한 용액 및 무균 패키징된 분말의 형태일 수 있다. 바람직하게는, 주사가능한 용액은 pH 약 4.5 내지 약 7.5에서 제제화된다.
본 발명의 조성물의 무균 주사가능한 형태는 수성 또는 유성 현탁액일 수 있다. 이러한 현탁액은 적합한 분산제 또는 습윤제 및 현탁제를 이용하여 당업계에 공지된 기술에 따라 제제화 수 있다. 멸균 주사가능한 제제는 또한 비-독성의 비경구적으로 허용되는 희석제 또는 용매 중의 멸균 주사가능한 용액 또는 현탁액, 예를 들어 1,3-부탄디올 중의 용액일 수 있다. 허용되는 비히클 및 용매 중에서, 물, 링거 용액 및 등장성 염화나트륨 용액을 사용할 수 있다. 또한, 멸균 고정유가 용매 또는 현탁 매질로서 통상적으로 사용된다. 상기 목적을 위해, 합성 모노- 또는 디-글리세리드를 비롯한 임의의 비자극성 고정유가 사용될 수 있다. 지방산, 예를 들면 올레산 및 그의 글리세리드 유도체는 주사용 제제에 유용하며, 제약학상 허용되는 천연 오일, 예컨대 올리브 오일, 피마자유, 특히 그들의 폴리옥시에틸렌화된 버전도 마찬가지이다. 이들 오일 용액 또는 현탁액은 또한 장쇄 알콜 희석제 또는 분산제, 예를 들어 카르복시메틸 셀룰로오스, 또는 에멀젼 및 현탁액을 비롯한 제약학상 허용되는 투여 형태의 제제에 통상적으로 사용되는 유사한 분산제를 함유할 수 있다. 또한, 통상적으로 사용되는 다른 계면활성제, 예를 들어 트윈 (Tween), 스팬 (Span) 및 다른 에멀젼화제, 또는 제약학상 허용되는 고체, 액체 또는 다른 투여 형태의 제조에 통상적으로 사용되는 생체이용률 증진제가 제제의 목적에 따라 사용될 수 있다. 화합물은 볼루스 주사 또는 연속 주입과 같은 주사에 의해 비경구 투여용으로 제제화될 수 있다. 주사용 단위 투여 형태는 앰플 또는 다중-투여 용기일 수 있다.
본 발명의 조성물은 또한 동결건조된 형태로 제공될 수 있다. 이러한 조성물은 투여전 재구성용 완충액, 예컨대 바이카르보네이트를 포함할 수 있거나, 또는 완충액은, 예를 들어 물과 함께 재구성하기 위해 동결건조된 조성물로 포함될 수 있다. 동결건조된 조성물은 적합한 혈관수축제, 예컨대 에피네프린을 추가로 포함할 수 있다. 동결건조된 조성물은 임의로 재구성용 완충액과 함께 패키징된 주사기로 제공될 수 있으며, 이에 따라 재구성된 조성물은 환자에게 즉시 투여될 수 있다.
유효량을 함유하는 상기의 투여 형태 중 어느 것이든 일상적인 실험의 범위 내에 있으며 본 발명의 범위 내에 있다. 치료적 유효 투여량은 투여 경로 및 투여 형태에 따라 달라질 수 있다. 본 발명의 대표적인 화합물 또는 화합물들은 높은 치료 지수를 나타내는 제제이다. 치료 지수는 LD50과 ED50 사이의 비로 표현될 수 있는, 독성과 치료 효과 사이의 투여량 비이다. LD50은 집단의 50%에게 치명적인 투여량이고, ED50은 집단의 50%에서 치료적으로 유효한 투여량이다. LD50과 ED50은 동물 세포 배양 또는 실험 동물의 표준 제약 절차에 의해 결정된다.
상기 기재된 대표적인 투여 형태뿐만 아니라, 제약학상 허용되는 부형제 및 담체, 및 투여 형태는 당업자에게 일반적으로 공지되어 있고, 본 발명에 포함된다. 임의의 특정 환자에 대한 특이적 투여와 치료 요법이 사용된 특이적 화합물의 활성, 환자의 연령, 체중, 전반적 건강 상태, 성별 및 식단, 및 투여 시간, 분비 속도, 약물 조합물, 치료되는 특정 질환에 대한 치료 의사 또는 수의사의 판단을 비롯한 여러 가지 요인에 따라 달라질 것이라는 것을 이해해야 한다. 활성 성분(들)의 양은 또한 조성물에서 특정 화합물 및 다른 치료제 (존재하는 경우)에 따라 달라질 것이다.
e. 사용 방법
본 발명은 syk 및/또는 JAK 활성을 억제하거나 감소시키는 방법, 뿐만 아니라 syk 및/또는 JAK 관련 상태, 증상, 질병, 장애 또는 질환의 치료 또는 완화가 필요한 환자 (예컨대, 인간 또는 비-인간)에서 이를 치료하거나 완화시키는 방법을 제공한다. 한 실시양태에서, syk 및/또는 JAK 관련 상태, 증상, 질병, 장애 또는 질환은 syk 및/또는 JAK 키나제 활성에 의해 적어도 부분적으로 매개된다. 보다 구체적인 실시양태에서, 본 발명은 syk 및/또는 JAK 키나제 활성에 의해 적어도 부분적으로 매개되는 질병 또는 장애 (심혈관 질환, 염증 질환 또는 자가면역 질환)의 치료 방법을 제공한다.
한 실시양태에서, 본 발명은 바람직하지 않은 혈전증을 특징으로 하는 포유동물에게 치료적 유효량의 본 발명의 화합물을 투여하는 단계를 포함하는, 상기 포유동물에서 질병을 예방하거나 치료하는 방법을 제공한다. 상기 질병에는 재협착, 급성 관상 동맥 증후군, 심근 경색, 불안정형 협심증, 난치성 협심증, 혈전용해 요법 후 또는 관상 혈관성형술 후 발생하는 폐색성 관상 혈전, 혈전성 매개된 뇌혈관 증후군, 색전성 뇌졸중, 혈전성 뇌졸중, 일과성 허혈 발작, 정맥 혈전증, 깊은 정맥 혈전증, 폐동맥 색전증, 응고병증, 파종성 혈관내 응고, 혈전성 혈소판감소성 자반증, 폐쇄혈전혈관염, 헤파린-유도 혈소판감소증과 관련된 혈전성 질환, 체외 순환과 관련된 혈전성 합병증, 심장 또는 다른 혈관내 카테터 삽입, 대동맥내 풍선 펌프, 관상동맥 스텐트 또는 심장 판막과 같은 기구 사용과 관련된 혈전성 합병증, 및 보철 장치의 삽입이 필요한 질병 등이 포함되나, 이에 제한되지는 않는다.
추가의 실시양태에서, 본 발명은 혈전증, 면역 혈소판 자반증, 헤파린 유도 혈소판감소증, 확장성 심근병증, 겸상 적혈구 질환, 아테롬성동맥경화증, 심근 경색, 혈관 염증, 불안정형 협심증 또는 급성 관상 동맥 증후군의 치료 방법을 제공한다.
또다른 실시양태에서, 본 발명은 또한 알레르기, 천식, 류마티스양 관절염, B 세포 매개 질환, 예컨대 비-호지킨 림프종, 항인지질 증후군, 루푸스, 건선, 다발성 경화증, 말기 신장 질환 또는 만성 림프구성 백혈병의 치료 방법을 제공한다.
또다른 실시양태에서, 본 발명은 용혈성 빈혈 또는 면역 혈소판감소성 자반증의 치료 방법을 제공한다.
본원에 기재된 화합물은 또한 JAK 키나제의 강력한 및/또는 선택적 억제제이다. 이 활성의 결과로서, 화합물은 JAK 키나제 활성, JAK 키나제가 역할을 하는 신호전달 캐스케이드, 및 이러한 신호전달 캐스케이드에 의해 일어나는 생물학적 반응을 조절하거나 억제하기 위해 다양한 시험관내, 생체내 및 생체외 관점에서 사용될 수 있다. 예를 들어, 한 실시양태에서 상기 화합물을 이용하여 시험관내 또는 생체내에서, 사실상 JAK 키나제를 발현하는 임의의 세포 유형, 예컨대 조혈 세포 (예를 들어, JAK3이 우세하게 발현됨)에서 JAK 키나제를 억제할 수 있다. 또한, 이들을 사용하여 JAK 키나제 (특히 JAK3)가 역할을 하는 신호전달 캐스케이드를 조절할 수 있다. 이러한 JAK-의존성 신호 전달 캐스케이드에는 통상적인 감마쇄, 예를 들어 IL-4, IL-7, IL-5, IL-9, IL-15 및 IL-21을 포함하는 시토킨 수용체의 신호전달 캐스케이드, 또는 IL-2, IL-4, IL-7, IL-9, IL-15 및 IL-21 수용체 신호전달 캐스케이드가 포함되나, 이에 제한되지는 않는다. 또한, 상기 화합물을 시험관내 또는 생체내에서 사용하여 이러한 JAK-의존성 신호 전달 캐스케이드에 의해 영향을 받는 세포적 또는 생물학적 반응을 조절 (특히, 억제)할 수 있다. 이러한 세포적 또는 생물학적 반응에는 IL-4/라모스 CD23 상향조절 및 IL-2 매개된 T-세포 증식이 포함되나, 이에 제한되지는 않는다. 중요하게는, 상기 화합물을 사용하여, JAK 키나제 활성에 의해 전적으로 또는 부분적으로 매개되는 질환 (본원에서 "JAK 키나제 매개 질환"으로 지칭함)의 치료 또는 예방에 대한 치료적 접근법으로서 생체내에서 JAK 키나제를 억제할 수 있다. 상기 화합물을 사용하여 치료하거나 예방할 수 있는 JAK 키나제 매개 질환의 비제한적 예에는 알레르기; 천식; 자가면역 질환, 예컨대 이식편 거부반응 (예를 들어, 신장, 심장, 폐, 간, 췌장, 피부, 소장, 대장, 숙주 대 이식편 반응 (HVGR) 및 이식편 대 숙주 반응 (GVHR)), 류마티스양 관절염 및 근위축성 측삭 경화증; T-세포 매개 자가면역 질환, 예컨대 다발성 경화증, 건선 및 쇼그렌 증후군; 제II형 염증 질환, 예컨대 혈관 염증 (혈관염, 동맥염, 아테롬성동맥경화증 및 관상 동맥 질환 포함); 중추신경계 질환, 예컨대 뇌졸중; 폐 질환, 예컨대 폐쇄성 기관지염 및 원발성 폐 고혈압; 고체, 지연성 제IV형 과민 반응; 및 혈액 악성종양 예컨대 백혈병 및 림프종이 포함되나, 이에 제한되지는 않는다.
상기 방법에 따라 치료 또는 예방될 수 있는 JAK 키나제에 의해 적어도 부분적으로 매개되는 질환의 예에는 알레르기, 천식, 자가면역 질환, 예를 들어 이식편 거부반응 (예컨대, 신장, 심장, 폐, 간, 췌장, 피부, 숙주 대 이식편 반응 (HVGR) 등), 류마티스양 관절염 및 근위축성 측삭 경화증, 다발성 경화증, 건선 및 쇼그렌 증후군, 제II형 염증 질환, 예를 들어 혈관 염증 (혈관염, 동맥염, 아테롬성동맥경화증 및 관상 동맥 질환 포함) 또는 다른 염증 질환, 예를 들어 골관절염, 염증성 장 질환, 궤양성 대장염, 크론병, 특발성 염증성 장 질환, 과민성 장 증후군, 경련성 결장, 저등급 흉터형성 (예컨대, 경피증, 증가된 섬유증, 켈로이드, 수술후 반흔, 폐 섬유증, 혈관 경련, 편두통, 재관류 손상 및 심근 경색후), 및 건성 컴플렉스 또는 증후군, 중추신경계 질환, 예컨대 뇌졸중, 폐 질환, 예컨대 폐쇄성 기관지염 및 원발성 폐 고혈압, 지연성 또는 세포-매개된 제IV형 과민증, 및 고체 및 혈액 악성종양, 예컨대 백혈병 및 림프종이 포함되나, 이에 제한되지는 않는다.
또다른 실시양태에서, 본 발명은 JAK 키나제를 JAK 키나제의 활성을 억제하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)과 접촉시키는 것을 포함하는, JAK 키나제의 활성을 억제하는 방법을 제공한다. 본원에 기재된 상기 방법의 특정 실시양태에서, 상기 방법은 생체내에서 수행된다.
또다른 실시양태에서, 본 발명은 JAK3 키나제를 생체내에서 JAK 키나제의 활성을 억제하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)과 접촉시키는 것을 포함하는, JAK 키나제의 활성을 억제하는 방법을 제공한다.
특정 실시양태에서, 화합물은 기관 및/또는 조직 이식 수용자에서의 거부반응을 치료하고/거나 예방하는데 (즉, 동종이식편 거부반응을 치료하고/거나 예방하는데) 사용될 수 있다. 동종이식편은 공여자 세포의 막에 존재하는 이식 (조직적합성) 항원에 대한 수용자의 세포-매개된 또는 체액성 면역 반응을 통해 거부될 수 있다. 가장 강력한 항원은 인간 백혈구 그룹 A (HLA) 항원으로 명명되는 유전자좌의 복합체에 의해 지배된다. ABO 혈액 그룹 항원과 함께, 이들은 인간에서 검출가능한 주된 이식 항원이다.
일반적으로, 이식 후 거부반응은 초급성 (이식 후 수 시간 내지 수 일 내에 발생); 급성 (이식 후 수 일 내지 수 개월 내에 발생); 및 만성 (이식 후 수 개월 내지 수 년 내에 발생)의 3개의 카테고리로 나눌 수 있다.
초급성 거부반응은 이식편 조직을 공격하는 숙주 항체의 생성에 의해 주로 유발된다. 초급성 거부반응에서, 항체는 이식 직후에 이식 혈관에서 관찰된다. 그 직후, 혈관 응고가 발생하고, 이는 허혈, 최종적으로 괴사 및 사망을 초래한다. 이식편 경색은 공지된 면역억제 요법에 대해 비반응성이다. HLA 항원을 시험관 내에서 동정할 수 있기 때문에, 이식전 스크리닝을 이용하여 초급성 거부반응을 유의하게 감소시킨다. 상기 스크리닝의 결과로서, 초급성 거부반응은 오늘날 비교적 흔치않다.
급성 거부반응은 이식편 조직에 있는 항원 특이적 세포의 축적에 의해 매개되는 것으로 생각된다. 이들 항원 (즉, HVGR 또는 GVHR)에 대한 T-세포-매개 면역 반응이 급성 거부반응의 원칙적인 메카니즘이다. 이들 세포의 축적은 이식편 조직의 손상을 초래한다. CD4+ 헬퍼 T-세포 및 CD8+ 세포독성 T-세포 둘 다 이 과정에 관여하며, 상기 항원은 공여자 및 숙주 수지상 세포에 의해 제시되는 것으로 여겨진다. CD4+ 헬퍼 T-세포는 다른 효과기 세포, 예컨대 대식세포 및 호산구를 이식편으로 동원하는 것을 보조한다. T-세포 활성화 신호 전달 캐스케이드 (예를 들어, CD28, CD40L 및 CD2 캐스케이드)의 접근에도 관여한다.
세포-매개 급성 거부반응은 많은 경우에 면역요법을 강화시킴으로써 역행될 수 있다. 성공적인 역행 이후, 이식편의 심각하게 손상된 성분들은 섬유증에 의해 치유되고, 이식편의 나머지는 정상으로 나타난다. 급성 거부반응을 해결한 후, 면역억제 약물의 투여량은 매우 낮은 수준으로 감소될 수 있다.
신장 이식에서 특히 문제가 되는 만성 거부반응은 종종 증가된 면역억제 요법에도 불구하고 서서히 진행한다. 크게는 세포-매개 제IV형 과민증으로 인한 것으로 생각된다. 병리학적 프로파일이 급성 거부반응과는 상이하다. 동맥 내피가 혈관 내강을 점차적으로 폐색시킬 수 있는 과도한 증식에 주로 관여하여, 허혈, 섬유증, 내막 비후 및 아테롬성 동맥경화증 변화를 초래한다. 만성 거부반응은 주로 이식편 맥관의 진행성 소멸로 인한 것이며, 이는 느린 혈관염 과정과 유사하다.
제IV형 과민증에서, CD8 세포독성 T-세포 및 CD4 헬퍼 T 세포는 각각 클래스 I 또는 클래스 II MHC 분자와 복합체를 형성한 경우 세포내에서 또는 세포외에서 합성된 항원을 인식한다. 대식세포는 항원-제시 세포로서 기능하며, 헬퍼 T-세포의 증식을 촉진시키는 IL-1을 방출한다. 헬퍼 T-세포는 인터페론 감마 및 IL-2를 방출하며, 이들은 함께 대식세포 활성화에 의해 매개된 지연성 과활성 반응 및 T 세포에 의해 매개된 면역성을 조절한다. 기관 이식의 경우, 세포독성 T-세포는 접촉시 이식편 세포를 파괴한다.
JAK 키나제가 T-세포의 활성화에 중요한 역할을 하기 때문에, 본원에 기재된 화합물이 이식편 거부반응의 여러 측면의 치료 및/또는 예방에 사용될 수 있으며, T-세포에 의해 적어도 부분적으로 매개되는 거부 반응 (예컨대, HVGR 또는 GVHR)의 치료 및/또는 예방에 특히 유용하다. 화합물은 또한 이식 수용자, 특히 신장 이식 수용자에서 만성 거부반응을 치료하고/거나 예방하기 위해 사용될 수 있다. 화합물은 또한 이식 수용자에서 조직 또는 기관을 이식하기 전에 상기 조직 또는 기관에 투여될 수 있다.
또다른 실시양태에서, 본 발명은 T-세포 매개 자가면역 질환을 앓는 환자에게 자가면역 질환을 치료하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하는, 상기 자가면역 질환의 치료 방법을 제공한다. 상기 방법의 특정 실시양태에서, 자가면역 질환은 다발성 경화증 (MS), 건선 또는 쇼그렌 증후군이다. 상기 자가면역 질환에는 종종 단일 기관 또는 단일 세포-유형 자가면역 장애로 지정되는 이들 자가면역 질환, 및 종종 전신성 자가면역 장애를 수반하는 것으로 지정되는 이들 자가면역 질환이 포함되나, 이에 제한되지는 않는다. 종종 단일 기관 또는 단일 세포-유형 자가면역 장애로 지정되는 질환의 비제한적 예에는 하시모토 갑상선염, 자가면역성 용혈성 빈혈, 악성 빈혈의 자가면역성 위축성 위염, 자가면역성 뇌척수염, 자가면역성 고환염, 굿패스츄어병, 자가면역성 혈소판감소증, 교감성 안염, 중증 근무력증, 그레이브병, 원발성 담즙성 간경변증, 만성 공격성 간염, 궤양성 대장염 및 막성 사구체병증이 포함된다. 종종 전신성 자가면역 장애를 수반하는 것으로 지정되는 질환의 비제한적 예에는 전신성 홍반성 루푸스, 류마티스양 관절염, 쇼그렌 증후군, 라이터 증후군, 다발성근염-피부근염, 전신성 경화증, 결절성 다발동맥염, 다발성 경화증 및 수포성 유천포창이 포함된다. 베타-세포 (체액성) 기반 또는 T-세포 기반일 수 있는 추가의 자가면역 질환에는 코간 증후군 (Cogan's syndrome), 강직성 척추염, 베게너의 육아종증, 자가면역성 탈모증, 제I형 또는 유년 발병 당뇨병 및 갑상선염이 포함된다.
상기 전구약물을 사용하여 치료하거나 예방할 수 있는 자가면역 질환의 유형에는 일반적으로 내인성 및/또는 외인성 기원의 면역원 또는 항원에 대한 체액성 및/또는 세포-매개 반응의 결과로서 발생하는 조직 손상을 수반하는 이들 장애가 포함된다. 이러한 질환은 종종 비아나필락시스성 (즉, 제II형, 제III형 및/또는 제IV형) 과민 반응을 수반하는 질환으로 지칭된다.
제I형 과민 반응은 일반적으로 비만 세포 및/또는 호염기 세포로부터 약리학적 활성 물질, 예컨대 히스타민이 방출된 후 특정 외인성 항원과 접촉함으로써 발생한다. 상기 언급한 바와 같이, 이러한 제I형 반응은 알레르기성 천식, 알레르기성 비염 등을 비롯한 수많은 질환에서 역할을 한다.
제II형 과민 반응 (또한, 세포독성, 세포용해 보체-의존성 또는 세포-자극성 과민 반응으로 지칭됨)은 면역글로불린이 세포 또는 조직의 항원성 성분, 또는 세포 또는 조직에 친밀하게 연결되는 항원 또는 합텐과 반응하는 경우 발생한다. 통상적으로 제II형 과민 반응과 관련된 질환에는 자가면역성 용혈성 빈혈, 태아적 모구증 및 굿패스츄어병이 포함되나, 이에 제한되지는 않는다.
제III형 과민 반응 (또한, 독성 복합체, 가용성 복합체 또는 면역 복합체 과민 반응으로 지칭됨)은 혈관 또는 조직 내의 가용성의 순환하는 항원-면역글로불린 복합체의 침착 (면역 복합체 침착 부위에서의 급성 염증 반응을 수반함)으로부터 발생한다. 원형적 제III형 반응 질환의 비제한적 예에는 아르투스 (Arthus) 반응, 류마티스양 관절염, 혈청 병, 전신성 홍반성 루푸스, 특정 유형의 사구체신염, 다발성 경화증 및 수포성 유천포창이 포함된다.
제IV형 과민 반응 (종종 세포성, 세포-매개, 지연성 또는 투베르쿨린-유형 과민 반응으로 불림)은 감작화된 T-림프구 (특정 항원과 접촉함으로써 발샘)에 의해 야기된다. 제IV형 반응을 수반하는 것으로 언급된 질환의 비제한적 예에는 접촉성 피부염 및 동종이식 거부반응이 있다.
임의의 상기 비아나필락시스성 과민 반응과 관련된 자가면역 질환은 구조 화학식 I 및 Ia에 따른 전구약물을 사용하여 치료하거나 예방할 수 있다. 특히, 상기 방법은 종종 단일 기관 또는 단일 세포-유형 자가면역 장애를 특징으로 하는이들 자가면역 질환 (하시모토 갑상선염, 자가면역성 용혈성 빈혈, 악성 빈혈의 자가면역성 위축성 위염, 자가면역성 뇌척수염, 자가면역성 고환염, 굿패스츄어병, 자가면역성 혈소판감소증, 교감성 안염, 중증 근무력증, 그레이브병, 원발성 담즙성 간경변증, 만성 공격성 간염, 궤양성 대장염 및 막성 사구체병증이 포함되나 이에 제한되지는 않음), 뿐만 아니라 종종 전신성 자가면역 장애를 수반하는 것을 특징으로 하는 이들 자가면역 질환 (전신성 홍반성 루푸스 (SLE), 류마티스양 관절염, 쇼그렌 증후군, 라이터 증후군, 다발성근염-피부근염, 전신선 경화증, 결절성 다발동맥염, 다발성 경화증 및 수포성 유천포창이 포함되나 이에 제한되지는 않음)의 치료 또는 예방에 사용될 수 있다.
당업자는 다수의 상기-열거한 자가면역 질환이 중증의 증상과 관련되며 그의 개선이 (심지어 근본적인 자가면역 질환이 개선될 수 없는 경우에도) 유의한 치료 이점을 제공한다는 것을 인지할 것이다.
본원에 기재된 화합물을 사용하는 요법은 단독으로 적용될 수 있거나, 또는 다른 통상적인 면역억제 요법제, 예를 들어 메르캅토퓨린; 코르티코스테로이드, 예컨대 프레드니손; 메틸프레드니솔론 및 프레드니솔론; 알킬화제, 예컨대 시클로포스파미드; 칼시뉴린 억제제, 예컨대 시클로스포린, 시롤리무스 및 타크롤리무스; 이노신 모노포스페이트 데히드로게나제의 억제제 (IMPDH), 예컨대 미코페놀레이트, 미코페놀레이트 모페틸 및 아자티오프린; 및 다양한 항체 (예를 들어, 항림프구 글로불린 (ALG), 항흉선세포 글로불린 (ATG), 모노클로날 항-T-세포 항체 (OKT3))를 비롯한, 수용자의 체액성 면역 반응은 그대로 남겨두면서 세포 면역을 억제하는 것으로 지정된 작용제 및 조사와 함께 또는 그를 보조하여 적용될 수 있다. 이들 다양한 작용제는 상업적으로 입수가능한 형태의 약물을 동반하는 처방 정보에 명시된 그들의 표준 또는 일반 투여에 따라 사용될 수 있다 (또한, 문헌 [2006 Edition of The Physician's Desk Reference]의 처방 정보 참조, 상기 개시물은 본원에 참조로 포함됨).
아자티오프린은 현재 상표명 아자산 (AZASAN) 하에 살릭스 파마슈티칼즈 인코포레이티드 (Salix Pharmaceuticals, Inc.)로부터 입수가능하고; 메르캅토퓨린은 현재 상표명 푸린톨 (PURINETHOL) 하에 게이트 파마슈티칼즈 인코포레이티드 (Gate Pharmaceuticals, Inc.)로부터 입수가능하고; 프레드니손 및 프레드니솔론은 현재 록산 래보러토리즈 인코포레이티드 (Roxane Laboratories, Inc.)로부터 입수가능하고; 메틸 프레드니솔론은 현재 화이자 (Pfizer)로부터 입수가능하고; 시롤리무스 (라파마이신)는 현재 상표명 라파문 (RAPAMUNE) 하에 와이어스-에이어스트 (Wyeth-Ayerst)로부터 입수가능하고; 타크롤리무스는 현재 상표명 프로그라프 (PROGRAF) 하에 후지사와 (Fujisawa)로부터 입수가능하고; 시클로스포린은 현재 상표명 샌드이뮨 (SANDIMMUNE) 하에 노바티스 (Novartis)로부터, 그리고 상표명 젠그라프 (GENGRAF) 하에 애보트 (Abbott)로부터 입수가능하고; IMPDH 억제제, 예컨대 미코페놀레이트 모페틸 및 미코페놀산은 현재 상표명 셀셉트 (CELLCEPT) 하에 로슈 (Roche)로부터, 그리고 상표명 마이포틱 (MYFORTIC) 하에 노바티스로부터 입수가능하고; 아자티오프린은 현재 상표명 이뮤란 (IMURAN) 하에 글락소 스미스 클라인 (Glaxo Smith Kline)으로부터 입수가능하고; 항체는 현재 상표명 오르소클론 (ORTHOCLONE) 하에 오르토 바이오테크 (Ortho Biotech)로부터, 상표명 시뮬렉트 (SIMULECT) (바실릭시맙) 하에 노바티스로부터, 그리고 상표명 제나팩스 (ZENAPAX) (다클리주맙) 하에 로슈로부터 입수가능하다.
또다른 실시양태에서, 화합물은 syk 키나제의 억제제와 함께, 또는 그것으로 보조하여 투여될 수 있다. syk 키나제는 Fcy 수용체 신호전달, 뿐만 아니라 다른 신호전달 캐스케이드, 예를 들어 B-세포 수용체 신호전달과 관련된 것들 (문헌 [Turner et al., (2000), Immunology Today 21:148-154]), 및 호중구 내의 인테그린 베타(1), 베타(2) 및 베타(3) (문헌 [Mocsai et al., (2002), Immunity 16:547-558])에서 중요한 역할을 하는 것으로 알려져 있다. 예를 들어, syk 키나제는 비만 세포에서 고친화성 IgE 수용체 신호 전달에 중추적인 역할을 하며, 이는 알레르기성 공격을 촉발시키는 다중 화학적 매개자의 활성화 및 후속적인 방출을 초래한다. 그러나, 지연성 또는 세포-매개 제IV형 과민 반응에 관여하는 경로의 조절을 보조하는 JAK 키나제와는 달리, syk 키나제는 즉각적인 IgE-매개 제I형 과민 반응에 관여하는 경로의 조절을 보조한다. syk 경로에 영향을 미치는 특정 화합물은 JAK 경로에도 영향을 미칠 수 있거나, 그렇지 않을 수 있다.
적합한 syk 억제 화합물은, 예를 들어 2003년 1월 31일 출원된 일련 번호 10/355,543 (공개 번호 2004/0029902); WO 03/063794; 2003년 7월 29일 출원된 일련 번호 10/631,029; WO 2004/014382; 2004년 7월 30일 출원된 일련 번호 10/903,263; 2004년 7월 30일 출원된 PCT/US2004/24716 (WO005/016893); 2004년 7월 30일 출원된 일련 번호 10/903,870; 2004년 7월 30일 출원된 PCT/US2004/24920; 2004년 11월 24일 출원된 일련 번호 60/630,808; 2005년 1월 19일 출원된 일련 번호 60/645,424; 및 2005년 2월 18일 출원된 일련 번호 60/654,620 (상기 개시물들은 본원에 참조로 포함됨)에 기재되어 있다. 본원에 기재된 syk 억제 화합물은 단독으로 사용될 수 있거나, 또는 1종 이상의 상기 기재된 통상적인 이식편 거부반응 치료제와 함께 사용될 수 있다.
특정 실시양태에서, 화합물은 syk 억제 화합물을 이용한 치료에 대해 또는 특정 질환을 위한 다른 현행 치료 중 하나에 대해 초기에 비-반응성 (내성)이거나 또는 비-반응성으로 되는 환자에서 이들 질환을 치료 또는 예방하는데 사용될 수 있다. 또한, 화합물은 syk-화합물 저항성 또는 비-반응성인 환자에서 syk 억제 화합물과 함께 사용될 수 있다. 화합물과 함께 투여될 수 있는 적합한 syk-억제 화합물이 하기 제공되어 있다.
또다른 실시양태에서, 본 발명은 T-세포 매개 자가면역 질환을 앓는 환자에게 본원에 기재된 바와 같이 자가면역 질환의 치료에 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며, 화합물이 syk 키나제를 10 μM 이상 범위의 IC50으로 억제하는 화합물과 함께 또는 그를 보조하여 투여되는 것인, T-세포 매개 자가면역 질환을 치료하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 이식 수용자에게 본원에 기재된 바와 같이 동종이식 이식편 거부반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하는, 상기 이식 수용자에서 동종이식 이식편 거부반응을 치료 또는 예방하는 방법을 제공한다. 추가의 실시양태에서, 상기 화합물은 이식 수용자에서 조직 또는 기관을 이식하기 전에 상기 조직 또는 기관에 투여된다.
또다른 실시양태에서, 본 발명은 이식 수용자에게 동종이식 이식편 거부반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 거부반응이 급성 거부반응인, 상기 이식 수용자에서 동종이식편 이식 거부증을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 이식 수용자에게 동종이식 이식편 거부반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 거부반응이 만성 거부반응인, 상기 이식 수용자에서 동종이식편 이식 거부증을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 이식 수용자에게 본원에 정의된 바와 같이 동종이식 이식편 거부반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 거부반응이 HVGR 또는 GVHR에 의해 매개되는 것인, 상기 이식 수용자에서 동종이식편 이식 거부증을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 이식 수용자에게 본원에 정의된 바와 같이 동종이식 이식편 거부반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 동종이식 이식편이 신장, 심장, 간 및 폐인, 상기 이식 수용자에서 동종이식편 이식 거부증을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 이식 수용자에게 본원에 정의된 바와 같이 동종이식 이식편 거부반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 동종이식 이식편이 신장, 심장, 간 및 폐이고, 화합물이 또다른 면역억제제와 함께 또는 그를 보조하여 투여되는 것인, 상기 이식 수용자에서 동종이식편 이식 거부증을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 이식 수용자에게 본원에 정의된 바와 같이 동종이식 이식편 거부반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 동종이식 이식편이 신장, 심장, 간 및 폐이고, 화합물이 또다른 면역억제제와 함께 또는 그를 보조하여 투여되고, 면역억제제가 시클로스포린, 타크롤리무스, 시롤리무스, IMPDH 억제제, 마이코페놀레이트, 마이코페놀레이트 모페틸, 항-T-세포 항체 및 OKT3으로부터 선택되는 것인, 상기 이식 수용자에서 동종이식편 이식 거부증을 치료 또는 예방하는 방법을 제공한다.
본원에 기재된 화합물은 IL-4 신호전달의 시토킨 감속재이다. 따라서, 화합물은 제I형 과민 반응의 반응을 늦출 수 있다. 따라서, 특정 실시양태에서 화합물은 이러한 반응, 및 이에 따라 이러한 과민 반응과 관련되거나, 그에 의해 매개되거나 야기되는 질환 (예를 들어, 알레르기)을 예방적으로 치료하기 위해 사용될 수 있다. 예를 들어, 알레르기 환자는 알레르겐에 대한 예상된 노출 이전에 알레르기성 반응의 개시 또는 진행을 지연시키거나, 이들 모두를 제거하기 위해 하나 이상의 본원에 기재된 JAK 선택적 화합물을 복용할 수 있다.
이러한 질환을 치료하거나 예방하는데 사용되는 경우, 화합물은 단독으로, 1종 이상 활성 화합물들의 혼합물로써, 또는 상기 질환 및/또는 상기 질환과 관련된 증상을 치료하는데 유용한 다른 작용제와의 혼합물 또는 조합물로 투여될 수 있다. 화합물은 또한 다른 장애 또는 질병의 치료에 유용한 작용제, 예컨대 스테로이드, 막 안정화제, 5-리폭시게나제 (5LO) 억제제, 류코트리엔 합성 및 수용체 억제제, IgE 이소형 스위칭 또는 IgE 합성의 억제제, IgG 이소형 스위칭 또는 IgG 합성의 억제제, 베타-효능제, 트립타제 억제제, 아스피린, 시클로옥시게나제 (COX) 억제제, 메토트렉세이트, 항-TNF 약물, 항-CD20 항체, PD4 억제제, p38 억제제, PDE4 억제제 및 항히스타민제 등과의 혼합물 또는 조합물로 투여될 수 있다. 화합물은 전구약물 자체의 형태로, 또는 활성 화합물 또는 전구약물을 포함하는 제약 조성물로 투여될 수 있다.
또다른 실시양태에서, 본 발명은 본원에 정의된 바와 같이 대상체에게 제IV형 과민 반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하는, 제IV형 과민 반응을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 본원에 정의된 바와 같이 대상체에게 제IV형 과민 반응을 치료하거나 예방하는데 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 알레르겐에 노출되기 전에 투여하는 것을 포함하며 예방적으로 실시되는 것인, 제IV형 과민 반응을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 본원에 정의된 바와 같이 JAK3 키나제가 역할을 하는 신호 전달 캐스케이드에 관여하는 수용체를 발현하는 세포를 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)과 접촉시키는 것을 포함하는, JAK3 키나제가 역할을 하는 신호 전달 캐스케이드를 억제하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 본원에 기재된 바와 같이 대상체에게 JAK 키나제-매개 질환의 치료 또는 예방에 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하는, JAK 키나제-매개 질환을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 본원에 기재된 바와 같이 대상체에게 JAK 키나제-매개 질환의 치료 또는 예방에 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 JAK 키나제-매개 질환이 HVGR인 GVHR인, JAK 키나제-매개 질환을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 본원에 기재된 바와 같이 대상체에게 JAK 키나제-매개 질환의 치료 또는 예방에 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 JAK 키나제-매개 질환이 급성 동종이식 거부반응인, JAK 키나제-매개 질환을 치료 또는 예방하는 방법을 제공한다.
또다른 실시양태에서, 본 발명은 본원에 기재된 바와 같이 대상체에게 JAK 키나제-매개 질환의 치료 또는 예방에 효과적인 양의 화합물 (여기서, 화합물은 본 발명의 화합물로부터 선택됨)을 투여하는 것을 포함하며 상기 JAK 키나제-매개 질환이 만성 동종이식 거부반응인, syk 및/또는 JAK 키나제-매개 질환을 치료 또는 예방하는 방법을 제공한다.
본 발명의 활성 화합물은 전형적으로 syk 및/또는 JAK/Stat 경로를 억제한다. syk 및/또는 JAK 키나제의 억제제로서의 특정 화합물의 활성은 시험관내 또는 생체내에서 평가될 수 있다. 일부 실시양태에서, 특정 화합물의 활성을 세포 분석으로 시험할 수 있다.
"세포 증식성 장애"는 세포의 비정상적 증식을 특징으로 하는 장애를 지칭한다. 증식성 장애는 세포 성장 속도와 관련해서는 어떠한 제한을 포함하지 않지만, 단지 성장 및 세포 분화에 영향을 미치는 정상적인 조절의 소실을 나타낸다. 따라서, 일부 실시양태에서, 증식성 장애의 세포는 정상 세포와 동일한 세포 분화 속도를 가질 수 있지만, 이러한 성장을 제한하는 신호에는 반응하지 않는다. "세포 증식성 장애"의 범위내에 비정상적인 조직 성장인 신생물 또는 종양이 있다. 암은 주변 조직으로 침윤하고/거나 새로운 콜로니 형성 부위로 전이하는 능력을 가진 세포 증식을 특징으로 하는 임의의 다양한 악성 신생물을 지칭한다.
일반적으로, 본원에 기재된 화합물로 치료가능한 세포 증식성 장애는 이상 세포 증식을 특징으로 하는 임의의 장애와 관련된다. 이들에는 양성 또는 악성, 전이성 또는 비-전이성의 다양한 종양 및 암이 포함된다. 조직 침윤 또는 전이와 같은 암의 특이적 특성은 본원에 기재된 방법을 이용하여 표적화될 수 있다. 세포 증식성 장애에는 난소암, 신장암, 위장관암, 신장암, 방광암, 췌장암, 폐 편평세포 암종 및 선암종 등을 비롯한 다양한 암이 포함된다.
일부 실시양태에서, 치료되는 세포 증식성 장애는 조혈계 세포의 이상 성장인 조혈 신생물이다. 조혈 악성종양은 조혈에 관여하는, 다능성 줄기 세포, 다기능 선조 세포, 소기능 수임 선조 세포, 전구체 세포 및 말단 분화된 세포에서 그의 기원을 가질 수 있다. 일부 혈액 악성종양은 자가 재생 능력을 가진 조혈 줄기 세포로부터 발생하는 것으로 여겨진다. 예를 들어, 이식시 급성 골수성 백혈병 (AML)의 특정 아형을 생성할 수 있는 세포 (문헌 [Cynthia K. Hahn, Kenneth N. Ross, Rose M. Kakoza, Steven Karr, Jinyan Du, Shao-E Ong, Todd R. Golub, Kimberly Stegmaier, Syk is a new target for AML differentiation, Blood, 2007, 110, Abstract 209])는 조혈 줄기 세포의 세포 표면 마커를 발현하여 백혈병 세포의 공급원으로서 조혈 줄기 세포를 연루시킨다. 조혈 줄기 세포의 세포 마커 특징을 갖지 않는 모세포는 이식시 종양을 자리잡게 할 수 없는 것으로 나타난다 (문헌 [Blaire et al., 1997, Blood 89:3104-3112]). 특정 혈액 악성종양의 줄기 세포 기원은 또한, 특정한 유형의 백혈병과 연관된 특이적 염색체 비정상이 백혈병 모세포 뿐만 아니라 조혈 계열의 정상 세포에서 발견될 수 있다는 관찰에 의해 뒷받침된다. 예를 들어, 만성 골수성 백혈병의 대략 95%와 연관된 상호 전위 t(9q34;22q11)가 골수성, 적구성 및 림프성 계열의 세포에 존재하는 것으로 나타나, 이는 염색체 이상이 조혈성 줄기 세포에서 기원함을 시사한다. 특정 유형의 CML에서 세포의 하위군은 조혈 줄기 세포의 세포 마커 표현형을 제시한다.
조혈 신생물이 종종 줄기 세포로부터 비롯됨에도 불구하고, 발달 계열의 수임 선조 세포 또는 보다 말단 분화된 세포 또한 일부 백혈병의 공급원일 수 있다. 예를 들어, 일반적인 골수성 선조 또는 과립백혈구/대식세포 선조 세포에서 융합 단백질 Bcr/Abl (만성 골수성 백혈병과 연관됨)의 강제 발현은 백혈병-유사 질병을 일으켰다. 더욱이, 백혈병의 아형과 연관된 일부 염색체 이상은 조혈 줄기 세포의 마커 표현형을 가진 세포 집단에서 발견되지 않지만, 조혈 경로의 더욱 분화된 상태의 마커를 제시하는 세포 집단에서는 발견된다 (문헌 [Turhan et al., 1995, Blood 85:2154-2161]). 따라서, 수임 선조 세포 및 다른 분화된 세포는 세포 분열에 대해 제한된 능력만을 가질 수 있는 반면에, 백혈병 세포는 일부 예에서 조혈 줄기 세포의 자가 재생 특징을 모방하는, 조절되지 않은 성장 능력을 가질 수 있다 (문헌 [Passegue et al., Proc. Natl. Acad. Sci. USA, 2003, 100:11842-9]).
일부 실시양태에서, 치료되는 조혈 신생물은 림프 신생물이다 (여기서 비정상 세포가 림프 계열 세포의 특정 표현형으로부터 유래하고/거나 이를 제시함). 림프 신생물은 B-세포 신생물, T 및 NK-세포 신생물, 및 호지킨 림프종으로 세분될 수 있다. B-세포 신생물은 전구체 B-세포 신생물 및 성숙/말초 B-세포 신생물로 추가로 세분될 수 있다. 예시적인 B-세포 신생물에는 전구체 B-림프모세포성 백혈병/림프종 (전구체 B-세포 급성 림프모세포성 백혈병)이 있고, 예시적인 성숙/말초 B-세포 신생물에는 B-세포 만성 림프구성 백혈병/소 림프구성 림프종, B-세포 전림프구성 백혈병, 림프형질세포성 림프종, 비장 변연부 B-세포 림프종, 모발상 세포 백혈병, 형질 세포 골수종/형질세포증, MALT 유형의 림프절외 변연부 B-세포 림프종, 림프절 변연부 B-세포 림프종, 여포성 림프종, 외투-세포 림프종, 미만성 거대 B-세포 림프종, 종격동 거대 B-세포 림프종, 원발성 삼출성 림프종, 및 버킷 림프종/버킷 세포 백혈병이 있다. T-세포 및 Nk-세포 신생물은 전구체 T-세포 신생물 및 성숙 (말초) T-세포 신생물로 추가로 세분된다. 예시적인 전구체 T-세포 신생물에는 전구체 T-림프모세포성 림프종/백혈병 (전구체 T-세포 급성 림프모세포성 백혈병)이 있고, 예시적인 성숙 (말초) T-세포 신생물에는 T-세포 전림프구성 백혈병 T-세포 과립형 림프구성 백혈병, 공격성 NK-세포 백혈병, 성인 T-세포 림프종/백혈병 (HTLV-1), 림프절외 NK/T-세포 림프종, 비강 유형, 장질환 유형의 T-세포 림프종, 간비장 감마-델타 T-세포 림프종, 피하 지방층염-유사 T-세포 림프종, 균상 식육종/세자리 증후군, 퇴행성 거대-세포 림프종, T/눌 세포, 원발성 피부 유형, 말초 T-세포 림프종, 달리 특징화되지 않은, 혈관면역모세포형 T-세포 림프종, 퇴행성 거대-세포 림프종, T/눌 세포, 원발성 전신성 유형이 있다. 림프 신생물의 제3 구성원은 호지킨 림프종이며, 이는 호지킨병으로도 지칭된다. 본 발명의 화합물로 치료될 수 있는 이러한 부류의 예시적인 진단으로는 특히 결절성 림프구-우세형 호지킨 림프종, 및 다양한 부류 형태의 호지킨병이 있으며, 그의 예시적인 구성원은 결절성 경화성 호지킨 림프종 (등급 1 및 2), 림프구-충만성 전형적 호지킨 림프종, 혼합 세포형 호지킨 림프종 및 림프구 결핍 호지킨 림프종이다. 다양한 실시양태에서, 이상 JAK 활성과 연관된 임의의 림프 신생물은 syk 및/또는 JAK 억제 화합물로 치료될 수 있다.
일부 실시양태에서, 치료되는 조혈 신생물은 골수성 신생물이다. 이 군에는 골수 계열 세포의 특정 표현형을 포함하거나 이를 제시하는 큰 부류의 세포 증식성 장애가 포함된다. 골수성 신생물은 골수증식성 질환, 골수이형성/골수증식성 질환, 골수이형성 증후군 및 급성 골수성 백혈병으로 세분될 수 있다. 예시적인 골수증식성 질환에는 만성 골수성 백혈병 (예를 들어, 필라델피아 염색체 양성 (t(9;22)(qq34;q11)), 만성 호중구성 백혈병, 만성 호산구성 백혈병/과호산구성 증후군, 만성 특발성 골수섬유증, 진성 적혈구증가증 및 본태성 고혈소판증이 있다. 예시적인 골수이형성/골수증식성 질환에는 만성 골수단구성 백혈병, 비정형 만성 골수성 백혈병 및 소아 골수단구성 백혈병이 있다. 예시적인 골수이형성 증후군에는 환상 철적모구를 갖는, 그리고 환상 철적모구를 갖지 않는 불응성 빈혈, 다계열성 이형성을 수반하는 불응성 혈구감소증 (골수이형성 증후군), 과다 모세포를 갖는 불응성 빈혈증 (골수이형성 증후군), 5q-증후군 및 골수이형성 증후군이 있다. 다양한 실시양태에서, 이상 syk 및/또는 JAK 활성과 연관된 임의의 골수성 신생물은 syk 및/또는 JAK 억제 화합물로 치료될 수 있다.
일부 실시양태에서, 본 발명의 화합물은 자체의 세분된 장애를 가진 큰 부류의 골수성 신생물을 나타내는 급성 골수성 백혈병 (AML)을 치료하는데 사용될 수 있다. 이러한 세분된 장애에는 특히 재발성 세포유전 전위를 수반하는 AML, 다계열성 이형성을 수반하는 AML, 및 달리 분류되지 않은 다른 AML이 포함된다. 예시적인 재발성 세포유전 전위를 수반하는 AML에는 특히 t(8;21)(q22;q22)를 갖는 AML, AML1(CBF-알파)/ETO, 급성 전골수구성 백혈병 (t(15;17)(q22;q11-12) 및 변이체, PML/RAR-알파를 갖는 AML), 비정상적인 골수 호산구 (inv(16)(p13q22) 또는 t(16;16)(p13;q11), CBFb/MYH11X)를 갖는 AML, 및 비정상 11q23 (MLL)을 갖는 AML이 포함된다. 예시적인 다계열성 이형성을 수반하는 AML에는 이전의 골수이형성 증후군과 연관되거나 연관되지 않는 것들이 있다. 어떠한 정의가능한 군으로도 분류되지 않는 다른 급성 골수성 백혈병에는 최소 분화성 AML, 비성숙형 AML, 성숙형 AML, 급성 골수단구성 백혈병, 급성 단구성 백혈병, 급성 적구성 백혈병, 급성 거핵구성 백혈병, 급성 호염기성 백혈병, 및 골수섬유증을 수반하는 급성 범골수증이 포함된다.
본 발명의 문맥내의 "치료"는 장애 또는 질환과 관련된 증상의 경감, 이들 증상의 추가 진행 또는 악화의 중지, 또는 질환 또는 장애의 방지 또는 예방을 의미한다.
용어 "포유동물"은 syk 및/또는 JAK를 발현하는 유기체를 포함한다. 포유동물의 예에는 마우스, 래트, 돼지, 염소, 말, 곰, 원숭이, 개, 고양이 및, 바람직하게는 인간이 포함된다. syk 및/또는 JAK를 발현하는 트랜스제닉 유기체 또한 본 정의에 포함된다.
본 발명의 방법은 포유동물 또는 비-인간 동물에게 유효량의 본원에 기재된 화합물 또는 조성물을 투여하는 것을 포함한다. 본원에 사용된 본 발명의 화합물 또는 조성물의 "유효량"은 syk 및/또는 JAK를 길항시키거나 억제하는 그의 양을 포함한다. syk 및/또는 JAK를 길항시키거나 억제하는 양은, 예를 들어 syk 및/또는 JAK 활성을 측정할 수 있는 임의의 분석 (예시적 시험 방법으로서 하기 가재한 것 포함)에 의해 검출가능하다. 또한, 유효량은, syk 및/또는 JAK의 억제로 치료가능한 syk 및/또는 JAK 관련 장애의 증상을 경감시키는 그의 양을 포함할 수 있다. 따라서, "syk의 길항제" 또는 "JAK의 길항제"는, 각각 syk 또는 JAK와 상호작용하는 화합물, 및 각각 syk 또는 JAK와 상호작용하기 위해 제2 화합물 (예컨대, 또다른 syk 또는 JAK 리간드)의 능력을 조절 (예컨대, 억제 또는 감소)하는 화합물을 포함한다. syk 또는 JAK 결합 화합물은, 바람직하게는 각각 syk 또는 JAK의 길항제이다. 단어 "syk 결합 화합물" 및 "JAK-결합 화합물" (예컨대, 수용체에 대한 결합 친화도를 나타냄)은 syk 또는 JAK와 상호작용하여 각각 syk 또는 JAK의 활성의 조절을 유발하는 이들 화합물을 포함한다. syk 및/또는 JAK 결합 화합물은 시험관내 (예컨대, 세포 및 비-세포 기반) 또는 생체내 방법을 이용하여 동정될 수 있다. 시험관내 방법에 대한 기재가 하기 제공된다.
본원에 기재된 방법 및 조성물에 제시되는 화합물의 양은 실시예에 기재된 임의의 분석에 의해 측정된 바와 같이 장애의 중증도에 있어서 검출가능한 감소를 유발하기에 충분해야 한다. 요구되는 syk 및/또는 JAK 조절제의 양은 주어진 세포 유형에 대한 조절제의 효과 및 장애의 치료에 요구되는 기간에 따라 달라질 것이다. 특정 실시양태에서, 본 발명의 조성물은 또다른 치료제를 추가로 포함할 수 있다. 제2 작용제가 사용되는 경우, 제2 작용제는 별도의 투여 형태로서, 또는 본 발명의 화합물 또는 조성물을 함유하는 단일 투여 형태의 일부로서 투여될 수 있다. 하나 이상의 본 발명의 화합물이 장애, 질환 또는 증상을 치료하기 위해 단일요법의 적용에 사용될 수 있지만, 또한 조합 요법에도 사용될 수 있으며, 여기서 본 발명의 화합물 또는 조성물 (치료제)의 사용은 동일한 것 및/또는 다른 유형의 장애, 증상 및 질환을 치료하기 위한 하나 이상의 다른 치료제의 사용과 조합된다. 조합 요법은 2개 이상의 치료제를 동시에 또는 순차적으로 투여하는 것을 포함한다. 작용제는 임의의 순서로 투여될 수 있다. 별법으로, 다중 치료제를 환자에게 투여할 수 있는 단일 조성물로 조합할 수 있다. 예를 들어, 단일 제약 조성물은 화학식 I에 따른 화합물 또는 그의 제약상 허용되는 염, 에스테르 또는 전구약물, 또다른 치료제 (예컨대, 메토트렉세이트) 또는 그의 제약상 허용되는 염, 에스테르 또는 전구약물, 및 제약상 허용되는 부형제 또는 담체를 포함할 수 있다.
본 발명은 화학식 I을 갖는 화합물, 본 발명의 화합물의 제조 방법, 하나 이상의 본 발명의 화합물 및 하나 이상의 제약상 허용되는 담체 또는 부형제로부터 제약 조정물을 제조하는 방법, 하나 이상의 본 발명의 화합물을 사용하여 다양한 장애, 증상 및 질환 (예컨대, 염증성, 자가면역, 신경계, 신경퇴행성, 종양학 및 심혈관), 예를 들어 RA, 골관절염, 과민성 장 질환 IBD, 천식, 만성 폐쇄성 폐 질환 COPD 및 MS를 치료하는 방법을 포함한다. 본 발명의 화합물 및 그의 제약상 허용되는 염 및/또는 중성 조성물은 제약상 허용되는 부형제 또는 담체와 함께 제제화될 수 있으며, 생성된 조성물은 다양한 장애, 증상 및 질환의 치료를 위해 포유동물, 예컨대 남성, 여성 및 동물에게 생체내 투여될 수 있다. 또한, 본 발명의 화합물은 다양한 장애, 증상 및 질환의 치료에 유용한 의약의 제조에 사용될 수 있다.
본 발명의 모든 화합물은, 각각의 분석에서 5 μM 미만 (최대 나노몰랄 단위 포함)의 범위, 및 일부 경우 나노몰랄 미만의 범위의 IC50을 나타내는 syk 및/또는 JAK 키나제의 강력한 억제제이다. 일부 실시양태에서, 본 발명의 화합물 syk 및 JAK 키나제 모두를 어느 정도로 억제하는 "이중" syk/JAK 억제제일 수 있다. 다른 실시양태에서, 본 발명의 화합물은 syk 키나제를 선택적으로 억제할 수 있지만, 하나 이상의 JAK 키나제를 현저히 억제하지는 않는다. 다른 실시양태에서, 본 발명의 화합물은 JAK 키나제를 선택적으로 억제할 수 있지만, 하나 이상의 syk 키나제를 현저히 억제하지는 않는다.
f.
키트
본 발명의 또다른 측면은 단일 패키지 내에 별도의 용기를 포함하는 키트를 제공하기 위한 것이다 (여기서, syk 및/또는 JAK가 역할을 하는 상태, 장애, 증상 및 질환을 치료하기 위해 본 발명의 제약적 화합물, 조성물 및/또는 그의 염을 제약상 허용되는 담체와 함께 사용함).
I.
실시예
하기 실시예는 본 발명을 예시하기 위해 제공되지만, 이에 제한되는 것은 아니다.
이들 화합물의 제조에 일반적으로 사용된 출발 물질 및 시약은 상업적 공급업체, 예컨대 알드리치 케미컬 코포레이션 (Aldrich Chemical Co.)으로부터 입수가능하거나, 또는 당업자에게 공지된 방법으로, 문헌 [Fieser and Fieser's Reagents for Organic Synthesis; Wiley & Sons: New York, 1967-2004, Volumes 1-22]; [Rodd's Chemistry of Carbon Compounds, Elsevier Science Publishers, 1989, Volumes 1-5 and Supplementals]; 및 [Organic Reactions, Wiley & Sons: New York, 2005, Volumes 1-65]와 같은 참고문헌에 설명되어 있는 절차에 따라 제조할 수 있다.
합성 반응식의 출발 물질 및 중간체는 여과, 증류, 결정화, 크로마토그래피 등을 비롯한 (이에 제한되지는 않음) 통상적 기술을 이용하여 단리 및 정제 (원하는 경우)할 수 있다. 이러한 물질은 물리적 상수 및 스펙트럼 데이터를 비롯한 통상적인 수단을 이용하여 특징화될 수 있다.
달리 명시되지 않는 한, 본원에 기재된 반응은 바람직하게는 불활성 분위기하에 대기압에서 약 -78℃ 내지 약 150℃, 보다 바람직하게는 약 0℃ 내지 약 125℃, 가장 바람직하고 편리하게는 약 실온 (또는 주위 온도), 예를 들어 약 20℃ 내지 약 75℃의 반응 온도 범위에서 수행된다.
하기 실시예와 관련하여, 본 발명의 화합물들은 본원에 기재된 방법 또는 당업계에 공지된 다른 방법을 이용하여 합성되었다.
화합물 및/또는 중간체는 2695 분리 모듈이 장착된 워터스 얼라이언스 (Waters Alliance) 크로마토그래피 시스템 (매사추세츠주, 밀포드)을 이용하는 고성능 액체 크로마토그래피 (HPLC)로 특징화할 수 있다. 분석 컬럼은 머크 (Merck) KGaA (독일 다름슈타트)의 C-18 스피드로드(SpeedROD) RP-18E 컬럼일 수 있다. 별법으로, 워터스 악퀴티 (Waters Acquity) UPLC BEH C-18 2.1 mm x 15 mm 컬럼이 장착된 워터스 유니티 (Waters Unity) (UPLC) 시스템을 이용하여 특징화를 수행할 수 있다. 전형적으로 5% 아세토니트릴/95% 물로 출발하여 얼라이언스 시스템의 경우에는 5분의 기간에 걸쳐, 악퀴티 시스템의 경우에는 1분에 걸쳐 95%의 아세토니트릴로 진행하는 구배 용리를 이용할 수 있다. 모든 용매는 0.1% 트리플루오로아세트산 (TFA)을 함유할 수 있다. 화합물은 220 nm 또는 254 nm에서의 자외선 (UV) 흡수에 의해 검출할 수 있다. HPLC 용매는 EMD 케미칼스, 인코포레이티드 (EMD Chemicals, Inc.) (뉴저지주, 깁스타운)로부터 입수할 수 있다. 일부 경우에, 순도는 유리 배킹 실리카 겔 플레이트, 예를 들어 EMD 실리카겔 60 2.5cm x 7.5cm 플레이트를 이용하여 박막 크로마토그래피 (TLC)로 평가할 수 있다. TLC 결과는 자외선 광하에 또는 공지된 요오드 증기 및 기타 다양한 염색 기술을 이용하여 육안으로 쉽게 검출할 수 있다.
질량 분광 분석은 이동상으로서 아세토니트릴/물을 사용하여 2종의 애질런트 (Agilent) 1100 시리즈 LCMS 기기 중 하나에서 수행할 수 있다. 한 시스템은 TFA를 변형제로 사용하여 양이온 방식으로 측정할 수 있고 [MH+, (M+1) 또는 (M+H)+로 보고함], 다른 한 시스템은 포름산 또는 아세트산암모늄을 사용하여 양이온 [MH+, (M+1) 또는 (M+H)+로 보고함] 및 음이온 [M-, (M-1) 또는 (M-H)-로 보고함] 방식 모두로 측정할 수 있다.
핵 자기 공명 (NMR) 분석은 배리언 (Varian) 400 MHz NMR (캘리포니아주, 팔로 알토)을 이용하여 일부 화합물에 대해서 수행할 수 있다. 스펙트럼 표준물은 TMS이거나, 또는 화학 이동이 공지된 용매일 수 있다.
본 발명의 일부 화합물의 순도는 원소 분석 (로버트슨 마이크로리트 (Robertson Microlit), 뉴저지주, 매디슨)으로 평가할 수 있다.
융점은 래버러토리 디바이시스 융점 측정기 (Laboratory Devices Mel-Temp apparatus) (매사추세츠주, 홀리스톤)로 측정할 수 있다.
정제용 분리는 Sq16x 또는 Sg100c 크로마토그래피 시스템 및 예비패키징된 실리카겔 컬럼 (모두 텔레다인 이스코 (Teledyne Isco) (네브라스카주, 링컨)로부터 구입함)을 사용하여 수행할 수 있다. 별법으로, 화합물 및 중간체는 실리카겔 (230 내지 400 메쉬) 패킹 물질을 사용한 플래시 컬럼 크로마토그래피, 또는 C-18 역상 컬럼을 사용한 HPLC로 정제할 수 있다. 이스코 시스템 및 플래시 컬럼 크로마토그래피에 사용되는 전형적인 용매는 디클로로메탄, 메탄올, 에틸 아세테이트, 헥산, 아세톤, 수성 히드록시아민 및 트리에틸 아민일 수 있다. 역상 HPLC에 사용되는 전형적인 용매는 0.1% 트리플루오로아세트산을 함유하는 다양한 농도의 아세토니트릴 및 물일 수 있다.
일반적 방법
하기 합성 반응식은 단지 본 발명의 화합물을 합성할 수 있는 몇가지 방법을 예시할 뿐이며, 이러한 합성 반응식에 다양한 변형이 가해질 수 있고, 본 출원에 포함된 개시내용을 참조하는 당업자에게 제안될 것이다.
실시예 1. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드 1
<반응식 1>
단계 1: 티오닐 클로라이드 (425 mL) 중 카르복실산 1.1 (85 g, 540 mmol)의 교반 용액에 피리딘 (8.5 mL, 0.11 mmol)을 서서히 첨가하였다. 반응물을 75℃에서 밤새 교반하였고, 상기 시간에 이를 농축시키고, 진공하에 밝은 황색 분말로 건조시켜, 다음 단계에 즉시 사용하였다.
단계 2: 이전 단계로부터의 황색 고체를 에탄올 750 mL로 서서히 희석하고, 밤새 환류시켰다. 다음 날, HPLC로 반응이 완료된 것을 측정하고, 이어서 얼음 배스에서 냉각시키고, 고체를 여과하고, 디에틸 에테르로 세척하여, 목적하는 에틸 에스테르 (1.3)를 회백색 분말 (91 g, 두 단계에 대해 87%)로서 수득하였다.
단계 3: 에스테르 1.3 (22 g, 120 mmol)을 옥시염화인 (60 mL, 600 mmol) 중에 용해시키고, 혼합물을 N,N-디에틸아닐린 (27 mL, 167 mmol)으로 처리하고, HPLC로 반응이 완료된 것이 측정될 때까지 혼합물을 105℃로 가열하였다. 이어서, 이를 실온으로 냉각시키고, 분쇄된 얼음 1 ℓ를 서서히 첨가하자 베이지색 침전물이 형성되었고, 이를 여과에 의해 수집하고, 진공하에 건조시켜, 목적하는 디클로라이드 (1.4)를 밝은 황색 분말 (22.5 g, 85%)로서 수득하였다.
단계 4: 디클로로피리미딘 1.4 (5.9 g, 27 mmol)를 아세토니트릴 (50 mL) 중에 용해시키고, 디이소프로필아민 (5.2 mL, 30 mmol)에 이어서 시클로부틸 아민 (1.9 g, 27 mmol)으로 순차적으로 처리하고, 모든 출발 물질이 소비될 때까지 실온에서 교반하였다. 이어서, 물을 사용하여 반응 혼합물을 총 150 mL의 부피로 희석하고, 침전물을 여과에 의해 수집하여, 목적하는 생성물을 밝은 황색 고체 (6.02 g, 87%)로서 수득하였다.
단계 5: 에틸 에스테르 1.5 (6.02 g, 24 mmol)를 1,4-디옥산 (26 mL)에 이어서 수성 수산화리튬 (1.0 M, 26 mL, 26 mmol)으로 희석하고, 모든 출발 물질이 카르복실산으로 전환될 때까지 실온에서 교반하였다. 이어서, 물을 사용하여 반응물을 총 100 mL의 부피로 희석하고, 6 M HCl을 사용하여 pH = 2로 산성화시켰다. 이어서, 생성된 현탁액을 여과하고, 흡인 건조시켜, 카르복실산 (64%) 3.51 g을 수득하였다.
단계 6: 카르복실산 1.6 (3.15 g, 15 mmol)을 N,N-디메틸포름아미드 (70 mL) 중에 용해시키고, HOBt (3.13 g, 23 mmol) 및 EDC (4.4 g, 23 mmol)로 처리하였다. 약 25분 동안 교반한 후, 암모니아 (1,4-디옥산 중 0.5 M, 72 mL, 36 mmol)를 첨가하고, 반응물을 밤새 교반하였다. 다음날 아침, 물을 사용하여 반응물을 총 500 mL의 부피로 희석하고, 목적하는 생성물을 여과에 의해 수집하여, 밝은-베이지색 고체 3.62 g (74%)을 수득하였다.
단계 7: 벤조트리아졸릴 에테르 1.7 (50 mg, 0.17 mmol), 1-(4-(4-아미노페닐)피페라진-1-일)에타논 (1-아세틸피페라진 및 4-플루오로니트로벤젠으로부터 두 단계로 제조함) (45 mg, 0.20 mmol) 및 p-톨루엔술폰산 (30 mg, 0.17 mmol)을 1,4-디옥산 (5 mL)으로 희석하고, 모든 출발 물질이 소비될 때까지 120℃에서 교반하였다. 반응물을 실온으로 냉각시키고, 물로 희석하고, 정제용 HPLC로 직접 정제하여, 동결건조시킨 후, 목적하는 생성물 1을 수득하였다.
하기 화합물을 실시예 1에 기재된 것과 유사한 절차를 이용하여 (단계 4에서 시클로부틸아민 대신에 시약 A 사용) 제조하였다.
실시예 32. 2,4-비스(4-(4-아세틸피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
<반응식 2>
단계 1: 화합물 1.4 (실시예 1, 1.05 g, 4.8 mmol)를 아세토니트릴 40 mL 중에 용해시켰다. 여기에 나트륨 티오메톡시드 (0.74 g, 10.5 mmol)를 첨가하였다. 이를 밤새 교반하고, 에틸 아세테이트로 희석하고, 염수로 3회 세척하고, 건조시키고, 진공에서 농축시켰다. 이어서, 이를 디옥산 20 mL 및 물 10 mL에 넣었다. 여기에 LiOH 수화물 500 mg을 첨가하였다. 혼합물을 4시간 동안 교반하였다. pH가 3에 도달할 때까지 혼합물에 1 N HCl을 첨가하였다. 이를 농축시키고, 에틸 아세테이트로 3회 추출하였다. 유기상을 합하고, 건조시키고, 진공에서 농축시켜, 백색 고체를 수득하였다. 이어서, 상기 고체를 무수 DMF 30 mL 중에 용해시켰다. 여기에 EDC 히드로클로라이드 (1.10 g, 5.7 mmol) 및 HOBt (0.77 g, 5.7 mmol)를 첨가하였다. 혼합물을 30분 동안 교반하고, 여기에 암모니아 (상업적 디옥산 중 0.5 N 용액, 29 mL, 14.5 mmol)를 첨가하였다. 혼합물을 밤새 교반하고, 진공에서 농축시키고, 에틸 아세테이트로 희석하고, 염수로 3회 세척하고, 건조시키고, 진공에서 농축시켜, 조 화합물 30.1을 수득하였다.
단계 2: 조 화합물 30.1 (42 mg, 0.20 mmol)을 NMP 4 mL 중에 용해시켰다. 여기에 MCPBA (133 mg, 0.50 mmol)를 첨가하였다. 이를 실온에서 1시간 동안 교반하였다. 이어서, 여기에 1-(4-(4-아미노페닐)피페라진-1-일)에타논 (175 mg, 0.80 mmol) 및 DIEA (140 ㎕, 0.80 mmol)를 첨가하였다. 이어서, 혼합물을 120℃ 배스에서 90분 동안 교반하였다. 이어서, 혼합물을 역상 정제용 HPLC 처리하여, 표제 화합물을 단리하였다.
실시예 33. 4-(1H-인다졸-6-일아미노)-2-(4-(4-아세틸피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
<반응식 3>
단계 3: 디클로로피리미딘 1.4 (실시예 1 참조; 1.04 g, 4.7 mmol)를 NMP (30 mL) 중에 용해시키고, 얼음 배스에서 교반하였다. 여기에 6-아미노인다졸 31.1 (690 mg, 5.2 mmol)을 첨가하고, 이어서 에틸디이소프로필아민 (DIEA, 1.64 mL, 9.4 mmol)을 적가하였다. 혼합물을 40분 동안 교반하고, 여기에 나트륨 티오메톡시드 (660 mg, 9.4 mmol)를 첨가하였다. 혼합물을 밤새 교반하고, 에틸 아세테이트로 희석하고, 염수로 3회 세척하고, 진공에서 농축시켜, 조 화합물 31.2를 밝은 갈색 고체로서 정량적 수율로 수득하였다.
단계 4: 에틸 에스테르 31.2 (4.7 mmol)를 THF 60 mL 중에 용해시켰다. 여기에 수산화리튬 수화물 (236 mg, 5.6 mmol) 및 물 20 mL를 첨가하였다. 혼합물을 밤새 교반하고, pH가 2에 도달할 때까지 여기에 1 N HCl을 조심스럽게 첨가하였다. 혼합물을 진공에서 농축시켜, THF를 제거하였다. 백색 고체를 분쇄하고, 부흐너 (Buechner) 깔대기를 이용하여 단리하였다. 이를 물로 세척하고, 진공 오븐에서 건조시켜, 화합물 31.3 (1.14 g, 81%)을 백색 고체로서 수득하였다.
단계 5: 카르복실산 31.3 (1.14 g, 3.8 mmol)을 DMF 30 mL 중에 용해시켰다. 여기에 EDC 히드로클로라이드 (1.09 g, 5.7 mmol) 및 HOBt 수화물 (770 mg, 5.7 mmol)를 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 이어서, 여기에 암모니아 (상업적 디옥산 중 0.5 N 용액, 22 mL, 11.4 mmol)를 첨가하였다. 혼합물을 2시간 동안 교반하였다. 이어서, 이를 진공에서 농축시키고, 물 및 에틸 아세테이트에 녹였다. 유기상을 분리하고, 염수로 4회 세척하였다. 이어서, 유기상을 MgSO4 상에서 건조시키고, 진공에서 농축시켜, 화합물 31.4를 밝은 황색 고체 (820 mg, 72%)로서 수득하였다.
단계 6: 화합물 31.4 (36 mg, 0.12 mmol)를 NMP 3 mL 중에 용해시켰다. 여기에 MCPBA (65% 순수, 48 mg, 0.18 mmol)를 첨가하였다. 이를 실온에서 30분 동안 교반하였다. 이어서, 여기에 1-(4-(4-아미노페닐)피페라진-1-일)에타논 (53 mg, 0.24 mmol) 및 pTSA (21 mg, 0.12 mmol)를 첨가하였다. 혼합물을 120℃ 배스에서 90분 동안 교반하였다. 이어서, 상기 혼합물을 정제용 HPLC 처리하여, 표제 화합물 31을 단리하였다.
실시예 34. 2-(4-(4-아세틸피페라진-1-일)-3-클로로페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (단계 4에서 시클로부틸아민 대신에 시클로프로필아민 사용)를 사용하여 제조하였다. 클로로피페라지닐아닐린의 합성을, NCS를 사용하여 실시예 36에 기재된 것과 유사한 방식으로 합성한 니트로피페라지닐 중간체를 염소화시킨 후, 황화된 백금을 사용하여 환원시킴으로써 달성하였다.
실시예 35. 2-(4-(4-아세틸피페라진-1-일)-3-클로로페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 32에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 36. 4-(시클로프로필아미노)-2-(4-(4-프로피오닐피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다. 피페라지닐아닐린을 Boc 피페라진 및 4-플루오로니트로벤젠으로부터 합성한 후, 디옥산 중 HCl을 사용하여 탈보호하고, 프로피오닐 클로라이드를 사용하여 아실화시키고, 최종적으로 Pd/C를 사용하여 수소화시켰다.
실시예 37. 2-(4-(4-(시클로프로판카르보닐)피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 36에 기재된 것과 유사한 절차 (프로피오닐 클로라이드 대신에 시클로프로필카르보닐 클로라이드 사용)를 이용하여 제조하였다.
실시예 38. 4-(시클로프로필아미노)-2-(4-(4-(2-메톡시아세틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 36에 기재된 것과 유사한 절차 (프로피오닐 클로라이드 대신에 메톡시아세틸 클로라이드 사용)를 이용하여 제조하였다.
실시예 39. 2-(4-(4-아세틸-2-옥소피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (단계 4에서 시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다. 옥소피페라지닐 아닐린을 4-니트로요오도벤젠 및 4-Boc-2-옥소피페리딘으로부터 요오드화구리/디메틸에틸렌디아민 촉매 조건을 이용하여 합성하였다. 이어서, 디옥산 중 HCl을 사용하여 Boc 기를 제거하고, 아세틸 클로라이드를 사용하여 생성된 아민을 아실화시키고, 최종적으로 수소 및 Pd/C를 사용하여 니트로 기를 환원시켰다.
실시예 40. 2-(4-(4-아세틸피페라진-1-일)-3-플루오로페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (단계 4에서 시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다. 아닐린을 물/DMF 중에서 가열하여 상응하는 카르복실 아지드로부터 합성하였다. 최종적으로 아지드를 3,4-디플루오로벤조산으로부터 합성하였다.
실시예 41. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1s,4s)-4-아미노시클로헥실아미노)피리미딘-5-카르복스아미드
<반응식 4>
실온에서, H2O (20 mL) 중 트랜스-4-아미노시클로헥산올 (2.07 g, 13.6 mmol) 및 NaHCO3 (3.50 g, 41.7 mmol)의 혼합물에 디옥산 (15 mL) 중 벤질 클로로포르메이트 (1.92 mL, 13.6 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 20시간 동안 교반하였다. 백색 침전물을 벤질 (1R,4R)-4-히드록시시클로헥실카르바메이트 (3.37 g)로서 수집하였다.
실온에서, CH2Cl2 (15 mL) 중 벤질 (1R,4R)-4-히드록시시클로헥실카르바메이트 (1.14 g, 4.58 mmol) 및 트리에틸아민 (1.30 mL, 9.34 mmol)의 현탁액에 메탄술포닐 클로라이드 (0.425 mL, 5.49 mmol)를 첨가하였다. 혼합물을 실온에서 20시간 동안 교반하였다. 추가의 메탄술포닐 클로라이드 (0.425 mL, 5.49 mmol) 및 트리에틸아민 (1.00 mL)를 첨가하였다. 48시간 동안 교반을 계속하였다. 반응 용액을 5% NaHCO3에 이어서 1 N HCl로 세척하였다. 유기상을 분리하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, (1R,4R)-4-(벤질옥시카르보닐)시클로헥실 메탄술포네이트를 고체 (1.13 g)로서 수득하였다.
DMF (10 mL) 중 (1R,4R)-4-(벤질옥시카르보닐)시클로헥실 메탄술포네이트 (1.13 g, 3.46 mmol) 및 NaN3 (0.674 g, 10.4 mmol)의 혼합물을 100℃에서 20시간 동안 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 물로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 벤질 (1s,4s)-4-아지도시클로헥실카르바메이트 (0.819 g)를 수득하였다.
실온에서, THF (8 mL) 및 H2O (0.100 mL, 5.56 mmol) 중 벤질 (1s,4s)-4-아지도시클로헥실카르바메이트 (0.410 g, 1.50 mmol)의 용액에 Ph3P (0.590 g, 2.25 mmol)를 첨가하였다. 용액을 70℃에서 20시간 동안 교반하였다. EtOAc 및 1 N HCl을 첨가하였다. 수성상을 분리하고, EtOAc로 세척하였다. 이어서, 5 N NaOH를 사용하여 이를 pH 12로 염기성화시켰다. 유리 아민 생성물을 EtOAc로 추출하였다. EtOAc 용액을 Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 벤질 (1s,4s)-4-아미노시클로헥실카르바메이트 (0.270 g)를 수득하였다.
CH3CN (10 mL) 중 에틸 2,4-디클로로피리미딘-5-카르복실레이트 (0.241 g, 1.09 mmol), 벤질 (1s,4s)-4-아미노시클로헥실카르바메이트 (0.270 g, 1.09 mmol) 및 트리에틸아민 (0.300 mL, 2.16 mmol)의 혼합물을 실온에서 20시간 동안 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 1 N HCl에 이어서 5% NaHCO3으로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 에틸 4-((1s,4s)-4-(벤질옥시카르보닐)시클로헥실아미노)-2-클로로피리미딘-5-카르복실레이트 (0.458 g)를 수득하였다.
THF (5 mL) 중 에틸 4-((1s,4s)-4-(벤질옥시카르보닐)시클로헥실아미노)-2-클로로피리미딘-5-카르복실레이트 (0.458 g, 1.06 mmol)의 용액에 수성 1 N LiOH (1.16 mL, 1.16 mmol)를 첨가하였다. 3시간 동안 교반한 후, 물 (10 mL)를 첨가하였다. 1 N HCl (2 mL)을 사용하여 용액을 pH 1 내지 2로 산성화시켰다. 생성물을 EtOAc로 추출하였다. EtOAc 용액을 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 4-((1s,4s)-4-(벤질옥시카르보닐)시클로헥실아미노)-2-클로로피리미딘-5-카르복실산을 고체 (0.409 g)로서 수득하였다.
DMF (5 mL) 중 4-((1s,4s)-4-(벤질옥시카르보닐)시클로헥실아미노)-2-클로로피리미딘-5-카르복실산 (0.409 g, 1.01 mmol) 및 HOBt (0.232 g, 1.52 mmol)의 용액에 EDC (0.291 g, 1.52 mmol)를 첨가하였다. 2시간 동안 교반한 후, NH3 (디옥산 중 0.5 M, 6.0 mL, 3.00 mmol)를 첨가하였다. 혼합물을 20시간 동안 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 1 N HCl에 이어서 5% NaHCO3으로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 벤질 (1s,4s)-4-(2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-5-카르바모일피리미딘-4-일아미노)시클로헥실카르바메이트를 고체 (0.440 g)로서 수득하였다.
디옥산 (4 mL) 중 벤질 (1s,4s)-4-(2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-5-카르바모일피리미딘-4-일아미노)시클로헥실카르바메이트 (0.220 g, 0.438 mmol), 1-(4-(4-아미노페닐)피페라진-1-일)에타논 (0.192 g, 0.877 mmol) 및 pTsOH 1수화물 (0.083 g, 0.437 mmol)의 혼합물을 100℃에서 3시간 동안 교반하였다. 이어서, 혼합물을 HPLC로 정제하여, 벤질 (1s,4s)-4-(2-(4-(4-아세틸피페라진-1-일)페닐아미노)-5-카르바모일피리미딘-4-일아미노)시클로헥실카르바메이트 (0.123 g)를 수득하였다.
MeOH (5 mL, 6 N HCl 3방울 함유) 중 벤질 (1s,4s)-4-(2-(4-(4-아세틸피페라진-1-일)페닐아미노)-5-카르바모일피리미딘-4-일아미노)시클로헥실카르바메이트 (0.123 g, 0.21 mmol) 및 Pd-C (10%, 40 mg)의 혼합물을 풍선 H2 하에 4시간 동안 수소화시켰다. 혼합물을 셀라이트를 통해 여과하고, 여과액을 진공에서 농축시켜, 표제 화합물을 고체로서 수득하였다.
실시예 42. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(피페리딘-4-일메틸아미노)피리미딘-5-카르복스아미드
<반응식 5>
CH3CN (10 mL) 중 에틸 2,4-디클로로피리미딘-5-카르복실레이트 (0.221 g, 1.00 mmol), 1-Boc-4-아미노메틸피페리딘 히드로클로라이드 (0.251 g, 1.00 mmol) 및 트리에틸아민 (0.556 mL, 4.00 mmol)의 혼합물을 실온에서 20시간 동안 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 1 N HCl에 이어서 5% NaHCO3으로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 에틸 4-((1-(tert-부톡시카르보닐)피페리딘-4-일)메틸아미노)-2-클로로피리미딘-5-카르복실레이트 (0.390 g)를 수득하였다.
THF (5 mL) 중 에틸 4-((1-(tert-부톡시카르보닐)피페리딘-4-일)메틸아미노)-2-클로로피리미딘-5-카르복실레이트 (0.390 g, 0.979 mmol)의 용액에 수성 1 N LiOH (1.10 mL, 1.10 mmol)를 첨가하였다. 20시간 동안 교반한 후, 물 (10 mL)을 첨가하였다. 1 N HCl (2 mL)을 사용하여 용액을 pH 1 내지 2로 산성화시켰다. 생성물을 EtOAc로 추출하였다. EtOAc 용액을 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 4-((1-(tert-부톡시카르보닐)피페리딘-4-일)메틸아미노)-2-클로로피리미딘-5-카르복실산을 고체 (0.353 g)로서 수득하였다.
DMF (5 mL) 중 4-((1-(tert-부톡시카르보닐)피페리딘-4-일)메틸아미노)-2-클로로피리미딘-5-카르복실산 (0.353 g, 0.953 mmol) 및 HOBt (0.219 g, 1.43 mmol)의 용액에 EDC (0.274 g, 1.43 mmol)를 첨가하였다. 1시간 동안 교반한 후, NH3 (디옥산 중 0.5 M, 5.5 mL, 2.75 mmol)을 첨가하였다. 혼합물을 20시간 동안 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 1 N HCl에 이어서 5% NaHCO3으로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, tert-부틸 4-((2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트를 고체 (0.410 g)로서 수득하였다.
디옥산 (4 mL) 중 tert-부틸 4-((2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트 (0.205 g, 0.438 mmol), 1-(4-(4-아미노페닐)피페라진-1-일)에타논 (0.192 g, 0.877 mmol) 및 pTsOH 1수화물 (0.166 g, 0.874 mmol)의 혼합물을 100℃에서 3시간 동안 교반하였다. 이어서, 혼합물을 HPLC로 정제하여, tert-부틸 4-((2-(4-(4-아세틸피페라진-1-일)페닐아미노)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트 (0.105 g)를 수득하였다.
TFA (2 mL) 중 tert-부틸 4-((2-(4-(4-아세틸피페라진-1-일)페닐아미노)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트 (0.105 g, 0.190 mmol)의 용액을 실온에서 4시간 동안 교반하였다. TFA를 진공에서 제거하였다. 잔류물을 HPLC로 정제하여, 표제 화합물 (90 mg)을 수득하였다.
실시예 43. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1-아세틸피페리딘-4-일)메틸아미노)피리미딘-5-카르복스아미드
실온에서, 아세토니트릴 (2 mL) 중 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(피페리딘-4-일메틸아미노)피리미딘-5-카르복스아미드 (22 mg, 0.049 mmol) 및 트리에틸아민 (0.040 mL, 0.29 mmol)의 용액에 아세트산 무수물 (0.020 mL, 0.21 mmol)을 첨가하였다. 용액을 실온에서 1시간 동안 교반하였다. 이어서, 혼합물을 HPLC로 정제하여, 표제 화합물 (8 mg)을 수득하였다.
실시예 44. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1-(메틸술포닐)피페리딘-4-일)메틸아미노)피리미딘-5-카르복스아미드
실온에서, 아세토니트릴 (2 mL) 중 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(피페리딘-4-일메틸아미노)피리미딘-5-카르복스아미드 (22 mg, 0.049 mmol) 및 트리에틸아민 (0.040 mL, 0.29 mmol)의 용액에 메탄술포닐 클로라이드 (0.020 mL, 0.26 mmol)를 첨가하였다. 용액을 실온에서 1시간 동안 교반하였다. 이어서, 혼합물을 HPLC로 정제하여, 표제 화합물 (14 mg)을 수득하였다.
실시예 45. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1-메틸피페리딘-4-일)메틸아미노)피리미딘-5-카르복스아미드
실온에서, MeOH (1 mL) 및 CH3CO2H (0.1 mL) 중 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(피페리딘-4-일메틸아미노)피리미딘-5-카르복스아미드 (25 mg, 0.055 mmol) 및 37% 수성 CH2O (0.020 mL, 0.27 mmol)의 용액에 NaBH3CN (23 mg, 0.36 mmol)를 첨가하였다. 용액을 20시간 동안 교반하였다. 이어서, 혼합물을 HPLC로 정제하여, 표제 화합물 (20 mg)을 수득하였다.
실시예 46. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1-카르바모일피페리딘-4-일)메틸아미노)피리미딘-5-카르복스아미드
아세트산 (2 mL) 중 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(피페리딘-4-일메틸아미노)피리미딘-5-카르복스아미드 (25 mg, 0.055 mmol) 및 KOCN (20 mg, 0.25 mmol)의 혼합물을 100℃에서 4시간 동안 교반하였다. 이어서, 혼합물을 HPLC로 정제하여, 표제 화합물 (8 mg)을 수득하였다.
실시예 47. 벤질 3-((2-(4-(4-아세틸피페라진-1-일)페닐아미노)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트
실시예 48. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(피페리딘-3-일메틸아미노)피리미딘-5-카르복스아미드
<반응식 6>
CH3CN (10 mL) 중 에틸 2,4-디클로로피리미딘-5-카르복실레이트 (0.221 g, 1.00 mmol), 3-아미노메틸-1-N-CBz-피페리딘 (0.248 g, 1.00 mmol) 및 트리에틸아민 (0.300 mL, 2.15 mmol)의 혼합물을 실온에서 20시간 동안 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 1 N HCl에 이어서 5% NaHCO3으로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 에틸 4-((1-(벤질옥시카르보닐)피페리딘-3-일)메틸아미노)-2-클로로피리미딘-5-카르복실레이트 (0.382 g)를 수득하였다.
THF (5 mL) 중 에틸 4-((1-(벤질옥시카르보닐)피페리딘-3-일)메틸아미노)-2-클로로피리미딘-5-카르복실레이트 (0.382 g, 0.88 mmol)의 용액에 수성 1 N LiOH (1.00 mL, 1.00 mmol)를 첨가하였다. 20시간 동안 교반한 후, 물 (10 mL)을 첨가하였다. 1 N HCl (2 mL)을 사용하여 용액을 pH 1 내지 2로 산성화시켰다. 생성물을 EtOAc로 추출하였다. EtOAc 용액을 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 4-((1-(벤질옥시카르보닐)피페리딘-3-일)메틸아미노)-2-클로로피리미딘-5-카르복실산 (0.350 g)을 수득하였다.
DMF (5 mL) 중 4-((1-(벤질옥시카르보닐)피페리딘-3-일)메틸아미노)-2-클로로피리미딘-5-카르복실산 (0.350 g, 0.87 mmol) 및 HOBt (0.200 g, 1.31 mmol)의 용액에 EDC (0.250 g, 1.30 mmol)를 첨가하였다. 1시간 동안 교반한 후, NH3 (디옥산 중 0.5 M, 6.0 mL, 3.0 mmol)을 첨가하였다. 혼합물을 20시간 동안 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 1 N HCl에 이어서 5% NaHCO3으로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 벤질 3-((2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트 (0.404 g)를 수득하였다.
디옥산 (8 mL) 중 벤질 3-((2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트 (0.404 g, 0.805 mmol), 1-(4-(4-아미노페닐)피페라진-1-일)에타논 (0.220 g, 1.00 mmol) 및 pTsOH 1수화물 (0.167 g, 0.879 mmol)의 혼합물을 100℃에서 3시간 동안 교반하였다. 이어서, 혼합물을 HPLC로 정제하여, 벤질 3-((2-(4-(4-아세틸피페라진-1-일)페닐아미노)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트 45 (0.270 g)를 수득하였다.
MeOH (10 mL, 6 N HCl 4방울 함유) 중 벤질 3-((2-(4-(4-아세틸피페라진-1-일)페닐아미노)-5-카르바모일피리미딘-4-일아미노)메틸)피페리딘-1-카르복실레이트 (90 mg, 0.15 mmol) 및 Pd-C (10%, 30 mg)의 혼합물을 풍선 H2 하에 4시간 동안 수소화시켰다. 혼합물을 셀라이트를 통해 여과하였다. 여과액을 진공에서 농축시켜, 표제 화합물 46 (56 mg)을 수득하였다.
실시예 49. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1-카르바모일피페리딘-5-일)메틸아미노)피리미딘-5-카르복스아미드
CH3CN (1 mL) 중 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(피페리딘-3-일메틸아미노)피리미딘-5-카르복스아미드 (24 mg, 0.053 mmol)의 현탁액에 H2O (1 mL) 중 KOCN (27 mg, 0.33 mmol)의 용액을 첨가하였다. 현탁액이 투명하게 되었다. 70℃에서 2시간 동안 교반한 후, 혼합물을 HPLC로 정제하여, 표제 화합물 (14 mg)을 수득하였다.
실시예 50. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(5-히드록시펜틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (시클로부틸 아민 대신에 5-아미노펜탄올 사용)를 이용하여 제조하였다.
실시예 51. (S)-2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(1-히드록시프로판-2-일아미노)피리미딘-5-카르복스아미드
<반응식 7>
단계 1: 디클로로피리미딘 1.4의 티오메틸 49.1로의 전환을 문헌 [Synthesis and evaluation of 2-{[2-(4-hydroxyphenyl)-ethyl]amino}pyrimidine-5-carboxamide derivatives as novel STAT6 inhibitors. Nagashima, Shinya; Yokota, Masaki; Nakai, Ei-ichi; Kuromitsu, Sadao; Ohga, Keiko; Takeuchi, Makoto; Tsukamoto, Shin-ichi; Ohta, Mitsuaki. Institute for Drug Discovery Research, Astellas Pharm Inc., Yodogawa-ku, Osaka, Japan. Bioorganic & Medicinal Chemistry (2007), 15(2), 1044-1055]에 기재된 것과 유사한 절차를 이용하여 달성하였다.
단계 2 내지 4를 실시예 1에 기재된 것과 유사한 절차를 이용하여 달성하였다.
단계 5: 상기 화합물을 실시예 25, 단계 2에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 53. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(시아노메틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 54. (R)-2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(1-히드록시프로판-2-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 55. 2-(4-(4-아세틸-2-카르바모일피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민을, 그리고 아세틸피페라진 대신에 Boc 보호된 피페라진 카르복실산 사용)를 이용하여 제조하였다.
실시예 56. (R)-2-(4-(4-아세틸-3-메틸피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다.
실시예 57. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(2-아미노-2-옥소에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 58. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(3-아미노-3-옥소프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 59. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(4-아미노-4-옥소부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 60. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(2-시아노에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 61. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(1-카르바모일시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 62. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(2-모르폴리노에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 63. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1R,2R)-2-카르바모일시클로펜틸아미노)피리미딘-5-카르복스아미드
상기 화합물을, 문헌 [An Efficient Route to Either Enantiomer of trans-2-Aminocyclopentanecarboxylic Acid. LePlae, P. R.; Umezawa, N.; Lee, H.-S.; Gellman, S. H. J. Org. Chem.; (Note); 2001; 66(16); 5629-5632]로부터의 절차를 이용하여 제조한 아민을 사용함으로써 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 64. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(-2-트랜스-페닐시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 65. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(3-히드록시프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 66. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(4-히드록시부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 67. 2-(4-(4-아세틸-2-(메틸카르바모일)피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민을, 그리고 아세틸피페라진 대신에 Boc 보호된 피페라진 카르복실산 사용)를 이용하여 제조하였다.
실시예 69. (R)-2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(2,3-디히드록시프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 70. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1R,3R)-3-카르바모일시클로펜틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 51에 기재된 것과 유사한 절차 (아민 유도 Boc 보호된 (1R,3R)-3-아미노시클로펜탄 카르복실산 사용)를 이용하여 제조하였다.
실시예 71. 메틸 4-(4-(5-카르바모일-4-(시클로프로필아미노)피리미딘-2-일아미노)페닐)피페라진-1-카르복실레이트
상기 화합물을 실시예 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, 적합한 아닐린 사용)를 이용하여 제조하였다.
실시예 72. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(2-옥소-1,2,3,4-테트라히드로퀴놀린-6-일아미노)피리미딘-5-카르복스아미드
표제 화합물을 6-아미노-3,4-디히드로퀴놀린-2(1H)-온을 사용하여 유사하게 합성하였다.
실시예 73. 4-((1s,4s)-4-아미노시클로헥실아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
<반응식 8>
EtOH (3 mL) 중 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1s,4s)-4-아미노시클로헥실아미노)피리미딘-5-카르복스아미드 (52 mg, 0.12 mmol)의 용액에 수성 3 M KOH (1.0 mL, 3.0 mmol)를 첨가하였다. 혼합물을 85℃에서 4시간 동안, 이어서 70℃에서 20시간 동안 교반하였다. 이를 진공에서 농축시켰다. 잔류물을 아세트산 (2 mL)으로 산성화시킨 후, 이를 HPLC로 정제하여, 표제 화합물 (25 mg)을 수득하였다.
실시예 74. (R)-2-(4-(4-아세틸-2-메틸피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다.
실시예 75. (R)-2-(4-(4-아세틸-2-메틸피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 76. (S)-2-(4-(4-아세틸-2-메틸피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 77. 2-(4-(4-카르바모일피페라진-1-일)페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 78. 4-(시클로부틸아미노)-2-(4-(4-(디메틸카르바모일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 79. 2-(6-(4-아세틸피페라진-1-일)피리딘-3-일아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 80. 2-(4-(4-아세틸피페라진-1-일)-2-메틸페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 81. (S)-2-(4-(4-(2-메톡시아세틸)-2-메틸피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 82. (S)-메틸 4-(4-(5-카르바모일-4-(2,2,2-트리플루오로에틸아미노)피리미딘-2-일아미노)페닐)-3-메틸피페라진-1-카르복실레이트
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 83. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(1-메틸-1H-인다졸-4-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 84. 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(벤조[c]티아디아졸-4-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 85. 4-(벤조[c]티아디아졸-4-일아미노)-2-(4-(4-프로피오닐피페라진-1-일)페닐아미노)-피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 86. 4-(1-메틸-1H-인돌-4-일아미노)-2-(4-(4-프로피오닐피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
표제 화합물을 실시예 33에 설명된 동일한 합성 반응식을 이용하여 제조하였다.
실시예 87. 4-(1,2-디메틸-1H-인돌-4-일아미노)-2-(4-(4-프로피오닐피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
표제 화합물을 실시예 32에 설명된 동일한 합성 반응식을 이용하여 제조하였다.
실시예 88. 4-(1-메틸-1H-인돌-4-일아미노)-2-(4-(4-프로피오닐피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
표제 화합물 실시예 33에 설명된 동일한 합성 반응식을 이용하여 제조하였다.
실시예 89. 4-(1,2-디메틸-1H-인돌-4-일아미노)-2-(4-(4-프로피오닐피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
표제 화합물 실시예 33에 설명된 동일한 합성 반응식을 이용하여 제조하였다.
실시예 92. 4-(시클로부틸아미노)-2-(2-옥소인돌린-5-일아미노)피리미딘-5-카르복스아미드
실시예 93. 2-(6-(4-아세틸피페라진-1-일)피리딘-3-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체 및 1-(4-(5-아미노피리딘-2-일)피페라진-1-일)에타논 (1-아세틸피페라진 및 2-클로로-5-니트로피리딘으로부터 두 단계로 제조)을 사용하여 제조하였다.
실시예 94. (R)-2-(4-(2-메틸-4-(메틸술포닐)피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 95. (S)-2-(4-(2-메틸-4-(메틸술포닐)피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 96. 4-(시클로프로필아미노)-2-(4-(1-(메틸술포닐)-1,2,3,6-테트라히드로피리딘-4-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다.
실시예 97. 4-(시클로프로필아미노)-2-(4-(1-(메틸술포닐)피페리딘-4-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다.
실시예 98. 4-(시클로프로필아미노)-2-(4-(4-(N-메틸메틸술폰아미도)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, tert-부틸 피페리딘-4-일카르바메이트 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용)를 이용하여 제조하였다.
실시예 99. 4-(시클로프로필아미노)-2-(4-(4-(메틸술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다.
실시예 100a. 4-(시클로프로필아미노)-2-(4-(4-(에틸술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다.
실시예 100b. 4-(시클로부틸아미노)-2-(4-(4-(메틸술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 100c. 2-(2-메틸-4-(4-(메틸술포닐)피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용, 4-플루오로-2-메틸니트로벤젠으로부터 유도된 아닐린 사용)를 이용하여 제조하였다.
실시예 101a. (S)-2-(4-(4-(에틸술포닐)-2-메틸피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 102. (S)-2-(4-(4-(시클로프로필술포닐)-2-메틸피페라진-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 트리플루오로에틸아민 사용)를 이용하여 제조하였다.
실시예 103. 4-(시클로부틸아미노)-2-(4-술파모일페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 4-아미노벤젠술폰아미드를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 104. 메틸 4-(5-카르바모일-4-(시클로부틸아미노)피리미딘-2-일아미노)페닐(메틸)카르바메이트
상기 화합물을 메틸 4-아미노페닐(메틸)카르바메이트 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 105. 이소프로필 4-(5-카르바모일-4-(시클로부틸아미노)피리미딘-2-일아미노)페닐(메틸)카르바메이트
상기 화합물을 이소프로필 4-아미노페닐(메틸)카르바메이트 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 106. 4-(시클로부틸아미노)-2-(4-(N,N-디메틸술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 4-아미노-N,N-디메틸벤젠술폰아미드 (4-니트로벤젠술폰산 클로라이드 및 디메틸 아민으로부터 제조한 후 환원)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 107. 메틸 4-(5-카르바모일-4-(시클로프로필아미노)피리미딘-2-일아미노)페닐(메틸)카르바메이트
상기 화합물을 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체 및 메틸 4-아미노페닐(메틸)카르바메이트 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 108. 이소프로필 4-(5-카르바모일-4-(시클로프로필아미노)피리미딘-2-일아미노)페닐(메틸)카르바메이트
상기 화합물을 단계 4에서 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체 및 이소프로필 4-아미노페닐(메틸)카르바메이트 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 제조하였다.
실시예 109. 4-(시클로프로필아미노)-2-(4-술파모일페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체 및 4-아미노벤젠술폰아미드를 사용하여 제조하였다.
실시예 110. 4-(시클로프로필아미노)-2-(4-(1-메틸우레이도)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, 보호된 N'Boc-N-메틸페닐렌 디아민으로부터 두 단계로 제조한 아닐린 사용)를 이용하여 제조하였다.
실시예 111. 4-(시클로프로필아미노)-2-(4-(메틸술피닐)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-티오메틸아닐린 사용, 후속으로 mCPBA를 사용한 산화)를 이용하여 제조하였다.
실시예 112. 2-(4-(4-아세틸피페라진-1-카르보닐)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤조일 클로라이드 및 N-아세틸피페라진으로부터 두 단계로 제조한 아닐린 사용)를 이용하여 제조하였다.
실시예 113. 2-(4-(1-아세틸피페리딘-4-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조하였다.
실시예 114. (시클로프로필아미노)-2-(4-(4-(피롤리딘-1-카르보닐)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 에틸 이소니페코테이트로부터 유도된 아닐린 사용)를 이용하여 제조하였다.
실시예 115. 4-(시클로프로필아미노)-2-(4-(4-(피페리딘-1-카르보닐)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 에틸 이소니페코테이트로부터 유도된 아닐린 사용)를 이용하여 제조하였다.
실시예 116. 4-(시클로프로필아미노)-2-(4-(4-(모르폴린-4-카르보닐)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 에틸 이소니페코테이트로부터 유도된 아닐린 사용)를 이용하여 제조하였다.
실시예 117. 4-(시클로프로필아미노)-2-(4-(4-(시클로프로필술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 118. 2-(4-(4-아세틸-1,4-디아제판-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 119. 2-(4-(4-아세트아미도피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (4-Boc 아미노피페리딘 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용, 이는 Boc 탈보호 후에 아세틸로 전환되고, 이어서 수소화를 이용하여 니트로 기를 아닐린으로 환원시킴).
실시예 120. 4-(시클로프로필아미노)-2-(4-(2-옥소피리딘-1(2H)-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (4-요오도아닐린 및 2-히드록시피리딘으로부터 유도된 아닐린 사용, 이는 CuI 및 적합한 리간드를 사용하여 커플링됨).
실시예 121. 4-(시클로프로필아미노)-2-(4-디옥소티오모르폴리노페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 122. 4-(시클로프로필아미노)-2-(4-(4-(2-메톡시에틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 1-메톡시에틸피페라진으로부터 두 단계로 유도된 아닐린 사용).
실시예 123. 4-(시클로프로필아미노)-2-(4-(4-(1-메틸시클로프로필)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 124. 4-(시클로프로필아미노)-2-(4-(4-(N-메틸아세트아미도)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 상기 기재된 아닐린에서 N-아세틸 기의 메틸화 (CH3I, Cs2CO3, DMF) 후에 니트로 환원 단계를 수행함).
실시예 125. 2-(4-(N-시클로부틸술파모일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤젠술포닐 클로라이드 및 시클로부틸아민으로부터 유도된 아닐린 사용).
실시예 126. 4-(시클로프로필아미노)-2-(4-(N-시클로프로필술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 상기 기재된 것과 유사한 아닐린 사용)
실시예 127. 4-(시클로프로필아미노)-2-(4-(N-(2-메톡시에틸)술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 상기 기재된 것과 유사한 아닐린 사용).
실시예 128. 4-(시클로프로필아미노)-2-(4-(N-(2-히드록시에틸)술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 상기 기재된 것과 유사한 아닐린 사용).
실시예 129. 4-(시클로부틸아미노)-2-(4-(메틸술포닐)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 130. 4-(시클로부틸아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 131. 4-(시클로프로필아미노)-2-(4-(4-(피리딘-2-일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 132. 4-(시클로부틸아미노)-2-(4-(메틸술포닐)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 133. 4-(시클로부틸아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 134. 4-(시클로프로필아미노)-2-(4-(4-(피리딘-2-일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 135. 2-(4-(4-(아미노메틸)피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 136. 4-(시클로프로필아미노)-2-(4-(N-피리미딘-2-일술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 137. 4-(시클로프로필아미노)-2-(4-(N-티아졸-2-일술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 138. 4-(시클로프로필아미노)-2-(4-(N-(5-메틸이속사졸-3-일)술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 139. 4-(시클로프로필아미노)-2-(4-(N-(2,6-디메틸피리미딘-4-일)술파모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 140. 4-(시클로부틸아미노)-2-(4-(1-메틸우레이도)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 141. 4-(시클로부틸아미노)-2-(4-(트리플루오로메톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 143. 2-(4-(2-모르폴리노-2-옥소에톡시)페닐아미노)-4-(m-톨릴아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 메타-톨루이딘 사용).
실시예 145. 2-(4-(2-모르폴리노에톡시)페닐아미노)-4-(m-톨릴아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 메타-톨루이딘 사용).
실시예 147. 4-(시클로프로필아미노)-2-(4-(이속사졸-3-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 148. (S)-2-(4-(1-아미노-3-메틸-1-옥소부탄-2-일아미노)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 트리플루오로에틸아민 사용, (S)-발린 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 149. (S)-2-(4-(1-아미노-4-메틸-1-옥소펜탄-2-일아미노)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 트리플루오로에틸아민 사용, 상기 기재된 것과 유사한 아닐린 사용).
실시예 151. 4-(1-메틸-1H-인돌-4-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
<반응식 9>
단계 1: 실온에서, CH3CN (6 mL) 중 에틸 2,4-디클로로피리미딘-5-카르복실레이트 (328 mg, 1.48 mmol) 및 1-메틸-1H-인돌-4-아민 (260 mg, 1.78 mmol)의 용액에 DIEA (0.4 mL, 2.22 mmol)를 첨가하였다. 혼합물을 실온에서 24시간 동안 교반하였다. 물 (15 mL)을 첨가하여 침전을 유도하였다. 침전물을 수집하고, 진공에서 건조시켜, 에틸 2-클로로-4-(1-메틸-1H-인돌-4-일아미노)피리미딘-5-카르복실레이트를 고체로서 수득하였다.
단계 2: THF (4 mL) 중 에틸 2-클로로-4-(1-메틸-1H-인돌-4-일아미노)피리미딘-5-카르복실레이트 (단계 1로부터의 조 물질)의 용액에 수성 1 N LiOH (2.25 mL, 2.25 mmol)를 첨가하였다. 혼합물을 실온에서 밤새 교반하였다. 1 N HCl을 사용하여 혼합물을 산성화시키자, 백색 고체가 침전되었고, 이를 수집하고, 진공에서 건조시켜, 2-클로로-4-(1-메틸-1H-인돌-4-일아미노)피리미딘-5-카르복실산 (325 mg)을 수득하였다.
단계 3: DMF (4 mL) 중 2-클로로-4-(1-메틸-1H-인돌-4-일아미노)피리미딘-5-카르복실산 (325 mg, 1.08 mmol) 및 HOBt (198 mg, 1.29 mmol)의 용액에 EDC (248 mg, 1.29 mmol)를 첨가하였다. 혼합물을 실온에서 1.5시간 동안 교반하였다. 암모니아 (디옥산 중 0.5 M, 8.00 mL, 4.00 mmol)를 첨가하였다. 이를 실온에서 밤새 교반하였다. 물 및 EtOAc를 첨가하였다. 유기상을 분리하고, 1 N HCl에 이어서 5% NaHCO3으로 세척하고, Na2SO4 상에서 건조시키고, 진공에서 농축시켜, 2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-4-(1-메틸-1H-인돌-4-일아미노)피리미딘-5-카르복스아미드 (378 mg)를 수득하였다.
단계 4: NMP (1 ml) 중 2-(1H-벤조[d][1,2,3]트리아졸-1-일옥시)-4-(1-메틸-1H-인돌-4-일아미노)피리미딘-5-카르복스아미드 (62 mg, 0.15 mmol)의 용액에 4-(2-(피롤리딘-1-일)에톡시)아닐린 (31 mg, 0.15 mmol) 및 p-톨루엔술폰산 수화물 (28 mg, 0.15 mmol)을 첨가하였다. 이를 100℃에서 4시간 동안 가열하고, 정제용 HPLC로 정제하여, 4-(1-메틸-1H-인돌-4-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드 (32 mg)를 수득하였다.
실시예 152. 4-(1H-인돌-4-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 151에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 153. 4-(2-메틸-2H-인다졸-7-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 151에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 154. 4-(1-메틸-1H-인다졸-7-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 151에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 155. 2-(4-(1H-이미다졸-1-일페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 상기 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 156. 2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)-4-(m-톨릴아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 메타-아니시딘 사용).
실시예 157. 4-(3,5-디메틸페닐아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 3,5-디메틸아닐린 사용).
실시예 158. 4-(3-메톡시페닐아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 메타-아니시딘 사용).
실시예 161. 2-(4-(2-히드록시에틸카르바모일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 트리플루오로에틸아민 사용).
실시예 162. 4-(4-(2-모르폴리노에톡시)페닐아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 2에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 163. 2-(4-(2-(피페리딘-1-일)에톡시)페닐아미노)-4-(m-톨릴아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 메타-톨루이딘 사용).
실시예 165. 2-(4-(2-메톡시에톡시)페닐아미노)-4-(m-톨릴아미노)피리미딘-5-카르복스아미드
실시예 166. 2-(4-(3-히드록시프로필카르바모일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 트리플루오로에틸아민 사용).
실시예 167. 2-(4-(5,6-디히드로-4H-1,3-옥사진-2-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을, 실시예 166을 디클로로메탄 중 DIPEA 및 디에틸아미노술푸르트리플루오라이드로 처리함으로써 제조하였다.
실시예 168. 4-(시클로부틸아미노)-2-(p-톨릴아미노)피리미딘-5-카르복스아미드
상기 화합물을 파라-톨루이딘 및 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 169. 2-(4-카르바모일페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 4-아미노벤즈아미드를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 170. 4-(시클로부틸아미노)-2-(4-(N-메틸시클로프로판카르복스아미도)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 N-(4-아미노페닐)-N-메틸시클로프로판카르복스아미드 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 171. 2-(3-클로로-4-(N-메틸아세트아미도)페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 N-(4-아미노-2-클로로페닐)-N-메틸아세트아미드 (2-클로로-4-니트로아닐린으로부터 세 단계로 제조)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 172. 2-(3-클로로-4-(N-메틸아세트아미도)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 단계 4에서 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체, 및 N-(4-아미노-2-클로로페닐)-N-메틸아세트아미드 (2-클로로-4-니트로아닐린으로부터 세 단계로 제조)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 173. 4-(시클로프로필아미노)-2-(4-(N-메틸시클로프로판카르복스아미도)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 단계 4에서 시클로부틸아민 대신에 시클로프로필아민을 사용하여 실시예 139에 기재된 바와 같이 합성한 중간체, 및 N-(4-아미노페닐)-N-메틸시클로프로판카르복스아미드 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 174. 4-(시클로프로필아미노)-2-(4-(4-(2-히드록시에틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 175. 4-(시클로프로필아미노)-2-(4-(4-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 에틸 이소니페코테이트로부터 유도된 아닐린 사용).
실시예 176. 4-(시클로프로필아미노)-2-(4-(4-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 에틸 이소니페코테이트로부터 유도된 아닐린 사용).
실시예 177. 4-(시클로프로필아미노)-2-(4-(4-(디메틸카르바모일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을, 4-(4-니트로페닐)피페라진-1-카르복스아미드를 수소화나트륨 및 메틸 요오다이드로 처리한 후, 수소화를 이용하여 니트로를 환원시킴으로써 제조하였다. 이어서, 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 아닐린을 커플링시켰다.
실시예 178. 2-(3-클로로-4-모르폴리노페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 179. 4-(시클로프로필아미노)-2-(4-(3,3-디플루오로피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 3,3-디플루오로피롤리딘 및 4-플루오로니트로벤젠으로부터 두 단계로 유도된 아닐린 사용).
실시예 180. 4-(시클로프로필아미노)-2-(4-(메틸카르바모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤조일클로라이드 및 메틸아민으로부터 유도된 아닐린 사용).
실시예 181. 4-(시클로프로필아미노)-2-(4-(디메틸카르바모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤조일클로라이드 및 디메틸아민으로부터 유도된 아닐린 사용).
실시예 182. 4-(시클로프로필아미노)-2-(4-(4-(메틸술포닐)피페라진-1-카르보닐)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤조일클로라이드로부터 유도된 아닐린 사용).
실시예 183. 4-(시클로프로필아미노)-2-(4-(티아졸-4-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 184. 2-(4-(1H-피라졸-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 185. 2-(4-(1H-테트라졸-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 186. 4-(시클로프로필아미노)-2-(4-(티오펜-2-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 187. 4-(시클로프로필아미노)-2-(4-포름아미도-3-히드록시페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 6-아미노벤족사졸 사용, 후속으로 정제하는 동안 가수분해하여 표제 화합물 수득).
실시예 188. 4-(시클로프로필아미노)-2-(4-(피리딘-2-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 189. 2-(4-(1-아세틸-1,2,3,6-테트라히드로피리딘-4-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 190. (R)-4-(시클로프로필아미노)-2-(4-(2-(메톡시메틸)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 (R)-2-메톡시메틸피롤리딘으로부터 두 단계로 제조한 아닐린 사용).
실시예 191. (S)-4-(시클로프로필아미노)-2-(4-(2-(메톡시메틸)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 190에 기재된 것과 유사한 절차를 이용하여 제조하였다 ((R)-이성질체 대신에 (S)-2-메톡시메틸피롤리딘 사용).
실시예 192. 4-(시클로프로필아미노)-2-(4-(피리딘-3-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 193. 4-(시클로프로필아미노)-2-(4-(에틸술포닐)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 194. 2-(1H-인돌-6-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 195. 1-(4-(5-카르바모일-4-(시클로프로필아미노)피리미딘-2-일아미노)페닐)피페리딘-4-카르복실산
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 에틸 이소니페코테이트 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 196. 4-(시클로프로필아미노)-2-(4-(4-(메틸술포닐)-1,4-디아제판-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, Boc 보호된 호모피페라진 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 197. 4-(시클로프로필아미노)-2-(4-(3,5-디메틸-1H-피라졸-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 198. (S)-2-(4-(2-카르바모일피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, (S)-프롤린아미드 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 199. 4-(시클로프로필아미노)-2-(4-(시클로프로필카르바모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤조일 클로라이드로부터 두 단계로 유도된 아닐린 사용).
실시예 200. 2-(4-(시클로부틸카르바모일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 199에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 201. (S)-4-(시클로프로필아미노)-2-(4-(2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, (S)-프롤린 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 202. (S)-4-(시클로프로필아미노)-2-(4-(2-(디메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 203. 4-(시클로프로필아미노)-2-(4-(2-히드록시에틸카르바모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤조일 클로라이드 및 에탄올아민으로부터 유도된 아닐린 사용).
실시예 204. 4-(시클로프로필아미노)-2-(4-(3-히드록시프로필카르바모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤조일 클로라이드 및 프로판올아민으로부터 유도된 아닐린 사용).
실시예 205. (R)-4-(시클로프로필아미노)-2-(4-(3-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 206. (R)-4-(시클로프로필아미노)-2-(4-(3-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 207. (S)-4-(시클로프로필아미노)-2-(4-(3-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 208. (S)-4-(시클로프로필아미노)-2-(4-(3-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 209. (S)-4-(시클로프로필아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 210. (S)-4-(시클로프로필아미노)-2-(4-(2-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 211. 4-(시클로프로필아미노)-2-(퀴녹살린-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 212. (S)-2-(4-(2-카르바모일아제티딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 213. 4-(시클로프로필아미노)-2-(4-(4-히드록시피페리딘-1-일술포닐)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-니트로벤젠술포닐 클로라이드 및 4-히드록시피페리딘으로부터 제조한 아닐린 사용).
실시예 214. 2-(4-(시클로프로필(메틸)카르바모일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 215. 2-(4-(시클로부틸(메틸)카르바모일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 216. 2-(4-(2-아미노피리딘-4-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 217. (R)-4-(시클로프로필아미노)-2-(4-(2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 218. (R)-4-(시클로프로필아미노)-2-(4-(2-(디메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 219. 4-(시클로프로필아미노)-2-(4-(3-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 220. 2-(4-((2S,4S)-2-카르바모일-4-히드록시피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 221. 4-(시클로프로필아미노)-2-(4-((2S,4S)-4-히드록시-2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 222. 4-(시클로부틸아미노)-2-(4-(디메틸아미노)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 N,N-디메틸벤젠-1,4-디아민을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 223. 2-(4-아세트아미도페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 N-(4-아미노페닐)아세트아미드를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 224. 2-(1H 인다졸-5-일아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드 16.
상기 화합물을 1H 인다졸-5-아민을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 225. 2-(1H 인다졸-6-일아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 1H 인다졸-6-아민을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 226. 4-(시클로부틸아미노)-2-(4-메톡시페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 p-아니시딘을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 227. 4-(시클로부틸아미노)-2-(4-(디에틸아미노)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 N,N-디에틸 페닐렌디아민을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 228. 4-(시클로부틸아미노)-2-(페닐아미노)피리미딘-5-카르복스아미드.
상기 화합물을 아닐린을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 229. 4-(시클로부틸아미노)-2-(4-(N-메틸프로피온아미도)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 N-(4-아미노페닐)-N-메틸프로피온아미드 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 230. 4-(시클로프로필아미노)-2-(4-(N-메틸프로피온아미도)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체, 및 N-(4-아미노페닐)-N-메틸프로피온아미드 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 제조하였다.
실시예 231. 4-(시클로프로필아미노)-2-(4-(N-메틸아세트아미도)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체, 및 N-(4-아미노페닐)-N-메틸아세트아미드 (N-메틸 4-니트로아닐린으로부터 두 단계로 제조)를 사용하여 제조하였다.
실시예 232. 이소프로필 4-(5-카르바모일-4-(시클로프로필아미노)피리미딘-2-일아미노)페닐(메틸)카르바메이트
상기 화합물을 시클로부틸아민 대신에 시클로프로필아민을 사용하여 반응식 1에 기재된 바와 같이 합성한 중간체, 및 이소프로필 4-아미노페닐(메틸)카르바메이트 (N-메틸 4-니트로아닐린으로부터 두 단계로 합성)를 사용하여 제조하였다.
실시예 233. 4-(시클로프로필아미노)-2-(2,3-디히드로벤조[b][1,4]디옥신-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 234. 4-(시클로프로필아미노)-2-(4-모르폴리노페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 235. 4-(시클로프로필아미노)-2-(4-(피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 236. 4-(시클로프로필아미노)-2-(4-(4-히드록시피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 4-히드록시피페리딘으로부터 유도된 아닐린 사용).
실시예 237. 4-(시클로프로필아미노)-2-(4-(4-플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 4-플루오로피페리딘으로부터 유도된 아닐린 사용).
실시예 238. 4-(시클로프로필아미노)-2-(4-(4-메틸피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 1-메틸피페라진으로부터 유도된 아닐린 사용).
실시예 239. 4-(시클로프로필아미노)-2-(4-(3,3-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 3,3-디플루오로피페리딘으로부터 유도된 아닐린 사용).
실시예 240. 2-(4-(4-카르바모일피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 이소니페코트아미드로부터 유도된 아닐린 사용, 이어서 메탄올 중 Pd/C 및 수소를 사용하여 환원).
실시예 241. 2-(4-(4-카르바모일피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (4-피페라지닐니트로벤젠으로부터 두 단계로 유도된 아닐린 사용).
실시예 242. 4-(시클로프로필아미노)-2-(4-(4,4-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로니트로벤젠 및 4,4-디플루오로피페리딘으로부터 유도된 아닐린 사용).
실시예 244. 4-(시클로프로필아미노)-2-(4-(메틸술포닐)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 245. 4-(시클로프로필아미노)-2-(4-(메틸티오)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 246. 4-(시클로프로필아미노)-2-(4-((4-(메틸술포닐)피페라진-1-일)메틸)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 247. 4-(시클로프로필아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 248. 2-(4-(1H-1,2,4-트리아졸-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 249. 2-(1H-인돌-5-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 250. 2-(1H-인다졸-5-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 251. 4-(시클로프로필아미노)-2-(4-(옥사졸-5-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 252. 2-(1H-인다졸-6-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 253. 4-(시클로프로필아미노)-2-(퀴놀린-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 254. (R)-2-(4-(3-카르바모일피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 255. (S)-2-(4-(3-카르바모일피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 256. 4-(시클로부틸아미노)-2-(2,3-디히드로벤조[b][1,4]디옥신-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 257. 4-(시클로부틸아미노)-2-(4-(피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 피페리딘 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 258. 4-(시클로부틸아미노)-2-(4-(4-히드록시피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-히드록시피페리딘 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 259. 4-(시클로부틸아미노)-2-(4-(4-플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-플루오로피페리딘 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 260. 4-(시클로부틸아미노)-2-(4-모르폴리노페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4-모르폴린 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 261. 4-(시클로부틸아미노)-2-(4-(4-메틸피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 1-메틸피페라진 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 262. 4-(시클로부틸아미노)-2-(4-(3,3-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 3,3-디플루오로피페리딘 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 263. 4-(시클로부틸아미노)-2-(4-(4,4-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 4,4-디플루오로피페리딘 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 264. (R)-2-(4-(2-카르바모일피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 265. 2-(4-((2S,4R)-2-카르바모일-4-히드록시피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 266. 4-(시클로프로필아미노)-2-(4-((2S,4R)-4-히드록시-2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 267. 4-(시클로프로필아미노)-2-(4-((2S,4R)-2-(디메틸카르바모일)-4-히드록시피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 268. 4-(시클로부틸아미노)-2-(4-(4-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (에틸 이소니페코테이트 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 269. 4-(시클로부틸아미노)-2-(4-(4-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (에틸 이소니페코테이트 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 270. 4-(시클로부틸아미노)-2-(4-(4-(2-히드록시에틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (1-히드록시에틸피페라진 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 271. 2-(3-클로로-4-모르폴리노페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 272. 4-(시클로부틸아미노)-2-(4-(3,3-디플루오로피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (3,3-디플루오로피롤리딘 및 4-플루오로니트로벤젠으로부터 유도된 아닐린 사용).
실시예 273. 4-(시클로부틸아미노)-2-(4-(메틸카르바모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 274. 4-(시클로부틸아미노)-2-(4-(디메틸카르바모일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 275. (S)-4-(메틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 메틸아민 사용).
실시예 276. (S)-4-(에틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 에틸아민 사용).
실시예 277. (S)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)-4-(프로프-2-이닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 프로파르길아민 사용, 메틸아민 대신에 프로파르길아민을 사용).
실시예 278. (S)-4-(시클로프로필메틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 시클로프로필메틸아민 사용).
실시예 279. (R)-2-(4-(3-카르바모일피페리딘-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 트리플루오로에틸아민 사용).
실시예 280. (R)-2-(4-(3-(메틸카르바모일)피페리딘-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 트리플루오로에틸아민 사용).
실시예 281. (S)-2-(4-(2-카르바모일피페리딘-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 트리플루오로에틸아민 사용).
실시예 282. (S)-2-(4-(2-(디메틸카르바모일)피페리딘-1-일)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 트리플루오로에틸아민 사용).
실시예 283. 2-(4-메톡시페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 트리플루오로에틸아민 사용, 마지막 단계에서 파라-아니시딘 사용).
실시예 284. 2-(4-카르바모일페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 트리플루오로에틸아민 사용, 마지막 단계에서 4-아미노벤즈아미드 사용).
실시예 285. (S)-4-(tert-부틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 tert-부틸아민 사용).
실시예 286. (S)-4-(2-메톡시에틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 2-메톡시에틸아민 사용).
실시예 287. (S)-4-(시클로펜틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 시클로펜틸아민 사용).
실시예 288: 4-(시클로프로필아미노)-2-(4-에톡시페닐아미노)피리미딘-5-카르복스아미드
중간체 361.1을 NMP 중 4-에톡시아닐린 361.2 [CAS 156-43-4] 및 pTSA와 함께 교반하였다. 반응물을 120℃에서 2시간 동안 밀봉된 튜브에서 가열하였다. 반응물을 냉각시키고, 수성 TFA를 사용하여 약간 산성으로 만들고, 역상 정제용 HPLC로 정제하여, 표제 화합물을 수득하였다.
실시예 289: 4-(시클로프로필아미노)-2-(4-페녹시페닐아미노)피리미딘-5-카르복스아미드
중간체 361.1을 실시예 288에 기재된 바와 같이 NMP 중 4-페녹시아닐린 [CAS 139-59-3] 및 pTSA와 함께 교반하였다. 역상 정제용 HPLC 처리하여, 표제 화합물을 수득하였다.
실시예 290: 4-(시클로프로필아미노)-2-(4-(트리플루오로메톡시)페닐아미노)피리미딘-5-카르복스아미드
중간체 361.1을 실시예 288에 기재된 바와 같이 NMP 중 4-(트리플루오로메톡시)아닐린 [CAS 461-82-5] 및 pTSA와 함께 교반하였다. 역상 정제용 HPLC 처리하여, 표제 화합물을 수득하였다.
실시예 291: 4-(시클로프로필아미노)-2-(4-(피리딘-3-일옥시)페닐아미노)피리미딘-5-카르복스아미드
중간체 361.1을 실시예 288에 기재된 바와 같이 NMP 중 4-(3-피리딜옥시)아닐린 [CAS 80650-45-9] 및 pTSA와 함께 교반하였다. 역상 정제용 HPLC 처리하여, 표제 화합물을 수득하였다.
실시예 292: 2-(4-(2-시아노에틸술포닐)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
중간체 361.1을 실시예 288에 기재된 바와 같이 NMP 중 3-(4-아미노페닐)술포닐 프로판니트릴 [CAS 84362-27-6] 및 pTSA와 함께 교반하였다. 역상 정제용 HPLC 처리하여, 표제 화합물을 수득하였다.
실시예 293: 4-(시클로프로필아미노)-2-(4-이소부톡시페닐아미노)피리미딘-5-카르복스아미드
중간체 361.1을 실시예 288에 기재된 바와 같이 NMP 중 4-(2-메틸프로폭시)아닐린 히드로클로라이드 [CAS 1050161-26-6] 및 pTSA와 함께 교반하였다. 역상 정제용 HPLC 처리하여, 표제 화합물을 수득하였다.
실시예 294: 4-(시클로프로필아미노)-2-(4-(티아졸-4-일메틸술포닐)페닐아미노)피리미딘-5-카르복스아미드
중간체 361.1을 실시예 288에 기재된 바와 같이 NMP 중 4-(티아졸-4-일메틸술포닐)아닐린 및 pTSA와 함께 교반하였다. 역상 정제용 HPLC 처리하여, 표제 화합물을 수득하였다.
실시예 295. (S)-4-(벤질아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 벤질아민을 사용).
실시예 296. (S)-4-(이소프로필아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 이소프로필아민 사용).
실시예 297. (S)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)-4-(2,3,6-트리플루오로벤질아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 2,3,6-트리플루오로벤질아민 사용).
실시예 298. (S)-4-(2-메톡시에틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 201에 기재된 것과 유사한 절차를 이용하여 제조하였다 (반응식 1에 기재된 출발 물질의 합성에서 시클로부틸아민 대신에 2-메톡시에틸아민 사용).
실시예 299. 4-(1-메틸-1H-인다졸-4-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 151에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 300.4-(1,2-디메틸-1H-인돌-4-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 301. 4-(4-클로로나프탈렌-1-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 302.4-(3-메틸신놀린-5-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 303. 4-(벤조[d]티아졸-7-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 304. 4-(나프탈렌-1-일아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 305. 4-(4-(메틸술포닐)페닐아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 48에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 306. 2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)-4-(2,2,2-트리플루오로에틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 화학을 이용하여 합성하였다 (시클로부틸아민 대신에 트리플루오로에틸아민을 사용).
실시예 307. 4-(벤질아미노)-2-(4-(2-(피롤리딘-1-일)에톡시)페닐아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 화학을 이용하여 합성하였다 (시클로부틸아민 대신에 벤질아민 사용).
실시예 309. 4-(시클로부틸아미노)-2-(2-옥소인돌린-5-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 5-아미노인돌린-2-온 및 반응식 1에 기재된 절차를 이용하여 제조하였다.
실시예 310. 4-(시클로부틸아미노)-2-(4-메틸-3-옥소-3,4-디히드로-2H-벤조[b][1,4]옥사진-7-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 N7-아미노-4-메틸-2H-벤조[b][1,4]옥사진-3(4H)-온 (2-아미노-5-니트로페놀 및 에틸 브로모아세테이트로부터 세 단계로 합성)을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 311. 4-(시클로부틸아미노)-2-(2-옥소-1,2,3,4-테트라히드로퀴놀린-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 6-아미노-3,4-디히드로퀴놀린-2(1H)-온 (3,4-디히드로퀴놀린-2(1H)-온의 니트로화에 이어서 철 분말을 사용하여 환원시킴)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 312. 4-(시클로부틸아미노)-2-(2,2,4-트리메틸-3-옥소-3,4-디히드로-2H-벤조[b][1,4]옥사진-7-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 N7-아미노-4-메틸-2H-벤조[b][1,4]옥사진-3(4H)-온 (2-아미노-5-니트로페놀 및 에틸 2-브로모-2-메틸프로파노에이트로부터 세 단계로 합성)을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 313. 4-(시클로부틸아미노)-2-(1-메틸-2-옥소-1,2,3,4-테트라히드로퀴놀린-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 6-아미노-1-메틸-3,4-디히드로퀴놀린-2(1H)-온 (3,4-디히드로퀴놀린-2(1H)-온의 니트로화에 이어서 메틸화, 후속으로 철 분말을 사용하여 환원)을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 314. 4-(시클로부틸아미노)-2-(4-메틸-3-옥소-3,4-디히드로-2H-벤조[b][1,4]옥사진-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 6-아미노-4-메틸-2H-벤조[b][1,4]옥사진-3(4H)-온 (2-아미노-4-니트로페놀 및 에틸 브로모아세테이트로부터 세 단계로 합성)을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 315. 4-(시클로부틸아미노)-2-(3-옥소-3,4-디히드로-2H-벤조[b][1,4]옥사진-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 6-아미노-2H-벤조[b][1,4]옥사진-3(4H)-온 (2-아미노-4-니트로페놀 및 에틸 브로모아세테이트로부터 두 단계로 합성)를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 316. 2-(1H 벤조[d][1,2,3]트리아졸-6-일아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드
상기 화합물을 1H-벤조[d][1,2,3]트리아졸-6-아민을 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 317. 4-(시클로부틸아미노)-2-(2-옥소-2,3-디히드로벤조푸란-5-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 5-아미노벤조푸란-2(3H)-온를 사용하여 반응식 1에 기재된 것과 유사한 절차를 이용함으로써 제조하였다.
실시예 318. 4-(시클로프로필아미노)-2-(2,2-디플루오로벤조[d][1,3]디옥솔-5-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 319. 4-(시클로프로필아미노)-2-(2-메틸벤조[d]티아졸-5-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 320. 2-(벤조[d]티아졸-5-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 321. 4-(시클로프로필아미노)-2-(이미다조[1,2-a]피리딘-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 322. 2-(1H-벤조[d]이미다졸-6-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 323. 2-(1H-벤조[d][1,2,3]트리아졸-6-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 324. 4-(시클로프로필아미노)-2-(3-메틸-1H-인다졸-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 325. 2-(벤조[c][1,2,5]티아디아졸-5-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용).
실시예 326. 2-(7-클로로-1H-인다졸-6-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차 (시클로부틸아민 대신에 시클로프로필아민 사용)를 이용하여 제조한 후, N-클로로숙신이미드를 사용하여 6-아미노인다졸 고리를 염소화시켰다.
실시예 327. 2-(3-클로로-1H-인다졸-5-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 실시예 326에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 328. 2-(1-(2-아미노-2-옥소에틸)-1H-인다졸-6-일아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다 (시클로부틸아민 대신에 시클로프로필아민 사용, 6-니트로인다졸 및 에틸 브로모아세테이트로부터 유도된 중간체 사용).
실시예 329. 4-(시클로부틸아미노)-2-(2,2-디플루오로벤조[d][1,3]디옥솔-5-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 330. 4-(시클로부틸아미노)-2-(이미다조[1,2-a]피리딘-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 331. 4-(시클로부틸아미노)-2-(3-메틸-1H-인다졸-6-일아미노)피리미딘-5-카르복스아미드
상기 화합물을 반응식 1에 기재된 것과 유사한 절차를 이용하여 제조하였다.
실시예 332
본 실시예에서는 본 발명의 화합물의 평가 방법과 함께 상기 분석에 대해 얻은 결과를 설명하였다. 본 발명의 화합물의 시험관내 및 생체내 인간 syk 활성을 당업계에 공지된 다양한 절차, 예컨대 인간 혈장 syk의 활성을 억제하는 그의 능력에 대한 시험에 의해 측정하였다. 본 발명의 화합물에 의해 나타나는 인간 syk 억제에 대한 강력한 친화도를 IC50 값 (nM)으로 측정할 수 있었다. IC50 값은 인간 syk 단백질분해 활성의 50% 억제를 제공하기 위해 요구되는 화합물의 농도 (nM)이다. IC50 값이 작아질수록 화합물은 syk 활성의 억제에 대해 보다 활성 (강력함)이다.
syk에 대한 억제 활성을 검출하고 측정하기 위한 시험관내 분석은 다음과 같다:
syk
티로신 인산화 활성의 억제
syk 티로신 인산화 활성을 억제하는 후보 분자의 능력을, 시험 화합물이 syk-특이적 기질의 syk-매개 티로신 인산화를 억제하는 능력을 측정함으로써 평가하였다.
SYK 티로신 인산화 활성을 퍼킨 엘머 라이프 앤드 애널리티컬 사이언시즈 (Perkin Elmer Life and Analytical Sciences, 매사추세츠주, 보스톤)에서 개발한 랜스 (LANCE, 상표명) 기술을 이용하여 측정하였다. 랜스 (상표명)는 시간차 형광 공명 에너지 전달 분석 (TR-FRET)과 같은 기술을 이용한 동차의 시간차 형광계 적용을 지칭한다 (일반적으로 www.perkinelmer.com/lifesciences의 [Perkin Elmer Application Note- How to Optimize a Tyrosine Kinase Assay Using Time Resolved Fluorescence-Based LANCE Detection] 절차 참조). 분석 원칙은 포스포특이적 유로퓸-표지 항체에서 수용체로서의 스트렙타비딘-알로피코시아닌으로의 에너지 전송을 이용하는 인산화 기질의 검출을 포함한다.
SYK 티로신 인산화 활성을 억제하는 후보 분자의 능력을 시험하기 위해, 분자를 30% DMSO 중에서 재구성하고, 후보 분자의 부재하에 DMSO를 함유하는 최종 희석액으로 연속적으로 희석 (1:3)하였다. 분석의 최종 DMSO 농도는 3%였다. 키나제 분석을 이액형 반응으로 수행하였다. 제1 반응은 후보 분자, 전장 활성 재조합 SYK 효소 (밀리포어, 캘리포니아주) 및 비오틴-표지 SYK-특이적 기질 비오틴-DEEDYESP-OH로 이루어지는 키나제 반응이다. 제2 반응은 키나제 반응을 종결시키고, 검출 시약-유로퓸-표지 항-포스포티로신 시약 (Eu-W1024-PY100, 퍼킨 엘머, 매사추세츠주, 보스톤) 및 스트렙타비딘-알로피코시아닌 검출 시약 (SA-APC, 프로자임 (Prozyme), 캘리포니아주)을 동시에 첨가하는 것을 포함한다. 키나제 반응은 흑색 U-바닥 96-웰 마이크로타이터 플레이트에서 수행하였다. 최종 반응 부피는 50 ㎕였고, 1 nM 활성 SYK 효소, 550 nM SYK-기질, 및 50 mM 트리스 (pH 7.5), 5 mM MgCl2 및 1 mM DTT를 함유하는 완충액 중에 희석된 100 μM ATP의 최종 농축물을 함유하였다. 반응을 실온에서 1시간 동안 수행하였다. 켄칭 완충액은 100 mM 트리스 (pH 7.5), 300 mM NaCl2, 20 mM EDTA, 0.02% Brij35 및 0.5% BSA를 함유한다. 검출 시약을 Eu-W1024-PY100에 대해 1:500 및 SA-APC에 대해 1:250의 희석액으로 반응 혼합물에 첨가하였다. 검출 시약을 함유하는 켄칭 완충액 50 ㎕를 첨가하여 키나제 반응을 종결시켰다. 검출을 실온에서 1시간 동안 수행하였다. 억제제의 존재 및 부재하에 인산화 기질의 검출을 TR-FRET 기기, 애널리스트 HT (Analyst HT) (몰레큘러 프로브스 (Molecular Probes), 캘리포니아주, 서니배일)로 측정하였고, 크라이터리온호스트 릴리즈 (CriterionHost Release) 2.0 (몰레큘러 프로브스, 캘리포니아주, 서니배일)을 이용하여 측정 조건을 설정하였다. 이용된 설정은 다음과 같다: 여기 360 nm, 방출 665 - 7.5 nm, 빔 스플리터 350 nm 50/50, 플래쉬 100 펄스, 지연 60 us, 통합 400 us, z-높이 2 mm. SYK-티로신 키나제 활성의 억제를 억제제가 없는 경우와 비교하여, 억제제의 존재 하에 관측한 최대 반응으로 계산하였다. IC50은 비-선형 회귀 분석으로 유도하였다.
세포내 포스포-유세포측정을 이용하여 온전한 비-호지킨 림프종 세포주 라모스 및 SUDHL-6에서 Syk 활성의 화합물 억제를 시험하였다. 로그 성장기의 10 X 106개의 세포를 분취하고; 세포를 B-세포 수용체에 특이적인 항체 3 ㎍/ml와 함께 10분 동안 인큐베이션하여 Syk 키나제를 활성화시켰다. 바로 이어서, 세포를 실온에서 5분 동안 1% 파라포름알데히드 중에 고정하고, 인산염 완충 염수로 세척한 후, 빙냉 메탄올 중에서 2시간 동안 인큐베이션하여 투과시켰다. 세포를 다시 인산염 완충 염수로 세척하고, 이어서 인산화 Erk (Y204) 및 BLNK (Y84) (이들은 Syk 키나제 활성의 지표임)에 특이적인 항체, 및 인산화 Syk (Y352) (Src 패밀리 키나제 활성의 척도)와 함께 30분 동안 인큐베이션하였다. 이용된 모든 항체는 BD 파밍겐 (BD Pharmingen, 캘리포니아주, 산호세)으로부터 구입하였다. 항체와 함께 인큐베이션한 후, 세포를 다시 세척하고, 유세포측정 처리하였다. 화합물에 의한 B 세포 수용체 신호전달 억제를 상술하는 대표적인 데이터를 IC50 범위로서 표 1에 나타냈다.
또한, 비-호지킨 림프종 B 세포주 SUDHL-4, SUDHL-6 및 톨레도 (Toledo) 상의 화합물의 항증식성 효과를 평가하였다. SUDHL-4 및 SUDHL-6이 성장 및 생존을 위해 B 세포 수용체 신호전달을 필요로 하는 반면 톨레도 세포주 (본원에서 음성 대조군으로서 작용함)는 그렇지 않다. 세포를 96-웰 플레이트의 각 웰에 나누고, 72시간 동안 화합물의 농도를 증가시키면서 인큐베이션한 후, 제조자에 의해 공급된 프로토콜에 따라 MTT 분석법 (케미콘 인터네셔널 인코포레이티드 (Chemicon International, Inc.), 캘리포니아주, 테메큐라)을 이용하여 세포 생존 및 증식을 측정하였다. 데이터는 5 또는 6회의 독립적 실험으로부터 IC50 ± 표준 편차로서 표 2에 상세히 설명하였다.
비-호지킨 림프종 B 세포주 SUDHL-4, SUDHL-6 및 톨레도의 아폽토시스의 유도를 아폽토시스 마커 카스파제 3을 측정함으로써 평가하였다. 세포를 24, 48 및 72 시간 동안 1, 3 또는 10 μM 화합물과 함께 인큐베이션하였다. 각 시점의 말미에, 세포를 모노클로날 토끼 안티-액티브 카스파제-3 안티바디 키트 (Monoclonal Rabbit Anti-Active Caspase-3 Antibody Kit) 및 관련 프로토콜 (BD 파밍겐)을 이용하여 유세포측정 분석을 위해 처리하였다. 두 독립적 실험으로부터의 데이터를 표 3a 및 3b에 나타냈다 (지시된 조건하에 화합물과 함께 인큐베이션한 후에 아폽토시스된 총 세포의 비율을 나타냄).
Syk 활성은 나타낸 바와 같이 B 세포 신호전달, 증식 및 생존을 위해 요구될 뿐만 아니라, B 세포 수용체의 교차결합 상의 세포 활성화를 위해서도 중요하다. B 세포 활성화는 세포 신호전달, 항원 전달 및 부착에 관련된 여러 단백질의 세포 표면 발현을 증가시킨다. 이들 중, CD80, CD86 및 CD69는 B 세포 활성화 상태를 결정하기 위해 일반적으로 측정된다. 그러므로, 비장으로부터 단리한 1차 마우스 B 세포를 등분하고, 화합물의 농도를 증가시키면서 (0.05에서 2 μM) 염소 항-마우스 IgD (이바이오사이언시즈 인코포레이티드 (eBiosciences, Inc.), 캘리포니아주, 샌디에고)의 존재하에 20시간 동안 인큐베이션하여, B 세포 수용체를 교차-결합시켰다. 이어서, 세포를 세척하고, CD80, CD86 및 CD69 B 세포 활성화 마커에 특이적인 항체와 함께 얼음 상에서 30분 동안 인큐베이션하였다. B 세포 마커 CD45RO로 염색하여 B 세포를 전체 집단으로부터 단리하였다. 모든 항체는 BD 파밍겐으로부터 구입하였다. 표 4에 이들 화합물이 마우스 1차 B 세포의 B 세포 수용체 유도 활성화를 억제하는 IC50 범위를 나타냈다.
하기 표에서, Syk 및/또는 Jak 분석에서의 활성을 다음과 같이 제공하였다: +++++ = IC50 < 0.0010 μM; ++++ = 0.0010 μM < IC50 < 0.010 μM, +++ = 0.010 μM < IC50 < 0.10 μM, ++ = 0.10 μM < IC50 < 1 μM, + = IC50 > 1 μM.
GPVI
-매개 혈소판 기능의
시험관내
억제
GPVI-특이적 효능제 콘불륵신(Convulxin)-유도 인간 혈소판 칼슘-이동 또는 응집의 억제를 측정하여 syk-매개 혈소판 기능을 억제하는 후보 분자의 능력을 시험하였다. 칼슘-이동을 96-웰 마이크로타이터 포맷으로 인간 세척 혈소판에서 평가하였다. 인간 혈소판-풍부 혈장 (PRP)을 사용하여 표준 큐벳 광 투과율 응집검출법 또는 96-웰 마이크로타이터 분석 (일반적으로 문헌 [Jantzen, H. M. et al. (1999) Thromb. Hemost. 81:111-117]의 절차 참조)으로 응집을 평가하였다.
콘불륵신
-매개 혈소판 칼슘-이동의
시험관내
억제
콘불륵신 유도 칼슘-이동의 억제를 FLIRP 칼슘 3 분석 키트 (몰레큘러 디바이시즈, 캘리포니아주, 서니배일)를 이용하여 인간 세척 혈소판에서 측정하였다. 세척 혈소판의 제조를 위해, 약물을 투여받은 적이 없는 건강한 지원자로부터 인간 정맥 혈액을 PGI2를 함유하는 ACD (85 mM 시트르산나트륨, 111 mM 글루코스, 71.4 mM 시트르산) (최종 0.2 μM PGI2를 함유하는 ACD 1.25 ml; PGI2는 시그마 (Sigma, 미주리주, 세인트 루이스)로부터 입수)내로 수집하였다. 혈소판-풍부 혈장 (PRP)을 실온에서 20분 동안 160 X g에서 원심분리하여 제조하였다. PRP를 730 g에서 10분 동안 원심분리하고, 혈소판 펠릿을 CGS (13 mM 시트르산나트륨, 30 mM 글루코스, 120 mM NaCl; 2 ml CGS/최초 혈액 부피 10 ml) 중에 재현탁시켜, 세척 혈소판을 제조하였다. 37 ℃에서 15분 동안 인큐베이션한 후, 10분 동안 730 g에서 원심분리하여 혈소판을 수집하고 Hepes-티로드 완충액 (10 mM Hepes, 138 mM NaCl, 5.5 mM 글루코스, 2.9 mM KCl, 12 mM NaHCO3, pH 7.4) 중에 3 X 108 혈소판/ml의 농도로 재현탁시켰다. 이 혈소판 현탁액을 실온에서 >45분 유지한 후, 칼슘 이동 분석에 사용하였다.
96-웰 플레이트 칼슘-이동 실험을 위해, 동일 부피의 3 X 108 세정 혈소판/ml를 1X 행크 평형 염 용액, pH 7.4, 20 mM Hepes 완충액 중에 재현탁시킨 동일 부피의 칼슘-3 분석 시약 A와 함께 인큐베이션하였다. 0.2 ml/웰의 전체 반응물 부피에는 1.5 X 108/ml 세척 혈소판/칼슘-3 분석 시약 A 혼합물, 10 μM 엡티피바티드 (Eptifibatide) (밀레니엄 파마슈티컬즈 인코포레이티드 (Millennium Pharmaceuticals Inc), 매사추세츠주, 캠브리지), 0.75% DMSO 중 시험 화합물의 연속 희석액 (1:3)이 포함된다. 최대 칼슘-이동을 판독하기 위해 각각의 8 세트 중 1개의 웰에는 DMSO를 단독으로 첨가하였다. 실온에서 20분 동안 예비 인큐베이션한 후, 96-웰 마이크로플레이트 판독기를 플렉스스테이션 (FlexStation, 몰레큘러 디바이시즈, 캘리포니아주, 서니배일)에 로딩하였다. 칼슘 이동을 측정하기 위한 플렉스스테이션 실험 조건을 소프트맥스 프로 (SOFTMax Pro)를 이용하여 설정하였다. 이용된 설정을 하기에 상술하였다. 형광 파라미터-분석 모드: 플렉스, 여기 485 nM, 525 nM (515 nM의 컷오프); 파라미터- PMT 감도- 6, 피펫 높이 230 ㎕, 판독 시간 2분 40초, 판독 간격 2초, 온도-23-25 ℃. 기준선 판독 18초 후, 125 ng/ml의 최종 농도로 콘불륵신을 첨가하여 칼슘-이동을 개시하였다. 칼슘-이동의 억제를 억제제의 부재하에 관측된 최대 반응과 비교하여, 억제제의 존재하에 관측된 최대 반응으로 계산하였다. IC50은 비-선형 회귀 분석으로 유도하였다.
콘불륵신
-매개 혈소판 응집의
시험관내
억제
응집 분석을 위한 인간 혈소판-풍부 혈장을 제조하기 위해, 약물을 투여받은 적이 없는 건강한 지원자로부터 인간 정맥 혈액을 0.38% 시트르산나트륨 (0.013 M, 최종 pH 7.0) 내로 수집하였다. 전혈을 실온에서 20분 동안 160 X g에서 원심분리하여 혈소판-풍부 혈장 (PRP)을 제조하였다. PRP 층을 취하여 새로운 튜브로 옮기고, 유리한 경우 혈소판-결핍 혈장 (PPP)을 사용하여 약 3 X 108 혈소판/mL의 혈소판 농도가 되도록 혈소판 수를 조정하였다. 남아있는 혈액 샘플 (PRP 분리 후)을 20분 동안 800 X g에서 원심분리하여 PPP를 제조하였다. 이어서, 상기 PRP 제조물을 96-웰 플레이트 또는 표준 큐벳 응집검출법에서의 응집 분석에 사용할 수 있었다.
콘불륵신 유도 응집의 억제를 문헌 [Frantantoni et al ., Am . J. Clin . Pathol. 94, 613 (1990)]에 기재된 절차와 유사한 마이크로타이터 플레이트 진탕기 및 플레이트 판독기를 이용하는 96-웰 바닥이 평평한 마이크로타이터 플레이트에서 측정하였다. 모든 단계는 실온에서 수행하였다. 혈소판-풍부 혈장 (PRP)을 사용한 96-웰 플레이트 응집의 경우, 0.2 mL/웰의 총 반응 부피에는 PRP 190 ㎕ (약 3 X 108 혈소판/ml, 상기 참조), 및 30% DMSO 또는 완충액 (대조군 웰용) 중 시험 화합물의 연속 희석액 5 ㎕가 포함되었다. 실온에서 20분 동안 예비 인큐베이션한 후, 용액에 대해 320 ng/ml의 콘불륵신 5 ㎕를 각 웰에 첨가하여, 최종 농도 8 ng/ml의 콘불륵신을 생성하였다. 이어서, 플레이트를 마이크로타이터 플레이트 진탕기 상에서 5분 동안 흔들고, 마이크로타이터 플레이트 판독기 (소프트맥스, 몰레큘러 디바이시즈, 캘리포니아주, 멘로 파크) 상에서 5분 판독치를 얻었다. t=5분에 650 nm에서 OD의 감소로부터 응집을 계산하였다. IC50은 비-선형 회귀 분석으로 유도하였다.
콘불륵신-유도 응집의 억제를 또한 큐벳 광 투과율 응집 분석을 위해 측정하였고, 시험 화합물의 연속 희석액 (1:2)을 96 웰 V-바닥 플레이트에서 30% DMSO로 제조하였다 (큐벳 중 최종 DMSO 농도는 0.3%임). 응집 반응을 개시하기 전에 시험 화합물 (DMSO 중 연속 희석액 5 ㎕)을 PRP와 함께 20분 동안 예비 인큐베이션하였고, 응집 반응은 크로노로그 (ChronoLog) 응집기에서 PRP 495 ㎕에 효능제 (125-250 ng/ml 콘불륵신)를 37 ℃에서 첨가하여 수행하였다. 응집 반응을 4분 동안 기록하고, 최대 응집 정도를 4분의 분석 기간 동안 발생한 최대 응집과 비교하여 기준선에서의 응집 정도와의 차이로 결정하였다. 응집 억제는 억제제의 부재하에 관측된 값과 비교하여 억제제 존재하에 관측된 최대 응집으로서 계산하였다. IC50은 비-선형 회귀 분석으로 유도하였다.
화합물, 및 그의 syk 및 PRP IC50 값의 예를 표 1-5에 제시하였다.
BCR
교차결합에 의해 유도된 라모스 세포의 칼슘 유동 분석
라모스 세포 (2G6.4C10, 버킷 림프종, ATCC 품목 번호: CRL-1923)를 실험 3일 또는 4일 전에 신선한 배지 중에서 5 X 105 세포/ml로 2차 배양하였다. 세포를 수확하고, 신선한 배지 중에 8 X 106 세포/ml로 재현탁시킨 후, 염료-로딩하였다. 동일 부피의 칼슘 3 로딩 염료 (몰레큘러 디바이스)를 첨가하고, 세포 현탁액 내로 혼합하였다. 로딩 세포를 96 웰 플레이트에 분주하고, 30분 동안 인큐베이션하였다. 이어서, 화합물을 염료-로딩 세포에 첨가하고, 추가로 30분 동안 인큐베이션하였다. 1000 rpm에서 3분 동안 세포를 회전시켜 침강시킨 후, 플렉스스테이션으로 형광 측정하였다. 5 ㎍/ml 항체 (어피니퓨어 (AffiniPure) F(ab')2 단편 당나귀 항-인간 IgM, 잭슨 이뮤노리서치 래보래토리즈 (Jackson ImmunoResearch Laboratories))를 첨가하여 BCR 자극을 수행하였다.
TCR
교차결합에 의해 유도된
저캣
(
Jurkat
) 세포의 칼슘 유동 분석
프로토콜은 상기 부문에 기술한 바와 같은 B 세포 칼슘 유동과 매우 유사하다. 유일한 차이는 T 세포 (클론 E6-1, 급성 T 세포 백혈병, ATCC 품목 번호: Tib-152) 및 항-인간 CD3 (기능적 등급의 정제 항-인간 CD3, 클론 OKT3, 이바이오사이언스, No. 16-0037)을 B 세포 및 항-인간 IgM으로 대체했다는 것이다. 세포 밀도는 동일하게 유지하였으나, 항체는 100 ng/ml의 농도로 사용하였다.
TCR
교차결합에 의해 유도된
저캣
세포의
IL
-2 분비
저캣 세포 증식 및 화합물 인큐베이션 절차는 상기 부문에서 저캣 칼슘 유동 분석에 대해 기재한 바와 동일하였다. 항체 (항 CD3, OKT3)를 신선한 플레이트 상에 100 ng/웰로 (세포 없이) 코팅하였다. 세포를 8 X 106 세포/ml로 현탁시키고, 별도의 플레이트에서 30분 동안 화합물과 함께 인큐베이션하였다. 인큐베이션 말미에, 세포를 항체-코팅된 플레이트로 옮기고, 16시간 동안 인큐베이션하였다. 인큐베이션한 후 세포 배양물 100 ㎕를 인큐베이션 후의 IL-2 측정에 사용하였다. IL-2 ELISA 키트 (인간 IL-2 ELISA 키트 II, BD 바이오사이언스 (BD Bioscience), No. 550611)를 이용하여 IL-2 수준을 측정하였다.
실시예 333 밀리포어 업스테이트 키나제프로파일러 (Millipore Upstate KinaseProfiler, 상표명) 스크리닝
이 분석에서 JAK3의 촉매적 활성에 대한 화합물의 효과를 직접적으로 측정하였다. 정제 인간 JAK3 (진뱅크 (GenBank) AF513860) 서열 (잔기 781 - C 말단)을 곤충 세포로부터 얻었다. ATP의 촉매적 가수분해를 방사측정 필터 결합 방법을 이용하여 측정하였다. 33[P]ATP 및 기질과 함께 키나제를 인큐베이션하여 33[P]를 기질로 도입시키고, 이어서 이를 여과에 의해 다른 반응 성분으로부터 분리할 수 있었다. 분석은 1, 0.3 또는 0.1 μM 화합물의 존재 또는 부재하에 10 μM ATP를 사용하여 수행하였다. 활성은 제어의 억제율 (%)로 표현하였다.
ND: 수행하지 않음
실시예 334 앰비트 키놈스캔 (Ambit KinomeScan) 스크리닝
이 분석은 관심의 대상이 되는 인간 키나제를 독점적 태그 (T7 박테리오파지)에 융합시키는 ATP-부위 의존성 경쟁 결합 분석이다. 고정 활성-부위 지정 리간드에 결합된 키나제의 양을 시험 화합물의 존재 및 부재하에 측정하였다. 앰비트 JAK 분석은 전장 단백질이 아닌 키나제 도메인을 이용한다. JAK3 결합에 사용한 도메인이 촉매적 도메인인 반면 JAK1 결합에 사용한 도메인은 유사 키나제 도메인이다 (문헌 [Mazen W Karaman, Sanna Herrgard, Daniel K Treiber, et. al. A Quantitative analysis of Kinase inhibitotr selectivity. Nature Biotechnology, 2008, Volume 26, No. 1, Page 127-132]).
<표 9a>
<표 9b>
실시예 335 JAK3/STAT6 세포 분석
인터류킨 4 (IL4)로 라모스 B 세포를 자극하여 JAK1/JAK3을 통한 신호전달을 유도함으로써 STAT6 (신호 변환제 및 전사 활성화제)의 인산화를 일으켰다. JAK3 및/또는 JAK1의 억제에 대한 화합물의 효과를 인산화된 STAT6의 양을 측정함으로써 평가할 수 있었다. 이는 특이적 포스포-STAT6 항체를 이용하여 웨스턴 블롯팅에 의해 수행하였다.
라모스 B 세포를 10 mM Hepes-완충 RPMI 배지 (2 X 107 세포/ml) 중에 현탁시켰다. 세포 (90 ㎕)를 3.3 ㎍/ml 인터류킨 4 (알앤디 시스템즈 인코포레이티드 (R & D Systems Inc), 카탈로그 번호 204-IL; 최종 농도: 0.33 ㎍/ml) 10 ㎕와 함께 인큐베이션하였다. 인큐베이션은 30% DMSO 중에 희석된 화합물 2 ㎕의 존재 또는 부재하에 37 ℃에서 10분 동안 수행하였다. 동일 부피의 2x 용해 완충액 (100 mM 트리스-HCl (pH 8.0), 2% 트리톤-X-100, 5 mM EDTA, 250 mM NaCl, 20% 글리세롤, 1.25 mM PMSF, 5 mM 나트륨 오르토반데이트, 5 mM β-글리세로포스페이트, 미니 완전 EDTA 프로테아제 억제제 칵테일 (시그마 (Sigma))을 첨가하여 반응을 종결시켰다.
샘플을 1 ㎕의 뉴클레아제, 벤조나제 (노바겐 (Novagen), 카탈로그 번호 71205-3)과 함께 실온에서 1시간 동안 인큐베이션한 후, 50 ㎕의 5x 로딩 완충액 (330 mM 트리스 (pH 6.8), 9.5% SDS, 34% 글리세롤, 0.01% 브로모페놀 블루, 10% 베타-메르캅토에탄올)를 첨가하였다.
세포 용해물 (15 ㎕)을 환원 조건하에 SDS-PAGE (노벡스 4-12% 트리스-글리신 겔, 인비트로겐) 처리한 후, 니트로셀룰로스 막 상에서 전기블로팅-이동시켰다. 후속으로, 막을 자이메드 (Zymed) 차단 완충액 (인비트로겐) 중에서 실온 (RT)에서 1시간 동안, 이어서 4 ℃에서 밤새 [자이메드 차단 완충액 중 1:500 항 포스포티로신- STAT6 (셀 시그널링 테크놀로지 (Cell Signaling Technology), 카탈로그 번호 9364) 1차 항체와 함께] 인큐베이션하였다. 트리스-완충 염수, 0.25% NP40 (TBSN)로 5 x 10분 세척한 후, 블롯을 자이메드 차단 완충액 중에서 1:10,000 HRP-접합 당나귀 항-토끼 2차 항체 (아머샴 바이오사이언시즈 (Amersham Biosciences), 카탈로그 번호 NA934V)의 존재하에 실온에서 1시간 동안 인큐베이션하였다. 4 x 10분 TBSN 세척 후, 블롯을 ECL (피어스 웨스턴 라이트닝 (Pierce Western Lightening), 퍼킨 엘머 카탈로그 번호 NEL101)에 의해 가시화하였다. 총 β3 함량을 측정하기 위해, 블롯을 스트리핑하고, TBSN으로 세척하고 (4 x), 4 ℃에서 밤새 차단 완충액 중에서 1:2000 C3A 항체를 사용하여 재탐지하였다. 4 x 10분 TBSN 세척 후, 블롯을 차단 완충액 중에서 1:10,000 염소 항-마우스 2차 항체와 함께 인큐베이션하고, TBSN으로 4회 더 세척하고, 웨스턴 라이트닝 시약에 노출시켰다. 배경에 걸친 자극 수준 및 화합물의 억제 정도를 농도측정법으로 측정하였다.
실시예 336 IL-4로 자극된 라모스 B-세포주에 대한 JAK 키나제 활성의 억제 분석
이들 실시예에서 본 발명의 화합물의 시험관내 및 생체내 인간 JAK 키나제 활성을 평가하는 방법을 설명하였으며, 이는 인간 혈장 JAK 키나제의 활성을 억제하는 그의 능력을 시험하는 것과 같이 당업계에 공지된 다양한 절차에 의해 결정할 수 있었다. 본 발명의 화합물에 의해 나타나는 인간 JAK 키나제 억제에 대한 강력한 친화도를 IC50 값 (nM)으로 측정할 수 있었다. IC50 값은 인간 JAK 키나제 활성의 50% 억제를 제공하는데 요구되는 화합물의 농도 (nM)이다. IC50 값이 작아질수록 화합물은 JAK 키나제 활성의 억제에 대해 보다 활성 (강력함)이다.
JAK 키나제에 대한 억제 활성을 검출하고 측정하기 위한 시험관내 분석은 다음과 같다:
JAK 키나제에 대한 화합물의 활성을 JAK 억제를 시험하기 위해 설계한 세포 분석으로 확인하였다. 요컨대, JAK 억제를 시토킨 인터류킨-4 (IL-4)로 활성화된 인간 라모스 B-세포로 시험하였다. 자극 20 내지 24시간 후에, CD23의 상향조절을 위해 세포를 염색하고, FACS로 분석하였다. IL-4를 사용하여 B-세포를 자극함으로써, JAK 키나제 JAK1 및 JAK3의 인산화를 통한 JAK/STAT 경로의 활성화를 유도하였다 (차례로, 인산화되고, 전사 인자 STAT-5 및 STAT-6을 활성화시킴). 친화도가 낮은 IgE 수용체 (CD23)를 활성화된 STAT-5로 상향조절하였다.
분석을 위해, 세포를 공급하는 증식 프로토콜에 따라 10% 우태혈청 (JRH, 카탈로그 번호 12106-500M)을 함유하는 RPMI 1640 배지 (셀그로 (Cellgro), 카탈로그 번호 10-040-CM) 중에서 인간 라모스 B-세포 (ATCC, 카탈로그 번호 CRL-1596)를 배양하고, 대략 3.5 X 105 세포/ml의 밀도에서 유지하였다. 분석 전날, 세포가 로그성장기에 있는지 확인하기 위하여 세포를 3.5 X 105 세포/mL로 희석하였다. 세포를 회전 침강시키고, ATCC 증식 프로토콜에 따라 열 불활성화된 (JRH 바이오사이언시즈, 인코포레이티드, 켄자스주, 레넥사, 카탈로그 번호 12106-500M) 5-10% 우태혈청 (FBS)을 함유하는 RPMI 1640 배지 (셀그로, 메디아텍, 인코포레이티드 (Cellgro, MediaTech, Inc.), 버지니아주, 헌던, 카탈로그 번호 10-040-CM) 중에 현탁시켰다. 세포를 3.5 X 104-5 세포/ml의 밀도에서 유지하였다. 실험 전날, 라모스 B-세포가 로그성장기에 있는지 확인하기 위하여 이를 3.5 X 105 세포/mL로 희석하고, 분취액을 96-웰 조직 배양 플레이트에 분주하였다. 세포를 37 ℃에서 1시간 동안 시험 화합물 (DMSO 중에 용해됨) 또는 DMSO (대조군)와 함께 인큐베이션하고, 이어서 IL-4 (페포테크 (Pepotech), 카탈로그 번호 200-04)로 20 내지 24시간 동안 자극하였다 (최종 농도는 50 유닛/ml임).
세포를 회전 침강시키고, 5% 혈청을 함유하는 RPMI 중에 현탁시켰다. 96-웰 조직 배양 플레이트에서 지점 당 5 X 104개의 세포를 사용하였다. 세포를 화합물 또는 DMSO (시그마-알드리치 (Sigma-Aldrich), 미주리주, 세인트 루이스, 카탈로그 번호 D2650) 비히클 대조군과 함께 37℃의 인큐베이터에서 1시간 동안 예비 인큐베이션하였다. 이어서, 세포를 50 유닛/mL의 최종 농도로 20 내지 24시간 동안 IL-4 (페프로테크 인코포레이티드 (Peprotech Inc.), 뉴저지주, 로키 힐, 카탈로그 번호 200-04)로 자극하였다. 이어서, 세포를 회전 침강시키고, 항-CD23-PE (BD 파밍겐, 캘리포니아주, 샌디에고, 카탈로그 번호 555711)로 염색하고, FACS로 분석하였다. 벡톤 딕킨슨 바이오사이언시즈 (Becton Dickinson Biosciences, 캘리포니아주, 산호세)로부터 구입한 BD LSR I 시스템 유세포측정기를 이용하여 검출을 수행하였다.
셀티터-글로.RTM. (CellTiter-Glo.RTM.) 발광 세포 생존도 분석 (프로메가 (Promega))을 이용하여 증식을 측정하였고, 이로써 대사적으로 활성인 세포의 지표로서 ATP 잔존량을 기준으로 배양물 중 생존 세포의 수를 결정하였다. 기질을 해동시키고 실온에 이르도록 하였다. 셀 티터-글로 시약 및 희석액을 함께 혼합한 후, 100 ㎕를 각 웰에 첨가하였다. 2분 동안 플레이트를 오비탈 진탕기에서 혼합하여 세포용해를 유도하였고, 실온에서 추가로 10분 동안 인큐베이션하여 신호가 평형을 유지하도록 하였다. 퍼킨 엘머 (코네티컷주, 셀튼)로부터 구입한 왈락 빅터2 (Wallac Victor2) 1420 멀티라벨 카운터를 이용하여 검출을 수행하였다.
이틀째, A549 세포를 2,4-피리미딘디아민 시험 화합물 또는 DMSO (대조군) (시그마-알드리치, 미주리주, 세인트 루이스, 카탈로그 번호 D2650)와 함께 1시간 동안 예비 인큐베이션하였다. 이어서, 세포를 IFNγ (75 ng/mL) (페프로테크 인코포레이티드, 뉴저지주, 로키 힐, 카탈로그 번호 300-02)으로 자극하고, 24시간 동안 인큐베이션하였다. 최종 시험 화합물 투여량 범위는 5% FBS, 0.3% DMSO를 함유하는 F12K 배지 200 ㎕ 중 30 μM 내지 14 nM였다.
삼일째, 세포 배지를 제거하고 세포를 PBS (포스페이트 완충 염수) 200 ㎕로 세척하였다. 각 웰을 트립신으로 처리하여 세포를 분리한 후, 완전 F12K 배지 200 ㎕를 첨가하여 중화시켰다. 세포를 펠릿화하고, 4℃에서 20분 동안 APC 접합된 마우스 항-인간 ICAM-1 (CD54) (BD 파밍겐, 캘리포니아주, 샌디에고, 카탈로그 번호 559771) 항체로 염색하였다. 세포를 빙냉 FACS 완충액 (PBS + 2% FBS)으로 세척하고, 표면 ICAM-1 발현을 유세포측정에 의해 분석하였다. BD 바이오사이언시즈 (캘리포니아주, 산호세)로부터 구입한 BD LSR I 시스템 유세포측정기를 이용하여 검출을 수행하였다. 사건을 라이브 스캐터 (live scatter)에 대해 게이팅 (gated)하고, 기하 평균을 계산하였다 (벡톤-딕킨슨 셀퀘스트 (Becton-Dickinson CellQuest) 소프트웨어 버전 3.3, 뉴저지주, 프랭클린 레이크스). 기하 평균을 화합물 농도에 대해 플롯팅하여 투여량 반응 곡선을 생성하였다.
실시예 337: 비-호지킨 림프종 세포주의 B 세포 수용체를 통한 Syk-매개 신호 전달의 억제.
세포를 화합물과 함께 (0.02 내지 2 uM) 또는 화합물 없이 1시간 동안 전처리한 후, 세포를 항-mu 항체 3 ㎍/ml와 함께 37℃에서 10분 동안 인큐베이션하여 B 세포 수용체 신호전달을 자극하였다. 칼슘 (Calcium) 3 로딩 염료 및 플렉스스테이션 (몰레큘러 디바이시즈)을 이용하여 Ca2 + 유동을 측정하였다. B 세포 수용체 신호전달을 BD 파밍겐 (캘리포니아주, 산호세)에 의해 공급된 프로토콜에 따라 세포내 포스포-유세포측정기로 분석하였다. Syk 활성화를 아미노산 위치 84 (pBLNK Y84)에서의 BLNK 티로신 인산화의 유도 및 아미노산 위치 204 (pERK Y204)에서의 ERK1/2 티로신 인산화의 유도에 의해 측정하였다. Src 패밀리 구성원 Lyn의 활성화를 아미노산 위치 352 (pSyk Y352)에서의 Syk 티로신 인산화의 유도에 의해 측정하였다. 데이터는 IC50 (μM)으로 표시하였다. 각각의 화합물은 효과적으로 B 세포 수용체-유도 Ca2 + 유동 및 Syk (Src 패밀리 구성원인 Lyn 제외)의 활성화를 억제하였다.
실시예 338: Syk 억제는 비-호지킨 림프종 세포주에 대한 항증식성 효과를 나타낸다
각각의 화합물의 농도를 증가시키면서 세포를 인큐베이션하고, 이어서 제조자 공급 프로토콜에 따라 MTT 분석 (회사, 도시, 주)을 이용하여 72시간 동안 증식의 정도를 평가하였다. 데이터는 IC50 값 (μM)으로 표시하였다 (5 또는 6회의 독립적 실험으로부터의 평균 ± 표준 편차로 나타냄). 각각의 화합물은 SUDHL-4 및 -6 세포주의 증식을 억제하였고, 이는 낮은 μM 범위에서 생존 및 성장 신호에 대해 Syk에 의존적이었다. Syk를 필요로하지 않는 톨레도 세포는 Syk 억제의 항증식성 효과에 눈에 띄게 덜 민감했다.
실시예 339: Syk 억제는 비-호지킨 림프종 세포주에서 아폽토시스를 유발한다
데이터는 대세포성 비-호지킨 림프종 B 세포주의 생존에 대한 Syk 및 Syk/JAK 억제의 효과를 평가하는 두가지 독립적 실험을 나타낸다. SUDHL-4 및 SUDHL-6 세포주는 생존에 대한 Syk-매개 B 세포 수용체 신호전달에 의존적인 반면, 톨레도 세포는 그렇지 않았다. 세포를 지시 농도 및 시간에서 화합물과 함께 인큐베이션하였고; 아폽토시스의 유도를 카스파제 3 검출 키트 (시그마-알드리치, 미주리주, 세인트 루이스)를 이용하여 유세포측정에 의해 측정하였다. 데이터는 아폽토시스 마커인 카스파제 3에 대해 양성인 전체 세포의 비율 (%)로 나타냈다. 예상대로, Syk 억제는 SUDHL-4 및 -6 세포주에서 아폽토시스를 유발하였으나, 톨레도 세포주는 그렇지 않았다.
실시예 340: Syk 억제제에 의한 마우스 1차 B 세포 활성화의 억제
마우스 1차 비장세포를 각각의 화합물의 농도를 증가시키면서 (0.05-2 μM) 1시간 동안 전처리한 후, 대조군 또는 염소 항-마우스 IgD 혈청을 첨가하였다. 16시간 후에 활성화 마커 CD80/86과 CD69를 염색하면서 항-IgD 유도 B 세포 활성화를 유세포측정에 의해 측정하였다.
실시예 341: 면역 매개 혈소판감소증의 마우스 모델
면역 매개 혈소판감소증은 혈소판 표면 당단백질에 대해 지정된 항체, 혈소판 표면의 약물-함유 복합체에 대한 항체에 의해, 또는 항체-코팅 세포 또는 혈소판 표면과 상호작용하는 면역 복합체에 의해 유발된다. 항체-매개 혈소판감소증의 마우스 모델에서 혈소판 제거를 억제하는 그들의 능력에 대해 선택 화합물을 평가하였다. 이 모델에서, 래트 항-마우스 GPIIb (클론 MWReg30) 항체 (BD 바이오사이언시즈, 파밍겐)의 정맥내 투여로부터 혈중 혈소판 (대략 50%)의 빠른 제거가 일어났다. 혈소판 제거의 억제능을 평가하기 위해, 화합물을 물 중 0.5% 메틸셀룰로스 중에 현탁시키고, 화합물이 최대 혈장 농도에 도달하면 (전형적으로는, 개별 화합물에 대한 별도의 약동학 실험을 기초로 1 - 2시간), 경구 위관 영양법 (100 ul/마우스)을 통해 투여한 후, 항체를 주사하였다. 항체 주사 4 및 8시간 후, 말단 혈액 샘플을 심장 천자를 통해 비히클 및 시험 품목 처리 마우스의 군 (n=5-10마리 마우스/군)으로부터 채취하였다. 혈액을 시트르산삼나트륨 또는 EDTA를 사용하여 항응고화시켰다. 혈소판 계수를 위해 혈액학 분석기 (헤마베트 (Hemavet), 드류 사이언티픽 (Drew Scientific)) 상에서 전혈 샘플을 측정하였다. 혈장 및 화합물 농도에 대해 남아있는 혈액을 질량 분광측정법에 의해 측정하였다.
평균 비-항체 처리군 및 래트 항-마우스 GPIIb 항체를 투여한 동물 사이의 혈소판 수의 차이를 측정하여 혈소판 제거를 결정하였다. 비히클 및 화합물 처리된 동물 사이의 혈소판 제거 차이를 비교하여 혈소판 제거의 억제를 결정하였다.
실시예 342: 콜라겐 항체 유도 관절염의 마우스 모델
선택 화합물의 억제 활성을 콜라겐 항체 유도 관절염 (CAIA)의 마우스 모델에서 조사하였다. 콜라겐 유도 관절염은 제II형 콜라겐과 보체에 대한 자가항체에 의해 매개되고, 그러므로 관절염은 제II형 콜라겐에 대한 폴리클로날 항체 또는 모노클로날 항체의 혼합물의 투여에 의해 유도될 수 있다. CAIA 모델 (콘드렉스, 인코포레이티드 (Chondrex, Inc.), 워싱턴주, 레드몬드)은 제II형 콜라겐의 83 아미노산 펩티드 단편 내에 클러스터링된 개별 에피토프를 인지하는 4개 클론의 혼합물을 이용한다. 이러한 에피토프는 닭, 마우스, 래트, 소, 돼지, 원숭이 및 인간을 비롯한 다양한 종의 제II형 콜라겐과 공통 아미노산 서열을 공유한다. 모델은 모노클로날 항체 칵테일에 이어서 박테리아성 지질다당류 (LPS)를 이용하여 7일 내에 마우스에서 중증의 지속적 관절염을 유발하였다. 이 모델은 위장관을 통해 흡수된 박테리아성 독소가 류마티스양 관절염을 앓는 환자에서 관절염을 유발하는 제II형 콜라겐에 대한 자가항체와 함께 상승작용적이고 병리학적인 역할을 한다는 가설을 기반으로 개발되었다.
이들 실험을 위해, 0일째에 8주령의 암컷 Balb/C 마우스 (찰스리버, 인코포레이티드 (Charles River, Inc.))에게 모노클로날 항체 칵테일 (로트 번호 OC-708)을 4 mg/마우스 (40 mg/ml)의 투여량으로 꼬리 정맥을 통해 정맥내 주사한 후, 생리식염수로 희석된 LPS를 25 ug/마우스의 투여량으로 복강내 주사하였다. 시험 품목의 투여를 항체 칵테일의 IV 주사 바로 전 또는 후에 시작하였다. 화합물을 물 중 0.5% 메틸셀룰로스 중에 현탁시키고, 7 내지 10일의 연구 기간 동안 경구 위관영양법 (100 ul/마우스)을 통해 매일 투여하였다. 임상적 염증 스코어를 매일 얻어냈다. 임상적 염증 스코어의 억제를 실험의 말미에서의 비히클 및 시험 품목 처리 마우스 사이의 차이를 기초로 결정하였다. 혈장 농도는 연구 종료일의 마지막 투여 1시간 후의 최대 농도를 나타낸다.
실시예 343: 라모스 B 세포에서의 Stat-6인산화에 대한 IL-4 유도 JAK1/3의 억제
화합물의 농도를 증가시키면서 라모스 B 세포를 1시간 동안 전처리한 후, 나타낸 바와 같이 IL-4를 첨가하였다. 세포를 IL-4와 함께 10분 동안 인큐베이션한 후, 세포내 유세포측정을 하여 IL-4 유도 Stat-6의 억제율 (%)을 측정하였다.
실시예 344: 라모스 B 세포에서의 Stat-6 인산화에 대한 IL-4 유도 JAK1/3의 억제
화합물의 농도를 증가시키면서 라모스 B 세포를 1시간 동안 전처리한 후, 나타낸 바와 같이 IL-4를 첨가하였다. 세포를 IL-4와 함께 10분 동안 인큐베이션 한 후, 세포내 유세포측정을 하여 IL-4 유도 Stat-6의 억제율 (%)을 측정하였다.
실시예 345: IL-2로 자극된 1차 인간 T-세포 증식 분석
말초혈로부터 유래하고 T-세포 수용체 및 CD28의 자극을 통해 예비 활성화된 1차 인간 T-세포는 시험관 내에서 시토킨 인터류킨-2 (IL-2)에 반응하여 증식한다. 이 증식 반응은 전사 인자 Stat-5를 인산화 및 활성화시키는 JAK-1 및 JAK-3 티로신 키나제의 활성화에 의존한다.
인간 1차 T-세포를 하기와 같이 제조하였다. 전혈을 건강한 지원자로부터 얻고, PBS와 1:1로 혼합하고, 혈액/PBS:피콜 비율 2:1로 피콜 하이페이크 (Ficoll Hypaque) (아머샴 파마시아 바이오테크 (Amersham Pharmacia Biotech), 뉴저지주, 피스카타웨이, 카탈로그 번호 17-1440-03)상에 층상화하고, 4℃ 및 1750 rpm에서 30분 동안 원심분리하였다. 혈청:피콜 계면에서 림프구를 회수하고, 5 부피의 PBS로 2회 세척하였다. 40 U/mL의 재조합 IL2 (알앤디 시스템즈 (R and D Systems), 미네소타주, 미네아폴리스, 카탈로그 번호 202-IL (20 ㎍))를 함유하는 아이슬 배지 (Yssel's medium) (제미니 바이오-프로덕츠 (Gemini Bio-products), 캘리포니아주, 우드랜드, 카탈로그 번호 400-103) 중에 세포를 재현탁시키고, 1 ㎍/mL 항-CD3 (BD 파밍겐, 캘리포니아주, 샌디에고, 카탈로그 번호 555336) 및 5 ㎍/mL 항-CD28 (이뮤노테크 (Immunotech), 브레아 캘리포니아의 베크만 콜터 (Beckman Coulter), 카탈로그 번호 IM1376)로 예비코팅된 플라스크에 시딩하였다. 1차 T-세포를 3 내지 4일 동안 자극한 후, 새 플라스크로 옮기고, 10% FBS 및 40 U/mL IL-2를 함유하는 RPMI 중에서 유지하였다.
1차 T-세포를 PBS로 2회 세척하여 IL-2를 제거하고, 아이슬 배지 중에 2 X 106 세포/mL로 재현탁시켰다. 80 U/mL IL-2를 함유하는 세포 현탁액 50 ㎕를 바닥이 평평한 96 웰 검정 플레이트의 각 웰에 첨가하였다. 비자극 대조군의 경우, 플레이트 상의 마지막 컬럼에서 IL-2를 제하였다. 화합물을 디메틸 술폭시드 (DMSO, 99.7% 순도, 세포 배양 시험, 시그마 알드리치, 미주리주, 세인트 루이스, 카탈로그 번호 D2650)로 5 mM로부터 3-배 희석으로 연속적으로 희석하였고, 이어서 아이슬 배지로 1:250으로 희석하였다. 2X 화합물 50 ㎕를 웰 당 2회 첨가하고, 세포가 37℃에서 72시간 동안 증식하도록 하였다.
셀티터-글로.RTM의 발광 세포 생존성 분석 (프로메가)을 이용하여 증식을 측정하였으며, 이로써 대사적으로 활성인 세포의 지표로서 ATP 잔존량을 기준으로 배양물 중 생존 세포의 수를 결정하였다. 기질을 해동시키고, 실온에 이르도록 하였다. 셀티터-글로 시약 및 희석액을 함께 혼합한 후, 100 ㎕를 각각의 웰에 첨가하였다. 플레이트를 오비탈 진탕기에서 2분 동안 혼합하여 세포 용해를 유도하였고, 추가로 10분 동안 실온에서 인큐베이션하여 신호가 평형을 유지하도록 하였다. 퍼킨 엘머 (코네티컷주, 셀튼)로부터 구입한 왈락 빅터2 1420 멀티라벨 카운터를 이용하여 검출을 수행하였다.
실시예 346. IFNγ로 자극된 A549 상피 세포주
A549 폐 상피 세포는 다양한 자극에 반응하여 ICAM-1 (CD54) 표면 발현을 상향조절한다. 그러므로 판독물로서 ICAM-1 발현을 이용하여, 상이한 신호전달경로에 대한 화합물의 효과를 동일 세포 유형에서 평가할 수 있었다. IFNγ는 JAK/Stat 경로의 활성화를 통해서 ICAM-1을 상향조절한다. 본 실시예에서, IFNγ에 의한 ICAM-1의 상향조절을 평가하였다.
A549 폐 상피 암종 세포주는 아메리칸 타입 컬쳐 콜렉션 (American Type Culture Collection)으로부터 유래한다. 10% 우태혈청, 100 I.U. 페니실린 및 100 ng/mL 스트렙토마이신을 함유하는 F12K 배지 (메디아텍 인코포레이티드 (Mediatech Inc.), 켄자스주, 레넥사, 카탈로그 번호 10-025-CV) (완전 F12k 배지)를 사용하여 통상의 배양을 수행하였다. 세포를 37℃에서 5% CO2의 가습 분위기하에 인큐베이션하였다. 분석에 사용하기에 앞서, A549 세포를 PBS로 세척하였고, 트립신 처리하여 (메디아텍 인코포레이티드, 카탈로그 번호 25-052-CI) 세포를 분리하였다. 트립신 세포 현탁액을 완전 F12K 배지로 중화하고, 원심분리하여 세포를 펠릿화하였다. 세포 펠릿을 완전 F12K 배지 중에 2.0 X 105/mL의 농도로 재현탁시켰다. 세포를 바닥이 평평한 조직배양 플레이트에서, 총 부피 100 ㎕로 웰 당 20,000으로 시딩하고, 밤새 부착하도록 두었다.
이틀째, A549 세포를 2,4-피리미딘디아민 시험 화합물 또는 DMSO (대조군) (시그마-알드리치, 미주리주, 세인트 루이스, 카탈로그 번호 D2650)과 함께 1시간 동안 예비 인큐베이션하였다. 이어서, 세포를 IFNγ (75 ng/mL) (페프로테크 인코포레이티드, 뉴저지주, 로키 힐, 카탈로그 번호 300-02)로 자극하고, 24시간 동안 인큐베이션하였다. 최종 시험 화합물 투여량 범위는 5% FBS, 0.3% DMSO를 함유하는 F12K 배지 200 ㎕ 중 30 μM 내지 14 nM이었다.
삼일째, 세포 배지를 제거하고 세포를 PBS (포스페이트 완충 염수) 200 ㎕로 세척하였다. 각 웰을 트립신으로 처리하여 세포를 분리한 후, 완전 F12K 배지 200 ㎕를 첨가하여 중화시켰다. 세포를 펠릿화시키고, 4℃에서 20분 동안 APC 접합된 마우스 항-인간 ICAM-1 (CD54) (BD 파밍겐, 캘리포니아주, 샌디에고, 카탈로그 번호 559771) 항체로 염색하였다. 세포를 빙냉 FACS 완충액 (PBS + 2% FBS)으로 세척하고, 표면 ICAM-1 발현을 유세포측정에 의해 분석하였다. BD 바이오사이언시즈 (캘리포니아주, 산호세)로부터 구입한 BD LSR I 시스템 유세포측정기를 이용하여 검출을 수행하였다. 사건을 라이브 스캐터에 대해 게이팅하고, 기하 평균을 계산하였다 (벡톤-딕킨슨 셀퀘스트 소프트웨어 버전 3.3, 뉴저지주, 프랭클린 레이크스). 기하 평균을 화합물 농도에 대해 플롯팅하여 투여량 반응 곡선을 생성하였다.
실시예 347. U937 IFNγICAM1 FACS 분석
인간 U937 단핵 세포는 다양한 자극에 반응하여 ICAM-1 (CD54) 표면 발현을 상향조절한다. 그러므로 판독물로서 ICAM-1 발현을 이용하여, 상이한 신호전달경로에 대한 화합물의 효과를 동일 세포 유형에서 평가할 수 있었다. IFNγ는 JAK/Stat 경로의 활성화를 통해서 ICAM-1을 상향조절한다. 본 실시예에서, IFNγ에 의한 ICAM-1의 상향조절을 평가하였다.
U937 인간 단핵 세포주를 ATCC (매릴랜드주, 로크빌, 카탈로그 번호 CRL-1593.2)로부터 얻었고, 10% (v/v) FCS를 함유하는 RPMI-1640 배지중에서 배양하였다. U937 세포를 10% RPMI에서 성장시켰다. 이어서, 세포를 96 웰 바닥이 평평한 플레이트에서 160 ㎕ 당 100,000 세포의 농도로 플레이팅하였다. 이어서, 시험 화합물을 다음과 같이 희석하였다: 10 mM 시험 화합물을 DMSO 중 1:5로 희석한 후 (DMSO 12 ㎕ 중 10 mM 시험 화합물 3㎕), 시험 화합물을 DMSO 중 1:3으로 연속적으로 희석하였다 (시험 화합물 6 ㎕를 연속적으로 DMSO 12 ㎕로 희석하여 3배 희석액을 수득함). 이어서, 시험 화합물 4 ㎕를 10% RPMI 76 ㎕에 넣어 10X 용액 (100 μM 시험 화합물, 5% DMSO)을 생성하였다. 대조군 웰의 경우, DMSO 4 ㎕를 10% RPMI 76 ㎕로 희석하였다.
분석을 8개 지점에서 (10 ㎕로부터 3-배 희석 농축액 8개 지점) 자극 조건 하의 DMSO 단독의 4개 웰 (대조 웰) 및 비자극 조건 하의 DMSO 단독의 4개 웰로 2회 반복 수행하였다.
희석된 화합물 플레이트를 멀티멕 (multimek) (베크만 콜터, 캘리포니아주, 브레아)을 이용하여 2X 혼합한 후, 회석된 화합물 20 ㎕를 세포 160 ㎕를 함유하는 96 웰 플레이트에 넣은 다음, 이를 다시 저속에서 2회 혼합하였다. 이어서, 세포와 화합물을 5% CO2하에 37℃에서 30분 동안 예비-인큐베이션하였다.
10% RPMI 중 인간 IFNγ의 100 ng/mL 용액을 제조하여 10X 자극 혼합물을 제조하였다. 이어서 세포와 화합물을 20 ㎕의 IFNγ 자극 혼합물로 자극하여 10 ng/mL IFNγ, 10 μM 시험 화합물 및 0.5% DMSO의 최종 농도를 수득하였다. 세포를 5% CO2하에 37℃에서 18 내지 24 시간 동안 자극을 위한 조건하에 유지하였다.
염색을 위해 세포를 96 웰 둥근 바닥 플레이트에 넣은 후, 염색 절차 기간 동안 얼음 상에서 유지시켰다. 세포를 4℃에서 5분 동안 1000 rpm에서 회전 침강시키고, 이어서 상층액을 제거하였다. 상층액의 제거에 이어서, 1㎕의 APC 접합된 마우스 항-인간 ICAM-1 항체를 FACS 완충액 100 ㎕ 마다 첨가하였다. 이어서, 세포를 암실에서 30분 동안 얼음 상에서 인큐베이션하였다. 인큐베이션한 후, FACS 완충액 150 ㎕를 첨가하고, 세포를 4℃에서 5분 동안 1000 rpm에서 원심분리하고, 이어서 상층액을 제거하였다. 상층액을 제거한 후, FACS 완충액 200 ㎕를 첨가하고 세포를 재현탁시켰다. 현탁시킨 후, 세포를 4℃에서 5분 동안 1000 rpm에서 원심분리하였다. 이어서, 상층액을 제거한 후, FACS 완충액 150 ㎕ 중에 세포를 재현탁시켰다.
캘리포니아주, 산호세의 BD 바이오사이언시즈로부터 구입한 BD LSR I 시스템 유세포 측정기를 이용하여 검출을 수행하였다. 살아있는 세포를 라이브 스캐터에 대해 게이팅하고, ICAM-APC의 기하 평균을 측정하였다 (벡톤-딕킨슨 셀퀘스트 소프트웨어 버전 3.3, 뉴저지주, 프랭클린 레이크스). 살아있는 세포 (%) 및 ICAM-1 발현 모두를 분석하였다. 시험 화합물에 대한 분석은 활성이 알려져 있는 대조군 화합물과 병행하여 수행하였다. 대조군 화합물에 대한 EC50은 전형적으로 40 내지 100 nM 이었다.
실시예 348. B 세포 신호전달의 분석:
인간 비-호지킨 림프종 B 세포주 SUDHL-4 (#ACC 495), SUDHL-6 (#ACC572) 및 카르파스-422 (#ACC32)를 DSMZ (브라운슈바이크, 독일)로부터 입수하였고; 톨레도 (#CRL-2631) 및 라모스 (#CRL-1596)를 아메리칸 타입 컬쳐 콜렉션 (ATCC; 버지니아주, 매너시스)으로부터 입수하였다. 모든 세포를 10% 우태 혈청 (ATCC) 및 페니실린/스트렙토마이신 (인비트로겐)으로 보충된 RPMI 배지 (인비트로겐, 캘리포니아주, 칼스배드)에서 유지하였고, 37℃의 가습 조직 배양 인큐베이터에서 유지하였다. 이들 연구에 사용한 항체는 폴리클로날 염소 f(ab)'2 항-인간 IgG (H+L) 및 항-인간 IgM (바이오소스 (BioSource), 캘리포니아주, 카마릴로)을 포함하며; 토끼 항-인간 Syk, 토끼 항-인간 포스포-Syk (Y525/526), 토끼 항-인간 포스포-Syk (Y352), 항-인간 BLNK, 항-인간 포스포-BLNK (Y84)를 셀 시그널링 테크놀로지스, 인코포레이티드 (매사추세츠주, 댄버스)로부터 입수하였다. 하기 항체를 포스포-유세포측정을 위해 벡톤 딕킨슨 (캘리포니아주, 산호세)으로부터 입수하였다: 알렉사 플루오르 488-접합된 마우스 항-인간 포스포-STAT6 (Y641), 피코에리트린 (PE)-접합된 마우스 항-인간 포스포-Zap70 (Y319)/Syk(Y352) 및 플루오레세인 이소티오시아네이트 (FITC)-접합된 마우스 항-인간 포스포-ERK1/2 (T202/Y204).
포스포-유세포측정을 본원에 기재한 바와 같이 본질적으로 수행하였다 (문헌 [Irish, Czerwinski et al. Blood 108(9): 3135-42 (2006)]). 성장 배지 중의 0.5 X 106개 세포를 1 ㎍/ml 항-μ 또는 항-γ 항체로 10분 동안 자극하였다. 유도된 신호전달을 1%의 최종 농도로 파라포름알데히드 (일렉트론 마이크로스코피 사이언시즈 (Electron Microscopy Sciences), 펜실베니아주, 햇필드)를 첨가하여 지정 시간 직후에 종결시켰다. 세포를 실온에 5분 동안 파라포름알데히드와 함께 인큐베이션하고, 인산염 완충 염수 (PBS)로 1회 세척한 후, 재현탁시키고, 예냉시킨 메탄올 (-80 ℃) (회사, 주소) 중에서 4℃에서 밤새 인큐베이션하였다. 후속으로, 고정된 투과성 세포를 PBS로 1회, 1% 소 혈청 알부민 (BSA) (시그마-알드리치, 미주리주, 세인트 루이스)을 함유하는 PBS로 2회 세척하고, 이어서 PBS + 1% BSA 중에 1:20으로 희석한 지정 항체로 염색하였다. 30분 후, 세포를 PBS로 1회 세척하고, FACS 칼리버 (벡톤 딕킨슨)를 이용하여 유세포측정을 수행하였다. 웨스턴 블롯 분석을 위해, 106개 세포를 2 ㎍/ml의 지정 BCR-특이적 항체로 30분 동안 자극하였다. 신호전달을 용해 완충액 중에 세포를 재현탁시킴으로써 종결시키고, 1시간 동안 얼음 상에서 인큐베이션하였다. 세포 파편을 원심분리에 의해 제거하고, 10% SDS-PAGE에 의해 명확한 단백질 용해물을 분리하고, 제조자의 권고에 따라 지정 항체로 탐침하였다. 나타나는 경우, 세포를 37℃에서 1시간 동안 몇몇 농도에서 Syk 억제제 또는 비히클 대조군 (0.5% DMSO)으로 전처리한 후, 항-BCR 항체로 자극하였다.
실시예 349. Syk 활성의 선택적 억제.
화합물을 정제 Syk를 억제하는 그의 능력에 대해 시험하였다. P459-72 및 P505-15 (표 9b에 나타낸 바와 같은 Syk-특이적 시리즈로부터의 2개의 화합물) 및 실시예 100b (Syk 및 JAK 이중 억제 활성을 가진 시리즈로부터)가 각각 43 nM, 6 nM 및 31 nM의 IC50으로 Syk 키나제 활성을 억제하는 것으로 밝혀졌다. Syk에 대한 이들 화합물의 선택성을 300 nM에서 각각의 비의존성 270개 패널에 대하여 정제 키나제를 스크리닝함으로써 결정하였다 (밀리포어). 비히클 대조군과 관련된 억제율 (%)을 계산하고, 숫자를 열-지도로 변환하여; 억제되지 않는 것은 녹색으로 나타내고, 적색과의 혼합이 증가하는 것은 50% 억제를 나타내는 황색과 100% 억제를 나타내는 적색을 사용하여 억제율 (%)이 증가하는 것을 나타낸다 (도 8). 도 8a에 도시한 바와 같이, 실시예 100b가 키나제를 다중으로 억제한 반면 (제3 열), P459-72 및 P505-15는 Syk에 대해 매우 특이적이었다 (각각 제1 열, 제2 열). 임의의 3개의 화합물에 의해 ≥80% 억제되는 키나제의 하위세트를 도 8b에 나타냈다. 실시예 100b는 Syk 및 MLK-1을 억제하였다 (제1 열). 300 nM에서 P505-15는 10개의 다양한 키나제를 억제하였다 (제2 열). 그러나, 50 nM (대략 10x 상기 6 nM의 그의 Syk IC50 값)에서 재시험한 경우에 Syk가 여전히 억제되는 유일한 키나제였다 (제3 열). P420-89는 몇몇 다른 키나제와 함께 Syk, JAK2 및 JAK3을 억제하였다 (제4 열).
정제 키나제 P505-15 (IC50 = 1 nM)의 밀리포어 패널을 사용한 것은 50 nM에서의 정제 Syk 키나제 활성의 98%를 억제하였다. IC50 값을 밀리포어 키나제 패널 중 300 nM에서 >80% 억제한 이들 키나제에 대해 결정하였다.
대조적으로, 다중-키나제 억제제 P420-89는 리겔 (Rigel)의 R788과 보다 유사하다. 300nM에서, P420-89는 추가로 32개의 키나제를 >80% 억제하면서, Syk를 88% 억제하였다. 이들 중에는 JAK 2 및 3 (각각 93% 및 85% 억제), Flt-3 (83-92% 억제) 및 cKit (95-97% 억제), 림프구 기능의 치료학적 조작을 위한 모든 표적이 있었다.
실시예 350 비-호지킨 림프종 B 세포주에서의 Syk의 선택적 억제 및 칼슘 유동 분석.
라모스 세포를 실험 3 내지 4일 전에 성장 배지에서 (대략 0.5 X 106 세포/ml를 유지하면서) 배양하였다. 세포를 수확하고, 8 X 106 세포/ml로 신선한 배지중에 재현탁시킨 후, 염료-로딩하였다. 동일 부피의 칼슘 3 로딩 염료 (몰레큘러 디바이시즈, 캘리포니아주, 서니배일)를 세포 현탁액에 첨가하였다. 로딩된 세포를 96 웰 플레이트에 분주하고, 20분 동안 인큐베이션하였다. 이어서, Syk 억제제를 로딩된 세포에 첨가하고, 추가로 30분 동안 인큐베이션하였다. B 세포를 5 ㎍/ml 항-μ항체로 자극하였다. 세포내 Ca2 + 농도의 변화를 플렉스스테이션 (몰레큘러 디바이시즈, 캘리포니아주, 서니배일)을 이용하여 측정하였다.
먼저, B 세포에서의 Syk 억제의 효능 및 선택성을 BCR-매개된 pSyk Y525/526 및 pBLNK Y84 (모두 Syk 키나제 활성의 척도임)의 유도, 및 pSyk Y352 (Src 키나제 활성의 척도임)의 유도를 측정하는 웨스턴 블롯에 의해 시험하였다. SUDHL-6 B 세포를 항-BCR 특이적 항체로 30분 동안 각각 Syk 억제제 또는 비히클 대조군의 존재 또는 부재하에 자극하였다. 0.16 또는 1 μM의 각각의 화합물로 처리하자 BCR-유도 Syk 자가인산화 (Y525/526)가 대략 각각 40% 및 60% (농도계측기로 추정)감소하였다 (데이터는 나타내지 않음). 확장된 범위의 농도를 이용하여 BCR 유도 Syk 및 Src 키나제 활성에 대한 이들 화합물의 효과를 추가로 평가하였다. 도 9, a-c에 나타낸 바와 같이, 각각의 화합물은 Syk 활성 (pBLNK Y84)을 0.16 내지 1 μM 범위의 IC50 값으로 억제한 반면, Src 활성 (pSyk Y352)에 대한 효과는 2.5 μM까지 관측되지 않았다.
BCR에 대해 더 말단의 신호전달 이벤트를 억제하는 각각 화합물의 능력을 또한 측정하였다. 세포를 다시 각각 다양한 농도의 Syk 억제제의 존재 또는 부재하에 항-BCR 항체로 자극하였다. pERK1/2 T202/Y204의 유도가 더 말단의 Syk-의존성 신호전달의 척도로 사용된 반면, pSyk Y352의 유도를 특이성 대조군으로서 측정하였다 (문헌 [Jiang, Craxton et al. J Exp Med 188(7): 1297-306 (1998)]). 도 12c에 BCR 신호전달에 대해 셋 중 가장 특이적이고 강력한 Syk 억제제인 P505-15의 효과를 도시하는 대표적인 FACS 플롯을 나타냈다. 125 nM에서, ERK1/2 활성화는 완전히 억제된 반면, 자극된 세포는 Syk Y352에 대해 여전히 양성으로 염색되어 있었다. 이 실험을 반복하였고, 여기서 Src 및 Syk 활성에 대한 세가지 모든 화합물의 효과를 결정하였다 (도 10a). 125 nM 미만의 농도는 ERK1/2에 대한 BCR 유도 Syk 신호전달을 억제하기에 충분했다. 대조적으로, Src 활성의 적당한 억제를 유발하는데에는 훨씬 더 높은 농도가 요구되었고; Src에 대한 효과는 웨스턴 블롯에 의해 관측되지 않았다 (도 9, a-c). 이들 Syk 억제제 중 아무것도 PMA-유도 ERK1/2 티로신 인산화를 억제하지 않아, 이들 화합물이 PKC의 하류 신호전달 이벤트를 억제하지 않는 것을 입증하였다.
P459-72 및 P505-15가 정제 및 세포 분석에서 Syk를 특이적으로 억제한 반면, 실시예 100b는 정제 JAK 키나제에 대한 활성을 추가적으로 입증하였다. 이들 화합물을, Syk를 필요로하지 않는 신호전달 경로인 B 세포에서의 JAK1/3을 통한 STAT-6로의 IL-4 신호전달의 억제에 대해 시험하였다. Syk 특이적 화합물은 2 μM 농도에서 IL4 신호전달을 억제하지 않았다. 반대로, 실시예 100b는 약 125 nM의 IC50으로 IL4 신호전달을 억제하였다 (도 10b).
이는 Syk의 선택적 억제가 약 100 nM의 IC50 값으로 B 세포에서 BCR-유도 Ca2+ 유동을 억제했음을 나타낸다. 이는, Syk를 억제함으로써 이들 화합물이 세포 반응을 차단하는 신호전달 경로를 억제한다는 것을 시사한다.
Syk의 선택적 억제는 Src (도 11 및 12) 또는 JAK (도 10b)에 영향을 미치지 않고 BCR 신호전달을 억제하기에 충분하였다. 추가로, P505-15 및 실시예 100b는 이들 세포에서 아폽토시스를 동일하게 유발하였다 (도 11b). 이 데이터는 NHL 세포주의 생존에서의 Syk 신호전달의 역할을 입증하고, 이 효과를 달성하기 위해 Syk가 아닌 키나제를 억제할 필요가 없음을 입증한다.
실시예 351. 카스파제 3 및 증식 분석: Syk 억제는 비-호지킨 림프종 B 세포주의 증식 및 생존을 방해한다.
아폽토시스의 유도를 공급된 프로토콜에 따라 PE-접합된 모노클로날 활성 카스파제-3 항체 아폽토시스 키트 (벡톤 딕킨슨)를 이용하여 측정하였다. 세포를 성장 배지 (0.5 X 106 세포/ml) 중에 현탁시키고, 지시 농도의 각각의 Syk 억제제 또는 비히클 대조군으로 24, 48 또는 72시간 동안 처리한 후, FACS 분석하였다. MTT (3-(4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸륨 브로마이드, 테트라졸) 분석 (회사 이름)을 세포 생존도 및 성장의 척도로서 제조자에 의해 공급된 프로토콜에 따라 이용하였다. 세포를 각각 지시 농도의 Syk 억제제 또는 비히클 대조군으로 72시간 동안 처리하였다.
SUDHL-4 및 SUDHL-6 세포를 앞서 "BCR-유형"으로서 분류하였고 (문헌 [Monti, Savage et al. Blood 105(5): 1851-61 (2005)]; [Polo, Juszczynski et al. Proc Natl Acad Sci U S A 104(9): 3207-12 (2007)]), 이는 R406에 의한 Syk 억제에 민감하였다 (문헌 [Chen, Monti et al. 2008]). 각각 BCR 및 BLNK 발현이 결핍되어 BCR 신호와 독립적으로 생존하는데 적합해진 톨레도 및 카르파스-422 세포주 (문헌 [Gabay, Ben-Bassat et al. Eur J Haematol 63(3): 180-91 (1999)]; [Sprangers, Feldhahn et al. Oncogene 25(36): 5056-62 (2006)])는 R406 (문헌 [Chen, Monti et al. 2008])에 영향받지 않았다. 다양한 농도의 각각의 Syk 억제제의 존재 또는 부재하에 72시간 동안 배양한 경우 이들 세포주의 증식을 시험하였다.
Syk의 선택적 억제는 "BCR-유형" NHL 세포주에서 아폽토시스를 유발하기에 충분했다. 세포를 1 또는 3 μM의 억제제와 함께 72시간 동안 인큐베이션하였다. 도 11a에 도시한 바와 같이, SUDHL-4 및 -6 세포는 각각 아폽토시스가 일어난 반면, 톨레도 및 카르파스-422 세포는 그렇지 않았다 (도 11a). 반복된 실험에서, P459-72 및 P505-15에 의한 Syk의 특이적 억제는 SUDHL 및 라모스 세포주에서만 아폽토시스를 유발하였다. 견주어 보면, Syk 및 JAK 키나제를 강력하게 억제하는 실시예 100b는 모든 "BCR-유형" 세포주 뿐만 아니라, 카르파스-422 및 JJN-3, BCR이 결핍된 다발성 골수종 세포주, 및 BLNK 발현에서 아폽토시스를 유발하였다 (문헌 [Sprangers, Feldhahn et al. Oncogene 25(36): 5056-62 (2006)]). 톨레도 세포는 여전히 세가지 모든 화합물에 영향을 받지 않았다 (도 11b). 별도 실험에서, SUDHL-6 및 톨레도 세포는 1 μM PMA로 72시간 처리하여 아폽토시스를 유도하는데 있어서 동일하게 민감하다는 것을 발견하였다. 이들 데이터는 특정 NHL 세포주의 생존에 있어서의 Syk의 특정 요구 사항을 입증한다.
실시예 352. 이종이식 연구, 및 종양 및 혈장 농도 분석.
Syk 억제는 이종이식 마우스 모델에서 종양 형성에 대해 보호하였다. 마우스를 입수하고 (회사), 사용전에 적어도 3일 동안 조직 내부에 순응시켰다. 라모스 세포 (3 X 106)를 0.5 ml 미만의 주사 부피로 27 게이지 바늘을 이용하여 의식있는 마우스의 뒷다리 측면 영역으로 피하 주사하였다. 주사한 후, 마우스를 처리 군 (n = 15)으로 무작위로 분류하고, 비히클, 또는 10, 15 또는 20 mg/kg의 억제제를 일일 2회 경구 위관 영양법으로 투여하였다. 체중을 1주일에 1회 이상 측정하고, 손으로 만져지는 종양이 형성되면 종양의 캘리퍼스 측정 (주 2회)을 시작하여 연구의 종료시까지 측정하였다. 종양 부피를 [최대 길이 x 폭 x 높이 x π/6]의 식을 이용하여 캘리퍼스 측정에 의해 평가하였다. 비히클 또는 임의의 처리 군에서 사이즈가 1.5 g을 초과하는 종양이 나타날 때까지 비히클 또는 억제제의 1일 2회 투여를 계속하였다. 종결 시점에 (라모스 접종 5주 후), 마우스를 케타민 칵테일로 마취하였다. CBC 및 심장 천자를 통한 혈장 농도 측정을 위해 혈액 샘플을 채취하고, 경추 탈구를 통해 안락사시켜졌다. 이어서, 종양을 적출하여 칭량하였다. 종양의 절반을 종양 조직 내의 억제제의 농도를 측정하기 위해 액체 질소 중에서 급속 동결시키고, 나머지 절반을 조직학적 조사를 위해 10% 완충 포르말린에 넣었다.
이종이식 마우스 모델에서의 라모스 종양 형성에 대한 Syk 억제 효과를 평가하였다. 종양 세포 접종일로부터 마우스에게 10, 15 또는 20 mg/kg P505-15 또는 비히클 대조군을 1일 2회 투여하기 시작하였다. 종양이 형성되기 시작하면 캘리퍼스 측정을 개시하고 (대략 종양 접종 3주 후), 연구의 종료시까지 3일마다 반복하여 측정하였다. 종양 중량이 대략 1.5 mg에 도달하기 시작하면 연구를 종결하였고, 그 시점에 종양을 적출하여 칭량하였다. 종양 및 혈장 샘플을 약동학 분석하였다.
종양 샘플을 콘테스 (Kontes, 등록상표) 마이크로튜브 펠렛 페슬 (Microtube Pellet Pestle, 등록상표) 로드스 앤 모터 (Rods and Motor) (킴블 체이스 (Kimble Chase), 뉴저지주, 바인랜드)를 이용하여 종양 1 g 당 염수 3 ml로 균질화하였다. 액체 크로마토그래피 텐덤 질량 분광측정기 (LC/MS/MS)를 이용하여 P505-15 농도에 대해 혈장 및 종양 샘플을 분석하였다. 간략하게, 혈장과 종양 샘플을 96-웰 캅티바 (Captiva, 상표명) 필터 플레이트 (0.2 ㎛, 배리안 인코포레이티드 (Varian, Inc.), 캘리포니아주, 팔로 알토)로 처리하였다. 혈장 및 균일화된 종양 샘플의 분취물을, 내부 표준 물질인 하기 화합물 A 200 ng/ml를 함유하는 아세토니트릴을 사용하여 침전시켰다.
<화합물 A>
혼합물을 볼텍싱하고, 4℃에서 30분 동안 냉각시켜 단백질 침전을 완료시켰다. 혼합물을 96-웰 수집 플레이트로 여과하였다. 터보-이온 스프레이 공급원이 장착된 사이엑스 (Sciex) API3000 LC/MS/MS에 여과액을 주입하였다. P505-15 및 화합물 A를 페노메넥스 루나 (Phenomenex Luna) 5μ HILIC 컬럼 (4.6 x 100 mm, 5mm; 페노메넥스, 캘리포니아주, 토랜드) 상에서 분리하였다. 10% 이동상 A (물 중 0.1% 포름산) 및 90% 이동상 B (10% 물, 90% 아세토니트릴 중 0.1% 포름산) → 65% 이동상 B의 이동상 구배 혼합물 (1.1분에 걸쳐)에 이어서 이동상 B 65% → 90%의 구배 (0.01분에 걸쳐)를 프로그래밍하였다. 양이온 모드에서 화합물 A (내부 표준 물질)의 m/z 357/295 생성 이온의 피크 영역에 대한 P505-15의 m/z 394/360 생성 이온의 피크 영역을 측정하였다. 분석 범위는 2 - 5000 ng/ml였다.
약동학 분석으로 10, 15 및 20 mg/kg 투여 군의 혈장에서 나타난 농도-시간 프로파일에 따른 정상-상태에서의 P505-15의 종양 농도를 나타냈다. Cmax, AUC (0-8) 및 종양 Cmin에서 투여량이 증가함에 따른 비선형 증가가 관측되었으나, 혈장 Cmin에서 투여량-비례적 증가가 나타났다. 혈장에서의 평균 Cmax 및 AUC (0-8)는 실험한 모든 투여량에 대한 종양에서의 그것보다 2배 이상 높았으나; 종양에서의 평균 최저 농도 (Cmin)는 혈장에서의 그것보다 높았다 (종양 구획에서의 P505-15의 축적을 나타냄) (표 11a).
<표 11a>
<표 11b>
Cmin으로부터 측정한 종양/혈장 비율이 증가하는 것으로 나타난 바와 같이, 혈장 및 종양 Cmin 사이의 차는 투여량이 증가할수록 보다 두드러졌다 (표 11b). Cmax 및 AUC (0-8)로부터 측정한 종양/혈장 비율은 다양한 투여 군에 걸쳐 유사하였다. 10, 15 및 20 mg/kg에서의 종양 농도는 P505-15에 대한 정상-상태에서의 전체 투여 간격에 걸쳐 각각 60, 170 및 640 nM 초과로 유지되었다.
세가지 농도 모두의 P505-15을 투여받은 마우스는 생체내에서 라모스 종양 성장으로부터 보호되었다. 이는 첫째로 캘리퍼스 측정 (데이터는 나타내지 않음)으로부터 명백해졌고, 이는 Syk 억제제의 존재하에 종양 성장 속도가 감소했음을 나타낸다. 연구 종료 시점에, 마우스를 안락사시키고, 종양을 적출하여 칭량하였다. 캘리퍼스 측정과 일치하게, 비히클 대조군과 비교하여 모든 투여 군에서 평균 종양 중량이 통계적으로 유의하게 감소하였다.
또한, Syk-특이적 억제제 P505-15를 라모스 종양 마우스 이종이식 모델에서 활성에 대해 시험하였다. 시험한 모든 농도에서, P505-15를 투여 (BID) 마우스에서 종양 성장이 통계적으로 유의하게 감소한 것으로 관측되었다. 시험한 최저 농도는 10 mg/kg이었고, 당일에 걸쳐 64 내지 140 nM 범위의 종양 농도에 도달했다. 이들 농도에서의 생체내 종양 성장의 억제는 < 125 nM의 농도로 일정하였으며, BCR-유도 Ca2 + 유동 및 pERK Y204로의 말단 BCR 신호전달을 억제하는 것으로 확인되었다 (도 12). Syk의 선택적인 약리학적 억제는 NHL 세포주의 증식 및 생존에 대해 효과적이다. 이들 데이터는 Syk의 선택적 표적화가 다양한 B-세포 증식성 장애에서 유사하게 임상적 이점을 가질 수 있음을 시사한다.
본원에 상술한 바와 같이, Syk를 실험적으로 B 세포 발생, 증식 및 생존에 관련시켰다. 더욱이, Syk는 종양 유전자로서 관련된다. 마우스에서 입양 이동된 골수 세포에서의 구성적 활성 Syk의 발현은 백혈병을 유발하였고, 과다-활성의 Syk는 인간에서 다양한 림프종과 관련되었다. 독성의 감소가 다른 표적외 (off-target) 키나제의 억제로 인해 발생할 수 있지만, B 세포 생물학에서의 Syk의 역할로 인해, 그의 선택적 억제가 B 세포 증식성 장애에서 임상적 이점을 제공하기에 충분할 수 있다.
본 발명은 수많은 실시양태를 제공한다. 실시예를 변형하여 본 발명의 다른 실시양태를 제공할 수 있다는 것은 명백하다. 그러므로, 본 발명의 범주가 실시예로 나타낸 특정 실시양태에 의해서 보다는 하기하는 특허청구범위에 의해 정의된다는 것을 인식하고 있을 것이다.
본 명세서에 언급되어 있고/있거나 출원 데이터 시트에 나열된 상기 모든 미국 특허, 미국 특허 출원 공보, 미국 특허 출원, 해외 특허, 해외 특허 출원 및 비-특허 간행물은 그의 전문이 본원에 참조로 포함된다. 상기 내용으로부터, 본 발명의 특정한 실시양태들이 예시를 목적으로 본원에 기재되었으나, 본 발명의 취지 및 범주에서 벗어나지 않으면서 다양한 변형을 행할 수 있다는 것을 이해할 것이다. 따라서, 본 발명은 첨부된 청구범위에 의한 것을 제외하고는 제한되지 않는다.
Claims (80)
- 하기 화학식 I을 갖는 화합물 또는 그의 호변이성질체 또는 그의 제약상 허용되는 염.
<화학식 I>
상기 식에서,
D1은 C1-8알킬, 아미노, 히드록시, C1-8알킬카르보닐, 아미노카르보닐, C1-8알콕시카르보닐아미노, 아릴C1-8알콕시카르보닐아미노, 페닐 및 헤테로시클릴C1-8알킬렌으로 이루어진 군으로부터 독립적으로 선택된 1개 내지 4개의 치환기로 임의로 치환된 C3-8시클로알킬이고;
R1은 H, C1-8알킬, 아미노, 아미노카르보닐, 히드록실, C1-8알콕시, C1-8할로알킬, C2-8알케닐, C2-8알키닐, 옥소, 시아노, C1-8알콕시카르보닐, C3-8시클로알킬, 아릴 및 헤테로시클릴로 이루어진 군으로부터 선택되고; 각각의 헤테로시클릴은 C1-8알킬, 할로, 옥소, 아미노, C1-8알콕시, C1-8알킬카르보닐, 아릴C1-8알콕시카르보닐, 아미노카르보닐, 아릴C1-8알킬렌카르보닐 및 C1-8알킬술포닐로 이루어진 군으로부터 선택된 1개 내지 4개의 치환기로 임의로 치환되고;
Y1은
(a) C1-8알킬, C1-8알콕시C1-8알킬, 아미노카르보닐, 히드록실, 옥소, 할로겐, 히드록시, C1-8알콕시 및 C1-8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1개 내지 3개의 치환기로 임의로 치환된 아릴;
(b) C1-8알킬, C1-8알콕시C1-8알킬, 아미노카르보닐, 히드록실, 옥소, 할로겐, 히드록시, C1-8알콕시 및 C1-8알킬술포닐로 이루어진 군으로부터 독립적으로 선택된 1개 내지 3개의 치환기로 임의로 치환된 헤테로아릴
로 이루어진 군으로부터 선택되고;
R2는
로 이루어진 군으로부터 선택되고;
여기서, R2는 C1-8알킬, C1-8알콕시, 할로, 아미노카르보닐, 옥소, 히드록실, 아미노, 카르복시, C1-8알킬아미노, C1-8알킬아미노카르보닐, 아미노C1-8알킬렌, C1-8알콕시C1-8알킬렌, C1-8알킬카르보닐, C1-8알콕시카르보닐, C3-8시클로알킬카르보닐, 헤테로시클릴카르보닐, C1-8알킬카르보닐아미노, C3-8시클로알킬카르보닐아미노, 헤테로시클릴카르보닐아미노, C1-8알킬술포닐, C3-8시클로알킬술포닐, 헤테로시클릴술포닐, C3-8시클로알킬, C1-8알킬시클로알킬렌 및 헤테로아릴로 이루어진 군으로부터 독립적으로 선택된 1개 이상의 기로 치환된다. - 제1항 내지 제7항 중 어느 한 항에 있어서, D1이 시클로프로필, 시클로부틸, 시클로펜틸 및 시클로헥실로 이루어진 군으로부터 선택되는 것인 화합물 또는 그의 호변이성질체 또는 그의 제약상 허용되는 염.
- 제8항에 있어서, D1이 시클로프로필인 화합물.
- 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(시클로펜틸아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1R)-2-히드록시시클로펜틸아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)-3-클로로페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)-3-클로로페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-프로피오닐피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(4-(시클로프로판카르보닐)피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(2-메톡시아세틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸-2-옥소피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)-3-플루오로페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1s,4s)-4-아미노시클로헥실아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸-2-카르바모일피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; (R)-2-(4-(4-아세틸-3-메틸피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(1-카르바모일시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1R,2R)-2-카르바모일시클로펜틸아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-(-2-트랜스-페닐시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸-2-(메틸카르바모일)피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸피페라진-1-일)페닐아미노)-4-((1R,3R)-3-카르바모일시클로펜틸아미노)피리미딘-5-카르복스아미드; 메틸 4-(4-(5-카르바모일-4-(시클로프로필아미노)피리미딘-2-일아미노)페닐)피페라진-1-카르복실레이트; 4-((1s,4s)-4-아미노시클로헥실아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; (R)-2-(4-(4-아세틸-2-메틸피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-카르바모일피페라진-1-일)페닐아미노)-4-(시클로부틸아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-(디메틸카르바모일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(N-메틸메틸술폰아미도)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(메틸술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(에틸술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-(메틸술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(1-아세틸피페리딘-4-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(피페리딘-1-카르보닐)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(시클로프로필술포닐)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세틸-1,4-디아제판-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-아세트아미도피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(2-옥소피리딘-1(2H)-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(2-메톡시에틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(1-메틸시클로프로필)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(N-메틸아세트아미도)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(피리딘-2-일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(피리딘-2-일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(4-(아미노메틸)피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(이속사졸-3-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(1H-이미다졸-1-일페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(2-히드록시에틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(디메틸카르바모일)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(3,3-디플루오로피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-(메틸술포닐)피페라진-1-카르보닐)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(티아졸-4-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(1H-피라졸-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(1H-테트라졸-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(티오펜-2-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(피리딘-2-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(1-아세틸-1,2,3,6-테트라히드로피리딘-4-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; (R)-4-(시클로프로필아미노)-2-(4-(2-(메톡시메틸)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필아미노)-2-(4-(2-(메톡시메틸)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(피리딘-3-일)페닐아미노)피리미딘-5-카르복스아미드; 1-(4-(5-카르바모일-4-(시클로프로필아미노)피리미딘-2-일아미노)페닐)피페리딘-4-카르복실산; 4-(시클로프로필아미노)-2-(4-(4-(메틸술포닐)-1,4-디아제판-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(3,5-디메틸-1H-피라졸-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-2-(4-(2-카르바모일피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필아미노)-2-(4-(2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필아미노)-2-(4-(2-(디메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (R)-4-(시클로프로필아미노)-2-(4-(3-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (R)-4-(시클로프로필아미노)-2-(4-(3-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필아미노)-2-(4-(3-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필아미노)-2-(4-(3-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필아미노)-2-(4-(2-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-2-(4-(2-카르바모일아제티딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(2-아미노피리딘-4-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; (R)-4-(시클로프로필아미노)-2-(4-(2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (R)-4-(시클로프로필아미노)-2-(4-(2-(디메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(3-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-((2S,4S)-2-카르바모일-4-히드록시피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-((2S,4S)-4-히드록시-2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-히드록시피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4-메틸피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(3,3-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(4-카르바모일피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-(4-카르바모일피페라진-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(4,4-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-(피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 2-(4-(1H-1,2,4-트리아졸-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; (R)-2-(4-(3-카르바모일피페리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-히드록시피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-메틸피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(3,3-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4,4-디플루오로피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (R)-2-(4-(2-카르바모일피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 2-(4-((2S,4R)-2-카르바모일-4-히드록시피롤리딘-1-일)페닐아미노)-4-(시클로프로필아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-((2S,4R)-4-히드록시-2-(메틸카르바모일)피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로프로필아미노)-2-(4-((2S,4R)-2-(디메틸카르바모일)-4-히드록시피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-(디메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(4-(2-히드록시에틸)피페라진-1-일)페닐아미노)피리미딘-5-카르복스아미드; 4-(시클로부틸아미노)-2-(4-(3,3-디플루오로피롤리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드; (S)-4-(시클로프로필메틸아미노)-2-(4-(2-(메틸카르바모일)피페리딘-1-일)페닐아미노)피리미딘-5-카르복스아미드로 이루어진 군으로부터 선택된 화합물, 또는 그의 호변이성질체 또는 그의 제약상 허용되는 염.
- 제1항 내지 제7항 및 제10항 내지 제12항 중 어느 한 항의 화합물, 또는 그의 호변이성질체 또는 그의 제약상 허용되는 염을 제약상 허용되는 담체 또는 희석제와 함께 포함하는, 심혈관 질환, 염증 질환, 자가면역 질환 및 세포 증식성 장애로 이루어진 군으로부터 선택되는, Syk 또는 JAK 키나제 활성에 의해 매개되는 질병 또는 장애를 치료하기 위한 조성물.
- 제13항에 있어서, 재협착, 혈전증, 면역 혈소판감소성 자반증, 헤파린 유도 혈소판감소증, 확장성 심근병증, 겸상 적혈구 질환, 아테롬성동맥경화증, 심근 경색증, 혈관 염증, 불안정형 협심증 및 급성 관상 동맥 증후군으로 이루어진 군으로부터 선택되는 심혈관 질환; 알레르기, 천식, 류마티스양 관절염, 비 호지킨 림프종, 항인지질 증후군, 루푸스, 건선, 다발성 경화증, 말기 신장 질환 및 크론병으로 이루어진 군으로부터 선택되는 염증 질환; 용혈성 빈혈, 면역 혈소판감소성 자반증, 다발성 경화증, 건선 및 쇼그렌 증후군으로 이루어진 군으로부터 선택되는 자가면역 질환; 또는 백혈병, 림프종, 골수증식성 장애, 혈액 악성종양 및 만성 특발성 골수섬유증으로 이루어진 군으로부터 선택되는 세포 증식성 장애를 치료하기 위한 조성물.
- 제13항의 조성물, 포장 및 사용 설명서를 포함하는, 심혈관 질환, 염증 질환, 자가면역 질환 및 세포 증식성 장애로 이루어진 군으로부터 선택되는, Syk 또는 JAK 키나제 활성에 의해 매개되는 질병 또는 장애를 치료하기 위한 키트.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4540608P | 2008-04-16 | 2008-04-16 | |
| US4541708P | 2008-04-16 | 2008-04-16 | |
| US61/045,406 | 2008-04-16 | ||
| US61/045,417 | 2008-04-16 | ||
| US12034408P | 2008-12-05 | 2008-12-05 | |
| US12034808P | 2008-12-05 | 2008-12-05 | |
| US61/120,344 | 2008-12-05 | ||
| US61/120,348 | 2008-12-05 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20100126863A KR20100126863A (ko) | 2010-12-02 |
| KR101623997B1 true KR101623997B1 (ko) | 2016-05-24 |
Family
ID=40750850
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107025540A KR101623997B1 (ko) | 2008-04-16 | 2009-04-16 | syk 또는 JAK 키나제 억제제로서의 2,6-디아미노-피리미딘-5-일-카르복스아미드 |
Country Status (13)
| Country | Link |
|---|---|
| EP (1) | EP2321283B1 (ko) |
| JP (2) | JP5705720B2 (ko) |
| KR (1) | KR101623997B1 (ko) |
| CN (1) | CN102066340B (ko) |
| CA (2) | CA2723205C (ko) |
| DO (1) | DOP2010000310A (ko) |
| EA (1) | EA024109B1 (ko) |
| HN (1) | HN2010002119A (ko) |
| HR (1) | HRP20161310T1 (ko) |
| MA (1) | MA32280B1 (ko) |
| MY (1) | MY155639A (ko) |
| SV (1) | SV2010003706A (ko) |
| WO (1) | WO2009145856A1 (ko) |
Families Citing this family (100)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA019973B1 (ru) | 2008-04-16 | 2014-07-30 | Портола Фармасьютиклз, Инк. | ИНГИБИТОРЫ Syk ПРОТЕИНКИНАЗ |
| KR20100132550A (ko) * | 2008-04-16 | 2010-12-17 | 포톨라 파마슈티컬스, 인코포레이티드 | syk 또는 JAK 키나제 억제제로서의 2,6-디아미노-피리미딘-5-일-카르복스아미드 |
| US8138339B2 (en) | 2008-04-16 | 2012-03-20 | Portola Pharmaceuticals, Inc. | Inhibitors of protein kinases |
| EP2361242B1 (en) | 2008-10-17 | 2018-08-01 | Oryzon Genomics, S.A. | Oxidase inhibitors and their use |
| WO2010084160A1 (en) | 2009-01-21 | 2010-07-29 | Oryzon Genomics S.A. | Phenylcyclopropylamine derivatives and their medical use |
| TW201040162A (en) * | 2009-05-06 | 2010-11-16 | Portola Pharm Inc | Inhibitors of JAK |
| CA2760061C (en) * | 2009-05-08 | 2017-02-28 | Astellas Pharma Inc. | Diamino heterocyclic carboxamide compound |
| US8859555B2 (en) | 2009-09-25 | 2014-10-14 | Oryzon Genomics S.A. | Lysine Specific Demethylase-1 inhibitors and their use |
| US8946296B2 (en) | 2009-10-09 | 2015-02-03 | Oryzon Genomics S.A. | Substituted heteroaryl- and aryl-cyclopropylamine acetamides and their use |
| WO2011075560A1 (en) | 2009-12-17 | 2011-06-23 | Merck Sharp & Dohme Corp. | Aminopyrimidines as syk inhibitors |
| US8759366B2 (en) | 2009-12-17 | 2014-06-24 | Merck Sharp & Dohme Corp. | Aminopyrimidines as SYK inhibitors |
| UA107100C2 (xx) | 2009-12-23 | 2014-11-25 | Конденсовані гетероароматичні піролідинони як інгібітори syk | |
| WO2011106574A2 (en) | 2010-02-24 | 2011-09-01 | Oryzon Genomics, S.A. | Inhibitors for antiviral use |
| WO2011106573A2 (en) | 2010-02-24 | 2011-09-01 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for diseases and disorders associated with hepadnaviridae |
| JP2011182847A (ja) | 2010-03-05 | 2011-09-22 | Three M Innovative Properties Co | 医療用粘着剤組成物 |
| MX2012012111A (es) | 2010-04-19 | 2013-05-30 | Oryzon Genomics Sa | Inhibidores de demetilasa-1 especifica de lisina y su uso. |
| CA2803842C (en) | 2010-06-30 | 2020-01-07 | Fujifilm Corporation | Nicotinamide derivative or salt thereof as syk-inhibitors |
| WO2012012619A1 (en) | 2010-07-21 | 2012-01-26 | Rigel Pharmaceuticals, Inc. | Protein kinase c inhibitors and uses thereof |
| MX341732B (es) | 2010-07-29 | 2016-08-30 | Oryzon Genomics S A * | Inhibidores de la demetilasa lsd1 basados en arilciclopropilamina y sus usos médicos. |
| US9006449B2 (en) | 2010-07-29 | 2015-04-14 | Oryzon Genomics, S.A. | Cyclopropylamine derivatives useful as LSD1 inhibitors |
| WO2012045010A1 (en) * | 2010-09-30 | 2012-04-05 | Portola Pharmaceuticals, Inc. | Combinations of 4-(3-(2h-1,2,3-triazo-2-yl) phenylamino)-2-((1r,2s)-2-aminocyclohexylamino) pyrimidine-5-carboxamide and fludarabine |
| WO2012045883A1 (en) | 2010-10-08 | 2012-04-12 | Oryzon Genomics S.A. | Cyclopropylamine inhibitors of oxidases |
| WO2012072713A2 (en) | 2010-11-30 | 2012-06-07 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for diseases and disorders associated with flaviviridae |
| WO2012107498A1 (en) * | 2011-02-08 | 2012-08-16 | Oryzon Genomics S.A. | Lysine demethylase inhibitors for myeloproliferative disorders |
| WO2012107499A1 (en) * | 2011-02-08 | 2012-08-16 | Oryzon Genomics S.A. | Lysine demethylase inhibitors for myeloproliferative or lymphoproliferative diseases or disorders |
| EP2489663A1 (en) | 2011-02-16 | 2012-08-22 | Almirall, S.A. | Compounds as syk kinase inhibitors |
| AU2012245387C1 (en) * | 2011-04-22 | 2016-05-05 | Signal Pharmaceuticals, Llc | Substituted Diaminocarboxamide and Diaminocarbonitrile pyrimidines, compositions thereof, and methods of treatment therewith |
| RU2013154412A (ru) | 2011-05-10 | 2015-06-20 | Мерк Шарп И Доум Корп. | Аминопиримидины в качестве ингибиторов syc |
| WO2012154518A1 (en) | 2011-05-10 | 2012-11-15 | Merck Sharp & Dohme Corp. | Bipyridylaminopyridines as syk inhibitors |
| EP2707357B1 (en) | 2011-05-10 | 2017-01-18 | Merck Sharp & Dohme Corp. | Pyridyl aminopyridines as syk inhibitors |
| WO2012156537A2 (en) * | 2011-05-19 | 2012-11-22 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for thrombosis and cardiovascular diseases |
| US20140329833A1 (en) * | 2011-05-19 | 2014-11-06 | Oryzon Genomics, S.A | Lysine demethylase inhibitors for inflammatory diseases or conditions |
| KR101255939B1 (ko) * | 2011-05-31 | 2013-04-23 | 동화약품주식회사 | 4-(1h-인다졸-6-일아미노)-n-아이소프로필-2-(메틸티오)피리미딘-5-카르복스아미드 화합물 또는 이의 약학적으로 허용가능한 염을 포함하는 당뇨병 예방 또는 치료용 조성물 |
| US9056873B2 (en) | 2011-06-22 | 2015-06-16 | Takeda Pharmaceutical Company Limited | Substituted 6-aza-isoindolin-1-one derivatives |
| WO2013054351A1 (en) * | 2011-08-08 | 2013-04-18 | Cadila Healthcare Limited | Heterocyclic compounds |
| US8987456B2 (en) | 2011-10-05 | 2015-03-24 | Merck Sharp & Dohme Corp. | 3-pyridyl carboxamide-containing spleen tyrosine kinase (SYK) inhibitors |
| EP2763974B1 (en) | 2011-10-05 | 2016-09-14 | Merck Sharp & Dohme Corp. | Phenyl carboxamide-containing spleen tyrosine kinase (syk) inhibitors |
| WO2013052394A1 (en) | 2011-10-05 | 2013-04-11 | Merck Sharp & Dohme Corp. | 2-pyridyl carboxamide-containing spleen tyrosine kinase (syk) inhibitors |
| CN104203914B (zh) | 2011-10-20 | 2017-07-11 | 奥瑞泽恩基因组学股份有限公司 | 作为lsd1抑制剂的(杂)芳基环丙胺化合物 |
| CN103958474B (zh) | 2011-10-20 | 2017-03-08 | 奥莱松基因组股份有限公司 | 作为lsd1抑制剂的(杂)芳基环丙基胺化合物 |
| CA2856306A1 (en) * | 2011-11-23 | 2013-05-30 | Portola Pharmaceuticals, Inc. | Selective kinase inhibitors |
| CA3094793A1 (en) * | 2011-11-23 | 2013-05-30 | Portola Pharmaceuticals, Inc. | Pyrazine kinase inhibitors |
| KR20140114344A (ko) | 2011-12-23 | 2014-09-26 | 셀좀 리미티드 | 키나제 억제제로서의 피리미딘-2,4-디아민 유도체 |
| KR101744607B1 (ko) | 2011-12-28 | 2017-06-08 | 후지필름 가부시키가이샤 | 신규인 니코틴아미드 유도체 또는 그 염 |
| KR20140108594A (ko) * | 2012-01-10 | 2014-09-11 | 에프. 호프만-라 로슈 아게 | 피리다진 아미드 화합물 및 syk 저해제로서의 이의 용도 |
| ME02648B (me) * | 2012-01-17 | 2017-06-20 | Astellas Pharma Inc | Jedinjenje pirazin karboksamida |
| MX358311B (es) * | 2012-04-17 | 2018-08-14 | Fujifilm Corp | Compuesto heterociclico que contiene nitrogeno o sal del mismo. |
| CN102731412A (zh) * | 2012-06-13 | 2012-10-17 | 盛世泰科生物医药技术(苏州)有限公司 | 一种2,4-二氯-5-嘧啶甲醛的合成方法 |
| US9487504B2 (en) | 2012-06-20 | 2016-11-08 | Merck Sharp & Dohme Corp. | Imidazolyl analogs as syk inhibitors |
| US9242984B2 (en) | 2012-06-20 | 2016-01-26 | Merck Sharp & Dohme Corp. | Pyrazolyl derivatives as Syk inhibitors |
| CN102731375A (zh) * | 2012-06-20 | 2012-10-17 | 盛世泰科生物医药技术(苏州)有限公司 | 4,6-二氯-5-嘧啶甲醛的合成 |
| EP2863915B1 (en) | 2012-06-22 | 2017-12-06 | Merck Sharp & Dohme Corp. | SUBSTITUTED DIAZINE AND TRIAZINE SPLEEN TYROSINE KINASE (Syk) INHIBITORS |
| WO2013192098A1 (en) | 2012-06-22 | 2013-12-27 | Merck Sharp & Dohme Corp. | SUBSTITUTED PYRIDINE SPLEEN TYROSINE KINASE (Syk) INHIBITORS |
| KR101446742B1 (ko) | 2012-08-10 | 2014-10-01 | 한국화학연구원 | N2,n4-비스(4-(피페라진-1-일)페닐)피리미딘-2,4-디아민 유도체 또는 이의 약학적으로 허용가능한 염 및 이를 유효성분으로 함유하는 암의 예방 또는 치료용 약학적 조성물 |
| WO2014031438A2 (en) | 2012-08-20 | 2014-02-27 | Merck Sharp & Dohme Corp. | SUBSTITUTED PHENYL SPLEEN TYROSINE KINASE (Syk) INHIBITORS |
| CN104640863B (zh) * | 2012-09-20 | 2016-06-08 | 山东亨利医药科技有限责任公司 | 嘧啶胺衍生物及其制备方法和应用 |
| WO2014048065A1 (en) * | 2012-09-28 | 2014-04-03 | Merck Sharp & Dohme Corp. | Triazolyl derivatives as syk inhibitors |
| WO2014060371A1 (en) | 2012-10-19 | 2014-04-24 | F. Hoffmann-La Roche Ag | Inhibitors of syk |
| EP2917186B1 (en) * | 2012-11-08 | 2017-10-18 | Bristol-Myers Squibb Company | Alkyl amide-substituted pyrimidine compounds useful in the modulation of il-12, il-23 and/or ifn |
| US9624210B2 (en) | 2012-12-12 | 2017-04-18 | Merck Sharp & Dohme Corp. | Amino-pyrimidine-containing spleen tyrosine kinase (Syk) inhibitors |
| EP2934525B1 (en) | 2012-12-21 | 2019-05-08 | Merck Sharp & Dohme Corp. | Thiazole-substituted aminopyridines as spleen tyrosine kinase inhibitors |
| WO2014176216A1 (en) | 2013-04-26 | 2014-10-30 | Merck Sharp & Dohme Corp. | Thiazole-substituted aminopyrimidines as spleen tyrosine kinase inhibitors |
| WO2014176210A1 (en) | 2013-04-26 | 2014-10-30 | Merck Sharp & Dohme Corp. | Thiazole-substituted aminoheteroaryls as spleen tyrosine kinase inhibitors |
| DK3030561T3 (en) | 2013-08-07 | 2017-03-27 | Cadila Healthcare Ltd | N-CYANOMETHYLAMIDES AS INHIBITORS OF JANUS KINASE |
| PT3060550T (pt) * | 2013-10-21 | 2019-08-27 | Merck Patent Gmbh | Compostos de heteroarilo como inibidores de btk e utilizações dos mesmos |
| KR20160093675A (ko) | 2013-12-05 | 2016-08-08 | 파마싸이클릭스 엘엘씨 | 브루톤 티로신 키나제의 억제제 |
| US9670196B2 (en) | 2013-12-20 | 2017-06-06 | Merck Sharp & Dohme Corp. | Thiazole-substituted aminoheteroaryls as Spleen Tyrosine Kinase inhibitors |
| US9783531B2 (en) | 2013-12-20 | 2017-10-10 | Merck Sharp & Dohme Corp. | Thiazole-substituted aminoheteroaryls as spleen tyrosine kinase inhibitors |
| EP3083559B1 (en) | 2013-12-20 | 2021-03-10 | Merck Sharp & Dohme Corp. | Thiazole-substituted aminoheteroaryls as spleen tyrosine kinase inhibitors |
| NZ715903A (en) | 2014-01-30 | 2017-06-30 | Signal Pharm Llc | Solid forms of 2-(tert-butylamino)-4-((1r,3r,4r)-3-hydroxy-4-methylcyclohexylamino)-pyrimidine-5-carboxamide, compositions thereof and methods of their use |
| EP3116506B1 (en) | 2014-03-13 | 2019-04-17 | Merck Sharp & Dohme Corp. | 2-pyrazine carboxamides as spleen tyrosine kinase inhibitors |
| MX2016012574A (es) * | 2014-03-28 | 2017-09-26 | Calitor Sciences Llc | Compuestos heteroarilo sustituidos y metodos de uso. |
| CA2959347C (en) | 2014-08-25 | 2023-03-07 | Salk Institute For Biological Studies | Ulk1 inhibitors and methods using same |
| US10059689B2 (en) * | 2014-10-14 | 2018-08-28 | Calitor Sciences, Llc | Substituted heteroaryl compounds and methods of use |
| ES2877642T3 (es) | 2014-12-16 | 2021-11-17 | Signal Pharm Llc | Formulaciones de 2-(terc-butilamino)-4-((1R,3R,4R)-3-hidroxi-4-metilciclohexilamino)-pirimidin-5-carboxamida |
| JP6903577B2 (ja) | 2014-12-16 | 2021-07-14 | シグナル ファーマシューティカルズ,エルエルシー | 皮膚におけるc−Jun N末端キナーゼの阻害の測定方法 |
| CA2975260A1 (en) | 2015-01-29 | 2016-08-04 | Signal Pharmaceuticals Llc | Isotopologues of 2-(tert-butylamino)-4-((1r,3r,4r)-3-hydroxy-4-methylcyclohexylamino)-pyrimidine-5-carboxamide |
| EP3302485B1 (en) | 2015-05-29 | 2023-07-12 | Alexion Pharmaceuticals, Inc. | Cerdulatinib for the treatment of b-cell malignancies |
| ES2819374T3 (es) | 2015-07-24 | 2021-04-15 | Celgene Corp | Métodos de síntesis del hidrocloruro de (1R,2R,5R)-5-amino-2-metilciclohexanol e intermedios útiles en los mismos |
| EP3328496A4 (en) * | 2015-08-02 | 2018-12-19 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Inhibitors of ack1/tnk2 tyrosine kinase |
| CA2950640A1 (en) | 2015-12-04 | 2017-06-04 | Portola Pharmaceuticals, Inc. | Cerdulatinib for treating hematological cancers |
| AR106830A1 (es) * | 2015-12-04 | 2018-02-21 | Asana Biosciences Llc | Usos de piridazinonas para tratar el cáncer |
| KR101936054B1 (ko) | 2017-06-23 | 2019-01-11 | 한국과학기술연구원 | 항염증 활성을 가지는 6-페녹시피리미딘 유도체, 이의 제조방법 및 이를 활성성분으로 하는 약학 조성물 |
| WO2019034153A1 (zh) * | 2017-08-18 | 2019-02-21 | 北京韩美药品有限公司 | 一种化合物,其药物组合物及其用途及应用 |
| EP3686197B1 (en) | 2017-09-21 | 2023-06-21 | Beijing Scitech-MQ Pharmaceuticals Limited | 2-substituted pyrazole amino-4-substituted amino-5-pyrimidine formamide compound, composition, and application thereof |
| JP2020537678A (ja) | 2017-10-19 | 2020-12-24 | バイエル・アニマル・ヘルス・ゲーエムベーハー | 動物における疾患の治療および予防のための縮合ヘテロ芳香族ピロリドンの使用 |
| ES2925450T3 (es) | 2017-11-06 | 2022-10-18 | Bristol Myers Squibb Co | Compuestos de isofuranona útiles como inhibidores de HPK1 |
| US10683297B2 (en) * | 2017-11-19 | 2020-06-16 | Calitor Sciences, Llc | Substituted heteroaryl compounds and methods of use |
| CN108299312B (zh) * | 2018-03-29 | 2020-10-30 | 郑州大学第一附属医院 | 一组嘧啶类衍生物及其在制备抗肿瘤药物中的应用 |
| WO2019213545A1 (en) * | 2018-05-04 | 2019-11-07 | Portola Pharmaceuticals, Inc. | Synthesis of cerdulatinib |
| TW202014412A (zh) * | 2018-05-04 | 2020-04-16 | 美商普托拉製藥有限公司 | 賽度替尼(cerdulatinib)之固體型式 |
| CN111718332B (zh) * | 2019-03-19 | 2021-08-17 | 北京赛特明强医药科技有限公司 | 2-取代吡唑氨基-4-取代氨基-5-嘧啶甲酰胺类化合物、组合物及其应用 |
| CN114364798A (zh) | 2019-03-21 | 2022-04-15 | 欧恩科斯欧公司 | 用于治疗癌症的Dbait分子与激酶抑制剂的组合 |
| AU2020378630A1 (en) | 2019-11-08 | 2022-05-26 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for the treatment of cancers that have acquired resistance to kinase inhibitors |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| WO2022078305A1 (zh) * | 2020-10-12 | 2022-04-21 | 四川海思科制药有限公司 | 一种杂环衍生物及其在医药上的应用 |
| EP4306172A1 (en) * | 2021-03-09 | 2024-01-17 | CSPC Zhongqi Pharmaceutical Technology (Shijiazhuang) Co., Ltd. | Use of tricyclic heteroaryl-containing compound |
| WO2023108536A1 (en) * | 2021-12-16 | 2023-06-22 | Lynk Pharmaceuticals Co. Ltd. | Tyk2 inhibitors and compositions and methods thereof |
| CN114621206B (zh) * | 2022-03-24 | 2023-11-24 | 安徽医科大学 | 一种5-取代的嘧啶二胺类衍生物及其制备方法与应用 |
| CN115304550A (zh) * | 2022-07-25 | 2022-11-08 | 南通大学 | 哌嗪苯基氨基取代的嘧啶氨基酸衍生物及制备方法与应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040029902A1 (en) * | 2002-02-01 | 2004-02-12 | Rajinder Singh | 2,4-Pyrimidinediamine compounds and their uses |
| WO2008009458A1 (en) * | 2006-07-21 | 2008-01-24 | Novartis Ag | 2, 4 -di (arylaminio) -pyrimidine-5-carboxamide compounds as jak kinases inhibitors |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2308821T3 (es) * | 1997-12-15 | 2008-12-01 | Astellas Pharma Inc. | Nuevos derivados de pirimidin-5-carboxamida. |
| ATE530530T1 (de) * | 2002-06-28 | 2011-11-15 | Astellas Pharma Inc | Diaminopyrimidincarbonsäureamidderivat |
| TW201040162A (en) * | 2009-05-06 | 2010-11-16 | Portola Pharm Inc | Inhibitors of JAK |
-
2009
- 2009-04-16 EA EA201001619A patent/EA024109B1/ru not_active IP Right Cessation
- 2009-04-16 CN CN200980122631.8A patent/CN102066340B/zh active Active
- 2009-04-16 JP JP2011505034A patent/JP5705720B2/ja active Active
- 2009-04-16 CA CA2723205A patent/CA2723205C/en active Active
- 2009-04-16 CA CA2960692A patent/CA2960692C/en active Active
- 2009-04-16 KR KR1020107025540A patent/KR101623997B1/ko active IP Right Grant
- 2009-04-16 MY MYPI2010004846A patent/MY155639A/en unknown
- 2009-04-16 WO PCT/US2009/002420 patent/WO2009145856A1/en active Application Filing
- 2009-04-16 EP EP09755219.4A patent/EP2321283B1/en active Active
-
2010
- 2010-10-15 SV SV2010003706A patent/SV2010003706A/es unknown
- 2010-10-15 DO DO2010000310A patent/DOP2010000310A/es unknown
- 2010-10-15 HN HN2010002119A patent/HN2010002119A/es unknown
- 2010-11-01 MA MA33300A patent/MA32280B1/fr unknown
-
2014
- 2014-10-31 JP JP2014223491A patent/JP2015078194A/ja active Pending
-
2016
- 2016-10-11 HR HRP20161310TT patent/HRP20161310T1/hr unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040029902A1 (en) * | 2002-02-01 | 2004-02-12 | Rajinder Singh | 2,4-Pyrimidinediamine compounds and their uses |
| WO2008009458A1 (en) * | 2006-07-21 | 2008-01-24 | Novartis Ag | 2, 4 -di (arylaminio) -pyrimidine-5-carboxamide compounds as jak kinases inhibitors |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2960692C (en) | 2019-09-24 |
| CN102066340B (zh) | 2014-05-14 |
| EA201001619A1 (ru) | 2011-06-30 |
| WO2009145856A1 (en) | 2009-12-03 |
| CA2960692A1 (en) | 2009-12-03 |
| EP2321283B1 (en) | 2016-07-13 |
| JP5705720B2 (ja) | 2015-04-22 |
| SV2010003706A (es) | 2011-03-23 |
| EA024109B1 (ru) | 2016-08-31 |
| HN2010002119A (es) | 2013-06-17 |
| DOP2010000310A (es) | 2011-03-15 |
| MY155639A (en) | 2015-11-13 |
| CA2723205A1 (en) | 2009-12-03 |
| CA2723205C (en) | 2017-03-14 |
| HRP20161310T1 (hr) | 2016-12-02 |
| JP2011518158A (ja) | 2011-06-23 |
| JP2015078194A (ja) | 2015-04-23 |
| MA32280B1 (fr) | 2011-05-02 |
| CN102066340A (zh) | 2011-05-18 |
| KR20100126863A (ko) | 2010-12-02 |
| EP2321283A1 (en) | 2011-05-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101623997B1 (ko) | syk 또는 JAK 키나제 억제제로서의 2,6-디아미노-피리미딘-5-일-카르복스아미드 | |
| US11414410B2 (en) | Inhibitors of protein kinases | |
| KR101773313B1 (ko) | syk 또는 JAK 키나제 억제제로서의 2,6-디아미노-피리미딘-5-일-카르복스아미드 | |
| US9139581B2 (en) | Inhibitors of protein kinases | |
| EP2635556B1 (en) | Benzamides and nicotinamides as syk modulators | |
| MX2010011463A (es) | 2,6-diamino-pirimidin-5-il-carboxamidas como inhibidores de syk o jak quinasas. | |
| EP2975027A1 (en) | Nicotinamides as jak kinase modulators | |
| AU2009251863B2 (en) | 2, 6-diamino-pyrimidin- 5-yl-carboxamides as syk or JAK kinases inhibitors | |
| NZ625114B2 (en) | Pyrazine kinase inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20190508 Year of fee payment: 4 |