KR101233377B1 - 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 - Google Patents
신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 Download PDFInfo
- Publication number
- KR101233377B1 KR101233377B1 KR1020080137223A KR20080137223A KR101233377B1 KR 101233377 B1 KR101233377 B1 KR 101233377B1 KR 1020080137223 A KR1020080137223 A KR 1020080137223A KR 20080137223 A KR20080137223 A KR 20080137223A KR 101233377 B1 KR101233377 B1 KR 101233377B1
- Authority
- KR
- South Korea
- Prior art keywords
- formula
- group
- photoelectric device
- organic photoelectric
- compound
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Electroluminescent Light Sources (AREA)
- Photovoltaic Devices (AREA)
- Light Receiving Elements (AREA)
- Pyridine Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
본 발명은 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자에 관한 것으로, 보다 상세하게는 정공과 전자의 수송능력 및 열적 안정성이 우수한 유기광전소자용 화합물을 포함하여, 구동전압이 낮고, 수명 및 효율 특성이 우수한 유기광전소자를 제공할 수 있는 유기광전소자용 화합물 및 이를 포함하는 유기광전소자에 관한 것이다.
유기광전소자는 유기 재료에 전류를 가하여 전기 에너지를 빛 에너지로 바꿔 주는 소자로서 양극(anode)과 음극(cathode) 사이에 기능성 유기 박막층이 삽입된 구조로 이루어져 있다. 이 때, 유기 박막층은 발광층, 정공 주입층, 정공 수송층, 전자 수송층, 전자 주입층 등을 포함할 수 있고, 발광층의 발광특성상 전자 차단층 또는 정공 차단층을 추가로 포함할 수 있다.
유기광전소자의 전기적인 특성은 발광소자(light emitting diodes, LED)와 유사하며, 극에서 정공이 주입되고 음극에서 전자가 주입되면, 각각의 정공과 전자가 서로 상대 전극을 향해 이동하다가 재결합(recombination)하여 에너지가 높은 여기자(exciton)를 형성하게 된다. 이 때, 형성된 여기자가 기저상태(ground state)로 이동하면서 특정 파장을 가지는 빛이 발생하게 되는 것이다.
높은 발광 효율을 얻기 위해서는 발광층 내의 정공과 전자의 결합이 원활히 이루어져야 한다. 그러나, 일반적으로 유기물의 정공의 이동이 전자의 이동보다 빠르기 때문에 발광층에서 여기자가 효과적으로 형성되지 못하여 소자의 발광 효율이 감소하는 문제점이 있다. 따라서 음극으로부터의 전자 주입 및 이동도를 높이는 동시에, 정공의 이동을 차단할 수 있는 신규한 화합물의 개발이 필요한 실정이다.
또한, 소자의 수명은 소자의 구동시 발생하는 줄 열(Joule heat)에 의하여 재료가 결정화면서, 수명이 단축될 수 있다. 이러한 문제점을 해결하기 위하여 전자의 이동 속도가 빠른 2-(4-비페닐릴)-5-(4-t-부틸페닐)-1,3,4-옥사디아졸(PBD)(Jpn. J. Appl. Phys., 27, L269 (1988))와 같은 재료가 제안되었으나, 열적 안정성이 부족하여 소자 구동시 결정화되는 문제점이 있었다. 또한, 정공 이동도를 낮추는 특성이 우수한 바쏘쿠프로인(BCP) 및 알루미늄 혼합 배위착체(BAlq,Bis(2-methyl-8-quinolinolate)-4-(phenylphenolate)aluminum)에 대한 연구도 활발히 진행되었다. 그러나 상기 재료들은 정공 이동도를 낮추는 특성이 우수한 반면, 전자주입 특성이 저하되고, 소자 구동시 결정화되는 문제점이 있어, 만 족할 만한 소자 특성을 보여 주지는 못하였다.
따라서, 유기 발광 소자의 효율 및 수명 특성을 개선하기 위해서는 전자의 주입 및 이동성이 우수하며, 열적 안정성이 높은 유기 화합물에 대한 개발이 요구된다.
본 발명의 일 구현예는 정공과 전자의 수송능력이 우수한 유기광전소자용 화합물을 제공한다.
본 발명의 다른 일 구현예는 상기 유기광전소자용 화합물을 포함하여 구동전압이 낮고, 수명 및 효율 특성이 우수한 유기광전소자를 제공한다.
본 발명의 또 다른 일 구현예는 상기 유기광전소자를 포함하는 표시장치를 제공한다.
본 발명이 이루고자 하는 기술적 과제들은 이상에서 언급한 기술적 과제들로 제한되지 않으며, 언급되지 않은 또 다른 기술적 과제들은 아래의 기재로부터 당업자에게 명확하게 이해될 수 있을 것이다.
본 발명의 일 구현예는 하기 화학식 1로 표시되는 유기 광전 소자용 화합물을 제공한다.
[화학식 1]
(상기 화학식 1에서 A1 내지 A10은 서로 같거나 다른 것으로, 각각 독립적으로 CR1 내지 CR10, SiR1 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R1 내지 R5는 융합링을 형성할 수 있고, 서로 인접한 R6 내지 R10은 융합링을 형성할 수 있고,
단, A1 내지 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1 내지 SiR5, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R1 내지 R5의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1 내지 R10은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환또는 비치환된 알케닐기, 치환 또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진 군에서 선택되는 것이고, Ar1은 치환 또는 비치환된 아릴렌기이고,
Ar2는 치환 또는 비치환된 아릴기이고,
l 및 m은 1 내지 4 사이의 정수이고, 이 때, l 및 m이 2 이상인 경우, 각각의 반복단위는 상이할 수 있다.)
상기 유기 광전 소자용 화합물은 하기 화학식 2로 표시될 수 있다:
[화학식2]
(상기 화학식 2에서,
A1, A3, A5, A6 내지 A15는 서로 같거나 다른 것으로, 각각 독립적으로 CR1, CR3, CR5, CR6 내지 CR15, SiR1, SiR3, SiR5, SiR6 내지SiR15, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R6 내지 R10 은 융합링을 형성할 수 있고, 서로 인접한 R11 내지 R15는 융합링을 형성할 수 있고,
단, A1, A3, 및 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1, SiR3, SiR5, 및 N으로 이루어진 군에서 선택되는 것을 포함하고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A11 내지 A15 중에서 선택된 적어도 어느 하나 이상은 SiR11 내지 SiR15, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R11 내지 R15의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1, R3, R5, R6 내지 R15은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환또는 비치환된 알케닐기, 치환 또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진군에서 선택되는 것이고,
Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2 및 Ar3는 서로 같거나 다른 것으로, 각각 독립적으로 치환 또는 비치환된 아릴기임.)
상기 아릴은 탄소수 6 내지 50의 아릴일 수 있다.
상기 서로 인접한 R1 내지 R5이 융합링을 형성하거나, 서로 인접한 R6 내지 R10이 융합링을 형성하는 경우, 상기 융합링을 형성한 A1 내지 A5을 포함하는 고리 및 융합링을 형성한 A6 내지 A10 을 포함하는 고리는 치환 또는 비치환된 헤테로 고리기일 수 있다.
상기 헤테로고리기는 티오펜기, 퓨란기, 피롤기, 이미다졸릴기, 티아졸릴기, 옥사졸릴기, 옥사디아졸릴기, 트리아졸릴기, 카바졸기, 피리디닐기, 피라다진기, 퀴놀리닐기, 이소퀴놀리닌기, 아크리딜기, 이미다조피리디닐기, 및 이미다조피리미디닐기로 이루어진 군에서 선택될 수 있다.
상기 이미다졸릴기 또는 트리아졸릴기의 질소(N) 원소에 결합되는 치환기는 치환 또는 비치환된 알킬기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 헤테로고리기로 이루어진 군에서 선택될 수 있다.
상기 화학식 2에서 상기 A1, A3, 및 A5 중 어느 하나가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 화학식 2에서 상기 A3가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 퀴놀리닐기 또는 이소퀴놀리닐기는 2번 또는 3번 위치에서 Ar1과 결합될 수 있다.
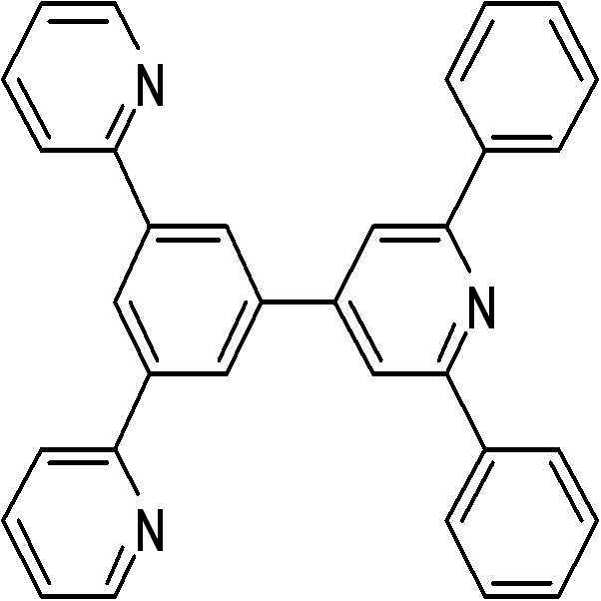
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 3 내지 화학식 52로 표시되는 화합물을 사용할 수 있다.
[화학식 3] [화학식 4] [화학식 5]
[화학식 6] [화학식 7] [화학식 8]
[화학식 9] [화학식 10] [화학식 11]
[화학식 12] [화학식 13] [화학식 14]
[화학식 15] [화학식 16] [화학식 17]
[화학식 18] [화학식 19]
[화학식 20] [화학식 21]
[화학식 22] [화학식 23]
[화학식 24]
[화학식 25] [화학식 26]
[화학식 27] [화학식 28]
[화학식 29] [화학식 30]
[화학식 31]
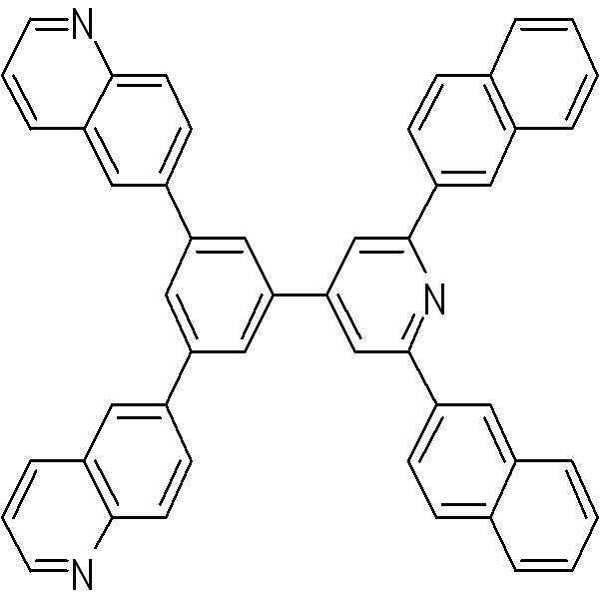
[화학식 32] [화학식 33]
[화학식 34] [화학식 35]
[화학식 36] [화학식 37]
[화학식 38] [화학식 39]
[화학식 40] [화학식 41]
[화학식 42] [화학식 43]
[화학식 44] [화학식 45]
[화학식 46] [화학식 47]
[화학식 48] [화학식 49]
[화학식 50] [화학식 51]
[화학식 52]
본 발명의 다른 일 구현예는 양극, 음극 및 상기 양극과 음극 사이에 개재되는 적어도 한 층 이상의 유기 박막층을 포함하는 유기 광전 소자에서, 상기 유기 박막층 중 적어도 어느 한 층은 본 발명의 일 구현예에 따른 유기 광전 소자용 화합물을 포함하는 유기 광전 소자를 제공한다.
본 발명의 또 다른 일 구현예는 상기 유기 광전 소자를 포함하는 표시장치를 제공한다.
기타 본 발명의 구현예들의 구체적인 사항은 이하의 상세한 설명에 포함되어 있다.
[화학식 1]
(상기 화학식 1에서 A1 내지 A10은 서로 같거나 다른 것으로, 각각 독립적으로 CR1 내지 CR10, SiR1 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R1 내지 R5는 융합링을 형성할 수 있고, 서로 인접한 R6 내지 R10은 융합링을 형성할 수 있고,
단, A1 내지 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1 내지 SiR5, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R1 내지 R5의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1 내지 R10은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환또는 비치환된 알케닐기, 치환 또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진 군에서 선택되는 것이고, Ar1은 치환 또는 비치환된 아릴렌기이고,
Ar2는 치환 또는 비치환된 아릴기이고,
l 및 m은 1 내지 4 사이의 정수이고, 이 때, l 및 m이 2 이상인 경우, 각각의 반복단위는 상이할 수 있다.)
상기 유기 광전 소자용 화합물은 하기 화학식 2로 표시될 수 있다:
[화학식2]
(상기 화학식 2에서,
A1, A3, A5, A6 내지 A15는 서로 같거나 다른 것으로, 각각 독립적으로 CR1, CR3, CR5, CR6 내지 CR15, SiR1, SiR3, SiR5, SiR6 내지SiR15, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R6 내지 R10 은 융합링을 형성할 수 있고, 서로 인접한 R11 내지 R15는 융합링을 형성할 수 있고,
단, A1, A3, 및 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1, SiR3, SiR5, 및 N으로 이루어진 군에서 선택되는 것을 포함하고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A11 내지 A15 중에서 선택된 적어도 어느 하나 이상은 SiR11 내지 SiR15, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R11 내지 R15의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1, R3, R5, R6 내지 R15은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환또는 비치환된 알케닐기, 치환 또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진군에서 선택되는 것이고,
Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2 및 Ar3는 서로 같거나 다른 것으로, 각각 독립적으로 치환 또는 비치환된 아릴기임.)
상기 아릴은 탄소수 6 내지 50의 아릴일 수 있다.
상기 서로 인접한 R1 내지 R5이 융합링을 형성하거나, 서로 인접한 R6 내지 R10이 융합링을 형성하는 경우, 상기 융합링을 형성한 A1 내지 A5을 포함하는 고리 및 융합링을 형성한 A6 내지 A10 을 포함하는 고리는 치환 또는 비치환된 헤테로 고리기일 수 있다.
상기 헤테로고리기는 티오펜기, 퓨란기, 피롤기, 이미다졸릴기, 티아졸릴기, 옥사졸릴기, 옥사디아졸릴기, 트리아졸릴기, 카바졸기, 피리디닐기, 피라다진기, 퀴놀리닐기, 이소퀴놀리닌기, 아크리딜기, 이미다조피리디닐기, 및 이미다조피리미디닐기로 이루어진 군에서 선택될 수 있다.
상기 이미다졸릴기 또는 트리아졸릴기의 질소(N) 원소에 결합되는 치환기는 치환 또는 비치환된 알킬기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 헤테로고리기로 이루어진 군에서 선택될 수 있다.
상기 화학식 2에서 상기 A1, A3, 및 A5 중 어느 하나가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 화학식 2에서 상기 A3가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 퀴놀리닐기 또는 이소퀴놀리닐기는 2번 또는 3번 위치에서 Ar1과 결합될 수 있다.
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 3 내지 화학식 52로 표시되는 화합물을 사용할 수 있다.
[화학식 3] [화학식 4] [화학식 5]
[화학식 6] [화학식 7] [화학식 8]
[화학식 9] [화학식 10] [화학식 11]
[화학식 12] [화학식 13] [화학식 14]
[화학식 15] [화학식 16] [화학식 17]
[화학식 18] [화학식 19]
[화학식 20] [화학식 21]
[화학식 22] [화학식 23]
[화학식 24]
[화학식 25] [화학식 26]
[화학식 27] [화학식 28]
[화학식 29] [화학식 30]
[화학식 31]
[화학식 32] [화학식 33]
[화학식 34] [화학식 35]
[화학식 36] [화학식 37]
[화학식 38] [화학식 39]
[화학식 40] [화학식 41]
[화학식 42] [화학식 43]
[화학식 44] [화학식 45]
[화학식 46] [화학식 47]
[화학식 48] [화학식 49]
[화학식 50] [화학식 51]
[화학식 52]
본 발명의 다른 일 구현예는 양극, 음극 및 상기 양극과 음극 사이에 개재되는 적어도 한 층 이상의 유기 박막층을 포함하는 유기 광전 소자에서, 상기 유기 박막층 중 적어도 어느 한 층은 본 발명의 일 구현예에 따른 유기 광전 소자용 화합물을 포함하는 유기 광전 소자를 제공한다.
본 발명의 또 다른 일 구현예는 상기 유기 광전 소자를 포함하는 표시장치를 제공한다.
기타 본 발명의 구현예들의 구체적인 사항은 이하의 상세한 설명에 포함되어 있다.
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
본 발명의 일 구현예에 따른 유기광전소자용 화합물은 치환기를 조절하여 에너지 레벨을 조절함으로써 정공과 전자의 수송능력을 향상시킬 수 있다. 특히, 아릴기 및 헤테로 고리가 순서대로 반복되는 구조를 가지는 본 발명의 일 구현예에 따른 유기광전소자용 화합물은 에너지 레벨을 낮추어 전자 전달 능력이 우수한 효과가 있다. 이로써, 본 발명의 일 구현예에 따른 유기광전소자용 화합물은 발광층, 정공수송층, 정공주입층, 전자수송층, 전자주입층, 또는 이들의 조합인 유기 박막층에 포함되어 우수한 전기화학적 및 열적 안정성으로 수명 특성이 우수하고, 낮은 구동전압에서도 높은 발광효율을 가지는 유기광전소자를 제공할 수 있다.
이하, 본 발명의 구현예를 상세히 설명하기로 한다. 다만, 이는 예시로서 제시되는 것으로, 이에 의해 본 발명이 제한되지는 않으며 본 발명은 후술할 청구범위의 범주에 의해 정의될 뿐이다.
본 명세서에 있어서, 별도의 정의가 없는 한, "알킬"이라 함은 탄소수 1 내지 50의 알킬, 보다 바람직하기로는 탄소수 1 내지 15의 알킬을 의미하고 "알콕시"라 함은 탄소수 1 내지 50의 알콕시, 보다 바람직하기로는 탄소수 1 내지 15의 알콕시를 의미하고 "알케닐"이라 함은 탄소수 2 내지 50의 알케닐, 보다 바람직하기로는 탄소수 2 내지 15의 알케닐을 의미하고 "사이클로알킬"이라 함은 탄소수 3 내지 50의 사이클로알킬, 보다 바람직하기로는 탄소수 3 내지 15의 사이클로알킬을 의미하고 "아릴"이라 함은 탄소수 6 내지 50의 아릴, 보다 바람직하기로는 탄소수 6 내지 25의 아릴을 의미하며 "헤테로고리기"라 함은 탄소수 1 내지 50의 헤테로고리기, 보다 바람직하기로는 탄소수 1 내지 25의 헤테로고리기를 의미한다.
특히, 본 명세서에서 "헤테로고리기"란 별도의 정의가 없는 한, 상기 헤테로 원자를 포함하는 탄소수 3 내지 50의 헤테로아릴기, 탄소수 1 내지 50의 헤테로사이클로알킬기, 탄소수 1 내지 50의 헤테로사이클로알케닐기, 탄소수 1 내지 50의 헤테로사이클로알키닐기 또는 이들의 융합 고리인 것을 의미한다. 상기 헤테로고리기는 상기한 헤테로 원자를 1 내지 20 개, 보다 구체적으로는 1 내지 15 개를 포함하는 것이 좋다.
본 명세서에서 별도의 정의가 없는 한, "에스테르"란 COOR로 표시되는 것을 의미하고 "카르보닐"이란 -COR'로 표시되는 것을 의미한다. 여기서 R, 및 R'은 각각 독립적으로 수소, 탄소수 1 내지 10의 알킬기, 탄소수 6 내지 20의 아릴기, 탄소수 3 내지 20의 사이클로알킬기, 탄소수 2 내지 10의 알케닐기, 탄소수 2 내지 10의 알키닐기, 또는 이들의 조합인 것이다.
본 명세서에서 "치환"이란 별도의 정의가 없는 한, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 탄소수 1 내지 10의 알킬기, 탄소수 1 내지 10의 알콕시기, 탄소수 2 내지 10의 알케닐기, 탄소수 2 내지 10의 알키닐기, 탄소수 3 내지 10의 사이클로알킬기, 탄소수 6 내지 20의 아릴기임.)
또한, 본 명세서에서 "헤테로 원자"란 별도의 정의가 없는 한, N, O, S, P, Se, 및 Si로 이루어진 군에서 선택되는 것을 의미한다.
또한, 본 명세서에서 "헤테로"란 별도의 정의가 없는 한, 하나의 고리내에 상기한 헤테로 원자를 1 내지 3개 함유하고, 나머지는 탄소인 것을 의미한다.
본 발명의 일 구현예는 아릴기 및 헤테로고리기가 순서대로 반복되는 구조를 가지는 하기 화학식 1로 표시되는 유기 광전 소자용 화합물을 제공한다.
[화학식1]
(상기 화학식 1에서 A1 내지 A10은 서로 같거나 다른 것으로, 각각 독립적으로 CR1 내지 CR10, SiR1 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R1 내지 R5는 융합링을 형성할 수 있고, 서로 인접한 R6 내지 R10은 융합링을 형성할 수 있고,
단, A1 내지 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1 내지SiR5, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R1 내지 R5의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1 내지 R10은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환또는 비치환된 알케닐기, 치환 또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진 군에서 선택되는 것이고,
Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2는 치환 또는 비치환된 아릴기이고,
l 및 m은 1 내지 4 사이의 정수이고, 이 때, l 및 m이 2 이상인 경우, 각각의 반복단위는 상이할 수 있다.)
A1 내지 A5 중에서 선택된 적어도 어느 하나 이상이 N을 포함하는 경우, 또는 A6 내지 A10 중에서 선택된 적어도 어느 하나 이상이 N을 포함하는 경우, LUMO(Lowest unoccupied molecular orbital) 에너지 준위를 낮추고 화합물의 전자 친화도를 높여 전자의 수송 특성을 향상시킬 수 있다. 이로써, 유기 광전 소자의 구동에 필요한 전압을 낮출 수 있게 되어 소자의 발광 효율을 향상시킬 수 있는 장점이 있다.
또한, Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2는 치환 또는 비치환된 아릴기인 경우, 상기 아릴은 탄소수 6 내지 50의 아릴인 것으로, 페닐과 같은 단환식 아릴 또는 나프틸, 안트라세닐, 페난트레닐, 파이레닐. 페릴레닐, 피레닐 등의 다환식 아릴을 사용하여 유기 광전 소자의 발광층으로 매우 유용하게 사용될 수 있다.
또한, 상기 l 및 m은 각각 독립적으로 2인 경우, 박막의 결정성을 낮춰 비정질 구조를 형성하여 유기 광전 소자의 열적 안정성을 보다 개선할 수 있다.
이에, 상기 본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 하기 화학식 2로 표시되는 것을 사용하는 것이 좋다.
[화학식 2]
(상기 화학식 2에서,
A1, A3, A5, A6 내지 A15는 서로 같거나 다른 것으로, 각각 독립적으로 CR1, CR3, CR5, CR6 내지 CR15, SiR1, SiR3, SiR5, SiR6 내지 SiR15, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R6 내지 R10 은 융합링을 형성할 수 있고, 서로 인접한 R11 내지 R15는 융합링을 형성할 수 있고,
단, A1, A3, 및 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1, SiR3, SiR5, 및 N으로 이루어진 군에서 선택되는 것을 포함하고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A11 내지 A15 중에서 선택된 적어도 어느 하나 이상은 SiR11 내지 SiR15, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R11 내지 R15의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1, R3, R5, R6 내지 R15은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환 또는 비치환된 알케닐기, 치환또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진 군에서 선택되는 것이고,
Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2 및 Ar3는 서로 같거나 다른 것으로, 각각 독립적으로 치환 또는 비치환된 아릴기이다.)
상기 A1, A3, 및 A5 중에서 선택된 적어도 어느 하나 이상은 N을 포함하고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 N을 포함하고, A11 내지 A15 중에서 선택된 적어도 어느 하나 이상은 N을 포함하는 것이 좋다.
상기 화학식 2에서 상기 A1, A3, 및 A5 중 어느 하나가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 화학식 2에서 상기 A3가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 퀴놀리닐기 또는 이소퀴놀리닐기는 2번 또는 3번 위치에서 Ar1과 결합될 수 있다.
또한, Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2 및 Ar3는 서로 같거나 다른 것으로, 각각 독립적으로 치환 또는 비치환된 아릴기인 경우, 상기 아릴은 탄소수 6 내지 50의 아릴인 것으로, 페닐과 같은 단환식 아릴 또는 나프틸, 안트라세닐, 페난트레닐, 파이레닐. 페릴레닐, 피레닐 등의 다환식 아릴을 사용하여 유기 광전 소자의 발광층으로 매우 유용하게 사용될 수 있다.
한편, 상기 화학식 1의 R1 내지 R10과 화학식 2의 R1, R3, R5, R6 내지 R15이 치환 또는 비치환된 아릴기, 또는 치환 또는 비치환된 아릴렌기인 경우, 상기 아릴은 탄소수 6 내지 50의 아릴인 것이다. 특히, 페닐, 비페닐, 터페닐, 스티렌 등의 단환식 아릴 또는 나프틸, 안트라세닐, 페난트레닐, 파이레닐. 페릴레닐, 피레닐 등의 다환식 아릴을 사용하여 유기 광전 소자의 발광층으로 매우 유용하게 사용될 수 있다.
상기 화학식 1에서 서로 인접한 R1 내지 R5는 융합링을 형성할 수 있고, 서로 인접한 R6 내지 R10은 융합링을 형성할 수 있다. 또한, 상기 화학식 2에서 상기 서로 인접한 R6 내지 R10 은 융합링을 형성할 수 있고, 서로 인접한 R11 내지 R15는 융합링을 형성할 수 있다. 이와 같이 융합링을 형성하는 경우, 상기 화학식 1에서 융합링을 형성한 A1 내지 A5을 포함하는 고리 및 융합링을 형성한 A6 내지 A10 을 포함하는 고리와, 상기 화학식 2에서 융합링을 형성한 A6 내지 A10 을 포함하는 고리 및 융합링을 형성한 A11 내지 A15 을 포함하는 고리는 치환 또는 비치환된 헤테로 고리기일 수 있다.
상기 헤테로고리기는 티오펜기, 퓨란기, 피롤기, 이미다졸릴기, 티아졸릴기, 옥사졸릴기, 옥사디아졸릴기, 트리아졸릴기, 카바졸기, 피리디닐기, 피라다진기, 퀴놀리닐기, 이소퀴놀리닌기, 아크리딜기, 이미다조피리디닐기, 및 이미다조피리미디닐기로 이루어진 군에서 선택되는 것을 사용할 수 있다.
특히, 상기 이미다졸릴기 또는 트리아졸릴기의 질소(N) 원소에 결합되는 치환기는 치환 또는 비치환된 메틸기, 에틸기, 프로필기, 이소프로필기, 부틸기, 터셔리-부틸기, 펜틸기, 헥실기, 헵틸기 등과 같은 알킬기 치환 또는 비치환된 사이클로펜틸기, 사이클로헥실기 등과 같은 사이클로알킬기 치환 또는 비치환된 페닐기, 비페닐기, 나프틸기 등과 같은 아릴기 및 치환 또는 비치환된 헤테로고리기로 이루어진 군에서 선택되는 것을 보다 바람직하게 사용할 수 있다. 이 때, 상기 헤테로고리기는 피리딜기, 비피리딜기, 퀴놀릴기, 이소퀴놀릴기 등과 같은 헤테로아릴기인 것이 바람직하다.
상술한 상기 화학식 1과 화학식 2로 표현되는 신규 화합물에 치환될 수 있는 다양한 치환기는 본 발명의 일 구현예에 따른 유기 광전 소자용 화합물의 근본적인 물성을 변화시키지는 않는다.
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 3 내지 화학식 17로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 3] [화학식 4] [화학식 5]
[화학식 6] [화학식 7] [화학식 8]
[화학식 9] [화학식 10] [화학식 11]
[화학식 12] [화학식 13] [화학식 14]
[화학식 15] [화학식 16] [화학식 17]
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 18 내지 화학식 24로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 18] [화학식 19]
[화학식 20] [화학식 21]
[화학식 22] [화학식 23]
[화학식 24]
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 25 내지 화학식 31로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 25] [화학식 26]
[화학식 27] [화학식 28]
[화학식 29] [화학식 30]
[화학식 31]
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 32 내지 화학식 52로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 32] [화학식 33]
[화학식 34] [화학식 35]
[화학식 36] [화학식 37]
[화학식 38] [화학식 39]
[화학식 40] [화학식 41]
[화학식 42] [화학식 43]
[화학식 44] [화학식 45]
[화학식 46] [화학식 47]
[화학식 48] [화학식 49]
[화학식 50] [화학식 51]
[화학식 52]
본 명세서에 있어서, 별도의 정의가 없는 한, "알킬"이라 함은 탄소수 1 내지 50의 알킬, 보다 바람직하기로는 탄소수 1 내지 15의 알킬을 의미하고 "알콕시"라 함은 탄소수 1 내지 50의 알콕시, 보다 바람직하기로는 탄소수 1 내지 15의 알콕시를 의미하고 "알케닐"이라 함은 탄소수 2 내지 50의 알케닐, 보다 바람직하기로는 탄소수 2 내지 15의 알케닐을 의미하고 "사이클로알킬"이라 함은 탄소수 3 내지 50의 사이클로알킬, 보다 바람직하기로는 탄소수 3 내지 15의 사이클로알킬을 의미하고 "아릴"이라 함은 탄소수 6 내지 50의 아릴, 보다 바람직하기로는 탄소수 6 내지 25의 아릴을 의미하며 "헤테로고리기"라 함은 탄소수 1 내지 50의 헤테로고리기, 보다 바람직하기로는 탄소수 1 내지 25의 헤테로고리기를 의미한다.
특히, 본 명세서에서 "헤테로고리기"란 별도의 정의가 없는 한, 상기 헤테로 원자를 포함하는 탄소수 3 내지 50의 헤테로아릴기, 탄소수 1 내지 50의 헤테로사이클로알킬기, 탄소수 1 내지 50의 헤테로사이클로알케닐기, 탄소수 1 내지 50의 헤테로사이클로알키닐기 또는 이들의 융합 고리인 것을 의미한다. 상기 헤테로고리기는 상기한 헤테로 원자를 1 내지 20 개, 보다 구체적으로는 1 내지 15 개를 포함하는 것이 좋다.
본 명세서에서 별도의 정의가 없는 한, "에스테르"란 COOR로 표시되는 것을 의미하고 "카르보닐"이란 -COR'로 표시되는 것을 의미한다. 여기서 R, 및 R'은 각각 독립적으로 수소, 탄소수 1 내지 10의 알킬기, 탄소수 6 내지 20의 아릴기, 탄소수 3 내지 20의 사이클로알킬기, 탄소수 2 내지 10의 알케닐기, 탄소수 2 내지 10의 알키닐기, 또는 이들의 조합인 것이다.
본 명세서에서 "치환"이란 별도의 정의가 없는 한, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 탄소수 1 내지 10의 알킬기, 탄소수 1 내지 10의 알콕시기, 탄소수 2 내지 10의 알케닐기, 탄소수 2 내지 10의 알키닐기, 탄소수 3 내지 10의 사이클로알킬기, 탄소수 6 내지 20의 아릴기임.)
또한, 본 명세서에서 "헤테로 원자"란 별도의 정의가 없는 한, N, O, S, P, Se, 및 Si로 이루어진 군에서 선택되는 것을 의미한다.
또한, 본 명세서에서 "헤테로"란 별도의 정의가 없는 한, 하나의 고리내에 상기한 헤테로 원자를 1 내지 3개 함유하고, 나머지는 탄소인 것을 의미한다.
본 발명의 일 구현예는 아릴기 및 헤테로고리기가 순서대로 반복되는 구조를 가지는 하기 화학식 1로 표시되는 유기 광전 소자용 화합물을 제공한다.
[화학식1]
(상기 화학식 1에서 A1 내지 A10은 서로 같거나 다른 것으로, 각각 독립적으로 CR1 내지 CR10, SiR1 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R1 내지 R5는 융합링을 형성할 수 있고, 서로 인접한 R6 내지 R10은 융합링을 형성할 수 있고,
단, A1 내지 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1 내지SiR5, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R1 내지 R5의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1 내지 R10은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환또는 비치환된 알케닐기, 치환 또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진 군에서 선택되는 것이고,
Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2는 치환 또는 비치환된 아릴기이고,
l 및 m은 1 내지 4 사이의 정수이고, 이 때, l 및 m이 2 이상인 경우, 각각의 반복단위는 상이할 수 있다.)
A1 내지 A5 중에서 선택된 적어도 어느 하나 이상이 N을 포함하는 경우, 또는 A6 내지 A10 중에서 선택된 적어도 어느 하나 이상이 N을 포함하는 경우, LUMO(Lowest unoccupied molecular orbital) 에너지 준위를 낮추고 화합물의 전자 친화도를 높여 전자의 수송 특성을 향상시킬 수 있다. 이로써, 유기 광전 소자의 구동에 필요한 전압을 낮출 수 있게 되어 소자의 발광 효율을 향상시킬 수 있는 장점이 있다.
또한, Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2는 치환 또는 비치환된 아릴기인 경우, 상기 아릴은 탄소수 6 내지 50의 아릴인 것으로, 페닐과 같은 단환식 아릴 또는 나프틸, 안트라세닐, 페난트레닐, 파이레닐. 페릴레닐, 피레닐 등의 다환식 아릴을 사용하여 유기 광전 소자의 발광층으로 매우 유용하게 사용될 수 있다.
또한, 상기 l 및 m은 각각 독립적으로 2인 경우, 박막의 결정성을 낮춰 비정질 구조를 형성하여 유기 광전 소자의 열적 안정성을 보다 개선할 수 있다.
이에, 상기 본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 하기 화학식 2로 표시되는 것을 사용하는 것이 좋다.
[화학식 2]
(상기 화학식 2에서,
A1, A3, A5, A6 내지 A15는 서로 같거나 다른 것으로, 각각 독립적으로 CR1, CR3, CR5, CR6 내지 CR15, SiR1, SiR3, SiR5, SiR6 내지 SiR15, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R6 내지 R10 은 융합링을 형성할 수 있고, 서로 인접한 R11 내지 R15는 융합링을 형성할 수 있고,
단, A1, A3, 및 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1, SiR3, SiR5, 및 N으로 이루어진 군에서 선택되는 것을 포함하고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A11 내지 A15 중에서 선택된 적어도 어느 하나 이상은 SiR11 내지 SiR15, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R11 내지 R15의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,
상기 R1, R3, R5, R6 내지 R15은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 니트릴기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알킬렌기, 치환 또는 비치환된 알콕시기, 치환 또는 비치환된 알케닐기, 치환또는 비치환된 알케닐렌기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 알키닐렌기, 치환 또는 비치환된 사이클로알킬기, 치환 또는 비치환된 사이클로알킬렌기, 치환 또는 비치환된 아릴기, 및 치환 또는 비치환된 아릴렌기로 이루어진 군에서 선택되는 것이고,
Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2 및 Ar3는 서로 같거나 다른 것으로, 각각 독립적으로 치환 또는 비치환된 아릴기이다.)
상기 A1, A3, 및 A5 중에서 선택된 적어도 어느 하나 이상은 N을 포함하고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 N을 포함하고, A11 내지 A15 중에서 선택된 적어도 어느 하나 이상은 N을 포함하는 것이 좋다.
상기 화학식 2에서 상기 A1, A3, 및 A5 중 어느 하나가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 화학식 2에서 상기 A3가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기일 수 있다.
상기 퀴놀리닐기 또는 이소퀴놀리닐기는 2번 또는 3번 위치에서 Ar1과 결합될 수 있다.
또한, Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2 및 Ar3는 서로 같거나 다른 것으로, 각각 독립적으로 치환 또는 비치환된 아릴기인 경우, 상기 아릴은 탄소수 6 내지 50의 아릴인 것으로, 페닐과 같은 단환식 아릴 또는 나프틸, 안트라세닐, 페난트레닐, 파이레닐. 페릴레닐, 피레닐 등의 다환식 아릴을 사용하여 유기 광전 소자의 발광층으로 매우 유용하게 사용될 수 있다.
한편, 상기 화학식 1의 R1 내지 R10과 화학식 2의 R1, R3, R5, R6 내지 R15이 치환 또는 비치환된 아릴기, 또는 치환 또는 비치환된 아릴렌기인 경우, 상기 아릴은 탄소수 6 내지 50의 아릴인 것이다. 특히, 페닐, 비페닐, 터페닐, 스티렌 등의 단환식 아릴 또는 나프틸, 안트라세닐, 페난트레닐, 파이레닐. 페릴레닐, 피레닐 등의 다환식 아릴을 사용하여 유기 광전 소자의 발광층으로 매우 유용하게 사용될 수 있다.
상기 화학식 1에서 서로 인접한 R1 내지 R5는 융합링을 형성할 수 있고, 서로 인접한 R6 내지 R10은 융합링을 형성할 수 있다. 또한, 상기 화학식 2에서 상기 서로 인접한 R6 내지 R10 은 융합링을 형성할 수 있고, 서로 인접한 R11 내지 R15는 융합링을 형성할 수 있다. 이와 같이 융합링을 형성하는 경우, 상기 화학식 1에서 융합링을 형성한 A1 내지 A5을 포함하는 고리 및 융합링을 형성한 A6 내지 A10 을 포함하는 고리와, 상기 화학식 2에서 융합링을 형성한 A6 내지 A10 을 포함하는 고리 및 융합링을 형성한 A11 내지 A15 을 포함하는 고리는 치환 또는 비치환된 헤테로 고리기일 수 있다.
상기 헤테로고리기는 티오펜기, 퓨란기, 피롤기, 이미다졸릴기, 티아졸릴기, 옥사졸릴기, 옥사디아졸릴기, 트리아졸릴기, 카바졸기, 피리디닐기, 피라다진기, 퀴놀리닐기, 이소퀴놀리닌기, 아크리딜기, 이미다조피리디닐기, 및 이미다조피리미디닐기로 이루어진 군에서 선택되는 것을 사용할 수 있다.
특히, 상기 이미다졸릴기 또는 트리아졸릴기의 질소(N) 원소에 결합되는 치환기는 치환 또는 비치환된 메틸기, 에틸기, 프로필기, 이소프로필기, 부틸기, 터셔리-부틸기, 펜틸기, 헥실기, 헵틸기 등과 같은 알킬기 치환 또는 비치환된 사이클로펜틸기, 사이클로헥실기 등과 같은 사이클로알킬기 치환 또는 비치환된 페닐기, 비페닐기, 나프틸기 등과 같은 아릴기 및 치환 또는 비치환된 헤테로고리기로 이루어진 군에서 선택되는 것을 보다 바람직하게 사용할 수 있다. 이 때, 상기 헤테로고리기는 피리딜기, 비피리딜기, 퀴놀릴기, 이소퀴놀릴기 등과 같은 헤테로아릴기인 것이 바람직하다.
상술한 상기 화학식 1과 화학식 2로 표현되는 신규 화합물에 치환될 수 있는 다양한 치환기는 본 발명의 일 구현예에 따른 유기 광전 소자용 화합물의 근본적인 물성을 변화시키지는 않는다.
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 3 내지 화학식 17로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 3] [화학식 4] [화학식 5]
[화학식 6] [화학식 7] [화학식 8]
[화학식 9] [화학식 10] [화학식 11]
[화학식 12] [화학식 13] [화학식 14]
[화학식 15] [화학식 16] [화학식 17]
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 18 내지 화학식 24로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 18] [화학식 19]
[화학식 20] [화학식 21]
[화학식 22] [화학식 23]
[화학식 24]
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 25 내지 화학식 31로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 25] [화학식 26]
[화학식 27] [화학식 28]
[화학식 29] [화학식 30]
[화학식 31]
본 발명의 일 구현예에 따른 유기 광전 소자용 화합물은 보다 구체적으로, 하기 화학식 32 내지 화학식 52로 표시되는 화합물을 사용할 수 있다. 그러나 본 발명의 화합물이 이에 한정되는 것은 아니다.
[화학식 32] [화학식 33]
[화학식 34] [화학식 35]
[화학식 36] [화학식 37]
[화학식 38] [화학식 39]
[화학식 40] [화학식 41]
[화학식 42] [화학식 43]
[화학식 44] [화학식 45]
[화학식 46] [화학식 47]
[화학식 48] [화학식 49]
[화학식 50] [화학식 51]
[화학식 52]
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
삭제
상기와 같은 화합물을 포함하는 유기광전소자용 화합물은 정공과 전자의 수송능력이 우수하여, 적절한 도펀트와 함께 발광 호스트로서의 역할도 할 수 있다. 특히, 상기 도펀트로는 환원성 도펀트인 것이 좋은 바, 보다 구체적으로 상기 환원성 도펀트는 알카리 금속, 알칼리토류 금속, 희토류 금속, 알카리 금속의 산화물, 알카리 금속의 할로겐화물, 알카리 금속의 유기 착체, 알카리토류 금속의 산화물, 알카리토류 금속의 할로겐화물, 알카리토류 금속의 유기 착체, 희토류 금속의 산화물, 희토류 금속의 할로겐화물, 및 희토류 금속의 유기 착체로 이루어진 군에서 선택되는 것을 사용할 수 있다.
이러한 본 발명의 일 구현예에 따른 유기광전소자용 화합물은 유기박막층에 사용되어 유기광전소자의 효율 특성을 향상시키며, 구동전압을 낮출 수 있다. 또한, 수명 특성을 향상시킬 수 있다.
이에 따라 본 발명의 일 구현예는 상기 유기광전소자용 화합물을 포함하는 유기광전소자를 제공한다. 이 때, 상기 유기광전소자라 함은 유기발광소자, 유기 태양 전지, 유기 트랜지스터, 유기 감광체 드럼, 유기 메모리 소자 등을 의미한다. 특히, 유기 태양 전지의 경우에는 본 발명의 일 구현예에 따른 유기광전소자용 화합물이 전극이나 전극 버퍼층에 포함되어 양자 효율을 증가시키며, 유기 트랜지스 터의 경우에는 게이트, 소스-드레인 전극 등에서 전극 물질로 사용될 수 있다.
이하에서는 유기광전소자에 대하여 구체적으로 설명한다.
본 발명의 다른 일 구현예는 양극, 음극 및 상기 양극과 음극 사이에 개재되는 적어도 한 층 이상의 유기 박막층을 포함하는 유기광전소자에 있어서, 상기 유기 박막층 중 적어도 어느 한 층은 본 발명의 일 구현예에 따른 유기광전소자용 화합물을 포함하는 유기광전소자를 제공한다.
상기 유기광전소자용 화합물을 포함할 수 있는 유기박막층으로는 발광층, 정공수송층, 정공주입층, 정공저지층, 전자수송층, 전자주입층, 전자저지층, 또는 이들이 조합된 어느 하나 이상의 층을 포함할 수 있는 바, 이 중에서 적어도 어느 하나의 층은 본 발명에 따른 유기광전소자용 화합물을 포함한다. 특히, 발광층, 정공수송층, 정공주입층, 전자수송층, 전자주입층, 또는 이들이 조합된 어느 하나 이상의 층에 본 발명의 일 구현예에 따른 유기광전소자용 화합물을 포함할 수 있다.
도 1 내지 도 5는 본 발명의 일 구현예에 따라 제조된 신규한 유기광전소자용 화합물을 이용한 유기 발광 소자의 단면도이다.
도 1 내지 도 5를 참조하면, 본 발명의 일 구현예에 따른 유기광전소자(100, 200, 300, 400, 및 500)는 양극 (120), 음극 (110), 및 이 양극과 음극 사이에 개재된 적어도 1 층의 유기박막층 (105)을 포함하는 구조를 갖는다.
상기 양극(120)은 양극 물질을 포함하며, 이 양극 물질로는 통상 유기 박막층으로 정공주입이 원활할 수 있도록 일함수가 큰 물질이 바람직하다. 본 발명에서 사용될 수 있는 양극 물질의 구체적인 예로는 니켈, 백금, 바나듐, 크롬, 구리, 아연, 금 등과같은 금속 및 이들의 합금 아연산화물, 인듐산화물, 인듐주석산화물(ITO), 인듐아연산화물(IZO) 등과 같은 금속 산화물 ZnO와 Al 또는 SnO2와 Sb와 같은 금속과 산화물의 조합 폴리(3-메틸티오펜), 폴리[3,4-(에틸렌-1,2-디옥시)티오펜](polyehtylenedioxythiophene: PEDT), 폴리피롤, 폴리아닐린 등과 같은 전도성 고분자 등을 사용할 수 있으나, 이에 한정되는 것은 아니다.
상기 음극(110)은 음극 물질을 포함하여, 이 음극 물질로는 통상 유기박막층으로 전자주입이 용이하도록 일 함수가 작은 물질인 것이 바람직하다. 음극 물질의 구체적인 예로는 마그네슘, 칼슘, 나트륨, 칼륨, 타이타늄, 인듐, 이트륨, 리튬, 가돌리늄, 알루미늄, 은, 주석, 납, 세슘, 바륨 등과 같은 금속 및 이들의 합금 LiF/Al, Liq/Al, LiO2/Al, LiF/Ca, LiF/Al, BaF2/Ca 등과 같은 다층 구조 물질 등을 사용할 수 있으나, 이에 한정되는 것은 아니다.
먼저 도 1을 참조하면, 도 1은 유기 박막층(105)으로서 발광층(130)만이 존재하는 유기광전소자(100)를 나타낸 것으로, 상기 유기박막층(105)은 발광층(130)만으로 존재할 수 있다.
도 2를 참조하면, 도 2는 유기박막층(105)으로서 전자수송층을 포함하는 발광층(230)과 정공수송층(140)이 존재하는 2 층형 유기광전소자(200)를 나타낸 것으로서, 유기박막층(105)은 발광층(230) 및 정공 수송층(140)을 포함하는 2층형일 수 있다. 이 경우 발광층(130)은 전자 수송층의 기능을 하며, 정공 수송층(140)은 ITO와 같은 투명전극과의 접합성 및 정공수송성을 향상시키는 기능을 한다.
도 3을 참조하면, 도 3은 유기박막층(105)으로서 전자수송층(150), 발광 층(130), 및 정공수송층(140)이 존재하는 3 층형 유기광전소자(300)를 나타낸 것으로서, 상기 유기박막층(105)에서 발광층(130)은 독립된 형태로 되어 있고, 전자수송성이나 정공수송성이 우수한 막 (전자수송층(150) 및 정공수송층(140))을 별도의 층으로 쌓은 형태를 나타내고 있다.
도 4를 참조하면, 도 4는 유기박막층(105)으로서 전자주입층(160), 발광층(130), 정공수송층(140), 및 정공주입층(170)이 존재하는 4 층형 유기광전소자(400)를 나타낸 것으로서, 상기 정공주입층(170)은 양극으로 사용되는 ITO와의 접합성을 향상시킬 수 있다.
도 5를 참조하면, 도 5는 유기박막층(105)으로서 전자주입층(160), 전자수송층(150), 발광층(130), 정공수송층(140), 및 정공주입층(170)과 같은 각기 다른 기능을 하는 5 개의 층이 존재하는 5 층형 유기광전소자(500)를 나타낸 것으로서, 상기 유기광전소자(500)는 전자주입층(160)을 별도로 형성하여 저전압화에 효과적이다.
상기에서 설명한 유기 발광 소자는, 기판에 양극을 형성한 후, 진공증착법(evaporation), 스퍼터링(sputtering), 플라즈마 도금, 이온도금 등과 같은 건식성막법 또는 스핀코팅(spin coating), 침지법(dipping), 유동코팅법(flow coating) 등과 같은 습식성막법 등으로 유기박막층을 형성한 후, 그 위에 음극을 형성하여 제조할 수 있다.
본 발명의 또 다른 일 구현예에 따르면, 상기 유기광전소자를 포함하는 표시장치를 제공한다.
이하에서는 본 발명의 구체적인 실시예들을 제시한다. 다만, 하기에 기재된 실시예들은 본 발명을 구체적으로 예시하거나 설명하기 위한 것에 불과하며, 이로서 본 발명이 제한되어서는 아니된다.
유기광전소자용 화합물의 합성
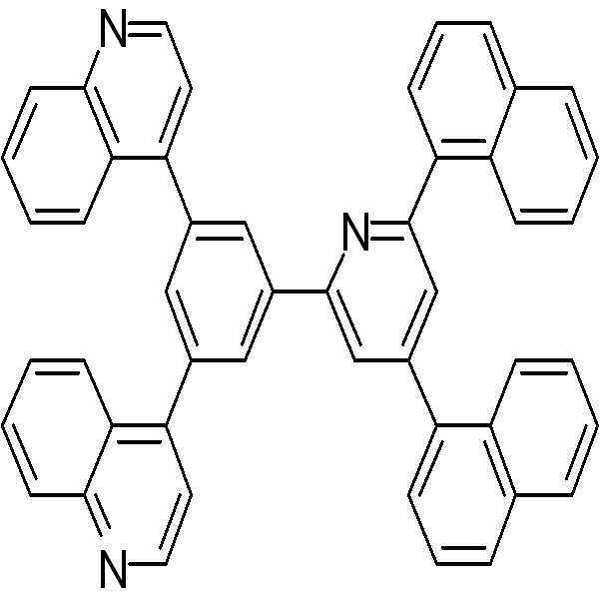
실시예 1: 화학식 28 화합물의 합성
본 발명의 유기광전소자용 화합물의 보다 구체적인 예로서 제시된 상기 화학식 28의 화합물은 아래의 반응식과 같은 4 단계를 통하여 합성되었다.
제 1단계 중간체 생성물(A)의 합성
[반응식 1]
트리브로모벤젠(tribromobenzene) 20 g (63.5 mmol), 퀴놀린-3-보로닉산 (quinoline-3-boronic acid) 24.2 g (139.8 mmol), 테트라키스(트리페닐포스핀)팔라듐(0) (tetrakis(triphenylphosphine)palladium(0)) 7.4 g (6.4 mmol) 및 탄산칼륨 (potassium carbonate) 52.7 g (381.2 mmol)을 테트라하이드로퓨란/물 (tetrahydrofuran/H2O=3/1의 부피비) 800 ml에 녹인 후, 85 ℃에서 18 시간 동안 반응하였다. 수득한 반응물을 에틸아세테이트(ethylacetate)로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 13 g (Y=50 %)의 고체를 얻었다.
제 2단계 중간체 생성물(B)의 합성
[반응식 2]
2-6-디브로모-4-아이오도피리딘(2-6-dibromo-4-iodopyridine) 10 g (36.5 mmol)을 테트라하이드로퓨란(tetrahydrofuran) 500 ml에 녹인 후 78 ℃ 로 유지시켰다. 여기에 부틸리튬(n-butyllithium, 1.6 M solution) 22.8 ml (36.51 mmol)을 천천히 떨어뜨리며 가한 후 78 ℃에서 1 시간 동안 교반하였다. 상기 혼합물에 트리이소프로필보레이트(triisopropyl borate) 10.1 ml (43.8 mmol)을 넣고 교반하면서 천천히 상온으로 올리면서 18 시간 동안 반응시켰다. 상기 반응 혼합물에 소듐하이드록사이드 수용액(sodium hydroxide water solution)을 넣고 1 시간 동안 교반시킨 후 염산(hydrochloric acid)를 사용하여 전체 용액의 산도를 중성으로 조절하였다. 수득한 반응물을 에틸아세테이트(ethylacetate)로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 2.83 g (Y=40 %)의 고체를 얻었다.
제 3단계 중간체 생성물(C)의 합성
[반응식 3]
상기 1 단계에서 얻은 중간체 생성물 (A) 4.81 g (11.7 mmol), 상기 2 단계에서 얻은 중간체 (B) 2.21 g (11.52 mmol), 테트라키스(트리페닐포스핀)팔라듐(0) (tetrakis(triphenyl-phosphine)palladium(0)) 1.26 g (1.1 mmol) 및 탄산칼륨 (potassium carbonate) 4.52 g (32.7 mmol)을 테트라하이드로퓨란/물 (tetrahydrofuran/H2O=3/1의 부피비) 180 ml에 녹인 후 75 ℃에서 18 시간 동안 반응시켰다. 수득한 반응물을 에틸아세테이트(ethylacetate)로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 3.74 g (Y=68 %)의 고체를 얻었다.
제 4단계 화학식 28 화합물의 합성
[반응식 4]
상기 3 단계에서 제조된 중간체 생성물 (C) 3.74 g (7.82 mmol), 나프탈렌- 2-보로닉산(naphthalene-2-boronic acid) 2.96 g (17.2 mmol), 테트라키스(트리페닐포스핀)팔라듐(0) (tetrakis(triphenylphosphine)palladium(0)) 0.9 g (0.78 mmol), 및 탄산칼륨 (potassium carbonate) 6.48 g (46.9 mmol)을 테트라하이드로퓨란/물 (tetrahydrofuran/H2O=3/1의 부피비) 160 ml에 녹인 후, 85 ℃에서 3 시간 동안 반응하였다. 수득한 반응물을 클로로포름(chloroform)으로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 2 g (Y=39 %)의 고체를 얻었다.
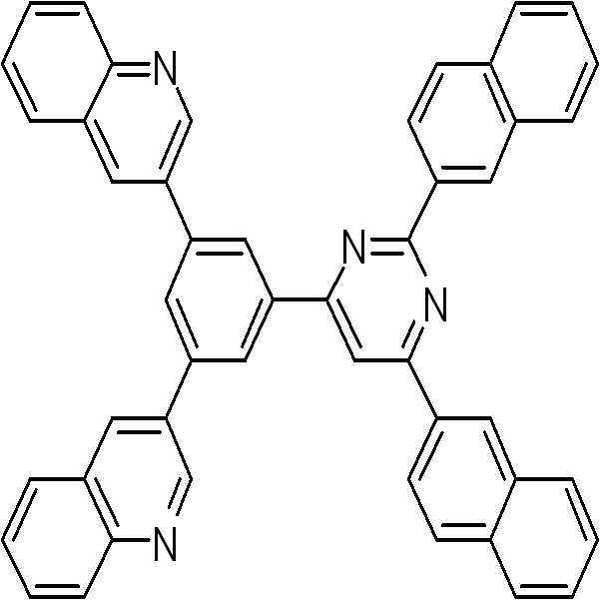
실시예 2: 화학식 30 화합물의 합성
본 발명의 유기광전소자용 화합물의 보다 구체적인 예로서 제시된 상기 화학식 30의 화합물은 아래의 반응식과 같은 3단계를 통하여 합성되었다.
제 1단계 중간체 생성물(D)의 합성
[반응식 5]
2,4,6-트리클로로피리미딘(2,4,6-Trichloropyrimidine) 20 g (109.04 mmol), 나프탈렌-2-보로닉산(naphthalene-2-boronic acid) 37.5 g (218.04 mmol), 테트라키스(트리페닐포스핀)팔라듐(0)(tetrakis(triphenylphosphine)palladium(0)) 6.3 g (5.45 mmol), 및 탄산칼륨(potassium carbonate) 60.3 g (436.29 mmol)을 테트라하이드로퓨란/물 (tetrahydrofuran/H2O=2/1의 부피비) 600 ml에 녹인 후 80 ℃에서 6 시간 동안 반응하였다. 수득한 반응물을 클로로포름(chloroform)으로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 29.5 g (Y=74 %)의 고체를 얻었다.
제 2단계 중간체 생성물(E)의 합성
[반응식 6]
상기 중간체 생성물 (A) 21.11 g (51.33 mmol) 과 비스피나콜레이토디보론(bis(pinacolato)diborone) 15.64 g (61.59 mmol), [1,1'-비스디페닐포스피노페로센]디클로로팔라듐(Ⅱ) ([1,1'-bis(diphenylphosphino)ferrocene]dichloropalladium(Ⅱ) complex with dichloromethane) 2.1 g (2.57 mmol), 포타슘아세테이트(potassium acetate) 15.1 g (153.98 mmol)을 톨루엔(toluene) 500 ml에 녹인 후 80 ℃에서 18 시간 동안 반응하였다. 수득한 반응물을 클로로포름(chloroform)으로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 21.9 g (Y=96 %)의 고체를 얻었다.
제 3단계 화학식 30 화합물의 합성
[반응식 7]
상기1 단계에서 제조된 중간체 생성물 (D) 3 g (8.18 mmol), 상기 2 단계에서 제조된 중간체 생성물 (E) 3.29 g (7.44 mmol), 테트라키스(트리페닐포스핀)팔라듐(0) (tetrakis(triphenylphosphine)palladium(0)) 0.43 g (0.37 mmol), 및 탄산칼륨 (potassium carbonate) 3.08 g (22.3 mmol)을 테트라하이드로퓨란/물 (tetrahydrofuran/H2O=3/1의 부피비) 120 ml에 녹인 후 85 ℃에서 18 시간 동안 반응하였다. 수득한 반응물을 클로로포름(chloroform)으로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 3.5 g (Y=70 %)의 고체를 얻었다.
실시예 3: 화학식 31 화합물의 합성
본 발명의 유기광전소자용 화합물의 보다 구체적인 예로서 제시된 상기 화학식 31의 화합물은 아래의 반응식과 같은 2단계를 통하여 합성되었다.
제 1단계 중간체 생성물(F)의 합성
[반응식 8]
상기 중간체 생성물 (F) 6 g(13.09 mmol), 2,4,6-트리클로로피리미딘(2,4,6-Trichloropyrimidine) 2.4 g(13.09 mmol), 테트라키스(트리페닐포스핀)팔라듐(0) (tetrakis(triphenylphosphine)palladium(0)) 0.38 g(0.33 mmol), 및 탄산칼륨(potassium carbonate) 3.62 g(26.19 mmol)을 테트라하이드로퓨란/물 (tetrahydrofuran/H2O=2/1의 부피비) 72 ml에 녹인 후80 ℃에서 6 시간 동안 반응하였다. 수득한 반응물을 클로로포름(chloroform)으로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 4.9 g (Y=78 %)의 고체를 얻었다.
제 2단계 화학식 31 화합물의 합성
[반응식 9]
상기 1 단계에서 제조된 중간체 생성물 (F) 4.9 g(10.22 mmol), 나프탈렌-2-보로닉산(naphthalene-2-boronic acid) 3.9 g(22.68 mmol), 테트라키스(트리페닐포스핀)팔라듐(0)(tetrakis(triphenylphosphine)palladium(0)) 0.6 g(0.52 mmol), 및 탄산칼륨(potassium carbonate) 5.7 g(41.24 mmol)을 테트라하이드로퓨란/물/톨루엔(tetrahydrofuran/H2O/toluene=3/2/2의 부피비) 350 ml에 녹인 후 110 ℃에서 24 시간 동안 반응하였다. 수득한 반응물을 클로로포름(chloroform)으로 추출한 후, 용매를 감압하여 제거하고 칼럼으로 분리한 후 건조시켜 3.9 g (Y=58 %)의 고체를 얻었다.
상기 실시예 1 내지 3에서 합성된 화합물에 대하여 핵자기공명분광법(1H NMR(nuclear magnetic resonance spectroscopy))로 분석한 결과를 각각 도 6 내지 도 8에 나타내었다.
유기발광소자의 제조
실시예 4
양극은 코닝(Corning) 15 Ω/cm2(1200Å) ITO 유리 기판을 50 mm x 50 mm xmm 크기로 잘라서 이소프로필 알코올과 순수물 속에서 각 5 분 동안 초음파 세정한 후, 30 분 동안 UV, 오존 세정하였다.
상기 유리 기판 상부에 진공도 65010-7 Pa의 조건으로,열 진공 증착하였다. 먼저, N1,N1'-(비페닐-4,4'-디일)비스(N1-(나프탈렌-2-일)-N4,N4-디페닐벤젠-1,4-디아민) (65nm) 정공 주입층을 증착하였고, N,N'-디(1-나프틸)-N,N'-디페닐벤지딘 (NPB) (40 nm) 정공수송층을 증착하였다.
이어서, N,N,N',N'-테트라키스(3,4-디메틸페닐)크라이센-6,12-디아민 5 중 량% 및 9-(3-(나프탈렌-1-일)페닐)-10-(나프탈렌-2-일)안트라센 95 중량%가 혼합된 발광층(25 nm)을 증착한 후, 상기 실시예 1에서 제조된 화합물(35 nm)을 전자수송층으로 증착시켰다.
상기 전자수송층 상부에 동일한 증착 조건으로 전자주입층으로서Liq를 0.5 nm의 두께로 진공 증착하고, Al를 100 nm의 두께로 진공 증착하여, Liq/Al 전극을 형성하였다. 제조된 유기발광소자의 구조는 도 5에 도시한 바와 같다.
실시예 5
전자수송층으로 본 발명의 실시예 2에서 제조된 화합물을 사용한 것을 제외하고는 상기 실시예 4와 동일하게 실시하여 유기 발광 소자를 제작하였다.
실시예 6
전자수송층으로 본 발명의 실시예 3에서 제조된 화합물을 사용한 것을 제외하고는 상기 실시예 4와 동일하게 실시하여 유기 발광 소자를 제작하였다.
비교예 1
전자수송층으로 전자수송물질인 Alq3를 사용한 점을 제외하고는 상기 실시예 4와 동일하게 실시하여 유기 발광 소자를 제작하였다.
물성 측정결과 및 분석
1) 구동 전압, 휘도, 발광 효율, 및 색좌표 측정
실시예 4 내지 6 및 비교예 1의 유기 발광 소자에 대하여 휘도계(Minolta Cs-1000A)로 1000 cd/m2의 밝기를 내는데 필요한 구동 전압(V), 및 색좌표를 측정하고, 동일 밝기의 전류 효율(cd/A) 및 전력 효율(lm/W)을 측정하여 표 1에 나타내었다.
2) 전압 변화에 따른 전류 밀도의 변화 측정
상기 실시예 4 내지 6, 및 비교예 1에서 제조된 각각의 유기발광소자에 대해, 전압을 0 V에서 14 V 까지 상승시키면서 전류-전압계(Keithley 2400)를 이용하여 단위소자에 흐르는 전류값을 측정하고, 측정된 전류값을 면적으로 나누어 전류 밀도를 측정하였다. 그 결과는 도 9에 나타내었다.
[표 1]
| 휘도 1000 cd/m2 | 색좌표 CIE | ||||
| 구동전압(V) | 전류효율(cd/A) | 전력효율(lm/W) | x | y | |
| 실시예 4 | 5.68 | 11.82 | 6.54 | 0.13 | 0.26 |
| 실시예 5 | 5.87 | 9.43 | 5.04 | 0.14 | 0.22 |
| 실시예 6 | 5.63 | 9.66 | 5.39 | 0.14 | 0.22 |
| 비교예 1 | 7.30 | 6.85 | 2.95 | 0.13 | 0.22 |
상기 표 1및 도 9를 참조하면, 실시예 4 내지 6의 유기 발광 소자는 비교예 1의 유기 발광 소자에 비하여 구동 전압이 현저히 낮음을 확인할 수 있다. 또한, 본 발명의 실시예 4 내지 6의 유기 발광 소자는 구동 전압이 현저히 낮은데 반해, 전류 효율 및 전력 효율은 월등히 높음을 확인할 수 있다.
이러한 유기 발광 소자의 측정 결과는, 발광층 내의 정공과 전자의 결합이 균형을 이루어 나타나는 결과로써, 실시예 4 내지 6에서 사용된 화합물이 일반적인 전자수송재료인 Alq3에 비하여, 우수한 전자 주입 특성 및 이동 특성을 가짐을 확인할 수 있었다.
본 발명의 단순한 변형 또는 변경은 모두 이 분야의 통상의 지식을 가진 자에 의하여 용이하게 실시될 수 있으며, 이러한 변형이나 변경은 모두 본 발명의 영역에 포함되는 것으로 볼 수 있다.
도 1 내지 도 5는 본 발명의 일 구현예에 따른 유기광전소자용 화합물을 포함하여 제조될 수 있는 유기광전소자에 대한 다양한 구현예들을 나타내는 단면도이다.
도 6은 본 발명의 실시예 1에 따라 제조된 화합물의 1H NMR 스펙트럼을 나타낸 것이다.
도 7은 본 발명의 실시예 2에 따라 제조된 화합물의 1H NMR 스펙트럼을 나타낸 것이다.
도 8은 본 발명의 실시예 3에 따라 제조된 화합물의 1H NMR 스펙트럼을 나타낸 것이다.
도 9는 본 발명의 실시예 4 내지 6 및 비교예 1에 따라 제조된 유기 발광 소자의 전압-전류 밀도 특성을 측정한 그래프이다.
<도면의 주요 부분에 대한 부호의 설명>
100 : 유기광전소자 : 음극
120 : 양극 : 유기 박막층
130 : 발광층 : 정공 수송층
150 : 전자수송층 : 전자주입층
170 : 정공주입층 : 발광층 + 전자수송층
Claims (19)
- 하기 화학식 2로 표시되는 것인 유기 광전 소자용 화합물:[화학식2](상기 화학식 2에서,A1, A3, A5, A6 내지 A15는 서로 같거나 다른 것으로, 각각 독립적으로 CR1, CR3, CR5, CR6 내지 CR15, SiR1, SiR3, SiR5, SiR6 내지SiR15, 및 N으로 이루어진 군에서 선택되는 것이고, 이 때, 상기 서로 인접한 R6 내지 R10 은 융합링을 형성할 수 있고, 서로 인접한 R11 내지 R15는 융합링을 형성할 수 있고,단, A1, A3, 및 A5 중에서 선택된 적어도 어느 하나 이상은 SiR1, SiR3, SiR5, 및 N으로 이루어진 군에서 선택되는 것을 포함하고, A6 내지 A10 중에서 선택된 적어도 어느 하나 이상은 SiR6 내지 SiR10, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R6 내지 R10의 적어도 어느 하나 이상의 원자가 헤테로 원자이고, A11 내지 A15 중에서 선택된 적어도 어느 하나 이상은 SiR11 내지 SiR15, 및 N으로 이루어진 군에서 선택되는 것을 포함하거나, 융합링을 이루는 서로 인접한 R11 내지 R15의 적어도 어느 하나 이상의 원자가 헤테로 원자이고,상기 R1, R3, R5, R6 내지 R15은 서로 같거나 다른 것으로, 각각 독립적으로 수소, 할로겐기, 시아노기, 니트로기, 아미드기, 카르보닐기, 에스테르기, 치환 또는 비치환된 알킬기, 치환 또는 비치환된 알콕시기, 치환또는 비치환된 알케닐기, 치환 또는 비치환된 알키닐기, 치환 또는 비치환된 사이클로알킬기, 및 치환 또는 비치환된 아릴기로 이루어진군에서 선택되는 것이고,Ar1은 치환 또는 비치환된 아릴렌기이고, Ar2 및 Ar3는 서로 같거나 다른 것으로, 각각 독립적으로 치환 또는 비치환된 아릴기이고,상기 A1, A3, 및 A5 중 어느 하나가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기임.)
- 제1항에 있어서,상기 화학식 2에서 상기 A3가 N을 포함하고, A6 내지 A10으로 이루어진 치환기와 A11 내지 A15으로 이루어진 치환기가 퀴놀리닐기 또는 이소퀴놀리닐기인 유기 광전 소자용 화합물.
- 제2항에 있어서,상기 퀴놀리닐기 또는 이소퀴놀리닐기는 퀴놀리닐기 또는 이소퀴놀리닐기의 2번 또는 3번 위치에서 Ar1과 결합되는 것인 유기 광전 소자용 화합물.
- 양극, 음극, 및 상기 양극과 음극 사이에 개재되는 적어도 한 층 이상의 유기 박막층을 포함하는 유기 광전 소자에 있어서,상기 유기 박막층 중 적어도 어느 한 층은 본 발명의 제1항에 따른 유기 광전 소자용 화합물을 포함하는 것인 유기 광전 소자.
- 제7항에 있어서,상기 유기 광전 소자용 화합물은 호스트 재료 또는 전하수송재료로 사용되는 것인 유기 광전 소자.
- 제7항에 있어서,상기 유기 박막층은 발광층, 정공수송층, 정공주입층, 전자수송층, 전자주입층, 및 이들의 조합으로 이루어진 군에서 선택되는 것인 유기 광전 소자.
- 제7항에 있어서,상기 유기 박막층 중 적어도 어느 한 층은 상기 유기 광전 소자용 화합물과 함께 환원성 도펀트를 더 포함하는 것인 유기 광전 소자.
- 제10항에 있어서,상기 환원성 도펀트는 알카리 금속, 알칼리토류 금속, 희토류 금속, 알카리 금속의 산화물, 알카리 금속의 할로겐화물, 알카리 금속의 유기 착체, 알카리토류 금속의 산화물, 알카리토류 금속의 할로겐화물, 알카리토류 금속의 유기 착체, 희토류 금속의 산화물, 희토류 금속의 할로겐화물, 및 희토류 금속의 유기 착체로 이루어진 군에서 선택되는 것인 유기 광전 소자.
- 제7항의 유기 광전 소자를 포함하는 것인 표시장치.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020080137223A KR101233377B1 (ko) | 2008-12-30 | 2008-12-30 | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| PCT/KR2009/007411 WO2010076986A2 (ko) | 2008-12-30 | 2009-12-10 | 신규한 유기 광전 소자용 화합물 및 이를 포함하는 유기 광전 소자 |
| EP09836307.0A EP2383323B1 (en) | 2008-12-30 | 2009-12-10 | Novel compounds for an organic photoelectric device, and organic photoelectric device comprising same |
| CN200980153457.3A CN102272263B (zh) | 2008-12-30 | 2009-12-10 | 有机光电装置用新化合物和包括该化合物的有机光电装置 |
| JP2011543417A JP5770637B2 (ja) | 2008-12-30 | 2009-12-10 | 新規な有機光電素子用化合物およびこれを含む有機光電素子 |
| US13/173,381 US8435648B2 (en) | 2008-12-30 | 2011-06-30 | Pyridinylene ring compound for organic optoelectronic device, organic light emitting diode including the same and display including the organic light emitting diode |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020080137223A KR101233377B1 (ko) | 2008-12-30 | 2008-12-30 | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20100078849A KR20100078849A (ko) | 2010-07-08 |
| KR101233377B1 true KR101233377B1 (ko) | 2013-02-18 |
Family
ID=42310315
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020080137223A KR101233377B1 (ko) | 2008-12-30 | 2008-12-30 | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US8435648B2 (ko) |
| EP (1) | EP2383323B1 (ko) |
| JP (1) | JP5770637B2 (ko) |
| KR (1) | KR101233377B1 (ko) |
| CN (1) | CN102272263B (ko) |
| WO (1) | WO2010076986A2 (ko) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9680108B2 (en) | 2014-06-11 | 2017-06-13 | Samsung Display Co., Ltd. | Organic light-emitting device |
| KR101770463B1 (ko) * | 2014-05-15 | 2017-08-23 | 주식회사 엘지화학 | 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| US10026906B2 (en) | 2015-01-12 | 2018-07-17 | Samsung Display Co., Ltd. | Condensed cyclic compound and organic light-emitting device including the same |
| US10062850B2 (en) | 2013-12-12 | 2018-08-28 | Samsung Display Co., Ltd. | Amine-based compounds and organic light-emitting devices comprising the same |
| US10147882B2 (en) | 2013-05-09 | 2018-12-04 | Samsung Display Co., Ltd. | Styrl-based compound and organic light emitting diode comprising the same |
| US10256416B2 (en) | 2013-07-01 | 2019-04-09 | Samsung Display Co., Ltd. | Compound and organic light-emitting device including the same |
| US10290811B2 (en) | 2014-05-16 | 2019-05-14 | Samsung Display Co., Ltd. | Organic light-emitting device |
| US10388882B2 (en) | 2013-03-04 | 2019-08-20 | Samsung Display Co., Ltd. | Anthracene derivatives and organic light emitting devices comprising the same |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101288557B1 (ko) * | 2008-12-24 | 2013-07-22 | 제일모직주식회사 | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| CN102574813B (zh) | 2009-08-21 | 2016-03-30 | 东曹株式会社 | 环状吖嗪衍生物和它们的制造方法、以及以它们作为构成成分的有机电致发光器件 |
| KR101387738B1 (ko) * | 2009-12-29 | 2014-04-22 | 제일모직주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| KR102158326B1 (ko) * | 2010-12-20 | 2020-09-21 | 주식회사 엘지화학 | 전자적 응용을 위한 전기활성 조성물 |
| KR101474800B1 (ko) * | 2011-08-19 | 2014-12-19 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| TWI727297B (zh) | 2011-08-25 | 2021-05-11 | 日商半導體能源研究所股份有限公司 | 發光元件,發光裝置,電子裝置,照明裝置以及新穎有機化合物 |
| JP6034146B2 (ja) * | 2011-11-11 | 2016-11-30 | 東ソー株式会社 | 含窒素縮環芳香族基を有する環状アジン化合物とその製造方法、及びそれらを構成成分とする有機電界発光素子 |
| JP6501771B2 (ja) * | 2014-06-11 | 2019-04-17 | 保土谷化学工業株式会社 | ピリミジン誘導体および有機エレクトロルミネッセンス素子 |
| JP6464944B2 (ja) * | 2014-07-03 | 2019-02-06 | 東ソー株式会社 | 環状アジン化合物、その製造方法、及びその用途 |
| KR102351957B1 (ko) * | 2014-07-10 | 2022-01-17 | 삼성디스플레이 주식회사 | 유기 발광 소자 및 이를 포함하는 유기 발광 표시 장치 |
| JP6387726B2 (ja) * | 2014-07-31 | 2018-09-12 | 東ソー株式会社 | N−トリアジルフェナジン化合物、その製造方法、およびその用途 |
| EP3147961A1 (en) * | 2015-09-28 | 2017-03-29 | Novaled GmbH | Organic electroluminescent device |
| EP3182478B1 (en) | 2015-12-18 | 2018-11-28 | Novaled GmbH | Electron injection layer for an organic light-emitting diode (oled) |
| EP3208861A1 (en) | 2016-02-19 | 2017-08-23 | Novaled GmbH | Electron transport layer comprising a matrix compound mixture for an organic light-emitting diode (oled) |
| EP3232490B1 (en) | 2016-04-12 | 2021-03-17 | Novaled GmbH | Organic light emitting diode comprising an organic semiconductor layer |
| EP3252841A1 (en) | 2016-05-30 | 2017-12-06 | Novaled GmbH | Organic light emitting diode comprising an organic semiconductor layer |
| EP3252837B1 (en) | 2016-05-30 | 2021-05-05 | Novaled GmbH | Organic light emitting diode comprising an organic semiconductor layer |
| EP3291319B1 (en) | 2016-08-30 | 2019-01-23 | Novaled GmbH | Method for preparing an organic semiconductor layer |
| WO2023137166A1 (en) * | 2022-01-14 | 2023-07-20 | Annexon, Inc. | Inhibitors of complement factors and uses thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20060096980A (ko) * | 2003-07-31 | 2006-09-13 | 미쓰비시 가가꾸 가부시키가이샤 | 화합물, 전하 수송 재료 및 유기 전계 발광 소자 |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4003824B2 (ja) * | 2001-07-11 | 2007-11-07 | 富士フイルム株式会社 | 発光素子 |
| JP4036041B2 (ja) * | 2002-06-24 | 2008-01-23 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子及び表示装置 |
| EP1549112A4 (en) * | 2002-09-20 | 2009-01-07 | Idemitsu Kosan Co | ORGANIC ELECTROLUMINESCENT ELEMENT |
| CN101638380A (zh) * | 2003-07-31 | 2010-02-03 | 三菱化学株式会社 | 化合物、电荷传输材料和有机电致发光元件 |
| JP4561221B2 (ja) * | 2003-07-31 | 2010-10-13 | 三菱化学株式会社 | 化合物、電荷輸送材料および有機電界発光素子 |
| JP4622433B2 (ja) * | 2003-10-06 | 2011-02-02 | 三菱化学株式会社 | 化合物、電子輸送材料および有機電界発光素子 |
| TWI428053B (zh) * | 2004-02-09 | 2014-02-21 | Idemitsu Kosan Co | Organic electroluminescent element |
| JP4992183B2 (ja) * | 2004-02-10 | 2012-08-08 | 三菱化学株式会社 | 発光層形成材料及び有機電界発光素子 |
| JP3779715B2 (ja) * | 2004-03-29 | 2006-05-31 | 正明 木村 | 容器内の米と水に対流状の連続した流れを起こし研ぎむらを無くした米研ぎ器。 |
| US7833632B2 (en) * | 2004-04-07 | 2010-11-16 | Idemitsu Kosan Co., Ltd. | Nitrogenous heterocycle derivative, and organic electroluminescent element employing the same |
| JP5109236B2 (ja) * | 2004-06-09 | 2012-12-26 | 三菱化学株式会社 | 正孔阻止材料及び有機電界発光素子 |
| JP4790260B2 (ja) * | 2004-12-22 | 2011-10-12 | 出光興産株式会社 | アントラセン誘導体を用いた有機エレクトロルミネッセンス素子 |
| WO2006067976A1 (ja) * | 2004-12-24 | 2006-06-29 | Pioneer Corporation | 有機化合物、電荷輸送材料および有機電界発光素子 |
| ES2637890T5 (es) * | 2004-12-28 | 2020-08-03 | Vestas Wind Sys As | Método de control de una turbina eólica conectada a una red de distribución de energía eléctrica |
| BRPI0611707A2 (pt) | 2005-06-29 | 2012-04-24 | Compumedics Ltd | conjunto de sensor com ponte condutiva |
| JP5167607B2 (ja) * | 2005-08-23 | 2013-03-21 | 三菱化学株式会社 | 電荷輸送材料、電荷輸送材料組成物及び有機電界発光素子 |
| US20090102361A1 (en) | 2005-08-31 | 2009-04-23 | Hodogaya Chemical Co., Ltd. | Compound having triazole ring structure substituted with pyridyl group and organic electroluminescent device |
| JP4878819B2 (ja) * | 2005-11-18 | 2012-02-15 | ケミプロ化成株式会社 | 新規なトリアジン誘導体およびそれを含む有機エレクトロルミネッセンス素子 |
| CN101331626B (zh) * | 2005-12-15 | 2011-08-17 | 出光兴产株式会社 | 有机电致发光元件用材料及使用其的有机电致发光元件 |
| TW200801513A (en) * | 2006-06-29 | 2008-01-01 | Fermiscan Australia Pty Ltd | Improved process |
| KR100903203B1 (ko) * | 2006-11-30 | 2009-06-18 | 에스에프씨 주식회사 | 안트라센 유도체 및 이를 채용한 유기전계발광소자 |
| JP2008147426A (ja) * | 2006-12-11 | 2008-06-26 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子 |
| KR101482772B1 (ko) * | 2007-04-12 | 2015-01-15 | 토소가부시키가이샤 | 페닐기 치환 1,3,5―트라이아진 화합물, 그 제조방법 및 이것을 구성 성분으로 하는 유기 전계발광소자 |
| JP2009228113A (ja) * | 2008-03-25 | 2009-10-08 | Tokyo Electron Ltd | ルテニウム膜の成膜方法 |
| JP5748948B2 (ja) * | 2008-10-03 | 2015-07-15 | 東ソー株式会社 | 1,3,5−トリアジン誘導体、その製造方法、及びこれを構成成分とする有機電界発光素子 |
-
2008
- 2008-12-30 KR KR1020080137223A patent/KR101233377B1/ko active IP Right Grant
-
2009
- 2009-12-10 CN CN200980153457.3A patent/CN102272263B/zh active Active
- 2009-12-10 WO PCT/KR2009/007411 patent/WO2010076986A2/ko active Application Filing
- 2009-12-10 EP EP09836307.0A patent/EP2383323B1/en active Active
- 2009-12-10 JP JP2011543417A patent/JP5770637B2/ja active Active
-
2011
- 2011-06-30 US US13/173,381 patent/US8435648B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20060096980A (ko) * | 2003-07-31 | 2006-09-13 | 미쓰비시 가가꾸 가부시키가이샤 | 화합물, 전하 수송 재료 및 유기 전계 발광 소자 |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10388882B2 (en) | 2013-03-04 | 2019-08-20 | Samsung Display Co., Ltd. | Anthracene derivatives and organic light emitting devices comprising the same |
| US10147882B2 (en) | 2013-05-09 | 2018-12-04 | Samsung Display Co., Ltd. | Styrl-based compound and organic light emitting diode comprising the same |
| US10256416B2 (en) | 2013-07-01 | 2019-04-09 | Samsung Display Co., Ltd. | Compound and organic light-emitting device including the same |
| US10062850B2 (en) | 2013-12-12 | 2018-08-28 | Samsung Display Co., Ltd. | Amine-based compounds and organic light-emitting devices comprising the same |
| KR101770463B1 (ko) * | 2014-05-15 | 2017-08-23 | 주식회사 엘지화학 | 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| US10290811B2 (en) | 2014-05-16 | 2019-05-14 | Samsung Display Co., Ltd. | Organic light-emitting device |
| US9680108B2 (en) | 2014-06-11 | 2017-06-13 | Samsung Display Co., Ltd. | Organic light-emitting device |
| US10026906B2 (en) | 2015-01-12 | 2018-07-17 | Samsung Display Co., Ltd. | Condensed cyclic compound and organic light-emitting device including the same |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2010076986A3 (ko) | 2010-08-26 |
| US8435648B2 (en) | 2013-05-07 |
| EP2383323A2 (en) | 2011-11-02 |
| US20110284832A1 (en) | 2011-11-24 |
| JP5770637B2 (ja) | 2015-08-26 |
| EP2383323A4 (en) | 2013-03-27 |
| WO2010076986A4 (ko) | 2010-10-28 |
| KR20100078849A (ko) | 2010-07-08 |
| EP2383323B1 (en) | 2017-02-15 |
| CN102272263B (zh) | 2014-12-10 |
| JP2012514324A (ja) | 2012-06-21 |
| WO2010076986A2 (ko) | 2010-07-08 |
| CN102272263A (zh) | 2011-12-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101233377B1 (ko) | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101288557B1 (ko) | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101174090B1 (ko) | 유기광전소자용 재료 및 이를 포함하는 유기광전소자 | |
| KR101288566B1 (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101506999B1 (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101387738B1 (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101297158B1 (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101257695B1 (ko) | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101247626B1 (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101311934B1 (ko) | 유기광전소자용 조성물 및 이를 이용한 유기광전소자 | |
| KR101212670B1 (ko) | 유기광전소자용 조성물, 이를 이용한 유기광전소자 및 이를 포함하는 표시장치 | |
| KR101233379B1 (ko) | 유기 광전 소자용 화합물 및 이를 포함하는 유기 광전 소자 | |
| KR101233369B1 (ko) | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101592085B1 (ko) | 신규한 화합물 및 이를 이용한 유기 전자 소자 | |
| KR20110043667A (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101233367B1 (ko) | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR20110079197A (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR101233375B1 (ko) | 신규한 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 | |
| KR20120013917A (ko) | 신규 화합물 | |
| CN112802969A (zh) | 有机光电子器件及显示器件 | |
| KR101233368B1 (ko) | 신규한 유기 광전 소자용 화합물 및 이를 포함하는 유기 광전 소자 | |
| KR101233376B1 (ko) | 유기광전소자 및 이를 포함하는 표시장치 | |
| KR20160131561A (ko) | 유기광전소자용 화합물, 이를 포함하는 유기광전소자, 및 표시장치 | |
| KR20140085400A (ko) | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20160119 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20170119 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20180122 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20190117 Year of fee payment: 7 |
|
| FPAY | Annual fee payment |
Payment date: 20200129 Year of fee payment: 8 |