KR101126030B1 - 사이토킨 및/또는 화학치료제 또는 방사선 치료와 연계하여면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을이용하여 면역계를 공동 상승 자극시키는 방법 - Google Patents
사이토킨 및/또는 화학치료제 또는 방사선 치료와 연계하여면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을이용하여 면역계를 공동 상승 자극시키는 방법 Download PDFInfo
- Publication number
- KR101126030B1 KR101126030B1 KR1020067000891A KR20067000891A KR101126030B1 KR 101126030 B1 KR101126030 B1 KR 101126030B1 KR 1020067000891 A KR1020067000891 A KR 1020067000891A KR 20067000891 A KR20067000891 A KR 20067000891A KR 101126030 B1 KR101126030 B1 KR 101126030B1
- Authority
- KR
- South Korea
- Prior art keywords
- deoxy
- immunostimulatory
- oligonucleotides
- substituted
- immunomeric
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2013—IL-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/117—Nucleic acids having immunomodulatory properties, e.g. containing CpG-motifs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55522—Cytokines; Lymphokines; Interferons
- A61K2039/55527—Interleukins
- A61K2039/55533—IL-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/10—X-ray therapy; Gamma-ray therapy; Particle-irradiation therapy
- A61N2005/1092—Details
- A61N2005/1098—Enhancing the effect of the particle by an injected agent or implanted device
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/17—Immunomodulatory nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/31—Combination therapy
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biotechnology (AREA)
- Animal Behavior & Ethology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Mycology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pulmonology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Radiation-Therapy Devices (AREA)
Abstract
본 발명은 환자의 암, 자가면역 장애, 천식, 호흡기 알레르기, 음식물 알레르기 및 감염성 질환의 치료를 포함하지만 이에 제한되지 않는 질환의 치료를 위해 사용되는 면역자극 화합물에 의해 유발된 면역 반응을 증진시키기 위한 최적화된 방법 및 조성물을 제공한다. 본 발명에 따른 최적화된 방법은 본 발명에 따른 면역자극 올리고누클레오티드 및 이뮤노머 화합물의 치료 효과와 사이토킨 면역치료 및/또는 화학치료제 및/또는 방사선의 치료 효과간의 공동 상승 작용을 제공한다.
Description
본 발명은 치료제로서 이뮤노머 화합물 및 면역자극 올리고누클레오티드의 용도에 관한 것이다.
관련 문헌의 요약
최근, 몇몇 연구자들은 면역 치료 분야에서 면역자극제로서 올리고누클레오티드 사용의 유효성을 입증하였다. 포스포디에스테르 및 포스포로티오에이트 올리고누클레오티드가 면역 자극을 유발할 수 있다는 관찰은 이들 화합물을 치료적 기구로서 개발하는 데 관심을 갖게 하였다. 이러한 노력은 천연 디누클레오티드 CpG를 함유하는 포스포로티오에이트 올리고누클레오티드에 집중되었다. 구라모토(Kuramoto) 등의 문헌(Jpn. J. Cancer Res. 83:1128-1131 (1992))은 CpG 디누클레오티드를 포함하는 팔린드롬을 함유하는 포스포디에스테르 올리고누클레오티드가 인터페론-알파 및 감마의 합성을 유도할 수 있으며, 자연 살해 활성(natural kill activity)을 증진시킴을 교시하고 있다. 크리그(Krieg) 등의 문헌(Nature 371:546-549 (1995))은 포스포로티오에이트 CpG 함유 올리고누클레오티드가 면역자극성임을 개시하고 있다. 리앙(Liang) 등의 문헌(J. Clin. Invest. 98:1119-1129 (1996))은 이러한 올리고누클레오티드가 사람 B 세포를 활성화시킴을 개시하고 있다. 몰도베아누(Moldoveanu) 등의 문헌(et al., Vaccine 16:1216-124 (1998))은 CpG 함유 포스포로티오에이트 올리고누클레오티드가 인플루엔자 바이러스에 대해 면역 반응을 증진시킴을 교시하고 있다. 맥클러스키(McCluskie)와 데이비스(Davis)의 문헌(J. Immunol. 161:4463-4466 (1998))은 CpG 함유 올리고누클레오티드가 효능있는 애주번트로서 작용하여 B형 간염 표면 항원에 대해 면역 반응을 증진시킴을 교시하고 있다.
CpG 함유 포스포로티오에이트 올리고누클레오티드의 다른 변형체는 면역 반응의 조절제로서 작용하는 능력에 영향을 미칠 수 있다[참조예: Zhao et al., Biochem. Pharmacol. (1996) 51:173-182; Zhao et al., Biochem Pharmacol. (1996) 52:1537-1544; Zhao et al., Antisense Nucleic Acid Drug Dev. (1997) 7:495-502; Zhao et al., Bioorg. Med. Chem. Lett. (1999) 9:3453-3458; Zhao et al., Bioorg. Med. Chem. Lett. (2000) 10:1051-1054; Yu et al., Bioorg. Med. Chem. Lett. (2000) 10:2585-2588; Yu et al., Bioorg. Med. Chem. Lett. (2001) 11:2263-2267; 및 Kandimalla et al., Bioorg. Med. Chem. (2001) 9:807-813]. 미국 특허 제 6,426,334호는 이들 화합물의 항암제로서의 가능성을 보여주고 있다.
면역반응을 조절할 수 있는 또 다른 수단은 사이토킨의 치료학적 용도에 의한 것이다. 사이토킨은 면역계의 세포가 기타 세포간의 반응을 조절하기 위해 생산하는 가용성 분자이다. 따라서, 사이토킨은 체액성 및 세포성 면역의 조절제이다. T 세포가 어떻게 면역 반응을 매개하는지에 관한 이해는 당해 반응을 조절하기 위해 중요하다. CD4+ T 헬퍼(Th) 세포는 Th1 또는 Th2 경로를 따라 분화한다. Th1 경로는 세포 매개 면역을 생성시키는데 중요하고 예를 들어, γ-인터페론 및 인터류킨-2(IL-2)의 생산을 특징으로 한다. Th2 반응은 체액성 면역을 생성시키는데 중요하고 예를 들어, IL-4 및 IL-5의 생산을 특징으로 한다. Th1 반응은 감염, 예를 들어, 바이러스 감염에 대한 면역계 방어 및 신생물 세포의 제거를 위한 신체의 면역계 감시를 위해 중요한 것으로 공지되어 있다.
문헌[참조: Krieg, A., M. et al. (미국 특허 제6,429,199호) 및 Krieg, A., M. et al(미국 특허 제6,218,371호)]은 면역자극 CpG 올리고누클레오티드 및 사이토킨, 특히, GM-CSF의 동시투여를 교시하고 있다. 문헌[참조: Decker et al.(Experimental Hematology 28:558-565(2000)]은 IL-2와 CpG 올리고누클레오티드의 동시 투여가 B 만성 림프구(B-CLL) 세포에서 TNF-α 및 IL-6의 생산을 증가시키지만 정상 B-세포에서는 그렇지 않음을 입증하였다.
이들 보고는, 질환의 치료를 위해 면역자극 올리고누클레오티드의 치료학적 효과를 추가로 최적화하여 면역자극 올리고누클레오티드의 항암 활성을 증진시킬 필요가 있음을 명백하게 한다.
발명의 요약
본 발명은 환자의 암, 자가면역질환, 천식, 호흡기 알레르기, 음식물 알레르 기 및 감염성 질환의 치료에 국한되지 않으면서 이들 질환의 치료에 사용되는 면역자극 화합물에 의해 유발되는 면역반응을 증진시키기 위한 최적화된 방법, 조성물 및 치료 섭생을 제공한다. 본 발명에 따른 최적화 방법은 본 발명에 따른 면역자극 올리고누클레오티드의 치료 효과와 사이토킨 면역치료 및/또는 화학치료제의 치료 효과간에 공동 상승 작용을 제공한다. 최적으로 5'말단을 제공하는 면역자극 올리고누클레오티드의 변형은 이의 항암 활성을 급격하게 증진시킨다. 당해 올리고누클레오티드는 본원에서 하나 이상의 면역자극 올리고누클레오티드를 포함할 수 있는 이뮤노머로서 언급된다.
따라서, 제 1 양태에서, 본 발명은 화학치료제와 함께 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을 암 환자에게 투여하는 것을 포함하여 암 환자에서 암을 치료하기 위한 방법으로서, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물 및 화학치료제가 상승적 치료 효과를 생성시키는 방법을 제공한다.
추가의 양태에서, 본 발명은 환자에서 면역 반응을 상승 작용적으로 자극시키는 방법을 제공한다. 당해 방법은 본 발명에 따른 치료학적 상승 작용을 하는 유효량의 하나 이상의 이뮤노머 화합물 또는 면역자극 올리고누클레오티드 및 치료학적 상승 작용을 하는 유효량의 IL-2(및/또는 동일계에서 IL-2 생산을 유도하는 제제, 예를 들어, DNA 백신 또는 IL-2를 발현하는 발현 벡터)의 조합물을 환자에게 투여함을 포함하고, 이러한 조합물의 투여는 환자에서 사이토킨의 생산을 공동 상승 작용적으로 자극한다. 본 발명에 따라 상승 작용적으로 자극되는 바람직한 사이토킨은 IL-12 및 인터페론-γ (IFN-γ), IFN-α, IFN-ß 또는 이의 조합으로 이루어진 군으로부터 선택된다.
본 발명에 따른 "이뮤노머"는 올리고누클레오티드의 3' 말단에 직접 연결되거나 누클레오시드 연결을 통해 직접 연결되거나 작용기화된 누클레오염기 또는 당에서 직접 연결되거나 비-누클레오티드 링커를 통해 함께 간접적으로 연결된, 2개 이상의 올리고누클레오티드를 포함하는 임의의 화합물을 의미하고, 이뮤노머 화합물에 있어서 하나 이상의 올리고누클레오티드는 접근가능한 5'말단을 갖는 면역자극 올리고누클레오티드이다. 본 발명에 대해서, 면역자극 올리고누클레오티드는 하나 이상의 면역자극 CpG 디누클레오티드, 면역자극 도메인 또는 기타 면역자극 잔기를 포함하는 올리고누클레오티드이다. 본원에 사용된 바와 같이, 용어 "접근가능한 5' 말단"은 올리고누클레오티드의 5' 말단이 충분히 가용하여 이뮤노머 화합물 또는 면역자극 올리고누클레오티드를 인지하고 결합하여 면역계를 자극하는 인자들이 5' 말단에 접근함을 의미한다. 당해 면역자극 올리고누클레오티드는 2차 구조를 포함할 수 있고, 단 5'말단은 접근 가능하게 유지되어 있어야 한다.
몇몇 양태에서, 본 발명에 따른 방법에 사용되는 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 CpG, C*pG, CpG* 및 C*pG*[여기서, C는 시티딘 또는 2'-데옥시시티딘이고, C*는 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘, 2'-데옥시-4-티오우리딘, 기타 비천연 피리미딘 누클레오시드 또는 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸-푸린이고, G는 구아노신 또는 2'-데옥시구아노신이고, G*는 2'데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신, 2'-O-치환된 아라비노구아노신 또는 기타 비천연 푸린 누클레오시드이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드 상호 연결체이다]로 이루어진 군으로부터 선택되는 면역자극 디누클레오티드를 포함한다. 특정 바람직한 양태에서, 면역자극 디누클레오티드는 CpG가 아니다.
몇몇 양태에서, 본 발명에 따른 방법에 사용되는 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 화학식 III의 면역자극 도메인을 포함한다:
5'-Nn-N1-Y-Z-N1-Nn-3' Ⅲ
상기식에서,
Y는 시티딘, 2'-데옥시티미딘, 2'-데옥시시티딘, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘, 2'-데옥시-4-티오우리딘, 기타 비천연 피리미딘 누클레오시드 또는 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸-푸린이고,
Z는 구아노신 또는 2'-데옥시구아노신, 2'데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신, 2'-O-치환된 아라비노구아노신, 2'-데옥시이노신 또는 기타 비천연 푸린 누클레오 시드이고,
각각의 위치에서 N1은 바람직하게 비염기성 누클레오시드, 아라비노누클레오시드, 2'-데옥시우리딘, α-데옥시리보누클레오시드, β-L-데옥시리보누클레오시드 및 포스포디에스테르 또는 변형된 누클레오시드 상호 연결체(이것은 길이가 약 2옴스트롱 내지 약 200옴스트롱인 링커, C2 내지 C18 알킬 링커, 폴리(에틸렌 글리콜) 링커, 2-아미노부틸-1,3-프로판에디올 링커, 글리세릴 링커, 2'-5' 누클레오시드 상호 연결체 및 포스포로티오에이트, 포스포로디티오에이트 또는 메틸포스포네이트 누클레오시드 상호 연결체로부터 비제한적으로 선택된다)이에 의해 3' 말단상의 인접 누클레오시드로 연결된 누클레오시드로 이루어진 군으로부터 선택되는 천연적으로 존재하거나 합성된 누클레오시드 또는 면역자극 잔기이고,
각각의 위치에서 Nn은 독립적으로 바람직하게 비염기성 누클레오시드, 아라비노누클레오시드, 2'-데옥시우리딘, α-데옥시리보누클레오시드, 2'-O-치환된 리보누클레오시드 및 변형된 누클레오시드 상호 연결체(이것은 아미노 링커, C2-C18 알킬 링커, 폴리(에틸렌 글리콜)링커, 2-아미노부틸-1,3-프로판디올 링커, 글리세릴 링커, 2'-5' 누클레오시드 연결체 및 메틸포스포네이트 누클레오시드 상호 연결체로 이루어진 군으로부터 선택된다)에 의해 3'말단상에 인접한 누클레오시드로 연결된 누클레오시드로 이루어진 군으로부터 선택되는 천연적으로 존재하는 누클레오시드 또는 면역자극 잔기이고,
단, 하나 이상의 N1 또는 Nn은 면역자극 잔기이고,
n은 0 내지 30의 수이고,
3' 누클레오시드는 임의로, 면역자극성일 수 있거나 아닐 수 있는 또 다른 올리고누클레오티드로 직접 연결되거나 비-누클레오티드 링커를 통해 연결된다.
제2 양태에서, 본 발명은 화학치료제와 함께, 면역자극 올리고누클레오티드 및/또는 상기된 바와 같은 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을 포함하는 이뮤노머 컨쥬게이트 및 접근 가능한 5' 말단 이외의 위치에서 면역자극 올리누클레오티드 및/또는 이뮤노머 화합물에 컨주게이팅된 암 항원을 투여함을 포함하는, 암 환자에서 암을 치료하는 방법을 제공한다.
제3 양태에서, 본 발명은 본 발명에 따른 면역자극 올리고누클레오티드 또는 면역자극 올리고누클레오티드 컨쥬게이트 및/또는 이뮤노머 화합물 또는 이뮤노머 컨쥬게이트, 화학치료제 및 생리학적으로 허용되는 담체를 포함하는 약제학적 제형을 제공한다.
제4 양태에서, 본 발명은 암 세포를 이온화 방사선에 감작시키는 방법을 제공한다. 당해 본 발명의 양태에 따른 방법은 포유동물에게 본 발명에 따른 면역자극 올리고누클레오티드 또는 이뮤노머 화합물을 투여하는 단계 및 동물을 이온화 방사선으로 치료하는 단계를 포함한다.
제5 양태에서, 본 발명은 치료학적으로 공동 상승 작용을 하는 유효량의 IL-2(및 임의로 항원)와 함께 치료학적 상승 작용을 하는 유효량의 하나 이상의 이뮤노머 화합물 또는 면역자극 올리고누클레오티드를 환자에게 투여함을 포함하여 환자에서 면역 반응을 상승 작용적으로 자극시키는 방법으로서, 상기 조합물의 투여가 환자에서 사이토킨의 생산을 상승 작용적으로 자극한다. 본 발명에 따라 상승 작용적으로 자극되는 바람직한 사이토킨은 IL-12 및 인터페론-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택된다. 발명의 제 2 양태의 특정 양태에서, 항원은 접근 가능한 5' 말단 이외의 위치에서 이뮤노머 화합물과 작동적으로 연합되어 있다.
본 발명의 제6 양태에서, 이뮤노머 화합물이 아닌 하나 이상의 면역자극 올리고누클레오티드는 치료학적 유효량의 IL-2와 함께 사용되고 환자에서 사이토킨의 생산을 상승 작용적으로 자극한다. 본 발명에 따라 공동 상승 작용적으로 자극되는 바람직한 사이토킨은 IL-12 및 IFN-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택된다. 본 발명에 따라, 이뮤노머 화합물이 아닌 바람직한 면역자극 올리고누클레오티드는 하나 이상의 면역자극 CpG(여기서, C는 사이토신 또는 데옥시사이토신이 아니고/아니거나 G는 구아노신 또는 2-데옥시구아노신이 아니다) 디누클레오티드를 함유하는 것들을 포함한다. 이뮤노머 화합물이 아닌 본 발명의 또 다른 바람직한 면역자극 올리고누클레오티드는 CpG가 아닌 또 다른 면역자극 잔기를 포함하는 것들이다. 당해 또 다른 면역자극 잔기의 예는 비천연적으로 존재하는 염기 및/또는 당을 포함하는 누클레오시드 및 올리고누클레오티드를 안정화시키는 헤어핀 구조와 같은 올리고누클레오티드 자체의 2차 구조물을 포함하지만 이에 제한되지 않는다.
제7 양태에서, 본 발명은 치료학적으로 공동 상승 작용을 하는 유효량의 하나 이상의 이뮤노머 화합물 또는 면역자극 올리고누클레오티드, 치료학적 상승 작용을 하는 유효량의 IL-2(및/또는 동일계에서 IL-2 생산을 유도하는 제제, 예를 들어, DNA 백신 또는 IL-2을 발현하는 발현 벡터) 및 임의로 항원을 포함하는 치료학적 조성물을 제공하고 여기서, 당해 배합물의 투여는 환자에서 사이토킨의 생산을 공동 상승 작용적으로 자극한다. 본 발명에 따라 공동 상승 작용적으로 자극된 바람직한 사이토킨은 IL-12 및 IFN-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택된다.
본 발명의 모든 양태에 따른 방법 및 조성물은 면역계 조정 및 면역 기반 치료를 포함하는 사람 또는 수의학적 질환에 대한 치료 방법에 유용하다. 특히 바람직한 질환 표적 대상은 암, 감염성 질환, 천식 및 알레르기를 포함한다.
도 1은 본 발명의 대표적인 이뮤노머 화합물에 대한 도식이다.
도 2는 본 발명의 여러 대표적인 이뮤노머 화합물을 도시한다.
도 3은 본 발명의 이뮤노머의 직렬 합성에 적합한 대표적인 소분자 링커 그룹을 도시한다.
도 4는 본 발명의 이뮤노머 화합물의 병렬 합성에 적합한 대표적인 소분자 링커 그룹을 도시한다.
도 5는 본 발명의 이뮤노머 화합물의 직렬 합성을 위한 합성 도식이다. DMTr = 4,4'-디메톡시트리틸; CE = 시아노에틸.
도 6은 본 발명의 이뮤노머 화합물의 병렬 합성을 위한 합성 도식이다. DMTr = 4,4'-디메톡시트리틸; CE = 시아노에틸.
도 7A는 BALB/c 마우스 비장 세포 배양물에서 올리고누클레오티드(Oligo) 1번 및 이뮤노머 2번-3번에 의한 IL-12의 유도를 나타내는 그래프이다. 이들 데이타는 접근 가능한 5' 말단을 갖는 이뮤노머 2번이 단량체성 올리고 1번 보다 강한 IL-12의 유도제이고 접근 가능한 5'말단을 갖지 않는 이뮤노머 3번은 올리고 1번과 비교하여 동등하거나 보다 약한 면역 자극 유발 능력을 갖는다는 것을 시사한다.
도 7B는 BALB/c 마우스 비장 세포 배양물에서 올리고 1번 및 이뮤노머 2번-3번에 의한 IL-6의 유도를 나타내는 그래프(각각 상부 대 바닥)이다. 이들 데이타는 접근 가능한 5' 말단을 갖는 이뮤노머 2번이 단량체성 올리고 1번 보다 강한 IL-6의 유도제이고 접근 가능한 5'말단을 갖지 않는 이뮤노머 3번은 올리고 1번과 비교하여 동등하거나 보다 약한 면역 자극 유도 능력을 갖는다는 것을 제안한다.
도 7C는 BALB/c 마우스 비장 세포 배양물에서 올리고 1번 및 이뮤노머 2번-3번에 의한 IL-10의 유도를 나타내는 그래프(각각 상부 대 바닥)이다.
도 8A는 각각 접근 불가능하고 접근 가능한 5' 말단을 갖는 상이한 농도의 이뮤노머 5번 및 6번의 세포 배양물에서 BALB/c 마우스 비장 세포 증식의 유도를 나타내는 그래프이다.
도 8B는 CpG 모티프의 5' 플랭킹 서열에서 면역원성 화학적 변형을 갖는 올리고 4 및 이뮤노머 5번 내지 6번에 의한 BALB/c 마우스 비장의 비대를 나타내는 그래프이다. 다시, 접근가능한 5' 말단을 갖는 이뮤노머 화합물(6)은 접근가능한 5'말단을 갖지 않는 이뮤노머 5 및 단량체성 올리고 4와 비교하여 비장 비대를 보다 크게 증가시키는 능력을 갖는다.
도 9A는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 올리고 4 및 이뮤노머 7 및 8에 의한 IL-12의 유도를 나타내는 그래프이다.
도 9B는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 올리고 4 및 이뮤노머 7 및 8에 의한 IL-6의 유도를 나타내는 그래프이다.
도 9C는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 올리고 4 및 이뮤노머 7 및 8에 의한 IL-10의 유도를 나타내는 그래프이다.
도 10A는 BALB/c 마우스 비장 세포 배양물에서 이뮤노머 14, 15 및 16에 의한 세포 증식 유도를 나타내는 그래프이다.
도 10B는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 이뮤노머 14, 15 및 16에 의한 IL-12의 세포 증식 유도를 나타내는 그래프이다.
도 10C는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 이뮤노머 14, 15 및 16에 의한 IL-6의 세포 증식 유도를 나타내는 그래프이다.
도 11A는 BALB/c 마우스 비장 세포 배양물에서 올리고 4 및 17 및 이뮤노머 19 및 20에 의한 세포 증식 유도를 나타내는 그래프이다.
도 10B는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 이뮤노머 14, 15 및 16에 의한 IL-12의 세포 증식 유도를 나타내는 그래프이다.
도 10C는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 이뮤노머 14, 15 및 16에 의한 IL-6의 세포 증식 유도를 나타내는 그래프이다.
도 11A는 BALB/c 마우스 비장 세포 배양물에서 올리고 4 및 17 및 이뮤노머 19 및 20에 의한 세포 증식 유도를 나타내는 그래프이다.
삭제
삭제
삭제
도 11B는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 올리고 4 및 17 및 이뮤노머 19 및 20에 의한 세포 증식 IL-12의 유도를 나타내는 그래프이다.
도11C는 BALB/c 마우스 비장 세포 배양물에서 상이한 농도의 올리고 4 및 17 및 이뮤노머 19 및 20에 의한 세포 증식 IL-6의 유도를 나타내는 그래프이다.
도 12는 올리고 4 및 이뮤노머 14, 23 및 24를 사용한 BALB/c 마우스 비장 비대를 나타내는 그래프이다.
도 13은 전립선 암에 대한 누드 마우스 모델에서 종양 성장에 대한 본 발명 에 따른 방법의 효과를 나타낸다.
도 14는 본 연구에 사용되는 마우스의 체중에 대한 본 발명에 따른 방법의 효과를 나타낸다.
도 15A는 BALB/c 비장세포가 올리고 1 및 IL-2로 처리된 후 IL-12 생산에 대한 공동 상승 작용 효과를 입증하는 그래프이다.
도 15B는 BALB/c 비장세포가 올리고 2 및 IL-2로 처리된 후 IL-12 생산에 대한 공동 상승 작용 효과를 입증하는 그래프이다.
도 15C는 BALB/c 비장세포가 올리고 3 및 IL-2로 처리된 후 IL-12 생산에 대한 공동 상승 작용 효과를 입증하는 그래프이다.
도 15D는 BALB/c 비장세포가 올리고 4 및 IL-2로 처리된 후 IL-12 생산에 대한 공동 상승 작용 효과를 입증하는 그래프이다.
도 16A는 BALB/c 비장세포가 올리고 1 및 IL-2로 처리된 후 IL-6 생산에 대한 효과를 입증하는 그래프이다.
도 16B는 BALB/c 비장세포가 올리고 2 및 IL-2로 처리된 후 IL-6 생산에 대한 효과를 입증하는 그래프이다.
도 16C는 BALB/c 비장세포가 올리고 3 및 IL-2로 처리된 후 IL-6 생산에 대한 효과를 입증하는 그래프이다.
도 16D는 BALB/c 비장세포가 올리고 4 및 IL-2로 처리된 후 IL-6 생산에 대한 효과를 입증하는 그래프이다.
도 17은 BALB/c 비장세포가 올리고 5 및 IL-2로 처리된 후 IL-12 생산에 대 한 공동 상승 작용 효과를 입증하는 그래프이다.
도 18A는 BALB/c 비장세포가 올리고 1 및 IL-2로 처리된 후 IFN-γ 생산에 대한 효과를 입증하는 그래프이다.
도 18B는 BALB/c 비장세포가 올리고 2 및 IL-2로 처리된 후 IFN-γ 생산에 대한 효과를 입증하는 그래프이다.
도 18C는 BALB/c 비장세포가 올리고 3 및 IL-2로 처리된 후 IFN-γ 생산에 대한 효과를 입증하는 그래프이다.
도 18D는 BALB/c 비장세포가 올리고 4 및 IL-2로 처리된 후 IFN-γ 생산에 대한 효과를 입증하는 그래프이다.
도 19는 BALB/c 비장세포가 올리고 5 및 IL-2로 처리된 후 IFN-γ 생산에 대한 효과를 입증하는 그래프이다.
본 발명은 면역 기반 치료에 사용되는 면역자극 화합물에 의해 유발되는 면역 반응을 증진시키기 위해 최적화된 방법 및 조성물에 관한 것이다. 본 발명에 따른 최적화된 방법은 면역자극 올리고누클레오티드 및 이뮤노머 화합물과 같은 면역자극 화합물의 치료 효과와 사이토킨 면역치료 및/또는 화학치료제의 치료 효과간의 공동 상승 작용을 유도한다. 본원에 인용된 허여된 특허, 특허원 및 참조문헌은 이의 각각이 구체적으로 및 개별적으로 참조로서 인용되는 것 처럼 동일한 정도로 참조로서 인용된다. 본원에 인용된 참조문헌과 본 명세서에 교시된 내용간에 모순이 있는 경우 후자의 교시가 발명의 목적을 위해 우선한다.
본 발명은 암 치료를 위해 면역치료 응용에 사용되는 면역자극 화합물에 의해 유발되는 항암 효과를 증진시키는 방법을 제공한다. 본 발명에 따른 방법에서, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 화학치료제와 배합되어 사용되는 경우 공동 상승 작용 치료 효과를 제공한다. 당해 결과는 면역자극 올리고누클레오티드 및 이뮤노머 화합물이 면역계 세포의 세포 분열을 유발한다는 사실의 관점에서 놀라운데 그 이유는 화학치료제는 정상적으로 활발하게 분열하는 세포를 사멸시키기 때문이다.
제1 양태에서, 본 발명은 화학치료제와 함께, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을 투여하는 것을 포함하여 암 환자에서 암을 치료하는 방법으로서, 상기 이뮤노머는 하나 초과의 접근가능한 5' 말단을 갖도록 함께 결합된 2개 이상의 올리고누클레오티드를 포함하며, 이러한 올리고누클레오티드중 하나 이상이 면역자극 올리고누클레오티드이다. 본원에 사용된 바와 같이, 용어 "접근가능한 5' 말단"은 올리고누클레오티드의 5' 말단이 이뮤노머 화합물을 인지하고 이에 결합하며 면역계를 자극하는 인자가 상기 5' 말단에 접근하게 되도록 이용가능하다는 것을 의미한다. 임의로, 5' OH는 포스페이트, 포스포로티오에이트 또는 포스포로디티오에이트 잔기, 방향족 또는 지방족 링커, 콜레스테롤 또는 접근성을 간섭하지 않는 또 다른 물질에 연결될 수 있다. 면역자극 올리고누클레오티드 및 이뮤노머 화합물은 척추동물에게 투여되는 경우 면역반응을 유도한다. 화학치료제와 배합되어 사용되는 경우, 상승 작용적 치료 효과가 수득된다.
본 발명에 따른 방법에 사용되는 바람직한 화학치료제는 비제한적으로, 젬시타빈(Gemcitabine), 메토트렉세이트(methotrexate), 빈크리스틴(vincristine), 아드리아마이신(adriamycin), 시스플라틴(cisplatin), 당 비함유 클로로에틸니트로소우레아(non-sugar containing chloroethylnitrosoureas), 5-플루오로우라실, 미토마이신 C, 블레오마이신(bleomycin), 독소루비신(doxorubicin), 다카르바진(dacarbazine), 탁솔(taxol), 프라질린(fragyline), 메글라민 GLA(Meglamine GLA), 발루비신(valrubicin), 카르무스타인과 폴리퍼포산(carmustaine and poliferposan), MMI270, BAY 12-9566, RAS 파메실 트랜스퍼라아제 억제제 (RAS famesyl transferase inhibitor), 파메실 트랜스퍼라아제 억제제 (famesyl transferase inhibitor), MMP, MTA/LY231514, LY264618/로메텍솔(Lometexol), 글라몰렉(Glamolec), CI-994, TNP-470, 히캄틴/토포테칸(Hycamtin/Topotecan), PKC412, 발스포다(Valspodar)/PSC833, 노반트론/미트록산트론(Novantrone/Mitroxantrone), 메타레트/수라민(Metaret/Suramin), 바티마스타트(Batimastat), E7070, BCH-4556, CS-682, 9-AC, AG3340, AG3433, 인셀(Incel)/VX-710, VX-853, ZD0101, ISI641, ODN 698, TA 2516/마르미스타트(Marmistat), BB2516/마르미스타트, CDP 845, D2163, PD183805, DX8951f, Lemonal DP 2202, FK 317, 피시바닐(Picibanil)/OK-432, AD 32/발루비신(Valrubicin), 메타스트론(Metastron)/스트론튬 유도체, 테모달/테모졸로미드(Temodal/Temozolomide), 에바세트/리포솜 독소루비신(Evacet/liposomal doxorubicin), 유탁산/플라클리탁셀(Yewtaxan/Placlitaxel), 탁솔/파클리탁셀, 젤로드/카페시타빈(Xeload/Capecitabine), 푸르툴론/옥시플루리딘(Furtulon/Doxifluridine), 시클로팍스/경구 파클리탁셀(Cyclopax/oral paclitaxel), 경구 탁소이드(Oral Taxoid), SPU-077/시스플라틴(Cisplatin), HMR 1275/플라보피리돌(Flavopiridol), CP-358 (774)/EGFR, CP-609 (754)/RAS 온코진 억제제, BMS-182751/경구 플라티넘, UFT(테가푸르/우라실:Tegafur/Uracil), 에르가미솔/레바미솔(Ergamisol/Levamisole), 에닐우라실(Eniluracil)/776C85/5FU 인핸서, 캄프토/레바미솔(Campto/Levamisole), 캄프토사르/이리노테칸(Camptosar/Irinotecan), 투모덱스/랄리트렉세트(Tumodex/Ralitrexed), 류스타틴/클라드리빈(Leustatin/Cladribine), 팍섹스/파클리탁셀(Paxex/Paclitaxel), 독실/리포솜 독소루비신(Doxil/liposomal doxorubicin), 캐릭스(Caelyx)/리포솜 독소루비신, 플루다라/플루다라빈(Fludara/Fludarabine), 파마루비신/에피루비신(Pharmarubicin/Epirubicin), 데포시트(DepoCyt), ZD1839, LU 79553/비스-나프탈이미드(Bis-Naphtalimide), LU 103793/돌라스타인(Dolastain), 캐틱스(Caetyx)/리포솜 독소루비신, 젬자르/젬시타빈(Gemzar/Gemcitabine), ZD 0473/아노르메드(Anormed), YM 116, 로딘 시드(lodine seeds), CDK4 및 CDK2 억제제, PARP 억제제, D4809/덱시포사미드(Dexifosamide), 이페스/메스넥스/이포사미드(Ifes/Mesnex/Ifosamide), 부몬/테니포시드(Vumon/Teniposide), 파라플라틴/카르보플라틴(Paraplatin/Carboplatin), 플라티놀/시스플라틴(Plantinol/cisplatin), 베페시드/에토포시드(Vepeside/Etoposide), ZD 9331, 탁소테레/도세탁셀(Taxotere/Docetaxel), 구아닌 아라비노시드의 프로드러그(prodrug), 탁산 아날로그(Taxane Analog), 니트로소우레아(nitrosoureas), 알킬화제 예컨대, 멜펠란 및 시클로포스파미드, 아미노글루테티미드(Aminoglutethimide), 아스파라기나아제(Asparaginase), 부술판(Busulfan), 카르보 플라틴(Carboplatin), 클로롬부실(Chlorombucil), 시타라빈(Cytarabine) HCl, 닥티노마이신(Dactinomycin), 다우노루비신(Daunorubicin) HCl, 에스트라무스틴 포스페이트 나트륨(Estramustine phosphate sodium), 에토포시드(Etoposide) (VP16-213), 플록스우리딘(Floxuridine), 플루오로우라실(Fluorouracil) (5-FU), 플루타미드(Flutamide), 히드록시우레아(Hydroxyurea) (히드록시카르바미드), 이포스파미드(Ifosfamide), 인터페론 알파-2a, 알파-2b, 류프롤리드 아세테이트(Leuprolide acetate) (LHRH-방출 인자 유사체), 로무스틴(Lomustine) (CCNU), 메클로르에타민(Mechlorethamine) HCl (질소 머스타드), 메르캅토푸린, 메스나(Mesna), 미토탄(Mitotane) (o.p'-DDD), 미톡산트론(Mitoxantrone) HCl, 옥트레오티드(Octreotide), 플리카마이신(Plicamycin), 프로카르바진(Procarbazine) HCl, 스트렙토조신(Streptozocin), 타목시펜 시트레이트(Tamoxifen citrate), 티오구아닌(Thioguanine), 티오테파(Thiotepa), 빈블라스틴 설페이트(Vinblastine sulfate), 암사크린(Amsacrine) (m-AMSA), 아자시티딘(Azacitidine), 에리트로포이에틴(Erthropoietin), 헥사메틸멜라민 (HMM), 인터류킨 2, 미토구아존 (메틸-GAG; 메틸 글리옥살 비스-구아닐히드라존; MGBG), 펜토스타틴(Pentostatin) (2'데옥시코포르마이신), 세무스틴(Semustine) (메틸-CCNU), 테니포시드(Teniposide) (VM-26) 및 빈데신 설페이트를 포함한다.
본 발명의 이러한 양태에 따른 방법에서, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물의 투여는 비제한적으로, 비경구, 경구, 설하, 피내, 국부, 비내, 에어로졸, 안구내, 기관내, 직장내, 질내를 포함하는 임의의 적합한 경로에 의해, 유전자 건, 피부 패치 또는 안약 또는 구강청결제 형태로 이루어질 수 있다. 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물의 치료학적 조성물의 투여는 질환의 증상 또는 대리표지자를 감소시키는데 효과적인 기간 및 투여량으로 공지된 공정으로 수행될 수 있다. 전신 투여될 경우, 치료 조성물은 바람직하게는 약 0.0001 마이크로몰 내지 약 10 마이크로몰의 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물의 혈액 수준을 달성하는데 충분한 투여량으로 투여된다. 국부 투여에 있어서, 이보다 훨씬 더 적은 농도가 효과적일 수 있으며, 훨씬 더 높은 농도가 허용될 수 있다. 바람직하게는, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물의 총 투여량은 약 0.0001mg/환자/1일 내지 약 200mg/체중 kg/1일이다. 본 발명의 하나 이상의 치료학적 조성물을 치료학적으로 유효한 양으로 단일 처리 에피소드로서 개체에 동시에 또는 연속적으로 투여하는 것이 바람직할 수 있다.
본 발명의 이러한 양태에 있어서, "와 함께"는 동일한 환자에서 동일한 질환을 치료하는 과정에 있음을 의미하며, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물 및/또는 화학치료제를, 동시 투여 뿐만 아니라 수 일 이하의 간격을 두고 순차적으로 투여하는 것을 포함하는 임의의 순서로 투여하는 것을 포함한다. 또한, 이러한 병용 처리는 독립적으로 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물, 및/또는 화학치료제의 단일 투여 그 이상을 포함할 수 있다. 면역자극 올리고누클레오티드 및/또는 이뮤노머 및/또는 화학치료제의 투여는 동일하거나 상이한 경로에 의해 이루어질 수 있다.
일부 구체예에서, 본 발명에 따라 사용된 이뮤노머 화합물은 동일하거나 상이할 수 있는 2개 이상의 면역자극 올리고누클레오티드 (이뮤노머와 관련하여)를 포함한다. 바람직하게는, 이들 면역자극 올리고누클레오티드 각각은 하나 이상의 접근가능한 5' 말단을 갖는다.
본 발명에 따른 방법의 특정 구체예에서, 면역자극 올리고누클레오티드(들) 이외에, 이뮤노머 화합물은 유전자에 상보적인 하나 이상의 올리고누클레오티드를 또한 포함한다. 본원에 사용된 바와 같이, 용어 "상보적"은 올리고누클레오티드가 생리학적 조건하에서 유전자의 영역에 하이브리드화되는 것을 의미한다. 일부 구체예에서, 올리고누클레오티드는 유전자의 발현을 하향조절한다. 이러한 하향조절 올리고누클레오티드는 바람직하게는, 안티센스 올리고누클레오티드, 리보자임 올리고누클레오티드, 작은 억제 RNA 및 데코이(decoy) 올리고누클레오티드로 구성된 군으로부터 선택된다. 본원에 사용된 바와 같이, 용어 "유전자의 하향조절"은 유전자의 전사 또는 유전자 생성물의 번역을 억제하는 것을 의미한다. 이와 같이, 본 발명에 따른 방법에 사용된 이뮤노머 화합물은 면역계를 자극하면서 하나 이상의 특정 질환 표적을 표적화하는데 사용될 수 있다.
특정 구체예에서, 본 발명에 따른 방법에 사용된 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 리보자임 또는 데코이 올리고누클레오티드를 포함한다. 본원에 사용된 바와 같은 용어 "리보자임"은 촉매 활성을 갖는 올리고누클레오티드를 의미한다. 바람직하게는, 리보자임은 특정 핵산 표적에 결합하여, 표적을 절단한다. 본원에 사용된 바와 같은 용어 "데코이 올리고누클레오티드"는 서열 특이적 방식으로 전사 인자에 결합하여, 전사 활성을 저지하는 올리고누클레오티드를 의미한다. 바람직하게는, 리보자임 또는 데코이 올리고누클레오티드는 비제한적으로 스템-루프 또는 헤어핀 구조를 포함하는 이차 구조를 나타낸다. 특정 구체예에서, 하나 이상의 올리고누클레오티드는 폴리(I)-폴리(dC)를 포함한다. 특정 구체예에서, Nn의 하나 이상의 세트는 3 내지 10개의 dG 및/또는 G의 스트링 또는 2'-치환된 리보 또는 아라비노 G를 포함한다.
본 발명의 목적상, 용어 "올리고누클레오티드"는 다수의 결합된 누클레오시드 유닛으로 형성된 폴리누클레오시드를 의미한다. 이러한 올리고누클레오티드는 게놈 또는 cDNA를 포함하는 존재하는 핵산 공급원으로부터 수득될 수 있으나, 바람직하게는 합성 방법에 의해 생성된다. 바람직한 구체예에서, 각각의 누클레오시드 유닛은 헤테로시클릭 염기 및 펜토푸라노실, 트레할로스, 아라비노스, 2'-데옥시-2'-치환된 아라비노스, 2'-O-치환된 아라비노스 또는 헥소스 당 기를 포함한다. 누클레오시드 잔기는 다양한 공지된 누클레오시드간 결합 중 어느 하나에 의해 서로 커플링될 수 있다. 이러한 누클레오시드간 결합은 비제한적으로, 포스포디에스테르, 포스포로티오에이트, 포스포로디티오에이트, 알킬포스포네이트, 알킬포스포노티오에이트, 포스포트리에스테르, 포스포르아미데이트, 실록산, 카르보네이트, 카르보알콕시, 아세트아미데이트, 카르바메이트, 모르폴리노, 보라노, 티오에테르, 브릿징된 포스포르아미데이트, 브릿징된 메틸렌 포스포네이트, 브릿징된 포스포로티오에이트, 및 설폰 누클레오시드간 결합을 포함한다. 용어 "올리고누클레오티드"는 하나 이상의 입체특이적 누클레오시드간 결합 (예를 들어, (Rp)- 또는 (Sp)-포스포로티오에이트, 알킬포스포네이트 또는 포스포트리에스테르 결합)을 갖는 폴리누클레오시드를 또한 포함한다. 본원에 사용된 바와 같이, "올리고누클레오티드" 및 "디누클레오티드"라는 용어는 결합이 포스페이트 기를 포함하는지의 여부에 상관없이 임의의 이러한 누클레오시드간 결합을 갖는 폴리누클레오시드 및 디누클레오시드를 포함하는 것으로 명백히 의도된다. 특정 바람직한 구체예에서, 누클레오시드간 결합은 포스포디에스테르, 포스포로티오에이트, 포스포로디티오에이트, 메틸포스포네이트 결합 또는 이들의 조합일 수 있다.
일부 구체예에서, 이뮤노머 화합물은 각각 약 3 내지 약 35개 누클레오시드 잔기, 바람직하게는 약 4 내지 약 30개의 누클레오시드 잔기, 더욱 바람직하게는 약 4 내지 약 20개의 누클레오시드 잔기를 갖는 올리고누클레오티드를 포함한다. 일부 구체예에서, 올리고누클레오티드는 약 5 또는 6개 내지 약 18개, 또는 약 5 또는 6개 내지 약 14개의 누클레오시드 잔기를 갖는다. 본원에 사용된 바와 같은 용어 "약"은 정확한 숫자가 중요하지는 않다는 것을 의미한다. 이와 같이, 올리고누클레오티드의 누클레오시드 잔기의 숫자는 중요하지 않으며, 1 또는 2개의 더 적은 누클레오시드 잔기를 갖거나, 1개 또는 수 개의 추가적인 누클레오시드 잔기를 갖는 올리고누클레오티드는 본 발명의 목적상 상기 기술된 각각의 구체예의 등가물인 것으로 간주된다. 일부 구체예에서, 하나 이상의 올리고누클레오티드는 11개의 누클레오티드를 갖는다.
용어 "올리고누클레오티드"는 또한 비제한적으로 단백질 기, 친지성 기, 삽입성물질, 디아민, 폴릭산, 콜레스테롤 및 아다만탄을 포함하는 추가적인 치환기를 갖는 폴리누클레오시드를 포함한다. 용어 "올리고누클레오티드"는 또한 비제한적으로, 펩티드 핵산 (PNA), 포스페이트기를 갖는 펩티드 핵산 (PHONA), 록킹된 핵산 (LNA), 모르폴리노-백본(backbone) 올리고누클레오티드, 및 알킬 링커 또는 아미노 링커를 지닌 백본 섹션을 갖는 올리고누클레오티드를 포함하는, 기타 핵염기(nucleobase) 함유 중합체를 포함한다.
본 발명에 따른 방법에 사용된 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 자연적으로 발생하는 누클레오시드, 변형된 누클레오시드 또는 이들의 혼합물을 포함할 수 있다. 본원에 사용된 용어 "변형된 누클레오시드"는 변형된 헤테로시클릭 염기, 변형된 당 부분, 또는 이들의 조합을 포함하는 누클레오시드이다. 일부 구체예에서, 변형된 누클레오시드는 본원에 기술된 바와 같은 비천연 피리미딘 또는 푸린 누클레오시드이다. 일부 구체예에서, 변형된 누클레오시드는 2'-치환된 리보누클레오시드, 아라비노누클레오시드 또는 2'-데옥시-2'-플루오로아라비노시드이다.
본 발명의 목적상, 용어 "2'-치환된 리보누클레오시드"는 2'-O-치환된 리보누클레오시드를 생성시키도록 펜토스 부분의 2' 위치에서의 히드록실기가 치환된 리보누클레오시드를 포함한다. 바람직하게는, 이러한 치환은 1-6개 포화 또는 불포화 탄소 원자를 함유하는 저급 알킬기, 또는 6-10개 탄소 원자를 갖는 아릴기로 이루어지며, 여기서 이러한 알킬기 또는 아릴기는 비치환되거나, 예를 들어, 할로, 히드록시, 트리플루오로메틸, 시아노, 니트로, 아실, 아실옥시, 알콕시, 카르복실, 카르보알콕시 또는 아미노기로 치환될 수 있다. 이러한 2'-O-치환된 리보누클레오시드의 예로는 비제한적으로 2'-O-메틸리보누클레오시드 및 2'-O-메톡시에틸리보누클레오시드를 포함한다.
용어 "2'-치환된 리보누클레오시드"는 또한 2'-히드록실기가 1-6개의 치환되거나 비치환된 탄소 원자를 함유하는 저급 알킬기, 또는 아미노 또는 할로 기로 치환된 리보누클레오시드를 포함한다. 이러한 2'-치환된 리보누클레오시드의 예로는 비제한적으로 2'-아미노, 2'-플루오로, 2'-알릴 및 2'-프로파르길 리보누클레오시드를 포함한다.
용어 "올리고누클레오티드"는 하이브리드 및 키메라 올리고누클레오티드를 포함한다. "키메라 올리고누클레오티드"는 1개 유형 이상의 누클레오시드간 결합을 갖는 올리고누클레오티드이다. 이러한 키메라 올리고누클레오티드의 한 바람직한 예는 포스포로티오에이트, 포스포디에스테르 또는 포스포로디티오에이트 영역 및 비이온성 결합 예컨대, 알킬포스포네이트 또는 알킬포스포노티오에이트 결합를 포함하는 키메라 올리고누클레오티드이다 (예를 들어, 페더슨(Pederson) 등의 미국특허 번호 5,635,377 및 5,366,878 참조).
"하이브리드 올리고누클레오티드"는 1개 유형 이상의 누클레오시드를 갖는 올리고누클레오티드이다. 이러한 하이브리드 올리고누클레오티드의 한 바람직한 예는 리보누클레오티드 또는 2'-치환된 리보누클레오티드 영역, 및 데옥시리보누클레오티드 영역을 포함한다 (예를 들어, 메텔레브 및 아그라왈(Metelev and Agrawal)의 미국특허 번호 5,652,355, 6,346,614 및 6,143,881 참조).
본 발명의 목적상, 용어 "면역자극 올리고누클레오티드"는 척추동물 예컨대, 어류, 조류 및 포유동물에 투여될 경우 면역반응을 유도하는 상기 기술된 바와 같은 올리고누클레오티드를 의미한다. 본원에 사용된 바와 같은 용어 "포유동물"은 비제한적으로, 래트, 마우스, 고양이, 개, 말, 소, 젖소, 돼지, 토끼, 사람 이외의 영장류 및 사람을 포함한다. 유용한 면역자극 올리고누클레오티드는 특허문헌[Agrawal et al., WO 98/49288, published November 5, 1998; WO 01/12804, published February 22, 2001; WO 01/55370, published August 2, 2001; PCT/US01/13682, filed April 30, 2001; and PCT/US01/30137, filed September 26, 2001]에 기술되어있다. 바람직하게는, 면역자극 올리고누클레오티드는 하나 이상의 포스포디에스테르, 포스포로티오에이트, 메틸포스포네이트, 또는 포스포르디티오에이트 누클레오시드간 결합을 포함한다.
추가의 양태에서, 본 발명은 환자에서 면역 반응을 상승 작용적으로 자극하는 방법을 제공한다. 당해 방법은 본 발명에 따른 치료학적으로 상승 작용을 하는 유효량의 하나 이상의 이뮤노머 화합물 또는 면역자극 올리고누클레오티드 및 치료학적으로 상승 작용을 하는 유효량의 IL-2(및/또는 동일계에서 IL-2 생산을 유도하는 제제, 예를 들어, DNA 백신 또는 IL-2 발현 발현 벡터)의 조합물을 환자에게 투여함을 포함하고 여기서, 상기 조합물의 투여는 환자에서 사이토킨의 생산을 상승 작용적으로 자극한다. 바람직하게, 본 발명에 따라 상승 작용적으로 자극되는 사이토킨은 IL-12 및 인터페론-γ(IFN-γ), IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택된다.
용어 "상승 작용을 하는 유효량"은, 이뮤노머 화합물 또는 면역자극 올리고누클레오티드 및 IL-2의 조합된 자극 효과가 부가적 이상이도록, 즉, 조합 자극 효과가 각각의 자극 효과의 합을 기준으로 계산된 예상되는 총 자극 효과를 초과하도록 유효 기간동안 투여되는 이뮤노머 화합물 또는 면역자극 올리고누클레오티드의 공지된 농도 및 IL-2의 공지된 농도를 지칭하는데 사용된다.
본원에 사용된 바와 같이, 용어 "사이토킨"은 면역계의 세포가 기타 세포간의 반응을 제어하기 위해 생산하는 임의의 많은 가용성 분자를 의미한다. 용어 "사이토킨"은 예를 들어, 인터류킨(예를 들어, IL-1, IL-2, IL-3, IL-6, IL-10, IL-12 등), 인터페론(예를 들어, IFN-알파, IFN-베타, IFN-감마), 케모킨, 조혈 성장 인자(예를 들어, 에리트로포이에틴), 종양 괴사 인자, 콜로니 자극 인자(예를 들어, G-CSF, M-CSF, GM-CSF) 및 형질전환 성장 인자(TGF-알파)를 포함한다.
본 발명에 따른 "이뮤노머"는 올리고누클레오티드의 3' 말단에 직접 연결되거나 누클레오시드 연결을 통해 직접 연결되거나 작용기화된 누클레오염기 또는 당에서 직접 연결되거나 비-누클레오티드 링커를 통해 함께 간접적으로 연결된, 2개 이상의 올리고누클레오티드를 포함하는 임의의 화합물을 의미하고, 이뮤노머 화합물에 있어서 하나 이상의 올리고누클레오티드는 접근가능한 5'말단을 갖는 면역자극 올리고누클레오티드이다. 본 발명에 대해서, 면역자극 올리고누클레오티드는 하나 이상의 면역자극 CpG 디누클레오티드, 면역자극 도메인 또는 기타 면역자극 잔기를 포함하는 올리고누클레오티드이다. 본원에 사용된 바와 같이, 용어 "접근가능한 5' 말단"은 올리고누클레오티드의 5' 말단이 충분히 가용하여 이뮤노머 화합물 또는 면역자극 올리고누클레오티드를 인지하고 결합하여 면역계를 자극하는 인자들이 5' 말단에 접근함을 의미한다.
일부 구체예에서, 이뮤노머 화합물의 하나 이상의 면역자극 올리고누클레오티드는 5'-Pyr-Pur-3'의 면역자극 누클레오티드를 포함하며, 여기서 Pyr은 천연 또는 합성 피리미딘 누클레오시드이며, Pur은 천연 또는 합성 푸린 누클레오시드이다. 본원에 사용된 바와 같은 용어 "피리미딘 누클레오시드"는 누클레오시드의 염기 성분이 피리미딘 염기인 누클레오시드를 의미한다. 유사하게는, 용어 "푸린 누클레오시드"는 누클레오시드의 염기 성분이 푸린 염기인 누클레오시드를 의미한다. 본 발명의 목적상, "합성" 피리미딘 또는 푸린 누클레오시드는 비천연 피리미딘 또는 푸린 염기, 비천연 당 부분, 또는 이들의 조합을 포함한다.
본 발명에 따른 방법에 사용되는 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물에서 바람직한 피리미딘 누클레오시드는 화학식 (I)의 구조를 갖는다.
상기식에서,
D는 수소 결합 도너(donor)이고;
D'는 수소, 수소 결합 도너, 수소 결합 억셉터(acceptor), 친수성 기, 소수성 기, 전자 끄는 기 및 전자 주는 기로 이루어지는 군으로부터 선택되며;
A는 수소 결합 억셉터 또는 친수성 기이며;
A'는 수소 결합 억셉터, 친수성 기, 소수성 기, 전자 끄는 기 및 전자 주는 기로 이루어지는 군으로부터 선택되며;
X는 탄소 또는 질소이고,
S'는 펜토오스 또는 헥소오스 당 고리, 또는 비천연 당이다.
바람직하게는, 당 고리는 포스페이트 부분, 변형된 포스페이트 부분, 또는 피리미딘 누클레오시드를 또 다른 누클레오시드나 누클레오시드 유사체에 결합시키기에 적합한 기타 링커 부분을 이용하여 유도체화된다.
바람직한 수소 결합 도너에는, 이들에 제한되는 것은 아니나, -NH, -NH2, -SH 및 -OH가 포함된다. 바람직한 수소 결합 억셉터에는, 이들에 제한되는 것은 아니나, C=O, C=S, 및 방향족 헤테로사이클의 고리 질소 원자, 예를 들어 시토신의 N3이 포함된다.
일부 구체예에서, 구조식 ( I )의 염기 부분은 비천연 피리미딘 염기이다. 바람직한 비천연 피리미딘 염기의 예로는, 이들에 제한되는 것은 아니나, 5-히드록시시토신, 5-히드록시메틸시토신, N4-알킬시토신, 바람직하게는 N4-에틸시토신, 및 4-티오우라실이 포함된다. 일부 구체예에서, 구조식 ( I ) 내의 당 부분 S'는 비천연 당 부분이다. 본 발명의 목적상, "천연 당 부분"은, 핵산의 일부, 예를 들어 리보오스 및 2'-데옥시리보오스로서 천연적으로 존재하는 당 부분이며, "비천연 당 부분"은, 핵산의 일부로서 천연적으로 존재하지는 않지만 올리고누클레오티드에 대한 백본에서 사용될 수 있는 임의의 당, 예를 들어 헥소오스이다. 아라비노오스 및 아라비노오스 유도체가 바람직한 당 부분의 예이다.
본 발명에 따른 방법에 사용되는 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물에서 바람직한 면역자극 푸린 누클레오시드 유사체는 화학식 II의 구조를 갖는다.
상기식에서,
D는 수소 결합 도너이고;
D'는 수소, 수소 결합 도너, 및 친수성 기로 이루어지는 군으로부터 선택되며;
A는 수소 결합 억셉터 또는 친수성 기이고;
X는 탄소 또는 질소이고;
각각의 L은 C, O, N 및 S로 이루어지는 군으로부터 독립적으로 선택되며;
S'는 펜토오스 또는 헥소오스 당 고리, 또는 비천연 당이다.
바람직하게는, 당 고리는 포스페이트 부분, 변형된 포스페이트 부분, 또는 피리미딘 누클레오시드를 또 다른 누클레오시드나 누클레오시드 유사체에 결합시키는데 적합한 기타 링커 부분을 이용하여 유도체화된다.
바람직한 수소 결합 도너에는, 이들에 제한되는 것은 아니나, -NH, -NH2, -SH 및 -OH가 포함된다. 바람직한 수소 결합 억셉터에는, 이들에 제한되는 것은 아니나, C=O, C=S, -NO2, 및 방향족 헤테로사이클의 고리 질소 원자, 예를 들어 구아닌의 N1이 포함된다.
일부 구체예에서, 구조직 ( II )의 염기 부분은 비천연 푸린 염기이다. 바람직한 비천연 푸린 염기의 예로는, 이들에 제한되는 것은 아니나, 6-티오구아닌 및 7-데아자구아닌이 포함된다. 일부 구체예에서, 구조식 ( II )의 당 부분 S'는 구조식 ( I )에 대해 상기 기술된 바와 같은 천연 당 부분이다.
바람직한 양태에서, 본 발명에 따른 방법에 사용되는 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물에서 면역자극 디누클레오티드는 CpG, C*pG, CpG* 및 C*pG*로 이루어진 군으로부터 선택되고 여기서, C는 시티딘 또는 2'-데옥시시티딘이며; C*는 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시티미딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-히드록시시티딘, 2'-데옥시-N4-알킬-시티딘, 2'-데옥시-4-티오우리딘, 기타 비천연 피리미딘 누클레오시드, 또는 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸-푸린이며; G는 구아노신 또는 2'-데옥시구아노신이며; G*는 2' 데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2'-치환된-아라비노구아노신, 2'-O 치환된 아라비노구아노신, 2'-데옥시이노신, 또는 기타 비천연 푸린 누클레오시드이며, p는 포스포디에스테르, 포스포로티오에이트, 및 포스포로디티오에이트로 이루어지는 군으로부터 선택된 누클레오시드간 결합이다. 특정의 바람직한 구체예에서, 면역자극성 디누클레오티드는 CpG가 아니다.
면역자극성 올리고누클레오티드는 면역자극성 디누클레오티드의 한 쪽 측면 또는 양쪽 측면 상에 면역자극성 부분을 포함할 수 있다. 따라서, 일부 구체예에서, 면역자극성 올리고누클레오티드는 하기 구조식(III)의 면역자극성 도메인을 포함한다:
5'-Nn-N1-Y-Z-N1-Nn-3' Ⅲ
상기식에서,
Y는 시티딘, 2' 데옥시티미딘, 2' 데옥시시티딘 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-데옥시티미딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-히드록시시티딘, 2'-데옥시-N4-알킬-시티딘, 2'-데옥시-4-티오우리딘, 기타 비천연 피리미딘 누클레오시드, 또는 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸-푸린이며;
Z는 구아노신 또는 2'-데옥시구아노신, 2' 데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신, 2'-O-치환된-아라비노구아노신, 2' 데옥시이노신, 또는 기타 비천연 푸린 누클레오시드이며;
각각의 경우에 N1은, 바람직하게는 아베이직 누클레오시드, 아라비노누클레오시드, 2'-데옥시우리딘, α-데옥시리보누클레오시드, β-L-데옥시리보누클레오시드, 및 포스포디에스테르 또는 변형된 누클레오시드간 결합에 의해 3' 측 면 상의 인접 누클레오시드에 결합된 누클레오시드로 이루어지는 군으로부터 선택된 천연 또는 합성 누클레오시드 또는 면역자극성 부분이며, 상기 변형된 누클레오티드간 결합은 이들에 제한되는 것은 아니나 약 2 옹스트롱 내지 약 200 옹스트롱의 길이를 갖는 링커, C2-C18 알킬 링커, 폴리(에틸렌 글리콜) 링커, 2-아미노부틸-1,3-프로판디올 링커, 글리세릴 링커, 2'-5' 누클레오시드간 결합, 및 포스포로티오에이트, 포스포로디티오에이트, 또는 메틸포스포네이트 누클레오시드간 결합으로부터 선택되며;
각각의 경우에 Nn은, 바람직하게는 아베이직 누클레오시드, 아라비노누클레오시드, 2'-데옥시우리딘, α-데옥시리보누클레오시드, 2'-O-치한된 리보누클레오시드, 및 변형된 누클레오시드간 결합에 의해 3' 측면 상의 인접 누클레오시드에 결합된 누클레오시드로 이루어지는 군으로부터 선택된 천연 누클레오시드 또는 면역자극성 부분이며, 상기 변형된 누클레오시드간 결합은 바람직하게는 아미노 링커, C2-C18 알킬 링커, 폴리(에틸렌 글리콜) 링커, 2-아미노부틸-1,3-프로판디올 링커, 글리세릴 링커, 2'-5' 누클레오시드간 결합, 및 메틸포스포네이트 누클레오시드간 결합으로 이루어지는 군으로부터 선택되며;
단, 상기 N1 또는 Nn중 하나 이상은 면역자극성 부분이며;
여기서 각각의 n은 독립적으로 0 내지 30의 수이며;
이뮤노머 화합물의 경우, 3' 말단은 직접 또는 비누클레오티드 링커에 의해 면역자극성이거나 아닐 수 있는 또 다른 올리고누클레오티드에 결합된다.
일부 바람직한 구체예에서, YZ는 아라비노시티딘 또는 2'-데옥시-2'-치환된 아라비노시티딘 및 아라비노구아노신 또는 2' 데옥시-2'-치환된 아라비노구아노신이다. 바람직한 면역자극성 부분에는, 메틸포스포네이트, 메틸포스포노티오에이트, 포스포트리에스테르, 포스포티오트리에스테르, 포스포로티오에이트, 포스포로디티오에이트, 트리에스테르 프로드러그, 설폰, 설폰아미드, 설파메이트, 포름아세탈, N-메틸히드록실아민, 카르보네이트, 카르바메이트, 모르폴리노, 보라노포스포네이트, 포스포르아미데이트, 특히 1차 아미노-포스포르아미데이트, N3 포스포르아미데이트 및 N5 포스포르아미데이트, 및 입체특이적 결합 (예를 들어, (Rp )- 또는 (SP )-포스포로티오에이트, 알킬포스포네이트, 또는 포스포트리에스테르 결합)을 포함하나 이들에 제한되지 않는 포스페이트 백본의 변형 부분이 포함된다.
본 발명에 따른 바람직한 면역자극성 부분에는, 2'-O-메틸리보오스, 2'-O-메톡시에틸리보오스, 2'-O-프로파르길리보오스 및 2'-데옥시-2'-플루오로리보오스를 포함하나 이들에 제한되지 않는 2'-치환된 펜토오스 당; 3'-O-메틸리보오스를 포함하나 이에 제한되지 않는 3'-치환된 펜토오스 당; 1',2'-디데옥시리보오스; 아라비노오스; 1'-메틸아라비노오스, 3'-히드록시메틸아라비노오스, 4'-히드록시메틸아라비노오스, 및 2'-치환된 아라비노오스 당을 포함하나 이들에 제한되지 않는 치환된 아라비노오스 당; 1,5-언히드로헥시톨을 포함하나 이에 제한되지 않는 헥소오스 당; 및 알파-아노머(alpha-anomer)를 포함하는 당 변형 부분을 갖는 누클레오시드가 추가로 포함된다. 변형된 당이 3'-데옥시리보누클레오시드 또는 3'-O-치환된 리보누클레오시드인 구체예에서, 면역자극성 부분은 2'-5' 누클레오시드간 결합에 의해 인접 누클레오시드에 결합된다.
본 발명에 따른 방법에 사용된 면역자극성 올리고누클레오티드 및/또는 이뮤노머 화합물에서의 바람직한 면역자극성 부분에는, 펩티드 핵산(PNA), 포스페이트 기를 갖는 펩티드 핵산(PHONA), 록킹된(locked) 핵산(LNA), 모노폴리노 백본 올리고누클레오티드, 및 알킬 링커 또는 아미노 링커를 포함하나 이들에 제한되지 않는, 길이가 약 2 옹스트롱 내지 약 200 옹스트롱인 백본 링커 섹션을 갖는 올리고누클레오티드를 포함하는 기타 탄수화물 백본 변형 부분 및 치환 부분을 갖는 올리고누클레오티드가 추가로 포함된다. 상기 알킬 링커는 분지되거나 분지되지 않을 수 있으며, 치환되거나 치환되지 않을 수 있으며, 키랄적으로 순수하거나 라세미 혼합물일 수 있다. 가장 바람직하게는, 그러한 알킬 링커는 약 2 내지 약 18개의 탄소수를 갖는다. 일부 바람직한 구체예에서, 그러한 알킬 링커는 약 3 내지 약 9개의 탄소수를 갖는다. 일부 알킬 링커는 히드록시, 아미노, 티올, 티오에테르, 에테르, 아미드, 티오아미드, 에스테르, 우레아 및 티오에테르로 이루어지는 군으로부터 선택된 하나 이상의 작용기를 포함한다. 일부의 그러한 작용기화된 알킬 링커는, 화학식 -O-(CH2-CH2-O-) n (n = 1 내지 9)으로 표시되는 폴리(에틸렌 글리콜) 링커이다. 일부 기타 작용기화된 알킬 링커는 펩티드 또는 아미노산이다.
본 발명에 따른 방법에 사용된 면역자극성 올리고누클레오티드 및/또는 이뮤노머 화합물에서의 바람직한 면역자극성 부분에는, β-L-데옥시리보누클레오시드 및 α-데옥시리보누클레오시드를 포함하나 이들에 제한되지 않는 DNA 이소폼(isoform)이 추가로 포함된다. 바람직한 면역자극성 부분에는 3' 변형 부분이 혼입되어 있으며, 2'-5', 2'-2', 3'-3' 및 5'-5' 결합을 포함하나 이들에 제한되지 않는 비천연 누클레오시드간 결합 위치를 갖는 누클레오시드가 추가로 포함된다.
본 발명에 따른 방법에 사용된 면역자극성 올리고누클레오티드 및/또는 이뮤노머에서의 바람직한 면역자극성 부분에는, 5-히드록시시토신, 5-히드록시메틸시토신, N4-알킬시토신, 바람직하게는 N4-에틸시토신, 4-티오우라실, 6-티오구아닌, 7-데아자구아닌, 이노신, 니트로피롤, C5-프로피닐피리미딘, 및 2,6-디아미노푸린을 포함하나 이에 제한되지 않는 디아미노푸린을 포함하나 이들에 제한되지 않는 변형된 헤테로시클릭 염기를 갖는 누클레오시드가 추가로 포함된다.
구체적인 예로서 예시하나 이들에 제한되지 않는, 예를 들어 상기 구조식 ( III )의 면역자극성 도메인에서, 위치 N1 또는 Nn에서의 메틸포스포네이트 누클레오시드간 결합은 면역자극성 부분, 길이가 약 2 옹스트롱 내지 약 200 옹스트롱인 링커이며, 위치 X1에서의 C2-C18 알킬 링커는 면역자극성 부분이며, 위치 X1에서의 β-L-데옥시리보누클레오시드는 면역자극성 부분이다. 면역자극성 부분의 대표적 위치 및 구조에 대해서는 하기 표 1이 참조된다. 지정된 위치에서의 면역자극성 부분으로서 링커를 언급한 것은 그러한 위치에 있는 누클레오시드 잔기가 이의 3'-히드록실에서 지시된 링커로 치환되어, 이 누클레오시드 잔기와 3' 측면 상의 인접한 누클레오시드 사이에서 변형된 누클레오시드간 결합을 형성함을 의미하는 것으로 이해된다. 유사하게, 지정된 위치에서의 면역자극성 부분으로서 변형된 누클레오시드간 결합을 언급한 것은 그 위치에 있는 누클레오시드 잔기가 열거된 결합에 의해 3' 측면 상의 인접한 누클레오시드에 결합됨을 의미한다.
표 1.
| 위치 | 전형적인 면역자극성 부분 |
| N1 | 천연 누클레오시드, 아베이직 누클레오시드, 아라비노누클레오시드, 2'-데옥시우리딘, β-L-데옥시리보누클레오시드 C2-C18 알킬 링커, 폴리(에틸렌 글리콜) 결합, 2-아미노부틸-1,3-프로판디올 링커 (아미노 링커), 2'-5' 누클레오시드간 결합, 메틸포스포네이트 누클레오시드간 결합 |
| Nn | 천연 누클레오시드, 비염기성 누클레오시드, 아라비노누클레오시드, 2'-데옥시우리딘, 2'-O-치환된 리보누클레오시드, 2'-5' 누클레오시드간 결합, 메틸포스포네이트 누클레오시드간 결합, 단 N1 및 N2는 둘 모두 아베이직 결합일 수 없다. |
삭제
하기 표 2에는 업스트림 강화(upstream potentiation) 도메인을 지닌 면역자극성 올리고누클레오티드 내의 면역자극성 부분의 대표적 위치 및 구조가 표시되어 있다. 본원에 사용된, 용어 "스페이서 9"는 화학식 -O-(CH2CH2-O) n - (여기서, n은 3이다)으로 표시되는 폴리(에틸렌 글리콜) 링커를 지칭한다. 상기 용어 "스페이서 18"은 식 -O-(CH2CH2-O) n - (여기서, n은 6이다)로 표시되는 폴리(에틸렌 글리콜) 링커를 지칭한다. 본원에 사용된, 용어 "C2-C18" 알킬 링커는 화학식 -O-(CH2) q -O- (여기서, q는 2 내지 18의 정수이다)로 표시되는 링커를 지칭한다. 따라서, "C3-링커" 및 "C3-알킬 링커"는 식 -O-(CH2)3-O-으로 표시되는 링커를 지칭한다. 스페이서 9, 스페이서 18 및 C2-C18 알킬 링커 각각에 대해서, 이러한 링커는 포스포디에스테르, 포스포로티오에이트, 포스포로디티오에이트, 또는 메틸포스포네이트 결합에 의해 인접한 누클레오시드에 연결된다.
표 2.
하기 표 3에는 다운스트림 강화 도메인을 지닌 면역자극성 올리고누클레오티드 내의 면역자극성 부분의 대표적 위치 및 구조가 표시되어 있다.
표 3
| 위치 | 전형적인 면역자극성 부분 |
| 5' N2 | 천연 누클레오시드, 2-아미노부틸-1,3-프로판디올 링커 |
| 5' N1 | 천연 누클레오시드, β-L-데옥시리보누클레오시드, C2-C18 알킬 링커, 폴리(에틸렌 글리콜), 아베이직 링커, 2-아미노부틸-1,3-프로판디올 링커 |
| 3' N1 | 천연 누클레오시드, 1',2'-디데옥시리보오스, 2'-O-메틸-리보누클레오시드, C2-C18 알킬 링커, 스페이서 9, 스페이서 18 |
| 3' N2 | 천연 누클레오시드, 1',2'-디데옥시리보오스, 3'-데옥시리보누클레오시드, β-L-데옥시리보누클레오시드, 2'-O-프로파르길-리보누클레오시드, C2-C18 알킬 링커, 스페이서 9, 스페이서 18, 메틸포스포네이트 누클레오시드간 결합 |
| 3' N3 | 천연 누클레오시드, 1',2'-디데옥시리보오스, C2-C18 알킬 링커, 스페이서 9, 스페이서 18, 메틸포스포네이트 누클레오시드간 결합, 2',5' 누클레오시드간 결합, d(G)n, 폴리I-폴리dC |
| 3'N2 + 3'N3 | 1',2'-디데옥시리보오스, β-L-데옥시리보누클레오시드, C2-C18 알킬 링커, d(G)n, 폴리I-폴리dC |
| 3'N3 + 3'N4 | 2'-O-메톡시에틸-리보누클레오시드, 메틸포스포네이트 누클레오시드간 결합, d(G)n, 폴리I-폴리dC |
| 3'N5 + 3'N6 | 1',2'-디데옥시리보오스, C2-C18 알킬 링커, d(G)n, 폴리I-폴리dC |
| 5'N1 + 3'N3 | 1',2'-디데옥시리보오스, d(G)n, 폴리I-폴리dC |
하기 표 3에는 다운스트림 강화 도메인을 지닌 면역자극성 올리고누클레오티드 내의 면역자극성 부분의 대표적 위치 및 구조가 표시되어 있다.
표 3
| 위치 | 전형적인 면역자극 부분 |
| 5'N2 | 메틸포스포네이트 누클레오시드간 결합 |
| 5'N1 | 메틸포스포네이트 누클레오시드간 결합 |
| 3'N1 | 1',2'-디데옥시리보오스, 메틸포스포네이트 누클레오시드간 결합, 2'-O-메틸 |
| 3'N2 | 1',2'-디데옥시리보오스, β-L-데옥시리보누클레오시드, C2-C18 알킬 링커, 스페이서 9, 스페이서 18, 2-아미노부틸-1,3-프로판디올 링커, 메틸포스포네이트 누클레오시드간 결합, 2'-O-메틸 |
| 3'N3 | 3'-데옥시리보누클레오시드, 3'-O-치환된 리보누클레오시드, 2'-O-프로파르길-리보누클레오시드 |
| 3'N2 + 3'N3 | 1',2'-디데옥시리보오스, β-L-데옥시리보누클레오시드 |
삭제
본 발명에 따른 방법에 사용된 이뮤노머 화합물은 직접 결합되거나 비-누클레오티드 링커를 통해 결합된 둘 이상의 올리고누클레오티드를 포함한다. 본 발명의 목적상, "비-누클레오티드 링커"는 공유 또는 비공유 결합에 의해 올리고누클레오티드에 결합될 수 있는 임의의 부분이다. 상기 링커는 약 2 옹스트롬 내지 약 200 옹스트롬의 길이인 것이 바람직하다. 바람직한 링커의 수 개의 예가 하기에 기술된다. 비공유 결합은 정전 상호작용, 소수성 상호작용, π-스태킹(stacking) 상호작용 및 수소 결합을 포함하나, 이로 제한되지 않는다. "비-누클레오티드 링커"란 용어는 상기 기술된 대로, 예컨대 두 개의 누클레오시드의 3'-히드록실기를 직접 연결시키는 포스포디에스테르, 포스포로티오에이트 또는 포스포로디티오에이트 작용기와 같은 상기 기술된 누클레오시드간 결합을 의미하고자 하는 것이 아니다. 본 발명의 목적상, 이러한 직접적 3'-3' 결합은 "누클레오시드 결합"인 것으로 고려된다.
삭제
삭제
삭제
몇몇 구체예에서, 비-누클레오티드 링커는 금 입자를 비제한적으로 포함하는 금속이다. 몇몇 다른 구체예에서, 비-누클레오티드 링커는 가용성 또는 불용성의 생분해가능한 중합체 비드이다.
또한 다른 구체예에서, 비-누클레오티드 링커는 올리고누클레오티드에 결합될 수 있게 하는 작용기를 지니는 유기 부분이다. 이러한 결합은 바람직하게 임의의 안정한 공유 결합에 의해 이루어진다.
몇몇 구체예에서, 비-누클레오티드 링커는 폴리펩티드, 항체, 지질, 항원, 알레르겐 및 올리고당류를 비제한적으로 포함하는 생체분자(biomolecule)이다. 몇몇 다른 구체예에서, 비-누클레오티드 링커는 소분자이다. 본 발명의 목적상, 소분자는 분자량이 1,000 Da 미만인 유기 부분이다. 몇몇 구체예에서, 소분자의 분자량은 750 Da 미만이다.
몇몇 구체예에서, 소분자는 지방족 또는 방향족 탄화수소이고, 이들 각각은 올리고누클레오티드를 연결시키거나 이에 부가된 선형 사슬 중에 히드록시, 아미노, 티올, 티오에테르, 에테르, 아미드, 티오아미드, 에스테르, 우레아 및 티오우레아로 구성된 군으로부터 선택된 하나 이상의 작용기를 포함하거나 포함하지 않을 수 있다. 소분자는 시클릭 또는 아시클릭일 수 있다. 소분자 링커의 예로는 아미노산, 탄수화물, 시클로덱스트린, 아다만탄, 콜레스테롤, 합텐 및 항생제가 있으나, 이로 제한되지 않는다. 그러나, 비-누클레오티드 링커를 기술하는 경우, "소분자"란 용어는 누클레오시드를 포함하는 것으로 의도되지 않는다.
몇몇 구체예에서, 소분자 링커는 화학식 HO-(CH2) o -CH(OH)-(CH2) p -OH (여기에서 o 및 p는 독립적으로 1 내지 약 6의 정수, 1 내지 약 4의 정수, 또는 1 내지 약 3의 정수이다)의 글리세롤 또는 글리세롤 동족체이다. 몇몇 다른 구체예에서, 소분자 링커는 1,3-디아미노-2-히드록시프로판의 유도체이다. 이러한 유도체의 몇몇은 화학식 HO-(CH2) m -C(O)NH-CH2-CH(OH)-CH2-NHC(O)-(CH2) m -OH (여기에서 m은 0 내지 약 10의 정수, 0 내지 약 6의 정수, 2 내지 약 6의 정수, 또는 2 내지 약 4의 정수이다)를 지닌다.
본 발명에 따른 방법에 사용된 이뮤노머 화합물에서 몇몇 비-누클레오티드 링커는 도 1에 개략적으로 도시된 대로, 둘 이상의 올리고누클레오티드를 결합시킬 수 있다. 예를 들어, 소분자 링커 글리세롤은 올리고누클레티드가 공유 결합될 수 있는 세 개의 히드록실기를 지닌다. 따라서, 본 발명에 따른 몇몇 이뮤노머 화합물은 이들의 3' 말단에서 비-누클레오티드 링커에 결합되는 둘 이상의 올리고누클레오티드를 포함한다. 이러한 이뮤노머 화합물의 몇몇은 각각이 접근가능한 5' 말단을 지니는 둘 이상의 면역자극 올리고누클레오티드를 포함한다.
본 발명에 따른 방법에 사용되는 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 자동 합성장치 및 도 5 및 6에 개략적으로 도시되고 추가로 실시예에 기술된 포스포르아미다이트 방법을 사용하여 편리하게 합성될 수 있다. 몇몇 구체예에서, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 직렬 합성 방법 (도 5 참조)에 의해 합성된다. 본원에서 사용된 "직렬 합성"이란 용어는 이뮤노머의 한 쪽 말단에서 시작하여 다른 쪽 말단으로 직렬적으로 진행되는 합성을 의미한다. 직렬 합성은 동일하거나 동일하지 않은 (길이, 염기 조성 및/또는 혼입되는 화학적 변형에 대하여) 단량체 유닛이 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물로 혼입될 수 있게 한다.
이뮤노머 화합물의 대안적인 합성 양식은 "병렬적 합성"이고, 여기에서 합성은 중심 링커 부분으로부터 바깥쪽을 향해 진행된다 (도 6 참조). 링커가 결합된 고체 지지체가 미국특허 제 5,912,332호에 개시된 바와 같이 병렬적 합성에 사용될 수 있다. 대안적으로, 조절된 포어 글래스 지지체에 부착된 포스페이트와 같은 범용 고체 지지체가 사용될 수 있다.
이뮤노머 화합물의 병렬적 합성은 직렬 합성에 비해 여러 가지 이점을 지닌다: (1) 병렬적 합성은 동일한 단량체 유닛을 혼입시킬 수 있고; (2) 직렬 합성과 달리, 둘 모두의 (또는 모든) 단량체 유닛이 동시에 합성되므로 합성 단계의 수 및 합성에 요구되는 시간이 하나의 단량체 유닛과 동일하고; (3) 합성 단계의 감소가 최종 이뮤노머 생성물의 순도 및 수율을 개선시킨다.
직렬 합성 또는 병렬적 합성 프로토콜에 의한 합성의 종료시에, 본 발명에 따른 방법에 사용되는 면역자극 올리고누클레오티드 또는 이뮤노머 화합물이 농축된 암모니아 용액에 의해 또는 변형된 누클레오시드가 혼입된 경우에는 포스포르아미다이트 서플라이어에 의해 권고된 바와 같이 편리하게 탈보호될 수 있다. 생성된 면역자극 올리고누클레오티드 및/또는 이뮤노머를 바람직하게 역상 HPLC에 의해 정제하고, 탈트리틸화시키고, 탈염시키고, 투석시킨다.
이뮤노머 화합물의 성분으로서 사용하기에 적합하거나 본 발명의 제4 양태에 따른 면역자극 올리고누클레오티드는 본원에 참조로서 인용되는 하기의 미국 특허 및 계류중인 미국 특허원에 기재되어 있다: 미국 특허 제6,426,334호 및 제6,476,000호 및 미국 특허원 제09/770,602호, 제09/845,623호, 제09/965,116호, 제60/440,587호, 제10/361,111호, 제60/471,247호, 제60/477호. 본 발명의 바람직한 면역자극 올리고누클레오티드 및 이뮤노머 화합물은 계류중인 미국 특허원 제10/279,684호에 기재되어 있다. 표 4는 본 발명에 따른 방법에 사용되는 대표적인 이뮤노머 화합물을 보여준다. 추가의 이뮤노머 화합물은 실시예 및 미국 특허원 제10/279,684호에 기재되어 있다.
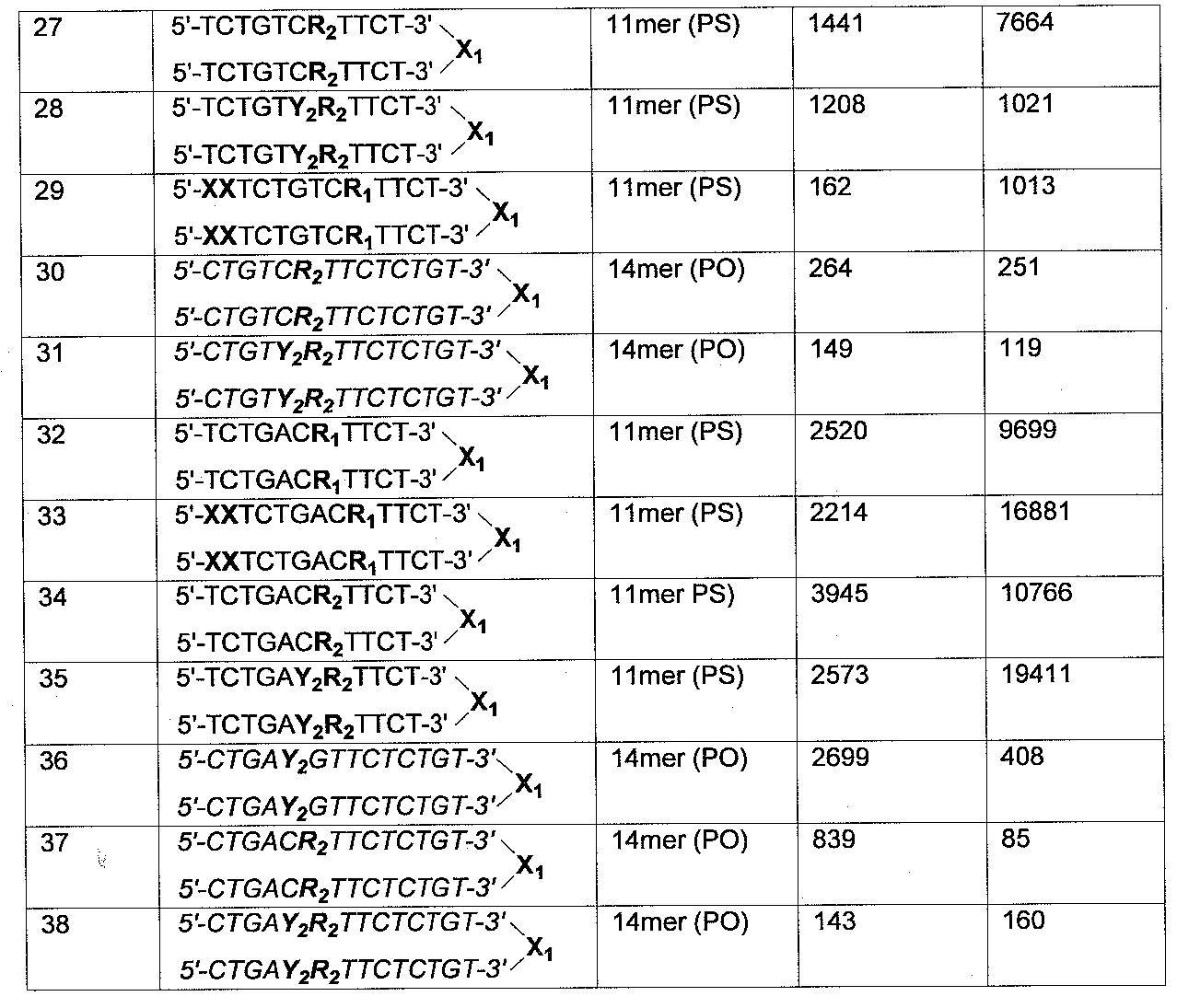
표 4. 이뮤노머 서열의 예
본 발명의 추가의 양태는 2개 이상의 올리고누클레오티드를 포함하는 면역자극 핵산을 제공하며, 여기서 면역자극 핵산은 2차 구조를 갖는다. 특정 양태에서, 면역자극 핵산은 상보적인 서열과의 수소 결합함에 의해 3'-말단 스템 루프 2차 구조를 갖는다. 특정 양태에서, 면역자극 활성을 감소시키는 핵산이 상보적인 서열과의 수소 결합에 의해 5'-말단 스템 루프 2차 구조를 형성한다. 이러한 양태에서, 면역자극 핵산은 화학식 I에 상세히 기재한 바와 같은 구조를 포함한다.
도메인 A-도메인 B-도메인 C (I)
도메인은 길이가 약 2 내지 약 12개의 누클레오티드일 수 있다. 도메인 A는 CpG, C*pG, C*pG* 및 CpG*으로 이루어진 군으로부터 선택되는 1개 이상의 디누클레오티드를 함유하거나 함유하지 않는 팔린드롬 또는 자가 상보적인 도메인을 갖거나 갖지 않는 5'-3' 또는 3'-5' 또는 2'-5' DNA, RNA, RNA-DNA, DNA-RNA일 수 있으며, 여기서, C는 시티딘 또는 2'-데옥시시티딘이고, G는 구아노신 또는 2'-데옥시구아노신이고, C*는 2'-데옥시티미딘, 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸-푸린, 2'-디데옥시-5-할로사이토신, 2'-데옥시-5-니트로사이토신, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5'-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘, 2'-데옥시-4-티오우리딘, 또는 기타 피리미딘 누클레오시드 유사체이고, G*는 2'-데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2'-치환된-아라비노구아노신, 2'-O-치환된 아라비노구아노신, 2'-데옥시이노신 또는 기타 푸린 누클레오시드 유사체이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드 상호 연결체이다. 특정 바람직한 양태에서, 면역자극 디누클레오티드는 CpG가 아니다.
특정 양태에서, 도메인 A는 CpG, C*pG, C*pG* 및 CpG*으로 이루어진 군으로부터 선택되는 하나 초과의 디누클레오티드를 갖는다.
하기 "X"에 의해 도시된 바와 같은 도메인 B는 3'-5' 연결체, 2'-5' 연결체, 3'-3' 연결체, 포스페이트 기, 누클레오시드일 수 있는, 도메인 A 및 C를 연결하는 링커 또는 지방족, 방향족, 아릴, 사이클릭, 키랄, 비키랄, 펩타이드, 탄수화물, 지질, 지방산, 모노-, 트리- 또는 헥사폴리에틸렌 글리콜 또는 헤테로사이클릭 잔기일 수 있는 비-누클레오시드 링커이다.
도메인 C는 CpG, C*pG, C*pG* 및 CpG*로 이루어진 군으로부터 선택되는 디누클레오티드를 갖거나 가질 수 없는 팔린드롬 또는 자가 상보적인 서열을 갖거나 갖지 않는 5'-3' 또는 3'-5' 또는 2'-5' DNA, RNA, RNA-DNA, DNA-RNA 폴리 I-폴리 C일 수 있으며, 여기서, C는 시티딘 또는 2'-데옥시시티딘이고, G는 구아노신 또는 2'-데옥시구아노신이고, C*는 2'-데옥시티미딘, 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸-푸린, 2'-디데옥시-5-할로사이토신, 2'-데옥시-5-니트로사이토신, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5'-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘, 2'-데옥시-4-티오우리딘, 또는 기타 피리미딘 누클레오시드 유사체이고, G*는 2'-데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2'-치환된-아라비노구아노신, 2'-O-치환된 아라비노구아노신, 2'-데옥시이노신 또는 기타 푸린 누클레오시드 유사체이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드 상호 연결체이다. 특정 바람직한 양태에서, 면역자극 디누클레오티드는 CpG가 아니다. 특정 양태에서, 도메인 B는 바람직하게 "이뮤노머"로서 언급되는 도메인 A 및 도메인 C의 올리고누클레오티드를 연결하는 비-누클레오티드 링커이다. 특정 바람직한 양태에서, 도메인 C는 디누클레오티드 CpG, C*pG, C*pG* 및 CpG*를 갖지 않는다.
비제한적인 예를 통해, 당해 양태의 특정 양태에서, 면역자극 핵산은 화학식 (II)에 상세히 도시된 바와 같은 구조를 갖는다.
당업자가 인지하는 바와 같이, 분자내 스템 루프의 형태로 분자의 말단에는 2차 구조 요소가 있다.
비제한적인 예를 통해, 본 양태의 특정 구체예에서, 면역자극 핵산은 화학식 III에 상세히 도시된 바와 같은 구조를 갖는다.
2개의 말단 서열이 상보적이어서 분자내 수소 결합을 허용하기 때문에 2개의 분자 말단이 차단되므로, 화학식 III에 도시된 구조는 본원에서 "말단 이량체"로서 언급된다. 추가로, 도메인 A 및 A'는 동일하거나 동일하지 않을 수 있고 도메인 B 및 B'는 동일하거나 동일하지 않을 수 있고 도메인 C 및 C'는 동일하거나 동일하지 않을 수 있다.
비제한적인 예를 통해, 당해 양태의 특정 양태에서, 면역자극 핵산은 화학식 IV에 도시된 구조를 갖는다.
당업자에 의해 인지되는 바와 같이, 도시된 분자의 말단은 이의 말단의 상보적인 서열이 당해 영역에 수소 결합되어 있기 때문에 2차 구조를 갖는다. 특정 양태에서, 리간드와 같은 분자는 말단에 부착되어 세포 흡수를 촉진시키거나 분자의 안정성을 개선시킬 수 있다.
본 발명의 몇몇 핵산 분자의 비제한적인 예는 표 5에 도시되어 있다.
표 5.
* 대문자-PS; 소문자-PO; 굵게 표시한-2'-O-메틸-리보누클레오티드(116 및 117에서); G-2'-데옥시-7-데아자-G(118에서); G -아라G(119에서); X-C3-링커(127 및 128에서).
또한, 본 발명의 핵산 분자는 비-누클레오티드 링커에 의해 연결된 2개의 이뮤노머일 수 있다. 이들 분자의 비제한적인 대표적인 예는 표 6에 제공된다.
표 6.
* 대문자-PS; 소문자-PO; X-C3-링커; Y-테트라에틸렌글리콜 링커; Z-헥사에틸렌글리콜 링커, 굵게 표시한-2'-O-메틸리보누클레오티드(134 및 147에서); G-2'-데옥시-7-데아자-G(135에서).
또한, 추가로 비제한적인 대표적인 예는 표 7에 제공된다.
표 7.
이탤릭체는 포스포디에스테르 연결체를 나타내고 또 다른 연결체는 다르게 지적되지 않는 경우 포스포로티오에이트이다.
밑줄친 부분 = 2'-OMe-누클레오시드; X = C3 링커
R= 2'-데옥시-7-데아자구아노신 G1 = 2'-데옥시-7-데아자구아노이스.
본 발명의 또 다른 양태는 면역자극 올리고누클레오티드 및/또는 이뮤노머의 서열이 적어도 부분적으로 자가 상보적인 면역자극 핵산을 제공한다. 본원에 사용되는 바와 같은 자가 상보적인 서열은 적합하게 정렬되는 경우 분자내 또는 보다 전형적으로는 분자 상호간 염기쌍을 G-C, A-T, A-U 및/또는 G-U 불안정한 쌍 사이에 형성할 수 있다. 일 구체예에서, 자가 상보성의 정도는 50% 이상이다. 예를 들어, 50% 이상의 자가 상보성인 8량체는 4, 5, 6, 7 또는 8개의 G-C, A-T, A-U 및/또는 G-U의 불안정한 염기쌍을 형성할 수 있는 서열을 가질 수 있다. 그러나 당해 염기쌍은 자가 상보적인 면역자극 올리고누클레오티드 및/또는 이뮤노머의 어느 하나의 말단에 위치한 염기를 반드시 포함할 필요는 없다. 핵산 안정화가 면역자극 올리고누클레오티드 및/또는 이뮤노머에 중요할 수 있는 경우, 염기쌍 형성 또는 어떠한 다른 적합한 수단에 의해 이중 가닥 핵산의 한 말단 또는 양 말단을 함께 클램핑하는 것이 유리할 수 있다. 자가 상보성의 정도는 면역자극 올리고누클레오티드 및/또는 이뮤노머간의 정렬에 의존하고 당해 정렬은 단일 또는 다중 누클레오시드 오버행 (overhang)을 포함하거나 포함하지 않을 수 있다. 또 다른 구체예에서, 자가 상보성의 정도는 60% 이상, 70% 이상, 80% 이상, 90% 이상 또는 심지어 100%이다.
비제한적인 예를 통해, 당해 양태의 특정 구체예에서, 면역자극 핵산은 화학식 V에 도시된 바와 같은 구조를 갖는다:
당업자에 의해 인지되는 바와 같이, 도시된 이뮤노머 화합물은 도메인의 서열이 분자내 수소 결합을 허용하도록 상보적이기때문에 2차 구조를 갖는다. 도메인 A 및 A'는 동일하거나 동일하지 않을 수 있고 도메인 A 및 C는 동일하거나 동일하지 않을 수 있고 도메인 A' 및 C는 동일하거나 동일하지 않을 수 있고 도메인 A' 및 C'는 동일하거나 동일하지 않을 수 있고 도메인 B 및 B'는 동일하거나 동일하지 않을 수 있고 도메인 C 및 C'는 동일하거나 동일하지 않을 수 있다. 더욱이, 추가의 이뮤노머는 분자간 수소 결합을 통해 결합함으로써 본 발명에 따른 이뮤노머의 쇄, 또는 다량체가 될 수 있다. n은 임의의 수의 연속 자가 상보적 이뮤노머 화합물일 수 있다.
본원에 사용된 바와 같이, 용어 "상보적"이란 핵산과 하이브리드화될 수 있는 능력을 갖고 있음을 의미한다. 이러한 하이브리드화는 통상적으로 상보적 가닥 사이에 수소 결합한 결과이고 바람직하게는 왓슨-크릭 또는 후그스틴 염기쌍을 형성하지만 기타 방식의 수소 결합 및 염기 스택킹이 또한 하이브리드화를 유도할 수 있다.
본원에 사용된 바와 같이, 용어 "2차 구조"는 분자간 수소 결합을 의미한다. 분자간 수소 결합은 이본쇄 핵산 분자를 형성시킨다.
비제한적인 대표적인 핵산 분자는 표 8에 제공된다.
표 8.
정상적인 글자체는 포스포로티오에이트 연결체를 나타낸다.
G1 = 2'-데옥시-7-데아자구아노신
G2 = 아라비노구아노신
G3 = 2'-데옥시이노신
C1 = 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸푸린
C2 = 아라비노시티딘
C3 = 2'-데옥시-5-하이드록시시티딘
X = C3 링커
본 발명의 방법에 사용하기 위해 특히 바람직한 이뮤노머는 하기의 구조를 갖는다.
본 발명의 모든 양태에 따른 방법 및 조성물은 질환을 치료하기 위한 치료학적 방법에 유용하고 여기서 치료는 면역계 조정 및 면역 기반 치료를 포함한다. 특히 바람직한 질환 표적물은 암, 감염성 질환 및 알레르기를 포함한다.
특정 양태에서, 치료 방법은 암을 치료하기 위한 것이다. 암 또는 종양은 담즙관 암; 뇌암; 유방암; 경부암 (cervial cancer); 융모막암종 (chorocarcinoma); 결장암 (colon cancer); 자궁내막암 (endometrial cancer); 식도암 (esophageal cancer); 위암 (gastric cancer); 상피내 신생물 (intraepithelial neoplasms); 림프종 (lymphomas); 간암; 폐암(예를 들어, 소세포 및 비소세포); 흑색종; 신경아종 (neuroblastomas); 구강암; 난소암; 췌장암; 전립선암; 직장암; 육종 (sarcomas); 피부암; 고환암 (testicular cancer); 갑상선암 (thyroid cancer) 및 망막암 (renal cancer) 및 기타 암종 및 육종을 포함하지만 이에 제한되지 않는다.
일부 구체예에서, 치료학적 방법은 감염을 치료하기 위한 것이다. 비제한적인 예를 통해, 인간을 감염시키는 것으로 밝혀진 바이러스는, 레트로비리대(Retroviridae)(예를 들어, 인간 면역결핍 바이러스, 예를 들어, HIV-1 (또한 HTLV-Ⅲ, LAV 또는 HTLV-III/LAV, 또는 HIV-III로서 언급됨), 및 기타 단리체, 예를 들어 HIV-LP; 피코나비리대(Picornaviridae) (예를 들어, 폴리오 바이러스, A형 간염 바이러스; 엔테로바이러스(enteroviruses), 인간 콕사키 바이러스(human Coxsackie viruses), 리노바이러스(rhinoviruses), 에코바이러스(echoviruses)); 칼시비리대(Calciviridae)(예를 들어, 위장염을 일으키는 종); 토가비리대(Togaviridae) (예를 들어, 말 뇌염 바이러스, 루벨라(rubella) 바이러스); 플라비리대(Flaviridae) (예를 들어, 뎅기 (dengue) 바이러스, 뇌염 바이러스, 황색 열 바이러스); 코로노리비대(Coronoviridae)(예를 들어, 코로나바이러스(coronaviruses); 라브도비라대(Rhabdoviradae) (예를 들어, 소포성 구내염 바이러스, 랍비 (rabies) 바이러스); 필로비리대(Filoviridae)(예를 들어, 에볼라 바이러스); 파라믹소비리대(Paramyxoviridae) (예를 들어, 파라인플루엔자 바이러스, 이하선염 바이러스, 홍역 바이러스, 호흡기 세포융합 바이러스); 오르토믹소비리대(Orthomyxoviridae)(예를 들어, 인플루엔자 바이러스); 분가비리대(Bungaviridae)(예를 들어. 한탄 바이러스, 분가 바이러스, 플레보바이러스 및 나이로 바이러스); 아레나 비리대 (출혈열 바이러스); 레오비리대 (예를 들어, 레오바이러스, 오르비바이러스 및 로타바이러스); 비르나비리대; 헤파드나비리대(Hepadnaviridae)(B형 간염 바이러스); 파르보비리대(Parvovirida) (파르보바이러스(parvoviruses)); 파포바비리대(Papovaviridae)(파필로마 바이러스, 폴리오마 바이러스); 아데노비리대(Adenoviridae)(대부분 아데노바이러스); 헤르페스비리대(Herpesviridae)(헤르페스 심플렉스 바이러스(HSV) 1 및 2, 바리셀라 조스터 바이러스, 사이토메갈로바이러스(CMV), 헤르페스 바이러스; 폭스비리대 (Poxviridae) (바리올라 (variola) 바이러스, 백시니아 바이러스, 폭스 (pox) 바이러스); 및 이리도비리대(Iridoviridae) (예를 들어, 아프리카 멧돼지 열 바이러스); 및 미분류 바이러스(예를 들어, 스폰지 형태의 뇌병증의 병인 제제, 델타 간염 바이러스 제제(B형 간염 바이러스에 속하는 결손체인 것으로 사료됨), A형 B형 간염 바이러스가 아닌 제제(부류 I= 내부로 전달됨; 부류 2= 비경구적으로 전달됨(즉, C형 간염 바이러스); 노르워크(Norwalk) 및 관련 바이러스 및 아스트로바이러스)를 포함하지만 이에 제한되지 않는다.
특정 양태에서, 본 발명의 치료학적 방법은 알레르기 치료에 관한 것이다. "알레르겐"은 민감한 피검체에서 알레르기 또는 천식 반응을 유도할 수 있는 물질(항원)을 의미한다. 알레르겐의 종류는 방대하고 꽃가루, 곤충 독, 동물 비듬 먼지, 진균류 포자 및 약제(예를 들어, 페니실린)를 포함할 수 있다. 천연, 동물성 및 식물성 알레르겐의 예는 하기의 속에 특이적인 단백질을 포함하나 이에 제한되지 않는다: 캐닌 (Canine) (캐니스 패밀리아리스(Canis familiaris)); 더마토파고이데(Dermatophagoides) (예를 들어, 더마토파고이데 파리내)); 펠리스 (펠리스 도메스티쿠스(Felis domesticus)); 암브로시아(Ambrosia)(암브로시아 아테미스폴리아); 롤륨(Lolium)(예를 들어, 롤륨 페레네(Lolium perenne) 또는 롤륨 멀티플로룸( Lolium multiflorum)); 크립토메리아(Cryptomeria)(크립토메리아 야포니카(Cryptomeria japonica)); 알테르나리아(Alternaria) (알테르나리아 알테르나타(Alternaria alternata)); 알더(Alder); 알누스(Alnus) (알누스 굴티노아사(Alnus gultinoasa)); 베툴라(Betula)(베툴라 베르루코사(Betula verrucosa)); 쿠어쿠스(Quercus)(쿠어쿠스 알바(Quercus alba)); 올레아(Olea)(올레아 유로파(Olea europa)); 아테미시아(Artemisia)(아테미시아 불가리스(Artemisia vulgaris)); 플란타고(Plantago)(예를 들어, 플란타고 란세올라타(Plantago lanceolata)); 파리에타리아(Parietaria)(예를 들어, 파리에타리아 오피시날리스(Parietaria officinalis) 또는 파리에타리아 유다이카(Parietaria judaica)); 블라텔라(Blattella)(예를 들어, 블라텔라 게르마니카(Blattella germanica)); 아피스(Apis)(예를 들어, 아피스 물티글로룸(Apis multiglorum)); 쿠프레써스(Cupressus) (예를 들어, 쿠프레써스 셈페르비렌스(Cupressus sempervirens), 쿠프레써스 아리조니카(Cupressus arizonica) 및 쿠프레써스 마크로카르파(Cupressus macrocarpa)) ; 유니페루스(Juniperus)(예를 들어, 유니페루스 사비노이데스(Juniperus sabinoides), 유니페루스 비르기니아나(Juniperus virginiana), 유니페루스 코뮤니스(Juniperus communis) 및 유니페루스 아스헤이(Junipers ashei)); 투야(Thuya) (예를 들어, 투야 오리엔탈리스(Thuya orientalis)); 카마에시파리스(Chamaecyparis)(예를 들어, 카마에시파리스 오브투사(Chamaecyparis obtusa)); 페리플라네타(Periplaneta)(예를 들어, 페리플라네타 아메리카나(Periplaneta americana)); 아그로피론(Agropyron)(예를 들어, 아그로피론 레펜스(Agropyron repens)); 세칼레(Secale)(예를 들어, 세칼레 세레알레); 트리티쿰(Triticum)(예를 들어, 트리티쿰 아에스티붐(Triticum aestivum)); 닥틸리스(Dactylis)(예를 들어, 탁틸리스 글로메라타(Dactylis glomerata)); 페스투카(Festuca)(예를 들어, 페스투카 엘라티오르(Festuca elatior)); 포아(Poa)(예를 들어, 포아 프라텐시스(Poa pratensis) 또는 포아 콤프레싸(Poa compressa)); 아베나(Avena)(예를 들어, 아베나 사티바(Avena sativa)); 홀쿠스(Holcus)(예를 들어, 홀쿠스 라나투스(Holcus lanatus)); 안톡산툼(Anthoxanthum)(예를 들어, 안톡산툼 오도란툼(Anthoxanthum odoratum)); 아르헤나테룸(Arrhenatherum)(예를 들어, 아르헤나테룸 엘라티우스(Arrhenatherum elatius)); 아그로스티스(Agrostis)(예를 들어, 아그로스티스 알바(Agrostis alba)); 플레움(Phleum)(예를 들어, 플레움 프라텐세(Phleum pratense)) ; 팔라리스(Phalaris)(예를 들어, 팔라리스 아룬디카세아(Phalaris arundinacea)); 파스팔룸(Paspalum)(예를 들어, 파스팔룸 노타툼(Paspalum notatum)); 소르굼(Sorghum)(예를 들어, 소르굼 할레펜시스(Sorghum halepensis)); 및 브로무스(Bromus)(예를 들어, 브로무스 이네르미스(Bromus inermis)). 특이적 알레르겐은 시중에서 구입할 수 있다 (예를 들어, INDOOR Biotechnologies Inc., Charlottesville, VA 22903)].
제2 양태에서, 본 발명은 화학요법제를 상기 기술된 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물 및 접근가능한 5' 말단 이외의 위치에서 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물에 컨쥬게이션된 항원을 포함하는 면역자극 올리고누클레오티드 및/또는 이뮤노머 컨쥬게이트와 함께 환자에게 투여하는 것을 포함하여, 암 환자의 암을 치료하는 방법을 제공한다. 몇몇 구체예에서, 비-누클레오티드 링커는 암과 관련된 항원을 포함하고, 이것은 올리고누클레오티드에 컨쥬게이션된다. 몇몇 다른 구체예에서, 항원은 이의 3' 말단 이외의 위치에서 올리고누클레오티드에 컨쥬게이션된다. 몇몇 구체예에서, 항원은 백신 효과를 제공한다. 본 발명의 목적상, "관련된(associated with)"이란 용어는 암이 존재할 때 항원이 존재하나, 암이 부재할 때 항원이 부재하거나 감소된 양으로 존재하는 것을 의미한다.
면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물은 항원에 공유 결합되거나, 다르게는 항원에 작동적으로 관련된다. 본원에서 사용된 "작동적으로 관련된"이란 용어는 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물 및 항원 둘 모두의 활성을 유지시키는 임의의 관련형태를 의미한다. 상기 작동적 관련형태의 비제한적인 예로는 동일한 리포솜 또는 그러한 다른 전달 비히클 또는 시약의 일부가 되는 것이 있다. 추가로, 항원을 엔코딩하는 핵산 분자가 발현 벡터로 클로닝되어 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물와 함께 투여될 수 있다. 본원에서 사용된 "벡터"란 용어는 이에 결합되어 있는 또 다른 핵산을 운반할 수 있는 핵산 분자를 언급한다. 바람직한 벡터는 자율적 복제가 가능하여 이에 결합된 핵산을 발현시킬 수 있는 것들이다 (예컨대, 에피솜). 벡터에 작동적으로 결합된 유전자의 발현을 유도할 수 있는 벡터를 본원에서 "발현 벡터"로서 언급한다. 일반적으로 재조합 DNA 기술에서 유용한 발현 벡터는, 벡터 형태에서 염색체에 결합되지 않은 일반적으로 원형 이중 가닥 DNA 루프를 의미하는 "플라스미드"의 형태로 종종 존재한다. 본 명세서에서, 플라스미드가 가장 일반적으로 사용되는 벡터의 형태이므로 "플라스미드" 및 "벡터"는 상호교환적으로 사용된다. 그러나 본 발명은 동등한 작용을 나타내고 당 분야에서 본원에 후속하여 공지될 발현 벡터의 다른 형태를 포함하도록 의도된다.
면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물이 항원에 공유적으로 결합되는 구체예에서, 상기 공유 결합은 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물상에서 면역자극 올리고누클레오티드의 접근가능한 5' 말단 이외의 임의의 위치에 존재하는 것이 바람직하다. 예를 들어, 항원은 누클레오시드간 결합에 부착될 수 있거나 비-누클레오티드 링커에 부착될 수 있다. 대안적으로, 항원 자체가 비-누클레오티드 링커일 수 있다.
제3 양태에서, 본 발명은 본 발명에 따른 면역자극 올리고누클레오티드 및/또는 면역자극 올리고누클레오티드 컨쥬게이트 및/또는 이뮤노머 화합물 또는 이뮤노머 컨쥬게이트, 화학요법제 및 생리학적으로 허용되는 담체를 포함하는 약제 조성물을 제공한다. 본원에서 사용된 "생리학적으로 허용되는"이란 용어는 이뮤노머의 유효성을 방해하지 않고 세포, 세포 배양액, 조직 또는 유기체와 같은 생물학적 시스템에 적합한 물질을 의미한다. 바람직하게는, 생물학적 시스템은 척추동물과 같은 살아있는 유기체이다. 바람직한 화학요법제로는 젬시타빈 메토트렉세이트, 빈크리스틴, 아드리아마이신, 시스플라틴, 당 비함유 클로로에틸니트로소우레아, 5-플루오로우라실, 미토마이신 C, 블레오마이신, 독소루비신, 다카르바진, 탁솔, 프라질린, 메글라민 GLA, 발루비신, 카르무스타인 및 폴리퍼포산, MMI270, BAY 12-9566, RAS 파메실 트랜스퍼라아제 억제제, 파메실 트랜스퍼라아제 억제제, MMP, MTA/LY231514, LY264618/로메텍솔, 글라몰렉, CI-994, TNP-470, 히캄틴/토포테칸, PKC412, 발스포다르/PSC833, 노반트론/미트록산트론, 메타레트/수라민, 바티마스타트, E7070, BCH-4556, CS-682, 9-AC, AG3340, AG3433, 인셀/VX-710, VX-853, ZD0101, ISI641, ODN 698, TA 2516/마르미스타트, BB2516/마르미스타트, CDP 845, D2163, PD183805, DX8951f, 레모날 DP 2202, FK 317, 이마티니브 메실레이트/글리벡, 이마티니브 메실레이트/글리벡, 피시바닐/OK-432, AD 32/발루비신, 메타스트론/스트론튬 유도체, 테모달/테모졸로미드, 에바세트/리포솜 독소루비신, 유탁산/파클리탁셀, 탁솔/파클리탁셀, 젤로드/카페시타빈, 프루툴론/독시플루리딘, 시클로팍스/경구 파클리탁셀, 경구 탁소이드, SPU-077/시스플라틴, HMR 1275/플라보피리돌, CP-358 (774)/EGFR, CP-609 (754)/RAS 온코진 억제제, BMS-182751/경구 플라티넘, UFT(테가푸르/우라실), 에르가미솔/레바미솔, 에닐우라실/776C85/5FU 인핸서, 캄프토/레바미솔, 캄프토사르/아이리노테칸, 투모덱스/랄리트렉세드, 루스타틴/클라드리빈, 팍세스/파클리탁셀, 독실/리포솜 독소루비신, 캘릭스/리포솜 독소루비신, 플루다라/플루다라빈, 파마루비신/에피루비신, 데포시트, ZD1839, LU 79553/비스-나프탈이미드, LU 103793/돌라스타틴, 캐틱스/리포솜 독소루비신, 젬자르/젬시타빈, ZD 0473/아노르메드, YM 116, 로딘 시드, CDK4 및 CDK2 억제제, PARP 억제제, D4809/덱시포사미드, 이페스/메스넥스/이포사미드, 부몬/테니포시드, 파라플라틴/카르보플라틴, 플란티놀/시스플라틴, 베페시드/에토포시드, ZD 9331, 탁소테레/도세탁셀, 구아닌 아라비노시드의 프로드러그` `42312, 탁산 유사체, 니트로소우레아, 멜펠란 및 시클로포스파미드와 같은 알킬화제, 아미노글루테티미드, 아스파라기나아제, 부술판, 카르보플라틴, 클로롬부실, 시타라빈 HCl, 닥티노마이신, 다우노루비신 HCl, 에스트라무스틴 포스페이트 나트륨, 에토포시드 (VP16-213), 플록스우리딘, 플루오로우라실 (5-FU), 플루타미드, 히드록시우레아 (히드록시카르바미드), 이포스파미드, 인터페론 알파-2a, 알파-2b, 류프롤리드 아세테이트 (LHRH-방출 인자 유사체), 로무스틴 (CCNU), 메클로르에타민 HCl (질소 머스타드), 메르캅토푸린, 메스나, 미토탄 (o.p'-DDD), 미톡산트론 HCl, 옥트레오티드, 플리카마이신, 프로카르바진 HCl, 스트렙토조신, 타목시펜 시트레이트, 티오구아닌, 티오테파, 빈블라스틴 설페이트, 암사크린 (m-AMSA), 아자시티딘, 에리트로포이에틴, 헥사메틸멜라민 (HMM), 인터류킨 2, 미토구아존 (메틸-GAG; 메틸 글리옥살 비스-구아닐히드라존; MGBG), 펜토스타틴 (2'데옥시코포르마이신), 세무스틴 (메틸-CCNU), 테니포시드 (VM-26) 및 빈데신 설페이트가 있으나, 이로 제한되지 않는다.
또 다른 구체예에서, 제형은 EFG, 항-유전형(anti-idiotype) 암 백신, Gp75 항원, GMK 흑색종 백신, MGV 강글리오시드 컨쥬게이트 백신, Her2/new, 오바렉스, M-박스, O-박스, L-박스, STn-KHL 테라토프, BLP25 (MUC-1), 리포솜 유전형 백신, 멜라신, 펩티드 항원 백신, 톡신/항원 백신, MVA-베이스드(MVA-vased) 백신, PACIS, BCG 백신, TA-HPV, TA-CIN, DISC-바이러스 및 ImmunCyst/TheraCys로 구성된 군으로부터 선택된 암 백신을 포함한다.
추가의 양태에서, 본 발명은 모노클로날 항체를 본원에 기술된 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물과 함께 환자에게 투여하는 것을 포함하여 암 환자에서 암을 치료하는 방법을 제공한다. 항체, 특히 모노클로날 항체 형태의 수동적 면역치료는 항암제로서 상당한 연구 및 개발의 대상이 되어 왔다. 본원에서 사용된 "모노클로날 항체"란 용어는 단일 분자 조성을 지닌 항체 분자를 의미한다. 모노클로날 항체 조성물은 특정 에피토프에 대하여 단일한 결합 특이성 및 친화력을 나타낸다. 따라서, "사람 모노클로날 항체"란 용어는 사람 배선(germline) 면역글로불린 서열로부터 유래된 가변 영역 및 불변 영역을 지니며 단일 결합 특이성을 나타내는 항체를 의미한다. 항암제의 예로는 파노렉스 (글락소-웰컴), 리툭산 (IDEC/Genentech/Hoffman la Roche), 밀로타르그 (Wyeth), 캄파트 (Millennium), 제발린 (IDEC and Schering AG), 벡사르 (Corixa/GSK), 에르비툭스 (Imclone/BMS), 아바스틴 (Genentech) 및 헤르셉틴 (Genentech/Hoffman la Roche)이 있으나, 이로 제한되지 않는다. 항체는 또한 암 항원을 모방하는 것처럼 보이는 (면역학적 의미에서) 항-유전형 항체를 이용하는 능동적 면역치료에서 사용될 수 있다. 모노클로날 항체는 재조합 DNA 기술 분야의 당업자에게 공지된 방법에 의해 생성될 수 있다.
본원에서 사용된 "담체"란 용어는 임의의 부형제, 희석제, 충전제, 염, 완충액, 안정화제, 가용화제, 지질, 또는 약제 제형에 사용되는 당 분야에 널리 공지된 다른 재료를 포함한다. 담체, 부형제 또는 희석제의 특성은 특정 응용에 대한 투여 경로에 의존할 것으로 이해될 것이다. 상기 재료를 함유하는 약제학적으로 허용되는 제형의 제조가, 예컨대 문헌[Remington's Pharmaceutical Sciences, 18th Edition, ed. A. Gennaro, Mack Publishing Co., Easton, PA, 1990]에 개시되어 있다.
톨(Toll)형 수용체(RLR)는 감염 센서로서 작용하고 선천적 및 후천적 면역 반응의 활성화를 유도한다. TLR은 병원체 관련 분자 패턴(PAMP)으로 불리우는 광범위하게 다양한 리간드를 인지한다. 보존된 병원체 관련 분자 생성물을 인지하면, TLR은 이들의 세포내 시그날 전달 도메인, 톨/인터류킨-1 수용체(TLR) 도메인 및 다운스트림 어댑터 단백질 MyD88을 통해 숙주 방어 반응을 활성화시킨다. 수지상 세포 및 마크로파아지는 정상적으로 톨형 수용체(TLR) 리간드 및 사이토킨(예를 들어, 인터류킨-1β; IL-6 및 종양 괴사 인자, TNF)에 반응하고 이들은 또한 천연 킬러(NK) 세포를 생성시키고 T 세포가 또한 관여된다. 박테리아 화합물에 의한 TLR 자극 후, 선천적 면역 세포는 다양한 사이토킨을 방출한다. TLR 리간드의 몇몇 예는 지질단백질; 펩티도글리캔, 자이모산(TLR2), 이중가닥 RNA, 폴리I:폴리C(TLR3), 리포폴리사카라이드, 열 쇼크 단백질, 탁솔(TLR4), 플라겔린(TLR5) 및 이미다조퀴놀린-R848, 레시퀴모드, 이미퀴모드; ssRNA(TLR7/8)을 포함하지만 이에 제한되지 않는다.
제4 양태에서, 본 발명은 암 세포를 이온화 방사선에 감작화시키는 방법을 제공한다. 본 발명의 본 양태에 따른 방법은 본 발명에 따른 면역자극 올리고누클레오티드 또는 이뮤노머 화합물을 포유동물에 투여하고 동물을 이온화 방사선으로 처리함을 포함한다. 특정 바람직한 양태에서, γ방사선은 분당 1.56 Gy로 조사한다. 특정 바람직한 양태에서, 방사선 치료는 약 0.1 내지 약 10.0 Gy, 바람직하게 약 0.25 내지 약 8.0 Gy, 보다 바람직하게, 약 0.5 내지 약 5.0Gy 또는 3.0Gy로서 주 2회, 주 4회 또는 2, 4 및 9일째에 3회 조사한다. 특정 양태에서, 면역자극 올리고누클레오티드 또는 이뮤노머 화합물로의 전처리는 γ방사선 조사하기 약 2 내지 약 6시간 전에 한다.
제5 양태에서, 본 발명은 치료학적 상승 작용을 하는 유효량의 IL-2 및 항원과 함께, 치료학적 상승 작용을 하는 유효량의 이뮤노머 화합물을 환자에게 투여함을 포함하여 환자내 면역반응을 상승 작용적으로 자극시키는 방법으로서, 상기 조합물의 투여는 환자에서 상승 작용적으로 사이토킨의 생산을 자극한다. 본 발명에 따라 자극된 바람직한 사이토킨은 하나 이상의 IL-12, 인터페론-γ, IFN-α 및 IFN-β를 포함하지만 이에 제한되지 않는다.
특정 구체예에서, 본 방법은 암을 치료하기 위한 것이고 항원은 암에 특이적이거나 암과 관련된다. 일부 구체예에서, 본 방법은 감염 치료를 위한 것이고 항원은 감염과 관련된다. 특정 구체예에서, 본 방법은 알레르기 치료를 위한 것이고 항원은 알레르기와 관련되어 있다. 본원에 사용된 바와 같이, 용어 "와 관련된"은 항원이, 암, 알레르겐 또는 감염성 질환이 존재하는 경우 존재하지만 암, 알레르겐 또는 감염성 질환이 부재인 경우 존재하지 않거나 감소된 양으로 존재함을 의미한다.
본원에 사용된 바와 같이, 용어 "항원"은 항체 또는 T 세포 항원 수용체에 의해 특이적으로 인지되고 결합되는 물질을 의미한다. 항원은 펩타이드, 단백질, 당단백질, 폴리사카라이드, 갱글리오사이드 및 지질; 이의 일부 및 이의 배합물을 포함할 수 있다. 본 항원은 천연적으로 존재하는 항원일 수 있거나 합성된 것일 수 있다. 합텐은 "항원"의 범위내에 포함된다. 합텐은 그 자체가 면역원성이 아니지만 항원성 결정인자를 함유하는 면역원성 분자와 컨주게이팅되는 경우 면역원성이 부여되는 저분자량의 화합물이다.
특정 구체예에서, 본 발명의 방법 및 조성물에 유용한 항원은 종양 관련되고/되거나 종양 특이적인 항원이다. 비제한적인 예는 전립선 암의 존재하에 상승될 수 있는 정상적으로 소량으로 혈중에 존재하는 마커인 전립선 특이적 항원(PSA) 및 전립선 산 포스파타제(PAP); 난소암을 앓는 환자에 상승된 수준으로 존재하고 때때로 기타 암의 존재하에 상승되는 암 항원 125(CA-125); 유방암 과정 및 처리에 대한 이의 반응 후 유용한 CA 15-3 및 CA 27-29; 췌장암의 전이에 대한 마커로서 일반적으로 사용되고 또한 결장직장, 위 및 담즙관 암을 앓는 환자에서 또한 상승되는 CA19-9; 정상적으로 소량으로 존재하지만 다양한 암을 앓는 환자의 혈중에서 상승될 수 있는 암배아 항원(CEA); 간세포 및 생식 세포(비세미노마) 암종에 대한 마커인 알파-페토단백질; 및 주로 위장관의 다양한 악성종양에서 상승되는 것으로 밝혀진 갈락토실 트랜스퍼라제의 동위효소인 갈락토실 트랜스퍼라제 II를 포함한다. 당업자에게 공지된 바와 같이, 종양 관련 및 종양 특이적 항원은 시중에서 입수가능하다. 또한, 재조합 핵산 기법에 의해 제조될 수 있는 항원 및/또는 합성 항원 예를 들어, 당해분야에 공지된 방법에 의해 생성된 펩티드가 고려된다.
본 발명의 제 5 양태의 특정 구체예에서, 본 발명은 상기된 바와 같이 이뮤노머 화합물을 포함하는 이뮤노머 컨쥬게이트 및 항원과 함께, 치료학적 상승 작용을 하는 유효량의 IL-2를 환자에게 투여함을 포함하여 암 환자의 암을 치료하는 방법을 제공한다. 특정 구체예에서, 항원은 접근 가능한 5'말단 이외의 위치에서 이뮤노머 화합물에 컨주게이팅된다. 일부 구체예에서, 이뮤노머 화합물의 비-누클레오티드 링커는 암과 관련된 항원을 포함한다. 일부 구체예에서, 항원은 5' 말단 이외의 위치에서 이뮤노머 화합물에 컨주게이팅된다. 일부 구체예에서, 항원은 백신 효과를 나타낸다. 본 발명의 목적을 위해, 용어 "과 관련된"은 항원이 암이 존재하는 경우 존재하지만 암이 부재인 경우는 존재하지 않거나 감소된 양으로 존재함을 의미한다.
본 발명의 제5 양태의 일부 구체예에서, 이뮤노머 화합물은 항원에 공유적으로 연결되거나 항원과 작동적으로 연관되어 있다. 본원에 사용된 바와 같이, 용어 "작동적으로 관련된"은 이뮤노머 화합물 및 항원의 활성을 유지하는 임의의 연합을 의미한다. 이러한 작동적 연합의 비제한적인 예는 동일한 리포좀 또는 기타 전달 비히클 또는 시제의 일부를 포함한다. 이뮤노머 화합물이 공유적으로 항원에 연결되는 구체예에서, 이러한 공유 연결체는 바람직하게 이뮤노머 화합물의 접근 가능한 5'말단 이외의 임의의 위치에서 이뮤노머 화합물상에 존재한다. 예를 들어, 항원은 누클레오시드 연결체에 부착되거나 비-누클레오시드 링커에 부착될 수 있다. 또한, 항원 자체는 비-누클레오시드 링커일 수 있다.
본 발명의 제6 양태에서, 이뮤노머 화합물이 아닌 하나 이상의 면역자극 올리고누클레오티드는 치료학적 유효량의 IL-2와 함께 사용되어 선택적으로 및 상승 작용적으로 환자에서 사이토킨의 생산을 자극한다. 본 발명에 따라 상승 작용적으로 자극된 바람직한 사이토킨은 IL-12 및 IFN-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택된다. 본 발명에 따라, 이뮤노머 화합물이 아닌 바람직한 면역자극 올리고누클레오티드는 하나 이상의 면역자극 CpG 디누클레오티드(여기서, C는 사이토신 또는 데옥시사이토신이 아니고/아니거나 G는 구아노신 또는 2-데옥시구아노신이 아니다)를 함유하는 것들을 포함한다. 이뮤노머 화합물이 아닌 본 발명의 또 다른 바람직한 면역자극 올리고누클레오티드는 CpG가 아닌 대안적인 면역자극 잔기를 포함하는 것들이다. 이러한 대안적인 면역자극 잔기의 예는 본원에 참조로서 인용되는 하기의 미국 특허 및 계류중인 미국 특허원에 기재된 바와 같이 올리고누클레오티드를 안정화시키는 헤어핀 구조와 같은 올리고누클레오티드 자체의 2차 구조 및 천연적으로 존재하지 않는 염기 및/또는 당을 포함하는 누클레오시드를 포함하지만 이에 제한되지 않는다: 미국 특허원 제6,426,334호 및 제6,476,000호 및 미국 특허원 제09/770,602호, 제09/845,623호, 제09/965,116호, 제60/440,587호, 제10/361,111호, 제60/471,247호, 제60/477,608호.
본 발명의 특정 양태에서, 이뮤노머 화합물 또는 면역자극 올리고누클레오티드 및 IL-2 각각은 환자에게 투여하기 전에 약제학적으로 허용되는 담체와 혼합된다. 특정 양태에서, 이뮤노머 화합물 또는 면역자극 올리고누클레오티드는 투여 전에 약제학적으로 허용되는 담체와 함께 혼합되거나 본 발명의 제4 양태에 기재된 바와 같이 약제학적 조성물의 일부로서 배합된다. 본원에 사용된 바와 같이, 용어 "담체"는 임의의 부형제, 희석제, 충전제, 염, 완충제, 안정화제, 가용화제, 지질 또는 약제학적 제제중에 사용하기 위해 당업계에 널리 공지된 기타 물질을 포함한다. 담체, 부형제 또는 희석제의 특징은 특정 적용을 위한 투여 경로에 의존하는 것으로 이해된다. 이들 물질을 함유하는 약제학적으로 허용되는 제형의 제제는 문헌[참조: Remington : The Science and Practice of Pharmacy, 20th Edition, ed. A. L. Gennaro, Lippincott Williams & Wilkins Publishing Co. , Philadelphia, PA, 19106 (ISBN: 0683306472)]에 기재되어 있다.
제7 양태에서, 본 발명은 약제학적으로 허용되는 담체, 치료학적 상승 작용을 하는 유효량의 이뮤노머 화합물 또는 면역자극 올리고누클레오티드, 치료학적 상승 작용을 하는 유효량의 IL-2 및 임의로 항원을 포함하는 치료학적 조성물로서, 이러한 치료학적 조성물의 투여는 환자에서 상승 작용적으로 사이토킨의 생산을 자극한다. 본 발명에 따라 상승 작용적으로 자극되는 바람직한 사이토킨은 IL-12 및 인터페론-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택된다.
발명의 모든 양태는 질환의 치료에 유용하고 특히 암, 감염성 질환 및 알레르기를 치료하기 위한 면역 기반 치료에 유용하다. 본원에 사용된 바와 같이, 용어 질환을 "치료하는" 또는 질환의 "치료"는 발병 후 질환의 예방, 질환의 징후 또는 증상의 감소 또는 근절 및 질환 재발의 예방을 포함한다.
본 발명에 따른 방법에서, IL-2와 함께 이뮤노머 화합물 또는 면역자극 올리고누클레오티드는 제한 없이, 비경구, 경구, 설하, 경피, 국소, 비강내, 에어로졸, 안내, 기관지내, 직장내, 질내, 유전자 총에 의한, 피부 패치 또는 안약 또는 마우스워시 형태를 포함하는 임의의 적합한 경로에 의해 투여될 수 있다. 이뮤노머 화합물, 면역자극 올리고누클레오티드, IL-2 또는 이의 치료학적 조성물의 투여는 치료학적 상승 작용을 하는 유효량을 사용하는 공지된 과정을 사용하여 질환을 치료하는데 효과적인 시간 동안 수행될 수 있다.
용어 "와 함께"는 동일한 환자에서 동일한 질환을 치료하는 과정에 있음을 의미하고, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물 및/또는 IL-2를, 동시 투여 뿐만 아니라 수 일 이하의 간격을 두고 순차적으로 투여하는 것을 포함하는 임의의 순서로 투여하는 것을 포함한다. 또한, 이러한 병용 처리는 독립적으로 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물, 및/또는 IL-2의 단일 투여 그 이상을 포함할 수 있다. 이뮤노머 화합물 및 IL-2의 투여는 동일하거나 상이한 경로에 의해 이루어질 수 있다.
당업자는 이뮤노머 화합물 또는 면역자극 올리고누클레오티드, IL-2 또는 둘 모두의 이러한 상승 작용 효과는 본 발명에 따라 치료될 조직, 기관, 특정 질환 또는 환자에 따라 상당히 다양할 수 있음을 인지할 것이다. 추가로, 당업자는 치료학적으로 상승 작용을 하는 유효량의 이뮤노머 화합물 또는 면역자극 올리고누클레오티드 또는 IL-2이 기타 성분의 양을 미세하게 조정하고 변화시켜 저하되거나 증가될 수 있음을 인지할 것이다.
전신 투여되는 경우, 이뮤노머 화합물은 바람직하게는, 약 0.0001 마이크로몰 내지 약 10마이크로몰 사이의 이뮤노머 화합물의 혈액 수준을 달성하기에 충분한 투여량으로 투여된다. 국소 투여를 위해서는 이 보다 훨씬 낮은 농도가 효과적일 수 있고 보다 높은 농도가 허용될 수 있다. 바람직하게는, 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물의 총 투여량은 하루 환자당 약 0.0001mg 내지 하루 체중 kg당 약 200mg의 범위이다. 개체에 단일 치료 에피소드로서 치료학적 상승 작용을 하는 유효량의 이뮤노머 화합물 또는 IL-2 각각을 동시에 또는 연속적으로 투여하는 것이 바람직할 수 있다. 바람직하게, IL-2는 약 750 내지 약 75,000 유니트의 양으로 투여된다.
본 발명은 사이토킨 및/또는 화학치료제 및 면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을 포함하는 키트를 제공하고, 후자는 2개 이상의 올리고누클레오티드가 함께 연결되어 이뮤노머 화합물이 하나 이상의 접근 가능한 5' 말단을 갖도록 2개 이상의 올리고누클레오티드를 포함하고 하나 이상의 올리고누클레오티드는 면역자극 올리고누클레오티드이다. 또 다른 측면에서, 키트는 본 발명에 따른 면역자극 올리고누클레오티드 및/또는 면역자극 올리고누클레오티드 컨쥬게이트 및/또는 이뮤노머 화합물 또는 이뮤노머 컨쥬게이트, 사이토킨 및/또는 화학요법제 및 생리학적으로 허용되는 담체를 포함한다. 키트는 또한 일반적으로 한 세트의 사용 지침서를 포함한다.
하기 실시예는 본 발명의 특정 바람직한 구체예를 설명하고자 하는 것이지, 본 발명의 범위를 제한하고자 하는 것은 아니다.
실시예 1: 면역조절 잔기를 함유하는 올리고누클레오티드의 합성
올리고누클레오티드는 도 5 및 6에 명시된 바와 같은 직렬 합성 또는 병렬 합성에 따라 자동화 DNA 합성기 (Expedite 8909; PerSeptive Biosystems, Framingham, MA)를 사용하여 1μmol 규모로 합성하였다.
데옥시리보누클레오시드 포스포르아미다이트는 제조원[Applied Biosystems(Foster City, CA)로부터 구입하였다. 1',2'-디데옥시리보오스 포스포르아미다이트, 프로필-1-포스포르아미다이트, 2-데옥시우리딘 포스포르아미다이트, 1,3-비스-[5-(4,4'-디메톡시트리틸)펜틸아미딜]-2-프로판올 포스포르아미다이트 및 메틸 포스폰아미다이트를 글렌 리서치(Glen Research) (Sterling, VA)로부터 얻었다. β-L-2'-데옥시리보누클레오시드 포스포르아미다이트, α-2'-데옥시리보누클레오시드 포스포르아미다이트, 모노-DMT-글리세롤 포스포르아미다이트 및 디-DMT-글리세롤 포스포르아미다이트를 켐진스(ChemGenes) (Ashland, MA)로부터 얻었다. (4-아미노부틸)-1,3-프로판디올 포스포르아미다이트 클론테크(Clontech) (Palo Alto, CA)로부터 얻었다. 아라비노시티딘 포스포르아미다이트, 아라비노구아노신, 아라비노티미딘 및 아라비노우리딘을 릴라이어블 파마슈티칼(Reliable Pharmaceutical) (St. Louis, MO)로부터 얻었다. 아라비노구아노신 포스포르아미다이트, 아라비노티미딘 포스포르아미다이트 및 아라비노우리딘 포스포르아미다이트를 하이브리돈, 인코포레이티드(Hybridon, Inc.) (Cambridge, MA) (Noronha et al. (2000) Biochem., 39:7050-7062)으로부터 얻었다.
모든 누클레오시드 포스포르아미다이트를 31P 및 1H NMR 스펙트럼으로 특성화시켰다. 변형된 누클레오시드를 정규 커플링 사이클을 이용하여 특정 부위에서 혼입시켰다. 합성 후에, 올리고누클레오티드를 농축된 수산화암모늄을 사용하여 탈보호시키고, 역상 HPLC로 정제한 다음, 투석시켰다. 정제된 올리고누클레오티드를 나트륨염 형태로서 사용전에 동결건조시켰다. 순도를 CGE 및 MALDI-TOF MS로 시험하였다.
실시예 2: 비장 세포 증식의 분석
비장세포 증식의 시험관내 분석을 상기된 바와 같은 표준 절차로 수행하였다 (참조: Zhao et al., Biochem Pharma 51:173-182 (1996)). 결과를 도 8A에 도시한다. 이러한 결과는, 보다 높은 농도에서, 두개의 접근가능한 5' 말단을 지니는 이뮤노머 6이 접근가능한 5' 말단을 지니지 않은 이뮤노머 5 또는 단일의 접근가능한 5' 말단을 지니는 올리고누클레오티드 4에 비해서 더 많은 비장세포 증식을 일으킴을 입증해준다. 이뮤노머 6은 또한 LPS 양성 대조군에 비해서 더 많은 비장세포 증식을 유발시킨다.
실시예 3: 생체내 비종대 분석
생체내 모델에 대한 시험관내 결과의 적용성을 시험하기 위해서, 선택된 올리고누클레오티드를 마우스에 투여하고 비장비대의 정도를 면역자극 활성 수준의 지표로서 측정하였다. 5 mg/kg의 단일 용량을 BALB/c 마우스(자성, 주령 4-6, (Harlan Sprague Dawley Inc, Baltic, CT))에게 복강내 투여하였다. 마우스를 올리고누클레오티드 투여 72 시간 후에 치사시키고, 비장을 수거하고, 중량을 측정하였다. 결과를 도 8B에 나타낸다. 이러한 결과는 두 개의 접근가능한 5' 말단을 지니는 이뮤노머 6이 올리고누클레오티드 4 또는 이뮤노머 5에 비해서 훨씬 큰 면역자극 효과를 지님을 입증해준다.
실시예 4: 사이토킨 분석
척추동물 세포, 바람직하게는 BALB/c 마우스 비장 세포 또는 사람 PBMC에서의 IL-12 및 IL-6의 분비를 샌드위치 ELISA로 측정하였다. 시토카인 항체와 시토카인 표준물을 포함하는 요구된 시약을 파밍진(PharMingen)(San Diego, CA)으로부터 구입하였다. ELISA 플레이트(Costar)를 PBSN 완충액 (PBS/0.05% 아지드화나트륨, pH 9.6)중의 5 μg/mL의 적절한 항체와 함께 밤새 4℃에서 인큐베이션한 후, 37℃에서 30분 동안 PBS/1% BSA로 블로킹시켰다. 세포 배양 상층액과 시토카인 표준물을 PBS/10% FBS로 적절히 희석시키고, 플레이트에 삼중으로 가하고, 25℃에서 2 시간 동안 인큐베이션하였다. 플레이트상에 1 μg/mL의 적절한 비오티닐화된 항체로 깔고 25℃에서 1.5 시간 동안 인큐베이션하였다. 플레이트를 이어서 PBS-T 완충액 (PBS/0.05% 트윈(Tween) 20)으로 광범하게 세척하고, 스트렙타비딘 컨쥬게이션된 퍼옥시다제(Sigma, St. Louis, MO)를 가한 후에 25℃에서 1.5 시간 동안 더 인큐베이션하였다. 플레이트를 슈어 블루(Sure BlueTM)(Kirkegaard and Perry) 발색시약으로 전개시키고, 반응을 정지 용액(Kirkegaard and Perry)을 가함으로써 종결시켰다. 색 변화를 세레스 900 HDI 분광계(Ceres 900 HDI Spectrophotometer) (Bio-Tek Instruments)로 측정하였다. 결과를 하기 도 5A에 나타낸다.
사람 말초 혈액 단핵세포(PBMC)를 건강한 지원자의 말초혈액으로부터 피콜-파큐 밀도구배 원심분리(Ficoll-Paque density gradient centrifugation) (Histopaque-1077, Sigma, St. Louis, MO)에 의해서 분리하였다. 요약하면, 헤파린화된 혈액을 코니칼 센트리퓨즈(conical centrifuge)중의 히스토파큐-1077(Histopaque-1077) (동일한 용적)상에 적층하고, 400 x g로 30분 동안 실온에서 원심분리하였다. 단핵세포를 함유하는 담황갈색의 피복물을 조심스럽게 제거하고, 등장성 포스페이트 완충 식염수(PBS)로 250 x g에서 10분 동안 원심분리에 의해서 2회 세척하였다. 생성된 세포 펠릿을 이어서 L-글루타민을 함유하는 RPMI 1640 배지(MediaTech, Inc., Herndon, VA)에 재현탁시키고, 10% 열 불활성화된 FCS 및 페니실린-스트렙토마이신(100U/ml)을 보충시켰다. 세포를 올리고누클레오티드의 존재 또는 부재하에서 1 X 106 세포/ml/웰로 상이한 시간 동안 24웰 플레이트에서 배양하였다. 인큐베이션 기간의 종료시점에, 상층액을 수거하고 IL-6 (BD Pharmingen, San Diego, CA), IL-10 (BD Pharmingen), IL-12 (BioSource International, Camarillo, CA), IFN-α (BioSource International) 및 -γ (BD Pharmingen) 및 TNF-α (BD Pharmingen)를 포함하는 다양한 시토카인에 대해서 샌드위치 ELISA로 검정할 때까지 -70℃에서 동결저장하였다. 결과를 하기 표 9 및 9A에 나타낸다.
모든 예에서, 세포 배양 상층액 중의 IL-12 및 IL-6의 수준을 각각 IL-12 및 IL-6에 대한 동일한 실험 조건하에 구성된 표준 곡선으로부터 계산하였다. 세포 배양 상층액 중의 IL-10, IFN-감마 및 TNF-α의 수준을 각각 IL-10, IFN-감마 및 TNF-α에 대한 동일한 실험 조건 하에 구성된 표준 곡선으로부터 계산하였다.
표 9. 사람 PBMC 배양물중의 이뮤노머 구조 및 면역자극 활성
D1 및 D2는 도너 1 및 2이다.
표 9A. BALB/c 마우스 비장 세포 배양물중에서 이뮤노머 구조 및 면역자극 활성
이택릴체는 포스포디에스테르 연결체를 나타낸다.
또한, 도 7A-C에 나타낸 결과는 두 개의 접근가능한 5' 말단을 지니는 이뮤노머 2가 각각 하나의 접근가능한 5' 말단을 지니거나 이러한 말단이 없는 올리고누클레오티드 1 또는 이뮤노머 3보다 IL-12 및 IL-6은 상승시키지만, IL-10은 상승시키지 않는다는 것을 입증해준다.
실시예 5: 비-천연 피리미딘 또는 비-천연 푸린 누클레오시드를 함유하는 이뮤노머 화합물의 면역자극 활성
표 10 내지 표 12에 도시된 바와 같이, 면역자극 활성은 면역자극 디누클레오티드 모티프중에 비-천연 피리미딘 누클레오시드 또는 비-천연 푸린 누클레오시드를 지니는 다양한 길이의 이뮤노머의 경우에 유지되었다.
표 10. 이뮤노머 구조 및 면역자극 활성
표 11. 이뮤노머 구조 및 면역자극 활성
표 12. 이뮤노머 구조 및 면역자극 활성
실시예 6: 면역자극 활성에 대한 링커의 효과
두개의 올리고누클레오티드를 연결하는 링커의 길이의 효과를 검사하기 위해, 동일한 올리고누클레오티드를 함유하나 상이한 링커를 함유하는 이뮤노머 화합물을 합성하고, 면역자극 활성에 대해 테스트하였다. 표 13에 나타낸 결과는 링커 길이가 이뮤노머 화합물의 면역자극 활성에서 역할을 한다는 것을 암시한다. 최상의 면역자극 효과는 C3 내지 C6-알킬 링커 또는 산재된 포스페이트 전하를 지니는 어베이직(abasic) 링커를 사용하여 달성되었다.
표 13. 이뮤노머 구조 및 면역자극 활성
실시예 7: 면역자극 활성에 대한 올리고누클레오티드 백본의 효과
일반적으로, 천연 포스포디에스테르 백본을 함유하는 면역자극 올리고누클레오티드는 포스포로티오에이트 백본을 지닌 동일한 길이의 올리고누클레오티드보다 면역자극성이 덜하다. 이러한 낮은 정도의 면역자극 활성은 실험 조건하에서 포스포디에스테르 올리고누클레오티드의 신속한 분해에 부분적으로 기인될 수 있다. 올리고누클레오티드의 분해는 주로 3' 말단으로부터 올리고누클레오티드를 분해하는 3'-엑소누클레아제의 결과이다. 본 실시예의 이뮤노머 화합물은 유리 3' 말단을 함유하지 않는다. 따라서, 포스포디에스테르 백본을 지니는 이뮤노머 화합물은 상응하는 단량체 올리고누클레오티드보다 실험 조건하에서 반감기가 더 길어야 하고, 이에 따라 개선된 면역자극 활성을 나타내야 한다. 표 14에 제시된 결과는 이러한 효과를 입증하는데, 이뮤노머 84 및 85는 BALB/c 마우스 비장 세포 배양물에서의 시토카인 유도에 의해 결정된 바와 같이 면역자극 활성을 나타낸다.
표 14. 이뮤노머 구조 및 면역자극 활성
L=C3-링커
실시예 8: 이뮤노머 화합물과 화학요법제 병용에 있어서의 생체내 항암 활성
PC3 세포를 인간 전립선 암 모델(PC3)을 확립시키기 위해 100 U/㎖ 페니실린 및 100 ㎍/㎖ 스트렙토마이신의 존재하에서 10 % 우태아 혈청(FBS)을 지닌 햄스(Ham's) F12K 배지에서 배양하였다. 4 내지 6주령의 수컷 무흉선 마우스(Frederick Cancer Research and Development Center, Frederick, MD)를 연구에 앞서 환경 적응을 위해 6일 동안 사육시켰다. 배양된 PC3 세포를 단층 배양물로부터 수거하고, 햄스 F12K 배지(10% FBS)로 두번 세척하고, FBS 비함유 햄스 F12K 배지:매트리겔 기저막 기질(Becton Dickinson Labware, Bedford, MA)(5:1 ; V/V)에 재현탁시키고, 각각의 마우스의 좌측 서혜부에 피하 주사하였다 (5 x 106 세포, 총 부피 0.2 ml). 상기 동물들을 일반 임상 관찰, 체중, 및 종양 성장에 대해 모니터링했다. 종양 성장을 캘리퍼스를 사용하여 이식물의 두개의 수직판 직경의 측정에 의해 모니터링했다. 종양 크기(g 중량)를 공식 1/2a X b2를 사용하여 계산하였는데, 여기서 'a'는 긴 직경(㎝)이고, 'b'는 짧은 직경(㎝)이다. 평균 종양 크기가 ~80 ㎎에 도달하는 경우, 인간 암 이종이식물을 지니는 상기 동물을 무작위적으로 치료군 및 대조군(5마리의 동물/군)으로 나누었다. 대조군에게는 멸균된 생리식염수(0.9% NaCl)만을 투여했다. 생리식염수중에 무균적으로 용해시킨 이뮤노머 26 또는 194를 주당 3회의 투여로 0.5 또는 1.0 ㎎/㎏/일의 용량으로 피하 주사하였다. 젬시타빈 HCl(Eli Lilly and Company, Indianapolis, IN)을 0일 및 3일째에 160 ㎎/㎏으로 복강내 주사로 2회 투여했다. 상세한 치료 스케줄은 하기에 나타냈다.
G1: 염수
G2: 젬시타빈(160mg/kg/일, IP, 0일째 및 3일째)
G3: 26(1.0mg/kg/일, SC, 6주동안 주당 3회)
G4: 26(0.5mg/kg/일, SC, 6주동안 주당 3회)
G5: 194(1.0mg/kg/일, SC, 6주동안 주당 3회)
G6: 194(0.5mg/kg/일, SC, 6주동안 주당 3회)
G7: 26(0.5mg/kg/일, SC, 6주동안 주당 3회) + 젬시타빈(160mg/kg/일, 0일 및 3일째)
G8: 194(0.5mg/kg/일, SC, 6주동안 주당 3회) + 젬시타빈(160mg/kg/일, 0일 및 3일째)
다양한 처리 후의 종양 측정을 표 15 및 도 13에 나타냈다. 모든 이뮤노머 26 및 194 처리된 동물에서의 종양 성장은 식염수 대조군과 비교하여 현저하게 억제되었다(p<0.5). 이러한 처리군에 있어서 용량-반응 관계의 경향이 있었다(도 13). 이뮤노머 26 및 194 사이의 현저한 차이는 없었다(표 15).
표 15. 26, 194, 젬시타빈의 치료 또는 병용 치료 후 종양 함유 마우스의 종양 질량
다양한 시점에서의 체중 측정치를 표 16 및 도 14에 나타내었다. 이뮤노머 26 또는 194 단독은 대조군과 비교하여 체중 증가에서 현저한 차이가 없었다. 젬시타빈 처리된 동물들은 첫번째 주에 체중 손실이 있었고 그 후의 주에 회복했다. 이뮤노머 26 또는 194와의 병용은 젬시타빈의 부작용 프로파일을 변화시키지 않았다. 모든 군에서 기타 임상적 이상 또는 사망이 관찰되지 않았다.
표 16. 26, 194 또는 식염수의 처리 후 종양 함유 마우스의 체중
요약하면, 이뮤노머 26 및 194는 중대한 부작용 없이 인간 전립선 암 PC3 이종이식물을 지니는 누드 마우스에서 종양 성장을 현저하게 억제하였다. 이뮤노머 26 또는 194를 젬시타빈과 병용하여 투여하는 경우, 각각의 화합물은 부작용 프로파일의 변화 없이 젬시타빈의 치료 효과를 현저히 증가시켰다. 게다가, 이뮤노머 26 또는 194 치료에서 용량 의존 반응의 경향이 있었다.
실시예 9 이뮤노머 화합물과 화학요법제 병용에 있어서의 생체내 항암 활성
실시예 8의 실험을 젬시타빈 대신 탁소테레(taxotere)를 사용하여 반복하였다. 탁소테레를 0일 및 7일째에 투여하였다. 이뮤노머 165를 주당 5일로 투여하였다. 이뮤노머 26 및 194를 0, 2, 4, 7, 9 및 11일째에 투여하였다. 결과를 하기 표 17에 나타내었다. 이러한 결과는 이뮤노머 및 탁소테레 사이의 상승작용을 명백하게 입증한다.
표 17. 이뮤노머 화합물과 기타 화학요법제의 병용에 있어서 생체내 항암 활성
표 17. 이뮤노머 화합물과 기타 화학요법제의 병용에 있어서 생체내 항암 활성
삭제
실시예 10 면역자극 올리고누클레오티드 및 IL-2의 투여
비장세포를 상기된 바와 같이 BALB/c 마우스로부터 분리하고 5 x 106 세포/ml의 밀도로 24웰 접시에 분주하였다. CpG 올리고누클레오티드를 TE 완충액(10mM 트리스-HCl, pH 7.5, 1mM EDTA)중에 용해시키고 최종 농도가 0.03, 0.1, 0.3, 1.0, 3.0 또는 10.0㎍/ml이 되도록 마우스 비장 세포 배양물에 첨가하였다. CpG 올리고누클레오티드 유도된 시간 의존적 사이토킨 분비에서 IL-2의 역할을 연구하기 위해, 재조합 인간 IL-2(Sigma)를 실험 개시점에서 10U/ml의 농도로 첨가하였다. 이어서 세포를 시험 올리고누클레오티드의 존재하에 4, 8, 24 및 48시간동안 37℃에서 인큐베이션하고 상청액을 ELISA 분석을 위해 수거하였다. 비처리된 세포(단지 IL-2 첨가)를 대조군으로서 사용하였다.
마우스 IL-12, IL-6 및 IFN-γ의 분비는 샌드위치 ELISA로 측정하였다. 사이토킨 항체 및 표준물을 포함하는 요구되는 시약은 제조원[PharMingen]으로부터 구입하였다. ELISA 플레이트(Costar)는 4℃에서 밤새 PBSN (PBS/0.05% 나트륨 아지드, pH 9.6) 완충액중에서 적당한 포획 항체와 인큐베이션함에 이어서 37℃에서 30분동안 PBS/1% BSA로 차단하였다. 세포 배양 상청액 및 사이토킨 표준물을 적당하게 PBS/1% BSA로 희석하고 플레이트에 3중으로 첨가하고 2시간동안 25℃에서 인큐베이션하였다. 플레이트를 세척하고 적당한 비오티닐화된 항체와 인큐베이션하고 1.5시간동안 25℃에서 인큐베이션하였다. 플레이트를 PBS/0.05% 트윈 20으로 광범위하게 세척하고 이어서 추가로 스트렙트아비딘 컨주게이팅된 퍼옥시다제(Sigma)를 첨가한 후 1.5시간동안 25℃에서 인큐베이션하였다. 플레이트를 Sure BlueTM(Kirkegaard and Perry) 발색 시약으로 발색시키고 정지 용액(Kirkegaard and Perry)을 첨가하여 반응을 종결시켰다. 색상 변화를 450nm에서 Ceres 900 HDI 분광계(Bio-Tek 장치)로 측정하였다. 세포 배양 상청액에서 IL-12, IL6 및 IFN-γ의 수준은 동일한 실험 조건하에 각각 IL-12, IL-6 및 IFN-γ에 대해 작성된 표준 곡선으로부터 계산하였다.
당해 연구에 사용되는 올리고누클레오티드는 표 18에 제공한다.
표 18.
결과는 도 15 내지 19에 나타낸다. 서열번호 86 내지 90을 단독으로 사용하여 단지 무시할정도로 IFN-γ 생산을 자극한다는 것을 시사하는 분석은 나타나지 않는다. 이러한 결과는 IL-6, IL-12 및 IFN-γ의 분비를 생성시키는데 서열번호 86 내지 90과 IL-2간의 공동 상승 작용을 입증한다.
등가물
이전의 발명은 명백하고 이해를 목적으로 약간 상세하게 기재되었지만 당업자는 본원에 기재된 내용으로부터 형태 및 세부적으로 다양한 변화가 본 발명 및 첨부된 청구항의 진정한 범위로부터 벗어나지 않으면서 만들어 질 수 있다는 것을 인지할 것이다.
Claims (18)
- 이뮤노머 화합물을 포함하는, 포유동물의 암을 치료하기 위한 조성물로서, 상기 조성물이 상기 포유동물에게 투여된 후에 상기 포유동물은 이온화 방사선으로 처리되고, 상기 이뮤노머 화합물은, 3' 말단, 누클레오티드간 결합, 또는 작용기화된 누클레오염기 또는 당에서 비-누클레오티드 링커에 의해 함께 연결된 2개의 올리고누클레오티드를 포함하며, 상기 올리고누클레오티드들 중 하나 이상은, 접근가능한 5' 말단을 지니고 CpG, C*pG, CpG* 및 C*pG*로 이루어진 군으로부터 선택된 면역자극 디누클레오티드를 포함하는, 면역자극 올리고누클레오티드인데, 여기서 C는 시티딘 또는 2'-데옥시시티딘이고, C*는 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘 또는 2'-데옥시-4-티오우리딘이고, G는 구아노신 또는 2'-데옥시구아노신이고, G*는 2'데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신 또는 2'-O-치환된 아라비노구아노신이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드간 결합인, 포유동물의 암을 치료하기 위한 조성물.
- 제1항에 있어서, γ방사선이 1.56Gy/분으로 조사되는, 조성물.
- 제1항에 있어서, 방사선 요법이 1주일에 2회, 1주일에 4회, 또는 2일, 4일 및 9일째에 3회 3Gy 방사선으로서 조사되는, 조성물.
- 제1항에 있어서, 상기 포유동물이 γ-방사선 조사 2 내지 6시간 전에 상기 이뮤노머 화합물로 전처리되는, 조성물.
- 이뮤노머 화합물과 IL-2를 포함하는, 환자의 면역 반응을 자극하기 위한 조성물로서, 상기 이뮤노머 화합물은, 3' 말단, 누클레오티드간 결합, 또는 작용기화된 누클레오염기 또는 당에서 비-누클레오티드 링커에 의해 함께 연결된 2개의 올리고누클레오티드를 포함하며, 상기 올리고누클레오티드들 중 하나 이상은, 접근가능한 5' 말단을 지니고 CpG, C*pG, CpG* 및 C*pG*로 이루어진 군으로부터 선택된 면역자극 디누클레오티드를 포함하는, 면역자극 올리고누클레오티드인데, 여기서 C는 시티딘 또는 2'-데옥시시티딘이고, C*는 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘 또는 2'-데옥시-4-티오우리딘이고, G는 구아노신 또는 2'-데옥시구아노신이고, G*는 2'데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신 또는 2'-O-치환된 아라비노구아노신이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드간 결합이며, 이러한 조성물의 투여가 IL-12 및 IFN-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택되는 하나 이상의 사이토킨의 생산을 상승적으로 자극하는, 환자의 면역 반응을 자극하기 위한 조성물.
- 삭제
- 삭제
- 제5항 또는 제8항에 있어서, 항원을 추가로 포함하는, 조성물.
- 제9항에 있어서, 상기 항원이 암, 감염성 질환 또는 알레르기와 관련된 항원인, 조성물.
- 삭제
- 이뮤노머 화합물과 IL-2를 포함하는, 환자의 암을 치료하기 위한 조성물로서, 상기 이뮤노머 화합물은, 3' 말단, 누클레오티드간 결합, 또는 작용기화된 누클레오염기 또는 당에서 비-누클레오티드 링커에 의해 함께 연결된 2개의 올리고누클레오티드를 포함하며, 상기 올리고누클레오티드들 중 하나 이상은, 접근가능한 5' 말단을 지니고 CpG, C*pG, CpG* 및 C*pG*로 이루어진 군으로부터 선택된 면역자극 디누클레오티드를 포함하는, 면역자극 올리고누클레오티드인데, 여기서 C는 시티딘 또는 2'-데옥시시티딘이고, C*는 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘 또는 2'-데옥시-4-티오우리딘이고, G는 구아노신 또는 2'-데옥시구아노신이고, G*는 2'데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신 또는 2'-O-치환된 아라비노구아노신이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드간 결합이며, 이러한 조성물의 투여가 IL-12 및 IFN-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택되는 하나 이상의 사이토킨의 생산을 상승적으로 자극하는, 환자의 암을 치료하기 위한 조성물.
- 제12항에 있어서, 암과 관련된 항원을 추가로 포함하는, 조성물.
- 이뮤노머 화합물과 IL-2를 포함하는, 환자의 알레르기를 치료하기 위한 조성물로서, 상기 이뮤노머 화합물은, 3' 말단, 누클레오티드간 결합, 또는 작용기화된 누클레오염기 또는 당에서 비-누클레오티드 링커에 의해 함께 연결된 2개의 올리고누클레오티드를 포함하며, 상기 올리고누클레오티드들 중 하나 이상은, 접근가능한 5' 말단을 지니고 CpG, C*pG, CpG* 및 C*pG*로 이루어진 군으로부터 선택된 면역자극 디누클레오티드를 포함하는, 면역자극 올리고누클레오티드인데, 여기서 C는 시티딘 또는 2'-데옥시시티딘이고, C*는 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘 또는 2'-데옥시-4-티오우리딘이고, G는 구아노신 또는 2'-데옥시구아노신이고, G*는 2'데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신 또는 2'-O-치환된 아라비노구아노신이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드간 결합이며, 이러한 조성물의 투여가 IL-12 및 IFN-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택되는 하나 이상의 사이토킨의 생산을 상승적으로 자극하는, 환자의 알레르기를 치료하기 위한 조성물.
- 제14항에 있어서, 알레르기와 관련된 항원을 추가로 포함하는, 조성물.
- 이뮤노머 화합물과 IL-2를 포함하는, 환자의 감염성 질환을 치료하기 위한 조성물로서, 상기 이뮤노머 화합물은, 3' 말단, 누클레오티드간 결합, 또는 작용기화된 누클레오염기 또는 당에서 비-누클레오티드 링커에 의해 함께 연결된 2개의 올리고누클레오티드를 포함하며, 상기 올리고누클레오티드들 중 하나 이상은, 접근가능한 5' 말단을 지니고 CpG, C*pG, CpG* 및 C*pG*로 이루어진 군으로부터 선택된 면역자극 디누클레오티드를 포함하는, 면역자극 올리고누클레오티드인데, 여기서 C는 시티딘 또는 2'-데옥시시티딘이고, C*는 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시-2'-치환된 아라비노시티딘, 2'-O-치환된 아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘 또는 2'-데옥시-4-티오우리딘이고, G는 구아노신 또는 2'-데옥시구아노신이고, G*는 2'데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2' 치환된-아라비노구아노신 또는 2'-O-치환된 아라비노구아노신이고, p는 포스포디에스테르, 포스포로티오에이트 및 포스포로디티오에이트로 이루어진 군으로부터 선택되는 누클레오시드간 결합이며, 이러한 조성물의 투여가 IL-12 및 IFN-γ, IFN-α, IFN-β 또는 이의 조합으로 이루어진 군으로부터 선택되는 하나 이상의 사이토킨의 생산을 상승적으로 자극하는, 환자의 감염성 질환을 치료하기 위한 조성물.
- 제16항에 있어서, 감염성 질환과 관련된 항원을 추가로 포함하는, 조성물.
- 삭제
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US48752903P | 2003-07-15 | 2003-07-15 | |
| US60/487,529 | 2003-07-15 | ||
| US50324203P | 2003-09-15 | 2003-09-15 | |
| US60/503,242 | 2003-09-15 | ||
| PCT/US2004/022797 WO2005009355A2 (en) | 2003-07-15 | 2004-07-15 | Synergistic stimulation of the immune system using immunostimulatory oligonucleotides and/or immunomer compounds in conjunction with cytokines and/or chemotherapeutic agents or radiation therapy |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20060033911A KR20060033911A (ko) | 2006-04-20 |
| KR101126030B1 true KR101126030B1 (ko) | 2012-03-19 |
Family
ID=34107742
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020067000891A KR101126030B1 (ko) | 2003-07-15 | 2004-07-15 | 사이토킨 및/또는 화학치료제 또는 방사선 치료와 연계하여면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을이용하여 면역계를 공동 상승 자극시키는 방법 |
Country Status (8)
| Country | Link |
|---|---|
| US (3) | US20060074040A1 (ko) |
| EP (2) | EP1648913A4 (ko) |
| JP (1) | JP2007531699A (ko) |
| KR (1) | KR101126030B1 (ko) |
| AU (1) | AU2004259204B2 (ko) |
| CA (1) | CA2532926A1 (ko) |
| MX (1) | MXPA06000619A (ko) |
| WO (1) | WO2005009355A2 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200114767A (ko) * | 2019-03-29 | 2020-10-07 | 한국수력원자력 주식회사 | 저선량방사선에 의한 류마티스 관절염 예방 |
| KR20200114769A (ko) * | 2019-03-29 | 2020-10-07 | 한국수력원자력 주식회사 | 저선량방사선에 의한 류마티스 관절염 치료 효과 |
Families Citing this family (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US20030026782A1 (en) * | 1995-02-07 | 2003-02-06 | Arthur M. Krieg | Immunomodulatory oligonucleotides |
| US6693086B1 (en) * | 1998-06-25 | 2004-02-17 | National Jewish Medical And Research Center | Systemic immune activation method using nucleic acid-lipid complexes |
| US20030022854A1 (en) | 1998-06-25 | 2003-01-30 | Dow Steven W. | Vaccines using nucleic acid-lipid complexes |
| KR100917101B1 (ko) * | 2000-08-04 | 2009-09-15 | 도요 보세키 가부시키가이샤 | 플렉시블 금속적층체 및 그 제조방법 |
| EP1322656B1 (en) * | 2000-09-26 | 2008-01-16 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
| US7785610B2 (en) * | 2001-06-21 | 2010-08-31 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same—III |
| US20030199466A1 (en) * | 2001-06-21 | 2003-10-23 | Fearon Karen L. | Chimeric immunomodulatory compounds and methods of using the same - ll |
| US7276489B2 (en) * | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| AR040996A1 (es) * | 2002-08-19 | 2005-04-27 | Coley Pharm Group Inc | Acidos nucleicos inmunoestimuladores |
| CA2502015A1 (en) | 2002-12-11 | 2004-06-24 | Coley Pharmaceutical Group, Inc. | 5' cpg nucleic acids and methods of use |
| US7354907B2 (en) * | 2003-02-07 | 2008-04-08 | Idera Pharmaceuticals, Inc. | Short immunomodulatory oligonucleotides |
| JP2006528697A (ja) * | 2003-05-16 | 2006-12-21 | イデラ ファーマシューティカルズ インコーポレイテッド | イムノマーを化学療法剤と組み合わせて用いる、癌の相乗的処置 |
| EP1648913A4 (en) * | 2003-07-15 | 2008-09-10 | Idera Pharmaceuticals Inc | SYNERGISTIC STIMULATION OF THE IMMUNE SYSTEM WITH IMMUNOSTIMULATING OLIGONUCLEOTIDES AND / OR IMMUNOMER COMPOUNDS RELATED TO CYTOKINES AND / OR CHEMOTHERAPEAN MEDICAMENTS OR RADIATION THERAPY |
| AU2004269379A1 (en) * | 2003-08-28 | 2005-03-10 | The Immune Response Corporation | Immunogenic HIV compositions and related methods |
| JP4989225B2 (ja) * | 2003-09-25 | 2012-08-01 | コーリー ファーマシューティカル グループ,インコーポレイテッド | 核酸親油性接合体 |
| CA2567789A1 (en) * | 2004-06-08 | 2006-08-03 | Coley Pharmaceutical Gmbh | Abasic oligonucleotide as carrier platform for antigen and immunostimulatory agonist and antagonist |
| CA2570786C (en) * | 2004-06-15 | 2013-05-28 | Idera Pharmaceuticals, Inc. | Modified cpg-containing oligonucleotide multimers in immune stimulation |
| MY159370A (en) * | 2004-10-20 | 2016-12-30 | Coley Pharm Group Inc | Semi-soft-class immunostimulatory oligonucleotides |
| JP2008531018A (ja) * | 2005-02-24 | 2008-08-14 | コーリー ファーマシューティカル グループ,インコーポレイテッド | 免疫刺激性オリゴヌクレオチド |
| EP1934239B8 (en) | 2005-10-12 | 2015-11-04 | Idera Pharmaceuticals, Inc. | Immune regulatory oligonucleotide (iro) compounds to modulate toll-like receptor based immune response |
| US8399423B2 (en) * | 2005-10-12 | 2013-03-19 | Idera Pharmaceuticals, Inc. | Immune regulatory oligonucleotide (IRO) compounds to modulate toll-like receptor based immune response |
| US7470674B2 (en) * | 2005-11-07 | 2008-12-30 | Idera Pharmaceuticals, Inc. | Immunostimulatory properties of oligonucleotide-based compounds comprising modified immunostimulatory dinucleotides |
| CA2642152C (en) * | 2006-02-15 | 2016-11-01 | Coley Pharmaceutical Gmbh | Compositions and methods for oligonucleotide formulations |
| NZ575437A (en) | 2006-09-27 | 2012-02-24 | Coley Pharm Gmbh | Cpg oligonucleotide analogs containing hydrophobic t analogs with enhanced immunostimulatory activity |
| TR201820474T4 (tr) * | 2007-08-13 | 2019-01-21 | Zoetis Belgium S A | Spesifik immün modülatör profilleri indükleyen tanımlı nükleotitler arası bağlar bağlamında rna sekansı motifleri. |
| WO2010042543A2 (en) * | 2008-10-06 | 2010-04-15 | Idera Pharmaceuticals, Inc. | Use of inhibitors of toll-like receptors in the prevention and treatment of hypercholesterolemia and hyperlipidemia and diseases related thereto |
| US8883174B2 (en) | 2009-03-25 | 2014-11-11 | The Board Of Regents, The University Of Texas System | Compositions for stimulation of mammalian innate immune resistance to pathogens |
| KR100998365B1 (ko) * | 2009-06-29 | 2010-12-06 | 압타바이오 주식회사 | 치료 효능이 있는 변형핵산 및 구아노신을 함유하는 올리고뉴클레오티드 변형체 |
| DE102009034779A1 (de) | 2009-07-25 | 2011-02-03 | Emc Microcollections Gmbh | Synthetische Analoga bakterieller Lipopeptide und ihre Anwendung zur Therapie und Prophylaxe allergischer Erkrankungen |
| WO2011031520A1 (en) * | 2009-08-27 | 2011-03-17 | Idera Pharmaceuticals, Inc. | Composition for inhibiting gene expression and uses thereof |
| KR101225378B1 (ko) * | 2010-11-12 | 2013-01-22 | 한국수력원자력 주식회사 | 전리방사선을 이용한 마우스의 사이토카인 조절방법 |
| US9260719B2 (en) * | 2013-01-08 | 2016-02-16 | Idera Pharmaceuticals, Inc. | Immune regulatory oligonucleotide (IRO) compounds to modulate toll-like receptor based immune response |
| US10894963B2 (en) | 2013-07-25 | 2021-01-19 | Exicure, Inc. | Spherical nucleic acid-based constructs as immunostimulatory agents for prophylactic and therapeutic use |
| US10434064B2 (en) | 2014-06-04 | 2019-10-08 | Exicure, Inc. | Multivalent delivery of immune modulators by liposomal spherical nucleic acids for prophylactic or therapeutic applications |
| WO2016044839A2 (en) | 2014-09-19 | 2016-03-24 | The Board Of Regents Of The University Of Texas System | Compositions and methods for treating viral infections through stimulated innate immunity in combination with antiviral compounds |
| EP3204040B1 (en) * | 2014-10-10 | 2021-12-08 | Idera Pharmaceuticals, Inc. | Treatment of cancer using tlr9 agonists and checkpoint inhibitors |
| EP3220895B1 (en) | 2014-11-21 | 2022-08-31 | Northwestern University | The sequence-specific cellular uptake of spherical nucleic acid nanoparticle conjugates |
| EP3238727B1 (en) * | 2014-12-25 | 2023-01-18 | National Institutes of Biomedical Innovation, Health and Nutrition | Non-aggregating immunostimulatory oligonucleotides |
| US11364304B2 (en) | 2016-08-25 | 2022-06-21 | Northwestern University | Crosslinked micellar spherical nucleic acids |
| IL292658A (en) | 2016-09-15 | 2022-07-01 | Idera Pharmaceuticals Inc | Immune modulation with tlr9 agonists for cancer therapy |
| US11433131B2 (en) | 2017-05-11 | 2022-09-06 | Northwestern University | Adoptive cell therapy using spherical nucleic acids (SNAs) |
| WO2024026474A1 (en) | 2022-07-29 | 2024-02-01 | Regeneron Pharmaceuticals, Inc. | Compositions and methods for transferrin receptor (tfr)-mediated delivery to the brain and muscle |
| WO2024098002A1 (en) | 2022-11-04 | 2024-05-10 | Regeneron Pharmaceuticals, Inc. | Calcium voltage-gated channel auxiliary subunit gamma 1 (cacng1) binding proteins and cacng1-mediated delivery to skeletal muscle |
| WO2024107765A2 (en) | 2022-11-14 | 2024-05-23 | Regeneron Pharmaceuticals, Inc. | Compositions and methods for fibroblast growth factor receptor 3-mediated delivery to astrocytes |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6218371B1 (en) * | 1998-04-03 | 2001-04-17 | University Of Iowa Research Foundation | Methods and products for stimulating the immune system using immunotherapeutic oligonucleotides and cytokines |
| US20020156033A1 (en) * | 2000-03-03 | 2002-10-24 | Bratzler Robert L. | Immunostimulatory nucleic acids and cancer medicament combination therapy for the treatment of cancer |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US621837A (en) * | 1899-03-28 | And gordon c | ||
| US5149797A (en) * | 1990-02-15 | 1992-09-22 | The Worcester Foundation For Experimental Biology | Method of site-specific alteration of rna and production of encoded polypeptides |
| TW244371B (ko) | 1992-07-23 | 1995-04-01 | Tri Clover Inc | |
| US5652355A (en) | 1992-07-23 | 1997-07-29 | Worcester Foundation For Experimental Biology | Hybrid oligonucleotide phosphorothioates |
| US6346614B1 (en) * | 1992-07-23 | 2002-02-12 | Hybridon, Inc. | Hybrid oligonucleotide phosphorothioates |
| US6429199B1 (en) | 1994-07-15 | 2002-08-06 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules for activating dendritic cells |
| US5912332A (en) | 1996-07-26 | 1999-06-15 | Hybridon, Inc. | Affinity-based purification of oligonucleotides using soluble multimeric oligonucleotides |
| US6426334B1 (en) * | 1997-04-30 | 2002-07-30 | Hybridon, Inc. | Oligonucleotide mediated specific cytokine induction and reduction of tumor growth in a mammal |
| EP1674574A1 (en) * | 1998-05-14 | 2006-06-28 | Coley Pharmaceutical GmbH | Methods for Regulating Hematopoiesis using CpG-Oligonucleotides |
| EP2314693A3 (en) | 1999-08-13 | 2012-11-28 | Idera Pharmaceuticals, Inc. | Modulation of oligonucleotide CpG-mediated immune stimulation by positional modification of nucleosides |
| ATE382690T1 (de) | 2000-01-26 | 2008-01-15 | Idera Pharmaceuticals Inc | Modulierung der durch cpg-oligonukleotide verursachte immunstimulierung durch positionsbedingte veränderung von nukleosiden |
| EP1278761B1 (en) | 2000-05-01 | 2005-04-06 | Hybridon, Inc. | MODULATION OF OLIGONUCLEOTIDE CpG-MEDIATED IMMUNE STIMULATION BY POSITIONAL MODIFICATION OF NUCLEOSIDES |
| EP1322656B1 (en) | 2000-09-26 | 2008-01-16 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
| US20020153033A1 (en) * | 2001-04-23 | 2002-10-24 | Miller Stephen F. | Collapsible structural frame strut with pop-in connector |
| WO2003035836A2 (en) * | 2001-10-24 | 2003-05-01 | Hybridon Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5' ends |
| US7276489B2 (en) * | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| WO2004064782A2 (en) * | 2003-01-16 | 2004-08-05 | Hybridon, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by utilizing modified immunostimulatory dinucleotides |
| JP2006528697A (ja) * | 2003-05-16 | 2006-12-21 | イデラ ファーマシューティカルズ インコーポレイテッド | イムノマーを化学療法剤と組み合わせて用いる、癌の相乗的処置 |
| CA2528597C (en) * | 2003-06-11 | 2014-08-05 | Hybridon, Inc. | Stabilized immunomodulatory oligonucleotides |
| EP1648913A4 (en) * | 2003-07-15 | 2008-09-10 | Idera Pharmaceuticals Inc | SYNERGISTIC STIMULATION OF THE IMMUNE SYSTEM WITH IMMUNOSTIMULATING OLIGONUCLEOTIDES AND / OR IMMUNOMER COMPOUNDS RELATED TO CYTOKINES AND / OR CHEMOTHERAPEAN MEDICAMENTS OR RADIATION THERAPY |
| CN101094594B (zh) * | 2003-12-08 | 2012-08-15 | 海布里顿公司 | 通过基于小寡核苷酸的化合物调节免疫刺激性质 |
| US7498425B2 (en) * | 2004-06-15 | 2009-03-03 | Idera Pharmaceuticals, Inc. | Immunostimulatory oligonucleotide multimers |
| CA2570786C (en) * | 2004-06-15 | 2013-05-28 | Idera Pharmaceuticals, Inc. | Modified cpg-containing oligonucleotide multimers in immune stimulation |
| US7470674B2 (en) * | 2005-11-07 | 2008-12-30 | Idera Pharmaceuticals, Inc. | Immunostimulatory properties of oligonucleotide-based compounds comprising modified immunostimulatory dinucleotides |
| JP2009521218A (ja) * | 2005-12-20 | 2009-06-04 | イデラ ファーマシューティカルズ インコーポレイテッド | 異なる長さのパリンドロームセグメントを含むパリンドローム免疫調節オリゴヌクレオチド(imo(tm))の免疫賦活作用 |
| ES2564303T3 (es) * | 2006-04-07 | 2016-03-21 | Idera Pharmaceuticals, Inc. | Compuestos de ARN inmunomodulador estabilizado (SIMRA) para TLR7 y TLR8 |
| JP2010512421A (ja) * | 2006-12-12 | 2010-04-22 | イデラ ファーマシューティカルズ インコーポレイテッド | Tlr9の合成アゴニスト |
| CN102921003B (zh) * | 2007-07-09 | 2014-11-26 | 艾德拉药物股份有限公司 | 稳定化免疫调控性rna(simra)化合物 |
| RU2468819C2 (ru) * | 2007-08-01 | 2012-12-10 | Идера Фармасьютикалз, Инк. | Новые синтетические агонисты tlr9 |
-
2004
- 2004-07-15 EP EP04778343A patent/EP1648913A4/en not_active Withdrawn
- 2004-07-15 KR KR1020067000891A patent/KR101126030B1/ko not_active IP Right Cessation
- 2004-07-15 MX MXPA06000619A patent/MXPA06000619A/es unknown
- 2004-07-15 US US10/892,550 patent/US20060074040A1/en not_active Abandoned
- 2004-07-15 AU AU2004259204A patent/AU2004259204B2/en not_active Ceased
- 2004-07-15 CA CA002532926A patent/CA2532926A1/en not_active Abandoned
- 2004-07-15 JP JP2006520344A patent/JP2007531699A/ja not_active Ceased
- 2004-07-15 EP EP11000717A patent/EP2363141A1/en not_active Withdrawn
- 2004-07-15 WO PCT/US2004/022797 patent/WO2005009355A2/en active Application Filing
-
2005
- 2005-07-01 US US11/173,983 patent/US7709617B2/en not_active Expired - Fee Related
-
2010
- 2010-04-09 US US12/757,425 patent/US20110158937A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6218371B1 (en) * | 1998-04-03 | 2001-04-17 | University Of Iowa Research Foundation | Methods and products for stimulating the immune system using immunotherapeutic oligonucleotides and cytokines |
| US20020156033A1 (en) * | 2000-03-03 | 2002-10-24 | Bratzler Robert L. | Immunostimulatory nucleic acids and cancer medicament combination therapy for the treatment of cancer |
Non-Patent Citations (1)
| Title |
|---|
| Experimental Hematology, Vol.28, Pages 558~568* |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200114767A (ko) * | 2019-03-29 | 2020-10-07 | 한국수력원자력 주식회사 | 저선량방사선에 의한 류마티스 관절염 예방 |
| KR20200114769A (ko) * | 2019-03-29 | 2020-10-07 | 한국수력원자력 주식회사 | 저선량방사선에 의한 류마티스 관절염 치료 효과 |
| KR102289054B1 (ko) * | 2019-03-29 | 2021-08-19 | 한국수력원자력 주식회사 | 저선량방사선에 의한 류마티스 관절염 예방 |
| KR102357566B1 (ko) * | 2019-03-29 | 2022-02-04 | 한국수력원자력 주식회사 | 저선량방사선에 의한 류마티스 관절염 치료 효과 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2007531699A (ja) | 2007-11-08 |
| WO2005009355A2 (en) | 2005-02-03 |
| EP1648913A2 (en) | 2006-04-26 |
| AU2004259204A1 (en) | 2005-02-03 |
| US20060074040A1 (en) | 2006-04-06 |
| MXPA06000619A (es) | 2006-04-11 |
| EP2363141A1 (en) | 2011-09-07 |
| CA2532926A1 (en) | 2005-02-03 |
| US20110158937A1 (en) | 2011-06-30 |
| US20060217328A1 (en) | 2006-09-28 |
| AU2004259204B2 (en) | 2010-08-19 |
| KR20060033911A (ko) | 2006-04-20 |
| US7709617B2 (en) | 2010-05-04 |
| WO2005009355A3 (en) | 2005-03-31 |
| EP1648913A4 (en) | 2008-09-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101126030B1 (ko) | 사이토킨 및/또는 화학치료제 또는 방사선 치료와 연계하여면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을이용하여 면역계를 공동 상승 자극시키는 방법 | |
| EP2650369B1 (en) | Novel synthetic agonists of TLR9 | |
| US7786089B2 (en) | Immunostimulatory activity of immune modulatory oligonucleotides (IMO™) containing different lengths of palindromic segments | |
| US20110293565A1 (en) | Novel synthetic agonists of tlr9 | |
| KR20060012622A (ko) | 화학요법제와 함께 이뮤노머를 사용하는 상승적 암 치료방법 | |
| JP2009520502A (ja) | Cgジヌクレオチド修飾物を含有するトール様受容体の新規な合成アゴニスト | |
| AU2014203624B2 (en) | Novel synthetic agonists of TLR9 | |
| CN100482673C (zh) | 使用免疫刺激性寡核苷酸和/或免疫子化合物结合细胞因子和/或化疗剂或放射治疗对免疫系统的协同刺激作用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| LAPS | Lapse due to unpaid annual fee |