JP2006528697A - イムノマーを化学療法剤と組み合わせて用いる、癌の相乗的処置 - Google Patents
イムノマーを化学療法剤と組み合わせて用いる、癌の相乗的処置 Download PDFInfo
- Publication number
- JP2006528697A JP2006528697A JP2006533117A JP2006533117A JP2006528697A JP 2006528697 A JP2006528697 A JP 2006528697A JP 2006533117 A JP2006533117 A JP 2006533117A JP 2006533117 A JP2006533117 A JP 2006533117A JP 2006528697 A JP2006528697 A JP 2006528697A
- Authority
- JP
- Japan
- Prior art keywords
- group
- immunostimulatory
- linker
- immunomer
- oligonucleotide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000002246 antineoplastic agent Substances 0.000 title claims abstract description 36
- 229940127089 cytotoxic agent Drugs 0.000 title claims abstract description 32
- 230000002195 synergetic effect Effects 0.000 title claims abstract description 13
- 206010028980 Neoplasm Diseases 0.000 title claims description 111
- 201000011510 cancer Diseases 0.000 title claims description 25
- 238000011282 treatment Methods 0.000 title description 50
- 108091034117 Oligonucleotide Proteins 0.000 claims abstract description 184
- 230000003308 immunostimulating effect Effects 0.000 claims abstract description 147
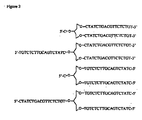
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 claims abstract description 84
- 238000000034 method Methods 0.000 claims description 59
- -1 Bachimas Chemical compound 0.000 claims description 52
- 239000002777 nucleoside Substances 0.000 claims description 51
- 235000000346 sugar Nutrition 0.000 claims description 33
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 claims description 32
- 150000003833 nucleoside derivatives Chemical class 0.000 claims description 30
- 229910052739 hydrogen Inorganic materials 0.000 claims description 29
- 239000001257 hydrogen Substances 0.000 claims description 29
- 125000003835 nucleoside group Chemical group 0.000 claims description 25
- 239000002773 nucleotide Substances 0.000 claims description 21
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerol Natural products OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 19
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 claims description 19
- 229960001592 paclitaxel Drugs 0.000 claims description 18
- 150000004713 phosphodiesters Chemical class 0.000 claims description 18
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 claims description 17
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 claims description 16
- 229930012538 Paclitaxel Natural products 0.000 claims description 16
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 claims description 16
- 239000005549 deoxyribonucleoside Substances 0.000 claims description 15
- 229960004679 doxorubicin Drugs 0.000 claims description 15
- 239000002342 ribonucleoside Substances 0.000 claims description 15
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 claims description 14
- 229960005277 gemcitabine Drugs 0.000 claims description 14
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 claims description 13
- 239000002718 pyrimidine nucleoside Substances 0.000 claims description 13
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 claims description 12
- 239000000370 acceptor Substances 0.000 claims description 12
- 229910052799 carbon Inorganic materials 0.000 claims description 12
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 claims description 12
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical compound CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 claims description 11
- 239000002212 purine nucleoside Substances 0.000 claims description 11
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 claims description 10
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 claims description 10
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 claims description 10
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 claims description 10
- MRWXACSTFXYYMV-FDDDBJFASA-N nebularine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC=C2N=C1 MRWXACSTFXYYMV-FDDDBJFASA-N 0.000 claims description 10
- 229910052757 nitrogen Chemical group 0.000 claims description 10
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 9
- 229960002949 fluorouracil Drugs 0.000 claims description 9
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 claims description 9
- 229920001223 polyethylene glycol Polymers 0.000 claims description 9
- 108090000623 proteins and genes Proteins 0.000 claims description 9
- 229960005486 vaccine Drugs 0.000 claims description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 8
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 claims description 8
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 claims description 8
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 claims description 8
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 claims description 8
- 229960004316 cisplatin Drugs 0.000 claims description 8
- VGONTNSXDCQUGY-UHFFFAOYSA-N desoxyinosine Natural products C1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 VGONTNSXDCQUGY-UHFFFAOYSA-N 0.000 claims description 8
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 claims description 8
- ZOCKGBMQLCSHFP-KQRAQHLDSA-N valrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)CCCC)[C@H]1C[C@H](NC(=O)C(F)(F)F)[C@H](O)[C@H](C)O1 ZOCKGBMQLCSHFP-KQRAQHLDSA-N 0.000 claims description 8
- IQFYYKKMVGJFEH-BIIVOSGPSA-N 2'-deoxythymidine Natural products O=C1NC(=O)C(C)=CN1[C@@H]1O[C@@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-BIIVOSGPSA-N 0.000 claims description 7
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 claims description 7
- 208000035657 Abasia Diseases 0.000 claims description 7
- 239000002215 arabinonucleoside Substances 0.000 claims description 7
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 claims description 7
- 229960003668 docetaxel Drugs 0.000 claims description 7
- 150000002402 hexoses Chemical class 0.000 claims description 7
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 claims description 6
- PFCLMNDDPTZJHQ-XLPZGREQSA-N 2-amino-7-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-1h-pyrrolo[2,3-d]pyrimidin-4-one Chemical compound C1=CC=2C(=O)NC(N)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PFCLMNDDPTZJHQ-XLPZGREQSA-N 0.000 claims description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 claims description 6
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 claims description 6
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 claims description 6
- XOGTZOOQQBDUSI-UHFFFAOYSA-M Mesna Chemical compound [Na+].[O-]S(=O)(=O)CCS XOGTZOOQQBDUSI-UHFFFAOYSA-M 0.000 claims description 6
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 claims description 6
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 claims description 6
- 229960000473 altretamine Drugs 0.000 claims description 6
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 claims description 6
- 229960004562 carboplatin Drugs 0.000 claims description 6
- JOZGNYDSEBIJDH-UHFFFAOYSA-N eniluracil Chemical compound O=C1NC=C(C#C)C(=O)N1 JOZGNYDSEBIJDH-UHFFFAOYSA-N 0.000 claims description 6
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 claims description 6
- 229960005420 etoposide Drugs 0.000 claims description 6
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 claims description 6
- 229960001101 ifosfamide Drugs 0.000 claims description 6
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 claims description 6
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 claims description 6
- 239000003112 inhibitor Substances 0.000 claims description 6
- 239000002502 liposome Substances 0.000 claims description 6
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 claims description 6
- 229910052760 oxygen Inorganic materials 0.000 claims description 6
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 claims description 6
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 6
- 229940063683 taxotere Drugs 0.000 claims description 6
- 229960003087 tioguanine Drugs 0.000 claims description 6
- PHNDUXLWAVSUAL-SHYZEUOFSA-N 1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-4-sulfanylidenepyrimidin-2-one Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=S)C=C1 PHNDUXLWAVSUAL-SHYZEUOFSA-N 0.000 claims description 5
- UHDGCWIWMRVCDJ-UHFFFAOYSA-N 1-beta-D-Xylofuranosyl-NH-Cytosine Natural products O=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 UHDGCWIWMRVCDJ-UHFFFAOYSA-N 0.000 claims description 5
- CKTSBUTUHBMZGZ-SHYZEUOFSA-N 2'‐deoxycytidine Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 CKTSBUTUHBMZGZ-SHYZEUOFSA-N 0.000 claims description 5
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 claims description 5
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 claims description 5
- CKZJTNZSBMVFSU-UBKIQSJTSA-N 4-amino-5-hydroxy-1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical class C1=C(O)C(N)=NC(=O)N1[C@@H]1O[C@H](CO)[C@@H](O)C1 CKZJTNZSBMVFSU-UBKIQSJTSA-N 0.000 claims description 5
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 claims description 5
- UHDGCWIWMRVCDJ-PSQAKQOGSA-N Cytidine Natural products O=C1N=C(N)C=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-PSQAKQOGSA-N 0.000 claims description 5
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 claims description 5
- CKTSBUTUHBMZGZ-UHFFFAOYSA-N Deoxycytidine Natural products O=C1N=C(N)C=CN1C1OC(CO)C(O)C1 CKTSBUTUHBMZGZ-UHFFFAOYSA-N 0.000 claims description 5
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 claims description 5
- UHDGCWIWMRVCDJ-ZAKLUEHWSA-N cytidine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-ZAKLUEHWSA-N 0.000 claims description 5
- MXHRCPNRJAMMIM-UHFFFAOYSA-N desoxyuridine Natural products C1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 MXHRCPNRJAMMIM-UHFFFAOYSA-N 0.000 claims description 5
- 125000000524 functional group Chemical group 0.000 claims description 5
- 229940029575 guanosine Drugs 0.000 claims description 5
- 229960001330 hydroxycarbamide Drugs 0.000 claims description 5
- 229960001614 levamisole Drugs 0.000 claims description 5
- 229960004857 mitomycin Drugs 0.000 claims description 5
- 150000002972 pentoses Chemical class 0.000 claims description 5
- 229960001278 teniposide Drugs 0.000 claims description 5
- 229960000653 valrubicin Drugs 0.000 claims description 5
- YKBGVTZYEHREMT-KVQBGUIXSA-N 2'-deoxyguanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 YKBGVTZYEHREMT-KVQBGUIXSA-N 0.000 claims description 4
- YKBGVTZYEHREMT-UHFFFAOYSA-N 2'-deoxyguanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1CC(O)C(CO)O1 YKBGVTZYEHREMT-UHFFFAOYSA-N 0.000 claims description 4
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 claims description 4
- RYVNIFSIEDRLSJ-UHFFFAOYSA-N 5-(hydroxymethyl)cytosine Chemical compound NC=1NC(=O)N=CC=1CO RYVNIFSIEDRLSJ-UHFFFAOYSA-N 0.000 claims description 4
- IHLOTZVBEUFDMD-UUOKFMHZSA-N 7-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2,2-dioxo-1h-imidazo[4,5-c][1,2,6]thiadiazin-4-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(NS(=O)(=O)NC2=O)=C2N=C1 IHLOTZVBEUFDMD-UUOKFMHZSA-N 0.000 claims description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 4
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 claims description 4
- YJDYDFNKCBANTM-QCWCSKBGSA-N SDZ PSC 833 Chemical compound C\C=C\C[C@@H](C)C(=O)[C@@H]1N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C(=O)[C@H](C(C)C)NC1=O YJDYDFNKCBANTM-QCWCSKBGSA-N 0.000 claims description 4
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical class C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 claims description 4
- 229950010817 alvocidib Drugs 0.000 claims description 4
- BIIVYFLTOXDAOV-YVEFUNNKSA-N alvocidib Chemical compound O[C@@H]1CN(C)CC[C@@H]1C1=C(O)C=C(O)C2=C1OC(C=1C(=CC=CC=1)Cl)=CC2=O BIIVYFLTOXDAOV-YVEFUNNKSA-N 0.000 claims description 4
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 claims description 4
- 150000001479 arabinose derivatives Chemical class 0.000 claims description 4
- CGVWPQOFHSAKRR-NDEPHWFRSA-N biricodar Chemical compound COC1=C(OC)C(OC)=CC(C(=O)C(=O)N2[C@@H](CCCC2)C(=O)OC(CCCC=2C=NC=CC=2)CCCC=2C=NC=CC=2)=C1 CGVWPQOFHSAKRR-NDEPHWFRSA-N 0.000 claims description 4
- 239000004202 carbamide Substances 0.000 claims description 4
- 235000012000 cholesterol Nutrition 0.000 claims description 4
- 229960004397 cyclophosphamide Drugs 0.000 claims description 4
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 claims description 4
- 125000006575 electron-withdrawing group Chemical group 0.000 claims description 4
- 125000001165 hydrophobic group Chemical group 0.000 claims description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 4
- 239000008194 pharmaceutical composition Substances 0.000 claims description 4
- 229940002612 prodrug Drugs 0.000 claims description 4
- 239000000651 prodrug Substances 0.000 claims description 4
- 230000004936 stimulating effect Effects 0.000 claims description 4
- 229960004964 temozolomide Drugs 0.000 claims description 4
- 150000003568 thioethers Chemical class 0.000 claims description 4
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 claims description 4
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 claims description 4
- 229950010938 valspodar Drugs 0.000 claims description 4
- 108010082372 valspodar Proteins 0.000 claims description 4
- IEJSCSAMMLUINT-NRFANRHFSA-N (2s)-2-[[4-[(2,7-dimethyl-4-oxo-1h-quinazolin-6-yl)methyl-prop-2-ynylamino]-2-fluorobenzoyl]amino]-4-(2h-tetrazol-5-yl)butanoic acid Chemical compound C([C@H](NC(=O)C1=CC=C(C=C1F)N(CC#C)CC=1C=C2C(=O)N=C(NC2=CC=1C)C)C(O)=O)CC=1N=NNN=1 IEJSCSAMMLUINT-NRFANRHFSA-N 0.000 claims description 3
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 claims description 3
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 claims description 3
- NVKGVBZZSJFQLM-UHFFFAOYSA-N 1-(2-chloroethyl)-1-nitrosourea Chemical compound NC(=O)N(N=O)CCCl NVKGVBZZSJFQLM-UHFFFAOYSA-N 0.000 claims description 3
- KCURWTAZOZXKSJ-JBMRGDGGSA-N 4-amino-1-[(2r,3s,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one;hydron;chloride Chemical compound Cl.O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 KCURWTAZOZXKSJ-JBMRGDGGSA-N 0.000 claims description 3
- OVONXEQGWXGFJD-UHFFFAOYSA-N 4-sulfanylidene-1h-pyrimidin-2-one Chemical compound SC=1C=CNC(=O)N=1 OVONXEQGWXGFJD-UHFFFAOYSA-N 0.000 claims description 3
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 claims description 3
- DHMYGZIEILLVNR-UHFFFAOYSA-N 5-fluoro-1-(oxolan-2-yl)pyrimidine-2,4-dione;1h-pyrimidine-2,4-dione Chemical compound O=C1C=CNC(=O)N1.O=C1NC(=O)C(F)=CN1C1OCCC1 DHMYGZIEILLVNR-UHFFFAOYSA-N 0.000 claims description 3
- TVICROIWXBFQEL-UHFFFAOYSA-N 6-(ethylamino)-1h-pyrimidin-2-one Chemical compound CCNC1=CC=NC(=O)N1 TVICROIWXBFQEL-UHFFFAOYSA-N 0.000 claims description 3
- NLLCDONDZDHLCI-UHFFFAOYSA-N 6-amino-5-hydroxy-1h-pyrimidin-2-one Chemical compound NC=1NC(=O)N=CC=1O NLLCDONDZDHLCI-UHFFFAOYSA-N 0.000 claims description 3
- KABRXLINDSPGDF-UHFFFAOYSA-N 7-bromoisoquinoline Chemical compound C1=CN=CC2=CC(Br)=CC=C21 KABRXLINDSPGDF-UHFFFAOYSA-N 0.000 claims description 3
- LOSIULRWFAEMFL-UHFFFAOYSA-N 7-deazaguanine Chemical compound O=C1NC(N)=NC2=C1CC=N2 LOSIULRWFAEMFL-UHFFFAOYSA-N 0.000 claims description 3
- XGWFJBFNAQHLEF-UHFFFAOYSA-N 9-anthroic acid Chemical compound C1=CC=C2C(C(=O)O)=C(C=CC=C3)C3=CC2=C1 XGWFJBFNAQHLEF-UHFFFAOYSA-N 0.000 claims description 3
- 108010006654 Bleomycin Proteins 0.000 claims description 3
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 claims description 3
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 claims description 3
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 claims description 3
- 108010025464 Cyclin-Dependent Kinase 4 Proteins 0.000 claims description 3
- 102100021906 Cyclin-O Human genes 0.000 claims description 3
- 102100036252 Cyclin-dependent kinase 4 Human genes 0.000 claims description 3
- 108010092160 Dactinomycin Proteins 0.000 claims description 3
- GUGHGUXZJWAIAS-QQYBVWGSSA-N Daunorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 GUGHGUXZJWAIAS-QQYBVWGSSA-N 0.000 claims description 3
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 claims description 3
- 102000003951 Erythropoietin Human genes 0.000 claims description 3
- 108090000394 Erythropoietin Proteins 0.000 claims description 3
- 101000897441 Homo sapiens Cyclin-O Proteins 0.000 claims description 3
- 101000904173 Homo sapiens Progonadoliberin-1 Proteins 0.000 claims description 3
- 108010050904 Interferons Proteins 0.000 claims description 3
- 102000014150 Interferons Human genes 0.000 claims description 3
- 108010002350 Interleukin-2 Proteins 0.000 claims description 3
- 102000000588 Interleukin-2 Human genes 0.000 claims description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 claims description 3
- 239000005517 L01XE01 - Imatinib Substances 0.000 claims description 3
- 108010000817 Leuprolide Proteins 0.000 claims description 3
- 229940127048 Metastron Drugs 0.000 claims description 3
- MSHZHSPISPJWHW-UHFFFAOYSA-N O-(chloroacetylcarbamoyl)fumagillol Chemical compound O1C(CC=C(C)C)C1(C)C1C(OC)C(OC(=O)NC(=O)CCl)CCC21CO2 MSHZHSPISPJWHW-UHFFFAOYSA-N 0.000 claims description 3
- 108010016076 Octreotide Proteins 0.000 claims description 3
- 229940123282 Oncogene inhibitor Drugs 0.000 claims description 3
- 239000012661 PARP inhibitor Substances 0.000 claims description 3
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 claims description 3
- 102100024028 Progonadoliberin-1 Human genes 0.000 claims description 3
- 101000996723 Sus scrofa Gonadotropin-releasing hormone receptor Proteins 0.000 claims description 3
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 claims description 3
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 claims description 3
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 claims description 3
- 229940009456 adriamycin Drugs 0.000 claims description 3
- 229940100198 alkylating agent Drugs 0.000 claims description 3
- 239000002168 alkylating agent Substances 0.000 claims description 3
- 150000001408 amides Chemical class 0.000 claims description 3
- 150000001413 amino acids Chemical class 0.000 claims description 3
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 claims description 3
- 229960003437 aminoglutethimide Drugs 0.000 claims description 3
- 229960001220 amsacrine Drugs 0.000 claims description 3
- 239000003242 anti bacterial agent Substances 0.000 claims description 3
- 229940088710 antibiotic agent Drugs 0.000 claims description 3
- 229960002756 azacitidine Drugs 0.000 claims description 3
- 229960001561 bleomycin Drugs 0.000 claims description 3
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 claims description 3
- 229960002092 busulfan Drugs 0.000 claims description 3
- 229940088954 camptosar Drugs 0.000 claims description 3
- 150000001720 carbohydrates Chemical class 0.000 claims description 3
- 229960003901 dacarbazine Drugs 0.000 claims description 3
- 229960000640 dactinomycin Drugs 0.000 claims description 3
- 229960000975 daunorubicin Drugs 0.000 claims description 3
- 229950010213 eniluracil Drugs 0.000 claims description 3
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 claims description 3
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 claims description 3
- 229960001904 epirubicin Drugs 0.000 claims description 3
- 229940105423 erythropoietin Drugs 0.000 claims description 3
- 150000002148 esters Chemical class 0.000 claims description 3
- AEOCXXJPGCBFJA-UHFFFAOYSA-N ethionamide Chemical compound CCC1=CC(C(N)=S)=CC=N1 AEOCXXJPGCBFJA-UHFFFAOYSA-N 0.000 claims description 3
- 229960000961 floxuridine Drugs 0.000 claims description 3
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 claims description 3
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 claims description 3
- 229960002074 flutamide Drugs 0.000 claims description 3
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 claims description 3
- 229960002584 gefitinib Drugs 0.000 claims description 3
- XLXSAKCOAKORKW-UHFFFAOYSA-N gonadorelin Chemical compound C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 XLXSAKCOAKORKW-UHFFFAOYSA-N 0.000 claims description 3
- 229960003685 imatinib mesylate Drugs 0.000 claims description 3
- SETFNECMODOHTO-UHFFFAOYSA-N indisulam Chemical compound C1=CC(S(=O)(=O)N)=CC=C1S(=O)(=O)NC1=CC=CC2=C1NC=C2Cl SETFNECMODOHTO-UHFFFAOYSA-N 0.000 claims description 3
- 229940079322 interferon Drugs 0.000 claims description 3
- 229960004768 irinotecan Drugs 0.000 claims description 3
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 claims description 3
- 229960004338 leuprorelin Drugs 0.000 claims description 3
- 229960002247 lomustine Drugs 0.000 claims description 3
- 229960004961 mechlorethamine Drugs 0.000 claims description 3
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 claims description 3
- QZIQJVCYUQZDIR-UHFFFAOYSA-N mechlorethamine hydrochloride Chemical compound Cl.ClCCN(C)CCCl QZIQJVCYUQZDIR-UHFFFAOYSA-N 0.000 claims description 3
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 claims description 3
- 229960001428 mercaptopurine Drugs 0.000 claims description 3
- 229960004635 mesna Drugs 0.000 claims description 3
- 229940101533 mesnex Drugs 0.000 claims description 3
- 229960000485 methotrexate Drugs 0.000 claims description 3
- 229950010895 midostaurin Drugs 0.000 claims description 3
- BMGQWWVMWDBQGC-IIFHNQTCSA-N midostaurin Chemical compound CN([C@H]1[C@H]([C@]2(C)O[C@@H](N3C4=CC=CC=C4C4=C5C(=O)NCC5=C5C6=CC=CC=C6N2C5=C43)C1)OC)C(=O)C1=CC=CC=C1 BMGQWWVMWDBQGC-IIFHNQTCSA-N 0.000 claims description 3
- 229960000350 mitotane Drugs 0.000 claims description 3
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 claims description 3
- BSIZUMJRKYHEBR-QGZVFWFLSA-N n-hydroxy-2(r)-[[(4-methoxyphenyl)sulfonyl](3-picolyl)amino]-3-methylbutanamide hydrochloride Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)N([C@H](C(C)C)C(=O)NO)CC1=CC=CN=C1 BSIZUMJRKYHEBR-QGZVFWFLSA-N 0.000 claims description 3
- 229960002700 octreotide Drugs 0.000 claims description 3
- 229960002340 pentostatin Drugs 0.000 claims description 3
- 229910052697 platinum Inorganic materials 0.000 claims description 3
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 claims description 3
- YKPYIPVDTNNYCN-INIZCTEOSA-N prinomastat Chemical compound ONC(=O)[C@H]1C(C)(C)SCCN1S(=O)(=O)C(C=C1)=CC=C1OC1=CC=NC=C1 YKPYIPVDTNNYCN-INIZCTEOSA-N 0.000 claims description 3
- 229960000624 procarbazine Drugs 0.000 claims description 3
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 claims description 3
- 108700042226 ras Genes Proteins 0.000 claims description 3
- LBGFKUUHOPIEMA-PEARBKPGSA-N sapacitabine Chemical compound O=C1N=C(NC(=O)CCCCCCCCCCCCCCC)C=CN1[C@H]1[C@@H](C#N)[C@H](O)[C@@H](CO)O1 LBGFKUUHOPIEMA-PEARBKPGSA-N 0.000 claims description 3
- 229960003440 semustine Drugs 0.000 claims description 3
- 229960001052 streptozocin Drugs 0.000 claims description 3
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 claims description 3
- 150000003437 strontium Chemical class 0.000 claims description 3
- AHBGXTDRMVNFER-FCHARDOESA-L strontium-89(2+);dichloride Chemical compound [Cl-].[Cl-].[89Sr+2] AHBGXTDRMVNFER-FCHARDOESA-L 0.000 claims description 3
- FQZYTYWMLGAPFJ-OQKDUQJOSA-N tamoxifen citrate Chemical compound [H+].[H+].[H+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 FQZYTYWMLGAPFJ-OQKDUQJOSA-N 0.000 claims description 3
- 229960003454 tamoxifen citrate Drugs 0.000 claims description 3
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 claims description 3
- 229940061532 tegafur / uracil Drugs 0.000 claims description 3
- 150000003573 thiols Chemical class 0.000 claims description 3
- 229960001196 thiotepa Drugs 0.000 claims description 3
- 229960000303 topotecan Drugs 0.000 claims description 3
- RXRGZNYSEHTMHC-BQBZGAKWSA-N troxacitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1O[C@@H](CO)OC1 RXRGZNYSEHTMHC-BQBZGAKWSA-N 0.000 claims description 3
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 claims description 3
- 229960004982 vinblastine sulfate Drugs 0.000 claims description 3
- 229960004528 vincristine Drugs 0.000 claims description 3
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 claims description 3
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 claims description 3
- 229960005212 vindesine sulfate Drugs 0.000 claims description 3
- NYHBQMYGNKIUIF-FJFJXFQQSA-N 9-beta-D-arabinofuranosylguanine Chemical compound C12=NC(N)=NC(O)=C2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O NYHBQMYGNKIUIF-FJFJXFQQSA-N 0.000 claims description 2
- RSWGJHLUYNHPMX-UHFFFAOYSA-N Abietic-Saeure Natural products C12CCC(C(C)C)=CC2=CCC2C1(C)CCCC2(C)C(O)=O RSWGJHLUYNHPMX-UHFFFAOYSA-N 0.000 claims description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 claims description 2
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 claims description 2
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 claims description 2
- 102000000578 Cyclin-Dependent Kinase Inhibitor p21 Human genes 0.000 claims description 2
- 108010016788 Cyclin-Dependent Kinase Inhibitor p21 Proteins 0.000 claims description 2
- 229920000858 Cyclodextrin Polymers 0.000 claims description 2
- KHPCPRHQVVSZAH-HUOMCSJISA-N Rosin Natural products O(C/C=C/c1ccccc1)[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 KHPCPRHQVVSZAH-HUOMCSJISA-N 0.000 claims description 2
- 239000002671 adjuvant Substances 0.000 claims description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 claims description 2
- 150000004945 aromatic hydrocarbons Chemical class 0.000 claims description 2
- 239000011324 bead Substances 0.000 claims description 2
- 229920002988 biodegradable polymer Polymers 0.000 claims description 2
- 239000004621 biodegradable polymer Substances 0.000 claims description 2
- 229960004117 capecitabine Drugs 0.000 claims description 2
- 235000014633 carbohydrates Nutrition 0.000 claims description 2
- 229960002436 cladribine Drugs 0.000 claims description 2
- 125000004122 cyclic group Chemical group 0.000 claims description 2
- 229940097362 cyclodextrins Drugs 0.000 claims description 2
- 229940104302 cytosine Drugs 0.000 claims description 2
- 239000003623 enhancer Substances 0.000 claims description 2
- 229940020967 gemzar Drugs 0.000 claims description 2
- 230000002163 immunogen Effects 0.000 claims description 2
- 229910052751 metal Inorganic materials 0.000 claims description 2
- 239000002184 metal Substances 0.000 claims description 2
- 229960003539 mitoguazone Drugs 0.000 claims description 2
- 229960001156 mitoxantrone Drugs 0.000 claims description 2
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 claims description 2
- 102000004169 proteins and genes Human genes 0.000 claims description 2
- 229910052717 sulfur Inorganic materials 0.000 claims description 2
- FIAFUQMPZJWCLV-UHFFFAOYSA-N suramin Chemical compound OS(=O)(=O)C1=CC(S(O)(=O)=O)=C2C(NC(=O)C3=CC=C(C(=C3)NC(=O)C=3C=C(NC(=O)NC=4C=C(C=CC=4)C(=O)NC=4C(=CC=C(C=4)C(=O)NC=4C5=C(C=C(C=C5C(=CC=4)S(O)(=O)=O)S(O)(=O)=O)S(O)(=O)=O)C)C=CC=3)C)=CC=C(S(O)(=O)=O)C2=C1 FIAFUQMPZJWCLV-UHFFFAOYSA-N 0.000 claims description 2
- 229960005314 suramin Drugs 0.000 claims description 2
- 229940061353 temodar Drugs 0.000 claims description 2
- KHPCPRHQVVSZAH-UHFFFAOYSA-N trans-cinnamyl beta-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OCC=CC1=CC=CC=C1 KHPCPRHQVVSZAH-UHFFFAOYSA-N 0.000 claims description 2
- DVQHYTBCTGYNNN-UHFFFAOYSA-N azane;cyclobutane-1,1-dicarboxylic acid;platinum Chemical compound N.N.[Pt].OC(=O)C1(C(O)=O)CCC1 DVQHYTBCTGYNNN-UHFFFAOYSA-N 0.000 claims 3
- 150000002431 hydrogen Chemical group 0.000 claims 2
- CZVCGJBESNRLEQ-UHFFFAOYSA-N 7h-purine;pyrimidine Chemical compound C1=CN=CN=C1.C1=NC=C2NC=NC2=N1 CZVCGJBESNRLEQ-UHFFFAOYSA-N 0.000 claims 1
- 101100409543 Homo sapiens PSMA3 gene Proteins 0.000 claims 1
- 102100035908 Proteasome subunit alpha type-3 Human genes 0.000 claims 1
- 101100409549 Spinacia oleracea PAG1 gene Proteins 0.000 claims 1
- ADFOJJHRTBFFOF-RBRWEJTLSA-N estramustine phosphate Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)OP(O)(O)=O)[C@@H]4[C@@H]3CCC2=C1 ADFOJJHRTBFFOF-RBRWEJTLSA-N 0.000 claims 1
- 229960004750 estramustine phosphate Drugs 0.000 claims 1
- 229940080856 gleevec Drugs 0.000 claims 1
- 150000002739 metals Chemical class 0.000 claims 1
- URBXHNSZZLMBOT-UHFFFAOYSA-N n-[9-(4-fluoro-3,5,6-trihydroxyoxan-2-yl)purin-6-yl]benzamide Chemical compound OC1C(F)C(O)C(O)OC1N1C2=NC=NC(NC(=O)C=3C=CC=CC=3)=C2N=C1 URBXHNSZZLMBOT-UHFFFAOYSA-N 0.000 claims 1
- 230000001225 therapeutic effect Effects 0.000 abstract description 12
- 241000699670 Mus sp. Species 0.000 description 103
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 35
- 241000699666 Mus <mouse, genus> Species 0.000 description 33
- 210000004027 cell Anatomy 0.000 description 33
- 101710142585 50S ribosomal protein 6, chloroplastic Proteins 0.000 description 30
- 125000005647 linker group Chemical group 0.000 description 30
- 239000000427 antigen Substances 0.000 description 29
- 108091007433 antigens Proteins 0.000 description 29
- 102000036639 antigens Human genes 0.000 description 29
- 230000015572 biosynthetic process Effects 0.000 description 24
- CTMZLDSMFCVUNX-VMIOUTBZSA-N cytidylyl-(3'->5')-guanosine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@H](OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=C(C(N=C(N)N3)=O)N=C2)O)[C@@H](CO)O1 CTMZLDSMFCVUNX-VMIOUTBZSA-N 0.000 description 24
- 210000004989 spleen cell Anatomy 0.000 description 24
- 238000003786 synthesis reaction Methods 0.000 description 24
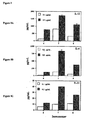
- 230000000259 anti-tumor effect Effects 0.000 description 23
- 230000004614 tumor growth Effects 0.000 description 21
- 102000004127 Cytokines Human genes 0.000 description 19
- 108090000695 Cytokines Proteins 0.000 description 19
- 238000004113 cell culture Methods 0.000 description 19
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 19
- 239000002953 phosphate buffered saline Substances 0.000 description 19
- 230000000694 effects Effects 0.000 description 18
- 230000006698 induction Effects 0.000 description 18
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 18
- 108010005774 beta-Galactosidase Proteins 0.000 description 16
- 102000004889 Interleukin-6 Human genes 0.000 description 14
- 108090001005 Interleukin-6 Proteins 0.000 description 14
- WQZGKKKJIJFFOK-FPRJBGLDSA-N beta-D-galactose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-FPRJBGLDSA-N 0.000 description 14
- 201000001441 melanoma Diseases 0.000 description 14
- 150000008300 phosphoramidites Chemical class 0.000 description 13
- 108020004414 DNA Proteins 0.000 description 12
- 108020004707 nucleic acids Proteins 0.000 description 12
- 102000039446 nucleic acids Human genes 0.000 description 12
- 150000007523 nucleic acids Chemical class 0.000 description 12
- 210000002966 serum Anatomy 0.000 description 12
- 125000001369 canonical nucleoside group Chemical group 0.000 description 11
- 208000029742 colonic neoplasm Diseases 0.000 description 11
- 206010006187 Breast cancer Diseases 0.000 description 10
- 208000026310 Breast neoplasm Diseases 0.000 description 10
- 230000004663 cell proliferation Effects 0.000 description 10
- 229940022353 herceptin Drugs 0.000 description 10
- 230000005764 inhibitory process Effects 0.000 description 10
- 239000000203 mixture Substances 0.000 description 10
- 210000004881 tumor cell Anatomy 0.000 description 10
- 241001465754 Metazoa Species 0.000 description 9
- 229960004641 rituximab Drugs 0.000 description 9
- 230000004083 survival effect Effects 0.000 description 9
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 8
- 108010074328 Interferon-gamma Proteins 0.000 description 8
- 210000001744 T-lymphocyte Anatomy 0.000 description 8
- 230000001093 anti-cancer Effects 0.000 description 8
- 239000012091 fetal bovine serum Substances 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 230000004048 modification Effects 0.000 description 8
- 238000012986 modification Methods 0.000 description 8
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 8
- 150000003384 small molecules Chemical group 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 206010009944 Colon cancer Diseases 0.000 description 7
- 230000028993 immune response Effects 0.000 description 7
- 238000009169 immunotherapy Methods 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 210000004988 splenocyte Anatomy 0.000 description 7
- 239000013598 vector Substances 0.000 description 7
- 102000003814 Interleukin-10 Human genes 0.000 description 6
- 108090000174 Interleukin-10 Proteins 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 6
- 210000000987 immune system Anatomy 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- 230000028327 secretion Effects 0.000 description 6
- 102000053642 Catalytic RNA Human genes 0.000 description 5
- 108090000994 Catalytic RNA Proteins 0.000 description 5
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 5
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 5
- 102000008070 Interferon-gamma Human genes 0.000 description 5
- 108091093037 Peptide nucleic acid Proteins 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 230000033289 adaptive immune response Effects 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 230000037396 body weight Effects 0.000 description 5
- 125000004432 carbon atom Chemical group C* 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 230000014509 gene expression Effects 0.000 description 5
- 210000002865 immune cell Anatomy 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 230000003389 potentiating effect Effects 0.000 description 5
- 108091092562 ribozyme Proteins 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 210000000952 spleen Anatomy 0.000 description 5
- 238000002054 transplantation Methods 0.000 description 5
- 125000002103 4,4'-dimethoxytriphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)(C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H])C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 4
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 description 4
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 4
- 230000003044 adaptive effect Effects 0.000 description 4
- 125000005600 alkyl phosphonate group Chemical group 0.000 description 4
- 230000005809 anti-tumor immunity Effects 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- 210000004443 dendritic cell Anatomy 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 4
- 238000011081 inoculation Methods 0.000 description 4
- 229960003130 interferon gamma Drugs 0.000 description 4
- 238000007912 intraperitoneal administration Methods 0.000 description 4
- 210000004072 lung Anatomy 0.000 description 4
- 210000002540 macrophage Anatomy 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 4
- 238000011580 nude mouse model Methods 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 125000006850 spacer group Chemical group 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 238000007920 subcutaneous administration Methods 0.000 description 4
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 3
- 102100037850 Interferon gamma Human genes 0.000 description 3
- 108090000978 Interleukin-4 Proteins 0.000 description 3
- 241000699660 Mus musculus Species 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 206010060862 Prostate cancer Diseases 0.000 description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- 125000000217 alkyl group Chemical group 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000002648 combination therapy Methods 0.000 description 3
- 238000011284 combination treatment Methods 0.000 description 3
- 239000012228 culture supernatant Substances 0.000 description 3
- NAGJZTKCGNOGPW-UHFFFAOYSA-N dithiophosphoric acid Chemical group OP(O)(S)=S NAGJZTKCGNOGPW-UHFFFAOYSA-N 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 125000000623 heterocyclic group Chemical group 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 230000005931 immune cell recruitment Effects 0.000 description 3
- 239000007928 intraperitoneal injection Substances 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- 238000003118 sandwich ELISA Methods 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 229960005322 streptomycin Drugs 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- 206010003445 Ascites Diseases 0.000 description 2
- 102000015790 Asparaginase Human genes 0.000 description 2
- 108010024976 Asparaginase Proteins 0.000 description 2
- 102100032484 Down syndrome critical region protein 8 Human genes 0.000 description 2
- 101001016533 Homo sapiens Down syndrome critical region protein 8 Proteins 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 229930182816 L-glutamine Natural products 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 102000003992 Peroxidases Human genes 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 108091028664 Ribonucleotide Proteins 0.000 description 2
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 206010041660 Splenomegaly Diseases 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 2
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 2
- 235000011114 ammonium hydroxide Nutrition 0.000 description 2
- 229960003272 asparaginase Drugs 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- XFILPEOLDIKJHX-QYZOEREBSA-N batimastat Chemical compound C([C@@H](C(=O)NC)NC(=O)[C@H](CC(C)C)[C@H](CSC=1SC=CC=1)C(=O)NO)C1=CC=CC=C1 XFILPEOLDIKJHX-QYZOEREBSA-N 0.000 description 2
- 229950001858 batimastat Drugs 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 229940022399 cancer vaccine Drugs 0.000 description 2
- 238000009566 cancer vaccine Methods 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000011254 conventional chemotherapy Methods 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 239000010432 diamond Substances 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- IIUMCNJTGSMNRO-VVSKJQCTSA-L estramustine sodium phosphate Chemical compound [Na+].[Na+].ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)OP([O-])([O-])=O)[C@@H]4[C@@H]3CCC2=C1 IIUMCNJTGSMNRO-VVSKJQCTSA-L 0.000 description 2
- 229960000390 fludarabine Drugs 0.000 description 2
- 229960005304 fludarabine phosphate Drugs 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 230000001031 immunopharmacological effect Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 239000000411 inducer Substances 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000015654 memory Effects 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- 235000020030 perry Nutrition 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 239000002336 ribonucleotide Substances 0.000 description 2
- 125000002652 ribonucleotide group Chemical group 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 230000000707 stereoselective effect Effects 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 150000003457 sulfones Chemical class 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- NJYXSKVOTDPOAT-LMVFSUKVSA-N (2r,3r,4r)-2-fluoro-3,4,5-trihydroxypentanal Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](F)C=O NJYXSKVOTDPOAT-LMVFSUKVSA-N 0.000 description 1
- UHEPSJJJMTWUCP-DHDYTCSHSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-[(1r)-1-hydroxyethyl]oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol;sulfuric acid Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H]([C@@H](C)O)O2)N)[C@@H](N)C[C@H]1N UHEPSJJJMTWUCP-DHDYTCSHSA-N 0.000 description 1
- STGXGJRRAJKJRG-JDJSBBGDSA-N (3r,4r,5r)-5-(hydroxymethyl)-3-methoxyoxolane-2,4-diol Chemical compound CO[C@H]1C(O)O[C@H](CO)[C@H]1O STGXGJRRAJKJRG-JDJSBBGDSA-N 0.000 description 1
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- DBBLJACMRYRHEL-UHFFFAOYSA-N 1,3-bis[[6,6-bis(4-methoxyphenyl)-6-phenylhexyl]amino]propan-2-yloxyphosphonamidous acid Chemical compound COC1=CC=C(C=C1)C(CCCCCNCC(CNCCCCCC(C2=CC=CC=C2)(C3=CC=C(C=C3)OC)C4=CC=C(C=C4)OC)OP(N)O)(C5=CC=CC=C5)C6=CC=C(C=C6)OC DBBLJACMRYRHEL-UHFFFAOYSA-N 0.000 description 1
- UYBWIEGTWASWSR-UHFFFAOYSA-N 1,3-diaminopropan-2-ol Chemical group NCC(O)CN UYBWIEGTWASWSR-UHFFFAOYSA-N 0.000 description 1
- MXHRCPNRJAMMIM-ULQXZJNLSA-N 1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-tritiopyrimidine-2,4-dione Chemical compound O=C1NC(=O)C([3H])=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 MXHRCPNRJAMMIM-ULQXZJNLSA-N 0.000 description 1
- HWPZZUQOWRWFDB-UHFFFAOYSA-N 1-methylcytosine Chemical compound CN1C=CC(N)=NC1=O HWPZZUQOWRWFDB-UHFFFAOYSA-N 0.000 description 1
- KZDCMKVLEYCGQX-UDPGNSCCSA-N 2-(diethylamino)ethyl 4-aminobenzoate;(2s,5r,6r)-3,3-dimethyl-7-oxo-6-[(2-phenylacetyl)amino]-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid;hydrate Chemical compound O.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 KZDCMKVLEYCGQX-UDPGNSCCSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- FTBBGQKRYUTLMP-UHFFFAOYSA-N 2-nitro-1h-pyrrole Chemical compound [O-][N+](=O)C1=CC=CN1 FTBBGQKRYUTLMP-UHFFFAOYSA-N 0.000 description 1
- 108020005029 5' Flanking Region Proteins 0.000 description 1
- LMEHJKJEPRYEEB-UHFFFAOYSA-N 5-prop-1-ynylpyrimidine Chemical compound CC#CC1=CN=CN=C1 LMEHJKJEPRYEEB-UHFFFAOYSA-N 0.000 description 1
- CQHICVVJQQDUJD-UHFFFAOYSA-N 7-aminoheptane-1,3-diol;aminophosphonous acid Chemical compound NP(O)O.NCCCCC(O)CCO CQHICVVJQQDUJD-UHFFFAOYSA-N 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 206010048998 Acute phase reaction Diseases 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 241000490494 Arabis Species 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- WTEVQBCEXWBHNA-UHFFFAOYSA-N Citral Natural products CC(C)=CCCC(C)=CC=O WTEVQBCEXWBHNA-UHFFFAOYSA-N 0.000 description 1
- 241000759568 Corixa Species 0.000 description 1
- 108010024986 Cyclin-Dependent Kinase 2 Proteins 0.000 description 1
- 102100036239 Cyclin-dependent kinase 2 Human genes 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 208000001382 Experimental Melanoma Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 1
- 229930010555 Inosine Natural products 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000006835 Lamins Human genes 0.000 description 1
- 108010047294 Lamins Proteins 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- WXJXBKBJAKPJRN-UHFFFAOYSA-N Methanephosphonothioic acid Chemical compound CP(O)(O)=S WXJXBKBJAKPJRN-UHFFFAOYSA-N 0.000 description 1
- 102100034256 Mucin-1 Human genes 0.000 description 1
- 108010008707 Mucin-1 Proteins 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101000641826 Mycobacterium phage L5 Gene 75 protein Proteins 0.000 description 1
- FSVCELGFZIQNCK-UHFFFAOYSA-N N,N-bis(2-hydroxyethyl)glycine Chemical compound OCCN(CCO)CC(O)=O FSVCELGFZIQNCK-UHFFFAOYSA-N 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- 230000006051 NK cell activation Effects 0.000 description 1
- 230000006042 NK cell recruitment Effects 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- TTZMPOZCBFTTPR-UHFFFAOYSA-N O=P1OCO1 Chemical class O=P1OCO1 TTZMPOZCBFTTPR-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 101150071746 Pbsn gene Proteins 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 244000088415 Raphanus sativus Species 0.000 description 1
- 235000006140 Raphanus sativus var sativus Nutrition 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 208000007660 Residual Neoplasm Diseases 0.000 description 1
- 238000011579 SCID mouse model Methods 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 230000029662 T-helper 1 type immune response Effects 0.000 description 1
- 210000000447 Th1 cell Anatomy 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000004658 acute-phase response Effects 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 210000005006 adaptive immune system Anatomy 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 230000003302 anti-idiotype Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000006023 anti-tumor response Effects 0.000 description 1
- 230000030741 antigen processing and presentation Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 230000009118 appropriate response Effects 0.000 description 1
- 238000011717 athymic nude mouse Methods 0.000 description 1
- 229940120638 avastin Drugs 0.000 description 1
- OHDRQQURAXLVGJ-HLVWOLMTSA-N azane;(2e)-3-ethyl-2-[(e)-(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S/1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C\1=N/N=C1/SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-HLVWOLMTSA-N 0.000 description 1
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 210000002469 basement membrane Anatomy 0.000 description 1
- 239000007998 bicine buffer Substances 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 201000008274 breast adenocarcinoma Diseases 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 230000000711 cancerogenic effect Effects 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 231100000357 carcinogen Toxicity 0.000 description 1
- 239000003183 carcinogenic agent Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000012916 chromogenic reagent Substances 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000002498 deadly effect Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 231100000517 death Toxicity 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 229940070968 depocyt Drugs 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 229940115080 doxil Drugs 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- GVGYEFKIHJTNQZ-RFQIPJPRSA-N ecgonine benzoate Chemical compound O([C@@H]1[C@@H]([C@H]2CC[C@@H](C1)N2C)C(O)=O)C(=O)C1=CC=CC=C1 GVGYEFKIHJTNQZ-RFQIPJPRSA-N 0.000 description 1
- 230000009881 electrostatic interaction Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 1
- 229940082789 erbitux Drugs 0.000 description 1
- NNYBQONXHNTVIJ-UHFFFAOYSA-N etodolac Chemical compound C1COC(CC)(CC(O)=O)C2=C1C(C=CC=C1CC)=C1N2 NNYBQONXHNTVIJ-UHFFFAOYSA-N 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000012997 ficoll-paque Substances 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 229960003297 gemtuzumab ozogamicin Drugs 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 210000004013 groin Anatomy 0.000 description 1
- 229940088013 hycamtin Drugs 0.000 description 1
- VDBLBOMHLNXRLR-UHFFFAOYSA-N hydrazinylphosphonous acid Chemical class NNP(O)O VDBLBOMHLNXRLR-UHFFFAOYSA-N 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000008629 immune suppression Effects 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 230000006054 immunological memory Effects 0.000 description 1
- 229960001438 immunostimulant agent Drugs 0.000 description 1
- 239000003022 immunostimulating agent Substances 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 229960003786 inosine Drugs 0.000 description 1
- 239000000138 intercalating agent Substances 0.000 description 1
- 230000017306 interleukin-6 production Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 238000011813 knockout mouse model Methods 0.000 description 1
- 210000005053 lamin Anatomy 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 229940063718 lodine Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229940115256 melanoma vaccine Drugs 0.000 description 1
- 210000003071 memory t lymphocyte Anatomy 0.000 description 1
- RXMBKOPBFXCPDD-UHFFFAOYSA-N methoxyphosphonamidous acid Chemical compound COP(N)O RXMBKOPBFXCPDD-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000004264 monolayer culture Methods 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- 239000002324 mouth wash Substances 0.000 description 1
- 229940051866 mouthwash Drugs 0.000 description 1
- CPQCSJYYDADLCZ-UHFFFAOYSA-N n-methylhydroxylamine Chemical class CNO CPQCSJYYDADLCZ-UHFFFAOYSA-N 0.000 description 1
- 230000031942 natural killer cell mediated cytotoxicity Effects 0.000 description 1
- WTEVQBCEXWBHNA-YFHOEESVSA-N neral Chemical compound CC(C)=CCC\C(C)=C/C=O WTEVQBCEXWBHNA-YFHOEESVSA-N 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 125000000018 nitroso group Chemical group N(=O)* 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 210000003200 peritoneal cavity Anatomy 0.000 description 1
- 210000004303 peritoneum Anatomy 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 238000001394 phosphorus-31 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000003834 purine nucleoside derivatives Chemical class 0.000 description 1
- 239000002213 purine nucleotide Substances 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 238000010242 retro-orbital bleeding Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 159000000000 sodium salts Chemical group 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 108010068698 spleen exonuclease Proteins 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical class NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229940110675 theracys Drugs 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000005758 transcription activity Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 150000005691 triesters Chemical class 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2887—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD20
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
Abstract
Description
本出願は、2003年5月16日に出願された米国仮出願第60/471,247号の利益を主張し、該仮出願は参照としてその全体が組み込まれる。
本発明は、イムノマーを治療薬として用いる抗癌用途に関する。
近年、数人の研究者らにより、オリゴヌクレオチドを免疫療法の用途において免疫刺激剤として用いることの有効性が示された。ホスホジエステルオリゴヌクレオチドおよびホスホロチオエートオリゴヌクレオチドが免疫刺激を誘導できるとの観察は、これらの化合物を治療ツールとして開発することへの関心を創出した。これらの努力は、天然のジヌクレオチドCpGを含むホスホロチオエートオリゴヌクレオチドに集中した。Kuramoto et al., Jpn. J. Cancer Res. 83:1128-1131 (1992)は、CpGジヌクレオチドを含むパリンドロームを含むホスホジエステルオリゴヌクレオチドが、インターフェロンアルファおよびガンマの合成を誘導し、ナチュラルキラー活性を増強できることを教示している。Krieg et al., Nature 371:546-549 (1995)は、ホスホロチオエートCpG含有オリゴヌクレオチドが免疫刺激性であることを開示している。Liang et al., J. Clin. Invest. 98:1119-1129 (1996)は、かかるオリゴヌクレオチドがヒトB細胞を活性化することを開示している。Moldoveanu et al., Vaccine 16:1216-124 (1998)は、CpG含有ホスホロチオエートオリゴヌクレオチドが、インフルエンザウィルスに対する免疫反応を増強することを教示している。McCluskie and Davis, J. Immunol.161:4463-4466 (1998)は、CpG含有オリゴヌクレオチドが、強力なアジュバントとして作用し、B型肝炎ウィルス表面抗原に対する免疫反応を増強することを教示している。
これらの報告は、免疫刺激性オリゴヌクレオチドの抗癌活性を増強する必要性の存在を明確にしている。
発明の簡単な概要
従って第1の側面において、本発明は、癌患者における癌を処置するための、該患者に免疫刺激性オリゴヌクレオチドおよび/またはイムノマーを化学療法剤と組み合わせて投与することを含む方法を提供し、ここで前記免疫刺激性オリゴヌクレオチドおよび/またはイムノマーおよび化学療法剤は相乗治療効果を創出する。
5’−Nn−N1−Y−Z−N1−Nn−3’ (III)
式中、
Yは、シチジン、2’−デオキシチミジン、2’−デオキシシチジン、アラビノシチジン、2’−デオキシ−2’−置換アラビノシチジン、2’−O−置換アラビノシチジン、2’−デオキシ−5−ヒドロキシシチジン、2’−デオキシ−N4−アルキル−シチジン、2’−デオキシ−4−チオウリジン、その他の非天然ピリミジンヌクレオシド、または1−(2’−デオキシ−β−D−リボフラノシル)−2−オキソ−7−デアザ−8−メチル−プリンであり;
Zは、グアノシンまたは2’−デオキシグアノシン、2’デオキシ−7−デアザグアノシン、2’−デオキシ−6−チオグアノシン、アラビノグアノシン、2’−デオキシ−2’置換アラビノグアノシン、2’−O−置換アラビノグアノシン、2’−デオキシイノシンまたはその他の非天然プリンヌクレオシドであり;
で表される免疫刺激性ドメインを含み、
ただし、N1またはNnの少なくとも1つは免疫刺激性部分であり;
ここでnは0〜30の数であり;
ここで3’ヌクレオシドは、随意的に、直接または非ヌクレオチドリンカーを介して他のオリゴヌクレオチドに結合されており、これは免疫刺激性であってもなくてもよい。
第3の側面において、本発明は、本発明による免疫刺激性オリゴヌクレオチドおよび/または免疫刺激性オリゴヌクレオチドおよび/またはイムノマーまたはイムノマー結合体、化学療法剤および生理学的に許容し得る担体とを含む、医薬製剤を提供する。
本発明は、免疫刺激性オリゴヌクレオチドおよび/またはイムノマーを抗癌剤として化学療法剤と組み合わせて治療に用いることに関する。本明細書に引用された、発行された特許、特許出願、および参考文献は、その各々が具体的また個別に参照として組み込まれると示された場合同様に、参照としてここに組み込まれる。本明細書に引用された任意の参考文献の任意の教示と本明細書の間に不一致がある場合は、本発明のために後者を優先する。
ある態様において、本発明による方法において用いるイムノマーは、2つまたは3つ以上の免疫刺激性オリゴヌクレオチドを含み、(イムノマーとの関連において)これは同一または異なっていてよい。好ましくは、かかる免疫刺激性オリゴヌクレオチドの各々は、少なくとも1つの到達可能5’末端を有する。
用語「オリゴヌクレオチド 」はハイブリッドおよびキメラオリゴヌクレオチドを含む。「キメラオリゴヌクレオチド」は、1種より多いヌクレオシド間結合を有するオリゴヌクレオチドである。かかるキメラオリゴヌクレオチドの好ましい1例は、ホスホロチオエート、ホスホジエステルまたはホスホロジチオエート部位およびアルキルホスホネートまたはアルキルホスホノチオエート結合などの非イオン結合を含むキメラオリゴヌクレオチドである(例えばPederson et al.の、米国特許第5,635,377号および第5,366,878号などを参照)。
Dは、水素結合供与体(hydrogen bond donor)であり;
D’は、水素、水素結合供与体、水素結合受容体(hydrogen bond acceptor)、親水基、疎水基、電子求引基および電子供与基からなる群から選択され;
Aは、水素結合受容体または親水基であり;
A’は、水素結合受容体、親水基、疎水基、電子求引基および電子供与基からなる群から選択され;
Xは、炭素または窒素であり;そして
S’は、ペントースもしくはヘキソース糖環、または天然に存在しない糖である、
を有する。
好ましい水素結合供与体は、限定なく、−NH−、−NH2、−SHおよび−OHを含む。好ましい水素結合受容体は、限定なく、C=O、C=S、および芳香族複素環の環窒素原子、例えばシトシンのN3を含む。
Dは、水素結合供与体であり;
D’は、水素、水素結合供与体、および親水基からなる群から選択され;
Aは、水素結合受容体または親水基であり;
Xは、炭素または窒素であり;
各Lは、独立してC、O、NおよびSからなる群から選択され;そして、
S’は、ペントースもしくはヘキソース糖環、または天然に存在しない糖である、
を有する。
好ましい水素結合供与体は、限定なく、−NH−、−NH2、−SHおよび−OHを含む。好ましい水素結合受容体は、限定なく、C=O、C=S、−NO2、および芳香族複素環の環窒素原子、例えばグアニンのN1を含む。
5’−Nn−N1−Y−Z−N1−Nn−3’ (III)
式中、
Yは、シチジン、2’デオキシチミジン、2’デオキシシチジン、アラビノシチジン、2’−デオキシ−2’−置換アラビノシチジン、2’−デオキシチミジン、2’−O−置換アラビノシチジン、2’−デオキシ−5−ヒドロキシシチジン、2’−デオキシ−N4−アルキル−シチジン、2’−デオキシ−4−チオウリジン、その他の非天然ピリミジンヌクレオシド、または1−(2’−デオキシ−β−D−リボフラノシル)−2−オキソ−7−デアザ−8−メチル−プリンであり;
N1は、各々の場合に、天然に存在するかまたは合成のヌクレオシドまたは免疫刺激部分であって、これらは、脱塩基ヌクレオシド、アラビノヌクレオシド、2’−デオキシウリジン、α−デオキシリボヌクレオシド、β−L−デオキシリボヌクレオシド、およびホスホジエステルまたは修飾ヌクレオシド間結合により隣接ヌクレオシドの3’側へ結合されたヌクレオシドからなる群から選択され、ここで前記修飾ヌクレオシド間結合は、限定することなく、約2オングストローム〜約200オングストロームの長さを有するリンカー、C2〜C18アルキルリンカー、ポリ(エチレングリコール)リンカー、2−アミノブチル−1,3−プロパンジオールリンカー、グリセリルリンカー、2’−5’ヌクレオシド間結合、およびホスホロチオエート、ホスホロジチオエート、もしくはメチルホスホネートヌクレオシド間結合から選択され;
で表される免疫刺激性ドメインを含み、
ただし、N1またはNnの少なくとも1つは免疫刺激性部分であり;
ここで各nは独立して、0〜30の数であり;そして
ここで、イムノマーの場合は、3’末端は直接または非ヌクレオチドリンカーを介して他のオリゴヌクレオチドに結合されており、これは免疫刺激性であってもなくてもよい。
本発明による方法において用いられる免疫刺激性オリゴヌクレオチドおよび/またはイムノマーにおける、好ましい免疫刺激性部分は、修飾複素環塩基を有するヌクレオシドをさらに含み、これらは、限定なく、5−ヒドロキシシトシン、5−ヒドロキシメチルシトシン、N4−アルキルシトシン、好ましくはN4−エチルシトシン、4−チオウラシル、6−チオグアニン、7−デアザグアニン、イノシン、ニトロピロール、C5−プロピニルピリミジン、および限定なく2,6−ジアミノプリンを含むジアミノプリンを含む。
さらに他の態様において、非ヌクレオチドリンカーは、オリゴヌクレオチドへの付着を許容する官能基を有する有機部分である。かかる付着は、任意の安定な共有結合によるのが好ましい。
ある態様において、小分子は脂肪族または芳香族炭化水素であり、これらのどちらも、随意的に、オリゴヌクレオチドを結合する直鎖においてまたはそれに付加されて、ヒドロキシ、アミノ、チオール、チオエーテル、エーテル、アミド、チオアミド、エステル、尿素、およびチオ尿素からなる群から選択される1つまたは2つ以上の官能基を含むことができる。小分子は、環式または非環式であることができる。小分子リンカーの例は、限定はされないが、アミノ酸、炭水化物、シクロデキストリン、アダマンタン、コレステロール、ハプテンおよび抗生物質を含む。しかし、非ヌクレオチドリンカーを記述するために、用語「小分子」はヌクレオシドを含むことを意図しない。
イムノマーのパラレル合成は、直線合成に対して幾つかの利点を有する:(1)パラレル合成は同一のモノマー単位の組み込みを許容する;(2)直線合成とは異なり、両方(または全て)のモノマー単位が同時に合成され、そのため合成に必要な合成ステップ数および時間が、モノマー単位のそれらと同じになる;および(3)合成ステップ数の減少は、最終イムノマー産物の純度および収率を改善する。
以下の例は、本発明のある好ましい態様をさらに説明することを意図しており、本発明の範囲を限定することは意図していない。
例1:免疫刺激性部分を含有するオリゴヌクレオチドの合成
オリゴヌクレオチドを、1μmolスケールでDNA自動合成装置(Expedite 8909; PerSeptive Biosystems, Framingham, MA)を用いて、図5および図6に概説した直線合成またはパラレル合成方法に従って合成した。
脾細胞増殖のin vitro解析を、前に記載した標準的方法(例えば、Zhao et al., Biochem Pharma 51:173-182(1996)を参照)を用いて行った。図8Aに結果を示す。これらの結果は、高濃度において、2つの到達可能5’末端を有するイムノマー6は、到達可能5’末端を有さないイムノマー5または1つの到達可能5’末端を有するオリゴヌクレオチド4よりも、多くの脾細胞増殖をもたらすことが示される。イムノマー6はまた、LPS陽性対照よりも多くの脾細胞増殖をもたらす。
in vitroでの結果をin vivoモデルに適用可能かどうかを試験するために、選択したオリゴヌクレオチドをマウスに投与し、免疫刺激活性レベルの指標として脾腫の程度を測定した。5mg/kgの単回用量をBALB/cマウス(雌、4〜6週齢、Harlan Sprague Dawley Inc. Baltic, CT)に腹腔内投与した。オリゴヌクレオチド投与の72時間後にマウスを犠牲にし、脾臓を採取して重量測定した。図8Bに結果を示す。これらの結果は、2つの到達可能5’末端を有するイムノマー6が、オリゴヌクレオチド4またはイムノマー5よりも大幅に高い免疫刺激効果を有することを示す。
脊椎動物細胞、好ましくはBALB/cマウス脾臓細胞またはヒトPBMCにおける、IL−12およびIL−6の分泌を、サンドイッチELISAで測定した。サイトカイン抗体および標準サイトカインを含む必要な試薬は、PharMingen, San Diego, CAより購入した。ELISAプレート(Costar)は、PBSN緩衝液(PBS/0.05%アジ化ナトリウム、pH9.6)中の5μg/mLの適当な抗体を用いて4℃にて1晩インキュベートし、次にPBS/1%BSAを用いて37℃にて30分間ブロッキングした。細胞培養上清および標準サイトカインは、PBS/10%FBSで適切に希釈し、前記プレートにトリプリケート(triplicate)で添加し、25℃で2時間インキュベートした。プレートに1μg/mLの適当なビオチン化抗体を加え、25℃で1.5時間インキュベートした。次にプレートをPBS−T緩衝液(PBS/0.05%Tween 20)でよく洗浄し、ストレプトアビジン結合ペルオキシダーゼ(Sigma, St. Louis, MO)を加えた後25℃で1.5時間さらにインキュベートした。プレートをSure Blue(登録商標)(Kirkegaard and Perry)発色試薬(chromogenic reagent)で発色させ、Stop Solution(Kirkegaard and Perry)を加えて反応を終了させた。色の変化をCeres 900 HDI分光光度計(Bio-Tek Instruments)で測定した。下の表5Aに結果を示す。
表5.ヒトPBMC培養物におけるイムノマー構造および免疫刺激活性
表9〜11に示すように、免疫刺激性ジヌクレオチドモチーフ内に非天然のピリミジンヌクレオシドまたは非天然のプリンヌクレオシドを含む、種々の長さのイムノマーでは、免疫刺激活性は維持された。
表9.イムノマー構造および免疫刺激活性
2つのオリゴヌクレオチドを結合するリンカーの長さの効果を試験するため、同じオリゴヌクレオチドを含むがリンカーの異なるイムノマーを合成し、免疫刺激活性を試験した。表12に示す結果は、リンカーの長さはイムノマーの免疫刺激活性に役割を果たすことを示唆する。最大の免疫刺激活性は、C3〜C6−アルキルリンカーまたは分散されたホスフェート電荷(interspersed phosphate charge)を有する脱塩基リンカーにより達成された。
一般に、天然のホスホジエステル主鎖を含む免疫刺激性オリゴヌクレオチドは、ホスホロチオエート主鎖を有する同じ長さのオリゴヌクレオチドより免疫刺激性が低い。この低い免疫刺激活性の程度は、部分的に、実験条件下におけるホスホジエステルオリゴヌクレオチドの迅速な分解による可能性がある。オリゴヌクレオチドの分解は、第1に3’エキソヌクレアーゼの結果であり、該ヌクレアーゼは3’末端からオリゴヌクレオチドを消化する。この例のイムノマーは遊離の3’末端を含まない。従って、ホスホジエステル骨格を有するイムノマーは、実験条件下において対応するモノマーオリゴヌクレオチドより長い半減期を有するはずであり、従って改善された免疫刺激活性を示す。表13に示す結果はこの効果を示しており、イムノマー84および85は、BALB/cマウスの脾臓細胞培養におけるサイトカイン誘導によって決定される免疫刺激活性を示す。
表13.イムノマー構造および免疫刺激活性
PC3細胞を、ペニシリン100U/mlおよびストレプトマイシン100μg/mlの存在下で10%ウシ胎仔血清(FBS)を含む90%Ham’sF12K培地中で培養し、ヒト前立腺癌モデル(PC3)を確立した。4〜6週齢の雄の胸腺欠損ヌードマウス(Frederick Cancer Research and Development Center, Frederick MD)を、試験前に環境調節のため6日間順応させた。培養PC3細胞は、単層培養から収集し、Ham’sF12K培地(10%FBS)で2回洗浄し、FBSなしのHam’sF12K培地:マトリゲル基底膜マトリクス(Becton Dickinson Labware, Bedford, MA)(5:1;V/V)中に再懸濁させ、各マウスの左鼡径部に皮下注射した(5×106細胞、全量0.2ml)。動物は、通常の臨床的所見、体重、および腫瘍増殖について観察した。腫瘍増殖は、キャリパー(caliper)を用いて、移植組織の2つの直交する直径を測定して監視した。腫瘍質量(グラムによる重量)は、式:1/2a×b2により計算し、式中「a」は長径(cm)、「b」は短径(cm)である。平均腫瘍サイズが〜80mgに達したら、ヒト癌の異種移植片を有する動物を処置群および対照群(1郡あたり5匹)にランダムに分けた。対照群には無菌生理食塩水(0.9%NaCl)のみを与えた。生理食塩水に無菌的に溶解したイムノマー255または285を、皮下注射により、0.5または1.0mg/kg/日を3用量/週で投与した。ゲムシタビンHCl(Eli Lilly and Company, Indianapolis, IN)を、腹腔内注射により、160mg/kgで2回、0日目および3日目に与えた。詳細な処置のスケジュールを以下に示す。
G2:ゲムシタビン(160mg/kg/日、IP、0日目および3日目)
G3:255(1.0mg/kg/日、SC、3用量/週で6週間)
G4:255(0.5mg/kg/日、SC、3用量/週で6週間)
G5:285(1.0mg/kg/日、SC、3用量/週で6週間)
G6:285(0.5mg/kg/日、SC、3用量/週で6週間)
G7:255(0.5mg/kg/日、SC、3用量/週で6週間)+ゲムシタビン(160mg/kg/日、IP、0日目および3日目)
G8:285(0.5mg/kg/日、SC、3用量/週で6週間)+ゲムシタビン(160mg/kg/日、IP、0日目および3日目)
種々の処置の後の腫瘍の測定値は、表14および図13に示す。イムノマー255および285で処置した全動物は、生理食塩水対照群に比べて、腫瘍の増殖が顕著に阻害された(p<0.5)。これらの処置群には用量反応関係の傾向が見られた(図13)。イムノマー255と285の間には有意な差はなかった(表14)。
例8の実験を、ゲムシタビンの代わりにタキソテレを用いて繰り返した。タキソテレは、0日目および7日目に投与した。イムノマー165は週に5日投与した。イムノマー255および285は、0、2、4、7、9および11日目に投与した。結果を下の表16に示す。これらの結果は、イムノマーとタキソテレの間に明らかな相乗効果を示す。
図15に示すIMO化合物および非CpGDNA:(5’CTATCTCACCTTCTCTGT−3’)を、上述のように合成、精製および解析した。
雌のBALB/c(H−2d)、C57BL/6、並びにIL−6およびIl−12ノックアウト(ko)マウス(両方ともC57BL/6バックグランドにてko)で5〜8週齢のものを、Jackson Laboratory (Bar Harbor, ME)から購入した。CT26.WT(ATCC, Rockville, MD)は、発癌物質誘導BALB/c未分化結腸癌である。CT26.CL25(ATCC, Rockville, MD)は、大腸菌β-gal遺伝子と共に形質導入されたCT26.WTのサブクローンである。4T1は、BALB/cマウスの乳房腺癌細胞株である。B16.F0は、C57BL/6由来のメラノーマ(ATCC)である。CT26.WTおよび4T1細胞は、RPMI1640、熱で不活性化した10%ウシ胎仔血清(FBS、Atlas Biologicals, Fort Colins, CO)、2mMのLグルタミン、100μg/mlのストレプトマイシン、100U/mlのペニシリン(Mediatech, VA)中で培養した。CT26.CL25は、同じ培地+400μg/mlのG418硫酸塩(Life Technologies, Grand Island, NY)中に維持する。B16.F0細胞は、10%FBSおよび抗生物質を含むDMEM中で増殖させた。
4T1腫瘍モデルについては、PBS100μl中の5×105細胞/マウスを、BALB/cマウスの右側腹低部に移植した。5日目に平均腫瘍サイズが50mm2に達した時、30mg/kgのドキソルビシン(Bedford lab. Bedford, OH)を3回、5、6および7日目にi.p注射してマウスに与えた。PBS100μl中に溶解したIMO2(1mg/kg)は、腫瘍周辺の注射により週に2回、全部で6回投与した。
CT26.WTまたはCT26.CL25腹膜腫瘍を有し、IMO化合物で処置されたマウスの長期生存動物(n=5)を、5×105の元の腫瘍細胞のi.pまたはi.vにより、さらなる処置なしで再チャレンジした。腫瘍を有するマウスにおけるIMO誘導抗腫瘍反応の特異性を評価するために、これらの長期生存動物(n=5)は、同系の臓器非関連乳房腫瘍4T1(5x105)でも再チャレンジした。i.v再チャレンジ群では、マウスは13日目に犠牲にし、肺を収集して、肺への転移を計測した。
T細胞反応を決定するため、各群からの2匹または3匹のマウスをs.c.腫瘍移植後26日目またはi.p.腫瘍接種後21日目に犠牲にし、各群の脾細胞からのプールされたT細胞を、T細胞濃縮カラム(R&D systems, Minneapolis, MN)を用いて精製した。精製したT細胞(2.5×105)は、2.5×105の、マイトマイシンC(50μg/ml、Sigma, St. Louis, MO)で処置したβ-galまたはOVAペプチドパルス同系脾臓細胞で24時間刺激した。次に、H−2d拘束(H-2d restricted)された抗原特異的(β-gal876−884)再刺激に特異的に反応するT細胞を、インターフェロン−ガンマ(IFN−γ)およびIL−4ELISPOT解析により、製造業者(R&D Systems)の指示に従って決定した。スポットは電子的に計測した(Zellnet, New York, NY)。
IMO1およびIMO2は強いIL−12分泌を誘導し、一方IMO2は、in vitroで低いIL−6産生を誘導する(図16)。In vivoでの免疫薬理学的効果を評価するため、IMO化合物、CpGイムノマー、および非CpGオリゴを、BALB/cマウスにi.p、s.cまたはi.mにて10mg/kgの用量で投与し、4時間後にそれらの血清をIL−12およびIL−6について評価した。IMO化合物は両方とも、従来のCpGオリゴと比べて、強い血清IL−12分泌を誘導した(表17)。しかし、合成CpRモチーフを含有するIMO2は、全3投与経路において、有意に低い血清IL−6を誘導し(表17)、我々の初期のin vitroでの研究結果が確認された。対照の非CpGDNAは、有意でないIL−12およびIL−6の誘導を示した。
表17.異なる経路で投与されたIMO化合物によるin vivoでのサイトカインの誘導a
ネズミ結腸癌CT26.CL25モデルにおけるIMO化合物の抗腫瘍活性を評価した。CT26.CL25皮下固形腫瘍を有するBALB/cマウスを、腫瘍接種6日目より、IMO化合物1mg/kgを1日おきに10回腫瘍周辺に投与して処置した。IMO化合物による処置は、75%までの動物において腫瘍増殖の完全な拒絶または阻害を引き起こした(図17A)。非CpGDNAで処置したマウスと比べて、24日目に、平均の腫瘍増殖阻害率72%および85%がそれぞれIMO1およびIMO2によって処置されたマウスで観察された。さらに、腹膜播種性腹水(peritoneal disseminated ascites)CT26.WT(図17B)およびCT26.CL25(図17C)を有するマウスに対して、1mg/kgの用量でIMO2を腹膜投与すると、マウスの生存率が大きく増加した。
IMO化合物で処置後のCT26.CL25腫瘍を有するマウスの血清を、β-gal特異的IgG1およびIgG2a抗体濃度について解析した。IMO化合物で処置したマウスは、抗β-gal特異的IgG2a抗体濃度が5倍以上(OD単位)増加した(図18)。従来のCpGDNAによる処置は、β-gal特異的IgG2a濃度が約2倍増加しただけであった。対象的に、β-gal特異的IgG1濃度は、中程度の0.5〜2倍の増加のみが観察された(図18)。
腫瘍を有するマウスに対するIMOによる処置が、腫瘍特異的CTL反応を引き起こすかどうかを試験するため、CT26.CL25腫瘍を有するマウスの異なる処置群から得た脾細胞から精製したT細胞を、マイトマイシンCで処置したβ-galまたはOVAペプチドパルス同系脾臓細胞で24時間刺激した。対照の非CpGDNAで処置したマウスに比べて、IMO化合物およびCpGDNAで処置したマウスにおいては、より高いIFN−γ誘導(図19A)が検出されたがIL−4は検出されなかった(図19B)ように、H−2d拘束(β-gal876−884)抗原への有意に高い腫瘍特異的CTL反応が見出された。
IMOによる処置が、腫瘍特異的適応免疫反応も誘導するかどうかを試験するため、CT26.CL25腹膜腫瘍をIMO処置により除去されたマウスを、再チャレンジした。前にIMO2で処置したマウスは、CT26.WTおよびCT26.CL25腫瘍のi.p再チャレンジを拒絶した(図20Aおよび20B)。腹膜注射した腫瘍からIMO2による処置後に生存したマウスはまた、i.v.接種の後の同じ腫瘍の肺転移を拒絶した(データ示さず)。同様の結果が、CT26.WTまたはCT26.CL25細胞で再チャレンジした、CT26.WT腫瘍モデル実験において見出された(データ示さず)。これらのデータは、IMO2で処置したマウスは、モデル腫瘍抗原β-galに対してのみでなく、親腫瘍(CT26)抗原に対しても適応免疫反応を発達させたことを示す。しかし、かかる免疫メモリーは腫瘍特異的であり、同じマウスは、同系の、臓器非関連4T1乳癌のチャレンジからは保護されなかった(図20C)。
IMO2の処置が特異的な抗腫瘍免疫を誘導するという概念と整合して、IMO処置後にCT26.CL25腫瘍を拒絶したマウスからの脾細胞をナイーブマウスに移植し、これらのマウスをCT26.CL25または4T1腫瘍細胞でチャレンジした。IMO2で処置したマウスからの脾細胞は、ナイーブマウスからの脾細胞と異なり、CT26.CL25腫瘍細胞による致命的な腫瘍チャレンジに対して保護された(図21A)。腫瘍再チャレンジ実験の場合と同様に、この保護は腫瘍特異的であり、4T1腫瘍細胞チャレンジには当てはまらなかった(図21B)。
IMO2の抗腫瘍活性について、B16.F0マウスメラノーマを有するマウスにおいてさらに試験した。B16.F0メラノーマを有するC57BL/6マウスを、腫瘍接種の8日目に開始して、1日おきに10回、1mg/kgのIMO2を腫瘍周辺に投与して処置した。図22Aに示すように、IMO2は、皮下にB16.F0メラノーマを有するC57BL/6マウスにおいて、71%の腫瘍増殖の阻害をもたらした。IMO1による処置もまた、IMO2と同じ程度の腫瘍阻害をもたらした(データ示さず)。
CT26.CL25結腸癌の場合と同様、B16.F0腫瘍を有するマウスのIMO2による処置は、対照の非CpGDNAで処置したマウスと比べて、血清IgG2aの総循環の有意な増加と、総IgG1濃度の減少または無変化をもたらした(図22Bおよび22C)。これらの結果は、B16.F0メラノーマを有するマウスにおける、IMO処置後の強力なTh1型免疫反応を示唆する。
IgG2a濃度の増加および腫瘍抗原特異的CTL反応を含む上記のデータは、結腸癌モデルにおける、IMO処置後の、Th1優位反応(Th1-dominated response)への明確なシフトを示唆した。B16メラノーマを有する、野生型(wt)、IL−12ko、およびIL−6koのC57BL/6マウスにおける、IMO化合物の抗腫瘍効果を試験した。B16.F0腫瘍を有するwtおよびIL−6ko C57BL/6マウスの、IMO2による処置は、腫瘍増殖の有意な減少をもたらした(図23)。しかし、IMOによる処置は、同じ腫瘍を有するIL−12koマウスに対して有意な効果を有さず、IMO誘導抗腫瘍活性にIL−12が必要であることを示唆している(図23)。
B16.F0腹水腫瘍または4T1皮下固形腫瘍を有するマウスにおける、化学療法剤とIMO化合物の相乗効果を試験した。IMO2の腫瘍周辺への注射およびドキソルビシン全身投与は、単独で、4T1腫瘍増殖の強力な阻害をもたらした(図24A)。組み合わせると、2つの処置はさらに強力であった(図24A)。ドセタキシルおよびIMO2の組み合わせ療法はまた、腹膜分散B16.F0メラノーマに対して大きな相乗効果を示し、各剤単独での処置に比べて、マウスの生存率が延長された(図24B)。
免疫細胞活性化に対するドセタキシルおよびIMO2処置の効果を、末梢血中のCD69+およびCD86+の集団の変化を測定して試験した。IMO2で処置したマウスは、CD69+およびCD86+細胞のパーセンテージの大幅な増加を示したが、1日目および3日目のドセタキシル30mg/kgの投与は、かかる活性化を阻害しなかった(図24C)。
マウス特異的免疫刺激性モチーフを含有するIMO2の結果に基づき、ヒト特異的モチーフを含有するIMO3を合成し、マウスのCT26.CL25腫瘍に対するその活性を試験した。IMO3は、この腫瘍モデルに対しても強力な抗腫瘍活性を示した(図25A)。予想通り、IMO2およびIMO3の両方は、マウスにおいてIL−12分泌を誘導した(図25B)。さらに、図26に示すように、IMO3によるヒトPBMCの活性化は、ヘルセプチンの存在下でHer−2陽性BT−474細胞の溶解を誘導した。
ナマルワ(Namalwa)B細胞リンパ腫細胞を、NOD/SCIDマウスに腹腔内注射により移植して、高度B細胞ヒト非ホジキンスリンパ腫と同様の疾患を生成した。腫瘍を有するマウスは、50mg/kgのリツキサンを4、6、8日目に、および/または2.5mg/kgのIMO2を4、6、8、11、14および21日目に、腹腔内注射して処置した(図27)。図28に示すように、腫瘍増殖は、リツキサンとIMO2の組み合わせにより有意に阻害された。
皮下移植されたHer−2過剰発現ヒト乳房腫瘍(BT474)を有するヌードマウスを、10mg/kgのヘルセプチンの腹腔内注射および/または1mg/kgのIMO化合物の腫瘍周辺注射により、週2回、6週間処置した(図27)。ヘルセプチンまたはIMO2単独による処置の後の腫瘍増殖は、PBS対照群と比べて70%および65%阻害された(図29)。腫瘍増殖の97%の著しい阻害が、ヘルセプチンとIMO2の組み合わせ処置により見出された(図29)。
皮下移植されたHer−2過剰発現ヒト乳房腫瘍(BT474)を有するヌードマウス。腫瘍を有するマウスは、リツキサンを5、7、9および11日目に、および/またはIMO2を5、7、9、11および13日目に、腹腔内注射して処置した。図30に示すように、腫瘍増殖は、IMO2および、リツキサンとIMO2の組合せにより、有意に阻害された。
前述の発明を、明確さと理解のためにある程度詳細に記述したが、この開示を読んだ当業者には、本発明の真の範囲および付属のクレームから乖離することなく、形態および詳細についての種々の改変が可能であることが理解される。
Claims (24)
- 癌患者における癌を処置するための方法であって、該患者に免疫刺激性オリゴヌクレオチドおよび/またはイムノマーを化学療法剤と組み合わせて投与することを含み、ここで前記免疫刺激性オリゴヌクレオチドおよび/またはイムノマーおよび化学療法剤は相乗効果を作り出す、前記方法。
- イムノマーが、非ヌクレチドオリンカーによって結合された、1つより多い5’末端を有する少なくとも2つのオリゴヌクレトチドを含み、ここで前記オリゴヌクレオチドの少なくとも1つは到達可能5’末端を有する免疫刺激性オリゴヌクレオチドであり、免疫刺激性ジヌクレオチドを含む、請求項1に記載の方法。
- 免疫刺激性オリゴヌクレオチドおよび/またはイムノマーが、構造:
5’−Nn−N1−Y−Z−N1−Nn−3’ (III)
式中、
Yは、シチジン、2’デオキシシチジン、アラビノシチジン、2’−デオキシチミジン、2’−デオキシ−2’−置換アラビノシチジン、2’−O−置換アラビノシチジン、2’−デオキシ−5−ヒドロキシシチジン、2’−デオキシ−N4−アルキル−シチジン、2’−デオキシ−4−チオウリジン、その他の非天然ピリミジンヌクレオシド、または1−(2’−デオキシ−β−D−リボフラノシル)−2−オキソ−7−デアザ−8−メチル−プリンであり;
Zは、グアノシンまたは2’−デオキシグアノシン、2’デオキシ−7−デアザグアノシン、2’−デオキシ−6−チオグアノシン、アラビノグアノシン、2’−デオキシ−2’置換アラビノグアノシン、2’−O−置換アラビノグアノシン、2’デオキシイノシンまたはその他の非天然プリンヌクレオシドであり;
N1は、各々の場合に、天然に存在するかまたは合成のヌクレオシドまたは免疫刺激性部分であって、これらは、脱塩基ヌクレオシド、アラビノヌクレオシド、2’−デオキシウリジン、α−デオキシリボヌクレオシド、β−L−デオキシリボヌクレオシド、およびホスホジエステルまたは修飾ヌクレオシド間結合により隣接ヌクレオシドの3’側へ結合されたヌクレオシド、からなる群から選択され、ここで前記修飾ヌクレオシド間結合は、限定することなく、約2オングストローム〜約200オングストロームの長さを有するリンカー、C2〜C18アルキルリンカー、ポリ(エチレングリコール)リンカー、2−アミノブチル−1,3−プロパンジオールリンカー、グリセリルリンカー、2’−5’ヌクレオシド間結合、およびホスホロチオエート、ホスホロジチオエート、もしくはメチルホスホネートヌクレオシド間結合から選択され;
Nnは、各々の場合に、好ましくは天然に存在するヌクレオシドまたは免疫刺激性部分であって、これらは、脱塩基ヌクレオシド、アラビノヌクレオシド、2’−デオキシウリジン、α−デオキシリボヌクレオシド、2’−O−置換リボヌクレオシド、および修飾ヌクレオシド間結合により隣接ヌクレオシドの3’側へ結合されたヌクレオシド、からなる群から選択され、ここで前記修飾ヌクレオシド間結合は、好ましくは、アミノリンカー、C2〜C18アルキルリンカー、ポリ(エチレングリコール)リンカー、2−アミノブチル−1,3−プロパンジオールリンカー、グリセリルリンカー、2’−5’ヌクレオシド間結合、およびメチルホスホネートヌクレオシド間結合からなる群から選択される;
で表される前記構造を有し、
ただし、N1またはNnの少なくとも1つは免疫刺激性部分であり;
ここで各nは独立して、0〜30までの数であり;そして
ここで、イムノマーの場合は、3’末端は直接または非ヌクレオチドリンカーを介して他のオリゴヌクレオチドに結合されており、これは免疫刺激性であってもなくてもよい;
請求項1に記載の方法。 - 化学療法剤が、ゲムシタビン、メトトレキサート、ビンクリスチン、アドリアマイシン、シスプラチン、糖非含有クロロエチルニトロソウレア、5−フルオロウラシル、マイトマイシンC、ブレオマイシン、ドキソルビシン、ダカルバジン、タキソール、フラギリン、メグラミンGLA、バルルビシン、カルムスタインおよびポリフェルポサン、MMI270、BAY12−9566、RASファメシルトランスフェラーゼ阻害剤、ファメシルトランスフェラーゼ阻害剤、MMP、MTA/LY231514、LY264618/ロメテキソール、グラモレク、CI−994、TNP−470、ヒカムチン/トポテカン、PKC412、バルスポダール/PSC833、ノバントロン/ミトロキサントロン、メタレット/スラミン、バチマスタット、E7070、BCH−4556、CS−682、9−AC、AG3340、AG3433、インセル/VX−710、VX−853、ZD0101、ISI641、ODN698、TA2516/マルミスタット、BB2516/マルミスタット、CDP845、D2163、PD183805、DX8951f、レモナールDP2202、FK317、メシル酸イマチニブ/グリべック、ピシバニル/OK−432、AD32/バルルビシン、メタストロン/ストロンチウム誘導体、テモダール/テモゾロミド、エバセット/リポソームドキソルビシン、ユータキサン/パクリタキセル、タキソール/パクリタキセル、キセロアド/カペシタビン、フルツロン/ドキシフルリジン、シクロパックス/経口パクリタキセル、経口タキソイド、SPU−077/シスプラチン、HMR1275/フラボピリドール、CP−358(774)/EGFR、CP−609(754)RAS腫瘍遺伝子阻害剤、BMS−182751/経口プラチナ、UFT(テガフール/ウラシル)、エルガミゾール/レバミソール、エニルウラシル/776C85/5FUエンハンサー、カンプト/レバミソール、カンプトサール/イリノテカン、ツモデックス/ラリトレキセド、ルイスタチン/クラドリビン、パキセックス/パクリタキセル、ドキシル/リポソームドキソルビシン、カエリクス/リポソームドキソルビシン、フルダラ/フルダラビン、ファルモルビシン/エピルビシン、デポシト、ZD1839、LU79553/ビス−ナフタリミド、LU103793/ドラスタイン、カエチックス/リポソームドキソルビシン、ゲムザール/ゲムシタビン、ZD0473/アノルメド、YM116、ロジンシード、CDK4およびCDK2阻害剤、PARP阻害剤、D4809/デキシホスファミド、イフェス/メスネックス/イホスファミド、ブモン/テニポシド、パラプラチン/カルボプラチン、プランチノール/シスプラチン、ベペシド/エトポシド、ZD9331、タキソテレ/ドセタキセル、グアニンアラビノシドのプロドラッグ、タキサン類似体、ニトロソウレア、メルフェランおよびシクロホスファミドなどのアルキル化剤、アミノグルテチミド、アルパラギナーゼ、ブスルファン、カルボプラチン、クロロンブシル、シタラビンHCl、ダクチノマイシン、ダウノルビシンHCl、エストラムスチンリン酸ナトリウム、エトポシド(VP16−213)、フロクスウリジン、フルオロウラシル(5−FU)、フルタミド、ヒドロキシウレア(ヒドロシキカルバミド)、イホスファミド、インターフェロンアルファ−2a、アルファ−2b、酢酸ロイプロリド(LHRH放出因子類似体)、ロムスチン(CCNU)、メクロレタミンHCl(ナイトロジェンマスタード)、メルカプトプリン、メスナ、ミトタン(o.p’−DDD)、ミトキサントロンHCl、オクトレオチド、プリカマイシン、プロカルバジンHCl、ストレプトゾシン、クエン酸タモキシフェン、チオグアニン、チオテパ、硫酸ビンブラスチン、アムサクリン(m−AMSA)、アザシチジン、エリスロポエチン、ヘキサメチルメラミン(HMM)、インターロイキン2、ミトグアゾン(メチル−GAG;メチルグリオキサールビス−グアニルヒドラゾン;MGBG)、ペントスタチン(2’デオキシコホルマイシン)、セムスチン(メチル−CCNU)、テニポシド(VM−26)および硫酸ビンデシンからなる群から選択される、請求項1に記載の方法。
- イムノマーが、構造:
5’−TCGTTGX−Y−XGTTGCT−5’
式中、XはC3リンカーであり、Yはグリセロールリンカーである、
を有する、請求項1に記載の方法。 - 水素結合供与体が、−NH−、−NH2、−SHおよび−OHからなる群から選択される、請求項7に記載の方法。
- 水素結合受容体が、C=O、C=S、−N=および芳香族複素環の環窒素原子からなる群から選択される、請求項7に記載の方法。
- 天然に存在しないプリンが6−チオグアニンまたは7−デアザグアニンである、請求項7に記載の免疫刺激性オリゴヌクレオチドおよび/またはイムノマー。
- 水素結合供与体が、−NH−、−NH2、−SHおよび−OHからなる群から選択される、請求項11に記載の方法。
- 水素結合受容体が、C=O、C=S、およびシトシンのN3を含む芳香族複素環の環窒素原子からなる群から選択される、請求項11に記載の方法。
- (I)の塩基部分が、天然に存在しないピリミジン塩基である、請求項11に記載の方法。
- 天然に存在しないピリミジン塩基が、5−ヒドロキシシトシン、5−ヒドロキシメチルシトシン、N4−アルキルシトシンからなる群から、好ましくはN4−エチルシトシンおよび4−チオウラシルから選択される、請求項14に記載の方法。
- (I)における糖部分S’が、天然に存在しない糖部分である、請求項11に記載の方法。
- 天然に存在しない糖部分が、ヘキソース、アラビノースおよびアラビノース誘導体からなる群から選択される、請求項16に記載の方法。
- 免疫刺激性オリゴヌクレオチドおよび/またはイムノマーが、約2オングストローム〜約200オングストロームの長さのリンカー、金属、溶解性または非溶解性の生体分解性ポリマービーズ、オリゴヌクレオチドの3’末端ヌクレオシドへの付着を許容する官能基を有する有機部分、生体分子、環式または非環式の小分子、脂肪族または芳香族炭化水素、からなる群から選択される非ヌクレオチドリンカーを含み、これらのいずれもが、オリゴヌクレオチドに結合しているかまたはそれに付加されている直鎖において、ヒドロキシ、アミノ、チオール、チオエーテル、エーテル、アミド、チオアミド、エステル、尿素、およびチオ尿素;アミノ酸、炭水化物、シクロデキストリン、アダマンタン、コレステロール、ハプテン、抗生物質、式:HO−(CH2)o−CH(OH)−(CH2)p−OHで表され、式中、oおよびpは独立して1〜約6の整数であるグリセロールまたはグリセロールホモログ、および1,3−ジアミノ−2−ヒドロキシプロパンの誘導体、からなる群から選択される1個または2個以上の官能基を随意的に含むことができる、請求項1に記載の方法。
- 免疫刺激性オリゴヌクレオチドおよび/またはイムノマーが、本質的にホスホジエステル結合からなるヌクレオシド間結合を有する、請求項1に記載の方法。
- 癌患者における癌を処置するための方法であって、該患者に化学療法剤と組み合わせて免疫刺激性オリゴヌクレオチド結合体および/またはイムノマー結合体を投与することを含む、前記方法。
- 免疫刺激性オリゴヌクレオチドおよび/またはイムノマー、化学療法剤および生理学的に許容し得る担体を含む、医薬製剤。
- ワクチンを投与することをさらに含む、請求項1に記載の方法。
- 免疫刺激性オリゴヌクレオチドおよび/またはイムノマーまたはワクチン、または両方が、免疫原性タンパク質に結合している、請求項22に記載の方法。
- アジュバントを投与することをさらに含む、請求項23に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US47124703P | 2003-05-16 | 2003-05-16 | |
| PCT/US2004/015313 WO2004103301A2 (en) | 2003-05-16 | 2004-05-14 | Synergistic treatment of cancer using immunomers in conjunction with chemotherapeutic agents |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006528697A true JP2006528697A (ja) | 2006-12-21 |
| JP2006528697A5 JP2006528697A5 (ja) | 2007-06-28 |
Family
ID=33476820
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006533117A Withdrawn JP2006528697A (ja) | 2003-05-16 | 2004-05-14 | イムノマーを化学療法剤と組み合わせて用いる、癌の相乗的処置 |
Country Status (8)
| Country | Link |
|---|---|
| US (3) | US7569554B2 (ja) |
| EP (1) | EP1628531A4 (ja) |
| JP (1) | JP2006528697A (ja) |
| KR (1) | KR20060012622A (ja) |
| AU (1) | AU2004241093B2 (ja) |
| CA (1) | CA2526212C (ja) |
| MX (1) | MXPA05012421A (ja) |
| WO (1) | WO2004103301A2 (ja) |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| KR100917101B1 (ko) * | 2000-08-04 | 2009-09-15 | 도요 보세키 가부시키가이샤 | 플렉시블 금속적층체 및 그 제조방법 |
| JP2004509970A (ja) * | 2000-09-26 | 2004-04-02 | ハイブリドン・インコーポレイテッド | 位置的化学変化による免疫刺激オリゴヌクレオチドアナログの免疫刺激活性の調節 |
| PT1404873E (pt) | 2001-06-21 | 2013-07-30 | Dynavax Tech Corp | Compostos de imunomodulação quiméricos e métodos de utilização dos mesmos |
| US7785610B2 (en) | 2001-06-21 | 2010-08-31 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same—III |
| US7276489B2 (en) * | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| AR040996A1 (es) | 2002-08-19 | 2005-04-27 | Coley Pharm Group Inc | Acidos nucleicos inmunoestimuladores |
| US10100316B2 (en) * | 2002-11-21 | 2018-10-16 | Archemix Llc | Aptamers comprising CPG motifs |
| US8853376B2 (en) | 2002-11-21 | 2014-10-07 | Archemix Llc | Stabilized aptamers to platelet derived growth factor and their use as oncology therapeutics |
| US7354907B2 (en) * | 2003-02-07 | 2008-04-08 | Idera Pharmaceuticals, Inc. | Short immunomodulatory oligonucleotides |
| MXPA06000619A (es) * | 2003-07-15 | 2006-04-11 | Hybridon Inc | Estimulacion sinergistica del sistema inmune usando oligonucleotidos inmunoestimuladores y/o compuestos inmunomeros en conjunto con citocinas y/o agentes quimioterapeuticos o terapia de radiacion. |
| CA2612162C (en) | 2005-07-01 | 2016-05-17 | Index Pharmaceuticals Ab | Use of oligonucleotides in steroid refractory or steroid dependent inflammatory conditions |
| US8148341B2 (en) | 2005-07-01 | 2012-04-03 | Index Pharmaceuticals Ab | Method for modulating responsiveness to steroids |
| AU2006283174A1 (en) * | 2005-08-24 | 2007-03-01 | Cell-Matrix, Inc. | Combination therapies for inhibiting integrin-extracellular matrix interactions |
| WO2007050034A1 (en) | 2005-10-28 | 2007-05-03 | Index Pharmaceuticals Ab | Composition and method for the prevention, treatment and/or alleviation of an inflammatory disease |
| US7470674B2 (en) * | 2005-11-07 | 2008-12-30 | Idera Pharmaceuticals, Inc. | Immunostimulatory properties of oligonucleotide-based compounds comprising modified immunostimulatory dinucleotides |
| GB0523041D0 (en) * | 2005-11-11 | 2005-12-21 | Cyclacel Ltd | Combination |
| MX2009003398A (es) | 2006-09-27 | 2009-08-12 | Coley Pharm Gmbh | Analogos de oligonucleotidos cpg que contienen analogos t hidrofobos con actividad inmunoestimuladora mejorada. |
| DK2073837T3 (da) * | 2006-10-06 | 2014-09-29 | Bavarian Nordic Inc | Rekombinant modificeret vaccinia-ankara-virus, der koder for et her-2-antigen, i kombination med en taxan til anvendelse til behandling af cancer |
| GB0625283D0 (en) * | 2006-12-19 | 2007-01-24 | Cyclacel Ltd | Combination |
| WO2009150405A1 (en) | 2008-06-09 | 2009-12-17 | Cyclacel Limited | Combination of spacitabine (cndac) and dna methyltransferase inhibitors such as decitabine and procaine |
| WO2011018225A1 (en) * | 2009-08-14 | 2011-02-17 | Roche Glycart Ag | Combination therapy of an afucosylated cd20 antibody with fludarabine and/or mitoxantrone |
| TWI409079B (zh) * | 2009-08-14 | 2013-09-21 | Roche Glycart Ag | 非典型岩藻醣化cd20抗體與苯達莫斯汀(bendamustine)之組合療法 |
| EP2425830A1 (en) * | 2010-09-03 | 2012-03-07 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Synergistic drug combination for the treatment of cancer |
| CN102172359A (zh) * | 2011-03-02 | 2011-09-07 | 张始状 | 腺苷与核苷组合在制备治疗肿瘤药物中的应用 |
| ES2743691T3 (es) | 2011-04-14 | 2020-02-20 | Cyclacel Ltd | Régimen de dosis para sapacitabina y decitabina en combinación para tratar la leucemia mieloide aguda |
| FR2975600B1 (fr) | 2011-05-24 | 2013-07-05 | Assist Publ Hopitaux De Paris | Agents pour le traitement de tumeurs |
| WO2012170384A1 (en) | 2011-06-06 | 2012-12-13 | Chevron Phillips Chemical Company Lp | Use of metallocene compounds for cancer treatment |
| US10894963B2 (en) | 2013-07-25 | 2021-01-19 | Exicure, Inc. | Spherical nucleic acid-based constructs as immunostimulatory agents for prophylactic and therapeutic use |
| EP3508198A1 (en) | 2014-06-04 | 2019-07-10 | Exicure, Inc. | Multivalent delivery of immune modulators by liposomal spherical nucleic acids for prophylactic or therapeutic applications |
| KR20170078843A (ko) | 2014-11-21 | 2017-07-07 | 노오쓰웨스턴 유니버시티 | 구형 핵산 나노입자 접합체의 서열 특이적 세포 흡수 |
| US11364304B2 (en) | 2016-08-25 | 2022-06-21 | Northwestern University | Crosslinked micellar spherical nucleic acids |
| US11696954B2 (en) | 2017-04-28 | 2023-07-11 | Exicure Operating Company | Synthesis of spherical nucleic acids using lipophilic moieties |
| WO2018209270A1 (en) | 2017-05-11 | 2018-11-15 | Northwestern University | Adoptive cell therapy using spherical nucleic acids (snas) |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997032604A1 (en) * | 1996-03-07 | 1997-09-12 | Novartis Ag | Antiproliferative combinations, containing raf-targeted oligonucleotides and chemotherapeutic compounds |
| WO2001083503A2 (en) * | 2000-05-01 | 2001-11-08 | Hybridon, Inc. | MODULATION OF OLIGONUCLEOTIDE CpG-MEDIATED IMMUNE STIMULATION BY POSITIONAL MODIFICATION OF NUCLEOSIDES |
| WO2001097843A2 (en) * | 2000-06-22 | 2001-12-27 | University Of Iowa Research Foundation | Methods for enhancing antibody-induced cell lysis and treating cancer |
| JP2002505666A (ja) * | 1997-04-30 | 2002-02-19 | ハイブリドン・インコーポレイテッド | オリゴヌクレオチド媒介特異的サイトカイン誘発および感染からのインビボ保護 |
| WO2002026757A2 (en) * | 2000-09-26 | 2002-04-04 | Hybridon, Inc. | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5149797A (en) | 1990-02-15 | 1992-09-22 | The Worcester Foundation For Experimental Biology | Method of site-specific alteration of rna and production of encoded polypeptides |
| TW244371B (ja) | 1992-07-23 | 1995-04-01 | Tri Clover Inc | |
| US6346614B1 (en) | 1992-07-23 | 2002-02-12 | Hybridon, Inc. | Hybrid oligonucleotide phosphorothioates |
| US5652355A (en) | 1992-07-23 | 1997-07-29 | Worcester Foundation For Experimental Biology | Hybrid oligonucleotide phosphorothioates |
| US5912332A (en) | 1996-07-26 | 1999-06-15 | Hybridon, Inc. | Affinity-based purification of oligonucleotides using soluble multimeric oligonucleotides |
| US6406705B1 (en) * | 1997-03-10 | 2002-06-18 | University Of Iowa Research Foundation | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| US20010034330A1 (en) * | 1998-08-10 | 2001-10-25 | Charlotte Kensil | Innate immunity-stimulating compositions of CpG and saponin and methods thereof |
| US6581606B2 (en) * | 1999-07-06 | 2003-06-24 | The Rx Files Corporation | Method, apparatus and system for use in treating patient with a drug having an antineoplastic effect to optimize therapy and prevent an adverse drug response |
| JP5268214B2 (ja) | 1999-08-13 | 2013-08-21 | イデラ ファーマシューティカルズ インコーポレイテッド | ヌクレオシドの位置的修飾によるオリゴヌクレオチドCpG−媒体免疫刺激の変調 |
| MXPA02005842A (es) * | 1999-12-13 | 2003-10-14 | Bioniche Life Sciences Inc | Oligonucleotidos sinteticos terapeuticamente utiles. |
| AU3108001A (en) * | 2000-01-20 | 2001-12-24 | Coley Pharmaceutical Group, Inc. | Immunostimulatory nucleic acids for inducing a th2 immune response |
| US6815429B2 (en) | 2000-01-26 | 2004-11-09 | Hybridon, Inc. | Modulation of oligonucleotide CpG-mediated immune stimulation by positional modification of nucleosides |
| US20020156033A1 (en) * | 2000-03-03 | 2002-10-24 | Bratzler Robert L. | Immunostimulatory nucleic acids and cancer medicament combination therapy for the treatment of cancer |
| EP1985702A3 (en) * | 2000-12-08 | 2010-08-18 | Coley Pharmaceutical GmbH | CPG-like nucleic acids and methods of use thereof |
| PT1404873E (pt) | 2001-06-21 | 2013-07-30 | Dynavax Tech Corp | Compostos de imunomodulação quiméricos e métodos de utilização dos mesmos |
| EP1501359A4 (en) * | 2001-08-03 | 2007-04-18 | Celldex Therapeutics Inc | COMPOSITIONS CONTAINING IMMUNOSTIMULATING OLIGONUCLEOTIDES AND USES THEREOF FOR AMPLIFYING IMMUNOTHERAPIES INDIRECTLY DISENGAGED BY THE FC RECEPTOR |
| WO2003035836A2 (en) * | 2001-10-24 | 2003-05-01 | Hybridon Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5' ends |
| US7276489B2 (en) * | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| AR040996A1 (es) * | 2002-08-19 | 2005-04-27 | Coley Pharm Group Inc | Acidos nucleicos inmunoestimuladores |
| CA2512484A1 (en) * | 2003-01-16 | 2004-05-08 | Hybridon, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by utilizing modified immunostimulatory dinucleotides |
| MXPA06000619A (es) * | 2003-07-15 | 2006-04-11 | Hybridon Inc | Estimulacion sinergistica del sistema inmune usando oligonucleotidos inmunoestimuladores y/o compuestos inmunomeros en conjunto con citocinas y/o agentes quimioterapeuticos o terapia de radiacion. |
| US7427405B2 (en) * | 2004-06-15 | 2008-09-23 | Idera Pharmaceuticals, Inc. | Immunostimulatory oligonucleotide multimers |
| US20060014713A1 (en) * | 2004-06-15 | 2006-01-19 | Hybridon, Inc. | Immunostimulatory oligonucleotide multimers |
-
2004
- 2004-05-14 EP EP04752345A patent/EP1628531A4/en not_active Withdrawn
- 2004-05-14 CA CA2526212A patent/CA2526212C/en active Active
- 2004-05-14 WO PCT/US2004/015313 patent/WO2004103301A2/en active Application Filing
- 2004-05-14 MX MXPA05012421A patent/MXPA05012421A/es active IP Right Grant
- 2004-05-14 AU AU2004241093A patent/AU2004241093B2/en not_active Ceased
- 2004-05-14 JP JP2006533117A patent/JP2006528697A/ja not_active Withdrawn
- 2004-05-14 KR KR1020057021896A patent/KR20060012622A/ko active IP Right Grant
- 2004-05-14 US US10/846,167 patent/US7569554B2/en active Active
-
2008
- 2008-01-28 US US12/020,694 patent/US7875594B2/en active Active
-
2011
- 2011-01-14 US US13/006,860 patent/US20120107303A1/en not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997032604A1 (en) * | 1996-03-07 | 1997-09-12 | Novartis Ag | Antiproliferative combinations, containing raf-targeted oligonucleotides and chemotherapeutic compounds |
| JP2002505666A (ja) * | 1997-04-30 | 2002-02-19 | ハイブリドン・インコーポレイテッド | オリゴヌクレオチド媒介特異的サイトカイン誘発および感染からのインビボ保護 |
| WO2001083503A2 (en) * | 2000-05-01 | 2001-11-08 | Hybridon, Inc. | MODULATION OF OLIGONUCLEOTIDE CpG-MEDIATED IMMUNE STIMULATION BY POSITIONAL MODIFICATION OF NUCLEOSIDES |
| WO2001097843A2 (en) * | 2000-06-22 | 2001-12-27 | University Of Iowa Research Foundation | Methods for enhancing antibody-induced cell lysis and treating cancer |
| WO2002026757A2 (en) * | 2000-09-26 | 2002-04-04 | Hybridon, Inc. | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
Also Published As
| Publication number | Publication date |
|---|---|
| US20080206265A1 (en) | 2008-08-28 |
| EP1628531A4 (en) | 2010-06-30 |
| US7875594B2 (en) | 2011-01-25 |
| AU2004241093A1 (en) | 2004-12-02 |
| US7569554B2 (en) | 2009-08-04 |
| WO2004103301A3 (en) | 2005-11-03 |
| AU2004241093B2 (en) | 2009-08-27 |
| KR20060012622A (ko) | 2006-02-08 |
| CA2526212A1 (en) | 2004-12-02 |
| US20050009773A1 (en) | 2005-01-13 |
| EP1628531A2 (en) | 2006-03-01 |
| US20120107303A1 (en) | 2012-05-03 |
| CA2526212C (en) | 2013-08-27 |
| MXPA05012421A (es) | 2006-02-22 |
| WO2004103301A2 (en) | 2004-12-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7875594B2 (en) | Synergistic treatment of cancer using immunomers in conjunction with chemotherapeutic agents | |
| AU2004259204B2 (en) | Synergistic stimulation of the immune system using immunostimulatory oligonucleotides and/or immunomer compounds in conjunction with cytokines and/or chemotherapeutic agents or radiation therapy | |
| EP2650369B1 (en) | Novel synthetic agonists of TLR9 | |
| US7786089B2 (en) | Immunostimulatory activity of immune modulatory oligonucleotides (IMO™) containing different lengths of palindromic segments | |
| US20110293565A1 (en) | Novel synthetic agonists of tlr9 | |
| AU2014203624B2 (en) | Novel synthetic agonists of TLR9 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070511 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070511 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100608 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100908 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100915 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20101008 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20101018 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20101108 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20101115 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101208 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110125 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110525 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20110526 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20110616 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20110812 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130213 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130218 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130308 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130313 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20130612 |