がんを治療するための特に面白いアプローチは、免疫治療として公知の、免疫応答を刺激する物質を用いた疾患の予防または治療を包含する。当該技術分野において免疫腫瘍学的方法とも呼ばれる免疫治療は、腫瘍ではなく宿主免疫系を標的とする療法を導入することによって、がんの治療に革命を起こし始めた。これらの療法は、独特な薬理学的応答特性を有し、したがって、多くの異なるタイプのがんを治癒させ得る療法を表す。肺、腎臓、膀胱及び皮膚のがんは、とりわけ、生存または腫瘍応答の点で免疫腫瘍学的方法を用いた治療から実質的な効能を得、メラノーマは潜在的に、最も多大なる恩恵を示す。免疫療法はしばしば、チェックポイント阻害抗体として公知の面白い新たなクラスの生物製剤を用いたチェックポイント阻害剤治療を特徴とする。
本開示は、がんを治療するための方法及び組成物、特に免疫治療法及び免疫治療組成物を特徴とする。いくつかの態様において、本開示は、第1の免疫応答プライマーポリペプチド及び第2の異なる免疫応答プライマーポリペプチドをコードする2つ以上のポリヌクレオチド(例えば、mRNA)、及び、任意選択で免疫応答共刺激シグナルポリペプチドをコードするポリヌクレオチド、ならびに、任意選択で、チェックポイント阻害剤ポリペプチドまたはチェックポイント阻害剤ポリペプチドを含むポリペプチドをコードするポリヌクレオチドを特徴とする併用療法を用いてがんを治療するための方法ならびに組成物を特徴とする。いくつかの態様において、本開示は、インターロイキン23(IL-23)ポリペプチドをコードするポリヌクレオチド、インターロイキン36ガンマ(IL-36ガンマ)ポリペプチドをコードするポリヌクレオチド、及び、任意選択で、OX40Lポリペプチドをコードするポリヌクレオチドを含む免疫調節組成物を提供する。他の態様において、本開示は、IL-23ポリペプチドをコードするポリヌクレオチド、インターロイキン18(IL-18)ポリペプチドをコードするポリヌクレオチド、及び、任意選択で、OX40Lポリペプチドをコードするポリヌクレオチドを含む免疫調節組成物を提供する。
いくつかの態様において、本開示は、IL-23、IL-36もしくはIL-18及び/またはOX40LをコードするmRNAを特徴とする組み合わせアプローチを用いてがんを治療する方法に関する。理論において束縛されることなく、抗がん免疫応答の刺激は、IL-12ファミリーのメンバー(例えば、IL-23)及び/またはIL-1ファミリーのメンバー(例えば、IL-36またはIL-18)をコードするmRNAを、例えば、腫瘍内に投与することによって可能である。IL-23は、例えば、T細胞、ナチュラルキラー細胞、マクロファージ、及びまたは樹状細胞の刺激において重要である。IL-36は、例えば、T細胞、ナチュラルキラー細胞、顆粒球、及び/または樹状細胞の刺激において重要である。IL-18は、IL-12とまとまって、細胞仲介性免疫を誘導し、例えば、T細胞、ナチュラルキラー細胞、及び/またはマクロファージの刺激において重要である。IL-36をコードするmRNA、またはIL-18をコードするmRNAは、IL-23をコードするmRNAとの組み合わせにおいて、例えば、腫瘍環境内での免疫系へ、例えば、これらのmRNAの腫瘍内注射を介して第1の刺激シグナルを提供すると考えられている。免疫応答共刺激シグナルポリペプチド、例えば、OX40LをコードするmRNAの投与は、IL-23及びIL-36をコードするmRNAとの組み合わせにおいて提供される場合、T細胞を刺激するOX40Lの能力に少なくとも一部起因して、第2の刺激シグナルを提供すると考えられている。
いくつかの態様において、本明細書に開示される免疫治療法は、(1)免疫原性を最適化するために腫瘍微小環境(TME)を転換し、及び/または(2)遠達制御及び抗がんメモリーを引き出すようT細胞応答を高めることができる。遠達効果、すなわち、腫瘍を局所的に治療してなおも包括的に作用することは、図44に示されている。
本開示のいくつかの態様は、IL-36をコードするmRNAとの組み合わせにおけるIL-23をコードするmRNAを用いた治療を特徴とする。本開示の他の態様は、IL-18をコードするmRNAとの組み合わせにおけるIL-23をコードするmRNAを用いた治療を特徴とする。例示的な態様は、脂質ナノ粒子(LNP)に封入されたmRNAを用いた治療を特徴とする。例示的な態様は、イオン性アミノ脂質系LNPにおけるmRNAの腫瘍内投与を特徴とする。
本開示の他の態様は、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害することを必要とする対象へ、IL-23、IL-36-ガンマまたはIL-18、及びOX40LをコードするmRNAを含む有効量の組成物を投与することによって、対象における腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害する組成物及び方法を特徴とする。いくつかの態様において、mRNAの組み合わせは、IL-23ポリペプチドをコードする第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドを含む。本開示の一態様は、IL-23ポリペプチドをコードする2つ以上のポリヌクレオチド(例えば、mRNA)、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドをコードするポリヌクレオチド(例えば、mRNA)、及びOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)を含む、医薬組成物に関する。
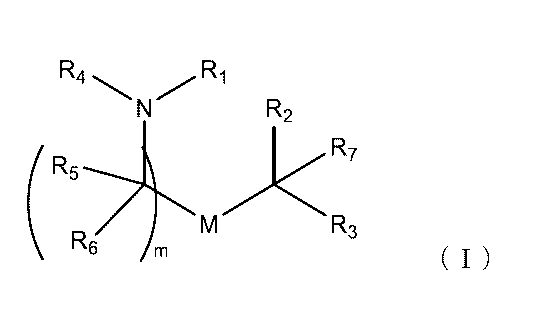
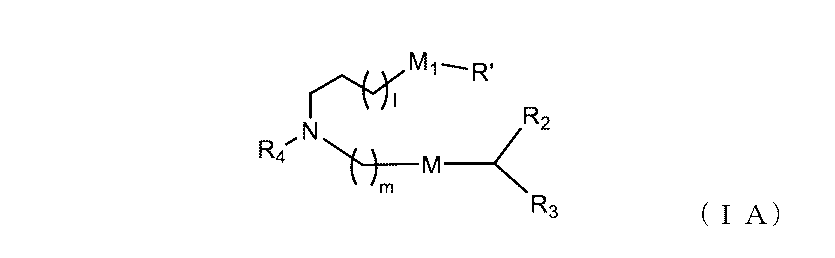
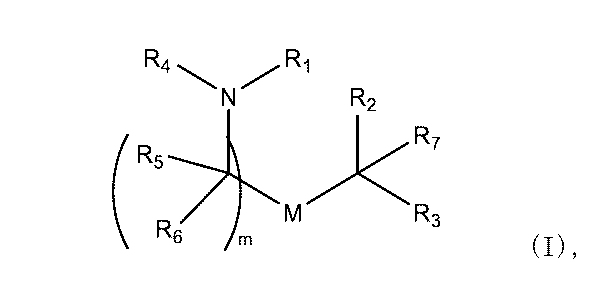
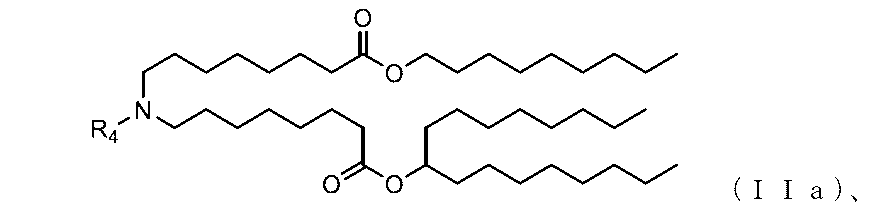
別の態様において、本組成物は、以下に開示される式(I)の化合物、例えば、化合物18、25、26または48など、イオン性アミノ脂質を含む脂質組成物である。本開示のいくつかの態様において、医薬組成物の脂質組成は、追加の脂質/成分を含む。例えば、脂質組成は、1つ以上のリン脂質、例えば、MSPCまたはDSPCを含むことができる。脂質組成は、DOTAPなどの第4級アミン化合物も含むことができる。
別の態様において、本出願は、(1)式(I)を有する化合物、(2)任意選択でヘルパー脂質(例えば、リン脂質)、(3)任意選択で、構造脂質(例えば、ステロール)、(4)任意選択で、脂質コンジュゲート(例えば、PEG-脂質)、及び(5)任意選択で、第4級アミン化合物を含む脂質組成物(例えば、脂質ナノ粒子(LNP))を提供する。
本明細書に提供する見出しは、本開示の種々の態様または態様の制限とはならず、全体として明細書に対する参照によって定義することができる。したがって、直後に定義される用語は、その全体が明細書に対する参照によってより完全に定義される。本開示を詳細に説明する前に、本開示が、具体的な組成物またはプロセスステップが変わり得るので、これらに制限されるものではないことが理解される。
I.定義
本開示がより容易に理解されることができるために、ある特定の用語を最初に定義する。本出願において使用する場合、本明細書で別段の明確な提供がない限り、以下の用語の各々は、以下に明らかにする意味を有する。追加の定義は、本出願のいたるところで明らかにされている。
本開示は、群の実際に1つのメンバーが所与の生成物またはプロセスにおいて存在する、採用される、またはそうでなければ、これらと関連する、実施形態を含む。本開示は、群のメンバーの2つ以上またはすべてが、所与の生成物またはプロセスにおいて存在する、採用される、またはそうでなければこれらと関連する、実施形態を含む。
本明細書及び添付の特許請求の範囲において、「a」、「an」及び「the」という単数形は、文脈で別段に明確に記載されていない限り、複数の指示物を含む。「a」(または「an」)という用語は、「1つ以上の」、及び「少なくとも1つの」という用語と同様に、本明細書で相互交換可能に使用することができる。ある特定の態様において、「a」または「an」という用語は、「単一の」を意味する。他の態様において、「a」または「an」という用語は、「2つ以上の」または「複数の」を含む。
さらに、本明細書で使用する場合の「及び/または」は、2つの指定された特徴または成分の各々の具体的な開示として、他を含みまたは他を含まないとするものとする。したがって、本明細書において「A及び/またはB」などの語句において使用されるような「及び/または」という用語は、「A及びB」、「AまたはB」、「A(単独)」、ならびに「B(単独)」を含むよう意図される。同様に、「A、B、及び/またはC」などの語句において使用されるような「及び/または」という用語は、以下の態様、すなわち、A、B、及びC;A、B、またはC;AまたはC;AまたはB;BまたはC;A及びC;A及びB;B及びC;A(単独);B(単独);ならびにC(単独)の各々を包含するよう意図される。
別段の定義がない限り、本明細書で使用される技術用語及び科学用語はすべて、本開示が関連する技術分野の当業者によって通常理解されるのと同じ意味を有する。例えば、Concise Dictionary of Biomedicine and Molecular Biology,Juo,Pei-Show,2nd ed.,2002,CRC Press;The Dictionary of Cell and Molecular Biology,3rd ed.,1999,Academic Press;及びOxford Dictionary Of Biochemistry And Molecular Biology,Revised,2000,Oxford University Pressは、本開示において使用される用語の多くの一般的な辞書とともに当業者に提供される。
態様が、「を含む」という言語を用いて本明細書で記載される場合は常に、「からなる」及び/または「から本質的になる」という点において説明される別の類似の態様も提供される。
単位、接頭辞、及び記号は、国際単位系(SI)の認可した形態で示される。数値範囲は、この範囲を規定する数を含む。ある範囲の値が列挙される場合、その範囲の列挙された上限値と下限値の間にある介在する各整数値、及びこの各分数も、このような値の間の各部分範囲とともに具体的に開示されることが理解されるべきである。いかなる範囲の上限値及び下限値も独立して、この範囲に含まれることができ、またはこの範囲から除外することができ、いずれかの限界値が含まれ、いずれの限界値も含まれず、またはいずれの限界値も含まれる各範囲も、本開示内に包含される。値が、明白に列挙される場合、列挙された値とほぼ同じ数量または量も本開示の範囲内にあることは理解されるべきである。組み合わせが開示される場合、その組み合わせの要素の各部分的組み合わせも具体的に開示され、本開示の範囲内にある。逆に、異なる要素または要素の群が個々に開示される場合、その組み合わせも開示される。開示の何らかの要素が複数の代替物を有するものとして開示される場合、各代替物が単一で除外される、または他の代替物との何らかの組み合わせにおける、その開示の例も、本明細書により開示され、開示の2つ以上の要素は、このような除外を有することができ、このような除外を有する要素の組み合わせはすべて、参照により開示される。
ヌクレオチドは、通常受け入れられている一文字コドンによって称される。別段の記載がない限り、核酸は、5’から3’の向きで左から右へと記載される。ヌクレオチドは、IUPAC-IUB Biochemical Nomenclature Commissionによって推奨される一般に公知の一文字記号によって本明細書で称される。したがって、Aはアデニンを表し、Cはシトシンを表し、Gはグアニンを表し、Tはチミンを表し、及びUはウラシルを表す。
アミノ酸は、一般に公知の三文字記号か、またはIUPAC-IUB Biochemical Nomenclature Commissionによって推奨される1文字記号のいずれかによって本明細書で称される。別段の記載がない限り、アミノ酸配列は、アミノからカルボキシへの向きで左から右へと記載される。
約:明細書及び特許請求の範囲のいたるところで数値と関連して使用される「約」という用語は、当業者になじみのある及び許容され得る、正確性の間隔を示す。概して、このような正確性の間隔は、±10%である。
範囲が与えられる場合、終点は含まれる。さらに、別段の記載がない限り、または文脈及び当業者の理解から明白ではない限り、範囲として表される値は、文脈に別段の明確な記載がない限り、本開示の異なる実施形態において記載された範囲内の何らかの特定の値または部分範囲を、その範囲の下限値の単位の10分の1まで保証することができる。
組み合わせにおいて投与された:本明細書で使用する場合、「組み合わせにおいて投与された」、「組み合わされた投与」、または「併用療法」という用語は、2つ以上の薬剤が患者に及ぼす各薬剤の効果の重複であり得るように同時にまたは間隔内で対象へ投与されることを意味する。いくつかの実施形態において、この2つ以上の薬剤は、互いに約60、30、15、10、5、または1分以内に投与される。いくつかの実施形態において、薬剤の投与は、組み合わせ(例えば、相乗)効果に達するよう、互いに十分に短い間隔である。
アミノ酸置換:「アミノ酸置換」という用語は、患者または参照配列(例えば、野生型配列)に存在するアミノ酸残基を別のアミノ酸残基と置き換えることを指す。アミノ酸は、患者または参照配列(例えば、野生型ポリペプチド配列)において、化学ペプチド合成を介してまたは当該技術分野において既知である組換え方法を通じて置換することができる。したがって、「位置Xにおける置換」に対する参照は、位置Xに存在するアミノ酸置換を代替的なアミノ酸残基と置換することを指す。いくつかの態様において、置換パターンは、スキームAnYにより説明することができ、式中Aは、位置nに天然にまたは元来存在するアミノ酸に対応する一文字コードであり、Yは、置換するアミノ酸残基である。他の態様において、置換パターンは、式An(YZ)により説明することができ、式中Aは、位置Xに天然にまたは元来存在するアミノ酸を置換するアミノ酸残基に対応する一文字コードであり、Y及びZは、代替的な置換アミノ酸残基である。
本開示の文脈において、置換(アミノ酸置換という場合は特に)は、核酸レベルで実施され、すなわち、アミノ酸残基を代替的アミノ酸残基で置換することは、第1のアミノ酸をコードするコドンを、第2のアミノ酸をコードするコドンで置換することによって実施される。
動物:本明細書で使用する場合、「動物」という用語は、動物界のいかなるメンバーもいう。いくつかの実施形態において、「動物」は、何らかの発生期にあるヒトを指す。いくつかの実施形態において、「動物」は、何らかの発生期にある非ヒト動物を指す。ある特定の実施形態において、非ヒト動物は、哺乳類(例えば、齧歯類、マウス、ラット、ウサギ、サル、イヌ、ネコ、ヒツジ、ウシ、霊長類、またはブタ)である。いくつかの実施形態において、動物は、哺乳類、鳥類、爬虫類、両生類、魚類、及び虫類を含むが、これらに限定されない。いくつかの実施形態において、動物は、形質転換動物、遺伝子操作された動物、またはクローンである。
およそ:本明細書で使用する場合、目的の1つ以上の値へ適用される場合の「およそ」という用語は、記載された参照値と類似の値を指す。ある特定の実施形態において、「およそ」という用語は、別段に記載されない限り、または文脈から明らかではない限り、記載された参照値のいずれかの方向(大または小)において25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%またはこれ未満の内に収まる値の範囲を指す(例外は、このような数が、可能な値の100%を超えるであろう場合である)。
と関係する:疾患に対して本明細書で使用する場合、「と関係する」という用語は、問題の症状、測定、特徴、または状態が、その疾患の診断、発症、存在、または進行に連関することを意味する。関係が疾患の原因として連関していることがあるかもしれないが、そうである必要はない。
2つ以上の部分に対して使用する場合、「と関係した」、「コンジュゲートした」、「連関した」、「付着した」、及び「結びつけられた」という用語は、2つ以上の部分に関して使用する場合、その部分が互いに、直接的に、または連結剤として機能する1つ以上の追加の部分を介して、物理的に関係または接続して、構造が使用される条件、例えば、生理学的条件の下でその部分が物理的に関係したままであるように十分に安定である構造を形成することを意味する。「関係」は、厳密には、直接的な化学的共有結合を通じてである必要はない。この用語は、「関係した」実体が物理的に関係したままであるように十分に安定である、イオン結合もしくは水素結合またはハイブリッド形成に基づいた接続性も示唆し得る。
生体適合性:本明細書で使用する場合、「生体適合性」という用語は、損傷、毒性または免疫系による拒絶の危険性がほとんどないかまったくない生きた細胞、組織、器官または系との適合性を意味する。
生分解性:本明細書で使用する場合、「生分解性」という用語は、生きているものの作用によって無害な産物へと分解することができることを意味する。
配列の最適化:「配列の最適化」という用語は、参照核酸配列における核酸塩基が代替的な核酸塩基と置き換えられ、結果的に、改良された特性、例えば、改良されたタンパク質発現または低下した免疫原性を備えた核酸配列を生じるプロセスまたは一連のプロセスを指す。
概して、配列の最適化の目的とは、参照ヌクレオチド配列によってコードされる同じポリペプチド配列をコードするよりも同義のヌクレオチド配列を生じることである。したがって、参照ヌクレオチド配列によってコードされるポリペプチドに関してコドン最適化されたヌクレオチド配列によってコードされるポリペプチドにおける(コドン最適化の結果としての)アミノ酸置換はない。
コドンの置換:配列の最適化の文脈における「コドンの置換」または「コドンの置き換え」という用語は、参照核酸配列中に存在するコドンを別のコドンと置き換えることを指す。コドンは、参照核酸配列において、例えば、化学ペプチド合成または当該技術分野において既知である組換え法を通じて置換することができる。したがって、核酸配列(例えば、mRNA)におけるある特定の位置での、または核酸配列(例えば、mRNA)のある特定の領域もしくはサブ配列内でのある特定の位置における「置換」または「置き換え」に対する参照は、このような位置または領域のコドンの、代替的なコドンとの置換を言う。
本明細書で使用する場合、「コドン領域」及び「コードする領域」という用語ならびにこれらの文法上の変形は、発現の際にポリペプチドまたはタンパク質を生じるポリヌクレオチドにおけるオープンリーディングフレーム(ORF)を指す。
化合物:本明細書で使用する場合、「化合物」という用語は、示される構造の立体異性体及び同位体をすべて含むよう意味される。本明細書で使用する場合、「立体異性体」という用語は、化合物の何らかの幾何異性体(例えば、cis及びtrans異性体)、鏡像異性体、またはジアステレオマーを意味する。本開示は、立体異性的に純粋な形態(例えば、幾何学的に純粋、鏡像異性的に純粋、またはジアステレオマー的に純粋)、並びに鏡像異性及び立体異性の混合物、例えば、ラセミ化合物を含む、本明細書に記載される化合物のいかなる及びすべての立体異性体も包含する。化合物の鏡像異性及び立体異性の混合物ならびにこれらをその構成要素である鏡像異性体または立体異性体へと分解する手段は周知である。「同位体」は、核における異なる数の中性子から結果的に生じる同じ原子番号だが異なる質量数を有する原子を指す。例えば、水素の同位体は、トリチウム及び重水素が含まれる。さらに、本開示の化合物、塩、または複合体は、常用法によって溶媒和物及び水和物を形成するために溶媒または水分子との組み合わせにおいて調製することができる。
保存的アミノ酸置換:「保存的アミノ酸置換」とは、アミノ酸残基が類似の側鎖を有するアミノ酸残基と置き換えられることである。類似の側鎖を有するアミノ酸残基のファミリーは、当該技術分野で規定されており、塩基性側鎖(例えば、リジン、アルギニン、またはヒスチジン)、酸性側鎖(例えば、アスパラギン酸またはグルタミン酸)、非帯電極性側鎖(例えば、グリシン、アスパラギン、グルタミン、セリン、トレオニン、チロシン、またはシステイン)、非極性側鎖(例えば、アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、またはトリプトファン)、ベータ分枝状側鎖(例えば、トレオニン、バリン、イソロイシン)及び芳香族側鎖(例えば、チロシン、フェニルアラニン、トリプトファン、またはヒスチジン)を含む。したがって、ポリペプチドにおけるアミノ酸が同じ側鎖ファミリー由来の別のアミノ酸と置き換えられる場合、アミノ酸置換は、保存的であるとみなされる。別の態様において、アミノ酸鎖は、側鎖ファミリーのメンバーの桁及び/または組成が異なる構造上類似した鎖と保存的に置き換えることができる。
非保存的アミノ酸置換には、(i)正に帯電した側鎖(例えば、Arg、HisまたはLys)を有する残基が、負に帯電した残基(例えば、GluまたはAsp)と、またはこれによって置換されたもの、(ii)親水性残基(例えば、SerまたはThr)が、疎水性残基(例えば、Ala、Leu、Ile、PheまたはVal)と、またはこれによって置換されたもの、(iii)システインまたはプロリンが何らかの他の残基と、またはこれによって置換されたもの、あるいは(iv)かさのある疎水性または芳香族側鎖(例えば、Val、His、IleまたはTrp)がより小さな側鎖(例えば、AlaまたはSer)を有するものまたは側鎖を有さないもの(例えば、Gly)と、またはこれらによって置換されたものが含まれる。
他のアミノ酸置換は、当業者によって容易に特定することができる。例えば、アミノ酸アラニンについては、置換は、D型アラニン、グリシン、ベータ-アラニン、L型システイン及びD型システインのいずれか1つから採用することができる。リジンについては、置き換えは、D型リジン、アルギニン、D型アルギニン、ホモアルギニン、メチオニン、D型メチオニン、オルニチン、またはD型オルニチンのいずれか1つであり得る。概して、単離されたポリペプチドの特性の変化を誘導すると期待できる機能的に重要な領域における置換は、(i)極性残基、例えば、セリンまたはトレオニンが疎水性残基、例えば、ロイシン、イソロイシン、フェニルアラニン、またはアラニンと(またはこれらによって)置換されたもの、(ii)システイン残基が何らかの他の残基と(またはこれによって)置換されたもの、(iii)正に帯電した側鎖、例えば、リジン、アルギニンまたはヒスチジンを有する残基が負に帯電した側鎖、例えば、グルタミン酸またはアスパラギン酸と(またはこれらによって)置換されたもの、あるいは(iv)かさのある側鎖、例えば、フェニルアラニンを有する残基が、このような側鎖を有さないもの、例えば、グリシンと(またはこれによって)置換されたものである。上述の非保存的置換のうちの1つがタンパク質の機能的特性を変化させることができる見込みは、このタンパク質の機能的に重要な領域に対して置換の位置と相関し、つまり、いくつかの非保存的置換は、したがって、生物学的特性に及ぼす効果がほとんどまたは全くない可能性がある。
保存された:本明細書で使用する場合、「保存された」という用語は、比較される2つ以上の配列の同じ位置において未変化のままのものである、ポリヌクレオチド配列またはポリペプチド配列のそれぞれヌクレオチドまたはアミノ酸残基を指す。比較的保存されたヌクレオチドまたはアミノ酸残基とは、配列の他の箇所で現れるヌクレオチドまたはアミノ酸よりも関連した配列において保存されたものである。
いくつかの実施形態において、2つ以上の配列は、互いに100%同一である場合、「完全に保存された」状態であるといわれる。いくつかの実施形態において、2つ以上の配列は、互いに少なくとも70%同一、少なくとも80%同一、少なくとも90%同一、または少なくとも95%同一である場合、「高度に保存された」状態であるといわれる。いくつかの実施形態において、2つ以上の配列は、互いに約70%同一、約80%同一、約90%同一、約95%、約98%、または約99%同一である場合、「高度に保存された」状態であるといわれる。いくつかの実施形態において、2つ以上の配列は、互いに少なくとも30%同一、少なくとも40%同一、少なくとも50%同一、少なくとも60%同一、少なくとも70%同一、少なくとも80%同一、少なくとも90%同一、または少なくとも95%同一である場合、「保存された」状態であるといわれる。いくつかの実施形態において、2つ以上の配列は、互いに約30%同一、約40%同一、約50%同一、約60%同一、約70%同一、約80%同一、約90%同一、約95%同一、約98%同一、または約99%同一である場合、「保存された」状態であるといわれる。配列の保存は、ポリヌクレオチドまたはポリペプチドの完全長に適用され得、あるいはその部分、領域または特徴に適用され得る。
接触させること:本明細書で使用する場合、「接触させること」という用語は、2つ以上の実体間の物理的接続を確立することを意味する。例えば、哺乳類細胞をナノ粒子組成物と接触させることは、哺乳類細胞及びナノ粒子が物理的接続を共有するようにすることを意味する。細胞を外部の実体とin vivo及びex vivoの両方で接触させる方法は、生物学的分野において周知である。例えば、哺乳類内に配置されたナノ粒子組成物及び哺乳類細胞を接触させることは、さまざまな投与経路(例えば、静脈内、筋肉内、皮内、及び皮下)によって実施され得、さまざまな量のナノ粒子組成物を包含し得る。そのうえ、2つ以上の哺乳類細胞は、ナノ粒子組成物によって接触させられ得る。
徐放性:本明細書で使用する場合、「徐放性」という用語は、治療結果をもたらすよう特定の放出パターンに従う医薬組成物または化合物の放出特性を指す。
共有結合性誘導体:ポリペプチドを指す場合の「共有結合性誘導体」という用語は、有機タンパク質性または非タンパク質性誘導体化剤及び/または翻訳後修飾による天然のタンパク質または出発タンパク質の修飾を含む。共有結合性修飾は従来より、タンパク質の標的とされるアミノ酸残基を、選択された側鎖もしくは末端残基と反応することのできる有機誘導体化剤と反応させることによって、または選択された組換え宿主細胞において機能する翻訳後修飾のつなぐ機序によって導入される。結果として生じる共有結合性誘導体は、生物活性にとって、イムノアッセイにとって、または抗タンパク質抗体の調製にとって、組換え糖タンパク質の免疫親和性精製にとって重要な残基を特定することに方向づけられたプログラムにおいて有用である。このような修飾は、当該技術分野における通常の技術のうちであり、過度の実験なしで実施される。
環状または環化:本明細書で使用される場合、「環状」という用語は、連続したループの存在を指す。環状分子は、環状である必要はなく、サブユニットの破壊されていない鎖を形成するよう接合されているに過ぎない。本開示の操作されたRNAまたはmRNAなどの環状分子は、単一の単位または多量体であり得、あるいは複雑なまたはより高次の構造の1つ以上の構成要素を含むことができる。
細胞障害性:本明細書で使用する場合、「細胞障害性」は、細胞(例えば、哺乳類細胞(例えば、ヒト細胞))、細菌、ウイルス、真菌、原生動物、寄生虫、プリオン、またはこれらの組み合わせに及ぼす殺傷効果または損傷性のある、毒性のある、もしくは致命的である効果を指す。
送達すること:本明細書で使用する場合、「送達すること」という用語は、実体を目的地へ提供することを意味する。例えば、ポリヌクレオチドを対象へ送達することは、ポリヌクレオチドを含むナノ粒子組成物を対象へ(例えば、静脈内、筋肉内、皮内、または皮下経路によって)投与することを包含し得る。哺乳類または哺乳類細胞へのナノ粒子組成物の投与は、1つ以上の細胞をナノ粒子組成物と接触させることを包含し得る。
送達剤:本明細書で使用する場合、「送達剤」は、標的とされる細胞へのポリヌクレオチドのin vivo、in vitro、またはex vivoでの送達を少なくとも一部容易にする何らかの物質を指す。
脱安定化した:本明細書で使用する場合、「脱安定の」、「脱安定化させる」、または「脱安定化している領域」は、領域または分子の出発形態、野生型形態または天然の形態よりも安定していない同じ領域または分子を意味する。
検出可能な標識:本明細書で使用する場合、「検出可能な標識」は、X線撮像、蛍光、化学発光、酵素活性、吸光度などを含む当該技術分野において既知である方法によって容易に検出される別の実体と付着、組み込みまたは会合した1つ以上のマーカー、シグナル、または部分を指す。検出可能な標識には、放射性同位体、発蛍光団、発色団、酵素、色素、金属イオン、ビオチン、アビジン、ストレプトアビジン及びハプテンなどのリガンド、量子ドット、ならびにこれらに類するものが含まれる。検出可能な標識は、本明細書で開示されるペプチドまたはタンパク質における何らかの位置に位置することができる。検出可能な標識は、アミノ酸、ペプチド、またはタンパク質の内部にあり得、あるいはN末端またはC末端に位置することができる。
ジアステレオマー:本明細書で使用する場合、「ジアステレオマー」という用語は、互いに鏡像ではなく、互いに重ねることのできない立体異性体を意味する。
消化する:本明細書で使用する場合、「消化する」という用語は、より小さな片または成分へと分解することを意味する。ポリペプチドまたはタンパク質を指す場合、消化は結果として、ペプチドの生成を生じる。
遠位の:本明細書で使用する場合、「遠位の」という用語は、中心から離れてあるいは目的の点または領域から離れて位置することを意味する。
ドメイン:本明細書で使用する場合、ポリペプチドを指す場合、「ドメイン」という用語は、1つ以上の特定可能な構造上のまたは機能的な特徴または特性(例えば、結合能、タンパク質間相互作用のための部位として役立つこと)を有するポリペプチドのモチーフを指す。
投与計画:本明細書で使用する場合、「投与計画」または「投与計画」とは、治療、予防、または緩和ケアに関する投与のまたは医師により決定された計画のスケジュールである。
有効量:本明細書で使用する場合、薬剤の「有効量」という用語は、有益なまたは所望の結果、例えば、臨床結果をもたらすのに十分な量であり、このようなものとして、「有効量」は、それが適用中である内容による。例えば、腫瘍を治療する薬剤を投与する内容において、薬剤の有効量は、例えば、薬剤の投与なしで得られる応答と比較して、腫瘍の大きさを減少もしくは低下させるまたは腫瘍の成長を阻害するのに十分な量である。「有効量」という用語は、「有効用量」、「治療有効量」、または「治療有効用量」と相互交換可能に使用することができる。
鏡像異性体:本明細書で使用する場合、「鏡像異性体」という用語は、少なくとも80%(すなわち、ある鏡像異性体の少なくとも90%及びその他の鏡像異性体の多くとも10%)、少なくとも90%、または少なくとも98%の光学純度または鏡像異性体過剰率(当該技術分野で標準的な方法によって測定される)を有する、本開示の化合物の各個々の光学的に活性のある形態を意味する。
封入する:本明細書で使用する場合、「封入する」という用語は、囲い込む、取り囲む、または包むことを意味する。
封入効率:本明細書で使用する場合、「封入効率」は、ナノ粒子組成物の調製において使用されるポリヌクレオチドの初期合計量に対する、ナノ粒子組成物の一部となるポリヌクレオチドの量を指す。例えば、97mgのポリヌクレオチドが組成物へ初期的に提供される合計100mgのポリヌクレオチドからナノ粒子組成物中に封入される場合、封入効率は97%として与えられ得る。本明細書で使用する場合、「封入」は、完全な、実質的な、または部分的な閉込め、囲い込み、取り囲み、または包み込みを指す場合がある。
コード化タンパク質切断シグナル:本明細書で使用する場合、「コード化タンパク質切断シグナル」は、タンパク質切断シグナルをコードするヌクレオチド配列を指す。
操作された:本明細書で使用する場合、本開示の実施形態は、構造的であろうと化学的であろうと、出発点の、野生型のまたは天然の分子から変化する特徴または特性を有するよう設計された場合に「操作された」ことである。
送達の亢進:本明細書で使用する場合、「送達の亢進」という用語は、対照ナノ粒子による目的の標的組織(例えば、MC3、KC2、またはDLinDMA)へのポリヌクレオチドの送達レベルと比較して、目的の標的組織(例えば、哺乳類肝臓)へのナノ粒子によるポリヌクレオチドのより多い(例えば、少なくとも1.5倍多い、少なくとも2倍多い、少なくとも3倍多い、少なくとも4倍多い、少なくとも5倍多い、少なくとも6倍多い、少なくとも7倍多い、少なくとも8倍多い、少なくとも9倍多い、少なくとも10倍多い)送達を意味する。特定の組織へのナノ粒子の送達のレベルは、組織中で産生されるタンパク質の量をこの組織の重量と比較すること、組織中のポリヌクレオチドの量をこの組織の重量と比較すること、組織中で産生されるタンパク質の量をこの組織中の総タンパク質量と比較すること、または組織中のポリヌクレオチドの量をこの組織中の全ポリヌクレオチドの量と比較することによって測定され得る。標的組織へのナノ粒子の送達の亢進が、治療中の対象において測定される必要がないことは理解され、送達の亢進は、動物モデル(例えば、ラットモデル)などの代用物において測定され得る。
エキソソーム:本明細書で使用する場合、「エキソソーム」とは、哺乳類細胞によって分泌される小胞、またはRNA分解に関与する複合体である。
発現:本明細書で使用する場合、核酸配列の「発現」は、次の事象の1つ以上を指す:(1)DNA配列からのRNAテンプレートの生成(例えば、転写による)、(2)RNA転写産物のプロセシング(例えば、スプライシング、編集、5’キャップ形成、及び/または3’末端プロセシング)、(3)RNAからポリペプチドまたはタンパク質への翻訳、ならびに(4)ポリペプチドまたはタンパク質の翻訳後修飾。
ex vivo:本明細書で使用する場合、「ex vivo」という用語は、生体(例えば、動物、植物、もしくはその微生物またはこれらの細胞もしくは組織)の外側で生じる事象を指す。ex vivo事象は、天然(例えば、in vivo)環境から最小限だけ変化した環境において起こり得る。
特徴(Feature):本明細書で使用する場合、「特徴」は、特徴(characteristic)、特性、または特有の要素を指す。ポリペプチドを指す場合、「特徴」は、分子の特有のアミノ酸配列に基づく構成要素として定義される。本開示のポリヌクレオチドによってコードされるポリペプチドの特徴は、表面顕在化、局所的な立体配座形状、折り畳み、ループ、半ループ、ドメイン、半ドメイン、部位、末端またはそれらのいずれかの組合せが含まれる。
製剤:本明細書で使用する場合、「製剤」には、少なくともポリヌクレオチド、ならびに担体、賦形剤、及び送達剤のうちの1つ以上が含まれる。
断片:「断片」は、本明細書で使用する場合、部分を指す。例えば、タンパク質の断片は、培養細胞から単離された完全長のタンパク質を消化することによって得られたポリペプチドを含むことができる。いくつかの実施形態において、断片とは、N末端、及び/またはC末端、及び/または内部のサブ配列が欠失した完全長タンパク質のサブ配列(例えば、IL-23のサブユニットの1つ)である。本開示のいくつかの好ましい態様において、本開示のタンパク質の断片は、機能的断片である。
機能的:本明細書で使用する場合、「機能的」生体分子とは、特徴とする特性及び/または活性を呈する形態にある生体分子である。したがって、本開示のポリヌクレオチドの機能的断片とは、機能的なインターロイキン断片を発現することのできるポリヌクレオチドである。本明細書で使用する場合、インターロイキンの機能的な断片は、野生型インターロイキンの断片(すなわち、インターロイキンの天然に存在する形態の断片)、またはその変異体もしくはバリアントを指し、この断片は、対応する完全長タンパク質の生物活性の最小約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、または少なくとも約95%を保持する。
ヘルパー脂質:本明細書で使用する場合、「ヘルパー脂質」という用語は、脂質性部分(脂質層、例えば、脂質二分子膜への挿入用)及び極性部分(脂質層の表面での生理学的溶液との相互作用用)を含む化合物または分子を指す。典型的には、ヘルパー脂質とは、リン脂質である。ヘルパー脂質の機能とは、アミノ脂質を「補完する」こと、及び二重層の膜融合性を増大させること、及び/または、例えば、細胞へ送達された核酸のエンドソーム・エスケープを容易にするのに役立つことである。ヘルパー脂質、LNPの表面に対する鍵となる構造的な構成要素であるとも考えられている。
相同性:本明細書で使用する場合、「相同性」という用語は、ポリマー分子間の、例えば、核酸分子(例えば、DNA分子及び/またはRNA分子)間の、及び/またはポリペプチド分子間の全体的な関連性を指す。概して、「相同性」という用語は、2つの分子間の進化上の関連性を含意する。したがって、相同的である2つの分子は、共通の進化上の祖先を有することになっている。本開示の文脈において、相同性という用語は、同一性及び類似性の両方を包含する。
いくつかの実施形態において、ポリマー分子は、分子中のモノマーの少なくとも25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、または99%が同一(実際に同じモノマー)である、または類似している(保存的置換)場合、互いに「相同的」であるとみなされる。「相同的」という用語は必ず、少なくとも2つの配列(ポリヌクレオチドまたはポリペプチド配列)間の比較を指す。
同一性:本明細書で使用する場合、「同一性」という用語は、ポリマー分子間、例えば、ポリヌクレオチド分子(例えば、DNA分子及び/またはRNA分子)間、及び/またはポリペプチド分子間の全体的なモノマー保存を指す。2つのポリヌクレオチド配列の同一性百分率の計算は、例えば、最適な比較目的のために2つの配列を整列させることによって実施することができる(ギャップは、最適な整列のために第1及び第2の核酸配列のうちの1つまたは両方において導入することができ、非同一性の配列を比較目的のために無視することができる)。ある特定の実施形態において、比較目的のために整列した配列の長さは、参照配列の長さの少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、または100%である。次に、対応するヌクレオチド位置にあるヌクレオチドを比較する。第1の配列における位置が第2の配列における対応する位置と同じヌクレオチドによって占有される場合、この分子はこの位置において同一である。2つの配列間の同一性百分率とは、これらの配列によって共有される同一の位置の数の関数であり、ギャップの数、及び2つの配列の最適な整列のために導入されることが必要な各ギャップの長さを考慮に入れる。配列の比較、及び2つの配列間の同一性百分率の決定は、算術アルゴリズムを用いてなし得る。DNA及びRNAを比較する場合、チミン(T)及びウラシル(U)は等価とみなすことができる。
適切なソフトウェアプログラムは、種々の源から、タンパク質及びヌクレオチド両配列の整列のために入手可能である。配列同一性百分率を決定するための1つの適切なプログラムは、米国政府のNational Center for Biotechnology Information BLASTウェブサイト(blast.ncbi.nlm.nih.gov)から入手可能なプログラムのBLAST一式の一部であるbl2seqである。bl2seqは、BLASTNまたはBLASTPのいずれかのアルゴリズムを用いて2つの配列間の比較を実行する。BLASTNは、核酸配列を比較するために使用されるのに対し、BLASTPは、アミノ酸配列を比較するために使用される。他の適切なプログラムは、例えば、バイオインフォマティクスプログラムのEMBOSS一式の一部であるNeedle,Stretcher,Water,or Matcherであり、また、www.ebi.ac.uk/Tools/psaでEuropean Bioinformatics Institute(EBI)から入手可能である。
配列の整列は、MAFFT、Clustal(ClustalW、Clustal XまたはClustal Omega)、MUSCLEなどのような、当該技術分野において既知である方法を用いて実施することができる。
ポリヌクレオチドまたはポリペプチドの参照配列と整列させる単一のポリヌクレオチドまたはポリペプチドの標的配列内にある異なる領域は各々、それ自体の配列同一性百分率を有し得る。配列同一性百分率の値が、最も近い10分の1に丸められることは特筆される。例えば、80.11、80.12、80.13、及び80.14は、80.1に切り捨てられるのに対し、80.15、80.16、80.17、80.18、及び80.19は80.2に切り上げられる。長さが常に整数であることになっていることも特筆される。
ある特定の態様において、第2のアミノ酸配列(または核酸配列)に対する第1のアミノ酸配列(または核酸配列)の同一性百分率(%ID)は、%ID=100×(Y/Z)として計算され、式中Yは、第1及び第2の配列の整列(目視検査または特定の配列整列プログラムによって整列)において同一の一致として点数化されるアミノ酸残基(または核酸塩基)の数であり、Zは、第2の配列における残基の総数である。第1の配列の長さが第2の配列よりも長い場合、第2の配列に対する第1の配列の同一性百分率は、第1の配列に対する第2の配列の同一性百分率よりも大きいことになる。
当業者は、配列同一性百分率の計算のための配列整列の作成が一次配列データによって排他的に実施される2配列間比較に限定されないことを理解するだろう。配列整列が、配列データを、構造データ(例えば、タンパク質の結晶構造)、機能データ(例えば、変異の位置)、または系統発生的データのような異種源に由来するデータと統合することによって作成することができることも理解されるだろう。複数の配列整列を作成するよう異種性データを統合する適切なプログラムは、www.tcoffee.orgで入手可能なT-Coffeeであり、例えば、EBIから代替的に入手可能である。配列同一性百分率を計算するために使用される最終的な整列が自動または手動のいずれかで精選することができることも理解されるだろう。
免疫チェックポイント阻害剤:「免疫チェックポイント阻害剤」または単に「チェックポイント阻害剤」は、免疫細胞ががん細胞によってオフになることを防止する分子を指す。本明細書で使用する場合、チェックポイント阻害剤という用語は、細胞障害性Tリンパ球関連タンパク質4(CTLA-4)、プログラム死細胞1受容体(PD-1)、またはPD-1リガンド1(PD-L1)のような阻害性チェックポイント分子を中和または阻害するポリペプチド(例えば、抗体)、またはこのようなポリペプチドをコードするポリヌクレオチド(例えば、mRNA)を指す。
免疫応答:「免疫応答」という用語は、病原体が侵入している人体、病原体に感染した細胞もしくは組織、がん細胞、または自己免疫もしくは病理学的炎症の場合は正常なヒト細胞もしくは組織に対する、選択的損傷、破壊、または除去を結果として生じる、例えば、リンパ球、抗原提示細胞、食細胞、顆粒球、及びこれらの細胞または肝臓によって産生される可溶性の高分子(抗体、サイトカイン、及び補体を含む)の作用を指す。
免疫応答共刺激シグナル:「免疫応答共刺激シグナル」という用語は、T細胞及び/またはNK細胞の動員、増殖、活性化、生存、またはこれらの組み合わせを促進する免疫刺激分子をいう。いくつかの態様において、免疫応答共刺激シグナルは、T細胞の増殖、機能及び記憶形成を亢進するポリペプチドである(例えば、OX40L)。いくつかの態様において、共刺激シグナルは、Th1、Th2及び/またはTh9の発達を促進し、Tregの発達もしくは活性を抑制し、CD4及び/またはCD8 T細胞の増殖及び/または生存を亢進し、及び/または記憶細胞を促進する。具体的な態様において、免疫応答共刺激シグナルポリペプチドは、OX40L、CD80、及びIL-15からなる群より選択される。いくつかの具体的な態様において、免疫応答共刺激シグナルポリペプチドは、OX40L及びCD80からなる群より選択される。
免疫応答プライマー:「免疫応答プライマー」という用語は、抗原提示及び/または認識を亢進する免疫刺激分子をいう。いくつかの態様において、免疫応答プライマーは、樹状細胞を刺激し、樹状細胞の成熟を促進し、抗原提示細胞のサイトカイン/ケモカインの産生を促進し、Th17細胞を増殖させ及び/または維持し、T細胞の増殖を亢進し、及び/またはTh1及び/またはTh9の分化を亢進するポリペプチドである。いくつかの態様において、免疫応答プライマーは、IL-12ファミリーのメンバー(例えば、IL-12、IL-23、IL-12p40サブユニット、IL-23p19サブユニット、IL-27、IL-35)である。他の態様において、免疫応答プライマーは、IL-1ファミリーのメンバー(例えば、IL-1α、IL-1β、IL-1Ra、IL-18、IL-33、IL-36Ra、IL-36α、IL-36β、IL-36γ、IL-37、IL-38)である。いくつかの態様において、免疫応答プライマーは、IL-23、IL-12p40サブユニット、IL-23p19サブユニット、IL-12、IL-36-ガンマ、及びIL-18からなる群より選択されるポリペプチドである。
炎症性応答:「炎症性応答」は、特異的及び非特異的防御系を含む免疫応答をいう。特異的な防御系反応とは、抗原に特異的な免疫系応答である。特異的な防御系反応の例としては、抗体応答が挙げられる。非特異的防御系反応は、免疫学的記憶が概して不可能な白血球、例えば、マクロファージ、好酸球及び好中球によって媒介される炎症性応答である。いくつかの態様において、免疫応答は、炎症性サイトカインレベルの上昇を結果的に生じる炎症性サイトカインの分泌を含む。
炎症性サイトカイン:「炎症性サイトカイン」という用語は、炎症性応答において上昇したサイトカインをいう。炎症性サイトカインの例としては、インターロイキン6(IL-6)、CXCL1(ケモカイン(C-X-Cモチーフ)リガンド1;GROαとしても公知、インターフェロンγ(IFNγ)、腫瘍壊死因子α(TNFα)、インターフェロンγ誘導性タンパク質10(IP-10)、または顆粒球コロニー刺激因子(G-CSF)が挙げられる。炎症性サイトカインという用語は、当該技術分野において既知である炎症性応答と関係する他のサイトカイン、例えば、インターロイキン1(IL-1)、インターロイキン8(IL-8)、インターロイキン12(IL-12)、インターロイキン13(IL-13)、インターロイキンα(IFN-α)なども含む。
in vitro:本明細書で使用する場合、「in vitro」という用語は、生体(例えば、動物、植物、または微生物)内よりもむしろ人工環境において、例えば、試験管または反応容器の中で、細胞培養において、ペトリ皿の中などで生じる事象をいう。
in vivo:本明細書で使用する場合、「in vivo」という用語は、生体(例えば、動物、植物、もしくは微生物またはこれらの細胞もしくは組織)内で生じる事象をいう。
挿入バリアント及び欠失バリアント:「挿入バリアント」は、ポリペプチドをいう場合、天然の配列または出発配列における特定の位置のアミノ酸のすぐ近くに挿入された1つ以上のアミノ酸を有するものである。アミノ酸の「すぐ近くに」は、アミノ酸のアルファ-カルボキシ官能基またはアルファ-アミノ官能基のいずれかへ結合したことを意味する。「欠失バリアント」は、ポリペプチドをいう場合、除去されたナイーブのアミノ酸配列または出発アミノ酸配列において1つ以上のアミノ酸を有するものである。通常、欠失バリアントは、分子の特定の領域において1つ以上のアミノ酸が欠失することになっている。
インタクト:本明細書で使用する場合、ポリペプチドにおいて、「インタクト」という用語は、野生型タンパク質に対応するアミノ酸を保有していること、例えば、野生型アミノ酸を変異させていないことまたは置換していないことを意味する。逆に、核酸において、「インタクト」という用語は、野生型核酸に対応する核酸塩基を保有していること、例えば、野生型核酸塩基を変異させていないことまたは置換していないことを意味する。
イオン性アミノ脂質:「イオン化可能なアミノ脂質」という用語は、1、2、3、またはそれ以上の脂肪酸または脂肪アルキル鎖及びpH滴定可能なアミノ頭部基(例えば、アルキルアミノ頭部基またはジアルキルアミノ頭部基)を有するアミノ脂質を含む。イオン化可能なアミノ脂質は、アミノ頭部基のpKaを下回るpHで典型的にプロトン化し(すなわち、正に帯電し)、pKaを上回るpHで実質的に帯電されない。このようなイオン性アミノ脂質は、DLin-MC3-DMA(MC3)及び(13Z,165Z)-N,N-ジメチル-3-ノニドコサ-13-16-ジエン-1-アミン(L608)を含むが、これらに限定されない。
in vitro:本明細書で使用する場合、「in vitro」という用語は、生体(例えば、動物、植物、または微生物)内よりもむしろ人工環境において、例えば、試験管または反応容器の中で、細胞培養において、ペトリ皿の中などで生じる事象をいう。
in vivo:本明細書で使用する場合、「in vivo」という用語は、生体(例えば、動物、植物、もしくは微生物またはこれらの細胞もしくは組織)内で生じる事象をいう。
単離された:本明細書で使用する場合、「単離された」という用語は、物質または実体が(天然であろうと実験設定においてであろうと)会合していた複数の成分の少なくともいくつかから分離された物質または実体をいう。単離された物質(例えば、ヌクレオチド配列またはタンパク質配列)は、単離前に結合していた物質に関して純度レベルを変化させることができる。単離した物質及び/または実体は、初めは結合していた他の成分の少なくとも約10%、約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、またはそれ以上から分離することができる。いくつかの実施形態において、単離された作用剤は、約80%超、約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%、または約99%超純粋である。本明細書で使用する場合、物質は、他の成分が実質的に含まれていない場合、「純粋」である。「実質的に単離された」という用語は、化合物が形成または検出された環境から実質的に分離されていることを意味する。部分的な分離は、例えば、本開示の化合物が濃縮された組成物を含むことができる。実質的な分離は、本開示の化合物またはその塩の少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、または少なくとも約99重量%を含有する組成物を含むことができる。
「単離され」ている本明細書に開示されたポリヌクレオチド、ベクター、ポリペプチド、細胞、または何らかの組成物とは、天然では認められない形態にあるポリヌクレオチド、ベクター、ポリペプチド、細胞、または組成物である。単離されたポリヌクレオチド、ベクター、ポリペプチド、または組成物は、天然で認められる形態ではもはやない程度まで精製されたものを含む。いくつかの態様において、単離されたポリヌクレオチド、ベクター、ポリペプチド、または組成物は、実質的に純粋である。
異性体:本明細書で使用する場合、「異性体」という用語は、本開示の何らかの化合物の何らかの互変異性体、立体異性体、鏡像異性体、またはジアステレオマーを意味する。本開示の化合物が、1つ以上のキラル中心及び/または二重結合を有することができ、それゆえ、二重結合異性体(すなわち、幾何E/Z異性体)またはジアステレオマー(例えば、鏡像異性体(すなわち、(+)または(-))またはcis/trans異性体)などの立体異性体として存在することができることは認識されている。本開示によると、本明細書で示されるキラル構造、及びそれゆえ、本開示の化合物は、対応する立体異性体をすべて、すなわち、立体異性体として純粋な形態(例えば、幾何異性体として純粋、鏡像異性体として純粋、またはジアステレオマーとして純粋)と鏡像異性混合物及び立体異性混合物、例えば、ラセミ化合物とをいずれも包含する。本開示の化合物の鏡像異性体混合物及び立体異性体混合物は、キラル相ガスクロマトグラフィー、キラル相高速液体クロマトグラフィー、当該化合物をキラル塩複合体として結晶化すること、またはキラル溶媒中で当該化合物を結晶化することなどの周知の方法によって、当該混合物の成分の鏡像異性体または立体異性体へと典型的に分解することができる。鏡像異性体及び立体異性体は、周知の不斉合成法によって立体異性体としてまたは鏡像異性体として純粋な中間体、試薬、及び触媒から得ることもできる。
リンカー:本明細書で使用する場合、「リンカー」は、原子、例えば、10~1,000個の原子からなる基をいい、炭素、アミノ、アルキルアミノ、酸素、硫黄、スルホキシド、スルホニル、カルボニル、及びイミンなどだがこれらに限定されない原子または基から構成することができる。リンカーは、第一の端部にある修飾された核酸塩基または糖部分の上にあるヌクレオシドまたはヌクレオチドへ、及び第2の端部にあるペイロード、例えば、検出可能な作用剤、または治療剤へ結合することができる。リンカーは、核酸配列への組込みに干渉しないのに十分な長さであり得る。リンカーは、本明細書で説明するように、ポリヌクレオチド多量体(例えば、2つ以上のキメラポリヌクレオチド分子またはIVTポリヌクレオチドの結合を通じて)またはポリヌクレオチドコンジュゲートを形成する及びペイロードを投与するなどのために、何らかの有用な目的に使用することができる。リンカーへ組み込むことができる化学基の例としては、アルキル、アルケニル、アルキニル、アミド、アミノ、エーテル、チオエーテル、エステル、アルキレン、ヘテロアルキレン、アリール、またはヘテロシクリルが挙げられるが、これらに限定されず、これらの各々は、本明細書で説明されるように、任意選択で置換することができる。リンカーの例としては、不飽和アルカン、ポリエチレングリコール(例えば、エチレンまたはプロピレングリコール単量体単位、例えば、ジエチレングリコール、ジプロピレングリコール、トリエチレングリコール、トリプロピレングリコール、テトラエチレングリコール、またはテトラエチレングリコール)、ならびにデキストランポリマー及びこれらの誘導体が挙げられるが、それらに限定されない。他の例としては、還元剤または光分解を用いて開裂することができる、例えば、ジスルフィド結合(-S-S-)またはアゾ結合(-N=N-)など、リンカー内の開裂可能な部分が挙げられるが、これらに限定されない。選択的に開裂可能な結合の非限定的な例としては、例えば、トリス(2-カルボキシエチル)ホスフィン(TCEP)、もしくは他の還元剤及び/または光分解の使用によって開裂することができ、ならびにエステル結合は、例えば、酸性または塩基性の加水分解によって開裂することができる。
投与方法:本明細書で使用する場合、「投与方法」は、静脈内、筋肉内、皮内、皮下、または組成物を対象へ送達する他の方法を含み得る。投与方法は、身体の特定の領域または系への送達を標的とするために(例えば、特異的に送達するために)選択され得る。
修飾された:本明細書で使用する場合、「修飾された」は、本開示の分子の変化した状態または構造をいう。分子は、化学的、構造的、および機能的方法を含む多くの方法で修飾することができる。いくつかの実施形態において、本開示のmRNA分子は、例えば、天然のリボヌクレオチドA、U、G、及びCに関する場合、非天然のヌクレオシド及び/またはヌクレオチドの導入によって修飾される。キャップ構造などの非参照ヌクレオチドは、A、C、G、Uリボヌクレオチドの化学構造とは異なるが、「修飾された」とみなされない。
ナノ粒子組成物:本明細書で使用する場合、「ナノ粒子組成物」とは、1つ以上の脂質を含む組成物である。ナノ粒子組成物は典型的には、マイクロメートル以下の桁の大きさであり、脂質二分子膜を含み得る。ナノ粒子組成物は、脂質ナノ粒子(LNP)、リポソーム(例えば、脂質小胞)、及びリポプレックスを包含する。例えば、ナノ粒子組成物は、直径が500nm以下の脂質二分子膜を有するリポソームであり得る。
天然に存在する:本明細書で使用する場合、「天然に存在する」は、人工的な助剤を有することなく天然に存在することを意味する。
非ヒト脊椎動物:本明細書で使用する場合、「非ヒト脊椎動物」は、野生型及び家畜種を含む、ホモ・サピエンス以外の脊椎動物をすべて含む。非ヒト脊椎動物の例としては、アルパカ、バンテン、バイソン、ラクダ、ネコ、ウシ、シカ、イヌ、ロバ、ガヤル、ヤギ、モルモット、ウマ、ラマ、ラバ、ブタ、ウサギ、トナカイ、ヒツジ、スイギュウ、及びヤクなどの哺乳類が挙げられるが、これらに限定されない。
核酸配列:「核酸配列」、「ヌクレオチド配列」、または「ポリヌクレオチド配列」という用語は、相互交換可能に使用され、連続的な核酸配列を指す。この配列は、一本鎖または二本鎖のいずれかのDNAまたはRNA、例えば、mRNAであり得る。
「核酸」という用語は、その最も広範な意味において、ヌクレオチドのポリマーを含む何らかの化合物及び/または物質を含む。これらのポリマーはしばしば、ポリヌクレオチドと呼ばれる。本開示の例示的な核酸またはポリヌクレオチドとしては、リボ核酸(RNA)、デオキシリボ核酸(DNA)、トレオース核酸(TNA)、グリコール核酸(GNA)、ペプチド核酸(PNA)、ロックされた核酸(LNA;β-D-リボ立体配置を有するLNA、α-L-リボ立体配置を有するα-LNA(LNAのジアステレオマー)、2’-アミノ官能化を有する2’-アミノ-LNA、及び2’-アミノ官能化を有する2’-アミノ-α-LNAを含む)、エチレン核酸(ENA)、シクロヘキセニル核酸(CeNA)またはこれらのハイブリッドもしくは組み合わせが挙げられるが、それらに限定されない。
「をコードするヌクレオチド配列」という語句は、ポリペプチドをコードする核酸(例えば、mRNA分子またはDNA分子)を指す。コード配列は、核酸が投与される個体または哺乳類の細胞において発現を方向付けることができるプロモーター及びポリアデニル化シグナルを含む調節エレメントへ作動可能に連結された開始シグナル及び終止シグナルをさらに含むことができる。コード配列は、シグナルペプチドをコードする配列をさらに含むことができる。
オフターゲット:本明細書で使用する場合、「オフターゲット」は、何らかの1つ以上の標的、遺伝子、または細胞転写産物に及ぼす何らかの意図せぬ効果を指す。
オープンリーディングフレーム:本明細書で使用する場合、「オープンリーディングフレーム」または「ORF」は、所与のリーディングフレームにおいて停止コドンを含有しない配列を指す。
作用可能に連結された:本明細書で使用する場合、「作用可能に連結された」という句は、2つ以上の分子、コンストラクト、転写産物、実体、部分などの間の機能的な接続をいう。
任意選択で置換された:本明細書では、「任意選択で置換されたX」(例えば、任意選択で置換されたアルキル)という形態の語句は、「Xであって、任意選択で置換されたX」(例えば、「アルキルであって、任意選択で置換されたアルキル」)と等価であることが意図されている。「X」(例えば、アルキル)の特徴はそれ自体、任意選択であることを意味するよう意図するものではない。
部分:本明細書で使用する場合、ポリヌクレオチドの「部分」または「領域」は、ポリヌクレオチドの完全長よりも短いポリヌクレオチドの何らかの部分として定義される。
患者:本明細書で使用する場合、「患者」は、特定の疾患または状態について治療を探索し得るまたは治療の必要性があり得る、治療を必要とする、治療を受けている、治療を受けようとしている、または訓練された専門家によるケアのもとにある対象を指す。
医薬として許容され得る:「医薬として許容され得る」という語句は、正確な医学的判断の範囲内であり、過剰な毒性、刺激、アレルギー応答、または他の問題もしくは合併症と有さないヒト及び動物の組織との接触での使用に適した、妥当な利益/危険比と釣り合った、化合物、材料、組成物、及び/または剤形を指すために本明細書で採用される。
医薬として許容され得る賦形剤:「医薬として許容され得る賦形剤」という語句は、本明細書で使用する場合、本明細書に記載される化合物以外の、ならびに患者において実質的に非毒性及び非炎症性である特性を有する、何らかの成分(例えば、活性のある化合物を懸濁または溶解することができるビヒクル)を指す。賦形剤には、例えば、以下を含むことができる:付着防止剤、抗酸化剤、結合剤、コーティング、圧縮助剤、崩壊剤、色素(着色剤)、皮膚軟化薬、乳化剤、充填剤(希釈剤)、フィルム形成剤もしくはフィルムコーティング剤、着香料、香料、滑剤(流動亢進剤)、潤滑剤、保存剤、プリントインク、溶剤、懸濁剤もしくは分散剤、甘味料、及び水和の水。例示的な賦形剤としては、ブチル化ヒドロキシトルエン(BHT)、炭酸カルシウム、リン酸カルシウム(二塩基性)、ステアリン酸カルシウム、クロスカルメロース、架橋型ポリビニルピロリドン、クエン酸、クロスポビドン、システイン、エチルセルロース、ゼラチン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ラクトース、ステアリン酸マグネシウム、マルチトール、マンニトール、メチオニン、メチルセルロース、メチルパラベン、微結晶性セルロース、ポリエチレングリコール、ポリビニルピロリドン、ポビドン、α化デンプン、プロピルパラベン、レチニルパルミタート、シェラック、二酸化ケイ素、カルボキシメチルセルロースナトリウム、クエン酸ナトリウム、グリコール酸デンプンナトリウム、ソルビトール、デンプン(トウモロコシ)、ステアリン酸、スクロース、タルク、二酸化チタン、ビタミンA、ビタミンE、ビタミンC、及びキシリトールが挙げられるが、これらに限定されない。
医薬として許容され得る塩:本開示は、本明細書で記載される化合物の医薬として許容され得る塩も含む。本明細書で使用する場合、「医薬として許容され得る塩」は、親化合物が既存の酸または塩基の部分をその塩形態へ転換することによって(例えば、遊離塩基基を適切な有機酸と反応させることによって)修飾された、開示された化合物の誘導体を指す。医薬として許容され得る塩の例としては、アミンなどの塩基性残基の鉱酸塩または有機酸塩、カルボン酸などの酸性残基のアルカリまたは有機塩などが挙げられるが、それらに限定されない。代表的な酸付加塩は、酢酸塩、酢酸、アジピン酸塩、アルギン酸塩、アスコルビン酸塩、アスパラギン酸塩、ベンゼンスルホン酸塩、ベンゼンスルホン酸、安息香酸塩、重硫酸塩、ホウ酸塩、酪酸塩、樟脳酸塩、カンファースルホン酸塩、クエン酸塩、シクロペンタンプロピオン酸塩、ジグルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、グルコヘプトン酸塩、グリセロリン酸塩、ヘミスルファート、へプトン酸塩、ヘキサン酸塩、臭化水素酸塩、塩酸塩、ヨウ化水素酸塩、2-ヒドロキシ-エタンスルホン酸塩、ラクトビオン酸塩、乳酸塩、ラウリン酸塩、ラウリル硫酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、メタンスルホン酸塩、2-ナフタレンスルホン酸塩、ニコチン酸塩、硝酸塩、オレイン酸塩、シュウ酸塩、パルミチン酸塩、パモ酸塩、ペクチン酸塩、過硫酸塩、3-フェニルプロピオン酸塩、リン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、ステアリン酸塩、コハク酸塩、硫酸塩、酒石酸塩、チオシアン酸塩、トルエンスルホン酸塩、ウンデカン酸塩、吉草酸塩などを含む。代表的なアルカリ金属塩またはアルカリ土類金属塩は、ナトリウム、リチウム、カリウム、カルシウム、マグネシウムなど、ならびにアンモニウム、テトラメチルアンモニウム、テトラエチルアンモニウム、メチルアミン、ジメチルアミン、トリメチルアミン、トリエチルアミン、エチルアミンなどを含むがそれらに限定されない非毒性アンモニウム、四級アンモニウム、及びアミンカチオンを含む。本開示の医薬として許容され得る塩は、例えば、非毒性の無機酸または有機酸から形成された親化合物の従来の非毒性塩を含む。本開示の医薬として許容され得る塩は、従来の化学法によって、塩基性部分または酸性部分を含有する親化合物から合成することができる。概して、このような塩は、水中でまたは有機溶媒中で、またはこれら2つの混合物中で、これらの化合物の遊離酸または遊離塩基の形態を化学量論量の適切な塩基または酸と反応させることによって調製することができ、概して、エーテル、酢酸エチル、エタノール、イソプロパノール、またはアセトニトリルのような非水性媒体が使用される。適切な塩のリストは、Remington’s Pharmaceutical
Sciences,17th ed.,Mack Publishing Company,Easton,Pa.,1985,p.1418,Pharmaceutical
Salts:Properties,Selection,and Use,P.H.Stahl and C.G.Wermuth(eds.),Wiley-VCH,2008,及びBerge et al.,Journal of Pharmaceutical Science,66,1-19(1977)において見つかり、これらは各々、その全体が参照により本明細書で援用される。
医薬として許容され得る溶媒和物:「医薬として許容され得る溶媒和物」という用語は、本明細書で使用する場合、適切な溶媒の分子が結晶格子の中に組み込まれた、本開示の化合物を意味する。適切な溶媒は、投与される用量で生理学的に耐容され得る。例えば、溶媒和物は、有機溶媒、水、またはこれらの混合物を含む溶液からの結晶化、再結晶、または沈殿によって調製することができる。適切な溶媒の例は、エタノール、水(例えば、一水和物、二水和物、及び三水和物)、N-メチルピロリジノン(NMP)、ジメチルスルホキシド(DMSO)、N,N’-ジメチルホルムアミド(DMF)、N,N’-ジメチルアセトアミド(DMAC)、1,3-ジメチル-2-イミダゾリジノン(DMEU)、1,3-ジメチル-3,4,5,6-テトラヒドロ-2-(1H)-ピリミジノン(DMPU)、アセトニトリル(ACN)、プロピレングリコール、酢酸エチル、ベンジルアルコール、2-ピロリドン、安息香酸ベンジルなどである。水が溶媒であるとき、この溶媒和物は、「水和物」と呼ばれる。
薬物動態:本明細書で使用する場合、「薬物動態」は、生体へ投与した物質の運命の決定に関する場合の分子または化合物の何らかの1つ以上の特性をいう。薬物動態は、吸収、分配、代謝及び排泄の程度及び速度を含むいくつかの領域へと分けられる。このことは通常、ADMEと呼ばれる。(A)吸収は、血液循環に入る物質のプロセスであり、(D)分配は、身体の流体及び組織のいたるところでの物質の分散または内転移であり、(M)代謝(または生体形質転換)は、親化合物から娘代謝産物への不可逆的形質転換であり、ならびに(E)排泄(または除去)は、身体からの物質の除去を指す。まれな場合、いくつかの薬剤は、身体組織中に不可逆的に蓄積する。
物理化学的:本明細書で使用する場合、物理的特性及び/または化学的特性の、または当該特性に関する、「物理化学的」手段である。
ポリヌクレオチド:本明細書で使用する場合の「ポリヌクレオチド」という用語は、リボヌクレオチド、デオキシリボヌクレオチド、これらの類似体、またはそれらの混合物を含む何らかの長さのヌクレオチドのポリマーを指す。当該用語は、当該分子の一次構造を指す。したがって、当該用語は、三本鎖、二本鎖及び一本鎖のデオキシリボ核酸(「DNA」)、ならびに三本鎖、二本鎖及び一本鎖のリボ核酸(「RNA」)を含む。当該用語は、例えば、ポリヌクレオチドのアルキル化によって、及び/またはキャッピングによって修飾された形態、ならびに未修飾形態も含む。より詳しくは、「ポリヌクレオチド」という用語は、ポリデオキシリボヌクレオチド(2-デオキシ-D-リボースを含有する)、スプライシングしていようとしていまいとにかかわらず、tRNA、rRNA、hRNA、siRNA及びmRNAを含むポリリボヌクレオチド(D-リボースを含有する)、プリン塩基またはピリミジン塩基のN-グリコシドまたはC-グリコシドであるその他のタイプのポリヌクレオチド、ならびにノルムクレオチド主鎖(normucleotidic backbone)を含有する他のポリマー、例えば、ポリアミド(例えば、ペプチド核酸「PNA」)及びポリモルホリノポリマー、ならびに他の合成配列特異的核酸ポリマーを含み、ただし、ポリマーが、DNA及びRNAにおいて認められるような、塩基対形成及び塩基スタッキングを可能にする立体配置において核酸塩基を含有することを条件とする。特定の態様において、ポリヌクレオチドは、mRNAを含む。他の態様において、mRNAは合成mRNAである。いくつかの態様において、合成mRNAは、少なくとも1つの非天然核酸塩基を含む。いくつかの態様において、ある特定のクラスの核酸塩基はすべて、非天然核酸塩基と置き換えられている(例えば、本明細書で開示されるポリヌクレオチドにおけるウリジンはすべて、非天然核酸塩基、例えば、5-メトキシウリジンと置き換えることができる)。いくつかの態様において、ポリヌクレオチド(例えば、合成RNAまたは合成DNA)は、天然核酸塩基のみを含み、すなわち、合成DNAの場合にはA、C、T及びU、または合成RNAの場合にはA、C、T、及びUである。
当業者は、本明細書で開示されたコドンマップにおけるT塩基がDNA中に存在するが、T塩基が対応するRNAにおけるU塩基によって置き換えられるであろうことを理解するであろう。例えば、DNA形態、例えば、ベクターまたはin vitroで翻訳(IVT)テンプレートにおけるコドン-ヌクレオチド配列は、対応する転写されたmRNAにおいて基づいたUとして転写されたそのT塩基を有するであろう。この点において、コドン最適化されたDNA配列(Tを含んでいる)及びその対応するRNA配列(Uを含んでいる)はいずれも、本開示のコドン最適化されたヌクレオチド配列とみなされる。当業者は、等価のコドンマップが、非天然塩基と置き換えられた1つ以上の塩基によって生じ得ることも理解するであろう。したがって、TTCコドン(DNAマップ)は、UUCコドン(RNAマップ)に対応するであろうし、これが順に、ΨΨCコドン(Uがシュードウリジンと置き換えられたRNAマップ)に対応するであろう。
標準的なA-T及びG-C塩基対は、チミジンのN3-H及びC4-オキシとアデノシンのそれぞれN1及びC6-NH2との間に、ならびにシチジンのC2-オキシ、N3及びC4-NH2とグアノシンのそれぞれC2-NH2、N’-H及びC6-オキシとの間に水素結合の形成を可能にする条件下で形成する。したがって、例えば、グアノシン(2-アミノ-6-オキシ-9-β-D-リボフラノシル-プリン)は、イソグアノシン(2-オキシ-6-アミノ-9-β-D-リボフラノシル-プリン)を形成するために修飾することができる。このような修飾は結果として、ヌクレオシド塩基を生じ、このヌクレオシド塩基はもはや、シトシンとの標準的な塩基対を有効に形成しないことになっている。しかしながら、イソシトシン(1-β-D-リボフラノシル-2-アミノ-4-オキシ-ピリミジン-)を形成するためのシトシン(1-β-D-リボフラノシル-2-オキシ-4-アミノ-ピリミジン)の修飾は結果として、修飾ヌクレオチドを生じ、このヌクレオチドは、グアノシンと有効に塩基対形成しないことになっているが、イソグアノシンとの塩基対形成を形成することになっている(Collinsらに対する米国特許第5,681,702号)。イソシトシンは、Sigma Chemical Co.(St. Louis, MO)から入手可能であり、イソシチジンは、Switzer et al.(1993)Biochemistry 32:10489-10496及びそこで引用されている参考文献によって説明される方法によって調製することができ、2’-デオキシ-5-メチル-イソシチジンは、Tor et al.(1993)J.Am.Chem.Soc.115:4461-4467の方法及びそこで引用されている参考文献によって調製することができ、イソグアニンヌクレオチドは、Switzer et al.,1993,上述、及びMantsch et al.(1993)Biochem.14:5593-5601によって説明される方法を用いて、またはCollins et al.に対する米国特許第5,780,610号において説明される方法によって調製することができる。他の非天然塩基対は、2,6-ジアミノピリミジン及びその相補体(1-メチルピラゾロ-[4,3]ピリミジン-5,7-(4H,6H)-ジオンの合成については、Piccirilli et al.(1990) Nature 343:33-37において説明される方法によって合成することができる。独特な塩基対を形成する他のこのような修飾ヌクレオチド単位は、Leach et al.(1992)J.Am.Chem.Soc.114:3675-3683及びSwitzer et al.,上述において説明されているものなどが公知である。
核酸配列:「核酸配列」、「ヌクレオチド配列」、または「ポリヌクレオチド配列」という用語は、相互交換可能に使用され、連続的な核酸配列を指す。この配列は、一本鎖または二本鎖のいずれかのDNAまたはRNA、例えば、mRNAであり得る。
「をコードするヌクレオチド配列」という語句及びそのバリアントは、本明細書に記載されるポリペプチドまたはその機能的断片をコードするヌクレオチド配列を含む核酸(例えば、mRNA分子またはDNA分子)コード配列をいう。コード配列は、核酸が投与される個体または哺乳類の細胞において発現を方向付けることができるプロモーター及びポリアデニル化シグナルを含む調節エレメントへ作動可能に連結された開始シグナル及び終止シグナルをさらに含むことができる。コード配列は、シグナルペプチドをコードする配列をさらに含むことができる。
ポリペプチド:「ポリペプチド」、「ペプチド」、及び「タンパク質」という用語は、何らかの長さのアミノ酸のポリマーを指すために本明細書で相互交換可能に使用される。ポリマーは、修飾アミノ酸を含むことができる。当該用語は、天然にまたは介入、例えば、ジスルフィド結合形成、グリコシル化、脂質化、アセチル化、リン酸化、または標識成分とのコンジュゲーションなど、その他の操作もしくは修飾によって修飾アミノ酸ポリマーも包含する。また、アミノ酸の1つ以上の類似体(例えば、ホモシステイン、オルニチン、p-アセチルフェニルアラニン、D-アミノ酸及びクレアチンなどの非天然アミノ酸を含む)ならびに当該技術分野において既知である他の修飾物を含むポリペプチドも本定義内に含まれる。
当該用語は、本明細書で使用する場合、何らかの大きさ、構造、または機能のタンパク質、ポリペプチド、及びペプチドをいう。ポリペプチドは、遺伝子産物、天然に存在ポリペプチド、合成ポリペプチド、相同体、相同分子種、パラログ、断片、ならびにこれらの他の等価物、上記のバリアント、及び類似体を含む。ポリペプチドは、単一のポリペプチドであり得、または二量体、三量体もしくは四量体などの多分子複合体であり得る。ポリペプチドは、一本鎖または多重鎖のポリペプチドも含むことができる。最も一般的には、ジスルフィド結合は、多重鎖ポリペプチドにおいて認められる。ポリペプチドという用語は、1つ以上のアミノ酸残基が、対応する天然のアミノ酸の人工化学類似体であるアミノ酸ポリマーへも適用することができる。いくつかの実施形態において、「ペプチド」は、50個以下のアミノ酸長、例えば、約5、10、15、20、25、30、35、40、45、または50アミノ酸長であり得る。
ポリペプチドバリアント:本明細書で使用する場合、「ポリペプチドバリアント」という用語は、アミノ酸配列が天然の配列または参照配列とは異なる分子を指す。アミノ酸配列バリアントは、天然の配列または参照配列と比較してアミノ酸配列内のある特定の位置に置換、欠失、及び/または挿入を有することができる。通常、バリアントは、天然の配列または参照配列に対して少なくとも約50%の同一性、少なくとも約60%の同一性、少なくとも約70%の同一性、少なくとも約80%の同一性、少なくとも約90%の同一性、少なくとも約95%の同一性、少なくとも約99%の同一性を有することになっている。いくつかの実施形態において、バリアントは、天然の配列または参照配列と少なくとも約80%、または少なくとも約90%同一であることになっている。
単位薬剤当たりのポリペプチド(PUD):本明細書で使用する場合、PUDまたは単位薬剤当たりの生成物は、合計日用量を細分した部分として定義され、体液または身体組織において測定されるような生成物(ポリペプチドなど)の通常1mg、pg、kgなどであり、通常、体液中での基準によって除されたpmol/mL、mmol/mLなどの濃度において定義される。
予防すること:本明細書で使用する場合、「予防すること」という用語は、感染、疾患、障害及び/または状態の発症を部分的にまたは完全に遅延させること、特定の感染、疾患、障害、及び/または状態の1つ以上の症状、特徴、または臨床症状の発症を部分的にまたは完全に遅延させること、感染、特定の疾患、障害、及び/または状態の1つ以上の症状、特徴、または臨床徴候の発症を部分的にまたは完全に遅延させること、及び/または感染、疾患、障害、及び/または状態と関係した病理学的性質を発症させる危険性を低下させることを指す。
プロドラッグ:本開示は、本明細書に記載される化合物のプロドラッグも含む。本明細書で使用する場合、「プロドラッグ」は、物質、分子または実体が化学的または物理的変化に応じて治療薬として作用すると断定する形態にある何らかの物質、分子または実体を指す。プロドラッグは、哺乳類対象へ投与される前、投与される際または投与された後に、活性薬部分を放出するまたは活性薬部分へと転換される何らかの方法で共有結合し得または隔離され得る。プロドラッグは、修飾が親化合物に対して通例の操作においてまたはin vivoでのいずれかで開裂するような方法で、化合物中に存在する官能基を修飾することによって調製することができる。プロドラッグは、哺乳類対象へ投与したときにヒドロキシル基、アミノ基、スルフヒドリル基、またはカルボキシル基がそれぞれ遊離のヒドロキシル基、アミノ基、スルフヒドリル基、またはカルボキシル基を形成するよう切断させる何らかの基へ結合した化合物を含む。プロドラッグの調製及び使用は、T.Higuchi and V.Stella,“Pro-drugs as Novel Delivery Systems,” Vol.14 of the A.C.S.Symposium Seriesにおいて、及びBioreversible Carriers in Drug Design,ed.Edward B.Roche,American Pharmaceutical Association and Pergamon Press,1987において考察されており、これらはいずれも、それらの全体が参照により本明細書により援用される。
増殖する:本明細書で使用する場合、「増殖する」という用語は、成長、増大もしくは増加すること、または迅速に成長、増大もしくは増加する原因となることを意味する。「増殖性」は、増殖する能力を有することを意味する。「抗増殖性」は、増殖特性に対抗するまたは不適切な特性を有することを意味する。
予防的:本明細書で使用する場合、「予防的」は、疾患の拡散を予防するのに使用される治療薬または作用コースを指す。
予防:本明細書で使用する場合、「予防」は、健康を維持し及び疾患の拡散を予防するために採られる手段を指す。「免疫予防」は、疾患の拡散を予防するために能動免疫または受動免疫を生じる手段を指す。
タンパク質切断部位:本明細書で使用する場合、「タンパク質切断部位」は、アミノ酸鎖の制御された切断が、化学的手段、酵素による手段、または光化学的手段によって達成することができる部位を指す。
タンパク質切断シグナル:本明細書で使用する場合、「タンパク質切断シグナル」は、切断のためにポリペプチドをフラッグ付けまたは標識する少なくとも1つのアミノ酸をいう。
目的のタンパク質:本明細書で使用する場合、「目的のタンパク質」または「所望のタンパク質」という用語は、本明細書に提供されるもの、ならびにこれらの断片、変異体、バリアント、及び変化物を含む。
近位の:本明細書で使用する場合、「近位の」という用語は、中心よりもまたは目的の地点もしくは領域よりもより近くに配置されていることを意味する。
シュードウリジン:本明細書で使用する場合、シュードウリジンは、ヌクレオシドウリジンのC-グリコシド異性体を指す。「シュードウリジン類似体」とは、シュードウリジンの何らかの修飾物、バリアント、アイソフォームまたは誘導体である。例えば、シュードウリジン類似体には、1-カルボキシメチル-シュードウリジン、1-プロピニル-シュードウリジン、1-タウリノメチル-シュードウリジン、1-タウリノメチル-4-チオ-シュードウリジン、1-メチルシュードウリジン(m1Ψ)、1-メチル-4-チオ-シュードウリジン(m1s4Ψ)、4-チオ-1-メチル-シュードウリジン、3-メチル-シュードウリジン(m3Ψ)、2-チオ-1-メチル-シュードウリジン、1-メチル-1-デアザ-シュードウリジン、2-チオ-1-メチル-1-デアザ-シュードウリジン、ジヒドロシュードウリジン、2-チオ-ジヒドロシュードウリジン、2-メトキシウリジン、2-メトキシ-4-チオ-ウリジン、4-メトキシ-シュードウリジン、4-メトキシ-2-チオ-シュードウリジン、N1-メチル-シュードウリジン、1-メチル-3-(3-アミノ-3-カルボキシプロピル)シュードウリジン(acp3Ψ)、及び2’-O-メチル-シュードウリジン(Ψm)が含まれるが、これらに限定されない。
精製された:本明細書で使用する場合、「精製する」、「精製された」、「精製」は、望ましくない成分、材料汚染、混合材または不完全物から実質的に純粋または清澄にすることを意味する。
参照核酸配列:「参照核酸配列」または「参照核酸」または「参照ヌクレオチド配列」または「参照配列」という用語は、配列が最適化されて得る出発核酸配列(例えば、RNA、例えば、mRNA配列)を指す。いくつかの実施形態において、参照核酸配列は、野生型核酸配列、その断片またはバリアントである。いくつかの実施形態において、参照核酸配列は、あらかじめ配列が最適化された核酸配列である。
反復トランスフェクション:本明細書で使用する場合、「反復されたトランスフェクション」という用語は、同じ細胞培養物にポリヌクレオチドを複数回用いたトランスフェクションをいう。細胞培養物は、少なくとも2回、少なくとも3回、少なくとも4回、少なくとも5回、少なくとも6回、少なくとも7回、少なくとも8回、少なくとも9回、少なくとも10回、少なくとも11回、少なくとも12回、少なくとも13回、少なくとも14回、少なくとも15回、少なくとも16回、少なくとも17回、少なくとも18回、少なくとも19回、少なくとも20回、少なくとも25回、少なくとも30回、少なくとも35回、少なくとも40回、少なくとも45回、少なくとも50回またはそれより多数回トランスフェクトすることができる。
塩:いくつかの態様において、本明細書に開示される腫瘍内送達のための医薬組成物は、その脂質構成要素のいくつかの塩を含む。「塩」という用語は、何らかのアニオン性及びカチオン性の複合体を含む。アニオンの非限定的な例としては、無機及び有機アニオン、例えば、フッ化物、塩化物、臭化物、ヨウ化物、シュウ酸塩(例えば、ヘミシュウ酸塩)、リン酸塩、ホスホン酸塩、リン酸水素塩、リン酸二水素塩、酸化物塩、炭酸塩、重炭酸塩、硝酸塩、亜硝酸塩、窒化物、亜硝酸水素塩、硫化物、亜硫酸塩、重硫酸塩、硫酸塩、チオ硫酸塩、硫酸水素塩、ホウ酸塩、ギ酸塩、酢酸塩、安息香酸塩、クエン酸塩、酒石酸塩、乳酸塩、アクリル酸塩、ポリアクリル酸塩、フマル酸塩、マレイン酸塩、イタコン酸塩、グリコール酸塩、グルコン酸塩、リンゴ酸塩、マンデル酸塩、チグリン酸塩、アスコルビン酸塩、サリチル酸塩、ポリメタクリル酸塩、過塩素酸塩、塩素酸塩、亜塩素酸塩、次亜塩素酸塩、臭素酸塩、次亜臭素酸塩、ヨウ素酸塩、アルキルスルホン酸塩、アリールスルホン酸塩、ヒ酸塩、亜ヒ酸塩、クロム酸塩、二クロム酸塩、シアン化物、シアン酸塩、チオシアン酸塩、水酸化物、過酸化物、過マンガン酸塩、及びこれらの混合物が挙げられる。
試料:本明細書で使用する場合、「試料」または「生物学的試料」という用語は、その組織、細胞または成分(例えば、血液、粘液、リンパ液、滑液、脳脊髄液、唾液、羊水、臍帯血、尿、膣液及び精液)の部分集合を指す。試料はさらに、例えば、血漿、血清、脊髄液、リンパ液、皮膚、気管、腸管、及び尿生殖路の外面切片、涙、唾液、母乳、血球、腫瘍、器官を含むがこれらに限定されない生体全体またはその組織、細胞もしくは成分、あるいはこれらの画分または部分から調製されたホモジェネート、溶解物または抽出物を含むことができる。試料はさらに、タンパク質または核酸分子などの細胞成分を含有し得る栄養ブロスまたはゲルなどの培地を指す。
シグナル配列:本明細書で使用する場合、「シグナル配列」、「シグナルペプチド」、及び「トランジットペプチド」という語句は、相互交換可能に使用され、ある特定の小器官、細胞区画、または細胞外輸送に対するタンパク質の輸送または局在を向かわせる配列を指す。この用語は、シグナル配列ポリペプチド及びシグナル配列をコードする核酸配列のいずれも包含する。したがって、核酸においてシグナル配列への参照は実際、シグナル配列ポリペプチドをコードする核酸配列を指す。
シグナル伝達経路:「シグナル伝達経路」は、細胞のある部分から細胞の別の部分へのシグナルの伝達における役割を担っている種々のシグナル伝達分子間の生化学的関連性を指す。本明細書で使用する場合、「細胞表面受容体」という語句は、例えば、シグナル及び細胞の形質膜を横切るこのようなシグナルの伝達を受信することができる分子及び分子の複合体を含む。
類似性:本明細書で使用する場合、「類似性」という用語は、ポリマー分子間の、例えば、ポリヌクレオチド分子(例えば、DNA分子及び/またはRNA分子)間の、及び/またはポリペプチド分子間の全体的な関連性を指す。互いに対する複数のポリマー分子の類似性百分率の計算は、同一性百分率の計算と同じ様式で実行することができるが、例外は、類似性百分率の計算が、当該技術分野において理解されているような保存的置換を考慮に入れることである。
特異的送達:本明細書で使用する場合、「特異的送達」、「特異的に送達する」、または「特異的に送達すること」という用語は、オフターゲット組織(例えば、哺乳類の脾臓)と比較して目的の標的組織(例えば、哺乳類の肝臓)への、ナノ粒子によるポリヌクレオチドのより多く(例えば、少なくとも1.5倍超、少なくとも2倍超、少なくとも3倍超、少なくとも4倍超、少なくとも5倍超、少なくとも6倍超、少なくとも7倍超、少なくとも8倍超、少なくとも9倍超、少なくとも10倍超)の送達を意味する。特定の組織へのナノ粒子の送達レベルは、組織において生成されたタンパク質の量を当該組織の重量と比較すること、組織におけるポリヌクレオチドの量を当該組織の重量と比較すること、組織において産生されるタンパク質の量を当該組織の総ポリヌクレオチドの重量と比較すること、または組織におけるポリヌクレオチドの量を当該組織における全ポリヌクレオチドの重量と比較することによって測定され得る。例えば、腎血管性標的化のために、組織1g当たり1.5、2倍、3倍、5倍、10倍、15倍、または20倍以上のポリヌクレオチドがこのポリヌクレオチドの全身投与後に哺乳類の肝臓または脾臓へ送達されるものと比較して腎臓へ送達される場合、ポリヌクレオチドは、肝臓及び脾臓と比較して腎臓へ特異的に提供される。標的組織へ特異的に送達するナノ粒子の能力が治療されている対象において測定される必要がなく、動物モデル(例えば、ラットモデル)などの代用物において測定され得ることは、理解されるだろう。
安定した:本明細書で使用する場合、「安定した」は、反応混合物からの有用な純度まで単離物を存続させるのに十分に堅牢であり、いくつかの場合において、効能のある治療剤へと製剤化することができる化合物を指す。
安定化した:本明細書で使用する場合、「安定化する」、「安定化した」、「安定化した領域」という用語は、安定にさせるまたは安定となることを意味する。
立体異性体:本明細書で使用する場合、「立体異性体」という用語は、化合物(例えば、本明細書に記載する何らかの式の化合物)が特に基本的な分子構造に関して考えられ得る立体化学的に及び立体配座上異性体の形態全部、ジアステレオマー、鏡像異性体及び/または配座異性体全部を有し得る、考えられ得る異なる異性形態及び立体配座形態をすべていう。本開示のいくつかの化合物は、異なる互変異性形態で存在し得、後者はすべて、本開示の範囲内に含まれる。
対象:「対象」または「個体」または「動物」または「患者」または「哺乳類」によって意味されるのは、診断、予後、または療法が所望である何らかの対象、特に哺乳類対象である。哺乳類対象は、ヒト、イヌ、ネコ、モルモット、ウサギ、ラット、マウス、ウマ、畜牛、乳牛などの家畜、農場飼育動物、動物園展示動物、競技用動物、ペット動物;類人猿、サル、オランウータン、及びチンパンジーなどの霊長類;イヌ及びオオカミなどのイヌ科;ネコ、ライオン、及びトラなどのネコ科;ウマ、ロバ、及びシマウマなどのウマ科;クマ、乳牛、ブタ、及びヒツジなどの食品動物;シカ及びキリンなどの有蹄類;マウス、ラット、ハムスター及びモルモットなどの齧歯類;ならびにその他を含むが、これらに限定されない。ある特定の実施形態において、哺乳類は、ヒト対象である。他の実施形態において、対象は、ヒト患者である。特定の実施形態において、対象は、がんの治療を必要とするヒト患者である。
実質的に:本明細書で使用する場合、「実質的に」という用語は、目的の特徴または特性の全部またはほぼ全部の程度または度合いを呈する定性的な条件を指す。生物分野の当業者は、生物学的及び化学的現象が、たとえあったとしても、完了へ向かっている及び/または完了へ進んでいるまたは絶対的な結果に達するもしくはこれを回避することがまれであることを理解するだろう。「実質的に」という用語はそれゆえ、多くの生物学的及び化学的現象において固有の完了性を欠く可能性を捕捉するために、本明細書において使用される。
実質的に等しい:投薬間の時間差に関する場合に本明細書で使用する場合、この用語は、プラス/マイナス2%を意味する。
実質的に同時の:本明細書で使用する場合及び複数の投与に関する場合、この用語は、2秒以内を意味する。
に罹患している:疾患、障害、及び/または状態「に罹患している」個体は、その疾患、障害、及び/または状態の1つ以上の症状で診断されまたはこれらの症状を示している。
に感染しやすい:疾患、障害、及び/または状態「に感染しやすい」個体は、この疾患、障害、及び/または状態の症状で診断されていない及び/またはこれらの症状を呈し得ないが、疾患またはその症状を発症する傾向を有する。いくつかの実施形態において、疾患、障害、及び/または状態(例えば、がん)に感染しやすい個体は、次の1つ以上を特徴とすることができる:(1)疾患、障害、及び/または状態の発症と関係する遺伝的変異、(2)疾患、障害、及び/または状態の発症と関係する遺伝的多形、(3)疾患、障害、及び/または状態の発症と関係するタンパク質及び/または核酸の発現及び/または活性の上昇及び/または低下、(4)疾患、障害、及び/または状態の発症と関係する習慣及び/または生活様式、(5)疾患、障害、及び/または状態の家族歴、ならびに(6)疾患、障害、及び/または状態の発症と関係する微生物への曝露及び/またはこの微生物による感染。いくつかの実施形態において、疾患、障害、及び/または状態に感染しやすい個体は、この疾患、障害、及び/または状態を発症するだろう。いくつかの実施形態において、疾患、障害、及び/または状態に感染しやすい個体は、この疾患、障害、及び/または状態を発症しないだろう。
持続性放出:本明細書で使用する場合、「持続性放出」という用語は、特定の時間にわたる放出速度により挙動する医薬組成物または化合物の放出特性を指す。
合成の:「合成の」という用語は、人為的に生成、調製、及び/または製造されていることを意味する。本開示のポリヌクレオチドまたは他の分子の合成は、化学的または酵素により得る。
標的とされる細胞:本明細書で使用する場合、「標的とされる細胞」は、目的の何らかの1つ以上の細胞を指す。この細胞は、in vitro、in vivo、in situで、または生体の組織もしくは器官において認められ得る。この生体は、動物、好ましくは哺乳類、より好ましくはヒト及び最も好ましくは患者であり得る。
標的組織:本明細書で使用する場合、「標的組織」は、ポリヌクレオチドの送達が結果として所望の生物学的及び/または薬理学的効果を生じるであろう、目的の何らかの1つ以上の組織タイプを指す。目的の標的組織の例としては、特異的な組織、器官、及び系またはその群が挙げられる。特定の適用において、標的組織は、腎臓、肺、脾臓、血管における血管内皮(例えば、冠状内または大腿内)、または腫瘍組織(例えば、腫瘍内注射を介する)であり得る。「オフターゲット組織」は、コードされたタンパク質の発現が、所望の生物学的及び/または薬理学的効果を結果として生じない何らかの1つ以上の組織タイプを指す。特定の適用において、オフターゲット組織は、肝臓及び膵臓を含み得る。
標的とされる配列:本明細書で使用する場合、「標的とされる配列」という語句は、タンパク質またはポリペプチドの輸送または局在を方向付けることができる配列を指す。
末端:本明細書で使用する場合、「末端(複数可)」という用語は、ポリペプチドに関する場合、ペプチドまたはポリペプチドの端部を指す。このような端部は、ペプチドまたはポリペプチドの最初または最後の部位のみに限定されるわけではなく、末端の領域における追加のアミノ酸を含むことができる。本開示のポリペプチド系分子は、N末端(遊離アミノ基(NH2)を有するアミノ酸によって終止)及びC末端(遊離カルボキシル基(COOH)を有するアミノ酸によって終止)をともに有することを特徴とすることができる。本開示のタンパク質は、いくつかの場合、ジスルフィド結合によってまたは非共有結合力(多量体、オリゴマー)によって一緒に生じる多重ポリペプチド鎖でできている。これらの種類のタンパク質は、N末端及びC末端を複数有することになっている。あるいは、ポリペプチドの末端は、場合により、有機コンジュゲートなどの非ポリペプチド系部分で始まりまたは終止するように修飾することができる。
治療剤:「治療剤」という用語は、対象へ投与したときに、治療効果、診断効果、及び/または予防効果を有する、及び/または所望の生物学的及び/または薬理学的効果を誘発する作用剤をいう。例えば、いくつかの実施形態において、IL-36-ガンマポリペプチドをコードするmRNAは、治療剤であり得る。
治療有効量:本明細書で使用する場合、「治療有効量」は、感染、疾患、障害、及び/または状態に罹患しているまたは感染しやすい対象へ投与したときに、感染、疾患、障害、及び/または状態の症状を治療、改善し、感染、疾患、障害、及び/または状態の発症を予防及び/または遅延させるのに十分である、送達される作用剤(例えば、核酸、薬物、治療剤、診断薬、予防薬など)の量を意味する。
治療有効結果:本明細書で使用する場合、「治療有効結果」という用語は、感染、疾患、障害、及び/または状態に罹患しているまたは感染しやすい対象において、感染、疾患、障害、及び/または状態の症状を治療、改善し、及び/または感染、疾患、障害、及び/または状態の発症を予防及び/または遅延させるのに十分である結果を意味する。
合計日用量:本明細書で使用する場合、「合計日用量」とは、24時間に所与または処方された量である。合計日用量は、単一単位用量または分割用量として投与することができる。
転写因子:本明細書で使用する場合、「転写因子」という用語は、DNAからRNAへの転写を、例えば、転写の活性化または抑制によって調節するDNA結合タンパク質を指す。いくつかの転写因子は転写のみの調節をもたらすが、その他は他のタンパク質と一緒に作用する。いくつかの転写因子は、ある特定の条件下での転写を活性化することも抑制することもできる。概して、転写因子は、標的遺伝子の調節領域における特定のコンセンサス配列と非常に類似した特定の1つのまたは複数の標的配列を結合する。転写因子は、標的遺伝子の転写を単独でまたは他の分子との複合体において調節し得る。
転写:本明細書で使用する場合、「転写」という用語は、外来性核酸を細胞へと導入する方法を指す。トランスフェクション方法は、化学的方法、物理的処置、及びカチオン性脂質または混合物を含むが、これらに限定されない。
トランスフェクション:本明細書で使用する場合、「トランスフェクション」は、細胞へのポリヌクレオチドの導入を指し、このポリヌクレオチドによってコードされるポリペプチドは発現し(例えば、mRNA)、またはこのポリペプチドは細胞の機能を調節する(例えば、siRNA、miRNA)。本明細書で使用する場合、核酸配列の「発現」は、ポリペプチドもしくはタンパク質へのポリヌクレオチド(例えば、mRNAの翻訳)及び/またはポリペプチドもしくはたんぱく質の翻訳後修飾を指す。
治療すること、治療、療法:本明細書で使用する場合、「治療すること」または「治療」または「療法」という用語は、過剰増殖性疾患、例えば、がんの1つ以上の症状または特徴の発症を部分的にまたは完全に軽減させ、改良し、改善し、緩和し、遅延させる、進行を抑制する、重症度を低減させる、及び/または発生率を低減させることを指す。例えば、がんを「治療すること」は、腫瘍の生存、成長、及び/または伝播を阻害することを指すことができる。治療は、疾患、障害、及び/または状態の徴候を呈していない対象へ、及び/または疾患、障害、及び/または状態の早期の徴候のみを呈する対象へ、疾患、障害、及び/または状態と関係する病理学的性質を発症する危険性を低下させる目的のために投与することができる。
腫瘍微小環境:本明細書で使用する場合、「腫瘍微小環境」は、浸潤免疫細胞及び/または炎症細胞、ならびに腫瘍内でのこのような細胞のタイプ(複数可)の有無に対する、腫瘍内細胞の組成を指す。1つの態様において、腫瘍微小環境とは、「炎症を起こした腫瘍微小環境」であり、腫瘍へと浸潤した免疫細胞及び/または炎症細胞の存在を指し、主要な細胞タイプは顆粒球である。別の態様において、腫瘍微小環境とは、「免疫抑制腫瘍微小環境」であり、腫瘍へと浸潤した免疫細胞及び/または炎症細胞の存在を指し、主要な細胞タイプは単球細胞及びマクロファージである。別の態様において、腫瘍微小環境とは、「免疫学的に欠乏している腫瘍微小環境」であり、免疫細胞及び/または炎症細胞の腫瘍への顕著な浸潤の欠如をいう。
非修飾の:本明細書で使用する場合、「未修飾の」は、何らかの方法で変化する前の何らかの物質、化合物または分子を指す。未修飾は、生体分子の野生型または天然形態を指すことができるが、必ずしもそうではない。分子は、一連の修飾を受けることができ、それにより各修飾された分子は、その後の修飾について「非修飾の」出発分子として役に立つことができる。
ウラシル:ウラシルとは、RNAの核酸における4つの核酸塩基の1つであり、Uという文字によって表される。ウラシルはリボース環へ、またはより具体的には、β-N1-グリコシド結合を介してリボフラノースへ結合して、ヌクレオシドウリジンを生じることができる。ヌクレオシドウリジンはまた、その核酸塩基の一文字表記、すなわちUにより通常略記される。したがって、本開示において、ポリヌクレオチド配列におけるモノマーがUである場合、このようなUは、「ウラシル」または「ウリジン」と相互交換可能に示される。
ウリジン含有量:「ウリジン含有量」または「ウラシル含有量」という用語は、相互交換可能であり、ある特定の核酸配列において存在するウラシルまたはウリジンの量を指す。ウリジン含有量またはウラシル含有量は、絶対値(配列中のウリジンまたはウラシルの総数)または相対的なもの(核酸配列における核酸塩基の総数に関するウリジンまたはウラシルの百分率)として表すことができる。
ウリジン修飾した配列:「ウリジン修飾した配列」という用語は、候補核酸配列のウリジン含有量及び/またはウリジンパターンに関して、異なる全体のもしくは局所的なウリジン含有量(より多量のまたはより少量のウリジン含有量)を用いて、または異なるウリジンパターン(例えば、勾配分布またはクラスター形成)を用いて配列を最適化した核酸(例えば、合成mRNA配列)を指す。本開示において、「ウリジン修飾した配列」及び「ウラシル修飾した配列」という用語は、等価及び相互交換可能とみなされる。
「高ウリジンコドン」は、2つまたは3つのウリジンを含むコドンとして定義され、「低ウリジンコドン」は、1つのウリジンを含むコドンとして定義され、「無ウリジンコドン」とは、いかなるウリジンも有しないコドンである。いくつかの実施形態において、ウリジン修飾した配列は、高ウリジンコドンを低ウリジンコドンでの置換、高ウリジンコドンを無ウリジンコドンでの置換、低ウリジンコドンを高ウリジンコドンでの置換、低ウリジンコドンを無ウリジンコドンでの置換、無ウリジンコドンを低ウリジンコドンでの置換、無ウリジンコドンを高ウリジンコドンでの置換、及びこれらの組み合わせを含む。いくつかの実施形態において、高ウリジンコドンは、別の高ウリジンコドンと置き換えることができる。いくつかの実施形態において、低ウリジンコドンは、別の低ウリジンコドンと置き換えることができる。いくつかの実施形態において、無ウリジンコドンは、別の無ウリジンコドンと置き換えることができる。ウリジン修飾した配列は、ウリジンが豊富であり得るかまたはウリジンが希少であり得る。
ウリジンが豊富な:本明細書で使用する場合、「ウリジンが豊富な」という用語及び文法上の変形は、対応する候補核酸配列のウリジン含有量に関して、配列が最適化された核酸(例えば、合成mRNA配列)におけるウリジン含有量(絶対値でまたは百分率値として表される)の増加を指す。ウリジンを豊富にすることは、候補核酸配列におけるコドンを、ウリジン核酸塩基をほとんど含有していない同義のコドンで置換することによって行うことができる。ウリジンを豊富にすることは、全体的(すなわち、候補核酸配列の全長に対する)または局所的(すなわち、候補核酸配列のサブ配列または領域に対する)であり得る。
ウリジンが希少な:本明細書で使用する場合、「ウリジンが希少な」という用語及び文法上の変形は、対応する候補核酸配列のウリジン含有量に関して、配列が最適化された核酸(例えば、合成mRNA配列)におけるウリジン含有量(絶対値でまたは百分率値として表される)の減少を指す。ウリジンを希少にすることは、候補核酸配列におけるコドンを、ウリジン核酸塩基をほとんど含有していない同義のコドンで置換することによって行うことができる。ウリジンを希少にすることは、全体的(すなわち、候補核酸配列の全長に対する)または局所的(すなわち、候補核酸配列の部分配列または領域に対する)であり得る。
バリアント:本開示において使用するバリアントという用語は、天然のバリアント(例えば、多形、アイソフォームなど)、及びナイーブの配列または出発配列(例えば、野生型配列)における少なくとも1つのアミノ酸残基が除去され、異なるアミノ酸配列が同じ位置のその場所に挿入された人工バリアントの両方をいう。これらのバリアントは、「置換バリアント」と説明することができる。置換は単一であり得、この場合、分子中のたった1つのアミノ酸が置換されており、または置換は複数であり得、この場合、2つ以上のアミノ酸が同じ分子において置換されている。アミノ酸が挿入されまたは欠失した場合、結果として生じるバリアントはそれぞれ、「挿入バリアント」または「欠失バリアント」であろう。
II.免疫調節ポリペプチドをコードするポリヌクレオチドを含む組み合わせ
本開示は、がんの治療のための組成物(「本開示の組成物」)を提供する。1つの実施形態において、この組成物は、単一の製剤において、少なくとも2つのポリヌクレオチド(例えば、mRNA)または少なくとも3つのポリヌクレオチド(例えば、mRNA)を含み、組成物の各々は、IL-23をコードする第1のポリヌクレオチド、IL-36-ガンマ(または、それに代わるものとして、IL-18)をコードする第2のポリヌクレオチド、及び/またはOX40Lをコードする第3のポリヌクレオチドから選択される。したがって、本開示は、例えば、(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、mRNA)、(ii)IL-36-ガンマポリペプチド(またはIL-18ポリペプチド)を含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、mRNA)、及び(iii)OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、mRNA)を提供し、第1のポリヌクレオチド、第2のポリヌクレオチド、及び第3のポリヌクレオチドは、種々の組み合わせで使用される。1つの態様において、この組成物は、第1のポリヌクレオチド、第2のポリヌクレオチド、及び第3のポリヌクレオチドを含む。「本開示のポリヌクレオチド」という用語は、本明細書に開示する第1のポリヌクレオチド、第2のポリヌクレオチド、及び第3のポリヌクレオチドを指す。
本明細書で使用する場合、「本開示の組み合わせ」という用語は、例えば、(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、mRNA)、及びIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、(ii)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、mRNA)、OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、mRNA)、(iii)IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、mRNA)、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、mRNA)、または(iv)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、mRNA)、IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、mRNA)、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、mRNA)の、組み合わせを含む。「本開示の組み合わせ」と用語は、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドからなる物理的な組み合わせに限定されず、これらのポリヌクレオチドのあらゆるものの個別投与、同時投与または連続投与も包含することが理解される。
それゆえ、別の実施形態において、本開示の組成物は、単一のポリペプチドであるIL-23、IL-36-ガンマもしくはIL-18、またはOX40Lをコードするポリヌクレオチド(例えば、mRNA)を含むが、組成物の各々(例えば、IL-23をコードする第1のポリヌクレオチドを含む組成物、IL-36-ガンマまたはIL-18をコードする第2のポリヌクレオチドを含む組成物、及びOX40Lをコードする第3のポリヌクレオチド)は、本明細書に記載される方法において併用することができる。
当業者は、本開示の代替的な実施形態が、ポリヌクレオチド及び/またはタンパク質としてのIL-23、IL-36-ガンマもしくはIL-18、及び/またはOX40の併用療法を含むことも認識するであろう。例えば、本開示は、(i)IL-23をコードする第1のポリヌクレオチド(例えば、mRNA)及びIL-36-ガンマもしくはIL-18を含む第2のタンパク質、IL-23を含む第1のタンパク質、及びIL-36ガンマ IL-18を含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、mRNA)または(iii)IL-23を含む第1のタンパク質及びIL-36ガンマもしくはIL-18を含む第2のタンパク質の、併用療法を包含する。同様に、本開示は、IL-23ポリヌクレオチド(例えば、mRNA)、またはIL-23ポリペプチドを含む第1のタンパク質か、IL-36-ガンマポリヌクレオチドもしくはIL-18ポリヌクレオチド(例えば、mRNA)、またはIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質か、OX40Lポリヌクレオチド(例えば、mRNA)、またはOX40Lポリペプチドを含む第3のタンパク質か、あるいはこれらの組み合わせかの、併用療法を包含する。
IL-23をコードするポリヌクレオチド
IL-23は、先天免疫及び適応免疫において重要な役割を担っている炎症性サイトカインである。Croxford et al.(2012)Eur.J.Immunol.42:2263-2273。IL-23は、はじめにジスルフィド結合のp19及びp40サブユニットからなる60kDaのヘテロ二量体タンパク質として機能する。IL-23は、炎症性サイトカインIL-12と構造的に及び機能的に類似している。IL-23は、IL-12と同じp40サブユニットを含有するが、IL-12のp35サブユニットよりもむしろp19を含む。Oppman et al.(2000)Immunity 13:715-725。p19サブユニットの前駆形態(NCBI Reference Sequence:NP_057668;NM_016584;Uniprot:Q9NPF7;IL-23A及びIL-23サブユニットアルファともいう)は、189アミノ酸長であるが、その成熟形態は、170アミノ酸長である。p40サブユニットの前駆形態(NCBI Reference Sequence:NM_002187;Uniprot:P29460;IL-12B、ナチュラルキラー細胞刺激因子2及び細胞障害性リンパ球成熟因子2ともいう)は、328アミノ酸長であるが、その成熟形態は、306アミノ酸長である。
樹状細胞及びマクロファージを含む多くの異なる免疫細胞は、抗原刺激の際にIL-23を産生する。IL-12とIL-23の間にある1つの違いは、IL-12がTH1 T細胞集団の発生及び活性と関係しているのに対し、IL-23がTh17 T細胞集団の発生及び活性と関係していることである。Vignali et al.(2014)Nat.Immunol.13:722-728を参照されたい。
いくつかの初期の研究は、抗腫瘍療法についてIL-23を関係があるとした(Belladonna et al.(2002)J.Immunol.168:5448-5454)が、より近年の研究は、IL-23についての潜在的な腫瘍形成化促進機能を示している。例えば、Croxford et al.(2012)Eur.J.Immunol.42:2263-2273.Langowski et al.(2007)Trends Immunol.28:207-212;Langowski et al.(2006)Nature 442:461-465;Teng et al.(2010)Proc.Natl.Acad.Sci.USA 107:8328-8333;Teng et al.(2012)Cancer Res.72:3987-3996を参照されたい。Langowski(2006)は、ヒト腫瘍におけるIL-23の増加を観察した。Ngiow et al.(2013)Trends Immunol.34:548-555;Wilke et al.(2011)Carcinogenesis 32:643-649;Xu et al.(2010)Clin.Dev.Immunol.2010も参照されたい。例えば、Wang et al.(2015)Clin.Exp.Rheumatol.33(Suppl.92):S87-S90は、IL-23の発現亢進ががんにおける病原性機能を有していると教示している。IL-23は、腫瘍の発生及び進行において原因となる役割を有しており、有害な予後結果及び転移性疾患への急速な進行と連関しており、このことは、IL-23発現の阻害が療法に有用であり得、がん、特に大腸癌の予防となり得ることを示唆してきた。Teng et
al.(2015)Nature Medicine 21:719-29は、IL-23が腫瘍化、成長、及び転移を間接的にまたは直接的に促進することを教示しており、IL-23発現の阻害が、がんの療法及び予防に使用することができたことを示している。
本開示において使用する場合、「IL-23ポリペプチド」という用語は、例えば、IL-23のIL-12p40サブユニット、IL-23のIL-23p19サブユニット、またはIL-12p40サブユニットポリペプチド及びIL-23p19サブユニットポリペプチドを含む融合タンパク質を指す。いくつかの態様において、この融合タンパク質は、N末端からC末端へと以下を含む:
(a)IL-12p40シグナルペプチドを含むIL-12p40サブユニット、ペプチドリンカー、及び成熟IL-23p19サブユニット、または
(b)IL-23p19シグナルペプチドを含むIL-23p19サブユニット、ペプチドリンカー、及び成熟IL-12p40。
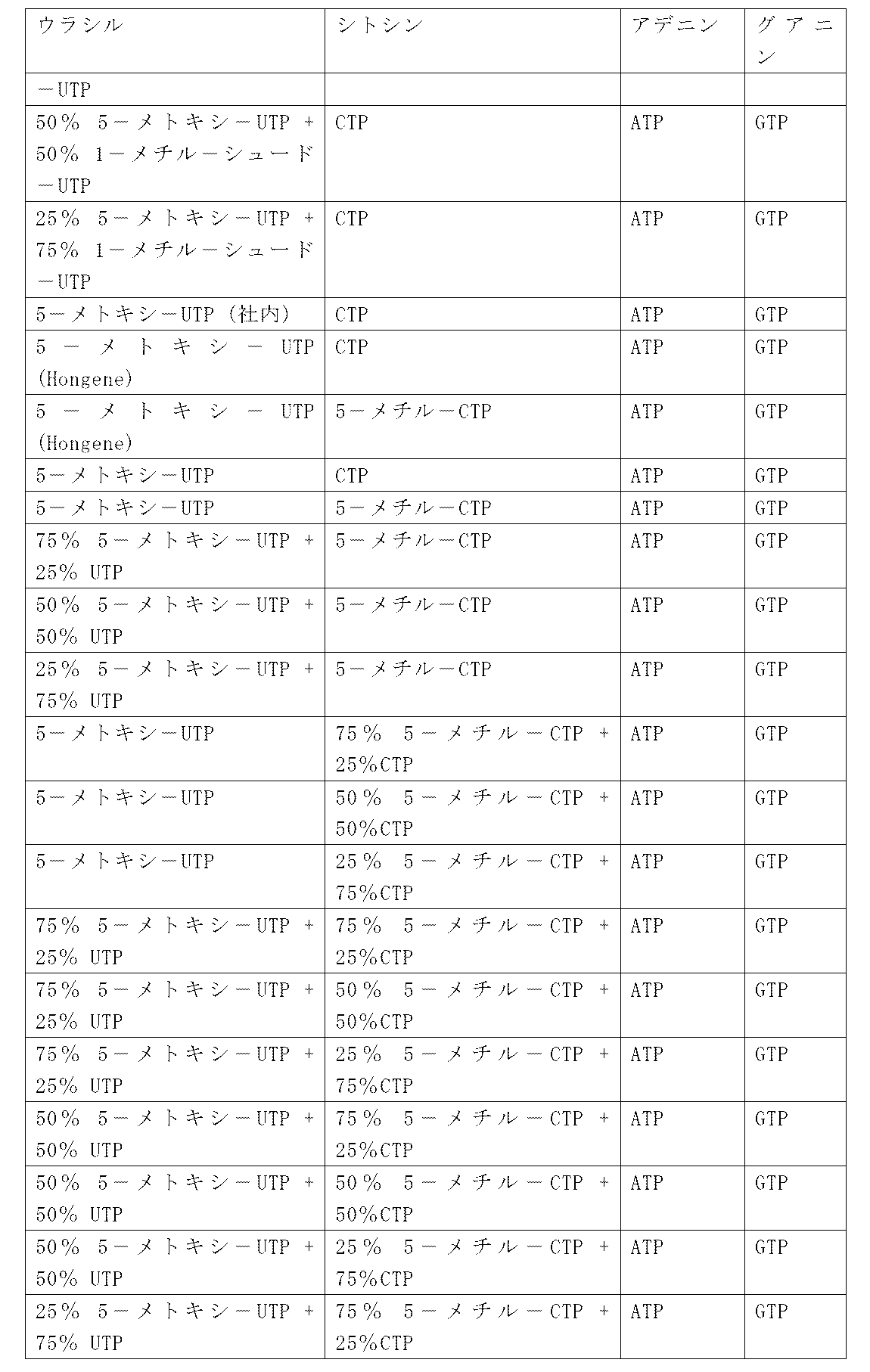
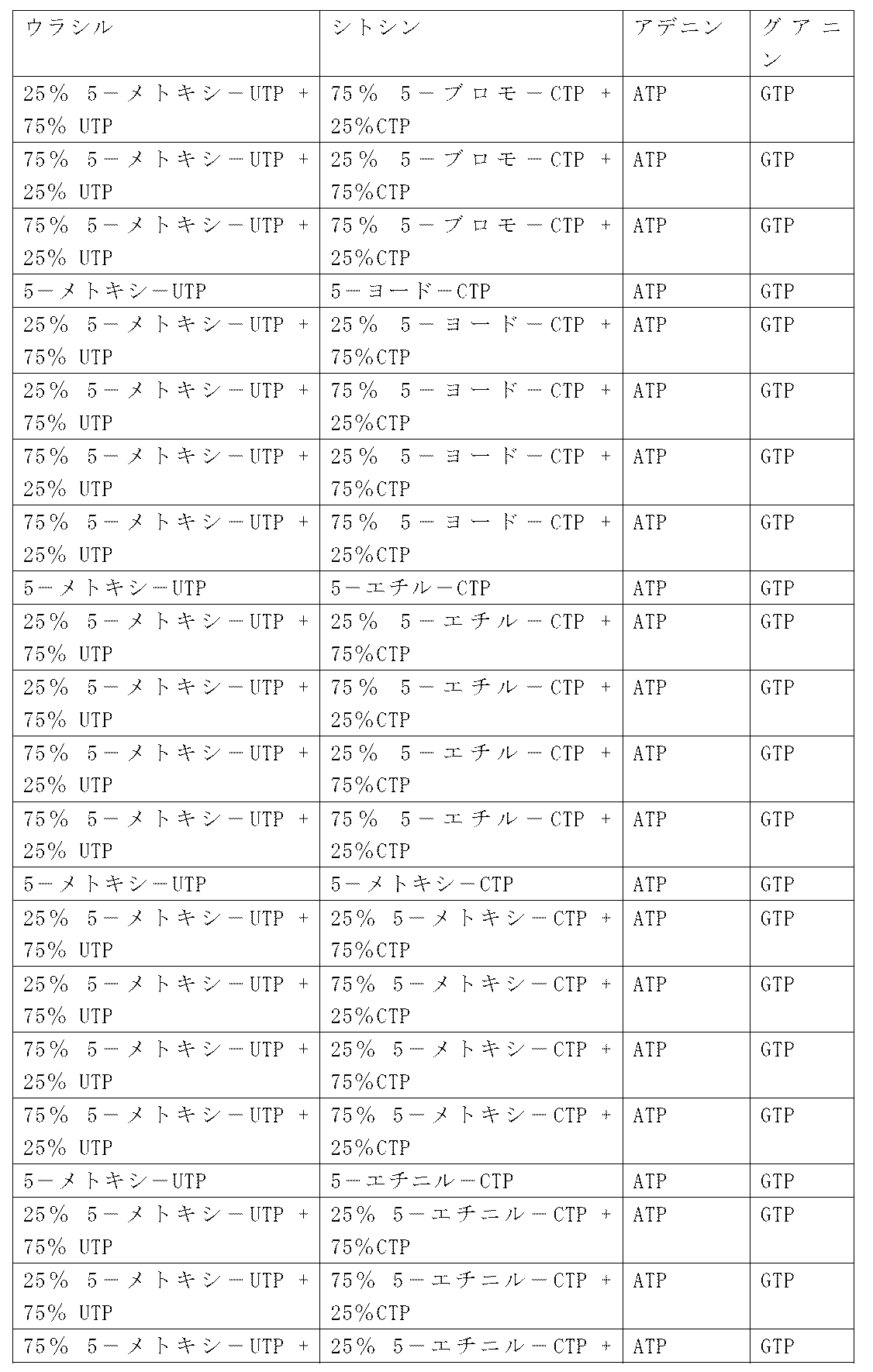
一つの特定の態様において、IL-23ポリペプチドは、表1のヒトまたはマウスIL-23ポリペプチドを含み、これからなり、またはこれから本質的になり(例えば、IL-12p40またはIL-23p19の前駆体または成熟体)、あるいはそれらに関する組み合わせである。一つの特定の態様において、IL-23ポリペプチドをコードするポリヌクレオチドは、表1のIL-23をコードするポリヌクレオチドを含み、これからなり、またはこれから本質的になる。
いくつかの実施形態において、IL-23ポリペプチドは、表1に列挙するIL-23アミノ酸配列または表1に列挙するヌクレオチド配列によってコードされるアミノ酸配列と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、このIL-23ポリペプチドは、対応する野生型IL-23ポリペプチドの活性(例えば、IL-23ポリペプチド受容体への結合)の少なくとも10%を有する。特定の実施形態において、IL-23ポリペプチドは、配列番号1、配列番号5または配列番号140と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、対応する野生型IL-23ポリペプチドの活性(例えば、IL-23ポリペプチド受容体への結合)の少なくとも10%を有する。別の特定の実施形態において、IL-23ポリペプチドは、配列番号1、配列番号5または配列番号140から本質的になり、対応する野生型IL-23ポリペプチドの活性(例えば、IL-23ポリペプチド受容体への結合)の少なくとも10%を有する。
他の実施形態において、本開示のポリヌクレオチドによってコードされるIL-23ポリペプチドは、表1に列挙されるアミノ酸配列、または1つ以上の保存的置換を有する配列番号1、5もしくは140に示されるアミノ酸配列を含み、この保存的置換は、IL-23ポリペプチドの受容体へのIL-23ポリペプチドの結合活性に大きく影響せず、すなわち、IL-23ポリペプチドは、置換後にIL-23受容体へ結合する。
いくつかの実施形態において、IL-23ポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、表1に列挙する核酸配列をコードするIL-23ポリペプチドと少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。特定の実施形態において、IL-23ポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号19、配列番号71、配列番号141または配列番号142と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。別の特定の実施形態において、IL-23ポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号19、配列番号71、配列番号141または配列番号142から本質的になる。IL-23ポリペプチドオープンリーディングフレーム(ORF)をコードするヌクレオチド配列(すなわち、mRNA、例えば、配列番号19、配列番号71または配列番号141)が、例えば、5’末端キャップ、5’UTR(例えば、配列番号27または配列番号44)、3’UTR(例えば、配列番号119または配列番号120)、及び/またはポリ-A尾部をさらに含む、より大きなコンストラクト内の1つの要素であり得ることは理解されるべきである。
IL-12ポリペプチドをコードするポリヌクレオチド
いくつかの態様において、第1のポリヌクレオチドは、IL-12ポリペプチドを含む第1のタンパク質をコードする。本開示において使用する場合、「IL-12ポリペプチド」という用語は、例えば、IL-12のIL-12p40サブユニット(すなわち、IL12B)、IL-12のIL-12p35サブユニット(すなわち、IL12Aa)、またはIL-12p40サブユニットポリペプチド及びIL-12p35サブユニットポリペプチドを含む融合タンパク質を指す。いくつかの態様において、この融合タンパク質は、以下から選択されるIL12Bポリペプチド:
(i)完全長のIL12Bポリペプチド(例えば、野生型IL12Bと同じ長さまたは本質的に同じ長さを有する)、
(ii)完全長のIL12Bポリペプチド配列の機能的断片(IL12B野生型よりも短い切断型(例えば、カルボキシ末端、アミノ末端、または内部領域の欠失)配列だが、IL12B酵素活性をなおも保有している)、
(iii)IL12Bポリペプチドのバリアント(例えば、全長の、または1つ以上のアミノ酸が置き換えられた切断型のIL12Bタンパク質、例えば、野生型IL12Bポリペプチドに関してIL12Bポリペプチド活性の全部またはほとんどを保有しているバリアント(例えば、V33I、V298F、または当該技術分野において既知である何らかの天然バリアントまたは人工バリアントなど)、または
(iv)(i)全長のIL12B野生型、その機能的断片もしくはバリアントと、(ii)異種性タンパク質とを含む、融合タンパク質、
及び/あるいは、以下から選択されるIL12Aポリペプチド:
(i)全長のIL12Aポリペプチド(例えば、野生型IL12Aと同じ長さまたは本質的に同じ長さを有する)、
(ii)完全長のIL12Aポリペプチドの機能的断片(例えば、IL12A野生型よりも短い切断型(例えば、カルボキシ末端領域、アミノ末端領域、または内部領域の欠失)配列だが、IL12A酵素活性をなおも保有している)、
(iii)IL12Aポリペプチドのバリアント(例えば、完全長の、または1つ以上のアミノ酸が置き換えられた切断型のIL12Aタンパク質、例えば、野生型IL12Aポリペプチドに関してIL12Aポリペプチド活性の全部またはほとんどを保有しているバリアント(当該技術分野において既知である天然バリアントまたは人工バリアントなど))、または
(iv)(i)完全長のIL12A野生型、その機能的断片もしくはバリアントと、(ii)異種性タンパク質とを含む、融合タンパク質
を含む。
一つの特定の態様において、IL-12ポリペプチドは、表1のヒトまたはマウスIL-12ポリペプチドを含み、これからなり、またはこれから本質的になり(例えば、IL-12p40またはIL-12p35の前駆体または成熟体)、あるいはそれらに関する組み合わせである。一つの特定の態様において、IL-12ポリペプチドをコードするポリヌクレオチドは、表1のIL-23をコードするポリヌクレオチドを含み、これからなり、またはこれから本質的になる。
いくつかの実施形態において、IL-12ポリペプチドは、表1に列挙するIL-12アミノ酸配列または表1に列挙するヌクレオチド配列によってコードされるアミノ酸配列と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、このIL-12ポリペプチドは、対応する野生型IL-12ポリペプチドの活性(例えば、IL-12ポリペプチド受容体への結合)の少なくとも10%を有する。
他の実施形態において、本開示のポリヌクレオチドによってコードされるIL-12ポリペプチドは、1つ以上の保存的置換を有する、表1に列挙されるアミノ酸配列を含み、この保存的置換は、IL-12ポリペプチドの受容体へのIL-12ポリペプチドの結合活性に大きく影響せず、すなわち、IL-12ポリペプチドは、置換後にIL-12受容体へ結合する。
いくつかの実施形態において、IL-12ポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、表1に列挙される核酸配列をコードするIL-12ポリペプチドと少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。特定の実施形態において、IL-12ポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号183と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。IL-12ポリペプチドオープンリーディングフレーム(ORF)をコードするヌクレオチド配列(すなわち、mRNA)が、例えば、5’末端キャップ、5’UTR(例えば、配列番号27または配列番号44)、3’UTR(例えば、配列番号119または配列番号120)、及び/またはポリ-A尾部をさらに含む、より大きなコンストラクト内の1つの要素であり得ることは理解されるべきである。
IL-36-ガンマポリペプチドをコードするポリヌクレオチド
いくつかの態様において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチドは、IL-36ポリペプチドを含む第2をコードするポリヌクレオチドと組み合わせることができる。
IL-36-ガンマは、サイトカインのインターロイキン1ファミリーのメンバーである。サイトカインのインターロイキン1ファミリーの他のメンバーと同様に、IL-36-ガンマは、完全な生物活性のためにN末端の開裂を必要とする。IL-36-ガンマは、シグナル配列を有さず、それゆえ、小胞体のゴルジ経路を通じて分泌されることはない。Gresnigt and van de Veerdonk(2013)Seminars in Immunology 25:458-465)を参照されたい。IL-36-ガンマが例えば、免疫細胞、他の上皮細胞、及び線維芽細胞に対して作用するために、どのようにして細胞から放出されるのかについては不明である(Gabay et al.(2015)Journal of Leukocyte Biology 97:645-652)。本発明の例示的な態様において、IL-36、例えば、IL-36-ガンマをコードするポリヌクレオチドは、異種性シグナルペプチドをコードする配列を含む。理論に縛られることなく、このような「操作された」シグナルペプチド-インターロイキンキメラタンパク質をコードするポリヌクレオチドは、in vivoで、インフラマソームの活性化の非存在下で発現した場合、活性のあるタンパク質の生成を準備すると考えられている。
1つの実施形態において、異種性シグナルペプチドは、免疫グロブリン重鎖または軽鎖から誘導される。例示的な実施形態において、異種性シグナルペプチドは、免疫グロブリン軽鎖から、例えば、当該軽鎖の可変領域から誘導される。例示的な実施形態において、異種性シグナルペプチドは、ヒト免疫グロブリンカッパ軽鎖可変領域hIGVK4から誘導される。例示的な態様において、本発明のポリヌクレオチドは、IL-36-ガンマポリペプチドをコードする配列へ作動可能に連結された異種性シグナルペプチドをコードする。
一つの特定の態様において、IL-36-ガンマポリペプチドは、表1のIL-36-ガンマポリペプチドを含み、これからなり、またはこれから本質的になる。一つの特定の態様において、IL-36-ガンマポリペプチドをコードするポリヌクレオチドは、表1のIL-36-ガンマをコードするポリヌクレオチドを含み、これからなり、またはこれから本質的になる。
いくつかの実施形態において、IL-36-ガンマポリペプチドは、表1に列挙するIL-36-ガンマアミノ酸配列または表1に列挙するヌクレオチド配列によってコードされるアミノ酸配列と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、このIL-36-ガンマポリペプチドは、対応する野生型IL-36-ガンマポリペプチドの活性(例えば、IL-36-ガンマポリペプチド受容体への結合)の少なくとも10%を有する。特定の実施形態において、IL-36-ガンマポリペプチドは、配列番号16と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、対応する野生型IL-36-ガンマポリペプチドの活性(例えば、IL-36-ガンマポリペプチド受容体への結合)の少なくとも10%を有する。別の特定の実施形態において、IL-36-ガンマポリペプチドは、本質的に配列番号16からなり、対応する野生型IL-36-ガンマポリペプチドの活性(例えば、IL-36-ガンマポリペプチド受容体への結合)の少なくとも10%を有する。
他の実施形態において、本開示のポリヌクレオチドによってコードされるIL-36-ガンマポリペプチドは、表1に列挙されるアミノ酸配列、または1つ以上の保存的置換を有する配列番号16に示されるアミノ酸配列を含み、この保存的置換は、IL-36-ガンマポリペプチドの受容体へのIL-36-ガンマポリペプチドの結合活性に大きく影響せず、すなわち、IL-36-ガンマポリペプチドは、置換後にIL-36-ガンマ受容体へ結合する。
いくつかの実施形態において、IL-36-ガンマポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、表1に列挙する核酸配列をコードするIL-36-ガンマポリペプチドと少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。特定の実施形態において、IL-36-ガンマポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号17、配列番号94、配列番号143または配列番号144と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。別の特定の実施形態において、IL-36-ガンマポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号17、配列番号94、配列番号143または配列番号144から本質的になる。IL-23ポリペプチドオープンリーディングフレーム(ORF)をコードするヌクレオチド配列(すなわち、mRNA、例えば、配列番号17、配列番号94、または配列番号143)が、例えば、5’末端キャップ、5’UTR(例えば、配列番号27または配列番号44)、3’UTR(例えば、配列番号119または配列番号120)、及び/またはポリ-A尾部をさらに含む、より大きなコンストラクト内の1つの要素であり得ることは理解されるべきである。
IL-18ポリペプチドをコードするポリヌクレオチド
いくつかの態様において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチドは、第2のタンパク質をコードする第2のポリヌクレオチドと組み合わせることができ、この第2のタンパク質は、IL-18ポリペプチドを含む。
インターフェロンガンマ誘導因子(IGIF)及びIFN-γ誘導因子としても公知のIL-18は、サイトカインのインターロイキン1ファミリーのメンバーである。IL-18は、2つの公知のアイソフォーム、アイソフォーム1及びアイソフォーム2を有する。アイソフォーム2は、残基27~30がない点でアイソフォーム1とは異なる。サイトカインのインターロイキン1ファミリーの他のメンバーと同様に、IL-18は、完全な生物活性のためにN末端の開裂を必要とする(Dinarello et al.(2013)Frontiers in Immunology 4:289)。IL-18は、シグナル配列を有さず、それゆえ、小胞体のゴルジ経路を通じて分泌されることはない。Gresnigt and van de Veerdonk(2013)Seminars in Immunology 25:458-465)を参照されたい。
IL-18は、シグナル伝達カスケードを活性化させるNFκB及びMAPKを誘導するためにIL-18α及びIL-18β共受容体を通じてシグナル伝達する炎症性アゴニストである(Dinarello et al.(2013)。IL-23の場合と同様に、抗がん療法のためのIL-18の有望な使用に関して矛盾した報告がある。Ma et al.(2016)Clin.Cancer Res.22:2969-2680は、IL-18を用いた併用処置が、抗PD-L1及び/または抗CTLA-4によって誘発される抗腫瘍活性を亢進することを教示している。しかしながら、Fabbi et al.(2015)J.Leukoc.Biol.97:665-675は、IL-18ががんにおいて異なる役割を担っている可能性があり、いくつかの症例では抗がん活性を、他の症例では腫瘍促進活性を有することを教示している。Fabbiは、前臨床研究及びいくつかの臨床試験でIL-18が抗腫瘍活性を有することを示唆しているが、他の研究は、IL-18が異なる腫瘍モデルにおいて浸潤促進性活性、血管新生促進性活性、及び免疫調節活性を発揮する可能性があることを示していると示している。例えば、Term et al.(2011)Cancer Res.71:5393-9は、IL-18ががんにおける免疫抑制サイトカインであり、腫瘍細胞によって産生されるIL-18がPD-1依存的な様式でNK制御型転移の発症を促進することを教示している。Kang et al.(2009)Carcinogenesis 30:1987-86は、IL-18が胃癌の転移及び免疫エスケープを増大させることを教示している。
本発明の例示的な態様において、IL-18をコードするポリヌクレオチドは、異種性シグナルペプチドをコードする配列を含む。理論に縛られることなく、このような「操作された」シグナルペプチド-インターロイキンキメラタンパク質をコードするポリヌクレオチドは、in vivoで、インフラマソームの活性化の非存在下で発現した場合、活性のあるタンパク質の生成を準備すると考えられている。
1つの実施形態において、異種性シグナルペプチドは、免疫グロブリン重鎖または軽鎖から誘導される。例示的な実施形態において、異種性シグナルペプチドは、免疫グロブリン軽鎖から、例えば、当該軽鎖の可変領域から誘導される。
例示的な実施形態において、異種性シグナルペプチドは、ヒト免疫グロブリンカッパ軽鎖可変領域hIGVK4から誘導される。例示的な態様において、本発明のポリヌクレオチドは、IL-18ポリペプチドをコードする配列へ作動可能に連結された異種性シグナルペプチドをコードする。
一つの特定の態様において、IL-18ポリペプチドは、表1のIL-18ポリペプチドを含み、これからなり、またはこれから本質的になる。一つの特定の態様において、IL-18ポリペプチドをコードするポリヌクレオチドは、表1のIL-18をコードするポリヌクレオチドを含み、これからなり、またはこれから本質的になる。
いくつかの実施形態において、IL-18ポリペプチドは、表1に列挙するIL-18アミノ酸配列または表1に列挙するヌクレオチド配列によってコードされるアミノ酸配列と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、このIL-18ポリペプチドは、対応する野生型IL-18ポリペプチドの活性(例えば、IL-18ポリペプチド受容体への結合)の少なくとも10%を有する。特定の実施形態において、IL-18ポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号148、配列番号155、配列番号156、配列番号157、配列番号158、配列番号159、配列番号160、配列番号161または配列番号162と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。別の特定の実施形態において、IL18ポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号148、配列番号155、配列番号156、配列番号157、配列番号158、配列番号159、配列番号160、配列番号161または配列番号162から本質的になる。IL-18ポリペプチドオープンリーディングフレーム(ORF)をコードするヌクレオチド配列(すなわち、mRNA、例えば、配列番号148、配列番号155、配列番号156、配列番号157、配列番号158、配列番号159、配列番号160、配列番号161または配列番号162)が、例えば、5’末端キャップ、5’UTR(例えば、配列番号27または配列番号44)、3’UTR(例えば、配列番号119または配列番号120)、及び/またはポリ-A尾部をさらに含む、より大きなコンストラクト内の1つの要素であり得ることは理解されるべきである。
OX40Lポリペプチドをコードするポリヌクレオチド
いくつかの態様において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチドは、第3のタンパク質をコードする第3のポリヌクレオチドと組み合わせることができ、この第3のタンパク質は、OX40Lポリペプチドを含む。他の態様において、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチドは、第3のタンパク質をコードする第3のポリヌクレオチドと組み合わせることができ、この第3のタンパク質はOX40Lポリペプチドを含む。ある特定の態様において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、及びIL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチドは、第3のタンパク質をコードする第3のポリヌクレオチドと組み合わせることができ、この第3のタンパク質はOX40Lポリペプチドを含む。
ヒトOX40Lは、Tanaka et al.によってヒトT細胞白血病ウイルスI型(HTLV-I)に感染したヒトリンパ球の表面上で最初に特定された(Tanaka
et al.,International Journal of Cancer(1985),36(5):549-55)。OX40Lとは、OX40(CD134)についてのリガンドである。OX40Lは、CD252(分化クラスター252)、腫瘍壊死因子(リガンド)スーパーファミリーのメンバー4、tax転写活性化型糖タンパク質1(TXGP1)、またはgp34とも呼ばれてきた。ヒトOX40Lは、183アミノ酸長であり、以下の3つのドメインを含有する:アミノ酸1~23の細胞質ドメイン、アミノ酸24~50の膜貫通ドメイン、及びアミノ酸51~183の細胞外ドメイン。
いくつかの実施形態において、第3のポリヌクレオチドは、哺乳類OX40LポリペプチドをコードするmRNAを含む。いくつかの実施形態において、哺乳類OX40Lポリペプチドは、マウスOX40Lポリペプチドである。いくつかの実施形態において、哺乳類OX40Lポリペプチドは、ヒトOX40Lポリペプチドである。いくつかの実施形態において、OX40Lポリペプチドは、表1Aに示すアミノ酸配列を含む。
いくつかの実施形態において、本開示の各ポリヌクレオチドは、mRNA、すなわち、IL-23ポリペプチドをコードするmRNA、IL-36-をコードするmRNA、及びOX40LポリペプチドをコードするmRNAを含む。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAは、哺乳類IL-23ポリペプチドをコードする。いくつかの実施形態において、IL-36-ガンマポリペプチドをコードするmRNAは、哺乳類IL-36-ガンマポリペプチドをコードする。いくつかの実施形態において、OX40LポリペプチドをコードするmRNAは、哺乳類OX40Lポリペプチドをコードする。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAは、マウスIL-23ポリペプチドをコードする。いくつかの実施形態において、IL-36-ガンマポリペプチドをコードするmRNAは、マウスIL-36-ガンマポリペプチドをコードする。いくつかの実施形態において、OX40LポリペプチドをコードするmRNAは、マウスOX40Lポリペプチドをコードする。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAは、ヒトIL-23ポリペプチドをコードする。いくつかの実施形態において、IL-36-ガンマポリペプチドをコードするmRNAは、ヒトIL-36-ガンマポリペプチドをコードする。いくつかの実施形態において、OX40LポリペプチドをコードするmRNAは、ヒトOX40Lポリペプチドをコードする。
いくつかの実施形態において、IL-23ポリペプチドは、表1に示されるヒトアミノ酸配列を含む。いくつかの実施形態において、IL-36-ガンマポリペプチドは、表1に示されるヒトアミノ酸配列を含む。他の実施形態において、OX40Lポリペプチドは、表1Aに示されるヒトアミノ酸配列を含む。
いくつかの実施形態において、OX40Lポリペプチドは、表1Aに列挙するアミノ酸配列または表1Aに列挙するヌクレオチド配列によってコードされるアミノ酸配列と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、このアミノ酸配列は、OX40受容体へ結合することができる。特定の実施形態において、OX40Lポリペプチドは、配列番号21と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含み、OX40受容体へ結合することができる。別の特定の実施形態において、OX40Lポリペプチドは、配列番号21から本質的になり、OX40受容体へ結合することができる。
ある特定の実施形態において、本開示のポリヌクレオチドによってコードされるOX40Lポリペプチドは、表1Aに列挙するアミノ酸配列、または1つ以上の保存的置換を有する配列番号21に示すアミノ酸配列を含み、この保存的置換は、OX40Lポリペプチドの受容体へのOX40Lポリペプチドの結合活性に大きく影響せず、すなわち、OX40Lポリペプチドは、置換後にOX40受容体へ結合する。
他の実施形態において、OX40Lポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、表1Aに列挙する核酸配列と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。特定の実施形態において、OX40Lポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号116、配列番号145または配列番号146と少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%同一の配列を含む。別の特定の実施形態において、OX40Lポリペプチドをコードするヌクレオチド配列(すなわち、mRNA)は、配列番号116、配列番号145または配列番号146から本質的になる。OX40Lポリペプチドオープンリーディングフレーム(ORF)をコードするヌクレオチド配列(すなわち、mRNA、例えば、配列番号116または配列番号145)が、例えば、5’末端キャップ、5’UTR(例えば、配列番号27または配列番号44)、3’UTR(例えば、配列番号119または配列番号120)、及び/またはポリ-A尾部をさらに含む、より大きなコンストラクト内の1つの要素であり得ることは理解されるべきである。
いくつかの実施形態において、本方法及び組成物に有用なポリヌクレオチド(例えば、mRNA)は、OX40Lの細胞外ドメインをコードするオープンリーディングフレームを含む。他の実施形態において、ポリヌクレオチド(例えば、mRNA)は、OX40Lの細胞質ドメインをコードするオープンリーディングフレームを含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNA)は、OX40Lの膜貫通ドメインをコードするオープンリーディングフレームを含む。ある特定の実施形態において、ポリヌクレオチド(例えば、mRNA)は、OX40Lの細胞外ドメイン及びOX40Lの膜貫通をコードするオープンリーディングフレームを含む。他の実施形態において、ポリヌクレオチド(例えば、mRNA)は、OX40Lの細胞外ドメイン及びOX40Lの細胞質ドメインをコードするオープンリーディングを含む。さらに他の実施形態において、このポリヌクレオチド(例えば、mRNA)は、OX40Lの細胞外ドメイン、OX40Lの膜貫通、及びOX40Lの細胞質ドメインをコードするオープンリーディングを含む。
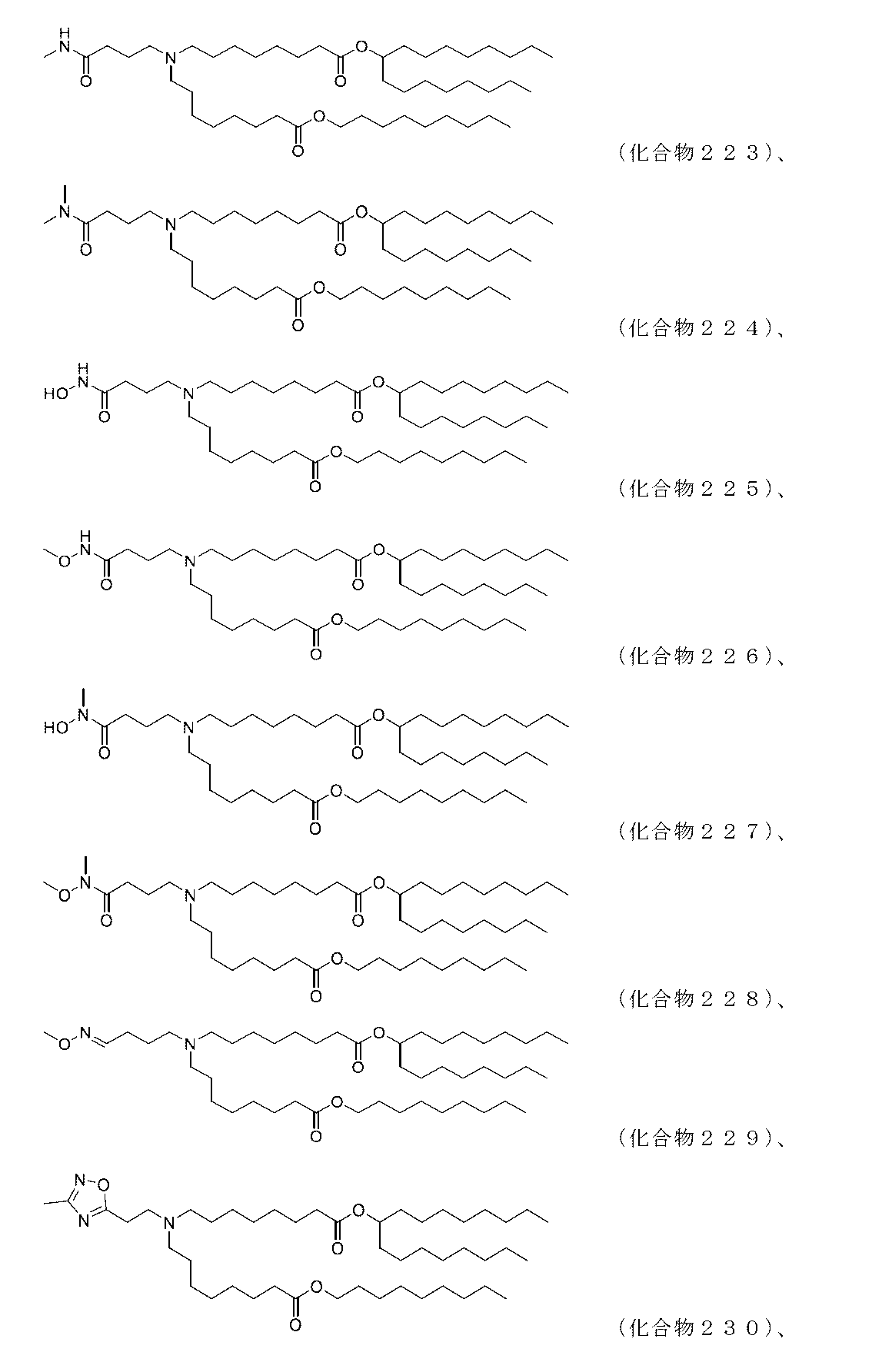
表1または表1Aは、例えば、IL-23、IL-36-ガンマ、及びOX40Lについての前駆体配列及び成熟配列、ならびにIL-23またはIL-36-ガンマを含むコンストラクトを表す。本開示において、IL-23ポリヌクレオチドまたはIL-23ポリペプチドは、「前駆体」形態及び「成熟」形態の両方を包含する。さらに、IL-23、IL-36-ガンマ、及びOX40Lをコードするポリヌクレオチドを含み、成分、このような3’UTR及び5’UTRをさらに含むコンストラクトは、IL-23、IL-36-ガンマ、及びOX40Lをコードするポリヌクレオチドとみなされるであろう。当業者は、表1または表1Aに疑うことなく開示したナイーブのシグナル配列及びプロペプチド配列(成熟した対応する形態についての前駆体に存在する配列及び成熟した対応する形態に存在しない配列)ならびに表1または表1Aに開示される非ナイーブのシグナルペプチド(IgKV4シグナルペプチド)に加えて、他のシグナル配列を使用することができることを理解するであろう。したがって、表1によるIL-23、IL-36-ガンマ、及びOX40Lのポリペプチドまたはポリヌクレオチドに対する参照は、当該技術分野において既知である代替的なシグナルペプチド(またはコード配列)が、当該IL-23、IL-36-ガンマ、及びOX40Lのポリペプチド(またはポリヌクレオチド)に結合したバリアントを包含する。本出願を通じて表1に開示される配列に対する参照が、等価に適用可能であり、当該技術分野において既知である当該配列の相同分子種及び機能的バリアント(例えば、多形バリアント)ならびにアイソフォームを包含することも理解される。
本明細書に提供するRNA配列に基づいて、ならびに特に表1及び表1Aにおいて、当業者は、対応するDNA配列(例えば、ウラシルからチミンへの転換)を理解するであろう。同様に、提供されるDNA配列に基づいて、当業者は、対応するRNA配列(例えば、チミンからウラシルへの転換)を理解するであろう。
いくつかの実施形態において、第1のポリヌクレオチドは、IL-23ポリペプチドをコードする、コドン最適化配列を含む、mRNA(例えば、配列番号141)を含む。いくつかの実施形態において、第2のポリヌクレオチドは、IL-36-ガンマポリペプチドをコードする、コドン最適化配列を含む、mRNA(例えば、配列番号143)を含む。他の実施形態において、第3のポリヌクレオチドは、OX40Lポリペプチドをコードする、コドン最適化された配列を含む、mRNA(例えば、配列番号145)を含む。
いくつかの実施形態において、第1のポリヌクレオチドは、全長であるIL-23ポリペプチドをコードするmRNAを含む。いくつかの実施形態において、第1のポリヌクレオチドは、野生型IL-23ポリペプチドのN末端またはC末端で少なくとも1個、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも14個、または少なくとも15個のアミノ酸を欠失しているヒトIL-23ポリペプチドをコードするmRNAを含む。
いくつかの実施形態において、第2のポリヌクレオチドは、全長であるIL-36-ガンマポリペプチドをコードするmRNAを含む。いくつかの実施形態において、第2のポリヌクレオチドは、野生型IL-36-ガンマポリペプチドのN末端またはC末端で少なくとも1個、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも14個、または少なくとも15個のアミノ酸を欠失している、ヒトIL-36-ガンマポリペプチドをコードするmRNAを含む。
いくつかの実施形態において、ポリヌクレオチドは、全長であるOX40LポリペプチドをコードするmRNAを含む。いくつかの実施形態において、ポリヌクレオチドは、183アミノ酸長であるヒトOX40LポリペプチドをコードするmRNAを含む。ある特定の実施形態において、OX40Lポリペプチドは、OX40LポリペプチドのN末端またはC末端で少なくとも1個、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも14個、または少なくとも15個のアミノ酸を欠失していることができる。
いくつかの実施形態において、本開示のポリヌクレオチド(例えば、mRNA)は、「構造上修飾され」または「化学的に修飾され」ている。本明細書で使用する場合、「構造の」修飾は、2つ以上の結合したヌクレオシドが、mRNA自体の著しい化学修飾を有さないポリヌクレオチドにおいて、挿入、欠失、複製、逆位または無作為化しているものである。化学結合は、構造の修飾をもたらすために必ず破壊されて再形成されることになっているので、構造の修飾は、化学的性質についてのものであり、それゆえ、化学修飾である。しかしながら、構造の修飾は結果として、異なるヌクレオチド配列をもたらすことになっている。例えば、「AUCG」というmRNAは、「AU-5meC-G」へと化学的に修飾することができる。同じmRNAは、「AUCG」から「AUCCCG」へと構造上修飾することができる。ここで、「CC」というジヌクレオチドが挿入され、結果として、ポリヌクレオチドへと構造上修飾を生じる。
いくつかの実施形態において、本開示のポリヌクレオチド(例えば、mRNA)は、同じヌクレオシドタイプのすべてもしくはいかなるものも均一な化学的修飾を有することができ、または同じヌクレオシドタイプのすべてもしくはいかなるものにおいても同じ出発修飾の単なる下向き滴定によって生じた修飾の集団を有することができ、または同じヌクレオシドタイプだが、ウリジンがすべてウリジン類似体、例えば、シュードウリジンもしくは5-メトキシウリジンによって置き換えられる場合などの無作為な組込みを有するいかなるものもすべて、化学的修飾の測定された百分率を有することができる。別の実施形態において、ポリヌクレオチド(例えば、IL-23ポリペプチドをコードするmRNA、IL-36-ガンマポリペプチドをコードするmRNA、及び/またはOX40LポリペプチドをコードするmRNA)は、ポリヌクレオチド全体(例えば、mRNA)(ウリジンすべて及びシトシンすべてなどは、同じ方法で修飾される)のいたるところで同じヌクレオシドタイプのうちの2つ、3つ、または4つの均一な化学修飾を有することができる。本開示のポリヌクレオチド(例えば、IL-23ポリペプチドをコードするmRNA、IL-36-ガンマポリペプチドをコードするmRNA及び/またはOX40LポリペプチドをコードするmRNA)が、化学的に及び/または構造上修飾される場合、そのmRNAは、「修飾mRNA」ということができる。化学修飾の非限定的な例は、本明細書の他の箇所でする。
いくつかの実施形態において、第1のポリヌクレオチド及び/または第2のポリヌクレオチドは、少なくとも1つの化学的に修飾されたヌクレオシドを含む。いくつかの実施形態において、この少なくとも1つの化学的に修飾されたヌクレオシドは、本明細書に開示される化学的に修飾されたヌクレオシドのいずれか及びこれらの組み合わせからなる群より選択される。
いくつかの実施形態において、この少なくとも1つの化学的に修飾されたヌクレオシドは、シュードウリジン、N1-メチルシュードウリジン、5-メチルシトシン、5-メトキシウリジン、及びこれらの組み合わせからなる群より選択される。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド及び/または第3のポリヌクレオチドにおけるヌクレオシドは、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%化学的に修飾される。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドにおける化学的に修飾されたヌクレオシドは、ウリジン、アデニン、シトシン、グアニン、及びそれらのいずれかの組合せからなる群より選択される。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドにおけるウリジンヌクレオシドは、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%化学的に修飾される。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドにおけるアデノシンヌクレオシドは、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%化学的に修飾される。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドにおけるシチジンヌクレオシドは、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%化学的に修飾される。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドにおけるグアノシンヌクレオシドは、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%化学的に修飾される。
いくつかの実施形態において、第1のタンパク質をコードするmRNA、第2のタンパク質をコードするmRNA、及び第3のタンパク質をコードするmRNAは各々、オープンリーディングフレームを含む。
いくつかの実施形態において、IL-23ポリペプチドは、表1に列挙するIL-23ポリペプチド配列に対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%のアミノ酸配列を含むIL-12p40サブユニットを含み、このアミノ酸配列は、IL-23p19サブユニットへ結合して、IL-23活性を有するIL-23を形成することができる。
いくつかの実施形態において、IL-12p40サブユニットは、表1に列挙するIL-23ポリペプチドをコードする配列に対して少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一の核酸配列によってコードされる。
いくつかの実施形態において、IL-23ポリペプチドは、表1に列挙するIL-23ポリペプチド配列に対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のアミノ酸配列を含むIL-23p19サブユニットを含み、このアミノ酸配列は、IL-12p40サブユニットへ結合して、IL-23活性を有するIL-23を形成することができる。
いくつかの実施形態において、IL-23p19サブユニットは、表1に列挙するIL-23ポリペプチドコード配列に対して少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一の核酸配列によってコードされる。
いくつかの実施形態において、IL-23タンパク質のIL-12p40サブユニット及びIL-23p19サブユニットは、一本鎖のポリプチド鎖または2つの異なる鎖上にある。いくつかの実施形態において、IL-12p40サブユニット及びIL-23p19サブユニットは、リンカーによって融合している。いくつかの実施形態において、IL-12p40サブユニットは、シグナルペプチドを含む。いくつかの実施形態において、IL-23p19サブユニットは、シグナルペプチドを含む。いくつかの実施形態において、IL-12p40サブユニットは、成熟型IL-12p40である(すなわち、シグナルペプチドを含んでいない)。いくつかの実施形態において、IL-23p19サブユニットは、成熟型IL-23p19である(すなわち、シグナルペプチドを含んでいない)。いくつかの実施形態において、IL-12p40サブユニットは、非天然のシグナルペプチドを含む。いくつかの態様において、IL-23p19サブユニットは、非ナイーブのシグナルペプチドを含む。
いくつかの実施形態において、IL-23は、以下の代替式のいずれかによるIL-12p40サブユニット及びIL-23p19サブユニットを含む融合ポリペプチドである:
[シグナルペプチド1]-[IL-12p40]-[リンカー]-[IL-23p19]
[シグナルペプチド2]-[IL-23p19]-[リンカー]-[IL-12p40]
式中、[シグナルペプチド1]は、IL-12p40シグナルペプチドまたは非ナイーブのシグナルペプチドであり得、[シグナルぺプチド2]は、IL-23p19シグナルペプチドまたは非ナイーブのシグナルペプチドであり得、[IL-12p40]は成熟型IL-12p40であり、[IL-23p19]は成熟型IL-23p29であり、かつ[リンカー]はペプチドリンカーである。
いくつかの実施形態において、ペプチドリンカーは、(GS)リンカーを含む。いくつかの実施形態において、(GS)リンカーは、(GnS)m配列を含み、式中nは1~20であり、かつmは1~100である。いくつかの実施形態において、(GS)リンカーは、配列GGS、GGGS、GGGGS(配列番号136)、GGGGGS(配列番号137)、GGGGGGS(配列番号138)、GGGGGGGS(配列番号139)、GGSGGGGSGG(配列番号183)、GGSGGGGG(配列番号184)、またはGSGSGSGS(配列番号185)を含む。いくつかの実施形態において、リンカーは、(EAAAK)q(配列番号163)を含むことができ、式中qは1~5の整数である。1つの実施形態において、リンカーは、(EAAAK)3、すなわち、EAAAKEAAAKEAAAK(配列番号164)を含むことができる。いくつかの実施形態において、リンカーは、Gly富化リンカーであり得、例えば、(Gly)pを含み、pは、1~40の整数である。いくつかの実施形態において、Glyの豊富なリンカーは、GGGGG(配列番号165)、GGGGGG(配列番号166)、GGGGGGG(配列番号167)またはGGGGGGGG(配列番号168)を含み得る。さらなる例示的なリンカーとしては、GGGGSLVPRGSGGGGS(配列番号169)、GSGSGS(配列番号170)、GGGGSLVPRGSGGGG(配列番号171)、GGSGGHMGSGG(配列番号172)、GGSGGSGGSGG(配列番号173)、GGSGG(配列番号174)、GSGSGSGS(配列番号175)、GGGSEGGGSEGGGSEGGG(配列番号176)、AAGAATAA(配列番号177)、GGSSG(配列番号178)、GSGGGTGGGSG(配列番号179)、GSGSGSGSGGSG(配列番号180)、GSGGSGSGGSGGSG(配列番号181)、及びGSGGSGGSGGSGGS(配列番号182)が挙げられるが、これらに限定されない。本明細書に記載されるリンカーは、本明細書に記載するポリヌクレオチドのいずれかにおいて使用することができる。
いくつかの実施形態において、上述の式によるIL-23ポリペプチド(すなわち、IL-12p40サブユニット及びIL-23p19サブユニットを含むIL-23ポリペプチド)は、表1に列挙するIL-23ポリペプチド配列に対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のアミノ酸配列を含み、このアミノ酸配列は、少なくとも1つのIL-23活性を有すること(例えば、IL-23受容体へ結合すること)ができる。
いくつかの実施形態において、上述の式によるIL-23ポリペプチド(すなわち、IL-12p40サブユニット及びIL-23p19サブユニットを含むIL-23ポリペプチド)は、表1に列挙する配列に対して少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一の核酸配列によってコードされる。
いくつかの実施形態において、IL-36-ガンマポリペプチドは、表1に列挙するIL-36-ガンマポリペプチド配列に対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のアミノ酸配列を含み、このポリペプチドは、IL-36-ガンマ活性を有すること(例えば、IL-36受容体へ結合すること)ができる。
いくつかの実施形態において、IL-36-ガンマポリペプチドは、表1に列挙するIL-36-ガンマポリペプチドコード配列に対して少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一の核酸配列によってコードされる。
いくつかの実施形態において、IL-18ポリペプチドは、表1に列挙するIL-18ポリペプチド配列に対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のアミノ酸配列を含み、このポリペプチドは、IL-18活性を有すること(例えば、IL-18受容体へ結合すること)ができる。
いくつかの実施形態において、IL-18ポリペプチドは、表1に列挙するIL-18ポリペプチドコード配列に対して少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一の核酸配列によってコードされる。
他の実施形態において、本開示の組成物は、第3のタンパク質をコードする第3のポリヌクレオチドをさらに含む。1つの実施形態において、第3のポリヌクレオチドは、第3のタンパク質をコードするmRNAを含む。別の実施形態において、第3のポリヌクレオチドは、OX40Lポリペプチドをコードする。
いくつかの実施形態において、OX40Lポリペプチドは、表1Aに列挙するOX40Lポリペプチド配列に対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のアミノ酸配列を含み、このポリペプチドは、OX40L活性を有する(例えば、OX40L受容体へ結合すること)ができる。
いくつかの実施形態において、OX40Lポリペプチドは、表1Aに列挙するOX40Lポリペプチドコード配列に対して少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一の核酸配列によってコードされる。
ある特定の実施形態において、この組成物は、第4のタンパク質をコードする第4のポリヌクレオチドをさらに含む。いくつかの実施形態において、第4のポリヌクレオチドは、第4のタンパク質をコードするmRNAを含む。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、miRNA結合部位を含む核酸配列をさらに含む。
いくつかの実施形態において、miRNA結合部位は、miR-122へ結合する。いくつかの実施形態において、miRNA結合部位は、miR-122-3pへまたはmiR-122-5pへ結合する。いくつかの実施形態において、miRNA結合部位は、配列番号24に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または100%同一のヌクレオチド配列を含み、miRNA結合部位は、miR-122(miR-122-3p、22nt-aacgccauuaucacacuaaaua)へ結合する。いくつかの実施形態において、miRNA結合部位は、配列番号26に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または100%同一のヌクレオチド配列を含み、miRNA結合部位は、miR-122(miR-122-5p、22nt-uggaguguga caaugguguuug)へ結合する。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、2つの異なるmiRNA結合部位または同じmiRNA結合部位を含む。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、または少なくとも10個のmiRNA結合部位を含む。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、5’UTRをさらに含む。いくつかの実施形態において、5’UTRは、表3に列挙する5’UTR配列に対して少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または100%同一の核酸配列を含む。別の特定の実施形態において、5’UTRは、配列番号27または配列番号44に対して少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または100%同一の核酸配列を含む。別の特定の実施形態において、5’UTRは、配列番号27または配列番号44の核酸配列から本質的になる。5’UTRが、例えば、5’末端キャップ、OFR(例えば、配列番号17、19、71、94、及び116)、3’UTR(例えば、配列番号119または120)、及び/またはポリ-A尾部をさらに含む、より大きなコンストラクト内の1つの要素であり得ることは理解されるべきである。いくつかの実施形態において、1つ以上のmiRNA結合部位は、1つ以上の起こり得る挿入部位で5’UTR内に配置することができる。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、3’UTRを含む。いくつかの実施形態において、3’UTRは、表4Aまたは表4Bに列挙する3’UTR配列に対して少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または100%同一の核酸配列を含む。特定の実施形態において、3’UTRは、配列番号119または配列番号120に対して少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または100%同一の核酸配列を含む。別の特定の実施形態において、3’UTRは、配列番号119または配列番号120の核酸配列から本質的になる。3’UTRが、例えば、5’末端キャップ、5’UTR(例えば、配列番号27または配列番号44)、OFR(例えば、配列番号17、19、71、94、及び116)、及び/またはポリ-A尾部をさらに含む、より大きなコンストラクト内の1つの要素であり得ることは理解されるべきである。
いくつかの実施形態において、miRNA結合部位(例えば、miR-122結合部位)は、3’UTR内に挿入される。いくつかの実施形態において、miRNA結合部位(例えば、miR-122結合部位)は、停止コドンとmiRNA結合部位(複数可)の間に3’UTR塩基がある場合の本発明のポリリボヌクレオチド、例えば、mRNAの内部のコード領域の停止コドンの下流にある3’UTR内に挿入される。いくつかの実施形態において、コンストラクトの中に停止コドンの複数のコピーがある場合、miRNA結合部位(例えば、miR-122結合部位)は、最終的な停止コドンの下流に挿入される。いくつかの実施形態において、miRNA結合部位(例えば、miR-122結合部位)は、停止コドン(またはコンストラクトの中に複数の停止コドンがある場合は最終の停止コドン)の約10、約20、約30、約40、約50、約60、約70、約80、約90、または約100塩基下流に挿入される。特定の実施形態において、miRNA結合部位(例えば、miR-122結合部位)は、停止コドンとmiR結合部位(複数可)の間に79個の3’UTR塩基があるよう、停止コドン(またはコンストラクトの中に複数の停止コドンがある場合は最終の停止コドン)の下流に挿入される。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、miRNA結合部位へ融合したスペーサー配列をさらに含む。いくつかの実施形態において、スペーサー配列は、少なくとも約10個のヌクレオチド、少なくとも約15個のヌクレオチド、少なくとも約20個のヌクレオチド、少なくとも約25個のヌクレオチド、少なくとも約30個のヌクレオチド、少なくとも約35個のヌクレオチド、少なくとも約40個のヌクレオチド、少なくとも約45個のヌクレオチド、少なくとも約50個のヌクレオチド、少なくとも約55個のヌクレオチド、少なくとも約60個のヌクレオチド、少なくとも約65個のヌクレオチド、少なくとも約70個のヌクレオチド、少なくとも約75個のヌクレオチド、少なくとも約80個のヌクレオチド、少なくとも約85個のヌクレオチド、少なくとも約90個のヌクレオチド、少なくとも約95個のヌクレオチド、または少なくとも約100個のヌクレオチドを含む。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、5’末端キャップをさらに含む。いくつかの実施形態において、5’末端キャップは、Cap0、Cap1、ARCA、イノシン、N1-メチル-グアノシン、2’フルオロ-グアノシン、7-デアザ-グアノシン、8-オキソ-グアノシン、2-アミノ-グアノシン、LNA-グアノシン、2-アジドグアノシン、Cap2、Cap4、5’メチルGキャップまたはこれらの類似体である。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、3’ポリ-A尾部を含む。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、コドン最適化されている。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、in vitroで転写(IVT)される。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、キメラである。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、第3のポリヌクレオチド、及び/または第4のポリヌクレオチドは、環状である。
いくつかの実施形態において、IL-23ポリペプチドIL-12p40サブユニット、IL-23ポリペプチドIL-23p19サブユニット、IL-36-ガンマポリペプチド、及び/またはOX40Lポリペプチドは、異種性ポリペプチドへ融合する。
いくつかの実施形態において、第1のポリヌクレオチド(例えば、mRNA)、第2のポリヌクレオチド(例えば、mRNA)、及び第3のポリヌクレオチド(例えば、mRNA)は、5’末端キャップ、5’UTR、オープンリーディングフレーム(ORF)、3’UTR、及びポリ-A尾部を含み、これらから本質的になり、またはこれらからなる。1つの実施形態において、第1のポリヌクレオチド(例えば、mRNA)は、配列番号27または44、配列番号19、71または141、及び配列番号119または120のうちの核酸配列を含み、これから本質的になり、またはこれからなる。別の実施形態において、第2のポリヌクレオチド(例えば、mRNA)は、配列番号27または44、配列番号17、94または143、及び配列番号119または120のうちの核酸配列を含み、これらから本質的になり、またはこれらからなる。さらに別の実施形態において、第3のポリヌクレオチド(例えば、mRNA)は、配列番号27または44、配列番号116または145、及び配列番号119または120のうちの核酸配列を含み、これから本質的になり、またはこれからなる。
特定の実施形態において、第1のポリヌクレオチドは、配列番号142に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または100%同一の核酸配列を含む。別の特定の実施形態において、第1のポリヌクレオチドは、配列番号142の核酸配列から本質的になる。さらに別の特定の実施形態において、第1のポリヌクレオチドは、配列番号142の核酸配列からなる。
特定の実施形態において、第2のポリヌクレオチドは、配列番号144に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または100%同一の核酸配列を含む。別の特定の実施形態において、第2のポリヌクレオチドは、配列番号144の核酸配列から本質的になる。さらに別の特定の実施形態において、第2のポリヌクレオチドは、配列番号144の核酸配列をからなる。
特定の実施形態において、第3のポリヌクレオチドは、配列番号146に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または100%同一の核酸配列を含む。別の特定の実施形態において、第3のポリヌクレオチドは、配列番号146の核酸配列から本質的になる。さらに別の特定の実施形態において、第3のポリヌクレオチドは、配列番号146の核酸配列からなる。
いくつかの実施形態において、第1のポリヌクレオチドは、表1に開示するIL-23コード配列のいずれかに対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のヌクレオチド配列を含む。
いくつかの実施形態において、第2のポリヌクレオチドは、表1に開示するIL-36-ガンマコード配列のいずれかに対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のヌクレオチド配列を含む。
いくつかの実施形態において、第2のポリヌクレオチドは、IL-18をコードする配列に対して少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%同一のヌクレオチド配列を含み、当該配列は、表1に開示するIL-18コード配列を含む。
いくつかの実施形態において、第3のポリヌクレオチドは、表1AのOX40Lコード配列またはOX40L_miR-122コンストラクトに対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも約99%、または100%同一のヌクレオチド配列を含む。
他の実施形態において、本開示のための組成物は、第4のタンパク質または第4のタンパク質をコードする第4のポリヌクレオチドを含む。例えば、第4のポリヌクレオチドは、第4のタンパク質をコードするmRNAを含むことができる。
いくつかの実施形態において、本明細書に開示する組成物は、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を抑制することを必要とする対象において、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を抑制することにおける使用のためにある。いくつかの実施形態において、本明細書に開示する組成物は、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を抑制することを必要とする対象において、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を抑制することにおける使用のためにある。
いくつかの実施形態において、本明細書に開示する組成物をがんを治療するためにそれを必要とする対象に投与し、組成物の投与はがんの症状を治療し、または緩和する。
いくつかの実施形態において、がんは、副腎皮質癌、進行癌、肛門癌、再生不良性貧血、胆管癌、膀胱癌、骨癌、骨転移、脳腫瘍、脳癌、乳癌、小児癌、原発不明癌、キャッスルマン病、子宮頸癌、結腸/直腸癌、子宮内膜癌、食道癌、ユーイングファミリー腫瘍、眼癌、胆嚢癌、消化管カルチノイド腫瘍、消化管間質腫瘍、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎細胞癌、咽頭及び下咽頭癌、急性リンパ性白血病、急性骨髄性白血病、慢性リンパ性白血病、慢性骨髄性白血病、慢性骨髄単球性白血病、肝癌、肝細胞癌(HCC)、非小細胞肺癌、小細胞肺癌、肺カルチノイド腫瘍、皮膚のリンパ腫、悪性中皮腫、多発性骨髄腫、骨髄異形成症候群、鼻腔及び副鼻腔癌、上咽頭癌、神経芽腫、非ホジキンリンパ腫、口腔及び中咽頭癌、骨肉腫、卵巣癌、膵癌、陰茎癌、下垂体腫瘍、前立腺癌、網膜芽細胞腫、横紋筋肉腫、唾液腺癌、成人軟部肉腫、基底細胞・扁平上皮細胞皮膚癌、メラノーマ、小腸癌、胃癌、精巣癌、咽頭癌、胸腺癌、甲状腺癌、子宮肉腫、膣癌、外陰癌、ワルデンシュトレーム・マクログロブリン血症、ウィルムス腫瘍、癌治療起因性二次性癌、ならびにそれらのいずれかの組合せからなる群から選択される。
いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドは、ポンプ、パッチ、薬剤リザーバー、ショートニードル装置、シングルニードル装置、マルチプルニードル装置、マイクロニードル装置、急速注射装置、バリスティックパウダー/粒子送達装置、カテーテル、ルーメン、冷凍子、カニューレ、微小カニューレ、または熱、RFエネルギー、電流を利用する装置、またはそれらのいずれかの組合せを備えた装置による送達のために製剤化される。いくつかの実施形態において、本明細書に開示する組成物の有効量は、約0.10mg/kg~約1000mg/kgである。いくつかの実施形態において、本明細書に開示する組成物は、ヒト対象への投与のために製剤化される。
いくつかの実施形態において、本明細書に開示する組成物及び製剤は、がんの治療における使用のためである。いくつかの実施形態において、開示する組成物及び製剤は、がんの治療のための薬剤の製造に使用される。
本明細書に開示するポリヌクレオチドの組み合わせ(例えば、IL-23ポリペプチドをコードするmRNAを含む第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドをコードするmRNAを含む第2のポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含む第3のポリヌクレオチド)を、開示する特定の形態に制限するようには全く意図していないことを理解すべきである。この点において、本節における特定のポリヌクレオチド及びその個々のコードしたポリペプチドに関連した本開示は、本明細書に開示するIL-23、IL-36-ガンマ、IL-18、及び/またはOX40Lコードポリヌクレオチドと組み合わせることになっている追加のポリヌクレオチド及びこれらの個々のコードしたポリペプチド、例えば、第3、第4、第5などのポリペプチドへ等価に適用可能である。したがって、「第1のポリヌクレオチド」または「第2のポリヌクレオチド」(または個々のコードしたポリペプチド)に関連した開示は、「第3のポリヌクレオチド」及び連続するポリヌクレオチド(またはこれらの個々のコードしたポリペプチド)へ等価に適用可能である。
加えて、第1または第2のポリヌクレオチドによってコードされる特定のタンパク質と関連した具体的な開示、例えば、「第2のポリヌクレオチドが野生型IL-36-ガンマポリペプチドのN末端またはC末端で少なくとも1個、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも14個、または少なくとも15個のアミノ酸を欠失するヒトIL-36-ガンマポリペプチドをコードするmRNAを含む」という開示は、第3の連続したタンパク質へ等価に適用可能であろう。したがって、当業者は、第3のタンパク質が例えばOX40Lである場合、第3のポリヌクレオチドが、本開示の第1のまたは第2のポリペプチドに関して先に開示されたように、野生型OX40LポリペプチドのN末端またはC末端で少なくとも1個、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも14個、または少なくとも15個のアミノ酸を欠失しているヒトOX40LポリペプチドをコードするmRNAを含むことができたことは理解されたであろう。
III.免疫調節ポリペプチドをコードするポリヌクレオチドの併用方法
免疫腫瘍学的方法としても公知の免疫療法は、腫瘍ではなく宿主免疫系を標的にする療法、独自の有害事象特性を有する療法、及び多くのタイプのがんを治癒し得る療法を導入することによって、がんの治療を刷新してきた。本明細書で使用する場合、「免疫療法」という用語は、免疫応答を誘導し、亢進し、または抑制することによる疾患の治療を指す。免疫応答を誘発または増幅するよう設計された免疫療法は、「活性化免疫療法」と呼ばれるのに対し、免疫応答を低減または抑制する免疫療法は、「抑制免疫療法」と呼ばれる。
肺、腎臓、膀胱及び皮膚のがんは、とりわけ、生存または腫瘍応答の点で免疫腫瘍学的方法を用いた治療から実質的な効能を誘導し、最大の利点をおそらく示すのはメラノーマである。免疫療法はしばしば、チェックポイント阻害抗体として公知の生物製剤の刺激的な新たなクラスを用いたチェックポイント阻害剤治療を特徴とする。標的には、例えば、PD-1、PD-L1、及びCTLA-4が含まれる。
PD-1、PD-L1、またはCTLA4を標的とするモノクローナル抗体は、がん細胞に対する免疫応答をブーストすることができ、ある特定のがんを治療する上で大いに有望であることが示されてきた。例えば、ペンブロリズマブ(Keytruda(登録商標))及びニボルマブ(Opdivo(登録商標))はPD-1を標的とし、アテゾリズマブ(Tecentriq(登録商標))はPD-L1を標的とし、イピリムマブ(Yervoy(登録商標))はCTLA-4へ結合してこれを阻害する。
これらの薬物に関する1つの懸念は、これらの薬物が免疫系に体内のいくつかの正常な器官を攻撃させることができ、このことが人によっては重篤なまたは生命の危機に瀕することさえある副作用をもたらす可能性がある点である。このような副作用を低減する1つの方法は、これらのチェックポイント阻害抗体と組み合わせて他の作用剤を投与することであり、これによって、医師が抗体の治療用量を低下させることが理想的に可能である。
それゆえ、本開示は、上述の第II節において開示した組成物のいずれかの投与を含む、がんを治療する(例えば、腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を抑制することを必要とする対象において腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を抑制する)ための方法を提供する。特に、本開示は、がんを治療すること(腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を抑制すること)を必要とする対象へ以下を投与することを含む、がんを治療するための方法を提供する:
(i)IL-23ポリペプチドを含むタンパク質をコードするmRNAを含む少なくとも1つのポリヌクレオチド、
(ii)IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含むタンパク質をコードするmRNAを含む少なくとも1つのポリヌクレオチド、及び/または
(iii)OX40Lポリペプチドを含むタンパク質をコードするmRNAを含む少なくとも1つのポリヌクレオチド。
いくつかの実施形態において、本開示は、腫瘍の大きさを減少もしくは低下させ及び/または腫瘍の成長を阻害することを必要とする対象へ、少なくとも2つのポリヌクレオチドを投与することを含む、当該対象において腫瘍の大きさを減少もしくは低下させ、及び/または腫瘍の成長を阻害する方法であって、この少なくとも2つのポリヌクレオチドがIL-23ポリペプチドをコードする第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドをコードする第2のポリヌクレオチド、及びOX40Lポリペプチドをコードする第3のポリヌクレオチドから選択される方法を提供する。一つの特定の態様において、腫瘍の大きさを減少もしくは低下させ、及び/または腫瘍の成長を阻害する必要のある対象において腫瘍の大きさを減少もしくは低下させ及び/または腫瘍の成長を阻害する方法は、この対象へ(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、(ii)IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、(iii)OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチド、及び/または(iv)これらの組み合わせを投与することを含む。別の特定の実施形態において、腫瘍の大きさを減少もしくは低下させ、及び/または腫瘍の成長を阻害することを必要とする対象における腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害する方法は、この対象へ、(i)IL-23ポリペプチド(例えば、配列番号141)を含む第1のタンパク質をコードする第1のポオリヌクレオチド、(ii)IL-36-ガンマポリペプチド(例えば、配列番号143)を含む第2のタンパク質をコードする第2のポリヌクレオチド、及び(iii)OX40Lポリペプチド(例えば、配列番号145)を含む第3のタンパク質をコードする第3のポリぺプチドを好ましくは1:2:1w/wの質量比で投与することを含む。いくつかの特定の態様において、腫瘍の大きさを減少もしくは低下させ、及び/または腫瘍の成長を阻害することを必要とする対象における腫瘍の大きさを減少もしくは低下させ、及び/または腫瘍の成長を阻害する方法は、この対象へ、有効量の追加のポリヌクレオチド、例えば、第4または第5のタンパク質をコードする第4または第5のポリヌクレオチドを投与することをさらに含む。
他の実施形態において、本開示は、本明細書に開示する第1、第2、及び/または第3のポリヌクレオチド(例えば、mRNA)を投与することによって、抗腫瘍効果を促進する(例えば、T細胞増殖を誘導する、腫瘍におけるT細胞浸潤を誘導する、記憶T細胞応答を誘導する、NK細胞数を増加させるなど)方法を提供する。
1つの実施形態において、本開示は、T細胞を活性化させることを必要とする対象においてT細胞を活性化させ、T細胞の増殖を誘導することを必要とする対象においてT細胞の増殖を誘導し、腫瘍へのT細胞の浸潤を誘導することを必要とする対象において腫瘍へのT細胞の浸潤を誘導し、及び/または記憶T細胞応答を誘導することを必要とする対象において記憶T細胞応答を誘導する方法であって、この対象へ、IL-23をコードする第1のポリヌクレオチド、IL-36-ガンマもしくはIL-18をコードする第2のポリヌクレオチド、OX40Lをコードする第3のポリヌクレオチド、またはこれらの組み合わせを投与することを含む方法を提供する。特定の実施形態において、T細胞を活性化させることを必要とする対象においてT細胞を活性化させ、T細胞の増殖を誘導することを必要とする対象においてT細胞の増殖を誘導し、腫瘍へのT細胞の浸潤を誘導することを必要とする対象において腫瘍へのT細胞の浸潤を誘導し、及び/または記憶T細胞応答を誘導することを必要とする対象において記憶T細胞応答を誘導する方法は、この対象へ、(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、配列番号141)、(ii)IL-36-ガンマポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、配列番号143)、及び(iii)OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(配列番号145)を、好ましくは1:2:1w/wの質量比で投与することを含む。ある特定の実施形態において、第1のポリヌクレオチド(例えば、mRNA)、第2のポリヌクレオチド(例えば、mRNA)、及び/または第3のポリヌクレオチド(例えば、mRNA)の腫瘍内投与は、他の投与経路と比較して抗腫瘍効果の効能(例えば、腫瘍へのT細胞の浸潤)を増大させることができる。
1つの実施形態において、対象において活性化したT細胞は、対象における腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害する。T細胞の活性化は、T細胞の増殖を測定すること、酵素結合免疫吸着検定法(ELISA)もしくは酵素結合免疫スポット検定法(ELISPOT)を用いてサイトカインの産生を測定すること、またはフローサイトメトリーなどの技術を用いてのT細胞活性化と関係する細胞表面マーカー(例えば、CD69、CD40L、CD137、CD25、CD71、CD26、CD27、CD28、CD30、CD154、及びCD134)の検出など、当該技術分野における応用を用いて測定することができる。
1つの実施形態において、対象におけるT細胞増殖は、対象における抗腫瘍免疫応答へ向けられる。別の態様において、対象におけるT細胞の増殖は、対象における腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害する。T細胞の増殖は、細胞計数、生存度染色、光学密度アッセイ、またはフローサイトメトリーなどの技術を用いてのT細胞活性化と関係する細胞表面マーカー(例えば、CD69、CD40L、CD137、CD25、CD71、CD26、CD27、CD28、CD30、CD154、及びCD134)の検出など、当該技術分野における応用を用いて測定することができる。
1つの実施形態において、対象の腫瘍へのT細胞の浸潤は、対象における抗腫瘍免疫応答に向けられる。別の態様において、対象の腫瘍へのT細胞の浸潤は、対象内の腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害する。腫瘍へのT細胞の浸潤は、組織切片の作製及び細胞マーカーに対する染色、腫瘍部位で局所サイトカイン産生を測定すること、またはフローサイトメトリーなどの技術を用いてのT細胞表面マーカーの検出など、当該技術分野における応用を用いて測定することができる。
1つの実施形態において、対象における記憶T細胞応答は、対象における抗腫瘍免疫応答に向けられる。別の態様において、対象における記憶T細胞応答は、対象における腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害する。記憶T細胞応答は、記憶T細胞と関係するT細胞マーカーを測定すること、記憶免疫応答と関連した局所サイトカイン産生を測定すること、またはフローサイトメトリーなどの技術を用いて記憶T細胞表面マーカーを検出することなど、当該技術分野における応用を用いて測定することができる。
ある特定の実施形態において、本方法によって活性化したT細胞は、CD4+細胞、CD8+細胞、CD62+(L-セレクチン+)細胞、CD69+細胞、CD40L+細胞、CD137+細胞、CD25+細胞、CD71+細胞、CD26+細胞、CD27+細胞、CD28+細胞、CD30+細胞、CD45+細胞、CD45RA+細胞、CD45RO+細胞、CD11b+細胞、CD154+細胞、CD134+細胞、CXCR3+細胞、CCR4+細胞、CCR6+細胞、CCR7+細胞、CXCR5+細胞、Crth2+細胞、ガンマデルタT細胞、またはそれらのいずれかの組合せである。いくつかの実施形態において、本方法によって活性化したT細胞は、Th1細胞である。他の実施形態において、本方法によって活性化したT細胞は、Th2細胞である。他の実施形態において、本開示によって活性化したT細胞は、細胞障害性T細胞である。
いくつかの実施形態において、本方法によって浸潤するT細胞は、CD4+細胞、CD8+細胞、CD62+(L-セレクチン+)細胞、CD69+細胞、CD40L+細胞、CD137+細胞、CD25+細胞、CD71+細胞、CD26+細胞、CD27+細胞、CD28+細胞、CD30+細胞、CD45+細胞、CD45RA+細胞、CD45RO+細胞、CD11b+細胞、CD154+細胞、CD134+細胞、CXCR3+細胞、CCR4+細胞、CCR6+細胞、CCR7+細胞、CXCR5+細胞、Crth2+細胞、ガンマデルタT細胞、またはそれらのいずれかの組合せである。いくつかの実施形態において、本方法によって浸潤するT細胞は、Th1細胞である。他の実施形態において、本方法によって浸潤するT細胞は、Th2細胞である。他の実施形態において、本開示によって浸潤するT細胞は、細胞障害性T細胞である。
いくつかの実施形態において、本方法によって誘導される記憶T細胞は、CD4+細胞、CD8+細胞、CD62+(L-セレクチン+)細胞、CD69+細胞、CD40L+細胞、CD137+細胞、CD25+細胞、CD71+細胞、CD26+細胞、CD27+細胞、CD28+細胞、CD30+細胞、CD45+細胞、CD45RA+細胞、CD45RO+細胞、CD11b+細胞、CD154+細胞、CD134+細胞、CXCR3+細胞、CCR4+細胞、CCR6+細胞、CCR7+細胞、CXCR5+細胞、Crth2+細胞、ガンマデルタT細胞、またはそれらのいずれかの組合せである。いくつかの実施形態において、本方法による記憶T細胞は、Th1細胞である。他の実施形態において、本方法による記憶T細胞は、Th2細胞である。他の実施形態において、本開示による記憶T細胞は、細胞障害性T細胞である。
本開示は、ナチュラルキラー(NK)細胞の数を増加させることを必要とする対象において、ナチュラルキラー細胞の数を増加させる方法であって、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-23をコードするmRNAを含むポリヌクレオチド、及び/またはIL-36-ガンマもしくはIL-18をコードするmRNAを含むポリヌクレオチドを投与することを含む方法をさらに提供する。特定の実施形態において、ナチュラルキラー(NK)細胞の数を増加させることを必要とする対象において、ナチュラルキラー細胞の数を増加させる方法は、対象へ、(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、配列番号141)、(ii)IL-36-ガンマポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、配列番号143)、及び(iii)OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチド(例えば、配列番号145)を、好ましくは1:2:1w/wの質量比で投与することを含む。1つの態様において、対象におけるNK細胞の数の増加は、対象内の抗腫瘍免疫応答に向けられる。別の態様において、対象におけるNK細胞の数の増加は、対象における腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害する。対象におけるNK細胞の数の増加は、NK細胞表面マーカー(例えば、CD335/NKp46、CD336/NKp44、CD337/NPp30)または細胞内NK細胞マーカー(例えば、パーフォリン、グランザイム、グラニュリシン)の検出など、当該技術分野における応用を用いて測定することができる。
ある特定の実施形態において、IL-23をコードするmRNA、IL-36-ガンマをコードするmRNAまたはIL-18をコードするmRNA、及びOX40LポリペプチドをコードするmRNAより選択される少なくとも2つのmRNAの投与は、この少なくとも2つのmRNAを投与されていない対象、またはIL-23単独をコードするmRNA、IL-36-ガンマ単独をコードするmRNA、IL-18をコードするmRNA、もしくはOX40L単独をコードするmRNAを投与された対象におけるNK細胞の数と比較して、対象におけるNK細胞の総数を増加させる。他の実施形態において、IL-23をコードするmRNA、IL-36-ガンマをコードするmRNA、IL-18をコードするmRNA、及びOX40LポリペプチドをコードするmRNAより選択される少なくとも2つのmRNAの投与は、OX40Lポリペプチド単独をコードするmRNA、IL-23単独をコードするmRNA、またはIL-36-ガンマ単独をコードするmRNA、またはIL-18をコードするmRNAを用いて形質転換した樹状細胞を投与した対象と比較して、対象におけるNK細胞の総数を増加させる。他の実施形態において、IL-23をコードするmRNA、IL-36-ガンマをコードするmRNA、IL-18をコードするmRNA、及びOX40LポリペプチドをコードするmRNAより選択される少なくとも2つのmRNAの投与は、この少なくとも2つのmRNAを投与されていない対象、またはIL-23単独をコードするmRNA、IL-36-ガンマ単独をコードするmRNA、IL-18単独をコードするmRNA、もしくはOX40Lポリペプチド単独をコードするmRNAを投与された対象と比較して、腫瘍微小環境内の、対象におけるNK細胞の総数を増加させる。他の実施形態において、IL-23をコードするmRNA、IL-36-ガンマをコードするmRNA、IL-18をコードするmRNA、及びOX40LポリペプチドをコードするmRNAより選択される少なくとも2つのmRNAの投与は、OX40Lポリペプチド単独をコードするmRNA、IL-23単独をコードするmRNA、IL-18単独をコードするmRNA、もしくはIL-36-ガンマ単独をコードするmRNAを投与された対象のものと比較して、腫瘍微小環境内の、対象におけるNK細胞の数を増加させる。他の実施形態において、腫瘍微小環境内でのNK細胞の濃度は上昇するのに対し、対象におけるNK細胞の総数は同じままである。
本開示のある特定の実施形態において、NK細胞の数は、対照(例えば、生理食塩水またはIL-23、IL-36-ガンマ、もしくはOX40Lの発現が生じないmRNA)と比較して少なくとも約2倍、少なくとも約3倍、少なくとも約4倍、少なくとも約5倍、少なくとも約6倍、少なくとも約7倍、少なくとも約8倍、少なくとも約9倍、または少なくとも約10倍増加する。特定の実施形態において、NK細胞の数は、IL-23をコードするmRNA、IL-36-ガンマをコードするmRNA、IL-18をコードするmRNA、及びOX40LポリペプチドをコードするmRNAより選択される少なくとも2つのmRNAによって、対照(例えば、生理食塩水またはIL-23、IL-36-ガンマ、IL-18、もしくはOX40Lの発現が生じないmRNA)と比較して少なくとも約2倍増加する。
1つの態様において、本明細書に開示する組み合わせの投与は、(i)第1のタンパク質単独をコードする第1のポリヌクレオチド(例えば、IL-23ポリペプチドを含むタンパク質をコードするポリヌクレオチド)の投与、(ii)第2のタンパク質単独をコードする第2のポリヌクレオチド(例えば、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含むタンパク質をコードするポリヌクレオチド)の投与、または(iii)第3のタンパク質単独をコードする第3のポリヌクレオチド(例えば、OX40Lポリペプチドを含むタンパク質をコードするポリヌクレオチド)の投与よりも少なくとも1.5倍、少なくとも2倍、少なくとも2.5倍、少なくとも3倍、少なくとも3.5倍、少なくとも4倍、少なくとも4.5倍、または少なくとも5倍、腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害する。腫瘍の大きさの減少もしくは低下または腫瘍の成長の阻害は、当該技術分野において既知である何らかの方法を用いて、過度の実験なしで測定することができる。
いくつかの態様において、腫瘍の大きさの減少もしくは低下、または腫瘍の成長の阻害は、対照(例えば、PBSを用いた処置、対照タンパク質をコードするポリヌクレオチドを用いた処置、または対照タンパク質を用いた処置)よりも少なくとも1.5倍、少なくとも2倍、少なくとも2.5倍、少なくとも3倍、少なくとも3.5倍、少なくとも4倍、少なくとも4.5倍、または少なくとも5倍である。
いくつかの態様において、本明細書に開示する方法により投与される第1のポリヌクレオチドは、RNA、例えば、第1のタンパク質(例えば、IL-23ポリペプチドを含むタンパク質)をコードするmRNAを含む。いくつかの態様において、本明細書に開示する方法により投与される第2のポリヌクレオチドは、RNA、例えば、第2のタンパク質(例えば、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含むタンパク質)をコードするmRNAを含む。いくつかの態様において、本明細書に開示する方法により投与される第3のポリヌクレオチドは、RNA、例えば、第3のタンパク質(例えば、OX40Lポリペプチドを含むタンパク質)をコードするmRNAを含む。
本明細書に開示する方法は、腫瘍内、腸内、胃腸内、硬膜外、経口、経皮、硬膜外硬膜周囲、脳内(大脳の中への)、脳室内(脳室の中への)、皮膚上(皮膚上への塗布)、皮内、(皮膚自体の中への)、皮下(皮膚の下への)、鼻腔内投与(鼻を経ての)、静脈内(静脈の中への)、腹腔内(腹腔の中への)、動脈内(動脈の中への)、筋肉内(筋肉の中への)、心内(心臓の中への)、経骨髄投与(骨髄の中への)、髄腔内(脊柱管の中への)、腹腔内、(腹腔の中への注入または注射)、膀胱内注入、硝子体内、(眼を通じて)、海綿体内注射、(陰茎の基部の中への)、膣内投与、子宮内、羊膜外投与、経皮(全身分布のためのインタクトな皮膚を通じての拡散)、経粘膜(粘膜を通じての拡散)、吸入(鼻呼吸)、舌下、口唇下、浣腸、点眼(結膜の上への)、または点耳液を含むがこれらに限定されない利用可能な何らかの経路によって本開示の組成物のいずれかを投与することを含む。
いくつかの態様において、本明細書に開示する方法は、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドを皮下に、静脈内に、筋肉内に、関節内に、滑液嚢内に、胸骨内に、くも膜下腔内に、肝臓内に、病変内に、頭蓋内に、脳室内に、経口に、吸入スプレーによって、局所的に、直腸に、鼻腔内に、頬側に、膣にまたは植え込まれたリザーバーを介して投与することを含む。
いくつかの態様において、本明細書に開示する方法は、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドを筋肉内、皮下、腫瘍内、または皮内への送達のための製剤として投与することを含む。いくつかの実施形態において、筋肉内、皮下、腫瘍内、または皮内への送達のための製剤は、追加のポリヌクレオチド、例えば、第3、第4、または第5のポリヌクレオチドを含む。ある特定の実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドの腫瘍内投与は、他の投与経路と比較して、抗腫瘍効果の効能を高めることができる。いくつかの実施形態において、追加のポリヌクレオチド、例えば、第3、第4または第5のポリヌクレオチドは、腫瘍内に投与され、他の投与経路と比較して抗腫瘍効果の効能を高める。
本明細書に開示する方法のいくつかの態様において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドは、in vivoでの送達のために製剤化される。いくつかの実施形態において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び第3のポリヌクレオチドは、種々の重量比で、例えば、同量(重量による)の各ポリヌクレオチドとともに、または他のポリヌクレオチドの量(重量による)の2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、または50倍で存在するポリヌクレオチドのいずれか1つとともに同時製剤化することができる。1つの実施形態において、IL-23:IL-36ガンマ:OX40Lポリヌクレオチドは、IL-23及びOX40Lポリヌクレオチドがほぼ同量であり、IL-36ガンマポリヌクレオチドが1.5、2.0、2.5、3.0、3.5、4.0、4.5または5.0倍多量の重量(質量)などの高量の重量(質量)で存在するような重量(質量)比で同時製剤化される。一つの特定の実施形態において、IL-23:IL-36ガンマ:OX40Lポリヌクレオチドは、1:2:1の重量(質量)比で同封製剤化される。本明細書で使用する場合、質量比は、1:1:2の重量(質量)比で製剤化されるOX40L:IL-23:IL-36ガンマをコードするポリヌクレオチド(例えば、mRNA)を含む組成物に対する参照によって参照することもできる。
他の実施形態において、IL-23:IL-36ガンマ:OX40Lポリヌクレオチドは、1:1:1、2:1:1、1:2:1、1:1:2、3:1:1、1:3:1、1:1:3、4:1:1、1:4:1、1:1:4、5:1:1、1:5:1、1:1:5、6:1:1、1:6:1、1:1:6、7:1:1、1:7:1、1:1:8、9:1:1、1:9:1、1:1:9、10:1:1、1:10:1、1:1:10、11:1:1、1:11:1、1:1:11、12:1:1、1:12:1、1:1:12、13:1:1、1:13:1、1:1:13、14:1:1、1:14:1、1:1:14、15:1:1、1:15:1、1:1:15、16:1:1、1:16:1、1:1:16、17:1:1、1:17:1、1:1:17、18:1:1、1:18:1、1:1:18、19:1:1、1:19:1、1:1:19、20:1:1、1:20:1、1:1:20、25:1:1、1:25:1、1:1:25、30:1:1、1:30:1、1:1:30、35:1:1、1:35:1、1:1:35、40:1:1、1:40:1、1:1:40、45:1:1、1:45:1、1:1:45、50:1:1、1:50:1、または1:1:50の重量(質量)比で同封製剤化される。他の実施形態において、これら3つのポリヌクレオチドの各々は、異なる重量で同封製剤物中に存在することができる。例に過ぎないが、IL-23:IL-36ガンマ:OX40Lポリヌクレオチドは、1:2:3、1:3:2、2:1:3、2:3:1、3:1:2、または3:2:1の重量(質量)比で、あるいは1:3:5、1:5:3、3:5:1、3:1:5、5:1:3、または5:3:1の重量(質量)比で、あるいは1:5:10、1:10:5、5:1:10、5:10:1、10:1:5、または10:5:1の重量(質量)比で同封製剤化することができる。特定の実施形態において、(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、配列番号140)、(ii)IL-36-ガンマポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、配列番号16)、及び(iii)OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチド(例えば、配列番号21)は、1:2:1の重量(質量)比で製剤化される。これは好ましい製剤であるが、当業者は、この比以外のこの3つの構成要素のいずれか1つの量が本明細書に開示する方法のいずれかにおける使用に適した製剤も提供し得ることを容易に認識するだろう。
ポリヌクレオチド同封製剤化は、単回用量としてまたは複数回用量として投与することができる。種々の重量(質量)比の同封製剤、例えば、第1のポリヌクレオチド、第2のポリヌクレオチド、及び第3のポリヌクレオチドが1:2:1w/wで存在する同封製剤#1、ならびに第1のポリヌクレオチド、第2のポリヌクレオチド、及び第3のポリヌクレオチドが1:1:2w/wで存在する同封製剤#2は各々、単回または複数回で、連続して、逐次、または同時に投与することができる。
1つの実施形態において、(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、配列番号140)、(ii)IL-36-ガンマポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、配列番号16)、及び(iii)OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチド(例えば、配列番号21)の1:2:1の同封製剤は、単回用量としてまたは複数回用量として投与される。
本明細書に開示する方法のいくつかの態様において、本明細書に開示される組成物の投与はがんを治療する。
本明細書に開示する方法のある特定の態様において、本明細書に開示する組成物は、副腎皮質癌、進行癌、肛門癌、再生不良性貧血、胆管癌、膀胱癌、骨癌、骨転移、脳腫瘍、脳癌、乳癌、小児癌、原発不明癌、キャッスルマン病、子宮頸癌、結腸/直腸癌、子宮内膜癌、食道癌、ユーイングファミリー腫瘍、眼癌、胆嚢癌、消化管カルチノイド腫瘍、消化管間質腫瘍、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎細胞癌、喉頭下咽頭癌、急性リンパ性白血病、急性骨髄性白血病、慢性リンパ性白血病、慢性骨髄性白血病、慢性骨髄単球性白血病、肝癌、肝細胞癌(HCC)、非小細胞肺癌、小細胞肺癌、肺カルチノイド腫瘍、皮膚のリンパ腫、悪性中皮腫、多発性骨髄腫、骨髄異形成症候群、鼻腔副鼻腔癌、上咽頭癌、神経芽腫、非ホジキンリンパ腫、口腔及び中咽頭癌、骨肉種、卵巣癌、膵癌、陰茎癌、下垂体腫瘍、前立腺癌、網膜芽細胞腫、横紋筋肉腫、唾液腺癌、成人軟部肉腫、基底細胞・扁平上皮細胞皮膚癌、メラノーマ、小腸癌、胃癌、精巣癌、咽頭癌、胸腺癌、甲状腺癌、子宮肉腫、膣癌、外陰癌、ワルデンシュトレーム・マクログロブリン血症、ウィルムス腫瘍、癌治療起因性二次性癌、ならびにそれらのいずれかの組合せからなる群より選択されるがんを治療するために投与される。
本明細書に開示する方法のいくつかの態様において、第1のポリヌクレオチド、第2のポリヌクレオチド、及び/または第3のポリヌクレオチドは、ポンプ、パッチ、薬剤リザーバー、ショートニードル装置、シングルニードル装置、マルチプルニードル装置、マイクロニードル装置、急速注射装置、バリスティックパウダー/粒子送達装置、カテーテル、ルーメン、冷凍子、カニューレ、微小カニューレ、または熱、RFエネルギー、電流、もしくはそれらのいずれかの組合せを利用する装置を備えた装置によって送達される。本明細書に開示する方法の他の態様において、追加のポリヌクレオチド、例えば、第3、第4または第5のポリヌクレオチドも、ポンプ、パッチ、薬剤リザーバー、ショートニードル装置、シングルニードル装置、マルチプルニードル装置、マイクロニードル装置、急速注射装置、バリスティックパウダー/粒子送達装置、カテーテル、ルーメン、冷凍子、カニューレ、微小カニューレ、または熱、RFエネルギー、電流、もしくはそれらのいずれかの組合せを利用する装置を備えた装置によって送達される。
いくつかの実施形態において、本開示の方法において使用する本明細書に開示する組成物の有効量は、約0.10mg/kg~約1000mg/kgである。いくつかの実施形態において、対象はヒトである。
本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドは、同じ組成物の一部である(例えば、溶液は、第1、第2、及び第3のポリヌクレオチドをいずれも含有する)。本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドは、異なる組成物の一部である(例えば、各ポリヌクレオチドは、異なる溶液であり得、または異なる溶液中で組み合わせることができる)。
本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、及びIL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチドは、同時に投与される。本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、及びIL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチドは、逐次投与される。本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、及びIL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチドは、連続して投与される(すなわち、第1のポリヌクレオチドを初めに投与することができ、次いで第2のポリヌクレオチドの投与となり、またはその逆もある)。
本明細書に開示する方法のいくつかの実施形態において、OX40Lポリペプチドを含む第1のタンパク質をコードするポリヌクレオチド、及びIL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードするポリヌクレオチドは、同時に投与される。本明細書に開示する方法のいくつかの実施形態において、OX40Lポリペプチドを含むタンパク質をコードするポリヌクレオチド、及びIL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含むタンパク質をコードするポリヌクレオチドは、逐次投与される。本明細書に開示する方法のいくつかの実施形態において、OX40Lポリペプチドを含むタンパク質をコードするポリヌクレオチド、及びIL-36-ガンマポリペプチドを含むタンパク質をコードするポリヌクレオチドは連続して投与される(すなわち、OX40Lポリヌクレオチドを初めに投与することができ、次いでIL-36-ガンマポリヌクレオチドまたはIL-18ポリヌクレオチドの投与となり、またはその逆もある)。
本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドは、同時に投与される。本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドは、逐次投与される。本明細書に開示する方法のいくつかの実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドは連続して投与される(すなわち、第1、第2、及び第3のポリヌクレオチドは、何らかの投与順序によって投与することができる)。特定の実施形態において、IL-23ポリペプチドを含む第1のタンパク質(例えば、配列番号141によってコードされる配列140)、IL-36-ガンマポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、配列番号143によってコードされる配列番号16)、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、配列番号145によってコードされる配列番号21)は、投与順序にかかわらず、1:2:1の最終的な重量(質量)比で投与される。
いくつかの実施形態において、本開示は、治療する腫瘍(近位腫瘍)に関して遠位に存在する腫瘍を治療する(例えば、腫瘍の大きさを減少させる)方法を提供する。いくつかの実施形態において、近位腫瘍は、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、mRNA)、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、mRNA)、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、mRNA)、あるいはこれらの組み合わせを用いて治療される。本明細書に開示する方法は、例えば、療法の腫瘍内投与が安全ではなくまたは実用的ではないであろう場所にある腫瘍を、本明細書に開示する組成物(例えば、IL-23ポリペプチドをコードするmRNA(例えば、配列番号141)、mRNAすなわちIL-36-ガンマポリペプチド(例えば、配列番号143)、及びOX40Lポリペプチドをコードする第3のmRNA(配列番号145))を1つ以上の接近可能な腫瘍へ腫瘍内投与することによって治療するために使用することができる。
いくつかの実施形態において、本開示は、チェックポイント阻害剤(例えば、抗PD-L1抗体及び/または抗PD-1抗体及び/または抗CTLA-4抗体)と一緒の、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、mRNA)、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、mRNA)、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、mRNA)、あるいはこれらの組み合わせの投与を含むチェックポイント阻害剤(例えば抗PD-L1抗体などのPD-1またはPD-L1を標的とする分子)に対して応答性がまったくないまたはほとんどない腫瘍を治療する方法を提供する。特定の実施形態において、IL-23ポリペプチドを含む第1のタンパク質(例えば、配列番号141によってコードされる配列番号140)、IL-36-ガンマポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、配列番号143によってコードされる配列番号16)、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチド(例えば、配列番号145によってコードされる配列番号21)は、チェックポイント阻害剤(例えば、抗PD-L1抗体及び/または抗PD-1抗体及び/または抗CTLA-4抗体)と一緒に投与される。
本明細書で使用する場合、「二剤」、「二剤療法」、「二剤併用療法」、「二剤mRNA療法」という用語、及びこれらの文法上の変形は、IL-23ポリペプチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチド、及びOX40Lポリペプチドより選択される2つのタンパク質をコードする2つのmRNAが、これを必要とする患者へ投与される併用治療を指す。いくつかの実施形態において、二剤療法は、IL-23ポリペプチド及びIL-36-ガンマポリペプチドまたはIL-18ポリペプチドをそれぞれコードする2つのmRNAから本質的になるかまたはこれらのmRNAからなる。二剤療法は、(i)両方のmRNAを含む単一の組成物として、または(ii)各1つが各mRNAをふくむ別個の組成物として投与することができる。いくつかの実施形態において、二剤療法におけるmRNAは、同時に投与される。他の実施形態において、二剤療法におけるmRNAは連続して投与される。
本明細書で使用する場合、「三剤」、「三剤療法」、「三剤併用療法」、「三剤mRNA療法」という用語、及びこれらの文法上の変形は、相互交換可能に使用され、IL-23ポリペプチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチド、及びOX40Lポリペプチドをコードする3つのmRNAが、これらを必要とする患者へ投与される併用治療を指す。いくつかの実施形態において、三剤療法は、IL-23ポリペプチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチド、及びOX40Lポリペプチドをそれぞれコードする3つのmRNAから本質的になるかまたはこれらのmRNAからなる。三剤療法は、例えば、(i)3つのmRNAを(例えば、1:2:1w/wのIL-23:IL-36ガンマ:OX40Lの最終的な重量(質量)比で)含む単一の組成物として、または(ii)1つもしくは2つのmRNAを(例えば、1:2:1w/wのIL-23:IL-36ガンマ:OX40Lの最終的な重量(質量)比で)各々1つを含む別個の組成物として投与することができる。いくつかの実施形態において、三剤療法におけるmRNAは、同時に投与される。他の実施形態において、三剤療法における各mRNA、またはこれらの組み合わせは、連続して投与される。特定の実施形態において、三剤療法は、1:2:1の重量(質量)比で好ましく製剤化され、何らかの投与順序により投与される(例えば、連続的、逐次、または同時)、(i)IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド(例えば、配列番号141によってコードされる配列番号140)、(ii)IL-36-ガンマポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド(例えば、配列番号143によってコードされる配列番号16)、及び(iii)OX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチド(例えば、配列番号145によってコードされる配列番号145)を含み、またはこれらから本質的になる。
いくつかの実施形態において、本開示は、本明細書に開示のポリヌクレオチドまたはポリヌクレオチドの組み合わせ(例えば、mRNA)を必要とする対象への本明細書に開示のポリヌクレオチドまたはポリヌクレオチドの組み合わせの投与が結果的に以下を生じる、治療方法を提供する:
(a)閾値レベルに対して、あるいはIL-23、IL-36-ガンマもしくはIL-18ポリペプチド、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中の顆粒球レベルの上昇、
(b)閾値レベルに対して、あるいはIL-23、IL-36-ガンマもしくはIL-18ポリペプチド、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中の交差提示樹状細胞レベルの上昇、
(c)閾値レベルに対して、またはOX40Lポリぺプチドをコードする単一のポリヌクレオチドの投与後の比に対して、二剤または三剤の投与後に対象から得た1つ以上の試料中のエフェクターT細胞とサプレッサーT細胞と比の上昇、
(d)閾値レベルに対して、またはOX40Lポリぺプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中のエフェクター記憶T細胞レベルの上昇、
(e)閾値レベルに対して、あるいはIL-23、IL-36-ガンマもしくはIL-18ポリペプチド、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中のPDL1発現レベルの上昇、あるいは
(f)これらの組み合わせ。
本開示は、腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害する必要のある対象における腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害する方法であって、対象へ、(i)第1のポリヌクレオチドがインターロイキン23ポリペプチド(IL-23)を含む第1のタンパク質をコードし、第2のポリヌクレオチドがインターロイキン36-ガンマポリペプチド(IL-36-ガンマ)またはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドが、IL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドを含む第2のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば、配列番号141、143及び145)を含む組成物を投与することを含む方法を提供し、第1のポリヌクレオチドはIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドはIL-36-ガンマポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドはOX40Lポリペプチド(OX40L)を含む第3のタンパク質をコードし、対象へのこの二剤または三剤の投与は結果として以下を生じる:
(a)閾値レベルに対して、あるいはIL-23、IL-36-ガンマもしくはIL-18ポリペプチド、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中の顆粒球レベルの上昇、
(b)閾値レベルに対して、あるいはIL-23、IL-36-ガンマもしくはIL-18ポリペプチド、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中の交差提示樹状細胞レベルの上昇、
(c)閾値レベルに対して、またはOX40Lポリぺプチドをコードする単一のポリヌクレオチドの投与後の比に対して、二剤または三剤の投与後に対象から得た1つ以上の試料中のエフェクター細胞とサプレッサーT細胞と比の上昇、
(d)閾値レベルに対して、またはOX40Lポリぺプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中のエフェクター記憶T細胞レベルの上昇、
(e)閾値レベルに対して、あるいはIL-23、IL-36-ガンマ、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、二剤または三剤の投与後に対象から得た1つ以上の試料中のPDL1発現レベルの上昇、あるいは
(f)これらの組み合わせ。
顆粒球、交差提示樹状細胞(例えば、CD103+細胞)、エフェクターT細胞(例えば、CD4+細胞またはCD8+細胞)、サプレッサーT細胞(例えば、Treg細胞)、エフェクター記憶T細胞(例えば、CD4+細胞またはCD8+細胞)、CD11b+細胞のレベル、PD-L1の発現などは、当該技術分野において既知である何らかの方法によって、対象から得た1つ以上の試料において測定することができる。
いくつかの実施形態において、顆粒球レベルの上昇は、(i)CD45+細胞の百分率としての顆粒球、または(ii)腫瘍1mg当たりの顆粒球として定量される。いくつかの実施形態において、交差提示樹状細胞は、CD103+細胞である。いくつかの実施形態において、交差提示樹状細胞レベルの上昇は、(i)腫瘍1mg当たりの交差提示樹状細胞、(ii)腫瘍流入領域リンパ節(TdLN)における交差提示CD103+樹状細胞、(iii)CD45+細胞の百分率としての交差提示CD103+樹状細胞、またはそれらのいずれかの組合せとして定量される。いくつかの実施形態において、エフェクターT細胞とサプレッサーT細胞との比は、CD8:Treg比として定量される。実施形態において、エフェクター記憶T細胞とはCD4+細胞及び/またはCD8+細胞である。いくつかの実施形態において、PD-L1発現レベルは、(i)陽性CD11b+細胞の数、または(ii)CD11b+細胞におけるPD-L1発現として定量される。
本開示は、(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドがIL-23ポリペプチドをコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA)を含む組成物を投与することを含む、顆粒球レベルの上昇を必要とする対象における顆粒球レベルを上昇させる方法であって、顆粒球レベルが、対象から得た1つ以上の試料において測定される、方法も提供する。いくつかの実施形態において、顆粒球レベルの上昇は、閾値レベルに対して、あるいはIL-23をコードする単一のポリヌクレオチドまたはIL-36-ガンマもしくはIL-18ポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対して、(i)CD45+細胞の百分率としての顆粒球、及び/または(ii)腫瘍1mg当たりの顆粒球として測定される。
交差提示樹状細胞レベルの上昇を必要とする対象へ、(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドが、OX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば、配列番号141、143及び145)を含む組成物を投与することを含む、対象における樹状細胞レベルを上昇させる方法であって、交差提示樹状細胞レベルが、対象から得た1つ以上の試料において測定される方法も提供される。いくつかの実施形態において、交差提示樹状細胞は、CD103+細胞である。いくつかの実施形態において、交差提示CD103+樹状細胞レベルの上昇は、閾値レベルに対して、またはIL-23をコードする単一のポリヌクレオチド、IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドをコードする単一のポリヌクレオチド、またはOX40Lをコードする単一のポリヌクレオチドの投与後のレベルに対して、(i)腫瘍1mg当たりの交差提示CD103+樹状細胞、(ii)TdLNにおける交差提示CD103+樹状細胞、(iii)CD45+細胞の百分率としての交差提示CD103+樹状細胞、または(iv)これらの組み合わせとして測定される。
本開示は、エフェクターT細胞とサプレッサーT細胞との比の上昇を必要とする対象へ、(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば配列番号141、143及び145)を含む組成物を投与することを含む、対象におけるエフェクターT細胞とサプレッサーT細胞との比を上昇させる方法であって、エフェクターT細胞とサプレッサーT細胞との比が対象から得られた1つ以上の試料において測定される、方法も提供する。いくつかの実施形態において、エフェクターT細胞とサプレッサーT細胞との比は、CD8+細胞と調節T細胞(Treg)との比、すなわちCD8:Tregの比として測定される。
本開示は、エフェクター記憶T細胞レベルを上昇させることを必要とする対象へ、(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば、配列番号141、143及び145)を含む組成物を投与することを含む、対象におけるエフェクター記憶T細胞レベルを上昇させる方法であって、エフェクター記憶T細胞レベルが、対象から得た1つ以上の試料において測定される方法も提供される。いくつかの実施形態において、エフェクター記憶T細胞は、CD4+細胞及び/またはCD8+細胞である。いくつかの実施形態において、エフェクター記憶T細胞レベルの上昇は、閾値レベルに対して、またはOX40Lをコードする単一ポリヌクレオチドの投与後のレベルに対して、腫瘍内でのエフェクター記憶T細胞として測定される。
本開示は、PD-L1陽性細胞レベルを上昇させることを必要とする対象へ、(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば、配列番号141、143及び145)を含む組成物を投与することを含む、対象におけるPD-L1陽性細胞レベルを上昇させる方法であって、PD-L1陽性細胞レベルが、対象から得た1つ以上の試料において測定される方法も提供される。いくつかの実施形態において、PD-L1陽性細胞は、CD11b+細胞である。
本明細書に開示する方法のいくつかの態様において、対象から得た1つまたは複数の試料は、腫瘍組織、腫瘍浸潤物、血液、血漿、及びそれらのいずれかの組合せからなる群より選択される。いくつかの実施形態において、1つ以上の対照試料は、健常対象または腫瘍に罹患している対象から得た1つまたは複数の試料である。
いくつかの実施形態において、閾値レベルは、所定の値、または1つ以上の試料から得た値であり、例えば、健常個体の集団または腫瘍に罹患している対象の集団からの試料のプールから得た値である。
本開示は、(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、(ii)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば、配列番号141、143及び145)、または(iii)本明細書に開示する何らかの組成物、を含む組成物を用いて腫瘍疾患を有する対象を治療するかどうかを判断する方法であって、
(i)二剤もしくは三剤の初期用量を被投与者へ投与すること、及び
(ii)二剤もしくは三剤の初期用量の投与後に対象が閾値レベルに関して以下の上昇を有すると判断された場合、対象を治療することを含む方法も提供する:
(a)顆粒球レベル、
(b)交差提示樹状細胞のレベル、
(c)エフェクターT細胞とサプレッサーT細胞との比、
(d)エフェクター記憶T細胞のレベル、
(e)PD-L1陽性細胞のレベル、
(f)PD-L1発現、または
(g)これらの組み合わせ。
(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドが、OX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば、配列番号141、143及び145)、または(iii)本明細書に開示する何らかの組成物、を含む組成物を用いた治療のための候補として腫瘍と診断された対象を選択する方法であって、
(i)二剤または三剤の初期用量を被投与者へ投与すること、及び
(ii)二剤または三剤の初期用量の投与後に対象が閾値レベルに関して以下の上昇を有すると判断された場合、治療のための対象を選択すること、を含む方法も提供する:
(a)顆粒球レベル、
(b)交差提示樹状細胞のレベル、
(c)エフェクターT細胞とサプレッサーT細胞との比、
(d)エフェクター記憶T細胞のレベル、
(e)PD-L1陽性細胞のレベル、
(f)PD-L1発現、または
(g)これらの組み合わせ。
本開示は、腫瘍を治療するための組成物の効能を測定する必要のある対象における腫瘍を治療するための組成物の効能を測定する方法であって、組成物が(i)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする、組み合わせ(二剤)における2つのポリヌクレオチド(例えば、mRNA)、または(ii)第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組み合わせ(三剤)における3つのポリヌクレオチド(例えば、mRNA、例えば、配列番号141、143及び145)、または(iii)本明細書に開示する何らかの組成物、を含む組成物の効能を測定する方法であって、対象から採取した少なくとも1つの試料において、(a)顆粒球レベル、(b)交差提示樹状細胞レベル、(c)エフェクターT細胞とサプレッサーT細胞との比、(d)エフェクター記憶T細胞のレベル、(e)PD-L1陽性細胞のレベル、(f)PD-L1発現、または(g)これらの組み合わせを測定することを含み、閾値レベルに関してこれらの測定結果の少なくとも1つの上昇は、対象が二剤または三剤を用いた処置に応答していることを示す、方法も提供する。
IV.疾患、障害及び/または状態
いくつかの実施形態において、本開示のポリヌクレオチド(例えば、mRNA)、例えば、IL-23ポリペプチドを含む第1のタンパク質をコードするmRNAを含む第1のポリヌクレオチド、IL-36-ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードするmRNAを含む第2のポリヌクレオチド、及び/またはOX40Lポリペプチドを含む第3のタンパク質をコードするmRNAを含む第3のポリヌクレオチドを使用して、腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害することを必要とする対象において腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害することができる。
いくつかの実施形態において、追加のポリヌクレオチド(例えば、第4のポリヌクレオチド)は、IL-23ポリペプチドを含む第1のタンパク質をコードするmRNAを含む第1のポリヌクレオチド、IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードするmRNAを含む第2のポリヌクレオチド、及び/またはOX40Lポリペプチドを含む第3のタンパク質をコードするmRNAを含む第3のポリヌクレオチドとの組み合わせで、腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害することを必要とする対象において腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害するために投与することができる。
したがって、いくつかの実施形態において、本開示のポリヌクレオチド(例えば、mRNA)、すなわち、IL-23ポリペプチドを含む第1のタンパク質をコードするmRNAを含む第1のポリヌクレオチド、IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードするmRNAを含む第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードするmRNAを含む第3のポリヌクレオチドを使用して、腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害することを必要とする対象において腫瘍の大きさを減少もしくは低下させまたは腫瘍の成長を阻害することができる。
いくつかの実施形態において、腫瘍は、疾患、障害、及び/または状態と関係している。特定の実施形態において、疾患、障害、及び/または状態はがんである。したがって、1つの態様において、IL-23ポリペプチドを含む第1のタンパク質をコードするmRNAを含む第1のポリヌクレオチド、IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドをコードするmRNAを含む第2のポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含む第3のポリヌクレオチドの投与により、がんを治療する。
別の態様において、OX40Lポリペプチドを含む第3のタンパク質をコードするmRNAを含む第3のポリヌクレオチドとさらに組み合わせた、IL-23ポリペプチドを含む第1のタンパク質をコードするmRNAを含む第1のポリヌクレオチド、IL-36-ガンマポリペプチドもしくはIL-18ポリペプチドをコードするmRNAを含む第2のポリヌクレオチドの投与により、がんを治療する。
「がん」とは、体内の異常な細胞の成長が制御されていないことを特徴とする幅広い、種々の疾患群をいう。調節されていない細胞の分裂及び成長は結果として、隣接組織に侵入し、リンパ系または血流を通じて身体の遠位の部分へ転移することもできる悪性腫瘍の形成を生じる。「がん」または「がん組織」は、種々の病期での腫瘍を含むことができる。ある特定の実施形態において、がんまたは腫瘍は第0期であり、このような場合、例えば、がんまたは腫瘍は、発生において非常に初期であり、転移していない。いくつかの実施形態において、がんまたは腫瘍は第I期であり、このような場合、例えば、がんまたは腫瘍は、大きさが比較的小さく、近隣の組織へ広がっておらず、転移していない。他の実施形態において、がんまたは腫瘍は、第II期または第III期であり、このような場合、例えば、がんまたは腫瘍は、第0期または第I期よりも大きく、近隣組織の中へと成長しているが、転移しておらず、例外は、リンパ節への転移の可能性である。他の実施形態において、がんまたは腫瘍は、第IV期であり、このような場合、例えば、がんまたは腫瘍は、転移している。第IV期は、進行癌または転移癌とも呼ぶことができる。
いくつかの態様において、がんは、副腎皮質癌、進行癌、肛門癌、再生不良性貧血、胆管癌、膀胱癌、骨癌、骨転移、脳腫瘍、脳癌、乳癌、小児癌、原発不明癌、キャッスルマン病、子宮頸癌、結腸/直腸癌、子宮内膜癌、食道癌、ユーイングファミリー腫瘍、眼癌、胆嚢癌、消化管カルチノイド腫瘍、消化管間質腫瘍、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎細胞癌、喉頭下咽頭癌、急性リンパ性白血病、急性骨髄性白血病、慢性リンパ性白血病、慢性骨髄性白血病、慢性骨髄単球性白血病、肝癌、非小細胞肺癌、小細胞肺癌、肺カルチノイド腫瘍、皮膚のリンパ腫、悪性中皮腫、多発性骨髄腫、骨髄異形成症候群、鼻腔副鼻腔癌、上咽頭癌、神経芽腫、非ホジキンリンパ腫、口腔及び中咽頭癌、骨肉種、卵巣癌、膵癌、陰茎癌、下垂体腫瘍、前立腺癌、網膜芽細胞腫、横紋筋肉腫、唾液腺癌、成人軟部肉腫、基底細胞・扁平上皮細胞皮膚癌、メラノーマ、小腸癌、胃癌、精巣癌、咽頭癌、胸腺癌、甲状腺癌、子宮肉腫、膣癌、外陰癌、ワルデンシュトレーム・マクログロブリン血症、ウィルムス腫瘍、がん治療により生じる二次がんを含むことができるが、これらに限定されない。
いくつかの態様において、腫瘍は固形腫瘍である。「固形腫瘍」は、肉腫、メラノーマ、癌腫、または他の固形腫瘍癌を含むが、これらに限定されない。「肉腫」は、胚性結合組織のような物質でできた腫瘍を指し、概して、線維状物質または均質な物質において包埋された密に詰められた細胞から構成されている。肉腫には、軟骨肉腫、線維肉腫、リンパ肉腫、黒色肉腫、粘液肉腫、骨肉腫、アベメシー肉腫、脂肪肉腫、脂肪肉腫、胞状軟部肉腫、エナメル上皮肉腫、ブドウ状肉腫、緑色肉腫(、絨毛癌、胎芽性肉腫、ウィルムス腫瘍肉腫、子宮内膜肉腫、間質肉腫、ユーイング肉腫、筋膜肉腫、線維肉腫、巨細胞肉腫、顆粒球肉腫、ホジキン肉腫、特発性多発性色素性肉腫、B細胞の免疫芽球性肉腫、リンパ腫、T細胞の免疫芽球性肉腫、ジェンセン肉腫、カポジ肉腫、クッパー肉腫、血管肉腫、白血肉腫症、悪性間葉細胞腫肉腫、傍骨性肉腫、網状赤血球肉腫、ラウス肉腫、漿液嚢胞性肉腫、滑膜肉腫、または末梢血管拡張性肉腫(telangiectaltic sarcoma)が含まれるが、これらに限定されない。
「メラノーマ」という用語は、皮膚及び他の器官のメラニン細胞系から生じる腫瘍をいう。メラノーマには、例えば、末端黒子型メラノーマ、無色素性メラノーマ、良性若年性メラノーマ、クラウドマンメラノーマ、S91メラノーマ、ハーディング・パッセーメラノーマ、若年性メラノーマ、悪性黒子メラノーマ、悪性メラノーマ、転移性メラノーマ、結節性メラノーマ、爪下メラノーマ、または表在性拡大型メラノーマが含まれる。
「癌腫」という用語は、周辺組織に浸潤して転移をもたらす傾向がある上皮細胞でできた悪性の新たな成長物をいう。例示的な癌腫としては、例えば、腺房癌、小葉癌、腺嚢癌腫、腺様嚢胞癌、腺腫様癌、副腎皮質癌、肺胞癌、肺胞上皮癌、基底細胞癌、基底細胞癌、類基底細胞癌、基底扁平細胞癌、気管支肺胞上皮癌、細気管支癌、気管支原性肺癌、大脳様癌、胆管細胞癌、絨毛癌、粘液癌、面皰癌、子宮体癌、篩状癌、鎧状癌、皮膚癌、円柱癌、円柱細胞癌、腺管癌、硬膜癌(carcinoma durum)、胎児性癌、脳様癌、類上皮癌、上皮アデノイド癌、外方発育癌、潰瘍癌、線維性癌、膠様癌、コロイド腺癌、巨細胞癌、巨細胞癌、腺癌、顆粒膜細胞癌、毛母癌、血性癌、肝細胞癌、ヒュルトレ細胞癌、硝子状癌、副腎様癌、乳児性胎生期癌、上皮内癌、表皮内癌、上皮内癌、クロンペシャー癌、カルチャスキー細胞癌、大細胞癌、レンズ状癌、レンズ状癌、脂肪腫様癌、リンパ上皮癌、髄様癌、髄様癌、黒色癌、軟性癌、粘液癌、粘液分泌性癌、粘液細胞癌、粘膜類表皮癌、粘液癌、粘液性癌、粘液腫状癌、上咽頭癌、燕麦細胞癌、骨化性癌、骨様癌、乳頭状癌、門脈周囲癌、前浸潤癌、有棘細胞癌、髄様癌、腎臓の腎細胞癌、予備細胞癌、肉腫性癌、シュナイダー癌腫、硬性癌、陰嚢癌、印環細胞癌、単純癌、小細胞癌、ソラノイド癌、回転楕円面細胞癌腫、紡錘細胞癌、海綿様癌、扁平上皮癌、扁平上皮癌、絞施型癌、血管拡張性癌、血管拡張様癌、移行上皮癌、結節癌、結節癌、いぼ状癌、または絨毛癌が挙げられる。
治療することができる追加のがんには、例えば、白血病、ホジキン病、非ホジキンリンパ腫、多発性骨髄腫、神経芽腫、乳癌、卵巣癌、肺癌、横紋筋肉腫、原発性血小板血症、原発性マクログロブリン血症、小細胞肺癌、原発性脳腫瘍、胃癌、結腸癌、悪性膵インスリノーマ、悪性カルチノイド、膀胱癌、前悪性皮膚病変、精巣癌、リンパ腫、甲状腺癌、甲状腺乳頭癌、神経芽腫、神経内分泌癌、食道癌、尿路生殖器癌、悪性高カルシウム血症、子宮頸癌、子宮内膜癌、副腎皮質癌、前立腺癌、ミューラー管癌、卵巣癌、腹膜癌、卵管癌、または子宮体部漿液性腺癌が含まれる。
本発明の方法に従った治療に適しているがん及び/または腫瘍は、直接的な腫瘍内投与及び/または局所的投与、すなわち、標的腫瘍の領域における投与を介して接触可能なものを含む。例えば、単純なシリンジ注射を用いた投与へ接触可能な腫瘍は、治療に容易に適している。また、治療に適しているのは、注射に何らかの撮像及び/または誘導投与を必要とする腫瘍、及び/または注射が画像誘導穿刺注射を介して、または部位へと直接的にカテーテル/カニューレを介して、もしくは内視鏡を介して可能であるものである。
治療に適した例示的ながん及び/または腫瘍は、メラノーマ、乳癌、例えば、TNBC、頭頸部癌、肉腫、CTLC、NHL、基底細胞癌、非小細胞肺癌(NSCLC)、肝細胞癌(HCC)、神経膠腫、胃癌、及び膵癌を含む。治療に特に適しているのは、メラノーマ、乳癌、例えば、TNBC、及び頭頸部癌である。
メラノーマ
メラノーマとは、皮膚癌の最も侵襲性の形態の1つである。さらに、発生率は増加の一途であり、利用可能な治療選択肢はほとんどない。メラノーマは、世界中で年間新たに132,000例の発生率で検出され(米国では年間新たに76,000例)、米国における年間およそ10,000例の死亡を占める。約25%が40歳未満の患者である。PD-1阻害剤(例えば、ニボルマブ、ペンブロリズマブ)は現行では、ケアの標準であり、37%の効果の持続性を、2年間で30%の進行のない生存を立証している。しかしながら、非レスポンダーについては迅速な進行も観察され(中央値4か月)、たったの40%の全体的な生存が3年間で観察され、平衡状態の証拠はなく、すなわち、治療した患者は退行し続ける。
したがって、この状況における新たな、より有効な治療についての明らかな必要性がある。メラノーマは、がんに対する免疫性を理解するためのモデル腫瘍としても役立っている。メラノーマ腫瘍関連抗原は、特定及び分類される最初のがん抗原であったが、さらなる研究は、これらの多くが他の腫瘍のタイプによっても発現することを示している。加えて、メラノーマ退行は白斑と関係しており、このタイプのがんにおける免疫系の活発な役割を視認でき、原発メラノーマの自然退行も、いくつかの症例で観察されてきた。これらの観察は、メラノーマにおける免疫系の活動度と関連して、この腫瘍が免疫療法に適していると立証すべきである強力な証拠を提供した。この背景に対し、メラノーマは、長く免疫腫瘍学的研究の最先端であり続け、免疫腫瘍学的方法に関する我々の理解を高めるためのモデル腫瘍として使用され続けるようであり、他のタイプの免疫療法応答がんにおける治療選択肢を知らせることになる。
三重陰性乳癌
乳癌は、異なるタイプの治療を必要とする異なる特徴を示す。たいていの乳癌は、ホルモン受容体陽性であり、このことは、がん細胞が、女性ホルモンであるエストロゲン及び/またはプロゲステロンへの曝露から成長するよう刺激されることを意味する。他の乳癌は、HER2陽性といわれており、このことは、この乳癌が細胞の複製及び成長に関与する生物学的経路であるヒト表皮成長因子受容体2を過剰発現することを意味する。HER2陽性乳癌は、乳癌のおよそ25%を占め、成長及び複製を遅延させるために受容体を標的とする作用剤を用いて治療される。エストロゲンまたはプロゲステロンへの曝露から成長するよう刺激されておらず、HER2陰性である乳癌は、三重陰性乳癌と呼ばれる。三重陰性乳癌は、他の乳癌よりも侵襲性が高い傾向にあり、他の乳癌と比較して治療選択肢は少数である。乳癌は歴史的に、免疫学的にサイレントであるとみなされてきたが、いくつかの前臨床試験及び臨床試験は、乳がん患者についての臨床成績を改善する可能性が免疫治療にあることを示唆している。全体として、免疫治療は、腫瘍自体に向けられる従来の化学療法処置及び標的化処置を上回るいくつかのカギとなる利点を持っている。第一に、免疫治療は概して結果的に副作用が低めとなり、より長期間及び/または毒性を追加されることなく他の作用剤と組み合わせて投与することができる。患者は、免疫治療に対する耐性を発展させる傾向もほとんどない場合があり、その理由は、複数のがん抗原を同時に標的として、同時にがん細胞を変化させるように適応させる免疫系の能力のためである。
頭頸部癌
頭頸部扁平上皮癌(HNSCC)は、種々の機序を介して免疫抑制状態を誘導する。HNSCC患者は、健常対照と比較してリンパ球の恒常性が変化している(主として、CD3+細胞、CD4+細胞、及びCD8+T細胞のレベルが低下)。この不均衡は、治癒を企図した治療の後、2年間そのままでさえある。一貫して、より多数の腫瘍浸潤CD4+リンパ球及びCD8+リンパ球は、HNSCC患者におけるより良好な全体的な生存と関係している。加えて、ナチュラルキラー細胞(NK)の機能は、HNSCC患者において低下している。
HNSCC細胞は、免疫サーベイランス及びその後の除去をエスケープするためのある特定の戦略を適用する。例えば、HNSCC細胞は、免疫系と間接的に相互作用して、免疫抑制性微小環境を維持する。本質的に、HNSCCは、生理学的状況下での自己免疫または免疫系の過剰活性化を回避するために、免疫系が免疫チェックポイントを通じて緊密に調節されているという事実を利用している。
腫瘍指向性免疫治療
免疫腫瘍学的方法の分野にとって重要な目標とは、応答率を改善し、免疫治療に応答する腫瘍発生数を、有害な副作用を高めることなく増加させることである。これらの目標を達成する1つのアプローチは、腫瘍指向性免疫治療を用いること、すなわち、免疫系の最も関連性のある部分に対して免疫活性化の的を絞ることである。これにより抗腫瘍効能を改善し、免疫関連有害事象を低減させ得る。腫瘍指向性免疫活性化は、腫瘍へのまたは腫瘍領域への免疫調節因子の直接的な局所注射によって達成することができる。標的チェックポイント阻害剤及び共刺激受容体に的を絞った療法は、局所の免疫活性化を介して腫瘍特異的T細胞応答を生じることができる。
腫瘍微小環境の調節
ある特定の実施形態において、本発明の組成物(例えば、二剤または三剤mRNA組成物)は、腫瘍微小環境を調節することができ、及び/または治療する対象における腫瘍微小環境に基づく治療のために選択でき得る。1つの実施形態において、本発明の組成物は、炎症性腫瘍微小環境を有する腫瘍の治療のために使用され得る。別の実施形態において、本発明の組成物は、免疫抑制性腫瘍微小環境を有する腫瘍の治療のために使用され得る。さらに別の実施形態において、本発明の組成物は、免疫学的に欠乏している腫瘍微小環境を有する腫瘍を治療するために使用される。腫瘍が炎症性腫瘍微小環境を有する状況、すなわち、腫瘍微小環境がすでに免疫及び/または炎症細胞の浸潤を示している状況において、三剤mRNA療法による治療ではなく二剤mRNA療法による治療が十分であり得る(実施例23、図43A-Bを参照のこと)。例えば、炎症性腫瘍微小環境を伴う腫瘍の治療のために、1つの実施形態において、腫瘍は、IL-12ファミリーのメンバー(例えば、IL-23)をコードするポリヌクレオチド及び免疫応答共刺激シグナル(例えば、OX40L)をコードするポリヌクレオチドで治療する。
V.併用療法
ある特定の実施形態において、本明細書に開示する治療方法は、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36ガンマポリペプチドもしくはIL-18ポリペプチドをコードする第2のポリヌクレオチド、及び/またはOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドを投与すること、ならびに1つまたは複数の抗がん薬を対象へ投与することをさらに含む。ある特定の実施形態において、本明細書に開示する治療方法は、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36ガンマポリペプチドもしくはIL-18ポリペプチドをコードする第2のポリヌクレオチド、OX40Lポリペプチドをコードする第3のポリヌクレオチドを投与することを含み、かつ1つまたは複数の抗がん薬を対象へ投与することをさらに含む。
いくつかの実施形態において、この1つまたは複数の抗がん薬はmRNAである。ある特定の実施形態において、この1つまたは複数の抗がん薬は、腫瘍抗原をコードするmRNAである。他の実施形態において、この1つまたは複数の抗がん薬は、腫瘍抗原でも腫瘍抗原をコードするmRNAでもない。いくつかの実施形態において、この1つまたは複数の抗がん薬は、米国食品医薬品局によって承認された作用薬である。他の実施形態において、この1つまたは複数の抗がん薬は、米国食品医薬品局によって承認される前の作用薬である。
いくつかの態様において、本発明の方法または組成物についての対象は、ケア療法の1つまたは複数の標準物質を用いて治療されてきた。他の態様において、本発明の方法または組成物についての対象は、ケア療法または抗がん療法の1つまたは複数の標準物質に対して応答してきていない。
近年、治療目的のための免疫チェックポイント阻害剤の導入ががん治療を変革してきた。目的のものは、チェックポイント阻害剤と他の共刺激分子または阻害分子との組み合わせを特徴とする療法である。
T細胞の調節、すなわち、活性化または阻害は、共刺激シグナルまたは共阻害シグナルを介して仲介される。この相互作用はリガンド/受容体の相互作用を介して発揮される。T細胞は、OX40などの活性化受容体及びプログラム細胞死受容体1(PD-1)または細胞障害性Tリンパ球関連タンパク質4(CTLA-4)などの阻害受容体(すなわち、免疫チェックポイント)の両方を無数保有する(Mellman et al.2011 Nature.;480:480-489)。この免疫チェックポイントの活性化は結果として、T細胞の失活を生じ、腫瘍細胞によるこれらの経路の動員は、免疫チェックポイントがうまく免疫をエスケープすることに寄与する。
ペンブロリズマブまたはニボルマブなど、プログラム死受容体1/プログラム死リガンド1(PD-1/PD-L1)とPD-L2の間の相互作用を標的とする免疫チェックポイント阻害剤は近年、種々の悪性腫瘍の治療に承認されてきており、メラノーマ、頭頸部扁平上皮癌(HNSCC)を含むがんの臨床試験で現在調査されている。これらの治験から入手可能なデータは、これらの患者集団における好ましい安全性及び毒性特性が付随する実質的な活性を示す。
例えば、チェックポイント阻害剤は、メラノーマの治療についての臨床試験において試験されてきた。特に、第III相臨床試験は、イピリムマブ及びペンブロリズマブなど、CTLA4及びPD-1免疫チェックポイントをそれぞれ標的とする療法がメラノーマ患者の3年生存率を約70%まで、及び全体の生存率(5年超)を約30%まで上昇させることを明らかにした。
同様に、チェックポイント阻害剤は、頭頸部癌の治療についての臨床試験において検査されてきた。前臨床試験において、HNSCC腫瘍の45~80%がプログラム細胞死リガンド1(PD-L1)を発現させることが示された(Zandberg et al.(2014)Oral Oncol.50:627-632)。現に、単一療法としてのまたはHNSCCの組み合わせレジメンにおける免疫チェックポイント阻害剤の効能及び安全性を評価する非常にたくさんの臨床試験がある。例えば、PD1、PD-L1、及びCTLA-4阻害剤を用いた臨床試験は、HNSCCにおいて試験中である。PD-1抗体ペンブロリズマブが転移性/再発性(R/M)HNSCC患者において有効であろうというデータは、第1b相キーノート-012第I/II相試験において得られた(Cheng.ASCO 2015、口頭発表)。より近年、無作為化チェックメイト-141第III相臨床試験のデータが発表された(Gillison.AACR 2016、口頭発表)。この試験では、白金不応性R/M HNSCC患者において2週間ごとに投与されたモノクローナルPD1抗体ニボルマブの効能を調査した。この試験は、この試験のニボルマブ群の優位性により、早期に終わった。
1つの態様において、対象は、本開示のポリヌクレオチドに先立ってPD-1アンタゴニストを用いてすでに治療されている。別の態様において、対象は、本開示のポリヌクレオチドに先立ってPD-1へ結合するモノクローナル抗体を用いて治療されている。別の態様において、対象は、本発明の方法または組成物のポリヌクレオチドに先立って抗PD-1モノクローナル抗体療法を用いて治療されている。他の態様において、抗PD-1モノクローナル抗体療法は、ニボルマブ、ペンブロリズマブ、ピディリズマブ、またはそれらのいずれかの組合せを含む。別の態様において、対象は、本開示のポリヌクレオチドに先立ってPD-L1へ結合するモノクローナル抗体を用いて治療されている。別の態様において、対象は、本発明の方法または組成物のポリヌクレオチドに先立って抗PD-L1モノクローナル抗体療法を用いて治療されている。他の態様において、抗PD-L1モノクローナル抗体療法は、デュルバルマブ、アベルマブ、MEDI473、BMS-936559、アエゾリズマブ、またはそれらのいずれかの組合せを含む。
いくつかの態様において、対象は、本開示の組成物を用いた治療に先立って、CTLA-4アンタゴニストを用いて治療されている。別の態様において、対象は、本開示の組成物に先立ってCTLA-4へ結合するモノクローナル抗体を用いてすでに治療されている。別の態様において、対象は、本開示のポリヌクレオチドに先立って、抗CTLA-4モノクローナル抗体を用いて治療されている。他の態様において、抗CTLA-4抗体療法は、イピリムマブまたはトレメリムマブを含む。
いくつかの態様において、本開示は、がんを治療する方法及び/または免疫治療の方法を必要とする対象へ(例えば、腫瘍内に、腹腔内に、または静脈内に)IL-23ポリペプチド、またはIL-36ガンマポリペプチド、IL-18ポリペプチド.OX40Lポリペプチドをそれぞれコードする第1、第2、及び/または第3のポリヌクレオチド(例えば、RNA、例えば、mRNA)を、PD-1アンタゴニスト、例えば、PD-1へ特異的に結合する抗体、例えば抗PD-1モノクローナル抗体またはその抗原結合部分との組み合わせで投与することを含む、当該対象におけるこれらの方法に関する。
一実施形態において、本開示に有用な抗PD-1抗体(またはその抗原結合部分)は、ペンブロリズマブである。ペンブロリズマブ(KEYTRUDA(登録商標)、ランブロリズマブ、及びMK-3475としても公知)は、ヒト細胞表面受容体PD-1(プログラム死1またはプログラム細胞死1)に対するヒト化モノクローナルIgG4抗体である。ペンブロリズマブは、例えば、米国特許第8,900,587号において説明されており、http://www.cancer.gov/drugdictionary?cdrid=695789(最新アクセス日:2014年12月14日)も参照されたい。ペンブロリズマブは、再発性または不応性メラノーマ及び進行性NSCLCの治療のためにFDAによって承認されている。
別の実施形態において、本開示に有用な抗PD-1抗体はニボルマブである。ニボルマブ(「OPDIVO(登録商標)」、旧名5C4、BMS-936558、MDX-1106、またはONO-4538としても公知)は、PD-1リガンド(PD-L1及びPD-L2)との相互作用を選択的に防止して、それにより抗腫瘍T細胞機能の下方調節を遮断する完全ヒトIgG4(S228P)PD-1免疫チェックポイント阻害抗体である(米国特許第8,008,449号;Wang et al.,2014 Cancer
Immunol Res.2(9):846-56)。ニボルマブは、腎細胞がん(腎腺癌、または副腎腫)、メラノーマ、及び非小細胞肺癌(NSCLC)を含む種々の進行性固形腫瘍において活性を示してきた(Topalian et al.,2012a;Topalian et al.,2014;Drake et al.,2013;WO 2013/173223。
他の実施形態において、抗PD-1抗体は、PD-1受容体に対するモノクローナル抗体であるMEDI0680(旧名AMP-514)である。MEDI0680は、例えば、米国特許第8,609,089B2号において、またはhttp://www.cancer.gov/drugdictionary?cdrid=756047(最新アクセス日2014年12月14日)において説明されている。
ある特定の実施形態において、抗PD-1抗体は、ヒト化モノクローナル抗体であるBGB-A317である。BGB-A317は、米国公開第2015/0079109号において説明されている。
ある特定の実施形態において、PD-1アンタゴニストは、B7-DC Fc融合タンパク質であるAMP-224である。AMP-224は、米国公開第2013/0017199号において、またはhttp://www.cancer.gov/publications/dictionaries/cancer-drug?cdrid=700595(最新アクセス日2015年7月8日)において考察されている。
他の実施形態において、本開示は、がんを治療する方法及び/または免疫治療の方法を必要とする対象へ(例えば、腫瘍内に、腹腔内に、または静脈内に)、IL-23ポリペプチド、またはIL-36ガンマポリペプチド、IL-18ポリペプチド、及びOX40Lポリペプチドをそれぞれコードする第1、第2、及び/または第3のポリヌクレオチド(例えば、RNA、例えば、mRNA)を、PD-1へ特異的に結合する抗体、例えば、抗PD-1モノクローナル抗体、例えば、ニボルマブ、ペンブロリズマブ、ピディリズマブ、もしくはそれらのいずれかの組合せを含む抗PD-1モノクローナル抗体、またはそれらの抗原結合部分と一緒に投与することを含む、当該対象におけるこれらの方法を含む。
いくつかの態様において、本開示は、がんを治療する方法及び/または免疫治療の方法を必要とする対象へ(例えば、腫瘍内に、腹腔内に、または静脈内に)IL-23ポリペプチド、またはIL-36ガンマポリペプチド、IL-18ポリペプチド、及びOX40Lポリペプチドをそれぞれコードする第1、第2、及び/または第3のポリヌクレオチド(例えば、RNA、例えば、mRNA)を、PD-L1アンタゴニスト、例えば、PD-L1へ特異的に結合する抗体、例えば、抗PD-L1モノクローナル抗体、例えば、デュルバルマブ、アベルマブ、MEDI473、BMS-936559、アテゾリズマブ、もしくはそれらのいずれかの組合せを含む抗PD-L1モノクローナル抗体、またはそれらの抗原結合部分との組み合わせで投与することを含む、当該対象におけるこれらの方法に関する。
ある特定の実施形態において、本開示に有用な抗PD-L1抗体は、MSB0010718C(アベルマブとも呼び、US2014/0341917を参照されたい)またはBMS-936559(旧12A4またはMDX-1105)である(例えば、米国特許第7,943,743号、WO2013/173223を参照されたい)。他の実施形態において、抗PD-L1抗体は、MPDL3280Aである(RG7446としても公知)(例えば、Herbst et al.(2013)J Clin Oncol 31(補遺):3000.Abstract;米国特許第8,217,149号を参照されたい)、MEDI4736(デュルバルマブとも呼ばれており、Khleif(2013)In:Proceedings from the European Cancer Congress 2013;2013年9月27日~10月1日、Amsterdam,
The Netherlandsである。
他の態様において、本開示は、がんを治療する方法及び/または免疫治療の方法を必要とする対象へ(例えば、腫瘍内に、腹腔内に、または静脈内に)IL-23ポリペプチド、またはIL-36ガンマポリペプチド、IL-18ポリペプチド、及びOX40Lポリペプチドをそれぞれコードする第1、第2、及び/または第3のポリヌクレオチド(例えば、RNA、例えば、mRNA)を、CTLA-4アンタゴニスト、例えば、CTLA-4へ特異的に結合する抗体、例えば、抗CTLA-4モノクローナル抗体、例えば、イピリムマブもしくはトレメリムマブ、またはそれらのいずれかの組合せを含む抗CTLA-4モノクローナル抗体、あるいはそれらの抗原結合部分との組み合わせで投与することを含む、当該対象におけるこれらの方法に関する。
例示的な臨床用抗CTLA-4抗体は、米国特許第6,984,720号において開示されるようなヒトmAb10D1(今ではイピリムマブとして公知であり、YERVOY(登録商標)として市販)である。本発明の方法に有用な別の抗CTLA-4抗体は、トレメリムマブ(CP-675,206としても公知)である。トレメリムマブは、ヒトIgG2モノクローナル抗CTLA-4抗体である。トレメリムマブは、WO/2012/122444、米国公開第2012/263677号、または国際公開第2007/113648 A2号において説明されている。
一実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチドは、CTLA-4へ特異的に結合する抗体もしくはその抗原結合部分、PD-1受容体へ特異的に結合する抗体もしくはその抗原結合部分、PD-L1受容体へ特異的に結合する抗体もしくはその抗原結合部分、それらをコードするポリヌクレオチド、またはそれらのいずれかの組合せとの組み合わせで投与される。
一実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36ガンマポリペプチドもしくはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチドは、PD-1もしくはPD-L1受容体へ特異的に結合する抗体もしくはその抗原結合部分、またはこれらをコードするポリヌクレオチドとの組み合わせで投与される。
別の実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチドは、CTLA-4へ特異的に結合する抗体もしくはその抗原結合部分、またはこれらをコードするポリヌクレオチドとの組み合わせで投与される。
さらに別の実施形態において、IL-23ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、IL-36ガンマポリペプチドまたはIL-18ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリペプチドは、PD-1またはPD-L1受容体へ特異的に結合する抗体またはその抗原結合部分、及びCTLA-4(またはそのポリヌクレオチド)へ特異的に結合する抗体またはその抗原結合部分との組み合わせで投与される。
VI.免疫調節ポリペプチドをコードする、配列最適化したポリヌクレオチド配列
いくつかの実施形態において、本開示のポリヌクレオチドは、本明細書に開示するポリペプチド、例えば、IL-23(IL-23の少なくとも1つのサブユニットまたはIL-23の両サブユニットを含む融合タンパク質)、IL-36-ガンマ、IL-18及び/またはOX40Lをコードする配列最適化したヌクレオチド配列を含む。いくつかの実施形態において、本開示のポリヌクレオチドは、IL-23ポリペプチドをコードするオープンリーディングフレーム(ORF)を含み、このORFは、配列最適化がされている(例えば、配列番号141)。いくつかの実施形態において、本開示のポリヌクレオチドは、IL-36ガンマポリペプチドまたはIL-18ポリペプチドをコードするオープンリーディングフレーム(ORF)を含み、このORFは、配列最適化がされている(例えば、配列番号143)。いくつかの実施形態において、本開示のポリヌクレオチドは、OX40Lポリペプチドをコードするオープンリーディングフレーム(ORF)を含み、このORFは、配列最適化がされている(例えば、配列番号145)。
いくつかの実施形態において、配列最適化したIL-23、IL-36ガンマもしくはIL-18ポリペプチド及び/またはOX40Lの配列、これらの断片、ならびにバリアントは、本明細書に開示する方法を実施するために使用される。いくつかの実施形態において、配列最適化したIL-23、IL-36ガンマもしくはIL-18ポリペプチド及び/またはOX40Lの断片ならびにこれらのバリアントは、それらの個々の野生型配列と組み合わせられまたは当該野生型配列に対する代替物である(表1及び表1Aにおいて示す)。
本明細書に開示する配列最適化したヌクレオチド配列は、対応する野生型ヌクレオチド酸配列とは及び他の公知の配列最適化したヌクレオチド配列とは異なっており、例えば、これらの配列最適化した核酸は、独自の組成特徴を有する。
いくつかの実施形態において、配列最適化したヌクレオチド配列(例えば、IL-23、IL-36ガンマもしくはIL-18ポリペプチド及び/またはOX40Lポリペプチド、これらの機能的断片またはそれらのバリアント)におけるウラシルまたはチミン核酸塩基の百分率は、参照野生型ヌクレオチド配列におけるウラシルまたはチミンの核酸塩基の百分率に関して変更させられる(例えば、低下させられる)。このような配列は、ウラシル改変したまたはチミン改変した配列と呼ばれる。ヌクレオチド配列中のウラシルまたはチミンの含有量の百分率は、配列中のウラシルまたはチミンの数をヌクレオチドの総数によって除して100を乗じたものによって求めることができる。いくつかの実施形態において、配列最適化したヌクレオチド配列は、参照野生型配列におけるウラシルまたはチミンの含有量よりも少量のウラシルまたはチミンの含有量を有する。いくつかの実施形態において、本開示の配列最適化したヌクレオチド配列におけるウラシルまたはチミンの含有量は、参照野生型配列におけるウラシルまたはチミンの含有量よりも多く、有益な効果、例えば、参照野生型配列と比較した場合、高い発現及び/またはシグナル伝達の応答をなおも維持している。
いくつかの実施形態において、本開示の最適化した配列は、その配列中にウラシルまたはチミン(DNAの場合)の独自の範囲を含有する。最適化した配列のウラシルまたはチミンの含有量は、種々の方法で、例えば、理論的最小値に対する(%UTMまたは%TTM)、野生型に対する(%UWTまたは%TWT)及び総ヌクレオチド含有量に対する(%UTLまたは%TTL)最適化した配列のウラシルまたはチミンの含有量で表すことができる。DNAについては、チミンは、ウラシルの代わりに存在すると認識されており、UのあるところではTに置換されるであろう。したがって、例えば、RNAに関して%UTM、%UWT、または%UTLと関連した開示はすべて、DNAに関して%TTM、%TWT、または%TTLに等しく適用可能である。
ウラシルまたはチミンの理論的最小値に対するウラシル含有量またはチミン含有量とは、配列最適化したヌクレオチド配列中のウラシルまたはチミンの数を、仮説上の配列におけるコドン全部が最小の考えられ得るウラシルまたはチミンの含有量を有する同義のコドンと置き換えられた仮説上のヌクレオチド配列におけるウラシルまたはチミンの総数によって除して、100を乗じることによって求めたパラメータを指す。このパラメータは、本明細書では%UTMまたは%TTMと略記される。
本開示のIL-23、IL-36ガンマ及び/またはOX40Lポリペプチドをコードするウラシル改変またはチミン改変した配列は、対応する野生型核酸配列(%UWTまたは%TWT)中のウラシルまたはチミンの含有量に対する当該就職した配列のウラシルまたはチミンの含有量により説明することもできる。「野生型核酸配列中のウラシルまたはチミンの含有量に対するウラシルまたはチミンの含有量」とは、配列最適化した核酸中のウラシルまたはチミンの数を、対応する野生型核酸配列中のウラシルまたはチミンの総数によって除して100を乗じたものによって求めたパラメータを指す。このパラメータは、本明細書において%UWTまたは%TWTと略記される。
いくつかの実施形態において、本開示のIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列は、対応する野生型核酸配列に関して連続したウラシルの数が減少している。例えば、2つの連続したロイシンは、4つのウラシルクラスターを含む配列CUUUUGによってコードすることができる。このようなサブ配列は、例えば、ウラシルクラスターを除去しているCUGCUCで置換することができる。フェニルアラニンはUUCまたはUUUによってコードすることができる。したがって、UUUによってコードされるフェニルアラニンがUUCによって置き換えられた場合でさえ、同義のコドンはウラシルペア(UU)をなおも含有している。したがって、配列中のフェニルアラニンの数は、コードされたポリペプチド中のフェニルアラニンの数を変化させることなく、除去することができないウラシルペア(UU)の最小数を確立している。
いくつかの実施形態において、本開示のIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列は、野生型核酸配列に対してウラシルトリプレット(UUU)の数が減少している。いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列は、野生型核酸配列中のウラシルペア(UU)の数に関してウラシルペア(UU)の数が減少している。いくつかの実施形態において、本開示のIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列は、野生型核酸配列中のウラシルペア(UU)の最小可能数に対応するウラシルペア(UU)の数を有する。
「野生型核酸配列中のウラシル対(UU)に対するウラシルペア(UU)」という語句は、配列最適化したヌクレオチド配列中のウラシルペア(UU)の数を対応する野生型ヌクレオチド配列中のウラシルペア(UU)の総数で除して100を乗じることによって求めたパラメータを指す。このパラメータは、本明細書において%UUWTと略記される。いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列は100%より少ない%UUWTを有する。
いくつかの実施形態において、本開示のポリヌクレオチドは、本明細書に開示するIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列を含む。いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列は、少なくとも1つの化学的に改変した核酸塩基、例えば、5-メトキシウラシルを含む。いくつかの実施形態において、本開示のIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列中の核酸塩基(例えば、ウラシル)の少なくとも95%は、改変した核酸塩基である。いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするウラシル改変した配列中のウラシルの少なくとも95%は、5-メトキシウラシルである。いくつかの実施形態において、ウラシル改変した配列を含むポリヌクレオチドは、miRNA結合部位、例えば、miR-122へ結合するmiRNA結合部位をさらに含む。いくつかの実施形態において、ウラシル改変した配列を含むポオリヌクレオチドは、送達剤、例えば、式(I)を有する化合物、例えば、化合物1~147のいずれか、または化合物1~232のいずれかを用いて製剤化される。
VII.配列の最適化のための方法
いくつかの実施形態において、本開示のポリヌクレオチド(例えば、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチド(例えば、野生型配列、その機能的断片、またはバリアントをコードするヌクレオチド配列を含むポリヌクレオチド)は、配列最適化がなされている。
配列最適化したヌクレオチド配列(ヌクレオチド配列は本明細書では「核酸」とも呼ばれる)は、参照配列(例えば、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする野生型配列)に関して、少なくとも1つのコドンの改変を含む。したがって、配列最適化した核酸において、少なくとも1つのコドンは、参照配列(例えば、野生型配列)中の対応するコドンとは異なる。
概して、配列最適化した核酸は、参照配列中のコドンを同義のコドン(すなわち、同じアミノ酸をコードするコドン)と置換することを含む少なくとも1つのステップによって生成される。このような置換は、例えば、コドン置換マップ(すなわち、コドン最適化された配列中の各アミノ酸をコードすることになっているコドンを提供する表)を適用することによって、または法則セット(例えば、グリシンが中性アミノ酸の隣にある場合、グリシンはある特定のコドンによってコードされるであろうが、極性アミノ酸の隣にある場合は、別のコドンによってコードされるであろう)を適用することによってもたらすことができる。コドンの置換(すなわち、「コドンの最適化」)に加えて、本明細書に開示する配列の最適化法は、有害なモチーフの除去(不安定性モチーフの置換)など、コドン最適化を厳密に取り扱ってはいない追加の最適化ステップを含む。これらの配列最適化した核酸(例えば、RNA、例えば、mRNA)を含む組成物及び製剤は、機能的に活性のあるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドのin vivoでの発現を容易にするために、当該核酸を必要とする対象へ投与することができる。
細胞培養物中の大きな分子の組換え発現は、数多くの制限(例えば、不良なタンパク質発現レベル、切断型発現産物を結果として生じる失速した翻訳、タンパク質ミスフォールディングなど)をともなって、課題の残るものとなる可能性がある。これらの制限は、機能的に活性のあるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、RNA、例えば、mRNA)、あるいはこれらを含む組成物または製剤をがんに罹患している患者へ投与することによって低減または回避することができ、それにより、がんを治療するためのIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの合成及び送達が内在的に生じる。
in vitroでの発現系(例えば、細胞培養)からin vivoでの発現への変更は、治療剤をコードする核酸配列の再設計を必要とする。コードされたアミノ酸配列を必ずしも変化させることなく異なるコドンを選択することによって天然に存在する遺伝子配列を再設計することはしばしば、タンパク質発現レベルの劇的な上昇をもたらすことができる(Gustafsson et al.,2004,Journal/Trends Biotechnol 22,346-53)。コドン適応指標(CAI)、mRNAの二次構造、シス調節配列、GC含有量及び多くの他の類似の変数などの変数は、タンパク質発現レベルと幾分相関していることが示されてきた(Villalobos et
al.,2006,”Journal/BMC Bioinformatics 7,285)。しかしながら、遺伝暗号の縮重により、すべてが同じ治療剤をコードすることができる数多くの異なる核酸配列がある。各アミノ酸は、最多6個の同義のコドンによってコードされ、これらのコドン間の選択は、遺伝子発現に影響する。加えて、コドンの用法(すなわち、異なる生体がポリペプチド配列を発現するためのコドンを使用する頻度)は、生体間で異なる(例えば、ヒトまたはヒト化治療用抗体の組換え産生は、ハムスター細胞培養において頻繁に生じる)。
いくつかの実施形態において、参照核酸配列は、コドンマップを適用することによって最適化された配列であり得る。当業者は、以下に開示されるコドンマップにおけるT塩基がDNA中に存在するのに対し、このT塩基が、対応するRNA中のU塩基によって置き換えられるであろうことを認識することになっている。例えば、DNA形態、例えば、ベクターまたはin vitro翻訳(IVT)テンプレートにおける本明細書に開示する配列最適化した核酸は、その対応する転写されたmRNAに基づいたUとして転写されたT塩基を有するであろう。この点において、配列最適化したDNA配列(Tを含む)及びこれらの対応するRNA配列(Uを含む)はいずれも、本開示の配列最適化した核酸とみなされる。当業者は、等価のコドンマップが非天然塩基と置き換えられた1つまたは複数の塩基によって生成されることができることも理解するであろう。したがって、例えば、TTCコドン(DNAマップ)は、UUCコドン(RNAマップ)に対応するであろうし、これは順にΨΨCコドン(Uがシュードウリジンと置き換えられたRNAマップ)に対応し得る。
一実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照配列は、ある特定のアミノ酸をコードするコドン全部を、コドンマップにおいて提供される代替的なコドンのたった1つと置き換えることによって最適化することができる。例えば、最適化された配列中のバリンはすべて、GTGまたはGTCまたはGTTによってコードされるであろう。
本開示の配列最適化したポリヌクレオチドは、1つまたは複数のコドン最適化法、またはその組み合わせを用いて生成することができる。核酸配列に配列最適化を行うために使用され得る配列の最適化法は、本明細書で詳細に説明されている。この方法リストは、包括的でも制限するものでもない。
以下で考察する配列の最適化法の各1つについて説明される設計の原理及び法則が多くの異なる方法において組み合わせることができ、例えば、参照核酸配列のいくつかの領域についてはG/C含有量の高い配列の最適化、他の領域についてはウリジン含有量の高い配列の最適化、及び配列全体で二次構造を最小限にするまたは有害モチーフを除外するための標的されたヌクレオチドの変異であることは認識されるだろう。
配列の最適化法の起こり得る組み合わせの選択は、例えば、合成ポリヌクレオチドを生成するために使用する具体的な化学的プロセスにより得る。このような選択は、配列最適化した核酸によってコードされるタンパク質、例えば、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドなどを含む完全配列、機能的断片、または融合タンパク質の特徴にもより得る。いくつかの実施形態において、このような選択は、配列最適化された核酸(例えば、治療用合成mRNA)によって標的化される具体的な組織または細胞により得る。
配列の最適化法または最適化法の適用及び解析から得られた設計の法則を組み合わせる機序は、単純であるかまたは複雑であるかのいずれかであり得る。例えば、組み合わせは、以下であり得る:
(i)連続的:各配列の最適化法または設計の法則セットは、全体的な配列の異なる部分配列へ適用され、例えば、コドン位置1~30のウリジンを減少させ、次に、配列の残りについて高頻度のコドンを選択すること、
(ii)階層的:いくつかの配列の最適化法または設計の法則セットは、階層的な決定様式で組み合わされる。例えば、最も多いGC富化コドンを使用して、これらのコドンのうちの最も頻度の高いものを選択することによって関係(通常である関係)を断ち切る。
(iii)多因子的/多パラメータ的:機械学習または他のモデル化技術を用いて、複数の重複する及びおそらく矛盾した必要条件を最善に満たす単一の配列を設計する。このアプローチは、数学に関する多くの技術、例えば遺伝アルゴリズムを適用するコンピュータの使用を必要とするであろう。
最終的には、これらのアプローチの各1つは、多くの場合において単一コドン表に要約することができる具体的な法則セット、すなわち、標的タンパク質(すなわち、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチド)における各アミノ酸についてのコドンに関する選抜されたリストを結果として生じることができ、具体的な法則または法則セットは、各アミノ酸位置について具体的なコドンをどのように選ぶかを示している。
a ウリジン含有量最適化
核酸配列中に局所で高濃度のウリジンが存在すると、特に合成mRNAの生成において修飾ウリジン類似体が使用される場合、翻訳、例えば、遅いかまたは早期に終結した翻訳に有害な影響を及ぼし得る。さらに、高いウリジン含有量はまた、TLR活性化に起因して合成mRNAのin vivoでの半減期も低下し得る。
したがって、核酸配列は、少なくとも1つのウリジン含有量最適化ステップを含む方法を用いて配列最適化してもよい。そのようなステップは、例えば、参照核酸中の少なくとも1つのコドンを代替コドンで置換してウリジン修飾した配列を生成することを包含し、ここで、ウリジン修飾配列は、少なくとも1つの以下の特性を有する:
(i)全体的なウリジン含有量の増減;
(ii)局所的ウリジン含有量の増減(すなわち、ウリジン含有量の変化は特定のサブ配列に限定される);
(iii)全体的なウリジン含有量を変えないウリジン分布の変化;
(iv)ウリジンクラスタリングの変化(例えば、クラスターの数、クラスターの位置、またはクラスター間の距離);または
(v)それらの組合せ。
いくつかの実施形態において、配列の最適化プロセスは、全体的なウリジン含有量を最適化すること、すなわち、参照核酸配列中のウリジン核酸塩基の百分率に対して配列最適化核酸中のウリジン核酸塩基の百分率を最適化することを包含する。例えば、核酸塩基のうち30%が参照配列中のウリジンであってもよく、そして核酸塩基中の10%が配列最適化核酸中のウリジンであってもよい。
他の実施形態では、配列の最適化プロセスは、参照核酸配列の特定の領域における局所ウリジン含有量を低減すること、すなわち、参照核酸配列の対応するサブ配列中のウリジン核酸塩基の百分率に対する配列最適化核酸のサブ配列におけるウリジン核酸塩基の百分率を低減することを包含する。例えば、参照核酸配列は、30%の局所ウリジン含有量を有する5’末端領域(例えば、30コドン)を有してもよく、そしてその同じ領域におけるウリジン含有量は、配列最適化核酸において10%に減少されてもよい。
特定の実施形態において、例えば、タンパク質翻訳に有害な影響を及ぼし得るウリジンクラスターの数、サイズ、位置、または分布を、減少または改変するために、参照核酸配列中のコドンを置換してもよい。原則として、参照核酸配列のウリジン含有量を減らすことが望ましいが、ある特定の実施形態では、参照核酸配列のいくつかのサブ配列のウリジン含有量、特に局所的ウリジン含有量を増大してもよい。
翻訳に対する悪影響を回避するためのウリジン含有量の低減は、他の設計目標を達成するために本明細書に開示される他の最適化方法と組み合わせて行ってもよい。例えば、ほとんどのアミノ酸に最も稀なコドンを使用すると、いくつかの例外を除いてU含有量が減少するので、ウリジン含有量の最適化を、傾斜の設計と組み合わせてもよい。
いくつかの実施形態において、ウリジン修飾した配列は、参照核酸配列と比較したとき、より低いトール様受容体(TLR)応答を誘導するように設計されている。いくつかのTLRは、核酸を認識しそしてそれに応答する。頻繁なウイルス構成要素である二本鎖(ds)RNAは、TLR3を活性化することが示されている。Alexopoulou et al.(2001)Nature、413:732-738及びWang et al.(2004)Nat.Med.10:1366-1373を参照のこと。一本鎖(ss)RNAは、TLR7を活性化する。Diebold et al.(2004)Science 303:1529-1531を参照のこと。RNAオリゴヌクレオチド、例えばホスホロチオエートヌクレオチド間結合を有するRNAは、ヒトTLR8のリガンドである。Heil et al.(2004)Science 303:1526-1529を参照のこと。細菌性及びウイルス性DNAに特徴的な非メチル化CpGモチーフを含むDNAは、TLR9を活性化する。Hemmi et al.(2000)Nature、408:740-745を参照のこと。
本明細書中で使用される場合、「TLR応答」という用語は、TLR7受容体による一本鎖RNAの認識として定義され、そしていくつかの実施形態において、受容体による一本鎖RNAの認識によって引き起こされるRNAの分解及び/または生理学的応答を包含する。RNAのTLR7への結合を決定及び定量する方法は、当該技術分野において既知である。同様に、RNAがTLR7媒介生理学的応答(例えば、サイトカイン分泌)を誘発したか否かを決定するための方法は、当該技術分野において周知である。いくつかの実施形態において、TLR応答は、TLR7の代わりにTLR3、TLR8、またはTLR9によって媒介され得る。
TLR7媒介性応答の抑制は、ヌクレオシド修飾を介して達成され得る。RNAは、事実上、100を超える異なるヌクレオシド修飾を受けている(mods.rna.albany.eduで入手可能なRNA修飾データベースを参照のこと)。例えば、ヒトrRNAは、細菌性rRNAよりも10倍多いシュードウリジン(Ψ)及び25倍多い2’-O-メチル化ヌクレオシドを有する。細菌性mRNAは、ヌクレオシド修飾を含まないが、哺乳動物mRNAは、N7-メチルグアノシン(m7G)に加えて、5-メチルシチジン(m5C)、N6-メチルアデノシン(m6A)、イノシン及び多くの2’-O-メチル化ヌクレオシドのような修飾ヌクレオシドを有する。
RNAの2つの重要な特徴であるウラシル及びリボースは、TLR7刺激に必要かつ十分であり、短い一本鎖RNA(ssRNA)は、それらが近接していくつかのウリジンを含む限り、配列非依存的様式でTLR7アゴニストとして作用する。Diebold et al.(2006)Eur.Immunol.36:3256-3267(これはその全体が参照により本明細書に組み込まれる)を参照のこと。したがって、本明細書に開示される1つ以上の最適化方法は、(局所的及び/または局所的に)ウリジン含有量を低減すること、及び/またはTLR7媒介応答を低減もしくは抑制するためにウリジンクラスタリングを低減もしくは修飾することを包含する。
いくつかの実施形態において、ウリジン修飾した配列によって引き起こされるTLR応答(例えば、TLR7によって媒介される応答)は、参照核酸配列によって生じるTLR応答よりも、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%低い。
いくつかの態様において、参照核酸配列によって引き起こされるTLR応答は、ウリジン修飾した配列によって引き起こされるTLR応答よりも、少なくとも約1倍、少なくとも約1.1倍、少なくとも約1.2倍、少なくとも約1.3倍、少なくとも約1.4倍、少なくとも約1.5倍、少なくとも約1.6倍、少なくとも約1.7倍、少なくとも約1.8倍、少なくとも約1.9倍、少なくとも約2倍、少なくとも約3倍、少なくとも約4倍、少なくとも約5倍、少なくとも約6倍、少なくとも約7倍、少なくとも約8倍、少なくとも約9倍、または少なくとも約10倍高い。
いくつかの実施形態において、ウリジン修飾した配列のウリジン含有量(平均の全体的なウリジン含有量)(絶対的または相対的)は、参照核酸配列のウリジン含有量(絶対的または相対的)より高い。したがって、いくつかの実施形態において、ウリジン修飾した配列は、参照核酸配列よりも、少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%多いウリジンを含む。
他の実施形態では、ウリジン修飾した配列のウリジン含有量(平均の全体的なウリジン含有量)(絶対的または相対的)は、参照核酸配列のウリジン含有量(絶対的または相対的)より低い。したがって、いくつかの実施形態において、ウリジン修飾した配列は、参照核酸配列よりも、少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%ウリジンが少ない。
いくつかの実施形態において、ウリジン修飾した配列のウリジン含有量(平均の全体的なウリジン含有量)(絶対的または相対的)は、ウリジン修飾した配列中の全核酸塩基の50%、49%、48%、47%、46%、45%、44%、43%、42%、41%、40%、39%、38%、37%、36%、35%、34%、33%、32%、31%、30%、29%、28%、27%、26%、25%、24%、23%、22%、21%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%または1%未満である。いくつかの実施形態において、ウリジン修飾した配列のウリジン含有量は、約10%~約20%である。いくつかの特定の実施形態において、ウリジン修飾した配列のウリジン含有量は、約12%~約16%である。
いくつかの実施形態において、参照核酸配列のウリジン含有量は、スライディングウィンドウを用いて測定され得る。いくつかの実施形態において、スライディングウィンドウの長さは5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、または40核酸塩基である。いくつかの実施形態において、スライディングウィンドウは、長さが40核酸塩基を超える。いくつかの実施形態において、スライディングウィンドウは、長さが20核酸塩基である。スライディングウィンドウで測定されたウリジン含有量に基づいて、参照核酸配列及び配列最適化核酸の長さ全体にわたってウリジン含有量を表すヒストグラムを生成することが可能である。
いくつかの実施形態において、参照核酸配列は、ある特定の百分率値より上または下にあるヒストグラム中のピークを減少または排除するために修飾されてもよい。いくつかの実施形態において、参照核酸配列は、65%、60%、55%、50%、45%、40%、35%、または30%のウリジンを超えるスライディングウィンドウ提示においてピークを排除するように修飾されてもよい。別の実施形態では、20の核酸塩基スライディングウィンドウを用いて測定したときに、ピークが配列最適化核酸中に30%を超えるウリジンを含まないように、参照核酸配列を修飾してもよい。いくつかの実施形態において、参照核酸配列は、20の核酸塩基スライディングウィンドウを使用して測定したときに、配列最適化核酸配列中のピークの所定数以下または以上がある特定の閾値を上回るかまたは下回るように修飾されてもよい。例えば、いくつかの実施形態において、参照核酸配列は、配列最適化核酸中のピークがないかまたは1、2、3、4、5、6、7、8、9もしくは10を超えないピークが、10%、15%、20%、25%または30%超のウリジンであるように修飾されてもよい。別の実施形態では、配列最適化核酸は、30%以上高いウリジン含有量を有する0個~2個のピークを含む。
いくつかの実施形態において、参照核酸配列は、連続したウリジンの発生を減らすために配列最適化されてもよい。例えば、2つの連続したロイシンは、4つのウリジンクラスターを含むであろう配列CUUUUGによってコード化され得る。そのようなサブ配列は、ウリジンクラスターを効果的に除去するであろうCUGCUCで置換されてもよい。したがって、参照核酸配列は、ウリジン対(UU)、ウリジントリプレット(UUU)またはウリジンクアドラプレット(UUUU)を減少または排除することによって配列最適化され得る。Uの高次の組合せは、低次の組合せの組合せとは見なされない。したがって、例えば、UUUUは、厳密にクアドラプレットであり、2つの連続したUの対ではないとみなされる;またはUUUUUUは、セクスタプレットであって、3つの連続したUの対でもなく、または2つの連続したUのトリプレットなどでもないと見なされる。
いくつかの実施形態において、全てのウリジン対(UU)及び/またはウリジントリプレット(UUU)及び/またはウリジンクアドラプレット(UUUU)を、参照核酸配列から除去してもよい。他の実施形態では、ウリジン対(UU)及び/またはウリジントリプレット(UUU)及び/またはウリジンクアドラプレット(UUUU)は、ある特定の閾値を下回って、配列最適化核酸中に例えば、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20回を超えない出現まで低減されてもよい。特定の実施形態では、配列最適化核酸は、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2または1つ未満のウリジン対を含む。別の特定の実施形態では、配列最適化核酸は、ウリジンの対及び/またはトリプレットを含まない。
フェニルアラニンコドン、すなわちUUCまたはUUUは、ウリジンの対またはトリプレットを含み、したがって、ウリジン含有量を低減するための配列の最適化は、多くともフェニルアラニンUのトリプレットをフェニルアラニンUの対に低減し得る。いくつかの実施形態において、ウリジン対(UU)及び/またはウリジントリプレット(UUU)の出現は、非フェニルアラニンUの対またはトリプレットのみを指す。したがって、いくつかの実施形態において、非フェニルアラニンウリジンの対(UU)及び/またはウリジンのトリプレット(UUU)は、配列最適化核酸中で、ある特定の閾値、例えば、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20回を超えない出現に減少されてもよい。特定の実施形態において、配列最適化核酸は、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、または1未満の非フェニルアラニンウリジンの対及び/またはトリプレットを含む。別の特定の実施形態では、配列最適化核酸は、非フェニルアラニンウリジン対及び/またはトリプレットを含まない。
いくつかの実施形態において、配列最適化核酸におけるウリジンの組合せ(例えば、対、トリプレット、クアドラプレット)の減少は、参照核酸配列に存在するウリジンの組合せに対する減少率として表されてもよい。
いくつかの実施形態において、配列最適化核酸は、参照核酸配列中に存在するウリジン対の総数の約1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、または65%を含んでもよい。いくつかの実施形態において、配列最適化核酸は、参照核酸配列中に存在するウリジンのトリプレットの総数の約1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、または65%を含んでもよい。いくつかの実施形態において、配列最適化核酸は、参照核酸配列中に存在するウリジンのクアドラプレットの総数の約1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、または65%を含んでもよい。
いくつかの実施形態において、配列最適化核酸は、参照核酸配列中に存在する非フェニルアラニンウリジンの対の総数の約1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、または65%を含んでもよい。いくつかの実施形態において、配列最適化核酸は、参照核酸配列中に存在する非フェニルアラニンウリジンのトリプレットの総数の約1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、または65%を含んでもよい。
いくつかの実施形態において、配列最適化配列中のウリジン含有量は、配列中の理論上の最小ウリジン含有量に関して表現されてもよい。「理論上の最小ウリジン含有量」という用語は、配列内の全てのコドンが最も低いウリジン含有量を持つ同義コドンに置き換えられた後の、核酸配列のウリジン含有量をその配列の長さの百分率として定義している。いくつかの実施形態において、配列最適化核酸のウリジン含有量は、参照配列(例えば、野生型配列)の理論上の最小ウリジン含有量と同一である。いくつかの態様では、配列最適化核酸のウリジン含有量は、参照配列(例えば、野生型配列)の理論上の最小ウリジン含有量の約90%、約95%、約100%、約105%、約110%、約115%、約120%、約125%、約130%、約135%、約140%、約145%、約150%、約155%、約160%、約165%、約170%、約175%、約180%、約185%、約190%、約195%または約200%である。
いくつかの実施形態において、配列最適化核酸のウリジン含有量は、参照配列(例えば、野生型配列)の理論上の最小ウリジン含有量と同一である。
参照核酸配列(例えば、野生型配列)は、それらの数、サイズ、位置、分布またはそれらの組合せに起因して翻訳に悪影響を及ぼすウリジンクラスターを含む場合がある。本明細書中で使用される場合、「ウリジンクラスター」という用語は、ある特定の閾値を超えるウリジン含有量(通常、百分率として記載される)を含む参照核酸配列または配列最適化核酸配列中のサブ配列を指す。したがって、ある特定の実施形態では、サブ配列が約10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%または65%を超えるウリジン含有量を含む場合、そのようなサブ配列は、ウリジンクラスターと見なされる。
ウリジンクラスターの悪影響は、例えば、TLR7反応を誘発することであり得る。したがって、本明細書に開示される核酸配列の最適化方法のいくつかの実施態様では、クラスターの数、クラスターのサイズ、クラスターの位置(例えば、核酸配列の5’及び/または3’末端近く)、クラスター間の距離、またはウリジンクラスターの分布(例えば、核酸配列に沿ったクラスターのある特定のパターン、発現産物中の二次構造要素に関するクラスターの分布、またはmRNAの二次構造に対するクラスターの分布)を減らすことが望ましい。
いくつかの実施形態において、参照核酸配列は少なくとも1つのウリジンクラスターを含み、ここで前記ウリジンクラスターは、参照核酸配列のサブ配列であり、前記サブ配列中の総ウリジン核酸塩基の百分率は、所定の閾値を超える。いくつかの実施形態において、サブ配列の長さは少なくとも約10、少なくとも約15、少なくとも約20、少なくとも約25、少なくとも約30、少なくとも約35、少なくとも約40、少なくとも約45、少なくとも約50、少なくとも約55、少なくとも約60、少なくとも約65、少なくとも約70、少なくとも約75、少なくとも約80、少なくとも約85、少なくとも約90、少なくとも約95、または少なくとも約100核酸塩基である。いくつかの実施形態において、このサブ配列は100核酸塩基より長い。いくつかの実施形態において、閾値は、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%または25%のウリジン含有量である。いくつかの実施形態において、閾値は25%を超える。
例えば、A、D、G、S及びRを含むアミノ酸配列は、核酸配列GCU、GAU、GGU、AGU、CGUによってコードされ得る。そのような配列はウリジンの対、トリプレット、またはクアドラプレットを含まないが、核酸塩基の3分の1はウリジンであろう。そのようなウリジンクラスターは、代替のコドンを使用することによって、例えば、ウリジンを含まないであろう、GCC、GAC、GGC、AGC、及びCGCを使用することによって除去されてもよい。
他の実施形態では、参照核酸配列は、少なくとも1つのウリジンクラスターを含み、前記ウリジンクラスターは、参照核酸配列のサブ配列であり、前記サブ配列のウリジン核酸塩基の百分率は、所定の閾値を上回るスライディングウィンドウを用いて測定される。いくつかの実施形態において、スライディングウィンドウの長さは5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、または40核酸塩基である。いくつかの実施形態において、スライディングウィンドウは、長さが40核酸塩基を超える。いくつかの実施形態において、閾値は、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%または25%のウリジン含有量である。いくつかの実施形態において、閾値は25%を超える。
いくつかの実施形態において、参照核酸配列は、少なくとも2つのウリジンクラスターを含む。いくつかの実施形態において、ウリジン修飾した配列は、参照核酸配列よりも少ないウリジンに富むクラスターを含む。いくつかの実施形態において、ウリジン修飾した配列は、参照核酸配列よりも多くのウリジン富化クラスターを含む。いくつかの実施形態において、ウリジン修飾した配列は、参照核酸配列中の対応するウリジン富化クラスターよりも長さが短いウリジン富化クラスターを含む。他の実施形態では、ウリジン修飾した配列は、参照核酸配列中の対応するウリジン富化クラスターよりも長さが長いウリジン富化クラスターを含む。
Kariko et al.(2005)Immunity 23:165-175;Kormann et al.(2010)Nature Biotechnology
29:154-157;またはSahin et al.(2014)Nature Reviews Drug Discovery 1 AOP、オンライン公開2014年9月19日m doi:10.1038/nrd4278(それらの全ては、それらの全体が参照により本明細書に組み込まれる)を参照のこと。
b.グアニン/シトシン(G/C)含有量
参照核酸配列は、参照核酸配列のグアニン/シトシン(G/C)含有量(絶対的または相対的)を変えることを包含する方法を用いて配列最適化してもよい。そのような最適化は、参照核酸配列の全体的なG/C含有量(絶対的または相対的)を変更する(例えば、増大または減少させる)こと;参照核酸配列中のG/C含有量の局所的変化を導入すること(例えば、参照核酸配列中の選択された領域またはサブ配列においてG/Cを増大または減少させる);参照核酸配列中のG/Cクラスターの頻度、サイズ、及び分布を変化させること、またはそれらの組合せを包含し得る。
いくつかの実施形態において、IL-23、IL-36ガンマ及び/またはOX40Lポリペプチドをコードする配列最適化核酸は、参照核酸配列のG/C含有量(絶対的または相対的)と比較してG/C含有量(絶対的または相対的)の全体的な増加を含む。いくつかの実施形態において、G/C含有量の全体的な増加(絶対的または相対的)は、参照核酸配列のG/C含有量(絶対的または相対的)に対して、少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%である。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする配列最適化核酸は、参照核酸配列のG/C含有量に対するG/C含有量(絶対的または相対的)の全体的な減少を含む。いくつかの実施形態において、G/C含有量の全体的な減少(絶対的または相対的)は、参照核酸配列のG/C含有量(絶対的または相対的)に対して少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%である。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする配列最適化核酸は、参照核酸配列中の対応するサブ配列のG/C含有量(絶対的または相対的)に対するサブ配列(すなわち、G/C修飾サブ配列)におけるグアニン/シトシン(G/C)含有量(絶対的または相対的)の局所的な増加を含む。いくつかの実施形態において、G/C含有量の局所的な増加(絶対的または相対的)は、参照核酸配列中の対応するサブ配列のG/C含有量(絶対的または相対的)に対して少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%までである。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする配列最適化核酸は、参照核酸配列中の対応するサブ配列のG/C含有量(絶対的または相対的)に対するサブ配列(すなわち、G/C修飾サブ配列)におけるグアニン/シトシン(G/C)含有量の(絶対的または相対的な)局所的な減少を含む。いくつかの実施形態において、G/C含有量の局所的な減少(絶対的または相対的)は、参照核酸配列中の対応するサブ配列のG/C含有量(絶対的または相対的)に対して、少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%である。
いくつかの実施形態において、G/C含有量(絶対的または相対的)は、サブ配列中で増加されるかまたは減少され、これは少なくとも約5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、または100核酸塩基の長さである。
いくつかの実施形態において、G/C含有量(絶対的または相対的)は、サブ配列中で増加されるかまたは減少され、これは少なくとも約100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800、810、820、830、840、850、860、870、880、890、900、910、920、930、940、950、960、970、980、990、または1000の核酸塩基の長さである。
いくつかの実施形態において、G/C含有量(絶対的または相対的)は、サブ配列中で増加されるかまたは減少され、これは少なくとも約1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000、5100、5200、5300、5400、5500、5600、5700、5800、5900、6000、6100、6200、6300、6400、6500、6600、6700、6800、6900、7000、7100、7200、7300、7400、7500、7600、7700、7800、7900、8000、8100、8200、8300、8400、8500、8600、8700、8800、8900、9000、9100、9200、9300、9400、9500、9600、9700、9800、9900、または10000の核酸塩基の長さである。
本明細書に記載のG及びCの含有量(絶対的または相対的)の増加または減少は、低いG/C含有量を有する同義コドンを、より高いG/C含有量を有する同義コドンで置換することによって、またはその逆によっても同様に行われ得る。例えば、Lは6つの同義コドンを持ち、そのうちの2つは2G/Cを有し(CUC、CUG)、3つは単一のG/Cを有し(UUG、CUU、CUA)、1つはG/Cを有さない(UUA)。したがって、参照核酸がある特定の位置にCUCコドンを有する場合、その位置でのG/C含有量は、CUCを単一のG/Cを有するコドンまたはG/Cを有さないコドンのいずれかと置き換えることによって減少されてもよい。
米国特許出願公開第20140228558号、同第20050032730 A1号;Gustafsson et al.(2012)Protein Expression and Purification 83:37-46を参照のこと(それらの全ては、その全体が参照により本明細書に組み込まれる)。
c.コドン頻度-コドン使用頻度バイアス
当該技術分野において既知である多数のコドン最適化方法は、参照核酸配列中のコドンをより高い頻度を有するコドンで置換することに基づく。したがって、いくつかの実施形態において、本明細書に開示されているIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする核酸配列は、非コドン最適化配列での使用頻度に関して、配列最適化核酸中の他の同義コドンと比較して1個以上のコドンの使用頻度における修飾の使用を含む方法を用いて配列最適化され得る。
本明細書中で使用される場合、「コドン頻度」という用語は、コドン使用頻度バイアス、すなわち、DNA/RNAのコードにおける同義コドンの出現頻度の相違を指す。コドン選択は、突然変異のバイアスと翻訳の最適化のための自然な選択との間のバランスを反映することが一般に認められている。最適なコドンは、より速い翻訳速度と高い精度を達成することを助ける。これらの要因の結果として、翻訳選択は、高度に発現された遺伝子においてより強力であると予想される。バイオインフォマティクス及び計算生物学の分野では、コドン使用頻度バイアスを分析するために多くの統計的方法が提案され使用されてきた。例えば、Comeron & Aguade(1998)J.Mol.Evol.47:268-74.‘frequency of optimal codons’(Fop)(Ikemura(1981)J.Mol.Biol.151(3):389-409)、the Relative Codon Adaptation(RCA)(Fox & Eril(2010)DNA Res.17(3):185-96)または‘Codon Adaptation Index’(CAI)(Sharp & Li(1987)Nucleic Acids Res.15(3):1281-95)のような方法を用いて遺伝子発現レベルを予測するが、一方で、情報理論による「effective number of codons」(Nc)及びShannonエントロピーなどの方法が、コドン使用頻度の均一性を測定するために使用される。対応分析及び主成分分析などの多変量統計法は、遺伝子間のコドン使用頻度の変動を分析するために広く使用されている(Suzuki et al.(2008)DNA Res.15(6):357-65;Sandhu et al.,In Silico Biol.2008;8(2):187-92)。
本明細書に開示されるIL-23、IL-36ガンマ及び/またはOX40Lポリペプチドをコードする核酸配列(例えば、野生型核酸配列、変異型核酸配列、キメラ核酸配列など、これは例えば、mRNAであってもよい)は、参照核酸配列中の少なくとも1つのコドンを、同義コドンセット中でより高いコドン頻度またはより低いコドン頻度を有する代替コドンで置換することを包含する方法を使用してコドン最適化され得る;ここで、得られた配列最適化核酸は、参照核酸配列に対して少なくとも1つの最適化特性を有する。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列中のコドンの少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%は代替コドンで置換され、各代替コドンは、同義コドンセット中の置換コドンのコドン頻度より高いコドン頻度を有する。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列中の少なくとも1つのコドンは、同義コドンセット中の置換コドンのコドン頻度より高いコドン頻度を有する代替コドンで置換され、参照核酸配列中の少なくとも1つのコドンは、同義コドンセット中の置換コドンのコドン頻度より低いコドン頻度を有する代替コドンで置換されている。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列中のコドンのうち少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、または少なくとも約75%は、代替コドンで置換され、各代替コドンは同義コドンセット中の置換コドンのコドン頻度より高いコドン頻度を有する。
いくつかの実施形態において、より高いコドン頻度を有する少なくとも1つの代替コドンは、同義コドンセットにおいて最も高いコドン頻度を有する。他の実施形態では、より高いコドン頻度を有する全ての代替コドンは、同義コドンセットにおいて最も高いコドン頻度を有する。
いくつかの実施形態において、より低いコドン頻度を有する少なくとも1つの代替コドンは、同義コドンセットの中で最も低いコドン頻度を有する。いくつかの実施形態において、より高いコドン頻度を有する全ての代替コドンは、同義コドンセットにおいて最も高いコドン頻度を有する。
いくつかの特定の実施形態において、少なくとも1つの代替コドンは、同義コドンセットにおいて2番目に高いか、3番目に高いか、4番目に高いか、5番目に高いか、または6番目に高い頻度を有する。いくつかの特定の実施形態において、少なくとも1つの代替コドンは、同義コドンセットにおいて2番目に低いか、3番目に低いか、4番目に低いか、5番目に低いか、または6番目に低い頻度を有する。
コドン頻度に基づく最適化は、上記のように、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列に対して全体的に、または局所的に適用することができる。いくつかの実施形態において、局所的に適用される場合、参照核酸配列の領域は、コドン頻度に基づいて改変され得、ある特定のサブ配列におけるコドンの全部またはある特定の百分率をそれぞれの同義コドンセットにおいてより高いまたはより低い頻度を有するコドンで置換する。したがって、いくつかの実施形態において、参照核酸配列のサブ配列中のコドンの少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約99%、または100%が代替コドンで置換され、各代替コドンは、同義コドンセット中の置換コドンのコドン頻度より高いコドン頻度を有する。
いくつかの実施形態において、IL-23、IL-36ガンマ及び/またはOX40Lポリペプチドをコードする参照核酸配列のサブ配列中の少なくとも1つのコドンは、同義コドンセット中の置換コドンのコドン頻度より高いコドン頻度を有する代替コドンで置換されており、参照核酸配列のサブ配列中の少なくとも1つのコドンは、同義コドンセット中の置換コドンのコドン頻度より低いコドン頻度を有する代替コドンで置換されている。
いくつかの実施形態において、IL-23及び/またはIL-36ガンマ、IL-18ポリペプチドをコードする参照核酸配列のサブ配列中のコドンのうち、少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、または少なくとも約75%は代替コドンで置換され、各代替コドンは、同義コドンのセット中の置換コドンのコドン頻度より高いコドン頻度を有する。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列のサブ配列において置換され、より高いコドン頻度を有する少なくとも1つの代替コドンが、同義コドンセットにおいて最も高いコドン頻度を有する。他の実施形態では、参照核酸配列のサブ配列において置換され、より低いコドン頻度を有する全ての代替コドンは、同義コドンセットにおいて最も低いコドン頻度を有する。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列のサブ配列において置換され、より低いコドン頻度を有する少なくとも1つの代替コドンは、同義コドンセットにおいて、最も低いコドン頻度を有する。いくつかの実施形態において、参照核酸配列のサブ配列において置換され、より高いコドン頻度を有する全ての代替コドンは、同義コドンセットにおいて最も高いコドン頻度を有する。
特定の実施形態では、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする配列最適化核酸は、特定の位置、例えば配列最適化核酸の5’末端もしくは3’末端、またはそれらの領域から所定の距離内(例えば、配列最適化核酸の5’末端または3’末端から少なくとも1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95または100コドン)で、参照核酸配列の対応するサブ配列中の全体コドン頻度より高いかまたは低い全体コドン頻度を有するサブ配列を含んでもよい。
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする配列最適化核酸は、参照核酸配列の対応するサブ配列において、その全体のコドン頻度より高いかまたは低い全体のコドン頻度を有する2つ以上のサブ配列を含み得る。当業者は、全体のコドン頻度が高いか、または低いサブ配列が、その全体的なコドン頻度が、高いかまたは低いか、サブ配列の長さ、サブ配列間の距離、サブ配列の位置などに応じて、無数のパターンで組織化され得ることを理解する。
米国特許第5082767号、同第8126653号、同第7561973号、同第8401798号、米国特許出願公開第20080046192号、同第20080076161号;国際公開番号WO2000018778;Welch et al.(2009)PLoS ONE 4(9):e7002;Gustafsson et al.(2012)Protein Expression and Purification
83:37-46;Chung et al.(2012)BMC Systems Biology 6:134(それらの全ては、その全体が参照により本明細書に組み込まれる)を参照のこと。
d.モチーフ置換の不安定化
配列の最適化に影響を与え得るモチーフは種々あるが、それらは、例えば、以下の種々の非排他的なカテゴリに収まる:
(i)一次配列に基づくモチーフ:ヌクレオチドの単純な配置によって定義されるモチーフ。
(ii)構造モチーフ:ある特定の二次構造を形成する傾向があるヌクレオチドの配列によってコードされるモチーフ。
(iii)局所モチーフ:1つの連続したサブ配列においてコードされたモチーフ。
(iv)分散モチーフ:2つ以上のバラバラなサブ配列においてコードされたモチーフ。(v)有利なモチーフ:ヌクレオチドの構造または機能を改善するモチーフ。
(vi)不利なモチーフ:ヌクレオチドの構造または機能に悪影響を及ぼすモチーフ。
不利なモチーフのカテゴリに収まる多くのモチーフがある。いくつかの例としては、例えば、比較的短い傾向がある制限酵素モチーフ、正確な配列、例えば、Xba1(TCTAGA)、EcoRI(GAATTC)、EcoRII(CCWGG、Wは、IUPAC多義性コードにそって、AまたはTを意味する)またはHindIII(AAGCTT)の制限部位モチーフ;酵素部位であって、T7 RNAポリメラーゼ(GnnnnWnCRnCTCnCnnWnD、ここでnは任意のヌクレオチドを意味し、RはAまたはGを意味し、WはAまたはTを意味し、DはAまたはGまたはTを意味するがCではない)などにおける、より長い傾向であり、コンセンサスで正確でない配列に基づく酵素部位;GGGGリピートのような構造モチーフ(Kim et al.(1991)Nature
351(6324):331-2);またはCUG-トリプレットリピートのような他のモチーフ(Querido et al.(2014)J.Cell Sci.124:1703-1714)が挙げられる。
したがって、本明細書に開示されるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする核酸配列は、参照核酸配列中の少なくとも1つの不安定化モチーフを置換すること、そのような不利なモチーフを除去すること、またはそれを有利なモチーフと置き換えることを包含する方法を用いて配列最適化されてもよい。
いくつかの実施形態において、最適化プロセスは、参照核酸配列中の有利及び/または不利なモチーフを同定することを包含し、そのようなモチーフは、例えば、最適化プロセスの前または最中に参照核酸配列の安定性の喪失を引き起こし得る特定のサブ配列である。例えば、最適化の間の特定の塩基の置換は、制限酵素によって認識されるサブ配列(モチーフ)を生成し得る。従って、最適化プロセスの間、配列最適化配列を、不利であることが公知のモチーフのライブラリーと比較することによって、不利なモチーフの出現をモニターしてもよい。次いで、不利なモチーフの同定を、事後フィルタとして使用して、すなわち、参照核酸配列に潜在的に導入され得るある特定の修飾を実際に実施すべきか否かを決定してもよい。
いくつかの実施形態において、不利なモチーフの同定は、本明細書に開示される配列の最適化方法の適用、すなわち、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列におけるモチーフの同定の前に使用されてもよく、それらの代替核酸配列との置換は、例えばウリジン減少の前の前処理ステップとして使用してもよい。
他の実施形態では、不利なモチーフの同定及びそれらの除去は、本明細書に開示されている2つ以上の配列の最適化方法を含む多様性核酸最適化方法に統合された追加の配列最適化技術として用いられる。この様式で使用される場合、最適化プロセスの間に同定された不利なモチーフは、例えば、元の設計原理をできるだけ厳密に保存するために、可能な限り少ない数の核酸塩基を置換することによって除去される(例えば、低いU.高い頻度など)。
例えば、それら全体が参照によって本明細書に組み込まれる、米国特許出願公開第20140228558号、同第20050032730号、または同第20140228558号を参照のこと。
e.制限されたコドンセット最適化
いくつかの特定の実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする参照核酸配列の配列の最適化は、制限コドンセット、例えば、あるコドンセット(ここで天然の数未満のコドンを使用して、20個の天然アミノ酸、20個の天然アミノ酸のサブセット、または例えば非天然アミノ酸を含むアミノ酸の拡張セットをコードする)を使用して実施できる。
遺伝子コードは全ての生物体の間で極めて類似しており、タンパク質翻訳に含まれる20の標準アミノ酸に加えて開始コドン及び停止コドンをコードする、64の項目を含む単純な表で表され得る。遺伝子コードは縮重しており、すなわち、一般に、2つ以上のコドンが各アミノ酸を特定する。例えば、アミノ酸ロイシンは、UUA、UUG、CUU、CUC、CUA、またはCUGコドンで指定され、一方で、アミノ酸セリンは、UCA、UCG、UCC、UCU、AGU、またはAGCコドンで指定される(1番目、2番目、または3番目の位置における相違)。天然の遺伝子コードは、天然に存在するアミノ酸をコードする62コドンを含む。したがって、本明細書に開示される方法のいくつかの実施形態において、20個のアミノ酸をコードするために62個未満のコドンを含む最適化コドンセット(遺伝子コード)は、61、60、59、58、57、56、55、54、53、52、51、50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、30、29、28、27、26、25、24、23、22、21、または20コドンを含んでもよい。
いくつかの実施形態において、制限コドンセットは、20未満のコドンを含む。例えば、あるタンパク質が20種類未満のアミノ酸を含む場合、そのようなタンパク質は、20未満のコドンを有するコドンセットによってコードされ得る。したがって、いくつかの実施形態において、最適化コドンセットは、参照核酸配列によってコードされるタンパク質中に異なる種類のアミノ酸が存在するのと同数のコドンを含む。いくつかの実施形態において、最適化コドンセットは、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、さらには1つのコドンを含む。
いくつかの態様では、Ala、Arg、Asn、Asp、Cys、Gln、Glu、Gly、His、Ile、Leu、Lys、Phe、Pro、Ser、Thr、Tyr、及びValからなる群より選択される少なくとも1つのアミノ酸、すなわち、2つ以上のコドンによって天然にコードされているアミノ酸は、天然に存在する同義コドンの数より少ないコドンでコードされている。例えば、いくつかの実施形態において、Alaは、3、2または1コドンによって配列最適化核酸中でコードされ得る;Cysは、配列最適化核酸において1コドンでコードされ得る;Aspは、配列最適化核酸において1コドンでコードされ得る;Gluは、配列最適化核酸において1コドンでコードされ得る;Pheは、配列最適化核酸において1コドンでコードされ得る;Glyは、配列最適化核酸において3コドン、2コドンまたは1コドンでコードされ得る;Hisは、配列最適化核酸において1コドンでコードされ得る;Ileは、配列最適化核酸において2コドンまたは1コドンでコードされ得る;Lysは、配列最適化核酸において1コドンでコードされ得る;Leuは、配列最適化核酸において5コドン、4コドン、3コドン、2コドンまたは1コドンによってコードされ得る;Asnは、配列最適化核酸において1コドンでコードされ得る;Proは、配列最適化核酸において3コドン、2コドン、または1コドンによってコードされ得る;Glnは、配列最適化核酸において1コドンでコードされ得る;Argは、配列最適化核酸において5コドン、4コドン、3コドン、2コドン、または1コドンによってコードされ得る;Serは、配列最適化核酸において、5コドン、4コドン、3コドン、2コドン、または1コドンによってコードされ得る;Thrは、配列最適化核酸において、3コドン、2コドン、または1コドンによってコードされ得る;Valは、配列最適化核酸において、3コドン、2コドン、または1コドンによってコードされ得る;そして、Tyrは、配列最適化核酸において1コドンによってコードされ得る。
いくつかの実施形態において、Ala、Arg、Asn、Asp、Cys、Gln、Glu、Gly、His、Ile、Leu、Lys、Phe、Pro、Ser、Thr、Tyr、及びValからなる群より選択される少なくとも1つのアミノ酸、すなわち、2つ以上のコドンによって天然にコードされるアミノ酸は、制限されたコドンセット中の単一のコドンによってコードされる。
いくつかの特定の実施形態において、配列最適化核酸はDNAであり、制限コドンセットは20個のコドンからなり、ここで各コドンは、20個のアミノ酸のうちの1個をコードする。いくつかの実施形態において、配列最適化核酸は、DNAであり、制限コドンセットは、GCT、GCC、GCA、及びGCGからなる群より選択される少なくとも1つのコドン;CGT、CGC、CGA、CGG、AGA、及びAGGからなる群より選択される少なくとも1つのコドン;AATまたはACCから選択される少なくとも1つのコドン;GATまたはGACから選択される少なくとも1つのコドン;TGTまたはTGCから選択される少なくとも1つのコドン;CAAまたはCAGから選択される少なくとも1つのコドン;GAAまたはGAGから選択される少なくとも1つのコドン;GGT、GGC、GGA、及びGGGからなる群より選択される少なくとも1つのコドン;CATまたはCACから選択される少なくとも1つのコドン;ATT、ATC、及びATAからなる群より選択される少なくとも1つのコドン;TTA、TTG、CTT、CTC、CTA、及びCTGからなる群より選択される少なくとも1つのコドン;AAAまたはAAGから選択される少なくとも1つのコドン;ATGコドン;TTTまたはTTCから選択される少なくとも1つのコドン;CCT、CCC、CCA、及びCCGからなる群より選択される少なくとも1つのコドン;TCT、TCC、TCA、TCG、AGT、及びAGCからなる群より選択される少なくとも1つのコドン;ACT、ACC、ACA、及びACGからなる群より選択される少なくとも1つのコドン;TGGコドン;TATまたはTACから選択される少なくとも1つのコドン;ならびにGTT、GTC、GTA及びGTGからなる群より選択される少なくとも1つのコドンを含む。
他の実施形態では、配列最適化核酸は、RNA(例えば、mRNA)であり、制限コドンセットは20コドンからなり、ここで各コドンは20アミノ酸のうちの1つをコードする。いくつかの実施形態において、配列最適化核酸はRNAであり、制限コドンセットは、GCU、GCC、GCA、及びGCGからなる群より選択される少なくとも1つのコドン;CGU、CGC、CGA、CGG、AGA、及びAGGからなる群より選択される少なくとも1つのコドン;AAUまたはACCから選択される少なくとも1つのコドン;GAUまたはGACから選択される少なくとも1つのコドン;UGUまたはUGCから選択される少なくとも1つのコドン;CAAまたはCAGから選択される少なくとも1つのコドン;GAAまたはGAGから選択される少なくとも1つのコドン;GGU、GGC、GGA、及びGGGからなる群より選択される少なくとも1つのコドン;CAUまたはCACから選択される少なくとも1つのコドン;AUU、AUC、及びAUAからなる群より選択される少なくとも1つのコドン;UUA、UUG、CUU、CUC、CUA、及びCUGからなる群より選択される少なくとも1つのコドン;AAAまたはAAGから選択される少なくとも1つのコドン;AUGコドン;UUUまたはUUCから選択される少なくとも1つのコドン;CCU、CCC、CCA、及びCCGからなる群より選択される少なくとも1つのコドン;UCU、UCC、UCA、UCG、AGU、及びAGCからなる群より選択される少なくとも1つのコドン;ACU、ACC、ACA、及びACGからなる群より選択される少なくとも1つのコドン;UGGコドン;UAUまたはUACから選択される少なくとも1つのコドン;ならびにGUU、GUC、GUA及びGUGからなる群より選択される少なくとも1つのコドンを含む。
いくつかの特定の実施形態において、制限されたコドンセットは、ある特定の組織または細胞への投与後の配列最適化核酸(例えば、合成mRNA)のin vivoでの発現について最適化されている。
いくつかの実施形態において、最適化コドンセット(例えば、20個のアミノ酸をコードする20個のコドンセット)は、少なくとも以下の特性のうちの1つに適合する:
(i)最適化されたコドンセットは、元のまたは天然コドンセットよりも高い平均G/C含有量を有するか;または、
(ii)最適化コドンセットは、元のもしくは天然コドンセットよりも低い平均U含有量を有するか;または、
(iii)最適化コドンセットは、最も高い頻度のコドンから構成されるか;または、
(iv)最適化コドンセットは、最も低い頻度のコドンから構成されるか;または、
(v)それらの組合せ。
いくつかの特定の実施形態において、最適化コドンセット中の少なくとも1つのコドンは、同義コドンセット中で2番目に高いか、3番目に高いか、4番目に高いか、5番目に高いか、または6番目に高い頻度を有する。いくつかの特定の実施形態において、最適化コドン中の少なくとも1つのコドンは、同義コドンセット中で2番目に低いか、3番目に低いか、4番目に低いか、5番目に低いか、または6番目に低い頻度を有する。
本明細書中で使用される場合、「天然コドンセット」という用語は、参照核酸配列をコードするために起源の生物体によって天然に使用されるコドンセットを指す。本明細書中で使用される場合、「元のコドンセット」という用語は、配列の最適化の開始前に参照核酸配列をコードするために使用されるコドンセット、または配列の最適化が、反復的または再帰的に適用される、新しい最適化反復の開始の時点で、参照核酸配列の最適化バリアントをコードするために使用されるコドンセットを指す。
いくつかの実施形態において、コドンセット中のコドンの5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%が、最も高い頻度を有するコドンである。他の実施形態では、コドンセット中のコドンの5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%が最も低い頻度を有するコドンである。
いくつかの実施形態において、コドンセット中のコドンの5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%が最も高いウリジン含有量を有するコドンである。いくつかの実施形態において、コドンセット中のコドンの5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%が最も低いウリジン含有量を有するコドンである。
いくつかの実施形態において、コドンセット中の平均G/C含有量(絶対的または相対的)は、元のコドンセットの平均G/C含有量(絶対的または相対的)よりも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%高い。いくつかの実施形態において、コドンセットの平均G/C含有量(絶対的または相対的)は、元のコドンセットの平均G/C含有量(絶対的または相対的)よりも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%低い。
いくつかの実施形態において、コドンセットのウラシル含有量(絶対的または相対的)は、元のコドンセットの平均ウラシル含有量(絶対的または相対的)よりも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%高い。いくつかの実施形態において、コドンセットのウラシル含有量(絶対的または相対的)は、元のコドンセットの平均ウラシル含有量(絶対的または相対的)より、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%低い。
また、米国特許出願公開第2011/0082055号、及び国際公開番号WO2000018778号(その両方とも参照によりその全体が本明細書に組み込まれる)も参照のこと。
VIII.配列最適化核酸の特性決定
本開示のいくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする、本明細書に開示の配列最適化核酸を含むポリヌクレオチド(例えばRNA、例えばmRNA)を、少なくとも1つの核酸配列特性(例えば、ヌクレアーゼに曝されたときの安定性)または発現特性が、配列最適化されていない核酸に対して改善されているか否か決定するために試験してもよい。
本明細書中で使用される場合、「発現特性」とは、in vivoで(例えば、それを必要とする対象への投与後の合成mRNAの翻訳効率)またはin vitroでの(例えば、in vitroのモデル系で試験された合成mRNAの翻訳効率)のいずれかにおける核酸配列の特性を指す。発現特性としては、限定するものではないが、投与後にIL-23、IL-36ガンマ、IL-18及び/またはOX40LポリペプチドをコードするmRNAによって産生されるタンパク質の量、ならびに産生される可溶性またはそうでなくとも機能的なタンパク質の量が挙げられる。いくつかの実施形態において、本明細書に開示される配列最適化核酸は、本明細書に開示されるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする配列最適化核酸配列(例えばRNA、例えばmRNA)によってコードされるタンパク質を発現する細胞の生存率に従って評価され得る。
特定の実施形態では、最適化されていない参照核酸配列に対するコドン置換を含む、本明細書に開示されている複数の配列最適化核酸(例えばRNA、例えばmRNA)を機能的に特徴付けて、目的の特性、例えば、in vitroのモデル系またはin vivoにおいて、標的組織もしくは細胞における発現特性を測定してもよい。
a.核酸配列の固有特性の最適化
本開示のいくつかの実施形態において、ポリヌクレオチドの所望の特性は、核酸配列の固有の特性である。例えば、ヌクレオチド配列(例えば、RNA、例えば、mRNA)は、in vivoまたはin vitroでの安定性について最適化された配列であってもよい。いくつかの実施形態において、ヌクレオチド配列は、特定の標的組織または細胞における発現に最適化された配列であってもよい。いくつかの実施形態において、核酸配列は、エンドヌクレアーゼ及びエキソヌクレアーゼによるその分解を防ぐことによって、その血漿半分を増大させるように最適化された配列である。
他の実施形態では、この核酸配列は、例えば、配列最適化核酸または配列最適化核酸を含む医薬組成物を水性条件下で、最小限の分解で保存できる時間を長くするために、溶液中での加水分解に対する耐性を高めるように最適化される配列である。
他の実施形態では、この配列最適化核酸は、例えば、凍結乾燥後に最小の分解で配列最適化核酸を保存できる時間を長くするために、乾燥保存条件における加水分解に対するその耐性を高めるように最適化され得る。
b.タンパク質発現に最適化された核酸配列
本開示のいくつかの実施形態において、ポリヌクレオチドの所望の特性は、本明細書に開示されている配列最適化配列によってコードされるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの発現レベルである。タンパク質発現レベルは、1つ以上の発現系を用いて測定してもよい。いくつかの実施形態において、発現は細胞培養系、例えば、CHO細胞またはHEK293細胞において測定され得る。いくつかの実施形態において、生細胞の抽出物、例えば、ウサギ網状赤血球溶解物から調製されたin vitro発現系、または精製された個々の成分のアセンブリによって調製されたin vitro発現系を用いて発現を測定してもよい。他の実施形態では、タンパク質発現は、in vivo系、例えばマウス、ウサギ、サルなどで測定される。
いくつかの実施形態において、溶液形態でのタンパク質発現が望ましい場合がある。したがって、いくつかの実施形態において、参照配列を配列最適化して、可溶性形態で最適化レベルの発現タンパク質を有する配列最適化核酸配列を得てもよい。タンパク質発現のレベルならびに他の特性、例えば、溶解度、凝集レベル、及び切断産物(すなわち、タンパク質分解、加水分解、または不完全な翻訳に起因する断片)の存在は、当該技術分野において既知である方法に従って、例えば、電気泳動(例えば、天然またはSDS-PAGE)またはクロマトグラフィー法(例えば、HPLC、サイズ排除クロマトグラフィーなど)を用いて測定され得る。
c.標的組織または標的細胞の生存率の最適化
いくつかの実施形態において、核酸配列によってコードされる異種治療用タンパク質の発現は、標的組織または細胞において有害な影響を及ぼし得、タンパク質収率を低下させるか、または発現産物の品質を低下させるか(例えば、タンパク質断片の存在または封入体中の発現されたタンパク質の沈殿に起因して)、または毒性を引き起こす場合がある。
したがって、本開示のいくつかの実施形態において、本明細書に開示されている核酸配列、例えば、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする核酸配列の配列の最適化を使用して、配列最適化核酸によってコードされるタンパク質を発現する標的細胞の生存率を増加させてもよい。
異種タンパク質発現はまた、自己または異種移植のための核酸配列でトランスフェクトされた細胞にとって有害であり得る。したがって、本開示のいくつかの実施形態において、本明細書に開示される核酸配列の配列の最適化を使用して、配列最適化されている核酸配列によってコードされるタンパク質を発現する標的細胞の生存率を増加し得る。細胞または組織の生存率、毒性、及び他の生理学的反応の変化は、当該技術分野において既知である方法に従って測定され得る。
d.免疫応答及び/または炎症反応の減少
いくつかの場合において、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドまたはその機能的フラグメントをコードする配列最適化核酸の投与は、免疫応答を引き起こし得、この免疫応答は、(i)治療剤(例えば、IL-23、IL-36ガンマ、IL-18及び/またはOX40LポリペプチドをコードするmRNA)、または(ii)そのような治療剤の発現産物(例えば、mRNAによってコードされるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチド)、または(iv)それらの組合せによって生じる場合がある。したがって、本開示のいくつかの実施形態において、本明細書に開示される核酸配列(例えば、mRNA)の配列最適化を使用して、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする核酸の投与によって、またはこのような核酸によってコードされるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの発現産物によって、引き起こされる免疫応答または炎症反応を減少させてもよい。
いくつかの態様において、炎症反応は、当該技術分野において既知である方法、例えばELISAを使用して、増大したレベルの1つ以上の炎症性サイトカインを検出することによって測定され得る。「炎症性サイトカイン」という用語は、炎症反応において上昇するサイトカインを指す。炎症性サイトカインの例としては、インターロイキン-6(IL-6)、CXCL1(ケモカイン(C-X-Cモチーフ)リガンド1;GROαとしても公知、インターフェロン-γ(IFNγ)、腫瘍壊死因子α(TNFα)、インターフェロンγ誘発性タンパク質10(IP-10)、または顆粒球コロニー刺激因子(G-CSF)が挙げられる。炎症性サイトカインという用語にはまた、当該技術分野において既知である炎症反応に関連する他のサイトカイン、例えばインターロイキン-1(IL-1)、インターロイキン-8(IL-8)、インターロイキン-13(IL-13)、インターフェロンα(IFN-α)なども包含する。
IX.マイクロRNA結合部位を含む免疫調節ポリペプチドをコードするポリヌクレオチド
IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、1つ以上のマイクロRNA結合部位をさらに含んでもよい。マイクロRNA(またはmiRNA)は、核酸分子の3’UTRに結合し、核酸分子の安定性を低下させることによって、または翻訳を阻害することによって、遺伝子発現を下方制御する、19~25ヌクレオチド長の非コードRNAである。
本発明はまた、上記の任意のポリリボヌクレオチドを含む医薬組成物及び製剤を提供する。いくつかの実施形態において、組成物または製剤は、送達剤をさらに含む。
いくつかの実施形態において、組成物または製剤は、ポリペプチドをコードする、本明細書に開示される配列最適化核酸配列を含むポリリボヌクレオチドを含んでもよい。いくつかの実施形態において、組成物または製剤は、ポリペプチドをコードする、本明細書に開示される配列最適化核酸配列と顕著な配列同一性を有するポリリボヌクレオチド(例えば、ORF)を含むポリリボヌクレオチド(例えば、RNA、例えば、mRNA)を含んでもよい。いくつかの実施形態において、ポリリボヌクレオチドはさらに、miRNA結合部位、例えば、miR-122に結合するmiRNA結合部位を含む。
マイクロRNA標的配列を本開示のポリヌクレオチド(例えば、3’UTR様領域または他の領域)に操作することによって、問題のマイクロRNAが利用可能であるならば、分解または翻訳の減少のために分子を標的にしてもよい。これは、ポリリボヌクレオチドの送達時のオフターゲット効果を減少し得る。例えば、本発明のポリリボヌクレオチドが組織または細胞に送達されることを意図していないが最終的には前記組織または細胞であるならば、この組織または細胞に豊富なmiRNAは、miRNAの複数の結合部位が、ポリリボヌクレオチドの5’UTR及び/または3’UTRに操作されている場合に、目的の遺伝子の発現を阻害し得る。したがって、いくつかの実施形態において、本開示のmRNAへの1つ以上のmiRNA結合部位の組み込みによって、核酸分子送達に対するオフターゲット効果の危険性が低減され得、及び/またはmRNAによってコードされるポリペプチドの発現の組織特異的調節が可能になり得る。なお他の実施形態では、本開示のmRNAへの1つ以上のmiRNA結合部位の組み込みは、in vivoでの核酸送達の際の免疫応答を調節し得る。さらなる実施形態において、本開示のmRNAへの1つ以上のmiRNA結合部位の組み込みは、本明細書に記載の脂質含有化合物及び組成物の急速な血液クリアランス(accelerated blood clearance)(ABC)を調節し得る。
逆に、miRNA結合部位をポリリボヌクレオチド配列(それらが天然に存在する)から除去して、特定の組織におけるタンパク質発現を増大させてもよい。例えば、特定のmiRNAの結合部位を、ポリリボヌクレオチドから除去して、miRNAを含む組織または細胞におけるタンパク質発現を改善してもよい。
マイクロRNAは、RNA転写物(それら自身で折り返されてしばしばプレmiRNA(前駆体-miRNA)と呼ばれる短いヘアピン構造を形成する)の領域から酵素によって得られる。プレmiRNAは、典型的には、その3’末端に2ヌクレオチドオーバーハングを有し、そして3’ヒドロキシル基及び5’リン酸基を有する。この前駆体mRNAは、核内で処理され、続いて細胞質に輸送され、そこでDICER(RNアーゼ III酵素)によってさらに処理されて、約22ヌクレオチドの成熟マイクロRNAが形成される。次いで成熟マイクロRNAを、リボ核粒子に組み込み、遺伝子サイレンシングを媒介するRNA誘導サイレンシング複合体、RISCを形成する。成熟miRNAについての当該分野で認識されている命名法は、典型的には、成熟miRNAが由来するプレmiRNAのアームを指す;「5p」とは、マイクロRNAがプレmiRNAヘアピンの5プライムアームに由来することを意味し、「3p」とはマイクロRNAがプレmiRNAヘアピンの3プライム末端に由来することを意味する。本明細書において番号で示されるmiRは、同じプレmiRNAの反対側のアームから生じる2つの成熟マイクロRNAのいずれか(例えば、3pまたは5pマイクロRNAのいずれか)を指す場合がある。本明細書で言及される全てのmiRは、3pまたは5pの指定によって特に指定されない限り、3p及び5pの両方のアーム/配列を含むことを意図している。
1つの実施形態において、miRNA結合部位(例えば、miR-122結合部位)は、ダイサーを含む活性RNA誘導サイレンシング複合体(RISC)の一部である、対応する成熟miRNAに結合する。別の態様において、RISC中の対応するmiRNAへのmiRNA結合部位の結合は、miRNA結合部位を含むmRNAを分解するか、またはmRNAが翻訳されるのを妨ぐ。
本明細書中で使用される場合、「マイクロRNA結合部位」という用語は、マイクロRNA標的部位もしくはマイクロRNA認識部位、またはマイクロRNAが結合もしくは会合する任意のヌクレオチド配列を指す。「結合」は、伝統的なワトソン-クリックハイブリダイゼーション法則に従い得るか、またはマイクロRNAと、マイクロRNA部位もしくはそれに隣接する標的配列との任意の安定した会合を反映し得ることを理解すべきである。
いくつかのマイクロRNA、例えば、miR-122は、正常組織に豊富に存在するが、がんまたは腫瘍組織にははるかに低いレベルで存在する。したがって、マイクロRNA標的配列(すなわち、マイクロRNA結合部位)を、IL-23及び/またはIL-36ガンマ、IL-18及び/または第3のタンパク質(例えば、OX40Lポリペプチド)をコードするポリヌクレオチド中に操作すること(例えば、3’UTR様領域または他の領域)は、正常な組織(マイクロRNAが豊富である場合)における分解または翻訳の減少のために分子を効果的に標的化し得、一方で、がんまたは腫瘍組織における高レベルの翻訳を提供する(マイクロRNAがはるかに低いレベルで存在する場合)。これによって、本開示の方法及び組成物のための腫瘍標的化アプローチが提供される。
いくつかの実施形態において、マイクロRNA結合部位(例えば、miR-122結合部位)は、miRNA(例えば、miR-122)と完全に相補的であり、それによってmiRNA結合部位に融合したmRNAが分解される。他の実施形態では、miRNA結合部位は、対応するmiRNAと完全に相補的ではない。ある特定の実施形態では、miRNA結合部位(例えば、miR-122結合部位)は、対応するmiRNA(例えば、miR-122)と同じ長さである。他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端、3’末端、またはその両方において、対応するマイクロRNA(例えば、22ntを有するmiR-122)よりも1ヌクレオチド短い。さらに他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端、3’末端、またはその両方において、対応するマイクロRNA(例えば、miR-122)よりも2ヌクレオチド短い。さらに他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端、3’末端、またはその両方において、対応するマイクロRNA(例えば、miR-122)よりも3ヌクレオチド短い。いくつかの実施形態において、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端、3’末端、またはその両方において、対応するマイクロRNA(例えば、miR-122)よりも4ヌクレオチド短い。他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端、3’末端、またはその両方において、対応するマイクロRNA(例えば、miR-122)よりも5ヌクレオチド短い。いくつかの実施形態において、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端、3’末端、またはその両方において、対応するマイクロRNA(例えば、miR-122)よりも6ヌクレオチド短い。他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端または3’末端における対応するマイクロRNA(例えば、miR-122)よりも7ヌクレオチド短い。他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端または3’末端における対応するマイクロRNA(例えば、miR-122)よりも8ヌクレオチド短い。他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端または3’末端における対応するマイクロRNA(例えば、miR-122)よりも9ヌクレオチド短い。他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端または3’末端における対応するマイクロRNA(例えば、miR-122)よりも10ヌクレオチド短い。他の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端または3’末端における対応するマイクロRNA(例えば、miR-122)よりも11ヌクレオチド短い。他の態様において、マイクロRNA結合部位(例えば、miR-122結合部位)は、5’末端または3’末端における対応するマイクロRNA(例えば、miR-122)より12ヌクレオチド短い。対応するmiRNAよりも短いmiRNA結合部位は、やはり1つ以上のmiRNA結合部位を組み込んでいるmRNAを分解するか、またはmRNAの翻訳を妨げ得る。
いくつかの実施形態において、マイクロRNA結合部位(例えば、miR-122結合部位)は、miRNA(例えば、miR-122)を含むRISC複合体がマイクロRNA結合部位を含むポリヌクレオチドを切断するように、miRNA(例えば、miR-122)に対して十分な相補性を有する。他の実施形態では、マイクロRNA結合部位(例えばmiR-122結合部位)は、miRNA(例えばmiR-122)を含むRISC複合体が、マイクロRNA結合部位を含むポリヌクレオチド中の不安定性を誘発するように不完全な相補性を有する。別の実施形態では、マイクロRNA結合部位(例えば、miR-122結合部位)は、miRNA(例えば、miR-122)を含むRISC複合体が、マイクロRNA結合部位を含むポリヌクレオチドの転写を抑制するように、不完全な相補性を有する。
miRNAに対して十分な相補性を有するmiRNA結合部位とは、ポリリボヌクレオチドのmiRNA媒介調節、例えば、ポリリボヌクレオチドのmiRNA媒介翻訳抑制または分解を促進するのに十分な程度の相補性を指す。本発明の例示的な態様において、miRNAに対して十分な相補性を有するmiRNA結合部位は、ポリリボヌクレオチドのmiRNA媒介分解、例えば、mRNAの、miRNAガイドのRNA誘導サイレンシング複合体(RISC)媒介切断を促進するのに十分な程度の相補性を指す。miRNA結合部位は、例えば、19~25ヌクレオチドの長さのmiRNA配列に対して、19~23ヌクレオチドの長さのmiRNA配列に対して、または22ヌクレオチドの長さのmiRNA配列に対して相補性を有し得る。miRNA結合部位は、miRNAの一部のみに対して、例えば、天然に存在するmiRNA配列の全長の1、2、3、または4ヌクレオチド未満の部分に対して、または天然に存在するmiRNA配列より1、2、3、または4ヌクレオチド短い部分に対して相補的であり得る(そのようなmiRNA結合部位は「不完全な相補性」を有する)。所望の調節がmRNA分解である場合、全もしくは完全相補性(例えば、全相補性、または天然に存在するmiRNAの長さの全部もしくはかなりの部分にわたる完全相補性)が好ましい。
1つの実施形態において、miRNA結合部位(例えば、miR-122結合部位)は、対応するmiRNA(例えば、miR-122)由来の1つのミスマッチを有する。別の実施形態では、miRNA結合部位は、対応するmiRNA由来の2つのミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の3つのミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の4つのミスマッチを有する。いくつかの実施形態において、miRNA結合部位は、対応するmiRNA由来の5つのミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の6つのミスマッチを有する。ある特定の実施形態では、miRNA結合部位は、対応するmiRNA由来の7つのミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の8つのミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の9つのミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の10個のミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の11個のミスマッチを有する。他の実施形態では、miRNA結合部位は、対応するmiRNA由来の12個のミスマッチを有する。
ある特定の実施形態では、miRNA結合部位(例えば、miR-122結合部位)は、対応するmiRNA(例えば、miR-122)の少なくとも約10の連続ヌクレオチドに相補的な少なくとも約10の連続ヌクレオチド、対応するmiRNAの少なくとも約11の連続ヌクレオチドに相補的な少なくとも約11の連続ヌクレオチド、対応するmiRNAの少なくとも約12の連続ヌクレオチドに相補的な少なくとも約12の連続ヌクレオチド、対応するmiRNAの少なくとも約13の連続ヌクレオチドに相補的な少なくとも約13の連続ヌクレオチド、または対応するmiRNAの少なくとも約14の連続ヌクレオチドに相補的な少なくとも約14の連続ヌクレオチドを有する。いくつかの実施形態において、miRNA結合部位は、対応するmiRNAの少なくとも約15の連続ヌクレオチドに相補的な少なくとも約15の連続ヌクレオチド、対応するmiRNAの少なくとも約16の連続ヌクレオチドに相補的な少なくとも約16の連続ヌクレオチド、対応するmiRNAの少なくとも約17の連続ヌクレオチドに相補的な少なくとも約17の連続ヌクレオチド、対応するmiRNAの少なくとも約18の連続ヌクレオチドに相補的な少なくとも約18の連続ヌクレオチド、対応するmiRNAの少なくとも約19の連続ヌクレオチドに相補的な少なくとも約19の連続ヌクレオチド、対応するmiRNAの少なくとも約20の連続ヌクレオチドに相補的な少なくとも約20の連続ヌクレオチド、または対応するmiRNAの少なくとも約21の連続ヌクレオチドに相補的な21の連続ヌクレオチドを有する。
いくつかの実施形態において、ポリヌクレオチドは、IL-23、IL-36ガンマ、IL-18及び/またはOX40LポリペプチドをコードするmRNA、ならびに少なくとも1つのmiR-122結合部位、少なくとも2つのmiR-122結合部位、少なくとも3つのmiR-122結合部位、少なくとも4つのmiR-122結合部位、または少なくとも5つのmiR-122結合部位を含む。一態様では、miRNA結合部位は、miR-122に結合するか、またはmiR-122に相補的である。別の態様では、miRNA結合部位は、miR-122-3pまたはmiR-122-5pに結合する。特定の態様では、miRNA結合部位は、配列番号24と少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%同一のヌクレオチド配列を含み、ここでこのmiRNA結合部位はmiR-122に結合する。別の特定の態様では、miRNA結合部位は、配列番号26と少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%同一のヌクレオチド配列を含み、ここでこのmiRNA結合部位はmiR-122に結合する。これらの配列を下の表2に示す。
いくつかの実施形態において、miRNA結合部位(例えば、miR-122結合部位)は、ポリヌクレオチド(例えば、3’UTR)の任意の位置で本開示のポリヌクレオチドに挿入される;ポリヌクレオチド中のmiRNA結合部位の挿入が、対応するmiRNA(例えば、miR-122)の非存在下で機能的IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの翻訳を妨害しない限り、ポリヌクレオチド中の挿入部位は、ポリヌクレオチド中のどこにあってもよい;そしてmiRNA(例えば、miR-122)の存在下では、ポリヌクレオチド中のmiRNA結合部位の挿入及び対応するmiRNAへのmiRNA結合部位の結合は、ポリヌクレオチドを分解するか、またはポリヌクレオチドの翻訳を妨げ得る。1つの実施形態において、miRNA結合部位は、ポリヌクレオチドの3’UTRに挿入される。
ある特定の実施形態では、miRNA結合部位は、mRNAをコードするIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの停止コドンから少なくとも約30ヌクレオチド下流に挿入される。他の実施形態では、miRNA結合部位は、ポリヌクレオチド、例えばIL-23、IL-36ガンマ、IL-18及び/またはOX40LポリペプチドコードmRNAの停止コドンから、少なくとも約10ヌクレオチド、少なくとも約15ヌクレオチド、少なくとも約20ヌクレオチド、少なくとも約25ヌクレオチド、少なくとも約30ヌクレオチド、少なくとも約35ヌクレオチド、少なくとも約40ヌクレオチド、少なくとも約45ヌクレオチド、少なくとも約50ヌクレオチド、少なくとも約55ヌクレオチド、少なくとも約60ヌクレオチド、少なくとも約65ヌクレオチド、少なくとも約70ヌクレオチド、少なくとも約75ヌクレオチド、少なくとも約80ヌクレオチド、少なくとも約85ヌクレオチド、少なくとも約90ヌクレオチド、少なくとも約95ヌクレオチド、または少なくとも約100ヌクレオチド下流に挿入される。他の実施形態では、miRNA結合部位は、ポリヌクレオチド、例えばIL-23、IL-36ガンマ、IL-18及び/またはOX40LポリペプチドコードmRNAの停止コドンから、約10ヌクレオチド~約100ヌクレオチド、約20ヌクレオチド~約90ヌクレオチド、約30ヌクレオチド~約80ヌクレオチド、約40ヌクレオチド~約70ヌクレオチド、約50ヌクレオチド~約60ヌクレオチド、約45ヌクレオチド~約65ヌクレオチド下流に挿入される。
IVTポリヌクレオチド構造
いくつかの実施形態において、IL-23、IL-36ガンマ、IL-18及び/またはOX40LポリペプチドをコードするmRNAを含む本開示のポリヌクレオチドは、IVTポリヌクレオチドである。従来、mRNA分子の基本成分は、少なくともコード領域、5’UTR、3’UTR、5’キャップ及びポリ-A尾部を含む。本開示のIVTポリヌクレオチドは、mRNAとして機能し得るが、それらの機能的及び/または構造的設計特徴において野生型mRNAとは区別され、例えば、核酸ベースの治療法を用いた有効なポリペプチド産生の既存の問題を克服するのに役立つ。
IVTポリヌクレオチドの一次コンストラクトは、第1の隣フランキング領域及び第2のフランキング領域に隣接する連結ヌクレオチドの第1の領域を含む。この第1の領域は、限定するものではないが、コードされたIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドを含んでもよい。第1のフランキング領域は、5’非翻訳領域(UTR)として機能する連結ヌクレオシドの配列、例えば、ポリペプチドの天然の5’UTRをコードする任意の核酸の5’UTR、または非天然の5’UTR、例えば、限定するものではないが、異種性5’UTRまたは合成5’UTRを含んでもよい。IL-23、IL-36ガンマ、IL-18及び/またはOX40LポリペプチドをコードするIVTは、その5末端に1つ以上のシグナル配列をコードするシグナル配列領域を含み得る。この隣接する領域は、1つ以上の完全または不完全5’UTR配列を含む、連結ヌクレオチドの領域を含み得る。このフランキング領域はまた、5’末端キャップも含んでもよい。第2のフランキング領域は、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの天然の3’UTR、または限定するものではないが、異種性3’UTRもしくは合成3’UTRなどの非天然3’UTRをコードし得る1つ以上の完全または不完全3’UTRを含む連結ヌクレオチドの領域を含み得る。この隣接する領域はまた、3’尾部付加配列を含んでもよい。3’尾部付加配列は、限定するものではないが、ポリ-A尾部、ポリA-Gのカルテット及び/またはステムループ配列であってもよい。
第1の領域の5’末端と第1のフランキング領域とを架橋することが第1の操作領域である。従来、この操作領域は開始コドンを含む。操作領域はあるいは、開始コドンを含む任意の翻訳開始配列またはシグナルを含んでもよい。
第1の領域の3’末端と第2のフランキング領域とを架橋することは、第2の操作領域である。従来、この操作領域は停止コドンを含む。操作領域はあるいは、停止コドンを含む任意の翻訳開始配列またはシグナルを含んでもよい。複数の連続停止コドンもまた、IVTポリヌクレオチドに使用してもよい。いくつかの実施形態において、本開示の操作領域は、2つの停止コドンを含んでもよい。第1の停止コドンは、「TGA」であっても、または「UGA」であってもよく、そして第二の停止コドンは「TAA」、「TGA」、「TAG」、「UAA」、「UGA」または「UAG」からなる群より選択され得る。
IVTポリヌクレオチド一次コンストラクトは、第1のフランキング領域及び第2のフランキング領域によって隣接される連結ヌクレオチドの第1の領域を含む。本明細書で使用される場合、「第1の領域」は、「コード領域」または「コードする領域」または単に「第1の領域」と呼ばれてもよい。この第1の領域は、限定するものではないが、目的のコードされたポリペプチドを含んでもよい。一態様では、第1の領域は、限定するものではないが、少なくとも1つの目的のポリペプチドをコードするオープンリーディングフレームを含んでもよい。オープンリーディングフレームは、全体的または部分的にコドン最適化されてもよい。隣接する領域は、完全にコドン最適化または部分的にコドン最適化され得る1つ以上の完全または不完全5’UTR配列を含む、連結ヌクレオチドの領域を含んでもよい。隣接する領域は、限定するものではないが、miR配列、TERZAK(商標)配列及び翻訳制御配列を含む、少なくとも1つの核酸配列を含んでもよい。隣接する領域はまた、5’末端キャップ138を含んでもよい。5’末端キャッピング領域は、天然に存在するキャップ、合成キャップ、または最適化されたキャップを含んでもよい。第2のフランキング領域は、1つ以上の完全または不完全3’UTRを含む連結ヌクレオチドの領域を含んでもよい。第2のフランキング領域は、完全にコドン最適化されてもよいし、または部分的にコドン最適化されていてもよい。フランキング領域は、限定するものではないが、miR配列及び翻訳制御配列を含む少なくとも1つの核酸配列を含んでもよい。第2のフランキング領域の後に、ポリヌクレオチド一次コンストラクトは3’尾部付加配列を含んでもよい。この3’尾部付加配列は、合成尾部付加領域を含んでも、及び/または連鎖終止ヌクレオシドを含んでもよい。合成尾部付加領域の非限定的な例としては、ポリA配列、ポリC配列、ポリA-Gカルテットが含まれる。連鎖終止ヌクレオシドの非限定的な例としては、2’-Oメチル、F及びロックされた核酸(LNA)が挙げられる。
第1の領域の5’末端と第1のフランキング領域とを架橋することが第1の操作領域である。従来、この操作領域は開始コドンを含む。操作領域はあるいは、任意の翻訳開始配列または開始コドンを含むシグナルを含んでもよい。
第1の領域の3’末端と第2のフランキング領域とを架橋することが、第2の操作領域である。従来、この操作領域は停止コドンを含む。操作領域はあるいは、任意の翻訳開始配列または停止コドンを含むシグナルを含んでもよい。本開示によれば、複数の連続停止コドンも使用してもよい。
いくつかの実施形態において、IVTポリヌクレオチドの第1及び第2のフランキング領域は、独立して、長さが15~1,000ヌクレオチドの範囲であってもよい(例えば、30、40、45、50、55、60、70、80、90、100、120、140、160、180、200、250、300、350、400、450、500、600、700、800、900、1,000、1,500、2,000、2,500、3,000、3,500、4,000、4,500,5,000,5,500ヌクレオチド超、または少なくとも30、40、45、50、55、60、70、80、90、100、120、140、160、180、200、250、300、350、400、450、500、600、700、800、900、1,000、1,500、2,000、2,500、3,000、3,500、4,000、4,500、5,000、5,500ヌクレオチド)。
いくつかの実施形態において、IVTポリヌクレオチドの尾部付加配列は、存在しないヌクレオチド長から500ヌクレオチド長までの範囲であり得る(例えば、少なくとも60、70、80、90、120、140、160、180、200、250、300、350、400、450、または500ヌクレオチド)。テール領域がポリ-A尾部である場合、その長さはポリA結合タンパク質の単位で、またはその関数として決定され得る。この実施形態では、ポリ-A尾部は、少なくとも4モノマーのポリA結合タンパク質に結合するのに十分な長さである。ポリA結合タンパク質モノマーは、約38ヌクレオチドのストレッチに結合する。そのように、約80ヌクレオチド及び160ヌクレオチドのポリ-A尾部が機能的であることが観察されている。
いくつかの実施形態において、IVTポリヌクレオチドのキャッピング領域は、単一のキャップまたはキャップを形成する一連のヌクレオチドを含んでもよい。この実施形態では、キャッピング領域は、1から10、例えば、2~9、3~8、4~7、1~5、5~10、または少なくとも2、または10以下のヌクレオチド長であってもよい。いくつかの実施形態において、キャップは存在しない。
いくつかの実施形態において、IVTポリヌクレオチドの第1及び第2の操作領域は、3~40、例えば5~30、10~20、15、または少なくとも4、または30以下の長さのヌクレオチドの範囲であってもよく、開始コドン及び/または停止コドンに加えて、1つ以上のシグナル及び/または制限配列を含んでもよい。
いくつかの実施形態において、IVTポリヌクレオチドは構造的に修飾されても化学的に修飾されてもよい。IVTポリヌクレオチドが化学的及び/または構造的に修飾されている場合、このポリヌクレオチドは「修飾IVTポリヌクレオチド」と呼ばれてもよい。
いくつかの実施形態において、IVTポリヌクレオチドが化学修飾されている場合、それらは全てもしくは任意の同じヌクレオシドタイプの均一な化学修飾、または全てもしくは任意の同じヌクレオシドタイプにおける同じ出発修飾の単なる下向き滴定によって生じる修飾の集団、または全てのウリジンがウリジン類似体、例えばシュードウリジンもしくは5-メトキシウリジンで置換されている場合のような、全ての任意の同一のヌクレオシドタイプであるがランダムな組み込みがある化学修飾の測定された百分率を有し得る。別の実施形態では、IVTポリヌクレオチドは、ポリヌクレオチド全体にわたって同じヌクレオシドタイプの2つ、3つ、または4つの均一な化学修飾を有してもよい(全てのウリジン及び全てのシトシンなどが同様に修飾される)。
いくつかの実施形態において、IVTポリヌクレオチドは、限定するものではないが、2Aペプチドなどの、本明細書に記載の自己切断ペプチドをコードする配列を含んでもよい。IVTポリヌクレオチド中の2Aペプチドのポリヌクレオチド配列は、本明細書中に記載される方法によって改変され得るかもしくはコドン最適化されてもよく、及び/または当該分野で公知である。いくつかの実施形態において、この配列を使用して、IVTポリヌクレオチド中の2つ以上の目的のポリペプチドのコード領域を分離してもよい。
キメラポリヌクレオチド構造
いくつかの実施形態において、本開示のポリヌクレオチドは、キメラポリヌクレオチドである。本明細書に開示されるキメラポリヌクレオチドまたはRNAコンストラクトは、IVTポリヌクレオチドと同様のモジュール構造を維持するが、このキメラポリヌクレオチドは、ポリヌクレオチドに有用な特性を付与する1つ以上の構造的及び/または化学的な修飾または改変を含む。したがって、本開示の修飾mRNA分子であるキメラポリヌクレオチドは、「キメラ修飾mRNA」または「キメラmRNA」と呼ばれる。
キメラポリヌクレオチドは、サイズ及び/または化学修飾パターン、化学修飾位置、化学修飾百分率または化学修飾集団、ならびにそれらの組合せが異なる部分または領域を有する。
キメラポリヌクレオチドがmRNAとして機能し、IL-23、IL-36ガンマ、IL-18、及び/またはOX40Lポリペプチドをコードする部分または領域の例は、限定するものではないが、非翻訳領域(UTR、例えば、5’UTRまたは3’UTR)、コード領域、キャップ領域、ポリ-A尾部領域、開始領域、停止領域、シグナル配列領域、及びそれらの組合せである。他の地域を結ぶか、またはその間にある地域または部分も、サブ領域を有するように設計されてもよい。
いくつかの実施形態において、本開示のキメラポリヌクレオチドは、式Xを含む構造を有する。
5’[An]x-L1-[Bo]y-L2-[Cp]z-L3 3’
式X
ここで:
A及びBの各々は独立して連結ヌクレオシドの領域を含み;
AまたはBのいずれか、あるいはA及びBの両方が、本明細書の他のいずれかに記載されているIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードし;
Cは連結ヌクレオシドの任意の領域であり;
少なくとも1つの領域A、B、またはCが位置的に修飾されており、前記位置的に修飾された領域が、1つ以上の同じヌクレオシドタイプのアデノシン、チミジン、グアノシン、シチジン、またはウリジンの少なくとも2つの化学修飾ヌクレオシドを含み、ここで同じ種類のヌクレオシドの少なくとも2つの化学修飾は異なる化学修飾であり;
n、o及びpは独立して15~1000の整数であり;
x及びyは独立して1~20であり;
zは0~5であり;
L1及びL2は独立して任意選択のリンカー部分であり、前記リンカー部分は核酸ベースまたは非核酸ベースのいずれかであり;そして
L3は任意選択のコンジュゲートまたは任意選択のリンカー部分であり、前記リンカー部分は、核酸ベースまたは非核酸ベースのいずれかである。
いくつかの実施形態において、Aの連結ヌクレオシドの領域の少なくとも1つは、5’非翻訳領域(UTR)として機能し得る一連の連結ヌクレオシドを含む。連結ヌクレオシドの配列は、天然の5’UTRであっても、または合成の5’UTRであってもよい。非限定的な例として、キメラポリヌクレオチドは、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードし得、Aの連結ヌクレオシドの配列は、IL-23、IL-36ガンマ、IL-18及び/または40Lポリペプチド、または非異種性5’UTR、例えば、限定するものではないが、合成UTRをコードし得る。
別の実施形態では、Aの連結ヌクレオシドの少なくとも1つの領域は、キャップ領域である。キャップ領域は、5’UTRとして機能するAの連結ヌクレオシドの領域に対して5’に位置し得る。キャップ領域は、限定するものではないが、Cap0、Cap1、ARCA、イノシン、N1-メチル-グアノシン、2’フルオロ-グアノシン、7-デアザ-グアノシン、8-オキソ-グアノシン、2-アミノ-グアノシン、LNA-グアノシン、2-アジド-グアノシン、Cap2及びCap4などの少なくとも1つのキャップを含んでもよい。
いくつかの実施形態において、本開示のポリヌクレオチドは、Cap1の5’UTRを含む。いくつかの実施形態において、本明細書に開示されるIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするための5’UTR配列、例えばCap1を含むポリヌクレオチドは、異なる5’UTR(例えば、Cap0、ARCA、イノシン、N1-メチル-グアノシン、2’フルオロ-グアノシン、7-デアザ-グアノシン、8-オキソ-グアノシン、2-アミノ-グアノシン、LNA-グアノシン、2-アジド-グアノシン、Cap2またはCap4)を含むIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするポリヌクレオチドと比較してIL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの発現を増大させる。いくつかの実施形態において、ポリヌクレオチドはCap1の5’UTRを含み、ここでポリヌクレオチドは、IL-23、IL-36ガンマ及び/またはOX40Lポリペプチドをコードする。いくつかの実施形態において、Cap1の5’UTRを含むポリヌクレオチドは、IL-23、IL-36ガンマ及び/またはOX40Lポリペプチド発現を増大させる。
いくつかの実施形態において、Bの連結ヌクレオシドの領域の少なくとも1つは、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする核酸配列の少なくとも1つのオープンリーディングフレームを含む。この核酸配列はコドン最適化されてもよく、及び/または少なくとも1つの修飾を含んでもよい。
いくつかの実施形態において、Cの連結ヌクレオシドの領域の少なくとも1つは、3’UTRとして機能し得る一連の連結ヌクレオシドを含む。連結ヌクレオシドの配列は、天然3’UTRであっても、または合成3’UTRであってもよい。非限定的な例として、キメラポリヌクレオチドは、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードし得、Cの連結ヌクレオシドの配列は、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドの3’UTRまたは非異種性3’UTR、例えば、限定するものではないが、合成UTRをコードし得る。
いくつかの実施形態において、Aの連結ヌクレオシドの領域の少なくとも1つは、5’UTRとして機能する連結ヌクレオシドの配列を含み、Cの連結ヌクレオシドの領域の少なくとも1つは、3’UTRとして機能する連結ヌクレオシドの配列を含む。いくつかの実施形態において、5’UTR及び3’UTRは、同じ種に由来しても、または異なる種に由来してもよい。別の実施形態では、5’UTR及び3’UTRは、同じ種または異なる種由来の異なるタンパク質由来の天然の非翻訳領域をコードし得る。
本開示のキメラポリヌクレオチド(その部分または領域を含む)は、ヘミマー、ギャップマー、ウィングマー、またはブロックマーとして分類され得る。
本明細書で使用される場合、「ヘミマー」とは、化学修飾(複数可)の1つのパターン、百分率、位置または集団の半分、及び化学修飾(複数可)の第2のパターン、百分率、位置、または集団の半分を含む領域または部分を含むキメラポリヌクレオチドである。本開示のキメラポリヌクレオチドはまた、ヘミマーサブ領域を含んでもよい。いくつかの実施形態において、部分または領域は、一方の50%及び他方の50%である。
いくつかの実施形態において、全キメラポリヌクレオチドは、一方が50%、他方が50%である。本開示の任意のキメラポリヌクレオチドの任意の領域または部分は、ヘミマーであり得る。ヘミマーの種類としては、パターンヘミマー、集団ヘミマーまたは位置ヘミマーが挙げられる。定義により、ヘミマーは、50:50百分率ヘミマーである。
本明細書中で使用される場合、「ギャップマー」は、部分または領域間にギャップを有する少なくとも3つの部分または領域を有するキメラポリヌクレオチドである。「ギャップ」は、結合したヌクレオシドの領域またはそれに隣接する2つの部分または領域のキメラ性とは異なる単一のヌクレオシドを含んでもよい。ギャップマーの2つの部分または領域は、互いに同じでも異なっていてもよい。
本明細書中で使用される場合、「ウイングマー」とは、部分または領域の間にギャップを有する少なくとも3つの部分または領域を有するキメラポリヌクレオチドである。ギャップマーとは異なり、ウイングマーのギャップを囲む2つの隣接する部分または領域は、程度または種類が同じである。そのような類似性は、異なる修飾の単位数の長さまたは修飾の数にある場合がある。ウングマーのウイングはギャップより長くても短くてもよい。ウイング部分または領域は、ギャップを含む領域よりも20、30、40、50、60、70、80、90または95%大きいかまたは短い長さであり得る。
本明細書において用いる場合、「ブロックマー」とは、パターン化されたポリヌクレオチドであって、この部分または領域は、等価なサイズまたは数、および修飾の種類である。ブロックマー中の領域またはサブ領域は、50、51、52、53、54、55、56、57、58、59、60、61 62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278、279、280、281、282、283、284、285、286、287、288、289、290、291、292、293、294、295、296、297、298、299、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490または500ヌクレオチド長であってもよい。
化学修飾パターンを有する本開示のキメラポリヌクレオチド(その部分または領域を含む)は、「パターンキメラ」と呼ばれる。パターンキメラはブロッカーとも呼ばれ得る。パターンキメラは、領域もしくは部分内、領域もしくは部分にまたがって、または領域もしくは領域間に、あるパターンの修飾を有するポリヌクレオチドである。
部分または領域内の修飾パターンは、定義された領域内で開始及び停止するパターンである。部分または領域にわたる修飾のパターンは、部分または領域で始まり、別の隣接する部分または領域で終わるパターンである。部分または領域間の修飾のパターンは、1つの部分または領域で始まって終わるパターンであり、必ずしも第1の領域または部分に隣接していない異なる部分または領域で繰り返されるパターンである。
パターンキメラまたはブロックマーの領域またはサブ領域は、各「A」及び各「B」が異なる化学修飾(塩基、糖または主鎖リンカーの少なくとも1つ)を表し、異なる種類の化学修飾(例えば、天然に存在する及び非天然に存在する)、修飾の異なるパーセンテージまたは修飾の異なる集団に相当する、ABAB[AB]nのような単純な交互するパターンを有し得る。このパターンはn回繰り返してもよく、ここでn=3~300である。さらに、各AまたはBは、1~2,500単位(例えば、ヌクレオシド)のパターンである場合もある。パターンは、AABBAABB[AABB]n(交互の二重重複)またはAAABBBAAABBB[AAABBB]n(交互の三重重複)パターンのような交互の重複であってもよい。パターンはn回繰り返してもよく、n=3~300である。
異なるパターンをまた一緒に混合して2次パターンを形成してもよい。例えば、1つの交互パターンを三重の交互パターンと組み合わせて、2次の交互パターンA’B’を形成してもよい。1つの例は[ABABAB][AAABBBAAABBB][ABABAB][AAABBBAAABBB][ABABAB][AAABBBAAABBB]であり、ここで[ABABAB]はA’であり、かつ[AAABBBAAABBB]はB’である。同様の方法で、これらのパターンはn回繰り返されてもよく、ここで、n=3~300である。
パターンは、ABCABC[ABC]nパターンを形成するための3つ以上の異なる修飾を含んでもよい。これらの3つの成分パターンはまた、AABBCCAABBCC[AABBCC]nのような重複であってもよく、ABCABCAABBCCABCABCAABBCCのような他のパターンとの組合せとして設計されてもよく、より高次のパターンであってもよい。
位置、パーセント、及び集団修飾の領域またはサブ領域は、各種修飾からの等しい寄与を受ける必要はない。「1-2-3-4」、「1-2-4-8」などのシリーズを形成してもよく、ここで各整数は特定の修飾型の単位数を表す。あるいは、「1-3-3-1-3-1-5」のような奇数のみ、または「2-4-2-4-6-4-8」のような偶数のみ、または奇数及び偶数の両方の単位の混合物、例えば「1-3-4-2-5-7-3-3-4」であってもよい。
パターンキメラは、その化学修飾の度合い(例えば、上記のような程度)または種類(例えば、異なる修飾)においてその化学修飾が変化し得る。
同じヌクレオシド種(A、C、G、T、またはU)の2つ以上のヌクレオシドメンバーの2つ以上の異なる化学修飾を有する少なくとも1つの領域を有する本開示のキメラポリヌクレオチド(その部分または領域を含む)は、「位置的修飾」キメラと呼ばれる。位置的修飾キメラはまた、本明細書では「選択的配置」キメラまたは「選択的配置ポリヌクレオチド」とも呼ばれる。その名称が示すように、選択的配置とは、A、C、G、TまたはUのいずれかへの修飾が合成方法によって同じである、当該技術分野におけるポリヌクレオチドとは異なり、ポリヌクレオチドまたはその領域における個々のAs、Cs、Gs、TsまたはUsに対して異なる修飾を有し得る、ポリヌクレオチドの設計を指す。例えば、位置的に修飾されたキメラポリヌクレオチドにおいて、As、Cs、Gs、TsまたはUsのいずれかのヌクレオシドタイプに対して2つ以上の異なる化学修飾が存在し得る。同じヌクレオシドタイプの任意の2つ以上に対する2つ以上の組合せもあり得る。例えば、位置的に修飾された、または選択的に配置されたキメラポリヌクレオチドは、分子中のアデニンの集団に対して3つの異なる修飾を含んでもよく、またコンストラクト(この全てが固有のランダムでない位置を有する)中のシトシンの集団に対して3つの異なる修飾を有してもよい。
化学修飾パーセントを有する本開示のキメラポリヌクレオチド(その部分または領域を含む)は、「パーセントキメラ」と呼ばれる。パーセントキメラは、少なくとも1%、少なくとも2%、少なくとも5%、少なくとも8%、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、または少なくとも99%の修飾の位置、パターンまたは集団を含む、領域または部分を有し得る。あるいは、パーセントキメラは、修飾の位置、パターンまたは集団に関して完全に修飾されてもよい。パーセントキメラの修飾パーセントは、天然に存在する修飾と天然に存在しない修飾との間で分けられ得る。
ある化学修飾集団を有する本開示のキメラポリヌクレオチド(その部分または領域を含む)は、「集団キメラ」と呼ばれる。集団キメラは、ヌクレオシド(それらの塩基、糖もしくは骨格結合、またはそれらの組合せ)が選択された修飾集団を有する領域または部分を含み得る。このような修飾は、表現型帰結を誘導、変更または調整する修飾などの機能的集団から選択されてもよい。例えば、機能的集団は、サイトカインのレベルを上昇させる化学修飾の集団であってもまたは選択であってもよい。他の機能的集団は、個々にまたは集合的に機能して、1つ以上のサイトカインのレベルを低下し得る。したがって、キメラポリヌクレオチドにおけるこれらの同様の機能の修飾の選択の使用は、「機能的集団キメラ」を構成するであろう。本明細書中で使用される場合、「機能的集団キメラ」は、その固有の機能的特徴が上記のような修飾の集団によって規定されるものであってもよいし、またはこの用語は、キメラポリヌクレオチド自体の全体的機能に適用されてもよい。例えば、全体として、キメラポリヌクレオチドは、未修飾または非キメラポリヌクレオチドと比較して異なるまたは優れた様式で機能し得る。
全ての任意の同じヌクレオシドタイプの均一な化学修飾、もしくは全ての任意の同一のヌクレオシドタイプにおいて同一開始修飾の単なる下向き滴定によって生成された修飾の集団を有するポリヌクレオチド、または、全ての任意の同じヌクレオシドタイプでただしランダムな取り込みを伴う化学修飾の測定されたパーセントを有するポリヌクレオチド(全てのウリジンがウリジン類似体、例えばシュードウリジンもしくは5-メトキシウリジンで置き換えられている場合など)は、キメラポリヌクレオチドとはみなされないことに注意すべきである。同様に、ポリヌクレオチド全体(例えば、全てのウリジン及び全てのシトシンなども同様に修飾されている)にわたって同じヌクレオシドタイプの2つ、3つまたは4つの均一な化学修飾を有するポリヌクレオチドは、キメラポリヌクレオチドとはみなされない。キメラではないポリヌクレオチドの一例は、標準シュードウリジン/5-メチルシトシン修飾ポリヌクレオチドである。これらの均一ポリヌクレオチドは、完全にin vitro転写(IVT)酵素合成を介して得られ、合成酵素の制限のため、ポリヌクレオチドで見られる同一ヌクレオシド種のそれぞれ、すなわち、アデノシン(A)、チミジン(T)、グアノシン(G)、シチジン(C)、またはウリジン(U)の出現に対して1種の修飾のみを含む。そのようなポリヌクレオチドは、IVTポリヌクレオチドとして特性決定される。
本開示のキメラポリヌクレオチドは、構造的に修飾されてもよいし、または化学修飾されてもよい。本開示のキメラポリヌクレオチドが化学的及び/または構造的に修飾される場合、このポリヌクレオチドは「修飾キメラポリヌクレオチド」と呼んでもよい。
キメラポリヌクレオチドの領域または部分は、リンカーまたはスペーサー部分によって分離されてもよい。そのようなリンカーまたはスペーサーは、核酸ベースであっても、または非ヌクレオシドであってもよい。
いくつかの実施形態において、キメラポリヌクレオチドは、限定されないが、2Aペプチドのような本明細書に記載の自己切断ペプチドをコードする配列を含んでもよい。
キメラポリヌクレオチド中の2Aペプチドのポリヌクレオチド配列は、本明細書に記載される方法及び/または当該技術分野において既知である方法により、修飾またはコドン最適化されてもよい。
上記にかかわらず、本開示のキメラポリヌクレオチドは、本明細書で定義されるように位置的修飾されておらず、キメラでもない領域または部分を含んでもよい。例えば、1つ以上のA、T、C、G、またはUでキメラポリヌクレオチドの領域または一部を均一に修飾してもよいが、ポリヌクレオチドは全領域または部分を通して均一には修飾されていないことになる。
本開示のキメラポリヌクレオチドは、完全に位置的修飾されていても部分的に位置的修飾されていてもよい。それらはまた、任意のパターンまたは設計であり得るサブ領域を有してもよい。
いくつかの実施形態において、ポリヌクレオチドの領域またはサブ領域は、存在しないことから500ヌクレオチド長まで(例えば、少なくとも60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、250、300、350、400、450、または500ヌクレオチド)に及んでもよい。この領域がポリ-A尾部である場合、長さは、ポリA結合タンパク質結合の単位または機能として決定され得る。この実施形態では、ポリ-A尾部は、ポリA結合タンパク質の少なくとも4つのモノマーに結合するのに十分な長さである。ポリA結合タンパク質モノマーは、約38ヌクレオチドのストレッチに結合する。このように、約80ヌクレオチド~約160ヌクレオチドのポリ-A尾部が機能的であることが観察されている。mRNAとして機能する本開示のキメラポリヌクレオチドは、ポリ-A尾部を含む必要はない。
本開示によれば、mRNAとして機能するキメラポリヌクレオチドは、キャッピング領域を有し得る。キャッピング領域は、単一のキャップを含んでも、またはキャップを形成する一連のヌクレオチドを含んでもよい。この実施形態では、キャッピング領域は、1から10、例えば、2~9、3~8、4~7、1~5、5~10、もしくは少なくとも2、または10もしくはそれ以下の長さヌクレオチドであってもよい。いくつかの実施形態において、キャップは存在しない。
本開示は、円形、すなわち環状のキメラポリヌクレオチドを企図する。この名前が示すように、環状ポリヌクレオチドは、性質として円形であり、これはライゲーション、共有結合、同じタンパク質もしくは他の分子もしくは複合体との共通会合、またはハイブリダイゼーションのいずれかによって、末端が何らかの形で結合されることを意味する。
キメラポリヌクレオチド、キメラポリヌクレオチドを含む製剤及び組成物、ならびにキメラポリヌクレオチドを作製、使用及び投与する方法はまた、国際特許出願第PCT/US2014/53907号にも記載されている。
いくつかの実施形態において、キメラポリヌクレオチドは、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードする。いくつかの実施形態において、本開示のキメラポリヌクレオチドは、表1に列挙されるIL-23及び/またはIL-36ガンマ、IL-18核酸配列、及び/または表1Aに列挙されるOX40L核酸配列のうちのいずれか1つを含む。いくつかの実施形態において、本開示のキメラポリヌクレオチドは、表1に列挙されるIL-23及び/もしくはIL-36ガンマ、IL-18ならびに/または表1Aに列挙されるOX40Lポリペプチドのうちいずれか1つをコードする。
環状ポリヌクレオチド
IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、環状であっても、または円形であってもよい。本明細書で使用する場合「環状ポリヌクレオチド」または「circP」とは、RNAと実質的に同様に作用し、RNAの特性を有する一本鎖環状ポリヌクレオチドを意味する。「環状」という用語はまた、circPの任意の二次または三次配置を包含することを意味する。環状ポリヌクレオチドは、性質として環状であり、ライゲーション、共有結合、同じタンパク質または他の分子もしくは複合体との共通会合、またはハイブリダイゼーションによるなどに関わらず、末端が何らかの形で結合されることを意味する。
環状ポリヌクレオチド、環状ポリヌクレオチドを含む製剤及び組成物、ならびに環状ポリヌクレオチドを作製、使用及び投与する方法はまた、国際特許出願番号PCT/US2014/53904(WO2015034925として公開、また、米国特許出願公開第2016-0194368号も参照のこと)にも開示されている。
いくつかの実施形態において、環状ポリヌクレオチドは、IL-23ポリペプチド、IL-36ガンマポリペプチド、またはOX40Lポリペプチドをコードする。いくつかの実施形態において、本開示の環状ポリヌクレオチドは、表1に列挙されるIL-23、IL-36ガンマ、IL-18核酸配列、または表1Aに列挙されるOX40L核酸配列のいずれか1つを含む。いくつかの実施形態において、本開示の環状ポリヌクレオチドは、表1に記載されるIL-23ポリペプチド、IL-36ガンマ、IL-18ポリペプチド、または表1Aに列挙されるOX40Lポリペプチドのうちいずれか1つをコードする。いくつかの実施形態において、環状ポリヌクレオチドは、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18またはOX40Lポリペプチドの発現を増加させる。
ポリヌクレオチドの多量体
いくつかの実施形態において、複数の異なるキメラポリヌクレオチド及び/またはIVTポリヌクレオチドは、3’末端が修飾されているヌクレオチドを使用して、3’末端を介して一緒に結合され得る。化学結合を使用して、細胞への送達の化学量論を制御してもよい。これは、1つのポリヌクレオチド種上の3’-アジド末端ヌクレオチド及び反対側のポリヌクレオチド種上のC5-エチニルまたはアルキニル含有ヌクレオチドを使用して、キメラポリヌクレオチド及び/またはIVTポリヌクレオチドを化学結合させることによって制御され得る。修飾ヌクレオチドは、製造元のプロトコルに従って、ターミナルトランスフェラーゼ(New England Biolabs、Ipswich、MA)を用いて転写後に付加される。3’-修飾ヌクレオチドの付加後、2つのポリヌクレオチド種を、銅の存在下または非存在下で水溶液中で組み合わせて、文献に記載されているようなクリック化学機構を介して新しい共有結合を形成してもよい。
別の例では、2つを超えるキメラポリヌクレオチド及び/またはIVTポリヌクレオチドを、官能基が導入されたリンカー分子を用いて一緒に結合してもよい。例えば、官能化糖分子は、3’官能基が導入mRNA分子上の同族部分(すなわち、3’-マレイミドエステル、3’-NHS-エステル、アルキニル)と反応する複数の化学反応基(SH-、NH2-、N3など)を含むように化学修飾してもよい。修飾された糖の上の反応基の数を、化学量論的様式で制御して、コンジュゲートされたキメラポリヌクレオチド及び/またはIVTポリヌクレオチドの化学量論比を直接制御してもよい。
いくつかの実施形態において、キメラポリヌクレオチド及び/またはIVTポリヌクレオチドを、あるパターンで一緒に結合してもよい。このパターンは、各「C」及び各「D」がキメラポリヌクレオチド、IVTポリヌクレオチド、異なるキメラポリヌクレオチドまたは異なるIVTポリヌクレオチドを表す、CD[CD]xのような単純な交互パターンであってもよい。このパターンは、x回繰り返されてもよく、ここでx=1-300である。パターンはまた、CCDD[CCDD]x(交互の二重重複)またはCCCDDD[CCCDDD]x(交互の三重重複)パターンのような交互の重複であってもよい。この交互の二重重複または交互の三重重複は、x回繰り返されてもよく、x=1-300である。
ポリヌクレオチドのコンジュゲート及び組合せ
本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、他のポリヌクレオチド、色素、挿入剤(例えばアクリジン)、架橋剤(例えば、ソラレン、マイトマイシンC)、ポルフィリン(TPPC4、テキサフィリン(texaphyrin)、サプフィリン(Sapphyrin))、多環芳香族炭化水素(例えば、フェナジン、ジヒドロフェナジン)、人工エンドヌクレアーゼ(例えば、EDTA)、アルキル化剤、リン酸塩、アミノ、メルカプト、PEG(例えば、PEG-40K)、MPEG、[MPEG]2、ポリアミノ、アルキル、置換アルキル、放射標識されたマーカー、酵素、ハプテン(例えば、ビオチン)、輸送/吸収促進剤(例えば、アスピリン、ビタミンE、葉酸)、合成リボヌクレアーゼ、タンパク質、例えば、糖タンパク質、またはペプチド、例えば、共リガンドに特異的親和性を有する分子、または抗体、例えば、がん細胞、内皮細胞、もしくは骨細胞など特定の細胞型に結合する抗体、ホルモン及びホルモン受容体、非ペプチド種、例えば脂質、レクチン、炭水化物、ビタミン、補因子、または薬物とコンジュゲートするように設計することができる。
コンジュゲーションは、安定性を上昇及び/または半減期の延長をもたらし得、ポリヌクレオチドを細胞、組織または生物の特定の部位に標的化するのに特に有用であり得る。
本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、1つ以上の異種性ポリペプチドをコードするヌクレオチド配列をさらに含んでもよい。一実施形態では、1つ以上の異種性ポリペプチドは、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチドもしくはOX40Lポリペプチドの薬物動態特性もしくは薬力学特性、またはIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチドもしくはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、少なくとも1つのmRNA)の薬物動態学的特性または薬力学的特性を改善する。別の実施形態では、この1つ以上の異種性ポリペプチドは、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドの半減期を延長し得るポリペプチドを含む。
本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、非翻訳領域として作用または機能する、1つ以上の領域または部分をさらに含んでもよい。定義上、遺伝子の野生型非翻訳領域(UTR)は、転写されるが翻訳されない。mRNAにおいて、5’UTRは、転写開始部位で開始し、開始コドンまで続くが、開始コドンは含まない。一方、3’UTRは、停止コドンのすぐ後に始まり、転写終止シグナルまで続く。核酸分子の安定性及び翻訳の点でUTRが果たす規制の役割についての証拠がますます増えている。UTRの調節機能は、とりわけ、分子の安定性を高めるために、本開示のポリヌクレオチドに組み込まれてもよい。特定の特徴を組み込んで、望ましくない臓器部位に誤って送付された場合に、転写物の制御された下方調節を確実にしてもよい。表3及び表4A及び4Bは、本開示のポリヌクレオチドにおいて利用され得る例示的なUTRのリストを提供する。
5’UTR及び翻訳開始
ある特定の実施形態において、本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、5’UTR及び/または翻訳開始配列をさらに含む。天然の5’UTRは、翻訳開始において役割を果たす特徴を有する。それらは、リボソームが多くの遺伝子の翻訳を開始するプロセスに関与することが一般的に知られているKozak配列のような特徴を保持している。5’UTRはまた、伸長因子結合に関与する二次構造を形成することも公知である。
特定の標的器官の豊富に発現された遺伝子に典型的に見出される特徴を操作することにより、本開示のポリヌクレオチドの安定性及びタンパク質産生を向上し得る。例えば、c-mycのようながんにおいて上方制御されることが公知のmRNAの5’UTRの導入は、がん細胞におけるポリヌクレオチドのような核酸分子の発現を向上するために使用され得る。ポリヌクレオチドの設計及び製造に有用な非翻訳領域としては、限定するものではないが、国際特許公開番号WO2014/164253(米国特許出願公開第20160022840号も参照のこと)に開示されるものが挙げられる。
表3に、本開示の5’-非翻訳領域の列挙を示す。A、U、CまたはGを含む、1つ以上のヌクレオチドが末端に付加または除去される5’UTRのバリアントを利用してもよい。
他の非UTR配列も、ポリヌクレオチド内の領域またはサブ領域として使用してもよい。例えば、イントロンまたはイントロン配列の一部をポリヌクレオチドの領域に組み込んでもよい。イントロン配列の組み込みは、タンパク質産生ならびにポリヌクレオチドレベルを上昇させ得る。
特徴の組合せは、フランキング領域に含まれてもよく、他の特徴内に含まれてもよい。例えば、ORFは、強力なKozak翻訳開始シグナルを含み得る5’UTR及び/またはポリ-A尾部のテンプレート付加用オリゴ(dT)配列を含み得る3’UTRに隣接し得る。5’UTRは、米国特許出願公開第2010-0293625号に記載されている5’UTRなどの同じ及び/または異なる遺伝子に由来する、第1のポリヌクレオチド断片及び第2のポリヌクレオチド断片を含んでもよい。
これらのUTRまたはその一部は、それらが選択された転写物と同じ向きに配置されてもよく、または向きもしくは位置を変更されてもよい。したがって、5’または3’UTRは、1つ以上の他の5’UTRまたは3’UTRを用いて反転されても、短縮されても、延長されても、作製されてもよい。
いくつかの実施形態において、UTR配列は、参照配列に対して何らかの方法で変更されてもよい。例えば、3’または5’UTRは、上記で教示されたような向きもしくは位置の変化によって野生型もしくは天然のUTRに対して改変されてもよいし、または追加のヌクレオチドの包含、ヌクレオチドの欠失、ヌクレオチドの交換もしくは転位によって改変されてもよい。「改変された」UTR(3’または5’のいずれか)を産生する、任意のこれらの変化がバリアントUTRを含む。
いくつかの実施形態において、5’または3’UTRのような2倍、3倍または4倍のUTRを使用してもよい。本明細書で使用する場合、「二重」UTRとは、同じUTRの2つのコピーが直列または実質的に直列にコードされたUTRである。例えば、米国特許出願公開第2010-0129877号に記載されているように、二重ベータグロビン3’UTRを使用してもよい。
いくつかの実施形態において、フランキング領域は異種であってもよい。いくつかの実施形態において、5’非翻訳領域は、3’非翻訳領域とは異なる種に由来し得る。非翻訳領域はまた、翻訳エンハンサーエレメント(TEE)も含んでもよい。非限定的な例として、TEEは、米国特許出願公開第2009-0226470号に記載されているものが挙げられる。
3’UTR及びAUリッチエレメント
特定の実施形態において、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、3’UTRをさらに含む。3’-UTRは、翻訳停止コドンのすぐ後に続くmRNAのセクションであり、遺伝子発現に転写後に影響する調節領域を含む場合が多い。3’-UTR内の調節領域は、mRNAのポリアデニル化、翻訳効率、局在化、及び安定性に影響し得る。一実施形態では、本開示に有用な3’-UTRは、調節プロテインまたはマイクロRNAのための結合部位を含む。いくつかの実施形態において、3’-UTRは、リプレッサータンパク質に結合し、かつmRNAの発現を阻害するサイレンサー領域を有する。他の実施形態では、3’-UTRは、AUリッチエレメントを含む。タンパク質は、AREに結合して、局所的な様式で転写物の安定性または減衰率に影響を及ぼすか、または翻訳開始に影響を及ぼす。他の実施形態では、3’-UTRは、mRNA転写物の末端にポリ(A)テールと呼ばれる数百のアデニン残基の付加を指示する配列AAUAAAを含む。
表4Aは、IL-23ポリペプチド、IL-36ガンマポリペプチド、またはOX40LポリペプチドをコードするmRNAに有用な3’-非翻訳領域の列挙を示す。1つ以上のヌクレオチドがA、U、CまたはGを含む末端に付加されるか、または除去されている3’UTRのバリアントを利用してもよい。
ある特定の実施形態において、本開示に有用な3’UTR配列は、配列番号45~62およびそれらのいずれかの組合せからなる群より選択される配列に対して、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または約100%同一であるヌクレオチド配列を含む。ある特定の実施形態において、3’UTR配列は、miRNA結合部位、例えばmiR-122結合部位をさらに含む。他の実施形態では、本開示に有用な3’UTR配列は、3’UTR-018(配列番号62)を含む。
ある特定の実施形態において、3’UTR配列は、3’UTRの機能を妨害することなく、1つ以上のmiRNA結合部位、例えばmiR-122結合部位、またはその中の任意の他の異種ヌクレオチド配列を含む。miRNA結合部位を含む3’UTR配列のいくつかの例を表4Bに列挙する。
ある特定の実施形態において、本開示に有用な3’UTR配列は、配列番号63または64に示される配列に対して、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または約100%同一であるヌクレオチド配列を含む。
5’キャップを有する領域
本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、5’キャップをさらに含み得る。IL-23、IL-36ガンマ、IL-18ポリペプチド、及び/またはOX40LポリペプチドコードmRNAに有用な5’キャップは、mRNAキャップ結合タンパク質(CBP)に結合し得、それによってmRNA安定性を上昇させ得る。キャップは、mRNAスプライシングの間に5’近位イントロンの除去をさらに補助し得る。
いくつかの実施形態において、本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、脱キャップを防止し、mRNA半減期を延長する非加水分解性キャップ構造を含む。キャップ構造の加水分解は、5’-ppp-5’ホスホロジエステル結合の切断を必要とするので、修飾ヌクレオチドを、キャッピング反応中に使用してもよい。例えば、New England Biolabs(Ipswich、MA)のワクシニアキャッピング酵素(Vaccinia Capping Enzyme)は、5’-ppp-5’キャップ中にホスホロチオエート結合を作製するための製造者の説明に従って、α-チオ-グアノシンヌクレオチドとともに使用してもよい。α-メチル-ホスホネート及びセレノ-ホスフェートヌクレオチドのような、追加的な修飾グアノシンヌクレオチドを使用してもよい。
ある特定の実施形態において、5’キャップは、5’末端及び/または5’末端前(anteterminal)ヌクレオチドのリボース糖を、糖環の2’-ヒドロキシル基で2’-O-メチル化したものを含む。他の実施形態では、IL-23ポリペプチド、IL-36ガンマポリペプチド、またはOX40LポリペプチドコードmRNAのキャップは、キャップ類似体を含み、本明細書ではまた、合成キャップ類似体、化学的キャップ、化学的キャップ類似体、または構造的もしくは機能的キャップ類似体とも呼ばれ、天然の(すなわち、内在性、野生型または生理学的)5’キャップとは、化学構造が異なり、一方では、キャップ機能を保持している。キャップ類似体は、本開示のポリヌクレオチドに化学的に(すなわち非酵素的に)または酵素的に合成及び/または結合されてもよい。
例えば、アンチリバースキャップアナログ(Anti-Reverse Cap Analog)(ARCA)キャップは、5’-5’-トリフォスフェート基によって結合された2つのグアニンを含み、ここで一方のグアニンは、N7メチル基ならびに3’-O-メチル基を含む(すなわち、N7,3’-O-ジメチル-グアノシン-5’-トリフォスフェート-5’-グアノシン(m7G-3’mppp-G;これは3’O-Me-m7G(5’)ppp(5’)Gで同等に指定され得る)。他の修飾されていないグアニンの3’-O原子は、キャップ化ポリヌクレオチドの5’末端ヌクレオチドに連結される.N7及び3’Oメチル化グアニンは、キャップ化ポリヌクレオチドの末端部分を提供する。
別の例示的なキャップは、mCAPであり、これはARCAに類似しているが、グアノシンに2’-O-メチル基を有する(すなわち、N7,2’-O-ジメチル-グアノシン-5’-トリホスフェート-5’-グアノシン、m7Gm-ppp-G)。
いくつかの実施形態において、キャップはジヌクレオチドキャップ類似体である。非限定的な例として、ジヌクレオチドキャップ類似体は、ボラノホスフェート基またはホスホロセレノエート基、例えば、米国特許第8,519,110号に記載されているジヌクレオチドキャップ類似体によって異なるホスフェート位置で修飾されてもよい。
別の実施形態では、キャップは、キャップ類似体は、当該技術分野において既知である及び/または本明細書に記載されるキャップ類似体のN7-(4-クロロフェノキシエチル)置換ジヌクレオチド型である。キャップ類似体のN7-(4-クロロフェノキシエチル)置換ジヌクレオチド形態の非限定的な例としては、N7-(4-クロロフェノキシエチル)-G(5’)ppp(5’)G及びN7-(4-クロロフェノキシエチル)-m3’-OG(5’)ppp(5’)Gキャップ類似体が挙げられる。例えば、Kore et al(2013)Bioorganic&Medicinal Chemistry
21:4570-4574に記載されている様々なキャップ類似体及びキャップ類似体を合成する方法を参照のこと。別の実施形態において、本開示のキャップ類似体は、4-クロロ/ブロモフェノキシエチル類似体である。
キャップ類似体は、ポリヌクレオチドまたはその領域の付随するキャッピングを可能にするが、in vitro転写反応において、転写物の20%までがキャップされないままであり得る。これは、内在性の細胞転写機構によって産生された核酸の内在性の5’キャップ構造からのキャップ類似体の構造的相違と同様に、翻訳能力の低下及び細胞安定性の低下につながり得る。
本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド及び/またはOX40LポリペプチドコードmRNAは、酵素を用いて、より真正な(authentic)5’キャップ構造を生成するために、製造後(IVTまたは化学合成のいずれであっても)にキャップしてもよい。本明細書中で使用される場合、「より真正な」という語句は、構造的または機能的に、内因性または野生型の特徴を密接に反映または模倣する特徴を指す。すなわち、「より真正な」特徴は、先行技術の合成特徴または類似体などと比較して、内在性の野生型、天然または生理学的な細胞機能及び/または構造をよりよく代表しているか、または対応する内因性、野生型、天然または生理学的特徴を1つ以上の観点においてしのいでいる。
本開示のより真正な5’キャップ構造の非限定的な例は、とりわけ、当該技術分野において既知である合成5’キャップ構造と(または野生型、天然または生理学的5’キャップ構造と)比較して、キャップ結合タンパク質の結合の向上、半減期の延長、5’エンドヌクレアーゼに対する感受性の減少及び/または5’脱キャップの減少を有する5’キャップ構造である。例えば、組換えワクシニアウイルスキャッピング酵素(Vaccinia Virus Capping Enzyme)及び組換え2’-O-メチルトランスフェラーゼ酵素は、ポリヌクレオチドの5’末端ヌクレオチドとグアニンキャップヌクレオチドとの間に標準の5’-5’-トリフォスフェート結合を生じ得、ここでこのキャップグアニンは、N7メチル化を含み、mRNAの5’末端ヌクレオチドは、2’-O-メチルを含む。そのような構造は、Cap1構造と呼ばれる。このキャップは、例えば、当技術分野で公知の他の5’キャップ類似体構造と比較して、より高い翻訳能力及び細胞安定性、ならびに細胞性炎症性サイトカインの活性化の低下をもたらし得る。キャップ構造としては、限定するものではないが、7mG(5’)ppp(5’)N、pN2p(cap 0)、7mG(5’)ppp(5’)NlmpNp(キャップ1)、及び7mG(5’)-ppp(5’)NlmpN2mp(キャップ2)が挙げられる。
本開示によれば、5’末端キャップは、内在性キャップまたはキャップ類似体を含んでもよい。本開示によれば、5’末端キャップは、グアニン類似体を含んでもよい。有用なグアニン類似体としては、限定するものではないが、イノシン、N1-メチルグアノシン、2’-フルオロ-グアノシン、7-デアザ-グアノシン、8-オキソグアノシン、2-アミノ-グアノシン、LNA-グアノシン、及び2-アジド-グアノシンが挙げられる。
ポリ-A尾部
いくつかの実施形態において、本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、さらにポリ-A尾部を含む。さらなる実施形態では、安定化のために、ポリ-A尾部上の末端基を取り込んでもよい。他の実施形態では、ポリ-A尾部は、des-3’ヒドロキシルテールを含む。有用なポリ-A尾部はまた、Li et al.(2005)Current Biology 15:1501-1507によって教示されるような構造的部分または2’-Oメチル修飾を含んでもよい。
一実施形態では、存在する場合、ポリ-A尾部の長さは、30ヌクレオチド長を超える。別の実施形態では、ポリ-A尾部は、35ヌクレオチド長を超える(例えば、少なくとも約35、40、45、50、55、60、70、80、90、100、120、140、160、180、200、250、300、350、400、450、500、600、700、800、900、1,000、1,100、1,200、1,300、1,400、1,500、1,600、1,700、1,800、1,900、2,000、2,500、及び3,000ヌクレオチドまたはそれより多い)。
いくつかの実施形態において、ポリヌクレオチドまたはその領域は、約30~約3,000ヌクレオチドを含む(例えば、30~50、30~100、30~250、30~500、30~750、30~1,000、30~1,500、30~2,000、30~2,500、50~100、50~250、50~500、50~750、50~1,000、50~1,500、50~2,000、50~2,500、50~3,000、100~500、100~750、100~1,000、100~1,500、100~2,000、100~2,500、100~3,000、500~750、500~1,000、500~1,500、500~2,000、500~2,500、500~3,000、1,000~1,500、1,000~2,000、1,000~2,500、1,000~3,000、1,500~2,000、1,500~2,500、1,500~3,000、2,000~3,000、2,000~2,500、及び2,500~3,000)。
いくつかの実施形態において、ポリ-A尾部は、ポリヌクレオチド全体の長さまたはポリヌクレオチドの特定領域の長さに対して設計される。この設計は、コード領域の長さ、特定の特徴もしくは領域の長さに基づいても、またはポリヌクレオチドから発現される最終産物の長さに基づいてもよい。
この文脈において、ポリ-A尾部は、そのポリヌクレオチドまたはその特徴よりも、長さが10、20、30、40、50、60、70、80、90、または100%長くてもよい。ポリ-A尾部はまた、それが属するポリヌクレオチドの一部として設計されてもよい。この状況では、ポリ-A尾部は、コンストラクトの全長、コンストラクト領域またはコンストラクトの全長マイナスポリ-A尾部の10、20、30、40、50、60、70、80または90%またはそれ以上であってもよい。さらに、操作された結合部位及びポリA結合タンパク質のためのポリヌクレオチドのコンジュゲーションは発現を向上させ得る。
さらに、複数の異なるポリヌクレオチドを、ポリ-A尾部の3’末端で修飾ヌクレオチドを用いて、3’末端を通じてPABP(ポリA結合タンパク質)を介して一緒に連結してもよい。関連する細胞株においてトランスフェクション実験を行ってもよく、タンパク質産生は、トランスフェクション後12時間、24時間、48時間、72時間及び7日目にELISAによってアッセイしてもよい。
いくつかの実施形態において、本開示のポリヌクレオチドは、ポリA-Gカルテット(Quartet)領域を含むように設計される。Gカルテット(G四重)は、DNA及びRNAの両方においてGリッチな配列によって形成され得る4つのグアニンヌクレオチドの環状水素結合アレイである。この実施形態では、Gカルテットはポリ-A尾部の末端に組み込まれる。得られたポリヌクレオチドは、様々な時点で、安定性、タンパク質産生及び半減期を含む他のパラメーターについてアッセイされる。ポリA-Gカルテットは、120ヌクレオチド単独のポリ-A尾部を用いて見られるmRNAの少なくとも75%に相当するmRNAからのタンパク質産生をもたらすことが発見されている。
開始コドン領域
いくつかの実施形態において、本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、開始コドン領域に類似するかまたは同様に機能する領域をさらに含む。
いくつかの実施形態において、ポリヌクレオチドの翻訳は、開始コドンAUGではないコドンで開始する。ポリヌクレオチドの翻訳は、限定するものではないが、ACG、AGG、AAG、CTG/CUG、GTG/GUG、ATA/AUA、ATT/AUU、TTG/UUGなどの代替開始コドンで開始し得る。Touriol et al.(2003)Biology of the Cell 95:169-178、ならびにMatsudaおよびMauro(2010)PLoS ONE 5:11を参照のこと。非限定的な例として、ポリヌクレオチドの翻訳は、代替の開始コドンACGで始まる。別の非限定的な例として、ポリヌクレオチド翻訳は、代替の開始コドンCTGまたはCUGで開始する。さらに別の非限定的な例として、ポリヌクレオチドの翻訳は、代替の開始コドンGTGまたはGUGで開始する。
限定するものではないが、開始コドンまたは代替開始コドンなどの翻訳を開始するコドンに隣接するヌクレオチドは、ポリヌクレオチドの翻訳効率、長さ及び/または構造に影響することが公知である。例えば、Matsuda及びMauro(2010)PLoS
ONE 5:11を参照のこと。翻訳を開始するコドンに隣接するヌクレオチドのいずれかのマスキングを使用することにより、ポリヌクレオチドの翻訳開始の位置、翻訳効率、長さ及び/または構造を変えてもよい。
いくつかの実施形態において、開始コドンまたは代替開始コドンをマスクするまたは隠す目的で、コドンの近くでマスキング剤を使用することで、マスクされた開始コドンまたは代替開始コドンでの翻訳開始の確率を低下させる。マスキング剤の非限定的な例としては、アンチセンスロック核酸(LNA)ポリヌクレオチド及びエキソン-ジャンクション複合体(EJC)が挙げられる。例えば、マスキング剤LNAポリヌクレオチド及びEJCを記載しているMatsuda及びMauro(2010)PLoS ONE 5:11を参照のこと。
別の実施形態では、マスキング剤を用いてポリヌクレオチドの開始コドンをマスクして、翻訳が別の開始コドンで開始する可能性を高める。いくつかの実施形態において、翻訳が、マスクされる開始コドンまたは代替開始コドンより下流にある開始コドンまたは代替開始コドンで開始される可能性を高める目的で、第1の開始コドンまたは代替開始コドンをマスクするためにマスキング剤を使用する。
いくつかの実施形態において、開始コドンまたは代替開始コドンは、miR結合部位の完全な相補体内に位置する。miR結合部位の完全な相補体は、マスキング剤に類似したポリヌクレオチドの翻訳、長さ及び/または構造の制御を補助し得る。非限定的な例として、開始コドンまたは代替開始コドンは、miR-122結合部位の完璧な相補体の中央に位置する。開始コドンまたは別の開始コドンは、第1のヌクレオチド、第2のヌクレオチド、第3のヌクレオチド、第4のヌクレオチド、第5のヌクレオチド、第6のヌクレオチド、第7のヌクレオチド、第8のヌクレオチド、第9のヌクレオチド、第10のヌクレオチド、第11のヌクレオチド、第12のヌクレオチド、第13のヌクレオチド、第14のヌクレオチド、第15のヌクレオチド、第16のヌクレオチド、第17のヌクレオチド、第18のヌクレオチド、第19のヌクレオチド、第20のヌクレオチドまたは第21のヌクレオチド後に位置されてもよい。
別の実施形態では、ポリヌクレオチドの開始コドンをポリヌクレオチド配列から除去して、開始コドンではないコドンからポリヌクレオチドの翻訳を開始させる。ポリヌクレオチドの翻訳は、除去された開始コドンに続くコドンまたは下流の開始コドンもしくは代替開始コドンで開始してもよい。非限定的な例において、開始コドンATGまたはAUGを、ポリヌクレオチド配列の最初の3ヌクレオチドとして除去して、下流の開始コドンまたは代替開始コドンに対して翻訳開始させる。開始コドンが除去されたポリヌクレオチド配列は、翻訳の開始、ポリヌクレオチドの長さ及び/またはポリヌクレオチドの構造を制御するか、または制御することを試みるために、下流の開始コドン及び/または代替開始コドンのための少なくとも1つのマスキング剤をさらに含んでもよい。
停止コドン領域
いくつかの実施形態において、本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、少なくとも1つの停止コドンまたは少なくとも2つの停止コドンを、3’非翻訳領域(UTR)の前にさらに含んでもよい。停止コドンは、UGA、UAA、及びUAGから選択されてもよい。いくつかの実施形態において、本開示のポリヌクレオチドは、停止コドンUGA及び1つのさらなる停止コドンを含む。さらなる実施形態において、付加停止コドンはUAAであってもよい。別の実施形態では、本開示のポリヌクレオチドは、3つの停止コドン、4つの停止コドン、またはそれ以上の停止コドンを含む。
X.ポリヌクレオチドの作製方法
本開示はまた、本明細書に開示されるポリヌクレオチドまたはその補体を作製するための方法を提供する。いくつかの態様において、本明細書に開示されており、かつIL-23ポリペプチド、IL-36ガンマポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、in vitro転写を用いて構築されてもよい。
他の態様では、本明細書に開示されており、かつIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、オリゴヌクレオチド合成機を用いた化学合成によって構築され得る。他の態様において、本明細書に開示され、かつIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、宿主細胞を用いて作製される。ある特定の態様では、本明細書に開示されており、かつIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、IVT、化学合成、宿主細胞発現、または当該技術分野において既知である任意の他の方法の1つ以上の組合せによって作製される。
天然に存在するヌクレオシド、非天然に存在するヌクレオシド、またはそれらの組合せは、候補ヌクレオチド配列中に存在する天然に存在するヌクレオシドを完全にまたは部分的に天然に置き換え得、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、またはOX40Lポリペプチドをコードする配列最適化されているヌクレオチド配列(例えばmRNA)中に組み込まれてもよい。次いで、得られたmRNAを、タンパク質を産生するか、及び/または治療結果を産生する能力について調べてもよい。
in vitro転写-酵素合成
本明細書中に開示されるポリヌクレオチドは、in vitro転写(IVT)系を用いて転写され得る。この系は、典型的には、転写緩衝液、ヌクレオチドトリフォスフェート(NTP)、RNアーゼ阻害剤及びポリメラーゼを含む。NTPは、限定するものではないが、天然及び非天然(改変)NTPを含む本明細書に記載のものから選択されてもよい。ポリメラーゼは、限定されるものではないが、T7 RNAポリメラーゼ、T3 RNAポリメラーゼ、及び突然変異ポリメラーゼ、例えば、限定するものではないが、修飾された核酸を組み込み得るポリメラーゼから選択され得る。米国特許出願公開第2013-0259923号を参照のこと。
IVT系は、典型的には、転写緩衝液、ヌクレオチドトリフォスフェート(NTP)、RNアーゼ阻害剤及びポリメラーゼを含む。NTPは、限定するものではないが、天然及び非天然(改変)NTPを含む、本明細書に記載のものから選択されてもよい。ポリメラーゼは、限定するものではないが、T7 RNAポリメラーゼ、T3 RNAポリメラーゼ、及び変異体ポリメラーゼ、例えば、限定するものではないが、本明細書に開示されたポリヌクレオチドを組み込み得るポリメラーゼから選択され得る。
任意の数のRNAポリメラーゼまたはバリアントが、本開示のポリヌクレオチドの合成に使用され得る。
RNAポリメラーゼは、RNAポリメラーゼ配列のアミノ酸を挿入または欠失させることによって修飾され得る。非限定的な例として、RNAポリメラーゼは、修飾されていないRNAポリメラーゼと比較して、2’-修飾ヌクレオチドトリフォスフェートを取り込む能力の増大を示すために改変される。国際公開第WO2008078180号及び米国特許第8,101,385号を参照のこと。
バリアントは、RNAポリメラーゼを進化させること、RNAポリメラーゼのアミノ酸及び/もしくは核酸配列を最適化することによって、及び/または当該技術分野において既知である他の方法を用いることによって得られ得る。非限定的な例として、T7 RNAポリメラーゼバリアントは、Esvelt et al.(2011)Nature 472:499-503によって記載された連続的定向進化系を用いて進化され、ここでは、T7 RNAポリメラーゼのクローンが、スレオニン(K93T)、I4M、A7T、E63V、V64D、A65E、D66Y、T76N、C125R、S128R、A136T、N165S、G175R、H176L、Y178H、F182L、L196F、G198V、D208Y、E222K、S228A、Q239R、T243N、G259D、M267I、G280C、H300R、D351A、A354S、E356D、L360P、A383V、Y385C、D388Y、S397R、M401T、N410S、K450R、P451T、G452V、E484A、H523L、H524N、G542V、E565K、K577E、K577M、N601S、S684Y、L699I、K713E、N748D、Q754R、E775K、A827V、D851NまたはL864Fに置換された93位のリジンなどであるが、これに限定されない少なくとも1つの変異をコードし得る。別の非限定的な例として、T7 RNAポリメラーゼバリアントは、米国特許出願公開第20100120024号及び同第20070117112号に記載のような少なくとも1つの突然変異をコードし得る。RNAポリメラーゼのバリアントとしてはまた、限定するものではないが、置換バリアント、保存的アミノ酸置換、挿入バリアント、欠失バリアント及び/または共有結合性誘導体が挙げられ得る。
1つの態様において、ポリヌクレオチドは、野生型またはバリアントのRNAポリメラーゼによって認識されるように設計され得る。そうすることで、ポリヌクレオチドは、野生型または親キメラポリヌクレオチドからの配列変化の部位または領域を含むように改変されてもよい。
ポリヌクレオチドまたは核酸合成反応は、ポリメラーゼを利用する酵素法によって行ってもよい。ポリメラーゼは、ポリヌクレオチドまたは核酸鎖中のヌクレオチド間のホスホジエステル結合の生成を触媒する。現在公知のDNAポリメラーゼは、アミノ酸配列比較及び結晶構造解析に基づいて異なるファミリーに分けられ得る。DNAポリメラーゼI(pol I)またはAポリメラーゼファミリー、例としては、E.coliのクレノウ断片、Bacillus DNAポリメラーゼI、サーマス・アクアティカス(Thermus aquaticus)(Taq)DNAポリメラーゼ、ならびにT7 RNAポリメラーゼ及びDNAポリメラーゼは、とりわけこれらのファミリーの中で最もよく研究されている。別の大きなファミリーは、DNAポリメラーゼα(polα)またはBポリメラーゼファミリー、例としては、全ての真核生物複製DNAポリメラーゼ及びファージT4及びRB69由来のポリメラーゼである。それらは類似の触媒機構を用いるが、これらのファミリーのポリメラーゼは、基質特異性、基質類似体取り込み効率、プライマー伸長の程度及び率、DNA合成様式、エキソヌクレアーゼ活性、ならびに阻害剤に対する感受性が異なる。
DNAポリメラーゼはまた、それらが必要とする最適な反応条件、例えば反応温度、pH、ならびにテンプレート及びプライマー濃度に基づいて選択される。2つ以上のDNAポリメラーゼの組合せを用いて、所望のDNA断片サイズ及び合成効率を達成することもある。例えば、Cheng et alは、pHを増大させ、グリセロール及びジメチルスルホキシドを添加し、変性時間を短縮させ、伸長時間を増大させ、3’~5’エキソヌクレアーゼ活性を有する二次熱安定性DNAポリメラーゼを利用して、クローン化インサート及びヒトゲノムDNAからの長い標的を効果的に増幅する。Cheng et al.(1994)Proc.Natl.Acad.Sci.USA 91:5695-5699。バクテリオファージT3、T7、及びSP6由来のRNAポリメラーゼは、生化学的及び生物物理学的研究のためのRNAを調製するために広く使用されている。RNAポリメラーゼ、キャッピング酵素、及びポリAポリメラーゼは、国際公開番号WO2014028429(米国特許出願公開第20150211039号も参照のこと)に開示されている。
1つの態様において、本明細書に記載されるポリヌクレオチドの合成に用いることができるRNAポリメラーゼは、Syn5 RNAポリメラーゼである。Zhu et al.(2013)Nucleic Acids Research 288:3545-3552を参照のこと。Syn5 RNAポリメラーゼは最近、Zhu et al.による海洋性シアノファージSyn5から特徴付けられ、プロモーター配列も確認された。Zhu et al.(2013)Nucleic Acids Research 288:3545-3552を参照のこと。Zhuらは、Syn5 RNAポリメラーゼが、T7 RNAポリメラーゼと比較して、より広い温度範囲及び塩度にわたってRNA合成を触媒することを見出した。さらに、プロモーターでヌクレオチドを開始する要件は、RNA合成に有望なSyn5 RNAポリメラーゼを作製するT7 RNAポリメラーゼと比較して、Syn5 RNAポリメラーゼについてはそれほどストリンジェントでないことが判明した。
1つの態様において、Syn5 RNAポリメラーゼを、本明細書に記載のポリヌクレオチドの合成に用いてもよい。非限定的な例として、Syn5 RNAポリメラーゼは、正確な3’末端を必要とするポリヌクレオチドの合成に使用され得る。
1つの態様において、ポリヌクレオチドの合成にSyn5プロモーターを使用してもよい。非限定的な例として、Syn5プロモーターは、Zhu et al.(2013)Nucleic Acids Research 288:3545-3552によって記載されているように5’-ATTGGGCACCCGTAAGGG-3’であってもよい。
1つの態様において、Syn5 RNAポリメラーゼは、本明細書に記載されるか、及び/または当該技術分野において既知である少なくとも1つの化学修飾を含むポリヌクレオチドの合成に使用され得る。(例えば、Zhu et al.(2013)Nucleic Acids Research 288:3545-3552に記載されているシュードUTP及び5Me-CTPの組み込みを参照のこと)。
1つの態様において、本明細書中に記載されるポリヌクレオチドは、Zhu et al.(2013)Nucleic Acids Research 288:3545-3552によって記載された改変及び改良された精製手順を使用して精製されたSyn5
RNAポリメラーゼを用いて合成されてもよい。
遺伝子工学における様々なツールは、テンプレートとして作用する標的遺伝子の酵素的増幅に基づいている。個々の遺伝子または特定の目的の領域及び他の研究ニーズの配列の研究のためには、ポリヌクレオチドまたは核酸の少量の試料から標的遺伝子の複数のコピーを生成することが必要である。そのような方法は、本開示のポリヌクレオチドの製造に適用されてもよい。
ポリメラーゼ連鎖反応(PCR)は、標的遺伝子の迅速な増幅、ならびにゲノムマッピング及び配列決定に広く適用されている。DNAを合成するための主要な成分は、テンプレートとしての標的DNA分子、標的DNA鎖の末端に相補的なプライマー、構成要素としてのデオキシヌクレオシドトリフォスフェート(dNTP)、及びDNAポリメラーゼを含む。PCRが変性、アニーリング及び伸長ステップを経るにつれて、新たに産生されたDNA分子は、標的DNAの指数関数的増幅を達成する次の複製サークルのテンプレートとして作用し得る。PCRは、変性及びアニーリングのために加熱及び冷却のサイクルを必要とする。基本PCRのバリエーションとしては、非対称PCR(Innis et
al.(1988)Proc.Natl.Acad.Sci.USA 85:9436-9440)、インバースPCR(Ochmanら(1988)Genetics 120:621-623)逆転写PCR(RT-PCR)(Freeman et al.(1999)BioTechniques 26:112-22,124-5)が挙げられる。RT-PCRでは、一本鎖RNAが所望の標的であり、最初に逆転写酵素によって二本鎖DNAに変換される。
種々の等温in vitro核酸増幅技術が、PCRの代替物または補体として開発されている。例えば、鎖置換増幅(SDA)は、ニックを形成する制限酵素の能力に基づいている。Walker et al.(1992)Proc.Natl.Acad.Sci.USA 89:392-396は、その内容が、その全体が参照により本明細書に組み込まれる。
制限酵素認識配列を、アニーリングしたプライマー配列に挿入する。プライマーは、DNAポリメラーゼ及びdNTPによって伸長されて二本鎖が形成される。二本鎖の一方の鎖のみが制限酵素によって切断される。次いで、各一本鎖は、その後の合成のためのテンプレートとして利用可能である。SDAは、PCRの複雑な温度制御サイクルを必要としない。
転写媒介増幅(TMA)とも呼ばれる、核酸配列ベース増幅(NASBA)はまた、DNAポリメラーゼ、逆転写酵素、RNアーゼH及びT7 RNAポリメラーゼの組合せを利用する等温増幅法でもある。Compton(1991)Nature 350:91-92。標的RNAは、テンプレートとして使用され、逆転写酵素はその相補的DNA鎖を合成する。RNアーゼHは、RNAテンプレートを加水分解し、DNAポリメラーゼがRNA標的に相補的な第1のDNA鎖に相補的なDNA鎖を合成し、DNA二本鎖を形成するためのスペースを作る。T7 RNAポリメラーゼは、このDNA二本鎖の相補的RNA鎖を連続的に生成する。これらのRNA鎖は、DNA合成の新しいサイクルのためのテンプレートとして働き、標的遺伝子の増幅をもたらす。
ローリングサークル増幅(RCA)は、一本鎖環状ポリヌクレオチドを増幅し、Ф29DNAポリメラーゼが、ポリヌクレオチドサークルの周りを連続的に進行してその配列を何度も繰り返し複製することによってプライマーを伸長させる、多数回の等温酵素合成を含む。したがって、環状テンプレートの直鎖状コピーが達成される。次いで、この直鎖状コピーにプライマーをアニーリングさせ、その相補鎖を合成してもよい。Lizardi
et al.(1998)Nature Genetics 19:225-232を参照のこと。一本鎖環状DNAはまた、RNAポリメラーゼの存在下でのRNA合成のテンプレートとしても機能し得る。Daubendiek et al.(1995)JACS 117:7818-7819を参照のこと。cDNA末端(RACE)RCAの逆急速増幅は、Polidoros et alに記載されている。メッセンジャーRNA(mRNA)をcDNAに逆転写し、続いてRNアーゼH処理を行い、cDNAを分離する。次いで、cDNAをCircLigaseにより環状DNAに環状化する。得られた環状DNAの増幅は、RCAにより達成される。Polidoros et al.(2006)BioTechniques 41:35-42。
任意の前述の方法を、本開示のポリヌクレオチドの1つ以上の領域の製造に利用してもよい。
リガーゼによるポリヌクレオチドまたは核酸のアセンブリも広く使用されている。DNAまたはRNAリガーゼは、ホスホジエステル結合の形成によるポリヌクレオチド鎖の5’及び3’末端の分子間ライゲーションを促進する。リガーゼ連鎖反応(LCR)は、2つの隣接するポリヌクレオチドプローブが標的遺伝子の一方の鎖にハイブリダイズし、リガーゼによって互いにカップリングさせる原理に基づく有望な診断技術である。標的遺伝子が存在しない場合、または標的遺伝子に一塩基多型(SNP)などのミスマッチがある場合、このプローブは連結し得ない。Wiedmann et al.(1994)PCR Methods and Application 3(4):s51-s64。LCRは、検出の感度を増大させるために、またはポリヌクレオチド及び核酸の合成に使用される場合は、生成物の量を増大させるために、様々な増幅技術と組み合わせてもよい。
現在、核酸用のいくつかのライブラリー調製キットが市販されている。それらには、少量の核酸試料を下流に適用するためのインデックス付きライブラリーに変換するための酵素及び緩衝液を備える。例えば、DNA断片は、末端調製、ライゲーション、サイズ選択、クリーンアップ、PCR増幅及び最終的なクリーンアップのためにNEWENGLAND BIOLABS(登録商標)によってNEBNEXT(登録商標)ULTRATM DNA Library Prep Kitに入れてもよい。
増幅技術の改善のための開発が続けられている。例えば、Asada et al.の米国特許第8,367,328号は、反応エンハンサーを利用してDNAポリメラーゼによるDNA合成反応の効率を増大することを教示している。反応エンハンサーは、酸性物質または酸性物質のカチオン性複合体を含む。Kitabayashi(キタバヤシ)et al.の米国特許第7.384,739号は、酵素DNA合成を促進するカルボン酸イオン供給物質(このカルボン酸イオン供給物質はシュウ酸、マロン酸、シュウ酸のエステル、マロン酸のエステル、マロン酸の塩及びマレイン酸のエステルから選択される)を教示する。Sobekらの米国特許第7,378,262号は、DNA増幅の忠実度を高めるための酵素組成物を開示している。この組成物は、3’エキソヌクレアーゼ活性を有するがポリメラーゼ活性を有さない1つの酵素と、ポリメラーゼである別の酵素とを含む。両方の酵素は熱安定性であり、低温で不活性になるように可逆的に改変されている。
Gettsらの米国特許第7,550,264号によって、cDNA分子の3’末端にオリゴデオキシヌクレオチドテールを結合させ、RNAポリメラーゼを用いてRNA転写を開始することによって、センスRNA分子の複数回の合成を行うことが教示されている。Rohayemの公開番号米国特許出願公開第2013/0183718号は、一本鎖DNAテンプレートに対するRNAポリメラーゼ活性を示すRNA依存性RNAポリメラーゼ(RdRp)によるRNA合成を教示している。鎖のないヌクレオチドを有するオリゴヌクレオチドは、Bennerの米国特許第6,617,106号に開示されるように、鎖のないヌクレオチドを含むテンプレートを、テンプレートのヌクレオチドに相補的なヌクレオチドの混合物と接触させる酵素重合によって合成され得る。
化学合成
IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド及び/またはOX40Lポリペプチドをコードする単離されたポリヌクレオチド配列を合成するために標準的な方法を適用してもよい。例えば、特定の単離ポリペプチドをコードするコドン最適化ヌクレオチド配列を含む単一のDNAまたはRNAオリゴマーを合成してもよい。他の態様では、所望のポリペプチドの部分をコードするいくつかの小さなオリゴヌクレオチドを合成し、次いでライゲードしてもよい。いくつかの態様では、個々のオリゴヌクレオチドは典型的には、相補的なアセンブリのために、5’または3’オーバーハングを含む。
本明細書に開示されるポリヌクレオチド(例えば、mRNA)は、当該技術分野において既知である化学合成方法及び可能性のある核酸塩基置換を用いて化学的に合成され得る。例えば、国際公開番号WO2014093924(米国特許出願公開第20150307542号も参照のこと)、WO2013052523(米国特許出願公開第20130115272号も参照のこと)。WO2013039857、WO2012135805(米国特許出願公開第20120251618号も参照のこと)、WO2013151671(米国特許出願公開第20150044277号も参照のこと);米国特許出願公開第20130115272号;または米国特許第8999380号、同第8710200号を参照のこと。
精製
本明細書に記載のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)の精製には、限定するものではないが、ポリヌクレオチドのクリーンアップ、品質保証及び品質管理が挙げられる。クリーンアップは、当該技術分野において既知である方法、例えば、限定するものではないが、AGENCOURT(登録商標)ビーズ(Beckman Coulter Genomics、Danvers、MA)、ポリ-Tビーズ、LNA(商標)オリゴ-T捕捉プローブ(EXIQON(登録商標)Inc、Vedbaek,Denmark)またはHPLCベースの精製方法、例えば、限定するものではないが、強アニオン交換HPLC、弱アニオン交換HPLC、逆相HPLC(RP-HPLC)、及び疎水性相互作用HPLC(HIC-HPLC)によって行われ得る。「精製された」という用語は、「精製されたポリヌクレオチド」などのポリヌクレオチドに関して使用される場合、少なくとも1つの汚染物質から分離されるものを指す。本明細書で使用される場合、「汚染物質」とは、別の物質を不適当、不純または劣悪にさせる任意の物質である。したがって、精製されたポリヌクレオチド(例えば、DNA及びRNA)とは、天然に存在するものとは異なる形態または設定で存在するか、またはそれを処置もしくは精製方法に供する前に存在したものとは異なる形態もしくは設定で存在する。
いくつかの実施形態において、本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)の精製とは、望ましくない免疫応答、例えば、サイトカイン活性を低減もしくは除去し得る不純物を取り除く。
いくつかの実施形態において、本開示のIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40Lポリペプチドをコードするポリヌクレオチド(例えば、mRNA)は、投与前に、カラムクロマトグラフィー(例えば、強アニオン交換HPLC、弱アニオン交換HPLC、逆相HPLC(RP-HPLC)、及び疎水性相互作用HPLC(HIC-HPLC)、または(LCMS))を用いて精製される。いくつかの実施形態において、カラムクロマトグラフィー(例えば、強アニオン交換HPLC、弱アニオン交換HPLC、逆相HPLC(RP-HPLC)、及び疎水性相互作用HPLC(HIC-HPLC)、または(LCMS))精製ポリヌクレオチド(本明細書に開示されるIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40Lポリペプチドをコードする)は、異なる精製方法によって精製されたIL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40Lポリペプチドをコードするポリヌクレオチドと比較して、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40Lポリペプチドの発現を増加する。
いくつかの実施形態において、カラムクロマトグラフィー(例えば、強アニオン交換HPLC、弱アニオン交換HPLC、逆相HPLC(RP-HPLC)、及び疎水性相互作用HPLC(HIC-HPLC)、または(LCMS))精製ポリヌクレオチドは、哺乳動物IL-23ポリペプチド、哺乳動物IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/または哺乳動物OX40Lポリペプチドをコードする。いくつかの実施形態において、この精製されたポリヌクレオチドは、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40Lポリペプチドをコードする。いくつかの実施形態において、この精製されたポリヌクレオチドは、ヒトIL-23ポリペプチド、ヒトIL-36ガンマポリペプチド、IL-18ポリペプチド及び/またはヒトOX40Lポリペプチドをコードする。
いくつかの実施形態において、精製ポリヌクレオチドは、少なくとも約80%純粋、少なくとも約85%純粋、少なくとも約90%純粋、少なくとも約95%純粋、少なくとも約96%純粋、少なくとも約97%純粋、少なくとも約98%純粋、少なくとも約99%純粋、または約100%純粋である。
限定されるものではないが、ゲル電気泳動、UV吸光度、または分析用HPLCなどの方法を使用して、品質保証及び/または品質管理チェックを行ってもよい。
別の実施形態において、ポリヌクレオチドは、逆転写PCRを含むがこれに限定されない方法によって配列決定され得る。
XI.化学修飾
本明細書において用いる場合、本開示による、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチド IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せにおいて、「化学修飾」または必要に応じて「化学的に修飾された」という用語は、アデノシン(A)、グアノシン(G)、ウリジン(U)、チミジン(T)またはシチジン(C)リボヌクレオチドまたはデオキシリボヌクレオチドに対する修飾であって、それらの位置、パターン、パーセントまたは集団のうちの1つ以上における修飾を指す。一般に、本明細書において、これらの用語は、天然に存在する5’末端mRNAキャップ部分におけるリボヌクレオチド修飾を指すものではない。
ポリペプチドにおいて、「修飾」という用語は、20アミノ酸の標準のセットと比較した修飾を指す。
修飾は、様々な別個の変更であり得る。いくつかの実施形態において、その領域は、1,2、またはそれ以上の(場合により異なる)ヌクレオシドまたはヌクレオチド(核酸塩基)修飾を含んでもよい。いくつかの実施形態において、細胞に導入された修飾ポリヌクレオチドは、未修飾ポリヌクレオチドと比較して、細胞において分解の低下を示す場合がある。他の実施形態において、修飾は、核酸塩基及び/または糖構造中にある。さらに他の実施形態では、修飾は主鎖構造内にある。
化学修飾
本開示のいくつかの実施形態は、IL-23ポリペプチドをコードするmRNAを含む第1のポリヌクレオチド、及びIL-36ガンマポリペプチドもしくはIL-18ポリペプチドをコードするmRNAを含む第2のポリヌクレオチド、またはOX40LポリペプチドをコードするmRNAを含む第3のポリヌクレオチドを提供し、ここでこのmRNAが少なくとも1つの化学修飾を含む。
本開示の他の実施形態は、IL-23ポリペプチドをコードするmRNAを含む第1のポリヌクレオチド、IL-36ガンマポリペプチド、またはIL-18ポリペプチドをコードするmRNAを含む第2のポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含む第3のポリヌクレオチドを提供し、ここでこのmRNAは、少なくとも1つの化学修飾を含む。
いくつかの実施形態において、化学修飾は、シュードウリジン、N1-メチルシュードウリジン、2-チオウリジン、4’-チオウリジン、5-メチルシトシン、2-チオ-1-メチル-1-デアザ-シュードウリジン、2-チオ-1-メチルシュードウリジン、2-チオ-5-アザウリジン、2-チオ-ジヒドロシュードウリジン、2-チオ-ジヒドロウリジン、2-チオ-シュードウリジン、4-メトキシ-2-チオ-シュードウリジン、4-メトキシ-シュードウリジン、4-チオ-1-メチル-シュードウリジン、4-チオ-シュードウリジン、5-アザ-ウリジン、ジヒドロシュードウリジン、5-メチルウリジン、)、5-メトキシウリジン、及び2’-O-メチルウリジンから選択される。
「ヌクレオシド」は、本明細書中で使用される場合、有機塩基(例えば、プリンまたはピリミジン)またはその誘導体(本明細書中では、「核酸塩基」とも呼ばれる)と組み合わせた糖分子(例えば、ペントースまたはリボース)またはその誘導体を含む化合物を指す。「ヌクレオチド」とは、本明細書において用いる場合、リン酸基を含むヌクレオシドを指す。修飾ヌクレオチドは、例えば、化学的に、酵素的に、または組換えなどにより、1つ以上の修飾または非天然ヌクレオシドを含むように任意の有用な方法によって合成され得る。ポリヌクレオチドは、連結されたヌクレオシドの領域(複数可)を含んでもよい。そのような領域は、可変の主鎖結合を有し得る。結合は、標準的なホスホジエステル結合であってもよく、その場合、ポリヌクレオチドは、ヌクレオチドの領域を含む。
修飾ヌクレオチド塩基対形成は、標準的なアデノシン-チミン、アデノシン-ウラシル、またはグアノシン-シトシン塩基対だけでなく、ヌクレオチド間に形成された塩基対及び/または非標準塩基もしくは修飾塩基を含む修飾ヌクレオチドも包含し、ここで水素結合供与体及び水素結合受容体の配置によって、非標準塩基と標準塩基との間、または2つの相補的非標準塩基構造間の水素結合が可能になる。そのような非標準塩基対形成の一例は、修飾ヌクレオチドイノシンとアデニン、シトシンまたはウラシルとの間の塩基対形成である。本開示のポリヌクレオチドに、塩基/糖またはリンカーの任意の組合せを組み込んでもよい。
当業者であれば、特記しない限り、本出願に記載のポリヌクレオチド配列は代表的なDNA配列中に「T」を挙げるが、その配列がRNAを表す場合には「T」を「U」で置き換えることを理解する。
本開示のポリヌクレオチド、組成物、方法及び合成プロセスにおいて有用なポリヌクレオチド(例えば、mRNAポリヌクレオチドのようなRNAポリヌクレオチド)の修飾としては、限定するものではないが、以下のヌクレオチド、ヌクレオシド及び核酸塩基が挙げられる:2-メチルチオ-N6-(cis-ヒドロキシイソペンテニル)アデノシン;2-メチルチオ-N6-メチルアデノシン;2-メチルチオ-N6-トレオニルカルバモイルアデノシン;N6-グリシニルカルバモイルアデノシン;N6-イソペンテニルアデノシン;N6-メチルアデノシン;N6-トレオニルカルバモイルアデノシン;1,2’-O-ジメチルアデノシン;1-メチルアデノシン;2’-O-メチルアデノシン;2’-O-リボシルアデノシン(リン酸塩);2-メチルアデノシン;2-メチルチオ-N6
イソペンテニルアデノシン;2-メチルチオ-N6-ヒドロキシノルバリル カルバモイルアデノシン;2’-O-メチルアデノシン;2’-O-リボシルアデノシン(リン酸塩);イソペンテニルアデノシン;N6-(cis-ヒドロキシイソペンテニル)アデノシン;N6,2’-O-ジメチルアデノシン;N6,2’-O-ジメチルアデノシン;N6,N6,2’-O-トリメチルアデノシン;N6,N6-ジメチルアデノシン;N6-アセチルアデノシン;N6-ヒドロキシノルバリルカルバモイルアデノシン;N6-メチル-N6-トレオニルカルバモイルアデノシン;2-メチルアデノシン;2-メチルチオ-N6-イソペンテニルアデノシン;7-デアザ-アデノシン;N1-メチル-アデノシン;N6,N6(ジメチル)アデニン;N6-cis-ヒドロキシ-イソペンテニル-アデノシン;α-チオ-アデノシン;2(アミノ)アデニン;2(アミノプロピル)アデニン;2(メチルチオ)N6(イソペンテニル)アデニン;2-(アルキル)アデニン;2-(アミノアルキル)アデニン;2-(アミノプロピル)アデニン;2-(ハロ)アデニン;2-(ハロ)アデニン;2-(プロピル)アデニン;2’-アミノ-2’-デオキシ-ATP;2’-アジド-2’-デオキシ-ATP;2’-デオキシ-2’-a-アミノアデノシン TP;2’-デオキシ-2’-a-アジドアデノシン TP;6(アルキル)アデニン;6(メチル)アデニン;6-(アルキル)アデニン;6-(メチル)アデニン;7(デアザ)アデニン;8(アルケニル)アデニン;8(アルキニル)アデニン;8(アミノ)アデニン;8(チオアルキル)アデニン;8-(アルケニル)アデニン;8-(アルキル)アデニン;8-(アルキニル)アデニン;8-(アミノ)アデニン;8-(ハロ)アデニン;8-(ヒドロキシル)アデニン;8-(チオアルキル)アデニン;8-(チオール)アデニン;8-アジド-アデノシン;アザ アデニン;デアザ アデニン;N6(メチル)アデニン;N6-(イソペンチル)アデニン;7-デアザ-8-アザ-アデノシン;7-メチルアデニン;1-デアザアデノシン TP;2’フルオロ-N6-Bz-デオキシアデノシン TP;2’-OMe-2-アミノ-ATP;2’O-メチル-N6-Bz-デオキシアデノシン TP;2’-a-エチニルアデノシン TP;2-アミノアデニン;2-アミノアデノシン TP;2-アミノ-ATP;2’-a-トリフルオロメチルアデノシン TP;2-アジドアデノシン TP;2’-b-エチニルアデノシン TP;2-ブロモアデノシン TP;2’-b-トリフルオロメチルアデノシン TP;2-クロロアデノシン TP;2’-デオキシ-2’,2’-ジフルオロアデノシン TP;2’-デオキシ-2’-a-メルカプトアデノシン TP;2’-デオキシ-2’-a-チオメトキシアデノシン TP;2’-デオキシ-2’-b-アミノアデノシン TP;2’-デオキシ-2’-b-アジドアデノシン TP;2’-デオキシ-2’-b-ブロモアデノシン TP;2’-デオキシ-2’-b-クロロアデノシン TP;2’-デオキシ-2’-b-フルオロアデノシン TP;2’-デオキシ-2’-b-ヨードアデノシン TP;2’-デオキシ-2’-b-メルカプトアデノシン TP;2’-デオキシ-2’-b-チオメトキシアデノシン TP;2-フルオロアデノシン TP;2-ヨードアデノシン TP;2-メルカプトアデノシン TP;2-メトキシ-アデニン;2-メチルチオ-アデニン;2-トリフルオロメチルアデノシン TP;3-デアザ-3-ブロモアデノシン TP;3-デアザ-3-クロロアデノシン TP;3-デアザ-3-フルオロアデノシン TP;3-デアザ-3-ヨードアデノシン TP;3-デアザアデノシン TP;4’-アジドアデノシン TP;4’-炭素環式アデノシン TP;4’-エチニルアデノシン TP;5’-ホモ-アデノシン TP;8-Aza-ATP;8-ブロモ-アデノシン TP;8-トリフルオロメチルアデノシン TP;9-デアザアデノシン TP;2-アミノプリン;7-デアザ-2,6-ジアミノプリン;7-デアザ-8-アザ-2,6-ジアミノプリン;7-デアザ-8-アザ-2-アミノプリン;2,6-ジアミノプリン;7-デアザ-8-アザ-アデニン、7-デアザ-2-アミノプリン;2-チオシチジン;3-メチルシチジン;5-ホルミルシチジン;5-ヒドロキシメチルシチジン;5-メチルシチジン;N4-アセチルシチジン;2’-O-メチルシチジン;2’-O-メチルシチジン;5,2’-O-ジメチルシチジン;5-ホルミル-2’-O-メチルシチジン;リシジン;N4,2’-O-ジメチルシチジン;N4-アセチル-2’-O-メチルシチジン;N4-メチルシチジン;N4,N4-ジメチル-2’-OMe-シチジン TP;4-メチルシチジン;5-アザ-シチジン;シュード-イソ-シチジン;ピロロ-シチジン;α-チオ-シチジン;2-(チオ)シトシン;2’-アミノ-2’-デオキシ-CTP;2’-アジド-2’-デオキシ-CTP;2’-デオキシ-2’-a-アミノシチジン TP;2’-デオキシ-2’-a-アジドシチジン TP;3(デアザ)5(アザ)シトシン;3(メチル)シトシン;3-(アルキル)シトシン;3-(デアザ)5(アザ)シトシン;3-(メチル)シチジン;4,2’-O-ジメチルシチジン;5(ハロ)シトシン;5(メチル)シトシン;5(プロピニル)シトシン;5(トリフルオロメチル)シトシン;5-(アルキル)シトシン;5-(アルキニル)シトシン;5-(ハロ)シトシン;5-(プロピニル)シトシン;5-(トリフルオロメチル)シトシン;5-ブロモ-シチジン;5-ヨード-シチジン;5-プロピニル シトシン;6-(アゾ)シトシン;6-アザ-シチジン;アザ シトシン;デアザ シトシン;N4(アセチル)シトシン;1-メチル-1-デアザ-シュードイソシチジン;1-メチル-シュードイソシチジン;2-メトキシ-5-メチル-シチジン;2-メトキシ-シチジン;2-チオ-5-メチル-シチジン;4-メトキシ-1-メチル-シュードイソシチジン;4-メトキシ-シュードイソシチジン;4-チオ-1-メチル-1-デアザ-シュードイソシチジン;4-チオ-1-メチル-シュードイソシチジン;4-チオ-シュードイソシチジン;5-アザ-ゼブラリン;5-メチル-ゼブラリン;ピロロ-シュードイソシチジン;ゼブラリン;(E)-5-(2-ブロモ-ビニル)シチジン TP;2,2’-アンヒドロ-シチジン TP塩酸塩;2’フルオロ-N4-Bz-シチジン TP;2’フルオロ-N4-アセチル-シチジン TP;2’-O-メチル-N4-アセチル-シチジン TP;2’O-メチル-N4-Bz-シチジン TP;2’-a-エチニルシチジン TP;2’-a-トリフルオロメチルシチジン TP;2’-b-エチニルシチジン TP;2’-b-トリフルオロメチルシチジン TP;2’-デオキシ-2’,2’-ジフルオロシチジン TP;2’-デオキシ-2’-a-メルカプトシチジン TP;2’-デオキシ-2’-a-チオメトキシシチジン TP;2’-デオキシ-2’-b-アミノシチジン TP;2’-デオキシ-2’-b-アジドシチジン TP;2’-デオキシ-2’-b-ブロモシチジン TP;2’-デオキシ-2’-b-クロロシチジン TP;2’-デオキシ-2’-b-フルオロシチジン TP;2’-デオキシ-2’-b-ヨードシチジン TP;2’-デオキシ-2’-b-メルカプトシチジン TP;2’-デオキシ-2’-b-チオメトキシシチジン TP;2’-O-メチル-5-(1-プロピニル)シチジン TP;3’-エチニルシチジン TP;4’-アジドシチジン
TP;4’-炭素環式シチジン TP;4’-エチニルシチジン TP;5-(1-プロピニル)アラ-シチジン TP;5-(2-クロロ-フェニル)-2-チオシチジン TP;5-(4-アミノ-フェニル)-2-チオシチジン TP;5-アミノアリル-CTP;5-シアノシチジン TP;5-エチニルアラ-シチジン TP;5-エチニルシチジン TP;5’-ホモ-シチジン TP;5-メトキシシチジン TP;5-トリフルオロメチル-シチジン TP;N4-アミノ-シチジン TP;N4-ベンゾイル-シチジン TP;シュードイソシチジン;7-メチルグアノシン;N2,2’-O-ジメチルグアノシン;N2-メチルグアノシン;ワイオシン;1,2’-O-ジメチルグアノシン;1-メチルグアノシン;2’-O-メチルグアノシン;2’-O-リボシルグアノシン(リン酸塩);2’-O-メチルグアノシン;2’-O-リボシルグアノシン(リン酸塩);7-アミノメチル-7-デアザグアノシン;7-シアノ-7-デアザグアノシン;アルカエオシン;メチルワイオシン;N2,7-ジメチルグアノシン;N2,N2,2’-O-トリメチルグアノシン;N2,N2,7-トリメチルグアノシン;N2,N2-ジメチルグアノシン;N2,7,2’-O-トリメチルグアノシン;6-チオ-グアノシン;7-デアザ-グアノシン;8-オキソ-グアノシン;N1-メチル-グアノシン;α-チオ-グアノシン;2(プロピル)グアニン;2-(アルキル)グアニン;2’-アミノ-2’-デオキシ-GTP;2’-アジド-2’-デオキシ-GTP;2’-デオキシ-2’-a-アミノグアノシン TP;2’-デオキシ-2’-a-アジドグアノシン TP;6(メチル)グアニン;6-(アルキル)グアニン;6-(メチル)グアニン;6-メチル-グアノシン;7(アルキル)グアニン;7(デアザ)グアニン;7(メチル)グアニン;7-(アルキル)グアニン;7-(デアザ)グアニン;7-(メチル)グアニン;8(アルキル)グアニン;8(アルキニル)グアニン;8(ハロ)グアニン;8(チオアルキル)グアニン;8-(アルケニル)グアニン;8-(アルキル)グアニン;8-(アルキニル)グアニン;8-(アミノ)グアニン;8-(ハロ)グアニン;8-(ヒドロキシル)グアニン;8-(チオアルキル)グアニン;8-(チオール)グアニン;アザ グアニン;デアザ グアニン;N(メチル)グアニン;N-(メチル)グアニン;1-メチル-6-チオ-グアノシン;6-メトキシ-グアノシン;6-チオ-7-デアザ-8-アザ-グアノシン;6-チオ-7-デアザ-グアノシン;6-チオ-7-メチル-グアノシン;7-デアザ-8-アザ-グアノシン;7-メチル-8-オキソ-グアノシン;N2,N2-ジメチル-6-チオ-グアノシン;N2-メチル-6-チオ-グアノシン;1-Me-GTP;2’フルオロ-N2-イソブチル-グアノシン TP;2’O-メチル-N2-イソブチル-グアノシン TP;2’-a-エチニルグアノシン TP;2’-a-トリフルオロメチルグアノシン TP;2’-b-エチニルグアノシン TP;2’-b-トリフルオロメチルグアノシン TP;2’-デオキシ-2’,2’-ジフルオログアノシン TP;2’-デオキシ-2’-a-メルカプトグアノシン TP;2’-デオキシ-2’-a-チオメトキシグアノシン TP;2’-デオキシ-2’-b-アミノグアノシン TP;2’-デオキシ-2’-b-アジドグアノシン TP;2’-デオキシ-
2’-b-ブロモグアノシン TP;2’-デオキシ-2’-b-クロログアノシン TP;2’-デオキシ-2’-b-フルオログアノシン TP;2’-デオキシ-2’-b-ヨードグアノシン TP;2’-デオキシ-2’-b-メルカプトグアノシン TP;2’-デオキシ-2’-b-チオメトキシグアノシン TP;4’-アジドグアノシン TP;4’-炭素環式グアノシン TP;4’-エチニルグアノシン TP;5’-ホモ-グアノシン TP;8-ブロモ-グアノシン TP;9-デアザグアノシン TP;N2-イソブチル-グアノシン TP;1-メチルイノシン;イノシン;1,2’-O-ジメチルイノシン;2’-O-メチルイノシン;7-メチルイノシン;2’-O-メチルイノシン;エポキシキューオシン;ガラクトシル-キューオシン;マンノシルキューオシン;キューオシン;アリルアミノ-チミジン;アザ チミジン;デアザ チミジン;デオキシ-チミジン;2’-O-メチルウリジン;2-チオウリジン;3-メチルウリジン;5-カルボキシメチルウリジン;5-ヒドロキシウリジン;5-メチルウリジン;5-タウリノメチル-2-チオウリジン;5-タウリノメチルウリジン;ジヒドロウリジン;シュードウリジン;(3-(3-アミノ-3-カルボキシプロピル)ウリジン;1-メチル-3-(3-アミノ-5-カルボキシプロピル)シュードウリジン;1-メチルシュードウリジン;1-エチル-シュードウリジン;2’-O-メチルウリジン;2’-O-メチルシュードウリジン;2’-O-メチルウリジン;2-チオ-2’-O-メチルウリジン;3-(3-アミノ-3-カルボキシプロピル)ウリジン;3,2’-O-ジメチルウリジン;3-メチル-シュード-ウリジン TP;4-チオウリジン;5-(カルボキシヒドロキシメチル)ウリジン;5-(カルボキシヒドロキシメチル)ウリジン メチルエステル;5,2’-O-ジメチルウリジン;5,6-ジヒドロ-ウリジン;5-アミノメチル-2-チオウリジン;5-カルバモイルメチル-2’-O-メチルウリジン;5-カルバモイルメチルウリジン;5-カルボキシヒドロキシメチルウリジン;5-カルボキシヒドロキシメチルウリジン メチルエステル;5-カルボキシメチルアミノメチル-2’-O-メチルウリジン;5-カルボキシメチルアミノメチル-2-チオウリジン;5-カルボキシメチルアミノメチル-2-チオウリジン;5-カルボキシメチルアミノメチルウリジン;5-カルボキシメチルアミノメチルウリジン;5-カルバモイルメチルウリジン TP;5-メトキシカルボニルメチル-2’-O-メチルウリジン;5-メトキシカルボニルメチル-2-チオウリジン;5-メトキシカルボニルメチルウリジン;5-メチルウリジン、)、5-メトキシウリジン;5-メチル-2-チオウリジン;5-メチルアミノメチル-2-セレノウリジン;5-メチルアミノメチル-2-チオウリジン;5-メチルアミノメチルウリジン;5-メチルジヒドロウリジン;5-オキシ酢酸-ウリジン TP;5-オキシ酢酸-メチルエステル-ウリジン TP;N1-メチル-シュード-ウラシル;N1-エチル-シュード-ウラシル;ウリジン 5-オキシ酢酸;ウリジン 5-オキシ酢酸 メチルエステル;3-(3-アミノ-3-カルボキシプロピル)-ウリジン TP;5-(イソ-ペンテニルアミノメチル)-2-チオウリジン TP;5-(イソ-ペンテニルアミノメチル)-2’-O-メチルウリジン TP;5-(イソ-ペンテニルアミノメチル)ウリジン TP;5-プロピニル ウラシル;α-チオ-ウリジン;1(アミノアルキルアミノ-カルボニルエチレニル)-2(チオ)-シュードウラシル;1(アミノアルキルアミノカルボニルエチレニル)-2,4-(ジチオ)シュードウラシル;1(アミノアルキルアミノカルボニルエチレニル)-4(チオ)シュードウラシル;1(アミノアルキルアミノカルボニルエチレニル)-シュードウラシル;1(アミノカルボニルエチレニル)-2(チオ)-シュードウラシル;1(アミノカルボニルエチレニル)-2,4-(ジチオ)シュードウラシル;1(アミノカルボニルエチレニル)-4(チオ)シュードウラシル;1(アミノカルボニルエチレニル)-シュードウラシル;1置換2(チオ)-シュードウラシル;1置換2,4-(ジチオ)シュードウラシル;1置換4(チオ)シュードウラシル;1置換シュードウラシル;1-(アミノアルキルアミノ-カルボニルエチレニル)-2-(チオ)-シュードウラシル;1-メチル-3-(3-アミノ-3-カルボキシプロピル)シュードウリジン TP;1-メチル-3-(3-アミノ-3-カルボキシプロピル)シュード-UTP;1-メチル-シュード-UTP;1-エチル-シュード-UTP;2(チオ)シュードウラシル;2’デオキシ ウリジン;2’フルオロウリジン;2-(チオ)ウラシル;2,4-(ジチオ)シュードウラシル;2’メチル,2’アミノ,2’アジド,2’フルオロ-グアノシン;2’-アミノ-2’-デオキシ-UTP;2’-アジド-2’-デオキシ-UTP;2’-アジド-デオキシウリジン TP;2’-O-メチルシュードウリジン;2’デオキシ ウリジン;2’フルオロウリジン;2’-デオキシ-2’-a-アミノウリジン TP;2’-デオキシ-2’-a-アジドウリジン TP;2-メチルシュードウリジン;3(3 アミノ-3 カルボキシプロピル)ウラシル;4(チオ)シュードウラシル;4-(チオ)シュードウラシル;4-(チオ)ウラシル;4-チオウラシル;5(1,3-ジアゾール-1-アルキル)ウラシル;5(2-アミノプロピル)ウラシル;5(アミノアルキル)ウラシル;5(ジメチルアミノアルキル)ウラシル;5(グアニジニウムアルキル)ウラシル;5(メトキシカルボニルメチル)-2-(チオ)ウラシル;5(メトキシカルボニル-メチル)ウラシル;5(メチル)2(チオ)ウラシル;5(メチル)2,4(ジチオ)ウラシル;5(メチル)4(チオ)ウラシル;5(メチルアミノメチル)-2(チオ)ウラシル;5(メチルアミノメチル)-2,4(ジチオ)ウラシル;5(メチルアミノメチル)-4(チオ)ウラシル;5(プロピニル)ウラシル;5(トリフルオロメチル)ウラシル;5-(2-アミノプロピル)ウラシル;5-(アルキル)-2-(チオ)シュードウラシル;5-(アルキル)-2,4(ジチオ)シュードウラシル;5-(アルキル)-4(チオ)シュードウラシル;5-(アルキル)シュードウラシル;5-(アルキル)ウラシル;5-(アルキニル)ウラシル;5-(アリルアミノ)ウラシル;5-(シアノアルキル)ウラシル;5-(ジアルキルアミノアルキル)ウラシル;5-(ジメチルアミノアルキル)ウラシル;5-(グアニジニウムアルキル)ウラシル;5-(ハロ)ウラシル;5-(l,3-ジアゾール-l-アルキル)ウラシル;5-(メトキシ)ウラシル;5-(メトキシカルボニルメチル)-2-(チオ)ウラシル;5-(メトキシカルボニル-メチル)ウラシル;5-(メチル)2(チオ)ウラシル;5-(メチル)2,4(ジチオ)ウラシル;5-(メチル)4(チオ)ウラシル;5-(メチル)-2-(チオ)シュードウラシル;5-(メチル)-2,4(ジチオ)シュードウラシル;5-(メチル)-4(チオ)シュードウラシル;5-(メチル)シュードウラシル;5-(メチルアミノメチル)-2(チオ)ウラシル;5-(メチルアミノメチル)-2,4(ジチオ)ウラシル;5-(メチルアミノメチル)-4-(チオ)ウラシル;5-(プロピニル)ウラシル;5-(トリフルオロメチル)ウラシル;5-アミノアリル-ウリジン;5-ブロモ-ウリジン;5-ヨード-ウリジン;5-ウラシル;6(アゾ)ウラシル;6-(アゾ)ウラシル;6-アザ-ウリジン;アリルアミノ-ウラシル;アザ ウラシル;デアザ ウラシル;N3(メチル)ウラシル;シュード-UTP-1-2-エタン酸;シュードウラシル;4-チオ-シュード-UTP;1-カルボキシメチル-シュードウリジン;1-メチル-1-デアザ-シュードウリジン;1-プロピニル-ウリジン;1-タウリノメチル-1-メチル-ウリジン;1-タウリノメチル-4-チオ-ウリジン;1-タウリノメチル-シュードウリジン;2-メトキシ-4-チオ-シュードウリジン;2-チオ-1-メチル-1-デアザ-シュードウリジン;2-チオ-1-メチル-シュードウリジン;2-チオ-5-アザ-ウリジン;2-チオ-ジヒドロシュードウリジン;2-チオ-ジヒドロウリジン;2-チオ-シュードウリジン;4-メトキシ-2-チオ-シュードウリジン;4-メトキシ-シュードウリジン;4-チオ-1-メチル-シュードウリジン;4-チオ-シュードウリジン;5-アザ-ウリジン;ジヒドロシュードウリジン;(±)1-(2-ヒドロキシプロピル)シュードウリジン TP;(2R)-1-(2-ヒドロキシプロピル)シュードウリジン TP;(2S)-1-(2-ヒドロキシプロピル)シュードウリジン TP;(E)-5-(2-ブロモ-ビニル)アラ-ウリジン TP;(E)-5-(2-ブロモ-ビニル)ウリジン TP;(Z)-5-(2-ブロモ-ビニル)アラ-ウリジン TP;(Z)-5-(2-ブロモ-ビニル)ウリジン TP;1-(2,2,2-トリフルオロエチル)-シュード-UTP;1-(2,2,3,3,3-ペンタフルオロプロピル)シュードウリジン TP;1-(2,2-ジエトキシエチル)シュードウリジン TP;1-(2,4,6-トリメチルベンジル)シュードウリジン TP;1-(2,4,6-トリメチル-ベンジル)シュード-UTP;1-(2,4,6-トリメチル-フェニル)シュード-UTP;1-(2-アミノ-2-カルボキシエチル)シュード-UTP;1-(2-アミノ-エチル)シュード-UTP;1-(2-ヒドロキシエチル)シュードウリジン TP;1-(2-メトキシエチル)シュードウリジン TP;1-(3,4-Bis-トリフルオロメトキシベンジル)シュードウリジン TP;1-(3,4-ジメトキシベンジル)シュードウリジン TP;1-(3-アミノ-3-カルボキシプロピル)シュード-UTP;1-(3-アミノ-プロピル)シュード-UTP;1-(3-シクロプロピル-プロパ-2-イニル)シュードウリジン TP;1-(4-アミノ-4-カルボキシブチル)シュード-UTP;1-(4-アミノ-ベンジル)シュード-UTP;1-(4-アミノ-ブチル)シュード-UTP;1-(4-アミノ-フェニル)シュード-UTP;1-(4-アジドベンジル)シュードウリジン TP;1-(4-ブロモベンジル)シュードウリジン TP;1-(4-クロロベンジル)シュードウリジン TP;1-(4-フルオロベンジル)シュードウリジン TP;1-(4-ヨードベンジル)シュードウリジン TP;1-(4-メタンスルホニルベンジル)シュードウリジン TP;1-(4-メトキシベンジル)シュードウリジン TP;1-(4-メトキシ-ベンジル)シュード-UTP;1-(4-メトキシ-フェニル)シュード-UTP;1-(4-メチルベンジル)シュードウリジン TP;1-(4-メチル-ベンジル)シュード-UTP;1-(4-ニトロベンジル)シュードウリジン TP;1-(4-ニトロ-ベンジル)シュード-UTP;1(4-ニトロ-フェニル)シュード-UTP;1-(4-チオメトキシベンジル)シュードウリジン TP;1-(4-トリフルオロメトキシベンジル)シュードウリジン TP;1-(4-トリフルオロメチルベンジル)シュードウリジン TP;1-(5-アミノ-ペンチル)シュード-UTP;1-(6-アミノ-ヘキシル)シュード-UTP;1,6-ジメチル-シュード-UTP;1-[3-(2-{2-[2-(2-アミノエトキシ)-エトキシ]-エトキシ}-エトキシ)-プロピオニル]シュードウリジン TP;1-{3-[2-(2-アミノエトキシ)-エトキシ]-プロピオニル } シュードウリジン TP;1-アセチルシュードウリジン TP;1-アルキル-6-(1-プロピニル)-シュード-UTP;1-アルキル-6-(2-プロピニル)-シュード-U
TP;1-アルキル-6-アリル-シュード-UTP;1-アルキル-6-エチニル-シュード-UTP;1-アルキル-6-ホモアリル-シュード-UTP;1-アルキル-6-ビニル-シュード-UTP;1-アリルシュードウリジン TP;1-アミノメチル-シュード-UTP;1-ベンゾイルシュードウリジン TP;1-ベンジルオキシメチルシュードウリジン TP;1-ベンジル-シュード-UTP;1-ビオチニル-PEG2-シュードウリジン TP;1-ビオチニルシュードウリジン TP;1-ブチル-シュード-UTP;1-シアノメチルシュードウリジン TP;1-シクロブチルメチル-シュード-UTP;1-シクロブチル-シュード-UTP;1-シクロヘプチルメチル-シュード-UTP;1-シクロヘプチル-シュード-UTP;1-シクロヘキシルメチル-シュード-UTP;1-シクロヘキシル-シュード-UTP;1-シクロオクチルメチル-シュード-UTP;1-シクロオクチル-シュード-UTP;1-シクロペンチルメチル-シュード-UTP;1-シクロペンチル-シュード-UTP;1-シクロプロピルメチル-シュード-UTP;1-シクロプロピル-シュード-UTP;1-エチル-シュード-UTP;1-ヘキシル-シュード-UTP;1-ホモアリルシュードウリジン TP;1-ヒドロキシメチルシュードウリジン TP;1-イソ-プロピル-シュード-UTP;1-Me-2-チオ-シュード-UTP;1-Me-4-チオ-シュード-UTP;1-Me-アルファ-チオ-シュード-UTP;1-メタンスルホニルメチルシュードウリジン TP;1-メトキシメチルシュードウリジン TP;1-メチル-6-(2,2,2-トリフルオロエチル)シュード-UTP;1-メチル-6-(4-モルホリノ)-シュード-UTP;1-メチル-6-(4-チオモルホリノ)-シュード-UTP;1-メチル-6-(置換フェニル)シュード-UTP;1-メチル-6-アミノ-シュード-UTP;1-メチル-6-アジド-シュード-UTP;1-メチル-6-ブロモ-シュード-UTP;1-メチル-6-ブチル-シュード-UTP;1-メチル-6-クロロ-シュード-UTP;1-メチル-6-シアノ-シュード-UTP;1-メチル-6-ジメチルアミノ-シュード-UTP;1-メチル-6-エトキシ-シュード-UTP;1-メチル-6-エチルカルボキシレート-シュード-UTP;1-メチル-6-エチル-シュード-UTP;1-メチル-6-フルオロ-シュード-UTP;1-メチル-6-ホルミル-シュード-UTP;1-メチル-6-ヒドロキシアミノ-シュード-UTP;1-メチル-6-ヒドロキシ-シュード-UTP;1-メチル-6-ヨード-シュード-UTP;1-メチル-6-イソ-プロピル-シュード-UTP;1-メチル-6-メトキシ-シュード-UTP;1-メチル-6-メチルアミノ-シュード-UTP;1-メチル-6-フェニル-シュード-UTP;1-メチル-6-プロピル-シュード-UTP;1-メチル-6-tert-ブチル-シュード-UTP;1-メチル-6-トリフルオロメトキシ-シュード-UTP;1-メチル-6-トリフルオロメチル-シュード-UTP;1-モルホリノメチルシュードウリジン TP;1-ペンチル-シュード-UTP;1-フェニル-シュード-UTP;1-ピバロイルシュードウリジン TP;1-プロパルギルシュードウリジン TP;1-プロピル-シュード-UTP;1-プロピニル-シュードウリジン;1-p-トリル-シュード-UTP;1-tert-ブチル-シュード-UTP;1-チオメトキシメチルシュードウリジン TP;1-チオモルホリノメチルシュードウリジン TP;1-トリフルオロアセチルシュードウリジン TP;1-トリフルオロメチル-シュード-UTP;1-ビニルシュードウリジン TP;2,2’-アンヒドロ-ウリジン TP;2’-ブロモ-デオキシウリジン TP;2’-F-5-メチル-2’-デオキシ-UTP;2’-OMe-5-Me-UTP;2’-OMe-シュード-UTP;2’-a-エチニルウリジン TP;2’-a-トリフルオロメチルウリジン TP;2’-b-エチニルウリジン TP;2’-b-トリフルオロメチルウリジン TP;2’-デオキシ-2’,2’-ジフルオロウリジン TP;2’-デオキシ-2’-a-メルカプトウリジン TP;2’-デオキシ-2’-a-チオメトキシウリジン TP;2’-デオキシ-2’-b-アミノウリジン TP;2’-デオキシ-2’-b-アジドウリジン TP;2’-デオキシ-2’-b-ブロモウリジン TP;2’-デオキシ-2’-b-クロロウリジン TP;2’-デオキシ-2’-b-フルオロウリジン TP;2’-デオキシ-2’-b-ヨードウリジン TP;2’-デオキシ-2’-b-メルカプトウリジン TP;2’-デオキシ-2’-b-チオメトキシウリジン TP;2-メトキシ-4-チオ-ウリジン;2-メトキシウリジン;2’-O-メチル-5-(1-プロピニル)ウリジン TP;3-アルキル-シュード-UTP;4’-アジドウリジン TP;4’-炭素環式ウリジン TP;4’-エチニルウリジン TP;5-(1-プロピニル)アラ-ウリジン TP;5-(2-フラニル)ウリジン TP;5-シアノウリジン TP;5-ジメチルアミノウリジン TP;5’-ホモ-ウリジン TP;5-ヨード-2’-フルオロ-デオキシウリジン TP;5-フェニルエチニルウリジン TP;5-トリジュウテロメチル-6-ジュウテロウリジン TP;5-トリフルオロメチル-ウリジン TP;5-ビニルアラウリジン TP;6-(2,2,2-トリフルオロエチル)-シュード-UTP;6-(4-モルホリノ)-シュード-UTP;6-(4-チオモルホリノ)-シュード-UTP;6-(置換-フェニル)-シュード-UTP;6-アミノ-シュード-UTP;6-アジド-シュード-UTP;6-ブロモ-シュード-UTP;6-ブチル-シュード-UTP;6-クロロ-シュード-UTP;6-シアノ-シュード-UTP;6-ジメチルアミノ-シュード-UTP;6-エトキシ-シュード-UTP;6-エチルカルボキシレート-シュード-UTP;6-エチル-シュード-UTP;6-フルオロ-シュード-UTP;6-ホルミル-シュード-UTP;6-ヒドロキシアミノ-シュード-UTP;6-ヒドロキシ-シュード-UTP;6-ヨード-シュード-UTP;6-イソ-プロピル-シュード-UTP;6-メトキシ-シュード-UTP;6-メチルアミノ-シュード-UTP;6-メチル-シュード-UTP;6-フェニル-シュード-UTP;6-フェニル-シュード-UTP;6-プロピル-シュード-UTP;6-tert-ブチル-シュード-UTP;6-トリフルオロメトキシ-シュード-UTP;6-トリフルオロメチル-シュード-UTP;アルファ-チオ-シュード-UTP;シュードウリジン 1-(4-メチルベンゼンスルホン酸)TP;シュードウリジン 1-(4-メチル安息香酸)TP;シュードウリジン TP 1-[3-(2-エトキシ)]プロピオン酸;シュードウリジン TP 1-[3-{2-(2-[2-(2-エトキシ)-エトキシ]-エトキシ)-エトキシ}]プロピオン酸;シュードウリジン TP
1-[3-{2-(2-[2-{2(2-エトキシ)-エトキシ}-エトキシ]-エトキシ)-エトキシ}]プロピオン酸;シュードウリジン TP 1-[3-{2-(2-[2-エトキシ]-エトキシ)-エトキシ}]プロピオン酸;シュードウリジン TP 1-[3-{2-(2-エトキシ)-エトキシ}]プロピオン酸;シュードウリジン TP 1-メチルホスホン酸;シュードウリジン TP 1-メチルホスホン酸 ジエチルエステル;シュード-UTP-N1-3-プロピオン酸;シュード-UTP-N1-4-ブタン酸;シュード-UTP-N1-5-ペンタン酸;シュード-UTP-N1-6-ヘキサン酸;シュード-UTP-N1-7-ヘプタン酸;シュード-UTP-N1-メチル-p-安息香酸;シュード-UTP-N1-p-安息香酸;ワイブトシン;ヒドロキシワイブトシン;イソワイオシン;ペルオキシワイブトシン;不十分修飾ヒドロキシワイブトシン;4-デメチルワイオシン;2,6-(ジアミノ)プリン;1-(アザ)-2-(チオ)-3-(アザ)-フェノキサジン-1-イル:1,3-(ジアザ)-2-(オキソ)-フェンチアジン-l-イル;1,3-(ジアザ)-2-(オキソ)-フェノキサジン-1-イル;1,3,5-(トリアザ)-2,6-(ジオキサ)-ナフタレン;2(アミノ)プリン;2,4,5-(トリメチル)フェニル;2‘メチル,2’アミノ,2’アジド,2’フルオロ-シチジン;2’メチル,2’アミノ,2’アジド,2’フルオロ-アデニン;2’メチル,2’アミノ,2’アジド,2’フルオロ-ウリジン;2’-アミノ-2’-デオキシリボース;2-アミノ-6-クロロ-プリン;2-アザ-イノシニル;2’-アジド-2’-デオキシリボース;2’フルオロ-2’-デオキシリボース;2’-フルオロ-修飾塩基;2’-O-メチル-リボース;2-オキソ-7-アミノピリドピリミジン-3-イル;2-オキソ-ピリドピリミジン-3-イル;2-ピリジノン;3 ニトロピロロ;3-(メチル)-7-(プロピニル)イソカルボスチリリル;3-(メチル)イソカルボスチリリル;4-(フルオロ)-6-(メチル)ベンズイミダゾール;4-(メチル)ベンズイミダゾール;4-(メチル)インドリル;4,6-(ジメチル)インドリル;5 ニトロインドール;5置換ピリミジン;5-(メチル)イソカルボスチリリル;5-ニトロインドール;6-(アザ)ピリミジン;6-(アゾ)チミン;6-(メチル)-7-(アザ)インドリル;6-クロロ-プリン;6-フェニル-ピロロ-ピリミジン-2-オン-3-イル;7-(アミノアルキルヒドロキシ)-1-(アザ)-2-(チオ)-3-(アザ)-フェンチアジン-l-イル;7-(アミノアルキルヒドロキシ)-1-(アザ)-2-(チオ)-3-(アザ)-フェノキサジン-1-イル;7-(アミノアルキルヒドロキシ)-1,3-(ジアザ)-2-(オキソ)-フェノキサジン-1-イル;7-(アミノアルキルヒドロキシ)-l,3-(ジアザ)-2-(オキソ)-フェンチアジン-l-イル;7-(アミノアルキルヒドロキシ)-l,3-(ジアザ)-2-(オキソ)-フェノキサジン-l-イル;7-(アザ)インドリル;7-(グアニジニウムアルキルヒドロキシ)-1-(アザ)-2-(チオ)-3-(アザ)-フェノキサジニル-イル;7-(グアニジニウムアルキルヒドロキシ)-1-(アザ)-2-(チオ)-3-(アザ)-フェンチアジン-l-イル;7-(グアニジニウムアルキルヒドロキシ)-1-(アザ)-2-(チオ)-3-(アザ)-フェノキサジン-1-イル;7-(グアニジニウムアルキルヒドロキシ)-1,3-(ジアザ)-2-(オキソ)-フェノキサジン-1-イル;7-(グアニジニウムアルキル-ヒドロキシ)-l,3-(ジアザ)-2-(オキソ)-フェンチアジン-l-イル;7-(グアニジニウムアルキルヒドロキシ)-l,3-(ジアザ)-2-(オキソ)-フェノキサジン-l-イル;7-(プロピニル)イソカルボスチリリル;7-(プロピニル)イソカルボスチリリル,プロピニル-7-(アザ)インドリル;7-デアザ-イノシニル;7-置換1-(アザ)-2-(チオ)-3-(アザ)-フェノキサジン-1-イル;7-置換1,3-(ジアザ)-2-(オキソ)-フェノキサジン-1-イル;9-(メチル)-イミジゾピリジニル;アミノインドリル;アントラセニル;bis-オルト-(アミノアルキルヒドロキシ)-6-フェニル-ピロロ-ピリミジン-2-オン-3-イル;bis-オルト-置換-6-フェニル-ピロロ-ピリミジン-2-オン-3-イル;ジフルオロトリル;ヒポキサンチン;イミジゾピリジニル;イノシニル;イソカルボスチリル;イソグアニシン;N2-置換プリン;N6-メチル-2-アミノ-プリン;N6-置換プリン;N-アルキル化誘導体;ナフタレニル;
ニトロベンズイミダゾリル;ニトロイミダゾリル;ニトロインダゾリル;ニトロピラゾリル;ヌブラリン;O6-置換プリン;O-アルキル化誘導体;オルト-(アミノアルキルヒドロキシ)-6-フェニル-ピロロ-ピリミジン-2-オン-3-イル;オルト-置換-6-フェニル-ピロロ-ピリミジン-2-オン-3-イル;オキソホルマイシン TP;パラ-(アミノアルキルヒドロキシ)-6-フェニル-ピロロ-ピリミジン-2-オン-3-イル;パラ-置換-6-フェニル-ピロロ-ピリミジン-2-オン-3-イル;ペンタセニル;フェナントラセニル;フェニル;プロピニル-7-(アザ)インドリル;ピレニル;ピリドピリミジン-3-イル;ピリドピリミジン-3-イル、2-オキソ-7-アミノ-ピリドピリミジン-3-イル;ピロロ-ピリミジン-2-オン-3-イル;ピロロピリミジニル;ピロロピリジニル;スチルベンジル;置換1,2,4-トリアゾール;テトラセニル;ツベルシジン;キサンチン;キサントシン-5’-TP;2-チオ-ゼブラリン;5-アザ-2-チオ-ゼブラリン;7-デアザ-2-アミノ-プリン;ピリジン-4-オン リボヌクレオシド;2-アミノ-リボシド-TP;ホルマイシン A TP;ホルマイシン B TP;ピロロシン TP;2’-OH-アラ-アデノシン TP;2’-OH-アラ-シチジン TP;2’-OH-アラ-ウリジン TP;2’-OH-アラ-グアノシン TP;5-(2-カルボメトキシビニル)ウリジン TP;及びN6-(19-アミノ-ペンタオキサノナデシル)アデノシン TP。
いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、上述の修飾された核酸塩基のうち少なくとも2つ(例えば、2、3、4またはそれ以上)の組合せを含む。
いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せにおける修飾された核酸塩基は、シュードウリジン(Ψ)、2-チオウリジン、4’-チオウリジン、5-メチルシトシン、2-チオ-1-メチル-1-デアザ-シュードウリジン、2-チオ-1-メチル-シュードウリジン、2-チオ-5-アザ-ウリジン、2-チオ-ジヒドロシュードウリジン、2-チオ-ジヒドロウリジン、2-チオ-シュードウリジン、4-メトキシ-2-チオ-シュードウリジン、4-メトキシ-シュードウリジン、4-チオ-1-メチル-シュードウリジン、4-チオ-シュードウリジン、5-アザ-ウリジン、ジヒドロシュードウリジン、5-メチルウリジン、)、5-メトキシウリジン、2’-O-メチル ウリジン 1-メチル-シュードウリジン(m1Ψ)、1-エチル-シュードウリジン(e1Ψ)、5-メトキシ-ウリジン(mo5U)、5-メチル-シチジン(m5C)、α-チオ-グアノシン、α-チオ-アデノシン、5-シアノ ウリジン、4’-チオ ウリジン 7-デアザ-アデニン、1-メチル-アデノシン(m1A)、2-メチル-アデニン(m2A)、N6-メチル-アデノシン(m6A)、及び2,6-ジアミノプリン、(I)、1-メチル-イノシニル(m1I)、ワイオシン(imG)、メチルワイオシン(mimG)、7-デアザ-グアノシン、7-シアノ-7-デアザ-グアノシン(preQ0)、7-アミノメチル-7-デアザ-グアノシン(preQ1)、7-メチル-グアノシン(m7G)、1-メチル-グアノシン(m1G)、8-オキソ-グアノシン、7-メチル-8-オキソ-グアノシン、2,8-ジメチルアデノシン、2-ゲラニルチオウリジン、2-リシジン、2-セレノウリジン、3-(3-アミノ-3-カルボキシプロピル)-5,6-ジヒドロウリジン、3-(3-アミノ-3-カルボキシプロピル)シュードウリジン、3-メチルシュードウリジン、5-(カルボキシヒドロキシメチル)-2’-O-メチルウリジン メチルエステル,5-アミノメチル-2-ゲラニルチオウリジン、5-アミノメチル-2-セレノウリジン、5-アミノメチルウリジン、5-カルバモイルヒドロキシメチルウリジン、5-カルバモイルメチル-2-チオウリジン、5-カルボキシメチル-2-チオウリジン、5-カルボキシメチルアミノメチル-2-ゲラニルチオウリジン、5-カルボキシメチルアミノメチル-2-セレノウリジン、5-シアノメチルウリジン、5-ヒドロキシシチジン、5-メチルアミノメチル-2-ゲラニルチオウリジン、7-アミノカルボキシプロピル-デメチルワイオシン、7-アミノカルボキシプロピルワイオシン、7-アミノカルボキシプロピルワイオシン メチルエステル,8-メチルアデノシン、N4,N4-ジメチルシチジン、N6-ホルミルアデノシン、N6-ヒドロキシメチルアデノシン、アグマチジン、環状N6-トレオニルカルバモイルアデノシン、グルタミル-キューオシン、メチル化不十分修飾ヒドロキシワイブトシン、N4,N4,2’-O-トリメチルシチジン、ゲラニル化 5-メチルアミノメチル-2-チオウリジン、ゲラニル化 5-カルボキシメチルアミノメチル-2-チオウリジン、Qbase、preQ0base、preQ1base、及びそれらの2つ以上の組合せからなる群より選択される。いくつかの実施形態において、少なくとも1つの化学的に修飾されたヌクレオシドは、シュードウリジン、1-メチル-シュードウリジン、1-エチル-シュードウリジン、5-メチルシトシン、5-メトキシウリジン、及びそれらの組合せからなる群より選択される。いくつかの実施形態において、ポリヌクレオチド(例えば、RNAポリヌクレオチド、例えば、mRNAポリヌクレオチド)は、上述の修飾された核酸塩基のうち少なくとも2つ(例えば、2、3、4以上)の組合せを含む。
塩基の修飾
ある特定の実施形態において、化学修飾は、ポリヌクレオチド中の核酸塩基(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)である。いくつかの実施形態において、ポリヌクレオチド中の修飾核酸塩基(例えば、mRNAポリヌクレオチドのようなRNAポリヌクレオチド)は、1-メチルシュードウリジン(m1Ψ)、1-エチルシュードウリジン(e1Ψ)、5-メトキシウリジン(mo5U)、5-メチル-シチジン(m5C)、シュードウリジン(Ψ)、α-チオ-グアノシン及びα-チオ-アデノシンからなる群より選択される。いくつかの実施形態において、ポリヌクレオチドは、少なくとも2つ(例えば、2、3、4またはそれ以上)の上述の修飾核酸塩基の組合せを含む。
いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、シュードウリジン(Ψ)及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、1-メチル-シュードウリジン(m1Ψ)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、1-エチル-シュードウリジン(e1Ψ)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、1-メチルシュードウリジン(m1Ψ)及び5-メチルシチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、1-エチル-シュードウリジン(e1Ψ)及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、2-チオウリジン(s2U)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、2-チオウリジン及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)はメトキシ-ウリジン(mo5U)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、5-メトキシ-ウリジン(mo5U)及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、2’-O-メチルウリジンを含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、2’-O-メチルウリジン及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、N6-メチル-アデノシン(m6A)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、N6-メチル-アデノシン(m6A)及び5-メチル-シチジン(m5C)を含む。
いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、特定の修飾のために均一に修飾される(例えば、完全に修飾され、全配列を通して修飾される)。例えば、ポリヌクレオチドは、5-メチル-シチジン(m5C)で均一に修飾されてもよく、このことは、mRNA配列中の全てのシトシン残基が5-メチル-シチジン(m5C)で置換されていることを意味する。同様に、ポリヌクレオチドは、配列中に存在する任意のタイプのヌクレオシド残基について、上記の修飾残基のような修飾された残基で置換することによって、均一に修飾されてもよい。
いくつかの実施形態において、オープンリーディングフレーム中の化学的に修飾されたヌクレオシドは、ウリジン、アデニン、シトシン、グアニン、及びそれらのいずれかの組合せからなる群より選択される。
いくつかの実施形態において、修飾核酸塩基は修飾シトシンである。修飾シトシンを有する核酸塩基及びヌクレオシドの例としては、N4-アセチル-シチジン(ac4C)、5-メチル-シチジン(m5C)、5-ハロ-シチジン(例えば、5-ヨード-シチジン)、5-ヒドロキシメチル-シチジン(hm5C)、1-メチル-シュードイソシチジン、2-チオ-シチジン(s2C)、2-チオ-5-メチル-シチジンが挙げられる。
いくつかの実施形態において、修飾核酸塩基は、修飾ウリジンである。修飾ウリジンを有する核酸塩基及びヌクレオシドの例としては、5-シアノウリジンまたは4’-チオウリジンが挙げられる。
いくつかの実施形態において、修飾核酸塩基は、修飾されたアデニンである。修飾アデニンを有する核酸塩基及びヌクレオシドの例としては、7-デアザ-アデニン、1-メチル-アデノシン(m1A)、2-メチル-アデニン(m2A)、N6-メチル-アデニン(m6A)及び2,6-ジアミノプリンが挙げられる。
いくつかの実施形態において、修飾核酸塩基は、修飾グアニンである。修飾されたグアニンを有する核酸塩基及びヌクレオシドの例としては、イノシン(I)、1-メチル-イノシン(m1I)、ワイオシン(imG)、メチルワイオシン(mimG)、7-デアザ-グアノシン、7-シアノ-7-デアザ-グアノシン(preQ0)、7-アミノメチル-7-デアザ-グアノシン(preQ1)、7-メチル-グアノシン(m7G)、1-メチル-グアノシン(m1G)、8-オキソ-グアノシン、7-メチル-8-オキソ-グアノシンが挙げられる。
いくつかの実施形態において、ポリヌクレオチド中の核酸塩基修飾ヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、5-メトキシウリジンである。
いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、少なくとも2つ(例えば、2、3、4またはそれ以上)の修飾核酸塩基の組合せを含む。
いくつかの実施形態において、本開示のポリヌクレオチド(例えば、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40LポリペプチドをコードするmRNAポリヌクレオチド)中のある種の核酸塩基(例えば、ウラシル)の少なくとも95%は、修飾核酸塩基である。いくつかの実施形態において、本開示のポリヌクレオチド(例えば、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、及び/またはOX40LポリペプチドをコードするmRNAポリヌクレオチド)中のウラシルの少なくとも95%は、5-メトキシウラシルである。
いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、5-メトキシウリジン(5mo5U)及び5-メチル-シチジン(m5C)を含む。
いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、特定の修飾のために均一に修飾される(例えば、完全に修飾され、全配列を通して修飾される)。例えば、ポリヌクレオチドは、5-メトキシウリジンで均一に修飾されてもよく、これはmRNA配列中の実質的に全てのウリジン残基を5-メトキシウリジンで置換することを意味する。同様に、ポリヌクレオチドは、配列中に存在する任意のタイプのヌクレオシド残基について、上記の任意の修飾残基のような修飾された残基で置換することによって、均一に修飾され得る。
いくつかの実施形態において、修飾核酸塩基は、修飾シトシンである。
いくつかの実施形態において、修飾核酸塩基は修飾ウラシルである。修飾ウラシルを有する核酸塩基及びヌクレオシドの例としては、5-メトキシウラシルが挙げられる。
いくつかの実施形態において、修飾核酸塩基は、修飾アデニンである。
いくつかの実施形態において、修飾核酸塩基は、修飾グアニンである。
いくつかの実施形態において、IL-23ポリペプチド、IL-36ガンマポリペプチド、OX40Lポリペプチド、またはそれらのいずれかの組合せをコードするオープンリーディングフレーム中の核酸塩基、糖、主鎖、またはそれらのいずれかの組合せは、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾される。
いくつかの実施形態において、IL-23ポリペプチド、IL-36ガンマポリペプチド、OX40Lポリペプチド、またはそれらのいずれかの組合せをコードするオープンリーディングフレーム中のウリジンヌクレオシドは、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾される。
いくつかの実施形態において、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、OX40Lポリペプチド、またはそれらのいずれかの組合せをコードするオープンリーディングフレーム中のアデノシンヌクレオシドは、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%または100%化学的に修飾される。
いくつかの実施形態において、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、OX40Lポリペプチド、またはそれらのいずれかの組合せをコードするオープンリーディングフレーム中のシチジンヌクレオシドは、少なくとも少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾される。
いくつかの実施形態において、IL-23ポリペプチド、IL-36ガンマポリペプチド、IL-18ポリペプチド、OX40Lポリペプチド、またはそれらのいずれかの組合せをコードするオープンリーディングフレーム中のグアノシンヌクレオシドは、少なくとも少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾される。
いくつかの実施形態において、ポリヌクレオチドは、ヌクレオシド間の任意の有用なリンカーを含んでもよい。本開示の組成物において有用な主鎖修飾を含むそのようなリンカーとしては、限定されないが、以下の、3’-アルキレンホスホネート、3’-アミノホスホルアミダート、アルケン含有主鎖、アミノアルキルホスホルアミダート、アミノアルキルホスホトリエステル、ボラノホスフェート、-CH2-O-N(CH3)-CH2-、-CH2-N(CH3)-N(CH3)-CH2-、-CH2-NH-CH2-、キラルホスホネート、キラルホスホロチオエート、ホルムアセチル及びチオホルムアセチル主鎖、メチレン(メチルイミノ)、メチレンホルムアセチル及びチオホルムアセチル主鎖、メチレンイミノ及びメチレンヒドラジノ主鎖、モルホリノ結合、-N(CH3)-CH2-CH2-、ヘテロ原子ヌクレオシド間結合を有するオリゴヌクレオシド、ホスフィナート、ホスホルアミダート、ホスホロジチオエート、ホスホロチオエートヌクレオシド間結合、ホスホロチオエート、ホスホトリエステル、PNA、シロキサン主鎖、スルファメート主鎖、スルフィドスルホキシド及びスルホン主鎖、スルホネート及びスルホンアミド主鎖、チオノアルキルホスホネート、チオノアルキルホスホトリエステル及びチオノホスホルアミダートが挙げられる。
いくつかの実施形態において、IL-23ポリヌクレオチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドもしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せの中の修飾核酸塩基は、1-メチル-シュードウリジン(m1Ψ)、5-メトキシ-ウリジン(mo5U)、5-メチル-シチジン(m5C)、シュードウリジン(Ψ)、α-チオ-グアノシン及びα-チオ-アデノシンからなる群より選択される。いくつかの実施形態において、ポリヌクレオチドは、少なくとも2つ(例えば、2、3、4またはそれ以上)の上述の修飾核酸塩基の組合せを含む。
いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドもしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、シュードウリジン(Ψ)及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、1-メチル-シュードウリジン(m1Ψ)を含む。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、1-メチル-シュードウリジン(m1Ψ)及び5-メチル-シチジン(m5C)を含む。
いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、2-チオウリジン(s2U)を含む。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、2-チオウリジン及び5-メチル-シチジン(m5C)を含む。
いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LをコードするmRNAを含むポリヌクレオチドポリペプチド、またはそれらのいずれかの組合せは、メトキシ-ウリジン(mo5U)を含む。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LをコードするmRNAを含むポリヌクレオチドまたはそれらのいずれかの組合せは、5-メトキシ-ウリジン(mo5U)及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、ポリヌクレオチド(例えば、mRNAポリヌクレオチドなどのRNAポリヌクレオチド)は、2’-O-メチルウリジンを含む。
いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、2’-O-メチルウリジン及び5-メチル-シチジン(m5C)を含む。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、N6-メチル-アデノシン(m6A)を含む。いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、N6-メチル-アデノシン(m6A)及び5-メチル-シチジン(m5C)を含む。
いくつかの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、特定の修飾のために、均一に修飾される(例えば、完全に修飾され、全配列にわたって修飾される)。例えば、ポリヌクレオチドは、5-メチル-シチジン(m5C)で均一に修飾されてもよく、これはmRNA配列中の全てのシトシン残基が5-メチル-シチジン(m5C)で置換されていることを意味する。同様に、ポリヌクレオチドは、配列中に存在する任意のタイプのヌクレオシド残基について、上記の任意の修飾残基のような修飾された残基で置換することによって、均一に修飾されてもよい。
いくつかの実施形態において、修飾核酸塩基は修飾シトシンである。修飾されたシトシンを有する核酸塩基及びヌクレオシドの例としては、N4-アセチル-シチジン(ac4C)、5-メチル-シチジン(m5C)、5-ハロ-シチジン(例えば、5-ヨード-シチジン)、5-ヒドロキシメチル-シチジン(hm5C)、1-メチル-シュードイソシチジン、2-チオ-シチジン(s2C)、2-チオ-5-メチル-シチジンが挙げられる。
いくつかの実施形態において、修飾核酸塩基は、修飾ウリジンである。修飾されたウリジンを有する核酸塩基及びヌクレオシドの例としては、5-シアノウリジンまたは4’-チオウリジンが挙げられる。
いくつかの実施形態において、修飾された核酸塩基は、修飾されたアデニンである。修飾されたアデニンを有する核酸塩基及びヌクレオシドの例としては、7-デアザ-アデニン、1-メチル-アデノシン(m1A)、2-メチル-アデニン(m2A)、N6-メチル-アデノシン(m6A)及び2,6-ジアミノプリンが挙げられる。
いくつかの実施形態において、修飾核酸塩基は修飾グアニンである。修飾されたグアニンを有する核酸塩基及びヌクレオシドの例としては、イノシン(I)、1-メチル-イノシン(m1I)、ワイオシン(imG)、メチルワイオシン(mimG)、7-デアザ-グアノシン、7-シアノ-7-デアザ-グアノシン(preQ0)、7-アミノメチル-7-デアザ-グアノシン(preQ1)、7-メチル-グアノシン(m7G)、1-メチル-グアノシン(m1G)、8-オキソ-グアノシンまたは7-メチル-8-オキソ-グアノシンが挙げられる。
本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチド中で有用であり得る他の修飾を表5に列挙する。
本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、ヌクレオシド間に任意の有用なリンカーを含み得る。主鎖修飾を含むそのようなリンカーを表6に示す。
本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、任意の有用な修飾、例えば、糖、核酸塩基、またはヌクレオシド間結合(例えば、結合ホスフェート/ホスホジエステル結合/ホスホジエステル主鎖)を含んでもよい。ピリミジン核酸塩基の1つ以上の原子は、任意選択で置換されたアミノ、任意選択で置換されたチオール、任意選択で置換されたアルキル(例えば、メチルまたはエチル)、またはハロ(例えば、クロロまたはフルオロ)で置き換えられても、または置換されてもよい。ある特定の実施形態において、糖及びヌクレオシド間結合のそれぞれに修飾(例えば、1つ以上の修飾)が存在する。本開示による修飾は、リボ核酸(RNA)からデオキシリボ核酸(DNA)、トレオース核酸(TNA)、グリコール核酸(GNA)、ペプチド核酸(PNA)、ロックされた核酸(LNA)ヘキシトール核酸(HNA)、またはそれらのハイブリッドの修飾であってもよい。追加の修飾が本明細書に記載される。修飾された核酸及びそれらの合成は、国際特許公開番号WO2013052523(米国特許出願公開第20130115272号も参照のこと)に開示されている。
いくつかの実施形態において、本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、mRNAが導入される細胞の先天性免疫応答を実質的に誘導しない。誘導された先天性免疫応答の特徴としては、1)炎症性サイトカインの発現増大、2)細胞内PRRの活性化(RIG-I、MDA5など、及び/または3)タンパク質翻訳の終結もしくは減少が挙げられる。
本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの任意の領域、またはそれらのいずれかの組合せは、本明細書に教示されるように、または国際特許公開番号WO2013052523号(米国特許出願公開第20130115272号も参照)に教示されるように化学的に修飾されてもよい。
いくつかの実施形態において、本開示の、修飾されたポリヌクレオチド、例えば、本明細書に記載の少なくとも1つの修飾を含むmRNAは、IL-23、IL-36ガンマ、IL-18ポリペプチド及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドをコードする。いくつかの実施形態において、本開示の修飾されたポリヌクレオチド、例えば、本明細書に記載の少なくとも1つの修飾を含むmRNAは、ヒトIL-23、IL-36ガンマ、IL18及び/またはOX40Lをコードする。
いくつかの実施形態において、本開示の、修飾されたポリヌクレオチド、例えば、本明細書に記載の少なくとも1つの修飾を含むmRNAは、表1に示されるアミノ酸配列を含むポリペプチドをコードする。いくつかの実施形態において、修飾されたポリヌクレオチド、例えば、本開示の、本明細書に記載の少なくとも1つの修飾を含むmRNAは、表1に示されるアミノ酸配列を含むポリペプチドをコードする。
いくつかの実施形態において、本開示の、修飾ポリヌクレオチド、例えば、本明細書に記載の少なくとも1つの修飾を含むmRNAは、少なくとも1つのIL-23、IL-36ガンマ、IL-18及び/またはOX40Lの変異体、断片、またはそのバリアント、例えば、IL-23、IL-36ガンマ、IL-18及び/またはOX40LのIL-23、IL-36ガンマ、IL-18及び/またはOX40Lの機能的な断片をコードする。
いくつかの実施形態において、本開示の、修飾ポリヌクレオチド、例えば、本明細書に記載の少なくとも1つの修飾を含むmRNAは、表1に列挙されるIL-23、IL-36ガンマ、IL-18及び/またはOX40L核酸配列から選択される。
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNA、及び本開示のOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドはまた、構成要素、例えば、ポリヌクレオチド分子の修飾リボヌクレオシド及び修飾リボヌクレオチドを含んでもよい。例えば、これらの構成要素は、本開示のポリヌクレオチドを調製するために有用であり得る。そのような構成要素は、国際特許出願番号WO2013052523(また、米国特許出願公開第20130115272号も参照のこと)及び国際出願公開番号WO2014093924(米国特許出願公開第20150307542号も参照のこと)に教示されている。
糖の修飾
本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド(例えば、本明細書に記載されるRNAまたはmRNA)、IL-36-ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド(例えば、本明細書に記載されるRNAまたはmRNA)、IL-18ポリペプチドをコードするmRNA、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチド(例えば、本明細書に記載されるRNAまたはmRNA)に組み込まれる修飾ヌクレオシド及びヌクレオチド(例えば、構成要素分子)を、リボ核酸の糖上で修飾してもよい。
例えば、2’ヒドロキシル基(OH)を、多数の異なる置換基で修飾してもまたは置換してもよい。2’位の例示的な置換としては、限定するものではないが、H、ハロ、任意選択で置換されていてもよいC1~6アルキル;任意選択で置換されたC1~6アルコキシ;任意選択で置換されたC6~10アリールオキシ;任意選択で置換されたC3~8シクロアルキル;任意選択で置換されたC3-8シクロアルコキシ;任意選択で置換されたC6~10アリールオキシ;任意選択で置換されたC6~10アリール-C1~6アルコキシ、任意選択で置換されたC1~12(ヘテロシクリル)オキシ;糖(例えば、リボース、ペントース、または本明細書に記載されるいずれか);ポリエチレングリコール(PEG)、-O(CH2CH2O)nCH2CH2OR(式中、RはHまたは任意選択で置換されたアルキルであり、nは0~20の整数(例えば、0~4、0~8、0~10、0~16、1~4、1~8、1~10、1~16、1~20、2~4、2~8、2~10、2~16、2~20、4~8、4~10、4~16、及び4~20)であり;2’-ヒドロキシルがC1~6アルキレンまたはC1~6ヘテロアルキレン架橋によって同じリボース糖の4’-炭素に連結されている、「ロックされた」核酸(LNA)(例示的な架橋はメチレン、プロピレン、エーテル、またはアミノ架橋を含んだ);本明細書で定義するアミノアルキル;本明細書で定義するアミノアルコキシ;本明細書で定義のアミノ;及び本明細書で定義されるようなアミノ酸が挙げられる。
一般に、RNAは、酸素を有する5員環である糖基リボースを含む。例示的な、非限定的修飾ヌクレオチドは、リボースの酸素の(例えば、S、Se、または、アルキレン、例えば、メチレンもしくはエチレンによる)置き換え;二重結合の付加(例えば、シクロペンテニルまたはシクロヘキセニルを用いたリボースを置き換えるため);リボースの環縮小(例えば、シクロブタンまたはオキセタンの4員環を形成するため);リボースの環拡大(例えば、追加の炭素またはヘテロ原子を有する6員環または7員環、例えば、アンヒドロヘキシトール、アルトリトール、マンニトール、シクロヘキサニル、シクロヘキセニル及びモルホリノであってホスホロアミダート主鎖も有するものを形成するため);多環式の形態(例えば、三環式の形態;ならびに「アンロックされた(unlocked)」形態、例えば、グリコール核酸(GNA)(例えば、リボースがホスホジエステル結合に結合したグリコールユニットによって置き換えられている、R-GNAまたはS-GNA)、トレオース核酸(TNA、リボースがα-L-トレオフラノシル-(3’→2’)で置き換えられている)、及びペプチド核酸(PNA、2-アミノ-エチル-グリシン結合がリボース及びホスホジエステルの主鎖に置き換わっている)、を含む。糖基はまた、リボース中の対応する炭素とは反対の立体化学配置を有する1つ以上の炭素を含んでもよい。したがって、ポリヌクレオチド分子としては、糖として例えばアラビノースを含んでいるヌクレオチドが挙げられる。このような糖修飾は、国際出願公開番号WO2013052523(米国特許出願公開第20130115272号も参照のこと)及び国際出願公開番号WO2014093924(米国特許出願公開第20150307542号も参照のこと)に教示される。
修飾糖、核酸塩基及びヌクレオシド間結合の組合せ
本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、糖、核酸塩基及び/またはヌクレオシド間結合への修飾の組合せを含んでもよい。これらの組合せは、本明細書に記載される1つ以上の修飾を含む場合がある。
修飾ヌクレオチド及び修飾ヌクレオチドの組合せの例を、下の表7に示す。修飾ヌクレオチドのこれらの組合せを使用して、本開示のポリヌクレオチドを形成してもよい。特に明記しない限り、修飾ヌクレオチドで、本開示のポリヌクレオチドの天然ヌクレオチドを完全に置換してもよい。非限定的な例として、天然ヌクレオチドであるウリジンは、本明細書に記載される修飾ヌクレオシドで置換されてもよい。別の非限定的な例において、天然ヌクレオチドウリジンは、本明細書に開示されている修飾ヌクレオシドの少なくとも1つと部分的に置換されていてもよい(例えば、約0.1%、1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または99.9%)。塩基/糖またはリンカーの任意の組合せを、本開示のポリヌクレオチドに組み込んでもよく、このような修飾は、国際特許公開番号WO2013052523(米国特許出願公開第20130115272号も参照のこと)及び国際出願公開番号WO2014093924(米国特許出願公開第20150307542号も参照)に教示されている。
修飾ヌクレオチド及び修飾ヌクレオチドの組合せのさらなる例を、以下の表8に示す。
XII.医薬組成物:製剤、投与、送達及び投与
本開示は、本明細書に開示される任意の組成物を含む医薬製剤、例えば、IL-23ポリペプチドを含む第1のタンパク質をコードするmRNAを含む第1のポリヌクレオチド、IL-36-ガンマポリペプチドを含む第2のタンパク質をコードするmRNAを含む第2のポリヌクレオチド、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/または第3のタンパク質をコードするmRNAを含む第3のポリヌクレオチドを提供し、ここでこの第3のタンパク質は、本明細書に他の箇所で記載のOX40Lポリペプチドを含む。
本開示のいくつかの実施形態において、ポリヌクレオチドは、1つ以上の医薬として許容され得る賦形剤と組み合わせて組成物及び複合体中に製剤化される。医薬組成物は、任意選択で1つ以上の追加の活性物質、例えば、治療上及び/または予防上活性な物質を含んでもよい。本開示の医薬組成物は、滅菌及び/または発熱物質フリーであり得る。医薬品の製剤及び/または製造における一般的な考察は、例えば、Remington:The Science and Practice of Pharmacy 21st ed.,Lippincott Williams&Wilkins、2005に見出すことができる。
いくつかの実施形態において、組成物は、ヒト、ヒト患者または対象に投与される。本開示の目的のために、「活性成分」という語句は、一般に、本明細書に記載されるように送達されるポリヌクレオチドを指す。
本明細書で提供される医薬組成物の記載は、主に、ヒトへの投与に適した医薬組成物に関するものであるが、当業者であれば、このような組成物が、任意の他の動物へ、例えば、非ヒト動物へ、例えば非ヒト哺乳動物への投与に一般的に適切であることを理解する。組成物を種々の動物への投与に適したものにするために、ヒトへの投与に適切な医薬組成物の改変はよく理解されており、通常の熟練した獣医学の薬理学者は、もしあれば単なる慣用的実験によってこのような改変をデザイン及び/または行い得る。医薬組成物の投与が企図される対象としては、限定するものではないが、ヒト及び/または他の霊長類;哺乳動物が挙げられる。
いくつかの実施形態において、本開示のポリヌクレオチドは、皮下、静脈内、腹腔内、腫瘍内、筋肉内、関節内、滑膜内、胸骨内、くも膜下腔内、肝内、病巣内、頭蓋内、脳室内、経口、吸入噴霧、局所、直腸、経鼻、口腔、膣内、腫瘍内に関して製剤化されるか、またはリザーバーを筋肉内、皮下、腫瘍内または皮内送達のために移植される。他の実施形態では、ポリヌクレオチドは、腫瘍内、腹腔内、または静脈内送達のために処方される。特定の実施形態において、本開示のポリヌクレオチドは、腫瘍内送達のために製剤化される。
本明細書に記載される医薬組成物の製剤は、薬理学の分野で公知であるか、または今後開発される任意の方法によって調製され得る。一般に、そのような調製方法は、活性成分を賦形剤及び/または1つ以上の他の補助成分と会合させ、次いで、必要であるか、及び/または望ましい場合には、生成物を所望の単回または複数回投与単位に分割するか、成形するか、及び/またはパッケージングするステップを包含する。
この開示による、医薬組成物中の活性成分、医薬として許容され得る賦形剤及び/または任意の追加の成分の相対量は、処置される対象の同一性、サイズ及び/または状態に応じて、さらに組成物が投与されるべき経路に応じて、変化する。例えば、この組成物は、0.1%~100%、例えば、0.5%~50%、1%~30%、5%~80%、または少なくとも80%(w/w)の活性成分を含んでもよい。
製剤
本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、1つ以上の賦形剤を使用して製剤化され得る。
1つ以上の賦形剤の機能は、例えば、(1)安定性を増大させること、(2)細胞トランスフェクションを増大させること;(3)(例えば、ポリヌクレオチドのデポ製剤からの)持続放出または遅延放出を可能にすること;(4)生体内分布を変更する(例えば、ポリヌクレオチドを特定の組織または細胞型に標的化する);(5)コードされたタンパク質の翻訳をin vivoで増大すること;及び/または(6)コードされたタンパク質の放出プロファイルをin vivoで変更することである。伝統的な賦形剤、例えば、本開示のありとあらゆる溶媒、分散媒、希釈剤または他の液体ビヒクル、分散または懸濁助剤、表面活性剤、等張剤、増粘剤または乳化剤、保存剤、賦形剤に加えて、限定するものではないが、リピドイド、リポソーム、脂質ナノ粒子、ポリマー、リポプレックス、コアシェルナノ粒子、ペプチド、タンパク質、(例えば、対象への移植のための)ポリヌクレオチドでトランスフェクトされた細胞、ヒアルロニダーゼ、ナノ粒子模倣物、及びそれらの組合せが挙げられる。したがって、本開示の製剤は、一緒になってポリヌクレオチドの安定性を増大させるか、ポリヌクレオチドによる細胞トランスフェクションを増大させるか、ポリヌクレオチドコード化タンパク質の発現を増大させるか、及び/またはポリヌクレオチドコードタンパク質の放出プロファイルを変更する各々の量で、1つ以上の賦形剤を含んでもよい。さらに、本開示のポリヌクレオチドは、自己組織化核酸ナノ粒子を使用して製剤化され得る。
本明細書に記載される医薬組成物の製剤は、薬理学の分野で公知であるかまたは今後開発される任意の方法によって調製され得る。一般に、このような調製方法は、活性成分を賦形剤及び/または1つ以上の他の補助成分と会合させるステップを包含する。
本開示による医薬組成物は、バルクで、単一の単位用量として、及び/または複数の単一の単位用量として調製しても、パッケージングしても及び/または販売してもよい。本明細書で使用する「単位用量」とは、所定量の活性成分を含む医薬組成物の別々の量を指す。活性成分の量は一般には、対象に投与されるであろう活性成分の用量及び/またはこのような用量の好都合な割合、例えば、そのような用量の二分の一または三分の一などの用量に等しい。
本開示による医薬組成物中の活性成分、医薬として許容され得る賦形剤、及び/または任意の追加の成分の相対量は、処置されている対象の同一性、大きさ及び/または状態に応じて、さらに組成物が投与されるべき経路に応じて変化し得る。例えば、組成物は、0.1%~99%(w/w)の活性成分を含んでもよい。一例として、この組成物は、0.1%~100%、例えば、0.5~50%、1~30%、5~80%、少なくとも80%(w/w)の活性成分を含んでもよい。
いくつかの実施形態においては、本明細書に記載される製剤は、少なくとも1つのポリヌクレオチドを含む。非限定的な例として、製剤は、1、2、3、4または5個のポリヌクレオチドを含む。他の実施形態では、本開示のポリヌクレオチドは、それを必要とする患者の腫瘍における腫瘍内送達のために製剤化される。
医薬製剤は、本明細書中で使用される場合、限定するものではないが、任意の及び全ての溶媒、分散媒、希釈剤、または他の液体ビヒクル、分散または懸濁助剤、表面活性剤、等張剤、増粘または乳化剤、保存剤などの、所望の特定の剤形に適したものを含む、医薬として許容され得る賦形剤をさらに含んでもよい。医薬組成物を製剤化するための様々な賦形剤及び組成物を調製するための技術は、当技術分野において既知である(Remington:The Science and Practice of Pharmacy、21st、Edition、A.R.Gennaro、Lippincott、Williams&Wilkins、Baltimore、MD、2006を参照のこと)。任意の従来の賦形剤媒体が、任意の望ましくない生物学的効果を生じさせるか、そうでなければ有害な様式で医薬組成物の任意の他の成分(単数または複数)と相互作用することによって、物質またはその誘導体と不適合であり得る場合を除いて、従来の賦形剤媒体の使用が、本開示の範囲内で企図され得る。
いくつかの実施形態においては、脂質ナノ粒子の粒径は増大されるか、及び/または減少される。粒径の変化は、限定するものではないが、炎症などの生物学的反応に対抗することを補助し得るか、または哺乳動物に送達される修飾mRNAの生物学的効果を増大し得る。
医薬組成物の製造に使用される医薬として許容され得る賦形剤としては、限定するものではないが、不活性希釈剤、表面活性剤及び/または乳化剤、保存剤、緩衝剤、滑沢剤及び/または油が挙げられる。そのような賦形剤は、任意選択で、本開示の医薬製剤に含まれてもよい。
いくつかの実施形態においては、ポリヌクレオチドは、コレステロールなどの分子を隔離し得るナノ構造中で投与されるか、それとともに投与されるか、それの中に製剤化されるか、それとともに送達される。これらのナノ構造の非限定的な例及びこれらのナノ構造の作製方法は、米国特許出願公開第20130195759号に記載されている。これらのナノ構造の例示的な構造は、米国特許出願公開第20130195759号に示されており、コア及びコアを取り囲むシェルを含んでもよい。
リピドイド
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36-ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、リピドイドとともに処方されてもよい。リピドイドの合成は、広範に記載されており、これらの化合物を含有する製剤は、ポリヌクレオチドの送達に特に適している(Mahon et al.,BioconjugChem.2010 21:1448-1454;Schroeder et al.,J Intern Med.2010 267:9-21;Akinc et al.,Nat Biotechnol.2008 26:561-569;Love et al.,Proc Natl Acad Sci USA.2010 107:1864-1869;Siegwart et al.,Proc Natl Acad Sci
US A 2011 108:12996-3001を参照のこと)。
これらのリピドイドは、げっ歯類及び非ヒト霊長類において二本鎖低分子干渉RNAを効果的に送達するために使用されてきたが(Akinc et al., Nat Biotechnol.2008 26:561-569;Frank-Kamenetsky et al., Proc Natl Acad Sci USA.2008 105:11915-11920;Akinc et al., Mol Ther.2009 17:872-879;Love et al., Proc Natl Acad
Sci US A. 2010 107:1864-1869;Leuschner et al., Nat Biotechnol.2011 29:1005~1010を参照のこと)、本開示は、ポリヌクレオチドを送達する際のそれらの製剤及び使用を記載する。
これらのリピドイドを含む複合体、ミセル、リポソームまたは粒子を調製してもよく、従って、局所的及び/または全身的な投与経路を介したリピドイド製剤の注射後、コードされたタンパク質の産生によって判断されるように、ポリヌクレオチドの効果的な送達が生じ得る。ポリヌクレオチドのリピドイド複合体は、限定されるものではないが、静脈内、腹腔内、腫瘍内、筋肉内、または皮下経路を含む様々な手段によって投与され得る。
核酸のin vivo送達は、多くのパラメーター、限定されるものではないが、製剤組成、粒子PEG化の性質、負荷の程度、ポリヌクレオチド対脂質比、及び限定されないが、粒径などの生物物理的パラメーターによって影響され得る(Akinc et al., Mol Ther.2009 17:872-879)。一例として、ポリ(エチレングリコール)(PEG)脂質のアンカー鎖長のわずかな変化が、in vivoの効能に重大な影響をもたらし得る。限定するものではないが、ペンタ[3-(1-ラウリルアミノプロピオニル)]-トリエチレンテトラミン塩酸塩(TETA-5LAP;別名98N12-5、Murugaiah et al., Analytical Biochemistry、401:61(2010)を参照のこと))、C12-200(誘導体及びバリアントを含む)及びMD1を含む異なるリピドイドによる製剤を、in vivo活性について試験してもよい。
本明細書で「98N12-5」と呼ばれるリピドイドは、Akinc et al.,
Mol Ther.(2009)17:872-879に開示される。
本明細書で「C12-200」と称するリピドイドは、Love et al., Proc.Natl.Acad.Sci.USA(2010)107:1864-1869及びLiu and Huang(2010)Molecular Therapy.2010:669-670に開示される。リピドイド製剤は、ポリヌクレオチドに加えて3または4またはそれを超える成分を含む粒子を含んでもよい。
リピドイド及びリピドイドを含むポリヌクレオチド製剤は、国際出願公開番号第WO2014093924号(米国特許出願公開第20150307542も参照のこと)に記載されている。
リポソーム、リポプレックス及び脂質ナノ粒子
本開示のポリヌクレオチドは、1つ以上のリポソーム、リポプレックスまたは脂質ナノ粒子を使用して製剤化してもよい。1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの医薬組成物は、リポソームを含む。リポソームは、人工的に調製された小胞であり、主として脂質二分子膜から構成され得、医薬製剤の投与のための送達ビヒクルとして使用されてもよい。リポソームは、種々のサイズ、例えば、限定するものではないが、直径が数百ナノメートルであってもよく、狭い水性区画によって分離された一連の同心二分子膜を含んでもよい、多重膜小胞(MLV)、直径が50nm未満であり得る、小さな単細胞小胞(SUV)、及び直径が50~500nmであり得る大きな単層の小胞(LUV)であってもよい。リポソームの設計は、リポソームの不健康な組織への付着を改善するため、または限定するものではないが、エンドサイトーシスなどの事象を活性化するために、限定するものではないが、オプソニンまたはリガンドを含んでもよい。リポソームは、医薬製剤の送達を改善するために、低pHを含んでも、または高pHを含んでもよい。
リポソームの形成は、生理化学的特徴、例えば、限定するものではないが、封入された医薬製剤及びリポソーム成分、脂質小胞が分散される媒体の性質、封入された物質の有効濃度及びその潜在的毒性、小胞の適用及び/または送達中に関与する任意のさらなるプロセス、意図される用途のための小胞の最適化サイズ、多分散性及び貯蔵寿命、ならびにバッチ間の再現性及び安全かつ効率的なリポソーム生成物の大量生産の可能性などの物理化学的特性に依存し得る。
非限定的な例として、合成膜小胞などのリポソームは、米国特許出願公開第20130177638号、同第20130177637号、同第20130177636号、同第20130177635号、同第20130177634号、同第20130177633号、同第20130183375号、同第20130183373号、及び同第20130183372号に記載された方法、装置及びデバイスによって調製される。
1つの実施形態において、本明細書に記載される医薬組成物としては、限定するものではないが、1,2-ジオレイルオキシ-N,N-ジメチルアミノプロパン(DODMA)リポソーム、Marina Biotech(Bothell、WA)のDiLa2リポソーム、1,2-ジリノレイルオキシ-3-ジメチルアミノプロパン(DLin-DMA)、2,2-ジリノレイル-4-(2-ジメチルアミノエチル)-[1,3]-ジオキソラン(DLin-KC2-DMA)、及びMC3(米国特許出願公開第20100324120号に記載されている)及び限定するものではないが、Janssen Biotech、Inc.(Horsham、PA)のDOXIL(登録商標)などの低分子薬物を送達し得るリポソームから形成されるロポソームなどのリポソームが挙げられる。
1つの実施形態において、本明細書に記載される医薬組成物は限定するものではないが、これまでに記載され、in vitro及びin vivoでのオリゴヌクレオチド送達のために適切であることが示された、安定化プラスミド-脂質粒子(SPLP)または安定化核酸脂質粒子(SNALP)の合成から形成されるリポソームなどのリポソームを含んでもよい(Wheeler et al.,Gene Therapy、1999 6:271-281;Zhang et al.,Gene Therapy、1999
6:1438-1447;Jeffs et al.,Pharm Res.2005
22:362-372;Morrissey et al.,Nat Biotechnol.2005 2:1002-1007;Zimmermann et al.,Nature、2006 441:111-114;Heyes et al.,J Contr Rel.2005 107:276-287;Semple et al.Nature Biotech.2010 28:172-176;Judge et al.,J Clin Invest.2009 119:661-673;deFougerolles Hum Gene Ther.2008 19:125-132;米国特許出願公開第20130122104号を参照のこと)。Wheeler et al.,のオリジナルの製造方法は、界面活性剤透析法であり、これは後にJeffs et
al.,によって改良され、自発的小胞形成法と呼ばれる。リポソーム製剤は、ポリヌクレオチドに加えて3~4個の脂質成分から構成される。一例として、リポソームとしては、限定するものではないが、Jeffs et alが記載するように、55%コレステロール、20%ジステアロイルホスファチジルコリン(DSPC)、10%PEG-S-DSG、及び15%1,2-ジオレイルオキシ-N、N-ジメチルアミノプロパン(DODMA)が挙げられる。別の例として、特定のリポソーム製剤としては、限定するものではないが、48%コレステロール、20%DSPC、2%PEG-c-DMA、及び30%のイオン性脂質を含み、このイオン性脂質は、Heyes et al.によって記載されているように、1,2-ジステアリルオキシ-N,N-ジメチルアミノプロパン(DSDMA)、DODMA、DLin-DMA、または1,2-ジリノレニルオキシ-3-ジメチルアミノプロパン(DLenDMA)であってもよい。
いくつかの実施形態において、リポソーム製剤は、約25.0%のコレステロール~約40.0%のコレステロール、約30.0%のコレステロール~約45.0%のコレステロール、約35.0%のコレステロール~約50.0%のコレステロール及び/または約48.5%のコレステロール~約60%のコレステロールを含む。他の実施形態では、製剤は、28.5%、31.5%、33.5%、36.5%、37.0%、38.5%、39.0%及び43.5%からなる群より選択される百分率のコレステロールを含む。いくつかの実施形態において、製剤は、約5.0%~約10.0%のDSPC及び/または約7.0%~約15.0%のDSPCを含む。
1つの実施形態において、医薬組成物は、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを送達するために形成されるリポソームを含む。ポリヌクレオチドは、リポソームによって封入されてもよく、及び/またはリポソームによって後に封入され得る水性コアに含有されてもよい。国際公開番号WO2012031046(米国特許第20130189351号も参照のこと)、WO2012031043(米国特許第20130202684号も参照のこと)、国際公開番号WO2012030901(米国特許出願公開第20130195969号も参照のこと)及びWO2012006378(米国特許出願公開第20130171241号も参照のこと)及び米国特許出願公開第20130189351号、同第20130195969号及び同第20130202684号を参照のこと)を参照のこと。
別の実施形態では、標的化送達のためにリポソームを製剤化する。非限定的な例として、リポソームは、肝臓への標的化送達のために製剤化される。標的化送達のために使用されるリポソームとしては、限定するものではないが、米国特許出願公開第20130195967号に記載されているリポソーム及び記載されているリポソームの作製方法を含んでもよい。
別の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、カチオン性水中油型エマルジョン中に製剤化され、このエマルジョン粒子は、油性コア及びエマルジョン粒子に分子を固定するポリヌクレオチドと相互作用し得るカチオン性脂質を含む。国際出願番号WO2012006380(US20160256541も参照のこと)を参照のこと。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、親水性相が分散している連続的な疎水相を含む油中水型エマルジョン中に製剤化する。非限定的な例として、このエマルジョンは、国際公開番号WO2013087791(米国特許出願公開第20140294904号も参照のこと)に記載されている方法によって製造してもよい。
別の実施形態では、脂質製剤は、少なくともイオン性脂質、トランスフェクションを増強し得る脂質、及び脂質部分に結合した親水性頭部基を含む少なくとも1つの脂質を含む。国際公開番号WO2011076807及び米国特許出願公開第20110200582号を参照のこと。別の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、官能化脂質二分子膜の間に架橋を有し得る脂質小胞中に製剤化する(米国特許出願公開第20120177724号を参照のこと)。
1つの実施形態において、ポリヌクレオチドは、国際特許公開番号WO2013086526(米国特許出願公開第20140356416号も参照のこと)に記載されているように、リポソーム中に製剤化する。ポリヌクレオチドは、国際特許公開番号WO2013086526に記載されているような逆pH勾配及び/または最適化された内部緩衝液組成物を使用してリポソーム中に封入してもよい。
1つの実施形態において、ポリヌクレオチド医薬組成物は、リポソーム、例えば、限定するものではないが、DiLa2リポソーム(Marina Biotech、Bothell、WA)、SMARTICLES(登録商標)(Marina Biotech、Bothell、WA)、中性DOPC(1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン)ベースのリポソーム(例えば、卵巣癌のためのsiRNA送達(Landen et al., Cancer Biology&Therapy 2006 5(12)1708-1713))及びヒアルロナンコーティングリポソーム(Quiet
Therapeutics,Israel)中に製剤化される。
1つの実施形態において、カチオン性脂質は、米国特許出願公開第20130090372号に記載されているものなどの低分子量カチオン性脂質である。別の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、官能化脂質二分子膜の間に架橋を有し得る脂質小胞中に製剤化される。
他の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、カチオン性脂質を含むリポソーム中に処方される。リポソームは、国際公開番号WO2013006825に記載されているように、ポリヌクレオチド中のリン酸塩に対するカチオン性脂質中の窒素原子のモル比(N:P比)が1:1~20:1であり得る。別の実施形態では、リポソームは、20:1より大きいかまたは1:1より小さいN:P比を有し得る。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、脂質-ポリカチオン複合体中に製剤化される。脂質-ポリカチオン複合体の形成は、当技術分野において既知である方法によって、及び/または米国特許出願公開大20120178702号に記載されているような方法によって達成され得る。非限定的な例として、ポリカチオンは、限定するものではないが、ポリリジン、ポリオルニチン及び/またはポリアルギニンのようなカチオン性ペプチドまたはポリペプチド、ならびに国際公開番号WO2012013326号または米国特許出願公開第20130142818号に記載のカチオン性ペプチドを含む。別の実施形態では、ポリヌクレオチドは、限定するものではないが、コレステロールまたはジオレオイルホスファチジルエタノールアミン(DOPE)のような非カチオン性脂質をさらに含み得る、脂質-ポリカチオン複合体中に製剤化される。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、アミノアルコールリピドイド中に製剤化する。本開示で用いられ得るアミノアルコールリピドイドは、米国特許第8,450,298号に記載された方法によって調製してもよい。
リポソーム製剤は、限定するものではないが、イオン性脂質成分の選択、イオン性脂質飽和の程度、PEG化の性質、全ての成分の比、及びサイズなどの生物物理学的パラメーターの影響を受ける場合がある。Semple et al.,(Sempleら、Nature Biotech.2010 28:172-176)による一例では、リポソーム製剤は、57.1%のイオン性脂質、7.1%のジパルミトイルホスファチジルコリン、34.3%のコレステロール及び1.4%のPEG-c-DMAから構成されていた。別の例として、イオン性脂質の組成を変えることにより、siRNAを様々な抗原提示細胞により効果的に送達することができた(Basha et al.,Mol Ther.2011 19:2186-2200)。いくつかの実施形態において、リポソーム製剤は、約35%~約45%のイオン性脂質、約40%~約50%のイオン性脂質、約50%~約60%のイオン性脂質及び/または約55%~約65%脂質を含む。いくつかの実施形態においては、リポソーム中の脂質対mRNAの比は、約5:1~約20:1、約10:1~約25:1、約15:1~約30:1及び/または少なくとも30:1である。
いくつかの実施形態においては、脂質ナノ粒子(LNP)製剤中のPEGの比は、増大もしくは減少するか、及び/またはPEG脂質の炭素鎖長がC14からC18に変更されて、LNP製剤の薬物動態学及び/または生体内分布が変化する。非限定的な例として、LNP製剤は、約0.5%~約3.0%、約1.0%~約3.5%、約1.5%~約4.0%、約2.0%~約4.5%、約2.5%~約5.0%及び/または約3.0%~約6.0%の脂質モル比のPEG-c-DOMG(R-3-[(ω-メトキシ-ポリ(エチレングリコール)2000)カルバモイル)]-1,2-ジミリスチルオキシプロピル-3-アミン)(本明細書ではPEG-DOMGとも呼ばれる)を、イオン性脂質、DSPC及びコレステロールと比較して含む。別の実施形態において、PEG-c-DOMGは、PEG脂質、例えば、限定するものではないが、PEG-DSG(1,2-ジステアロイル-sn-グリセロール、メトキシポリエチレングリコール)、PEG-DMG(1,2-ジミリストイル-sn-グリセロール)及び/またはPEG-DPG(1,2-ジパルミトイル-sn-グリセロール、メトキシポリエチレングリコール)で置き換えられてもよい。イオン性脂質は、限定するものではないが、DLin-MC3-DMA、DLin-DMA、C12-200及びDLin-KC2-DMAのような当該分野で公知の任意の脂質から選択されてもよい。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、国際公開番号WO2012170930(米国特許出願公開第20140294938号も参照)に記載されているような脂質ナノ粒子中に製剤化される。
別の実施形態では、ポリヌクレオチド(複数可)を含む製剤は、ポリヌクレオチド(複数可)を含む製剤は、少なくとも1つの脂質を含み得るナノ粒子である。この脂質は、限定するものではないが、DLin-DMA、DLin-K-DMA、98N12-5、C12-200、DLin-MC3-DMA、DLin-KC2-DMA、DODMA、PLGA、PEG、PEG-DMG、PEG化脂質及びアミノアルコール脂質から選択され得る。別の態様では、この脂質は、限定するものではないが、DLin-DMA、DLin-D-DMA、DLin-MC3-DMA、DLin-KC2-DMA、DODMA及びアミノアルコール脂質などのカチオン性脂質である。アミノアルコールカチオン性脂質は、米国特許出願公開第20130150625号に記載されている脂質であってもよいし、及び/または記載されている方法によって作製されてもよい。非限定的な例として、カチオン性脂質は、2-アミノ-3-[(9Z、12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]-2-{[(9Z、2Z)-オクタデカ-9,12-ジエン-1-イルオキシ]メチル}プロパン-1-オール(米国特許出願公開第20130150625中の化合物1);2-アミノ-3-[(9Z)-オクタデカ-9-エン-1-イルオキシ]-2-{[(9Z)-オクタデカ-9-エン-1-イルオキシ]メチル}プロパン-1-オール(米国特許出願公開第20130150625号の化合物2);2-アミノ-3-[(9Z、12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]-2-[(オクチルオキシ)メチル]プロパン-1-オール(米国特許出願公開第20130150625号の化合物3);及び2-(ジメチルアミノ)-3-[(9Z、12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]-2-{[(9Z、12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]メチル}プロパン-1-オール(米国特許出願公開第20130150625号の化合物4);またはその任意の医薬として許容される塩もしくは立体異性体であり得る。
本開示は、有利な特性を有する医薬組成物を提供する。特に、本出願は、以下を含む医薬組成物を提供する:
(i)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド;または、(ii)IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、もしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド;または、
(iii)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド及びIL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチドもしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド;または
(iv)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチド;または、
(v)IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチドもしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを含むポリヌクレオチド;または
(vi)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、もしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチド;
ならびに、
(b)送達剤。
いくつかの実施形態においては、送達剤は、式(I)を有する化合物であって、
式中、
R1は、C5~30アルキル、C5~20アルケニル、-R*YR”、-YR”、及びR”M’R’からなる群より独立して選択され;
R2及びR3は独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及びR*OR”からなる群より独立して選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1~6アルキルからなる群より選択され、ここでQは、炭素環、複素環、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-N(R)2、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-N(R)R8、-O(CH2)nOR、-N(R)C(=NR9)N(R)2、-N(R)C(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、-N(OR)C(O)R、-N(OR)S(O)2R、-N(OR)C(O)OR、-N(OR)C(O)N(R)2、-N(OR)C(S)N(R)2、-N(OR)C(=NR9)N(R)2、-N(OR)C(=CHR9)N(R)2、-C(=NR9)N(R)2、-C(=NR9)R、-C(O)N(R)OR、及び-C(R)N(R)2C(O)ORから選択され、及び各々のnは、独立して、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、-S-S-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
R8は、C3~6炭素環及び複素環からなる群より独立して選択され;
R9は、H、CN、NO2、C1~6アルキル、-OR、-S(O)2R、-S(O)2N(R)2、C2~6アルケニル、C3~6炭素環及び複素環からなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつmは、5、6、7、8、9、10、11、12、及び13から選択される、化合物、
あるいはそれらの塩または立体異性体を含む。
いくつかの実施形態においては、式(I)の化合物のサブセットとしては、
R1が、C5-20アルキル、C5~20アルケニル、-R*YR”、-YR”、及びR”M’R’からなる群より選択され;
R2及びR3が独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1-6アルキルからなる群より独立して選択され、ここでQは、炭素環、複素環、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-N(R)2、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、及び-C(R)N(R)2C(O)ORから選択され、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつmは、5、6、7、8、9、10、11、12、及び13から選択される、
化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられ、ここでアルキル及びアルケニル基は、直鎖であっても、または分枝されていてもよい。
いくつかの実施形態においては、式(I)の化合物のサブセットとしては、R4が、-(CH2)nQ、-(CH2)nCHQR、-CHQR、または-CQ(R)2である場合、(i)nが1、2、3、4もしくは5である場合、Qが-N(R)2ではないか、または(ii)nが1または2である場合、Qが、5員、6員もしくは7員のヘテロシクロアルキルではない、化合物のサブセットが挙げられる。
別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~30アルキル、C5~20アルケニル、-R*YR”、-YR”、及びR”M’R’からなる群より選択され;
R2及びR3が独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1-6アルキルからなる群より独立して選択され、ここでQは、C3~6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロアリール、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-CRN(R)2C(O)OR、-N(R)R8、-O(CH2)nOR、-N(R)C(=NR9)N(R)2、-N(R)C(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、-N(OR)C(O)R、-N(OR)S(O)2R、-N(OR)C(O)OR、-N(OR)C(O)N(R)2、-N(OR)C(S)N(R)2、-N(OR)C(=NR9)N(R)2、-N(OR)C(=CHR9)N(R)2、-C(=NR9)N(R)2、-C(=NR9)R、-C(O)N(R)OR、ならびにN、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロシクロアルキルから選択され、これは、オキソ(=O)、OH、アミノ、及びC1~3アルキルから選択される1つ以上の置換基で置換され、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、-S-S-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2-3アルケニル、及びHからなる群より選択され;
R8は、C3~6炭素環及び複素環からなる群より選択され;
R9は、H、CN、NO2、C1~6アルキル、-OR、-S(O)2R、-S(O)2N(R)2、C2~6アルケニル、C3~6炭素環及び複素環からなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~20アルキル、C5~20アルケニル、-R*YR”、-YR”、及びR”M’R’からなる群より独立して選択され;
R2及びR3が、独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より独立して選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1-6アルキルからなる群より独立して選択され、ここでQは、C3-6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロアリール、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-CRN(R)2C(O)OR、ならびにN、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロシクロアルキルから選択され、これは、オキソ(=O)、OH、アミノ、及びC1~3アルキルから選択される1つ以上の置換基で置換されており、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
さらに別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~30アルキル、C5~20アルケニル、-R*YR”、-YR”、及びR”M’R’からなる群より独立して選択され;
R2及びR3が、独立して、H、C1-14アルキル、C2-14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1~6アルキルからなる群より独立して選択され、ここでQは、C3-6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員の複素環、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-CRN(R)2C(O)OR、-N(R)R8、-O(CH2)nOR、-N(R)C(=NR9)N(R)2、-N(R)C(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、-N(OR)C(O)R、-N(OR)S(O)2R、-N(OR)C(O)OR、-N(OR)C(O)N(R)2、-N(OR)C(S)N(R)2、-N(OR)C(=NR9)N(R)2、-N(OR)C(=CHR9)N(R)2、-C(=NR9)R、-C(O)N(R)OR、及び-C(=NR9)N(R)2から選択され、かつ各々のnは、独立して1、2、3、4、及び5から選択され;かつQが5員~14員の複素環であり、かつ(i)R4が、-(CH2)nQであり、nが1もしくは2であるか、または(ii)R4が、-(CH2)nCHQRであり、nが1であるか、または(iii)R4が、-CHQR、及び-CQ(R)2である場合、Qは、5員~14員のヘテロアリールまたは8~14員のヘテロシクロアルキルであり;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、-S-S-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
R8は、C3~6炭素環及び複素環からなる群より選択され;
R9は、H、CN、NO2、C1~6アルキル、-OR、-S(O)2R、-S(O)2N(R)2、C2~6アルケニル、C3~6炭素環及び複素環からなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
さらに別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~20アルキル、C5~20アルケニル、-R*YR”、-YR”、及び-R”M’R’からなる群より独立して選択され;
R2及びR3は、独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より独立して選択され、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3-6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1-6アルキルからなる群より選択され、ここでQは、C3-6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員の複素環、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-CRN(R)2C(O)ORから選択され、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;かつQが5員~14員の複素環であり、かつ(i)R4が、-(CH2)nQであり、ここでnが1もしくは2であるか、または(ii)R4が、-(CH2)nCHQRであり、ここでnが1であるか、または(iii)R4が、-CHQR、及び-CQ(R)2であるならば、Qは5員~14員のヘテロアリールまたは8~14員のヘテロシクロアルキルのいずれかであり;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より独立して選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
さらに別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~30アルキル、C5~20アルケニル、-R*YR”、-YR”、及び-R”M’R’からなる群より独立して選択され;
R2及びR3が、独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3-6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1~6アルキルからなる群より選択され、ここでQは、C3~6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロアリール、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-CRN(R)2C(O)OR、-N(R)R8、-O(CH2)nOR、-N(R)C(=NR9)N(R)2、-N(R)C(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、-N(OR)C(O)R、-N(OR)S(O)2R、-N(OR)C(O)OR、-N(OR)C(O)N(R)2、-N(OR)C(S)N(R)2、-N(OR)C(=NR9)N(R)2、-N(OR)C(=CHR9)N(R)2、-C(=NR9)R、-C(O)N(R)OR、及び-C(=NR9)N(R)2から選択され、かつ各々のnは、独立して1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、-S-S-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
R8は、C3~6炭素環及び複素環からなる群より選択され;
R9は、H、CN、NO2、C1~6アルキル、-OR、-S(O)2R、-S(O)2N(R)2、C2~6アルケニル、C3-6炭素環及び複素環からなる群より独立して選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
さらに別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~20アルキル、C5~20アルケニル、-R*YR”、-YR”、及び-R”M’R’からなる群より選択され;
R2及びR3が、独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より独立して選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4が、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1~6アルキルからなる群より独立して選択され、ここでQは、C3~6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロアリール、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-CRN(R)2C(O)ORから選択され、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より独立して選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、あるいはそれらの塩または立体異性体が挙げられる。
さらに別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~30アルキル、C5~20アルケニル、-R*YR”、-YR”、及び-R”M’R’からなる群より独立して選択され;
R2及びR3が、独立して、H、C2~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及びR*OR”からなる群より独立して選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4が、-(CH2)nQまたは-(CH2)nCHQRであり、ここでQは、-N(R)2であり、かつnは、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、-S-S-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より独立して選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC1~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
さらに別の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~20アルキル、C5~20アルケニル、-R*YR”、-YR”、及び-R”M’R’からなる群より独立して選択され;
R2及びR3が、独立して、H、C2~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より独立して選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4が、-(CH2)nQまたは-(CH2)nCHQRであり、ここでQは、-N(R)2であり、かつnは、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC1~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物の別のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
さらに他の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~30アルキル、C5~20アルケニル、-R*YR”、-YR”、及び-R”M’R’からなる群より選択され;
R2及びR3が、独立して、C1-14アルキル、C2-14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択され、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、-(CH2)nQ、-(CH2)nCHQR、-CHQR、及びCQ(R)2からなる群より選択され、ここでQは、-N(R)2であり、かつnは、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1-3アルキル、C2-3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1-3アルキル、C2-3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、-S-S-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC1~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
さらに他の実施形態では、式(I)の化合物の別のサブセットとしては、
R1が、C5~20アルキル、C5~20アルケニル、-R*YR”、-YR”、及びR”M’R’からなる群より独立して選択され;
R2及びR3が、独立して、C1-14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4が、-(CH2)nQ、-(CH2)nCHQR、-CHQR、及びCQ(R)2からなる群より選択され、ここでQは、-N(R)2であり、かつnは、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC1~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつ
mは、5、6、7、8、9、10、11、12、及び13から選択される、化合物のサブセット、
あるいはそれらの塩または立体異性体が挙げられる。
特定の実施形態では、式(I)の化合物のサブセットとしては、
式(IA):
の化合物、またはその塩もしくは立体異性体が挙げられ、ここでlは、1、2、3、4、及び5から選択され;mは、5、6、7、8、及び9から選択され;M1は結合であるか、またはM’であり;R4は、非置換のC1-3アルキル、または-(CH2)nQであり、ここでQは、OH、-NHC(S)N(R)2、-NHC(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)R8、-NHC(=NR9)N(R)2、-NHC(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、ヘテロアリールまたはヘテロシクロアルキルであり;M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-P(O)(OR’)O-、-S-S-、アリール基、及びヘテロアリール基から選択され;かつR2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される。
いくつかの実施形態においては、式(I)の化合物のサブセットとしては、式(IA)の化合物、またはその塩もしくは立体異性体が挙げられ、
式中
lは、1、2、3、4、及び5から選択され;mは、5、6、7、8、及び9から選択され;
M1は結合であるか、またはM’であり;
R4は、非置換のC1-3アルキル、または-(CH2)nQであり、ここでQは、OH、-NHC(S)N(R)2、または-NHC(O)N(R)2であり;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-P(O)(OR’)O-、アリール基、及びヘテロアリール基から選択され;かつ
R2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される。
特定の実施形態では、式(I)の化合物のサブセットとしては、式(II)の化合物:
またはその塩もしくは立体異性体が挙げられ、式中lは、1、2、3、4、及び5から選択され;M1は結合であるか、またはM’であり;R4は、非置換のC1-3アルキル、または-(CH2)nQであり、ここでnは、2、3、または4であり、かつQは、OH、-NHC(S)N(R)2、-NHC(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)R8、-NHC(=NR9)N(R)2、-NHC(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、ヘテロアリールまたはヘテロシクロアルキルであり;M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-P(O)(OR’)O-、-S-S-、アリール基、及びヘテロアリール基から選択され;かつ
R2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される。
いくつかの実施形態においては、式(I)の化合物のサブセットとしては、式(II)の化合物、またはその塩もしくは立体異性体が挙げられ、式中
lは、1、2、3、4、及び5から選択され;
M1は結合であるか、またはM’であり;
R4は、非置換のC1~3アルキル、または-(CH2)nQであり、ここでnは、2、3、または4であり、かつQは、OH、-NHC(S)N(R)2、または-NHC(O)N(R)2であり;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-P(O)(OR’)O-、アリール基、及びヘテロアリール基から選択され;かつ
R2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される。
いくつかの実施形態においては、式(I)の化合物は、式(IIa)の化合物、
またはその塩であり、式中R4は、上記のとおりである。
いくつかの実施形態においては、式(I)の化合物は、式(IIb)の化合物、
またはその塩であり、式中R4は上記のとおりである。
いくつかの実施形態においては、式(I)の化合物は、式(IIc)の化合物、
またはその塩であり、式中R4は上記のとおりである。
いくつかの実施形態においては、式(I)の化合物は、式(IIe)の化合物:
またはその塩であり、式中R4は上記のとおりである。
いくつかの実施形態においては、式(IIa)、(IIb)、(IIc)、または(IIe)の化合物は、R4を含み、これは、-(CH2)nQ及び-(CH2)nCHQRから選択され、ここでQ、R及びnは上記で規定されるとおりである。
いくつかの実施形態においては、Qは、-OR、-OH、-O(CH2)nN(R)2、-OC(O)R、-CX3、-CN、-N(R)C(O)R、-N(H)C(O)R、-N(R)S(O)2R、-N(H)S(O)2R、-N(R)C(O)N(R)2、-N(H)C(O)N(R)2、-N(H)C(O)N(H)(R)、-N(R)C(S)N(R)2、-N(H)C(S)N(R)2、-N(H)C(S)N(H)(R)、及び複素環からなる群より選択され、式中Rは上記で規定されるとおりである。いくつかの態様では、nは、1または2である。いくつかの実施形態においては、Qは、OH、-NHC(S)N(R)2、または-NHC(O)N(R)2である。
いくつかの実施形態においては、式(I)の化合物は、式(IId)の化合物、
またはその塩であり、式中R2及びR3は、独立して、C5~14アルキル及びC5~14アルケニルからなる群より選択され、nは、2、3、及び4から選択され、かつR’、R”、R5、R6及びmは、上記で規定されるとおりである。
式(IId)の化合物のいくつかの態様では、R2は、C8アルキルである。式(IId)の化合物のいくつかの態様では、R3は、C5~C9アルキルである。式(IId)の化合物のいくつかの態様では、mは、5、7、または9である。式(IId)の化合物のいくつかの態様では、各々のR5は、Hである。式(IId)の化合物のいくつかの態様では、各々のR6は、Hである。
別の態様では、本出願は、脂質組成物(例えば、脂質ナノ粒子(LNP))を提供し、これは:(1)式(I)を有する化合物;(2)任意選択でヘルパー脂質(例えば、リン脂質);(3)任意選択で構造脂質(例えば、ステロール);(4)任意選択で脂質コンジュゲート(例えば、PEG-脂質);及び(5)任意選択で四級アミン化合物を含む。例示的な実施形態では、脂質組成物(例えば、LNP)はさらに、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せ、例えば、ポリヌクレオチドまたはその中に封入されたポリヌクレオチドを含む。
1つの特定の実施形態では、この脂質組成物(例えば、LNP)は、さらにIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを含む。別の特定の実施形態では、この脂質組成物(例えば、LNP)は、さらにIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを含む。
本明細書において用いる場合、「アルキル」または「アルキル基」という用語は、直鎖または分枝した、飽和された炭化水素であって、1つ以上の炭素原子(例えば、1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ、10、11、12、13、14、15、16、17、18、19、20個以上の炭素原子)を含む炭化水素を意味する。
「C1~14アルキル」という表記は、直鎖または分枝した、飽和された炭化水素であって、1~14個の炭素原子を含む炭化水素を意味する。アルキル基は、任意選択で置換されていてもよい。
本明細書において用いる場合、「アルケニル」または「アルケニル基」という用語は、直鎖または分枝した炭化水素であって、2つ以上の炭素原子(例えば、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ、10、11、12、13、14、15、16、17、18、19、20個以上の炭素原子)及び少なくとも1つの二重結合を含む炭化水素を意味する。
「C2~14アルケニル」という表記は、直鎖または分枝した炭化水素であって、2~14個の炭素原子及び少なくとも1つの二重結合を含む炭化水素を意味する。アルケニル基は、1つ、2つ、3つ、4つ以上の二重結合を含んでもよい。例えば、C18アルケニルは、1つ以上の二重結合を含んでもよい。2つの二重結合を含むC18アルケニル基は、リノレイル基であってもよい。アルケニル基は任意選択で置換されていてもよい。
本明細書において用いる場合、「炭素環」または「炭素環式基」(という用語は、炭素原子の1つ以上の環を含む単環式または多環式の系を意味する。環は、3、4、5、6、7、8、9、10、11、12、13、14、または15員の環であってもよい。
表記「C3~6炭素環」とは、3~6個の炭素原子を有する単一の環を含む炭素環を意味する。炭素環は、1つ以上の二重結合及びを含んでもよく、芳香族(例えば、アリール基)であってもよい。炭素環の例としては、シクロプロピル、シクロペンチル、シクロヘキシル、フェニル、ナフチル、及び1,2-ジヒドロナフチル基が挙げられる。炭素環は、任意選択で置換されていてもよい。
本明細書において用いる場合、「複素環」または「複素環式基」という用語は、1つ以上の環を含む、単環式または多環式の系であって、少なくとも1つの環が、少なくとも1つのヘテロ原子を含む系を意味する。ヘテロ原子は、例えば、窒素、酸素、または硫黄原子であってもよい。環は、3、4、5、6、7、8、9、10、11、または12員の環であってもよい。複素環は、1つ以上の二重結合を含んでもよく、かつ芳香族(例えば、ヘテロアリール基)であってもよい。複素環の例としては、イミダゾリル、イミダゾリジニル、オキサゾリル、オキサゾリジニル、チアゾリル、チアゾリジニル、ピラゾリジニル、ピラゾリル、イソオキサゾリジニル、イソオキサゾリル、イソチアゾリジニル,イソチアゾリル、モルホリニル、ピロリル、ピロリジニル、フリル、テトラヒドロフリル、チオフェニル、ピリジニル、ピペリジニル、キノリル、及びイソキノリル基が挙げられる。複素環は、任意選択で置換されていてもよい。
本明細書において用いる場合、「生分解性の基」とは、対象における脂質のより速い代謝を促進し得る基である。生分解性の基とは、限定するものではないが、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基であってもよい。
本明細書において用いる場合、「アリール基」とは、1つ以上の芳香族環を含むカルボサイクリック族である。アリール基の例としては、フェニル及びナフチル基が挙げられる。
本明細書において用いる場合、「ヘテロアリール基」とは、1つ以上の芳香族環を有する複素環式基である。ヘテロアリール基の例としては、ピロリル、フリル、チオフェニル、イミダゾリル、オキサゾリル、及びチアゾリルが挙げられる。アリール及びヘテロアリール基は両方とも、任意選択で置換されていてもよい。例えば、M及びM’は、任意選択で置換されているフェニル、オキサゾール、及びチアゾールからなる非限定的な基から選択され得る。本明細書における式では、M及びM’は、独立して、上記の生分解性の基の列挙から選択され得る。
アルキル、アルケニル、及びシクリル(例えば、カルボシクリル及びヘテロシクリル)基は、別段特定しない限り、任意選択で置換されてもよい。任意の置換基は、限定するものではないが、ハロゲン原子(例えば、塩化物、臭化物、フッ化物、またはヨウ化物基)、カルボン酸(例えば、-C(O)OH)、アルコール(例えば、ヒドロキシル、-OH)、エステル(例えば、-C(O)ORまたは-OC(O)R)、アルデヒド(例えば、-C(O)H)、カルボニル(例えば、-C(O)R、代わりにC=Oと示される)、ハロゲン化アシル(例えば、-C(O)X、Xは、臭化物、フッ化物、塩化物、ヨウ化物から選択されるハロゲン化物である)、炭酸塩(例えば、-OC(O)OR)、アルコキシ(例えば、-OR)、アセタール(例えば、-C(OR)2R”、ここで各々のORは、同じであってもまたは異なってもよいアルコキシ基であり、かつR”は、アルキルまたはアルケニル基である)、リン酸塩(例えば、P(O)4
3-)、チオール(例えば、-SH)、スルホキシド(例えば、-S(O)R)、スルフィン酸(例えば、-S(O)OH)、スルホン酸(例えば、-S(O)2OH)、チアール(例えば、-C(S)H)、硫酸塩(例えば、S(O)4
2-)、スルホニル(例えば、-S(O)2-)、アミド(例えば、-C(O)NR2、または-N(R)C(O)R)、アジド(例えば、-N3)、ニトロ(例えば、-NO2)、シアノ(例えば、-CN)、イソシアノ(例えば、-NC)、アシルオキシ(例えば、-OC(O)R)、アミノ(例えば、-NR2、-NRH、または-NH2)、カルバモイル(例えば、-OC(O)NR2、-OC(O)NRH、または-OC(O)NH2)、スルホンアミド(例えば、-S(O)2NR2、-S(O)2NRH、-S(O)2NH2、-N(R)S(O)2R、-N(H)S(O)2R、-N(R)S(O)2H、または-N(H)S(O)2H)、アルキル基、アルケニル基、及びシクリル(例えば、カルボシクリルまたはヘテロシクリル)基からなる群より選択され得る。
前述のいずれにおいても、Rは、本明細書において規定されたような、アルキルまたはアルケニル基である。いくつかの実施形態においては、置換基自体が、さらに、例えば、本明細書に規定されるような、1つ、2つ、3つ、4つ、5つ、または6つの置換基で置換されてもよい。例えば、C1~6アルキル基はさらに、本明細書に記載されるような、1つ、2つ、3つ、4つ、5つ、または6つの置換基で置換されてもよい。
式(I)、(IA)、(II)、(IIa)、(IIb)、(IIc)、(IId)、及び(IIe)のいずれか1つの化合物は、適用可能な場合、以下の特徴のうちの1つ以上を含む。
いくつかの実施形態においては、R4は、C3~6炭素環、-(CH2)nQ、-CH2)nCHQR、-CHQR、及びCQ(R)2からなる群より選択され、ここでQは、C3~6炭素環、N、O、S及びPから選択される1つ以上のヘテロ原子を有する5員~14員の芳香族または非芳香族複素環、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-N(R)2、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、及びC(R)N(R)2C(O)ORから選択され、かつ各々のnは、独立して1、2、3、4、及び5から選択される。
別の実施形態では、R4は、C3-6炭素環、-CH2)nQ、-CH2)nCHQR、-CHQR、及び-CQ(R)2からなる群より選択され、ここでQは、C3~6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロアリール、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-C(R)N(R)2C(O)OR、ならびにN、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロシクロアルキルから選択され、これは、オキソ(=O)、OH、アミノ、及びC1~3アルキルから選択される1つ以上の置換基で置換されており、かつ、各々のnは、独立して、1、2、3、4、及び5から選択される。
別の実施形態では、R4は、C3-6炭素環、-CH2)nQ、-CH2)nCHQR、-CHQR、及びCQ(R)2からなる群より独立して選択され、ここでQは、C3~6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員の複素環、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-C(R)N(R)2C(O)ORから選択され、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;そしてQが5員~14員の複素環であり、かつ(i)R4が、-(CH2)nQであり、nが1または2であるか、または(ii)R4が、-CH2)nCHQRであり、ここでnが1であるか、または(iii)R4が、-CHQR、及び-CQ(R)2であるならば、Qは、5員~14員のヘテロアリールまたは8~14員のヘテロシクロアルキルである。
別の実施形態では、R4は、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、及び-CQ(R)2からなる群より独立して選択され、ここでQは、C3~6炭素環、N、O及びSから選択される1つ以上のヘテロ原子を有する5員~14員のヘテロアリール、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、-C(R)N(R)2C(O)ORから選択され、かつ各々のnは、独立して、1、2、3、4、及び5から選択される。
別の実施形態では、R4は、非置換のC1~4アルキル、例えば、非置換のメチルである。
特定の実施形態では、本開示によって、式(I)を有する化合物が提供され、式中R4は、-CH2)nQまたは-CH2)nCHQRであり、ここでQは、-N(R)2であり、かつnは、3、4、及び5から選択される。
特定の実施形態では、本開示は、式(I)を有する化合物を提供し、式中R4は、-CH2)nQ、-CH2)nCHQR、-CHQR、及びCQ(R)2からなる群より独立して選択され、ここでQは、-N(R)2、及びnは、1、2、3、4、及び5から選択される。
特定の実施形態では、本開示は、式(I)を有する化合物を提供し、式中R2及びR3は、独立して、C2~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し、かつR4は、-CH2)nQまたは-CH2)nCHQRであり、ここでQは、-N(R)2であり、かつnは、3、4、及び5から選択される。
特定の実施形態では、R2及びR3は、独立して、C2~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成する。
いくつかの実施形態においては、R1は、C5~20アルキル及びC5~20アルケニルからなる群より独立して選択される。
他の実施形態では、R1は、-R*YR”、-YR”、及び-R”M’R’からなる群より独立して選択される。
特定の実施形態では、R1は、-R*YR”及び-YR”から選択される。いくつかの実施形態においては、Yは、シクロプロピル基である。いくつかの実施形態においては、R*は、C8アルキルまたはC8アルケニルである。特定の実施形態では、R”は、C3~12アルキルである。例えば、R”は、C3アルキルであってもよい。例えば、R”は、C4~8アルキル(例えば、C4、C5、C6、C7、またはC8アルキル)であってもよい。
いくつかの実施形態においては、R1は、C5~20アルキルである。いくつかの実施形態においては、R1は、C6アルキルである。いくつかの実施形態においては、R1は、C8アルキルである。他の実施形態では、R1は、C9アルキルである。特定の実施形態では、R1は、C14アルキルである。他の実施形態では、R1は、C18アルキルである。
いくつかの実施形態においては、R1は、C5~20アルケニルである。特定の実施形態では、R1は、C18アルケニルである。いくつかの実施形態においては、R1は、リノレイルである。
特定の実施形態では、R1は分枝されている(例えば、デカン-2-イル、ウンデカン-3-イル、ドデカン-4-イル、トリデカン-5-イル、テトラデカン-6-イル、2-メチルウンデカン-3-イル、2-メチルデカン-2-イル、3-メチルウンデカン-3-イル、4-メチルドデカン-4-イル、またはヘプタデカ-9-イル)。特定の実施形態では、R1は、
である。
特定の実施形態では、R1は、非置換のC5~20アルキルまたはC5-20アルケニルである。特定の実施形態では、R’は、置換されているC5~20アルキルまたはC5~20アルケニル(例えば、1-シクロプロピルノニルのようなC3~6炭素環で置換されている)である。
他の実施形態では、R1は、-R”M’R’である。
いくつかの実施形態においては、R’は、-R*YR”及び-YR”から選択される。いくつかの実施形態においては、Yは、C3~8シクロアルキルである。いくつかの実施形態においては、Yは、C6~10アリールである。いくつかの実施形態においては、Yは、シクロプロピル基である。いくつかの実施形態においては、Yは、シクロヘキシル基である。特定の実施形態では、R*は、C1アルキルである。
いくつかの実施形態においては、R”は、C3~12アルキル及びC3~12アルケニルからなる群より選択される。いくつかの実施形態においては、Yに隣接するR”は、C1アルキルである。いくつかの実施形態においては、Yに隣接するR”は、C4~9アルキル(例えば、C4、C5、C6、C7またはC8またはC9アルキル)である。
いくつかの実施形態においては、R’は、C4アルキル及びC4アルケニルから選択される。特定の実施形態では、R’は、C5アルキル及びC5アルケニルから選択される。いくつかの実施形態においては、R’は、C6アルキル及びC6アルケニルから選択される。いくつかの実施形態においては、R’は、C7アルキル及びC7アルケニルから選択される。いくつかの実施形態においては、R’は、C9アルキル及びC9アルケニルから選択される。
他の実施形態では、R’は、C11アルキル及びC11アルケニルから選択される。他の実施形態では、R’は、C12アルキル、C12アルケニル、C13アルキル、C13アルケニル、C14アルキル、C14アルケニル、C15アルキル、C15アルケニル、C16アルキル、C16アルケニル、C17アルキル、C17アルケニル、C18アルキル、及びC18アルケニルから選択される。特定の実施形態では、R’は分枝されている(例えば、デカン-2-イル、ウンデカン-3-イル、ドデカン-4-イル、トリデカン-5-イル、テトラデカン-6-イル、2-メチルウンデカン-3-イル、2-メチルデカン-2-イル、3-メチルウンデカン-3-イル、4-メチルドデカン-4-イルまたはヘプタデカ-9-イル)。特定の実施形態では、R’は、
である。
特定の実施形態では、R’は、非置換のC1~18アルキルである。特定の実施形態では、R’は、置換されているC1~18アルキル(例えば、1-シクロプロピルノニルのようなC3~6炭素環で置換されているC1~15アルキル)。
いくつかの実施形態においては、R”は、C3~14アルキル及びC3~14アルケニルからなる群より選択される。いくつかの実施形態においては、R”は、C3アルキル、C4アルキル、C5アルキル、C6アルキル、C7アルキル、またはC8アルキルである。いくつかの実施形態においては、R”は、C9アルキル、C10アルキル、C11アルキル、C12アルキル、C13アルキル、またはC14アルキルである。
いくつかの実施形態においては、M’は、-C(O)O-である。いくつかの実施形態においては、M’は、-OC(O)-である。
他の実施形態では、M’は、アリール基またはヘテロアリール基である。例えば、M’は、フェニル、オキサゾール、及びチアゾールからなる群より選択されてもよい。
いくつかの実施形態においては、Mは、-C(O)O-である。いくつかの実施形態においては、Mは、-OC(O)-である。いくつかの実施形態においては、Mは、-C(O)N(R’)-である。いくつかの実施形態においては、Mは、-P(O)(OR’)O-である。
他の実施形態では、Mは、アリール基またはヘテロアリール基である。例えば、Mは、フェニル、オキサゾール、及びチアゾールからなる群より選択され得る。
いくつかの実施形態においては、Mは、M’と同じである。他の実施形態では、Mは、M’とは異なる。
いくつかの実施形態においては、各々のR5は、Hである。特定のこのような実施形態では、各々のR6はまたHでもある。
いくつかの実施形態においては、R7は、Hである。他の実施形態では、R7は、C1-3アルキル(例えば、メチル、エチル、プロピル、またはi-プロピル)である。
いくつかの実施形態においては、R2及びR3は、独立して、C5-14アルキルまたはC5~14アルケニルである。
いくつかの実施形態においては、R2及びR3は同じである。いくつかの実施形態においては、R2及びR3は、C8アルキルである。特定の実施形態では、R2及びR3は、C2アルキルである。他の実施形態では、R2及びR3は、C3アルキルである。いくつかの実施形態においては、R2及びR3は、C4アルキルである。特定の実施形態では、R2及びR3は、C5アルキルである。他の実施形態では、R2及びR3は、C6アルキルである。いくつかの実施形態においては、R2及びR3は、C7アルキルである。
他の実施形態では、R2及びR3は、異なる。特定の実施形態では、R2は、C8アルキルである。いくつかの実施形態においては、R3は、C1~7(例えば、C1、C2、C3、C4、C5、C6、またはC7アルキル)またはC9アルキルである。
いくつかの実施形態においては、R7及びR3は、Hである。
特定の実施形態では、R2は、Hである。
いくつかの実施形態においては、mは、5、7、または9である。
いくつかの実施形態においては、R4は、-(CH2)nQ 及び-(CH2)nCHQRから選択される。
いくつかの実施形態においては、Qは、-OR、-OH、-O(CH2)nN(R)2、-OC(O)R、-CX3、-CN、-N(R)C(O)R、-N(H)C(O)R、-N(R)S(O)2R、-N(H)S(O)2R、-N(R)C(O)N(R)2、-N(H)C(O)N(R)2、-N(H)C(O)N(H)(R)、-N(R)C(S)N(R)2、-N(H)C(S)N(R)2、-N(H)C(S)N(H)(R)、-C(R)N(R)2C(O)OR、炭素環、及び複素環からなる群より選択される。
特定の実施形態では、Qは、-OHである。
特定の実施形態では、Qは、置換されるか、または非置換の5員~10員のヘテロアリールであり、例えば、Qは、イミダゾール、ピリミジン、プリン、2-アミノ-1,9-ジヒドロ-6H-プリン-6-オン-9-イル(またはグアニン-9-イル)、アデニン-9-イル、シトシン-1-イル、またはウラシル-1-イルである。特定の実施形態では、Qは、置換された5員~14員のヘテロシクロアルキル、例えば、オキソ(=O)、OH、アミノ、及びC1~3アルキルから選択される1つ以上の置換基で置換されている。例えば、Qは、4-メチルピペラジニル、4-(4-メトキシベンジル)ピペラジニル、またはイソインドリン-2-イル-1,3-ジオンである。
特定の実施形態では、Qは、非置換のまたは非置換のC6~10アリール(例えば、フェニル)またはC3~6シクロアルキルである。
いくつかの実施形態においては、nは1である。他の実施形態では、nは2である。さらなる実施形態では、nは、3である。特定の他の実施形態では、nは、4である。例えば、R4は、-(CH2)2OHであってもよい。例えば、R4は、-(CH2)3OHであってもよい。例えば、R4は-(CH2)4OHであってもよい。例えば、R4は、ベンジルであってもよい。例えば、R4は、4-メトキシベンジルであってもよい。
いくつかの実施形態においては、R4は、C3~6炭素環である。いくつかの実施形態においては、R4は、C3~6シクロアルキルである。例えば、R4は、例えば、OH、ハロ、C1~6アルキル、などで任意選択で置換されているシクロヘキシルであってもよい。例えば、R4は、2-ヒドロキシシクロヘキシルであってもよい。
いくつかの実施形態においては、Rは、Hである。
いくつかの実施形態においては、Rは、非置換のC1~3アルキルまたは非置換のC2~3アルケニルである。例えば、R4は、-CH2CH(OH)CH3または-CH2CH(OH)CH2CH3であってもよい。
いくつかの実施形態においては、Rは、非置換のC1~3アルキル、例えば、CH2OHである。例えば、R4は、-CH2CH(OH)CH2OHであってもよい。
いくつかの実施形態においては、R2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成する。いくつかの実施形態においては、R2及びR3は、それらが結合される原子と一緒になって、N、O、S及びPから選択される1つ以上のヘテロ原子を有する5員~14員の芳香族または非芳香族複素環を形成する。いくつかの実施形態においては、R2及びR3は、それらが結合される原子と一緒になって、任意選択で置換されているC3~20炭素環(例えば、C3~18炭素環、C3~15炭素環、C3~12炭素環、またはC3~10炭素環)、芳香族または非芳香族のいずれかを形成する。いくつかの実施形態においては、R2及びR3は、それらが結合される原子と一緒になって、C3~6炭素環を形成する。他の実施形態では、R2及びR3は、それらが結合される原子と一緒になって、C6炭素環、例えば、シクロヘキシルまたはフェニル基を形成する。特定の実施形態では、複素環またはC3~6炭素環は、1つ以上のアルキル基で置換される(例えば、同じ環の原子で、または隣接するかまたは隣接していない環原子)である。例えば、R2及びR3は、それらが結合される原子と一緒になって、1つ以上のC5アルキル置換基を保有するシクロヘキシルまたはフェニル基を形成し得る。特定の実施形態では、R2及びR3によって形成された複素環またはC3~6炭素環は、炭素環基で置換される。例えば、R2及びR3は、それらが結合される原子と一緒になって、シクロヘキシルまたはフェニル基(シクロヘキシルで置換されている)を形成し得る。いくつかの実施形態においては、R2及びR3は、それらが結合される原子と一緒になって、C7~15炭素環、例えば、シクロヘプチル、シクロペンタデカニル、またはナフチル基を形成する。
いくつかの実施形態においては、R4は、-(CH2)nQ及び-(CH2)nCHQRから選択される。いくつかの実施形態においては、Qは、-OR、-OH、-O(CH2)nN(R)2、-OC(O)R、-CX3、-CN、-N(R)C(O)R、-N(H)C(O)R、-N(R)S(O)2R、-N(H)S(O)2R、-N(R)C(O)N(R)2、-N(H)C(O)N(R)2、-N(H)C(O)N(H)(R)、-N(R)C(S)N(R)2、-N(H)C(S)N(R)2、-N(H)C(S)N(H)(R)、及び複素環からなる群より選択される。他の実施形態では、Qは、イミダゾール、ピリミジン、及びプリンからなる群より選択される。
いくつかの実施形態においては、R2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成する。いくつかの実施形態においては、R2及びR3は、それらが結合される原子と一緒になって、C3~6炭素環、例えば、フェニル基を形成する。特定の実施形態では、複素環またはC3~6炭素環は、1つ以上のアルキル基で置換されている(例えば、同じ還原子でまたは隣接もしくは隣接していない環原子で)。例えば、R2及びR3は、それらが結合される原子と一緒になって、1つ以上のC5アルキル置換基を保有するフェニル基を形成し得る。
いくつかの実施形態においては、本開示の医薬組成物である、式(I)の化合物は、以下からなる群より選択される:
及びその塩または立体異性体。
他の実施形態では、式(I)の化合物は、化合物1~化合物147、またはその塩もしくは立体異性体からなる群より選択される。
本明細書において開示される脂質化合物のアミン部分は、特定の条件下でプロトン化されてもよい。例えば、式(I)による脂質の中央のアミン部分は、通常は、アミノ部分のpKaより下のpHでプロトン化され(すなわち、正に荷電されている)、pKaを超えるpHでは実質的に荷電されていない。このような脂質は、イオン性アミノ脂質と呼ばれる場合もある。いくつかの実施形態においては、イオン性脂質は、イオン性アミノ脂質であり、当該分野では、「イオン性カチオン性脂質」と呼ばれる場合もある。
いくつかの実施形態においては、イオン性アミノ脂質、例えば、式(I)の化合物の量は、脂質組成物中で約1モル%~99モル%の範囲である。
1つの実施形態において、イオン性アミノ脂質、例えば、式(I)の化合物の量は、脂質組成物中で、少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、または99モル%である。
1つの実施形態において、イオン性アミノ脂質、例えば、式(I)の化合物の量は、脂質組成物中で、約30モル%~約70モル%、約35モル%~約65モル%、約40モル%~約60モル%、及び約45モル%~約55モル%の範囲である。
1つの特定の実施形態では、イオン性アミノ脂質、例えば、式(I)の化合物の量は、脂質組成物中で、約50モル%である。
イオン性アミノ脂質、例えば、式Iの化合物に加えて、本明細書に開示される医薬組成物の脂質組成物は、追加の成分、例えば、リン脂質、構造脂質、四級アミン化合物、PEG-脂質、及びそれらのいずれかの組合せを含んでもよい。
脂質組成物の追加の成分
A.リン脂質
本明細書に開示される医薬組成物の脂質組成物は、1つ以上のリン脂質、例えば、1つ以上の飽和リン脂質もしくは(ポリ)不飽和リン脂質またはそれらの組合せを含んでもよい。一般的には、リン脂質は、リン脂質部分及び1つ以上の脂肪酸部分を含む。例えば、リン脂質は、式(VII)による脂質であってもよく:
ここで、Rpは、リン脂質部分であり、かつR1及びR2は、同じであってもまたは異なってもよい、不飽和を有する、または有さない脂肪酸部分である。
リン脂質部分は、例えば、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルグリセロール、ホスファチジルセリン、ホスファチジン酸、2-リゾホスファチジルコリン、及びスフィンゴミエリンからなる非限定的な群より選択され得る。
脂肪酸部分は、例えば、ラウリン酸、ミリスチン酸、ミリストレイン酸、パルミチン酸、パルミトレイン酸、ステアリン酸、オレイン酸、リノール酸、アルファ-リノレン酸、エルカ酸、フィタン酸、アラキジン酸、アラキドン酸、エイコサペンタエン酸、ベヘン酸、ドコサペンタエン酸、及びドコサヘキサエン酸からなる非限定的な群から選択され得る。
特定のリン脂質は、膜への融合を促進し得る。例えば、カチオン性リン脂質は、膜の1つ以上の負に荷電されたリン脂質と相互作用し得る(例えば、細胞膜、細胞内膜)。膜に対するリン脂質の融合によって、脂質含有組成物(例えば、LNP)の1つ以上の要素(例えば、治療剤)が、膜を通過することを可能にし、例えば1つ以上の要素の標的組織(例えば、腫瘍組織)への送達が可能になり得る。
分枝、酸化、環化、及びアルキンを含む修飾及び置換を有する天然種を含む非天然リン脂質種もまた意図される。例えば、リン脂質は、1つ以上のアルキン(例えば、1つ以上の二重結合が三重結合で置換されているアルケニル基)で官能化されていてもよいし、または架橋されていてもよい。適切な反応条件下で、アルキン基は、アジドに暴露されると銅触媒付加環化を受ける場合がある。このような反応は、ナノ粒子組成物の脂質二分子膜を官能化して膜透過もしくは細胞認識を促進するか、またはナノ粒子組成物を標的化もしくは画像化部分(例えば、色素)などの有用成分に結合させるのに有用であり得る。
リン脂質としては、限定するものではないが、グリセロリン脂質、例えば、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジルグリセロール、及びホスファチジン酸が挙げられる。また、リン脂質としては、スフィンゴミエリンなどのスフィンゴリン脂質が挙げられる。いくつかの実施形態において、本明細書に開示される腫瘍内送達のための医薬組成物は、2つ以上のリン脂質を含んでもよい。2つ以上のリン脂質が使用される場合、そのようなリン脂質は、同じリン脂質クラス(例えば、MSPC及びDSPC)または異なるクラス(例えば、MSPC及びMSPE)に属する場合がある。
リン脂質は、対称型であっても非対称型であってもよい。本明細書中で使用される場合、「対称リン脂質」という用語は、スフィンゴシン主鎖の可変脂肪酸部分及び炭化水素鎖が、匹敵する数の炭素原子を含む、適合する脂肪酸部分及びスフィンゴ脂質を有するグリセロリン脂質を包含する。本明細書中で使用される場合、「非対称リン脂質」という用語は、リゾ脂質、異なる脂肪酸部分(例えば、炭素原子数及び/または不飽和(例えば、二重結合)の数が異なる脂肪酸部分)を有するグリセロリン脂質、ならびに可変脂肪酸部分及びスフィンゴシン主鎖の炭化水素鎖は、異なる数の炭素原子を含む(例えば、可変脂肪酸部分は、炭化水素鎖よりも少なくとも2個多い炭素原子または炭化水素鎖より少なくとも2個少ない炭素原子を含む)スフィンゴ脂質を包含する。
いくつかの実施形態においては、本明細書に開示される医薬組成物の脂質組成物は、少なくとも1つの対称リン脂質を含む。対称リン脂質は、以下からなる非限定的な群から選択され得る、
1,2-ジプロピオニル-sn-グリセロ-3-ホスホコリン(03:0 PC)、
1,2-ジブチリル-sn-グリセロ-3-ホスホコリン(04:0 PC)、
1,2-ジペンタノイル-sn-グリセロ-3-ホスホコリン(05:0 PC)、
1,2-ジヘキサノイル-sn-グリセロ-3-ホスホコリン(06:0 PC)、
1,2-ジヘプタノイル-sn-グリセロ-3-ホスホコリン(07:0 PC)、
1,2-ジオクタノイル-sn-グリセロ-3-ホスホコリン(08:0 PC)、
1,2-ジノナノイル-sn-グリセロ-3-ホスホコリン(09:0 PC)、
1,2-ジデカノイル-sn-グリセロ-3-ホスホコリン(10:0 PC)、
1,2-ジウンデカノイル-sn-グリセロ-3-ホスホコリン(11:0 PC,DUPC)、
1,2-ジラウロイル-sn-グリセロ-3-ホスホコリン(12:0 PC)、
1,2-ジトリデカノイル-sn-グリセロ-3-ホスホコリン(13:0 PC)、
1,2-ジミリストイル-sn-グリセロ-3-ホスホコリン(14:0 PC,DMPC)、
1,2-ジペンタデカノイル-sn-グリセロ-3-ホスホコリン(15:0 PC)、1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン(16:0 PC,DPPC)、
1,2-ジフィタノイル-sn-グリセロ-3-ホスホコリン(4ME 16:0 PC)、
1,2-ジヘプタデカノイル-sn-グリセロ-3-ホスホコリン(17:0 PC)、1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(18:0 PC,DSPC)、
1,2-ジノナデカノイル-sn-グリセロ-3-ホスホコリン(19:0 PC)、
1,2-ジアラキドイル-sn-グリセロ-3-ホスホコリン(20:0 PC)、
1,2-ジヘナラキドイル-sn-グリセロ-3-ホスホコリン(21:0 PC)、
1,2-ジベヘノイル-sn-グリセロ-3-ホスホコリン(22:0 PC)、
1,2-ジトリコサノイル-sn-グリセロ-3-ホスホコリン(23:0 PC)、
1,2-ジリグノセロイル-sn-グリセロ-3-ホスホコリン(24:0 PC)、
1,2-ジミリストオレオイル-sn-グリセロ-3-ホスホコリン(14:1(Δ9-Cis)PC)、
1,2-ジミリステライドイル-sn-グリセロ-3-ホスホコリン(14:1(Δ9-Trans)PC)、
1,2-ジパルミトオレオイル-sn-グリセロ-3-ホスホコリン(16:1(Δ9-Cis)PC)、
1,2-ジパルミテライドイル-sn-グリセロ-3-ホスホコリン(16:1(Δ9-Trans)PC)、
1,2-ジペントロセレノイル-sn-グリセロ-3-ホスホコリン(18:1(Δ6-Cis)PC)、
1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(18:1(Δ9-Cis)PC,DOPC)、
1,2-ジエライドイル-sn-グリセロ-3-ホスホコリン(18:1(Δ9-Trans)PC)、
1,2-ジリノオレオイル-sn-グリセロ-3-ホスホコリン(18:2(Cis)PC,DLPC)、
1,2-ジリノレノイル-sn-グリセロ-3-ホスホコリン(18:3(Cis)PC,DLnPC)、
1,2-ジエイコセノイル-sn-グリセロ-3-ホスホコリン(20:1(Cis)PC)、
1,2-ジアラキドノイル-sn-グリセロ-3-ホスホコリン(20:4(Cis)PC,DAPC)、
1,2-ジエルコイル-sn-グリセロ-3-ホスホコリン(22:1(Cis)PC)、
1,2-ジドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン(22:6(Cis)PC,DHAPC)、
1,2-ジネルボノイル-sn-グリセロ-3-ホスホコリン(24:1(Cis)PC)、
1,2-ジヘキサノイル-sn-グリセロ-3-ホスホエタノールアミン(06:0 PE)、
1,2-ジオクタノイル-sn-グリセロ-3-ホスホエタノールアミン(08:0 PE)、
1,2-ジデカノイル-sn-グリセロ-3-ホスホエタノールアミン(10:0 PE)、
1,2-ジラウロイル-sn-グリセロ-3-ホスホエタノールアミン(12:0 PE)、
1,2-ジミリストイル-sn-グリセロ-3-ホスホエタノールアミン(14:0 PE)、
1,2-ジペンタデカノイル-sn-グリセロ-3-ホスホエタノールアミン(15:0
PE)、
1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン(16:0 PE)、
1,2-ジフィタノイル-sn-グリセロ-3-ホスホエタノールアミン(4ME 16:0 PE)、
1,2-ジヘプタデカノイル-sn-グリセロ-3-ホスホエタノールアミン(17:0
PE)、
1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン(18:0 PE,DSPE)、
1,2-ジパルミトレオイル-sn-グリセロ-3-ホスホエタノールアミン(16:1
PE)、
1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(18:1(Δ9-Cis)PE,DOPE)、
1,2-ジエライドイル-sn-グリセロ-3-ホスホエタノールアミン(18:1(Δ9-Trans)PE)、
1,2-ジリノレオイル-sn-グリセロ-3-ホスホエタノールアミン(18:2 PE,DLPE)、
1,2-ジリノレノイル-sn-グリセロ-3-ホスホエタノールアミン(18:3 PE,DLnPE)、
1,2-ジアラキドノイル-sn-グリセロ-3-ホスホエタノールアミン(20:4 PE,DAPE)、
1,2-ジドコサヘキサエノイル-sn-グリセロ-3-ホスホエタノールアミン(22:6 PE,DHAPE)、
1,2-ジ-O-オクタデセニル-sn-グリセロ-3-ホスホコリン(18:0 ジエーテル PC)、
1,2-ジオレオイル-sn-グリセロ-3-ホスホ-rac-(1-グリセロール)ナトリウム塩(DOPG)、及び
それらのいずれかの組合せ。
いくつかの実施形態においては、本明細書に開示される医薬組成物の脂質組成物は、DLPC、DMPC、DOPC、DPPC、DSPC、DUPC、18:0 Diether PC、DLnPC、DAPC、DHAPC、DOPE、4ME 16:0 PE、DSPE、DLPE、DLnPE、DAPE、DHAPE、DOPG、及びそれらのいずれかの組合せからなる非限定的な群から選択される少なくとも1つの対称性リン脂質を含む。
いくつかの実施形態においては、本明細書に開示される医薬組成物の脂質組成物は、少なくとも1つの非対称性のリン脂質を含む。非対称性のリン脂質は、以下からなる非限定的な群より選択され得る、
1-ミリストイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(14:0-16:0 PC,MPPC)、
1-ミリストイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(14:0-18:0 PC,MSPC)、
1-パルミトイル-2-アセチル-sn-グリセロ-3-ホスホコリン(16:0-02:0 PC)、
1-パルミトイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(16:0-14:0 PC,PMPC)、
1-パルミトイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(16:0-18:0 PC,PSPC)、
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン(16:0-18:1 PC,POPC)、
1-パルミトイル-2-リノレオイル-sn-グリセロ-3-ホスホコリン(16:0-18:2 PC,PLPC)、
1-パルミトイル-2-アラキドノイル-sn-グリセロ-3-ホスホコリン(16:0-20:4 PC)、
1-パルミトイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン(14:0-22:6 PC)、
1-ステアロイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(18:0-14:0 PC,SMPC)、
1-ステアロイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(18:0-16:0 PC,SPPC)、
1-ステアロイル-2-オレオイル-sn-グリセロ-3-ホスホコリン(18:0-18:1 PC,SOPC)、
1-ステアロイル-2-リノレオイル-sn-グリセロ-3-ホスホコリン(18:0-18:2 PC)、
1-ステアロイル-2-アラキドノイル-sn-グリセロ-3-ホスホコリン(18:0-20:4 PC)、
1-ステアロイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン(18:0-22:6 PC)、
1-オレオイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(18:1-14:0 PC,OMPC)、
1-オレオイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(18:1-16:0 PC,OPPC)、
1-オレオイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(18:1-18:0 PC,OSPC)、
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-18:1 PE,POPE)、
1-パルミトイル-2-リノレオイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-18:2 PE)、
1-パルミトイル-2-アラキドノイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-20:4 PE)、
1-パルミトイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-22:6 PE)、
1-ステアロイル-2-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-18:1 PE)、
1-ステアロイル-2-リノレオイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-18:2 PE)、
1-ステアロイル-2-アラキドノイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-20:4 PE)、
1-ステアロイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-22:6 PE)、
1-オレオイル-2-コレステリルヘミサクシノイル-sn-グリセロ-3-ホスホコリン(OChemsPC)、及びそれらのいずれかの組合せ。
脂質組成物中で有用な非対称性の脂質はまた、リゾ脂質であってもよい。リゾ脂質は、以下からなる非限定的な例から選択され得る、
1-ヘキサノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(06:0 Lyso PC)、
1-ヘプタノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(07:0 Lyso PC)、
1-オクタノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(08:0 Lyso PC)、
1-ノナノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(09:0 Lyso PC)、
1-デカノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(10:0 Lyso PC)、
1-ウンデカノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(11:0 Lyso PC)、
1-ラウロイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(12:0 Lyso PC)、
1-トリデカノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(13:0 Lyso PC)、
1-ミリストイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(14:0 Lyso PC)、
1-ペンタデカノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(15:0
Lyso PC)、
1-パルミトイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(16:0 Lyso PC)、
1-ヘプタデカノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(17:0
Lyso PC)、
1-ステアロイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(18:0 Lyso PC)、
1-オレオイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(18:1 Lyso PC)、
1-ノナデカノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(19:0 Lyso PC)、
1-アラキドイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(20:0 Lyso PC)、
1-ベヘノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(22:0 Lyso PC)、
1-リグノセロイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(24:0 Lyso PC)、
1-ヘキサコサノイル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリン(26:0
Lyso PC)、
1-ミリストイル-2-ヒドロキシ-sn-グリセロ-3-ホスホエタノールアミン(14:0 Lyso PE)、
1-パルミトイル-2-ヒドロキシ-sn-グリセロ-3-ホスホエタノールアミン(16:0 Lyso PE)、
1-ステアロイル-2-ヒドロキシ-sn-グリセロ-3-ホスホエタノールアミン(18:0 Lyso PE)、
1-オレオイル-2-ヒドロキシ-sn-グリセロ-3-ホスホエタノールアミン(18:1 Lyso PE)、
1-ヘキサデシル-sn-グリセロ-3-ホスホコリン(C16 Lyso PC)、及びそれらのいずれかの組合せ。
いくつかの実施形態においては、本明細書に開示される医薬組成物の脂質組成物は、MPPC、MSPC、PMPC、PSPC、SMPC、SPPC、及びそれらのいずれかの組合せからなる群より選択される少なくとも1つの非対称性のリン脂質を含む。いくつかの実施形態においては、非対称性のリン脂質は、1-ミリストイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(MSPC)である。
いくつかの実施形態においては、本明細書に開示される脂質組成物は、1つ以上の対称性のリン脂質、1つ以上の非対称性のリン脂質、またはそれらの組合せを含んでもよい。多数のリン脂質が存在する場合、それらは、等モル比で存在しても、または非等モル比で存在してもよい。
1つの実施形態において、本明細書に開示される医薬組成物の脂質組成物は、脂質組成物中で、約1モル%~約20モル%、約5モル%~約20モル%、約10モル%~約20モル%、約15モル%~約20モル%、約1モル%~約15モル%、約5モル%~約15モル%、約10モル%~約15モル%、約5モル%~約10モル%の範囲であるリン脂質(例えば、MSPC)の総量を含む。1つの実施形態において、リン脂質の量は、脂質組成物中で約8モル%~約15モル%である。1つの実施形態において、リン脂質(例えば、MSPC)の量は、脂質組成物中で約10モル%である。
いくつかの態様では、特定のリン脂質(例えば、MSPC)の量は、脂質組成物中で、少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19または20モル%である。
B.四級アミン化合物
本明細書に開示される医薬組成物の脂質組成物は、1つ以上の四級アミン化合物(例えば、DOTAP)を含んでもよい。「四級アミン化合物」という用語は、1つ以上の四級アミン基(例えば、トリアルキルアミノ基)を有し、永続的に正電荷を有し、塩の形態で存在する化合物を含むために使用される。例えば、1つ以上の四級級アミン基は、脂質またはポリマー(例えば、PEG)中に存在し得る。いくつかの実施形態においては、四級アミン化合物は、(1)四級アミン基、ならびに(2)(i)直鎖または分枝鎖の飽和または不飽和の炭化水素鎖、及び(ii)任意選択で四級アミン基と炭化水素鎖との間にエーテル、エステル、カルボニル、またはケタール結合を含む少なくとも1つの疎水性尾部基を含む。いくつかの実施形態においては、四級アミン基は、トリメチルアンモニウム基であってもよい。いくつかの実施形態においては、四級アミン化合物は、2つの同一の炭化水素鎖を含む。いくつかの実施形態においては、四級アミン化合物は、2つの異なる炭化水素鎖を含む。
いくつかの実施形態においては、本明細書に開示される医薬組成物の脂質組成物は、少なくとも1つの四級アミン化合物を含む。四級アミン化合物は、以下からなる非限定的な群から選択され得る、
1,2-ジオレオイル-3-トリメチルアンモニウム-プロパン(DOTAP)、
N-[1-(2,3-ジオレオイルオキシ)プロピル]-N,N,N-トリメチルアンモニウムクロライド(DOTMA)、
1-[2-(オレオイルオキシ)エチル]-2-オレイル-3-(2-ヒドロキシエチル)イミダゾリニウムクロライド(DOTIM)、
2,3-ジオレイルオキシ-N-[2(スペルミンカルボキサミド)エチル]-N,N-ジメチル-1-プロパンアミニウムトリフルオロアセテート(DOSPA)、
N,N-ジステアリル-N,N-ジメチルアンモニウムブロミド(DDAB)、
N-(1,2-ジミリストイルオキシプロパ-3-イル)-N,N-ジメチル-N-ヒドロキシエチルアンモニウムブロミド(DMRIE)、
N-(1,2-ジオレオイルオキシプロパ-3-イル)-N,N-ジメチル-N-ヒドロキシエチルアンモニウムブロミド(DORIE)、
N,N-ジオレイル-N,N-ジメチルアンモニウムクロライド(DODAC)、
1,2-ジラウロイル-sn-グリセロ-3-エチルホスホコリン(DLePC)、
1,2-ジステアロイル-3-トリメチルアンモニウム-プロパン(DSTAP)、
1,2-ジパルミトイル-3-トリメチルアンモニウム-プロパン(DPTAP)、
1,2-ジリノレオイル-3-トリメチルアンモニウム-プロパン(DLTAP)、
1,2-ジミリストイル-3-トリメチルアンモニウム-プロパン(DMTAP)
1,2-ジステアロイル-sn-グリセロ-3-エチルホスホコリン(DSePC)
1,2-ジパルミトイル-sn-グリセロ-3-エチルホスホコリン(DPePC)、
1,2-ジミリストイル-sn-グリセロ-3-エチルホスホコリン(DMePC)、
1,2-ジオレオイル-sn-グリセロ-3-エチルホスホコリン(DOePC)、
1,2-ジ-(9Z-テトラデセノイル)-sn-グリセロ-3-エチルホスホコリン(14:1 EPC)、
1-パルミトイル-2-オレオイル-sn-グリセロ-3-エチルホスホコリン(16:0-18:1 EPC)、
及びそれらのいずれかの組合せ。
1つの実施形態において、四級アミン化合物は、1,2-ジオレオイル-3-トリメチルアンモニウム-プロパン(DOTAP)である。
四級アミン化合物、例えば、その全体が参照によって本明細書に組み込まれる米国特許出願公開番号第2013/0245107及び米国特許出願公開第2014/0363493号、米国特許番号第8,158,601号、及び国際公開番号WO2015/123264及びWO2015/148247に記載される四級アミン化合物は、当該技術分野において既知である。
1つの実施形態において、本明細書に開示される脂質組成物中の四級アミン化合物(例えば、DOTAP)の量は、約0.01モル%~約20モル%の範囲である。
1つの実施形態において、本明細書に開示される脂質組成物中の四級アミン化合物(例えば、DOTAP)の量は、約0.5モル%~約20モル%、約0.5モル%~約15モル%、約0.5モル%~約10モル%、約1モル%~約20モル%、約1モル%~約15モル%、約1モル%~約10モル%、約2モル%~約20モル%、約2モル%~約15モル%、約2モル%~約10モル%、約3モル%~約20モル%、約3モル%~約15モル%、約3モル%~約10モル%、約4モル%~約20モル%、約4モル%~約15モル%、約4モル%~約10モル%、約5モル%~約20モル%、約5モル%~約15モル%、約5モル%~約10モル%、約6モル%~約20モル%、約6モル%~約15モル%、約6モル%~約10モル%、約7モル%~約20モル%、約7モル%~約15モル%、約7モル%~約10モル%、約8モル%~約20モル%、約8モル%~約15モル%、約8モル%~約10モル%、約9モル%~約20モル%、約9モル%~約15モル%、約9モル%~約10モル%の範囲である。
1つの実施形態において、本明細書に開示される脂質組成物中の四級アミン化合物(例えば、DOTAP)の量は、約5モル%~約10モル%の範囲である。
1つの実施形態において、本明細書に開示される脂質組成物中の四級アミン化合物(例えば、DOTAP)の量は、約5モル%である。1つの実施形態において、本明細書に開示される脂質組成物中の四級アミン化合物(例えば、DOTAP)の量は、約10モル%である。
いくつかの実施形態においては、四級アミン化合物(例えば、DOTAP)の量は、本明細書に開示される脂質組成物中で、少なくとも約0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、11.5、12、12.5、13、13.5、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5または20モル%である。
いくつかの実施形態においては、本明細書に開示される医薬組成物の脂質組成物は、式(I)の化合物を含む。1つの実施形態において、式(I)の化合物(例えば、化合物18、25、26または48)対、四級アミン化合物(例えば、DOTA)のモル比は、約100:1~約2.5:1である。1つの実施形態において、式(I)の化合物(例えば、化合物18、25、26または48)対、四級アミン化合物(例えば、DOTAP)のモル比は、約90:1、約80:1、約70:1、約60:1、約50:1、約40:1、約30:1、約20:1、約15:1、約10:1、約9:1、約8:1、約7:1、約6:1、約5:1、または約2.5:1である。1つの実施形態において、本明細書に開示される脂質組成物中の式(I)の化合物(例えば、化合物18、25、26または48)対、四級アミン化合物(例えば、DOTAP)のモル比は、約10:1である。
いくつかの態様では、本明細書に開示される医薬組成物の脂質組成物は、四級アミン化合物を含まない。いくつかの態様では、本明細書に開示される医薬組成物の脂質組成物は、DOTAPを含まない。
C、構造脂質
本明細書に開示される医薬組成物の脂質組成物は、1つ以上の構造脂質を含んでもよい。本明細書において用いる場合、「構造脂質」とは、ステロールを指し、及びまた脂質含有ステロール部分を指す。いくつかの実施形態においては、構造脂質は、コレステロール、フェコステロール、シトステロール、エルゴステロール、カンペステロール、スチグマステロール、ブラシカステロール、トマチジン、トマチン、ウルソル酸、アルファ-トコフェロール、及びそれらの混合物からなる群より独立して選択される。いくつかの実施形態においては、この構造脂質はコレステロールである。
1つの実施形態において、本明細書に開示される医薬組成物の脂質組成物中の構造脂質(例えば、コレステロールのようなステロール)の量は、約20モル%~約60モル%、約25モル%~約55モル%、約30モル%~約50モル%、または約35モル%~約45モル%の範囲である。
1つの実施形態において、本明細書に開示される脂質組成物中の構造脂質(例えば、コレステロールのようなステロール)の量は、約25モル%~約30モル%、約30モル%~約35モル%、または約35モル%~約40モル%の範囲である。
1つの実施形態において、本明細書に開示される脂質組成物中の構造脂質(例えば、コレステロールのようなステロール)の量は、約23.5モル%、約28.5モル%、約33.5モル%、または約38.5モル%である。
いくつかの実施形態においては、本明細書に開示される脂質組成物中の構造脂質(例えば、コレステロールのようなステロール)の量は、少なくとも約20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、または60モル%である。
いくつかの態様では、開示される腫瘍内送達のための医薬組成物の脂質組成物の成分は、コレステロールを含まない。
D.ポリエチレングリコール(PEG)-脂質
本明細書に開示される医薬組成物の脂質組成物は、1つ以上のポリエチレングリコール(PEG)脂質を含んでもよい。
本明細書において用いる場合、「PEG-脂質」という用語は、ポリエチレングリコール(PEG)修飾脂質を指す。PEG-脂質の非限定的な例としては、PEG修飾ホスファチジルエタノールアミン及びホスファチジン酸、PEG-セラミドコンジュゲート(例えば、PEG-CerC14またはPEG-CerC20)、PEG修飾ジアルキルアミン及びPEG修飾1,2-ジアシルオキシプロパン-3-アミンが挙げられる。このような脂質はまた、PEG化脂質とも呼ばれる。例えば、PEG脂質は、PEG-c-DOMGであっても、PEG-DMGであっても、PEG-DLPEであっても、PEG-DMPEであっても、PEG-DPPCであっても、またはPEG-DSPE脂質であってもよい。
いくつかの実施形態においては、上記PEG-脂質としては限定するものではないが、1,2-ジミリストイル-sn-グリセロールメトキシポリエチレングリコール(PEG-DMG)、1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン-N-[アミノ(ポリエチレングリコール)](PEG-DSPE)、PEG-ジステリルグリセロール(PEG-DSG)、PEG-ジパルメトレイル、PEG-ジオレイル、PEG-ジステアリル、PEG-ジアシルグリカミド(PEG-DAG)、PEG-ジパルミトイルホスファチジルエタノールアミン(PEG-DPPE)、またはPEG-l,2-ジミリストイルオキシルプロピル-3-アミン(PEG-c-DMA)が挙げられる。
1つの実施形態において、上記PEG-脂質は、PEG修飾ホスファチジルエタノールアミン、PEG修飾ホスファチジン酸、PEG修飾セラミド、PEG修飾ジアルキルアミン、PEG修飾ジアシルグリセロール、PEG修飾ジアルキルグリセロール、及びそれらの混合物からなる群より選択される。
いくつかの実施形態においては、上記PEG-脂質の脂質部分としては、約C14~約C22、好ましくは約C14~約C16の長さを有するものが挙げられる。いくつかの実施形態においては、PEG部分、例えば、mPEG-NH2は、約1000、2000、5000、10,000、15,000または20,000ダルトンというサイズを有する。1つの実施形態において、PEG-脂質は、PEG2k-DMGである。
1つの実施形態において、本明細書に記載される脂質ナノ粒子は、非拡散性PEGであるPEG脂質を含んでもよい。非拡散性PEG非限定的な例としては、PEG-DSG及びPEG-DSPEが挙げられる。
PEG-脂質、例えば、その全体が参照によって本明細書に組み込まれる、米国特許第8158601号及び国際公開番号WO2015/130584に記載されるPEG-脂質は当該技術分野において既知である。
1つの実施形態において、本明細書に開示される医薬組成物の脂質組成物中のPEG-脂質の量は、約0.1モル%~約5モル%、約0.5モル%~約5モル%、約1モル%~約5モル%、約1.5モル%~約5モル%、約2モル%~約5モル%モル%、約0.1モル%~約4モル%、約0.5モル%~約4モル%、約1モル%~約4モル%、約1.5モル%~約4モル%、約2モル%~約4モル%、約0.1モル%~約3モル%、約0.5モル%~約3モル%、約1モル%~約3モル%、約1.5モル%~約3モル%、約2モル%~約3モル%、約0.1モル%~約2モル%、約0.5モル%~約2モル%、約1モル%~約2モル%、約1.5モル%~約2モル%、約0.1モル%~約1.5モル%、約0.5モル%~約1.5モル%、または約1モル%~約1.5モル%の範囲である。
1つの実施形態において、本明細書に開示される脂質組成物中のPEG-脂質の量は、約1.5モル%である。
1つの実施形態において、本明細書に開示される脂質組成物中のPEG-脂質の量は、少なくとも約0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、または5モル%である。
いくつかの態様では、本明細書に開示される医薬組成物の脂質組成物は、PEG-脂質を含まない。
いくつかの実施形態においては、本明細書に開示される脂質組成物は、イオン性アミノ脂質、例えば、式(I)の化合物、及び非対称性のリン脂質を含む。いくつかの実施形態においては、脂質組成物は、化合物18及びMSPCを含む。
いくつかの実施形態においては、本明細書に開示される脂質組成物は、イオン性アミノ脂質、例えば、式(I)の化合物、及び四級アミン化合物を含む。いくつかの実施形態においては、この脂質組成物は、化合物18及びDOTAPを含む。
いくつかの実施形態においては、本明細書に開示される脂質組成物は、イオン性アミノ脂質、例えば、式(I)の化合物、非対称性のリン脂質、及び四級アミン化合物を含む。いくつかの実施形態においては、脂質組成物は、化合物18、MSPC及びDOTAPを含む。
1つの実施形態において、上記脂質組成物は、約50モル%の式(I)の化合物(例えば、化合物18、25、26または48)、約10モル%のDSPC、またはMSPC、約33.5モル%のコレステロール、約1.5モル%のPEG-DMG、及び約5モル%のDOTAPを含む。1つの実施形態において、この脂質組成物は、約50モル%の式(I)の化合物(例えば、化合物18、25、26または48)、約10モル%のDSPC、またはMSPC、約28.5モル%のコレステロール、約1.5モル%のPEG-DMG、及び約10モル%のDOTAPを含む。
上記脂質ナノ粒子の成分は、望ましい転帰に基づいてポリヌクレオチドの最適な送達のために調整してもよい。非限定的な例として、脂質ナノ粒子は、40~60モル%のイオン性アミノ脂質(例えば、式(I)の化合物)、8~16モル%のリン脂質、30~45モル%のコレステロール、1~5モル%のPEG脂質、及び任意選択で1~15モル%の四級アミン化合物を含んでもよい。
いくつかの実施形態においては、上記脂質ナノ粒子は、45~65モル%のイオン性アミノ脂質(例えば、式(I)の化合物)、5~10モル%リン脂質、25~40モル%のコレステロール、0.5~5モル%のPEG脂質、及び任意選択で1~15モル%の四級アミン化合物を含んでもよい。
核酸脂質粒子の非限定的な例は、その全体が参照によって本明細書に組み込まれる、米国特許出願公開番号第20140121263号に開示される。
E.他のイオン性アミノ酸脂質
本明細書に開示される医薬組成物の脂質組成物は、式(I)による脂質に加えて1つ以上のイオン性アミノ脂質を含んでもよい。
イオン性脂質は、以下からなる非限定的な群から選択され得る、
3-(ジドデシルアミノ)-N1,N1,4-トリドデシル-1-ピペラジンエタンアミン(KL10)、
N1-[2-(ジドデシルアミノ)エチル]-N1,N4,N4-トリドデシル-1,4-ピペラジンジエタンアミン(KL22)、
14,25-ジトリデシル-15,18,21,24-テトラアザ-オクタトリアコンタン(KL25)、
1,2-ジリノレイルオキシ-N,N-ジメチルアミノプロパン(DLin-DMA)、2,2-ジリノレイル-4-ジメチルアミノメチル-[1,3]-ジオキソラン(DLin-K-DMA)、
ヘプタトリアコンタ-6,9,28,31-テトラエン-19-イル 4-(ジメチルアミノ)ブタノエート(DLin-MC3-DMA)、
2,2-ジリノレイル-4-(2-ジメチルアミノエチル)-[1,3]-ジオキソラン(DLin-KC2-DMA)、
1,2-ジオレイルオキシ-N,N-ジメチルアミノプロパン(DODMA)、(13Z,165Z)-N,N-ジメチル-3-ノニドコサ-13-16-ジエン-1-アミン(L608)、
2-({8-[(3β)-コレステ-5-エン-3-イルオキシ]オクチル}オキシ)-N,N-ジメチル-3-[(9Z,12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]プロパン-1-アミン(オクチル-CLinDMA)、
(2R)-2-({8-[(3β)-コレステ-5-エン-3-イルオキシ]オクチル}オキシ)-N,N-ジメチル-3-[(9Z,12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]プロパン-1-アミン(オクチル-CLinDMA(2R))、及び(2S)-2-({8-[(3β)-コレステ-5-エン-3-イルオキシ]オクチル}オキシ)-N,N-ジメチル-3-[(9Z,12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]プロパン-1-アミン(オクチル-CLinDMA(2S))。これらに加えて、イオン性アミノ脂質はまた、環状アミン基を含む脂質であってもよい。
イオン性脂質はまた、その全体が参照によって本明細書に組み込まれる、国際公開番号WO2015/199952(米国特許出願公開第20150376115号も参照のこと)に開示される化合物も含んでもよい。例えば、イオン性アミノ脂質としては、限定するものではないが、以下が挙げられる:
及びそれらのいずれかの組合せ。
F.他の脂質組成物成分
本明細書に開示される医薬組成物の脂質組成物は、上記のものに加えて、1つ以上の成分を含んでもよい。例えば、脂質組成物は、1つ以上の透過性増強分子、炭化水素、ポリマー、表面改変剤(例えば、サーファクタント)、または他の成分を含んでもよい。例えば、透過性増強分子は、米国特許出願公開番号2005/0222064に記載の分子であってもよい。炭水化物は、単糖(例えば、グルコース)及び多糖類(例えば、グリコーゲンならびにその誘導体及び類似体)を含んでもよい。脂質組成物は、緩衝液、例えば、限定するものではないが、7のpHで、クエン酸またはリン酸の塩及び/または糖を含んでもよい。塩及び/または糖は、等張性のために本明細書に記載される製剤中に含まれてもよい。
ポリマーは、本明細書に開示される医薬組成物を封入するかまたは部分的に封入するために含まれてもよいし、及び/または用いられてもよい(例えば、脂質ナノ粒子形態中の医薬組成物)。ポリマーは、生分解性であっても、及び/または生体適合性であってもよい。ポリマーは、限定するものではないが、ポリアミン、ポリエーテル、ポリアミド、ポリエステル、ポリカルバメート、ポリ尿素、ポリカーボネート、ポリスチレン、ポリイミド、ポリスルホン、ポリウレタン、ポリアセチレン、ポリエチレン、ポリエチレンイミン、ポリイソシアネート、ポリアクリレート、ポリメタクリレート、ポリアクリロニトリル、及びポリアリレートから選択され得る。
脂質組成物とポリヌクレオチドとの間の比は、約10:1~約60:1(wt/wt)の範囲である。
いくつかの実施形態においては、脂質組成物とポリヌクレオチドとの間の比は、約10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、21:1、22:1、23:1、24:1、25:1、26:1、27:1、28:1、29:1、30:1、31:1、32:1、33:1、34:1、35:1、36:1、37:1、38:1、39:1、40:1、41:1、42:1、43:1、44:1、45:1、46:1、47:1、48:1、49:1、50:1、51:1、52:1、53:1、54:1、55:1、56:1、57:1、58:1、59:1または60:1(wt/wt)であり得る。いくつかの実施形態においては、脂質組成物対、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドのwt/wt比は、約20:1または約15:1である。
いくつかの実施形態においては、本明細書に開示される医薬組成物は、2つ以上のポリペプチド、例えば、2つ、3つまたはそれ以上のポリペプチドを含んでもよい。例えば、本明細書に開示される医薬組成物は、2つ、3つまたはそれ以上のポリヌクレオチド(例えば、mRNA)を含んでもよい。
1つの実施形態において、本明細書に記載される脂質ナノ粒子は、ポリヌクレオチド(例えば、mRNA)を、脂質:ポリヌクレオチドの重量比が5:1、10:1、15:1、20:1、25:1、30:1、35:1、40:1、45:1、50:1、55:1、60:1もしくは70:1で、またはある範囲、もしくは限定するものではないが、5:1~約10:1、約5:1~約15:1、約5:1~約20:1、約5:1~約25:1、約5:1~約30:1、約5:1~約35:1、約5:1~約40:1、約5:1~約45:1、約5:1~約50:1、約5:1~約55:1、約5:1~約60:1、約5:1~約70:1、約10:1~約15:1、約10:1~約20:1、約10:1~約25:1、約10:1~約30:1、約10:1~約35:1、約10:1~約40:1、約10:1~約45:1、約10:1~約50:1、約10:1~約55:1、約10:1~約60:1、約10:1~約70:1、約15:1~約20:1、約15:1~約25:1,約15:1~約30:1、約15:1~約35:1、約15:1~約40:1、約15:1~約45:1、約15:1~約50:1、約15:1~約55:1、約15:1~約60:1もしくは約15:1~約70:1などの任意のこれらの範囲で含んでもよい。
1つの実施形態において、本明細書に記載される脂質ナノ粒子は、およそ0.1mg/ml~2mg/ml、例えば、限定するものではないが、0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml、0.6mg/ml、0.7mg/ml、0.8mg/ml、0.9mg/ml、1.0mg/ml、1.1mg/ml、1.2mg/ml、1.3mg/ml、1.4mg/ml、1.5mg/ml、1.6mg/ml、1.7mg/ml、1.8mg/ml、1.9mg/ml、2.0mg/mlまたは2.0mg/ml超の濃度でポリヌクレオチドを含んでもよい。
1つの実施形態において、本明細書に記載されるポリヌクレオチド及び脂質ナノ粒子を含む製剤は、本明細書に記載されるポリヌクレオチド(例えば、mRNA)の0.15mg/ml~2mg/mlを含んでもよい。いくつかの実施形態においては、この製剤はさらに、10mMのクエン酸塩緩衝液を含んでもよく、この製剤はさらに、10%(w/w)のスクロース(例えば、少なくとも1%(w/w)、少なくとも2%(w/w)/、少なくとも3%(w/w)、少なくとも4%(w/w)、少なくとも5%(w/w)、少なくとも6%(w/w)、少なくとも7%(w/w)、少なくとも8%(w/w)、少なくとも9%(w/w)または10%(w/w))を含んでもよい。
ナノ粒子組成物
いくつかの実施形態においては、本明細書に記載される医薬組成物は、脂質ナノ粒子(LNP)として製剤化される。従って、本開示はまた、(i)本明細書に記載されるような式(I)の化合物などの送達剤を含む脂質組成物、及び(ii)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを含むナノ粒子組成物も提供する。このようなナノ粒子組成物では、本明細書に開示される脂質組成物は、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを封入し得る。
1つの特定の実施形態では、(i)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、別々に(すなわち、ナノ粒子の2つの集団中で)封入される。別の特定の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、別々に(すなわち、ナノ粒子の3つの集団中で)封入される。1つの特定の実施形態では、(i)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド及びIL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、(ii)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、または(iii)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、一緒に(すなわち、単一集団のナノ粒子中で)封入される。別の特定の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチドまたはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチド一緒に(すなわち、単一集団のナノ粒子中で)封入する。
ナノ粒子組成物は典型的には、およそマイクロメートル以下のサイズにされ、脂質二分子膜を含んでもよい。ナノ粒子組成物は、脂質ナノ粒子(LNP)、リポソーム(例えば、脂質小胞)、及びリポプレックスを包含する。例えば、ナノ粒子組成物は、500nm以下の直径を有する脂質二分子膜を有するリポソームであってもよい。
ナノ粒子組成物としては、例えば、脂質ナノ粒子(LNP)、リポソーム、及びリポプレックスが挙げられる。いくつかの実施形態においては、ナノ粒子組成物は、1つ以上の脂質二分子膜を含む小胞である。特定の実施形態では、ナノ粒子組成物は、水性区画で分けられた2つ以上の同心二分子膜を含む。脂質二分子膜は、お互いに官能化されるか、及び/または架橋されてもよい。脂質二分子膜は、1つ以上のリガンド、タンパク質、またはチャネルを含んでもよい。
本開示のナノ粒子組成物は、式(I)による少なくとも1つの化合物を含む。例えば、ナノ粒子組成物は、1つ以上の化合物1-147、または1つ以上の化合物1-232を含んでもよい。ナノ粒子組成物はまた、様々な他の成分を含んでもよい。例えば、ナノ粒子組成物は、式(I)、(II)、または(IIa)-(IId)による脂質に加えて1つ以上の他の脂質、例えば、(i)少なくとも1つのリン脂質、(ii)少なくとも1つの四級アミン化合物、(iii)少なくとも1つの構造脂質、(iv)少なくとも1つのPEG-脂質、または(v)それらのいずれかの組合せを含んでもよい。
いくつかの実施形態においては、上記ナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)を含む。いくつかの実施形態においては、ナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)及びリン脂質(例えば、DSPC、またはMSPC)を含む。いくつかの実施形態においては、ナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)、リン脂質(例えば、DSPC、またはMSPC)、及び四級アミン化合物(例えば、DOTAP)を含む。いくつかの実施形態においては、ナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)、及び四級アミン化合物(例えば、DOTAP)を含む。
いくつかの実施形態においては、上記ナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)からなるか、または本質的にそれらからなる、脂質組成物を含む。いくつかの実施形態においては、このナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)及びリン脂質(例えば、DSPC、またはMSPC)からなるか、または本質的にそれらからなる、脂質組成物を含む。いくつかの実施形態においては、このナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)、リン脂質(例えば、DSPC、またはMSPC)、及び四級アミン化合物(例えば、DOTAP)からなるか、または本質的にそれらからなる、脂質組成物を含む。いくつかの実施形態においては、このナノ粒子組成物は、式(I)の化合物(例えば、化合物18、25、26または48)、及び四級アミン化合物(例えば、DOTAP)からなるか、または本質的にそれらからなる、脂質組成物を含む。
1つの実施形態において、上記ナノ粒子組成物は、(1)約50モル%の式(I)の化合物(例えば、化合物18、25、26または48);約10モル%のDSPC、またはMSPC;約33.5モル%のコレステロール;約1.5モル%のPEG-DMG(例えば、PEG2k-DMG);約5モル%のDOTAPを含む、脂質組成物;及び(2)ポリヌクレオチドを含む。
1つの実施形態において、上記ナノ粒子組成物は、(1)約50モル%の式(I)の化合物(例えば、化合物18、25、26または48);約10モル%のDSPC、またはMSPC;約28.5モル%のコレステロール;約1.5モル%のPEG-DMG(例えば、PEG2k-DMG);約10モル%のDOTAPを含む、脂質組成物;及び(2)ポリヌクレオチドを含む。
1つの実施形態において、上記ナノ粒子組成物は、(1)約50モル%の式(I)の化合物(例えば、化合物18、25、26または48);約10モル%のDSPC、またはMSPC;約23.5モル%のコレステロール;約1.5モル%のPEG-DMG(例えば、PEG2k-DMG);約15モル%のDOTAPを含む、脂質組成物;及び(2)ポリヌクレオチドを含む。
本明細書に一般的に定義されているとおり、「脂質」という用語は、疎水性または両親媒性の特性を有する低分子を指す。脂質は、天然に存在してもよいし、または合成であってもよい。脂質のクラスの例としては、限定するものではないが、脂肪、ワックス、ステロール含有代謝物、ビタミン、脂肪酸、グリセロ脂質、グリセロリン脂質、スフィンゴ脂質、糖脂質、及びポリケチド、及びプレノール脂質が挙げられる。いくつかの場合には、いくつかの脂質の両親媒性の特性によって、それらは、リポソーム、小胞、または膜を水性媒体中で形成するようになる。
いくつかの実施形態においては、脂質ナノ粒子(LNP)は、イオン性脂質を含んでもよい。本明細書において用いる場合、「イオン性脂質」という用語は、当該分野においてその通常の意味を有し、かつ1つ以上の荷電部分を含む脂質を指す場合がある。いくつかの実施形態においては、イオン性脂質は、正に荷電されてもよいし、または負に荷電されてもよい。イオン性脂質は、正に荷電されてもよく、この場合、この脂質は、「カチオン性脂質」と呼ばれてもよい。例えば、イオン性分子は、イオン性アミノ脂質と呼ばれるアミン基を含んでもよい。本明細書において用いる場合、「荷電部分」とは、正規の荷電、例えば、単価(+1、または-1)、二価(+2、または-2)、三価(+3、または-3)などを保持する化学基である。この荷電された部分は、アニオン性(すなわち、負に荷電された)であっても、またはカチオン性(すなわち、正に荷電された)であってもよい。正に荷電された部分の例としては、アミン基(例えば、一級、二級、及び/または三級のアミン)、アンモニウム基、ピリジニウム基、グアニジン基、及びイミジゾリウム基が挙げられる。特定の実施形態では、荷電された部分は、アミン基を含む。負に荷電された基またはその前駆体の例としては、カルボキシレート基、スルホン酸基、硫酸基、ホスホン酸基、リン酸基、ヒドロキシル基などが挙げられる。荷電された部分の電荷は、ある場合には、環境条件とともに変化し得、例えば、pHの変化は、その部分の荷電を変化し得るか、及び/またはその部分を荷電させるか、非荷電し得る。一般には、その分子の電荷密度は、任意選択で選択され得る。
「荷電した」または「荷電した部分」という用語は、分子上の「部分的負電荷」または「部分的正電荷」を意味しないことが理解されるべきである。「部分的負電荷」及び「部分的正電荷」という用語は、当技術分野で通常の意味を有する。官能基が、電子密度が結合の1つの原子に向かって引っ張られるように極性化される結合を含み、その原子上に部分的負電荷を生成する場合、「部分負電荷」が生じる場合がある。当業者は、このように分極し得る結合を一般に認識する。
いくつかの実施形態においては、イオン性脂質は、イオン性アミノ脂質であり、当技術分野で「イオン性カチオン性脂質」と呼ばれることもある。1つの実施形態において、イオン性アミノ脂質は、リンカー構造体を介して連結される、正に荷電した親水性の頭部及び疎水性の尾部を有してもよい。
ナノ粒子組成物は、様々な方法によって特徴付けられ得る。例えば、ナノ粒子組成物の形態及びサイズ分布を調べるために、顕微鏡法(例えば、透過型電子顕微鏡法または走査型電子顕微鏡法)を使用してもよい。動的光散乱法または電位差測定法(例えば、電位差滴定法)を使用して、ゼータ電位を測定してもよい。動的光散乱を利用して粒径を決定してもよい。Zetasizer Nano ZS(Malvern Instruments Ltd、Malvern、Worcestershire、UK)のような装置を使用して、粒径、多分散性指数、及びゼータ電位などのナノ粒子組成物の複数の特性を測定してもよい。
ナノ粒子のサイズは、限定されるものではないが、炎症などの生物学的反応に対抗することを補助する場合があり、またはポリヌクレオチドの生物学的効果を増大する場合もある。
本明細書で使用する場合、ナノ粒子組成物の文脈における「サイズ」または「平均サイズ」とは、ナノ粒子組成物の平均直径を指す。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、脂質ナノ粒子中で製剤化される。いくつかの態様では、脂質ナノ粒子は、約10~約100nm、例えば、限定するものではないが、約10~約20nm、約10~約30nm、約10~約40nm、約10~約50nm、約10~約60nm、約10~約70nm、約10~約80nm、約10~約90nm、約20~約30nm、約20~約40nm、約20~約50nm、約20~約60nm、約20~約70nm、約20~約80nm、約20~約90nm、約20~約100nm、約30~約40nm、約30~約50nm、約30~約60nm、約30~約70nm、約30~約80nm、約30~約90nm、約30~約100nm、約40~約50nm、約40~約60nm、約40~約70nm、約40~約80nm、約40~約90nm、約40~約100nm、約50~約60nm、約50~約70nm、約50~約80nm、約50~約90nm、約50~約100nm、約60~約70nm、約60~約80nm、約60~約90nm、約60~約100nm、約70~約80nm、約70~約90nm、約70~約100nm、約80~約90nm、約80~約100nm及び/または約90~約100nmの直径を有する。
1つの実施形態において、ナノ粒子は、約10~500nmの直径を有する。1つの実施形態において、ナノ粒子は、100nm超、150nm超、200nm超、250nm超、300nm超、350nm超、400nm超、450nm超、500nm超、550nm超、600nm超、650nm超、700nm超、750nm超、800nm超、850nm超、900nm超、950nm超、または1000nm超の直径を有する。
いくつかの実施形態においては、ナノ粒子組成物の最大寸法は、1μm以下(例えば、1μm、900nm、800nm、700nm、600nm、500nm、400nm、300nm、200nm、175nm、150nm、125nm、100nm、75nm、50nm以下)である。
ナノ粒子組成物は、相対的に均一であり得る。多分散性指数は、ナノ粒子組成物の均一性、例えば、ナノ粒子組成物の粒径分布を指すために使用され得る。小さい(例えば、0.3未満)多分散性指数は一般に、狭い粒径分布を指す。ナノ粒子組成物は、約0~約0.25、例えば、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.20、0.21、0.22、0.23、0.24、または0.25の多分散性指数を有し得る。いくつかの実施形態においては、本明細書に開示されるナノ粒子組成物の多分散性指数は、約0.10~約0.20であってもよい。
ナノ粒子組成物のゼータ電位を使用して、組成物の界面動電位を示し得る。例えば、ゼータ電位は、ナノ粒子組成物の表面電荷を表し得る。比較的高電荷の種が細胞、組織、及び体内の他の要素と望ましくない相互作用をする可能性があるため、比較的低電荷の正または負のナノ粒子組成物が一般に望ましい。いくつかの実施形態においては、本明細書に開示されるナノ粒子組成物のゼータ電位は、約-10mV~約+20mV、約-10mV~約+15mV、約10mV~約+10mV、約-10mV~約+5mV、約-10mV~約0mV、約-10mV~約-5mV、約-5mV~約+20mV、約-5mV~約+15mV、約-5mV~約+10mV、約-5mV~約+5mV、約-5mV~約0mV、約0mV~約+20mV、約0mV~約+15mV、約0mV~約+10mV、約0mV~約+5mV、約+5mV~約+20mV、約+5mV~約+15mV、または約+5mV~約+10mVであり得る。
いくつかの実施形態においては、脂質ナノ粒子のゼータ電位は、約0mV~約100mV、約0mV~約90mV、約0mV~約80mV、約0mV~約70mV、約0mV~約60mV、約0mV~約50mV、約0mV~約40mV、約0mV~約30mV、約0mV~約20mV、約0mV~約10mV、約10mV~約100mV、約10mV~約90mV、約10mV~約80mV、約10mV~約70mV、約10mV~約60mV、約10mV~約50mV、約10mV~約40mV、約10mV~約30mV、約10mV~約20mV、約20mV~約100mV、約20mV~約90mV、約20mV~約80mV、約20mV~約70mV、約20mV~約60mV、約20mV~約50mV、約20mV~約40mV、約20mV~約30mV、約30mV~約100mV、約30mV~約90mV、約30mV~約80mV、約30mV~約70mV、約30mV~約60mV、約30mV~約50mV、約30mV~約40mV、約40mV~約100mV、約40mV~約90mV、約40mV~約80mV、約40mV~約70mV、約40mV~約60mV、及び約40mV~約50mVであってもよい。いくつかの実施形態においては、脂質ナノ粒子のゼータ電位は、約10mV~約50mV、約15mV~約45mV、約20mV~約40mV、及び約25mV~約35mVであってもよい。いくつかの実施形態においては、脂質ナノ粒子のゼータ電位は、約10mV、約20mV、約30mV、約40mV、約50mV、約60mV、約70mV、約80mV、約90mV、及び約100mVであってもよい。
ポリヌクレオチドの「封入効率」という用語は、提供された初期量に対して、調製後のナノ粒子組成物によって封入されるか、そうでなければそれと会合されるポリヌクレオチドの量を表す。本明細書で使用される場合、「封入」とは、完全な、実質的な、または部分的な囲い込み、閉じ込め、包囲、または包装を指す場合もある。
封入効率は望ましくは高い(例えば、100%に近い)。封入効率は、例えば、1つ以上の有機溶媒または界面活性剤を使用してナノ粒子組成物を破壊する前後のナノ粒子組成物を含有する溶液中のポリヌクレオチドの量を比較することによって測定され得る。
蛍光を使用して、溶液中の遊離のポリヌクレオチドの量を測定してもよい。本明細書に記載されるナノ粒子組成物に関しては、ポリヌクレオチドの封入効率は、少なくとも50%、例えば、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%であってもよい。いくつかの実施形態においては、封入効率は、少なくとも80%であってもよい。特定の実施形態では、封入効率は、少なくとも90%であってもよい。
本明細書に開示される医薬組成物中に存在するポリヌクレオチドの量は、ポリヌクレオチドのサイズ、所望の標的及び/または用途、またはナノ粒子組成物の他の特性ならびにポリヌクレオチドの特性などの多数の要因に依存し得る。
例えば、ナノ粒子組成物において有用なmRNAの量は、mRNAのサイズ(長さまたは分子量として表される)、配列及び他の特徴に依存し得る。ナノ粒子組成物中のポリヌクレオチドの相対量も変化し得る。
本開示の脂質ナノ粒子組成物中に存在する脂質組成物及びポリヌクレオチドの相対量は、効能及び忍容性の考慮に従って最適化され得る。ポリヌクレオチドとしてのmRNAを含む組成物では、N:P比は、有用な測定基準として有用であり得る。
ナノ粒子組成物のN:P比は、発現と耐容性の両方を制御するので、低いN:P比及び強い発現を有するナノ粒子組成物が望ましい。N:P比は、ナノ粒子組成物中の脂質対RNAの比によって変化する。
一般に、より低いN:P比が好ましい。1つ以上のRNA、脂質、及びその量は、約2:1~約30:1、例えば2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、12:1、14:1、16:1、18:1、20:1、22:1、24:1、26:1、28:1、または30:1のN:P比を提供するように選択され得る。特定の実施形態において、N:P比は、約2:1~約8:1であり得る。他の実施形態では、N:P比は、約5:1~約8:1である。特定の実施形態では、N:P比は、5:1~6:1である。1つの特定の態様において、N:P比は約5.67:1である。
ナノ粒子組成物を提供することに加えて、本開示はまた、ポリヌクレオチドを封入することを含む、脂質ナノ粒子を製造する方法を提供する。このような方法は、本明細書に開示される医薬組成物のいずれかを使用すること、及びページ : 295
当該技術分野において既知である脂質ナノ粒子の製造方法に従って脂質ナノ粒子を製造することを包含する。例えば、Wang(et al.2015)Adv.Drug Deliv.Rev.87:68-80;Silva et al.(2015)Curr.Pharm.Technol.16:940-954;Naseri et al.(2015)Adv.Pharm.Bull.5:305-13;Silva et al.(2015)Curr.Pharm.Biotechnol.16:291-302及びそこに引用されている参考文献を参照のこと。
いくつかの実施形態において、本開示のポリヌクレオチドは、脂質ナノ粒子中に製剤化され、ポリヌクレオチドは、表1に開示されるmRNAを含む。いくつかの実施形態において、本開示のポリヌクレオチドは、脂質ナノ粒子中に処方され、このポリヌクレオチドは、表1に記載される配列を含む。
脂質ナノ粒子製剤は典型的には、脂質、具体的には、イオン性アミノ脂質、例えば、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、またはジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)を含み、及びさらに天然の脂質、ステロール及び粒子の凝集を低減し得る分子、例えば、PEGまたはPEG修飾脂質を含む。
1つの実施形態において、脂質ナノ粒子製剤は、(i)2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)からなる群より選択される少なくとも1つの脂質;(ii)DSPC、DPPC、POPC、DOPE及びSMから選択される天然の脂質;(iii)ステロール、例えば、コレステロール;及び(iv)PEG-脂質、例えば、PEG-DMGまたはPEG-cDMAから(約20~60%イオン性アミノ脂質:5~25%の天然の脂質:25~55%のステロール;0.5~15%のPEG-脂質というモル比で)本質的になる。
1つの実施形態において、製剤としては、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択されるイオン性アミノ脂質をモル基準で約25%~約75%、例えば、モル基準で約35~約65%、約45~約65%、約60%、約57.5%、約50%または約40%含む。
1つの実施形態において、この製剤は、天然の脂質のモル基準で、約0.5%~約15%、例えば、モル基準で、約3~約12%、約5~約10%または約15%、約10%、または約7.5%を含む。例示的な天然の脂質としては、限定するものではないが、DSPC、POPC、DPPC、DOPE及びSMが挙げられる。1つの実施形態において、この製剤は、ステロールのモル基準で約5%~約50%(例えば、モル基準で約15~約45%、約20~約40%、約40%、約38.5%、約35%、または約31%)を含む。例示的なステロールは、コレステロールである。1つの実施形態において、この製剤は、モル基準で約0.5%~約20%のPEGまたはPEG修飾脂質(例えば、モル基準で約0.5~約10%、約0.5~約5%、約1.5%、約0.5%、約1.5%、約3.5%、または約5%)を含む。1つの実施形態において、PEGまたはPEG修飾脂質は、2,000Daという平均分子量のPEG分子を含む。他の実施形態では、このPEGまたはPEG修飾脂質は、2,000未満、例えば約1,500Da、約1,000Da、または約500Daの平均分子量のPEG分子を含む。例示的なPEG修飾脂質としては、限定するものではないが、PEG-ジステアロイルグリセロール(PEG-DMG)(本明細書ではまたPEG-C14またはC14-PEGともいう)、PEG-cDMA(さらにReyes et al.(2005)J.controlled Release 107:276-287で考察される)が挙げられる。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される25~75%のイオン性アミノ脂質、0.5~15%の天然の脂質、5~50%のステロール、及び0.5~20%のPEGまたはPEG修飾脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される35~65%のイオン性アミノ脂質、3~12%の天然の脂質、15~45%のステロール、及び0.5~10%のPEGまたはPEG修飾脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される45~65%のイオン性アミノ脂質、5~10%の天然の脂質、25~40%のステロール、及び0.5~10%のPEGまたはPEG修飾脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される約60%のイオン性アミノ脂質、約7.5%の天然の脂質、約31%のステロール、及び約1.5%のPEGまたはPEG修飾脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される約50%のイオン性アミノ脂質、約10%の天然の脂質、約38.5%のステロール、及び約1.5%のPEGまたはPEG修飾脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される約50%のイオン性アミノ脂質、約10%の天然の脂質、約35%のステロール、約4.5%または約5%のPEGまたはPEG修飾脂質、及び約0.5%の標的化脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される約40%のイオン性アミノ脂質、約15%の天然の脂質、約40%のステロール、及び約5%のPEGまたはPEG修飾脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノン-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオエート(L319)から選択される約57.2%のイオン性アミノ脂質、約7.1%の天然の脂質、約34.3%のステロール、及び約1.4%のPEGまたはPEG修飾脂質をモル基準で含む。
1つの実施形態において、本開示の製剤は、PEG-cDMA(PEG-cDMAは、さらに、Reyes et al.(2005)J.Controlled Release 107:276-287において考察される)であるPEG脂質から選択される約57.5%のイオン性アミノ脂質、約7.5%の天然の脂質、約31.5%のステロール、及び約3.5%のPEGまたはPEG修飾脂質をモル基準で含む。
いくつかの実施形態においては、脂質ナノ粒子製剤は、本質的に、脂質混合物であって、モル比が約20~70%のイオン性アミノ脂質:5~45%の天然の脂質:20~55%のコレステロール:0.5~15%のPEG修飾脂質;例えば、モル比が約20~60%のイオン性アミノ脂質:5~25%の天然の脂質:25~55%のコレステロール:0.5~15%のPEG修飾脂質の脂質混合物からなる。
特定の実施形態では、このモルの脂質比は、およそ50/10/38.5/1.5(イオン性アミノ脂質/天然脂質のモル%、例えば、DSPC/Chol/PEG修飾脂質、例えば、PEG-DMG、PEG-DSGまたはPEG-DPG)、57.2/7.1134.3/1.4(イオン性アミノ脂質/天然脂質のモル%、例えば、DPPC/Chol/PEG修飾脂質、例えば、PEG-cDMA)、40/15/40/5(イオン性アミノ脂質/天然脂質のモル%、例えば、DSPC/Chol/PEG修飾脂質、例えば、PEG-DMG)、50/10/35/4.5/0.5(イオン性アミノ脂質/天然脂質のモル%、例えば、DSPC/Chol/PEG修飾脂質、例えば、PEG-DSG)、50/10/35/5(イオン性アミノ脂質/天然の脂質、例えば、DSPC/Chol/PEG修飾脂質、例えば、PEG-DMG)、40/10/40/10(イオン性アミノ脂質/天然脂質のモル%、例えば、DSPC/Chol/PEG修飾脂質、例えば、PEG-DMGまたはPEG-cDMA)、35/15/40/10(イオン性アミノ脂質/天然脂質のモル%、例えば、DSPC/Chol/PEG修飾脂質、例えば、PEG-DMGまたはPEG-cDMA)または52/13/30/5(イオン性アミノ脂質/天然脂質のモル%、例えば、DSPC/Chol/PEG修飾脂質、例えば、PEG-DMGまたはPEG-cDMA)である。
例示的な脂質ナノ粒子組成物、及びこれを作製する方法は、例えば、Semple et al.(2010)Nat.Biotechnol.28:172-176;Jayarama et al.(2012)Angew.Chem.Int.Ed.51:8529-8533;及びMaier et al.(2013)Molecular Therapy 21:570-1578に記載される。
1つの実施形態において、本明細書に記載される脂質ナノ粒子製剤は、イオン性アミノ脂質、PEG脂質及び構造脂質を含み、及び任意選択で非カチオン性脂質を含む。非限定的な例として、脂質ナノ粒子は、約40~60%のイオン性アミノ脂質、約5~15%の非カチオン性脂質、約1-2%のPEG脂質及び約30~50%の構造脂質を含む。別の非限定的な例として、脂質ナノ粒子は、約50%のイオン性アミノ脂質、約10%の非カチオン性脂質、約1.5%のPEG脂質及び約38.5%の構造脂質を含む。さらに別の非限定的な例として、脂質ナノ粒子は、約55%のイオン性アミノ脂質、約10%の非カチオン性脂質、約2.5%のPEG脂質及び約32.5%構造脂質を含む。1つの実施形態において、このイオン性アミノ脂質は、限定するものではないが、DLin-KC2-DMA、DLin-MC3-DMA及びL319のような、本明細書に記載される任意のイオン性アミノ脂質である。
1つの実施形態において、本明細書に記載される脂質ナノ粒子製剤は、4成分の脂質ナノ粒子である。この脂質ナノ粒子は、イオン性アミノ脂質、非カチオン性脂質、PEG脂質及び構造脂質を含んでもよい。非限定的な例として、脂質ナノ粒子は、約40~60%のイオン性アミノ脂質、約5~15%の非カチオン性脂質、約1~2%のPEG脂質及び約30~50%の構造脂質を含んでもよい。別の非限定的な例として、脂質ナノ粒子は、約50%イオン性アミノ脂質、約10%の非カチオン性脂質、約1.5%のPEG脂質及び約38.5%の構造脂質を含んでもよい。さらに別の非限定的な例として、脂質ナノ粒子は、約55%のイオン性アミノ脂質、約10%の非カチオン性脂質、約2.5%のPEG脂質及び約32.5%の構造脂質を含んでもよい。1つの実施形態において、このイオン性アミノ脂質は、限定するものではないが、DLin-KC2-DMA、DLin-MC3-DMA及びL319のような本明細書に記載される任意のイオン性アミノ脂質であってもよい。
1つの実施形態において、本明細書に記載される脂質ナノ粒子製剤は、イオン性アミノ脂質、非カチオン性脂質、PEG脂質及び構造脂質を含む。非限定的な例として、この脂質ナノ粒子は、約50%のイオン性アミノ脂質DLin-KC2-DMA、約10%の非カチオン性脂質DSPC、約1.5%のPEG脂質PEG-DOMG及び約38.5%の構造脂質コレステロールを含む。非限定的な例として、脂質ナノ粒子は、約50%のイオン性アミノ脂質DLin-MC3-DMA、約10%の非カチオン性脂質DSPC、約1.5%のPEG脂質PEG-DOMG及び約38.5%の構造脂質コレステロールを含む。非限定的な例として、脂質ナノ粒子は、約50%のイオン性アミノ脂質DLin-MC3-DMA、約10%の非カチオン性脂質DSPC、約1.5%のPEG脂質PEG-DMG及び約38.5%の構造脂質コレステロールを含む。さらに別の非限定的な例として、脂質ナノ粒子は、約55%のイオン性アミノ脂質L319、約10%の非カチオン性脂質DSPC、約2.5%のPEG脂質PEG-DMG及び約32.5%の構造脂質コレステロールを含む。
1つの実施形態において、脂質は、切断可能な脂質、例えば、国際公開番号WO2012170889に記載の脂質である。別の実施形態では、脂質は、例えば、限定するものではないが、米国特許出願公開第20130064894号の式(I)のようなカチオン性脂質である。
1つの実施形態において、この脂質は、当該技術分野において既知であるか、及び/または国際公開番号WO2012040184、WO2011153120、WO2011149733、WO2011090965、WO2011043913、WO2011022460、WO2012061259、WO2012054365、WO2012044638、WO2010080724、WO201021865、WO2013086373及びWO2013086354に記載のような方法によって合成される。
別の実施形態では、カチオン性脂質は、トリアルキルカチオン性脂質である。トリアルキルカチオン性脂質及びトリアルキルカチオン性脂質を作製及び使用する方法の非限定的な例は、国際特許出願番号WO2013126803に記載されている。
1つの実施形態において、ポリヌクレオチドのLNP製剤は、PEG-c-DOMGを3%の脂質モル比で含む。別の実施形態では、ポリヌクレオチドのLNP製剤は、PEG-c-DOMGを1.5%脂質モル比で含む。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの医薬組成物は、国際公開番号WO2012099755に記載される少なくとも1つのPEG化脂質を含む。
1つの実施形態において、LNP製剤は、PEG-DMG 2000(1,2-ジミリストイル-sn-グリセロ-3-ホスホエタノールアミン-N-[メトキシ(ポリエチレングリコール)-2000)を含む。1つの実施形態において、LNP製剤は、当該分野で公知のイオン性アミノ脂質であるPEG-DMG 2000及び少なくとも1つの他の成分を含んでもよい。別の実施形態では、LNP製剤は、当該分野で公知のイオン性アミノ脂質であるPEG-DMG 2000、DSPC及びコレステロールを含む。非限定的な例として、LNP製剤は、PEG-DMG 2000、DLin-DMA、DSPC及びコレステロールを含む。別の非限定的な例として、LNP製剤は、PEG-DMG 2000、DLin-DMA、DSPC及びコレステロールを、2:40:10:48のモル比で含む(例えば、Geall et al.(2012)Proc.Nat’l.Acad.Sci.USA 109:14604-9を参照のこと)。
1つの実施形態において、LNP製剤は、国際公開番号WO2011127255またはWO2008103276に記載の方法によって製剤化される。非限定的な例として、本明細書に記載される、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、WO2011127255及び/またはWO2008103276に記載されるようなLNP製剤中に封入される;また、それら全体が参照によって本明細書に組み込まれる、米国特許出願公開第20130037977及び米国特許出願公開第20100015218号を参照のこと。
1つの実施形態において、本明細書に記載される、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、米国特許出願公開番号第20120207845号に記載されるような非経口経路で送達されるナノ粒子中に製剤化される。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、米国特許出願公開番号第20130156845号または国際公開番号WO2013093648またはWO2012024526に記載される方法によって作製される脂質ナノ粒子中に製剤化される。
本明細書に記載される脂質ナノ粒子は、米国特許出願公開番号第20130164400号に記載されるシステム及び/または方法によって無菌的な環境で作成され得る。
1つの実施形態において、LNP製剤は、米国特許第8,492,359号に記載の核酸-脂質粒子のようなナノ粒子中に製剤化される。非限定的な例として、脂質粒子は、1つ以上の活性剤または治療剤;1つ以上のイオン性アミノ脂質(粒子中に存在する総脂質の約50モル%~約85モル%を含む);1つ以上の非カチオン性脂質(粒子中に存在する総脂質の約13モル%~約49.5モル%を含む);及び粒子の凝集を阻害する1つ以上のコンジュゲートされた脂質(粒子中に存在する総脂質の約0.5モル%~約2モル%を含む)を含む。ナノ粒子中の核酸は、本明細書に記載されるポリヌクレオチドであってもよく、及び/または当技術分野において既知であってもよい。
1つの実施形態において、LNP製剤は、国際公開番号WO2011127255またはWO2008103276に記載の方法によって製剤化される。非限定的な例として、本明細書に記載される修飾されたRNAは、WO2011127255及び/またはWO2008103276に記載されるようなLNP製剤中に封入される。
1つの実施形態において、本明細書に記載されるLNP製剤は、ポリカチオン性の組成物を含む。非限定的な例として、このポリカチオン性の組成物は、米国特許出願公開番号第20050222064号の式1~60から選択される。別の実施形態では、ポリカチオン性の組成物を含んでいるLNP製剤は、in vivo及び/またはin vitroで本明細書において記載される修飾RNAの送達のために用いられる。
1つの実施形態において、本明細書に記載されるLNP製剤は、さらに、透過性増強分子を含む。非限定的な透過性増強分子は、米国特許出願公開番号第20050222064号に記載される。
1つの実施形態において、ポリヌクレオチド医薬組成物は、リポソーム、例えば、限定するものではないが、DiLa2 リポソーム(Marina Biotech,Bothell,WA)、SMARTICLES(登録商標)(Marina Biotech,Bothell,WA)、天然のDOPC(1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン)ベースのリポソーム(例えば、卵巣癌のためのsiRNA送達(Landen et al.(2006)Cancer Biology & Therapy 5:1708-1713)及びヒアルロナンコーティングリポソーム(Quiet Therapeutics,Israel)中に製剤化される。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、米国特許出願公開番号第2012060293号に記載されるような凍結乾燥されたゲル相のリポソーム組成物中に製剤化される。
ナノ粒子製剤は、リン酸塩コンジュゲートを含んでもよい。リン酸塩コンジュゲートは、in vivo循環時間を延長するか、及び/またはナノ粒子の標的化送達を増大し得る。本開示での使用のためのリン酸塩コンジュゲートは、国際出願番号WO2013033438または米国特許出願公開番号第20130196948号に記載の方法によって作製され得る。非限定的な例として、リン酸塩コンジュゲートは、国際出願番号WO2013033438に記載の式のいずれか1つの化合物を含んでもよい;また、米国特許出願公開第20130066086号を参照のこと。
ナノ粒子製剤は、ポリマーコンジュゲートを含んでもよい。このポリマーコンジュゲートは、水溶性コンジュゲートであってもよい。このポリマーコンジュゲートは、米国特許出願公開番号第20130059360号に記載のような構造を有し得る。1つの実施形態において、本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドとのポリマーコンジュゲートは、米国特許出願公開番号第20130072709号に記載の方法、及び/またはセグメント化されたポリマー試薬を使用して作製され得る。別の実施形態では、ポリマーコンジュゲートは、限定するものではないが、米国特許出願公開番号第20130196948号に記載のポリマーコンジュゲートのような環部分を含むペンダント側鎖を有し得る。
ナノ粒子製剤は、対象における本開示のナノ粒子の送達を亢進するためのコンジュゲートを含んでもよい。さらに、このコンジュゲートは、対象におけるナノ粒子の食作用性のクリアランスを阻害し得る。1つの実施形態において、このコンジュゲートは、ヒト膜タンパク質CD47、例えば、Rodriguez et al.(2013)Science 339:971-975によって記載された「自己」粒子から設計された「自己」ペプチドである。Rodriguez et alによって示されるように、自己ペプチドは、ナノ粒子の送達の亢進をしたナノ粒子のマクロファージ媒介クリアランスを遅延させた。別の実施形態では、このコンジュゲートは、膜タンパク質CD47である。例えば、Rodriguez et al.(2013)Science 339:971-975を参照のこと。Rodriguez et al.は、「自己」ペプチドと同様に、CD47が、スクランブルされたペプチド及びPEGでコーティングされたナノ粒子と比較して、対象における循環粒子比を増大し得ることを示した。
1つの実施形態において、本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、対象における本開示のナノ粒子の送達を亢進するためのコンジュゲートを含むナノ粒子中に製剤化される。このコンジュゲートは、CD47膜であってもよく、またはこのコンジュゲートは、以前に記載される「自己」ペプチドなどのCD47膜タンパク質から誘導されてもよい。別の態様では、このナノ粒子は、PEG及びCD47のコンジュゲートまたはそれらの誘導体を含んでもよい。さらに別の態様では、このナノ粒子は、上記の「自己」ペプチド及び膜タンパク質CD47の両方を含む。
別の態様では、「自己」ペプチド及び/またはCD47タンパク質は、本開示のポリヌクレオチドの送達について本明細書に記載されるように、ウイルス様粒子または偽ウイルス粒子にコンジュゲートされる。
別の実施形態では、本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを含む医薬組成物は、分解可能な結合を有するコンジュゲートを含んでもよい。コンジュゲートの非限定的な例としては、イオン性水素原子を含む芳香族部分、スペーサー部分、及び水溶性ポリマーが挙げられる。非限定的な例として、分解性結合を有するコンジュゲートを含む医薬組成物、及びこのような医薬組成物を送達するための方法は、米国特許出願公開番号第20130184443号に記載される。
ナノ粒子製剤は、炭水化物担体及びポリヌクレオチドを含む炭水化物ナノ粒子であってもよい。非限定的な例として、炭水化物担体としては、限定するものではないが、無水物修飾フィトグリコーゲンまたはグリコーゲン型物質、フィトグリコーゲンオクテニルスクシネート、フィトグリコーゲンベータデキストリン、無水物修飾フィトグリコーゲンベータデキストリンが挙げられる。例えば、国際公開番号WO2012109121号を参照のこと;また、米国特許出願公開第20140066363号も参照のこと。
本開示のナノ粒子製剤は、粒子の送達を改善するために界面活性剤またはポリマーでコーティングしてもよい。1つの実施形態において、ナノ粒子は、限定するものではないが、PEGコーティング及び/または中性表面電荷を有するコーティングなどの親水性コーティングでコーティングされる。親水性コーティングは、限定するものではないが、中枢神経系内のポリヌクレオチドなどの、より大きなペイロードを有するナノ粒子を送達することを補助し得る。非限定的な例として、親水性コーティングを含むナノ粒子及びそのようなナノ粒子を作製する方法は、米国特許出願公開第20130183244号に記載されている。
1つの実施形態において、本開示の脂質ナノ粒子は、親水性ポリマー粒子である。親水性ポリマー粒子及び親水性ポリマー粒子を作製する方法の非限定的な例は、米国特許出願公開第20130210991号に記載されている。
別の実施形態において、本開示の脂質ナノ粒子は、疎水性ポリマー粒子である。脂質ナノ粒子製剤は、イオン性カチオン性脂質を、迅速に排出される脂質ナノ粒子(reLNP)として公知の生分解性のイオン性カチオン性脂質で置換することによって改善され得る。限定するものではないが、DLinDMA、DLin-KC2-DMA、及びDLin-MC3-DMAなどのイオン性カチオン性脂質は、経時的に血漿及び組織に蓄積することが示されており、可能性としては毒性源であり得る。迅速に排出される脂質の迅速な代謝は、ラットにおける1mg/kg用量~10mg/kg用量までの幅で、脂質ナノ粒子の耐容性及び治療指数を改善し得る。酵素的に分解されたエステル結合を含めることにより、カチオン性成分の分解及び代謝プロファイルが改善され得、一方ではやはりreLNP製剤の活性は維持される。エステル結合は、脂質鎖の内部に位置してもよいし、またはそれは、脂質鎖の末端に最終的に位置してもよい。内部エステル結合は、脂質鎖中の任意の炭素を置換し得る。
1つの実施形態において、内部エステル結合は、飽和炭素のいずれかの側に位置する。
1つの実施形態において、免疫応答は、ナノ種、ポリマー及び免疫原を含み得る脂質ナノ粒子を送達することによって誘発される。例えば、米国特許出願公開番号第20120189700号及び国際公開第WO2012099805号を参照のこと。このポリマーは、ナノ種を封入してもよいし、またはナノ種を部分的に封入してもよい。免疫原は、本明細書に記載される組み換えタンパク質、修飾されたRNA及び/または本明細書に記載されるIL-23ポリペプチドをコードするmRNAを含む本明細書に記載されるポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチドまたはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/または本明細書に記載されるOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドであってもよい。
脂質ナノ粒子は、粒子の表面特性を変化させて脂質ナノ粒子が粘膜障壁を浸透し得るように操作してもよい。粘液は、限定するものではないが、口腔(例えば、口腔及び食道の膜及び扁桃組織)、眼、胃腸(例えば、胃、小腸、大腸、結腸、直腸)、鼻、呼吸器(例えば、鼻、咽頭、気管及び気管支の膜)、生殖器(例えば、膣、頸部及び尿道の膜)などの粘膜組織に位置する。より高い薬物封入効率及び広い範囲の薬物の持続的送達を提供する能力のために好ましい、10~200nmより大きいナノ粒子は、粘膜障壁を通って急速に拡散するには大きすぎると考えられてきた。粘液は、連続的に分泌され、捨てられ、廃棄されるか、または消化されてリサイクルされるので、捕捉された粒子の大部分が、数秒または数時間以内に粘膜組織から除去され得る。低分子量ポリエチレングリコール(PEG)で高密度にコーティングされた大きなポリマーナノ粒子(直径200nm~500nm)は、水中で拡散する同じ粒子よりもわずか4~6倍低く、粘液を介して拡散した(Lai et al.(2007)Proc.Nat’l.Acad.Sci.USA 104:1482-487;Lai et al.,(2009)Adv.Drug Deliv.Rev.61:158-171)。ナノ粒子の輸送は、限定するものではないが、透過率及び/または光漂白(FRAP)後の蛍光回復及び高分解能複数粒子追跡(MPT)を含む、蛍光顕微鏡技術を用いて決定され得る。非限定的な例として、粘膜障壁を浸透し得る組成物は、米国特許第8,241,670号または国際特許公開第WO2013110028号(米国特許出願公開第US20150297531号も参照のこと)に記載のように作製され得る。
粘液に浸透するように操作された脂質ナノ粒子は、ポリマー材料(すなわち、ポリマーコア)及び/またはポリマー-ビタミンコンジュゲート及び/またはトリブロックコポリマーを含んでもよい。ポリマー材料としては、限定するものではないが、ポリアミン、ポリエーテル、ポリアミド、ポリエステル、ポリカルバメート、ポリ尿素、ポリカーボネート、ポリ(スチレン)、ポリイミド、ポリスルホン、ポリウレタン、ポリアセチレン、ポリエチレン、ポリエチレンイミン、ポリイソシアネート、ポリアクリレート、ポリメタクリレート、ポリアクリロニトリル、及びポリアリレートが挙げられる。ポリマー材料は、生分解性であっても、及び/または生体適合性であってもよい。生体適合性ポリマーの非限定的な例は、国際特許公開番号WO2013116804に記載されている;また、その全体が参照により本明細書に組み込まれる米国特許出願公開第20130203713号も参照のこと。ポリマー材料をさらに照射してもよい。非限定的な例として、ポリマー材料をガンマ線照射してもよい。例えば、国際出願番号WO2012082165を参照のこと;また、その全体が参照により本明細書に組み込まれる、米国特許出願公開第20130101609号も参照のこと。
特定のポリマーの非限定的な例としては、ポリ(カプロラクトン)(PCL)、エチレン酢酸ビニルポリマー(EVA)、ポリ(乳酸)(PLA)、ポリ(L-乳酸)(PLLA)、ポリ(グリコール酸)(PGA)、ポリ(乳酸-co-グリコール酸)(PLGA)、ポリ(L-乳酸-co-グリコール酸)(PLLGA)、ポリ(D,L-ラクチド)(PDLA)、ポリ(L-ラクチド)(PLLA)、ポリ(D,L-ラクチド-co-カプロラクトン)、ポリ(D,L-ラクチド-co-カプロラクトン-co-グリコリド)、ポリ(D,L-ラクチド-co-PEO-co-D,L-ラクチド)、ポリ(D,L-ラクチド-co-PPO-co-D,L-ラクチド)、ポリアルキルシアノアクリレート、ポリウレタン、ポリ-L-リジン(PLL)、ヒドロキシプロピルメタクリレート(HPMA)、ポリエチレングリコール、ポリ-L-グルタミン酸、ポリ(ヒドロキシ酸)、ポリ無水物、ポリオルトエステル、ポリ(エステルアミド)、ポリアミド、ポリ(エステルエーテル)、ポリカーボネート、ポリアルキレン、例えば、ポリエチレン及びポリプロピレン、ポリアルキレングリコール、例えば、ポリ(エチレングリコール)(PEG)、ポリアルキレンオキシド(PEO)、ポリアルキレンテレフタレート、例えば、ポリ(エチレンテレフタレート)、ポリビニルアルコール(PVA)、ポリビニルエーテル、ポリビニルエステル、例えば、ポリ(酢酸ビニル)、ポリハロゲン化ビニル、例えば、ポリ(塩化ビニル)(PVC)、ポリビニルピロリドン、ポリシロキサン、ポリスチレン(PS)、ポリウレタン、誘導体化セルロース、例えば、アルキルセルロース、ヒドロキシアルキルセルロース、セルロースエーテル、セルロースエステル、ニトロセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、アクリル酸のポリマー、例えば、ポリ(メチル(メタ)アクリレート)(PMMA)、ポリ(エチル(メタ)アクリレート)、ポリ(ブチル(メタ)アクリレート)、ポリ(イソブチル(メタ)アクリレート)、ポリ(ヘキシル(メタ)アクリレート)、ポリ(イソデシル(メタ)アクリレート)、ポリ(ラウリル(メタ)アクリレート)、ポリ(フェニル(メタ)アクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)、ポリ(オクタデシルアクリレート)ならびにこれらのコポリマー及び混合物、ポリジオキサノン及びそのコポリマー、ポリヒドロキシアルカノエート、ポリプロピレンフマレート、ポリオキシメチレン、ポロキサマー、ポリ(オルト)エステル、ポリ(酪酸)、ポリ(吉草酸)、ポリ(ラクチド-co-カプロラクトン)、PEG-PLGA-PEG及びトリメチレンカーボネート、ポリビニルピロリドンが挙げられる。脂質ナノ粒子は、コポリマー、例えば、限定するものではないが、ブロックコポリマー(例えば、国際公開番号WO2013012476に記載の分枝したポリエーテル-ポリアミドブロックコポリマー)、及び(ポリ(エチレングリコール))-(ポリ(プロピレンオキシド))-(ポリ(エチレングリコール))トリブロックコポリマーでコーティングされてもよいし、またはそれと会合されてもよい。例えば、米国特許出願公開番号第20120121718号及び同第20100003337号、及び米国特許番号第8,263,665号を参照のこと。
コポリマーは、一般に安全とみなされる(GRAS)ポリマーであってもよく、脂質ナノ粒子の形成は、新しい化学物質が生成されないような方法であり得る。例えば、脂質ナノ粒子は、ヒト粘液にやはり迅速に浸透し得る新しい化学物質を形成することなくPLGAナノ粒子をコーティングするポロキサマーを含んでもよい。Yang et al.,(2011)Angew.Chem.Int.Ed.50:2597-2600。ヒト粘液に浸透し得るナノ粒子を製造するための非限定的な拡張可能な方法は、Xu et al.,(2013)J.Control Release 170:279-86に記載される。
ポリマー-ビタミンコンジュゲートのビタミンは、ビタミンEであってもよい。このコンジュゲートのビタミン部分は、他の適切な成分、例えば、限定するものではないが、ビタミンA、ビタミンE、他のビタミン、コレステロール、疎水性部分、または他のサーファクタントの疎水性成分(例えば、ステロール鎖、脂肪酸、炭化水素鎖及びアルキレンオキシド鎖)で置換されてもよい。
粘液に浸透するように操作された脂質ナノ粒子としては、表面変質剤、例えば、限定するものではないが、ポリヌクレオチド、アニオン性タンパク質(例えば、ウシ血清アルブミン)、界面活性剤(例えば、ジメチルジオクタデシルアンモニウムブロミドなどのカチオン性界面活性剤)、糖または糖誘導体(例えば、シクロデキストリン)、核酸、ポリマー(例えば、ヘパリン、ポリエチレングリコール及びポロキサマー)、粘液溶解剤(例えば、N-アセチルシステイン、オオヨモギ、ブロメライン、パパイン、クレロデンドルム(clerodendrum)、アセチルシステイン、ブロムヘキシン、カルボシステイン、エプラジノン、メスナ、アンブロキソール、ソブレロール、ドミオドール、レトステイン、ステプロニン、チオプロニン、ゲルソリン、チモシンβ4ドーナーゼアルファ、ネルテキシン、エルドステイン)及びrhDNアーゼを含む種々のDNアーゼが挙げられる。表面改変剤は、粒子の表面に埋め込まれてもよいし、もしくは取り込まれてもよいし、または脂質ナノ粒子の表面に(例えば、コーティング、吸着、共有結合、または他のプロセスによって)配置されてもよい。例えば、米国特許出願公開第20100215580号、第20080166414号、及び第20130164343号を参照のこと。
1つの実施形態において、粘液浸透脂質ナノ粒子は、本明細書に記載される少なくとも1つのポリヌクレオチドを含む。このポリヌクレオチドは、脂質ナノ粒子中に封入されてもよく、及び/または粒子の表面上に配置されてもよい。ポリヌクレオチドは、脂質ナノ粒子に共有結合されてもよい。粘液浸透脂質ナノ粒子の製剤は、複数のナノ粒子を含んでもよい。さらに、製剤は、粘液と相互作用し得、周囲の粘液の構造的及び/または接着の特性を変化させて、粘膜浸透性脂質ナノ粒子の粘膜組織への送達を増大し得る粘膜付着を減少させ得る粒子を含んでもよい。
別の実施形態において、粘液浸透脂質ナノ粒子は、粘膜浸透促進コーティングを含む低張性製剤である。製剤は、それが送達されている上皮に対して低張性であってもよい。低張性製剤の非限定的な例は、国際特許公開第WO2013110028号に見出すことができる;また、その全体が参照により本明細書に組み込まれる米国特許出願公開第20150297531号も参照のこと。
1つの実施形態において、粘膜障壁を介する送達を向上するために、ポリヌクレオチド製剤は、低張溶液を含むか、または低張溶液である。低張液は、限定するものではないが、粘液浸透性粒子などの粘液透過性粒子が膣上皮表面に到達できる速度を増大させることが見出された。例えば、Ensign et al.,(2013)Biomaterials 34:6922-9を参照のこと。
1つの実施形態において、ポリヌクレオチドは、限定するものではないが、ATUPLEX(商標)システム、DACCシステム、DBTCシステム及びSilence Therapeutics(London,United Kingdom)の他のsiRNA-リポプレックス技術、STEMGENT(登録商標)(Cambridge,MA)のSTEMFECT(商標)、及びポリエチレンイミン(PEI)またはプロタミンベースの標的化及び非標的化送達の核酸などのリポプレックスとして製剤化される。Aleku et al.,(2008)Cancer Res.68:9788-9798;Strumberg et al.,(2012)Int.J.Clin.Pharmacol.Ther.50:76-78;Santel et al.,(2006)Gene Ther.13:1222-1234;Santel et al.,(2006)Gene Ther.13:1360-1370;Gutbier et al.,(2010)Pulm.Pharmacol.Ther.23:334-344;Kaufmann et al.,(2010)Microvasc.Res.80:286-293;Weide et al.,(2009)J.Immunother.32:498-507;Weide et al.,(2008)J.Immunother.31:180-188;Pascolo(2004)Expert Opin.Biol.Ther.4:1285-1294;Fotin-Mleczek et al.,(2011)J.Immunother.34:1-15;Song et al.,(2005)Nature Biotechnol.23:709-717;Peer et al.,(2007)Proc.Natl.Acad.Sci.USA 6:104:4095-4100;deFougerolles(2008)Hum.Gene Ther.19:125-132)を参照のこと。
1つの実施形態において、このような製剤はまた、限定するものではないが、肝細胞、免疫細胞、腫瘍細胞、内皮細胞、抗原提示細胞、及び白血球を含む、in vivoで異なる細胞型に受動的または能動的に向けられるように、構築されるか、またはそのような組成物である(Akinc et al.,(2010)Mol.Ther.18:1357-1364;Song et al.,(2005)Nat.Biotechnol.23:709-717;Judge et al.,(2009)J.Clin.Invest.119:661-673;Kaufmann et al.,(2010)Microvasc.Res.80:286-293;Santel et al.,(2006)Gene Ther.13:1222-1234;Santel et al.,(2006)Gene Ther.13:1360-1370;Gutbier et
al.,(2010)Pulm.Pharmacol.Ther.23:334-344;Basha et al.,(2011)Mol.Ther.19:2186-2200;Fenske及びCullis(2008)Expert Opin.Drug Deliv 5:25-44;Peer et al.,(2008)Science 319:627-630;Peer and Lieberman(2011)Gene
Ther.18:1127-1133)。肝細胞への製剤の受動的標的化の一例としては、アポリポタンパク質Eに結合し、これらの製剤のin vivoでの肝細胞への結合及び取り込みを促進することが示されているDLin-DMA、DLin-KC2-DMA及びDLin-MC3-DMAベースの脂質ナノ粒子製剤が挙げられる(Akinc et al.(2010)Mol.Ther.18:1357-1364)。
製剤はまた、限定するものではないが、葉酸、トランスフェリン、N-アセチルガラクトサミン(GalNAc)、及び抗体標的アプローチによって例示されるように、それらの表面上に異なるリガンドを発現させることによって選択的に標的化され得る。例えば、Kolhatkar et al.,Curr Drug Discov Technol.2011 8:197-206;Musacchio及びTorchilin、Front Biosci.2011 16:1388-1412;Yu et al.,Mol Membr Biol.2010 27:286-298;Patil et al.,Crit Rev Ther Drug Carrier Syst.2008 25:1-61;Benoit et al.,Biomacromolecules.2011 12:2708-2714;Zhao et al.,Expert Opin Drug Deliv.2008 5:309-319;Akinc et al.,Mol Ther.2010 18:1357-1364;Srinivasan et al.,Methods Mol Biol.2012 820:105-116;Ben-Arie et al.,Methods Mol Biol.2012 757:497-507;Peer 2010 J Control Release.20:63-68;Peer et al.,Proc Natl Acad Sci USA.2007 104:4095-4100;Kim et al.,Methods Mol Biol.2011 721:339-353;Subramanya et al.,Mol Ther.2010 18:2028-2037;Song et al.,Nat Biotechnol.2005 23:709-717;Peer et al.,Science.2008 319:627-630;ならびにPeer及びLieberman、Gene Ther.2011 18:1127-1133(これらの全ては、それら全体が参照により本明細書に組み込まれる)を参照のこと。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び本開示のOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、固体脂質ナノ粒子として製剤化される。
固体脂質ナノ粒子(SLN)は、平均直径が10~1,000nmの球形であり得る。SLNは、親油性分子を可溶化し得、かつ界面活性剤及び/または乳化剤で安定化され得る固体脂質コアマトリックスを有する。さらなる実施形態において、脂質ナノ粒子は、自己組織化脂質-ポリマーナノ粒子であってもよい。Zhang et al.,(2008)ACS Nano 2:1696-1702を参照のこと。非限定的な例として、SLNは、国際特許公開番号WO2013105101に記載されているSLNであってもよい。別の非限定的な例として、SLNは、国際特許公開番号WO2013105101に記載された方法またはプロセスによって作製され得る。
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36-ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、及びそれらのいずれかの組合せの効能を改善するために、リポソーム、リポプレックスまたは脂質ナノ粒子を使用してもよい。なぜなら、これらの製剤は、ポリヌクレオチドによる細胞トランスフェクションを増大し得るか;及び/またはコードされたIL-23、IL-36、IL-18及びOX40Lの翻訳を増大し得るからである。そのような例の1つは、ポリプレックスプラスミドDNAの効果的な全身送達を可能にする脂質封入の使用を包含する。Heyes et al.(2007)Mol.Ther.15:713-720を参照のこと。リポソーム、リポプレックスまたは脂質ナノ粒子は、ポリヌクレオチドの安定性を増大するためにも使用してもよい。
1つの実施形態において、本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、徐放性及び/または標的化送達のために製剤化する。
本明細書で使用される「徐放性」とは、治療結果を達成するために放出の特定のパターンに適合する医薬組成物または化合物放出プロファイルを指す。1つの実施形態において、ポリヌクレオチドは、徐放性及び/または標的化送達のために、本明細書中に記載されるか、及び/または当該技術分野において既知である送達剤に封入される。本明細書で使用される場合、「封入する」という用語は、囲む、包囲するまたは包むことを意味する。これは、本開示の化合物の製剤に関連するので、封入は、実質的であっても、完全であってもまたは部分的であってもよい。「実質的に封入された」という用語は、本開示の医薬組成物または化合物の少なくとも50、60、70、80、85、90、95、96、97、98、99、99.9、99.9または99.999%超が、送達剤内に囲まれてもよいし、包囲されてもよいし、または封入されてもよいことを意味する。「部分的封入」とは、本開示の医薬組成物または化合物の10、10、20、30、40、50またはそれ未満が、送達剤内に囲まれてもよいいし、包囲されてもよいし、または封入されてもよいことを意味する。有利には、封入は、蛍光及び/または電子顕微鏡写真を用いて、本開示の医薬組成物または化合物の脱出または活性を測定することによって決定され得る。例えば、本開示の医薬組成物または化合物の少なくとも1、5、10、20、30、40、50、60、70、80、85、90、95、96、97、98、99、99.9、99.99または99.99%超が送達剤中に封入される。
1つの実施形態において、徐放性製剤は、限定するものではないが、トリブロックコポリマーを含む。非限定的な例として、製剤は、2つの異なるタイプのトリブロックコポリマーを含む。国際公開番号WO2012131104及びWO2012131106を参照のこと;また、米国特許出願公開第20140219923号及び米国特許第20150165042号(これらはそれら全体が参照により本明細書に組み込まれる)も参照のこと。
別の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、脂質ナノ粒子または迅速に除去された脂質ナノ粒子に封入され、次いで、脂質ナノ粒子または迅速に除去された脂質ナノ粒子は、本明細書に記載されるか及び/または当該技術分野において既知であるポリマー、ヒドロゲル及び/または外科用シーラントに封入されてもよい。非限定的な例として、ポリマー、ヒドロゲルまたは外科用シーラントとは、PLGA、エチレン酢酸ビニル(EVAc)、ポロキサマー、GELSITE(登録商標)(Nanotherapeutics、Inc.Alachua、FL)、HYLENEX(登録商標)(Halozyme Therapeutics、San Diego CA)、外科的シーラント、例えば、フィブリノーゲンポリマー(Ethicon Inc.Cornelia、GA)、TISSELL(登録商標)(Baxter International、Inc Deerfield、IL)、PEGベースのシーラント、またはCOSEAL(登録商標)(Baxter International、Inc Deerfield、IL)である。
別の実施形態では、脂質ナノ粒子は、対象に注入されたときにゲルを形成し得る当該技術分野において既知である任意のポリマーに封入される。別の非限定的な例として、脂質ナノ粒子は、生分解性であり得るポリマーマトリックスに封入される。
1つの実施形態において、徐放性及び/または標的化送達のための製剤は、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを含み、また、少なくとも1つの制御放出コーティングも含む。
徐放性コーティングとしては、限定するものではないが、OPADRY(登録商標)、ポリビニルピロリドン/酢酸ビニルコポリマー、ポリビニルピロリドン、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、EUDRAGIT RL(登録商標)、EUDRAGIT RS(登録商標)、及びセルロース誘導体、例えば、エチルセルロース水性分散AQUACOAT(登録商標)及びSURELEASE(登録商標))が挙げられる。
1つの実施形態において、ポリヌクレオチド徐放性及び/または標的化送達製剤は、ポリカチオン性側鎖を含み得る少なくとも1つの分解性ポリエステルを含む。分解性ポリエステルとしては、限定するものではないが、ポリ(セリンエステル)、ポリ(L-ラクチド-co-L-リジン)、ポリ(4-ヒドロキシ-L-プロリンエステル)、及びこれらの組合せが挙げられる。別の実施形態では、分解性ポリエステルは、PEGコンジュゲーションを含んで、PEG化ポリマーを形成し得る。
1つの実施形態において、少なくとも1つのポリヌクレオチドを含むポリヌクレオチド徐放性及び/または標的化送達製剤は、米国特許第8,404,222号に記載されるような少なくとも1つのPEG及び/またはPEG関連ポリマー誘導体を含む。
別の実施形態では、少なくとも1つのポリヌクレオチドを含むポリヌクレオチド徐放性送達製剤は、米国特許出願公開第20130130348号に記載の徐放性ポリマーシステムである。
1つの実施形態において、本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド及びIL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチドまたはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチドを、治療用ナノ粒子に封入する。
治療用ナノ粒子は、本明細書に記載され、かつ限定するものではないが、国際公開番号WO2010005740、WO2010030763、WO2010005721、WO2010005723、WO2012054923、米国特許出願公開第20110262491号、同第20100104645号、同第20100087337号、同第20100068285号、同第20110274759号、同第20100068286号、同第20120288541号、同第20130123351号、及び同第20130230567号、ならびに米国特許第8,206,747号、同第8,293,276号、同第8,318,208号、及び同第8,318,211号などの当該技術分野において既知である方法によって製剤化され得る。別の実施形態では、治療用ポリマーナノ粒子は、米国特許出願公開第20120140790号に記載の方法によって特定され得る。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、持続性放出のために製剤化する。
本明細書で使用される場合「持続性放出」とは、特定の期間にわたる放出速度に適合する医薬組成物または化合物を指す。期間としては、限定するものではないが、時間、日、週、月及び年が挙げられる。非限定的な例として、持続性放出性ナノ粒子は、ポリマー及び治療剤、例えば、限定するものではないが、本開示のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド及びIL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチドを含む。国際公開番号WO2010075072号、及び米国特許出願公開第20100216804号、同第20110217377号、及び同第20120201859号を参照のこと。別の非限定的な例において、持続性放出性製剤は、限定するものではないが、結晶、高分子ゲル及び/または微小粒子懸濁物などのバイオアベイラビリティを持続させる薬剤を含む。米国特許出願公開第20130150295号を参照のこと。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリペプチドは、標的特異的であるように製剤化され得る。
非限定的な例として、治療用ナノ粒子はコルチコステロイドを含む。国際公開番号WO2011084518を参照のこと。非限定的な例として、治療用ナノ粒子は、国際公開番号WO2008121949、WO2010005726、WO2010005725、WO2011084521、及び米国特許出願公開番号第20100069426号、同第20120004293号、及び同第20100104655号に記載されているナノ粒子に製剤化される。
1つの実施形態において、本開示のナノ粒子は、ポリマーマトリックスを含む。非限定的な例として、ナノ粒子は、2つ以上のポリマー、例えば、限定するものではないが、ポリエチレン、ポリカーボネート、ポリ無水物、ポリヒドロキシ酸、ポリプロピルフマレート、ポリカプロラクトン、ポリアミド、ポリアセタール、ポリエーテル、ポリエステル、ポリ(オルトエステル)、ポリシアノアクリレート、ポリビニルアルコール、ポリウレタン、ポリホスファゼン、ポリアクリレート、ポリメタクリレート、ポリシアノアクリレート、ポリ尿素、ポリスチレン、ポリアミン、ポリリジン、ポリ(エチレンイミン)、ポリ(セリンエステル)、ポリ(L-ラクチド-co-L-リジン)、ポリ(4-ヒドロキシ-L-プロリンエステル)またはそれらの組合せを含む。
1つの実施形態において、治療用ナノ粒子はジブロックコポリマーを含む。一実施形態において、このジブロックコポリマーは、限定するものではないが、ポリエチレン、ポリカーボネート、ポリ酸無水物、ポリヒドロキシ酸、ポリプロピルフマレート、ポリカプロラクトン、ポリアミド、ポリアセタール、ポリエーテル、ポリエステル、ポリ(オルトエステル)、ポリシアノアクリレート、ポリビニルアルコール、ポリウレタン、ポリホスファゼン、ポリアクリレート、ポリメタクリレート、ポリシアノアクリレート、ポリ尿素、ポリスチレン、ポリアミン、ポリリジン、ポリ(エチレンイミン)、ポリ(セリンエステル)、ポリ(L-ラクチド-co-L-リジン)、ポリ(4-ヒドロキシ-L-プロリンエステル)またはそれらの組合せなどのポリマーとの組合せでPEGを含む。さらに別の実施形態では、ジブロックコポリマーは、国際特許公開第WO2013120052号に記載されているような高Xジブロックコポリマーである;また、その全体が参照により本明細書に組み込まれる、米国特許出願公開第20150337068号も参照のこと。
非限定的な例として、治療用ナノ粒子は、PLGA-PEGブロックコポリマーを含む。米国特許出願公開第20120004293号及び米国特許第8,236,330号を参照のこと。別の非限定的な例において、治療用ナノ粒子は、PEGとPLAまたはPEGとPLGAとのジブロックコポリマーを含むステルスナノ粒子である。米国特許第8,246,968号及び国際公開番号WO2012166923号を参照のこと。さらに別の非限定的な例において、治療用ナノ粒子は、米国特許出願公開第20130172406号に記載されるような、ステルスナノ粒子または標的特異的ステルスナノ粒子である。
1つの実施形態において、治療用ナノ粒子は、マルチブロックコポリマーを含む。例えば、米国特許出願公開第8,263,665号及び同第8,287,910号、ならびに米国特許出願公開第20130195987号を参照のこと。さらに別の非限定的な例では、脂質ナノ粒子は、ブロックコポリマーPEG-PLGA-PEGを含む。例えば、Lee et al.,(2003)Pharmaceutical Research 20:1995-2000;Li et al.,(2003)Pharmaceutical Research 20:884-888;及びChang et al.,(2007)J.Controlled Release.118:245-253を参照のこと。
本開示のIL-23、IL-36ガンマ及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、PEG-PLGA-PEGブロックコポリマーを含む脂質ナノ粒子中に製剤化され得る。
1つの実施形態において、治療用ナノ粒子は、マルチブロックコポリマーを含む。例えば、米国特許第号8,263,665号及び同第8,287,910号、ならびに米国特許出願公開第20130195987号を参照のこと。
1つの実施形態において、本明細書に記載されるブロックコポリマーは、非ポリマーミセル及びブロックコポリマーを含むポリイオン複合体に含まれる。例えば、米国特許出願公開第20120076836号を参照のこと。
1つの実施形態において、治療用ナノ粒子は、少なくとも1種のアクリルポリマーを含む。アクリルポリマーとしては、限定するものではないが、アクリル酸、メタクリル酸、アクリル酸及びメタクリル酸コポリマー、メタクリル酸メチルコポリマー、エトキシエチルメタクリレート、シアノエチルメタクリレート、アミノアルキルメタクリレートコポリマー、ポリ(アクリル酸)、ポリ(メタクリル酸)、ポリシアノアクリレート及びそれらの組合せが挙げられる。
1つの実施形態において、治療用ナノ粒子は、少なくとも1つのポリ(ビニルエステル)ポリマーを含む。ポリ(ビニルエステル)ポリマーは、ランダムコポリマーなどのコポリマーであってもよい。非限定的な例として、ランダムコポリマーは、国際公開番号WO2013032829または米国特許出願公開第20130121954号に記載されているような構造を有する。1つの態様において、ポリ(ビニルエステル)ポリマーは、本明細書に記載されるポリヌクレオチドにコンジュゲートされ得る。
1つの実施形態において、治療用ナノ粒子は、少なくとも1つのジブロックコポリマーを含む。このジブロックコポリマーは、限定するものではないが、ポリ(乳酸)-ポリ(エチレン)グリコールコポリマーであってもよい。例えば、国際特許公開番号WO2013044219を参照のこと。
非限定的な例として、治療用ナノ粒子は、癌を治療するために使用される。国際公開番号WO2013044219号を参照のこと;また、その全体が参照により本明細書に組み込まれる、米国特許出願公開第20150017245号も参照のこと。
1つの実施形態において、治療用ナノ粒子は、本明細書に記載されるか、及び/または当該技術分野において既知である少なくとも1つのカチオン性ポリマーを含む。
1つの実施形態において、治療用ナノ粒子は、限定するものではないが、ポリリジン、ポリエチレンイミン、ポリ(アミドアミン)デンドリマー、ポリ(ベータ-アミノエステル)及びそれらの組合せなどの少なくとも1つのアミン含有ポリマーを含む。例えば、米国特許第8,287,849号を参照のこと。
別の実施形態では、本明細書に記載されるナノ粒子は、国際特許出願番号WO2013059496に記載されているようなアミンカチオン性脂質を含む。1つの態様において、カチオン性脂質は、アミノ-アミンまたはアミノ-アミド部分を有する。
1つの実施形態において、治療用ナノ粒子は、ポリカチオン側鎖を含み得る少なくとも1つの分解性ポリエステルを含む。分解性ポリエステルとしては、限定するものではないが、ポリ(セリンエステル)、ポリ(L-ラクチド-co-L-リジン)、ポリ(4-ヒドロキシ-L-プロリンエステル)、及びそれらの組合せが挙げられる。別の実施形態では、分解性ポリエステルは、PEGコンジュゲーションを含み、PEG化ポリマーを形成し得る。
別の実施形態において、治療用ナノ粒子は、少なくとも1つの標的化グリガンドのコンジュゲーションを含む。標的化リガンドは、限定するものではないが、モノクローナル抗体のような当該技術分野において既知である任意のリガンドであり得る。Kirpotin et al(2006)Cancer Res.66:6732-6740を参照のこと。
1つの実施形態において、治療用ナノ粒子は、癌を標的化するために使用され得る水溶液中に製剤化される(国際公開番号WO2011084513号及び米国特許出願公開第20110294717号を参照のこと)。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを、米国特許第8,404,799号に記載された方法を用いて製剤化する。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを、合成ナノキャリアに封入するか、結合するか及び/または会合する。
0925
合成ナノキャリアとしては、限定するものではないが、国際公開番号WO2010005740、WO2010030763、WO201213501、WO2012149252、WO2012149255、WO2012149259、WO2012149265、WO2012149268、WO2012149282、WO2012149301、WO2012149393、WO2012149405、WO2012149411、WO2012149454及びWO2013019669、及び米国特許出願公開第20110262491号、同第20100104645号、同第20100087337号、及び同第20120244222号に記載のものが挙げられる。合成ナノキャリアは、当該技術分野において既知であるか、及び/または本明細書に記載される方法を用いて製剤化してもよい。非限定的な例として、合成ナノキャリアは、国際公開番号WO2010005740号、WO2010030763号、WO201213501号、米国特許出願公開第20110262491号、同第20100104645号、同第20100087337号及び同第2012024422号に記載されている方法によって製剤化され得る。別の実施形態では、合成ナノキャリア製剤は、国際公開番号WO2011072218及び米国特許第8,211,473号に記載の方法によって凍結乾燥されてもよい。さらに別の実施形態では、合成ナノキャリアを含むがこれに限定されない本開示の製剤は、米国特許出願公開第20130230568に記載の方法によって凍結乾燥されてもよいし、再構成されてもよい。
1つの実施形態において、合成ナノキャリアは、本明細書に記載されるポリヌクレオチドを放出する反応基を含む(国際公開番号WO20120952552及び米国特許出願公開第20120171229号を参照のこと)。
1つの実施形態において、合成ナノキャリアは、合成ナノキャリアの送達からの免疫応答を向上するための免疫刺激剤を含む。非限定的な例として、合成ナノキャリアは、免疫系のTh1ベースの応答を増強し得るTh1免疫刺激剤を含んでもよい(国際公開番号第WO2010123569号及び米国特許出願公開第20110223201号を参照のこと)。
一実施形態において、合成ナノキャリアは、標的放出のために製剤化される。1つの実施形態において、合成ナノキャリアは、ポリヌクレオチドを特定のpHで及び/または所望の時間間隔後に放出するように製剤化される。非限定的な例として、合成ナノ粒子は、ポリヌクレオチドを24時間後及び/またはpH4.5で放出するように製剤化される(国際公開番号WO2010138193号及びWO2010138194号、ならびに米国特許出願公開第20110020388号及び同第20110027217号を参照のこと)。
一実施形態において、合成ナノキャリアは、本明細書に記載されるポリヌクレオチドの持続性放出及び/または持続放出のために製剤化される。非限定的な例として、持続性放出のための合成ナノキャリアは、本明細書に記載されるか、及び/または国際公開番号WO2010138192及び米国特許出願公開第20100303850号(これらの両方は、それら全体が参照により本明細書に組み込まれる)に記載される、当該技術分野において既知である方法によって製剤化される。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せは、徐放性及び/または持続性放出のために製剤化され、この製剤は結晶性側鎖(CYSC)ポリマーである少なくとも1つのポリマーを含む。CYSCポリマーは、米国特許第8,399,007号に記載されている。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せは、双性イオン性脂質に封入されるか、結合されるか及び/または会合される。双性イオン性脂質の非限定的な例、及び双性イオン性脂質を使用する方法は、米国特許出願公開第20130216607号に記載される。一態様では、双性イオン性脂質は、本明細書に記載されるリポソーム及び脂質ナノ粒子に使用してもよい。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを、米国特許出願公開第20130197100号に記載されるコロイドナノ粒子中に製剤化する。
一実施形態において、ナノ粒子は、経口投与のために最適化される。ナノ粒子は、限定するものではないが、キトサンまたはその誘導体などの少なくとも1つのカチオン性バイオポリマーを含んでもよい。非限定的な例として、ナノ粒子は、米国特許出願公開第20120282343号に記載の方法によって製剤化され得る。
いくつかの実施形態において、LNPは、脂質KL52(米国特許出願公開番号2012/0295832号に開示されているアミノ脂質)を含む。このような脂質の取り込みにより、LNP投与の活性及び/または安全性(ALT/AST、白血球細胞計数及びサイトカイン誘導のうちの1つ以上を調べることによって測定される)を改善し得る。KL52を含むLNPは、静脈内投与されても、及び/または1回以上の用量で投与されてもよい。いくつかの実施形態において、KL52を含むLNPの投与は、MC3を含むLNPと比較して同等または改善されたmRNA及び/またはタンパク質発現をもたらす。
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、より小さいLNPを用いて送達する。このような粒子は、0.1um未満から最大で100nmまで、例えば、限定するものではないが、0.1um未満、1.0um未満、5um未満、10um未満、15um未満、20um未満、25um未満、30um未満、35um未満、40um未満、50um未満、55um未満、60um未満、65um未満、70um未満、75um未満、80um未満、85um未満、90um未満、95um未満、100um未満、125um未満、150um未満、175um未満、200um未満、225um未満、250um未満、275um未満、300um未満、325um未満、350um未満、375um未満、400um未満、425um未満、450um未満、475um未満、500um未満、525um未満、550um未満、575um未満、600um未満、625um未満、650um未満、675um未満、700um未満、725um未満、750um未満、775um未満、800um未満、825um未満、850um未満、875um未満、900um未満、925um未満、950um未満、または975um未満の直径である場合がある。
別の実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、約1nm~約100nm、約1nm~約10nm、約1nm~約20nm、約1nm~約30nm、約1nm~約40nm、約1nm~約50nm、約1nm~約60nm、約1nm~約70nm、約1nm~約80nm、約1nm~約90nm、約5nm~約 100nm、約5nm~約10nm、約5nm~約20nm、約5nm~約30nm、約5nm~約40nm、約5nm~約50nm、約5nm~約60nm、約5nm~約70nm、約5nm~約80nm、約5nm~約90nm、約10~約50 nm、約20~約50nm、約30~約50nm、約40~約50nm、約20~約60nm、約30~約60nm、約40~約60nm、約20~約70nm、約30~約70nm、約40~約70nm、約50~約70nm、約60~約70nm、約20~約80nm、約30~約80nm、約40~約80nm、約50~約80nm、約60~約80nm、約20~約90nm、約30~約90nm、約40~約90nm、約50~約90nm、約60~約90nm及び/または約70~約90nmの直径を有する場合がある、より小さいLNPを使用して送達される。
いくつかの実施形態では、そのようなLNPは、マイクロ流体ミキサーを含む方法を用いて合成される。マイクロ流体ミキサーの例としては、限定するものではないが、Microinnova(Allerheiligen bei Wildon、Austria)及び/またはジグザグヘリンボーンマイクロミキサー(SHM)を含むスリット櫛形マイクロミキサーが挙げられるがこれらに限定されない。Zhigaltsev et al.,(2012)Langmuir 28:3633-40;Belliveau et al.,(2012)Molecular Therapy-Nucleic Acids 1:e37;Chen et al.,(2012)J.Am.Chem.Soc.134:6948-51を参照のこと。
いくつかの実施形態では、SHMを含むLNP生成の方法は、少なくとも2つの入力ストリームの混合をさらに含み、ここで、混合は、マイクロ構造誘導カオス移流(MICA)によって行われる。この方法によれば、流体ストリームは、ヘリングボーンパターン内に存在するチャネルを通って流れ、回転流を引き起こし、流体を互いに折り畳む。この方法はまた、流体混合のための表面を含んでもよく、この表面が流体循環中の向きを変える。SHMを使用してLNPを生成する方法としては、米国特許出願公開第2004/0262223号及び同第2012/0276209号に開示される方法が挙げられる。
1つの実施形態において、本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せは、例えば、限定するものではないが、Slit Interdigital Microstructured Mixer(SIMM-V2)または標準的なスリットインターデジタルマイクロミキサー(standard Slit Interdigital Micro Mixer)(SSIMM)またはCaterpillar(CPMM)もしくはImpinging-jet(IJMM)(Institut fur Mikrotechnik Mainz GmbH、Mainz Germany)のようなマイクロミキサーを用いて作製された脂質ナノ粒子中に製剤化される。
1つの実施形態において、本開示の、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを、マイクロ流体技術を用いて作製された脂質ナノ粒子中に製剤化する。Whitesides(2006)Nature 442:368-373;及びAbraham et al.,(2002)Science 295:647-651を参照のこと。非限定的な例として、制御されたマイクロ流体製剤は、低レイノルズ数でマイクロチャネル内の定常圧力駆動流のストリームを混合する受動的方法を包含する。例えば、Abraham et al.,(2002)Science 295:647-651を参照のこと。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを、限定するものではないが、Harvard Apparatus(Holliston、MA)またはドロマイトマイクロフルイディクス(Dolomite Microfluidics)(Royston、UK)のマイクロミキサーチップなどのマイクロミキサーチップを用いて作製された脂質ナノ粒子に製剤化してもよい。マイクロミキサーチップは、2つ以上の流体ストリームを分割及び再結合機構で迅速に混合するために使用され得る。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、国際公開番号WO2013063468または米国特許第8,440,614号に記載された薬物封入マイクロスフェアを使用して送達用に製剤化される。マイクロスフェアは、国際特許公開番号WO2013063468に記載されているような式(I)、(II)、(III)、(IV)、(V)または(VI)の化合物を含んでもよい。別の態様において、アミノ酸、ペプチド、ポリペプチド、脂質(APPL)は、本開示のポリヌクレオチドを細胞に送達する際に有用である。国際特許公開番号WO2013063468を参照のこと;また、その全体が参照により本明細書に組み込まれる、米国特許出願公開番号第20130158021号も参照のこと。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、約10~約100nm例えば、限定するものではないが、約10~約20nm、約10~約30nm、約10~約40nm、約10~約50nm、約10~約60nm、約10~約70nm、約10~約80nm、約10~約90nm、約20~約30nm、約20~約40nm、約20~約50nm、約20~約60nm、約20~約70nm、約20~約80nm、約20~約90nm、約20~約100nm、約30~約40nm、約30~約50nm、約30~約60nm、約30~約70nm、約30~約80nm、約30~約90nm、約30~約100nm、約40~約50nm、約40~約60nm、約40~約70nm、約40~約80nm、約40~約90nm、約40~約100nm、約50~約60nm、約50~約70nm約50~約80nm、約50~約90nm、約50~約100nm、約60~約70nm、約60~約80nm、約60~約90nm、約60~約100nm、約70~約80nm、約70~約90nm、約70~約100nm、約80~約90nm、約80~約100nm及び/または約90~約100nmの直径を有する脂質ナノ粒子中に製剤化する。
1つの実施形態において、脂質ナノ粒子は、約10~500nmの直径を有する。1つの実施形態において、脂質ナノ粒子は、100nm超、150nm超、200nm超、250nm超、300nm超、350nm超、400nm超、450nm超、500nm超、550nm超、600nm超、650nm超、700nm超、750nm超、800nm超、850nm超、900nm超、950nm超または1000nm超の直径を有する。
1つの態様において、脂質ナノ粒子は、国際特許公開番号WO2013059922(その全体が参照により本明細書に組み込まれる、米国特許出願公開第20140328759号も参照のこと)に記載されている限界サイズの脂質ナノ粒子である。この限界サイズの脂質ナノ粒子は、水性コアまたは疎水性コアを取り囲む脂質二分子膜を含んでもよく、この脂質二分子膜は、リン脂質、例えば、限定するものではないが、ジアシルホスファチジルコリン、ジアシルホスファチジルエタノールアミン、セラミド、スフィンゴミエリン、ジヒドロスフィンゴミエリン、セファリン、セレブロシド、C8-C20脂肪酸ジアシルフォスファチジルコリン、及び1-パルミトイル-2オレオイルホスファチジルコリン(POPC)を含んでもよい。別の態様では、限界サイズの脂質ナノ粒子は、ポリエチレングリコール-脂質、例えば、限定するものではないが、DLPE-PEG、DMPE-PEG、DPPC-PEG及びDSPE-PEGを含んでもよい。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの任意の組合せを、国際公開番号WO2013063530に記載の送達方法を用いて、特定の位置に送達、局在化及び/または濃縮させる。また、その全体が参照により本明細書に組み込まれる、米国特許出願公開第20140323907号も参照のこと。非限定的な例として、ポリヌクレオチドを対象に送達する前、同時または後に、空のポリマー粒子を対象に投与してもよい。空のポリマー粒子は、対象と接触したときに一度は体積の変化を受け、対象の特定の位置に固定され、埋め込まれ、固定化されまたは閉じ込められるようになる。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、活性物質放出系(例えば、米国特許出願公開第20130102545号を参照のこと)中に製剤化する。この活性物質放出系は、1)触媒的に活性な核酸とハイブリダイズするオリゴヌクレオチド阻害剤鎖に結合した少なくとも1つのナノ粒子、及び2)治療的に活性な物質に結合した少なくとも1つの基質分子に結合した化合物(例えば、本明細書に記載されるポリヌクレオチド)を含んでもよく、ここでこの治療的に活性な物質は、触媒的に活性な核酸による基質分子の切断によって放出される。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、非細胞材料を含む内部コア及び細胞膜を含む外部表面を備えるナノ粒子中に製剤化する。細胞膜は、細胞またはウイルスに由来する膜に由来し得る。非限定的な例として、ナノ粒子は、国際特許公開番号WO2013052167に記載された方法によって製造される。別の非限定的な例として、国際特許公開番号WO2013052167に記載のナノ粒子を用いて、本明細書に記載されるポリヌクレオチドを送達する。また、その全体が参照によって本明細書に組み込まれる、米国特許出願公開第20130337066号を参照のこと。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、多孔質ナノ粒子支持脂質二分子膜(プロトセル)中に製剤化する。プロトセルは、国際公開番号WO2013056132号(その全体が参照により本明細書に組み込まれる、米国特許出願公開番号20150272885号も参照のこと)に記載されている。
1つの実施形態において、本明細書に記載される、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、米国特許第8,420,123号及び第8,518,963号、ならびに欧州特許第2073848号B1に記載されたポリマーナノ粒子中に、またはそこに記載される方法によって作製されたポリマーナノ粒子中に製剤化する。非限定的な例として、ポリマーナノ粒子は、米国特許第8,518,963号に記載されるナノ粒子、または記載される方法よって製造されたナノ粒子のような高いガラス転移温度を有する。別の非限定的な例として、経口及び非経口製剤用のポリマーナノ粒子は、欧州特許2073848B1号に記載された方法によって製造される。
別の実施形態では、本明細書に記載される、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、イメージングに使用されるナノ粒子中に製剤化する。ナノ粒子は、例えば、米国特許出願公開第20130129636号に記載のリポソームナノ粒子であってもよい。非限定的な例として、リポソームは、ガドリニウム(III)2-{4,7-ビス-カルボキシメチル-10-[(N,N-ジステアリルアミドメチル-N’-アミド-メチル]-1,4,7,10-テトラ-アザシクロドデカ-1-イル}-酢酸及び中性の完全に飽和したリン脂質成分を含んでもよい(例えば、米国特許出願公開第20130129636号を参照のこと)。
1つの実施形態において、本開示で使用され得るナノ粒子は、米国特許出願公開第20130130348号に記載の方法によって形成される。
本開示のナノ粒子は、限定するものではないが、欠乏が貧血から神経管欠損への健康上の危険につながる可能性がある栄養素をさらに含んでもよい。例えば、国際特許公開番号WO2013072929に記載されているナノ粒子を参照のこと;また、その全体が参照によって本明細書に組み込まれる、米国特許出願公開第20150224035号も参照のこと。非限定的な例として、栄養素は、第一鉄、第二鉄塩または元素鉄、ヨウ素、葉酸、ビタミンまたは微量栄養素の形態の鉄である。
1つの実施形態において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、膨潤性ナノ粒子中に製剤化する。膨潤性ナノ粒子は、限定するものではないが、米国特許第8,440,231号に記載されたものであってもよい。非限定的な実施形態として、膨潤性ナノ粒子は、本開示のポリヌクレオチドの肺系への送達に使用される(例えば、米国特許第8,440,231号を参照のこと)。
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、限定するものではないが、米国特許第8,449,916号に記載されているものなどのポリ酸無水物ナノ粒子中に製剤化する。
本開示のナノ粒子及び微小粒子は、マクロファージ及び/または免疫応答を調節するために幾何学的に操作してもよい。一態様において、幾何学的に操作された粒子は、限定するものではないが、肺送達のような標的化送達のために本開示のポリヌクレオチドを組み込むために、様々な形状、サイズ及び/または表面電荷を有し得る(例えば、国際公開番号WO2013082111を参照のこと)。幾何学的に操作した粒子が有し得る他の物理的特徴としては、限定するものではないが、開窓、斜めの腕、非対称性及び表面粗さ、細胞及び組織との相互作用を変化し得る電荷が挙げられる。非限定的な例として、本開示のナノ粒子は、国際公開番号WO2013082111(米国特許出願公開第200150037428号も参照のこと)に記載された方法によって作製される。
1つの実施形態において、本開示のナノ粒子は、限定するものではないが、国際公開番号WO2013090601(米国特許出願公開第20130184444号も参照)に記載されているような水溶性ナノ粒子である。このナノ粒子は、良好な水溶性を示すために、小型で双性イオン性のリガンドを有する無機ナノ粒子であってもよい。ナノ粒子はまた、小さな流体力学的直径(HD)、時間、pH、及び塩分に対する安定性、ならびに低レベルの非特異的タンパク質結合を有し得る。
1つの実施形態において、本開示のナノ粒子は、米国特許出願公開第20130172406号に記載の方法によって開発される。
1つの実施形態において、本開示のナノ粒子は、ステルスナノ粒子または標的特異的ステルスナノ粒子、例えば、限定するものではないが、米国特許出願公開第20130172406号に記載のナノ粒子である。本開示のナノ粒子は、米国特許出願公開第20130172406号に記載の方法によって作製されてもよい。
別の実施形態において、ステルスまたは標的特異的ステルスナノ粒子は、ポリマーマトリックスを含む。ポリマーマトリックスは、2つ以上のポリマー、例えば、限定するものではないが、ポリエチレン、ポリカーボネート、ポリ酸無水物、ポリヒドロキシ酸、ポリプロピルフマレート、ポリカプロラクトン、ポリアミド、ポリアセタール、ポリエーテル、ポリエステル、ポリ(オルトエステル)、ポリシアノアクリレート、ポリビニルアルコール、ポリウレタン、ポリホスファゼン、ポリアクリレート、ポリメタクリレート、ポリシアノアクリレート、ポリ尿素、ポリスチレン、ポリアミン、ポリエステル、ポリ無水物、ポリエーテル、ポリウレタン、ポリメタクリレート、ポリアクリレート、ポリシアノアクリレートまたはそれらの組合せを含んでもよい。
1つの実施形態において、ナノ粒子は、高密度核酸層を有するナノ粒子-核酸ハイブリッド構造である。非限定的な例として、ナノ粒子-核酸ハイブリッド構造は、米国特許出願公開第20130171646号に記載の方法によって作製される。ナノ粒子は、限定するものではないが、本明細書に記載されるか、及び/または当該技術分野において既知であるポリヌクレオチドなどの核酸を含んでもよい。
本開示のナノ粒子の少なくとも1つは、コアのナノ構造に埋め込まれてもよいし、あるいは低密度多孔性3-D構造またはナノ構造内もしくは表面上に少なくとも1つのペイロードを担持もしくはそれと会合し得るコーティングでコーティングされてもよい。少なくとも1つのナノ粒子を含むナノ構造の非限定的な例は、国際特許公開番号WO2013123523に記載されている。また、その全体が参照によって本明細書に組み込まれる、米国特許出願公開第20150037249号も参照のこと。
ヒアルロニダーゼ
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せの筋肉内、腫瘍内、または皮下に局在する注射は、ヒアルロナンの加水分解を触媒するヒアルロニダーゼを含んでもよい。
ヒアルロニダーゼは、間質障壁の構成要素であるヒアルロナンの加水分解を触媒することにより、ヒアルロナンの粘度を低下させ、それによって組織透過性を増大させる(Frost、Expert Opin.Drug Deliv.(2007)4:427-440)。トランスフェクトされた細胞によって産生されるコードされたタンパク質の分散及び全身分布を速めることは有用である。あるいは、ヒアルロニダーゼを用いて、筋肉内、腫瘍内、または皮下に投与される、本開示のポリヌクレオチドに曝露された細胞の数を増大し得る。
ナノ粒子模倣物
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、ナノ粒子模倣物内に封入されてもよいし、及び/またはナノ粒子模倣物に吸収されてもよい。ナノ粒子模倣体は、限定するものではないが、病原体、ウイルス、細菌、真菌、寄生虫、プリオン及び細胞などの送達機能生物体または粒子を模倣し得る。非限定的な例として、本開示のポリヌクレオチドは、ウイルスの送達機能を模倣し得る非ビリオン粒子に封入してもよい(国際公開番号WO2012006376及び米国特許出願公開第20130171241号及び同第20130195968号を参照のこと)。
ナノチューブ
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、限定するものではないが、ロゼットナノチューブ、リンカーを有する双子塩基を有するロゼットナノチューブ、カーボンナノチューブ及び/または単層カーボンナノチューブなどの少なくとも1つのナノチューブに付着させてもよいし、そうでなければ結合させてもよい。ポリヌクレオチドは、限定するものではないが、立体的、イオン的、共有結合的及び/または他の力などの力によってナノチューブに結合されてもよい。ポリヌクレオチドを含むナノチューブ及びナノチューブ製剤は、国際特許出願第PCT/US2014/027077号(WO2014152211として公開)に記載されている。
自己組織化ナノ粒子
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、自己組織化ナノ粒子中に製剤化してもよい。核酸自己組織化ナノ粒子は、国際特許出願第PCT/US2014/027077号(WO2014152211として公開)、段落[000740]~[000743]などに記載されている。ポリマーに基づく自己組織化ナノ粒子は、国際特許出願第PCT/US2014/027077号に記載されている。また、その全体が参照によって本明細書に組み込まれる、米国特許出願公開第20160038612号も参照のこと。
自己組織化高分子
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、送達のために両親媒性高分子(AM)中に製剤化してもよい。AMは、ポリ(エチレングリコール)に共有結合したアルキル化糖主鎖を有する生体適合性の両親媒性ポリマーを含む。水溶液中で、AMは、自己組織化してミセルを形成する。AMを形成する方法及びAMの非限定的な例は、米国特許出願公開第20130217753号に記載される。
無機ナノ粒子
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、無機ナノ粒子中に製剤化してもよい(米国特許第8,257,745号)。無機ナノ粒子は、限定するものではないが、水膨張性である粘土物質を含んでもよい。非限定的な例として、無機ナノ粒子としては、単純なケイ酸塩から製造された合成スメクタイト粘土が挙げられる(例えば、米国特許第5,585,108号及び第8,257,745号を参照のこと)。
いくつかの実施形態では、無機ナノ粒子は、本明細書に開示されるポリヌクレオチドのコア及びポリマーシェルを含む。このポリマーシェルは、本明細書に記載されたポリマーのいずれであってもよく、当該技術分野において既知である。さらなる実施形態において、ポリマーシェルを使用して、コア中のポリヌクレオチドを保護してもよい。
半導電性及び金属性のナノ粒子
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを、半導電性及び金属性の材料を含む水分散性ナノ粒子中に製剤化してもよいし(米国特許出願公開第20120228565号)、または磁性ナノ粒子中に形成してもよい(米国特許出願公開第20120265001号及び同第20120283503号)。水分散性ナノ粒子は、疎水性ナノ粒子であっても、または親水性ナノ粒子であってもよい。
いくつかの実施形態では、半導体ナノ粒子及び/または金属ナノ粒子は、本明細書に開示されたポリヌクレオチドのコア及びポリマーシェルを含んでもよい。ポリマーシェルは、本明細書に記載された任意のポリマーであってもよく、当該技術分野において既知である。さらなる実施形態において、このポリマーシェルを使用して、コア中のポリヌクレオチドを保護してもよい。
外科用シーラント:ゲル及びヒドロゲル
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、対象に注入されたときにゲルを形成する当該技術分野において既知である任意のヒドロゲル中に封入される。ゲル及びヒドロゲルのような外科用シーラントは、国際特許出願番号PCT/US2014/027077号に記載されている。
懸濁製剤
いくつかの実施形態では、ポリヌクレオチド、水不混和性オイルデポー、界面活性剤及び/または共界面活性剤及び/または共溶媒を含む懸濁製剤が提供される。油と界面活性剤との組合せは、ポリヌクレオチドによる懸濁製剤を可能にし得る。水不混和性デポー中のポリヌクレオチドの送達を使用して、デポーから周囲の生理学的環境へのmRNAの持続性放出を通じたバイオアベイラビリティを改善し、及びヌクレアーゼによるポリヌクレオチド分解を防止してもよい。
いくつかの実施形態において、mRNAの懸濁製剤は、ポリヌクレオチド、油性溶液及び界面活性剤の組合せを用いて調製される。このような製剤は、ポリヌクレオチドを含む水相と、油及び界面活性剤を含む油性相とを含む二層の系として調製され得る。懸濁製剤用の例示的な油としては、限定するものではないが、ゴマ油及びミグリオール(飽和ココナツ油及びパーム核油由来のカプリル酸及びカプリン酸脂肪酸及びグリセリンまたはプロピレングリコールのエステルを含む)、コーン油、大豆油、ピーナッツ油、ミツロウ及び/またはヤシの種子油が挙げられる。例示的な界面活性剤としては、限定するものではないが、Cremophor、ポリソルベート20、ポリソルベート80、ポリエチレングリコール、トランスクトール、CAPMUL(登録商標)、ラブラゾール、ミリスチン酸イソプロピル、及び/またはSpan 80が挙げられる。いくつかの実施形態では懸濁物は、限定するものではないが、エタノール、グリセロール及び/またはプロピレングリコールを含む共溶媒を含んでもよい。
懸濁物は、まず、ポリヌクレオチドの水溶液と1種以上の界面活性剤を含む油性相とを含むポリヌクレオチド製剤を調製することによって形成され得る。懸濁物の形成は、2つの相(水性及び油性)を混合した結果として生じる。いくつかの実施形態では、このような懸濁物を、水相に送って水中油型エマルジョンを形成してもよい。いくつかの実施形態では、懸濁物を水相に送達することにより、ポリヌクレオチドを含む油性相が、ナノメートルサイズの液滴からマイクロメートルサイズの液滴までの大きさの範囲であり得る液滴を形成する、水中油型エマルジョンが形成される。いくつかの実施形態では、油、界面活性剤、共界面活性剤及び/または共溶媒の特定の組合せを利用して、油相中にポリヌクレオチドを懸濁させてもよいし、及び/または水環境への送達の際に水中油型エマルジョンを形成してもよい。
いくつかの実施形態において、懸濁物は、ポリヌクレオチドの周囲環境への放出の調整を提供する。このような実施形態では、ポリヌクレオチドの放出は、水不混和性のデポーからの拡散、その後の周囲環境(例えば、水環境)への再可溶化によって調整されてもよい。
いくつかの実施形態では、水不混和性デポー内のポリヌクレオチド(例えば、油相中に懸濁された)は、変化したポリヌクレオチドの安定性(例えば、ヌクレアーゼによる分解の変化)をもたらす。
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、注入時に、エマルジョンが自然に(例えば、水相に送達される場合)形成されるように製剤化する。そのような粒子形成は、油相から水相へのポリヌクレオチドの放出のために高い表面積対体積比を提供し得る。
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、限定するものではないが、米国特許第8,496,945号に記載されているナノエマルジョンなどのナノエマルジョン中に製剤化する。ナノエマルジョンは、本明細書に記載されるナノ粒子を含んでもよい。非限定的な例として、ナノ粒子は、脂質または界面活性剤層で取り囲まれるか、またはコーティングされ得る液体疎水性コアを含んでもよい。脂質または界面活性剤層は、少なくとも1つの膜一体化ペプチドを含んでもよく、また標的化リガンドも含んでもよい(例えば、米国特許第8,496,945号を参照のこと)。
カチオン及びアニオン
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、カチオンまたはアニオンを含んでもよい。いくつかの実施形態では、製剤は、限定するものではないが、Zn2+、Ca2+、Cu2+、Mg2+及びそれらの組合せなどの金属カチオンを含む。非限定的な例として、製剤は、金属カチオンと複合体化されたポリマー及びポリヌクレオチドを含む(例えば、米国特許第6,265,389号及び第6,555,525号を参照のこと)。
いくつかの実施形態において、二価カチオンと一価カチオンとの組合せを含むカチオン性ナノ粒子は、ポリヌクレオチドを用いて製剤化される。このようなナノ粒子は、所定の期間(例えば、時間、日など)にわたって溶液中で自然に形成し得る。そのようなナノ粒子は、二価カチオン単独の存在下でも、または一価カチオン単独の存在下でも形成されない。カチオン性ナノ粒子中の、またはカチオン性ナノ粒子を含む1以上のデポー中のポリヌクレオチドの送達は、長時間作用型デポーとして作用するか、及び/またはヌクレアーゼによる分解速度を低下させることによって、ポリヌクレオチドバイオアベイラビリティを改善し得る。
成形されたナノ粒子及び微小粒子
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、ナノ粒子及び/または微小粒子中で製剤化してもよい。一例として、ナノ粒子及び/または微小粒子は、LIQUIDA TECHNOLOGIES(登録商標)(Morrisville,NC)のPRINT(登録商標)技術を用いて製造してもよい(例えば、国際公開番号WO2007024323参照のこと)。
いくつかの実施形態では、ナノ粒子は、本明細書に開示されるポリヌクレオチドのコア及びポリマーシェルを含む。ポリマーシェルは、本明細書に記載されたポリマーのいずれであってもよく、当該技術分野において既知である。さらなる実施形態において、ポリマーシェルを使用して、コア中のポリヌクレオチドを保護してもよい。
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、微小粒子中に製剤化する。この微小粒子は、ポリヌクレオチドのコア、ならびに生体適合性及び/または生分解性ポリマー表層を含んでもよい。非限定的な例として、本開示で使用され得る微小粒子は、米国特許第8,460,709号、米国特許出願公開第20130129830号及び国際特許公開番号WO2013075068に記載されている微小粒子であってもよい。別の非限定的な例として、微小粒子は、所望の期間にわたって本開示のポリヌクレオチドの放出を延長するように設計され得る(例えば、米国特許出願公開第20130129830号における治療タンパク質の持続放出を参照のこと)。
ナノジャケット及びナノリポソーム
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、Keystone Nano(State College、PA)によって、NanoJackets(ナノジャケット)及びNanoLiposomes(ナノリポソーム)中に製剤化され得る。Nanojackets(ナノジャケット)は、カルシウム、リン酸塩を含む、体内に自然に存在する化合物でできており、少量のケイ酸塩を含んでもよい。NanoJacketsは、5~50nmのサイズの範囲であってもよく、限定するものではないが、ポリヌクレオチドなどの親水性及び疎水性化合物を送達するために使用され得る。
NanoLiposomes(ナノリポソーム)は、限定するものではないが、体内に天然に存在する脂質などの脂質でできている。ナノリポソームは、60~80nmのサイズの範囲であってもよく、限定するものではないが、ポリヌクレオチドなどの親水性及び疎水性化合物を送達するために使用してもよい。1つの態様において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、限定するものではないが、Ceramide NanoLiposomesなどのNanoLiposome中に製剤化される。
ミニ細胞
1つの態様において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、細菌ミニ細胞中に製剤化してもよい。非限定的な例として、細菌ミニ細胞は、国際公開番号WO2013088250または米国特許出願公開第20130177499号に記載されているものである。本明細書に記載されるポリヌクレオチドなどの治療剤を含む細菌ミニ細胞を、治療剤を脳腫瘍に送達するために使用してもよい。
半固体組成物
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、疎水性マトリックスと製剤化して、半固体組成物を形成する。非限定的な例として、半固体組成物またはペースト様組成物は、国際特許公開番号WO201307604に記載された方法によって製造される。半固体組成物は、国際特許公開番号WO201307604に記載されているような持続性放出製剤であってもよい。
別の実施形態において、半固体組成物はさらに、組成物の周囲に形成された微小孔性膜または生分解性ポリマーを有する(例えば、国際特許公開番号WO201307604を参照)。
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、国際特許公開番号WO201307604に記載されるような半固体混合物の特性を有し得る(例えば、少なくとも10-4N・mm-2の弾性率、及び/または少なくとも100mPa・sの粘度)である。
エキソソーム
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、エキソソーム中に製剤化する。エキソソームは、少なくとも1つのポリヌクレオチドを負荷され、細胞、組織及び/または生物に送達され得る。非限定的な例として、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、国際公開番号WO2013084000に記載されているエキソソーム中にロードしてもよい。
シルクベースの送達
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、持続放出シルクベースの送達システム中で製剤化する。シルクフィブロイン溶液を、限定するものではないが、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せをなどの治療剤と接触させることによって、シルクベースの送達システムを形成してもよい。非限定的な例として、本開示で使用することができる持続性放出シルクベースの送達システム及びそのようなシステムを作製する方法は、米国特許出願公開第20130177611号に記載されている。
微小粒子
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せは、微小粒子を含む。微小粒子は、限定するものではないが、ポリ(α-ヒドロキシ酸)、ポリヒドロキシ酪酸、ポリカプロラクトン、ポリオルトエステル及びポリ無水物などの本明細書に記載されるか、及び/または当技術分野で公知のポリマーを含んでもよい。微小粒子は、ポリヌクレオチドなどの生物学的に活性な分子を吸着する吸着剤表面を有し得る。非限定的な例として、本開示で使用するための微小粒子及び微小粒子の作製方法は、米国特許出願公開第2013195923号及び同第20130195898号及び米国特許第8,309,139号及び同第8,206,749号に記載されている。
別の実施形態において、製剤は、微小粒子及びポリヌクレオチドを含むマイクロエマルジョンである。非限定的な例として、微小粒子を含むマイクロエマルジョンは、米国特許出願公開第2013195923号及び同第20130195898号、ならびに米国特許第8,309,139号及び第第8,206,749号に記載されている。
アミノ酸脂質
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを、アミノ酸脂質中に製剤化する。アミノ酸脂質は、アミノ酸残基及び1つ以上の親油性末端を含む親油性化合物である。アミノ酸脂質及びアミノ酸脂質の作製方法の非限定的な例は、米国特許第8,501,824号に記載されている。
いくつかの実施形態では、アミノ酸脂質は、親水性部分及び親油性部分を有する。親水性部分はアミノ酸残基であってもよく、親油性部分は少なくとも1つの親油性尾部を含んでもよい。
いくつかの実施形態では、アミノ酸脂質製剤を使用して、ポリヌクレオチドを対象に送達する。
別の実施形態では、アミノ酸脂質製剤は、ポリヌクレオチドに結合し放出するアミノ酸脂質を含む放出可能な形態のポリヌクレオチドを送達する。非限定的な例として、ポリヌクレオチドの放出は、限定するものではないが、米国特許第7,098,032号、同第6,897,196号、同第6,426,086号、同第7,138,382号、同第5,563,250号及び同第5,505,931号に記載されているような酸不安定性リンカーによって提供され得る。
微小胞
いくつかの実施形態において、IL-23、IL-36-ガンマ、IL-18及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドが、微小胞中に製剤化される。微小胞の非限定的な例としては、米国特許出願公開第20130209544号に記載されるものが挙げられる。
いくつかの実施形態では、微小胞は、ARRDC1媒介性微小胞(ARMM)である。ARMMの非限定的な例及びARMMを作製する方法は、国際特許公開番号WO2013119602号に記載されている。
高分子電解質間複合体
いくつかの実施形態では、IL-23、IL-36-ガンマ、IL-18及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、高分子電解質間複合体中に製剤化する。高分子電解質間複合体は、電荷-ダイナミックポリマーが1つ以上のアニオン分子と複合体を形成するときに形成される。電荷動的ポリマー及び高分子電解質間複合体の非限定的な例、ならびに高分子電解質間複合体を作製する方法は、米国特許第8,524,368号に記載されている。
結晶性ポリマー系
いくつかの実施形態では、IL-23、IL-36-ガンマ、IL-18及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、結晶性ポリマー系中に製剤化する。結晶性ポリマー系は、結晶性部分及び/または結晶性部分を含む末端単位を有するポリマーである。「CYCポリマー」と呼ばれる結晶性部分を含む結晶性部分及び/または末端単位を有するポリマー、結晶性ポリマー系及びそのようなポリマー及び系を作製する方法の非限定的な例は、米国特許第8,524,259号に記載されている。
賦形剤
医薬製剤は、本明細書中で使用される場合、限定するものではないが、所望の特定の剤形に適した、ありとあらゆる溶媒、分散媒、希釈剤または他の液体ビヒクル、分散または懸濁助剤、表面活性剤、等張剤、増粘または乳化剤、保存剤、固体結合剤、潤滑剤、香味剤、安定剤、酸化防止剤、浸透圧調節剤、pH調整剤などを含む医薬として許容され得る賦形剤をさらに含んでもよい。医薬組成物を製剤化するための様々な賦形剤及びその組成物を調製するための技術は、当技術分野で公知である(Remington:The Science and Practice of Pharmacy、21st、Edition,A.R.Gennaro(Lippincott、Williams&Wilkins、Baltimore、MD、2006を参照のこと)。任意の従来の賦形剤媒体が、任意の望ましくない生物学的効果を生じさせることによって、またはそうでなければその医薬組成物の任意の他の成分と有害な様式で相互作用することなどによって、物質またはその誘導体と不適合である場合を除いて、本開示の範囲内で、従来の賦形剤媒体の使用が考慮され得、その使用は本開示の範囲内にあると考えられる。
いくつかの実施形態において、医薬として許容され得る賦形剤は、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%純粋である。いくつかの実施形態では、賦形剤は、ヒト及び獣医学的使用のための使用が承認されている。いくつかの実施形態では、賦形剤は、United States and Drug Administration(米国食品医薬品局)によって承認され得る。いくつかの実施形態において、賦形剤は、薬学的グレードのものであってもよい。いくつかの実施形態では、賦形剤は、米国薬局方(USP)、欧州薬局方(EP)、英国薬局方及び/または国際薬局方の基準を満たし得る。
医薬組成物の製造に使用される医薬として許容され得る賦形剤としては、限定するものではないが、不活性希釈剤、分散剤及び/または顆粒剤、表面活性剤及び/または乳化剤、崩壊剤、結合剤、保存剤、緩衝剤、滑沢剤、及び/または油が挙げられる。そのような賦形剤は、任意選択で、医薬組成物に含まれてもよい。組成物はまた、ココアバター及び座薬ワックスのような賦形剤、着色剤、コーティング剤、甘味剤、着香剤及び/または香料を含んでもよい。
例示的な希釈剤としては、限定するものではないが、炭酸カルシウム、炭酸ナトリウム、リン酸カルシウム、リン酸二カルシウム、硫酸カルシウム、リン酸水素カルシウム、リン酸ナトリウムラクトース、スクロース、セルロース、微結晶性セルロース、カオリン、マンニトール、ソルビトール、イノシトール、塩化ナトリウム、乾燥デンプン、コーンスターチ、粉末糖など、及び/またはそれらの組合せが挙げられる。
例示的な造粒剤及び/または分散剤としては、限定するものではないが、ジャガイモデンプン、コーンスターチ、タピオカデンプン、デンプングリコール酸ナトリウム、粘土、アルギン酸、グアーガム、柑橘類パルプ、寒天、ベントナイト、セルロース及び木製品、天然スポンジ、陽イオン交換樹脂、炭酸カルシウム、ケイ酸塩、炭酸ナトリウム、架橋ポリ(ビニル-ピロリドン)(クロスポビドン)、カルボキシメチルスターチナトリウム(デンプングリコール酸ナトリウム)、カルボキシメチルセルロース、架橋ナトリウムカルボキシメチルセルロース(クロスカルメロース)、メチルセルロース、アルファ化デンプン(デンプン1500)、微晶質デンプン、水不溶性デンプン、カルシウムカルボキシメチルセルロース、マグネシウムアルミニウムシリケート(VEEGUM(登録商標))、ラウリル硫酸ナトリウム、四級アンモニウム化合物等、及び/またはそれらの組合せが挙げられる。
例示的な界面活性剤及び/または乳化剤としては、限定するものではないが、天然の乳化剤(例えば、アカシア、寒天、アルギン酸、アルギン酸ナトリウム、トラガカント、コンドルクス(chondrux)、コレステロール、キサンタン、ペクチン、ゼラチン、卵黄、カゼイン、羊毛脂、コレステロール、ワックス及びレシチン)、コロイド粘土(例えば、ベントナイト[ケイ酸アルミニウム]及びVEEGUM(登録商標)[ケイ酸アルミニウムマグネシウム])、長鎖アミノ酸誘導体、高分子量アルコール(例えば、ステアリルアルコール、セチルアルコール、オレイルアルコール、トリアセチンモノステアレート、エチレングリコールジステアレート、グリセリルモノステアレート及びプロピレングリコールモノステアレート、ポリビニルアルコール)、カルボマー(例えば、カルボキシポリメチレン、ポリアクリル酸、アクリル酸ポリマー、及びカルボキシビニルポリマー)、カラギーナン、セルロース誘導体(例えば、カルボキシメチルセルロースナトリウム、粉末セルロース、ヒドロキシメチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース)、ソルビタン脂肪酸エステル(例えば、ポリオキシエチレンソルビタンモノラウレート[TWEEN(登録商標)20]、ポリオキシエチレンソルビタン[TWEEN(登録商標)60]、ポリオキシエチレンソルビタンモノオレエート[TWEEN(登録商標)80]、ソルビタンモノパルミテート[SPAN(登録商標)40]、ソルビタンモノステアレート[SPAN(登録商標)60]、ソルビタントリステアレート[SPAN(登録商標)65]、グリセリルモノオレエート、ソルビタンモノオレアート[SPAN(登録商標)80])、ポリオキシエチレンエステル(例えば、ポリオキシエチレンモノステアレート[MYRJ(登録商標)45]、ポリオキシエチレン硬化ヒマシ油、ポリエトキシル化ヒマシ油、ポリオキシメチレンステアレート、及びSOLUTOL(登録商標))、ショ糖脂肪酸エステル、ポリエチレングリコール脂肪酸エステル(例えば、CREMOPHOR(登録商標))、ポリオキシエチレンエーテル(例えば、ポリオキシエチレンラウリルエーテル[BRIJ(登録商標)30])、ポリ(ビニル-ピロリドン)、ジエチレングリコールモノラウレート、トリエタノールアミンオレエート、オレイン酸ナトリウム、オレイン酸カリウム、オレイン酸エチル、オレイン酸、ラウリン酸エチル、ラウリル硫酸ナトリウム、PLUORINC(登録商標)F68、POLOXAMER(登録商標)188、臭化セトリモニウム、塩化セチルピリジニウム、塩化ベンザルコニウム、ドキュセートナトリウムなど、及び/またはそれらの組合せが挙げられる。
例示的な結合剤としては、限定するものではないが、デンプン(例えば、コーンスターチ及びデンプンペースト);ゼラチン;糖類(例えば、スクロース、グルコース、デキストロース、デキストリン、糖蜜、ラクトース、ラクチトール、マンニトール);アミノ酸(例えば、グリシン);天然および合成のゴム(例えば、アカシア、アルギン酸ナトリウム、アイリッシュ・モスの抽出物、パンワールゴム、ガッチ(ghatti)ガム、イサポール皮(isapol husks)粘液、カルボキシメチルセルロース、メチルセルロース、エチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、微結晶セルロース、酢酸セルロース、ポリ(ビニル-ピロリドン)、マグネシウムアルミニウムシリケート(VEEGUM(登録商標))、及びカラマツアラボガラクタン);アルギン酸塩;ポリエチレンオキシド;ポリエチレングリコール;無機カルシウム塩;ケイ酸;ポリメタクリレート;ワックス;水;アルコール;等;及びそれらの組合せが挙げられる。
例示的な保存剤としては、限定するものではないが、抗酸化剤、キレート剤、抗菌保存剤、抗真菌保存剤、アルコール保存剤、酸性保存剤、及び/または他の保存剤が挙げられる。酸化は、mRNA、特に液体mRNA製剤の潜在的な分解経路である。酸化を防止するために、酸化防止剤を製剤に添加してもよい。例示的な抗酸化剤としては、限定するものではないが、アルファトコフェロール、アスコルビン酸、パルミチン酸アコルビル、ベンジルアルコール、ブチル化ヒドロキシアニソール、EDTA、m-クレゾール、メチオニン、ブチル化ヒドロキシトルエン、モノチオグリセロール、メタ重亜硫酸カリウム、プロピオン酸、没食子酸プロピル、アスコルビン酸ナトリウム、重亜硫酸ナトリウム、メタ重亜硫酸ナトリウム、チオグリセロール及び/または亜硫酸ナトリウムが挙げられる。例示的なキレート剤としては、エチレンジアミン四酢酸(EDTA)、クエン酸一水和物、エデト酸二ナトリウム、エデト酸二カリウム、エデト酸、フマル酸、リンゴ酸、リン酸、エデト酸ナトリウム、酒石酸及び/またはエデト酸三ナトリウムが挙げられる。例示的な抗菌性保存剤としては、限定するものではないが、塩化ベンザルコニウム、塩化ベンゼトニウム、ベンジルアルコール、ブロノポール、セトリミド、塩化セチルピリジニウム、クロルヘキシジン、クロロブタノール、クロロクレゾール、クロロキシレノール、クレゾール、エチルアルコール、グリセリン、ヘキセチジン、イミド尿素、フェノール、フェノキシエタノール、フェニルエチルアルコール、フェニル水銀硝酸塩、プロピレングリコール、及び/またはチメロサールが挙げられる。例示的な抗真菌保存剤としては、限定するものではないが、ブチルパラベン、メチルパラベン、エチルパラベン、プロピルパラベン、安息香酸、ヒドロキシ安息香酸、安息香酸カリウム、ソルビン酸カリウム、安息香酸ナトリウム、プロピオン酸ナトリウム及び/またはソルビン酸が挙げられる。例示的なアルコール保存剤としては、限定するものではないが、エタノール、ポリエチレングリコール、フェノール、フェノール化合物、ビスフェノール、クロロブタノール、ヒドロキシ安息香酸、及び/またはフェニルエチルアルコールが挙げられる。例示的な酸性保存剤としては、限定するものではないが、ビタミンA、ビタミンC、ビタミンE、ベータカロテン、クエン酸、酢酸、デヒドロ酢酸、アスコルビン酸、ソルビン酸、及び/またはフィチン酸が挙げられる。他の保存剤としては、限定するものではないが、トコフェロール、酢酸トコフェロール、メシル酸デテロキシム、セトリミド、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、エチレンジアミン、ラウリル硫酸ナトリウム(SLS)、ラウリルエーテル硫酸ナトリウム(SLES)、亜硫酸水素ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸カリウム、メタ重亜硫酸カリウム、GLYDANT PLUS(登録商標)、PHENONIP(登録商標)、メチルパラベン、GERMALL(登録商標)115、GERMABEN(登録商標)II、NEOLONE(商標)、KATHON(商標)、及び/またはEUXYL(登録商標)が挙げられる。
いくつかの実施形態において、ポリヌクレオチド溶液のpHは、安定性を改善するためにpH5とpH8との間に維持される。pHを制御する例示的な緩衝液としては、限定するものではないが、リン酸ナトリウム、クエン酸ナトリウム、コハク酸ナトリウム、ヒスチジン(またはヒスチジン-HCl)、炭酸ナトリウム及び/またはリンゴ酸ナトリウムが挙げられる。別の実施形態において、上記の例示的な緩衝液は、追加の一価の対イオン(限定するものではないが、カリウムを含む)とともに使用してもよい。二価カチオンは、緩衝液対イオンとしても使用してもよいが、これらは複合体形成及び/またはmRNA分解のせいで好ましくはない。
例示的な緩衝剤としては、また、限定するものではないが、クエン酸緩衝溶液、酢酸緩衝溶液、リン酸緩衝溶液、塩化アンモニウム、炭酸カルシウム、塩化カルシウム、クエン酸カルシウム、グルビオン酸カルシウム、グルセプト酸カルシウム、グルコン酸カルシウム、Dグルコン酸、グリセロリン酸カルシウム、乳酸カルシウム、プロパン酸、レブリン酸カルシウム、ペンタン酸、第二リン酸カルシウム、リン酸、第三リン酸カルシウム、リン酸水酸化カルシウム、酢酸カリウム、塩化カリウム、グルコン酸カリウム、カリウム混合物、リン酸水素二カリウム、リン酸二水素カリウム、リン酸カリウム混合物、酢酸ナトリウム、炭酸水素ナトリウム、塩化ナトリウム、クエン酸ナトリウム、乳酸ナトリウム、二塩基リン酸ナトリウム、一塩基リン酸ナトリウム、リン酸ナトリウム混合物、トロメタミン、水酸化マグネシウム、水酸化アルミニウム、アルギン酸、発熱物質を含まない水、等張性生理食塩水、リンゲル液、エチルアルコールなど、及び/またはそれらの組合せも挙げられる。
例示的な潤滑剤としては、限定するものではないが、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸、シリカ、滑石、モルト(Malt)、ベヘン酸グリセリル、水素添加植物油、ポリエチレングリコール、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウム、ロイシン、ラウリル硫酸マグネシウム、ラウリル硫酸ナトリウム、など、及びそれらの組合せが挙げられる。
例示的な油としては、限定するものではないが、アーモンド油、アプリコット核油、アボカド油、ババス油、ベルガモット油、クロフサスグリ油(black current
seed)、ルリヂサ油、ジュニパータール油、カモミール油、キャノーラ油、カラウェー油、カルナウバ油、ヒマシ油、シナモン油、カカオバター油、ココナッツ油、タラ肝油、コーヒー油、コーン油、綿実油、エミュー油、ユーカリ油、月見草油、魚油、亜麻仁油、ゲラニオール油、ゴード(gourd)油、ブドウ種子油、ヘーゼルナッツ油、ヒソップ油、ミリスチン酸イソプロピル、ホホバ油、ククイナッツ油、ラバンジン油、ラベンダー油、レモン油、アオモジ(litsea cubeba)油、マカダミアナッツ油、アオイ油、マンゴー種子油、メドウフォーム種子油、ミンク油、ナツメグ油、オリーブ油、オレンジ油、オレンジラフィー油、パーム油、パーム核油、杏仁油、ピーナッツ油、ポピー種子油、カボチャ種子油、ナタネ油、コメヌカ油、ローズマリー油、ベニバナ油、ビャクダン油、サザンカ(sasquana)油、セイボリー(savoury)油、シーバックソーン油、ゴマ油、シアバター油、シリコーン油、ダイズ油、ヒマワリ油、ティーツリー油、アザミ油、ツバキ油、ベチバー油、クルミ油、及びコムギ胚芽油が挙げられる。例示的な油としては、限定するものではないが、ステアリン酸ブチル、カプリル酸トリグリセリド、カプリン酸トリグリセリド、シクロメチコン、セバシン酸ジエチル、ジメチコン360、ミリスチン酸イソプロピル、鉱油、オクチルドデカノール、オレイルアルコール、シリコーン油、及び/またはそれらの組合せが挙げられる。
調合者の判断に従って、カカオバター及び坐薬ワックス、着色剤、コーティング剤、甘味剤、着香剤及び/または着香剤などの賦形剤が組成物中に存在してもよい。
例示的な添加剤としては、生理学的に生体適合性の緩衝液(例えば、トリメチルアミン塩酸塩)、キレート剤(例えば、DTPAまたはDTPA-ビスアミドなど)またはカルシウムキレート複合体(例えば、カルシウムDTPA、CaNaDTPA-ビスアミドとして)、または、任意選択で、カルシウム塩もしくはナトリウム塩(例えば、塩化カルシウム、アスコルビン酸カルシウム、グルコン酸カルシウムまたは乳酸カルシウム)の添加が挙げられる。さらに、抗酸化剤及び懸濁化剤を使用してもよい。
mRNAの凍結保護剤
いくつかの実施形態では、ポリヌクレオチド製剤は凍結保護剤を含む。本明細書で使用される場合、「凍結保護剤」という用語は、所定の物質と組み合わせたときに、凍結時に生じるその物質に対する損傷を低減または排除するのに役立つ1つ以上の物質を指す。いくつかの実施形態では、凍結中にポリヌクレオチドを安定化するために凍結保護剤をポリヌクレオチドと組み合わせる。-20℃~-80℃の間のmRNAの凍結保存は、ポリヌクレオチドの長期間(例えば、36ヶ月間)の安定性のために有利であり得る。いくつかの実施形態において、凍結保護剤は、凍結/融解サイクルを通じて、及び凍結保存条件下で、ポリヌクレオチドを安定化させるためにポリヌクレオチド製剤に含まれる。本開示の凍結保護剤としては、限定するものではないが、スクロース、トレハロース、ラクトース、グリセロール、デキストロース、ラフィノース及び/またはマンニトールが挙げられる。トレハロースは、Food and Drug Administration(食品医薬品局)によって一般に安全とみなされるもの(GRAS)として列挙され、市販の医薬製剤に一般的に使用されている。
充填剤
いくつかの実施形態では、ポリヌクレオチド製剤は充填剤を含む。本明細書で使用される場合、「充填剤」という用語は、製剤に所望のコンシステンシーを付与するか、及び/または製剤成分の安定化を付与するために製剤に含まれる1つ以上の剤を指す。いくつかの実施形態において、充填剤は、長期間(例えば、36ヶ月間)保存する間に凍結乾燥されたポリヌクレオチドを安定化させる、「薬学上優れた」ケーキを生じるために、凍結乾燥ポリヌクレオチド製剤中に含まれる。本開示の充填剤は、限定するものではないが、スクロース、トレハロース、マンニトール、グリシン、ラクトース及び/またはラフィノースを含んでもよい。いくつかの実施形態では、凍結中にポリヌクレオチドを安定化させるため、及び凍結乾燥のための充填剤を提供するために、凍結保護剤及び充填剤(例えば、スクロース/グリシンまたはトレハロース/マンニトール)の組合せを含んでもよい。
本開示の製剤及びポリヌクレオチドを製剤化するための方法の非限定的な例はまた、2012年12月14日に出願された国際公開番号WO2013090648にも示される。
裸の送達
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せは、裸の細胞(例えば、腫瘍細胞)に送達され得る。本明細書で使用される場合、「裸の」とは、トランスフェクションを促進する剤を含まないポリヌクレオチドを送達することを指す。例えば、細胞、例えば腫瘍細胞に送達されるポリヌクレオチドは、改変を含まない場合がある。IL-23、IL-36ガンマ、IL-18、及び/またはOX40LポリペプチドをコードするmRNAを含む裸のポリヌクレオチドは、当該分野で公知(例えば、腫瘍内投与)、及び本明細書に記載される投与経路を用いて腫瘍細胞に送達され得る。
非経口投与及び注射可能な投与
非経口投与、例えば、腫瘍内投与のための液体剤形としては、例えば、限定するものではないが、医薬として許容され得るエマルジョン、マイクロエマルジョン、溶液、懸濁物、シロップ、及び/またはエリキシル剤が挙げられる。有効成分に加えて、液体剤形は、当該分野で一般的に使用される不活性希釈剤、例えば、水または他の溶媒、可溶化剤及び乳化剤、例えば、エチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3-ブチレングリコール、ジメチルホルムアミド、オイル(具体的には、綿実油、落花生油、コーン油、胚芽油、オリーブ油、ヒマシ油及びゴマ油)、グリセロール、テトラヒドロフルフリルアルコール、ポリエチレングリコール及びソルビタンの脂肪酸エステル、及びそれらの混合物などを含む。不活性希釈剤に加えて、経口組成物は、アジュバント、例えば、湿潤剤、乳化剤及び懸濁化剤、甘味料、香味料及び/または芳香剤を含んでもよい。非経口投与のためのある特定の実施形態において、組成物は、CREMOPHOR(登録商標)、アルコール、油、変性油、グリコール、ポリソルベート、シクロデキストリン、ポリマー、及び/またはそれらの組合せなどの可溶化剤と混合される。
非経口投与、例えば腫瘍内投与のための医薬組成物は、少なくとも1つの不活性成分を含んでもよい。使用される不活性成分のいずれか、またはいずれも、米国食品医薬品局(FDA)によって承認されていない場合がある。非経口投与のための医薬組成物に使用するための不活性成分の非網羅的なリストとしては、塩酸、マンニトール、窒素、酢酸ナトリウム、塩化ナトリウム及び水酸化ナトリウムが挙げられる。
注射用調製物、例えば、滅菌注射用水性懸濁物または油性懸濁物は、適切な分散剤、湿潤剤、及び/または懸濁化剤を用いて、公知の技術に従って製剤化され得る。滅菌注射用調製物は、例えば、1,3-ブタンジオール中の溶液として、非毒性の非経口的に許容される希釈剤及び/または溶媒中の滅菌注射用溶液、懸濁物及び/またはエマルジョンであってもよい。とりわけ使用することができる許容されるビヒクル及び溶媒とは、水、リンゲル溶液、U.S.P.、及び等張性塩化ナトリウム溶液である。滅菌固定油は、通常、溶媒または懸濁媒体として使用される。この目的のために、合成モノグリセリドまたはジグリセリドを含む任意の低刺激性固定油を使用してもよい。オレイン酸のような脂肪酸は、注射剤の調製に使用してもよい。滅菌製剤はまた、局所麻酔薬、保存剤及び緩衝剤のようなアジュバントを含んでもよい。
例えば、腫瘍内のような注射可能な製剤は、例えば、細菌保持フィルターによる濾過によって、及び/または滅菌水もしくは他の滅菌注射用媒体に使用前に溶解もしくは分散され得る滅菌固体組成物の形態で滅菌剤を組み込むことによって、滅菌され得る。
注射可能な製剤、例えば、腫瘍内の製剤は、組織、器官及び/または対象の領域、例えば腫瘍に直接注射することができる。
活性成分の効果を延長するために、腫瘍内注射からの活性成分の吸収を遅らせることが望ましい場合が多い。これは、水溶性の低い結晶質または非晶質の材料の液体懸濁物の使用によって達成され得る。次いで、薬物の吸収速度は、その溶解速度に依存し、その溶解速度は、結晶サイズ及び結晶形態に依存し得る。あるいは、非経口投与された剤形の遅延吸収は、その薬物を油性ビヒクル中に溶解または懸濁させることによって達成される。注射可能なデポー形態は、ポリラクチド-ポリグリコリドのような生分解性ポリマー中に薬物のマイクロカプセルマトリックスを形成することによって作製される。薬物対ポリマーの比及び使用される特定のポリマーの性質に依存して、薬物放出速度を制御し得る。他の生分解性ポリマーの例としては、ポリ(オルトエステル)及びポリ(無水物)が挙げられる。デポー注射用製剤は、体組織に適合するリポソームまたはマイクロエマルジョン中に薬剤を封じ込めることによって調製される。
剤形
本明細書に記載される医薬組成物は、局所、鼻腔内、気管内または注射(例えば、静脈内、腫瘍内、眼内、硝子体内、筋肉内、心臓内、腹腔内、皮下)などの本明細書に記載される剤形に製剤化してもよい。
液体剤形
非経口投与(例えば、腫瘍内)のための液体剤形としては、限定するものではないが、医薬として許容され得るエマルジョン、マイクロエマルジョン、溶液、懸濁物、シロップ及び/またはエリキシルが挙げられる。有効成分に加えて、液体剤形は、水または他の溶媒、可溶化剤及び乳化剤、例えば、エチルアルコール、イソプロピルアルコール、エチルカーボネート、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3-ブチレングリコール、ジメチルホルムアミド、オイル(具体的には、綿実油、落花生油、コーン油、胚芽油、オリーブ油、ヒマシ油及びゴマ油)、グリセロール、テトラヒドロフルフリルアルコール、ポリエチレングリコール及びソルビタンの脂肪酸エステル、ならびにそれらの混合物が挙げられる。非経口投与のためのある特定の実施形態において、組成物は、可溶化剤、例えば、CREMOPHOR(登録商標)、アルコール、オイル、変性油、グリコール、ポリソルベート、シクロデキストリン、ポリマー、及び/またはそれらの組合せと混合されてもよい。
注射可能
注射可能な調製物(例えば、腫瘍内)、例えば、滅菌注射用水性または油性懸濁物は、公知の技術に従って製剤化されてもよく、これには、適切な分散剤、湿潤剤及び/または懸濁化剤を含んでもよい。滅菌注射用調製物は、非毒性の非経口的に許容される希釈剤及び/または溶媒(例えば、1,3-ブタンジオール中の溶液)中の滅菌注射用溶液、懸濁物、及び/またはエマルジョンであってもよい。なかでも、使用することができる許容されるビヒクル及び溶媒としては、限定するものではないが、水、リンゲル溶液、U.S.P.、及び等張性塩化ナトリウム溶液が挙げられる。滅菌固定油は、通常、溶媒または懸濁媒体として使用される。この目的のために、合成モノグリセリドまたはジグリセリドを含む任意の低刺激性固定油を使用してもよい。オレイン酸のような脂肪酸を、注射剤の調製に使用してもよい。
注射可能な製剤は、例えば、細菌保持フィルターによる濾過によって、及び/または滅菌水もしくは他の滅菌注射用媒体に使用前に溶解または分散され得る滅菌固体組成物の形態で滅菌剤を組み込むことによって、滅菌され得る。
活性成分の効果を延長するために、皮下または筋肉内注射からの活性成分の吸収を遅らせることが望ましい場合がある。これは、水溶性の低い結晶質または非晶質の材料の液体懸濁物の使用によって達成され得る。次いで、ポリヌクレオチドの吸収速度は、その溶解速度に依存し、その溶解速度は、結晶サイズ及び結晶形態に依存し得る。あるいは、非経口的に投与されたポリヌクレオチドの吸収遅延は、油性ビヒクル中にポリヌクレオチドを溶解または懸濁させることによって達成され得る。注射可能なデポー形態は、ポリラクチド-ポリグリコリドのような生分解性ポリマー中のポリヌクレオチドのマイクロカプセルマトリックスを形成することによって作製される。ポリマーに対するポリヌクレオチドの比、及び使用される特定のポリマーの性質に依存して、ポリヌクレオチドの放出速度が制御され得る。他の生分解性ポリマーの例としては、限定するものではないが、ポリ(オルトエステル)及びポリ(無水物)が挙げられる。デポーの注射可能な製剤は、ポリヌクレオチドを体組織に適合するリポソームまたはマイクロエマルジョンに封じ込めることによって調製され得る。
腫瘍内送達の方法
本明細書に開示される医薬組成物は、腫瘍への投与に適している。「腫瘍」という用語は、本明細書では広い意味で使用され、生理学的機能を持たず、かつ制御されない通常の急速な細胞増殖から生じる任意の異常な新生組織の成長を指す。本明細書で使用される「腫瘍」という用語は、良性腫瘍及び悪性腫瘍の両方に関する。
ある特定の実施形態において、本開示は、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18をコードするmRNAを含むポリヌクレオチドを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを、腫瘍に送達する方法を提供し、この方法は、本明細書に記載される医薬組成物中にポリヌクレオチドを、例えば、脂質ナノ粒子形態で製剤化すること、及び医薬組成物を腫瘍へ投与することを包含する。腫瘍へのこの医薬組成物の投与は、当技術分野で公知の任意の方法(例えば、ボーラス注射、灌流、外科的移植など)を用いて行ってもよい。
本明細書中に開示される腫瘍内投与のための医薬組成物を用いる、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの、単独または組み合わせての腫瘍への送達によって:
(i)腫瘍におけるポリヌクレオチドの保持を増大させること;
(ii)腫瘍周辺組織において発現されたポリペプチドのレベルと比較して、腫瘍において発現されたポリペプチドのレベルを増大させること;
(iii)オフターゲット組織(例えば、腫瘍周囲組織、または遠隔の場所、例えば肝臓組織)へのポリヌクレオチドまたは発現産物の漏出を減少させること;または、
(iv)それらのいずれかの組合せ、
が可能になり、
ここで、特定の特性に関して観察される増大または減少とは、対応する参照組成物(例えば、式(I)の化合物が存在しないか、または別のイオン性アミノ脂質、例えばMC3で置換されている組成物)と比較したものである。
1つの実施形態において、漏出の減少は、非腫瘍組織、例えば、腫瘍周囲組織または別の組織もしくは器官、例えば、肝臓組織における腫瘍におけるポリペプチド発現に対する、腫瘍におけるポリペプチド発現の比の増大として定量化され得る。
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらの組合せを腫瘍に送達することは、IL-23、IL-36ガンマ、IL-18及び/またはOX40Lポリペプチドをコードするポリヌクレオチドを含む、本明細書に開示される医薬組成物を、例えば、ナノ粒子の形態で対象に投与することを包含し、ここでこの医薬組成物の投与は、腫瘍を組成物と接触させることを包含する。
IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドは、腫瘍中の細胞と医薬組成物とを接触させる際にmRNAである場合は、翻訳可能なmRNAを細胞内で翻訳して目的のポリペプチドを産生し得る。しかし、実質的に翻訳可能ではないmRNAもまた、腫瘍に送達され得る。実質的に非翻訳可能なmRNAは、ワクチンとして有用である場合もあり、及び/または細胞の翻訳成分を隔離して、細胞内の他の種の発現を低下させる場合もある。
本明細書に開示される医薬組成物は、特異的送達を増大し得る。本明細書中で使用される場合、「特異的送達」という用語は、より多くの(例えば、少なくとも1.5倍、少なくとも2倍超、少なくとも3倍超、少なくとも4倍超、少なくとも5倍超、少なくとも6倍超、少なくとも7倍超、少なくとも8倍超、少なくとも9倍超、少なくとも10倍超)のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、本明細書に開示される医薬組成物によって(例えば、ナノ粒子形態で)、オフターゲット組織(例えば、哺乳動物の肝臓)と比較して、目的の標的組織(例えば、腫瘍)へ送達することを意味する。
特定の組織へのナノ粒子の送達のレベルは、例えば、
(i)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドから発現されるタンパク質の量を組織中で前記組織の重量に対して比較すること;
(ii)組織中のポリヌクレオチドの量を前記組織の重量と比較すること;または
(iii)IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドから発現されるタンパク質の量を、組織中で前記組織中の総タンパク質量と比較すること、
によって測定され得る。
腫瘍または腫瘍における特定のクラスの細胞への特異的送達は、IL-23、IL-36ガンマ及び/またはOX40Lポリペプチドをコードするポリヌクレオチドを含む、より高い割合の医薬組成物が、医薬組成物の対象への投与の際に、他のオフターゲットの目的地と比較して、標的の目的地(例えば、標的組織)に送達される。
改善された腫瘍内送達のための方法
本開示はまた、本明細書中に開示される医薬組成物(例えば、ナノ粒子形態)が腫瘍に投与されるとき、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの改善された腫瘍内送達を達成する方法を提供する。送達におけるこの改善は、例えば、
(i)腫瘍中において、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの保持の増大;
(ii)腫瘍周囲組織における発現されたポリペプチドのレベルと比較した、腫瘍における発現されたポリペプチドのレベルの増大;
(iii)オフターゲット組織(例えば、腫瘍周囲組織、または遠隔の場所、例えば肝臓組織)へのポリヌクレオチドまたは発現産物の漏出の減少;または、
(iv)それらのいずれかの組合せ、
に起因し得、
ここで、特定の特性について観察される増大または低下とは、対応する参照組成物(例えば、式(I)の化合物が存在しないか、または別のイオン性アミノ脂質、例えばMC3で置換されている組成物)と比較したものである。
1つの実施形態において、漏出の減少は、非腫瘍組織、例えば、腫瘍周囲組織または別の組織もしくは器官、例えば、肝臓組織における、ポリペプチド発現に対する腫瘍におけるポリペプチド発現の比の増大として定量され得る。
本明細書中に開示される医薬組成物を使用する結果として生じる送達の別の改善とは、他の脂質成分が、同じ治療剤または治療剤をコードするポリヌクレオチドを送達するために使用される場合に観察される免疫応答に対する免疫応答の低下である。
したがって、本開示は、対象の腫瘍組織における治療剤(例えば、医薬組成物の一部として投与されるポリペプチド)の保持を増大させる方法であって、腫瘍組織の腫瘍内に、本明細書に開示される医薬組成物を投与することを包含し、腫瘍組織における治療剤の保持が、対応する参照組成物の投与後の腫瘍組織における治療剤の保持と比較して増大している方法を提供する。
また、対象における腫瘍組織中のポリヌクレオチドの保持を増大させる方法であって、腫瘍組織の腫瘍内に、本明細書に開示される医薬組成物を投与することを包含し、腫瘍組織におけるポリヌクレオチドの保持が、対応する参照組成物の投与後の腫瘍組織におけるポリヌクレオチドの保持と比較して増大している方法も提供する。
対象における腫瘍組織中で発現されたポリペプチドの保持を増大する方法であって、本明細書に開示される医薬組成物を腫瘍組織に投与することを包含し、この医薬組成物が、発現されたポリペプチドをコードするポリヌクレオチドを含み、かつ腫瘍組織における発現したポリペプチドの保持が、対応する参照組成物を投与した後の腫瘍組織におけるポリペプチドの保持と比較して増大されている方法も提供される。
本開示はまた、腫瘍内投与されたポリヌクレオチドの発現漏出を減少させることを必要とする対象に腫瘍内投与されたポリヌクレオチドの発現漏出を減少させる方法であって、本明細書に開示される医薬組成物として前記腫瘍組織に対して腫瘍内に前記ポリヌクレオチドを投与することを含み、ここで非腫瘍組織中のポリペプチドの発現レベルは、対応する参照組成物を投与した後の非腫瘍組織中のポリペプチドの発現レベルと比較して減少している方法も提供する。
腫瘍内投与される治療剤(例えば、医薬組成物の一部として投与されるポリペプチド)の発現漏出を減少させることを必要とする対象に腫瘍内投与される治療剤の発現漏出を減少させる方法であって、前記治療剤を腫瘍組織に腫瘍内に、本明細書に開示される医薬組成物として投与することを含み、ここで非腫瘍組織中の治療剤の量が、対応する参照組成物を投与した後の非腫瘍組織中の治療剤の量と比較して減少している、方法も提供される。
対象の腫瘍における発現されたポリペプチドの発現漏出を低下する方法であって、本明細書に開示される医薬組成物を腫瘍組織に投与することを含み、この医薬組成物が、発現されたポリペプチドをコードするページ : 345
ポリヌクレオチドを含み、非腫瘍組織中の発現されたポリペプチドの量が、対応する参照組成物の投与後の非腫瘍組織中の発現されたポリペプチドの量と比較して減少している方法も提供される。
いくつかの実施形態では、非腫瘍組織は、腫瘍周囲組織である。他の実施形態では、非腫瘍組織は肝臓組織である。
本開示はまた、医薬組成物、例えば、当該技術分野において既知である脂質を含む医薬組成物の腫瘍内投与によって引き起こされる免疫応答を、そのような組成物中の1つまたは全ての脂質を式(I)の化合物で置き換えることによって、低減または予防する方法も提供した。例えば、MC3(または当該技術分野において既知である他の脂質)を含む医薬組成物中のIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの投与によって生じる免疫応答を、式(I)の化合物(例えば、化合物18)でMC3を置き換えることによって予防する(回避する)か、または改善し得る。
いくつかの実施形態では、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを本明細書に開示される医薬組成物中で投与した後に観察される免疫応答は、治療剤またはIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、もしくはそれらのいずれかの組合せを、リン酸緩衝生理食塩水(PBS)または別の生理学的緩衝溶液(例えば、リンゲル溶液、タイロード溶液、ハンクス平衡塩溶液など)の中で投与した時に観察される免疫応答と比較して上昇していない。
いくつかの実施形態では、治療剤、またはIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、もしくはそれらのいずれかの組合せを、本明細書に開示される医薬組成物中で投与した後に観察される免疫応答は、PBSまたは別の生理学的緩衝溶液が単独で投与された場合に観察される免疫応答と比較して上昇しない。
いくつかの実施形態では、本明細書中に開示される医薬組成物が対象に腫瘍内投与される場合、免疫応答は観察されない。
したがって、本開示はまた、治療剤またはIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、それを必要とする対象に送達する方法であって、本明細書に開示される医薬組成物を対象に腫瘍内投与することを包含し、ここでこの医薬組成物の投与によって引き起こされる免疫応答が、以下、
(i)PBS単独、または別の生理学的緩衝溶液(例えば、リンゲル溶液、タイロード溶液、ハンクス平衡塩溶液など);
(ii)治療剤、またはIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びIL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチドを、PBSもしくは別の生理学的緩衝液溶液中で;または治療剤もしくはIL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、PBSもしくは別の生理学的緩衝溶液中で;あるいは、
(iii)対応する参照組成物、すなわち式(I)の化合物が別のイオン性アミノ脂質、例えば、MC3で置換された同じ医薬組成物、
の腫瘍内投与によって引き起こされる免疫応答と比較して上昇していない方法を提供する。
XIII.キットとデバイス
キット
本開示は、本開示の方法または組成物を簡便に及び/または効果的に実施するための様々なキットを提供する。典型的には、キットは、ユーザが対象の複数の処置を行うか、及び/または複数の実験を行うことを可能にするのに十分な量及び/または数の構成要素を備える。
1つの態様において、本開示は、本開示のポリヌクレオチドを備えるキットを提供する。いくつかの実施形態では、このキットは、1つ以上のポリヌクレオチドを備える。
このキットは、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを含む、タンパク質の産生のためであり得る。このキットはさらに、パッケージング及び使用説明書及び/または製剤組成物を形成するための送達剤を備える。この送達剤は、本明細書に開示されている生理食塩水、緩衝溶液、リピドイドまたは任意の送達剤を含んでもよい。
いくつかの態様では、本開示は、ポリヌクレオチド(例えば、mRNA)組成物または本明細書に開示されるポリヌクレオチド(例えば、mRNA)を含む脂質ナノ粒子を含む容器と、任意の医薬として許容され得る担体と、個体におけるがんの進行を処置または遅延させるための脂質ナノ粒子または医薬組成物の投与のための使用説明書を含む添付文書とを備えるキットを提供する。いくつかの態様では、この添付文書は、個体におけるがんの進行を処置または遅延させるための、チェックポイント阻害剤ポリペプチド及び任意の医薬として許容され得る担体を含む組成物と組み合わせた、医薬組成物の投与のための説明書をさらに備える。
他の態様では、本開示は、本明細書に開示されるポリヌクレオチド(例えば、mRNA)及び任意の医薬として許容され得る担体を含む脂質ナノ粒子を含む医薬、ならびに医薬の投与のための使用説明書を含む添付文書を単独で、または個体におけるがんの進行を処置もしくは遅延させるためのチェックポイント阻害剤ポリペプチド及び任意の医薬として許容され得る担体を含む組成物と組み合わせて備えるキットを提供する。いくつかの態様では、このキットは、個体におけるがんの進行を治療または遅延させるための第1の医薬及び第2の医薬の投与のための説明書を備える添付文書をさらに備える。
関連する態様において、チェックポイント阻害剤ポリペプチドは、PD1、PD-L1、CTLA4、またはそれらの組合せを阻害する。いくつかの態様において、チェックポイント阻害剤ポリペプチドとは、抗体、例えば、抗CTLA4抗体またはCTLA4に特異的に結合するその抗原結合断片、抗PD1抗体またはPD1に特異的に結合するその抗原結合断片、抗PD-L1抗体、またはPD-L1に特異的に結合するその抗原結合断片、及びそれらの組合せである。いくつかの態様において、チェックポイント阻害剤ポリペプチドは、アテゾリズマブ、アベルマブ、またはデュルバルマブから選択される抗PD-L1抗体である。いくつかの態様において、チェックポイント阻害剤ポリペプチドは、トレメリムマブまたはイピリムマブから選択される抗CTLA-4抗体である。いくつかの態様において、チェックポイント阻害剤ポリペプチドは、ニボルマブまたはペムブロリズマブから選択される抗PD1抗体である。
いくつかの実施形態において、キットは、例えば、塩化ナトリウム、塩化カルシウム、リン酸塩及び/またはEDTAを含む緩衝液を備える。別の実施形態において、緩衝液としては、限定するものではないが、生理食塩水、2mMカルシウムを含む生理食塩水、5%スクロース、2mMカルシウムを含む5%スクロース、5%マンニトール、2mMカルシウムを含む5%マンニトール、リンゲル乳酸塩、塩化ナトリウム、2mMのカルシウム及びマンノースを含む塩化ナトリウム(例えば、米国特許出願公開第20120258046号を参照のこと)が挙げられる。さらなる実施形態において、緩衝溶液は沈殿されるか、または凍結乾燥される。各成分の量は、一貫した、再現性のある高濃度の生理食塩水または単純な緩衝液製剤を可能にするように変更されてもよい。成分はまた、ある期間にわたって、及び/または種々の条件下で、緩衝液中の修飾RNAの安定性を増大させるために変化されてもよい。1つの態様において、本開示は、標的細胞に導入された場合に翻訳可能領域によってコードされるタンパク質の所望量を産生するのに有効な量で提供される、翻訳可能領域を含むポリヌクレオチドと;細胞の先天性免疫応答を実質的に阻害するのに有効な量で提供される、阻害性核酸を含む第2のポリヌクレオチドと;パッケージング及び使用説明書を備える、タンパク質産生のためのキットを提供する。
1つの態様において、本開示は、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及び/またはOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドであって、このポリヌクレオチドが、細胞ヌクレアーゼによる分解の減少を示すポリヌクレオチド、ならびにパッケージング及び使用説明書を備えるタンパク質産生のためのキットを提供する。
いくつかの実施形態では、単一ポリヌクレオチドは、(i)IL-23ポリペプチドをコードするmRNA及びIL-36ガンマポリペプチドをコードするmRNAもしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、(ii)IL-23ポリペプチドをコードするmRNA及びOX40LポリペプチドをコードするmRNA、または(iii)IL-36ガンマポリペプチドをコードするmRNA、もしくはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNA、を含む。いくつかの実施形態において、単一ポリヌクレオチドは、IL-23ポリペプチドをコードするmRNA、IL-36ガンマポリペプチドをコードするmRNA、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、第3のタンパク質(例えば、OX40Lポリペプチド)をコードするmRNA、またはそれらのいずれかの組合せを含む。
デバイス
本開示は、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチドを組み込み得るデバイスを提供する。例えば、このデバイスは、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチド、またはそれらのいずれかの組合せを組み込んでもよい。これらのデバイスは、ヒト患者のような、それを必要とする対象に即座に送達可能な製剤中にポリヌクレオチドを合成するための試薬を安定な製剤中に含む。いくつかの実施形態において、単一のポリヌクレオチドは、IL-23ポリペプチドをコードするmRNA及びIL-36ガンマポリペプチドをコードするmRNA、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチドを含む。いくつかの実施形態において、単一ポリヌクレオチドは、IL-23ポリペプチドをコードするmRNA、IL-36ガンマポリペプチドをコードするmRNA、またはIL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、OX40LポリペプチドをコードするmRNA、またはそれらの組合せを含む。
投与のためのデバイスは、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-36ガンマポリペプチドをコードするmRNAを含むポリヌクレオチド、IL-18ポリペプチドをコードするmRNAを含むポリヌクレオチド、及びOX40LポリペプチドをコードするmRNAを含むポリヌクレオチドを、本明細書に教示される単回投与、複数回投与または分割投与計画によって送達するために使用され得る。そのようなデバイスは、例えば、国際公開番号WO2013151666A2号に教示されている。
細胞、器官及び組織への複数投与のための当該技術分野において既知である方法及びデバイスは、本開示の実施形態として、本明細書に開示される方法及び組成物と組み合わせた使用について、企図される。これらとしては、例えば、複数のニードルを有する方法及びデバイス、例えばルーメンまたはカテーテルを使用するハイブリッドデバイス、ならびに熱、電流または放射線駆動機構を利用するデバイスが挙げられる。
本開示によれば、これらの複数投与装置を利用して、本明細書で企図される単一用量、複数用量または分割用量を送達してもよい。そのような装置は、例えば、国際公開番号WO2013151666A2号に教示されている。
本開示の他の実施形態:
E1.腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害することを必要とする対象において腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害する方法であって、対象に対して少なくとも2つのポリヌクレオチドを組み合わせて投与することを包含し、ここで、前記少なくとも2つのポリヌクレオチドが、インターロイキン-23(IL-23)ポリペプチドを含む第1のタンパク質をコードする第1のポリヌクレオチド、インターロイキン-36ガンマ(IL-36ガンマ)ポリペプチドを含む第2のタンパク質をコードする第2のポリヌクレオチド、及びOX40Lポリペプチドを含む第3のタンパク質をコードする第3のポリヌクレオチドから選択される、前記方法。
E2.実施形態1に記載の方法であって、前記少なくとも2つのポリヌクレオチドが、(i)前記第1のポリヌクレオチド及び前記第2のポリヌクレオチド;(ii)前記第1のポリヌクレオチド及び前記第3のポリヌクレオチド;(iii)前記第2のポリヌクレオチド及び第3のポリヌクレオチド;または(iv)前記第1のポリヌクレオチド、前記第2のポリヌクレオチド、及び前記第3のポリヌクレオチドを含む、前記方法。
E3.実施形態1に記載の方法であって、前記少なくとも2つのポリヌクレオチドが、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド、前記及び第3のポリヌクレオチドを含む、前記方法。
E4.実施形態1に記載の方法であって、前記投与が、(i)前記第1のタンパク質をコードする前記第1のポリヌクレオチドの投与;(ii)前記第2のタンパク質をコードする前記第2のポリヌクレオチドの投与;または(iii)前記第3のタンパク質をコードする前記第3のポリヌクレオチドの投与よりも、少なくとも1.5倍、少なくとも2倍、少なくとも2.5倍、少なくとも3倍、少なくとも3.5倍、少なくとも4倍、少なくとも4.5倍、または少なくとも5倍良く腫瘍の大きさを減少もしくは低下させるか、または腫瘍の成長を阻害する、前記方法。
E5.実施形態1または4に記載の方法であって、前記第1のポリヌクレオチドが、前記第1のタンパク質をコードするmRNAを含む、前記方法。
E6.実施形態1~5のいずれか1つに記載の方法であって、前記第2のポリヌクレオチドが、前記第2のタンパク質をコードするmRNAを含む、前記方法。
E7.実施形態1~6のいずれか1つに記載の方法であって、前記第3のポリヌクレオチドが、第3のタンパク質をコードするmRNAを含む、前記方法。
E8.実施形態1~7のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドが、少なくとも1つの化学的に修飾されたヌクレオシドを含む、前記方法。
E9.実施形態8に記載の方法であって、前記少なくとも1つの化学的に修飾されたヌクレオシドが、セクションXIに列挙される任意のヌクレオシド及びそれらの組合せからなる群より選択される、前記方法。
E10.実施形態8または9に記載の方法であって、前記少なくとも1つの化学的に修飾されたヌクレオシドは、シュードウリジン、N1-メチルシュードウリジン、5-メチルシトシン、5-メトキシウリジン、及びそれらの組合せからなる群より選択される、前記方法。
E11.実施形態1~10のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチド中の前記ヌクレオシドが、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾されている、方法。
E12.実施形態8~11のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチド中の前記化学的に修飾されたヌクレオシドが、ウリジン、アデニン、シトシン、グアニン、及びそれらのいずれかの組合せからなる群より選択される、前記方法。
E13.実施形態1~12のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチド中のウリジンヌクレオシドが、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾されている、前記方法。
E14.実施形態1~13のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、第2のポリヌクレオチド及び/または第3のポリヌクレオチド中のアデノシンヌクレオシドが、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾されている、前記方法。
E15.実施形態1~14のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチド中のシチジンヌクレオシドが、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾されている、前記方法。
E16.実施形態1~15のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチド中のグアノシンヌクレオシドが、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも99%、または100%化学的に修飾されている、前記方法。
E17.実施形態5~16のいずれか1つに記載の方法であって、前記第1のタンパク質をコードするmRNA、前記第2のタンパク質をコードするmRNA、及び前記第3のタンパク質をコードするmRNAの各々が、オープンリーディングフレームを含む、前記方法。
E18.実施形態1~17のいずれか1つに記載の方法であって、前記IL-23ポリペプチドが、表1に列挙される配列に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一のアミノ酸配列を含むIL-12p40サブユニットを含み、前記アミノ酸配列が、IL-23p19サブユニットに結合し得、かつIL-23活性を有するIL-23を形成し得る、前記方法。
E19.実施形態18に記載の方法であって、前記IL-12p40サブユニットが、表1に列挙される配列に対して少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一である核酸配列によってコードされる、前記方法。
E20.実施形態1~19のいずれか1つに記載の方法であって、前記IL-23ポリペプチドが、表1に列挙される配列に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一であるアミノ酸配列を含むIL-23p19サブユニットを含み、前記アミノ酸配列が、IL-12p40サブユニットに結合し得、かつIL-23活性を有するIL-23を形成し得る、前記方法。
E21.実施形態20に記載の方法であって、前記IL-23p19サブユニットが、表1に列挙される配列に対して少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一である核酸配列によってコードされる、前記方法。
E22.実施形態20または21に記載の方法であって、前記IL-12p40サブユニット及びIL-23P19サブユニットが、単一のポリペプチド鎖または2つの異なる鎖上である、前記方法。
E23.実施形態20または21に記載の方法であって、前記IL-12p40サブユニット及びIL-23P19サブユニットが、リンカーによって融合される、前記方法。
E24.前記リンカーが、(GS)リンカーを含む、実施形態23の方法。
E25.前記(GS)リンカーが(GnS)mを含み、nが、1~10であり、かつmが、1~100である、実施形態24の方法。
E26.前記(GS)リンカーが、GGS、GGGS、GGGGS(配列番号136)、GGGGGS(配列番号137)、GGGGGGS(配列番号138)、またはGGGGGGGS(配列番号139)を含む、実施形態24の方法。
E27.実施形態1~26のいずれか1つに記載の方法であって、前記IL-23ポリペプチドが、表1に列挙される配列に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一であるアミノ酸配列を含み、ここで前記アミノ酸配列が、少なくとも1つのIL-23活性を有し得る、前記方法。
E28.実施形態27に記載の方法であって、前記IL-23ポリペプチドが、表1に列挙される配列に対して少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一である核酸配列によってコードされる、前記方法。
E29.実施形態1~28のいずれか1つに記載の方法であって、前記IL-36ガンマポリペプチドが、表1に列挙される配列に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一であるアミノ酸配列を含み、ここで前記アミノ酸配列が、IL-36ガンマ活性を有し得る、前記方法。
E30.実施形態29に記載の方法であって、前記IL-36ガンマポリペプチドが、表1に列挙される配列に対して少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一である核酸配列によってコードされる、前記方法。
E31.実施形態1~30のいずれか1つに記載の方法であって、前記OX40Lポリペプチドが、表1Aに列挙される配列に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一であるアミノ酸配列を含み、前記アミノ酸配列が、OX40L活性を有し得る、前記方法。
E32.実施形態31に記載の方法であって、前記OX40Lポリペプチドが、表1Aに列挙される配列に対して少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一である核酸配列によってコードされる、前記方法。
E33.実施形態1~32のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドがさらに、miRNA結合部位を含む核酸配列を含む、方法。
E34.前記miRNA結合部位がmiR-122に結合する、実施形態33に記載の方法。
E35. 前記miRNA結合部位が、miR-122-3pまたはmiR-122-5pに結合する実施形態33または34に記載の方法。
E36.実施形態34に記載の方法であって、前記miRNA結合部位が、aacgccauua ucacacuaaa ua(配列番号23)に対して少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%同一であるヌクレオチド配列を含み、前記miRNA結合部位がmiR-122に結合する、前記方法。
E37.実施形態34に記載の方法であって、前記miRNA結合部位が、uggaguguga caaugguguu ug(配列番号25)に対して少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%同一であるヌクレオチド配列を含み、前記miRNA結合部位がmiR-122に結合する、前記方法。
E38.実施形態33~37のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、第2のポリヌクレオチド、及び第3のポリヌクレオチドが、異なるmiRNA結合部位または同じmiRNA結合部位を含む、前記方法。
E39.実施形態17~38のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドがさらに5’非翻訳領域(UTR)を含む、前記方法。
E40.実施形態39に記載の方法であって、前記5’UTRが表3に列挙される配列に対して少なくとも90%、95%、96%、97%、98%、99%、または100%同一である核酸配列を含む、前記方法。
E41.実施形態17~40のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドが3’非翻訳領域(UTR)を含む、前記方法。
E42.実施形態41に記載の方法であって、前記3’UTRが、表4Aまたは4Bに列挙される配列に対して少なくとも90%、95%、96%、97%、98%、99%、または100%同一である核酸配列を含む、前記方法。
E43.前記miRNA結合部位が、前記3’UTR内に挿入される、実施形態40または41に記載の方法。
E44.実施形態43に記載の方法であって、前記第1のポリヌクレオチド及び/または前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドがさらにmiRNA結合部位に融合されたスペーサー配列を含む、前記方法。
E45.実施形態44に記載の方法であって、前記スペーサー配列が、少なくとも約10ヌクレオチド、少なくとも約20ヌクレオチド、少なくとも約30ヌクレオチド、少なくとも約40ヌクレオチド、少なくとも約50ヌクレオチド、少なくとも約60ヌクレオチド、少なくとも約70ヌクレオチド、少なくとも約80ヌクレオチド、少なくとも約90ヌクレオチド、または少なくとも約100ヌクレオチドを含む、方法。
E46.実施形態17~45のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドがさらに5’末端キャップを含む、方法。
E47.実施形態46に記載の方法であって、前記5’末端キャップが、Cap0、Cap1、ARCA、イノシン、N1-メチル-グアノシン、2’フルオロ-グアノシン、7-デアザ-グアノシン、8-オキソ-グアノシン、2-アミノ-グアノシン、LNA-グアノシン、2-アジドグアノシン、Cap2、Cap4、5’メチルGキャップ、またはそれらの類似体である、前記方法。
E48.実施形態17~47のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または第2のポリヌクレオチド及び/または第3のポリヌクレオチドが3’ポリAテールを含む、方法。
E49.実施形態33~48のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドが、少なくとも2つ、少なくとも3つ、少なくとも4つ、少なくとも5つ、少なくとも6つ、少なくとも7つ、少なくとも8つ、少なくとも9つ、または少なくとも10個のmiRNA結合部位を含む、方法。
E50.実施形態1~49のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または第2のポリヌクレオチド及び/または第3のポリヌクレオチドがコドン最適化される、方法。
E51.実施形態1~50のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または第2のポリヌクレオチド及び/または第3のポリヌクレオチドが、in vitroで転写されている(IVT)、前記方法。
E52.実施形態1~51のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドが、キメラである、方法。
E53.実施形態1~51のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド及び/または第2のポリヌクレオチド及び/または第3のポリヌクレオチドが、環状である、前記方法。
E54.実施形態18~53のいずれか1つに記載の方法であって、前記IL-12p40サブユニット、IL-23p19サブユニット、IL-36ガンマポリペプチド、及び/またはOX40Lポリペプチドが、異種性ポリペプチドに融合される、前記方法。
E55.実施形態1~54のいずれか1つに記載の方法であって、前記第1のポリヌクレオチドが、表1のIL-23-コード配列またはhIL-23_miR-122コンストラクト(配列番号19または配列番号71)に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一であるヌクレオチド配列を含む、前記方法。
E56.実施形態1~55のいずれか1つに記載の方法であって、前記第2のポリヌクレオチドが、表1のIL-36-コード配列またはhIL-36_miR-122コンストラクト(配列番号17または配列番号94)に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一であるヌクレオチド配列を含む、前記方法。
E57.実施形態1~56のいずれか1つに記載の方法であって、前記第3のポリヌクレオチドが、表1のOX40L-コード配列またはOX40L_miR-122コンストラクト(配列番号116)に対して少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも99%、または100%同一であるヌクレオチド配列を含む、前記方法。
E58.実施形態1~57のいずれか1つに記載の方法であって、さらに第4のタンパク質または前記第4のタンパク質をコードする第4のポリヌクレオチドを投与することを包含する、前記方法。
E59.前記第4のポリヌクレオチドが、前記第4のタンパク質をコードするmRNAを含む、実施形態58に記載の方法。
E60.実施形態1~59のいずれか1つに記載の方法であって、前記第1のポリヌクレオチド、前記第2のポリヌクレオチド、前記第3のポリヌクレオチド、及び/または前記第4のポリヌクレオチドが、送達剤とともに製剤化される、前記方法。
E61.前記送達剤が、リピドイド、リポソーム、リポプレックス、脂質ナノ粒子、ポリマー化合物、ペプチド、タンパク質、細胞、ナノ粒子模倣体、ナノチューブ、またはコンジュゲートを含む、実施形態60に記載の方法。
E62.前記送達剤が脂質ナノ粒子である、実施形態60に記載の方法。
E63.実施形態62に記載の方法であって、前記脂質ナノ粒子が、DLin-DMA、DLin-K-DMA、98N12-5、C12-200、DLin-MC3-DMA、DLin-KC2-DMA、DODMA、PLGA、PEG、PEG-DMG、PEG化脂質、アミノアルコール脂質、KL22、及びそれらの組合せからなる群より選択される脂質を含む、前記方法。
E64.実施形態60~63または80のいずれか1つに記載の方法であって、前記送達剤が、式(I)
を有する化合物、
またはその塩もしくは立体異性体を含み、式中
R1は、C5~20アルキル、C5~20アルケニル、-R*YR”、-YR”、及びR”M’R’からなる群より選択され;
R2及びR3は独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、-YR”、及び-R*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4は、C3~6炭素環、-(CH2)nQ、-(CH2)nCHQR、-CHQR、-CQ(R)2、及び非置換のC1~6アルキルからなる群より選択され、ここでQは、炭素環、複素環、-OR、-O(CH2)nN(R)2、-C(O)OR、-OC(O)R、-CX3、-CX2H、-CXH2、-CN、-N(R)2、-C(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、-N(R)C(S)N(R)2、及び-C(R)N(R)2C(O)ORから選択され、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)2-、アリール基、及びヘテロアリール基から選択され;
R7は、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のRは、独立して、C1~3アルキル、C2~3アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、-R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつmは、5、6、7、8、9、10、11、12、及び13から選択され;
ただし、R4が、-(CH2)nQ、-(CH2)nCHQR、-CHQR、または-CQ(R)2であるならば、(i)nが1、2、3、4もしくは5である場合、Qは、-N(R)2ではなく、または(ii)nが、1もしくは2である場合、Qは、5員、6員もしくは7員のヘテロシクロアルキルではない、前記方法。
E65.実施形態64の方法であって、前記化合物は式(IA)の化合物:
またはその塩もしくは立体異性体であって、式中、
lは、1、2、3、4、及び5から選択され;
mは、5、6、7、8、及び9から選択され;
M1は結合であるか、またはM’であり;
R4は、非置換のC1~3アルキル、または-(CH2)nQであり、ここでnは、1、2、3、4、または5であり、かつQは、OH、-NHC(S)N(R)2、または-NHC(O)N(R)2であり;
M及びM’は、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-P(O)(OR’)O-、アリール基、及びヘテロアリール基から選択され;かつ
R2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される、前記方法。
E66.mが、5、7、または9である、実施形態64~66のいずれか1つに記載の方法。
E67.実施形態64に記載の方法であって、前記化合物が、式(II)の化合物:
またはその塩もしくは立体異性体であって、式中
lが、1、2、3、4、及び5から選択され;
M1が結合であるか、またはM’であり;
R4が、非置換のC1~3アルキル、または-(CH2)nQであり、ここでnが、2、3、または4であり、かつQが、OH、-NHC(S)N(R)2、または-NHC(O)N(R)2であり;
M及びM’が、独立して、-C(O)O-、-OC(O)-、-C(O)N(R’)-、-P(O)(OR’)O-、アリール基、及びヘテロアリール基から選択され;かつ
R2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される、前記方法。
E68.実施形態64~67のいずれか1つに記載の方法であって、前記化合物が、化合物1~化合物147、ならびにその塩及び立体異性体から選択される、方法。
E69.実施形態64に記載の方法であって、前記化合物が、式(IIa)の化合物、
またはその塩もしくは立体異性体である、前記方法。
E70.実施形態64に記載の方法であって、前記化合物が、式(IIb)の化合物、
またはその塩もしくは立体異性体である、前記方法。
E71.実施形態64または65に記載の方法であって、前記化合物が、式(IIc)もしくは(IIe)の化合物、
またはその塩もしくは立体異性体である、前記方法。
E72.実施形態64に記載の方法であって、式中R4が、-(CH2)nQ及び-(CH2)nCHQRから選択され、ここでQ、R及びnは、請求項64において上記される、前記方法。
E73.実施形態64に記載の方法であって、前記化合物が、式(IId)の化合物、
またはその塩もしくは立体異性体であり、
式中R2及びR3が、独立して、C5~14アルキル及びC5~14アルケニルからなる群より選択され、nが、2、3、及び4から選択され、かつR’、R”、R5、R6及びmが、請求項64において上記される、前記方法。
E74.式中R2が、C8アルキルである、実施形態73に記載の方法。
E75.式中R3が、C5アルキル、C6アルキル、C7アルキル、C8アルキル、またはC9アルキルである、実施形態73または74に記載の方法。
E76.mが、5、7、または9である、実施形態73~75のいずれか1つに記載の方法。
E77.各々のR5が、Hである実施形態73~76のいずれか1つに記載の方法。
E78.各々のR6が、Hである、実施形態77に記載の方法。
E79.実施形態60~63のいずれか1つに記載の方法であって、前記送達剤が、式(I)を有する化合物
またはその塩もしくは立体異性体であり、式中、
R1が、C5~30アルキル、C5~20アルケニル、R*YR”、YR”、及びR”M’R’からなる群より選択され;
R2及びR3が、独立して、H、C1~14アルキル、C2~14アルケニル、-R*YR”、YR”、及びR*OR”からなる群より選択されるか、またはR2及びR3は、それらが結合される原子と一緒になって、複素環または炭素環を形成し;
R4が、C3~6炭素環、(CH2)nQ、(CH2)nCHQR、CHQR、CQ(R)2、及び非置換のC16アルキルからなる群より独立して選択され、ここでQは、炭素環、複素環、OR、-O(CH2)nN(R)2、C(O)OR、OC(O)R、CX3、CX2H、CXH2、CN、N(R)2、C(O)N(R)2、N(R)C(O)R、-N(R)S(O)2R、-N(R)C(O)N(R)2、N(R)C(S)N(R)2、-N(R)R8、-O(CH2)nOR、-N(R)C(=NR9)N(R)2、-N(R)C(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、-N(OR)C(O)R、-N(OR)S(O)2R、-N(OR)C(O)OR、-N(OR)C(O)N(R)2、-N(OR)C(S)N(R)2、-N(OR)C(=NR9)N(R)2、-N(OR)C(=CHR9)N(R)2、-C(=NR9)N(R)2、-C(=NR9)R、-C(O)N(R)OR、及びC(R)N(R)2C(O)ORから選択され、かつ各々のnは、独立して、1、2、3、4、及び5から選択され;
各々のR5は、独立して、C13アルキル、C23アルケニル、及びHからなる群より選択され;
各々のR6は、独立して、C13アルキル、C23アルケニル、及びHからなる群より選択され;
M及びM’は、独立して、C(O)O、OC(O)、C(O)N(R’)、N(R’)C(O)、C(O)、C(S)、-C(S)S、SC(S)、CH(OH)、P(O)(OR’)O、S(O)2、-S-S-、アリール基、及びヘテロアリール基から選択され;R7は、C13アルキル、C23アルケニル、及びHからなる群より選択され;
R8は、C3~6炭素環及び複素環からなる群より選択され;
R9は、H、CN、NO2、C1~6アルキル、-OR、-S(O)2R、-S(O)2N(R)2、C2~6アルケニル、C3~6炭素環及び複素環からなる群より選択され;各々のRは、独立して、C13アルキル、C23アルケニル、及びHからなる群より選択され;
各々のR’は、独立して、C1~18アルキル、C2~18アルケニル、R*YR”、-YR”、及びHからなる群より選択され;
各々のR”は、独立して、C3~14アルキル及びC3~14アルケニルからなる群より選択され;
各々のR*は、独立して、C1~12アルキル及びC2~12アルケニルからなる群より選択され;
各々のYは、独立して、C3~6炭素環であり;
各々のXは、独立して、F、Cl、Br、及びIからなる群より選択され;かつmは、5、6、7、8、9、10、11、12、及び13から選択され;かつ
ただしR4が、-(CH2)nQ、-(CH2)nCHQR、-CHQR、または-CQ(R)2であるならば(i)nが1、2、3、4もしくは5である場合、Qは、-N(R)2ではないか、または(ii)nが、1または2である場合、Qは、5員、6員もしくは7員のヘテロシクロアルキルでない、前記方法。
E80.実施形態79の組成物であって、前記送達剤が式(IA)の化合物:
またはその塩もしくは立体異性体であり、式中
lが、1、2、3、4、及び5から選択され;
mが、5、6、7、8、及び9から選択され;
M1は結合であるか、またはM’であり;
R4は、非置換のC13アルキル、または(CH2)nQであり、Qは、OH、NHC(S)N(R)2、または-NHC(O)N(R)2、-NHC(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)R8、-NHC(=NR9)N(R)2、-NHC(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、ヘテロアリールまたはヘテロシクロアルキルであり;
M及びM’は、独立して、C(O)O、OC(O)、C(O)N(R’)、P(O)(OR’)O、-S-S-、アリール基、及びヘテロアリール基から選択され;かつ
R2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される、前記組成物。
E81.mが、5、7、または9である、請求項79または80に記載の組成物。
E82.実施形態79~81のいずれか1つに記載の組成物であって、前記化合物が、式(II)の化合物
またはその塩もしくは立体異性体であって、式中
lは、1、2、3、4、及び5から選択され;
M1は結合であるか、またはM’であり;
R4は、非置換のC13アルキル、または(CH2)nQであり、ここでnは、2、3、または4であって、かつQは、OH、-NHC(S)N(R)2、または-NHC(O)N(R)2、-N(R)C(O)R、-N(R)S(O)2R、-N(R)R8、-NHC(=NR9)N(R)2、-NHC(=CHR9)N(R)2、-OC(O)N(R)2、-N(R)C(O)OR、ヘテロアリールまたはヘテロシクロアルキルであり;
M及びM’は、独立して、C(O)O、OC(O)、C(O)N(R’)、P(O)(OR’)O、-S-S-、アリール基、及びヘテロアリール基から選択され;かつ
R2及びR3は、独立して、H、C1~14アルキル、及びC2~14アルケニルからなる群より選択される、前記組成物。
E83.M1がM’である、実施形態80~82のいずれか1つに記載の組成物。
E84.M及びM’が、独立して、-C(O)O-または-OC(O)-である、請求項83に記載の組成物。
E85.lが1、3、または5である、実施形態80~84のいずれか1つに記載の組成物。
E86.前記化合物が、化合物1~化合物232、その塩及び立体異性体、ならびにそれらのいずれかの組合せからなる群より選択される、請求項79に記載の組成物。
E87.前記送達剤が、さらにリン脂質を含む、実施形態60~86のいずれか1つに記載の方法。
E88.実施形態87に記載の方法であって、前記リン脂質が、1,2-ジリノレオイル-sn-グリセロ-3-ホスホコリン(DLPC)、
1,2-ジミリストイル-sn-グリセロ-ホスホコリン(DMPC)、1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC)、1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン(DPPC)、1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)、1,2-ジウンデカノイル-sn-グリセロ-ホスホコリン(DUPC)、1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン(POPC)、1,2-ジ-O-オクタデセニル-sn-グリセロ-3-ホスホコリン(18:0 Diether PC)、1-オレオイル-2-コレステリルヘミサクシノイル-sn-グリセロ-3-ホスホコリン(OChemsPC)、1-ヘキサデシル-sn-グリセロ-3-ホスホコリン(C16 Lyso PC)、1,2-ジリノレノイル-sn-グリセロ-3-ホスホコリン、1,2-ジアラキドノイル-sn-グリセロ-3-ホスホコリン、1,2-ジドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン、1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(DOPE)、1,2-ジフィタノイル-sn-グリセロ-3-ホスホエタノールアミン(ME 16:0 PE)、1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン、1,2-ジリノレオイル-sn-グリセロ-3-ホスホエタノールアミン、1,2-ジリノレノイル-sn-グリセロ-3-ホスホエタノールアミン、1,2-ジアラキドノイル-sn-グリセロ-3-ホスホエタノールアミン、1,2-ジドコサヘキサエノイル-sn-グリセロ-3-ホスホエタノールアミン、1,2-ジオレオイル-sn-グリセロ-3-ホスホノ-rac-(1-グリセロール)ナトリウム塩(DOPG)、スフィンゴミエリン、及びそれらの混合物からなる群より選択される、前記方法。
E89.実施形態87に記載の方法であって、前記リン脂質が、1-ミリストイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(14:0-16:0 PC,MPPC)、
1-ミリストイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(14:0-18:0 PC,MSPC)、
1-パルミトイル-2-アセチル-sn-グリセロ-3-ホスホコリン(16:0-02:0 PC)、
1-パルミトイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(16:0-14:0 PC,PMPC)、
1-パルミトイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(16:0-18:0 PC,PSPC)、
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン(16:0-18:1 PC,POPC)、
1-パルミトイル-2-リノレオイル-sn-グリセロ-3-ホスホコリン(16:0-18:2 PC,PLPC)、
1-パルミトイル-2-アラキドノイル-sn-グリセロ-3-ホスホコリン(16:0-20:4 PC)、
1-パルミトイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン(14:0-22:6 PC)、
1-ステアロイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(18:0-14:0 PC,SMPC)、
1-ステアロイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(18:0-16:0 PC,SPPC)、
1-ステアロイル-2-オレオイル-sn-グリセロ-3-ホスホコリン(18:0-18:1 PC,SOPC)、
1-ステアロイル-2-リノレオイル-sn-グリセロ-3-ホスホコリン(18:0-18:2 PC)、
1-ステアロイル-2-アラキドノイル-sn-グリセロ-3-ホスホコリン(18:0-20:4 PC)、
1-ステアロイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン(18:0-22:6 PC)、
1-オレオイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(18:1-14:0 PC,OMPC)、
1-オレオイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(18:1-16:0 PC,OPPC)、
1-オレオイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(18:1-18:0 PC,OSPC)、
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-18:1 PE,POPE)、
1-パルミトイル-2-リノレオイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-18:2 PE)、
1-パルミトイル-2-アラキドノイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-20:4 PE)、
1-パルミトイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホエタノールアミン(16:0-22:6 PE)、
1-ステアロイル-2-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-18:1 PE)、
1-ステアロイル-2-リノレオイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-18:2 PE)、
1-ステアロイル-2-アラキドノイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-20:4 PE)、
1-ステアロイル-2-ドコサヘキサエノイル-sn-グリセロ-3-ホスホエタノールアミン(18:0-22:6 PE)、
1-オレオイル-2-コレステリルヘミサクシノイル-sn-グリセロ-3-ホスホコリン(OChemsPC)、及びそれらのいずれかの組み合わせ、
からなる群より選択される、前記方法。
E90.前記送達剤がさらに構造脂質を含む、実施形態60~89のいずれか1つに記載の方法。
E91.実施形態90に記載の方法であって、前記構造脂質が、コレステロール、フェコステロール、シトステロール、エルゴステロール、カンペステロール、スチグマステロール、ブラシカステロール、トマチジン、ウルソル酸、アルファ-トコフェロール、及びそれらの混合物からなる群より選択される、方法。
E92.前記送達剤が、さらにPEG脂質を含む、実施形態60~91のいずれか1つに記載の方法。
E93.前記PEG脂質が、PEG修飾ホスファチジルエタノールアミン、PEG修飾ホスファチジン酸、PEG修飾セラミド、PEG修飾ジアルキルアミン、PEG修飾ジアシルグリセロール、PEG修飾ジアルキルグリセロール、及びそれらの混合物からなる群より選択される、実施形態92に記載の方法。
E94.実施形態60~93のいずれか1つに記載の方法であって、前記送達剤がさらに、3-(ジドデシルアミノ)-N1,N1,4-トリドデシル-1-ピペラジンエタンアミン(KL10)、N1-[2-(ジドデシルアミノ)エチル]-N1,N4,N4-トリドデシル-1,4-ピペラジンジエタンアミン(KL22)、14,25-ジトリデシル-15,18,21,24-テトラアザ-オクタトリアコンタン(KL25)、1,2-ジリノレイルオキシ-N,N-ジメチルアミノプロパン(DLin-DMA)、2,2-ジリノレイル-4-ジメチルアミノメチル-[1,3]-ジオキソラン(DLin-K-DMA)、ヘプタトリアコンタ-6,9,28,31-テトラエン-19-イル 4-(ジメチルアミノ)ブタノエート(DLin-MC3-DMA)、2,2-ジリノレイル-4-(2-ジメチルアミノエチル)-[1,3]-ジオキソラン(DLin-KC2-DMA)、1,2-ジオレイルオキシ-N,N-ジメチルアミノプロパン(DODMA)、2-({8-[(3β)-コレステ-5-エン-3-イルオキシ]オクチル}オキシ)-N,N-ジメチル-3-[(9Z,12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]プロパン-1-アミン(オクチル-CLinDMA)、(2R)-2-({8-[(3β)-コレステ-5-エン-3-イルオキシ]オクチル}オキシ)-N,N-ジメチル-3-[(9Z,12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]プロパン-1-アミン(オクチル-CLinDMA(2R))、及び(2S)-2-({8-[(3β)-コレステ-5-エン-3-イルオキシ]オクチル}オキシ)-N,N-ジメチル-3-[(9Z,12Z)-オクタデカ-9,12-ジエン-1-イルオキシ]プロパン-1-アミン(オクチル-CLinDMA(2S))からなる群より選択されるイオン性脂質を含む、方法。
E95.前記送達剤がさらに、四級アミン化合物を含む、実施形態60~94のいずれか1つに記載の方法。
E96.実施形態95に記載の方法であって、前記四級アミン化合物が、
1,2-ジオレオイル-3-トリメチルアンモニウム-プロパン(DOTAP)、
N-[1-(2,3-ジオレオイルオキシ)プロピル]-N,N,N-トリメチルアンモニウムクロライド(DOTMA)、
1-[2-(オレオイルオキシ)エチル]-2-オレイル-3-(2-ヒドロキシエチル)イミダゾリニウムクロライド(DOTIM)、
2,3-ジオレイルオキシ-N-[2(スペルミンカルボキサミド)エチル]-N,N-ジメチル-1-プロパンアミニウムトリフルオロアセテート(DOSPA)、
N,N-ジステアリル-N,N-ジメチルアンモニウムブロミド(DDAB)、
N-(1,2-ジミリストイルオキシプロパ-3-イル)-N,N-ジメチル-N-ヒドロキシエチルアンモニウムブロミド(DMRIE)、
N-(1,2-ジオレオイルオキシプロパ-3-イル)-N,N-ジメチル-N-ヒドロキシエチルアンモニウムブロミド(DORIE)、
N,N-ジオレイル-N,N-ジメチルアンモニウムクロライド(DODAC)、
1,2-ジラウロイル-sn-グリセロ-3-エチルホスホコリン(DLePC)、
1,2-ジステアロイル-3-トリメチルアンモニウム-プロパン(DSTAP)、
1,2-ジパルミトイル-3-トリメチルアンモニウム-プロパン(DPTAP)、
1,2-ジリノレオイル-3-トリメチルアンモニウム-プロパン(DLTAP)、
1,2-ジミリストイル-3-トリメチルアンモニウム-プロパン(DMTAP)、
1,2-ジステアロイル-sn-グリセロ-3-エチルホスホコリン(DSePC)、
1,2-ジパルミトイル-sn-グリセロ-3-エチルホスホコリン(DPePC)、
1,2-ジミリストイル-sn-グリセロ-3-エチルホスホコリン(DMePC)、
1,2-ジオレオイル-sn-グリセロ-3-エチルホスホコリン(DOePC)、
1,2-ジ-(9Z-テトラデセノイル)-sn-グリセロ-3-エチルホスホコリン(14:1 EPC)、
1-パルミトイル-2-オレオイル-sn-グリセロ-3-エチルホスホコリン(16:0-18:1 EPC)、
及びそれらのいずれかの組合せ、からなる群より選択される、前記方法。
E97.実施形態1~57のいずれか1つに記載の第1のポリヌクレオチド、または実施形態60~96のいずれか1つに記載の送達剤中に製剤化された実施形態1~57のいずれか1つに記載の第1のポリヌクレオチドを含む組成物。
E98.実施形態1~59のいずれか1つに記載の第2のポリヌクレオチド、または実施形態60~96のいずれか1つに記載の送達剤中に製剤化された実施形態1~57のいずれか1つに記載の第2のポリヌクレオチドを含む組成物。
E99.実施形態1~57のいずれか1つに記載の第3のポリヌクレオチド、および実施形態60~96のいずれか1つに記載の送達剤中に製剤化された実施形態1~57のいずれか1つに記載の第3のポリヌクレオチドを含む組成物。
E100.組成物であって(i)実施形態1~59のいずれか1つに記載の第1のポリヌクレオチド、及び実施形態1~57のいずれか1つに記載の第2のポリヌクレオチド、(ii)実施形態1~57のいずれか1つに記載の第1のポリヌクレオチド、及び実施形態1~57のいずれか1つに記載の第3のポリヌクレオチド、(iii)実施形態1~57のいずれか1つに記載の第2のポリヌクレオチド、及び実施形態1~57のいずれか1つに記載の第3のポリヌクレオチド、または(iv)実施形態1~57のいずれか1つに記載の第1のポリヌクレオチド、実施形態1~57のいずれか1つに記載の第2のポリヌクレオチド、及び実施形態1~59のいずれか1つに記載の第3のポリヌクレオチド、を含む前記組成物。
E101.請求項93に記載の組成物であって、実施形態1~57のいずれか1つに記載の第1のポリヌクレオチド、実施形態1~57のいずれか1つに記載の第2のポリヌクレオチド、及び実施形態1~57のいずれか1つに記載の第3のポリヌクレオチド、を含む前記組成物。
E102.さらに送達剤を含む、実施形態101に記載の組成物。
E103.実施形態102に記載の組成物であって、前記送達剤が、リピドイド、リポソーム、リポプレックス、脂質ナノ粒子、ポリマー化合物、ペプチド、タンパク質、細胞、ナノ粒子模倣体、ナノチューブ、またはコンジュゲーを含む、組成物。
E104.実施形態102の組成物であって、前記送達剤が、実施形態64~104のいずれか1つに記載の送達剤を含む、前記組成物。
E105.実施形態87~104のいずれか1つに記載の組成物であって、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害することが必要な対象において、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害することにおける使用のための前記組成物。
E106.実施形態98の組成物と組み合わせた実施形態97の組成物であって、腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害することが必要な対象における腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害することにおいて使用するための前記組成物。
E107.前記第1のポリヌクレオチド、前記第2のポリヌクレオチド及び/または前記第3のポリヌクレオチドが、in vivo送達のために製剤化される、実施形態1~96のいずれか1つに記載の方法、または実施形態97~106のいずれか1つに記載の組成物。
E108.前記第1のポリヌクレオチド及び/または前記第2のポリヌクレオチド、及び/または前記第3のポリヌクレオチドが、筋肉内、皮下、腫瘍内、または皮内送達のために製剤化される、実施形態107に記載の方法または組成物。
E109.前記第1のポリヌクレオチド及び/または前記第2のポリヌクレオチドが、皮下に、静脈内に、筋肉内に、関節内に、ページ : 368
滑液嚢内に、胸骨内に、くも膜下腔内に、肝臓内に、病変内に、頭蓋内に、脳室内に、経口的に、吸入スプレーにより、局所的に、経直腸的に、経鼻的に、頬側に、膣にまたは埋込み型リザーバーを介して投与される、実施形態1~96、107及び108のいずれか1つに記載の方法または実施形態97~108のいずれか1つに記載の組成物。
E110.投与が癌を処置する、実施形態1~96、107及び108のいずれか1つに記載の方法、または実施形態97~109のいずれか1つに記載の組成物。
E111.実施形態110に記載の方法であって、前記癌が、副腎皮質癌、進行癌、肛門癌、再生不良性貧血、胆管癌、膀胱癌、骨癌、骨転移、脳腫瘍、脳癌、乳癌、小児癌、原発不明癌、キャッスルマン病、子宮頸癌、結腸/直腸癌、子宮内膜癌、食道癌、ユーイングファミリー腫瘍、眼癌、胆嚢癌、消化管カルチノイド腫瘍、消化管間質腫瘍、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎細胞癌、喉頭及び下咽頭癌、急性リンパ性白血病、急性骨髄性白血病、慢性リンパ性白血病、慢性骨髄性白血病、慢性骨髄単球性白血病、肝癌、肝臓癌(HCC)、非小細胞肺癌、小細胞肺癌、肺カルチノイド腫瘍、皮膚のリンパ腫、悪性中皮腫、多発性骨髄腫、骨髄異形成症候群、鼻腔及び副鼻腔癌、上咽頭癌、神経芽腫、非ホジキンリンパ腫、口腔及び口咽頭癌、骨肉腫、卵巣癌、膵臓癌、陰茎癌、下垂体腫瘍、前立腺癌、網膜芽細胞腫、横紋筋肉腫、唾液腺癌、成人軟部肉腫、基底及び扁平細胞皮膚癌、メラノーマ、小腸癌、胃癌、精巣癌、咽喉癌、胸腺癌、甲状腺癌、子宮肉腫、膣癌、外陰癌、ワルデンストレームマクログロブリン血症、ウィルムス腫瘍、がん治療により生じる二次がん及びそれらのいずれかの組合せからなる群より選択される、前記方法。
E112.前記第1のポリヌクレオチド、前記第2のポリヌクレオチド、及び/または前記第3のポリヌクレオチドが、ポンプ、パッチ、薬物リザーバー、ページ : 369ショートニードル装置、ページ : 369
シングルニードル装置、ページ : 369
マルチプルニードル装置、ページ : 369
マイクロニードル装置、
ページ : 369
ジェット式注射装置、バリスティックパウダー/粒子送達装置、カテーテル、ルーメン、クライオプローブ、カニューレ、マイクロカニューレまたは熱を利用するデバイス、RFエネルギー、電流またはそれらのいずれかの組合せを含むデバイスによって送達される、実施形態1~96及び107~111のいずれか1つに記載の方法、または実施形態97のいずれか1つに記載の組成物。
E113.有効量が約0.10mg/kgと約1,000mg/kgとの間である、実施形態1~96及び107~112のいずれか1つに記載の方法、または実施形態97~112のいずれか1つに記載の組成物。
E114.前記対象がヒトである、実施形態1~96及び107~113のいずれか1つに記載の方法、または実施形態97~113のいずれか1つに記載の組成物。
E115.実施形態107~113のいずれか1つに記載の組成物、ならびに実施形態1~97及び107~115のいずれか1つに記載の方法に従う使用説明書を備えるキット。
E116.実施形態1~96または107~113のいずれか1つに記載の方法、実施形態97~115に記載の組成物、または実施形態123に記載のキットであって、対象へのポリヌクレオチドの投与が、以下の結果:
閾値レベルに対する、またはIL-23、IL-36ガンマ、もしくはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する、二剤または三剤の投与後の対象から得られた1つ以上の試料中の顆粒球レベルの上昇;
閾値レベルに対する、またはIL-23、IL-36ガンマ、もしくはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する、二剤または三剤の投与後の対象から得られた1つ以上の試料における交差提示樹状細胞レベルの上昇;
閾値レベルに対する、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後の比に対する、二剤または三剤の投与後の対象から得られた1つ以上の試料中のエフェクター:サプレッサーT細胞比の上昇、
閾値レベルに対する、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する、二剤または三剤の投与後の対象から得られた1つ以上の試料中のエフェクター記憶T細胞レベルの上昇、
閾値レベルに対する、またはIL-23、IL-36-ガンマ、もしくはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する、二剤または三剤の投与後の対象から得られた1つ以上の試料中のPDL1発現レベルの上昇、
または
それらの組合せ、
を生じる、方法、組成物またはキット。
E117.腫瘍の大きさを減少もしくは低下さまたは腫瘍の成長を阻害する必要のある対象における腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害する方法であって、対象に対して:
第1のポリヌクレオチドがインターロイキン23ポリペプチド(IL-23)を含む第1のタンパク質をコードし、第2のポリヌクレオチドが、インターロイキン36ガンマポリペプチド(IL-36ガンマ)を含む第2のタンパク質をコードする、2つのポリヌクレオチドを組み合わせて(二剤);または、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチド(OX40L)を含む第3のタンパク質をコードする3つのポリヌクレオチドを組み合わせて(三剤)、含む組成物を投与することを包含し、
前記対象に対する前記二剤または三剤の投与は以下の結果:
閾値レベルに対するまたはIL-23、IL-36-ガンマ、もしくはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する二剤または三剤の投与後の対象から得られた1つ以上の試料中の顆粒球レベルの上昇、
閾値レベルに対するまたはIL-23、IL-36-ガンマ、もしくはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する二剤または三剤の投与後の対象から得られた1つ以上の試料中の交差提示樹状細胞レベルの上昇、
閾値レベルに対するまたはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後の比に対する二剤または三剤の投与後の対象から得られた1つ以上の試料中のエフェクター:サプレッサーT細胞比の上昇、
閾値レベルに対する、またはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する、二剤または三剤の投与後の対象から得られた1つ以上の試料中のエフェクター記憶T細胞レベルの上昇、
閾値レベルに対するまたはIL-23、IL-36-ガンマ、もしくはOX40Lポリペプチドをコードする単一のポリヌクレオチドの投与後のレベルに対する、二剤または三剤の投与後の対象から得られた1つ以上の試料中のPDL1発現レベルの上昇、またはそれらの組合せ、
を生じる、前記方法。
E118.実施形態117に記載の方法であって、顆粒球レベルの上昇が、
(i)CD45+細胞の百分率としての顆粒球、または
(ii)腫瘍1mgあたりの顆粒球
として測定される、前記方法。
E119.前記交差提示樹状細胞がCD103+細胞である、実施形態117に記載の方法。
E120.実施形態117に記載の方法であって、前記交差提示樹状細胞レベルの上昇が、
(i)腫瘍1mgあたりの交差提示樹状細胞、
(ii)腫瘍流入領域リンパ節(TdLN)における交差提示CD103+樹状細胞、または
(iii)CD45+細胞の百分率としての交差提示CD103+樹状細胞、
として定量される、前記方法。
E121.エフェクター:サプレッサーT細胞比が、CD8:Treg比として定量される、実施形態117に記載の方法。
E122.エフェクター記憶T細胞がCD4+及び/またはCD8+細胞である、実施形態117に記載の方法。
E123.実施形態117に記載の方法であって、PDL1発現レベルが、
(i)陽性CD11b+細胞の数、または
(ii)CD11b+細胞におけるPDL1発現
として定量される、方法。
E124.顆粒球レベルの上昇を必要とする対象において顆粒球レベルを上昇させる方法であって、前記対象に対して:
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードする、2つのポリヌクレオチドを組み合わせて(二剤);または、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、3つのポリヌクレオチドを組み合わせて(三剤)、
含む組成物を投与することを含み、
ここで、顆粒球レベルは、対象から得られた1つ以上の試料において測定される、前記方法。
E125.実施形態124に記載の方法であって、顆粒球レベルの上昇が、
(i)CD45+細胞の百分率としての顆粒球、及び/または
(ii)腫瘍1mgあたりの顆粒球を、
閾値レベルに対する、またはIL-23をコードする単一のポリヌクレオチドもしくはIL-36ガンマをコードする単一のポリヌクレオチドの投与後のレベルに対して測定する、実施形態124に記載の方法。
E126.交差提示樹状細胞レベルの上昇を必要とする対象における交差提示樹状細胞レベルを上昇させる方法であって、前記対象に対して、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードする、2つのポリヌクレオチドを組み合わせて(二剤);または、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、3つのポリヌクレオチドを組み合わせて(三剤)、
含む組成物を投与することを含み、
ここで交差提示樹状細胞レベルが、前記対象から得られた1つ以上の試料において測定される、前記方法。
E127.前記交差提示樹状細胞がCD103+細胞である、実施形態126に記載の方法。
E128.実施形態127に記載の方法であって、交差提示CD103+樹状細胞レベルの上昇が:
(i)腫瘍1mgあたりの交差提示CD103+樹状細胞、
(ii)TdLN中の交差提示CD103+樹状細胞、
(iii)交差提示CD103+樹状細胞を、CD45+細胞の百分率として、または
(iv)それらの組合せ、
として、
閾値レベルに対する、またはIL-23をコードする単一のポリヌクレオチド、IL-36ガンマをコードする単一のポリヌクレオチド、あるいはOX40Lをコードする単一のポリヌクレオチドの投与後のレベルに対して、測定される、方法。
E129.エフェクター:サプレッサーT細胞比を上昇させることを必要とする対象におけるエフェクター:サプレッサーT細胞比を上昇させる方法であって、前記対象に対して:
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードする、組合せにおける2つのポリヌクレオチド(二剤)、または、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組合せにおける3つのポリヌクレオチド(三剤)、
含む組成物を投与することを含み、
ここでエフェクター:サプレッサーT細胞比が、前記対象から得られた1つ以上の試料において測定される、方法。
E130.エフェクター:サプレッサーT細胞比がCD8:Treg比として測定される、実施形態129に記載の方法。
E131.エフェクター記憶T細胞レベルを上昇させることを必要とする対象へ、エフェクター記憶T細胞レベルを上昇させる方法であって、前記対象に対して:
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードする、組合せにおける2つのポリヌクレオチド(二剤)、または、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組合せにおける3つのポリヌクレオチド(三剤)を
含む組成物を投与することを含み、
ここで前記エフェクター記憶T細胞レベルが、前記対象から得られた1つ以上の試料において測定される、前記方法。
E132.前記エフェクター記憶T細胞がCD4+及び/またはCD8+細胞である、実施形態131に記載の方法。
E133.実施形態132に記載の方法であって、エフェクター記憶T細胞レベルの上昇が、腫瘍内のエフェクター記憶T細胞として、閾値レベルに対する、またはOX40Lをコードする単一のポリヌクレオチドの投与後のレベルに対して、測定される、方法。
E134.PDL1陽性細胞レベルを上昇させることを必要とする対象へPDL1陽性細胞レベルを上昇させる方法であって、前記対象に対して、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードする、組合せにおける2つのポリヌクレオチド(二剤)、または、
第1のポリヌクレオチドがIL-23ポリペプチドを含む第1のタンパク質をコードし、第2のポリヌクレオチドがIL-36ガンマポリペプチドを含む第2のタンパク質をコードし、第3のポリヌクレオチドがOX40Lポリペプチドを含む第3のタンパク質をコードする、組合せにおける3つのポリヌクレオチド(三剤)を
含む組成物を投与することを含み、
前記PDL1陽性細胞レベルが、前記対象から得られた1つ以上の試料において測定される、前記方法。
E135.前記PDL1陽性細胞がCD11b+細胞である、実施形態134に記載の方法。
E136.対象から得られた試料が、腫瘍組織、腫瘍浸潤物、血液、血漿、及びそれらの組合せからなる群より選択される、実施形態117~135のいずれか1つに記載の方法。
E137.前記1つ以上の対照試料が、健常対象または腫瘍を保有している対象から得られた試料(複数可)である、実施形態117~136のいずれか1つに記載の方法。
E138.前記閾値レベルが、所定の値または1つ以上の試料から得られた値である、実施形態117~137のいずれか1つに記載の方法。
等価物及び範囲
当業者であれば、本明細書に記載された開示に従って、特定の実施形態に対する多くの均等物を、日常的な実験を超えないものを用いて、認識するか、または確認し得る。本開示の範囲は、上記の詳細な説明に限定されるものではなく、添付の特許請求の範囲に記載されている。
特許請求の範囲において、「a」、「an」、及び「the」などの冠詞は、文脈から逆に示されるか、そうでないことを明示してない限り、1つ以上を意味し得る。ある群の1つ以上のメンバーとの間に「または」を含む請求項または詳細な説明は、文脈から逆に示されるか、そうでないことを明示してない限り、その群のメンバーの1つ、2つ以上、または全てが、所定の製品またはプロセスに存在するか、そこで使用されるか、そうでなければ関連する場合に満たされるとみなされる。本開示は、この群の正確に1つのメンバーが所定の製品またはプロセスに存在するか、使用されるか、または関連する実施形態を包含する。本開示は、この群のメンバーの2つ以上または全てが所定の製品またはプロセスに存在するか、使用されるか、または関連する実施形態を包含する。
「含む、包含する、備える(comprising)」という用語は、開かれていることを意図しており、追加の要素またはステップを包含することを可能とするが、必須ではないことにも留意されたい。「含む(comprising)」という用語が本明細書で使用される場合、したがって「からなる」という用語も包含され、開示される。
範囲が示されている場合、終点が含まれる。さらに、文脈及び当業者の理解から別段示されるか、そうでないことを明白に示さない限り、範囲として表される値は、その文脈が別段明白に示さない限り、本開示の異なる実施形態に挙げられた範囲内の任意の特定の値または部分範囲を、その範囲の下限の単位の10分の1までということが理解される。
さらに、先行技術に含まれる本開示の任意の特定の実施形態は、特許請求の範囲のいずれか1つ以上から明白に除外され得ることが理解される。そのような実施形態は当業者に公知であるとみなされるので、除外が本明細書に明示的に示されていない場合でさえ、そのような実施形態は排除されてもよい。本開示の組成物の任意の特定の実施形態(例えば、それによってコードされる任意の核酸またはタンパク質;任意の生産方法;任意の使用方法など)は、任意の理由のために、先行技術の存在に関連しようとしまいと、任意の1つ以上の請求項から排除され得る。
引用された全ての情報源、例えば、参照、刊行物、データベース、データベースエントリー、及び本明細書に引用された技術は、引用により明示的に記載されていなくても、参照によって、本出願に組み込まれる。引用された情報源及び本出願の矛盾する記述の場合、本出願内の言及が優先するものとする。
セクション及び表の見出しは、限定することを意図するものではない。
実施例1
式Iによる化合物の合成
A.全般的考察
使用した全ての溶媒及び試薬は、商業的に得られ、別段の記載がない限り、そのまま使用した。1H NMRスペクトルは、Bruker Ultrashield 300MHz機器を使用して300Kで、CDCl3中で記録した。化学シフトは、1HのTMS(0.00)に対する百万分率(ppm)として報告されている。ISCO RediSeP Rf Gold Flash Cartridges(粒径:20~40ミクロン)を使用して、ISCO CombiFlash Rf+Lumen Instrumentsでシリカゲルクロマトグラフィーを行った。逆相クロマトグラフィーは、RediSep Rf Gold C18 High Performanceカラムを使用してISCO CombiFlash Rf+Lumen Instrumentsで行った。全ての最終化合物は、Waters Acquity UPLC装置(DAD及びELSDを備える)及びZORBAX Rapid Resolution High Definition(RRHD)SB-C18LCカラム)2.1mm、50mm、1.8μm及び0.1%TFAを含む水中の65~100%アセトニトリルの勾配)を用いて、5分間にわたって1.2mL/分で逆相UPLC-MS(保持時間、RT、分単位)による分析により85%を超えて純粋であることが確認された。注入容積は5μLであり、カラム温度は80℃であった。検出は、Waters SQD質量分析計(Milford、MA、USA)及び蒸発光散乱検出器を使用するポジティブモードのエレクトロスプレーイオン化(ESI)に基づく。
下記の代表的な手順は、化合物1-232の合成に有用である。
以下の略語を本明細書で用いる。
THF:テトラヒドロフラン
DMAP:4-ジメチルアミノピリジン
LDA:リチウムジイソプロピルアミド
rt:室温
DME:1,2-ジメトキエタン
n-BuLi:n-ブチルリチウム
B.化合物2:ヘプタデカン-9-イル8-((2-ヒドロキシエチル)(テトラデシル)アミノ)オクタノエート
代表的な手順1:
ヘプタデカン-9-イル 8-ブロモオクタノエート(方法A)
ジクロロメタン(20mL)中の8-ブロモオクタン酸(1.04g、4.6mmol)及びヘプタデカン-9-オール(1.5g、5.8mmol)の溶液に、N-(3-ジメチルアミノプロピル)-N’ -エチルカルボジイミド塩酸塩(1.1g、5.8mmol)、N,N-ジイソプロピルエチルアミン(3.3mL、18.7mmol)及びDMAP(114mg、0.9mmol)を加えた。この反応物を室温で18時間撹拌させた。この反応物をジクロロメタンで希釈し、飽和重炭酸ナトリウムで洗浄した。この有機層を分離し、ブラインで洗浄し、MgSO4で乾燥させた。有機層を濾過し、減圧下でエバポレートさせた。その残渣をシリカゲルクロマトグラフィー(ヘキサン中0~10%酢酸エチル)により精製して、ヘプタデカン-9-イル8-ブロモオクタノエート(875mg、1.9mmol、41%)を得た。
1H NMR(300MHz、CDCl3)δ:ppm 4.89(m,1H);3.42(m,2H);2.31(m,2H);1.89(m,2H);1.73-1.18(br.m,36H);0.88(m,6H)。
ヘプタデカン-9-イル8-((2-ヒドロキシエチル)アミノ)オクタノエート(方法B)
エタノール(3mL)中のヘプタデカン-9-イル8-ブロモオクタノエート(3.8g、8.2mmol)及び2-アミノエタン-1-オール(15mL、248mmol)の溶液を、62℃で18時間撹拌した。その反応混合物を減圧下で濃縮し、残渣を酢酸エチル及び水に採取した。その有機層を分離し、水、ブラインで洗浄し、Na2SO4で乾燥させた。その混合物を濾過し、減圧下でエバポレートさせた。その残渣をシリカゲルクロマトグラフィー(ジクロロメタン中0~100%(ジクロロメタン中、1%NH4OH、20%MeOHの混合物)で精製して、ヘプタデカン-9-イル8((2-ヒドロキシエチル)アミノ)オクタノエート(3.1g、7mmol、85%)を得た。UPLC/ELSD:RT=2.67分。MS(ES):C27H55NO3についてはm/z(MH+)442.68。
1H NMR(300MHz、CDCl3)δ:ppm4.89(p,1H);3.67(t,2H);2.81(t,2H);2.65(t,2H);2.30(t,2H);2.05(br.m,2H);1.72-1.41(br.m,8H);1.40-1.20(br.m,30H);0.88(m,6H)。
ヘプタデカン-9-イル 8-((2-ヒドロキシエチル)(テトラデシル)アミノ)オクタノエート(方法C)
化学式:C41H83NO3
分子量:638.12
ヘプタデカン-9-イル8-((2-ヒドロキシエチル)アミノ)オクタノエート(125mg、0.28mmol)、1-ブロモテトラデカン(94mg、0.34mmol)及びN,N-ジイソプロピルエチルアミン(44mg、0.34mmol)のエタノール溶液を、65℃で18時間撹拌させた。この反応物を室温に冷却し、溶媒を減圧下でエバポレートさせた。その残留物を酢酸エチル及び飽和重炭酸ナトリウム中に採取した。その有機層を分離し、Na2SO4で乾燥し、減圧下でエバポレートさせた。残渣をシリカゲルクロマトグラフィー(ジクロロメタン中の0~100%(1%NH4OH、20%MeOHの混合物))により精製し、ヘプタデカン-9-イル8-((2-ヒドロキシエチル)(テトラデシル)アミノ)オクタノエート(89mg、0.14mmol、50%)を得た。UPLC/ELSD:RT=3.61分。C41H83NO3に関してMS(ES):m/z(MH+)638.91。1H NMR(300MHz、CDCl3)δ:ppm4.86(p,1H);3.72-3.47(br.m,2H);2.78-2.40(br.m,5H);2.28(t,2H);1.70-1.40(m,10H);1.38-1.17(br.m,54H);0.88(m,9H)。
中間体の合成:
中間体A:2-オクチルデカン酸
THF(10mL)中のジイソプロピルアミンの溶液(2.92mL、20.8mmol)を-78℃に冷却し、n-BuLiの溶液(7.5mL、18.9mmol、ヘキサン中2.5M)を添加した。その反応物を0℃に温めさせた。0℃のTHF(20mL)中のデカン酸(2.96g、17.2mmol)及びNaH(754mg、18.9mmol、60%w/w)の溶液に、LDAの溶液を添加し、その混合物をrt(室温)で30分間撹拌させた。この時間の後、1-ヨードオクタン(5g、20.8mmol)を加え、その反応混合物を45℃で6時間加熱した。その反応を1N HCl(10mL)でクエンチした。その有機層をMgSO4で乾燥させ、濾過し、減圧下でエバポレートした。その残渣をシリカゲルクロマトグラフィー(ヘキサン中0~20%酢酸エチル)により精製して、2-オクチルデカン酸(1.9g、6.6mmol、38%)を得た。1H NMR(300MHz,CDCl3)δ:ppm 2.38(br.m,1H);1.74-1.03(br.m,28H);0.91(m,6H)。
中間体B:7-ブロモヘプチル 2-オクチルデカノエート
7-ブロモヘプチル 2-オクチルデカノエートを、方法Aを用いて。2-オクチルデカン酸及び7-ブロモヘプタン-1-オールから合成した。1H NMR(300MHz,CDCl3)δ:ppm4.09(br.m,2H);3.43(br.m,2H);2.48-2.25(br.m,1H);1.89(br.m,2H);1.74-1.16(br.m,36H);0.90(m,6H)。
中間体C:(2-ヘキシルシクロプロピル)メタノール
ジクロロメタン(20mL)中のジエチル亜鉛(20mL、20mmol、ヘキサン中1M)の溶液を、5分間-40℃に冷却させた。次いでジクロロメタン(10mL)中のジヨードメタン(3.22mL、40mmol)溶液を滴下した。その反応物を-40℃で1時間撹拌させた後、ジクロロメタン(10mL)中のトリクロロ酢酸(327mg、2mmol)及びDME(1mL、9.6mmol)の溶液を添加した。その反応物を-15℃に温めさせ、この温度で1時間撹拌させた。次いで、ジクロロメタン(10mL)中の(Z)-ノン-2-エン-1-オール(1.42g、10mmol)の溶液を-15℃の溶液に添加した。次いで、その反応物をゆっくりrt(室温)に温めさせ、18時間撹拌した。この時間後、飽和NH4Cl(200mL)を加え、反応物をジクロロメタン(3×)で抽出し、ブラインで洗浄し、Na2SO4で乾燥させた。その有機層を濾過し、減圧下でエバポレートし、その残渣をシリカゲルクロマトグラフィー(ヘキサン中0~50%酢酸エチル)により精製して、(2-ヘキシルシクロプロピル)メタノール(1.43g、9.2mmol、92%)を得た。1H NMR(300MHz,CDCl3)δ:ppm3.64(m,2H);1.57-1.02(m,12H);0.99-0.80(m,4H);0.72(m,1H)、0.00(m,1H)。
C.化合物18:ヘプタデカン-9-イル 8-((2-ヒドロキシエチル)(8-(ノニルオキシ)-8-オキソオクチル)アミノ)オクタノエート
化学式:C44H87NO5
分子量:710.18
化合物18を、上記の一般手順及び代表的な手順1に従って合成した。
UPLC/ELSD:RT=3.59分。C44H87NO5に関してMS(ES):m/z(MH+)710.89。1H NMR(300MHz,CDCl3)δ:ppm4.86(m,1H);4.05(t,2H);3.53(br.m,2H);2.83-2.36(br.m,5H);2.29(m,4H);0.96-1.71(m,64H);0.88(m,9H)。
D.化合物136:ノニル 8-((2-ヒドロキシエチル)((9Z,12Z)-オクタデカ-9,12-ジエン-1-イル)アミノ)オクタノエート
代表的な手順2:
ノニル 8-ブロモオクタノエート(方法A)
ジクロロメタン(100mL)中の8-ブロモオクタン酸(5g、22mmol)及びノナン-1-オール(6.46g、45mmol)の溶液に、N-(3-ジメチルアミノプロピル)-N’-エチルカルボジイミド塩酸塩(4.3g、22mmol)及び DMAP(547mg、4.5mmol)を添加した。その反応を、rt(室温)で18時間撹拌させた。その反応物を、ジクロロメタンで希釈して、飽和炭酸水素ナトリウムで洗浄した。その有機層を分離して、ブラインで洗浄し、MgSO4で乾燥させた。その有機層を濾過して、真空状態でエバポレートした。その残渣をシリカゲルクロマトグラフィー(ヘキサン中の0~10%酢酸エチル)で精製して、ノニル 8-ブロモオクタノエート(6.1g、17mmol、77%)を得た。
1H NMR(300MHz,CDCl3)δ:ppm4.06(t,2H);3.40(t,2H);2.29(t,2H);1.85(m,2H);1.72-0.97(m,22H);0.88(m,3H)。
ノニル 8-((2-ヒドロキシエチル)アミノ)オクタノエート
エタノール(2mL)中のノニル 8-ブロモオクタノエート(1.2g、3.4mmol)及び2-アミノエタン-1-オール(5mL、83mmol)の溶液を、62℃で18時間撹拌させた。その反応混合物を真空中で濃縮し、その残渣を酢酸エチル及び水で抽出した。その有機層を分離して、水、ブラインで洗浄し、Na2SO4で乾燥させた。その有機層を、濾過して、減圧下でエバポレートした。その残渣を、シリカゲルクロマトグラフィー(ジクロロメタン中0~100%(ジクロロメタン中1%NH4OH、20%MeOHの混合物))によって精製して、ノニル 8-((2-ヒドロキシエチル)アミノ)オクタノエート(295mg、0.9mmol、26%)を得た。
UPLC/ELSD:RT=1.29分。C19H39NO3についてMS(ES):m/z(MH+)330.42。
1H NMR(300MHz,CDCl3)δ:ppm4.07(t,2H);3.65(t,2H);2.78(t,2H);2.63(t,2H);2.32-2.19(m,4H);1.73-1.20(m,24H);0.89(m,3H)。
ノニル 8-((2-ヒドロキシエチル)((9Z,12Z)-オクタデカ-9,12-ジエン-1-イル)アミノ)オクタノエート
化学式:C37H71NO3
分子量:577.98
エタノール(2mL)中のノニル 8-((2-ヒドロキシエチル)アミノ)オクタノエート(150mg、0.46mmol)、(6Z,9Z)-18-ブロモオクタデカ-6,9-ジエン(165mg、0.5mmol)及びN,N-ジイソプロピルエチルアミン(65mg、0.5mmol)の溶液を、48時間、灌流して撹拌させた。その反応物を、rt(室温)まで冷却させ、溶媒を真空状態でエバポレートさせた。その残渣をシリカゲルクロマトグラフィー(ジクロロメタン中で0~10%MeOH)によって精製してノニル 8-((2-ヒドロキシエチル)((9Z,12Z)-オクタデカ-9,12-ジエン-1-イル)アミノ)オクタノエート(81mg、0.14mmol、30%)を、HBr塩として得た。
UPLC/ELSD:RT=3.24分。MS(ES):C37H71NO3についてm/z(MH+)578.64。
1H NMR(300MHz,CDCl3)δ:ppm 10.71(br.,1H);5.36(br.m,4H);4.04(m,4H);3.22-2.96(br.m,5H);2.77(m,2H);2.29(m,2H);2.04(br.m,4H);1.86(br.m,4H);1.66-1.17(br.m,40H);0.89(m,6H)。
E.化合物138:ジノニル 8,8’-((2-ヒドロキシエチル)アザンジイル)ジオクタノエート
代表的な手順3:
ジノニル 8,8’-((2-ヒドロキシエチル)アザンジイル)ジオクタノエート
化学式:C36H71NO5
分子量:597.97
THF/CH3CN(1:1)(3mL)中のノニル8-ブロモオクタノエート(200mg、0.6mmol)及び2-アミノエタン-1-オール(16mg、0.3mmol)及びN,N-ジイソプロピルエチルアミン(74mg、0.6mmol)の溶液を、63℃で72時間撹拌させた。その反応物をrt(室温)まで冷却させ、溶媒を真空状態でエバポレートさせた。その残渣を、酢酸エチル及び飽和炭酸水素ナトリウムで抽出した。有機層を分離し、Na2SO4で乾燥し、真空状態でエバポレートした。その残渣を、シリカゲルクロマトグラフィー(ジクロロメタン中0~10%MeOH)によって精製して、ジノニル 8,8’-((2-ヒドロキシエチル)アザンジイル)ジオクタノエート(80mg、0.13mmol、43%)を得た。
UPLC/ELSD:RT=3.09分。MS(ES):C36H71NO5についてm/z(MH+)598.85。
1H NMR(300MHz,CDCl3)δ:ppm4.05(m,4H);3.57(br.m,2H);2.71-2.38(br.m,6H);2.29(m,4H)、1.71-1.01(br.m,49H)、0.88(m,6H)。
本明細書に開示される全ての他の脂質化合物は、上記のような代表的な手順1~3と類似の方法、及び/または当該技術分野において既知である方法によって得てもよい。
実施例2
ナノ粒子組成物の生成
A.ナノ粒子組成物の生成
ナノ粒子は、2つの流体ストリームのうちの1つがポリヌクレオチドを含み、もう一方が脂質成分を有する、2つの流体ストリームのマイクロ流体工学及びT接合混合などの混合プロセスで作製してもよい。
脂質組成物は、本明細書に開示されるイオン性アミノ脂質、例えば、式(I)による脂質、リン脂質(Avanti Polar Lipids、Alabaster、ALから入手可能なDOPEまたはDSPCなど)、PEG脂質(Avanti Polar Lipids、Alabaster、ALから入手可能なPEG-DMGとしても公知の1,2ジミリストイル-sn-グリセロールメトキスポリエチレングリコールなど)及び構造脂質(例えば、Sigma Aldrich、Taufkirchen、Germanyから入手可能なコレステロール、またはコルチコステロイド(プレドニゾロン、デキサメタゾン、プレドニゾン、及びヒドロコルチゾンなど)、またはこれらの組合せ)を、エタノール中約50mMの濃度で組み合わせることによって調製される。溶液は、例えば-20℃で保存のために冷蔵する必要がある。脂質を合わせて所望のモル比を得て、水及びエタノールで、約5.5mM~約25mMの最終脂質濃度に希釈する。
ポリヌクレオチド及び脂質組成物を含むナノ粒子組成物は、脂質溶液を、約5:1~約50:1という脂質組成物対ポリヌクレオチドの重量:重量比で、ポリヌクレオチドを含む溶液と組み合わせることによって調製される。脂質溶液を、約10ml/分~約18ml/分の流速で、ポリヌクレオチド溶液にNanoAssemblrマイクロ流体系システムを使用して迅速に注入して、約1:1~約4:1という水対エタノール比を有する懸濁物を生成する。
RNAを含むナノ粒子組成物については、脱イオン水中で0.1mg/mlの濃度のRNAの溶液を、pH3~4で、50mMクエン酸ナトリウム緩衝液中に希釈してストック溶液を形成する。
ナノ粒子組成物は、エタノールを除去し、緩衝液交換を達成するために透析によって処理してもよい。製剤を、10kDの分子量カットオフを有するSlide-A-Lyzerカセット(Thermo Fisher Scientific Inc., Rockford,IL)を使用して、一次産物の体積の200倍の体積で、リン酸緩衝化生理食塩水(PBS)(pH7.4)に対して2回透析する。最初の透析は室温で3時間行う。次いで、その製剤を4℃で一晩透析する。得られたナノ粒子懸濁物を0.2μmの滅菌フィルター(Sarstedt、Numbrecht、Germany)を通してガラスバイアルにろ過し、クリンプクロージャーで密閉する。0.01mg/ml~0.10mg/mlのナノ粒子組成物溶液が一般に得られる。
上記の方法は、ナノ沈殿及び粒子形成を誘導する。同じナノ沈殿を達成するために、T-接合及び直接注入を含むがこれに限定されない代替プロセスを使用してもよい。
B.ナノ粒子組成物の特性決定
Zetasizer Nano ZS(Malvern Instruments Ltd,Malvern,Worcestershire,UK)を使用して、ナノ粒子組成物の、粒径、多分散性指数(PDI)、及びゼータ電位は、粒径を測定する際に1×PBSで、またゼータ電位を測定する際にmM PBSで測定されることが可能である。
紫外可視分光法を使用して、ナノ粒子組成物中のポリヌクレオチド(例えば、RNA)の濃度を測定してもよい。1×PBS中の100μLの希釈製剤を、メタノールとクロロホルムの4:1(v/v)混合物900μLに添加する。混合後、溶液の吸光度スペクトルを、例えば、DU 800分光光度計(Beckman Coulter、Beckman Coulter、Inc.,Brea、CA)で、230nm~330nmの間で記録する。ナノ粒子組成物中のポリヌクレオチドの濃度は、組成物中に使用されたポリヌクレオチドの吸光係数、及び例えば260nmの波長における吸光度と、例えば、330nmの波長におけるベースライン値との間の差に基づいて計算され得る。
RNAを含むナノ粒子組成物については、QUANT-IT(商標)RIBOGREEN(登録商標)RNAアッセイ(Invitrogen Corporation、Carlsbad、CA)を使用して、ナノ粒子組成物によるRNAの封入を評価してもよい。試料を、TE緩衝液(10mMのTris-HCl、1mMのEDTA、pH7.5)中でおよそ5μg/mLの濃度に希釈する。50μLの希釈試料を、ポリスチレン96ウェルプレートに移し、50μLのTE緩衝液または50μLの2%Triton X-100溶液のいずれかをウェルに添加する。このプレートを37℃の温度で15分間インキュベートする。RIBOGREEN(登録商標)試薬を、TE緩衝液で1:100に希釈し、この溶液100μLを各ウェルに加える。蛍光強度は、例えば、約480nmの励起波長、及び例えば、約520nmの発光波長で、蛍光プレートリーダー(Wallac Victor 1420 Multilablel Counter;Perkin Elmer、Waltham、MA)を使用して測定してもよい。試薬ブランクの蛍光値を、各試料の蛍光値から差し引き、そしてインタクトな試料(Triton X-100を添加しない)の蛍光強度を、破壊された試料の蛍光値(Triton X-100の添加によって引き起こされる)で割ることにより遊離RNAの百分率を決定する。
ナノ粒子組成物の例示的な製剤を以下の表9に示す。
実施例3
A20(リンパ腫)及びMC38-C(結腸癌)モデルにおけるIL-23のmRNA単独療法の有効性
IL-23のmRNA単独療法を用いた単独療法の有効性を、A20リンパ腫モデル及びMC38-C結腸癌モデルにおいて評価した。MC-38結腸腺癌腫瘍を、C57BL/6マウスの皮下で確立した。Rosenberg et al.,Science 233(4770):1318-21(1986)を参照のこと。A20マウスB細胞リンパ腫細胞(A20、ATCC番号TIB-208;ATCC,Manassas、VA)を、供給者の説明に従って培養した。A20細胞を、BALB/cマウスの皮下に接種して皮下腫瘍を生じさせた。腫瘍を大きさ及び触知性に関してモニターした。Kim et
al.,Journal of Immunology 122(2):549-554(1979);Donnou et al.,Advances in Hematology 2012:701704(2012)を参照のこと。
IL-23をコードするmRNA(miR-122結合部位を有さないmRNA)及びNST-FIX対照mRNAに対応するポリヌクレオチドを、本明細書に記載されるように調製した。このmRNAを、化合物18LNP中に製剤化した。
MC-38またはA20腫瘍が、一旦、およそ100mm3の平均サイズに達すれば、動物を単回腫瘍内投与のmRNA(2.5μg/用量)で処置した。
対照動物を等用量の陰性対照mRNAで処置した。「NST」対照は、対照タンパク質をコードするmRNAの非翻訳性バージョンであり、mRNAは、複数の停止コドンを含む。
腫瘍体積を、手動のキャリパーを使用して、示された時点で測定した。腫瘍体積は、立方ミリメートルで記録した。
A20リンパ腫モデルにおけるIL-23のmRNA単独療法の有効性を、図1A及び図1Bに示す。図1Aは、NST-FIX mRNA対照(2.5μgmRNA)での処置を示す。12人の対象のうち1例(8.3%)において完全応答(「CR」)が観察された。図1Bは、miRNA結合部位を含まないmIL-23をコードするmRNA「miRless」(2.5μgmRNA)による処理を示す。IL-23のmRNAによる処置は、12例の対象のうち5例(41.6%)において完全応答を誘発した。MC38-C結腸癌モデルにおけるIL-23のmRNA単独療法の有効性を2A及び図2Bに示す。図2Aは、NST-OXL40のmRNA対照(2.5μgのmRNA)での処置を示す。図2Bは、miRNA結合部位を含まないmIL-23をコードするmRNA「miRless」(2.5μgmRNA)による処理を示す。IL-23のmRNAの投与は、10例の対象のうち4例(40%)において完全応答を誘発した。部分応答が10例の対象のうち2例(20%)で観察された。
実施例4
IL-23をコードするmRNAに対するIL-36ガンマまたはIL-18をコードするmRNAの追加は、MC38-Cモデルにおける有効性を増大する
IL-23のmRNA処置へのインターロイキン36ガンマまたはインターロイキン18をコードするmRNAのへの添加の影響もまた、MC38-C結腸癌モデルにおいて評価された。実施例3のように、MC-38結腸腺癌腫瘍を、C57BL/6マウスの皮下に確立して皮下腫瘍を生じさせた。
IL-23、IL-36ガンマ及びIL-18のmRNAをコードするmRNAに対応するポリヌクレオチドを、本明細書に記載されるように調製した。このmRNAを、化合物18LNPに製剤化した。MC38腫瘍が、一旦、約100mm3の平均サイズに達すれば、動物を単一の腫瘍内投与のmRNAで処置した。対照動物は、等用量の陰性対照mRNAで処置した。
腫瘍体積を、手動のキャリパーを使用して、示された時点で測定した。腫瘍体積は立方ミリメートルで記録した。in vivoでの有効性の研究は、投薬後50日にわたって行った。
このデータによって、IL-23をコードするmRNAを含む処置へのIL-36ガンマまたはIL-18の追加が、MC38-C結腸癌モデルにおける処置の有効性を増大させることが示された。図3Aは、IL-23及びNST-FIX mRNA対照(各mRNA2.5μg)をコードするmRNAでの処置を示す。10例の対象中3例(30%)において完全応答が観察された。部分応答は10例の対象のうち6例(60%)で観察された。90日までの延長データを図3Eに示す。
図3Bは、IL-23及びIL-36ガンマをコードするmRNAによる処置(各mRNA2.5μg)を示す。10例の対象のうち9例(90%)において完全応答が観察された。部分応答は、10例の対象のうちの1例(10%)で観察された。90日までの延長データを図3Fに示す。
図3Cは、IL-23をコードするmRNA及びIL-18をコードする第2のmRNA(各mRNA2.5μg)を用いた処置を示す。10例中6例(60%)において完全応答が観察された。部分応答は10例の対象のうち3例(30%)で観察された。
図3Dは、NST-FIX mRNA対照単独(5μgmRNA)による処置を示す。70日目までの延長されたデータを図3Gに示す。
このデータによって、IL-23をコードするmRNAとIL-36ガンマをコードする第2のmRNAの組合せが、IL-23のmRNA単独療法より有効であることが示される。さらに、IL-23及びIL-36ガンマ併用療法は、IL-36ガンマ単剤療+陰性対照mRNAより効果的であった(示さず)。このデータによってまた、IL-23
mRNAをコードするmRNAとIL-18をコードする第2のmRNAとの組合せが、IL-23をコードするmRNAを用いた単独療法よりも有効であることが示される。さらに、IL-23をコードするmRNAとIL-18をコードするmRNAとの組合せは、IL-18をコードするmRNA単独療法+陰性対照mRNAよりも効果的であった(示さず)。
実施例5
IL-36ガンマ及びIL-18併用療法に対するmiR-122結合部位の追加の効果
IL-36ガンマをコードするmRNAをIL-23のmRNA療法と組み合わせる有効性、ならびにIL-23をコードするmRNAとの併用療法で使用されるIL-36ガンマをコードするmRNAに対するmiR-122追加の効果を評価した。
IL-23 mRNA併用療法を用いる有効性を、上記のようなA20リンパ腫モデルにおいて評価した。A20マウスB細胞リンパ腫細胞を、供給者の説明に従って培養し、BALB/cマウスの皮下に接種して皮下腫瘍を生成させ、A20腫瘍が一旦、約100mm3の平均サイズに達すれば、動物を単一腫瘍内投与のmRNAで処置した。
NST-FIX対照をコードするmRNA、miR-122なしの、IL-23またはIL-18をコードするmRNA「miRless」、及びmiR-122を有するIL-36ガンマまたはIL-18をコードするmRNAに対応するポリヌクレオチドを、本明細書に記載したように調製した。このmRNAは、化合物18LNPに製剤化した。腫瘍体積は、手動のキャリパーを使用して、示された時点で測定した。腫瘍体積は立方ミリメートルで記録した。in vivoでの有効性の研究は、投薬後80日にわたって行った。
図4A~4Cによって、IL-23をコードするmRNAに対するIL-36ガンマをコードするmRNAの追加が、A20リンパ腫モデルにおける有効性を増大させることが示される。図4Aは、miR-122なしのIL-23をコードするmRNA「miRless」及びNST-FIXのmRNA(それぞれ2.5μgのmRNA)を含む併用療法による処置を示す。12例の対象のうち8例(66.6%)で完全応答が観察された。部分応答は、12例の対象のうち1例(8.3%)で観察された。図4Bは、miR-122なしのIL-23をコードするmRNA「miRless」、及びmiR-122を有するIL-36ガンマをコードするmRNA(各2.5μgのmRNA)を用いた処置を示す。12例の対象のうち10例(83.3%)において完全応答が観察された。図4Cは、miR122結合部位を有さないIL-23をコードするmRNA「miRless」、及びmiR122結合部位を有さないIL-18をコードするmRNA「miRless」(各2.5μgのmRNA)での処置を示す。12例の対象のうち6例(50%)において完全応答が観察された。図4Dは、NST-FIXのmRNA対照(5μgmRNA)での処置を示す。IL-23をコードするmRNAに加えてIL-36ガンマまたはIL-18の組合せをコードするmRNAは、単独成分+陰性対照mRNAより優れていた(IL-1単独療法は示さず)。IL-23をコードするmRNA+mRNAの5’UTR領域においてmR122結合部位を含むIL-36ガンマをコードするmRNAとの組合せの有効性は、miRless mRNA(すなわち、5’UTR領域におけるmiR-122結合部位なしのmRNA)を含む組合せに比べて特に高かった。
実施例6
A20リンパ腫モデルにおける、IL-36ガンマをコードするmRNA+IL-23をコードするmRNAの有効性
IL-23のみをコードするmRNAと固定された5mg用量のmRNAを上回る、IL-36ガンマをコードするmRNAに+IL-23をコードするmRNAの有効性を、A20リンパ腫モデルにおいて評価した。実験は上記で詳細であるように行った。
図5Aは、IL-23(5μgのmRNA)をコードするmRNAによる処置を示す。10例の対象のうち1例(10%)において完全応答が観察された。部分応答が、10例の対象のうち4例(40%)で観察された。図5Bは、IL-36ガンマ(5μgmRNA)をコードするmRNAによる処置を示す。10例の対象のうち2例(20%)において完全応答が観察された。部分応答が、10例の対象のうちの1例(10%)で観察された。図5Cは、IL-23をコードするmRNA及びIL-36ガンマをコードするmRNA(各mRNA2.5μg)による処置を示す。図5Dは、NST-FIX mRNA対照(5μgmRNA)での処置を示す。このデータは、IL-23/IL-36ガンマmRNAの組合せが、固定の5μgのmRNA用量での単剤療法の投与よりも優れていたことを示している。
実施例7
MC38-M結腸癌モデルにおける、IL-23をコードするmRNA+IL-36ガンマまたはIL-18をコードするmRNAの有効性
IL-23をコードするmRNA+IL-36ガンマまたはIL-18をコードするmRNAを含む併用療法の有効性を、上記のようにMC38結腸癌モデルにおいて評価した。先の実施例の実験は、MC38-Cモデル(免疫原性は強い)を使用して行った。対照的に、現在の実施例における実験は、MC38-Mモデル(免疫原性がほとんどない)を使用して行った。免疫浸潤の相違及び両方のモデル間の組織学的相違を、図6A及び6Bに示す。
図7A及び7Bによって、MC38-M結腸癌モデルにおいて説得力のあるIL-23のmRNA単独療法の有効性がないことが示される。図7Aは、化合物18ベースのLNPにおけるNST-OX40LのmRNA対照(2.5μgのmRNA)による処置を示す。応答は観察されなかった。図7Bは、化合物18ベースのLNPにおけるmiR-122を含まないIL-23をコードするmRNA「miRless」(2.5μgのmRNA)による処置を示す。部分応答は1つだけが観察された(10のうちの1つ、10%)。MC38-Mは、OX40L、抗PD-1抗体、及びIL-23単独療法が無効である比較的感受性のないモデルである。
図7Cは、IL-23をコードするmRNAとIL-36ガンマをコードするmRNAとの組合せが、免疫原性がほとんどないMC38-M結腸癌において有効であることを示す。この図は、IL-23をコードするmRNA及びIL-36ガンマをコードするmRNA(各mRNA2.5μg)による処置を示す。IL-23をコードするmRNA及びIL-36ガンマをコードするmRNAによる処置は、10例の対象のうち2例(20%)において完全応答を誘発し、10例の対象のうちの5例(50%)において部分応答が観察された。
図7Eは、IL-23をコードするmRNAとIL-18をコードするmRNAとの組合せが、免疫原性の低いMC38-M結腸癌において有効であることを示す。この図は、IL-23をコードするmRNA及びIL-18をコードするmRNA(各mRNA2.5μg)を用いた処置を示す。図7Dは、NST-FIXのmRNA対照(5μgのmRNA)での処置を示す。
実施例8
MC38-M結腸癌モデルにおける、IL-23、IL-36ガンマ、及びOX40LをコードするmRNAの三剤併用の有効性
IL-23をコードするmRNA、IL-36ガンマをコードするmRNA、及びOX40LをコードするmRNAを含む三剤併用療法の有効性を、上記のように、MC38結腸癌モデルにおいて評価した。現在の実施例における実験は、MC38-Mモデル(免疫原性がほとんどない)を使用して行った、図9Cを参照のこと。
図8は、OX40LがA20腫瘍モデルにおいて有効であったことを示す。対照的に、OX40LがMC38-M結腸癌モデルにおいて使用された場合、説得力がある有効性が欠如していた(図9A)。観察された効果は、同じモデルを抗PD-1抗体で処置した場合に観察された効果と同様であった(図9B)。
対照的に、IL-23をコードするmRNAがmiR-122結合部位を含む場合(化合物18ベースのLNPにおいて5μgのmRNA)、MC38-M結腸癌モデルにおける有効性が観察された(図10A)。完全応答は観察されなかったが、8つのエスケープが観察された。70日まで延長された実験データを図10Dに示す。
miR-122結合部位を含むIL-23をコードするmRNA(2.5μgのmRNA)を、miR-122結合部位を含むIL-36ガンマをコードするmRNA(2.5μgのmRNA)と組み合わせた場合(図10B)、3例の完全応答動物(25%)が観察され、エスケープの数は8例から6例に減少した。70日目まで延長された実験データを図10Eに示す。
miR-122結合部位を含むIL-23をコードするmRNA(1.7μgのmRNA)を、miR-122結合部位を含むIL-36ガンマをコードするmRNA(1.7μgのmRNA)と、及びmiR-122結合部位を含むOX40LをコードするmRNA(1.7μgのmRNA)と組み合わせた場合(図10C)、3例の完全応答動物が観察され(25%)、エスケープの数は6例から4例にさらに減少した。70日まで延長された実験データを図10Fに示す。
さらなる実験は、MC38ルシフェラーゼ細胞を用いたMC38モデルにおける、ニ剤の単一投与及びまたは三剤の単一投与または複数回投与を評価した。miR-122結合部位を含むIL-23をコードするmRNAを、miR-122結合部位を含むIL-36ガンマをコードするmRNAと組合せ、単回用量(8μg)で投与した。miR-122結合部位を含むIL-23をコードするmRNA、miR-122結合部位を含むIL-36ガンマをコードするmRNA、及びmiR-122結合部位を含むOX40LをコードするmRNAを、12μgの単回用量または複数回用量で投与した。対照と比較して、生物発光は、二剤組合せの単回投与、ならびに三剤組合せによる単回及び複数回投与の両方で減少し、三剤組合せでは有意な減少が示された(図10G)。しかしながら、三剤組合せの複数回投与で処置したマウスでは、処置関連死に対応して、45日を上回る生存期間が短縮された(図10H)。
実施例9
mRNAから生成されたIL-23の生物活性
細胞に導入されたmRNAから産生されたIL-23タンパク質の活性を、バイオアッセイで評価し、組換えIL-23タンパク質の活性と比較した。マウスIL-23またはヒトIL-23をコードするmRNAに対応するポリヌクレオチドを、本明細書に記載されるように調製した。HeLa細胞を、マウスIL-23をコードするmRNA(mRNA mIL-23)、ヒトIL-23をコードするmRNA(mRNA hIL-23)でトランスフェクトするか、または偽トランスフェクトして、その上清をトランスフェクトした細胞から採取した。採取された上清中のIL-23タンパク質の量を、ELISAにより測定し、次いで様々なレベル(偽(0ng/ml)、0.1ng/ml、1ng/ml、3.3ng/ml、10ng/ml、または100ng/ml)のmRNA産生タンパク質、または組換えマウスIL-23(reC,MIL-23)、または組換えヒトIL-23(mRNA hIL-23)を、培養したマウス一次脾細胞に添加した。その脾細胞を、IL-23含有上清または組換えタンパク質と共に3日間培養し、次いで、脾細胞によって産生されたIL-17の量を測定した。IL-17産生は、IL-23の生物活性の指標として役立つ。
図11は、mRNAから産生されたIL-23が、等価の生物活性、すなわち、初代マウス脾細胞から組換えIL-23タンパク質(例えば、rec hIL-23と比較したタンパク質形態mRNA hIL-23)へのIL-17発現の誘導を有することを示す。さらに、ヒトIL-23 mRNAからのin vivo発現は、マウスオルソログからの発現よりも大きいことが決定された(データ示さず)。
実施例10
mRNAから産生されたIL-36ガンマの生物活性
細胞に導入されたmRNAから産生されたIL-36ガンマタンパク質の活性を、バイオアッセイで評価し、組換えIL-36ガンマタンパク質の活性と比較した。マウスIL-36ガンマまたはヒトIL-36ガンマをコードするmRNAに対応するポリヌクレオチドを、本明細書に記載されるように調製した。
マウスIL-36ガンマ実験のために、HeLa細胞を、マウスIL-36ガンマタンパク質(mIL-36γ mRNA_v1)をコードするmRNAでトランスフェクトするか、または偽トランスフェクトし、トランスフェクトした細胞からの上清を回収した。様々な濃度の分泌成熟マウスIL-36ガンマまたは組換えマウスIL-36ガンマ(rmIL-36γ)を含有する収集された上清に、骨髄由来樹状細胞(BMDC)を曝露し、暴露されたBMDCによるIL6産生を評価した。IL6産生は、マウスIL-36ガンマ活性の指標として役立つ。図12Aは、マウスIL-36ガンマタンパク質をコードするmRNAが、組換えヒトIL-36ガンマタンパク質(mIL-36γと比較してrmIL-36γ)と同等の生物活性を有することを示す。
ヒトIL-36ガンマ実験のために、類表皮癌(例えば、A431)細胞を使用してIL-36ガンマの生物活性を評価した。B16F10細胞を、異なるシグナルペプチド(hIL-36γ mRNA_v1;hIL-36γ mRNA_v2;またはhIL-36γ mRNA_v3)を有するヒトIL-36ガンマをコードするmRNAでトランスフェクトし、トランスフェクトした細胞由来の上清を回収した。上清中のhIL-36gの濃度を、ELISAによって決定した。A431細胞を、様々なレベルでhIL-36g含有上清または組換えヒトIL-36ガンマタンパク質(rhIL-36γ)に曝露し、処理したA431細胞の上清中のIL8産生を測定した。IL8産生は、ヒトIL-36ガンマ活性の指標として役立つ。図12Bは、mRNA由来ヒトIL-36ガンマタンパク質が、組換えヒトIL-36ガンマタンパク質(hIL-36γ mRNA_v1;hIL-36γ mRNA_v2;またはhIL-36γmRNA_v3(rhIL-36γと比較))と同等の生物活性を有することを示す。
実施例11
OX40Lのin vitroにおける生物学的活性
T細胞活性化は、T細胞受容体複合体からの一次シグナル(例えば、CD3刺激)及び共刺激リガンド-受容体相互作用(例えば、OX40L/OX40R相互作用)からの第2のシグナルという、2つの同時の細胞シグナル伝達事象を含む。Kober et al.,European Journal of Immunology 38:2678-2688(2008)。この実施例では、mOX40L_miR-122またはhOX40L_miR-122で処置された細胞の表面上に発現されたOX40Lの共刺激生物学的活性を評価した。
A.OX40L発現細胞の調製
マウスメラノーマ細胞(B16F10、ATCC番号CRL-6475;ATCC,Manassas、VA)を、1ウェルあたり300,000細胞の密度で6ウェルプレートに播種した。ヒト子宮頸癌細胞(HeLa)を、上記のように6ウェルプレートに播種した。OX40LポリペプチドをコードするmRNAを含み、さらにmiR-122結合部位(マウスOX40L、mOX40L_miR-122、配列番号66;ヒトOX40L、hOX40L_miR-122、配列番号65)を含む、ポリヌクレオチドを、実施例2に上記されるようにL2K中に製剤化した。細胞播種の24時間後、3μgのmOX40L_miR-122またはhOX40L_miR-122のmRNAを含有する製剤を各ウェルに添加した。対照細胞は、偽処置したか、または陰性対照mRNA(開始コドンなし以外は同じmRNAの非翻訳性バージョン)で処理した。その細胞を37℃で24時間インキュベートした。
B.ナイーブCD4+T細胞の調製
Balb/cマウス由来の脾臓を取り出し、脾臓細胞の単一細胞懸濁物を生成するために当該分野で標準的な技術を使用して処理した。全CD4+T細胞を、マウスCD4T細胞単離キット(Miltenyi、San Diego、CA)を使用して脾臓細胞懸濁物から単離した。ナイーブなヒトCD4+T細胞を、市販の磁気ビーズT細胞単離キットを使用して、非CD4細胞を枯渇させることにより、ヒト末梢血単核細胞(PBMC)から単離した。
C.T細胞活性化アッセイ
アゴニスト抗マウスCD3抗体(R&D Systems、Minneapolis、MN)またはDynabeadsヒトT-活性化因子の存在下で、トランスフェクトしたB16F10細胞またはHeLa細胞の各ウェルに200,000個のT細胞を加え、その細胞を、72時間(マウス)または120時間(ヒト)同時培養した。アッセイの模式図を図13Aに示す。
T細胞との同時培養の後、マウスIL-2産生を、マウスIL-2 ELISAを使用して測定した。(マウスIL-2 DuoSet ELISA、R&D Systems、Minneapolis、MN)。CD4+T細胞によって産生されるIL-2の量は、T細胞活性化の指標として働く。結果を図13Bに示す。ヒトIL-2 ELISA(ヒトIL-2 DuoSet ELISA、R&D Systems、Minneapolis、MN)を使用して、ヒトIL-2産生を測定した。結果を、図13A、図13B、及び図13Cに示す。
D.結果
図13Bは、mOX40L_miR-122で処置したB16F10細胞の表面上のOX40L発現が、in vitroでT細胞IL-2応答を誘発することを示す。mOX40L_miR-122のmRNAは、約12ng/mlのIL-2を誘導した。非翻訳陰性対照mRNAで処理したB16F10細胞は、偽処理細胞(すなわち、約6ng/mlのIL-2)に匹敵するT細胞活性化のベースラインレベルを示した。したがって、mOX40L_miR-122のmRNAは、対照(偽処置または非翻訳mRNA)と比較して約2倍高いIL-2発現を誘導した。
図13C及び図13Dは、DynabeadsヒトT活性化因子が、一次T細胞活性化因子として存在する場合に、OX40L mRNAトランスフェクトしたHeLa細胞との同時培養がIL-2産生を大きく増強したことを示す。OX40L発現なしでは、IL-2産生はほとんど検出されなかった。図13Eは、予備刺激(すなわち、非ナイーブ)CD4+T細胞を使用して同じ実験を行った場合のヒトIL-2産生の増大と同様のレベルを示す。
これらの結果、OX40Lポリペプチドが共刺激分子として生物学的に活性であることが示される。
実施例12
OX40L mRNAで処置した腫瘍内の免疫細胞集団の調節
先天性免疫ナチュラルキラー(NK)細胞及び適応性CD4+/CD8+T細胞に対するOX40Lの実証された活性を考慮して、以下の研究の目的は、腫瘍関連免疫細胞集団に対するOX40L腫瘍内治療の薬力学的効果を評価することであった。マウスA20及びMC38腫瘍モデルを上記のように確立した。
A.フローサイトメトリーによる細胞分化
A20腫瘍を、脂質ナノ粒子中に製剤化したmOX40L_miR-122または対照mRNA(RNA/LNP)の単一の12.5μg用量で処置した。腫瘍試料は、処置の24時間後に最初に分析した。成熟NK細胞表面マーカーDX5に対する抗体を使用してNK細胞を分化させた。結果を図14Aに示す。mOX40L_miR-122による処置の14日後に、他の腫瘍試料を分析した。抗マウスCD4抗体及び抗マウスCD8抗体をそれぞれ使用して、CD4+及びCD8+T細胞を同定した。結果を図14B~図14Cに示す。
同様の実験を、MC38腫瘍モデルで行った。MC38腫瘍を有するマウスに、mOX40L_miR-122またはNST-OX40Lの単回の腫瘍内注射を投与した。いくつかの動物では、最初の投与の6日後に、2回目の用量のmRNAを投与した。免疫細胞浸潤物を、mRNAの各投与の24時間後及び72時間後にCD8+細胞について評価した。結果を図14Dに示す。
B.結果
図14Aは、A20腫瘍へのmOX40L_miR-122の投与の24時間後、NK細胞浸潤が、対照と比較してOX40L投与動物において有意に増大したことを示す。図14B~図14Cは、A20腫瘍へのMOX40L_miR-122の投与の14日後、腫瘍微小環境へのCD4+T細胞(図14B)及びCD8+T細胞(図14C)の両方の浸潤が対照腫瘍試料と比較して有意に増大したことを示す。
図14Dは、対照処置腫瘍と比較した、MC38腫瘍におけるmOX40L_miR-122の2回目の投与の72時間後の浸潤性CD8+T細胞の有意な増大を示す。
2つの腫瘍モデルからのこれらのデータによって、OX40LポリペプチドをコードするmRNAを含むポリヌクレオチドの投与が、腫瘍微小環境内の先天性免疫細胞及び適応免疫細胞の両方の数の増大を促進することが実証される。
実施例13
腫瘍内投与後のOX40Lをコードするポリヌクレオチドのin vivo活性
A.OX40L修飾mRNAの調製
OX40Lポリペプチド(マウスOX40L)をコードするmRNAを含み、かつさらにmiRNA結合部位(miR-122)を含むポリヌクレオチドを、上記のとおり調製した(mox40L_miR-122;配列番号66)。陰性対照mRNAも調製した(複数の停止コドンを含む同じmRNAの非翻訳性バージョン:NST_OX40L_122)。
B.急性骨髄性白血病(AML)腫瘍モデル
急性骨髄性白血病(AML)腫瘍を、DBA/2マウスの皮下に確立した。マウスAML細胞P388D1、ATCC番号CCL-46;ATCC,Manassas、VA)を、供給者の説明に従って培養した。細胞をマウスに皮下接種して、皮下腫瘍を生じさせた。腫瘍の大きさ及び触診可能性についてモニターした。
一旦、腫瘍が確立すれば、動物を2つの群、すなわちmOX40L_miR-122群及び対照群に分けた。各群の腫瘍内投与は、腫瘍移植の7日後から開始して7日ごと(Q7D)であった。グループIは、体重1kgあたり12.5μg(固定用量)のmRNAの用量で、mOX40L_miR-122の腫瘍内投与で処置した。グループIIは、同じ投与計画で対照NST_OX40L_122 mRNAの腫瘍内投与で処置した。
C.結果
結果を図15A及び図15Bに示す。図15Aは、腫瘍内投与の対照NST_OX40L_122 mRNAで処置した動物における個々の腫瘍の成長を示す。図15Bは、mOX40L_miR-122 mRNAの腫瘍内投与で処置した動物における個々の腫瘍の成長を示す。これらの結果により、miRNA結合部位を含むOX40Lポリペプチドをコードするポリヌクレオチドの腫瘍内投与が、対照mRNAまたはPBS処置と比較して腫瘍の成長を減少または阻害することが示される。
実施例14
OX40LポリペプチドをコードするmRNA、及び抗PD-1抗体の組合せのin vivo有効性
A.OX40L修飾mRNA及び抗PD-1の調製
OX40Lポリペプチド(マウスOX40L)をコードするmRNAを含み、かつmiRNA結合部位(miR-122)をさらに含むポリヌクレオチドを、上記のように調製した(mox40L_miR-122;配列番号66)。陰性対照mRNAもまた調製した(NST_OX40L_122)。
抗-PD-1(BioXcell BE0146、抗mPD-1、クローンRMP1-14、ロット番号5792-599016J1)の投与溶液を、ストック(6.37mg/mL)のアリコートを、無菌PBS中で0.5mg/mLに希釈することによって調製した。0.5mg/mLの投薬溶液によって、5mg/kgの投薬量が10mL/kgの投薬容積で得られた。抗PD-1投薬溶液を、毎日新鮮に調製し、4℃で遮光して保存した。
ラットIgG2a(BioXcell BE0089、ラットIgG2a、クローン2A3、ロット番号601416M1)投与溶液は、ストック(7.38mg/mL)のアリコートを無菌PBS中で0.5mg/mLに希釈することによって調製した。0.5mg/mLの投薬溶液によって、10mL/kgの投薬容積で5mg/kgの投薬量が得られた。抗PD-1投薬溶液を、毎日新鮮に調製し、4℃で遮光して保存した。
B.MC38結腸腺癌モデル
MC-38結腸腺癌腫瘍を、上記のようにC57BL/6マウスの皮下に確立した。
一旦、腫瘍が確立すれば、動物を群に分け、以下の表に示す以下の併用療法の1つの腫瘍内投与を与えた。
マウスには7日ごとに腫瘍内投与のmRNAを与えた(Q7D)。マウスには2週間ごとに抗体の腫瘍内投与を与えた(BIWx2)。
C.結果
結果を図16A~図16E及び図17に示す。図16Aは、腫瘍内投与の対照抗体と組み合わせた、腫瘍内投与の対照NST_OX40L_122 mRNAで処置した動物における個々の腫瘍の成長を示す。対照群には0/15の完全応答動物(CR)がいた。図16Bは、腫瘍内投与の対照抗体と組み合わせた、mOX40L_miR-122 mRNAの腫瘍内投与で処置した動物における個々の腫瘍の成長を示す。移植後90日までに、この群ではCRは0/15であった。図16Cは、腫瘍内投与の抗PD-1抗体と組み合わせた腫瘍内対照mRNAで処置した動物における個々の腫瘍の成長を示す。移植後90日までに、この群についてのCRは2/15であった。図16Dは、腫瘍内投与の抗PD-1抗体と組み合わせた腫瘍内投与のmOX40L_miR-122 mRNAで処置した動物における個々の腫瘍の成長を示す。移植後90日目までに、二重併用群についてCRは6/15であった。図16Eは、腫瘍内投与の抗PD-1抗体と組み合わせた、腫瘍内投与のPBSで処置した動物における個々の腫瘍の成長を示す。移植後90日までに、この群についてのCRは0/15であった。図16Fは、腫瘍内投与の対照抗体と組み合わせた、腫瘍内投与のPBSで処置した動物における個々の腫瘍の成長を示す。移植後90日までに、この処置群についてのCRは0/14であった。
これらの結果、OD-40LポリペプチドをコードするmRNAを含むポリヌクレオシド及び免疫療法剤、例えば、抗PD-1抗体を含む併用療法が、in vivoでMC38マウス腫瘍モデルにおいて腫瘍の成長を阻害または減少するのに有効であることが示される。mOX40L_miR-122と抗PD-1との組合せは、相乗的なin vivoの抗腫瘍効果を示した。これらの結果によってまた、より低い用量のmRNAが、併用療法において使用され得ることも示される。
図17によって、同じ処置群における動物の生存曲線が示される。これらの結果、改変OX40L mRNAの腫瘍内投与を抗PD-1抗体の腫瘍内投与と組み合わせることが、対照治療群と比較してマウス腫瘍モデルにおける生存を効果的に増大させることが示される。
実施例15
併用療法による処置後のin vivoの記憶免疫応答
マウスを、実施例14に上記したように、抗PD-1抗体と組み合わせたmOX40L_miR-122で処置した。接種後90日目に、mOX40L_miR-122+抗PD-1併用療法群由来の4匹の完全応答動物(CR)に、5×105個のMC38腫瘍細胞を再抗原投与した。対照として、10匹のナイーブ動物にはまた、5×105個のMC38細胞を接種した。分析の結果を図18A及び図18Bに示す。
図18Aは、MC38細胞をチャレンジしたナイーブ動物における個々の腫瘍の成長を示す。ナイーブマウスは、移植のおよそ5日後に検出可能な腫瘍の発達を開始し、研究中に腫瘍は成長し続けた。図18Bは、以前にmOX40L_miR-122と抗PD-1抗体との併用療法の腫瘍内投与を与えられた完全応答動物における個々の腫瘍の成長を示す。完全応答動物は、腫瘍細胞の再チャレンジ後23日間、腫瘍の成長を示さなかった(0/4匹の動物)。対照的に、ナイーブ動物は、高い割合の腫瘍の成長を示した。これらの結果、抗PD-1抗体と組み合わせたOX40LポリペプチドをコードするmRNAの腫瘍内投与が、抗腫瘍効果を伴う記憶免疫応答を誘導することが示される。
実施例16
三剤mRNA療法による一次処置腫瘍及び未処置遠位腫瘍の両方における顕著な有効性
実験は、MC38-Sマウス腫瘍モデルを使用して行った。各動物の各脇腹に腫瘍を植え込んだ。図19Aを参照のこと。1つの脇腹の原発性腫瘍を、対照mRNA(OX40Lをコードする非翻訳mRNA)、IL-23及びIL36ガンマをコードするmRNAの組合せ、またはIL-23、IL-36ガンマ及びOX40LをコードするmRNAの三剤の組合せで処置した。次いで、第1の腫瘍の処置の効果を、第2の(未処置の)腫瘍で測定した。図19A。1処置あたりのmRNAの総用量は、5μgのmRNAであった。mRNAは単一の腫瘍内投与として投与した。
図19B及び19Cは、対照mRNAで処置したマウスの処置腫瘍及び遠位腫瘍の両方において大きな腫瘍体積を示す。二剤mRNA療法を、近位腫瘍に投与した場合(図19D)、この遠位腫瘍において9つの完全応答(50%)が観察された(図19E)。三剤mRNA療法を近位腫瘍に投与した場合(図19F)、遠位腫瘍において15の完全応答(83.3%)が観察された(図19G)。
このデータによって、mRNA治療組成物を用いた腫瘍の処置が他の部位で腫瘍を効果的に処置し得ることが示される。
実施例17
三剤mRNAに加えて抗PD-L1 Abは、B16F10-AP3腫瘍モデルを処置することが困難な有効性の改善を示す。
チェックポイント阻害剤に応答しないモデルで処置が困難である三剤療法(IL-23、IL-36ガンマ及びOX40LをコードするmRNAの三剤組合せ)の改善された有効性を評価するために、B16F10-AP3マウスメラノーマ細胞モデルを用いた。先の実施例と同様に、総mRNA投与量は、腫瘍内に単回投与された全mRNAの5μgであった。抗PD-L1抗体を、10mg/kgで1週あたり2回、腹腔内に投与した。
図20Aは、対照mRNAで処置したマウスにおける腫瘍体積を示す。抗PD-L1抗体を単独で投与した場合、応答は観察されなかった(図20B)。三剤mRNA療法(IL23、IL36ガンマ、及びOX40LをコードするmRNA)を投与した場合、完全応答はいずれも観察されなかった(図20C)。一方で、三剤mRNA療法を抗PD-L1抗体と組み合わせて投与した場合、15例のうち5つの完全応答が観察された(33%)。1匹のマウスにおける完全応答に加えて、腫瘍の大きさは60mm3未満に減少した(図20D)。
このデータによって、従来の治療、例えば、抗PD-L1抗体による処置に対して不応性の腫瘍が、本明細書に開示されるいくつかのmRNAによるこのような治療(例えば、IL-23、IL-36ガンマ、及びOX40LをコードするmRNAを含む三剤療法)と組み合わせることによって有効に処置され得ることが示される。
実施例18
IL-23:IL-36ガンマ二剤療法及びIL23:IL-36ガンマ:OX40L三剤治療による処置後の記憶免疫応答
二剤併用療法で処置した動物における記憶免疫応答を評価した。MC38-S腫瘍細胞を接種したマウスを、IL-23ポリペプチドをコードするmRNAを含むポリヌクレオチドとIL-36ガンマポリペプチドをコードするmRNAを含む第2のポリヌクレオチドとからなる二剤併用療法で処置した。5μgの全mRNAを、4週間にわたって腫瘍内に週1回注射した(Q7D)。
10匹のマウスのうち10匹が完全応答であった。ナイーブ動物を同じ癌で抗原投与した場合、全てのマウス(15例のうち15例)がエスケープであった(図21A)。対照的に、完全応答動物であったマウスを同じ癌で再チャレンジした場合、再チャレンジされたマウスのいずれにおいても腫瘍の成長は観察されなかった(図21B)。
二剤mRNA療法(IL-23:IL-36)で処置したマウスでは、上記で考察したように、局所治療後の抗がんメモリーの発生(すなわち、最初の処置からの完全応答動物であった再抗原投与したマウスにおいて腫瘍は増殖しなかった)が観察され、また三剤mRNA療法(IL23:IL-36ガンマ:OX40L)で処置したマウスについても観察された(初期処置からの完全応答動物であった5例の再チャレンジしたマウスのうち5例で腫瘍は増殖しなかった;示さず)。
実施例19
免疫細胞のレベルに対する二剤及び三剤治療の効果
二剤療法(IL-23及びIL-36ガンマをそれぞれコードするmRNAの二剤の組合せ)及び三剤治療(それぞれ、IL-23、IL-36ガンマ及びOX40LをコードするmRNAの三剤組合せ)の有効性を評価するために、免疫細胞レベルを評価した。
MC38-R腫瘍細胞を接種したマウスを、二剤療法で処置すると、CD45+細胞のパーセントとして顆粒球として(図22A)、または腫瘍1mgあたりの顆粒球として(図22B)測定された、MC38-R腫瘍におけるLy6G+顆粒球のレベルの顕著な上昇が生じた。三剤療法による処置後にも顆粒球の劇的な増大が観察された(図23)。
二剤及び三剤療法による処置は、交差提示樹状細胞のレベルを上昇させた(図24A及び24Bを参照のこと)。
二剤治療による処置は、CD45+細胞の割合としてCD103+樹状細胞として(図24A)または腫瘍の1mgあたりのCD103+樹状細胞として(図24B)測定した、MC28-R腫瘍における交差提示CD103+樹状細胞のレベルを上昇させた。三剤治療による、MC38-R腫瘍細胞を接種したマウスの処置は、腫瘍及び流入領域リンパ節の両方における交差提示樹状細胞において同様の増大を示した(図25A及び図25Bを参照のこと)。これらの樹状細胞の増大は、腫瘍1mgあたりのCD103+樹状細胞を定量した分析(図25A)でも、及び腫瘍流入領域リンパ節のCD8+樹状細胞(図25B)を定量した分析でも観察された。
三剤療法による処置は、腫瘍1mgあたりのCD11b+樹状細胞として測定された、腫瘍中のCD11b+樹状細胞のレベルを上昇させた(図26A)。CD11b+樹状細胞の増大はまた、流入領域リンパ節でも観察された(図26B)。三剤療法の投与は、流入リンパ節におけるCD11b+樹状細胞におけるCD86活性化の変化を引き起こした(図26C及び図26Dを参照のこと)。
図27A及び図27Bは、CD8 cDC1細胞の百分率として(図27A)または平均蛍光強度(MFI)として(図27B)測定した、MC38腫瘍への三剤mRNA治療の腫瘍内投与後の24時間及び72時間後の流入領域リンパ節におけるCD8 cDC1に対するCD86活性化を示す。
さらに、二剤及び三剤療法の投与後、CD86及びMHCIの初期の増大が観察された。CD86及びMHCIは、7時間での二剤処理後のCD8+樹状細胞でより高かったが、MHCIは、7日目での三剤処理後の方が高かった。CD103+樹状細胞において、投与後に観察されたCD86及びMHCIの初期の増大があった。流入領域リンパ節におけるCD8+DC細胞では、投与後にCD86及びMHCIも増大した。CD86及びMHCIは、72時間で二剤の後のCD8+流入領域リンパ節がより高かったが、MHCIは7日で三剤の後に高かった(データは示さず)。
三剤療法の投与はまた、腫瘍(図28A)及び流入領域リンパ節(図28B)の両方における炎症性樹状細胞(iDC)の増大も引き起こした。三剤療法の投与後、炎症性樹状細胞でもCD86の増大が観察された(図28C及び図28D)。
二剤療法または三剤療法による処置はまた、MC38-R腫瘍におけるCD8:Treg比を増大させ、これによって、エフェクター:サプレッサーT細胞比の改善が示された(図29)。この効果は、二剤または三剤療法の投与後7日目にさらに顕著であった。
活性化すると、ナイーブT細胞サブセットは、エフェクター細胞への増殖及び分化を受け、続いて記憶T細胞のプールが生成される。移動パターン及び機能に基づいて、それらは中央記憶(主にリンパ節へのホーミング)及びエフェクター記憶(主にリンパ系外の部位へのホーミング)サブセットに分類される。二剤療法または三剤療法による処置は、腫瘍内のCD4+(図30A)及びCD8+(図30B)中枢及びエフェクター記憶T細胞を増大させた。OX40L:IL-23:IL-36ガンマ三剤療法は、IL-23:IL-36ガンマ二剤よりも腫瘍におけるエフェクター記憶細胞のより大きな増大を引き起こした。
図31は、MC38-R腫瘍細胞を接種されたマウスの生存に対する細胞障害性T細胞枯渇の効果を示す。腫瘍内に5μg用量の三剤mRNAを投与してマウスを処置した。図中の矢印は、mRNA三剤療法の投与日を示した。抗体枯渇(円)は、mRNA投与の2日前に開始した。最も長い生存は、三剤単独、三剤プラス対照抗体、または三剤+抗CD4抗体で処置したマウスで観察された。三剤+抗CD8抗体との同時投与は、生存率の劇的な低下をもたらし、細胞障害性T細胞が、OX40L:IL-23:IL-36ガンマ三剤療法による生存利益にとって必須であることが実証された。
実施例20
MC38モデルにおける三剤のmRNA療法及び抗PDL1抗体を含む併用療法の有効性
二剤及び三剤療法の投与は、PD-L1のレベルを上昇させた。三剤治療の投与後に、癌細胞、例えば、CD45-、FsChi及びMHCII-においてPD-L1レベルのわずかな増大が観察された(図32A及び32B)。
二剤のIL-23:IL-36ガンマの投与はまた、PD-L1に対して陽性のCD11b+細胞の割合の増大ももたらした(図33A)。この観察は、CD11b+細胞におけるPD-L1発現の増大と相関した(図33B)。三剤の組合せの投与はまた、PDL1陽性のCD11b+細胞の百分率の増大(図34A)及びCD11b+細胞のPDL1発現の増大(図34B)ももたらした。
三剤mRNA治療による処置に応答した、MC38モデルにおけるPD-L1の発現の増大によって、抗PD-L1抗体と三剤治療を組み合わせる合理性が示された。総mRNA投与量は、全mRNA量の5ugであり、腫瘍内に単回用量として投与した。抗体(抗PD-L1抗体10F.9G2または対照)に、10mg/kgで週2回腹腔内投与した。陰性の対照抗体(図35A)または抗PD-L1抗体(図35B)を単独で投与した場合、応答は観察されなかった。三剤mRNA治療(IL23、IL36γ、及びOX40LをコードするmRNA)を投与した場合、完全応答は観察されなかったが(図35C)、15匹のマウスのうち4匹が腫瘍の縮小を示した。一方では、三剤mRNA療法を抗PD-L1抗体と組み合わせて投与した場合、15匹のマウスのうち12匹が腫瘍サイズの縮小または完全応答を経験した(図35D)。このデータによって、従来の治療、例えば、抗PD-L1抗体による処置に対して不応性の腫瘍が、本明細書に開示されるいくつかのmRNA(例えば、IL-23、IL-36ガンマ、及びOX40LをコードするmRNAを含む三剤療法)とこのような治療との組合せによって有効に処置され得ることが示される。
実施例21
HCC同系モデルにおける二剤療法及び三剤療法の有効性
上記に示す以前の実験は、mRNA併用療法、例えばIL-23/IL-36ガンマ(二剤)及びIL-23/IL-36ガンマ/OX40L(三剤)併用療法が、MC38結腸腺癌、A20マウスB細胞リンパ腫、またはB16F10-AP3メラノーマモデルにおいて有効であることを示す。本開示で使用される細胞系、例えば、H22、MC38、及びB16F10細胞系のそれぞれ1つを使用して、異なる腫瘍微小環境をモデル化してもよい。MC38細胞は、免疫抑制環境をモデル化するが、B16F10細胞は、免疫抑制性環境をモデル化する。本実験では、二剤及び三剤の併用療法の有効性は、炎症性腫瘍微小環境をモデル化する肝癌細胞株である同系H22細胞株で評価した。
マウスに、三剤併用療法(IL-23/IL-36ガンマ/OX40L)中の各mRNA2.5μg、すなわち、化合物18脂質ナノ粒子中に処方された合計7.5μg、または対照mRNA7.5μg(NST-FIX)を投与した。mRNAを、腫瘍内Q7D×3(N=10マウス/群)に投与した。30日後、全ての対照マウスが、容積1,500mm3を超える腫瘍を有した(図36A)。対照的に、三剤療法で処置されたマウスのいずれも容積1,500mm3を超える腫瘍は有していなかった(図36B)。このように、三剤併用療法は、HCC同系モデルにおいても有効であることが示された。
実施例22
MC38-M(R)におけるOASISの一部としてのヒトIL-36対マウスIL-36の有効性
三剤mRNA療法におけるヒトIL-36ガンマ対マウスIL-36の有効性を決定するために研究を設計して、OX40L、IL-23、及びマウスIL-36ガンマまたはヒトIL-36ガンマのいずれかをコードするmRNAの複数の組合せを試験した。この研究の設計を表11に示す。
MC-38-M結腸腺癌腫瘍を、上記のようにC57BL/6マウスの皮下に確立した。
腫瘍が確立したら、動物を群に分け、以下の表に示す以下の併用療法のうちの1つの腫瘍内投与を与えた。各群は15匹の動物を含んだ。各動物には、合計の容積用量25ulで5μg/マウスの合計mRNA用量をqdx4で投与した。
ヒトIL-36ガンマまたはマウスIL-36ガンマのいずれかを使用した場合、腫瘍サイズの減少が観察された;しかし、マウスIL-36ガンマを使用する三剤療法の有効性は優れていた(図37)。このデータによって、OX40L単剤療法が腫瘍サイズの減少をもたらさなかったことが示される。IL-23単独療法は、腫瘍サイズの減少をもたらした。しかし、IL-23に対する腫瘍の応答は、IL-23及びOX40Lの相乗的組合せに対する応答よりも低かった。腫瘍サイズの減少は、試験したOX40及びIL-23に対するmIL-36ガンマ比の全てで観察された(図38A)。平均腫瘍体積に対するこれらの組成物の効果はあまり顕著ではないが(図38B)、hIL-36ガンマを含む三剤mRNAの組合せに関して同様の効果が観察された。研究における各々の群、及び各個々の動物に対応するデータを、図39A~図39Oに示す。第8群(OX40L単独療法)の全ての動物がエスケープであった(図39H)。群内の4匹の動物(IL-23単独療法)は完全応答動物であった(図39I)。OX40LとIL-23の単独療法の組合せにより、9例の完全応答動物が得られた(図39E)。従って、OX40LとIL-23の単独療法の組合せは、相加的ではなく相乗的であった。最も効果的な併用療法は、OX40LをコードするmRNA、IL-23をコードするmRNA、及びIL-36ガンマをコードするマウスmRNAを1:1:0.125の比率で含む三剤療法であった(図39D)。そのような三剤療法は、10回の完全応答に加えて100mm3未満の腫瘍体積を有する2匹の動物を生じた。グループ内の15匹の動物のうち、12がエスケープであった。図40、及び図41A~41Oは、試験した種々の療法の体重に対する影響を示す。
図42は、試験した種々の療法の生存率に対する効果を示す。この研究では、OX40L単独療法で処置された動物で30日を越えて生存した動物はなかった。50日後、IL-23単独療法で処置した動物の生存率は40%をわずかに下回った。しかし、OX40L及びIL-23の両方で処置した動物の生存率は、50日後に70%に近く、OX40L及びIL-23の組合せの相乗作用が再び示された。最も高い生存率は、三剤療法mOX40L:mIL-23:mIL-36ガンマを用いて、1:1:1比(生存率90%以上)または1:1:0.5(生存率80%)で処置した動物に相当した。マウスIL-36ガンマを使用した場合に観察された生存率は、ヒトIL-36ガンマを使用した場合に観察された生存率よりも有意に高かった。
実施例23
炎症性腫瘍微小環境モデルにおける三剤mRNA療法と同様に有効な二剤mRNA療法
MC38-Sマウス腫瘍モデルを、炎症腫瘍微小環境のモデルとして使用して実験を行った。腫瘍を植え込み、IL-23及びOX40Lをコードする二剤mRNA療法(すなわち、1つの免疫応答プライマー及び1つの免疫応答共刺激シグナル)またはIL-23、IL-36ガンマ及びOX40Lをコードする三剤mRNA療法(すなわち、2つの免疫応答プライマー及び1つの免疫応答共刺激シグナル)のいずれかを用いて動物を処置した。1処置あたりのmRNAの総用量は、5μgのmRNAであった。適切な量のNST対照mRNAを添加することにより、各用量におけるmRNAの総量を一定に保った。mRNAを、単一の腫瘍内投与として投与した。腫瘍体積を、植え込み後、経時的に測定した。その結果を図43A(三剤mRNA療法)及び43B(二剤mRNA療法)に示す。その結果によって、二剤及び三剤mRNA療法の両方が、動物における腫瘍の成長を阻害するのに有効であることが実証される。
このデータによって、炎症を起こした腫瘍微小環境を有する腫瘍の有効な処置が、単一の免疫応答プライマー及び単一の免疫応答共刺激シグナルをコードするmRNA(複数可)を使用して(すなわち二剤mRNA療法)達成され得ることが示される。
他の実施形態
使用された言葉は限定ではなく説明のための言葉であり、変更が本開示のその広範な態様において、真の範囲及び精神から逸脱することなく添付の特許請求の範囲内でなされ得ることが理解されるべきである。
本開示は、いくつかの記載された実施形態に関してある程度の長さで、かつある程度詳細に記載されているが、本開示は、任意のそのような事項もしくは実施形態または任意の特定の実施形態に限定されるべきであるとは意図しておらず、先行技術に照らしてそのような請求の範囲を可能な限り広範に解釈できるように、添付の特許請求の範囲を参照して解釈され、したがって本開示の意図された範囲を効果的に包含するべきである。
本明細書中に言及される全ての刊行物、特許出願、特許及び他の参考文献は、その全体が参照により組み込まれる。矛盾する場合、定義を含む本明細書が優先する。さらに、セクションの見出し、材料、方法、及び実施例は、例示に過ぎず、限定することを意図するものではない。
本発明の実施形態において、例えば以下の項目が提供される。
(項目1)
少なくとも2つのポリヌクレオチドを含む、腫瘍の大きさを減少させ、または腫瘍の成長を阻害するための組成物であって、前記少なくとも2つのポリヌクレオチドが、
(i)第1の免疫応答プライマーポリペプチドをコードする少なくとも1つのポリヌクレオチド、
(ii)第2の免疫応答プライマーポリペプチドをコードする少なくとも1つのポリヌクレオチド、
(iii)免疫応答共刺激シグナルペプチドをコードする少なくとも1つのポリヌクレオチド、及び
(iv)これらの組み合わせ
からなる群より選択される、組成物。
(項目2)
前記少なくとも2つのポリヌクレオチドが、
(i)第1の免疫応答プライマーポリペプチドをコードする少なくとも1つのポリヌクレオチド及び第2の免疫応答プライマーポリペプチドをコードする少なくとも1つのポリヌクレオチド、ならびに
(ii)第1の免疫応答プライマーポリペプチドをコードする少なくとも1つのポリヌクレオチド、第2の免疫応答プライマーポリペプチドをコードする少なくとも1つのポリヌクレオチド、及び免疫応答共刺激シグナルポリペプチドをコードする少なくとも1つのポリヌクレオチド
からなる群より選択される、項目1に記載の組成物。
(項目3)
前記第1及び第2の免疫応答プライマーポリペプチドが、
(a)樹状細胞を刺激すること、
(b)樹状細胞の成熟を促進すること、
(c)抗原提示細胞サイトカイン及び/またはケモカインの産生を促進すること、
(d)Th17細胞を増殖させることまたは維持すること、
(e)Th1及び/またはTh9の分化を亢進すること、ならびに
(f)(a)~(f)のいずれかの組み合わせ
からなる群より選択される、1つ以上の活性を有する、項目1または2のいずれかに記載の組成物。
(項目4)
前記第1または第2の免疫応答プライマーポリペプチドが、IL-12ファミリーのメンバーである、項目1~3のいずれか一項に記載の組成物。
(項目5)
IL-12ファミリーのメンバーは、IL-12、IL-23、IL-12p40サブユニット、IL-23p19サブユニット、IL-27、IL-35、及びそれらの組み合わせからなる群より選択されるポリペプチドを含む、項目4に記載の組成物。
(項目6)
前記免疫応答プライマーポリペプチドが、IL-23ポリペプチドである、項目5に記載の組成物。
(項目7)
前記IL-23ポリペプチドが、配列番号1、配列番号5または配列番号140のアミノ酸配列を含む、項目6に記載の組成物。
(項目8)
前記IL-23ポリペプチドが、配列番号141または配列番号142に示されるヌクレオチド配列を含むヌクレオチド配列によってコードされる、項目6に記載の組成物。
(項目9)
前記第1または第2の免疫応答プライマーポリペプチドが、IL-1ファミリーのメンバーである、項目1~3のいずれか一項に記載の組成物。
(項目10)
前記IL-1ファミリーのメンバーが、IL-1α、IL-1β、IL-1Ra、IL-18、IL-33、IL-36Ra、IL-36α、IL-36β、IL-36γ、IL-37、IL-38、及びこれらの組み合わせからなる群より選択されるポリペプチドを含む、項目9に記載の組成物。
(項目11)
前記免疫応答プライマーポリペプチドが、IL-36ガンマポリペプチドである、項目10に記載の組成物。
(項目12)
IL-36ガンマポリペプチドが、配列番号16に示されるアミノ酸配列を含む、項目11に記載の組成物。
(項目13)
IL-36ガンマポリペプチドが、配列番号143または配列番号144に示されるヌクレオチド配列を含むヌクレオチド配列によってコードされる、項目12に記載の組成
物。
(項目14)
前記免疫応答プライマーポリペプチドが、IL-18ポリペプチドである、項目10に記載の組成物。
(項目15)
IL-18ポリペプチドが、配列番号147、149、151または153に示されるアミノ酸配列を含む、項目14に記載の組成物。
(項目16)
IL-18ポリペプチドが、配列番号148及び配列番号155~162からなる群より選択されるヌクレオチド配列を含むヌクレオチド配列によってコードされる、項目15に記載の組成物。
(項目17)
前記組成物が、第1の免疫応答プライマーポリペプチド及び第2の免疫応答プライマーポリペプチドをコードする少なくとも2つのポリヌクレオチドを含み、前記第1の免疫応答プライマーポリペプチドが、IL-12ファミリーのメンバーであり、かつ前記第2の免疫応答プライマーポリペプチドが、IL-1ファミリーのメンバーである、項目1または2のいずれか一項に記載の組成物。
(項目18)
前記第1の免疫応答プライマーポリペプチドが、IL-23ポリペプチドであり、かつ前記第2の免疫応答プライマーポリペプチドが、IL-36ガンマポリペプチドである、項目17に記載の組成物。
(項目19)
前記第1の免疫応答プライマーポリペプチドが、IL-23ポリペプチドであり、かつ前記第2の免疫応答プライマーポリペプチドが、IL-18ポリペプチドである、項目17に記載の組成物。
(項目20)
前記免疫応答共刺激シグナルポリペプチドが、
(a)T細胞の増殖、T細胞の生存、T細胞の動員を活性化、刺激、促進、もしくは亢進すること、またはこれらの組み合わせ、及び
(b)NK細胞の増殖、NK細胞の生存、NK細胞の動員を活性化、刺激、促進もしくは亢進すること、またはこれらの組み合わせ
からなる群より選択される少なくとも1つの活性を有する、先行項目のいずれかに記載の組成物。
(項目21)
前記免疫応答共刺激シグナルポリペプチドが、
(c)T細胞の増殖及び/または機能を促進または亢進すること、
(d)Th1、Th2及び/またはTh9細胞発生を促進または亢進すること、
(e)Tregの発生及び/または活性を阻害または抑制すること、
(f)記憶細胞の発生及び/または活性を促進または亢進すること、ならびに
(g)(c)~(f)のいずれかの組み合わせ
からなる群より選択される少なくとも1つの活性を有する、先行項目のいずれかに記載の組成物。
(項目22)
前記免疫応答共刺激シグナルポリペプチドが、OX40L、CD80、IL-15、及びそれらのいずれかの組合せからなる群より選択される、先行項目のいずれかに記載の組成物。
(項目23)
前記免疫応答共刺激シグナルポリペプチドが、OX40L及びIL-15、ならびにそれらのいずれかの組合せからなる群より選択される、項目22に記載の組成物。
(項目24)
前記免疫応答共刺激シグナルポリペプチドが、OX40Lポリペプチドである、項目23に記載の組成物。
(項目25)
前記OX40Lポリペプチドが、配列番号21に示されるアミノ酸配列を含む、項目24に記載の組成物。
(項目26)
前記OX40Lポリペプチドが、配列番号145または配列番号146に示されるヌクレオチド配列を含むヌクレオチド配列によってコードされる、項目25に記載の組成物。(項目27)
前記組成物が、チェックポイント阻害剤ポリペプチドまたはチェックポイント阻害剤ポリペプチドを含むポリペプチドをコードするポリヌクレオチドをさらに含む、先行項目のいずれかに記載の組成物。
(項目28)
前記チェックポイント阻害剤ポリペプチドがPD1、PD-L1、CTLA4、またはこれらの組み合わせを阻害する、項目27に記載の組成物。
(項目29)
前記チェックポイント阻害剤ポリペプチドが、抗体またはその抗原結合断片である、項目28に記載の組成物。
(項目30)
前記抗体が、CTLA4を特異的に結合する抗CTLA4抗体またはその抗原結合フラグメント、PD1を特異的に結合する抗PD1抗体またはその抗原結合フラグメント、PD-L1を特異的に結合する抗PD-L1抗体またはその抗原結合断片、及びこれらの組み合わせである、項目29に記載の組成物。
(項目31)
前記抗PD-L1抗体が、アテゾリズマブ、アベルマブ、またはデュルバルマブである、項目30に記載の組成物。
(項目32)
前記抗CTLA-4抗体が、トレメリムマブまたはイピリムマブである、項目30に記載の組成物。
(項目33)
前記抗PD1抗体が、ニボルマブまたはペンブロリズマブである、項目30に記載の組成物。
(項目34)
少なくとも第1及び第2のポリペプチドをコードする少なくとも2つのポリヌクレオチドを含む、腫瘍の大きさを減少させまたは腫瘍の成長を阻害するための組成物であって、前記少なくとも2つのポリヌクレオチドが、
(i)IL-23ポリペプチドをコードするポリヌクレオチド、
(ii)IL-36ガンマポリペプチドをコードするポリヌクレオチド、
(iii)IL-18ポリペプチドをコードするポリヌクレオチド、
(iv)OX40Lポリペプチドをコードするポリヌクレオチド、
(v)CD80ポリペプチドをコードするポリヌクレオチド、
(vi)抗CTLA4抗体をコードするポリヌクレオチド、及び
(vii)それらのいずれかの組合せ
からなる群より選択される、組成物。
(項目35)
前記少なくとも2つのポリヌクレオチドが、
(i)IL-23ポリペプチドをコードするポリヌクレオチド、
(ii)IL-36ガンマポリペプチドをコードするポリヌクレオチド、
(iii)IL-18ポリペプチドをコードするポリヌクレオチド、
(iv)OX40Lポリペプチドをコードするポリヌクレオチド、及び
(v)それらのいずれかの組合せ
からなる群より選択される、項目34に記載の組成物。
(項目36)
前記少なくとも2つのポリヌクレオチドが、
(i)IL23ポリペプチドをコードするポリヌクレオチド、及びIL36ガンマポリペプチドをコードするポリヌクレオチド、
(ii)IL23ポリペプチドをコードするポリヌクレオチド、及びIL-18ポリペプチドをコードするポリヌクレオチド、
(iii)IL23ポリペプチドをコードするポリヌクレオチド、及びOX40Lポリペプチドをコードするポリヌクレオチド、
(iv)IL36ガンマポリペプチドをコードするポリヌクレオチド、及びOX40Lポリペプチドをコードするポリヌクレオチド、
(v)IL36ガンマポリペプチドをコードするポリヌクレオチド、及びIL18ポリペプチドをコードするポリヌクレオチド、ならびに
(vi)IL18ポリペプチドをコードするポリヌクレオチド、及びOX40Lポリペプチドを含むポリヌクレオチド
からなる群より選択される、項目34に記載の組成物。
(項目37)
第3のポリペプチドをコードする少なくとも1つの第3のポリヌクレオチドをさらに含む、項目34に記載の組成物。
(項目38)
少なくとも第1、第2及び第3のポリヌクレオチドをコードする少なくとも3つのポリヌクレオチドを含む組成物であって、前記少なくとも3つのポリヌクレオチドが、
(i)IL23ポリペプチドをコードする第1のポリヌクレオチド、IL36ガンマポリペプチドをコードする第2のポリヌクレオチド、及びOX40Lポリペプチドをコードする第3のポリヌクレオチド、ならびに
(ii)IL23ポリペプチドをコードする第1のポリヌクレオチド、IL18ポリペプチドをコードする第2のポリヌクレオチド、及びOX40Lポリペプチドをコードする第3のポリヌクレオチド
からなる群より選択される、組成物。
(項目39)
前記組成物が、IL23ポリペプチドをコードする第1のポリヌクレオチド、IL36ガンマポリペプチドをコードする第2のポリヌクレオチド、及びOX40Lポリペプチドをコードする第3のポリヌクレオチドを含む、項目38に記載の組成物。
(項目40)
前記組成物が、IL23ポリペプチドをコードする第1のポリヌクレオチド、IL18ポリペプチドをコードする第2のポリヌクレオチド、及びOX40Lポリペプチドをコードする第3のポリヌクレオチドを含む、項目38に記載の組成物。
(項目41)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、(i)IL-12p40ポリペプチドをコードするオープンリーディングフレーム(ORF)、(ii)IL-23p19ポリペプチドをコードするORF、または(iii)IL-12p40ポリペプチド及びIL-23p19ポリペプチドの両方をコードするORFを含む、項目38~40のいずれかに記載の組成物。
(項目42)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、IL-12p40ポリペプチド及びIL-23p19ポリペプチドの両方をコードするORFを含む、項目41に記載の組成物。
(項目43)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、IL-12p40ポリペプチド及びIL-23p19ポリペプチドをコードするORF、ならびに前記IL-12p40ポリペプチドと前記IL-23p19ポリペプチドの間に操作可能に位置取られたリンカーを含む、項目41に記載の組成物。
(項目44)
前記リンカーが、Gly/Serリンカーである、項目43に記載の組成物。
(項目45)
前記Gly/Serリンカーが(GnS)mを含み、nが1、2 3、4、5、6、7、8、9、10、15、または20であり、かつmが1、2、3、4、5、6、7、8、9、10、15、または20である、項目44に記載の組成物。
(項目46)
前記Gly/Serリンカーが(GnS)mを含み、nが6であり、かつmが1である、項目45に記載の組成物。
(項目47)
前記IL-23ポリペプチドが、配列番号140に示されるアミノ酸配列を含む、項目43に記載の組成物。
(項目48)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、配列番号141に示されるヌクレオチド配列を含む、項目43に記載の組成物。
(項目49)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、少なくとも1つのマイクロRNA(miR)結合部位を含む、項目48に記載の組成物。
(項目50)
前記miR結合部位が、miR-122結合部位である、項目49に記載の組成物。
(項目51)
前記miR-122結合部位が、miR-122-3pまたはmiR-122-5p結合部位である、項目49に記載の組成物。
(項目52)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、少なくとも1つのmiR-122-5p結合部位を含む3’UTRを含む、項目48に記載の組成物。
(項目53)
前記miR-122-5p結合部位が、配列番号26に示されるヌクレオチド配列を含む、項目52に記載の組成物。
(項目54)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、配列番号120に示されるヌクレオチド配列を含む3’UTRを含む、項目48に記載の組成物。
(項目55)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、配列番号27に示されるヌクレオチド配列を含む5’UTRを含む、項目48に記載の組成物。
(項目56)
IL-23ポリペプチドをコードする前記第1のポリヌクレオチドが、配列番号142に示されるヌクレオチド配列を含む、項目38に記載の組成物。
(項目57)
IL-36ガンマポリペプチドをコードする前記第2のポリヌクレオチドが、IL-36-ガンマポリペプチドをコードするORFへ作動可能に連結された異種性シグナルペプチドをコードするヌクレオチド配列を含む、項目38~56のいずれか一項に記載の組成物。
(項目58)
前記異種性シグナルペプチドが、ヒト免疫グロブリンカッパ軽鎖可変領域、hIGVK4に由来する、項目57に記載の組成物。
(項目59)
前記IL-36ガンマポリペプチドが、配列番号16に示されるアミノ酸配列を含む、項目57に記載の組成物。
(項目60)
IL-36ガンマポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号143に示されるヌクレオチド配列を含む、項目57に記載の組成物。
(項目61)
IL-36ガンマポリペプチドをコードする前記第2のポリヌクレオチドが、少なくとも1つのマイクロRNA(miRNA)結合部位を含む、項目60に記載の組成物。
(項目62)
前記miR結合部位が、miR-122結合部位である、項目61に記載の組成物。
(項目63)
前記miR-122結合部位が、miR-122-3pまたはmiR-122-5p結合部位である、項目62に記載の組成物。
(項目64)
IL-36ガンマポリペプチドをコードする前記第2のポリヌクレオチドが、少なくとも1つのmiR-122-5p結合部位を含む3’UTRを含む、項目60に記載の組成物。
(項目65)
前記miR-122-5p結合部位が、配列番号26に示されるヌクレオチド配列を含む、項目64に記載の組成物。
(項目66)
IL-36ガンマポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号120に示されるヌクレオチド配列を含む3’UTRを含む、項目60に記載の組成物。(項目67)
IL-36ガンマポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号27に示されるヌクレオチド配列を含む5’UTRを含む、項目66に記載の組成物。
(項目68)
IL-36ガンマポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号144に示されるヌクレオチド配列を含む、項目60に記載の組成物。
(項目69)
IL-18ポリペプチドをコードする前記第2のポリヌクレオチドが、IL-18ポリペプチドをコードするORFへ作動可能に連結された異種性シグナルペプチドをコードするヌクレオチド配列を含む、項目38~56のいずれか一項に記載の組成物。
(項目70)
前記異種性シグナルペプチドが、ヒト免疫グロブリンカッパ軽鎖可変領域(hIGVK4)に由来する、項目69に記載の組成物。
(項目71)
前記IL-18ポリペプチドが、配列番号147、配列番号149、配列番号151または配列番号153に示されるアミノ酸配列を含む、項目69に記載の組成物。
(項目72)
IL-18ポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号148及び配列番号155~162からなる群より選択されるヌクレオチド配列を含む、項目69に記載の組成物。
(項目73)
IL-18ポリペプチドをコードする前記第2のポリヌクレオチドが、少なくとも1つのマイクロRNA(miR)結合部位を含む、項目72に記載の組成物。
(項目74)
前記miR結合部位が、miR-122結合部位である、項目73に記載の組成物。
(項目75)
前記miR-122結合部位が、miR-122-3pまたはmiR-122-5p結合部位である、項目74に記載の組成物。
(項目76)
IL-18ポリペプチドをコードする前記第2のポリヌクレオチドが、少なくとも1つのmiR-122-5p結合部位を含む3’UTRを含む、項目72に記載の組成物。
(項目77)
前記miR-122-5p結合部位が、配列番号26に示されるヌクレオチド配列を含む、項目76に記載の組成物。
(項目78)
IL-18ポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号120に示されるヌクレオチド配列を含む3’UTRを含む、項目72に記載の組成物。
(項目79)
IL-18ポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号27に示されるヌクレオチド配列を含む5’UTRを含む、項目78に記載の組成物。
(項目80)
IL-18ポリペプチドをコードする前記第2のポリヌクレオチドが、配列番号161に示されるヌクレオチド配列を含む、項目69に記載の組成物。
(項目81)
前記OX40Lポリペプチドが、配列番号21に示されるアミノ酸配列を含む、項目38~80のいずれか一項に記載の組成物。
(項目82)
OX40Lポリペプチドをコードする前記第3のポリヌクレオチドが、配列番号145に示されるヌクレオチド配列を含む、項目81に記載の組成物。
(項目83)
OX40Lポリペプチドをコードする前記第3のポリヌクレオチドが、少なくとも1つのマイクロRNA(miR)結合部位を含む、項目82に記載の組成物。
(項目84)
前記miR結合部位が、miR-122結合部位である、項目83に記載の組成物。
(項目85)
前記miR-122結合部位が、miR-122-3pまたはmiR-122-5p結合部位である、項目84に記載の組成物。
(項目86)
OX40Lポリペプチドをコードする前記第3のポリヌクレオチドが、少なくとも1つのmiR-122-5p結合部位を含む3’UTRを含む、項目85に記載の組成物。
(項目87)
前記miR-122-5p結合部位が、配列番号26に示されるヌクレオチド配列を含む、項目86に記載の組成物。
(項目88)
OX40Lポリペプチドをコードする前記第3のポリヌクレオチドが、配列番号120に示されるヌクレオチド配列を含む3’UTRを含む、項目82に記載の組成物。
(項目89)
OX40Lポリペプチドをコードする前記第3のポリヌクレオチドが、配列番号27に示されるヌクレオチド配列を含む5’UTRを含む、項目88に記載の組成物。
(項目90)
OX40Lポリペプチドをコードする前記第3のポリヌクレオチドが、配列番号146に示されるヌクレオチド配列を含む、項目81に記載の組成物。
(項目91)
チェックポイント阻害剤ポリペプチドまたはチェックポイント阻害剤ポリペプチドを含むポリペプチドをコードするポリヌクレオチドをさらに含む、項目38~90のいずれか一項に記載の組成物。
(項目92)
前記チェックポイント阻害剤ポリペプチドが、PD1、PD-L1、CTLA4、またはこれらの組み合わせを阻害する、項目91に記載の組成物。
(項目93)
前記チェックポイント阻害剤ポリペプチドが、抗体または前記抗体をコードするポリヌクレオチドである、項目92に記載の組成物。
(項目94)
前記抗体が、CTLA4を特異的に結合する抗CTLA4抗体またはその抗原結合断片、PD1を特異的に結合する抗PD1抗体またはその抗原結合フラグメント、PD-L1を特異的に結合する抗PD-L1抗体またはその抗原結合フラグメント、及びそれらの組合せである、項目93に記載の組成物。
(項目95)
前記抗PD-L1抗体が、アテゾリズマブ、アベルマブ、またはデュルバルマブである、項目94に記載の組成物。
(項目96)
前記抗CTLA-4抗体が、トレメリムマブまたはイピリムマブである、項目94に記載の組成物。
(項目97)
前記抗PD1抗体が、ニボルマブまたはペンブロリズマブである、項目94に記載の組成物。
(項目98)
各ポリヌクレオチドが、修飾されたmRNAを含む、項目1~97のいずれか一項に記載の組成物。
(項目99)
各mRNAが、少なくとも1つの化学修飾を含む、項目98に記載の組成物。
(項目100)
前記化学修飾が、シュードウリジン、N1-メチルシュードウリジン、2-チオウリジン、4’-チオウリジン、5-メチルシトシン、2-チオ-1-メチル-1-デアザ-シュードウリジン、2-チオ-1-メチル-シュードウリジン、2-チオ-5-アザ-ウリジン、2-チオ-ジヒドロシュードウリジン、2-チオ-ジヒドロウリジン、2-チオ-シュードウリジン、4-メトキシ-2-チオ-シュードウリジン、4-メトキシ-シュードウリジン、4-チオ-1-メチル-シュードウリジン、4-チオ-シュードウリジン、5-アザ-ウリジン、ジヒドロシュードウリジン、5-メチルウリジン、5-メチルウリジン、5-メトキシウリジン、及び2’-O-メチルウリジンからなる群より選択される、項目99に記載の組成物。
(項目101)
前記化学修飾が、シュードウリジン、N1-メチルシュードウリジン、5-メチルシトシン、5-メトキシウリジン、及びこれらの組み合わせからなる群より選択される、項目100に記載の組成物。
(項目102)
前記化学修飾が、N1-メチルシュードウリジンである、項目100に記載の組成物。(項目103)
前記組成物中の各mRNAが、完全に修飾されたN1-メチルシュードウリジンを含む、項目98に記載の組成物。
(項目104)
腫瘍内送達のために製剤化された、項目1~103のいずれか一項に記載の組成物。
(項目105)
脂質ナノ粒子担体中に製剤化された、項目1~103のいずれか一項に記載の組成物。(項目106)
前記脂質ナノ粒子担体が、約20~60%のイオン性アミノ脂質、5~25%のリン脂質、25~55%のステロール、及び0.5~15%のPEG修飾された脂質のモル比を含む、項目105に記載の組成物。
(項目107)
前記脂質ナノ粒子担体が、約50%のイオン性アミノ脂質、約10%のリン脂質、約38.5%のコレステロール、及び約11.5%のPEG修飾された脂質のモル比を含む、項目105に記載の組成物。
(項目108)
前記脂質ナノ粒子担体が、約49.83%のイオン性アミノ脂質、約9.83%のリン脂質、約30.33%のコレステロール、及び約2.0%のPEG修飾された脂質のモル比を含む、項目105に記載の組成物。
(項目109)
前記イオン性アミノ脂質が、例えば、2,2-ジリノレイル-4-ジメチルアミノエチル-[1,3]-ジオキソラン(DLin-KC2-DMA)、ジリノレイル-メチル-4-ジメチルアミノブチラート(DLin-MC3-DMA)、及びジ((Z)-ノナ-2-エン-1-イル)9-((4-(ジメチルアミノ)ブタノイル)オキシ)ヘプタデカンジオアート(L319)からなる群より選択される、項目106~108のいずれか一項に記載の組成物。
(項目110)
前記イオン性アミノ脂質が、化合物18である、項目109に記載の組成物。
(項目111)
前記脂質ナノ粒子担体が、約20~60%の化合物18、5~25%のリン脂質、25~55%のコレステロール、及び0.5~15%のPEG修飾された脂質のモル比を含む、項目105に記載の組成物。
(項目112)
前記脂質ナノ粒子担体が、約50%の化合物18、約10%のリン脂質、約38.5%のコレステロール、及び約1.5%のPEG修飾された脂質のモル比を含む、項目105に記載の組成物。
(項目113)
前記脂質ナノ粒子担体が、約49.83%の化合物18、約9.83%のリン脂質、約30.33%のコレステロール、及び約2.0%のPEG修飾脂質のモル比を含む、項目105に記載の組成物。
(項目114)
(i)ヒトOX40Lポリペプチドをコードするポリヌクレオチド、
(ii)ヒトIL-23ポリペプチドをコードするポリヌクレオチドであって、前記ヒトIL-23ポリペプチドが、ヒトIL-23p19サブユニットへ作動可能に連結されたヒトIL-12p40サブユニットを含む、ポリヌクレオチド、及び
(iii)ヒトIL-36ガンマポリペプチドをコードするポリヌクレオチドであって、前記ヒトIL-36ガンマポリペプチドが異種性シグナルペプチドを含む、ポリヌクレオチド
を含む、脂質ナノ粒子であって、
前記ポリヌクレオチドが、修飾されたmRNAであり、及び
前記mRNAが、1:1:2のOX40L:IL-23:IL-36ガンマ質量比で製剤化された、脂質ナノ粒子。
(項目115)
(i)ヒトOX40Lポリペプチドをコードする前記ポリヌクレオチドが、配列番号145に示されるヌクレオチド配列を含み、
(ii)ヒトIL-23ポリペプチドをコードする前記ポリヌクレオチドが、配列番号141に示されるヌクレオチド配列を含み、かつ
(iii)ヒトIL-36ガンマポリペプチドをコードする前記ポリヌクレオチドが、配列番号143に示されるヌクレオチド配列を含む、項目114に記載の脂質ナノ粒子。(項目116)
各ポリヌクレオチド(i)~(iii)が、配列番号120に示されるヌクレオチド配列を含む3’UTRを含む、項目115に記載の脂質ナノ粒子。
(項目117)
各ポリヌクレオチド(i)~(iii)が、配列番号27に示されるヌクレオチド配列を含む5’UTRを含む、項目115または116に記載の脂質ナノ粒子。
(項目118)
(i)ヒトOX40Lポリペプチドをコードする前記ポリヌクレオチドが、配列番号146に示されるヌクレオチド配列を含み、
(ii)IL-23ポリペプチドをコードする前記ポリヌクレオチドが、配列番号142に示されるヌクレオチド配列を含み、かつ
(iii)ヒトIL-36ガンマポリペプチドをコードする前記ポリヌクレオチドが、配列番号144に示されるヌクレオチド配列を含む、項目114に記載の脂質ナノ粒子。(項目119)
各mRNAが、少なくとも1つの化学修飾を含む、項目114~118のいずれか一項に記載の脂質ナノ粒子。
(項目120)
前記化学修飾が、シュードウリジン、N1-メチルシュードウリジン、2-チオウリジン、4’-チオウリジン、5-メチルシトシン、2-チオ-1-メチル-1-デアザ-シュードウリジン、2-チオ-1-メチル-シュードウリジン、2-チオ-5-アザ-ウリジン、2-チオ-ジヒドロシュードウリジン、2-チオ-ジヒドロウリジン、2-チオ-シュードウリジン、4-メトキシ-2-チオ-シュードウリジン、4-メトキシ-シュードウリジン、4-チオ-1-メチル-シュードウリジン、4-チオ-シュードウリジン、5-アザ-ウリジン、ジヒドロシュードウリジン、5-メチルウリジン、5-メチルウリジン、5-メトキシウリジン、及び2’-O-メチルウリジンからなる群より選択される、項目119に記載の脂質ナノ粒子。
(項目121)
前記化学修飾が、シュードウリジン、N1-メチルシュードウリジン、5-メチルシトシン、5-メトキシウリジン、及びこれらの組み合わせからなる群より選択される、項目120に記載の脂質ナノ粒子。
(項目122)
前記化学修飾が、N1-メチルシュードウリジンである、項目121に記載の脂質ナノ粒子。
(項目123)
前記脂質ナノ粒子中の各mRNAが、完全に修飾されたN1-メチルシュードウリジンを含む、項目119に記載の脂質ナノ粒子。
(項目124)
腫瘍内送達のために製剤化された、項目114~123のいずれか一項に記載の脂質ナノ粒子。
(項目125)
前記脂質ナノ粒子が、約20~60%の化合物18、5~25%のリン脂質、25~55%のコレステロール、及び0.5~15%のPEG修飾脂質のモル比を含む、項目114~124のいずれか一項に記載の脂質ナノ粒子。
(項目126)
前記脂質ナノ粒子が、約50%の化合物18、約10%のリン脂質、約38.5%のコレステロール、及び約1.5%のPEG修飾脂質のモル比を含む、項目114~124のいずれか一項に記載の脂質ナノ粒子。
(項目127)
前記脂質ナノ粒子が、約49.83%の化合物18、約9.83%のリン脂質、約30.33%のコレステロール、及び約2.0%のPEG修飾された脂質のモル比を含む、項目114~124のいずれか一項に記載の脂質ナノ粒子。
(項目128)
項目114~127のいずれか一項に記載の脂質ナノ粒子、及び医薬として許容され得る担体または賦形剤を含む、組成物。
(項目129)
項目114~127のいずれか一項に記載の脂質ナノ粒子及び任意選択の医薬として許容され得る担体を含む組成物、または個体におけるがんの進行を治療するもしくは遅延させるうえでの使用のための項目128に記載の組成物であって、前記治療が、第2の組成物と組み合わせた前記脂質ナノ粒子の投与を含み、前記第2の組成物が、チェックポイント阻害剤ポリペプチド及び任意選択の医薬として許容され得る担体を含む、前記組成物。(項目130)
個体におけるがんの進行を治療するまたは遅延させる薬剤の製造における、項目114~127のいずれか一項に記載の脂質ナノ粒子及び任意選択の医薬として許容され得る担体の使用であって、前記薬剤が、前記脂質ナノ粒子及び前記任意選択の医薬として許容され得る担体を含み、前記治療が、チェックポイント阻害剤ポリペプチド及び任意選択の医薬として許容され得る担体を含む組成物との組み合わせにおける前記薬剤の投与を含む、前記使用。
(項目131)
項目114~127のいずれか一項に記載の脂質ナノ粒子及び任意選択の医薬として許容され得る担体または項目128に記載の組成物を含む容器、ならびに個体におけるがんの進行を治療するまたは遅延させるための前記脂質ナノ粒子または医薬組成物の投与のための説明書を含む添付文書を含む、キット。
(項目132)
前記添付文書が、個体におけるがんの進行を治療するまたは遅延させるための、チェックポイント阻害剤ポリペプチド及び任意選択の医薬として許容され得る担体を含む組成物との組み合わせでの前記医薬組成物の投与のための説明をさらに含む、項目131に記載のキット。
(項目133)
項目114~127のいずれか一項に記載の脂質ナノ粒子及び任意選択の医薬として許容され得る担体または項目128に記載の医薬組成物を含む薬剤、ならびに個体におけるがんの進行を治療するもしくは遅延させるための、前記薬剤単独のための説明、または前記薬剤と、チェックポイント阻害剤ポリペプチド及び任意選択の医薬として許容され得る担体を含む組成物との組み合わせにおける投与のための説明を含む添付文書を含む、キット。
(項目134)
個体におけるがんの進行を治療するまたは遅延させるための、第1の薬剤及び第2の薬剤の投与のための説明を含む添付文書をさらに含む、項目133に記載のキット。
(項目135)
前記チェックポイント阻害剤ポリペプチドが、PD1、PD-L1、CTLA4、またはそれらの組み合わせを阻害する、項目114~127のいずれか一項に記載の脂質ナノ粒子、項目128もしくは129に記載の組成物、項目130に記載の使用、または項目131~134のいずれか一項に記載のキット。
(項目136)
前記チェックポイント阻害剤ポリペプチドが、抗体である、項目114~127のいずれか一項に記載の脂質ナノ粒子、項目128もしくは129に記載の組成物、項目130に記載の使用、または項目131~134のいずれか一項に記載のキット。
(項目137)
前記チェックポイント阻害剤ポリペプチドが、CTLA4を特異的に結合する抗CTLA4抗体またはその抗原結合断片、PD1を特異的に結合する抗PD1抗体またはその抗原結合断片、PD-L1を特異的に結合する抗PD-L1抗体またはその抗原結合断片、及びそれらの組み合わせから選択される抗体である、項目114~127のいずれか一項に記載の脂質ナノ粒子、項目128もしくは129に記載の組成物、項目130に記載の使用、または項目131~134のいずれか一項に記載のキット。
(項目138)
前記チェックポイント阻害剤ポリペプチドが、アテゾリズマブ、アベルマブ、またはデュルバルマブから選択される抗PD-L1抗体である、項目114~127のいずれか一項に記載の脂質ナノ粒子、項目128もしくは129に記載の組成物、項目130に記載の使用、または項目131~134のいずれか一項に記載のキット。
(項目139)
前記チェックポイント阻害剤ポリペプチドが、トレメリムマブまたはイピリムマブから選択される抗CTLA-4抗体である、項目114~127のいずれか一項に記載の脂質ナノ粒子、項目128もしくは129に記載の組成物、項目130に記載の使用、または項目131~134のいずれか一項に記載のキット。
(項目140)
前記チェックポイント阻害剤ポリペプチドが、ニボルマブまたはペンブロリズマブから選択される抗PD1抗体である、項目114~127のいずれか一項に記載の脂質ナノ粒子、項目128もしくは129に記載の組成物、項目130に記載の使用、または項目131~134のいずれか一項に記載のキット。
(項目141)
腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害する必要のある対象へ、項目1~113及び128~129のいずれか一項に記載の組成物、または項目114~127のいずれか一項に記載の脂質ナノ粒子を投与することを含む、前記対象における腫瘍の大きさを減少もしくは低下させ、または腫瘍の成長を阻害する、方法。
(項目142)
前記組成物が、腫瘍内投与される、項目141に記載の方法。
(項目143)
前記組成物が、局部的に投与される、項目141に記載の方法。
(項目144)
前記組成物が、腹腔内投与される、項目141に記載の方法。
(項目145)
前記腫瘍が、肝細胞癌である、項目141~144のいずれかに記載の方法。
(項目146)
前記腫瘍が、卵巣腫瘍、結腸腫瘍または散在性胃腫瘍である、項目141~144のいずれかに記載の方法。