JP7586813B2 - 抗cd33抗体及びその使用方法 - Google Patents
抗cd33抗体及びその使用方法 Download PDFInfo
- Publication number
- JP7586813B2 JP7586813B2 JP2021511561A JP2021511561A JP7586813B2 JP 7586813 B2 JP7586813 B2 JP 7586813B2 JP 2021511561 A JP2021511561 A JP 2021511561A JP 2021511561 A JP2021511561 A JP 2021511561A JP 7586813 B2 JP7586813 B2 JP 7586813B2
- Authority
- JP
- Japan
- Prior art keywords
- amino acid
- seq
- acid sequence
- hvr
- chain variable
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title claims description 56
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 1519
- 210000004027 cell Anatomy 0.000 claims description 137
- 238000006467 substitution reaction Methods 0.000 claims description 102
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 claims description 69
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 65
- 102000056982 human CD33 Human genes 0.000 claims description 62
- 206010028980 Neoplasm Diseases 0.000 claims description 47
- 201000010099 disease Diseases 0.000 claims description 47
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 43
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 43
- 239000012634 fragment Substances 0.000 claims description 35
- 150000007523 nucleic acids Chemical class 0.000 claims description 34
- 102000039446 nucleic acids Human genes 0.000 claims description 32
- 108020004707 nucleic acids Proteins 0.000 claims description 32
- 125000000539 amino acid group Chemical group 0.000 claims description 24
- 201000011510 cancer Diseases 0.000 claims description 21
- 239000013598 vector Substances 0.000 claims description 21
- 238000000338 in vitro Methods 0.000 claims description 20
- 208000035475 disorder Diseases 0.000 claims description 17
- 206010012289 Dementia Diseases 0.000 claims description 16
- 208000014674 injury Diseases 0.000 claims description 16
- 208000024827 Alzheimer disease Diseases 0.000 claims description 12
- 238000010494 dissociation reaction Methods 0.000 claims description 11
- 230000005593 dissociations Effects 0.000 claims description 11
- 230000006378 damage Effects 0.000 claims description 10
- 238000004519 manufacturing process Methods 0.000 claims description 10
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 claims description 9
- 201000011240 Frontotemporal dementia Diseases 0.000 claims description 8
- 201000004810 Vascular dementia Diseases 0.000 claims description 8
- 238000012575 bio-layer interferometry Methods 0.000 claims description 7
- 239000008194 pharmaceutical composition Substances 0.000 claims description 7
- 102000003839 Human Proteins Human genes 0.000 claims description 6
- 108090000144 Human Proteins Proteins 0.000 claims description 6
- 208000027418 Wounds and injury Diseases 0.000 claims description 6
- 238000000684 flow cytometry Methods 0.000 claims description 6
- 208000035473 Communicable disease Diseases 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 3
- 238000012258 culturing Methods 0.000 claims description 2
- 108090000623 proteins and genes Proteins 0.000 description 159
- 102000004169 proteins and genes Human genes 0.000 description 149
- 235000018102 proteins Nutrition 0.000 description 148
- 230000027455 binding Effects 0.000 description 142
- 210000004443 dendritic cell Anatomy 0.000 description 121
- 210000000274 microglia Anatomy 0.000 description 117
- 235000001014 amino acid Nutrition 0.000 description 101
- 239000003446 ligand Substances 0.000 description 99
- 108090000765 processed proteins & peptides Proteins 0.000 description 81
- 239000000427 antigen Substances 0.000 description 75
- 108091007433 antigens Proteins 0.000 description 75
- 102000036639 antigens Human genes 0.000 description 75
- 210000002540 macrophage Anatomy 0.000 description 70
- 230000014509 gene expression Effects 0.000 description 68
- 102000004196 processed proteins & peptides Human genes 0.000 description 62
- 229940124294 CD33 monoclonal antibody Drugs 0.000 description 55
- 102000005962 receptors Human genes 0.000 description 52
- 108020003175 receptors Proteins 0.000 description 52
- 210000001616 monocyte Anatomy 0.000 description 50
- 230000000694 effects Effects 0.000 description 48
- 210000000440 neutrophil Anatomy 0.000 description 45
- 102000014461 Ataxins Human genes 0.000 description 42
- 108010078286 Ataxins Proteins 0.000 description 42
- 210000001744 T-lymphocyte Anatomy 0.000 description 41
- 230000005764 inhibitory process Effects 0.000 description 40
- 230000001717 pathogenic effect Effects 0.000 description 39
- 230000001413 cellular effect Effects 0.000 description 36
- 210000001185 bone marrow Anatomy 0.000 description 35
- 230000002401 inhibitory effect Effects 0.000 description 34
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 32
- 229920001184 polypeptide Polymers 0.000 description 32
- 210000002443 helper t lymphocyte Anatomy 0.000 description 30
- -1 Lewy body Chemical compound 0.000 description 29
- 210000003690 classically activated macrophage Anatomy 0.000 description 28
- 230000003993 interaction Effects 0.000 description 25
- 230000002829 reductive effect Effects 0.000 description 25
- 230000009467 reduction Effects 0.000 description 24
- 108010073807 IgG Receptors Proteins 0.000 description 22
- 210000004985 myeloid-derived suppressor cell Anatomy 0.000 description 22
- 230000007115 recruitment Effects 0.000 description 22
- 102000009490 IgG Receptors Human genes 0.000 description 21
- 230000006870 function Effects 0.000 description 21
- 230000001965 increasing effect Effects 0.000 description 21
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 20
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 20
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 20
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 20
- 230000003247 decreasing effect Effects 0.000 description 19
- 231100000491 EC50 Toxicity 0.000 description 18
- 102000009109 Fc receptors Human genes 0.000 description 18
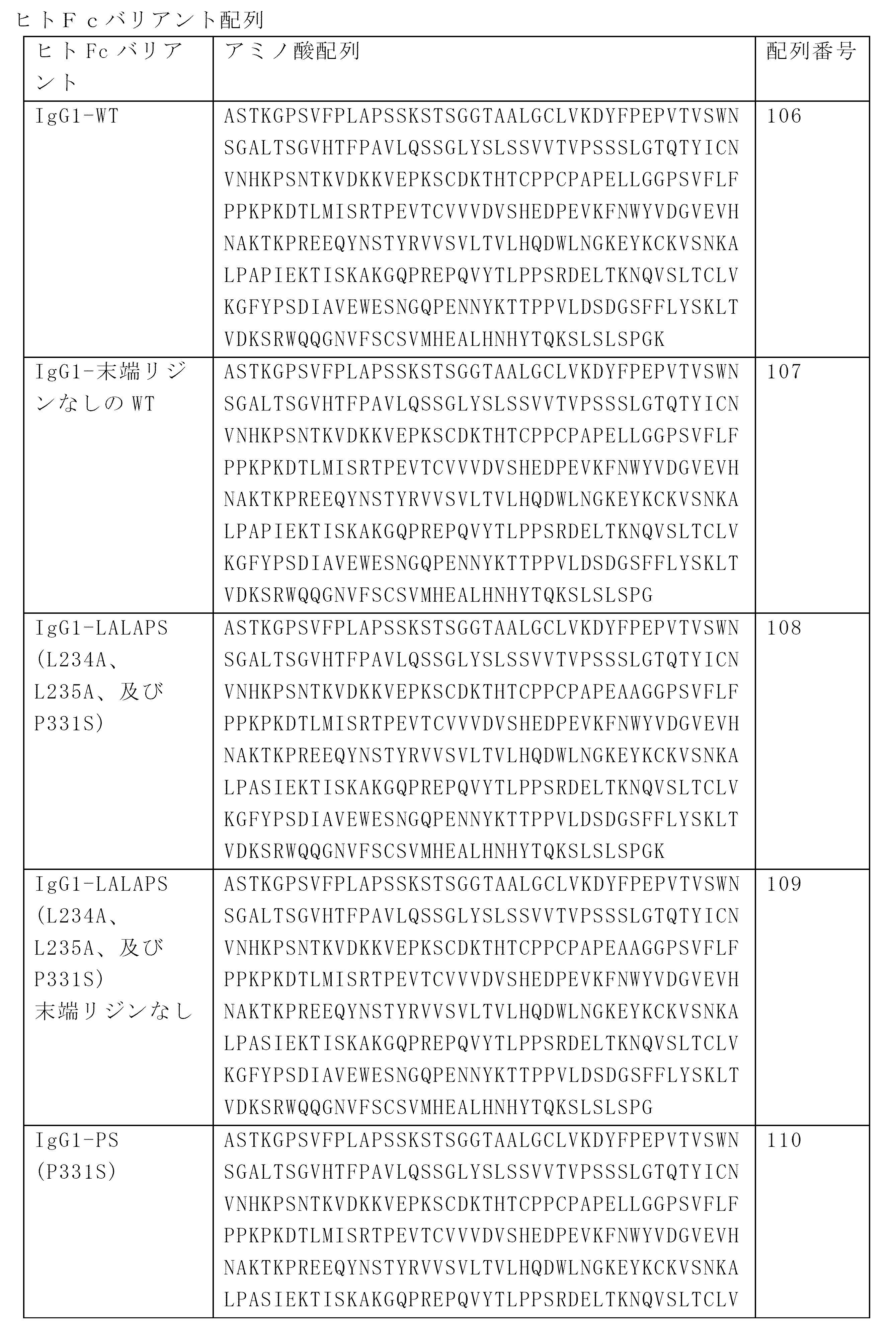
- 108010087819 Fc receptors Proteins 0.000 description 18
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 18
- 208000015181 infectious disease Diseases 0.000 description 18
- 210000002997 osteoclast Anatomy 0.000 description 18
- 210000004881 tumor cell Anatomy 0.000 description 18
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 17
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 17
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 17
- 150000001413 amino acids Chemical class 0.000 description 17
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 17
- 108010074708 B7-H1 Antigen Proteins 0.000 description 16
- 108060003951 Immunoglobulin Proteins 0.000 description 16
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 16
- 229940024606 amino acid Drugs 0.000 description 16
- 210000003714 granulocyte Anatomy 0.000 description 16
- 102000018358 immunoglobulin Human genes 0.000 description 16
- 230000001506 immunosuppresive effect Effects 0.000 description 16
- 230000026731 phosphorylation Effects 0.000 description 16
- 238000006366 phosphorylation reaction Methods 0.000 description 16
- 230000011664 signaling Effects 0.000 description 16
- 230000004913 activation Effects 0.000 description 15
- 230000035755 proliferation Effects 0.000 description 15
- 102000043334 C9orf72 Human genes 0.000 description 14
- 108700030955 C9orf72 Proteins 0.000 description 14
- 102100022338 Integrin alpha-M Human genes 0.000 description 14
- 102000036770 Islet Amyloid Polypeptide Human genes 0.000 description 14
- 108010041872 Islet Amyloid Polypeptide Proteins 0.000 description 14
- 210000004322 M2 macrophage Anatomy 0.000 description 14
- 210000002798 bone marrow cell Anatomy 0.000 description 14
- 230000001976 improved effect Effects 0.000 description 14
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 14
- 231100001221 nontumorigenic Toxicity 0.000 description 14
- 102100038078 CD276 antigen Human genes 0.000 description 13
- 101710185679 CD276 antigen Proteins 0.000 description 13
- 230000001939 inductive effect Effects 0.000 description 13
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 12
- 230000004048 modification Effects 0.000 description 12
- 238000012986 modification Methods 0.000 description 12
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 11
- 230000009286 beneficial effect Effects 0.000 description 11
- 230000007423 decrease Effects 0.000 description 11
- KZNQNBZMBZJQJO-UHFFFAOYSA-N 1-(2-azaniumylacetyl)pyrrolidine-2-carboxylate Chemical compound NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 10
- 229930186217 Glycolipid Natural products 0.000 description 10
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 10
- 102100040243 Microtubule-associated protein tau Human genes 0.000 description 10
- 208000001089 Multiple system atrophy Diseases 0.000 description 10
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 10
- 230000001154 acute effect Effects 0.000 description 10
- 238000005516 engineering process Methods 0.000 description 10
- 210000004408 hybridoma Anatomy 0.000 description 10
- 230000001537 neural effect Effects 0.000 description 10
- 108010026424 tau Proteins Proteins 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- 230000008733 trauma Effects 0.000 description 10
- 108010009992 CD163 antigen Proteins 0.000 description 9
- 102100021396 Cell surface glycoprotein CD200 receptor 1 Human genes 0.000 description 9
- 101000969553 Homo sapiens Cell surface glycoprotein CD200 receptor 1 Proteins 0.000 description 9
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 9
- 241000699666 Mus <mouse, genus> Species 0.000 description 9
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 9
- 102100025831 Scavenger receptor cysteine-rich type 1 protein M130 Human genes 0.000 description 9
- 238000003556 assay Methods 0.000 description 9
- 230000001684 chronic effect Effects 0.000 description 9
- 230000001419 dependent effect Effects 0.000 description 9
- 239000003814 drug Substances 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 230000035772 mutation Effects 0.000 description 9
- 125000003729 nucleotide group Chemical group 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 9
- 102000002785 Ataxin-10 Human genes 0.000 description 8
- 108010043914 Ataxin-10 Proteins 0.000 description 8
- 102100026565 Ataxin-8 Human genes 0.000 description 8
- 101710147490 Ataxin-8 Proteins 0.000 description 8
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 8
- 206010005003 Bladder cancer Diseases 0.000 description 8
- 208000003174 Brain Neoplasms Diseases 0.000 description 8
- 206010006187 Breast cancer Diseases 0.000 description 8
- 208000026310 Breast neoplasm Diseases 0.000 description 8
- 206010009944 Colon cancer Diseases 0.000 description 8
- 206010014733 Endometrial cancer Diseases 0.000 description 8
- 206010014759 Endometrial neoplasm Diseases 0.000 description 8
- 201000008808 Fibrosarcoma Diseases 0.000 description 8
- 102000003886 Glycoproteins Human genes 0.000 description 8
- 108090000288 Glycoproteins Proteins 0.000 description 8
- 208000008839 Kidney Neoplasms Diseases 0.000 description 8
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 8
- 241001465754 Metazoa Species 0.000 description 8
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 8
- 206010033128 Ovarian cancer Diseases 0.000 description 8
- 206010061535 Ovarian neoplasm Diseases 0.000 description 8
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 8
- 206010060862 Prostate cancer Diseases 0.000 description 8
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 8
- 208000015634 Rectal Neoplasms Diseases 0.000 description 8
- 206010038389 Renal cancer Diseases 0.000 description 8
- 208000006265 Renal cell carcinoma Diseases 0.000 description 8
- 101150069237 TYROBP gene Proteins 0.000 description 8
- 102000002689 Toll-like receptor Human genes 0.000 description 8
- 108020000411 Toll-like receptor Proteins 0.000 description 8
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 8
- 230000015556 catabolic process Effects 0.000 description 8
- 230000004663 cell proliferation Effects 0.000 description 8
- 208000029742 colonic neoplasm Diseases 0.000 description 8
- 238000006731 degradation reaction Methods 0.000 description 8
- 230000028993 immune response Effects 0.000 description 8
- 238000003780 insertion Methods 0.000 description 8
- 230000037431 insertion Effects 0.000 description 8
- 201000010982 kidney cancer Diseases 0.000 description 8
- 208000032839 leukemia Diseases 0.000 description 8
- 201000005202 lung cancer Diseases 0.000 description 8
- 208000020816 lung neoplasm Diseases 0.000 description 8
- 206010025135 lupus erythematosus Diseases 0.000 description 8
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 8
- 208000020984 malignant renal pelvis neoplasm Diseases 0.000 description 8
- 201000001441 melanoma Diseases 0.000 description 8
- 239000002773 nucleotide Substances 0.000 description 8
- 201000002528 pancreatic cancer Diseases 0.000 description 8
- 208000008443 pancreatic carcinoma Diseases 0.000 description 8
- 238000003127 radioimmunoassay Methods 0.000 description 8
- 206010038038 rectal cancer Diseases 0.000 description 8
- 201000001275 rectum cancer Diseases 0.000 description 8
- 201000007444 renal pelvis carcinoma Diseases 0.000 description 8
- 230000009870 specific binding Effects 0.000 description 8
- 230000004083 survival effect Effects 0.000 description 8
- 238000002560 therapeutic procedure Methods 0.000 description 8
- 201000005112 urinary bladder cancer Diseases 0.000 description 8
- 101710137189 Amyloid-beta A4 protein Proteins 0.000 description 7
- 102100022704 Amyloid-beta precursor protein Human genes 0.000 description 7
- 101710151993 Amyloid-beta precursor protein Proteins 0.000 description 7
- 102000005666 Apolipoprotein A-I Human genes 0.000 description 7
- 108010059886 Apolipoprotein A-I Proteins 0.000 description 7
- 102000007372 Ataxin-1 Human genes 0.000 description 7
- 108010032963 Ataxin-1 Proteins 0.000 description 7
- 102000007371 Ataxin-3 Human genes 0.000 description 7
- 108010032947 Ataxin-3 Proteins 0.000 description 7
- 102000007368 Ataxin-7 Human genes 0.000 description 7
- 108010032953 Ataxin-7 Proteins 0.000 description 7
- 102000007370 Ataxin2 Human genes 0.000 description 7
- 108010032951 Ataxin2 Proteins 0.000 description 7
- 101800001288 Atrial natriuretic factor Proteins 0.000 description 7
- 101800001890 Atrial natriuretic peptide Proteins 0.000 description 7
- 102400001282 Atrial natriuretic peptide Human genes 0.000 description 7
- 101150014718 C9orf72 gene Proteins 0.000 description 7
- 102000055006 Calcitonin Human genes 0.000 description 7
- 108060001064 Calcitonin Proteins 0.000 description 7
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 7
- 241000282412 Homo Species 0.000 description 7
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 description 7
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 7
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 7
- 102000004877 Insulin Human genes 0.000 description 7
- 108090001061 Insulin Proteins 0.000 description 7
- 101800003015 Medin Proteins 0.000 description 7
- 102400001156 Medin Human genes 0.000 description 7
- 102000016943 Muramidase Human genes 0.000 description 7
- 108010014251 Muramidase Proteins 0.000 description 7
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 7
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 7
- 108010071690 Prealbumin Proteins 0.000 description 7
- 108091000054 Prion Proteins 0.000 description 7
- 102000029797 Prion Human genes 0.000 description 7
- 108010057464 Prolactin Proteins 0.000 description 7
- 102000003946 Prolactin Human genes 0.000 description 7
- 102000003890 RNA-binding protein FUS Human genes 0.000 description 7
- 108090000292 RNA-binding protein FUS Proteins 0.000 description 7
- 102000054727 Serum Amyloid A Human genes 0.000 description 7
- 108700028909 Serum Amyloid A Proteins 0.000 description 7
- 102000019197 Superoxide Dismutase Human genes 0.000 description 7
- 108010012715 Superoxide dismutase Proteins 0.000 description 7
- 102100040347 TAR DNA-binding protein 43 Human genes 0.000 description 7
- 101710150875 TAR DNA-binding protein 43 Proteins 0.000 description 7
- 102000009190 Transthyretin Human genes 0.000 description 7
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 7
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 7
- 108090000848 Ubiquitin Proteins 0.000 description 7
- 102000044159 Ubiquitin Human genes 0.000 description 7
- 102000003802 alpha-Synuclein Human genes 0.000 description 7
- 108090000185 alpha-Synuclein Proteins 0.000 description 7
- PLOPBXQQPZYQFA-AXPWDRQUSA-N amlintide Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H]1NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CCCCN)CSSC1)[C@@H](C)O)C(C)C)C1=CC=CC=C1 PLOPBXQQPZYQFA-AXPWDRQUSA-N 0.000 description 7
- DZHSAHHDTRWUTF-SIQRNXPUSA-N amyloid-beta polypeptide 42 Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O)[C@@H](C)CC)C(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C(C)C)C1=CC=CC=C1 DZHSAHHDTRWUTF-SIQRNXPUSA-N 0.000 description 7
- 230000000259 anti-tumor effect Effects 0.000 description 7
- 210000003719 b-lymphocyte Anatomy 0.000 description 7
- 210000004369 blood Anatomy 0.000 description 7
- 239000008280 blood Substances 0.000 description 7
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 7
- 229960004015 calcitonin Drugs 0.000 description 7
- NSQLIUXCMFBZME-MPVJKSABSA-N carperitide Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)=O)[C@@H](C)CC)C1=CC=CC=C1 NSQLIUXCMFBZME-MPVJKSABSA-N 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 238000003776 cleavage reaction Methods 0.000 description 7
- 238000000586 desensitisation Methods 0.000 description 7
- 230000003828 downregulation Effects 0.000 description 7
- 229940125396 insulin Drugs 0.000 description 7
- 210000004558 lewy body Anatomy 0.000 description 7
- 239000004325 lysozyme Substances 0.000 description 7
- 235000010335 lysozyme Nutrition 0.000 description 7
- 229960000274 lysozyme Drugs 0.000 description 7
- 230000003278 mimic effect Effects 0.000 description 7
- 210000000066 myeloid cell Anatomy 0.000 description 7
- 102000007863 pattern recognition receptors Human genes 0.000 description 7
- 108010089193 pattern recognition receptors Proteins 0.000 description 7
- 229940097325 prolactin Drugs 0.000 description 7
- 230000007017 scission Effects 0.000 description 7
- 239000007790 solid phase Substances 0.000 description 7
- 241000894007 species Species 0.000 description 7
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 7
- 238000013519 translation Methods 0.000 description 7
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 6
- 102100035248 Alpha-(1,3)-fucosyltransferase 4 Human genes 0.000 description 6
- 108010060215 Apolipoprotein E3 Proteins 0.000 description 6
- 102000008128 Apolipoprotein E3 Human genes 0.000 description 6
- 101150076800 B2M gene Proteins 0.000 description 6
- 101150036788 CD9 gene Proteins 0.000 description 6
- 101150064066 CTSL gene Proteins 0.000 description 6
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 6
- 101150074775 Csf1 gene Proteins 0.000 description 6
- 102000015833 Cystatin Human genes 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 6
- 102000004878 Gelsolin Human genes 0.000 description 6
- 108090001064 Gelsolin Proteins 0.000 description 6
- 101001022185 Homo sapiens Alpha-(1,3)-fucosyltransferase 4 Proteins 0.000 description 6
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 description 6
- 101000795107 Homo sapiens Triggering receptor expressed on myeloid cells 1 Proteins 0.000 description 6
- 101000795117 Homo sapiens Triggering receptor expressed on myeloid cells 2 Proteins 0.000 description 6
- 102100034980 ICOS ligand Human genes 0.000 description 6
- 101710093458 ICOS ligand Proteins 0.000 description 6
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 6
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 6
- 102000017578 LAG3 Human genes 0.000 description 6
- 101100262697 Mus musculus Axl gene Proteins 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 6
- 102000038030 PI3Ks Human genes 0.000 description 6
- 108091007960 PI3Ks Proteins 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- 208000024770 Thyroid neoplasm Diseases 0.000 description 6
- 102100021398 Transforming growth factor-beta-induced protein ig-h3 Human genes 0.000 description 6
- 102100029681 Triggering receptor expressed on myeloid cells 1 Human genes 0.000 description 6
- 102100029678 Triggering receptor expressed on myeloid cells 2 Human genes 0.000 description 6
- 230000003213 activating effect Effects 0.000 description 6
- 239000002246 antineoplastic agent Substances 0.000 description 6
- 230000001640 apoptogenic effect Effects 0.000 description 6
- 102000015736 beta 2-Microglobulin Human genes 0.000 description 6
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 6
- 108700006666 betaIG-H3 Proteins 0.000 description 6
- 108050004038 cystatin Proteins 0.000 description 6
- 238000012217 deletion Methods 0.000 description 6
- 230000037430 deletion Effects 0.000 description 6
- 150000002270 gangliosides Chemical class 0.000 description 6
- 230000002519 immonomodulatory effect Effects 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 230000002757 inflammatory effect Effects 0.000 description 6
- 101150062900 lpl gene Proteins 0.000 description 6
- 210000002569 neuron Anatomy 0.000 description 6
- 208000003476 primary myelofibrosis Diseases 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 210000003289 regulatory T cell Anatomy 0.000 description 6
- 102210009321 rs3865444 Human genes 0.000 description 6
- 230000001225 therapeutic effect Effects 0.000 description 6
- 201000002510 thyroid cancer Diseases 0.000 description 6
- HVCOBJNICQPDBP-UHFFFAOYSA-N 3-[3-[3,5-dihydroxy-6-methyl-4-(3,4,5-trihydroxy-6-methyloxan-2-yl)oxyoxan-2-yl]oxydecanoyloxy]decanoic acid;hydrate Chemical compound O.OC1C(OC(CC(=O)OC(CCCCCCC)CC(O)=O)CCCCCCC)OC(C)C(O)C1OC1C(O)C(O)C(O)C(C)O1 HVCOBJNICQPDBP-UHFFFAOYSA-N 0.000 description 5
- 108700028369 Alleles Proteins 0.000 description 5
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 5
- 208000009137 Behcet syndrome Diseases 0.000 description 5
- 101150049756 CCL6 gene Proteins 0.000 description 5
- 102100027207 CD27 antigen Human genes 0.000 description 5
- 101150013553 CD40 gene Proteins 0.000 description 5
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 5
- 208000011990 Corticobasal Degeneration Diseases 0.000 description 5
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 description 5
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 description 5
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 description 5
- 102000004127 Cytokines Human genes 0.000 description 5
- 108090000695 Cytokines Proteins 0.000 description 5
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 5
- 206010067889 Dementia with Lewy bodies Diseases 0.000 description 5
- 108010016626 Dipeptides Proteins 0.000 description 5
- 108010021472 Fc gamma receptor IIB Proteins 0.000 description 5
- 102100031351 Galectin-9 Human genes 0.000 description 5
- 101100229077 Gallus gallus GAL9 gene Proteins 0.000 description 5
- 208000010412 Glaucoma Diseases 0.000 description 5
- 102100034459 Hepatitis A virus cellular receptor 1 Human genes 0.000 description 5
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 5
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 5
- 101001068136 Homo sapiens Hepatitis A virus cellular receptor 1 Proteins 0.000 description 5
- 101000831286 Homo sapiens Protein timeless homolog Proteins 0.000 description 5
- 101000752245 Homo sapiens Rho guanine nucleotide exchange factor 5 Proteins 0.000 description 5
- 101000669511 Homo sapiens T-cell immunoglobulin and mucin domain-containing protein 4 Proteins 0.000 description 5
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 5
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 5
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 5
- 102000002698 KIR Receptors Human genes 0.000 description 5
- 108010043610 KIR Receptors Proteins 0.000 description 5
- 201000002832 Lewy body dementia Diseases 0.000 description 5
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 description 5
- 101100019396 Mus musculus Itgax gene Proteins 0.000 description 5
- 208000021320 Nasu-Hakola disease Diseases 0.000 description 5
- 208000018737 Parkinson disease Diseases 0.000 description 5
- 206010035226 Plasma cell myeloma Diseases 0.000 description 5
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 5
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 5
- 101100341505 Rattus norvegicus Itgad gene Proteins 0.000 description 5
- 201000007737 Retinal degeneration Diseases 0.000 description 5
- 208000007014 Retinitis pigmentosa Diseases 0.000 description 5
- 208000009106 Shy-Drager Syndrome Diseases 0.000 description 5
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 5
- 208000006011 Stroke Diseases 0.000 description 5
- 102100039367 T-cell immunoglobulin and mucin domain-containing protein 4 Human genes 0.000 description 5
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 5
- 101150021063 Timp2 gene Proteins 0.000 description 5
- 102000005354 Tissue Inhibitor of Metalloproteinase-2 Human genes 0.000 description 5
- 208000030886 Traumatic Brain injury Diseases 0.000 description 5
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 5
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 5
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 5
- 108010079206 V-Set Domain-Containing T-Cell Activation Inhibitor 1 Proteins 0.000 description 5
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 5
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 5
- 206010064930 age-related macular degeneration Diseases 0.000 description 5
- 239000000556 agonist Substances 0.000 description 5
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 230000003110 anti-inflammatory effect Effects 0.000 description 5
- 230000000692 anti-sense effect Effects 0.000 description 5
- 230000001580 bacterial effect Effects 0.000 description 5
- 210000004899 c-terminal region Anatomy 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 229940127089 cytotoxic agent Drugs 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 201000006517 essential tremor Diseases 0.000 description 5
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 5
- 208000002780 macular degeneration Diseases 0.000 description 5
- 201000006417 multiple sclerosis Diseases 0.000 description 5
- 201000003077 normal pressure hydrocephalus Diseases 0.000 description 5
- 238000002823 phage display Methods 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 208000031334 polycystic lipomembranous osteodysplasia with sclerosing leukoencephaly Diseases 0.000 description 5
- 230000004481 post-translational protein modification Effects 0.000 description 5
- 201000002212 progressive supranuclear palsy Diseases 0.000 description 5
- 230000027425 release of sequestered calcium ion into cytosol Effects 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 230000004258 retinal degeneration Effects 0.000 description 5
- 201000000306 sarcoidosis Diseases 0.000 description 5
- 208000020431 spinal cord injury Diseases 0.000 description 5
- 230000008685 targeting Effects 0.000 description 5
- 230000009529 traumatic brain injury Effects 0.000 description 5
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 4
- IVNJKQPHHPMONX-WCCKRBBISA-N 2-aminoacetic acid;(2s)-2-amino-5-(diaminomethylideneamino)pentanoic acid Chemical compound NCC(O)=O.OC(=O)[C@@H](N)CCCNC(N)=N IVNJKQPHHPMONX-WCCKRBBISA-N 0.000 description 4
- 102100022464 5'-nucleotidase Human genes 0.000 description 4
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 4
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 4
- 239000004475 Arginine Substances 0.000 description 4
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- 102100025221 CD70 antigen Human genes 0.000 description 4
- 206010009900 Colitis ulcerative Diseases 0.000 description 4
- 206010010904 Convulsion Diseases 0.000 description 4
- 101150118364 Crkl gene Proteins 0.000 description 4
- 102100031051 Cysteine and glycine-rich protein 1 Human genes 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 102100029722 Ectonucleoside triphosphate diphosphohydrolase 1 Human genes 0.000 description 4
- 102000007665 Extracellular Signal-Regulated MAP Kinases Human genes 0.000 description 4
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 4
- 208000001860 Eye Infections Diseases 0.000 description 4
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 4
- 206010018691 Granuloma Diseases 0.000 description 4
- 102000016285 Guanine Nucleotide Exchange Factors Human genes 0.000 description 4
- 108010067218 Guanine Nucleotide Exchange Factors Proteins 0.000 description 4
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 description 4
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 4
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 4
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 4
- 101001012447 Homo sapiens Ectonucleoside triphosphate diphosphohydrolase 1 Proteins 0.000 description 4
- 101000868279 Homo sapiens Leukocyte surface antigen CD47 Proteins 0.000 description 4
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 4
- 101000836877 Homo sapiens Sialic acid-binding Ig-like lectin 11 Proteins 0.000 description 4
- 101000863882 Homo sapiens Sialic acid-binding Ig-like lectin 7 Proteins 0.000 description 4
- 101000863883 Homo sapiens Sialic acid-binding Ig-like lectin 9 Proteins 0.000 description 4
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 4
- 101000610604 Homo sapiens Tumor necrosis factor receptor superfamily member 10B Proteins 0.000 description 4
- 101000617285 Homo sapiens Tyrosine-protein phosphatase non-receptor type 6 Proteins 0.000 description 4
- 208000023105 Huntington disease Diseases 0.000 description 4
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 4
- 102000017761 Interleukin-33 Human genes 0.000 description 4
- 108010067003 Interleukin-33 Proteins 0.000 description 4
- 108090001005 Interleukin-6 Proteins 0.000 description 4
- 102100032913 Leukocyte surface antigen CD47 Human genes 0.000 description 4
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 4
- 241000282567 Macaca fascicularis Species 0.000 description 4
- 108010058398 Macrophage Colony-Stimulating Factor Receptor Proteins 0.000 description 4
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 4
- 208000029725 Metabolic bone disease Diseases 0.000 description 4
- 208000034578 Multiple myelomas Diseases 0.000 description 4
- 208000008589 Obesity Diseases 0.000 description 4
- 208000010191 Osteitis Deformans Diseases 0.000 description 4
- 208000001132 Osteoporosis Diseases 0.000 description 4
- 208000027067 Paget disease of bone Diseases 0.000 description 4
- 102000045595 Phosphoprotein Phosphatases Human genes 0.000 description 4
- 108700019535 Phosphoprotein Phosphatases Proteins 0.000 description 4
- 102000003923 Protein Kinase C Human genes 0.000 description 4
- 108090000315 Protein Kinase C Proteins 0.000 description 4
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 4
- 206010040047 Sepsis Diseases 0.000 description 4
- 102000001555 Sialic Acid Binding Ig-like Lectin 3 Human genes 0.000 description 4
- 102100027125 Sialic acid-binding Ig-like lectin 11 Human genes 0.000 description 4
- 102100029957 Sialic acid-binding Ig-like lectin 5 Human genes 0.000 description 4
- 101710110535 Sialic acid-binding Ig-like lectin 5 Proteins 0.000 description 4
- 102100029946 Sialic acid-binding Ig-like lectin 7 Human genes 0.000 description 4
- 102100029965 Sialic acid-binding Ig-like lectin 9 Human genes 0.000 description 4
- 102000004584 Somatomedin Receptors Human genes 0.000 description 4
- 108010017622 Somatomedin Receptors Proteins 0.000 description 4
- 101100215487 Sus scrofa ADRA2A gene Proteins 0.000 description 4
- 108010016672 Syk Kinase Proteins 0.000 description 4
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 4
- 102000007238 Transferrin Receptors Human genes 0.000 description 4
- 108010033576 Transferrin Receptors Proteins 0.000 description 4
- 102100040112 Tumor necrosis factor receptor superfamily member 10B Human genes 0.000 description 4
- 102100038183 Tyrosine-protein kinase SYK Human genes 0.000 description 4
- 102100033019 Tyrosine-protein phosphatase non-receptor type 11 Human genes 0.000 description 4
- 101710116241 Tyrosine-protein phosphatase non-receptor type 11 Proteins 0.000 description 4
- 102100021657 Tyrosine-protein phosphatase non-receptor type 6 Human genes 0.000 description 4
- 201000006704 Ulcerative Colitis Diseases 0.000 description 4
- 208000002552 acute disseminated encephalomyelitis Diseases 0.000 description 4
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 4
- 206010003246 arthritis Diseases 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 230000008499 blood brain barrier function Effects 0.000 description 4
- 210000001218 blood-brain barrier Anatomy 0.000 description 4
- 208000016738 bone Paget disease Diseases 0.000 description 4
- 230000022534 cell killing Effects 0.000 description 4
- 206010009887 colitis Diseases 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 230000036461 convulsion Effects 0.000 description 4
- 230000001086 cytosolic effect Effects 0.000 description 4
- 239000012636 effector Substances 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- 208000011323 eye infectious disease Diseases 0.000 description 4
- 210000005260 human cell Anatomy 0.000 description 4
- 210000002865 immune cell Anatomy 0.000 description 4
- 230000005746 immune checkpoint blockade Effects 0.000 description 4
- 230000003053 immunization Effects 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- 230000006674 lysosomal degradation Effects 0.000 description 4
- 201000004792 malaria Diseases 0.000 description 4
- 230000035800 maturation Effects 0.000 description 4
- 230000002025 microglial effect Effects 0.000 description 4
- 230000005012 migration Effects 0.000 description 4
- 238000013508 migration Methods 0.000 description 4
- 206010028537 myelofibrosis Diseases 0.000 description 4
- 235000020824 obesity Nutrition 0.000 description 4
- 230000011164 ossification Effects 0.000 description 4
- 208000002865 osteopetrosis Diseases 0.000 description 4
- 238000012216 screening Methods 0.000 description 4
- 102000009076 src-Family Kinases Human genes 0.000 description 4
- 108010087686 src-Family Kinases Proteins 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 230000009885 systemic effect Effects 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 238000002054 transplantation Methods 0.000 description 4
- 210000004981 tumor-associated macrophage Anatomy 0.000 description 4
- 230000035899 viability Effects 0.000 description 4
- 230000029663 wound healing Effects 0.000 description 4
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 3
- 108010040471 CC Chemokines Proteins 0.000 description 3
- 102000001902 CC Chemokines Human genes 0.000 description 3
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 3
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 3
- 241000699800 Cricetinae Species 0.000 description 3
- 208000011231 Crohn disease Diseases 0.000 description 3
- 102000006354 HLA-DR Antigens Human genes 0.000 description 3
- 108010058597 HLA-DR Antigens Proteins 0.000 description 3
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 3
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 3
- 102100022297 Integrin alpha-X Human genes 0.000 description 3
- 108090001007 Interleukin-8 Proteins 0.000 description 3
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- 101100273728 Mus musculus Cd33 gene Proteins 0.000 description 3
- 102220556120 Myeloid cell surface antigen CD33_A14V_mutation Human genes 0.000 description 3
- 208000012902 Nervous system disease Diseases 0.000 description 3
- 208000025966 Neurological disease Diseases 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 206010057249 Phagocytosis Diseases 0.000 description 3
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 3
- 102000004422 Phospholipase C gamma Human genes 0.000 description 3
- 108010056751 Phospholipase C gamma Proteins 0.000 description 3
- 241000288906 Primates Species 0.000 description 3
- 108010029485 Protein Isoforms Proteins 0.000 description 3
- 102000001708 Protein Isoforms Human genes 0.000 description 3
- 108010076504 Protein Sorting Signals Proteins 0.000 description 3
- 206010057190 Respiratory tract infections Diseases 0.000 description 3
- 102000014400 SH2 domains Human genes 0.000 description 3
- 108050003452 SH2 domains Proteins 0.000 description 3
- 101150036449 SIRPA gene Proteins 0.000 description 3
- 108010029180 Sialic Acid Binding Ig-like Lectin 3 Proteins 0.000 description 3
- 102000007073 Sialic Acid Binding Immunoglobulin-like Lectins Human genes 0.000 description 3
- 108010047827 Sialic Acid Binding Immunoglobulin-like Lectins Proteins 0.000 description 3
- 230000006052 T cell proliferation Effects 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 108091006374 cAMP receptor proteins Proteins 0.000 description 3
- 238000012875 competitive assay Methods 0.000 description 3
- 238000002591 computed tomography Methods 0.000 description 3
- 125000000151 cysteine group Chemical class N[C@@H](CS)C(=O)* 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 238000009169 immunotherapy Methods 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000009401 metastasis Effects 0.000 description 3
- 210000004498 neuroglial cell Anatomy 0.000 description 3
- 230000000242 pagocytic effect Effects 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 230000008782 phagocytosis Effects 0.000 description 3
- 238000003752 polymerase chain reaction Methods 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 239000002157 polynucleotide Substances 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 230000000770 proinflammatory effect Effects 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 208000020029 respiratory tract infectious disease Diseases 0.000 description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 description 3
- 210000000225 synapse Anatomy 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 230000032258 transport Effects 0.000 description 3
- 230000004614 tumor growth Effects 0.000 description 3
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 2
- 208000037259 Amyloid Plaque Diseases 0.000 description 2
- 244000303258 Annona diversifolia Species 0.000 description 2
- 235000002198 Annona diversifolia Nutrition 0.000 description 2
- 102100029647 Apoptosis-associated speck-like protein containing a CARD Human genes 0.000 description 2
- 102100036842 C-C motif chemokine 19 Human genes 0.000 description 2
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 2
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 2
- 102100036846 C-C motif chemokine 21 Human genes 0.000 description 2
- 101710155855 C-C motif chemokine 4 Proteins 0.000 description 2
- 102100021984 C-C motif chemokine 4-like Human genes 0.000 description 2
- 102100025248 C-X-C motif chemokine 10 Human genes 0.000 description 2
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 2
- 101150065475 C1QA gene Proteins 0.000 description 2
- 102100021703 C3a anaphylatoxin chemotactic receptor Human genes 0.000 description 2
- 108010017009 CD11b Antigen Proteins 0.000 description 2
- 108010071134 CRM197 (non-toxic variant of diphtheria toxin) Proteins 0.000 description 2
- 206010051226 Campylobacter infection Diseases 0.000 description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 2
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 2
- 102100025470 Carcinoembryonic antigen-related cell adhesion molecule 8 Human genes 0.000 description 2
- 102100035904 Caspase-1 Human genes 0.000 description 2
- 208000006547 Central Nervous System Lupus Vasculitis Diseases 0.000 description 2
- 102100039496 Choline transporter-like protein 4 Human genes 0.000 description 2
- 108010005939 Ciliary Neurotrophic Factor Proteins 0.000 description 2
- 102100031614 Ciliary neurotrophic factor Human genes 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- 102100031237 Cystatin-A Human genes 0.000 description 2
- 101100015729 Drosophila melanogaster drk gene Proteins 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 208000032027 Essential Thrombocythemia Diseases 0.000 description 2
- 108010021468 Fc gamma receptor IIA Proteins 0.000 description 2
- 102100033039 Glutathione peroxidase 1 Human genes 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 108010009202 Growth Factor Receptors Proteins 0.000 description 2
- 102000009465 Growth Factor Receptors Human genes 0.000 description 2
- 102100033067 Growth factor receptor-bound protein 2 Human genes 0.000 description 2
- 108091009389 Growth factor receptor-bound protein 2 Proteins 0.000 description 2
- 102100035943 HERV-H LTR-associating protein 2 Human genes 0.000 description 2
- 102100029360 Hematopoietic cell signal transducer Human genes 0.000 description 2
- 102100028006 Heme oxygenase 1 Human genes 0.000 description 2
- 102400001369 Heparin-binding EGF-like growth factor Human genes 0.000 description 2
- 101800001649 Heparin-binding EGF-like growth factor Proteins 0.000 description 2
- 101000728679 Homo sapiens Apoptosis-associated speck-like protein containing a CARD Proteins 0.000 description 2
- 101000713106 Homo sapiens C-C motif chemokine 19 Proteins 0.000 description 2
- 101000713085 Homo sapiens C-C motif chemokine 21 Proteins 0.000 description 2
- 101000858088 Homo sapiens C-X-C motif chemokine 10 Proteins 0.000 description 2
- 101000896583 Homo sapiens C3a anaphylatoxin chemotactic receptor Proteins 0.000 description 2
- 101000914320 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 8 Proteins 0.000 description 2
- 101000715398 Homo sapiens Caspase-1 Proteins 0.000 description 2
- 101000889282 Homo sapiens Choline transporter-like protein 4 Proteins 0.000 description 2
- 101000921786 Homo sapiens Cystatin-A Proteins 0.000 description 2
- 101001014936 Homo sapiens Glutathione peroxidase 1 Proteins 0.000 description 2
- 101001021491 Homo sapiens HERV-H LTR-associating protein 2 Proteins 0.000 description 2
- 101000990188 Homo sapiens Hematopoietic cell signal transducer Proteins 0.000 description 2
- 101001079623 Homo sapiens Heme oxygenase 1 Proteins 0.000 description 2
- 101001046668 Homo sapiens Integrin alpha-X Proteins 0.000 description 2
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 description 2
- 101000599048 Homo sapiens Interleukin-6 receptor subunit alpha Proteins 0.000 description 2
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 2
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 2
- 101000956317 Homo sapiens Membrane-spanning 4-domains subfamily A member 4A Proteins 0.000 description 2
- 101000979342 Homo sapiens Nuclear factor NF-kappa-B p105 subunit Proteins 0.000 description 2
- 101000884271 Homo sapiens Signal transducer CD24 Proteins 0.000 description 2
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 2
- 101000809875 Homo sapiens TYRO protein tyrosine kinase-binding protein Proteins 0.000 description 2
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 2
- 101000743488 Homo sapiens V-set and immunoglobulin domain-containing protein 4 Proteins 0.000 description 2
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 2
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 2
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 2
- 108010001127 Insulin Receptor Proteins 0.000 description 2
- 102100036721 Insulin receptor Human genes 0.000 description 2
- 102100025390 Integrin beta-2 Human genes 0.000 description 2
- 102100037850 Interferon gamma Human genes 0.000 description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 2
- 108090000177 Interleukin-11 Proteins 0.000 description 2
- 102000003815 Interleukin-11 Human genes 0.000 description 2
- 102000013462 Interleukin-12 Human genes 0.000 description 2
- 108010065805 Interleukin-12 Proteins 0.000 description 2
- 102000049772 Interleukin-16 Human genes 0.000 description 2
- 101800003050 Interleukin-16 Proteins 0.000 description 2
- 102000003810 Interleukin-18 Human genes 0.000 description 2
- 108090000171 Interleukin-18 Proteins 0.000 description 2
- 102000013264 Interleukin-23 Human genes 0.000 description 2
- 108010065637 Interleukin-23 Proteins 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 102100037792 Interleukin-6 receptor subunit alpha Human genes 0.000 description 2
- 230000004163 JAK-STAT signaling pathway Effects 0.000 description 2
- 102100032352 Leukemia inhibitory factor Human genes 0.000 description 2
- 108090000581 Leukemia inhibitory factor Proteins 0.000 description 2
- 102100034238 Linker for activation of T-cells family member 2 Human genes 0.000 description 2
- 101710172064 Low-density lipoprotein receptor-related protein Proteins 0.000 description 2
- 102000043136 MAP kinase family Human genes 0.000 description 2
- 108091054455 MAP kinase family Proteins 0.000 description 2
- 102100038556 Membrane-spanning 4-domains subfamily A member 4A Human genes 0.000 description 2
- 102000015728 Mucins Human genes 0.000 description 2
- 108010063954 Mucins Proteins 0.000 description 2
- 101710147545 Myeloid cell surface antigen CD33 Proteins 0.000 description 2
- 102220556080 Myeloid cell surface antigen CD33_G304R_mutation Human genes 0.000 description 2
- SQVRNKJHWKZAKO-PFQGKNLYSA-N N-acetyl-beta-neuraminic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-PFQGKNLYSA-N 0.000 description 2
- 241000588653 Neisseria Species 0.000 description 2
- 102100023050 Nuclear factor NF-kappa-B p105 subunit Human genes 0.000 description 2
- 108090000630 Oncostatin M Proteins 0.000 description 2
- 102100031942 Oncostatin-M Human genes 0.000 description 2
- 102000012404 Orosomucoid Human genes 0.000 description 2
- 108010061952 Orosomucoid Proteins 0.000 description 2
- 239000012270 PD-1 inhibitor Substances 0.000 description 2
- 239000012668 PD-1-inhibitor Substances 0.000 description 2
- 208000030852 Parasitic disease Diseases 0.000 description 2
- 241000589516 Pseudomonas Species 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 108091006236 SLC7A7 Proteins 0.000 description 2
- 108091006238 SLC7A8 Proteins 0.000 description 2
- 102100038081 Signal transducer CD24 Human genes 0.000 description 2
- 241000193990 Streptococcus sp. 'group B' Species 0.000 description 2
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 2
- 102100038717 TYRO protein tyrosine kinase-binding protein Human genes 0.000 description 2
- 208000034799 Tauopathies Diseases 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 2
- 101000980463 Treponema pallidum (strain Nichols) Chaperonin GroEL Proteins 0.000 description 2
- 102100040247 Tumor necrosis factor Human genes 0.000 description 2
- 102100038296 V-set and immunoglobulin domain-containing protein 4 Human genes 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 206010047505 Visceral leishmaniasis Diseases 0.000 description 2
- 102100032726 Y+L amino acid transporter 1 Human genes 0.000 description 2
- 208000017733 acquired polycythemia vera Diseases 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 229960005305 adenosine Drugs 0.000 description 2
- 230000004075 alteration Effects 0.000 description 2
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 210000001130 astrocyte Anatomy 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 229960004117 capecitabine Drugs 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 230000034196 cell chemotaxis Effects 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 208000011235 central nervous system lupus Diseases 0.000 description 2
- GBVKRUOMSUTVPW-AHNVSIPUSA-N chembl1089636 Chemical compound N([C@H]([C@@H](OC(=O)CCC(=O)N[C@@H](C(O)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CCCCNC(=O)CCC(=O)O[C@H]([C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)C(=O)O[C@@H]1C(=C2[C@@H](OC(C)=O)C(=O)[C@]3(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]3[C@H](OC(=O)C=3C=CC=CC=3)[C@](C2(C)C)(O)C1)OC(C)=O)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCCNC(=O)CCC(=O)O[C@H]([C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)C(=O)O[C@@H]1C(=C2[C@@H](OC(C)=O)C(=O)[C@]3(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]3[C@H](OC(=O)C=3C=CC=CC=3)[C@](C2(C)C)(O)C1)OC(C)=O)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C(=O)O[C@@H]1C(=C2[C@@H](OC(C)=O)C(=O)[C@]3(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]3[C@H](OC(=O)C=3C=CC=CC=3)[C@](C2(C)C)(O)C1)OC(C)=O)C)C=1C=CC=CC=1)C(=O)C1=CC=CC=C1 GBVKRUOMSUTVPW-AHNVSIPUSA-N 0.000 description 2
- 238000002983 circular dichroism Methods 0.000 description 2
- 238000011260 co-administration Methods 0.000 description 2
- 238000011961 computed axial tomography Methods 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 210000002889 endothelial cell Anatomy 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 229960005277 gemcitabine Drugs 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 101150098203 grb2 gene Proteins 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 230000016784 immunoglobulin production Effects 0.000 description 2
- 210000005008 immunosuppressive cell Anatomy 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 230000008595 infiltration Effects 0.000 description 2
- 238000001764 infiltration Methods 0.000 description 2
- 208000027866 inflammatory disease Diseases 0.000 description 2
- 108090000681 interleukin 20 Proteins 0.000 description 2
- 230000037041 intracellular level Effects 0.000 description 2
- 238000000111 isothermal titration calorimetry Methods 0.000 description 2
- 230000002147 killing effect Effects 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 230000005923 long-lasting effect Effects 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 230000002132 lysosomal effect Effects 0.000 description 2
- 238000013507 mapping Methods 0.000 description 2
- 239000003607 modifier Substances 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 108010046239 paclitaxel-Angiopep-2 conjugate Proteins 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 229940121655 pd-1 inhibitor Drugs 0.000 description 2
- MCYTYTUNNNZWOK-LCLOTLQISA-N penetratin Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=CC=C1 MCYTYTUNNNZWOK-LCLOTLQISA-N 0.000 description 2
- 108010043655 penetratin Proteins 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 108010011110 polyarginine Proteins 0.000 description 2
- 208000037244 polycythemia vera Diseases 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 238000000159 protein binding assay Methods 0.000 description 2
- 238000002818 protein evolution Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 231100001258 radiotoxin Toxicity 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 125000005629 sialic acid group Chemical group 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 230000005909 tumor killing Effects 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical group C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 102100034111 Activin receptor type-1 Human genes 0.000 description 1
- 208000022099 Alzheimer disease 2 Diseases 0.000 description 1
- 102000009091 Amyloidogenic Proteins Human genes 0.000 description 1
- 108010048112 Amyloidogenic Proteins Proteins 0.000 description 1
- 101100454262 Arabidopsis thaliana LA2 gene Proteins 0.000 description 1
- 101100191131 Arabidopsis thaliana P67 gene Proteins 0.000 description 1
- 101100189950 Arabidopsis thaliana PER67 gene Proteins 0.000 description 1
- 102100022278 Arachidonate 5-lipoxygenase-activating protein Human genes 0.000 description 1
- 208000002109 Argyria Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 102100031151 C-C chemokine receptor type 2 Human genes 0.000 description 1
- 101710149815 C-C chemokine receptor type 2 Proteins 0.000 description 1
- YDNKGFDKKRUKPY-JHOUSYSJSA-N C16 ceramide Natural products CCCCCCCCCCCCCCCC(=O)N[C@@H](CO)[C@H](O)C=CCCCCCCCCCCCCC YDNKGFDKKRUKPY-JHOUSYSJSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 238000011537 Coomassie blue staining Methods 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 108010036694 Dynamin I Proteins 0.000 description 1
- 102100021236 Dynamin-1 Human genes 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 101001094579 Enterobacteria phage HK97 Crossover junction endodeoxyribonuclease rusA Proteins 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 101150010917 GP67 gene Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 241000699694 Gerbillinae Species 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 208000023661 Haematological disease Diseases 0.000 description 1
- 206010061190 Haemophilus infection Diseases 0.000 description 1
- 241000606768 Haemophilus influenzae Species 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 101000799140 Homo sapiens Activin receptor type-1 Proteins 0.000 description 1
- 101000755875 Homo sapiens Arachidonate 5-lipoxygenase-activating protein Proteins 0.000 description 1
- 101000935587 Homo sapiens Flavin reductase (NADPH) Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000282553 Macaca Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 101100490437 Mus musculus Acvrl1 gene Proteins 0.000 description 1
- 208000007101 Muscle Cramp Diseases 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 241000282339 Mustela Species 0.000 description 1
- 241000186359 Mycobacterium Species 0.000 description 1
- 101000668235 Mycobacterium phage L5 Gene 67 protein Proteins 0.000 description 1
- 208000003926 Myelitis Diseases 0.000 description 1
- 208000014767 Myeloproliferative disease Diseases 0.000 description 1
- CRJGESKKUOMBCT-VQTJNVASSA-N N-acetylsphinganine Chemical compound CCCCCCCCCCCCCCC[C@@H](O)[C@H](CO)NC(C)=O CRJGESKKUOMBCT-VQTJNVASSA-N 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 101150059463 P2RY12 gene Proteins 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102000058015 Suppressor of Cytokine Signaling 3 Human genes 0.000 description 1
- 108700027337 Suppressor of Cytokine Signaling 3 Proteins 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 101150117115 V gene Proteins 0.000 description 1
- 241000618809 Vitales Species 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 210000001642 activated microglia Anatomy 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 208000013404 behavioral symptom Diseases 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- 229940022399 cancer vaccine Drugs 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 238000010370 cell cloning Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000007541 cellular toxicity Effects 0.000 description 1
- 229940106189 ceramide Drugs 0.000 description 1
- ZVEQCJWYRWKARO-UHFFFAOYSA-N ceramide Natural products CCCCCCCCCCCCCCC(O)C(=O)NC(CO)C(O)C=CCCC=C(C)CCCCCCCCC ZVEQCJWYRWKARO-UHFFFAOYSA-N 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 238000012412 chemical coupling Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 201000002687 childhood acute myeloid leukemia Diseases 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- 230000003467 diminishing effect Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 229940087477 ellence Drugs 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000005206 flow analysis Methods 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 210000004392 genitalia Anatomy 0.000 description 1
- 150000002339 glycosphingolipids Chemical class 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 230000003284 homeostatic effect Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 229940029329 intrinsic factor Drugs 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 210000005210 lymphoid organ Anatomy 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 229940051875 mucins Drugs 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 230000015286 negative regulation of phagocytosis Effects 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- VVGIYYKRAMHVLU-UHFFFAOYSA-N newbouldiamide Natural products CCCCCCCCCCCCCCCCCCCC(O)C(O)C(O)C(CO)NC(=O)CCCCCCCCCCCCCCCCC VVGIYYKRAMHVLU-UHFFFAOYSA-N 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 229940043515 other immunoglobulins in atc Drugs 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical group [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 description 1
- 230000010399 physical interaction Effects 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000004063 proteosomal degradation Effects 0.000 description 1
- 230000000722 protumoral effect Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 238000002708 random mutagenesis Methods 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000019254 respiratory burst Effects 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 238000002702 ribosome display Methods 0.000 description 1
- 102210007708 rs3826656 Human genes 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 229930184616 taxin Natural products 0.000 description 1
- KOTXAHKUCAQPQA-AAUVPWARSA-N taxine Chemical compound C1([C@@H]([C@@H](O)C(=O)O[C@@H]2C=3/C[C@@](C([C@H](O)C4=C(C)[C@@H](OC(C)=O)CC(C4(C)C)[C@@H](OC(C)=O)\C=3)=O)(C)[C@@H](O)C2)N(C)C)=CC=CC=C1 KOTXAHKUCAQPQA-AAUVPWARSA-N 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229910052720 vanadium Inorganic materials 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Hematology (AREA)
- Communicable Diseases (AREA)
- Psychiatry (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
本願は、2018年8月31日に出願された米国仮特許出願第62/726,053号に基づく利益を主張するものであり、この仮出願は、参照によりその全体が本明細書に組み込まれる。
ASCIIテキストファイルでの次の提出物の内容は、その全体において参照により本明細書に組み込まれる:コンピュータ可読形態(CRF)の配列表(ファイル名:735022002840SEQLIST.TXT、記録日:2019年8月26日、サイズ:112KB)。
本開示は、抗CD33抗体及びかかる抗体の治療的使用に関する。
(a)配列番号120のアミノ酸配列を含む重鎖及び配列番号122のアミノ酸配列を含む軽鎖、または
(b)配列番号121のアミノ酸配列を含む重鎖及び配列番号122のアミノ酸配列を含む軽鎖を含む、単離された抗体に関する。
HVR-L3は、配列番号59のアミノ酸配列を含み、(dd)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号40のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号60のアミノ酸配列を含み、(ee)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号40のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号61のアミノ酸配列を含み、(ff)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号40のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号62のアミノ酸配列を含み、(gg)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号60のアミノ酸配列を含み、(hh)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号62のアミノ酸配列を含み、(ii)HVR-H1は、配列番号23のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号60のアミノ酸配列を含み、(jj)HVR-H1は、配列番号23のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号62のアミノ酸配列を含み、(kk)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号59のアミノ酸配列を含み、(ll)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号61のアミノ酸配列を含み、(mm)HVR-H1は、配列番号28のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号59のアミノ酸配列を含み、(nn)HVR-H1は、配列番号28のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号61のアミノ酸配列を含む。
「CD33」または「CD33ポリペプチド」という用語は、特記なき限り、本明細書では同義に使用され、本明細書では、霊長類(例えば、ヒト及びカニクイザル)及びげっ歯類(例えば、マウス及びラット)などの哺乳動物を含む、任意の脊椎動物源に由来する任意の天然CD33を意味する。いくつかの実施形態において、この用語は、野生型配列と、天然に存在するバリアント配列、例えば、スプライスバリアントまたはアレルバリアントの両方を包含する。いくつかの実施形態において、この用語は、「完全長」のプロセシングされていないCD33とともに、細胞内でのプロセシングから生じる任意の形態のCD33を包含する。いくつかの実施形態において、CD33は、ヒトCD33アイソフォーム1(NCBI参照配列:NP_001763.3)である。いくつかの実施形態において、例示的なヒトCD33のアミノ酸配列は、配列番号1である。カニクイザルCD33のアミノ酸配列は、配列番号2(NCBI参照配列:XP_005590138.1)である。
本開示は、部分的には、1つ以上の改善及び/または向上した機能的特徴を(例えば、配列番号3の配列を含む重鎖可変領域及び配列番号4の配列を含む軽鎖可変領域を有する抗CD33抗体と比べて)呈する抗CD33抗体(例えば、改善/向上した動態でCD33の細胞表面レベルを低下させる及び/またはCD33に結合する抗体を含む);かかる抗体を作製及び使用する方法;かかる抗体を含む医薬組成物;かかる抗体をコードする核酸;ならびにかかる抗体をコードする核酸を含む宿主細胞に関する。
一態様において、本開示は、本開示のCD33タンパク質内のエピトープなどの領域と相互作用する、または別様に結合する、単離された(例えば、モノクローナル)抗体などの抗体を提供する。いくつかの実施形態において、本抗体は、(例えば、配列番号3の配列を含む重鎖可変領域及び配列番号4の配列を含む軽鎖可変領域を有する抗CD33抗体と比べて)改善/向上した動態で本開示のCD33タンパク質内のエピトープなどの領域と相互作用する、または別様に結合する。いくつかの実施形態において、本抗体は、対照抗体のものよりも(例えば、配列番号3の配列を含む重鎖可変領域及び配列番号4の配列を含む軽鎖可変領域を有する抗CD33抗体と比べて)低い半数有効濃度(EC50)で、樹状細胞などのヒト細胞上のCD33タンパク質内のエピトープなどの領域と相互作用する、または別様に結合する。いくつかの実施形態において、本開示の抗CD33抗体は、CD33タンパク質に結合し、CD33タンパク質に結合した後、1つ以上のCD33活性、例えば、細胞上のCD33発現に関連する活性を調節する。したがって、本明細書で使用される場合、本開示のCD33タンパク質は、限定するものではないが、哺乳動物CD33タンパク質、ヒトCD33タンパク質、マウスCD33タンパク質、及びラットCD33タンパク質を含む。
本開示のCD33タンパク質は、1つ以上のCD33リガンドと相互作用する(例えば、結合する)ことができる。
本開示の特定の態様は、1つ以上の改善及び/または向上した機能的特徴を含む抗CD33抗体に関する。いくつかの実施形態において、本開示の抗CD33抗体は、参照または対照の抗体(例えば、配列番号3のアミノ酸配列を含む重鎖可変領域及び配列番号4のアミノ酸配列を含む軽鎖可変領域を含む抗CD33抗体)と比べて、1つ以上の改善及び/または向上した機能的特徴を含む。いくつかの実施形態において、本開示の抗CD33抗体は、参照または対照の抗CD33抗体(例えば、配列番号3のアミノ酸配列を含む重鎖可変領域及び配列番号4のアミノ酸配列を含む軽鎖可変領域を含む抗CD33抗体)のものよりも高いCD33(例えば、ヒトCD33)に対する親和性を有する。いくつかの実施形態において、本開示の抗CD33抗体は、参照または対照の抗体(例えば、配列番号3のアミノ酸配列を含む重鎖可変領域及び配列番号4のアミノ酸配列を含む軽鎖可変領域を含む抗CD33抗体)のものよりも低い半数有効濃度(EC50)で、ヒト初代樹状細胞などのヒト細胞に結合する。いくつかの実施形態において、本開示の抗CD33抗体は、参照または対照の抗体(例えば、配列番号3の配列を含む重鎖可変領域及び配列番号4の配列を含む軽鎖可変領域を含む抗CD33抗体)のものよりも低い半数有効濃度(EC50)で、CD33の細胞レベルを低下させる(例えば、細胞表面レベルを低下させる、または下げる)。
いくつかの実施形態において、本開示の抗CD33抗体は、立体構造エピトープに結合し得る。いくつかの実施形態において、本開示の抗CD33抗体は、非連続的CD33エピトープに結合し得る。いくつかの実施形態において、非連続的CD33エピトープは、2個以上のペプチド、3個以上のペプチド、4個以上のペプチド、5個以上のペプチド、6個以上のペプチド、7個以上のペプチド、8個以上のペプチド、9個以上のペプチド、または10個以上のペプチドを含む。いくつかの実施形態において、本開示の抗CD33抗体は、1つ以上のペプチドを含むCD33エピトープに結合し得る。本明細書に開示されるように、CD33エピトープは、配列番号1のアミノ酸配列の5個以上、6個以上、7個以上、8個以上、9個以上、10個以上、11個以上、12個以上、13個以上、14個以上、15個以上、16個以上、17個以上、18個以上、19個以上、もしくは20個以上のアミノ酸残基、または配列番号1のアミノ酸配列に対応する哺乳動物CD33タンパク質上の5個以上、6個以上、7個以上、8個以上、9個以上、10個以上、11個以上、12個以上、13個以上、14個以上、15個以上、16個以上、17個以上、18個以上、19個以上、もしくは20個以上のアミノ酸残基を含む、1つ以上のペプチドを含み得る。
6C7H28、6C7H29、6C7H30、6C7H31、6C7H32、6C7H33、6C7H34、6C7H35、6C7H36、6C7H37、6C7H38、6C7H39、6C7H40、6C7H41、6C7H42、6C7H43、6C7H44、6C7H45、6C7H46、6C7H47、6C7H48、6C7H49、6C7H50、6C7H51、6C7H52、6C7H53、及び6C7H54、ならびにこれらの任意の組み合わせから選択される1つ以上の抗体の量と比較して約1.5倍~100倍の範囲、または100倍超の過剰量で存在する。いくつかの実施形態において、抗CD33抗体は、6C7H1、6C7H2、6C7H3、6C7H4、6C7H5、6C7H6、6C7H7、6C7H8、6C7H9、6C7H10、6C7H11、6C7H12、6C7H13、6C7H14、6C7H15、6C7H16、6C7H17、6C7H18、6C7H19、6C7H20、6C7H21、6C7H22、6C7H23、6C7H24、6C7H25、6C7H26、6C7H27、6C7H28、6C7H29、6C7H30、6C7H31、6C7H32、6C7H33、6C7H34、6C7H35、6C7H36、6C7H37、6C7H38、6C7H39、6C7H40、6C7H41、6C7H42、6C7H43、6C7H44、6C7H45、6C7H46、6C7H47、6C7H48、6C7H49、6C7H50、6C7H51、6C7H52、6C7H53、及び6C7H54、ならびにこれらの任意の組み合わせから選択される1つ以上の抗体の量と比較して約2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、または100倍の過剰量で存在する。
いくつかの実施形態において、本開示の抗CD33抗体は、HVR-H1、HVR-H2、及びHVR-H3(表7に示す)から選択される1つ以上(例えば、1つ以上、2つ以上、または3つ全て)のHVRを含む重鎖可変領域を含む。いくつかの実施形態において、重鎖可変領域は、HVR-H1、HVR-H2、及びHVR-H3(表7に示す)を含む。いくつかの実施形態において、本開示の抗CD33抗体は、HVR-L1、HVR-L2、及びHVR-L3(表8に示す)から選択される1つ以上(例えば、1つ以上、2つ以上、または3つ全て)のHVRを含む軽鎖可変領域を含む。いくつかの実施形態において、重鎖可変領域は、HVR-L1、HVR-L2、及びHVR-L3(表8に示す)を含む。
配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号62のアミノ酸配列を含み、(gg)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号60のアミノ酸配列を含み、(hh)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号62のアミノ酸配列を含み、(ii)HVR-H1は、配列番号23のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号60のアミノ酸配列を含み、(jj)HVR-H1は、配列番号23のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号62のアミノ酸配列を含み、(kk)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号59のアミノ酸配列を含み、(ll)HVR-H1は、配列番号30のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号61のアミノ酸配列を含み、(mm)HVR-H1は、配列番号28のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号59のアミノ酸配列を含み、(nn)HVR-H1は、配列番号28のアミノ酸配列を含み、HVR-H2は、配列番号33のアミノ酸配列を含み、HVR-H3は、配列番号39のアミノ酸配列を含み、HVR-L1は、配列番号47のアミノ酸配列を含み、HVR-L2は、配列番号53のアミノ酸配列を含み、HVR-L3は、配列番号61のアミノ酸配列を含む。
本明細書に提供される抗体のいずれかのいくつかの実施形態において、本抗体は、<1μM、<100nM、<10nM、<1nM、<0.1nM、<0.01nM、または<0.001nM(例えば、10-8M以下、例えば、10-8M~10-13M、例えば、10-9M~10-13M)の解離定数(Kd)を有する。解離定数は、ELISA、表面プラズモン共鳴(SPR)、バイオレイヤー干渉法(例えば、ForteBioによるOctet Systemを参照されたい)、等温滴定熱量測定(ITC)、示差走査熱量測定(DSC)、円偏光二色性(CD)、ストップフロー分析、及び比色または蛍光によるタンパク質融解分析などの任意の生化学的技術または生物物理学的技術を含む、任意の分析技術によって決定され得る。一実施形態において、Kdは、放射標識抗原結合アッセイ(RIA)によって測定される。いくつかの実施形態において、RIAは、目的の抗体のFabバージョン及びその抗原を用い、例えばChen et al.J.Mol.Biol.293:865-881(1999)に記載されているように行われる。いくつかの実施形態において、Kdは、BIACORE表面プラズモン共鳴アッセイを使用して測定され、例えば、BIACORE-2000またはBIACORE-3000(BIAcore,Inc.、Piscataway,NJ)を使用したアッセイは、約10応答単位(RU)で固定化抗原CM5チップを用い、25℃で行われる。いくつかの実施形態において、KDは、一価抗体(例えば、Fab)または完全長抗体を使用して決定される。いくつかの実施形態において、KDは、一価形態の完全長抗体を使用して決定される。
本明細書に提供される抗体のいずれかのいくつかの実施形態において、本抗体は、抗体断片である。抗体断片としては、Fab、Fab′、Fab′-SH、F(ab′)2、Fv、及びscFv断片、ならびに以下に記載される他の断片が挙げられるが、これらに限定されない。特定の抗体断片の概説については、Hudson et al.Nat.Med.9:129-134(2003)を参照されたい。scFv断片の概説については、例えば、WO93/16185、ならびに米国特許第5571894号及び同第5587458号を参照されたい。サルベージ受容体結合エピトープ残基を含み、延長されたin vivo半減期を有するFab及びF(ab′)2断片の詳解については、米国特許第5869046号を参照されたい。
本明細書に提供される抗体のいずれかのいくつかの実施形態において、本抗体は、キメラ抗体である。特定のキメラ抗体は、例えば、米国特許第4816567号に記載されている。一例において、キメラ抗体は、非ヒト可変領域(例えば、マウス、ラット、ハムスター、ウサギ、またはサルなどの非ヒト霊長類に由来する可変領域)及びヒト定常領域を含む。更なる例において、キメラ抗体は、クラスまたはサブクラスが親抗体のクラスまたはサブクラスから変化した「クラススイッチ」抗体である。キメラ抗体には、それらの抗原結合性断片が含まれる。
本明細書に提供される抗体のいずれかのいくつかの実施形態において、本抗体は、ヒト抗体である。ヒト抗体は、当該技術分野で公知の様々な技術を使用して生成することができる。ヒト抗体については、van Dijk et al.Curr.Opin.Pharmacol.5:368-74(2001)及びLonberg Curr.Opin.Immunol.20:450-459(2008)に一般的に記載されている。
特定の実施形態において、抗CD33抗体は、アンタゴニスト抗体である。特定の実施形態において、抗CD33抗体は、アゴニスト抗体または不活性抗体である。いくつかの実施形態において、本開示の抗CD33抗体は、IgGクラス、IgMクラス、またはIgAクラスのものである。いくつかの実施形態において、本開示の抗CD33抗体は、IgGクラスものであり、IgG1、IgG2、IgG3、またはIgG4アイソタイプを有する。本明細書に提供される抗体のいずれかのいくつかの実施形態において、本抗体は、Fcを含む。いくつかの実施形態において、Fcは、ヒトIgG1、IgG2、IgG3、及び/またはIgG4アイソタイプである。いくつかの実施形態において、本抗体は、IgGクラス、IgMクラス、またはIgAクラスのものである。
いくつかの実施形態において、本開示の抗CD33抗体は、Fcγ受容体に結合する能力を保持する。いくつかの実施形態において、かかる抗体は、受容体活性化と適合する正確なエピトープ特異性を有するとき、例えばCD33受容体をクラスター化し、一時的に刺激する特長を有し得る。いくつかの実施形態において、かかる抗体は、後に、CD33の分解、CD33の脱感作、CD33の切断、CD33の内在化、CD33のシェディング、CD33発現の下方制御、及び/またはCD33のリソソーム分解を誘導することによって、CD33発現及び/またはCD33タンパク質の1つ以上の活性の長期持続的阻害剤として作用し得る。
膵臓癌、前立腺癌、卵巣癌、線維肉腫、または甲状腺癌から選択されるがんに由来し得る);腫瘍細胞上のCD33リガンドへの結合;樹状細胞、骨髄由来樹状細胞、単球、ミクログリア、T細胞、好中球、及び/またはマクロファージ上のCD33リガンドへの結合;ミクログリア、マクロファージ、樹状細胞、骨髄由来樹状細胞、好中球、T細胞、ヘルパーT細胞、または細胞傷害性T細胞のうちの1つ以上による腫瘍細胞殺傷の阻害;ミクログリア、マクロファージ、樹状細胞、骨髄由来樹状細胞、好中球、T細胞、ヘルパーT細胞、または細胞傷害性T細胞のうちの1つ以上の抗腫瘍細胞増殖活性の阻害;ミクログリア、マクロファージ、樹状細胞、骨髄由来樹状細胞、好中球、T細胞、ヘルパーT細胞、または細胞傷害性T細胞のうちの1つ以上の抗腫瘍細胞転移活性の阻害;免疫抑制性樹状細胞、免疫抑制性マクロファージ、骨髄由来抑制性細胞、腫瘍関連マクロファージ、または制御性T細胞の促進;TREM1、TREM2、FcgR、DAP10、及びDAP12などの1つ以上のITAMモチーフ含有受容体の阻害;モチーフD/Ex0-2YxxL/IX6-8YxxL/I(配列番号104)を含む1つ以上の受容体の阻害;病原体関連分子パターン(PAMP)を特定する受容体、及び損傷関連分子パターン(DAMP)を特定する受容体などの1つ以上のパターン認識受容体(PRR)によるシグナル伝達の阻害;1つ以上のToll様受容体によるシグナル伝達の阻害;JAK-STATシグナル伝達経路の阻害;活性化B細胞の核内因子カッパ軽鎖エンハンサー(NFκB)の阻害;PLCγ/PKC/カルシウム動員の阻害;PI3K/Akt、Ras/MAPKシグナル伝達の阻害;ミクログリア、マクロファージ、樹状細胞、骨髄由来樹状細胞、好中球、T細胞、ヘルパーT細胞、または細胞傷害性T細胞のうちの1つ以上に発現したCD86などの1つ以上の炎症性受容体の発現の調節;1つ以上のCD33依存的遺伝子の発現増大;破壊されたCD33依存的遺伝子発現の正常化;ならびにNFAT転写因子などの1つ以上のITAM依存的遺伝子の発現減少を含み得る。本開示の抗CD33抗体は、CD33タンパク質の1つ以上の活性を一時的に誘導するその能力について、当該技術分野で公知であり本明細書に開示される任意の好適な技術またはアッセイを利用して試験され得る。かかる抗体が一時的に誘導する活性にかかわらず、かかる抗体は、後に、CD33の分解、CD33の脱感作、CD33の切断、CD33の内在化、CD33のシェディング、CD33発現の下方制御、及び/またはCD33のリソソーム分解を誘導することによって、CD33発現及び/またはCD33タンパク質の1つ以上の活性の長期持続的阻害剤として作用し得る。いくつかの実施形態において、CD33抗体は、Fc受容体への結合とは関係なくCD33タンパク質の1つ以上の活性を一時的に誘導する。
本開示の抗CD33抗体の別のクラスには、不活性抗体が含まれる。本明細書で使用される場合、「不活性」抗体とは、その標的抗原(例えば、CD33)に特異的に結合するが、抗原機能を調節する(例えば、低下/阻害するまたは活性化/誘導する)ことはない抗体を意味する。例えば、CD33の場合、不活性抗体は、CD33の細胞レベルを調節せず、CD33と1つ以上のCD33リガンドとの間の相互作用(例えば、結合)を調節せず、またはCD33タンパク質の1つ以上の活性を調節しない。いくつかの実施形態において、細胞表面上でCD33をクラスター化する能力を有しない抗体は、受容体活性化と適合するエピトープ特異性を有している場合であっても、不活性抗体であり得る。
本開示の抗CD33抗体の第3のクラスには、1つ以上のCD33活性を遮断するか、または別様に阻害する抗体が含まれる。いくつかの実施形態において、CD33タンパク質に結合する抗体には、CD33の細胞レベル(例えば、CD33の細胞表面レベル)を低下させ、CD33及び/または1つ以上のCD33リガンドの間の相互作用(例えば、結合)を阻害し、CD33タンパク質の1つ以上の活性を阻害する抗体が含まれ得る。かかる抗体は、CD33と1つ以上のCD33リガンドとの間の相互作用(例えば、結合)を防止すること、または1つ以上のCD33リガンドの存在下でCD33の細胞外ドメインから細胞の細胞質内へのシグナル伝達を防止することのいずれかによって、CD33タンパク質の1つ以上の活性を阻害する。抗体はまた、CD33の分解、CD33の脱感作、CD33の切断、CD33の内在化、CD33のシェディング、CD33発現の下方制御、及び/またはCD33のリソソーム分解を誘導することによりCD33の細胞表面レベルを低下させることによって、CD33タンパク質の1つ以上の活性を阻害し得る。いくつかの実施形態において、かかる抗CD33抗体は、CD33を一時的に活性化しない場合がある。
いくつかの実施形態において、本明細書に記載されるIgG1バリアントのうちの1つ以上は、補体活性化をなくすために、A330L変異(Lazar et al.,(2006)Proc Natl Acad Sci USA,103:4005-4010)、またはL234F、L235E、及び/またはP331S変異のうちの1つ以上(Sazinsky et al.,(2008)Proc Natl Acad Sci USA,105:20167-20172)と組み合わせることができ、ここで、アミノ酸の位置は、EUナンバリング規則に従う。いくつかの実施形態において、本明細書に記載されるIgGバリアントは、抗CD33抗体のヒト血清中半減期を向上させる1つ以上の変異(例えば、EUナンバリング規則に従ったM252Y、S254T、T256E変異)と組み合わせることができる(Dall’Acqua et al.,(2006)J Biol Chem,281:23514-23524、及びStrohl e al.,(2009)Current Opinion in Biotechnology,20:685-691)。
本開示の特定の態様は、本開示のCD33タンパク質上の1つ以上のドメイン及び第2の抗原に結合する二重特異性抗体に関する。二重特異性抗体を生成する方法は、当該技術分野で周知であり、本明細書に記載される。いくつかの実施形態において、本開示の二重特異性抗体は、本開示のCD33タンパク質の1つ以上のアミノ酸残基、例えば、ヒトCD33(配列番号1)の1つ以上のアミノ酸残基、または配列番号1のアミノ酸残基に対応するCD33タンパク質上のアミノ酸残基に結合する。いくつかの実施形態において、本開示の二重特異性抗体は、第1の抗原及び第2の抗原を認識する。いくつかの実施形態において、第1の抗原は、CD33タンパク質またはその天然に存在するバリアントである。いくつかの実施形態において、第2の抗原もまた、CD33タンパク質またはその天然に存在するバリアントである。いくつかの実施形態において、第2の抗原は、血液脳関門を通過する輸送を促進する抗原である(例えば、Gabathuler R.,Neurobiol.Dis.37(2010)48-57を参照されたい)。このような第2の抗原には、限定するものではないが、トランスフェリン受容体(TR)、インスリン受容体(HIR)、インスリン様成長因子受容体(IGFR)、低密度リポタンパク質受容体関連タンパク質1及び2(LPR-1及び2)、ジフテリア毒素受容体、CRM197、ラマ単一ドメイン抗体、TMEM30(A)、タンパク質形質導入ドメイン、TAT、Syn-B、ペネトラチン、ポリアルギニンペプチド、ANG1005などのアンジオペプペプチド(例えば、Gabathuler,2010参照)、ならびに血液脳関門内皮細胞上に豊富に存在する他の細胞表面タンパク質(例えば、Daneman et al.,PLoS One.2010 Oct 29;5(10):e13741参照)が含まれる。いくつかの実施形態において、第2の抗原は、限定するものではないが、アミロイドβ、アミロイドβオリゴマー、アミロイドβ斑、アミロイド前駆体タンパク質またはその断片、タウ、IAPP、α-シヌクレイン、TDP-43、FUSタンパク質、C9orf72(9番染色体オープンリーディングフレーム72)、c9RANタンパク質、プリオンタンパク質、PrPSc、ハンチンチン、カルシトニン、スーパーオキシドジスムターゼ、アタキシン、アタキシン1、アタキシン2、アタキシン3、アタキシン7、アタキシン8、アタキシン10、レビー小体、心房性ナトリウム利尿因子、膵島アミロイドポリペプチド、インスリン、アポリポタンパク質AI、血清アミロイドA、メディン、プロラクチン、トランスサイレチン、リゾチーム、β2ミクログロブリン、ゲルゾリン、ケラトエピテリン、シスタチン、免疫グロブリン軽鎖AL、S-IBMタンパク質、リピート関連非ATG(RAN)翻訳産物、ジペプチドリピート(DPR)ペプチド、グリシン-アラニン(GA)リピートペプチド、グリシン-プロリン(GP)リピートペプチド、グリシン-アルギニン(GR)リピートペプチド、プロリン-アラニン(PA)リピートペプチド、ユビキチン、及びプロリン-アルギニン(PR)リピートペプチドを含む、病因タンパク質である。いくつかの実施形態において、第2の抗原は、免疫細胞上に発現している1つ以上のリガンド及び/またはタンパク質であり、限定するものではないが、CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、LIGHT、BTLA、CD38、TIGIT、VISTA、KIR、GAL9、TIM1、TIM3、TIM4、A2AR、LAG3、DR5、CD39、CD70、CD73、TREM1、TREM2、Siglec-5、Siglec-7、Siglec-9、Siglec-11、SirpA、CD47、CSF1-受容体、CD3、及びホスファチジルセリンを含む。いくつかの実施形態において、第2の抗原は、1つ以上の腫瘍細胞上に発現しているタンパク質、脂質、多糖または糖脂質である。
本開示の特定の態様は、本開示のCD33タンパク質、CD33タンパク質の天然に存在するバリアント、及びCD33タンパク質の疾患バリアントのうちの1つ以上に結合する抗体断片に関する。いくつかの実施形態において、抗体断片は、Fab、Fab′、Fab′-SH、F(ab′)2、Fv、またはscFv断片である。
本明細書に記載される抗体はいずれもフレームワークを更に含む。いくつかの実施形態において、フレームワークは、ヒト免疫グロブリンフレームワークである。例えば、いくつかの実施形態において、抗体(例えば、抗CD33抗体)は、上記実施形態のいずれかにあるようなHVRを含み、アクセプターヒトフレームワーク、例えば、ヒト免疫グロブリンフレームワークまたはヒトコンセンサスフレームワークを更に含む。ヒト免疫グロブリンフレームワークがヒト抗体の一部である場合もあれば、非ヒト抗体が1つ以上の内因性フレームワークをヒトフレームワーク領域(複数可)に置き換えることによってヒト化される場合もある。ヒト化に使用され得るヒトフレームワーク領域としては、「ベストフィット」法(例えば、Sims et al.J.Immunol.151:2296(1993)を参照されたい)を使用して選択されるフレームワーク領域;特定のサブグループの軽鎖または重鎖可変領域を持つヒト抗体のコンセンサス配列に由来するフレームワーク領域(例えば、Carter et al.Proc.Natl.Acad.Sci.USA,89:4285(1992)、及びPresta et al.J.Immunol.,151:2623(1993)を参照されたい);ヒト成熟(体細胞変異)フレームワーク領域またはヒト生殖細胞系列フレームワーク領域(例えば、Almagro and Fransson,Front.Biosci.13:1619-1633(2008)を参照されたい);及びFRライブラリのスクリーニングから得られるフレームワーク領域(例えば、Baca et al.,J.Biol.Chem.272:10678-10684(1997)及びRosok et al.,J.Biol.Chem.271:22611-22618(1996)を参照されたい)が挙げられるが、これらに限定されない。
いくつかの実施形態において、本開示の抗CD33抗体は、上述の可変重鎖配列を含む完全長重鎖と、上述の可変軽鎖配列を含む完全長軽鎖とを含む。特定の実施形態において、抗CD33抗体は、配列番号120または121の完全長重鎖配列、及び配列番号122の完全長軽鎖配列を含む。
免疫関連タンパク質の発現の調節
いくつかの実施形態において、本開示の抗CD33抗体は、細胞内に発現しているCD33タンパク質に結合した後、PD-L1、PD-L2、B7-H2、B7-H3、CD200R、CD163及び/またはCD206の発現を調節し得る。発現の調節(例えば、増大または減少)には、限定するものではないが、遺伝子発現における調節、転写発現における調節、またはタンパク質発現における調節が含まれ得る。遺伝子、転写産物(例えば、mRNA)、及び/またはタンパク質の発現を決定するには、当該技術分野で公知である任意の方法が使用され得る。例えば、ノーザンブロット分析は、抗炎症メディエーターの遺伝子発現レベルを決定するために使用され得、RT-PCRは、抗炎症メディエーターの転写のレベルを決定するために使用され得、ウェスタンブロット分析は、抗炎症メディエーターのタンパク質レベルを決定するために使用され得る。
いくつかの実施形態において、本開示の抗CD33抗体は、細胞内に発現しているCD33タンパク質に結合した後、抗原特異的T細胞の増殖を誘導する骨髄由来樹状細胞の能力を向上及び/または正常化し得る。
いくつかの実施形態において、本開示の抗CD33抗体は、細胞上に発現しているCD33タンパク質に結合した後、樹状細胞、マクロファージ、単球、好中球、破骨細胞、皮膚のランゲルハンス細胞、クッパー細胞、T細胞、ヘルパーT細胞、細胞傷害性T細胞、及びミクログリア細胞の増殖、生存、及び/または機能を増大させ得る。
いくつかの実施形態において、本開示の抗CD33アンタゴニスト抗体は、細胞傷害性T細胞、ヘルパーT細胞、またはその両方の活性を増大させ得る。いくつかの実施形態において、本開示の抗CD33アンタゴニスト抗体は、限定するものではないが、膀胱癌、脳癌、乳癌、結腸癌、直腸癌、子宮内膜癌、腎臓癌、腎細胞癌、腎盂癌、白血病、肺癌、黒色腫、非ホジキンリンパ腫、膵臓癌、前立腺癌、卵巣癌、線維肉腫、及び甲状腺癌などの固形腫瘍を含む腫瘍を含む、細胞傷害性T細胞、ヘルパーT細胞、またはその両方の活性の減少に関連する病態及び/または疾患を予防し、そのリスクを低下させ、または治療するのに有益である。
いくつかの実施形態において、本開示の抗CD33アゴニスト抗体は、活性を減少させ、増殖を減少させ、生存率を低下させ、機能性を低下させ、腫瘍もしくはリンパ系器官(例えば、脾臓及びリンパ節)への浸潤、CD14+骨髄細胞の数を減少させ、腫瘍成長速度を減少させ、腫瘍体積を低減させ、骨髄由来抑制性細胞(MDSC)の分化、生存、及び/または1つ以上の機能を低減もしくは阻害し、及び/または制御性T細胞もしくは抑制性腫瘍埋没型免疫抑制性樹状細胞、もしくは腫瘍関連マクロファージ、もしくは骨髄由来抑制性細胞のアポトーシスを促進し得る。いくつかの実施形態において、本開示の抗CD33アゴニスト抗体は、限定するものではないが、CD33を発現しない固形腫瘍、例えば膀胱癌、脳癌、乳癌、結腸癌、直腸癌、子宮内膜癌、腎臓癌、腎細胞癌、腎盂癌、肺癌、黒色腫、非ホジキンリンパ腫、膵臓癌、前立腺癌、卵巣癌、線維肉腫、甲状腺癌、及びCD33を発現する血液腫瘍、例えば白血病細胞を含む腫瘍を含む、1つ以上の種類の免疫抑制性細胞の活性に関連する病態及び/または疾患を予防し、そのリスクを低下させ、または治療するのに有益である。
いくつかの実施形態において、本開示の抗CD33アンタゴニスト抗体は、1つ以上のチェックポイント阻害療法及び/または免疫調節療法、例えばPD-1阻害剤、またはCTL4、アデノシン経路、PD-L1、PD-L2、OX40、TIM3、及び/またはLAG3のうちの1つ以上を標的とする療法の有効性を増大させ得る。
いくつかの実施形態において、本開示の抗CD33アンタゴニスト抗体は、ゲムシタビン、カペシタビン、アントラサイクリン、ドキソルビシン(Adriamycin(登録商標))、エピルビシン(Ellence(登録商標))、タキサン、パクリタキセル(Taxol(登録商標))、ドセタキセル(Taxotere(登録商標))、5-フルオロウラシル(5-FU)、シクロホスファミド(Cytoxan(登録商標))、カルボプラチン(Paraplatin(登録商標))、オキサリプラチン(Elotaxin(登録商標))、ロイコボリン、及び/またはテモゾロミド(Temodar(登録商標))などの1つ以上の化学療法剤の有効性を増大させ得る。
本開示の抗CD33抗体は、ポリクローナル抗体、モノクローナル抗体、ヒト化抗体及びキメラ抗体、ヒト抗体、抗体断片(例えば、Fab、Fab′-SH、Fv、scFv、及びF(ab′)2)、二重特異性抗体及び多特異性抗体、多価抗体、ヘテロコンジュゲート抗体、コンジュゲート抗体、ライブラリ由来抗体、改変されたエフェクター機能を有する抗体、抗体の一部分を含む融合タンパク質、ならびに本開示のCD33タンパク質のアミノ酸残基を有するエピトープなどの抗原認識部位を含む免疫グロブリン分子の任意の他の改変形態(抗体のグリコシル化バリアント、抗体のアミノ酸配列バリアント、及び共有結合的に修飾された抗体を含む)を包含し得る。抗CD33抗体は、ヒト、ネズミ、ラットまたは任意の他の起源であってよい(キメラ抗体またはヒト化抗体を含む)。
ポリクローナル抗体、例えば抗CD33ポリクローナル抗体は、一般に、関連抗原及びアジュバントの皮下(sc)注射または腹腔内(ip)注射を複数回行うことによって動物内で産生される。関連抗原(例えば、精製されたまたは組み換えの本開示のCD33タンパク質)を、免疫しようとする種において免疫原性であるタンパク質、例えば、キーホールリンペットヘモシアニン(KLH)、血清アルブミン、ウシサイログロブリン、またはダイズトリプシン阻害剤に、二官能性剤または誘導体化剤、例えば、マレイミドベンゾイルスルホスクシンイミドエステル(システイン残基を介したコンジュゲート)、N-ヒドロキシスクシンイミド(リジン残基を介する)、グルタルアルデヒド、コハク酸無水物、SOCl2、またはR1N=C=NR(式中、R及びR1は独立して低級アルキル基である)を使用して、コンジュゲートすることが有用であり得る。用いることができるアジュバントの例としては、フロイント完全アジュバント及びMPL-TDMアジュバント(モノホスホリルリピドA、合成トレハロースジコリノミコール酸エステル)が挙げられる。当業者であれば、過度な実験をすることなく、免疫化プロトコルを選択することができる。
抗CD33モノクローナル抗体などのモノクローナル抗体は、実質的に同種の抗体集団から得られるものであり、すなわち、その集団に含まれる個々の抗体は、微量で存在し得る可能性のある天然に存在する変異及び/または翻訳後修飾(例えば、異性化、アミド化)を除き、同一である。したがって、「モノクローナル」という修飾語は、異なる抗体の混合物ではないという抗体の特徴を示す。
本開示の抗CD33抗体またはその抗体断片は、ヒト化抗体またはヒト抗体を更に含み得る。非ヒト(例えば、マウス)抗体のヒト化型は、非ヒト免疫グロブリンに由来する最小配列を含む、キメラ免疫グロブリン、免疫グロブリン鎖、またはその断片(例えば、Fab、Fab′-SH、Fv、scFv、F(ab′)2、または抗体の他の抗原結合サブ配列)である。ヒト化抗体には、レシピエントの相補性決定領域(CDR)の残基が、所望の特異性、親和性、及び能力を有するマウス、ラット、またはウサギなどの非ヒト種(ドナー抗体)のCDRの残基に置き換えられている、ヒト免疫グロブリン(レシピエント抗体)が含まれる。場合により、ヒト免疫グロブリンのFvフレームワーク残基が、対応する非ヒト残基に置き換えられる。ヒト化抗体はまた、レシピエント抗体にも、移入されたCDRまたはフレームワーク配列にも見出されない残基を含み得る。一般に、ヒト化抗体は、少なくとも1つ、典型的には2つの可変ドメインの実質的に全てを含み、ここで、CDR領域の全てまたは実質的に全ては、非ヒト免疫グロブリンのCDR領域に対応し、FR領域の全てまたは実質的に全ては、ヒト免疫グロブリンコンセンサス配列のFR領域である。ヒト化抗体はまた、最適には、免疫グロブリン定常領域(Fc)の少なくとも一部、典型的にはヒト免疫グロブリンの少なくとも一部を含む。Jones et al.,Nature 321:522-525(1986)、Riechmann et al.,Nature 332:323-329(1988)、及びPresta,Curr.Opin.Struct.Biol.2:593-596(1992)。
特定の実施形態において、全抗体の抗CD33抗体ではなく、抗CD33抗体断片を使用する利点がある。断片サイズがより小さければ、迅速なクリアランス及び良好な脳透過性が可能になる。
二重特異性抗体(BsAb)は、同じまたは別のタンパク質(例えば、1つ以上の本開示のCD33タンパク質)上のエピトープを含む、少なくとも2つの異なるエピトープに対する結合特異性を有する抗体である。あるいは、BsAbの1つの部分を標的CD33抗原に結合するように武装させてもよく、別の部分を第2のタンパク質に結合するアームと組み合わせてもよい。このような抗体は、完全長抗体または抗体断片から得ることができる(例えば、F(ab′)2二重特異性抗体)。
多価抗体は、その抗体が結合する抗原を発現する細胞によって、二価抗体よりも速く内在化(及び/または異化)され得る。本開示の抗CD33抗体またはその抗体断片は、3つ以上の抗原結合部位を有する(IgMクラス以外の)多価抗体(例えば、四価抗体)であり得、抗体のポリペプチド鎖をコードする核酸の組み換え発現によって容易に生成することができる。多価抗体は、二量体化ドメイン、及び3つ以上の抗原結合部位を含み得る。好ましい二量体化ドメインは、Fc領域またはヒンジ領域を含む。このシナリオでは、抗体は、Fc領域と、Fc領域のアミノ末端側に3つ以上の抗原結合部位とを含むことになる。本明細書における好ましい多価抗体は、3~約8の抗原結合部位を含むが、好ましくは4つの抗原結合部位を含む。多価抗体は、少なくとも1つのポリペプチド鎖(好ましくは2つのポリペプチド鎖)を含み、ここで、ポリペプチド鎖(複数可)は、2つ以上の可変ドメインを含む。例えば、ポリペプチド鎖(複数可)は、VD1-(X1)n-VD2-(X2)n-Fcを含み得、ここで、VD1は第1の可変ドメインであり、VD2は第2の可変ドメインであり、FcはFc領域の1つのポリペプチド鎖であり、X1及びX2はアミノ酸またはポリペプチドを表し、nは0または1である。同様に、ポリペプチド鎖(複数可)は、VH-CH1-可動性リンカー-VH-CH1-Fc領域鎖またはVH-CH1-VH-CH1-Fc領域鎖を含み得る。本明細書における多価抗体は、好ましくは、少なくとも2つ(好ましくは4つ)の軽鎖可変ドメインポリペプチドを更に含む。本明細書における多価抗体は、例えば、約2~約8の軽鎖可変ドメインポリペプチドを含み得る。ここで企図される軽鎖可変ドメインポリペプチドは、軽鎖可変ドメインを含み、場合により、CLドメインを更に含む。多価抗体は、CD33抗原だけでなく、限定するものではないが、更なる抗原である、Aβペプチド抗原、またはαシヌクレインタンパク質抗原、またはタウタンパク質抗原、またはTDP-43タンパク質抗原、またはプリオンタンパク質抗原、またはハンチンチンタンパク質抗原、またはRAN翻訳産物抗原、例えば、グリシン-アラニン(GA)、グリシン-プロリン(GP)、グリシン-アルギニン(GR)、プロリン-アラニン(PA)、もしくはプロリン-アルギニン(PR)から構成されるジペプチドリピート(DPRペプチド)、インスリン受容体、インスリン様成長因子受容体、トランスフェリン受容体、または抗体の血液脳関門を通過する輸送を促進する任意の他の抗原を認識し得る。
ヘテロコンジュゲート抗体もまた、本開示の範囲内である。ヘテロコンジュゲート抗体は、共有結合した2つの抗体(例えば、本開示の抗CD33抗体またはその抗体断片)から構成される。例えば、ヘテロコンジュゲート中の抗体の一方がアビジンにカップリングされ、他方がビオチンにカップリングされ得る。このような抗体は、例えば、望まれない細胞に免疫系細胞を標的化するために提案されており(米国特許第4,676,980号)、HIV感染症の治療に使用されている。国際公開第WO91/00360号、同第WO92/200373号、及びEP0308936。抗体は、架橋剤を必要とするものを含め、合成タンパク質化学における公知の方法を使用してin vitroで調製され得ることが企図される。例えば、ジスルフィド交換反応を使用して、またはチオエーテル結合を形成することにより、免疫毒素を構築してもよい。この目的に好適な試薬の例としては、イミノチオレート及びメチル-4-メルカプトブチルイミデート、ならびに例えば米国特許第4,676,980号に開示されているものが挙げられる。ヘテロコンジュゲート抗体は、任意の簡便な架橋方法を使用して作製することができる。好適な架橋剤は、当該技術分野で周知であり、いくつかの架橋技術とともに、米国特許第4,676,980号に開示されている。
本開示の抗CD33抗体を修飾して、抗体のエフェクター機能を改変し、及び/または血清中半減期を延長することが望ましい場合がある。例えば、定常領域上のFc受容体結合部位を修飾または変異させて、特定のFc受容体、例えばFcγRI、FcγRII、及び/またはFcγRIIIに対する結合親和性を除去または低減させることができる。いくつかの実施形態において、エフェクター機能は、抗体のFc領域(例えば、IgGのCH2ドメイン中)のN-グリコシル化を除去することによって低下する。いくつかの実施形態において、エフェクター機能は、PCT WO99/58572及びArmour et al.,Molecular Immunology 40:585-593(2003)、Reddy et al.,J.Immunology 164:1925-1933(2000)に記載されるように、ヒトIgGの233~236、297、及び/または327~331などの領域を修飾することによって低下する。
本開示の抗CD33抗体またはその抗体断片のアミノ酸配列修飾もまた企図される。例えば、抗体または抗体断片の結合親和性及び/または他の生物学的特性を改善することが望ましいことがある。抗体または抗体断片のアミノ酸配列バリアントは、その抗体もしくは抗体断片をコードする核酸中に適切なヌクレオチド変化を導入することによって、またはペプチド合成によって調製される。かかる修飾としては、例えば、抗体のアミノ酸配列内の残基からの欠失、及び/またはその残基への挿入、及び/またはその残基の置換が挙げられる。欠失、挿入及び置換は、最終的な構築物に到達するように、任意の組み合わせがなされる。ただし、最終的な構築物が所望の特徴(すなわち、本開示のCD33タンパク質と結合し、または物理的に相互作用する能力)を有することを条件とする。また、アミノ酸の変化により、抗体の翻訳後プロセスも変わる場合があり、例えば、グリコシル化部位の数または位置が変更する場合がある。
(1)疎水性:ノルロイシン、met、ala、val、leu、ile;
(2)中性親水性:cys、ser、thr;
(3)酸性:asp、glu;
(4)塩基性:asn、gln、his、lys、arg;
(5)鎖配向に影響する残基:gly、pro;及び
(6)芳香族性:trp、tyr、phe。
本開示の抗CD33抗体またはその抗体断片は、検出可能なマーカー、毒素、または治療剤にコンジュゲートすることができる。検出可能なマーカー、毒素、または治療剤などの分子を抗体にコンジュゲートするには、当該技術分野で公知である任意の好適な方法を使用してよい。
本開示の抗CD33抗体またはその抗体断片を更に修飾して、当該技術分野において公知であり、容易に入手可能な更なる非タンパク質性部分を含有させることができる。好ましくは、抗体の誘導体化に好適な部分は、水溶性ポリマーである。水溶性ポリマーの非限定的な例には、ポリエチレングリコール(PEG)、エチレングリコール/プロピレングリコールのコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニルアルコール、ポリビニルピロリドン、ポリ-1,3-ジオキソラン、ポリ-1,3,6-トリオキサン、エチレン/無水マレイン酸コポリマー、ポリアミノ酸(ホモポリマーまたはランダムコポリマーのいずれか)、及びデキストランまたはポリ(n-ビニルピロリドン)ポリエチレングリコール、ポリプロピレングリコールホモポリマー、ポリプロピレンオキシド/エチレンオキシドコポリマー、ポリオキシエチル化ポリオール(例えば、グリセロール)、ポリビニルアルコール、ならびにこれらの混合物が挙げられるが、これらに限定されない。ポリエチレングリコールプロピオンアルデヒドは、水中でのその安定性により、製造における利点を有し得る。ポリマーは、任意の分子量のものであってよく、分岐でも非分岐でもよい。抗体に結合させるポリマーの数は様々であり得、2つ以上のポリマーを結合させる場合、それらは同じ分子であっても異なる分子であってもよい。一般に、誘導体化に使用されるポリマーの数及び/または種類は、限定するものではないが、改善しようとする抗体の特定の特性または機能、抗体誘導体が規定条件下の療法で使用されるかどうかなどの検討事項に基づいて決定することができる。かかる技術及び他の好適な処方は、Remington:The Science and Practice of Pharmacy,20th Ed.,Alfonso Gennaro,Ed.,Philadelphia College of Pharmacy and Science(2000)に開示されている。
本開示の抗CD33抗体の抗原結合活性は、例えば、ELISA、表面プラズモン共鳴(SPR)、ウェスタンブロットなどの公知の方法によって試験することができる。
本開示の抗CD33抗体は、例えば、米国特許第4,816,567号に記載されている組み換え法及び組成物を使用して生成することができる。いくつかの実施形態において、本開示の抗CD33抗体のうちのいずれかをコードするヌクレオチド配列を有する単離された核酸が提供される。かかる核酸は、抗CD33抗体のVLを含むアミノ酸配列及び/またはVHを含むアミノ酸配列(例えば、抗体の軽鎖及び/または重鎖)をコードし得る。いくつかの実施形態において、かかる核酸を含む1つ以上のベクター(例えば、発現ベクター)が提供される。いくつかの実施形態では、かかる核酸を含む宿主細胞も提供される。いくつかの実施形態において、宿主細胞は、(1)抗体のVLを含むアミノ酸配列及び抗体のVHを含むアミノ酸配列をコードする核酸を含むベクター、または(2)抗体のVLを含むアミノ酸配列をコードする核酸を含む第1のベクター、及び抗体のVHを含むアミノ酸配列をコードする核酸を含む第2のベクターを含む(例えば、それらで形質転換されている)。いくつかの実施形態において、宿主細胞は、真核細胞、例えば、チャイニーズハムスター卵巣(CHO)細胞またはリンパ系細胞(例えば、Y0、NS0、Sp20細胞)である。本開示の宿主細胞は、限定するものではないが、単離細胞、in vitro培養細胞、及びex vivo培養細胞も含む。
本明細書では、本開示の抗CD33抗体及び薬学的に許容される担体を含む医薬組成物及び/または医薬製剤が提供される。
本開示の抗CD33抗体を含む本開示の医薬組成物は、公知の方法に従って、例えば、ボーラスもしくはある期間にわたる連続注入による静脈内投与、筋肉内、腹腔内、脳髄内、頭蓋内、脊髄内、皮下、関節内、髄液内、髄腔内、経口、局所または吸入の各経路によって、該抗体での治療を必要とする個体、好ましくはヒトに投与することができる。
本明細書に開示されるように、本開示の抗CD33抗体は、様々な疾患及び障害を予防し、そのリスクを低下させ、または治療するために使用され得る。
認知症は、それまでに障害のなかった人において、正常な老化から予想され得るものを超える全体的認知能力の重大な損失として現れる非特異的症候群(すなわち、徴候及び症状の集まり)である。認知症は、特有の全体的な脳傷害の結果として、変化しないこともある。あるいは、認知症は、進行性であり、身体の損傷または疾患によって長期的な減退がもたらされる場合もある。認知症は、高齢者集団においてより多く一般的にみられるが、65歳以前に発症することもある。認知症によって影響を受ける認知領域には、限定するものではないが、記憶、注意持続時間、言語及び問題解決が含まれる。一般に、個体が認知症と診断されるまでには、少なくとも6か月間、症状が存在する必要がある。
前頭側頭型認知症(FTD)は、脳の前頭葉の進行性変性から生じる病態である。この変性は、時間の経過とともに側頭葉に進むことがある。罹患率では、FTDは、アルツハイマー病(AD)に次いで、初老年性認知症症例の20%を占める。FTDの臨床的特徴には、記憶障害、行動異常、人格変化、及び言語障害が含まれる(Cruts,M.& Van Broeckhoven,C.,Trends Genet.24:186-194(2008);Neary,D.,et al.,Neurology 51:1546-1554(1998);Ratnavalli,E.,Brayne,C.,Dawson,K.& Hodges,J.R.,Neurology 58:1615-1621(2002))。
アルツハイマー病(AD)は、認知症の最も一般的な形態である。この疾患に治療法はなく、進行するにつれて悪化し、最終的には死に至る。ほとんどの場合、ADは、65歳を越えた人において診断される。しかしながら、あまり一般的ではない早期発症型のアルツハイマー病は、より早期に発症することがある。
パーキンソン病は、特発性もしくは原発性パーキンソニズム、低運動性硬直症候群(HRS)、または振戦麻痺と呼ばれることもあり、運動系制御に影響を与える神経変性脳障害である。脳内におけるドーパミン産生細胞の進行性死がパーキンソン病の主要な症状を引き起こす。ほとんどの場合、パーキンソン病は、50歳を越えた人において診断される。パーキンソン病は、ほとんどの人で特発性(原因不明)である。しかしながら、遺伝的要因がこの疾患にも関与している。
本明細書で使用される場合、筋萎縮性側索硬化症(ALS)または運動ニューロン疾患またはルーゲーリッグ病は、同義に使用され、急速に進行する筋力低下、筋萎縮及び線維束性収縮、筋痙縮、発話困難(構音障害)、嚥下困難(嚥下障害)ならびに呼吸困難(呼吸障害)を特徴とする様々な病因を有する消耗性疾患を意味する。
ハンチントン病(HD)は、ハンチンチン遺伝子(HTT)の常染色体優性変異によって引き起こされる遺伝性神経変性疾患である。ハンチンチン遺伝子内のサイトカイン-アデニン-グアニン(CAG)のトリプレットリピートが伸長すると、当該遺伝子によってコードされるハンチンチンタンパク質(Htt)の変異型が産生される。この変異型ハンチンチンタンパク質(mHtt)は毒性があり、ニューロン死に関与する。ハンチントン病の症状は、35~44歳の間に現れるのが最も一般的であるが、あらゆる年齢で発生し得る。
タウパチー病またはタウオパチーは、脳内における微小管関連タンパク質タウの凝集によって引き起こされる神経変性疾患の一種である。アルツハイマー病(AD)が最もよく知られたタウパチー病であり、タウタンパク質がニューロン内で不溶性神経原線維変化(NFT)の形態で蓄積することを伴う。他のタウパチー病及び障害には、進行性核上性麻痺、ボクサー認知症(慢性外傷性脳症)、17番染色体に連鎖する前頭側頭型認知症パーキンソニズム、Lytico-Bodig病(グアムのパーキンソン-認知症複合症候群)、神経原線維変化優性認知症、神経節膠腫及び神経節細胞腫、髄膜血管腫症、亜急性硬化性全脳炎、鉛脳症、結節性硬化症、ハレルフォルデン・スパッツ病、リポフスチン症、ピック病、皮質基底核変性症、嗜銀顆粒病(AGD)、ハンチントン病、ならびに前頭側頭葉変性症が含まれる。
多発性硬化症(MS)は、散在性硬化症または散在性脳脊髄炎と呼ばれることもある。MSは、脳及び脊髄の軸索を覆う脂質性ミエリン鞘が損傷を受けて、脱髄及び瘢痕化ならびに広範な徴候及び症状が生じる炎症性疾患である。MSは、脳及び脊髄の神経細胞が互いに効果的に情報伝達を行う能力に影響を及ぼす。神経細胞は、ミエリンと呼ばれる絶縁性物質内にある軸索と呼ばれる長い線維に沿って活動電位と呼ばれる電気信号を送ることによって情報を伝達している。MSでは、身体自体の免疫系がミエリンを攻撃し、損傷を与える。ミエリンが失われると、軸索は、シグナル伝達を効果的に行うことができなくなる。MSの発症は、通常、若年成人で起こり、女性でより一般的である(http://en.wikipedia.org/wiki/Multiple_sclerosis - cite_note-pmid18970977-1)。
本開示の更なる態様は、治療有効量の単離された本開示の抗CD33抗体を、それを必要とする個体に投与することにより、がんを予防し、そのリスクを低下させ、または治療する方法を提供する。単離された本開示の抗体のいずれも、これらの方法で使用することができる。いくつかの実施形態において、単離された抗体は、本開示のアゴニスト抗体である。他の実施形態において、単離された抗体は、本開示のアンタゴニスト抗体である。他の実施形態において、単離された抗体は、本開示の不活性抗体である。他の実施形態において、単離された抗体は、本開示の抗体コンジュゲートである。
本抗体のいずれかのいくつかの実施形態において、本明細書において提供される抗CD33抗体のうちのいずれも、試料または個体におけるCD33の存在を検出するために有用である。本明細書で使用される「検出する」という用語は、定量的検出または定性的検出を包含する。本明細書では、個体または個体に由来する組織試料におけるCD33の検出などの診断目的で本開示の抗体を使用する方法が提供される。いくつかの実施形態において、個体はヒトである。
本明細書では、本明細書に記載される抗CD33抗体を含む製造品(例えば、キット)が提供される。製造品は、本明細書に記載される抗体を含む1つ以上の容器を含み得る。容器は、バイアル、ボトル、ジャー、軟包装(例えば、密封マイラーバッグまたはプラスチック袋)などを含むがこれらに限定されない、任意の好適な包装であってよい。容器は、単位用量、バルク包装(例えば、複数回用量包装)または分割単位用量でもよい。
以下の実施例の目的は、マウス抗ヒトCD33抗体である6C7のヒト化バリアントを生成すること、及びこのヒト化抗体のCD33への結合を解析することであった。マウス6C7抗体は、配列EVKLEESGGGLVQPGGSMKLSCVGSGFTFSNYCMNWVRQSPEKGLEWVAEIRLKSNNYVTNYVESVKGRFTISRDDSKSRVYLQMNNLRGEDTGFYYCTRDGYYVPFAYWGQGTLVTVSA(配列番号3)を含む重鎖可変領域、及びQLVLTQSSSASFSLGASAKLTCTLSSQHSTYTIEWYQQQPLKPPKYVMELKKDGSHSTGDGIPDRFSGSSSGADRYLSISNIQPEDEAIYICGVGDTIKEQFVYVFGGGTKVTVL(配列番号4)の配列を含む軽鎖可変領域を含むものであった。抗CD33抗体6C7は、以前にWO2016/201388に開示されており、ここで、重鎖可変領域は配列番号65によってコードされるものであり、軽鎖可変領域は配列番号242によってコードされるものであった。
以下の実施例の目的は、ヒト化抗CD33 6C7抗体(上記の実施例1に記載したようなもの)が初代ヒト樹状細胞上のCD33の細胞表面レベルを低下させることができるかどうかを試験することであった。
以下の実施例の目的は、抗CD33抗体6C7H5の結合特性及び他の望ましい機能的特性を維持しつつ、抗体を不安定にし得る配列を除去した、抗CD33抗体6C7H5のバリアントを生成し、解析することであった。
抗CD33抗体6C7H8の哺乳動物細胞への結合を、上記の実施例1に記載した方法を使用したフローサイトメトリーにより、2μg/mLの抗体濃度で試験した。結果を図3に示す。
抗体6C7H5にはあったが抗体6C7H8では低減していた結合特性及び他の機能的特性を復元するために、更なるタンパク質工学操作を抗CD33抗体6C7H8に行った。抗体6C7H8のHVR H1、HVR L2、ならびに重鎖のフレームワーク1及びフレームワーク2の標的変異誘発を行うことにより、35種の更なる抗CD33抗体を生成した。別個の工学操作アプローチでは、標的変異誘発による抗体6C7H8のHVR H1の標的変異誘発により、19種の更なるバリアント抗CD33抗体が得られた。抗CD33抗体の組み換えCD33への結合をELISAによって試験した。結果を図6A及び図6Bに示す。
ヒトCD33に対する抗体バリアントの親和性パラメータを、BioLayer干渉法により、標準的技術(Estep et al.(2013)MAbs 5(2):270-8)に従うForteBioアッセイで測定し、親抗体(抗体6C7H8)及び親ヒト化抗体(抗体6C7H5)のものと比較した。簡潔に述べると、抗体を抗ヒトFc Biosensors(Pall ForteBio)で捕捉した。次いで、組み換えヒトCD33(10nM、Sino Biologicals)を、捕捉された抗CD33表面に結合させた(会合時間200秒、解離時間1200秒)。ローカルフィッティングを使用して、各抗体の会合速度定数及び解離速度定数(それぞれka及びkd)を抽出した。見かけの親和性定数(KD)を比率kd/kaから計算した。結果を以下の表2に示す。
抗体バリアントの初代ヒト樹状細胞への結合を、実施例1に記載した方法に従い、2μg/mLの抗体濃度で評価した。結果を図7に示す。
抗CD33抗体バリアント6C7H9~6C7H30が樹状細胞の表面上のCD33のレベルを低下させる能力について、実施例2に記載した方法に従って評価した。抗CD33抗体バリアントを、親抗体(6C7H8)、親ヒト化抗体(6C7H5)、及び6C7キメラ抗体と比較した。半数有効濃度(EC50)及びCD33の最大低下を以下の表3にまとめる。11種の抗CD33抗体バリアント(6C7H10、6C7H13、6C7H17、6C7H19、6C7H20、6C7H21、6C7H22、6C7H23、6C7H24、6C7H25、及び6C7H30)に関するこれらの試験の結果は、図8A及び図8Bに示してある。ここでは、これらのバリアントを親6C7H8抗体、親6C7H5ヒト化抗体、及び6C7キメラ抗体と比較している。
結合及び機能的活性が改善した抗体を得るために、HVR H1、HVR H3、HVR L2、HVR L3、重鎖フレームワーク1、重鎖フレームワーク2、重鎖フレームワーク3、軽鎖フレームワーク1、及び軽鎖フレームワーク2における標的変異誘発により、本開示の抗CD33抗体の更なる工学操作を行い、24種の更なる抗CD33抗体バリアント(6C7H31~6C7H54)を得た。抗CD33抗体バリアント6C7H31~6C7H54の重鎖可変領域HVR配列は、以下の表7に示してある。抗体の軽鎖可変領域HVR配列は、以下の表8に示してある。抗体の重鎖フレームワーク領域は、以下の表9に示してある。抗体の軽鎖フレームワーク領域は、以下の表10に示してある。抗体の重鎖可変領域配列は、以下の表11に示してある。抗体の軽鎖可変領域配列は、以下の表12に示してある。
抗CD33抗体バリアント6C7H31~6C7H54の初代ヒト樹状細胞への結合を、実施例1に記載した方法に従ったフローサイトメトリーにより、1μg/mLの抗体濃度で評価した。抗CD33抗体バリアントを、親ヒト化抗体(6C7H5)及び6C7キメラ抗体と比較した。これらの試験の結果を図9に示す。
ヒトCD33及びカニクイザルCD33に対する抗CD33抗体6C7H54の親和性パラメータを、BioLayer干渉法により、上述の方法に従うForteBioアッセイで測定した。結果を以下の表5にまとめる。
24種の抗CD33抗体バリアント(6C7H31~6C7H54)が樹状細胞の表面上のCD33のレベルを低下させる能力について、上記の実施例2に記載した方法に従って更に評価した。抗CD33抗体バリアントを、ヒト樹状細胞上のCD33細胞表面レベルを低下させる能力について、親ヒト化抗体、6C7H5、及び6C7キメラ抗体と比較した。半数有効濃度(EC50)を以下の表6にまとめる。また、抗CD33バリアントのうちの3種(6C7H38、6C7H47、及び6C7H54)に関する結果は図11に示してあり、ここでは、これらのバリアントを親6C7H5ヒト化抗体及び6C7キメラ抗体と比較している。
この実施例の目的は、抗CD33抗体がin vitro及びin vivoで初代骨髄細胞上のCD33の細胞表面レベルを低下させる能力に対するFcの影響を評価することであった。
非公式の配列表
CD33配列(配列番号1~2)
ヒトCD33のアミノ酸配列(配列番号1):
MPLLLLLPLLWAGALAMDPNFWLQVQESVTVQEGLCVLVPCTFFHPIPYYDKNSPVHGYWFREGAIISRDSPVATNKLDQEVQEETQGRFRLLGDPSRNNCSLSIVDARRRDNGSYFFRMERGSTKYSYKSPQLSVHVTDLTHRPKILIPGTLEPGHSKNLTCSVSWACEQGTPPIFSWLSAAPTSLGPRTTHSSVLIITPRPQDHGTNLTCQVKFAGAGVTTERTIQLNVTYVPQNPTTGIFPGDGSGKQETRAGVVHGAIGGAGVTALLALCLCLIFFIVKTHRRKAARTAVGRNDTHPTTGSASPKHQKKSKLHGPTETSSCSGAAPTVEMDEELHYASLNFHGMNPSKDTSTEYSEVRTQ
カニクイザルCD33のアミノ酸配列(配列番号2):
MDGEHLKGRNQGAQETSASDMPLLLLPLLWAGALAMDPRVRLEVQESVTVQEGLCVLVPCTFFHPVPYHTRNSPVHGYWFREGAIVSLDSPVATNKLDQEVQEETQGRFRLLGDPSRNNCSLSIVDARRRDNGSYFFRMEKGSTKYSYKSTQLSVHVTDLTHRPQILIPGALDPDHSKNLTCSVPWACEQGTPPIFSWMSAAPTSLGLRTTHSSVLIITPRPQDHGTNLTCQVKFPGAGVTTERTIQLNVSYASQNPRTDIFLGDGSGKQGVVQGAIGGAGVTVLLALCLCLIFFTVKTHRRKAARTAVGRIDTHPATGPTSSKHQKKSKLHGATETSGCSGTTLTVEMDEELHYASLNFHGMNPSEDTSTEYSEVRTQ
参照抗CD33抗体配列(配列番号3~4)
マウス6C7抗体の重鎖可変領域(配列番号3)
EVKLEESGGGLVQPGGSMKLSCVGSGFTFSNYCMNWVRQSPEKGLEWVAEIRLKSNNYVTNYVESVKGRFTISRDDSKSRVYLQMNNLRGEDTGFYYCTRDGYYVPFAYWGQGTLVTVSA
マウス6C7抗体の軽鎖可変領域(配列番号4)
QLVLTQSSSASFSLGASAKLTCTLSSQHSTYTIEWYQQQPLKPPKYVMELKKDGSHSTGDGIPDRFSGSSSGADRYLSISNIQPEDEAIYICGVGDTIKEQFVYVFGGGTKVTVL
その他の配列
モチーフD/Ex0-2YxxL/IX6-8YxxL/I(配列番号104)
ASTKGPSVFP LAPCSRSTSE STAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSNFGTQT YTCNVDHKPS NTKVDKTVER KCCVECPPCP(配列番号105)
完全長抗体配列(6C7H54可変領域;IgG2)
末端リジンありの重鎖(配列番号120)
EVQLVESGGGLVQPGGSLRLSCAGSGFTFSNYEMNWVRQAPGKGLEWVAEIRLKSNNYVTNYAASVKGRFTISRDDSKNSVYLQMNSLKTEDTGVYYCTRAGYYVPFAYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
末端リジンなしの重鎖(配列番号121)
EVQLVESGGGLVQPGGSLRLSCAGSGFTFSNYEMNWVRQAPGKGLEWVAEIRLKSNNYVTNYAASVKGRFTISRDDSKNSVYLQMNSLKTEDTGVYYCTRAGYYVPFAYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG
軽鎖(配列番号122)
QLMLTQSPSASASLGASVKLTCTLSSQHSTYTIEWYQQQPGKGPRYLMELKKEGSHSTGDGIPDRFSGSSSGAERYLTISSLQSEDEADYYCGVGHTIKEQFVYVFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
Claims (18)
- CD33に結合する単離された抗体であって、前記抗体は、HVR-H1、HVR-H2、及びHVR-H3を含む重鎖可変領域並びにHVR-L1、HVR-L2、及びHVR-L3を含む軽鎖可変領域を含み、
HVR-H1が配列番号8のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号9のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号54のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号9のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号9のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号55のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号10のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号11のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号12のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号13のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号14のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号15のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号16のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号17のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号18のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号19のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号20のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号21のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号22のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号23のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号24のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号25のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号26のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号27のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号28のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号58のアミノ酸配列を含む;
HVR-H1が配列番号29のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号59のアミノ酸配列を含む;
HVR-H1が配列番号29のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号60のアミノ酸配列を含む;
HVR-H1が配列番号29のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号61のアミノ酸配列を含む;
HVR-H1が配列番号29のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号62のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号40のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号59のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号40のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号60のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号40のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号61のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号40のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号62のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号60のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号62のアミノ酸配列を含む;
HVR-H1が配列番号23のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号60のアミノ酸配列を含む;
HVR-H1が配列番号23のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号62のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号59のアミノ酸配列を含む;
HVR-H1が配列番号30のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号61のアミノ酸配列を含む;
HVR-H1が配列番号23のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号59のアミノ酸配列を含む;または
HVR-H1が配列番号23のアミノ酸配列を含み、HVR-H2が配列番号33のアミノ酸配列を含み、HVR-H3が配列番号39のアミノ酸配列を含み、HVR-L1が配列番号47のアミノ酸配列を含み、HVR-L2が配列番号53のアミノ酸配列を含み、及びHVR-L3が配列番号61のアミノ酸配列を含む、抗体。 - 前記抗体が、
配列番号68のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号69のアミノ酸配列を含む重鎖可変領域、及び配列番号98のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号69のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号69のアミノ酸配列を含む重鎖可変領域、及び配列番号99のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号70のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号71のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号72のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号73のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号74のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号75のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号76のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号77のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号78のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号79のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号80のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号81のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号82のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号83のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号84のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号85のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号86のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号87のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号88のアミノ酸配列を含む重鎖可変領域、及び配列番号97のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号89のアミノ酸配列を含む重鎖可変領域、及び配列番号100のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号89のアミノ酸配列を含む重鎖可変領域、及び配列番号101のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号89のアミノ酸配列を含む重鎖可変領域、及び配列番号102のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号89のアミノ酸配列を含む重鎖可変領域、及び配列番号103のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号90のアミノ酸配列を含む重鎖可変領域、及び配列番号100のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号90のアミノ酸配列を含む重鎖可変領域、及び配列番号101のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号90のアミノ酸配列を含む重鎖可変領域、及び配列番号102のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号90のアミノ酸配列を含む重鎖可変領域、及び配列番号103のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号91のアミノ酸配列を含む重鎖可変領域、及び配列番号100のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号91のアミノ酸配列を含む重鎖可変領域、及び配列番号101のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号91のアミノ酸配列を含む重鎖可変領域、及び配列番号102のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号91のアミノ酸配列を含む重鎖可変領域、及び配列番号103のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号92のアミノ酸配列を含む重鎖可変領域、及び配列番号101のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号92のアミノ酸配列を含む重鎖可変領域、及び配列番号103のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号93のアミノ酸配列を含む重鎖可変領域、及び配列番号101のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号93のアミノ酸配列を含む重鎖可変領域、及び配列番号103のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号83のアミノ酸配列を含む重鎖可変領域、及び配列番号101のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号83のアミノ酸配列を含む重鎖可変領域、及び配列番号103のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号92のアミノ酸配列を含む重鎖可変領域、及び配列番号100のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号92のアミノ酸配列を含む重鎖可変領域、及び配列番号102のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号93のアミノ酸配列を含む重鎖可変領域、及び配列番号100のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号93のアミノ酸配列を含む重鎖可変領域、及び配列番号102のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号83のアミノ酸配列を含む重鎖可変領域、及び配列番号100のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号83のアミノ酸配列を含む重鎖可変領域、及び配列番号102のアミノ酸配列を含む軽鎖可変領域を含む;
配列番号120のアミノ酸配列を含む重鎖、及び配列番号122のアミノ酸配列を含む軽鎖を含む;または
配列番号121のアミノ酸配列を含む重鎖、及び配列番号122のアミノ酸配列を含む軽鎖を含む
請求項1に記載の抗体。 - 重鎖可変領域が、配列番号23のアミノ酸配列を含むHVR-H1、配列番号33のアミノ酸配列を含むHVR-H2、及び配列番号39のアミノ酸配列を含むHVR-H3を含み、且つ軽鎖可変領域が、配列番号47のアミノ酸配列を含むHVR-L1、配列番号53のアミノ酸配列を含むHVR-L2、及び配列番号61のアミノ酸配列を含むHVR-L3を含む、請求項1に記載の抗体。
- 前記抗体が、配列番号83のアミノ酸配列を含む重鎖可変領域、及び配列番号102のアミノ酸配列を含む軽鎖可変領域を含む、請求項2に記載の抗体。
- 前記抗体が:
(a)配列番号120のアミノ酸配列を含む重鎖、及び配列番号122のアミノ酸配列を含む軽鎖を含む;または
(b)配列番号121のアミノ酸配列を含む重鎖、及び配列番号122のアミノ酸配列を含む軽鎖を含む
請求項2または4に記載の抗体。 - (i)前記抗体は、モノクローナル抗体である;及び/または
(ii)前記抗体は、IgGクラス、IgMクラス、またはIgAクラスのものである、請求項1~5のいずれか1項に記載の抗体。 - 前記抗体は、IgGクラスのものであり、IgG1、IgG2、IgG3、またはIgG4アイソタイプを有する、請求項6に記載の抗体。
- (i)前記抗体は、Fc領域においてC127S、L234A、L234F、L235A、L235E、S267E、K322A、L328F、A330S、P331S、E345R、E430G、S440Y、及びこれらの任意の組み合わせからなる群から選択される残基位置に1つ以上のアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従う;
(ii)前記抗体は、IgG4アイソタイプを有し、残基位置228にS228Pアミノ酸置換、残基位置234にL234Aアミノ酸置換、及び残基位置235にL235Aアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従う;または
(iii):
(a)Fc領域は、位置E430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(b)Fc領域は、位置L234A、L235A、及びP331Sにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(c)Fc領域は、位置L234A、L235A、P331S、及びE430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(d)Fc領域は、位置K322A及びE430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(e)Fc領域は、位置P331S及びE430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(f)Fc領域は、位置A330S、P331S、及びE430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(g)Fc領域は、位置K322A、A330S、及びP331Sにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(h)Fc領域は、位置K322A、P331S、及びE430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(i)Fc領域は、位置E430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(j)Fc領域は、位置A330S、P331S、及びE430Gにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(k)Fc領域は、位置S267E及びL328Fにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(l)Fc領域は、位置C127Sにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(m)Fc領域は、位置E345R、E430G、及びS440Yにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、
(n)Fc領域は、位置P331Sにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従うか、または
(o)Fc領域は、位置L234A、L235A、及びP331Sにアミノ酸置換を含み、前記残基位置のナンバリングは、EUナンバリングに従う、
請求項1~7のいずれか1項に記載の抗体。 - (i)前記抗体は、ヒトCD33またはカニクイザルCD33タンパク質上のアミノ酸残基を含むエピトープに結合する抗体断片である;
(ii)前記抗体は、ヒトCD33、ヒトCD33の天然に存在するバリアント、及びヒトCD33の疾患バリアントからなる群から選択される1つ以上のヒトタンパク質に結合する抗体断片である、
請求項1~8のいずれか1項に記載の抗体。 - 前記抗体断片は、ヒトCD33、ヒトCD33の天然に存在するバリアント、及びヒトCD33の疾患バリアントからなる群から選択される1つ以上のヒトタンパク質に結合する第2の抗体断片に架橋されている、及び/または前記断片は、Fab、Fab′、Fab′-SH、F(ab′)2、Fv、またはscFv断片である、
請求項9に記載の抗体。 - (i)前記抗体は、配列番号3のアミノ酸配列を含む重鎖可変領域及び配列番号4のアミノ酸配列を含む軽鎖可変領域を含む抗CD33抗体よりも少なくとも1.8倍低いヒトCD33についての解離定数(KD)を有し、前記KDは、BioLayer干渉法によって決定される;
(ii)前記抗体は、200pMまたは200pM未満のヒトCD33についての解離定数(KD)を有し、前記KDは、BioLayer干渉法によって決定される;
(iii)前記抗体は、フローサイトメトリーによって測定して40pM未満の半数有効濃度(EC50)で、in vitroでCD33の細胞表面レベルを低下させる;及び/または
(iv)前記抗体は、配列番号118のアミノ酸配列を含むFc領域を含む、
請求項1~10のいずれか1項に記載の抗体。 - 請求項1~11のいずれか1項に記載の抗体の軽鎖及び重鎖をコードする核酸配列を含む、1つ以上の単離された核酸。
- 請求項12に記載の1つ以上の核酸を含む、1つ以上のベクター。
- 請求項13に記載の1つ以上のベクターを含む、単離された宿主細胞。
- CD33に結合する抗体を生成する方法であって、前記抗体が生成されるように請求項14に記載の細胞を培養することを含む、方法。
- 前記細胞によって生成された前記抗体を回収することを更に含む、請求項15に記載の方法。
- 請求項1~11のいずれか1項に記載の抗体並びに薬学的に許容される担体を含む、医薬組成物。
- 認知症、前頭側頭型認知症、アルツハイマー病、血管性認知症、混合型認知症、タウパチー病、感染症、及びがんからなる群から選択される疾患、障害、または傷害を予防し、そのリスクを低下させ、または治療する方法であって、それを必要とする個体に、治療有効量の抗体を投与することを含む方法において使用するための、請求項1~11のいずれか1項に記載の抗体。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862726053P | 2018-08-31 | 2018-08-31 | |
| US62/726,053 | 2018-08-31 | ||
| PCT/US2019/048994 WO2020047374A1 (en) | 2018-08-31 | 2019-08-30 | Anti-cd33 antibodies and methods of use thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2021534797A JP2021534797A (ja) | 2021-12-16 |
| JPWO2020047374A5 JPWO2020047374A5 (ja) | 2022-09-07 |
| JP7586813B2 true JP7586813B2 (ja) | 2024-11-19 |
Family
ID=67957407
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021511561A Active JP7586813B2 (ja) | 2018-08-31 | 2019-08-30 | 抗cd33抗体及びその使用方法 |
Country Status (22)
| Country | Link |
|---|---|
| US (2) | US12247073B2 (ja) |
| EP (1) | EP3843851A1 (ja) |
| JP (1) | JP7586813B2 (ja) |
| KR (1) | KR20210070986A (ja) |
| CN (2) | CN112912144A (ja) |
| AR (1) | AR119259A1 (ja) |
| AU (1) | AU2019331018A1 (ja) |
| BR (1) | BR112021003016A2 (ja) |
| CA (1) | CA3108808A1 (ja) |
| CL (1) | CL2021000501A1 (ja) |
| CO (1) | CO2021003078A2 (ja) |
| CR (1) | CR20210155A (ja) |
| EA (1) | EA202190235A1 (ja) |
| EC (1) | ECSP21022299A (ja) |
| IL (1) | IL281008A (ja) |
| MA (1) | MA53492A (ja) |
| MX (1) | MX2021002299A (ja) |
| PE (1) | PE20211096A1 (ja) |
| PH (1) | PH12021550332A1 (ja) |
| SG (1) | SG11202101552SA (ja) |
| TW (1) | TW202016307A (ja) |
| WO (1) | WO2020047374A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JOP20190248A1 (ar) | 2017-04-21 | 2019-10-20 | Amgen Inc | بروتينات ربط مولد ضد trem2 واستخداماته |
| CA3057447A1 (en) | 2017-08-03 | 2019-02-07 | Alector Llc | Anti-cd33 antibodies and methods of use thereof |
| BR112021003016A2 (pt) * | 2018-08-31 | 2021-05-18 | Alector Llc | anticorpos isolados, ácido nucleico isolado, vetor, célula hospedeira, métodos para produzir um anticorpo e para prevenir, reduzir o risco ou tratar uma doença e composição farmacêutica |
| BR112022011337A2 (pt) * | 2019-12-12 | 2022-08-23 | Alector Llc | Método para tratar e/ou retardar a progressão de uma doença ou lesão em um indivíduo |
| MA71661A (fr) * | 2020-10-14 | 2025-05-30 | Denali Therapeutics Inc. | Protéines de fusion comprenant des enzymes sulfoglucosamine sulfohydrolase et méthodes associées |
| WO2023081898A1 (en) | 2021-11-08 | 2023-05-11 | Alector Llc | Soluble cd33 as a biomarker for anti-cd33 efficacy |
| WO2024026318A2 (en) * | 2022-07-25 | 2024-02-01 | Rhode Island Hospital | Diagnosis, prognosis and treatment of malignant neoplasms |
| CN115724959B (zh) * | 2022-11-11 | 2023-06-20 | 杭州华葵金配生物科技有限公司 | 靶向甲型流感病毒核蛋白的抗体及其应用 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018518176A (ja) | 2015-06-12 | 2018-07-12 | アレクトル エルエルシー | 抗cd33抗体及びその使用方法 |
Family Cites Families (129)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5730A (en) | 1848-08-22 | Improvement in steam cotton-presses | ||
| US69A (en) | 1836-10-27 | Machine eor picking or breaking wool and ginned or seedless cotton | ||
| US8124A (en) | 1851-05-27 | mcfarlan | ||
| US982A (en) | 1838-10-16 | Stove fob -warming and cooking | ||
| US4657760A (en) | 1979-03-20 | 1987-04-14 | Ortho Pharmaceutical Corporation | Methods and compositions using monoclonal antibody to human T cells |
| US4469863A (en) | 1980-11-12 | 1984-09-04 | Ts O Paul O P | Nonionic nucleic acid alkyl and aryl phosphonates and processes for manufacture and use thereof |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5206344A (en) | 1985-06-26 | 1993-04-27 | Cetus Oncology Corporation | Interleukin-2 muteins and polymer conjugation thereof |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| US5567610A (en) | 1986-09-04 | 1996-10-22 | Bioinvent International Ab | Method of producing human monoclonal antibodies and kit therefor |
| ES2058199T3 (es) | 1987-09-23 | 1994-11-01 | Bristol Myers Squibb Co | Heteroconjugados de anticuerpos para la eliminacion de celulas infectadas por el vih. |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| ATE102631T1 (de) | 1988-11-11 | 1994-03-15 | Medical Res Council | Klonierung von immunglobulin sequenzen aus den variabelen domaenen. |
| US5175384A (en) | 1988-12-05 | 1992-12-29 | Genpharm International | Transgenic mice depleted in mature t-cells and methods for making transgenic mice |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| DE69029036T2 (de) | 1989-06-29 | 1997-05-22 | Medarex Inc | Bispezifische reagenzien für die aids-therapie |
| US5225212A (en) | 1989-10-20 | 1993-07-06 | Liposome Technology, Inc. | Microreservoir liposome composition and method |
| US5959177A (en) | 1989-10-27 | 1999-09-28 | The Scripps Research Institute | Transgenic plants expressing assembled secretory antibodies |
| AU659083B2 (en) | 1989-12-14 | 1995-05-11 | Sloan-Kettering Institute For Cancer Research | Therapeutic uses of the hypervariable region of monoclonal antibody M195 and constructs thereof |
| ATE139258T1 (de) | 1990-01-12 | 1996-06-15 | Cell Genesys Inc | Erzeugung xenogener antikörper |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5321131A (en) | 1990-03-08 | 1994-06-14 | Hybridon, Inc. | Site-specific functionalization of oligodeoxynucleotides for non-radioactive labelling |
| US5229275A (en) | 1990-04-26 | 1993-07-20 | Akzo N.V. | In-vitro method for producing antigen-specific human monoclonal antibodies |
| WO1992000373A1 (en) | 1990-06-29 | 1992-01-09 | Biosource Genetics Corporation | Melanin production by transformed microorganisms |
| AU8507191A (en) | 1990-08-29 | 1992-03-30 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| CA2095633C (en) | 1990-12-03 | 2003-02-04 | Lisa J. Garrard | Enrichment method for variant proteins with altered binding properties |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| EP0586505A1 (en) | 1991-05-14 | 1994-03-16 | Repligen Corporation | Heteroconjugate antibodies for treatment of hiv infection |
| US5719262A (en) | 1993-11-22 | 1998-02-17 | Buchardt, Deceased; Ole | Peptide nucleic acids having amino acid side chains |
| DK51092D0 (da) | 1991-05-24 | 1992-04-15 | Ole Buchardt | Oligonucleotid-analoge betegnet pna, monomere synthoner og fremgangsmaade til fremstilling deraf samt anvendelser deraf |
| EP0940468A1 (en) | 1991-06-14 | 1999-09-08 | Genentech, Inc. | Humanized antibody variable domain |
| GB9114948D0 (en) | 1991-07-11 | 1991-08-28 | Pfizer Ltd | Process for preparing sertraline intermediates |
| EP0604580A1 (en) | 1991-09-19 | 1994-07-06 | Genentech, Inc. | EXPRESSION IN E. COLI OF ANTIBODY FRAGMENTS HAVING AT LEAST A CYSTEINE PRESENT AS A FREE THIOL, USE FOR THE PRODUCTION OF BIFUNCTIONAL F(ab') 2? ANTIBODIES |
| US5565332A (en) | 1991-09-23 | 1996-10-15 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| FI941572A7 (fi) | 1991-10-07 | 1994-05-27 | Oncologix Inc | Anti-erbB-2-monoklonaalisten vasta-aineiden yhdistelmä ja käyttömenete lmä |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| EP0617706B1 (en) | 1991-11-25 | 2001-10-17 | Enzon, Inc. | Multivalent antigen-binding proteins |
| US5869619A (en) | 1991-12-13 | 1999-02-09 | Xoma Corporation | Modified antibody variable domains |
| ATE249840T1 (de) | 1991-12-13 | 2003-10-15 | Xoma Corp | Verfahren und materialien zur herstellung von modifizierten variablen antikörperdomänen und ihre therapeutische verwendung |
| US5700922A (en) | 1991-12-24 | 1997-12-23 | Isis Pharmaceuticals, Inc. | PNA-DNA-PNA chimeric macromolecules |
| DE69334255D1 (de) | 1992-02-06 | 2009-02-12 | Novartis Vaccines & Diagnostic | Marker für Krebs und biosynthetisches Bindeprotein dafür |
| US5714350A (en) | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| US5573905A (en) | 1992-03-30 | 1996-11-12 | The Scripps Research Institute | Encoded combinatorial chemical libraries |
| ZA932523B (en) | 1992-04-10 | 1994-10-08 | Res Dev Foundation | Immunotoxins directed against cd33 related surface antigens |
| WO1994002499A1 (en) | 1992-07-27 | 1994-02-03 | Hybridon, Inc. | Oligonucleotide alkylphosphonothioates |
| JPH08500017A (ja) | 1992-08-17 | 1996-01-09 | ジェネンテク,インコーポレイテッド | 二特異的免疫アドヘジン |
| CA2154358A1 (en) | 1993-01-21 | 1994-08-04 | Hybridon, Inc. | Integrated oligonucleotides |
| US5637684A (en) | 1994-02-23 | 1997-06-10 | Isis Pharmaceuticals, Inc. | Phosphoramidate and phosphorothioamidate oligomeric compounds |
| US5789199A (en) | 1994-11-03 | 1998-08-04 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5739277A (en) | 1995-04-14 | 1998-04-14 | Genentech Inc. | Altered polypeptides with increased half-life |
| EP0822830B1 (en) | 1995-04-27 | 2008-04-02 | Amgen Fremont Inc. | Human anti-IL-8 antibodies, derived from immunized xenomice |
| EP0823941A4 (en) | 1995-04-28 | 2001-09-19 | Abgenix Inc | HUMAN ANTIBODIES DERIVED FROM IMMUNIZED XENO MOUSES |
| US5962674A (en) | 1995-06-01 | 1999-10-05 | Hybridon, Inc. | Synthesis of oligonucleotides containing alkylphosphonate internucleoside linkages |
| US5955599A (en) | 1995-06-01 | 1999-09-21 | Hybridon, Inc. | Process for making oligonucleotides containing o- and s- methylphosphotriester internucleoside linkages |
| US5614622A (en) | 1995-06-01 | 1997-03-25 | Hybridon, Inc. | 5-pentenoyl moiety as a nucleoside-amino protecting group, 4-pentenoyl-protected nucleotide synthons, and related oligonucleotide syntheses |
| US6140482A (en) | 1995-06-01 | 2000-10-31 | Hybridon, Inc. | Primary phosphoramidate internucleoside linkages and oligonucleotides containing the same |
| US5637683A (en) | 1995-07-13 | 1997-06-10 | Cornell Research Foundation, Inc. | Nucleic acid analog with amide linkage and method of making that analog |
| US5652356A (en) | 1995-08-17 | 1997-07-29 | Hybridon, Inc. | Inverted chimeric and hybrid oligonucleotides |
| AU7378096A (en) | 1995-09-28 | 1997-04-17 | Alexion Pharmaceuticals, Inc. | Porcine cell interaction proteins |
| DE19544393A1 (de) | 1995-11-15 | 1997-05-22 | Hoechst Schering Agrevo Gmbh | Synergistische herbizide Mischungen |
| AU4089397A (en) | 1996-08-26 | 1998-03-19 | Hybridon, Inc. | Improved reagents and process for synthesis of oligonucleotides containing phosphorodithioate internucleoside linkages |
| US5886165A (en) | 1996-09-24 | 1999-03-23 | Hybridon, Inc. | Mixed backbone antisense oligonucleotides containing 2'-5'-ribonucleotide- and 3'-5'-deoxyribonucleotides segments |
| EP1500329B1 (en) | 1996-12-03 | 2012-03-21 | Amgen Fremont Inc. | Human antibodies that specifically bind human TNF alpha |
| US5739314A (en) | 1997-04-25 | 1998-04-14 | Hybridon, Inc. | Method for synthesizing 2'-O-substituted pyrimidine nucleosides |
| US6040498A (en) | 1998-08-11 | 2000-03-21 | North Caroline State University | Genetically engineered duckweed |
| US6610833B1 (en) | 1997-11-24 | 2003-08-26 | The Institute For Human Genetics And Biochemistry | Monoclonal human natural antibodies |
| BR9813365A (pt) | 1997-12-05 | 2004-06-15 | Scripps Research Inst | Método para produção e humanização de um anticorpo monoclonal de rato |
| US6506559B1 (en) | 1997-12-23 | 2003-01-14 | Carnegie Institute Of Washington | Genetic inhibition by double-stranded RNA |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| DE19956568A1 (de) | 1999-01-30 | 2000-08-17 | Roland Kreutzer | Verfahren und Medikament zur Hemmung der Expression eines vorgegebenen Gens |
| IL145496A0 (en) | 1999-03-24 | 2002-06-30 | Exiqon As | Improved synthesis of [2.2.1] bicyclo nucleosides |
| KR20010001577A (ko) | 1999-06-07 | 2001-01-05 | 윤종용 | 고분자 광산발생제를 이용한 올리고펩티드 핵산 탐침의 제조방법 |
| AU6629200A (en) | 1999-08-25 | 2001-03-19 | Philip P Garner | Alpha-helical peptide nucleic acid alpha-pna |
| US7125978B1 (en) | 1999-10-04 | 2006-10-24 | Medicago Inc. | Promoter for regulating expression of foreign genes |
| DE60022369T2 (de) | 1999-10-04 | 2006-05-18 | Medicago Inc., Sainte Foy | Verfahren zur regulation der transkription von fremden genen in gegenwart von stickstoff |
| WO2001029058A1 (en) | 1999-10-15 | 2001-04-26 | University Of Massachusetts | Rna interference pathway genes as tools for targeted genetic interference |
| GB9927444D0 (en) | 1999-11-19 | 2000-01-19 | Cancer Res Campaign Tech | Inhibiting gene expression |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| ES2405944T3 (es) | 2000-11-30 | 2013-06-04 | Medarex, Inc. | Ácidos nucleicos que codifican las secuencias de inmunoglobulina humana reorganizadas a partir de ratones transcromoscómicos transgénicos zadas |
| US6455308B1 (en) | 2001-08-01 | 2002-09-24 | Isis Pharmaceuticals, Inc. | Antisense modulation of serum amyloid A4 expression |
| US7718387B2 (en) | 2001-09-20 | 2010-05-18 | Board Of Regents, The University Of Texas System | Measuring circulating therapeutic antibody, antigen and antigen/antibody complexes using ELISA assays |
| US20030206916A1 (en) | 2002-05-03 | 2003-11-06 | Rush-Presbyterian-St. Luke's Medical Center | Immunogenic peptides |
| CA2502413A1 (en) | 2002-11-01 | 2004-05-21 | The Regents Of The University Of Colorado, A Body Corporate | Quantitative analysis of protein isoforms using matrix-assisted laser desorption/ionization time of flight mass spectrometry |
| HUE026914T2 (en) | 2002-11-07 | 2016-08-29 | Immunogen Inc | Anti-CD33 antibodies and a method of treating acute myeloid leukemia |
| MXPA06011199A (es) | 2004-03-31 | 2007-04-16 | Genentech Inc | Anticuerpos anti-tgf-beta humanizados. |
| MX2007008017A (es) | 2004-12-31 | 2007-09-12 | Genentech Inc | Polipeptidos que se ligan a br3 y usos de los mismos. |
| EP1851245B1 (en) | 2005-01-26 | 2012-10-10 | Amgen Fremont Inc. | Antibodies against interleukin-1 beta |
| US7700099B2 (en) | 2005-02-14 | 2010-04-20 | Merck & Co., Inc. | Non-immunostimulatory antibody and compositions containing the same |
| TW200726776A (en) | 2005-07-29 | 2007-07-16 | Friedrich Alexander University Of Erlangen Nuremberg | CD33-specific single-chain immunotoxin and methods of use |
| US7420041B2 (en) | 2006-02-24 | 2008-09-02 | Arius Research Inc. | Cytotoxicity mediation of cells evidencing surface expression of TROP-2 |
| HUE066795T2 (hu) | 2006-03-15 | 2024-09-28 | Alexion Pharma Inc | Paroxysmalis nocturnalis haemoglobinuriában szenvedõ betegek kezelése egy komplement inhibitorral |
| AR060871A1 (es) | 2006-05-09 | 2008-07-16 | Genentech Inc | Union de polipeptidos con supercontigos optimizados |
| WO2008058021A2 (en) | 2006-11-02 | 2008-05-15 | Seattle Genetics, Inc. | Methods of treating neoplastic, autoimmune and inflammatory diseases |
| UY30776A1 (es) | 2006-12-21 | 2008-07-03 | Medarex Inc | Anticuerpos cd44 |
| CN100592373C (zh) | 2007-05-25 | 2010-02-24 | 群康科技(深圳)有限公司 | 液晶显示面板驱动装置及其驱动方法 |
| CA3187687A1 (en) | 2007-09-14 | 2009-03-19 | Adimab, Llc | Rationally designed, synthetic antibody libraries and uses therefor |
| US8877688B2 (en) | 2007-09-14 | 2014-11-04 | Adimab, Llc | Rationally designed, synthetic antibody libraries and uses therefor |
| FR2945538B1 (fr) | 2009-05-12 | 2014-12-26 | Sanofi Aventis | Anticorps humanises specifiques de la forme protofibrillaire du peptide beta-amyloide. |
| DE102009045006A1 (de) | 2009-09-25 | 2011-04-14 | Technische Universität Dresden | Anti-CD33 Antikörper und ihre Anwendung zum Immunotargeting bei der Behandlung von CD33-assoziierten Erkrankungen |
| EP3187877A1 (en) | 2009-09-25 | 2017-07-05 | XOMA Technology Ltd. | Screening methods |
| EP3336225B1 (en) | 2010-07-16 | 2020-02-19 | Adimab, LLC | Antibody libraries |
| UA112062C2 (uk) | 2010-10-04 | 2016-07-25 | Бьорінгер Інгельхайм Інтернаціональ Гмбх | Cd33-зв'язувальний агент |
| WO2012074097A1 (ja) | 2010-12-03 | 2012-06-07 | 協和発酵キリン株式会社 | 抗cd33抗体 |
| US20130309223A1 (en) | 2012-05-18 | 2013-11-21 | Seattle Genetics, Inc. | CD33 Antibodies And Use Of Same To Treat Cancer |
| CN102952191B (zh) | 2012-09-17 | 2014-05-14 | 浙江大学 | 全人源抗cd33单链抗体zjl101及其应用 |
| EP2978446B1 (en) | 2013-03-27 | 2020-03-04 | The General Hospital Corporation | Anti-cd33 antibody for use in treating alzheimer's disease |
| AU2014362238A1 (en) | 2013-12-13 | 2016-06-09 | Genentech, Inc. | Anti-CD33 antibodies and immunoconjugates |
| AR101669A1 (es) | 2014-07-31 | 2017-01-04 | Amgen Res Munich Gmbh | Constructos de anticuerpos para cdh19 y cd3 |
| US20170313770A1 (en) * | 2014-10-01 | 2017-11-02 | Order-Made Medical Research Inc. | Reagents for detecting or diagnosing cancer cells having high invasive capacity |
| EP3227340B1 (en) | 2014-12-04 | 2020-06-17 | Mediterranea Theranostic S.R.L. | Humanized anti-trop-2 monoclonal antibodies and uses thereof |
| WO2016201389A2 (en) | 2015-06-12 | 2016-12-15 | Alector Llc | Anti-cd33 antibodies and methods of use thereof |
| CA3057447A1 (en) | 2017-08-03 | 2019-02-07 | Alector Llc | Anti-cd33 antibodies and methods of use thereof |
| JOP20190116A1 (ar) | 2018-05-24 | 2019-11-24 | Janssen Biotech Inc | الأجسام المضادة لتكتل التمايز 33 (cd33)، والأجسام المضادة ثنائية النوعية لتكتل التمايز 33 (cd33)/تكتل التمايز 3 (cd3) واستخداماتها |
| BR112021003016A2 (pt) | 2018-08-31 | 2021-05-18 | Alector Llc | anticorpos isolados, ácido nucleico isolado, vetor, célula hospedeira, métodos para produzir um anticorpo e para prevenir, reduzir o risco ou tratar uma doença e composição farmacêutica |
| WO2020047452A2 (en) | 2018-08-31 | 2020-03-05 | Novartis Ag | Methods of making chimeric antigen receptor-expressing cells |
| BR112022011337A2 (pt) | 2019-12-12 | 2022-08-23 | Alector Llc | Método para tratar e/ou retardar a progressão de uma doença ou lesão em um indivíduo |
-
2019
- 2019-08-30 BR BR112021003016-6A patent/BR112021003016A2/pt not_active Application Discontinuation
- 2019-08-30 CN CN201980070570.9A patent/CN112912144A/zh active Pending
- 2019-08-30 CN CN202110955735.XA patent/CN113801229B/zh active Active
- 2019-08-30 JP JP2021511561A patent/JP7586813B2/ja active Active
- 2019-08-30 MA MA053492A patent/MA53492A/fr unknown
- 2019-08-30 PE PE2021000264A patent/PE20211096A1/es unknown
- 2019-08-30 TW TW108131323A patent/TW202016307A/zh unknown
- 2019-08-30 US US17/272,083 patent/US12247073B2/en active Active
- 2019-08-30 AR ARP190102478A patent/AR119259A1/es not_active Application Discontinuation
- 2019-08-30 SG SG11202101552SA patent/SG11202101552SA/en unknown
- 2019-08-30 KR KR1020217009223A patent/KR20210070986A/ko not_active Ceased
- 2019-08-30 EA EA202190235A patent/EA202190235A1/ru unknown
- 2019-08-30 WO PCT/US2019/048994 patent/WO2020047374A1/en not_active Ceased
- 2019-08-30 CR CR20210155A patent/CR20210155A/es unknown
- 2019-08-30 EP EP19769302.1A patent/EP3843851A1/en active Pending
- 2019-08-30 AU AU2019331018A patent/AU2019331018A1/en not_active Abandoned
- 2019-08-30 MX MX2021002299A patent/MX2021002299A/es unknown
- 2019-08-30 CA CA3108808A patent/CA3108808A1/en active Pending
-
2021
- 2021-02-16 PH PH12021550332A patent/PH12021550332A1/en unknown
- 2021-02-21 IL IL281008A patent/IL281008A/en unknown
- 2021-02-26 CL CL2021000501A patent/CL2021000501A1/es unknown
- 2021-03-09 CO CONC2021/0003078A patent/CO2021003078A2/es unknown
- 2021-03-30 EC ECSENADI202122299A patent/ECSP21022299A/es unknown
-
2025
- 2025-02-06 US US19/047,214 patent/US20250270319A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018518176A (ja) | 2015-06-12 | 2018-07-12 | アレクトル エルエルシー | 抗cd33抗体及びその使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2020047374A1 (en) | 2020-03-05 |
| MX2021002299A (es) | 2021-04-28 |
| EP3843851A1 (en) | 2021-07-07 |
| CA3108808A1 (en) | 2020-03-05 |
| CN113801229B (zh) | 2024-11-26 |
| CO2021003078A2 (es) | 2021-03-19 |
| US20210317208A1 (en) | 2021-10-14 |
| CN113801229A (zh) | 2021-12-17 |
| CL2021000501A1 (es) | 2021-07-23 |
| US12247073B2 (en) | 2025-03-11 |
| US20250270319A1 (en) | 2025-08-28 |
| AR119259A1 (es) | 2021-12-09 |
| AU2019331018A1 (en) | 2021-03-11 |
| PH12021550332A1 (en) | 2021-10-04 |
| SG11202101552SA (en) | 2021-03-30 |
| IL281008A (en) | 2021-04-29 |
| CN112912144A (zh) | 2021-06-04 |
| BR112021003016A2 (pt) | 2021-05-18 |
| KR20210070986A (ko) | 2021-06-15 |
| EA202190235A1 (ru) | 2021-07-02 |
| JP2021534797A (ja) | 2021-12-16 |
| CR20210155A (es) | 2021-05-10 |
| ECSP21022299A (es) | 2021-04-29 |
| MA53492A (fr) | 2021-09-15 |
| PE20211096A1 (es) | 2021-06-14 |
| TW202016307A (zh) | 2020-05-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220162309A1 (en) | Anti-cd33 antibodies and methods of use thereof | |
| TWI868807B (zh) | 抗trem2抗體及其使用方法 | |
| JP7586813B2 (ja) | 抗cd33抗体及びその使用方法 | |
| JP7535495B2 (ja) | 抗Siglec-5抗体及びその使用方法 | |
| US20230035072A1 (en) | Methods of use of anti-cd33 antibodies | |
| JP7382970B2 (ja) | 抗Siglec-7抗体及びその使用方法 | |
| HK40059921A (zh) | 抗cd33抗体及其使用方法 | |
| HK40048108A (en) | Anti-cd33 antibodies and methods of use thereof | |
| HK40079770A (en) | Methods of use of anti-cd33 antibodies | |
| HK40047633A (en) | Anti-siglec-7 antibodies and methods of use thereof | |
| HK40019909B (zh) | 抗cd33抗体及其使用方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220830 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220830 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230801 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230922 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240312 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240610 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241015 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241107 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7586813 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |