JP7584577B2 - ヒトcgrp受容体結合タンパク質 - Google Patents
ヒトcgrp受容体結合タンパク質 Download PDFInfo
- Publication number
- JP7584577B2 JP7584577B2 JP2023101810A JP2023101810A JP7584577B2 JP 7584577 B2 JP7584577 B2 JP 7584577B2 JP 2023101810 A JP2023101810 A JP 2023101810A JP 2023101810 A JP2023101810 A JP 2023101810A JP 7584577 B2 JP7584577 B2 JP 7584577B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- sequence
- group
- amino acid
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2869—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against hormone receptors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/32—Immunoglobulins specific features characterized by aspects of specificity or valency specific for a neo-epitope on a complex, e.g. antibody-antigen or ligand-receptor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
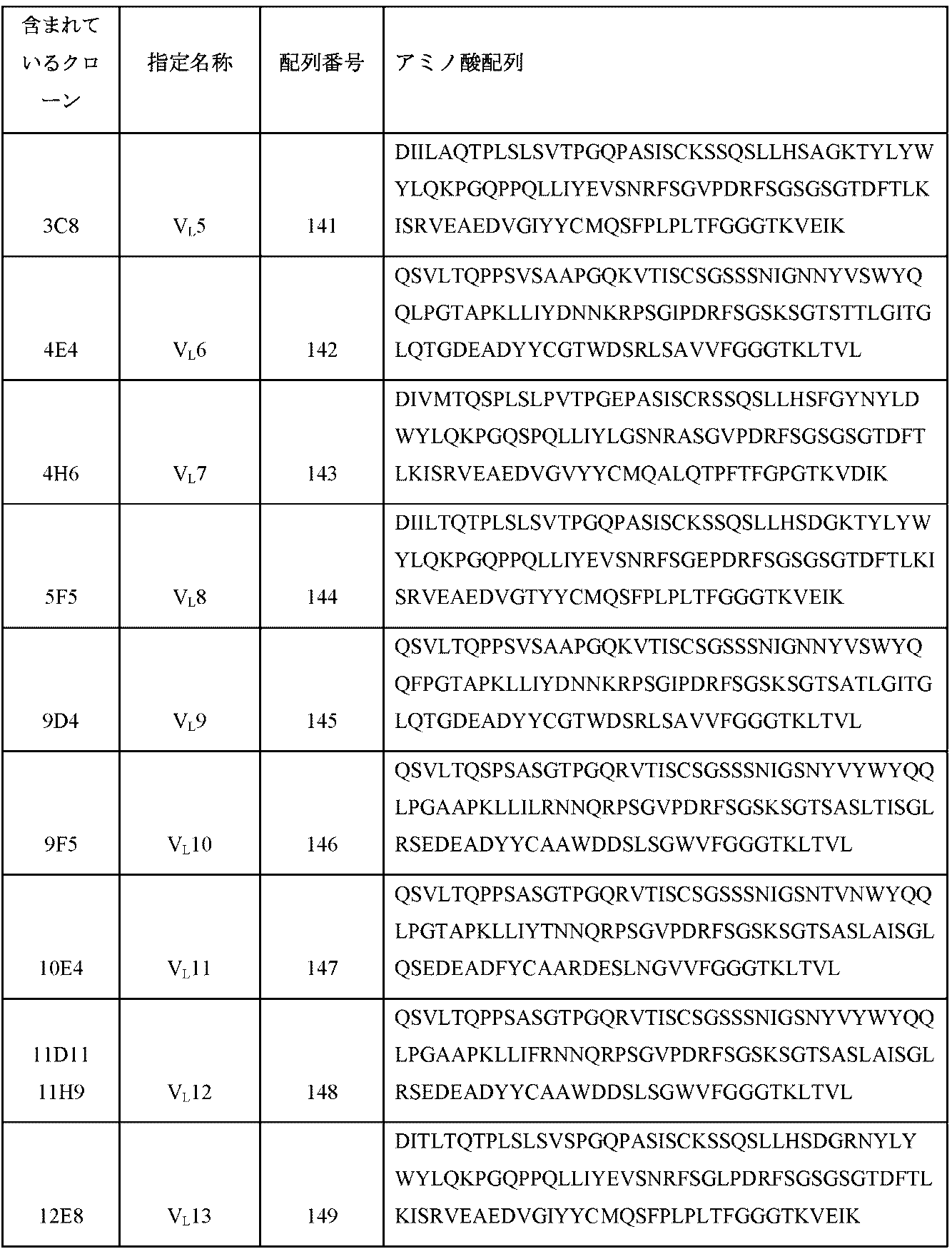
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
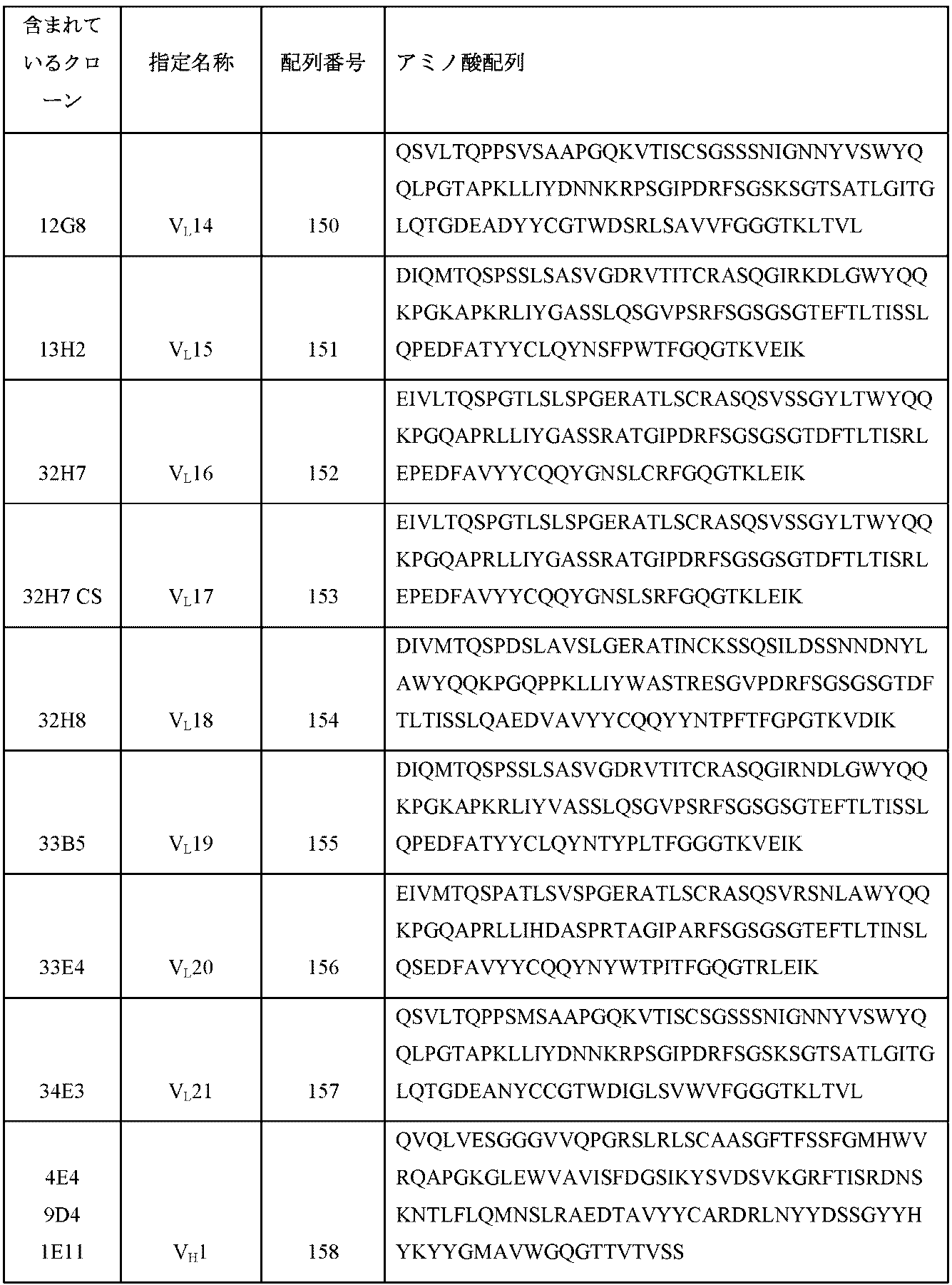
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Endocrinology (AREA)
- Biochemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Microbiology (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Diabetes (AREA)
- General Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Emergency Medicine (AREA)
- Physics & Mathematics (AREA)
- Rheumatology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Cardiology (AREA)
Description
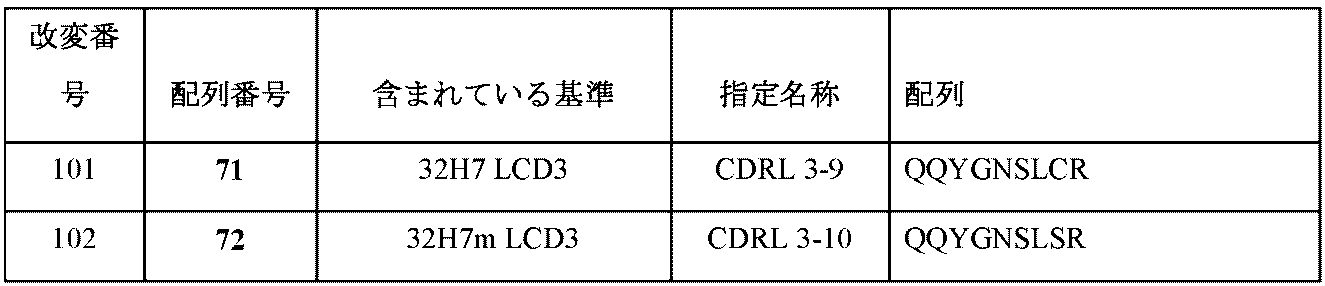
CDR1 RASQGIRX1DLG(配列番号103)、式中、X1は、NおよびKから成る群から選択される。
CDR2 X1ASSLQS(配列番号104)、式中、X1は、AおよびGから成る群から選択される。
CDR3 LQYNX1X2PWT(配列番号105)、式中、X1は、IおよびSから成る群から選択され、X2は、YおよびFから成る群から選択される。
K4コンセンサス
CDR3 QQYGNSLX1R(配列番号106)、式中、X1は、SおよびCから成る群から選択される。
K1,4コンセンサス
CDR1 RASQX1X2X3X4GX5LX6(配列番号107)、式中、X1は、SおよびGから成る群から選択され、X2は、VおよびIから成る群から選択され、X3は、SおよびRから成る群から選択され、X4は、S、NおよびKから成る群から選択され、X5は、YおよびDから成る群から選択され、X6は、TおよびGから成る群から選択される。
CDR2 X1ASSX2X3X4(配列番号108)、式中、X1は、GおよびAから成る群から選択され、X2は、RおよびLから成る群から選択され、X3は、AおよびQから成る群から選択され、X4は、TおよびSから成る群から選択される。
CDR3 X1QYX2X3X4X5X6X7(配列番号109)、式中、X1は、QおよびLから成る群から選択され、X2は、GおよびNから成る群から選択され、X3は、NおよびTから成る群から選択され、X4は、S、YおよびFから成る群から選択され、X5は、LおよびPから成る群から選択され、X6は、C、W、およびSから成る群から選択され、X7は、RおよびTから成る群から選択される。
K3コンセンサス
CDR1 KSSQSLLHSX1GX2X3YLY(配列番号110)、式中、X1は、DおよびAから成る群から選択され、X2は、RおよびKから成る群から選択され、X3は、NおよびTから成る群から選択される。
K2,3コンセンサス
CDR1 X1SSQSLLHSX2GX3X4YLX5(配列番号111)、式中、X1は、RおよびKから成る群から選択され、X2は、F、D、およびAから成る群から選択され、X3は、Y、R、およびKから成る群から選択され、X4は、NおよびTから成る群から選択され、X5は、DおよびYから成る群から選択される。
CDR2 X1X2SNRX3S(配列番号112)、式中、X1は、LおよびEから成る群から選択され、X2は、GおよびVから成る群から選択され、X3は、AおよびFから成る群から選択される。
CDR3 MQX1X2X3X4PX5T(配列番号113)、式中、X1は、AおよびSから成る群から選択され、X2は、LおよびFから成る群から選択され、X3は、QおよびPから成る群から選択され、X4は、TおよびLから成る群から選択され、X5は、FおよびLから成る群から選択される。
Lm3コンセンサス
CDR2 RX1NQRPS(配列番号114)、式中、X1は、NおよびSから成る群から選択される。
Lm1,2,3コンセンサス
CDR1 SGSSSNIGX1NX2VX3(配列番号115)、式中、X1は、NおよびSから成る群から選択され、X2は、YおよびTから成る群から選択され、X3は、S、N、およびYから成る群から選択される。
CDR2 X1X2NX3RPS(配列番号116)、式中、X1は、D、T、およびRから成る群から選択され、X2は、NおよびSから成る群から選択され、X3は、KおよびQから成る群から選択される。
CDR3 X1X2X3DX4X5LX6X7VV(配列番号117)、式中、X1は、GおよびAから成る群から選択され、X2は、TおよびAから成る群から選択され、X3は、WおよびRから成る群から選択され、X4は、SおよびDから成る群から選択され、X5は、RおよびSから成る群から選択され、X6は、SおよびNから成る群から選択され、X7は、AおよびGから成る群から選択される。
LmAllコンセンサス
CDR1 X1GX2X3SX4X5X6X7X8X9X10X11(配列番号118)、式中、X1は、SおよびQから成る群から選択され、X2は、存在または不在であって、存在する場合はSであり、X3は、SおよびDから成る群から選択され、X4は、存在または不在であって、存在する場合はNであり、X5は、IおよびLから成る群から選択され、X6は、GおよびRから成る群から選択され、X7は、NおよびSから成る群から選択され、X8は、NおよびFから成る群から選択され、X9は、YおよびTから成る群から選択され、X10は、VおよびAから成る群から選択され、X11は、S、N、およびYから成る群から選択される。
CDR2 X1X2NX3RPS(配列番号119)、式中、X1は、D、G、T、およびRから成る群から選択され、X2は、N、K、およびSから成る群から選択され、X3は、K、N、およびQから成る群から選択される。
CDR3 X1X2X3DX4X5X6X7X8X9V(配列番号120)、式中、X1は、G、N、およびAから成る群から選択され、X2は、T、S、およびAから成る群から選択され、X3は、WおよびRから成る群から選択され、X4は、SおよびDから成る群から選択され、X5は、RおよびSから成る群から選択され、X6は、LおよびVから成る群から選択され、X7は、S、Y、およびNから成る群から選択され、X8は、A、H、およびGから成る群から選択され、X9は、VおよびLから成る群から選択される。
HC1コンセンサス
CDR1 X1YYMX2(配列番号121)、式中、X1は、GおよびDから成る群から選択され、X2は、HおよびYから成る群から選択される。
CDR2 WIX1PNSGGTNYAQKFQG(配列番号122)、式中、X1は、NおよびSから成る群から選択される。
CDR3 X1X2X3SX4X5X6X7X8GX9X10X11X12YYX13GMDV(配列番号123)、式中、X1は、DおよびGから成る群から選択され、X2は、QおよびGから成る群から選択され、X3は、MおよびYから成る群から選択され、X4は、IおよびGから成る群から選択され、X5は、IおよびYから成る群から選択され、X6は、MおよびAから成る群から選択され、X7は、存在または不在であって、存在する場合はLであり、X8は、存在または不在であって、存在する場合はRであり、X9は、VおよびLから成る群から選択され、X10は、FおよびYから成る群から選択され、X11は、PおよびSから成る群から選択され、X12は、PおよびHから成る群から選択され、X13は、存在または不在であって、存在する場合はYである。
HC2コンセンサス
CDR2 RIKSX1TDGGTTDYX2APVKG(配列番号124)、式中、X1は、KおよびTから成る群から選択され、X2は、TおよびAから成る群から選択される。
HC3コンセンサス
CDR1 X1YX2MX3(配列番号125)、式中、X1は、TおよびSから成る群から選択され、X2は、SおよびAから成る群から選択され、X3は、NおよびSから成る群から選択される。
CDR2 X1ISX2SX3X4X5X6YYADSVKG(配列番号126)、式中、X1は、SおよびAから成る群から選択され、X2は、SおよびGから成る群から選択され、X3は、SおよびGから成る群から選択され、X4は、SおよびGから成る群から選択され、X5は、YおよびRから成る群から選択され、X6は、RおよびTから成る群から選択される。
CDR3 X1X2X3X4X5X6X7PYSX8X9WYDYYYGMDV(配列番号127)、式中、X1は、EおよびDから成る群から選択され、X2は、GおよびQから成る群から選択され、X3は、VおよびRから成る群から選択され、X4は、SおよびEから成る群から選択され、X5は、GおよびVから成る群から選択され、X6は、SおよびGから成る群から選択され、X7は、存在または不在であり、存在する場合はSであり、X8は、IおよびSから成る群から選択され、X9は、SおよびGから成る群から選択される。
HC4コンセンサス
CDR1 SX1GMH(配列番号128)、式中、X1は、FおよびYから成る群から選択される。
CDR2 VISX1DGSX2KYX3X4DSVKG(配列番号129)、式中、X1は、FおよびYから成る群から選択され、X2は、IおよびHから成る群から選択され、X3は、SおよびYから成る群から選択され、X4は、VおよびAから成る群から選択される。
CDR3 X1RX2X3X4X5X6SX7X8YYX9X10X11YYGX12X13V(配列番号130)、式中、X1は、DおよびEから成る群から選択され、X2は、LおよびKから成る群から選択され、X3は、NおよびRから成る群から選択され、X4は、YおよびVから成る群から選択され、X5は、YおよびTから成る群から選択され、X6は、DおよびMから成る群から選択され、X7は、SおよびTから成る群から選択され、X8は、GおよびLから成る群から選択され、X9は、HおよびYから成る群から選択され、X10は、存在または不在であって、存在する場合はYであり、X11は、KおよびFから成る群から選択され、X12は、MおよびLから成る群から選択され、X13は、AおよびDから成る群から選択される。
HCAコンセンサス
CDR1 X1X2X3MX4(配列番号131)、式中、X1は、NおよびSから成る群から選択され、X2は、A、Y、およびFから成る群から選択され、X3は、W、A、およびGから成る群から選択され、X4は、SおよびHから成る群から選択される。
CDR2 X1IX2X3X4X5X6GX7X8X9X10X11X12X13X14VKG(配列番号132)、式中、X1は、R、A、およびVから成る群から選択され、X2は、K、S、およびWから成る群から選択され、X3は、S、G、F、およびYから成る群から選択され、X4は、存在または不在であって、存在する場合は、KおよびTから成る群から選択され、X5は、存在または不在であって、存在する場合はTであり、X6は、DおよびSから成る群から選択され、X7は、GおよびSから成る群から選択され、X8は、T、R、I、N、およびHから成る群から選択され、X9は、TおよびKから成る群から選択され、X10は、DおよびYから成る群から選択され、X11は、YおよびSから成る群から選択され、X12は、T、A、およびVから成る群から選択され、X13は、AおよびDから成る群から選択され、X14は、PおよびSから成る群から選択される。
CDR3 X1X2X3X4X5X6X7X8X9X10X11X12X13X14X15X16X17GX18X19V(配列番号133)、式中、X1は、D、A、およびEから成る群から選択され、X2は、R、Q、およびGから成る群から選択され、X3は、T、R、L、G、およびKから成る群から選択され、X4は、G、E、N、I、およびRから成る群から選択され、X5は、Y、V、およびAから成る群から選択され、X6は、S、G、Y、AおよびTから成る群から選択され、X7は、I、P、D、AおよびMから成る群から選択され、X8は、存在または不在であって、存在する場合は、SおよびYから成る群から選択され、X9は、存在または不在であって、存在する場合は、W、S、およびTから成る群から選択され、X10は、S、G、およびLから成る群から選択され、X11は、S、G、L、およびYから成る群から選択され、X12は、存在または不在であって、存在する場合は、WおよびYから成る群から選択され、X13は、YおよびHから成る群から選択され、X14は、存在または不在であって、存在する場合は、YおよびDから成る群から選択され、X15は、Y、KおよびFから成る群から選択され、X16は、存在または不在であって、存在する場合はYであり、X17は、存在または不在であって、存在する場合はYであり、X18は、MおよびLから成る群から選択され、X19は、DおよびAから成る群から選択される。
HCBコンセンサス
CDR1 X1X2X3X4X5(配列番号134)、式中、X1は、N、G、D、S、およびAから成る群から選択され、X2は、A、F、およびYから成る群から選択され、X3は、W、Y、A、およびGから成る群から選択され、X4は、MおよびLから成る群から選択され、X5は、SおよびHから成る群から選択される。
CDR2 X1IX2X3X4X5X6X7X8X9X10X11X12X13X14X15X16X17G(配列番号135)、式中、X1は、R、W、A、V、SおよびFから成る群から選択され、X2は、K、N、S、W、およびRから成る群から選択され、X3は、S、P、G、F、およびYから成る群から選択され、X4は、存在または不在であって、存在する場合、K、T、およびRから成る群から選択され、X5は、存在または不在であって、存在する場合、TおよびAから成る群から選択され、X6は、D、N、H、S、およびYから成る群から選択され、X7は、GおよびSから成る群から選択され、X8は、GおよびSから成る群から選択され、X9は、T、G、R、I、N、H、およびYから成る群から選択され、X10は、T、K、R、およびPから成る群から選択され、X11は、D、N、Y、およびEから成る群から選択され、X12は、YおよびSから成る群から選択され、X13は、T、A、およびVから成る群から選択され、X14は、A、Q、およびDから成る群から選択され、X15は、P、K、およびSから成る群から選択され、X16は、VおよびFから成る群から選択され、X17は、KおよびQから成る群から選択される。
CDR3 X1X2X3X4X5SX6X7X8X9X10X11X12X13X14X15X16GX17X18V(配列番号136)、式中、X1は、D、G、A、およびEから成る群から選択され、X2は、R、G、およびQから成る群から選択され、X3は、T、M、Y、R、L、G、およびKから成る群から選択され、X4は、G、S、E、N、IおよびRから成る群から選択され、X5は、Y、I、G、V、およびAから成る群から選択され、X6は、S、I、Y、G、AおよびTから成る群から選択され、X7は、I、M、A、PおよびDから成る群から選択され、X8は、存在または不在であって、存在する場合は、S、L、およびYから成る群から選択され、X9は、存在または不在であって、存在する場合は、W、R、S、およびTから成る群から選択され、X10は、S、G、およびLから成る群から選択され、X11は、S、V、L、G、およびYから成る群から選択され、X12は、存在または不在であって、存在する場合、F、Y、およびWから成る群から選択され、X13は、Y、P、S、およびHから成る群から選択され、X14は、存在または不在であって、存在する場合は、Y、P、D、およびHから成る群から選択され、X15は、Y、K、およびFから成る群から選択され、X16は、存在または不在であって、存在する場合はYであり、X17は、存在または不在であって、存在する場合はYであり、X18は、MおよびLから成る群から選択される。
本発明の好ましい実施形態では、例えば以下が提供される:
(項目1)
単離抗原結合タンパク質であって、ヒトCGRP受容体を選択的に阻害する、単離抗原結合タンパク質。
(項目2)
前記単離抗原結合タンパク質は、前記ヒトCGRP受容体を、100以上の選択率で選択的に阻害する、項目1に記載の単離抗原結合タンパク質。
(項目3)
前記単離抗原結合タンパク質は、前記ヒトCGRP受容体を、500以上の選択率で選択的に阻害する、項目2に記載の単離抗原結合タンパク質。
(項目4)
前記単離抗原結合タンパク質は、100nM以下のKDで、ヒトCGRPに特異的に結合する、項目1に記載の単離抗原結合タンパク質。
(項目5)
前記単離抗原結合タンパク質は、FACS結合検定を使用して決定して、10nM以下のKDで、ヒトCGRPに特異的に結合する、項目4に記載の単離抗原結合タンパク質。
(項目6)
前記単離抗原結合タンパク質は、CGRP結合競合検定において、10nM未満のKiを有する、項目1に記載の単離抗原結合タンパク質。
(項目7)
前記単離抗原結合タンパク質は、ヒトCGRP Rを発現する細胞からの膜に対する放射性標識125I-CGRP結合競合検定において、1nM未満のKiを有する、項目6に記載の単離抗原結合タンパク質。
(項目8)
前記単離抗原結合タンパク質は、ヒトCGRP Rへの結合に対して基準抗体と競合し、前記基準抗体は、(i)配列番号161、163、164、166、および168から成る群から選択される配列を含む重鎖可変領域と、(ii)配列番号140、143、146、148、および150から成る群から選択される配列を含む軽鎖可変領域と、を含む、項目1に記載の単離抗原結合タンパク質。
(項目9)
前記基準抗体は、(i)配列番号32、34、35、37、および39から成る群から選択される配列によって定義される重鎖と、(ii)配列番号15、18、21、23、および25から成る群から選択される配列によって定義される軽鎖と、を含む、項目8に記載の単離抗原結合タンパク質。
(項目10)
前記基準抗体は、以下の配列対のうちの1つによって定義される、重鎖および軽鎖を含む、項目9に記載の単離抗原結合タンパク質:
配列番号32および配列番号15、
配列番号34および配列番号18、
配列番号35および配列番号21、
配列番号37および配列番号23、ならびに
配列番号39および配列番号25。
(項目11)
(A)(i)配列番号134を有するCDRH1と、(ii)配列番号135を有するCDRH2と、(iii)配列番号136を有するCDRH3と、(iv)1つ、2つ、3つ、または4つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、または(iii)のCDRHとから成る群から選択される、1つまたは複数の重鎖相補性決定領域(CDRH)、
(B)(i)配列番号107、111、および118から成る群から選択されるCDRL1と、(ii)配列番号108、112、および119から成る群から選択されるCDRL2と、(iii)配列番号109、113、および120から成る群から選択されるCDRL3と、任意で(iv)1つ、2つ、3つ、または4つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、および(iii)のCDRLとから成る群から選択される、1つまたは複数の軽鎖相補性決定領域(CDRL)、
または(C)(A)の1つまたは複数の重鎖CDRHおよび(B)の1つまたは複数の重鎖CDRL、
を含む、単離抗原結合タンパク質。
(項目12)
前記CDRHは、(i)配列番号131を有するCDRH1と、(ii)配列番号132を有するCDRH2と、(iii)配列番号133を有するCDRH3と、(iv)1つ、2つ、または3つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、および(iii)のCDRHとから成る群からさらに選択される、項目11に記載の単離抗原結合タンパク質。
(項目13)
前記CDRHは、(i)配列番号76、88、100、121、125、および128から成る群から選択されるCDRH1と、(ii)配列番号89、101、122、124、126、および129から成る群から選択されるCDRH2と、(iii)配列番号78、90、102、123、127、および130から成る群から選択されるCDRH3と、(iv)1つ、2つ、または3つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、および(iii)のCDRHとから成る群からさらに選択される、項目12に記載の単離抗原結合タンパク質。
(項目14)
前記CDRHは、(i)配列番号73、76、79、82、85、88、92、97、および100から成る群から選択されるCDRH1と、(ii)配列番号74、77、80、83、86、89、91、93、95、98、101、および129から成る群から選択されるCDRH2と、(iii)配列番号75、78、81、84、87、90、96、99、102、および123から成る群から選択されるCDRH3と、(iv)1つ、2つ、または3つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、および(iii)のCDRHとから成る群からさらに選択される、項目13に記載の単離抗原結合タンパク質。
(項目15)
前記CDRLは、(i)配列番号107、111、および115から成る群から選択されるCDRL1と、(ii)配列番号108、112および116から成る群から選択されるCDRL2と、(iii)配列番号109、113および117から成る群から選択されるCDRL3と、(iv)1つ、2つ、3つ、または4つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、および(iii)のCDRLとから成る群からさらに選択される、項目11に記載の単離抗原結合タンパク質。
(項目16)
前記CDRLは、(i)配列番号42、45、51、57、62、69、103、および110から成る群から選択されるCDRL1と、(ii)配列番号43、52、55、58、63、70、104、108、および114から成る群から選択されるCDRL2と、(iii)配列番号44、47、53、56、59、64、105、および106から成る群から選択されるCDRL3と、(iv)1つ、2つ、または3つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、および(iii)のCDRLとから成る群からさらに選択される、項目15に記載の単離抗原結合タンパク質。
(項目17)
前記CDRLは、(i)配列番号42、45、48、51、54、57、62、65、66、および69から成る群から選択されるCDRL1と、(ii)配列番号43、46、49、52、55、58、61、63、67、および70から成る群から選択されるCDRL2と、(iii)配列番号44、47、50、53、56、59、64、68、71、および72から成る群から選択されるCDRL3と、(iv)1つ、2つ、または3つのアミノ酸置換、欠失、または挿入を含む(i)、(ii)、および(iii)のCDRLとから成る群からさらに選択される、項目16に記載の単離抗原結合タンパク質。
(項目18)
前記単離抗原結合タンパク質は、少なくとも1つのCDRHおよび少なくとも1つのCDRLを含む、項目11~17のうちのいずれかに記載の単離抗原結合タンパク質。
(項目19)
前記単離抗原結合タンパク質は、少なくとも2つのCDRHおよび少なくとも2つのCDRLを含む、項目18に記載の単離抗原結合タンパク質。
(項目20)
前記単離抗原結合タンパク質は、CDRH1、CDRH2、CDRH3、CDRL1、CDRL2、およびCDRL3を含む、項目11~19のうちのいずれかに記載の単離抗原結合タンパク質。
(項目21)
配列番号158~170から成る群から選択されるアミノ酸配列と少なくとも90%の配列同一性を有する、重鎖可変領域(VH)配列を含む、単離抗原結合タンパク質。
(項目22)
配列番号137~153から成る群から選択されるアミノ酸配列と少なくとも90%の配列同一性を有する、軽鎖可変領域(VL)配列を含む、単離抗原結合タンパク質。
(項目23)
配列番号158、159、および162~172から成る群から選択されるアミノ酸配列と少なくとも90%の配列同一性を有するVH配列と、配列番号137、138、140~145、148~151、および153~157から成る群から選択されるアミノ酸配列と少なくとも90%の配列同一性を有するVL配列と、を含む、単離抗原結合タンパク質。
(項目24)
前記単離抗原結合タンパク質は、モノクローナル抗体、Fab断片、Fab’断片、F(ab’)2断片、Fv断片、二重特異性抗体、および単鎖抗体から成る群から選択される、項目1~23のうちのいずれかに記載の単離抗原結合タンパク質。
(項目25)
前記単離抗原結合タンパク質は、完全なヒト抗体、ヒト化抗体、およびキメラ抗体から成る群から選択される、モノクローナル抗体である、項目24に記載の単離抗原結合タンパク質。
(項目26)
前記モノクローナル抗体は、IgG1型、IgG2型、IgG3型、またはIgG4型抗体である、項目25に記載の単離抗原結合タンパク質。
(項目27)
前記モノクローナル抗体は、IgG1またはIgG2抗体である、項目26に記載の単離抗原結合タンパク質。
(項目28)
項目1~27のうちのいずれかに記載の抗原結合タンパク質をコードする、単離核酸ポリヌクレオチド。
(項目29)
前記ポリヌクレオチドは、配列番号175、176、178、179、180、181、182、183、186、187、188、189、191、192、193、194、195、196、197、200、201、202、203、204、205、206、207、208、209、および210から成る群から選択される配列と80%以上同一である配列を含む、項目28に記載の単離核酸ポリヌクレオチド。
(項目30)
前記ポリヌクレオチドは、配列番号224~258から成る群から選択される配列と80%以上同一である配列を含む、項目28に記載の単離核酸ポリヌクレオチド。
(項目31)
前記ポリヌクレオチドは、配列番号224~258から成る群から選択される配列と、ストリンジェントなハイブリダイゼーション条件下でハイブリッド形成可能な配列を含む、項目28に記載の単離核酸ポリヌクレオチド。
(項目32)
項目28~31のうちのいずれかに記載の単離ポリヌクレオチドを含む、発現ベクター。
(項目33)
項目32に記載の発現ベクターで形質転換された、細胞株。
(項目34)
前記抗原結合タンパク質を分泌する宿主細胞から前記抗原結合タンパク質を調製することを含む、項目1~27のうちのいずれかに記載の抗原結合タンパク質を形成する方法。
(項目35)
前記抗原結合タンパク質は、可溶性CGRP受容体を含む免疫原を使用して生成される、項目34に記載の方法。
(項目36)
前記可溶性CGRP受容体は、ヒトCRLRおよびヒトRMAP1のN末端細胞外ドメイン(ECD)を共発現および精製することによって得られる、項目35に記載の方法。
(項目37)
前記ヒトCRLRのECDは、配列番号6を含み、前記RAMP1のECDは、配列番号8を含む、項目36に記載の方法。
(項目38)
項目1~27のうちのいずれかに記載の抗原結合タンパク質および薬学的に許容される賦形剤を含む、薬学的組成物。
(項目39)
患者において、CGRP Rと関連付けられる状態を治療するための方法であって、項目1~27のうちのいずれかに記載の有効量の単離抗原結合タンパク質を患者に投与することを含む、方法。
(項目40)
前記状態は頭痛である、項目39に記載の方法。
(項目41)
前記状態は片頭痛である、項目40に記載の方法。
(項目42)
前記方法は、予防的処置を含む、項目39~41のうちのいずれかに記載の方法。
「ポリヌクレオチド」または「核酸」という用語は、単鎖および二重鎖ヌクレオチドポリマーの両方を含む。ポリヌクレオチドを含むヌクレオチドは、リボヌクレオチドまたはデオキシリボヌクレオチド、またはいずれかの種類のヌクレオチドの修飾形態であり得る。該修飾は、ブロモウリジンおよびイノシン誘導体等の塩基修飾、2’,3’-ジデオキシリボース等のリボース修飾、およびホスホロチオエート、ホスホロジチオエート、ホスホロセレノエート、ホスホロジセレノエート、ホスホロアニロチオエート、ホスホルアニラデート、およびホスホロアミデート等のヌクレオチド間結合修飾を含む。
アルゴリズム:Needleman et al.,1970,J.Mol.Biol.48:443-453
比較マトリクス:上記Henikoff et al.,1992からのBLOSUM62
ギャップペナルティ:12(但し、末端ギャップのペナルティはない)
ギャップ長ペナルティ:4
類似性の閾値:0
ヒトCGRP R(hCGRP R)タンパク質を含む、CGRP Rタンパク質に結合する抗原結合タンパク質が、本明細書において提供される。抗原結合タンパク質は、1つまたは複数の相補性決定領域(CDR)が、本明細書に記載されるように、組み込まれ、および/または結合される、ポリペプチドである。いくつかの抗原結合タンパク質において、CDRは、「フレームワーク」領域に組み込まれ、それはCDRを配向し、CDRの適切な抗原結合特性が達成されるようにする。一般に、提供される抗原結合タンパク質は、CGRPとCGRP Rとの間の相互作用を干渉、遮断、低減、または調節することができる。
本明細書に開示される抗原結合タンパク質は、CGRP R、特に、ヒトCGRP Rに結合する。CGRP Rは、CRLRおよびRAMP1の両方を含む多量体である。ヒトCRLRのヌクレオチド配列は、本明細書において、配列番号1として提供される。ヒトCRLRのアミノ酸配列は、本明細書において、配列番号2として提供される。ヒトRAMP1のヌクレオチド配列は、本明細書において、配列番号3として提供される。ヒトRAMP1のアミノ酸配列は、本明細書において、配列番号4として提供される。本明細書に記載される抗原結合タンパク質は、CGRP Rの細胞外部分に結合し、それはCRLRおよびRAMP1の細胞外部分を含む。典型的なヒトCRLRの細胞外ドメイン(「ECD」)は、配列番号5として提示されるヌクレオチド配列によってコード化され、配列番号6として提示されるアミノ酸配列を有する。この配列は、シグナルペプチドを含み、典型的な成熟(シグナルペプチドを差し引いた)CRLR ECDは、配列番号10として提示されるアミノ酸配列を有する。ヒトRAMP1の典型的なECDは、配列番号7として提示されるヌクレオチド配列によってコード化され、配列番号8として提示されるアミノ酸配列を有する。この配列は、シグナルペプチドを含み、典型的な成熟(シグナルペプチドを差し引いた)RAMP1 ECDは、配列番号11として提示されるアミノ酸配列を有する。以下に記載されるように、CGRP Rタンパク質は、断片を含んでもよい。本明細書で使用するそれらの用語は、同義的に使用されて、受容体、特に、指定されない限り、CGRPに特異的に結合するヒト受容体を意味する。
CGRP Rという用語は、CGRP Rアミノ酸配列の翻訳後修飾、例えば、可能なN結合グリコシル化部位も含む。したがって、抗原結合タンパク質は、1つまたは複数の位置においてグリコシル化されるタンパク質に結合するか、またはそこから生成されてもよい。
CGRP Rの活性を調節するために有用な多様な選択的結合剤が提供される。これらの薬剤は、例えば、抗原結合タンパク質ドメインを含む抗原結合タンパク質(例えば、単鎖抗体、ドメイン抗体、免疫接着、および抗原結合領域を有するポリペプチド)を含み、CGRP R、特にヒトCGRP Rに特異的に結合する。それらの薬剤のいくつかは、例えば、CGRP Rに対するCGRPの結合を阻害する際に有用であり、CGRP Rシグナル伝達と関連付けられる1つまたは複数の活性を阻害、干渉、または調節するために用いることができる。
提供される抗原結合タンパク質のいくつかは、通常、自然発生する抗体に伴う構造を有する。これらの抗体の構造単位は、通常、1つまたは複数の四量体を含み、それぞれ2つの同一のポリペプチド鎖のカプレットで構成されるが、ある種の哺乳類種は、単一の重鎖のみを有する抗体も生成する。通常の抗体において、各対またはカプレットは、1つの全長「軽」鎖(所定の実施形態において、約25kDa)および1つの全長「重」鎖(所定の実施形態において、約50~70kDa)を含む。各個別の免疫グロブリン鎖は、いくつかの「免疫グロブリンドメイン」で構成され、それぞれ約90~110個のアミノ酸で構成され、特徴的な折り畳みパターンを発現する。これらのドメインは、抗体ポリペプチドが構成される基本単位である。各鎖のアミノ末端部分は、通常、抗原認識に関与する可変ドメインを含む。カルボキシ末端部分は、鎖の他の末端よりも進化的に保存され、「定常領域」または「C領域」と称される。ヒト軽鎖は、一般に、κおよびλ軽鎖として分類され、これらのそれぞれは、1つの可変ドメインおよび1つの定常ドメインを含む。重鎖は、通常、μ、δ、γ、α、またはε鎖として分類され、これらは、抗体のアイソタイプを、それぞれIgM、IgD、IgG,IgA、およびIgEと定義する。IgGは、いくつかのサブタイプを有し、IgG1、IgG2、IgG3、およびIgG4を含むが、これらに限定されない。IgMサブタイプは、IgM1、およびIgM2を含む。IgAサブタイプは、IgA1およびIgA2を含む。ヒトにおいて、IgAおよびIgDアイソタイプは、4つの重鎖および4つの軽鎖を含み、IgGおよびIgEアイソタイプは、2つの重鎖および2つの軽鎖を含み、IgMアイソタイプは、5つの重鎖および5つの軽鎖を含む。重鎖C領域は、通常、エフェクタ機能に関与し得る1つまたは複数のドメインを含む。重鎖定常領域ドメインの数は、アイソタイプに依存する。IgG重鎖は、例えば、CH1、CH2、およびCH3として知られている、それぞれ3つのC領域ドメインを含む。提供される抗体は、これらのアイソタイプおよびサブタイプのうちのいずれかを有し得る。所定の実施形態において、CGRP R抗体は、IgG1、IgG2、またはIgG4サブタイプである。
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(配列番号29として示される配列の最後の326個の残基)
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(配列番号14として示される配列の最後の107個の残基)
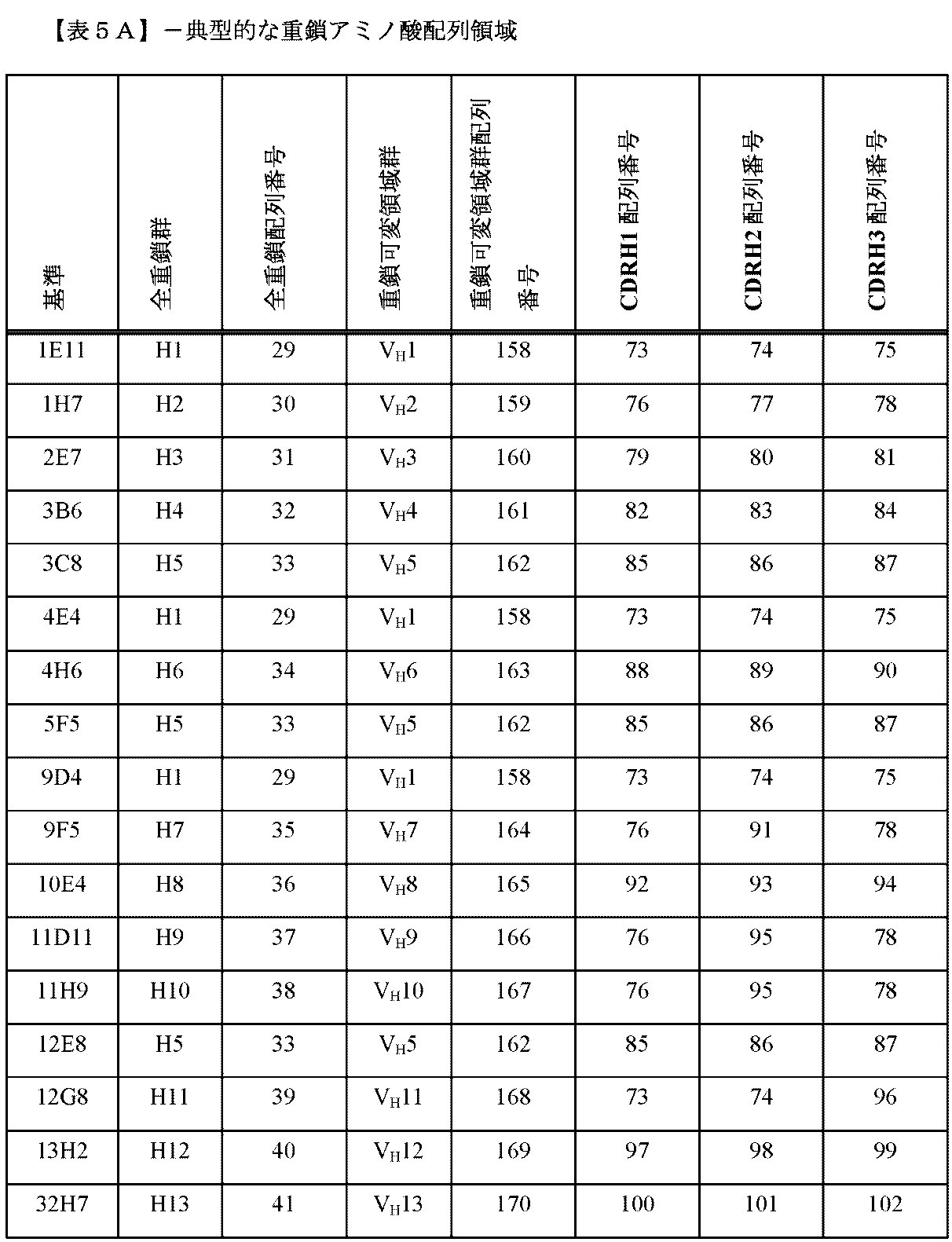
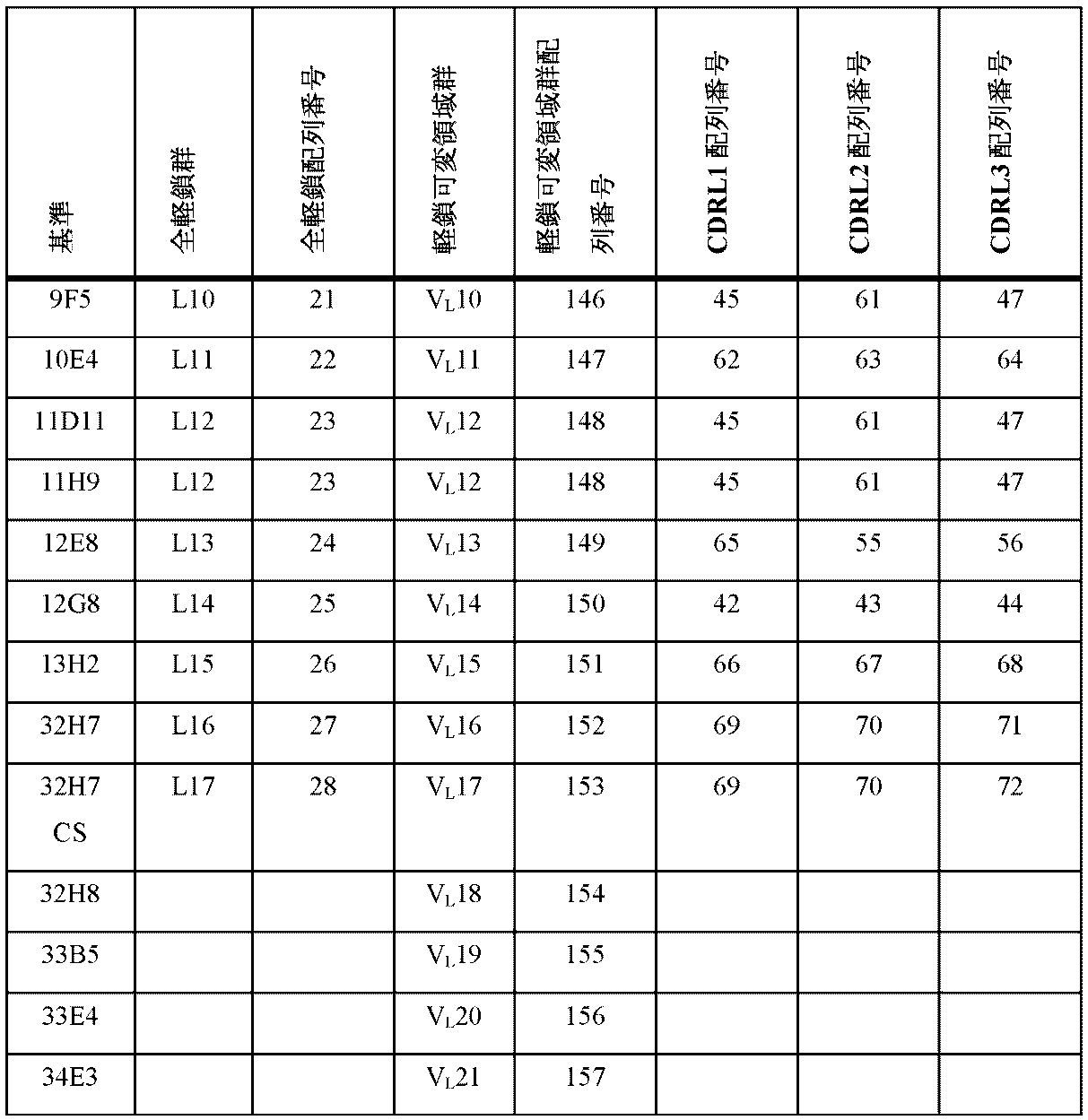
以下の表3に示される、VH1、VH2、VH3、VH4、VH5、VH6、VH7、VH8、VH9、VH10、VH11、VH12、およびVH13から成る群から選択される抗体重鎖可変領域、および/またはVL1、VL2、VL3、VL4、VL5、VL6、VL7、VL8、VL9、VL10、VL11、VL12、VL13、VL14、VL15、VL16、およびVL17から成る群から選択される抗体軽鎖可変領域、およびこれらの軽鎖および重鎖可変領域の免疫的に機能する断片、誘導体、変異体、および変異型を含む抗原結合タンパク質も提供される。
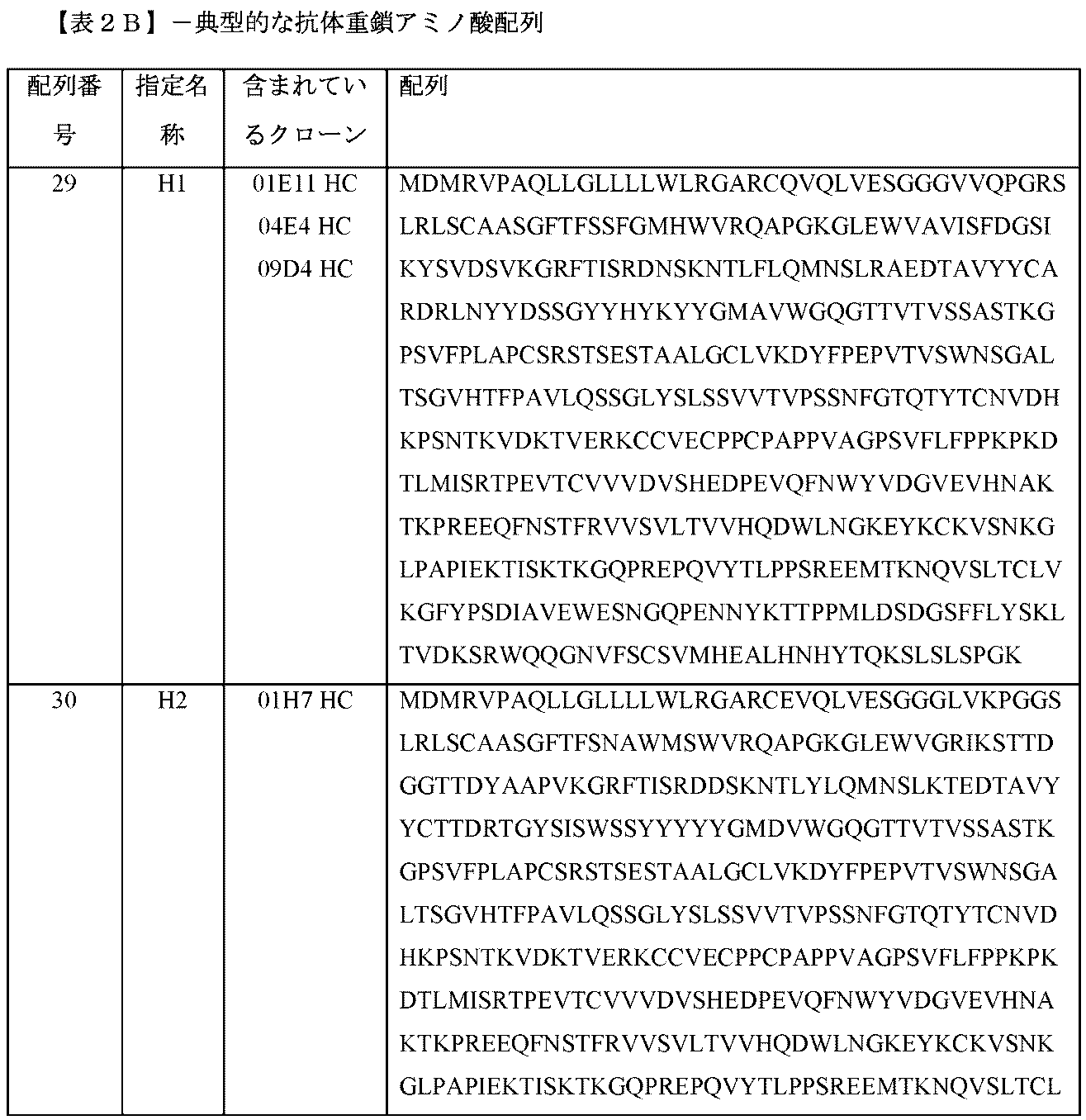
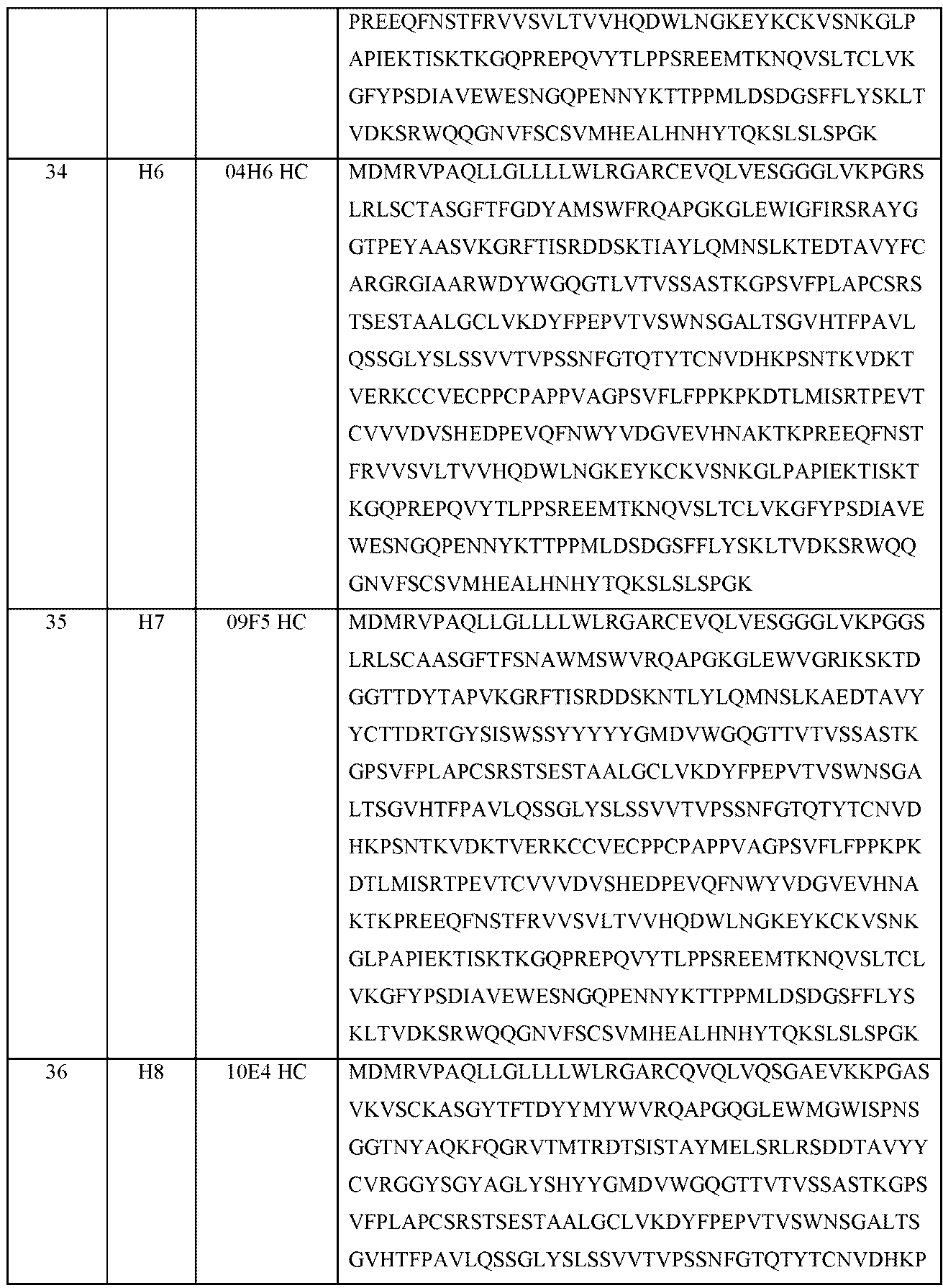
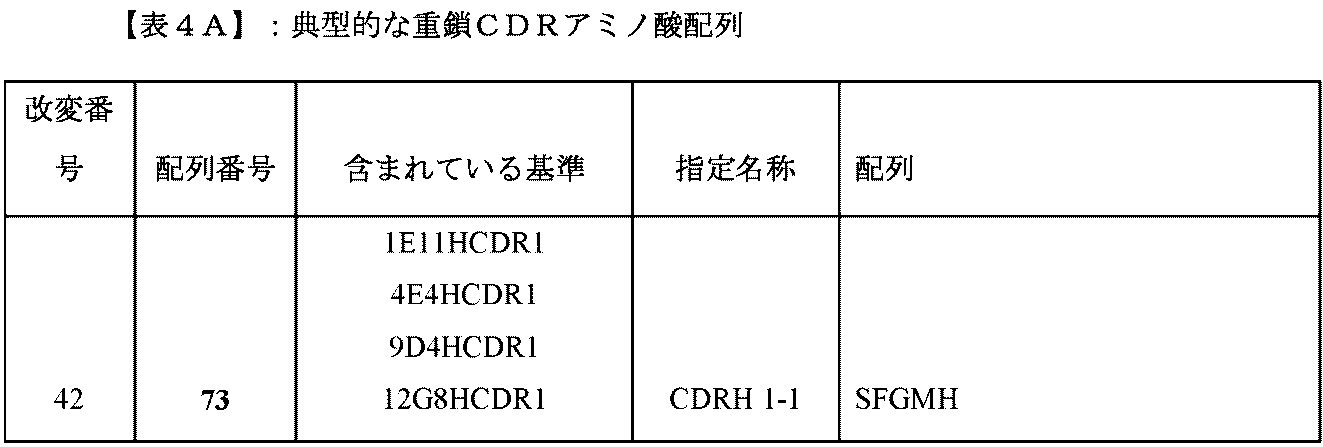
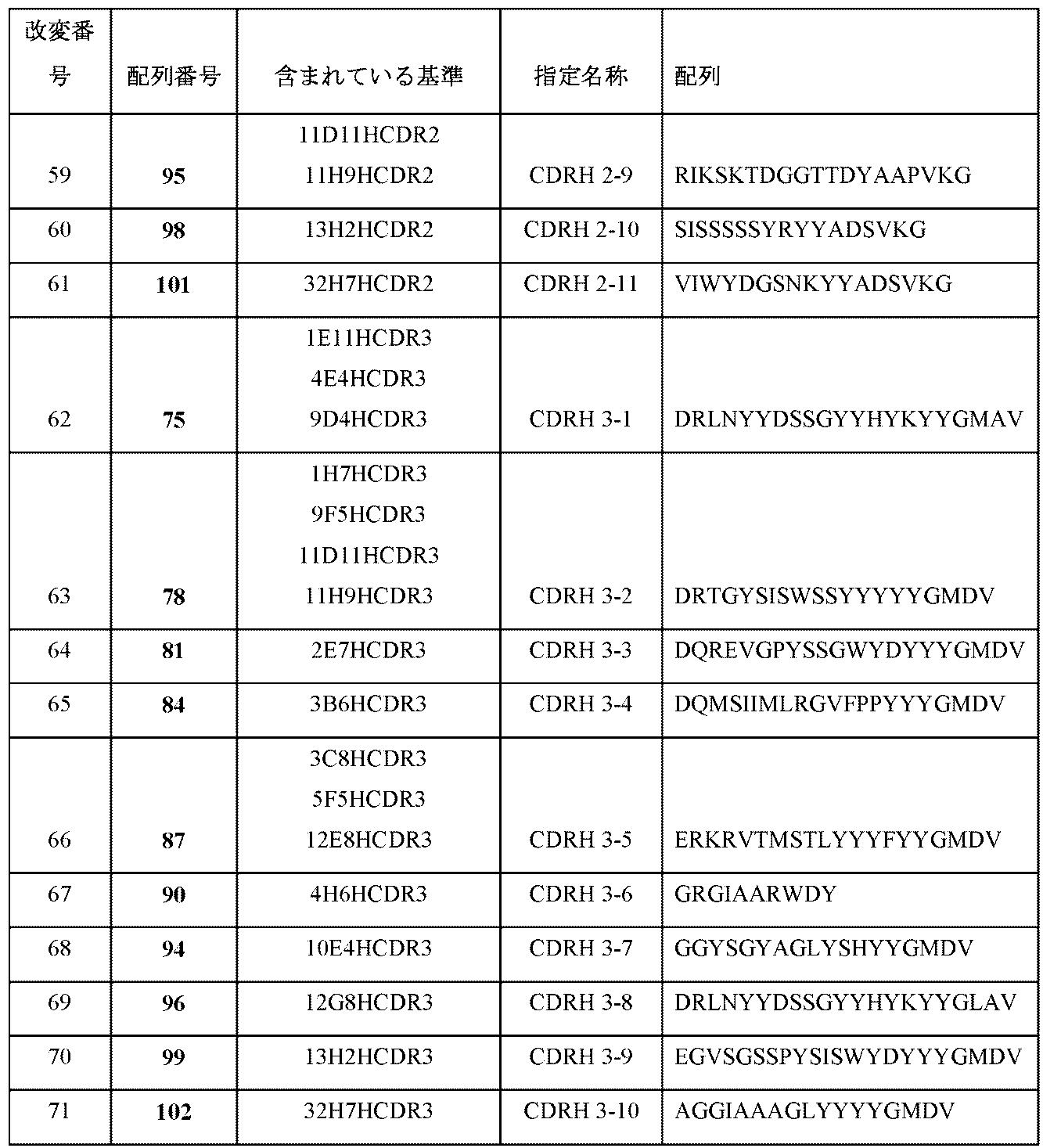
本明細書に開示される抗原結合タンパク質は、ポリペプチドであり、1つまたは複数のCDRが移植、挿入、および/または結合される。抗原結合タンパク質は、1、2、3、4、5または6個のCDRを有し得る。抗原結合タンパク質は、したがって、例えば、1つの重鎖CDR1(「CDRH1」)、および/または1つの重鎖CDR2(「CDRH2」)、および/または1つの重鎖CDR3(「「CDRH3」)、および/または1つの軽鎖CDR1(「CDRL1」)、および/または1つの軽鎖CDR2(「CDRL2」)、および/または1つの軽鎖CDR3(「CDRL3」)を含む。いくつかの抗原結合タンパク質は、CDRH3およびCDRL3の両方を含む。特定の重鎖および軽鎖CDRは、表4Aおよび4Bにおいてそれぞれ特定される。
K1コンセンサス
CDR1 RASQGIRX1DLG(配列番号103)、式中、X1は、NおよびKから成る群から選択される。
CDR2 X1ASSLQS(配列番号104)、式中、X1は、AおよびGから成る群から選択される。
CDR3 LQYNX1X2PWT(配列番号105)、式中、X1は、IおよびSから成る群から選択され、X2は、YおよびFから成る群から選択される。
K4コンセンサス
CDR3 QQYGNSLX1R(配列番号106)、式中、X1は、SおよびCから成る群から選択される。
K1,4コンセンサス
CDR1 RASQX1X2X3X4GX5LX6(配列番号107)、式中、X1は、SおよびGから成る群から選択され、X2は、VおよびIから成る群から選択され、X3は、SおよびRから成る群から選択され、X4は、S、NおよびKから成る群から選択され、X5は、YおよびDから成る群から選択され、X6は、TおよびGから成る群から選択される。
CDR2 X1ASSX2X3X4(配列番号108)、式中、X1は、GおよびAから成る群から選択され、X2は、RおよびLから成る群から選択され、X3は、AおよびQから成る群から選択され、X4は、TおよびSから成る群から選択される。
CDR3 X1QYX2X3X4X5X6X7(配列番号109)、式中、X1は、QおよびLから成る群から選択され、X2は、GおよびNから成る群から選択され、X3は、NおよびTから成る群から選択され、X4は、S、YおよびFから成る群から選択され、X5は、LおよびPから成る群から選択され、X6は、C、WおよびSから成る群から選択され、X7は、RおよびTから成る群から選択される。
K3コンセンサス
CDR1 KSSQSLLHSX1GX2X3YLY(配列番号110)、式中、X1は、DおよびAから成る群から選択され、X2は、RおよびKから成る群から選択され、X3は、NおよびTから成る群から選択される。
K2,3コンセンサス
CDR1 X1SSQSLLHSX2GX3X4YLX5(配列番号111)、式中、X1は、RおよびKから成る群から選択され、X2は、F、DおよびAから成る群から選択され、X3は、Y、RおよびKから成る群から選択され、X4は、NおよびTから成る群から選択され、X5は、DおよびYから成る群から選択される。
CDR2 X1X2SNRX3S(配列番号112)、式中、X1は、LおよびEから成る群から選択され、X2は、GおよびVから成る群から選択され、X3は、AおよびFから成る群から選択される。
CDR3 MQX1X2X3X4PX5T(配列番号113)、式中、X1は、AおよびSから成る群から選択され、X2は、LおよびFから成る群から選択され、X3は、QおよびPから成る群から選択され、X4は、TおよびLから成る群から選択され、X5は、FおよびLから成る群から選択される。
Lm3コンセンサス
CDR2 RX1NQRPS(配列番号114)、式中、X1は、NおよびSから成る群から選択される。
Lm1,2,3コンセンサス
CDR1 SGSSSNIGX1NX2VX3(配列番号115)、式中、X1は、NおよびSから成る群から選択され、X2は、YおよびTから成る群から選択され、X3は、S、NおよびYから成る群から選択される。
CDR2 X1X2NX3RPS(配列番号116)、式中、X1は、D、TおよびRから成る群から選択され、X2は、NおよびSから成る群から選択され、X3は、KおよびQから成る群から選択される。
CDR3 X1X2X3DX4X5LX6X7VV(配列番号117)、式中、X1は、GおよびAから成る群から選択され、X2は、TおよびAから成る群から選択され、X3は、WおよびRから成る群から選択され、X4は、SおよびDから成る群から選択され、X5は、RおよびSから成る群から選択され、X6は、SおよびNから成る群から選択され、X7は、AおよびGから成る群から選択される。
LAllコンセンサス
CDR1 X1GX2X3SX4X5X6X7X8X9X10X11(配列番号118)、式中、X1は、SおよびQから成る群から選択され、X2は、存在または不在であって、存在する場合はSであり、X3は、SおよびDから成る群から選択され、X4は、存在または不在であって、存在する場合はNであり、X5は、IおよびLから成る群から選択され、X6は、GおよびRから成る群から選択され、X7は、NおよびSから成る群から選択され、X8は、NおよびFから成る群から選択され、X9は、YおよびTから成る群から選択され、X10は、VおよびAから成る群から選択され、X11は、S、NおよびYから成る群から選択される。
CDR2 X1X2NX3RPS(配列番号119)、式中、X1は、D、G、TおよびRから成る群から選択され、X2は、N、KおよびSから成る群から選択され、X3は、K、NおよびQから成る群から選択される。
CDR3 X1X2X3DX4X5X6X7X8X9V(配列番号120)、式中、X1は、G、NおよびAから成る群から選択され、X2は、T、SおよびAから成る群から選択され、X3は、WおよびRから成る群から選択され、X4は、SおよびDから成る群から選択され、X5は、RおよびSから成る群から選択され、X6は、LおよびVから成る群から選択され、X7は、S、YおよびNから成る群から選択され、X8は、A、HおよびGから成る群から選択され、X9は、VおよびLから成る群から選択される。
HC1コンセンサス
CDR1 X1YYMX2(配列番号121)、式中、X1は、GおよびDから成る群から選択され、X2は、HおよびYから成る群から選択される。
CDR2 WIX1PNSGGTNYAQKFQG(配列番号122)、式中、X1は、NおよびSから成る群から選択される。
CDR3 X1X2X3SX4X5X6X7X8GX9X10X11X12YYX13GMDV(配列番号123)、式中、X1は、DおよびGから成る群から選択され、X2は、QおよびGから成る群から選択され、X3は、MおよびYから成る群から選択され、X4は、IおよびGから成る群から選択され、X5は、IおよびYから成る群から選択され、X6は、MおよびAから成る群から選択され、X7は、存在または不在であって、存在する場合はLであり、X8は、存在または不在であって、存在する場合はRであり、X9は、VおよびLから成る群から選択され、X10は、FおよびYから成る群から選択され、X11は、PおよびSから成る群から選択され、X12は、PおよびHから成る群から選択され、X13は、存在または不在であって、存在する場合はYである。
HC2コンセンサス
CDR2 RIKSX1TDGGTTDYX2APVKG(配列番号124)、式中、X1は、KおよびTから成る群から選択され、X2は、TおよびAから成る群から選択される。
HC3コンセンサス
CDR1 X1YX2MX3(配列番号125)、式中、X1は、TおよびSから成る群から選択され、X2は、SおよびAから成る群から選択され、X3は、NおよびSから成る群から選択される。
CDR2 X1ISX2SX3X4X5X6YYADSVKG(配列番号126)、式中、X1は、SおよびAから成る群から選択され、X2は、SおよびGから成る群から選択され、X3は、SおよびGから成る群から選択され、X4は、SおよびGから成る群から選択され、X5は、YおよびRから成る群から選択され、X6は、RおよびTから成る群から選択される。
CDR3 X1X2X3X4X5X6X7PYSX8X9WYDYYYGMDV(配列番号127)、式中、X1は、EおよびDから成る群から選択され、X2は、GおよびQから成る群から選択され、X3は、VおよびRから成る群から選択され、X4は、SおよびEから成る群から選択され、X5は、GおよびVから成る群から選択され、X6は、SおよびGから成る群から選択され、X7は、存在または不在であって、存在する場合はSであり、X8は、IおよびSから成る群から選択され、X9は、SおよびGから成る群から選択される。
HC4コンセンサス
CDR1 SX1GMH(配列番号128)、式中、X1は、FおよびYから成る群から選択される。
CDR2 VISX1DGSX2KYX3X4DSVKG(配列番号129)、式中、X1は、FおよびYから成る群から選択され、X2は、IおよびHから成る群から選択され、X3は、SおよびYから成る群から選択され、X4は、VおよびAから成る群から選択される。
CDR3 X1RX2X3X4X5X6SX7X8YYX9X10X11YYGX12X13V(配列番号130)、式中、X1は、DおよびEから成る群から選択され、X2は、LおよびKから成る群から選択され、X3は、NおよびRから成る群から選択され、X4は、YおよびVから成る群から選択され、X5は、YおよびTから成る群から選択され、X6は、DおよびMから成る群から選択され、X7は、SおよびTから成る群から選択され、X8は、GおよびLから成る群から選択され、X9は、HおよびYから成る群から選択され、X10は、存在または不在であって、存在する場合はYであり、X11は、KおよびFから成る群から選択され、X12は、MおよびLから成る群から選択され、X13は、AおよびDから成る群から選択される。
HCAコンセンサス
CDR1 X1X2X3MX4(配列番号131)、式中、X1は、NおよびSから成る群から選択され、X2は、A、Y、およびFから成る群から選択され、X3は、W、A、およびGから成る群から選択され、X4は、SおよびHから成る群から選択される。
CDR2 X1IX2X3X4X5X6GX7X8X9X10X11X12X13X14VKG(配列番号132)、式中、X1は、R、A、およびVから成る群殻選択され、X2は、K、S、およびWから成る群から選択され、X3は、S、G、F、およびYから成る群から選択され、X4は、存在または不在であって、存在する場合は、KおよびTから成る群から選択され、X5は、存在または不在であって、存在する場合はTであり、X6は、DおよびSから成る群から選択され、X7は、GおよびSから成る群から選択され、X8は、T、R、I、NおよびHから成る群から選択され、X9は、TおよびKから成る群から選択され、X10は、DおよびYから成る群から選択され、X11は、YおよびSから成る群から選択され、X12は、T、A、およびVから成る群から選択され、X13は、AおよびDから成る群から選択され、X14は、PおよびSから成る群から選択される。
CDR3 X1X2X3X4X5X6X7X8X9X10X11X12X13X14X15X16X17GX18X19V(配列番号133)、式中、X1は、D、AおよびEから成る群から選択され、X2は、R、QおよびGから成る群から選択され、X3は、T、R、L、GおよびKから成る群から選択され、X4は、G、E、N、IおよびRから成る群から選択され、X5は、Y、V、およびAから成る群から選択され、X6は、S、G、Y、AおよびTから成る群から選択され、X7は、I、P、D、AおよびMから成る群から選択され、X8は、存在または不在であって、存在する場合は、SおよびYから成る群から選択され、X9は、存在または不在であって、存在する場合は、W、SおよびTから成る群から選択され、X10は、S、GおよびLから成る群から選択され、X11は、S、G、LおよびYから成る群から選択され、X12は、存在または不在であって、存在する場合は、WおよびYから成る群から選択され、X13は、YおよびHから成る群から選択され、X14は、存在または不在であって、存在する場合は、YおよびDから成る群から選択され、X15は、Y、KおよびFから成る群から選択され、X16は、存在または不在であって、存在する場合はYであり、X17は、存在または不在であって、存在する場合はYであり、X18は、MおよびLから成る群から選択され、X19は、DおよびAから成る群から選択される。
HCBコンセンサス
CDR1 X1X2X3X4X5(配列番号134)、式中、X1は、N、G、D、SおよびAから成る群から選択され、X2は、A、FおよびYから成る群から選択され、X3は、W、Y、AおよびGから成る群から選択され、X4は、MおよびLから成る群から選択され、X5は、SおよびHから成る群から選択される。
CDR2 X1IX2X3X4X5X6X7X8X9X10X11X12X13X14X15X16X17G(配列番号135)、式中、X1は、R、W、A、V、SおよびFから成る群から選択され、X2は、K、N、S、WおよびRから成る群から選択され、X3は、S、P、G、FおよびYから成る群から選択され、X4は、存在または不在であって、存在する場合は、K、TおよびRから成る群から選択され、X5は、存在または不在であって、存在する場合は、TおよびAから成る群から選択され、X6は、D、N、H、SおよびYから成る群から選択され、X7は、GおよびSから成る群から選択され、X8は、GおよびSから成る群から選択され、X9は、T、G、R、I、N、HおよびYから成る群から選択され、X10は、T、K、RおよびPから成る群から選択され、X11は、D、N、YおよびEから成る群から選択され、X12は、YおよびSから成る群から選択され、X13は、T、AおよびVから成る群から選択され、X14は、A、QおよびDから成る群から選択され、X15は、P、KおよびSから成る群から選択され、X16は、VおよびFから成る群から選択され、X17は、KおよびQから成る群から選択される。
CDR3 X1X2X3X4X5SX6X7X8X9X10X11X12X13X14X15X16GX17X18V(配列番号136)、式中、X1は、D、G、AおよびEから成る群から選択され、X2は、R、GおよびQから成る群から選択され、X3は、T、M、Y、R、L、GおよびKから成る群から選択され、X4は、G、S、E、N、IおよびRから成る群から選択され、X5は、Y、I、G、VおよびAから成る群から選択され、X6は、S、I、Y、G、AおよびTから成る群から選択され、X7は、I、M、A、PおよびDから成る群から選択され、X8は、存在または不在であって、存在する場合は、S、LおよびYから成る群から選択され、X9は、存在または不在であって、存在する場合は、W、R、SおよびTから成る群から選択され、X10は、S、GおよびLから成る群から選択され、X11は、S、V、L、GおよびYから成る群から選択され、X12は、存在または不在であって、存在する場合は、F、YおよびWから成る群から選択され、X13は、Y、P、SおよびHから成る群から選択され、X14は、存在または不在であって、存在する場合は、Y、P、DおよびHから成る群から選択され、X15は、Y、KおよびFから成る群から選択され、X16は、存在または不在であって、存在する場合はYであり、X17は、存在または不在であって、存在する場合はYであり、X18は、MおよびLから成る群から選択される。
一態様に従って、(A)(i)配列番号73、76、79、82、85、88、92、97、および100から成る群から選択されるCDRH1、(ii)配列番号74、77、80、83、86、89、91、93、95、98、101、および129から成る群から選択されるCDRH2、(iii)配列番号75、78、81、84、87、90、96、99、102、および123から成る群から選択されるCDRH3、および(iv)5個、4個、3個、2個、または1個を超えないアミノ酸の、1つまたは複数、例えば、1個、2個、3個、4個以上のアミノ酸置換、欠失、または挿入を含む(i)、(ii)および(iii)のCDRH、から成る群から選択される、1つまたは複数の重鎖相補性決定領域(CDRH)、(B)(i)配列番号42、45、48、51、54、57、62、65、66、および69から成る群から選択されるCDRL1、(ii)配列番号43、46、49、52、55、58、61、63、67、および70から成る群から選択されるCDRL2、(iii)配列番号44、47、50、53、56、59、64、68、71、および72から成る群から選択される、CDRL3、および(iv)5個、4個、3個、2個、または1個を超えないアミノ酸の、1つまたは複数の、例えば、2個、3個、4個以上のアミノ酸置換、欠失、または挿入を含む、(i)、(ii)および(iii)のCDRLから成る群から選択される、1つまたは複数の軽鎖相補性決定領域(CDRL)、または(C)(A)の1つまたは複数の重鎖CDRHおよび(B)の1つまたは複数の軽鎖CDRLを含む、CGRP Rと結合する、単離結合タンパク質が提供される。
抗原結合たんぱく質が、エピトープ例えば、CGRP Rの一方または両方の成分、またはCGRP Rの細胞外ドメインと結合すると言われる場合、これは、抗原結合タンパク質が、CGRP Rの特定部分に特異的に結合することを意味し、CRLR、RAMP1、またはCRLRおよびRAMP1の両方にわたる部分上であってもよい。抗原結合タンパク質が、(RAMP1ではなく)CRLRのみと結合する場合において、抗原結合タンパク質は、CRLRが特にAM1およびAM1受容体と共有されるため、CGRP Rを選択的に結合することが予期されない。同様に、抗原結合タンパク質が、(CRLRではなく)RAMP1のみと結合する場合において、抗原結合タンパク質は、RAMAP1が特にAMY1受容体と共有されるため、CGRP Rを選択的に結合することが予期されない。抗原結合タンパク質が、CRLRおよびRAMP1の両方と相互作用する場合において、抗原結合タンパク質は、残基または残基の配列、あるいはCRLRおよびRAMP1の両方における領域と結合することが予期される。前述の実施形態のいずれにおいても、抗原結合タンパク質は、CRLRまたはRAMP1内のすべての残基と接触することが予期されない。同様に、CRLR、RAMP1、またはその細胞外ドメイン内のすべてのアミノ酸置換または欠失が、結合親和性に有意に影響することが予期されるわけではない。
別の態様において、CGRP Rへの特異的な結合に対して、上述のエピトープに結合する、例証または「基準」抗体または機能断片のうちの1つと競合する、抗原結合タンパク質が提供される。そのような抗原結合タンパク質は、本明細書で例証される抗原結合タンパク質のうちの1つ、または重複するエピトープと同一のエピトープに結合し得る。例証または基準抗原結合タンパク質と同一のエピトープと競合するか、または結合する抗原結合タンパク質および断片は、同様の機能特性を示すことが予期される。例証される抗原結合タンパク質および断片は、重鎖および軽鎖、可変領域ドメインVL1-VL17およびVH1-VH13、および表2A、2B、3、4A、4B、5A、および5Bに含まれるCDRを有するものを含む。したがって、具体的な実施例として、提供される抗原結合タンパク質は、(a)表5Aおよび5Bに列挙される抗体に対して列挙される6つのCDRすべて、(b)VL1-VL17およびVH1-VH13から選択され、表5Aおよび5Bに列挙される抗体に対して列挙されるVHおよびVL、または(c)表5Aおよび5Bに列挙される抗体に対して特定される2つの軽鎖および2つの重鎖を有する抗体と競合するものを含む。適切な基準抗体の一実施例には、配列番号158~170として同定される配列のうちのいずれかに対応する配列を有する重鎖可変領域、および配列番号137~153として同定される配列のうちのいずれかに対応する配列を有する、軽い鎖可変領域を有するものが挙げられる。
提供される抗原結合タンパク質は、CGRP Rに結合するモノクローナル抗体を含む。モノクローナル抗体は、該技術分野において知られている任意の技術を使用して、例えば、免疫付与スケジュールの完了後、トランスジェニック動物から採取された膵臓細胞を不死化することによって生成され得る。膵臓細胞は、該技術分野において知られている任意の技術を使用して、例えば、それらを骨髄腫細胞と融合してハイブリドーマを生成することによって不死化することができる。ハイブリドーマ生成融合手順において使用するための骨髄腫細胞は、好ましくは、非抗体生成であり、高い融合効率および酵素欠損を有し、それらが所望の融合細胞(ハイブリドーマ)のみの成長を支持する所定の選択的媒体において成長できないようにする。マウス融合に使用するのに適した細胞株の実施例には、Sp-20、P3-X63/Ag8、P3-X63-Ag8.653、NS1/1.Ag4 1、Sp210-Ag14、FO、NSO/U、MPC-11、MPC11-X45-GTG 1.7およびS194/5XXO Bulが挙げられ、ラット融合に使用される細胞の実施例には、R210.RCY3、Y3-Ag1.2.3、IR983Fおよび4B210が挙げられる。細胞融合に有用な他の細胞株は、U-266、GM1500-GRG2、LICR-LON-HMy2およびUC729-6である。モノクローナル抗体を調製する典型的な方法は、以下の実施例2に記載される。
前述の配列に基づくキメラおよびヒト化抗体も提供される。治療薬として使用するためのモノクローナル抗体は、使用前に様々な方法で修飾され得る。一実施例は、キメラ抗体であり、これは、機能的免疫グロブリン軽鎖または重鎖、あるいはその免疫学的機能部分を生成するように、共役結合される、異なる抗体からのタンパク質切片で構成される抗体である。一般に、重鎖および/または軽鎖の部分は、特定の種に由来する抗体における対応する配列と同一または相同であるか、または特定の抗体クラスまたはサブクラスに属するが、鎖の残りは、別の種に由来する抗体における対応する配列と同一または相同であるか、または別の抗体クラスまたはサブクラスに属する。キメラ抗体に関連する方法については、例えば、参照することにより本明細書に組み込まれる、米国特許第4,816,567号、およびMorrison et al.,1985,Proc.Natl.Acad.Sci.USA 81:6851-6855を参照されたい。CDR移植は、例えば、米国特許第6,180,370号、第5,693,762号、第5,693,761号、第5,585,089号、および第5,530,101号に記載されている。
完全ヒト抗体も提供される。ヒトを抗原に曝露させることなく、所定の抗原に特異的な完全ヒト抗体を形成するための方法が使用可能である(「完全ヒト抗体」)。完全ヒト抗体の生成を実装するために提供される1つの具体的な手段は、マウス液性免疫系の「ヒト化」である。内因性Ig遺伝子が不活性化されたマウスへのヒト免疫グロブリン(Ig)位置の導入は、任意の所望の抗原により免疫付与され得る動物である、マウスにおいて、完全ヒトモノクローナル抗体(mAb)を生成する1つの手段である。完全ヒト抗体の使用は、マウスまたはマウス由来mAbを治療薬としてヒトに投与することによってもたらされ得る場合がある、免疫原性およびアレルギー性反応を最小化することができる。
提供される抗原結合タンパク質は、上述のように、1つまたは複数のCDRあるいは1つまたは複数の可変領域を含む、二特異性および二機能性抗体も含む。二特異性または二機能性抗体は、いくつかの例において、2つの異なる重鎖/軽鎖対および2つの異なる結合部位を有する人工ハイブリッド抗体である。二特異性抗体は、ハイブリドーマの融合またはFab’断片の結合が挙げられるが、これに限定されない、多様な方法によって生成することができる。例えば、Songsivilai and Lachmann,1990,Clin.Exp.Immunol.79:315-321、Kostelny et al.,1992,J.Immunol.148:1547-1553を参照されたい。
提供される抗原結合タンパク質のいくつかは、上で開示される抗原結合タンパク質(例えば、表2-5に列挙される配列を有するもの)の変異型である。例えば、抗原結合タンパク質のいくつかは、表2-5に列挙される重鎖または軽鎖、可変領域、またはCDRの1つ以上において、1つまたは複数の保存アミノ酸置換を有する。
1)疎水性:ノルロイシン、Met、Ala、Val、Leu、Ile
2)中性親水性:Cys、Ser、Thr、Asn、Gln
3)酸性:Asp、Glu
4)塩基性:His、Lys、Arg
5)鎖配向に影響する残基:Gly、Proおよび
6)芳香族:Trp、Tyr、Phe
抗原結合タンパク質は、天然種において見出されるものとは異なるか、または変更されたグリコシル化パターンを有し得る。該技術分野において知られるように、グリコシル化パターンは、タンパク質の配列(例えば、以下で論じられる、特定のグリコシル化アミノ酸残基の有無)、またはタンパク質が生成される宿主細胞または生物の両方に依存し得る。特定の発現系は、以下で論じられる。
一部の実施形態において、抗原結合は、1つまたは複数の標識を含む。「標識基」または「標識」という用語は、任意の検出可能な標識を意味する。適切な標識基の実施例には、以下の放射性アイソトープまたは放射性ヌクリド(例えば、3H、14C、15N、35S、90Y、99Tc、111In、125I、131I)、蛍光基(例えば、FITC、ローダミン、ランタニド蛍光体)、酵素基(例えば、西洋ワサビペルオキシダーゼ、β-ガラクトシダーゼ、ルシフェラーゼ、アルカリンホスファターゼ)、化学発光基、ビオチニル群、または二次レポータにより認識される事前決定したポリペプチドエピトープ(例えば、ロイシンジッパー対配列、二次抗体の結合部位、金属結合ドメイン、エピトープタグ)が挙げられるが、これらに限定されない。一部の実施形態において、標識基は、様々な長さのスペーサアームを介して抗原結合タンパク質に結合され、潜在的な立体障害を低減する。タンパク質を標識するための様々な方法が、該技術分野において知られており、適合するとみなされるように使用することができる。
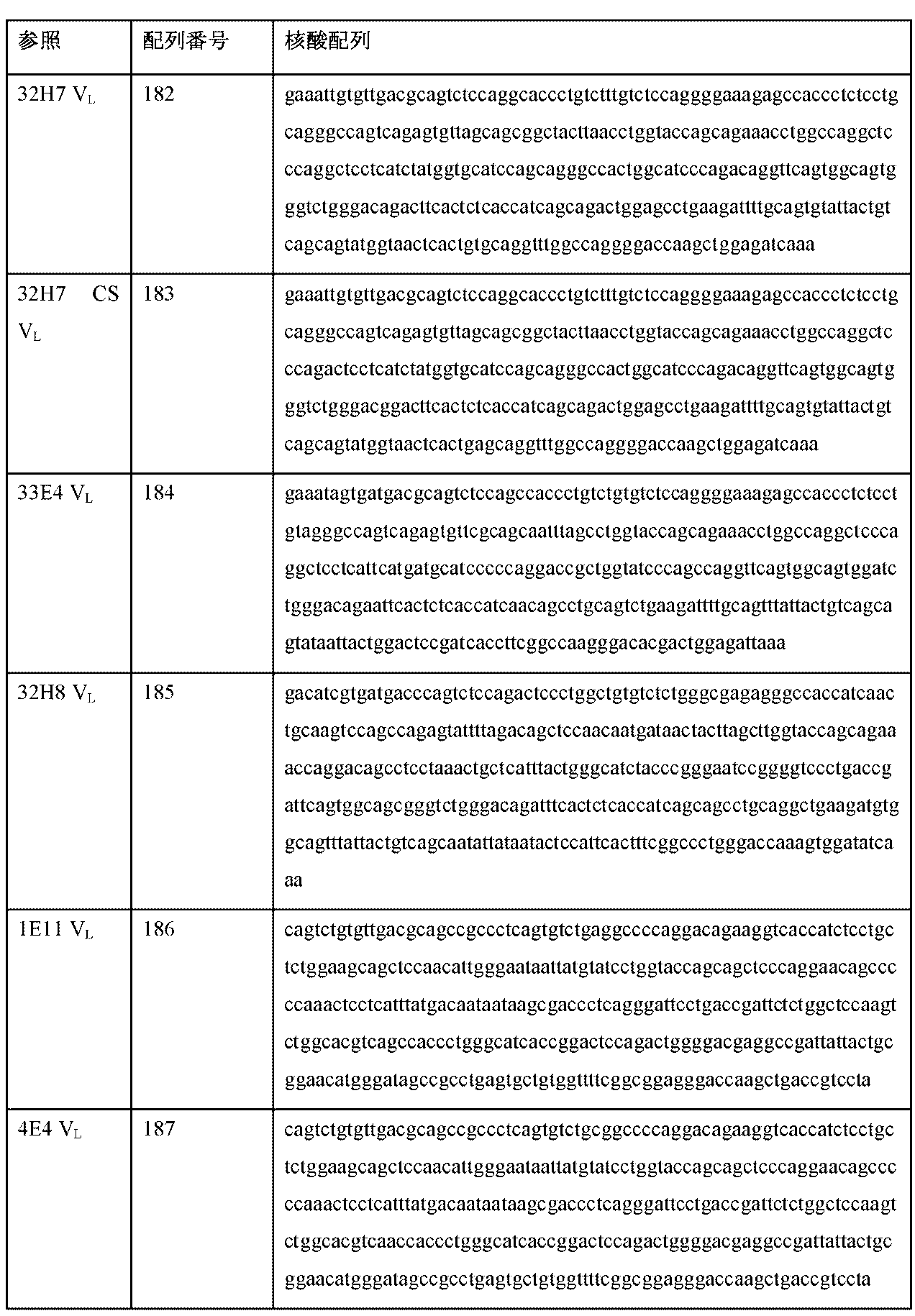
本明細書に記載される抗原結合タンパク質をコード化する核酸、またはその部分も提供され、抗体の一方または両方の鎖をコード化する核酸、またはその断片、誘導体、変異体、または変型、重鎖可変領域またはCDRのみをコード化するポリヌクレオチド、ハイブリダイゼーションプローブとして使用するのに十分なポリヌクレオチド、ポリペプチドをコード化するポリヌクレオチドを同定、分析、変異、または増幅させるためのPCRプライマまたは配列決定プライマ、ポリヌクレオチドの発現を阻害するためのアンチセンス核酸、および前述の相補配列を含む。核酸は、任意の長さであり得る。それらは、例えば、5、10、15、20、25、30、35、40、45、50、75、100、125、150、175、200、250、300、350、400、450、500、750、1,000、1,500、またはそれ以上のヌクレオチド長であり得、および/または1つまたは複数の追加の配列、例えば、調節配列を含み得、および/または大きい核酸、例えば、ベクターの一部であり得る。核酸は、単鎖または二重鎖であり得、RNAおよび/またはDNAヌクレオチド、およびそれらの人工変異体(例えば、ペプチド核酸)を含むことができる。
提供される非ヒト抗体は、例えば、任意の抗体生成動物、例えば、マウス、ラット、ウサギ、ヤギ、ロバ、または非ヒト霊長類(例えば、サル(例えば、カニクイザルまたは赤毛サル)または類人猿(例えば、チンパンジー)に由来し得る。非ヒト抗体は、例えば、インビトロ細胞培養および細胞培養ベースの適用、または抗体への免疫反応が起こらないか、または有意でない、回避できる、関心事でないか、または所望される任意の他の適用において使用することができる。ある実施形態において、抗体は、上述のように、および/または以下の実施例1~3において記載されるように、該技術分野において知られている方法を使用して、動物に免疫付与することによって生成することができる。それらの実施例は、3つの異なる免疫原調製-(i)CGRP R-RAMP1およびCRLRの2つの主要成分の全長版を発現する全体細胞、(ii)そのような細胞からの膜抽出物、および(iii)CRLRおよびRAMP1のN末端細胞外ドメインを共発現および精製することによって得られる可溶性CGRP Rを使用して、抗CGRP R抗体の生成について説明する。抗体は、ポリクローナル、モノクローナルであり得、または組み換えDNAを発現することによって宿主細胞において合成され得る。完全ヒト抗体は、ヒト免疫グロブリン位を含有する形質転換動物に免疫付与するか、または一連のヒト抗体を発現しているファージ表示ライブラリを選択することによって、上述のように調製することができる。
上述のような少なくとも1つのポリヌクレオチドを含む、プラスミド、発現ベクター、転写または発現カセットの形態の発現系および構造物、ならびにそのような発現系および構造物を含む宿主細胞も、本明細書において提供される。
抗原結合タンパク質は、生物試料中のCGRP Rを検出し、CGRP Rを生成する細胞または組織の特定に有用である。例えば、CGRP R抗原結合タンパク質は、診断分析、例えば、組織または細胞中で発現したCGRP Rを検出および/または定量するための結合分析において使用することができる。CGRP Rに特異的に結合する抗原結合タンパク質は、必要とする患者において、CGRP Rに関連する疾患の治療に使用することもできる。さらに、CGRP R抗原結合タンパク質を使用して、そのリガンドCGRPと複合体を形成するのを阻害し、それによって、細胞または組織におけるCGRP Rの生物活性を調節することができる。調整され得る活性の実施例には、血管拡張の阻害および/または神経性炎症が挙げられるが、これらに限定されない。CGRP Rに結合する抗原結合タンパク質は、したがって、他の結合化合物との相互作用を調整および/または遮断することができ、そのようにして、CGRP Rに関連する疾患を緩和する際の治療用途を有し得る。
ヒトCGRP Rに関連する疾患または状態には、患者において、CGRP RとそのリガンドCGRPの相互作用によって少なくとも部分的に発症する、任意の疾患または状態を含む。疾患または状態の重度も、CGRP RとCGRPの相互作用によって増減し得る。本明細書に記載される抗原結合タンパク質によって治療され得る疾患および状態の実施例には、頭痛、例えば、群発頭痛、片頭痛による頭の痛みを含む偏頭痛、慢性疼痛、II型糖尿病、炎症、例えば、神経性炎症、心血管疾患、および内毒素血および敗血症に伴う血行動態異常が挙げられる。
本明細書に記載される抗原結合タンパク質は、CGRP Rと関連付けられる疾患および/または状態を検出、診断、または監視する診断目的で使用することができる。当業者に知られている標準的な免疫組織学的方法を使用して、試料中のCGRP Rの存在を検出するための方法も提供される(例えば、Tijssen,1993,Practice and Theory of Enzyme Immunoassays,Vol 15(Eds R.H.Burdon and P.H.van Knippenberg,Elsevier,Amsterdam)、Zola,1987,Monoclonal Antibodies:A Manual of Techniques,pp.147-158(CRC Press,Inc.)、Jalkanen et al.,1985,J.Cell.Biol.101:976-985、Jalkanen et al.,1987,J.Cell Biol.105:3087-3096を参照)。CGRP Rの検出は、インビボまたはインビトロで行うことができる。
抗原結合タンパク質を使用する方法も提供される。いくつかの方法において、抗原結合タンパク質は、患者に提供される。抗原結合タンパク質は、ヒトCGRP RへのCGRPの結合を阻害する。
A. ヒトCRLRおよびRMAP1の分子クローニング
ヒトCRLR cDNA(GenBank受入番号U17473、配列番号1)およびRAMP1 cDNA(GenBank受入番号AJ001014、配列番号3)を、下記の通り、HEK293EBNA細胞(Invotrogen)のトランスフェクションのために、哺乳類細胞発現ベクターpcDNA3.1-ZeoおよびpcDNA3.1-Hyg(Invitrogen,Carlsbad,CA)にそれぞれクローニングした。hCRLR cDNAおよびhRAMP1 cDNAも、AM-1CHO細胞(米国特許第6,210,924)のトランスフェクションのために、pDSRα24ベクター(Kim,H.Y.et al.J.Inv.Derm.Symp.Proc.(2007)12:48-49)にクローニングした。
1.293EBNA細胞におけるヒトCGRP Rの安定発現
HEK293EBNA細胞(ATCCまたはInvitrogenから入手可能)を、100mm皿当たり1.5x106細胞の密度で播種した。24時間後、Invitrogenにより提供される指示に従って、huRAMP1/pcDNA3.1―HygおよびhuCRLR/pcDNA3.1―Zeoの線形化DNA6μgと、FuGene6(Invitrogen,Carlsbad,CA)により、細胞を共トランスフェクトした。2日後、細胞をトリプシン化し、400μg/mLヒグロマイシン+250μg/mLゼオシンを含有する成長培地に二次培養した。2週間後、得られた薬物耐性コロニーをトリプシン化し、結合してプールにした。プールは、4回のFACSに供し、Alexa647標識化CGRP8―37ペプチドアナログ(下記)を分類した。各回で、発現する細胞の最も高い5%を収集した。
AM-1CHO細胞(UrlaubおよびChasinのProc.Natl.Acad.Sci.77,4216(1980))に記載されるCHO DHFR欠損細胞株からの無血清成長培地に適合した変異体を、100mm皿当たり、1.5x106細胞の密度で播種した。24時間後、Invitrogenにより提供される指示に従って、pDSRα24/huRAMP1およびpDSRα24/huCRLRそれぞれの線形化したDNA4μgと、FuGene6(Invitrogen,Carlsbad,CA)により、細胞を共トランスフェクトした。トランスフェクションから2日後に、トランスフェクトした細胞をトリプシン化し、10%の透析したFBSを含有するCHO DHFR選択的成長培地に、ヒポキサンチン/チミジン補充なしに播種した。2週間後、得られたトランスフェクト化コロニーをトリプシン化し、プールした。プールは、FACS分類検定に供した。
293EBNA細胞を、100mm皿に1.5x106細胞/皿の密度で、DMEM(高グルコース)+5%FBS+1%MEM非必須アミノ酸+1%ピルビン酸ナトリウム中で播種した。翌日、FuGENE6トランスフェクション試薬(Roche)と、pcDNA3.1/ゼオシン/huCRLRプラスpcDNA3.1/ヒグロマイシン/huRAMP2を使用して、細胞を共トランスフェクトした。両方のDNA組成物をFspIで線形化した。48時間後、100mm皿に移し、3つの細胞密度で(8x105、3.2x105、および8x104細胞/皿)、200μg/mLゼオシンを含有する成長培地中で、細胞を二次培養した。培地は、週に2回交換した。1週間後、200μg/mLヒグロマイシン+200μg/mLゼオシンを含有する培地をプレートに与えた。2週間後、96コロニーを、クローニングリングを用いて単離した。残りのコロニーは、単一のプール培地に収集した。クローンおよびプールは、受容体アゴニストまたはホルスコリンによる刺激に対するそれらの応答について検定した。いくつかのクローンは、良好な応答を示し、後次実験で使用するために1つを選択した。
293EBNA細胞を、100mm皿に1.5x106細胞/皿の密度で、DMEM(高グルコース)+5%FBS+1%MEM非必須アミノ酸+1%ピルビン酸ナトリウム中で播種した。翌日、FuGENE6と、pcDNA3.1/ゼオシン/cynoCRLRプラスpcDNA3.1/ヒグロマイシン/cynoRAMP1を使用して、細胞を共トランスフェクトした。両方の組成物をFspIで線形化した。48時間後、200μg/mLゼオシン+400μg/mLヒグロマイシンを1:20、1:40、1:100、および1:200の希釈で含有する成長培地中で、細胞を二次培養した。培地は、週に2回交換した。2週間後、96個のトランスフェクトしたコロニーを、クローニングリングを用いて単離した。クローンは、CGRPリガンドによる刺激に対するそれらの応答について検定した。いくつかのクローンが、同様の高レベルの応答を示し、後次実験に使用するために1つを選択した。
CGRP8-37ペプチドアナログを、以下の配列により合成した(Midwest Bio-Tech Inc.Fishers,IN)。
Ac-WVTHRLAGLLSRSGGVVRCNFVPTDVGPFAF-NH2(配列番号9)
ヒトCRLR(配列番号6)およびヒトRAMP1(配列番号8)のN末端細胞外ドメイン(ECD)を含有する可用性CGRP受容体ポリペプチドを、下記のような対応するcDNA(配列番号5または配列番号7を含有するベクターと、293 6E細胞を一時的に共トランスフェクトすることによって生成した(Durocher,et al.,Nucleic Acids Res.30:E9(2002))。一般に使用されるタグ(polyHis、Flag、HAおよび/またはFc)を、分泌および/または後次精製を促進するように用いた。
膜抽出は、Bosse,R.et al.,(Journal of Biomolecular Screening,3(4):285-292(1998))によって記載される方法を使用して、CGRP受容体発現細胞から調製した。簡潔に述べると、約5gの細胞ペーストを、50mLのPBS中、3,000rpmで10分間、4℃でペレット化し、30mLの冷溶解バッファ(25mM HEPES、pH7.4、3mM MgCl2プラス1Rocheプロテアーゼ阻害剤カクテル錠/50mL)中で再懸濁させた。溶解物は、Glas-Col(テフロン(登録商標)-ガラスホモジナイザ)を用いて、約20ストローク、5,000rpmで均質化し、JA21中、20,000rpmで15分間、4℃で回転させた。このプロセスを再度繰り返し、最終ペレットを約1~5mLの「最終ペレット」バッファ(25mM HEPES、pH7.4、3mM MgCl2、10%(w/v)スクロースプラス1Rocheプロテアーゼ阻害剤カクテル錠/50mL)中で再懸濁させた。膜抽出物を、16Gおよび25Gニードルを2-3回通過させることによってせん断した。総膜タンパク質濃度は、マイクロプレートBCAタンパク質測定(Pierce)を用いて決定した。
A. 免疫付与
免疫付与は、実施例1に記載のとおり調製した、以下の形態のCGRP受容体抗原を使用して行なった。
(i)細胞表面において全長ヒトCRLRおよびRAMP1を発現し、CHO細胞を、配列番号2を有するポリペプチドをコード化するヒト全長CRLR cDNA(配列番号1)および配列番号4を有するポリペプチドをコード化するRAMP1 cDNA(配列番号3)で共トランスフェクトすることによって得られる、AM-1 CHOトランスフェクタント、
(ii)上記(i)に記載される細胞からの膜抽出、および
(iii)実施例1に記載されるようなCRLRのN末端ECD(配列番号6)およびRAMP1の細胞外ドメイン(ECD)(配列番号8)を共発現および精製することによって得られる、可溶性CGRP受容体。
適切な力価を呈する動物を特定し、リンパ球を排出リンパ節から得て、必要に応じて、各群にプールした。リンパ球は、適切な培地中(例えば、Dulbecco’s Modified Eagle Medium;DMEM、Invitrogen,Carlsbad,CAから入手可能)で、リンパ組織から解離し、細胞を組織から放出して、DMEM中に懸濁させた。適切な方法を使用して、B細胞を選択および/または拡大し、適切な融合パートナー、例えば、非分泌性骨髄腫P3X63Ag8.653細胞と融合させた(American Type Culture Collection CRL 1580、Kearney et al,J.Immunol.123,1979,1548-1550)。
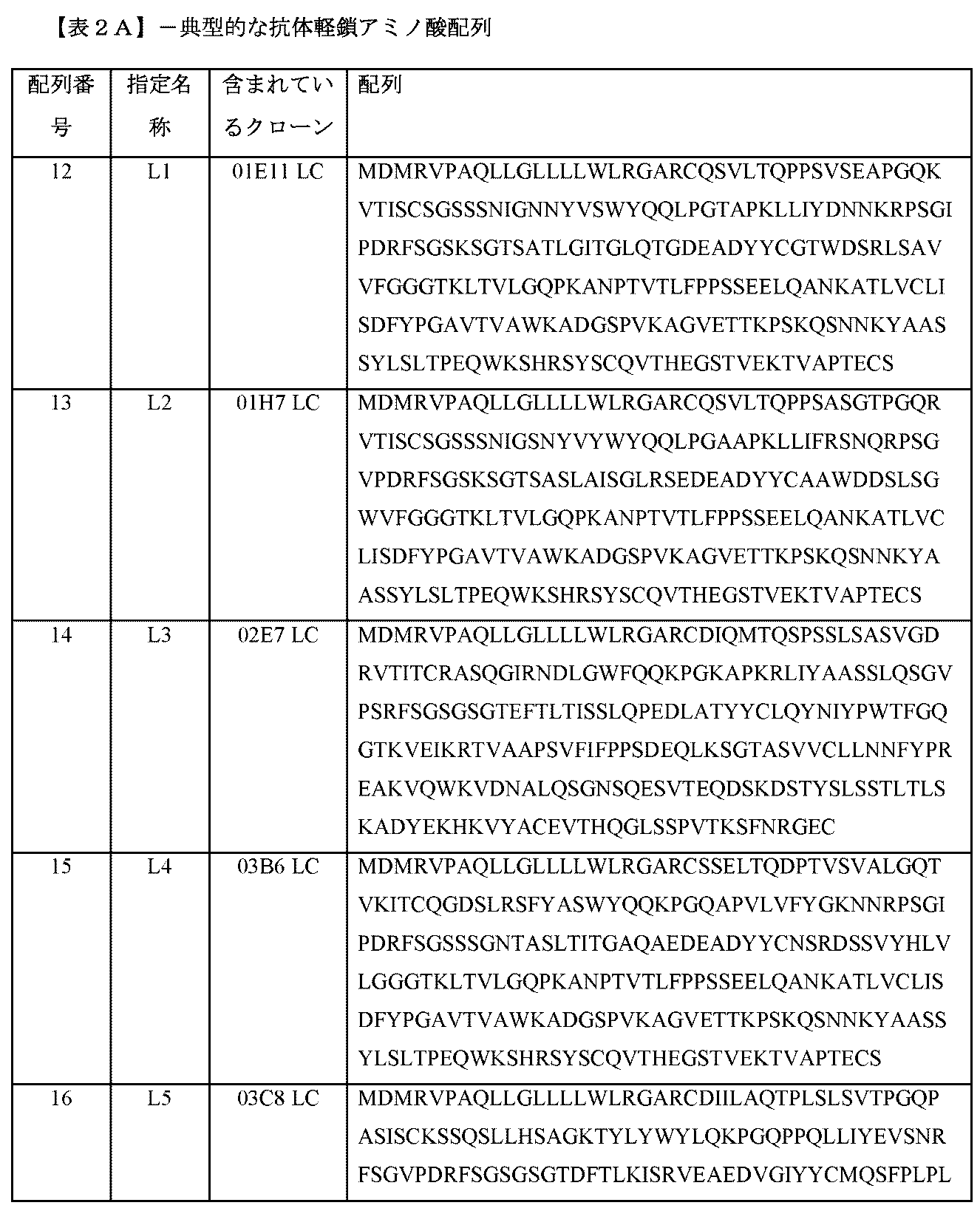
選択したサブクローニングモノクローナル抗体を、標準RT-PCR法を使用して配列決定した。表2Aは、本明細書に開示される典型的な抗体の軽鎖のアミノ酸配列を示す。表2Bは、本明細書に開示される典型的な抗体の重鎖のアミノ酸配列を示す。
A. FMATによるCGRP受容体特異的抗体の選択
14日の培養後、ハイブリドーマ上清を、CGRP R特異的モノクローナル抗体について、Fluorometric Microvolume Assay Technology(FMAT)(Applied Biosystems,Foster City,CA)によってスクリーニングした。上清は、AM-1 CHO huCGRP R細胞またはヒトCGRP Rでトランスフェクトした組み換えHEK293細胞のいずれかに対してスクリーニングし、親HEK293細胞(実施例1に記載されるように調製)に対して逆スクリーニングした。
リガンド結合競合方法を、CGRP受容体に結合し、CGRPリガンド結合を遮断する抗体を(ハイブリドーマ上清中で)特定するために開発した。384ウェルプレート(Corning Costar、カタログ番号3712)を、5,000AM1 huCGRP R プール2細胞および20,000個の非トランスフェクトCHO-S細胞により各ウェルで調製した。20μLの抗CGRP Rハイブリドーマ上清を各ウェルに添加し、プレートを1時間室温で培養した。次に、10μLの2.8μg/mLのAlexa647-CGRP8-37ペプチドを各ウェルに添加し、プレートをさらに3時間、室温で培養した。細胞に結合したAlexa647-CGRP8-37の量を、FMAT8200細胞検出システム(Applied Biosystems)上で測定した。出力データは、シグナル強度のFL1数値(高いFL1値は、高いシグナル強度を示す)および細胞の画像の両方であった。
Rハイブリドーマ上清の実施例を示す。
A.CGRP受容体抗体活性
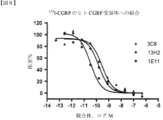
選択されたCGRP受容体抗体を、インビトロCGRP受容体媒介性cAMP検定においてスクリーニングし、本来の能力を決定した。インビトロcAMP検定は、ATCC(ATCC番号HTB-10、「HTB-10細胞」)から取得したヒト神経芽細胞腫由来の細胞株(SK-N-MC、Spengler,et al.,(1973)In Vitro 8:410)を用いた。HTB-10細胞は、CRLRおよびRAMP1を発現し、CGRP受容体を形成する(L.M.McLatchie et al,1998)。組み換えカニクイザルCGRP Rを発現する293EBNA細胞株を、実施例1に記載されるように生成し、ラットCGRP受容体を発現するラットL6細胞株を、ATCC(CRL-1458)から取得した。
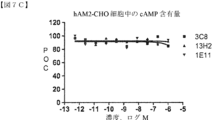
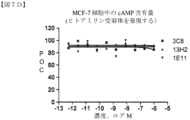
関連受容体AM1(hCRLR+hRAMP2を発現するHEK293細胞、D.R.Poyner,et al,Pharmacological review,54:233-246,2002)、AM2(hCRLR+hRAMP3を発現するCHO細胞、D.R.Poyner,et al,Pharmacological review,54:233-246,2002)またはヒトアミリンAMY1受容体(hCTR+hRAMP1を発現するMCF-7細胞、Wen-Ji Chen,et al,Molecular pharmacology,52:1164-1175,1997)を発現する細胞を使用して、試験した抗体の選択性を決定した。AM1発現HEK293細胞株は、上記の実施例1に記載されるように生成した。AM2発現CHO細胞株は、EuroScreen(現在のPerkinElmer,Inc.)から購入し、ヒトアミリンAMY1受容体発現MCF-7細胞株(Zimmermann,et al,Journal of Endocrinology,423-431,1997)は、ATCC(HTB-22)から取得した。上述のようにプロットされた典型的な結果を、図7B(hAM1-HEK細胞)、7C(hAM2-CHO細胞)および7D(hAMY-MCF-7細胞)に示す。試験した抗体のいずれも、試験した範囲において、hAM1、hAM2またはhAMY1受容体に対して有意な阻害活性を有しなかったことに留意されたい。
125I標識化CGRP(Amersham Biosciences,Piscataway,NJ)およびHTB-10細胞からの細胞膜(PerkinElmer Inc.,Waltham,Massachusetts)を、試験抗体の様々な濃度の存在下で、放射性リガンド結合実験に使用し、対応するKi値を決定した。CGRP結合検定は、室温で、110μL結合緩衝液(20mM Tris-HCl、pH7.5、5.0mM MgSO4、0.2% BSA(Sigma)、1錠のCompleteTM/50mL緩衝液(プロテアーゼ阻害剤))、20μL試験化合物(10X)、20μL125I-hαCGRP(Amersham Biosciences、10X)、および50μLヒト神経芽細胞腫細胞(HTB-10)膜懸濁液(10μg/ウェル、PerkinElmer)を含有する96ウェルプレートにおいて行った。プレートを、60rpmで振動させながら室温で2時間培養し、次いで、各ウェルの内容物を0.5%ポリエチレンイミン(PEI)処理した(少なくとも1時間)GF/C96ウェルフィルタプレートによりろ過した。GF/Cフィルタプレートを、氷冷50mM Tris、pH7.5で6回洗浄し、55℃のオーブンで1時間乾燥させた。次に、GF/Cプレートの底部を密閉した。40μL MicroscintTM 20を各ウェルに添加し、GF/Cプレートの上部をTopSealTM-A(プレスオン接着密閉フィルム)で密閉し、GF/Cプレーを、TopCount NXT(Packard)で計数した。データは、Prizmを使用して分析した(GraphPad Software Inc.)
細胞上で発現されるCGRP受容体に対する抗CGRP R mAbの親和性は、FACS法を使用して決定した。簡潔に述べると、上述のとおり調製されたAM-1 CHO huCGRP R発現細胞を、10%FBS、NEAA、PS、L Glut、NaPyrおよび0.05%アジ化ナトリウムを含有するDMEM培地において、ウェル当たり16,000または160,000細胞の密度で96ウェルプレートに播種した。CGRP受容体抗体を、50nM~1pMの同一培地において滴定し、細胞とともに培養した。総容量120μL中、プレートシェーカ上で、一晩4℃で培養した後、細胞をPBS+2%FBSで2回洗浄し、遠心分離して、その都度上清を破棄した。7AAD(5μL/ウェル)を含有する100μL/ウェルのG抗-Hu Fc Cy5(5μg/mL、Jackson ImmunoResearch Laboratories Inc.,West Grove,PA,USA)を、次に添加し、4℃で40分間培養した。細胞をPBS+2%FBSで2回洗浄し、遠心分離して、その都度上清を破棄した。次に100μL PBS+2% FBS緩衝液を添加し、FACSによって分析して、結合幾何平均を決定した。Kdは、KinExAソフトウェアを使用して、各抗体濃度における負の幾何平均を、存在する遊離Abの量とすることによって計算した。Rathanaswami,et al.,Biochemical and Biophysical Research Communications 334(2005)1004-1013。2つの異なる細胞濃度において得られたデータを、n曲線分析によって解析し、Rathanaswami,et al.,Biochemical and Biophysical Research Communications 334(2005)1004-1013に記載されるように、Kdおよび95%信頼区間を決定した。
Biacore分析(Karlsson,R.et al.,Methods;A Companion to Methods in Enzymology,6:99-110(1994)は、以下のように行った。製造者の指示に従い、10mM HEPES、0.15M NaCl、3.4mM EDTA、0.005% P-20、pH7.4(HBS-EPバッファ)の連続フローを使用して、抗CGRP受容体抗体をCM5センサーチップ表面に固定した。センサーチップ表面上のカルボキシル基を、0.2M N-エチル-N’(ジメチルアミノプロピル)カルボジイミド(EDC)および0.05M N-ヒドロキシスクシニミド(NHS)を含有する60μLの混合液を注入することによって活性化した。特定の表面を、10mM酢酸中に希釈された180μLの抗CGRP受容体抗体を、pH4.0、濃度30μg/mLで注入することによって取得した。表面上の過剰な反応基を、60μLの1Mエタノールアミンを注入することによって不活性化した。別個の抗体に対する最終固定レベルは、以下のとおりであった。
ウェスタンブロットを使用して、可溶性CGRP受容体-muFc融合タンパク質に対する結合について、3つの代表的なCGRP受容体遮断抗体を試験した。
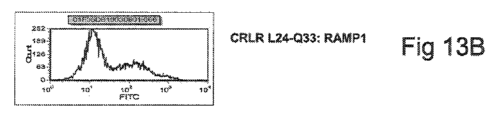
天然RAMP1とキメラCRLR、または天然CRLRとキメラRAMP1のいずれかで形成されるCGRP受容体を使用して、抗体結合に関与するCGRP受容体配列を特定した。試験したヒトCGRP受容体遮断交代のすべてが、ラットCGRP受容体に対する機能的活性を示すことができなかったため、キメラ成分は、ヒト配列バックグラウンドにおいて、ラット配列の領域を含んでいた。以下のキメラを、FACSによる結合分析用に生成した。
RAMP1キメラ番号1(Q28~A34)、配列番号217
ヒトRAMP1におけるアミノ酸残基Q28~A34を、ラットRAMP1からの対応する配列で置換した。この範囲は、ヒトとラットRAMP1との間で異なる5つのアミノ酸残基を含んだ。
RAMP1キメラ番号2(Q43~E53)、配列番号218
ヒトRAMP1におけるアミノ酸残基Q43~E53を、ラットRAMP1からの対応する配列で置換した。この範囲は、ヒトとラットRAMP1との間で異なる6つのアミノ酸残基を含んだ。
RAMP1キメラ番号3(R67~E78)、配列番号219
ヒトRAMP1におけるアミノ酸残基R67~E78を、ラットRAMP1からの対応する配列で置換した。この範囲は、ヒトとラットRAMP1との間で異なる7つのアミノ酸残基を含んだ。
CRLRキメラ番号1(L24~Q33)、配列番号223
ヒトCRLRにおけるアミノ酸残基L24~Q33を、ラットCRLRからの対応する配列で置換した。この範囲は、ヒトCRLRとラットCRLRとの間で異なる8つのアミノ酸残基を含んでいた。
CRLR-Fc融合分子の成熟形態におけるCRLR部分(シグナルペプチドが除去されている、配列番号10として本明細書に開示)は、116個のアミノ酸(グリシンリンカーに先行する)を含み、3つのジスルフィド結合の形成によって形成される3つの大きいループ構造を有する。CRLRにおける3つのジスルフィド結合は、配列位置26におけるCys1であり(このパラグラフに列挙されるすべてのCRLR配列位置は、配列番号10として提示される成熟配列に関する)、配列位置52においてCys3に結合され(CRLR C1-C3と称される)、配列位置43におけるCys2は、配列位置83におけるCys5に結合され(CRLRC2-C5と称される)、配列位置66におけるCys4は、配列位置105におけるCys6に結合される(C4-C6と称される)。RAMP1-Fc融合分子の成熟形態におけるRAMP1部分は、グリシンリンカーに先行して91個のアミノ酸(配列番号11)を含み、これも3つの分子内ジスルフィド結合を形成する。RAMP1における3つのジスルフィド結合は、配列位置1においてCys1であり(このパラグラフに列挙されるすべてのRAMP1配列位置は、配列番号11として提示される成熟配列に関する)、配列位置56におけるCys5に結合され(RAMP1 C1-C5と称される)、配列位置14におけるCys2は、配列位置46におけるCys4に結合され(RAMP1 C2-C4に参照される)、配列位置31におけるCys3は、配列位置78におけるCys6に結合される(RAMP1 C3-C6と称される)。
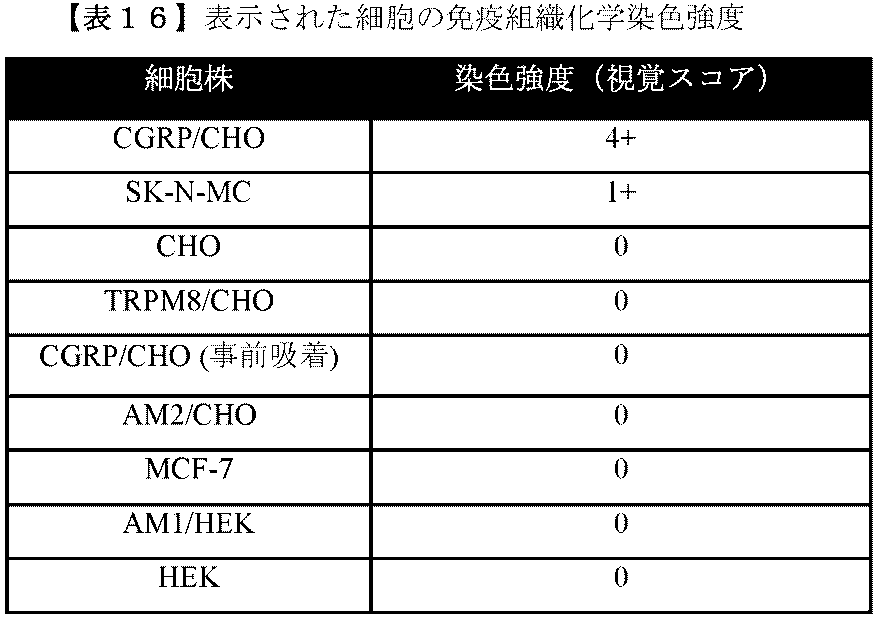
ヒトCGRP受容体の1つまたは他の成分(RAMP1またはCRLR)に対する市販の抗体を、上記実施例4に記載されるようなHTB-10細胞を使用して、CGRP受容体媒介性cAMP検定においてスクリーニングし、抗体が生物活性を有するか否かを決定した。データを、以下の表15に提示する。それらの抗体は、本明細書に開示される典型的な抗体が強い生物活性を有する濃度範囲において、検出不可能(「ND」)、非常に弱い(「VW」)、または弱い(「W」)生物活性のいずれかを有した。
2-4x106個の細胞を、コラプラグ(Integra LifeSciences Co.,Plainsboro,NJ)ごとに注入した。コラプラグをOCT培地(Sakura Finetek Inc.,Torrance,CA)に埋め込み、-20℃で凍結させ、クリオスタットを使用して、20μmの切片に切断した。切片を4%パラホルムアルデヒドで1時間、室温(RT)で固定し、続いて、リン酸緩衝生理食塩水で洗浄した。内因性ペルオキシダーゼを3% H2O2/PBSで15分間遮断し、続いて、切片を遮断溶液(3%正常ヤギ血清(Vector Labs,Burlingame,CA)および0.3%トリトンX-100を含むPBS)中で1時間培養した。続いて、切片をヒト抗CGRP受容体一次抗体(32H7、0.03-0.1μg/mL)中、4℃で一晩培養し、PBS中で洗浄して、1%正常ヤギ血清中の二次抗体(ビオチン化ヤギ抗ヒトIgG Fc断片、1:800、Jackson Immunoresearch,West Grove,PA)において1時間、室温で培養した。Vector Eliteキットを使用し、製造者(Vector Labs,Burlingame CA)に従って、免疫反応を増幅させ、色原体として3,3’-ジアミノベンジジン-ニッケル(Sigma-Aldrich,St.Louis,MO)を使用して、染色を展開させた。切片をキシレンでクリアし、Permountにより(Fisher Chemicals,Fair Lawn,NJ)カバースリップした。免疫反応は、Nikon E-800顕微鏡および関連ソフトウェア(Nikon,Melville,NY)を使用して分析した。
Claims (11)
- 重鎖と軽鎖とを含むヒトカルシトニン遺伝子関連ペプチド(CGRP)受容体に特異的に結合する組み換え抗体であって、前記抗体は、重鎖核酸と軽鎖核酸とを発現する宿主細胞から単離され、
(a)前記重鎖核酸が配列番号244の配列を含み、前記軽鎖核酸が配列番号226の配列を含む;
(b)前記重鎖核酸が配列番号257の配列を含み、前記軽鎖核酸が配列番号239の配列を含む;
(c)前記重鎖核酸が配列番号248の配列を含み、前記軽鎖核酸が配列番号230の配列を含む;
(d)前記重鎖核酸が配列番号246の配列を含み、前記軽鎖核酸が配列番号228の配列を含む;
(e)前記重鎖核酸が配列番号249の配列を含み、前記軽鎖核酸が配列番号231の配列を含む;
(f)前記重鎖核酸が配列番号255の配列を含み、前記軽鎖核酸が配列番号237の配列を含む;
(g)前記重鎖核酸が配列番号242の配列を含み、前記軽鎖核酸が配列番号224の配列を含む;
(h)前記重鎖核酸が配列番号247の配列を含み、前記軽鎖核酸が配列番号229の配列を含む;
(i)前記重鎖核酸が配列番号250の配列を含み、前記軽鎖核酸が配列番号232の配列を含む;
(j)前記重鎖核酸が配列番号256の配列を含み、前記軽鎖核酸が配列番号238の配列を含む;
(k)前記重鎖核酸が配列番号252の配列を含み、前記軽鎖核酸が配列番号234の配列を含む;
(l)前記重鎖核酸が配列番号253の配列を含み、前記軽鎖核酸が配列番号235の配列を含む;
(m)前記重鎖核酸が配列番号254の配列を含み、前記軽鎖核酸が配列番号236の配列を含む;
(n)前記重鎖核酸が配列番号243の配列を含み、前記軽鎖核酸が配列番号225の配列を含む;
(o)前記重鎖核酸が配列番号251の配列を含み、前記軽鎖核酸が配列番号233の配列を含む;
(p)前記重鎖核酸が配列番号245の配列を含み、前記軽鎖核酸が配列番号227の配列を含む;
(q)前記重鎖核酸が配列番号258の配列を含み、前記軽鎖核酸が配列番号240の配列を含む;または
(r)前記重鎖核酸が配列番号258の配列を含み、前記軽鎖核酸が配列番号241の配列を含む、組み換え抗体。 - 前記宿主細胞が前記抗体を分泌し、前記抗体が前記宿主細胞の培地から単離される、請求項1に記載の組み換え抗体。
- 前記重鎖核酸が配列番号247の配列を含み、前記軽鎖核酸が配列番号229の配列を含む、請求項1または2に記載の組み換え抗体。
- 前記重鎖核酸が配列番号251の配列を含み、前記軽鎖核酸が配列番号233の配列を含む、請求項1または2に記載の組み換え抗体。
- 請求項1~4のいずれか一項に記載の抗体および薬学的に許容される賦形剤を含む薬学的組成物。
- 請求項1~4のいずれか一項に記載の抗体を含む、処置を必要とする患者においてCGRP受容体媒介性の血管拡張または神経性炎症と関連付けられる症状を処置するための薬学的組成物。
- 前記症状が頭痛である、請求項6に記載の薬学的組成物。
- 前記症状が片頭痛である、請求項6に記載の薬学的組成物。
- 前記抗体が、片頭痛発作の頻度を低減させるために前記患者に対して周期的に投与される、請求項8に記載の薬学的組成物。
- 請求項1~4のいずれか一項に記載の抗体を生成する方法であって、
請求項1~4のいずれか一項に記載の抗体の前記重鎖核酸および軽鎖核酸を発現する宿主細胞から前記抗体を単離すること
を含む、方法。 - 前記宿主細胞が前記抗体を分泌し、前記抗体が前記宿主細胞の培地から単離される、請求項10に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US20356908P | 2008-12-23 | 2008-12-23 | |
| US61/203,569 | 2008-12-23 | ||
| US26462209P | 2009-11-25 | 2009-11-25 | |
| US61/264,622 | 2009-11-25 | ||
| JP2020196689A JP2021036912A (ja) | 2008-12-23 | 2020-11-27 | ヒトcgrp受容体結合タンパク質 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020196689A Division JP2021036912A (ja) | 2008-12-23 | 2020-11-27 | ヒトcgrp受容体結合タンパク質 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023116783A JP2023116783A (ja) | 2023-08-22 |
| JP7584577B2 true JP7584577B2 (ja) | 2024-11-15 |
Family
ID=41718325
Family Applications (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011543606A Active JP5761805B2 (ja) | 2008-12-23 | 2009-12-18 | ヒトcgrp受容体結合タンパク質 |
| JP2014164088A Active JP6261132B2 (ja) | 2008-12-23 | 2014-08-12 | ヒトcgrp受容体結合タンパク質 |
| JP2015219157A Withdrawn JP2016026224A (ja) | 2008-12-23 | 2015-11-09 | ヒトcgrp受容体結合タンパク質 |
| JP2018246704A Withdrawn JP2019062907A (ja) | 2008-12-23 | 2018-12-28 | ヒトcgrp受容体結合タンパク質 |
| JP2020196689A Withdrawn JP2021036912A (ja) | 2008-12-23 | 2020-11-27 | ヒトcgrp受容体結合タンパク質 |
| JP2023101810A Active JP7584577B2 (ja) | 2008-12-23 | 2023-06-21 | ヒトcgrp受容体結合タンパク質 |
Family Applications Before (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011543606A Active JP5761805B2 (ja) | 2008-12-23 | 2009-12-18 | ヒトcgrp受容体結合タンパク質 |
| JP2014164088A Active JP6261132B2 (ja) | 2008-12-23 | 2014-08-12 | ヒトcgrp受容体結合タンパク質 |
| JP2015219157A Withdrawn JP2016026224A (ja) | 2008-12-23 | 2015-11-09 | ヒトcgrp受容体結合タンパク質 |
| JP2018246704A Withdrawn JP2019062907A (ja) | 2008-12-23 | 2018-12-28 | ヒトcgrp受容体結合タンパク質 |
| JP2020196689A Withdrawn JP2021036912A (ja) | 2008-12-23 | 2020-11-27 | ヒトcgrp受容体結合タンパク質 |
Country Status (42)
Families Citing this family (118)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SI2380592T1 (en) | 2005-11-14 | 2018-06-29 | Teva Pharmaceuticals International Gmbh | The antibody to the calcitonin-related peptide antagonist |
| BRPI0820387A2 (pt) * | 2007-11-21 | 2015-05-26 | Amgen Inc | Agentes de ligação de wise e epítopos |
| CN101959528A (zh) | 2008-03-04 | 2011-01-26 | 辉瑞有限公司 | 治疗慢性疼痛的方法 |
| JO3382B1 (ar) * | 2008-12-23 | 2019-03-13 | Amgen Inc | أجسام مضادة ترتبط مع مستقبل cgrp بشري |
| RU2535074C2 (ru) | 2009-08-28 | 2014-12-10 | Лэйбрис Байолоджикс, Инк. | Способы лечения висцеральной боли путем введения антител-антагонистов, направленных против пептида, связанного с геном кальцитонина |
| TWI692485B (zh) | 2011-05-20 | 2020-05-01 | 美商艾爾德生物控股有限責任公司 | 抗降血鈣素基因相關胜肽(anti-cgrp)組成物及其用途 |
| US9708393B2 (en) * | 2011-05-20 | 2017-07-18 | Alderbio Holdings Llc | Use of anti-CGRP antibodies and antibody fragments to prevent or inhibit photophobia or light aversion in subjects in need thereof, especially migraine sufferers |
| NZ717704A (en) | 2011-05-20 | 2022-08-26 | H Lundbeck As | Use of anti-cgrp or anti-cgrp-r antibodies or antibody fragments to treat or prevent chronic and acute forms of diarrhea |
| CA2906737C (en) | 2013-03-15 | 2023-08-15 | Amgen Inc. | Human pac1 antibodies |
| JP6469644B2 (ja) | 2013-03-15 | 2019-02-13 | アムジエン・インコーポレーテツド | 抗ccr7抗原結合タンパク質に関係する方法および組成物 |
| US20170114122A1 (en) | 2015-10-23 | 2017-04-27 | Alderbio Holdings Llc | Regulation of glucose metabolism using anti-cgrp antibodies |
| SG11201600853UA (en) | 2013-08-05 | 2016-03-30 | Twist Bioscience Corp | De novo synthesized gene libraries |
| AU2014340174B2 (en) | 2013-10-24 | 2019-09-12 | Amgen Inc. | Drug delivery system with temperature-sensitive control |
| CN105873626A (zh) | 2013-10-24 | 2016-08-17 | 美国安进公司 | 注射器和组装方法 |
| WO2015119906A1 (en) | 2014-02-05 | 2015-08-13 | Amgen Inc. | Drug delivery system with electromagnetic field generator |
| US10556945B2 (en) | 2014-03-21 | 2020-02-11 | Teva Pharmaceuticals International Gmbh | Antagonist antibodies directed against calcitonin gene-related peptide and methods using same |
| FI3119431T3 (fi) * | 2014-03-21 | 2024-03-20 | Teva Pharmaceuticals Int Gmbh | Kalsitoniinigeeniin liittyvää peptidiä vastaan suunnattuja antagonisti-vasta-aineita ja menetelmiä niiden käyttämiseksi |
| SG11201609219QA (en) | 2014-05-07 | 2016-12-29 | Amgen Inc | Autoinjector with shock reducing elements |
| CN106488782B (zh) | 2014-06-03 | 2021-03-09 | 安姆根有限公司 | 用于辅助药物递送装置的用户的装置和方法 |
| CA2960756C (en) | 2014-09-15 | 2023-08-01 | Amgen Inc. | Bi-specific anti-cgrp receptor/pac1 receptor antigen binding proteins and uses thereof |
| US10695506B2 (en) | 2014-10-14 | 2020-06-30 | Amgen Inc. | Drug injection device with visual and audio indicators |
| US10799630B2 (en) | 2014-12-19 | 2020-10-13 | Amgen Inc. | Drug delivery device with proximity sensor |
| JP2017538512A (ja) | 2014-12-19 | 2017-12-28 | アムジエン・インコーポレーテツド | ライブボタンまたはユーザインタフェースフィールドを含む薬物送達装置 |
| KR20170128234A (ko) | 2015-01-16 | 2017-11-22 | 주노 쎄러퓨티크스 인코퍼레이티드 | Ror1에 특이적인 항체 및 키메라 항원 수용체 |
| CA2975852A1 (en) | 2015-02-04 | 2016-08-11 | Twist Bioscience Corporation | Methods and devices for de novo oligonucleic acid assembly |
| EP3556411B1 (en) | 2015-02-17 | 2021-06-30 | Amgen Inc. | Drug delivery device with vacuum assisted securement and/or feedback |
| ES2905870T3 (es) | 2015-02-27 | 2022-04-12 | Amgen Inc | Dispositivo de suministro de fármacos que tiene un mecanismo de protección de aguja con un umbral de resistencia ajustable al movimiento de la protección de aguja |
| US9981239B2 (en) | 2015-04-21 | 2018-05-29 | Twist Bioscience Corporation | Devices and methods for oligonucleic acid library synthesis |
| JOP20200116A1 (ar) | 2015-04-24 | 2017-06-16 | Amgen Inc | طرق لعلاج أو الوقاية من الصداع النصفي |
| US10464983B2 (en) | 2015-05-13 | 2019-11-05 | The Board Of Regents Of The University Of Oklahoma | Variants of adrenomedullin and calcitonin gene-related peptide and methods of use |
| WO2017039786A1 (en) | 2015-09-02 | 2017-03-09 | Amgen Inc. | Syringe assembly adapter for a syringe |
| EA201890763A1 (ru) | 2015-09-18 | 2018-08-31 | Твист Байосайенс Корпорейшн | Библиотеки вариантных олигонуклеиновых кислот и их синтез |
| KR102794025B1 (ko) | 2015-09-22 | 2025-04-09 | 트위스트 바이오사이언스 코포레이션 | 핵산 합성을 위한 가요성 기판 |
| WO2017100501A1 (en) | 2015-12-09 | 2017-06-15 | Amgen Inc. | Auto-injector with signaling cap |
| WO2017120178A1 (en) | 2016-01-06 | 2017-07-13 | Amgen Inc. | Auto-injector with signaling electronics |
| AU2017213844A1 (en) | 2016-02-02 | 2018-08-02 | Fred Hutchinson Cancer Center | Anti-ROR1 antibodies and uses thereof |
| ES2814287T3 (es) | 2016-03-15 | 2021-03-26 | Amgen Inc | Reducir la probabilidad de rotura de cristal en dispositivos de administración de fármaco |
| JP7116685B2 (ja) | 2016-04-15 | 2022-08-10 | エイチ. ルンドベック アー/エス | ヒト化抗pacap抗体及びそれらの使用 |
| US11541168B2 (en) | 2016-04-29 | 2023-01-03 | Amgen Inc. | Drug delivery device with messaging label |
| US11389588B2 (en) | 2016-05-02 | 2022-07-19 | Amgen Inc. | Syringe adapter and guide for filling an on-body injector |
| MX2018013616A (es) | 2016-05-13 | 2019-02-21 | Amgen Inc | Montaje de cubierta protectora de vial. |
| US11238150B2 (en) | 2016-05-16 | 2022-02-01 | Amgen Inc. | Data encryption in medical devices with limited computational capability |
| EP3465124A1 (en) | 2016-06-03 | 2019-04-10 | Amgen Inc. | Impact testing apparatuses and methods for drug delivery devices |
| EP3478342B1 (en) | 2016-07-01 | 2025-03-12 | Amgen Inc. | Drug delivery device having minimized risk of component fracture upon impact events |
| US20190328965A1 (en) | 2016-08-17 | 2019-10-31 | Amgen Inc. | Drug delivery device with placement detection |
| EP3516528B1 (en) | 2016-09-21 | 2025-10-15 | Atlas Data Storage, Inc. | Nucleic acid based data storage |
| EA201990548A1 (ru) | 2016-09-23 | 2019-09-30 | Тева Фармасьютикалз Интернэшнл Гмбх | Лечение кластерной головной боли |
| KR20190066607A (ko) | 2016-09-23 | 2019-06-13 | 테바 파마슈티컬스 인터내셔널 게엠베하 | 불응성 편두통의 치료 |
| WO2018081234A1 (en) | 2016-10-25 | 2018-05-03 | Amgen Inc. | On-body injector |
| WO2018132572A1 (en) * | 2017-01-11 | 2018-07-19 | The Board Of Trustees Of The Leland Stanford Junior University | R-spondin (rspo) surrogate molecules |
| EP3570917A1 (en) | 2017-01-17 | 2019-11-27 | Amgen Inc. | Injection devices and related methods of use and assembly |
| EP3574019A4 (en) | 2017-01-26 | 2021-03-03 | Surrozen, Inc. | TISSUE-SPECIFIC WNT SIGNAL ENHANCEMENT MOLECULES AND THEIR USES |
| MX2019009755A (es) | 2017-02-17 | 2019-10-07 | Amgen Inc | Mecanismo de insercion para dispositivo de suministro de farmacos. |
| EP3582825A1 (en) | 2017-02-17 | 2019-12-25 | Amgen Inc. | Drug delivery device with sterile fluid flowpath and related method of assembly |
| JP2020508661A (ja) | 2017-02-22 | 2020-03-26 | ツイスト バイオサイエンス コーポレーション | 核酸ベースのデータ保存 |
| US20190071490A1 (en) | 2017-03-02 | 2019-03-07 | Beth Israel Deaconess Medical Center, Inc. | Preventing Post-Ictal Headaches |
| WO2018165143A1 (en) | 2017-03-06 | 2018-09-13 | Amgen Inc. | Drug delivery device with activation prevention feature |
| EP3592402A1 (en) | 2017-03-07 | 2020-01-15 | Amgen Inc. | Needle insertion by overpressure |
| IL268386B2 (en) | 2017-03-09 | 2023-11-01 | Amgen Inc | Insertion mechanism for a drug delivery device |
| US11957883B2 (en) | 2017-03-28 | 2024-04-16 | Amgen Inc. | Plunger rod and syringe assembly system and method |
| EP3634539A1 (en) | 2017-06-08 | 2020-04-15 | Amgen Inc. | Syringe assembly for a drug delivery device and method of assembly |
| CN110709121B (zh) | 2017-06-08 | 2022-06-24 | 安进公司 | 扭矩驱动式药物递送装置 |
| AU2018288604B2 (en) | 2017-06-22 | 2023-12-21 | Amgen Inc. | Device activation impact/shock reduction |
| MX2019015479A (es) | 2017-06-23 | 2020-02-20 | Amgen Inc | Dispositivo electronico de administracion de farmacos con tapa accionada por un conjunto de conmutador. |
| WO2019014014A1 (en) | 2017-07-14 | 2019-01-17 | Amgen Inc. | NEEDLE INSERTION-RETRACTING SYSTEM HAVING DOUBLE TORSION SPRING SYSTEM |
| EP4292576A3 (en) | 2017-07-21 | 2024-01-17 | Amgen Inc. | Gas permeable sealing member for drug container and methods of assembly |
| US11484648B2 (en) | 2017-07-25 | 2022-11-01 | Amgen Inc. | Drug delivery device with container access system and related method of assembly |
| US11617837B2 (en) | 2017-07-25 | 2023-04-04 | Amgen Inc. | Drug delivery device with gear module and related method of assembly |
| EP3664863A2 (en) | 2017-08-09 | 2020-06-17 | Amgen Inc. | Hydraulic-pneumatic pressurized chamber drug delivery system |
| EP3668567A1 (en) | 2017-08-18 | 2020-06-24 | Amgen Inc. | Wearable injector with sterile adhesive patch |
| US11103636B2 (en) | 2017-08-22 | 2021-08-31 | Amgen Inc. | Needle insertion mechanism for drug delivery device |
| MA50611A (fr) | 2017-10-04 | 2020-08-12 | Amgen Inc | Adaptateur d'écoulement destiné à un dispositif d'administration de médicament |
| CN111132711B (zh) | 2017-10-06 | 2022-07-01 | 安进公司 | 带有联锁组件的药物递送装置及相关组装方法 |
| WO2019074579A1 (en) | 2017-10-09 | 2019-04-18 | Amgen Inc. | DRUG DELIVERY DEVICE COMPRISING A DRIVE ASSEMBLY AND ASSEMBLY METHOD THEREOF |
| KR102637566B1 (ko) | 2017-10-20 | 2024-02-16 | 트위스트 바이오사이언스 코포레이션 | 폴리뉴클레오타이드 합성을 위한 가열된 나노웰 |
| US11826480B2 (en) | 2017-11-03 | 2023-11-28 | Amgen Inc. | Systems and approaches for sterilizing a drug delivery device |
| WO2019090303A1 (en) | 2017-11-06 | 2019-05-09 | Amgen Inc. | Fill-finish assemblies and related methods |
| WO2019089178A1 (en) | 2017-11-06 | 2019-05-09 | Amgen Inc. | Drug delivery device with placement and flow sensing |
| WO2019094138A1 (en) | 2017-11-10 | 2019-05-16 | Amgen Inc. | Plungers for drug delivery devices |
| EP3710090A1 (en) | 2017-11-16 | 2020-09-23 | Amgen Inc. | Door latch mechanism for drug delivery device |
| AR114080A1 (es) | 2018-01-12 | 2020-07-22 | Amgen Inc | Anticuerpos pac1 y sus usos |
| MX2020010320A (es) | 2018-04-02 | 2021-01-08 | Amgen Inc | Composiciones de erenumab y usos de las mismas. |
| IL277797B1 (en) | 2018-04-12 | 2024-11-01 | Amgen Inc | Methods for making stable protein compositions |
| CN118957038A (zh) | 2018-05-18 | 2024-11-15 | 特韦斯特生物科学公司 | 用于核酸杂交的多核苷酸、试剂和方法 |
| US10835685B2 (en) | 2018-05-30 | 2020-11-17 | Amgen Inc. | Thermal spring release mechanism for a drug delivery device |
| US11083840B2 (en) | 2018-06-01 | 2021-08-10 | Amgen Inc. | Modular fluid path assemblies for drug delivery devices |
| JP2021530223A (ja) | 2018-07-09 | 2021-11-11 | スロゼン, インコーポレイテッド | 組織特異性Wntシグナル増強分子及びその使用 |
| MX2021000748A (es) | 2018-07-24 | 2021-03-26 | Amgen Inc | Dispositivos de suministro para administrar farmacos. |
| US12303677B2 (en) | 2018-07-24 | 2025-05-20 | Amgen Inc. | Hybrid drug delivery devices with optional grip portion and related method of preparation |
| CA3103682A1 (en) | 2018-07-24 | 2020-01-30 | Amgen Inc. | Delivery devices for administering drugs |
| WO2020023336A1 (en) | 2018-07-24 | 2020-01-30 | Amgen Inc. | Hybrid drug delivery devices with grip portion |
| EP3829692A1 (en) | 2018-07-31 | 2021-06-09 | Amgen Inc. | Fluid path assembly for a drug delivery device |
| MA53724A (fr) | 2018-09-24 | 2021-12-29 | Amgen Inc | Systèmes et procédés de dosage interventionnel |
| WO2020068476A1 (en) | 2018-09-28 | 2020-04-02 | Amgen Inc. | Muscle wire escapement activation assembly for a drug delivery device |
| CN117159846A (zh) | 2018-10-02 | 2023-12-05 | 安进公司 | 具有内部力传递的用于药物递送的注射系统 |
| MA53818A (fr) | 2018-10-05 | 2022-01-12 | Amgen Inc | Dispositif d'administration de médicament ayant un indicateur de dose |
| SG11202103800RA (en) | 2018-10-15 | 2021-05-28 | Amgen Inc | Drug delivery device having damping mechanism |
| EP3866889A1 (en) | 2018-10-15 | 2021-08-25 | Amgen Inc. | Platform assembly process for drug delivery device |
| TWI831847B (zh) | 2018-11-01 | 2024-02-11 | 美商安進公司 | 部分針頭縮回之藥物遞送裝置及其操作方法 |
| EP3873566B1 (en) | 2018-11-01 | 2024-11-27 | Amgen Inc. | Drug delivery devices with partial drug delivery member retraction |
| MA54057A (fr) | 2018-11-01 | 2022-02-09 | Amgen Inc | Dispositifs d'administration de médicament à rétraction partielle d'élément d'administration de médicament |
| CA3124980A1 (en) | 2018-12-26 | 2020-07-02 | Twist Bioscience Corporation | Highly accurate de novo polynucleotide synthesis |
| WO2020146527A1 (en) | 2019-01-08 | 2020-07-16 | Alder Biopharmaceuticals, Inc. | Acute treatment and rapid treatment of headache using anti-cgrp antibodies |
| JP2022521551A (ja) | 2019-02-26 | 2022-04-08 | ツイスト バイオサイエンス コーポレーション | Glp1受容体の変異体核酸ライブラリ |
| MX2021012557A (es) | 2019-04-24 | 2021-11-12 | Amgen Inc | Conjuntos y metodos de verificacion de esterilizacion de jeringuillas. |
| WO2020239014A1 (zh) * | 2019-05-30 | 2020-12-03 | 山东博安生物技术有限公司 | 抗cgrp抗体及其应用 |
| MX2021015791A (es) | 2019-06-28 | 2022-04-01 | Amgen Inc | Proteínas de unión al antígeno biespecificas anti-receptor de cgrp/anti-receptor pac1. |
| AU2020337250A1 (en) | 2019-08-23 | 2022-03-03 | Amgen Inc. | Drug delivery device with configurable needle shield engagement components and related methods |
| JP2022548783A (ja) | 2019-09-23 | 2022-11-21 | ツイスト バイオサイエンス コーポレーション | 単一ドメイン抗体のバリアント核酸ライブラリー |
| WO2021061829A1 (en) | 2019-09-23 | 2021-04-01 | Twist Bioscience Corporation | Variant nucleic acid libraries for crth2 |
| SG10202003296VA (en) | 2020-04-06 | 2021-11-29 | H Lundbeck As | Treatment of most bothersome symptom (mbs) associated with migraine using anti-cgrp antibodies |
| KR20230109668A (ko) | 2020-11-16 | 2023-07-20 | 서로젠 오퍼레이팅, 인크. | 간-특이적 Wnt 신호 증강 분자 및 그의 용도 |
| US20240139171A1 (en) | 2021-03-02 | 2024-05-02 | Cgrp Diagnostics Gmbh | Treatment and/or reduction of occurrence of migraine |
| AU2022279223A1 (en) | 2021-05-21 | 2023-10-19 | Amgen Inc. | Method of optimizing a filling recipe for a drug container |
| WO2023026205A1 (en) | 2021-08-24 | 2023-03-02 | Cgrp Diagnostics Gmbh | Preventative treatment of migraine |
| EP4519313A1 (en) * | 2022-05-05 | 2025-03-12 | Amgen Inc. | Heteromultimer binding dll3 and cd3 |
| TW202432600A (zh) | 2022-11-07 | 2024-08-16 | 美商安進公司 | 用於治療肥胖症之方法 |
| WO2025226754A1 (en) | 2024-04-23 | 2025-10-30 | Amgen Inc. | Method for predicting osmolality of protein solutions |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005503809A (ja) | 2001-09-27 | 2005-02-10 | メルク エンド カムパニー インコーポレーテッド | ヒト化カルシトニン遺伝子関連ペプチド受容体をコードする単離dna分子、関連する非ヒトトランスジェニック動物及びアッセイ方法 |
| JP2012513214A (ja) | 2008-12-23 | 2012-06-14 | アムジェン インコーポレイテッド | ヒトcgrp受容体結合タンパク質 |
Family Cites Families (105)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US4263428A (en) | 1978-03-24 | 1981-04-21 | The Regents Of The University Of California | Bis-anthracycline nucleic acid function inhibitors and improved method for administering the same |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| IE52535B1 (en) | 1981-02-16 | 1987-12-09 | Ici Plc | Continuous release pharmaceutical compositions |
| DE3374837D1 (en) | 1982-02-17 | 1988-01-21 | Ciba Geigy Ag | Lipids in the aqueous phase |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| HUT35524A (en) | 1983-08-02 | 1985-07-29 | Hoechst Ag | Process for preparing pharmaceutical compositions containing regulatory /regulative/ peptides providing for the retarded release of the active substance |
| DE3474511D1 (en) | 1983-11-01 | 1988-11-17 | Terumo Corp | Pharmaceutical composition containing urokinase |
| US4740461A (en) | 1983-12-27 | 1988-04-26 | Genetics Institute, Inc. | Vectors and methods for transformation of eucaryotic cells |
| US4751180A (en) | 1985-03-28 | 1988-06-14 | Chiron Corporation | Expression using fused genes providing for protein product |
| US4935233A (en) | 1985-12-02 | 1990-06-19 | G. D. Searle And Company | Covalently linked polypeptide cell modulators |
| JPS63502716A (ja) | 1986-03-07 | 1988-10-13 | マサチューセッツ・インステチュート・オブ・テクノロジー | 糖タンパク安定性の強化方法 |
| US4959455A (en) | 1986-07-14 | 1990-09-25 | Genetics Institute, Inc. | Primate hematopoietic growth factors IL-3 and pharmaceutical compositions |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US5260203A (en) | 1986-09-02 | 1993-11-09 | Enzon, Inc. | Single polypeptide chain binding molecules |
| DE3785186T2 (de) | 1986-09-02 | 1993-07-15 | Enzon Lab Inc | Bindungsmolekuele mit einzelpolypeptidkette. |
| US4912040A (en) | 1986-11-14 | 1990-03-27 | Genetics Institute, Inc. | Eucaryotic expression system |
| US5011912A (en) | 1986-12-19 | 1991-04-30 | Immunex Corporation | Hybridoma and monoclonal antibody for use in an immunoaffinity purification system |
| US4965195A (en) | 1987-10-26 | 1990-10-23 | Immunex Corp. | Interleukin-7 |
| US4968607A (en) | 1987-11-25 | 1990-11-06 | Immunex Corporation | Interleukin-1 receptors |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| AU643427B2 (en) | 1988-10-31 | 1993-11-18 | Immunex Corporation | Interleukin-4 receptors |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| JPH02229119A (ja) | 1989-02-28 | 1990-09-11 | Toyo Jozo Co Ltd | 動脈硬化予防および治療剤 |
| US5683888A (en) | 1989-07-22 | 1997-11-04 | University Of Wales College Of Medicine | Modified bioluminescent proteins and their use |
| US5292658A (en) | 1989-12-29 | 1994-03-08 | University Of Georgia Research Foundation, Inc. Boyd Graduate Studies Research Center | Cloning and expressions of Renilla luciferase |
| US6673986B1 (en) | 1990-01-12 | 2004-01-06 | Abgenix, Inc. | Generation of xenogeneic antibodies |
| WO1991010741A1 (en) | 1990-01-12 | 1991-07-25 | Cell Genesys, Inc. | Generation of xenogeneic antibodies |
| US6713610B1 (en) | 1990-01-12 | 2004-03-30 | Raju Kucherlapati | Human antibodies derived from immunized xenomice |
| WO1991018982A1 (en) | 1990-06-05 | 1991-12-12 | Immunex Corporation | Type ii interleukin-1 receptors |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5874299A (en) | 1990-08-29 | 1999-02-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5877397A (en) | 1990-08-29 | 1999-03-02 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| ATE158021T1 (de) | 1990-08-29 | 1997-09-15 | Genpharm Int | Produktion und nützung nicht-menschliche transgentiere zur produktion heterologe antikörper |
| US6255458B1 (en) | 1990-08-29 | 2001-07-03 | Genpharm International | High affinity human antibodies and human antibodies against digoxin |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5789650A (en) | 1990-08-29 | 1998-08-04 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US6300129B1 (en) | 1990-08-29 | 2001-10-09 | Genpharm International | Transgenic non-human animals for producing heterologous antibodies |
| ES2142801T3 (es) | 1991-03-11 | 2000-05-01 | Univ Georgia Res Found | Clonacion y expresion de luciferasa de renilla. |
| EP0590076A4 (en) | 1991-06-14 | 1997-02-12 | Dnx Corp | Production of human hemoglobin in transgenic pigs |
| DE69224906T2 (de) | 1991-07-08 | 1998-10-29 | Univ Massachusetts | Thermotropes flüssig-kristallines segment-blockcopolymer |
| US5262522A (en) | 1991-11-22 | 1993-11-16 | Immunex Corporation | Receptor for oncostatin M and leukemia inhibitory factor |
| WO1993019180A1 (en) * | 1992-03-17 | 1993-09-30 | Ciba-Geigy Ag | Genetically engineered antibodies |
| AU675661B2 (en) | 1992-07-24 | 1997-02-13 | Abgenix, Inc. | Generation of xenogeneic antibodies |
| DK0672141T3 (da) | 1992-10-23 | 2003-06-10 | Immunex Corp | Fremgangsmåder til fremstilling af opløselige, oligomere proteiner |
| US5766880A (en) | 1992-10-27 | 1998-06-16 | Queen's University At Kingston | Isolated nucleic acid molecules encoding multidrug resistance proteins |
| US5457035A (en) | 1993-07-23 | 1995-10-10 | Immunex Corporation | Cytokine which is a ligand for OX40 |
| DE69435112D1 (de) | 1993-09-10 | 2008-08-21 | Univ Columbia | Verwendung von grünem fluoreszenzprotein |
| WO1995021191A1 (en) | 1994-02-04 | 1995-08-10 | William Ward | Bioluminescent indicator based upon the expression of a gene for a modified green-fluorescent protein |
| WO1996003993A2 (en) | 1994-08-05 | 1996-02-15 | The Rockefeller University | Modulation of thymocyte and t cell functional activity |
| EP0777684B1 (en) | 1994-08-16 | 2004-04-28 | Human Genome Sciences, Inc. | Calcitonin receptor |
| US5777079A (en) | 1994-11-10 | 1998-07-07 | The Regents Of The University Of California | Modified green fluorescent proteins |
| DE69637481T2 (de) | 1995-04-27 | 2009-04-09 | Amgen Fremont Inc. | Aus immunisierten Xenomäusen stammende menschliche Antikörper gegen IL-8 |
| US5874304A (en) | 1996-01-18 | 1999-02-23 | University Of Florida Research Foundation, Inc. | Humanized green fluorescent protein genes and methods |
| US5804387A (en) | 1996-02-01 | 1998-09-08 | The Board Of Trustees Of The Leland Stanford Junior University | FACS-optimized mutants of the green fluorescent protein (GFP) |
| US5876995A (en) | 1996-02-06 | 1999-03-02 | Bryan; Bruce | Bioluminescent novelty items |
| US5925558A (en) | 1996-07-16 | 1999-07-20 | The Regents Of The University Of California | Assays for protein kinases using fluorescent protein substrates |
| WO1998003534A1 (en) | 1996-07-23 | 1998-01-29 | Smithkline Beecham Corporation | Calcitonin gene-related peptide receptor component factor (houdc44) |
| US5976796A (en) | 1996-10-04 | 1999-11-02 | Loma Linda University | Construction and expression of renilla luciferase and green fluorescent protein fusion genes |
| US6255455B1 (en) * | 1996-10-11 | 2001-07-03 | The Trustees Of The University Of Pennsylvania | Rh(D)-binding proteins and magnetically activated cell sorting method for production thereof |
| DE69738539T2 (de) | 1996-12-03 | 2009-03-26 | Amgen Fremont Inc. | Vollkommen humane Antikörper die EGFR binden |
| IL129767A0 (en) | 1996-12-12 | 2000-02-29 | Prolume Ltd | Apparatus and method for detecting and identifying infectious agents |
| CA2196496A1 (en) | 1997-01-31 | 1998-07-31 | Stephen William Watson Michnick | Protein fragment complementation assay for the detection of protein-protein interactions |
| DE19732944A1 (de) | 1997-07-31 | 1999-02-04 | Thomae Gmbh Dr K | Peptidische CGRP-Antagonisten |
| US6342220B1 (en) | 1997-08-25 | 2002-01-29 | Genentech, Inc. | Agonist antibodies |
| JP2002507410A (ja) | 1998-03-27 | 2002-03-12 | プロルーム・リミテッド | ルシフェラーゼ、蛍光タンパク質、ルシフェラーゼおよび蛍光タンパク質をコードする核酸および、診断、高処理スクリーニングおよび新規アイテムにおけるその使用 |
| US6268474B1 (en) | 1998-04-30 | 2001-07-31 | Creighton University | Peptide antagonists of CGRP-receptor superfamily and methods of use |
| US6210924B1 (en) | 1998-08-11 | 2001-04-03 | Amgen Inc. | Overexpressing cyclin D 1 in a eukaryotic cell line |
| CA2341029A1 (en) | 1998-08-17 | 2000-02-24 | Abgenix, Inc. | Generation of modified molecules with increased serum half-lives |
| EP1234174A1 (en) * | 1999-12-02 | 2002-08-28 | Myriad Genetics, Inc. | Protein-protein interactions |
| US20020090646A1 (en) | 2000-05-03 | 2002-07-11 | Amgen Inc. | Calcitonin-related molecules |
| FR2821080B1 (fr) | 2001-02-20 | 2003-12-19 | Sanofi Synthelabo | Anticorps specifique de l'adrenomedulline humaine, composition pharmaceutique le contenant, ses applications therapeutiques |
| EP1423428B2 (en) * | 2001-06-20 | 2012-11-14 | Fibron Ltd. | Antibodies that block fgfr3 activation, methods of screening for and uses thereof |
| US7658924B2 (en) | 2001-10-11 | 2010-02-09 | Amgen Inc. | Angiopoietin-2 specific binding agents |
| AR039067A1 (es) * | 2001-11-09 | 2005-02-09 | Pfizer Prod Inc | Anticuerpos para cd40 |
| ES2382800T3 (es) * | 2002-01-18 | 2012-06-13 | Zymogenetics, Inc. | Multímeros Zcytor17 receptores de citocinas |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| US20040110170A1 (en) | 2002-05-18 | 2004-06-10 | The Regents Of The University Of California | Cloning and characterization of calcitonin gene related peptide receptors |
| US20070071744A1 (en) * | 2002-06-07 | 2007-03-29 | Gotz Munch | Agents which bind to epitopes of glycoprotein VI |
| DK1556020T3 (da) | 2002-08-12 | 2009-06-22 | Birkir Sveinsson | Anvendelse af CGRP-antagonistforbindelser til behandling af psoriasis |
| US20040176577A1 (en) * | 2002-09-10 | 2004-09-09 | Eva Rojer | Immunoassays for specific determination of SCCA isoforms |
| WO2004097421A2 (en) | 2003-04-29 | 2004-11-11 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with calcitonin receptor-like receptor (calcrl) |
| RU2378285C2 (ru) * | 2004-02-11 | 2010-01-10 | Амилин Фармасьютикалз, Инк. | Гибридные полипептиды с селектируемыми свойствами |
| US7423128B2 (en) * | 2004-11-03 | 2008-09-09 | Amgen Fremont Inc. | Anti-properdin antibodies, and methods for making and using same |
| EP2284194A1 (en) * | 2004-12-21 | 2011-02-16 | AstraZeneca AB | Antibodies directed to angiopoietin-2 and uses thereof |
| EP1900374B1 (en) | 2005-06-16 | 2014-03-12 | Takayuki Shindo | Angiogenetic agent containing adrenomedulin as the active ingredient |
| GB0521139D0 (en) * | 2005-10-18 | 2005-11-23 | Univ Sheffield | Therapeutic agent |
| US8168592B2 (en) | 2005-10-21 | 2012-05-01 | Amgen Inc. | CGRP peptide antagonists and conjugates |
| SI2380592T1 (en) | 2005-11-14 | 2018-06-29 | Teva Pharmaceuticals International Gmbh | The antibody to the calcitonin-related peptide antagonist |
| WO2007076336A1 (en) * | 2005-12-22 | 2007-07-05 | Eli Lilly And Company | Treatment of migraine with anti-cgrp antibodies |
| MX2009001293A (es) * | 2006-08-03 | 2009-02-11 | Astrazeneca Ab | Anticuerpos dirigidos a (v(6 y usos de los mismos. |
| GB0708002D0 (en) * | 2007-04-25 | 2007-06-06 | Univ Sheffield | Antibodies |
| JP5745861B2 (ja) | 2008-03-04 | 2015-07-08 | ファイザー・リミテッドPfizer Limited | 炎症性疼痛を治療する方法 |
| FR2934597B1 (fr) * | 2008-07-31 | 2013-04-19 | Univ Aix Marseille Ii | Anticorps se liant aux recepteurs de l'adrenomedulline et leurs utilisations comme medicament. |
| RU2535074C2 (ru) | 2009-08-28 | 2014-12-10 | Лэйбрис Байолоджикс, Инк. | Способы лечения висцеральной боли путем введения антител-антагонистов, направленных против пептида, связанного с геном кальцитонина |
| US9401875B2 (en) | 2012-06-01 | 2016-07-26 | Nippon Telegraph And Telephone Corporation | Packet transfer processing method and packet transfer processing device |
| US9300829B2 (en) | 2014-04-04 | 2016-03-29 | Canon Kabushiki Kaisha | Image reading apparatus and correction method thereof |
| CA2960756C (en) * | 2014-09-15 | 2023-08-01 | Amgen Inc. | Bi-specific anti-cgrp receptor/pac1 receptor antigen binding proteins and uses thereof |
| JOP20200116A1 (ar) * | 2015-04-24 | 2017-06-16 | Amgen Inc | طرق لعلاج أو الوقاية من الصداع النصفي |
| US11385238B2 (en) * | 2017-06-30 | 2022-07-12 | Amgen Inc. | Methods of protein clips recovery |
| MX2020010320A (es) * | 2018-04-02 | 2021-01-08 | Amgen Inc | Composiciones de erenumab y usos de las mismas. |
-
2009
- 2009-12-02 JO JOP/2009/0461A patent/JO3382B1/ar active
- 2009-12-18 NZ NZ606090A patent/NZ606090A/en unknown
- 2009-12-18 SG SG2011045556A patent/SG172307A1/en unknown
- 2009-12-18 HU HUE19181187A patent/HUE072123T2/hu unknown
- 2009-12-18 RS RS20250696A patent/RS67071B1/sr unknown
- 2009-12-18 LT LTEP16199717.6T patent/LT3184546T/lt unknown
- 2009-12-18 BR BR122020010360-4A patent/BR122020010360B1/pt active IP Right Grant
- 2009-12-18 RS RS20171121A patent/RS56567B1/sr unknown
- 2009-12-18 PE PE2011001269A patent/PE20120427A1/es active IP Right Grant
- 2009-12-18 RS RSP20191122 patent/RS59343B1/sr unknown
- 2009-12-18 EA EA201891500A patent/EA201891500A3/ru unknown
- 2009-12-18 KR KR1020197013698A patent/KR20190054181A/ko not_active Ceased
- 2009-12-18 PT PT191811876T patent/PT3569620T/pt unknown
- 2009-12-18 DK DK09775072.3T patent/DK2379594T3/en active
- 2009-12-18 SI SI200931989T patent/SI3184546T1/sl unknown
- 2009-12-18 KR KR1020177013822A patent/KR101853393B1/ko active Active
- 2009-12-18 SI SI200931756T patent/SI2379594T1/sl unknown
- 2009-12-18 ES ES16199717T patent/ES2746571T3/es active Active
- 2009-12-18 PT PT16199717T patent/PT3184546T/pt unknown
- 2009-12-18 PT PT97750723T patent/PT2379594T/pt unknown
- 2009-12-18 MY MYPI2011002908A patent/MY180564A/en unknown
- 2009-12-18 HU HUE16199717A patent/HUE045966T2/hu unknown
- 2009-12-18 AU AU2009330175A patent/AU2009330175C1/en active Active
- 2009-12-18 BR BRPI0922505-6A patent/BRPI0922505B1/pt active IP Right Grant
- 2009-12-18 NZ NZ623541A patent/NZ623541A/en unknown
- 2009-12-18 EP EP25165937.1A patent/EP4585264A3/en active Pending
- 2009-12-18 MX MX2011006804A patent/MX2011006804A/es active IP Right Grant
- 2009-12-18 PL PL09775072T patent/PL2379594T3/pl unknown
- 2009-12-18 KR KR1020117017235A patent/KR101740615B1/ko active Active
- 2009-12-18 CN CN201610333096.2A patent/CN106084045B/zh active Active
- 2009-12-18 HR HRP20250807TT patent/HRP20250807T1/hr unknown
- 2009-12-18 CN CN200980157606.3A patent/CN102348722B/zh active Active
- 2009-12-18 HU HUE09775072A patent/HUE034506T2/en unknown
- 2009-12-18 PL PL16199717T patent/PL3184546T3/pl unknown
- 2009-12-18 LT LTEP19181187.6T patent/LT3569620T/lt unknown
- 2009-12-18 SG SG10201401879TA patent/SG10201401879TA/en unknown
- 2009-12-18 DK DK19181187.6T patent/DK3569620T3/da active
- 2009-12-18 LT LTEP09775072.3T patent/LT2379594T/lt unknown
- 2009-12-18 FI FIEP19181187.6T patent/FI3569620T3/fi active
- 2009-12-18 SI SI200932214T patent/SI3569620T1/sl unknown
- 2009-12-18 ES ES09775072.3T patent/ES2643835T3/es active Active
- 2009-12-18 US US12/642,711 patent/US9102731B2/en active Active
- 2009-12-18 EP EP19181187.6A patent/EP3569620B1/en active Active
- 2009-12-18 HR HRP20171690TT patent/HRP20171690T1/hr unknown
- 2009-12-18 SM SM20170504T patent/SMT201700504T1/it unknown
- 2009-12-18 DK DK16199717.6T patent/DK3184546T3/da active
- 2009-12-18 KR KR1020187011418A patent/KR20180043850A/ko not_active Ceased
- 2009-12-18 ME MEP-2019-240A patent/ME03601B/me unknown
- 2009-12-18 EP EP09775072.3A patent/EP2379594B8/en active Active
- 2009-12-18 MA MA34035A patent/MA32982B1/fr unknown
- 2009-12-18 JP JP2011543606A patent/JP5761805B2/ja active Active
- 2009-12-18 PL PL19181187.6T patent/PL3569620T3/pl unknown
- 2009-12-18 CA CA2746858A patent/CA2746858C/en active Active
- 2009-12-18 UA UAA201109219A patent/UA108066C2/ru unknown
- 2009-12-18 WO PCT/US2009/068858 patent/WO2010075238A1/en not_active Ceased
- 2009-12-18 NO NO09775072A patent/NO2379594T3/no unknown
- 2009-12-18 ES ES19181187T patent/ES3036151T3/es active Active
- 2009-12-18 EP EP16199717.6A patent/EP3184546B8/en active Active
- 2009-12-18 EA EA201100892A patent/EA031320B1/ru active Protection Beyond IP Right Term
- 2009-12-22 TW TW110149087A patent/TW202241950A/zh unknown
- 2009-12-22 AR ARP090105053A patent/AR074857A1/es active IP Right Grant
- 2009-12-22 TW TW105134382A patent/TWI688403B/zh active
- 2009-12-22 TW TW108136419A patent/TWI754176B/zh active
- 2009-12-22 TW TW098144377A patent/TWI574697B/zh active
-
2011
- 2011-06-01 TN TN2011000283A patent/TN2011000283A1/fr unknown
- 2011-06-06 IL IL213429A patent/IL213429A/en active Protection Beyond IP Right Term
- 2011-06-23 CL CL2011001578A patent/CL2011001578A1/es unknown
- 2011-07-15 CO CO11088995A patent/CO6400232A2/es active IP Right Grant
- 2011-07-22 ZA ZA2011/05418A patent/ZA201105418B/en unknown
- 2011-07-22 CR CR20110400A patent/CR20110400A/es unknown
-
2012
- 2012-09-12 US US13/612,615 patent/US20130071410A1/en not_active Abandoned
-
2013
- 2013-04-10 AU AU2013205271A patent/AU2013205271C1/en active Active
-
2014
- 2014-08-12 JP JP2014164088A patent/JP6261132B2/ja active Active
-
2015
- 2015-06-26 US US14/752,493 patent/US9862771B2/en active Active
- 2015-11-09 JP JP2015219157A patent/JP2016026224A/ja not_active Withdrawn
-
2016
- 2016-01-26 IL IL243784A patent/IL243784A/en active IP Right Grant
-
2017
- 2017-08-28 CY CY20171100901T patent/CY1119465T1/el unknown
- 2017-11-28 US US15/824,827 patent/US20180142029A1/en not_active Abandoned
-
2018
- 2018-12-04 CY CY2018032C patent/CY2018032I1/el unknown
- 2018-12-10 HU HUS1800047C patent/HUS1800047I1/hu unknown
- 2018-12-12 NL NL300961C patent/NL300961I2/nl unknown
- 2018-12-14 LT LTPA2018017C patent/LTC2379594I2/lt unknown
- 2018-12-17 NO NO2018042C patent/NO2018042I1/no unknown
- 2018-12-20 LU LU00095C patent/LUC00095I2/fr unknown
- 2018-12-28 JP JP2018246704A patent/JP2019062907A/ja not_active Withdrawn
-
2019
- 2019-02-07 JO JOP/2019/0017A patent/JOP20190017B1/ar active
- 2019-07-25 HR HRP20191341TT patent/HRP20191341T8/hr unknown
- 2019-09-19 CY CY20191100989T patent/CY1122658T1/el unknown
-
2020
- 2020-11-27 JP JP2020196689A patent/JP2021036912A/ja not_active Withdrawn
- 2020-12-03 US US17/111,453 patent/US12134652B2/en active Active
- 2020-12-03 US US17/111,442 patent/US12122841B2/en active Active
-
2023
- 2023-06-21 JP JP2023101810A patent/JP7584577B2/ja active Active
-
2024
- 2024-10-02 US US18/904,787 patent/US20250129172A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005503809A (ja) | 2001-09-27 | 2005-02-10 | メルク エンド カムパニー インコーポレーテッド | ヒト化カルシトニン遺伝子関連ペプチド受容体をコードする単離dna分子、関連する非ヒトトランスジェニック動物及びアッセイ方法 |
| JP2012513214A (ja) | 2008-12-23 | 2012-06-14 | アムジェン インコーポレイテッド | ヒトcgrp受容体結合タンパク質 |
Non-Patent Citations (3)
| Title |
|---|
| Biology of Reproduction,2004年,Vol.70,p.1658-1663 |
| Journal of Anesthesia,2019年,33,pp.131-139 |
| Journal of Pharmacology and Experimental Therapeutics,2006年11月,Vol.319, No.2,749-757ページ |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7584577B2 (ja) | ヒトcgrp受容体結合タンパク質 | |
| HK1230633A1 (en) | Human cgrp receptor binding proteins | |
| HK1163699A (en) | Human cgrp receptor binding antibodies | |
| HK1163699B (en) | Human cgrp receptor binding antibodies | |
| HK1167147A (en) | Human cgrp receptor binding proteins |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230621 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240508 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240808 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241004 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241105 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7584577 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |