JP7363359B2 - 分析用試料の調製方法、分析方法および分析用試料の調製用キット - Google Patents
分析用試料の調製方法、分析方法および分析用試料の調製用キット Download PDFInfo
- Publication number
- JP7363359B2 JP7363359B2 JP2019192037A JP2019192037A JP7363359B2 JP 7363359 B2 JP7363359 B2 JP 7363359B2 JP 2019192037 A JP2019192037 A JP 2019192037A JP 2019192037 A JP2019192037 A JP 2019192037A JP 7363359 B2 JP7363359 B2 JP 7363359B2
- Authority
- JP
- Japan
- Prior art keywords
- sample
- preparing
- analysis
- esterification
- sialic acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000004458 analytical method Methods 0.000 title claims description 150
- 238000002360 preparation method Methods 0.000 title claims description 21
- 238000005464 sample preparation method Methods 0.000 title claims description 7
- 238000012284 sample analysis method Methods 0.000 title 1
- 238000007112 amidation reaction Methods 0.000 claims description 316
- 239000000523 sample Substances 0.000 claims description 257
- 238000005886 esterification reaction Methods 0.000 claims description 210
- 235000000346 sugar Nutrition 0.000 claims description 194
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 claims description 150
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 claims description 127
- 238000000034 method Methods 0.000 claims description 125
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical group CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 108
- 239000000538 analytical sample Substances 0.000 claims description 95
- 230000032050 esterification Effects 0.000 claims description 81
- 239000003795 chemical substances by application Substances 0.000 claims description 79
- 230000009435 amidation Effects 0.000 claims description 70
- 230000004048 modification Effects 0.000 claims description 61
- 238000012986 modification Methods 0.000 claims description 61
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 56
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 54
- 238000006243 chemical reaction Methods 0.000 claims description 41
- 238000004949 mass spectrometry Methods 0.000 claims description 41
- 239000007790 solid phase Substances 0.000 claims description 31
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 claims description 25
- 239000002904 solvent Substances 0.000 claims description 24
- 238000009833 condensation Methods 0.000 claims description 19
- 230000005494 condensation Effects 0.000 claims description 19
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 claims description 18
- 230000018044 dehydration Effects 0.000 claims description 18
- 238000006297 dehydration reaction Methods 0.000 claims description 18
- 239000003960 organic solvent Substances 0.000 claims description 18
- 150000003141 primary amines Chemical class 0.000 claims description 17
- 150000001875 compounds Chemical class 0.000 claims description 16
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 16
- 239000012374 esterification agent Substances 0.000 claims description 15
- 238000007273 lactonization reaction Methods 0.000 claims description 15
- 229910021529 ammonia Inorganic materials 0.000 claims description 12
- 150000003839 salts Chemical class 0.000 claims description 12
- 238000004587 chromatography analysis Methods 0.000 claims description 11
- 229910052799 carbon Inorganic materials 0.000 claims description 10
- 150000002772 monosaccharides Chemical class 0.000 claims description 9
- 239000002253 acid Substances 0.000 claims description 8
- 150000001408 amides Chemical class 0.000 claims description 8
- 125000003277 amino group Chemical group 0.000 claims description 8
- 125000004432 carbon atom Chemical group C* 0.000 claims description 8
- 150000002429 hydrazines Chemical class 0.000 claims description 8
- 239000003125 aqueous solvent Substances 0.000 claims description 7
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical class ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 claims description 6
- 125000000217 alkyl group Chemical group 0.000 claims description 5
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 5
- 230000002862 amidating effect Effects 0.000 claims description 4
- AYNNSCRYTDRFCP-UHFFFAOYSA-N triazene Chemical group NN=N AYNNSCRYTDRFCP-UHFFFAOYSA-N 0.000 claims description 3
- 125000000686 lactone group Chemical group 0.000 claims 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims 1
- 125000001483 monosaccharide substituent group Chemical group 0.000 claims 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 claims 1
- 239000000243 solution Substances 0.000 description 192
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 54
- 238000001819 mass spectrum Methods 0.000 description 53
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 52
- 125000005629 sialic acid group Chemical group 0.000 description 40
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 33
- 102000003886 Glycoproteins Human genes 0.000 description 30
- 108090000288 Glycoproteins Proteins 0.000 description 30
- WGYKZJWCGVVSQN-UHFFFAOYSA-N propylamine Chemical compound CCCN WGYKZJWCGVVSQN-UHFFFAOYSA-N 0.000 description 30
- 150000001412 amines Chemical class 0.000 description 24
- 238000010586 diagram Methods 0.000 description 24
- KBGAYAKRZNYFFG-BOHATCBPSA-N aceneuramic acid Chemical compound OC(=O)C(=O)C[C@H](O)[C@@H](NC(=O)C)[C@@H](O)[C@H](O)[C@H](O)CO KBGAYAKRZNYFFG-BOHATCBPSA-N 0.000 description 22
- 150000002596 lactones Chemical class 0.000 description 22
- 102000002068 Glycopeptides Human genes 0.000 description 20
- 108010015899 Glycopeptides Proteins 0.000 description 20
- 238000002013 hydrophilic interaction chromatography Methods 0.000 description 20
- -1 methanol or ethanol Chemical compound 0.000 description 20
- 108090000765 processed proteins & peptides Proteins 0.000 description 18
- 239000000376 reactant Substances 0.000 description 18
- 239000003153 chemical reaction reagent Substances 0.000 description 17
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 15
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 14
- DNGJVDGPCGXBFF-UHFFFAOYSA-N 4-methyl-n-(methyldiazenyl)aniline Chemical compound CN=NNC1=CC=C(C)C=C1 DNGJVDGPCGXBFF-UHFFFAOYSA-N 0.000 description 13
- 150000002500 ions Chemical class 0.000 description 13
- 238000006011 modification reaction Methods 0.000 description 13
- BPOZIJBDYFHEJR-UHFFFAOYSA-N n-(ethyldiazenyl)-4-methylaniline Chemical compound CCN=NNC1=CC=C(C)C=C1 BPOZIJBDYFHEJR-UHFFFAOYSA-N 0.000 description 13
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 11
- 239000011159 matrix material Substances 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 239000000047 product Substances 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- 239000011324 bead Substances 0.000 description 10
- 238000011156 evaluation Methods 0.000 description 10
- 210000002966 serum Anatomy 0.000 description 10
- DQJCDTNMLBYVAY-ZXXIYAEKSA-N (2S,5R,10R,13R)-16-{[(2R,3S,4R,5R)-3-{[(2S,3R,4R,5S,6R)-3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy}-5-(ethylamino)-6-hydroxy-2-(hydroxymethyl)oxan-4-yl]oxy}-5-(4-aminobutyl)-10-carbamoyl-2,13-dimethyl-4,7,12,15-tetraoxo-3,6,11,14-tetraazaheptadecan-1-oic acid Chemical compound NCCCC[C@H](C(=O)N[C@@H](C)C(O)=O)NC(=O)CC[C@H](C(N)=O)NC(=O)[C@@H](C)NC(=O)C(C)O[C@@H]1[C@@H](NCC)C(O)O[C@H](CO)[C@H]1O[C@H]1[C@H](NC(C)=O)[C@@H](O)[C@H](O)[C@@H](CO)O1 DQJCDTNMLBYVAY-ZXXIYAEKSA-N 0.000 description 9
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 9
- FDJKUWYYUZCUJX-AJKRCSPLSA-N N-glycoloyl-beta-neuraminic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@@H]1O[C@](O)(C(O)=O)C[C@H](O)[C@H]1NC(=O)CO FDJKUWYYUZCUJX-AJKRCSPLSA-N 0.000 description 9
- FDJKUWYYUZCUJX-UHFFFAOYSA-N N-glycolyl-beta-neuraminic acid Natural products OCC(O)C(O)C1OC(O)(C(O)=O)CC(O)C1NC(=O)CO FDJKUWYYUZCUJX-UHFFFAOYSA-N 0.000 description 9
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 9
- 239000007787 solid Substances 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 8
- 102000000447 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Human genes 0.000 description 8
- 108010055817 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Proteins 0.000 description 8
- 150000002148 esters Chemical class 0.000 description 8
- 150000002339 glycosphingolipids Chemical class 0.000 description 8
- OVRNDRQMDRJTHS-RTRLPJTCSA-N N-acetyl-D-glucosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-RTRLPJTCSA-N 0.000 description 7
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 7
- 239000000654 additive Substances 0.000 description 7
- 239000007791 liquid phase Substances 0.000 description 7
- 238000007086 side reaction Methods 0.000 description 7
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 7
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 6
- 229940059260 amidate Drugs 0.000 description 6
- NPUKDXXFDDZOKR-LLVKDONJSA-N etomidate Chemical compound CCOC(=O)C1=CN=CN1[C@H](C)C1=CC=CC=C1 NPUKDXXFDDZOKR-LLVKDONJSA-N 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 5
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 5
- 229930186217 Glycolipid Natural products 0.000 description 5
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 5
- 230000000996 additive effect Effects 0.000 description 5
- 150000001413 amino acids Chemical class 0.000 description 5
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 238000001212 derivatisation Methods 0.000 description 5
- 125000001183 hydrocarbyl group Chemical group 0.000 description 5
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 239000003643 water by type Substances 0.000 description 5
- JLLYLQLDYORLBB-UHFFFAOYSA-N 5-bromo-n-methylthiophene-2-sulfonamide Chemical compound CNS(=O)(=O)C1=CC=C(Br)S1 JLLYLQLDYORLBB-UHFFFAOYSA-N 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- OFLXLNCGODUUOT-UHFFFAOYSA-N acetohydrazide Chemical compound C\C(O)=N\N OFLXLNCGODUUOT-UHFFFAOYSA-N 0.000 description 4
- WARCRYXKINZHGQ-UHFFFAOYSA-N benzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1 WARCRYXKINZHGQ-UHFFFAOYSA-N 0.000 description 4
- 102000038379 digestive enzymes Human genes 0.000 description 4
- 108091007734 digestive enzymes Proteins 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- MGJXBDMLVWIYOQ-UHFFFAOYSA-N methylazanide Chemical compound [NH-]C MGJXBDMLVWIYOQ-UHFFFAOYSA-N 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 230000035484 reaction time Effects 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- WXTMDXOMEHJXQO-UHFFFAOYSA-N 2,5-dihydroxybenzoic acid Chemical compound OC(=O)C1=CC(O)=CC=C1O WXTMDXOMEHJXQO-UHFFFAOYSA-N 0.000 description 3
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 3
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 108090000631 Trypsin Proteins 0.000 description 3
- 102000004142 Trypsin Human genes 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 235000011114 ammonium hydroxide Nutrition 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 150000001718 carbodiimides Chemical class 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000007385 chemical modification Methods 0.000 description 3
- 238000007405 data analysis Methods 0.000 description 3
- 238000011033 desalting Methods 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 125000004494 ethyl ester group Chemical group 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 150000003840 hydrochlorides Chemical class 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 238000004811 liquid chromatography Methods 0.000 description 3
- 150000004702 methyl esters Chemical class 0.000 description 3
- NQMRYBIKMRVZLB-UHFFFAOYSA-N methylamine hydrochloride Chemical compound [Cl-].[NH3+]C NQMRYBIKMRVZLB-UHFFFAOYSA-N 0.000 description 3
- 230000009257 reactivity Effects 0.000 description 3
- 238000005063 solubilization Methods 0.000 description 3
- 230000007928 solubilization Effects 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 230000001629 suppression Effects 0.000 description 3
- 239000012588 trypsin Substances 0.000 description 3
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- HVCOBJNICQPDBP-UHFFFAOYSA-N 3-[3-[3,5-dihydroxy-6-methyl-4-(3,4,5-trihydroxy-6-methyloxan-2-yl)oxyoxan-2-yl]oxydecanoyloxy]decanoic acid;hydrate Chemical compound O.OC1C(OC(CC(=O)OC(CCCCCCC)CC(O)=O)CCCCCCC)OC(C)C(O)C1OC1C(O)C(O)C(O)C(C)O1 HVCOBJNICQPDBP-UHFFFAOYSA-N 0.000 description 2
- BMTZEAOGFDXDAD-UHFFFAOYSA-M 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholin-4-ium;chloride Chemical compound [Cl-].COC1=NC(OC)=NC([N+]2(C)CCOCC2)=N1 BMTZEAOGFDXDAD-UHFFFAOYSA-M 0.000 description 2
- VVJKKWFAADXIJK-UHFFFAOYSA-N Allylamine Chemical compound NCC=C VVJKKWFAADXIJK-UHFFFAOYSA-N 0.000 description 2
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 description 2
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 2
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 2
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- AMQJEAYHLZJPGS-UHFFFAOYSA-N N-Pentanol Chemical compound CCCCCO AMQJEAYHLZJPGS-UHFFFAOYSA-N 0.000 description 2
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 2
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical class ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- GPDHNZNLPKYHCN-DZOOLQPHSA-N [[(z)-(1-cyano-2-ethoxy-2-oxoethylidene)amino]oxy-morpholin-4-ylmethylidene]-dimethylazanium;hexafluorophosphate Chemical compound F[P-](F)(F)(F)(F)F.CCOC(=O)C(\C#N)=N/OC(=[N+](C)C)N1CCOCC1 GPDHNZNLPKYHCN-DZOOLQPHSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 230000029936 alkylation Effects 0.000 description 2
- 238000005804 alkylation reaction Methods 0.000 description 2
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 2
- 238000007098 aminolysis reaction Methods 0.000 description 2
- 125000002344 aminooxy group Chemical group [H]N([H])O[*] 0.000 description 2
- LNTHITQWFMADLM-UHFFFAOYSA-N anhydrous gallic acid Natural products OC(=O)C1=CC(O)=C(O)C(O)=C1 LNTHITQWFMADLM-UHFFFAOYSA-N 0.000 description 2
- YHNUDLCUIKMNSN-UHFFFAOYSA-N bis(1,2,4-triazol-1-yl)methanone Chemical compound C1=NC=NN1C(=O)N1C=NC=N1 YHNUDLCUIKMNSN-UHFFFAOYSA-N 0.000 description 2
- HQABUPZFAYXKJW-UHFFFAOYSA-N butan-1-amine Chemical compound CCCCN HQABUPZFAYXKJW-UHFFFAOYSA-N 0.000 description 2
- 150000001721 carbon Chemical group 0.000 description 2
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 150000001733 carboxylic acid esters Chemical class 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 238000003795 desorption Methods 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 108010005965 endoglycoceramidase Proteins 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- XWBDWHCCBGMXKG-UHFFFAOYSA-N ethanamine;hydron;chloride Chemical compound Cl.CCN XWBDWHCCBGMXKG-UHFFFAOYSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 229930182830 galactose Natural products 0.000 description 2
- 230000005484 gravity Effects 0.000 description 2
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 238000000752 ionisation method Methods 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- 230000001035 methylating effect Effects 0.000 description 2
- HDZGCSFEDULWCS-UHFFFAOYSA-N monomethylhydrazine Chemical compound CNN HDZGCSFEDULWCS-UHFFFAOYSA-N 0.000 description 2
- IWCGEJKKDAJKJE-UHFFFAOYSA-N n-(benzyldiazenyl)-4-methylaniline Chemical compound C1=CC(C)=CC=C1NN=NCC1=CC=CC=C1 IWCGEJKKDAJKJE-UHFFFAOYSA-N 0.000 description 2
- 229950006780 n-acetylglucosamine Drugs 0.000 description 2
- 150000002823 nitrates Chemical class 0.000 description 2
- 230000000269 nucleophilic effect Effects 0.000 description 2
- RZXMPPFPUUCRFN-UHFFFAOYSA-N p-toluidine Chemical compound CC1=CC=C(N)C=C1 RZXMPPFPUUCRFN-UHFFFAOYSA-N 0.000 description 2
- DPBLXKKOBLCELK-UHFFFAOYSA-N pentan-1-amine Chemical compound CCCCCN DPBLXKKOBLCELK-UHFFFAOYSA-N 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-O phosphonium Chemical compound [PH4+] XYFCBTPGUUZFHI-UHFFFAOYSA-O 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 150000008163 sugars Chemical group 0.000 description 2
- WGTYBPLFGIVFAS-UHFFFAOYSA-M tetramethylammonium hydroxide Chemical compound [OH-].C[N+](C)(C)C WGTYBPLFGIVFAS-UHFFFAOYSA-M 0.000 description 2
- 150000004654 triazenes Chemical class 0.000 description 2
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 2
- WJKHJLXJJJATHN-UHFFFAOYSA-N triflic anhydride Chemical compound FC(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)F WJKHJLXJJJATHN-UHFFFAOYSA-N 0.000 description 2
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 2
- 125000005500 uronium group Chemical group 0.000 description 2
- QZJYVUZPVGHEML-UHFFFAOYSA-N (2-cyano-2-hydroxyiminoethyl) acetate Chemical compound CC(=O)OCC(=NO)C#N QZJYVUZPVGHEML-UHFFFAOYSA-N 0.000 description 1
- DIOHEXPTUTVCNX-UHFFFAOYSA-N 1,1,1-trifluoro-n-phenyl-n-(trifluoromethylsulfonyl)methanesulfonamide Chemical compound FC(F)(F)S(=O)(=O)N(S(=O)(=O)C(F)(F)F)C1=CC=CC=C1 DIOHEXPTUTVCNX-UHFFFAOYSA-N 0.000 description 1
- OXDSKEQSEGDAFN-UHFFFAOYSA-N 1,1,1-trifluoro-n-phenylmethanesulfonamide Chemical compound FC(F)(F)S(=O)(=O)NC1=CC=CC=C1 OXDSKEQSEGDAFN-UHFFFAOYSA-N 0.000 description 1
- DXLQEJHUQKKSRB-UHFFFAOYSA-N 1,1,1-trifluoro-n-pyridin-2-yl-n-(trifluoromethylsulfonyl)methanesulfonamide Chemical compound FC(F)(F)S(=O)(=O)N(S(=O)(=O)C(F)(F)F)C1=CC=CC=N1 DXLQEJHUQKKSRB-UHFFFAOYSA-N 0.000 description 1
- KEXFRBIOHPDZQM-UHFFFAOYSA-N 1,1-bis(2,2-dimethylpropoxy)-n,n-dimethylmethanamine Chemical compound CC(C)(C)COC(N(C)C)OCC(C)(C)C KEXFRBIOHPDZQM-UHFFFAOYSA-N 0.000 description 1
- ORHBGEQYIZTYHV-UHFFFAOYSA-N 1,1-di(propan-2-yl)urea Chemical compound CC(C)N(C(C)C)C(N)=O ORHBGEQYIZTYHV-UHFFFAOYSA-N 0.000 description 1
- GSFFXKGTGPMVLM-UHFFFAOYSA-N 1,1-dibutoxy-n,n-dimethylmethanamine Chemical compound CCCCOC(N(C)C)OCCCC GSFFXKGTGPMVLM-UHFFFAOYSA-N 0.000 description 1
- BWKAYBPLDRWMCJ-UHFFFAOYSA-N 1,1-diethoxy-n,n-dimethylmethanamine Chemical compound CCOC(N(C)C)OCC BWKAYBPLDRWMCJ-UHFFFAOYSA-N 0.000 description 1
- OWQPOVKKUWUEKE-UHFFFAOYSA-N 1,2,3-benzotriazine Chemical compound N1=NN=CC2=CC=CC=C21 OWQPOVKKUWUEKE-UHFFFAOYSA-N 0.000 description 1
- ONRNRVLJHFFBJG-UHFFFAOYSA-N 1,2-di(imidazol-1-yl)ethane-1,2-dione Chemical compound C1=CN=CN1C(=O)C(=O)N1C=CN=C1 ONRNRVLJHFFBJG-UHFFFAOYSA-N 0.000 description 1
- BOSWPVRACYJBSJ-UHFFFAOYSA-N 1,3-di(p-tolyl)carbodiimide Chemical compound C1=CC(C)=CC=C1N=C=NC1=CC=C(C)C=C1 BOSWPVRACYJBSJ-UHFFFAOYSA-N 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- SGJBIFUEFLWXJY-UHFFFAOYSA-N 1-(dibutoxymethoxy)butane Chemical compound CCCCOC(OCCCC)OCCCC SGJBIFUEFLWXJY-UHFFFAOYSA-N 0.000 description 1
- YGABUCCNCBMODG-UHFFFAOYSA-N 1-(trifluoromethylsulfonyl)imidazole Chemical compound FC(F)(F)S(=O)(=O)N1C=CN=C1 YGABUCCNCBMODG-UHFFFAOYSA-N 0.000 description 1
- MPPPKRYCTPRNTB-UHFFFAOYSA-N 1-bromobutane Chemical compound CCCCBr MPPPKRYCTPRNTB-UHFFFAOYSA-N 0.000 description 1
- CYNYIHKIEHGYOZ-UHFFFAOYSA-N 1-bromopropane Chemical compound CCCBr CYNYIHKIEHGYOZ-UHFFFAOYSA-N 0.000 description 1
- BMVXCPBXGZKUPN-UHFFFAOYSA-N 1-hexanamine Chemical compound CCCCCCN BMVXCPBXGZKUPN-UHFFFAOYSA-N 0.000 description 1
- NHXXFZYWRWVMQS-UHFFFAOYSA-N 1-tert-butyl-1,3-di(propan-2-yl)urea Chemical compound CC(C)NC(=O)N(C(C)C)C(C)(C)C NHXXFZYWRWVMQS-UHFFFAOYSA-N 0.000 description 1
- FPIVAWNGRDHRSQ-UHFFFAOYSA-N 2-[di(propan-2-yloxy)methoxy]propane Chemical compound CC(C)OC(OC(C)C)OC(C)C FPIVAWNGRDHRSQ-UHFFFAOYSA-N 0.000 description 1
- NAMYKGVDVNBCFQ-UHFFFAOYSA-N 2-bromopropane Chemical compound CC(C)Br NAMYKGVDVNBCFQ-UHFFFAOYSA-N 0.000 description 1
- FMMYTRQXHORTCU-UHFFFAOYSA-N 2-chloroethyl methanesulfonate Chemical compound CS(=O)(=O)OCCCl FMMYTRQXHORTCU-UHFFFAOYSA-N 0.000 description 1
- ANGGPYSFTXVERY-UHFFFAOYSA-N 2-iodo-2-methylpropane Chemical compound CC(C)(C)I ANGGPYSFTXVERY-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- AGDYKCPGMDASQO-UHFFFAOYSA-N 4-methyl-n-(propan-2-yldiazenyl)aniline Chemical compound CC(C)N=NNC1=CC=C(C)C=C1 AGDYKCPGMDASQO-UHFFFAOYSA-N 0.000 description 1
- ZATZIBWEALYTHN-UHFFFAOYSA-N 4-methyl-n-[(4-nitrophenyl)methyldiazenyl]aniline Chemical compound C1=CC(C)=CC=C1NN=NCC1=CC=C([N+]([O-])=O)C=C1 ZATZIBWEALYTHN-UHFFFAOYSA-N 0.000 description 1
- TZCYLJGNWDVJRA-UHFFFAOYSA-N 6-chloro-1-hydroxybenzotriazole Chemical compound C1=C(Cl)C=C2N(O)N=NC2=C1 TZCYLJGNWDVJRA-UHFFFAOYSA-N 0.000 description 1
- DDUHZTYCFQRHIY-UHFFFAOYSA-N 7-chloro-3',4,6-trimethoxy-5'-methylspiro[1-benzofuran-2,4'-cyclohex-2-ene]-1',3-dione Chemical compound COC1=CC(=O)CC(C)C11C(=O)C(C(OC)=CC(OC)=C2Cl)=C2O1 DDUHZTYCFQRHIY-UHFFFAOYSA-N 0.000 description 1
- 108010055851 Acetylglucosaminidase Proteins 0.000 description 1
- 229920001342 Bakelite® Polymers 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 108090000317 Chymotrypsin Proteins 0.000 description 1
- OIFBSDVPJOWBCH-UHFFFAOYSA-N Diethyl carbonate Chemical compound CCOC(=O)OCC OIFBSDVPJOWBCH-UHFFFAOYSA-N 0.000 description 1
- HWBLTYHIEYOAOL-UHFFFAOYSA-N Diisopropyl sulfate Chemical compound CC(C)OS(=O)(=O)OC(C)C HWBLTYHIEYOAOL-UHFFFAOYSA-N 0.000 description 1
- 108010067770 Endopeptidase K Proteins 0.000 description 1
- PLUBXMRUUVWRLT-UHFFFAOYSA-N Ethyl methanesulfonate Chemical compound CCOS(C)(=O)=O PLUBXMRUUVWRLT-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- PNKUSGQVOMIXLU-UHFFFAOYSA-N Formamidine Chemical compound NC=N PNKUSGQVOMIXLU-UHFFFAOYSA-N 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- 108010053229 Lysyl endopeptidase Proteins 0.000 description 1
- 108010090665 Mannosyl-Glycoprotein Endo-beta-N-Acetylglucosaminidase Proteins 0.000 description 1
- OKIZCWYLBDKLSU-UHFFFAOYSA-M N,N,N-Trimethylmethanaminium chloride Chemical compound [Cl-].C[N+](C)(C)C OKIZCWYLBDKLSU-UHFFFAOYSA-M 0.000 description 1
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- AFBPFSWMIHJQDM-UHFFFAOYSA-N N-methyl-N-phenylamine Natural products CNC1=CC=CC=C1 AFBPFSWMIHJQDM-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108010059712 Pronase Proteins 0.000 description 1
- RJFAYQIBOAGBLC-BYPYZUCNSA-N Selenium-L-methionine Chemical compound C[Se]CC[C@H](N)C(O)=O RJFAYQIBOAGBLC-BYPYZUCNSA-N 0.000 description 1
- 239000012317 TBTU Substances 0.000 description 1
- 108090001109 Thermolysin Proteins 0.000 description 1
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- KPFBUSLHFFWMAI-HYRPPVSQSA-N [(8r,9s,10r,13s,14s,17r)-17-acetyl-6-formyl-3-methoxy-10,13-dimethyl-1,2,7,8,9,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-17-yl] acetate Chemical compound C1C[C@@H]2[C@](CCC(OC)=C3)(C)C3=C(C=O)C[C@H]2[C@@H]2CC[C@](OC(C)=O)(C(C)=O)[C@]21C KPFBUSLHFFWMAI-HYRPPVSQSA-N 0.000 description 1
- CLZISMQKJZCZDN-UHFFFAOYSA-N [benzotriazol-1-yloxy(dimethylamino)methylidene]-dimethylazanium Chemical compound C1=CC=C2N(OC(N(C)C)=[N+](C)C)N=NC2=C1 CLZISMQKJZCZDN-UHFFFAOYSA-N 0.000 description 1
- 238000010306 acid treatment Methods 0.000 description 1
- 239000003929 acidic solution Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 229940125644 antibody drug Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 108010030518 arginine endopeptidase Proteins 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 239000004637 bakelite Substances 0.000 description 1
- RROBIDXNTUAHFW-UHFFFAOYSA-N benzotriazol-1-yloxy-tris(dimethylamino)phosphanium Chemical compound C1=CC=C2N(O[P+](N(C)C)(N(C)C)N(C)C)N=NC2=C1 RROBIDXNTUAHFW-UHFFFAOYSA-N 0.000 description 1
- HUZCTWYDQIQZPM-UHFFFAOYSA-N benzyl 2,2,2-trichloroethanimidate Chemical compound ClC(Cl)(Cl)C(=N)OCC1=CC=CC=C1 HUZCTWYDQIQZPM-UHFFFAOYSA-N 0.000 description 1
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 1
- KCXMKQUNVWSEMD-UHFFFAOYSA-N benzyl chloride Chemical compound ClCC1=CC=CC=C1 KCXMKQUNVWSEMD-UHFFFAOYSA-N 0.000 description 1
- 229940073608 benzyl chloride Drugs 0.000 description 1
- HTJDVAQGUYGUON-UHFFFAOYSA-N benzyl n,n'-di(propan-2-yl)carbamimidate Chemical compound CC(C)NC(=NC(C)C)OCC1=CC=CC=C1 HTJDVAQGUYGUON-UHFFFAOYSA-N 0.000 description 1
- NHOWLEZFTHYCTP-UHFFFAOYSA-N benzylhydrazine Chemical compound NNCC1=CC=CC=C1 NHOWLEZFTHYCTP-UHFFFAOYSA-N 0.000 description 1
- 238000007068 beta-elimination reaction Methods 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- IOVVFSGCNWQFQT-UHFFFAOYSA-N bis(2,3,4,5,6-pentafluorophenyl) carbonate Chemical compound FC1=C(F)C(F)=C(F)C(F)=C1OC(=O)OC1=C(F)C(F)=C(F)C(F)=C1F IOVVFSGCNWQFQT-UHFFFAOYSA-N 0.000 description 1
- PFYXSUNOLOJMDX-UHFFFAOYSA-N bis(2,5-dioxopyrrolidin-1-yl) carbonate Chemical compound O=C1CCC(=O)N1OC(=O)ON1C(=O)CCC1=O PFYXSUNOLOJMDX-UHFFFAOYSA-N 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- RDHPKYGYEGBMSE-UHFFFAOYSA-N bromoethane Chemical compound CCBr RDHPKYGYEGBMSE-UHFFFAOYSA-N 0.000 description 1
- GZUXJHMPEANEGY-UHFFFAOYSA-N bromomethane Chemical compound BrC GZUXJHMPEANEGY-UHFFFAOYSA-N 0.000 description 1
- KMGBZBJJOKUPIA-UHFFFAOYSA-N butyl iodide Chemical compound CCCCI KMGBZBJJOKUPIA-UHFFFAOYSA-N 0.000 description 1
- XKLVLDXNZDIDKQ-UHFFFAOYSA-N butylhydrazine Chemical compound CCCCNN XKLVLDXNZDIDKQ-UHFFFAOYSA-N 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229940106189 ceramide Drugs 0.000 description 1
- 150000001783 ceramides Chemical class 0.000 description 1
- 229960002376 chymotrypsin Drugs 0.000 description 1
- TUFGVZMNGTYAQD-UHFFFAOYSA-N comins' reagent Chemical compound FC(F)(F)S(=O)(=O)N(S(=O)(=O)C(F)(F)F)C1=CC=C(Cl)C=N1 TUFGVZMNGTYAQD-UHFFFAOYSA-N 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- LMEDOLJKVASKTP-UHFFFAOYSA-N dibutyl sulfate Chemical compound CCCCOS(=O)(=O)OCCCC LMEDOLJKVASKTP-UHFFFAOYSA-N 0.000 description 1
- DENRZWYUOJLTMF-UHFFFAOYSA-N diethyl sulfate Chemical compound CCOS(=O)(=O)OCC DENRZWYUOJLTMF-UHFFFAOYSA-N 0.000 description 1
- 229940008406 diethyl sulfate Drugs 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- IEJIGPNLZYLLBP-UHFFFAOYSA-N dimethyl carbonate Chemical compound COC(=O)OC IEJIGPNLZYLLBP-UHFFFAOYSA-N 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 1
- GAFRWLVTHPVQGK-UHFFFAOYSA-N dipentyl sulfate Chemical compound CCCCCOS(=O)(=O)OCCCCC GAFRWLVTHPVQGK-UHFFFAOYSA-N 0.000 description 1
- GCSAXWHQFYOIFE-UHFFFAOYSA-N dipyridin-2-yl carbonate Chemical compound C=1C=CC=NC=1OC(=O)OC1=CC=CC=N1 GCSAXWHQFYOIFE-UHFFFAOYSA-N 0.000 description 1
- IKYOVSVBLHGFMA-UHFFFAOYSA-N dipyridin-2-yloxymethanethione Chemical compound C=1C=CC=NC=1OC(=S)OC1=CC=CC=N1 IKYOVSVBLHGFMA-UHFFFAOYSA-N 0.000 description 1
- KMJYGLJORYOCJF-OABTZWTBSA-L disodium;5-acetamido-2-[[6-[5-acetamido-6-[2-[[6-[5-acetamido-6-[5-acetamido-6-[[(3s)-4-[[(2s)-6-amino-1-[[(1s,2r)-1-carboxy-2-hydroxypropyl]amino]-1-oxohexan-2-yl]amino]-3-[[(2s)-2-[[(2s)-2-[[(2s)-2,6-diaminohexanoyl]amino]-3-methylbutanoyl]amino]propano Chemical compound [Na+].[Na+].OC1C(NC(C)=O)C(NC(=O)C[C@H](NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@@H](N)CCCCN)C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)OC(CO)C1OC1C(NC(C)=O)C(O)C(OC2C(C(OC3C(C(O)C(O)C(CO)O3)OC3C(C(O)C(OC4C(C(O)C(O)C(COC5(OC(C(NC(C)=O)C(O)C5)[C@H](O)[C@H](O)CO)C([O-])=O)O4)O)C(CO)O3)NC(C)=O)C(O)C(COC3C(C(O)C(O)C(CO)O3)OC3C(C(O)C(OC4C(C(O)C(O)C(COC5(OC(C(NC(C)=O)C(O)C5)[C@H](O)[C@H](O)CO)C([O-])=O)O4)O)C(CO)O3)NC(C)=O)O2)O)C(CO)O1 KMJYGLJORYOCJF-OABTZWTBSA-L 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 125000003700 epoxy group Chemical group 0.000 description 1
- UVECLJDRPFNRRQ-UHFFFAOYSA-N ethyl trifluoromethanesulfonate Chemical compound CCOS(=O)(=O)C(F)(F)F UVECLJDRPFNRRQ-UHFFFAOYSA-N 0.000 description 1
- 239000012021 ethylating agents Substances 0.000 description 1
- WHRIKZCFRVTHJH-UHFFFAOYSA-N ethylhydrazine Chemical compound CCNN WHRIKZCFRVTHJH-UHFFFAOYSA-N 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 235000021255 galacto-oligosaccharides Nutrition 0.000 description 1
- 150000003271 galactooligosaccharides Chemical class 0.000 description 1
- 150000002256 galaktoses Chemical class 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 1
- 238000006698 hydrazinolysis reaction Methods 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical compound CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 238000005040 ion trap Methods 0.000 description 1
- FMKOJHQHASLBPH-UHFFFAOYSA-N isopropyl iodide Chemical compound CC(C)I FMKOJHQHASLBPH-UHFFFAOYSA-N 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000001906 matrix-assisted laser desorption--ionisation mass spectrometry Methods 0.000 description 1
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical class CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- VUQUOGPMUUJORT-UHFFFAOYSA-N methyl 4-methylbenzenesulfonate Chemical compound COS(=O)(=O)C1=CC=C(C)C=C1 VUQUOGPMUUJORT-UHFFFAOYSA-N 0.000 description 1
- MBXNQZHITVCSLJ-UHFFFAOYSA-N methyl fluorosulfonate Chemical compound COS(F)(=O)=O MBXNQZHITVCSLJ-UHFFFAOYSA-N 0.000 description 1
- PUVRRPLSJKDMKH-UHFFFAOYSA-N methyl n,n'-di(propan-2-yl)carbamimidate Chemical compound CC(C)NC(OC)=NC(C)C PUVRRPLSJKDMKH-UHFFFAOYSA-N 0.000 description 1
- OIRDBPQYVWXNSJ-UHFFFAOYSA-N methyl trifluoromethansulfonate Chemical compound COS(=O)(=O)C(F)(F)F OIRDBPQYVWXNSJ-UHFFFAOYSA-N 0.000 description 1
- 239000012022 methylating agents Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- AXTNYCDVWRSOCU-UHFFFAOYSA-N n'-tert-butyl-n-ethylmethanediimine Chemical compound CCN=C=NC(C)(C)C AXTNYCDVWRSOCU-UHFFFAOYSA-N 0.000 description 1
- KSVMTHKYDGMXFJ-UHFFFAOYSA-N n,n'-bis(trimethylsilyl)methanediimine Chemical compound C[Si](C)(C)N=C=N[Si](C)(C)C KSVMTHKYDGMXFJ-UHFFFAOYSA-N 0.000 description 1
- XLDBGFGREOMWSL-UHFFFAOYSA-N n,n'-bis[2,6-di(propan-2-yl)phenyl]methanediimine Chemical compound CC(C)C1=CC=CC(C(C)C)=C1N=C=NC1=C(C(C)C)C=CC=C1C(C)C XLDBGFGREOMWSL-UHFFFAOYSA-N 0.000 description 1
- IDVWLLCLTVBSCS-UHFFFAOYSA-N n,n'-ditert-butylmethanediimine Chemical compound CC(C)(C)N=C=NC(C)(C)C IDVWLLCLTVBSCS-UHFFFAOYSA-N 0.000 description 1
- DBNQIOANXZVWIP-UHFFFAOYSA-N n,n-dimethyl-1,1-bis[(2-methylpropan-2-yl)oxy]methanamine Chemical compound CC(C)(C)OC(N(C)C)OC(C)(C)C DBNQIOANXZVWIP-UHFFFAOYSA-N 0.000 description 1
- NSLGQFIDCADTAS-UHFFFAOYSA-N n,n-dimethyl-1,1-dipropoxymethanamine Chemical compound CCCOC(N(C)C)OCCC NSLGQFIDCADTAS-UHFFFAOYSA-N 0.000 description 1
- PVWOIHVRPOBWPI-UHFFFAOYSA-N n-propyl iodide Chemical compound CCCI PVWOIHVRPOBWPI-UHFFFAOYSA-N 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 239000012038 nucleophile Substances 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- FZFZFCIODKYFEV-UHFFFAOYSA-N pentan-1-amine;hydrochloride Chemical compound Cl.CCCCCN FZFZFCIODKYFEV-UHFFFAOYSA-N 0.000 description 1
- 229940100684 pentylamine Drugs 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- HKOOXMFOFWEVGF-UHFFFAOYSA-N phenylhydrazine Chemical compound NNC1=CC=CC=C1 HKOOXMFOFWEVGF-UHFFFAOYSA-N 0.000 description 1
- 229940067157 phenylhydrazine Drugs 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- SWWHCQCMVCPLEQ-UHFFFAOYSA-N propan-2-yl methanesulfonate Chemical compound CC(C)OS(C)(=O)=O SWWHCQCMVCPLEQ-UHFFFAOYSA-N 0.000 description 1
- RHNDDRWPYPWKNW-UHFFFAOYSA-N propan-2-yl n,n'-di(propan-2-yl)carbamimidate Chemical compound CC(C)NC(OC(C)C)=NC(C)C RHNDDRWPYPWKNW-UHFFFAOYSA-N 0.000 description 1
- DKORSYDQYFVQNS-UHFFFAOYSA-N propyl methanesulfonate Chemical compound CCCOS(C)(=O)=O DKORSYDQYFVQNS-UHFFFAOYSA-N 0.000 description 1
- PYNUOAIJIQGACY-UHFFFAOYSA-N propylazanium;chloride Chemical compound Cl.CCCN PYNUOAIJIQGACY-UHFFFAOYSA-N 0.000 description 1
- UKPBXIFLSVLDPA-UHFFFAOYSA-N propylhydrazine Chemical compound CCCNN UKPBXIFLSVLDPA-UHFFFAOYSA-N 0.000 description 1
- 238000005932 reductive alkylation reaction Methods 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 125000005630 sialyl group Chemical group 0.000 description 1
- 239000007974 sodium acetate buffer Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000004885 tandem mass spectrometry Methods 0.000 description 1
- CQXDYHPBXDZWBA-UHFFFAOYSA-N tert-butyl 2,2,2-trichloroethanimidate Chemical compound CC(C)(C)OC(=N)C(Cl)(Cl)Cl CQXDYHPBXDZWBA-UHFFFAOYSA-N 0.000 description 1
- RKSOPLXZQNSWAS-UHFFFAOYSA-N tert-butyl bromide Chemical compound CC(C)(C)Br RKSOPLXZQNSWAS-UHFFFAOYSA-N 0.000 description 1
- ZWZVWGITAAIFPS-UHFFFAOYSA-N thiophosgene Chemical compound ClC(Cl)=S ZWZVWGITAAIFPS-UHFFFAOYSA-N 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- GKASDNZWUGIAMG-UHFFFAOYSA-N triethyl orthoformate Chemical compound CCOC(OCC)OCC GKASDNZWUGIAMG-UHFFFAOYSA-N 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- GRGCWBWNLSTIEN-UHFFFAOYSA-N trifluoromethanesulfonyl chloride Chemical compound FC(F)(F)S(Cl)(=O)=O GRGCWBWNLSTIEN-UHFFFAOYSA-N 0.000 description 1
- BFPOZPZYPNVMHU-UHFFFAOYSA-M trimethyl-[3-(trifluoromethyl)phenyl]azanium;hydroxide Chemical compound [OH-].C[N+](C)(C)C1=CC=CC(C(F)(F)F)=C1 BFPOZPZYPNVMHU-UHFFFAOYSA-M 0.000 description 1
- MDTPTXSNPBAUHX-UHFFFAOYSA-M trimethylsulfanium;hydroxide Chemical compound [OH-].C[S+](C)C MDTPTXSNPBAUHX-UHFFFAOYSA-M 0.000 description 1
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/62—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating the ionisation of gases, e.g. aerosols; by investigating electric discharges, e.g. emission of cathode
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/04—Preparation or injection of sample to be analysed
- G01N30/06—Preparation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/62—Detectors specially adapted therefor
- G01N30/72—Mass spectrometers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2400/00—Assays, e.g. immunoassays or enzyme assays, involving carbohydrates
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2440/00—Post-translational modifications [PTMs] in chemical analysis of biological material
- G01N2440/38—Post-translational modifications [PTMs] in chemical analysis of biological material addition of carbohydrates, e.g. glycosylation, glycation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2560/00—Chemical aspects of mass spectrometric analysis of biological material
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Organic Chemistry (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Food Science & Technology (AREA)
- Cell Biology (AREA)
- Genetics & Genomics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- Other Investigation Or Analysis Of Materials By Electrical Means (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Sampling And Sample Adjustment (AREA)
- Bioinformatics & Computational Biology (AREA)
- Biophysics (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Spectroscopy & Molecular Physics (AREA)
- General Engineering & Computer Science (AREA)
Description
本発明の第2の態様は、第1の態様の分析用試料の調製方法により試料を調製することと、調製した前記分析用試料の分析を行うこととを備える分析方法に関する。
本発明の第3の態様は、第1の態様の分析用試料の調製方法に用いられる分析用試料の調製用キットに関する。
図1は、本実施形態の分析用試料の調製方法に係る分析方法の流れを示すフローチャートである。本実施形態の分析用試料の調製方法では、試料に含まれる糖鎖のシアル酸をエステル化した後、エステル化されたシアル酸を結合様式特異的にアミド化する。ステップS1001において、糖鎖を含む試料が用意される。
糖鎖を含む試料は、特に限定されず、糖鎖、糖ペプチドおよび糖タンパク質、ならびに糖脂質からなる群から選択される少なくとも一つの分子を含むことができる。ペプチドおよび糖ペプチドは、2以上50未満のアミノ酸からなるペプチド主鎖を備えるとし、タンパク質および糖タンパク質は、50以上のアミノ酸からなるペプチド主鎖を備えるとすることができる。しかし、慣例的な例外もあり、ペプチドとタンパク質の範囲の境界および糖ペプチドおよび糖タンパク質の範囲の境界はこれに限定されない。本実施形態の分析用試料の調製方法では、糖鎖に含まれるシアル酸の結合様式特異的な修飾が行われる。試料中の糖鎖は、N-結合型糖鎖(N型糖鎖)若しくはO-結合型糖鎖(O型糖鎖)、または糖脂質型糖鎖等、末端または末端以外の位置にシアル酸を有する可能性がある糖鎖を含むことが好ましい。また、試料中の糖鎖は、α2,3-シアル酸、α2,8-シアル酸およびα2,9-シアル酸の少なくとも一つを含むか、含む可能性があることがより好ましく、これに加えてα2,6-シアル酸を含むか、含む可能性があることがさらに好ましい。
ステップS1001が終了したら、ステップS1003に進む。
ステップS1003において、試料をエステル化のための反応溶液(以下、エステル化反応溶液と呼ぶ)と接触させ、糖鎖に含まれるシアル酸の少なくとも一部をエステル化するエステル化反応を行う(以下、エステル化反応と記載した場合、特に言及が無い限り、ステップS1003のエステル化反応を指す)。エステル化反応は、糖鎖に含まれるシアル酸を、ラクトン化以外のエステル化に供する反応である。しかし、エステル化反応において、一部のシアル酸についてラクトン化以外のエステル化が起きれば、他の一部のシアル酸がラクトン化されることも妨げない。以下の実施形態において、「ラクトン化以外のエステル化」とは、エステル化反応溶液の成分の一部がシアル酸のカルボン酸に結合し、カルボン酸エステルを形成することを指す。すなわち、エステル化反応溶液の成分の一部がカルボン酸エステルを示す-COORのRの部分に導入されることに相当する。エステル化反応では、結合様式非特異的に糖鎖に含まれるシアル酸をエステル化することが好ましい。エステル化反応では、α2,3-シアル酸、α2,6-シアル酸、α2,8-シアル酸およびα2,9-シアル酸のカルボキシ基が好適にエステル化される。
エステル化反応溶液がアルコールを含む場合、エステル化反応溶液はさらに、縮合剤を含むことが好ましく、縮合剤に加えさらに添加剤を含むことがより好ましい。エステル化反応溶液は、メタノールまたはエタノール等のアルコールと、塩酸等の酸とを含むようにしてもよい。
エステル化反応溶液に含まれるエステル化剤は、特に限定されないが、エステル化剤のうち、アルキル化剤が好ましく、メチル化剤、エチル化剤、イソプロピル化剤等のプロピル化剤、tert-ブチル化剤等のブチル化剤、またはベンジル化剤がより好ましく、メチル化剤またはエチル化剤がさらに好ましい。
エステル化反応では、少なくともα2,3-シアル酸,α2,8-シアル酸およびα2,9-シアル酸の少なくとも一つがエステル化されるように用いるアルコールまたはエステル化剤等の濃度が調整されることが好ましい。結合様式特異的に修飾を行う観点からは、α2,6-シアル酸をエステル化するように用いるアルコールまたはエステル化剤等の濃度が調整されることが好ましい。また、試料における糖鎖の全てのシアル酸がエステル化されても結合様式特異的な修飾を行うことができるため、エステル化反応溶液における、アルコール、縮合剤若しくは添加剤、またはエステル化剤の濃度は、他の面で支障がない限り、高めに設定することができる。
エステル化反応は、液相でも固相でも行うことができる。試料とエステル化反応溶液とを接触させることができれば、エステル化反応を起こす際の試料の状態は特に限定されない。
ステップS1003が終了したら、ステップS1005に進む。
ステップS1005において、試料を、反応溶液(以下、アミド化反応溶液と呼ぶ)と接触させ、ステップS1003のエステル化により修飾されているシアル酸をアミド化するアミド化反応(以下、アミド化反応と記載した場合、特に言及が無い限り、ステップS1005のアミド化反応を指す)が行われる。アミド化反応では、ステップS1003でエステル化されたシアル酸のエステル化修飾がアミド化修飾に変換(以下、適宜エステルアミド変換と呼ぶ)される。アミド化反応では、α2,3-シアル酸、α2,8-シアル酸およびα2,9-シアル酸の少なくとも一つ、特にα2,3-シアル酸およびα2,8-シアル酸の少なくとも一つがアミド化される。
なお、アミド化反応には脱水縮合剤は必要ではなく含まれなくてよいが、アミド化反応溶液に脱水縮合剤が含まれていてもよい。例えば、ステップS1003で試料に加えたエステル化反応溶液を除去しないで、アンモニア、アミンまたはこれらの塩を試料に加えることにより、アミド化反応溶液を調製してもよい。このように、アミド化反応は、簡便な操作で行うことができる。あるいは、ステップS1003で試料に加えたエステル化反応溶液を除去するための操作の後、試料をアミド化反応溶液と接触させることのみによりアミド化反応が行われる。また、アミド化反応では、試料とアミド化反応溶液とを接触させた後、試料と脱水縮合剤とを反応させる操作を行わないようにできるが、例えば他の目的のため行ってもよい。
表1
α2,6-x2 α2,6-+α2,3- α2,3-x2
Neu5Ac x2 0 +13 +26
Neu5Ac + Neu5Gc +16 +29 +42
Neu5Gc x2 +32 +45 +58
表2
α2,6-x2 α2,6-+α2,3- α2,3-x2
Neu5Ac x2 0 +27 +54
Neu5Ac + Neu5Gc +16 +43 +70
Neu5Gc x2 +32 +59 +86
この場合、ピークは好適に分離される。シアル酸を3以上含む糖鎖でも同様である。このように、試料に含まれる糖鎖の複雑性に応じてエステル化とアミド化の組み合わせは適宜選択できる。
以下の実施形態では、「アミン」の語は、ヒドラジン、ヒドラジン誘導体およびヒドロキシアミンを含み、アンモニアおよびアンモニアの塩を含まないものとする。アミド化反応においてアミンを用いる場合、アミド化反応剤に含まれるアミンは、第一級アミン、ヒドラジン、ヒドラジン誘導体およびヒドロキシアミンならびにこれらの塩から選択される少なくとも一つの化合物であることが好ましい。α2,3-シアル酸等のカルボキシ基はα2,6-シアル酸のカルボキシ基に比べて立体障害が比較的大きい位置にあるため、第一級アミンは、他のアミンと比べ、α2,3-シアル酸等と選択的に反応しやすいと考えられる。
アミド化反応溶液における、メチルアミンまたはエチルアミン等のアミド化反応剤の濃度は、重量/体積%で、0.01%以上が好ましく、0.1%以上がより好ましく、1%以上がさらに好ましい。アミド化反応溶液におけるアミド化反応剤の濃度が高いほど、より確実にエステル化されたシアル酸のアミド化を行うことができる。アミド化反応溶液における、メチルアミンまたはエチルアミン等のアミド化反応剤の濃度は、重量/体積%で、40%未満が好ましく、20%未満がより好ましい。これにより、高濃度による意図しない反応を抑制したり、α2.6‐シアル酸をアミド化することを抑制し結合様式特異的な修飾を容易にすることができる。
アミド化反応溶液の溶媒は、アミド化を確実に起こす観点から水系溶媒、有機溶媒または水系溶媒と有機溶媒の混合溶媒が好ましい。アミド化反応溶液の溶媒は、例えば、水、メタノール若しくはエタノール等のアルコール、ジメチルスルホキシド(DMSO)またはアセトニトリルまたはこれらの混合液とすることができる。結合様式特異的にα2,6-シアル酸と他のシアル酸を修飾する場合には、α2,6-シアル酸のアミド化を抑制する観点から、アミド化反応溶液の溶媒は、有機溶媒を含むことが好ましい。
アミド化反応溶液のpHは、7.7以上である。アミド化反応溶液のpHは、8.0以上が好ましく、8.8以上がより好ましく、10.3以上がさらに好ましい。アミド化反応溶液のpHが高くなると、加水分解等の副反応が抑制されたり、様々なアミド化反応剤を用いてより確実にエステル化されたシアル酸がアミド化されるため好ましい。
アミド化反応は、数秒~数分以内に完了する。従って、アミド化反応によりエステル化されたシアル酸をアミド化するために、試料をアミド化反応溶液と接触させる時間(以下、反応時間と呼ぶ)は、1時間未満が好ましく、30分未満がより好ましく、15分未満がさらに好ましく、5分未満がさらに好ましく、1分未満が最も好ましい。好適には、試料をアミド化反応溶液で洗浄したり、担体等に保持されている試料に対して一時的に通液するだけでもよい。試料とアミド化反応溶液とが接触する時間は、特に限定されないが、反応を十分完了させる等の観点から適宜0.1秒以上または1秒以上等とすることができる。また、試料とアミド化反応溶液を混合し、そのまま反応時間を設けずに乾固してもよい。アミド化反応の反応時間を短く設定することで、より効率的に試料の解析を行うことができる。
試料とアミド化反応溶液とを接触させることができれば、アミド化反応を起こす際の試料の状態は特に限定されず、固相でも液相でもよい。液相でアミド化反応を行う場合、上述したようにエステル化反応後の溶液を残したまま試料にアミド化反応溶液を加えてもよいし、エステル化反応後に精製、脱塩、可溶化等の公知の前処理を行ってもよい。固相に固定した状態でアミド化反応が行われる場合、固相でエステル化反応に供した試料を、固相に固定した状態を維持して、アミド化反応を行ってもよい。また、試料をエステル化反応に供した後、固相に固定してアミド化反応を行ってもよい。
ステップS1007が終了したら、ステップS1009が開始される。
ステップS1009が終了したら、処理が終了される。
糖ペプチドまたは糖タンパク質にエステル化反応溶液およびアミド化反応溶液を加え、上述のようにシアル酸を修飾した場合、糖ペプチドまたは糖タンパク質に含まれるアミノ酸の側鎖、主鎖の末端にあるアミノ基およびカルボキシ基の間で分子内脱水縮合等の副反応が起こる場合がある。この場合、シアル酸修飾の前にアミノ基を化学修飾などで先にブロックしておくことで、シアル酸修飾時にペプチド部分の副反応を抑制出来る。詳細は、以下の文献を参照されたい:Takashi Nishikaze, Sadanori Sekiya, Shinichi Iwamoto, Koichi Tanaka. “A Universal Approach to linkage-Specific Derivatization for Sialic Acids on Glycopeptides,” Journal of The American Society for Mass Spectrometry, 2017年6月, Volume 28, Issue 1 Supplement, ポスター番号MP091。例えば、糖ペプチドまたは糖タンパク質に対してジメチルラベル化またはグアニジル化などのアミノ基をブロックする反応を行い、その後、エステル化反応およびアミド化反応を行うことができる。
本実施形態の分析用試料の調製方法に好適に用いられる分析用試料の調製用キット(以下、調製用キットと呼ぶ)が提供される。
(変形例1)
上述の実施形態において、アミド化反応で得られた試料の分析に加え、エステル化反応で得られた試料の分析を行ってもよい。アミド化反応で得られた試料の分析を第1分析、エステル化反応で得られた試料の分析を第2分析と呼ぶ。
上述の実施形態では、エステル化されたシアル酸をアミド化反応によりアミド化し、結合様式特異的にシアル酸の修飾を行う例を説明した。しかし、特に結合様式特異的な修飾を目的とすることなく、シアル酸をアミド化する際に上記アミド化反応を用いてもよい。
発明者らは、さらに驚くべきことに、上述のアミド化反応において、アミド化反応溶液の溶媒の組成に基づいて構造特異的に糖鎖におけるシアル酸のアミド化を行うことができることを見出した。このことは、例えば上述の図1のフローチャートのステップS1005または図3のフローチャートのステップS2005においてアミド化反応を行った際、同一または異なる結合様式のシアル酸について、糖鎖におけるシアル酸の位置またはシアル酸近傍の糖鎖の構造に基づいて、シアル酸が選択的にアミド化されることを指す。ここで、「シアル酸近傍の糖鎖の構造」とは、シアル酸が直接結合する単糖と他の糖との結合についての構造を含む。
上述の変形例3において、結合様式特異的かつ構造特異的にアミノ酸を修飾してもよい。本変形例では、α2,6-シアル酸は、エステル化反応でエステル化される。α2,6-シアル酸以外のシアル酸のうち変形例3に記載した条件を満たすものが第1段階のアミド化で修飾される。この第1段階のアミド化を起こす反応を第1アミド化反応と呼び、第1アミド化反応におけるアミド化反応溶液およびアミド化反応剤をそれぞれ第1アミド化反応溶液および第1アミド化反応剤と呼ぶ。α2,6-シアル酸以外のシアル酸のうち変形例3に記載した条件を満たさないものが第2段階のアミド化で修飾される。この第2段階のアミド化を起こす反応を第2アミド化反応と呼び、第2アミド化反応におけるアミド化反応溶液およびアミド化反応剤をそれぞれ第2アミド化反応溶液および第2アミド化反応剤と呼ぶ。第1アミド化反応剤および第2アミド化反応剤は、これらがシアル酸に結合することにより生成される修飾体が質量分析等の分析により区別して検出されるように選択される。
上述した複数の例示的な実施形態またはその変形は、以下の態様の具体例であることが当業者により理解される。
実施例1~4では、N型糖鎖を担体に結合させた状態でエステル化反応およびアミド化反応を行い、得られた糖鎖試料を質量分析により分析した。
以下の1-3の手順を番号順に行い、α2,3-シアル酸を二つ含む糖鎖A2 glycan (33A2)を作成した。α2,3-シアリルグリコペプチド(α2,3- Sialylglycopeptide(SGP)、伏見製薬所)からPNGase Fを用いてA2 glycan (33A2) を遊離した。遊離した糖鎖はStage Tip Carbonで脱塩処理した。Stage Tip Carbonは、エムポアディスクカーボン(3M製)を、直径約1 mmに切り抜き、200 μLのチップに詰めたカーボンカラムである。
1. α2,3-SGPを1 nmol/μLの濃度で含む溶液20 μLが分注されたチューブに対して、PNGase F(SIGMA) 0.25U/μLを10μL加えた(2.5U/チューブ)。
2. 軽くタッピングと遠心を行い、37℃でオーバーナイト(o/n)のインキュベーションした。
3. 翌日、糖鎖をStage Tip Carbonを用いて脱塩した。
α2,6-シアル酸を含むA2GN1糖鎖(東京化成工業)を水に再溶解させ、混合し、評価用糖鎖試料とした。
以下の1-8の手順を番号順に行い、作成された上記評価用糖鎖試料をエステル化反応およびアミド化反応に供した。エステル化反応で1-メチル-3-p-トリルトリアゼン(MTT)および1-エチル-3-p-トリルトリアゼン(ETT)のいずれを用いたか、および、アミド化反応におけるアミド化反応剤は、各実施例の結果のところで説明する。
1. 作成された評価用糖鎖試料をヒドラジドビーズ(BlotGlyco; 住友ベークライト)に結合させた。BlotGlycoのプロトコルに従って、結合が行われた。
2. 溶媒をDMSOとし、500mMのMTTまたはETTを含む溶液を100 μLビーズに加え、60 ℃で1時間反応させた(エステル化反応)。
3. ビーズをメタノール200 μLにより3回洗浄した。
4. アミド化反応溶液100 μLをビーズに加えて撹拌した後、遠心によりアミド化反応溶液を除去した。
5. ビーズをメタノール200 μLにより3回洗浄した。
6. 糖鎖試料をビーズから遊離させた。Blotglycoのプロトコルに従って、遊離が行われた。
7. 遊離された糖鎖試料を減圧遠心濃縮により乾固させた。
8. 糖鎖をStage Tip Carbonを用いて脱塩した。
脱塩し乾固した糖鎖を20 μLの水に再溶解させた。再溶解により得られた溶液0.5 μLを700 μm μフォーカスプレート(Hudson Surface Technology)に滴下した。マトリックスとして50% アセトニトリル(ACN)に溶解させた5mg/mL 2,5-ジヒドロキシ安息香酸(DHB)を含むマトリックス溶液(5mMのNaClを含む)を加え、常温常圧で風乾した後、エタノール0.2 μLを添加し再結晶させて質量分析用試料を得た。その後、MALDI-四重極イオントラップ(Quadrupole Ion Trap)-飛行時間型(Time of Flight)質量分析計(MALDI-QIT-TOF-MS)(AXIMA-Resonance, Shimadzu/Kratos) を用い正イオンモードで測定を行った。
図6は、本実施例で用いたα2,3-シアル酸を含む糖鎖試料(以下、α2,3-糖鎖試料と呼ぶ)の構造を示す概念図である。α2,3-糖鎖試料は、N-アセチル-D-グルコサミン(GlcNAc)およびマンノース(Man)からなる基本型の構造と、2つの側鎖とを備える。2つの側鎖にはそれぞれGlcNAc、ガラクトース(Gal)およびシアル酸(Neu5Ac)が結合されている。
図7のマススペクトル(a)は、固相担体に糖鎖を結合した状態でシアル酸に対するメチルエステル化修飾反応を行った後、アミド化反応を行わず、糖鎖を遊離させて得られた試料のマススペクトルである。マススペクトルは、横軸に検出したイオンのm/z、縦軸に検出したイオンの検出信号の強度を示し、以下の各図でも同様である。m/z 2070.9のピークは糖鎖中の2か所のシアル酸が双方ともメチルエステル化されたα2,6-糖鎖試料のピークである。これに対して、α2,3-糖鎖試料については、2か所のシアル酸がメチルエステル化されたピーク(m/z 2273.9)と、2か所のシアル酸のうち一方がメチルエステル化し、他方がラクトン化したピーク(m/z 2241.9)との双方が観測された。
図8は、固相担体に糖鎖を結合した状態でシアル酸に対するメチルエステル化修飾反応を行った後、それぞれ重量/体積%で5.6% アンモニア水 (a)、10% メチルアミン溶液(b)、17.5% エチルアミン溶液(c)、16.7% ジメチルアミン溶液(d)および20% トリメチルアミン溶液(e)を用いてアミド化反応を行って得られた試料のマススペクトルを示す図である。(a)のアンモニアを用いた場合では、図7の(a)に示したm/z 2273.9やm/z 2241.9のピークが検出されず、糖鎖中の2つのシアル酸がアミド化された糖鎖に対応するm/z 2243.9のピークに集約された。従って、α2,3-シアル酸の構造特異的にアミド化されたことがわかる。(b)は図7と同様である。(c)のエチルアミンを用いた場合でも問題なく、結合様式特異的にエチルアミド化(m/z 2300.0)されたことがわかる。一方で、ジメチルアミン(d)またはトリメチルアミン(e)を用いた場合ではα2,3-シアル酸を含む糖鎖のピークが消失した。これらは、ラクトンのアミノリシス(非特許文献2参照)を起こしにくいアミンであるので、加水分解が促進された結果、おおもとのカルボン酸(-COOH)構造に戻りイオン化効率が低下し、正イオンモードでは検出されなくなったためと考察できる。
図9は、固相担体に糖鎖を結合した状態でシアル酸に対するメチルエステル化修飾反応を行った後、それぞれ水 (a)、メタノール(b)、ジメチルスルホキシド(c)およびアセトニトリル(d)を溶媒とした5または6%(重量/体積%)のメチルアミン溶液を用いてアミド化反応を行って得られた試料のマススペクトルを示す図である。有機溶媒でも問題なくα2,3-シアル酸に特異的なアミド化が進行したことが示された。溶媒を水とした場合よりも、有機溶媒条件下で行った方が、α2,6-シアル酸エステルのアミド化がより抑制された。
図10の上段(a)は、MTTを用いてシアル酸に対するメチルエステル化修飾反応を行った後、17.5 %(重量/体積%)エチルアミン溶液を用いてエチルアミド化反応を行って得られた試料のマススペクトルである。図10の下段(b)は、ETTを用いてシアル酸に対するエチルエステル化修飾反応を行った後、10 %(重量/体積%)メチルアミン溶液を用いてメチルアミド化反応を行って得られた試料のマススペクトルを示す図である。エステルとアミンの組み合わせを変えても、問題なくエステル化されたα2,3-シアル酸が選択的にアミドに変換されたことがわかる。
実施例5では、糖脂質型糖鎖を担体に結合させた状態でエステル化反応およびアミド化反応を行い、得られた糖鎖試料を質量分析により分析した。
試料としてスフィンゴ糖脂質であるHuman Disialoganglioside(ジシアロガングリオシド)GD1a および GD1b(HyTest)を使用した。0.2% Tritonx100 を含む 50 mM 酢酸ナトリウム緩衝液(pH5.5)45 μLに上記糖脂質を溶解し、60℃で20分間温置した後、Endoglycoceramidase I (以下の文献を参考に放線菌から精製したもの;Ishibashi Y, Nakasone T, Kiyohara M, Horibata Y, Sakaguchi K, Hijikata A, Ichinose S, Omori A, Yasui Y, Imamura A, Ishida H, Kiso M, Okino N, and Ito M. “A novel endoglycoceramidase hydrolyzes oligogalactosylceramides to produce galactooligosaccharides and ceramides,” Journal of Biological Chemistry, 2007年, Volume 282, pp.11386-11396)を 5 μL加え、37 ℃で16時間糖鎖脱離反応を行った。
以下の1-7の手順を番号順に行い、作成された上記評価用糖鎖試料をエステル化反応およびアミド化反応に供した。
1. 作成された評価用糖鎖試料を固相担体(BlotGlyco)に結合させた。BlotGlycoのプロトコルに従って、結合が行われた。
2. 溶媒をDMSOとし、500mMのMTTを含む溶液をビーズに加え、エステル化反応を行った。
3. 固相担体をメタノール200 μLにより3回洗浄した。
4. メチルアミン溶液200 μLにより固相担体を3回洗浄することでアミド化反応を行った。
5. 固相担体を水200 μLにより3回洗浄した。
6. BlotGlycoのプロトコルに基づき、糖鎖の還元末端にMALDI用高感度化ラベルaoWRを反応させた。
7. HILICプレート(Waters)を用いて試料から過剰試薬を除去した。
DHBをマトリックスとし、Ultraflex II TOF/TOF-MS(Bruker)を用い正イオンモードで測定を行った。
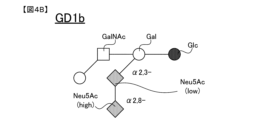
本実施例で用いたGD1a糖鎖およびGD1b糖鎖の構造は、それぞれ上記図4Aおよび4Bに示した。
上述の実施例では、固相担体に結合された状態でアミド化反応を行った。本実施例では、標準血清由来N型糖鎖を試料とし、固相担体に吸着させた状態でアミド化反応を行い、得られた糖鎖試料を質量分析により分析した。
市販の血清を還元アルキル化した後、トリプシン消化およびPNGase Fによる糖鎖の遊離を行い、N型糖鎖を調製した。
以下の1-5の手順を番号順に行い、血清中糖タンパク質由来のN型糖鎖をエステル化反応に供し、還元末端をaoWRでラベル化した。
1. 調製したN型糖鎖をビーズ(BlotGlyco)に結合させた。結合はBlotGlycoのプロトコルに沿って行われた。
2. DMSOに溶解させた500mMのMTT溶液を100 μLビーズに加え、60 ℃で1時間反応させた。
3. ビーズをメタノール200 μLにより3回洗浄した。
4. aoWR試薬により糖鎖を標識し、回収した。
5. HILICプレート(Waters)を用いてaoWR試薬を除去した。
上記エステル化反応後のヒト血清糖タンパク質由来N型糖鎖を、99%アセトニトリル/1%酢酸を用いて希釈し、90%アセトニトリル濃度に調製した。その後、糖鎖試料を含む溶液をHILICプレート(waters)にアプライし、背面から真空吸引することで溶液をプレートの担体に通液させ、HILIC担体上に糖鎖を吸着させた。その後、エステルアミド変換を行うため5~40%(重量/体積%)のエチルアミンを含むアセトニトリルをアミド化反応溶液としてプレートに添加し、背面から真空吸引することでアミド化反応溶液をプレートの担体に通液させた。その後、プレートに95%アセトニトリル/1%酢酸を加え、同じく背面から真空吸引することでプレート担体を洗浄した。これを三回繰り返した。最後に5%アセトニトリル/1%酢酸をプレートに添加し糖鎖をHILICプレートから溶出させた。
DHBをマトリックスとし、Ultraflex II TOF/TOF-MS(Bruker)を用い正イオンモードで測定を行った。
図12は、本実施例で検出したヒト血清糖タンパク質由来N型糖鎖の構造の一例を示す概念図である。図12に示された糖鎖試料は、GlcNAcおよびManからなる基本型の構造と、3つの側鎖とを備える。3つの側鎖にはそれぞれGlcNAc、Galおよびシアル酸(Neu5Ac)が結合されている。シアル酸の結合様式はα2,3-またはα2,6-である。後述の実施例7でも同様の糖鎖が検出された。
本実施例では、標準血清由来N型糖鎖を試料とし、液相でアミド化反応を行い、得られた糖鎖試料を質量分析により分析した。評価用糖鎖試料の作成とエステル化反応は、実施例6と同様の条件で行った。
上記の方法で調製したヒト血清糖タンパク質由来N型糖鎖をチューブ内に分注し、2.5~40%(重量/体積%)エチルアミンを含むアセトニトリル溶液で10倍に希釈し、軽くボルテックスミキサーで混合することでアミド化反応を行った。その後、試料を含む溶液をHILICプレート(Waters)にアプライし、背面から真空吸引することで当該溶液をプレートの担体に通液させ、HILIC担体上に糖鎖を吸着させた。その後、95%アセトニトリル/1%酢酸をプレートに加え、同じく背面から真空吸引することでプレート担体を洗浄した。これを三回繰り返した。最後に5%アセトニトリル/1%酢酸をプレートに添加して糖鎖をHILICプレートから溶出させた。
DHBをマトリックスとし、MALDI-QIT-TOF-MS(AXIMA-Resonance, Shimadzu/Kratos) を用い正イオンモードで測定を行った。
実施例8では、スフィンゴ糖脂質(Glycosphingolipid; GSL)から得られたGSL糖鎖を担体に結合させた状態でエチルエステル化反応を行い、得られた糖鎖試料に対してアミド化反応を行い、質量分析により分析した。
実施例5の方法と同様の方法でα2,3-またはα2,8-シアル酸を合計二つ含む糖鎖(GD1a、GD1b)を作成した。遊離した糖鎖はグライコブロッティング法により固相担体へ結合させ、1-エチル-3-p-トリルトリアゼン(ETT)によりエチルエステル化を行い、aoWR標識糖鎖(100 μL)として回収した。A2GN1糖鎖についても、上記実施例1と同様に試料を作成し、本実施例の上記と同様にエステル化反応に供した。
得られたaoWR標識糖鎖溶液25 μLを250 μLのアミン溶液(濃度1 mol/L、溶媒はアセトニトリル)と混合し、HILICプレート(Waters)を用いて試料から過剰試薬を除去した。DHBをマトリックスとし、Ultraflex II TOF/TOF-MS(Bruker)を用い正イオンモードで測定を行った。A2GN1糖鎖についても、同様にアミド化反応および質量分析に供した。
図16は、GD1aおよびA2GN1糖鎖を試料としてエチルエステル化修飾反応を行った後、アミド化反応を行わなかった試料(a)と、1 M(Mはmol/L) メチルアミン、エチルアミンおよびプロピルアミンをそれぞれ含むアセトニトリル溶液を用いたアミド化反応を行って得られた試料(b、c、d)のマススペクトルを示す図である。GD1aについては、ETTによるエチルエステル化を行い、アミド化を行わないと、2つのα2,3-シアル酸がメチルエステル化された場合に対応するピーク(m/z 1776)が検出された。以下の各図において、マススペクトル中に示された矢印は、ピークと生成物の修飾体とを対応付けて示す。メチルエステル化の後、メチルアミン溶液によるアミド化反応を行うとシアル酸の一つのみがメチルアミド化された生成物(m/z 1761)に集約された。同様にエチルアミン、プロピルアミン溶液を用いた場合においてもシアル酸の一つのみがアミド化された生成物(m/z 1775、1789)に集約された。
実施例9では、アミド化反応溶液としてアセトニトリルを溶媒としたプロピルアミン溶液を用い、プロピルアミン溶液におけるプロピルアミンの濃度を0 M-3 Mの範囲の複数の濃度にそれぞれ調製した。その他は、実施例8と同様の方法でGSL糖鎖の質量分析を行った。
図19は、様々な濃度のプロピルアミン溶液をアミド化反応溶液としてそれぞれ用いた場合に得られたGD1aのマススペクトルを示す図である。GD1aの場合、0.125 Mのプロピルアミン溶液を用いた場合では、エステルアミド交換はほぼ進行せず、0.25 Mまたは0.5 Mより高い濃度を用いた場合に糖鎖の末端に存在するα2,3-シアル酸一つのみがプロピルアミド化した。
Claims (24)
- 糖鎖を含む試料からの分析用試料の調製方法であって、
前記糖鎖に含まれるシアル酸の少なくとも一部を、メチルエステル化、エチルエステル化、プロピルエステル化、ブチルエステル化、ペンチルエステル化、ヘキシルエステル化、およびベンジルエステル化からなる群から選択される少なくとも一つのエステル化に供するエステル化反応を行うことと、
前記試料と、前記エステル化により修飾されているシアル酸と反応させるアンモニア、第一級アミン、ヒドラジン、ヒドラジン誘導体およびヒドロキシアミンならびにこれらの塩からなる群から選択される少なくとも一つの化合物を含む、アミド化反応溶液とを接触させ、前記エステル化により修飾されているシアル酸のエステル化修飾をアミド化修飾に変換するアミド化反応を行うこととを備え、
前記アミド化反応において、前記アミド化反応溶液における前記化合物の濃度は、前記エステル化により修飾されているα2,6-シアル酸のエステル化修飾から前記アミド化修飾への変換が起きないように調節され、前記エステル化により修飾されているα2,3-シアル酸の少なくとも一部、α2,8-シアル酸、およびα2,9-シアル酸からなる群から選択される少なくとも一つのシアル酸のエステル化修飾がアミド化修飾に変換される分析用試料の調製方法。 - 請求項1に記載の分析用試料の調製方法において、
前記アミド化反応溶液の溶媒は、有機溶媒を含む、分析用試料の調製方法。 - 請求項2に記載の分析用試料の調製方法において、
前記有機溶媒は、アセトニトリルである、分析用試料の調製方法。 - 請求項2または3に記載の分析用試料の調製方法において、
前記アミド化反応において、α2,3-シアル酸の少なくとも一部、α2,8-シアル酸、およびα2,9-シアル酸からなる群から選択される少なくとも一つのシアル酸が、前記少なくとも一つのシアル酸の前記糖鎖における位置または前記糖鎖の構造に基づいてアミド化される分析用試料の調製方法。 - 請求項2から4までのいずれか一項に記載の分析用試料の調製方法において、
前記アミド化反応において、α2,3-シアル酸のうち該α2,3-シアル酸が直接結合する単糖の4位に別の単糖が結合していない2,3-シアル酸のエステル化修飾がアミド化修飾に変換される分析用試料の調製方法。 - 請求項1から5までのいずれか一項に記載の分析用試料の調製方法において、
前記試料と、エステル化反応溶液とを接触させることにより前記エステル化反応を行
うことを備え、
前記エステル化反応溶液は、アルコールおよびエステル化剤の少なくとも一つを含む、分析用試料の調製方法。 - 請求項6に記載の分析用試料の調製方法において、
前記エステル化反応溶液はエステル化剤を含み、
前記エステル化剤はトリアゼン誘導体である、分析用試料の調製方法。 - 請求項6または7に記載の分析用試料の調製方法において、
前記アミド化反応は、前記試料から前記エステル化反応溶液を除去するための操作の後、 前記試料を前記アミド化反応溶液と接触させることのみにより行われる、分析用試料の調製方法。 - 請求項6から8までのいずれか一項に記載の分析用試料の調製方法において、
前記アミド化反応溶液は、脱水縮合剤を含まない、分析用試料の調製方法。 - 請求項1から9までのいずれか一項に記載の分析用試料の調製方法において、
前記試料と前記アミド化反応溶液とを接触させた後、前記試料と脱水縮合剤とを反応させる操作を行わない、分析用試料の調製方法。 - 請求項1から10までのいずれか一項に記載の分析用試料の調製方法において、
前記アミド化反応を行うために前記試料と前記アミド化反応溶液とを接触させる時間は30分より短い、分析用試料の調製方法。 - 請求項1から11までのいずれか一項に記載の分析用試料の調製方法において、
前記アミド化反応の前に、前記エステル化反応により生成したラクトン構造を開裂するための操作を行わない、分析用試料の調製方法。 - 請求項1から12までのいずれか一項に記載の分析用試料の調製方法において、
前記化合物は第一級アミンである、分析用試料の調製方法。 - 請求項13に記載の分析用試料の調製方法において、
前記第一級アミンのアミノ基に結合した炭素原子に1以下の炭素原子が直接結合している、分析用試料の調製方法。 - 請求項1から14までのいずれか一項に記載の分析用試料の調製方法において、
前記化合物はアルキル基を含む、分析用試料の調製方法。 - 請求項1から15までのいずれか一項に記載の分析用試料の調製方法において、
前記アミド化反応溶液のpHは、7.7以上である、分析用試料の調製方法。 - 請求項6から9までのいずれか一項に記載の分析用試料の調製方法において、
前記試料と前記エステル化反応溶液とを接触させた際に、前記エステル化により修飾されなかったシアル酸の少なくとも一部がラクトン化され、
前記試料と、前記アミド化反応溶液とを接触させた際に、前記ラクトン化により修飾されているシアル酸のラクトン構造がアミド化修飾に変換される分析用試料の調製方法。 - 請求項1から17までのいずれか一項に記載の分析用試料の調製方法において、
前記エステル化反応および前記アミド化反応の少なくとも一つは、前記試料が固相担体に結合または吸着した状態で行われる、分析用試料の調製方法。 - 請求項4または5に記載の分析用試料の調製方法において、
前記有機溶媒を含むアミド化反応溶液を用いて前記アミド化反応を行った後、水系溶媒を含むアミド化反応溶液を前記アミド化反応に供された前記試料と接触させ、前記アミド化反応でアミド化されなかったシアル酸のアミド化を行うことをさらに備える、分析用試料の調製方法。 - 請求項1から19までのいずれか一項に記載の分析用試料の調製方法において、
前記アミド化反応に供した後の前記試料から第1分析用試料を調製することと、
前記エステル化反応に供した後、前記アミド化反応に供する前の前記試料から第2分析用試料を調製することと
を備える分析用試料の調製方法。 - 請求項1から19までのいずれか一項の分析用試料の調製方法により試料を調製することと、
調製した前記分析用試料の分析を行うことと
を備える分析方法。 - 請求項20に記載の分析用試料の調製方法により前記第1分析用試料および前記第2分析用試料を調製することと、
調製した前記第1分析用試料および前記第2分析用試料の分析を行うことと、
前記第1分析用試料の前記分析で得られたデータと前記第2分析用試料の前記分析で得られたデータの違いに基づいて、前記試料に含まれる糖鎖の解析を行うことと
を備える分析方法。 - 請求項21または22に記載の分析方法において、
前記分析は、質量分析およびクロマトグラフィの少なくとも一つにより行われる分析方法。 - 請求項1から19までのいずれか一項に記載の分析用試料の調製方法に用いられる分析用試料の調製用キットであって、
前記エステル化反応に用いられるアルコールまたはエステル化剤と前記化合物とを含む分析用試料の調製用キット。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019192037A JP7363359B2 (ja) | 2019-10-21 | 2019-10-21 | 分析用試料の調製方法、分析方法および分析用試料の調製用キット |
| US17/073,608 US20210164989A1 (en) | 2019-10-21 | 2020-10-19 | Method for preparing analysis sample, analysis method, and kit for preparing analysis sample |
| EP20202649.8A EP3812767A1 (en) | 2019-10-21 | 2020-10-19 | Method for preparing analysis sample, analysis method, and kit for preparing analysis sample |
| CN202011132543.0A CN112763286A (zh) | 2019-10-21 | 2020-10-21 | 分析用试样的制备方法、分析方法和分析用试样的制备用试剂盒 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019192037A JP7363359B2 (ja) | 2019-10-21 | 2019-10-21 | 分析用試料の調製方法、分析方法および分析用試料の調製用キット |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2021067524A JP2021067524A (ja) | 2021-04-30 |
| JP2021067524A5 JP2021067524A5 (ja) | 2022-02-24 |
| JP7363359B2 true JP7363359B2 (ja) | 2023-10-18 |
Family
ID=74095640
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019192037A Active JP7363359B2 (ja) | 2019-10-21 | 2019-10-21 | 分析用試料の調製方法、分析方法および分析用試料の調製用キット |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20210164989A1 (ja) |
| EP (1) | EP3812767A1 (ja) |
| JP (1) | JP7363359B2 (ja) |
| CN (1) | CN112763286A (ja) |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013068594A (ja) | 2011-09-05 | 2013-04-18 | Sumitomo Bakelite Co Ltd | シアロ糖鎖をアミド化修飾する方法 |
| JP2013076629A (ja) | 2011-09-30 | 2013-04-25 | Sumitomo Bakelite Co Ltd | α2,6−シアロ糖鎖とα2,3−シアロ糖鎖とを識別する方法 |
| US20160289346A1 (en) | 2013-11-21 | 2016-10-06 | Repetoire Genesis Incorporation | Glycan analysis |
| JP2018109525A (ja) | 2016-12-28 | 2018-07-12 | 株式会社島津製作所 | 分析用試料の調製方法および分析方法 |
| JP2019152475A (ja) | 2018-03-01 | 2019-09-12 | 株式会社島津製作所 | 試料の調製方法および分析方法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS54109785A (en) | 1978-02-16 | 1979-08-28 | Nec Corp | Semiconductor device |
| WO2007099856A1 (ja) * | 2006-02-23 | 2007-09-07 | National University Corporation Hokkaido University | 質量分析用生体関連分子のエステル化法及び得られたエステル化誘導体の質量分析方法 |
| WO2012111775A1 (ja) * | 2011-02-16 | 2012-08-23 | 株式会社セルシード | セリン、スレオニンの翻訳後修飾解析用標識剤 |
| JP6135710B2 (ja) * | 2015-03-31 | 2017-05-31 | 株式会社島津製作所 | 分析用試料の調製方法および分析方法 |
| CN108700551B (zh) * | 2016-02-22 | 2021-12-03 | 株式会社岛津制作所 | 唾液酸糖链解析方法 |
| JP7012598B2 (ja) | 2018-04-26 | 2022-01-28 | 清水建設株式会社 | トイレブース利用予約装置、トイレブース利用予約システム、トイレブース利用予約方法 |
-
2019
- 2019-10-21 JP JP2019192037A patent/JP7363359B2/ja active Active
-
2020
- 2020-10-19 EP EP20202649.8A patent/EP3812767A1/en active Pending
- 2020-10-19 US US17/073,608 patent/US20210164989A1/en active Pending
- 2020-10-21 CN CN202011132543.0A patent/CN112763286A/zh active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013068594A (ja) | 2011-09-05 | 2013-04-18 | Sumitomo Bakelite Co Ltd | シアロ糖鎖をアミド化修飾する方法 |
| JP2013076629A (ja) | 2011-09-30 | 2013-04-25 | Sumitomo Bakelite Co Ltd | α2,6−シアロ糖鎖とα2,3−シアロ糖鎖とを識別する方法 |
| US20160289346A1 (en) | 2013-11-21 | 2016-10-06 | Repetoire Genesis Incorporation | Glycan analysis |
| JP2018109525A (ja) | 2016-12-28 | 2018-07-12 | 株式会社島津製作所 | 分析用試料の調製方法および分析方法 |
| JP2019152475A (ja) | 2018-03-01 | 2019-09-12 | 株式会社島津製作所 | 試料の調製方法および分析方法 |
Non-Patent Citations (4)
| Title |
|---|
| LAGEVEEN-KAMMEIJER, G.S.M. et al.,Highly sensitive CE-ESI-MS analysis of N-glycans from complex biological samples,NATURE COMMUNICATIONS,2019年05月13日,Vol.10/No.2137,p.1-7,https://doi.org/10.1038/s41467-019-09910-7 |
| LI, H. et al.,MALDI-MS analysis of sialylated N-glycan linkage isomers using solid-phase two step derivatization method,ANALYTICA CHIMICA ACTA,2016年04月25日,Vol.924,p.77-85,http://dx.doi.org/10.1016/j.aca.2016.04.023 |
| YANG, S. et al.,Solid-Phase Chemidcal Modification for Sialic Acid Linkage Analysis:Application to Glycoproteins of Hose Cells Used in Influenza Virus Propagation,ANALYTICAL CHEMISTRY,2017年08月09日,Vol.89,p.9508-9517,DOI: 10.1021/acs.analchem.7b02514 |
| 富岡 あづさ, 亀山 昭彦,「MALDI‐QIT‐TOF MSによるメチルエステル化シアロ糖鎖の解析」,第56回質量分析総合討論会講演要旨集,日本質量分析学会,2008年05月01日,p. 482-483 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN112763286A (zh) | 2021-05-07 |
| US20210164989A1 (en) | 2021-06-03 |
| JP2021067524A (ja) | 2021-04-30 |
| EP3812767A1 (en) | 2021-04-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3279655B1 (en) | Method of preparing sample for analysis and analysis method | |
| Morelle et al. | Analysis of protein glycosylation by mass spectrometry | |
| Miura et al. | Glycoblotting-assisted O-glycomics: ammonium carbamate allows for highly efficient O-glycan release from glycoproteins | |
| Harvey | Analysis of carbohydrates and glycoconjugates by matrix‐assisted laser desorption/ionization mass spectrometry: An update for 2007–2008 | |
| EP3534158B1 (en) | Method for preparing sample and analysis method | |
| EP3343225A1 (en) | Method of preparing sample for analysis and analysis method | |
| JP7047669B2 (ja) | 分析用試料の調製方法、分析方法および分析用試料の調製用キット | |
| US20180094293A1 (en) | Labeled glycan amino acid complexes useful in lc-ms analysis and methods of making the same | |
| WO2016159291A1 (ja) | 分析用試料の調製方法および分析方法 | |
| JP2005291958A (ja) | 糖鎖標識試薬 | |
| JP7363359B2 (ja) | 分析用試料の調製方法、分析方法および分析用試料の調製用キット | |
| Morelle et al. | Structural analysis of permethylated oligosaccharides using electrospray ionization quadrupole time‐of‐flight tandem mass spectrometry and deutero‐reduction | |
| JP7375816B2 (ja) | 分析用試料の調製方法、分析方法および分析用試料の調製用キット | |
| EP3632936A1 (en) | Method for preparing analytical sample, analysis method, and kit for preparing analytical sample | |
| CN110857936B (zh) | 分析用试样的制备方法、分析方法和分析用试样的制备用试剂盒 | |
| JP7255423B2 (ja) | 分析用試料の調製方法、分析方法および分析用試料の調製用キット | |
| WO2023243136A1 (ja) | 分析用試料の調製方法および分析方法 | |
| Belicka | Introduction to Glycomics and Glycan Analysis | |
| Ren et al. | Qualitative and Quantitative Methods for N-Glycans in N-Glycomics | |
| Karas et al. | Principles and applications of matrix-assisted UV—laser desorption/ionization mass spectrometry | |
| Hanisch et al. | Approaches to the O-Glycoproteome |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20210330 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210715 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210812 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220215 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220215 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20221130 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230110 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230307 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230511 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230905 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230918 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 7363359 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |