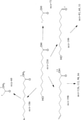
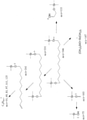
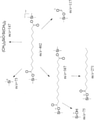
JP7004500B2 - ω-ヒドロキシル化脂肪酸誘導体を生産する方法 - Google Patents
ω-ヒドロキシル化脂肪酸誘導体を生産する方法 Download PDFInfo
- Publication number
- JP7004500B2 JP7004500B2 JP2016519714A JP2016519714A JP7004500B2 JP 7004500 B2 JP7004500 B2 JP 7004500B2 JP 2016519714 A JP2016519714 A JP 2016519714A JP 2016519714 A JP2016519714 A JP 2016519714A JP 7004500 B2 JP7004500 B2 JP 7004500B2
- Authority
- JP
- Japan
- Prior art keywords
- fatty acid
- seq
- cyp153a
- hydroxy
- hydroxy fatty
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 229940053200 antiepileptics fatty acid derivative Drugs 0.000 title claims description 143
- 239000000194 fatty acid Substances 0.000 claims description 357
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 338
- 229930195729 fatty acid Natural products 0.000 claims description 338
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 248
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 248
- 229920001184 polypeptide Polymers 0.000 claims description 247
- 150000004665 fatty acids Chemical class 0.000 claims description 153
- 102000005297 Cytochrome P-450 CYP4A Human genes 0.000 claims description 131
- 108010081498 Cytochrome P-450 CYP4A Proteins 0.000 claims description 131
- 229910052799 carbon Inorganic materials 0.000 claims description 131
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 130
- 244000005700 microbiome Species 0.000 claims description 129
- 230000004927 fusion Effects 0.000 claims description 126
- 238000000034 method Methods 0.000 claims description 99
- 238000004519 manufacturing process Methods 0.000 claims description 88
- 235000019387 fatty acid methyl ester Nutrition 0.000 claims description 80
- 150000007523 nucleic acids Chemical group 0.000 claims description 71
- 230000000694 effects Effects 0.000 claims description 60
- 108010021809 Alcohol dehydrogenase Proteins 0.000 claims description 52
- 238000006243 chemical reaction Methods 0.000 claims description 52
- 108020002982 thioesterase Proteins 0.000 claims description 48
- 102000007698 Alcohol dehydrogenase Human genes 0.000 claims description 46
- 102000005488 Thioesterase Human genes 0.000 claims description 45
- 230000035772 mutation Effects 0.000 claims description 45
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 38
- 239000002994 raw material Substances 0.000 claims description 35
- 102000004316 Oxidoreductases Human genes 0.000 claims description 28
- -1 swill Substances 0.000 claims description 26
- 150000002191 fatty alcohols Chemical class 0.000 claims description 22
- 108090000854 Oxidoreductases Proteins 0.000 claims description 21
- 102200074510 rs2015352 Human genes 0.000 claims description 21
- 238000004113 cell culture Methods 0.000 claims description 19
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 claims description 18
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 18
- 239000002028 Biomass Substances 0.000 claims description 16
- 235000021588 free fatty acids Nutrition 0.000 claims description 16
- 239000002699 waste material Substances 0.000 claims description 13
- 240000008042 Zea mays Species 0.000 claims description 11
- 229920002678 cellulose Polymers 0.000 claims description 11
- 239000001913 cellulose Substances 0.000 claims description 11
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 claims description 10
- 235000002017 Zea mays subsp mays Nutrition 0.000 claims description 10
- 235000005822 corn Nutrition 0.000 claims description 10
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 9
- 240000000111 Saccharum officinarum Species 0.000 claims description 9
- 235000007201 Saccharum officinarum Nutrition 0.000 claims description 9
- 239000001569 carbon dioxide Substances 0.000 claims description 9
- 229910002092 carbon dioxide Inorganic materials 0.000 claims description 9
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 claims description 8
- 239000003546 flue gas Substances 0.000 claims description 8
- 241001520808 Panicum virgatum Species 0.000 claims description 7
- 239000010865 sewage Substances 0.000 claims description 6
- 239000010902 straw Substances 0.000 claims description 6
- 210000004027 cell Anatomy 0.000 description 271
- 108090000623 proteins and genes Proteins 0.000 description 107
- 108020001507 fusion proteins Proteins 0.000 description 93
- 102000037865 fusion proteins Human genes 0.000 description 93
- 102000004190 Enzymes Human genes 0.000 description 82
- 108090000790 Enzymes Proteins 0.000 description 82
- 229940088598 enzyme Drugs 0.000 description 79
- 241000588724 Escherichia coli Species 0.000 description 72
- 102000040430 polynucleotide Human genes 0.000 description 70
- 108091033319 polynucleotide Proteins 0.000 description 70
- 239000002157 polynucleotide Substances 0.000 description 70
- 230000014509 gene expression Effects 0.000 description 57
- ZDHCZVWCTKTBRY-UHFFFAOYSA-N 12-hydroxylauric acid Chemical compound OCCCCCCCCCCCC(O)=O ZDHCZVWCTKTBRY-UHFFFAOYSA-N 0.000 description 56
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 56
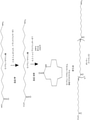
- 230000037361 pathway Effects 0.000 description 50
- 239000000203 mixture Substances 0.000 description 49
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 48
- 239000008103 glucose Substances 0.000 description 48
- 150000001875 compounds Chemical class 0.000 description 46
- 102000004169 proteins and genes Human genes 0.000 description 46
- 101150053185 P450 gene Proteins 0.000 description 45
- 235000018102 proteins Nutrition 0.000 description 45
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 44
- 238000001727 in vivo Methods 0.000 description 44
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 43
- 235000010633 broth Nutrition 0.000 description 41
- 238000000855 fermentation Methods 0.000 description 40
- 230000004151 fermentation Effects 0.000 description 40
- 239000013598 vector Substances 0.000 description 39
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 38
- 150000002500 ions Chemical class 0.000 description 38
- 230000002255 enzymatic effect Effects 0.000 description 37
- 108010025188 Alcohol oxidase Proteins 0.000 description 31
- 150000002148 esters Chemical class 0.000 description 31
- 238000001819 mass spectrum Methods 0.000 description 30
- 239000000047 product Substances 0.000 description 30
- 239000002253 acid Substances 0.000 description 29
- 239000005051 trimethylchlorosilane Substances 0.000 description 28
- 241000196324 Embryophyta Species 0.000 description 27
- 239000000284 extract Substances 0.000 description 27
- 239000013604 expression vector Substances 0.000 description 26
- 239000000126 substance Substances 0.000 description 25
- 108020004414 DNA Proteins 0.000 description 23
- 238000002703 mutagenesis Methods 0.000 description 23
- 231100000350 mutagenesis Toxicity 0.000 description 23
- GHLKSLMMWAKNBM-UHFFFAOYSA-N dodecane-1,12-diol Chemical compound OCCCCCCCCCCCCO GHLKSLMMWAKNBM-UHFFFAOYSA-N 0.000 description 22
- 230000001965 increasing effect Effects 0.000 description 22
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 21
- 230000001580 bacterial effect Effects 0.000 description 21
- 102000004020 Oxygenases Human genes 0.000 description 19
- 108090000417 Oxygenases Proteins 0.000 description 19
- 235000001014 amino acid Nutrition 0.000 description 19
- 239000012634 fragment Substances 0.000 description 19
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 18
- 230000015572 biosynthetic process Effects 0.000 description 18
- 102000039446 nucleic acids Human genes 0.000 description 18
- 108020004707 nucleic acids Proteins 0.000 description 18
- 239000013612 plasmid Substances 0.000 description 18
- 101710129019 Long-chain acyl-[acyl-carrier-protein] reductase Proteins 0.000 description 17
- 238000013467 fragmentation Methods 0.000 description 17
- 238000006062 fragmentation reaction Methods 0.000 description 17
- 239000002609 medium Substances 0.000 description 17
- 235000000346 sugar Nutrition 0.000 description 17
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 16
- 102000003929 Transaminases Human genes 0.000 description 16
- 108090000340 Transaminases Proteins 0.000 description 16
- 239000000543 intermediate Substances 0.000 description 16
- 239000000463 material Substances 0.000 description 16
- 239000000758 substrate Substances 0.000 description 16
- 108010001348 Diacylglycerol O-acyltransferase Proteins 0.000 description 15
- 102000002148 Diacylglycerol O-acyltransferase Human genes 0.000 description 15
- 235000011187 glycerol Nutrition 0.000 description 15
- 241000894006 Bacteria Species 0.000 description 14
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 14
- 239000003550 marker Substances 0.000 description 14
- OJURWUUOVGOHJZ-UHFFFAOYSA-N methyl 2-[(2-acetyloxyphenyl)methyl-[2-[(2-acetyloxyphenyl)methyl-(2-methoxy-2-oxoethyl)amino]ethyl]amino]acetate Chemical compound C=1C=CC=C(OC(C)=O)C=1CN(CC(=O)OC)CCN(CC(=O)OC)CC1=CC=CC=C1OC(C)=O OJURWUUOVGOHJZ-UHFFFAOYSA-N 0.000 description 14
- 239000004474 valine Substances 0.000 description 14
- 102100027841 Acyl-CoA wax alcohol acyltransferase 2 Human genes 0.000 description 13
- 102000005369 Aldehyde Dehydrogenase Human genes 0.000 description 13
- 108020002663 Aldehyde Dehydrogenase Proteins 0.000 description 13
- 108091023020 Aldehyde Oxidase Proteins 0.000 description 13
- 239000003795 chemical substances by application Substances 0.000 description 13
- 239000001963 growth medium Substances 0.000 description 13
- 150000002430 hydrocarbons Chemical group 0.000 description 13
- 241000894007 species Species 0.000 description 13
- 229940024606 amino acid Drugs 0.000 description 12
- 125000003729 nucleotide group Chemical group 0.000 description 12
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 11
- 238000001212 derivatisation Methods 0.000 description 11
- 230000006870 function Effects 0.000 description 11
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 11
- 230000000813 microbial effect Effects 0.000 description 11
- 229920000642 polymer Polymers 0.000 description 11
- 230000001105 regulatory effect Effects 0.000 description 11
- PBLZLIFKVPJDCO-UHFFFAOYSA-N 12-aminododecanoic acid Chemical compound NCCCCCCCCCCCC(O)=O PBLZLIFKVPJDCO-UHFFFAOYSA-N 0.000 description 10
- 102000048262 Aldehyde oxidases Human genes 0.000 description 10
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 10
- 101710198130 NADPH-cytochrome P450 reductase Proteins 0.000 description 10
- 241000607142 Salmonella Species 0.000 description 10
- 229930006000 Sucrose Natural products 0.000 description 10
- 235000004279 alanine Nutrition 0.000 description 10
- 150000001413 amino acids Chemical class 0.000 description 10
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 10
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 10
- 230000003197 catalytic effect Effects 0.000 description 10
- 235000010980 cellulose Nutrition 0.000 description 10
- 230000009088 enzymatic function Effects 0.000 description 10
- 101150016526 fadE gene Proteins 0.000 description 10
- UQDUPQYQJKYHQI-UHFFFAOYSA-N methyl laurate Chemical compound CCCCCCCCCCCC(=O)OC UQDUPQYQJKYHQI-UHFFFAOYSA-N 0.000 description 10
- 239000002773 nucleotide Substances 0.000 description 10
- 239000003208 petroleum Substances 0.000 description 10
- 239000011347 resin Substances 0.000 description 10
- 229920005989 resin Polymers 0.000 description 10
- 239000005720 sucrose Substances 0.000 description 10
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 9
- 108090001060 Lipase Proteins 0.000 description 9
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 9
- 125000000539 amino acid group Chemical group 0.000 description 9
- 230000001588 bifunctional effect Effects 0.000 description 9
- 230000001851 biosynthetic effect Effects 0.000 description 9
- 125000004432 carbon atom Chemical group C* 0.000 description 9
- 238000002474 experimental method Methods 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- JOSXCARTDOQGLV-UHFFFAOYSA-N omega-hydroxytetradecanoic acid Natural products OCCCCCCCCCCCCCC(O)=O JOSXCARTDOQGLV-UHFFFAOYSA-N 0.000 description 9
- HQHCYKULIHKCEB-UHFFFAOYSA-N tetradecanedioic acid Chemical compound OC(=O)CCCCCCCCCCCCC(O)=O HQHCYKULIHKCEB-UHFFFAOYSA-N 0.000 description 9
- 102100022089 Acyl-[acyl-carrier-protein] hydrolase Human genes 0.000 description 8
- 108010039731 Fatty Acid Synthases Proteins 0.000 description 8
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 8
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 8
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 8
- 238000005516 engineering process Methods 0.000 description 8
- 230000000670 limiting effect Effects 0.000 description 8
- WVYBBOXJKXXXOY-UHFFFAOYSA-N methyl 12-hydroxydodecanoate Chemical compound COC(=O)CCCCCCCCCCCO WVYBBOXJKXXXOY-UHFFFAOYSA-N 0.000 description 8
- AOTMRIXFFOGWDT-UHFFFAOYSA-N omega-hydroxyhexadecanoic acid methyl ester Natural products COC(=O)CCCCCCCCCCCCCCCO AOTMRIXFFOGWDT-UHFFFAOYSA-N 0.000 description 8
- 239000004475 Arginine Substances 0.000 description 7
- 241000194107 Bacillus megaterium Species 0.000 description 7
- 101100114750 Bacillus megaterium (strain ATCC 14581 / DSM 32 / JCM 2506 / NBRC 15308 / NCIMB 9376 / NCTC 10342 / NRRL B-14308 / VKM B-512) cyp102A1 gene Proteins 0.000 description 7
- 101710088194 Dehydrogenase Proteins 0.000 description 7
- 108090000371 Esterases Proteins 0.000 description 7
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 7
- 102000004882 Lipase Human genes 0.000 description 7
- 239000004367 Lipase Substances 0.000 description 7
- 241000187492 Mycobacterium marinum Species 0.000 description 7
- 102220498987 Phosphatidylinositol 4-phosphate 5-kinase type-1 beta_F87A_mutation Human genes 0.000 description 7
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 7
- 150000001720 carbohydrates Chemical class 0.000 description 7
- 238000000576 coating method Methods 0.000 description 7
- 239000000470 constituent Substances 0.000 description 7
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 7
- 150000003951 lactams Chemical class 0.000 description 7
- 235000019421 lipase Nutrition 0.000 description 7
- 150000004702 methyl esters Chemical class 0.000 description 7
- 150000002894 organic compounds Chemical class 0.000 description 7
- 230000008569 process Effects 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 238000013518 transcription Methods 0.000 description 7
- 230000035897 transcription Effects 0.000 description 7
- 101710146995 Acyl carrier protein Proteins 0.000 description 6
- 108010001058 Acyl-CoA Dehydrogenase Proteins 0.000 description 6
- 102000002735 Acyl-CoA Dehydrogenase Human genes 0.000 description 6
- 102100026608 Aldehyde dehydrogenase family 3 member A2 Human genes 0.000 description 6
- 102100037885 Calcium-independent phospholipase A2-gamma Human genes 0.000 description 6
- 102000018832 Cytochromes Human genes 0.000 description 6
- 108010052832 Cytochromes Proteins 0.000 description 6
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 6
- 241000206597 Marinobacter hydrocarbonoclasticus Species 0.000 description 6
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 6
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 6
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 6
- 229920002472 Starch Polymers 0.000 description 6
- 125000000217 alkyl group Chemical group 0.000 description 6
- 230000008827 biological function Effects 0.000 description 6
- 235000014633 carbohydrates Nutrition 0.000 description 6
- LQZZUXJYWNFBMV-UHFFFAOYSA-N dodecan-1-ol Chemical compound CCCCCCCCCCCCO LQZZUXJYWNFBMV-UHFFFAOYSA-N 0.000 description 6
- 101150115959 fadR gene Proteins 0.000 description 6
- 108090001018 hexadecanal dehydrogenase (acylating) Proteins 0.000 description 6
- 230000006872 improvement Effects 0.000 description 6
- 230000001939 inductive effect Effects 0.000 description 6
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 238000007254 oxidation reaction Methods 0.000 description 6
- 239000008107 starch Substances 0.000 description 6
- 235000019698 starch Nutrition 0.000 description 6
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 6
- BZUNJUAMQZRJIP-UHFFFAOYSA-N 15-hydroxypentadecanoic acid Chemical compound OCCCCCCCCCCCCCCC(O)=O BZUNJUAMQZRJIP-UHFFFAOYSA-N 0.000 description 5
- 101710186512 3-ketoacyl-CoA thiolase Proteins 0.000 description 5
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 5
- 241000193830 Bacillus <bacterium> Species 0.000 description 5
- 101100012355 Bacillus anthracis fabH1 gene Proteins 0.000 description 5
- 101100012357 Bacillus subtilis (strain 168) fabHA gene Proteins 0.000 description 5
- 108030002325 Carboxylate reductases Proteins 0.000 description 5
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 5
- 102000053602 DNA Human genes 0.000 description 5
- 229930091371 Fructose Natural products 0.000 description 5
- 239000005715 Fructose Substances 0.000 description 5
- 229920002488 Hemicellulose Polymers 0.000 description 5
- 101000937642 Homo sapiens Malonyl-CoA-acyl carrier protein transacylase, mitochondrial Proteins 0.000 description 5
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 5
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 5
- 108030004480 Long-chain acyl-[acyl-carrier-protein] reductases Proteins 0.000 description 5
- 108010011449 Long-chain-fatty-acid-CoA ligase Proteins 0.000 description 5
- 102100027329 Malonyl-CoA-acyl carrier protein transacylase, mitochondrial Human genes 0.000 description 5
- TUNFSRHWOTWDNC-UHFFFAOYSA-N Myristic acid Natural products CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 description 5
- 241000191023 Rhodobacter capsulatus Species 0.000 description 5
- 241000316848 Rhodococcus <scale insect> Species 0.000 description 5
- 101150070497 accC gene Proteins 0.000 description 5
- 108010069175 acyl-CoA transferase Proteins 0.000 description 5
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 5
- 125000003118 aryl group Chemical group 0.000 description 5
- 230000002238 attenuated effect Effects 0.000 description 5
- 239000001768 carboxy methyl cellulose Substances 0.000 description 5
- 239000011248 coating agent Substances 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 238000012217 deletion Methods 0.000 description 5
- 230000037430 deletion Effects 0.000 description 5
- 101150026389 fabF gene Proteins 0.000 description 5
- 101150090981 fabG gene Proteins 0.000 description 5
- 101150035981 fabH gene Proteins 0.000 description 5
- 101150072202 fabV gene Proteins 0.000 description 5
- 235000021255 galacto-oligosaccharides Nutrition 0.000 description 5
- 150000003271 galactooligosaccharides Chemical class 0.000 description 5
- 229930182830 galactose Natural products 0.000 description 5
- 239000007789 gas Substances 0.000 description 5
- 239000000499 gel Substances 0.000 description 5
- 230000002068 genetic effect Effects 0.000 description 5
- 125000002791 glucosyl group Chemical group C1([C@H](O)[C@@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 5
- 230000033444 hydroxylation Effects 0.000 description 5
- 238000005805 hydroxylation reaction Methods 0.000 description 5
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 5
- 229960000310 isoleucine Drugs 0.000 description 5
- 101150068528 mabA gene Proteins 0.000 description 5
- 229920000609 methyl cellulose Polymers 0.000 description 5
- 239000001923 methylcellulose Substances 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 239000011368 organic material Substances 0.000 description 5
- 230000002018 overexpression Effects 0.000 description 5
- 229920001277 pectin Polymers 0.000 description 5
- 239000001814 pectin Substances 0.000 description 5
- 235000010987 pectin Nutrition 0.000 description 5
- 229920000728 polyester Polymers 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 108040006686 pyruvate synthase activity proteins Proteins 0.000 description 5
- 150000008163 sugars Chemical class 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 230000002103 transcriptional effect Effects 0.000 description 5
- 229920001221 xylan Polymers 0.000 description 5
- 150000004823 xylans Chemical class 0.000 description 5
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 4
- KGEACANGAYABKT-UHFFFAOYSA-N 12-oxododecanoic acid Chemical compound OC(=O)CCCCCCCCCCC=O KGEACANGAYABKT-UHFFFAOYSA-N 0.000 description 4
- DWXOPJCPYKBNEC-UHFFFAOYSA-N 13-hydroxytridecanoic acid Chemical compound OCCCCCCCCCCCCC(O)=O DWXOPJCPYKBNEC-UHFFFAOYSA-N 0.000 description 4
- UGAGPNKCDRTDHP-UHFFFAOYSA-N 16-hydroxyhexadecanoic acid Chemical compound OCCCCCCCCCCCCCCCC(O)=O UGAGPNKCDRTDHP-UHFFFAOYSA-N 0.000 description 4
- 102000000452 Acetyl-CoA carboxylase Human genes 0.000 description 4
- 108010016219 Acetyl-CoA carboxylase Proteins 0.000 description 4
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 108010018763 Biotin carboxylase Proteins 0.000 description 4
- 108020004705 Codon Proteins 0.000 description 4
- 241000195493 Cryptophyta Species 0.000 description 4
- GUBGYTABKSRVRQ-CUHNMECISA-N D-Cellobiose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-CUHNMECISA-N 0.000 description 4
- 101100390711 Escherichia coli (strain K12) fhuA gene Proteins 0.000 description 4
- 239000004471 Glycine Substances 0.000 description 4
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 4
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 4
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 4
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 4
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- JHWNWJKBPDFINM-UHFFFAOYSA-N Laurolactam Chemical group O=C1CCCCCCCCCCCN1 JHWNWJKBPDFINM-UHFFFAOYSA-N 0.000 description 4
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 4
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 4
- 108091034117 Oligonucleotide Proteins 0.000 description 4
- 241000235070 Saccharomyces Species 0.000 description 4
- 241000293871 Salmonella enterica subsp. enterica serovar Typhi Species 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- 102000004357 Transferases Human genes 0.000 description 4
- DRQXUCVJDCRJDB-UHFFFAOYSA-N Turanose Natural products OC1C(CO)OC(O)(CO)C1OC1C(O)C(O)C(O)C(CO)O1 DRQXUCVJDCRJDB-UHFFFAOYSA-N 0.000 description 4
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 4
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 4
- 235000003704 aspartic acid Nutrition 0.000 description 4
- 230000009286 beneficial effect Effects 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 4
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 4
- 238000004422 calculation algorithm Methods 0.000 description 4
- 238000006473 carboxylation reaction Methods 0.000 description 4
- 150000005829 chemical entities Chemical class 0.000 description 4
- 238000012258 culturing Methods 0.000 description 4
- 230000000593 degrading effect Effects 0.000 description 4
- 210000003527 eukaryotic cell Anatomy 0.000 description 4
- 150000002192 fatty aldehydes Chemical class 0.000 description 4
- 229940013640 flavin mononucleotide Drugs 0.000 description 4
- FVTCRASFADXXNN-SCRDCRAPSA-N flavin mononucleotide Chemical compound OP(=O)(O)OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O FVTCRASFADXXNN-SCRDCRAPSA-N 0.000 description 4
- FVTCRASFADXXNN-UHFFFAOYSA-N flavin mononucleotide Natural products OP(=O)(O)OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O FVTCRASFADXXNN-UHFFFAOYSA-N 0.000 description 4
- 239000011768 flavin mononucleotide Substances 0.000 description 4
- FTSSQIKWUOOEGC-RULYVFMPSA-N fructooligosaccharide Chemical compound OC[C@H]1O[C@@](CO)(OC[C@@]2(OC[C@@]3(OC[C@@]4(OC[C@@]5(OC[C@@]6(OC[C@@]7(OC[C@@]8(OC[C@@]9(OC[C@@]%10(OC[C@@]%11(O[C@H]%12O[C@H](CO)[C@@H](O)[C@H](O)[C@H]%12O)O[C@H](CO)[C@@H](O)[C@@H]%11O)O[C@H](CO)[C@@H](O)[C@@H]%10O)O[C@H](CO)[C@@H](O)[C@@H]9O)O[C@H](CO)[C@@H](O)[C@@H]8O)O[C@H](CO)[C@@H](O)[C@@H]7O)O[C@H](CO)[C@@H](O)[C@@H]6O)O[C@H](CO)[C@@H](O)[C@@H]5O)O[C@H](CO)[C@@H](O)[C@@H]4O)O[C@H](CO)[C@@H](O)[C@@H]3O)O[C@H](CO)[C@@H](O)[C@@H]2O)[C@@H](O)[C@@H]1O FTSSQIKWUOOEGC-RULYVFMPSA-N 0.000 description 4
- 229940107187 fructooligosaccharide Drugs 0.000 description 4
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 4
- 230000001976 improved effect Effects 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 229930027917 kanamycin Natural products 0.000 description 4
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 4
- 229960000318 kanamycin Drugs 0.000 description 4
- 229930182823 kanamycin A Natural products 0.000 description 4
- 239000008101 lactose Substances 0.000 description 4
- 239000011159 matrix material Substances 0.000 description 4
- 230000037353 metabolic pathway Effects 0.000 description 4
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 4
- NDBSIOZEOQUDBF-UHFFFAOYSA-N methyl 12-aminododecanoate Chemical compound COC(=O)CCCCCCCCCCCN NDBSIOZEOQUDBF-UHFFFAOYSA-N 0.000 description 4
- QFZLQCAXDXMEFE-UHFFFAOYSA-N methyl 12-oxododecanoate Chemical compound COC(=O)CCCCCCCCCCC=O QFZLQCAXDXMEFE-UHFFFAOYSA-N 0.000 description 4
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 4
- 230000000243 photosynthetic effect Effects 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 210000001236 prokaryotic cell Anatomy 0.000 description 4
- 235000019231 riboflavin-5'-phosphate Nutrition 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 4
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 4
- UNFWWIHTNXNPBV-WXKVUWSESA-N spectinomycin Chemical compound O([C@@H]1[C@@H](NC)[C@@H](O)[C@H]([C@@H]([C@H]1O1)O)NC)[C@]2(O)[C@H]1O[C@H](C)CC2=O UNFWWIHTNXNPBV-WXKVUWSESA-N 0.000 description 4
- 229960000268 spectinomycin Drugs 0.000 description 4
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- 230000000153 supplemental effect Effects 0.000 description 4
- 101150087812 tesA gene Proteins 0.000 description 4
- XLKZJJVNBQCVIX-UHFFFAOYSA-N tetradecane-1,14-diol Chemical compound OCCCCCCCCCCCCCCO XLKZJJVNBQCVIX-UHFFFAOYSA-N 0.000 description 4
- 230000009466 transformation Effects 0.000 description 4
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- RULSWEULPANCDV-PIXUTMIVSA-N turanose Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](C(=O)CO)O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O RULSWEULPANCDV-PIXUTMIVSA-N 0.000 description 4
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 4
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 3
- RILFOORPZLBCJK-UHFFFAOYSA-N 12-hydroxydodec-2-enoic acid Chemical compound OCCCCCCCCCC=CC(O)=O RILFOORPZLBCJK-UHFFFAOYSA-N 0.000 description 3
- BJBZLNPBZRNMAI-UHFFFAOYSA-N 14-hydroxytetradec-2-enoic acid Chemical compound OCCCCCCCCCCCC=CC(O)=O BJBZLNPBZRNMAI-UHFFFAOYSA-N 0.000 description 3
- YSNNTXAJZMWJCI-UHFFFAOYSA-N 16-hydroxyhexadec-2-enoic acid Chemical compound OCCCCCCCCCCCCCC=CC(O)=O YSNNTXAJZMWJCI-UHFFFAOYSA-N 0.000 description 3
- JQNQKNGCSLCPDE-UHFFFAOYSA-N 18-hydroxyoctadec-2-enoic acid Chemical compound OCCCCCCCCCCCCCCCC=CC(O)=O JQNQKNGCSLCPDE-UHFFFAOYSA-N 0.000 description 3
- 108700037654 Acyl carrier protein (ACP) Proteins 0.000 description 3
- 241000228245 Aspergillus niger Species 0.000 description 3
- 101100276525 Bacillus subtilis (strain 168) cypB gene Proteins 0.000 description 3
- 102000014914 Carrier Proteins Human genes 0.000 description 3
- 108010078791 Carrier Proteins Proteins 0.000 description 3
- 241000193401 Clostridium acetobutylicum Species 0.000 description 3
- 241000660147 Escherichia coli str. K-12 substr. MG1655 Species 0.000 description 3
- 108010074122 Ferredoxins Proteins 0.000 description 3
- 241000233866 Fungi Species 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 102000004157 Hydrolases Human genes 0.000 description 3
- 108090000604 Hydrolases Proteins 0.000 description 3
- 108091029795 Intergenic region Proteins 0.000 description 3
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 3
- 102100034337 Long-chain-fatty-acid-CoA ligase 6 Human genes 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- 241000206589 Marinobacter Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000186359 Mycobacterium Species 0.000 description 3
- 102100036777 NADPH:adrenodoxin oxidoreductase, mitochondrial Human genes 0.000 description 3
- 101710192343 NADPH:adrenodoxin oxidoreductase, mitochondrial Proteins 0.000 description 3
- 241000512220 Polaromonas Species 0.000 description 3
- 101710104207 Probable NADPH:adrenodoxin oxidoreductase, mitochondrial Proteins 0.000 description 3
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 3
- 241000589516 Pseudomonas Species 0.000 description 3
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- 108091081024 Start codon Proteins 0.000 description 3
- 241000192584 Synechocystis Species 0.000 description 3
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- 108091023040 Transcription factor Proteins 0.000 description 3
- 102000040945 Transcription factor Human genes 0.000 description 3
- 108090000992 Transferases Proteins 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 150000001298 alcohols Chemical class 0.000 description 3
- 230000004075 alteration Effects 0.000 description 3
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- 210000003050 axon Anatomy 0.000 description 3
- 239000011942 biocatalyst Substances 0.000 description 3
- 239000013592 cell lysate Substances 0.000 description 3
- 150000001793 charged compounds Chemical class 0.000 description 3
- 239000007795 chemical reaction product Substances 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- VCIQTMGWJDEYRX-UHFFFAOYSA-N dodec-1-ene-1,12-diol Chemical compound OCCCCCCCCCCC=CO VCIQTMGWJDEYRX-UHFFFAOYSA-N 0.000 description 3
- 239000011152 fibreglass Substances 0.000 description 3
- 230000002538 fungal effect Effects 0.000 description 3
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 3
- 238000010353 genetic engineering Methods 0.000 description 3
- QQHJDPROMQRDLA-UHFFFAOYSA-N hexadecanedioic acid Chemical compound OC(=O)CCCCCCCCCCCCCCC(O)=O QQHJDPROMQRDLA-UHFFFAOYSA-N 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 239000002029 lignocellulosic biomass Substances 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- VBKONVSYRQSMHY-UHFFFAOYSA-N methyl 14-hydroxytetradecanoate Chemical compound COC(=O)CCCCCCCCCCCCCO VBKONVSYRQSMHY-UHFFFAOYSA-N 0.000 description 3
- 239000003471 mutagenic agent Substances 0.000 description 3
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 239000011846 petroleum-based material Substances 0.000 description 3
- 229920005906 polyester polyol Polymers 0.000 description 3
- 229920001225 polyester resin Polymers 0.000 description 3
- 239000004645 polyester resin Substances 0.000 description 3
- 239000004814 polyurethane Substances 0.000 description 3
- 229920002635 polyurethane Polymers 0.000 description 3
- 238000002708 random mutagenesis Methods 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 239000012925 reference material Substances 0.000 description 3
- 230000003248 secreting effect Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 230000001568 sexual effect Effects 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 229920001169 thermoplastic Polymers 0.000 description 3
- 239000004416 thermosoftening plastic Substances 0.000 description 3
- FGTNBYWFNITQJR-UHFFFAOYSA-N trimethylsilyl decanoate Chemical compound CCCCCCCCCC(=O)O[Si](C)(C)C FGTNBYWFNITQJR-UHFFFAOYSA-N 0.000 description 3
- 210000005253 yeast cell Anatomy 0.000 description 3
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 2
- WNZVVHVYAKZZBU-UHFFFAOYSA-N 1,17-Heptadecanediol Chemical compound OCCCCCCCCCCCCCCCCCO WNZVVHVYAKZZBU-UHFFFAOYSA-N 0.000 description 2
- YJCJVMMDTBEITC-UHFFFAOYSA-N 10-hydroxycapric acid Chemical compound OCCCCCCCCCC(O)=O YJCJVMMDTBEITC-UHFFFAOYSA-N 0.000 description 2
- KQGAHNAFXMVSGY-UHFFFAOYSA-N 11-hydroxylauric acid Chemical compound CC(O)CCCCCCCCCC(O)=O KQGAHNAFXMVSGY-UHFFFAOYSA-N 0.000 description 2
- KNRCBASNXNXUQQ-UHFFFAOYSA-N 11-hydroxyundecanoic acid Chemical compound OCCCCCCCCCCC(O)=O KNRCBASNXNXUQQ-UHFFFAOYSA-N 0.000 description 2
- SWTNRXKFJNGFRF-UHFFFAOYSA-N 14-aminotetradecanoic acid Chemical compound NCCCCCCCCCCCCCC(O)=O SWTNRXKFJNGFRF-UHFFFAOYSA-N 0.000 description 2
- JHRQMZPLCYCFPI-UHFFFAOYSA-N 17-hydroxymargaric acid Chemical compound OCCCCCCCCCCCCCCCCC(O)=O JHRQMZPLCYCFPI-UHFFFAOYSA-N 0.000 description 2
- VLHZUYUOEGBBJB-UHFFFAOYSA-N 18-hydroxyoctadecanoic acid Chemical compound OCCCCCCCCCCCCCCCCCC(O)=O VLHZUYUOEGBBJB-UHFFFAOYSA-N 0.000 description 2
- JYZJYKOZGGEXSX-UHFFFAOYSA-N 2-hydroxymyristic acid Chemical compound CCCCCCCCCCCCC(O)C(O)=O JYZJYKOZGGEXSX-UHFFFAOYSA-N 0.000 description 2
- BNWKMHUFFKDAMV-UHFFFAOYSA-N 7-hydroxylauric acid Chemical compound CCCCCC(O)CCCCCC(O)=O BNWKMHUFFKDAMV-UHFFFAOYSA-N 0.000 description 2
- PPHSOXADSWJILD-UHFFFAOYSA-N 8-hydroxylauric acid Chemical compound CCCCC(O)CCCCCCC(O)=O PPHSOXADSWJILD-UHFFFAOYSA-N 0.000 description 2
- KDMSVYIHKLZKET-UHFFFAOYSA-N 8-hydroxyoctanoic acid Chemical compound OCCCCCCCC(O)=O KDMSVYIHKLZKET-UHFFFAOYSA-N 0.000 description 2
- XKNUGGWMUJBFJT-UHFFFAOYSA-N 9-hydroxylauric acid Chemical compound CCCC(O)CCCCCCCC(O)=O XKNUGGWMUJBFJT-UHFFFAOYSA-N 0.000 description 2
- 241000589291 Acinetobacter Species 0.000 description 2
- 102000048456 Acyl carrier protein (ACP) Human genes 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 241000228212 Aspergillus Species 0.000 description 2
- 241000194108 Bacillus licheniformis Species 0.000 description 2
- 235000014469 Bacillus subtilis Nutrition 0.000 description 2
- 101000950981 Bacillus subtilis (strain 168) Catabolic NAD-specific glutamate dehydrogenase RocG Proteins 0.000 description 2
- 241000193388 Bacillus thuringiensis Species 0.000 description 2
- 241000995051 Brenda Species 0.000 description 2
- 206010069747 Burkholderia mallei infection Diseases 0.000 description 2
- 101100173127 Caldanaerobacter subterraneus subsp. tengcongensis (strain DSM 15242 / JCM 11007 / NBRC 100824 / MB4) fabZ gene Proteins 0.000 description 2
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 2
- 108090000489 Carboxy-Lyases Proteins 0.000 description 2
- 102000004031 Carboxy-Lyases Human genes 0.000 description 2
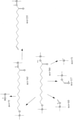
- RGJOEKWQDUBAIZ-IBOSZNHHSA-N CoASH Chemical compound O[C@@H]1[C@H](OP(O)(O)=O)[C@@H](COP(O)(=O)OP(O)(=O)OCC(C)(C)[C@@H](O)C(=O)NCCC(=O)NCCS)O[C@H]1N1C2=NC=NC(N)=C2N=C1 RGJOEKWQDUBAIZ-IBOSZNHHSA-N 0.000 description 2
- 102000005870 Coenzyme A Ligases Human genes 0.000 description 2
- 241000192700 Cyanobacteria Species 0.000 description 2
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 2
- 108020005199 Dehydrogenases Proteins 0.000 description 2
- 241000701988 Escherichia virus T5 Species 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 101150071111 FADD gene Proteins 0.000 description 2
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 2
- 201000003641 Glanders Diseases 0.000 description 2
- 102000016901 Glutamate dehydrogenase Human genes 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- 102100031415 Hepatic triacylglycerol lipase Human genes 0.000 description 2
- 101000836620 Homo sapiens Nucleic acid dioxygenase ALKBH1 Proteins 0.000 description 2
- 241000223198 Humicola Species 0.000 description 2
- 241001619535 Hyphomonas neptunium Species 0.000 description 2
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 241000235395 Mucor Species 0.000 description 2
- 102100027051 Nucleic acid dioxygenase ALKBH1 Human genes 0.000 description 2
- 235000021314 Palmitic acid Nutrition 0.000 description 2
- 241000736131 Sphingomonas Species 0.000 description 2
- 241000192707 Synechococcus Species 0.000 description 2
- 241000192593 Synechocystis sp. PCC 6803 Species 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- XJLXINKUBYWONI-DQQFMEOOSA-N [[(2r,3r,4r,5r)-5-(6-aminopurin-9-yl)-3-hydroxy-4-phosphonooxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [(2s,3r,4s,5s)-5-(3-carbamoylpyridin-1-ium-1-yl)-3,4-dihydroxyoxolan-2-yl]methyl phosphate Chemical compound NC(=O)C1=CC=C[N+]([C@@H]2[C@H]([C@@H](O)[C@H](COP([O-])(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](OP(O)(O)=O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 XJLXINKUBYWONI-DQQFMEOOSA-N 0.000 description 2
- 238000004760 accelerator mass spectrometry Methods 0.000 description 2
- ZSLZBFCDCINBPY-ZSJPKINUSA-N acetyl-CoA Chemical compound O[C@@H]1[C@H](OP(O)(O)=O)[C@@H](COP(O)(=O)OP(O)(=O)OCC(C)(C)[C@@H](O)C(=O)NCCC(=O)NCCSC(=O)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 ZSLZBFCDCINBPY-ZSJPKINUSA-N 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 238000001261 affinity purification Methods 0.000 description 2
- 150000001335 aliphatic alkanes Chemical group 0.000 description 2
- 101150112926 alkJ gene Proteins 0.000 description 2
- 150000001336 alkenes Chemical class 0.000 description 2
- 125000003368 amide group Chemical group 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 238000007845 assembly PCR Methods 0.000 description 2
- 229940097012 bacillus thuringiensis Drugs 0.000 description 2
- 239000012620 biological material Substances 0.000 description 2
- OCKPCBLVNKHBMX-UHFFFAOYSA-N butylbenzene Chemical compound CCCCC1=CC=CC=C1 OCKPCBLVNKHBMX-UHFFFAOYSA-N 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 238000012219 cassette mutagenesis Methods 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- RGJOEKWQDUBAIZ-UHFFFAOYSA-N coenzime A Natural products OC1C(OP(O)(O)=O)C(COP(O)(=O)OP(O)(=O)OCC(C)(C)C(O)C(=O)NCCC(=O)NCCS)OC1N1C2=NC=NC(N)=C2N=C1 RGJOEKWQDUBAIZ-UHFFFAOYSA-N 0.000 description 2
- 239000005516 coenzyme A Substances 0.000 description 2
- 229940093530 coenzyme a Drugs 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 230000007797 corrosion Effects 0.000 description 2
- 238000005260 corrosion Methods 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- FOTKYAAJKYLFFN-UHFFFAOYSA-N decane-1,10-diol Chemical compound OCCCCCCCCCCO FOTKYAAJKYLFFN-UHFFFAOYSA-N 0.000 description 2
- KDTSHFARGAKYJN-UHFFFAOYSA-N dephosphocoenzyme A Natural products OC1C(O)C(COP(O)(=O)OP(O)(=O)OCC(C)(C)C(O)C(=O)NCCC(=O)NCCS)OC1N1C2=NC=NC(N)=C2N=C1 KDTSHFARGAKYJN-UHFFFAOYSA-N 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- VILAVOFMIJHSJA-UHFFFAOYSA-N dicarbon monoxide Chemical compound [C]=C=O VILAVOFMIJHSJA-UHFFFAOYSA-N 0.000 description 2
- 150000002016 disaccharides Chemical class 0.000 description 2
- TVIDDXQYHWJXFK-UHFFFAOYSA-N dodecanedioic acid Chemical compound OC(=O)CCCCCCCCCCC(O)=O TVIDDXQYHWJXFK-UHFFFAOYSA-N 0.000 description 2
- 239000003792 electrolyte Substances 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 230000009483 enzymatic pathway Effects 0.000 description 2
- ADTIBIOIERBRIB-UHFFFAOYSA-N eta-Oxy-caprylsaeure-methylester Natural products COC(=O)CCCCCCCO ADTIBIOIERBRIB-UHFFFAOYSA-N 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 101150078207 fabA gene Proteins 0.000 description 2
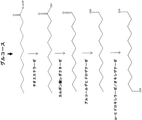
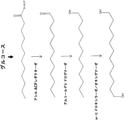
- 230000004133 fatty acid degradation Effects 0.000 description 2
- 150000002194 fatty esters Chemical class 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000003205 fragrance Substances 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 238000000769 gas chromatography-flame ionisation detection Methods 0.000 description 2
- 230000004077 genetic alteration Effects 0.000 description 2
- 231100000118 genetic alteration Toxicity 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- QILZKVKOYZPEQK-UHFFFAOYSA-N hexadec-1-ene-1,16-diol Chemical compound OCCCCCCCCCCCCCCC=CO QILZKVKOYZPEQK-UHFFFAOYSA-N 0.000 description 2
- GJBXIPOYHVMPQJ-UHFFFAOYSA-N hexadecane-1,16-diol Chemical compound OCCCCCCCCCCCCCCCCO GJBXIPOYHVMPQJ-UHFFFAOYSA-N 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N iron Chemical group [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 238000011031 large-scale manufacturing process Methods 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 150000007931 macrolactones Chemical class 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- GTYMDEWSAQEWDO-UHFFFAOYSA-N methyl 16-hydroxyhexadec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCCCO GTYMDEWSAQEWDO-UHFFFAOYSA-N 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- 239000003345 natural gas Substances 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- YDPSQMGOAILWPE-UHFFFAOYSA-N octadec-2-enedioic acid Chemical compound OC(=O)CCCCCCCCCCCCCCC=CC(O)=O YDPSQMGOAILWPE-UHFFFAOYSA-N 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 210000003463 organelle Anatomy 0.000 description 2
- 235000006408 oxalic acid Nutrition 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 150000002972 pentoses Chemical group 0.000 description 2
- 239000013520 petroleum-based product Substances 0.000 description 2
- 230000029553 photosynthesis Effects 0.000 description 2
- 238000010672 photosynthesis Methods 0.000 description 2
- 239000004014 plasticizer Substances 0.000 description 2
- 229920006122 polyamide resin Polymers 0.000 description 2
- 229920000647 polyepoxide Polymers 0.000 description 2
- 239000004848 polyfunctional curative Substances 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 150000004804 polysaccharides Chemical class 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- 230000006337 proteolytic cleavage Effects 0.000 description 2
- 239000011535 reaction buffer Substances 0.000 description 2
- 238000010188 recombinant method Methods 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 230000037432 silent mutation Effects 0.000 description 2
- 239000010421 standard material Substances 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- BGHCVCJVXZWKCC-UHFFFAOYSA-N tetradecane Chemical compound CCCCCCCCCCCCCC BGHCVCJVXZWKCC-UHFFFAOYSA-N 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- WCAVMUSBVBDXDE-UHFFFAOYSA-N trimethyl(12-trimethylsilyloxydodecoxy)silane Chemical compound C[Si](C)(C)OCCCCCCCCCCCCO[Si](C)(C)C WCAVMUSBVBDXDE-UHFFFAOYSA-N 0.000 description 2
- XSMIOONHPKRREI-UHFFFAOYSA-N undecane-1,11-diol Chemical compound OCCCCCCCCCCCO XSMIOONHPKRREI-UHFFFAOYSA-N 0.000 description 2
- 238000011144 upstream manufacturing Methods 0.000 description 2
- GGQQNYXPYWCUHG-RMTFUQJTSA-N (3e,6e)-deca-3,6-diene Chemical compound CCC\C=C\C\C=C\CC GGQQNYXPYWCUHG-RMTFUQJTSA-N 0.000 description 1
- QHBZHVUGQROELI-SOFGYWHQSA-N (E)-10-hydroxydec-2-enoic acid Chemical compound OCCCCCCC\C=C\C(O)=O QHBZHVUGQROELI-SOFGYWHQSA-N 0.000 description 1
- GQNUOWMXNITYLS-SOFGYWHQSA-N (e)-10-oxodec-2-enoic acid Chemical compound OC(=O)\C=C\CCCCCCC=O GQNUOWMXNITYLS-SOFGYWHQSA-N 0.000 description 1
- XAUQWYHSQICPAZ-UHFFFAOYSA-N 10-amino-decanoic acid Chemical compound NCCCCCCCCCC(O)=O XAUQWYHSQICPAZ-UHFFFAOYSA-N 0.000 description 1
- DFLXEAPGLFGJKD-UHFFFAOYSA-N 10-aminodec-2-enoic acid Chemical compound NCCCCCCCC=CC(O)=O DFLXEAPGLFGJKD-UHFFFAOYSA-N 0.000 description 1
- GBMPJGRZJKHERD-UHFFFAOYSA-N 10-hydroxylauric acid Chemical compound CCC(O)CCCCCCCCC(O)=O GBMPJGRZJKHERD-UHFFFAOYSA-N 0.000 description 1
- FYURGFQVSMALOD-UHFFFAOYSA-N 10-oxocapric acid Chemical compound OC(=O)CCCCCCCCC=O FYURGFQVSMALOD-UHFFFAOYSA-N 0.000 description 1
- ZAIVBSWJDDHIPX-UHFFFAOYSA-N 12-aminododec-2-enoic acid Chemical compound NCCCCCCCCCC=CC(O)=O ZAIVBSWJDDHIPX-UHFFFAOYSA-N 0.000 description 1
- ZHKXETUAXVNNHM-UHFFFAOYSA-N 12-oxododec-2-enoic acid Chemical compound OC(=O)C=CCCCCCCCCC=O ZHKXETUAXVNNHM-UHFFFAOYSA-N 0.000 description 1
- SHKBDFZQUYIIBZ-UHFFFAOYSA-N 14-aminotetradec-2-enoic acid Chemical compound NCCCCCCCCCCCC=CC(O)=O SHKBDFZQUYIIBZ-UHFFFAOYSA-N 0.000 description 1
- BIZUKDODZSNIHB-UHFFFAOYSA-N 14-oxotetradec-2-enoic acid Chemical compound OC(=O)C=CCCCCCCCCCCC=O BIZUKDODZSNIHB-UHFFFAOYSA-N 0.000 description 1
- VRNVZSGJXRCUTI-UHFFFAOYSA-N 14-oxotetradecanoic acid Chemical compound OC(=O)CCCCCCCCCCCCC=O VRNVZSGJXRCUTI-UHFFFAOYSA-N 0.000 description 1
- ZVRQKBZSJNBTCW-UHFFFAOYSA-N 15-hydroxypentadec-2-enoic acid Chemical compound OCCCCCCCCCCCCC=CC(O)=O ZVRQKBZSJNBTCW-UHFFFAOYSA-N 0.000 description 1
- BUAOCDXGFVQTIJ-UHFFFAOYSA-N 16-aminohexadec-2-enoic acid Chemical compound NCCCCCCCCCCCCCC=CC(O)=O BUAOCDXGFVQTIJ-UHFFFAOYSA-N 0.000 description 1
- QJGFZBNNVXTCLL-UHFFFAOYSA-N 16-aminohexadecanoic acid Chemical compound NCCCCCCCCCCCCCCCC(O)=O QJGFZBNNVXTCLL-UHFFFAOYSA-N 0.000 description 1
- NKVUEIHJDGURIA-UHFFFAOYSA-N 16-oxohexadecanoic acid Chemical compound OC(=O)CCCCCCCCCCCCCCC=O NKVUEIHJDGURIA-UHFFFAOYSA-N 0.000 description 1
- PSPLRVUNJCIFMU-UHFFFAOYSA-N 18-aminooctadec-2-enoic acid Chemical compound NCCCCCCCCCCCCCCCC=CC(O)=O PSPLRVUNJCIFMU-UHFFFAOYSA-N 0.000 description 1
- ACQSOZZSYSEKHC-UHFFFAOYSA-N 18-aminooctadecanoic acid Chemical compound NCCCCCCCCCCCCCCCCCC(O)=O ACQSOZZSYSEKHC-UHFFFAOYSA-N 0.000 description 1
- LLWAJHROFZNFHK-UHFFFAOYSA-N 18-oxooctadec-2-enoic acid Chemical compound OC(=O)C=CCCCCCCCCCCCCCCC=O LLWAJHROFZNFHK-UHFFFAOYSA-N 0.000 description 1
- KNFZISOSQCZZJK-UHFFFAOYSA-N 18-oxooctadecanoic acid Chemical compound OC(=O)CCCCCCCCCCCCCCCCC=O KNFZISOSQCZZJK-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- ASJSAQIRZKANQN-CRCLSJGQSA-N 2-deoxy-D-ribose Chemical compound OC[C@@H](O)[C@@H](O)CC=O ASJSAQIRZKANQN-CRCLSJGQSA-N 0.000 description 1
- HKOQIEFWZHFFQS-UHFFFAOYSA-N 2-hydroxyhexadec-2-enoic acid Chemical compound CCCCCCCCCCCCCC=C(O)C(O)=O HKOQIEFWZHFFQS-UHFFFAOYSA-N 0.000 description 1
- UHPMCKVQTMMPCG-UHFFFAOYSA-N 5,8-dihydroxy-2-methoxy-6-methyl-7-(2-oxopropyl)naphthalene-1,4-dione Chemical compound CC1=C(CC(C)=O)C(O)=C2C(=O)C(OC)=CC(=O)C2=C1O UHPMCKVQTMMPCG-UHFFFAOYSA-N 0.000 description 1
- UQXNEWQGGVUVQA-UHFFFAOYSA-N 8-aminooctanoic acid Chemical compound NCCCCCCCC(O)=O UQXNEWQGGVUVQA-UHFFFAOYSA-N 0.000 description 1
- UEXYJHLCLUYOFA-UHFFFAOYSA-N 8-oxooctanoic acid Chemical compound OC(=O)CCCCCCC=O UEXYJHLCLUYOFA-UHFFFAOYSA-N 0.000 description 1
- ZGXJTSGNIOSYLO-UHFFFAOYSA-N 88755TAZ87 Chemical compound NCC(=O)CCC(O)=O ZGXJTSGNIOSYLO-UHFFFAOYSA-N 0.000 description 1
- QGFSQVPRCWJZQK-UHFFFAOYSA-N 9-Decen-1-ol Chemical compound OCCCCCCCCC=C QGFSQVPRCWJZQK-UHFFFAOYSA-N 0.000 description 1
- 241000186361 Actinobacteria <class> Species 0.000 description 1
- 102000057234 Acyl transferases Human genes 0.000 description 1
- 108700016155 Acyl transferases Proteins 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 101000935487 Agrobacterium fabrum (strain C58 / ATCC 33970) 3-oxopimeloyl-[acyl-carrier-protein] synthase Proteins 0.000 description 1
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N Alanine Chemical compound CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 1
- 108010031025 Alanine Dehydrogenase Proteins 0.000 description 1
- 241000908790 Alcanivorax jadensis Species 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 101100388296 Arabidopsis thaliana DTX51 gene Proteins 0.000 description 1
- 241001513093 Aspergillus awamori Species 0.000 description 1
- 241000892910 Aspergillus foetidus Species 0.000 description 1
- 241001225321 Aspergillus fumigatus Species 0.000 description 1
- 241000351920 Aspergillus nidulans Species 0.000 description 1
- 241001057184 Axion Species 0.000 description 1
- 241000193744 Bacillus amyloliquefaciens Species 0.000 description 1
- 241000193752 Bacillus circulans Species 0.000 description 1
- 241001328122 Bacillus clausii Species 0.000 description 1
- 241000193749 Bacillus coagulans Species 0.000 description 1
- 241000193422 Bacillus lentus Species 0.000 description 1
- 101000745610 Bacillus megaterium (strain ATCC 14581 / DSM 32 / JCM 2506 / NBRC 15308 / NCIMB 9376 / NCTC 10342 / NRRL B-14308 / VKM B-512) NADPH-cytochrome P450 reductase Proteins 0.000 description 1
- 241000194103 Bacillus pumilus Species 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 108700026508 Bacillus subtilis CYP102A3 Proteins 0.000 description 1
- 241000193764 Brevibacillus brevis Species 0.000 description 1
- DKPFZGUDAPQIHT-UHFFFAOYSA-N Butyl acetate Natural products CCCCOC(C)=O DKPFZGUDAPQIHT-UHFFFAOYSA-N 0.000 description 1
- 210000003771 C cell Anatomy 0.000 description 1
- HJHAVTKVUQHXLS-UHFFFAOYSA-N C(=CCCCCCCCCCCCCCCCO)O Chemical compound C(=CCCCCCCCCCCCCCCCO)O HJHAVTKVUQHXLS-UHFFFAOYSA-N 0.000 description 1
- CPULDCFUFOCTFV-UHFFFAOYSA-N COC(=O)C=CCCCCCCCN Chemical compound COC(=O)C=CCCCCCCCN CPULDCFUFOCTFV-UHFFFAOYSA-N 0.000 description 1
- 102220617216 CPX chromosomal region candidate gene 1 protein_F88V_mutation Human genes 0.000 description 1
- XWTAWJQRJVYINL-UHFFFAOYSA-N C[Si](OC=CCCCCCCCCCCO[Si](C)(C)C)(C)C Chemical compound C[Si](OC=CCCCCCCCCCCO[Si](C)(C)C)(C)C XWTAWJQRJVYINL-UHFFFAOYSA-N 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 241000010804 Caulobacter vibrioides Species 0.000 description 1
- 241000195585 Chlamydomonas Species 0.000 description 1
- 206010008631 Cholera Diseases 0.000 description 1
- 241000123346 Chrysosporium Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 241000218631 Coniferophyta Species 0.000 description 1
- 241001528480 Cupriavidus Species 0.000 description 1
- 241000252867 Cupriavidus metallidurans Species 0.000 description 1
- 241001051767 Cyanobium sp. PCC 7001 Species 0.000 description 1
- 241000159506 Cyanothece Species 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- YAHZABJORDUQGO-NQXXGFSBSA-N D-ribulose 1,5-bisphosphate Chemical compound OP(=O)(O)OC[C@@H](O)[C@@H](O)C(=O)COP(O)(O)=O YAHZABJORDUQGO-NQXXGFSBSA-N 0.000 description 1
- 101150042222 DGAT1 gene Proteins 0.000 description 1
- 230000033616 DNA repair Effects 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 108010013369 Enteropeptidase Proteins 0.000 description 1
- 102100029727 Enteropeptidase Human genes 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- 241000588722 Escherichia Species 0.000 description 1
- 241001522878 Escherichia coli B Species 0.000 description 1
- 241000644323 Escherichia coli C Species 0.000 description 1
- 241000901842 Escherichia coli W Species 0.000 description 1
- 108091060211 Expressed sequence tag Proteins 0.000 description 1
- 102100026693 FAS-associated death domain protein Human genes 0.000 description 1
- 108010074860 Factor Xa Proteins 0.000 description 1
- 101710172176 Fasciclin-1 Proteins 0.000 description 1
- 102000000476 Fatty Acid Transport Proteins Human genes 0.000 description 1
- 108010055870 Fatty Acid Transport Proteins Proteins 0.000 description 1
- 102000003983 Flavoproteins Human genes 0.000 description 1
- 108010057573 Flavoproteins Proteins 0.000 description 1
- 241000223218 Fusarium Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 241000193385 Geobacillus stearothermophilus Species 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- QCNWZROVPSVEJA-UHFFFAOYSA-N Heptadecanedioic acid Chemical compound OC(=O)CCCCCCCCCCCCCCCC(O)=O QCNWZROVPSVEJA-UHFFFAOYSA-N 0.000 description 1
- 101000911074 Homo sapiens FAS-associated death domain protein Proteins 0.000 description 1
- 101000642431 Homo sapiens Pre-mRNA-splicing factor SPF27 Proteins 0.000 description 1
- 241001480714 Humicola insolens Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical group C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 238000012404 In vitro experiment Methods 0.000 description 1
- 241000235649 Kluyveromyces Species 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- 241000186660 Lactobacillus Species 0.000 description 1
- 235000019738 Limestone Nutrition 0.000 description 1
- 108030006555 Lysine 6-dehydrogenases Proteins 0.000 description 1
- 102000008109 Mixed Function Oxygenases Human genes 0.000 description 1
- 108010074633 Mixed Function Oxygenases Proteins 0.000 description 1
- 102000002568 Multienzyme Complexes Human genes 0.000 description 1
- 108010093369 Multienzyme Complexes Proteins 0.000 description 1
- 108010021466 Mutant Proteins Proteins 0.000 description 1
- 102000008300 Mutant Proteins Human genes 0.000 description 1
- XCOBLONWWXQEBS-KPKJPENVSA-N N,O-bis(trimethylsilyl)trifluoroacetamide Chemical compound C[Si](C)(C)O\C(C(F)(F)F)=N\[Si](C)(C)C XCOBLONWWXQEBS-KPKJPENVSA-N 0.000 description 1
- 241000221960 Neurospora Species 0.000 description 1
- 241000424623 Nostoc punctiforme Species 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 229920000299 Nylon 12 Polymers 0.000 description 1
- NLNJBCNCLWUPKI-UHFFFAOYSA-N OCCCCCCCCCCCCCCC=CC(O)=O Chemical compound OCCCCCCCCCCCCCCC=CC(O)=O NLNJBCNCLWUPKI-UHFFFAOYSA-N 0.000 description 1
- 241000795633 Olea <sea slug> Species 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241000930992 Paraburkholderia fungorum Species 0.000 description 1
- 241000228143 Penicillium Species 0.000 description 1
- 241000228150 Penicillium chrysogenum Species 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 241000222385 Phanerochaete Species 0.000 description 1
- 108091000041 Phosphoenolpyruvate Carboxylase Proteins 0.000 description 1
- 241000235648 Pichia Species 0.000 description 1
- 241000222350 Pleurotus Species 0.000 description 1
- 241000209504 Poaceae Species 0.000 description 1
- 102100036347 Pre-mRNA-splicing factor SPF27 Human genes 0.000 description 1
- 241000192138 Prochlorococcus Species 0.000 description 1
- 101100378793 Pseudomonas oleovorans alkH gene Proteins 0.000 description 1
- 241000589776 Pseudomonas putida Species 0.000 description 1
- 102100021702 Putative cytochrome P450 2D7 Human genes 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 241000235402 Rhizomucor Species 0.000 description 1
- 241000235403 Rhizomucor miehei Species 0.000 description 1
- 241000158504 Rhodococcus hoagii Species 0.000 description 1
- 241001524101 Rhodococcus opacus Species 0.000 description 1
- 241000187563 Rhodococcus ruber Species 0.000 description 1
- 241000190984 Rhodospirillum rubrum Species 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 241000193448 Ruminiclostridium thermocellum Species 0.000 description 1
- 101100215626 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) ADP1 gene Proteins 0.000 description 1
- 241000235088 Saccharomyces sp. Species 0.000 description 1
- 241001466077 Salina Species 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 241000235346 Schizosaccharomyces Species 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 241000187747 Streptomyces Species 0.000 description 1
- 241000187398 Streptomyces lividans Species 0.000 description 1
- 241001468239 Streptomyces murinus Species 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- 108020005038 Terminator Codon Proteins 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 241001313706 Thermosynechococcus Species 0.000 description 1
- 101710151118 Thioesterase TesA Proteins 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 241000222354 Trametes Species 0.000 description 1
- 241000223259 Trichoderma Species 0.000 description 1
- 241000378866 Trichoderma koningii Species 0.000 description 1
- 241000223262 Trichoderma longibrachiatum Species 0.000 description 1
- 241000499912 Trichoderma reesei Species 0.000 description 1
- 241000223261 Trichoderma viride Species 0.000 description 1
- ZVNYJIZDIRKMBF-UHFFFAOYSA-N Vesnarinone Chemical compound C1=C(OC)C(OC)=CC=C1C(=O)N1CCN(C=2C=C3CCC(=O)NC3=CC=2)CC1 ZVNYJIZDIRKMBF-UHFFFAOYSA-N 0.000 description 1
- 108020000999 Viral RNA Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 241000235013 Yarrowia Species 0.000 description 1
- 235000007244 Zea mays Nutrition 0.000 description 1
- 241001478412 Zizania palustris Species 0.000 description 1
- 241000588901 Zymomonas Species 0.000 description 1
- 241000588902 Zymomonas mobilis Species 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000001651 autotrophic effect Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 229940054340 bacillus coagulans Drugs 0.000 description 1
- 108010051210 beta-Fructofuranosidase Proteins 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000000035 biogenic effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- OCCHGMDNQHGUHB-UHFFFAOYSA-N bis(trimethylsilyl) tetradecanedioate Chemical compound C[Si](C)(C)OC(=O)CCCCCCCCCCCCC(=O)O[Si](C)(C)C OCCHGMDNQHGUHB-UHFFFAOYSA-N 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 150000001722 carbon compounds Chemical class 0.000 description 1
- 230000006860 carbon metabolism Effects 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- JJWKPURADFRFRB-UHFFFAOYSA-N carbonyl sulfide Chemical compound O=C=S JJWKPURADFRFRB-UHFFFAOYSA-N 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 230000021523 carboxylation Effects 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000001925 catabolic effect Effects 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 210000003850 cellular structure Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- SECPZKHBENQXJG-UHFFFAOYSA-N cis-palmitoleic acid Natural products CCCCCCC=CCCCCCCCC(O)=O SECPZKHBENQXJG-UHFFFAOYSA-N 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000012411 cloning technique Methods 0.000 description 1
- 230000004186 co-expression Effects 0.000 description 1
- 239000003245 coal Substances 0.000 description 1
- 238000002485 combustion reaction Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 235000021438 curry Nutrition 0.000 description 1
- 101150090781 cyp102A1 gene Proteins 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 108010078934 cytochrome P-450 CYP153 (Acinetobacter) Proteins 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- SUYVUBYJARFZHO-RRKCRQDMSA-N dATP Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@H]1C[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 SUYVUBYJARFZHO-RRKCRQDMSA-N 0.000 description 1
- SUYVUBYJARFZHO-UHFFFAOYSA-N dATP Natural products C1=NC=2C(N)=NC=NC=2N1C1CC(O)C(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 SUYVUBYJARFZHO-UHFFFAOYSA-N 0.000 description 1
- RGWHQCVHVJXOKC-SHYZEUOFSA-J dCTP(4-) Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)C1 RGWHQCVHVJXOKC-SHYZEUOFSA-J 0.000 description 1
- HAAZLUGHYHWQIW-KVQBGUIXSA-N dGTP Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@H]1C[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 HAAZLUGHYHWQIW-KVQBGUIXSA-N 0.000 description 1
- NHVNXKFIZYSCEB-XLPZGREQSA-N dTTP Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C1 NHVNXKFIZYSCEB-XLPZGREQSA-N 0.000 description 1
- INSRQEMEVAMETL-UHFFFAOYSA-N decane-1,1-diol Chemical compound CCCCCCCCCC(O)O INSRQEMEVAMETL-UHFFFAOYSA-N 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- QNXYZQSFDTZEBK-UHFFFAOYSA-N dodec-11-en-1-ol Chemical compound OCCCCCCCCCCC=C QNXYZQSFDTZEBK-UHFFFAOYSA-N 0.000 description 1
- MAZWDMBCPDUFDJ-UHFFFAOYSA-N dodec-2-enedioic acid Chemical compound OC(=O)CCCCCCCCC=CC(O)=O MAZWDMBCPDUFDJ-UHFFFAOYSA-N 0.000 description 1
- BWELVAFPJUDDFX-UHFFFAOYSA-N dodecane-1,10-diol Chemical compound CCC(O)CCCCCCCCCO BWELVAFPJUDDFX-UHFFFAOYSA-N 0.000 description 1
- MHTWXBYRJHQAET-UHFFFAOYSA-N dodecane-1,11-diol Chemical compound CC(O)CCCCCCCCCCO MHTWXBYRJHQAET-UHFFFAOYSA-N 0.000 description 1
- PKBPBCBNUCWCBN-UHFFFAOYSA-N dodecane-1,9-diol Chemical compound CCCC(O)CCCCCCCCO PKBPBCBNUCWCBN-UHFFFAOYSA-N 0.000 description 1
- MMXKVMNBHPAILY-UHFFFAOYSA-N dodecanoic acid ethyl ester Natural products CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 1
- 239000010791 domestic waste Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 125000003700 epoxy group Chemical group 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 108010052305 exodeoxyribonuclease III Proteins 0.000 description 1
- 101150015067 fabB gene Proteins 0.000 description 1
- 101150004992 fadA gene Proteins 0.000 description 1
- 101150069125 fadB gene Proteins 0.000 description 1
- 230000004129 fatty acid metabolism Effects 0.000 description 1
- 230000004136 fatty acid synthesis Effects 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 230000008713 feedback mechanism Effects 0.000 description 1
- 239000003337 fertilizer Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 239000002803 fossil fuel Substances 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 230000037433 frameshift Effects 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 150000003278 haem Chemical class 0.000 description 1
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 1
- 239000011121 hardwood Substances 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- BQJBHRUQFJFNTO-UHFFFAOYSA-N heptadec-2-enedioic acid Chemical compound OC(=O)CCCCCCCCCCCCCC=CC(O)=O BQJBHRUQFJFNTO-UHFFFAOYSA-N 0.000 description 1
- 235000008216 herbs Nutrition 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- IVJLSPVMJRCRPF-UHFFFAOYSA-N hexadec-15-en-1-ol Chemical compound OCCCCCCCCCCCCCCC=C IVJLSPVMJRCRPF-UHFFFAOYSA-N 0.000 description 1
- IWTMSCUHCJHPPR-UHFFFAOYSA-N hexadec-2-enedioic acid Chemical compound OC(=O)CCCCCCCCCCCCC=CC(O)=O IWTMSCUHCJHPPR-UHFFFAOYSA-N 0.000 description 1
- VLKZOEOYAKHREP-UHFFFAOYSA-N hexane Substances CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 230000000640 hydroxylating effect Effects 0.000 description 1
- 239000003317 industrial substance Substances 0.000 description 1
- 239000002440 industrial waste Substances 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000001573 invertase Substances 0.000 description 1
- 235000011073 invertase Nutrition 0.000 description 1
- YAQXGBBDJYBXKL-UHFFFAOYSA-N iron(2+);1,10-phenanthroline;dicyanide Chemical compound [Fe+2].N#[C-].N#[C-].C1=CN=C2C3=NC=CC=C3C=CC2=C1.C1=CN=C2C3=NC=CC=C3C=CC2=C1 YAQXGBBDJYBXKL-UHFFFAOYSA-N 0.000 description 1
- 238000002307 isotope ratio mass spectrometry Methods 0.000 description 1
- 238000010930 lactamization Methods 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 229940039696 lactobacillus Drugs 0.000 description 1
- 239000006028 limestone Substances 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 229940041033 macrolides Drugs 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000013028 medium composition Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- SZGHOKWWURKSHG-UHFFFAOYSA-N methyl 10-aminodecanoate Chemical compound COC(=O)CCCCCCCCCN SZGHOKWWURKSHG-UHFFFAOYSA-N 0.000 description 1
- UWJQRRLFMAEIOB-UHFFFAOYSA-N methyl 10-hydroxydec-2-enoate Chemical compound COC(=O)C=CCCCCCCCO UWJQRRLFMAEIOB-UHFFFAOYSA-N 0.000 description 1
- NFJQGHRDVMDLKM-UHFFFAOYSA-N methyl 10-hydroxydecanoate Chemical compound COC(=O)CCCCCCCCCO NFJQGHRDVMDLKM-UHFFFAOYSA-N 0.000 description 1
- UUZQMRLNBBJECB-UHFFFAOYSA-N methyl 10-oxodec-2-enoate Chemical compound COC(=O)C=CCCCCCCC=O UUZQMRLNBBJECB-UHFFFAOYSA-N 0.000 description 1
- LVPNLDGNIRVDRF-UHFFFAOYSA-N methyl 10-oxodecanoate Chemical compound COC(=O)CCCCCCCCC=O LVPNLDGNIRVDRF-UHFFFAOYSA-N 0.000 description 1
- GAFBLJGHVUEMPC-UHFFFAOYSA-N methyl 12-aminododec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCN GAFBLJGHVUEMPC-UHFFFAOYSA-N 0.000 description 1
- WOKPQDWZODVZMN-UHFFFAOYSA-N methyl 12-hydroxydodec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCO WOKPQDWZODVZMN-UHFFFAOYSA-N 0.000 description 1
- RPXSBMKUHKOWQV-UHFFFAOYSA-N methyl 12-oxododec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCC=O RPXSBMKUHKOWQV-UHFFFAOYSA-N 0.000 description 1
- QIBQWSGKFRJAQD-UHFFFAOYSA-N methyl 12-trimethylsilyloxydodecanoate Chemical compound COC(=O)CCCCCCCCCCCO[Si](C)(C)C QIBQWSGKFRJAQD-UHFFFAOYSA-N 0.000 description 1
- FJOBFTBKQNPPSC-UHFFFAOYSA-N methyl 14-aminotetradec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCN FJOBFTBKQNPPSC-UHFFFAOYSA-N 0.000 description 1
- MXPGNULHXUWMNA-UHFFFAOYSA-N methyl 14-aminotetradecanoate Chemical compound COC(=O)CCCCCCCCCCCCCN MXPGNULHXUWMNA-UHFFFAOYSA-N 0.000 description 1
- DUWNPMYTZCQIQK-UHFFFAOYSA-N methyl 14-hydroxytetradec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCO DUWNPMYTZCQIQK-UHFFFAOYSA-N 0.000 description 1
- SDRQPLWGWWJJBZ-UHFFFAOYSA-N methyl 14-oxotetradecanoate Chemical compound COC(=O)CCCCCCCCCCCCC=O SDRQPLWGWWJJBZ-UHFFFAOYSA-N 0.000 description 1
- KSQCFERAKOHFJI-UHFFFAOYSA-N methyl 14-trimethylsilyloxytetradecanoate Chemical compound COC(=O)CCCCCCCCCCCCCO[Si](C)(C)C KSQCFERAKOHFJI-UHFFFAOYSA-N 0.000 description 1
- LXJQKNOGRMDVIH-UHFFFAOYSA-N methyl 16-aminohexadec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCCCN LXJQKNOGRMDVIH-UHFFFAOYSA-N 0.000 description 1
- XHBGHEJULUAFGB-UHFFFAOYSA-N methyl 16-aminohexadecanoate Chemical compound COC(=O)CCCCCCCCCCCCCCCN XHBGHEJULUAFGB-UHFFFAOYSA-N 0.000 description 1
- SFSXSFKPWYPOSI-UHFFFAOYSA-N methyl 16-oxohexadec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCCC=O SFSXSFKPWYPOSI-UHFFFAOYSA-N 0.000 description 1
- ZVNKCEVQFIMBAM-UHFFFAOYSA-N methyl 16-oxohexadecanoate Chemical compound COC(=O)CCCCCCCCCCCCCCC=O ZVNKCEVQFIMBAM-UHFFFAOYSA-N 0.000 description 1
- DTUGGANAXZUOHS-UHFFFAOYSA-N methyl 18-aminooctadec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCCCCCN DTUGGANAXZUOHS-UHFFFAOYSA-N 0.000 description 1
- WULNKGRWRDHKKB-UHFFFAOYSA-N methyl 18-aminooctadecanoate Chemical compound COC(=O)CCCCCCCCCCCCCCCCCN WULNKGRWRDHKKB-UHFFFAOYSA-N 0.000 description 1
- RFSYYTXJXIOCNI-UHFFFAOYSA-N methyl 18-hydroxyoctadec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCCCCCO RFSYYTXJXIOCNI-UHFFFAOYSA-N 0.000 description 1
- RGSSITYAPHDCNP-UHFFFAOYSA-N methyl 18-oxooctadec-2-enoate Chemical compound COC(=O)C=CCCCCCCCCCCCCCCC=O RGSSITYAPHDCNP-UHFFFAOYSA-N 0.000 description 1
- LHAJLOOCIUSIMM-UHFFFAOYSA-N methyl 18-oxooctadecanoate Chemical compound COC(=O)CCCCCCCCCCCCCCCCC=O LHAJLOOCIUSIMM-UHFFFAOYSA-N 0.000 description 1
- RVTLMGSZWNZFCA-UHFFFAOYSA-N methyl 2-aminododecanoate Chemical class CCCCCCCCCCC(N)C(=O)OC RVTLMGSZWNZFCA-UHFFFAOYSA-N 0.000 description 1
- ZYKOKVARXPKXFW-UHFFFAOYSA-N methyl 8-aminooctanoate Chemical compound COC(=O)CCCCCCCN ZYKOKVARXPKXFW-UHFFFAOYSA-N 0.000 description 1
- HVAXGLYKECRETN-UHFFFAOYSA-N methyl 8-oxooctanoate Chemical compound COC(=O)CCCCCCC=O HVAXGLYKECRETN-UHFFFAOYSA-N 0.000 description 1
- 108010036691 methylamine dehydrogenase Proteins 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 239000010813 municipal solid waste Substances 0.000 description 1
- 231100000707 mutagenic chemical Toxicity 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- BOPGDPNILDQYTO-NNYOXOHSSA-N nicotinamide-adenine dinucleotide Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 BOPGDPNILDQYTO-NNYOXOHSSA-N 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 1
- BNJOQKFENDDGSC-UHFFFAOYSA-N octadecanedioic acid Chemical compound OC(=O)CCCCCCCCCCCCCCCCC(O)=O BNJOQKFENDDGSC-UHFFFAOYSA-N 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- OEIJHBUUFURJLI-UHFFFAOYSA-N octane-1,8-diol Chemical compound OCCCCCCCCO OEIJHBUUFURJLI-UHFFFAOYSA-N 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 238000012261 overproduction Methods 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- ZBPYFGWSQQFVCJ-UHFFFAOYSA-N pentadecane-1,15-diol Chemical compound OCCCCCCCCCCCCCCCO ZBPYFGWSQQFVCJ-UHFFFAOYSA-N 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 239000003348 petrochemical agent Substances 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 239000002952 polymeric resin Substances 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 230000004952 protein activity Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 108091006091 regulatory enzymes Proteins 0.000 description 1
- 230000000284 resting effect Effects 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- NNNVXFKZMRGJPM-KHPPLWFESA-N sapienic acid Chemical compound CCCCCCCCC\C=C/CCCCC(O)=O NNNVXFKZMRGJPM-KHPPLWFESA-N 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical compound OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002910 solid waste Substances 0.000 description 1
- TYFQFVWCELRYAO-UHFFFAOYSA-N suberic acid Chemical compound OC(=O)CCCCCCC(O)=O TYFQFVWCELRYAO-UHFFFAOYSA-N 0.000 description 1
- 150000003890 succinate salts Chemical class 0.000 description 1
- 125000000185 sucrose group Chemical group 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 101150026728 tesB gene Proteins 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- OMXCOTJRRMSYHG-UHFFFAOYSA-N tetradec-1-ene-1,14-diol Chemical compound OCCCCCCCCCCCCC=CO OMXCOTJRRMSYHG-UHFFFAOYSA-N 0.000 description 1
- HABBDUAFSHZDDO-UHFFFAOYSA-N tetradec-2-enedioic acid Chemical compound OC(=O)CCCCCCCCCCC=CC(O)=O HABBDUAFSHZDDO-UHFFFAOYSA-N 0.000 description 1
- 238000009482 thermal adhesion granulation Methods 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000011426 transformation method Methods 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- OXAJUFMPAOVNAC-UHFFFAOYSA-N tridec-1-ene-1,13-diol Chemical compound OCCCCCCCCCCCC=CO OXAJUFMPAOVNAC-UHFFFAOYSA-N 0.000 description 1
- QMTCVGUNYZWEJH-UHFFFAOYSA-N tridec-2-enedioic acid Chemical compound OC(=O)CCCCCCCCCC=CC(O)=O QMTCVGUNYZWEJH-UHFFFAOYSA-N 0.000 description 1
- RCJWLPSXENMRKS-UHFFFAOYSA-N undec-1-ene-1,11-diol Chemical compound OCCCCCCCCCC=CO RCJWLPSXENMRKS-UHFFFAOYSA-N 0.000 description 1
- PRHYKPOPIDLQKJ-UHFFFAOYSA-N undec-2-enedioic acid Chemical compound OC(=O)CCCCCCCC=CC(O)=O PRHYKPOPIDLQKJ-UHFFFAOYSA-N 0.000 description 1
- LWBHHRRTOZQPDM-UHFFFAOYSA-N undecanedioic acid Chemical compound OC(=O)CCCCCCCCCC(O)=O LWBHHRRTOZQPDM-UHFFFAOYSA-N 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/70—Vectors or expression systems specially adapted for E. coli
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/64—Fats; Fatty oils; Ester-type waxes; Higher fatty acids, i.e. having at least seven carbon atoms in an unbroken chain bound to a carboxyl group; Oxidised oils or fats
- C12P7/6409—Fatty acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0006—Oxidoreductases (1.) acting on CH-OH groups as donors (1.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0008—Oxidoreductases (1.) acting on the aldehyde or oxo group of donors (1.2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0071—Oxidoreductases (1.) acting on paired donors with incorporation of molecular oxygen (1.14)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0071—Oxidoreductases (1.) acting on paired donors with incorporation of molecular oxygen (1.14)
- C12N9/0077—Oxidoreductases (1.) acting on paired donors with incorporation of molecular oxygen (1.14) with a reduced iron-sulfur protein as one donor (1.14.15)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1025—Acyltransferases (2.3)
- C12N9/1029—Acyltransferases (2.3) transferring groups other than amino-acyl groups (2.3.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/16—Hydrolases (3) acting on ester bonds (3.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
- C12P7/04—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic
- C12P7/18—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic polyhydric
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/40—Preparation of oxygen-containing organic compounds containing a carboxyl group including Peroxycarboxylic acids
- C12P7/42—Hydroxy-carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/64—Fats; Fatty oils; Ester-type waxes; Higher fatty acids, i.e. having at least seven carbon atoms in an unbroken chain bound to a carboxyl group; Oxidised oils or fats
- C12P7/6436—Fatty acid esters
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y114/00—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14)
- C12Y114/14—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14) with reduced flavin or flavoprotein as one donor, and incorporation of one atom of oxygen (1.14.14)
- C12Y114/14001—Unspecific monooxygenase (1.14.14.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y114/00—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14)
- C12Y114/15—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14) with reduced iron-sulfur protein as one donor, and incorporation of one atom of oxygen (1.14.15)
- C12Y114/15003—Alkane 1-monooxygenase (1.14.15.3)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y203/00—Acyltransferases (2.3)
- C12Y203/01—Acyltransferases (2.3) transferring groups other than amino-acyl groups (2.3.1)
- C12Y203/0102—Diacylglycerol O-acyltransferase (2.3.1.20)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y203/00—Acyltransferases (2.3)
- C12Y203/01—Acyltransferases (2.3) transferring groups other than amino-acyl groups (2.3.1)
- C12Y203/01075—Long-chain-alcohol O-fatty-acyltransferase (2.3.1.75)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y301/00—Hydrolases acting on ester bonds (3.1)
- C12Y301/01—Carboxylic ester hydrolases (3.1.1)
- C12Y301/01005—Lysophospholipase (3.1.1.5)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y301/00—Hydrolases acting on ester bonds (3.1)
- C12Y301/02—Thioester hydrolases (3.1.2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y301/00—Hydrolases acting on ester bonds (3.1)
- C12Y301/02—Thioester hydrolases (3.1.2)
- C12Y301/02014—Oleoyl-[acyl-carrier-protein] hydrolase (3.1.2.14), i.e. ACP-thioesterase
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y102/00—Oxidoreductases acting on the aldehyde or oxo group of donors (1.2)
- C12Y102/01—Oxidoreductases acting on the aldehyde or oxo group of donors (1.2) with NAD+ or NADP+ as acceptor (1.2.1)
- C12Y102/01042—Hexadecanal dehydrogenase (acylating) (1.2.1.42), i.e. fatty acyl-CoA reductase
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E50/00—Technologies for the production of fuel of non-fossil origin
- Y02E50/10—Biofuels, e.g. bio-diesel
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Enzymes And Modification Thereof (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Peptides Or Proteins (AREA)
Description
本出願は、2013年6月14日に出願された米国仮出願第61/835,464号の恩典を主張し、その開示内容はすべて、参照により本明細書に組み入れられる。
本出願は、ASCII書式で電子的に提出された配列表を含み、それはその全体が参照により本明細書に組み入れられる。2014年6月16日に作成された前記ASCIIコピーの名称はLS00048PCT_SL.txtであり、サイズは342,103バイトである。
本開示は、ω-ヒドロキシル化脂肪酸誘導体、およびそれらを生産する方法に関する。本明細書において、本開示は、ω-ヒドロキシル化脂肪酸誘導体を高い純度および収量で提供する、新規かつ環境負荷の少ない生産方法を包含する。選択的発酵を通じてω-ヒドロキシル化脂肪酸誘導体を産生する組換え微生物も、さらに包含される。
ω-ヒドロキシル化(ω-ヒドロキシ)脂肪酸誘導体には、産業用物質の構成成分として、数多くの商業的用途がある。産業界では、ω-ヒドロキシ脂肪酸;ω-ヒドロキシ脂肪酸メチルエステル;ω-オキソ脂肪酸;ω-アミノ脂肪酸;ω-アミノ脂肪酸メチルエステル;α-、ω-二酸(α,ω-二酸);ω-カルボキシ脂肪酸メチルエステル(ω-カルボキシ脂肪酸メチルエステル);α-、ω-ジエステル(α,ω-ジエステル);α-、ω-ジオール(α,ω-ジオール)などを含む、さまざまな種類のω-ヒドロキシ脂肪酸誘導体が認知されている。これらの分子はまた、さまざまな他の化合物の前駆体としても重要である。例えば、α,ω-ジカルボン酸および他のα,ω-二官能性分子は、ポリマー樹脂、金属加工液、接着剤、腐食防止剤、コンデンサー用電解質、ジエステル合成潤滑剤、繊維、粉末コーティング硬化剤、可塑剤、ポリエステルコーティング、エポキシ樹脂、ポリアミド樹脂、香味剤、芳香剤、界面活性剤、洗剤、添加物などにおける産業的用途のある重要な化学物質である。現在、ω-ヒドロキシ脂肪酸誘導体は依然として大半は石油系材料から、またはパラフィンおよび脂肪酸の生物変換を通じて製造されている。これらの化合物を生産するための化学的方法は、有害な試薬の使用を必要とし、エネルギーを大量に消費する上に、環境への負荷も大きい。その反対に、新進的な発酵経路は、環境に優しい工程と見なされてはいるが、依然として費用がかかり過ぎる上、製造しうる生成物の種類も限られている。このため、再生可能な原料からの、さまざまな種類および官能性のω-ヒドロキシ脂肪酸誘導体の直接生産のための工程は、環境にとってより安全であるだけでなく、費用対効果もかなり高いと考えられる。本開示はこの需要に応えるものである。
本開示の1つの局面は、再生可能な原料由来の炭素源の存在下において発酵ブロス中で増殖させた場合にインビボでω-ヒドロキシル化(ω-ヒドロキシ)脂肪酸誘導体を産生させるための組換え微生物を提供する。本微生物は、EC 3.1.2.-、3.1.1.5、もしくは3.1.2.14のチオエステラーゼ;またはEC 2.3.1.75もしくはEC 2.3.1.20のエステルシンターゼ;およびEC 1.14.15.3の改変されたω-ヒドロキシラーゼを含むポリペプチドをコードする少なくとも2種の核酸配列を発現するように操作された経路を含む。改変されたω-ヒドロキシラーゼは、改変されたシトクロムP450モノオキシゲナーゼ(P450)酵素活性を有し、かつインビボで炭化水素鎖のω位を効率的に触媒する。1つの態様において、改変されたω-ヒドロキシラーゼは、EC 1.14.15.3のω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントである。もう1つの態様において、改変されたω-ヒドロキシラーゼは、CYP153A-レダクターゼハイブリッド融合ポリペプチドである。もう1つの態様において、CYP153A-レダクターゼハイブリッド融合ポリペプチドは、自給型(self-sufficient)CYP153A-RedRhFハイブリッド融合タンパク質である。さらにもう1つの態様において、ω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントである改変されたω-ヒドロキシラーゼは、配列番号:6に対して少なくとも90%の配列同一性を有し、かつ、V141I、V141T、V141Q、V141G、V141M、V141L、R27L、R82D、R178N、A231T、N309R、N407A、V415R、T516V、P666A、P666Dおよび/またはA796Vを含む1つまたは複数の突然変異を有する。本明細書において、ω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントは、アミノ酸位置27、82、141、178、231、309、407、415、516、666および/または796に少なくとも1つの突然変異を有する。本組換え微生物は、ω-ヒドロキシ脂肪酸およびω-ヒドロキシ脂肪酸メチルエステルを非限定的に含むω-ヒドロキシ脂肪酸誘導体を産生する。
[本発明1001]
(a)EC 3.1.2.-、3.1.1.5、もしくは3.1.2.14のチオエステラーゼ;またはEC 2.3.1.75もしくはEC 2.3.1.20のエステルシンターゼ;および
(b)EC 1.14.15.3の改変されたω-ヒドロキシラーゼ
を含むポリペプチドをコードする少なくとも2つの核酸配列を発現するように操作された経路を含む、再生可能な原料由来の炭素源の存在下において発酵ブロス中で増殖させた場合にインビボでω-ヒドロキシ脂肪酸誘導体を産生させるための組換え微生物。
[本発明1002]
改変されたω-ヒドロキシラーゼが、改変されたシトクロムP450モノオキシゲナーゼ酵素活性を有し、かつインビボで炭化水素鎖のω位を効率的に触媒する、本発明1001の組換え微生物。
[本発明1003]
改変されたω-ヒドロキシラーゼがCYP153A-レダクターゼハイブリッド融合ポリペプチドである、本発明1002の組換え微生物。
[本発明1004]
CYP153A-レダクターゼハイブリッド融合ポリペプチドが、自給型(self-sufficient)CYP153A-RedRhFハイブリッド融合タンパク質である、本発明1003の組換え微生物。
[本発明1005]
改変されたω-ヒドロキシラーゼが、EC 1.14.15.3のω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントである、本発明1001の組換え微生物。
[本発明1006]
ω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントが、配列番号:6に対して少なくとも90%の配列同一性を有し、かつ、V141I、V141T、V141Q、V141G、V141M、V141L、R27L、R82D、R178N、A231T、N309R、N407A、V415R、T516V、P666A、P666DおよびA796Vからなる群より選択される1つまたは複数の突然変異を有する、本発明1005の組換え微生物。
[本発明1007]
ω-ヒドロキシ脂肪酸およびω-ヒドロキシ脂肪酸メチルエステルからなる群より選択されるω-ヒドロキシ脂肪酸誘導体を産生する、本発明1001の組換え微生物。
[本発明1008]
EC 1.1.1.1/2のアルコールデヒドロゲナーゼまたはEC 1.1.3.13もしくはEC 1.1.3.20のアルコールオキシダーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1001の組換え微生物。
[本発明1009]
ω-オキソ脂肪酸およびω-オキソ脂肪酸メチルエステルからなる群より選択されるω-ヒドロキシ脂肪酸誘導体を産生する、本発明1008の組換え微生物。
[本発明1010]
EC 1.2.1.3/4/5のアルデヒドデヒドロゲナーゼまたはEC 1.2.3.1のアルデヒドオキシダーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1008の組換え微生物。
[本発明1011]
α,ω-二酸またはω-カルボキシ脂肪酸メチルエステルであるω-ヒドロキシ脂肪酸誘導体を産生する、本発明1010の組換え微生物。
[本発明1012]
EC 6.2.1.3のアシル-CoAリガーゼまたはEC 2.8.3.6のアシル-CoAトランスフェラーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1010の組換え微生物。
[本発明1013]
α,ω-ジエステルであるω-ヒドロキシ脂肪酸誘導体を産生する、本発明1012の組換え微生物。
[本発明1014]
EC 2.6.1のアミノトランスフェラーゼまたはEC 1.4.9、EC 1.4.98もしくはEC 1.4.99のアミンデヒドロゲナーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1008の組換え微生物。
[本発明1015]
ω-アミノ脂肪酸およびω-アミノ脂肪酸メチルエステルからなる群より選択されるω-ヒドロキシ脂肪酸誘導体を産生する、本発明1014の組換え微生物。
[本発明1016]
EC 1.1.-.-のアルコールデヒドロゲナーゼおよび1.2.99のカルボン酸レダクターゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1001の組換え微生物。
[本発明1017]
ω-ヒドロキシ脂肪酸誘導体がα,ω-ジオールである、本発明1016の組換え微生物。
[本発明1018]
本発明1001~1017のいずれかの微生物を含む細胞培養物。
[本発明1019]
ω-ヒドロキシ遊離脂肪酸;ω-ヒドロキシ脂肪酸メチルエステル;ω-オキソ脂肪酸;ω-オキソ脂肪酸メチルエステル;α,ω-二酸;α,ω-ジオール;ω-アミノ脂肪酸;およびω-アミノ脂肪酸メチルエステルからなる群より選択されるω-ヒドロキシ脂肪酸誘導体を産生する、本発明1018の細胞培養物。
[本発明1020]
(a)発酵ブロス中に組換え微生物を用意する段階であって、該微生物が、
EC 3.1.2.-、3.1.1.5、もしくは3.1.2.14のチオエステラーゼ;またはEC 2.3.1.75もしくはEC 2.3.1.20のエステルシンターゼ;および
EC 1.14.15.3の改変されたω-ヒドロキシラーゼ
を含むポリペプチドをコードする少なくとも2つの核酸配列を発現するように操作された経路を含む、段階;
(b)炭素源を含有する再生可能な原料を該発酵ブロスに添加する段階;ならびに
(c)該発酵ブロスからω-ヒドロキシ脂肪酸誘導体を単離する段階
を含む、ω-ヒドロキシ脂肪酸誘導体を生産する方法。
[本発明1021]
改変されたω-ヒドロキシラーゼがCYP153A-レダクターゼハイブリッド融合ポリペプチドである、本発明1020の方法。
[本発明1022]
CYP153A-レダクターゼハイブリッド融合ポリペプチドが、自給型CYP153A-RedRhFハイブリッド融合タンパク質である、本発明1021の方法。
[本発明1023]
改変されたω-ヒドロキシラーゼが、EC 1.14.15.3のω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントである、本発明1020の方法。
[本発明1024]
ω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントが、配列番号:6に対して少なくとも90%の配列同一性を有し、かつ、V141I、V141T、V141Q、V141G、V141M、V141L、R27L、R82D、R178N、A231T、N309R、N407A、V415R、T516V、P666A、P666DおよびA796Vからなる群より選択される1つまたは複数の突然変異を有する、本発明1023の方法。
[本発明1025]
ω-ヒドロキシ脂肪酸誘導体が、ω-ヒドロキシ遊離脂肪酸またはω-ヒドロキシ脂肪酸メチルエステルである、本発明1020の方法。
[本発明1026]
組換え微生物が、EC 1.1.1.1/2のアルコールデヒドロゲナーゼまたはEC 1.1.3.13もしくはEC 1.1.3.20のアルコールオキシダーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1020の方法。
[本発明1027]
ω-ヒドロキシ脂肪酸誘導体がω-オキソ脂肪酸またはω-オキソ脂肪酸メチルエステルである、本発明1026の方法。
[本発明1028]
組換え微生物が、EC 1.2.1.3/4/5のアルデヒドデヒドロゲナーゼまたはEC 1.2.3.1のアルデヒドオキシダーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1026の方法。
[本発明1029]
ω-ヒドロキシ脂肪酸誘導体がα,ω-二酸またはα,ω-脂肪酸ジ-メチルエステルである、本発明1028の方法。
[本発明1030]
組換え微生物が、EC 2.6.1のアミノトランスフェラーゼまたはEC 1.4.9、EC 1.4.98もしくはEC 1.4.99のアミンデヒドロゲナーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、本発明1026の方法。
[本発明1031]
ω-ヒドロキシ脂肪酸誘導体がω-アミノ脂肪酸またはω-アミノ脂肪酸メチルエステルである、本発明1030の方法。
[本発明1032]
組換え微生物が、EC 1.2.99.6のカルボン酸レダクターゼまたはおよびEC 1.1.-.-のアルコールデヒドロゲナーゼを含むポリペプチドをコードする核酸をさらに発現するように操作されている、本発明1020の方法。
[本発明1033]
ω-ヒドロキシ脂肪酸誘導体がα,ω-ジオールである、本発明1032の方法。
[本発明1034]
再生可能な原料が炭素系である、本発明1001~1033のいずれかの方法。
[本発明1035]
炭素系の再生可能な原料が、トウモロコシ、サトウキビ、モロコシ、テンサイ、スイッチグラス、エンシレージ、わら、材木、パルプ、下水、生ごみ、セルロース系都市廃棄物、煙道ガス(flu-gas)、合成ガス、バイオマス加水分解物、および二酸化炭素からなる群より選択される、本発明1034の方法。
[本発明1036]
炭素源が、グルコース、フルクトース、マンノース、ガラクトース、キシロース、アラビノース、フルクトオリゴ糖、ガラクトオリゴ糖、デンプン、セルロース、ペクチン、キシラン、スクロース、マルトース、セロビオース、ツラノース、ヘミセルロース、メチルセルロース、カルボキシメチルセルロースナトリウム、コハク酸塩、乳酸塩、酢酸塩、エタノール、メタノール、グリセロール、廃脂肪酸およびそれらの混合物からなる群より選択される、本発明1001の方法。
[本発明1037]
炭素源がグルコース、グリセロールまたはスクロースである、本発明1001の方法。
[本発明1038]
ポリウレタン、ポリエステルポリオール、ポリエステル樹脂、アルキルコート樹脂(alkyl coating resin)、ファイバーグラス樹脂、ゲルコート樹脂(gel coating resin)、およびポリエステル熱可塑性物質からなる群より選択される、本発明1020の方法によって生産されるポリマー組成物。
[本発明1039]
(a)EC 1.2.1.42のアシル-ACPレダクターゼ;
(b)EC 1.1.-.-のアルコールデヒドロゲナーゼ;および
(c)EC 1.14.15.3の改変されたω-ヒドロキシラーゼ
を含むポリペプチドをコードする少なくとも3種の核酸配列を発現するように操作された経路を含む、再生可能な原料由来の炭素源の存在下において発酵ブロス中で増殖させた場合にインビボでω-ヒドロキシ脂肪酸誘導体を産生させるための組換え微生物。
[本発明1040]
改変されたω-ヒドロキシラーゼが、改変されたシトクロムP450酵素活性を有し、かつインビボで炭化水素鎖のω位を効率的に触媒する、本発明1039の組換え微生物。
[本発明1041]
改変されたω-ヒドロキシラーゼがCYP153A-レダクターゼハイブリッド融合ポリペプチドである、本発明1040の組換え微生物。
[本発明1042]
CYP153A-レダクターゼハイブリッド融合ポリペプチドが、自給型CYP153A-RedRhFハイブリッド融合タンパク質である、本発明1041の組換え微生物。
[本発明1043]
改変されたω-ヒドロキシラーゼが、EC 1.14.15.3のω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントである、本発明1039の組換え微生物。
[本発明1044]
ω-ヒドロキシラーゼハイブリッド融合タンパク質バリアントが、配列番号:6に対して少なくとも90%の配列同一性を有し、かつ、V141I、V141T、V141Q、V141G、V141M、V141L、R27L、R82D、R178N、A231T、N309R、N407A、V415R、T516V、P666A、P666DおよびA796Vからなる群より選択される1つまたは複数の突然変異を有する、本発明1043の組換え微生物。
[本発明1045]
ω-ヒドロキシ脂肪酸誘導体がα,ω-ジオールである、本発明1039の組換え微生物。
[本発明1046]
本発明1039~1045のいずれかの微生物を含む細胞培養物。
[本発明1047]
(a)発酵ブロス中に組換え微生物を用意する段階であって、該微生物が、EC 1.2.1.42のアシル-ACPレダクターゼ;EC 1.1.-.-のアルコールデヒドロゲナーゼ;およびEC 1.14.15.3の改変されたω-ヒドロキシラーゼを含むポリペプチドをコードする少なくとも3種の核酸配列を発現するように操作された経路を含む、段階;
(b)炭素源を含有する再生可能な原料を該発酵ブロスに添加する段階;ならびに
(c)該発酵ブロスからω-ヒドロキシ脂肪酸誘導体を単離する段階
を含む、ω-ヒドロキシ脂肪酸誘導体を生産する方法。
[本発明1048]
ω-ヒドロキシ脂肪酸誘導体がα,ω-ジオールである、本発明1047の方法。
[本発明1049]
再生可能な原料が炭素系である、本発明1047~1048のいずれかの方法。
[本発明1050]
炭素系の再生可能な原料が、トウモロコシ、サトウキビ、スイッチグラス、エンシレージ、わら、材木、下水、生ごみ、セルロース系都市廃棄物、煙道ガス、合成ガス、および二酸化炭素からなる群より選択される、本発明1049の方法。
[本発明1051]
炭素源が、グルコース、フルクトース、マンノース、ガラクトース、キシロース、アラビノース、フルクトオリゴ糖、ガラクトオリゴ糖、デンプン、セルロース、ペクチン、キシラン、スクロース、マルトース、セロビオース、ツラノース、ヘミセルロース、メチルセルロース、カルボキシメチルセルロースナトリウム、コハク酸塩、乳酸塩、酢酸塩、エタノール、メタノール、グリセロールおよびそれらの混合物からなる群より選択される、本発明1047の方法。
[本発明1052]
炭素源がグルコース、グリセロールまたはスクロースである、本発明1047の方法。
全体的概観
ω-ヒドロキシ脂肪酸誘導体の生産のための新規かつ環境負荷の少ない方法の開発は、産業界にとって著しい改善を意味する。本方法は、これらの化合物を、再生可能な原料由来の単純な炭素源から効率的に生産することを可能にする。特に、本方法は、再生可能な材料、例えば、トウモロコシ、サトウキビもしくはリグノセルロース系バイオマス由来の糖質;またはグリセロール、煙道ガス、合成ガスなどの廃棄物;またはバイオマスもしくは天然ガスなどの有機材料の再構成物もしくは二酸化炭素などからの、ω-ヒドロキシ脂肪酸誘導体の生産を提供する。
本明細書で用いる場合、「ω-ヒドロキシル化脂肪酸誘導体」および「ω-ヒドロキシル化脂肪酸誘導体」および「ω-ヒドロキシ脂肪酸誘導体」および「ω-ヒドロキシル脂肪酸誘導体」および「ω-OH脂肪酸誘導体」という用語は、本明細書において互換的に用いられ、脂肪酸代謝によって生じ、かつ、少なくとも1つのOH基をω位に有するかまたは少なくとも1つのOH基をω位に有する中間体に由来する、化学的実体のことを指す。本明細書において、「ω位」とは、その主要官能基に対して反対側の末端にある、脂肪酸誘導体の末端炭素原子のことを指す。そのようなω-ヒドロキシ脂肪酸誘導体には、ω-ヒドロキシ脂肪酸;ω-ヒドロキシ-脂肪酸メチルエステル;ω-カルボキシ-脂肪酸メチルエステル;ω-オキソ脂肪酸;ω-アミノ脂肪酸;ω-アミノ脂肪酸メチルエステル;ならびにα,ω-二酸;α,ω-ジエステル;およびα,ω-ジオールが非限定的に含まれる。「ω-ヒドロキシ脂肪酸誘導体」という用語は、「α,ω-二官能性脂肪酸誘導体」を含む。
脂肪酸合成は、細菌生合成機構の最も保存された系の1つである。脂肪酸シンターゼ(FAS)多酵素複合体はすべての細菌および真核生物に存在する。FAS関連遺伝子のほとんどは、細胞の増殖および生存のために不可欠である。真核生物および細菌のFASは、本質的に同じ種類の生化学的形質転換を生じさせる。真核生物において、FASはFAS Iと称され、その触媒ドメインの大半は1つのポリペプチド鎖(解離不可能)によってコードされる。細菌などの原核生物において、FASはFASIIと称され、その個々の酵素およびキャリアータンパク質は、不連続な(解離しうる)タンパク質をコードする別個の遺伝子によってコードされる。そのため、FASIIは大きな多様性および独特の特質を有する複雑な系である。
適したω-ヒドロキシラーゼ/ω-オキシゲナーゼ(EC 1.14.15.3)およびそれらの酸化還元パートナーの例が、表2Aおよび2B(前記)に列記されている。これらは、シトクロムP450としても知られる、ある種の非ヘム二鉄オキシゲナーゼ(例えば、シュードモナス・プチダGPo1由来のalkB)またはある種のヘム型P450オキシゲナーゼ(例えば、マリノバクター・アクアエオレイ由来のcyp153A)である。シトクロムP450は、偏在性に分布している酵素であり、高度の複雑性を有する上に、幅広い領域にわたる活性を呈する。それらは、広範囲にわたる種々の基質を変換して種々の化学的反応を触媒する遺伝子のスーパーファミリーによってコードされる、タンパク質である。Cyp153Aは、炭化水素鎖をω位に対する高い選択性を伴ってヒドロキシル化する可溶性細菌シトクロムP450のサブファミリーである(van Beilen et al. (2006) Appl. Environ. Microbiol. 72:59-65)。cyp153Aファミリーのメンバーは、インビトロでアルカン、脂肪酸または脂肪アルコールのω位を選択的にヒドロキシル化することが示されており、これには例えば、マイコバクテリウム属種HXN-1500由来のcyp153A6(Funhoff et al. (2006) J. Bacteriol. 188:5220-5227)、マイコバクテリウム・マリヌム由来のcyp153A16、およびポラノモナス(Polaromonas)属種JS666由来のcyp153A(Scheps et al. (2011) Org. Biomol. Chem. 9:6727-6733)ならびにマイコバクテリウム・マリヌム由来のcyp153A(Honda-Malca et al. (2012) Chem. Commun. 48:5115-5117)がある。
本開示では、組換え宿主細胞において発現させた場合にω-ヒドロキシル化脂肪酸誘導体組成物の高い力価、収量および/または生産性をもたらすCYP153A-レダクターゼハイブリッド融合ポリペプチドバリアントを特定している。本開示の非限定的な例においては、CYP153A(G307A)-RedRhFハイブリッド融合ポリペプチド(下記の実施例6を参照)を、CYP153A-レダクターゼハイブリッド融合ポリペプチドバリアントを効率的に操作するための鋳型として用いて(下記の実施例14~10を参照)、より多くの量のω-OH脂肪酸およびω-OH脂肪酸誘導体を産生させた。例えば、CYP153A-レダクターゼハイブリッド融合ポリペプチドバリアントは、宿主細胞において発現させた場合に、インビボで、グルコースなどの単純な炭素源から、ドデカン酸などの化合物を12-ヒドロキシドデカン酸に効率的に変換させることができた。例えば再生可能な原料に由来するような、任意の単純な炭素源が適している。操作されたCYP153A-レダクターゼハイブリッド融合ポリペプチドバリアント(すなわち、操作されたCYP153A-RedRhFハイブリッド融合ポリペプチドバリアントによって例示されている)は、再生可能な原料由来の炭素源(例えば、グルコース)を用いて、宿主細胞(例えば、大腸菌)においてチオエステラーゼと共発現させた場合に、インビボで脂肪酸を特定の望ましい化合物(ω-OH脂肪酸を含む)に効率的に変換させうることが示された(実施例、下記を参照)。本開示に従うことにより、突然変異させた遺伝子、例えばCYP153Aタンパク質をコードする遺伝子をc末端レダクターゼドメインと連結させることによって、他のハイブリッド融合ポリペプチドバリアントを操作することができる(前記の表2Aから2Dまでを参照)。例えば、両方の遺伝子(P5450およびレダクターゼドメイン)を突然変異させる、または一方の遺伝子(P450またはレダクターゼドメイン)を突然変異させる変形物も、本明細書に包含される。これらの指示に従うことで、他の種類のω-ヒドロキシラーゼから同様の融合タンパク質バリアントを作り出し、組換え宿主細胞において発現させて、ω-OH脂肪酸誘導体を産生させることができる。
バリアントポリペプチドとは、本明細書で用いる場合、野生型または鋳型ポリペプチドとは少なくとも1つのアミノ酸が異なるアミノ酸配列を有するポリペプチドを指す。例えば、バリアント(例えば突然変異体)は、以下の保存的アミノ酸置換、例えば、これらに限定されるわけではないが、アラニン、バリン、ロイシンおよびイソロイシンなどの脂肪族アミノ酸の、別の脂肪族アミノ酸による置き換え;セリンのトレオニンによる置き換え;トレオニンのセリンによる置き換え;例えばアスパラギン酸およびグルタミン酸などの酸性残基の、別の酸性残基による置き換え;アスパラギンおよびグルタミンなどのアミド基を保有する残基の、アミド基を保有する別の残基による置き換え;リジンおよびアルギニンなどの塩基性残基の、別の塩基性残基との交換;ならびに、フェニルアラニンおよびチロシンなどの芳香族残基の、別の芳香族残基による置き換えのうちの、1つまたは複数を有しうる。いくつかの態様において、バリアントポリペプチドは、約1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100個、またはそれ以上のアミノ酸置換、付加、挿入または欠失を有する。バリアントまたは突然変異体として機能するポリペプチドの好ましい断片のいくつかは、対応する野生型ポリペプチドの生物学的機能(例えば、酵素活性)の一部またはすべてを保っている。いくつかの態様において、断片は、対応する野生型ポリペプチドの生物学的機能の少なくとも75%、少なくとも80%、少なくとも90%、少なくとも95%または少なくとも98%、またはそれ以上を保っている。他の態様において、断片または突然変異体は、対応する野生型ポリペプチドの生物学的機能の約100%を保っている。他の態様において、いくつかの断片は、対応する野生型ポリペプチドと比べて増大した生物学的機能を示す。生物活性に影響を及ぼさずにどのアミノ酸残基を置換し、挿入し、または欠失させることができるかを判定する上での手引きは、当技術分野において周知のコンピュータプログラム、例えば、LASERGENEソフトウェア(DNASTAR, Inc., Madison, WI)を用いて見いだすことができる。いくつかの態様において、断片は、対応する野生型ポリペプチドまたは鋳型ポリペプチドと比較して増大した生物学的機能を示す。例えば、断片は、対応する野生型ポリペプチドまたは鋳型ポリペプチドと比較して、酵素活性の点で少なくとも10%、少なくとも25%、少なくとも50%、少なくとも75%または少なくとも90%の改善を呈しうる。他の態様において、断片は、対応する野生型ポリペプチドまたは鋳型ポリペプチドと比較して、酵素活性の点で少なくとも100%、少なくとも200%、または少なくとも500%の改善を呈する。
いくつかの態様においては、ポリヌクレオチド(または遺伝子)配列が、ポリヌクレオチド配列と機能的に連結したプロモーターを含む組換えベクターにより、宿主細胞に与えられる。ある態様において、プロモーターは、発生段階調節性の、オルガネラ特異的な、組織特異的な、誘導性の、構成性の、または細胞特異的なプロモーターである。いくつかの態様において、組換えベクターは、ポリヌクレオチド配列と機能的に結びついた発現制御配列;ポリヌクレオチド配列と機能的に結びついた選択マーカー;ポリヌクレオチド配列と機能的に結びついたマーカー配列;ポリヌクレオチド配列と機能的に結びついた精製部分;ポリヌクレオチド配列と機能的に結びついた分泌配列;およびポリヌクレオチド配列と機能的に結びついたターゲティング配列より選択される、少なくとも1つの配列を含む。本明細書に記載の発現ベクターは、ポリヌクレオチド配列を、宿主細胞における該ポリヌクレオチド配列の発現に適した形態で含む。当業者には、発現ベクターの設計が、形質転換させようとする宿主細胞の選択、および所望のポリペプチドの発現レベルなどの要因に依存しうることが理解されるであろう。上述のポリヌクレオチド配列によってコードされるポリペプチド、例えば融合ポリペプチドを産生させるために、本明細書に記載の発現ベクターは宿主細胞に導入することができる(前記)。原核生物、例えば大腸菌におけるポリペプチドをコードする遺伝子の発現は、融合または非融合ポリペプチドのいずれかの発現を導く構成性または誘導性プロモーターを含有するベクターを用いて実施されることが最も多い。融合ベクターは、その中にコードされているポリペプチド、通常は組換えポリペプチドのアミノ末端またはカルボキシ末端に、いくつかのアミノ酸を付加する。そのような融合ベクターは、典型的には、組換えポリペプチドの発現を増大させること;組換えポリペプチドの溶解性を高めること;および、アフィニティー精製におけるリガンドとして作用することによって組換えポリペプチドの精製を助けることを含む3つの目的の、1つまたは複数に役立つ。多くの場合、融合発現ベクターでは、融合部分と組換えポリペプチドの接合部にタンパク質分解切断部位が導入されている。これにより、融合ポリペプチドの精製後に、融合部分からの組換えポリペプチドの分離が可能になる。そのような酵素およびそれらのコグネイト認識配列の例には、第Xa因子、トロンビンおよびエンテロキナーゼが含まれる。例示的な融合発現ベクターには、pGEXベクター(Pharmacia Biotech, Inc., Piscataway, NJ;Smith et al. (1988) Gene 67: 31-40)、pMALベクター(New England Biolabs, Beverly, MA)、およびpRITSベクター(Pharmacia Biotech, Inc., Piscataway, N. J.)が含まれ、これらはそれぞれ、グルタチオンS-トランスフェラーゼ(GST)、マルトースE結合タンパク質またはプロテインAを標的組換えポリペプチドと融合させるものである。
本開示の宿主細胞または微生物には、酵素活性に対する特定の突然変異の効率を検討するための変更を含むように遺伝子操作されたまたは改変された宿主菌株または宿主細胞(すなわち、組換え細胞または微生物)が含まれる。どの生来の酵素経路が元の宿主細胞に存在しているかに応じて、さまざまな任意選択的な遺伝的操作および変更を、1つの宿主細胞から別のものまでに互換的に用いることができる。1つの態様において、宿主菌株は、他の生合成ポリペプチド(例えば、酵素)と組合せてCYP153A-レダクターゼハイブリッド融合ポリペプチドまたはそのバリアントの発現を検討するために用いることができる。宿主菌株は、発酵の構成成分、炭素源(例えば、原料)、温度、圧力、培養物混入低減条件(reduced culture contamination condition)および酸素レベルを含む培養条件を非限定的に含む、具体的な変数を検討するためのいくつかの遺伝的変更を含みうる。
ω-ヒドロキシ脂肪酸誘導体を産生させる目的で、生産宿主細胞(前記)にいくつかの改変を加えた。したがって、本開示は、操作されていないまたは生来の宿主細胞(例えば、対照細胞としての役目を果たす野生型宿主細胞)に比してω-脂肪酸生合成経路をもたらすように操作された、組換え宿主細胞を提供し、これは例えば、菌株改良を通じて実現される。本開示の生産宿主生物には、植物細胞、動物細胞、または微生物細胞が含まれる。微生物または微生物細胞、例えば細菌、シアノバクテリウム、酵母、藻類または糸状菌などを、生産宿主として用いることができる。生産宿主として用いうる微生物の非限定的な例には、大腸菌、S.セレビシエなど(下記)が含まれる。微生物菌株は、再生可能な原料由来のグルコースまたは他の炭素源を、脂肪酸または脂肪酸エステル、例えば脂肪酸メチルエステル(FAME)、脂肪酸エチルエステル(FAEE)、および脂肪アルコール(FALC)などに効率的に変換させる。これを達成する目的で、脂肪酸の生産のためのチオエステラーゼ(例えば、大腸菌由来のTesA)またはFAMEの生産のためのエステルシンターゼ(例えば、M.ハイドロカーボノクラスティカス由来のES9)を含む重要な酵素を発現するように、菌株を注意深く操作した。さまざまな化合物の生産のための高密度発酵に関するプロトコールおよび手順は確立されている(参照により本明細書に組み入れられる、米国特許第8,372,610号;第8,323,924号;第8,313,934号;第8,283,143号;第8,268,599号;第8,183,028号;第8,110,670号;第8,110,093号;および第8,097,439号を参照)。
本明細書で用いる場合、現代炭素分率すなわちfMという用語は、米国国立標準技術研究所(National Institute of Standards and Technology;NIST)標準物質(Standard Reference Material;SRM)4990Bおよび4990C、それぞれシュウ酸標準品HOxIおよびHOxIIとして知られるもの、によって定義されるものと同じ意味を有する。基本的定義はHOxIの14C/12C同位体比の0.95倍に相当する(西暦1950年を基準とする)。これは、減衰補正された産業革命前の木とおおむね等しい。現在の生体生物圏(植物材料)については、fMはおよそ1.1である。バイオ生成物(bioproduct)(例えば、本開示に従って産生されたω-OH脂肪酸および誘導体を含む脂肪酸誘導体)は、生物的に産生された有機化合物を含む。特に、本明細書における脂肪酸生合成経路を用いて産生された脂肪酸誘導体(例えば、ω-OH脂肪酸およびその誘導体)は、これまで再生可能資源から産生されたことはなく、したがって新規な組成物である。これらの新たなバイオ生成物は、石油化学炭素由来の有機化合物とは、二核種炭素同位体フィンガープリント法(dual carbon-isotopic fingerprinting)または14C年代測定法(14C dating)に基づいて区別することができる。さらに、生物起源炭素の具体的な供給源(例えば、グルコースとグリセロールとの対比)を、二核種炭素同位体フィンガープリント法によって決定することもできる(例えば、米国特許第7,169,588号を参照されたい)。バイオ生成物を石油系の有機化合物と区別しうることは、これらの材料の流通下でのトラッキングに有益である。例えば、生物学に基づく炭素同位体プロファイルと石油系の炭素同位体プロファイルの両方を含む有機化合物または化学物質は、石油系の材料だけでできた有機化合物および化学物質と区別することができる。それ故に、本明細書におけるバイオ生成物は、そのユニークな炭素同位体プロファイルに基づいて、流通下で追跡またはトラッキングすることができる。バイオ生成物は、各試料中の安定炭素同位体比(13C/12C)を比較することによって、石油系の有機化合物と区別することができる。所与のバイオ生成物における13C/12C比は、二酸化炭素が固定された時点の大気中の二酸化炭素における13C/12C比の結果である。それはまた、厳密な代謝経路も反映する。地域的変動も起こる。石油、C3植物(広葉植物)、C4植物(イネ科草本)、および海洋炭酸塩はすべて、13C/12Cおよび対応するδ13C値の点で有意差を示す。さらに、C3植物およびC4植物の脂質物質は、代謝経路の結果として、同じ植物の炭水化物成分から誘導される材料とは異なる分析結果を示す。測定精度内で、13Cは同位体分別効果に起因する大きな変動を示し、バイオ生成物に関して最も重要なのは光合成機構である。植物における炭素同位体比の違いの主因は、植物における光合成炭素代謝の経路の違い、特に一次カルボキシル化(すなわち、大気CO2の初期固定)時に起こる反応の違いと密接に関連している。草木の二大クラスは、C3(またはカルビン・ベンソン)光合成回路が組み込まれているものと、C4(またはハッチ・スラック)光合成回路が組み込まれているものである。C3植物では、一次CO2固定またはカルボキシル化反応にリブロース-1,5-二リン酸カルボキシラーゼ酵素が関与し、最初の安定生成物は3-炭素化合物である。広葉樹および針葉樹などのC3植物は、温帯気候帯において優勢である。C4植物では、もう1つの酵素であるホスホエノールピルビン酸カルボキシラーゼが関与するさらなるカルボキシル化反応が、一次カルボキシル化反応である。最初の安定炭素化合物は4-炭素酸であり、それが後に脱炭酸される。そのようにして放出されたCO2は、C3回路によって再び固定される。C4植物の例には、暖地型牧草、トウモロコシ、およびサトウキビがある。C4植物およびC3植物はいずれも、ある範囲の13C/12C同位体比を示すが、典型的な値は、C4植物については約-7~約-13パーミル、C3植物については約-19~約-27パーミルである(例えば、Stuiver et al. (1977) Radiocarbon 19:355を参照されたい)。石炭および石油は一般に後者の範囲に含まれる。13C測定尺度は、元はピーディー(Pee Dee)ベレムナイト(PDB)石灰石によって設定されたゼロ点によって定義されたものであり、ここでの値は、この材料からの千分の一偏位(parts per thousand deviations)で与えられる。δ13C値は、千分率(パーミル)で表されて‰と略記され、以下のように計算される。
δ13C(‰)=[(13C/12C)試料-(13C/12C)標準物質]/(13C/12C)標準物質×1000
ω-ヒドロキシル脂肪酸誘導体などの化合物は、多くの産業的用途において有益かつ望ましい分子である。本開示は、そのような化合物をインビボで組換え微生物を通じて産生させ、それによって、ある範囲にわたる有用な産物を生じさせる。そのような産物には、ω-ヒドロキシ脂肪酸誘導体が含まれる。ω-ヒドロキシ脂肪酸誘導体には、ω-ヒドロキシ脂肪酸;ω-ヒドロキシ-脂肪酸メチルエステル;ω-アミノ脂肪酸;ω-オキソ脂肪酸、ω-アミノ脂肪酸メチルエステル;ω-オキソ脂肪酸メチルエステル;α,ω-二酸;α,ω-ジエステル;およびα,ω-ジオールならびにそれらの組成物が非限定的に含まれる。本明細書では主に偶数鎖ω-ヒドロキシ-脂肪酸誘導体が記載されているが、7個、9個、11個、13個、15個、19個などの炭素を有するもののような奇数鎖ω-ヒドロキシ-脂肪酸誘導体も含まれる。
菌株を、ルリア-ベルターニ(LB)培地中で一晩かけて増殖させた。培養物を新鮮なLB培地中に1:10に希釈し、32℃で2~3時間(h)増殖させた上で、規定FA2培地(下記の表10を参照)中に再び1:10に希釈した。いくつかの実験では、培地に0.5mM δ-アミノレブリン酸および微量ビタミン溶液を加えた。スペクチノマイシン(100μg/ml)またはカナマイシン(50μg/ml)などの抗生物質を、菌株が各々の抗生物質耐性マーカーを有するプラスミドを含む場合には添加した。32℃での4~5時間の増殖後に、培養物を1mM IPTGによって誘導し、同じ温度でさらに16~18時間培養した。いくつかの実験では、誘導時にドデカン酸、ドデカノールまたはドデカン酸メチルエステルを最終濃度1g/Lで添加した。脂肪酸メチルエステルの誘導体を産生させることを目的とする培養物には、誘導時にメタノール(2%、v/v)を加えた。
ω-ヒドロキシ(hyroxy)脂肪酸誘導体を産生した培養物を採取し、ボルテクサー(vortexer)(DVX-2500多チューブボルテクサー、VWR)を2500rpmで30分間用いて、酢酸ブチルによって抽出した。抽出物を、Eppendorf遠心分離機(遠心分離機5424)にて、15000rpmで15分間、室温で遠心処理した。上清(100μL)を、インサート付きのGCバイアルにピペットで移し、100μLのN,O-ビス(トリメチルシリル)トリフルオロアセトアミド(BSTFA)および1%トリメチルクロロシラン(TMCS)を添加することによって誘導体化して、ボルテクサーを用いて30秒間混合した。誘導体化を行うかまたは行わなかった上清の両方をGC-MSに別々に注入して、化合物同定のためのクロマトグラムおよび質量スペクトルを作成した。GC-MSパラメーターは以下の通りとした。
分析用カラム:DB-1HT、15m×250μm×0.1μm、Agilentからカタログ番号J&W 122-1111Eとして入手可能
オーブン温度:最初は50℃として、5分間保持し、25℃/分で300℃まで上昇させて、5.24分間保持し、合計運用時間を24分間とする
カラム流:1.2mL/分
入り口温度:300℃
試料サイズ:1μL
分割比:20:1
ソフトウェア:ChemStation E.02.01.1177
MSパラメーター
トランスファーライン温度:300℃
MSソース(MS source):230℃
MS Quad:150℃
オートサンプラー
Combi PAL(CTC analytics)、LEAP Technologiesにより販売
ガスクロマトグラフ FIDを装着したAgilent 7890、または同等物。
データシステム ChemStationソフトウェアB.04.03、または同等物。
分析用カラム:DB-1(10m×0.18mm×0.2μM)、または同等物。
オートサンプラー:Combi PAL、CTC analytics(Leap Technologies)
初期温度:60℃で0.5分間保持、25℃/分で300℃に上昇させて、0.9分間保持し、合計運用時間を11分間とする
注入器温度:320℃
検出器:水素炎イオン化検出器(FID)
検出器温度:350℃
水素流量:40mL/分
気流量:450mL/分
補給流量:45mL/分(N2)
分割比:50:1
カラム流量:0.8mL/分
試料サイズ:1μL
本実施例では、cyp153A P450オキシゲナーゼオペロンを発現する組換え大腸菌株による、外因性に添加された脂肪酸のω-ヒドロキシ脂肪酸への変換を示す。本実験の目的は、cyp153A P450オキシゲナーゼオペロンの効率を調べることとした。cyp153A P450オキシゲナーゼは、これまでのところ、インビトロでしか使用されておらず(例えば、Honda-Malca et al. (2012) Chem. Commun. 48:5115-5117を参照)、本実験の目的は、インビボで外因性脂肪酸を与えた場合に、これらのオペロンがω-ヒドロキシ脂肪酸誘導体を産生しうるか否かを検証することとした。
本実施例では、改変されたcyp153A P450オキシゲナーゼオペロンを発現する組換え大腸菌株による、外因性に添加された脂肪酸のω-ヒドロキシ脂肪酸への変換を示す。同様に、本実験の目的は、この改変されたcyp153A P450オキシゲナーゼオペロンの、インビボでのω-ヒドロキシ脂肪酸誘導体の産生に関する能力および効率を調べることとした。
本実施例では、cyp153A P450オキシゲナーゼをレダクターゼドメインと融合させたハイブリッドタンパク質を発現する組換え大腸菌株による、外因性に添加された脂肪酸、脂肪酸メチルエステルまたは脂肪アルコールの、それぞれω-ヒドロキシ脂肪酸、ω-ヒドロキシ脂肪酸メチルエステルまたはα,ω-ジオールへの変換を示す。本実験の目的は、ω-ヒドロキシ脂肪酸誘導体の生産を大きく改良するためにcyp153A P450オキシゲナーゼをレダクターゼドメインと融合させたハイブリッド融合タンパク質を作り出すこととした。
本実施例では、CYP153A P450オキシゲナーゼをレダクターゼドメインと融合させたキメラ性ハイブリッドタンパク質を発現する組換え大腸菌株による、グルコースなどの再生可能な糖質原料からのω-ヒドロキシ脂肪酸、ω-ヒドロキシ脂肪酸メチルエステルおよびα,ω-ジオールの産生を示す。
本実施例では、cyp153A P450オキシゲナーゼをレダクターゼドメインおよびアルコールオキシダーゼおよびアルデヒドデヒドロゲナーゼと融合させたキメラ性ハイブリッドタンパク質を発現する組換え大腸菌株による、グルコースなどの再生可能な糖質原料からのα,ω-二酸の産生を実証する。
この実験の目的は、バチルス・メガテリウム由来のシトクロムP450 cyp102A1のF87Aバリアント(P450-BM3)を発現する遺伝的に改変された宿主菌株を用いることによって、インビボでω-ヒドロキシル化脂肪酸またはα,ω-二酸を産生させることが可能であるか否かを調べることであった。このcyp102A1バリアントを発現する組換え大腸菌株を用いることによって、少量の末端近傍ヒドロキシル化(ω-1、ω-2、ω-3、ω-4、ω-5)脂肪酸の産生が可能であることが見いだされた。しかし、同じ大腸菌株を使用することによって、ω-ヒドロキシ脂肪酸またはα,ω-二酸を産生させることは不可能であった。
本実施例の目的は、バチルス・リケニフォルミス由来のシトクロムP450-BM3型オキシゲナーゼcyp102A7を発現する大腸菌株を、末端近傍ヒドロキシル化脂肪酸の産生に関して検証することとした。データにより、シトクロムP450-BM3型オキシゲナーゼcyp102A7を発現する組換え大腸菌株による、ω-1、ω-2およびω-3-ヒドロキシ脂肪酸および脂肪アルコールの効率的な産生が実証された。このことは驚くべきであり、予想外であった。
アシル-CoAシンテターゼ/リガーゼ遺伝子またはトランスフェラーゼ遺伝子を、pCL派生ベクター中のcyp153A-RedRhF融合タンパク質をコードする遺伝子の下流に、この2つの遺伝子がオペロンを形成し、かつオペロンの転写がIPTG誘導性Ptrcプロモーターによって制御されるようにクローニングする。適したcyp153AおよびRedRhF融合パートナーの例は、表2Aおよび2Dに提示されている。適したアシル-CoAシンテターゼ/リガーゼまたはトランスフェラーゼの例は、表7に提示されている。その結果得られたプラスミドを、脂肪酸メチルエステルを産生する大腸菌株、例えば、KASH286に形質転換導入する(前記の実施例6および表14を参照)。この菌株を、実施例1および2に記載したように、それがグルコースからω-ヒドロキシル化脂肪酸誘導体を産生する能力に関して分析する。この菌株はα,ω-ジエステルを産生すると予想される。
cyp153A-RedRhF融合タンパク質をコードする遺伝子、アルコールオキシダーゼまたはデヒドロゲナーゼをコードする遺伝子、およびアミノトランスフェラーゼまたはトランスアミナーゼをコードする遺伝子を、この3種の遺伝子がオペロンを形成し、かつオペロンの転写がIPTG誘導性Ptrcプロモーターによって制御されるように、pCL派生ベクター中にクローニングする。適したcyp153AおよびRedRhF融合パートナーの例は、表2Aおよび2Dに提示されている。適したアルコールオキシダーゼまたはデヒドロゲナーゼの例は表3Aに提示されており、適したアミノトランスフェラーゼまたはトランスアミナーゼの例は表4に提示される。その結果得られたプラスミドを、脂肪酸を産生する大腸菌株、例えばstNH1293に形質転換導入する(前記の実施例6および表14を参照)。この菌株を、実施例1および2に記載したように、それがグルコースからω-ヒドロキシル化脂肪酸誘導体を産生する能力に関して分析する。この菌株はω-アミノ脂肪酸を産生すると予想される。または、その結果得られたプラスミドを、脂肪酸メチルエステルを産生する大腸菌株、例えばKASH286に形質転換導入する(前記の実施例6および表14を参照)。この菌株を、実施例1および2に記載したように、それがグルコースからω-ヒドロキシル化脂肪酸誘導体を産生する能力に関して分析する。この菌株はω-アミノ脂肪酸メチルエステルを産生すると予想される。
脂肪酸生合成は遍在的な性質を持つことから、本明細書において提供された実施例を、糖質の範囲を越える原料を天然に利用する他の生物においてさらに実行することができる。例えば、これらの経路を、光合成微生物において発現させて、CO2からのω-ヒドロキシル化脂肪酸誘導体の産生を可能にすることができると考えられる。具体的には、光バイオリアクターまたはオープンポンドなどにおいて適した条件下で増殖させた場合に培養物から単離しうると考えられるω-ヒドロキシル化脂肪酸誘導体を産生すると考えられるシアノバクテリウムの細胞質中で、それらを発現させることができると考えられる。または、これらの経路を、一酸化炭素を利用する生物クロストリジウム(Clostridia)属のものなどにおいて発現させうることも、当業者には明らかであろう。例えば、これらの操作された微生物を、適切な条件下で(例えば、製鋼所の煙道ガスからの、または天然ガスもしくはバイオマスなどの有機材料の再構成物に由来する合成ガスからのCOが供給されるリアクターにおいて)増殖させると、それらは培養物から回収しうるω-ヒドロキシル化脂肪酸誘導体を産生すると考えられる。
本実施例では、さまざまなCYP153A P450オキシゲナーゼドメインをさまざまなレダクターゼドメインと融合させたさらなるキメラ性ハイブリッドタンパク質を発現する組換え大腸菌株による、グルコースなどの再生可能な糖質原料からのω-ヒドロキシ脂肪酸の産生を示す。
ライブラリーのスクリーニング
本明細書に記載されたプロトコールはすべて、培養物を増殖させるための96ウェルプレート‐master block‐2mLシステム(Greiner Bio-One, Monroe, NCまたはCorning, Amsterdam, Netherlands)、および培養ブロスから脂肪酸種を抽出するためのプレート(Costar, Inc.)に依拠したものである。以下に提示するプロトコールは、発酵条件の例である。代替的なプロトコールを用いて脂肪酸種の産生を評価することもできる。
(96ウェルプレート中で増殖させたLB培養物からの)30μLのLB培養物を用いて290μLのPlim培地(表21、後述)に接種し、続いてそれを32℃で振盪しながらおよそ16時間インキュベートした。一晩播種物(overnight seed)の40μLを用いて、360μLのPlim培地に接種した。32℃で2時間増殖させた後に、培養物をIPTG(最終濃度1mM)によって誘導した(表21、後述)。特記されない限り、培養物を続いて32℃で振盪しながら20時間インキュベートし、その後にそれらを、以下に詳述する標準的な抽出プロトコールに従って抽出した。
(96ウェルプレート中で増殖させたLB培養物からの)40μLのLB培養物を用いて360μLのLB培地(表21、後述)に接種し、続いてそれを32℃で振盪しながらおよそ4時間インキュベートした。LB播種物(seed)の40μLを用いて、360μLのNlim培地に接種した。2時間32℃で増殖させた後に、培養物をIPTG(最終濃度1mM)によって誘導した(表21、後述)。特記されない限り、培養物を続いて35℃で振盪しながら20時間インキュベートし、その後にそれらを、以下に詳述する標準的な抽出プロトコールに従って抽出した。
抽出しようとする各ウェルに対して、80μLの1M HClを添加し、続いて400μLの酢酸ブチル(内部標準物質としての500mg/Lのペンタデカノールとともに)を添加した。続いて96ウェルプレートを、プレートシーラー(ALPS-300ヒーター;Abgene, ThermoScientific, Rockford, IL)を用いて熱溶着させて、MIXMATE混合機(Eppendorf, Hamburg, Germany)を用いて2000rpmで15分間振盪させた。振盪の後に、プレートを室温にて4500rpmで10分間遠心処理して(Allegra X-15R、ローターSX4750A、Beckman Coulter, Brea, CA)、水層と有機層を分離した。有機層の100μLを96ウェルプレートに移し(ポリプロピレン製、Corning, Amsterdam, Netherlands)、100μLのBSTFAで誘導体化した。その後、プレートを熱溶着させ、w-OH FFA法を用いるGC-FIDによって評価するまで-20℃で保存した。w-OH FFA法は以下の通りに実施した:1μLの試料を、スプリット1-20で、水素炎イオン化検出器(FID)を備えたAgilent 7890A GC Ultraデバイス(Agilent, Santa Clara, CA)の中の分析用カラム(DB-1、10m×180μm×膜厚0.2μM、JW 121-101Aより入手可能)に注入した。機器はC10~C18脂肪酸およびω-ヒドロキシ脂肪酸を検出および定量するように設定した。上記に詳述したプロトコールは標準的な条件を表しており、分析結果を最適化するために必要に応じて改変してもよい。
エラープローンライブラリーの調製には、当業者に公知の標準的な手法を用いた。1つの例では、ベクター中に制限エンドヌクレアーゼを用いてベクター骨格を調製し、DNAインサートにおける多様性の創出は、ミスマッチヌクレオチドの組み入れを促進する条件下でのDNA鋳型からのPCR増幅によって行った。1つのアプローチでは、ベクター骨格および多様性を有するDNAインサートのクローニングを、INFUSION Cloning System(Clontech Laboratories, Inc., Mountain View, CA)を製造元のプロトコールに従って用いて行った。
飽和ライブラリーの調製には、当業者に公知の標準的な手法を用いた。1つの例では、ベクター中に制限エンドヌクレアーゼを用いてベクター骨格を調製し、DNAインサートにおける多様性の創出は縮重プライマーを用いて行った。1つのアプローチでは、ベクター骨格および多様性を有するDNAインサートのクローニングを、INFUSION Cloning System(Clontech Laboratories, Inc., Mountain View, CA)を製造元のプロトコールに従って用いて行った。
ω-OH脂肪酸誘導体種の生産に関してさらに改良されたCYP153-レダクターゼハイブリッド融合ポリペプチドバリアント(例えば、CYP153A-RedRhFハイブリッドタンパク質バリアント)を得るために、有益であると同定された突然変異を組合せた。組合せライブラリーの調製には、当業者に公知の標準的な手法を用いた。1つの例では、ベクター中に制限エンドヌクレアーゼを用いてベクター骨格を調製し、DNAインサートにおける多様性の創出は、所望の突然変異を導入するためのプライマーを用いて行った。上記のように、1つのアプローチでは、ベクター骨格および多様性を有するDNAインサートのクローニングを、INFUSION Cloning System(Clontech Laboratories, Inc., Mountain View, CA)を製造元のプロトコールに従って用いて行った。組合せライブラリーは、トランスファーPCR(tPCR)プロトコール(Erijman et al. (2011) J. Structural Bio.175:171-177)を用いて作製することもできる。
エラープローンライブラリー、飽和ライブラリーまたは組合せライブラリーにおいてライブラリーの多様性を生じさせたら、それを上記の方法の1つを用いてスクリーニングした。2種類のヒットが同定された:(1)ω-ヒドロキシ脂肪酸の量の増加(ωOH FFA力価);および/または(2)脂肪酸からω-ヒドロキシ脂肪酸への変換の増加。各ヒット中のハイブリッドcyp153A-RedRhFタンパク質バリアントにおける突然変異を、当業者によって慣行的に使用されている標準的な手法を用いるシークエンシングによって同定した。後述の表23、24および25は、飽和ライブラリーにおいて有益であると同定された突然変異(ヒット)を列記している。
本実施例では、飽和ライブラリーまたはコンビナトリアル突然変異誘発ライブラリーのスクリーニングのために構築した菌株およびプラスミドについて説明する。
CYP153A-Red450RhF融合タンパク質のP450触媒ドメインの完全飽和ライブラリーを構築し、CYP153A(G307A)-Red450RhF(すなわち、鋳型ポリペプチド)を上回る改善を示すバリアントに関してスクリーニングした。G307A(位置307におけるグリシン残基がアラニンで置き換えられている)は、CYP153Aのω-ヒドロキシラーゼ活性を向上させる有益な突然変異である(Honda Malca et al. (2012) Chem. Commun. 48:5115を参照)。ヒットに関する選択基準は、(1)ω-ヒドロキシ脂肪酸の量(ωOHFFA力価)の増大;および/または(2)脂肪酸のω-ヒドロキシ脂肪酸への変換の増加とした。
ハイブリッドCYP153A-Red450RhF融合タンパク質のレダクターゼドメインの部分的飽和ライブラリー(10番目のアミノ酸毎に突然変異させた)を構築し、触媒P450 CYP153Aドメインの部位飽和突然変異誘発ライブラリーにおいて同定されたバリアントの1つであるCYP153A(V141I、A231T、G307A)-Red450RhF(配列番号:32)を上回る改善を示すバリアントに関してスクリーニングした。ヒットに関する選択基準は、(1)ω-ヒドロキシドデカン酸の量(ωOH FFA力価)の増大;および/または(2)ドデカン酸のω-ヒドロキシドデカン酸への変換の増加とした。飽和ライブラリーの調製には、当業者に公知の標準的な手法を用いた。ライブラリーに関しては、CYP153A(V141I、A231T、G307A)-Red450RhFを保有するpLC81をBZ128に形質転換導入した。ライブラリーを、上記の標準的なプロトコールの1つを用いてスクリーニングした。改良されたバリアントを、以下の表26に示している。特に、バリアントA796V(配列番号:42)およびP666Aは、酵素を有意に改善した。
FIOC:対照に比しての改良の倍数;対照は太字にしている
レダクターゼドメインの部分的飽和ライブラリーにおいて同定された有益な突然変異(実施例17)を、CYP153A(G307A)-Red450RhF融合タンパク質をさらに改良するための組合せライブラリーの基盤とした。選択基準は、(1)ω-ヒドロキシドデカン酸(ωOH FFA力価)の量の増大;および/または(2)ドデカン酸のω-ヒドロキシドデカン酸への変換の増加とした。
FIOC:対照に比しての改良の倍数;対照は太字にしている
飽和ライブラリーにおいて同定された有益な突然変異(実施例16および17)を、CYP153A(G307A)-Red450RhF融合タンパク質をさらに改良するための組合せライブラリーの基盤とした。選択基準は、(1)ω-ヒドロキシドデカン酸の量(ωOH FFA力価)の増大;および/または(2)fドデカン酸のω-ヒドロキシドデカン酸への変換の増加とした。組合せライブラリーをpLC81中に構築し、BZ128に形質転換導入した。組合せライブラリーの構築には、当業者に公知の標準的な手法を用いた。ライブラリーを、上記の標準的なプロトコールの1つを用いてスクリーニングした。最も改良されたバリアントの上位から2つを、表28に示している。
位置141における変化は基質特異性に影響を及ぼすことが認められた。このため、これらの2つの位置での部位飽和突然変異誘発を、CYP153A(G307A、A796V)-Red450RhFにおいて実施した。ヒットに関する選択基準は、(1)ω-ヒドロキシヘキサデセン酸の量の増加;および/または(2)ヘキサデセン酸のω-ヒドロキシヘキサデセン酸への変換の増加とした。
本実施例では、改良されたハイブリッドCYP153A-Red450RhF融合タンパク質を発現する組換え大腸菌株による、グルコースなどの再生可能な糖質原料からのω-ヒドロキシ脂肪酸の高い収量での産生を示す。
本実施例では、改良されたハイブリッドCYP153A-Red450RhF融合タンパク質ならびに異種アルコールオキシダーゼ(alkJ)およびアルデヒドデヒドロゲナーゼ(alkH)を発現する組換え大腸菌株による、グルコースなどの再生可能な糖質原料からのα,ω-二酸(dicacid)の高い収量での産生を示す。
Claims (15)
- CYP153A ω-ヒドロキシラーゼドメインおよびP450RhFレダクターゼドメインを含むCYP153A-レダクターゼハイブリッド融合ポリペプチドバリアントを発現するように操作された組換え微生物であって、
該ハイブリッド融合ポリペプチドバリアントが、該ドメインの一方または両方に1つまたは複数の突然変異を有し、かつ該ハイブリッド融合ポリペプチドバリアントが、自給型(self-sufficient)であり、かつ脂肪酸誘導体のω-OH脂肪酸誘導体への反応を触媒するω-ヒドロキシラーゼ酵素活性を有し、該脂肪酸誘導体が、脂肪酸、脂肪酸メチルエステルおよび/または脂肪アルコールを含み、該ω-OH脂肪酸誘導体が、ω-ヒドロキシ脂肪酸、ω-ヒドロキシ脂肪酸メチルエステルおよび/またはα,ω-ジオールを含み、該ハイブリッド融合ポリペプチドバリアントが、配列番号:6に示されるアミノ酸配列からなるポリペプチドと比較して、高いω-ヒドロキシラーゼ酵素活性を有し、かつ該ハイブリッド融合ポリペプチドバリアントが、配列番号:6に対して少なくとも91%の配列同一性を有し、かつ該ハイブリッド融合ポリペプチドバリアントが、配列番号:6の配列に対応させた位置に、配列番号:6のG307Aの突然変異、ならびに、配列番号:6のV141I、V141T、V141Q、V141G、V141M、R27L、R82D、R178N、A231T、N309R、N407A、V415R、T516V、P666A、P666DおよびA796Vからなる群より選択される1つまたは複数の突然変異を含む、前記組換え微生物。 - ハイブリッド融合ポリペプチドバリアントがアミノ酸位置141における突然変異を有する、請求項1記載の組換え微生物。
- 前記突然変異がV141IまたはV141Tである、請求項2記載の組換え微生物。
- ハイブリッド融合ポリペプチドバリアントの突然変異が、
(i) V141IおよびA231T;
(ii) R27L、R82D、V141M、R178N、およびN407A;
(iii) P666A;
(iv) A796V;
(v) A796V、P666D、およびT516V;
(vi) V141I、A231T、およびA796V;
(vii) R27L、R82D、V141M、R178N、N407A、およびA796V;または
(viii) V141T、A231T、およびA796V
である、請求項1記載の組換え微生物。 - ω-ヒドロキシ脂肪酸およびω-ヒドロキシ脂肪酸メチルエステルからなる群より選択されるω-ヒドロキシ脂肪酸誘導体を産生する、請求項1~4のいずれか一項記載の組換え微生物。
- EC 1.1.-.-のアルコールデヒドロゲナーゼおよび1.2.99のカルボン酸レダクターゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、請求項1~4のいずれか一項記載の組換え微生物。
- ω-ヒドロキシ脂肪酸誘導体がα,ω-ジオールである、請求項6記載の組換え微生物。
- 請求項1~7のいずれか一項記載の微生物を含む細胞培養物。
- ω-ヒドロキシ遊離脂肪酸;ω-ヒドロキシ脂肪酸メチルエステル;およびα,ω-ジオールからなる群より選択されるω-ヒドロキシ脂肪酸誘導体を産生する、請求項8記載の細胞培養物。
- (a)請求項1~7のいずれか一項記載の組換え微生物を用意する段階;
(b)炭素源を含有する再生可能な原料を発酵ブロスに添加する段階;ならびに
(c)該発酵ブロスからω-ヒドロキシ脂肪酸誘導体を単離する段階
を含む、ω-ヒドロキシ脂肪酸誘導体を生産する方法。 - 再生可能な原料が炭素系である、請求項10記載の方法。
- 炭素系の再生可能な原料が、トウモロコシ、サトウキビ、モロコシ、テンサイ、スイッチグラス、エンシレージ、わら、材木、パルプ、下水、生ごみ、セルロース系都市廃棄物、煙道ガス(flu-gas)、合成ガス、バイオマス加水分解物、および二酸化炭素からなる群より選択される、請求項11記載の方法。
- EC 3.1.2.-、3.1.1.5、または3.1.2.14のチオエステラーゼを含むポリペプチドをコードする核酸配列をさらに発現するように操作されている、請求項1~4のいずれか一項記載の組換え微生物。
- チオエステラーゼがFatAである、請求項13記載の組換え微生物。
- チオエステラーゼがFatA3である、請求項13記載の組換え微生物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021129428A JP7406529B2 (ja) | 2013-06-14 | 2021-08-06 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361835464P | 2013-06-14 | 2013-06-14 | |
| US61/835,464 | 2013-06-14 | ||
| PCT/US2014/042594 WO2014201474A1 (en) | 2013-06-14 | 2014-06-16 | Methods of producing omega-hydroxylated fatty acid derivatives |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019183765A Division JP7168539B2 (ja) | 2013-06-14 | 2019-10-04 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
| JP2021129428A Division JP7406529B2 (ja) | 2013-06-14 | 2021-08-06 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016521577A JP2016521577A (ja) | 2016-07-25 |
| JP2016521577A5 JP2016521577A5 (ja) | 2021-09-24 |
| JP7004500B2 true JP7004500B2 (ja) | 2022-02-04 |
Family
ID=51177165
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016519714A Active JP7004500B2 (ja) | 2013-06-14 | 2014-06-16 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
| JP2019183765A Active JP7168539B2 (ja) | 2013-06-14 | 2019-10-04 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
| JP2021129428A Active JP7406529B2 (ja) | 2013-06-14 | 2021-08-06 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019183765A Active JP7168539B2 (ja) | 2013-06-14 | 2019-10-04 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
| JP2021129428A Active JP7406529B2 (ja) | 2013-06-14 | 2021-08-06 | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US10711288B2 (ja) |
| EP (2) | EP2984490B1 (ja) |
| JP (3) | JP7004500B2 (ja) |
| KR (4) | KR20240049856A (ja) |
| CN (3) | CN105378486B (ja) |
| AU (2) | AU2014277874B2 (ja) |
| BR (2) | BR112015031233A2 (ja) |
| CA (1) | CA2915229A1 (ja) |
| MX (1) | MX2015016947A (ja) |
| MY (1) | MY197101A (ja) |
| SI (1) | SI2984490T1 (ja) |
| WO (1) | WO2014201474A1 (ja) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20240049856A (ko) | 2013-06-14 | 2024-04-17 | 게노마티카 인코포레이티드 | 오메가-수산화 지방산 유도체를 생성하는 방법들 |
| JP6680690B2 (ja) | 2014-04-10 | 2020-04-15 | アールイージー ライフ サイエンシズ リミテッド ライアビリティ カンパニー | 有機化合物の半合成経路 |
| WO2015176020A1 (en) | 2014-05-16 | 2015-11-19 | Provivi, Inc. | Synthesis of olefinic alcohols via enzymatic terminal hydroxylation |
| PL3087179T3 (pl) | 2014-06-16 | 2020-09-21 | Genomatica, Inc. | Polipeptydy fuzyjne związane z omega-hydroksylazą o ulepszonych właściwościach |
| JP6925258B2 (ja) | 2014-07-18 | 2021-08-25 | ジェノマティカ, インコーポレイテッド | 脂肪ジオールの微生物による産生 |
| WO2016168247A1 (en) * | 2015-04-15 | 2016-10-20 | William Marsh Rice University | Modified fatty acid biosynthesis with acp-dependent thiolases |
| JP7164112B2 (ja) * | 2015-10-27 | 2022-11-01 | コリア リサーチ インスティテュート オブ バイオサイエンス アンド バイオテクノロジー | 重鎖アミノカルボン酸の生産方法 |
| EP3378940B1 (en) * | 2015-10-27 | 2020-06-03 | Korea Research Institute of Bioscience and Biotechnology | Method for producing heavy chain diol |
| WO2017101987A1 (en) * | 2015-12-15 | 2017-06-22 | REG Life Sciences, LLC | Omega-hydroxylase-related fusion polypeptide variants with improved properties |
| CN107201356A (zh) * | 2016-03-17 | 2017-09-26 | 中国科学院青岛生物能源与过程研究所 | 支撑p450脂肪酸脱羧酶活性的还原伴侣蛋白组合及其应用 |
| KR102677413B1 (ko) | 2017-04-03 | 2024-06-24 | 게노마티카 인코포레이티드 | 중쇄 지방산 유도체의 생산을 위해 개선된 활성을 갖는 티오에스테라제 변이체 |
| KR102170282B1 (ko) * | 2017-12-15 | 2020-10-29 | 건국대학교 산학협력단 | α,ω-디올류 생산하는 재조합 미생물 및 α,ω-디올류의 생산방법 |
| TWI701040B (zh) * | 2018-03-19 | 2020-08-11 | 國立臺灣大學 | 蛋白質的用途及包含該蛋白質之全細胞催化系統及其應用 |
| CN111989399B (zh) | 2018-04-16 | 2024-07-12 | 韩国生命工学研究院 | 多不饱和脂肪酸的多羟基衍生物的制备方法 |
| EP3824071A4 (en) * | 2018-07-17 | 2022-04-20 | Conagen Inc. | BIOSYNTHETIC MANUFACTURE OF GAMMA LACTONES |
| KR102117828B1 (ko) | 2018-07-19 | 2020-06-02 | 서울대학교산학협력단 | 레귤론 변이를 통한 지방산 및 지방산 유도체 생산에서 불포화도 감소 |
| CA3109062A1 (en) | 2018-08-31 | 2020-03-05 | Genomatica, Inc. | Xylr mutant for improved xylose utilization or improved co-utilization of glucose and xylose |
| CN111218485B (zh) * | 2018-11-26 | 2023-01-24 | 中国科学院大连化学物理研究所 | 一种生产ω-1-羟基脂肪酸的方法 |
| CN111218430B (zh) * | 2018-11-26 | 2022-06-14 | 中国科学院大连化学物理研究所 | 一种nadh类似物依赖型的细胞色素p450还原酶及其应用 |
| CN111592996A (zh) * | 2019-12-09 | 2020-08-28 | 福建省水产研究所(福建水产病害防治中心) | 一种芽孢杆菌cqn-2高密度发酵培养方法 |
| CN117083382A (zh) * | 2021-03-29 | 2023-11-17 | 基因组股份公司 | 细菌中非天然单不饱和脂肪酸的产生 |
| WO2023178211A1 (en) | 2022-03-16 | 2023-09-21 | Genomatica, Inc. | Microorganisms and methods for production of fatty acid derivatives with reduced levels of byproducts |
| CN114480513A (zh) * | 2022-04-01 | 2022-05-13 | 北京林业大学 | 一种基因编辑酵母体外合成麝香酮的方法 |
| CN115537369B (zh) * | 2022-11-09 | 2024-03-01 | 云南农业大学 | 2-十二烯二酸促进蒙氏假单胞菌生长和定殖的应用 |
| CN116790529A (zh) * | 2023-05-24 | 2023-09-22 | 天津大学 | P450 bm3蛋白突变体及其应用 |
| CN117343970A (zh) * | 2023-10-24 | 2024-01-05 | 杭州佳嘉乐生物技术有限公司 | 一种提升植物油脂亲肤感的油脂发酵方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006051729A1 (ja) | 2004-11-10 | 2006-05-18 | Marine Biotechnology Institute Co., Ltd. | P450遺伝子の単離法 |
Family Cites Families (62)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1305083C (en) | 1987-02-18 | 1992-07-14 | Yoshiharu Kimura | Microorganism belonging to genus rhodococcus, and a process for producing alkene derivative and unsaturated fatty acid |
| US5482846A (en) | 1988-08-31 | 1996-01-09 | University Of Florida | Ethanol production in Gram-positive microbes |
| US5424202A (en) | 1988-08-31 | 1995-06-13 | The University Of Florida | Ethanol production by recombinant hosts |
| US5000000A (en) | 1988-08-31 | 1991-03-19 | University Of Florida | Ethanol production by Escherichia coli strains co-expressing Zymomonas PDC and ADH genes |
| US5028539A (en) | 1988-08-31 | 1991-07-02 | The University Of Florida | Ethanol production using engineered mutant E. coli |
| EP0528881A4 (en) | 1990-04-24 | 1993-05-26 | Stratagene | Methods for phenotype creation from multiple gene populations |
| US5602030A (en) | 1994-03-28 | 1997-02-11 | University Of Florida Research Foundation | Recombinant glucose uptake system |
| US6428767B1 (en) | 1995-05-12 | 2002-08-06 | E. I. Du Pont De Nemours And Company | Method for identifying the source of carbon in 1,3-propanediol |
| US5939250A (en) | 1995-12-07 | 1999-08-17 | Diversa Corporation | Production of enzymes having desired activities by mutagenesis |
| US5965408A (en) | 1996-07-09 | 1999-10-12 | Diversa Corporation | Method of DNA reassembly by interrupting synthesis |
| EP1021551A1 (en) | 1997-10-06 | 2000-07-26 | Centre National De La Recherche Scientifique | Plant fatty acid hydroxylase genes |
| CN102936536B (zh) | 2002-04-29 | 2014-01-29 | 陶氏环球技术有限责任公司 | 关于种子油工业应用的综合化学方法 |
| US20040242831A1 (en) | 2003-05-30 | 2004-12-02 | Dong Tian | Enzyme catalyzed polyesters and polyol polymers |
| JP2009079057A (ja) | 2005-04-22 | 2009-04-16 | Mitsubishi Chemicals Corp | ポリエステル及びその製造方法 |
| US20100242345A1 (en) | 2006-05-19 | 2010-09-30 | LS9, Inc | Production of fatty acids & derivatives thereof |
| MX2008014603A (es) | 2006-05-19 | 2009-02-06 | Ls9 Inc | Produccion de acidos grasos y derivados de los mismos. |
| US8110670B2 (en) * | 2006-05-19 | 2012-02-07 | Ls9, Inc. | Enhanced production of fatty acid derivatives |
| EP3281931A1 (en) | 2006-10-13 | 2018-02-14 | Elevance Renewable Sciences, Inc. | Methods of making organic compounds by metathesis |
| EP2076484B1 (en) | 2006-10-13 | 2020-01-08 | Elevance Renewable Sciences, Inc. | Synthesis of terminal alkenes from internal alkenes via olefin metathesis |
| US8110093B2 (en) | 2007-03-14 | 2012-02-07 | Ls9, Inc. | Process for producing low molecular weight hydrocarbons from renewable resources |
| CA2678915C (en) | 2007-03-28 | 2019-04-09 | Ls9, Inc. | Enhanced production of fatty acid derivatives |
| US20080293060A1 (en) | 2007-04-23 | 2008-11-27 | Ls9, Inc. | Methods and Compositions for Identification of Hydrocarbon Response, Transport and Biosynthesis Genes |
| BRPI0813359A2 (pt) | 2007-05-22 | 2014-10-14 | Ls9 Inc | Ácidos nucleicos isolados, vetor, células, métodos para produzir um hidrocarboneto, para produzir uma cetona alifática, para produzir um polipeptídeo purificado, para produzir um hidrocarboneto, para produzir biocombustíveis, hidrocarboneto, biocombustível, polipeptídeo isolado, ácido nucleico isolado, organismos geneticamente engenheirados, método para identificar uma enzima útil para a produção de hidrocarbonetos |
| JP5324129B2 (ja) | 2007-05-25 | 2013-10-23 | 神戸天然物化学株式会社 | Cyp153による芳香族化合物の製造方法 |
| US20100199548A1 (en) | 2007-07-06 | 2010-08-12 | Ls9, Inc. | Systems and methods for the production of fatty esters |
| FR2921362B1 (fr) | 2007-09-20 | 2012-09-21 | Arkema France | Procede de synthese d'acides gras omega-insatures |
| CA2692266C (en) | 2007-09-27 | 2019-04-16 | Ls9, Inc. | Reduction of the toxic effect of impurities from raw materials by extractive fermentation |
| TWI351779B (en) | 2007-12-03 | 2011-11-01 | Advance Smart Ind Ltd | Apparatus and method for correcting residual capac |
| US8183028B2 (en) | 2007-12-21 | 2012-05-22 | Ls9, Inc. | Methods and compositions for producing olefins |
| CN102027109B (zh) | 2008-05-16 | 2016-01-06 | Reg生命科学有限责任公司 | 产生碳氢化合物的方法和组合物 |
| WO2009142983A1 (en) | 2008-05-23 | 2009-11-26 | Alliant Techsystems Inc. | Broadband patch antenna and antenna system |
| US8273694B2 (en) | 2008-07-28 | 2012-09-25 | Jeffrey A Brown | Synthetic compositions obtained from algae |
| WO2010021711A1 (en) | 2008-08-18 | 2010-02-25 | Ls9, Inc. | Systems and methods for the production of mixed fatty esters |
| WO2010024319A1 (ja) | 2008-08-28 | 2010-03-04 | 三井化学株式会社 | オレフィンの製造方法 |
| EP2975122B1 (en) | 2008-10-07 | 2018-06-06 | REG Life Sciences, LLC | Method and compositions for producing fatty aldehydes |
| WO2010062480A2 (en) | 2008-10-28 | 2010-06-03 | Ls9, Inc. | Methods and compositions for producing fatty alcohols |
| US7989875B2 (en) | 2008-11-24 | 2011-08-02 | Nxp B.V. | BiCMOS integration of multiple-times-programmable non-volatile memories |
| CN102325864B (zh) | 2008-12-23 | 2016-01-27 | Reg生命科学有限责任公司 | 硫酯酶相关的方法和组合物 |
| US8071799B2 (en) | 2009-01-29 | 2011-12-06 | Energy & Environmental Research Center Foundation | Chain-selective synthesis of fuel components and chemical feedstocks |
| JP5353768B2 (ja) | 2009-03-06 | 2013-11-27 | 国立大学法人東京工業大学 | 樹脂組成物 |
| WO2010118409A1 (en) | 2009-04-10 | 2010-10-14 | Ls9, Inc. | Production of commercial biodiesel from genetically modified microorganisms |
| CN111808892A (zh) | 2009-04-27 | 2020-10-23 | 基因组股份公司 | 脂肪酸酯的产生 |
| BRPI1009980A2 (pt) | 2009-05-01 | 2015-08-25 | Univ California | Produtos de ésteres de ácidos graxos a partir de polímeros de biomassa |
| US20110162259A1 (en) | 2009-09-25 | 2011-07-07 | Ls9, Inc. | Production of fatty acid derivatives |
| US8809563B2 (en) | 2009-11-09 | 2014-08-19 | Exxonmobil Chemical Patents Inc. | Metathesis catalyst and process for use thereof |
| US8237003B2 (en) | 2009-11-09 | 2012-08-07 | Exxonmobil Chemical Patents Inc. | Metathesis catalyst and process for use thereof |
| US8361769B1 (en) * | 2009-11-16 | 2013-01-29 | U.S. Department Of Energy | Regioselective alkane hydroxylation with a mutant CYP153A6 enzyme |
| US20110124071A1 (en) | 2009-11-17 | 2011-05-26 | LS9, Inc | Methods and compositions for producing hydrocarbons |
| US8530221B2 (en) | 2010-01-14 | 2013-09-10 | Ls9, Inc. | Production of branched chain fatty acids and derivatives thereof in recombinant microbial cells |
| AR084377A1 (es) | 2010-04-08 | 2013-05-15 | Ls9 Inc | Metodos y composiciones relacionados con enzimas de alcohol graso biosintetico |
| JP5996527B2 (ja) | 2010-05-28 | 2016-09-21 | テラヴィア ホールディングス, インコーポレイテッド | 用途に応じた油を含む食品成分 |
| US8372610B2 (en) | 2010-09-15 | 2013-02-12 | Ls9, Inc. | Production of odd chain fatty acid derivatives in recombinant microbial cells |
| JP2012097163A (ja) * | 2010-10-29 | 2012-05-24 | Dainippon Printing Co Ltd | ポリエステル樹脂組成物 |
| WO2012071439A1 (en) * | 2010-11-22 | 2012-05-31 | The Regents Of The University Of California | Host cells and methods for producing diacid compounds |
| JP6071904B2 (ja) | 2011-02-02 | 2017-02-01 | テラヴィア ホールディングス, インコーポレイテッド | 組み換え油産生微生物から生成される用途に応じた油 |
| WO2013006733A2 (en) * | 2011-07-06 | 2013-01-10 | Verdezyne, Inc. | Biological methods for preparing a fatty dicarboxylic acid |
| DE102011110946A1 (de) | 2011-08-15 | 2016-01-21 | Evonik Degussa Gmbh | Biotechnologisches Syntheseverfahren von omegafunktionalisierten Carbonsäuren und Carbonsäure-Estern aus einfachen Kohlenstoffquellen |
| EP2639308A1 (de) | 2012-03-12 | 2013-09-18 | Evonik Industries AG | Enzymatische omega-Oxidation und -Aminierung von Fettsäuren |
| CA2888197C (en) | 2012-10-15 | 2023-03-07 | Genomatica, Inc. | Microorganisms and methods for production of specific length fatty alcohols and related compounds |
| FR3003577B1 (fr) | 2013-03-19 | 2016-05-06 | Ferropem | Inoculant a particules de surface |
| KR20240049856A (ko) | 2013-06-14 | 2024-04-17 | 게노마티카 인코포레이티드 | 오메가-수산화 지방산 유도체를 생성하는 방법들 |
| PL3087179T3 (pl) | 2014-06-16 | 2020-09-21 | Genomatica, Inc. | Polipeptydy fuzyjne związane z omega-hydroksylazą o ulepszonych właściwościach |
-
2014
- 2014-06-16 KR KR1020247011911A patent/KR20240049856A/ko active Search and Examination
- 2014-06-16 MY MYPI2015002915A patent/MY197101A/en unknown
- 2014-06-16 BR BR112015031233A patent/BR112015031233A2/pt not_active Application Discontinuation
- 2014-06-16 EP EP14738962.1A patent/EP2984490B1/en active Active
- 2014-06-16 BR BR122020002919-6A patent/BR122020002919B1/pt active IP Right Grant
- 2014-06-16 CN CN201480033702.8A patent/CN105378486B/zh active Active
- 2014-06-16 EP EP20168885.0A patent/EP3745133A1/en active Pending
- 2014-06-16 CN CN202410501856.0A patent/CN118374462A/zh active Pending
- 2014-06-16 KR KR1020217015238A patent/KR102387905B1/ko active IP Right Grant
- 2014-06-16 SI SI201431627T patent/SI2984490T1/sl unknown
- 2014-06-16 CN CN202410503321.7A patent/CN118460487A/zh active Pending
- 2014-06-16 JP JP2016519714A patent/JP7004500B2/ja active Active
- 2014-06-16 MX MX2015016947A patent/MX2015016947A/es active IP Right Grant
- 2014-06-16 KR KR1020227012365A patent/KR20220053681A/ko active Application Filing
- 2014-06-16 US US14/897,285 patent/US10711288B2/en active Active
- 2014-06-16 KR KR1020167000963A patent/KR102256678B1/ko active Application Filing
- 2014-06-16 CA CA2915229A patent/CA2915229A1/en active Pending
- 2014-06-16 WO PCT/US2014/042594 patent/WO2014201474A1/en active Application Filing
- 2014-06-16 AU AU2014277874A patent/AU2014277874B2/en active Active
-
2019
- 2019-10-04 JP JP2019183765A patent/JP7168539B2/ja active Active
-
2020
- 2020-06-29 US US16/915,454 patent/US11981952B2/en active Active
- 2020-12-23 AU AU2020294235A patent/AU2020294235B2/en active Active
-
2021
- 2021-08-06 JP JP2021129428A patent/JP7406529B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006051729A1 (ja) | 2004-11-10 | 2006-05-18 | Marine Biotechnology Institute Co., Ltd. | P450遺伝子の単離法 |
Non-Patent Citations (1)
| Title |
|---|
| Chem.Commun.,2012 ,Vol.48, p.5115-5117 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7406529B2 (ja) | ω-ヒドロキシル化脂肪酸誘導体を生産する方法 | |
| JP6738852B2 (ja) | 改良された脂肪酸誘導体産生方法 | |
| JP7094343B2 (ja) | 改良された特性を有するアシル-acpレダクターゼ | |
| JP7564800B2 (ja) | 特性が改良されたオメガ-ヒドロキシラーゼ関連融合ポリペプチド | |
| JP7458358B2 (ja) | 改良された特性を有するω-ヒドロキシラーゼ関連融合ポリペプチドバリアント |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160523 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170612 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170612 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180611 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180907 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181211 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20190606 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191004 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20191004 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20191016 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191114 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20191115 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20191118 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20200124 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20200129 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20200706 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210226 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210408 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20210421 |
|
| C13 | Notice of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: C13 Effective date: 20210617 |
|
| C28A | Non-patent document cited |
Free format text: JAPANESE INTERMEDIATE CODE: C2838 Effective date: 20210617 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210719 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20210805 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210806 |
|
| C23 | Notice of termination of proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C23 Effective date: 20211110 |
|
| C03 | Trial/appeal decision taken |
Free format text: JAPANESE INTERMEDIATE CODE: C03 Effective date: 20211209 |
|
| C30A | Notification sent |
Free format text: JAPANESE INTERMEDIATE CODE: C3012 Effective date: 20211209 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220104 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7004500 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |