JP6895380B2 - 治療免疫細胞の有効性を改良するための方法 - Google Patents
治療免疫細胞の有効性を改良するための方法 Download PDFInfo
- Publication number
- JP6895380B2 JP6895380B2 JP2017541243A JP2017541243A JP6895380B2 JP 6895380 B2 JP6895380 B2 JP 6895380B2 JP 2017541243 A JP2017541243 A JP 2017541243A JP 2017541243 A JP2017541243 A JP 2017541243A JP 6895380 B2 JP6895380 B2 JP 6895380B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- sequence
- seq
- antibody
- receptor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 210000002865 immune cell Anatomy 0.000 title claims description 70
- 238000000034 method Methods 0.000 title claims description 36
- 230000001225 therapeutic effect Effects 0.000 title description 10
- 210000004027 cell Anatomy 0.000 claims description 92
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 73
- 102000005962 receptors Human genes 0.000 claims description 59
- 108020003175 receptors Proteins 0.000 claims description 59
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 50
- 206010028980 Neoplasm Diseases 0.000 claims description 47
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 claims description 42
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 claims description 42
- 108091008874 T cell receptors Proteins 0.000 claims description 38
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims description 38
- 239000002773 nucleotide Substances 0.000 claims description 37
- 125000003729 nucleotide group Chemical group 0.000 claims description 37
- 201000011510 cancer Diseases 0.000 claims description 36
- 108020004707 nucleic acids Proteins 0.000 claims description 36
- 102000039446 nucleic acids Human genes 0.000 claims description 36
- 150000007523 nucleic acids Chemical class 0.000 claims description 36
- 108090000623 proteins and genes Proteins 0.000 claims description 33
- 239000012634 fragment Substances 0.000 claims description 21
- 210000000822 natural killer cell Anatomy 0.000 claims description 21
- 150000001413 amino acids Chemical class 0.000 claims description 20
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 claims description 18
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 claims description 18
- 102100022682 NKG2-A/NKG2-B type II integral membrane protein Human genes 0.000 claims description 15
- 101150069255 KLRC1 gene Proteins 0.000 claims description 14
- 101100404845 Macaca mulatta NKG2A gene Proteins 0.000 claims description 14
- 102000004169 proteins and genes Human genes 0.000 claims description 14
- 101000945371 Homo sapiens Killer cell immunoglobulin-like receptor 2DL2 Proteins 0.000 claims description 13
- 108010043610 KIR Receptors Proteins 0.000 claims description 13
- 102000002698 KIR Receptors Human genes 0.000 claims description 13
- 102100033599 Killer cell immunoglobulin-like receptor 2DL2 Human genes 0.000 claims description 13
- 238000002347 injection Methods 0.000 claims description 12
- 239000007924 injection Substances 0.000 claims description 12
- 101001027081 Homo sapiens Killer cell immunoglobulin-like receptor 2DL1 Proteins 0.000 claims description 11
- 230000000735 allogeneic effect Effects 0.000 claims description 11
- 210000002472 endoplasmic reticulum Anatomy 0.000 claims description 11
- 230000028993 immune response Effects 0.000 claims description 11
- -1 CD3ζ Proteins 0.000 claims description 10
- 102100037363 Killer cell immunoglobulin-like receptor 2DL1 Human genes 0.000 claims description 10
- 241000607479 Yersinia pestis Species 0.000 claims description 9
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 8
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 8
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 8
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 8
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 claims description 7
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 claims description 7
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 claims description 7
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 claims description 7
- 101000917824 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-b Proteins 0.000 claims description 7
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 claims description 7
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 claims description 7
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 claims description 7
- 102100040678 Programmed cell death protein 1 Human genes 0.000 claims description 7
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 claims description 7
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 6
- 238000000338 in vitro Methods 0.000 claims description 6
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 claims description 5
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 claims description 5
- 101150046249 Havcr2 gene Proteins 0.000 claims description 4
- 102100022132 High affinity immunoglobulin epsilon receptor subunit gamma Human genes 0.000 claims description 4
- 108091010847 High affinity immunoglobulin epsilon receptor subunit gamma Proteins 0.000 claims description 4
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims description 4
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims description 4
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 claims description 4
- 230000004807 localization Effects 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 claims description 3
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 claims description 3
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 claims description 3
- 108060003951 Immunoglobulin Proteins 0.000 claims description 3
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 claims description 3
- 210000004443 dendritic cell Anatomy 0.000 claims description 3
- 102000018358 immunoglobulin Human genes 0.000 claims description 3
- 210000002540 macrophage Anatomy 0.000 claims description 3
- 239000011159 matrix material Substances 0.000 claims description 3
- 210000001616 monocyte Anatomy 0.000 claims description 3
- 238000002054 transplantation Methods 0.000 claims description 3
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 claims description 2
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 claims description 2
- 238000001361 intraarterial administration Methods 0.000 claims description 2
- 238000007913 intrathecal administration Methods 0.000 claims description 2
- 230000014759 maintenance of location Effects 0.000 claims description 2
- 230000010412 perfusion Effects 0.000 claims description 2
- 238000001356 surgical procedure Methods 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 13
- 239000008194 pharmaceutical composition Substances 0.000 claims 3
- 102100022089 Acyl-[acyl-carrier-protein] hydrolase Human genes 0.000 claims 1
- 101000964894 Bos taurus 14-3-3 protein zeta/delta Proteins 0.000 claims 1
- 101000824278 Homo sapiens Acyl-[acyl-carrier-protein] hydrolase Proteins 0.000 claims 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 claims 1
- 210000002288 golgi apparatus Anatomy 0.000 claims 1
- 230000002489 hematologic effect Effects 0.000 claims 1
- 238000010253 intravenous injection Methods 0.000 claims 1
- 239000000427 antigen Substances 0.000 description 32
- 108091007433 antigens Proteins 0.000 description 32
- 102000036639 antigens Human genes 0.000 description 32
- 230000003308 immunostimulating effect Effects 0.000 description 28
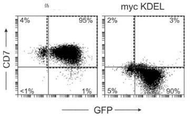
- 239000005090 green fluorescent protein Substances 0.000 description 24
- 230000003828 downregulation Effects 0.000 description 23
- 108090000765 processed proteins & peptides Proteins 0.000 description 22
- 239000003446 ligand Substances 0.000 description 19
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 18
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 18
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 18
- 101000914496 Homo sapiens T-cell antigen CD7 Proteins 0.000 description 16
- 108010076504 Protein Sorting Signals Proteins 0.000 description 16
- 102100027208 T-cell antigen CD7 Human genes 0.000 description 16
- 210000004369 blood Anatomy 0.000 description 14
- 239000008280 blood Substances 0.000 description 14
- 210000004881 tumor cell Anatomy 0.000 description 14
- 238000010361 transduction Methods 0.000 description 13
- 230000026683 transduction Effects 0.000 description 13
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 10
- 210000000170 cell membrane Anatomy 0.000 description 10
- 208000032839 leukemia Diseases 0.000 description 10
- 102000004196 processed proteins & peptides Human genes 0.000 description 10
- 230000011664 signaling Effects 0.000 description 10
- 238000010186 staining Methods 0.000 description 9
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 8
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 8
- 108010004729 Phycoerythrin Proteins 0.000 description 8
- 229920001184 polypeptide Polymers 0.000 description 8
- 230000035755 proliferation Effects 0.000 description 8
- 241000699666 Mus <mouse, genus> Species 0.000 description 7
- 238000010367 cloning Methods 0.000 description 7
- 230000001404 mediated effect Effects 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 210000005259 peripheral blood Anatomy 0.000 description 7
- 239000011886 peripheral blood Substances 0.000 description 7
- 230000001177 retroviral effect Effects 0.000 description 7
- 208000009329 Graft vs Host Disease Diseases 0.000 description 6
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 6
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 6
- 102000015736 beta 2-Microglobulin Human genes 0.000 description 6
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 208000024908 graft versus host disease Diseases 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 230000008685 targeting Effects 0.000 description 6
- 108020004705 Codon Proteins 0.000 description 5
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 5
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 description 5
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 description 5
- 108010004469 allophycocyanin Proteins 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 238000001802 infusion Methods 0.000 description 5
- 108091008042 inhibitory receptors Proteins 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 238000005457 optimization Methods 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 4
- 102100024217 CAMPATH-1 antigen Human genes 0.000 description 4
- 108010065524 CD52 Antigen Proteins 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 4
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 4
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 4
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 4
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 4
- 102000014150 Interferons Human genes 0.000 description 4
- 108010050904 Interferons Proteins 0.000 description 4
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 4
- 102000015696 Interleukins Human genes 0.000 description 4
- 108010063738 Interleukins Proteins 0.000 description 4
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 4
- 230000006044 T cell activation Effects 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- 102000009618 Transforming Growth Factors Human genes 0.000 description 4
- 108010009583 Transforming Growth Factors Proteins 0.000 description 4
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 4
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 238000002659 cell therapy Methods 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 210000004408 hybridoma Anatomy 0.000 description 4
- 229940079322 interferon Drugs 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 102000003390 tumor necrosis factor Human genes 0.000 description 4
- 108010031480 Artificial Receptors Proteins 0.000 description 3
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 3
- 229940045513 CTLA4 antagonist Drugs 0.000 description 3
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 3
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 3
- 101000937544 Homo sapiens Beta-2-microglobulin Proteins 0.000 description 3
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 description 3
- 101001109508 Homo sapiens NKG2-A/NKG2-B type II integral membrane protein Proteins 0.000 description 3
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 description 3
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 3
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 description 3
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 3
- 230000003213 activating effect Effects 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 230000001093 anti-cancer Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 239000011324 bead Substances 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 102000047279 human B2M Human genes 0.000 description 3
- 230000003960 inflammatory cascade Effects 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 108091005475 signaling receptors Proteins 0.000 description 3
- 102000035025 signaling receptors Human genes 0.000 description 3
- 230000004936 stimulating effect Effects 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 230000002459 sustained effect Effects 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 2
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 2
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 2
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 2
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 2
- 101710178046 Chorismate synthase 1 Proteins 0.000 description 2
- 108020004635 Complementary DNA Proteins 0.000 description 2
- 101710152695 Cysteine synthase 1 Proteins 0.000 description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 2
- 102000001301 EGF receptor Human genes 0.000 description 2
- 108060006698 EGF receptor Proteins 0.000 description 2
- 108010009202 Growth Factor Receptors Proteins 0.000 description 2
- 102000009465 Growth Factor Receptors Human genes 0.000 description 2
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 2
- 208000017604 Hodgkin disease Diseases 0.000 description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 2
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 2
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 2
- 101100334515 Homo sapiens FCGR3A gene Proteins 0.000 description 2
- 101100334524 Homo sapiens FCGR3B gene Proteins 0.000 description 2
- 101000998120 Homo sapiens Interleukin-3 receptor subunit alpha Proteins 0.000 description 2
- 101000945333 Homo sapiens Killer cell immunoglobulin-like receptor 2DL3 Proteins 0.000 description 2
- 101001023379 Homo sapiens Lysosome-associated membrane glycoprotein 1 Proteins 0.000 description 2
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 2
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 2
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 2
- 102100026720 Interferon beta Human genes 0.000 description 2
- 108010047761 Interferon-alpha Proteins 0.000 description 2
- 102000006992 Interferon-alpha Human genes 0.000 description 2
- 108090000467 Interferon-beta Proteins 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102100033493 Interleukin-3 receptor subunit alpha Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 108010002586 Interleukin-7 Proteins 0.000 description 2
- 102100033634 Killer cell immunoglobulin-like receptor 2DL3 Human genes 0.000 description 2
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 2
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 102100035133 Lysosome-associated membrane glycoprotein 1 Human genes 0.000 description 2
- 208000034578 Multiple myelomas Diseases 0.000 description 2
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 2
- 108010053210 Phycocyanin Proteins 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 102100032831 Protein ITPRID2 Human genes 0.000 description 2
- 108091028664 Ribonucleotide Proteins 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 2
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 239000005547 deoxyribonucleotide Substances 0.000 description 2
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 230000008472 epithelial growth Effects 0.000 description 2
- 102000006815 folate receptor Human genes 0.000 description 2
- 108020005243 folate receptor Proteins 0.000 description 2
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 description 2
- 102000057310 human KLRC1 Human genes 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000001506 immunosuppresive effect Effects 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 description 2
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 2
- 230000002688 persistence Effects 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 239000002336 ribonucleotide Substances 0.000 description 2
- 125000002652 ribonucleotide group Chemical group 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 108091005703 transmembrane proteins Proteins 0.000 description 2
- 102000035160 transmembrane proteins Human genes 0.000 description 2
- 108010015889 zeta receptor Proteins 0.000 description 2
- JBFQOLHAGBKPTP-NZATWWQASA-N (2s)-2-[[(2s)-4-carboxy-2-[[3-carboxy-2-[[(2s)-2,6-diaminohexanoyl]amino]propanoyl]amino]butanoyl]amino]-4-methylpentanoic acid Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)C(CC(O)=O)NC(=O)[C@@H](N)CCCCN JBFQOLHAGBKPTP-NZATWWQASA-N 0.000 description 1
- QNRATNLHPGXHMA-XZHTYLCXSA-N (r)-(6-ethoxyquinolin-4-yl)-[(2s,4s,5r)-5-ethyl-1-azabicyclo[2.2.2]octan-2-yl]methanol;hydrochloride Chemical compound Cl.C([C@H]([C@H](C1)CC)C2)CN1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OCC)C=C21 QNRATNLHPGXHMA-XZHTYLCXSA-N 0.000 description 1
- YKBGVTZYEHREMT-KVQBGUIXSA-N 2'-deoxyguanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 YKBGVTZYEHREMT-KVQBGUIXSA-N 0.000 description 1
- CKTSBUTUHBMZGZ-SHYZEUOFSA-N 2'‐deoxycytidine Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 CKTSBUTUHBMZGZ-SHYZEUOFSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- UZOVYGYOLBIAJR-UHFFFAOYSA-N 4-isocyanato-4'-methyldiphenylmethane Chemical compound C1=CC(C)=CC=C1CC1=CC=C(N=C=O)C=C1 UZOVYGYOLBIAJR-UHFFFAOYSA-N 0.000 description 1
- 206010000830 Acute leukaemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 102000003966 Alpha-1-microglobulin Human genes 0.000 description 1
- 101800001761 Alpha-1-microglobulin Proteins 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 108010074708 B7-H1 Antigen Proteins 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 206010061692 Benign muscle neoplasm Diseases 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 238000011357 CAR T-cell therapy Methods 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 101100228196 Caenorhabditis elegans gly-4 gene Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 1
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- CKTSBUTUHBMZGZ-UHFFFAOYSA-N Deoxycytidine Natural products O=C1N=C(N)C=CN1C1OC(CO)C(O)C1 CKTSBUTUHBMZGZ-UHFFFAOYSA-N 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 239000012571 GlutaMAX medium Substances 0.000 description 1
- 206010066476 Haematological malignancy Diseases 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 102100029360 Hematopoietic cell signal transducer Human genes 0.000 description 1
- 102100034459 Hepatitis A virus cellular receptor 1 Human genes 0.000 description 1
- 208000032672 Histiocytosis haematophagic Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 101000834898 Homo sapiens Alpha-synuclein Proteins 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000990188 Homo sapiens Hematopoietic cell signal transducer Proteins 0.000 description 1
- 101001068136 Homo sapiens Hepatitis A virus cellular receptor 1 Proteins 0.000 description 1
- 101000971513 Homo sapiens Natural killer cells antigen CD94 Proteins 0.000 description 1
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 1
- 101000831286 Homo sapiens Protein timeless homolog Proteins 0.000 description 1
- 101000752245 Homo sapiens Rho guanine nucleotide exchange factor 5 Proteins 0.000 description 1
- 101000652359 Homo sapiens Spermatogenesis-associated protein 2 Proteins 0.000 description 1
- 101000809875 Homo sapiens TYRO protein tyrosine kinase-binding protein Proteins 0.000 description 1
- 101000837849 Homo sapiens Trans-Golgi network integral membrane protein 2 Proteins 0.000 description 1
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102100021593 Interleukin-7 receptor subunit alpha Human genes 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- 125000002066 L-histidyl group Chemical group [H]N1C([H])=NC(C([H])([H])[C@](C(=O)[*])([H])N([H])[H])=C1[H] 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 208000004987 Macrophage activation syndrome Diseases 0.000 description 1
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 101100341510 Mus musculus Itgal gene Proteins 0.000 description 1
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 201000004458 Myoma Diseases 0.000 description 1
- 102100021462 Natural killer cells antigen CD94 Human genes 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 1
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 1
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 102000002727 Protein Tyrosine Phosphatase Human genes 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 235000001537 Ribes X gardonianum Nutrition 0.000 description 1
- 235000001535 Ribes X utile Nutrition 0.000 description 1
- 235000016919 Ribes petraeum Nutrition 0.000 description 1
- 244000281247 Ribes rubrum Species 0.000 description 1
- 235000002355 Ribes spicatum Nutrition 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 208000000389 T-cell leukemia Diseases 0.000 description 1
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 description 1
- 206010042971 T-cell lymphoma Diseases 0.000 description 1
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 102100038717 TYRO protein tyrosine kinase-binding protein Human genes 0.000 description 1
- 102100028621 Trans-Golgi network integral membrane protein 2 Human genes 0.000 description 1
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 1
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 1
- 102100033019 Tyrosine-protein phosphatase non-receptor type 11 Human genes 0.000 description 1
- 101710116241 Tyrosine-protein phosphatase non-receptor type 11 Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 238000010317 ablation therapy Methods 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 108010001122 alpha(2)-microglobulin Proteins 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 238000010241 blood sampling Methods 0.000 description 1
- 230000005880 cancer cell killing Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 208000024207 chronic leukemia Diseases 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 238000003501 co-culture Methods 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000001010 compromised effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 206010052015 cytokine release syndrome Diseases 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000028023 exocytosis Effects 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 238000010362 genome editing Methods 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 229940029575 guanosine Drugs 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 102000047041 human KIR2DL1 Human genes 0.000 description 1
- 230000005934 immune activation Effects 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940124589 immunosuppressive drug Drugs 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 108010089256 lysyl-aspartyl-glutamyl-leucine Proteins 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 230000003990 molecular pathway Effects 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 210000004967 non-hematopoietic stem cell Anatomy 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 108020000494 protein-tyrosine phosphatase Proteins 0.000 description 1
- 210000003289 regulatory T cell Anatomy 0.000 description 1
- 208000015347 renal cell adenocarcinoma Diseases 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000011282 treatment Methods 0.000 description 1
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 1
- 229940045145 uridine Drugs 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/15—Cells of the myeloid line, e.g. granulocytes, basophils, eosinophils, neutrophils, leucocytes, monocytes, macrophages or mast cells; Myeloid precursor cells; Antigen-presenting cells, e.g. dendritic cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4613—Natural-killer cells [NK or NK-T]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
- A61K39/464412—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464429—Molecules with a "CD" designation not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/289—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD45
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0646—Natural killers cells [NK], NKT cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the cancer treated
- A61K2239/48—Blood cells, e.g. leukemia or lymphoma
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/04—Fusion polypeptide containing a localisation/targetting motif containing an ER retention signal such as a C-terminal HDEL motif
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/05—Fusion polypeptide containing a localisation/targetting motif containing a GOLGI retention signal
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/06—Fusion polypeptide containing a localisation/targetting motif containing a lysosomal/endosomal localisation signal
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
Description
免疫細胞は、強力かつ特異的な「生きた薬剤」であり得る。免疫細胞は、正常な組織を温存しながら腫瘍細胞を標的化する潜在性を有し、いくつかの臨床的観察は、それらが主要な抗癌活性を有し得ることを示している。したがって、同種造血幹細胞移植(HSCT)を受ける患者において、T細胞媒介移植片対宿主病(GvHD)(Weiden,PL et al.,N.Engl.J.Med.1979;300(19):1068−1073;Appelbaum,FR Nature,2001;411(6835):385−389;Porter,DL et al.,N.Engl.J.Med.1994;330(2):100−106;Kolb,HJ et al.Blood.1995;86(5):2041−2050;Slavin,S.et al.,Blood.1996;87(6):2195−2204)、及びドナーナチュラルキラー(NK)細胞アロ反応性(Ruggeri L,et al.Science.2002;295(5562):2097−2100;Giebel S,et al.Blood.2003;102(3):814−819;Cooley S,et al.Blood.2010;116(14):2411−2419)は、白血病再発と逆関係にある。HSCTの文脈に加えて、抑制性シグナルからT細胞を放出する(Sharma P,et al.,Nat Rev Cancer. 2011;11(11):805−812.;Pardoll DM.,Nat Rev Cancer.2012;12(4):252−264)、またはそれらを腫瘍細胞に架橋する(Topp MS,et al.J.Clin.Oncol.2011;29(18):2493−2498)抗体の投与は、固形腫瘍または白血病のいずれかを有する患者において主要な臨床的応答を生成した。最後に、遺伝子改変自家Tリンパ球の注入は、治療抵抗性白血病及びリンパ腫を有する患者において完全かつ持続的な寛解を誘導した(Maude SL,et al.N Engl J Med.2014;371(16):1507−1517)。
方法
Claims (15)
- キメラ抗原受容体(CAR)をコードするヌクレオチド配列を含む第1の核酸と、局在化ドメインに連結した抗体をコードするヌクレオチド配列を含む第2の核酸と、を含む、操作された免疫細胞であって、
前記抗体が:
CD3ε、TCRα、TCRβ、TCRγ、TCRδ、CD3δ、CD3γ、及びCD3ζからなる群から選択される、CD3/T細胞受容体(TCR)複合体中の因子;または
プログラム細胞死タンパク質1(PD−1)、細胞傷害性Tリンパ球関連タンパク質4(CTLA−4)、T細胞免疫グロブリン及びムチンドメイン含有3(Tim3)、キラー免疫グロブリン様受容体(KIR)2DL1、KIR2DL2/DL3、並びにNKG2Aから成る群から選択される、免疫応答を下方制御する前記受容体;
に結合し、前記局在化ドメインに連結した抗体が、前記因子または前記受容体の細胞表面発現を下方制御する、操作された免疫細胞。 - 前記操作された免疫細胞が、操作されたT細胞、操作されたナチュラルキラー(NK)細胞、操作されたNK/T細胞、操作された単球、操作されたマクロファージ、または操作された樹状細胞である、請求項1に記載の操作された免疫細胞。
- 前記CARが、抗CD19−4−1BB−CD3ζCARである、請求項1または2に記載の操作された免疫細胞。
- 前記抗体が、単鎖可変断片(scFv)である、請求項1〜3のいずれか一項に記載の操作された免疫細胞。
- 前記抗体またはscFVが、CD3εに結合し、かつ:
配列番号12のアミノ酸配列とCDR1〜3内の配列が同一であり、配列番号12のアミノ酸配列と少なくとも85%の配列同一性を有する可変重鎖(VH);及び
配列番号13のアミノ酸配列とCDR1〜3内の配列が同一であり、配列番号13のアミノ酸配列と少なくとも85%の配列同一性を有する可変軽鎖(VL);
を含む、請求項1または4に記載の操作された免疫細胞。 - 前記抗体またはscFVが、NKG2Aに結合し、かつ:
配列番号32のアミノ酸配列とCDR1〜3内の配列が同一であり、配列番号32のアミノ酸配列と少なくとも85%の配列同一性を有する可変重鎖(VH);及び
配列番号33のアミノ酸配列とCDR1〜3内の配列が同一であり、配列番号33のアミノ酸配列と少なくとも85%の配列同一性を有する可変軽鎖(VL);
を含む、請求項1または4に記載の操作された免疫細胞。 - 前記抗体またはscFVが、KIR2DL1及びKIR2DL2/DL3に結合し、かつ:
配列番号36のアミノ酸配列とCDR1〜3内の配列が同一であり、配列番号36のアミノ酸配列と少なくとも85%の配列同一性を有する可変重鎖(VH);及び
配列番号37のアミノ酸配列とCDR1〜3内の配列が同一であり、配列番号37のアミノ酸配列と少なくとも85%の配列同一性を有する可変軽鎖(VL);
を含む、請求項1または4に記載の操作された免疫細胞。 - 前記局在化ドメインが、小胞体(ER)またはゴルジ保持配列;プロテオソーム局在化配列;あるいはCD8α、CD8β、4−1BB、CD28、CD34、CD4、FcεRIγ、CD16、OX40、CD3ζ、CD3ε、CD3γ、CD3δ、TCRα、CD32、CD64、VEGFR2、FAS、またはFGFR2Bに由来する膜貫通ドメイン配列を含む、請求項1〜7のいずれか一項に記載の操作された免疫細胞。
- 前記ERまたはゴルジ保持配列が、アミノ酸配列KDEL(配列番号4)、KKXX(配列番号9)、KXD/E(配列番号10)、またはYQRL(配列番号11)を含み、ここで、Xは、任意のアミノ酸であるか、あるいは前記プロテオソーム局在化配列が、PESTモチーフを含む、請求項8に記載の操作された免疫細胞。
- 対象における癌を治療するための、請求項1〜9のいずれか一項に記載の操作された免疫細胞を含む医薬組成物。
- 静脈内注入、動脈内注入、腫瘍への直接注射及び/または手術後の腫瘍母地の灌流、人工スキャフォールドにおける腫瘍部位での移植、髄腔内投与、または眼内投与によって前記対象に投与するのに適している、請求項10に記載の医薬組成物。
- 前記癌が、固形腫瘍または血液学的悪性腫瘍である、請求項10または11に記載の医薬組成物。
- 請求項1〜9のいずれか一項に記載の操作された免疫細胞を生成するためのインビトロの方法であって、
免疫細胞に、キメラ抗原受容体をコードするヌクレオチド配列を含む核酸と、局在化ドメインに連結した抗体をコードするヌクレオチド配列を含む核酸とを導入する工程であって、それによって操作された免疫細胞を生成する、工程、を含み、
前記抗体が:
CD3ε、TCRα、TCRβ、TCRγ、TCRδ、CD3δ、CD3γ、及びCD3ζからなる群から選択される、CD3/T細胞受容体(TCR)複合体中の因子;または
プログラム細胞死タンパク質1(PD−1)、細胞傷害性Tリンパ球関連タンパク質4(CTLA−4)、T細胞免疫グロブリン及びムチンドメイン含有3(Tim3)、キラー免疫グロブリン様受容体(KIR)2DL1、KIR2DL2/DL3、並びにNKG2Aから成る群から選択される、免疫応答を下方制御する前記受容体;
に結合し、前記局在化ドメインに連結した抗体が、前記因子または前記受容体の細胞表面発現を下方制御する、方法。 - 前記操作された免疫細胞が、同種細胞から生成される、請求項13に記載の方法。
- 前記操作された免疫細胞が、自家細胞から生成される、請求項13に記載の方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021095192A JP7320560B2 (ja) | 2015-02-06 | 2021-06-07 | 治療免疫細胞の有効性を改良するための方法 |
| JP2023119583A JP2023153141A (ja) | 2015-02-06 | 2023-07-24 | 治療免疫細胞の有効性を改良するための方法 |
| JP2023119584A JP2023153142A (ja) | 2015-02-06 | 2023-07-24 | 治療免疫細胞の有効性を改良するための方法 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562112765P | 2015-02-06 | 2015-02-06 | |
| US62/112,765 | 2015-02-06 | ||
| US201562130970P | 2015-03-10 | 2015-03-10 | |
| US62/130,970 | 2015-03-10 | ||
| PCT/SG2016/050063 WO2016126213A1 (en) | 2015-02-06 | 2016-02-05 | Methods for enhancing efficacy of therapeutic immune cells |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021095192A Division JP7320560B2 (ja) | 2015-02-06 | 2021-06-07 | 治療免疫細胞の有効性を改良するための方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018507685A JP2018507685A (ja) | 2018-03-22 |
| JP6895380B2 true JP6895380B2 (ja) | 2021-06-30 |
Family
ID=56564429
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017541243A Active JP6895380B2 (ja) | 2015-02-06 | 2016-02-05 | 治療免疫細胞の有効性を改良するための方法 |
| JP2021095192A Active JP7320560B2 (ja) | 2015-02-06 | 2021-06-07 | 治療免疫細胞の有効性を改良するための方法 |
| JP2023119583A Pending JP2023153141A (ja) | 2015-02-06 | 2023-07-24 | 治療免疫細胞の有効性を改良するための方法 |
| JP2023119584A Pending JP2023153142A (ja) | 2015-02-06 | 2023-07-24 | 治療免疫細胞の有効性を改良するための方法 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021095192A Active JP7320560B2 (ja) | 2015-02-06 | 2021-06-07 | 治療免疫細胞の有効性を改良するための方法 |
| JP2023119583A Pending JP2023153141A (ja) | 2015-02-06 | 2023-07-24 | 治療免疫細胞の有効性を改良するための方法 |
| JP2023119584A Pending JP2023153142A (ja) | 2015-02-06 | 2023-07-24 | 治療免疫細胞の有効性を改良するための方法 |
Country Status (18)
| Country | Link |
|---|---|
| US (4) | US10765699B2 (ja) |
| EP (2) | EP3253865B1 (ja) |
| JP (4) | JP6895380B2 (ja) |
| KR (1) | KR20170109052A (ja) |
| CN (4) | CN107709548B (ja) |
| AU (2) | AU2016216149B2 (ja) |
| CA (1) | CA2975851A1 (ja) |
| DK (1) | DK3253865T3 (ja) |
| ES (1) | ES2926384T3 (ja) |
| HR (1) | HRP20220890T1 (ja) |
| HU (1) | HUE059662T2 (ja) |
| LT (1) | LT3253865T (ja) |
| PL (1) | PL3253865T3 (ja) |
| PT (1) | PT3253865T (ja) |
| RS (1) | RS63574B1 (ja) |
| SG (2) | SG11201706236SA (ja) |
| SI (1) | SI3253865T1 (ja) |
| WO (1) | WO2016126213A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021137024A (ja) * | 2015-02-06 | 2021-09-16 | ナショナル ユニバーシティ オブ シンガポール | 治療免疫細胞の有効性を改良するための方法 |
| US11648269B2 (en) | 2017-08-10 | 2023-05-16 | National University Of Singapore | T cell receptor-deficient chimeric antigen receptor T-cells and methods of use thereof |
| US11945865B2 (en) | 2016-11-22 | 2024-04-02 | National University Of Singapore | Blockade of CD7 expression and chimeric antigen receptors for immunotherapy of T-cell malignancies |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10428305B2 (en) | 2014-05-15 | 2019-10-01 | National University Of Singapore | Modified natural killer cells that express IL15 and uses thereof |
| SG11201706774WA (en) | 2015-02-27 | 2017-09-28 | Icell Gene Therapeutics Llc | Chimeric antigen receptors (cars) targeting hematologic malignancies, compositions and methods of use thereof |
| SG11201810023QA (en) | 2016-05-27 | 2018-12-28 | Agenus Inc | Anti-tim-3 antibodies and methods of use thereof |
| WO2018081978A1 (zh) * | 2016-11-03 | 2018-05-11 | 深圳华大基因研究院 | 提高基因编辑效率的方法和系统 |
| US11458169B2 (en) | 2017-02-22 | 2022-10-04 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | TIM3-binding chimeric antigen receptors |
| TW201837175A (zh) * | 2017-03-13 | 2018-10-16 | 美商凱特製藥公司 | 用於黑色素瘤之嵌合抗原受體及其用途 |
| CA3056591A1 (en) | 2017-03-27 | 2018-10-04 | National University Of Singapore | Stimulatory cell lines for ex vivo expansion and activation of natural killer cells |
| CA3056439A1 (en) | 2017-03-27 | 2018-10-04 | National University Of Singapore | Truncated nkg2d chimeric receptors and uses thereof in natural killer cell immunotherapy |
| EP3697425A1 (en) * | 2017-10-18 | 2020-08-26 | Chemotherapeutisches Forschungsinstitut Georg-Speyer-Haus | Methods and compounds for improved immune cell therapy |
| WO2019084273A1 (en) | 2017-10-25 | 2019-05-02 | Actinium Pharmaceuticals, Inc. | METHODS OF ANTI-CD45-BASED LYMPHODEPPLICATION AND USES THEREOF IN COMBINATION WITH ACT-BASED ANTICANCER THERAPIES |
| JP7372920B2 (ja) * | 2017-12-29 | 2023-11-01 | セレクティス | Car t細胞の作製を改良するための方法 |
| EP3743109A4 (en) * | 2018-01-25 | 2021-11-10 | Cullinan Mica Corp. | ANTI-MICA / B ANTIBODIES AND THEIR METHODS OF USE |
| CN108314739B (zh) * | 2018-02-05 | 2020-07-14 | 深圳市默赛尔生物医学科技发展有限公司 | 多信号嵌合抗原受体及其表达基因、其修饰的nk细胞及应用 |
| AR114269A1 (es) * | 2018-02-26 | 2020-08-12 | Ablynx Nv | Secuencias nucleotídicas mejoradas que codifican para péptidos de unión |
| JP7334985B2 (ja) * | 2018-04-02 | 2023-08-29 | ナショナル ユニヴァーシティー オブ シンガポール | 免疫細胞で発現される膜結合抗サイトカイン非シグナル伝達バインダーによるヒトサイトカインの中和 |
| WO2019226945A1 (en) * | 2018-05-23 | 2019-11-28 | National University Of Singapore | Blockade of cd2 surface expression and expression of chimeric antigen receptors for immunotherapy of t-cell malignancies |
| US20200054675A1 (en) * | 2018-06-01 | 2020-02-20 | Washington University | Suppression of cytokine release syndrome in chimeric antigen receptor cell therapy |
| CN109207430A (zh) * | 2018-09-25 | 2019-01-15 | 华东师范大学 | 一种嵌合抗原受体nk细胞及其制备方法和应用 |
| CN109266618B (zh) * | 2018-10-18 | 2021-04-23 | 赛元生物科技(杭州)有限公司 | 能够靶向肿瘤细胞的巨噬细胞及其制备方法 |
| KR20200049594A (ko) * | 2018-10-24 | 2020-05-08 | 주식회사 툴젠 | 조작된 면역 세포 |
| CN109652379B (zh) * | 2018-12-29 | 2022-08-16 | 博生吉医药科技(苏州)有限公司 | Cd7嵌合抗原受体修饰的nk-92mi细胞及其应用 |
| WO2020180882A1 (en) | 2019-03-05 | 2020-09-10 | Nkarta, Inc. | Cd19-directed chimeric antigen receptors and uses thereof in immunotherapy |
| JP7137696B2 (ja) | 2019-05-14 | 2022-09-14 | プロヴェンション・バイオ・インコーポレイテッド | 1型糖尿病を予防するための方法および組成物 |
| GB201914611D0 (en) * | 2019-10-09 | 2019-11-20 | Autolus Ltd | Engineered immune cell |
| CN113005088A (zh) * | 2019-12-19 | 2021-06-22 | 苏州方德门达新药开发有限公司 | 工程改造的t细胞、其制备及应用 |
| CN113088495A (zh) * | 2020-01-09 | 2021-07-09 | 苏州方德门达新药开发有限公司 | 工程改造的t细胞、其制备及应用 |
| CN112195155A (zh) * | 2020-08-11 | 2021-01-08 | 广东万海细胞生物科技有限公司 | 一种通用car-t细胞及其制备方法 |
| CN114525259A (zh) * | 2020-11-03 | 2022-05-24 | 南京北恒生物科技有限公司 | 靶向cd7的嵌合抗原受体及其用途 |
| WO2022104109A1 (en) | 2020-11-13 | 2022-05-19 | Catamaran Bio, Inc. | Genetically modified natural killer cells and methods of use thereof |
| CA3200770A1 (en) * | 2020-12-14 | 2022-06-23 | Lillian SEU | Methods and reagents for characterizing car t cells for therapies |
| US11883432B2 (en) | 2020-12-18 | 2024-01-30 | Century Therapeutics, Inc. | Chimeric antigen receptor system with adaptable receptor specificity |
| CN113416701B (zh) * | 2021-07-28 | 2023-05-09 | 新疆西部赛澳生物科技有限责任公司 | 一种nk细胞培养基及培养方法 |
| CN116731205B (zh) * | 2023-05-19 | 2024-02-27 | 皖南医学院第一附属医院(皖南医学院弋矶山医院) | 一种表达TGFβRII和TIM3胞外区的免疫增强型融合蛋白及其应用 |
Family Cites Families (62)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| ATE87659T1 (de) | 1986-09-02 | 1993-04-15 | Enzon Lab Inc | Bindungsmolekuele mit einzelpolypeptidkette. |
| US5260203A (en) | 1986-09-02 | 1993-11-09 | Enzon, Inc. | Single polypeptide chain binding molecules |
| CA2018248A1 (en) * | 1989-06-07 | 1990-12-07 | Clyde W. Shearman | Monoclonal antibodies against the human alpha/beta t-cell receptor, their production and use |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| ATE297465T1 (de) | 1991-11-25 | 2005-06-15 | Enzon Inc | Verfahren zur herstellung von multivalenten antigenbindenden proteinen |
| US5885573A (en) * | 1993-06-01 | 1999-03-23 | Arch Development Corporation | Methods and materials for modulation of the immunosuppressive activity and toxicity of monoclonal antibodies |
| CA2304208A1 (en) | 1997-09-19 | 1999-03-25 | Dana-Farber Cancer Institute, Inc. | Intrabody-mediated control of immune reactions |
| EP1235842A4 (en) | 1999-10-15 | 2003-04-23 | Univ Massachusetts | GENESIS OF THE RNA INTERFERENCE PATH AS AID OF TARGETED GENTIAN INTERFERENCE |
| US6326193B1 (en) | 1999-11-05 | 2001-12-04 | Cambria Biosciences, Llc | Insect control agent |
| AU2001275474A1 (en) | 2000-06-12 | 2001-12-24 | Akkadix Corporation | Materials and methods for the control of nematodes |
| AU2002220265A1 (en) * | 2000-11-03 | 2002-05-15 | University Of Vermont And State Agricultural College | Compositions for inhibiting grb7 |
| WO2003051926A2 (en) | 2001-12-14 | 2003-06-26 | Friedrich-Alexander-Universitaet Erlangen-Nuernberg | Anti-cd7 immunotoxin as fusion protein |
| US20090191213A9 (en) | 2003-07-02 | 2009-07-30 | Novo Nordisk A/S | Compositions and methods for regulating NK cell activity |
| KR20060079180A (ko) | 2003-07-02 | 2006-07-05 | 노보 노르디스크 에이/에스 | Nk 세포 활성을 조절하기 위한 조성물 및 방법 |
| WO2005017163A2 (en) | 2003-08-15 | 2005-02-24 | Imperial College Innovations Limited | Phenotypic knockout of cell-surface proteins |
| US7435596B2 (en) | 2004-11-04 | 2008-10-14 | St. Jude Children's Research Hospital, Inc. | Modified cell line and method for expansion of NK cell |
| US20130266551A1 (en) * | 2003-11-05 | 2013-10-10 | St. Jude Children's Research Hospital, Inc. | Chimeric receptors with 4-1bb stimulatory signaling domain |
| EP1791868B1 (en) * | 2004-07-01 | 2011-02-23 | Novo Nordisk A/S | Antibodies binding to receptors kir2dl1, -2, 3 but not kir2ds4 and their therapeutic use |
| WO2006047637A1 (en) | 2004-10-27 | 2006-05-04 | Medimmune, Inc. | Use of modulators of epha2 and ephrina1 for the treatment and prevention of infections |
| JP5855326B2 (ja) | 2005-01-06 | 2016-02-09 | ノヴォ ノルディスク アー/エス | 抗kir組み合わせ治療および方法 |
| US20070036773A1 (en) | 2005-08-09 | 2007-02-15 | City Of Hope | Generation and application of universal T cells for B-ALL |
| AU2006302254B2 (en) | 2005-10-06 | 2011-05-26 | Xencor, Inc. | Optimized anti-CD30 antibodies |
| WO2007126782A2 (en) * | 2006-03-28 | 2007-11-08 | Hampton University | Hadron treatment planning with adequate biological weighting |
| ES2582386T3 (es) * | 2007-03-01 | 2016-09-12 | Symphogen A/S | Composiciones de anticuerpos recombinantes contra el receptor del factor de crecimiento epidérmico |
| ES2424745T3 (es) | 2007-09-07 | 2013-10-08 | Agensys, Inc. | Anticuerpos y moléculas relacionadas que se unen a las proteínas 24P4C12 |
| MX2010007935A (es) | 2008-01-24 | 2010-08-23 | Novo Nordisk As | Anticuerpo monoclonal humanizado anti-nkg2a humano. |
| WO2011047146A2 (en) * | 2009-10-14 | 2011-04-21 | Centocor Ortho Biotech Inc. | Methods of affinity maturing antibodies |
| US9273283B2 (en) * | 2009-10-29 | 2016-03-01 | The Trustees Of Dartmouth College | Method of producing T cell receptor-deficient T cells expressing a chimeric receptor |
| WO2011059836A2 (en) | 2009-10-29 | 2011-05-19 | Trustees Of Dartmouth College | T cell receptor-deficient t cell compositions |
| CN106220739A (zh) | 2010-12-09 | 2016-12-14 | 宾夕法尼亚大学董事会 | 嵌合抗原受体‑修饰的t细胞治疗癌症的用途 |
| LT3401400T (lt) | 2012-05-25 | 2019-06-10 | The Regents Of The University Of California | Būdai ir kompozicijos, skirtos rnr molekulės nukreipiamai tikslinės dnr modifikacijai ir rnr molekulės nukreipiamam transkripcijos moduliavimui |
| HUE061555T2 (hu) * | 2012-07-13 | 2023-07-28 | Univ Pennsylvania | CAR-ok tumorellenes hatásának toxicitáskezelése |
| ES2824024T3 (es) * | 2012-10-10 | 2021-05-11 | Sangamo Therapeutics Inc | Compuestos modificadores de células T y usos de los mismos |
| US8697359B1 (en) | 2012-12-12 | 2014-04-15 | The Broad Institute, Inc. | CRISPR-Cas systems and methods for altering expression of gene products |
| KR101521224B1 (ko) * | 2012-12-20 | 2015-05-19 | 한양대학교 산학협력단 | T 세포 특이적인 인간화 단일조각항체 전달체 |
| EA201590397A8 (ru) * | 2012-12-27 | 2016-08-31 | Адуро Биотек, Инк. | Способствующие экспрессии антигенных последовательностей у listeria партнеры для гибридизации, представляющие собой сигнальные пептиды, и способы их получения и применения |
| NZ750426A (en) | 2013-02-06 | 2020-06-26 | Celgene Corp | Modified t lymphocytes having improved specificity |
| US9890393B2 (en) | 2013-05-29 | 2018-02-13 | Cellectis | Methods for engineering T cells for immunotherapy by using RNA-guided CAS nuclease system |
| EP3858378A1 (en) * | 2013-11-21 | 2021-08-04 | Autolus Limited | Cell |
| GB201405845D0 (en) | 2014-04-01 | 2014-05-14 | Ucl Business Plc | Signalling system |
| WO2016011210A2 (en) | 2014-07-15 | 2016-01-21 | Juno Therapeutics, Inc. | Engineered cells for adoptive cell therapy |
| JP2017531430A (ja) * | 2014-10-07 | 2017-10-26 | セレクティスCellectis | Carによって誘導される免疫細胞の活性を調節するための方法 |
| EP3215166B1 (en) | 2014-10-31 | 2024-04-24 | The Trustees of the University of Pennsylvania | Altering gene expression in car-t cells and uses thereof |
| CA3224507A1 (en) * | 2014-12-24 | 2016-06-30 | Autolus Limited | Cell co-expressing chimeric antigen receptors binding cd19 and cd22 |
| RS63574B1 (sr) | 2015-02-06 | 2022-10-31 | Nat Univ Singapore | Metode za povećanje efikasnosti imuno ćelija |
| SG11201706774WA (en) | 2015-02-27 | 2017-09-28 | Icell Gene Therapeutics Llc | Chimeric antigen receptors (cars) targeting hematologic malignancies, compositions and methods of use thereof |
| RU2688692C2 (ru) * | 2015-03-02 | 2019-05-22 | Инновейтив Целлюлар Терапевтикс КО., ЛТД. | Фармацевтическая композиция, обладающая противоопухолевым эффектом, и способ снижения ингибирующего эффекта pd-l1 на т-клетки человека |
| AU2016279050A1 (en) | 2015-06-19 | 2018-01-04 | Massachusetts Institute Of Technology | Tumor immunotherapy |
| MA42895A (fr) | 2015-07-15 | 2018-05-23 | Juno Therapeutics Inc | Cellules modifiées pour thérapie cellulaire adoptive |
| IL295616A (en) | 2015-07-31 | 2022-10-01 | Us Health | Adapted cells and treatment methods |
| WO2017062604A1 (en) | 2015-10-06 | 2017-04-13 | Regents Of The University Of Minnesota | Therapeutic compounds and methods |
| US20180371052A1 (en) | 2015-12-22 | 2018-12-27 | Icell Gene Therapeutics Llc | Chimeric antigen receptors and enhancement of anti-tumor activity |
| WO2017213979A1 (en) | 2016-06-06 | 2017-12-14 | St. Jude Children's Research Hospital | Anti-cd7 chimeric antigen receptor and method of use thereof |
| US20200283534A1 (en) | 2016-06-24 | 2020-09-10 | iCell Gene Therapeuticics LLC | CHIMERIC ANTIGEN RECEPTORS (CARs), COMPOSITIONS AND METHODS THEREOF |
| CA2937157A1 (en) | 2016-07-25 | 2018-01-25 | Ucl Business Plc | Protein-based t-cell receptor knockdown |
| KR102546839B1 (ko) | 2016-08-03 | 2023-06-23 | 워싱턴 유니버시티 | 키메라 항원 수용체를 이용한 t 세포 악성종양의 치료를 위한 car-t 세포의 유전자 편집 |
| US10550183B2 (en) | 2016-11-22 | 2020-02-04 | National University Of Singapore | Blockade of CD7 expression and chimeric antigen receptors for immunotherapy of T-cell malignancies |
| GB201622044D0 (en) | 2016-12-22 | 2017-02-08 | Ucl Business Plc | T cell-targeted T cells |
| US20210137978A1 (en) | 2017-01-10 | 2021-05-13 | The General Hospital Corporation | Modified t cells and methods of their use |
| AU2018313939A1 (en) | 2017-08-10 | 2020-02-06 | National University Of Singapore | T cell receptor-deficient chimeric antigen receptor T-cells and methods of use thereof |
| SG11202104334SA (en) | 2018-11-14 | 2021-05-28 | MediSix Therapeutics Pte Ltd | Two-gene vectors for generating car-t cells and uses thereof |
-
2016
- 2016-02-05 RS RS20220680A patent/RS63574B1/sr unknown
- 2016-02-05 US US15/548,577 patent/US10765699B2/en active Active
- 2016-02-05 HR HRP20220890TT patent/HRP20220890T1/hr unknown
- 2016-02-05 AU AU2016216149A patent/AU2016216149B2/en active Active
- 2016-02-05 EP EP16746922.0A patent/EP3253865B1/en active Active
- 2016-02-05 SG SG11201706236SA patent/SG11201706236SA/en unknown
- 2016-02-05 KR KR1020177024662A patent/KR20170109052A/ko not_active Application Discontinuation
- 2016-02-05 PT PT167469220T patent/PT3253865T/pt unknown
- 2016-02-05 HU HUE16746922A patent/HUE059662T2/hu unknown
- 2016-02-05 DK DK16746922.0T patent/DK3253865T3/da active
- 2016-02-05 SG SG10201913124RA patent/SG10201913124RA/en unknown
- 2016-02-05 CN CN201680018962.7A patent/CN107709548B/zh active Active
- 2016-02-05 CN CN202111064400.5A patent/CN113713091A/zh active Pending
- 2016-02-05 SI SI201631593T patent/SI3253865T1/sl unknown
- 2016-02-05 WO PCT/SG2016/050063 patent/WO2016126213A1/en active Application Filing
- 2016-02-05 LT LTEPPCT/SG2016/050063T patent/LT3253865T/lt unknown
- 2016-02-05 ES ES16746922T patent/ES2926384T3/es active Active
- 2016-02-05 CN CN202210661143.1A patent/CN114891816A/zh active Pending
- 2016-02-05 CA CA2975851A patent/CA2975851A1/en active Pending
- 2016-02-05 PL PL16746922.0T patent/PL3253865T3/pl unknown
- 2016-02-05 CN CN202210667502.4A patent/CN115029362A/zh active Pending
- 2016-02-05 EP EP22180254.9A patent/EP4134430A1/en active Pending
- 2016-02-05 JP JP2017541243A patent/JP6895380B2/ja active Active
-
2020
- 2020-07-30 US US16/943,400 patent/US20210046112A1/en active Pending
-
2021
- 2021-06-07 JP JP2021095192A patent/JP7320560B2/ja active Active
-
2022
- 2022-06-29 AU AU2022204601A patent/AU2022204601A1/en active Pending
- 2022-07-12 US US17/862,797 patent/US20220370501A1/en active Pending
- 2022-07-12 US US17/862,721 patent/US11679132B2/en active Active
-
2023
- 2023-07-24 JP JP2023119583A patent/JP2023153141A/ja active Pending
- 2023-07-24 JP JP2023119584A patent/JP2023153142A/ja active Pending
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021137024A (ja) * | 2015-02-06 | 2021-09-16 | ナショナル ユニバーシティ オブ シンガポール | 治療免疫細胞の有効性を改良するための方法 |
| US11679132B2 (en) | 2015-02-06 | 2023-06-20 | National University Of Singapore | Methods for enhancing efficacy of therapeutic immune cells |
| JP7320560B2 (ja) | 2015-02-06 | 2023-08-03 | ナショナル ユニバーシティ オブ シンガポール | 治療免疫細胞の有効性を改良するための方法 |
| US11945865B2 (en) | 2016-11-22 | 2024-04-02 | National University Of Singapore | Blockade of CD7 expression and chimeric antigen receptors for immunotherapy of T-cell malignancies |
| US11648269B2 (en) | 2017-08-10 | 2023-05-16 | National University Of Singapore | T cell receptor-deficient chimeric antigen receptor T-cells and methods of use thereof |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7320560B2 (ja) | 治療免疫細胞の有効性を改良するための方法 | |
| US20230364140A1 (en) | T cell receptor-deficient chimeric antigen receptor t-cells and methods of use thereof | |
| TW202134264A (zh) | 嵌合抗原受體及其用途 | |
| JP2021500894A (ja) | キメラ抗原受容体発現細胞を作製する方法 | |
| JP2021525068A (ja) | T細胞悪性腫瘍の免疫療法のためのcd2表面発現の遮断およびキメラ抗原受容体の発現 | |
| JP2021525067A (ja) | T細胞悪性腫瘍の免疫療法のためのキメラ抗原受容体およびcd2の遺伝子編集 | |
| US20240060089A1 (en) | Vector-free process for manufacture of engineered immune cells | |
| TW202216752A (zh) | 用於過繼細胞療法之提供靶向共刺激之嵌合分子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190131 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20191024 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20191105 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200204 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200331 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200706 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200929 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20201202 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210409 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210507 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210607 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6895380 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R157 | Certificate of patent or utility model (correction) |
Free format text: JAPANESE INTERMEDIATE CODE: R157 |