JP6273326B2 - 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー - Google Patents
移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー Download PDFInfo
- Publication number
- JP6273326B2 JP6273326B2 JP2016151624A JP2016151624A JP6273326B2 JP 6273326 B2 JP6273326 B2 JP 6273326B2 JP 2016151624 A JP2016151624 A JP 2016151624A JP 2016151624 A JP2016151624 A JP 2016151624A JP 6273326 B2 JP6273326 B2 JP 6273326B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- poly
- ethylene glycol
- solution
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title description 151
- 229920001184 polypeptide Polymers 0.000 title description 149
- 102000004196 processed proteins & peptides Human genes 0.000 title description 148
- 239000000178 monomer Substances 0.000 title description 56
- 238000004255 ion exchange chromatography Methods 0.000 title description 31
- 239000012615 aggregate Substances 0.000 title description 2
- 239000012634 fragment Substances 0.000 title description 2
- 239000000463 material Substances 0.000 claims description 170
- 229920001223 polyethylene glycol Polymers 0.000 claims description 155
- 238000000034 method Methods 0.000 claims description 109
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 67
- 238000005277 cation exchange chromatography Methods 0.000 claims description 43
- 238000011068 loading method Methods 0.000 claims description 36
- 239000004471 Glycine Substances 0.000 claims description 33
- 238000002360 preparation method Methods 0.000 claims description 16
- 238000004519 manufacturing process Methods 0.000 claims description 11
- 230000008569 process Effects 0.000 claims description 10
- 229920000232 polyglycine polymer Polymers 0.000 claims 4
- 239000000243 solution Substances 0.000 description 127
- 239000000654 additive Substances 0.000 description 124
- 229920000642 polymer Polymers 0.000 description 109
- 230000000996 additive effect Effects 0.000 description 86
- 239000000872 buffer Substances 0.000 description 76
- 239000001509 sodium citrate Substances 0.000 description 76
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 76
- 210000004027 cell Anatomy 0.000 description 72
- 235000018102 proteins Nutrition 0.000 description 66
- 102000004169 proteins and genes Human genes 0.000 description 66
- 108090000623 proteins and genes Proteins 0.000 description 66
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 62
- 238000010828 elution Methods 0.000 description 59
- 235000002639 sodium chloride Nutrition 0.000 description 51
- 238000004587 chromatography analysis Methods 0.000 description 50
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 42
- 239000000126 substance Substances 0.000 description 41
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical group OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 36
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 35
- 229960002920 sorbitol Drugs 0.000 description 35
- 239000011780 sodium chloride Substances 0.000 description 31
- KWIUHFFTVRNATP-UHFFFAOYSA-N glycine betaine Chemical compound C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 30
- 239000003480 eluent Substances 0.000 description 27
- 108020004414 DNA Proteins 0.000 description 25
- 238000004458 analytical method Methods 0.000 description 25
- 238000011067 equilibration Methods 0.000 description 25
- 239000000600 sorbitol Substances 0.000 description 22
- 150000003839 salts Chemical class 0.000 description 20
- 239000007853 buffer solution Substances 0.000 description 19
- 150000001875 compounds Chemical class 0.000 description 18
- 229920001451 polypropylene glycol Polymers 0.000 description 18
- 238000011084 recovery Methods 0.000 description 18
- 229960003237 betaine Drugs 0.000 description 15
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 14
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 14
- 229930006000 Sucrose Natural products 0.000 description 14
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 14
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 14
- -1 poly (oxyethylene) Polymers 0.000 description 14
- 229960002429 proline Drugs 0.000 description 14
- 229960004793 sucrose Drugs 0.000 description 14
- 239000000811 xylitol Substances 0.000 description 14
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 14
- 229960002675 xylitol Drugs 0.000 description 14
- 235000010447 xylitol Nutrition 0.000 description 14
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 13
- 235000001014 amino acid Nutrition 0.000 description 13
- 238000005342 ion exchange Methods 0.000 description 12
- 239000012071 phase Substances 0.000 description 12
- 102000005962 receptors Human genes 0.000 description 12
- 108020003175 receptors Proteins 0.000 description 12
- 238000001179 sorption measurement Methods 0.000 description 12
- 125000003275 alpha amino acid group Chemical group 0.000 description 11
- 229940024606 amino acid Drugs 0.000 description 11
- 150000001413 amino acids Chemical class 0.000 description 11
- 229920005862 polyol Polymers 0.000 description 11
- 150000003077 polyols Chemical class 0.000 description 11
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 10
- 235000000346 sugar Nutrition 0.000 description 10
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- LYCAIKOWRPUZTN-UHFFFAOYSA-N ethylene glycol Natural products OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 9
- 239000012064 sodium phosphate buffer Substances 0.000 description 9
- 230000001225 therapeutic effect Effects 0.000 description 9
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 8
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 8
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 8
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 8
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 8
- 230000001419 dependent effect Effects 0.000 description 8
- 239000008103 glucose Substances 0.000 description 8
- 238000000926 separation method Methods 0.000 description 8
- 239000005720 sucrose Substances 0.000 description 8
- 238000005406 washing Methods 0.000 description 8
- 229930091371 Fructose Natural products 0.000 description 7
- 239000005715 Fructose Substances 0.000 description 7
- 230000001143 conditioned effect Effects 0.000 description 7
- 229960005150 glycerol Drugs 0.000 description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 7
- 229920000831 ionic polymer Polymers 0.000 description 7
- 230000004048 modification Effects 0.000 description 7
- 238000012986 modification Methods 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 7
- RFSUNEUAIZKAJO-VRPWFDPXSA-N D-Fructose Natural products OC[C@H]1OC(O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-VRPWFDPXSA-N 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 229930182821 L-proline Natural products 0.000 description 6
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 6
- 238000011210 chromatographic step Methods 0.000 description 6
- 239000012228 culture supernatant Substances 0.000 description 6
- 235000013681 dietary sucrose Nutrition 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 5
- 230000005526 G1 to G0 transition Effects 0.000 description 5
- 239000007987 MES buffer Substances 0.000 description 5
- 229920001030 Polyethylene Glycol 4000 Polymers 0.000 description 5
- 229920002684 Sepharose Polymers 0.000 description 5
- 238000001042 affinity chromatography Methods 0.000 description 5
- 239000004202 carbamide Substances 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 238000009826 distribution Methods 0.000 description 5
- 229960002737 fructose Drugs 0.000 description 5
- 229960001031 glucose Drugs 0.000 description 5
- 229960002449 glycine Drugs 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 210000004962 mammalian cell Anatomy 0.000 description 5
- 239000000203 mixture Chemical class 0.000 description 5
- 229930014626 natural product Natural products 0.000 description 5
- 238000001556 precipitation Methods 0.000 description 5
- 241000894007 species Species 0.000 description 5
- 150000008163 sugars Chemical class 0.000 description 5
- 150000003672 ureas Chemical class 0.000 description 5
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 4
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 4
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 4
- SEQKRHFRPICQDD-UHFFFAOYSA-N N-tris(hydroxymethyl)methylglycine Chemical compound OCC(CO)(CO)[NH2+]CC([O-])=O SEQKRHFRPICQDD-UHFFFAOYSA-N 0.000 description 4
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 4
- 239000003463 adsorbent Substances 0.000 description 4
- 125000000539 amino acid group Chemical group 0.000 description 4
- 239000000427 antigen Substances 0.000 description 4
- 230000000890 antigenic effect Effects 0.000 description 4
- 102000036639 antigens Human genes 0.000 description 4
- 108091007433 antigens Proteins 0.000 description 4
- 238000013375 chromatographic separation Methods 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 238000011143 downstream manufacturing Methods 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 230000014759 maintenance of location Effects 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 150000007523 nucleic acids Chemical class 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 239000011347 resin Substances 0.000 description 4
- 229920005989 resin Polymers 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 125000001424 substituent group Chemical group 0.000 description 4
- 229920000428 triblock copolymer Polymers 0.000 description 4
- GUQQBLRVXOUDTN-XOHPMCGNSA-N 3-[dimethyl-[3-[[(4r)-4-[(3r,5s,7r,8r,9s,10s,12s,13r,14s,17r)-3,7,12-trihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]pentanoyl]amino]propyl]azaniumyl]-2-hydroxypropane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CC(O)CS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 GUQQBLRVXOUDTN-XOHPMCGNSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 238000009825 accumulation Methods 0.000 description 3
- 238000005349 anion exchange Methods 0.000 description 3
- 239000003729 cation exchange resin Substances 0.000 description 3
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 3
- 229940127121 immunoconjugate Drugs 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 239000012535 impurity Substances 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 229920002521 macromolecule Polymers 0.000 description 3
- 229920001983 poloxamer Polymers 0.000 description 3
- 239000001103 potassium chloride Substances 0.000 description 3
- 235000011164 potassium chloride Nutrition 0.000 description 3
- 239000007974 sodium acetate buffer Substances 0.000 description 3
- IHPYMWDTONKSCO-UHFFFAOYSA-N 2,2'-piperazine-1,4-diylbisethanesulfonic acid Chemical compound OS(=O)(=O)CCN1CCN(CCS(O)(=O)=O)CC1 IHPYMWDTONKSCO-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- DVLFYONBTKHTER-UHFFFAOYSA-N 3-(N-morpholino)propanesulfonic acid Chemical compound OS(=O)(=O)CCCN1CCOCC1 DVLFYONBTKHTER-UHFFFAOYSA-N 0.000 description 2
- 102100022014 Angiopoietin-1 receptor Human genes 0.000 description 2
- 239000008001 CAPS buffer Substances 0.000 description 2
- 241000700199 Cavia porcellus Species 0.000 description 2
- 102100030322 Ephrin type-A receptor 1 Human genes 0.000 description 2
- 229920000896 Ethulose Polymers 0.000 description 2
- 239000001859 Ethyl hydroxyethyl cellulose Substances 0.000 description 2
- RYECOJGRJDOGPP-UHFFFAOYSA-N Ethylurea Chemical compound CCNC(N)=O RYECOJGRJDOGPP-UHFFFAOYSA-N 0.000 description 2
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 2
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 101000753291 Homo sapiens Angiopoietin-1 receptor Proteins 0.000 description 2
- 101000938354 Homo sapiens Ephrin type-A receptor 1 Proteins 0.000 description 2
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 description 2
- 108010001127 Insulin Receptor Proteins 0.000 description 2
- 102100036721 Insulin receptor Human genes 0.000 description 2
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- 239000007993 MOPS buffer Substances 0.000 description 2
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 2
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- FSVCELGFZIQNCK-UHFFFAOYSA-N N,N-bis(2-hydroxyethyl)glycine Chemical compound OCCN(CCO)CC(O)=O FSVCELGFZIQNCK-UHFFFAOYSA-N 0.000 description 2
- XGEGHDBEHXKFPX-UHFFFAOYSA-N N-methylthiourea Natural products CNC(N)=O XGEGHDBEHXKFPX-UHFFFAOYSA-N 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 239000007990 PIPES buffer Substances 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical class OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 2
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 2
- 229920000463 Poly(ethylene glycol)-block-poly(propylene glycol)-block-poly(ethylene glycol) Polymers 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 2
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 2
- 101710151245 Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- 102000013275 Somatomedins Human genes 0.000 description 2
- UZMAPBJVXOGOFT-UHFFFAOYSA-N Syringetin Natural products COC1=C(O)C(OC)=CC(C2=C(C(=O)C3=C(O)C=C(O)C=C3O2)O)=C1 UZMAPBJVXOGOFT-UHFFFAOYSA-N 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- 239000007997 Tricine buffer Substances 0.000 description 2
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 2
- 239000008351 acetate buffer Substances 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 229960003767 alanine Drugs 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 238000005571 anion exchange chromatography Methods 0.000 description 2
- 239000012062 aqueous buffer Substances 0.000 description 2
- 239000007998 bicine buffer Substances 0.000 description 2
- 229920001400 block copolymer Polymers 0.000 description 2
- 238000005341 cation exchange Methods 0.000 description 2
- 229920001429 chelating resin Polymers 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 238000011097 chromatography purification Methods 0.000 description 2
- 239000007979 citrate buffer Substances 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- KCFYHBSOLOXZIF-UHFFFAOYSA-N dihydrochrysin Natural products COC1=C(O)C(OC)=CC(C2OC3=CC(O)=CC(O)=C3C(=O)C2)=C1 KCFYHBSOLOXZIF-UHFFFAOYSA-N 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 239000006167 equilibration buffer Substances 0.000 description 2
- 235000019326 ethyl hydroxyethyl cellulose Nutrition 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 229940126864 fibroblast growth factor Drugs 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 238000005194 fractionation Methods 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 2
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 239000003456 ion exchange resin Substances 0.000 description 2
- 229920003303 ion-exchange polymer Polymers 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 2
- XGEGHDBEHXKFPX-NJFSPNSNSA-N methylurea Chemical compound [14CH3]NC(N)=O XGEGHDBEHXKFPX-NJFSPNSNSA-N 0.000 description 2
- 238000012434 mixed-mode chromatography Methods 0.000 description 2
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 2
- 239000008055 phosphate buffer solution Substances 0.000 description 2
- 238000005498 polishing Methods 0.000 description 2
- 229960000502 poloxamer Drugs 0.000 description 2
- 229920000570 polyether Polymers 0.000 description 2
- OTYBMLCTZGSZBG-UHFFFAOYSA-L potassium sulfate Chemical compound [K+].[K+].[O-]S([O-])(=O)=O OTYBMLCTZGSZBG-UHFFFAOYSA-L 0.000 description 2
- 229910052939 potassium sulfate Inorganic materials 0.000 description 2
- 235000011151 potassium sulphates Nutrition 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 2
- 238000001542 size-exclusion chromatography Methods 0.000 description 2
- 235000011083 sodium citrates Nutrition 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- STMDPCBYJCIZOD-UHFFFAOYSA-N 2-(2,4-dinitroanilino)-4-methylpentanoic acid Chemical compound CC(C)CC(C(O)=O)NC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O STMDPCBYJCIZOD-UHFFFAOYSA-N 0.000 description 1
- SXGZJKUKBWWHRA-UHFFFAOYSA-N 2-(N-morpholiniumyl)ethanesulfonate Chemical compound [O-]S(=O)(=O)CC[NH+]1CCOCC1 SXGZJKUKBWWHRA-UHFFFAOYSA-N 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 101100481403 Bos taurus TIE1 gene Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 102100024217 CAMPATH-1 antigen Human genes 0.000 description 1
- 108010065524 CD52 Antigen Proteins 0.000 description 1
- 102100024423 Carbonic anhydrase 9 Human genes 0.000 description 1
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 description 1
- 208000026005 Central nervous system vascular disease Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 108010049959 Discoidins Proteins 0.000 description 1
- 102000001301 EGF receptor Human genes 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 102000012545 EGF-like domains Human genes 0.000 description 1
- 108050002150 EGF-like domains Proteins 0.000 description 1
- 108010055196 EphA2 Receptor Proteins 0.000 description 1
- 108010055191 EphA3 Receptor Proteins 0.000 description 1
- 108010055179 EphA4 Receptor Proteins 0.000 description 1
- 108010055182 EphA5 Receptor Proteins 0.000 description 1
- 108010055207 EphA6 Receptor Proteins 0.000 description 1
- 108010055153 EphA7 Receptor Proteins 0.000 description 1
- 108010055155 EphA8 Receptor Proteins 0.000 description 1
- 108010055334 EphB2 Receptor Proteins 0.000 description 1
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 description 1
- 102100030324 Ephrin type-A receptor 3 Human genes 0.000 description 1
- 102100021616 Ephrin type-A receptor 4 Human genes 0.000 description 1
- 102100021605 Ephrin type-A receptor 5 Human genes 0.000 description 1
- 102100021606 Ephrin type-A receptor 7 Human genes 0.000 description 1
- 102100021601 Ephrin type-A receptor 8 Human genes 0.000 description 1
- 102100030779 Ephrin type-B receptor 1 Human genes 0.000 description 1
- 102100031968 Ephrin type-B receptor 2 Human genes 0.000 description 1
- 102100031982 Ephrin type-B receptor 3 Human genes 0.000 description 1
- 102100031983 Ephrin type-B receptor 4 Human genes 0.000 description 1
- 102100031984 Ephrin type-B receptor 6 Human genes 0.000 description 1
- 102100036725 Epithelial discoidin domain-containing receptor 1 Human genes 0.000 description 1
- 101710131668 Epithelial discoidin domain-containing receptor 1 Proteins 0.000 description 1
- 241000402754 Erythranthe moschata Species 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 101150017750 FGFRL1 gene Proteins 0.000 description 1
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 description 1
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 description 1
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 1
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 1
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 1
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 1
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 description 1
- 102100026149 Fibroblast growth factor receptor-like 1 Human genes 0.000 description 1
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 1
- 102000006354 HLA-DR Antigens Human genes 0.000 description 1
- 108010058597 HLA-DR Antigens Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101100165850 Homo sapiens CA9 gene Proteins 0.000 description 1
- 101000914324 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 5 Proteins 0.000 description 1
- 101000914321 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 7 Proteins 0.000 description 1
- 101001064150 Homo sapiens Ephrin type-B receptor 1 Proteins 0.000 description 1
- 101001064458 Homo sapiens Ephrin type-B receptor 3 Proteins 0.000 description 1
- 101001064451 Homo sapiens Ephrin type-B receptor 6 Proteins 0.000 description 1
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 description 1
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 1
- 101000617725 Homo sapiens Pregnancy-specific beta-1-glycoprotein 2 Proteins 0.000 description 1
- 101000686031 Homo sapiens Proto-oncogene tyrosine-protein kinase ROS Proteins 0.000 description 1
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000727826 Homo sapiens Tyrosine-protein kinase RYK Proteins 0.000 description 1
- 101001103033 Homo sapiens Tyrosine-protein kinase transmembrane receptor ROR2 Proteins 0.000 description 1
- 101000851018 Homo sapiens Vascular endothelial growth factor receptor 1 Proteins 0.000 description 1
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 description 1
- 102000010781 Interleukin-6 Receptors Human genes 0.000 description 1
- 108010038501 Interleukin-6 Receptors Proteins 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101000807562 Mus musculus Tyrosine-protein kinase receptor UFO Proteins 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- FQYUMYWMJTYZTK-UHFFFAOYSA-N Phenyl glycidyl ether Chemical compound C1OC1COC1=CC=CC=C1 FQYUMYWMJTYZTK-UHFFFAOYSA-N 0.000 description 1
- XSEQBUVOXWTHGU-UHFFFAOYSA-N Pieristoxin G Natural products CC1(O)CC2(C(C(O)C3(O)C4(C)C)O)C(O)C1CCC2(O)C(C)(O)C3C1C4O1 XSEQBUVOXWTHGU-UHFFFAOYSA-N 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 102100022019 Pregnancy-specific beta-1-glycoprotein 2 Human genes 0.000 description 1
- GOOHAUXETOMSMM-UHFFFAOYSA-N Propylene oxide Chemical group CC1CO1 GOOHAUXETOMSMM-UHFFFAOYSA-N 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 1
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 1
- 102100023347 Proto-oncogene tyrosine-protein kinase ROS Human genes 0.000 description 1
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 1
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 1
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- XSTXAVWGXDQKEL-UHFFFAOYSA-N Trichloroethylene Chemical compound ClC=C(Cl)Cl XSTXAVWGXDQKEL-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 102100029759 Tyrosine-protein kinase RYK Human genes 0.000 description 1
- 102100039616 Tyrosine-protein kinase transmembrane receptor ROR2 Human genes 0.000 description 1
- 238000005411 Van der Waals force Methods 0.000 description 1
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000002156 adsorbate Substances 0.000 description 1
- 150000003797 alkaloid derivatives Chemical group 0.000 description 1
- MXKCYTKUIDTFLY-ZNNSSXPHSA-N alpha-L-Fucp-(1->2)-beta-D-Galp-(1->4)-[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAc-(1->3)-D-Galp Chemical compound O[C@H]1[C@H](O)[C@H](O)[C@H](C)O[C@H]1O[C@H]1[C@H](O[C@H]2[C@@H]([C@@H](NC(C)=O)[C@H](O[C@H]3[C@H]([C@@H](CO)OC(O)[C@@H]3O)O)O[C@@H]2CO)O[C@H]2[C@H]([C@H](O)[C@H](O)[C@H](C)O2)O)O[C@H](CO)[C@H](O)[C@@H]1O MXKCYTKUIDTFLY-ZNNSSXPHSA-N 0.000 description 1
- 229910000147 aluminium phosphate Chemical class 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003957 anion exchange resin Substances 0.000 description 1
- 238000011091 antibody purification Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 239000012148 binding buffer Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000012928 buffer substance Substances 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 125000000837 carbohydrate group Chemical group 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 208000025222 central nervous system infectious disease Diseases 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000012045 crude solution Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 125000002791 glucosyl group Chemical group C1([C@H](O)[C@@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005374 membrane filtration Methods 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 229920000620 organic polymer Polymers 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 238000004375 physisorption Methods 0.000 description 1
- 239000000419 plant extract Substances 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001508 potassium citrate Substances 0.000 description 1
- 229960002635 potassium citrate Drugs 0.000 description 1
- QEEAPRPFLLJWCF-UHFFFAOYSA-K potassium citrate (anhydrous) Chemical compound [K+].[K+].[K+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O QEEAPRPFLLJWCF-UHFFFAOYSA-K 0.000 description 1
- 235000011082 potassium citrates Nutrition 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 239000012146 running buffer Substances 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- PRWXGRGLHYDWPS-UHFFFAOYSA-L sodium malonate Chemical compound [Na+].[Na+].[O-]C(=O)CC([O-])=O PRWXGRGLHYDWPS-UHFFFAOYSA-L 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- 239000008137 solubility enhancer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000012799 strong cation exchange Methods 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical compound NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/16—Extraction; Separation; Purification by chromatography
- C07K1/18—Ion-exchange chromatography
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D15/00—Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08—Selective adsorption, e.g. chromatography
- B01D15/26—Selective adsorption, e.g. chromatography characterised by the separation mechanism
- B01D15/36—Selective adsorption, e.g. chromatography characterised by the separation mechanism involving ionic interaction, e.g. ion-exchange, ion-pair, ion-suppression or ion-exclusion
- B01D15/361—Ion-exchange
- B01D15/362—Cation-exchange
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/26—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against hormones ; against hormone releasing or inhibiting factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Analytical Chemistry (AREA)
- Microbiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Mycology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Endocrinology (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
タンパク質、特に免疫グロブリンは、今日の医療ポートフォリオにおいて重要な役割を果たしている。医薬用途で使用するためのポリペプチドは主に、CHO細胞、NS0細胞、Sp2/0細胞、COS細胞、HEK細胞、BHK細胞、PER.C6(登録商標)細胞などの哺乳動物細胞において産生されている。
- 非イオン性ポリマーと添加剤とを含む溶液を、抗体が吸着されたクロマトグラフィー材料にアプライする工程であって、単量体形態の抗体がイオン交換クロマトグラフィー材料に吸着されたままである、工程、ならびに、
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態の抗体を回収し、それによって単量体形態の抗体を産生する工程
を含む、単量体形態の抗体を産生するための方法である。
- 非イオン性ポリマーと添加剤とを含む溶液を、ポリペプチドが吸着されたクロマトグラフィー材料にアプライする工程であって、単量体形態のポリペプチドがイオン交換クロマトグラフィー材料に吸着されたままである、工程、および
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態のポリペプチドを回収し、それによって宿主細胞タンパク質含量を低減させたポリペプチド調製物を産生する工程
を含む、宿主細胞タンパク質含量を低減させたポリペプチド調製物を産生するための方法であって、
該調製物は、哺乳動物細胞の培養上清、特にCHO細胞の培養上清から得られるものである。
- 添加剤が存在しない溶液中で、ポリペプチドの50%未満が溶液中に溶解して残存する非イオン性ポリマーの濃度を決定する工程、および
- 前工程で決定された濃度の非イオン性ポリマーが存在する溶液中で、ポリペプチドの95%超が溶液中に溶解して残存する添加剤の濃度を決定する工程
を含む、ポリペプチドのイオン交換クロマトグラフィーで使用するための非イオン性ポリマーおよび添加剤の濃度を決定するための方法であって、
それによって非イオン性ポリマーおよび添加剤の濃度を決定する。
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態の抗体を回収し、それによって単量体形態の抗体を産生する工程
を含む、単量体形態の抗体を産生するための方法であって、
ここで、クロマトグラフィーの分離効率(分離度)は、非イオン性ポリマーの非存在下でのクロマトグラフィーに比べて向上し、かつ
非イオン性ポリマーの採用された濃度により、添加剤の非存在下において、抗体の部分的または完全な沈殿がもたらされる。
- 非イオン性ポリマーと添加剤とを任意で含む第1の溶液をイオン交換クロマトグラフィー材料にアプライし、それによってイオン交換クロマトグラフィー材料を平衡化する工程、
- 平衡化したクロマトグラフィー材料にポリペプチドを含む緩衝溶液をアプライし、それによってポリペプチドをクロマトグラフィー材料に吸着させる工程であって、該溶液が非イオン性ポリマーおよび添加剤を本質的に含まない、工程、
- 非イオン性ポリマーと添加剤とを含む緩衝溶液をクロマトグラフィー材料にアプライする工程であって、単量体形態のポリペプチドがイオン交換クロマトグラフィー材料に吸着されたままである、工程、および
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態のポリペプチドを回収する工程
を含む。
[本発明1001]
- ポリ(エチレングリコール)と、ソルビトール、キシリトール、グリセロール、グリシン、ベタイン、プロリン、フルクトース、グルコース、およびスクロースを含む群より選択される1種またはそれ以上の添加剤とを含む溶液を、IgGクラスの抗体が吸着されたカチオン交換クロマトグラフィー材料にアプライする工程であって、単量体形態のIgGクラスの抗体がカチオン交換クロマトグラフィー材料に吸着されたままである、工程、ならびに
- ポリ(エチレングリコール)と前記1種またはそれ以上の添加剤とを含む溶液をアプライすることによって、カチオン交換クロマトグラフィー材料から単量体形態のIgGクラスの抗体を回収する工程
を含む、単量体形態のIgGクラスの抗体を産生するための方法であって、
ポリ(エチレングリコール)ポリマーが、約5〜15重量%の濃度を有し、かつ/または前記添加剤が、3〜25重量%の濃度を有する、方法。
[本発明1002]
- ポリ(エチレングリコール)と、ソルビトール、キシリトール、グリセロール、グリシン、ベタイン、プロリン、フルクトース、グルコース、およびスクロースを含む群より選択される1種またはそれ以上の添加剤とを含む溶液を、IgGクラスの抗体が吸着されたカチオン交換クロマトグラフィー材料にアプライする工程であって、単量体形態のIgGクラスの抗体がカチオン交換クロマトグラフィー材料に吸着されたままである、工程、ならびに
- ポリ(エチレングリコール)と、ソルビトール、キシリトール、グリセロール、グリシン、ベタイン、プロリン、フルクトース、グルコース、およびスクロースを含む群より選択される1種またはそれ以上の添加剤と、溶出化合物とを含む溶液をアプライすることによって、カチオン交換クロマトグラフィー材料から単量体形態のIgGクラスの抗体を回収し、それによって、宿主細胞タンパク質含量を低減させたIgGクラスの抗体調製物を産生する工程
を含む、宿主細胞タンパク質含量を低減させたIgGクラスの抗体調製物を産生するための方法であって、
ポリ(エチレングリコール)が、約5〜15重量%の濃度を有し、かつ/または前記添加剤が、3〜25重量%の濃度を有する、方法。
[本発明1003]
ポリ(エチレングリコール)が約7〜13重量%の濃度を有し、かつ/または前記添加剤が3〜25重量%の濃度を有することを特徴とする、前記本発明のいずれかの方法。
[本発明1004]
ポリ(エチレングリコール)が約7〜13重量%の濃度を有し、かつ/または前記添加剤が12〜25重量%の濃度を有することを特徴とする、前記本発明のいずれかの方法。
[本発明1005]
ポリ(エチレングリコール)が約7〜13重量%の濃度を有し、かつ/または前記添加剤が12〜20重量%の濃度を有することを特徴とする、前記本発明のいずれかの方法。
[本発明1006]
ポリ(エチレングリコール)が約3,500 Da±20%の分子量を有することを特徴とする、前記本発明のいずれかの方法。
[本発明1007]
前記添加剤がソルビトールであることを特徴とする、前記本発明のいずれかの方法。
[本発明1008]
単量体形態の抗体が100 kDa〜200 kDaの分子量を有することを特徴とする、前記本発明のいずれかの方法。
[本発明1009]
- ポリ(エチレングリコール)と、ソルビトール、キシリトール、グリセロール、グリシン、ベタイン、プロリン、フルクトース、グルコース、およびスクロースを含む群より選択される1種またはそれ以上の添加剤とを任意で含む第1の溶液を、カチオン交換クロマトグラフィー材料にアプライし、それによって該材料を平衡化する工程、
- 平衡化した該クロマトグラフィー材料にIgGクラスの抗体を含む溶液をアプライし、それによって該クロマトグラフィー材料にロードする工程、
- ポリ(エチレングリコール)と、ソルビトール、キシリトール、グリセロール、グリシン、ベタイン、プロリン、フルクトース、グルコース、およびスクロースを含む群より選択される1種またはそれ以上の添加剤とを含む溶液を、該クロマトグラフィー材料にアプライし、それによって、単量体形態のIgGクラスの抗体を該クロマトグラフィー材料から脱着/溶出することにより、単量体形態のIgGクラスの抗体を産生する工程
をさらに含むことを特徴とする、前記本発明のいずれかの方法。
本明細書には、単量体形態の関心対象ポリペプチドを、凝集形態の関心対象ポリペプチドなどの他の成分から分離することによって、単量体形態の関心対象ポリペプチドを産生するための、少なくとも1つのクロマトグラフィー工程を含む方法が報告される。一態様において、方法は、関心対象のポリペプチドを含む溶液とカチオン交換クロマトグラフィー材料とを接触させる工程を含み、その際、クロマトグラフィー材料との接触工程は非イオン性ポリマーおよび添加剤の非存在下で行われ、かつ回収工程は非イオン性ポリマーおよび添加剤の存在下で行われる。
(1) 疎水性:ノルロイシン, Met, Ala, Val, Leu, Ile;
(2) 中性親水性:Cys, Ser, Thr, Asn, Gln;
(3) 酸性:Asp, Glu;
(4) 塩基性:His, Lys, Arg;
(5) 鎖配向に影響を及ぼす残基:Gly, Pro;
(6) 芳香族:Trp, Tyr, Phe。
- 添加剤が存在しない溶液中で、ポリペプチドの50%未満が溶液中に残存する非イオン性ポリマーの濃度を決定する工程、
- 前工程で決定された濃度の非イオン性ポリマーが存在する溶液中で、ポリペプチドの95%超が溶液中に残存する添加剤の濃度を決定する工程、
を含み、それによって、非イオン性ポリマーおよび添加剤の濃度を決定する。
- 非イオン性ポリマーと添加剤とを含む溶液を、抗体が吸着されたクロマトグラフィー材料にアプライする工程であって、単量体形態の抗体がイオン交換クロマトグラフィー材料に吸着されたままである、工程、および
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態の抗体を回収し、それによって宿主細胞タンパク質含量を低減させた抗体調製物を産生する工程
を含む。
a)抗体をコードする核酸を含む哺乳動物細胞を培養し、該細胞または培養培地から抗体を回収する工程、
b)以下の工程:
- 非イオン性ポリマーと添加剤とを含む溶液を、抗体が吸着されたクロマトグラフィー材料にアプライする工程であって、単量体形態の抗体がイオン交換クロマトグラフィー材料に吸着されたままである、工程、および
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態の抗体を回収し、それによって抗体を産生する工程
を含むカチオン交換クロマトグラフィー法で抗体を精製する工程
を含む。
- クロマトグラフィーカラムに充填されたクロマトグラフィー材料を平衡化するサブ工程、
- 平衡化したクロマトグラフィー材料に、関心対象のポリペプチドを含む溶液を、クロマトグラフィー材料への該ポリペプチドの吸着/結合に適した条件下でアプライし、それによってクロマトグラフィーカラムにロードするサブ工程、
- 必要に応じて、クロマトグラフィー材料から該ポリペプチドを脱着/溶出することなく、クロマトグラフィー材料を洗浄するサブ工程、
- 回収溶液をクロマトグラフィー材料にアプライし、それによってクロマトグラフィー材料から該ポリペプチドを脱着/溶出することによって、関心対象のポリペプチドを回収するサブ工程。
a)該抗体をコードする核酸を含む哺乳動物細胞を培養し、該細胞または培養培地から該抗体を回収する工程、
b)以下の工程:
- 非イオン性ポリマーと添加剤とを含む溶液を、該抗体が吸着されたクロマトグラフィー材料にアプライする工程であって、単量体形態の4本鎖完全長抗体がイオン交換クロマトグラフィー材料に吸着されたままである、工程、および
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態の4本鎖完全長抗体を回収し、それによって該抗体を産生する工程
を含むカチオン交換クロマトグラフィー法で該抗体を精製する工程
を含む。
- 非イオン性ポリマーと添加剤とを任意で含む第1の溶液をイオン交換クロマトグラフィー材料にアプライし、それによってイオン交換クロマトグラフィー材料を平衡化する工程、
- 平衡化したクロマトグラフィー材料にポリペプチドを含む緩衝溶液をアプライし、それによってポリペプチドをクロマトグラフィー材料に吸着させる工程であって、該溶液が非イオン性ポリマーおよび添加剤を本質的に含まない、工程、
- 非イオン性ポリマーと添加剤とを含む緩衝溶液をクロマトグラフィー材料にアプライする工程であって、単量体形態のポリペプチドがイオン交換クロマトグラフィー材料に吸着されたままである、工程、ならびに
- 非イオン性ポリマーと添加剤と溶出化合物とを含む溶液をアプライすることによって、イオン交換クロマトグラフィー材料から単量体形態のポリペプチドを回収する工程
を含む。一態様では、回収する工程は勾配溶出により行う。
各抗体(抗IL17抗体:配列についてはWO 2010/034443参照;抗CSF-1R抗体:配列についてはPCT/EP2010/069090参照;抗Ang2/VEGF抗体:配列についてはWO 2010/040508参照)は第1段階においてプロテインAアフィニティクロマトグラフィーにより精製した。プロテインAカラムからの溶出は酸性条件下で実施した。その後サンプルを1Mクエン酸で約pH3.5に調整し、約1時間インキュベートした。続いて、1M TRIS/HCl, pH8〜9または1M TRIS溶液(TRIS:トリス-ヒドロキシメチル-アミノ-メタン)を加えることによってpHを5.0または5.5に調整した。4℃で12〜18時間インキュベートした後、サンプルを深層濾過した。このサンプルは5mg/ml〜20 mg/mlのタンパク質濃度を有する溶液である。この物質は以下では調整済みプロテインA溶出液と呼ばれ、カチオン交換クロマトグラフィー材料にロードするために調製された溶出液である。
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
交換材料: Poros 50HS
カラム: 内径8mm、長さ100mm、体積5.03ml
流速: 90cm/h(=0.75ml/分)
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、pH5.0に調整、4カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液1: 10mMクエン酸ナトリウム緩衝液、pH5.0に調整、1カラム体積
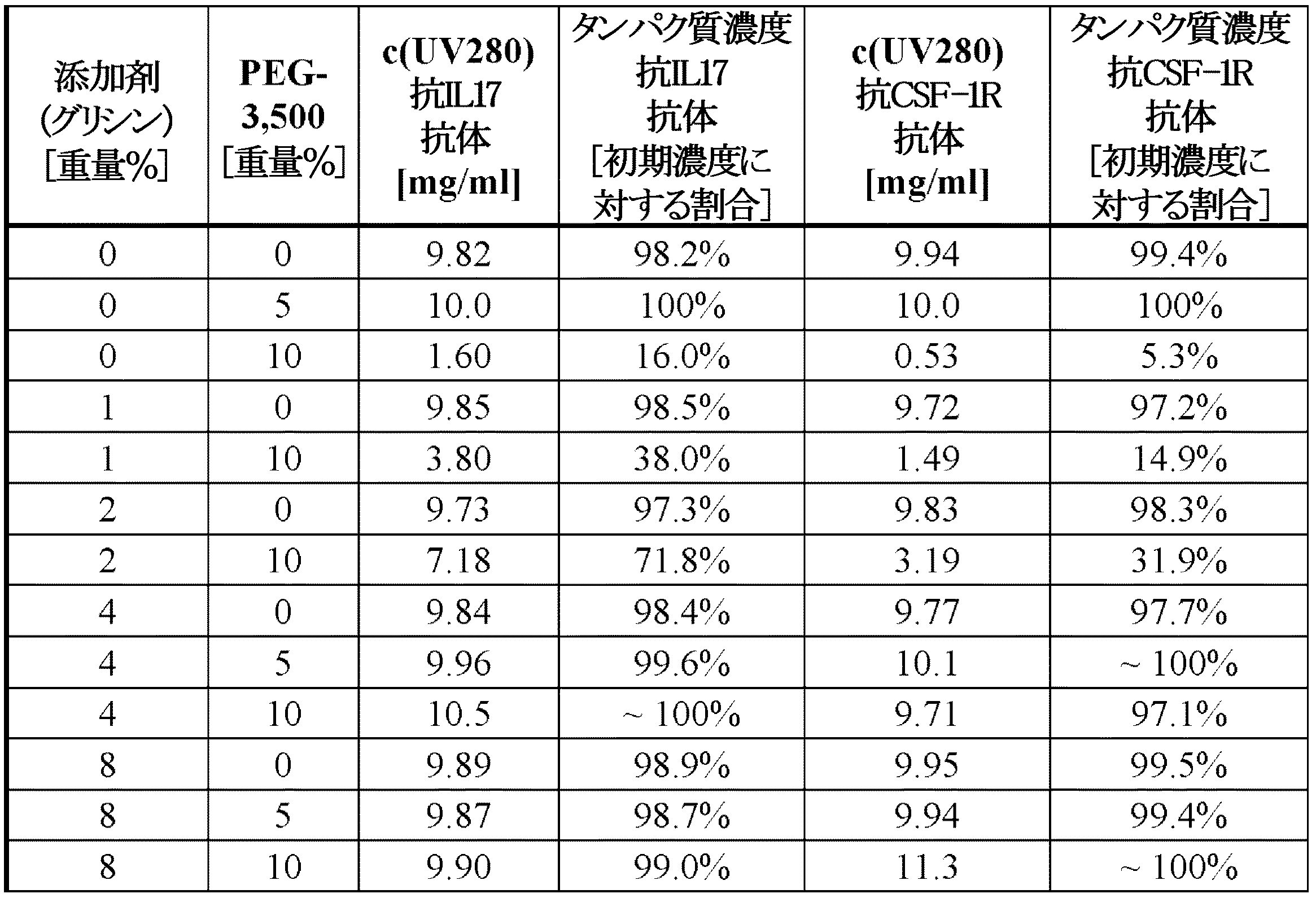
洗浄液2: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 35mM酢酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整、4カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 35mM酢酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整、1カラム体積
溶出液: 750mM塩化ナトリウムを含有する、35mM酢酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整、
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 25mM MES緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.5に調整、4カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 35mM MES緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.5に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、35mM MES緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.5に調整、
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
交換材料: SP Sepharose FF
平衡化溶液: 30mMクエン酸ナトリウム緩衝液、pH5.0に調整、4カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液1: 30mMクエン酸ナトリウム緩衝液、pH5.0に調整、1カラム体積
洗浄液2: 30mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出液: 750mM塩化ナトリウムを含有する、30mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
交換材料: Toyopearl CM-650 M
平衡化溶液: 30mMクエン酸ナトリウム緩衝液、pH5.0に調整、4カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液1: 30mMクエン酸ナトリウム緩衝液、pH5.0に調整、1カラム体積
洗浄液2: 30mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出液: 750mM塩化ナトリウムを含有する、30mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
交換材料: CM Sepharose FF
平衡化溶液: 30mMクエン酸ナトリウム緩衝液、pH5.0に調整、4カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液1: 30mMクエン酸ナトリウム緩衝液、pH5.0に調整、1カラム体積
洗浄液2: 30mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出液: 750mM塩化ナトリウムを含有する、30mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、15%(w/w) D-ソルビトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、20%(w/w)キシリトール、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、20%(w/w)キシリトール、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、20%(w/w)キシリトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、20%(w/w)キシリトール、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、20%(w/w)キシリトール、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、20%(w/w)キシリトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、30%(w/w)グリセロール、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、30%(w/w)グリセロール、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、30%(w/w)グリセロール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、30%(w/w)グリセロール、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、30%(w/w)グリセロール、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、30%(w/w)グリセロール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w)サッカロース、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w)サッカロース、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w)サッカロース、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w)サッカロース、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w)サッカロース、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w)サッカロース、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w) D-フルクトース、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w) D-フルクトース、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w) D-フルクトース、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w) D-フルクトース、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w) D-フルクトース、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、25%(w/w) D-フルクトース、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)グリシン、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)グリシン、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)グリシン、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)グリシン、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)グリシン、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)グリシン、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w) L-プロリン、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w) L-プロリン、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w) L-プロリン、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w) L-プロリン、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w) L-プロリン、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w) L-プロリン、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)ベタイン、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)ベタイン、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)ベタイン、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗CSF-1R抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)ベタイン、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)ベタイン、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 3,500 Da)、8%(w/w)ベタイン、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 400 Da)、15%(w/w)ソルビトール、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 400 Da)、15%(w/w)ソルビトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、22.5カラム体積
クロマトグラフィー条件
ポリペプチド: 抗IL17抗体
平衡化溶液: 10mMクエン酸ナトリウム緩衝液、pH5.0に調整、2カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 10,000 Da)、15%(w/w)ソルビトール、pH5.0に調整、4カラム体積
溶出液: 750mM塩化ナトリウムを含有する、10mMクエン酸ナトリウム緩衝液、10%(w/w)ポリ(エチレングリコール)(MW 10,000 Da)、15%(w/w)ソルビトール、pH5.0に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、30カラム体積
クロマトグラフィー条件
ポリペプチド: 抗Ang2/VEGF抗体
交換材料: Poros 50HS
カラム: 内径11mm、長さ250mm、体積23ml
流速: 90cm/h
平衡化溶液: 40mMリン酸ナトリウム緩衝液、pH5.0に調整、3カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 40mMリン酸ナトリウム緩衝液、pH5.0に調整、3カラム体積
溶出液: 40mMリン酸ナトリウム緩衝液、pH7.5に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、12カラム体積
クロマトグラフィー条件
ポリペプチド: 抗Ang2/VEGF抗体
交換材料: Poros 50HS
カラム: 内径11mm、長さ250mm、体積23ml
流速: 90cm/h
平衡化溶液: 40mMリン酸ナトリウム緩衝液、5%PEG 4000、pH5.0に調整、3カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 40mMリン酸ナトリウム緩衝液、5%PEG 4000、pH5.0に調整、3カラム体積
溶出液: 40mMリン酸ナトリウム緩衝液、5%PEG 4000、pH7.5に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、12カラム体積
クロマトグラフィー条件
ポリペプチド: 抗Ang2/VEGF抗体
交換材料: Poros 50HS
カラム: 内径11mm、長さ250mm、体積23ml
流速: 90cm/h
平衡化溶液: 40mMリン酸ナトリウム緩衝液、pH5.0に調整、3カラム体積
ローディング: クロマトグラフィー材料1リットルあたり20gのタンパク質
洗浄液: 40mMリン酸ナトリウム緩衝液、10%PEG 4000、8%グリシン、pH5.0に調整、3カラム体積
溶出液: 40mMリン酸ナトリウム緩衝液、10%PEG 4000、8%グリシン、pH7.5に調整
溶出法: 0%(v/v)から100%(v/v)溶出液までの線形勾配、12カラム体積
Claims (5)
- - ポリ(エチレングリコール)とグリシンとを任意で含む第1の溶液を、カチオン交換クロマトグラフィー材料にアプライし、それによって該材料を平衡化する工程、
- 平衡化した該クロマトグラフィー材料にIgGクラスの抗体を含む溶液をアプライし、それによって該クロマトグラフィー材料にロードする工程、および
- ポリ(エチレングリコール)とグリシンとを含む溶液を、該クロマトグラフィー材料にアプライし、それによって、単量体形態のIgGクラスの抗体を該クロマトグラフィー材料から脱着/溶出することにより、単量体形態のIgGクラスの抗体を産生する工程
を含む、単量体形態のIgGクラスの抗体を産生するための方法であって、
ポリ(エチレングリコール)が、5〜15重量%の濃度を有し、かつグリシンが、4〜8重量%の濃度を有する、前記方法。 - - ポリ(エチレングリコール)とグリシンとを任意で含む第1の溶液を、カチオン交換クロマトグラフィー材料にアプライし、それによって該材料を平衡化する工程、
- 平衡化した該クロマトグラフィー材料にIgGクラスの抗体を含む溶液をアプライし、それによって該クロマトグラフィー材料にロードする工程、および
- ポリ(エチレングリコール)とグリシンとを含む溶液を、該クロマトグラフィー材料にアプライし、それによって、単量体形態のIgGクラスの抗体を該クロマトグラフィー材料から脱着/溶出することにより、単量体形態のIgGクラスの抗体を産生する工程
を含む、宿主細胞タンパク質含量を低減させたIgGクラスの抗体調製物を産生するための方法であって、
ポリ(エチレングリコール)が、5〜15重量%の濃度を有し、かつグリシンが、4〜8重量%の濃度を有する、前記方法。 - ポリ(エチレングリコール)が、7〜13重量%の濃度を有する、請求項1から2のいずれか一項記載の方法。
- ポリ(エチレングリコール)が3,500 Da±20%の分子量を有することを特徴とする、請求項1から3のいずれか一項記載の方法。
- 単量体形態の抗体が100 kDa〜200 kDaの分子量を有することを特徴とする、請求項1から4のいずれか一項記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP11158523.8 | 2011-03-16 | ||
| EP11158523 | 2011-03-16 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013558420A Division JP5984854B2 (ja) | 2011-03-16 | 2012-03-14 | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018000397A Division JP6523491B2 (ja) | 2011-03-16 | 2018-01-05 | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017019805A JP2017019805A (ja) | 2017-01-26 |
| JP6273326B2 true JP6273326B2 (ja) | 2018-01-31 |
Family
ID=45819216
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013558420A Active JP5984854B2 (ja) | 2011-03-16 | 2012-03-14 | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー |
| JP2016151624A Active JP6273326B2 (ja) | 2011-03-16 | 2016-08-02 | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー |
| JP2018000397A Active JP6523491B2 (ja) | 2011-03-16 | 2018-01-05 | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013558420A Active JP5984854B2 (ja) | 2011-03-16 | 2012-03-14 | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018000397A Active JP6523491B2 (ja) | 2011-03-16 | 2018-01-05 | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー |
Country Status (9)
| Country | Link |
|---|---|
| US (3) | US9394337B2 (ja) |
| EP (2) | EP2686334B2 (ja) |
| JP (3) | JP5984854B2 (ja) |
| ES (2) | ES2656167T5 (ja) |
| HR (2) | HRP20180028T4 (ja) |
| PL (2) | PL2686334T5 (ja) |
| SG (1) | SG193378A1 (ja) |
| SI (2) | SI3318571T1 (ja) |
| WO (1) | WO2012123488A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2656167T5 (es) | 2011-03-16 | 2021-03-26 | Hoffmann La Roche | Cromatografía de intercambio iónico con selectividad mejorada para la separación de monómeros, agregados y fragmentos polipeptídicos mediante la modulación de la fase móvil |
| US9573810B2 (en) * | 2012-07-21 | 2017-02-21 | K-Technologies, Inc. | Processes for the removal and recovery of minor elements in wet-process phosphoric acid |
| KR101838039B1 (ko) | 2013-03-14 | 2018-03-14 | 이엠디 밀리포어 코포레이션 | 단백질 a 기반 크로마토그래피를 이용한 단백질 순도의 증가 방법 |
| GB2516808A (en) * | 2013-05-31 | 2015-02-11 | Innova Biosciences Ltd | Antibody composition and buffer system therefor |
| HK1223108A1 (zh) * | 2013-08-19 | 2017-07-21 | F. Hoffmann-La Roche Ag | 用羟基磷灰石层析分离双特异性抗体和双特异性抗体生产副产物 |
| WO2021064066A1 (en) * | 2019-10-04 | 2021-04-08 | Merck Patent Gmbh | Elution of monoclonal antibodies in protein a affinity chromatography |
| WO2022133262A1 (en) * | 2020-12-20 | 2022-06-23 | Regeneron Pharmaceuticals, Inc. | Methods for identification of scrambled disulfides in biomolecules |
| CN113388026B (zh) * | 2021-08-03 | 2022-09-27 | 江西理工大学 | 一种螺旋藻藻蓝蛋白和藻油的同步提取方法 |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5204244A (en) | 1987-10-27 | 1993-04-20 | Oncogen | Production of chimeric antibodies by homologous recombination |
| US5202238A (en) | 1987-10-27 | 1993-04-13 | Oncogen | Production of chimeric antibodies by homologous recombination |
| US5429746A (en) | 1994-02-22 | 1995-07-04 | Smith Kline Beecham Corporation | Antibody purification |
| EP1500661A1 (en) | 1998-06-01 | 2005-01-26 | Genetech, Inc. | Separation of protein monomers from aggregates by use of ion-exchange chromatography |
| JP4685238B2 (ja) * | 1998-06-09 | 2011-05-18 | ツエー・エス・エル・ベーリング・アクチエンゲゼルシヤフト | 静脈投与用免疫グロブリン及び他の免疫グロブリン生成物の製造法 |
| IL140155A (en) | 1998-06-09 | 2005-12-18 | Statens Seruminstitut | Process for producing immunoglobulins for intravenous administration and other immunoglobulin products |
| DE19836213A1 (de) * | 1998-08-11 | 2000-02-24 | Gerhard Harry Scholz | Verfahren zur Elution von Biomolekülen von Chromatographie-Materialien |
| WO2004013162A2 (en) | 2002-08-06 | 2004-02-12 | Akzo Nobel Nv. | Increased dynamic binding capacity in ion exchange chromatography by addition of polyethylene glycol |
| CN1208346C (zh) | 2003-04-09 | 2005-06-29 | 中国科学院过程工程研究所 | 血红蛋白-人血清白蛋白偶联物制备血液代用品及其制备方法 |
| SE0400886D0 (sv) | 2004-04-02 | 2004-04-02 | Amersham Biosciences Ab | Process of purification |
| KR100554481B1 (ko) * | 2004-06-30 | 2006-03-03 | 씨제이 주식회사 | 반코마이신 염산염의 정제방법 |
| TWI320788B (en) | 2005-05-25 | 2010-02-21 | Hoffmann La Roche | Method for the purification of antibodies |
| EP2049570B1 (en) * | 2006-06-01 | 2016-08-10 | President and Fellows of Harvard College | Purification of a bivalently active antibody using a non-chromatographic method |
| US7691980B2 (en) | 2007-01-09 | 2010-04-06 | Bio-Rad Laboratories, Inc. | Enhanced capacity and purification of antibodies by mixed mode chromatography in the presence of aqueous-soluble nonionic organic polymers |
| JP2010534664A (ja) * | 2007-07-23 | 2010-11-11 | セントコア・オーソ・バイオテツク・インコーポレーテツド | Il−17拮抗薬を用いた線維症関連疾患治療の方法及び組成物 |
| EP2261254A3 (en) * | 2007-12-21 | 2011-04-13 | Amgen, Inc | Anti-amyloid antibodies and uses thereof |
| EP2242762B1 (en) | 2008-01-18 | 2015-12-16 | Bio-Rad Laboratories, Inc. | Enhanced purification of antibodies and antibody fragments by apatite chromatography |
| EP2291388A4 (en) † | 2008-06-03 | 2013-02-13 | Patrys Ltd | METHOD FOR PURIFYING ANTIBODIES |
| ES2493042T3 (es) | 2008-09-29 | 2014-09-11 | Roche Glycart Ag | Anticuerpos contra la IL-17 humana y usos de los mismos |
| US8268314B2 (en) | 2008-10-08 | 2012-09-18 | Hoffmann-La Roche Inc. | Bispecific anti-VEGF/anti-ANG-2 antibodies |
| EP3067417B1 (en) | 2009-06-16 | 2018-07-25 | Genzyme Corporation | Improved methods for purification of recombinant aav vectors |
| US8394922B2 (en) * | 2009-08-03 | 2013-03-12 | Medarex, Inc. | Antiproliferative compounds, conjugates thereof, methods therefor, and uses thereof |
| TW201138821A (en) * | 2010-03-26 | 2011-11-16 | Roche Glycart Ag | Bispecific antibodies |
| ES2656167T5 (es) | 2011-03-16 | 2021-03-26 | Hoffmann La Roche | Cromatografía de intercambio iónico con selectividad mejorada para la separación de monómeros, agregados y fragmentos polipeptídicos mediante la modulación de la fase móvil |
-
2012
- 2012-03-14 ES ES12708546T patent/ES2656167T5/es active Active
- 2012-03-14 SI SI201231907T patent/SI3318571T1/sl unknown
- 2012-03-14 WO PCT/EP2012/054449 patent/WO2012123488A1/en not_active Ceased
- 2012-03-14 EP EP12708546.2A patent/EP2686334B2/en active Active
- 2012-03-14 SG SG2013067947A patent/SG193378A1/en unknown
- 2012-03-14 HR HRP20180028TT patent/HRP20180028T4/hr unknown
- 2012-03-14 JP JP2013558420A patent/JP5984854B2/ja active Active
- 2012-03-14 PL PL12708546T patent/PL2686334T5/pl unknown
- 2012-03-14 ES ES17201391T patent/ES2865449T3/es active Active
- 2012-03-14 PL PL17201391T patent/PL3318571T3/pl unknown
- 2012-03-14 SI SI201231179T patent/SI2686334T2/sl unknown
- 2012-03-14 EP EP17201391.4A patent/EP3318571B1/en active Active
-
2013
- 2013-09-12 US US14/025,622 patent/US9394337B2/en active Active
-
2016
- 2016-06-16 US US15/184,883 patent/US10377793B2/en active Active
- 2016-08-02 JP JP2016151624A patent/JP6273326B2/ja active Active
-
2018
- 2018-01-05 JP JP2018000397A patent/JP6523491B2/ja active Active
-
2019
- 2019-06-24 US US16/450,827 patent/US20200148719A1/en not_active Abandoned
-
2021
- 2021-04-13 HR HRP20210588TT patent/HRP20210588T1/hr unknown
Also Published As
| Publication number | Publication date |
|---|---|
| HRP20210588T1 (hr) | 2021-05-28 |
| PL2686334T3 (pl) | 2018-03-30 |
| EP3318571A1 (en) | 2018-05-09 |
| US20170107249A1 (en) | 2017-04-20 |
| WO2012123488A1 (en) | 2012-09-20 |
| US20200148719A1 (en) | 2020-05-14 |
| SI2686334T1 (en) | 2018-03-30 |
| JP5984854B2 (ja) | 2016-09-06 |
| JP2014511829A (ja) | 2014-05-19 |
| ES2656167T5 (es) | 2021-03-26 |
| EP2686334B2 (en) | 2020-07-01 |
| SG193378A1 (en) | 2013-10-30 |
| PL2686334T5 (pl) | 2020-10-19 |
| ES2865449T3 (es) | 2021-10-15 |
| US20140081000A1 (en) | 2014-03-20 |
| JP2017019805A (ja) | 2017-01-26 |
| HRP20180028T4 (hr) | 2020-10-02 |
| JP2018058900A (ja) | 2018-04-12 |
| EP2686334B1 (en) | 2017-11-15 |
| HRP20180028T1 (hr) | 2018-02-09 |
| SI2686334T2 (sl) | 2020-10-30 |
| SI3318571T1 (sl) | 2021-08-31 |
| JP6523491B2 (ja) | 2019-06-05 |
| US9394337B2 (en) | 2016-07-19 |
| PL3318571T3 (pl) | 2021-07-05 |
| EP3318571B1 (en) | 2021-02-17 |
| ES2656167T3 (es) | 2018-02-23 |
| EP2686334A1 (en) | 2014-01-22 |
| US10377793B2 (en) | 2019-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6273326B2 (ja) | 移動相の調整によって、ポリペプチド単量体、凝集物およびフラグメントを分離するための選択性を向上させた、イオン交換クロマトグラフィー | |
| KR101921767B1 (ko) | 단백질 정제 | |
| JP5448825B2 (ja) | 非凝集抗体Fcドメインの製造方法 | |
| US10246484B2 (en) | Method for purifying recombinant protein | |
| RU2586515C2 (ru) | Препарат антитела, обогащенного изоформами и способ его получения | |
| TW201522365A (zh) | 純化抗體的方法 | |
| US20140371427A1 (en) | IgG2 DISULFIDE ISOFORM SEPARATION | |
| JP2016519144A (ja) | 最小限の単量体の分離を伴う組換えポリクローナル多量体の分離 | |
| JP2022540838A (ja) | 眼科用タンパク質医薬品の精製方法(Refining method of ophthalmic protein pharmaceuticals) | |
| CN114539416B (zh) | 一种双特异性抗体的层析纯化工艺 | |
| JP2016504337A (ja) | イオン交換クロマトグラフィーを使用して高マンノースグリコフォームのレベルを制御する方法 | |
| CN110724204B (zh) | Fc融合蛋白的纯化方法 | |
| KR20220101168A (ko) | 이온 교환 크로마토그래피 동안 항체의 수율을 증가시키는 방법 | |
| US20240383945A1 (en) | Purification method of antibody composition | |
| WO2025219869A1 (en) | Methods of purifying immunoglobulins comprising n-terminal glutamine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170626 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170925 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20171207 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180105 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6273326 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |