JP6267190B2 - 悪液質の予防用または治療用組成物 - Google Patents
悪液質の予防用または治療用組成物 Download PDFInfo
- Publication number
- JP6267190B2 JP6267190B2 JP2015511378A JP2015511378A JP6267190B2 JP 6267190 B2 JP6267190 B2 JP 6267190B2 JP 2015511378 A JP2015511378 A JP 2015511378A JP 2015511378 A JP2015511378 A JP 2015511378A JP 6267190 B2 JP6267190 B2 JP 6267190B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- cachexia
- peptide
- preventing
- treatment
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 206010006895 Cachexia Diseases 0.000 title claims description 88
- 239000000203 mixture Substances 0.000 title claims description 55
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 109
- 238000011282 treatment Methods 0.000 claims description 42
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 18
- 230000002265 prevention Effects 0.000 claims description 14
- 208000024891 symptom Diseases 0.000 claims description 12
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 11
- 206010028980 Neoplasm Diseases 0.000 claims description 8
- 239000008194 pharmaceutical composition Substances 0.000 claims description 8
- 201000011510 cancer Diseases 0.000 claims description 7
- 239000007924 injection Substances 0.000 claims description 6
- 238000002347 injection Methods 0.000 claims description 6
- 208000019693 Lung disease Diseases 0.000 claims description 5
- 230000009885 systemic effect Effects 0.000 claims description 5
- 208000034189 Sclerosis Diseases 0.000 claims description 4
- 239000004480 active ingredient Substances 0.000 claims description 4
- 230000032683 aging Effects 0.000 claims description 4
- 230000001684 chronic effect Effects 0.000 claims description 4
- 208000030507 AIDS Diseases 0.000 claims description 3
- 208000023275 Autoimmune disease Diseases 0.000 claims description 3
- 206010007558 Cardiac failure chronic Diseases 0.000 claims description 3
- 208000011231 Crohn disease Diseases 0.000 claims description 3
- 201000003883 Cystic fibrosis Diseases 0.000 claims description 3
- 206010020100 Hip fracture Diseases 0.000 claims description 3
- 208000001647 Renal Insufficiency Diseases 0.000 claims description 3
- 208000015181 infectious disease Diseases 0.000 claims description 3
- 201000006370 kidney failure Diseases 0.000 claims description 3
- 210000004185 liver Anatomy 0.000 claims description 3
- 206010025135 lupus erythematosus Diseases 0.000 claims description 3
- 201000008827 tuberculosis Diseases 0.000 claims description 3
- 206010003246 arthritis Diseases 0.000 claims description 2
- 235000013305 food Nutrition 0.000 claims description 2
- 206010040047 Sepsis Diseases 0.000 claims 1
- 235000001014 amino acid Nutrition 0.000 description 37
- 229940024606 amino acid Drugs 0.000 description 35
- 150000001413 amino acids Chemical class 0.000 description 32
- 210000004027 cell Anatomy 0.000 description 32
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 25
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 25
- 108010088535 Pep-1 peptide Proteins 0.000 description 21
- 230000000694 effects Effects 0.000 description 21
- 208000009386 Experimental Arthritis Diseases 0.000 description 19
- 238000000034 method Methods 0.000 description 17
- 208000016261 weight loss Diseases 0.000 description 17
- 230000004580 weight loss Effects 0.000 description 17
- 238000002474 experimental method Methods 0.000 description 16
- 239000012634 fragment Substances 0.000 description 16
- 206010039073 rheumatoid arthritis Diseases 0.000 description 15
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 13
- 102000004889 Interleukin-6 Human genes 0.000 description 13
- 108090001005 Interleukin-6 Proteins 0.000 description 13
- 102000004196 processed proteins & peptides Human genes 0.000 description 13
- 241001465754 Metazoa Species 0.000 description 11
- 241000699670 Mus sp. Species 0.000 description 10
- 230000008859 change Effects 0.000 description 10
- 108010017842 Telomerase Proteins 0.000 description 9
- 239000002158 endotoxin Substances 0.000 description 8
- 230000006698 induction Effects 0.000 description 8
- 102000016267 Leptin Human genes 0.000 description 7
- 108010092277 Leptin Proteins 0.000 description 7
- -1 aromatic amino acids Chemical class 0.000 description 7
- 206010061428 decreased appetite Diseases 0.000 description 7
- 229940039781 leptin Drugs 0.000 description 7
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical compound O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 7
- 229920006008 lipopolysaccharide Polymers 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- 125000003412 L-alanyl group Chemical group [H]N([H])[C@@](C([H])([H])[H])(C(=O)[*])[H] 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 238000010171 animal model Methods 0.000 description 6
- 208000022531 anorexia Diseases 0.000 description 6
- 230000037396 body weight Effects 0.000 description 6
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 6
- 230000013595 glycosylation Effects 0.000 description 6
- 238000006206 glycosylation reaction Methods 0.000 description 6
- 239000007758 minimum essential medium Substances 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 239000002953 phosphate buffered saline Substances 0.000 description 6
- 239000011347 resin Substances 0.000 description 6
- 229920005989 resin Polymers 0.000 description 6
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 5
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 210000002027 skeletal muscle Anatomy 0.000 description 5
- 210000003411 telomere Anatomy 0.000 description 5
- 102000055501 telomere Human genes 0.000 description 5
- 108091035539 telomere Proteins 0.000 description 5
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 4
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 4
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 4
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 210000000577 adipose tissue Anatomy 0.000 description 4
- 208000007502 anemia Diseases 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 230000001965 increasing effect Effects 0.000 description 4
- 230000002757 inflammatory effect Effects 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 235000016709 nutrition Nutrition 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 229960005322 streptomycin Drugs 0.000 description 4
- 238000005406 washing Methods 0.000 description 4
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 206010007559 Cardiac failure congestive Diseases 0.000 description 3
- 102000008186 Collagen Human genes 0.000 description 3
- 108010035532 Collagen Proteins 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 206010019280 Heart failures Diseases 0.000 description 3
- 125000000570 L-alpha-aspartyl group Chemical group [H]OC(=O)C([H])([H])[C@]([H])(N([H])[H])C(*)=O 0.000 description 3
- 206010030113 Oedema Diseases 0.000 description 3
- 229930182555 Penicillin Natural products 0.000 description 3
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 3
- 208000037062 Polyps Diseases 0.000 description 3
- 239000012980 RPMI-1640 medium Substances 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- 238000002835 absorbance Methods 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 150000001720 carbohydrates Chemical group 0.000 description 3
- 210000000349 chromosome Anatomy 0.000 description 3
- 208000020832 chronic kidney disease Diseases 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 3
- 238000011221 initial treatment Methods 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 210000003205 muscle Anatomy 0.000 description 3
- 230000035764 nutrition Effects 0.000 description 3
- 229940049954 penicillin Drugs 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000004584 weight gain Effects 0.000 description 3
- 235000019786 weight gain Nutrition 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- DHBXNPKRAUYBTH-UHFFFAOYSA-N 1,1-ethanedithiol Chemical compound CC(S)S DHBXNPKRAUYBTH-UHFFFAOYSA-N 0.000 description 2
- 208000017667 Chronic Disease Diseases 0.000 description 2
- PHEDXBVPIONUQT-UHFFFAOYSA-N Cocarcinogen A1 Natural products CCCCCCCCCCCCCC(=O)OC1C(C)C2(O)C3C=C(C)C(=O)C3(O)CC(CO)=CC2C2C1(OC(C)=O)C2(C)C PHEDXBVPIONUQT-UHFFFAOYSA-N 0.000 description 2
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 108010002352 Interleukin-1 Proteins 0.000 description 2
- 102000000589 Interleukin-1 Human genes 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- 125000003440 L-leucyl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])C(C([H])([H])[H])([H])C([H])([H])[H] 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- 125000002842 L-seryl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])O[H] 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 206010028289 Muscle atrophy Diseases 0.000 description 2
- 230000004989 O-glycosylation Effects 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 102000002689 Toll-like receptor Human genes 0.000 description 2
- 108020000411 Toll-like receptor Proteins 0.000 description 2
- 102100024333 Toll-like receptor 2 Human genes 0.000 description 2
- 230000001464 adherent effect Effects 0.000 description 2
- 230000029936 alkylation Effects 0.000 description 2
- 238000005804 alkylation reaction Methods 0.000 description 2
- 230000004596 appetite loss Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 230000003833 cell viability Effects 0.000 description 2
- 230000007541 cellular toxicity Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 208000037976 chronic inflammation Diseases 0.000 description 2
- 230000006020 chronic inflammation Effects 0.000 description 2
- 238000012790 confirmation Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 235000012631 food intake Nutrition 0.000 description 2
- 230000037406 food intake Effects 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 235000003642 hunger Nutrition 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 208000019017 loss of appetite Diseases 0.000 description 2
- 235000021266 loss of appetite Nutrition 0.000 description 2
- 230000002132 lysosomal effect Effects 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 201000000585 muscular atrophy Diseases 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- PHEDXBVPIONUQT-RGYGYFBISA-N phorbol 13-acetate 12-myristate Chemical compound C([C@]1(O)C(=O)C(C)=C[C@H]1[C@@]1(O)[C@H](C)[C@H]2OC(=O)CCCCCCCCCCCCC)C(CO)=C[C@H]1[C@H]1[C@]2(OC(C)=O)C1(C)C PHEDXBVPIONUQT-RGYGYFBISA-N 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 230000037351 starvation Effects 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 231100000820 toxicity test Toxicity 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 238000000844 transformation Methods 0.000 description 2
- ZGYICYBLPGRURT-UHFFFAOYSA-N tri(propan-2-yl)silicon Chemical compound CC(C)[Si](C(C)C)C(C)C ZGYICYBLPGRURT-UHFFFAOYSA-N 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- ZPGDWQNBZYOZTI-SFHVURJKSA-N (2s)-1-(9h-fluoren-9-ylmethoxycarbonyl)pyrrolidine-2-carboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1C(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21 ZPGDWQNBZYOZTI-SFHVURJKSA-N 0.000 description 1
- REITVGIIZHFVGU-IBGZPJMESA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-[(2-methylpropan-2-yl)oxy]propanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](COC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 REITVGIIZHFVGU-IBGZPJMESA-N 0.000 description 1
- ADOHASQZJSJZBT-SANMLTNESA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-[1-[(2-methylpropan-2-yl)oxycarbonyl]indol-3-yl]propanoic acid Chemical compound C12=CC=CC=C2N(C(=O)OC(C)(C)C)C=C1C[C@@H](C(O)=O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21 ADOHASQZJSJZBT-SANMLTNESA-N 0.000 description 1
- JAUKCFULLJFBFN-VWLOTQADSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-[4-[(2-methylpropan-2-yl)oxy]phenyl]propanoic acid Chemical compound C1=CC(OC(C)(C)C)=CC=C1C[C@@H](C(O)=O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21 JAUKCFULLJFBFN-VWLOTQADSA-N 0.000 description 1
- SJVFAHZPLIXNDH-QFIPXVFZSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-phenylpropanoic acid Chemical compound C([C@@H](C(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)C1=CC=CC=C1 SJVFAHZPLIXNDH-QFIPXVFZSA-N 0.000 description 1
- CBPJQFCAFFNICX-IBGZPJMESA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-4-methylpentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CC(C)C)C(O)=O)C3=CC=CC=C3C2=C1 CBPJQFCAFFNICX-IBGZPJMESA-N 0.000 description 1
- BUBGAUHBELNDEW-SFHVURJKSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-4-methylsulfanylbutanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CCSC)C(O)=O)C3=CC=CC=C3C2=C1 BUBGAUHBELNDEW-SFHVURJKSA-N 0.000 description 1
- KJYAFJQCGPUXJY-UMSFTDKQSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-4-oxo-4-(tritylamino)butanoic acid Chemical compound C([C@@H](C(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)C(=O)NC(C=1C=CC=CC=1)(C=1C=CC=CC=1)C1=CC=CC=C1 KJYAFJQCGPUXJY-UMSFTDKQSA-N 0.000 description 1
- OTKXCALUHMPIGM-FQEVSTJZSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-5-[(2-methylpropan-2-yl)oxy]-5-oxopentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CCC(=O)OC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 OTKXCALUHMPIGM-FQEVSTJZSA-N 0.000 description 1
- WDGICUODAOGOMO-DHUJRADRSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-5-oxo-5-(tritylamino)pentanoic acid Chemical compound C([C@@H](C(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)CC(=O)NC(C=1C=CC=CC=1)(C=1C=CC=CC=1)C1=CC=CC=C1 WDGICUODAOGOMO-DHUJRADRSA-N 0.000 description 1
- UMRUUWFGLGNQLI-QFIPXVFZSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-6-[(2-methylpropan-2-yl)oxycarbonylamino]hexanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CCCCNC(=O)OC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 UMRUUWFGLGNQLI-QFIPXVFZSA-N 0.000 description 1
- VCFCFPNRQDANPN-IBGZPJMESA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)hexanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CCCC)C(O)=O)C3=CC=CC=C3C2=C1 VCFCFPNRQDANPN-IBGZPJMESA-N 0.000 description 1
- QWXZOFZKSQXPDC-NSHDSACASA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)propanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](C)C(O)=O)C3=CC=CC=C3C2=C1 QWXZOFZKSQXPDC-NSHDSACASA-N 0.000 description 1
- HNICLNKVURBTKV-NDEPHWFRSA-N (2s)-5-[[amino-[(2,2,4,6,7-pentamethyl-3h-1-benzofuran-5-yl)sulfonylamino]methylidene]amino]-2-(9h-fluoren-9-ylmethoxycarbonylamino)pentanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@H](C(O)=O)CCCN=C(N)NS(=O)(=O)C1=C(C)C(C)=C2OC(C)(C)CC2=C1C HNICLNKVURBTKV-NDEPHWFRSA-N 0.000 description 1
- KYBXNPIASYUWLN-WUCPZUCCSA-N (2s)-5-hydroxypyrrolidine-2-carboxylic acid Chemical compound OC1CC[C@@H](C(O)=O)N1 KYBXNPIASYUWLN-WUCPZUCCSA-N 0.000 description 1
- LZOLWEQBVPVDPR-VLIAUNLRSA-N (2s,3r)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-[(2-methylpropan-2-yl)oxy]butanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H]([C@H](OC(C)(C)C)C)C(O)=O)C3=CC=CC=C3C2=C1 LZOLWEQBVPVDPR-VLIAUNLRSA-N 0.000 description 1
- LOGFVTREOLYCPF-KXNHARMFSA-N (2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCN LOGFVTREOLYCPF-KXNHARMFSA-N 0.000 description 1
- QXVFEIPAZSXRGM-DJJJIMSYSA-N (2s,3s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-methylpentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H]([C@@H](C)CC)C(O)=O)C3=CC=CC=C3C2=C1 QXVFEIPAZSXRGM-DJJJIMSYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- 125000000979 2-amino-2-oxoethyl group Chemical group [H]C([*])([H])C(=O)N([H])[H] 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 229940117976 5-hydroxylysine Drugs 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 102000005600 Cathepsins Human genes 0.000 description 1
- 108010084457 Cathepsins Proteins 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- 238000011763 DBA/1J (JAX™ mouse strain) Methods 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108700039887 Essential Genes Proteins 0.000 description 1
- 101710145505 Fiber protein Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 description 1
- 206010020674 Hypermetabolism Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000003777 Interleukin-1 beta Human genes 0.000 description 1
- 108090000193 Interleukin-1 beta Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 102000010781 Interleukin-6 Receptors Human genes 0.000 description 1
- 108010038501 Interleukin-6 Receptors Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 206010023232 Joint swelling Diseases 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 125000001176 L-lysyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C([H])([H])C([H])([H])C(N([H])[H])([H])[H] 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- 125000000769 L-threonyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])[C@](O[H])(C([H])([H])[H])[H] 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 1
- 125000003798 L-tyrosyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C1=C([H])C([H])=C(O[H])C([H])=C1[H] 0.000 description 1
- 125000003580 L-valyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(C([H])([H])[H])(C([H])([H])[H])[H] 0.000 description 1
- 206010024305 Leukaemia monocytic Diseases 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- 206010025476 Malabsorption Diseases 0.000 description 1
- 208000004155 Malabsorption Syndromes Diseases 0.000 description 1
- 208000001145 Metabolic Syndrome Diseases 0.000 description 1
- 102000013967 Monokines Human genes 0.000 description 1
- 108010050619 Monokines Proteins 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 102000008934 Muscle Proteins Human genes 0.000 description 1
- 108010074084 Muscle Proteins Proteins 0.000 description 1
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 1
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 description 1
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 238000011530 RNeasy Mini Kit Methods 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000025747 Rheumatic disease Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 108010060888 Toll-like receptor 2 Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical compound CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 230000002917 arthritic effect Effects 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 206010003549 asthenia Diseases 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 229930189065 blasticidin Natural products 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 230000021523 carboxylation Effects 0.000 description 1
- 238000006473 carboxylation reaction Methods 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 230000006652 catabolic pathway Effects 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 231100000676 disease causative agent Toxicity 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000005265 energy consumption Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 230000008713 feedback mechanism Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000012997 ficoll-paque Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000036252 glycation Effects 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 125000002349 hydroxyamino group Chemical group [H]ON([H])[*] 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 230000002267 hypothalamic effect Effects 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 201000006894 monocytic leukemia Diseases 0.000 description 1
- 230000020763 muscle atrophy Effects 0.000 description 1
- 210000001087 myotubule Anatomy 0.000 description 1
- 230000007498 myristoylation Effects 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- 235000006286 nutrient intake Nutrition 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 230000026792 palmitoylation Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 108010091748 peptide A Proteins 0.000 description 1
- 239000000863 peptide conjugate Substances 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 238000002953 preparative HPLC Methods 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 230000004952 protein activity Effects 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 235000002137 reduced nutrient intake Nutrition 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000003118 sandwich ELISA Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000012086 standard solution Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000010798 ubiquitination Methods 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/10—Peptides having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/45—Transferases (2)
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/17—Amino acids, peptides or proteins
- A23L33/18—Peptides; Protein hydrolysates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
- C12N9/1241—Nucleotidyltransferases (2.7.7)
- C12N9/1276—RNA-directed DNA polymerase (2.7.7.49), i.e. reverse transcriptase or telomerase
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/07—Nucleotidyltransferases (2.7.7)
- C12Y207/07049—RNA-directed DNA polymerase (2.7.7.49), i.e. telomerase or reverse-transcriptase
Description
(2)中性親水性:cys、ser、thr;
(3)酸性:asp、glu;
(4)塩基性:asn、gln、his、lys、arg;
(5)鎖配向に影響を及ぼす残基:gly、pro;及び
(6)芳香族:trp、tyr、phe。
配列番号1のペプチドを従来に知られた固相ペプチド合成法(SPPS:solid phase peptide synthesis)によって製造した。具体的には、ペプチドは、ASP48S(Peptron、Inc.,大韓民国・大田)を利用して、Fmoc固相合成法を介して、C末端からアミノ酸一つずつカップリングすることによって合成した。次のように、ペプチドのC末端の最初のアミノ酸が樹脂に付着されたものを使用した。例えば、次の通りである:
NH2−Ala−2−chloro−Trityl Resin
NH2−Arg(Pbf)−2−chloro−Trityl Resin
NH2−Lys(Boc)−2−chloro−Trityl Resinで保護されたアミノ酸(8当量)と、カップリング試薬HBTU(8当量)/HOBt(8当量)/NMM(16当量)とをDMFに溶解させて添加した後、常温で2時間反応させ、DMF、MeOH、DMFの順に洗浄した。
20%のDMF中のピペリジン(piperidine in DMF)を加え、常温で5分間2回反応させ、DMF、MeOH、DMFの順に洗浄した。
細胞株の培養
健常者から血液を採血(50ml)した後、Ficoll−PaqueTM PLUS(GE Healthcare Life Sciences,Piscataway,NJ,USA)を使用して、PBMC(peripheral blood mononuclear cell)層を回収した。回収されたPBMCは、ヒト血清(20%)が添加されたRPMI 1640培地(Invitrogen/Life Technologies,Carlsbad,CA,USA)で富化させ、30分ほどヒト血清をコーティングした100mmポリスチレン細胞培養プレートに移し、2時間ほど37℃、5%培養器で2時間培養した。その後、底に付着したモノサイトを、冷たいPBS(phosphate buffered saline)(Gibco/Life Technologies,Carlsbad,CA,USA)で引き離した後、96ウェルプレートにウェル当たり1×105セルになるように、RPMI 1640培地(supplemented with penicillin-streptomycin;100mg/ml,human serum;20%)で富化させ、実験前日に培養させておいた。
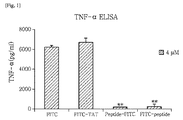
PEP 1がいかなる影響を及ぼすかということを調べるために、TNF−αに対するELISA(enzyme linked immunosorbent assay)実験を行った。PBMCに由来したモノサイトを、96ウェルプレートに、ウェル当たり1×105セルになるように、前日に培養させた。その後、LPS(lipopolysaccharide;10ng/ml,Sigma)を2時間処理し、PBSで3回洗浄した。OPTI−MEM培地(Invitrogen/Life Technologies,Carlsbad,CA,USA)を入れ、1時間飢餓状態処理(starvation)を行った後、FITC(fluorescein isothiocyanate)、FITC−TAT、PEP 1−FITC及びFITC−PEP 1で4μM処理し、2時間培養した。培養が終わった後、細胞培養液を集め、ELISA(R&D,Minneapolis,MN,USA)キットマニュアルによって、TNF−αを定量した。具体的な定量方法は、次の通りである。
THP−1細胞の培養
悪液質マーカーに対する影響を確認するために、THP−1細胞を培養した。THP−1細胞(human monocytic leukemia derived cell line)は、ATCC(American Type Culture Collection,Manassas,VA,USA)から購入し、10%FBS(Life technologies)、1%ペニシリン/ストレプトマイシン、及び0.05mM 2−mercaptoethanol(Sigma−Aldrich,St.Louis,MO,USA)が補強されたRPMI−1640(Life technologies,Carlsbad,CA,USA)培地で、37℃、5% CO2条件で培養した。
THP−1細胞を分化させた後、大食細胞類似THF−1細胞を、完全成長培地(complete growth medium)で2回洗浄した。その後、細胞を、10ng/mL LPS(Sigma−Aldrich)及び/または20μM PEP−1で4時間37℃で処理した。
全体RNAを抽出し、メーカーのプロトコルによって、QiagenのRNeasyミニキット(Valencia,CA,USA)を使用して精製した。そして、cDNAを、メーカーのプロトコルによって、Reverse Transcription System(Promega,Madison,WI,USA)を使用して合成した。
その後、THP−1細胞からのcDNAサンプルを、リアルタイム定量PCR分析(qPCR)のためのテンプレートとして使用した。リアルタイムPCRは、下記表2に示したレプチン、IL−1β及びIL−6に対するプライマー、SYBR Green Master Mix(Qiagen)及びBio−Rad(Mercules,CA,USA)CFX 96 real-time PCR instrumentを利用して実施した。熱循環(thermocycling)条件は、次の通りである:
CIA(Collagen induced arthritis)動物モデル構築
本発明によるペプチドを含む組成物が、関節リウマチ(RA)による悪液質に及ぼす効果を調べるために、コラーゲン誘発関節リウマチ(CIA:Collagen−induced rheumatoid arthritis)を起こしたマウスの体重変化を測定した。
DBA/1Jマウス5週齢のオス(Orient Bio Inc.,韓国)を使用して、初日に38匹のネズミに一次誘導を進め、CIAを起こす前に、ペプチド組成物を投与する初期治療群(preventive)16匹(1nM、100μL(すなわち、約0.2ngの投与量)8匹;10nM、100μL(すなわち、約2ngの投与量)8匹)、CIAを起こした後、ペプチド組成物を投与する後期治療群(therapeutic)16匹(1nM、100μL 8匹;10nM、100μL 8匹)及びPBS処理群6匹に区分した。
前記一次実験時のように、5週齢のネズミを使用して、初日に、38匹のネズミに一次誘導を進め、CIAを起こさせた後、ペプチド組成物を投与する治療群32匹(0.2nM、100μL(すなわち、約0.04ng)8匹;1nM、100μL(すなわち、約0.2ng)8匹;2nM、100μL(すなわち、約0.4ng)8匹;5nM、100μL(すなわち、約1ng)8匹)、PBS処理群6匹に区分した。
初期治療群(pre−1nM及びpre−10nM)並びに後期治療群(thera−1nM及びthera−10nM)の体重変化を調べれば、PEP 1処理を施した治療群が、CIA対照群に比べ、全体的に体重増加が確認され、10nMに比べ、1nMの処理群において、体重増加程度にすぐれる(図7)。
各濃度のペプチド処理群とCIA対照群との体重変化を調べれば、全体的にPEP 1処理群が、CIA対照群に比べ、体重増加を示し、特に1nM以下の低い濃度処理群において、目立った体重増加を確認することができた(図8、図9)。
(1)細胞の準備
ATCCから得たHeLa細胞株を、MEM(Minimum Essential Medium)に10%ウシ胎児血清(Invitrogen,USA)とEarle’s salts、non-essential amino acids、ピルビン酸ナトリウム、100μg/mlペニシリン及び100units/mlストレプトマイシン(streptomycin)を添加し、37℃、5%CO2培養器で培養した。
一方、前記培養された細胞株を、96ウェルプレートに分周し、培地に10%ウシ胎児血清(Invitrogen,USA)と、100μg/mlペニシリン及び100units/mlストレプトマイシンとを添加し、37℃、5%CO2培養器で12時間培養した。PBS洗浄後、MEM(Minimum Essential Medium)で1時間の飢餓(starvation)を行った。各PEP 1 20uM水溶液を100μLで処理し、37℃で24時間培養した後、MTTアッセイ方法を利用して、細胞生存率及び毒性を分析した。その結果は、図10に示した通りである。
Claims (12)
- 活性成分として、配列番号1のアミノ酸配列からなるペプチドを含む、悪液質の予防または治療のための組成物。
- 前記組成物は、悪液質と係わる症状を除去するために使用されるか、あるいは悪液質を治療または予防するために使用される、請求項1に記載の悪液質の予防または治療のための組成物。
- 前記悪液質は、AIDS、癌、股関節部骨折後、慢性心不全、COLD(慢性閉鎖性肺疾患)とCOPD(慢性閉鎖性肺疾患)とを含む慢性肺疾患、肝硬化症、腎不全、関節リウマチを含む自家免疫疾患、全身性ループス、敗血症、結核、嚢胞性線維症、クローン病及び重度感染から選択される一つ以上によって引き起こされる、請求項1に記載の悪液質の予防または治療のための組成物。
- 前記悪液質は、老化によって引き起こされる、請求項1に記載の悪液質の予防または治療のための組成物。
- 前記ペプチドは、0.001〜1ng/kgの1回投与量で投与される、請求項1に記載の悪液質の予防または治療のための組成物。
- 前記ペプチドは、0.01〜0.4ng/kgの1回投与量で投与される、請求項1に記載の悪液質の予防または治療のための組成物。
- 前記ペプチドは、1日〜5日ごとに1回投与される、請求項1に記載の悪液質の予防または治療のための組成物。
- 前記ペプチドは、1.5日〜2.5日ごとに1回投与される、請求項1に記載の悪液質の予防または治療のための組成物。
- 0.05nM〜5nMの濃度のペプチドを含む、請求項1に記載の悪液質の予防または治療のための組成物。
- 注射用に製剤化される、請求項1に記載の悪液質の予防または治療のための組成物。
- 医薬組成物である、請求項1に記載の悪液質の予防または治療のための組成物。
- 食品組成物である、請求項1に記載の悪液質の予防または治療のための組成物。
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20120050533 | 2012-05-11 | ||
| KR20120050529 | 2012-05-11 | ||
| KR10-2012-0050529 | 2012-05-11 | ||
| KR10-2012-0050533 | 2012-05-11 | ||
| KR10-2012-0071989 | 2012-07-02 | ||
| KR20120071989 | 2012-07-02 | ||
| KR20120104207 | 2012-09-19 | ||
| KR10-2012-0104207 | 2012-09-19 | ||
| PCT/KR2013/004176 WO2013169077A1 (ko) | 2012-05-11 | 2013-05-10 | 악액질 예방 또는 치료용 조성물 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015517489A JP2015517489A (ja) | 2015-06-22 |
| JP2015517489A5 JP2015517489A5 (ja) | 2016-06-30 |
| JP6267190B2 true JP6267190B2 (ja) | 2018-01-24 |
Family
ID=49551008
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015511378A Active JP6267190B2 (ja) | 2012-05-11 | 2013-05-10 | 悪液質の予防用または治療用組成物 |
| JP2015511374A Active JP6262722B2 (ja) | 2012-05-11 | 2013-05-10 | 関節リウマチの予防用または治療用組成物 |
| JP2015511371A Active JP6262721B2 (ja) | 2012-05-11 | 2013-05-10 | 敗血症の予防用または治療用の組成物 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015511374A Active JP6262722B2 (ja) | 2012-05-11 | 2013-05-10 | 関節リウマチの予防用または治療用組成物 |
| JP2015511371A Active JP6262721B2 (ja) | 2012-05-11 | 2013-05-10 | 敗血症の予防用または治療用の組成物 |
Country Status (6)
| Country | Link |
|---|---|
| US (3) | US9844584B2 (ja) |
| EP (3) | EP2875824B1 (ja) |
| JP (3) | JP6267190B2 (ja) |
| KR (3) | KR101997757B1 (ja) |
| CN (3) | CN104507489B (ja) |
| WO (3) | WO2013169077A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022001591A (ja) * | 2012-05-11 | 2022-01-06 | ジェムバックス アンド カエル カンパニー,リミティド | 抗炎症活性を有するペプチド、及びそれを含む組成物 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6267190B2 (ja) | 2012-05-11 | 2018-01-24 | ジェムバックス アンド カエル カンパニー,リミティド | 悪液質の予防用または治療用組成物 |
| US10967000B2 (en) | 2012-07-11 | 2021-04-06 | Gemvax & Kael Co., Ltd. | Cell-penetrating peptide, conjugate comprising same and composition comprising same |
| KR102258864B1 (ko) | 2013-04-19 | 2021-06-01 | 주식회사 젬백스앤카엘 | 허혈성 손상 치료 및 예방용 조성물 |
| CN105535931A (zh) | 2013-06-07 | 2016-05-04 | 凯尔杰姆维克斯有限公司 | 在癌症免疫疗法中有用的生物标记 |
| US10561703B2 (en) | 2013-06-21 | 2020-02-18 | Gemvax & Kael Co., Ltd. | Method of modulating sex hormone levels using a sex hormone secretion modulator |
| CA2926183C (en) | 2013-10-23 | 2018-07-03 | Gemvax & Kael Co., Ltd. | Composition for treating and preventing benign prostatic hyperplasia |
| WO2015076621A1 (ko) | 2013-11-22 | 2015-05-28 | 주식회사 카엘젬백스 | 혈관 신생 억제 활성을 가지는 펩티드 및 이를 포함하는 조성물 |
| KR102314231B1 (ko) | 2013-12-17 | 2021-10-19 | 주식회사 젬백스앤카엘 | 전립선 암 치료용 조성물 |
| JP6420459B2 (ja) | 2014-04-11 | 2018-11-07 | ジェムバックス アンド カエル カンパニー,リミティド | 線維症抑制活性を有するペプチド及びこれを含む組成物 |
| ES2962532T3 (es) | 2014-04-30 | 2024-03-19 | Gemvax & Kael Co Ltd | Composición para el trasplante de órganos, tejidos o células, kit y procedimiento de trasplante |
| ES2936383T3 (es) | 2014-08-08 | 2023-03-16 | Fundacion Del Sector Publico Estatal Centro Nac De Investigaciones Oncologicas Carlos Iii F S P Cnio | Terapias basadas en transcriptasa inversa de la telomerasa para el tratamiento de afecciones asociadas con el infarto de miocardio |
| KR102413243B1 (ko) | 2014-12-23 | 2022-06-27 | 주식회사 젬백스앤카엘 | 안질환 치료 펩티드 및 이를 포함하는 안질환 치료용 조성물 |
| WO2016137162A1 (ko) * | 2015-02-27 | 2016-09-01 | 주식회사 젬백스앤카엘 | 청력 손상 방어용 펩타이드 및 이를 포함하는 조성물 |
| KR102638286B1 (ko) | 2015-07-02 | 2024-02-20 | 주식회사 젬백스앤카엘 | 항바이러스 활성 효능을 가지는 펩티드 및 이를 포함하는 조성물 |
| CN108431021B (zh) * | 2015-11-03 | 2021-09-07 | 珍白斯凯尔有限公司 | 具有神经元损失预防和再生效果的肽以及包含该肽的组合物 |
| KR101897121B1 (ko) * | 2016-03-09 | 2018-09-10 | 주식회사 바이오펩 | 염증성 질환의 예방 또는 치료용 펩타이드 및 이의 용도 |
| KR20180123512A (ko) | 2016-04-07 | 2018-11-16 | 주식회사 젬백스앤카엘 | 텔로머라제 활성 증가 및 텔로미어 연장 효능을 가지는 펩티드 및 이를 포함하는 조성물 |
| KR20200001730A (ko) * | 2018-06-28 | 2020-01-07 | 차의과학대학교 산학협력단 | 김치를 포함하는 악액질 예방, 개선 또는 치료용 조성물 |
| KR102276941B1 (ko) * | 2018-07-03 | 2021-07-14 | 서울대학교산학협력단 | 류마티스 관절염 치료용 펩티드 및 그의 용도 |
| KR102486196B1 (ko) * | 2020-04-09 | 2023-01-06 | 대진대학교 산학협력단 | 무당벌레 유충 유래 펩타이드를 유효성분으로 포함하는 패혈증의 예방 또는 치료용 약제학적 조성물 |
Family Cites Families (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000515523A (ja) | 1996-07-22 | 2000-11-21 | ザ・ビクトリア・ユニバーシティ・オブ・マンチェスター | 創傷および線維性障害の治療における性ステロイド機能モジュレーターの使用 |
| US6610839B1 (en) * | 1997-08-14 | 2003-08-26 | Geron Corporation | Promoter for telomerase reverse transcriptase |
| JP2001510985A (ja) * | 1996-10-01 | 2001-08-07 | ジェロン コーポレイション | ヒトテロメラーゼ触媒性サブユニット |
| ES2285769T3 (es) | 1997-05-15 | 2007-11-16 | Chugai Seiyaku Kabushiki Kaisha | Remedio para la caquexia. |
| CN1270634A (zh) | 1997-07-01 | 2000-10-18 | 卡姆比亚生物系统有限责任公司 | 脊椎动物端粒酶基因和蛋白质及其用途 |
| US7030211B1 (en) | 1998-07-08 | 2006-04-18 | Gemvax As | Antigenic peptides derived from telomerase |
| IL132406A0 (en) | 1998-10-21 | 2001-03-19 | Pfizer Prod Inc | Treatment of bph with cgmp elevators |
| US6815426B2 (en) | 2001-02-16 | 2004-11-09 | E. I. Du Pont De Nemours And Company | Angiogenesis-inhibitory tripeptides, compositions and their methods of use |
| US6622663B2 (en) | 2001-03-27 | 2003-09-23 | Exxonmobil Research And Engineering Company | Fuel composition supply means for driving cycle conditions in spark ignition engines |
| JP4228700B2 (ja) | 2001-04-10 | 2009-02-25 | 日本新薬株式会社 | 慢性関節リウマチの治療剤 |
| US20030008822A1 (en) | 2001-05-16 | 2003-01-09 | Charles Dinarello | Use of IL-18 inhibitors for the treatment or prevention of sepsis |
| US20030143228A1 (en) | 2001-10-29 | 2003-07-31 | Baylor College Of Medicine | Human telomerase reverse transcriptase as a class-II restricted tumor-associated antigen |
| CN1658895A (zh) | 2002-04-10 | 2005-08-24 | 应用研究系统Ars股份公司 | 护骨素在治疗和/或预防纤维变性疾病中的应用 |
| KR20050020987A (ko) | 2002-06-12 | 2005-03-04 | 바이오겐 아이덱 엠에이 인코포레이티드 | 아데노신 수용체 길항제를 사용하여 허혈 재관류 손상을치료하는 방법 |
| KR20050040517A (ko) | 2003-10-29 | 2005-05-03 | 주식회사 오리엔트 | 허혈성 질환에 대한 저항성을 나타내는 형질전환 생쥐 |
| PT1530965E (pt) | 2003-11-11 | 2006-05-31 | Udo Mattern | Sistema de administracao de libertacao controlada de hormonas sexuais para aplicacao nasal |
| GB0426146D0 (en) * | 2004-11-29 | 2004-12-29 | Bioxell Spa | Therapeutic peptides and method |
| US20090215852A1 (en) * | 2005-03-21 | 2009-08-27 | Chroma Group, Inc. | Compositions and methods for ameliorating cachexia |
| JPWO2007061029A1 (ja) | 2005-11-25 | 2009-05-07 | 学校法人慶應義塾 | 前立腺癌治療剤 |
| WO2007069068A2 (en) | 2005-12-16 | 2007-06-21 | Diatos | Cell penetrating peptide conjugates for delivering nucleic acids into cells |
| WO2007097561A1 (en) | 2006-02-20 | 2007-08-30 | Ewha University - Industry Collaboration Foundation | Peptide having cell membrane penetrating activity |
| WO2008015580A2 (en) | 2006-07-24 | 2008-02-07 | Forhumantech. Co., Ltd. | Pharmaceutical composition for alleviation and treatment of ischemic conditions and method for delivering the same |
| AU2008211854C1 (en) | 2007-01-29 | 2014-01-23 | Procell Therapeutics Inc. | Novel macromolecule transduction domains and methods for identification and uses thereof |
| SG182976A1 (en) | 2007-06-29 | 2012-08-30 | Ahngook Pharmaceutical Co Ltd | Predictive markers for ovarian cancer |
| BRPI0815416A2 (pt) | 2007-08-15 | 2014-10-21 | Amunix Inc | Composições e métodos para modificar propriedades de polipeptídeos biologicamente ativos |
| US20090136917A1 (en) | 2007-10-25 | 2009-05-28 | Szalay Aladar A | Systems and methods for viral therapy |
| GB2455539B (en) | 2007-12-12 | 2012-01-18 | Cambridge Entpr Ltd | Anti-inflammatory compositions and combinations |
| PT2310044T (pt) | 2008-06-16 | 2016-11-18 | Mediolanum Farm S P A | Imunoterapia antitumor |
| KR101414854B1 (ko) | 2008-07-08 | 2014-07-03 | 엘지전자 주식회사 | 디지털 텔레비전 및 디지털 텔레비전 시스템 |
| ES2334315B1 (es) | 2008-07-29 | 2011-02-28 | Universitat Pompeu Fabra | Peptidos con capacidad de penetracion celular y sus usos. |
| JP5337809B2 (ja) | 2008-09-22 | 2013-11-06 | 日清ファルマ株式会社 | 抗炎症性ペプチド |
| KR101169030B1 (ko) | 2009-01-21 | 2012-07-26 | 애니젠 주식회사 | 신규한 세포막 투과 도메인 및 이를 포함하는 세포내 전달 시스템 |
| US7928067B2 (en) | 2009-05-14 | 2011-04-19 | Ischemix Llc | Compositions and methods for treating ischemia and ischemia-reperfusion injury |
| EP2433953B1 (en) | 2009-05-20 | 2015-07-08 | Toray Industries, Inc. | Cell membrane-permeable peptides |
| KR20110057049A (ko) | 2009-11-23 | 2011-05-31 | 박의신 | 기능성 전립선염 치료제 |
| KR20110062943A (ko) | 2009-12-04 | 2011-06-10 | 주식회사종근당 | 퀴나졸린 유도체를 유효성분으로 하는 전립선 비대증 예방 또는 치료제 |
| US9200277B2 (en) | 2010-01-11 | 2015-12-01 | Curna, Inc. | Treatment of sex hormone binding globulin (SHBG) related diseases by inhibition of natural antisense transcript to SHBG |
| RS59462B1 (sr) | 2010-02-16 | 2019-11-29 | Ultimovacs As | Polipeptidi |
| FR2960542B1 (fr) | 2010-05-27 | 2012-08-17 | Esther Suzy Arlette Fellous | Peptide en tant que medicament, en particulier pour le traitement du cancer |
| KR101263212B1 (ko) | 2010-05-28 | 2013-05-10 | 성신여자대학교 산학협력단 | 신규한 세포막 투과성 펩타이드 및 그의 용도 |
| WO2011150493A1 (en) | 2010-05-30 | 2011-12-08 | The Governing Council Of The University Of Toronto | Mitochondrial penetrating peptides as carriers for antimicrobials |
| KR101348284B1 (ko) | 2010-09-09 | 2014-01-03 | 주식회사 나이벡 | 인간 유래 세포 투과성 펩타이드와 생리활성 펩타이드 결합체 및 그 용도 |
| US20120208755A1 (en) | 2011-02-16 | 2012-08-16 | Intarcia Therapeutics, Inc. | Compositions, Devices and Methods of Use Thereof for the Treatment of Cancers |
| KR20120121196A (ko) | 2011-04-26 | 2012-11-05 | 주식회사 글루칸 | 관절염 치료제 |
| KR101284772B1 (ko) | 2011-05-24 | 2013-07-17 | 정종문 | 항염증, 진통효과를 가지는 기능성 식품 조성물 |
| KR20120133661A (ko) | 2011-05-31 | 2012-12-11 | 주식회사 바이오포트코리아 | 아스타잔틴을 포함하는 항염증제 |
| KR101361445B1 (ko) | 2011-12-26 | 2014-02-12 | 성균관대학교산학협력단 | 펩타이드, 5-플루오로우라실, 및 성숙수지상세포를 포함하는 암 치료용 약학적 조성물 |
| DE13746292T1 (de) | 2012-02-10 | 2014-10-30 | Hakushinkouseikai Foundation | Proliferationsmittel für monozyten, kulturmedium zur proliferation von monozyten, verfahren zur herstellung von monozyten, verfahren zur herstellung dendritischer zellen und verfahren zur herstellung eines impfstoffs mit dendritischen zellen |
| KR102041381B1 (ko) | 2012-03-12 | 2019-11-27 | 젬백스 에이에스 | 능동적인 면역치료법을 이용한 비-소세포성 폐암의 치료 |
| JP6267190B2 (ja) | 2012-05-11 | 2018-01-24 | ジェムバックス アンド カエル カンパニー,リミティド | 悪液質の予防用または治療用組成物 |
| JP6466833B2 (ja) * | 2012-05-11 | 2019-02-06 | ジェムバックス アンド カエル カンパニー,リミティド | 抗炎症活性を有するペプチド、及びそれを含む組成物 |
| US10967000B2 (en) | 2012-07-11 | 2021-04-06 | Gemvax & Kael Co., Ltd. | Cell-penetrating peptide, conjugate comprising same and composition comprising same |
| TWI655287B (zh) | 2012-09-19 | 2019-04-01 | 韓商傑姆維克斯&凱爾有限公司 | 穿膜胜肽以及包含該胜肽之共軛物及組成物(三) |
| WO2014046490A1 (ko) | 2012-09-19 | 2014-03-27 | 주식회사 카엘젬백스 | 세포 투과성 펩티드, 그를 포함한 컨쥬게이트 및 그를 포함한 조성물 |
| JP6510410B2 (ja) | 2012-09-19 | 2019-05-08 | ジェムバックス アンド カエル カンパニー,リミティド | 細胞透過性ペプチド、それを含んだコンジュゲート、及びそれを含んだ組成物 |
| KR102258864B1 (ko) | 2013-04-19 | 2021-06-01 | 주식회사 젬백스앤카엘 | 허혈성 손상 치료 및 예방용 조성물 |
| CN105535931A (zh) | 2013-06-07 | 2016-05-04 | 凯尔杰姆维克斯有限公司 | 在癌症免疫疗法中有用的生物标记 |
| US10561703B2 (en) | 2013-06-21 | 2020-02-18 | Gemvax & Kael Co., Ltd. | Method of modulating sex hormone levels using a sex hormone secretion modulator |
| CA2926183C (en) | 2013-10-23 | 2018-07-03 | Gemvax & Kael Co., Ltd. | Composition for treating and preventing benign prostatic hyperplasia |
| WO2015076621A1 (ko) | 2013-11-22 | 2015-05-28 | 주식회사 카엘젬백스 | 혈관 신생 억제 활성을 가지는 펩티드 및 이를 포함하는 조성물 |
| KR102314231B1 (ko) | 2013-12-17 | 2021-10-19 | 주식회사 젬백스앤카엘 | 전립선 암 치료용 조성물 |
| JP6420459B2 (ja) | 2014-04-11 | 2018-11-07 | ジェムバックス アンド カエル カンパニー,リミティド | 線維症抑制活性を有するペプチド及びこれを含む組成物 |
| ES2962532T3 (es) | 2014-04-30 | 2024-03-19 | Gemvax & Kael Co Ltd | Composición para el trasplante de órganos, tejidos o células, kit y procedimiento de trasplante |
-
2013
- 2013-05-10 JP JP2015511378A patent/JP6267190B2/ja active Active
- 2013-05-10 CN CN201380036874.6A patent/CN104507489B/zh active Active
- 2013-05-10 JP JP2015511374A patent/JP6262722B2/ja active Active
- 2013-05-10 US US14/400,293 patent/US9844584B2/en active Active
- 2013-05-10 WO PCT/KR2013/004176 patent/WO2013169077A1/ko active Application Filing
- 2013-05-10 KR KR1020147033768A patent/KR101997757B1/ko active IP Right Grant
- 2013-05-10 EP EP13787037.4A patent/EP2875824B1/en active Active
- 2013-05-10 KR KR1020147033767A patent/KR101873773B1/ko active IP Right Grant
- 2013-05-10 CN CN201380036936.3A patent/CN104487081B/zh active Active
- 2013-05-10 WO PCT/KR2013/004156 patent/WO2013169067A1/ko active Application Filing
- 2013-05-10 JP JP2015511371A patent/JP6262721B2/ja active Active
- 2013-05-10 US US14/400,324 patent/US9730984B2/en active Active
- 2013-05-10 KR KR1020147033766A patent/KR101997756B1/ko active IP Right Grant
- 2013-05-10 WO PCT/KR2013/004145 patent/WO2013169060A1/ko active Application Filing
- 2013-05-10 CN CN201380036882.0A patent/CN104661672B/zh active Active
- 2013-05-10 EP EP13787603.3A patent/EP2875825B1/en active Active
- 2013-05-10 EP EP13787982.1A patent/EP2875826B1/en active Active
- 2013-05-10 US US14/400,299 patent/US9907837B2/en active Active
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022001591A (ja) * | 2012-05-11 | 2022-01-06 | ジェムバックス アンド カエル カンパニー,リミティド | 抗炎症活性を有するペプチド、及びそれを含む組成物 |
| JP7449909B2 (ja) | 2012-05-11 | 2024-03-14 | ジェムバックス アンド カエル カンパニー,リミティド | 抗炎症活性を有するペプチド、及びそれを含む組成物 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6267190B2 (ja) | 悪液質の予防用または治療用組成物 | |
| JP6788062B2 (ja) | 抗炎症活性を有するペプチド、及びそれを含む組成物 | |
| JP7007333B2 (ja) | 抗炎症活性を有するペプチド、及びそれを含む組成物 | |
| CN106456697B (zh) | 具有纤维化抑制活性的肽和含有其的组合物 | |
| KR20140104288A (ko) | Tnf-알파 저해제 | |
| KR20160086864A (ko) | 항염증 활성을 갖는 펩티드 및 이를 포함하는 조성물 | |
| JP5982394B2 (ja) | MMP基質で連結したβig−h3断片ペプチド及びそのリウマチ性関節炎予防及び治療用途 | |
| JP2024056904A (ja) | 抗炎症活性を有するペプチド、及びそれを含む組成物 | |
| TWI836435B (zh) | 抗發炎胜肽及包含其之成分 | |
| KR20140104287A (ko) | Tnf-알파 저해제 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160510 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160510 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170323 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A132 Effective date: 20170404 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170704 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171003 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20171121 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6267190 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |