JP5077908B2 - アシル化トコフェロールの製造法 - Google Patents
アシル化トコフェロールの製造法 Download PDFInfo
- Publication number
- JP5077908B2 JP5077908B2 JP2006030327A JP2006030327A JP5077908B2 JP 5077908 B2 JP5077908 B2 JP 5077908B2 JP 2006030327 A JP2006030327 A JP 2006030327A JP 2006030327 A JP2006030327 A JP 2006030327A JP 5077908 B2 JP5077908 B2 JP 5077908B2
- Authority
- JP
- Japan
- Prior art keywords
- tocopherol
- water
- temperature
- reaction
- catalyst
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/54—Improvements relating to the production of bulk chemicals using solvents, e.g. supercritical solvents or ionic liquids
Landscapes
- Pyrane Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
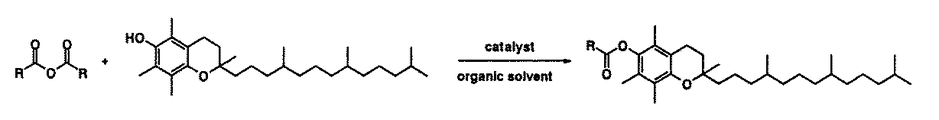
本発明は、化1のカルボン酸無水物と化2のトコフェロールから化3のアシル化トコフェロールを、一段階の反応プロセスで、触媒無添加、短時間の反応条件下で、選択的に合成することを特徴とするものである(化4)。本発明では、上記反応溶媒として、温度100〜400℃、圧力0.1〜40MPaの亜臨界流体、超臨界流体が用いられ、好適には、亜臨界水が用いられる。また、反応条件として、好適には、温度200〜250℃、圧力5MPa、反応時間が60秒以下、好適には3〜60秒の範囲であり、反応時間は、より好適には10秒程度に調整される。化1、化3、化4の式中、Rはアルキル基及びアルキル基以外のヘテロ原子を含む置換基である。
(1)カルボン酸無水物とトコフェロールから高速で連続的にアシル化トコフェロールを合成することができる。
(2)触媒及び有機溶媒を用いない合成プロセスを実現できる。
(3)そのため、触媒及び有機溶媒の残存がなく、生体に対して有害性のない安全性の高い生体適合性アシル化トコフェロール組成物を提供できる。
(4)アシル化トコフェロールが水に溶解しないため、排出された油水分散水溶液に対して更に水を注入することで、洗浄しつつ油水二層に分液し、高純度の生成物を容易に回収できる。
(5)畜産、食品、医薬品として有用な生体適合性を有するアシル化トコフェロールの新しい大量生産プロセスとして、既存の生産プロセスに代替し得る新しい生産技術を提供できる。
本実施例では、トコフェロールから酢酸トコフェロールへのアシル化の条件を決定するために、2,6−ジメチルフェノールを用いて検討した。合成条件を、無触媒、所定温度、圧力5MPa、滞留時間9.9秒の条件で一定として温度の効果を検討とした。図7の流通式高温高圧反応装置の本体(主要部分)を図5の流通型高温高圧流体その場赤外分光測定装置に設置した装置に、まず、純水を流量5.0ml/minで送液し、所定温度、圧力5MPaに設定し、亜超臨界水とした。その後、トルエンを内標準として添加した(2,6−ジメチルフェノールの5mol%)、無水酢酸/2,6−ジメチルフェノール(モル比:1.1/1)混合溶液0.5ml/minをポンプで送液した(混合後の水溶液濃度:0.53mol/kg)。
本実施例では、実施例1,2の知見から、トコフェロールに対して、無触媒、温度250℃、圧力5MPa、滞留時間9.9秒の条件で一定として実施した。ここで、トコフェロールは抗酸化力の最も大きいα体を用いたが、その他のβ体、γ体、δ体及びミックストコフェロールに関しても適用が可能である。
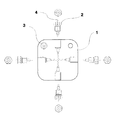
2 φ4mm×5.0mmL六角ネジ
3 ワンリングフェラル付オネジ
4 SUS316チューブ
5 水送液ポンプ
6 反応物送液ポンプ
7 洗浄水送液ポンプ
8 冷却フランジ(冷却水が循環する)
9 水加熱コイル
10 反応物導入管
11 温度センサ
12 温度センサーシース
13 炉体
14 高温高圧フローセル(通常昇温ではティー型、急速昇温ではクロス型)
15 ZnSe窓
16 溶媒導入管
17 排出配管
18 ティー
19 背圧弁
21 水溶液
22 洗浄水
23 水溶液ポンプ
24 洗浄用純水送液ポンプ
25 炉体加熱システム
26 炉体
27 高温高圧赤外フローセル
28 冷却水(入口)
29 冷却水(出口)
30 背圧弁
31 排出水溶液受器
32 可動鏡
33 可動鏡
34 干渉計
35 光源
36 赤外レーザー
37 MCT受光器
38 TGS受光器
39 解析モニター
Claims (4)
- 無水カルボン酸とトコフェロールからアシル化トコフェロールを合成する方法であって、1)高温高圧状態の亜臨界ないし超臨界流体を反応溶媒として使用し、触媒及び有機溶媒を用いることなく、無水カルボン酸とトコフェロールから一段階の合成反応でアシル化トコフェロールを合成すること、2)その際に、高温高圧状態の亜臨界水ないし超臨界水を反応溶媒として使用すること、を特徴とするアシル化トコフェロールの製造方法。
- 温度200〜400℃、圧力5〜40MPaの亜臨界水ないし超臨界水を反応溶媒として使用する、請求項1記載の方法。
- 流通式高温高圧装置に、基質及び反応溶媒を導入し、反応時間を3〜60秒の範囲で変化させることで合成反応を実施する、請求項1記載の方法。
- 請求項1に記載の方法において、アシル化後、回収水溶液に水を注入してデカンテーションし、油/水二層溶液に分離後、アシル化トコフェロールを含む油層を分液回収する一方、水層からは酢酸と水を共沸蒸留によって分離回収することを特徴とする簡易な連続分離法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006030327A JP5077908B2 (ja) | 2006-02-07 | 2006-02-07 | アシル化トコフェロールの製造法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006030327A JP5077908B2 (ja) | 2006-02-07 | 2006-02-07 | アシル化トコフェロールの製造法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007210912A JP2007210912A (ja) | 2007-08-23 |
| JP2007210912A5 JP2007210912A5 (ja) | 2007-10-04 |
| JP5077908B2 true JP5077908B2 (ja) | 2012-11-21 |
Family
ID=38489670
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006030327A Expired - Fee Related JP5077908B2 (ja) | 2006-02-07 | 2006-02-07 | アシル化トコフェロールの製造法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5077908B2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102712565B (zh) * | 2010-01-13 | 2014-12-31 | 帝斯曼知识产权资产管理有限公司 | 在微反应系统中酰化 |
| CN114195751A (zh) * | 2022-01-14 | 2022-03-18 | 宁波大红鹰生物工程股份有限公司 | 一种d-α-生育酚醋酸酯的合成精制工艺 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4243464A1 (de) * | 1992-12-22 | 1994-06-23 | Basf Ag | Verfahren zur Herstellung von alpha-Tocopherol und alpha-Tocopherylacetat in flüssigem oder überkritischem Kohlendioxid |
| DE60110975T2 (de) * | 2000-07-10 | 2005-10-27 | Dsm Ip Assets B.V. | Acylierungsverfahren |
| JP2005281270A (ja) * | 2004-03-31 | 2005-10-13 | National Institute Of Advanced Industrial & Technology | アリルアルコール化合物の異性化とその装置 |
-
2006
- 2006-02-07 JP JP2006030327A patent/JP5077908B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2007210912A (ja) | 2007-08-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5816184B2 (ja) | ニトロ化反応器への水相のリサイクルによるニトロアルカン回収法 | |
| Bi et al. | Catalyst-free and highly selective electrophilic mono-fluorination of acetoacetamides: facile and efficient preparation of 2-fluoroacetoacetamides in PEG-400 | |
| EP2346805A2 (en) | Manufacture of gamma-delta-unsaturated ketones | |
| JP5077908B2 (ja) | アシル化トコフェロールの製造法 | |
| JP2009132663A (ja) | アクロレイン類の製造法とその装置 | |
| CN113816973B (zh) | 一种医药中间体苯并噻唑[2,3-b]喹唑啉二酮衍生物的制备方法 | |
| JP4836181B2 (ja) | アシル化合物の製造法とその装置 | |
| JP5146928B2 (ja) | クライゼン転位化合物の製造方法とその合成装置 | |
| EP3109227B1 (en) | Method for continuously producing ketomalonic acid compound using flow reactor | |
| JP5369349B2 (ja) | 5−ヒドロキシメチル−2−フルフリルアルデヒドの製造法とその装置 | |
| JP4953341B2 (ja) | ポリアシル化合物の製造法とその装置 | |
| JP2015224218A (ja) | パーフルオロアルキルパーフルオロアルカンスルホネートの製造方法 | |
| RU2641815C2 (ru) | Способ получения гидроксида холина из триметиламина и этиленоксида | |
| JP4784913B2 (ja) | シトラールの合成反応法とその装置 | |
| EP0199661B1 (fr) | Procédé de préparation d'acylbiphényles | |
| JP2007291096A (ja) | 選択的逐次ポリアシル化法とその装置 | |
| CN113149896A (zh) | 一种3-氨基吡啶的制备方法 | |
| JP5549898B2 (ja) | 5−ヒドロキシメチル−2−フルフラールの製造法 | |
| JP4320402B2 (ja) | ジアリルエーテル化合物の合成反応法とその装置 | |
| JP2005281270A (ja) | アリルアルコール化合物の異性化とその装置 | |
| Fierro et al. | Heterogeneous catalysts in the preparation of 2-aryl-1, 3-dinitropropanes from β-nitrostyrenes or benzaldehydes | |
| JP5688735B2 (ja) | ハロゲン化置換糖類の製造方法及びその製造装置 | |
| JP2010013398A (ja) | モノニトロ化法とその製造反応装置 | |
| JP2007230886A (ja) | 反応制御方法 | |
| WO2024046955A1 (en) | Improved process for preparing p-aminobenzoic acid-2-ethylhexyl ester |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070720 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081204 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20081204 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20100601 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120110 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120312 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120404 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20120404 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120404 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120510 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120709 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120806 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120822 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150907 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5077908 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313117 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |